Изобретение относится к способу получения кислотно-аддитивных солей соединений формулы I
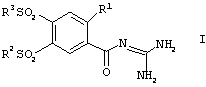
в которой R1, R2 и R3, независимо друг от друга, представляют собой алкил, имеющий от 1 до 12 атомов углерода, который отличается тем, что, на стадии А соединения формулы II
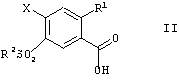
в которой R1 и R2 имеют значения, указанные выше, и Х представляет собой F, Cl, Br, алкил- или арил-сульфонат или перфтороалкилсульфонат, переводят по традиционным способам в сложные эфиры формулы III
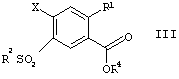
в которой R1, R2 и Х имеют значения, указанные выше, и R представляет собой алкил, имеющий от 1 до 10 атомов углерода, и, на стадии В, их переводят в присутствии алкилсульфината в соединения формулы IV
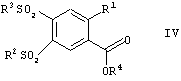
в которой R1, R2, R3 и R4 имеют значения, указанные выше, полученные соединения формулы IV на стадии С переводят при помощи реакции с гуанидином в соответствующие соединения формулы I, и, на стадии D, их обрабатывают пригодной кислотой с целью получения кислотно-аддитивной соли.
Сульфонилбензоилгуанидины известны и описаны, например, в ЕР 0758644 A1. Эти вещества являются ингибиторами клеточного Na+/H+ антипортера, т.е., они являются активными ингредиентами, которые ингибируют механизм обмена Na+/H+ клеток (Dusing и др., Med. Klin. 1992, 87, 367-384) и, следовательно, являются хорошими противоаритмиками, пригодными, в частности, для лечения аритмии, являющейся следствием кислородной недостаточности.
Вещества проявляют хорошее кардиозащитное действие и, таким образом, являются особенно пригодными для лечения острого инфаркта миокарда, профилактики инфаркта, постинфарктного лечения, хронической сердечной недостаточности и для лечения стенокардии. Они, более того, противодействуют патологическим гипоксическим и ишемическим повреждениям, позволяя лечить заболевания, первичной или вторичной причиной которых они являются. Эти активные ингредиенты, таким образом, являются высоко пригодными для профилактических применений.
Благодаря защитному действию этих веществ при патологических гипоксических или ишемических случаях, из этого следуют другие возможные применения при хирургических вмешательствах для защиты органов со временно сниженным снабжением, при трансплантациях органов для защиты удаленных органов, при ангиопластических сосудистых или сердечных вмешательствах, при ишемии нервной системы, при терапии шоковых состояний и для предотвращения эссенциальной гипертонии.
Эти соединения, более того, также могут применяться в качестве терапевтиков при заболеваниях, вызванных пролиферацией клеток, таких как артериосклероз, диабет и поздние осложнения диабета, опухолевые заболевания, фибротические заболевания, в частности, легких, печени и почек, и гипертрофия и гиперплазия органов. Дополнительно, соединения пригодны для диагностического применения для распознавания заболеваний, которые сопровождаются повышенной активностью антипортера Na+/H+, например, в эритроцитах, тромбоцитах или лейкоцитах.
Соединения, таким образом, можно применять в качестве медикаментозно активных ингредиентов в человеческой и ветеринарной медицине. Их, более того, можно применять в качестве промежуточных продуктов для получения других медикаментозно активных ингредиентов.
Соединения формулы I можно получать, например, как описано в ЕР 0758644. Известные из него способы синтеза основаны на введении алкилсульфоновых групп в кольцо соответствующей ароматической карбоновой кислоты и включают множество отдельных стадий, в некоторых случаях с недостаточными выходами. Известные способы, более того, имеют реакционные условия, которые невыгодны при промышленном производстве. Таким образом, например, введение алкилсульфоновых групп в кольцо ароматической карбоновой кислоты при помощи нуклеофильного замещения пригодных уходящих групп алкилсульфанами, после которого следует окисление, является проблематичным благодаря чрезвычайно сильному и долговременному негативному раздражению запахом алкилсульфанов, даже если их освобождают только в следовом количестве.
В случае прямого введения алкилсульфонильной группы в кольцо ароматической карбоновой кислоты при помощи нуклеофильного замещения пригодных уходящих групп алкилсульфинатом, для достижения адекватных скоростей реакции необходимы температуры, по меньшей мере, в 120°С, даже при применении высокополярных растворителей. Наблюдалось, что, хотя в этом диапазоне температур имеет место медленная реакция разложения, она сильно повышается при повышенных температурах с высокой экзотермичностью. Благодаря существенному образованию тепла из-за этого разложения, при больших порциях имеется риск того, что управление температурой реакции выйдет из-под контроля. Соответственно, из соображений безопасности, невозможно применять эту реакцию в промышленном масштабе.
Целью настоящего изобретения, таким образом, было представить улучшенный способ получения соединений формулы I и их кислотно-аддитивных солей, который избегает вышеуказанных проблематических реакционных стадий и дополнительно обеспечивает лучшие выходы продукта.
Эта цель достигалась при помощи способа по изобретению, который имеет черты п.1 формулы изобретения. Неожиданно было обнаружено, что обмен уходящей группы Х в сложных эфирах формулы III протекает намного более быстро либо при более низкой температуре, чем в случае соответствующей свободной кислоты, которую применяют в способах, известных ранее в технике, что ведет к существенному улучшению выхода. Способ по изобретению, таким образом, также дает возможность применять недорогие исходные соединения с хлорными заместителями на ароматическом кольце в качестве уходящих групп, получая при этом очень хорошие результаты. Более того, было обнаружено, что согласно способу по изобретению можно проводить стадии А и В и стадии С и D друг за другом без обработки реакционных смесей, что дает возможность избежать потерь выхода продукта и сложных рабочих стадий.
В соединениях формул I, II, III и IV радикалы имеют следующие предпочтительные значения:
R1, R2, R3 и R4 независимо друг от друга предпочтительно представляют собой метил, этил, н-пропил, н-бутил или н-пентил. Особенное предпочтение отдается метилу или этилу, в частности, метилу.
Х предпочтительно представляет собой F, CF3SO2 или Cl, в частности Cl.
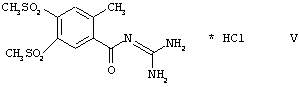
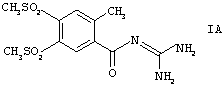
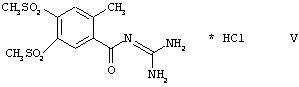
Способ по изобретению особенно пригоден для получения кислотно-аддитивных солей соединений формулы I, в которой R1, R2 и R3 одновременно обозначают метальную группу (соединения формулы IA). Особенно предпочтительной кислотно-аддитивной солью является гидрохлорид.
Способ, таким образом, особенно пригоден для получения соединения формулы V:
Реакция по способу по изобретению проста в осуществлении, соответствующие исходные соединения формулы II переводят, на стадии А, в сложные эфиры по традиционным способам этерификации, известным из литературы, таким как, например, кислотно-катализируемая этерификация с применением соответствующего спирта, такого как метанол или этанол, в присутствии избытка спирта в качестве растворителя или в присутствии пригодного со-растворителя, реакция солей карбоновых кислот соединений формулы II с пригодным алкилирующим агентом, таким как, например, диалкилсульфат, или реакция свободных кислот со сложными ортоэфирами.
Другой возможной реакцией этерификации является перевод кислоты в кислотный галид и последующая реакция с соответствующим спиртом с получением сложного эфира.
Этерификацию предпочтительно проводят при помощи реакции карбоновокислотных солей соединений формулы II с алкилирующими агентами, такими как, например, диалкилсульфат, или реакции соединений формулы II со сложным ортоэфиром.
Реакция солей карбоновых кислот с алкилирующими агентами преимущественно проводится при помощи предпочтительного добавления диалкилсульфата к соответствующей карбоновокислотной соли, растворенной в инертном растворителе, соль предпочтительно получают in situ добавлением основания, такого как, например, карбонат, гидрогенкарбонат, гидроксид или алкоксид, в частности, алкоксида щелочного металла, такого как, например, трет-бутоксид калия, или гидроксида, такого как, например, гидроксид натрия, и проведения реакции при комнатной температуре или повышенной температуре и атмосферном давлении. Диметилсульфат и диэтилсульфат являются особенно предпочтительными в качестве алкилирующих агентов.
Карбоновую кислоту формулы II, которую необходимо этерифицировать, или ее соль предпочтительно применяют в молярном соотношении к алкилирующему агенту в от 1:1 до 1:8, в частности, от 1:2 до 1:4.
Образования сложного эфира особенно предпочтительно достигают при помощи реакции соответствующих кислот со сложным ортоэфиром, таким как, например, триалкилортоацетат, тетраалкилортокарбонат или ортосиликат. Предпочтительными сложными ортоэфирами являются триэтилортоацетат, тетраметил или тетраэтилортокарбонат или ортосиликат. Тетраметилортоацетат особенно предпочтителен. Реакция этерификации преимущественно проводится при повышенных температурах, предпочтительно при 30-180°С, в частности, при 80-120°С, в инертном растворителе.
Карбоновую кислоту формулы II, которую необходимо этерифицировать, предпочтительно применяют в молярном соотношении к сложному ортоэфиру от 1:1 до 1:5, в частности, от 1:1,5 до 1:3.
Предпочтительными растворителями для стадии А являются амиды, такие как, например, диметилформамид, диметилацетамид, тетраметилмочевина, циклические мочевины, такие как, например, N, N-диметилимидазолидинон, или гексаметилфосфорный триамид или 1-метил-2-пирролидон (N-метилпирролидон, NMP). Если образование сложного эфира проводят при помощи сложного ортоэфира, предпочтение также отдается простым эфирам, таким как, например, диэтиловый эфир, тетрагидрофуран или диоксан, либо углеводородам, таким как, например, толуол, бензол, гексан или гептан. NMP особенно предпочтителен.
Также можно применять смеси растворителей.
Продолжительность реакции на стадии А зависит от условий реакции, которые были выбраны. В общем, продолжительность реакции составляет от 0,5 часа до 2 дней, предпочтительно от 1 до 15 часов.
На стадии В соединения формулы III подвергают реакции с алкилсульфинатом, предпочтительно с алкилсульфинатом щелочного металла, предпочтительно в полярных растворителях при температуре, предпочтительно в диапазоне 30-150°С, предпочтительно 50-110°С, в частности, при 80-90°С.
Применяемый алкилсульфинат щелочного металла представляет собой предпочтительно алкилсульфинат натрия или алкилсульфинат калия, в частности, метилсульфинат натрия или метилсульфинат калия.
Соединения формулы II предпочтительно применяют в молярном соотношении к алкилсульфинату щелочного металла в от 1:1 до 1:4, в частности, от 1:1,5 до 1:3.
Пригодными полярными апротонными растворителями для стадии В являются предпочтительно диметилсульфоксид, сульфолан (тетрагидротиофен 1,1-диоксид), диметилформамид, диметилацетамид, тетраметилмочевина, циклические мочевины, такие как, например, N,N-диметилимидазолидинон, или гексаметилфосфорный триамид или N-метилпирролидон (NMP). NMP особенно предпочтителен.
Также можно применять смеси этих растворителей.
Продолжительность реакции на стадии В зависит от выбранных условий реакции. В общем, продолжительность реакции составляет от 0,5 часа до 2 дней, предпочтительно от 1 до 25 часов.
В особенно предпочтительном осуществлении изобретения стадию В можно проводить без обработки реакционной смеси после стадии А. С этой целью проводят этерификацию соединений формулы II, как это описано выше, при помощи реакции с алкилирующими агентами или предпочтительно при помощи реакции со сложными ортоэфирами в полярном апротонном растворителе, который также можно применять и для стадии В, предпочтительно NMP. Затем к полученной реакционной смеси добавляют алкилсульфинат, и смеси дают прореагировать далее по способу, описанному выше для стадии В.
На стадии С соединения формулы IV подвергают реакции с гуанидином, предпочтительно в органическом растворителе при температурах от -20 до +60°С, предпочтительно при от -10 до +30°С, при атмосферном давлении. Применяемые для этой стадии органические растворители предпочтительно представляют собой простые эфиры, такие как, тетрагидрофуран или диоксан, или спирты, такие как метанол, этанол, н-пропанол или и-пропанол. Смеси упомянутых растворителей также можно применять. В предпочтительном осуществлении изобретения, гуанидин освобождают от его кислотно-аддитивной соли, такой как, например, хлорид гуанидиния, в одном из этих растворителей, добавляя основание, такое как, например, гидроксид или алкоксид щелочного металла, в частности метоксид натрия, и затем подвергают реакции (без) с соединениями формулы IV.
Соединения формулы IV предпочтительно применяют в молярном соотношении к гуанидину от 1:1 до 1:6, в частности от 1:2 до 1:4.
Продолжительность реакционной стадии С зависит от выбранных условий реакции. В общем, продолжительность реакции составляет от 0,5 до 20 часов, предпочтительно от 1 до 5 часов.
На стадии D кислотно-аддитивную соль образуют обработкой соединений формулы I соответствующей кислотой. Пригодными кислотами являются предпочтительно те, которые образуют физиологически приемлемые и переносимые соли с соединениями формулы I.
Для этой цели предпочтительно можно применять неорганические растворители, например, серную кислоту, азотную кислоту, гидрогалогеновые кислоты, такие как, соляная кислота бромоводородная кислота, фосфорные кислоты, такие как ортофосфорная кислота, сульфаминовую кислоту, более того, органические кислоты, в частности алифатические, алициклические, аралифатические, ароматические или гетероциклические одноосновные или полиосновные карбоновые, сульфоновые или серные кислоты, например, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, пиваловую кислоту, диэтилуксусную кислоту, малоновую кислоту, сукциновую кислоту, пимелиновую кислоту, фумаровую кислоту, малеиновую кислоту, молочную кислоту, виннокаменную кислоту, яблочную кислоту, бензойную кислоту, салициловую кислоту, 2- или 3-фенилпропионовую кислоту, лимонную кислоту, глюконовую кислоту, аскорбиновую кислоту, никотиновую кислоту, изоникотиновую кислоту, метан- или этансульфоновую кислоту, п-толуолсульфоновую кислоту, нафталенмоно- и - дисульфоновую кислоты или лаурилсерную кислоту. Соляная кислота является особенно предпочтительной.
Обработку кислотой предпочтительно проводят, растворяя соединения формулы I в растворителе и добавляя эквимолярное количество газообразной или жидкой кислоты или раствора кислоты в пригодном растворителе.
В предпочтительном осуществлении изобретения стадию D можно проводить после стадии С без предварительной обработки реакционной смеси, т.е., без выделения соединения формулы I, причем с целью образования кислотно-аддитивной соли, соответствующую кислоту добавляют непосредственно в реакционную смесь, полученную на стадии С. В этом случае кислотно-аддитивная соль соединений формулы выпадает в осадок из раствора в кристаллическом виде.
Количество растворителей для отдельных стадий А, В, С и D не является критическим, предпочтительно можно добавлять от 10 до 500 г растворителя на 1 г соединений формулы I, II, III или IV, подлежащих реагированию.
Соединения формул I, II, III и IV можно получить при помощи традиционных стадий обработки, таких как, например, добавление воды к реакционной смеси и экстракция после удаления растворителя. Проведение дистилляции или кристаллизации может представлять преимущества для дальнейшей очистки продукта.
Даже без дополнительных осуществлений, допускается, что специалист в данной области техники будет в состоянии использовать приведенное выше описание в широчайшем объеме. Предпочтительные осуществления таким образом можно упомянуть лишь как иллюстративное описание, которое ни коим образом не является ограничивающим.
Приведенные ниже примеры имеют цель проиллюстрировать изобретение без внесения ограничения. Если не упоминается другое, проценты обозначают процент по весу. Все температуры приведены в градусах Цельсия.
Используются следующие сокращения:
Пример 1
Раствор 29,5 г 4-хлоро-5-метансульфонил-2-метилбензойной кислоты и 18,39 г триметилортоацетата в 100 мл диоксана выдерживали при температуре флегмы до полного прореагирования кислоты. Добавляли 150 мл толуола и удаляли растворитель до той степени, чтобы смесь все еще подлежала перемешиванию. Последовательно добавляли 150 мл 1-метил-2-пирролидона (NMP) и 15,8 г метансульфината натрия, и смесь перемешивали при 80°С на протяжении 5 ч. После добавления дополнительных 5,3 г метансульфината натрия смесь перемешивали на протяжении 25 ч. Традиционная обработка давала метил 4,5-бисметансульфонил-2-метилбензоат.
Пример 2
Раствор 100,0 г 4-хлоро-5-метансульфонил-2-метилбензойной кислоты и 68,1 г триметилортоацетата в 322 мл. NMP выдерживали при температуре флегмы до полного прореагирования кислоты. После отгонки избытка сложного ортоэфира добавляли 96,5 г метансульфината натрия и смесь перемешивали при 90°С на протяжении 18 ч. Традиционная обработка давала метил 4,5-бисметансульфонил-2-метилбензоат.
Пример 3
При перемешивании 87,4 мл THF добавляли к 50,4 г 30%-ного раствора метоксида натрия в метаноле. После этого вводили 28,95 г хлорида гуанидиния. Суспензию перемешивали при 16-24°С на протяжении 2 ч и охлаждали до 10°С перед тем, как в смесь ввести 30,8 г метил 4,5-бисметансульфонил-2-метилбензоата. После перемешивания смеси при 10°С в течение 1 ч, к ней добавляли соответствующее количество раствора соляной кислоты. Традиционная обработка давала хлорид N-(4,5-бис-метансульфонил-2-метилбензоил)гуанидиния.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРАЗИНА И ИХ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ | 1992 |
|
RU2124008C1 |
| СПОСОБ ПОЛУЧЕНИЯ АСИММЕТРИЧНО ЗАМЕЩЕННЫХ ТРИАЗИНОВ | 1994 |
|
RU2125995C1 |
| 8-ЦИАН-1-ЦИКЛОПРОПИЛ-7-(2,8-ДИАЗАБИЦИКЛО(4.3.0)-НОНАН-8-ИЛ)-6-ФТОР-1,4-ДИГИДРО-4-ОКСО-3-ХИНОЛИНКАРБОНОВЫЕ КИСЛОТЫ, ИХ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 1997 |
|
RU2173318C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-ПЕНТАФТОРСУЛЬФАНИЛБЕНЗОИЛГУАНИДИНОВ | 2004 |
|
RU2382030C2 |
| СПОСОБ ПОЛУЧЕНИЯ НОРБЕНЗОМОРФАНА | 1996 |
|
RU2167868C2 |
| ПРОИЗВОДНЫЕ МОЧЕВИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1998 |
|
RU2198883C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ (3-ОКСО-2,3-ДИГИДРО-1Н-ИЗОИНДОЛ-1-ИЛ)-АЦЕТИЛГУАНИДИНА | 2004 |
|
RU2397159C2 |
| ПРОИЗВОДНЫЕ БЕНЗОФУРАНА | 2000 |
|
RU2278862C2 |
| СЛОЖНЫЕ ЭФИРЫ ТИЕНИЛКАРБОНОВОЙ КИСЛОТЫ И АМИНОСПИРТОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИХОЛИНЕРГИЧЕСКОЙ АКТИВНОСТЬЮ | 1990 |
|
RU2073677C1 |
| ОРТОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ БЕНЗОЙНОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2125981C1 |
Изобретение относится к способу получения кислотно-аддитивных солей соединений формулы (I),
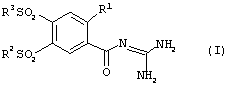
в которой R1, R2 и R3 представляют собой алкил, имеющий от 1 до 12 атомов углерода. Вещества формулы I являются ингибиторами клеточного Na+/H+ антипортера и, следовательно, являются хорошими противоаритмиками, пригодными, в частности, для лечения аритмии, являющейся следствием кислородной недостаточности. Способ включает следующие стадии: алкилпроизводные 4-хлор-5-метансульфонилбензойной кислоты переводят в сложный эфир, который затем подвергают реакции с алкилсульфинатом, полученный продукт обрабатывают гуанидином и далее получают кислотно-аддитивные соли соединения I. Настоящий способ обеспечивает лучший выход продукта и упрощает технологию. 9 з.п. ф-лы.
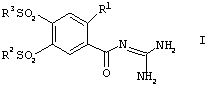
в которой R1, R2 и R3, независимо друг от друга, представляют собой алкил, имеющий от 1 до 12 атомов углерода, отличающийся тем, что на стадии А соединения формулы II
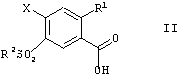
в которой R1 и R2 имеют значения, указанные выше, и Х представляет собой F, Cl, Br, алкил- или арил-сульфонат или перфтороалкилсульфонат, переводят по традиционным способам в сложные эфиры формулы III
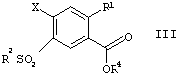
в которой R1, R2 и Х имеют значения, указанные выше, и R4 представляет собой алкил, имеющий от 1 до 10 атомов углерода, и на стадии В их переводят в присутствии алкилсульфината в соединения формулы IV
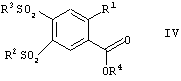
в которой R1, R2, R3 и R4 имеют значения, указанные выше, полученные соединения формулы IV на стадии С переводят при помощи реакции с гуанидином в соответствующие соединения формулы I, и на стадии D их обрабатывают пригодной кислотой с целью получения кислотно-аддитивной соли.
| RU 96115324 А, 20.10.1998 | |||
| ЕР 758644 А, 19.02.1997. |
Авторы
Даты
2005-08-20—Публикация
2001-04-17—Подача