Данное изобретение относится к синтезу новых химических веществ, поиску новых физиологически активных веществ, соединений-лидеров и лекарственных кандидатов, получаемых на основании скрининга комбинаторных или фокусированных библиотек соединений, а также к фармацевтической композиции, способам их получения и применения.
Более конкретно, настоящее изобретение относится к азогетероциклам, включающим 3-(пиперидин-2-ил)-пиридиновый фрагмент, в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемым солям, оксидам или гидратам, представляющим значительный интерес как потенциальные физиологически активные вещества, к фокусированной библиотеке и фармацевтической композиции, включающей указанные соединения, к способам их получения и применения.
Существует большое количество физиологически активных соединений-лидеров и лекарств, молекулы которых одновременно включают пиридиновый и пиперидиновый фрагменты. Среди них значительное количество соединений являются потенциальными агонистами, антагонистами и модуляторами никотиновых рецепторов. Хотя биомишени, на которые действуют 2-гетероциклил-пиперидины, весьма разнообразны. Это рецепторы (дофаминовые, ацетилхолиновые, серотониновые и т.д.), ферменты (ротамаза, глюкозидаза, ацетилхолинэстераза и т.д.), ионные каналы (например, натриевый) и т.д.
Учитывая высокий потенциал физиологической активности замещенных пиперидинов, актуальной является разработка новых соединений этого типа и фармацевтических композиций, включающих эти соединения, способов их получения и применения.
В результате проведенных исследований, направленных на поиск новых физиологически активных веществ, соединений-лидеров, изобретатели получили неизвестные ранее азогетероциклы, включающие 3-(пиперидин-2-ил)-пиридиновый фрагмент, в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, которым свойственна физиологическая активность, разработали фармацевтическую композицию, включающую эти соединения, а также предложили способы их получения и применения.
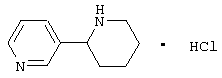
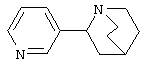
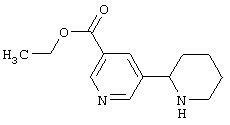
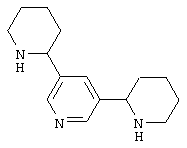
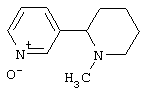
Известно, что соединения, содержащие связанные между собой пиридиновый и пиперидиновый циклы, обладают разнообразной физиологической активностью. Так, никотиновыми агонистами являются алкалоид анабазин или 2-(3-пиридинил)-пиперидин [С.Ghelardini, P.C.Lazareno, D.Wilkison, B.Collins - Pharmacol. Res., 1995, 31(Suppl.), p.51] и 2-(3-пиридил)хинуклидин [М. Bencherif, P.M. Lippiello, W.S. - Pat. Intern. WO 9607410, 1996; Drug Data Rep. 1998, 20(6), p.555], представленные ниже:
Замещенный 4-(4-пиридил)пиперидин, представленный ниже, проявляет высокую ингибирующую активность по отношению к ланостерол синтезу, что обеспечивает его антиатеросклеротическое и гипохолестеринемическое действие [AstraZeneca plc. ЕР 0966462, December 29, 1999]
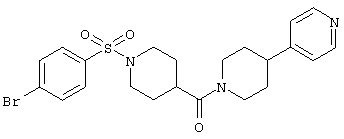
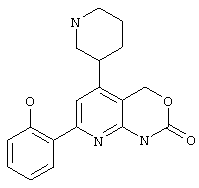
Гетероаннелированный 4-(пиперидин-3-ил)-пиридин, показанный ниже, является высокоэффективным ингибитором каппа В киназы (IKK-beta), весьма перспективным потенциальным средством для лечения широкого круга аллергических и воспалительных заболеваний [Bayer AG, US 6562811, May 13, 2003]. Спиро-производное пиперидина, представленное ниже, является эффективньм и селективньм антагонистом хемокинового МСР-1 рецептора, что позволяет рассматривать его как средство для предотвращения и лечения хронических воспалительных процессов (атеросклероз и т.д.) [Daiichi Pharmaceutical Co., Ltd. WO 0157044, August 9, 2001]
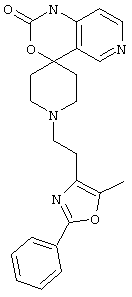
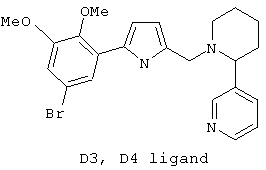
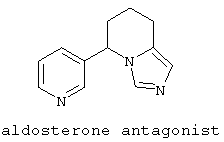
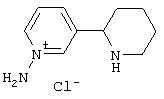
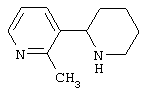
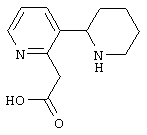
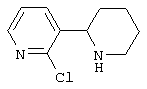
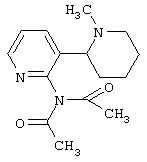
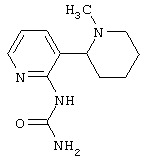
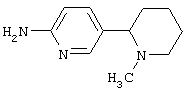
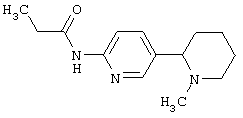
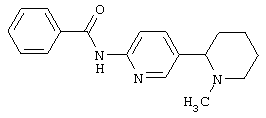
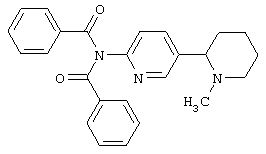
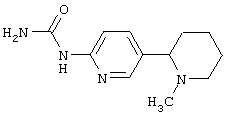
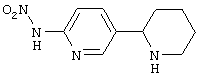
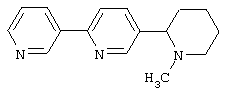
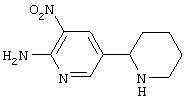
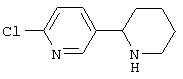
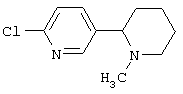
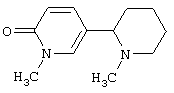
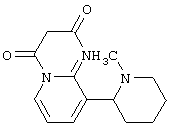
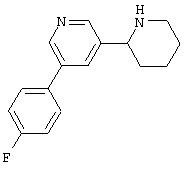
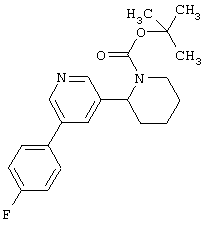
Следует отметить, что известно лишь несколько замещенных, аннелированных и гетероаннелированных 3-(пиперидин-2-ил)-пиридинов, в основном это прямые производные никотинового агониста анабазина, представленные в Таблице. Следует отметить, однако, что замещение и незначительные вариации в структуре 3-(пиперидин-2-ил)-пиридинов может привести к полной потере аффинности к никотиновому рецептору и приобретению новых фармакологических свойств. Так, вещество, полученное алкилированием пиперидинового цикла анабазина (показано ниже), проявляет свойства высокоэффективного лиганда дофаминовых рецепторов D3 и D4 [Mach R. et al. Bioorg.Med.Chem. 2003, 11(2):225-234]. Аннелированное производное анабазина является антагонистом альдостерона [Yamanouchi Phannaceutical Co., Ltd. JP 1997071586, March 18, 1997].
Известные 3-(пиперидин-2-ил)-пиридины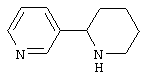
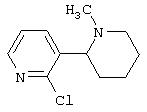
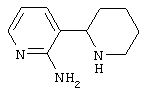
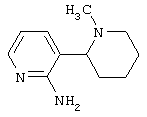
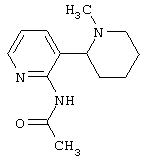








Ниже приведены определения терминов, которые использованы в описании изобретения:
«Комбинаторная библиотека» означает коллекцию соединений, полученных параллельным синтезом, предназначенную для поиска лидера или оптимизации биологической активности лид-соединения, причем каждое соединение библиотеки соответствует общему скэффолду и библиотека является коллекцией родственных гомологов или аналогов.
«Фокусированная библиотека» означает комбинаторную библиотеку или совокупность нескольких комбинаторных библиотек, или совокупность библиотек и веществ, специальным образом организованную с целью увеличения вероятности нахождения хитов и лидеров или с целью повышения эффективности их оптимизации. Дизайн фокусированных библиотек, как правило, связан с направленным поиском эффекторов (ингибиторов, активаторов, агонистов, антагонистов и т.п.) определенных биомишеней (ферментов, рецепторов, ионных каналов и т.п.).
«Лид-соединение» означает соединение с выдающейся активностью, относящейся к определенной болезни.
«Скэффолд» означает общую структурную формулу или молекулярный каркас, или инвариантную область соединений, характерную для всех соединений, входящих в комбинаторную библиотеку.
«Хемотип» означает серию соединений, объединенную общей структурной формулой и обладающую определенным общим свойством, например каким-то видом физиологичекой активности. Можно сказать, например, "новый хемотип активаторов калиевых каналов" или "известный хемотип киназных ингибиторов" и т.д. Как правило, наличие общего структурного фрагмента у соединений в рамках одного хемотипа является необходимым и достаточным условием для наличия у них общего свойства.
«Заместитель» означает химический радикал или группу, которые присоединяются к другому радикалу, группе или к скэффолду, включая, но не ограничивая атом галогена, «инертный заместитель», нитрогруппа, сульфогруппа, сульфамидная группа, гидроксильная группа, аминогруппа, карбоксиалкильная группа, алкоксикарбонильная группа, карбамоильная группа и др.
«Инертный заместитель» ("Non-interfering substituent") означает низко- или нереакционоспособный радикал, инертный к дальнейшим превращениям и к среде, включая, но не ограничивая C1-С7алкил, C2-С7алкенил, С2-С7алкинил, C1-С7алкокси, С2-C12аралкил, замещенный аралкил, С2-C12 гетероциклилалкил, замещенный гетероциклилалкил, С7-С12 алкарил, С3-С10циклоалкил, С3-С10циклоалкенил, фенил, замещенный фенил, толуил, ксиленил, бифенил, С2-С12алкоксиалкил, С2-С10алкилсульфинил, C2-С10алкилсульфонил, (CH2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, замещенный алкокси, фторалкил, арилоксиалкил, гетероциклил, замещенный гетероциклил и нитроалкил; где m и n имеют значение от 1 до 7. Предпочтительными «инертными заместителями» являются C1-С7алкил, C2-С7алкенил, С2-С7алкинил, C1-С7алкокси, С7-С12аралкил, С7-С12алкарил, С3-С10циклоалкил, С3-С10циклоалкенил, фенил, замещенный фенил, (СН2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, гетероциклил и замещенный гетероциклил.
«Электрофильный заместитель» означает химический радикал, который присоединяется к скэффолду в результате реакции с электрофильным реагентом, например, выбранным из группы органических галогенидов (необязательно замещенных C1-C7алкил галогенидов, необязательно замещенных арилС1-С7алкил галогенидов, необязательно замещенных гетероциклилС1-С7алкил галогенидов, необязательно замещенных арил галогенидов, необязательно замещенных гетероциклил галогенидов), органических кислот или их производных (ангидридов, имидазолидов, галогенангидридов), эфиров органических сульфокислот или органических сульфохлоридов, органических галогенформиатов, органических изоцианатов и органических изотиоцианатаминометилов.
«NH-Защитный заместитель» означает химический радикал, который присоединяется к скэффолду или полупродукту синтеза для временной защиты аминогруппы в мультифункциональных соединениях, включая, но не ограничивая: амидный заместитель, такой как формил, необязательно замещенный ацетил (например, трихлорацетил, трифторацетил, 3-фенилпропионил и др.), необязательно замещенный бензоил и др.; карбаматный заместитель, такой как необязательно замещенный C1-C7алкилоксикарбонил, например метилоксикарбонил, этилоксикарбонил, трет-бутилоксикарбонил, 9-флуоренилметилоксикарбонил (Fmoc) и др.; необязательно замещенный C1-C7 алкильный заместитель, например трет-бутил, бензил, 2,4-диметиксибензил, 9-фенилфлуоренил и др.; сульфонильный заместитель, например бензолсульфонил, п-толуолсульфонил и др. Более подробно «NH-Защитные заместители» описаны в книге: Protective groups in jrganic synthesis, Third Edition Greene T.W. and Wuts P.G.M. 1999, p.494-653. Издательство John Wiley & Sons, Inc., New York, Chichester, Weinheim, Brisbane, Toronto, Singapore.
«Замещенная группа, замещенный радикал или скэффолд» означают соответственно группу, радикал или скэффолд, у которых имеется заместитель, включая, но не ограничивая: инертный заместитель, атом галогена, нитрогруппа, цианогруппа, сульфогруппа, гидроксильная группа, аминогруппа, карбоксиалкильная группа, карбоксильная группа, карбамоильная группа, например, замещенный алкил означает алкил, у которого один или несколько заместителей, например гидроксиалкил или метилоксикарбонилалкил, амино-метоксикарбонил-метил, диметиламиноалкил, 2-гидрокси-2-метоксикарбонил-этил и др.; замещенная амино группа означает аминогруппу, у которой имеется один или два заместителя, например ациламиногруппа, N,N-диалкиламино группа, N-ацил-N-арил-амино группа, ацетил-метоксикарбонилметил-амино группа и др.; замещенный фенил означает фенил, у которого имеется один или несколько заместителей, например 2-метоксикарбонилфенил, 4-амино-3-метоксикарбонилфенил, 3,4-диаминофенил и др.
«Необязательно замещенная группа, необязательно замещенный радикал или скэффолд» означают соответственно группу, радикал или скэффолд, включающие группы, радикалы или скэффолды с заместителями и без заместителей. Например, понятие необязательно замещенная аминогруппа включает: незамещенную аминогруппу и аминогруппы, содержащие любые, не противоречащие химии заместители, включая, но не ограничивая ациламино группы, N,N-диалкиламино группы, N-ацил-N-арил-амино группы, ацил-метоксикарбонилметил-амино группы и др.
«Арил» означает один или более ароматических циклов, каждый из которых включает 5 или 6 атомов углерода. «Арил» может быть конденсированным полициклом, например, как нафталин, или неконденсированным, например, как бифенил. «Замещенный арил» имеет один или несколько «не мешающих» заместителей.
«Галоген» означает атом фтора, хлора, брома или йода.
«Гетероцикл» означает один или несколько насыщенных или ароматических циклов с 5, 6 или 7 атомами, по крайней мере, один из которых является гетероатомом. Преимущественными гетероатомами являются сера, кислород и азот. «Гетероцикл» может быть конденсированным полициклом, например, как бензимидазол, бензоксазол, бензтиазол, хинолин, или неконденсированным, например, как бипиридил.
«Азогетероцикл» означает гетероцикл, включающий, по крайней мере, один атом азота, например, как бензимидазол, бензоксазол, бензтиазол, хинолин.
«Замещенный гетероцикл» означает гетероцикл, имеющий один или несколько «не мешающих» заместителей.
«Конденсированная система» означает наличие системы конденсированных циклов, например, как в бензимидазоле, акридине или тетралине.
«Аннелированный цикл» или «конденсированный цикл» означает би- или полициклическую систему, в которой «конденсированный» цикл и (поли)цикл, с которым он «аннелирован», имеют как минимум два общих атома.
«Гетероаннелированный цикл» означает цикл, который прикрепляется («аннелируется» или «конденсируется») к другому (поли)циклу и содержит как минимум один гетероатом.
«Параллельный синтез» означает метод проведения химического синтеза комбинаторной библиотеки индивидуальных соединений.
Целью настоящего изобретения являются новые азогетероциклы, включающие 3-(пиперидин-2-ил)-пиридиновый фрагмент.
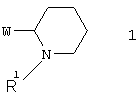
Поставленная цель достигается азогетероциклами, включающими 3-(пиперидин-2-ил)-пиридиновый фрагмент общей формулы 1
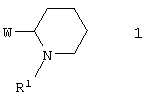
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 представляет собой атом водорода, инертный заместитель или NH-защитный заместитель, a W представляет собой необязательно замещенный азагетероциклил, такой как: пиридин-3-ил, пиразоло[1,5-а]пиридин-6-ил, 3,4-дигидро-2Н-пиридо[1,2-а]пиримидин-7-ил, 3,4-дигидро-2Н-пиридо[1,2-а]пиримидин-9-ил, имидазо[1,2-а]пиримидин-6-ил, имидазо[1,2-а]пиримидин-8-ил или [1,8]нафтиридин-3-ил, исключая 5-бром-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 5-(4-фторфенил)-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, и соединения, в которых W представляет собой незамещенный пиридин-3-ил, незамещенный пиридин-3-ил 1-оксид, алкилзамещенный пиридин-3-ил, галогензамещенный пиридин-3-ил, 2-метилпиридин-3-ил, 2-карбоксиметилпиридин-3-ил, необязательно замещенный по атому азота аминогруппы 2-аминопиридин-3-ил, 3-фторпиридин-5-ил, 5-(4-фторфенил)-пиридин-3-ил, 3-этоксикарбонилпиридин-5-ил, 3-пиперидин-2-ил-пиридин-5-ил, 2-хлорпиридин-5-ил, 2-метилпиридин-5-ил, 2-метоксипиридин-5-ил, [2,3']бипиридин-5-ил, необязательно замещенный по атому азота аминогруппы 2-аминопиридин-5-ил, 2-амино-3-нитропиридин-5-ил, 1-амино-пиридин-3-илиум, 1-метил-2-оксо-1H-пиридин-5-ил, 5-бром-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 5-(4-фторфенил)-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 7-(1-метилпиперидин-2-ил)-пиридо[1,2-а]пиримидин-2,4-дион, 9-(1 -метилпиперидин-2-ил)-пиридо[1,2-а]пиримидин-2,4-дион.
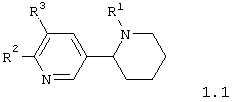
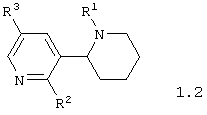
Среди соединений общей формулы 1, составляющих один из объектов настоящего изобретения, предпочтительными являются 1,2,3,4,5,6-гексагидро-[2,3']бипиридинилы общей формулы 1.1 или 1.2
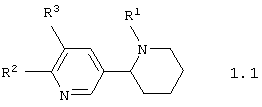
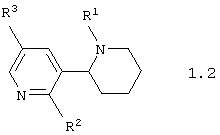
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 имеет вышеуказанное значение, R2 представляет атом водорода, атом галогена, необязательно замещенную гидроксилиную группу, необязательно замещенную меркапто группу или необязательно замещенную аминогруппу, а R3 представляет атом галогена, формильную группу, карбоксильную группу, необязательно замещенную алкилоксикарбонильную группу, необязательно замещенную аминокарбонильную группу, необязательно замещенную аминометильную группу, необязательно замещенный фенил, необязательно замещенный арил или необязательно замещенный гетероциклил.
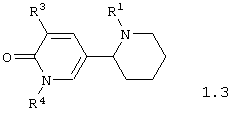
Среди соединений общей формулы 1, составляющих один из объектов настоящего изобретения, предпочтительными являются 1,2,3,4,5,6-1'Н-гексагидро-[2,3'] бипиридинилоны общей формулы 1.3 и 1.4
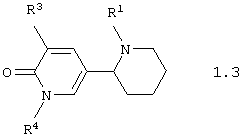
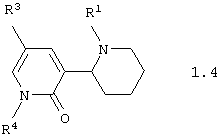
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 и R3 имеют вышеуказанное значение, a R4 представляет атом водорода, инертный заместитель или электрофильный заместитель.
Среди соединений общей формулы 1, составляющих один из объектов настоящего изобретения, предпочтительными являются пиперидин-2-ил-пиразоло[1,5-а]пиридины общей формулы 1.5 и 1.6
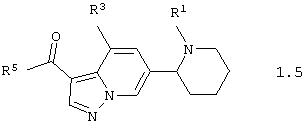
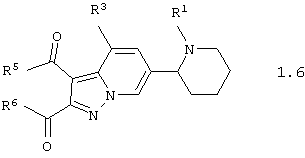
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 и R3 имеют вышеуказанное значение, а R5 и R6 независимо друг от друга представляют необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, или R5 и R6 вместе с карбонильными группами, к которым они присоединены, и вместе с атомами углерода, к которым присоединены карбонильные группы, образуют необязательно замещенный по атому азота пирролидин-2,5-дион.
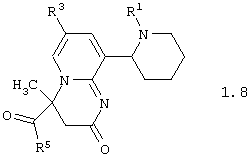
Среди соединений общей формулы 1, составляющих один из объектов настоящего изобретения, предпочтительными являются пиперидин-2-ил-пиридо[1,2-а]пиримидины общей формулы 1.7 и 1.8
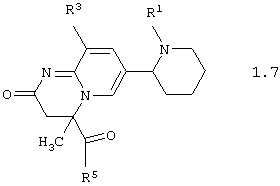
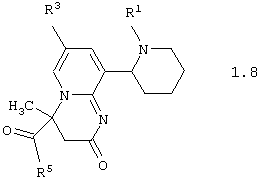
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1, R3 и R5 имеют вышеуказанное значение.
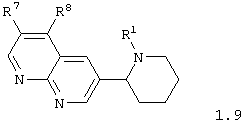
Среди соединений общей формулы 1, составляющих один из объектов настоящего изобретения, предпочтительными являются 3-пиперидин-2-ил-[1,8]нафтиридины общей формулы 1.9
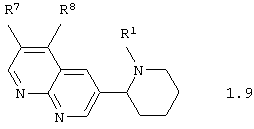
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 имеет вышеуказанное значение, а R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклический или ароматический цикл.
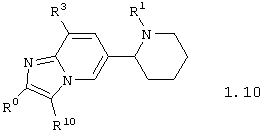
Среди соединений общей формулы 1, составляющих один из объектов настоящего изобретения, предпочтительными являются пиперидин-2-ил-имидазо[1,2-а]пиридины общей формулы 1.10 и 1.11
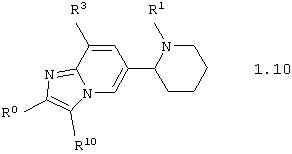
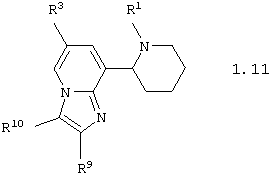
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 и R3 имеют вышеуказанное значение, а R9 и R10 независимо друг от друга представляют атом водорода, инертный заместитель, необязательно замещенный фенил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенную карбоксильную группу, необязательно замещенную карбамоильную группу или необязательно замещенную аминогруппу.
Целью настоящего изобретения являются фокусированная библиотека для поиска биологически активных соединений-лидеров.
Поставленная цель достигается фокусированной библиотекой, включающей, по крайней мере, один азогетероцикл общей формулы 1 или их фармацевтически приемлемую соль, N-оксид или гидрат, исключая 5-бром-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 5-(4-фторфенил)-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин и соединения, в которых W представляет собой незамещенный пиридин-3-ил, незамещенный пиридин-3-ил 1-оксид, алкил замещенный пиридин-3-ил, галоген замещенный пиридин-3-ил, 2-метилпиридин-3-ил, 2-карбоксиметилпиридин-3-ил, необязательно замещенный по атому азота аминогруппы 2-аминопиридин-3-ил, 3-фторпиридин-5-ил, 5-(4-фторфенил)-пиридин-3-ил, 3-этоксикарбонилпиридин-5-ил, 3-пиперидин-2-ил-пиридин-5-ил, 2-хлорпиридин-5-ил, 2-метилпиридин-5-ил, 2-метоксипиридин-5-ил, [2,3']бипиридин-5-ил, необязательно замещенный по атому азота аминогруппы 2-аминопиридин-5-ил, 2-амино-3-нитропиридин-5-ил, 1-амино-пиридин-3-илиум, 1-метил-2-оксо-1H-пиридин-5-ил, 5-бром-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 5-(4-фторфенил)-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 7-(1-метилпиперидин-2-ил)-пиридо [1,2-а]пиримидин-2,4-дион, 9-(1-метилпиперидин-2-ил)-пиридо[1,2-а]пиримидин-2,4-дион.
Целью настоящего изобретения являются новая фармацевтическая композиция в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку.
Поставленная цель достигается фармацевтической композицией, обладающей активностью в отношении действия никотинового рецептора, включающей, по крайней мере, один азогетероцикл общей формулы 1 или их фармацевтически приемлемую соль, N-оксид или гидрат, исключая 5-бром-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 5-(4-фторфенил)-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин и соединения, в которых W представляет собой незамещенный пиридин-3-ил, незамещенный пиридин-3-ил 1-оксид, алкил замещенный пиридин-3-ил, галоген замещенный пиридин-3-ил, 2-метилпиридин-3-ил, 2-карбоксиметилпиридин-3-ил, необязательно замещенный по атому азота аминогруппы 2-аминопиридин-3-ил, 3-фторпиридин-5-ил, 5-(4-фторфенил)-пиридин-3-ил, 3-этоксикарбонилпиридин-5-ил, 3-пиперидин-2-ил-пиридин-5-ил, 2-хлорпиридин-5-ил, 2-метилпиридин-5-ил, 2-метоксипиридин-5-ил, [2,3']бипиридин-5-ил, необязательно замещенный по атому азота аминогруппы 2-аминопиридин-5-ил, 2-амино-3-нитропиридин-5-ил, 1-амино-пиридин-3-илиум, 1-метил-2-оксо-1H-пиридин-5-ил, 5-бром-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 5-(4-фторфенил)-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 7-(1-метилпиперидин-2-ил)-пиридо[1,2-а]пиримидин-2,4-дион, 9-(1-метилпиперидин-2-ил)-пиридо[1,2-а]пиримидин-2,4-дион.
Биологическую активность синтезированных соединений определяли на клетках рабдомиосакомы, в которых никотиновый рецептор контролирует натриевую проницаемость и, как результат, клеточный трансмембранный электрический потенциал, который, в свою очередь, измерялся с помощью пары анионных флуоресцентных зондов (DiBAC4(5) и DiBAC4(3)) по изменению ФРЕТ при клеточной деполяризации как описано в [Okun I., Okun A., Kaler G. Pat. US 6287758, 2001]. Измерения ФРЕТ производились с помощью флуоресцентного параллельного считывателя VICTOR2V (PerkinElmer, USA) путем возбуждения флуоресцентного донора (DiBAC4(3)) светом с длиной волны 485 nm и измеряя интенсивность флуоресценции акцептора (DiBAC4(5)) при длине волны 615 nm. При деполяризации клеточной мембраны в результате активации никотинового рецептора эффективность ФРЕТ возрастает, что проявляется в увеличении интенсивности флуоресценции акцептора.
Ниже изобретение описывается с помощью примеров получения конкретных соединений и фокусированной библиотеки. Структуры полученных соединений подтверждались данными хроматографического и спектрального анализа.
Приведенные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
1-Метил-1,2,3,4,5,6-гексагидро[2,3']бипиридинил-6'-иламин 2.1: белые кристаллы с т.пл. 96-97°С; 1Н ЯМР (ДМСО-D6): 1.25 (м, 1Н), 1.45 (д, 1Н), 1.53 (м, 1Н), 1.63 (м, 1Н), 1.7 (м, 1Н), 1.78 (м, 1Н), 1.97 (с, 3Н), 2.0 (м, 1Н), 2.82 (д, 1Н), 2.95 (д, 1Н), 6.15 (ушир с, 2Н), 6.45 (дд, 1Н), 7.23 (д, 1Н), 7.8 (д, 1Н) и 1-метил-1,2,3,4,5,6-гексагидро[2,3']бипиридинил-2'-иламин 2.2: белые кристаллы, т.пл. 92-94°С; 1Н ЯМР (ДМСО-D6): 1.25 -1.75 (м, 6Н), 1.85 (с, 3Н), 2.0 (тд, 1Н), 2.57 (дд, 1Н), 2.9 (д, 1Н), 5.7 (ушир с, 2Н), 6.4 (д, 1Н), 7.27 (дд, 1Н), 7.75 (д, 1Н) получены, как описано в [Садыков, А. С.. Химия алкалоидов Anabasis Aphylla. Изд-во АН УзССР, Ташкент -1956, 94-95].
Пример 1. 5'-Бром-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламин 1.1.1(1). Растворяют 5 ммоль 1-метил-1,2,3,4,5,6-гексагидро[2,3']бипиридинил-6'-иламина 2. в 10 мл 10% H2SO4 и 0.5 мл концентрированной HCl. К этому раствору медленно при перемешивании прибавляют 5 ммоль брома. После того как была прибавлена половина брома, начиналось выпадение осадка, который медленно растворялся при нагревании до 50°С. Полученный раствор перемешивают при 50°С 1 час, охлаждают и выдерживают при 0°С 24 часа. Затем реакционную массу выливают в водный раствор NaOH. Осадок отделяют и перекристаллизовывают из ацетонитрила. Получают 1.1.1(1), с выходом 75%, 1Н ЯМР (DMSO-d6): 1.25 (м, 1Н), 1.33 (м, 1Н), 1.5-1.65 (м, 3Н), 1.72 (д, 1Н), 1.9 (с, 3Н), 2.0 (т, 1Н), 2.65 (д, 1Н), 2.92 (д, 1Н), 6.0 (с, 2Н), 7.6 (с, 1Н), 7.8 (с, 1Н). MS (70eV): M+ 269, 271.
Пример 2. 5'-Бром-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-2' -иламин 1.2.1(1). К раствору 5 ммоль 1-метил-1,2,3,4,5,6-гексагидро[2,3']бипиридинил-2'-иламина 2.2 в 15 мл уксусной кислоты медленно прибавляли бром (5.2 ммоль) при комнатной температуре. Затем красный раствор нагревают до 50°С и перемешивают до появления желтой окраски (около 1 часа). Реакционную массу выливают в водный раствор NaOH, выпавший осадок отфильтровывают и перекристаллизовывают из ацетонитрила. Получают 1.2.1(1), с выходом 70%, 1Н ЯМР (DMSO-d6): 1.25 (м, 1Н), 1.5-1.75 (м, 5Н), 2.0 (м+с, 4Н), 2.8-3.0 (м, 2Н), 6.5 (с, 2Н), 7.4 (с, 1Н), 7.9 (с, 1Н). MS (70eV): M+ 269, 271.
Пример 3. 5'-Бром-2-хлор-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил 1.2.2(1). К раствору 1 ммоль 5'-бром-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламина 1.1.1(1) в 10 мл HCl, охлажденному до -5°С, прикапывают раствор NaNO2 (1.2 ммоль) в 0.5 мл воды. Затем перемешивают при -5°С (1.5 часа), выливают реакционную массу в водный раствор Na2СО3, экстрагируют этилацетатом, экстракт сушат над Na2SO4 и концентрируют. Остаток экстрагируют горячим гексаном. Гексановый экстракт концентрируют, получают 1.2.2(1), с выходом 90%, 1Н ЯМР (DMSO-d6): 1.3 (м, 2Н), 1.5-1.75 (м, 4Н), 2.0 (с, 3Н), 2.1 (т, 1Н), 3.0 (д, 1Н), 3.25 (д, 1Н), 8.1 (с, 1Н), 8.45 (с, 1Н).
Пример 4. 5'-Бром-2-фтор-1 -метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил 1.2.3(1). К раствору 10 ммоль 5'-бром-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламина 1.1.1(1) в 20 мл 65% HF в пиридине при -10°С медленно прибавляют твердый NaNO2 (15 ммоль) в течение 1 часа. После перемешивания в течение 3 часов при -10°С реакционную массу выливают в холодный 20% водный раствор КОН (300 мл), экстрагируют этилацетатом, экстракт сушат над Na2SO4 и упаривают. Продукт подвергают флэш-хроматографии. Получают 1.2.3(1), с выходом 75%, 1Н ЯМР (DMSO-d6): 1.3 (м, 2Н), 1.4 (м, 1Н), 1.5-1.75 (м, 4Н), 2.0 (с, 3Н), 2.1 (т, 1Н), 2.95 (д, 1Н), 3.07 (д, 1Н), 8.1 (д, 1Н), 8.27 (с, 1Н). 19F ЯМР (CFCl3): -77.62 (s).
Пример 5. 1-Метил-5'-(2-тиенил)-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-2'-иламин 1.1.4(1). Прибавляют 1 ммоль 5'-Бром-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-2'-иламина 1.2.1(1) в 2 мл ТГФ к смеси из 1.5 ммоль тиофен-2-бороновой кислоты 3.3(1) 3 ммоль Na2СО3 и 50 мг PdCl2(PPh3)2 в 2 мл воды. Полученную смесь нагревают 10 мин при 130°С в микроволновой печи. После щелочной обработки и экстракции твердый продукт очищают флэш-хроматографией. Получают 1.1.4(1) с выходом 80%. 1Н ЯМР(DMSO-d6): 1.35 (м, 1Н), 1.5-1.6 (м, 2Н), 1.67 (м, 1Н), 1.8 (м, 2Н), 2.05 (м+с, 4Н), 2.95 (м, 2Н) 6.4 (ушир с, 2Н), 7.1 (т, 1Н), 7.25 (д, 1Н), 7.4 (д,1Н), 7.5 (с, 1Н), 8.15 (с, 1Н).
Пример 6. 1-Метил-5'-формил-2-фтор-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил 1.1.5(1). К раствору 5 ммоль 5'-бром-2-фтор-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинила 1.2.3(1) в абсолютном ТГФ (50 мл) прикалывают при -80°С под аргоном 6 ммоль бутиллития (1.6 М в гексане). Реакционную массу перемешивают при -80°С 30 мин и затем сразу приливают 20 ммоль ДМФА. Реакционной смеси дают нагреться до комнатной температуры, затем приливают 50 мл воды, органический слой отделяют, а водный слой экстрагируют этилацетатом. Органические экстракты объединяют, сушат над Na2SO4, концентрируют и продукт очищают колоночной хроматографией. Получают 1.1.5(1), с выходом 85%, 1Н ЯМР (DMSO-d6): 1.3-1.45 (м, 2Н), 1.5-1.8 (м, 4Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.95 (д, 1Н), 3.15 (д, 1Н), 8.4 (д, 1Н), 8.7 (с, 1Н), 10.1 (с, 1Н).
Пример 7. 1-Метил-5'-(3-фенилпропиламино)метил-2-фтор-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил 1.1.7(1). Перемешивают 12 часов 1 ммоль 1-метил-5'-формил-2-фтор -1,2,3,4,5,6-гексагидро-[2,3']бипиридинила 1.1.5(1), 3 ммоль 3-фенилпропиламина и 3 ммоль боргидрида натрия в 20 мл метанола. Затем прибавляют 20 мл 10% HCl, смесь перемешивают 10 мин, подщелачивают Na2CO3 и экстрагируют этилацетатом. Продукт очищают колоночной хроматографией. Получают 1.1.7(1), с выходом 60%, 1Н ЯМР (DMSO-d6): 1.3 (м, 2Н), 1.4 (м, 1Н), 1.5-1.75 (м, 4Н), 2.0 (с, 3Н), 2.1 (т, 1Н), 2.45-2.6 (м, 6Н), 2.95 (д, 1Н), 3.07 (д, 1Н), 7.1-7.25 (м, 5Н), 7.9 (д, 1Н), 8.0 (с, 1Н).
Пример 8. 1-(1-Метил-2-фтор-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-5'-илметил)-3-(4-фторфенил)-1-(3-фенилпропил)-мочевина 1.1.7(2). Нагревают в микроволновой печи при 160°С 10 мин 0.3 ммоль 1-метил-5'-(3-фенилпропиламино) метил-2-фтор-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил 1.1.7(1) и 0.4 ммоль 4-фторфенилизоцианата в 3 мл абсолютного этанола. Реакционную массу упаривают и получают количественно 1.1.7(2), LC-MS: 479 (М+1).
Пример 9. 5'-Бром-1-метил-1,2,3,4,5,6-гексагидро-1'H-[2,3']бипиридинил-2'-он 1.4.1(1). К раствору 1 ммоль 5'-бром-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламина 1.1.1(1) в 10 мл 10% H2SO4, охлажденному до -5°С, прикапывают раствор NaNO2 (1.2 ммоль) в 0.5 мл воды. Затем перемешивают при -5°С (1.5 часа), выливают реакционную массу в водный раствор Na2СО3, выпавший кристаллический продукт отфильтровывают. Получают 1.4.1(1), с выходом 65%, 1Н ЯМР (DMSO-d6): 1.1-1.3 (м, 2Н), 1.5-1.75 (м, 4Н), 2.0 (с, 3Н), 2.1 (т, 1Н), 2.9 (д, 1Н), 3.2 (д, 1Н), 7.4 (с, 1Н), 7.55 (с, 1Н), MS (70eV): M+ 270, 272.
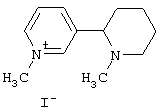
Пример 10. 6-(1-Бензоилпиперидин-2-ил)-пиразоло[1,5-а]пиридин-3-карбоновой кислоты этиловый эфир 1.5.1(1). Растворяют в 20 мл воды 10 ммоль 97% гидроксиламино-O-сульфокислоты, 10 ммоль 1-бензоил-1,2,3,4,5,6-гексагидро-1'H-[2,3']бипиридинила и 10 ммоль NaOH. Полученную смесь перемешивают 1 час при 70-90°С, охлаждают до комнатной температуры, прибавляют 10 ммоль NaHCO3 и экстрагируют этилацетатом (3×10 мл). Затем водную фазу насыщают Na2SO4 и еще раз экстрагируют этилацетатом. Водную фазу упаривают в вакууме при 30°С. К остатку прибавляют 6 мл абсолютного этанола, неорганический осадок отфильтровывают, фильтрат охлаждают до -20°С и прибавляют 47% HI (0.72 мл, 4 ммоль). Полученную смесь перемешивают при -20°С 30 мин, осадок отфильтровывают и промывают 2 мл холодного абсолютного этанола. Получают 1'-амино-1-бензоил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-1'-иум иодид 2.3(1), с выходом 40%, LC-MS 282 (М-128). Продукт хранят при низкой температуре. К суспензии из 10 ммоль соединения 2.3(1) и 15 ммоль К2СО3 в 50 мл сухого ДМФА медленно прибавляют 11 ммоль этилпропиолата 4.1, смесь перемешивают 3 часа при комнатной температуре при пропускании воздуха. Реакционную массу выливают в 200 мл воды, экстрагировали этилацетатом (3×50 мл), летучие вещества удаляют в вакууме, а маслянистый коричневый остаток очищают колоночной хроматографией. Получают 1.5.1(1), с выходом 25%, 1Н ЯМР (DMSO-d6): 1.35 (т, 3Н), 1.55 (м, 3Н), 1.7 (м, 1Н), 1.95 (м, 1Н), 2.5 (м, 1Н), 2.85 (м, 1Н), 3.5-3.9 (ушир с, 1Н), 4.3 (к, 2Н), 5.5-5.9 (уширенный, 1Н), 7.45 (м, 5Н), 7.6 (д, 1Н), 8.1 (д, 1Н), 8.45 (с, 1Н), 8.75 (с, 1Н).
Пример 11. 6-(1-Бензоилпиперидин-2-ил)-пиразоло[1,5-а]пиридин-2,3-дикарбоновой кислоты диметиловый эфир 1.6.1(1). К суспензии из 10 ммоль соединения (2.3) и 15 ммоль К2СО3 в 50 мл сухого DMF медленно прибавляют 11 ммоль диметилацетилендикарбоксилата 4.2. Смесь перемешивают 7 часов при комнатной температуре до прекращения выделения пузырьков воздуха. Затем ее выливают в 200 мл воды, экстрагируют этилацетатом (3×50 мл), летучие продукты удаляют в вакууме, а маслянистый коричневый остаток очищают колоночной хроматографией. Получают 1.6.1(1), с выходом 25%, 1Н ЯМР (DMSO-d6): 1.55 (м, 3Н), 1.7 (м, 1Н), 1.95 (м, 1Н), 2.5 (м, 1Н), 2.85 (м, 1Н), 3.5-3.9 (ушир с, 1Н), 3.85 (с, 3Н), 3.95 (с, 3Н), 5.6-5.9 (ушир с, 1Н), 7.45 (м, 5Н), 7.65 (д, 1Н), 8.1 (д, 1Н), 8.75 (с, 1Н).
Пример 12. 6-Метил-2-оксо-8-(1-метил-2-пиперидинил)пиридо[1,2-а]пиримидин-6-карбоновая кислота 1.7(1). К раствору 2 ммоль соединения 1.1 (R1=СН3, R2=H) в сухом этилацетате медленно прикапывают 2.5 ммоль цитраконового ангидрида 4.3 в течение 2-х часов при комнатной температуре. Реакционная масса краснеет и выпадает темный смолистый осадок. Реакционную массу перемешивают при комнатной температуре 48 часов, затем концентрируют в вакууме и разделяют на препаративном хроматографе (H2O-MeOH-AcOH), выделяют две диастереомерные фракции соединения 1.7(1) в соотношении 1:1 (общий выход 40%) с почти идентичными спектрами ЯМР. 1Н ЯМР (DMSO-d6): 1.3-1.6 (м, 5Н), 1.4 (с, 3Н), 1.8 (д, 1Н), 1.9 (с, 3Н), 2.1 (т, 1Н), 2.75 (д, 1Н). 2.8 (д, 1Н), 2.9 (д, 1Н), 3.15 (д, 1Н), 7.0 (д, 1Н), 7.75 (д, 1Н), 8.2 (с, 1Н).
Пример 13. 2-(1-Метил-пиперидин-2-ил)-бензо[с]-[1,8]нафтиридин 1.9(1). К раствору 3 ммоль Na2CO3 и 50 мг PdCl2(PPh3)2 в 2 мл воды прибавляют 1.5 ммоль 2-формилфенилборной кислоты 4.4(1), а затем прибавляют 1 ммоль 5'-бром-1-метил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламин 1.1.1(1) в 2 мл ТГФ. Реакционную массу нагревают 10 мин при перемешивании в микроволновой печи при 130°С. Раствор выливают в водный раствор Na2СО3, экстрагируют этилацетатом и подвергают флэш-хроматографии. Получают 1.9(1): 1Н ЯМР (DMSO-d6): 1.4 (м, 1Н), 1.5-1.9 (м, 5Н), 2.0 (с, 3Н), 2.0 (т, 1Н), 3.0 (д, 1Н), 3.2 (д, 1H), 7.85 (т, 1Н), 8.0 (т, 1H), 8.3 (д, 1Н), 8.9 (д, 1Н), 9.0 (с, 1Н), 9.1 (с, 1Н), 9.5 (с, 1Н). LCMS: 278 (М+1).
Пример 14. 4-(4-Бромфенил)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.1(1). К раствору 1 ммоля соединения 1.1 (R1=СН3, R2=H) в 10 мл абсолютного этанола прибавляют 1.1 ммоля 4-бромфенацилбромида 4.5(1) и кипятят полученную смесь при перемешивании 1 час. После охлаждения реакционную массу выливают в водный раствор NaHCO3 (100 мл) и экстрагируют дважды 30 мл этилацетата. Экстракт сушат над Na2SO4 и упаривают. Остаток перекристаллизовывают из этилацетата. Получают 1.10.1(1), выход 80%, 1H ЯМР (ДМСО-d6): 1.3 (м, 1Н), 1.5-1.7 (м, 4Н), 1.75 (д, 1Н), 1.97 (с, 3Н), 2.1 (т, 1Н), 2.82 (д, 1Н), 2.95 (д, 1Н), 7.25 (д, 1Н), 7.5 (д, 1Н), 7.6 (д, 2Н), 7.9 (д, 2Н), 8.33 (с, 1Н), 8.4 (с, 1Н). MS (70 eV) M+ 369, 371.
Пример 15. 7-(1-Метил-2-пиперидинил)имидазо[1,2-а]пиридин-4-карбоновой кислоты гидробромид 1.10.1(2). К раствору 10 ммоль соединения 1.1 (R1=CH3, R2=H) в 100 мл абсолютного этанола прибавляют 11 ммоль бромпировиноградной кислоты 4.5(2) и полученную смесь кипятят 3 часа. После охлаждения образовавшийся осадок отфильтровывают и промывают этанолом. Получают 1.10.1(2), с выходом 70%, 1Н ЯМР(D2O): 1.9 (м, 1Н), 2.15 (к, 1Н), 2.25 (м, 2Н), 2.4 (м, 2Н), 2.85 (с, 3Н), 3.45 (т, 1Н), 3.9 (д, 1Н), 4.6 (д, 1Н), 8.15 (АВ, 2Н), 8.5 (с, 1Н), 9.0 (с, 1Н).
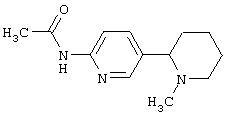
Пример 16. Общая методика получения амидов 7-(1-метил-2-пиперидинил) имидазо[1,2-а]пиридин-4-карбоновой кислоты 1.10.1(3-5). Растворяют 1 ммоль гидробромида 7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-4-карбоновой кислоты 1.10.1(2), 1.1 ммоль POCl3 и 1.5 ммоль соответствующего амина 3.8 в 2 мл сухого придина и нагревают полученную смесь 15 мин в микроволновой печи при 160°С. Реакционную массу охлаждают, выливают в раствор NaHCO3, экстрагируют этилацетатом или хлористым метиленом, сушат экстракт над Na2SO4 и, если необходимо, подвергают флэш-хроматографии, или перекристаллизовывают из подходящего растворителя. Получают 1.10.1(3-5), выход 30-80%, N-пропил-7-(1-метил-2-пиперидинил)-имидазо[1,2-а]пиридин-4-карбоксамид 1.10.1(3): 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.35 (м, 1Н), 1.45-1.65 (м, 6Н), 1.75 (д, 1Н), 1.95 (с, 3Н), 2.07 (т, 1Н), 2.8 (д, 1Н), 3.0 (д, 1Н), 3.25 (к, 2Н), 7.3 (д, 1Н), 7.55 (д, 1Н), 8.2 (ушир с, 1Н), 8.27 (с, 1Н), 8.5 (с, 1Н); N-(4-бромфенил)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-4-карбоксамид 1.10.1(4): 1Н ЯМР (DMSO-d6): 1.35 (м, 1Н), 1.45-1.65 (м, 6Н), 1.75 (д, 1Н), 1.95 (с, ЗН), 2.07 (т, 1Н), 2.8 (д, 1Н), 3.0 (д, 1Н), 7.3 (д, 1H), 7.5 (д, 2Н), 7.6 (д, 1H), 7.9 (д, 2Н), 8.45 (с, 1H), 8.55 (с, 1Н), 10.3 (ушир с, 1Н); Н-(4-метоксибензил)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-4-карбоксамид 1.10.1(5): 1Н ЯМР (DMSO-d6): 1.35 (м, 1Н), 1.45-1.65 (м, 6Н), 1.75 (д, 1Н), 1.95 (с, 3Н), 2.07 (т, 1Н), 2.8 (д, 1H), 2.95 (д, 1H), 3.22 (с, 3Н), 4.4 (д, 2Н), 6.85 (д, 2Н), 7.25 (д, 2Н), 7.3 (д, 1Н), 7.5 (д, 1H), 8.3 (с, 1Н), 8.5 (с, 1Н), 8.7 (ушир с, 1Н).
Пример 17. Общий способ получения 6-(1-метилпиперидин-2-ил)-имидазо[1,2-а]пиридин-3-иламинов 1.10.2(1-13). Смешивают 1 ммоль соединения 2.1, 1.1 ммоль альдегида 3.9 и 1.1 ммоль изонитрила 3.10 в 5-10 мл метанола. К реакционной смеси прибавляют 4 ммоль уксусной кислоты и выдерживают при комнатной температуре 72 часа. Реакционную смесь выливают в водный раствор NaHCO3, продукт отфильтровывают или экстрагируют этилацетатом, а затем перекристаллизовывают из смеси гексан/этилацетат или этанола. В некоторых случаях используют флэш-хроматографию. Получают 1.10.2(1-13): 4-(3,4,5-триметоксифенил)-5-циклоаоктиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(1): 1Н ЯМР (DMSO-d6): 1.25-1.7 (м, 21Н), 1.8 (д, 1Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.85 (д, 1Н), 3.0 (д, 1Н), 3.7 (с, 3Н), 3.85 (с, 6Н), 4.65 (с, 1Н), 7.15 (д, 1Н), 7.4 (д, 1Н), 7.5 (с, 2Н), 8.4 (с, 1Н); 4-(4-метокскарбонилифенил)-5-(1-адамантиламино)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(2): 1Н ЯМР (DMSO-d6): 1.3-1.75 (м, 18Н), 1.87 (с, 3Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.85 (д, 1Н), 2.95 (д, 1Н), 3.7 (с, 3Н), 4.4 (с, 1Н), 7.2 (д, 1Н), 7.4 (д, 1Н), 7.95 (д, 2Н), 8.3 (с, 1Н), 8.4 (д, 2Н); 4-(4-ацетамидофенил)-5-циклооктиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(3): 1Н ЯМР (DMSO-d6): 1.2-1.7 (м, 20Н), 1,77 (д, 1Н), 1.95 (с, 3Н), 2.05 (с+м, 4Н), 2.8 (д, 1Н), 2.95 (д, 1Н), 3.15 (м, 1Н), 4.6 (с, 1Н), 7.15 (д, 1Н), 7.4 (д, 1Н), 7.6 (д, 2Н), 8.05 (д, 2Н), 8.15 (с, 1Н), 9.9 (с, 1Н); 4-(4-гидрокси-3,5-ди-трет-бутилфенил)-5-циклооктиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(4): 1Н ЯМР (DMSO-d6): 1.2-1.7 (м, 33Н), 1,77 (д, 1H), 1.95 (с, 3Н), 2.05 (м, 1Н), 2.8 (д, 1Н), 2.95 (д, 1Н), 3.15 (м, 1Н), 4.4 (с, 1Н), 6.85 (с, 1Н), 7.1 (д, 1Н), 7.4 (д, 1Н), 7.9 (с, 2Н), 8.15 (с, 1Н). MS (70eV) M+ 544; 4-(4-гидроксифенил)-5-циклооктиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(5): 1H ЯМР (DMSO-d6): 1.2-1.7 (м, 19Н), 1,77 (д, 1Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.8 (д, 1Н), 2.95 (д, 1Н), 3.15 (м, 1Н), 4.5 (с, 1Н), 6.8 (д, 2Н), 7.1 (д, 1Н), 7.35 (д, 1Н), 7.95 (д, 2Н), 8.1 (с, 1Н), 9.3 (с, 1Н). MS (70eV) M+ 432; 4-(3,4-дигидроксифенил)-5-циклооктиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(6): 1H ЯМР (DMSO-d6): 1.2-1.7 (м, 19Н), 1,75 (д, 1Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.8 (д, 1Н), 2.95 (д, 1Н), 3.15 (м, 1Н), 4.4 (с, 1Н), 6.5 (д, 1Н), 7.1 (д, 1Н), 7.35 (д, 1Н), 7.45 (д, 1Н), 7.6 (с, 1Н), 8.1 (с, 1Н), 8.7 (уширенный с, 2Н). MS (70eV) M+ 448; 4-(4-гидрокси-3,5-ди-трнт-бутилфенил)-5-(1-адамантиламино)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(7); 1Н ЯМР (DMSO-d6): 1.2-1.7 (м, 35Н), 1,77 (д, 1Н), 1.8 (с, 3Н), 1.95 (с, 3Н), 2.05 (м, 1Н), 2.8 (д, 1Н), 2.95 (д, 1Н), 4.3 (с, 1Н), 6.8 (с, 1Н), 7.1 (д, 1Н), 7.4 (д, 1Н), 8.1 (с, 2Н), 8.25 (с, 1Н). MS (70eV) M+ 568; 4-(4-гидроксифенил)-5-(1-адамантиламино)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(8): 1НЯМР (DMSO-d6): 1.2-1.7 (м, 17Н), 1,77 (д, 1Н), 1.85 (с, 3Н), 1.95 (с, 3Н), 2.08 (т, 1Н), 2.82 (д, 1Н), 2.95 (д, 1Н), 4.4 (с, 1Н), 6.75 (д, 2Н), 7.1 (д, 1Н), 7.32 (д, 1Н), 8.0 (д, 2Н), 8.25 (с, 1Н), 9.3 (с, 1Н). MS (70eV) М+ 456; 4-(3,4-дигидрогсифенил)-5-(1-адамантиламино)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(9): 1Н ЯМР (DMSO-d6): 1.2-1.7 (м, 17Н), 1,77 (д, 1Н), 1.9 (с, 3Н), 1.98 (с, 3Н), 2.08 (т, 1Н), 2.82 (д, 1Н), 2.95 (д. 1Н), 4.3 (с, 1Н), 6.7 (д, 1Н), 7.1 (д, 1Н), 7.35 (д, 1Н), 7.45 (д, 1Н), 7.6 (с, 1Н), 8.25 (с, 1Н), 8.7 (уширенный с, 2Н). MS (70eV) М+ 472; 4-(N-этилкарбазолил-3)-5-циклооктиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(10): 1Н ЯМР (DMSO-d6): 1.2-1.7 (м, 22Н), 1,77 (д, 1Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.8 (д, 1Н), 2.95 (д, 1Н), 3.2 (м, 1Н), 4.45 (к, 2Н), 4.6 (д, 1Н), 7.15 (д, 1Н), 7.2 (т, 1Н), 7.45 (м, 2Н), 7.6 (м, 2Н), 8.15 (д, 1Н), 8.2 (с, 1Н), 8.33 (д, 1Н), 8.9 (с, 1Н). MS (70eV) M+ 533; 4-(4-цианофенил)-5-пропиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(11): 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.3 (м, 1Н), 1.5-1.7 (м, 6Н), 1,77 (д, 1Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.8-3.0 (м, 4Н), 4.95 (т, 1Н), 7.2 (д, 1Н), 7.45 (д, 1Н), 7.85 (д, 2Н), 8.2 (с, 1Н), 8.3 (д, 2Н); 4-изопропил-5-пропиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(12): 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.2 (д, 6Н), 1.3-1.7 (м, 7Н), 1,77 (д, 1Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.8-3.0 (м, 4Н), 3.15 (м, 1Н), 4.45 (т, 1Н), 7.05 (д, 1Н), 7.3 (д, 1Н), 8.0 (с, 1Н); 4-(4-толил)-5-пропиламино-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин 1.10.2(13): 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.3 (м, 1Н), 1.5-1.7 (м, 6Н), 1,75 (д, 1Н), 1.95 (с, 3Н), 2.1 (т, 1Н), 2.32 (с, 3Н), 2.8-2.9 (м, 3Н), 2.96 (д, 1Н), 4.7 (т, 1Н), 7.15 (д, 1Н), 7.25 (д, 2Н), 7.4 (д, 1Н), 8.0 (д, 2Н), 8.15 (с, 1Н).
Пример 18. Общий способ получения N-[6-(1-метилпиперидин-2-ил)-имидазо [1,2-а]пиридин-3-ил]-ацетамидов и их аналогов 1.10.2(14-18). Нагревают 0.5 ммоль амина 1.10.2(1-13) и 1 ммоль соответствующего хлорангидрида, ангидрида, изоцианата или изотиоцианата в 2.5 мл сухого диоксана или ТГФ 10 мин в микроволновой печи при 170°С. Реакционную массу выливают в водный раствор NaHCO3, экстрагируют несколько раз этилацетатом и подвергают флэш-хроматографии. Получают 1.10.2(14-18), с выходом 60-80%: N-трифторацетил-N-пропил-4-(4-толил)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-5-амин 1.10.2(14): 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.3-1.7 (м, 7Н), 1,75 (д, 1Н), 1.95 (2с, 3Н), 2.1 (м, 1Н), 2.32 (с, 3Н), 3.0 (м, 2Н), 3.6 (м,1Н), 3.9 (м, 1Н), 7.25 (д, 2Н), 7.4 (д, 1Н), 7.6 (д, 1Н), 7.75 (д, 2Н), 8.4 (с, 1Н); N-ацетил-N-пропил-4-(4-толил)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-5-амин 1.10.2(15); 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.3-1.7 (м, 11Н), 1.95 (2с, 3Н), 2.1 (т, 1Н), 2.32 (с, 3Н), 3.0 (м, 2Н), 3.4 (м, 1Н), 3.75 (м, 1Н), 7.25 (д, 2Н), 7.4 (д, 1H), 7.6 (д, 1Н), 7.75 (д, 2Н), 8.1 (с, 1Н); N-(4-фторфенилкарбамоил)-N-пропил-4-(4-толил)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-5-амин 1.10.2(16): 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.3-1.7 (м, 7Н), 1.78 (д, 1Н), 1.95 (с, 3Н), 2.05 (м, 1Н), 2.32 (с, 3Н), 2.9 (м, 2Н), 3.4 (м,1Н), 3.7 (м, 1Н), 7.0 (т, 2Н), 7.25 (д, 2Н), 7.35 (м, 3Н), 7.6 (д, 1Н), 7.75 (м, 2Н), 7.95 (д, 1Н), 8.6 (с, 1Н); N-бензоил-N-пропил-4-(4-толил)-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-5-амин 1.10.2(17): 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.3-1.7 (м, 7Н), 1.75 (д, 1Н), 1.85 и 1.95 (2с, 3Н), 2.05 (м, 1Н), 2.3 (с, 3Н), 3.0 (м, 2Н), 3.5 (м, 1Н), 4.1 (м, 1Н), 6.95 (м, 2Н), 7.15 (м, 3Н), 7.25 (т, 1Н), 7.3 (м, 2Н), 7.4 (м, 1Н), 7.8 (м, 2Н), 8.1 (с, 1Н). MS (70 eV) М+ 466; N-(4-фторфенилкарбамоил)-N-пропил-4-изопропил-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-5-амин 1.10.2(18): 0.9 (т, 3Н), 1.2-1.75 (м, 11Н), 1.95 (2с, 3Н), 2.1 (т, 1Н), 2.8-3.0 (м, 3Н), 3.4 (м,1Н), 3.6 (м, 1Н), 7.0 (т, 2Н), 7.25 (д, 1Н), 7.35 (м, 2Н), 7.5 (д, 1Н), 7.9 (д, 1Н), 8.25 (с, 1Н).
Пример 19. 7-(1-Метил-2-пиперидинил)имидазо [1,2-а]пиридин-5-карбоновая кислота гидробромид 1.11.1(1). К раствору 10 ммоль соединения (1.2: R1=СН3, R2=H) в 100 мл абсолютного этанола прибавляют 11 ммоль бромпировиноградной кислоты 4.5(2), кипятят 3 часа, охлаждают и упаривают, затем остаток снова растворяют в 25 мл MeCN/MeOH 1:1 и выдерживают полученный раствор в течение 12 часов при 0°С. Осадок отфильтровывают и промывают этилацетатом. Получают 1.11.1(1), с выходом 77%, 1Н ЯМР (DMSO-d6): 1.7 (м, 1Н), 1.95-2.0 (м, 5Н), 2.15 (м, 1Н), 2.3 (с, 3Н), 3.6 (д, 1Н), 4.9 (д, 1Н), 7.1 (дд, 1Н), 7.7 (д, 1Н), 8.6 (с, 1Н), 8.63 (д, 1Н), 9.6 (ушир с, 1Н), 12.8 (ушир с, 1Н).
Пример 20. Общий способ получения амидов 7-(1-метил-2-пиперидинил) имидазо[1,2-а]пиридин-5-карбоновой кислоты 1.11.1(2-3). Растворяют 1 ммоль соединения 1.11.1(1), 1.1 ммоль POCl3 и 1.5 ммоль соответствующего амина 3-8 в 2 мл сухого пиридина и нагревают смесь 15 мин в микроволновой печке при 160°С. Реакционную массу охлаждают, выливают в водный раствор NaHCO3, экстрагируют этилацетатом или хлористым метиленом, сушат над Na2SO4 и подвергают флэш-хроматографии. Получают 1.11.1(2-3), с выходом 30-80%: N-пропил-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-5-карбоксамид 1.11.1(2): 1Н ЯМР (DMSO-d6): 0.9 (т, 3Н), 1.35-1.85 (м, 8Н), 2.0 (с, 3Н), 2.2 (т, 1Н), 3.0 (д, 1Н), 3.25 (к, 2Н), 3.7 (д, 1Н), 6.95 (дд, 1Н), 7.3 (д, 1Н), 8.2 (ушир с, 1Н), 8.27 (с, 1Н), 8.4 (д, 1Н); N-фенетил-7-(1-метил-2-пиперидинил)имидазо[1,2-а]пиридин-5-карбоксамид 1.11.1(3): 1Н ЯМР (DMSO-d6): 1.3-1.5 (м, 2Н). 1.6-1.85 (м, 4Н), 2.0 (с, 3Н), 2.15 (т, 1Н), 2.9 (т, 2Н), 3.0 (д, 1Н), 3.5 (к, 2Н), 3.7 (д, 1Н), 6.95 (дд, 1Н), 7.2-7.35 (м, 6Н), 8.2 (ушир т, 1Н), 8.37 (с, 1Н), 8.45 (д, 1Н)
Пример 21. В соответствии с данным изобретением способ получения 5'-бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламинов или их смесей общей формулы 1.1.1 и 5'-бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-2'-иламинов или их смесей общей формулы 1.2.1 заключается в действии брома 3.1 на соответственно 1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламином 2.1 или 1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-2'-иламином 2.2 по схеме 1
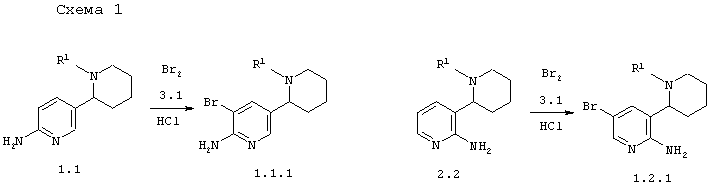
в которых R1 имеет вышеуказанное значение.
В соответствии с данным изобретением способ получения 5'-бром-6'-хлор-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов общей формулы 1.1.2 и энантиомерных 5'-бром-2'-хлор-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов или их смесей общей формулы 1.2.2 заключается в действии нитрит натрия 3.2 в присуствии соляной кислоты на соответственно 5'-бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламинами 1.1.1 или на 5'-бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-2'-иламинами 1.2.1 по схеме 2

в которых R1 имеет вышеуказанное значение.
В соответствии с данным изобретением способ получения 5'-бром-6'-фтор-1,2,3,4,5,б-гексагидро-[2,3']бипиридинилов или общей формулы 1.1.3 и энантиомерных 5'-бром-2'-фтор-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов или их смесей общей формулы 1.2.3 заключается в действии нитрит натрия 3.2 в присутствии HF на соответственно 5'-бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламинами 1.1.1 или 5'-бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-2'-иламинами 1.2.1 по схеме 3
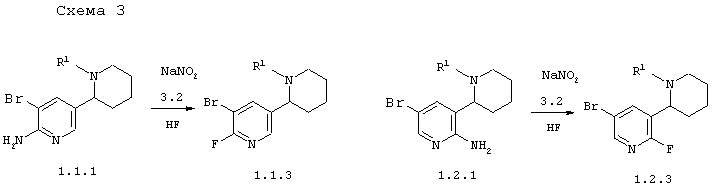
в которых R1 имеет вышеуказанное значение.
В соответствии с данным изобретением способ получения замещенных 1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов общей формулы 1.1.4 заключается во взаимодействии в присутствии палладиевого катализатора соответствующих бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов 1.1.2, 1.1.3, 1.2.2 или 1.2.3 с борными кислотами 3.3 или [1,3,2]диоксабороланами 3.4 по схеме 4
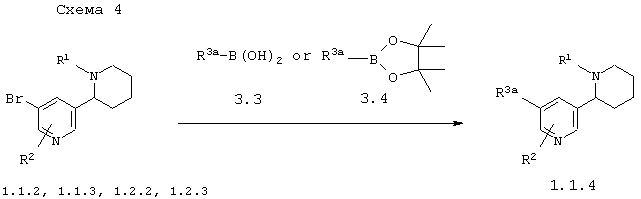
в которых: R1 и R2 имеют вышеуказанное значение, a R3a представляет необязательно замещенный фенил, необязательно замещенный арил или необязательно замещенный гетероциклил.
В соответствии с данным изобретением способ получения 5'-формил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов общей формулы 1.1.5 заключается в последовательном действии на соответствующие бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилы 1.1.2, 1.1.3, 1.2.2 или 1.2.3 бутиллитием 3.5, а затем диметилформамидом 3.6 по схеме 5
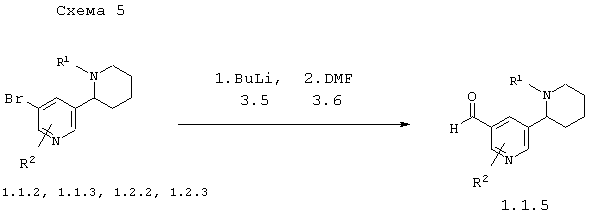
в которых: R1 и R2 имеют вышеуказанное значение.
В соответствии с данным изобретением способ получения 1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-5'-карбоновых кислот общей формулы 1.1.6 заключается в последовательном действии на соответствующие бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилы 1.1.2, 1.1.3, 1.2.2 или 1.2.3 бутиллитием 3.5, а затем СО2 3.7 по схеме 6

в которых: R1 и R2 имеют вышеуказанное значение.
В соответствии с данным изобретением способ получения 5'-аминометил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов общей формулы 1.1.7 заключается в последовательном взаимодействии аминов 3.8 с 5'-формил-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилами 1.1.5 и восстановлении образующихся продуктов реакции по схеме 7
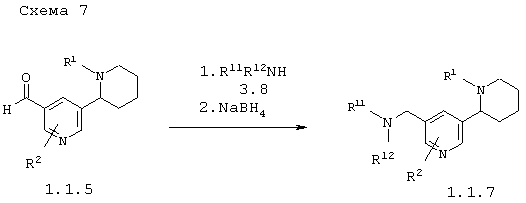
в которых: R1 и R2 имеют вышеуказанное значение, а R11 и R12 независимо друг от друга представляют атом водорода или инертный заместитель.
В соответствии с данным изобретением способ получения замещенных 1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов общей формулы 1.1.8 заключается в ацилировании аминов 3.8 производными 1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-5'-карбоновых кислот 1.1.6.1 по схеме 8
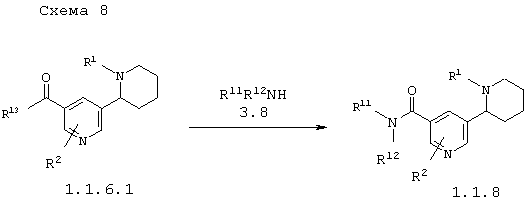
в которых: R1, R2, R11 и R12 имеют вышеуказанное значение, а R13 представляет атом хлора, имидазол-1-ил или остаток смешанного ангидрида.
В соответствии с данным изобретением способ получения 5'-бром-1,2,3,4,5,6-1'H-гексагидро-[2,3']бипиридинилонов общей формулы 1.3.1, 1.3.2, 1.4.1 и 1.4.2 заключается в действии нитрит натрия 3.2 в присутствии серной кислоты на 5'-бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилиламинами 1.1.1 или 1.2.1 и последующем алкилировании образующихся энантиомерных 5'-бром-1,2,3,4,5,6-1'H-гексагидро-[2,3']бипиридинилонов или их смесей общей формулы 1.3.1 и 1.4.1 алкилирующими реагентами 3.9 по схеме 9
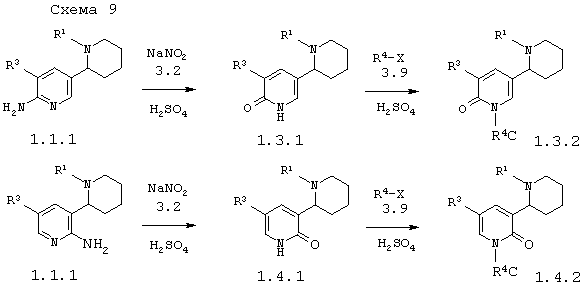
в которых: R1, R3 и R4 имеют вышеуказанное значение.
В соответствии с данным изобретением способ получения пиперидин-2-ил-пиразоло[1,5-a]пиридинов общей формулы 1.5.1, 1.5.2 или 1.5.3 заключается во взаимодействии солей 1'-амино-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-1'-ия 2.3 с этиловым эфиром ацетиленкарбоновой кислоты 4.1, последующим гидролизом образующихся эфиров 1.5.1 до кислот 1.5.2 и ацилировании аминов 3.8 производными кислоты 1.5.2а до амидов 1.5.3 по схеме 10
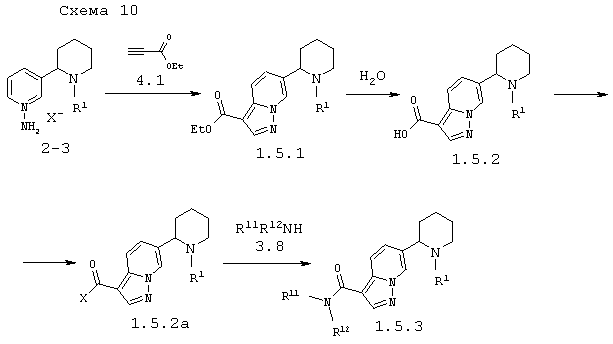
в которых: R1, R11 и R12 имеют вышеуказанное значение, а Х представляет атом хлора, имидазол-ил или остаток смешанного ангидрида.
В соответствии с данным изобретением способ получения пиперидин-2-ил-пиразоло[1,5-а]пиридинов общей формулы 1.6 заключается во взаимодействии солей 1'-амино-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-1'-ия 2-3 с диэтиловым эфиром ацетилендикарбоновой кислоты 4.2, гидролизом образующихся диэфиров 1.6.1 до дикислот 1.6.2, дегидратацией последних в ангидриды 1.6.3 и превращением последних в амиды 1.6.4 и 1.6.5 или имиды 1.6.6 взаимодействием с аминами 3.8 или 3.10 по схеме 11
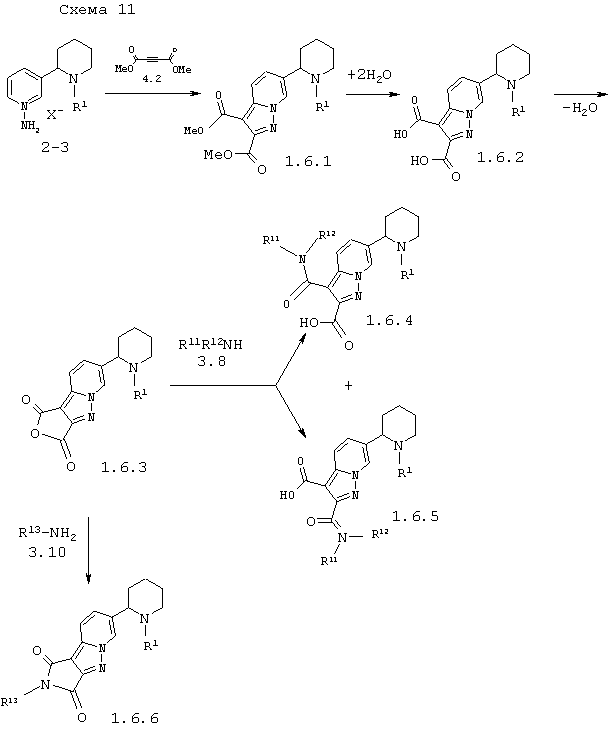
в которых: R1, R11 и R12 имеют вышеуказанное значение, a R13 представляет атом водорода или остаток первичного амина.
В соответствии с данным изобретением способ получения пиперидин-2-ил-пиридо[1,2-а]пиримидинов общей формулы 1.7 и 1.8 заключается во взаимодействии амино-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов 1.1 (R4=NH2) или 1.2 (R4=NH2) c малеиновыми ангидридами 4.3 по схеме 12
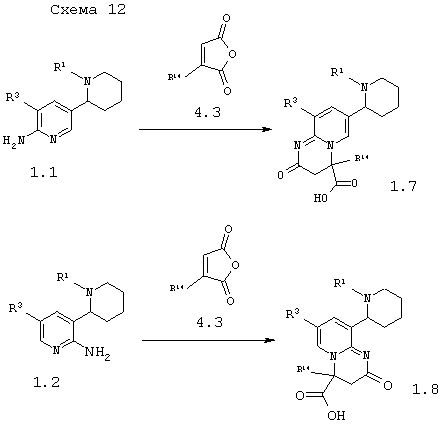
в которых: R1 и R3 имеют вышеуказанное значение, а R14 представляет атом водорода, инертный заместитель, необязательно замещенный карбоксиметил или необязательно замещенный аминкарбонилметил.
В соответствии с данным изобретением способ получения 3-пиперидин-2-ил-[1,8]нафтиридинов общей формулы 1.9 заключается во взаимодействии 5'-бром-1,2,3,4,5,6-гексагидро-[2,3']бипиридинил-6'-иламинов 1.1.1 с α-формилборными кислотами 4.4 по схеме 13
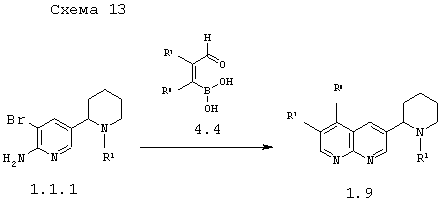
в которых R1, R7 и R8 имеют вышеуказанное значение.
В соответствии с данным изобретением способ получения пиперидин-2-ил-имидазо[1,2-а]пиридинов общей формулы 1.10.1 и 1.11.1 заключается во взаимодействии амино-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов 1.1 с α-галогенкарбонильными соединениями 4.5 по схеме 14
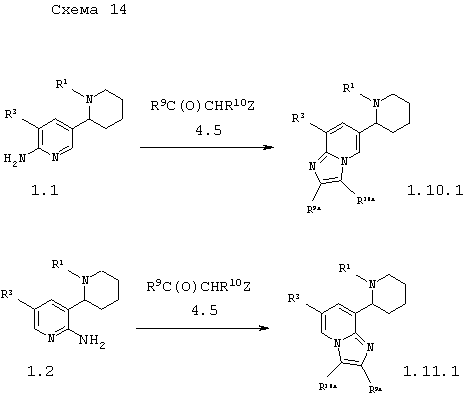
в которых R1 и R3 имеют вышеуказанное значение, a R9a и R10a независимо друг от друга представляют атом водорода, инертный заместитель, необязательно замещенную карбоксильную группу или необязательно замещенную карбомаильную группу.
В соответствии с данным изобретением способ получения пиперидин-2-ил-имидазо[1,2-а]пиридинов общей формулы 1.10.2 и 1.11.2 заключается во взаимодействии амино-1,2,3,4,5,6-гексагидро-[2,3']бипиридинилов 1.1 с альдегидами 3.9 и изоцианидами 3.10 по схеме 15
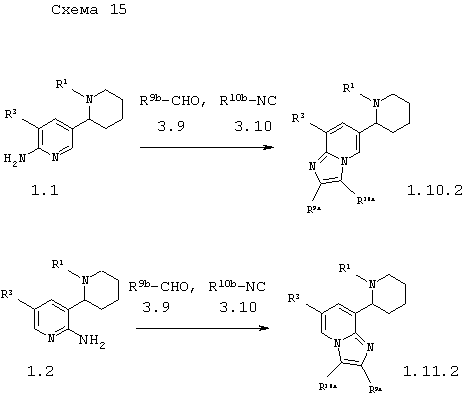
в которых R1 и R3 имеют вышеуказанное значение, а R9b представляет необязательно замещенный фенил, необязательно замещенный арил или необязательно замещенный гетероциклил, а R10b представляет замещенную аминогруппу.
Пример 22. Фокусированная библиотека новых (пиперидин-2-ил)-пиридинов общей формулы 1. Фокусированную библиотеку составляют из 35 соединений, синтез которых описан в примерах 1-20, и определяют их активность на никотиновый рецептор на клетках рабдомиосакомы. В качестве стандарта используют грамицидин. Клетки рабдомиосакомы выращивают в среде Дулбеко при 37°С во влажной атмосфере с содержанием СО2 5% до примерно 100% конфлуентности в лунках 96 луночных тарелок. Среду удаляют из лунок и замещают свежей средой (250 μL), содержащей смесь красителей в соотношении 1:1 в конечной концентрации 1 мкМ по каждому красителю. Клетки инкубируют в течение 30 минут для того, чтобы концентрации красителей уравновесились между внутри и внеклеточной средами в соответствии с клеточным трансмембранным потенциалом. После 30 минутного уравновешивания красителей производят первое измерение флуоресценции клеток в состоянии покоя (Io), после чего изучаемые 3-пиридилметиламины общей формулы (1) или (2), растворенные в диметилсульфоксиде, добавляют в каждую лунку. Концентрацию доводят до 30 μM и измеряют флуоресценцию при нулевом времени (°Ii). Клетки выдерживают 10 минут вместе с 3-пиридилметиламинами общей формулы (1) или (2), после чего производят повторное измерение флуоресценции (10Ii). Прирост интенсивности (ΔIi=10Ii-0Ii) характеризует деполяризацию клеток, которую выражают в процентах относительно деполяризации, вызванной грамицидином Д (ΔIГрД=10IГрД-0IГрД):ΔIi/ΔIГрД×100%. Эффект каждого соединения измеряют в четырех повторах и достоверность эффекта оценивают по коэффициенту Стюдента с доверительным интервалом 95%. Результаты скрининга биологической активности на никотиновый рецептор изменялись от нескольких единиц % ГрД до нескольких десятков% ГрД и свидетельствовали о перспективности новых соединений общей формулы 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2679914C9 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ПИРАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2686117C1 |
| ЗАМЕЩЕННЫЕ ИМИДАЗОПИРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ HDM2 | 2013 |
|
RU2690663C2 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ Haspin киназы | 2012 |
|
RU2548363C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТИХ СОЕДИНЕНИЙ | 2007 |
|
RU2478635C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2700004C1 |
| ИНГИБИТОРЫ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2011 |
|
RU2586974C2 |
| Анелированные 9-гидрокси-1,8-диоксо-1,3,4,8-тетрагидро-2Н-пиридо[1,2-a]пиразин-7-карбоксамиды - ингибиторы интегразы ВИЧ, способы их получения и применения | 2019 |
|
RU2717101C1 |
| Соединения 1-циано-пирролидинов в качестве ингибиторов USP30 | 2016 |
|
RU2717238C2 |
| Имидазопиридиновые соединения в качестве ингибиторов PAD | 2018 |
|
RU2782743C2 |
Изобретение относится к новым азагетероциклам, включающим фрагмент пиперидин-2-ила-, общей формулы 1
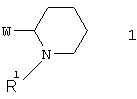
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 представляет собой атом водорода, инертный заместитель или NH-защитный заместитель; W представляет собой необязательно замещенный азагетероциклил, такой как: пиридин-3-ил, пиразоло[1,5-а]пиридин-6-ил, 3,4-дигидро-2Н-пиридо[1,2-а]пиримидин-7-ил, 3,4-дигидро-2Н-пиридо[1,2-а]пиримидин-9-ил,имидазо[1,2-а]пиримидин-6-ил, имидазо[1,2-а]пиримидин-8-ил или [1,8]нафтиридин-3-ил. Соединения настоящего изобретения обладают активностью в отношении никотинового рецептора и могут быть использованы в фармацевтической промышленности. Изобретение также относится к фокусированной библиотеке для поиска физиологически активных соединений-лидеров и к фармацевтической композиции на основе новых соединений формулы 1. 3 н. и 6 з.п. ф-лы, 1 табл.
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых
R1 представляет собой атом водорода, инертный заместитель или NH-защитный заместитель;
W представляет собой необязательно замещенный азагетероциклил, такой как пиридин-3-ил, пиразоло[1,5-а]пиридин-6-ил, 3,4-дигидро-2Н-пиридо[1,2-а]пиримидин-7-ил, 3,4-дигидро-2Н-пиридо[1,2-а]пиримидин-9-ил, имидазо[1,2-а]пиримидин-6-ил, имидазо[1,2-а]пиримидин-8-ил или [1,8]нафтиридин-3-ил, исключая соединения общей формулы 1, в которых W представляет собой незамещенный пиридин-3-ил, незамещенный пиридин-3-ил 1-оксид, алкилзамещенный пиридин-3-ил, галогензамещенный пиридин-3-ил, 2-карбоксиметилпиридин-3-ил, необязательно замещенный по атому азота аминогруппы 2-аминопиридин-3-ил, 3-фторпиридин-5-ил, 5-(4-фторфенил)пиридин-3-ил, 3-этоксикарбонилпиридин-5-ил, 3-пиперидин-2-ил-пиридин-5-ил, 2-хлорпиридин-5-ил, 2-метилпиридин-5-ил, 2-метоксипиридин-5-ил, [2,3']бипиридин-5-ил, необязательно замещенный по атому азота аминогруппы 2-аминопиридин-5-ил, 2-амино-3-нитропиридин-5-ил, 1-амино-пиридин-3-илиум или 1-метил-2-оксо-1H-пиридин-5-ил, 5-бром-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 5-(4-фторфенил)-3-(2-N-трет.-бутоксикарбонил-пиперидинил)пиридин, 7-(1-метилпиперидин-2-ил)пиридо[1,2-a]пиримидин-2,4-дион, 9-(1-метилпиперидин-2-ил)пиридо[1,2-a]пиримидин-2,4-дион.
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых
R1 имеет вышеуказанное значение;
R2 представляет атом водорода, атом галогена, необязательно замещенную гидроксильную группу, необязательно замещенную меркаптогруппу или необязательно замещенную аминогруппу; R3 представляет атом галогена, формильную группу, карбоксильную группу, необязательно замещенную алкилоксикарбонильную группу, необязательно замещенную аминокарбонильную группу, необязательно замещенную аминометильную группу, необязательно замещенный фенил, необязательно замещенный арил или необязательно замещенный гетероциклил.
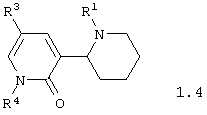
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 и R3 имеют вышеуказанное значение, а R4 представляет атом водорода, инертный заместитель или электрофильный заместитель.
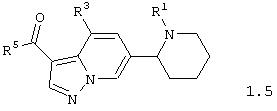
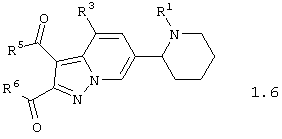
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых
R1 и R3 имеют вышеуказанное значение;
R5 и R6 независимо друг от друга представляют необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, или R5 и R6 вместе с карбонильными группами, к которым они присоединены, и вместе с атомами углерода, к которым присоединены карбонильные группы, образуют необязательно замещенный по атому азота пирролидин-2,5-дион.
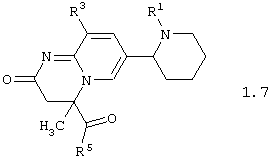
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1, R3 и R5 имеют вышеуказанное значение.
в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых R1 имеет вышеуказанное значение, а R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклический или ароматический цикл.

в виде отдельных энантиомеров или смесей энантиомеров или их фармацевтически приемлемые соли, оксиды или гидраты, в которых
R1 и R3 имеют вышеуказанное значение; а
R9 и R10 независимо друг от друга представляют атом водорода, инертный заместитель, необязательно замещенный фенил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенную карбоксильную группу, необязательно замещенную карбамоильную группу или необязательно замещенную аминогруппу.
| US 5594011 A,14.01.1997.US 5677459A, 14.10.1997.US 5703100A, 30.12.1997 .US 5723477A, 03.03.1998.US 5705512A, 06.01.1998.US 5276043A, 04.04.1994.WO 92/15306A1, 17.09.1992 | |||
| Экономайзер | 0 |
|
SU94A1 |
| и др | |||
| Конденсация N-метил- α -и α '-аминоанабазинов с малоновым эфиром. | |||
Авторы
Даты
2005-08-27—Публикация
2004-04-01—Подача