ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к имидазопиридиновым соединениям формулы (I), (II) и (III) наряду с их полиморфами, стереоизомерами, пролекарствами на их основе, их сольватами, сокристаллами, промежуточными соединениями на их основе, их фармацевтически приемлемыми солями и метаболитами, которые ингибируют фермент PAD4.
Способ получения вышеуказанных гетероциклических соединений формулы (I), (II) и (III), их полиморфов, стереоизомеров, пролекарств на их основе, их сольватов, сокристаллов, промежуточных соединений на их основе, их фармацевтически приемлемых солей, фармацевтических композиций на их основе и их метаболитов, пригодных для получения таких соединений, также описан в данном документе и является пригодным для получения таких соединений.
Соединения, описанные в данном документе, ингибируют фермент PAD4 из семейства PAD и могут применяться для лечения различных нарушений, связанных с делением клеток или воспалением.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
PAD (белок аргинин-деиминаза) входит в семейство ферментов, которые обеспечивают процесс цитруллинирования в живых тканях (J.Е. Jones, et al. Curr. Opin. Drug Discov. Devel., 2009, 12, 616-627). Семейство PAD состоит из отдельных ферментов PAD1, PAD2, PAD3, PAD4 и PAD6. Ферменты семейства PAD оказывают влияние и регулируют различные физиологические и патологические процессы в организме человека и, следовательно, являются важными.
Повышение уровней этих ферментов было связано с различными заболеваниями, например, с дифференцировкой клеток (K. Nakashima et al., J. Biol. Chem., 1999, 274, 27786-27792), плюрипотентностью стволовых клеток (M.А. Christophorou et al., Nature, 2014, 507, 104-108), апоптозом (G.Y. Liu, Apoptosis, 2006, 11, 183-196), образованием нейтрофильной внеклеточной ловушки (NET) (Y. Wang et al., J. Cell Biol., 2009, 184, 205-213), регуляцией транскрипции (P. Li et al., Mol. Cell Biol., 2008, 28, 4745-4758), процессированием антигена при аутофагии (J.М. Ireland et al., J. Exp. Med., 2011, 208, 2625-2632), воспалением (D. Makrygiannakis et al., Ann. Rheum. Dis., 2006, 65, 1219-1222), ороговением кожи (E. Candi et al., Nat. Rev. Mol. Cell Biol., 2005, 6, 328-340), демиелинизацией при рассеянном склерозе (F.G. Mastronardi et al., J. Neurosci., 2006, 26, 11387-11396), регуляцией хемокина (Т. Loos et al., Blood, 2008, 112, 2648-2656), восстановлением повреждения спинного мозга (S. Lange et al., Dev. Biol., 2011, 355, 205-214) и различными нормальными клеточными процессами. Повышение уровней фермента PAD становится непосредственной причиной вышеуказанных заболеваний из-за повышения скорости процесса цитруллинирования.
Ферменты не только катализируют цитруллинирование, но также продуцируют аутоиммунные антитела, которые распознают цитруллинированные белки. Введение цитруллина, являющегося результатом активности PAD, изменяет как структуру, так и функцию белков. На уровнях физиологической активности PAD регулируют множество клеточных сигнальных путей, таких как дифференцировка клеток, апоптоз и транскрипция генов ( et al. Int. J. Biochem. Cell Biol., 2006, 38, 1662-1677). Таким образом, эти ферменты играют ключевую роль в патогенезе вышеуказанных заболеваний.
et al. Int. J. Biochem. Cell Biol., 2006, 38, 1662-1677). Таким образом, эти ферменты играют ключевую роль в патогенезе вышеуказанных заболеваний.
PAD4 также известна своим участием в образовании нейтрофильных внеклеточных ловушек (NET) и, более конкретно, в цитруллинировании гистонов, которое происходит во время нетоза (J. Cedervall, А.-K. Olsson, Oncoscience, 2015, 2(11), 900-901). Таким образом, фермент PAD4 связан с заболеваниями, характеризующимися ненормальными уровнями нейтрофильных внеклеточных ловушек (NET). Предполагаемая роль PAD4 в нетозе важна при ревматоидном артрите (RA), поскольку NET дефектны в отсутствие PAD4, и PAD4 высвобождается внеклеточно в суставах, пораженных RA, возможно из-за патологического состояния нейтрофилов при RA. Следовательно, лекарственные средства-ингибиторы PAD, обеспечат значительный терапевтический потенциал из-за того факта, что NET связаны со многими заболеваниями.
Примеры некоторых соединений-ингибиторов PAD представляют собой хлорамидин, фторхлоридин и их родственные аналоги, которые известны и действуют в качестве необратимых ингибиторов, которые необратимо инактивируют PAD4 и других изоферментов PAD (Н.D. Lewis et al., Nature Chemical Biology, 2015, 11, 189-191). Такие соединения являются полезными при ревматоидном артрите (RA). Было обнаружено, что PAD4, обнаруженная в синовиальной ткани, ответственна за цитруллинирование разнообразных суставных белков. Такие цитруллинированные белковые субстраты продуцируют антитела к цитруллинированным белкам, которые ответственны за патогенез заболевания (Y. Kochi et al., Ann. Rheum. Dis., 2011, 70, 512-515).
Поскольку известно, что соединения, которые ингибируют ферментативную активность PAD4, также снижают патологическую активность при многих заболеваниях, то такие соединения можно применять при повреждениях и болезненных патологиях. Таким образом, ингибиторы PAD4 имеют более широкую применимость при лечении заболеваний, особенно заболеваний, связанных с NET.
В US 20050159334 раскрыто лечение RA посредством введения подходящего ингибитора PAD, таким образом, соединения-ингибиторы PAD имеют прямое отношение к лечению RA.
Соединения-ингибиторы PAD, такие как хлорамидин, были широко исследованы для демонстрации их эффективности на нескольких животных моделях заболеваний, таких как коллаген-индуцированный артрит (V.С. Willis et al., J. Immunol., 2011, 186(7), 4396-4404), индуцированный натриевой солью сульфата декстрана (DSS) экспериментальный колит (A.A. Chumanevich et al., Am. J. Physiol. Gastrointest. Liver Physiol., 2011, 300(6), G929-G938), атеросклероз и артериальный тромбоз линии мышей MRL/lpr, склонной к волчанке (J.S. Knight et al., Circ. Res., 2014, 114(6), 947-956), восстановление повреждения спинного мозга (S. Lange et al., Dev. Biol., 2011, 355(2), 205-214) и экспериментальный аутоиммунный энцефаломиелит (ЕАЕ).
Подобно RA, применение ингибиторов PAD4 для лечения форм рака (J.L. Slack et al., Cellular and Molecular Life Sciences, 2011, 68(4), 709-720) также было исследовано ранее. Предполагается, что ингибиторы PAD4 также обладают антипролиферативной ролью. PAD4 деиминирует остатки аргинина в гистонах в промоторах целевых генов р53, таких как р21, которые вовлечены в остановку клеточного цикла и индукцию апоптоза (Р. Li et al., Molecular & Cell Biology, 2008, 28(15), 4745-4758).
Соединения, ингибирующие PAD4, описанные выше, имеют широкое применение. Следовательно, необходима идентификация химического остатка, который способствует ингибированию PAD. Однако применение ингибиторов PAD при различных других заболеваниях, при которых нарушена регуляция активности PAD, все еще нуждается в изучении. Идентификация и разработка новых соединений-ингибиторов PAD4 для лечения нарушений, опосредованных PAD4, крайне необходима для эффективного лечения таких заболеваний, как ревматоидный артрит, васкулит, системная красная волчанка, кожная красная волчанка, язвенный колит, рак, кистозный фиброз, астма, рассеянный склероз и псориаз.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
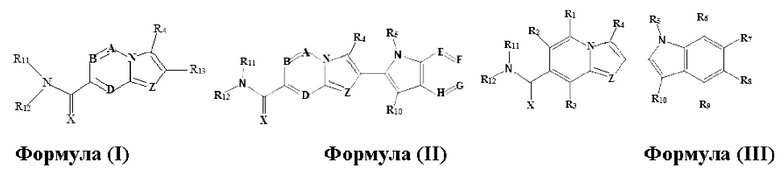
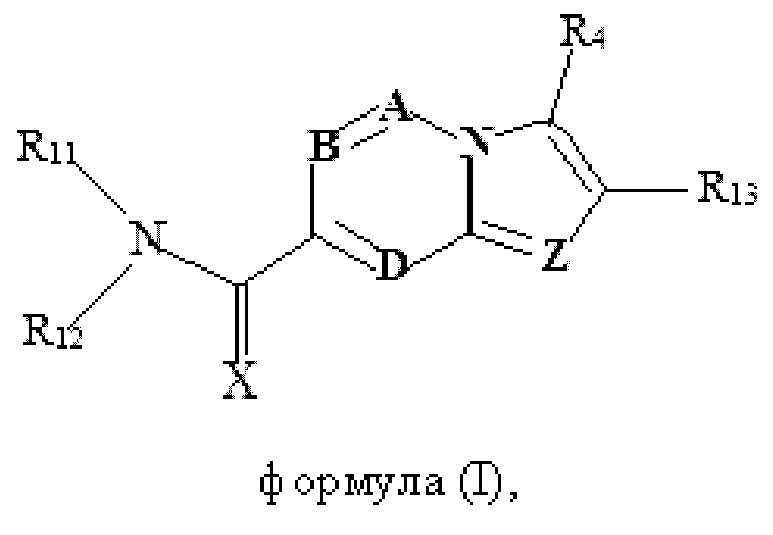
В настоящем изобретении раскрыто соединение формулы I,
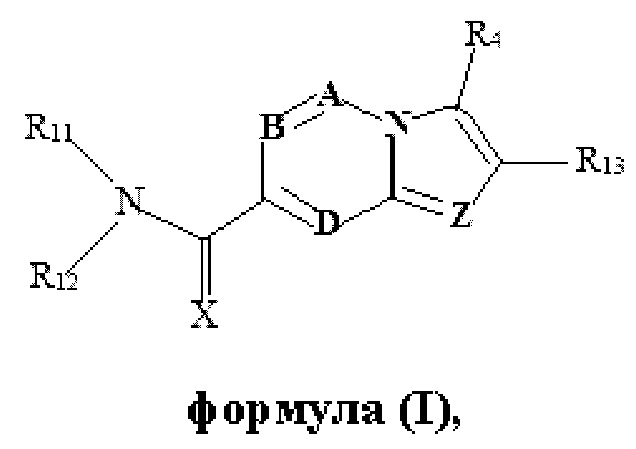
X выбран из О или S; Z представляет собой N; А выбран из N или CR1;
В выбран из N или CR2; D выбран из N или CR3; R1, R2, R3 и R4 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С3-6циклоалкила, С1-6арила, С1-6гетероциклила, С1-6гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-6алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(СО)СН=СН-СН2-N(СН3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноцнклического или бициклического арнла и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетеро атомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклическнй арил и 5-10-членный моноциклический или бициклическнй гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, C(O)С1-6галогеналкила, C(O)NR15, С(О)С1-6алкиламино, С(О)С5-6арила, С(О)С1-6гетероарила, SO2C1-6галогеналкила, SO2C3-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-10гетероциклил и С1-10гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В настоящем изобретении также описано соединение формулы II,
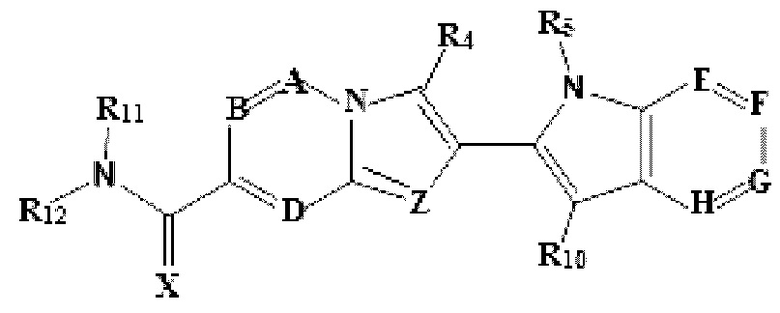
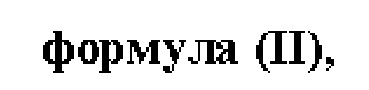
X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; Е выбран из N или CR6; F отсутствует или выбран из N и CR7; G отсутствует или выбран из N и CR8; Н отсутствует или выбран из N и CR9; R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, C1-6алкила, C1-6алкокси, С3-6циклоалкила, C1-6галогеналкила, C1-6галогеналкокси, C1-6ациламино, C1-6алкиламино, C5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-9арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-9арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано;
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В настоящем изобретении дополнительно описано соединение формулы III,
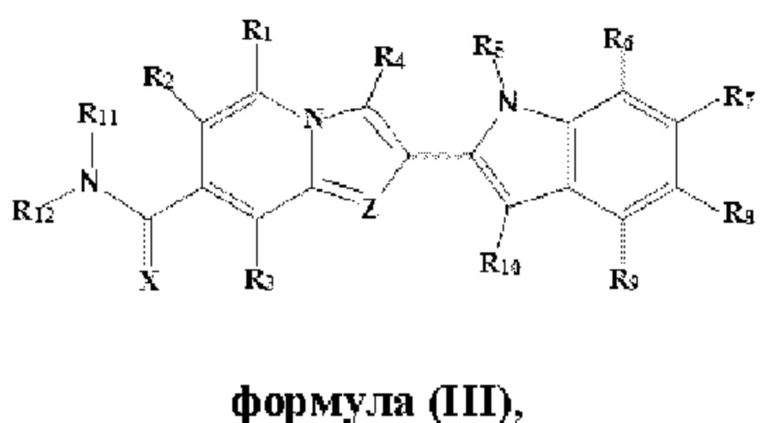
X выбран из О или S; Z представляет собой N; R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, C1-10гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-9арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-9арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано;
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В настоящем изобретении дополнительно описан способ получения соединений формулы (I), формулы (II) и формулы (III), или их полиморфов, стереоизомеров, пролекарств на их основе, их сольватов, сокристаллов, промежуточных соединений на их основе, их фармацевтически приемлемых солей и метаболитов.
В настоящем изобретении дополнительно раскрыта фармацевтическая композиция, содержащая соединение формулы (I), формулы (II) и формулы (III), или его фармацевтически приемлемую соль, вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одной или несколькими другими фармацевтическими композициями.
В настоящем изобретении дополнительно раскрыт способ ингибирования одного или нескольких представителей из семейства PAD в клетке эффективным количеством соединения по настоящему изобретению.
В настоящем изобретении дополнительно раскрыт способ лечения состояния, опосредованного одним или несколькими PAD, при этом способ включает введение субъекту, страдающему от состояния, опосредованного одним или несколькими представителями семейства PAD, терапевтически эффективного количества соединения формулы (I), формулы (II) и формулы (III) или фармацевтической композиции по настоящему изобретению с другими необходимыми с клинической точки зрения средствами или биологическими средствами субъекту, нуждающемуся в этом.
В настоящем изобретении дополнительно раскрыто соединение формулы (I), формулы (II) и формулы (III), применяемое для лечения ревматоидного артрита, васкулита, системной красной волчанки, язвенного колита, рака, кистозного фиброза, астмы, кожной красной волчанки и псориаза.
Эти и другие признаки, аспекты и преимущества объекта настоящего изобретения станут более понятны со ссылкой на следующее описание. Данное краткое описание предоставлено для представления набора понятий в упрощенном виде. Данное краткое описание не предназначено для определения ключевых признаков или существенных признаков изобретения, так же как и не предназначено для применения для ограничения объема объекта настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ
Специалист в данной области техники поймет, что настоящее изобретение может подвергаться изменениям и модификациям, отличным от конкретно описанных изменений и модификаций. Следует понимать, что настоящее изобретение включает все такие изменения и модификации. Настоящее изобретение также включает все такие стадии, признаки, композиции и соединения, упомянутые или указанные в данном описании, по отдельности или совместно, и любые и все комбинации любых или нескольких таких стадий или признаков.
Определения
Для удобства, перед дополнительным описанием настоящего изобретения, здесь собраны некоторые термины, используемые в описании и примерах. Эти определения должны быть прочитаны с учетом остальной части раскрытия и должны быть понятны специалисту в данной области техники. Термины, применяемые в данном документе, имеют значения, распознаваемые и известные специалистам в данной области техники, однако, для удобства и полноты, конкретные термины и их значения изложены ниже.
Форма единственного числа применяется для обозначения одного или нескольких (т.е. по меньшей мере одного) грамматических объектов.
По всему описанию и последующей формуле изобретения, если контекст не требует иного, слово "содержать", и такие вариации, как "содержит" или "содержащий", будет подразумевать включение установленного целого числа или стадии или группы целых чисел, при этом без исключения любого другого целого числа или стадии или группы целых чисел или стадий.
Термин "включающий" применяется в значении "включающий без ограничения". "Включающий" и "включающий без ограничения" применяются взаимозаменяемо.
В структурной формуле, приведенной в данном документе и по всему настоящему изобретению, следующие термины имеют указанное значение, если конкретно не указано иное.
Кроме того, соединение формулы (I), формулы (II) и формулы (III) может представлять собой его производные, аналоги, стереоизомеры, диастереомеры, геометрические изомеры, полиморфы, сольваты, сокристаллы, промежуточные соединения, метаболиты, пролекарства или фармацевтически приемлемые соли и композиции.
Соединения формулы (I), формулы (II) и формулы (III), а также их полиморфы, стереоизомеры, пролекарства на их основе, их сольваты, сокристаллы, промежуточные соединения на их основе, их фармацевтически приемлемые соли и метаболиты могут также называться "соединениями по настоящему изобретению".
Соединения в соответствии с формулой (I), формулой (II) и формулой (III) содержат один или несколько асимметричных центров (также называемых хиральными центрами) и могут, следовательно, существовать в виде отдельных энантиомеров, диастереоизомеров или других стереоизомерных форм, или в виде их смесей. Хиральные центры, такие как хиральные атомы углерода, могут также присутствовать в заместителе, таком как алкильная группа. Если не указана стереохимия хирального центра, присутствующего в формуле (I), формуле (II) и формуле (III), или в любой химической структуре, проиллюстрированной в данном документе, структура предназначена для включения любого стереоизомера и всех их смесей. Таким образом, соединения в соответствии с формулой (I), формулой (II) и формулой (III), содержащие один или несколько хиральных центров, можно применять в виде рацемических модификаций, включая рацемические смеси и рацематы, энантиомерно обогащенные смеси, или в виде энантиомерно чистых отдельных стереоизомеров. Отдельные стереоизомеры соединения в соответствии с формулой (I), формулой (II) и формулой (III), которые содержат один или несколько асимметричных центров, можно разделять с помощью способов, известных специалистам в данной области техники. Например, такое разделение можно осуществлять (1) посредством образования диастереоизомерных солей, комплексов или других производных; (2) посредством селективной реакции со стереоизомер-специфичным реагентом, например, посредством ферментативного окисления или восстановления; или (3) с помощью газожидкостной или жидкостной хроматографии в хиральной среде, например, на хиральном носителе, таком как диоксид кремния со связанным хиральным лигандом или в присутствии хирального растворителя. Следует понимать, что если необходимый стереоизомер превращают в другой химический структурный элемент с помощью одной из процедур разделения, описанных выше, необходима дополнительная стадия для высвобождения необходимой формы.
В качестве альтернативы, конкретные стереоизомеры можно синтезировать посредством асимметричного синтеза с применением оптически активных реагентов, субстратов, катализаторов или растворителей, или посредством превращения одного энантиомера в другой посредством асимметричного превращения.
Следует понимать, что ссылки в данном документе на соединения формулы (I), формулы (II) и формулы (III) и их соли охватывают соединения формулы (I), формулы (II) и формулы (III) в виде свободных оснований или в виде их солей, например в виде их фармацевтически приемлемых солей. Таким образом, в одном варианте осуществления настоящее изобретение направлено на соединения формулы (I), формулы (II) и формулы (III) в виде свободного основания. В другом варианте осуществления настоящее изобретение направлено на соединения формулы (I), формулы (II) и формулы (III) и их соли. В дополнительном варианте осуществления настоящее изобретение направлено на соединения формулы (I), формулы (II) и формулы (III) и их фармацевтически приемлемые соли.
Следует понимать, что можно получать фармацевтически приемлемые соли соединений в соответствии с формулой (I, II и III). Действительно, в определенных вариантах осуществления настоящего изобретения фармацевтически приемлемые соли соединений в соответствии с формулой (I), формулой (II) и формулой (III) могут быть предпочтительны по сравнению с соответствующим свободным основанием, поскольку такие соли придают большую стабильность или растворимость молекуле, тем самым облегчая составление лекарственной формы. Соответственно, настоящее изобретение дополнительно направлено на соединения формулы (I), формулы (II) и формулы (III) и их фармацевтически приемлемые соли.
"Энантиомерный избыток" (ее) представляет собой избыток одного энантиомера по сравнению с другим, выражаемый в процентах. В рацемической модификации, поскольку оба энантиомера присутствуют в равных количествах, энантиомерный избыток равен нулю (0% ее). Однако, если один энантиомер был обогащен так, что он составляет 95% продукта, то энантиомерный избыток будет составлять 90% ее (количество обогащенного энантиомера, 95%, минус количество других энантиомеров, 5%).
"Энантиомерно обогащенный" относится к продуктам, энантиомерный избыток которых (ее) больше нуля. Например, термин 'энантиомерно обогащенный' относится к продуктам, энантиомерный избыток которых превышает 50% ее, превышает 75% ее и превышает 90% ее. 'Энантиомерно чистый' относится к продуктам, энантиомерный избыток которых составляет 99% или больше.
В объем 'соединений по настоящему изобретению' включены все сольваты (включая гидраты), комплексы, полиморфы, пролекарства, меченые радиоактивным изотопом производные и стереоизомеры соединений формулы (I), формулы (II) и формулы (III) и их соли.
Соединения по настоящему изобретению могут существовать в твердой или жидкой форме. В твердом состоянии соединения по настоящему изобретению могут существовать в кристаллической или некристаллической форме или в виде их смеси. Для соединений по настоящему изобретению, которые находятся в кристаллической форме, специалист в данной области техники поймет, что фармацевтически приемлемые сольваты могут образовываться, когда молекулы растворителя включаются в кристаллическую решетку во время кристаллизации. Сольваты могут предусматривать неводные растворители, такие как этанол, изопропиловый спирт, N,N-диметилсульфоксид (DMSO), уксусную кислоту, этаноламин и этилацетат, или они могут предусматривать воду в качестве растворителя, который включен в кристаллическую решетку. Сольваты, в которых вода является растворителем, который включается в кристаллическую решетку, как правило, называются 'гидратами'. Гидраты включают стехиометрические гидраты, а также композиции, содержащие различные количества воды. Настоящее изобретение включает все такие сольваты.
Дополнительно следует понимать, что определенные соединения по настоящему изобретению, которые существуют в кристаллической форме, включая их различные сольваты, могут проявлять полиморфизм (т.е., способность существовать в виде различных кристаллических структур). Такие различные кристаллические формы, как правило, известны как 'полиморфные формы'. Настоящее изобретение включает такие полиморфы. Полиморфы имеют одинаковый химический состав, но отличаются упаковкой, геометрическим расположением и другими описательными свойствами кристаллического твердого состояния. Следовательно, полиморфы могут иметь различные физические свойства, такие как форма, плотность, твердость, деформируемость, стабильность и способность к растворению. Полиморфы, как правило, характеризуются различными точками плавления, IR-спектрами и порошковой дифракционной рентгенограммой, которые можно применять для идентификации. Следует понимать, что различные полиморфы можно получать, например, посредством изменения или регулирования условий реакции или реагентов, применяемых при получении соединения. Например, изменения температуры, давления или растворителя могут приводить к образованию полиморфов. Кроме того, один полиморф может спонтанно превращаться в другую полиморфную форму при определенных условиях.
Настоящее изобретение также включает меченые изотопом соединения, которые идентичны соединениям формулы (I, II и III) и их солям, за исключением того, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, наиболее часто встречающихся в природе. Примеры изотопов, которые можно включать в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода и фтора, такие как 3Н, 11С, 14С и 18F.
Термин "сокристаллы" относится к твердым веществам, которые представляют собой кристаллические однофазные материалы, состоящие из двух или более различных молекулярных и/или ионных соединений, обычно в стехиометрическом соотношении, которые не являются ни сольватами, ни простыми солями.
Термин "замещенный" в отношении группы указывает на то, что атом водорода, присоединенный к атому, являющемуся членом в пределах группы, заменен. Следует понимать, что термин 'замещенный' включает явное положение о том, что такое замещение должно соответствовать допустимой валентности замещенного атома и заместителя, и что замещение приводит к образованию стабильного соединения (т.е. соединения, которое не подвергается спонтанному превращению, такому как перегруппировка, циклизация или отщепление). В определенных вариантах осуществления один атом может быть замещен более чем одним заместителем, при условии, что такое замещение соответствует допустимой валентности атома. Подходящие заместители определены в данном документе для каждой замещенной или необязательно замещенной группы.
Термин "полиморфы" относится к кристаллическим формам одной и той же молекулы, и различные полиморфы могут иметь различные физические свойства, такие как, например, значения температуры плавления, значения теплоты плавления, свойства растворимости, скорости растворения и/или колебательные спектры из-за расположения или конформации молекул в кристаллической решетке.
Термин "пролекарства" относится к предшественнику соединения формулы (I, II и III), который при введении подвергается химическому превращению посредством метаболических процессов перед превращением в активные фармакологические вещества. В целом, такие пролекарства будут представлять собой функциональные производные соединения по настоящему изобретению, которые легко превращаются in vivo в соединение по настоящему изобретению.
Термин "алкил" относится к насыщенной углеводородной цепи, содержащей указанное число атомов углерода. Например, без ограничения, С1-6алкил относится к алкильной группе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода. Алкильные группы могут представлять собой группы с линейной или разветвленной цепью. Иллюстративные разветвленные алкильные группы имеют одно, два или три ответвления. Предпочтительные алкильные группы включают без ограничения метил, этил, н-пропил, изопропил, бутил и изобутил.
Термин "С(O)алкил" относится к алкильной группе, определенной выше, присоединенной посредством карбонильной группы к остальной части молекулы. Например, С(O)С1-6алкил относится к алкильной группе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством карбонильной группы к остальной части молекулы. Предпочтительные С(O)алкильные группы включают без ограничения -С(O)СН3, -С(O)СН2СН3 и т.п.
Термин "SO2 алкил" относится к алкильной группе, определенной выше, присоединенной посредством сульфонильной группы к остальной части молекулы. Например, SO2C1-6алкил относится к алкильной группе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством сульфонильной группы к остальной части молекулы. Предпочтительные SO2алкильные группы включают без ограничения -SO2CH3, -SO2CH2CH3 и т.п.
Термин "алкокси" относится к алкильной группе, присоединенной посредством атома кислорода к остальной части молекулы. Например, С1-6алкокси относится к алкильной группе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством атома кислорода к остальной части молекулы. Предпочтительные алкоксигруппы включают без ограничения -ОСН3 (метокси), ОС2Н5 (этокси) и т.п.
Термин "алкиламино" относится к алкильной группе, определенной выше, присоединенной посредством аминогруппы или алкильной группы к остальной части молекулы. Например, С1-6алкиламино относится к алкильной группе, содержащей 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством аминогруппы к остальной части молекулы. Предпочтительные алкиламино группы включают без ограничения -NHCH3, -N(СН3)2 и т.п.
Термин "C(O)NR" относится к алкиламиногруппе, определенной выше, присоединенной посредством карбонильной группы к остальной части молекулы. Предпочтительные C(O)NR-группы включают C(O)NCH3, C(O)NCH2CH3 и т.п.
Термин "SO2NR" относится к алкиламиногруппе, определенной выше, присоединенной посредством сульфонильной группы к остальной части молекулы. Предпочтительные SO2NR-rpynnbi включают SO2NCH3, SO2NCH2CH3 и т.п.
Термин "С(O)алкиламино" относится к алкиламиногруппе, определенной выше, присоединенной посредством карбонильной группы к остальной части молекулы. Например, С(O)С1-6алкиламино относится к алкиламиногруппе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством карбонильной группы к остальной части молекулы. Предпочтительные С(O)алкиламиногрулпы включают без ограничения -C(O)NHCH3, -C(O)N(CH3)2 и т.п.
Термин "SO2 алкиламино" относится к алкиламиногруппе, определенной выше, присоединенной посредством сульфонильной связи к остальной части молекулы. Например, SO2C1-6алкиламино относится к алкиламиногруппе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством сульфонильной группы к остальной части молекулы. Предпочтительные SO2алкиламиногруппы включают без ограничения -SO2NHCH3, -SO2N(CH3)2 и т.п.
Термин "ациламино" относится к ацильной группе, присоединенной посредством карбонильной группы к остальной части молекулы. Например, С1-6ациламино относится к ацильной группе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством аминогруппы к остальной части молекулы. Предпочтительные ациламиногруппы включают без ограничения -(CO)NHCH3, -(CO)N(СН3)2 и т.п.
Термин "галогеналкил" относится к алкильной группе, определенной выше, содержащей галоген и присоединенной посредством алкильной группы к остальной части молекулы. Например, С1-6галогеналкил относится к алкильной группе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством атома галогена к остальной части молекулы. Предпочтительные галогеналкильные группы включают без ограничения -CH2Cl, -CHCl2 и т.п.
Термин "С(O)галогеналкил" относится к галогеналкильной группе, определенной выше, присоединенной посредством карбонильной группы к остальной части молекулы. Например, С(O)С1-6галогеналкил относится к галогеналкильной группе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством карбонильной группы к остальной части молекулы. Предпочтительные С(O)галогеналкильные группы включают без ограничения -(СО)CH2Cl, -С(O)CHCl2 и т.п.
Термин "SO2галогеналкил" относится к гало ге нал кил ьной группе, определенной выше, присоединенной посредством сульфонильной связи к остальной части молекулы. Например, SO2C1-6галогеналкил относится к галогеналкильной группе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством сульфонильной группы к остальной части молекулы. Предпочтительные SO2галогеналкильные группы включают без ограничения -SO2CH2Cl, -SO2CHCl2 и т.п.
Термин "галогеналкокси" относится к алкоксигруппе, определенной выше, присоединенной посредством атома кислорода к остальной части молекулы. Например, С1-6галогеналкокси относится к алкоксигруппе, содержащей от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, присоединенной посредством атома галогена к остальной части молекулы. Предпочтительные галогеналкоксигруппы включают без ограничения -OCH2Cl, -OCHCl2 и т.п.
Термин "галоген" относится к радикалу, представляющему собой галоген, например, фтор, хлор, бром или йод. "Галогеналкил" относится к алкильной группе, определенной ранее в данном документе, в которой по меньшей мере один из атомов водорода был заменен радикалом, представляющим собой галоген. "С1-6галогеналкил" относится к C1-6алкильной группе, в которой по меньшей мере один из атомов водорода был заменен радикалом, представляющим собой галоген. Примером "галогеналкила" является трифторметил или 2,2,2-трифторэтил.
Термин "циклоалкил" относится к насыщенному углеводородному кольцу, содержащему указанное число атомов углерода. Например, без ограничения С3-6циклоалкил относится к циклоалкильной группе, содержащей от 3 до 6 атомов, являющихся членами, или 3 атома, являющихся членами. Предпочтительные циклоалкильные группы включают без ограничения циклопропильные, циклобутильные, циклопентильные, циклогексильные группы и т.п.
Термин "SO2C3-6циклоалкил" относится к циклоалкильной группе, определенной выше, присоединенной посредством сульфонильной группы к остальной части молекулы. Например, SO2C3-6циклоалкил относится к циклоалкильной группе, содержащей от 3 до 6 атомов углерода, присоединенной посредством сульфонильной группы к остальной части молекулы. Предпочтительные SO2циклоалкильные группы включают без ограничения -SO2С3циклоалкил и т.п.
Термин "арил" относится к ароматическому кольцу, содержащему указанное число атомов углерода. Например, С5-6арил относится к арильной группе, содержащей 5 или 6 атомов, являющихся членами, или 6 атомов, являющихся членами. Предпочтительные арильные группы включают без ограничения фенил и т.п.
Термин "С(O)арил" относится к арильной группе, определенной выше, присоединенной посредством карбонильной группы к остальной части молекулы. Например, С(O)С5-6арил относится к алкильной группе, содержащей от 5 до 6 атомов углерода, присоединенной посредством карбонильной группы к остальной части молекулы. Предпочтительные С(O)арильные группы включают без ограничения -С(О)С6Н5, -С(О)С5Н5 и т.п.
Термин "SO2арил" относится к арильной группе, определенной выше, присоединенной посредством сульфонильной группы к остальной части молекулы. Например, SO2C5-6арил относится к арильной группе, содержащей от 5 до 6 атомов углерода, присоединенной посредством сульфонильной группы к остальной части молекулы. Предпочтительные SO2арильные группы включают без ограничения -SO2C6H5, -SO2C5H5 и т.п.
Термин "гетероарил" относится к ароматическим кольцам, содержащим от 1 до 3 гетероатомов в кольце. "Гетероарильные" группы могут быть замещены одним или несколькими заместителями, если это определено в данном документе. "С1-6гетероарильные" кольца содержат 1 или 6 атомов углерода в качестве атомов, являющихся членами. "Гетероарил" включает пиридинил, тетразолил и пиразолил. "Гетероатом" относится к атому азота, серы или кислорода, например, к атому азота или атому кислорода.
Термин "С(O)гетероарил" относится к гетероарильной группе, определенной выше, присоединенной посредством карбонильной группы к остальной части молекулы. Например, С(O)С1-6гетероарил относится к алкильной группе, содержащей от 1 до 6 атомов углерода, присоединенных посредством карбонильной группы к остальной части молекулы. Предпочтительные С(O)гетероарильные группы включают без ограничения -С(O)пиридинил, -С(O)пиразолил и т.п.
Термин "SO2гетероарил" относится к арильной группе, определенной выше, присоединенной посредством сульфонильной группы к остальной части молекулы. Например, SO2C1-6гетероарил относится к арильной группе, содержащей от 1 до 6 атомов углерода, присоединенной посредством сульфонильной группы к остальной части молекулы. Предпочтительные SO2гетероарильные группы включают без ограничения -SO2пиридинил, -SO2пиразолил и т.п.
Термины "гетероциклический" и "гетероциклил" относятся к насыщенным или ненасыщенным моноциклическим алифатическим кольцам, содержащим 5, 6 или 7 членов кольца, включая 1 или 2 гетероатома, или к насыщенным или ненасыщенным бициклическим алифатическим кольцам, содержащим 5, 6 или 7 членов кольца, включая 1 или 2 гетероатома. В определенных вариантах осуществления "гетероциклильные" группы являются насыщенными. В других вариантах осуществления "гетероциклильные" группы являются ненасыщенными. 'Гетероциклильные' группы, содержащие более одного гетероатома, могут содержать различные гетероатомы. 'Гетероциклильные' группы могут быть замещенными одним или несколькими заместителями, определенными в данном документе. 'Гетероциклил' включает пиперидинил, тетрагидропиранил, азепинил, оксазепинил, азабицикло[3.1.0]гексанил.
Фраза "фармацевтически приемлемый" относится к таким соединениям, материалам, композициям и лекарственным формам, которые в пределах объема тщательной медицинской оценки являются подходящими для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения или другой проблемы или осложнения в соответствии с приемлемым соотношением пользы/риска.
Применяемый в данном документе термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют необходимую биологическую активность заявленного соединения и проявляют минимальные нежелательные токсикологические эффекты. Такие фармацевтически приемлемые соли можно получать in situ во время конечного выделения и очистки соединения или посредством осуществления отдельной реакции очищенного соединения в его форме свободного основания с подходящей кислотой.
Соли и сольваты, имеющие отличные от фармацевтически приемлемых противоионов или связанные растворители, находятся в пределах объема настоящего изобретения, например, для применения в качестве промежуточных соединений при получении других соединений формулы (I), формулы (II) и формулы (III), и их фармацевтически приемлемых солей. Таким образом, один вариант осуществления настоящего изобретения включает соединения формулы (I), формулы (II) и формулы (III) и их соли. Соединения в соответствии с формулой (I), формулой (II) и формулой (III) содержат основную функциональную группу и, следовательно, способны к образованию фармацевтически приемлемых солей присоединения кислоты посредством обработки подходящей кислотой. Подходящие кислоты включают фармацевтически приемлемые неорганические кислоты и фармацевтически приемлемые органические кислоты. Иллюстративные фармацевтически приемлемые соли присоединения кислоты включают гидрохлорид, гидробромид, нитрат, метилнитрат, сульфат, бисульфат, сульфамат, фосфат, ацетат, гидроксиацетат, фенилацетат, пропионат, бутират, изобутират, валерат, малеат, гидроксималеат, акрилат, фумарат, малат, тартрат, цитрат, салицилат, гликолят, лактат, гептаноат, фталат, оксалат, сукцинат, бензоат, о-ацетоксибензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, нафтоат, гидроксинафтоат, манделат, таннат, формиат, стеарат, аскорбат, пальмитат, олеат, пируват, памоат, малонат, лаурат, глутарат, глутамат, эстолат, метансульфонат (мезилат), этансульфонат (эзилат), 2-гидроксиэтансульфонат, бензолсульфонат (безилат), аминобензолсульфонат, п-толуолсульфонат (тозилат) и нафталин-2-сульфонат.
Термин "ингибитор PAD" или "ингибитор для PAD" применяют для идентификации соединения, которое способно к взаимодействию с нейтрофильными внеклеточными ловушками (NET) и, более конкретно, к цитруллинированию гистонов, которое происходит во время нетоза. Ингибирование ферментативной активности PAD4 означает снижение способности фермента PAD4 таким образом, что образование цитруллина ингибируется в процессе цитруллинирования. Предпочтительно, такое ингибирование специфично для фермента PAD4.
Термин, описанный один раз, имеет одинаковое значение на протяжении всего патента.
Несмотря на широкую применимость соединений, ингибирующих PAD4, описанных выше, идентификация химического остатка, который способствует ингибированию PAD, все еще остается проблемой. Идентификация и разработка новых соединений-ингибиторов PAD4 для лечения нарушений, опосредованных PAD4, крайне необходима для лечения таких заболеваний, как, например, ревматоидный артрит, васкулит, системная красная волчанка, кожная красная волчанка, язвенный колит, рак, кистозный фиброз, астма, рассеянный склероз и псориаз.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, его полиморфы, стереоизомеры, пролекарства на его основе, его сольваты, сокристаллы, промежуточные соединения на его основе, его фармацевтически приемлемые соли, и метаболиты, где
X выбран из О или S; Z представляет собой N; А выбран из N или CR1;
В выбран из N или CR2; D выбран из N или CR3; R1, R2, R3 и R4 независимо выбраны из водорода, гидроксила, циано, амино, галогена, C1-6алкила, С1-6алкокси, С3-6циклоалкила, C1-6галогеналкила, C1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, C1-6гетероарила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, C1-6гетероарил и C1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С3-6циклоалкила, С5-10арила, C1-6гетероциклила, C1-6гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-6алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклическнй арил и 5-10-членный моноциклический или бициклическнй гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-10гетероциклил и С1-10гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R1, R2, R3 и R4 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-6арила, С1-6гетероциклила, С1-6гетероарила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-4алкил, С1-4алкокси, С1-6гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-6алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси и гидроксила; R13 выбран из водорода, 5-10 членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклическнй арил и 5-10-членный моноциклический или бициклическнй гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила и SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-10гетероциклил и С1-10гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила или С1-6гетероарила; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-4алкокси, С3-6циклоалкила, С1-4 галогеналкила, С1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-6арила, С1-6гетероциклила, С1-6гетероарила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-4алкил, С1-4алкокси, С1-6гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-6алкокси, С1-4галогеналкила, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-6алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10 членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклическнй арил и 5-10-членный моноциклический или бициклическнй гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-10гетероциклил и С1-10гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R1, R2, R3 и R4 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-4галогеналкила, C1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-6арила, С1-6гетероциклила, С1-6гетероарила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-4алкил, С1-4алкокси, С1-6гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-6алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси и гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С5-10арила, С1-10гетероциклила или С1-10гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-10гетероциклил и С1-10гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила или С1-6гетероарила; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-4гетероциклила, С1-4гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-4гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила, SO2C1-4гетероарила, С1-4ациламино или С1-4алкиламино, где С1-4алкил, С1-4алкокси, С1-4гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-4гетероциклила, С1-4гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-4алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, C1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила или С(O)С1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-10гетероциклил и С1-10гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила и С1-6гетероарила; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-4гетероциклила, С1-4гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-4гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила, SO2C1-4гетероарила, С1-4ациламино или С1-4алкиламино, где С1-4алкил, С1-4алкокси, С1-4гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-4гетероциклила, С1-4гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-4алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-4алкиламино, С1-4ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-4алкила, галогена, С1-44алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклическнй арил и 5-10-членный моноциклический или бициклическнй гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила или С(O)С1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-10гетероциклил и С1-10гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила или С1-6гетероарила и их комбинаций; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-4гетероциклила, С1-4гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-4гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила, SO2C1-4гетероарила, С1-4ациламино или C1-4алкиламино, где С1-4алкил, С1-4алкокси, С1-4гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-4гетероциклила, С1-4гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-4алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси и гидроксила и их комбинаций; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила и С(O)С1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-10гетероциклил и С1-10гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 независимо выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С5-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила или С1-6гетероарила; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С5-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила, SO2C1-6гетероарила, С1-4ациламино или С1-4алкиламино, где С1-4алкил, С1-6алкокси, С1-6гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано и гидроксила; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-4алкиламино, С1-4ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-4алкила, галогена, С1-4алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклическнй арил и 5-10-членный моноциклический или бициклическнй гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-9арила, С1-9гетероциклила и С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-6циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4галогеналкила, С1-4алкокси, С3-6циклоалкила, C5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, C1-4галогеналкокси, С5-6арила, С1-6гетероциклила или С1-6гетероарила; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, C1-6гетероциклила, С1-6гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила, SO2C1-6гетероарила, С1-4ациламино или С1-6алкиламино, где С1-4алкил, С1-4алкокси, С1-6гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано и гидроксила; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-4алкиламино, С1-4ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-4алкила, галогена, С1-4алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-6циклоалкил, С5-9арил, С1-9гетероциклил и С1-6гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4галогеналкила, С1-4алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила или С1-6алкокси; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила, SO2C1-6гетероарила, С1-4ациламино или С1-4алкиламино, где С1-4алкил, С1-4алкокси, С1-6гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано и гидроксила; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-4алкиламино, С1-4ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-4алкила, галогена, С1-4алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклическнй арил и 5-10-членный моноциклический или бициклическнй гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-9арила, С1-9гетероциклила и С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-6циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4галогеналкила, С1-4алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила или С1-6гетероарила; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси и С5-6арила, где С1-4алкил, С1-4алкокси и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, циано и гидроксила; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-4алкиламино, С1-4ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-4алкила, галогена, С1-4алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклическнй арил и 5-10-членный моноциклический или бициклическнй гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-6циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4галогеналкила, С1-4алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и пиано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R1, R2 и R3 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, C1-4галогеналкокси, С5-6арила, С1-6 гетероциклила или С1-6 гетероарила; R4 выбран из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-5циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-6арила, С1-6гетероциклила, С1-6 гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила, SO2C1-6гетероарила, С1-4ациламино или С1-4алкиламино, где С1-4алкил, С1-4алкокси, С1-6гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероциклила, C1-6гетероарила, циано и гидроксила; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-4алкиламино, С1-4ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-4алкила, галогена, С1-4алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила c1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4 галогеналкила, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-6циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4 галогеналкила, С1-4алкокси, С3-6циклоалкила, С5-6арила, С1-6 гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1;
В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила или С5-6арила, где С1-4алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, NH(CO)CH=CH-CH2-N(CH3)2 или С1-2алкиламино; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4 галогеналкила, С3-5циклоалкила, С5-9арила, С1-9 гетероциклила или C1-9 гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9 гетероциклил и C1-9 гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4 галогеналкила, С3-5циклоалкила, С5-6арила, C1-6 гетероарила, С1-6 гетероциклила, оксо, галогена и циано, где С5-6арил, C1-6 гетероарил и С1-6 гетеро циклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1алкила, С1алкокси, С3циклоалкила или С6арила, где С1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, NH(CO)CH=CH-CH2-N(CH3)2 или C1-2алкиламино; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, C1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, C1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода и С1-2 галкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила и С5-6арила, где С1-4алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено амино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, C1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила и С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, C1-6гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и C1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода и С1алкила; R4 выбран из водорода, С1алкила, С1алкокси, С3циклоалкила и С6арила, где С1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено амино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического ар ила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, C1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила и С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, C1-6гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и C1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -CH2OH и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или C1алкила; R4 выбран из водорода, C1алкила, C1алкокси, С3циклоалкила или С6арила, где C1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R11 и R12 взяты вместе с образованием 5-6-членного моноциклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-6-членное моноциклическое насыщенное гетероциклическое кольцо необязательно замещено амино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, C1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, C1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, C1-6гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -CH2OH и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1алкила; R4 выбран из водорода, С1алкила, С1алкокси, С3циклоалкила или С6арила, где С1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R11 и R12 взяты вместе с образованием 5-10-членного бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, C1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, С1-6 гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, C1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -CH2OH и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1алкила; R4 выбран из водорода, С1алкила, С1алкокси, С3циклоалкила или С6арила, где С1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R11 и R12 взяты вместе с образованием 5-членного моноциклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-членное моноциклическое насыщенное гетероциклическое кольцо необязательно замещено амино; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический ар ил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила или C1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, C1-6гетероарила, С1-6гетероциклила, оксо, галогена и циано, где С5-6арил, C1-6гетероарил и С1-6гетеро циклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1алкила; R4 выбран из водорода, С1алкила, С1алкокси, С3циклоалкила или С6арила, где С1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено амино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического арила, где 5-9-членный моноциклический арил необязательно замещен 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, C1-6гетероциклила или С1-6гетероарила.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1алкила; R4 выбран из водорода, С1алкила, С1алкокси, С3циклоалкила или С6арила, где С1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R11 и R12 взяты вместе с образованием 5-6-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-6-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено амино; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1 гетероатомом, выбранным из S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4 галогеналкила, С3-5циклоалкила, С5-6арила, C1-6 гетероциклила или C1-6гетероарила.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1алкила; R4 выбран из водорода, С1алкила, С1алкокси, С3циклоалкила или С6арила, где C1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R11 и R12 взяты вместе с образованием 5-6-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-6-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено амино; и R13 представляет собой индол, где индол необязательно замещен 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, C1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, C1-6гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и C1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X представляет собой О; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила или С5-6арила, где C1-4 алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-2алкиламино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, C1-6гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X представляет собой О; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила или С5-6арила, где С1-4алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10 членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-2алкиламино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4 галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила и С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, C1-6гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X представляет собой О; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила и С5-6арила, где С1-4 алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-2алкиламино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический или бициклический гетероарил необязательно замещен 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, C1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9 гетероциклила и С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9 гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, С1-6 гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X представляет собой О; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила или С5-6арила, где С1-4 алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-2алкиламино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического арила и 5-9-членного бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9-членный моноциклический арил и 5-9-членный бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9 гетероциклила и С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, С1-6 гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR4; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила или С5-6арила, где С1-4 алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-2алкиламино и NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода и 5-9-членного бициклического гетероарила с 1-5 гетероатомами, выбранными из N или О, где 5-9-членный бициклический гетероарил необязательно замещен 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, C1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9 гетероциклила или С1-9 гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9 гетероциклил и С1-9 гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4 галогеналкила, С3-5циклоалкила, С5-6арила, С1-6 гетероарила, C1-6 гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6 гетероарил и С1-6 гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X представляет собой О; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила или С5-6арила, где С1-4 алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10 членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-2алкиламино или NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического ар ила и 5-9-членного моноциклического или бициклического гетероарила с 1 гетероатомом, выбранным из N, S или О, где 5-9-членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы I, описанное в данном документе, где X представляет собой S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2 и R3 независимо выбраны из водорода или С1-2алкила; R4 выбран из водорода, С1-4алкила, С1-4алкокси, С3-5циклоалкила или С5-6арила, где С1-4алкил и С1-4алкокси необязательно замещены одной или несколькими группами, выбранными из С1-4алкила и С1-4алкокси; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-2алкиламино или NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из водорода, 5-9-членного моноциклического или бициклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-9 членный моноциклический или бициклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, фтора, брома, хлора, С1-4алкила, С1-4алкокси, C1-4галогеналкила, С3-5циклоалкила, С5-9арила, C1-9гетероциклила или C1-9гетероарила, где С1-4алкил, С1-4алкокси, С3-5циклоалкил, С5-9арил, С1-9гетероциклил и С1-9ргетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-4алкила, С1-4алкокси, С1-4 галогеналкила, С3-5циклоалкила, С5-6арила, С1-6гетероарила, C1-6гетероциклила, оксо, галогена и циано, где С5-6арил, C1-6гетероарил и C1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы II, его полиморфы, стереоизомеры, пролекарства на его основе, его сольваты, сокристаллы, промежуточные соединения на его основе, его фармацевтически приемлемые соли и метаболиты, где
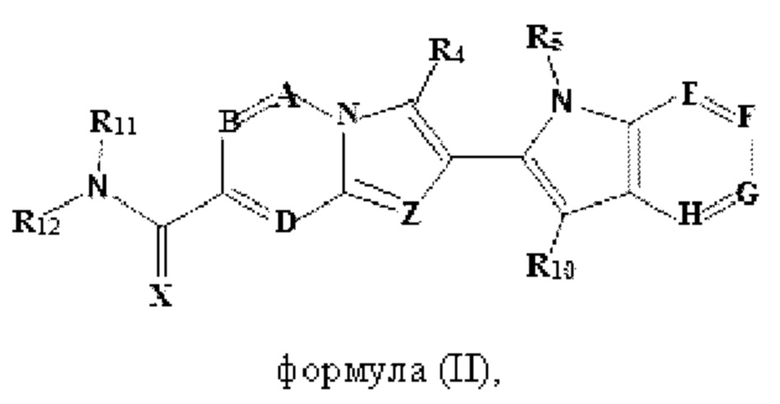
X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; Е выбран из N или CR6; F отсутствует или выбран из N и CR7; G отсутствует или выбран из N и CR8; Н отсутствует или выбран из N и CR9; R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, C1-6галогеналкила, C1-6 галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, C1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(О)С5-6арила, С(O)С1-6 гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-10гетероарил и C1-6 галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-9арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-9арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано;
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинации.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы II, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; Е выбран из N или CR6; F отсутствует или выбран из N и CR7; G отсутствует или выбран из N и CR8; Н отсутствует или выбран из N и CR9; R1, R2, R3, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, галогена, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С1-4 галогеналкокси, С3-5циклоалкила или С5-6арила; R4 и R5 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4 галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-6арила, С1-6гетероциклила, С1-9гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-4алкила, SO2C1-4 галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2RC1-4алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-4алкил, С1-4алкокси, С1-9гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С1-4алкилгидрокси, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы II, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; Е выбран из N или CR6; F отсутствует или представляет собой CR7; G отсутствует или представляет собой CR8; Н отсутствует или представляет собой CR9; R1, R2, R3, R6, R7, R8; R9 и R10 независимо выбраны из водорода, галогена, C1-2алкила, С1-2алкокси или С5-6арила; R4 и R5 независимо выбраны из водорода, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С1-9гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С1-4алкилгидрокси, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, NH(CO)CH=CH-CH2-N(CH3)2 или С1-2алкиламино.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы II, описанное в данном документе, где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; Е выбран из N или CR6; F отсутствует или представляет собой CR7; G отсутствует или представляет собой CR8; Н отсутствует или представляет собой CR9; R1, R2, R3, R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1алкила или С1алкокси; R4 выбран из водорода, С1алкила, С1алкокси, С3циклоалкила или С6арила, где С1алкил и С1алкокси необязательно замещены одной или несколькими группами, выбранными из С1алкила и С1алкокси; R5 выбран из водорода, С1-4алкила, C1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-9арила, C1-4гетероциклила или C1-9гетероарила, где С1-4алкил, С1-4алкокси, C1-9гетероарил и C1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, C1-4алкилгидрокси, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, C1-6гетероарила, циано, галогена и гидроксила, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, C1-6алкила, C1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амин о и NH(CO)CH=CH-CH2-N(СН3)2.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы III, его полиморфы, стереоизомеры, пролекарства на его основе, его сольваты, сокристаллы, промежуточные соединения на его основе, его фармацевтически приемлемые соли и метаболиты, где
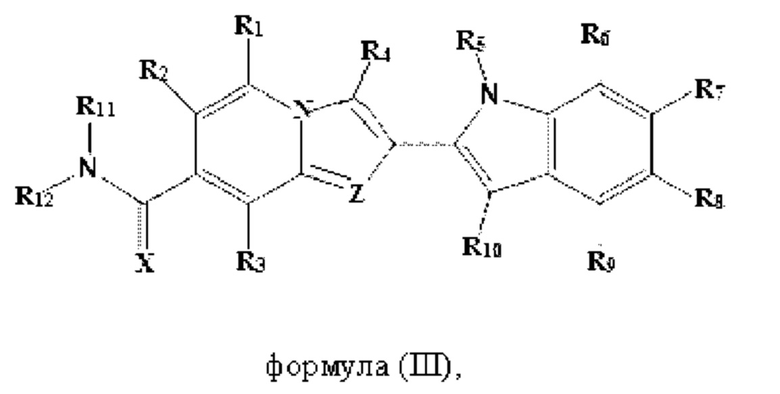
X выбран из О или S; Z представляет собой N; R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, C1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, C1-6ациламино, C1-6алкиламино, C5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, C(O)C1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-10гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-9арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-9арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы III, описанное в данном документе, где X выбран из О или S; Z представляет собой N; R1, R2, R3, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С1-4 галогеналкокси, С3-5циклоалкила, С5-6арила, С1-6гетероциклила или С1-6гетероарила; R4 и R5 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-10гетероциклила, С1-10гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-10гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-9арила, С1-6гетероциклила, С1-6 гетероарила, циано, галогена и гидроксила, где С5-9арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы III, описанное в данном документе, где X выбран из О или S; Z представляет собой N; R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-9арила, С1-9гетероциклила, С1-9гетероарила, С(O)С1-4алкила, С(O)С1-4галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-4алкил, С1-4алкокси, С1-9гетероарил и С1-4галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С1-4алкилгидрокси, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси и гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы III, описанное в данном документе, где X выбран из О или S; Z представляет собой N; R1, R2, R3, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, галогена, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С1-4 галогеналкокси, С3-5циклоалкила или С5-6арила; R4 и R5 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4 галогеналкила, С1-4галогеналкокси, С1-4ациламино, С1-4алкиламино, С5-9арила, С1-9гетероциклила, С1-9эгетероарила, С(O)С1-4алкила, С(O)С1-4 галогеналкила, C(O)NR15, С(O)С1-4алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-4алкила, SO2C1-4галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-4алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-4алкил, С1-4алкокси, С1-9гетероарил и С1-4 галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С1-4алкилгидрокси, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы III, описанное в данном документе, где X выбран из О или S; Z представляет собой N; R1, R2, R3, R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-4алкила, С1-4алкокси или С5-6арила; R4 и R5 независимо выбраны из водорода, С1-4алкила, С1-4алкокси, С3-6циклоалкила, С1-4галогеналкила, С1-4галогеналкокси, С5-9арила, С1-9гетероциклила или С1-9гетероарила, где С1-4алкил, С1-4алкокси, С1-9гетероарил и С1-4 галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-4алкила, С1-4алкокси, С1-4 галогеналкила, С1-4алкилгидрокси, С3-6циклоалкила, С5-6арила, С1-6гетероциклила, C1-6гетероарила, циано, галогена и гидроксила, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, C1-4алкиламино и NH(CO)CH=CH-CH2-N(CH3)2.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы (I) или его полиморфы, стереоизомеры, пролекарства на его основе, его сольваты, сокристаллы, промежуточные соединения на его основе, его фармацевтически приемлемые соли и метаболиты, которые выбраны из группы, состоящей из
1) (R)-(3-аминопиперидин-1-ил)(2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
2) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
3) (R)-(3-аминопиперидин-1-ил)(2-(1-бензил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
4) (R)-(3-аминопиперидин-1-ил)(2-(1-этил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
5) (R)-(3-аминопиперидин-1-ил)(2-(1-этил-3-фенил-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
6) (R)-(3-аминопирролидин-1-ил)(2-(1-этил-3-фенил-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
7) (R)-(3-аминопирролидин-1-ил)(2-(1-этил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
8) (R)-(3-аминопирролидин-1-ил)(2-(1-(циклопропилметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
9) (2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)(гексагидро-2Н-пиридо[4,3-b][1,4]оксазин-6(5Н)-ил)метанона,
10) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-4-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
11) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((тетрагидро-2Н-пиран-4-ил)метил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
12) (R)-(3-аминопиперидин-1-ил)(2-(1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
13) (R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
14) (R)-4-((2-(7-(3-аминопиперидин-1-карбонил)-3-метилимидазо[1,2-а]пиридин-2-ил)-1Н-индол-1-ил)метил)бензонитрила,
15) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-3-илметил)-1H-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
16) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
17) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(2,2,2-трифторэтил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
18) (R)-4-((2-(7-(3-аминопиперидин-1-карбонил)-3-метилимидазо[1,2-а]пиридин-2-ил)-1Н-индол-1-ил)метил)-1-метилпиридин-2-(1Н)-она,
19) (R)-(3-аминопиперидин-1-ил)(2-(3-этилбензо[b]тиофен-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
20) (R)-(3-аминопиперидин-1-ил)(2-(1-(4-хлорбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
21) (R)-(3-аминопиперидин-1-ил)(2-(1-(2-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
22) (R)-(3-аминопиперидин-1-ил)(2-(1-этил-5-фенил-1Н-пиррол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
23) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
24) (R)-(3-аминопиперидин-1-ил)(2-(1-этил-1Н-пирроло[2,3-b]пиридин-2-ил)-3-метилимидазо [1,2-а]пиридин-7-ил)метанона,
25) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1H-индол-2-ил)-3,5-диметилимидазо[1,2-а]пиридин-7-ил)метанона,
26) (R)-(3-аминопиперидин-1-ил)(2-(1-бензил-1Н-индол-2-ил)-3,5-диметилимидазо[1,2-а]пиридин-7-ил)метанона,
27) (R)-(3-аминопиперидин-1-ил)(3,5-диметил-2-(1-(пиридин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
28) (R)-(3-аминопиперидин-1-ил)(2-(1-(циютопропилметил)-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
29) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-5-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
30) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-7-метил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
31) (R)-(3-аминопиперидин-1-ил)(2-(2-этилфенил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
32) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-ил)метанона,
33) (R)-(3-аминопиперидин-1-ил)(3-циклопропил-2-(1-(циклопропилметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
34) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-ил)метанона,
35) (R)-(3-аминопиперидин-1-ил)(2-(1-(3-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
36) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(тиофен-3-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
37) (R)-(3-аминопиперидин-1-ил)(2-(1-(фуран-3-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
38) (R)-3-аминопиперидин-1-ил)(2-(1-(1-(4-фторфенил)этил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
39) (R)-(3-аминопиперидин-1-ил)(2-(1-этил-5-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а] пиридин-7-ил)метанона,
40) (R)-(3-аминопиперидин-1-ил)(2-(1-(циютопропилметил)-4-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
41) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((4-метилтиазол-2-ил)метил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
42) (R)-(3-аминопиперидин-1-ил)(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
43) (R)-(3-аминопиперидин-1-ил)(2-(5-бром-1-(циклопропилметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
44) (R)-(3-аминопиперидин-1-ил)(2-(7-хлор-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
45) (R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метантиона,
46) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-метил-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
47) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-7-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
48) (R)-(3-аминопиперидин-1-ил)(2-(1-((2,4-диметилтиазол-5-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
49) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((2-метилтиазол-5-ил)метил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
50) соли (R)-(3-аминопиперидин-1-ил)(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты,
51) (R)-(3-аминопиперидин-1-ил)(2-(6-метокси-1-(пиридин-3-илметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
52) соли R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты,
53) (R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
54) (R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(4-фторбензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
55) (R)-(3-аминопиперидин-1-ил)(2-(5,6-дифтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
56) (R,E)-4-(диметиламино)-N-(1-(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)бут-2-енамида,
57) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
58) соли (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиримидин-5-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты,
59) (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридазин-3-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона,
60) (R)-(3-аминопиперидин-1-ил)(2-(1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
61) (R)-(3-аминопиперидин-1-ил)(2-(1-(циклобутилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
62) (R)-(3-аминопиперидин-1-ил)(2-(1-((3-фторпиридин-2-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
63) (R)-(3-аминопиперидин-1-ил)(2-(1-((5-метоксипиридин-2-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
64) (R)-(3-аминопиперидин-1-ил)(2-(1-(2-метоксиэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
65) (R)-(3-аминопиперидин-1-ил)(2-(1-(2-гидроксиэтил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
66) (R)-(3-аминопиперидин-1-ил)(2-(6-метокси-1-(пиридин-4-илметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
67) (R)-(3-аминопиперидин-1-ил)(2-(1-этил-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
68) (R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(пиридин-4-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
69) (R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(пиридин-3-илметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
70) (R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
71) (R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
72) (R)-(3-аминопиперидин-1-ил)(2-(1-этил-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
73) (R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
74) (R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(пиридин-4-илметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
75) (R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
76) (R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(4-фторбензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
77) (R)-(3-аминопиперидин-1-ил)(2-(7-хлор-1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
78) соли (R)-(3-аминопиперидин-1-ил)(2-(1-(2,2-дифторэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты,
79) (R)-(3-аминопиперидин-1-ил)(2-(1-((5-фторпиридин-2-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
80) (R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-6-метокси-1Н-индол-2-ил)-3-метилимидазо [1,2-а] пиридин-7-ил)метанона,
81) (R)-(3-аминопиперидин-1-ил)(2-(1-(4-(гидроксиметил)бензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
82) (R)-(3-аминопиперидин-1-ил)(2-(1-изобутил-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
83) (R)-(3-аминопиперидин-1-ил)(2-(1-(2,2-дифторэтил)-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона,
84) (R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона, и
85) (R)-(3-аминопиперидин-1-ил)(2-(1-(4-фтор-3-метоксибензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона, и
86) (R)-(3-аминопиперидин-1-ил)(2-(1-(циютопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-ил)метанона.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы (I), формулы (II) и формулы (III) по любому из пп. 1-11 или их полиморфов, стереоизомеров, пролекарств на их основе, их сольватов, сокристаллов, промежуточных соединений на их основе, их фармацевтически приемлемых солей и метаболитов.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы (I) или их полиморфов, стереоизомеров, пролекарств на их основе, их сольватов, сокристаллов, промежуточных соединений на их основе, их фармацевтически приемлемых солей и метаболитов, при этом способ включает осуществление реакции R13CH(O) и R4CH2NO2 с соединением, выбранным из формулы (IVA) или формулы (IV),
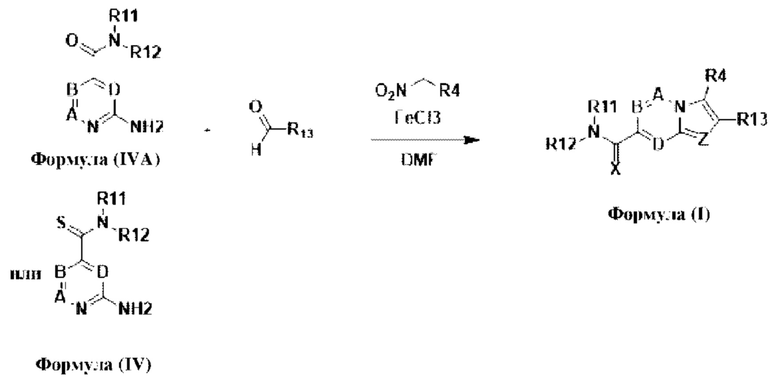
где R13 в R13CH(O) выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из группы, состоящей из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2RC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-6гетероциклил и С1-6гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; А в формулах (IVA) и (IV) выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца, необязательно с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, NHC(NH)CH2Cl, -NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; R4 в R4CH2NO2 выбран из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2RC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-10арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-10арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; X в формуле (I) выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R1, R2, R3 и R4 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С3-6циклоалкила, С5-10арила, C1-6гетероциклила, С1-6гетероарила, циано и гидроксила; R11 представляет собой водород; R12 выбран из С1-6алкиламино и 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, или R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, -NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; R13 выбран из водорода, 5-10-членного моноциклического или бициклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членный моноциклический или бициклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из гидроксила, циано, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, C1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-6алкила, C(O)C1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С3-6циклоалкил, С5-10арил, С1-6гетероциклил и С1-6гетероарил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С5-6арила, С1-6гетероарила, С1-6гетероциклила, оксо, галогена, гидроксила и циано, где С5-6арил, С1-6гетероарил и C1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы (II) или их полиморфов, стереоизомеров, пролекарств на их основе, их сольватов, сокристаллов, промежуточных соединений на их основе, их фармацевтически приемлемых солей и метаболитов, при этом способ включает осуществление реакции формулы (V) и R4CH2NO2 с соединением, выбранным из формулы (IVA) или формулы (IV),
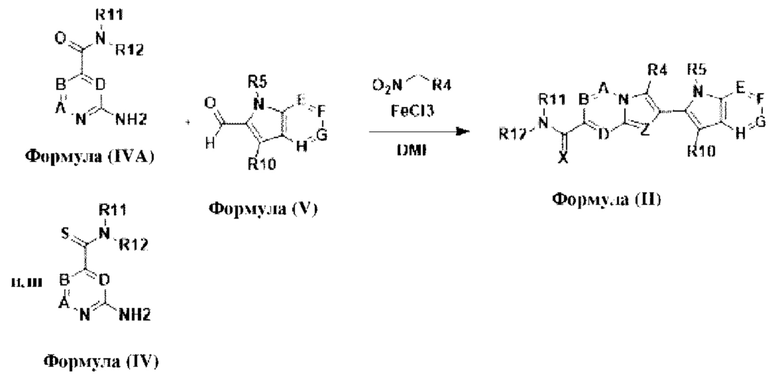
где А в формулах (IVA) и (IV) выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца, необязательно с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, C1-6алкила, галогена, C1-6алкокси или гидроксила; R4 в R4CH2NO2 выбран из водорода, гидроксила, циано, амино, галогена, С1-6алкила, C1-6алкокси, С3-6циклоалкила, C1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-6алкила, C(O)C1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-10арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-10арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; Е в формуле (V) выбран из N, С5-6арила или CR6; F отсутствует или выбран из N и CR7; G отсутствует или выбран из N и CR8; Н отсутствует или выбран из N и CR9; R1, R2, R3, R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, C1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, C1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6 галогеналкила, C1-6алкилгидрокси, С3-6циклоалкила, С5-10арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-10арил, C1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; X в формуле (II) выбран из О или S; Z представляет собой N; А выбран из N или CR1; В выбран из N или CR2; D выбран из N или CR3; Е выбран из N или CR6; F отсутствует или выбран из N и CR7; G отсутствует или выбран из N и CR8; Н отсутствует или выбран из N и CR9; R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, C(O)C1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где C1-6алкил, С1-6алкокси, С1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-10арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-10арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца, необязательно с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, С1-6ациламино, -NHC(NH)CH2Cl, NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы (III) или их полиморфов, стереоизомеров, пролекарств на их основе, их сольватов, сокристаллов, промежуточных соединений на их основе, их фармацевтически приемлемых солей и метаболитов, при этом способ включает осуществление реакции формулы (VII), R4CH2NO2 с соединением, выбранным из формулы (VIA) или формулы (VI),
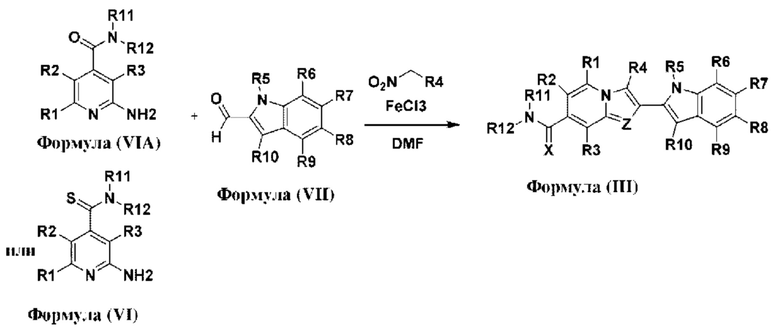
где R1, R2 и R3 в формуле (VIA) и формуле (VI) независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, С1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкил амино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-6алкилгидрокси, С3-6циклоалкила, С5-10арила, С1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-10арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R5, R6, R7, R8, R9 и R10 в формуле (VII) и R4 в R4CH2NO2 независимо выбраны из водорода, гидроксила, циано, амино, галогена, C1-6алкила, С1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, C1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, C(O)C1-6алкила, С(O)С1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(О)С5-6арила, C(О)C1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, C1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, C1-6алкилгидрокси, С3-6циклоалкила, С5-10арила, C1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-10арил, С1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; X в формуле (III) выбран из О или S; Z представляет собой N; R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, гидроксила, циано, амино, галогена, С1-6алкила, C1-6алкокси, С3-6циклоалкила, С1-6галогеналкила, С1-6галогеналкокси, C1-6ациламино, С1-6алкиламино, С5-10арила, С1-6гетероциклила, С1-6гетероарила, С(O)С1-6алкила, C(O)C1-6галогеналкила, C(O)NR15, С(O)С1-6алкиламино, С(O)С5-6арила, С(O)С1-6гетероарила, SO2C1-6алкила, SO2C1-6галогеналкила, SO2C3-6циклоалкила, SO2NR15, SO2NC1-6алкиламино, SO2C5-6арила или SO2C1-6гетероарила, где С1-6алкил, С1-6алкокси, С1-6гетероарил и С1-6галогеналкокси необязательно замещены одной или несколькими группами, выбранными из водорода, оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, C1-6алкилгидрокси, С3-6циклоалкила, С5-10арила, C1-6гетероциклила, С1-6гетероарила, циано, галогена и гидроксила, где С5-10арил, C1-6гетероарил и С1-6гетероциклил необязательно замещены одной или несколькими группами, выбранными из водорода, C1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного или ненасыщенного гетероциклического кольца, необязательно с 1-5 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное или ненасыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино, С1-6алкиламино, C1-6ациламино, -NHC(NH)CH2Cl, -NH(CO)CH=CH-CH2-N(CH3)2, С1-6алкила, галогена, С1-6алкокси или гидроксила; и R15 выбран из группы, состоящей из водорода, С1-6алкила и их комбинаций.
В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I), формулы (II) и формулы (III) или его фармацевтически приемлемую соль по любому из пп. 1-11 вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одной или несколькими другими фармацевтическими композициями.
В еще одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, описанной в данном документе, где композиция находится в форме, выбранной из таблетки, капсулы, порошка, сиропа, раствора, аэрозоля и суспензии.
В одном варианте осуществления настоящего изобретения предусмотрены соединения формулы (I), формулы (II) и формулы (III) или их фармацевтически приемлемая соль, описанная в данном документе, где фармацевтически приемлемая соль выбрана из соли, полученной из неорганических оснований, таких как Li, Na, K, Са, Mg, Fe, Cu, Zn и Mn; солей органических оснований, таких как соли N,N'-диацетилэтилендиамина, глюкамина, триэтиламина, холина, дициклогексил амина, бензиламина, триалкиламина, тиамина, гуанидина, диэтаноламина, α-фенилэтиламина, пиперидина, морфолина, пиридина, гидроксиэтилпирролидина, гидроксиэтилпиперидина, аммония, соли замещенного аммония, соли алюминия и т.п. Соли также включают соли аминокислот, таких как глицин, аланин, цистин, цистеин, лизин, аргинин, фенилаланин и гуанидин. При необходимости соли могут включать соли присоединения кислоты, которые представляют собой сульфаты, нитраты, фосфаты, перхлораты, бораты, гидрогалогениды, ацетаты, тартраты, малеаты, цитраты, сукцинаты, пальмоаты, метансульфонаты, тозилаты, бензоаты, салицилаты, гидроксинафтоаты, бензолсульфонаты, аскорбаты, глицерофосфаты, кетоглутараты.
В одном варианте осуществления настоящего изобретения предусмотрены соединения формулы (I), формулы (II) и формулы (III) или их фармацевтически приемлемая соль для применения в изготовлении лекарственного препарата для ингибирования одного или нескольких PAD в клетке.
В одном варианте осуществления настоящее изобретение относится к способу ингибирования одного или нескольких представителей семейства PAD в клетке с помощью эффективного количества соединений формулы (I), формулы (II) и формулы (III) или их фармацевтически приемлемой соли вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одной или несколькими другими фармацевтическими композициями.
В одном варианте осуществления настоящее изобретение относится к способу лечения состояния, опосредованного одним или несколькими PAD, при этом способ включает введение субъекту, страдающему от состояния, опосредованного одним или несколькими представителями семейства PAD, терапевтически эффективного количества соединений формулы (I), формулы (II) и формулы (III) или их фармацевтически приемлемой соли вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одной или несколькими другими фармацевтическими композициями.
В одном варианте осуществления настоящего изобретения предусмотрено соединение формулы (I), формулы (II) и формулы (III), применяемое для лечения ревматоидного артрита, васкулита, системной красной волчанки, язвенного колита, рака, кистозного фиброза, астмы, кожной красной волчанки и псориаза.
В одном варианте осуществления настоящее изобретение относится к применению соединения формулы (I), формулы (II) и формулы (III) или фармацевтически приемлемой соли или композиции для лечения состояния, опосредованного одним или несколькими представителями семейства PAD; или для лечения и/или предупреждения лечения ревматоидного артрита, васкулита, системной красной волчанки, язвенного колита, рака, кистозного фиброза, астмы, кожной красной волчанки и псориаза вместе с другими необходимыми с клинической точки зрения средствами или биологическими средствами.
В одном варианте осуществления настоящее изобретение относится к применению соединения формулы (I), формулы (II) и формулы (III) или фармацевтически приемлемой соли или композиции для лечения состояния, опосредованного одним или несколькими представителями семейства PAD; или для лечения и/или предупреждения индуцированного кислотой повреждения легких, синдрома дыхательной недостаточности, индуцированной аллергеном астмы, аллергического бронхолегочного заболевания, хронического заболевания легких у недоношенных детей, хронического обструктивного заболевания легких, колита, кистозного фиброза, подагрического артрита, воспалительного заболевания кишечника, воспалительного заболевания легких, воспалительной боли, ювенильного ревматоидного артрита, заболевания почек, повреждения почек, вызванного паразитарными инфекциями, профилактики отторжения трансплантированной почки, повреждения легких, волчанки, волчаночного нефрита, рассеянного склероза, мышечной дистрофии, индуцированной не аллергеном астмы, остеоартрита, периодонтита, перитонеального эндометриоза, псориаза, легочного заболевания, легочного фиброза, пиогенного стерильного артрита, почечного заболевания, ревматического заболевания, ревматоидного артрита, сепсиса, острой боли и язвенного колита, вместе с другими необходимыми с клинической точки зрения средствами или биологическими средствами.
В одном варианте осуществления настоящее изобретение относится к способу лечения и/или предупреждения состояния, опосредованного нарушением функционирования одного или нескольких представителями семейства PAD, включающему введение субъекту, страдающему от состояния, опосредованного одним или несколькими представителями семейства PAD, терапевтически эффективного количества соединения формулы (I), формулы (II) и формулы (III) или его фармацевтически приемлемой соли вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одним или несколькими другими фармацевтическими композициями.
В одном варианте осуществления настоящее изобретение относится к способу лечения ревматоидного артрита, при этом указанный способ включает введение комбинации соединений формулы (I), формулы (II) и формулы (III) или их фармацевтически приемлемой соли вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одной или несколькими другими фармацевтическими композициями, с другими необходимыми с клинической точки зрения средствами или биологическими средствами субъекту, нуждающемуся в этом.
В одном варианте осуществления настоящее изобретение относится к способу лечения рака, при этом указанный способ включает введение комбинации соединений формулы (I), формулы (II) и формулы (III) или их фармацевтически приемлемых солей вместе с фармацевтически приемлемым носителем, с другими необходимыми с клинической точки зрения средствами, представляющими собой иммуномодуляторы, субъекту, нуждающемуся в этом.
ПРИМЕРЫ
Как используется в данном документе, символы и условные обозначения, применяемые в таких способах, схемах и примерах, соответствуют таковым, применяемым в современной научной литературе, например, журнал Американского химического общества. Если не указано иное, все исходные материалы получали от коммерческих поставщиков и применяли без дополнительной очистки. В примерах и по всему описанию могут применяться, в частности, следующие аббревиатуры.
Аббревиатуры:
АсОН - Уксусная кислота
ВОС2О - Ди-трет-бутилдикарбонат
nBuLi - н-Бутиллитий
ВиОН - Бутанол
Bz - Бензил
Cbz - Карбоксибензил
сНех - Циклогексан
Cs2CO3 - Карбонат цезия
DCM/СН2С12 - Дихлорметан
DIAD - Диизопропилазодикарбоксилат
Диоксан - 1,4-Диоксан
DIPEA - N,N-диизопропилэтиламин
DMSO - Диметилсульфоксид
DMF - N,N-диметилформамид
Et3N - Триэтиламин
Эфир - Диэтиловый эфир
EtOAc - Этилацетат
HATU - о-(7-Азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат
HPLC - Высокоэффективная жидкостная хроматография
IPA - Изопропиловый спирт
K2CO3 - Карбонат калия
KOH - Гидроксид калия
LiOH - Гидроксид лития
LCMS или LC/MS - Жидкостная хроматография с масс-спектрометрией
МеОН - Метанол
Мин. - Минуты
Na2SO4 - Сульфат натрия
NaHCO3 - Бикарбонат натрия
NH4Cl - Хлорид аммония
Тетракиспалладий - Тетракис(трифенилфосфин)палладий
Pd/C - Палладий на угле
PTSA - п-Толуолсульфоновая кислота
К. д. - круглодонная(колба)
К. т./ к. т. - Комнатная температура
Rt - Время удерживания
TFA - Трифторуксусная кислота
TFAA - Трифторуксусный ангидрид
THF / thf - Тетрагидрофуран
TLC / tic - Тонкослойная хроматография
TMEDA - Тетраметилэтилендиамин
HOBt - Гидроксибензотриазол
EDC.HCl - Гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида.
В следующих примерах представлены подробности, касающиеся синтеза, реакций и вариантов применения соединений согласно настоящему изобретению. Следует понимать, что следующие примеры являются лишь иллюстративными, и что настоящее изобретение не ограничено подробностями, изложенными в данных примерах.
Соединения согласно настоящему изобретению могут быть получены множеством способов, включая стандартные способы в области химии. Любая ранее определенная переменная будет все так же иметь ранее определенное значение, если не указано иное. Иллюстративные способы общего синтеза указаны на нижеприведенных схемах и могут быть легко приведены в соответствие для получения других соединений по настоящему изобретению.
Также предусмотрен способ получения соединений формулы (I, II и III), представленный на следующей схеме 1, где все группы являются такими, как определено выше.
Пример 1
Общая процедура синтеза соединений формулы I, формулы II и формулы III
Схема 1
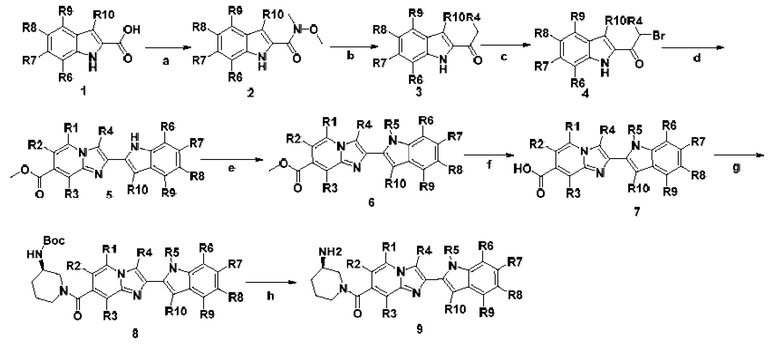
Указанный способ получения соединений формулы (I, II и III) включает следующие стадии.
Стадия 1. Соединение 1 подвергали превращению в соединение 2 в стандартных условиях с применением гидрохлорида N,O-диметилгидроксиламина, триэтиламина, HOBt и EDC.HCl (условие реакции а).
Стадия 2. Посредством обработки соединения 2 бромидом этилмагния (условие реакции b) получали промежуточное соединение 3.
Стадия 3. Промежуточное соединение 3 подвергали превращению в соединение 4 с применением фенилтриметиламмония трибромида (условие реакции с).
Стадия 4. Посредством обработки соединения 4 метил-2-аминоизоникотинатом или этил-2-хлор-6-метилизоникотинатом и NaHCO3 (условие реакции d) получали промежуточное соединение 5.
Стадия 5. Промежуточное соединение 5 подвергали превращению в соединение 6 путем осуществления реакции с замещенными бромидами (бромметилциклопропан) и Cs2CO3 (условие реакции е).
Стадия 6. Соединение 6 подвергали гидролизу с получением соединения 7 при условии реакции f.
Стадия 7. Посредством проведения реакции сочетания между соединением 7 и замещенными карбаматами, например трет-бутил-(R)-пиперидин-3-илкарбаматом, (условие реакции g) получали соединение 8.
Стадия 8. Соединение 8 подвергали превращению в конечное соединение 9 посредством удаления Вос-защитной группы (условие реакции h).
Общие положения и методы анализа
Соединения, применяемые в реакционных процессах, если не указано иное, были коммерчески доступны и приобретены у Combi-Blocks, Индия. Данные ЯМР получали на 400-МГц спектрометре от Varian. Все соединения были охарактеризованы с помощью 1Н ЯМР, а также масс-спектрометрии (MS-ESI, масс-спектрометрии с ионизацией электрораспылением). Все химические сдвиги 1Н приводились в частях на миллион (ppm) и измерялись относительно TMS или остаточного дейтерированного DMSO в качестве растворителя. Измерения MS (ESI) проводили на масс-спектрометре от Waters. Выходы представленных соединений относятся к выделенным соединениям.
Приведенные ниже примеры представлены исключительно в качестве иллюстрации и, следовательно, не должны быть истолкованы как ограничивающие объем настоящего изобретения.
Кроме того, класс соединений формулы I, формулы II и формулы III получали с применением общей процедуры, как описано выше.
Соединение 1
Синтез (R)-(3-аминопиперидин-1-ил)(2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (соединение-1)
Схема 2
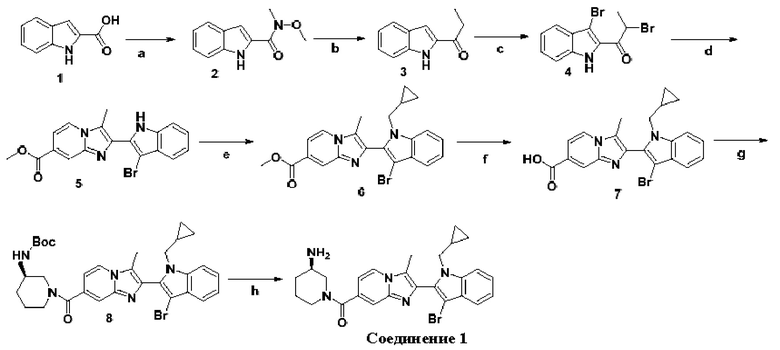
Стадия 1. Получение N-Метокси-N-метил-1H-индол-2-карбоксамида (2)
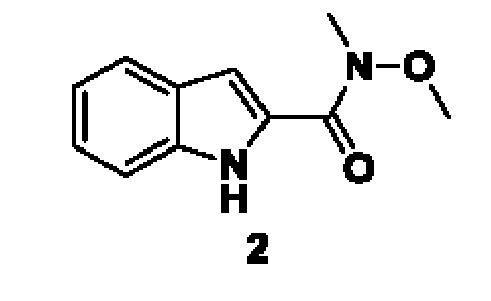
К перемешиваемому раствору 1H-индол-2-карбоновой кислоты (1, 25 г, 155,5 ммоль) и гидрохлорида N,О-диметилгидроксиламина (30,26 г, 310,2 ммоль) в DCM (500 мл) добавляли триэтиламин (107 мл, 775,6 ммоль) и HOBt (36,7 г, 232,9 ммоль) с последующим добавлением EDC.HCl (44,4 г, 232,6 ммоль) при 0°С (условие реакции а). Реакционную смесь перемешивали при к. т.в течение 4 ч. К реакционной смеси добавляли воду и DCM. DCM-слой отделяли и промывали солевым раствором, высушивали над сульфатом натрия и концентрировали при пониженном давлении. К полученному неочищенному веществу добавляли диэтиловый эфир (200 мл), перемешивали в течение 30 мин. и фильтровали с получением белого твердого вещества. Данное твердое вещество растворяли в EtOAc, пропускали через слой целита и выпаривали с получением указанного в заголовке соединения в виде грязно-белого твердого вещества (2) (27 г, выход 87%). MS (ESI): масса, рассч. для C11H12N2O2, 204,23; найденное значение масса/заряд, 205,1 [М+Н]+.
Стадия 2. Получение 1-(1H-индол-2-ил)пропан-1-она (3)
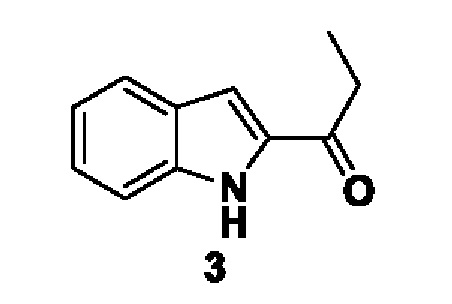
К перемешиваемому раствору N-метокси-N-метил-1H-индол-2-карбоксамида (2, 10 г, 49,01 ммоль) в THF (200 мл) по каплям добавляли 3 М раствор бромида этилмагния (49 мл, 147 ммоль) при 0°С (условие реакции b). Реакционную смесь перемешивали при к. т.в течение 16 ч. Реакционную смесь гасили насыщенным раствором NH4Cl (100 мл) при 0°С и экстрагировали с помощью EtOAc (500 мл). Органический слой отделяли, промывали солевым раствором, высушивали над сульфатом натрия и концентрировали при пониженном давлении. Неочищенное вещество очищали посредством колоночной флеш-хроматографии с получением указанного в заголовке соединения в виде грязно-белого твердого вещества (3) (53%, 4,5 г, выход 53%). MS (ESI): масса, рассч. для C11H11NO, 173,22; найденное значение масса/заряд, 174,1 [М+Н]+.
Стадия 3. Получение 2-бром-1-(3-бром-1Н-индол-2-ил)пропан-1-она (4)
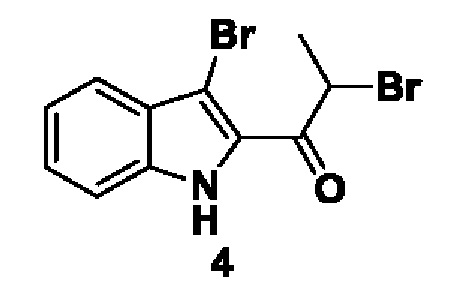
К перемешиваемому раствору 1-(1Н-индол-2-ил)пропан-1-она (3, 2,5 г, 14,45 ммоль) в THF (50 мл) добавляли трибромид фенилтриметиламмония (16,3 г, 43,35 ммоль) и перемешивали с обратным холодильником в течение 16 ч. (условие реакции с). Реакционную смесь охлаждали до к. т., добавляли воду (25 мл) и экстрагировали с помощью EtOAc (100 мл). Органический слой промывали насыщенным раствором NaHCO3 (20 мл), солевым раствором (20 мл) и выпаривали. Неочищенный продукт очищали посредством колоночной хроматографии с получением указанного в заголовке соединения в виде коричневого твердого вещества (4) (4 г, выход 86%). MS (ESI): масса, рассч. для C11H9Br2MO, 331,01; найденное значение масса/заряд, 333,9 [М+2Н]+.
Стадия 4. Получение метил-2-(3-бром-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (5)
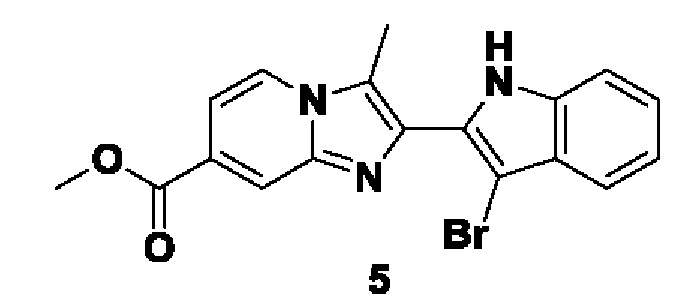
К перемешиваемому раствору 2-бром-1-(3-бром-1Н-индол-2-ил)пропан-1-она (4, 2 г, 5,24 ммоль) и метил-2-аминоизоникотината (0,92 г, 5,24 ммоль) в EtOH (20 мл) добавляли NaHCO3 (1,52 г, 26,2 ммоль) и перемешивали при 90°С в течение 16 ч. в герметичной пробирке (условие реакции d). Реакционную смесь охлаждали до к. т., добавляли воду (50 мл) и экстрагировали с помощью EtOAc (2×50 мл). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный продукт очищали посредством колоночной флеш-хроматографии с применением 25-30% EtOAc в гексане с получением указанного в заголовке продукта в виде коричневого твердого вещества (5) (0,45 г, выход 20,5%). MS (ESI): масса, рассч. для C18H14BrN3O2, 384,23; найденное значение масса/заряд, 385,0 [М+Н]+.
Стадия 5. Получение метил-2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (6)
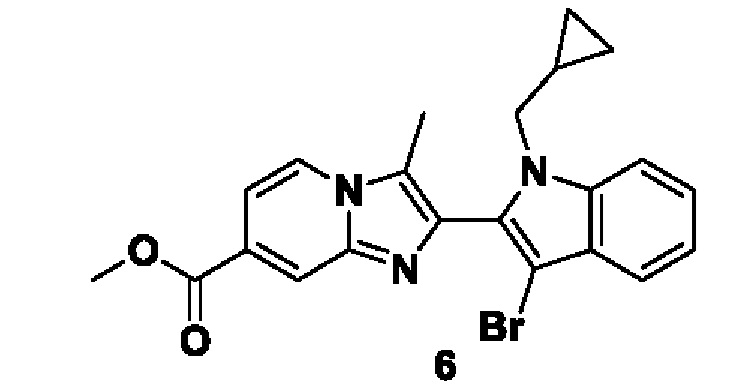
К перемешиваемому раствору метил-2-(3-бром-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (5, 0,4 г, 1,01 ммоль) в DMF (8 мл) добавляли Cs2CO3 (0,98 г, 3,01 ммоль) с последующим добавлением (бромметил)циклопропана (0,24 мл, 1,51 ммоль) и перемешивали при 80°С в течение 16 ч. (условие реакции е). Реакционную смесь охлаждали до к.т., добавляли воду (20 мл) и экстрагировали с помощью EtOAc (50 мл). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный продукт очищали посредством колоночной флеш-хроматографии с применением 25-30% EtOAc в гексане с получением указанного в заголовке продукта в виде коричневой смолы (6) (0,42 г, выход 90%). MS (ESI): масса, рассч. для C22H20BrN3O2, 438,33; найденное значение масса/заряд, 440,1 [М+2Н]+.
Стадия 6. Получение 2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоновой кислоты (7)
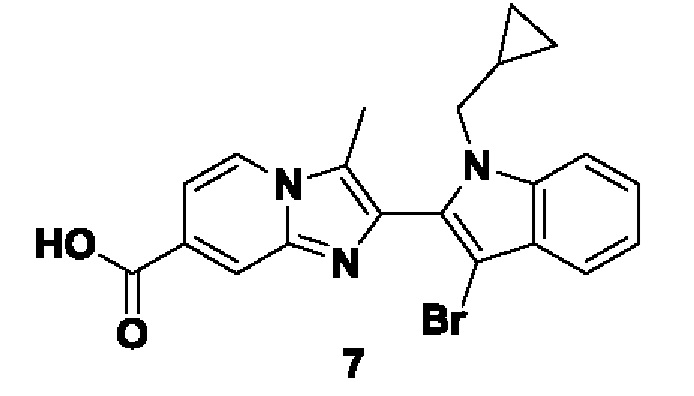
К перемешиваемому раствору метил-2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (6, 0,42 г, 0,98 ммоль) в МеОН (10 мл) добавляли 5 н. раствор NaOH (0,2 мл, 4,51 ммоль) и перемешивали с обратным холодильником в течение 1 ч (условие реакции f). Реакционную смесь охлаждали до к.т., выпаривали до сухого состояния. Полученное неочищенное вещество растворяли в воде (10 мл), подкисляли с применением насыщенного раствора лимонной кислоты, и соединение экстрагировали с помощью EtOAc (2×30 мл). Органический слой отделяли, промывали солевым раствором (10 мл), высушивали над безводным Na2SO4 и выпаривали под вакуумом с получением продукта в виде коричневого твердого вещества (7) (0,34 г, выход 83%). MS (ESI): масса, рассч. для C21H18BrN3O2, 424,30; найденное значение масса/заряд, 426,1 (М+2Н)+.
Стадия 7. Получение трет-бутил-(R)-(1-(2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (8)
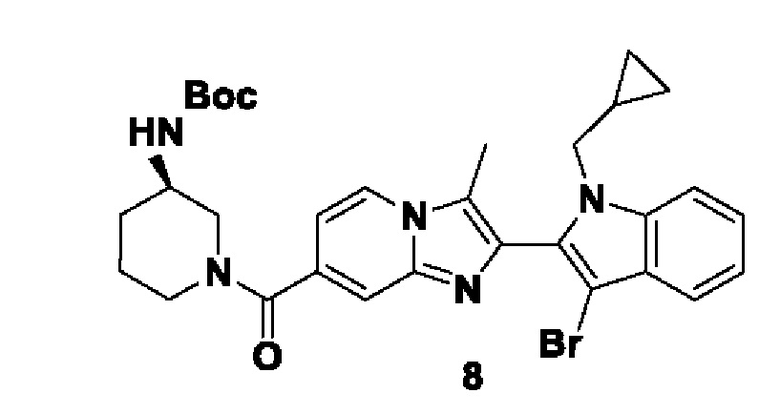
К раствору трет-бутил-(R)-пиперидин-3-ил-12-азанкарбоксилата (0,018 г, 0,09 ммоль) и 2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоновой кислоты (7, 0,04 г, 0,09 ммоль) в DCM (10 мл) при к. т.добавляли триэтиламин (0,037 мл, 0,27 ммоль) и пропилфосфоновый ангидрид (Т3Р, 50% в этилацетатном растворителе) (0,05 мл, 0,18 ммоль). Реакционную смесь перемешивали при к.т. в течение 12 ч (условие реакции g). Ее разбавляли с помощью DCM и промывали насыщенным раствором бикарбоната натрия. Органический слой отделяли, высушивали над сульфатом натрия и выпаривали при пониженном давлении с получением неочищенного вещества. Неочищенный продукт очищали посредством колоночной флеш-хроматографии с применением 5% метанола в DCM с получением необходимого продукта (8) (0,035 г, выход 82,5%). MS (ESI): масса, рассч. для C31H36BrN5O3, 605,0; найденное значение масса/заряд 606,3 [М+Н]+.
Стадия 8. Получение (R)-(3-аминопиперидин-1-ил)(2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо [1,2-а]пиридин-7 -ил)метанона (соединение 1)
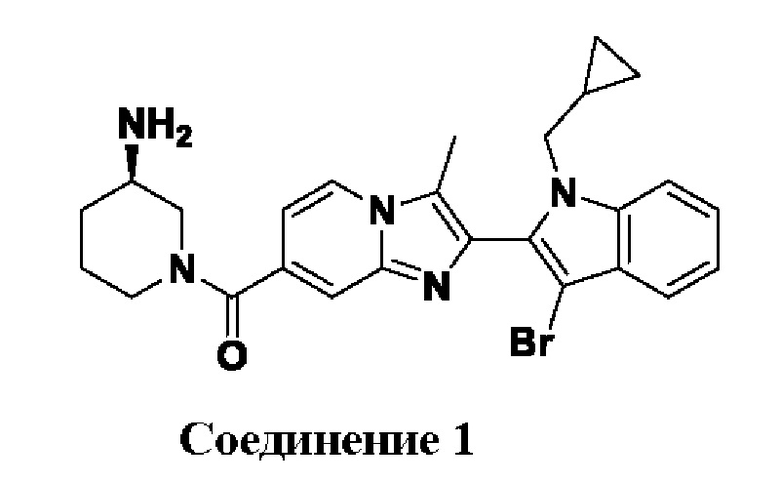
К перемешиваемому раствору трет-бутил-(R)-(1-(2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (8, 0,035 г, 0,005 ммоль) в DCM (10 мл) добавляли трифторуксусную кислоту (0,5 мл) при 0°С, затем его перемешивали при к.т. в течение 2 ч (условие реакции h). После завершения реакции растворитель выпаривали. Неочищенное вещество растворяли в воде (10 мл) и нейтрализовали с помощью насыщенного раствора NaHCO3 с получением неочищенного продукта. Неочищенное вещество очищали посредством колоночной флеш-хроматографии с применением 3-5% метанола в DCM с получением необходимого продукта (соединение 1) (0,012 г, выход 60%). 1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,45 (d, J=7,2 Гц, 1H), 7,67-7,61 (m, 2H), 7,49 (d, J=8 Гц, 1H), 7,29 (t, J=7,6 Гц, 1H), 7,20 (t, J=7,6 Гц, 1H), 7,02 (d, J=6,8 Гц, 1H), 4,49 (bs, 1H), 4,17 (d, J=7,2 Гц, 2H), 2,99 (bs, 1H), 1,97 (m, 2H), 1,69 (m, 2H), 1,50 (m, 2H), 1,31 (m, 1H), 1,26 (s, 3H), 1,00 (m, 1H), 0,87-0,84 (m, 2H), 0,26-0,25 (m, 2H), 0,04 (m, 2H). MS (ESI): масса, рассч. для C26H28BrN5O, 506,1; масса/заряд найденное значение 508,3 [М+2Н]+.
Соединение 2
Синтез (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (соединение-2)
Промежуточное соединение 8 синтезировали с применением процедуры, указанной на схеме 2 выше.
Схема 3
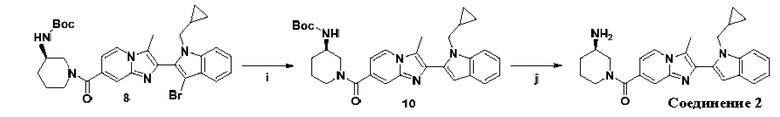
Стадия 1. Получение трет-бутил-(R)-(1-(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (10)
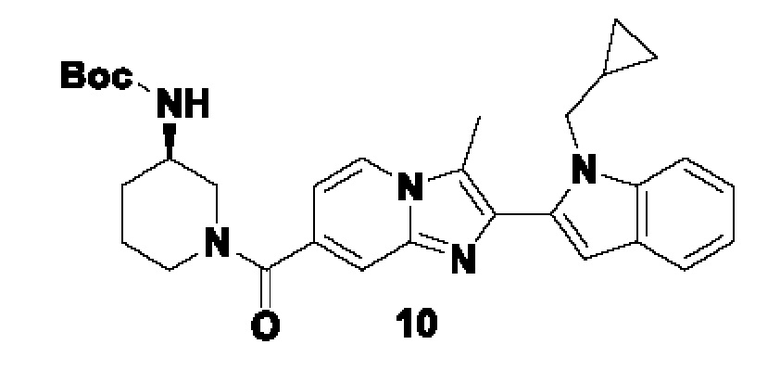
К перемешиваемому раствору трет-бутил-(R)-(1-(2-(3-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (8, 0,07 г, 0,33 ммоль) в МеОН (6 мл) добавляли цинковый порошок (0,1 г, 3,33 ммоль) с последующим добавлением гидроксида аммония (2 мл) и перемешивали при 90°С в течение 16 ч (условие реакции i). Реакционную смесь охлаждали до к.т., фильтровали через целит и фильтрат выпаривали. К неочищенному продукту добавляли воду (10 мл) и экстрагировали с помощью DCM (30 мл). Органический слой отделяли, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный продукт очищали посредством колоночной флеш-хроматографии с применением 2-6% МеОН в DCM с получением продукта в виде грязно-белого твердого вещества (10) (0,03 г, выход 35%). MS (ESI): масса, рассч. для C31H37N5O3, 527,29; найденное значение масса/заряд, 528,3 (М+Н)+.
Стадия 2. Получение (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (соединение 2)
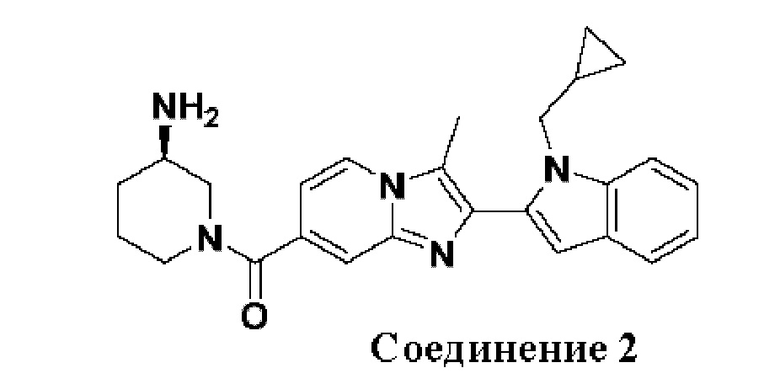
К перемешиваемому раствору трет-бутил-(R)-(1-(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-металимидазо[1,2-а]пиридтш-7-карбонил)пиперидин-3-ш[)карбамата (10, 0,03 г, 0,05 ммоль) в 1,4-диоксане (1 мл) добавляли 4М HCl в диоксане (0,5 мл) и реакционную смесь перемешивали при к. т.в течение 2 ч. (условие реакции j). Реакционную смесь выпаривали, растворяли в воде (5 мл) и повышали основность с применением насыщенного раствора NaHCO3. Соединение экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой высушивали над безводным Na2SO4. Неочищенный продукт очищали посредством колоночной флеш-хроматографии с применением 2-8% МеОН в DCM с получением продукта в виде коричневого твердого вещества (соединение 2) (0,005 г, выход 20%).
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,8 Гц, 1H), 7,57 (t, J=6,8 Гц, 2H), 7,16-7,14 (m, 2H), 7,06-6,99 (m, 2H), 6,64 (s, 1H), 4,46 (d, J=6,8 Гц, 2H), 2,91 (s, 3H), 2,65-2,59 (m, 2H), 2,00-1,95 (m, 3H), 1,69-l,55(m, 2H), 1,43-1,35 (m, 2H), 1,10 (m, 1H), 0,83-0,81 (m, 2H), 0,27-0,25 (m, 2H), 0,15-0,13 (m, 2H). MS (ESI): масса, рассч. для C26H29N5O, 427,55; масса/заряд найденное значение, 428,3 [М+Н]+.
Следующие соединения (соединения 3, 4, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 35, 36, 37, 38, 41, 42, 45, 46, 48 и 49) синтезировали с применением указанной выше процедуры, представленной для соединения 2 выше.
Соединение 3
(R)-(3-аминопиперидин-1-ил)(2-(1-бензил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
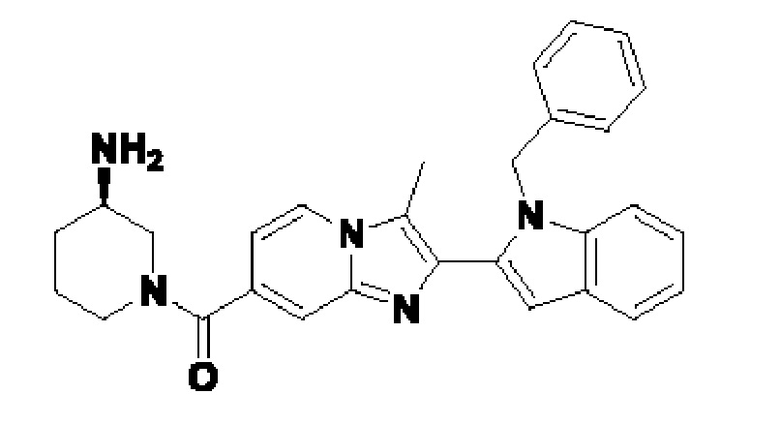
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,40 (d, J=6,8 Гц, 1H), 7,61-7,59 (m, 2H), 7,37 (d, J=7,6 Гц, 1H), 7,16-7,02 (m, 5H), 6,95-6,93 (m, 3H), 6,75 (s, 1H), 5,89 (s, 2H), 2,97-2,88 (m, 2H), 2,69-2,59 (m, 3H), 2,58-2,50 (m, 3H), 1,82-1,75 (m, 1H), 1,66-1,59 (m, 1H), 1,33-1,25 (m, 1H), 1,21-1,15 (m, 3H). MS (ESI): масса, рассч. для C29H29N5O, 463,59; масса/заряд найденное значение, 464,2 (М+Н)+.
Соединение 4
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
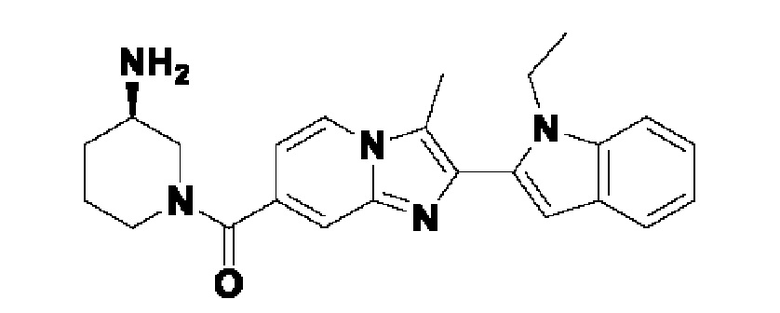
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,8 Гц, 1Н), 7,63 (s, 1Н), 7,58 (d, J=8 Гц, 1H), 7,51 (d, J=8 Гц, 1H), 7,18 (t, J=7,6 Гц, 1H), 7,06 (t, J=8 Гц, 1H), 7,00 (d, J=7,2 Гц, 1H), 6,63 (s, 1H), 4,54 (t, J=7,2 Гц, 2H), 3,01 (bs, 1H), 2,84 (bs, 2H), 2,65 (s, 3H), 1,99-1,97 (m, 2H), 1,88 (bs, 1H), 1,69 (bs, 1H), 1,45 (bs, 2H), 1,33-1,31 (m, 2H), 1,32 (t, J=6,8 Гц, 3H). MS (ESI): масса, рассч. для C24H27N5O, 401,22; масса/заряд найденное значение, 402,2 [М+Н]+.
Соединение 5
Синтез (R)-(3-аминопиперидин-1-ил)(2-(1-этил-3-фенил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (соединение 5)
Промежуточное соединение 1 синтезировали с применением процедуры, указанной для промежуточного соединения 6 на схеме 2 выше.
Схема 4
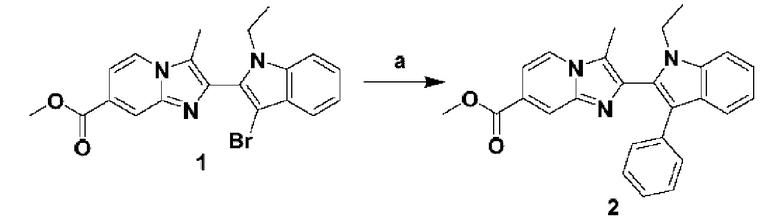
Стадия 6. Получение метил-2-(1-этил-3-фенил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (2)
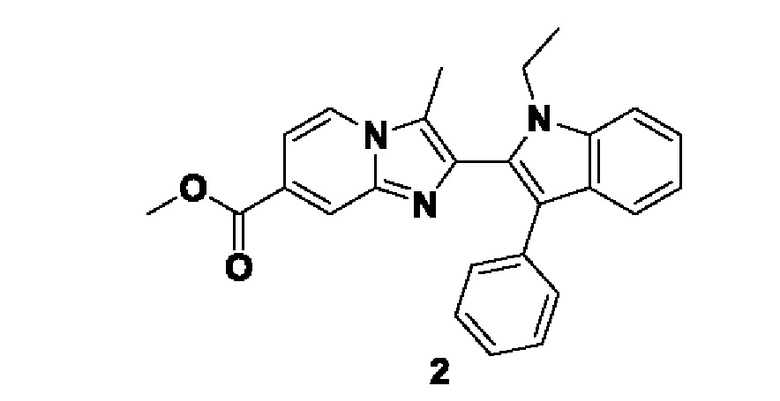
К перемешиваемому раствору метил-2-(3-бром-1-этил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (1, 0,27 г, 0,65 ммоль) в смеси диоксан : вода (8:2, 10 мл) добавляли фенилбороновую кислоту (0,12 г, 0,98 ммоль), K2CO3 (0,27 г, 1,96 ммоль), Pd(PPh3)4 (0,04 г, 0,03 ммоль) и перемешивали при 85°С в течение 16 ч. Реакционную смесь охлаждали до к.т., фильтровали через целит и диоксан выпаривали. К полученному неочищенному продукту добавляли воду (10 мл), подкисляли с применением насыщенного раствора лимонной кислоты, и соединение экстрагировали с помощью EtOAc (50 мл). Органический слой промывали солевым раствором (10 мл), высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 15-30% EtOAc в гексане с получением указанного в заголовке продукта в виде коричневого смолистого вещества (2) (0,22 г, выход 78%). MS (ESI): масса, рассч. для C26H23N3O2, 409,49; найденное значение масса/заряд, 410,2 (М+Н)+.
Дополнительные стадии для соединений 5 и 6 проводили с применением процедуры, проиллюстрированной для соединения 1.
Соединение 5
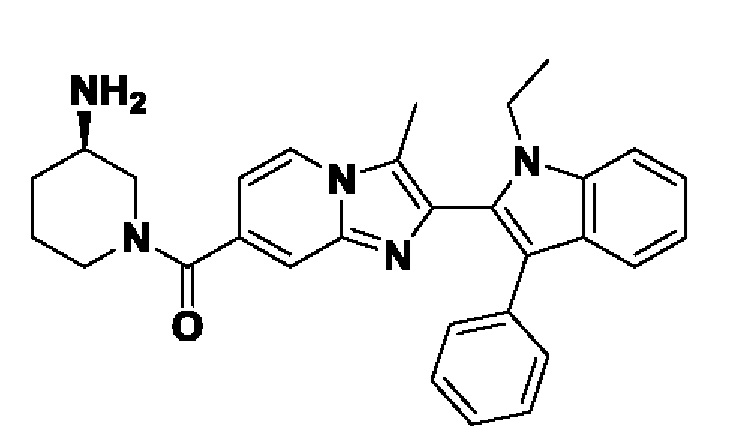
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,26 (d, J=7,2 Гц, 1H), 7,71-7,66 (m, 2Н), 7,59 (d, J=8,0 Гц, 1H), 7,30-7,24 (m, 3H), 7,20-7,16 (m, 2H), 7,13-7,11 (m, 2H), 6,95-6,93-7,01 (m, 1H), 4,30-4,28 (m, 2H), 3,65-3,62 (m, 2H), 3,02-2,98 (m, 2H), 3,27-3,23 (m, 1H), 1,85 (s, 3H), 1,69-1,65 (m, 1H), 1,47-1,44 (m, 1H), 1,26-1,24 (m, 5H), 1,18-1,15 (m, 2H). MS (ESI): масса, рассч. для C30H31N5O, 477,61; масса/заряд найденное значение, 478,3 (М+Н)+.
Соединение 6
(R)-(3-аминопирролидин-1-ил)(2-(1-этил-3-фенил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
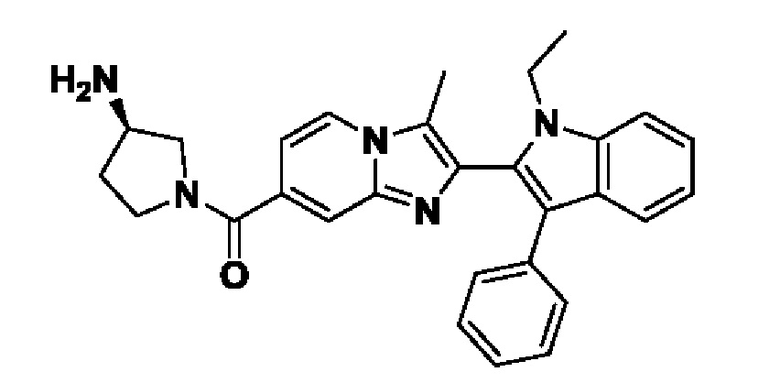
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,25 (d, J=7,2 Гц, 1H), 7,81-7,78 (m, 1H), 7,69 (d, J=8,0 Гц, 1H), 7,60 (d, J=8,4 Гц, 1H), 7,30-7,24 (m, 3Н), 7,19-7,13 (m, 4Н), 7,06-7,01 (m, 1H), 4,31-4,28 (m, 2H), 3,65-3,62 (m, 2H), 3,51-3,47 (m, 2H), 3,27-3,23 (m, 1H), 1,96-1,94 (m, 2H), 1,86 (s, 3H), 1,65-1,62 (m, 1H), 1,26-1,24 (m, 3H), 1,18-1,15 (m, 1H). MS (ESI): масса, рассч. для C29H29N5O, 463,59; масса/заряд найденное значение, 464,2 (М+Н)+.
Соединение 7
(R)-(3-аминопирролидин-1-ил)(2-(1-этил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
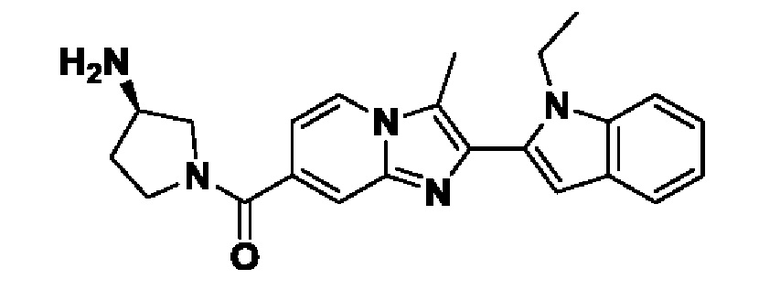
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,8 Гц, 1H), 7,76-7,74 (m, 1H), 7,58 (d, J=8,0 Гц, 1H), 7,51(d, J=8,4 Гц, 1H), 7,17(t, J=7,6 Гц, 1H), 7,11-7,03 (m, 2H), 6,64 (s, 1H), 4,58-4,53 (m, 2H), 3,67-3,63 (m, 2H), 3,55-3,49 (m, 2H), 3,27 (br s, 2H), 3,10-2,99 (m, 2H), 2,88-2,81 (m, 2H), 2,63 (s, 3H), 1,99-1,95 (m, 1H), 1,22 (t, J=6,8 Гц,1H). MS (ESI): масса, рассч. для C23H25N5O, 387,49; масса/заряд найденное значение, 388,2 (М+Н)+.
Соединение 8
(R)-(3-адшного1рролидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
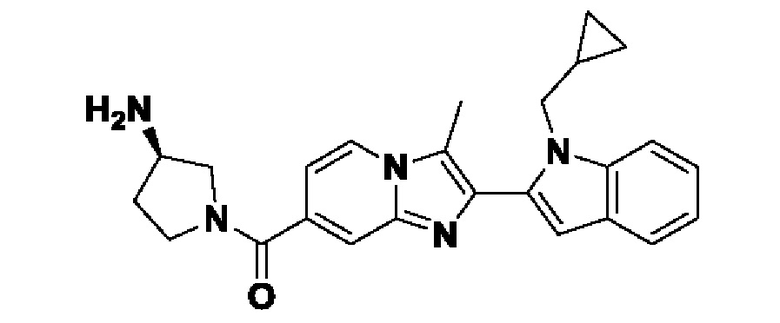
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=7,2 Гц, 1H), 7,77-6,73 (m, 1H), 7,57 (t, J=7,6 Гц, 2H), 7,18-7,14 (m, 1H), 7,11-7,09 (m, 1H), 7,06-7,03 (m, 1H), 6,65 (s, 1H), 4,49 (d, J=6,8 Гц, 2H), 3,67-3,60 (m, 2H), 3,57-3,50 (m, 2H), 3,23-3,19 (m, 1H), 2,63 (s, 3H), 1,96-1,89 (m, 1H), 1,65-1,60 (m, 1H), 1,23-1,15 (m, 2H), 1,09 (m, 1H), 0,26-0,25 (m, 2H), 0,15-0,13 (m, 2H). MS (ESI): масса, рассч. для C25H27N5O, 413,53; масса/заряд найденное значение, 414,2 (М+Н)+.
Соединение 9
(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)(гексагидро-2Н-пиридо[4,3-b][1,4]оксазин-6(5Н)-ил)метанон
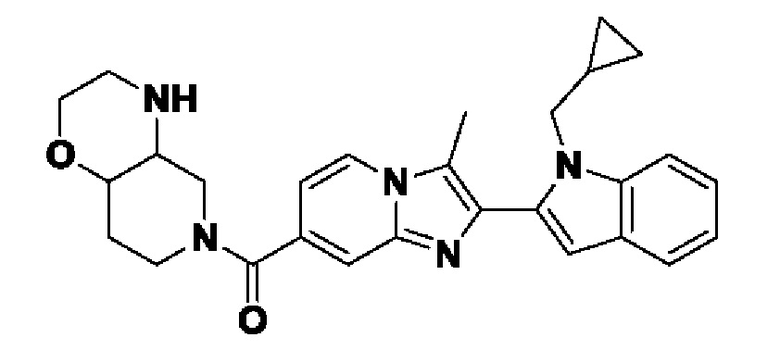
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=7,2 Гц, 1H), 7,62 (s, 1H), 7,57 (t, J=6,8 Гц, 2H), 7,18-7,14 (m, 1H), 7,06-6,99 (m, 2Н), 6,64 (s, 1H), 4,48 (d, J=7,2 Гц, 2H), 3,76-3,72 (m, 2Н), 3,44-3,40 (m, 2Н), 2,85-2,78 (m, 2Н), 2,65 (s, 3Н), 2,01-1,97 (m, 2Н), 1,85-1,81 (m, 1H), 1,67-l,61 (m, 1H), 1,21-1,19 (m, 3H), 1,10-1,05 (m, 1H), 0,27-0,25 (m, 2H), 0,15-0,13 (m, 2H). MS (ESI): масса, рассч. для C28H31N5O2, 469,59; масса/заряд найденное значение, 470,3 (М+Н)+.
Соединение 10
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-4-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
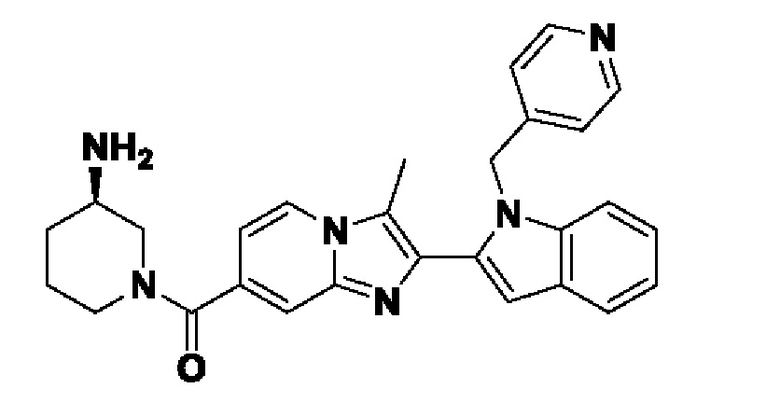
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,40 (d, J=6,8 Гц, 1H), 7,35-7,33 (m, 2H), 7,63 (d, J=7,6 Гц, 1H), 7,57 (s, 1H), 7,35 (d, J=8,0 Гц, 1H), 7,13-7,07 (m, 2H), 6,98-6,96 (m, 1H), 6,90-6,88 (m, 2H), 6,78 (s, 1H), 5,95 (s, 2H), 4,19-4,11 (m, 1H), 3,65-3,61 (m, 2H), 2,99-2,95 (m, 1H), 2,80-2,79 (m, 2H), 2,64 (s, 3H), 1,86-1,83 (m, 1H), 1,66-1,63 (m, 1H), 1,45-1,42 (m, 1H), 1,31-1,29 (m, 1H), 1,21-1,18 (m, 1H). MS (ESI): масса, рассч. для C28H28N6O, 464,57; масса/заряд найденное значение, 465,3 (М+Н)+.
Соединение 11
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((тетрагидро-2Н-пиран-4-ил)метил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
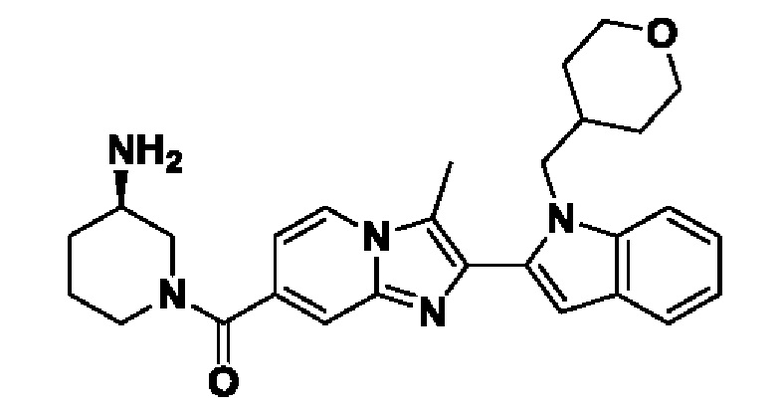
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,8 Гц, 1H), 7,62 (s, 1H), 7,56 (t, J=7,2 Гц, 2H), 7,18-7,14 (m, 1H), 7,06-7,00 (m, 1H), 6,98-6,95 (m, 1H), 6,65 (s, 1H), 4,52 (d,J=7,2 Гц, 1H), 4,19-4,11 (m, 1H), 3,65-3,62 (m, 2H), 3,48-3,41 (m, 1H), 3,07-3,01 (m, 2H), 2,78-2,75 (m, 2H), 2,67-2,63 (m, 2H), 2,61 (s, 3H), 1,99-1,95 (m, 2H), 1,70-1,67 (m, 1H), 1,1.65-1,61 (m, 1H), 1,28-1,21 (m, 1H), 1,18-1,11 (m, 4H), 1,03-1,00 (m, 2H). MS (ESI): масса, рассч. для C28H33N5O2, 471,61; масса/заряд найденное значение, 472,3 (М+Н)+.
Соединение 12
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
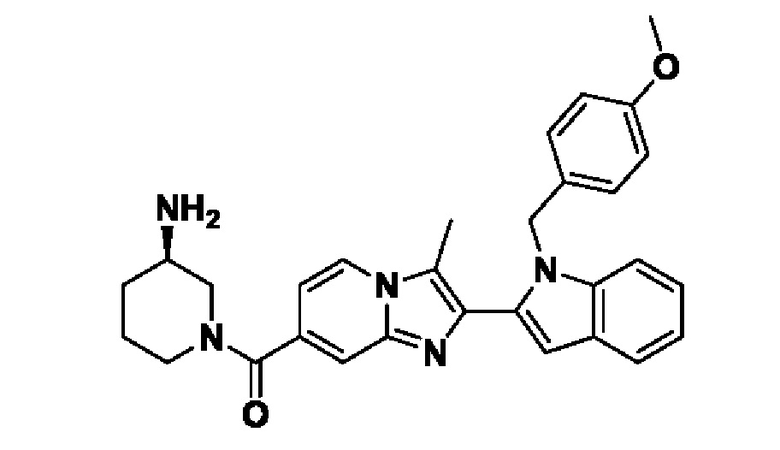
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,40 (s, 1H), 7,60-7,57 (m, 2Н), 7,41-7,39 (m, 2Н), 7,11-7,07 (m, 1H), 7,05-7,01 (m, 1H), 6,99-6,97 (m, 1H), 6,92-6,90 (m, 2H), 6,72-6,70 (m, 2H), 5,80 (s, 2H), 3,63 (s, 3Н), 2,83-2,8l(m, 2H), 2,68-2,65 (m, 2H), 2,64 (s, ЗН), 2,06-2,01 (m, 2H), 1,88-1,85 (m, 1H), 1,68-1,65 (m, 1H), 1,44-1,41 (m, 1H), 1,21-1,18 (m, 2H). MS (ESI): масса, рассч. для C30H31N5O2, 493,61; масса/заряд найденное значение, 494,3 (М+Н)+.
Соединение 13
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пириднн-7-ил)метанон
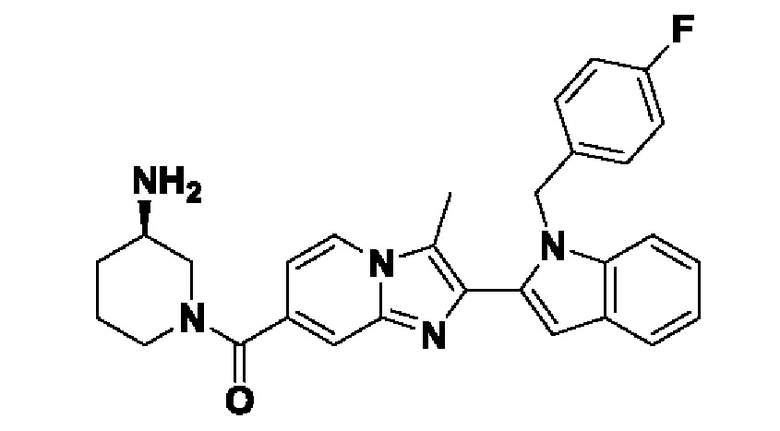
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,40 (d, J=7,2 Гц, 1H), 7,61-7,59 (m, 2Н), 7,40 (d, J=7,2 Гц, 1H), 7,12-7,08 (m, 1Н), 7,02-6,98 (m, 6H), 6,75 (s, 1H), 5,86 (s, 2H), 4,05-4,01 (m, 1H), 3,57-3,51 (m, 1H), 2,97-2,94 (m, 1H), 2,78-2,71 (m, 1H), 2,62 (s, 3H), 2,02-1,98 (m, 2H), 1,84-1,81 (m, 1H), 1,67-1,61 (m, 1H), 1,44-1,41 (m, 1H), 1,25-1,21 (m, 2H). MS (ESI): масса, рассч. для C29H28FN5O, 481,58; масса/заряд найденное значение, 482,2 (М+Н)+.
Соединение 14
(R)-4-((2-(7-(3-аминопиперидин-1-карбонил)-3-метилимидазо[1,2-а]пиридин-2-ил)-1Н-индол-1-ил)метил)бензонитрил
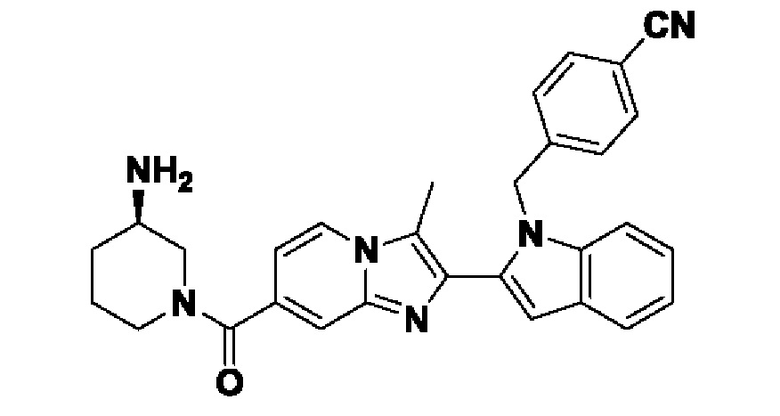
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=7,2 Гц, 1H), 7,66-7,59 (m, 4Н), 7,35 (d, J=8,0 Гц, 1H), 7,14-7,12 (m, 2H), 7,08-7,05 (m, 2H), 6,97 (d, J=7,2 Гц, 1H), 6,81 (s, 1H), 5,99 (s, 2H), 2,93-2,89 (m, 2H), 2,64 (s, 3H), 1,99-1,97 (m, 1H), 1,88-1,85 (m, 1H), 1,68-1,65 (m, 1H), 1,45-1,41 (m, 3Н), 1,33-1,29 (m, 1H), 1,22-1,19 (m, 2H). MS (ESI): масса, рассч. для C30H28N6O 488,60; масса/заряд найденное значение, 489,2 (М+Н)+.
Соединение 15
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-3-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
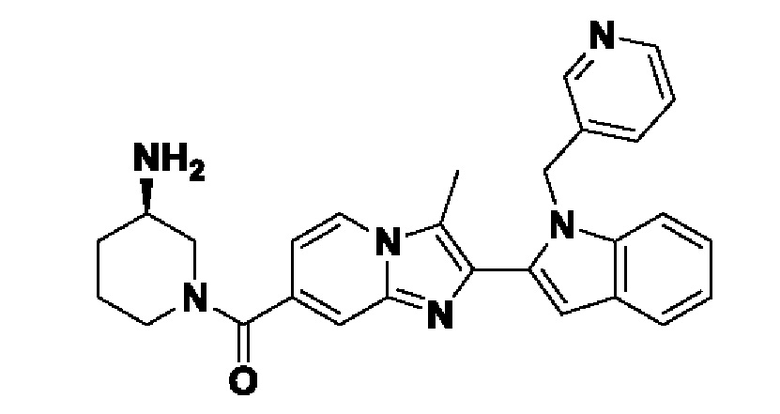
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,8 Гц, 1H), 8,32 (d, J=4,0 Гц, 1H), 8,26 (s, 1H), 7,62-7,59 (m, 2H), 7,46-7,44 (m, 1H), 7,37-7,35 (m, 1H), 7,20-7,18 (m, 1H), 7,13-7,07 (m, 2H), 6,99-6,97 (m, 1H), 6,78 (s, 1H), 5,93 (s, 2H), 4,19-4,11 (m, 1H), 3,65-3,61 (m, 2H), 2,98-2,95 (m, 1H), 2,70-2,67 (m, 2H), 2,63 (s, 3H), 1,85-1,83 (m, 1H), 1,66-1,63 (m, 1H), 1,45-1,42 (m, 1H), 1,27-1,21 (m, 2H). MS (ESI): масса, рассч. для C28H28N6O, 464,23; масса/заряд найденное значение, 465,2 (М+Н)+.
Соединение 16
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
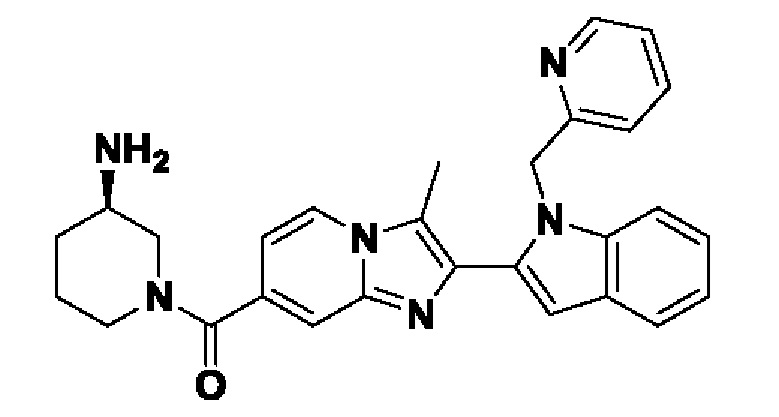
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42-8,38 (m, 2Н), 7,62 (d, J=6,8 Гц, 1H), 7,57-7,52 (m, 2H), 7,34 (d, J=8,0 Гц, 1H), 7,15-7,05 (m, 3H), 7,04-6,95 (m, 1H), 6,78 (s, 1H), 6,64 (d, J=8,0 Гц, 1H), 5,96 (s, 2H), 4,19-4,11 (m, 1H), 3,55-3,49 (m, 1H), 2,97-2,95 (m, 2H), 2,79-2,73 (m, 2H), 2,63 (s, 3H), 1,87-1,82 (m, 1H), 1,66-1,63 (m, 1H), 1,45-1,42 (m, 1H), 1,28-1,22 (m, 2H). MS (ESI): масса, рассч. для C28H28N6O, 464,23; масса/заряд найденное значение, 465,2 (М+Н)+.
Соединение 17
(К)-(3-аминопиперидин-1 -ил)(3 -метил-2 -(1-(2,2,2-трифторэтил)-1Н-ин дол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
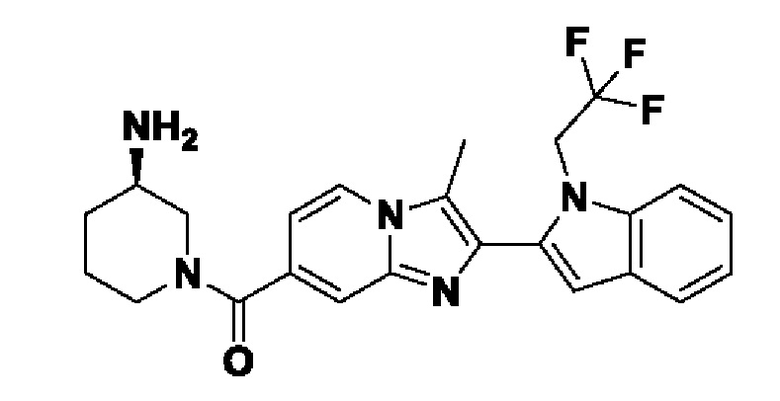
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=7,2 Гц, 1H), 7,66 -7,61 (m, 3Н), 7,24 (t, J=7,2 Гц, 1H), 7,12 (t, J=7,4 Гц, 1H), 7,01 (d, J=7,2 Гц, 1H), 6,83 (s, 1H), 5,85-5,80 (m, 2Н), 4,1 (bs, 1H), 3,60 (bs, 1H), 3,00 (bs, 1H), 2,66-2,63 (m, 4Н), 1,88-1,83 (m, 2Н), 1,67 (bs, 2Н), 1,46 (bs, 1H), 1,27-1,22 (m, 2Н). MS (ESI): масса, рассч. для C24H24F3N5O, 455,49; масса/заряд найденное значение, 456,2 (М+Н)+.
Соединение 18
(R)-4-((2-(7-(3-аминопиперидин-1-карбонил)-3-метилимидазо[1,2-а]пиридин-2-ил)-1Н-индол-1-ил)метил)-1-метилпиридин-2(1Н)-он
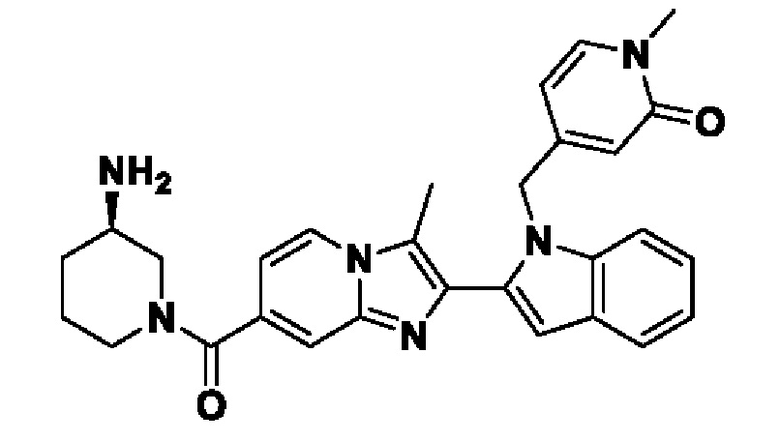
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,8 Гц, 1H), 7,61 (d, J=8,0 Гц, 1H), 7,57 (s, 1H), 7,47 (d, J=6,8 Гц, 1H), 7,37 (d, J=8,0 Гц, 1H), 7,16-7,10 (m, 2H), 6,98 (d, J=7,2 Гц, 1H), 6,80 (s, 1H), 5,87 (d, J=5,6 Гц, 1H), 5,77 (s, 2H), 5,65 (s, 1H), 4,19-4,11 (m, 1H), 3,65-3,61 (m, 1H), 3,24 (s, 3H), 2,97-2,93 (m, 1H), 2,65 (s, 3H), 2,64-2,61 (m, 2H), 1,86-1,83 (m, 2H), 1,66-1,63 (m, 2H), 1,44-1,41 (m, 1H), 1,24-1,19 (m, 1H). MS (ESI): масса, рассч. для C29H30N6O2, 494,24; масса/заряд найденное значение, 495,4 (М+Н)+.
Соединение 19
(R)-(3-аминопиперидин-1-ил)(2-(3-этилбензо[b]тиофен-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
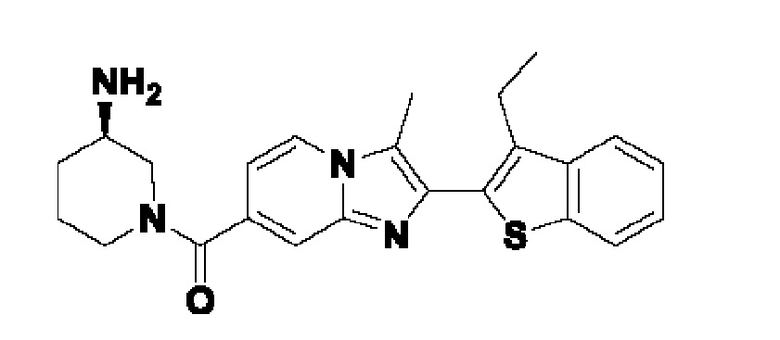
1НЯМР (400 МГц, DMSO-ds) δ (ppm): 8,38 (d, J=6,8 Гц, 1H), 7,96 (d, J=7,2 Гц, 1H), 7,87 (d, J=7,5 Гц, 1H), 7,59 (s, 1H), 7,45-7,36 (m, 2Н), 6,97 (d, J=7,2 Гц, 1H), 4,02-3,99 (m, 1H), 3,49-3,45 (m, 1H), 3,03-2,97 (m, 3H), 2,69-2,60 (m, 2H), 2,58 (s, 3H), 2,14-2,08 (m, 1H), 1,88-1,83 (m, 1H), 1,69-1,61 (m, 1H), 1,46-1,39 (m, 1H), 1,31-1,26 (m, 2H), 1,19-1,12 (m, 3H). MS (ESI): масса, рассч. для C24H26N4OS, 418,56; масса/заряд найденное значение, 419,2 (М+Н)+.
Соединение 20
Синтез (R)-(3-аминопиперидин-1-ил)(2-(1-(4-хлорбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (соединение 20)
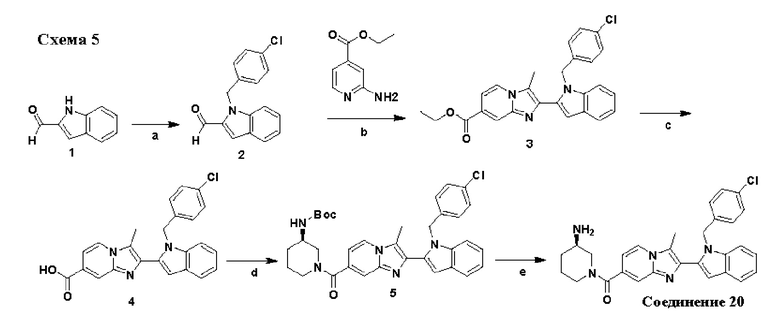
Стадия 1. Получение этил-2-(1-(4-хлорбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (2)
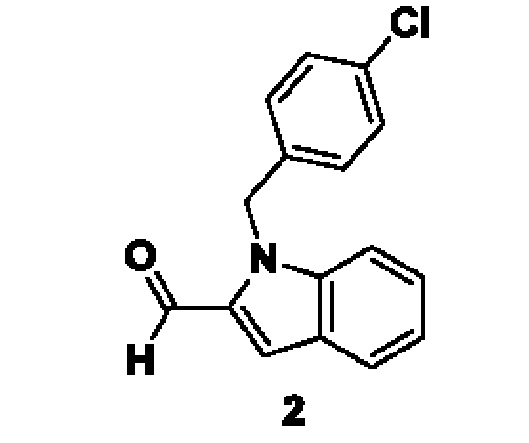
К перемешиваемому раствору 1Н-индол-2-карбальдегида (1, 0,5 г, 3,44 ммоль) в DMF (10 мл) добавляли карбонат калия (1,42 г, 10,3 ммоль) с последующим добавлением 1-(бромметил)-4-хлорбензола (0,84 г, 4,13 ммоль) и затем реакционную смесь перемешивали при к.т. в течение 4 ч. (условие реакции а). Реакционную смесь выливали в измельченный лед, что в результате приводило к образованию осадка. Осадок фильтровали через спеченную воронку и высушивали над вакуумом с получением указанного в заголовке соединения в виде твердого вещества бежевого цвета (2) (0,86 г, выход 93,4%). MS (ESI): масса, рассч. для C16H12ClNO, 269,73; найденное значение масса/заряд 270,1 (М+Н)+.
Стадия 2. Получение этил-2-(1-(4-хлорбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (3)
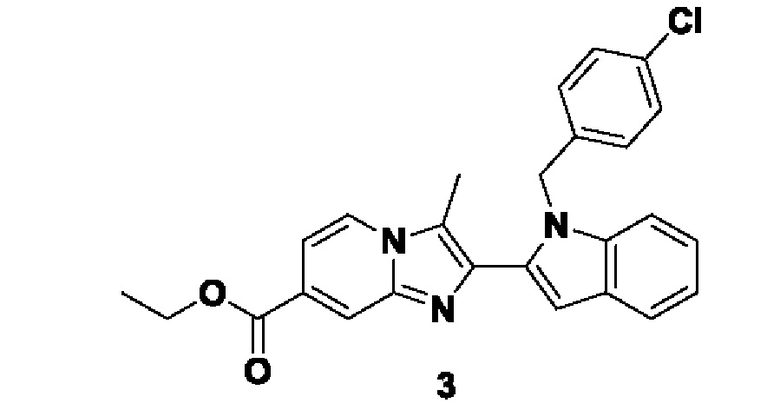
К перемешиваемому раствору 1-(4-хлорбензил)-1Н-индол-2-карбальдегида (2, 0,38 г, 1,44 ммоль) и этил-2-аминоизоникотината (0,2 г, 1,2 ммоль) в DMF добавляли нитроэтан (1,1 г, 14,3 ммоль) с последующим добавлением FeCl3 (0,04 г, 0,28 ммоль) и перемешивали при 90°С в атмосфере воздуха в течение 5 ч (условие реакции b). Реакционную смесь охлаждали до к.т., разбавляли этилацетатом и выпаривали под вакуумом с получением неочищенного соединения. Неочищенное вещество очищали посредством колоночной флеш-хроматографии с применением этилацетата в гексане в качестве элюента с получением продукта в виде бледно-желтого смолистого твердого вещества (3) (0,07 г, выход 10,9%). MS (ESI): масса, рассч. для C26H22ClN3O2, 443,93; найденное значение масса/заряд, 444,1 (М+Н)+.
Стадия 3. Получение 2-(1-(4-хлорбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоновой кислоты (4)
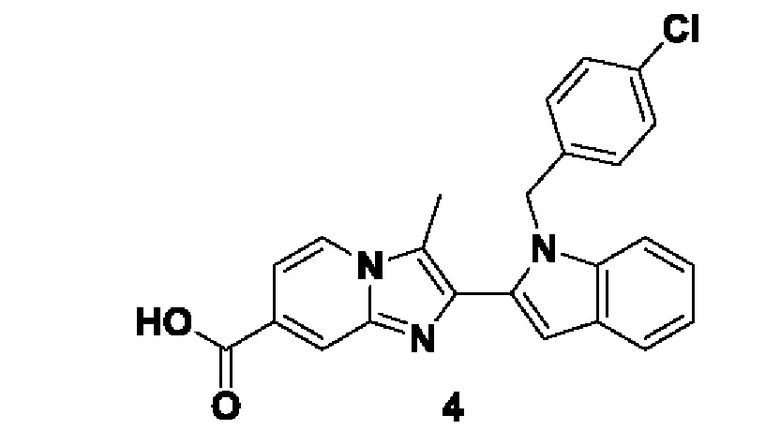
К перемешиваемому раствору этил-2-(1-(4-хлорбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (3, 0,08 г, 0,18 ммоль) в этаноле (5 мл) добавляли 5 н. раствор гидроксида натрия (0,18 мл, 9,0 ммоль) и нагревали при 80°С в течение 1 ч (условие реакции с). Реакционную смесь охлаждали до к.т. и выпаривали до сухого состояния. Полученный неочищенный продукт растворяли в воде (10 мл), подкисляли с применением насыщенного раствора лимонной кислоты и экстрагировали с помощью дихлорметана (40 мл). Органический слой высушивали над безводным сульфатом натрия и выпаривали под вакуумом с получением продукта в виде бесцветного смолистого твердого вещества (4) (0,06 г, выход 80,3%). MS (ESI): масса, рассч. для C24H18ClN3O2, 415,88; найденное значение масса/заряд, 416,1 (М+Н)+.
Стадия 4. Получение трет-бутил-(R)-(1-(2-(1-(4-хлорбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридш1-7-карбонил)пиперидин-3-ил)карбамата (5)
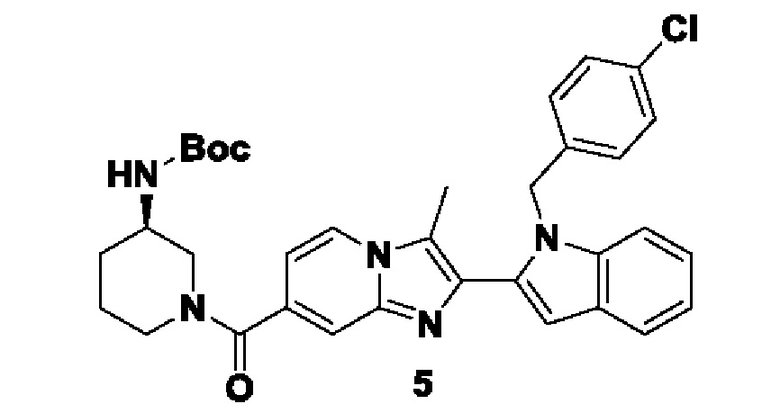
К перемешиваемому раствору 2-(1-этил-1Н-пирроло[2,3-b]пиридин-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоновой кислоты (4, 0,06 г, 0,144 ммоль) в DCM (3 мл) добавляли трет-бутил-(R)-пиперидин-3-илкарбамат (0,043 г, 0,216 ммоль), Et3N (0,06 мл, 0,432 ммоль), 50% раствор Т3Р в этилацетате (0,068 мл, 0,216 ммоль) и реакционную смесь перемешивали при к.т. в течение 5 ч (условие реакции d). Реакционную смесь гасили водой (10 мл) и экстрагировали с помощью этилацетата (25 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенное вещество очищали посредством колоночной хроматографии с применением этилацетата в гексане с получением продукта в виде грязно-белого твердого вещества (5) (0,09 г, выход 61%). MS (ESI): масса, рассч. для C34H36ClN5O3, 598,14; найденное значение масса/заряд, 599,2 (М+Н)+.
Стадия 5. Получение (R)-(3-аминопиперидин-1-ил)(2-(1-(4-хлорбензил)-1Н-индол-2-ил)-3-метилимидазо[1Д-а]пиридин-7-ил)метанона (6, соединение 20)
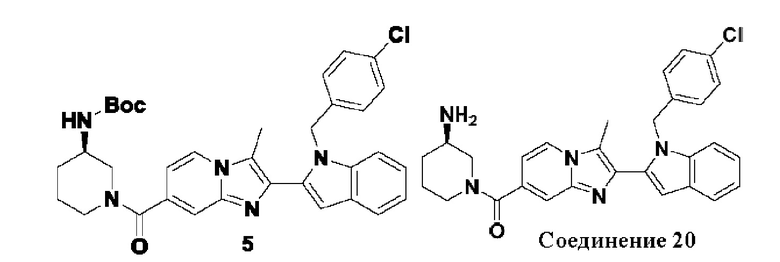
К перемешиваемому раствору трет-бутил-(R)-(1-(2-(1-этил-1Н-пирроло[2,3-b]пиридин-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (5, 0,05 г, 0,083 ммоль) в DCM (3 мл) добавляли TFA (0,5 мл) и реакционную смесь перемешивали при к.т. в течение 2 ч (условие реакции е). Повышали основность реакционной смеси с применением насыщенного раствора бикарбоната натрия и ее экстрагировали с помощью MeOH/DCM (2×25 мл). Объединенный органический слой высушивали над безводным сульфатом натрия. Неочищенный продукт очищали посредством колоночной флеш-хроматографии с применением 7% МеОН в DCM с получением указанного в заголовке соединения в виде твердого вещества коричневого цвета (0,007 г, выход 26,8%) (6, соединение 20) 1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,8 Гц, 1H), 7,62-7,59 (m, 2Н), 7,37 (d, J=8,0 Гц, 1H), 7,23 (d, J=8,4 Гц, 2H), 7,12-7,00 (m, 2Н), 6,99-6,98 (m, 3Н), 6,76 (s, 1H), 5,91 (s, 2H), 4,12 (bs, 1H), 3,6 (bs, 1H), 3,00 (bs, 1H), 2,79 (bs, 1H), 2,65-2,63 (m, 1H), 1,88-1,84 (m, 2H), 1,68 (bs, 2H), 1,46-1,43 (m, 2H), 1,28-1,12 (m, 3H). MS (ESI): масса, рассч. для C29H28ClN3O, 498,03; найденное значение масса/заряд, 499,2 (М+Н)+.
Следующие соединения (соединения 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 39, 40, 43, 44 и 47) синтезировали с применением указанной выше процедуры, проиллюстрированной для соединения 20.
Соединение 21
(R)-(3-аминопиперидин-1-ил)(2-(1-(2-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
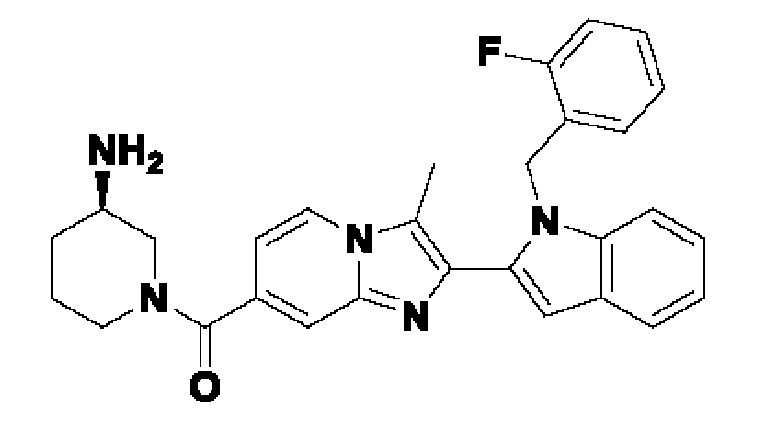
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,39 (d, J=7,2 Гц, 1H), 7,62-7,59 (m, 2H), 7,37 (d, J=8 Гц, 1H), 7,17-7,05 (m, 4H), 7,14 (d, J=6,8 Гц, 1H), 6,96-6,89 (m, 1H), 6,78 (s, 1H), 6,52-6,48 (m, 1H), 5,97 (s, 2H), 4,10 (bs, 1H), 2,99 (bs, 1H), 2,80 (bs, 2H), 2,62 (s, 3H), 1,88 (bs, 2H), 1,68 (bs, 1H), 1,46 1,68 (bs, 1H), 1,31-1,21 (m, 3H). MS (ESI): масса, рассч. для C29H28FN5O, 481,58; найденное значение масса/заряд, 482,4 (М+Н)+.
Соединение 22
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-5-фенил-1Н-пиррол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
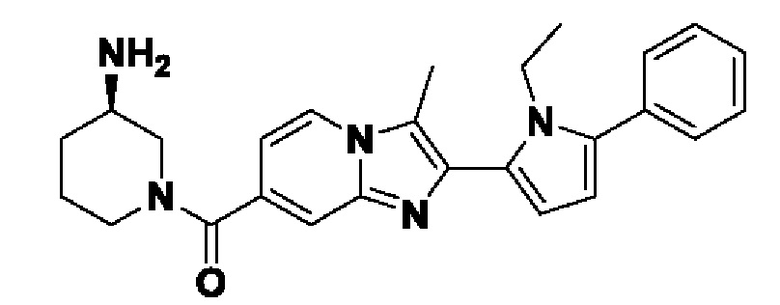
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,35 (d, J=7,2 Гц, 1H), 7,56 (s, 1H), 7,46-7,44 (m, 4H), 7,36-7,34 (m, 1H), 6,95 (d, J=6,8 Гц, 1H), 6,30 (d, J=3,6 Гц, 1H), 6,21 (d, J=3,6 Гц, 1H), 4,40-4,38 (m, 2H), 3,05 (bs, 1H), 2,73 (bs, 2H), 2,57 (s, 3H), 1,88-1,84 (m, 2H), 1,68 (bs, 2H), 1,46 (bs, 1H), 1,28-1,22 (m, 3H), 0,90-0,83 (m, 3H). MS (ESI): масса, рассч. для C26H29N5O, 427,55; найденное значение масса/заряд, 428,3(М+Н)+.
Соединение 23
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
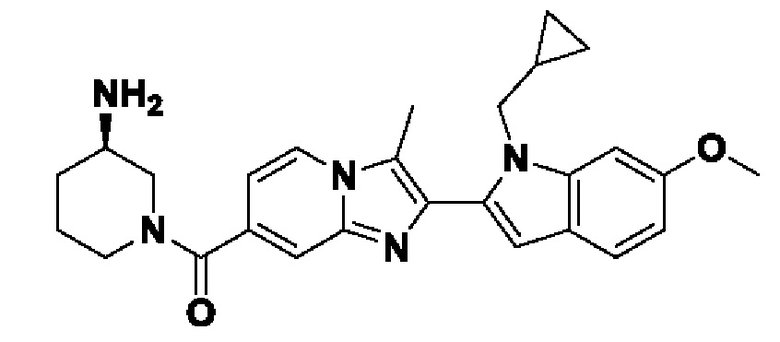
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,8 Гц, 1H), 7,63 (s, 1Н), 7,45 (d, J=8,8 Гц, 1H), 7,08 (s, 1H), 6,99 (d, J=6,4 Гц, 1H), 6,71 (d, J=7,6 Гц, 1H), 6,55 (s, 1H), 5,15 (bs, 2H), 4,46 (d, J=6,8 Гц, 2H), 3,82 (s, 3H), 3,08-2,92 (m, 3H), 2,61 (s, 3H), 1,97 -1,88 (m, 2H), 1,71 (bs, 1H), 1,48-1,36 (bs, 3H), 1,09 (m, 1H), 0,26 (d, J=7,6 Гц, 2H), 0,13 (d, J=4 Гц, 2H). MS (ESI): масса, рассч. для C27H31N5O2, 457,58; найденное значение масса/заряд, 458,58 (М+Н).
Соединение 24
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-1Н-пирроло[23-b]пиридин-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
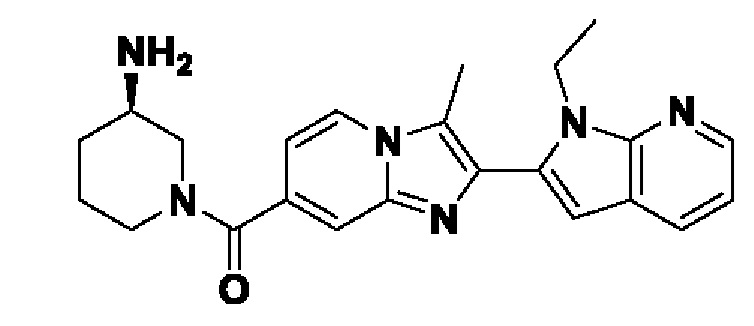
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=6,4 Гц, 1H), 8,28-8,25 (m, 1H), 7,98 (d, J=7,2 Гц, 1H), 7,63 (s, 1H), 7,13-7,11 (m, 1H), 7,01-6,99 (m, 1H), 6,67 (s, 1H), 4,71-4,65 (m, 2Н), 4,24-4,21 (m, 1H), 3,55-3,49 (m, 1H), 3,00-2,96 (m, 1H), 2,69-2,66 (m, 1H), 2,65 (s, 3Н), 2,21-2,19 (m, 2Н), 1,87-1,83 (m, 2Н), 1,68-1,65 (m, 1H), 1,45-1,42 (m, 1H), 1,35-1,33 (m, 1Н), 1,26-1,24 (m, 3Н). MS (ESI): масса, рассч. для C23H26N6O, 402,22; найденное значение масса/заряд, 403,1(М+Н)+.
Соединение 25
(R)-(3-адшнопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3,5-диметилимидазо[1,2-а]пиридин-7-ил)метанон
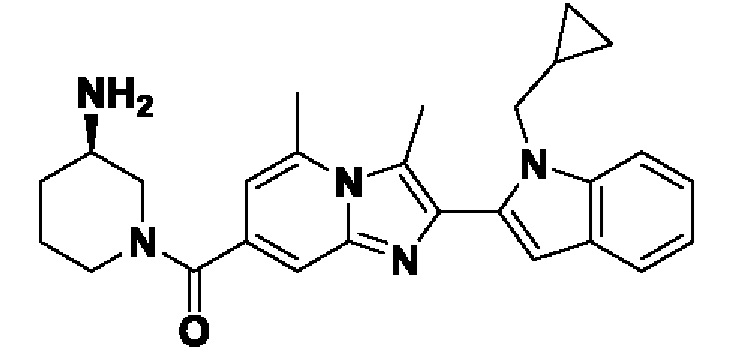
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 7,57 (t, J=7,2 Гц, 2H), 7,40 (s, 1H), 7,16 (t, J=7,6 Гц, 1H), 7,04 (t, J=7,6 Гц, 1H), 6,66 (s, 1H), 6,53 (s, 1H), 4,33 (d, J=6,8 Гц, 2H), 4,09-4,04 (m, 1H), 2,95 (s, 3H), 2,88 (s, 3H), 2,65-2,61 (m, 2H), 1,88-1,85 (m, 2H), 1,67-1,64 (m, 1H), 1,43-1,39 (m, 1H), 1,27-1,24 (m, 2H), 1,21-1,19 (m, 2H), 1,06-1,02 (m, 1H), 0,27-0,25 (m, 2H), 0,11-0,09 (m, 2H). MS (ESI): масса, рассч. для C27H31N5O, 441,25; найденное значение масса/заряд, 442,3 (М+Н)+.
Соединение 26
(R)-(3-аминопиперидин-1-ил)(2-(1-бензил-1Н-индол-2-ил)-3,5-диметилимидазо[1,2-а]пиридин-7-ил)метанон
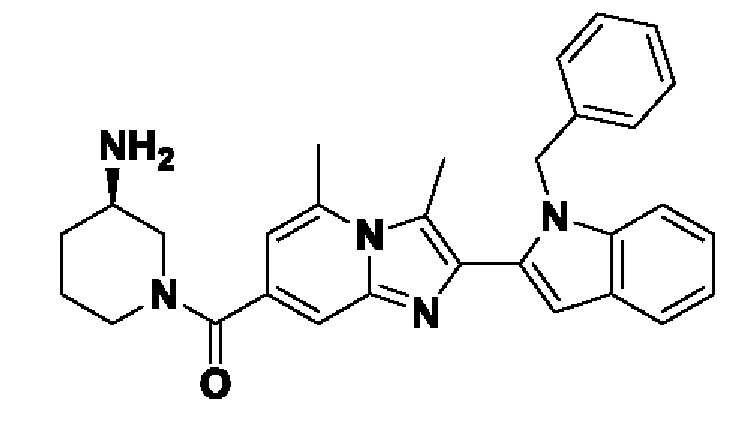
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 7,62 (d, J=8,0 Гц, 1H), 7,40-7,37 (m, 2Н), 7,19-7,09 (m, 5Н), 6,94 (d, J=6,8 Гц, 2H), 6,66 (s, 2Н), 5,75 (s, 2Н), 4,19-4,14 (m, 1Н), 3,75-3,71 (m, 1H), 2,94 (s, 3H), 2,89 (s, 3H), 1,89-1,87 (m, 2H), 1,86-1,85 (m, 2H), 1,67-1,64 (m, 1H), 1,43-1,39 (m, 2H), 1,27-1,24 (m, 2H). MS (ESI): масса, рассч. для C30H31N50, 477,25; найденное значение масса/заряд, 478,5 (М+Н)+.
Соединение 27
(R)-(3-адшнопиперидин-1-ил)(3,5-диметил-2-(1-(пиридин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
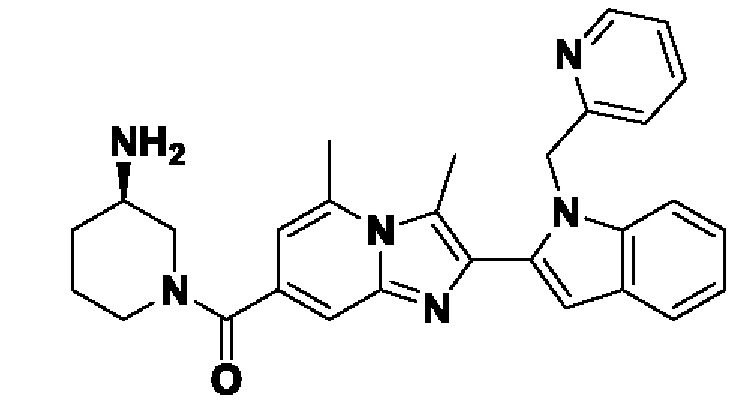
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,40 (d, J=6,8 Гц, 1H), 7,63-7,61 (m, 1H), 7,55-7,51 (m, 1H), 7,37-7,35 (m, 2Н), 7,15-7,10 (m, 4Н), 6,67-6,64 (m, 2Н), 5,80 (s, 2Н), 3,75-3,71 (m, 1Н), 2,92 (s, 3Н), 2,88 (s, 3Н), 2,65-2,61 (m, 1H), 2,01-1,98 (m, 1H), 1,97-1,94 (m, 2H), 1,88-1,85 (m, 2H), 1,43-1,39 (m, 2H), 1,27-1,24 (m, 2H). MS (ESI): масса, рассч. для C29H30N6O, 478,25; найденное значение масса/заряд, 479,2 (М+Н)+.
Соединение 28
(R)-(3-адшнопиперидин-1-ил)(2-(1-(циклопропилметил)-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
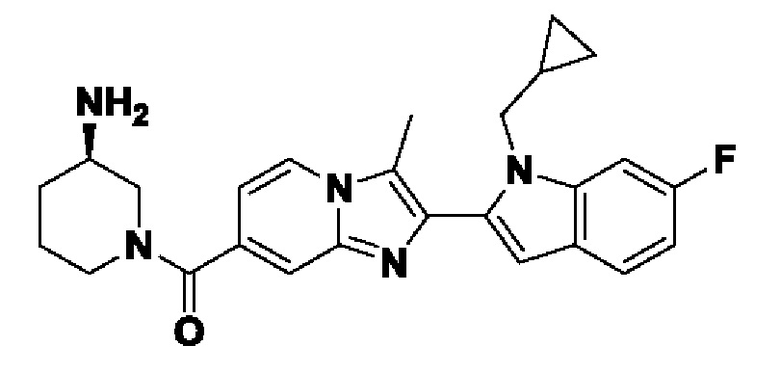
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,4 Гц, 1H), 7,60-7,55 (m, 2H), 7,44 (d, J=9,6 Гц, 1H), 6,9 (d, J=7,2 Гц, 1H), 6,92-6,88 (m, 1H), 6,54 (s, 1H), 4,46 (d, J=6,8 Гц, 2H), 4,25 (m, 1H), 3,28 (m, 2H), 2,83 (m, 1H), 2,62 (s, 3H), 1,99-1,95 (m, 1H), 1,82(m, 2H), 1,68 (m, 2H), 1,46 (m, 2H), 1,07 (m, 1H), 0,27-0,25 (m, 2H), 0,14-013 (m, 2H). MS (ESI): масса, рассч. для C26H28FN5O, 445,23; найденное значение масса/заряд, 446,2 (М+Н)+.
Соединение 29
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-5-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
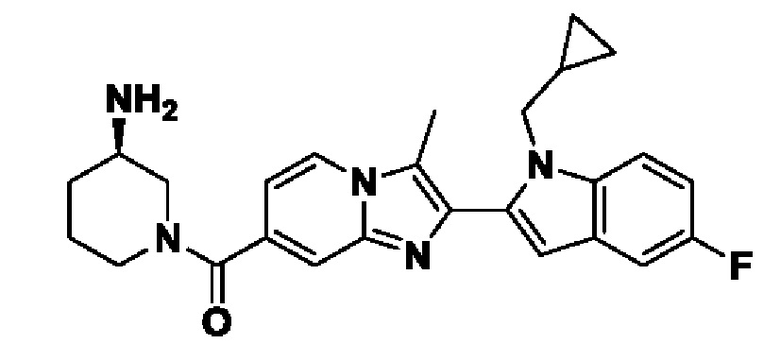
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=7,2 Гц, 1H), 7,61-7,57 (m, 2Н), 7,35-7,32 (m, 1H), 7,03-6,98 (m, 2Н), 6,64 (s, 1H), 4,48 (d, J=6,8 Гц, 2H), 4,21-4,11 (m, 2Н), 3,63-3,60 (m, 1Н), 2,99-2,95 (m, 1H), 2,78-2,74 (m, 1H), 2,65 (s, 3H), 1,86-1,83 (m, 1H), 1,71-1,68 (m, 3H), 1,46-1,43 (m, 1H), 1,28-1,25 (m, 1H), 1,09-1,03 (m, 1H), 0,27-0,25 (m, 2H), 0,14-0,11 (m, 2H). MS (ESI): масса, рассч. для C26H28FN5O, 445,23; найденное значение масса/заряд, 446,2 (М+Н)+.
Соединение 30
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-7-метил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
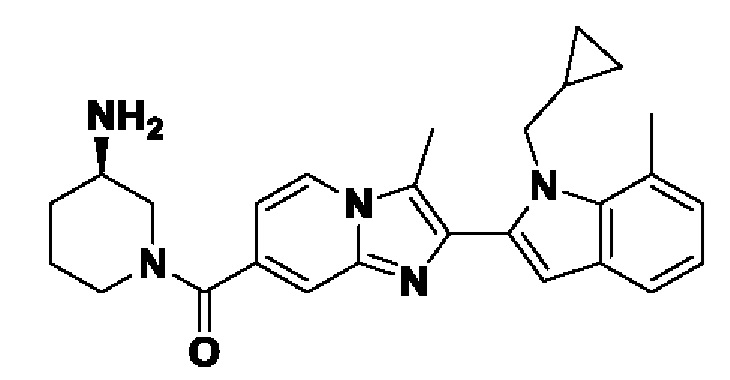
1НЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=7,2 Гц, 1H), 7,60 (s, 1H), 7,42 (d, J=6,4 Гц, 1H), 7,00-6,98 (m, 1H), 6,96-6,93 (m, 2H), 6,60 (s, 1H), 4,65 (d, J=6,0 Гц, 2H), 4,21-4,11 (m, 2H), 3,01-2,98 (m, 1H), 2,79-2,77 (m, 2H), 2,76 (s, 3H), 2,65 (s, 3H), 1,89-1,85 (m, 2H), 1,69-1,66 (m, 1H), 1,46-1,43 (m, 1H), 1,32-1,27 (m, 2H), 0,89-0,85 (m, 1H), 0,15-0,14 (m, 2H), 0,24-0,25 (m, 2H). MS (ESI): масса, рассч. для C27H31N5O, 441,25; найденное значение масса/заряд, 442,4 (М+Н)+.
Соединение 31
Синтез (R)-(3-аминопиперидин-1-ил)(2-(2-этилфенил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (соединение 31)
Схема 6
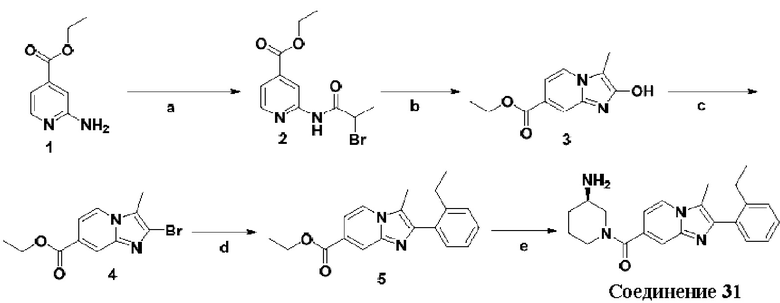
Стадия 1. Этил-2-(2-бромпропанамидо)изоникотинат

К перемешиваемому раствору этил-2-аминоизоникотината (1, 2 г, 12,0 ммоль) в DCM (20 мл) добавляли 2-бромпропановую кислоту (2,2 г, 14,4 ммоль), Et3N (3,3 мл, 24,1 ммоль), 50% раствор Т3Р в этилацетате (12,1 мл, 18,1 ммоль) и реакционную смесь перемешивали при к.т. в течение 16 ч. К реакционной смеси добавляли воду (50 мл) и соединение экстрагировали с помощью DCM (100 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии с применением 20-30% EtOAc в гексане с получением продукта в виде желтого твердого вещества (2,3 г, выход 64%). MS (ESI): масса, рассч. для C11H13BrN2O3, 301,14; найденное значение масса/заряд, 303,0 (М+2Н)+.
Стадия 2. Этил-2-гидрокси-3-метилимидазо[1,2-а]пиридин-7-карбоксилат
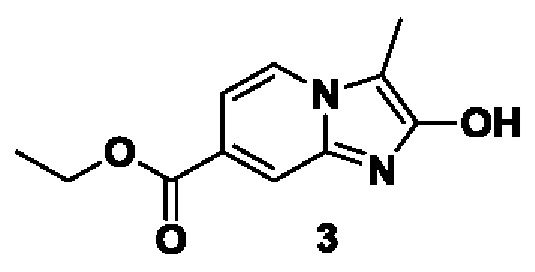
К перемешиваемому раствору этил-2-(2-бромпропанамидо)изоникотината (2, 1 г, 3,33 ммоль) в EtOH (20 мл) добавляли К2СО3 (1,37 г, 9,99 ммоль) и перемешивали при 80°С в течение 5 ч. Реакционную смесь выпаривали до сухого состояния, растирали диэтиловым эфиром и высушивали с получением неочищенного продукта в виде коричневого смолистого твердого вещества (1,0 г, выход 80%). MS (ESI): масса, рассч. для C11H12N2O3, 220,08; найденное значение масса/заряд, 221,1 (М+Н)+.
Стадия 3. Этил-2-бром-3-метилимидазо[1,2-а]пиридин-7-карбоксилат
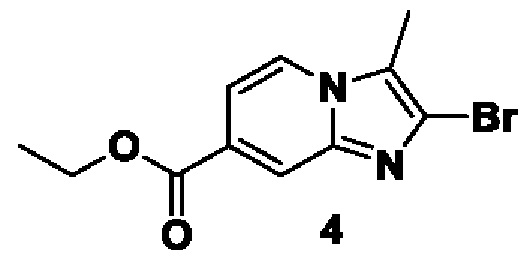
К перемешиваемому раствору этил-2-гидрокси-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (4, 1,0 г, 5,45 ммоль) в 1,2-дихлорэтане (20 мл) добавляли POBr3 (4,6 г, 16,3 ммоль) и перемешивали при 90°С в течение 16 ч. Реакционную смесь охлаждали до к.т., гасили насыщенным раствором Na2CO3 (50 мл) и экстрагировали с помощью EtOAc (100 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии с применением 30-40% EtOAc в гексане с получением продукта в виде коричневого твердого вещества (0,2 г, выход 21%). MS (ESI): масса, рассч. для C11H11BrN2O2, 283,13; найденное значение масса/заряд, 285,0 (М+2Н)+.
Стадия 4. Этил-2-(2-этилфенил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилат
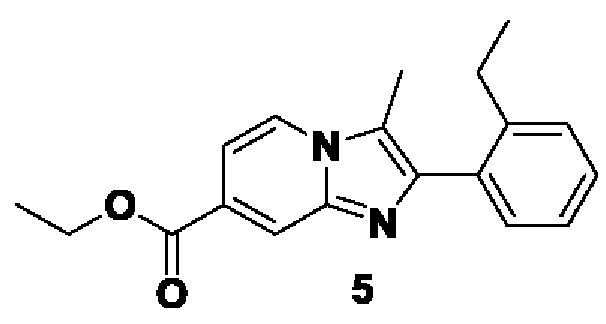
К перемешиваемому раствору этил-2-бром-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (5, 0,2 г, 0,70 ммоль) в диоксане (5 мл) добавляли (2-этилфенил)бороновую кислоту (0,16 г, 1,06 ммоль), К2СО3 (0,3 г, 2,12 ммоль), Pd(dppf)Cl2.DCM (0,03 г, 0,03 ммоль) и реакционную смесь перемешивали при 85°С в течение 16 ч. Реакционную смесь фильтровали через целит и растворитель выпаривали. К полученному неочищенному продукту добавляли воду (10 мл) и соединение экстрагировали с помощью EtOAc (25 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии с применением 25-30% EtOAc в гексане с получением продукта в виде коричневого твердого вещества (0,15 г, выход 71%). MS (ESI): масса, рассч. для C19H20N2O2, 308,15; найденное значение масса/заряд, 309,1 (М+Н)+.
Остальные стадии для соединения 31 проводили с применением процедуры, проиллюстрированной для соединения 20.
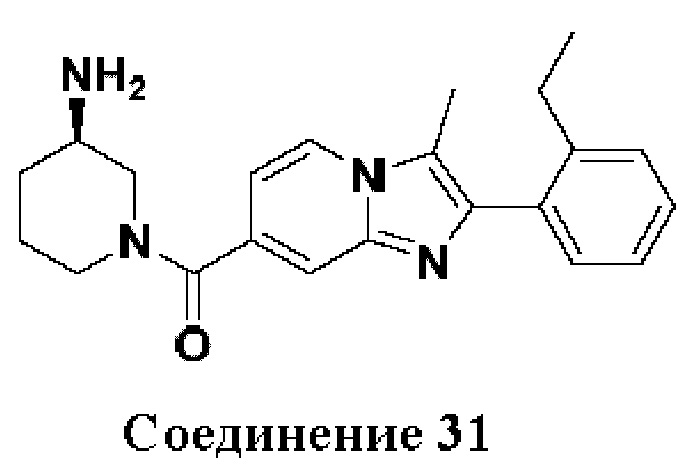
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,34 (d, J=6,8 Гц, 1H,), 7,57 (s, 1Н), 7,35-7,31 (m, 2H), 7,27-7,24 (m, 2H), 6,96 (d, J=6,4 Гц, 1H), 4,01-3,98 (m, 2H), 3,66-3,61 (m, 1H), 3,49-3,41 (m, 1H), 3,02-2,97 (m, 1H), 2,83-2,79 (m, 2H), 2,67-2,61 (m, 1H), 2,38 (s, 3H), 1,88-1,82 (m, 1H), 1,69-1,62 (m, 1H), 1,48-1,42 (m, 1H), 1,33-1,29 (m, 1H), 1,21-1,19 (m, 1H), 1,02-0,98 (m, 3H). MS (ESI): масса, рассч. для C22H26N4O, 362,21; найденное значение масса/заряд, 363,2 (М+Н)+.
Соединение 32
Синтез (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-ил)метанона (соединение 32)
Схема 7
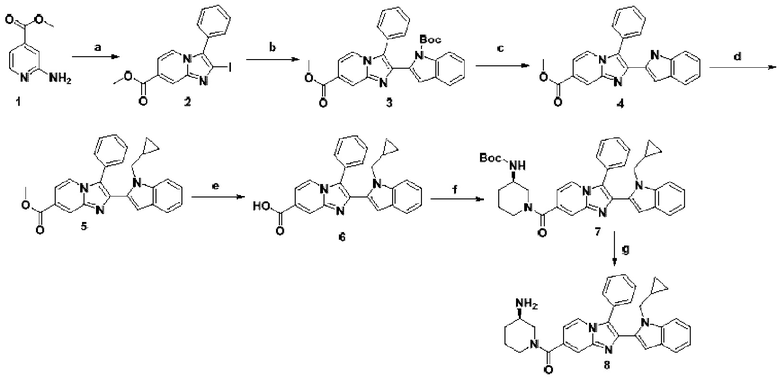
Стадия 1. Метил-2-йод-3-фенилимидазо[1,2-а]пиридин-7-карбоксилат
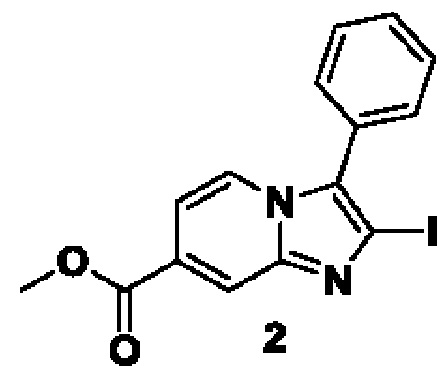
К перемешиваемому раствору метил-2-аминоизоникотината (1, 1 г, 6,5 ммоль) и фенилацетилена (0,79 мл, 7,8 ммоль) в 1,2-дихлорбензоле (20 мл) добавляли йод (1,6 г, 6,5 моль) и ацетат меди(II) (0,1 г, 0,65 ммоль). Реакционную смесь заполняли посредством 5 кг/см кислорода в стальном сосуде и перемешивали при 120°С в течение 12 ч. Затем реакционную смесь фильтровали и выпаривали с получением остатка, который растворяли в воде (50 мл). Ее экстрагировали с помощью этилацетата (2×20 мл) и органический слой высушивали над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали посредством градиентной колоночной хроматографии с применением 20% EtOAc/гексан в качестве элюента с получением необходимого продукта в виде бледно-желтого твердого вещества (0,3 г, выход 12,2%). MS (ESI): масса, рассч. для C15H11IN2O2, 377,99; найденное значение масса/заряд, 380,0 [М+Н]+.
Стадия 2. Метил-2-(1-(трет-бутоксикарбонил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбоксилат
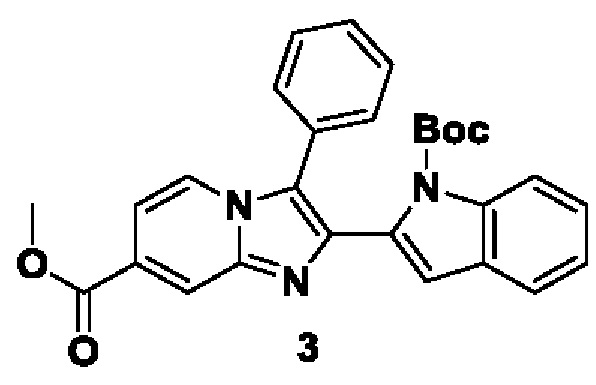
К раствору метил-2-йод-3-фенилимидазо[1,2-а]пиридин-7-карбоксилата (2, 0,17 г, 0,44 ммоль) и (1-(трет-бутоксикарбонил)-1Н-индол-2-ил)бороновой кислоты (0,17 г, 0,66 ммоль) в 1,4-диоксане (10 мл) и воде (2 мл) добавляли карбонат натрия (0,13 г, 1,3 ммоль) и смесь продували газообразным аргоном в течение 20 мин. Затем добавляли Pd(PPh3)4 (0,015 г, 0,002 ммоль) и продувку продолжали в течение 5 мин. Затем реакционную смесь перемешивали в течение 12 ч. при 90°С в герметичной пробирке. К реакционной смеси добавляли воду (10 мл) и ее экстрагировали с помощью EtOAc (2×20 мл). Органический слой промывали насыщенным раствором NH4Cl и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством градиентной колоночной хроматографии с применением 20% EtOAc/гексана в качестве элюента с получением необходимого продукта в виде бледно-желтого твердого вещества (0,1 г, выход 53,5%). MS (ESI): масса, рассч. для C28H25N3O4, 467,18; найденное значение масса/заряд, 468,3 [М+Н]+.
Стадия 3. Метил-2-(1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбоксилат
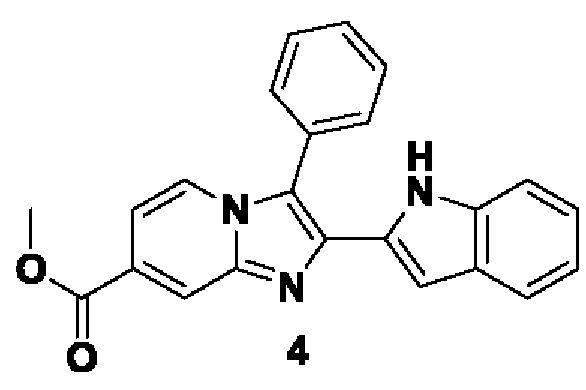
К раствору метил-2-(1-(трет-бутоксикарбонил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбоксилата (3, 0,08 г, 0,1 ммоль) в DCM (2 мл) добавляли трифторуксусную кислоту (0,04 мл, 0,5 ммоль) при 0°С. Смесь перемешивали в течение 2 ч при к.т. в атмосфере N2. Реакционную смесь концентрировали под вакуумом и нейтрализовали с применением водного раствора бикарбоната натрия. Водную фазу затем экстрагировали с помощью DCM (2×20 мл). Органический слой высушивали над Na2SO4 и концентрировали с получением необходимого продукта в виде бледно-желтого твердого вещества (4; 0,06 г, выход 99%). MS (ESI): масса, рассч. для C23H17N3O2, 367,13; найденное значение масса/заряд, 368,3 [М+Н]+.
Стадия 4. Метил-2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-фенштимидазо[1,2-а]пиридин-7-карбоксилат
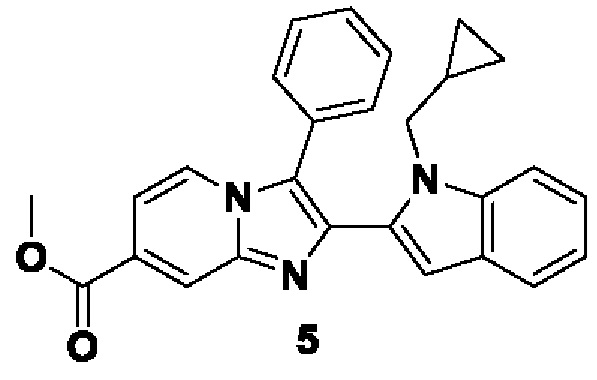
К раствору метил-2-(1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбоксилата (4, 0,06 г, 0,16 ммоль) в DMF (10 мл) добавляли карбонат цезия (0,025 г, 0,19 ммоль) с последующим добавлением (бромметил)циклопропана (0,025 г, 0,19 ммоль). Смесь перемешивали в течение 12 ч при к.т. К реакционной смеси добавляли воду (20 мл) и ее экстрагировали с помощью EtOAc (2×20 мл). Органический слой промывали водой и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением бледно-желтого твердого вещества (5; 0,06 г, выход 88,9%). MS (ESI): масса, рассч. для C27H23N3O2, 421,8; найденное значение масса/заряд, 422,3 [М+Н]+.
Стадия 5. 2-(1-(Циклопропилметил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбоновая кислота
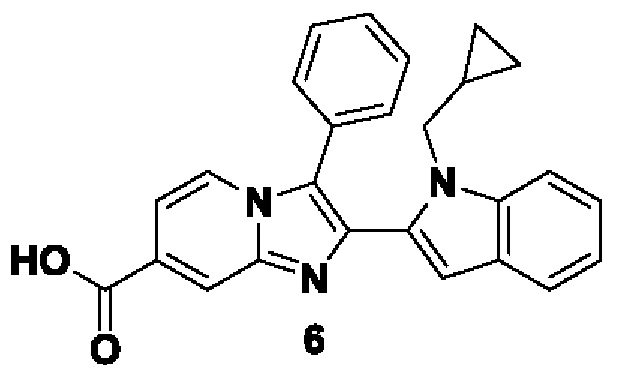
К раствору метил-2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбоксилата (5, 0,06 г, 0,14 ммоль) в этаноле (20 мл) добавляли 5 М раствор гидроксида натрия (0,14 мл, 0,72 ммоль). Обеспечивали перемешивание реакционной смеси при 80°С в течение 45 мин. После завершения реакции реакционную смесь выпаривали до сухого состояния. Затем неочищенный продукт растворяли в воде, нейтрализовали с помощью лимонной кислоты до осаждения продукта. Смесь фильтровали с получением необходимого продукта в виде грязно-белого твердого вещества (6; 0,04 г, выход 70,2%). MS (ESI): масса, рассч. для C26H21N3O2, 407,16; найденное значение масса/заряд, 408,3 [М+Н]+.
Стадия 6. Трет-бутил-(R)-(1-(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамат
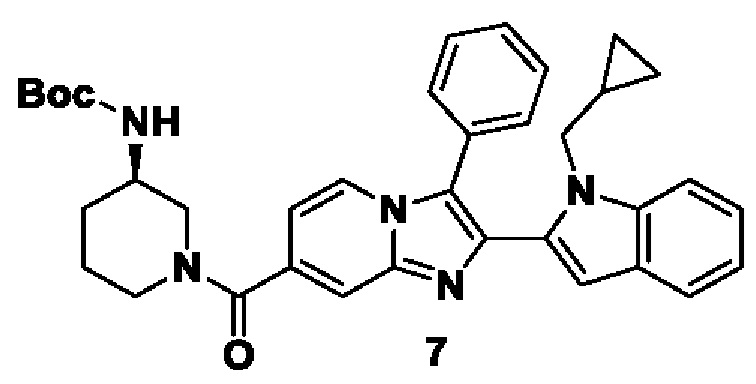
К раствору трет-бутил-(R)-пиперидин-3-ил-12-азанкарбоксилата (0,02 г, 0,1 ммоль) и 2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбоновой кислоты (6, 0,04 г, 0,09 ммоль) в DCM (10 мл) при к.т. добавляли триэтиламин (0,04 мл, 0,2 ммоль) и пропилфосфоновый ангидрид (Т3Р, 50% в этилацетате) (0,67 мл, 0,2 ммоль). Реакционную смесь перемешивали при к.т. в течение 12 ч. Ее разбавляли с помощью DCM и промывали насыщенным раствором бикарбоната натрия. Органический слой отделяли, высушивали над сульфатом натрия и выпаривали при пониженном давлении с получением неочищенного вещества. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 5% метанола в DCM с получением необходимого продукта (7; 0,04 г, выход 69,2%). MS (ESI): масса, рассч. для C36H39N5O3, 589,3; найденное значение масса/заряд, 590,3 [М+Н]+.
Стадия 7. (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-ил)метанон (соединение 32)
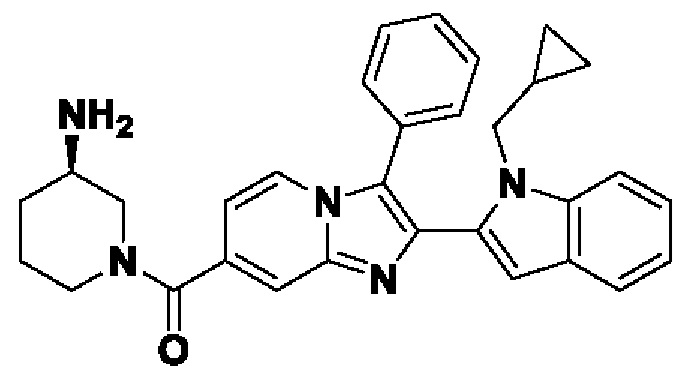
К перемешиваемому раствору трет-бутил-(R)-(1-(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (7, 0,04 г, 0,06 ммоль) в DCM (10 мл) добавляли TFA (0,02 мл, 0,3 ммоль) при 0°С, затем ее перемешивали при к.т. в течение 2 ч. После завершения реакции растворитель выпаривали. Неочищенное вещество растворяли в воде (10 мл) и нейтрализовали с помощью насыщенного раствора NaHCO3 с получением неочищенного вещества. Неочищенный продукт очищали посредством градиентной колоночной хроматографии с применением 5% метанола в DCM с последующим применением колонки для препаративной HPLC: Inertsil ODS 3V (250 мм X 4,6 мм X 5 микрон), подвижная фаза (А): 0,1% аммиак в воде, подвижная фаза (В): ацетонитрил, скорость потока: 1,0 мл/мин с получением необходимого продукта в виде грязно-белого твердого вещества (0,02 г, выход 68,9%). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,21 (d, J=7,2 Гц, 1H), 7,21 (s, 1H), 7,52 (m, 6Н), 7,39 (d, J=8 Гц, 1H), 7,13 (d, J=7,2 Гц, 1H), 6,98-6,94 (m, 2H), 6,19 (s, 1H), 4,46 (d, J=8 Гц, 2H), 2,78 (m, 2H), 1,86 (m, 2H), 1,72 (m, 2H), 1,45 (m, 2H), 1,30 (m, 2H), 1,12 (m, 2H), 0,30 (d, J=7,6 Гц, 2H), 0,16 (d, J=3,6 Гц, 2H). MS (ESI): масса, рассч. для C31H31N5O, 489,25; найденное значение масса/заряд, 490,3 [М+Н]+.
Следующие соединения (соединения 33 и 34) синтезировали с применением указанной выше процедуры, представленной для соединения 32.
Соединение 33
(R)-(3-аминопиперидин-1-ил)(3-циклопропил-2-(1-(циклопропилметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
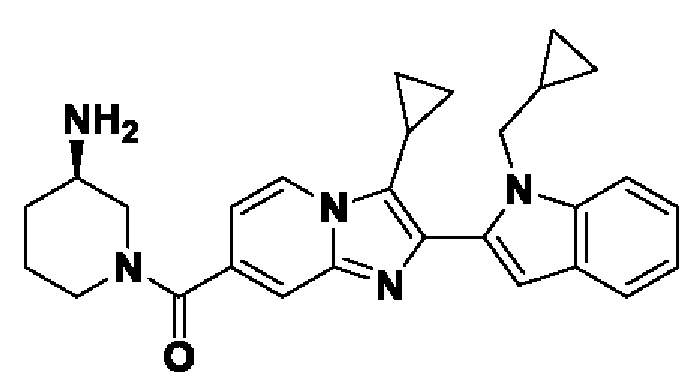
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,55 (d, J=7,2 Гц, 1H), 7,63 (s, 1H), 7,58 (t, J=7,6 Гц, 2H), 7,17 (t, J=7,2 Гц, 1H), 7,05 (t, J=8 Гц, 2H), 6,73 (s, 1H), 4,47 (d, J=7,2 Гц, 2H), 3,9 (bs, 2Н), 3,03 (bs, 1H), 2,85 (m, 2Н), 2,12-2,08 (m, 1H), 2,01-1,95 (m, 2Н), 1,88 (m, 1H), 1,73-1,69 (m, 1Н), 1,45-1,44 (m, 2H), 1,08-1,06 (m, 2H), 0,85-0,81 (m, 1H), 0,39 (d, J=4,4 Гц, 2H), 0,21 (d, J=8 Гц, 2H), 0,01 (d, J=4,4 Гц, 2H). MS (ESI): масса, рассч. для C28H31N5O, 453,25; найденное значение масса/заряд, 454,3 [М+Н]+.
Соединение 34
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-ил)метанон
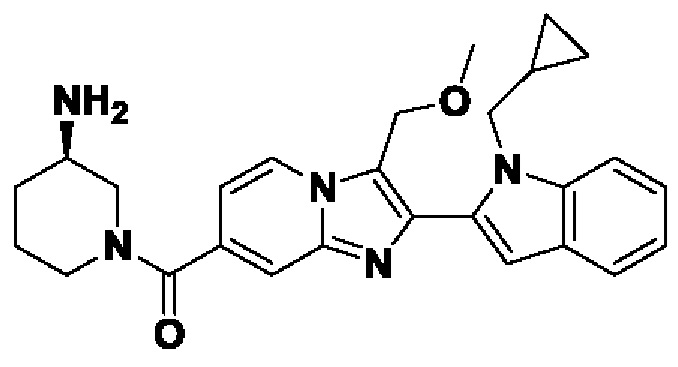
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,52 (d, J=7,2 Гц, 1H), 7,66 (s, 1H), 7,59 (t, J=8,8 Гц, 2H), 7,19 (t, J=7,6 Гц, 1H), 7,07-7,02 (m, 2Н), 6,47 (s, 1H), 4,87 (s, 2Н), 4,47 (d, J=6,8 Гц, 2H), 3,8 (m, 3Н), 3,04 (bs, 1H), 2,96-2,92 (m, 3H), 2,81 (s, 1H), 2,01-1,95 (m, 2H), 1,88 (m, 1H), 1,73-1,69 (m, 2H), 1,45-1,44 (m, 2H), 0,21 (d, J=8 Гц, 2H), 0,01 (d, J=4,4 Гц, 2H). MS (ESI): масса, рассч. для C27H31N5O2, 457,25; найденное значение масса/заряд, 458,2 [М+Н]+.
Соединение 35
(R)-(3-аминопиперидин-1-ил)(2-(1-(3-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
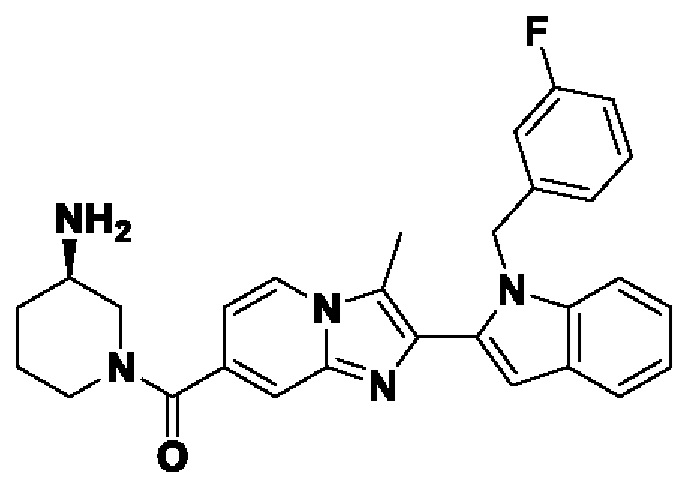
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,8 Гц, 1H), 7,61-7,59 (m, 2Н), 7,39 (d, J=8,0 Гц, 1H), 7,23-7,18 (m, 1H), 7,13-7,04 (m, 2H), 6,99-6,97 (m, 1H), 6,93-6,91 (m, 1H), 6,80-6,76 (m, 3H), 5,91 (s, 2H), 4,05-4,01 (m, 1H), 3,49-3,45 (m, 1H), 2,99-2,95 (m, 1H), 2,73-2,71 (m, 2H), 2,63 (s, 3H), 1,86-1,83 (m, 2H), 1,67-1,61 (m, 1H), 1,44-1,41 (m, 1H), 1,26-1,21 (m, 2H). MS (ESI): масса, рассч. для C29H28FN5O, 481,23; найденное значение масса/заряд, 482,2 (М+Н)+.
Соединение 36
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(тиофен-3-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
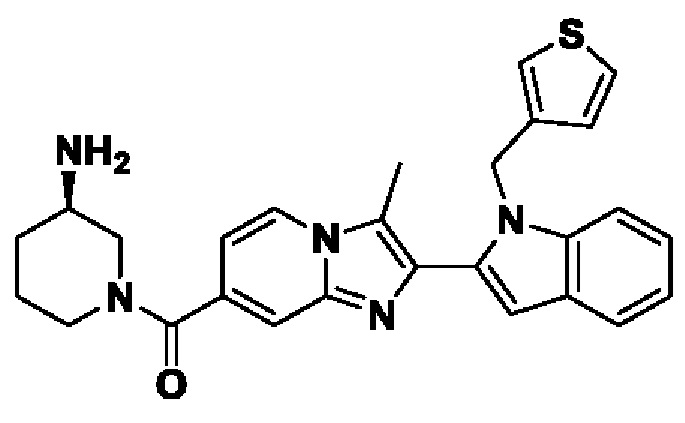
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=7,2 Гц, 1H), 7,63 (s, 1H), 7,58 (d, J=8,0 Гц, 1H), 7,53 (d, J=8,0 Гц, 1H), 7,31-7,29 (m, 1H), 7,13-7,11 (m, 2H), 7,06-7,00 (m, 2H), 6,76 (d, J=4,4 Гц, 1H), 6,71 (s, 1H), 5,85 (s, 2H), 4,22-4,16 (m, 1H), 3,66-3,61 (m, 1H), 2,97-2,95 (m, 1H), 2,64-2,61 (m, 5H), 1,84-1,81 (m, 2H), 1,66-1,59 (m, 2H), 1,44-1,42 (m, 2H). MS (ESI): масса, рассч. для C27H27N5OS, 469,19; найденное значение масса/заряд, 470,2 (М+Н)+.
Соединение 37
(R)-(3-аминопиперидин-1-ил)(2-(1-(фуран-3-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
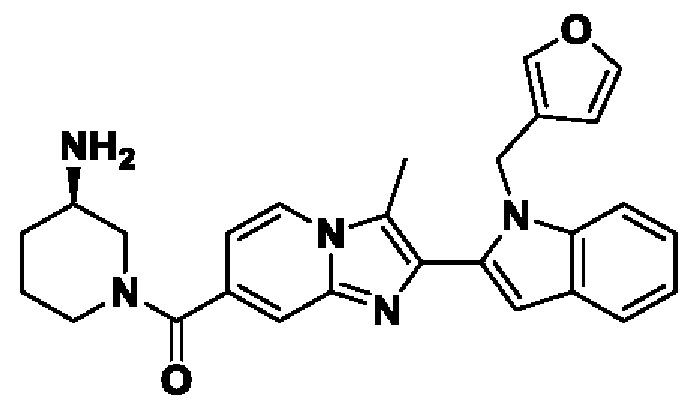
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=7,2 Гц, 1H), 7,65 (s, 1Н), 7,58 (d, J=8,0 Гц, 2H), 7,48 (s, 1H), 7,40 (s, 1H), 7,16-7,12 (m, 1H), 7,06-7,00 (m, 2H), 6,69 (s, 1H), 6,15 (s, 1H), 5,67 (s, 2H), 4,22-4,16 (m, 1H), 3,57-3,55 (m, 1H), 3,02-2,99 (m, 1H), 2,76-2,73 (m, 2H), 2,64 (s, 3H), 1,84-1,81 (m, 2H), 1,69-1,65 (m, 2H), 1,30-1,28 (m, 1H), 1,21-1,18 (m, 1H). MS (ESI): масса, рассч. для C27H27N5O2, 453,22; найденное значение масса/заряд, 454,2 (М+Н)+.
Соединение 38
(R)-3-аминопиперидин-1-ил)(2-(1-(1-(4-фторфенил)этил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
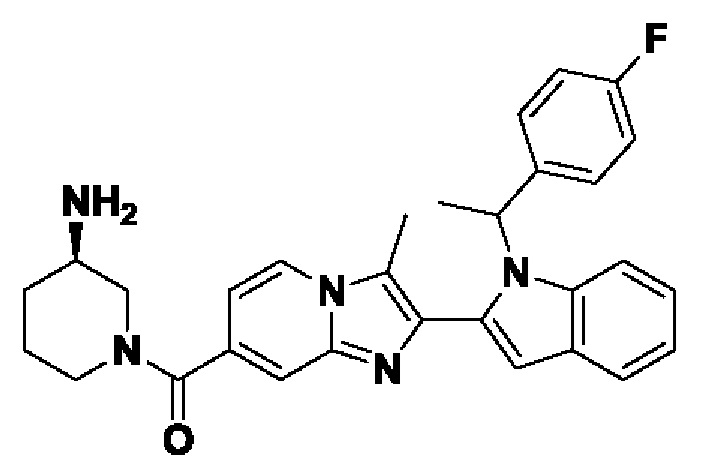
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,4 Гц, 1H), 7,61-7,57 (m, 2Н), 7,32-7,30 (m, 2Н), 7,11-7,08 (m, 2Н), 6,98-6,95 (m, 4Н), 6,74 (s, 1Н), 6,48-6,45 (m, 1H), 4,22-4,18 (m, 1H), 3,59-3,55 (m, 1H), 2,97-2,94 (m, 1H), 2,72-2,70 (m, 2H), 2,63 (s, 3H), 1,88-1,86 (m, 4H), 1,68-1,65 (m, 2H), 1,44-1,41 (m, 1H), 1,27-1,25 (m, 2H). MS (ESI): масса, рассч. для C30H30FN5O, 495,24; найденное значение масса/заряд, 496,2 (М+Н)+.
Соединение 39
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-5-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
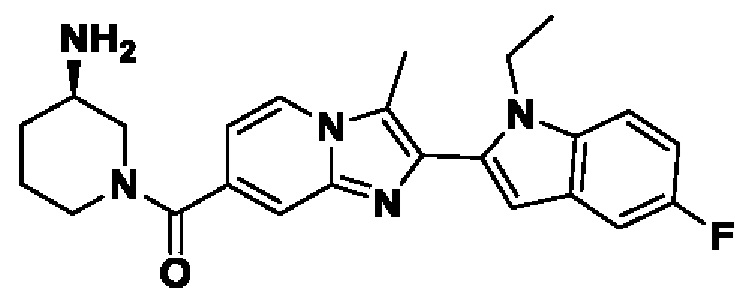
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,36 (d, J=7,2 Гц, 1H), 7,60 (s, 1H), 7,5-7,750 (m, 1H), 7,33 (d, J=9,6 Гц, 1H), 7,02-6,97 (m, 2H), 6,62 (s, 1H), 4,7-4,46 (m, 2H), 4,20 (m, 2H), 2,65 (s, 4H), 1,84 (m, 2H), 1,69 (m, 1H), 1,41 (m, 1H), 1,29-1,13 (m, 7H). MS (ESI): масса, рассч. для C24H26FN5O, 419,2; найденное значение масса/заряд 420,2 (М+Н)+.
Соединение 40
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-4-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
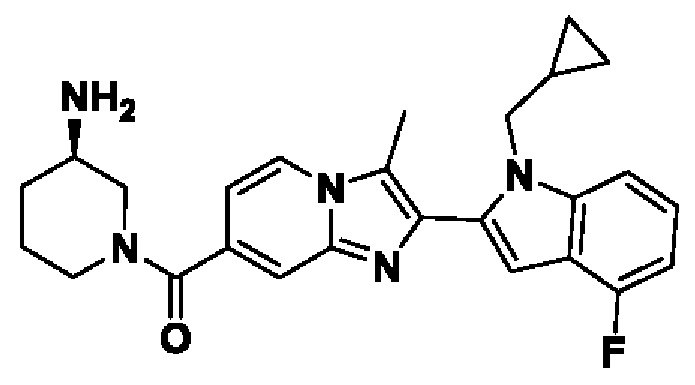
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=6,8 Гц, 1H), 7,63 (s, 1H), 7,44 (d, J=8,4 Гц, 1H), 7,17-7,11 (m, 1H), 7,01 (d, J=6,4 Гц, 1H), 6,82 (t, J=8,4 Гц, 1H), 6,69 (s, 1H), 4,50 (d, J=6,4 Гц, 2H), 4,20 (m, 1H), 3,49 (m, 1H), 3,02 (m, 1H), 2,79 (m, 2H), 2,63 (s, 3H), 1,88 (m, 2H), 1,70 (m, 2H), 1,48-1,45 (m, 1H), 1,31-1,28 (m, 1H), 1,10 (m, 1H), 0,27 (m, 2H), 0,15 (m, 2H). MS (ESI): масса, рассч. для C26H28FN5O, 445,2; найденное значение масса/заряд, 446 (М+Н)+.
Соединение 41
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((4-метилтиазол-2-ил)метил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
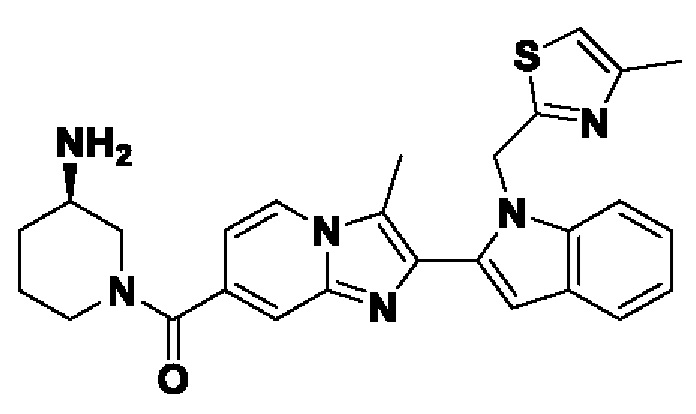
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=4,4 Гц, 1H), 7,61 (d, J=8 Гц, 2H), 7,52 (d, J=8,4 Гц, 1H), 7,17 (t, J=7,6 Гц, 1H), 7,09 (t, J=7,6 Гц, 1H), 7,0 (d, J=7,2 Гц, 1H), 7,44 (d, J=8,4 Гц, 1H), 7,17-7,11 (m, 1H), 7,01 (d, J=6,4 Гц, 1H), 6,80 (s, 1H), 3,02 (m, 2H), 2,80 (m, 2H), 2,65 (s, 3H), 2,23 (s, 3H), 1,68 (m, 2H), 1,47-1,45 (m, 2H), 1,1-1,22 (m, 3H). MS (ESI): масса, рассч. для C27H28N6OS, 484,2; найденное значение масса/заряд, 485,2 (М+Н)+.
Соединение 42
(R)-(3-аминопиперидин-1-ил)(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
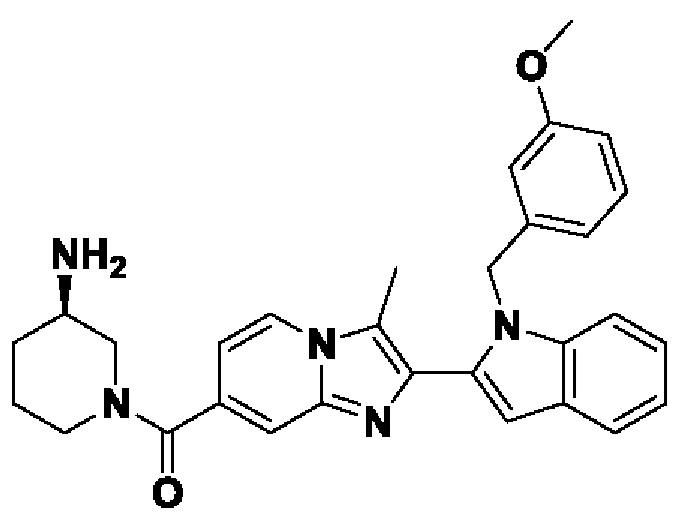
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,8 Гц, 1H), 7,61 (t, J=8,8 Гц, 2H), 7,39 (d, J=8,0 Гц, 1H), 7,12-7,03 (m, 3H), 6,69 (d, J=5,2 Гц, 1H), 6,75 (s, 1H), 6,67-6,64 (m, 1H), 6,51 (s, 2H), 5,86 (s, 2H), 4,71-4,67 (m, 1H), 4,22-4,19 (m, 1H), 3,55 (s, 3H), 3,09-2,99 (m, 1H), 2,91-2,88 (m, 2H), 2,63 (s, 3Н), 1,89-1,86 (m, 1H), 1,68-1,65 (m, 1H), 1,48-1,41 (m, 2H), 1,21-1,18 (m, 2H). MS (ESI): масса, рассч. для C30H31N5O2, 493,25; найденное значение масса/заряд, 494,2 (М+Н)+.
Соединение 43
(R)-(3-аминопиперидин-1-ил)(2-(5-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
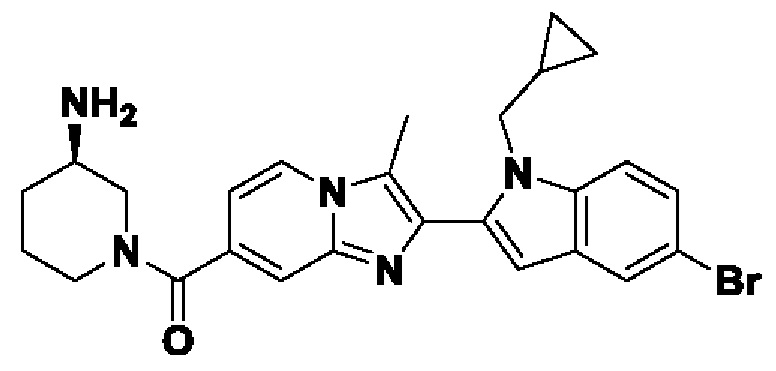
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,45 (d, J=7,2 Гц, 1H), 7,77 (s, 1H), 7,70 (s, 1H), 7,57 (d, J=8,4 Гц, 1H), 7,28 (bs, 1H), 6,71 (bs, 1H), 6,65 (s, 1H), 4,49 (bs, 2H), 3,16 (bs, 3H), 2,06-1,89 (m, 2H), 1,53 (bs, 2H), 1,31-1,28 (m, 5H), 1,09 (bs, 1H), 0,83 (bs, 2H), 0,28 (bs, 2H), 0,15 (bs, 2H). MS (ESI): масса, рассч. для C26H28BrN5O, 506,45; найденное значение масса/заряд, 508,1 [М+Н]2+.
Соединение 44
(R)-(3-аминопиперидин-1-ил)(2-(7-хлор-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
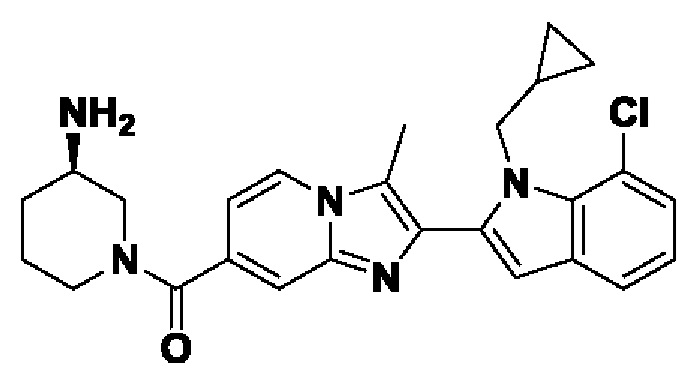
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=7,2 Гц, 1H), 7,67 (s, 1H), 7,58 (d, J=8 Гц, 1H), 7,22 (d, J=7,6 Гц, 1Н),7,08-7,02 (m, 2H), 6,74 (s, 1H), 4,80 (d, J=6,8 Гц, 2H), 4,0 (bs, 2H), 2,98 (m, 3H), 2,61 (s, 3H), 1,89 (m, 2H), 1,71 (m, 1H), 1,48-1,46 (m, 2H), 1,22 (m, 1H), 1,02 (m, 1H), 0,20-0,18 (m, 2H), -0,08 (m, 2H). MS (ESI): масса, рассч. для C26H28ClN5O, 461,20; найденное значение масса/заряд, 462,1 (М+Н)+.
Соединение 45
Синтез (R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метантион
Соединение 45 получали из соединения 13 в соответствии со стадией, представленной ниже.

К перемешиваемому раствору (R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (соединение 13, 0,05 г, 0,11 ммоль) в толуоле (2 мл) добавляли реагент Лавессона (0,06 г, ОД 5 ммоль) и перемешивали при 100°С в течение 16 ч (условие реакции а). Реакционную смесь охлаждали до к.т., добавляли насыщенный NaHCO3 (10 мл) и соединение экстрагировали с помощью EtOAc (30 мл). Органический экстракт промывали солевым раствором (10 мл), высушивали над сульфатом натрия и выпаривали. Неочищенный продукт очищали посредством колоночной хроматографии с применением 2-6% МеОН в DCM с последующей преп. HPLC (аналитические условия: колонка: Inertsil ODS 3V (250 мм X 4,6 мм X 5 микрон), подвижная фаза (А): 0,1% ацетат аммония в воде, подвижная фаза (В): ACN, скорость потока: 1,0 мл/мин., Rt: 14,43) с получением продукта в виде желтого твердого вещества (соединение 45) (0,015 г, выход 29%). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,36 (d, J=5,2 Гц, 1H), 7,61-7,59 (m, 1H), 7,42-7,38 (m, 2H), 7,12-7,00 (m, 6H), 6,92-6,90 (m, 1H), 6,74 (s, 1H), 5,86 (s, 2H), 5,08-4,90 (m, 2H), 3,84-3,76 (m, 1H), 3,45-3,42 (m, 1H), 3,10-3,05 (m, 1H), 2,84-2,81 (m, 1H), 2,62 (s, 3H), 1,85-1,81 (m, 2H), 1,67-1,59 (m, 2H), 1,32-1,29 (m, 1H). MS (ESI): масса, рассч. для C29H28FN5S, 497,20; найденное значение масса/заряд, 498,1 (М+Н)+.
Соединение 46
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-метил-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
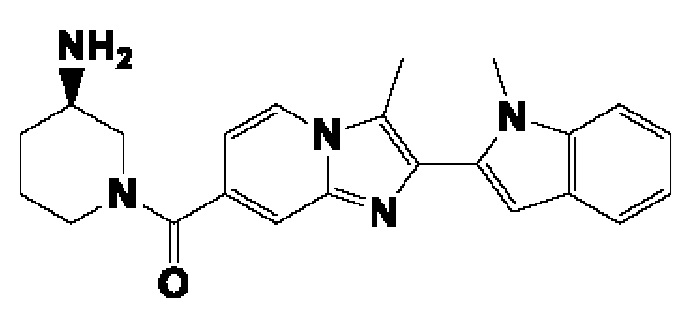
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=7,2 Гц, 1H), 7,64 (s, 1Н), 7,59 (d, J=8 Гц, 1H), 7,49 (d, J=8,4 Гц, 1H), 7,20 (t, J=6,4 Гц, 1H), 7,07 (t, J=7,6 Гц, 1H), 6,99 (d, J=6,8 Гц, 1H), 6,66 (s, 1H), 4,12 (m, 1H), 3,96 (s, 3H), 2,65 (s, 3H), 1,87 (m, 1H), 1,68 (m, 2H), 1,47 (m, 1H), 1,26-1,22 (m, 4H), 0,88-0,84 (m, 2H). MS (ESI): масса, рассч. для C23H25N5O, 387,20; найденное значение масса/заряд 388,2 (М+Н)+.
Соединение 47
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-7-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
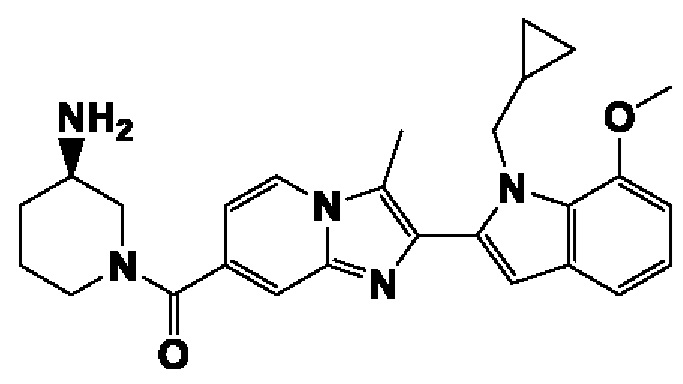
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=7,2 Гц, 1H), 7,67 (s, 1H), 7,58 (d, J=8 Гц, 1H), 7,22 (d, J=7,6 Гц, 1H), 7,08-7,02 (m, 2H), 6,74 (s, 1H), 4,80 (d, J=6,8 Гц, 2H), 4,0 (bs, 2H), 3,95 (s, 3H), 2,98 (m, 3H), 2,61 (s, 3H), 1,89 (m, 2H), 1,71 (m, 1H), 1,48-1,46 (m, 2H), 1,22 (m, 1H), 1,02 (m, 1H), 0,20-0,18 (m, 2H), -0,08 (m, 2H). MS (ESI): масса, рассч. для C27H31N5O2, 457,2; найденное значение масса/заряд, 458,1 (М+Н)+.
Соединение 48
(R)-(3-аминопиперидин-1-ил)(2-(1-((2,4-диметилтиазол-5-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон

1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=6,8 Гц, 1H), 7,62-7,58 (m, 2H), 7,49 (d, J=8,0 Гц, 1H), 7,18 (t, J=6,8 Гц, 1H), 7,07 (t, J=6,8 Гц, 1H), 7,00 (d, J=7,2 Гц, 1H), 6,72 (s, 1H), 6,00 (s, 2H), 4,22-4,16 (m, 1H), 3,66-3,61 (m, 1H), 2,99-2,95 (m, 1H), 2,64-2,63 (m, 1H), 2,62 (s, 3H), 2,56 (s, 3H), 2,17 (s, 3H), 2,01-1,95 (m, 1H), 1,84-1,81 (m, 2H), 1,66-1,59 (m, 2H), 1,44-1,42 (m, 1H), 1,22-1,20 (m, 1H). MS (ESI): масса, рассч. для C28H30N6OS, 498,22; найденное значение масса/заряд, 499,2 (М+Н)+.
Соединение 49
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((2-метилтиазол-5-ил)метил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
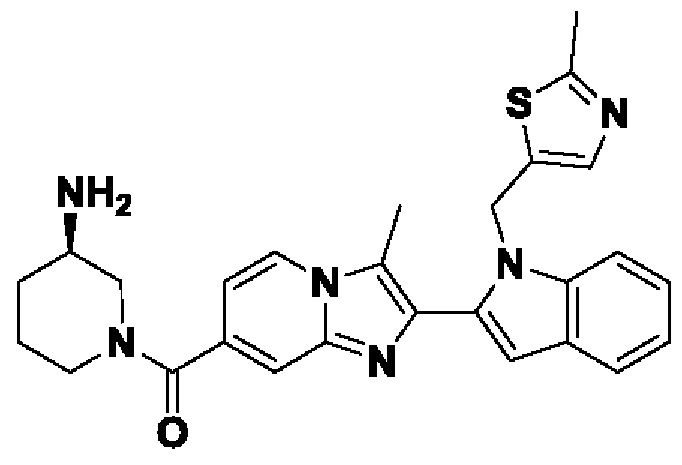
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,46 (d, J=7,2 Гц, 1H), 7,67-7,64 (m, 2Н), 7,58 (d, J=7,6 Гц, 1H), 7,51 (s, 1H), 7,17 (t, J=7,2 Гц, 1H), 7,08-7,02 (m, 2H), 6,74 (s, 1H), 6,07 (s, 2H), 4,66-4,61 (m, 1H), 4,12-4,08 (m, 1H), 3,05-3,01 (m, 1H), 2,94-2,91 (m, 2H), 2,66 (s, 3H), 2,41 (s, 3H), 1,90-1,87 (m, 1H), 1,70-1,67 (m, 1H), 1,49-1,45 (m, 1H), 1,37-1,33 (m, 1H), 1,26-1,21 (m, 2H). MS (ESI): масса, рассч. для C27H28N6OS, 484,20; найденное значение масса/заряд 485,1 (М+Н)+.
Соединение 50
Синтез соли (R)-(3-аминопиперидин-1-ил)(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты (соединение 50)
Стадия 1. Синтез этил-3-метил-2-(1-(фенилсульфонил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-карбоксилата (2)
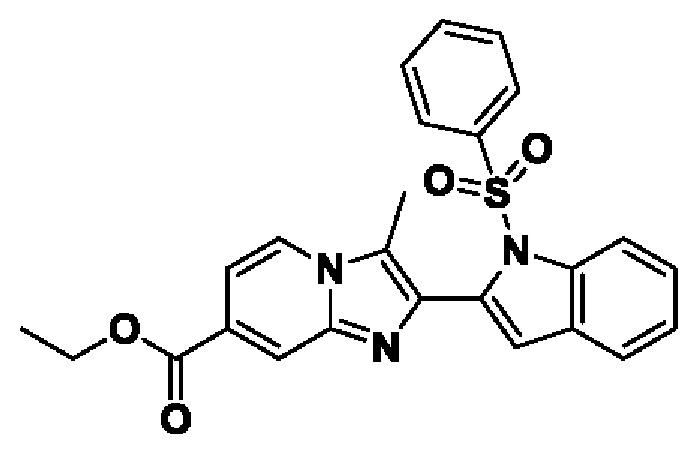
К перемешиваемому раствору этил-2-аминоизоникотината (1, 6,0 г, 36,11 ммоль) и 1-(фенилсульфонил)-1Н-индол-2-карбальдегида (11,3 г, 40,44 ммоль) в нитроэтане (60 мл) добавляли хлорид железа (0,55 г, 3,37 ммоль) и затем реакционную смесь нагревали с обратным холодильником при 90°С в течение 5 ч. После завершения реакции добавляли ледяную воду и реакционную смесь экстрагировали с помощью этилацетата. Органический слой высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного вещества. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 12,0 г и 0-30% этилацетата в гексане в качестве элюента. Необходимые фракции концентрировали при пониженном давлении с получением этил-3-метил-2-(1-(фенилсульфонил)-1Н-индол-2-ил)имидазо[1,2а]пиридин-7-карбоксилата (2) в виде желтого твердого вещества. Выход: 3,4 г (35%). MS (ESI): 459,22; найденное значение масса/заряд: 460,39 [М+Н]+1.
Стадия 2. Синтез этил-2-(1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (3)
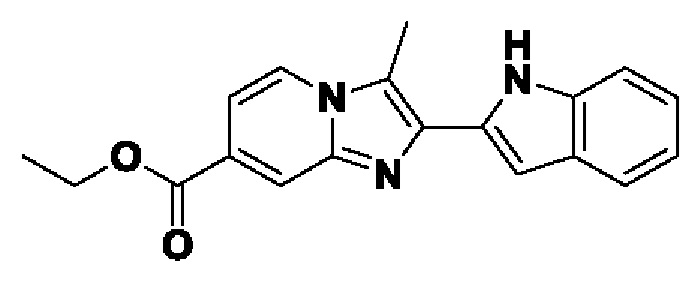
К перемешиваемому раствору этил-3-метил-2-(1-(фенилсульфонил)-1Н-индол-2-ил)имидазо[1,2а]пиридин-7-карбоксилата (2, 3,40 г 7,40 ммоль) в тетрагидрофуране (10 мл) медленно добавляли 1 М фторид тетрабутиламмония в тетрагидрофуране (30 мл) при 0°С. Реакционную смесь нагревали с обратным холодильником при 60°С в течение приблизительно 12 ч. После завершения реакции добавляли ледяную воду и реакционную смесь экстрагировали с помощью этилацетата. Органический слой высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного вещества. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 12,0 г и 30% этилацетата в гексане в качестве элюента с получением этил-2-(1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (3) в виде желтого твердого вещества. Выход: 2,2 г (93%), MS (ESI): 319,11; найденное значение масса/заряд, 320,34 [М+Н]+.
Стадия 3. Синтез этил-2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (4)
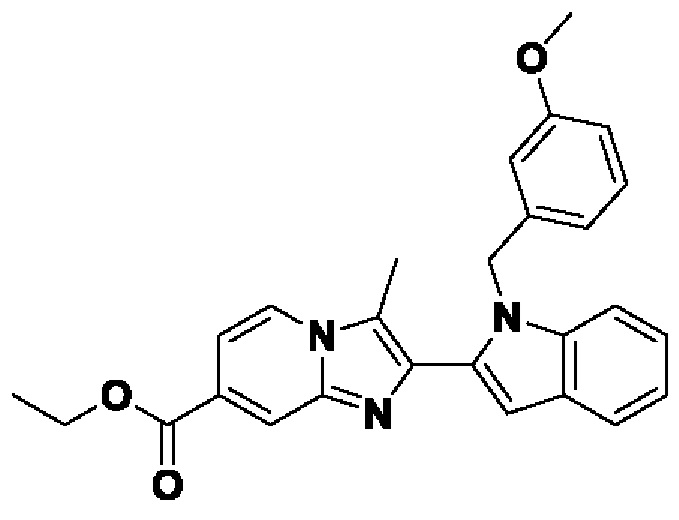
К перемешиваемому раствору этил-2-(1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (3, 2,20 г, 6,89 ммоль) в N,N-диметилформамиде (20 мл) добавляли карбонат цезия (6,72 г, 20,68 ммоль) при к.т. Добавляли 1-(хлорметил)-3-метоксибензол (1,20 г, 20,68 ммоль) и перемешивали в течение приблизительно 10 мин. при к.т., а затем полученную смесь нагревали до 90°С в течение 3 ч. После завершения реакции реакционную смесь охлаждали до к.т. и разбавляли этилацетатом (50 мл × 3). Органическую фазу промывали водой и солевым раствором, высушивали над безводным сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 12,0 г и 30-50% этилацетата в гексане в качестве элюента с получением этил-2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (4) в виде желтого твердого вещества. Выход: 1,2 г (40%). MS (ESI): 439,50; найденное значение масса/заряд, 440,04 [М+Н]+1.
Стадия 4. Синтез 2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоновой кислоты (5)
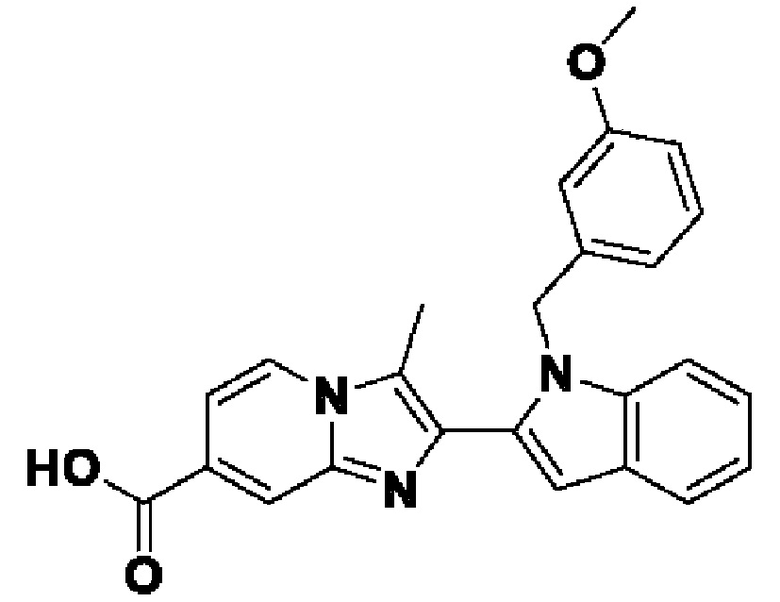
К перемешиваемому раствору этил-2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (1,20 г, 2,73 ммоль) в тетрагидрофуране (10 мл) добавляли метанол (4 мл) и 5 н. раствор гидроксида натрия (4 мл) и полученную смесь нагревали до 60°С в течение 3 ч. После завершения реакции реакционную смесь выпаривали при пониженном давлении и подкисляли до рН 2-3 с помощью лимонной кислоты при 0°С. Неочищенное вещество экстрагировали с помощью дихлорметана (30 мл × 2), промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении до 2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоновой кислоты (5) в виде твердого вещества бледно-желтого цвета. Выход: 0,850 г (78%). MS (ESI): 412; найденное значение масса/заряд, 413 [М+Н]+.
Стадия 5. Синтез трет-бутил-(R)-(1-(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (6)
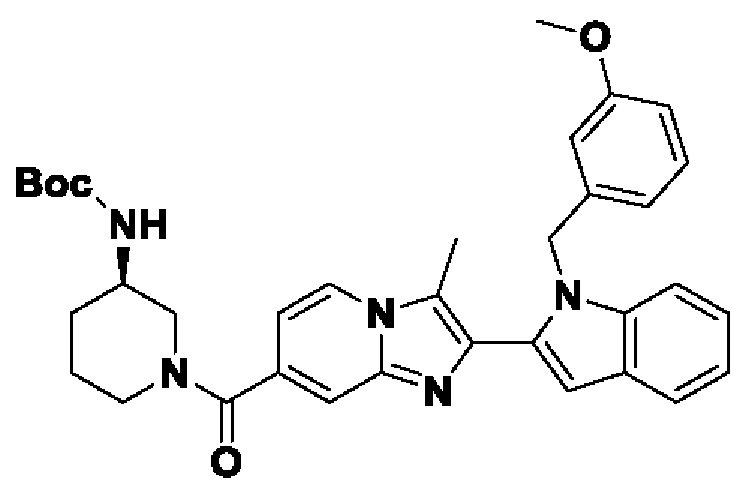
К перемешиваемому раствору 2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоновой кислоты (5, 0,85 г, 2,06 ммоль) в дихлорметане (20 мл) добавляли трет-бутил-(11)-пиперидин-3-илкарбамат (0,49 г, 2,47 ммоль), триэтиламин (0,8 мл, 6,18 ммоль) и пропилфосфорный ангидрид в 50% этилацетате (2,1 мл, 6,80 ммоль) при 0°С. Обеспечивали перемешивание реакционной смеси при к.т. в течение 1 ч. После завершения реакции реакционную смесь гасили раствором бикарбоната натрия (20 мл) и экстрагировали с помощью дихлорметана (20 мл × 2). Объединенные органические слои промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 40,0 г и 30-50% этилацетата в гексане в качестве элюента с получением трет-бутил-(R)-(1-(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (6) в виде коричневого твердого вещества. Выход: 0,640 г (86%). MS (ESI): 594,30; найденное значение масса/заряд, 595,41 [М+Н]+1.
Стадия 6. Синтез соли (R)-(3-аминопиперидин-1-ил)(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо [1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты (соединение 50)
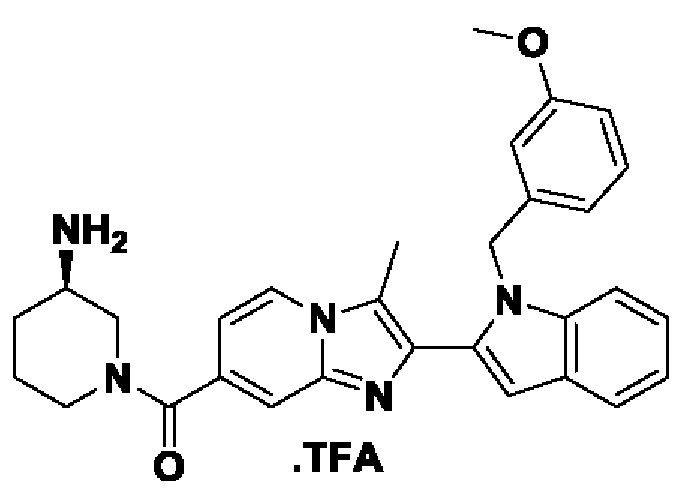
К перемешиваемому раствору смеси трет-бутил-(R)-(1-(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (0,64 г, 1,08 ммоль) в дихлорметане (60 мл) добавляли трифторуксусную кислоту (10 мл) при 0°С. Реакционную смесь перемешивали при к.т. в течение 2 ч. После завершения реакции реакционную смесь концентрировали при пониженном давлении с удалением трифторуксусной кислоты. Неочищенное вещество растворяли в минимальном объеме воды, и повышали его основность с помощью насыщенного раствора бикарбоната натрия (20 мл), и экстрагировали с помощью дихлорметана (50 мл × 2). Органический слой промывали солевым раствором, высушивали над безводным сульфатом натрия и концентрировали с получением неочищенного продукта. Неочищенное вещество очищали посредством преп. HPLC с обращенной фазой с получением (R)-(3-аминопиперидин-1-ил)(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а] пиридин-7-ил)метанона трифторацетата в виде грязно-желтого твердого вещества. Выход: 0,49 г (93%).
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,49 (d, J=7,0 Гц, 1H), 7,76 (s, 1H), 7,63 (d, J=7,6 Гц, 1H), 7,42 (d, J=8,04 Гц, 1H)), 7,15-7,07 (m, 4H), 6,80 (s, 1H), 6,69 (dJ=8,2 Гц, 1H), 6,53 (s, 2Н), 5,83 (s, 2Н), 4,ll(bs, 2Н), 3,57 (s, 3Н), 3,27 (bs, 3Н), 2,65 (s, 3Н), 1,98 (m, 1H), 1,73 (m, 1H), 1,58 (m, 2Н). MS (ESI): масса, рассч. для C30H31N5O2, 494,11; найденное значение масса/заряд, 495,07 [М+Н]+1.
Следующие соединения синтезировали с применением указанной выше процедуры, проиллюстрированной для соединения 50.
Соединение 51
(R)-(3-аминопиперидин-1-ил)(2-(6-метокси-1-(пиридин-3-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон

1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=7,08 Гц, 1H), 8,33 (d, J=4,52 Гц, 1H), 8,26 (s, 1H), 7,59 (s, 1Н), 7,50 (d, J=8,6 Гц, 1H), 7,36 (dJ=7,81 Гц, 1H), 7,22-7,19 (m, 1H), 7,03 (s, 1H), 6,98 (d, J=7,08 Гц, 1H), 6,74 (d, J=8,01 Гц, 1H), 6,70 (s, 1H), 5,92 (bs, 2H), 4,27-4,10 (m, 1H), 3,75 (s, 3H), 3,56 (bs, 1H), 2,98-2,95 (m, 2H), 2,66 (m, 1H), 2,62 (s, 3H), 1,85-1,82 (m, 1H), 1,71-1,67 (m, 3H), 1,44-1,42 (m, 1H), 1,27-1,23 (m, 1H). MS (ESI): масса, рассч. для C29H30N6O2, 494,43; найденное значение масса/заряд, 495,07 [М+Н]+.
Соединение 52
Соль (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты
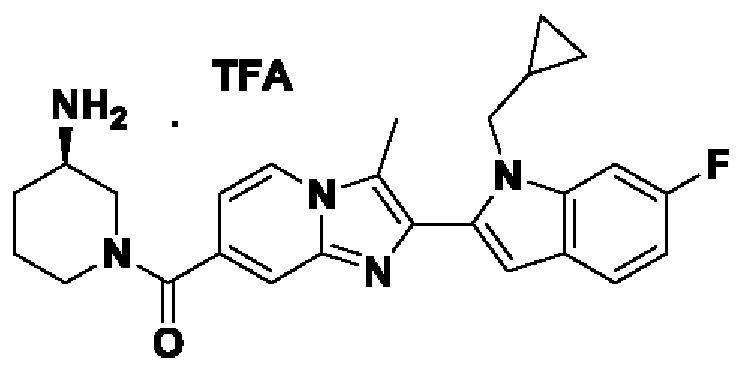
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,51(d, J=7,08 Гц, 1H), 7,95 (s, 1Н), 7,76 (s, 1H), 7,62-7,58 (m, 1H), 7,49 (d, J=10,3 Гц, 1H), 7,10 (d, J=6,56 Гц, 1H), 6,94 (t, J=8,04 Гц, 1H), 6,70 (s, 1H), 4,45(d, J=6,64 Гц, 2H), 3,29 (s, 4H), 2,64 (s, 3H), 2,01 (s, 1H), 1,75 (s, 1H), 1,60 (s, 2H), 1,06 (s, 1H), 0,28(d, J=7,48 Гц, 2H), 0,15 (d, J=3,88 Гц, 2H). MS (ESI): масса, рассч. для C26H28FN5O, 445; найденное значение масса/заряд, 446,45 [М+Н]+.
Соединение 53
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
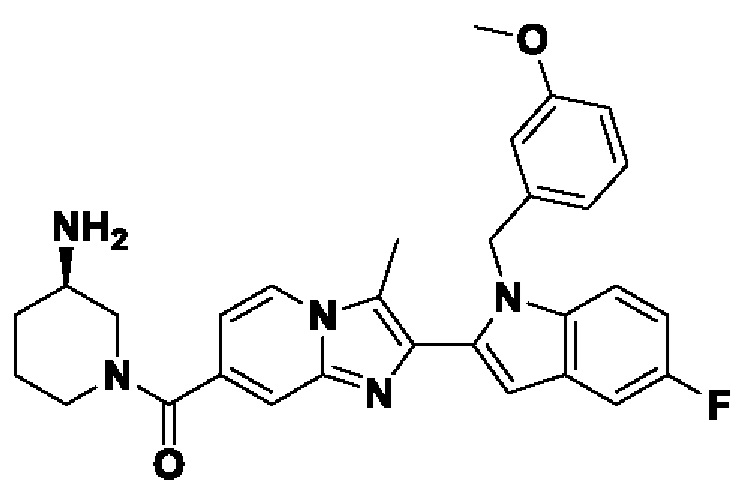
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,9 Гц, 1H), 7,62 (s, 1H), 7,43-7,36 (m, 2Н), 7,08 (t, J=7,3 Гц, 1H), 7,01-6,94 (m, 2Н), 6,76 (s, 1H), 6,67 (d, J=6,9 Гц, 1H), 6,53-6,51 (m, 2Н), 5,87 (s, 2Н), 4,30-4,08 (m, 1H), 3,57 (s, 4Н), 2,98 (s, 1H), 2,80 (s, 1H), 2,64 (s, 5Н), 2,01 (bs, 1H), 1,85-1,83 (m, 1H), 1,68 (m, 1H), 1,45-1,42 (m, 1H), 1,26-1,23 (s, 1H). MS (ESI): масса, рассч. для C30H30FN5O2, 511,51; найденное значение масса/заряд 512,67 [M+1]+1.
Соединение 54
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
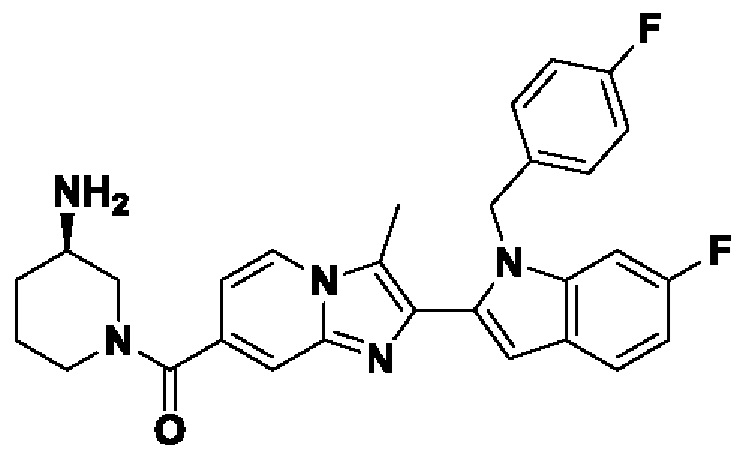
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,96 Гц, 1H), 7,63-7,60 (m, 2H), 7,31 (d, J=10,04 Гц, 1H), 7,03-6,99 (m, 5H), 6,93 (t, J=8,6 Гц, 1H), 6,78 (s, 1H), 5,86 (s, 2H), 4,25-4,10 (m, 1H), 3,56 (m, 1H), 2,98 (bs, 1H), 2,82 (m, 1H), 2,62 (m, 5H), 1,85-1,82 (m, 1H), 1,69 (bs, 2H), 1,45-1,42 (m, 1H), 1,24-1,22 (m, 1H). MS (ESI): масса, рассч. для C29H27F2N5O, 499,22; найденное значение масса/заряд, 500,37 [М+Н]+.
Соединение 55
(R)-(3-аминопиперидин-1-ил)(2-(5,6-дифтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
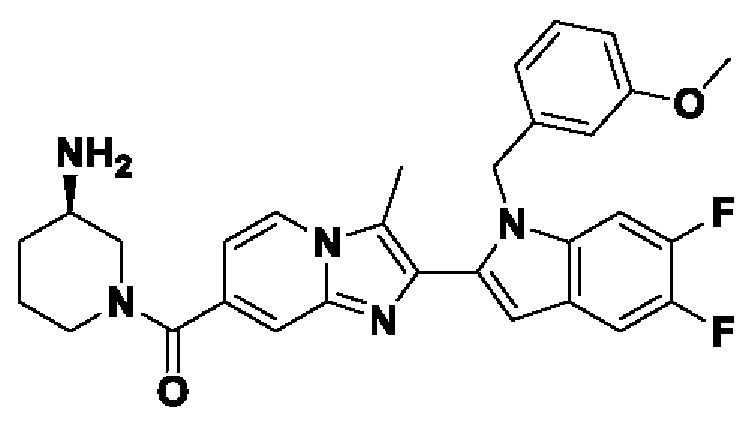
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,84 Гц, 1H), 7,63-7,54 (m, 2H), 7,08 (t, J=7,8 Гц, 1H), 6,99 (d, J=6,76 1H), 6,77 (s, 1H), 6,69 (d, J=7,56 2H), 6,50 (m, 2H), 5,86 (s, 2H), 4,24-4,01 (bs, 2H), 3,56 (s, 3H), 2,97 (bs, 2H), 2,62 (m, 4H), 1,82 (m, 1H), 1,69 (m, 2H), 1,43 (d, J=9,08, 1H), 1,23-1,09 (m, 2H). MS (ESI): масса, рассч. для C30H29F2N5O2,529,59; найденное значение масса/заряд, 530,29 [М+Н]+1.
Соединение 56
Синтез (R,E)-4-(диметиламино)-N-(1-(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)бут-2-енамида
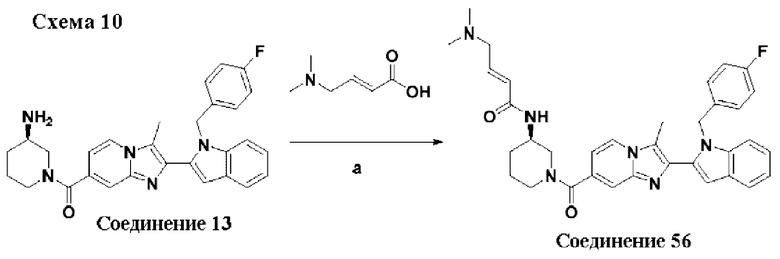
К перемешиваемому раствору (Е)-4-(диметиламино)бут-2-еновой кислоты (0,103 г, 0,623 ммоль) в дихлорметане (10 мл) добавляли (R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон (0,200 г, 0,415 ммоль), триэтиламин (0,18 мл, 1,28 ммоль), пропилфосфоновый ангидрид в 50% этилацетате (0,85 мл, 1,33 ммоль) при 0°С. Обеспечивали перемешивание реакционной смеси при к.т. в течение 2 ч. После завершения реакции реакционную смесь гасили раствором бикарбоната натрия (20 мл) и экстрагировали с помощью дихлорметана (50 мл × 2). Объединенные органические слои промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали посредством преп. HPLC с получением (R,Е)-4-(диметиламино)-N-(1-(2-(1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)бут-2-енамида в виде грязно-белого твердого вещества. Выход: 0,12 г (49%).
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,40 (s, 1H), 8,01 (s, 1Н), 7,62 (d, J=7,6 Гц, 2H), 7,44 (d, J=7,6 Гц, 1H), 7,14-7,11 (m, 1H), 7,06-6,99 (m, 6H), 6,76 (s, 1H), 6,55-6,43 (m, 1H), 6,06 (d, J=14,2 Гц, 1H), 5,88 (s, 2H), 4,13-3,68 (m, 3H), 3,11-2,94 (m, 4H), 2,63 (s, 3H), 2,11 (s, 6H), 1,87 (d, J=9,2 Гц, 1H), 1,79 (m, 1H), 1,53-1,51 (m, 2H). MS (ESI): масса, рассч. для C35H37FN6O2, 592,30; найденное значение масса/заряд 593,4 [М+Н]+1.
Соединение 57
Синтез (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона (соединение 57)
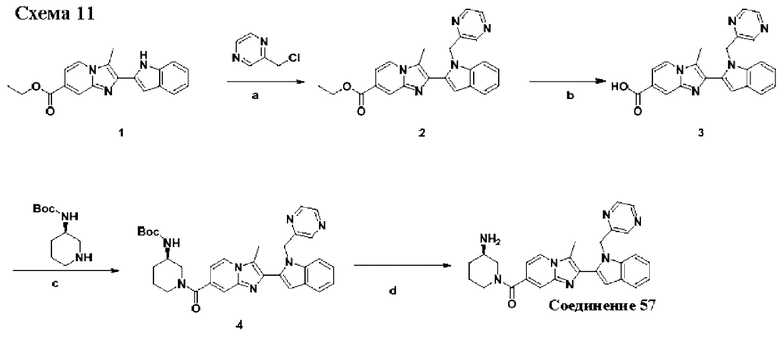
Стадия 1. Этил-3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-карбоксилат (2)
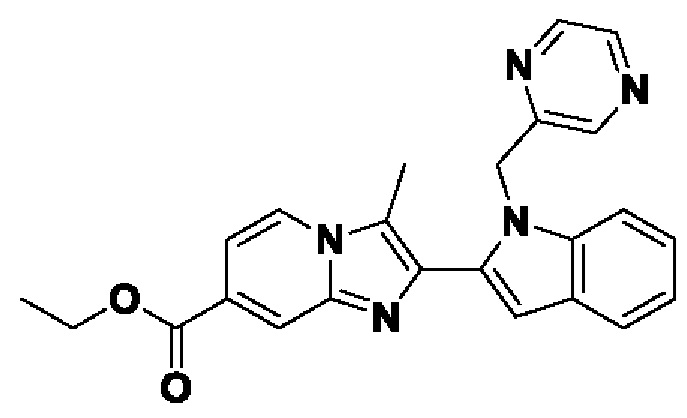
К перемешиваемому раствору этил-2-(1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбоксилата (1, 0,3 г, 0,94 ммоль) в N,N-диметилформамиде (10 мл) добавляли карбонат цезия (1,5 г, 4,7 ммоль) и 2-(хлорметил)пиразин (0,15 г, 1,13 ммоль) и перемешивали при 60°С в течение 3 ч. После завершения реакции реакционную смесь охлаждали до к.т. и разбавляли с помощью этилацетата (10 мл × 3). Органическую фазу промывали водой, солевым раствором, высушивали над безводным сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное вещество очищали путем применения CombiFlash, RediSep 12 г и 50-70% этилацетата в гексане в качестве элюента с получением этил-3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-карбоксилата (2) в виде светло-коричневого твердого вещества. Выход: 0,108 г (28%). MS (ESI): 411,17; найденное значение масса/заряд, 412,21.
Стадия 2. Синтез 3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-a]пиридин-7-карбоновой кислоты (3)
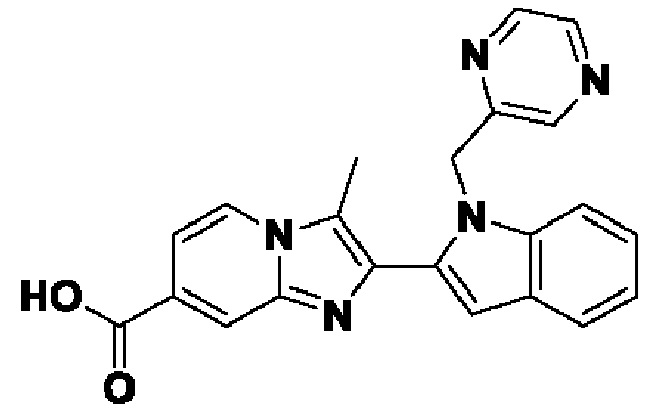
К перемешиваемому раствору этил-3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-карбоксилата (2, 0,108 г, 0,267 ммоль) в тетрагидрофуране (4 мл) добавляли метанол (2 мл) и 5 н. раствор гидроксида натрия в воде (2 мл) и полученную смесь нагревали до 60°С в течение 1 ч. После завершения реакции реакционную смесь выпаривали при пониженном давлении и подкисляли до рН 2-3 с помощью лимонной кислоты при 0°С. Неочищенное вещество экстрагировали с помощью дихлорметана (50 мл × 2), промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-карбоновой кислоты (3) в виде грязно-белого твердого вещества. Выход: 0,10 г, 99%. MS (ESI): 383,14; найденное значение масса/заряд, 382,11 [М-Н]-1.
Стадия 3. Синтез трет-бутил-(R)-(1-(3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (4)
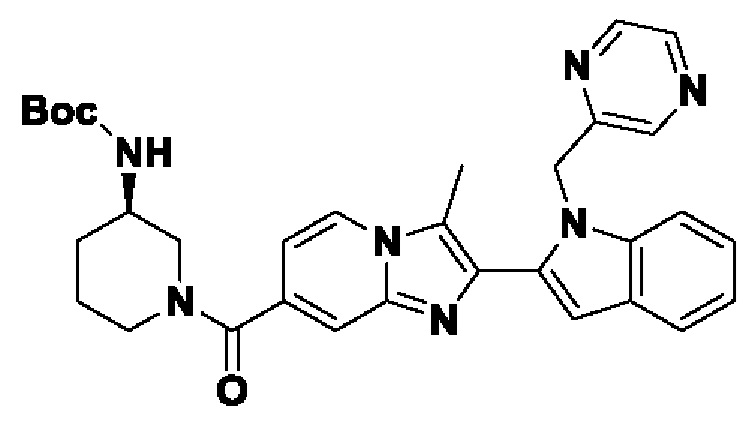
К перемешиваемому раствору 3-метил-2-(1-(пиразин-2-илметил)-1H-индол-2-ил)имидазо[1,2-а]пиридин-7-карбоновой кислоты (3, 0,10 г, 0,261 ммоль) в дихлорметане (10 мл) добавляли трет-бутил-(11)-пиперидин-3-илкарбамат (0,06 г, 0,313 ммоль), триэтиламин (0,11 мл, 0,80 ммоль), пропилфосфоновый ангидрид в 50% этилацетате (0,50 мл, 0,83 ммоль) при 0°С. Обеспечивали перемешивание реакционной смеси при к.т. в течение 3 ч. После завершения реакции реакционную смесь гасили раствором бикарбоната натрия (20 мл) и экстрагировали с помощью дихлорметана (5 мл × 2). Объединенные органические слои промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенное вещество очищали путем применения CombiFlash, RediSep 4,0 г и 1-5% метанола в дихлорметане в качестве элюента с получением трет-бутил-(R)-(1-(3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (4) в виде грязно-белого твердого вещества. Выход: 0,07 г, 47%. MS (ESI): 565,28; найденное значение масса/заряд, 566,18 [М+Н]+1.
Стадия 4. Синтез (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона (соединение 57)
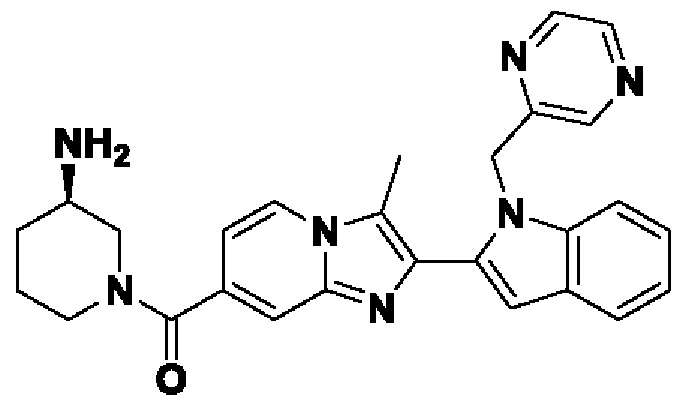
К перемешиваемому раствору смеси трет-бутил-(R)-(1-(3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (4, 0,07 г, 0,123 ммоль) в дихлорметане (2,0 мл) добавляли трифторуксусную кислоту (0,5 мл) при 0°С. Реакционную смесь перемешивали при к.т. в течение 3 ч. После завершения реакции реакционную смесь концентрировали при пониженном давлении с удалением трифторуксусной кислоты. Неочищенное вещество растворяли в минимальном объеме воды, и повышали его основность с помощью насыщенного раствора бикарбоната натрия (20 мл), и экстрагировали с помощью дихлорметана (10 мл × 2). Органический слой промывали солевым раствором, высушивали над безводным сульфатом натрия и концентрировали с получением (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона в виде белого твердого вещества. Выход: 0,05 г (87%).
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,49 (s, 1H), 8,43-8,40 (m, 2Н), 8,15 (s, 1H), 7,64 (d, J=7,56 Гц, 1H), 7,57 (s, 1H), 7,47 (d, J=8,12 Гц, 1H), 7,16-7,07 (m, 2Н), 6,99 (d,J=7,04 Гц, 1H), 6,82 (s, 1Н), 6,05 (s, 2H), 4,26-4,09 (m, 2H), 3,59-3,51 (m, 2H), 3,00 (bs, 2H), 2,64 (s, 3Н), 1,85 (bs, 1H), 1,68 (bs, 1H), 1,46-1,43 (m, 1H), 1,35-1,23 (m, 2H). MS (ESI): масса, рассч. для C27H27N7O, 465,23; найденное значение масса/заряд, 466,17 [М+Н]+1.
Следующие соединения синтезировали с применением указанной выше процедуры, проиллюстрированной для соединения 57.
Соединение 58
Соль (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиримидин-5-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты
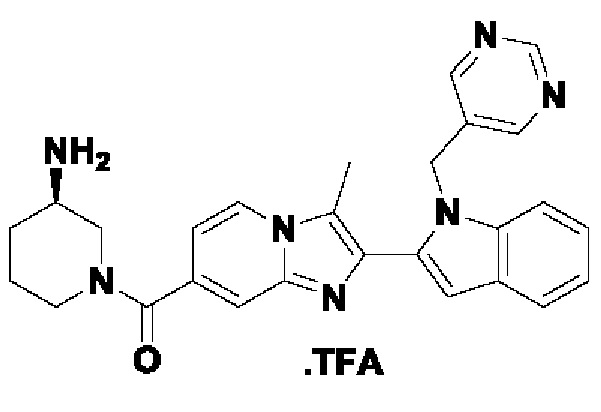
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,99 (s, 1H), 8,54 (s, 2Н), 8,48 (d, J=6,5 Гц, 1H), 7,70 (s, 1H), 7,65 (d, J=7,6 Гц, 1H), 7,55 (d, J=8,0 Гц, 1H), 7,20- 7,16 (m, 1H), 7,13-7,09 (m, 1H), 7,05 (d, J=11,4 Гц, 1H), 6,84 (s, 1H), 5,93 (s, 2H), 4,09 (s, 2H), 3,29 (m, 3H), 2,67 (s, 3Н), 1,99 (s, 2H), 1,74 (s, 1H), 1,58 (m, 2H), 1,23 (s, 1H). MS (ESI): масса, рассч. для C27H27N7O, 465,11; найденное значение масса/заряд, 466,07 [М+Н]+1.
Соединение 59
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридазин-3-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанон
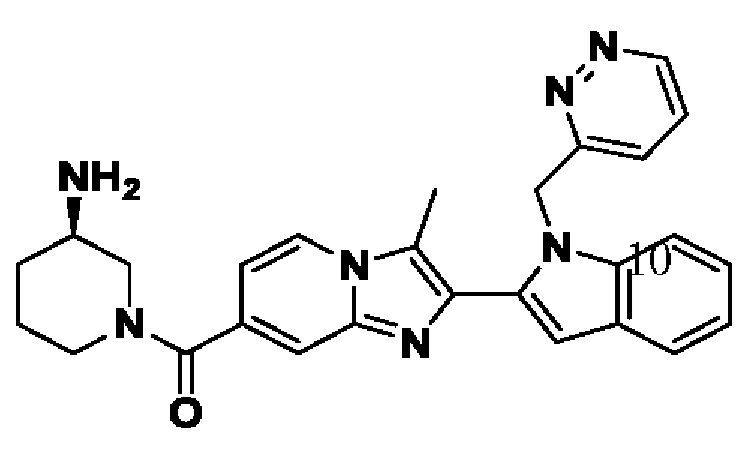
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 9,06 (d, J=4,76 Гц, 1H), 8,43 (d, J=7,0 Гц, 1H), 7,64 (d, J=7,25 Гц, 1H), 7,57 (s, 1H), 7,55-7,51 (m, 1H), 7,43 (d, J=7,68 Гц, 1H), 7,18 (d, J=7,31 Гц, 1H), 7,13-7,07 (m, 2H), 7,00 (d, J=6,96 Гц, 1H), 6,83 (s, 1H), 6,17 (s, 2H), 4,25-4,08 (s, 1H), 3,54 (bs, 1H), 2,96 (bs, 1H), 2,66 (s, 3H), 1,88-1,83 (m, 4H), 1,70 (m, 2H), 1,44-1,41 (m, 1H), 1,28-1,23 (m, 1H). MS (ESI): масса, рассч. для C27H27N7O, 465,34; найденное значение масса/заряд, 466,67 [М+Н]+1.
Соединение 60
(R)-(3-аминопиперидин-1-ил)(2-(1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
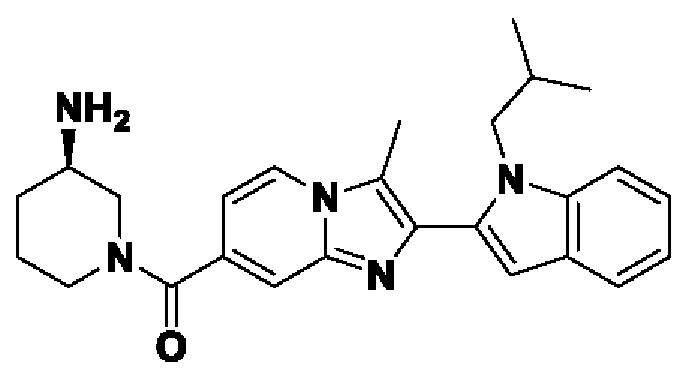
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,45 (d, J=2,9 Гц, 1H), 7,71 (s, 1H), 7,59 (d, J=7,8 Гц, 1H), 7,54 (d, J=8,2 Гц, 1H), 7,17 (t, J=7,2 Гц, 1H), 7,07-7,02 (m, 2Н), 6,65 (s, 1Н), 4,45 (d, J=7,0 Гц, 2H), 4,18 (m, 2H), 3,12 (bs, 2H), 2,63 (s, 3H), 1,98-1,95 (m, 2H), 1,73 (m, 1H), 1,53 (m, 2H), 1,23 (s, 2H), 0,84 (m, 1H), 0,64 (d, J=6,4 Гц, 6H). MS (ESI): масса, рассч. для C26H31N5O, 429,31; найденное значение масса/заряд, 430,24 [М+Н]+.
Соединение 61
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклобутилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
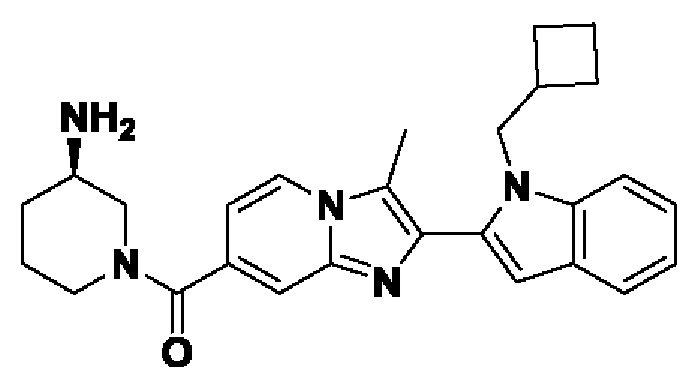
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=6,92 Гц, 1H), 7,65 (s, 1Н), 7,57 (t, J=7,56 Гц, 2H), 7,17 (t, J=7,20 Гц, 1H), 7,07-7,00 (m, 2H), 6,63 (s, 1H), 4,67 (d, J=6,76 Гц, 2H), 4,30-4,14 (m, 1H), 3,63 (bs, 1H), 3,01 (bs, 2H), 2,72 (m, 1H), 2,63 (s, 3H), 2,59-2,55 (m, 1H), 1,87 (d, J=9,8 Гц, 1H), 1,70-1,62 (m, 6H), 1,53-1,48 (m, 4H), 1,35-1,23 (m, 1H). MS (ESI): масса, рассч. для C27H31N5O, 441,25; найденное значение масса/заряд, 442,27 [М+Н]+1.
Соединение 62
(R)-(3-аминопиперидин-1-ил)(2-(1-((3-фторпиридин-2-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
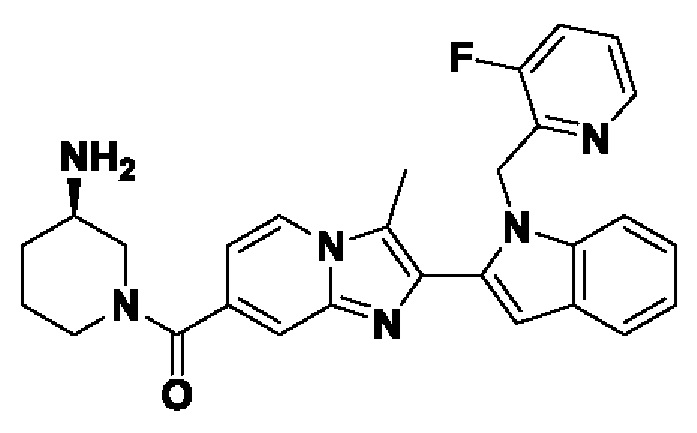
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,39 (d, J=6,92 Гц, 1H), 8,14 (d, J=4,44 Гц, 1H), 7,61-7,54 (m, 3Н), 7,44 (d, J=8,08 Гц, 1H), 7,27-7,23 (m, 1H), 7,13-7,09 (m, 1Н), 7,07-7,03 (m, 1H), 6,97 (d, J=6,04 Гц, 1H), 6,73 (s, 1H), 6,09 (s, 2H), 4,25-4,07 (m, 1H), 3,57 (bs, 1H), 2,98 (m, 2H), 2,66 (m, 1H), 2,61 (s, 3H), 1,85 (d, J=9,68 Гц, 1H), 1,69-1,58 (m, 2H), 1,45-1,42 (m, 1H), 1,23 (m, 2H). MS (ESI): масса, рассч. для C27H31N5O, 482,22; найденное значение масса/заряд, 483,30 [М+Н]+1.
Соединение 63
(R)-(3-аминопиперидин-1-ил)(2-(1-((5-метоксипиридин-2-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
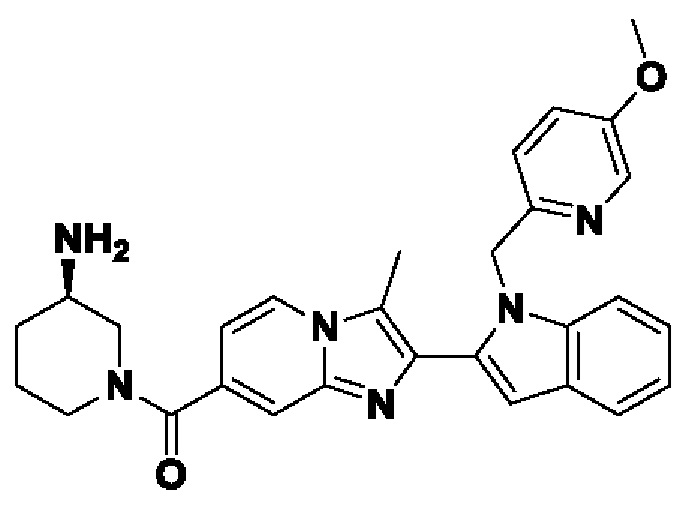
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,96 Гц, 1H), 8,13 (d, J=2,72 Гц, 1H), 7,63-7,60 (m, 1Н), 7,38 (d, J=7,96 Гц, 1H), 7,19-7,16 (dd, J=2,8 Гц, 8,6 Гц, 1H), 7,13-7,04 (m, 2H), 7,00 (d, J=6,24 Гц, 1H), 6,77 (s, 1H), 6,70 (d, J=8,64 Гц, 2H), 5,90 (s, 2H), 4,26-4,01 (s, 2H), 3,71 (s, 3H), 3,58 (m, 1H), 2,96 (bs, 2H), 2,65 (s, 3H), 1,85-1,69 (m, 4H), 1,45-1,42 (m, 1H), 1,26-1,23 (m, 1H). MS (ESI): масса, рассч. для C29H30N6O2, 494,23; найденное значение масса/заряд, 495,29 [М+Н]+1.
Соединение 64
(R)-(3-аминопиперидин-1-ил)(2-(1-(2-метоксиэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
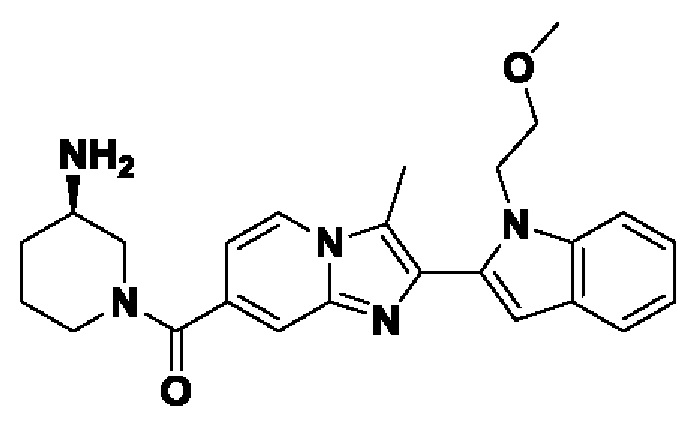
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=7,0 Гц, 1H), 7,62 (s, 1H), 7,60-7,54 (m, 2H), 7,18 (t, J=1,6 Гц, 1H), 7,06 (t, J=7,4 Гц, 1H), 7,00 (d, J=6,8 Гц, 1H), 6,67 (s, 1H), 4,72 (t, J=5,6 Гц, 2H), 4,28-4,12 (m, 1H), 3,58 (t, J=5,8 Гц, 2H), 3,07 (s, 3H), 2,98-2,74 (m, 2H), 2,64 (s, 5H), 1,86-1,84 (m, 1H), 1,72 (m, 2H), 1,47-1,44 (m, 1H), 1,29-1,24 (m, 1H). MS (ESI): масса, рассч. для C25H29N5O2, 431,23; найденное значение масса/заряд, 432,27 [М+Н]+1.
Соединение 65
Синтез (R)-(3-аминопиперидин-1-ил)(2-(1-(2-гидроксиэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона
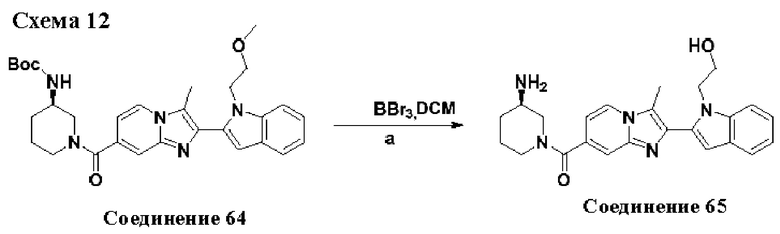
К перемешиваемому раствору трет-бутил-(R)-(1-(2-(1-(2-метоксиэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пипфидин-3-ил)карбамата (4, 0,20 г, 0,30 ммоль) в дихлорметане (4 мл) добавляли трибромид бора (1 М раствор в дихлорметане) (5 мл) при 0°С. Реакционную смесь перемешивали при к.т. в течение 3 ч. После завершения реакции реакционную смесь концентрировали при пониженном давлении с удалением трибромида бора. Неочищенный продукт растворяли в минимальном объеме воды, и повышали его основность с помощью насыщенного раствора бикарбоната натрия (20 мл), и экстрагировали с помощью дихлорметана (20 мл × 2). Органический слой промывали солевым раствором, высушивали над безводным сульфатом натрия и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали посредством преп. HPLC с получением (R)-(3-аминопиперидин-1-ил)(2-(1-(2-гидроксиэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона в виде грязно-белого твердого вещества.
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,45 (d, J=6,8 Гц, 1H), 7,64 (s, 1H), 7,60 (d, J=7,2 Гц, 1H), 7,55 (d, J=6,9 Гц, 1H), 7,18 (t, J=7,4 Гц, 1H), 7,08 (d, J=7,44 Гц, 1H), 7,05-7,02 (m, 1H), 6,66 (s, 1H), 5,24 (bs, 1H), 4,56 (t, J=5,80 Гц, 2H), 4,25-4,06 (m, 1H), 3,69 (t, J=5,8 Гц, 2H), 3,07 (bs, 1H), 2,80 (bs, 2H), 2,64 (s, 3H), 1,87 (s, 4H), 1,75-1,72 (m, 1H), 1,49 (m, 1H), 1,32 (m, 1H). MS (ESI): масса, рассч. для C24H27N5O2, 417,22; найденное значение масса/заряд, 418,39 [М+Н]+1.
Соединение 66
(R)-(3-аминопиперидин-1-ил)(2-(6-метокси-1-(пиридин-4-илметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
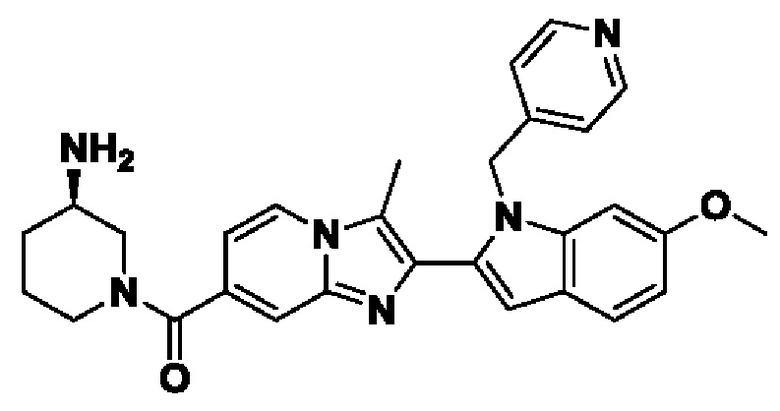
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,35 (s, 2Н), 7,55 (s, 2Н), 6,90 (s, 4Н), 6,74 (s, 3Н), 5,94 (s, 2Н), 4,21-4,05 (m, 1H), 3,72 (s, 3Н), 2,97 (bs, 2Н), 2,63-2,49 (m, 4Н), 1,84 (m, 2Н), 1,69 (m, 2Н), 1,44 (bs, 1Н), 1,24 (m, 2H). MS (ESI): масса, рассч. для C29H30N6O2, 494,22; найденное значение масса/заряд, 495,07 [M+H]+1.
Соединение 67
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
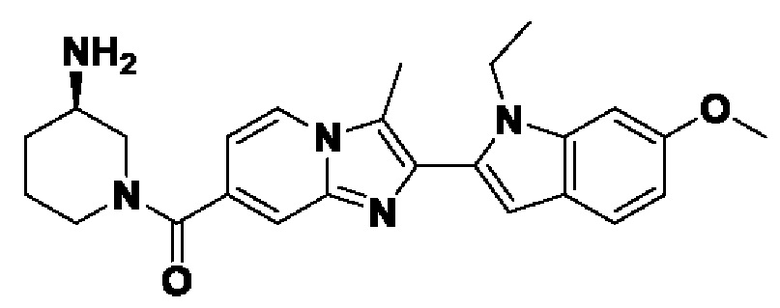
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,96 Гц, 1H), 7,61 (s, 1H), 7,46 (d, J=8,56 Гц, 1H), 7,04 (s, 1H), 6,99 (d, J=6,56 Гц, 1H), 6,72 (d, J=8,56 Гц, 1H), 6,56 (s, 1H), 4,54 (d, J=7,0 Гц, 2H), 4,28-4,08 (m, 2H), 3,83 (s, 3H), 3,63 (m, 1H), 3,00 (bs, 2H), 2,67 (m, 1H), 2,62 (s, 3H), 1,85 (d, J=9,80 Гц, 1H), 1,71 (bs, 2H), 1,45 (d, J=10,08 Гц, 2H), 1,23-1,20 (t, J=6,8 Гц, 3Н). MS (ESI): масса, рассч. для C25H29N5O2, 431,23; найденное значение масса/заряд, 432,32 [М+Н]+.
Соединение 68
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(пиридин-4-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
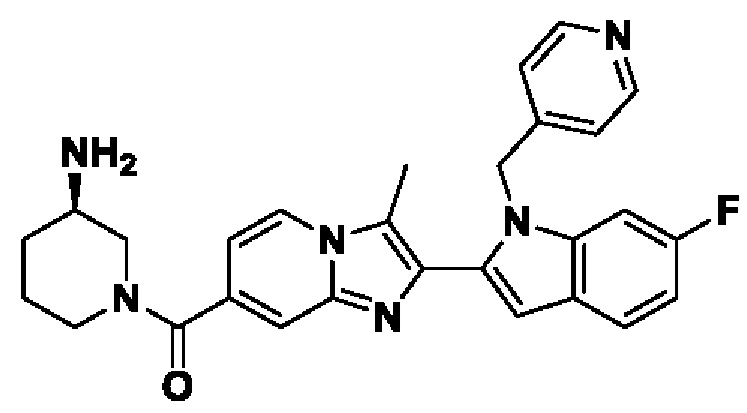
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,36 (s, 3Н), 7,65 (s, 1H), 7,56 (s, 1H), 7,28 (d, J=8,4 Гц, 1H), 6,97-6,84 (m, 5Н), 5,95 (s, 2Н), 4,21-4,10 (m, 2Н), 3,50 (m, 1H), 2,97 (bs, 2H), 2,64 (s, 3Н), 1,83 (m, 2H), 1,67 (m, 2H), 1,23 (s, 2H). MS (ESI): масса, рассч. для C28H27FN6O, 482; найденное значение масса/заряд, 483,33 [М+Н]+.
Соединение 69
(R)-(3-аминнопиперидин-1-ил)(2-(6-фтор-1-(пиридин-3-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
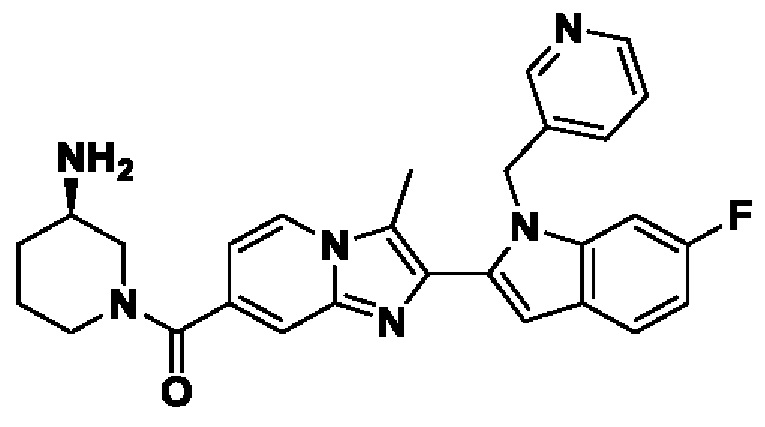
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=7,0 Гц, 1H), 8,34 (d, J=3,8 Гц, 1H), 8,27 (s, 1H), 7,63 (t, J=6,2 Гц, 2H), 7,39-7,36 (m, 2H), 7,23-7,19 (m, 1H), 7,02 (d, J=7,0 Гц, 1H), 6,94 (t, J=6,3 Гц, 1H), 6,81 (s, 1H), 5,92 (s, 2H), 4,08 (bs, 2H), 3,5 (bs, 1H), 3,02 (bs, 1H), 2,85 (bs, 2H), 2,63 (s, 3H), 1,88-1,87 (m, 1H), 1,69 (bs, 1H), 1,48-1,45 (m, 1H), 1,35-1,33 (m, 1H), 1,22 (s, 1H). MS (ESI): масса, рассч. для C28H27FN6O, 482,22; найденное значение масса/заряд, 483,14 [M+H]+1.
Соединение 70
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
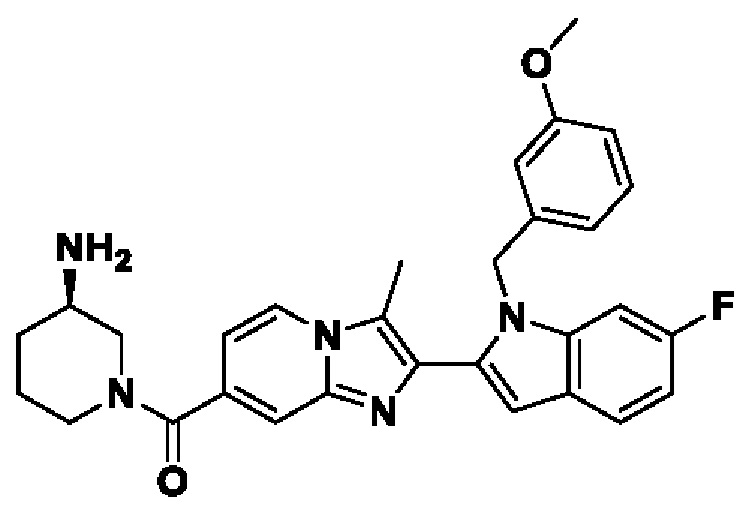
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=7,96 Гц, 1H), 7,63-7,60 (m, 2H), 7,29 (d, J=9,36 Гц, 1H), 7,08 (t, J=8,12 Гц, 1H), 6,99 (d, J=6,4 Гц, 1H), 6,92 (t, J=8,3 Гц, 1H), 6,78 (s, 1H), 6,69 (d, J=7,04 Гц, 1H), 6,53 (s, 2H), 5,85 (s, 2H), 4,26-4,08 (m, 1H), 3,56 (s, 4H), 2,98 (m, 1H), 2,62 (s, 3H), 1,84-1,83 (m, 2H), 1,71-1,70 (m, 2H), l,46-l,42(m, 1H), 1,23 (s, 3H). MS (ESI): масса, рассч. для C30H30FN5O2, 511,24; найденное значение масса/заряд, 512,38 [М+Н]+1.
Соединение 71
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
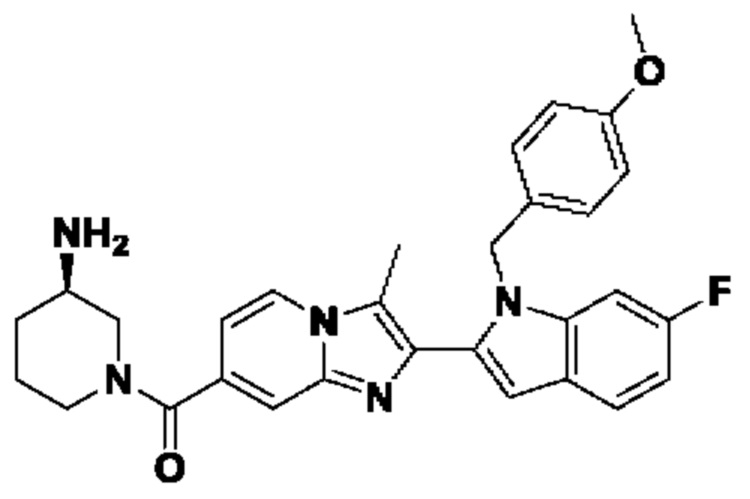
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=6,96 Гц, 1H), 7,62-7,58 (m, 2H), 7,29 (d, J=10,24 Гц, 1H), 7,00 (d, J=6,72 Гц, 1H), 6,94-6,88 (m, 3H), 6,75-6,72 (m, 3H), 5,79 (s, 2H), 4,27-4,08 (m, 1H), 3,62 (s, 3H), 2,98 (bs, 2H), 2,63 (m, 5H), 1,85-1,73 (m, 4H), 1,45-1,42 (m, 1H), 1,25-1,22 (m, 1H). MS (ESI): масса, рассч. для C30H30FN5O2, 511,24; найденное значение масса/заряд, 512,25 [М+Н]+1.
Соединение 72
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
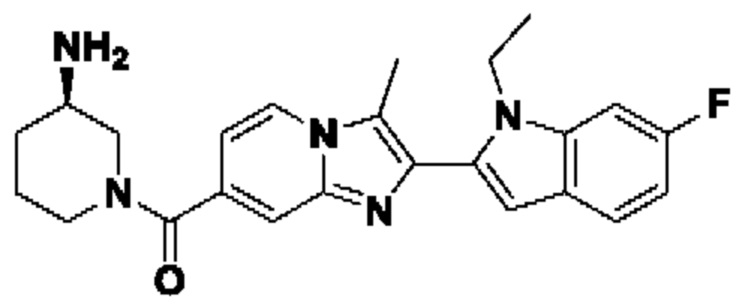
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=6,96 Гц, 1H), 7,62-7,57 (m, 2H), 7,42 (d, J=9,2 Гц, 1H), 7,00 (d, J=6,52 Гц, 1H), 6,92 (t, J=8,24 Гц, 1H), 6,66 (s, 1H), 4,54 (d, J=7,04 Гц, 2H), 4,28-4,03 (m, 2H), 3,60 (bs, 1H), 3,00 (bs, 2H), 2,80 (m, 1H), 2,63 (s, 3H), 1,86-1,83 (m, 1H), 1,68-1,56 (m, 2H), 1,46-1,44 (m, 1H), 1,23-1,19 (s, 4H). MS (ESI): масса, рассч. для C24H26FN5O, 419,21; найденное значение масса/заряд, 420,31 [М+Н]+1.
Соединение 73
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
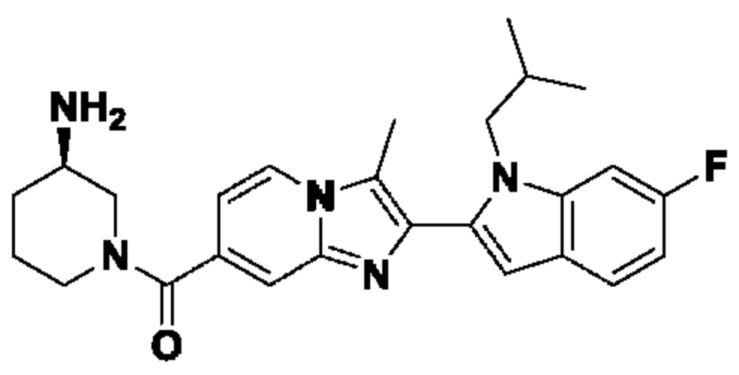
1Н ЯМР (400 МГц, DMSO-d6) (ppm): 8,42 (d, J=7,0 Гц, 1H), 7,63 (s, 1H), 7,60-7,56 (m, 1H), 7,43 (d, J=9,44 Гц, 1H), 7,00 (d, J=6,16 Гц, 1H), 6,91 (t, J=7,6 Гц, 1H), 6,66 (s, 1H), 4,41 (d, J=7,28 Гц, 2H), 4,27-4,11 (m, 1H), 3,00 (bs, 2H), 2,83-2,66 (m, 2H), 2,62 (s, 3H), 1,93-1,92 (m, 1H), 1,88 (s, 2H), 1,75-1,72 (m, 2H), l,47-l,45(m, 1H), 1,28-1,25 (m, 1H), 0,64 (d, J=6,64 Гц, 6H). MS (ESI): масса, рассч. для C26H30FN5O, 447,24; найденное значение масса/заряд, 448,45 [M+H]+1.
Соединение 74
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(пиридин-4-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон

1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,9 Гц, 1Н), 8,37 (d, J=4,8 Гц, 2H), 7,57 (s, 1Н), 7,36-7,42 (m, 2H), 6,99-6,96 (m, 2H), 6,91 (d, J=4,7 Гц, 2H), 6,82 (s, 1H), 5,97 (s, 2H), 4,24-4,08 (m, 1H), 3,50 (m, 1H), 3,38 (m, 1H), 2,96 (bs, 1H), 2,65 (s, 3H), 1,82 (m, 2H), l,71(m, 1H), 1,60 (m, 1H), 1,41 (m, 1H), 1,23 (m, 2H). MS (ESI): масса, рассч. для C28H27FN6O, 482,21; найденное значение масса/заряд, 483,21 [М+Н]+1.
Соединение 75
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
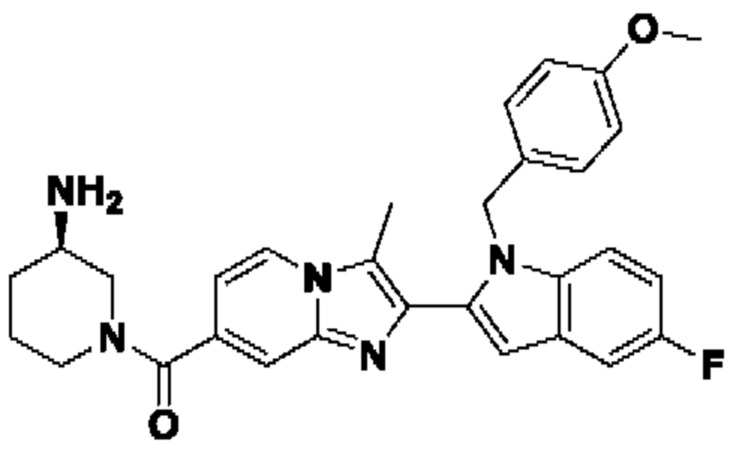
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,44 (d, J=6,96 Гц, 1Н), 7,63 (s, 1Н), 7,44-7,41 (m, 1Н), 7,36 (d, J=7,6 Гц, 1H), 7,01-6,91(m, 4Н), 6,74-6,72 (m, 3Н), 5,82 (s, 2Н), 4,27-4,10 (m, 1Н), 3,62 (s, 3Н), 2,97 (bs, 2Н), 2,79 (m, 2Н), 2,64 (s, 3Н), 1,83 (m, 1Н), 1,70 (m, 2Н), 1,45-1,43 (m, 1Н), 1,27-1,24 (m, 1Н). MS (ESI): масса, рассч. для C30H30FN5O2, 511,32; найденное значение масса/заряд, 512,32 [М+Н]+1.
Соединение 76
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
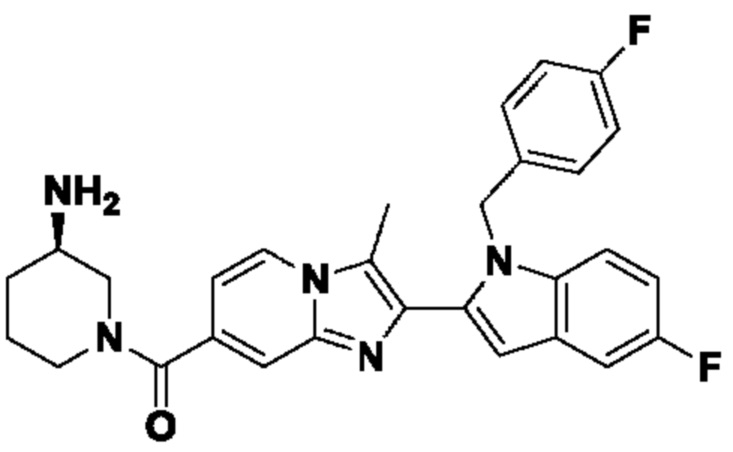
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=6,92 Гц, 1Н), 7,61 (s, 1Н), 7,44-7,37 (m, 2Н), 7,03-7,37 (m, 6Н), 6,77 (s, 1Н), 5,88 (s, 2Н), 4,27-4,09 (m, 1Н), 3,60 (bs, 1Н), 2,98 (bs, 1H), 2,83 (bs, 1H), 2,64 (s, 3H), 1,85-1,83 (m, 1H), 1,69 (bs, 3H), 1,45-1,42 (m, 1H), 1,31-1,20 (m, 2H). MS (ESI): масса, рассч. для C29H27F2N5O, 499,22; найденное значение масса/заряд, 500,38 [M+H]+1.
Соединение 77
(R)-(3-аминопиперидин-1-ил)(2-(7-хлор-1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
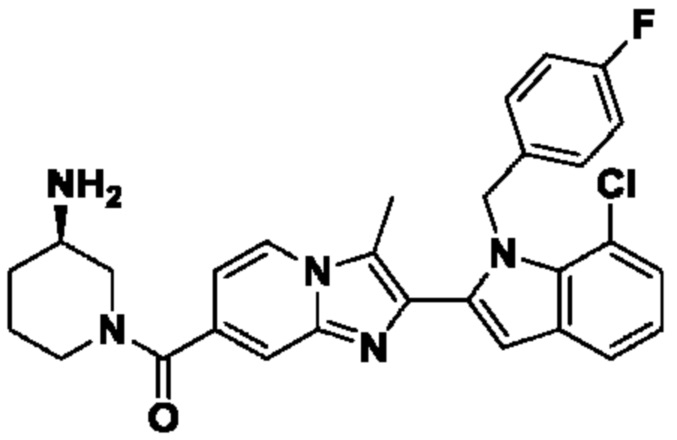
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,96 Гц, 1Н), 7,63 (d, J=7,72 Гц, 1H), 7,61 (s, 1H), 7,16 (d, J=7,44 Гц, 1H), 7,08 (t, J=7,68 Гц, 1H), 6,99-6,97 (m, 3H), 6,89 (s, 1H), 6,73-6,70 (m, 2H), 6,15 (s, 2H), 4,26-4,09 (m, 2H), 2,98 (bs, 2H), 2,66 (m, 1H), 2,59 (s, 3H), 1,88 (s, 2H), 1,83 (m, 1H), 1,75-1,65 (m, 1H), 1,45-1,42 (m, 1H), 1,28-1,23 (m,
1Н). MS (ESI): масса, рассч. для C29H27ClFN5O, 515,19; найденное значение масса/заряд, 516,18 [М+Н]+1.
Соединение 78
Синтез соли (R)-(3-аминопиперидин-1-ил)(2-(1-(2,2-дифгорэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты
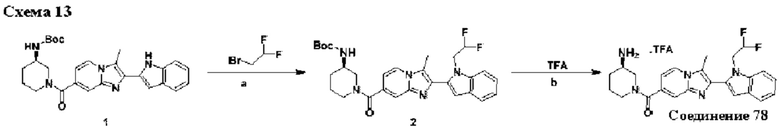
Стадия 1. Синтез трет-бутил-(R)-(1-(2-(1-(2,2-дифгорэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (2)
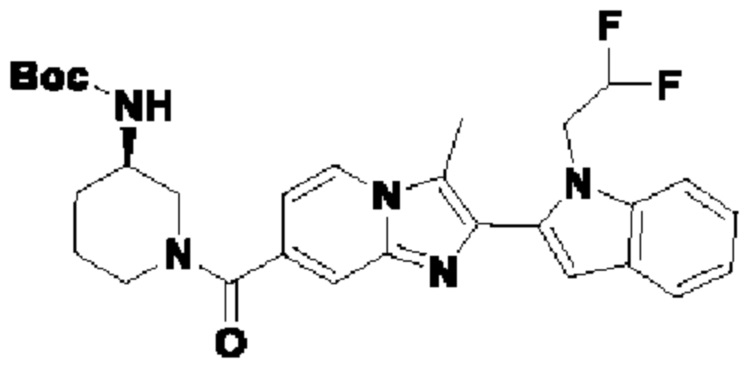
К перемешиваемому раствору трет-бутил-(R)-(1-(2-(1Н-индол-2-ил)-3-металимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (1, 0,50 г, 1,05 ммоль) в N,N-диметилформамиде (5,0 мл) добавляли карбонат цезия (1,7 г, 5,28 ммоль) и 2-бром-1,1-дифторэтан (0,22 мл, 2,64 ммоль) при к.т. Реакционную смесь перемешивали при 60°С в течение 4 ч. После завершения реакции реакционную смесь разбавляли водой и экстрагировали с помощью этил ацетата (200 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 12,0 г и 70% этилацетата в гексане в качестве элюента с получением трет-бутил-(R)-(1-(2-(1-(2,2-дифторэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата в виде коричневого твердого вещества (2). Выход: 0,13 г (26%), MS (ESI): 537; найденное значение масса/заряд 538,32 [M+l]+1.
Стадия 2. Синтез соли (R)-(3-аминопиперидин-1-ил)(2-(1-(2,2-дифторэтил)-1Н-индол-2-ил)-3-метилимидазо [1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты (соединение 78)
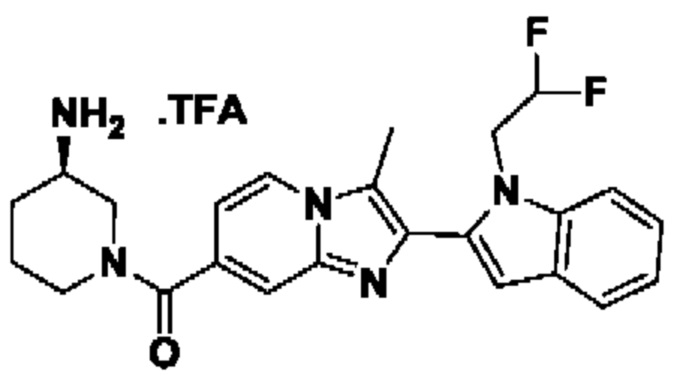
К перемешиваемому раствору трет-бутил-(R)-(1-(2-(1-(2,2-дифторэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (2, 0,13 г, 0,24 ммоль) в дихлорметане (2,0 мл) добавляли трифторуксусную кислоту (1,0 мл) при 0°С. Реакционную смесь перемешивали при к.т. в течение 2 ч. После завершения реакции реакционную смесь концентрировали при пониженном давлении с удалением трифторуксусной кислоты. Неочищенное вещество растворяли в минимальном объеме воды, и повышали его основность с помощью насыщенного раствора бикарбоната натрия, и экстрагировали с помощью дихлорметана. Органический слой промывали солевым раствором, высушивали над безводным сульфатом натрия и концентрировали с получением неочищенного вещества. Неочищенное вещество очищали посредством преп. HPLC с получением соли (R)-(3-аминопиперидин-1-ил)(2-(1-(2,2-дифторэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты в виде белого твердого вещества. Выход: 0,007 г (7%).
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,50 (d, J=6,9 Гц, 1H), 7,75 (s, 1H), 7,64-7,60 (m, 2H), 7,23 (t, J=7,3 Гц, 1H), 7,14 -7,07 (m, 2H), 6,81 (s, 1H), 6,47 (t, J=55,6 Гц, 1H), 5,05 (t, J=14,4 Гц, 2H), 3,29 (m, 4H), 2,68 (s, 3H), 2,58 (s, 1H), 2,00 (m, 2H), 1,76 (m, 2H), 1,60-1,59 (m, 2H). MS (ESI): масса, рассч. для C24H25F2N5O, 437,23; найденное значение масса/заряд, 438,27 [M+l]+1.
Следующие соединения 79-82 синтезировали с применением указанной выше процедуры, проиллюстрированной для соединения 78.
Соединение 79
(R)-(3-аминопиперидин-1-ил)(2-(1-((5-фторпиридин-2-ил)метил)-1Н-индол-2-ил)-3-мети лимидазо[1,2-а]пиридин-7-ил)метанон

1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,44 (s, 1Н), 8,42 (s, 1H), 7,62 (t, J=7,96 Гц, 2H), 7,53 (t, J=9,00 Гц, 1H), 7,38 (d, J=7,92 Гц, 1H), 7,14-7,06 (m, 2H), 7,00 (d, J=6,96 Гц, 1H), 6,84-6,80 (m, 2H), 5,97 (s, 2H), 4,14 (s, 2H), 3,65 (bs, 1H), 3,12 (bs, 2H), 2,96 (m, 2H), 2,65 (s, 3H), 1,90-1,87 (m, 1H), 1,69 (bs, 1H), 1,48-1,46 (m, 1H), 1,36-1,23 (m, 1H). MS (ESI): масса, рассч. для C28H27FN6O, 482; найденное значение масса/заряд, 483,30 [M+l]+1.
Соединение 80
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
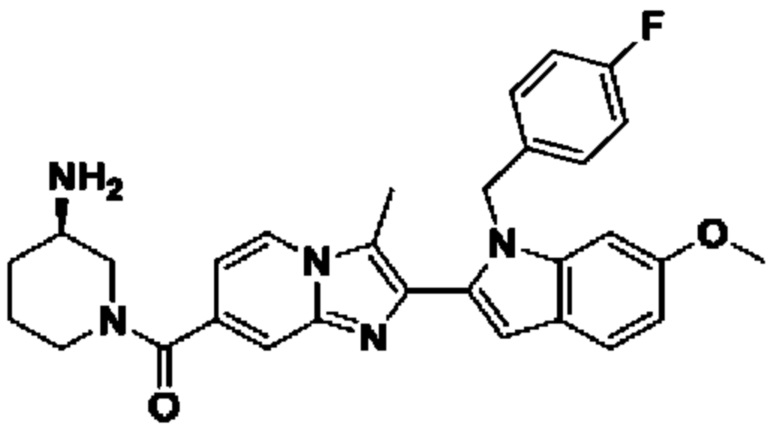
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,41 (d, J=6,96 Гц, 1Н), 7,60 (s, 1Н), 7,49 (d, J=8,6 Гц, 1Н), 7,03-6,96 (m, 6Н), 6,73 (d, J=8,56 Гц, 1Н), 6,68 (s, 1Н), 5,85 (s, 2Н), 4,29-4,08 (m, 2Н), 3,73 (s, 3Н), 3,00 (bs, 2Н), 2,71 (m, 1Н), 2,61 (s, 3Н), 1,8-1,84 (m, 2Н), 1,68 (bs, 2Н), 1,45-1,43 (m, 1Н), 1,27-1,23 (m, 1Н). MS (ESI): масса, рассч. для C30H30FN5O2, 511; найденное значение масса/заряд 512,35 [М+1]+.
Соединение 81
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-(гидроксиметил)бензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
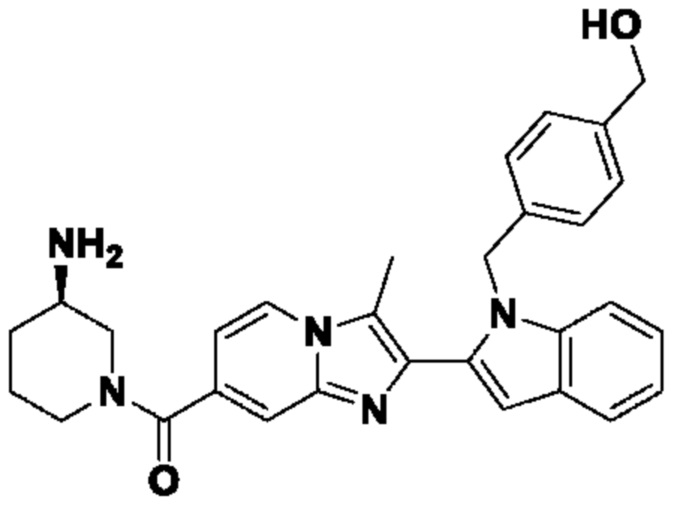
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=6,96 Гц, 1H), 7,61 (s, 2H), 7,38 (d, J=8,0 Гц, 1H), 7,11-7,03 (m, 4H), 6,99 (d, J=6,72 Гц, 1H), 6,91 (d, J=7,88 Гц, 2H), 6,76 (s, 1H), 5,89 (s, 2H), 5,02 (t, J=5,44 Гц, 1H), 4,33 (s, 2H), 4,09 (bs, 1H), 3,59 (bs, 1H), 3,00-2,95 (m, 2H), 2,65 (s, 3H), 2,17-1,99 (m, 2H), 1,83 (m, 1H), 1,69 (m, 1H), 1,45 (m, 1H), 1,26-1,24 (m, 1H). MS (ESI): масса, рассч. для C30H31N5O2, 493,25; найденное значение масса/заряд, 494,39 [М+Н]+1.
Соединение 82
(R)-(3-аминопиперидин-1-ил)(2-(1-изобутил-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
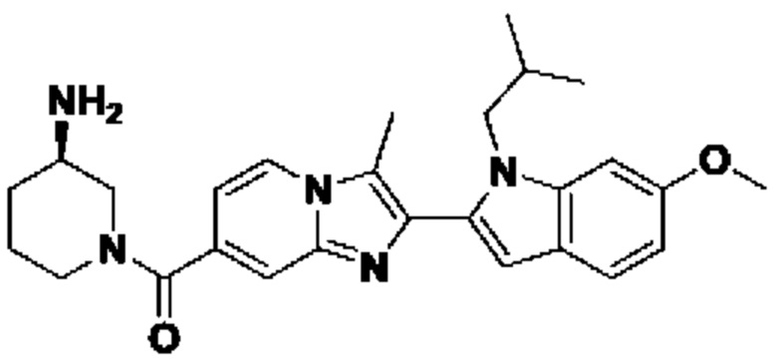
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,40 (d, J=7,0 Гц, 1Н), 7,61 (s, 1Н), 7,46 (d, J=8,5 Гц, 1Н), 7,04 (s,1Н), 6,98 (d, J=6,9 Гц, 1Н), 6,72 (dd, J=8,7, 1,5 Гц, 1H), 6,55 (s, 1H), 4,41 (d, J=7,1 Гц, 2H), 4,11 (bs, 1H), 3,82 (s, 3H), 3,61 (bs, 1H), 2,98 (bs, 1H), 2,66 (m, 1H), 2,61 (s, 3H), 1,98-1,91 (m, 1H), 1,88 (m, 3H), 1,75-1,70 (m, 1H), 1,47-1,44 (m, 1H), 1,29-1,24 (m, 1H), 0,64 (d, J=6,6 Гц, 6H). MS (ESI): масса, рассч. для C27H33N5O2, 459,59; найденное значение масса/заряд, 460,41 [М+Н]+1.
Соединение 83
(R)-(3-аминопиперидин-1-ил)(2-(1-(2,2-дифторэтил)-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
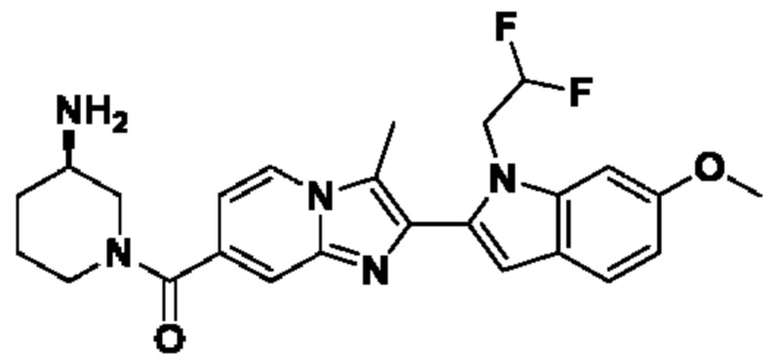
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,44 (d, J=7,0 Гц, 1Н), 7,63 (s, 1Н), 7,49 (d, J=8,5 Гц, 1H), 7,16 (s, 1H), 7,02 (d, J=6,8 Гц, 1H), 6,78-6,75 (m, 1H), 6,70 (s, 1H), 6,45 (t, J=56,0 Гц, 1H), 5,03 (t, J=14,5 Гц, 2H), 4,17 (bs, 1H), 3,83 (s, 3H), 3,04 (bs, 1H), 2,81 (m, 2H), 2,65 (s, 3H), 1,90 (m, 4H), 1,75-1,70 (m, 1H), 1,48-1,46 (m, 1H), 1,32-1,01 (m, 1H). MS (ESI): масса, рассч. для C25H27F2N5O2, 467,52; найденное значение масса/заряд, 468,17 [М+Н]+1.
Соединение 84
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
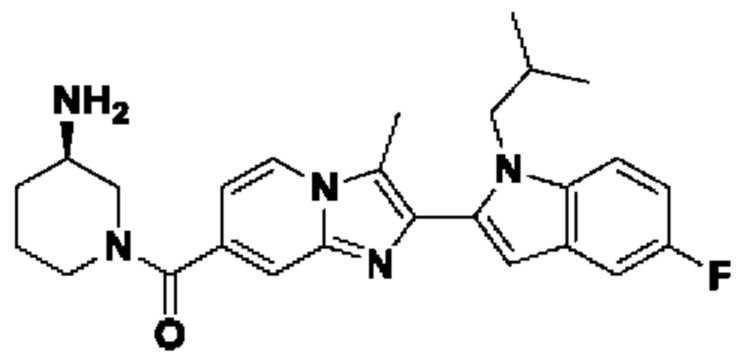
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,42 (d, J=7,0 Гц, 1Н), 7,63 (s, 1Н), 7,58-7,55 (m, 1H), 7,36-7,33 (dd, J=2,3 Гц, 7,0 Гц, 1Н), 7,03-6,99 (m, 2H), 6,64 (s, 1Н), 4,44 (d, J=7,2 Гц, 2H), 4,28-4,11 (m, 1Н), 3,60 (bs, 1H), 2,99-2,78 (m, 2H), 2,66 (m, 1H), 2,62 (s, 3H), 1,98-1,91 (m, 1H), 1,87-1,73 (m, 4H), 1,47-1,44 (m, 1H), 1,29-1,23 (m, 1H), 0,63 (d,J=6,6 Гц, 6H). MS (ESI): масса, рассч. для C26H30FN5O, 447,24; найденное значение масса/заряд, 448,39 [М+Н]+1.
Соединение 85
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-фтор-3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанон
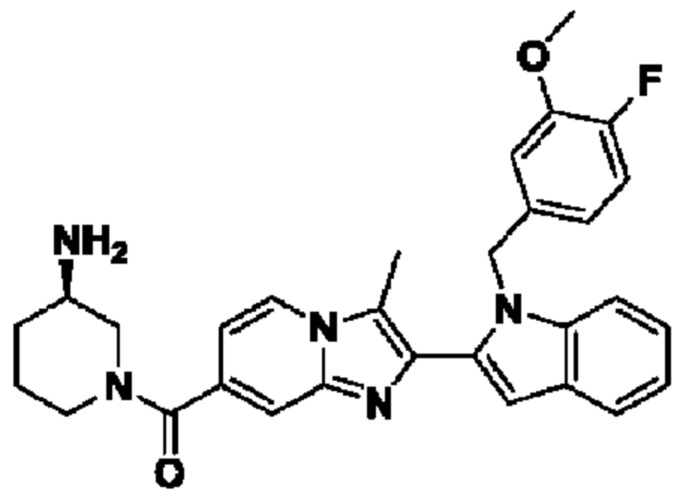
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,43 (d, J=7,0 Гц, 1Н), 7,62 (d, J=7,9 Гц, 2Н), 7,47 (d, J=8,0 Гц, 1Н), 7,13 (т, У=7,84 Гц, 1Н), 7,06 (t, /=7,32 Гц, 1Н), 7,01-6,96 (т, 3Н), 6,76 (s, 1Н), 6,49 (bs, 1Н), 5,83 (s, 2Н), 4,29-4,10 (m, 1Н), 3,62 (s, 3Н), 2,98 (bs, 2Н), 2,63 (s, 3Н), 1,82 (m, 1Н), 1,66 (m, 3Н), 1,45 (m, 1Н), 1,23 (m, 3Н). MS (ESI): масса, рассч. для C26H30FN5O, 511,24; найденное значение масса/заряд, 512,48 [М+Н]+1.
Соединение 86
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-ил)метанон
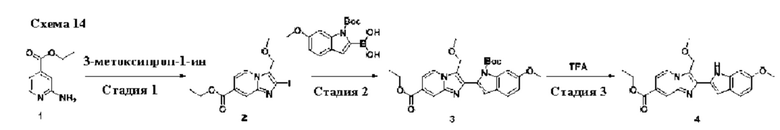
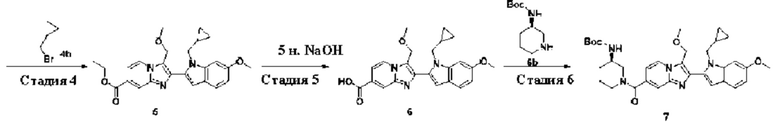
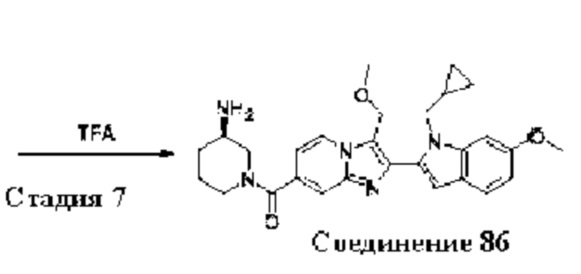
Стадия 1. Синтез этил-2-йод-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата(2)

К перемешиваемому раствору метил-2-аминоизоникотината (1, 5,0 г, 30,0 ммоль) и 3-метоксипроп-1-ина (2,53 г, 36,1 ммоль) в 1,2-дихлорбензоле (100 мл) добавляли йод (7,63 г, 30,0 моль) и ацетат меди(II) (0,54 г, 3,0 ммоль). Реакционную смесь продували посредством 5 кг/см2 кислорода в стальном сосуде и перемешивали при 120°С в течение 12 ч. После завершения реакции реакционную смесь непосредственно пропускали через силикагель с размером 100-200 меш и элюировали с помощью гексана (2000 мл) с последующим элюированием 20% этилацетатом в гексане в качестве элюента с получением этил-2-йод-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (2) в виде белого твердого вещества. Выход 7,40 г (68,1%). MS (ESI): масса 360,15; найденное значение масса/заряд, 361,01 [М+Н]+1.
Стадия 2. Синтез этил-2-(1-(трет-бутоксикарбонил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (3)
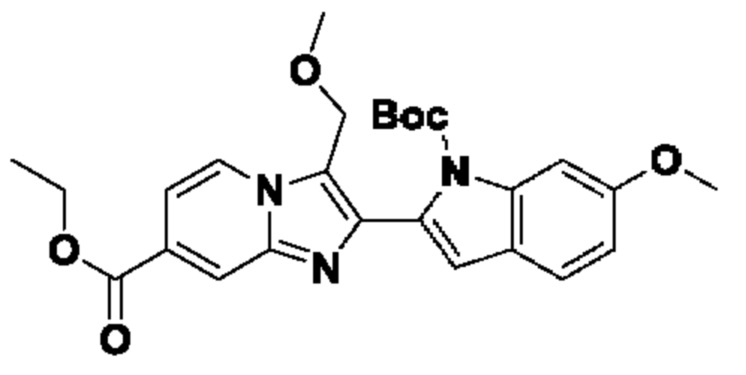
К раствору этил-2-йод-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (2, 0,8 г, 2,22 ммоль) и (1-(трет-бутоксикарбонил)-6-метокси-1Н-индол-2-ил)бороновой кислоты (0,97 г, 3,33 ммоль) в 1,4-диоксане (40 мл) и воде (8 мл) добавляли фосфат калия (1,4 г, 6,66 ммоль) и смесь продували газообразным аргоном в течение 20 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (0,12 г, 0,11 ммоль) и продувку продолжали в течение 5 мин. Реакционную смесь перемешивали в течение 4 ч при 90°С в герметичной пробирке. После завершения реакции добавляли воду (100 мл) и экстрагировали с помощью этилацетата (200 мл × 2). Органический слой промывали насыщенным раствором хлорида аммония, солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 40,0 г и 30-40% этилацетата в гексане в качестве элюента с получением этил-2-(1-(трет-бутоксикарбонил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (3) в виде масляной жидкости. Выход 0,8 г (80%). MS (ESI): масса 479,21; найденное значение масса/заряд, 480,19 [М+Н]+1.
Стадия 3. Синтез этил-2-(6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (4)

К раствору этил-2-(1-(трет-бутоксикарбонил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (3, 0,8 г, 1,64 ммоль) в дихлорметане (50 мл) добавляли трифторуксусную кислоту (8,0 мл) при 0°С. Реакционную смесь перемешивали в течение 5 ч при комнатной температуре. После завершения реакции смесь концентрировали под вакуумом и нейтрализовали с применением водного раствора бикарбоната натрия. Водную фазу затем экстрагировали с помощью дихлорметана (2 × 20 мл). Органический слой высушивали над сульфатом натрия и концентрировали с получением этил-2-(6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (4) в виде бледно-желтого твердого вещества. Выход 0,55 г. MS (ESI): масса 379,15; найденное значение масса/заряд, 380,24 [М+Н]+1.
Стадия 4. Синтез этил-2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (5)
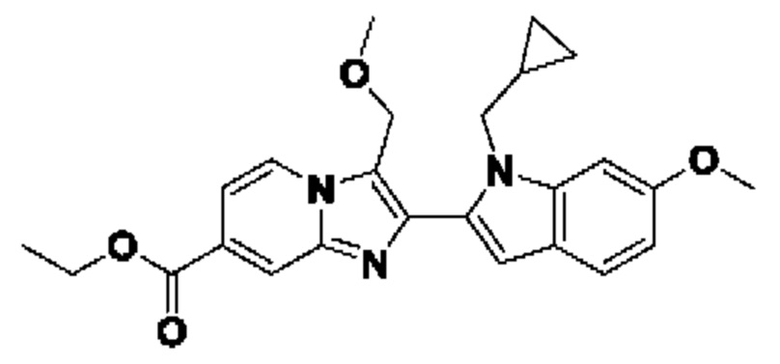
К перемешиваемому раствору этил-2-(6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (4, 0,5 г, 1,32 ммоль) в N,N-диметилформамиде (10 мл) добавляли карбонат цезия (1,23 г, 3,95 ммоль) и (бромметил)циклопропан (0,21 г, 1,58 ммоль). Реакционную смесь перемешивали при 60°С в течение 3 ч. После завершения реакции реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом (100 мл × 3). Органическую фазу промывали водой, солевым раствором, высушивали над безводным сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 40,0 г и 10-15% этилацетата в гексане в качестве элюента с получением этил-2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (5) в виде желтого твердого вещества. Выход: 0,30 г (52%). MS (ESI): 433,20; найденное значение масса/заряд, 434,14 [М+Н]+1.
Стадия 5. Синтез 2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоновой кислоты (6)
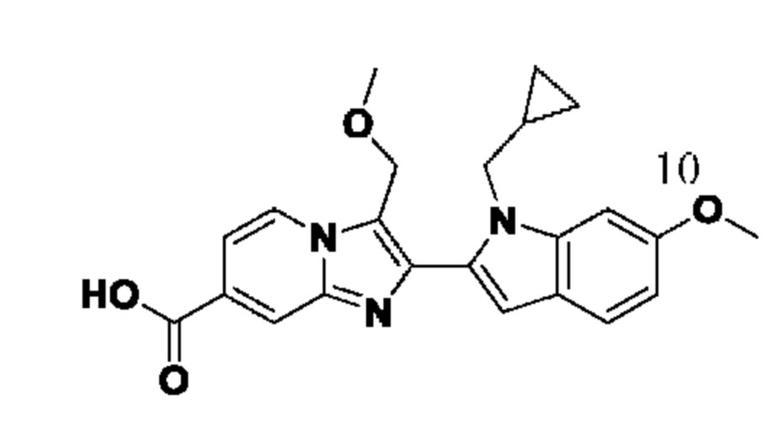
К перемешиваемому раствору этил-2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоксилата (5, 0,30 г, 0,629 ммоль) в тетрагидрофуране (10 мл) добавляли метанол (5 мл) и 5 н. раствор гидроксида натрия в воде (5 мл) и полученную смесь нагревали до 60°С в течение 3 ч. После завершения реакции реакционную смесь выпаривали при пониженном давлении и подкисляли до рН 2-3 с помощью лимонной кислоты при 0°С. Неочищенное вещество экстрагировали с помощью дихлорметана (10 мл × 2), промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоновой кислоты (6) в виде желтого твердого вещества. Выход: 0,20 г (71%). MS (ESI): 405,17; найденное значение масса/заряд, 404,12 [М-Н]-1.
Стадия 6. Синтез трет-бутил-(R)-(1-(2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-и л)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (7)
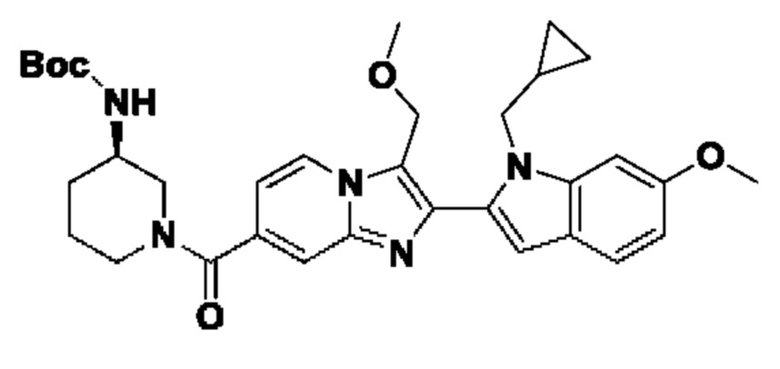
К перемешиваемому раствору 2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбоновой кислоты (6, 0,20 г, 0,508 ммоль) в дихлорметане (10 мл) добавляли трет-бутил-(11)-пиперидин-3-илкарбамат (0,122 г, 0,61 ммоль), триэтиламин (0,22 мл, 1,57 ммоль) и пропилфосфоновый ангидрид в 50% этилацетате (1,2 мл, 1,62 ммоль) при 0°С. Обеспечивали перемешивание реакционной смеси при комнатной температуре в течение 1 ч. После завершения реакции реакционную смесь гасили раствором бикарбоната натрия (20 мл) и экстрагировали с помощью дихлорметана (20 мл × 2). Объединенные органические слои промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 12,0 г и 2-5% метанола в дихлорметане в качестве элюента с получением трет-бутил-(R)-(1-(2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (7) в виде грязно-белого твердого вещества. Выход: 0,14 г (48%). MS (ESI): 587,31; найденное значение масса/заряд, 588,27 [М+Н]+1.
Стадия 7. Синтез (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-ил)метанона (пример 86)
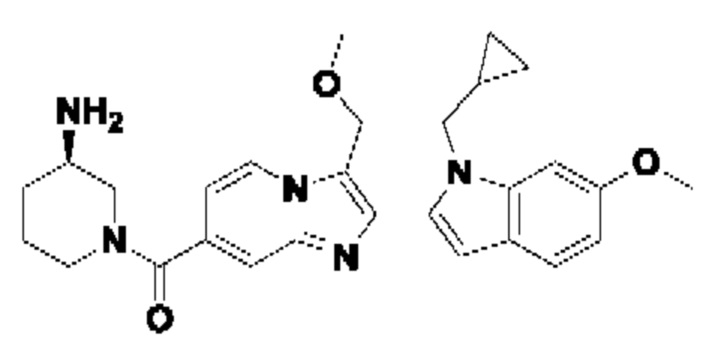
К перемешиваемому раствору смеси трет-бутил-(R)-(l-(2-(l-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)карбамата (7, 0,14 г, 0,24 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (1,0 мл) при 0°С .Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. После завершения реакции реакционную смесь концентрировали при пониженном давлении с удалением трифторуксусной кислоты. Неочищенное вещество растворяли в минимальном объеме воды, и повышали его основность с помощью насыщенного раствора бикарбоната натрия (20 мл), и экстрагировали с помощью дихлорметана (20 мл × 2). Органический слой промывали солевым раствором, высушивали над безводным сульфатом натрия, концентрировали и очищали посредством препаративной хроматографии с обращенной фазой с получением (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-ил)метанона в виде желтого твердого вещества. Выход: 0,03 г (30%).
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,54 (d, J=7,0 Гц, 1H), 7,66 (s, 1H), 7,48 (d, J=8,56 Гц, 1H), 7,1 (s, 1H), 7,03 (d, J=7,21 Гц, 1H), 6,72 (d, J=8,56 Гц, 1H), 6,58 (s, 1H), 4,88 (s, 2H), 4,49 (d, J=6,64 Гц, 2H), 4,28-4,09 (m, 1H), 3,83 (s, 3H), 3,76-3,53 (m, 1H), 3,34-3,32 (m, 4H), 3,00-2,85 (m, 2H), 2,65 (s, 1H), 1,83 (m, 1H), 1,72 (bs, 2H), 1,47-1,44 (m, 1H), 1,26-1,23 (m, 1H), 1,09 (m, 1H), 0,27 (d, J=7,64 Гц, 2H), 0,15 (d, J=3,96 Гц, 2H). MS (ESI): масса, рассчитанная для C28H33N5O3, 487,26; найденное значение масса/заряд, 488,41 [М+Н]+1.
СИНТЕЗ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
Синтез 2-бром-1-(3-этилбензо[b]тиофен-2-ил)пропан-1-она (промежуточное соединение для соединения 19)
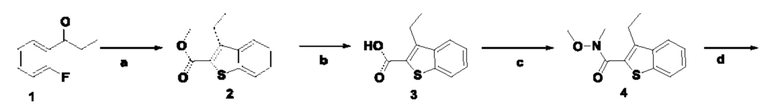

Стадия 1. Получение метил-3-этилбензо[b]тиофен-2-карбоксилата (2)
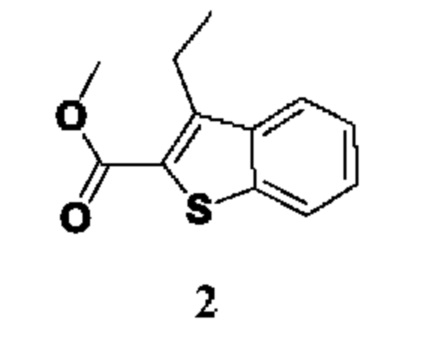
К суспензии NaH (60% в масле, 1,7 г, 42,7 ммоль) в THF (50 мл) добавляли метил 2-меркаптоацетат (4,1 г, 39,4 ммоль) при к.т. и перемешивали в течение 30 мин. К реакционной смеси добавляли раствор 1-(2-фторфенил)пропан-1-он (1, 5,0 г, 32,8 ммоль) в THF и обеспечивали нагревание с обратным холодильником в течение 16 ч (условие реакции а). Завершение реакции отслеживали посредством LCMS, поскольку исходный материал и продукт сильно схожи при TLC (2:8 EtOAc:гексан). Реакционную смесь охлаждали до к.т., разбавляли с помощью EtOAc (100 мл) и промывали с помощью 1 н. NaOH (20 мл) и воды (20 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное неочищенное вещество очищали посредством колоночной хроматографии с получением продукта в виде коричневого масла (2) (4,0 г, выход 57,14%). MS (ESI): масса, рассч. для C12H12O2S, 220,06; найденное значение масса/заряд, 221,1 (М+Н)+.
Стадия 2. Получение 3-этилбензо[b]тиофен-2-карбоновой кислоты (3)
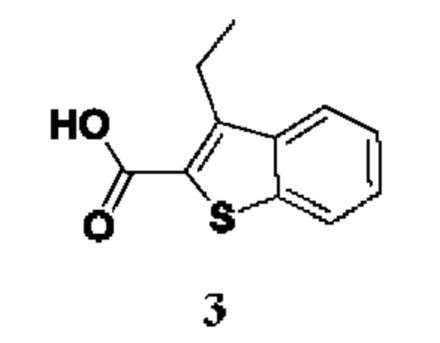
К раствору метил-3-этилбензо[b]тиофен-2-карбоксилата (2, 4,0 г, 18,1 ммоль) в смеси THF:MeOH:H2O (8:2:1, 40 мл) добавляли LiOH (1,7 г, 72,7 ммоль) при 0°С и перемешивали при к.т. в течение 3 ч (условие реакции b). Реакционную смесь выпаривали, растворяли в воде (20 мл) и подкисляли с применением насыщенного раствора лимонной кислоты. Образованный белый осадок собирали путем фильтрации и высушивали с получением продукта (3) (2,7 г, выход 73%). MS (ESI): масса, рассч. для C11H10O2S, 206,04; найденное значение масса/заряд, 207,1 (М+Н)+.
Стадия 3. Получение 3-этил-N-метокси-N-метилбензо[b]тиофен-2-карбоксамида(4)
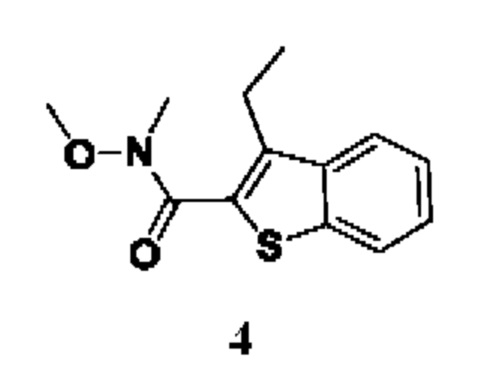
К перемешиваемому раствору 3-этилбензо[b]тиофен-2-карбоновой кислоты (3, 2,5 г, 12,1 ммоль) и гидрохлорида N,O-диметилгидроксиламина (1,8 г, 18,2 ммоль) в DCM (30 мл) добавляли триэтиламин (8,4 мл, 60,6 ммоль), HOBt (2,4 г, 18,2 ммоль) с последующим добавлением EDC.HC1 (2,8 г, 18,2 ммоль) при 0°С и реакционную смесь перемешивали при к.т. в течение 4 ч (условие реакции с). К реакционной смеси добавляли воду (50 мл) и слой DCM разделяли. Органический слой промывали солевым раствором (20 мл), высушивали и выпаривали с получением неочищенного продукта. Неочищенное вещество очищали посредством градиентной колоночной хроматографии с применением 20-25% этилацетата в гексане с получением продукта в виде грязно-белого твердого вещества (4) (2,15 г, выход 72%). MS (ESI): масса, рассч. для C13H15NO2S, 249,08; найденное значение масса/заряд, 250,2 [М+Н]+.
Стадия 4. Получение 1-(3-этилбензо[b]тиофен-2-ил)пропан-1-она (5)
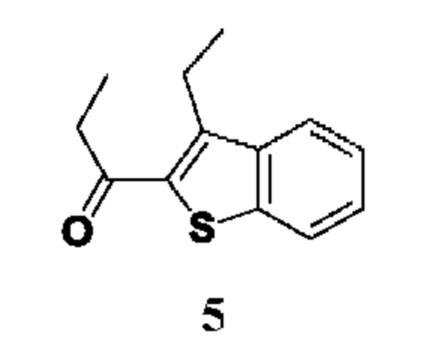
К перемешиваемому раствору 3-этил-N-метокси-N-метилбензо[b]тиофен-2-карбоксамида (4, 2,1 г, 8,43 ммоль) в THF (20 мл) добавляли по каплям 3 М раствор бромида этилмагния (8,4 мл, 25,3 ммоль) при 0°С и реакционную смесь перемешивали при к.т. в течение 16 ч (условие реакции d). Реакционную смесь гасили насыщенным раствором NH4Cl (10 мл) при 0°С и экстрагировали с помощью EtOAc (50 мл). Органический слой выпаривали, очищали посредством колоночной флеш-хроматографии с получением указанного в заголовке соединения в виде коричневого масла (5) (1,7 г, выход 92%). MS (ESI): масса, рассч. для C13H14OS, 218,08; найденное значение масса/заряд, 219,1 [М+Н]+.
Стадия 5. Получение 2-бром-1-(3-этилбензо[b]тиофен-2-ил)пропан-1-она (6)
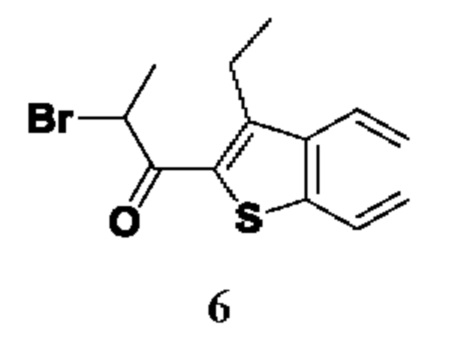
К перемешиваемому раствору 1-(3-этилбензо[b]тиофен-2-ил)пропан-1-она (5, 0,5 г, 2,29 ммоль) в THF (5 мл) добавляли трибромид триметилфениламмония (0,95 г, 2,52 ммоль) и перемешивали при 80°С в течение 3 ч (условие реакции е). Реакционную смесь охлаждали до к.т., добавляли воду (20 мл) и соединение экстрагировали с помощью EtOAc (50 мл). Органический экстракт промывали насыщенным раствором NaHCO3 (20 мл), высушивали над сульфатом натрия и выпаривали. Неочищенное вещество очищали посредством колоночной хроматографии с применением 0-25% EtOAc в гексане с получением продукта в виде бледно-желтого смолистого твердого вещества (6) (0,6 г, выход 88%). MS (ESI): масса, рассч. для C13H13BrOS, 295,99; найденное значение масса/заряд, 297,0 (М+Н)+.
Остальные стадии подобны стадиям, указанным для соединения-1 (начиная со стадии 4).
Синтез 1-(4-хлорбензил)-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 20)
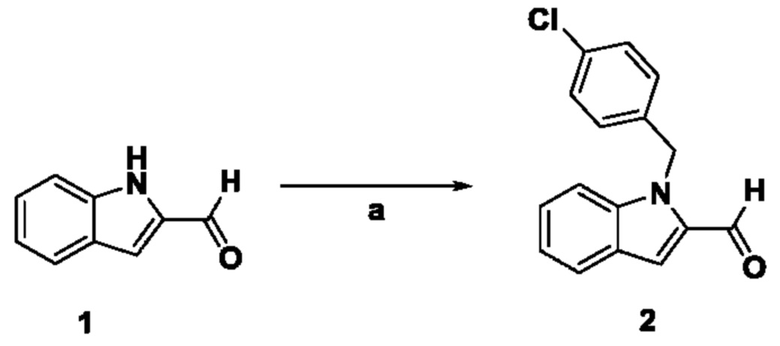
К перемешиваемому раствору 1Н-пирроло[2,3-b]пиридин-2-карбальдегида (1, 0,5 г, 3,44 ммоль) в DMF (10 мл) добавляли карбонат калия (1,42 г, 10,3 ммоль) с последующим добавлением 1-(бромметил)-4-хлорбензола (0,84 г, 4,13 ммоль) и реакционную смесь перемешивали при такой же температуре в течение 4 ч (условие реакции а). Реакционную смесь гасили водой и экстрагировали с помощью этилацетата (30 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 10-15% этилацетата в гексане с получением продукта в виде грязно-белого твердого вещества (2) (0,86 г, выход 93,4%). 1Н ЯМР (400 МГц, DM SO) δ (ppm): 9,9 (s, 1H), 7,79 (d, J=8 Гц, 1H), 7,60-7,56 (m, 2H), 7,39-7,36 (m, 1H), 7,31 (d, J=8 Гц, 2H), 7,18-7,14 (m, 1H), 7,06 (d, J=8 Гц, 2H), 5,8 (s, 2H). MS (ESI): масса, рассч. для C16H12ClNO, 269,73; найденное значение масса/заряд, 270,1 (М+Н)+.
Следующее соединение, указанное ниже, синтезировали с применением указанной выше процедуры, проиллюстрированной для 1-(4-хлорбензил)-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 20).
Синтез 1-(2-фторбензил)-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 21)
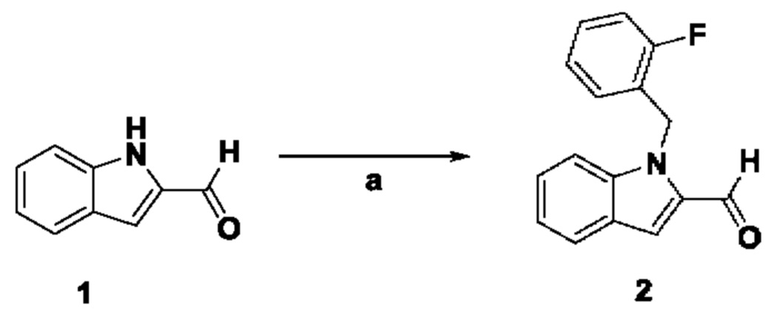
К перемешиваемому раствору 1Н-индол-2-карбальдегида (1, 1 г, 6,89 ммоль) в DMF (15 мл) добавляли карбонат калия (2,85 г, 20,6 ммоль) с последующим добавлением 1-(хлорметил)-2-фторбензола (1,19 г, 8,26 ммоль) и реакционную смесь перемешивали при такой же температуре в течение 4 ч (условие реакции а). Реакционную смесь выливали в измельченный лед, разбавляли водой и экстрагировали с помощью этилацетата. Органический слой высушивали над безводным сульфатом натрия, выпаривали под вакуумом с получением неочищенного вещества. Неочищенное вещество очищали посредством колоночной флеш-хроматографии с применением этилацетата и гексана с получением 1-(2-фторбензил)-1Н-индол-2-карбальдегида в виде твердого вещества серого цвета (2) (выход: 1,8 г, 96,5%). 1H ЯМР (400 МГц, DMSO) δ (ppm): 9,90 (s, 1Н), 7,81 (d, J=8 Гц, 1Н), 7,58-7,54 (m, 2Н), 7,40-7,36 (m, 1Н), 7,28-7,15 (m, 3Н), 7,01-6,97 (m, 1Н), 6,55-6,51 (m, 1Н), 5,88 (s, 2Н). MS (ESI): масса, рассч. для C16H12FNO, 253,09; найденное значение масса/заряд, 254,0 (М+Н)+.
Синтез 1-этил-5-фенил-1Н-пиррол-2-карбальдегида (промежуточное соединение для соединения 22)
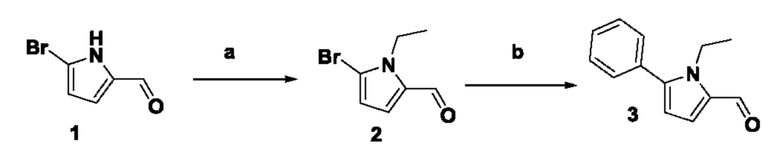
Стадия 1. Получение 5-бром-1-этил-1Н-пиррол-2-карбальдегида (2)
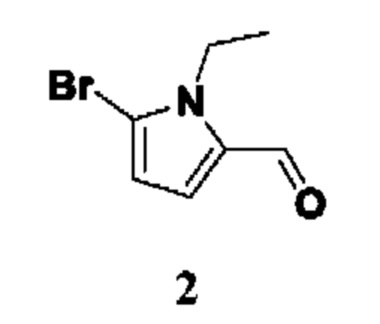
К перемешиваемому раствору 5-бром-1Н-пиррол-2-карбальдегида (1, 1 г, 5,7 ммоль) в DMF (15 мл) добавляли карбонат калия (3,14 г, 22 ммоль) с последующим добавлением этилиодида (1,33 г, 8,6 ммоль) и реакционную смесь перемешивали при такой же температуре в течение 16 ч (условие реакции а). Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата. Органический слой высушивали над безводным сульфатом натрия и выпаривали под вакуумом с получением неочищенного вещества. Неочищенное вещество очищали посредством колоночной флеш-хроматографии с применением этилацетата в гексане в качестве элюента с получением указанного в заголовке соединения в виде жидкости оранжевого цвета (0,9 г, выход 77,58%) (2) MS (ESI): масса, рассч. для C7H8BrNO, 202,05; найденное значение масса/заряд 204,0 (М+2Н)+.
Стадия 2. Получение 1-этил-5-фенил-1Н-пиррол-2-карбальдегида (3)
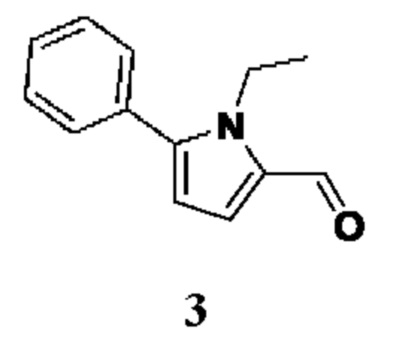
К перемешиваемому раствору 5-бром-1-этил-1Н-пиррол-2-карбальдегида (2, 0,9 г, 4,45 ммоль) в 1,4-диоксане в герметичной пробирке добавляли фенилбороновую кислоту (0,8 г, 6,67 ммоль), карбонат калия (1,84 г, 13,3 ммоль), затем реакционную смесь продували азотом. После продувки в течение нескольких минут добавляли комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (0,18 г, 0,22 ммоль) и затем нагревали до 80°С в течение 12 ч (условие реакции b). После завершения реакции реакционную смесь фильтровали через слой целита, фильтраты выпаривали до сухого состояния с получением неочищенного продукта. Неочищенное вещество очищали посредством градиентной колоночной хроматографии с применением 12% этилацетата в гексане с получением указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета (3) (0,52 г, выход 59,09%). MS (ESI): масса, рассч. для C13H13NO, 199,25; найденное значение масса/заряд 200,0 (М+Н)+.
Синтез 1-(циклопропилметил)-6-метокси-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 23)
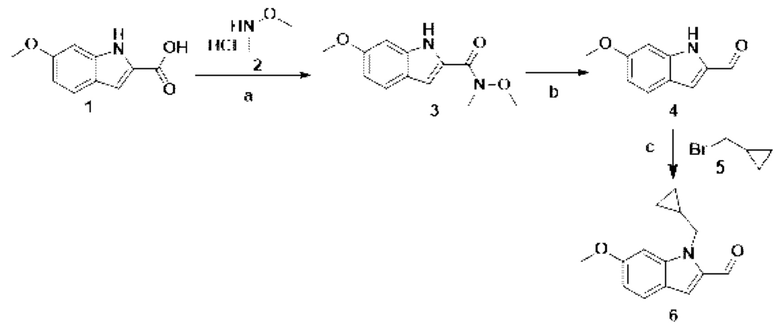
Стадия 1. Получение N,6-диметокси-N-метил-1Н-индол-2-карбоксамида (3)
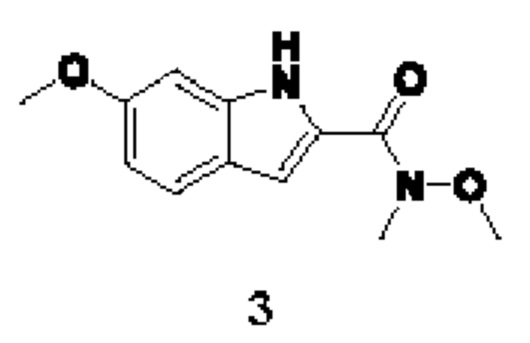
К перемешиваемому раствору 6-метокси-1Н-индол-2-карбоновой кислоты (1, 3 г, 15,69 ммоль) в DCM (20 мл) добавляли гидрохлорид N,O-диметилгидроксиламина (2, 3 г, 31,38 ммоль) с последующим добавлением гидроксибензотриазола (3,6 г, 23,5 ммоль), гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (4,5 г, 23,5 ммоль) и TEA (11,3 мл, 120,7 ммоль) и реакционную смесь перемешивали при такой же температуре в течение 5 ч (условие реакции а). Реакционную смесь гасили водой, экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 25-30% этилацетата в гексане с получением продукта в виде твердого вещества бежевого цвета (3) (Выход: 75%, 0,86 г). MS (ESI): масса, рассч. для C12H14N2O3, 234,10, найденное значение масса/заряд, 235 (М+Н)+.
Стадия 2. Получение 6-метокси- 1H-индол-2-карбальдегида (4)
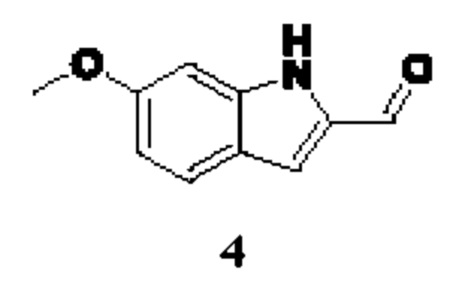
К перемешиваемому раствору N,6-диметокси-N-метил-1Н-индол-2-карбоксамида (3, 2 г, 8,54 ммоль) в THF (20 мл) медленно добавляли 1 М раствор LAH в THF (12,8 мл, 12,75 ммоль) в условиях охлаждения и затем обеспечивали перемешивание реакционной смеси при к.т. в течение 1 ч (условие реакции b). Реакционную смесь гасили хлоридом аммония, экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 5-10% этилацетата в гексане с получением продукта в виде белого твердого вещества (4) (Выход: 60%, 0,9 г). MS (ESI): масса, рассч. для C10H9NO2, 175,06; найденное значение масса/заряд, 176,1 (М+Н)+.
Стадия 3. Получение 1-(циклопропилметил)-6-метокси-1Н-индол-2-карбальдегида (6)
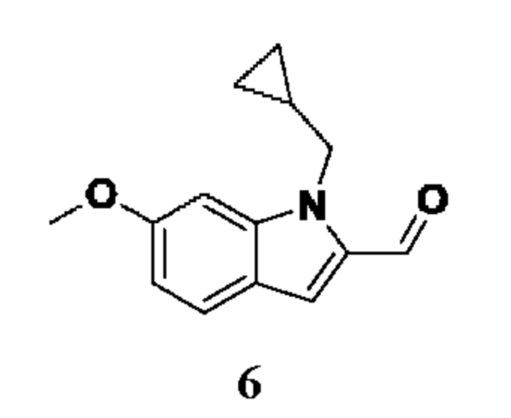
К перемешиваемому раствору 6-метокси-1Н-индол-2-карбальдегида (4, 0,28 г, 1,6 ммоль) в DMF (5 мл) добавляли карбонат калия (1,1 г, 8 ммоль) с последующим добавлением (бромметил)циклопропана (5, 0,23 мл, 1,72 ммоль) и реакционную смесь перемешивали при такой же температуре в течение 4 ч (условие реакции с). Реакционную смесь гасили водой, экстрагировали с помощью этилацетата (20 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 5-10% этилацетата в гексане с получением продукта в виде коричневой жидкости (6) (выход: 63%, 0,23 г). 1H ЯМР (400 МГц, DMSO) δ (ppm): 9,72 (s, 1Н), 7,62 (d, J=8 Гц, 1Н), 7,3 (s, 1H), 7,07 (s, 1H), 6,78 (d, J=8 Гц, 1H), 4,43 (d, J=8 Гц, 2H), 3,84 (s, 3H), 1,26-1,21 (m, 1H), 0,40-0,38 (m, 4H). MS (ESI): масса, рассч. для C14H15NO2, 229,1; найденное значение масса/заряд, 230,2 (М+Н)+.
Синтез 1-этил-1Н-пирроло[2,3-b]пиридин-2-карбальдегида (промежуточное соединение для соединения 24)
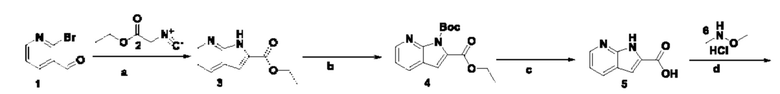
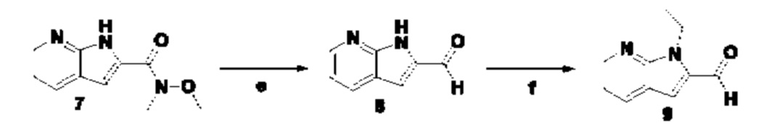
Стадия 1. Получение этил-1Н-пирроло[2,3-b]пиридин-2-карбоксилата (3)
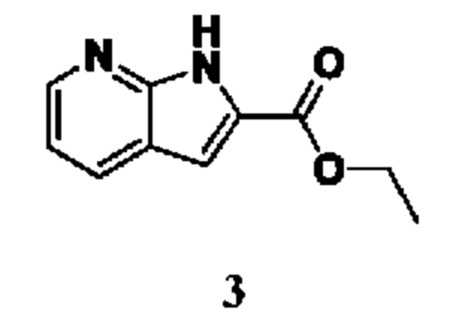
К перемешиваемому раствору 2-бромникотинальдегида (1, 10,0 г, 53,7 ммоль) в DMSO (100 мл) добавляли CS2CO3 (35,0 г, 107 ммоль), CuI (1,05 г, 5,37 ммоль) с последующим добавлением этил-2-изоцианоацетата (2, 7,9 мл, 69,8 ммоль) и перемешивали при 80°С в течение 16 ч (условие реакции а). Реакционную смесь охлаждали до к.т. и фильтровали через целит. К полученному добавляли воду (100 мл) и соединение экстрагировали с помощью EtOAc (200 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенное вещество очищали посредством колоночной хроматографии с применением 30-50% EtOAc в гексане с получением продукта в виде коричневого смолистого твердого вещества (3) (4,5 г, выход 45%). MS (ESI): масса, рассч. для C10H10N2O2, 190,20; найденное значение масса/заряд 191,0 (М+Н)+.
Стадия 2. Получение 1-(трет-бутил)-2-этил-1Н-пирроло[2,3-b]пиридин-1,2-дикарбоксилата (4)
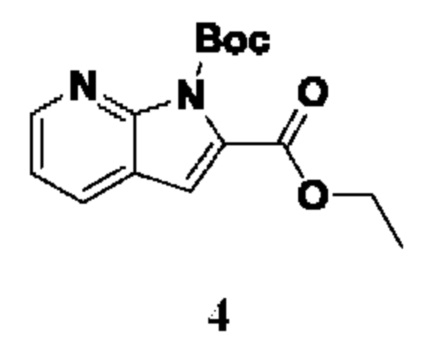
К перемешиваемому раствору этил-1Н-пирроло[2,3-b]пиридин-2-карбоксилата (3, 34,5 г, 23,6 ммоль) в THF (50 мл) добавляли триэтиламин (6,5 мл, 47,3 ммоль) с последующим добавлением Вос-ангидрида (3,6 г, 35,5 ммоль) и перемешивали при к.т. в течение 16 ч (условие реакции b). К реакционной смеси добавляли воду (100 мл) и экстрагировали с помощью EtOAc (200 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенное вещество очищали посредством колоночной хроматографии с применением 20-30% EtOAc в гексане с получением продукта в виде коричневой смолы (4) (5,5 г, выход 81%). MS (ESI): масса, рассч. для C15H18N2O4, 290,32; найденное значение масса/заряд, 291,1 (М+Н)+.
Стадия 3. Получение 1Н-пирроло[2,3-b]пиридин-2-карбоновой кислоты (5)
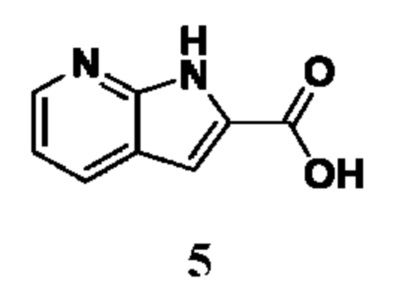
К перемешиваемому раствору 1-(трет-бутил)-2-этил-1Н-пирроло[2,3-b]пиридин-1,2-дикарбоксилата (4, 5,5 г, 18,9 ммоль) в THF (40 мл) добавляли LiOH (3,9 г, 94,8 ммоль) в воде (10 мл) и перемешивали при к.т. в течение 4 ч (условие реакции с). Реакционную смесь выпаривали, растворяли в минимальном количестве воды. К ней добавляли насыщенный раствор лимонной кислоты до обеспечения кислотных условий и образованный осадок собирали путем фильтрации и высушивали с получением продукта в виде белого твердого вещества (5) (2,5 г, выход 81%). MS (ESI): масса, рассч. для C8H6N2O2, 162,04; найденное значение масса/заряд, 163,1 (М+Н)+.
Стадия 4. Получение N-метокси-N-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксамида (7)
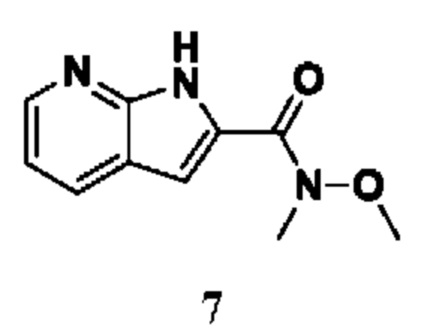
К перемешиваемому раствору 1Н-пирроло[2,3-b]пиридин-2-карбоновой кислоты (5, 2,5 г, 15,4 ммоль) и гидрохлорида N,O-диметилгидроксиламина (6, 1,8 г, 18,5 ммоль) в DCM (50 мл) добавляли триэтиламин (10,6 мл, 77,1 ммоль), HOBt (3,54 г, 23,14 ммоль) с последующим добавлением EDC.HCl (4,42 г, 23,18 ммоль) при 0°С и реакционную смесь перемешивали при к.т. в течение 16 ч (условие реакции d). Реакционную смесь охлаждали до к.т., фильтровали через целит и фильтрат выпаривали. К неочищенному веществу добавляли воду (10 мл) и соединение экстрагировали с помощью DCM (30 мл). Органический слой высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 2-4% МеОН в DCM с получением продукта в виде грязно-белого твердого вещества (7) (2,6 г, выход 82%). MS (ESI): масса, рассч. для C10H11N3O2, 205,09; найденное значение масса/заряд 206,1 (М+Н)+.
Стадия 5. Получение 1Н-пирроло[2,3-b]пиридин-2-карбальдегида (8)
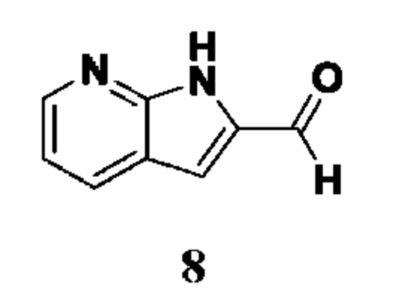
К перемешиваемому раствору N-метокси-N-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксамида (7, 0,5 г, 2,43 ммоль) в THF (10 мл) добавляли 1 М LAH в THF (3,6 мл, 3,65 ммоль) при -78°С и реакционную смесь перемешивали при такой же температуре в течение 3 ч (условие реакции е). Повышали основность реакционной смеси с применением насыщенного раствора Na2CO3 и экстрагировали с помощью DCM (2 × 25 мл). Реакционную смесь гасили насыщенным раствором NH4Cl (10 мл) и соединение экстрагировали с помощью EtOAc (50 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали с получением неочищенного продукта. Неочищенное вещество очищали посредством колоночной флеш-хроматографии с применением 25-30% EtOAc в гексане с получением соединения в виде белого твердого вещества (8) (0,3 г, выход 85%). MS (ESI): масса, рассч. для C8H6N2O, 146,15; найденное значение масса/заряд, 147,1 (М+Н)+.
Стадия 6. Получение 1-этил-1Н-пирроло[2,3-b]пиридин-2-карбальдегида (9)
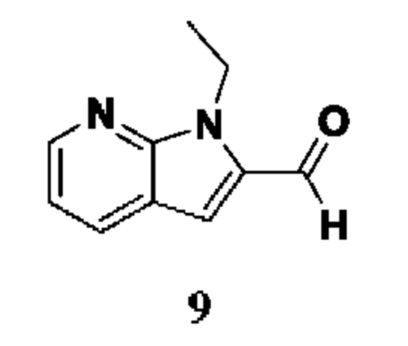
К перемешиваемому раствору 1Н-пирроло[2,3-b]пиридин-2-карбальдегида (8, 0,3 г, 2,19 ммоль) в DMF (10 мл) добавляли К2СО3 (0,91 г, 6,57 ммоль) с последующим добавлением этилиодида (0,5 г, 3,28 ммоль) и реакционную смесь перемешивали при такой же температуре в течение 16 ч (условие реакции f). К реакционной смеси добавляли воду (15 мл) и экстрагировали с помощью EtOAc (50 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали с получением неочищенного продукта. Неочищенное вещество очищали посредством колоночной флеш-хроматографии с применением 15-20% EtOAc в гексане с получением соединения в виде бесцветного масла (9) (0,34 г, выход 95%). MS (ESI): масса, рассч. для C10H10N2O, 174,08; найденное значение масса/заряд, 175,2 (М+Н)+.
Синтез 1-(циклопропилметил)-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 25)
К перемешиваемому раствору 1Н-индол-2-карбальдегида (1, 1 г, 6,89 ммоль) в DMF (20 мл) добавляли карбонат калия (2,8 г, 20,67 ммоль) и (бромметил)циклопропан (0,678 мл, 7,58 ммоль) при к.т. Реакционную смесь перемешивали при к.т. в течение 12 ч (условие реакции а). Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 3-7% этилацетата в гексане с получением 1-(циклопропилметил)-1Н-индол-2-карбальдегида в виде желтого твердого вещества (2) (1 г, выход 76). 1Н ЯМР (400 МГц, DMSO) δ (ppm): 9,88 (s, 1Н), 7,75 (d, J=8 Гц, 1Н), 7,64 (d, J=8 Гц, 1Н), 7,46 (s, 1Н), 7,41-7,37 (m, 1Н), 7,16-7,12 (m, 1Н), 4,45 (d, J=8 Гц, 2H), 1,24-1,14 (m, 1Н), 0,39-0,35 (m, 4H). MS (ESI): масса, рассч. для C13H13NO, 199,1; найденное значение масса/заряд, 200,1 (М+Н)+.
Синтез 1-бензил-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 26)
К перемешиваемому раствору 1Н-индол-2-карбальдегида (1, 1 г, 6,89 ммоль) в DMF (20 мл) добавляли карбонат калия (2,8 г, 20,68 ммоль) и (бромметил)бензол (1,2 г, 7,58 ммоль) при к.т. (условие реакции а). Реакционную смесь перемешивали при к.т. в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 3-7% этилацетата в гексане с получением 1-бензил-1Н-индол-2-карбальдегида в виде вязкой жидкости (2) (0,5 г, выход 33%). 1H ЯМР (400 МГц, DMSO) δ (ppm): 9,92 (s, 1Н), 7,78 (d, J=8 Гц, 1Н), 7,58 (d, J=8 Гц, 1Н), 7,54 (s, 1Н), 7,38-7,35 (m, 1Н), 7,26-7,20 (m, 2Н), 7,18-7,13 (m, 2Н), 7,05 (d, J=4 Гц, 2Н), 5,82 (s, 2Н). MS (ESI): масса, рассч. для C16H13NO, 235,10; найденное значение масса/заряд, 236,1 (М+Н)+.
Синтез 1-(пиридин-2-илметил)-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 27)
К перемешиваемому раствору 1Н-индол-2-карбальдегида (1, 1 г, 6,89 ммоль) в DMF (20 мл) добавляли карбонат цезия (6,7 г, 20,68 ммоль) и 2-(бромметил)пиридин (1,1 г, 6,89 ммоль) при к.т. (условие реакции а). Реакционную смесь нагревали с обратным холодильником при 80°С в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 3-7% этилацетата в гексане с получением 1-(пиридин-2-илметил)-1Н-индол-2-карбальдегида в виде желтого твердого вещества (2) (0,8 г, выход 50%). 1H ЯМР (400 МГц, DMSO) δ (ppm): 9,92 (s, 1Н), 8,45 (d,J=4 Гц, 1Н), 7,79 (d, J=8 Гц, 1Н), 7,66 (m, 1Н), 7,56 (d, J=12 Гц, 2Н), 7,37-7,33 (m, 1Н), 7,22-7,19 (m, 1Н), 7,17-7,13 (m, 1Н), 6,88 (d, J=8 Гц, 1Н), 5,89 (s, 2Н). MS (ESI): масса, рассч. для C16H12ClNO, 269,73; найденное значение масса/заряд, 270,1 (М+Н)+.
Синтез 1-(циклопропилметил)-6-фтор-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 28)
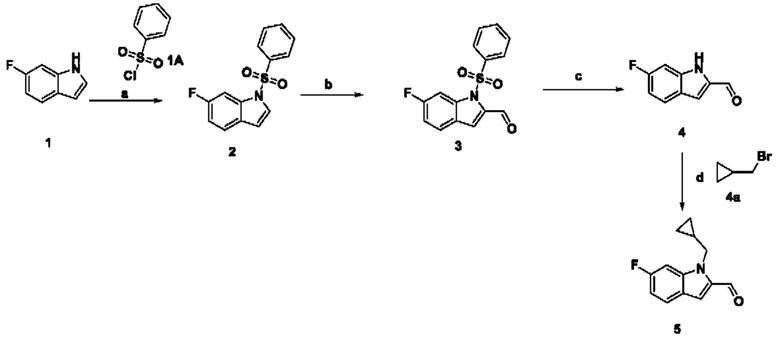
Стадия 1. Получение 6-фтор-1-(фенилсульфонил)-1Н-индола (2)
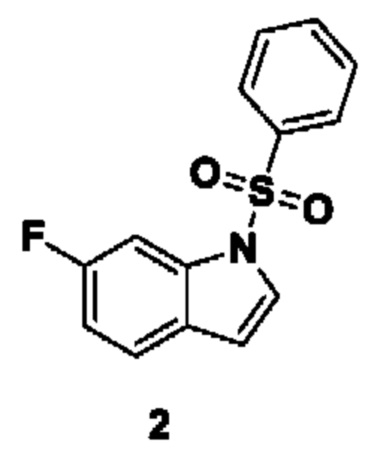
К раствору гидрида натрия (0,88 г, 22,2 ммоль) в DMF (50 мл) добавляли раствор 6-фтор-1Н-индола (1, 3,0 г, 22,2 ммоль) в DMF при 0°С по каплям в течение 15 мин. Бензолсульфонилхлорид в DMF (2,86 мл, 22,2 ммоль) добавляли при 0°С и перемешивали в течение 2 ч при к.т. в атмосфере N2 (условие реакции а). К реакционной смеси добавляли ледяную воду (50 мл), затем отфильтровывали осадок и промывали ледяной водой с получением белого твердого вещества (2) (6,0 г, 98,19%).
Стадия 2. Получение 6-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3) (промежуточное соединение для соединений 52, 54, 68, 69, 70, 71, 72 и 73)
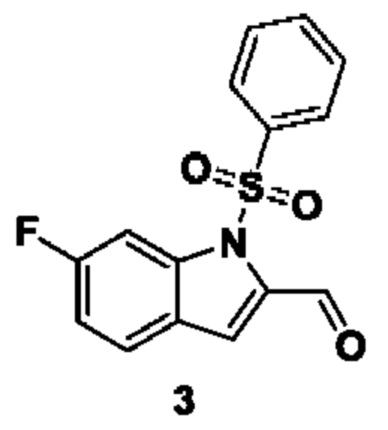
К раствору 6-фтор-1-(фенилсульфонил)-1Н-индола (2, 6,0 г, 22,0 ммоль) в сухом THF (60 мл) добавляли 2 М раствор диизопропиламида лития в THF (10,9 мл г, 22,0 ммоль) при -78°С и перемешивали в течение 5-8 мин с последующим добавлением сухого DMF (2,5 мл, 33,0 ммоль) при -78°С и перемешиванием в течение 10 мин при -78°С в атмосфере N2 (условие реакции b). К реакционной смеси добавляли водный раствор хлорида аммония (20 мл), затем экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором NH4Cl и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением желтого твердого вещества (3) (6,0 г, 90,90%). MS (ESI): масса/заряд 304,2 (М+Н)+.
Стадия 3. Получение 6-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (4)
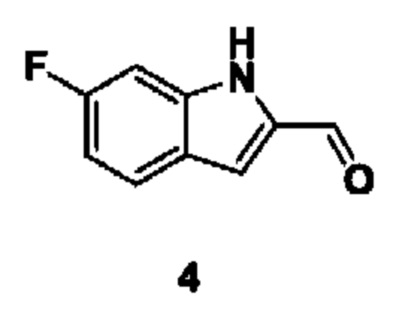
К перемешиваемому раствору 6-дифтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3, 1 г, 3,3 ммоль) в THF (50 мл) добавляли TBAF (1 M в THF) (9,15 мл, 16,5 ммоль) при к.т. Реакционную смесь перемешивали при к.т. в течение 12 ч (условие реакции с). Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 15-25% этилацетата в гексане с получением 6-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида в виде клейкого твердого вещества (4) (0,45 г, выход 90%) MS (ESI): масса, рассч. для C9H6FNO, масса/заряд 163; найденное значение, 164 (М+Н)+.
Стадия 4. Получение 1-(циклопропилметил)-6-фтор-1Н-индол-2-карбальдегида (5)
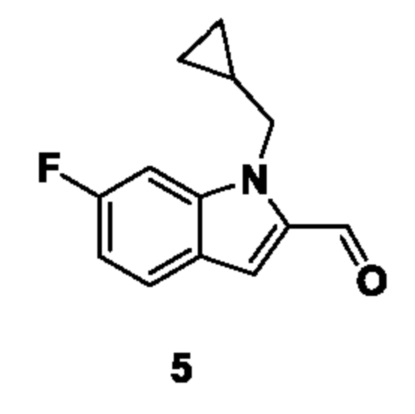
К перемешиваемому раствору 6-фтор-1Н-индол-2-карбальдегида (4, 0,5 г, 3,44 ммоль) в DMF (10 мл) добавляли карбонат калия (1,42 г, 10,3 ммоль) с последующим добавлением (бромметил)циклопропана (0,84 г, 4,13 ммоль) и реакционную смесь перемешивали при такой же температуре в течение 4 ч (условие реакции d). Реакционную смесь гасили водой, экстрагировали с помощью этилацетата (30 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 10-15% этилацетата в гексане с получением продукта в виде наполовину белого твердого вещества (5) (выход: 93,4%, 0,86 г). 1H ЯМР (400 МГц, DMSO)δ (ppm): 9,81 (s, 1Н), 7,69-7,66 (m, 1Н), 7,25 (d, J=6,8 Гц, 1Н), 7,07 (d, J=8 Гц, 1Н), 6,97-6,91 (m, 1Н), 4,43 (d, J=8 Гц, 2Н), 1,32-1,25 (m, 1Н), 0,5-0,45 (m, 2Н), 0,42-0,38 (m, 2Н). MS (ESI): масса, рассч. для C13H12FNO, 217,09; найденное значение масса/заряд, 218,0 (М+Н)+.
Синтез 1-(циклопропилметил)-5-фтор-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 29)
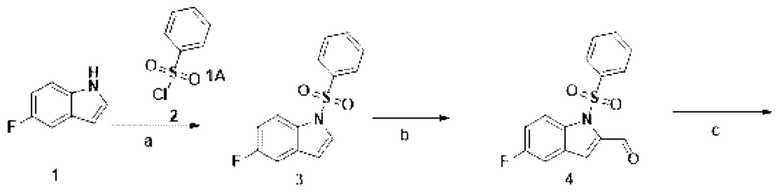
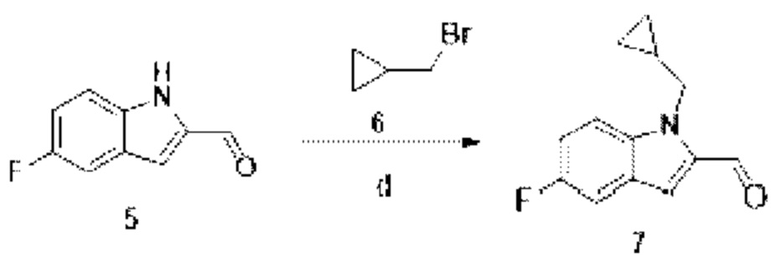
Стадия 1. Получение 5-фтор-1-(фенилсульфонил)-1Н-индола (3)
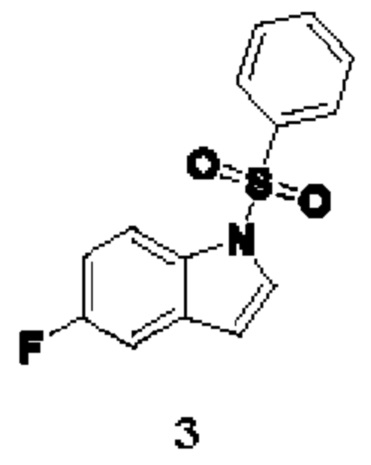
К раствору гидрида натрия (0,06 г, 15 ммоль) в DMF (10 мл) по каплям добавляли раствор 5-фтор-1Н-индола (1, 0,2 г, 15 ммоль) в DMF при 0°С в течение 15 мин с последующим добавлением раствора бензолсульфонилхлорида (2, 0,26 г, 15 ммоль) в DMF при 0°С и реакционную смесь перемешивали в течение 2 ч при к.т. в атмосфере N2 (условие реакции а). К реакционной смеси добавляли ледяную воду (50 мл), затем осадок отфильтровывали и промывали ледяной водой с получением коричневого твердого вещества (3) (0,25 г, выход 62,50%). MS (ESI) масса/заряд 275,0 (М+Н)+.
Стадия 2. Получение 5-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (4) (промежуточное соединение для соединений 53, 74, 75, 76 и 84)
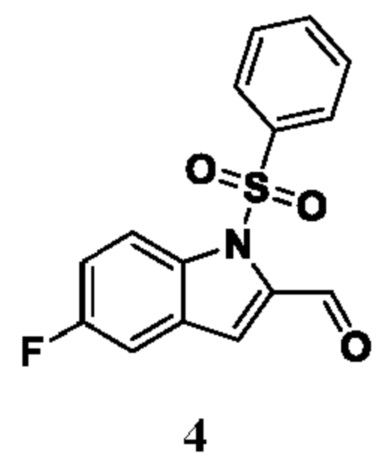
К раствору 5-фтор-1-(фенилсульфонил)-1Н-индола (3, 0,250 г, 1,0 ммоль) в сухом THF (50 мл) добавляли 1 М раствор диизопропиламида лития в THF (0,5 мл г, 1,0 ммоль) при -78°С с последующим добавлением сухого DMF (0,11 мл, 1,5 ммоль) при -78°С и перемешиванием в течение 10 мин при -78°С в атмосфере N2 (условие реакции b). К реакционной смеси добавляли водный раствор хлорида аммония (20 мл) и экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором NH4Cl и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением коричневого твердого вещества (4) (0,150 г, выход 54,54%). MS (ESI) масса/заряд 304,1 (М+Н)+.
Стадия 3. Получение 5-фтор-1Н-индол-2-карбальдегида (5)
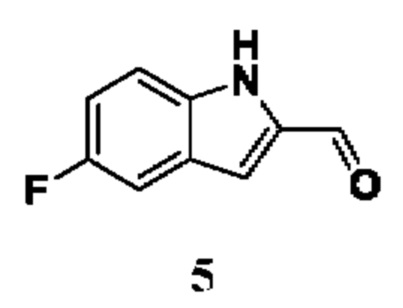
К перемешиваемому раствору 5-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (4, 1,85 г, 6,105 ммоль) в THF (50 мл) добавляли TBAF (1 M в THF) (9,15 мл, 9,158 ммоль) при к.т. (условие реакции с). Реакционную смесь перемешивали при к.т. в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 15-25% этилацетата в гексане с получением 5-фтор-1Н-индол-2-карбальдегида в виде клейкого твердого вещества (5) (0,65 г, выход 65%) MS (ESI): масса, рассч. для C9H6FNO, 163,15; найденное значение масса/заряд, 162,0 [М-Н]-.
Стадия 4. Получение 1-(циклопропилметил)-5-фтор-1Н-индол-2-карбальдегида (7)
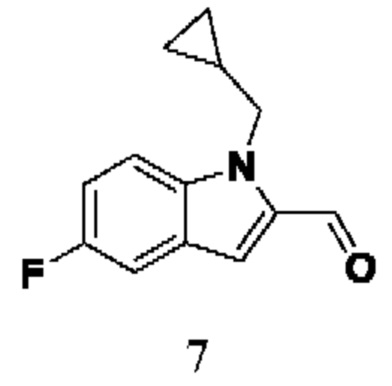
К перемешиваемому раствору 5-фтор-1Н-индол-2-карбальдегида (5, 0,65 г, 3,98 ммоль) в DMF (50 мл) добавляли карбонат калия (1,64 г, 11,94 ммоль) и (бромметил)циклопропан (6, 0,58 мл, 5,98 ммоль) при к.т. Реакционную смесь перемешивали при к.т. в течение 12 ч (условие реакции d). Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 3-7% этилацетата в гексане с получением 1-(циклопропилметил)-5-фтор-1Н-индол-2-карбальдегида в виде клейкого твердого вещества (7) (0,76 г, выход 88%). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 9,90 (s, 1Н), 7,73-7,69 (m, 1Н), 7,55-7,52 (m, 1Н), 7,44 (s, 1Н), 7,29-7,24 (m, 1Н), 4,50 (d, J=7,2 Гц, 2H), 1,23-1,16 (m, 1Н), 0,41-0,32 (m, 4Н). MS (ESI): масса, рассч. для C13H12FNO, 217,24: найденное значение масса/заряд, 218,1 [М+Н]+.
Синтез 1-(циклопропилметил)-7-метил-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 30)
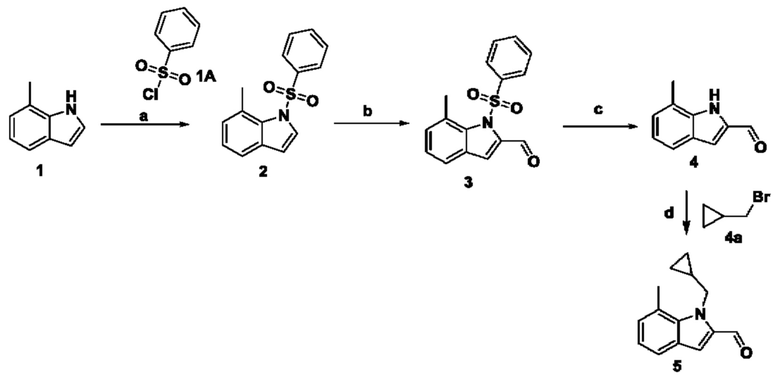
Стадия 1. Получение 7-метил-1-(фенилсульфонил)-1Н-индола (2)
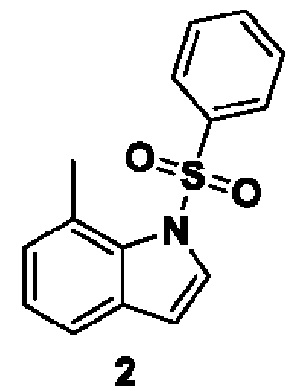
К раствору гидрида натрия (0,92 г, 23 ммоль) в DMF (10 мл) по каплям добавляли раствор 7-метил-1H-индола (1, 3,0 г, 23 ммоль) в DMF при 0°C в течение 15 мин. Бензолсульфонилхлорид в DMF (2,96 мл, 23 ммоль) добавляли при 0°C и перемешивали в течение 2 ч при к.т. в атмосфере N2 (условие реакции а). К реакционной смеси добавляли ледяную воду (50 мл), затем отфильтровывали осадок и промывали ледяной водой с получением коричневого твердого вещества (2) (5,30 г, 85,50%). MS (ESI) масса/заряд 272,1 (М+Н)+.
Стадия 2. Получение 7-метил-1-(фенилсулъфонил)-1Н-индол-2-карбальдегида (3)
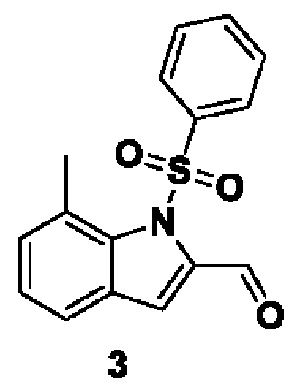
К раствору 7-метил-1-(фенилсульфонил)-1Н-индола (2, 5,3 г, 20,0 ммоль) в сухом THF (50 мл) добавляли 1,5 М раствор диизопропиламида лития в THF (13,0 мл, 20,0 ммоль) при -78°C и перемешивали в течение 5-8 мин с последующим добавлением сухого DMF (2,33 мл, 30,0 ммоль) при -78°C и перемешиванием в течение 10 мин при -78°C в атмосфере N2 (условие реакции b). К реакционной смеси добавляли водный раствор хлорида аммония (20 мл), затем экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором NH4Cl и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением красной вязкой жидкости (3) (5,0 г, 85,47%). MS (ESI) масса/заряд 300,2 (М+Н)+.
Стадия 3. Получение 7-метил-1Н-индол-2-карбальдегида (4)
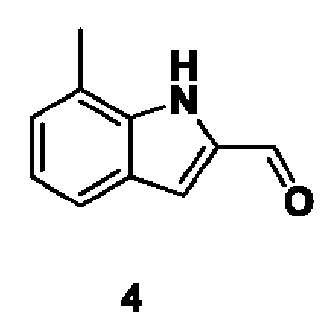
К перемешиваемому раствору 7-метил-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3, 2 г, 6,68 ммоль) в THF (20 мл) добавляли 1 М раствор фторида тетрабутиламмония в THF (10 мл, 10,2 ммоль) и перемешивали при 80°C в течение 1 ч (условие реакции с). Реакционную смесь охлаждали до к.т., добавляли воду (20 мл) и экстрагировали с помощью EtOAc (100 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенное вещество очищали посредством колоночной хроматографии с применением 15-20% EtOAc в гексане с получением продукта в виде коричневого твердого вещества (4) (0,8 г, выход 58%). MS (ESI): масса, рассч. для C10H9NO, 159,07; найденное значение масса/заряд 160,1 (М+Н)+.
Стадия 4. Получение 1-(циклопропилметил)-7-метил-1Н-индол-2-карбальдегида (5)
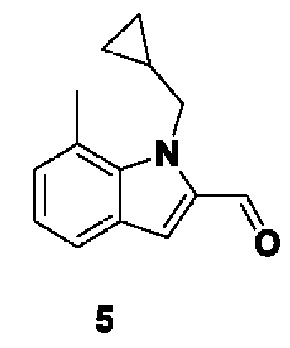
К перемешиваемому раствору 7-метил-1Н-индол-2-карбальдегида (4, 0,85 г, 5,345 ммоль) в DMF (20 мл) добавляли карбонат калия (2,21 г, 16,035 ммоль) и (бромметил)циклопропан (4а, 0,78 мл, 8,018 ммоль) при к.т. Реакционную смесь перемешивали при к.т. в течение 12 ч (условие реакции d). Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 3-7% этилацетата в гексане с получением 1-(циклопропилметил)-7-метил-1Н-индол-2-карбальдегида в виде клейкого твердого вещества (5) (0,52 г, выход 45%). 1Н ЯМР (400 МГц, CDCl3) δ (ppm): 9,82 (s, 1H), 7,58 (d, J=8,0 Гц, 1Н), 7,26 (s, 1H), 7,13 (d, J=6,8 Гц, 1H), 6,26 (m, 1H), 4,83 (d, J=6,8 Гц, 2H), 2,77 (s, 3Н), 1,15-1,10 (m, 1H), 0,41-0,33 (m, 4H). MS (ESI): масса, рассч. для C14H15NO, 213,28; найденное значение масса/заряд, 214,1 [М+Н]+.
Синтез 3-(хлорметил)тиофена (промежуточное соединение для соединения 36)
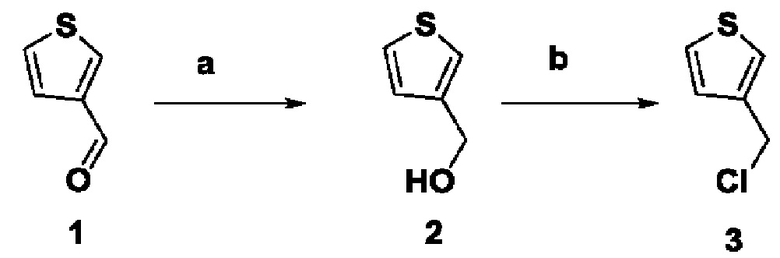
Стадия 1. Получение тиофен-3-илметанола (2)
К перемешиваемому раствору тиофен-3-карбальдегида (1, 1 г, 8,92 ммоль) в МеОН (10 мл) добавляли NaBH4 (0,5 г, 13,3 ммоль) частями при 0°C и перемешивали при к.т. в течение 1 ч (условие реакции а). Реакционную смесь гасили льдом и МеОН выпаривали. К полученному неочищенному веществу добавляли воду (5 мл) и экстрагировали с помощью EtOAc (2 X 20 мл). Органический слой промывали солевым раствором (5 мл), высушивали над безводным Na2SO4 и выпаривали под вакуумом с получением продукта в виде коричневого масла (2) (0,9 г, выход 90%). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 7,45-7,43 (m, 1H), 7,26 (s, 1H), 7,03 (d, J=4,4 Гц, 1H), 5,05 (t, J=6,0 Гц, 1H), 4,45 (d, J=5,6 Гц, 2H).
Стадия 2. Получение 3-(хлорметил)тиофена (3)
К перемешиваемому раствору тиофен-3-илметанола (2, 0,5 г, 4,38 ммоль) в DCM (5 мл) добавляли SOCl2 (0,6 мл, 8,77 ммоль) по каплям при 0°C и реакционную смесь перемешивали при к.т. в течение 1 ч (условие реакции b). Реакционную смесь выпаривали под вакуумом и высушивали с получением продукта в виде коричневого масла (3) (0,5 г, выход 80%). 1Н ЯМР (400 МГц, DMSO-d6): δ 7,45-7,43 (m, 1H), 7,26 (s, 1H), 7,03 (d, J=4,4 Гц, 1H), 4,78 (s, 2Н).
Синтез 3-(хлорметил)фурана (промежуточное соединение для соединения 37)
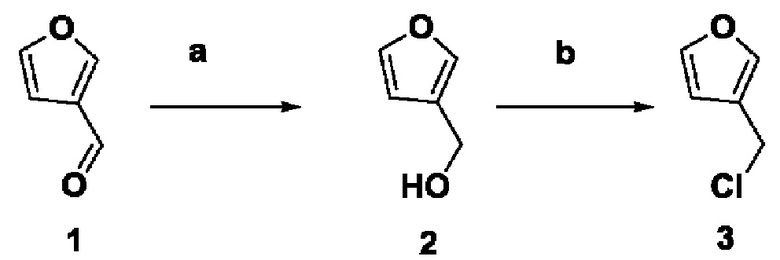
Стадия 1. Получение фуран-3-илметанола (2)
К перемешиваемому раствору фуран-3-карбальдегида (1, 1 г, 10,4 ммоль) в МеОН (10 мл) добавляли NaBH4 (0,6 г, 15,6 ммоль) частями при 0°C и перемешивали при к.т. в течение 1 ч (условие реакции а). Реакционную смесь гасили льдом и МеОН выпаривали. К полученному неочищенному веществу добавляли воду (5 мл) и экстрагировали с помощью EtOAc (2 X 20 мл). Органический слой промывали солевым раствором (5 мл), высушивали над безводным Na2SO4 и выпаривали под вакуумом с получением продукта в виде коричневого масла (2) (0,6 г, выход 60%). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 7,56-7,50 (m, 2Н), 6,41 (s, 1H), 4,90 (t, J=5,2 Гц, 1H), 4,31 (d, J=6,0 Гц, 2H).
Стадия 2. Получение 3-(хлорметил)фурана (3)
К перемешиваемому раствору фуран-3-илметанола (2, 0,5 г, 5,10 ммоль) в DCM (5 мл) добавляли SOCl2 (0,7 мл, 10,2 ммоль) по каплям при 0°C и реакционную смесь перемешивали при к.т. в течение 1 ч (условие реакции b). Реакционную смесь выпаривали под вакуумом и высушивали с получением продукта в виде коричневого масла (3) (0,5 г, выход 84%). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 7,75-7,65 (m, 2Н), 6,53 (s, 1H), 4,68 (s, 2H).
Синтез 1-(1-хлорэтил)-4-фторбензола (промежуточное соединение для соединения 38)
Стадия 1. Получение 1-(4-фторфенил)этан-1-ола (2)
К перемешиваемому раствору 1-(4-фторфенил)этан-1-она (1, 2,0 г, 17,6 ммоль) в МеОН (20 мл) добавляли NaBH4 (1,0 г, 26,5 ммоль) частями при 0°C и перемешивали при к.т. в течение 1 ч (условие реакции а). Реакционную смесь гасили льдом и МеОН выпаривали. К полученному неочищенному веществу добавляли воду (10 мл) и экстрагировали с помощью EtOAc (2 X 25 мл). Органический слой промывали солевым раствором (10 мл), высушивали над безводным Na2SO4 и выпаривали под вакуумом с получением продукта в виде бесцветного масла (2) (1,9 г, выход 95%). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 7,36-7,33 (m, 2Н), 7,14-7,07 (m, 2Н), 5,12 (d, J=4,0 Гц, 1H), 4,72-4,67 (m, 1H), 1,28 (d, J=6,8 Гц, 3Н).
Стадия 2. Получение 1-(1-хлорэтил)-4-фторбензола (3)
К перемешиваемому раствору 1-(4-фторфенил)этан-1-ола (2, 0,5 г, 3,57 ммоль) в DCM (5 мл) добавляли SOCl2 (0,7 мл, 7,10 ммоль) по каплям при 0°C и реакционную смесь перемешивали при к.т. в течение 1 ч (условие реакции b). Реакционную смесь выпаривали под вакуумом и высушивали с получением продукта в виде коричневого масла (3) (0,5 г, выход 89%). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 7,53-7,51 (m, 2Н), 7,21-7,16 (m, 2Н), 5,36-5,33 (m, 1Н), 1,76 (d, J=6,8 Гц, 3H).
Синтез 1-этил-5-фтор-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 39)
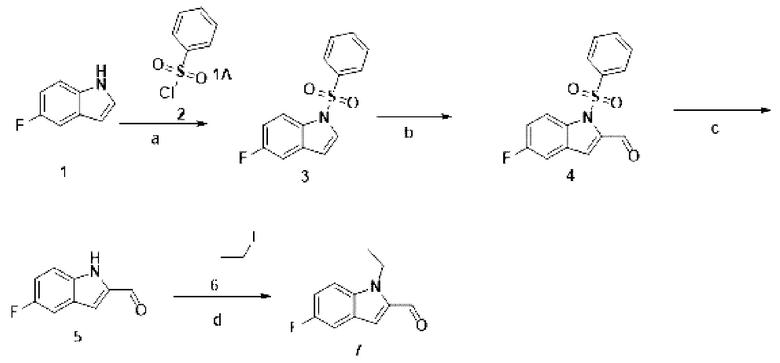
Стадия 1. Получение 5-фтор-1-(фенилсульфонил)-1Н-индола (3)
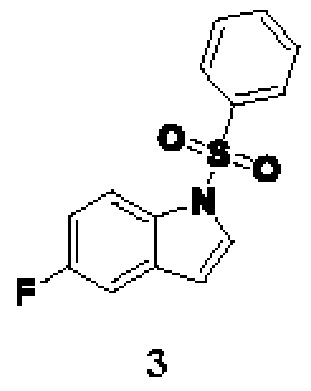
К раствору гидрида натрия (0,06 г, 15 ммоль) в DMF (10 мл) по каплям добавляли раствор 5-фтор-1H-индопа (1, 0,2 г, 15 ммоль) в DMF при 0°C в течение 15 мин с последующим добавлением раствора бензолсульфонилхлорида (2, 0,26 г, 15 ммоль) в DMF при 0°C и реакционную смесь перемешивали в течение 2 ч при к.т. в атмосфере N2 (условие реакции а). К реакционной смеси добавляли ледяную воду (50 мл), затем осадок отфильтровывали и промывали ледяной водой с получением коричневого твердого вещества (3) (0,25 г, выход 62,50%). MS (ESI) масса/заряд 275,0 (М+Н)+.
Стадия 2. Получение 5-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (4)
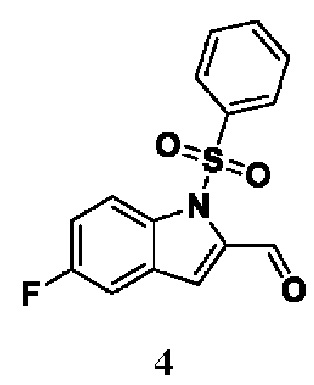
К раствору 5-фтор-1-(фенилсульфонил)-1Н-индола (3, 0,250 г, 1,0 ммоль) в сухом THF (50 мл) добавляли 1 М раствор диизопропиламида лития в THF (0,5 млг, 1,0 ммоль) при -78°C с последующим добавлением сухого DMF (0,11 мл, 1,5 ммоль) при -78°C и перемешиванием в течение 10 мин при -78°C в атмосфере N2 (условие реакции b). К реакционной смеси добавляли водный раствор хлорида аммония (20 мл) и экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором NH4Cl, солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением коричневого твердого вещества (4) (0,150 г, выход 54,54%). MS (ESI) масса/заряд 304,1 (М+Н)+.
Стадия 3. Получение 5-фтор-1Н-индол-2-карбальдегида (5)
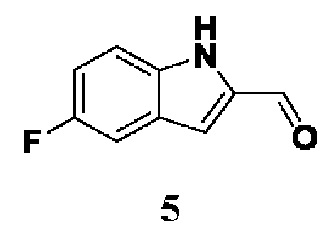
К перемешиваемому раствору 5-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (4, 1,85 г, 6,105 ммоль) в THF (50 мл) добавляли TBAF (1 M в THF) (9,15 мл, 9,158 ммоль) при к.т. (условие реакции с). Реакционную смесь перемешивали при к.т. в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 15-25% этилацетата в гексане с получением 5-фтор-1Н-индол-2-карбальдегида в виде клейкого твердого вещества (5) (0,65 г, выход 65%) MS (ESI): масса, рассч. для C9H6FNO, 163,15; найденное значение масса/заряд, 164,0 (М+Н)+.
Стадия 4. Получение 1-этил-5-фтор-1Н-индол-2-карбальдегида (7)
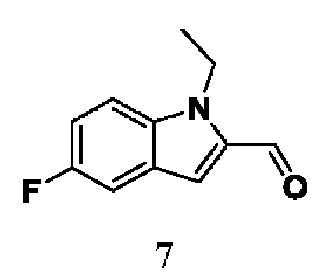
К перемешиваемому раствору 5-фтор-1Н-индол-2-карбальдегида (5, 0,6 г, 3,98 ммоль) в DMF (50 мл) добавляли карбонат калия (1,64 г, 11,94 ммоль) и этилиодид (6, 0,43 мл, 5,4 ммоль) при к.т. (условие реакции d). Реакционную смесь перемешивали при к.т. в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 3-7% этилацетата в гексане с получением 1-(циклопропилметил)-5-фтор-1Н-индол-2-карбальдегида в виде клейкого твердого вещества (7) (0,3 г, выход 43,6%). MS (ESI): масса, рассч. для C11H10FNO, 191,07: найденное значение масса/заряд, 192,1 [М+Н]+.
Синтез 1-(циклопропилметил)-4-фтор-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 40)
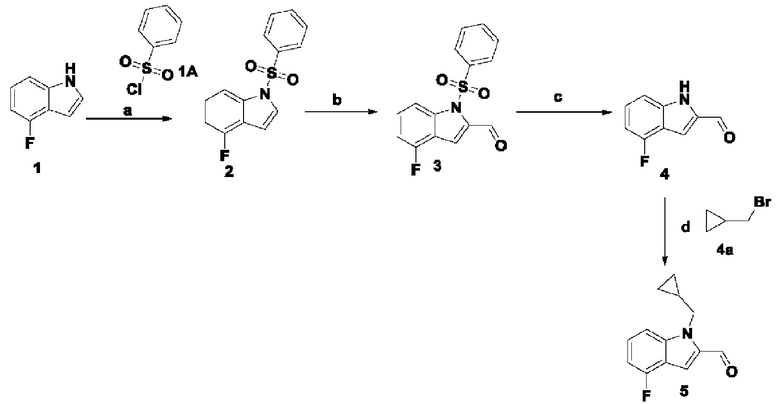
Стадия 1. Получение 4-фтор-1-(фенилсульфонил)-1Н-индола (2)
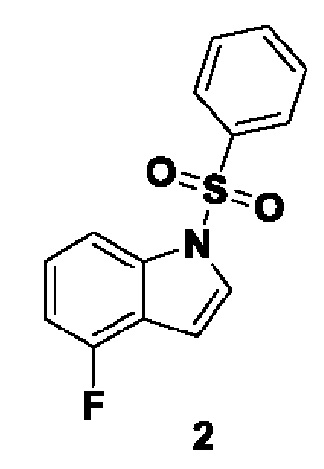
К раствору гидрида натрия (0,88 г, 22,2 ммоль) в DMF (50 мл) по каплям добавляли раствор 4-фтор-1H-индола (1, 3,0 г, 22,2 ммоль) в DMF при 0°C в течение 15 мин. Бензолсульфонилхлорид в DMF (2,86 мл, 22,2 ммоль) добавляли при 0°C и перемешивали в течение 2 ч при к.т. в атмосфере N2 (условие реакции а). К реакционной смеси добавляли ледяную воду (50 мл), затем отфильтровывали осадок и промывали ледяной водой с получением белого твердого вещества (2). (7,0 г - неочищенное вещество).
Стадия 2. Получение 4-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3)
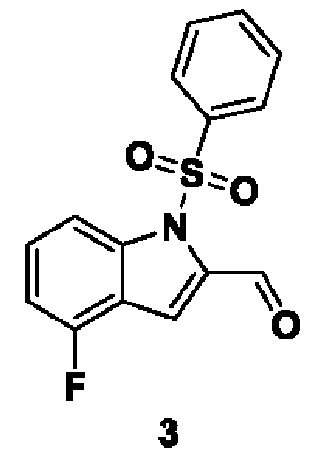
К раствору 4-фтор-1-(фенилсульфонил)-1Н-индола (2, 7,0 г, 22,0 ммоль) в сухом THF (60 мл) добавляли 2 М раствор диизопропиламида лития в THF (10,9 мл, 22,0 ммоль) при -78°C и перемешивали в течение 5-8 мин с последующим добавлением сухого DMF (2,5 мл, 33,0 ммоль) при -78°C и перемешиванием в течение 10 мин при -78°C в атмосфере N2 (условие реакции b). К реакционной смеси добавляли водный раствор хлорида аммония (20 мл), затем экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором NH4Cl и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением красной жидкости (3) (6,80 г, 88,31%).
Стадия 3. Получение 4-фтор-1Н-индол-2-карбальдегида (4)
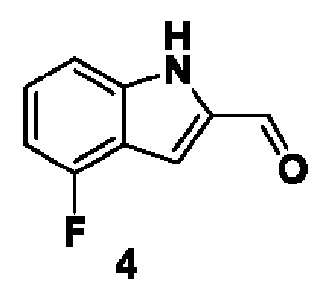
К раствору 4-фтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (4, 3,0 г, 9,9 ммоль) в сухом THF (20 мл) добавляли 1 М раствор фторида тетрабутиламмония в THF (14,8 мл) и реакционную смесь перемешивали в течение приблизительно 12 ч при к.т. (условие реакции с). Реакционную смесь гасили водой и затем экстрагировали с помощью этилацетата (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 5-10% этилацетата в гексане с получением продукта в виде желтого твердого вещества (4) (выход: 99%, 1,6 г). MS (ESI): масса, рассч. для C9H6FNO, 163,04; найденное значение масса/заряд 164 (М+Н)+.
Стадия 4. Получение 1-(циклопропилметил)-4-фтор-1Н-индол-2-карбальдегида(5)
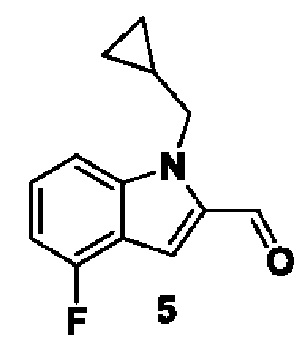
К перемешиваемому раствору 4-фтор-1Н-индол-2-карбальдегида (4, 1,6 г, 9,877 ммоль) в DMF (10 мл) добавляли карбонат калия (6,8 г, 49,38 ммоль) с последующим добавлением (бромметил)циклопропана (6, 1,4 мл, 10,65 ммоль) и реакционную смесь перемешивали при к.т. в течение 12 ч (условие реакции d). Реакционную смесь гасили водой, экстрагировали с помощью этилацетата (30 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 5-10% этилацетата в гексане с получением продукта в виде коричневой жидкости (5) (выход: 47,6%, 1 г). 1Н ЯМР (400 МГц, DMSO) δ (ppm): 9,90 (s, 1H), 7,55-7,50 (m, 2Н), 7,40-7,35 (m, 1H), 6,95-6,90 (m, 1H), 4,46 (d, J=8 Гц, 2Н), 1,22-1,21 (m, 1H), 0,42-0,36 (m, 4H). MS (ESI): масса, рассч. для C13H12FNO, 217,24; найденное значение масса/заряд, 218 [М+Н]+.
Синтез 2-(хлорметил)-4-метилтиазола (промежуточное соединение для соединения 41)
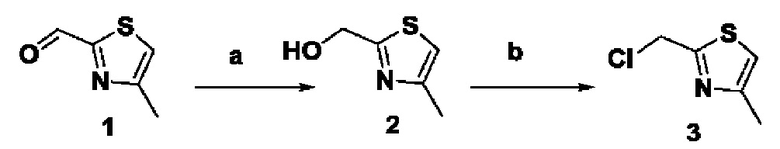
Стадия 1. Получение (4-метилтиазол-2-ил)метанола (2)
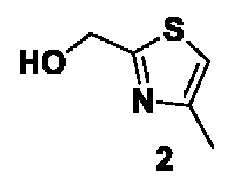
К перемешиваемому раствору 4-метилтиазол-2-карбальдегида (1, 1 г, 7,8 ммоль) в МеОН (10 мл) добавляли NaBH4 (0,5 г, 15,6 ммоль) частями при 0°C и перемешивали при к.т. в течение 1 ч (условие реакции а). Реакционную смесь гасили льдом и МеОН выпаривали. К полученному неочищенному веществу добавляли воду (5 мл) и экстрагировали с помощью EtOAc (2 X 20 мл). Органический слой промывали солевым раствором (5 мл), высушивали над безводным Na2SO4 и выпаривали под вакуумом с получением продукта в виде коричневого масла (2) (1 г, выход 79,5%). MS (ESI): масса, рассч. для C5H7NOS 129,02; найденное значение масса/заряд 130,1 (М+Н)+.
Стадия 2. Получение 2-(хлорметил)-4-метилтиазола (3)
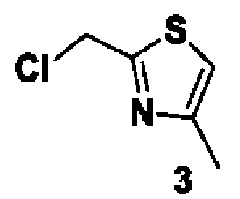
К перемешиваемому раствору (4-метилтиазол-2-ил)метанола (2, 1 г, 7,7 ммоль) в DCM (20 мл) по каплям добавляли SOCl2 (0,89 мл, 11,55 ммоль) при 0°C и реакционную смесь перемешивали при к.т. в течение 1 ч (условие реакции b). Реакционную смесь выпаривали под вакуумом и высушивали с получением продукта в виде коричневого масла (3) (1 г, выход 88,3%). 1НЯМР (400 МГц, CDCl3) δ (ppm): 6,91 (s, 1H), 4,82 (s, 2Н), 2,45 (s, 3Н).
Синтез 5-бром-1-(циклопропилметил)-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 43)
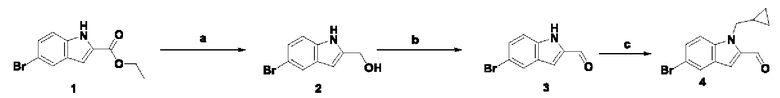
Стадия 1. Получение (5-бром-1Н-индол-2-ил)метанола (2)
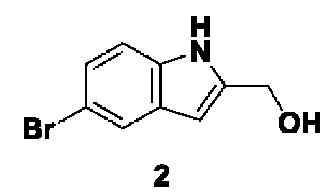
К раствору этил-5-бром-1Н-индол-2-карбоксилата (1, 5,0 г, 18,6 ммоль) в THF (35 мл) по каплям добавляли 1 М раствор алюмогидрида лития в THF (37,2 мл, 37,2 ммоль) при 0°C в течение 20 мин. Реакционную смесь перемешивали в течение 2 ч при к.т. в атмосфере N2 (условие реакции а). К реакционной смеси по каплям добавляли ледяной водн. раствор NH4Cl (20 мл) при 0°C, разбавляли водой и экстрагировали с помощью этилацетата (2 X 200 мл). Органический слой высушивали с применением Na2SO4 и выпаривали. Неочищенное вещество очищали посредством градиентной колоночной хроматографии с применением 20% этилацетата в гексане с получением твердого вещества розового цвета (2) (4,1 г, выход 97%). MS (ESI): масса, рассч. для C9H8BrNO, масса/заряд 226,07 найденное значение 228,0 [М+Н]2+.
Стадия 2. Получение 5-бром-1Н-индол-2-карбальдегида (3)

К раствору (5-бром-1Н-индол-2-ил)метанола (3, 4,1 г, 18,1 ммоль) в хлороформе (50 мл) добавляли MnO2 (15,7 г, 181 ммоль) и нагревали при 90°C в течение 2 ч в атмосфере N2 (условие реакции b). Реакционную смесь отфильтровывали и фильтрат выпаривали с получением неочищенного вещества. Неочищенное вещество очищали посредством градиентной колоночной хроматографии с применением 20% этилацетата в гексане с получением твердого вещества розового цвета (3) (4,1 г, выход 97%). MS (ESI): масса, рассч. для C9H6BrNO, масса/заряд 224,06, найденное значение 226,0 [М+Н]2+.
Стадия 3. 5-Бром-1-(циклопропилметил)-1Н-индол-2-карбальдегид (4)
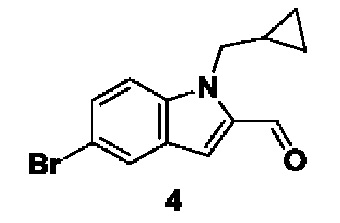
К перемешиваемому раствору 5-бром-1Н-индол-2-карбальдегида (3, 1,18 г, 5,22 ммоль) в DMF (20 мл) добавляли карбонат калия (1,4 г, 10,44 ммоль) и (бромметил)циклопропан (0,78 мл, 7,8 ммоль) при к.т. Реакционную смесь перемешивали при к.т. в течение 12 ч (условие реакции с). Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенное вещество очищали посредством градиентной колоночной хроматографии с применением 20% этилацетата в гексане с получением 5-бром-1-(циклопропилметил)-1Н-индол-2-карбальдегида в виде клейкого твердого вещества (4) (0,9 г, выход 62%). MS (ESI): масса, рассч. для C13H12BrNO, 278,15; найденное значение масса/заряд, 280,0 [М+Н]2+.
Синтез 7-хлор-1-(циклопропилметил)-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 44)
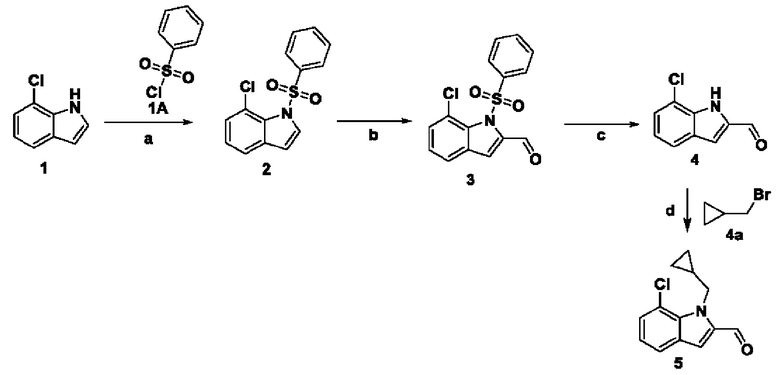
Стадия 1. Получение 7-хлор-1-(фенилсульфонил)-1Н-индола (2)
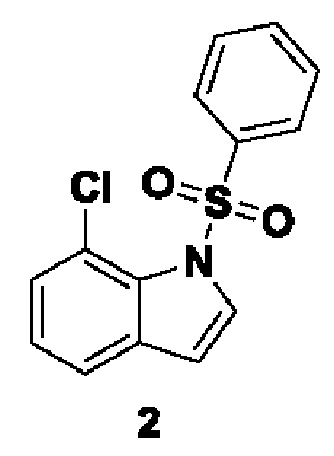
К раствору гидрида натрия (1,68 г, 42 ммоль) в DMF (10 мл) по каплям добавляли раствор 7-хлор-1H-индола (1, 3,2 г, 21 ммоль) в DMF при 0°C в течение 15 мин. Бензолсульфонилхлорид в DMF (2,8 мл, 23 ммоль) добавляли при 0°C и перемешивали в течение 2 ч при к.т. в атмосфере N2 (условие реакции а). К реакционной смеси добавляли ледяную воду (50 мл) и отфильтровывали осадок. Осадок промывали ледяной водой и очищали посредством градиентной колоночной хроматографии с применением 30% этилацетата в гексане с получением указанного в заголовке соединения в виде бледно-коричневого твердого вещества (2) (5 г, 81,8%). MS (ESI): масса, рассч. для C14H10ClNO2S, 219,01; найденное значение масса/заряд, 220,1 [М+Н]+.
Стадия 2. Получение 7-хлор-1-(фенилсулъфонил)-1Н-индол-2-карбальдегида (3)
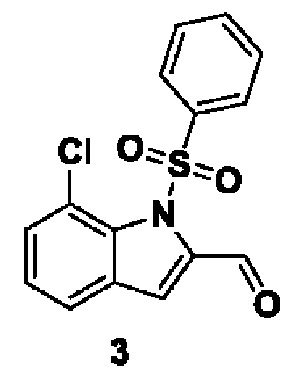
К раствору 7-хлор-1-(фенилсульфонил)-1Н-индола (2, 5 г, 17 ммоль) в сухом THF (50 мл) добавляли 1,5 М раствор диизопропиламида лития в THF (17,0 мл, 34 ммоль) при -78°C и перемешивали в течение 30 мин с последующим добавлением сухого DMF (1,65 мл, 20 ммоль) при -78°C. Его перемешивали в течение 10 мин при -78°C в атмосфере N2 (условие реакции b). К реакционной смеси добавляли водный раствор хлорида аммония (20 мл) и экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором NH4Cl и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали посредством градиентной колоночной хроматографии с применением 30% этилацетата в гексане с получением указанного в заголовке соединения в виде бледно-коричневой вязкой жидкости (3) (3,0 г, 55,3%). MS (ESI): масса, рассч. для C15H10ClNO3S, 319,01; найденное значение масса/заряд, 320,1 [М+Н]+.
Стадия 3. Получение 7-хлор-1Н-индол-2-карбальдегида (4)
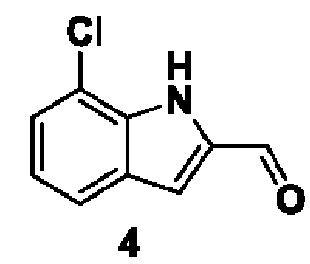
К перемешиваемому раствору 7-хлор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3, 3 г, 9,40 ммоль) в THF (20 мл) добавляли 1 М раствор фторида тетрабутиламмония в THF (18,8 мл, 18,8 ммоль) и перемешивали при 80°C в течение 1 ч (условие реакции с). Реакционную смесь охлаждали до к.т., добавляли воду (20 мл) и экстрагировали с помощью EtOAc (100 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенное вещество очищали посредством колоночной хроматографии с применением 15-20% EtOAc в гексане с получением продукта в виде коричневого твердого вещества (4) (1,6 г, выход 95%). MS (ESI): масса, рассч. для C9H6ClNO, 179,01; найденное значение масса/заряд 180,1 (М+Н)+.
Стадия 4. Получение 1-(циклопропилметил)-7-хлор-1Н-индол-2-карбальдегида (5)
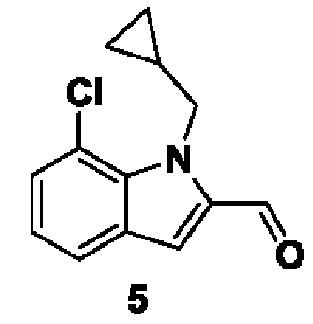
К перемешиваемому раствору 7-хлор-1Н-индол-2-карбальдегида (4, 1 г, 5,5 ммоль) в DMF (20 мл) добавляли карбонат цезия (3,5 г, 11 ммоль) и (бромметил)циклопропан (4а, 0,65 мл, 6,7 ммоль) при к.т. (условие реакции d). Реакционную смесь перемешивали при к.т. в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенное вещество очищали посредством градиентной колоночной хроматографии с применением 20% этилацетата в гексане с получением 1-(циклопропилметил)-7-хлор-1Н-индол-2-карбальдегида в виде клейкого твердого вещества (5) (0,7 г, выход 54%). 1Н ЯМР (400 МГц, CDCl3) δ (ppm): 9,87 (s, 1H), 7,64 (d, J=8,0 Гц, 1H), 7,37 (d, J=7,6 Гц, 1H) 7,29 (s, 1H), 7,08 (t,J=7,6 Гц, 1H), 5,00-4,92 (m, 2Н), 1,36-1,32 (m, 2Н), 1,25 (m, 1H), 0,43-0,41 (m, 2H). MS (ESI): масса, рассч. для C13H12ClNO, 233,06; найденное значение масса/заряд, 234,1 [М+Н]+.
Синтез 1-(циклопропилметил)-7-метокси-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 47)
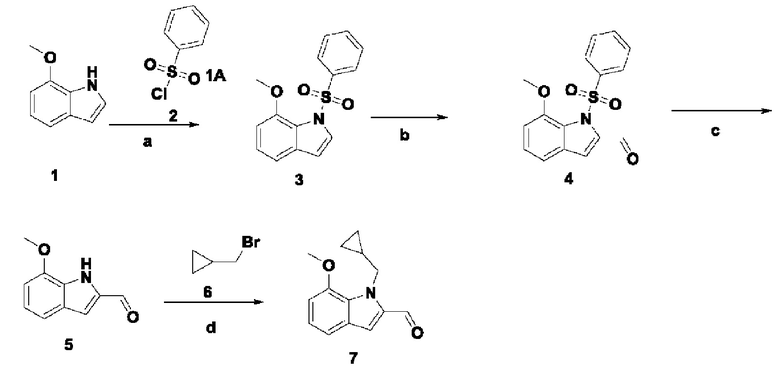
Стадия 1. Получение 7-метокси-1-(фенилсульфонил)-1Н-индола
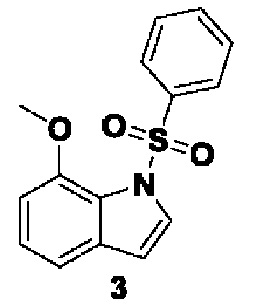
К раствору гидрида натрия (1,6 г, 40 ммоль) в DMF (10 мл) по каплям добавляли раствор 7-метокси-1H-индола (1, 3 г, 20 ммоль) в DMF при 0°C в течение 15 мин с последующим добавлением раствора бензолсульфонилхлорида (2, 2,86 мл, 22 ммоль) в DMF при 0°C и реакционную смесь перемешивали в течение 2 ч при к.т. в атмосфере N2. К реакционной смеси добавляли ледяную воду (50 мл), затем осадок отфильтровывали и промывали ледяной водой с получением коричневого твердого вещества (3) (5,6 г, выход 97,5%). MS (ESI) масса/заряд 288,1 (М+Н)+.
Стадия 2. Получение 7-метокси-1-(фенилсульфонил)-1Н-индол-2-карбальдегида
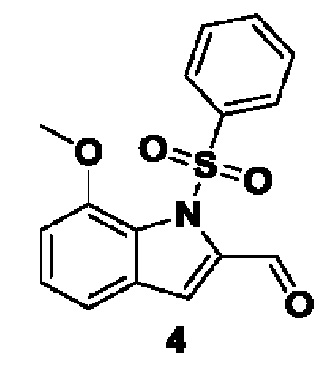
К раствору 7-метокси-1-(фенилсульфонил)-1Н-индола (3, 3 г, 10,4 ммоль) в сухом THF (50 мл) добавляли 1 М раствор диизопропиламида лития в THF (5,2 мл, 20 ммоль) при -78°C и перемешивали в течение 45 мин при такой же температуре. Сухой DMF (1 мл, 12 ммоль) добавляли при -78°C и перемешивали в течение 10 мин. К реакционной смеси добавляли водный раствор хлорида аммония (20 мл) и экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором NH4Cl и солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением коричневого твердого вещества (4) (1,2 г, выход 37,5%). MS (ESI) масса/заряд 304,1 (М+Н)+.
Стадия 3. Получение 7-метокси-1Н-индол-2-карбальдегида
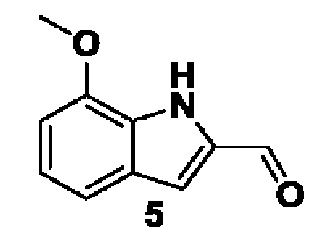
К перемешиваемому раствору 7-метокси-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (4, 1,1 г, 3,4 ммоль) в THF (50 мл) добавляли TBAF (1 M в THF) (6,9 мл, 6,9 ммоль) при к.т. Реакционную смесь перемешивали при к.т. в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 15-25% этилацетата в гексане с получением 5-фтор-1H-индол-2-карбальдегида в виде клейкого твердого вещества (5) (0,47 г, выход 79,6%). MS (ESI): масса, рассч. для C10H9NO2, 175,06; найденное значение масса/заряд, 176,1 [М+Н]+.
Стадия 4. Получение 1-(циклопропилметил)-7-метокси-1Н-индол-2-карбальдегида
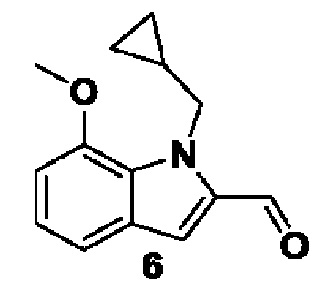
К перемешиваемому раствору 7-метокси-1Н-индол-2-карбальдегида (5, 0,47 г, 2,6 ммоль) в DMF (50 мл) добавляли карбонат калия (0,55 г, 5,2 ммоль) и (бромметил)циклопропан (6, 0,41 мл, 4,02 ммоль) при к.т. Реакционную смесь перемешивали при к.т. в течение 12 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (50 мл × 2). Объединенные органические экстракты промывали солевым раствором, высушивали над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 3-7% этилацетата в гексане с получением указанного в заголовке соединения в виде клейкого твердого вещества (6) (0,41 г, выход 68%). MS (ESI): масса, рассч. для C14H15NO2, 229,1: найденное значение масса/заряд, 230,1 [М+Н]+.
Синтез 5-(хлорметил)-2,4-диметилтиазола (промежуточное соединение для соединения 48)
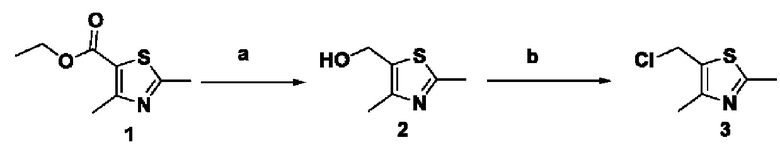
Стадия 1. (2,4-Диметилтиазол-5-ил)метанол
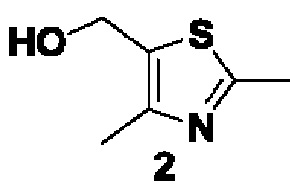
К перемешиваемому раствору этил-2,4-диметилтиазол-5-карбоксилата (1, 0,5 г, 2,70 ммоль) в THF (10 мл) добавляли 1 М LAH в THF (4 мл, 4,05 ммоль) по каплям при 0°C и перемешивали при к.т. в течение 1 ч. Реакционную смесь гасили насыщенным раствором NH4Cl, фильтровали через целит и экстрагировали с помощью EtOAc (2 X 25 мл). Органический слой промывали солевым раствором (5 мл), высушивали над безводным Na2SO4 и выпаривали. Неочищенное вещество очищали посредством градиентной колоночной хроматографии с применением 50-60% EtOAc в гексане с получением продукта в виде бесцветного масла (0,3 г, выход 79%). MS (ESI): масса, рассч. для C6H9NOS, 143,04; найденное значение масса/заряд 144,1 (М+Н)+.
Стадия 2. 5-(Хлорметил)-2,4-диметилтиазол
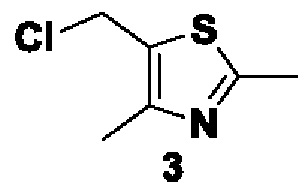
К перемешиваемому раствору (2,4-диметилтиазол-5-ил)метанола (2, 0,3 г, 2,09 ммоль) в DCM (5 мл) добавляли SOCl2 (0,3 мл, 4,19 ммоль) по каплям при 0°C и реакционную смесь перемешивали при к.т. в течение 1 ч. Реакционную смесь выпаривали под вакуумом и высушивали с получением продукта в виде коричневого масла (0,25 г, выход 75%) (3). 1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 4,99 (s, 2Н), 2,59 (s, 3Н), 2,30 (s, 3Н).
Синтез 2-бром-1-(3-этилбензо[b]тиофен-2-ил)пропан-1-она (промежуточное соединение для соединения 49)
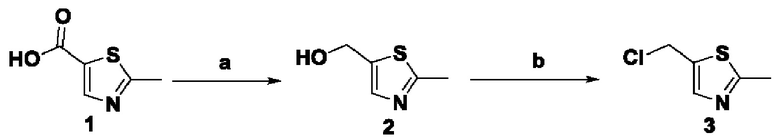
Стадия 1. (2-Метилтиазол-5-ил)метанол
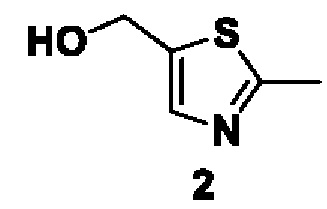
К перемешиваемому раствору 2-метилтиазол-5-карбоновой кислоты (1, 1,0 г, 6,99 ммоль) в THF (10 мл) при -10°C добавляли триэтиламин (1,02 мл, 7,34 ммоль) с последующим добавлением этилхлорформиата (0,66 мл, 6,99 ммоль) в THF (2 мл) по каплям при -10°C и перемешивали при такой же температуре в течение 1 ч. Реакционную смесь фильтровали через целит и фильтрат охлаждали до -10°C. К фильтрату добавляли суспензию NaBH4 (0,68 г, 17,4 ммоль) в воде (2 мл) и обеспечивали достижение к.т. и перемешивали в течение 2 ч. Реакционную смесь разбавляли с помощью 2 н. раствора NaOH (5 мл) и экстрагировали с помощью EtOAc (2 X 25 мл). Органический слой промывали солевым раствором (5 мл), высушивали над безводным Na2SO4 и выпаривали. Неочищенный остаток очищали посредством градиентной колоночной хроматографии с применением 40-60% EtOAc в гексане с получением продукта в виде желтого масла (2) (0,2 г, выход 25%). MS (ESI): масса, рассч. для C5H7NOS, 129,02; найденное значение масса/заряд 130,1 (М+Н)+.
Стадия 2. 5-(Хлорметил)-2-метилтиазол
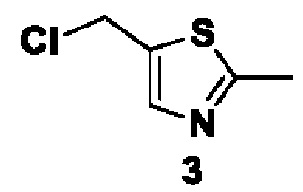
К перемешиваемому раствору (2-метилтиазол-5-ил)метанола (2, 0,2 г, 1,55 ммоль) в DCM (5 мл) добавляли SOCl2 (0,23 мл, 3,10 ммоль) по каплям при 0°C и реакционную смесь перемешивали при к.т. в течение 1 ч. Реакционную смесь нейтрализовали с применением холодного раствора NaHCO3 (5 мл) и экстрагировали с помощью DCM (2 X 25 мл). Органический слой промывали солевым раствором (5 мл), высушивали над безводным Na2SO4 и выпаривали с получением продукта в виде желтого масла. (0,2 г, выход 90%). MS (ESI): масса, рассч. для C5H6ClNS, 146,99; найденное значение масса/заряд 148,1 (М+Н)+.
Синтез этил-2-амино-6-метилизоникотината (промежуточное соединение для соединений 25, 26 и 27)
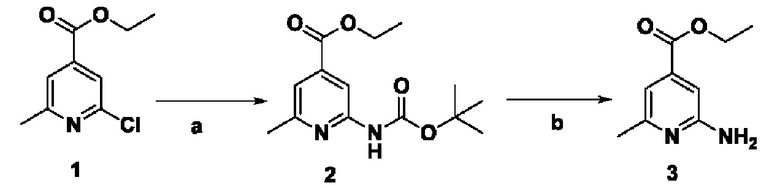
Стадия 1. Получение этил-2-((трет-бутоксикарбонил)амино)-6-метилизоникотината (2)
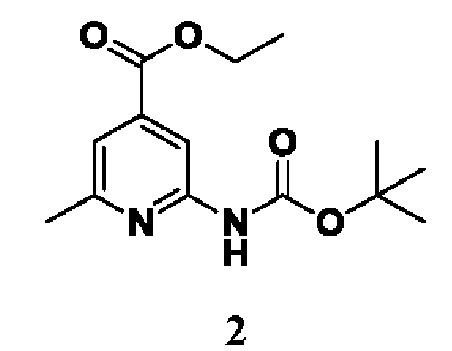
К перемешиваемому раствору этил-2-хлор-6-метилизоникотината (1, 5,2 г, 26,1 ммоль) в 1,4-диоксане (50 мл) добавляли трет-бутилкарбамат (4,6 г, 39,1 ммоль), Cs2CO3 (21,3 г, 65,3 ммоль), XPhos (1,24 г, 2,61 ммоль) с последующим добавлением бис(дибензилиденацетон)палладия(0) (0,75 г, 1,31 ммоль) и перемешивали при 85°C в течение 16 ч (условие реакции а). Реакционную смесь охлаждали до к.т., фильтровали через целит. К полученному добавляли воду (100 мл) и соединение экстрагировали с помощью EtOAc (200 мл). Органический слой высушивали над безводным Na2SO4 и выпаривали под вакуумом. Неочищенное вещество очищали посредством колоночной хроматографии с применением 15-20% EtOAc в гексане с получением продукта в виде коричневого смолистого твердого вещества (2) (3,5 г, выход 58%). MS (ESI): масса, рассч. для C14H20N2O4, 280,14; найденное значение масса/заряд 281,2 (М+Н)+.
Стадия 2. Получение этил-2-амино-6-метилизоникотината (3)
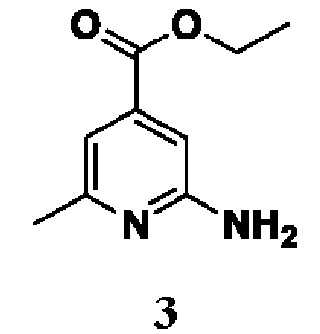
К перемешиваемому раствору этил-2-((трет-бутоксикарбонил)амино)-6-метилизоникотината (2, 3,5 г, 12,5 ммоль) в DCM (30 мл) добавляли TFA (10 мл) и перемешивали при к.т. в течение 16 ч (условие реакции b). Реакционную смесь выпаривали, добавляли воду (20 мл) и повышали ее основность с применением насыщенного раствора Na2CO3. Образованный осадок собирали путем фильтрации и высушивали с получением продукта (3) в виде грязно-белого твердого вещества. (1,6 г, выход 72%). MS (ESI): масса, рассч. для C9H12N2O2, 180,09; найденное значение масса/заряд 181,1 (М+Н)+.
Синтез 1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3) (промежуточное соединение для соединений 50, 57, 58, 59, 60, 61, 62, 63, 78, 79, 81 и 85)

Стадия а. Синтез 1-(фенилсульфонил)-1Н-индола (2)
К перемешиваемому раствору 1H-индола (1, 10,0 г, 85,36 ммоль) в N,N-диметилформамиде (100 мл) добавляли гидрид натрия (4,08 г, 170,94 ммоль) медленно при 0°C, реакционную смесь перемешивали при 0°C в течение 40 мин. Добавляли бензолсульфонилхлорид (22,6 г, 128,20 ммоль) по каплям, затем реакционную смесь перемешивали при к.т. в течение 1 ч. После завершения реакции реакционную смесь гасили льдом, полученное твердое вещество фильтровали и высушивали. Неочищенное вещество очищали посредством колоночной хроматографии (100-200 силикагель) с применением 20% этилацетата в гексане в качестве элюента. Необходимые фракции концентрировали при пониженном давлении с получением 1-(фенилсульфонил)-1Н-индола (2) в виде белого твердого вещества. Выход: 16,2 г (76%). MS (ESI): 257,12; найденное значение масса/заряд, 258,23 [М+Н]+.
Стадия b. Синтез 1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3)
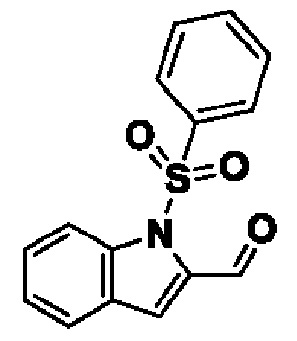
К перемешиваемому раствору 1-(фенилсульфонил)-1H-индола (2, 16,2 г, 62,97 ммоль) в тетрагидрофуране (150 мл) добавляли 2,5 М н-бутиллитий в гексане (35,5 мл, 89,07 ммоль) по каплям при -78°C. Реакционную смесь перемешивали при -78° в течение 1 ч. N,N-диметилформамид (6,57 мл, 83,50 ммоль) добавляли при -78°C и реакционную смесь дополнительно перемешивали при -78°C в течение 1 ч. После завершения реакции реакционную смесь гасили хлоридом аммония, экстрагировали с помощью этилацетата (100 мл × 2). Органический слой промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 40,0 г и 20% этилацетата в гексане в качестве элюента. Необходимые фракции концентрировали при пониженном давлении с получением 1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3) в виде желтого твердого вещества. Выход: 12,6 г (73%). MS (ESI): 285,11; найденное значение масса/заряд, 256,39 [М+Н]+.
Синтез 6-метокси-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3) (промежуточное соединение для соединений 51, 67, 80, 82 и 83)
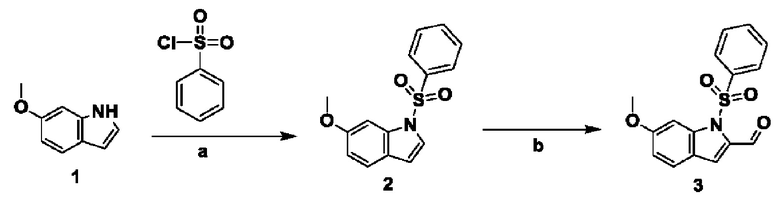
Стадия а. Синтез 6-метокси-1-(фенилсульфонил)-1Н-индола (2)
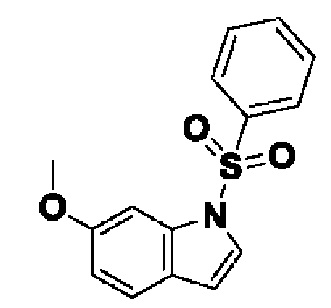
К перемешиваемому раствору 6-метокси-1Н-индола (1, 10,0 г, 68,02 ммоль) в N,N-диметилформамиде (100 мл) добавляли гидрид натрия (5,44 г, 136,05 ммоль) медленно при 0°C, реакционную смесь перемешивали при к.т. при 0°C в течение 40 мин. Добавляли бензолсульфонилхлорид (17,8 г, 102,03 ммоль) по каплям, затем реакционную смесь перемешивали при к.т. в течение 1 ч. После завершения реакции реакционную смесь гасили льдом, полученное твердое вещество фильтровали и высушивали. Неочищенное вещество очищали посредством колоночной хроматографии (100-200 силикагель) с применением 20% этилацетата в гексане в качестве элюента. Необходимые фракции концентрировали при пониженном давлении с получением 6-метокси-1-(фенилсульфонил)-1Н-индола (2) в виде белого твердого вещества. Выход: 16,5 г (84%). MS (ESI): 286,11; масса/заряд найденное значение, 287,52 [М+Н]+.
Стадия b. 6-Метокси-1-(фенилсульфонил)-1Н-индол-2-карбальдегид (3)
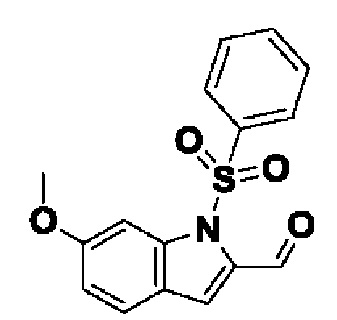
К перемешиваемому раствору 6-метокси-1-(фенилсульфонил)-1Н-индола (2, 6,0 г, 20,9 ммоль) в тетрагидрофуране (60 мл) добавляли 2,5 М н-бутиллитий в гексане (13,37 мл, 33,44 ммоль) по каплям при -78°C и реакционную смесь перемешивали при -78°C в течение 1 ч. N,N-диметилформамид (2,3 мл, 31,3 ммоль) добавляли при -78°C и реакционную смесь перемешивали при -78° в течение 1 ч. Реакционную смесь гасили насыщенным раствором хлорида аммония, экстрагировали с помощью этилацетата (50 мл × 2). Органический слой промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 40,0 г и 20% этилацетата в гексане в качестве элюента. Необходимые фракции концентрировали при пониженном давлении с получением 6-метокси-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3) в виде желтого твердого вещества. Выход: 5,1 г (78%). MS (ESI): 314,21; найденное значение масса/заряд, 315,22 [М+Н]+.
Синтез 5,6-дифтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (промежуточное соединение для соединения 55)
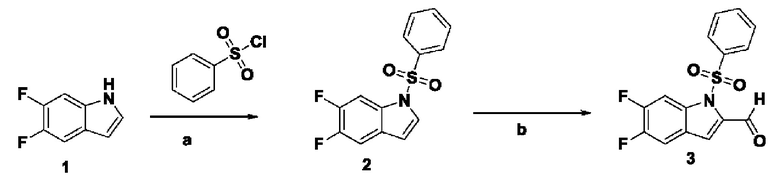
Стадия 1. Синтез 5,6-дифтор-1-(фенилсульфонил)-1Н-индола (2)
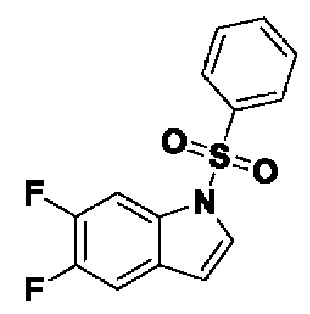
К раствору 5,6-дифтор-1H-индола (1, 5,0 г, 32,67 ммоль) в N,N-диметилформамиде (50 мл) частями добавляли гидрид натрия (60%, 3,1 г, 81,61 ммоль) в течение 15 мин при 0°C. Через 15 мин добавляли бензолсульфонилхлорид (6,4 мл, 49,0 ммоль) при 0°C и перемешивали в течение 2 ч при к.т. в атмосфере N2. После завершения реакции к реакционной смеси добавляли ледяную воду (150 мл). Осадок в виде твердого вещества отфильтровывали и промывали ледяной водой. Неочищенное вещество очищали посредством CombiFlash с применением RediSep 40 г и 20% этилацетата в гексане в качестве элюента с получением 5,6-дифтор-1-(фенилсульфонил)-1H-индола (2) в виде грязно-белого твердого вещества. Выход: 8,8 г (92,63%). MS (ESI): 293; найденное значение масса/заряд, 294,01 [М+Н]+1.
Стадия 2. Синтез 5,6-дифтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3)
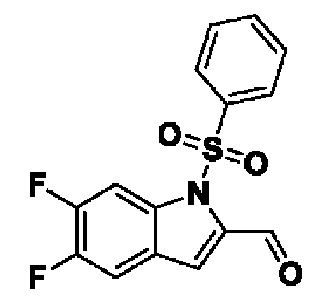
К раствору 5,6-дифтор-1-(фенилсульфонил)-1Н-индола (2, 8,8 г, 30,12 ммоль) в сухом тетрагидрофуране (80 мл) добавляли 2,5 М раствор н-бутиллития в гексане (20,0 мл, 45,37 ммоль) при -78°C и перемешивали в течение 45 мин с последующим добавлением безводного N,N-диметилформамида (2,5 мл, 45,37 ммоль) при -78°C. Реакционную массу перемешивали в течение 30 мин при -78°C в атмосфере N2. После завершения реакции реакционную смесь гасили водным раствором хлорида аммония (30 мл) и экстрагировали с помощью этилацетата (100 мл × 2). Органический слой промывали насыщенным раствором хлорида аммония и солевым раствором (100 мл), высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали посредством CombiFlash с применением RediSep 40 г и 30% этилацетата в гексане в качестве элюента с получением 5,6-дифтор-1-(фенилсульфонил)-1Н-индол-2-карбальдегида (3) в виде желтой жидкости. Выход: 7,0 г, (72,9%). MS (ESI): 321,30; найденное значение масса/заряд, 322,1 [М+Н]+1.
Синтез (1-(трет-бутоксикарбонил)-6-метокси-1Н-индол-2-ил)бороновой кислоты (промежуточное соединение для соединения 86)
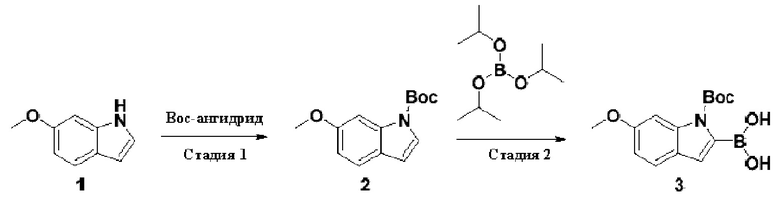
Стадия 1. Синтез трет-бутил-6-метокси-1Н-индол-1-карбоксилата (2)
К перемешиваемому раствору 6-метокси-1Н-индола (1, 2,0 г, 13,64 ммоль) в дихлорметане (20 мл) добавляли триэтиламин (5,60 мл, 40,8 ммоль), N,N-диметиламинопиридин (0,08 г, 0,68 ммоль) и boc-ангидрид (3,9 мл, 16,3 ммоль) при 0°C и затем реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После завершения реакции реакционную смесь разбавляли дихлорметаном (100 мл × 3). Органическую фазу промывали водой, солевым раствором, высушивали над безводным сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного соединения. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 40,0 г и 1-5% этилацетата в гексане в качестве элюента с получением трет-бутил-6-метокси-1Н-индол-1-карбоксилата (2) в виде маслянистой жидкости. Выход: 3,0 г (89%). MS (ESI): 247,12; найденное значение масса/заряд, 246,01 [М-Н]-1.
Стадия 2. Синтез (1-(трет-бутоксикарбонил)-6-метокси-1Н-индол-2-ил)бороновой кислоты (3)
К перемешиваемому раствору трет-бутил-6-метокси-1Н-индол-1-карбоксилата (2, 2,5 г, 10,12 ммоль), триизопропилбората (2, 2,7 мл, 20,24 ммоль) в тетрагидрофуране (25 мл) добавляли 1 М диизопропиламид лития в тетрагидрофуране (10 мл, 20,24 ммоль) по каплям при 0°C и реакционную смесь перемешивали при 0°C в течение 3 ч. После завершения реакции реакционную смесь гасили насыщенным раствором хлорида аммония, экстрагировали с помощью этилацетата (50 мл × 2). Органический слой промывали солевым раствором, высушивали над безводным сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта. Неочищенное вещество очищали посредством CombiFlash с применением колонки RediSep 40,0 г и 10-20% этилацетата в гексане в качестве элюента. Необходимые фракции концентрировали при пониженном давлении с получением (1-(трет-бутоксикарбонил)-6-метокси-1Н-индол-2-ил)бороновой кислоты (3) в виде грязно-белого твердого вещества. Выход: 1,3 г (44%).
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 8,11 (s, 2Н), 7,65 (s, 1H), 7,43 (d, J=8,56 Гц, 1H), 6,82 (d, J=8,56 Гц, 1H), 6,55 (s, 1H), 3,79 (s, 3H), 1,59 (s, 9H). MS (ESI): масса, рассчитанная для C14H18BNO5, 291,13; найденное значение масса/заряд 191,01 [М+Н-100]+1.
Пример 2
Общая процедура для биологической оценки
Анализ на связывание с определением поляризации флуоресценции
Связывание соединений с PAD4 определяли с помощью анализа поляризации флуоресценции (FP). PAD4 разбавляли до 1 мкМ в аналитическом буфере (100 мМ HEPES, 50 мМ NaCl, 1 мМ DTT, 5% глицерин и 1 мМ CHAPS) и добавляли в лунки, содержащие соединения в различных концентрациях или среду-носитель DMSO (1%), в 384-луночном черном планшете. В планшет добавляли 10 нМ меченного флуоресцеином зонда (JPAD-00085). Аналитический планшет инкубировали в течение 60 минут при к.т. перед измерением значения FP посредством считывания в модуле FP (λex 485/λem 535 нм) на приборе Pherastar. IC50 рассчитывали с применением программного обеспечения XL-fit, модель 205 (Lewis et. al, Nat Chem Biol. 2015, 11(3), 189-91).
Биохимический анализ с определением выделения аммиака
Анализ на цитруллинирование проводили посредством определения выделения аммиака. PAD4 разбавляли до 120 нМ в аналитическом буфере (100 мМ HEPES, 50 мМ NaCl, 2 мМ DDT, 0,6 мг/мл BSA, рН 7,4), добавляли в лунки, содержащие соединение в различных концентрациях или среду-носитель DMSO (конечное значение 1%), в черном 384-луночном планшете. После предварительной инкубации длительностью 60 мин при к.т. инициировали прохождение реакции посредством добавления субстрата (1,5 мМ ВАЕЕ в 200 мМ HEPES, 50 мМ NaCl, 350 мкМ CaCl2, 2 мМ, рН 7,4). Реакцию останавливали через 60 мин посредством добавления останавливающего буфера/буфера для обнаружения, содержащего 50 мМ EDTA, 2,6 мМ о-фталевого альдегида и 2,6 мМ DTT. Аналитический планшет инкубировали при к.т. в течение 90 мин перед измерением значений флуоресценции (λex 405/λem 460 нм) на ридере Тесал. IC50 рассчитывали с применением программного обеспечения XL-fit, модель 205 (Lewis et. al Nat Chem Biol. 2015, 11(3), 189-91).
Активность в отношении PAD4
В таблице 1 ниже представлена активность выбранных соединений по настоящему изобретению в анализах с PAD4, описанных выше. Соединения с активностью, обозначенной как "А", характеризовались IC50≤1 мкМ; соединения с активностью, обозначенной как "В", характеризовались IC50 1-10 мкМ; и соединения с активностью, обозначенной как "С", характеризовались IC50≥10 мкМ.
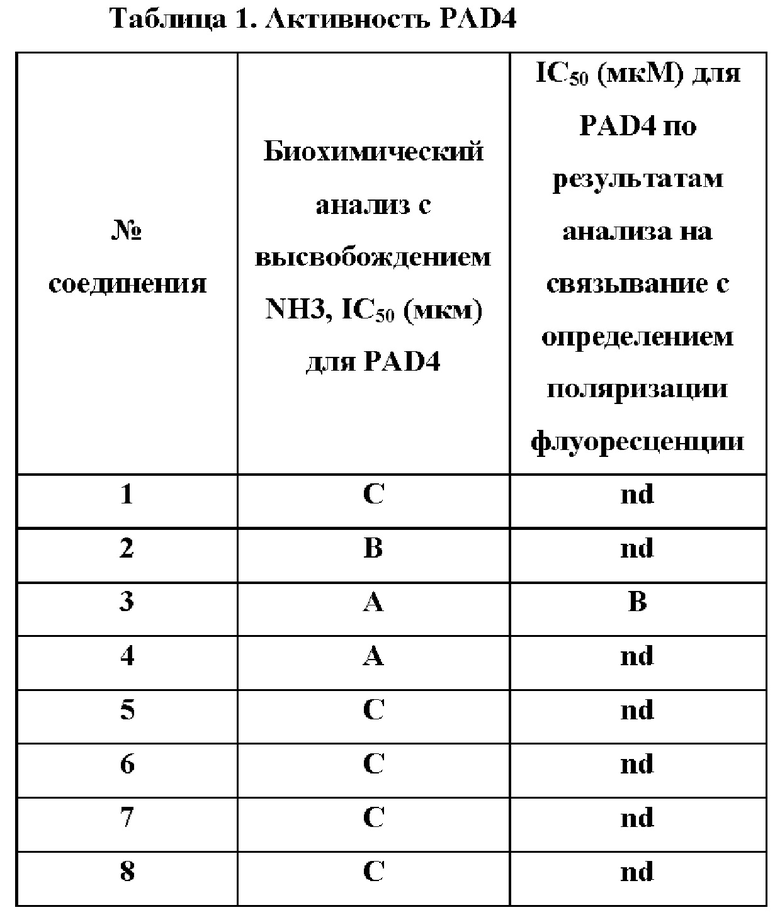
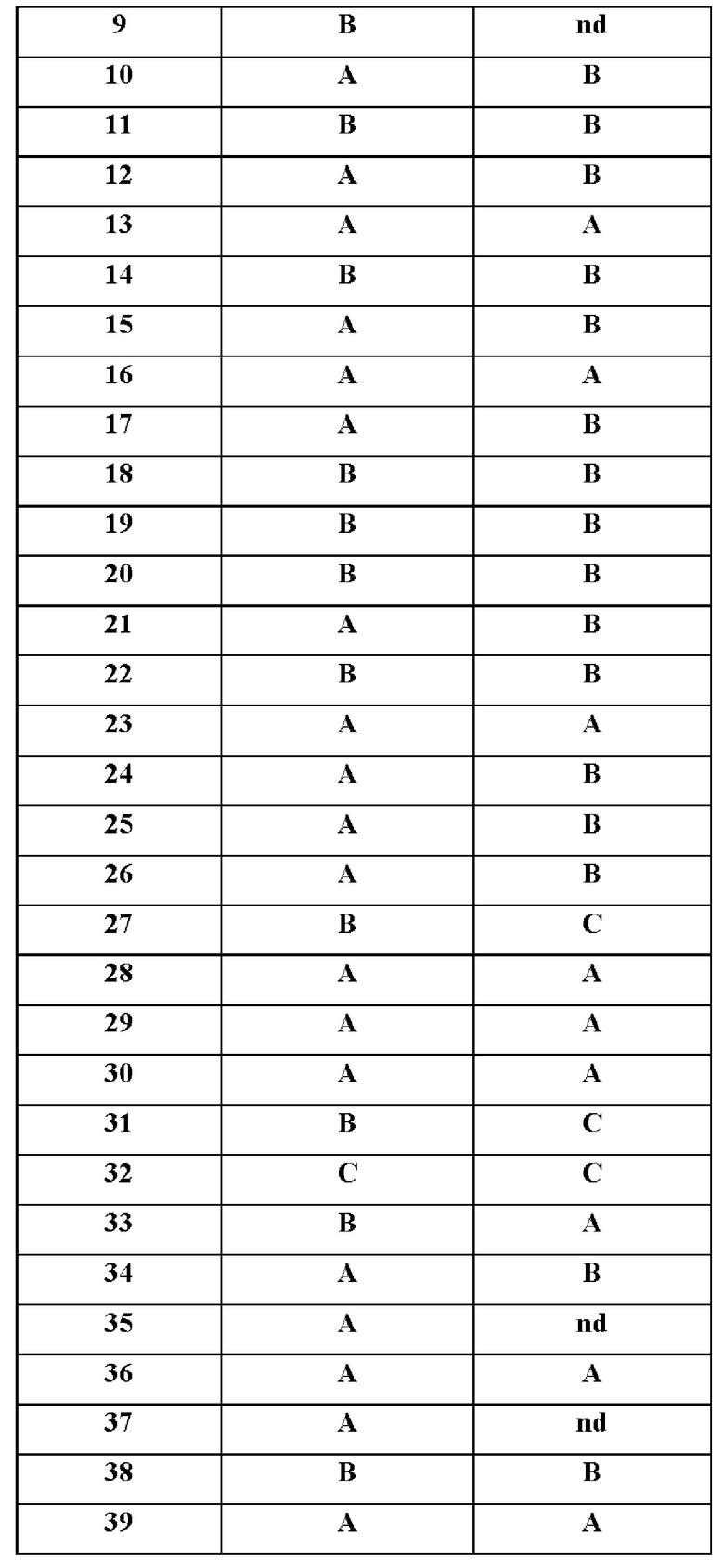
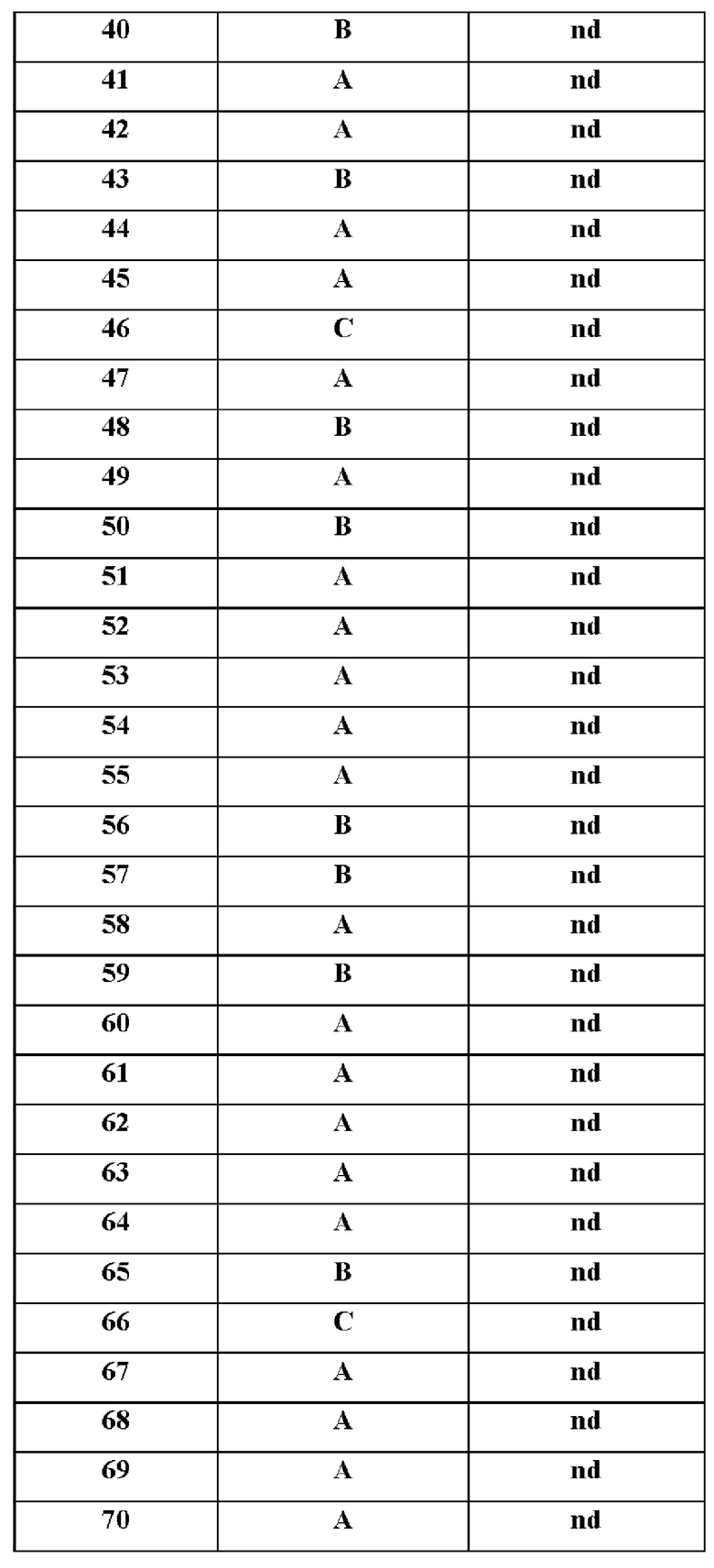
В таблице 1 показано, что большинство тестируемых соединений оказались активными в отношении фермента PAD4 при оценке посредством биохимического анализа с определением выделения аммиака и анализа на связывание с определением поляризации флуоресценции. Значения IC50 отображают эффективность соединений в ингибировании ферментативной активности PAD4. Значение IC50 указывает на то, сколько потребуется конкретного лекарственного средства или соединения для ингибирования данного биологического процесса или компонента процесса, такого как фермент. Низкое значение IC50 обозначает высокую эффективность ингибирования тестируемого соединения (соединения 1-48, описанные в данном документе). Однако в приведенной выше таблице 1 высокая эффективность обозначается как "А", "В" и "С", где "А" отвечает наименьшему значению IC50 и, следовательно, наибольшей эффективности.
Биохимический анализ с определением выделения аммиака показал, что 55 соединений из 86 характеризуются значением IC50, составляющим ≤1 мкМ, обозначенным как "А". Данные 55 соединений представляли собой соединения 3, 4, 10, 12, 13, 15-17, 21, 23-26, 28-30, 34-37, 39, 41, 42, 44, 45, 47, 49, 51-55, 58, 60-64, 67-80, 82, 83 & 85.
С другой стороны, анализ на связывание с определением поляризации флуоресценции показал, что 9 соединений активно ингибируют ферментативную активность PAD4. Отдельные соединения представляют собой соединения 13, 16, 23, 28-30, 33, 36, и 39 соответственно.
Следовательно, может быть предположено, что соединения-3, 4, 10, 12, 13, 15-17, 21, 23-26, 28-30, 34-37, 39, 41, 42, 44, 45, 47, 49, 51-55, 58, 60-64, 67-80, 82, 83 & 85 могут способствовать в лечении РАВ4-опосредованных нарушений.
| название | год | авторы | номер документа |
|---|---|---|---|
| Гетероциклические соединения в качестве ингибиторов PAD | 2018 |
|
RU2764243C2 |
| Соединение-ингибитор мультикиназ и его кристаллическая форма и применение | 2017 |
|
RU2723985C1 |
| СОЕДИНЕНИЯ ТИЕНОПИРИДИНОНА | 2019 |
|
RU2827549C2 |
| Гетероароматические соединения и их применение в качестве допаминовых D1 лигандов | 2013 |
|
RU2617842C2 |
| НОВЫЕ ХИНОЛИНОВЫЕ СОЕДИНЕНИЯ | 2018 |
|
RU2810113C2 |
| Новый ингибитор на основе производного хинолина | 2019 |
|
RU2802283C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2654857C2 |
| ПРОТИВОРАКОВЫЕ БЕНЗОПИРАЗИНЫ, ДЕЙСТВУЮЩИЕ ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ FGFR-КИНАЗ | 2012 |
|
RU2639863C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806625C2 |
| Новое соединение в качестве ингибитора протеинкиназы и содержащая его фармацевтическая композиция | 2019 |
|
RU2785734C1 |
Группа изобретений относится к области органической химии и фармакологии и направлена на лечение нарушений, опосредованных PAD4. Раскрыты гетероциклические соединения формулы (I), где X выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2, R3 и R4 независимо выбраны из водорода, C1-6алкила, С3-6циклоалкила или С6арила, где С1-6алкил необязательно замещен С1-6алкокси; R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(СО)СН=СН-СН2-N(СН3)2; и R13 выбран из 6-членного моноциклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-3 гетероатомами, выбранными из N, S или О, где 6-членный моноциклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-6алкила, С1-6алкокси или С6арила, где С1-6алкил и С6арил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, C1-6галогеналкила, C1-6алкокси, С3-6циклоалкила, С6арила, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, оксо, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, C1-6алкокси, оксо, галогена, -CH2OH и циано. Кроме того, раскрыты гетероциклические соединения формул (II) и (III), способы получения гетероциклических соединений формул (I), (II) и (III), фармацевтическая композиция, обладающая активностью ингибиторов PAD4 на основе указанных выше соединений, способ ингибирования PAD4 в клетке, а также способы лечения состояний, опосредованных PAD4, и применение соединений формул (I), (II) и (III) для лечения состояний, опосредованных PAD4. Группа изобретений обеспечивает эффективное ингибирование PAD4, что может быть пригодными для лечения различных нарушений, в том числе ревматоидного артрита, васкулита, системной красной волчанки, кожной красной волчанки, язвенного колита, рака, кистозного фиброза, астмы, рассеянного склероза и псориаза. 15 н. и 10 з.п. ф-лы, 1 табл., 2 пр.
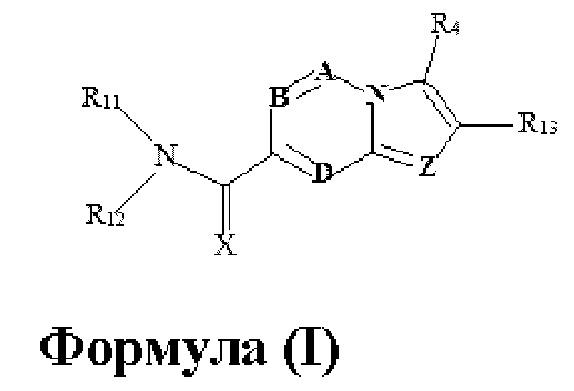
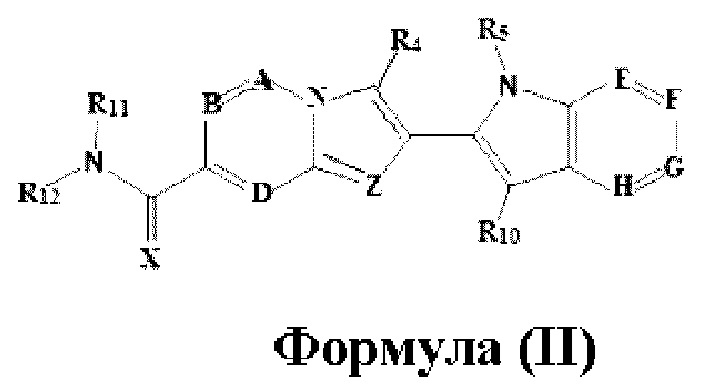
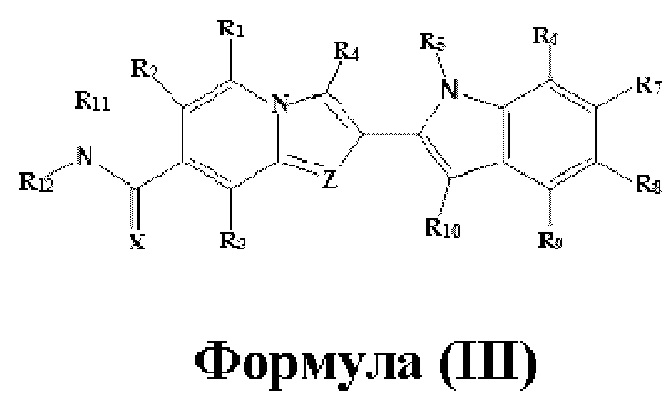
1. Соединение формулы (I)
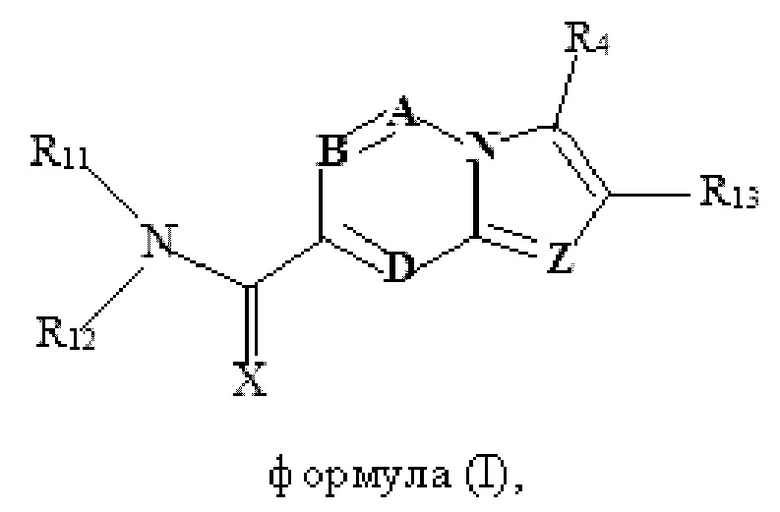
его стереоизомеры и его фармацевтически приемлемые соли,
где
X выбран из О или S;
Z представляет собой N;
А представляет собой CR1;
В представляет собой CR2;
D представляет собой CR3;
R1, R2, R3 и R4 независимо выбраны из водорода, C1-6алкила, С3-6циклоалкила или С6арила, где
С1-6алкил необязательно замещен С1-6алкокси;
R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(СО)СН=СН-СН2-N(СН3)2; и
R13 выбран из 6-членного моноциклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-3 гетероатомами, выбранными из N, S или О, где
6-членный моноциклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-6алкила, С1-6алкокси или С6арила, где С1-6алкил и С6арил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, C1-6галогеналкила, C1-6алкокси, С3-6циклоалкила, С6арила, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, оксо, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, C1-6алкокси, оксо, галогена, -CH2OH и циано.
2. Соединение формулы (I) по п. 1, его стереоизомеры и его фармацевтически приемлемые соли, где
X выбран из О или S;
Z представляет собой N;
А представляет собой CR1;
В представляет собой CR2;
D представляет собой CR3;
R1, R2 и R3 независимо выбраны из водорода или С1-4алкила;
R4 выбран из С1-4алкила, С3-5циклоалкила или С6арила, где
С1-4алкил необязательно замещен С1-4алкокси;
R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2; и
R13 выбран из 6-членного моноциклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-3 гетероатомами, выбранными из N, S или О, где
6-членный моноциклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, C1-6алкила, С1-6алкокси или С6арила, где C1-6алкил и С6арил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, C1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С6арила, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, оксо, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, С1-6алкокси, оксо, галогена, -CH2OH и циано.
3. Соединение формулы (I) по п. 1, его стереоизомеры и его фармацевтически приемлемые соли, где
X выбран из О или S;
Z представляет собой N;
А представляет собой CR1;
В представляет собой CR2;
D представляет собой CR3;
R1, R2 и R3 независимо выбраны из водорода или С1-4алкила;
R4 выбран из C1-4алкила, С3-5циклоалкила или С6арила, где С1-4алкил необязательно замещен С1-4алкокси;
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2;
R13 выбран из 6-членного моноциклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-3 гетероатомами, выбранными из N, S или О, где
6-членный моноциклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-4алкила, С1-4алкокси или С6арила, где С1-4алкил и С6арил необязательно замещены одной или несколькими группами, выбранными из С1-4алкила, С1-4галогеналкила, С1-4алкокси, С3-6циклоалкила, С6арила, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, оксо, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано.
4. Соединение формулы (I) по п. 1, его стереоизомеры и его фармацевтически приемлемые соли, где
X выбран из О или S;
Z представляет собой N;
А представляет собой CR1;
В представляет собой CR2;
D представляет собой CR3;
R1, R2 и R3 независимо выбраны из водорода или С1-2алкила;
R4 выбран из водорода, С1-4алкила, С3-5циклоалкила или С6арила, где
С1-4алкил необязательно замещен С1-4алкокси;
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2; и
R13 выбран из 6-членного моноциклического арила и 5-9-членного моноциклического или бициклического гетероарила с 1-3 гетероатомами, выбранными из N, S или О, где
6-членный моноциклический арил и 5-9-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из фтора, брома, хлора, С1-4алкила, С1-4алкокси или С6арила, где С1-4алкил и С6арил необязательно замещены одной или несколькими группами, выбранными из гидроксила, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-5циклоалкила, С6арила, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, оксо и галогена, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, C1-6алкокси, оксо, галогена, -СН2ОН и циано.
5. Соединение формулы (II)
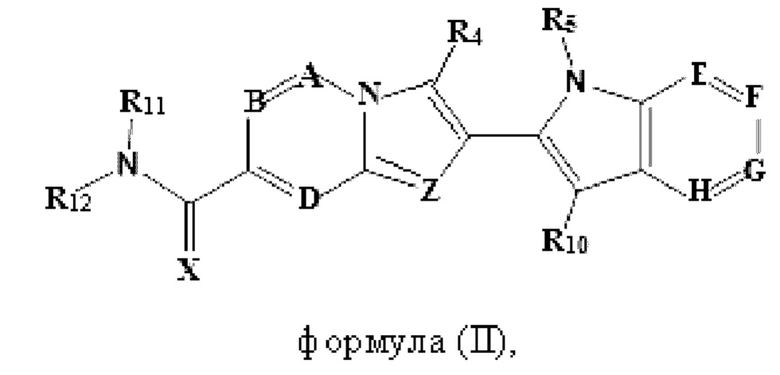
его стереоизомеры и его фармацевтически приемлемые соли,
где
X выбран из О или S;
Z представляет собой N;
А представляет собой CR1;
B представляет собой CR2;
D представляет собой CR3;
Е выбран из N или CR6;
F представляет собой CR7;
G представляет собой CR8;
Н представляет собой CR9;
R1, R2, R3 и R4 независимо выбраны из водорода, С1-6алкила, С3-6циклоалкила или С6арила, где
С1-6алкил необязательно замещен С1-6алкокси;
R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-6алкила, С1-6алкокси или С6арила, где
С1-6алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, гидроксила, -СН2ОН и циано; и
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2.
6. Соединение формулы (II) по п. 5, его стереоизомеры и его фармацевтически приемлемые соли, где
X выбран из О или S;
Z представляет собой N;
А представляет собой CR1;
В представляет собой CR2;
D представляет собой CR3;
Е выбран из N или CR6;
F представляет собой CR7;
G представляет собой CR8;
Н представляет собой CR9;
R1, R2 и R3 независимо выбраны из водорода или С1-4алкила;
R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-4алкила, C1-4алкокси или С6арила;
R4 выбран из водорода, С1-4алкила, С3-6циклоалкила или С6арила, где С1-4алкил необязательно замещен С1-4алкокси;
R5 выбран из С1-4алкила, С1-4алкокси или С6арила, где
С1-4алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано; и
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2.
7. Соединение формулы (II) по п. 5, его стереоизомеры и его фармацевтически приемлемые соли, где
X выбран из О или S;
Z представляет собой N;
А представляет собой CR1;
В представляет собой CR2;
D представляет собой CR3;
Е выбран из N или CR6;
F представляет собой CR7;
G представляет собой CR8;
Н представляет собой CR9;
R1, R2 и R3 независимо выбраны из водорода или C1-2алкила;
R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-2алкила, С1-2алкокси или С6арила;
R4 выбран из водорода, С1-4алкила, С3-6циклоалкила или С6арила, где
С1-4алкил необязательно замещен С1-4алкокси;
R5 выбран из С1-4алкила, С1-4алкокси или С6арила, где
С1-4алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -CH2OH и циано; и
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2.
8. Соединение формулы (III)
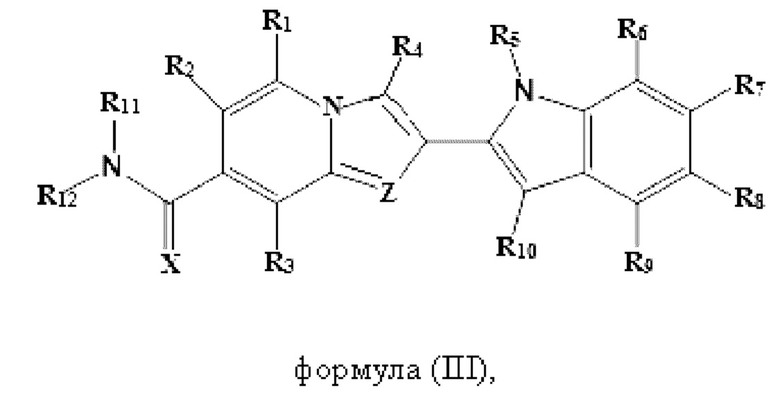
его стереоизомеры и его фармацевтически приемлемые соли,
где
X выбран из О или S;
Z представляет собой N;
R1, R2, R3 и R4 независимо выбраны из водорода, С1-6алкила, С3-6циклоалкила или С6арила, где С1-6алкил необязательно замещен С1-6алкокси;
R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-6алкила, С1-6алкокси или С6арила, где
С1-6алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано; и
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2.
9. Соединение формулы (III) по п. 8, его стереоизомеры и его фармацевтически приемлемые соли, где
X выбран из О или S;
Z представляет собой N;
R1, R2 и R3 независимо выбраны из водорода или С1-4алкила;
R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-4алкила, С1-4алкокси или С6арила;
R4 выбран из водорода, С4алкила, С3-6циклоалкила или С6арила, где
С1-4алкил необязательно замещен С1-4алкокси;
R5 выбран из С1-4алкила, С1-4алкокси или С6арила, где
С1-4алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-4алкила, С1-4алкокси, С1-4 галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из C1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано; и
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2.
10. Соединение формулы (III) по п. 8, его стереоизомеры и его фармацевтически приемлемые соли, где
X выбран из О или S;
Z представляет собой N;
R1, R2 и R3 независимо выбраны из водорода или С1-4алкила;
R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-4алкила, C1-4алкокси или С6арила;
R4 выбран из водорода, C1-4алкила, С3-6циклоалкила или С6арила, где
С1-4алкил необязательно замещен С1-4алкокси;
R5 выбран из С4алкила, С1-4алкокси или С6арила, где
С1-4алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-4алкила, С1-4алкокси, С1-4галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -CH2OH и циано; и
R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где
5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2.
11. Соединение или его стереоизомеры и его фармацевтически приемлемые соли, выбранное из группы, состоящей из:
(R)-(3-аминопиперидин-1-ил)(2-(3-бром-1-(циклопропилметил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (1),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (2),
(R)-(3-аминопиперидин-1-ил)(2-(1-бензил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (3),
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (4),
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-3-фенил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (5),
(R)-(3-аминопирролидин-1-ил)(2-(1-этил-3-фенил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (6),
(R)-(3-аминопирролидин-1-ил)(2-(1-этил-lH-индол-2-ил)-3-метилимидазо[l,2-а]пиридин-7-ил)метанона (7),
(R)-(3-аминопирролидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (8),
(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)(гексагидро-2Н-пиридо[4,3-b][1,4]оксазин-6(5Н)-ил)метанона (9),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-4-илметил)-1H-индол-2-ил)имидазо [1,2-а] пиридин-7-ил)метанона (10),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((тетрагидро-2Н-пиран-4-ил)метил)-1Н-индол-2-ил)имидазо [1,2-а]пиридин-7-ил)метанона (11),
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (12),
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (13),
(R)-4-((2-(7-(3-аминопиперидин-1-карбонил)-3-метилимидазо[1,2-а]пиридин-2-ил)-1H-индол-1-ил)метил)бензонитрила (14),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-3-илметил)-1Н-индол-2-ил)имидазо [1,2-а] пиридин-7-ил)метанона (15),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридин-2-илметил)-1Н-индол-2-ил)имидазо [1,2-а] пиридин-7-ил)метанона (16),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(2,2,2-трифторэтил)-1Н-индол-2-ил)имидазо [1,2-а] пиридин-7-ил)метанона (17),
(R)-4-((2-(7-(3-аминопиперидин-1-карбонил)-3-метилимидазо[1,2-а]пиридин-2-ил)-1H-индол-1-ил)метил)-1-метилпиридин-2(1Н)-она (18),
(R)-(3-аминопиперидин-1-ил)(2-(3-этилбензо[b]тиофен-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (19),
(R)-(3-аминопипер идин-1-ил)(2-(1-(4-хлорбензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (20),
(R)-(3-аминопиперидин-1-ил)(2-(1-(2-фторбензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (21),
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-5-фенил-1Н-пиррол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (22),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (23),
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-1Н-пирроло[2,3-b]пиридин-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (24),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3,5-диметилимидазо[1,2-а]пиридин-7-ил)метанона (25),
(R)-(3-аминопиперидин-1-ил)(2-(1-бензил-1Н-индол-2-ил)-3,5-диметилимидазо[1,2-а]пиридин-7-ил)метанона (26),
(R)-(3-аминопиперидин-1-ил)(3,5-диметил-2-(1-(пиридин-2-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона (27),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (28),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-5-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (29),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-7-метил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (30),
(R)-(3-аминопиперидин-1-ил)(2-(2-этилфенил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (31),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1H-индол-2-ил)-3-фенилимидазо[1,2-а]пиридин-7-ил)метанона (32),
(R)-(3-аминопиперидин-1-ил)(3-циклопропил-2-(1-(циклопропилметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона (33),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-1Н-индол-2-ил)-3-(метоксиметил)имидазо[1,2-а]пиридин-7-ил)метанона (34),
(R)-(3-аминопипер идин-1-ил)(2-(1-(3-фторбензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (35),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(тиофен-3-илметил)-1Н-индол-2-ил)имидазо[1,2-а] пиридин-7-ил)метанона (36),
(R)-(3-аминопиперидин-1-ил)(2-(1-(фуран-3-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (37),
(R)-3-аминопиперидин-1-ил)(2-(1-(1-(4-фторфенил)этил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (38),
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-5-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (39),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-4-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (40),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((4-метилтиазол-2-ил)метил)-1Н-индол-2-ил)имидазо [1,2-а]пиридин-7-ил)метанона (41),
(R)-(3-аминопиперидин-1-ил)(2-(1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (42),
(R)-(3-аминопиперидин-1-ил)(2-(5-бром-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (43),
(R)-(3-аминопиперидин-1-ил)(2-(7-хлор-1-(циклопропилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (44),
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метантиона (45),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-метил-1H-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона (46),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-7-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (47),
(R)-(3-аминопиперидин-1-ил)(2-(1-((2,4-диметилтиазол-5-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (48),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-((2-метилтиазол-5-ил)метил)-1Н-индол-2-ил)имидазо [1,2-а]пиридин-7-ил)метанона (49),
соли (R)-(3-аминопиперидин-1-ил)(2-(1-(3-метоксибензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты (50),
(R)-(3-аминопиперидин-1-ил)(2-(6-метокси-1-(пиридин-3-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (51),
соли (R)-(3-аминопиперидин-1-ил)(2-(1-(циклопропилметил)-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты (52),
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (53),
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (54),
(R)-(3-аминопиперидин-1-ил)(2-(5,6-дифтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (55),
(R,Е)-4-(диметиламино)-N-(1-(2-(1-(4-фторбензил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-карбонил)пиперидин-3-ил)бут-2-енамида (56),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиразин-2-илметил)-1Н-индол-2-ил)имидазо [1,2-а] пиридин-7-ил)метанона (57),
соли (R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиримидин-5-илметил)-1Н-индол-2-ил)имидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты (58),
(R)-(3-аминопиперидин-1-ил)(3-метил-2-(1-(пиридазин-3-илметил)-1Н-индол-2-ил)имидазо [1,2-а] пиридин-7-ил)метанона (59),
(R)-(3-аминопиперидин-1-ил)(2-(1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (60),
(R)-(3-аминопиперидин-1-ил)(2-(1-(циклобутилметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (61),
(R)-(3-аминопиперидин-1-ил)(2-(1-((3-фторпиридин-2-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (62),
(R)-(3-аминопиперидин-1-ил)(2-(1-((5-метоксипиридин-2-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (63),
(R)-(3-аминопиперидин-1-ил)(2-(1-(2-метоксиэтил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (64),
(R)-(3-аминопиперидин-1-ил)(2-(1-(2-гидроксиэтил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (65),
(R)-(3-аминопиперидин-1-ил)(2-(6-метокси-1-(пиридин-4-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (66),
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (67),
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(пиридин-4-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (68),
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(пиридин-3-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (69),
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (70),
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (71),
(R)-(3-аминопиперидин-1-ил)(2-(1-этил-6-фтор-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (72),
(R)-(3-аминопиперидин-1-ил)(2-(6-фтор-1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (73),
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(пиридин-4-илметил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (74),
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(4-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (75),
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (76),
(R)-(3-аминопиперидин-1-ил)(2-(7-хлор-1-(4-фторбензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (77),
соли (R)-(3-аминопиперидин-1-ил)(2-(1-(2,2-дифторэтил)-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона и трифторуксусной кислоты (78),
(R)-(3-аминопиперидин-1-ил)(2-(1-((5-фторпиридин-2-ил)метил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (79),
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-фторбензил)-6-метокси-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (80),
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-(гидроксиметил)бензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (81),
(R)-(3-аминопиперидин-1-ил)(2-(1-изобутил-6-метокси-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (82),
(R)-(3-аминопиперидин-1-ил)(2-(1-(2,2-дифторэтил)-6-метокси-1H-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (83),
(R)-(3-аминопиперидин-1-ил)(2-(5-фтор-1-изобутил-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (84) и
(R)-(3-аминопиперидин-1-ил)(2-(1-(4-фтор-3-метоксибензил)-1Н-индол-2-ил)-3-метилимидазо[1,2-а]пиридин-7-ил)метанона (85).
12. Способ получения соединений формулы (I) по любому из пп. 1-4 или их стереоизомеров и их фармацевтически приемлемых солей, при этом способ включает осуществление реакции R13CH(O) и R4CH2NO2 с соединением, выбранным из формулы (IVA) или формулы (IV),
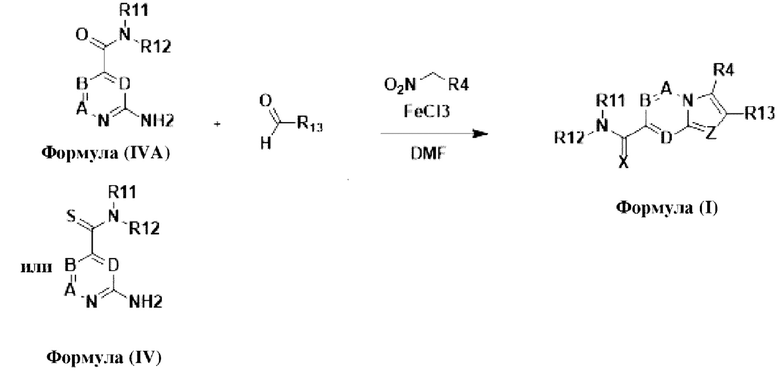
где R13 в R13CH(O) выбран из 6-членного моноциклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-3 гетероатомами, выбранными из N, S или О, где 6-членный моноциклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из группы, состоящей из галогена, С1-6алкила, С1-6алкокси или С6арила, где С1-6алкил и С6арил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С6арила, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, оксо, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -CH2OH и циано; А в формулах (IVA) и (IV) представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2; R4 в R4CH2NO2 выбран из водорода, С1-6алкила, С3-6циклоалкила или С6арила, где С1-6алкил необязательно замещен С1-6алкокси; X в формуле (I) выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R1, R2, R3 и R4 независимо выбраны из водорода, С1-6алкила, С3-6циклоалкила или С6арила, где С1-6алкил необязательно замещен С1-6алкокси; R11 и R12 могут быть взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца с 1-3 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2; и R13 выбран из 6-членного моноциклического арила и 5-10-членного моноциклического или бициклического гетероарила с 1-3 гетероатомами, выбранными из N, S или О, где 6-членный моноциклический арил и 5-10-членный моноциклический или бициклический гетероарил необязательно замещены 1-5 заместителями, выбранными из галогена, С1-6алкила, С1-6алкокси или С6арила, где C1-6алкил и С6арил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6галогеналкила, С1-6алкокси, С3-6циклоалкила, С6арила, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, оксо, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано.
13. Способ получения соединений формулы (II) по любому из пп. 5-7 или их стереоизомеров и их фармацевтически приемлемых солей, при этом способ включает осуществление реакции формулы (V) и R4CH2NO2 с соединением, выбранным из формулы (IVA) или формулы (IV),
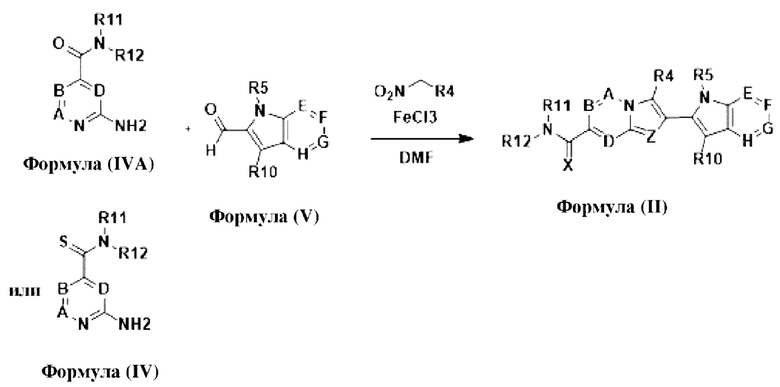
где А в формулах (IVA) и (IV) представляет собой CR1; В представляет собой CR2; D представляет собой CR3; R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2; R4 в R4CH2NO2 выбран из водорода, С1-6алкила, С3-6циклоалкила или С6арила, где С1-6алкил необязательно замещен С1-6алкокси; Е в формуле (V) выбран из N или CR6; F представляет собой CR7; G представляет собой CR8; Н представляет собой N и CR9; R1, R2 и R3 независимо выбраны из водорода или С1-6алкила; R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-6алкила, С1-6алкокси или С6арила, где С1-6алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С1-С3-6циклоалкила, С6арила, 5-6-членнного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные H3N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано; X в формуле (II) выбран из О или S; Z представляет собой N; А представляет собой CR1; В представляет собой CR2; D представляет собой CR3; Е выбран из N или CR6; F представляет собой CR7; G представляет собой CR8; Н представляет собой CR9; R1, R2, R3 и R4 независимо выбраны из водорода, С1-6алкила, С3-6циклоалкила или С6арила, где С1-6алкил необязательно замещен С1-6алкокси; R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-6алкила, С1-6алкокси или С6арила, где С1-6алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано; и R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2.
14. Способ получения соединений формулы (III) по любому из пп. 8-10 или их стереоизомеров и их фармацевтически приемлемых солей, при этом способ включает осуществление реакции формулы (VII), R4CH2NO2 с соединением, выбранным из формулы (VIA) или формулы (VI),
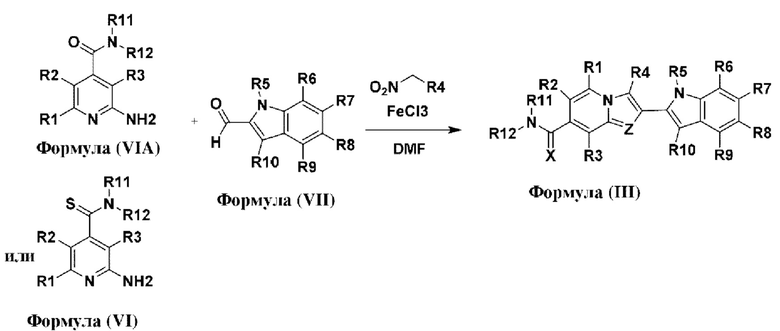
где R1, R2 и R3 в формуле (VIA) и формуле (VI) и R4 в R4CH2NO2 независимо выбраны из водорода, С1-6алкила, С3-6циклоалкила или С6арила, где С1-6алкил необязательно замещен С1-6алкокси; R5, R6, R7, R8, R9 и R10 в формуле (VII) независимо выбраны из водорода, галогена, С1-6алкила, С1-6алкокси или С6арила, где С1-6алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано; X в формуле (III) выбран из О или S; Z представляет собой N; R1, R2, R3 и R4 независимо выбраны из водорода, С1-6алкила, С3-6циклоалкила или С6арила, где С1-6алкил необязательно замещен С1-6алкокси; R5, R6, R7, R8, R9 и R10 независимо выбраны из водорода, галогена, С1-6алкила, С1-6алкокси или С6арила, где С1-6алкил необязательно замещен одной или несколькими группами, выбранными из оксо, С1-6алкила, С1-6алкокси, С1-6галогеналкила, С3-6циклоалкила, С6арила, 5-6-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранные из N, S и О, 5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из N, S и О, галогена и гидроксила, где С6арил, гетероарил и гетероциклил необязательно замещены одной или несколькими группами, выбранными из С1-6алкила, С1-6алкокси, оксо, галогена, -СН2ОН и циано; и R11 и R12 взяты вместе с образованием 5-10-членного моноциклического или бициклического насыщенного гетероциклического кольца, необязательно с 1-3 гетероатомами, выбранными из N, S или О, где 5-10-членное моноциклическое или бициклическое насыщенное гетероциклическое кольцо необязательно замещено заместителями, выбранными из амино или -NH(CO)CH=CH-CH2-N(CH3)2.
15. Фармацевтическая композиция, обладающая активностью ингибиторов PAD4, которая содержит эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп. 1-11 вместе с фармацевтически приемлемым носителем.
16. Фармацевтическая композиция по п. 15, где композиция находится в форме, выбранной из таблетки, капсулы, порошка, сиропа, раствора, аэрозоля и суспензии.
17. Соединения по любому из пп. 1-11 или их фармацевтически приемлемая соль для применения в изготовлении лекарственного препарата для ингибирования PAD4 в клетке.
18. Способ ингибирования PAD4 в клетке с помощью эффективного количества соединения по любому из пп. 1-11.
19. Способ лечения состояния, опосредованного PAD4, при этом способ включает введение субъекту, страдающему от состояния, опосредованного PAD4, терапевтически эффективного количества соединения по любому из пп. 1-11 или фармацевтической композиции по п. 15 или 16.
20. Соединение формулы (I), формулы (II) и формулы (III) по любому из пп. 1-11, применяемое для лечения состояния, опосредованного PAD4, выбранного из ревматоидного артрита, васкулита, системной красной волчанки, язвенного колита, рака, кистозного фиброза, астмы, кожной красной волчанки и псориаза.
21. Применение соединения по любому из пп. 1-11 или фармацевтической композиции по п. 15 или 16 для лечения состояния, опосредованного PAD4, выбранного из ревматоидного артрита, васкулита, системной красной волчанки, язвенного колита, рака, кистозного фиброза, астмы, кожной красной волчанки и псориаза.
22. Применение соединения по любому из пп. 1-11 или фармацевтической композиции по п. 15 или 16 для лечения состояния, опосредованного PAD4, выбранного из индуцированного кислотой повреждения легких, синдрома дыхательной недостаточности, индуцированной аллергеном астмы, аллергического бронхолегочного заболевания, хронического заболевания легких у недоношенных детей, хронического обструктивного заболевания легких, колита, кистозного фиброза, подагрического артрита, воспалительного заболевания кишечника, воспалительного заболевания легких, воспалительной боли, ювенильного ревматоидного артрита, заболевания почек, повреждения почек, вызванного паразитарными инфекциями, профилактики отторжения трансплантированной почки, повреждения легких, волчанки, волчаночного нефрита, рассеянного склероза, мышечной дистрофии, индуцированной не аллергеном астмы, остеоартрита, периодонтита, перитонеального эндометриоза, псориаза, легочного заболевания, легочного фиброза, пиогенного стерильного артрита, почечного заболевания, ревматического заболевания, ревматоидного артрита, сепсиса, острой боли и язвенного колита.
23. Способ лечения и/или предупреждения состояния, опосредованного нарушением функционирования PAD4, включающий введение субъекту, страдающему от состояния, опосредованного PAD4, терапевтически эффективного количества соединения по любому из пп. 1-11 или фармацевтической композиции по п. 15 или 16.
24. Способ лечения ревматоидного артрита, опосредованного PAD4, при этом указанный способ включает введение комбинации соединений по любому из пп. 1-11 или фармацевтической композиции по п. 15 или 16 субъекту, нуждающемуся в этом.
25. Способ лечения рака, опосредованного PAD4, при этом указанный способ включает введение комбинации соединений по любому из пп. 1-11 или фармацевтической композиции по п. 15 или 16 субъекту, нуждающемуся в этом.
| WO 2016185279 A1, 24.11.2016 | |||
| WO 2014015905 A1, 30.01.2014 | |||
| HUW D LEWIS et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| NATURE CHEMICAL BIOLOGY, vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 2017015971 A1, 20.04.2017 | |||
| RU 2011106786 A1, 27.08.2012. | |||
Авторы
Даты
2022-11-01—Публикация
2018-10-16—Подача