Область техники, к которой относится изобретение
Изобретение относится к конденсированным производным тиофена, полезным для лечения шизофрении, болезни Альцгеймера, маниакально-депрессивного психоза и тому подобного, к их фармацевтическому применению и к промежуточному продукту их синтеза.
Предпосылки создания изобретения
Шизофрения является психическим заболеванием, которое охватывает примерно 1% всего населения. В большинстве случаев шанс выздоровления низок и больные и их семьи вынуждены тяжело страдать в течение длительного периода времени. Чтобы избежать этого, было проведено много исследований, касающихся этиологии шизофрении, разработки лекарственных средств для ее лечения и тому подобного.
Первой предложенной гипотезой, касающейся этиологии шизофрении, была гипотеза избыточного дофамина. На основе этой гипотезы были созданы в качестве антипсихотических средств различные соединения, обладающие ингибирующей активностью по отношению к дофаминовым рецепторам, которые давали некоторые терапевтические эффекты.
Состояния шизофрении включают положительные симпотомы, в основном проявляющиеся бредом, галлюцинацией и тому подобным, отрицательные симпотомы, в основном проявляющиеся социальным аутизмом, эмоциональной вялостью и тому подобным, расстройство функции узнавания, такое как нарушения памяти, неспособность к обучению и тому подобное, и тому подобное. Так называемое типичное антипсихотическое средство, нацеленное только на ингибирование дофаминового рецептора, сравнительно эффективно воздействует на положительные симптомы, но неэффективно против отрицательных симптомов и расстройств функции узнавания. При использовании типичного антипсихотического средства ингибирующее действие на дофаминовый рецептор неизбежно вызывает экстрапирамидные побочные эффекты (например, дистонию, акатизию, позднюю дискинезию и тому подобное). Эти недостатки налагают ограничение на разработку антипсихотического средства на основе лишь так называемой гипотезы избыточного дофамина.
В попытке решить вышеописанные проблемы были исследованы и разработаны антипсихотические средства, например серотонин-дофаминовый антагонист (SDA), обладающие в качестве основного ингибирующим действием на серотониновый рецептор, вместо ингибирующего действия на дофаминовый рецептор. Типичные примеры антипсихотических средств типа SDA включают рисперидон, Сероквел и тому подобное. Однако проблемы низкой эффективности против отрицательных симптомов и нарушения функции узнавания или экстрапирамидальных побочных эффектов не были полностью преодолены [American Journal of Psychiatry 151, 825 (1994)].
Одной из гипотез этиологии шизофрении, более передовой, чем гипотеза избыточного дофамина и серотонин-дофаминовая гипотеза, является гипотеза функционального угнетения глутаминокислотной нервной системы (НС с глутаминовой кислотой в качестве медиатора) [Trends in Neuroscience 13, 272 (1990)] . Эта гипотеза была подкреплена тем, что (1) фенциклидин (РСР), который является ингибитором рецептора NMDA (N-метил-D-аспарагиновая кислота), вызывает у человека психические состояния, подобные шизофрении с положительными и отрицательными симптомами [American Journal of Psychiatry 135, 1081 (1978), там же 148, 1301 (1991)], (2) кора головного мозга больных шизофренией показывает более низкую реактивность глутаминокислотной нервной системы [Neuroscience Letters 121, 77 (1991)], (3) число NMDA рецепторов, также присутствующих в глутаминокислотной нервной системе, показывает компенсаторный рост [Life Science 55, 1683 (1994)], (4) агонисты NMDA рецепторов, такие как глицин, D-циклосерин и тому подобное, эффективны в ослаблении негативных симптомов шизофрении [British Journal of Psychiatry 169, 610 (1996), American Journal of Psychiatry 152, 1213 (1995), там же 151, 1234 (1994)] и тому подобное.
Клозапин и оланзапин являются атипичными антипсихотическими средствами, отличающимися их эффективностью против как положительных, так и отрицательных симптомов шизофрении [Psychopharmacology 63, 51 (1992), Neuropsychopharmacology 14, 111 (1996)]. Эти атипичные антипсихотические средства подавляют анормальные поведенческие реакции, вызываемые у испытуемых животных [Psychopharmacology 120, 67 (1995), там же 129, 79 (1997), Pharmacology, Biochemistry and Behavior 47, 579 (1994)] и анормальную физиологическую функцию [Psychopharmacology 111, 339 (1993), Journal of Pharmacology and Experimental Therapeutics 271, 787 (1994)] путем функционального угнетения глутаминокислотной нервной системы ингибиторами NMDA рецепторов, такими как РСР и МК-801 (дизоцилпинмалеат), и их ингибирующая способность часто выше, чем у типичных антипсихотических средств. Другими словами, превосходные клинические эффекты атипичного антипсихотического средства можно приписать ослаблению функционального угнетения глутаминокислотной нервной системы в дополнение к обычному ингибирующему действию на дофаминовые и серотониновые рецепторы.
Нарушения нейрофизиологических функций, вызываемые ингибитором NMDA рецепторов включают нейротоксичность, вызываемую ингибитором NMDA рецепторов [Archive of General Psychiatry 52, 998 (1995)], и была глубоко исследована нейротоксичность, вызываемая ингибитором МК-801. Это нейротоксическое действие может быть ингибировано различными антипсихотическими средствами, причем ингибирующее действие сильнее у клозапина и оланзапина, которые являются атипичными антипсихотическими средствами, чем у галоперидола и тому подобного, которые являются типичными антипсихотическими средствами [Schizophrenia Research 15, 57 (1995), там же 21, 33 (1996)]. Используя это нейротоксическое действие, вызываемое ингибитором МК-801, в качестве показателя, можно произвести отбор антипсихотического средства, обладающего ослабляющим действием на функциональное угнетение глутаминокислотной нервной системы, то есть одной из характеристик клозапина и оланзапина. Кроме того, вызываемое ингибитором МК-801 нейротоксическое действие рассматривают также как модель нарушения функции узнавания, наблюдаемого при различных заболеваниях, таких как болезнь Альцгеймера и тому подобное [Brain Research-Brain Research Reviews, 20, 250-267 (1995)], и соединение, способное ингибировать эту нейротоксичность, эффективно также в качестве лекарственного средства для лечения болезни Альцгеймера, маниакально-депрессивного психоза и тому подобного.
Между прочим, применение клозапина ограничено, так как он вызывает серьезный агранулоцитоз, хотя он также обладает сильным антипсихотическим действием [New England Journal of Medicine 324, 746 (1991)]. Уменьшение вероятности побочных эффектов также является важным аспектом при разработке антипсихотического средства. Недавно было сообщение [CNS•Drugs 7, 139 (1997)] о том, что в механизм возникновения агранулоцитоза может быть вовлечен радикал-катион, образованный как метаболит клозапина. Поэтому, чтобы избежать возникновения агранулоцитоза, важно подавлять образование радикал-катиона.
Уже были различные сообщения о подходящей модификации химических структур клозапина и оланзапина. Например, WO95/17400, WO96/18621, WO96/18623, WO96/18629, WO96/18630 и WO96/19479 раскрывают дибензоксазепин, публикация рассмотренных патентов Японии 42-24513, 42-24514, 43-27404, 45-20909, 45-6822, 46-29861, 48-34599 и 49-40236 и публикация нерассмотренного патента Японии 47-4425 раскрывают дибензоксазепин или дибензтиазепин, WO93/07143 раскрывает пиридобензоксазепин. Journal of Heterocyclic Chemistry 31, 1053 (1994) раскрывает тиенобензоксазепин, и публикация нерассмотренного патента Японии 63-8378 раскрывает дибензотиазапин.
Кроме того, бензотиофен раскрыт, например, в публикации нерассмотренных патентов Японии 52-87196 и 51-76296, касающихся производного 1,2,3,4-тетрагидробензотиено[2,3-b][1,5]бензодиазепина.
Но маловероятно, что эти соединения устраняют проблемы эффективности против негативных симптомов и нарушения функции узнавания, экстрапирамидных побочных эффектов и тому подобного, и нет сообщения об активации функции глутаминокислотной нервной системы посредством клозапина и оланзапина, имеющих подходящим образом модифицированные химические структуры.
Раскрытие сущности изобретения
Создатели настоящего изобретения, основываясь на гипотезе функционального угнетения глутаминокислотной нервной системы, провели интенсивные исследования, пытаясь создать соединение, которое бы ослабляло как положительные, так и отрицательные симптомы шизофрении, и нарушение функции узнавания и которое было бы свободным от серьезных побочных эффектов, таких как экстрапирамидальные нарушения, агранулоцитоз и тому подобное. В результате было найдено, что конденсированное производное тиофена, имеющее формулу (I), обладает сильным ингибирующим действием на дофаминовые рецепторы и ослабляющим действием на функциональное угнетение глутаминокислотной нервной системы, проявляет антиметамфетаминовое действие, антиапоморфиновое действие, ингибирующее действие на условный рефлекс избегания, ингибирующее действие на МК-801-индуцированную нейротоксичность, антагонистическое действие на МК-801-стимулированное различение, общее с клозапином действие на различение и тому подобное у испытуемых животных, таких как мышь, крыса и тому подобное, и полезно в качестве антипсихотического средства, что это производное проявляет меньшие побочные эффекты в экстрапирамидальной системе, такие как индукция каталепсии и тому подобное, и что промежуточный продукт реакции, соответствующий промежуточному радикал-катиону, считавшемуся причиной агранулоцитоза, индуцированного клозапином, не был обнаружен при анализе промежуточного продукта реакции по ЭСР-спектру, полученному методом электронно-спинового резонанса с использованием окисления соединения формулы (I) пероксидазой хрена как модели - реакции обмена веществ с участием этого соединения, и это в конечном счете привело к созданию настоящего изобретения.
Таким образом, главной целью настоящего изобретения является создание конденсированного производного тиофена, полезного в качестве лекарственного средства для лечения шизофрении и тому подобного, и важного промежуточного продукта его синтеза. Конденсированное производное тиофена формулы (I) полезно также в качестве лекарственного средства для лечения болезни Альцгеймера и маниакально-депрессивного психоза.
В соответствии с настоящим изобретением предлагается следующее.
(1) Конденсированное производное тиофена формулы (I)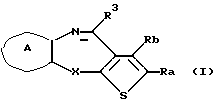
где Ra и Rb являются одинаковыми или различными и каждый представляет водород, алкил, циклоалкил, ацил, алкенил, арил, гетероарил, аралкил, алкокси, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, алкоксиалкил, ацилоксиалкил, ациламиноалкил, галоген, алкилгалогенид или нитро или Ra и Rb вместе могут образовывать бензольное кольцо или циклогексеновое кольцо, необязательно имеющее заместители R1, R2, причем R1, R2 являются одинаковыми или различными и каждый представляет водород, алкил, алкокси, гидроксил или галоген;
X представляет NH, О, S, SO, SO2 или N-R4, где R4 представляет алкил при условии, что, когда Х представляет NH, Ra и Rb вместе образуют бензольное кольцо, необязательно имеющее заместители R1, R2, и, когда Х представляет S, SO или SO2, Ra и Rb вместе образуют бензольное кольцо или циклогексеновое кольцо, необязательно имеющее заместители R1, R2;
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, циклоалкила, алкокси, алкоксиалкила, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино, ациламино, гидроксила и циано, или бензольное кольцо без заместителя; и
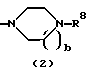
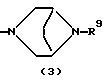
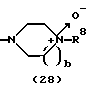
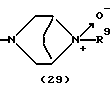
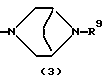
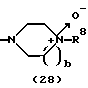
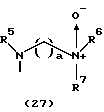
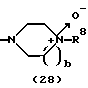
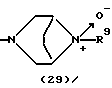
R3 представляет группу формулы (1), формулы (2), формулы (3), формулы (26), формулы (27), формулы (28), формулы (29) или формулы (30):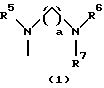
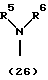
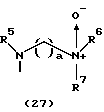
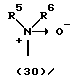
в формуле (I), формуле (26), формуле (27) и формуле (30) R5, R6 и R7 являются одинаковыми или различными и каждый представляет водород, алкил, циклоалкил, арил, гетероарил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, и а равно целому числу 2-4,
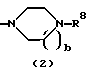
в формуле (2) и формуле (28) R8 представляет водород, алкил, циклоалкил, арил, гетероарил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, b равно 1 или 2, при условии, что исключена комбинация: Х представляет О и R8 представляет аралкил, а когда Х представляет О, то алкил алкила, гидроксиалкила или алкоксиалкила у R8 имеет 1-4 углеродных атома,
в формуле (3) и формуле (29) R9 представляет водород, алкил, циклоалкил, арил, гетероарил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил,
или его фармацевтически приемлемая соль или их гидрат.
(2) Конденсированное производное тиофена, указанное выше в (1), где формула (I) представляет собой формулу (IA)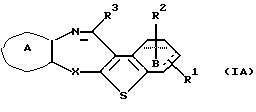
где Х представляет NH, О, S, SO, SO2 или N-R4, где R4 представляет алкил;
R1 и R2 являются одинаковыми или различными и каждый представляет водород, алкил, алкокси, гидроксил или галоген;
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, циклоалкила, алкокси, алкоксиалкила, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино, ациламино, гидроксила и циано, или бензольное кольцо без заместителя;
кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, или циклогексановое кольцо, в котором указанная связь является одинарной связью, при условии, что когда Х представляет NH, то связь, показанная пунктирной и сплошной линиями, не является одинарной связью; и
R3 представляет группу формулы (1), формулы (2), формулы (3), формулы (26), формулы (27), формулы (28), формулы (29) или формулы (30):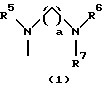
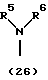
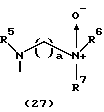
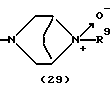
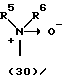
в формуле (1), формуле (26), формуле (27) и формуле (30) R5, R6 и R7 являются одинаковыми или различными и каждый представляет водород, алкил, циклоалкил, арил, гетероарил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, и а равно целому числу 2-4,
в формуле (2) и формуле (28) R8 представляет водород, алкил, циклоалкил, арил, гетероарил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, b равно 1 или 2,
в формуле (3) и формуле (29) R9 представляет водород, алкил, циклоалкил, арил, гетероарил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил,
или его фармацевтически приемлемая соль или их гидрат.
(3) Конденсированное производное тиофена, указанное выше в (2), в котором кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, или его фармацевтически приемлемая соль или их гидрат.
(4) Конденсированное производное тиофена, указанное выше в (2), в котором Х представляет NH, О или S, R1 и R2 являются одинаковыми или различными и каждый представляет водород, галоген, алкокси или алкил, кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена и алкилгалогенида, или бензольное кольцо без заместителя, кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, и R3 представляет группу формулы (2), где R представляет гидроксиалкоксиалкил, метил или этил и b=1, или его фармацевтически приемлемая соль или их гидрат.
(5) Конденсированное производное тиофена, указанное выше в (2), в котором Х представляет NH, R1 и R2 являются одинаковыми или различными и представляют каждый водород, галоген, алкокси или алкил, кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена и алкилгалогенида, или бензольное кольцо без заместителя, кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, и R3 представляет группу формулы (2), где R8 представляет метил или этил и b=1, или его фармацевтически приемлемая соль или их гидрат.
(6) Конденсированное производное тиофена, указанное выше в (2), которое является соединением, выбранным из группы, состоящей из:
12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепина,
8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
8-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепина,
8-бром-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепина,
9-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепина,
9-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
9-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепина,
9-бром-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепина,
9-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепина,
8,9-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
8,10-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепина,
3-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
8-фтор-3-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
2-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
8-фтор-2-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепина,
8-фтор-3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепина,
8,9-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
7,8-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
3-бром-8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепина,
3-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепина,
1-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
4-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
3,8-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина,
3-фтор-8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина и
12-(4-этилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепина,
или его фармацевтически приемлемая соль или их гидрат.
(7) Фармацевтическое средство, содержащее конденсированное производное тиофена формулы (IA) или его фармацевтически приемлемую соль или их гидрат, фармацевтическая композиция, содержащая указанное производное и фармацевтически приемлемую добавку, и антипсихотическое средство, содержащее в качестве активного компонента соединение формулы (IA).
(8) Производное бензотиофена формулы (IIА)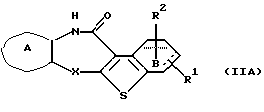
где Х представляет NH, О, S, SO, SО2 или N-R4, где R4 представляет алкил, R1 и R2 являются одинаковыми или различными и представляют каждый водород, алкил, алкокси, гидроксил или галоген, кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, циклоалкила, алкокси, алкоксиалкила, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино, ациламино, гидроксила и циано, или бензольное кольцо без заместителя, и кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, или циклогексановое кольцо, в котором указанная связь является одинарной связью, при условии, что когда Х представляет NH, то связь, показанная пунктирной и сплошной линиями, не является одинарной связью, которое является важным промежуточным соединением для синтеза производного формулы (IА).
(9) Производное бензотиофена, указанное выше в (8), в котором Х представляет NH, О или S, R1 и R2 являются одинаковыми или различными и каждый представляет водород, галоген, алкокси или алкил, кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена, гидроксила и алкилгалогенида, или бензольное кольцо без заместителя и кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, или циклогексановое кольцо, в котором указанная связь является одинарной связью, при условии, что, когда Х представляет NH, связь, показанная пунктирной и сплошной линиями, не является одинарной связью.
(10) Производное бензотиофена, указанное выше в (8), которое является соединением, выбранным из группы, состоящей из:
6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
8-хлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
8-бром-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12 (11Н)-она,
8-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
9-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
9-хлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
9-бром-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
9-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
9-метокси-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
8,9-дифтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
3-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
8-фтор-3-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
3-метокси-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
8-фтор-3-метокси-8Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
2-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
8-фтор-2-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
3,9-диметил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
1,2,3,4-тетрагидро-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-она,
1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11Н)-она,
8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11Н)-она,
[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-она,
8-метил-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-она,
8-фтор-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-она,
1,2,3,4-тетрагидро-[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-она,
1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11H)-она,
8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-она,
8-метил-[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-она,
8-фтор-[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-она,
8,9-дихлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
7,8-дихлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
9-трифторметил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
3-бром-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
6-метил-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
3-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
3-хлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
1-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
4-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она,
3,8-дифтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она и
3-фтор-8-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она.
(11) Конденсированное производное тиофена, указанное выше в (1), где формула (I) представляет собой формулу (IB)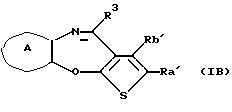
где Ra' и Rb' являются одинаковыми или различными и каждый представляет водород, алкил, циклоалкил, ацил, алкенил, арил, гетероарил, аралкил, алкокси, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, алкоксиалкил, ацилоксиалкил, ациламиноалкил, галоген, алкилгалогенид или нитро;
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, циклоалкила, алкокси, алкоксиалкила, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино, ациламино, гидроксила и циано, или бензольное кольцо без заместителя; и
R3 представляет группу формулы (1), формулы (2), формулы (3), формулы (26), формулы (27), формулы (28), формулы (29) или формулы (30):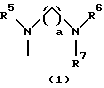
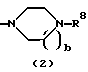
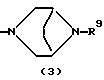
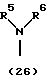
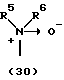
в формуле (1), формуле (26), формуле (27) и формуле (30) R5, R6 и R7 являются одинаковыми или различными и каждый представляет водород, алкил, циклоалкил, арил, гетероарил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, и а равно целому числу 2-4,
в формуле (2) и формуле (28) R8 представляет водород, алкил, имеющий 1-4 углеродных атома, циклоалкил, гидроксиалкил, имеющий 1-4 углеродных атома, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, в котором алкил, имеющий 1-4 углеродных атома, замещен алкокси, и b равно 1 или 2,
в формуле (3) и формуле (29) R9 представляет водород, алкил, циклоалкил, арил, гетероарил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, или его фармацевтически приемлемая соль или их гидрат.
(12) Конденсированное производное тиофена, указанное выше в (11), в котором Ra' и Rb' являются одинаковыми или различными и каждый представляет водород или алкил, кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена и алкилгалогенида, или бензольное кольцо без заместителя и R3 представляет группу формулы (2), где R8 представляет гидроксиалкоксиалкил, метил или этил и b=1, или его фармацевтически приемлемая соль или их гидрат.
(13) Конденсированное производное тиофена, указанное выше в (11), в котором Ra' представляет алкил, Rb' представляет водород или алкил, кольцо А представляет бензольное кольцо, имеющее один заместитель, выбранный из группы, состоящей из алкила, алкокси и галогена, или бензольное кольцо без заместителя и R3 представляет группу формулы (2), где R8 представляет метил, и b=1, или его фармацевтически приемлемая соль или их гидрат.
(14) Конденсированное производное тиофена, указанное выше в (11), которое является соединением, выбранным из группы, состоящей из:
2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепина,
2-этил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепина,
2,8-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5] бензоксазепина,
8-метокси-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5]бензоксазепина,
2,6-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5] бензоксазепина,
2,9-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5] бензоксазепина,
2,3-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5] бензоксазепина,
8-хлор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5]бензоксазепина и
8-фтор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепина
или его фармацевтически приемлемая соль или их гидрат.
(15) Фармацевтическое средство, содержащее конденсированное производное тиофена формулы (IB) или его фармацевтически приемлемую соль или их гидрат, фармацевтическая композиция, содержащая указанное производное и фармацевтически приемлемую добавку, и антипсихотическое средство, содержащее в качестве активного компонента соединение формулы (IB).
(16) Производное тиенобензоксазепинона формулы (IIB)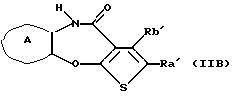
где Ra' и Rb' являются одинаковыми или различными и каждый представляет водород, алкил, циклоалкил, ацил, алкенил, арил, гетероарил, аралкил, алкокси, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, алкоксиалкил, ацилоксиалкил, ациламиноалкил, галоген, алкилгалогенид или нитро, и кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, циклоалкила, алкокси, алкоксиалкила, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино, ациламино, гидроксила и циано, или бензольное кольцо без заместителя, которое является важным промежуточным соединением для синтеза производного формулы (IВ).
(17) Производное тиенобензоксазепинона, указанное выше в (16), в котором Ra' и Rb' являются одинаковыми или различными и каждый представляет водород или алкил и кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена, гидроксила и алкилгалогенида, или бензольное кольцо без заместителя.
(18) Производное тиенобензоксазепинона, указанное выше в (16), которое является соединением, выбранным из группы, состоящей из:
2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она,
2,3-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она,
2,8-диметилтиено[2,3-b][I,5]бензоксазепин-4(5Н)-она,
8-хлор-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она,
8-фтор-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она,
8-метокси-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она,
2,6-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она,
2,9-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она и
2-этилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она.
Подробное описание изобретения
В настоящем изобретении каждый использованный символ конкретно означает следующее.
Алкил представляет собой алкил, имеющий 1-5 углеродных атомов, такой как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил и пентил.
Циклоалкил представляет собой циклоалкил, имеющий 3-6 углеродных атомов, такой как циклопропил, циклопентил, циклогексил и тому подобное.
Алкокси представляет собой алкокси, имеющий 1-5 углеродных атомов, такой как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси и тому подобное.
Арил представляет собой фенил или нафтил, предпочтительно фенил.
Гетероарил представляет собой пиридил, фурил, тиенил и тому подобное.
Аралкил представляет собой аралкил, в котором арил замещен алкилом, имеющим 1-5 углеродных атомов, и его примерами являются бензил, 1-фенилэтил, 2-фенилэтил, 3-фенилпропил, 4-фенилбутил и тому подобное.
Гидроксиалкил представляет собой гидроксиалкил, имеющий 1-5 углеродных атомов, такой как гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 1-гидроксипропил, 4-гидроксибутил, 1-гидрокси-1-метилэтил и тому подобное.
Гидроксиалкоксиалкил представляет собой гидроксиалкоксиалкил, в котором алкил, имеющий 1-4 углеродных атома, связан с гидроксиалкилом, имеющим 1-4 углеродных атома, через один атом кислорода, и его примерами являются 2-(2-гидроксиэтокси)этил и тому подобное.
Аминоалкил представляет собой аминоалкил, в котором алкил, имеющий 1-5 углеродных атомов, является замещенным аминогруппой, и примерами его являются аминометил, 2-аминоэтил, 1-аминоэтил, 3-аминопропил, 1-аминопропил, 4-аминобутил, 1-амино-1-метилэтил и тому подобное.
Моноалкиламиноалкил представляет собой такой моноалкиламиноалкил, в котором атом азота аминоалкила замещен одним алкилом, имеющим 1-5 углеродных атомов, и примерами его являются метиламинометил, N-метил-2-аминоэтил, N-метил-1-аминоэтил, N-метил-3-аминопропил, N-метил-1-аминопропил, N-метил-4-аминобутил, N-метил-1-амино-1-метилэтил и тому подобное.
Диалкиламиноалкил представляет собой такой диалкиламиноалкил, в котором атом азота аминоалкила замещен двумя алкилами, имеющими 1-5 углеродных атомов, и примерами его являются диметиламинометил, N,N-диметил-2-аминоэтил, N, N-диметил-1-аминоэтил, N,N-диметил-3-аминопропил, N,N-диметил-1-аминопропил, N,N-диметил-4-аминобутил, N,N-диметил-1-амино-1-метилэтил и тому подобное.
Алкоксиалкил представляет собой алкоксиалкил, в котором алкил, имеющий 1-5 углеродных атомов, замещен алкоксигруппой, и его примерами являются метоксиметил, метоксиэтил, этоксиметил, этоксиэтил и тому подобное.
Галоген представляет собой фтор, хлор, бром или й од. Алкилгалогенид представляет собой алкилгалогенид, имеющий 1-5 углеродных атомов, такой как фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил и тому подобное.
Моноалкиламино представляет собой амино, замещенный одним алкилом, имеющим 1-5 углеродных атомов, такой как метиламино, этиламино и тому подобное.
Диалкиламино представляет собой амино, замещенный двумя алкилами, имеющими 1-5 углеродных атомов, такой как диметиламино, диэтиламино и тому подобное.
Ацил представляет собой ацил, имеющий 2-7 углеродных атомов, такой как ацетил, пропаноил, бутаноил, пивалоил, бензоил и тому подобное.
Ациламино представляет собой ациламино, в котором амино или моноалкиламино связан с ацилом, имеющим 1-5 углеродных атомов, такой как N-ацетил-N-метиламино и тому подобное. При использовании в данном описании ацил означает ацил, имеющий 2-5 углеродных атомов, такой как ацетил, пропаноил, бутаноил, пивалоил и тому подобное.
Алкоксикарбонил представляет собой алкоксикарбонил, имеющий 2-8 углеродных атомов, такой, как метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, бензилоксикарбонил, пентоксикарбонил и тому подобное.
Кольцо В предпочтительно представляет собой бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью.
Группа формулы (1) при определении указанными R5, R6, R7 и целым числом а представляет собой N-(N',N'-диметил-2-аминоэтил)амино, N-(N',N'-диметил-2-аминоэтил)-N-метиламино и тому подобное.
Группа формулы (2) при определении указанными R8 и целым числом b представляет собой пиперазин-1-ил, 4-метилпиперазин-1-ил, 4-этилпиперазин-1-ил, 4-пропилпиперазин-1-ил, 4-изопропилпиперазин-1-ил, 4-[2-(2-гидроксиэтокси)этил]пиперазин-1-ил, 4-метилгомопиперазин-1-ил и тому подобное, предпочтительно 4-метилпиперазин-1-ил.
Группа формулы (3) при определении указанным R9 представляет собой 8-метил-3,8-диазабицикло[3.2.1]октан-3-ил и тому подобное.
Группа формулы (26) при определении указанными R5 и R6 представляет собой амино, N,N-диметиламино и тому подобное.
Группа формулы (27) при определении указанными R5, R6, R7 и целым числом а представляет собой N-(N', N'-диметил-2-аминоэтил)амино-N'-оксид, N-(N', N'-диметил-2-аминоэтил)-N-метиламино-N'-оксид и тому подобное.
Группа формулы (28) при определении указанными R8 и целым числом b представляет собой 4-метилпиперазин-4-оксид-1-ил и тому подобное.
Группа формулы (29) при определении указанным R9 представляет собой 8-метил-3,8-диазабицикло[3.2.1]октан-8-оксид-3-ил и тому подобное.
Группа формулы (30) при определении указанными R5 и R6 представляет собой амино-N-оксид, N,N-диметиламино-N-оксид и тому подобное.
Соединение формулы (I) представляет собой, в частности, соединение формулы (IA) или соединение формулы (IB).
Соединение формулы (IA), его фармацевтически приемлемая соль и их гидраты предпочтительно представляют собой конденсированное производное тиофена формулы (IA), где
Х представляет NH, О или S,
R1 и R2 являются одинаковыми или различными и каждый представляет водород, галоген, алкокси или алкил,
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена и алкилгалогенида, или бензольное кольцо без заместителя,
кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, и
R3 представляет группу формулы (2), где R8 представляет гидроксиалкоксиалкил, метил или этил и b=1, его фармацевтически приемлемую соль и их гидраты.
Более предпочтительными являются конденсированное производное тиофена формулы (IA), где
Х представляет NH,
R1 и R2 являются одинаковыми или различными и каждый каждый представляет водород, галоген, алкокси или алкил,
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена и алкилгалогенида, или бензольное кольцо без заместителя,
кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, и
R3 представляет группу формулы (2), где R8 представляет метил или этил, и b=1, его фармацевтически приемлемая соль и их гидраты.
Предпочтительные соединения формулы (IA) включают следующие соединения, где число означает номер примера:
(1) 12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепин,
(2) 8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(6) 8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(7) 8-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(8) 8-бром-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(49) 9-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(10) 9-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(11) 9-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(12) 9-бром-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(13) 9-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5] бензодиазепин,
(50) 8,9-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепин,
(15) 8,10-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено-[2,3-b] [1,5]бензодиазепин,
(16) 3-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(17) 8-фтор-3-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин,
(18) 2-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(19) 8-фтор-2-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин,
(20) 3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5] бензодиазепин,
(21) 8-фтор-3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепин,
(22) 8,9-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепин,
(23) 7,8-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено [2,3-b][1,5] бензодиазепин,
(25) 3-бром-8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено [2,3-b] [1,5]бензодиазепин,
(42) 3-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(43) 3-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепин,
(45) 1-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(46) 4-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин,
(47) 3,8-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено [2,3-b][1,5] бензодиазепин,
(48) 3-фтор-8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено [2,3-b] [1,5]бензодиазепин и
(51) 12-(4-этилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин.
Настоящее изобретение охватывает также фармацевтически приемлемые соли указанных выше соединений и их гидраты.
Соединение формулы (IIА) предпочтительно представляет собой производное бензотиофена, где
Х представляет NH, О или S,
R1 и R2 являются одинаковыми или различными и каждый представляет водород, галоген, алкокси или алкил,
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена и алкилгалогенида, или бензольное кольцо без заместителя и
кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, или циклогексановое кольцо, в котором указанная связь является одинарной связью, при условии, что, когда X представляет NH, связь, показанная пунктирной и сплошной линиями, не является одинарной связью.
Конкретные соединения формулы (IIА) включают следующие:
6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
8-хлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
8-бром-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
8-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
9-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
9-хлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
9-бром-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11H)-он,
9-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11H)-он,
9-метокси-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
8,9-дифтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
3-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
8-фтор-3-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
3-метокси-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11H)-он,
8-фтор-3-метокси-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
2-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
8-фтор-2-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11H)-он,
3,9-диметил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
1,2,3,4-тетрагидро-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-он,
1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11H)-он,
8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12 (11H)-он,
[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11H)-он,
8-метил-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11H)-он,
8-фтор-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11H)-он,
1,2,3,4-тетрагидро-[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-он,
1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-он,
8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-он,
[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-он,
8-метил-[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-он,
8-фтор-[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-он,
8,9-дихлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
7,8-дихлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
9-трифторметил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
3-бром-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
6-метил-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
3-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
3-хлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
1-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11H)-он,
4-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он,
3,8-дифтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он и
3-фтор-8-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он.
Соединение формулы (IB) предпочтительно представляет собой конденсированное производное тиофена, где
Ra' и Rb' являются одинаковыми или различными и каждый представляет водород или алкил,
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена и алкилгалогенида, или бензольное кольцо без заместителя и
R3 представляет группу формулы (2), где R8 представляет гидроксиалкоксиалкил, метил или этил и b=1, его фармацевтически приемлемую соль и их гидраты.
Более предпочтительными являются конденсированное производное тиофена формулы (IB), где
Ra' представляет алкил,
Rb' представляет водород или алкил,
кольцо А представляет бензольное кольцо, имеющее один заместитель, выбранный из группы, состоящей из алкила, алкокси и галогена, или бензольное кольцо без заместителя и
R3 представляет группу формулы (2), где R8 представляет метил и b=1,
его фармацевтически приемлемая соль и их гидраты.
Предпочтительные соединения формулы (IB) включают следующие соединения, где числа в круглых скобках являются номерами примеров:
(125) 2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5] бензоксазепин,
(130) 2-этил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5] бензоксазепин,
(138) 2,8-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин,
(142) 8-метокси-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5]бензоксазепин,
(143) 2,6-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5]бензоксазепин,
(145) 2,9-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5]бензоксазепин,
(144) 2,3-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин,
(146) 8-хлор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин и
(147) 8-фтор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин.
Настоящее изобретение охватывает также фармацевтически приемлемые соли указанных выше соединений и их гидраты.
Соединение формулы (IIB) предпочтительно представляет собой производное тиенобензоксазепинона, где
Ra' и Rb' являются одинаковыми или различными и каждый представляют водород или алкил,
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена, гидроксила и алкилгалогенида, или бензольное кольцо без заместителя.
Предпочтительные соединения формулы (IIB) включают следующие соединения, где числа в круглых скобках являются номерами примеров:
(98) 2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он,
(101) 2,3-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он,
(102) 2,8-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он,
(105) 8-хлор-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он,
(106) 8-фтор-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он,
(107) 8-метокси-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он,
(108) 2,6-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он,
(109) 2,9-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он и
(116) 2-этилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он.
Фармацевтически приемлемая соль соединения формулы (I), в частности формулы (IA) или формулы (IB), включает соли с неорганической кислотой, такой как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и соли с органической кислотой, такой как уксусная кислота, пропионовая кислота, янтарная кислота, гликолевая кислота, молочная кислота, яблочная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, аскорбиновая кислота, малеиновая кислота, лимонная кислота, винная кислота, фумаровая кислота и тому подобное. Соединение формулы (I), в частности формулы (IA) или формулы (IB), и его фармацевтически приемлемые соли могут существовать в форме гидратов или сольватов, и настоящее изобретение охватывает также эти гидраты (1/2 гидраты, моногидраты, дигидраты, тригидраты и тому подобное) и сольваты.
Когда соединения по настоящему изобретению включают асимметрический атом, они могут быть получены в форме рацемической смеси или оптически активного соединения. Когда соединения по настоящему изобретению включают по меньшей мере два асимметрических атома, они могут быть получены в форме соответственных диастереомеров или их смесей. Настоящее изобретение охватывает также эти смеси и отдельные изомеры. Кроме того, настоящее изобретение охватывает стереоизомеры.
Ниже описаны способы синтеза соединений по настоящему изобретению.
Способ 1: синтез соединения формулы (IA)
Производное бензотиофена формулы (IIА)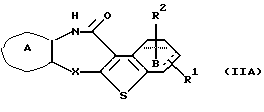
где каждый символ - такой, как определенный выше, выдерживают с подходящим хлорирующим агентом, таким как тионилхлорид, оксихлорид фосфора, пентахлорид фосфора и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, хлороформ, 1,2-дихлорэтан, произвольные смеси указанных растворителей и тому подобное, или без растворителя при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (4А)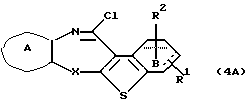
где каждый символ - такой, как определенный выше. Полученное соединение формулы (4А) выдерживают с соединением формулы (5)
H-R3 (5)
где R3 - такой, как определенный выше, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, хлороформ, 1,2-дихлорэтан, произвольные смеси указанных растворителей и тому подобное, или без растворителя при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (IA).
Способ 2: синтез соединения формулы (IA)
Производное бензотиофена формулы (IIА) выдерживают с подходящим сульфурирующим агентом, таким как тетрасульфат дифосфора, реактив Лоэссона (Lawesson) и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, хлороформ, 1,2-дихлорэтан, произвольные смеси указанных растворителей и тому подобное, или без растворителя при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (7)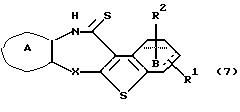
где каждый символ - такой, как определенный выше. Полученное соединение формулы (7) подвергают взаимодействию с подходящим метилирующим агентом, таким как метилйодид, метилбромид и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как тетрагидрофуран, N,N-диметилформамид, ацетонитрил, N-метилпирролидон, дихлорметан, хлороформ, 1,2-дихлорэтан, произвольные смеси указанных растворителей и тому подобное, в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, трет-бутоксид калия, алкоксид натрия, бутиллитий и тому подобное, или без основания с получением соединения формулы (8)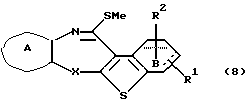
где каждый символ - такой, как определенный выше. Полученное соединение формулы (7) или формулы (8) выдерживают с соединением формулы (5) в растворителе, не оказывающем вредного влияния на реакцию, таком как тетрагидрофуран, N, N-диметилформамид, ацетонитрил, N-метилпирролидон, дихлорметан, бензол, толуол, ксилол, хлороформ, 1,2-дихлорэтан, произвольные смеси указанных растворителей и тому подобное, или без растворителя при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (IА).
Способ 3: синтез соединения формулы (IA), где Х представляет NH, N-R4, О или S
Производное бензотиофена формулы (9)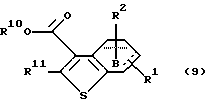
где R10 представляет алкил, R11 представляет галоген, а другие символы - такие, как определенные выше, выдерживают с соединением формулы (10)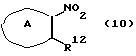
где R12 представляет NH2, NH-R4, ОН или SH, а кольцо В - такое, как определенное выше, в растворителе, не оказывающем вредного влияния на реакцию, таком как N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, этанол, 1,4-диоксан, произвольные смеси указанных растворителей и тому подобное, или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, трет-бутоксид калия, алкоксид натрия, бутиллитий и тому подобное, при температуре в пределах от -20oС до 170oС в течение 1-24 часов с получением соединения формулы (11)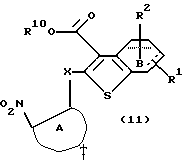
где каждый символ - такой, как определенный выше.
Соединение формулы (11а)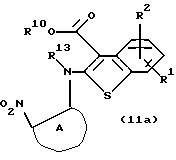
где R13 представляет водород или алкил, а другие символы - такие, как определенные выше, которое представляет собой соединение формулы (11), где Х представляет NH или N-R4, можно также синтезировать следующим образом.
Например, производное бензотиофена формулы (12)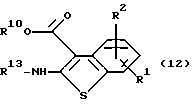
где каждый символ - такой, как определенный выше, выдерживают с соединением формулы (13)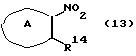
где R14 представляет галоген, а кольцо А - такое, как определенное выше, в растворителе, не оказывающем вредного влияния на реакцию, таком как N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, этанол, 1,4-диоксан, произвольные смеси указанных растворителей и тому подобное, или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, трет-бутоксид калия, алкоксид натрия, бутиллитий и тому подобное, при температуре в пределах от -20oС до 170oС в течение 1-24 часов с получением соединения формулы (11а).
В частности, из соединений формулы (11а) соединение, в котором R13 представляет алкил, может быть также получено путем выдерживания соединения, в котором R13 представляет водород, с алкилгалогенидом формулы (6), которое будет описано позже, в растворителе, не оказывающем вредного влияния на реакцию, таком как N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, 1,4-диоксан, произвольные смеси указанных растворителей и тому подобное, или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, трет-бутоксид калия, алкоксид натрия, бутиллитий, диизопропиламинлитий и тому подобное, при температуре в пределах от комнатной до 170oС в течение 1-24 часов.
Полученное соединение формулы (11) выдерживают с водородом при давлении от нормального до 100 атм в растворителе, не оказывающем вредного влияния на реакцию, таком как этанол, метанол, этилацетат, диметилформамид, уксусная кислота, вода, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии подходящего металлического катализатора, такого как палладий на углероде, палладиевая чернь, гидроксид палладия, никель Ренея, оксид платины и тому подобное, при температуре в пределах от комнатной до 150oС в течение 1-24 часов с получением соединения формулы (14)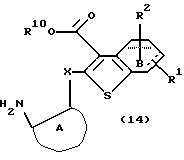
где каждый символ - такой, как определенный выше.
Соединение формулы (14) может быть также получено путем выдерживания соединения формулы (11) с подходящим неорганическим реагентом, таким как железо, цинк, хлорид олова (II) и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как этанол, метанол, 1,4-диоксан, диметилформамид, уксусная кислота, вода, произвольная смесь указанных растворителей и тому подобное, в присутствии подходящей кислоты, такой как хлороводородная кислота, уксусная кислота и тому подобное, при температуре в пределах от -20oС до 150oС в течение 1-24 часов.
Кроме того, из соединений формулы (14) соединение, в котором Х представляет S или О, может быть также получено путем выдерживания соединения формулы (9) с соединением формулы (25)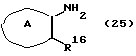
где R16 представляет ОН или SH, а кольцо А - такое, как определенное выше, в растворителе, не оказывающем вредного влияния на реакцию, таком как N, N-диметилформамид, диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, этанол, 1,4-диоксан, произвольные смеси указанных растворителей и тому подобное, или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, трет-бутоксид калия, алкоксид натрия, бутиллитий и тому подобное, при температуре в пределах от -20oС до 150oС в течение 1-24 часов. Полученное соединение формулы (14) выдерживают с соединением формулы (5) в растворителе, не оказывающем вредного влияния на реакцию, таком как анизол, толуол, ксилол, мезитилен, нитробензол, 1,2-дихлорэтан, произвольные смеси указанных растворителей и тому подобное, или без растворителя, в присутствии кислоты Льюиса, такой как тетрахлорид титана, тетрахлорид олова, хлорид алюминия и т.п., при температуре от комнатной до 170oС с получением соединения формулы (IA).
Способ 4:
Соединение формулы (IАа)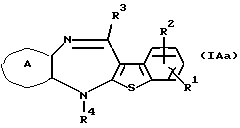
где каждый символ - такой, как определенный выше, которое является соединением формулы (IА), где Х представляет N-R4, может быть также получено путем выдерживания производного бензотиофена формулы (IАb)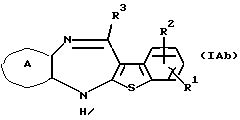
где каждый символ - такой, как определенный выше, с алкилгалогенидом формулы (6)
Hal-R4 (6)
где Hal представляет галоген и R - такой, как определенный выше, в растворителе, не оказывающем вредного влияния на реакцию, таком как N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, 1,4-диоксан, произвольные смеси указанных растворителей и тому подобное, или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, трет-бутоксид калия, алкоксид натрия, бутиллитий и тому подобное, при температуре в пределах от комнатной до 170oС в течение 1-24 часов.
Способ 5:
Соединение формулы (IАс)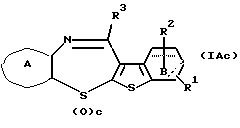
где с равен 1 или 2, а другие символы - такие, как определенные выше, которое является соединением формулы (IA), где X представляет SO или SО2, может быть также получено путем выдерживания производного бензотиофена формулы (IAd)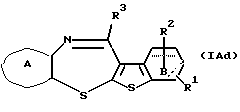
где каждый символ - такой, как определенный выше, с окислителем, таким как пероксид водорода, м-хлорпербензойная кислота, периодат натрия, пербромат натрия и тому подобное, в растворителе, который не оказывает вредного влияния на реакцию, таком как вода, этанол, уксусная кислота, муравьиная кислота, дихлорметан, хлороформ, произвольные смеси указанных растворителей и тому подобное, или без растворителя при температуре в пределах от -78oС до 120oС в течение 1-24 часов.
Способ 6: синтез соединения формулы (IIА)
Соединение формулы (14) выдерживают с органическим основанием, таким как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганическим основанием, таким как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидриксид калия, трет-бутоксид калия, алкоксид натрия, бутил-литий и тому подобное, или подходящей кислотой Льюиса, такой как тетрахлорид титана, тетрахлорид олова, хлорид алюминия, трифторид бора и тому подобное, или подходящей кислотой, такой как серная кислота, фосфорная кислота и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как дихлорметан, хлороформ, тетрагидрофуран, диметилсульфоксид, N, N-диметилформамид, бензол, толуол, ксилол, произвольная смесь указанных растворителей и тому подобное, при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (IIА).
Соединение формулы (14) выдерживают с подходящим неорганическим основанием, таким как гидроксид натрия, гидроксид калия, гидроксид бария и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как метанол, этанол, вода, тетрагидрофуран, 1,4-диоксан, произвольная смесь указанных растворителей и тому подобное, при температуре в пределах от комнатной до 150oС в течение 1-24 часов с получением соединения формулы (15)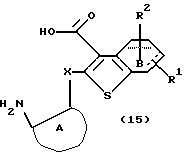
где каждый символ - такой, как определенный выше. Полученное соединение формулы (15) выдерживают с подходящим конденсирующим агентом, таким как дициклогексилкарбодиимид, диизопропилкарбодиимид, N-этил-N'-3-диметиламинопропилкарбодиимид, диэтилфосфорилазид, дифенилфосфорилазид и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, гексан, этилацетат, диэтиловый эфир, тетрагидрофуран, диоксан, хлороформ, дихлорметан, 1,2-дихлорэтан, N,N-диметилформамид, диметилсульфоксид, N-метилпирродидон, пиридин, произвольная смесь указанных растворителей и тому подобное, при температуре в пределах от комнатной до 100oС в течение от 10 минут до 24 часов с получением соединения формулы (IIА).
Способ 7: синтез соединения формулы (IIА)
Соединение формулы (16)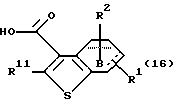
где каждый символ - такой, как определенный выше, выдерживают с подходящим хлорирующим агентом, таким как тионилхлорид, оксихлорид фосфора, пентахлорид фосфора, оксалилхлорид и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное, или без растворителя при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (17)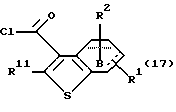
где каждый символ - такой, как определенный выше. Полученное соединение формулы (17) выдерживают с соединением формулы (18)
где каждый символ - такой, как определенный выше, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, гексан, этилацетат, диэтиловый эфир, тетрагидрофуран, диоксан, хлороформ, дихлорметан, 1,2-дихлорэтан, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, пиридин, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия и тому подобное, при температуре в пределах от комнатной до 170oС в течение от 10 минут до 24 часов с получением соединения формулы (19)
Соединение формулы (19) может быть также получено путем выдерживания соединения формулы (16) с соединением формулы (18) в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, гексан, этилацетат, диэтиловый эфир, тетрагидрофуран, диоксан, хлороформ, дихлорметан, 1,2-дихлорэтан, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, пиридин, произвольная смесь указанных растворителей и тому подобное, и подходящим конденсирующим агентом, таким как дициклогексилкарбодиимид, диизопропилкарбодиимид, N-этил-N'-3-диметиламинопропилкарбодиимид, диэтилфосфорилазид, дифенилфосфорилазид и тому подобное, при температуре в пределах от комнатной до 100oС в течение от 10 минут до 24 часов.
Полученное соединение формулы (19) выдерживают в растворителе, не оказывающем вредного влияния на реакцию, таком как метанол, этанол, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, гексаметилфосфорный триамид, бензол, толуол, ксилол, хлороформ, дихлорэтан и тому подобное, произвольная смесь указанных растворителей и тому подобное, в присутствии органического основания, такого как пиридин, триэтиламин, N,N-диизопропилэтиламин и тому подобное, или неорганического основания, такого как карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, гидрид натрия и тому подобное, при температуре в пределах от комнатной до 170oС в течение от 10 минут до 24 часов с получением соединения формулы (IIA).
Способ 8:
Соединение формулы (IIАа)
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIА), где Х представляет SO или SO2, может быть также получено путем выдерживания производного бензотиофена формулы (IIAb)
где каждый символ - такой, как определенный выше, с окислителем, таким как пероксид водорода, м-хлорпербензойная кислота, периодат натрия, пербромат натрия и тому подобное, в растворителе, который не оказывает вредного влияния на реакцию, таком как вода, этанол, уксусная кислота, муравьиная кислота, дихлорметан, хлороформ, произвольная смесь указанных растворителей и тому подобное, или без растворителя при температуре в пределах от -78oС до 120oС в течение 1-24 часов.
Способ 9:
Соединение формулы (IIАс)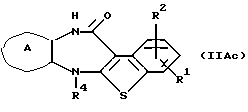
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIА), где Х представляет N-R4, может быть также получено путем выдерживания производного бензотиофена формулы (IIAd)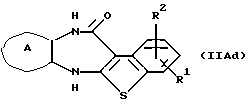
где каждый символ - такой, как определенный выше, с алкилгалогенидом формулы (6) в растворителе, не оказывающем вредного влияния на реакцию, таком как N, N-диметилформамид, диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, 1,4-диоксан, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, трет-бутоксид калия, алкоксид натрия, бутиллитий, диизопропиламид лития и тому подобное, при температуре в пределах от комнатной до 170oС в течение 1-24 часов.
Способ 10:
Соединение формулы (IIАе)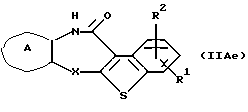
где каждый символ - такой, как определенный выше, при условии, что исключается соединение, в котором Х представляет NH, которое является соединением формулы (IIА), где кольцо В представляет бензольное кольцо, может быть также получено путем выдерживания производного 1,2,3,4-тетрагидробензотиофена формулы (IIAf)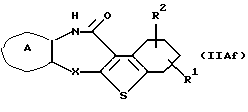
где каждый символ - такой, как определенный выше, с подходящим окислителем, таким как сера, N-бромсукцинимид, N-хлорсукцинимид, N-йодсукцинимид, дихлордициано-п-бензохинон, или подходящим катализатором на основе благородного металла, таким как палладий на углероде, гидроксид палладия, палладиевая чернь, оксид платины и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, мезитилен, хлороформ, тетра-хлорид углерода, 1,4-диоксан, произвольная смесь указанных растворителей и тому подобное, или без растворителя при температуре в пределах от 0oС до 250oС в течение 1-48 часов.
Способ 11:
Соединение формулы (IIАg)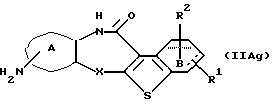
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIА), где заместителем в кольце А является амино, может быть получено путем выдерживания соединения формулы (IIAh)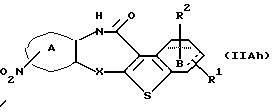
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIA), где заместителем в кольце А является нитро, с водородом в растворителе, не оказывающем вредного влияния на реакцию, таком как метанол, этанол, этилацетат, диоксан, бензол, толуол, ксилол, диэтиловый эфир, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное, с использованием палладия на углероде, гидроксида палладия, оксида платины и тому подобного в качестве катализатора при температуре 0oС-100oС и давлении от нормального до 100 атм в течение времени от 10 минут до 24 часов.
Способ 12:
Соединение формулы (IIAi)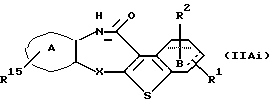
где R15 представляет фтор, хлор, бром, йод или циано, а другие символы - такие, как определенные выше, которое является соединением формулы (IIА), где заместителем в
кольце А является циано или галоген, может быть получено путем диазотирования соединения формулы (IIАg) в растворителе, не оказывающем вредного влияния на реакцию, таком как вода, разбавленная хлороводородная кислота и тому подобное, с использованием нитрита натрия и тому подобного при температуре от -10oС до комнатной и выдерживанием с фторборной кислотой, фтороводородпиридином, хлоридом натрия, хлоридом меди (1), бромидом натрия, бромидом меди (1), йодидом натрия, йодидом калия и тому подобным при температуре в пределах от -10oС до 100oС.
Способ 13: синтез соединения формулы (IA), где Х представляет NH и связь, показанная пунктирной и сплошной линиями в кольце В, является двойной связью.
Используя бензилцианид формулы (20)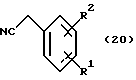
где каждый символ - такой, как определенный выше, в качестве исходного материала, способом, описанным в нерассмотренной публикации 7-89965 патента Японии, получают производное бензотиофена формулы (21)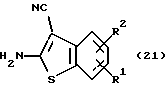
где каждый символ - такой, как определенный выше.
Полученное соединение формулы (21) выдерживают с соединением формулы (13) в растворителе, не оказывающем вредного влияния на реакцию, таком как N, N-диметилформамид, диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, этанол, 1,4-диоксан, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как гидрид натрия, карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, трет-бутоксид калия, алкоксид натрия, бутиллитий и тому подобное, при температуре в пределах от -50oС до 170oС в течение 1-24 часов с получением соединения формулы (22)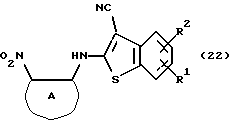
где каждый символ - такой, как определенный выше.
Полученное соединение формулы (22) выдерживают с подходящим восстановителем, таким как железо, цинк, хлорид олова (II) и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как этанол, метанол, 1,4-диоксан, диметилформамид, уксусная кислота, вода, произвольная смесь указанных растворителей и тому подобное, в присутствии подходящей кислоты, такой как хлороводородная кислота, серная кислота, азотная кислота, фосфорная кислота, уксусная кислота и тому подобное, при температуре в пределах от -20oС до 150oС в течение 1-24 часов с получением соединения формулы (23)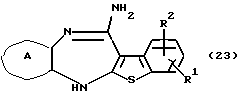
где каждый символ - такой, как определенный выше, или его соли с неорганической кислотой, такой как хлороводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное.
Соединение формулы (23) может быть получено путем выдерживания соединения формулы (22) с водородом при давлении в пределах от нормального до 100 атм в растворителе, не оказывающем вредного влияния на реакцию, таком как этанол, метанол, этилацетат, диметилформамид, уксусная кислота, вода, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии подходящего металлического катализатора, такого как палладий на углероде, палладиевая чернь, гидроксид палладия, никель Ренея, оксид платины и тому с подобное, при температуре в пределах от комнатной до 150oС в течение 1-24 часов или путем выдерживания соединения формулы (24)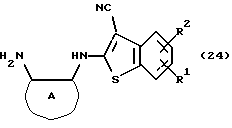
где каждый символ - такой, как определенный выше, которое получают путем выдерживания с подходящим восстановителем, таким как гидросульфит натрия, железо, цинк, хлорид олова (II) и тому подобное, в присутствии хлороводородной кислоты, уксусной кислоты и тому подобного, или в нейтральных условиях, при температуре в пределах от -20oС до 150oС в течение 1-24 часов в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, диметилсульфоксид, N,N-диметилформамид, 1,4-диоксан, этанол, метанол, уксусная кислота, вода, произвольная смесь указанных растворителей и тому подобное, в присутствии или в отсутствие подходящей неорганической кислоты, такой как хлороводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, при температуре в пределах от комнатной до 180oС в течение 1-24 часов.
Полученное соединение формулы (23) выдерживают с соединением формулы (1), (2), (3), (26), (27), (28), (29) или (30) в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, диметилсульфоксид, N,N-диметилформамид, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии подходящего органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как карбонат калия, карбонат натрия и тому подобное, или в отсутствие основания при температуре в пределах от комнатной до 180oС в течение 1-20 часов с получением соединения формулы (IA), где Х представляет NH, и связь, показанная пунктирной и сплошной линиями в кольце В, является двойной связью.
Способ 14:
Соединения формул (IАе) и (IAf):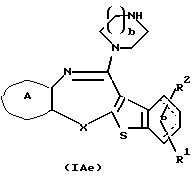
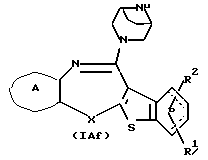
где каждый символ - такой, как определенный выше, при условии, что, когда Х представляет NH, связь, показанная пунктирной и сплошной линиями, не является одинарной связью, которые являются соединениями формулы (IA), где R3 представляет группу формулы (2) или (3), и R8 или R9 представляет водород, могут быть также получены путем выдерживания соединения, в котором R3 представляет алкоксикарбонил или ацил формулы (2а), (2b), (3а) или (3b):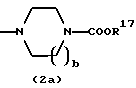
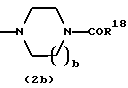
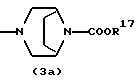
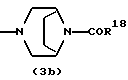
где R17 представляет алкил или аралкил, R18 представляет алкил или арил и b - такой, как определенный выше, в растворителе, не оказывающем вредного влияния на реакцию, таком как этанол, метанол, 1,4-диоксан, тетрагидрофуран, бензол, толуол, вода, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии неорганической кислоты, такой как хлороводородная кислота, серная кислота или тому подобное, или органической кислоты, такой как уксусная кислота, трифторуксусная кислота, п-толуолсульфоновая кислота и тому подобное, при 0oС-150oС в течение 1-18 часов.
Соединения формул (IАе) и (IAf) могут быть также получены путем выдерживания соединений формул (2с) и (3с):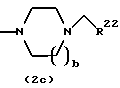
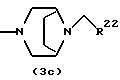
где R22 представляет арил и b - такой, как определенный выше, с водородом при давлении в пределах от нормального до 100 атм в растворителе, не оказывающем вредного влияния на реакцию, таком как этанол, метанол, этилацетат, диметилформамид, уксусная кислота, вода, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии подходящего металлического катализатора, такого как палладий на углероде, палладиевая чернь, гидроксид палладия, никель Ренея, оксид платины и тому подобное, при температуре в пределах от комнатной до 150oС в течение 1-24 часов.
Способ 15:
Соединения формул (IАg) и (IAh):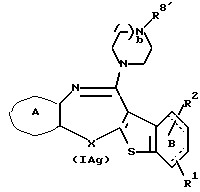
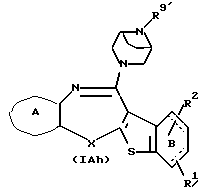
где R8' и R9' представляют каждый ацил или алкоксикарбонил, а другие символы - такие, как определенные выше, при условии, что, когда Х представляет NH, связь, показанная пунктирной и сплошной линиями, не является одинарной связью, которые являются соединениями формулы (IA), где R3 представляет группу формулы (2) или (3), и R8 или R9 представляет ацил или алкоксикарбонил, могут быть также получены путем выдерживания соединений (IАе) и (IAf) (R8 или R9 представляет водород) с подходящим ацилирующим агентом, таким как ацилгалогенид формулы (31)
Hal-CO-R19 (31)
где Hal представляет галоген и R19 представляет алкил или арил, или ангидрид кислоты формулы (32)
(R19СО)2О (32)
где R19 - такой, как определенный выше, или галогенид сложного эфира формулы (33)
Hal-COОR20 (33)
где Hal представляет галоген и R20 представляет алкил или аралкил в качестве алкоксикарбонилирующего агента, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, хлороформ, 1,4-диоксан, тетрагидрофуран, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии основания, такого как пиридин, триэтиламин, N,N-диметиламинопиридин, гидрид натрия, карбонат калия, гидроксид натрия, трет-бутоксид калия, алкоксид натрия, бутиллитий, литийдиизопропиламин и тому подобное, при температуре в пределах от -50oС до 150oС в течение времени от 10 минут до 15 часов.
Способ 16:
Соединения формул (IAi) и (IAj):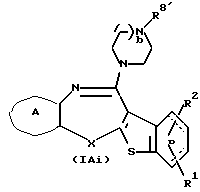
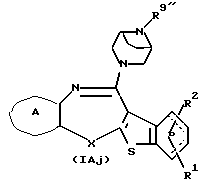
где R8'' и R9'' представляют каждый алкил, циклоалкил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, а другие символы - такие, как определенные выше, при условии, что, когда Х представляет NH, связь, показанная пунктирной и сплошной линиями, не является одинарной связью, которые являются соединениями формулы (IA), где R3 представляет группу формулы (2) или (3), и R8 или R9 представляет алкил, циклоалкил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, могут быть получены путем выдерживания соединений (IАе) и (IAf) (R8 или R9 представляет водород) с подходящим алкилирующим агентом, таким как соединение формулы (34)
Hal-R21 (34)
где Hal представляет галоген и R21 представляет алкил, циклоалкил, аралкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, хлороформ, 1,4-диоксан, тетрагидрофуран, произвольная смесь указанных растворителей и тому подобное, или без растворителя в присутствии подходящего основания, такого как пиридин, триэтиламин, N,N-диметиламинопиридин, гидрид натрия, карбонат калия, гидроксид натрия, трет-бутоксид калия, алкоксид натрия, бутиллитий, литийдиизопропиламин и тому подобное, при температуре в пределах от -50oС до 200oС в течение времени от 10 минут до 24 часов.
Способ 17:
Из соединений формулы (IA) соединение, в котором R3, представляет группу формулы (27), (28), (29) или (30), может быть получено путем выдерживания соответствующего соединения (1), (2), (3) или (26) с подходящим окислителем, таким как водный пероксид водорода, м-хлорбензойная кислота, трет-бутилгидропероксид и тому подобное, в растворителе, не оказывающем вредного влияния на реакцию, таком как метиленхлорид, хлороформ, 1,2-диметоксиэтан, бензол, толуол, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, метанол, этанол, вода, произвольная смесь указанных растворителей и тому подобное, при температуре в пределах от -30oС до 130oС в течение времени от 10 минут до 12 часов.
Способ 18:
Соединение формулы (IIА), где Х представляет О, S, SO или SO2 и связь, показанная пунктирной и сплошной линиями в кольце В, является двойной связью, может быть также получено путем выдерживания соединения формулы (IIА), где Х представляет О, S, SO или SО2 и связь, показанная пунктирной и сплошной линиями в кольце В, является одинарной связью, в растворителе, не оказывающем вредного влияния на реакцию, таком как бензол, толуол, ксилол, мезитилен, дихлорметан, хлороформ, этилацетат, метанол, этанол, тетрагидрофуран, 1,4-диоксан, диметилсульфоксид, N, N-диметилформамид, произвольная смесь указанных растворителей и тому подобное, в присутствии подходящего окислителя, такого как 2,3-дихлор-5,6-дициано-1,4-бензохинон, хлоранил, диоксид марганца, пероксид никеля, палладий на углероде, тетраацетат свинца и тому подобное, при температуре в пределах от комнатной до 200oС в течение 1-24 часов.
Способ 19: синтез соединения формулы (IB)
Производное тиенобензоксазепинона формулы (IIB)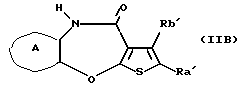
где каждый символ - такой, как определенный выше, выдерживают с подходящим хлорирующим агентом, таким как тионилхлорид, оксихлорид фосфора, пентахлорид фосфора и тому подобное, в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное), или без растворителя при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (4В)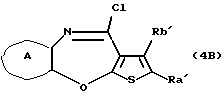
где каждый символ - такой, как определенный выше. Затем соединение формулы (4В) выдерживают с соединением формулы (5)
Н-R3 (5)
где R3 - такой, как определенный выше, в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное), или без растворителя при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (IB).
Способ 20: синтез соединения формулы (IВа)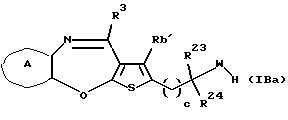
где W представляет атом кислорода или азота, связанный с водородом или одним C1-C5 алкилом, R23 и R24, одинаковые или различные, каждый представляет водород, C1-C4 алкил и тому подобное, с равно целому числу от 0 до 4, а другие символы - такие, как определенные выше, которое является соединением формулы (IB) (Ra' представляет гидроксиалкил, аминоалкил или моноалкиламиноалкил).
Например, соединение формулы (IBb) (Ra' представляет ацилоксиалкил или ациламиноалкил), синтезированное способом 19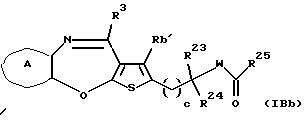
где R25 представляет водород или алкил, имеющий 1-4 углеродных атома, и тому подобное, а другие символы - такие, как определенные выше, выдерживают с основанием, таким как гидроксид натрия, гидроксид калия, аммиак и тому подобное, или кислотой, такой как хлороводородная кислота, бромоводородная кислота, уксусная кислота, муравьиная кислота, серная кислота и тому подобное, в воде или в смешанном растворителе, состоящем из воды и подходящего растворителя, такого как метанол, этанол, пиридин, диоксан и тому подобное, при температуре в пределах от комнатной до 100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IBa).
Способ 21: синтез соединения формулы (IВс)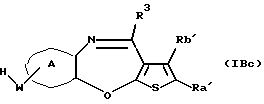
где каждый символ - такой, как определенный выше, которое является соединением формулы (IB), где заместитель в кольце А представляет собой гидрокси, амино или моноалкиламино.
Например, соединение формулы (IBd), которое является соединением формулы (IВ), где заместителем в кольце А является ацилокси или ациламино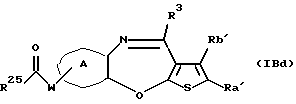
где каждый символ - такой, как определенный выше, выдерживают с основанием, таким как гидроксид натрия, гидроксид калия, аммиак и тому подобное, или кислотой, такой как хлороводородная кислота, бромоводородная кислота, уксусная кислота, муравьиная кислота, серная кислота и тому подобное, в воде или в смешанном растворителе, состоящем из воды и подходящего растворителя, такого как метанол, этанол, пиридин, диоксан и тому подобное, при температуре в пределах от комнатной до 100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IВс).
Способ 22: синтез соединения формулы (IВе)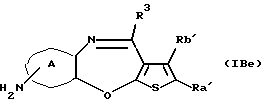
где каждый символ - такой, как определенный выше, которое является соединением формулы (IВ), где заместитель в кольце А представляет собой амино.
Соединение формулы (IBf)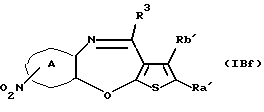
где каждый символ - такой, как определенный выше, которое является соединением формулы (IB), где заместителем в кольце А является нитро, и которое синтезировано способом 19, выдерживают с водородом в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, метанол, этанол, этилацетат, диоксан, бензол, толуол, ксилол, диэтиловый эфир, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное), с использованием палладия на активированном угле, гидроксида палладия, оксида платины и тому подобного в качестве катализатора при температуре в пределах от 0oС до 100oС и давлении в пределах от нормального до 100 атм в течение времени от 10 минут до 24 часов с получением соединения формулы (IВе).
Способ 23: синтез соединения формулы (IIB)
Производное 2-галоген-3-тиофенкарбоновой кислоты формулы (35)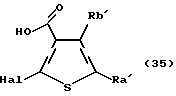
где Hal представляет галоген, а другие символы - такие, как определенные выше, выдерживают с подходящим хлорирующим агентом, таким как тионилхлорид, оксихлорид фосфора, пентахлорид фосфора, оксалилхлорид и тому подобное, в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное), или без растворителя при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (36)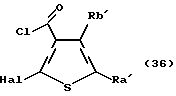
где каждый символ - такой, как определенный выше.
Полученное соединение формулы (36) выдерживают с соединением формулы (37)
где кольцо А - такое, как определенное выше, в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, гексан, этилацетат, диэтиловый эфир, тетрагидрофуран, диоксан, хлороформ, дихлорметан, 1,2-дихлорэтан, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, пиридин, произвольная смесь указанных растворителей и тому подобное), или без растворителя в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин и тому подобное, или неорганического основания, такого как карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия и тому подобное, при температуре в пределах от комнатной до 170oС в течение времени от 10 минут до 24 часов с получением соединения формулы (38)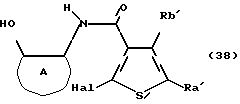
где каждый символ - такой, как определенный выше.
Соединение формулы (38) может быть также получено путем выдерживания соединения формулы (35) и соединения формулы (37) в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, гексан, этилацетат, диэтиловый эфир, тетрагидрофуран, диоксан, хлороформ, дихлорметан, 1,2-дихлорэтан, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, пиридин, произвольная смесь указанных растворителей и тому подобное), вместе с подходящим конденсирующим агентом, таким как дициклогексилкарбодиимид, диизопропилкарбодиимид, N-этил-N'-3-диметиламинопропилкарбодиимид, диэтилфосфорилазид, дифенилфосфорилазид и тому подобное, при температуре в пределах от комнатной до 100oС в течение времени от 10 минут до 24 часов.
Полученное соединение формулы (38) выдерживают в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, метанол, этанол, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, триамид гексаметилфосфора, бензол, толуол, ксилол, хлороформ, дихлорэтан и тому подобное, произвольная смесь указанных растворителей и тому подобное), в присутствии органического основания, такого как пиридин, триэтиламин, N, N-диизопропилэтиламин и тому подобное, или неорганического основания, такого как карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия, гидрид натрия и тому подобное, или алкоксид металла или этоксид натрия, метоксид натрия, трет-бутоксид калия и тому подобное, при температуре в пределах от комнатной до 170oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIB).
Способ 24: синтез соединения (IIBa)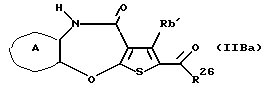
где R26 представляет алкил, имеющий 1-4 углеродных атома, такой как метил, этил, пропил, бутил и тому подобное, а другие символы - такие, как определенные выше, которое является соединением формулы (IIB), где Ra' представляет ацил, отличный от формила.
Соединение формулы (IIВb), которое является соединением формулы (IIB), где Ra' представляет водород, и синтезировано способом 23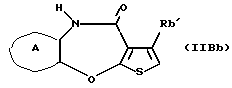
где каждый символ - такой, как определенный выше, выдерживают с соединением формулы (39)
где каждый символ - такой, как определенный выше, или соединением формулы (40) (40)
(40)
где R26 - такой, как определенный выше, в присутствии хлорида алюминия и тому подобного в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, нитробензол, гексан, хлорофор, 1,2-дихлорэтан и тому подобное, произвольная смесь указанных растворителей и тому подобное), при температуре в пределах от 0oС до 100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBa).
Способ 25: синтез соединения формулы (IIВс)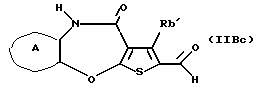
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIB), где Ra' представляет формил.
Соединение формулы (IIBc) может быть получено путем выдерживания соединения формулы (IIВb) с хлоридом алюминия и тому подобным в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, нитробензол, гексан, хлороформ, 1,2-дихлорэтан и тому подобное, произвольная смесь указанных растворителей и тому подобное), в присутствии дихлорметилметилового эфира и тому подобного при температуре в пределах от 0oС до 100oС в течение времени от 10 минут до 24 часов.
Кроме того, соединение формулы (IIBc) может быть также получено путем выдерживания соединения формулы (IIВb) с N,N-диметилформамидом, N-метилформанилидом, N-метилморфолином, N,N-диизопропилформамидом и тому подобным в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, триамид гексаметилфосфора, бензол, толуол, ксилол, хлороформ, дихлорэтан и тому подобное, произвольная смесь указанных растворителей и тому подобное), или без растворителя в присутствии галогенирующего агента, такого как оксихлорид фосфора, фосген, оксалилхлорид, тионилхлорид и тому подобное, при температуре 0oС-100oС в течение времени от 10 минут до 24 часов.
Способ 26: синтез соединения формулы (IIBd)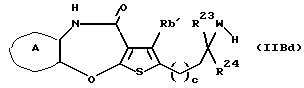
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIB), где Ra' представляет гидроксиалкил, аминоалкил или моноалкиламиноалкил.
Соединение формулы (IIВе) (соединением формулы (IIB),
где Ra' представляет ацилоксиалкил или ациламиноалкил)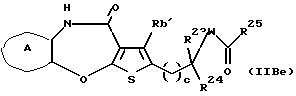
где каждый символ - такой, как определенный выше, синтезированное способом 36, описанным ниже, выдерживают с основанием, таким как гидроксид натрия, гидроксид калия, аммиак и тому подобное, или кислотой, такой как хлороводородная кислота, бромоводородная кислота, уксусная кислота, муравьиная кислота, серная кислота и тому подобное, в подходящем растворителе, таком как вода и смешанный растворитель, состоящий из воды и подходящего растворителя (например, метанола, этанола, пиридина, диоксана и тому подобного), при температуре в пределах от комнатной до 100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBd).
Способ 27: синтез соединения формулы (IIBf)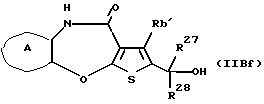
где R27 и R28, одинаковые или различные, каждый представляет алкил, имеющий 1-4 углеродных атома, а другие символы - такие, как определенные выше, из соединений формулы (IIB), где Ra' представляет гидроксиалкил.
Например, соединение формулы (IIBg)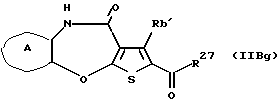
где каждый символ - такой, как определенный выше, выдерживают с металлоалкильным соединением, таким как соединение формулы (41)
R28MgBr (41)
где R28 представляет алкил, имеющий 1-4 углеродных атома, и тому подобное в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, диэтиловый эфир, тетрагидрофуран, хлороформ, дихлорэтан, произвольная смесь указанных растворителей и тому подобное), при 0oС-100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBf).
Способ 28: синтез соединения формулы (IIBh)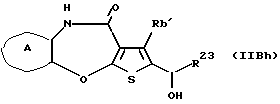
где каждый символ - такой, как определенный выше, из соединений формулы (IIB), где Ra' представляет гидроксиалкил.
Например, соединение формулы (IIBi)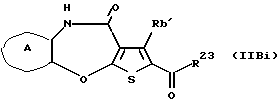
где каждый символ - такой, как определенный выше, выдерживают с борогидридом натрия, литийалюминийгидридом и тому подобным в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, метанол, этанол, бензол, толуол, ксилол, диэтиловый эфир, тетрагидрофуран, хлороформ, дихлорэтан, произвольная смесь указанных растворителей и тому подобное), при 0oС-100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBh).
Способ 29: синтез соединения формулы (IIBj)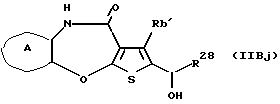
где каждый символ - такой, как определенный выше, из соединений формулы (IIB), где Ra' представляет гидроксиалкил.
Например, соединение формулы (IIBc) выдерживают с соединением формулы (41) в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, диэтиловый эфир, тетрагидрофуран, хлороформ, дихлорэтан, произвольная смесь указанных растворителей и тому подобное), при 0oС-100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBj).
Способ 30: синтез соединения формулы (IIBk)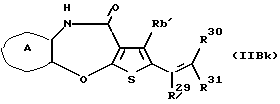
где R29, R30 и R31, одинаковые или различные, каждый представляет водород или алкил, имеющий 1-3 углеродных атома, а другие символы - такие, как определенные выше, из соединений формулы (IIB), где Ra' представляет алкенил.
Из соединений формулы (IIB), где Ra' представляет гидроксиалкил, соединение формулы (IIBl)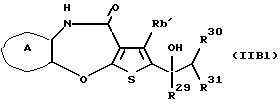
где каждый символ - такой, как определенный выше, выдерживают в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, метанол, этанол, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, триамид гексаметилфосфора, бензол, толуол, ксилол, хлороформ, дихлорэтан и тому подобное, произвольная смесь указанных растворителей и тому подобное), в присутствии кислоты, такой как хлороводородная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, трифторуксусная кислота и тому подобное, при температуре в пределах от комнатной до 190oС с получением соединения формулы (IIBk).
Способ 31: синтез соединения формулы (IIBm)
где каждый символ - такой, как определенный выше, из соединений формулы (IIB), где Ra' представляет алкил.
Соединение формулы (IIBi) выдерживают с триэтилсиланом, литийалюминийгидридом и тому подобным в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, трифторуксусная кислота, метанол, бензол, толуол, ксилол, диэтиловый эфир, хлороформ, дихлорэтан, произвольная смесь указанных растворителей и тому подобное), при температуре 0oС-100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBm).
Способ 32: синтез соединения формулы (IIBn)
где R32 представляет алкил, имеющий 2-5 углеродных атома, а другие символы - такие, как определенные выше, которое является соединением формулы (IIВ), где Ra' представляет алкил, отличный от метила.
Соединение формулы (IIВо)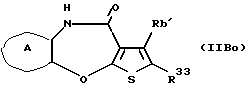
где R33 представляет алкенил, имеющий 2-5 углеродных атомов, а другие символы - такие, как определенные выше, которое является соединением формулы (IIB), где Ra' представляет алкенил, выдерживают с водородом в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, метанол, этанол, этилацетат, диоксан, бензол, толуол, ксилол, диэтиловый эфир, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное), с использованием палладия на активированном угле, гидроксида палладия, оксида платины и тому подобного в качестве катализатора при 0oС-100oС и давлении от нормального до 100 атм в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBn).
Способ 33: синтез соединения формулы (IIBp)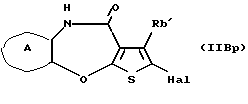
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIВ), где Ra' представляет галоген.
Соединение формулы (IIВb) выдерживают с фтором, хлором, бромом, йодом, монохлоридом йода, N-бромсукцинимидом, N-йодсукцинимидом и тому подобным в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, уксусная кислота, метанол, этанол, этилацетат, диоксан, бензол, толуол, ксилол, диэтиловый эфир, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное), при температуре в пределах от комнатной до 100oС течение времени от 10 минут до 24 часов с получением соединения формулы (IIBp).
Способ 34: синтез соединения формулы (IIBq)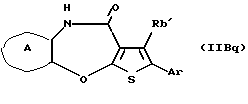
где Аr представляют арил или гетероарил, а другие символы такие, как определенные выше, которое является соединением формулы (IIB), где Ra, представляет арил или гетероарил.
Соединение формулы (IIВр) выдерживают с соединением формулы (42)
Ar-Y (42)
где Y представляет дигидроксиборил, диэтилборил, трибутилстаннил, триметилстаннил и тому подобное и Аr - такой, как определенный выше, и тетракистрифенилфосфинпалладием и тому подобным в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, метанол, этанол, этилацетат, диоксан, бензол, толуол, ксилол, диэтиловый эфир, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное), при температуре в пределах от комнатной до 100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBq).
Способ 35: синтез соединения формулы (IIBr)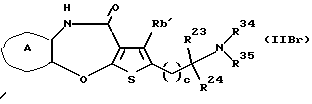
где R34 и R35, одинаковые или различные, каждый представляет водород или алкил, имеющий 1-5 углеродных атомов, такой как метил, этил, пропил, бутил, пентил и тому подобное, а другие символы - такие, как определенные выше, которое является соединением формулы (IIB), где Ra' представляет аминоалкил, моноалкиламиноалкил или диалкиламиноалкил.
Из соединений формулы (IIB), где Ra' представляет гидроксиалкил, соединение формулы (IIBs)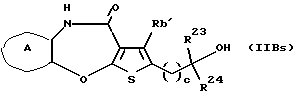
где каждый символ - такой, как определенный выше, выдерживают с соединением формулы (43)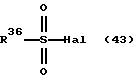
где R36 представляет метил, этил, трифторметил, фенил, 4-метилфенил и тому подобное и Hal - такой, как определенный выше, или соединением формулы (44)
где R36 - такой, как определенный выше, в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, хлороформ, дихлорэтан, пиридин, произвольная смесь указанных растворителей и тому подобное), в присутствии органического основания, такого как пиридин, триэтиламин и тому подобное, или неорганического основания, такого как карбонат калия, карбонат натрия, гидроксид натрия, гидроксид калия и тому подобное, при температуре в пределах от комнатной до 170oС в течение 1-24 часов с получением соединения формулы (45)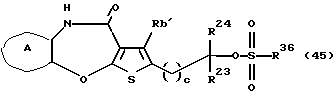
где каждый символ - такой, как определенный выше.
Полученное соединение формулы (45) выдерживают с соединением формулы (46)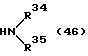
где каждый символ - такой, как определенный выше, в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, метанол, этанол, диоксан, бензол, толуол, ксилол, диэтиловый эфир, хлороформ, дихлорэтан, произвольная смесь указанных растворителей и тому подобное), при температуре в пределах от комнатной до 100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBr).
Способ 36: синтез соединения формулы (IIВe), которое является соединением формулы (IIB), где Ra' представляет ацилоксиалкил или ациламиноалкил.
Например, вышеуказанное соединение формулы (IIBd), которое является соединением формулы (IIB), где Ra' представляет аминоалкил или моноалкиламиноалкил, выдерживают с указанным выше соединением формулы (39) или (40) или этилформиатом, фенилформиатом и тому подобным в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, бензол, толуол, ксилол, хлороформ, дихлорэтан, пиридин, произвольная смесь указанных растворителей и тому подобное), при температуре в пределах от комнатной до 100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIВе).
Способ 37: синтез соединения формулы (IIBt)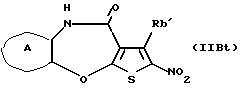
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIB), где Ra' представляет нитро.
Например, соединение формулы (IIВb) подвергают взаимодействию с подходящим нитрирующим реагентом, таким как смесь концентрированная азотная кислота-концентрированная серная кислота, ацетилнитрат, тетрафторборат нитрония и тому подобное, при 0oС-100oС в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBt).
Способ 38: синтез соединения формулы (IIBu)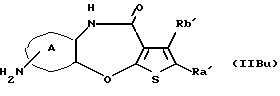
где каждый символ - такой, как определенный выше, которое является соединением формулы (IIB), где заместителем в кольце А является амино.
Соединение формулы (IIBv), которое является соединением формулы (IIB)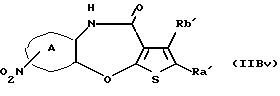
где заместителем в кольце А является нитро, а каждый символ - такой, как определенный выше, выдерживают с водородом в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, метанол, этанол, этилацетат, диоксан, бензол, толуол, ксилол, диэтиловый эфир, хлороформ, 1,2-дихлорэтан, произвольная смесь указанных растворителей и тому подобное), с использованием палладия на активированном угле, гидроксида палладия, оксида платины и тому подобного в качестве катализатора при температуре в пределах от 0oС до 100oС и давлении в пределах от нормального до 100 атм в течение времени от 10 минут до 24 часов с получением соединения формулы (IIBu).
Способ 39: синтез соединения формулы (IIBw)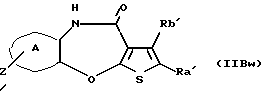
где Z представляет фтор, хлор, бром, йод или циано, а другие символы - такие, как определенные выше, которое является соединением формулы (IIВ), где заместителем в кольце А является циано или галоген.
Например, соединение формулы (IIBu) диазотируют в подходящем растворителе, таком как растворитель, не оказывающий вредного влияния на реакцию (например, вода, разбавленная хлороводородная кислота и тому подобное) с использованием нитрита натрия и тому подобного при температуре в пределах от -10oС до комнатной температуры и выдерживают с фторборной кислотой, гидрофторидом пиридина, хлоридом натрия, хлоридом меди (I), бромидом натрия, бромидом меди (I), йодидом натрия, йодидом калия и тому подобным при температуре в пределах от -10oС до 100oС с получением соединения (IIBw).
При необходимости очистки соединения, полученного описанным выше способом, в виде соли неорганической или органической кислоты выполняют следующие стадии. Соединение формулы (IA) или соединение формулы (IB) растворяют в подходящем растворителе, таком как метанол, этанол, изопропиловый спирт, этилацетат, диэтиловый эфир, диизопропиловый эфир, бензол, толуол, ксилол, хлороформ, метиленхлорид и тому подобное, произвольно смешанный растворитель, состоящий из вышеуказанных растворителей, и тому подобное, и добавляют неорганическую кислоту, такую как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, или органическую кислоты, такую как уксусная кислота, пропионовая кислота, янтарная кислота, гликолевая кислота, молочная кислота, яблочная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, аскорбиновая кислота, малеиновая кислота, лимонная кислота, винная кислота, фумаровая кислота и тому подобное, или ее гидрат. Полученные кристаллы перекристаллизовывают из подходящего растворителя, такого как метанол, этанол, изопропиловый спирт, этилацетат, диэтиловый эфир, диизопропиловый эфир, бензол, толуол, ксилол, хлороформ, метиленхлорид, дихлорэтан и тому подобное или произвольно смешанный растворитель, состоящий из вышеуказанных растворителей, с получением соли неорганической или органической кислоты, гидрата или сольвата соединения формулы (IA) или соединения формулы (IB).
Полученное соединение по настоящему изобретению может быть очищено одним или несколькими методами, выбранными из кристаллизации, хроматографии, экстракции и фильтрования.
Когда полученное очищенное соединение представляет собой рацемат, целевое оптически активное соединение может быть отделено путем, например, препаративной перекристаллизации из оптически активной кислоты или путем пропускания соединения через колонку, заполненную оптически активным носителем. Стереоизомер может быть выделен путем перекристаллизации, колоночной хроматографии и тому подобного.
Соединение формулы (I), в частности (IA) и (IB), по настоящему изобретению, полученное описанным выше образом, полезно в качестве нового антипсихотического средства, которое эффективно в отношении как положительных, так и отрицательных симптомов шизофрении, вызывает меньше побочных эффектов экстрапирамидального двигательного расстройства и тому подобного и вызывает менее серьезные побочные эффекты, такие как агранулоцитоз и тому подобное. Предлагаемое в соответствии с настоящим изобретением соединение (I), в частности (IA) и (IB), полезно в качестве лекарственного средства для лечения болезни Альцгеймера и маниакально-депрессивного психоза. Соединения формул (IIA) и (IIB) полезны в качестве важных промежуточных продуктов синтеза соединений формул (IA) и (IB).
При использовании соединения формулы (I) в качестве фармацевтического средства предлагаемое соединение смешивают с фармацевтически приемлемым носителем (например, наполнителем, связывающим веществом, разрыхлителем, корректирующим веществом, корригентом, эмульгатором), разбавителем, солюбилизатором и тому подобным с получением традиционными методами фармацевтической композиции, из которой изготавливают лекарственное средство в форме таблетки, капсулы, гранулы, порошка, сиропа, суспензии, раствора, инъекционного раствора, раствора для вливания, средства для наложения, суппозитория и тому подобного, и вводят перорально или парентерально.
При использовании таблеток для перорального введения обычно применяемые носители включают сахарозу, лактозу, маннит, мальтит, декстран, кукурузный крахмал и тому подобное, типичные смазывающие вещества, такие как стеарат магния, консерванты, такие как парабены, сорбины и тому подобное, антиоксиданты, такие как аскорбиновая кислота, α-токоферол, цистеин и тому подобное, разрыхлители, связывающие вещества и тому подобное. При пероральном введении лекарственного средства в форме капсул эффективные разбавители включают лактозу и сухой кукурузный крахмал. Жидкость для перорального применения включает сироп, суспензию, раствор, эмульсию и тому подобное, которые могут содержать типичный инертный разбавитель, используемый в данной области, такой как вода. Кроме того, могут быть использованы подслащивающие вещества или корригенты.
В случае парентерального введения, такого как подкожная инъекция, внутривенная инъекция, внутримышечная инъекция, внутрибрюшинная инъекция, вливание и тому подобное, производят надлежащее регулирование рН, буферизацию и стерилизацию раствора активного компонента. Примеры используемого носителя или растворителя включают дистиллированную воду, раствор Рингера, изотонический солевой раствор и тому подобное. Для внутривенного применения общую концентрацию растворенного вещества регулируют так, чтобы раствор был изотоническим.
Суппозитории могут быть получены путем смешивания с лекарственным веществом подходящего нераздражающего наполнителя, такого как наполнители, твердые при нормальной температуре, но становящиеся жидкими при температуре в кишке и тающие в прямой кишке с высвобождением лекарственного вещества, такие как масло какао и полиэтиленгликоли, и тому подобное.
Дозу определяют в зависимости от возраста, массы тела, времени введения, способа введения, комбинации лекарственных средств, состояния пациента, проходящего лечение, и других факторов. Соединение по настоящему изобретению, его оптические изомеры и фармацевтически приемлемые соли низкотоксичны и могут быть использованы без вреда. Хотя суточная доза колеблется в зависимости от состояния и массы пациентов, вида соединения, способа введения и тому подобного, в случае перорального применения она составляет примерно 0,01-300 мг на человека в сутки, предпочтительно 0,1-100 мг/человек/сутки, в случае парентерального применения является желательным, чтобы она составляла примерно 0,01-50 мг/человек/сутки, предпочтительно 0,01-10 мг/человек/сутки при инъекции подкожно, внутривенно, внутримышечно и интраректально.
Далее настоящее изобретение описано более подробно на примерах синтеза исходных материалов, примерах и экспериментальных примерах, которые ни в коей мере не ограничивают настоящее изобретение.
Пример 1 синтеза исходных материалов
Используя циклогексанон в качестве исходного материала и следуя способу, раскрытому в публикации [Archiv der Pharmazie (Weinheim), 317, 675 (1984)], синтезировали этил 2-аминобензо[b]тиофен-3-карбоксилат.
1Н-ЯМР (400 МГц, СDСl3) δ: 8,10 (д, J=7,3 Гц, 1Н), 7,50 (д, J=7,3 Гц, 1Н), 7,31 (т, J=7,3 Гц, 1Н), 7,13 (т, J=7,3 Гц, 1Н), 6,53 (ш.с, 2Н), 4,42 (кв, J=7,3 Гц, 2Н), 1,46 (т, J=7,3 Гц, 3Н).
Пример 2 синтеза исходных материалов
Используя 3-метилциклогексанон в качестве исходного материала и следуя способу, раскрытому в публикации [Archiv der Pharmazie (Weinheim), 317, 675 (1984)], синтезировали метил 2-амино-5-метилбензо[b]тиофен-3-карбоксилат.
1Н-ЯМР (400 МГц, CDCl3) δ: 7,89 (с, 1Н), 7,37 (д, J=8,3 Гц, 1H), 6,97 (д, J=8,3 Гц, 1Н), 6,49 (ш.с, 2Н), 3,95 (с, 3Н), 2,43 (с, 3Н).
Пример 3 синтеза исходных материалов
Используя 4-метилциклогексанон в качестве исходного материала и следуя способу, раскрытому в публикации [Archiv der Pharmazie (Weinheim), 317, 675 (1984)], синтезировали этил 2-амино-6-метилбензо[b]тиофен-3-карбоксилат.
Температура плавления: 126-128oС.
Пример 4 синтеза исходных материалов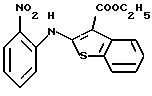
Этил 2-аминобензо[b] тиофен-3-карбоксилат (5 г) и 2-фтор-нитробензол (2 мл) растворяли в N,N-диметилформамиде (150 мл) и нагревали до 60oС. К полученному раствору добавляли карбонат калия (8 г) и смесь перемешивали при 100oС в течение 18 часов.
После охлаждения реакционную смесь вливали в ледяную воду и выпавшие в осадок кристаллы собирали путем фильтрования. Кристаллы промывали водой и диизопропиловым эфиром и высушивали при 60oС с получением этил 2-(2-нитроанилино)бензо[b]тиофен-3-карбоксилата (5,7 г).
1H-ЯМР (400 МГц, СDСl3) δ: 12,2 (с, 1Н), 8,32 (д, J=8,3 Гц, 1H), 8,25 (д, J=8,3 Гц, 1H), 8,10 (д, J=8,8 Гц, 1Н), 7,67-7,62 (м, 2Н), 7,42 (т, J=7,8 Гц, 1H), 7,27 (м, 1H), 7,16 (т, J=7,8 Гц, 1H), 4,57 (кв, J=7,3 Гц, 2Н), 1,52 (т, J=7,3 Гц, 3Н).
Пример 5 синтеза исходных материалов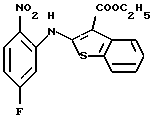
Этил 2-аминобензо[b] тиофен-3-карбоксилат (69,3 г) и 2,4-дифторнитробензол (50 г) растворяли в диметилсульфоксиде (550 мл) и нагревали до 50oС. К полученному раствору добавляли карбонат калия (63 г) и смесь перемешивали при 100oС в течение 70 минут. После охлаждения реакционной смеси давали остыть до 70oС и вливали в воду (2,5 л). Реакционной смеси давали еще постоять и затем фильтровали. Отфильтрованные оранжевые кристаллы промывали этилацетатом с получением этил 2-(5-фтор-2-нитроанилино)бензо[b]тиофен-3-карбоксилата (50,7 г).
Температура плавления 137-140oС.
1H-ЯМР (400 МГц, CDCl3) δ: 12,40 (ш.с, 1H), 8,33-8,29 (м, 2Н), 7,79 (дд, J= 7,8, 2,9 Гц, 1H), 7,65 (д, J=8,3 Гц, 1H), 7,42 (дд, J=8,3, 8,3 Гц, 1H), 7,29 (дд, J= 6,9, 8,3 Гц, 1H), 6,80-6,77 (м, 1H), 4,54 (кв, J=6,8 Гц, 2Н), 1,49 (т, J=6,8 Гц, 3Н).
ИК (KBr): 3085, 2993, 1624, 1582, 1553, 1510, 1274, 1274, 1206, 1035 см-1.
MC: m/e 360.
Пример 6 синтеза исходных материалов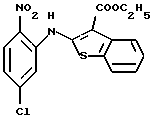
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат (4,0 г), 2,4-дихлорнитробензол (3,8 г) и диметилсульфоксид (55 мл), получали так же, как в примере 4 синтеза исходных материалов, этил 2-(5-хлор-2-нитроанилино)бензо[b]тиофен-3-карбоксилат (3,2 г).
1H-ЯМР (400 МГц, CDCl3) δ: 12,27 (ш.с, 1Н), 8,31 (д, J=8,3 Гц, 1Н), 8,19 (д, J= 8,8 Гц, 1Н), 8,08 (с, 1Н), 7,65 (д, J=7,3 Гц, 1Н), 7,41 (дд, J=7,3, 8,3 Гц, 1Н), 7,28 (дд, J=7,8, 7,3 1Н), 7,06 (д, J=8,3 Гц, 1Н), 4,54 (кв, J= 7,3 Гц, 2Н), 1,49 (т, J=7,3 Гц, 3Н).
Пример 7 синтеза исходных материалов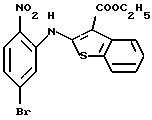
Используя этил 2-аминобензо[b]тиофен-3-карбоксилат,
2,4-дибромнитробензол и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, этил 2-(5-бром-2-нитроанилино)бензо[b] тиофен-3-карбоксилат.
Пример 8 синтеза исходных материалов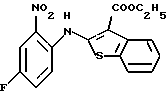
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат, 2,5-дифторнитробензол и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, этил 2-(4-фтор-2-нитроанилино)бензо[b]тиофен-3-карбоксилат.
Пример 9 синтеза исходных материалов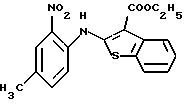
Используя этил 2-аминобензо[b]тиофен-3-карбоксилат (4,0 г), 4-фтор-3-нитротолуол (3,3 г) и диметилсульфоксид (55 мл), получали так же, как в примере 4 синтеза исходных материалов, этил 2-(4-метил-2-нитроанилино)бензо[b] тиофен-3-карбоксилат (6,5 г).
1H-ЯМР (400 МГц, CDCl3) δ: 12,06 (ш.с, 1Н), 8,27 (д, J=8,3 Гц, 1H), 8,01 (с, 1Н), 7,95 (д, J=8,8 Гц, 1H), 7,58 (д, J=7,3 Гц, 1Н), 7,44 (д, J=8,3 Гц, 1Н), 7,38 (дд, J=8,8, 8,3 Гц, 1H), 7,21 (д, J=7,3 Гц, 1Н), 4,53 (кв, J=7,3 Гц, 2Н), 2,40 (с, 3Н), 1,49 (т, J=7,3 Гц, 3Н).
Пример 10 синтеза исходных материалов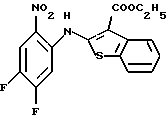
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат, 2,4,5-трифторнитробензол и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, этил 2-(4,5-дифтор-2-нитроанилино)бензо[b]тиофен-3-карбоксилат.
Пример 11 синтеза исходных материалов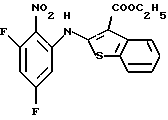
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат, 2,4,6-трифторнитробензол и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, этил 2-(3,5-дифтор-2-нитроанилино)бензо[b]тиофен-3-карбоксилат.
Пример 12 синтеза исходных материалов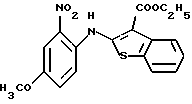
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат, 2-фтор-5-метоксинитробензол и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, этил 2-(4-метокси-2-нитроанилино)бензо[b] тиофен-3-карбоксилат.
Пример 13 синтеза исходных материалов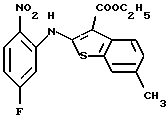
Используя этил 2-амино-6-метилбензо[b] тиофен-3-карбоксилат (4,5 г), 2,4-дифторнитробензол (3,1 г) и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, этил 2-(5-фтор-2-нитроанилино)-6-метилбензо[b]тиофен-3-карбоксилат (5,1 г).
Температура плавления: 147-149oС.
Пример 14 синтеза исходных материалов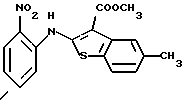
Используя метил 2-амино-5-метилбензо[b] тиофен-3-карбоксилат, 2-фторнитробензол и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, метил 2-(2-нитроанилино)-5-метилбензо[b]тиофен-3-карбоксилат.
Пример 15 синтеза исходных материалов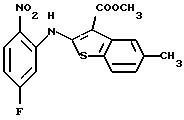
Используя метил 2-амино-5-метилбензо[b] тиофен-3-карбоксилат (3,11 г), 2,4-дифторнитробензол (1,54 г) и диметилсульфоксид (30 мл), получали так же, как в примере 4 синтеза исходных материалов, метил 2-(5-фтор-2-нитроанилино)-5-метилбензо[b]тиофен-3-карбоксилат.
1H-ЯМР (400 МГц, СDСl3) δ: 12,44 (ш.с, 1Н), 8,34 (дд, J=9,3, 3,4 Гц, 1Н), 8,14 (с, 2Н), 7,82 (д, J=8,3 Гц, 1Н), 7,55 (д, J=7,8 Гц, 1Н), 7,14 (д, J=8,3 Гц, 1Н), 6,83-6,78 (м, 1Н), 4,09 (с, 3Н), 2,49 (с, 3Н).
Пример 16 синтеза исходных материалов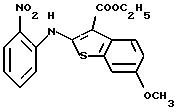
Используя этил 2-амино-6-метоксибензо[b] тиофен-3-карбоксилат, 2-фторнитробензол и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, этил 2-(2-нитроанилино)-6-метоксибензо[b] тиофен-3-карбоксилат.
Пример 17 синтеза исходных материалов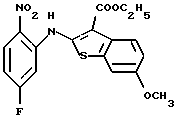
Используя этил 2-амино-6-метоксибензо[b]тиофен-3-карбоксилат, 2,4-дифторнитробензол и диметилсульфоксид, получали так же, как в примере 4 синтеза исходных материалов, этил 2-(5-фтор-2-нитроанилино)-6-метоксибензо[b]тиофен-3-карбоксилат.
Пример 18 синтеза исходных материалов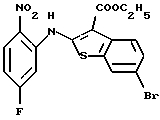
Используя этил 6-бром-2-аминобензо[b] тиофен-3-карбоксилат (8,8 г), 2,4-дифторнитробензол (5,6 г) и диметилсульфоксид (100 мл), получали так же, как в примере 4 синтеза исходных материалов, этил 6-бром-2-(5-фтор-2-нитроанилино)бензо[b]тиофен-3-карбоксилат (10 г).
1H-ЯМР (400 МГц, CDCl3) δ: 12,35 (с, 1Н), 8,31 (дд, 1Н), 8,17 (д, J=8,8 Гц, 1Н), 7,76-7,71 (м, 2Н), 7,50 (д, J=8,8 Гц, 1Н), 6,82 (дд, 1Н), 4,53 (кв, J=7,3 Гц, 2Н), 1,48 (т, J=7,3 Гц, 3Н).
Пример 19 синтеза исходных материалов
Этил 2-(2-нитроанилино)бензо[b]тиофен-3-карбоксилат (4,9 г) растворяли в этилацетате (200 мл) и добавляли 10%-ный палладий на углероде (0,5 г). Смесь перемешивали с водородом (60 кг/см2) при 60oС в течение 5 часов. Реакционную смесь охлаждали и отфильтровывали катализатор. Фильтрат выпаривали при пониженном давлении с получением этил 2-(2-аминоанилино)бензо[b]тиофен-3-карбоксилата (3,5 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,61 (с, 1Н), 8,14 (д, J=7,8, Гц, 1Н), 7,47 (д, J= 7,8 Гц, 1Н), 7,33-7,35 (м, 2Н), 7,10-7,12(м, 2Н), 6,80-6,86 (м, 2Н), 4,47 (кв, J=7,3 Гц, 2Н), 3,88 (ш.с, 2Н), 1,50 (т, J=7,3 Гц, 3Н).
Пример 20 синтеза исходных материалов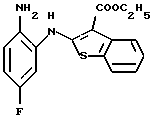
Этил 2-(5-фтор-2-нитроанилино)бензо[b] тиофен-3-карбоксилат (50,7 г) растворяли в этилацетате (1000 мл) и добавляли 10%-ный палладий на углероде (8,0 г). Смесь перемешивали с водородом (60 кг/см2) при 55oС в течение 5 часов. Реакционную смесь охлаждали и отфильтровывали катализатор. Фильтрат выпаривали при пониженном давлении и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ) с получением этил 2-(2-амино-5-фторанилино)бензо[b]тиофен-3-карбоксилата (24,5 г).
Температура плавления 141-142oС.
1H-ЯМР (400 МГц, СDСl3)  9,87 (с, 1Н), 8,14 (д, J=8,8 Гц 1Н), 7,50 (д, J=7,3 Гц, 1Н), 7,31-7,35 (м, 1Н), 7,19-7,11 (м, 2Н), 6,75-6,85 (м, 2Н), 3,69 (ш.с, 2Н), 4,45 (кв, J=7,3 Гц, 2Н), 1,48 (т, J=7,3 Гц, 3Н).
9,87 (с, 1Н), 8,14 (д, J=8,8 Гц 1Н), 7,50 (д, J=7,3 Гц, 1Н), 7,31-7,35 (м, 1Н), 7,19-7,11 (м, 2Н), 6,75-6,85 (м, 2Н), 3,69 (ш.с, 2Н), 4,45 (кв, J=7,3 Гц, 2Н), 1,48 (т, J=7,3 Гц, 3Н).
ИК (КВr): 3417, 3353, 3234, 2994, 1633, 1605, 1551, 1479, 1384, 1235, 1039 см-1.
MC: m/e 330.
Пример 21 синтеза исходных материалов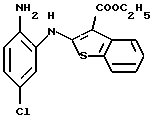
Этил 2-(5-хлор-2-нитроанилино)бензо[b] тиофен-3-карбоксилат (3,2 г) суспендировали в этаноле (40 мл) и добавляли при перемешивании смеси раствор, полученный путем растворения дигидрата хлорида олова (II) (7,7 г) в этаноле (50 мл) и 18%-ной хлороводородной кислоте (50 мл). Смесь перемешивали при 60oС в течение 2 часов и охлаждали до 30oС. Добавляли карбонат калия, пока реакционная смесь не становилась щелочной. После фильтрования через целит фильтрат экстрагировали этилацетатом, промывали водой и сушили над сульфатом магния. После естественной фильтрации растворитель выпаривали при пониженном давлении с получением этил 2-(2-амино-5-хлоранилино)бензо[b]тиофен-3-карбоксилата (2,6 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,71 (с, 1Н), 8,14 (д, J=8,3 Гц 1Н), 7,51 (д, J=7,3 Гц, 1Н), 7,38 (c, 1Н), 7,36 (т, J=7,3 Гц 1Н), 7,15 (дд, J=7,8, 7,3 Гц, 1Н), 7,09 (д, J= 7,8 Гц, 1Н), 6,77 (д, J=8,3 Гц, 1Н), 4,47 (кв, J=7,3 Гц, 2Н), 3,88 (ш.с, 2Н), 1,50 (т, J=7,3 Гц, 3Н).
Пример 22 синтеза исходных материалов
Используя этил 2-(5-хлор-2-нитроанилино)бензо[b] тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-5-хлоранилино)бензо[b]тиофен-3-карбоксилат.
Пример 23 синтеза исходных материалов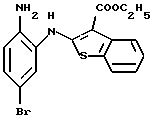
Используя этил 2-(5-бром-2-нитроанилино)бензо[b] тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-5-броманилино)бензо[b]тиофен-3-карбоксилат.
Пример 24 синтеза исходных материалов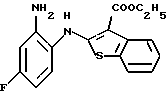
Используя этил 2-(4-фтор-2-нитроанилино)бензо[b] тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-4-фторанилино)бензо[b]тиофен-3-карбоксилат.
Пример 25 синтеза исходных материалов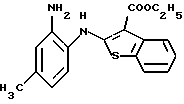
Используя этил 2-(4-метил-2-нитроанилино)бензо[b] тиофен-3-карбоксилат (6,5 г), этилацетат (140 мл), 10%-ный палладий на углероде и водород (500 мг, 60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-4-метиланилино)бензо[b]тиофен-3-карбоксилат (3,1 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,46 (ш.с, 1Н), 8,12 (д, J=8,3 Гц 1Н), 7,45 (д, J= 7,3 Гц, 1Н), 7,33 (дд, J=7,3, 7,8 Гц, 1Н), 7,18 (д, J=8,3 Гц, 1Н), 7,10 (дд, J= 7,8, 8,3 Гц, 1Н), 6,67 (c, 1Н), 6,63 (д, J=7,8 Гц, 1Н), 4,46 (кв, J=7,3 Гц, 2Н), 3,83 (ш.с, 2Н), 1,56 (с, 3Н), 1,26 (т, J=7,3 Гц, 3Н).
Пример 26 синтеза исходных материалов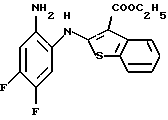
Используя этил 2-(4,5-дифтор-2-нитроанилино)бензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-4,5-дифторанилино)бензо[b]тиофен-3-карбоксилат.
Пример 27 синтеза исходных материалов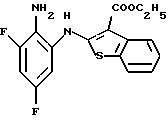
Используя этил 2-(3,5-дифтор-2-нитроанилино)бензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-3,5-дифторанилино)бензо[b]тиофен-3-карбоксилат.
Пример 28 синтеза исходных материалов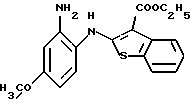
Используя этил 2-(4-метокси-2-нитроанилино)бензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-4-метоксианилино)бензо[b]тиофен-3-карбоксилат.
Пример 29 синтеза исходных материалов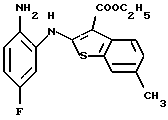
Используя этил 2-(5-фтор-2-нитроанилино)-6-метил-бензо[b] тиофен-3-карооксилат (1,9 г), этилацетат (200 мл), 10%-ный палладий на углероде (0,4 г) и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-5-фторанилино)-6-метилбензо[b] тиофен-3-карбоксилат (1,54 г).
Температура плавления: 174-175oС.
Пример 30 синтеза исходных материалов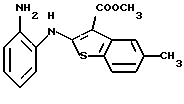
Используя метил 2-(2-нитроанилино)-5-метилбензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, метил 2-(2-аминоанилино)-5-метилбензо[b]тиофен-3-карбоксилат.
Пример 31 синтеза исходных материалов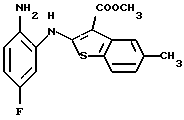
Используя метил 2-(5-фтор-2-нитроанилино)-5-метилбензо[b]тиофен-3-карбоксилат (4,42 г), этилацетат (400 мл), 10%-ный палладий на углероде и водород (400 мг, 60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, метил 2-(2-амино-5-фторанилино)-5-метилбензо[b] тиофен-3-карбоксилат (1,82 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,84 (с, 1Н), 7,94 (с, 1Н), 7,40 (д, J=7,8 Гц, 1Н), 7,19 (д, J=9,3 Гц, 1Н), 6,98 (д, J=8,3 Гц, 1Н), 6,86-6,77 (м, 2Н), 4,01 (с, 3Н), 3,69 (ш.с, 2Н), 2,45 (с, 3Н).
Пример 32 синтеза исходных материалов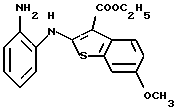
Используя этил 2-(2-нитроанилино)-6-метоксибензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-аминоанилино)-6-метоксибензо[b]тиофен-3-карбоксилат.
Пример 33 синтеза исходных материалов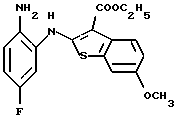
Используя этил 2-(5-фтор-2-нитроанилино)-6-метоксибензо-[b] тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-5-фторанилино)-6-метоксибензо[b]тиофен-3-карбоксилат.
Пример 34 синтеза исходных материалов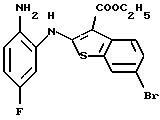
Используя этил 6-ором-2-(5-фтор-2-нитроанилино)бензо[b] тиофен-3-карбоксилат (10 г), этанол (80 мл), 18%-ную хлороводородную кислоту (80 мл) и дигидрат хлорида олова (II) (20,6 г), получали так же, как в примере 21 синтеза исходных материалов, этил 6-бром-2-(2-амино-5-фторанилино)бензо[b]тиофен-3-карбоксилат (3,8 г).
1H-ЯМР (400 МГц, CDCl3) δ: 9,81 (с, 1Н), 7,98 (д, J=8,8 Гц, 1H), 7,60 (с, 1Н), 7,41 (д, J=8,8 Гц, 1Н), 7,13 (д, J=9,3
Гц, 1H), 6,84-6,76 (м, 2Н), 4,44 (кв, J=7,3 Гц, 2Н), 3,75 (ш.с, 2Н), 1,47 (т, J=7,3 Гц, 3Н).
Пример 35 синтеза исходных материалов
Используя этил 6-бром-2-(5-фтор-2-нитроанилино)бензо[b] -тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 6-бром-2-(2-амино-5-фторанилино)бензо[b]тиофен-3-карбоксилат.
Пример 36 синтеза исходных материалов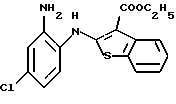
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат (6,0 г), 2,5-дихлорнитробензол (5,8 г) и диметилсульфоксид (70 мл), получали так же, как в примере 4 синтеза исходных материалов, неочищенные кристаллы (9,5 г) этил 2-(4-хлор-2-нитроанилино)бензо[b] тиофен-3-карбоксилата. Без очистки, используя этанол (100 мл), 18%-ную хлороводородную кислоту (100 мл) и дигидрат хлорида олова (II) (22,5 г), получали так же, как в примере 21 синтеза исходных материалов, этил 2-(2-амино-4-хлоранилино)бензо[b]тиофен-3-карбоксилат (3,0 г).
1H-ЯМР (400 МГц, CDCl3) δ: 9,51 (с, 1Н), 8,11 (д, J=8,3 Гц, 1Н), 7,46 (д, J= 7,8 Гц, 1Н), 7,29 (дд, J=7,3, 8,3 Гц, 1Н), 7,23 (д, J=8,3 Гц, 1Н), 7,11 (дд, J= 7,3, 3,8 Гц, 1Н), 6,81 (с, 1H), 6,75 (д, J=8,3 Гц, 1H), 4,45 (кв, J=7,3 Гц, 2Н), 3,95 (ш.с, 2Н), 1,48 (т, J=7,3 Гц, 3Н).
Пример 37 синтеза исходных материалов
Используя этил 2-(4-хлор-2-нитроанилино)бензо[b] тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-4-хлоранилино)бензо[b]тиофен-3-карбоксилат.
Пример 38 синтеза исходных материалов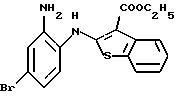
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат (6,0 г), 2,5-дибромнитробензол (8,5 г) и диметилсульфоксид (70 мл), получали так же, как в примере 4 синтеза исходных материалов, неочищенные кристаллы (7,3 г) этил 2-(4-бром-2-нитроанилино)бензо[b] тиофен-3-карбоксилата. Без очистки, используя этанол (70 мл), 10%-ную хлороводородную кислоту (70 мл) и дигидрат хлорида олова (II) (15,7 г), получали так же, как в примере 21 синтеза исходных материалов, этил 2-(2-амино-4-броманилино)бензо[b]тиофен-3-карбоксилат (3,3 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,52 (с, 1H), 8,11 (д, 1H), 7,46 (д, J=8,3 Гц, 1H), 7,31 (дд, 1Н), 7,18 (д, J=8,3 Гц, 1H), 7,11 (дд, 1H), 6,99 (с, 1H), 6,90 (д, 1H), 4,44 (кв, J=7,3 Гц, 2Н), 3,94 (ш.с, 2Н), 1,48 (т, J=7,3 Гц, 3Н).
Пример 39 синтеза исходных материалов
Используя этил 2-(4-бром-2-нитроанилино)бензо[b] тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см3), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-4-броманилино)бензо[b]тиофен-3-карбоксилат.
Пример 40 синтеза исходных материалов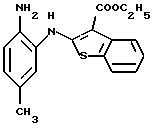
Используя этил 2-аминобензо[b]тиофен-3-карбоксилат (3,0 г), 3-фтор-4-нитротолуол (2,1 г) и диметилсульфоксид (25 мл), получали так же, как в примере 4 синтеза исходных материалов, этил 2-(5-метил-2-нитроанилино)бензо[b] тиофен-3-карбоксилат (5,4 г). Без очистки, используя 10%-ный палладий на углероде (1,5 г), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-5-метиланилино)бензо[b]тиофен-3-карбоксилат (1,6 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,61 (с, 1Н), 8,14 (д, J=7,8 Гц, 1Н), 7,47 (д, J=7,8 Гц, 1Н), 7,32 (дд, J=7,8, 7,8 Гц, 1Н), 7,13 (с, 1Н), 7,10 (дд, J= 7,8, 7,8 Гц, 1Н), 6,95 (д, J=7,8 Гц, 1Н), 6,76 (д, J=7,8 Гц, 1Н), 4,46 (кв, J=7,3 Гц, 2Н), 3,73 (ш.с, 2Н), 2,28 (с, 3Н), 1,50 (т, J=7,3 Гц, 3Н).
Пример 41 синтеза исходных материалов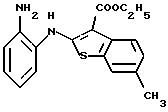
Используя этил 2-амино-6-метилбензо[b] тиофен-3-карбоксилат (4,18 г), 2-фторнитробензол (2,5 г) и диметилсульфоксид (50 мл), получали так же, как в примере 4 синтеза исходных материалов, неочищенные кристаллы (7,5 г) этил 6-метил-2-(2-нитроанилино)бензо[b] тиофен-3-карбоксилата. Без очистки, используя этанол (50 мл), 18%-ную хлороводородную кислоту (70 мл) и дигидрат хлорида олова (II) (16 г), получали так же, как в примере 21 синтеза исходных материалов, этил 2-(2-аминоанилино)-6-метилбензо[b]тиофен-3-карбоксилат (3,7 г).
1Н-ЯМР (400 МГц, CDCl3) δ: 9,53 (ш.с, 1Н), 7,99 (д, J=8,3 Гц, 1H), 7,32 (д, J=7,8 Гц, 1Н), 7,25 (с, 1Н), 7,13 (м, 2Н), 6,83-6,80 (м, 2Н), 4,44 (кв, J=7,3 Гц, 2Н), 3,86 (ш.с, 2Н), 2,37 (с, 3Н), 1,47 (т, J=7,3 Гц, 3Н).
Пример 42 синтеза исходных материалов
Используя этил 6-метил-2-(2-нитроанилино)бензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-аминоанилино)-6-метилбензо[b]тиофен-3-карбоксилат.
Пример 43 синтеза исходных материалов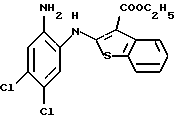
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат (6,0 г), 2,4,5-трихлорнитробензол (6,8 г) и диметилсульфоксид (70 мл), получали так же, как в примере 4 синтеза исходных материалов, неочищенные кристаллы (10,3 г) этил 2-(4,5-дихлор-2-нитроанилино)бензо[b] тиофен-3-карбоксилата. Без очистки, используя этанол (100 мл), 18%-ную хлороводородную кислоту (100 мл) и дигидрат хлорида олова (II) (22,8 г), получали так же, как в примере 21 синтеза исходных материалов, этил 2-(2-амино-4,5-дихлоранилино)бензо[b]тиофен-3-карбоксилат (5,3 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,33 (с, 1Н), 8,15 (д, J=7,3 Гц, 1Н), 7,44 (д, J= 7,8 Гц, 1Н), 7,32 (дд, J=7,8, 7,3 Гц, 1Н), 7,25 (д, J=8,8 Гц, 1Н), 7,12 (дд, J= 7,8, 7,3 Гц, 1Н), 6,69 (д, J=8,8 Гц, 1H), 4,47 (кв, J=7,3 Гц, 2Н), 4,10 (ш.с, 2Н), 1,49 (т, J=7,3 Гц, 3Н).
Пример 44 синтеза исходных материалов
Используя этил 2-(4,5-дихлор-2-нитроанилино)бензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-4,5-дихлоранилино)бензо[b]тиофен-3-карбоксилат.
Пример 45 синтеза исходных материалов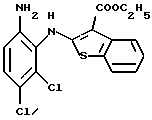
Используя этил 2-аминобензо[b] тиофен-3-карбоксилат (6,6 г), 2,3,4-трихлорнитробензол (7,0 г) и диметилсульфоксид (70 мл), получали так же, как в примере 4 синтеза исходных материалов, неочищенные кристаллы (12 г) этил 2-(2,3-дихлор-6-нитроанилино)бензо[b] тиофен-3-карбоксилата. Без очистки, используя этанол (40 мл), 18%-ную хлороводородную кислоту (60 мл) и дигидрат хлорида олова (II) (24,6 г), получали так же, как в примере 21 синтеза исходных материалов, этил 2-(6-амино-2,3-дихлоранилино)бензо[b]тиофен-3-карбоксилат (4,2 г).
Пример 46 синтеза исходных материалов
Используя этил 2-(2,3-дихлор-6-нитроанилино)бензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(6-амино-2,3-дихлоранилино)бензо[b]тиофен-3-карбоксилат.
Пример 47 синтеза исходных материалов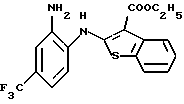
Используя этил 2-аминобензо[b]тиофен-3-карбоксилат (5,0 г), 4-фтор-3-нитробензотрифторид (5,1 г) и диметилсульфоксид (65 мл), получали так же, как в примере 4 синтеза исходных материалов, этил 2-(2-нитро-4-трифторметиланилино)бензо[b] тиофен-3-карбоксилат (12 г). Без очистки, используя этанол (50 мл), 18%-ную хлороводородную кислоту (50 мл) и дигидрат хлорида олова (II) (10,9 г), получали так же, как в примере 21 синтеза исходных материалов, этил 2-(2-амино-4-трифторметиланилино)бензо[b]тиофен-3-карбоксилат (2,8 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,93 (с, 1Н), 8,16 (д, J=8,3 Гц, 1Н), 7,52 (м, 2Н), 7,36 (дд, J=7,3, 8,3 Гц, 1Н), 7,17 (дд, J=7,3, 6,9 Гц, 1Н), 7,08 (м, 2Н), 4,48 (кв, J=7,3 Гц, 2Н), 4,08 (ш.с, 2Н), 1,51 (т, J=7,3 Гц, 3Н).
Пример 48 синтеза исходных материалов
Используя этил 2-(2-амино-4-трифторметиланилино)бензо[b]тиофен-3-карбоксилат, этилацетат, 10%-ный палладий на углероде и водород (60 кг/см2), получали так же, как в примере 19 синтеза исходных материалов, этил 2-(2-амино-4-трифторметиланилино)бензо[b]тиофен-3-карбоксилат.
Пример 49 синтеза исходных материалов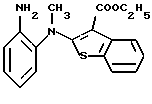
Этил 2-(2-нитроанилино)бензо[b]тиофен-3-карбоксилат (6,0 г) растворяли в N, N-диметилформамиде (120 мл) и смесь перемешивали при 0oС, добавляя при этом порциями трет-бутоксид калия (3,0 г). Добавляли по каплям при охлаждении льдом метилйодид (12,4 г) и смесь перемешивали при 0oС в течение 5 минут и нагревали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом, промывали насыщенным рассолом и сушили над безводным сульфатом магния. После естественной фильтрации выпаривали при пониженном давлении растворитель и остаток разделяли путем колоночной хроматографии на силикагеле (гексан: этилацетат = 4:1) с получением неочищенных кристаллов (2,8 г) этил 2-(N-метил-2-нитроанилино)бензо[b] тиофен-3-карбоксилата. Без очистки, используя этанол (50 мл), 18%-ную хлороводородную кислоту (50 мл) и дигидрат хлорида олова (II) (12,6 г), кристаллы обрабатывали так же, как в примере 21 синтеза исходных материалов, с получением этил 2-(2-амино-N-метиланилино)бензо[b]тиофен-3-карбоксилата (3,2 г).
1H-ЯМР (400 МГц, СDСl3) δ: 8,07 (д, 1Н), 7,49 (д, 1Н), 7,30-7,24 (м, 2Н), 7,13-7,08 (м, 2Н), 6,79-6,74 (м, 2Н), 4,26 (кв, J=7,3 Гц, 2Н), 4,10 (ш. с, 2Н), 3,36 (с, 3Н), 1,33 (т, J=7,3 Гц, 3Н).
Пример 1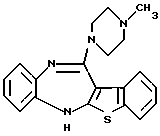
Этил 2-(2-аминоанилино)бензо[b] тиофен-3-карбоксилат (3,5 г) и 1-метилпиперазин (20 мл) растворяли в анизоле (50 мл) и к полученному раствору добавляли по каплям тетрахлорид титана (3,1 мл) при перемешивании смеси при комнатной температуре. По окончании капельного добавления смесь перемешивали при 140oС в течение 20 часов. Реакционную смесь охлаждали до 80oС и вливали в ледяную воду. Полученный осадок фильтровали. Фильтрат экстрагировали этилацетатом (900 мл), промывали насыщенным рассолом и сушили над МgSО4. Растворитель выпаривали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат-метанол) и полученное маслянистое вещество растворяли в этилацетате (50 мл) и к раствору добавляли раствор (10 мл) малеиновой кислоты (580 мг) в этилацетате. Выпавшие в осадок кристаллы собирали путем фильтрования и перекристаллизовывали из смеси этилацетат-метанол с получением 12-(4-метилпиперазин-1-ил)-6Н[1] бензотиено[2,3-b][1,5]бензодиазепин • 2 малеата (1,14 г).
Температура плавления 248-249oС (разложение).
Пример 2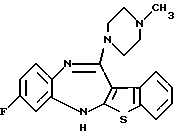
Этил 2-(2-амино-5-фторанилино)бензо[b] тиофен-3-карбоксилат (24,5 г) и 1-метилпиперазин (135 мл) растворяли в анизоле (400 мл) и к полученному раствору добавляли по каплям тетрахлорид титана (21 мл) при перемешивании смеси при комнатной температуре. По окончании капельного добавления смесь перемешивали при 140oС в течение 17 часов. Реакционную смесь охлаждали до 80oС и вливали в ледяную воду. Полученный осадок фильтровали. Фильтрат экстрагировали этилацетатом, промывали насыщенным рассолом и сушили над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат-метанол) и полученное маслянистое вещество (17 г) растворяли в этилацетате (400 мл). К полученному раствору добавляли раствор малеиновой кислоты (5,9 г) в этилацетате (100 мл) и этаноле (20 мл). Выпавшие в осадок кристаллы собирали путем фильтрования и перекристаллизовывали из этанола с получением 8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 1 малеата (10,2 г).
Температура плавления 225-227oС (разложение).
1H-ЯМР (400 МГц, СDСl3) δ: 8,35 (с, 1Н), 7,82 (д, J=7,8 Гц, 1Н), 7,74 (ш, 1Н), 7,37 (дд, J=8,3, 6,8 Гц, 1Н), 7,25 (дд, J=8,3, 6,8 Гц, 1Н), 6,89 (дд, 1Н), 6,78 (дд, 1Н), 6,63 (дд, 1Н), 6,03 (с, 2Н), 2,5-4,5 (ш.с, 8Н), 2,82 (с, 3Н).
ИК (КВr): 3435, 3283, 3060, 2837, 2614, 1616, 1580, 1463, 1387, 1353, 1152, 966, 865 см-1.
MC: m/e 366.
Анал.вычисл. для C20H19FH4S • C4H4О4: С 59,74; Н 4,80; N 11,61%.
Найдено: С 59,71; Н 4,82; N 11,46%.
Пример 3
Альтернативно, используя 2 эквивалента малеиновой кислоты, получали 8-фтор-12-(4-метилпиперазин-1-ил)-6Н[1] бензотиено[2,3-b] [1,5]бензодиазепин • дималеат • моногидрат.
Температура плавления 123-125oС (разложение).
Пример 4
Альтернативно, используя фумаровую кислоту вместо малеиновой кислоты, получали 8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1/2 фумарат (494 мг).
Температура плавления 193-195oС (разложение).
Пример 5
Альтернативно, используя 2 эквивалента хлороводородной кислоты вместо малеиновой кислоты, получали 8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 2 гидрохлорид • 3 гидрат.
Температура плавления 268-270oС (разложение).
Пример 6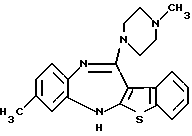
Так же, как в примере 1, используя этил 2-(2-амино-5-броманилино)бензо[b]тиофен-3-карбоксилат (1,6 г), 1-метилпиперазин (8 мл), анизол (25 мл), тетрахлорид титана (1,3 мл) и малеиновую кислоту, получали 8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин • 3/2 малеат (166 мг).
Температура плавления 198-201oС (разложение).
Пример 7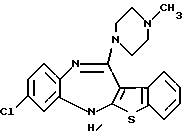
Так же, как в примере 1, используя этил 2-(2-амино-5-хлоранилино)бензо[b] тиофен-3-карбоксилат (2,6 г), 1-метилпиперазин (15 мл), анизол (50 мл) и тетрахлорид титана (2,3 мл), получали 8-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин (363 мг).
Температура плавления 87-90oС (разложение).
Пример 8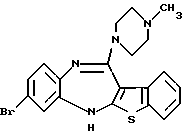
Так же, как в примере 1, используя этил 2-(2-амино-5-броманилино)бензо[b] тиофен-3-карбоксилат, 1-метилпиперазин, анизол и тетрахлорид титана, получали 8-бром-12-(4-метилпиперазин-1-ил)-6Н- [1]бензотиено[2,3-b] [1,5]бензодиазепин.
Пример 9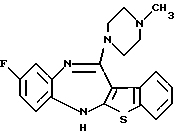
Так же, как в примере 1, используя этил 2-(2-амино-4-фторанилино)бензо[b] тиофен-3-карбоксилат, 1-метилпиперазин, анизол и тетрахлорид титана, получали 9-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепин.
Пример 10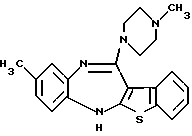
Так же, как в примере 1, используя этил 2-(2-амино-4-метиланилино)бензо[b] тиофен-3-карбоксилат (3,7 г), 1-метилпиперазин (19 мл), анизол (60 мл) и тетрахлорид титана (3,0 мл), получали 9-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин (1,18 г).
Температура плавления 184-186oС.
Анал. вычисл. для C21H22N4S: С 69,58; Н 6,12; N 15,46%.
Найдено: С 69,45; Н 6,20; N 15,11%.
Пример 11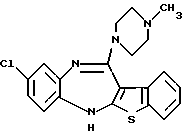
Так же, как в примере 1, используя этил 2-(2-амино-4-хлоранилино)бензо[b] тиофен-3-карбоксилат (3,0 г), 1-метилпиперазин (17 мл), анизол (75 мл), тетрахлорид титана (2,9 мл) и малеиновую кислоту, получали 9-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 2 малеат • 1/2 гидрат (1,37 г).
Температура плавления 105-107oС (разложение).
Анал. вычисл. для С20H19N4S • 2C4H4O4 • 1/2H2O: С 53,89; Н 4,52; N 8,98%.
Найдено: С 53,94; Н 4,45; N 9,00%.
Пример 12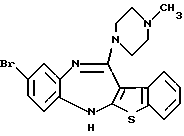
Так же, как в примере 1, используя этил 2-(2-амино-4-броманилино)бензо[b] тиофен-3-карбоксилат (3,3 г), 1-метилпиперазин (17 мл), анизол (75 мл), тетрахлорид титана (3,0 мл) и малеиновую кислоту, получали 9-бром-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 2 малеат.
Температура плавления 113-114oС (разложение).
Анал. вычисл. для C20H19BrN4S • 2C4H4О4: С 50,99; Н 4,13; N 8,50%.
Найдено: С 50,73; Н 4,15; N 8,60%.
Пример 13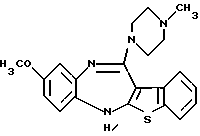
Так же, как в примере 1, используя этил 2-(2-амино-4-метоксианилино)бензо[b] тиофен-3-карбоксилат, 1-метилпиперазин, анизол и тетрахлорид титана, получали 9-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин.
Пример 14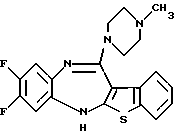
Так же, как в примере 1, используя этил 2-(2-амино-4,5-дифторанилино)бензо[b] тиофен-3-карбоксилат, 1-метилпиперазин, анизол и тетрахлорид титана, получали 8,9-дифтор-12-(4-метилпиперазин-1-ил)-6H-[1] бензотиено[2,3-b][1,5]бензодиазепин.
Пример 15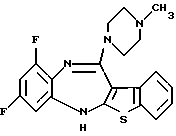
Так же, как в примере 1, используя этил 2-(2-амино-3,5-дифторанилино)бензо[b] тиофен-3-карбоксилат, 1-метилпиперазин, анизол и тетрахлорид титана, получали 8,10-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин.
Пример 16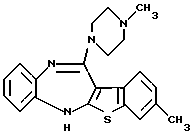
Используя этил 2-(2-аминоанилино)-6-метилбензо[b] тиофен-3-карбоксилат (3,7 г), 1-метилпиперазин (80 мл), анизол (16 мл) и тетрахлорид титана (3 мл), таким же образом, как в примере 1, получали 3-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин (1,4 г).
1H-ЯМР (400 МГц, СDСl3) δ: 7,65 (д, J=8,3 Гц, 1Н), 7,38 (с, 1Н), 7,12 (д, J= 8,3 Гц, 1Н), 7,03 (т, J=7,8 Гц, 1Н), 6,97 (дд, J=7,3, 7,8 Гц, 1Н), 6,86 (дд, J= 7,3, 5,9 Гц, 1Н), 6,64 (д, J=7,8 Гц, 1H), 5,10 (ш.с, 1Н), 4,20-1,75 (м, 8Н), 2,38 (с, 3Н), 2,33 (с, 3Н).
Пример 17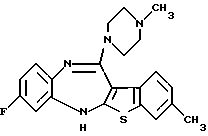
Используя этил 2-(2-амино-5-фторанилино)-6-метилбензо[b] тиофен-3-карбоксилат, 1-метилпиперазин, анизол, тетрахлорид титана и хлороводородную кислоту, таким же образом, как в примере 1, получали 8-фтор-3-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин • 2 гидрохлорид • 3/2 гидрат.
Температура плавления 273-275oС (разложение).
Пример 18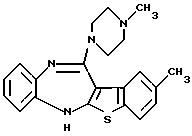
Используя метил 2-(2-аминоанилино)-5-метилбензо[b]тиофен-3-карбоксилат, 1-метилпиперазин, анизол и тетрахлорид титана, таким же образом, как в примере 1, получали 2-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин.
Пример 19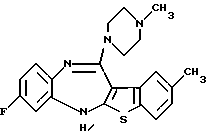
Используя метил 2-(2-амино-5-фторанилино)-5-метилбензо [b] тиофен-3-карбоксилат (1,82 г), 1-метилпиперазин (9,7 мл), анизол (30 мл), тетрахлорид титана (1,51 мл) и малеиновую кислоту, таким же образом, как в примере 1, получали 8-фтор-2-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено [2,3-b] [1,5]бензодиазепин • 1 малеиновая кислота • 1/2Н2О (928 мг).
Температура плавления 199-201oС (разложение).
Анал. вычисл. для C21H21FH4S • C4H4О4 • 1/2H2О: С 59,39; Н 5,18; N 11,08%.
Найдено: С 59,49; Н 4,98; N 11,04%.
Пример 20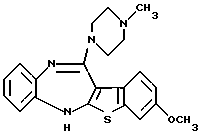
Используя этил 2-(2-аминоанилино)-5-метоксибензо[b]тиофен-3-карбоксилат, 1-метилпиперазин, анизол и тетрахлорид титана, таким же образом, как в примере 1, получали 3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин.
Пример 21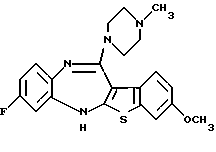
Используя этил 2-(2-амино-5-фторанилино)-6-метоксибензо [b]тиофен-3-карбоксилат, 1-метилпиперазин, анизол и тетрахлорид титана, таким же образом, как в примере 1, получали 8-фтор-3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин.
Пример 22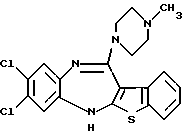
Используя этил 2-(2-амино-4,5-дихлоранилино)бензо[b] -тиофен-3-карбоксилат (5,3 г), 1-метилпиперазин (2,7 мл), анизол (120 мл), тетрахлорид титана (4,8 мл) и фумаровую кислоту, таким же образом, как в примере 1, получали 8,9-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин • 1 фумарат (571 мг).
Температура плавления 243-245oС (разложение).
Анал. вычисл. для C20H18Cl2N4S • C4H4O4: С 54,04; Н 4,16; N 10,50%.
Найдено: С 54,00; Н 4,10; N 10,41%.
Пример 23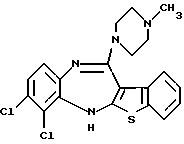
Используя этил 2-(6-амино-2,3-дихлоранилино)бензо[b]тиофен-3-карбоксилат (4,2 г), 1-метилпиперазин (22 мл), анизол (100 мл), тетрахлорид титана (3,9 мл) и фумаровую кислоту, таким же образом, как в примере 1, получали 7,8-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 1 фумарат (660 мг).
Температура плавления 235-236oС (разложение).
Анал. вычисл. для C20H18Cl2N4S • C4H4О4: С 54,04; Н 4,16; N 10,50%.
Найдено: С 53,69; Н 4,19; N 10,33%.
Пример 24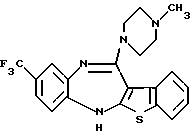
Используя этил 2-(2-амино-4-трифторметиланилино)бензо-[b]тиофен-3-карбоксилат (2,8 г), 1-метилпиперазин (15 мл), анизол (60 мл), тетрахлорид титана (2,5 мл) и малеиновую кислоту, таким же образом, как в примере 1, получали 12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 2 малеат (363 мг).
Температура плавления 128-129oС.
Анал. вычисл. для C21H19F3N4S • 2C4H4О4: С 53,70; Н 4,20; N 8,64%.
Найдено: С 53,56; Н 4,26; N 8,56%.
Пример 25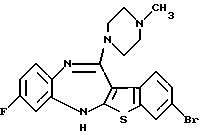
Используя этил 6-бром-2-(2-амино-5-фторанилино)бензо[b] тиофен-3-карбоксилат (3,8 г), 1-метилпиперазин (16 мл), анизол (85 мл) и тетрахлорид титана (3,0 мл), таким же образом, как в примере 1, получали 3-бром-8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин (1,16 мг).
Температура плавления 219-221oС.
Анал. вычисл. для C20H18BrFN4S: С 53,94; Н 4,07; N 12,58%.
Найдено: С 53,72; Н 3,88; N 12,41%.
Пример 26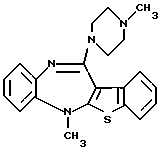
Используя этил 2-(N-метил-2-нитроанилино)бензо[b] тиофен-3-карбоксилат (3,2 г), 1-метилпиперазин, анизол (80 мл) и тетрахлорид титана (3,5 мл), таким же образом, как в примере 1, получали 6-метил-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензодиазепин (166 мг).
Температура плавления 88-90oС.
Пример 50 синтеза исходных материалов
К раствору 2-аминобензо[b]тиофен-3-карбонитрила (116 г), диметилформамида (370 мл) и 2,4-дифторнитробензола (73 мл) добавляли измельченный в порошок карбонат калия (276 г) и смесь перемешивали при 55oС в течение 5,5 часов. Реакционную смесь перемешивали при охлаждении льдом в течение 30 минут и добавляли воду (1,9 л). Смесь перемешивали еще 30 минут. Выпавшие в осадок кристаллы отфильтровывали с использованием отсоса и промывали водой (1,9 л) и высушивали в сушильном боксе в течение ночи с получением неочищенных кристаллов. Полученные кристаллы суспендировали в этилацетате (700 мл) и смесь перемешивали при нагреве с обратным холодильником в течение 2 часов, обеспечивая при этом удаление воды. Реакционную смесь охлаждали и перемешивали при 20oС в течение 1 часа. Выпавшие в осадок кристаллы отфильтровывали с использованием отсоса, промывали этилацетатом (150 мл) и высушивали с получением 2-(5-фтор-2-нитроанилино)бензо[b]тиофен-3-карбонитрила (123 г) в виде красного кристаллического порошка.
Температура плавления 161-163oС.
Пример 51 синтеза исходных материалов
К раствору 2-амино-6-фторбензо[b] тиофен-3-карбонитрила (15 г), тетрагидрофурана (140 мл) и 2-фторнитробензола (11,3 г) добавляли порциями 60%-ный гидрид натрия (3,5 г) при охлаждении льдом и смеси давали постоять при 5oС в течение 30 минут. Выпавшие в осадок кристаллы отфильтровывали с использованием отсоса, промывали изопропиловым эфиром (120 мл) и высушивали с получением 6-фтор-2-(2-нитроанилино)бензо[b]тиофен-3-карбонитрила (8,0 г).
1H-ЯМР (400 МГц, СDС13) δ: 10,13 (ш.с, 1Н), 8,28 (д, J=8,3 Гц, 1Н), 7,75 (м, 1Н), 7,61-7,57 (м, 2Н), 7,43 (м, 1Н), 7,25 (м, 1Н), 7,10 (м, 1Н).
Пример 52 синтеза исходных материалов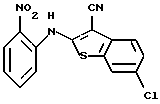
Используя 2-амино-6-хлорбензо[b] тиофен-3-карбонитрил и 2-фторнитробензол, таким же образом, как в примере 51 синтеза исходных материалов, получали 6-хлор-2-(2-нитроанилино)бензо[b]тиофен-3-карбонитрил.
Пример 53 синтеза исходных материалов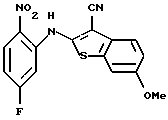
Используя 2-амино-6-метоксибензо[b]тиофен-3-карбонитрил (5,2 г) и 2,4-дифторнитробензол (4,0 г), таким же образом, как в примере 51 синтеза исходных материалов, получали 6-метокси-2-(5-фтор-2-нитроанилино)бензо[b]тиофен-3-карбонитрил (2,5 г).
1H-ЯМР (400 МГц, СDСl3) δ: 10,04 (ш.с, 1Н), 8,33 (м, 1Н), 7,74 (д, J=8,8 Гц, 1Н), 7,23 (с, 1Н), 7,13 (д, J=8,8 Гц, 1Н), 7,04 (д, J=10,3 Гц, 1Н), 6,70 (м, 1Н), 3,88 (с, 3Н).
Пример 54 синтеза исходных материалов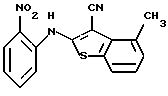
Используя 2-амино-4-метилбензо[b] тиофен-3-карбонитрил (3,8 г), 2-хлорнитробензол (3,5 г) и диметилсульфоксид (45 мл), таким же образом, как в примере 51 синтеза исходных материалов, получали 4-метил-2-(2-нитроанилино)бензо[b]тиофен-3-карбонитрил (5,8 г).
1H-ЯМР (400 МГц, СDСl3) δ: 10,31 (ш.с, 1Н), 8,28 (д, J=8,3 Гц, 1Н), 7,66-7,52 (м, 3Н), 7,27-7,11 (м, 2Н), 7,08 (д, J=7,4 Гц, 1Н), 2,81 (с, 3Н).
Пример 55 синтеза исходных материалов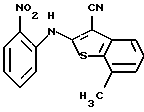
Используя 2-амино-7-метилбензо[b] тиофен-3-карбонитрил и 2-фторнитробензол, таким же образом, как в примере 51 синтеза исходных материалов, получали 7-метил-2-(2-нитроанилино)бензо[b]тиофен-3-карбонитрил.
Пример 56 синтеза исходных материалов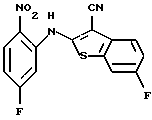
Используя 2-амино-6-фторбензо[b] тиофен-3-карбонитрил (4,9 г) и 2,4-дифторнитробензол (4,1 г), таким же образом, как в примере 51 синтеза исходных материалов, получали 6-фтор-2-(5-фтор-2-нитроанилино)бензо[b]тиофен-3-карбонитрил (7,8 г).
1H-ЯМР (400 МГц, СDСl3) δ: 10,23 (ш.с, 1Н), 8,35 (д, J=9,3, 5,1 Гц, 1Н), 7,81 (дд, J= 8,8, 4,9 Гц, 1Н), 7,48 (д, J=8,3 Гц, 1Н), 7,31-7,28 (м, 1Н), 7,14 (д, J=9,3 Гц, 1Н), 6,76 (м, 3Н).
Пример 57 синтеза исходных материалов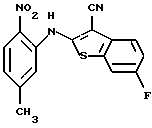
Используя 2-амино-6-фторбензо[b] тиофен-3-карбонитрил (5,0 г), 3-фтор-4-нитротолуол (4,7 г) и диметилсульфоксид (55 мл), таким же образом, как в примере 51 синтеза исходных материалов, получали 6-фтор-2-(5-метил-2-нитроанилино)бензо[b]тиофен-3-карбонитрил (7,5 г).
1H-ЯМР (400 МГц, СDСl3)  10,19 (ш.с, 1Н), 8,17 (д, J=8,8 Гц, 1Н), 7,75 (м, 1Н), 7,44 (д, J=8,3 Гц, 1Н), 7,24-7,22 (м, 2Н), 6,89 (д, J=8,8 Гц, 1Н), 2,41 (м, 3Н).
10,19 (ш.с, 1Н), 8,17 (д, J=8,8 Гц, 1Н), 7,75 (м, 1Н), 7,44 (д, J=8,3 Гц, 1Н), 7,24-7,22 (м, 2Н), 6,89 (д, J=8,8 Гц, 1Н), 2,41 (м, 3Н).
Пример 58 синтеза исходных материалов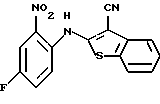
Используя 2-аминобензо[b] тиофен-3-карбонитрил (4,0 г) и 2,5-дифторнитробензол (3,7 г), таким же образом, как в примере 51 синтеза исходных материалов, получали 2-(4-фтор-2-нитроанилино)бензо[b]тиофен-3-карбонитрил (6,7 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,94 (ш.с, 1Н), 8,01 (м, 1Н), 7,79 (дд, J=7,9 Гц, 1Н), 7,71 (д, J=8,3 Гц, 1Н), 7,62 (м, 1Н), 7,50 (дд, J=7,3, 8,3 Гц, 1Н), 7,42-7,35 (м, 2Н).
Пример 59 синтеза исходных материалов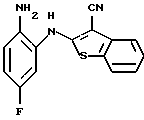
Гидросульфит натрия (86%, 233 г) суспендировали в диметилформамиде (240 мл) и суспензию нагревали до 110oС. К этой суспензии добавляли по каплям при 110oС раствор 2-(5-фтор-2-нитроанилино)бензо[b] тиофен-3-карбонитрила (120 г), диметилформамида (720 мл) и воды (27,5 мл), который (раствор) уже был нагрет до 65-70oС. Реакционную смесь перемешивали при 110oС в течение 1 часа и охлаждали до 20oС. Добавляли воду (3,3 л) 6 порциями в течение 1 часа и смесь перемешивали при 20oС в течение 1,5 часов. Выпавшие в осадок кристаллы отфильтровывали с использованием отсоса и промывали водой (2 л) с получением 2-(2-амино-5-фторанилино)бензо[b] тиофен-3-карбонитрила (158 г, влажная масса) в виде кристаллов цвета охры.
Температура плавления 178-180oС (разложение).
Пример 27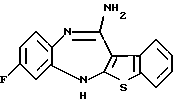
2-(2-Амино-5-фторанилино)бензо[b] тиофен-3-карбонитрил (155 г) суспендировали в смеси метанола (250 мл) и воды (200 мл) и к суспензии добавляли 35%-ную водную хлороводородную кислоту (42 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 5,5 часов. Реакционную смесь охлаждали и перемешивали при 20oС в течение 1 часа. Выпавшие в осадок кристаллы отфильтровывали с использованием отсоса, промывали последовательно водой (500 мл) и изопропиловым спиртом (200 мл) и высушивали в сушильном боксе в течение ночи с получением 12-амино-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин • 1 гидрохлорида (104 г) в виде желтых кристаллов.
Температура плавления 213-216oС (разложение).
Пример 28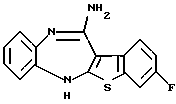
Хлорид олова (II) (50 г) растворяли в 18%-ной хлороводородной кислоте (250 мл), раствор нагревали до 50oС и добавляли к нему суспензию 6-фтор-2-(2-нитроанилино)бензо[b] тиофен-3-карбонитрила (20 г) в этаноле (280 мл). Смесь нагревали с обратным холодильником в течение 4 часов. Затем реакционную смесь охлаждали до 40oС и вливали в воду (1 л), после чего давали смеси постоять еще 30 минут. Выпавшие в осадок кристаллы отфильтровывали с использованием отсоса и промывали водой (500 мл) с получением 12-амино-3-фтор-8Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорида (15 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 11,46 (с, 1Н), 9,92 (с, 1Н), 9,00 (с, 1H), 7,84 (д, J=6,3 Гц, 1Н), 7,69 (м, 1Н), 7,31 (м, 1Н), 7,20-6,98 (м, 4Н).
Пример 29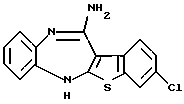
Используя 6-хлор-2-(2-нитроанилино)бензо[b] тиофен-3-карбонитрил, таким же образом, как в примере 28, получали 12-амино-3-хлор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-1 гидрохлорид.
Пример 30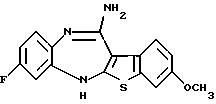
Используя 6-метокси-2-(5-фтор-2-нитроанилино)бензо[b] тиофен-3-карбонитрил (2,5 г), таким же образом, как в примере 28, получали 12-амино-8-фтор-3-метокси-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин • 1 гидрохлорид (2,1 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 11,68 (ш.с, 1H), 10,02 (ш.с, 1H), 9,09 (ш. с, 1H), 9,01 (ш.с, 1H), 7,58 (д, J=8,8 Гц, 1H), 7,53 (с, 1H), 7,10-6,95 (м, 3Н), 6,86 (д, J=9,3 Гц, 1H), 3,78 (с, 3Н).
Пример 31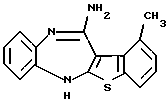
Используя 4-метил-2-(2-нитроанилино)бензо[b] тиофен-3-карбонитрил (2,5 г), таким же образом, как в примере 28, получали 12-амино-1-метил-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид.
1H-ЯМР (400 МГц, ДМСО-d6)  11,32 (с, 1Н), 10,02 (с, 1Н), 9,08 (с, 1Н), 8,64 (с, 1Н), 7,71 (д, J=7,3 Гц, 1Н), 7,27-7,15 (м, 5Н), 7,02 (д, J=7,3 Гц, 1Н), 2,36 (м, 3Н).
11,32 (с, 1Н), 10,02 (с, 1Н), 9,08 (с, 1Н), 8,64 (с, 1Н), 7,71 (д, J=7,3 Гц, 1Н), 7,27-7,15 (м, 5Н), 7,02 (д, J=7,3 Гц, 1Н), 2,36 (м, 3Н).
Пример 32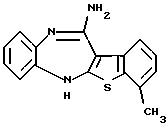
Используя 7-метил-2-(2-нитроанилино)бензо[b]тиофен-3-карбонитрил, таким же образом, как в примере 28, получали 12-амино-4-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид.
Пример 33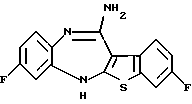
Используя 6-фтор-2-(5-фтор-2-нитроанилино)бензо[b] тиофен-3-карбонитрил (7,8 г), таким же образом, как в примере 28, получали 12-амино-3,8-дифтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин 1 гидрохлорид (4,8 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 11,51 (с, 1Н), 10,08 (с, 1Н), 9,05 (с, 2Н), 7,86 (д, J=8,7 Гц, 1Н), 7,70 (м, 1Н), 7,32 (м, 1Н), 7,11 (м, 1Н), 7,00 (м, 1Н), 6,86 (д, J=9,3 Гц, 1Н).
Пример 34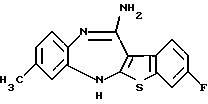
Используя 6-фтор-2-(5-метил-2-нитроанилино)бензо[b]-тиофен-3-карбонитрил (7,4 г), таким же образом, как в примере 28, получали 12-амино-3-фтор-8-метил-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (8,5 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 11,53 (с, 1Н), 9,92 (ш.с, 1Н), 9,02 (ш.с, 1Н), 8,95 (ш. с, 1Н), 7,84 (д, J=8,8 Гц, 1Н), 7,68 (д, J=8,7 Гц, 1Н), 7,30 (дд, J=8,8, 9,3 Гц, 1Н), 6,96-6,91 (м, 2Н), 6,97 (с, 1Н), 2,22 (м, 3Н).
Пример 35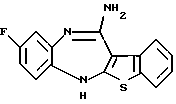
Используя 2-(4-фтор-2-нитроанилино)бензо[b]тиофен-3-карбонитрил (6,7 г), таким же образом, как в примере 28, получали 12-амино-9-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (4,8 г).
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 11,73 (с, 1Н), 10,06 (с, 1Н), 9,14 (с, 1Н), 9,11 (с, 1Н), 7,87 (д, J=7,8 Гц, 1Н), 7,68 (д, J=7,8 Гц, 1Н), 7,42 (дд, J= 8,3, 7,3 Гц, 1H), 7,28 (дд, J=7,8; 7,3 Гц, 1Н), 7,10-7,04 (м, 2Н), 6,93 (дд, J=9,3, 2,4 Гц, 1Н).
Пример 36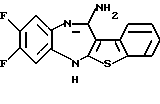
Используя 2-аминобензо[b] тиофен-3-карбонитрил (5,0 г) и 2,4,5-трифторнитробензол (5,1 г), получали так же, как в примере 51 синтеза исходных материалов, неочищенные кристаллы (8,7 г) 2-(4,5-дифтор-2-нитроанилино)бензо[b] тиофен-3-карбонитрила. Без очистки, используя дигидрат хлорида олова (II) (95 г), 18%-ную хлороводородную кислоту (65 мл) и этанол (120 мл), получали так же, как в примере 28, 12-амино-8,9-дифтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (7,7 г).
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 11,36 (ш.с, 1Н), 9,97 (с, 1Н), 9,16 (ш.с, 1H), 9,09 (ш. с, 1Н), 7,90 (д, J=7,8 Гц, 1Н), 7,69 (д, J=8,3 Гц, 1H), 7,44 (т, J=7,8 Гц, 1H), 7,32 (дд, 7,3 Гц, 1Н), 7,21 (дд, J=7,9, 8,7 Гц, 1Н), 7,05 (т, J=7,8 Гц, 1Н).
Пример 37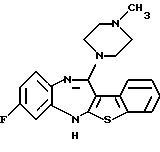
К 12-(4-метилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепину (63,5 г) добавляли этанол (320 мл) и смесь нагревали для растворения. Добавляли активированный древесный уголь (1,9 г) для естественной фильтрации и смесь промывали этанолом (220 мл). Раствор нагревали до 35oС и добавляли к нему по каплям при перемешивании раствор малеиновой кислоты (20,1 г) в водном органическом растворе (95 мл, при естественной фильтрации после растворения). Раствор перемешивали при 35oС в течение 1 часа, охлаждали и перемешивали при 20oС в течение 2 часов. Выпавшие в осадок кристаллы собирали путем фильтрования, промывали этанолом (130 мл) и высушивали при 50oС с получением 12-(4-метилпиперазин-1-ил)-8-фтор-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепин • 1 малеата (50,5 г) в виде бледно-желтых кристаллов.
Температура плавления 225-227oС (разложение).
Используя подходящую органическую или неорганическую кислоту вместо малеиновой кислоты, использованной в вышеописанных примерах, можно синтезировать следующие соли.
Пример 38
12-(4-метилпиперазин-1-ил)-8-фтор-6Н-[1] -бензотиено[2,3-b] [1,5] бензодиазепин (1 метансульфонат.
Температура плавления 303,5oС (разложение).
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 9,64 (ш.с, 1Н), 8,36 (с, 1Н), 7,82 (д, 1Н), 7,38 (дд, 1Н), 7,25 (дд, 1Н), 6,89 (дд, 1Н), 6,79 (дд, 1Н), 6,62 (д, 1Н), 3,10-3,60 (м, 8Н), 2,85 (с, 3Н), 2,30 (с, 3Н).
ИК (КВr): 3246, 1618, 1518, 1385 см-1.
MC: m/e 366.
Анал. вычисл. для C20H19FN4S • CH4О3S: С 54,53; Н 5,01; N 12,11%.
Найдено: С 54,35; Н 5,04; N 11,94%.
Пример 39
12-(4-метилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин • 2 нитрат.
Температура плавления 170oС (разложение).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 9,78 (ш.с, 1Н), 7,92 (д, 1Н), 7,58-7,77 (м, 1Н), 7,45 (дд, 1Н), 7,33 (дд, 1Н), 6,77-6,98 (м, 3Н), 3,20-3,90 (м, 8Н), 2,84 (с, 3Н).
ИК (КВr): 3462, 3043, 1599, 1508 см-1.
MC: m/e 366.
Анал. вычисл. для С20Н19FN4S • 2НNО3 • 0,5Н2О: С 47,90; Н 4,42; N 16,76%.
Найдено: С 47,89; Н 4,44; N 16,75%.
Пример 40
12-(4-метилпиперазин-1-ил)-8-фтор-6Н-[1] -бензотиено[2,3-b] [1,5] бензодиазепин • 1,5 сульфат.
Температура плавления 236-239oС (разложение).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 9,69 (ш, 1Н), 7,87 (д, 1Н), 7,80-7,86 (м, 1Н), 7,42 (дд, 1Н), 7,30 (дд, 1Н), 6,60-7,10 (м, 3Н), 3,80-4,40 (м, 8Н), 2,89 (с, 3Н).
ИК (КВr): 3406, 2986, 1597, 1510 см-1.
MC: m/e 366.
Анал. вычисл. для C20H19FN4S • 1,5H2SО4 • 1,5H2O: С 44,43; Н 4,66; N 10,36%.
Найдено: С 44,45; Н 4,65; N 10,31%.
Пример 41
12-(4-метилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин • 2 фосфат.
Температура плавления 189-192oС (разложение).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 8,29 (с, 1Н), 7,81 (д, 1Н), 7,71 (д, 1Н), 7,35 (дд, 1Н), 7,23 (дд, 1Н), 6,87 (дд, 3Н), 6,70 (д, 1Н), 6,56 (д, 1Н), 2,40-3,90 (м, 8Н), 2,44 (с, 3Н).
ИК (КВr): 3429, 2922, 1597, 1510 см-1.
MC: m/e 366.
Анал. вычисл. для С20Н19FN4S • 2Н3РO4 • 1H2O: С 41,38; Н 4,69; N 9,65%.
Найдено: С 41,54; Н 5,11; N 9,66%.
Пример 42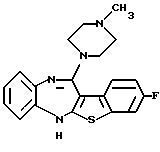
12-Амино-3-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин • 1 гидрохлорид (12 г) растворяли в N-метилпиперазине (140 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до 40oС, экстрагировали этилацетатом (250 мл) и промывали насыщенным рассолом (100 мл). Этилацетатный слой сушили над сульфатом магния. Раствор подвергали естественному фильтрованию и выпаривали при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат-метанол) с получением неочищенных кристаллов 3-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина. Полученные неочищенные кристаллы растворяли в этилацетате (30 мл) и к полученному раствору добавляли раствор малеиновой кислоты (1,83 г) в этаноле (20 мл). Выпавшие в осадок кристаллы собирали путем фильтрования и перекристаллизовывали из водного этанола с получением 3-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 малеата (2,82 г).
Температура плавления 209oС.
Анал. вычисл. для C20H19FN4S • C4H4O4: С 59,74; Н 4,80; N 11,61%.
Найдено: С 59,66; Н 4,69; N 11,56%.
Пример 43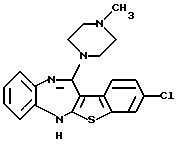
Используя 12-амино-3-хлор-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепин • 1 гидрохлорид и N-метилпиперазин, таким же образом, как в примере 42, получали 3-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин.
Пример 44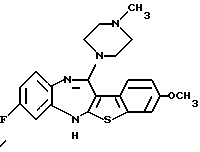
Используя 12-амино-8-фтор-3-метокси-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (1,6 г), N-метилпиперазин (50 мл) и лимонную кислоту, таким же образом, как в примере 42, получали неочищенные кристаллы (1,0 г) 8-фтор-3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепина. Кристаллы растворяли в этаноле (10 мл) и к полученному раствору добавляли раствор лимонной кислоты (552 мг) в этаноле (10 мл). Выпавшую в осадок соль перекристаллизовывали из смешанного растворителя, состоявшего из этилацетата и этанола, с получением 8-фтор-3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 цитрат дигидрата (204 мг).
Температура плавления 118-120oС.
Анал. вычисл. для C21H21FN4OS • C6H8O7 • 2H2O: С 51,92; Н 5,33; N 8,97%.
Найдено: С 52,18; Н 5,19; N 8,63%.
Пример 45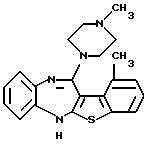
Используя 12-амино-1-метил-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепин • 1 гидрохлорид и N-метилпиперазин, таким же образом, как в примере 42, получали 1-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин.
Пример 46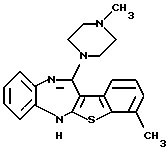
Используя 12-амино-4-метил-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепин • 1 гидрохлорид и N-метилпиперазин, таким же образом, как в примере 42, получали 4-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин.
Пример 47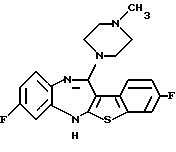
Используя 12-амино-3,8-дифтор-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепин • 1 гидрохлорид (8,0 г), N-метилпиперазин (100 мл) и малеиновую кислоту, таким же образом, как в примере 42, получали 3,8-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 малеат (3,4 г).
Температура плавления 211-213oС.
Анал. вычисл. для C20H18FN4S • C4H4О4: С 57,59; Н 4,43; N 11,19%.
Найдено: С 57,58; Н 4,37; N 11,10%.
Пример 48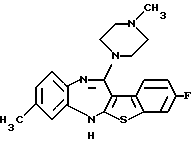
Используя 12-амино-3-фтор-8-метил-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин • 1 гидрохлорид (8,5 г), N-метилпиперазин (100 мл) и хлороводородную кислоту, таким же образом, как в примере 42, получали 3-фтор-8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 2 гидрохлорид.
Температура плавления 240-242oС.
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 11,82 (ш.с, 1Н), 11,09 (ш.с, 1H), 7,89-7,54 (м, 2Н), 7,33-7,26 (м, 2Н), 6,98-6,96 (м, 2Н), 4,79-2,87 (м, 11Н), 2,24 (с, 3Н).
Пример 49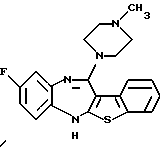
Используя 12-амино-9-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (2,0 г), N-метилпиперазин (40 мл) и малеиновую кислоту, таким же образом, как в примере 42, получали 9-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 2 малеат (1,2 г).
Температура плавления 136-137oС.
Анал. вычисл. для C20H19FN4S • 2C4H4O4: С 56,18; Н 4,55; N 9,36%.
Найдено: С 56,14; Н 4,58; N 9,32%.
Пример 50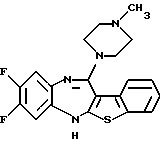
Используя 12-амино-8,9-дифтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (4,0 г), N-метилпиперазин (40 мл) и малеиновую кислоту, таким же образом, как в примере 42, получали 8,9-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 малеат (924 мг).
Температура плавления 144-146oС (разложение).
Анал. вычисл. для С20Н18F2N4S • C4H4O4: С 57,59; Н 4,43; N 11,19%.
Найдено: С 57,39; Н 4,44; N 11,10%.
Пример 51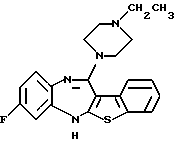
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (1,3 г), N-этилпиперазин (25 мл) и малеиновую кислоту, таким же образом, как в примере 42, получали 12-(4-этилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 1 малеат (731 мг).
Температура плавления 211-212oС.
Анал. вычисл. для C21H21FN4S • C4H4O4: С 60,47; Н 5,07; N 11,28%.
Найдено: С 60,30; Н 5,03; N 11,18%.
Пример 52
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (1,5 г), N-н-пропилпиперазин (17 мл), диметилсульфоксид (10 мл) и хлороводородную кислоту, таким же образом, как в примере 42, получали неочищенные кристаллы (850 мг) 8-фтор-12-(4-пропилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина. Неочищенные кристаллы растворяли в этилацетате (12 мл) и к полученному раствору добавляли раствор 5,5 моль/л хлороводородной кислоты в эфире с получением 8-фтор-12-(4-пропилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин • 2 гидрохлорид • 1,5 гидрата (757 мг).
Температура плавления 215-217oС (разложение).
Анал. вычисл. для С22Н23FN4S • 2НСl • 3/2Н2O: С 53,44; Н 5,71; N 11,33%.
Найдено: С 53,33; Н 5,78; N 11,14%.
Пример 53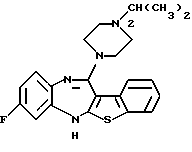
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (1,5 г), N-изопропилпиперазин (17 мл), диметилсульфоксид (10 мл) и малеиновую кислоту, таким же образом, как в примере 42, получали 8-фтор-12-(4-изопропилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 малеат (521 мг).
Температура плавления 217oС.
Анал. вычисл. для C22H23FN4S • С4H4O4: С 61,16; Н 5,33; N 10,97%.
Найдено: С 61,03; Н 5,30; N 10,91%.
Пример 54
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (1,7 г), N-циклопропилпиперазин (8 г), диметилсульфоксид (10 мл) и малеиновую кислоту, таким же образом, как в примере 42, получали 12-(4-циклопропилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин • 1 малеат (877 мг).
Температура плавления 182-183oС.
Анал. вычисл. для C22H21FN4S • C4H4O4: С 61,40; Н 4,95; N 11,02%.
Найдено: С 61,28; Н 4,88; N 10,82%.
Пример 55
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (1,3 г), N-(2-гидроксиэтил)пиперазин (12,5 мл), диметилсульфоксид (5 мл) и малеиновую кислоту, таким же образом, как в примере 42, получали 8-фтор-12-[4-(2-гидроксиэтил)пиперазин-1-ил]-6Н-[1]бензотиено[2,3-b] [1,5]бензодиазепин • 2 малеат • 1 гидрат (1,18 г).
Температура плавления 75-77oС.
Анал. вычисл. для C21H21FN4OS • 2C4H4О4 • Н2O: С 53,86; Н 4,83; N 8,66%.
Найдено: С 53,80; Н 4,94; N 8,67%.
Пример 56
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (1,4 г), N-метилгомопиперазин (5,4 г), диметилсульфоксид (25 мл) и лимонную кислоту, таким же образом, как в примере 42, получали 8-фтор-12-(4-метилгомопиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 цитрат • 0,5 гидрат (455 мг).
Температура плавления 98-100oС (разложение).
Анал. вычисл. для C21H21FN4OS • C6H8O7 • 1/2Н2O: С 55,76; Н 5,20; N 9,63%.
Найдено: С 55,48; Н 5,60; N 8,64%.
Пример 57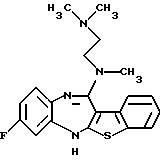
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепин • 1 гидрохлорид (1,3 г), N,N,N'-триметилэтилендиамин (13 г), диметилсульфоксид (5 мл) и лимонную кислоту, таким же образом, как в примере 42, получали 8-фтор-12-[N-(2-диметиламиноэтил)-N-метиламино] -6Н-[1] бензотиено[2,3-b][1,5] бензодиазепин • 1 цитрат • 1 гидрат (289 мг).
Температура плавления 72-74oС (разложение).
Анал. вычисл. для С20Н21FN4S • С6Н8O7 • H2O: С 53,97; Н 5,40; N 9,68%.
Найдено: С 53,60; Н 5,27; N 9,02%.
Пример 58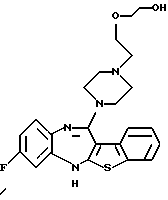
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (1,6 г), 1-[2-(2-гидроксиэтокси)этил]пиперазин (13 г) и диметилсульфоксид (5 мл), таким же образом, как в примере 42, получали 8-фтор-12-{4-[2-(2-гидроксиэтокси)этил]-1-пиперазинил}-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепин (422 мг).
Температура плавления 198oС.
Анал. вычисл. для C23H25FN4O2S: С 62,71; Н 5,72; N 12,72%.
Найдено: С 62,63; Н 5,59; N 12,57%.
Пример 59
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (2,1 г), N-бензилпиперазин (25 г), диметилсульфоксид (10 мл) и хлороводородную кислоту, таким же образом, как в примере 42, получали 8-фтор-12-(4-бензилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 2 гидрохлорид • 1/4 гидрат (360 г).
Температура плавления 260-262oС.
Пример 60
Используя 12-амино-8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид (2,0 г), трет-бутил-1-пиперазинкарбоксилат (5 г) и диметилсульфоксид (15 мл), таким же образом, как в примере 42, получали 8-фтор-12-(4-трет-бутоксикарбонилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепин (1,6 г).
1Н-ЯМР (400 МГц, CDCl3) δ: 7,76 (д, J=7,8 Гц, 1Н), 7,6 (д, J=7,8 Гц, 1H), 7,32 (дд, J=7,4, 7,1 Гц, 1Н), 7,22 (дд, J=9,2, 8,3 Гц, 1H), 6,97 (дд, J= 8,8, 2,9 Гц, 1H), 6,70 (дд, J=8,3, 2,8 Гц, 1H), 6,42 (дд, J=8,8, 2,9 Гц, 1H), 5,18 (ш.с, 1H), 4,20-0,70 (м, 9Н), 1,44 (с, 9Н).
Пример 61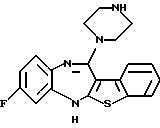
8-Фтор-12-(4-трет-бутоксикарбонилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b] [1,5] бензодиазепин (1,6 г) растворяли в трифторуксусной кислоте (8 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Трифторуксусную кислоту выпаривали при пониженном давлении. Остаток растворяли в этилацетате и к полученному раствору добавляли насыщенный водный раствор гидрокарбоната натрия. Смесь перемешивали при комнатной температуре в течение 2 часов и этилацетатный слой сушили над сульфатом магния. После естественной фильтрации выпаривали растворитель и остаток разделяли и очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол=4:1) с получением 8-фтор-12-(пиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина (1,7 г), который обрабатывали малеиновой кислотой с получением 8-фтор-12-(пиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин • 3/2 малеат • 1/2 гидрата (347 мг).
Температура плавления 141-143oС (разложение).
Анал. вычисл. для C19H17FN4S • 3/2C4H4O4 • 1/2H2O: С 56,17; Н 4,34; N 10,48%.
Найдено: С 56,30; Н 4,58; N 10,08%.
Пример 62
8-Фтор-3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5] бензодиазепин (500 мг) растворяли в дихлорметане (15 мл) и добавляли этандитиол (2,10 мл) и хлорид алюминия (2,51 г). Смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли к реакционной смеси воду (50 мл) и затем 10%-ный водный раствор гидроксида натрия, пока смесь не становилась щелочной. Смесь экстрагировали хлороформом, промывали водой, промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток разделяли путем колоночной хроматографии на силикагеле (хлороформ:метанол = 5:1) и перекристаллизовывали из этилацетата с получением 8-фтор-3-гидрокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]-бензодиазепина (251 мг).
1H-ЯМР (400 МГц, СDСl3) δ: 7,59 (д, 1Н), 7,01 (д, 1Н), 6,96 (дд, 1Н), 6,83 (дд, 1Н), 6,68 (м, 1Н), 6,41 (дд, 1Н), 5,09 (ш.с, 1Н), 4,00-2,00 (м, 8Н), 2,34 (с, 3Н).
Пример 63
8-Фтор-12-(пиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] -бензодиазепин (260 мг) растворяли в толуоле (5 мл) и добавляли безводную уксусную кислоту (230 мг) и триэтиламин (375 мг). Смесь перемешивали при 80oС в течение 30 минут. Давали реакционной смеси остыть до комнатной температуры и экстрагировали ее хлороформом, промывали водой и сушили над безводным сульфатом магния. После естественной фильтрации выпаривали при пониженном давлении растворитель и остаток перекристаллизовывали из метанола с получением 8-фтор-12-(4-ацетилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1/4 гидрата (97 мг).
Температура плавления >290oС.
Анал. вычисл. для C21H19FN4OS • 1/4H2O: С 63,22; Н 4,93; N 14,04%.
Найдено: С 62,97; Н 4,67; N 13,75%.
Пример 64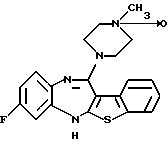
К раствору 8-фтор-12-(4-метилпиперазин-1-ил)-8Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина (100 мг) в этаноле (2 мл) добавляли 30%-ный водный раствор пероксида водорода (0,1 мл) и смесь перемешивали при комнатной температуре в течение 3 часов и затем оставляли стоять в течение суток. Полученную суспензию фильтровали и растворитель выпаривали при пониженном давлении. Полученный остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 5:1) с получением 8-фтор-12-(4-метилпиперазин-4 -оксид-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепина (50 мг) в виде желтого маслянистого вещества.
1Н-ЯМР (400 МГц, СDСl3) δ: 3,00-3,80 (8Н, м, СН2х4), 3,25 (3Н, с, СН3), 6,46 (1Н, дд, J=2,9, 8,8 Гц, АrН), 6,47 (1Н, ддд, J=2,4, 2,9, 8,3 Гц, АrН), 6,97 (1Н, дд, J=2,9, 8,8 Гц, АrН), 7,24 (1H, д, J=7,4 Гц, АrН), 7,37 (1H, дд, J=7,3, 7,8 Гц, АrН), 7,63 (1H, д, J=8,3 Гц, АrН), 7,72 (1H, д, J=8,3 Гц, АrН).
МС: т/е 383 (М+1).
Пример 65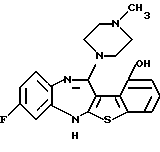
Используя 8-фтор-1-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин, дихлорметан, этандитиол и хлорид алюминия, таким же образом, как в примере 62, получали 8-фтор-1-гидрокси-12-(4-метилпиперазин-1-
ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин.
Пример 66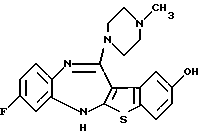
Используя 8-фтор-2-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин, дихлорметан, этандитиол и хлорид алюминия, таким же образом, как в примере 62, получали 8-фтор-2-гидрокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин.
Пример 67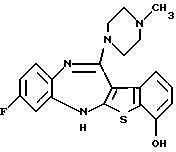
Используя 8-фтор-4-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин, дихлорметан, этандитиол и хлорид алюминия, таким же образом, как в примере 62, получали 8-фтор-4-гидрокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин.
Пример 68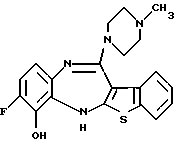
Используя 8-фтор-7-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин, дихлорметан, этандитиол и хлорид алюминия, таким же образом, как в примере 62, получали 8-фтор-7-гидрокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин.
Пример 69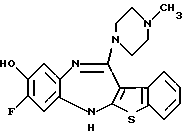
Используя 8-фтор-9-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин, дихлорметан, этандитиол и хлорид алюминия, таким же образом, как в примере 62, получали 8-фтор-9-гидрокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин.
Пример 70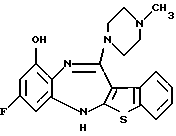
Используя 8-фтор-10-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b][1,5]бензодиазепин, дихлорметан, этандитиол и хлорид алюминия, таким же образом, как в примере 62, получали 8-фтор-10-гидрокси-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин.
Пример 71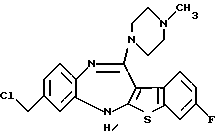
8-Фтор-8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин растворяли в тетрахлориде углерода и подвергали взаимодействию с 2,2'-азобис(изобутилонитрилом) в присутствии N-хлорсукцинимида с получением 8-хлорметил-3-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5]бензодиазепина.
Пример 72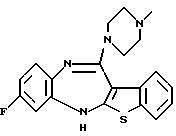
12-Амино-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин гидрохлорид (102 г) суспендировали в толуоле (600 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 3 часов для удаления воды. Смесь охлаждали до 70oС в атмосфере азота и добавляли к ней N-метилпиперазин (300 мл). Смесь перемешивали при нагревании в атмосфере азота до тех пор, пока внутренняя температура не достигала 120oС, с удалением при этом толуола в течение 1,5 часов. Смесь нагревали в атмосфере азота при 120oС в течение 2,5 часов и охлаждали до 25oС в атмосфере азота. Добавляли к реакционной смеси для экстрагирования этилацетат (600 мл) и воду (450 мл) и полученный этилацетатный слой промывали три раза водой (300 мл). После того как было подтверждено, что рН промывной воды составляет 7-8, растворитель концентрировали при пониженном давлении. Добавляли ацетонитрил (100 мл) и смесь азеотропно концентрировали досуха при пониженном давлении. К остатку добавляли ацетонитрил (300 мл) и смесь нагревали для растворения. Раствор охлаждали и перемешивали при температуре в пределах от -10oС до -5oС в течение 2,5 часов для обеспечения возможности выпадения кристаллов. Выпавшие в осадок кристаллы отфильтровывали путем отсоса и промывали ацетонитрилом (100 мл) с последующим высушиванием, получив в результате 8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин (65,5 г).
Температура плавления 167-169oС.
Пример 73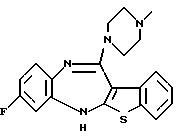
Используя эквивалентное количество хлороводородной кислоты, вместо малеиновой кислоты в примере 2, получали 8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин • 1 гидрохлорид.
Температура плавления 310,3oС.
МС: m/e 366.
Анал. вычисл. для C20H19FN4S • HCl: С 59,62; Н 5,00; N 13,91%.
Найдено: С 59,43; Н 5,02; N 13,88%.
Пример 60 синтеза исходных материалов
2-Бром-4,5,6,7-тетрагидробензо[b] тиофен-3-карбоновую кислоту (6 г) суспендировали в тионилхлориде (30 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 75 минут. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (50 мл). Этот толуольный раствор добавляли по каплям к раствору 2-аминофенола (2,5 г) в пиридине (50 мл) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 2 часов и путем тонкослойной хроматографии убеждались в окончании реакции. Выпаривали при пониженном давлении растворитель и остаток растворяли в этилацетате. Смесь промывали разбавленной хлороводородной кислотой и насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Выпаривали при пониженном давлении растворитель. К остатку добавляли диизопропиловый эфир и смесь фильтровали с получением 2-бром-4,5,6,7-тетрагидро-N-(2-гидроксифенил)бензо[b]тиофен-3-карбоксамида (5,3 г).
1H-ЯМР (400 МГц, СDСl3) δ: 8,65 (ш, 1Н), 7,94 (ш, 1Н), 7,15-7,19 (м, 2Н), 7,06 (д, J=8,3 Гц, 1Н), 6,91 (м, 1Н), 2,75-2,78 (м, 2Н), 2,67-2,70 (м, 2Н), 1,77-1,86 (м, 4Н).
Пример 61 синтеза исходных материалов
Используя 2-бром-4,5,6,7-тетрагидробензо[b] тиофен-3-карбоновую кислоту (6 г), тионилхлорид (30 мл) и 2-амино-5-метилфенол (3,14 г), таким же образом, как в примере 60 синтеза исходных материалов, получали 2-бром-4,5,6,7-тетрагидро-N-(2-гидрокси-4-метилфенил)бензо[b] тиофен-3-карбоксамид (5,8 г).
1H-ЯМР (400 МГц, СDСl3) δ: 9,66 (с, 1Н), 9,33 (ш, 1Н), 7,62 (д, J=8,3 Гц, 1Н), 6,71 (с, 1Н), 6,62 (д, J=8,3 Гц, 1Н), 2,66-2,50 (м, 4Н), 2,22 (с, 3Н), 1,76-1,72 (м, 4Н).
Пример 62 синтеза исходных материалов
Используя 2-бром-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоновую кислоту, тионилхлорид и 2-амино-5-фторфенол, таким же образом, как в примере 60 синтеза исходных материалов, получали 2-бром-4,5,6,7-тетрагидро-N-(4-фтор-2-гидроксифенил)бензо[b]тиофен-3-карбоксамид.
Пример 63 синтеза исходных материалов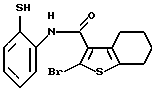
Используя 2-бром-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоновую кислоту, тионилхлорид и 2-аминотиофенол, таким же образом, как в примере 60 синтеза исходных материалов, получали 2-бром-4,5,6,7-тетрагидро-N-(2-меркаптофенил)бензо[b]тиофен-3-карбоксамид.
Пример 64 синтеза исходных материалов
Используя 2-бром-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоновую кислоту, тионилхлорид и 2-амино-5-метилтиофенол, таким же образом, как в примере 60 синтеза исходных материалов, получали 2-бром-4,5,6,7-тетрагидро-N-(2-меркапто-4-метилфенил)бензо[b]тиофен-3-карбоксамид.
Пример 65 синтеза исходных материалов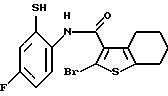
Используя 2-бром-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоновую кислоту, тионилхлорид и 2-амино-5-фтортиофенол, таким же образом, как в примере 60 синтеза исходных материалов, получали 2-бром-4,5,6,7-тетрагидро-N-(4-фтор-2-меркаптофенил)бензо[b]тиофен-3-карбоксамид.
Пример 74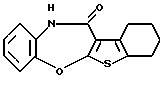
К раствору 2-бром-4,5,6,7-тетрагидро-N-(2-гидроксифенил)бензо[b] тиофен-3-карбоксамида (5,3 г) в диметилсульфоксиде (50 мл) добавляли карбонат калия (4,2 г) и смесь перемешивали при 140oС в течение 4 часов. Путем тонкослойной хроматографии убеждались в окончании реакции. Смесь охлаждали до комнатной температуры и вливали в воду (300 мл). После нейтрализации хлороводородной кислотой смесь экстрагировали два раза хлороформом и промывали насыщенным рассолом. Органический слой сушили над сульфатом магния и выпаривали при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (хлороформ) с получением 1,2,3,4-тетрагидро-[1]бензотиено[2,3-b] [1,5]бензоксазепин-12(11Н)-она (2,1 г).
1H-ЯМР (400 МГц, ДМСО-d6)  7,81 (ш, 1Н), 7,10-7,17 (м, 3Н), 6,98 (д, J=8,3 Гц, 1Н), 2,75-2,78 (м, 2Н), 2,58-6,61 (м, 2Н), 1,73-1,83 (м, 4Н).
7,81 (ш, 1Н), 7,10-7,17 (м, 3Н), 6,98 (д, J=8,3 Гц, 1Н), 2,75-2,78 (м, 2Н), 2,58-6,61 (м, 2Н), 1,73-1,83 (м, 4Н).
Пример 75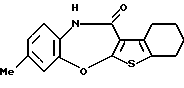
Используя 2-бром-4,5,6,7-тетрагидро-N-(2-гидрокси-4-метилфенил)бензо[b] тиофен-3-карбоксамид (5,8 г), диметилсульфоксид (80 мл) и карбонат калия (4,7 г), таким же образом, как в примере 18, получали 1,2,3,4-тетрагидро-8-метил-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11H)-он (1,87 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 10,03 (с, 1Н), 7,03-6,99 (м, 3Н), 2,62-2,56 (м, 4Н), 2,25 (с, 3Н), 1,73-1,67 (м, 4Н).
Пример 76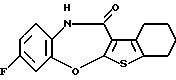
Используя 2-бром-4,5,6,7-тетрагидро-N-(4-фтор-2-гидроксифенил)бензо[b] тиофен-3-карбоксамид, диметилсульфоксид и карбонат калия, таким же образом, как в примере 74, получали 8-фтор-1,2,3,4-тетрагидро[1]бензотиено[2,3-b] [1,5]бензоксазепин-12(11Н)-он.
Пример 77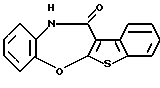
1,2,3,4-Тетрагидро[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-он (1,5 г) и дихлордициано-п-бензохинон (2,6 г) растворяли в бензоле (45 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 12 часов. Реакционную смесь выпаривали при пониженном давлении для удаления растворителя и остаток добавляли к смеси хлороформ-вода. Органический слой промывали водой и сушили над сульфатом магния. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ) с получением [1]бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-она (1,25 г).
Температура плавления 240-242oС.
Пример 78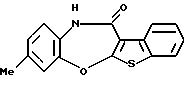
Используя 1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b][1,5] бензоксазепин-12(11Н)-он (1,87 г), дихлордициано-п-бензохинон (3,1 г) и бензол (55 мл), таким же образом, как в примере 77, получали 8-метил-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11H)-он (1,5 г).
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 10,26 (с, 1Н), 8,25 (д, J=8,3 Гц, 1H), 7,89 (д, J=7,8 Гц, 1Н), 7,43-7,38 (м, 2Н), 7,14-7,06 (м, 2Н), 7,10 (с, 1H), 2,09 (с, 3Н).
Пример 79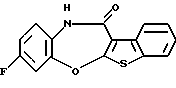
Используя 8-фтор-1,2,3,4-тетрагидро[1] бензотиено[2,3-b] [1,5]бензоксазепин-12(11H)-он, дихлордициано-п-бензохинон и бензол, таким же образом, как в примере 77, получали 8-фтор-[1] бензотиено[2,3-b] [1,5]бензоксазепин-12(11H)-он.
Пример 80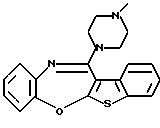
[1]Бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-он (0,7 г) суспендировали в оксихлориде фосфора (5 мл) и добавляли N,N-диметиланилин (0,17 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Растворитель выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (10 мл) при охлаждении льдом и смесь перемешивали при нагревании с обратным холодильником в течение 40 минут. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали при пониженном давлении. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом магния. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол=100:1). Полученное маслянистое вещество растворяли в этилацетате и добавляли раствор фумаровой кислоты (135 мг) в этаноле. Полученные кристаллы перекристаллизовывали из смеси этилацетат-этанол с получением 12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b] [1,5]бензоксазепин • 1/2 фумарата (264 мг).
Температура плавления 240-242oC.
Пример 81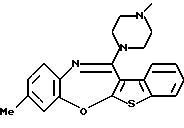
Используя 8-метил-[1]бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-он (1,5 г), оксихлорид фосфора (15,3 мл), N,N-диметиланилин (380 мг), 1-метилпиперазин (25 мл) и фумаровую кислоту (176 мг), таким же образом, как в примере 80, получали 8-метил-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензоксазепин • 1/2 фумарат • 1/4 гидрат (221 мг).
Температура плавления 140-141oС (этанол/вода).
Пример 82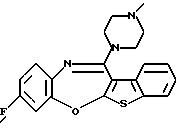
Используя 8-фтор-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11Н)-он, оксихлорид фосфора, N,N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 80, получали 8-фтор-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5] бензоксазепин.
Пример 83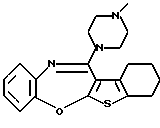
Используя 1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5]бензоксазепин-12(11Н)-он (0,6 г), оксихлорид фосфора (5 мл), N,N-диметиланилин (0,14 мл), 1-метилпиперазин (10 мл) и фумаровую кислоту (260 мг), таким же образом, как в примере 80, получали 1,2,3,4-тетрагидро-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензоксазепин фумарат (575 мг).
Температура плавления 247-249oС (этанол/вода).
Пример 84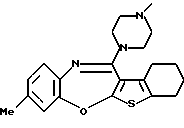
Используя 1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b] [1,5]бензоксазепин-12(11Н)-он, оксихлорид фосфора, N,N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 80, получали 1,2,3,4-тетрагидро-8-метил-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензоксазепин.
Пример 85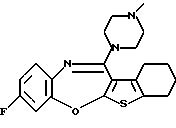
Используя 8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b][1,5]бензоксазепин-12(11Н)-он, оксихлорид фосфора, N,N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 80, получали 8-фтор-1,2,3,4-тетрагидро-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензоксазепин.
Пример 66 синтеза исходных материалов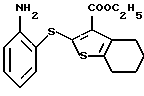
2-Аминобензолтиол (1,1 г) растворяли в N,N-диметилформамиде (25 мл) и добавляли 60%-ный гидрид натрия (360 мг). Смесь перемешивали при комнатной температуре в течение 20 минут. Добавляли к смеси этил 2-бром-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксилат (2,6 г) и смесь перемешивали при 140oС в течение 1,5 часов и давали ей остыть до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (300 мл), промывали водой (200 мл) и сушили над безводным сульфатом натрия. Выпаривали при пониженном давлении растворитель и полученные неочищенные кристаллы промывали изпропиловым эфиром и фильтровали с получением этил 2-(2-аминобензолтио)-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксилата (1,4 г).
1H-ЯМР (400 МГц, СDСl3) δ: 7,50 (д, J=7,4 Гц, 1Н), 7,28 (м, 1Н), 6,80 (м, 2Н), 4,43 (ш.с., 2Н), 4,38 (кв, J=7,3 Гц, 2Н), 2,78 (м, 2Н), 2,52 (м, 2Н), 1,73-1,60 (м, 4Н), 1,41 (т, 3Н).
Пример 86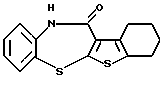
Этил 2-(2-аминобензолтио)-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоксилат (1,4 г) растворяли в N,N-диметилформамиде (20 мл) и добавляли 60%-ный гидрид натрия (170 мг). Смесь перемешивали при 80oС в течение 1,5 часов и при 110oС в течение 45 минут. Реакционной смеси давали остыть и вливали ее в воду (300 мл) с последующим подкислением 35%-ной хлороводородной кислотой. Отфильтровывание выпавших в осадок кристаллов дало 1,2,3,4-тетрагидро[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-он (1,3 г).
1H-ЯМР (400 МГц, CDCl3) δ: 8,54 (ш.с, 1Н), 7,79 (д, 1Н), 7,64-7,45 (м, 3Н), 3,27-2,82 (м, 4Н), 2,36-1,57 (м, 4Н).
Альтернативно, используя 2-бром-4,5,6,7-тетрагидро-N-(2-меркаптофенил)бензо[b] тиофен-3-карбоксамид, диметилсульфоксид и карбонат калия, таким же образом, как в примере 18, получали 1,2,3,4-тетрагидро [1]бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-он.
Пример 87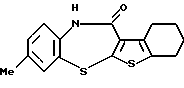
Используя 2-бром-4,5,6,7-тетрагидро-N-(2-меркапто-4-метилфенил)бензо[b] тиофен-3-карбоксамид, диметилсульфоксид и карбонат калия, таким же образом, как в примере 18, получали 1,2,3,4-тетрагидро-8-метил-[1]бензотиено[2,3-b] [1,5]бензотиазепин-12(11H)-он (1,87 г).
Пример 88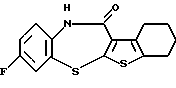
Используя 2-бром-4,5,6,7-тетрагидро-N-(4-фтор-2-меркаптофенил)бензо[b] тиофен-3-карбоксамид, диметилсульфоксид и карбонат калия, таким же образом, как в примере 74, получали 8-фтор-1,2,3,4-тетрагидро[1]бензотиено[2,3-b] [1,5]бензотиазепин-12(11H)-он.
Пример 89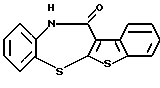
Используя 1,2,3,4-тетрагидро[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-он (1,2 г), дихлордициано-п-бензохинон (2,1 г) и толуол (20 мл), таким же образом, как в примере 77, получали [1]бензотиено[2,3-b][1,5]бензотиазепин-12(11H)-он (500 мг).
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 10,77 (ш.с, 1Н), 8,10 (д, J=8,3 Гц, 1H), 7,96 (д, J=6,4 Гц, 1Н), 7,56 (д, J=8,4 Гц, 1Н), 7,42 (м, 3Н), 7,31 (д, J=8,4 Гц, 1H), 7,19 (дд, J=7,4, 7,8 Гц, 1H).
Пример 90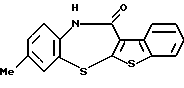
Используя 1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b][1,5]бензотиазепин-12(11H)-он, дихлордициано-п-бензохинон и бензол, таким же образом, как в примере 77, получали 8-метил-[1]бензотиено[2,3-b][1,5]бензотиазепин-12(11H)-он.
Пример 91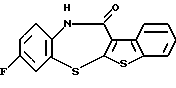
Используя 8-фтор-1,2,3,4-тетрагидро[1] бензотиено[2,3-b] [1,5]бензотиазепин-12(11Н)-он, дихлордициано-п-бензохинон и бензол, таким же образом, как в примере 77, получали 8-фтор-[1] бензотиено[2,3-b] [1,5]бензотиазепин-12(11Н)-он.
Пример 92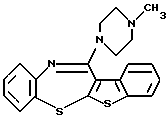
Используя [1] бензотиено[2,3-b][1,5]бензотиазепин-12-(11Н)-он (500 мг), оксихлорид фосфора (6,3 мл), N,N-диметиланилин (190 мг) и 1-метилпиперазин (5 мл), таким же образом, как в примере 80, получали 12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензотиазепин (278 мг).
1H-ЯМР (400 МГц, СDСl3) δ: 7,87 (д, J=7,8 Гц, 1Н), 7,70 (д, J=7,8 Гц, 1Н), 7,38-7,29 (м, 3Н), 7,20 (дд, J=7,3, 7,8 Гц, 1Н), 7,07 (д, J=8,3 Гц, 1Н), 6,91 (дд, J= 8,3, 8,5 Гц, 1Н), 4,11-3,84 (м, 2Н), 3,24-3,06 (м, 2Н), 2,76 (м, 1Н), 2,50-2,30 (м, 3Н), 2,33 (с, 3Н).
Пример 93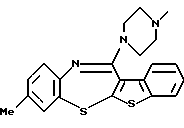
Используя 8-метил-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-он, оксихлорид фосфора, N,N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 80, получали 8-метил-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензотиазепин.
Пример 94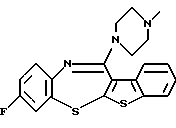
Используя 8-фтор-[1] бензотиено [2,3-b] [1,5]бензотиазепин-12(11Н)-он, оксихлорид фосфора, N,N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 80, получали 8-фтор-12-(4-метилпиперазин-1-ил)-[1]бензотиено [2,3-b][1,5] бензотиазепин.
Пример 95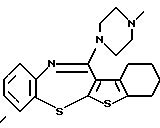
Используя 1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5]бензотиазепин-12(11Н)-он, оксихлорид фосфора, N,N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 80, получали 1,2,3,4-тетрагидро-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензотиазепин.
Пример 96
Используя 1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-он, оксихлорид фосфора, N,N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 80, получали 1,2,3,4-тетрагидро-8-метил-12-(4-метилпиперазин-1-ил)-[1]бензотиено [2,3-b][1,5]бензотиазепин.
Пример 97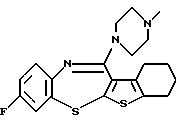
Используя 8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b][1,5]бензотиазепин-12(11Н)-он, оксихлорид фосфора, N,N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 80, получали 8-фтор-1,2,3,4-тетрагидро-12-(4-метилпиперазин-1-ил)-[1]бензотиено[2,3-b][1,5]бензотиазепин.
Пример 67 синтеза исходных материалов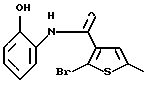
2-Бром-5-метил-3-тиофенкарбоновую кислоту (5 г) суспендировали в тионилхлориде (20 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 75 минут. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (5 мл). Этот толуольный раствор добавляли по каплям к раствору 2-аминофенола (3,7 г) в пиридине (30 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 6 часов и выпаривали при пониженном давлении растворитель. Остаток растворяли в этилацетате. Раствор промывали разбавленной хлороводородной кислотой и насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и к остатку добавляли диизопропиловый эфир. Выпавшие в осадок кристаллы отфильтровали и промывали гексаном с получением N-(2-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (5,5 г).
1Н-ЯМР (400 МГц, СDСl3) δ: 2,45 (3Н, с, СН3), 6,92 (1Н, т, АrН), 7,06 (1Н, д, АrН), 7,16 (3Н, м, ArH, H тиофенового кольца), 8,53, 8,63 (1Н, 1H, ш, ш, NH, ОН).
Пример 68 синтеза исходных материалов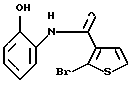
2-Бром-3-тиофенкарбоновую кислоту (30 г) суспендировали в тионилхлориде (35 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (10 мл). Этот толуольный раствор добавляли по каплям к раствору 2-аминофенола (19 г) в пиридине (100 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 20 минут и выпаривали при пониженном давлении растворитель. Остаток растворяли в этилацетате. Раствор промывали разбавленной хлороводородной кислотой и насыщенным водным раствором гидрокарбоната натрия и выпавшие в осадок кристаллы собирали путем фильтрования с получением N-(2-гидроксифенил)-5-бром-3-тиофенкарбоксамида (21 г). Фильтрат концентрировали и выпавшие кристаллы собирали путем фильтрования с получением N-(2-гидроксифенил)-2-бром-3-тиофенкарбоксамида (10 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 6,82 (1Н, т, J=7,8 Гц, ArH), 6,91 (1Н, д, J=8,3 Гц, ArH), 7,00 (1Н, т, J=7,8 Гц, ArH), 7,40 (1H, д, J=5,3 Гц, Н тиофенового кольца), 7,68 (1Н, д, J=5,8 Гц, Н тиофенового кольца), 7,81 (1H, д, J=7,8 Гц, ArH), 9,30 (1H, ш, NH или ОН), 9,87 (1H, ш, NH или ОН).
Пример 69 синтеза исходных материалов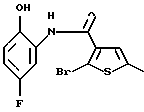
2-Бром-5-метил-3-тиофенкарбоновую кислоту (3 г) суспендировали в тионилхлориде (15 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 40 минут. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (5 мл). Этот толуольный раствор добавляли по каплям к раствору 2-амино-4-фторфенола (1,7 г) в пиридине (20 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 1,5 часов и выпаривали при пониженном давлении растворитель. К остатку добавляли смесь вода-этил-ацетат. Выпавшие в осадок кристаллы собирали путем фильтрования с получением N-(3-фтор-6-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (2,1 г). Фильтрат экстрагировали три раза этилацетатом и полученный органический слой промывали водой. Органический слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. К остатку добавляли этилацетат и выпавшие в осадок кристаллы собирали путем фильтрования с получением N-(3-фтор-6-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (1,3 г).
Температура плавления 210-212oС.
Пример 70 синтеза исходных материалов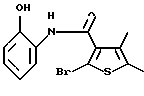
2-Бром-4,5-диметил-3-тиофенкарбоновую кислоту (2,9 г) суспендировали в тионилхлориде (15 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 65 минут. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (25 мл). Этот толуольный раствор добавляли по каплям к раствору 2-аминофенола (1,5 г) в пиридине (30 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 1,5 часов и выпаривали при пониженном давлении растворитель. К остатку добавляли этилацетат и смесь промывали разбавленной хлороводородной кислотой, водой и насыщенным рассолом. Органический слой сушили над сульфатом магния и выпаривали при пониженном давлении растворитель. К остатку добавляли диизопропиловый эфир и выпавшие в осадок кристаллы собирали путем фильтрования с получением N-(2-гидроксифенил)-2-бром-4,5-диметил-3-тиофенкарбоксамида (3,3 г).
1H-ЯМР (400 МГц, CD3OD) δ: 2,20 (3Н, с, СН3), 2,33 (3Н, с, СН3), 6,90 (2Н, м, АrН), 7,03 (1Н, м, АrН), 7,87 (1Н, м, ArH).
Пример 71 синтеза исходных материалов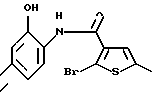
2-Бром-5-метил-3-тиофенкарбоновую кислоту (3 г) суспендировали в тионилхлориде (15 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 70 минут. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (20 мл). Этот толуольный раствор добавляли по каплям к раствору 2-амино-5-метилфенола (1,7 г) в пиридине (20 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 2 часов и выпаривали при пониженном давлении растворитель. К остатку добавляли смесь разбавленная хлороводородная кислота-этилацетат. Выпавшие в осадок кристаллы собирали путем фильтрования с получением N-(2-гидрокси-4-метилфенил)-2-бром-5-метил-3-тиофенкарбоксамида (3,3 г).
Температура плавления 210-212oС.
Пример 72 синтеза исходных материалов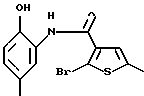
2-Бром-5-метил-3-тиофенкарбоновую кислоту (2 г) суспендировали в тионилхлориде (10 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 50 минут. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (20 мл). Этот толуольный раствор добавляли по каплям к раствору 2-амино-4-метилфенола (1,1 г) в пиридине (20 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 2,5 часов и выпаривали при пониженном давлении растворитель. К остатку добавляли смесь этилацетат-диизопропиловый эфир. Выпавшие в осадок кристаллы собирали путем фильтрования с получением N-(2-гидрокси-5-метилфенил)-2-бром-5-метил-3-тиофенкарбоксамида (2,6 г).
Температура плавления 173-175oС.
Пример 73 синтеза исходных материалов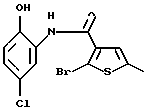
2-Бром-5-метил-3-тиофенкарбоновую кислоту (3,5 г) суспендировали в тионилхлориде (17 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (20 мл). Этот толуольный раствор добавляли по каплям к раствору 2-амино-4-хлорфенола (2,3 г) в пиридине (35 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 1,5 часов и выпаривали при пониженном давлении растворитель. К остатку добавляли смесь этилацетат-диизопропиловый эфир и выпавшие в осадок кристаллы собирали путем фильтрования и промывали разбавленной хлороводородной кислотой и затем диизопропиловым эфиром с получением N-(3-хлор-6-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (4,1 г).
Температура плавления 232-235oС.
Пример 74 синтеза исходных материалов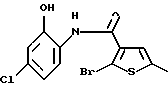
2-Бром-5-метил-3-тиофенкарбоновую кислоту (4,6 г) суспендировали в тионилхлориде (15 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 35 минут. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (20 мл). Этот толуольный раствор добавляли по каплям к раствору 2-амино-5-хлорфенола (3,0 г) в пиридине (15 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 1 часа и вливали в смесь разбавленная хлороводородная кислота-этилацетат. Выпавшие в осадок кристаллы собирали путем фильтрования с получением N-(4-хлор-2-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (3,4 г).
1H-ЯМР (400 МГц, СD3ОD) δ: 2,42 (3Н, с, СН3), 6,87 (1Н, д, J=8,8 Гц, АrН), 6,90 (1Н, с, Н тиофенового кольца), 7,12 (1Н, с, АrН), 7,84 (1Н, д, J= 8,8 Гц, АrН), 9,23 (1Н, ш, NH или ОН), 10,48 (1Н, ш, NH или ОН).
Пример 75 синтеза исходных материалов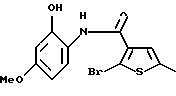
2-Бром-5-метил-3-тиофенкарбонилхлорид (2,6 г), полученный так, как описано выше, из 2-бром-5-метил-3-тиофенкарбоновой кислоты и тионилхлорида, суспендировали в толуоле (20 мл). Этот толуольный раствор добавляли по каплям к раствору 2-амино-5-метоксифенола (2,0 г) в пиридине (50 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 2,5 часов и выпаривали при пониженном давлении растворитель. Выпавшие в осадок кристаллы собирали путем фильтрования и промывали разбавленной хлороводородной кислотой и затем диизопропиловым эфиром с получением N-(2-гидрокси-4-метоксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (2,1 г).
Температура плавления 183-184oС.
Пример 76 синтеза исходных материалов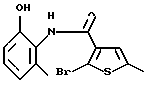
2-Бром-5-метил-3-тиофенкарбонилхлорид (2,6 г), полученный так, как описано выше, из 2-бром-5-метил-3-тиофенкарбоновой кислоты и тионилхлорида, суспендировали в толуоле (20 мл). Этот толуольный раствор добавляли по каплям к раствору 2-амино-3-метилфенола (1,4 г) в пиридине (30 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 3 часов и добавляли к ней смесь диизопропиловый эфир-этилацетат. Выпавшие в осадок кристаллы собирали путем фильтрования и промывали разбавленной хлороводородной кислотой и диизопропиловым эфиром с получением N-(2-гидрокси-6-метилфенил)-2-бром-5-метил-3-тиофенкарбоксамида (3,0 г).
Температура плавления 164-167oС.
Пример 77 синтеза исходных материалов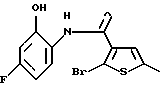
Используя 2-бром-5-метил-3-тиофенкарбоновую кислоту, тионилхлорид и 2-амино-5-фторфенол, таким же образом, как в примере 67 синтеза исходных материалов, получали N-(4-фтор-2-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамид.
Пример 78 синтеза исходных материалов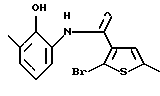
Используя 2-бром-5-метил-3-тиофенкарбоновую кислоту, тионилхлорид и 2-амино-6-метилфенол, таким же образом, как в примере 67 синтеза исходных материалов, получали N-(2-гидрокси-3-метилфенил)-2-бром-5-метил-3-тиофенкарбоксамид.
Пример 79 синтеза исходных материалов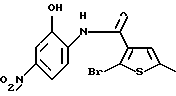
Используя 2-бром-5-метил-3-тиофенкарбоновую кислоту, тионилхлорид и 2-амино-5-нитрофенол, таким же образом, как в примере 67 синтеза исходных материалов, получали N-(2-гидрокси-4-нитрофенил)-2-бром-5-метил-3-тиофенкарбоксамид.
Пример 80 синтеза исходных материалов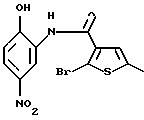
Используя 2-бром-5-метил-3-тиофенкарбоновую кислоту, тионилхлорид и 2-амино-4-нитрофенол, таким же образом, как в примере 67 синтеза исходных материалов, получали N-(2-гидрокси-5-нитрофенил)-2-бром-5-метил-3-тиофенкарбоксамид.
Пример 81 синтеза исходных материалов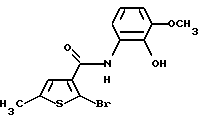
2-Бром-5-метил-3-тиофенкарбоновую кислоту (2,52 г) суспендировали в тионилхлориде (12 мл) и смесь перемешивали при 60oС в течение 70 минут. Выпаривали при пониженном давлении тионилхлорид и остаток растворяли в толуоле (20 мл). Этот толуольный раствор добавляли по каплям к раствору 2-амино-6-метоксифенолгидрохлорида (2,0 г) в пиридине (42 мл) при 0oС. Смесь перемешивали при комнатной температуре в течение 2 часов и выпаривали при пониженном давлении растворитель. К остатку добавляли смесь этилацетат-диизопропиловый эфир. Выпавшие в осадок кристаллы собирали путем фильтрования и промывали 0,5 н. хлороводородной кислотой, диизопропиловым эфиром и гексаном с получением N-(2-гидрокси-3-метоксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (3,46 г).
Температура плавления 169-172oС.
1Н-ЯМР (400 МГц, СDС13) δ: 2,41 (3Н, с, СН3), 3,89 (3Н, с, СН3), 6,27 (1Н, с, ОН), 6,68 (1Н, д, J=8,3 Гц, АrН), 6,86 (1Н, дд, J=8,3 Гц, АrН), 7,09 (1Н, с, Н тиофенового кольца), 8,62 (1Н, ш.с, NH).
МС: m/e 342.
Пример 98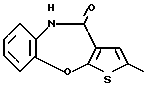
К раствору N-(2-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (15 г) в диметилсульфоксиде (100 мл) добавляли карбонат калия (13 г) и смесь перемешивали при 140oС в течение 1,5 часов. Реакционную смесь охлаждали до комнатной температуры и вливали в воду (800 мл). После нейтрализации хлороводородной кислотой смесь экстрагировали два раза хлороформом и промывали водой и насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. К остатку добавляли хлороформ и выпавшие кристаллы собирали путем фильтрования с получением 2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (3,3 г).
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (1Н, с, СН3), 6,72 (1Н, с, Н тиофенового кольца), 7,09-7,23 (4Н, м, АrН), 10,12 (1Н, ш, NH).
Пример 99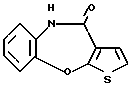
К раствору N-(2-гидроксифенил)-2-бром-3-тиофенкарбоксамида (16 г) в диметилсульфоксиде (160 мл) добавляли карбонат калия (15 г) и смесь перемешивали при 150-160oС в течение 25 минут. Реакционную смесь охлаждали до комнатной температуры и вливали в смесь вода-этилацетат. Выпавшие в осадок кристаллы собирали путем фильтрования и промывали водой и диизопропиловым эфиром с получением тиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (5,3 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 7,02 (2Н, с, Н тиофенового кольца), 7,12-7,26 (4Н, м, АrН), 10,20 (1Н, ш, NH).
Пример 100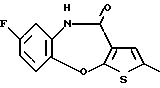
К раствору N-(3-фтор-6-гидроксифенил)-2-бром-3-тиофенкарбоксамида (3,3 г) в диметилсульфоксиде (100 мл) добавляли карбонат калия (2,8 г) и смесь перемешивали при 140oС в течение 1 часа. Реакционную систему охлаждали до комнатной температуры и вливали в разбавленную хлороводородную кислоту при охлаждении льдом. Выпавшие в осадок кристаллы собирали путем фильтрования, растворяли в хлороформе, промывали насыщенным рассолом и сушили над сульфатом магния. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол= 99,5:0,5). Выпаривали при пониженном давлении растворитель.
К остатку добавляли этилацетат и выпавшие кристаллы собирали путем фильтрования с получением 7-фтор-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (350 мг).
Температура плавления 274-275oС.
Пример 101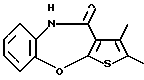
К раствору N-(2-гидроксифенил)-2-бром-4,5-дифенил-3-тиофенкарбоксамида (3,3 г) в диметилсульфоксиде (50 мл) добавляли карбонат калия (2,8 г) и смесь перемешивали при 160-170oС в течение 20 минут. Реакционную систему охлаждали до комнатной температуры и вливали в смесь вода-этилацетат. Отфильтровывали нерастворимые материалы и фильтрат экстрагировали этилацетатом, промывали водой и сушили над сульфатом магния. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат=4:1) с получением 2,3-диметилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-она (1,4 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 2,13 (3Н, с, СН3), 2,21 (3Н, с, СН3), 7,11-7,22 (4Н, м, АrН), 10,17 (1Н, ш, NH).
Пример 102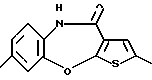
К раствору N-(2-гидрокси-4-метилфенил)-2-бром-3-тиофенкарбоксамида (3,4 г) в диметилсульфоксиде (30 мл) добавляли карбонат калия (2,9 г) и смесь перемешивали при 140-150oС в течение 1 часа. Реакционную систему охлаждали до комнатной температуры и вливали в воду. Выпавшие в осадок кристаллы собирали путем фильтрования, промывали водой и очищали путем колоночной хроматографии на силикагеле (хлороформ) с получением 2,8-диметилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-она (1,2 г).
Температура плавления 211-215oС.
Пример 103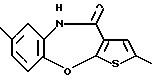
К раствору N-(2-гидрокси-5-метилфенил)-2-бром-3-тиофенкарбоксамида (2,9 г) в диметилсульфоксиде (24 мл) добавляли карбонат калия (2,4 г) и смесь перемешивали при 140-150oС в течение 2 часов. Реакционную систему охлаждали до комнатной температуры и вливали в ледяную воду. Выпавшие в осадок кристаллы собирали путем фильтрования. Фильтрат экстрагировали два раза хлороформом и органический слой сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель. Остаток и вышеупомянутые кристаллы объединяли и очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол= 20: 1). Полученное твердое вещество собирали путем отфильтровывания из гексана с получением 2,7-диметилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-она (1,0 г).
Температура плавления 175-179oС.
Пример 104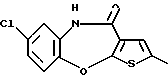
К раствору N-(3-хлор-6-гидроксифенил)-2-бром-3-тиофенкарбоксамида (4,1 г) в диметилсульфоксиде (33 мл) добавляли карбонат калия (3,3 г) и смесь перемешивали при 140-150oС в течение 75 минут. Реакционную систему охлаждали до комнатной температуры и вливали в ледяную воду. Выпавшие в осадок кристаллы собирали путем фильтрования. Фильтрат экстрагировали два раза хлороформом, органический слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. Остаток и вышеупомянутые кристаллы объединяли и очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол=20:1, гексан:этилацетат=1:1-этилацетат:метанол=20:1). Полученное твердое вещество собирали путем отфильтровывания из смеси гексан-этилацетат с получением 7-хлор-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (660 мг).
Температура плавления 250-253oС
Пример 105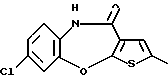
Используя N-(4-хлор-2-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамид и карбонат калия, путем осуществления аналогичной реакции получали 8-хлор-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он.
Пример 106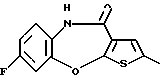
Используя N-(4-фтор-2-гидроксифенил)-2-бром-5-метил-3-тиофенкарбоксамид и карбонат калия, путем осуществления аналогичной реакции получали 9-фтор-2-метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он.
Пример 107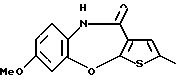
К раствору N-(2-гидрокси-4-метоксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (2,1 г) в диметилсульфоксиде (17 мл) добавляли карбонат калия (1,7 г) и смесь перемешивали при 145oС в течение 2 часов. Реакционную систему охлаждали до комнатной температуры и вливали в ледяную воду. Выпавшие в осадок кристаллы собирали путем фильтрования и очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 20:0-20:1). Полученное твердое вещество собирали путем отфильтровывания из смеси диизопропиловый эфир-этилацетат-метанол с получением 8-метокси-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она (530 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (3Н, с, СН3), 3,72 (3Н, с, ОСН3), 6,52 (1Н, с, Н тиофенового кольца), 6,70-7,07 (2Н, м, АrН), 7,28 (1Н, д, АrН), 10,25 (1Н, ш, NH).
Пример 108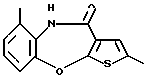
К раствору N-(2-гидрокси-6-метилфенил)-2-бром-5-метил-3-тиофенкарбоксамида (3,0 г) в диметилсульфоксиде (25 мл) добавляли карбонат калия (2,5 г) и смесь перемешивали при 145oС в течение 2 часов. Реакционную систему охлаждали до комнатной температуры и вливали в ледяную воду. Выпавшие в осадок кристаллы собирали путем фильтрования и фильтрат экстрагировали хлороформом, промывали два раза водой и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток и кристаллы, полученные ранее, очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 20: 0-20:1). Полученное твердое вещество собирали путем отфильтровывания из смеси диизопропиловый эфир-гексан с получением 2,6-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (700 мг).
Температура плавления 198-200oС.
Пример 109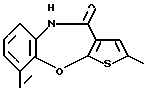
Используя N-(2-гидрокси-3-метилфенил)-2-бром-5-метил-3-тиофенкарбоксамид и карбонат калия, таким же образом, как в примере 98, получали 2,9-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он.
Пример 110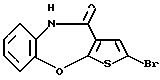
Тиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (2 г) суспендировали в уксусной кислоте (30 мл) и к суспензии добавляли по каплям в течение 30 минут раствор брома (1,5 г) в уксусной кислоте (10 мл). Смесь перемешивали при комнатной температуре в течение 35 минут и вливали в воду. Выпавшие в осадок кристаллы собирали путем фильтрования и промывали водой и диизопропиловым эфиром с получением 2-бромтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (2,2 г).
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 7,12-7,16 (3Н, м, АrН, H тиофенового кольца), 7,20-7,26 (2Н, м, АrН), 10,29 (1Н, ш, NH).
Пример 111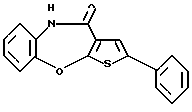
2-Бромтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он (1,0 г) растворяли в смеси 2 М карбонат натрия (8 мл)-толуол (8 мл)-этанол (8 мл) и добавляли фенилборат (620 мг) и тетракистрифенилфосфинпалладий (390 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 80 минут. Реакционную систему охлаждали до комнатной температуры и добавляли диизопропиловый эфир и этилацетат. Выпавшие кристаллы собирали путем фильтрования и промывали этилацетатом и водой с получением 2-фенилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-она (830 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 7,18-7,46 (8Н, м, АrН), 7,65 (2Н, м, АrН), 10,34 (1Н, ш, NH).
Пример 112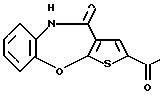
Тиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (5 г) суспендировали в 1,2-дихлорэтане (50 мл) и добавляли ацетилхлорид (2,2 г). К этой реакционной системе добавляли порциями хлорид алюминия (15 г) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную систему выливали на лед. Добавляли хлороформ и смесь перемешивали 15 минут. Выпавшие в осадок кристаллы собирали путем фильтрования с получением 2-ацетилтиено[2,3-b][1,5] бензоксазепин-4(5Н)-она (5,2 г).
1H-ЯМР (400 МГц, СDСl3) δ: 2,50 (3Н, с, СН3), 6,97 (1Н, д, АrН), 7,17-7,20 (3Н, м, АrН), 7,80 (1Н, с, Н тиофенового кольца).
Пример 113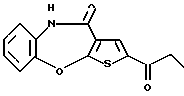
Тиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,5 г) суспендировали в 1,2-дихлорэтане (20 мл) и добавляли пропионилхлорид (770 мг). К этой реакционной системе добавляли порциями хлорид алюминия (4,7 г) при охлаждении льдом. Отфильтровывали нерастворимый материал и фильтрат вливали в ледяную воду и добавляли хлороформ. Водный слой экстрагировали два раза хлороформом и объединенный органический слой сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и выпавшие в осадок кристаллы собирали путем фильтрования с получением 2-пропионилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (1,4 г).
Температура плавления 205-210oС (разложение).
Пример 114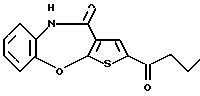
Тиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,5 г) суспендировали в 1,2-дихлорэтане (20 мл) и добавляли бутирилхлорид (880 мг). К этой реакционной системе добавляли порциями хлорид алюминия (4,6 г) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 45 минут. Отфильтровывали нерастворимый материал и фильтрат вливали в ледяную воду и добавляли хлороформ. Органический слой промывали водой и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и добавляли смесь вода-этанол. Выпавшие в осадок кристаллы собирали путем фильтрования. Полученные кристаллы промывали смесью хлороформ-диизопропиловый эфир с получением 2-бутирилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (1,2 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,89 (3Н, т, J=7,3 Гц, СН3), 1,59 (2Н, м, CH2), 2,90 (2Н, т, J=7,3 Гц, СН2), 7,14-7,31 (4Н, м, АrН), 7,93 (1Н, с, Н тиофенового кольца), 10,41 (1Н, ш, NH).
Пример 115
Тиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,9 г) суспендировали в метиленхлориде (20 мл) и добавляли дихлорметилметиловый эфир (4,0 г). К этой реакционной системе добавляли хлорид алюминия (4,6 г) при охлаждении льдом и смесь перемешивали 15 минут. Реакционную смесь вливали в смесь ледяная вода-хлороформ и полученную смесь перемешивали при комнатной температуре в течение 20 минут. Водный слой экстрагировали 5 раз хлороформом и соединенный органический слой сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и к остатку добавляли диизопропиловый эфир. Выпавшие в осадок кристаллы собирали путем фильтрования с получением 2-формилтиено[2,3-b[1,5]бензоксазепин-4(5Н)-она (1,2 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 7,14-7,33 (4Н, м, АrН), 8,08 (1Н, с, Н тиофенового кольца), 9,81 (1Н, с, НС=O), 10,45 (1Н, ш, NH).
Пример 116
2-Ацетилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,5 г) растворяли в трифторуксусной кислоте (20 мл) и добавляли триэтилсилан (2 г). Смесь перемешивали при комнатной температуре в течение 42 часов. Выпаривали при пониженном давлении растворитель и остаток растворяли в хлороформе. Смесь промывали водой и насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель. К остатку добавляли хлороформ и этилацетат и выпавшие в осадок кристаллы собирали путем фильтрования. Полученные кристаллы промывали диизопропиловым эфиром с получением 2-этилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (1,1 г).
1H-ЯМР (400 МГц, СDСl3) δ: 1,26 (3Н, т, J=7,3 Гц, СН3), 2,69 (2Н, кв, J= 7,0 Гц, 16,1 Гц, CH2), 6,82 (1H, с, Н тиофенового кольца), 6,93 (1H, д, J= 7,8 Гц, АrН), 7,10-7,18 (3Н, м, ArH).
Пример 117
2-Пропионилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (1,2 г) растворяли в трифторуксусной кислоте (20 мл) и добавляли триэтилсилан (2 г). Смесь перемешивали при комнатной температуре в течение 20 часов. Выпаривали при пониженном давлении растворитель и остаток растворяли в хлороформе. Смесь промывали водой и насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель. К остатку добавляли хлороформ и этилацетат и выпавшие в осадок кристаллы собирали путем фильтрования. Полученные кристаллы промывали диизопропиловым эфиром с получением 2-пропилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (930 мг).
1H-ЯМР (400 МГц, CDCl3) δ: 0,94 (3Н, т, J=7,3 Гц, СН3), 1,61 (2Н, м, СН2), 2,60 (2Н, т, J=7,3 Гц, СН2), 6,79 (1Н, с, Н тиофенового кольца), 6,91 (1Н, д, J=7,3 Гц, АrН), 7,08-7,15 (3Н, м, АrН), 7,34 (ш, NH).
Пример 118
2-Бутирилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,1 г) растворяли в трифторуксусной кислоте (20 мл) и добавляли триэтилсилан (1,3 г). Смесь перемешивали при комнатной температуре в течение 72 часов. Выпаривали при пониженном давлении растворитель и остаток растворяли в хлороформе. Смесь промывали водой и насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель. К остатку добавляли хлороформ и этилацетат и выпавшие в осадок кристаллы собирали путем фильтрования. Полученные кристаллы промывали диизопропиловым эфиром с получением 2-бутилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-она (600 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,87 (3Н, т, J=7,3 Гц, СН3), 1,30 (2Н, м, СН2), 1,52 (2Н, м, CH2), 2,65 (2Н, т, J=7,8 Гц, CH2), 6,74 (1Н, с, Н тиофенового кольца), 7,11-7,23 (4Н, м, АrН), 10,41 (1Н, ш, NH).
Пример 119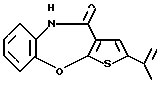
2-Ацетилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он (1,8 г) суспендировали в эфире (15 мл) и добавляли при охлаждении льдом 20 эквивалентных количеств метилйодида магния. Смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь вливали в 1 М хлороводородную кислоту при охлаждении льдом и отфильтровывали нерастворимый материал. Полученную смесь экстрагировали два раза хлороформом. Хлороформный слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. Остаток суспендировали в толуоле и добавляли каталитическое количество п-толуолсульфоновой кислоты. Смесь перемешивали при нагревании с обратным холодильником в течение 20 минут. Реакционную систему охлаждали до комнатной температуры и промывали насыщенным водным раствором гидрокарбоната натрия. Выпаривали при пониженном давлении растворитель и к остатку добавляли диизопропиловый эфир. Выпавшие в осадок кристаллы собирали путем фильтрования с получением 2-изопропенилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (800 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 2,04 (3Н, с, СН3), 5,00 (1Н, с, олефин), 5,22 (1Н, с, олефин), 7,00 (1Н, с, Н тиофенового кольца), 7,14-7,27 (4Н, м, АrН), 10,25 (1Н, ш, NH).
Пример 120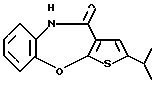
2-Изопропенилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (780 мг) суспендировали в диоксане (40 мл) и добавляли 10%-ный палладий на активированном угле (100 мг). Вводили водород и смесь перемешивали при температуре 40oС и давлении 50 атм в течение 7,5 часов. Отфильтровывали катализатор и выпаривали при пониженном давлении растворитель с получением 2-изопропилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (600 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 1,21 (6Н, д, J=6,8 Гц, СН3), 3,01 (1Н, м, СН), 6,75 (1Н, с, Н тиофенового кольца), 7,10-7,23 (4Н, м, АrН), 10,15 (1Н, ш, NH).
Пример 121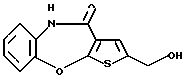
2-Формилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он (1,6 г) суспендировали в метаноле (30 мл) и добавляли борогидрид натрия (480 мг). Смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь разбавляли водой и экстрагировали 3 раза хлороформом. Органический слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. К остатку добавляли хлороформ и диизопропиловый эфир и выпавшие в осадок кристаллы собирали путем фильтрования с получением 2-гидроксиметилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-она (1,0 г).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 4,47 (2Н, д, СН2), 5,52 (1Н, т, ОН), 6,84 (1Н, с, Н тиофенового кольца), 7,10-7,23 (4Н, м, АrН), 10,14 (1Н, ш, NH).
Пример 122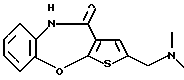
2-Гидроксиметилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,0 г) растворяли в метиленхлориде (10 мл) и добавляли триэтиламин (450 мг) и метансульфонилхлорид (500 мг). Смесь
перемешивали при комнатной температуре в течение 15 минут и выпаривали при пониженном давлении растворитель. К остатку добавляли 2 М раствор диметиламина в метаноле и смесь перемешивали при комнатной температуре в течение 14 часов. Выпаривали при пониженном давлении растворитель и к остатку добавляли хлороформ. После промывки водой водный слой экстрагировали два раза хлороформом. Органический слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат) с получением 2-(N,N-диметиламинометил)тиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (500 мг).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 1,98 (6Н, с, СН3), 3,46 (2Н, с, СН2), 6,87 (1Н, с, Н тиофенового кольца), 7,12-7,25 (4Н, м, АrН), 10,41 (1Н, ш, NH).
Пример 123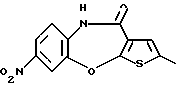
Используя N-(2-гидрокси-4-нитрофенил)-2-бром-5-метил-3-тиофенкарбоксамид и карбонат калия, таким же образом, как в примере 98, получали 2-метил-8-нитротиено[2,3-b][1,5]бензоксазепин-4(5Н)-он.
Пример 124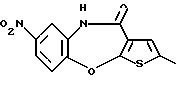
Используя N-(2-гидрокси-5-нитрофенил)-2-бром-5-метил-3-тиофенкарбоксамид и карбонат калия, таким же образом, как в примере 98, получали 2-метил-7-нитротиено[2,3-b][1,5]бензоксазепин-4(5Н)-он.
Пример 125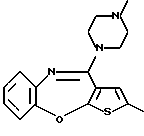
2-Метилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (1,0 г) суспендировали в оксихлориде фосфора (6,4 мл) и добавляли N,N-диметиланилин (240 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (25 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 40 минут. Реакционную систему охлаждали до комнатной температуры и растворитель выпаривали при пониженном давлении. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 100:1). Полученное соединение перекристаллизовывали из диизопропилового эфира с получением 2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепина (520 мг).
Температура плавления 132-133oС.
Пример 126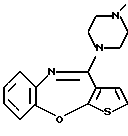
Тиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,2 г) суспендировали в оксихлориде фосфора (8,5 мл) и добавляли N,N-диметиланилин (310 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа и растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении. К остатку добавляли 1-метилпиперазин (25 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 30 минут. Реакционную систему охлаждали до комнатной температуры и растворитель выпаривали при пониженном давлении. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 100:1,5). Полученное соединение преобразовывали в фумарат, который перекристаллизовывали из смеси этилацетат-этанол с получением 4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин фумарата (650 мг).
Температура плавления 200-202oС.
Пример 127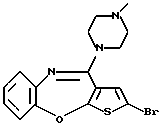
2-Бромтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (800 мг) суспендировали в оксихлориде фосфора (5 мл) и добавляли N,N-диметиланилин (155 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа и растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении. К остатку добавляли 1-метилпиперазин (10 мл) и смесь перемешивали при комнатной температуре в течение 30 минут и затем при нагревании с обратным холодильником в течение 5 минут. Реакционную систему охлаждали до комнатной температуры и растворитель выпаривали при пониженном давлении. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 100:1). Полученное соединение перекристаллизовывали из смеси диизопропиловый эфир-этилацетат с получением 2-бром-4-(4-метилпиперазин-1-ил) тиено[2,3-b][1,5]бензоксазепина (300 мг).
Температура плавления 150-151oС.
Пример 128
2-Ацетилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он (1,2 г) суспендировали в оксихлориде фосфора (7 мл) и добавляли N,N-диметиланилин (280 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1,5 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении. К остатку добавляли 1-метилпиперазин (20 мл) и смесь перемешивали при 80oС в течение 15 минут. Реакционную систему охлаждали до комнатной температуры и растворитель выпаривали при пониженном давлении. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 100: 0,5). Полученное соединение перекристаллизовывали из смеси диизопропиловый эфир-этилацетат с получением 2-ацетил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепина (80 мг).
Температура плавления 143-144oС.
Пример 129
2-Фенилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (1,2 г) суспендировали в оксихлориде фосфора (6,5 мл) и добавляли N,N-диметиланилин (250 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (20 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Реакционную систему охлаждали до комнатной температуры и растворитель выпаривали при пониженном давлении. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 100:1). Полученное соединение перекристаллизовывали из этилацетата с получением 4-(4-метилпиперазин-1-ил)-2-фенилтиено[2,3-b][1,5]бензоксазепина (620 мг).
Температура плавления 163-164oС.
Пример 130
2-Этилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,1 г) суспендировали в оксихлориде фосфора (7 мл) и добавляли N,N-диметиланилин (270 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 3 часов и растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении. К остатку добавляли 1-метилпиперазин (13 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Реакционную систему охлаждали до комнатной температуры и выпаривали при пониженном давлении растворитель. К остатку добавляли этилацетат и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 100:1). Полученное соединение перекристаллизовывали из смеси этилацетат-этанол в виде малеата с получением 2-этил-4-(4-метилпиперазин-1-ил) тиено[2,3-b] [1,5] бензоксазепин • дималеата (630 мг).
Температура плавления 154-156oС.
Пример 131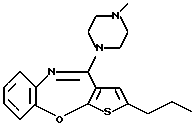
2-Пропилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (910 мг) суспендировали в оксихлориде фосфора (6 мл) и добавляли N,N-диметиланилин (220 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (10 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 40 минут. Реакционную систему охлаждали до комнатной температуры и выпаривали при пониженном давлении растворитель. К остатку добавляли этилацетат и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 100:1). Полученное соединение перекристаллизовывали из смеси этилацетат-этанол в виде малеата с получением 4-(4-метилпиперазин-1-ил)-2-пропилтиено[2,3-b] [1,5] бензоксазепин • дималеата (550 мг).
Температура плавления 175-177oС.
Пример 132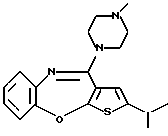
2-Изопропилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (550 мг) суспендировали в оксихлориде фосфора (3 мл) и добавляли N,N-диметиланилин (120 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 50 минут. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (6 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 50 минут. Реакционную систему охлаждали до комнатной температуры и выпаривали при пониженном давлении растворитель. К остатку добавляли этилацетат и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ). Полученное соединение перекристаллизовывали из смеси этилацетат-этанол в виде малеата с получением 2-изопропил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин • дималеата (280 мг).
Температура плавления 170-172oС.
Пример 133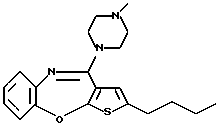
2-Бутилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он (580 мг) суспендировали в оксихлориде фосфора (4 мл) и добавляли N,N-диметиланилин (130 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (6 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 2 часов. Реакционную систему охлаждали до комнатной температуры и выпаривали при пониженном давлении растворитель. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 100:1). Полученное соединение перекристаллизовывали из смеси этилацетат-этанол в виде фумарата с получением 2-бутил-4-(4-метилпиперазин-1-ил) тиено[2,3-b][1,5]бензоксазепин • фумарата (320 мг).
Температура плавления 202-204oС.
Пример 134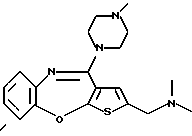
2-(N, N-Диметиламинометил)тиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (500 мг) суспендировали в оксихлориде фосфора (3 мл) и добавляли N,N-диметиланилин (110 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (6 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Реакционную систему охлаждали до комнатной температуры и выпаривали при пониженном давлении растворитель. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 100:1). Полученное соединение перекристаллизовывали из смеси этилацетат-этанол в виде фумарата с получением 2-(N, N-диметиламинометил)-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин • 1/2 фумарат • 1/5 гидрата (71 мг).
Температура плавления 188-189oС.
Пример 135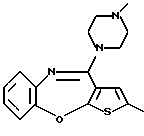
2-Метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он (800 мг) суспендировали в оксихлориде фосфора (5 мл) и добавляли N,N-диметиланилин (218 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилгомопиперазин (10 мл). Смесь перемешивали при 150oС в течение 1 часа. Реакционную систему охлаждали до комнатной температуры и добавляли хлороформ. Смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ). Полученное соединение перекристаллизовывали из ацетонитрила в виде гидрохлорида с получением 2-метил-4-(4-метилгомопиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин • гидрохлорид • 3/4 гидрата (270 мг).
Температура плавления 243-245oС.
Пример 136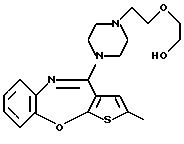
2-Метилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он (600 мг) суспендировали в оксихлориде фосфора (4 мл) и добавляли N,N-диметиланилин (160 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 30 минут. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли толуол (10 мл) и 1-[2-(2-гидроксиэтокси)этил] пиперазин (2,5 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Реакционную систему охлаждали до комнатной температуры и добавляли хлороформ. Смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 100:1). Полученное соединение перекристаллизовывали из смеси гексан-этилацетат с получением 4-[4-(2-(2-гидроксиэтокси)этил)пиперазин-1-ил] -2-метилтиено[2,3-b][1,5]бензоксазепина (350 мг).
Температура плавления 111-112oС.
Пример 137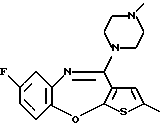
7-Фтор-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (500 мг) суспендировали в оксихлориде фосфора (5 мл) и добавляли N,N-диметиланилин (240 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 1,5 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (6 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Реакционную систему охлаждали до комнатной температуры и добавляли этилацетат. Смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 100:1). Полученное соединение перекристаллизовывали из смеси этилацетат-этанол в виде малеиновой кислоты с получением 7-фтор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5]бензоксазепин • дималеата (450 мг).
Температура плавления 137-139oС.
Пример 138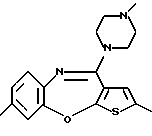
2,8-Диметилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (1 г) суспендировали в оксихлориде фосфора (6 мл) и добавляли N,N-диметиланилин (220 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 2,5 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (14 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 2,5 часов и выпаривали при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 100:1-20:1) и полученное соединение перекристаллизовывали из смеси диизопропиловый эфир-гексан с получением 2,8-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина (310 мг).
Температура плавления 149-150oС.
Пример 139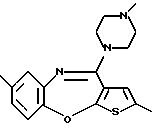
2,7-Диметилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (1 г) суспендировали в оксихлориде фосфора (6 мл) и добавляли N,N-диметиланилин (220 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 2 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (14 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 3,5 часов. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 50:1-20:1) и полученное соединение перекристаллизовывали из смеси диизопропиловый эфир-гексан с получением 2,7-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина (330 мг).
Температура плавления 146-148oС.
Пример 140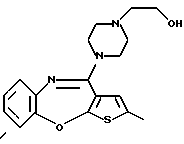
2-Метилтиено[2,3-b] [1,5]бензоксазепин-4(5Н)-он (1,2 г) суспендировали в оксихлориде фосфора (8 мл). Добавляли N,N-диметиланилин (280 мг) и смесь кипятили при нагревании с обратным холодильником в течение 3 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении. К остатку добавляли 1-(2-гидроксиэтил)пиперазин (15 мл) и смесь перемешивали при 140-150oС в течение 2 часов. Реакционную смесь очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 50:1, этилацетат). Полученное соединение затем перекристаллизовывали из смеси этилацетат-гексан с получением 4-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метилтиено[2,3-b][1,5]бензоксазепина (210 мг).
Температура плавления 87-89oС.
Пример 141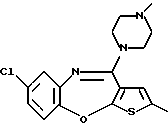
7-Хлор-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (660 мг) суспендировали в оксихлориде фосфора (4 мл). Добавляли N,N-диметиланилин (130 мг) и смесь перемешивали при нагревании с обратным холодильником в течение 4,5 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении. К остатку добавляли 1-метилпиперазин (10 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 2 часов. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 20:1). Полученное соединение преобразовывали в фумарат, который перекристаллизовывали из смеси этилацетат-метанол с получением 7-хлор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин • фумарата (250 мг).
Температура плавления 227-228oС.
Пример 142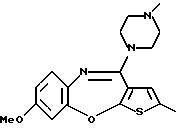
8-Метокси-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (530 мг) суспендировали в оксихлориде фосфора (3 мл). Добавляли N,N-диметиланилин (120 мг) и смесь перемешивали при нагревании с обратным холодильником в течение 1,5 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (9 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 2 часов. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 50:1). Полученное соединение преобразовывали в фумарат, который перекристаллизовывали из смеси этилацетат-гексан-метанол с получением 8-метокси-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин • фумарата (330 мг).
Температура плавления 219-222oС.
Пример 143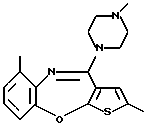
2,6-Диметилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (860 мг) суспендировали в оксихлориде фосфора (5 мл). Добавляли N,N-диметиланилин (190 мг) и смесь перемешивали при нагревании с обратным холодильником в течение 1,5 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (14 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 1,5 часов. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ: метанол = 50:1-20:1). Полученное соединение перекристаллизовывали из гексана с получением 2,6-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5]бензоксазепина (490 мг).
Температура плавления 114-117oС.
Пример 144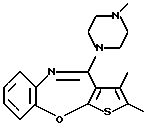
2,3-Диметилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,4 г) суспендировали в оксихлориде фосфора (14 мл). Добавляли N,N-диметиланилин (340 мг) и смесь перемешивали при нагревании с обратным холодильником в течение 2,5 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении и к остатку добавляли 1-метилпиперазин (20 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Реакционную систему охлаждали до комнатной температуры. Добавляли этилацетат и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 9:1). Полученное соединение преобразовывали в фумарат, который перекристаллизовывали из этанола с получением 2,3-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин • 1/2 фумарата.
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 2,03 (3Н, с, СН3), 2,21 (3Н, с, СН3), 2,26 (3Н, с, СН3), 2,35-3,80 (8Н, ш, СН2), 6,61 (1Н, с, фумаровая кислота), 6,97-7,11 (4Н, м, АrН).
Пример 145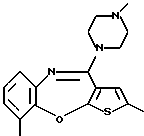
Используя 2,9-диметилтиено[2,3-b][1,5]бензоксазепин-4(5Н)-он, оксихлорид фосфора, N, N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 125, получали 2,9-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5] бензоксазепин.
Пример 146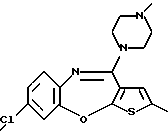
Используя 8-хлор-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он, оксихлорид фосфора, N, N-димeтилaнилин и 1-метилпиперазин, таким же образом, как в примере 125, получали 8-хлор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин.
Пример 147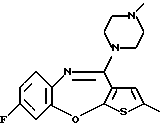
Используя 8-фтор-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он, оксихлорид фосфора, N, N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 125, получали 8-фтор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b][1,5]бензоксазепин.
Пример 148
Используя 2-метил-8-нитротиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он, оксихлорид фосфора, N, N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 125, получали 2-метил-4-(4-метилпиперазин-1-ил)-8-нитротиено[2,3-b][1,5]бензоксазепин.
Пример 149
Используя 2-метил-7-нитротиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он, оксихлорид фосфора, N, N-диметиланилин и 1-метилпиперазин, таким же образом, как в примере 125, получали 2-метил-4-(4-метилпиперазин-1-ил)-7-нитротиено[2,3-b] [1,5]бензоксазепин.
Пример 150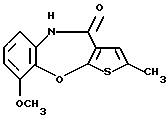
Раствор N-(2-гидрокси-3-метоксифенил)-2-бром-5-метил-3-тиофенкарбоксамида (2,30 г) и метоксида натрия (549 мг) в N,N-диметилформамиде (12 мл) перемешивали при нагревании с обратным холодильником в течение 19 часов. Реакционную систему охлаждали до комнатной температуры и вливали в воду (50 мл). Смесь нейтрализовали хлороводородной кислотой, экстрагировали два раза хлороформом и промывали водой. Органический слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (растворитель для элюирования представлял собой смесь гексан:этилацетат=1:1) с получением 2-метил-9-метокситиено[2,3-b][1,5]бензоксазепин-4(5Н)-она (1,87 г).
Температура плавления 160-164oС.
1H-ЯМР (400 МГц, ДМСО-d6) δ: 2,31 (3Н, с, СН3), 3,81 (3Н, с, СН3), 6,71 (1Н, с, Н тиофенового кольца), 6,72 (1Н, д, J=8,3 Гц, АrН), 6,86 (1Н, д, J= 8,3 Гц, АrН), 7,10 (1Н, дд, J=8,3, 8,3 Гц) 10,09 (1Н, ш.с, NH).
Пример 151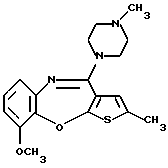
2-Метил-9-метокситиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (1,58 г) суспендировали в оксихлориде фосфора (13 мл). Добавляли N,N-диметиланилин (330 мг) и смесь перемешивали при нагревании с обратным холодильником в течение 2 часов. Растворитель полностью выпаривали азеотропно с толуолом при пониженном давлении. К остатку добавляли 1-метилпиперазин (20 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 3 часов. Реакционную систему охлаждали до комнатной температуры и выпаривали при пониженном давлении растворитель. К остатку добавляли хлороформ и смесь промывали водой и насыщенным рассолом и сушили над сульфатом натрия. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 100:1) с получением 2-метил-9-метокси-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина (1,90 г) в виде жидкости. Полученную жидкость (350 мг) и фумаровую кислоту (77 мг) растворяли в метаноле (20 мл) и выпаривали при пониженном давлении растворитель. Полученный остаток промывали горячим этилацетатом с получением 2-метил-9-метокси-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5]бензоксазепин • фумарата (240 мг).
Температура плавления 239-241oС.
1Н-ЯМР (400 МГц, ДМСО-d6) δ: 2,28 (3Н, с, СН3), 2,33(3Н, с, СН3), 2,50-4,50 (8Н, ш. с, CH2х4), 3,78 (3Н, с, СН3), 6,51 (1Н, с, Н тиофенового кольца), 6,58 (1Н, д, J=7,8 Гц, АrН), 6,60 (2Н, с, фумаровая кислота), 6,74 (1Н, д, J=8,3 Гц, АrН), 6,98 (1Н, дд, J=7,8 Гц, 8,3 Гц, АrН).
МС: m/е 343.
Анал. вычисл. для С18Н21N3O2S • С4Н4O4 • 0,2Н2О: С 57,06; Н 5,53; N 9,07%.
Найдено: С 57,06; Н 5,51; N 9,08%.
Пример 152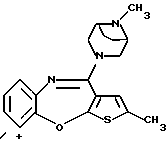
2-Метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-он (370 мг) растворяли в оксихлориде фосфора (7,3 г) и добавляли N,N-диметиланилин (73 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 40 минут. Оксихлорид фосфора полностью выпаривали азеотропно с толуолом при пониженном давлении. Остаток растворяли в толуоле и смесь промывали два раза насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. Остаток растворяли в ацетонитриле (10 мл) и к полученному раствору добавляли 8-метил-3,8-дизабицикло[3.2.1] октан • 2 гидрохлорид (240 мг) и диизопропилэтиламин (470 мг). Смесь перемешивали при нагревании с обратным холодильником в течение 4,5 часов. Добавляли 8-метил-3,8-диазабицикло[3.2.1]октан • 2 гидрохлорид (240 мг) и диизопропилэтиламин (470 мг) и через 12 часов еще добавляли 8-метил-3,8-диазабицикло[3.2.1] октан • 2 гидрохлорид (240 мг) и диизопропилэтиламин (470 мг). Смесь перемешивали 6 часов. Реакционной системе давали остыть до комнатной температуры и выпаривали при пониженном
давлении растворитель. Остаток разбавляли этилацетатом и промывали три раза водой. Органический слой сушили над сульфатом натрия и выпаривали при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле и полученное соединение перекристаллизовывали из диизопропилового эфира с получением 2-метил-4-(8-метил-3,8-диазабицикло[3.2.1] октан-3-ил)тиено[2,3-b][1,5]бензоксазепина (300 мг).
Температура плавления 156-159oС.
1H-ЯМР (400 МГц, СDСl3) δ: 1,80 (2Н, м), 2,01 (2Н, м), 2,33 (3Н, с), 2,35 (3Н, с), 3,17 (4Н, м), 4,00 (2Н, м), 6,29 (1Н, с), 6,95-7,08 (4Н, м).
Пример 153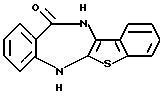
трет-Бутоксид калия (718 мг) суспендировали в 1,2-диметоксиэтане (35 мл) и смесь нагревали с обратным холодильником. К смеси добавляли по каплям этил 2-(2-аминоанилино)бензо[b] тиофен-3-карбоксилат (1,0 г), растворенный в 1,2-диметоксиэтане (35 мл), в течение 15 минут. Через 30 минут добавляли трет-бутоксид калия (359 мг) и смесь нагревали с обратным холодильником в течение 1 часа. По окончании реакции реакционной смеси давали остыть до комнатной температуры и вливали ее в 0,5 н. хлороводородную кислоту. Смешанный раствор экстрагировали 3 раза хлороформом, промывали водой и сушили над сульфатом магния. Раствор фильтровали и растворитель выпаривали при пониженном давлении. Выпавшие в осадок кристаллы промывали этилацетатом и диизопропиловым эфиром с получением 6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-она (300 мг).
1H-ЯМР (400 МГц, СDСl3) δ: 7,10-7,18 (3Н, м), 7,36-7,44 (2Н, м), 7,51 (1Н, д, J=8,8 Гц), 7,68 (1Н, с), 7,88 (1Н, д, J=7,8 Гц), 7,97 (1Н, д, J=7,8 Гц), 11,47 (1Н, ш.с).
Пример 154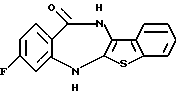
Используя трет-бутоксид калия и этил 2-(2-аминоанилино)-5-фторбензо[b] тиофен-3-карбоксилат, таким же образом, как в примере 153, получали 8-фтор-6Н-[1]бензотиено[2,3-b][1,5]бензодиазепин-12(11Н)-он.
Температура плавления 294-250oС.
МС: т/е=284.
1H-ЯМР (270 МГц, СDСl3) δ: 11,54 (1Н, ш.с), 7,97-8,00 (1Н, м), 7,88-7,92 (1Н, м), 7,73 (1Н, с), 7,36-7,47 (3Н, м), 7,10-7,18 (1Н, м), 6,96-7,04 (1Н, м).
Пример 1 изготовления лекарственного средства
Соединение (50 мг) формулы (I) по настоящему изобретению тщательно перемешивают с лактозой (98 мг), кукурузным крахмалом (45 мг) и гидроксипропилцеллюлозой (3 мг) в месильной машине. Полученную смесь пропускают через сито 200 меш, высушивают при 50oС и пропускают через сито 24 меш. Продукт смешивают с тальком (3 мг) и стеаратом магния (1 мг) и изготавливают таблетки массой 200 мг, пользуясь пуансоном диаметром 9 мм. Полученные таблетки могут быть при необходимости покрыты сахаром или пленкой.
Экспериментальный пример 1: Эффекты против МК-801-индуцированной нейротоксичности
Крысам-самкам SD (возраст примерно 9-12 недель) вводили перорально предлагаемые в соответствии с настоящим изобретением соединения или наполнитель (0,5% гидроксипропилметилцеллюлоза, 2 мл/кг). Спустя час вводили подкожно МК-801 (0,5 мг/кг, 1 мл/кг), растворенный в дистиллированной воде. Через четыре часа после введения МК-801 крыс анестезировали пентобарбиталом и заменяли кровь физиологическим раствором, после чего производили перфузионную фиксацию головного мозга раствором формалина. После обезглавливания мозг крыс быстро извлекали и подвергали последующей фиксации тем же самым раствором формалина. Мозг заливали парафином и разрезали с получением параллельных лобной поверхности срезов через задний поясной участок коры головного мозга. Мозговые срезы окрашивали гематоксилино-эозиновым (ГЭ) красителем. Число вакуолизированных клеток подсчитывали с помощью оптического микроскопа и подсчитывали в процентах относительно группы, обработанной наполнителем.
Ингибирующее действие против МК-801-индуцированной нейротоксичности определяется способностью предотвращать вакуолярную реакцию нервных клеток от введения МК-801, которую выражают в процентах относительно группы, обработанной наполнителем. Испытание показало, что соединения формулы (I) по настоящему изобретению подавляли МК-801-индуцированную нейротоксичность, причем эффективное количество для 50%-ного ингибирования МК-801-индуцированной нейротоксичности составляло не более 10 мг/кг.
Экспериментальный пример 2: Ингибирующее действие против метамфетамининдуцированной гиперактивности
Были использованы группы из 15 мышей-самцов ddY (20-30 г, возраст 4 недели). Им перорально вводили испытуемые соединения. Спустя час мышам вводили подкожно метамфетамин в физиологическом растворе при дозе 1 мг/кг и сразу же их помещали в бокс для испытаний (внутренние размеры: 25х15х14 (высота) см), снабженный парой инфракрасных лучей. В промежутке от 10 до 40 минут после начала наблюдения подсчитывали число прерываний инфракрасных лучей за 30 минут и использовали его как показатель метамфетамининдуцированной гиперактивности. Вычисляли значения ED50 испытуемых соединений в отношении угнетения гиперактивности. Испытание показало, что соединения формулы (I) по настоящему изобретению подавляли метамфетамининдуцированную гиперактивность, причем эффективное количество для 50%-ного ингибирования метамфетамининдуцированной гиперактивности составляло не более 10 мг/кг.
Экспериментальный пример 3: Испытание в отношении стимулированного клозапином различения
После похудания, в результате ограничения питания, до 80% массы тела при свободном доступе к пище крыс помещали в ящик Скиннера, снабженный двумя рычагами. Там их приучали последовательно нажимать 10 раз либо правый, либо левый рычаг для получения награды в виде катышка пищи. Затем им вводили внутрибрюшинно клозапин или физиологический раствор в случайно чередующейся последовательности один раз (один сеанс) каждый день, причем лекарственное средство или физиологический раствор вводили не более чем 3 дня подряд. Когда вводили клозапин при дозе 5 мг/кг, один из рычагов был связан с наградой, а при введении физиологического раствора с наградой был связан другой рычаг, благодаря чему крысы приобрели способность к различению. После приобретения способности к различению вводили соединение по настоящему изобретению для подтверждения общего с клозапином действия. Испытание показало, что соединения формулы (I) по настоящему изобретению действовали сообща с клозапиновым стимулом различения.
Экспериментальный пример 4: Испытание в отношении различения, стимулированного МК-801
После похудания, в результате ограничения питания, до 80% массы тела при свободном доступе к пище крыс помещали в ящик Скиннера, снабженный двумя рычагами. Там их приучали последовательно нажимать 10 раз либо правый, либо левый рычаг для получения награды в виде катышка пищи. Затем им вводили внутрибрюшинно МК-801 или физиологический раствор в случайно чередующейся последовательности один раз (один сеанс) каждый день, причем лекарственное средство или физиологический раствор вводили не более чем 3 дня подряд. Когда вводили МК-801 при дозе 0,1 мг/кг, один из рычагов был связан с наградой, а при введении физиологического раствора с наградой был связан другой рычаг, благодаря чему крысы приобрели способность к различению. После приобретения способности к различению вводили соединение по настоящему изобретению для подтверждения антагонизма с различением, стимулированным МК-801. Испытание показало, что соединения формулы (I) по настоящему изобретению оказывали антагонистическое действие на стимулирующий эффект МК-801 в отношении различения.
Экспериментальный пример 5: Антиапоморфиновое действие
Были использованы группы из 15 мышей-самцов ddY (20-30 г, возраст 4 недели). Им перорально вводили соединения по настоящему изобретению. Спустя час мышам вводили подкожно водный раствор апоморфина в аскорбиновой кислоте при дозе 0,5 мг/кг и сразу же их помещали в бокс для испытаний (внутренние размеры: 25х15х14 (высота) см), снабженный парой инфракрасных лучей. Число прерываний инфракрасных лучей за 30 минут, начиная сразу же от начала наблюдения, использовали как показатель апоморфининдуцированной гиперактивности. Соединения формулы (I) по настоящему изобретению угнетали апоморфининдуцированную гиперактивность, причем эффективное количество для 50%-ного ингибирования апоморфининдуцированной гиперактивности составляло не более 10 мг/кг.
Экспериментальный пример 6: Торможение условного рефлекса избегания
Крыс-самцов Vistar (250-400 г, возраст 14-25 недель) помещали в бокс для испытаний (30х30х35 (высота) см), снабженный шестом (диаметр 2,5 см) в его центре и сеткой на полу, и подавали 5-секундный звуковой раздражитель (условный раздражитель) и затем 10-секундный электрический удар (переменный ток 400 В, 0,6 мА), тем самым заставляя их научиться избегать электрического удара, влезая на шест во время действия звукового раздражителя. Каждый сеанс состоял из 10 секунд действия условного раздражителя и электрического удара с 2-минутными интервалами. Крыс (10 на группу), устойчиво проявляющих способность к по крайней мере 80%-ной реакции избегания, использовали для исследования торможения условного рефлекса избегания соединением по настоящему изобретению. С течением времени определяли условный рефлекс избегания в моменты 1, 3, 5 и 24 часа после введения соединений по настоящему изобретению и в каждый момент времени определяли эффективное количество для 50%-ного ингибирования соединениями по настоящему изобретению условного рефлекса избегания. Испытание показало, что эффективное количество для 50%-ного ингибирования условного рефлекса избегания соединениями формулы (I) по настоящему изобретению составляло не более 20 мг/кг.
Экспериментальный пример 7: Индукция каталепсии
Для испытания использовали группы из 8 мышей-самцов ddY (20-30 г, возраст 4 недели). Им вводили испытуемые соединения и измеряли время (доходившее до 30 секунд максимум), в течение которого мыши могли держать передние конечности лежащими на планке, закрепленной на высоте 4 см, при положении тела под углом 45o (время каталепсии), в моменты 1, 3, 5 и 7 часов после введения. Силу индукции каталепсии испытуемыми соединениями определяли путем суммирования времени в четырех моментах определения при каждой дозе (суммарное значение) и обратного (регрессивного) определения дозы, дающей среднее время 10 с, на основе которого вычисляли значения ED10c. Испытание показало, что значение ED10c соединений формулы (I) по настоящему изобретению составляло не менее чем 100 мг/кг.
Экспериментальный пример 8: Анализ промежуточного продукта при окислении пероксидазой хрена
Смешивали раствор (10 мкл) 16 мМ предлагаемых соединений в диметилсульфоксиде, раствор (100 мкл) 5 мМ диэтилентриамин-пентауксусной кислоты в фосфатном буфере (50 мМ, рН 7,4), раствор (100 мкл) 100 мМ глутатиона в фосфатном буфере (50 мМ, рН 7,4), 50 мМ фосфатный буфер (750 мкл) и N-оксид 5,5-диметил-1-пиролина (1,1 мкл) и к смеси добавляли раствор (50 мкл) 0,5 мг/мл пероксидазы хрена в фосфатном буфере (50 мМ, рН 7,4). Смесь инкубировали при 25oС в течение 4,5 минут. Реакционную смесь подвергали ЭСР-спектроскопии (спектроскопия электронно-спинового резонанса). Результат показал, что соединения формулы (I) по настоящему изобретению не дают промежуточного радикал-катиона в ходе окисления пероксидазой хрена.
Вышеописанные экспериментальные примеры говорят о том, что соединения формулы (I) по настоящему изобретению, в частности соединения формул (IA) и (IВ), проявляют антиметамфетаиновую активность, антиапоморфиновую активность, подавление условного рефлекса избегания, подавление МК-801-индуцированной нейротоксичности, антагонизм по отношению к МК-801-стимулированному различению и содействие клозапинстимулированному различению у испытуемых животных, таких как мыши и крысы, и полезны в качестве антипсихотических средств. Понятно также, что они вызывают меньше побочных эффектов на экстрапирамидальную систему, таких как индукция каталепсии. Кроме того, эти примеры показали, что соединения формулы (I) по настоящему изобретению согласно анализу их промежуточного продукта методом ЭСР-спектроскопии с использованием окисления пероксидазы хрена в качестве реакции-модели метаболизма предлагаемых соединений не дают промежуточного продукта реакции, соответствующего промежуточному радикал-катиону, который, возможно, участвует в агранулоцитозе, индуцируемом клозапином.
Соединения формулы (I) по настоящему изобретению, в частности соединения формул (IA) и (IB), эффективны в отношении как положительных, так и отрицательных симптомов шизофрении, дают менее опасные побочные эффекты, такие как экстрапирамидальное двигательное расстройство, и тому подобное, меньше дают опасных побочных эффектов, таких как агранулоцитоз, и полезны в качестве новых антипсихотических средств. Эти соединения полезны также в качестве лекарственных средств для лечения болезни Альцгеймера и маниакально-депрессивного психоза.
Кроме того, соединения формул (IIA) и (IIB) полезны как важные промежуточные продукты синтеза соединений формул (IA) и (IB) соответственно.
Данное изобретение основано на заявках 236700/1997, 277771/1997 и 165725/1998, поданных в Японии, содержания которых включены в данное описание в качестве ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИЗОХИНОЛИНА И ИХ СОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2256661C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE10 | 2011 |
|
RU2543386C2 |
| ПРОИЗВОДНОЕ 2-АМИНОПРОПАН-1,3-ДИОЛА, ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ СИНТЕЗА | 1998 |
|
RU2198162C2 |
| НОВОЕ АНТИТРОМБОТИЧЕСКОЕ СРЕДСТВО | 2010 |
|
RU2570426C2 |
| ПРОИЗВОДНОЕ ПИРИДИНА | 2013 |
|
RU2640588C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО АМИДА | 2001 |
|
RU2257384C2 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ МЕДИЦИНСКОЕ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2287529C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2020 |
|
RU2840815C2 |
| БЕНЗИМИДАЗОЛЬНОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2008 |
|
RU2451017C2 |
| СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TRPM8 | 2012 |
|
RU2563030C2 |
Изобретение относится к производному тиофена формулы I, в которой Ra и Rb могут быть одинаковыми или разными и означают водород, алкил, ацил, алкенил, фенил или Ra и Rb вместе могут образовывать бензольное кольцо или циклогексеновое кольцо, его фармацевтически приемлемым солям и гидратам. Соединение формулы (I) полезно в качестве нового антипсихотического средства, эффективного в отношении как положительных, так и отрицательных симптомов шизофрении, которое дает менее опасные побочные эффекты. Кроме того, это соединение полезно также в качестве лекарственного средства для лечения болезни Альцгеймера и маниакально-депрессивного психоза. 7 с. и 13 з.п. ф-лы.
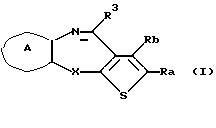
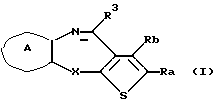
где Ra и Rb являются одинаковыми или различными и каждый представляет водород, алкил, ацил, алкенил, фенил, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или галоген, или Ra и Rb вместе могут образовывать бензольное кольцо или циклогексеновое кольцо, необязательно имеющие заместители R1, R2, причем R1, R2 являются одинаковыми или различными и каждый представляет водород, алкил, алкокси, гидроксил или галоген;
Х представляет NH, О, S или N-R4, где R4 представляет алкил, при условии, что, когда Х представляет NH, Ra и Rb вместе образуют бензольное кольцо, необязательно имеющее заместители R1, R2, и, когда Х представляет S, Ra и Rb вместе образуют бензольное кольцо или циклогексеновое кольцо, необязательно имеющие заместители R1, R2;
кольцо А представляет бензольное кольцо, имеющее 1-2 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино и гидроксила, или бензольное кольцо без заместителя;
R3 представляет группу формулы (1), формулы (2), формулы (3), формулы (26) или формулы (28)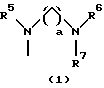
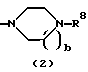
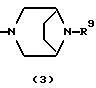
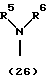
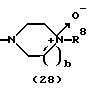
в формуле (1) и формуле (26) R5, R6 и R7 являются одинаковыми или различными и каждый представляет водород, алкил, фенил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, и а равно целому числу 2-4,
в формуле (2) и формуле (28) R8 представляет водород, алкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, b = 1, при условии, что, когда Х представляет О, то алкил алкила, гидроксиалкила или алкоксиалкила у R8 имеет 1-4 углеродных атома,
в формуле (3) R9 представляет водород или алкил,
или его фармацевтически приемлемая соль или их гидрат.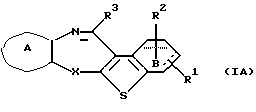
где Х представляет NH, О, S, или N-R4, где R4 представляет алкил;
R1 и R2 являются одинаковыми или различными и каждый представляет водород, алкил, алкокси, гидроксил или галоген;
кольцо А представляет бензольное кольцо, имеющее 1-2 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино и гидроксила, или бензольное кольцо без заместителя;
кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, или циклогексановое кольцо, в котором указанная связь является одинарной связью, при условии, что когда Х представляет NH, то связь, показанная пунктирной и сплошной линиями, не является одинарной связью; и
R3 представляет группу формулы (1), формулы (2), формулы (3), формулы (26) или формулы (28)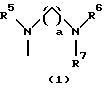
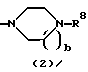
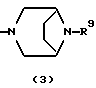
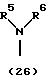
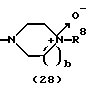
в формуле (1) и формуле (26) R5, R6 и R7 являются одинаковыми или различными и каждый представляет водород, алкил, фенил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, и а равно целому числу 2-4,
в формуле (2) и формуле (28) R8 представляет водород, алкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, b = 1,
в формуле (3) R9 представляет водород или алкил,
или его фармацевтически приемлемая соль или их гидрат.
12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8-бром-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
9-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
9-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
9-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
9-бром-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
9-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8,9-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8,10-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8-фтор-3-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
2-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8-фтор-2-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8-фтор-3-метокси-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
8,9-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
7,8-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-бром-8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
1-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
4-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3,8-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-фтор-8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина и
12-(4-этилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
или его фармацевтически приемлемая соль или их гидрат.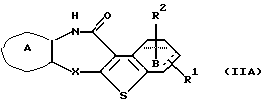
где Х представляет NH, О, S, или N-R4, где R4 представляет алкил;
R1 и R2 являются одинаковыми или различными и каждый представляет водород, алкил, алкокси, гидроксил или галоген;
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино и гидроксила, или бензольное кольцо без заместителя; и
кольцо В представляет бензольное кольцо, в котором связь, показанная пунктирной и сплошной линиями, является двойной связью, или циклогексановое кольцо, в котором указанная связь является одинарной связью,
при условии, что когда Х представляет NH, то связь, показанная пунктирной и сплошной линиями, не является одинарной связью.
6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
8-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
8-хлор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
8-бром-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
8-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
9-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
9-хлор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
9-бром-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11H)-она,
9-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
9-метокси-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
8,9-дифтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
3-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
8-фтор-3-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
3-метокси-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
8-фтор-3-метокси-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12 (11H)-она,
2-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11H)-она,
8-фтор-2-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11H)-она,
3,9-диметил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11H)-она,
1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11H)-она,
1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11H)-она,
8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11H)-она,
[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11Н)-она,
8-метил-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11Н)-она,
8-фтор-[1] бензотиено[2,3-b] [1,5] бензоксазепин-12(11Н)-она,
1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
8-метил-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
8-фтор-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
8,9-дихлор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
7,8-дихлор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11H)-она,
9-трифторметил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11H)-она,
3-бром-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11H)-она,
6-метил-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11H)-она,
3-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
3-хлор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
1-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
4-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
3,8-дифтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она и
3-фтор-8-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она.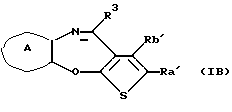
где Ra' и Rb' являются одинаковыми или различными и каждый представляет водород, алкил, ацил, алкенил, фенил, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или галоген;
кольцо А представляет бензольное кольцо, имеющее 1-2 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино и гидроксила, или бензольное кольцо без заместителя;
R3 представляет группу формулы (1), формулы (2), формулы (3), формулы (26) или формулы (28)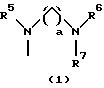
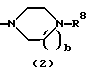
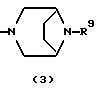
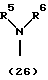
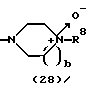
в формуле (1) и формуле (26) R5, R6 и R7 являются одинаковыми или различными и каждый представляет водород, алкил, фенил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, и а равно целому числу 2-4,
в формуле (2) и формуле (28) R8 представляет водород, алкил, имеющий 1-4 углеродных атома, гидроксиалкил, имеющий 1-4 углеродных атома, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, в котором алкил, имеющий 1-4 углеродных атома, замещен алкокси, и b= 1,
в формуле (3) R9 представляет водород или алкил,
или его фармацевтически приемлемая соль или их гидрат.
2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина,
2-этил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина,
2,8-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина,
8-метокси-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина,
2,6-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина,
2,9-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина,
2,3-диметил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина,
8-хлор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина и
8-фтор-2-метил-4-(4-метилпиперазин-1-ил)тиено[2,3-b] [1,5] бензоксазепина
или его фармацевтически приемлемая соль или их гидрат.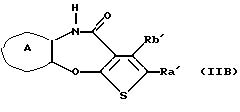
где Ra' и Rb' являются одинаковыми или различными и каждый представляет водород, алкил, циклоалкил, ацил, алкенил, фенил, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или галоген;
кольцо А представляет бензольное кольцо, имеющее 1-4 одинаковых или различных заместителя, выбранных из группы, состоящей из алкила, алкокси, галогена, алкилгалогенида, нитро, амино, моноалкиламино, диалкиламино и гидроксила, или бензольное кольцо без заместителя.
2-метилтиено [2,3-b] [1,5] бензоксазепин-4(5Н)-она,
2,3-диметилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она,
2,8-диметилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она,
8-хлор-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она,
8-фтор-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она,
8-метокси-2-метилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она,
2,6-диметилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она,
2,9-диметилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она и
2-этилтиено[2,3-b] [1,5] бензоксазепин-4(5Н)-она.
Приоритет по пунктам и признакам:
02.09.1997 - по п. 1 при значениях Ra и Rb, X, кольца A, R3, R5, R6, R7, R8 и R9, указанных в п. 12, за исключением случаев, когда заместитель кольца А представляет гидроксил, R3 представляет группу формулы (3), формулы (26) или формулы (28); в формуле (28) R8 представляет ацил или алкоксикарбонил, в формуле (3) R9 представляет водород или алкил; по п. 12, за исключением случаев, когда заместитель кольца А представляет гидроксил, R3 представляет группу формулы (3), формулы (26) или формулы (28); в формуле (28) R8 представляет ацил или алкоксикарбонил, в формуле (3) R9представляет водород или алкил; пп. 13-18, за исключением случаев, когда заместитель кольца А представляет гидроксил; п. 19, за исключением случаев, когда заместитель кольца А представляет гидроксил; п. 20;
09.10.1997 - по п. 1, при значениях Ra и Rb, X, R1, R2, R4, кольца A, R3, R5, R6, R7, R8 и R9, указанных в п. 2, за исключением случаев, когда R1 и/или R2 представляют гидроксил, заместитель кольца А представляет гидроксил, R3 представляет группу формулы (26) или (28), в формуле (26) R5 и R6 являются одинаковыми или различными и каждый представляет водород, алкил, фенил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, в формуле (28) R8 представляет водород, алкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, b= 1; п. 2, за исключением случаев, когда R1 и/или R2 представляют гидроксил, заместитель кольца А представляет гидроксил, R3 представляет группу формулы (26) или (28), в формуле (26) R5 и R6 являются одинаковыми или различными и каждый представляет водород, алкил, фенил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, в формуле (28) R8 представляет водород, алкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, b= 1; пп. 3-5, за исключением случаев, когда R1 и R2 являются одинаковыми или различными и каждый представляет галоген или алкокси; п. 6, за исключением соединений, выбранных из:
8,9-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
7,8-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-бром-8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
1-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено-[2,3-b] [1,5] бензодиазепина,
4-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3,8-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-фтор-8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина и
12-(4-этилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина;
пп. 7-9, за исключением случаев, когда R1 и/или R2 представляют гидроксил, заместитель кольца А представляет гидроксил; п. 10, за исключением случаев, когда R1 и/или R2 представляют галоген, алкокси; п. 11 для первых 25 по ходу изложения соединений;
12.06.1998 - по п. 11 для соединений, выбранных из:
1,2,3,4-тетрагидро-8-метил-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
8-фтор-1,2,3,4-тетрагидро-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
8-метил-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она,
8-фтор-[1] бензотиено[2,3-b] [1,5] бензотиазепин-12(11Н)-она;
31.08.1998 - по п. 1 и 2 - для случаев, когда R1 и/или R2 представляют гидроксил, заместитель кольца А представляет гидроксил, R3 представляет группу формулы (26) или (28), в формуле (26) R5 и R6 являются одинаковыми или различными и каждый представляет водород, алкил, фенил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или алкоксиалкил, в формуле (28) R8 представляет водород, алкил, гидроксиалкил, гидроксиалкоксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, ацил, алкоксикарбонил или алкоксиалкил, b= 1; пп. 4 и 5 - для случаев, когда R1 и R2 являются одинаковыми или различными и каждый представляет галоген или алкокси; п. 6 - для соединений, выбранных из:
8,9-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
7,8-дихлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-бром-8-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-фтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-хлор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
1-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено-[2,3-b] [1,5] бензодиазепина,
4-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3,8-дифтор-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина,
3-фтор-8-метил-12-(4-метилпиперазин-1-ил)-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина и
12-(4-этилпиперазин-1-ил)-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепина;
п. 9 - для случаев, когда R1 и/или R2 представляют гидроксил, заместитель кольца А представляет гидроксил; п. 10 - для случаев, когда R1 и/или R2 представляют галоген, алкокси; п. 11 - для соединений, выбранных из:
8,9-дихлор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
7,8-дихлор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
9-трифторметил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
3-бром-8-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
6-метил-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
3-фтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
3-хлор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
1-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
4-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она,
3,8-дифтор-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она и
3-фтор-8-метил-6Н-[1] бензотиено[2,3-b] [1,5] бензодиазепин-12(11Н)-она;
п. 12 - для случаев, когда заместитель кольца А представляет гидроксил, R3 представляет группу формулы (3), формулы (26) или формулы (28); в формуле (28) R8 представляет ацил или алкоксикарбонил, в формуле (3) R9 представляет водород или алкил; п. 18 - для случаев, когда заместитель кольца А представляет гидроксил; п. 19 - для случаев, когда заместитель кольца А представляет гидроксил.
| RU 94030480 А1, 10.10.1996 | |||
| Магнитоупругий датчик | 1971 |
|
SU454436A1 |
| Приспособление для остановки ходовой тележки грузовой вагонетки канатно-подвесной дороги при обрыве поддерживающего кузов вагонетки тягового троса | 1935 |
|
SU48455A1 |
Авторы
Даты
2003-01-27—Публикация
1998-08-31—Подача