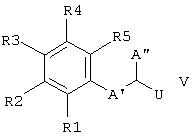
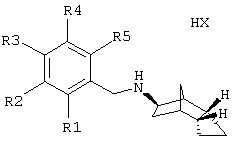
Изобретение относится к замещенным производным норборниламина с экзоконфигурацией азота и эндоаннелированными пяти-, шести- или семичленными циклами формулы I и с экзоконфигурацией азота и экзоаннелированными пяти-, шести- или семичленными циклами формулы Ia,
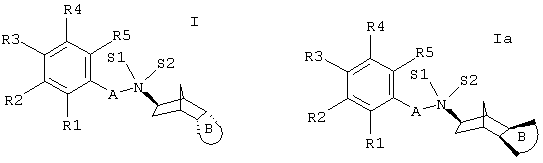
где обозначают
А - (С1-С4) - алкилен;
S1 - свободную пару электронов или (С1-С4)-алкил;
S2 - (С1-С4)-алкил или Н;
причем, если S1 и S2 обозначают алкил, Х- в образующейся группировке [-N+(S1S2)-X-] соответствует фармакологически приемлемому аниону или трифторацетату;
В - насыщенное или ненасыщенное углеродное пяти-, шести- или семичленное кольцо, которое независимо друг от друга может быть одно- или многократно оксо-, гидрокси-, (C1-C4)-алкоксигруппой и (C1-C4)-алкилом;
и R1, R2, R3, R4 и R5 - независимо друг от друга Н, ОН, F, Cl, Br, I, CN, NO2, амидиногруппу, -CO2R(11), -CONR(11)R(12), -SOrR(11), -SOsNR (11) R (12), (C1-C4) -алкил, (C1-C4) -алкоксигруппу, (C1-C4) -алкокси(C1-C4) -алкил, (C1-C4) -алкокси(C1-C4) -алкилоксигруппу, гидрокси-(C1-C4)-алкил, (С3-С7)-циклоалкокси или фенилоксигруппу,
причем фенил не замещен или замещен вплоть до трех заместителями, независимо друг от друга выбранными из группы, состоящей из F, Cl, Br и метоксигруппы;
амино-, (C1-C4) -алкиламино-, ди(C1-C4) -алкиламиногруппу, амино(C1-C4) -алкил, ди(C1-C4) -алкиламино(C1-C4) -алкил, (C1-C4)-алкиламино-(C1-C4)-алкил, причем атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
R11 и R12- независимо друг от друга Н или (C1-C4)-алкил,
причем атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
r - 0, 1 или 2;
s - 1 или 2;
или каждые из R1 и R2, R2 и R3, R3 и R4 или R4 и R5 - вместе группу -O-(СН2)n-O-;
n - 1 или 2;
и каждый из остальных остатков R1, R2, R3, R4 или R5 независимо друг от друга Н, ОН, F, Cl, Br, I, CN, NO2, амидиногруппу, -CO2R(11), -CONR(11)R(12); -SOrR(11), -SOsNR(11)R(12), (С1-С4)-алкил, (C1-C4)-алкоксигруппу, (C1-C4)-алкокси(C1-C4)-алкил, (С3-С7) -циклоалкоксигруппу, гидрокси-(C1-C4) -алкил, амино-, (C1-C4) -алкиламино-, ди(C1-C4) -алкил-аминогруппу, амино(C1-C4) -алкил, ди(C1-C4) -алкиламино-(C1-C4)-алкил, (C1-C4)-алкиламино-(C1-C4)-алкил,
причем атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
R11 и R12 - независимо друг от друга Н или (C1-C4)-алкил,
причем атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
r - 0, 1 или 2;
s - 1 или 2;
при этом бензил-(октагидро-4,7-метано-инден-5-ил)-амин исключается, а также их фармацевтически приемлемые соли или трифторацетаты.
Предпочтительны соединения с экзоконфигурацией азота и эндоаннелированным пяти- или шестичленным кольцом формулы I и с экзоконфигурацией азота и экзоаннелированным пяти- или шестичленным кольцом формулы Ia, в которых обозначают
А - (С1-С2)-алкилен;
S1 - свободную пару электронов или метил;
S2 - Н;
В - насыщенное или ненасыщенное углеродное пяти- или шестичленное кольцо;
R1, R2, R3, R4 и R5 - независимо друг от друга Н, аминогруппу, гидроксиметил, ОН, метоксигруппу, F, Cl, Br или иод;
или R2 и R3 - вместе -O-СН2-O-;
и остающиеся остатки R1, R4 и R5 независимо друг от друга Н, ОН, F, Cl, Br, I, CN, NO2, (С1-С2)-алкокси-, амино-, (С1-С2)-алкиламино- или ди- (C1-C2)-алкиламиногруппу,
причем атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
при этом исключается бензил-(октагидро-4,7-метано-инден-5-ил)-амин, а также их фармацевтически приемлемые соли и трифторацетаты.
Особенно предпочтительны соединения с экзоконфигурацией азота и эндоаннелированным пяти- или шестичленным кольцом формулы I и с экзоконфигурацией азота и экзоаннелированным пяти- или шестичленным кольцом формулы Ia, в которых обозначают:
А - (С1-С2)-алкилен;
S1 - свободную пару электронов;
S2 - Н;
В - насыщенное или ненасыщенное углеродное пяти- или шестичленное кольцо;
R1, R3 и R5 - водород;
и R2 и R4 - независимо друг от друга Н, метоксигруппу, F или Cl;
или R2 и R3 - вместе -О-СН2-О-;
и R1, R4 и R5 - водород;
при этом исключается бензил-(октагидро-4,7-метано-инден-5-ил)-амин, а также их фармацевтически приемлемые соли или трифторацетаты.
Наиболее предпочтительны следующие соединения с экзоконфигурацией азота и эндоаннелированным пяти- или шестичленным кольцом формулы I и с экзоконфигурацией азота и экзоаннелированным пятичленным кольцом формулы Ia:
экзо/эндо-(3-хлорбензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-бензо[1,3]диоксол-5-илметил-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(рац)-(3-метоксибензил)-(октагидро-4,7-метано- инден-5-ил)амин,
экзо/эндо-(+)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(-)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-[1-(3-метоксифенил)-этил]-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)-(3-метоксибензил)амин,
экзо/эндо-(3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)-(3-метоксибензил)амин,
экзо/эндо-(декагидро-1,4-метано-нафталин-2-ил)-(3-метоксибензил)амин,
экзо/ендо-(3,5-дифторбензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(октагидро-4,7-метано-инден-5-ил)амин
и
экзо/эндо-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
а также их фармацевтически приемлемые соли или трифторацетаты.
Особенно предпочтительны следующие соединения с экзоконфигурацией азота и эндоаннелированными пяти- или шестичленными циклами формулы I:
экзо/эндо-(3-хлорбензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(октагидро-4,7-метано-инден-5-ил)амин
экзо/эндо-(3-фторбензил)-(3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)амин,
экзо/эндо-бензо[1,3]диоксол-5-илметил-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(рац)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(+)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(декагидро-1,4-метано-нафталин-2-ил)-(3-метоксибензил)амин,
экзо/эндо-(-)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин и
экзо/эндо-(3,5-дифторбензил)-(октагидро-4,7-метано-инден-5-ил)-амин,
а также их фармацевтически приемлемые соли или трифторацетаты.
В качестве аддитивных солей кислот принимают во внимание все фармакологически приемлемые соли, например галогениды, в частности хлориды, лактаты, сульфаты, цитраты, тартраты, ацетаты, фосфаты, метилсульфонаты, пара-толуолсульфонаты, адипинаты, фумараты, глюконаты, глутаматы, глицерофосфаты, малеаты и памоаты. Указанная группа соответствует также фармакологически приемлемым анионам. Но речь идет также о трифторацетатах.
Если соединение формулы I или Ia содержит один или более центров асимметрии, то они могут иметь как S-, так и R-конфигурацию. Соединения могут быть представлены в виде оптических изомеров, диастереомеров, рацематов или их смесей. Конечно, аминозаместитель должен находиться в экзоположении и кольцо быть эндо- или экэоаннелированным.
Названные алкильные или алкиленовые остатки могут быть как линейными, так и разветвленными.
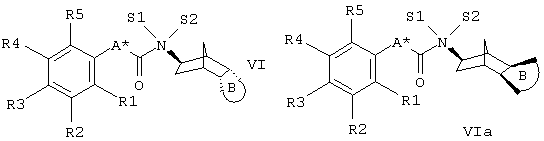
Дополнительно изобретение относится к способу получения соединений формулы I или Ia, отличающемуся тем, что а) соединение формулы II или IIa
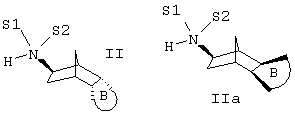
подвергают взаимодействию с соединением формулы III в присутствии подходящего восстановителя и, возможно, также кислоты Льюиса непосредственно с образованием соединений формулы I или Ia,
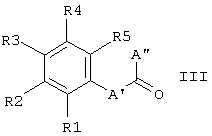
где S1, S2, В, R1, R2, R3, R4 и R5 имеют приведенные выше значения, в то время как независимо друг от друга А' соответствует связи или (С1-С3)-алкилу и А'' соответствует Н или (С1-С3)-алкилу и А' и А'' вместе с атомом углерода карбонильной группы содержат столько атомов углерода, как указано выше для А;
или
b) образованный из соединений формул II или IIa и III промежуточное соединение формулы IV или IVa,
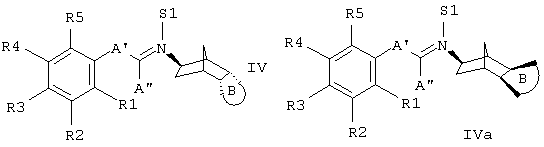
где если S1 обозначает (С1-С4)-алкил, образуется ониевый азот, которому соответствует противоион, такой как, например, хлорид или тозилат,
выделяют и затем подходящим восстановителем переводят в соединения формулы I или Ia,
или
с) соединение формулы II или IIa превращают с алкилирующим агентом формулы V,
где U обозначает нуклеофильно замещаемую группу, такую как хлор, бром и иод, а также мезилат, тозилат, трифлат или другую хорошо удаляемую группу, а другие остатки определены, как описано выше, но здесь атому углерода карбонильной группы соответствует атом углерода, связанный с U,
предпочтительно в присутствии ненуклеофильного основания, такого как диизопропилэтиламин,
или
а) амиды карбоновых кислот формулы VI или VIa
где А обозначает связь или (С1-С3)-алкил и другие
остатки определены, как описано выше, восстанавливают до соответствующих аминов;
или
e) соединения формулы I или Ia, в которых S1 обозначает свободную пару электронов и S2 обозначает водород, одно- или диалкилируют алкилирующим средством формулы VII,
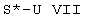
где S* обозначает (С1-С4)-алкил и U имеет описанное выше значение, так что в результате этого взаимодействия образуется третичный амин или четвертичная соль аммония;
или
f) дициклопентадиенилплатиновый комплекс формулы VIII
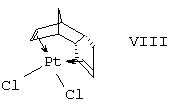
подвергают взаимодействию с аминами типа формулы IX,
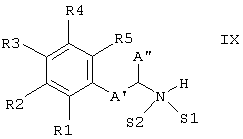
где S1, S2, R1, R2, R3, R4 и R5 имеют вышеприведенные значения, в то время как независимо друг от друга А' обозначает связь или (С1-С3)-алкил и А'' обозначает Н или (С1-С3)-алкил и А' и А'' вместе с атомом углерода, с которым связан атом азота, содержат столько атомов углерода, как описано выше для А,
и затем образовавшееся промежуточное соединение восстанавливают до получения соединения формулы I (J.K. Stille, D.B. Fox JACS 1970 (92), 1974),
и в случае необходимости переводят в фармацевтически приемлемую соль или трифторацетат.
В описании патента US 4024274 (Ное 74/F018) описан норборниламин подобной структуры, но с неизвестной пространственной структурой, с хорошей диуретической и салуретической активностью.
При анализе множества описанных в патенте примеров следует выделить некоторые соединения указанного типа в качестве сильных ингибиторов натрий-водородного обмена, подтип 3 (NHE3). Соединения были на основании этого испытаны на их салидиуретическое действие и неожиданно не было подтвержено никакого салидиуретического действия, так что взаимосвязь между NНЕ3-активностью и салидиурезом не могла быть показана.
Поскольку пространственная структура трицикла была неизвестна, существовал выбор между четырьмя возможными парами энантиомеров, то есть всего восемью пространственно различными структурами. Для указанных пар энантиомеров показано, что только две пары проявляют сильное NHE3-ингибирующее действие, тогда как две другие пары энантиомеров едва проявляют NНЕ3-блокирующие свойства. Поиск наиболее активных структур путем рентгеноструктурного анализа показал, что в случае наиболее сильных NНЕ3-активных пар энантиомеров речь идет о соединениях с определенной экзоконфигурацией для азота, а также с определенным эндоаннелированным пятичленным кольцом. Несколько менее активная пара энантиомеров обладает определенной экзоконфигурацией азота, а также определенно экзоаннелированным пятичленным кольцом. Обе оставшиеся пары энантиомеров с определенными эндо/экзо- или эндо/эндоконфигурациями едва проявляют NНЕ3-ингибируюшее действие.
Далее неожиданно было показано, что определенные разделенные энантиомеры - соединения из примера, которые имели определенную экзоконфигурацию атома азота, а также определенно эндоаннелированное пятичленное кольцо, оба были одинаково активными по отношению к NHE3. Из-за их зеркального пространственного расположения ожидали четкого различия активностей.
В противоположность известным ингибиторам натрий-водородного обмена, подтипа 3 по патенту EP-OS 825178 {НОЕ 96/F226), которые представлены относительно полярными структурами и соответствуют ацилгуанидинному типу (J.-R. Schwark и др. Eur. J. Physiol (1998) 436:797), в случае предложенных соединений речь идет о неожиданно липофильных веществах, которые не относятся к ацилгунидиновому типу и представляют собой совершенно новые структуры для ингибирования NHE3. Вслед за только что названными ацилгуанидинами и затрудненно действующим скваламином (M.Donowitz и др. Am. J. Physiol. 276 (Cell Physiol. 45): C136-C144) активность наблюдалась через один час, речь идет о третьем классе веществ NНЕ3-ингибиторов, которые были известны ранее. В противоположность вышеназванным NHE3-ингибиторам они проявляют повышенную проницаемость через мембраны и незамедлительное наступление действия.
NHE3 был обнаружен в различных частях тела, предпочтительно в желчном пузыре, кишечнике и почках (Larry Fliegel и др., Biochem. Cell. Biol. 76: 735-741, 1998), а также в головном мозге (Е. Ма и др. Neuroscience 79:591-603).
Предлагаемые согласно; изобретению соединения формулы I или Ia пригодны для применения в качестве антигипертензивных средств для лечения первичной и вторичной гипертонии.
Кроме того, соединения индивидуально или в сочетании с NHE-ингибиторами других подтипов могут защищать от острой или хронической кислородной недостаточности органа путем уменьшения или затруднения индуцированных ишемией нарушений. Они применимы таким образом в качестве лекарственных средств, например, при оперативных вмешательствах (например, при трансплантации органов, почки и печени, причем эти соединения могут быть использованы для зашиты органа у донора перед или во время отделения, для защиты отделенного органа, например, при обработке или хранении в физиологической жидкости, а также при его пересадке в организм реципиента) или острой и хронической почечной недостаточности. С особенной пользой удается снизить индуцированные ишемией нарушения в кишечнике.
В соответствии с их защитным действием против индуцированных ишемией нарушений соединения потенциально применимы также в качестве лекарственных средств для лечения ишемии нервной системы, в частности ЦНС, причем они, например, применимы для лечения острых приступов или отека мозга. Кроме того, предложенные соединения формулы I или Ia равным образом применимы для лечения форм шоков, таких как, например, аллергический, кардиогенный, гиповолемический и бактериальный шоки.
Далее соединения индуцируют улучшение дыхательного импульса и поэтому привлекаются к лечению затруднения дыхания при следующих клинических состояниях и заболеваниях: затрудненный центральный дыхательный импульс (например, центральный синдром временной остановки дыхания во время сна, внезапная детская смерть, постоперационная гипоксия), обусловленные мускулатурой нарушения дыхания, нарушения дыхания после длительной искусственной вентиляции легких, нарушения дыхания при адаптации к высокогорью, обструктивные и смешанные формы временной остановки дыхания во время сна, острые и хронические заболевания легких с гипоксией и гиперкапнией.
Дополнительно соединения повышают мускульный тонус верхних дыхательных путей, так что подавляется храп.
Комбинация NHE-ингибитора с ингибитором карбоангидразы (например, ацетазоламидом), причем последний приводит к метаболическому ацидозу и таким образом повышает устойчивость дыхания, оказывается полезной благодаря усиленному действию и уменьшенному введению активного вещества.
Показано, что соединения согласно изобретению обладают мягким послабляющим действием и поэтому с пользой могут быть использованы в качестве слабительных средств или при угрожающих запорах, причем уменьшение застойных явлений в кишечнике особенно полезно при ишемических нарушениях.
Дополнительно существует возможность ингибирования образования желчных камней.
Кроме того, предлагаемые согласно изобретению соединения формулы I или Ia могут оказывать ингибирующее действие на пролиферацию клеток, например пролиферацию фибробластных клеток и пролиферацию клеток гладких мускулов сосудов. Поэтому в случае соединений формулы I или Ia речь идет о ценных терапевтических средствах при заболеваниях, при которых пролиферация клеток является первичной или вторичной причиной, и поэтому могут быть использованы в качестве антиатеросклеротических средств, средств против поздних диабетических осложнений, раковых заболеваний, фибротических заболеваний, таких как фиброз легких, фиброз печени или фиброз почки, эндотелиальной дисфункции, гипертрофии и гиперплазии органов, в частности при гиперплазии простаты или гипертрофии простаты.
Предлагаемые согласно изобретению соединения являются активными ингибиторами клеточного натрий-протонного обмена, который при многочисленных заболеваниях (эссенциальной гипертонии, атеросклерозе, диабете и т.д.) повышен в таких клетках, которые легко доступны для измерений, как, например, в эритроцитах, тромбоцитах или лейкоцитах. Соединения согласно изобретению поэтому пригодны в качестве простых научных средств, например при их применении в качестве диагностических средств для определения и распознавания определенных форм гипертонии, а также атеросклероза, диабета, пролиферативных заболеваний и т.д. Сверх того, соединения формулы I или Ia применимы для профилактической терапии для предотвращения генеза кровяного давления, например эссенциальной гипертонии.
Кроме того, обнаружено, что NHE-ингибиторы оказывают благоприятное влияние на сывороточные липопротеины. Вообще признано, что для возникновения артериосклеротических изменений сосудов, в частности коронарных сердечных заболеваний, слишком высокое содержание жира в крови, так называемая гиперлипопротеинемия, представляет собой существенный фактор риска. Поэтому для профилактики и регрессии атеросклеротических изменений снижение повышенного сывороточного липопротеина имеет исключительное значение. Предлагаемые соединения поэтому могут привлекаться для профилактики и для регрессии атеросклеротических изменений, в то время как они исключают причинный фактор риска. Благодаря такой защите сосудов в отношении синдрома эндотелиальной дисфункции соединения формулы I или Ia являются ценными лекарственными средствами для предупреждения и лечения спазм коронарных сосудов, атерогенеза и атеросклероза, левовентрикулярной гипертонии и дилатационной кардиомиопатии, и тромботических заболеваний.
Названные соединения поэтому находят применение для получения лекарственного средства для предупреждения и лечения временной остановки дыхания во время сна и мускульно обусловленных нарушений дыхания; для получения лекарственного средства для предупреждения и лечения храпа; для получения лекарственного средства для снижения кровяного давления; для получения лекарственного средства с послабляющим действием для предупреждения и лечения кишечных запоров; для получения лекарственного средства для предупреждения и лечения заболеваний, вызываемых ишемией и реперфузией центральных и периферических органов, таких как острая почечная недостаточность, острый приступ, состояние эндогенного шока, кишечные заболевания и т.д.; для получения лекарственного средства для лечения гиперхолестеринемии; для получения лекарственного средства для предупреждения атерогенеза и атеросклероза; для получения лекарственного средства для предупреждения и лечения заболеваний, вызванных повышенным уровнем холестарина; для получения лекарственного средства для предупреждения и лечения заболеваний, вызванных эндотелиальной дисфункцией; для получения лекарственного средства для лечения поражения эктопаразитами; для получения лекарственного средства для лечения названных болезней в сочетании с понижающими кровяное давление веществами, предпочтительно с ингибиторами ангиотензинпревращающего фермента (АСЕ) и антагонистами рецепторов ангиотензина. Комбинация NHE-ингибитора формулы I или Ia с понижающим уровень жира в крови активным веществом, предпочтительно с ингибитором HMG-CoA-редуктаэы (например, ловастатином или правастатином), причем последний приводит к гиполипидемическому действию и таким образом повышает гиполипидемические свойства NHE-ингибитора формулы I или Ia, представляет собой благоприятную комбинацию с усиленным действием и уменьшенным введением активного вещества.
В качестве лекарственного средства нового типа для понижения повышенного уровня кровяного давления предлагается введение ингибиторов натрий-протонного обмена формулы I или Ia, а также комбинации ингибиторов натрий-протонного обмена с понижающими кровяное давление и/или гиполипидемически действующими лекарственными средствами.
Лекарственное средство, которое содержит соединение I или Ia, можно при этом вводить перорально, парентерально, внутривенно, ректально или путем ингаляций, причем предпочтительное введение зависит от соответствующей картины заболевания. Соединения I или Ia при этом могут применяться индивидуально или вместе с галеновыми вспомогательными веществами как в ветеринарии, так и в медицине.
Какие вспомогательные вещества применимы для желательной готовой препаративной формы лекарственного средства известно специалисту на основании его специальных знаний. Наряду с растворителями, гелеобразователями, основами суппозиториев, вспомогательными средствами для таблетирования и другими носителями активного вещества могут быть использованы, например, антиоксиданты, диспергаторы, эмульгаторы, вспениватели, вкусовые добавки, консерванты, солюбилизаторы или красители.
Для пероральной формы применения активные соединения смешивают с подходящими добавками, такими как носители, стабилизаторы или инертные разбавители, и переводят обычными способами в подходящие формы применения, такие как таблетки, драже, капсулы, водные, спиртовые или масляные растворы. В качестве инертного носителя могут быть использованы, например, гуммиарабик, магнезия, карбонат магния, фосфат калия, молочный сахар, глюкоза или крахмал, в частности кукурузный крахмал. При этом препаративная форма может быть получена как в виде сухих, так и в виде влажных гранулятов. В качестве масляного носителя или в качестве растворителя могут быть использованы, например, растительные или животные масла, такие как подсолнечное мало или рыбий жир.
Для подкожного или внутривенного применения активные соединения, при желании, с обычными веществами, такими как солюбилизаторы, эмульгаторы или другие вспомогательные вещества, вносят в раствор, суспензию или эмульсию. В качестве растворителя речь идет, например, о воде, физиологическом растворе поваренной соли или спирте, например этаноле, пропаноле, глицерине, кроме того, растворах сахаров, таких как растворы глюкозы или маннита, или также смеси различных названных растворителей.
В качестве фармацевтической готовой формы для применения в виде аэрозолей или спреев пригодны, например, растворы, суспензии или эмульсии активного соединения формулы I или Ia в фармацевтически приемлемом растворителе, в особенности в таком, как этанол или вода, или в смеси таких растворителей.
Готовая препаративная форма может содержать также еще другие фармацевтические вспомогательные вещества, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, и газ-носитель. Такая готовая препаративная форма содержит активное вещество обычно в концентрации примерно от 0,1 до 10, в частности примерно от 0,3 до 3 мас.%.
Дозировка вводимого активного вещества формулы I или Ia и частота введения зависят от силы действия и продолжительности действия используемых соединений; кроме того, от вида и тяжести излечиваемого заболевания, также и от пола, возраста, веса и индивидуальных особенностей излечиваемого млекопитающего.
В среднем дневная доза соединения формулы I или Ia при весе пациента примерно 75 кг составляет по меньшей мере 0,001 мг/кг, предпочтительно 1-10 мг/кг, самое большее 100 мг/кг веса тела. При острых приступах болезни могут также быть необходимы еще большие и прежде всего более частые дозировки, например до 4 отдельных доз в день. В частности, при внутривенном введении, например, в случае инфарктного пацента в отделении интенсивной терапии может оказаться необходимым до 200 мг в день.
Экспериментальная часть:
Использованные сокращения:
СН2Cl2 - дихлорметан
CI - химическая ионизация
DIP - диизопропиловый эфир
ЭА - этилацетат
ES - электрораспыление
НОАс - уксусная кислота
Н2O - вода
H2O2 - пероксид водорода
т.кип. - температура кипения
МеОН - метанол
MgSO4 - сульфат магния
т.пл. - температура плавления
MS - масс-спектр
МТВ - метил-трет-бутиловый эфир
NaBH4 - боргидрид натрия
NaHCO3 - гидрокарбонат натрия
NaOH - гидроксид натрия
RT - комнатная темпаратура
ТГФ - тетрагидрофуран
TFA - трифторуксусная кислота
HCl - соляная кислота
Описание синтеза некоторых аминов
амин 1)
Синтез экзо/эндо-октагидро-4,7-метано-инден-5-иламина
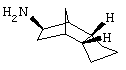
a1) N,N'-диоксид бис-(6-хлор-3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)-диазена и изомеры
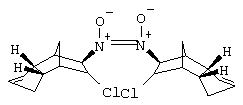
В смесь 167 г дициклопентадиена, 160 мл ледяной уксусной кислоты и 160 мл этанола прибавляли 167 г изоамилнитрита и затем по каплям при перемешивании при -10°C 420 мл 15%-ного раствора хлористого водорода в этаноле. Перемешивали следующие 3 часа при комнатной температуре. После прибавления 500 мл диизопропилового эфира перемешивали еще 10 минут и отфильтровывали кристаллы. Почти бесцветные кристаллы, т.пл. 177-178°С.
b1) октагидро-4,7-метано-инден-5-иламин
Суспензию из 10 г N,N'-диоксида бис-(6-хлор-3а,4,5,6,7, 7а-гексагидро-1Н-4,7-метано-инден-5-ил)-диазена, 60 мл метанола и никеля Ренея гидрировали 10 часов при 100°С под давлением Н2 100 ат. Катализатор отфильтровывали, растворитель упаривали на роторном испарителе под уменьшенным давлением, смешивали полукристаллический остаток с водой и сильно подщелачивали путем прибавления 10 н NaOH. После от 3- до 4-кратного экстрагирования метил-трет-бутиловым эфиром и высушивания органической фазы над сульфатом натрия растворитель отгоняли и масло перегоняли в вакууме. Т.кип.5мм 86-91°С. или
а2) 3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-иламин и 3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-иламин
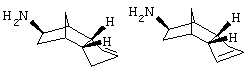
20 г экзо-5-изотиоцианато-5,6-дигидроэндодициклопентадиена (Maybridge international) растворияли в 60 мл муравьиной кислоты и 27 часов кипятили с обратным холодильником. Летучие компоненты удаляли в вакууме, добавляли 50 мл 20%-ного водного раствора NaOH и трижды экстрагировали по 100 мл CH2Cl2. Сушили над MgSO4 и растворитель удаляли в вакууме. Получили 13,4 г бледно-желтого масла.
Rf (CH2Cl2/MeOH/HOAc/H2O 32:8:1:1)=0,57; MS(ES+):150 (М+Н)+
b2) трет-бутиловый эфир (3а,4,5,6,7,7а-гексагидро-1H-4,7-метано-инден-5-ил) карбаминовой кислоты и трет-бутиловый эфир (3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)карбаминовой кислоты
12,8 г смеси 3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-иламина и 3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-иламина растворяли в 200 мл ТГФ и при RT смешивали с раствором 18,7 г ди-трет-бутилдикарбоната в 200 мл ТГФ. Затем прибавляли по каплям 12 мл триэтиламина и перемешивали 2 часа при RT. Летучие компоненты удаляли в вакууме и остаток хроматографировали на силикагеле с DIP. Получили 15 г бесцветного масла, которое кристаллизовали из н-гептана; т.пл. 94°С.
Rf(DIP) = 0,68 MS (CI+):250 (M+H)+
с2) трет-бутиловый эфир (октагидро-4,7-метано-инден-5-ил)-
карбаминовой кислоты
500 мг смеси трет-бутилового эфира (3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)карбаминовой кислоты и трет-бутилового эфира (3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)-карбаминовой кислоты растворяли в 20 мл метанола и 2 мл уксусной кислоты и гидрировали с помощью 200 мг 10%-ного Pd/C (50% воды) под атмосферой водорода (1 бар) в течение 6 часов. Катализатор отфильтровывали и летучие компоненты удаляли в вакууме. Получили 470 мг смолообразного аморфного твердого вещества.
Rf(DIP)=0,70 MS (CI+):252 (М+Н)+
d2) трифторацетат октагидро-4,7-метано-инден-5-иламина
460 мг трет-бутилового эфира (октагидро-4,7-метано-инден-5-ил)-карбаминовой кислоты растворяли в 5 мл трифторуксусной кислоты и 24 часа перемешивали при RT. Затем летучие компоненты удаляли в вакууме и получили 390 мг бледно-желтого пенообразного продукта.
Rf(ЭА/НЕР/МеОН/СН2Cl2/насыщенный водный раствор NH3 10:5:5:5:1)=0,30
MS (CI+):152 (M+H)+
или
а3) октагидро-4,7-метано-инден-5-иламин
3,3 г смеси 3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-иламина и 3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-иламина (пример амина 1, а2) растворяли в 30 мл метанола и восстанавливали под атмосферой водорода в присутствии 0,5 г Pd/C (10%). Через 4 часа катализатор отфильтровывали и промывали метанолом. Фильтрат упаривали в вакууме и получали 3 г желаемого продукта в виде масла. MS(ES+):152 (М+Н)+
Амин 2) Синтез эндо/экэо-октагидро-4,7-метано-инден-5-иламина
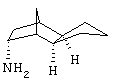
Предварительно насыщенный при 10° С МНз раствор 15 г трицикло[5,2,1,02,6]декан-8-она в 60 мл метанола после добавления никеля Ренея гидрировали в автоклаве при 90°С и давлении водорода 100 бар свыше 10 часов. После фильтрования катализатора и перегонки растворителя при уменьшенном давлении с помощью 10 н NaOH сильно подщелачивали и экстрагировали 2-3 раза этилацетатом или диизопропиловым эфиром. Объединенные органические фазы сушили и фракционировали в вакууме. Т. кип.6-7мм 86-88°С.
Амин 3)
Синтез эндо/эндооктагидро-4,7-метано-инден-5-иламина
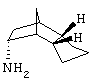
a) оксим 1,3а,4,6,7,7а-гексагидро-4,7-метано-инден-5-она
10 г N,N'-диоксида бис-(6-хлор-3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)диазена из амина 1, а1) суспендировали в 75 мл изоамилового спирта и при перемешивании медленно нагревали до кипения. После полного растворения охлаждали на ледяной бане до комнатной температуры и прибавляли 25 мл осушенного этанола, 12,5 мл ледяной уксусной кислоты и 6 г цинковой пыли. Кипятили в течение часа, охлаждали, цинк отфильтровывали и этанол отгоняли. Остаток перемешивали в 300 мл простого эфира и выдерживали в течение ночи. Затем эфир декантировали от осадка и промывали трижды раствором карбоната натрия и дважды водой. После высушивания над сульфатом магния фильтровали и затем фильтрат упаривали. Последующей перегонкой в вакууме получено 3,3 г масла, которое сразу использовали дальше.
b) октагидро-4,7-метано-инден-5-иламин
2,2 г оксима 1,3а,4,6,7,7а-гексагидро-4,7-метано-инден-5-она растворяли в 50 мл метанола и прибавляли около 10% никеля Ренея, растворенного в 50% воды. Через 20 часов гидрировали при 100 барах и 100°С, катализатор отфильтровывали и растворитель отгоняли. Остаток извлекали простым эфиром и 6 н гидроокисью натрия, фазы разделяли, водную фазу трижды экстрагировали эфиром, объединенные органические фазы сушили сульфатом магния, фильтровали и фильтрат упаривали. Оставалось 1,8 г бесцветного масла, которое очищали перегонкой с шариковым дефлегматором. Получили 0,96 г желаемого амина в виде масла.
MS (CI+):152,2 (М+Н)+
Амин 4)
Синтез экзо/экзооктагидро-4,7-метано-инден-5-иламина
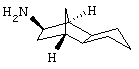
a) октагидро-4,7-метано-инден-5-ол
25 г трицикло[5.2.1.0(2,6)]декан-8-она (Aldrich) растворяли в 100 мл метанола и при комнатной температуре при легком охлаждении и перемешивании порциями в течение 2 ч прибавляли 6,3 г твердого боргидрида натрия. Затем перемешивали еще 2 ч и выдерживали в течение ночи. При охлаждении затем прибавляли по каплям около 40 мл 2 н HCl и далее 20 мл воды. Смесь упаривали, остаток смешивали с этилацетатом и этилацетатную фазу промывали один раз водой и один раз раствором гидрокарбоната натрия. После высушивания сульфатом магния этилацетатную фазу фильтровали и упаривали. Оставалось 26 г масла, которое очищали перегонкой в вакууме. Получили 20,7 г маслянистой жидкости (т.кип.0.5 76°C).
b) 2-(октагидро-4,7-метано-инден-5-ил)изоиндол-1,3-дион
К раствору 1,66 г 11 октагидро-4,7-метано-инден-5-ола, 1,47 г фталимида и 2,62 г трифенилфосфина в 15 мл ТГФ при перемешивании добавляли 1,7 г диэтилазодикарбоксилата, разбавленного 5 мл ТГФ. После выдерживания в течение ночи реакционную смесь упаривали, остаток перемешивали с простым эфиром, осадок отсасывали и фильтрат упаривали. Остаток очищали через силикагель/толуол. Получили 1,36 г желтого масла.
MS (CI+):282,2 (M+Н)+
с) экзо/экзооктагидро-4,7-метано-инден-5-иламин
К раствору 1,12 г 2-(октагидро-4,7-метано-инден-5-ил)изоиндол-1,3-диона в 15 мл этанола прибавляли по каплям 0,4 г гидразингидрата и перемешивали 2 ч при 65°С. Затем при помощи конц. HCl устанавливали рН 1-2, смешивали с 10 мл этанола, осадок отфильтровывали и фильтрат упаривали. Остаток очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). После сушки вымораживанием получили 567 мг продукта в виде трифторацетата. Обработкой гидроокисью натрия и этилацетатом получено 322 мг свободного амина.
MS (CI+):152,0 (М+Н)+
Примеры
Если не указано иное, в приведенных примерах речь идет о рацематах.
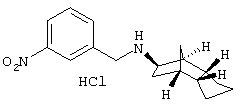
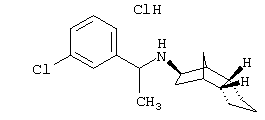
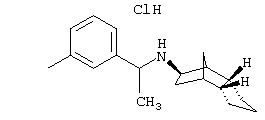
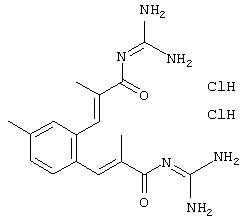
Пример 1: (экзо/эндо)-(3-хлррбензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
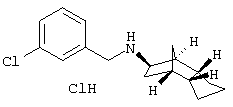
Раствор 0,54 г экзо/эндооктагидро-4,7-метано-инден-5-иламина (амина 1) и 0,562 г 3-хлорбензальдегида в 20 мл толуола после прибавления небольшого каталитического количества п-толуолсульфокислоты нагревали до кипения 5 часов и после выдерживания в течение ночи при комнатной температуре отгоняли растворитель. Остаток растворяли в метаноле и прибавляли к охлажденному льдом желтому раствору при перемешивании маленькими порциями 0,181 г бораната натрия. Перемешивали несколько часов при комнатной температуре и сильно подкисляли с помощью пересыщенного метанольного раствора хлористого водорода. После кратковременного перемешивания осадок отфильтровывали и отгоняли растворитель из фильтрата. Остаток образует от бесцветного до слабо-желтого кристаллическое вещество, т.пл. 241°С.
Пример 2: (экзо/эндо)-(3-фторбензил)-(3а,4,5,6,7,7а-гекса-гидро-1Н-4,7-метано-инден-5-ил)амин и (экзо/эндо)-(3-фтор-бензил)-(3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)амин

300 мг смеси из 3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-иламина и 3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-иламина (смотри амин 1, а2), 315 мкл 3-фторбензальдегида, а также 10 мг п-толуолсульфокислоты растворяли в 5 мл толуола (безводного) и 5 часов кипятили с обратным холодильником. Затем летучие компоненты удаляли в вакууме, остаток извлекали 20 мл МеОН, добавляли 152 мг NaBH4 и выдерживали 15 часов при RT. Реакционную смесь разбавляли затем 200 мл ЭА и дважды промывали по 50 мл насыщенного водного раствора NaHCO3. Сушили над MgSO4 и растворитель удаляли в вакууме. Препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (градиент 5:95-95:5) получено 150 мг бесцветного масла.
Rf(ЭА)=0,40; MS (CI+):258 (М+H)+
Пример 3: (экзо/эндо)-(3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)-(3-метоксибензил)амин и (экзо/эндо)-(3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)(3-метоксибензил)амин
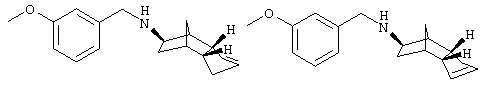
Соединения примера 3 были синтезированы аналогично примеру 2).
Rf(ЭА)=0,35; MS (CI+):270 (M+Н)+
Пример 4: (экзо/эндо)-5-(3-метоксибензиламино)-октагидро-4,7-метано-инден-2-ол
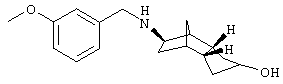
а) трет-бутиловый эфир (3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)карбаминовой кислоты и трет-бутиловый эфир (3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)карбаминовой кислоты, 12,8 г смеси из 3а, 4,5,6,7,7а-гексагидро-1Н-4,7-метано- инден-5-иламина и 3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано- инден-5-иламина растворяли в 200 мл ТГФ и при RT смешивали с раствором 18,7 г ди-трет-бутилдикарбоната в 200 мл ТГФ. Затем прибавляли по каплям 12 мл триэтиламина и перемешивали 2 часа при RT. Летучие компоненты удаляли в вакууме. Хроматографией на силикагеле с DIP получено 15 г бесцветного масла. Кристаллизацией из н-гептана получено 4,9 г бесцветных кристаллов, т.пл. 94°С.
Rf(DIP)=0,68; MS(ES+):250 (M+H)+
b) трет-бутиловый эфир (2-гидрокси-октагидро-4,7-метано- инден-5-ил)карбаминовой кислоты
4,87 г смеси из трет-бутилового эфира (3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)карбаминовой кислоты и трет-бутилового эфира (3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)карбаминовой кислоты растворяли в 30 мл толуола (безводного) и при RT шприцем добавляли 20 мл 2 М раствора боран-диметилсульфидного комплекса в толуоле. 24 часа перемешивали при RT, добавляли шприцем следующие 10 мл 2 М раствора боран-диметилсульфидного комплекса в толуоле и снова перемешивали 6 часов при RT. Летучие компоненты удаляли в вакууме, добавляли 200 мл CH2Cl2 и 33 мл 3 н водного раствора NaOH и медленно смешивали с 7 мл 30%-ного водного раствора H2O2. Перемешивали 10 минут при RT и добавляли следующие 100 мл 3 н родного раствора NaOH, а также 20 мл 30%-ного водного раствора H2O2. Следующие 10 минут перемешивали при RT и затем реакционную смесь трижды экстрагировали по 200 мл CH2Cl2. Сушили над MgSO4 и растворитель удаляли в вакууме. Хроматографией на силикагеле с МТБ получено 2,9 г аморфного твердого вещества, которое было еще загрязнено региоизомерами.
Rf(МТВ) = 0,47; MS(CI+): 268 (M+H)+
c) 5-амино-октагидро-4,7-метано-инден-2-ол-трифторацетат
300 мг трет-бутилового эфира (2-гидрокси-октагидро-4,7-метано-инден-5-ил)карбаминовой кислоты растворяли в 3 мл трифторуксусной кислоты и перемешивали 30 минут при RT. Затем летучие компоненты удаляли в вакууме. Получили 340 мг смолообразного твердого вещества, которое было использовано дальше.
Rf(ЭА/НЕР/МеОН/СН2Cl2/насыщенный водный раствор NH3 10:5:5:5:1) = 0,28;
MS(ES+): 168 (М+Н)+
d) 5-(3-метоксибензиламино)-октагидро-4,7-метано-инден-2-ол
309 мг 5-амино-октагидро-4,7-метано-инден-2-ол-трифтор-ацетата и 225 мг 3-метоксибензальдегида растворяли в 10 мл толуола (безводного) и 5 часов кипятили с обратным холодильником. Затем летучие компоненты удаляли в вакууме. Остаток вносили в 10 мл МеОН, смешивали с 208 мг NaBH4 и перемешивали 16 часов при RT. Затем разбавляли 100 мл ЭА и дважды промывали по 30 мл 10%-ного водного раствора NaHCO3. Сушили над MgSO4 и растворитель удаляли в вакууме. Хроматографией на силикагеле с ЭА/МеОН 2:1 получено 100 мг аморфного твердого вещества.
Rf(ЭА/MeOH 2:1) = 0,20;
MS(ES+): 288 (М+Н)+
Пример 5: рац-(экзо/эндо)-(3-метоксибензил)-(октагидро-4,7-
метано-инден-5-ил)амин-гидрохлорид
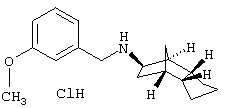
Смесь из 1,08 г 3-метоксибензальдегида, 1,1 г (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1), каталитического количества п-толуолсульфокислоты и 20 мл безводного толуола кипятили 3 часа с обратным холодильником, толуол отгоняли при пониженном давлении и остаток растворяли в 20 мл метанола. К указанному метанольному раствору прибавляли маленькими порциями при охлаждении 0,36 г боргидрида натрия и перемешивали 18 часов при комнатной температуре. После прибавления раствора хлористого водорода в метаноле отфильтровывали от осадка и отгоняли растворитель под уменьшенным давлением. Остаток кипятили в этаноле, отфильтровывали и прибавляли к фильтрату при перемешивании 150 мл диэтилового эфира. Выдерживали несколько часов в холодильнике и отфильтровывали кристаллическое вещество. Бесцветные кристаллы, т.пл. 190-194°С.
Пример 6: (+)-(экзо/эндо)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид и (-)-(экзо/эндо)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
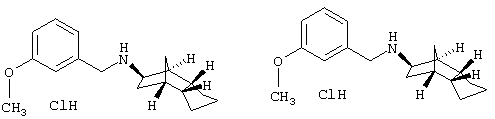
500 мг рац-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорида из примера 5) разделяли в несколько заходов на препаративной колонке Diacel Chemicals (CSP-Chiralpak-AS 250×25, 10 мкм). Условия были следующими: поток: 3 мл/мин, температура: 24°С, смесь элюэнтов: н-гексан/этанол/изопропанол/TFA 10/1/1/0,1, длина волны: 230 нм.
После сушки вымораживанием получили
(+)-энантиомер: 198 мг, чистота по данным ВЭЖХ: 98%
(-)-энантиомер: 218 мг, чистота по данным ВЭЖХ: 99%
Для превращения в гидрохлорид 75 мг каждого энантиомера смешивали с раствором карбоната калия и этилацетатом и хорошо встряхивали. После разделения фаз водную фазу еще дважды экстрагировали этилацетатом. Объединенные органические фазы сушили сульфатом магния, фильтровали и упаривали в вакууме. Остаток фильтровали через 5 г силикагеля, фильтрат упаривали, остаток смешивали с 2 н соляной кислотой и сушили вымораживанием.
После сушки вымораживанием получили:
(+)-энантиомер: 53 мг, значение вращения: +33° (Na, 589 нм), MS(ES+): 272,2 [H+H)+
(-)-энантиомер: 51 мг, значение вращения: -32°, (Na, 589 нм), MS(ES+):272,2 (М+Н)+
Пример 7: (эндо/экзо)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
Смесь 2,2 г 3-метоксибензальдегида, 40 мл метанола, 3,3 г (эндо/экзо)-октагидро-4,7-метано-инден-5-иламина (амина 2) и катализатора никеля Ренея гидрировали в автоклаве при 80°С и 60 барах давления водорода 6 часов. Остаток растворяли в этилацетате, отфильтровывали от катализатора, отгоняли растворитель при пониженном давлении, сушили над сульфатом натрия и снова пропускали через роторный испаритель. После растворения остатка в небольшом количестве этилацетата смешивали с избытком эфирной соляной кислоты, из которой при перемешивании выпадал осадок. Бесцветное кристаллическое вещество (из диизопропилового эфира/метанола) с т.пл. 206-208°С.
Пример 8: (эндо/эндо)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
190 мг 3-метоксибензальдегида, 211 мг (эндо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 3) и 423 мг триэтиламина помещали при исключении влаги в 5 мл сухого CH2Cl2. Через мембрану при перемешивании прибавляли по каплям 0,7 мл 1 молярного раствора тетрахлорида титана в толуоле. Через 18 часов при комнатной температуре добавляли 887 мг триацетоксиборгидрида и перемешивали еще один час. Затем прибавляли 3 мл 5 н раствора гидроксида натрия и 10 мл воды, далее трижды экстрагировали 20 мл этилацетата, сушили, фильтровали и упаривали в вакууме. Остаток растворяли в 2 н соляной кислоте и экстрагировали простым эфиром. Водные фазы упаривали и очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой. Чистые фракции объединяли, ацетонитрил удаляли на роторном испарителе, карбонатом калия устанавливали рН 11, экстрагировали CH2Cl2, объединенные фазы сушили и упаривали. Остаток извлекали 2 н соляной кислотой и небольшим количеством ацетонитрила и сушили вымораживанием. Получили 10 мг гидрохлорида в виде белого твердого вещества.
MS(ES+):272,2 (М+Н)+
Пример 9: (экзо/экзо)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
Смесь из 150 мг 3-метоксибензальдегида, 167 мг (экзо/экзо)-октагидро-4,7-метано-инден-5-иламина (амина 4), каталитического количества п-толуолсульфокислоты и 15 мл безводного толуола кипятили 3 часа с обратным холодильником, толуол отгоняли под уменьшенным давлением и остаток растворяли в 10 мл метанола. К указанному метанольному раствору при охлаждении льдом прибавляли маленькими порциями 50 мг боргидрида натрия и выдерживали при комнатной температуре. После прибавления раствора хлористого водорода в метаноле отфильтровывали от осадка и отгоняли растворитель под уменьшенным давлением. Остаток очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). Полученный после сушки вымораживанием трифторацетат превращали действием гидроокиси натрия/этилацетата в свободный амин и затем 2 н HCl превращали в гидрохлорид. Получили 125 мг белого продукта.
MS(CI+): 272,2 (М+Н)+
Пример 10: (экзо/эндо)-(3-фторбензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
124 мг 3-фтобензальдегида, 151 мг (экзо/эндо)-(октагидро-4,7-метано-инден-5-иламина (амина 1) и 303 мг триэтиламина при исключении влаги вносили в 10 мл сухого CH2Cl2. Через мембрану при перемешивании прибавляли по каплям 0,5 мл одномолярного раствора тетрахлорида титана в толуоле. Через 18 часов при комнатной температуре добавляли 3 мл одномолярного раствора цианоборгидрида натрия в ТГФ и перемешивали еще 15 мин. Затем прибавляли 5 мл 5 н раствора гидроксида натрия и 15 мл воды, далее трижды экстрагировали 25 мл этилацетата, сушили, фильтровали и упаривали в вакууме. Остаток фильтровали через силикагель (СН2Cl2/метанол 97:3), снова сушили и сырой продукт очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой. Чистые фракции объединяли, ацетонитрил удаляли на роторном испарителе, карбонатом калия устанавливали рН 11, трижды экстрагировали этилацетатом и объединенные фазы сушили и упаривали. Остаток извлекали 2 н соляной кислотой и небольшим количеством ацетонитрила и сушили вымораживанием. Получили 144 мг белого твердого вещества.
MS(CI+):260 [M+Н)+
Пример 11: (экзо/эндо)-(3,5-дифторбензил)-(октагидро-4,7-
метано-инден-5-ил)амин-гидрохлорид
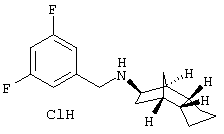
200 мг 3,5-дифторбензальдегида и 151 мг (экзо/эндо)-(октагидро-4,7-метано-инден-5-иламина (амина 1) растворяли в 15 мл толуола (безводного), смешивали с 11 мг п-толуолсульфокислоты и кипятили 3 часа с обратным холодильником. Затем летучие компоненты удаляли в вакууме. Остаток извлекали 10 мл метанола при охлаждении льдом и перемешивании, смешивали с 64 мг NaBH4 и выдерживали в течение ночи.
Раствор метанольным HCl доводили до рН 1-2, выпавшее твердое вещество отфильтровывали и раствор упаривали. Остаток растворяли в горячем этаноле, фильтровали и при перемешивании охлаждали. Добавлением диэтилового эфира продукт осаждали, отсасывали, промывали эфиром и сушили. Получили 212 мг белого твердого вещества.
MS(CI+):278,3 (M+H)+
Пример 12: (экзо/эндо)-[1-(3-метоксифенил)-этил]-(октагидро-
4,7-метано-инден-5-ил)амин-гидрохлорид
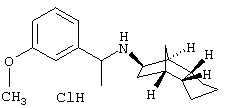
К раствору 0,75 г 3-метоксиацетофенона и 2,7 г (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1) в 15 мл н-пентана прибавляли по каплям при 5-10°С за 10 минут смесь 0,73 г тетрахлорида титана и 3 мл н-пентана. Перемешивали еще один час при 5-10°С и выдерживали в течение ночи при комнатной температуре. После фильтрования осадка отгоняли растворитель на роторном испарителе. Теперь растворяли остаток в 20 мл метанола и порциями при охлаждении при 5-10°С смешивали с 0,96 г боргидрида натрия. Смесь перемешивали 15-20 часов при комнатной температуре и затем растворитель отгоняли. Остаток смешивали с водой, подкисляли соляной кислотой и экстрагировали этилацетатом, причем выпадали кристаллы, которые отфильтровывали и перекристаллизовывали из небольшого количества воды (т.пл. 257-259°С). Водный фильтрат сильно подщелачивали с помощью 2 н NaOH, экстрагировали этилацетатом и отгоняли растворитель после сушки органического раствора над сульфатом натрия. После растворения остатка в небольшом количестве этилацетата раствор сильно подкисляли при помощи раствора хлористого водорода в диэтиловом эфире, кристаллы отфильтровывали и перекристаллизовывали из небольшого количества воды (т.пл. 257-259°С).
Пример 13: (экэо/эндо)-(3-бромбензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
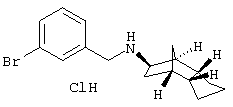
1,9 г 3-бромбензальдегида, 1,5 г (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1) и 60 мг п-толуолсульфокислоты растворяли в 180 мл безводного толуола и кипятили 5 часов с обратным холодильником. Летучие компоненты удаляли в вакууме и остаток растворяли в 120 мл метанола. Прибавляли 530 мг NaBH4 и перемешивали 2 часа при RT. Выдерживали 18 часов при RT и затем летучие компоненты удаляли в вакууме. Извлекали 200 мл насыщенного водного раствора NaHCO3 и трижды экстрагировали по 200 мл ЭА. Сушили над MgSO4 и растворитель удаляли в вакууме. Остаток извлекали 12 мл 10%-ного водного раствора HCl и летучие компоненты удаляли в вакууме. Остаток перемешивали с 50 мл ЭА и получили 3,0 г кристаллического гидрохлорида, т.пл. 248°С.
Rf(ЭА)=0,44; MS(CI+):320(M+H)+
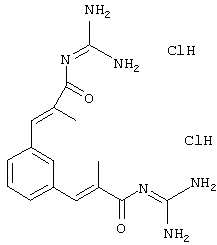
Пример 14: (экзо/эндо)-3-[(октагидро-4,7-метано-инден-5-ил-амино)метил]бензойная кислота
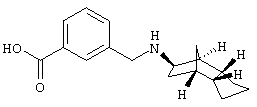
а) бутиловый эфир 3-[(октагидро-4,7-метано-инден-5-иламино)-метил]бензойной кислоты
1 г (3-бромбензил)-(октагидро-4,7-метано-инден-5-ил)-амин-гидрохлорида из примера 13), 115 мг 1,3-бис(дифенилфосфино)пропана, 63 мг ацетата Pd(II), а также 4 мл три-н- бутиламина растворяли в 10 мл 1-бутанола и 2 мл ДМФА и перемешивали под атмосферой СО (нормальное давление) 8 часов при 110°С. Затем снова добавляли 115 мг 1,3-бис(дифенилфосфино)пропана и 63 мг ацетата Pd(II) и перемешивали еще 7 часов при 110°С. После охлаждения прибавляли 100 мл насыщенного водного раствора Na2СО3 и трижды экстрагировали по 100 мл ЭА. Сушили над MgSO4 и растворитель удаляли в вакууме. Хроматографией на силикагеле с DIP/2% триэтиламина получено 600 мг бесцветного масла.
Rf(DIP/2% триэтиламина)=0,42; MS(ES+):342(M+H)+
b) 3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензойная кислота
600 мг бутилового эфира 3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензойной кислоты растворяли в 1 мл н-бутанола и прибавляли 2,1 мл 1 н водного раствора NaOH. Перемешивали 18 часов при RT, затем 4 часа при 60°С. Затем летучие компоненты удаляли в вакууме и дважды с помощью 5 мл воды н-бутанольный остаток подвергали азеотропной перегонке при уменьшенном давлении. Остаток извлекали 5 мл 10%-ного водного раствора HCl, летучие компоненты удаляли в вакууме и из остатка дважды азеотропно отгоняли воду с помощью 5 мл толуола. Продукт еще содержал значительное количество исходного вещества, поэтому его снова растворяли в 6 мл метанола и смешивали с 1 мл 2 н водного раствора NaOH. Перемешивали 3 часа при RT и затем прибавляли еще 5 мл 2 н водного раствора NaOH и кипятили 4 часа с обратным холодильником. Летучие компоненты удаляли в вакууме, извлекали 20 мл воды и доводили до рН 7 разбавленным водным раствором HCl. Снова перемешивали 1 час при RT, продукт отсасывали и сушили в вакууме. Получили 260 мг кристаллического твердого вещества, т.пл. 258-261°С.
MS(CI+): 286 (M+Н)+
Пример 15: (экзо/эндо)-[3-(2-метоксиэтокси)бензил]-(окта-гидро-4,7-метано-инден-5-ил)амин-гидрохлорид
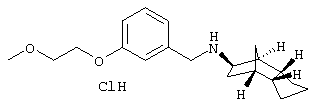
a) 3-(2-метоксиэтокси)бензальдегид
1,0 г 3-гидроксибензальдегида, 1,1 г 1-бром-2-метоксиэтана и 10,7 г Cs2СОз перемешивали в 10 мл ДМФА (безводного) 4 часа при 40°С. Разбавляли 100 мл воды и дважды экстрагировали по 50 мл ЗА. Сушили над MgSO4 и растворитель удаляли в вакууме. Получили 1,3 г бесцветного масла.
Rf(DIP)=0,24; MS(CI+):181 (М+Н)+
b) [3-(2-метоксиэтокси)бензил]-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид;
300 мг 3-(2-метоксиэтокси)бензальдегида, 253 мг (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1) и 10 мг п-толуолсульфокислоты растворяли в 30 мл безводного толуола и кипятили 5 часов с обратным холодильником. Летучие компоненты удаляли в вакууме и остаток растворяли в 20 мл метанола. Прибавляли 90 мг NaBH4 и перемешивали 2 часа при RT. Выдерживали в течение 18 часов при RT и затем летучие компоненты удаляли в вакууме. Извлекали 50 мл насыщенного водного раствора NaHCO3 и трижды экстрагировали по 50 мл ЭА. Сушили над MgSO4 и растворитель удаляли в вакууме. Остаток извлекали 2 мл 10%-ного водного раствора HCl и летучие компоненты удаляли в вакууме. Остаток перемешивали с 10 мл диэтилового эфира и получили 163 мг кристаллического гидрохлорида, т.пл. 134°С.
Rf(ЭА)=0,30; MS(CI+):316 (М+H)+
Пример 16: (экзо/эндо)-(3-иодбензил)˜(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
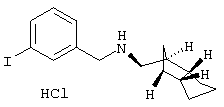
a) 1-бромметил-З-иодбенэол
4,4 г.3-иодтолуола растворяли в 10 мл хлорбензола и при 132°С порциями смешивали со смесью 3,6 г N-бромсукцинимида и 100 мг дибензоилпероксида. Перемешивали еще один час при 132°С, после охлаждения разбавляли 100 мл ЭА и промывали сначала 100 мл насыщенного водного раствора Na2SO4 и затем 100 мл насыщенного водного раствора Na2CO3. Сушили над MgSO4 и растворитель удаляли в вакууме. Получили 5,3 г бледно-желтого масла.
Rf(ЭА/HEP 1:8)=0,44; MS(ES+):298 (М+H)+
b) (3-иодбензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
755 мг (экзо/эндо)-(октагидро-4,7-метано-инден-5-иламина (амина 1) и 830 мкл триэтиламина растворяли в 20 мл безводного ТГФ и при 0°С медленно смешивали с 2,8 г 1-бром-метил-3-иодбензола. Перемешивали 30 минут при 0°С и затем 5 дней при RT. Затем прибавляли 100 мл насыщенного водного раствора Na2CO3 и дважды экстрагировали по 100 мл ЭА. Сушили над MgSO4 и растворитель удаляли в вакууме. Остаток растворяли в 20 мл метанола и устанавливали рН <2 10%-ным водным раствором HCl. Летучие компоненты удаляли в вакууме, остаток перемешивали с 10 мл ЭА и сушили в вакууме. Получили 1,74 г бесцветных кристаллов, т.пл. 220-224°С (с разложением).
MS(CI+):368 (M+H)+
Пример 17: (экзо/эндо)-3-[ (октагидро-4,7-метано-инден-5-ил-амино)метил]бензонитрил-гидрохлорид
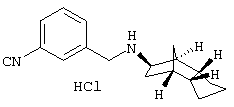
750 мг 3-цианобензальдегида, 865 мг (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1) и 1,74 г триэтиламина помещали при исключении влаги в 30 мл сухого CH2Cl2. Через мембрану прибавляли по каплям 2,86 мл одномолярного раствора тетрахлорида титана в толуоле при перемешивании. Через 18 часов при комнатной температуре добавляли 17,2 мл одномолярного раствора цианоборгидрида натрия в ТГФ и перемешивали еще 15 мин. Затем добавляли 20 мл 5 н раствора гидроксида натрия и 60 мл воды, далее трижды экстрагировали 50 мл этилацетата, сушили, фильтровали и упаривали в вакууме. Остаток фильтровали через силикагель (СН2Cl2/метанол 97/3), снова высушивали и сырой продукт очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). После сушки вымораживанием получили 1,1 г желаемого продукта в виде белого порошка в форме трифторацетата.
250 мг указанного порошка переводили в гидрохлорид, как описано в примере 9). Получили 175 мг белого твердого вещества.
MS(CI+):267,3 (M+H)+
Пример 18: гидрохлорид метилового эфира (экзо/эндо)-3- [(октагидро-4,7-метано-инден-5-иламино)метил]бензойной кислоты и гидрохлорид этилового эфира (экзо/эндо)-3-({октагидро-4,7-метано-инден-5-иламино)метил]бензойной кислоты
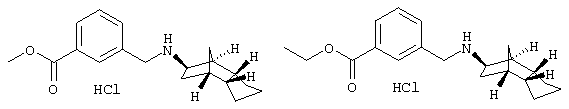
а) дигидрохлорид этилового эфира (экзо/эндо)-3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензимидиновой кислоты
500 мг трифторацетата 3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензонитрила из примера 17) растворяли в 20 мл сухого этанола (загрязненного 5% метанола и 5 изопропанола) и при перемешивании и охлаждении льдом через раствор пропускали 3 часа газообразный хлористый водород. Выдерживали в течение ночи при комнатной температуре и на следующий день азотом удаляли избыток газообразного хлористого водорода и остаток упаривали. Получили 587 мг этилового эфира бензамидиновой кислоты в виде белого порошка, который загрязнен незначительным количеством метилового эфира бензамидиновой кислоты.
Сырой продукт сразу использовали дальше.
b) гидрохлорид метилового эфира (экзо/эндо)-3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензойной кислоты и гидрохлорид этилового эфира (экзо/эндо)-3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензойной кислоты
100 мг продукта из а) растворяли в 6 мл смеси воды и трифторуксусной кислоты (5:1) и 3 часа перемешивали при комнатной температуре. После выдерживания в течение ночи растворитель удаляли и остаток очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). Выпадающие при этом трифторацетаты этилового и метилового эфиров извлекали раствором карбоната калия и экстрагировали этиловым эфиром уксусной кислоты. После высушивания и отгонки этилового эфира уксусной кислоты остаток смешивали с 2 н соляной кислотой и сушили вымораживанием. Получили 28 мг этилового эфира и 7 мг метилового эфира.
Метиловый эфир: MS(ES+):300,2 (M+H)+
Этиловый, эфир: MS(ES+):314,3 (M+H)+
Пример 19: (экзо/эндо)-{3-[(октагидро-4,7-метано-инден-5-ил-амино)метил]фенил}метанол-гидрохлорид:
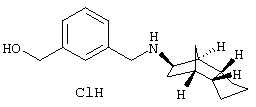
К 0,43 мл одномолярного раствора алюмогидрида лития в ТГФ при перемешивании и исключении влаги прибавляли по каплям 50 мг растворенной в 5 мл ТГФ смеси метилового/этилового эфиров, полученной как описано в примере 18b). После перемешивания при комнатной температуре и выдерживания до конца недели при охлаждении льдом медленно прибавляли по каплям воду, образовавшийся осадок отсасывали и хорошо промывали этиловым эфиром уксусной кислоты. Водные фазы экстрагировали этиловым эфиром уксусной кислоты и объединенные органические фазы сушили сульфатом магния. После отфильтровывания осушителя растворитель отгоняли и остаток очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). Затем, как описано в примере 10), превращали в гидрохлорид.
После сушки вымораживанием получили 7 мг продукта.
MS(ES+): 272,2 (М+Н)+
Пример 20: (экзо/эндо)-3-[(октагидро-4,7-метано-инден-5-ил-амино)метил]бензамид-трифторацетат
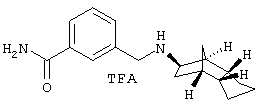
45 мг дигидрохлорида этилового эфира 3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензимидиновой кислоты из примера 18а) нагревали 8 часов при 60°С и затем выдерживали три недели при комнатной температуре. Твердое вещество очищали затем препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). После сушки вымораживанием выделяли 4 мг желаемого продукта.
MS(ES+):285,2 [Н+Н)+
Пример 21: (экзо/эндо)-(3-аминометил-бензил)-(октагидро-4,7-метано-инден-5-ил)амин-бис-трифторацетат
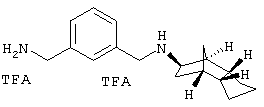
К 5 мл одномолярного раствора алюмогидрида лития в ТГФ прибавляли по каплям 100 мг 3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензонитрил-трифторацетата из примера 17), растворенного в 5 мл сухого ТГФ. Затем нагревали 5 часов при 80°С. Потом при охлаждении льдом медленно прибавляли по каплям воду и смешивали с гидроокисью натрия. Осадок отфильтровывали и промывали простым эфиром. После экстрагирования водной фазы объединенные органические фазы сушили и затем отфильтровывали от осушителя. После упаривания остаток очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). После сушки вымораживанием выделяли 26 мг продукта.
MS(ES+):271,2 (M+H)+
Пример 22: (экзо/эндо)-3-[(октагидро-4,7-метано-инден-5-ил-амино)метил]бензамидин-бис-трифторацетат
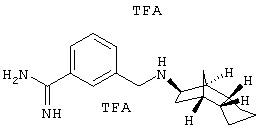
200 мг дигидрохлорида этилового эфира 3-[(октагидро-4,7-метано-инден-5-иламино)метил]бензимидиновой кислоты из примера 18а) растворяли в 15 мл сухого этанола и медленно конденсировали около 20 мл аммиака. Через 3 часа кипячения с обратным холодильником в аммиаке выдерживали в течение ночи для испарения аммиака. Остаток упаривали и затем очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). После сушки вымораживанием получили 89 мг желаемого продукта.
MS(CI+): 284,3 (М+Н)+
Пример 23: (экзо/эндо)-(3-нитробензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
750 мг 3-нитробензальдегида, 751 мг (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1) и 1,5 г триэтиламина помещали при исключении влаги в 30 мл сухого CH2Cl2. Через мембрану прибавляли по каплям 2,48 мл одномолярного раствора тетрахлорида титана в толуоле при перемешивании. Через 18 часов при комнатной температуре прибавляли 14,89 мл одномолярного раствора цианоборгидрида натрия в ТГФ и перемешивали еще 15 мин. Затем добавляли 20 мл 5 н раствора гидроксида натрия и 60 мл воды, потом трижды экстрагировали 50 мл этилацетата, сушили, фильтровали и упаривали в вакууме. Остаток фильтровали через силикагель (СН2Cl2/метанол 95:5), снова высушивали и сырой продукт очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). Часть полученного таким образом (3-нитробензил)-(октагидро-4,7-метано-инден-5-ил)- амин-трифторацетата распределяли между этиловым эфиром уксусной кислоты и раствором карбоната калия (рН 11). Водную фазу снова трижды экстрагировали этилацетатом и объединенные органические фазы сушили и упаривали. Остаток извлекали 2 н соляной кислотой и небольшим количеством ацетонитрила и сушили вымораживанием. Получили 300 мг белого твердого вещества.
MS(ES+):287,2 (M+H)+
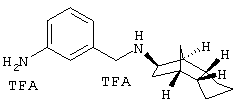
Пример 24: (экзо/эндо)-(3-аминобензил)-(октагидро-4,7-метано-инден-5-ил)амин-бис-трифторацетат
100 мг (3-нитробензил)-(октагидро-4,7-метано-инден-5-ил)амин-трифторацетата из примера 23) растворяли в смеси из по 5 мл этанола и этилового эфира уксусной кислоты. Затем прибавляли 57 мг цинковой пыли и перемешивали 4 часа при 60°С. Потом добавляли 25 г цинковой пыли и перемешивали еще два часа при 60°С. Реакционную смесь упаривали, остаток извлекали этиловым эфиром уксусной кислоты и органическую фазу трижды промывали раствором карбоната калия, сушили, фильтровали и упаривали. Остаток очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). После вымораживания получили 23 мг желаемого продукта.
MS(ES+):257,2 (M+H)+
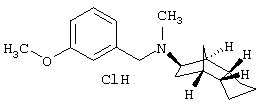
Пример 25: (экзо/эндо)-(3-метоксибензил)-метил-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
50 мг (экзо/эндо)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амина из примера 5) помещали в 5 мл осушенного ацетона, прибавляли 20 мг карбоната калия, перемешивали 30 мин и затем прибавляли по каплям 9 мкл метилиодида. После выдерживания до конца недели реакционную смесь упаривали, остаток извлекали водой и этилацетатом, фазы разделяли, водную фазу дважды экстрагировали этилацетатом и объединенные органические фазы сушили, фильтровали и упаривали. Остаток хроматографировали на силикагеле с этиловым эфиром уксусной кислоты/гептаном. Полученный амин извлекали 2 н соляной кислотой и сушили вымораживанием. Получили 14 мг желаемого продукта.
MS(CI+):286,4 (М+Н)+
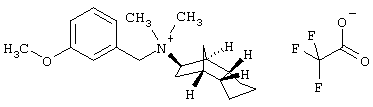
Пример 26: (экзо/эндо)-(3-метоксибензил)-диметил-(октагидро-4,7-метано-инден-5-ил)аммоний-трифторацетат
53 мг (экзо/эндо)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амина из примера 5 помещали в 5 мл осушенного ацетона и затем прибавляли по каплям 61 мкл метилиодида. После выдерживания до конца недели прибавляли еще 50 мкл метилиодида. После выдерживания в течение ночи прибавляли три капли N-этилдиизопропиламина и перемешивали еще 5 часов. Затем реакционную смесь упаривали и очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). После сушки вымораживанием получили 53 мг желаемого продукта.
MS(ES+):300,3 (М+)
Пример 27: (экзо/экзо)-(3-фторбензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
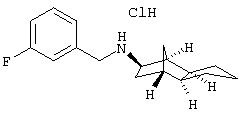
Смесь 80 мг 3-фторбензальдегида, 97 мг (экзо/экзо)-октагидро-4,7-метано-инден-5-иламина (амина 4), каталитического количества п-толуолсульфокислоты и 7,5 мл безводного толуола кипятили 3 часа с обратным холодильником, толуол отгоняли при пониженном давлении и остаток растворяли в 5 мл метанола. К указанному метанольному раствору прибавляли при охлаждении льдом маленькими порциями 29 мг боргидрида натрия и оставляли нагреваться до комнатной температуры. После прибавления 2 н HCl осадок отфильтровывали, растворяли в горячем этаноле и выливали в холодный простой эфир. Полученный таким образом осадок извлекали 2 н NaOH и дихлорметаном, водную фазу отделяли и органическую фазу промывали 2 н NaOH. Затем органическую фазу сушили MgSO4, фильтровали и упаривали. Остаток переводили в гидрохлорид при помощи 2 н HCl. Получили 35 мг белого продукта.
MS(CI+):260,0 (М+H)+
Пример 28: (экзо/эндо)-(2-трифторметилбензил)-(октагидро-4,7-
метано-инден-5-ил)амин-гидрохлорид
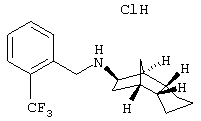
К смеси 98 мг (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1), 103 мг диизопропилэтиламина и 2 мл дихлорметана медленно при перемешивании прибавляли по каплям 158 мг 2-(трифторметил)бензилбромида, растворенного в 2 мл дихлорметана. После выдерживания в течение ночи растворитель отгоняли и остаток очищали препаративной ВЭЖХ на RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). Фракции, содержащие продукт, объединяли, ацетонитрил удаляли на роторном испарителе, устанавливали рН 11 карбонатом калия и прибавляли этилацетат. Водную фазу трижды экстрагировали этилацетатом, объединенные фазы сушили и упаривали. Остаток извлекали 2 н соляной кислотой и небольшим количеством ацетонитрила и сушили вымораживанием. После сушки вымораживанием получили 127 мг желаемого продукта.
MS(CI+): 310,2 (М+Н)+
Пример 29: (экзо/эндо)-(3-диметиламинобензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид 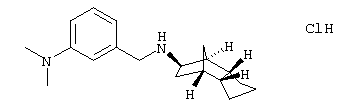
a) (экзо/эндо)-3-диметиламино-N-(октагидро-4,7-метано-инден-5-ил)бензамид
После добавления 1,78 г (0,011 моля) N,N-карбонилдиимидазола к раствору 1,65 г (0,01 моля) 3-N,N-диметиламинобензойной кислоты в 40 мл безводного ТГФ перемешивали 3 часа при комнатной температуре под атмосферой аргона и затем смешивали с 1,82 г (0,012 моля) (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1). Перемешивали один час при комнатной температуре и отгоняли растворитель после выдерживания в течение ночи. Остаток смешивали с водой и устанавливали 2 н HCl рН 3-4. После перемешивания магнитной мешалкой около 30 минут отфильтровывали бесцветный кристаллический (экзо/эндо)-З-диметиламино-N-(октагидро-4,7-метано-инден-5-ил)бензамид, промывали твердое вещество водой и сушили в потоке воздуха, т.пл. 152-156°С;
MS(CI+): 299,4 (М+Н)+
b) (экзо/эндо)-(3-диметиламинобензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
К раствору 2 г (0,0067 моля) (экзо/эндо)-3-диметиламино-N-(октагидро-4,7-метано-инден-5-ил)бензамида в 100 мл безводного 1,2-диметоксиэтана прибавляли сначала 1,38 г (0,0097 моля) эфирата бортрифторида и затем при 10-15°С порциями 1,13 г (0,03 моля) бораната натрия. После постепенного нагревания до 70°С и позднее до 90°С и после выдерживания в течение ночи растворитель отгоняли, остаток смешивали с водой и сильно подщелачивали при помощи 2 н NaOH. Экстрагировали 4 раза этилацетатом, органическую фазу промывали водой, сушили и упаривали растворитель. После дальнейшей колоночной хроматографии на силикагеле со смесью 1 части этилацетата и 3 частей толуола смешивали с пересыщенным раствором хлористого водорода. Осадок (экзо/эндо)-(3-диметиламинобензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорида отфильтровывали и сушили. Бесцветное кристаллическое твердое вещество, т.пл.: 166-170°С (с разложением).
MS(CI+):285,2 (M+H)+
Пример 30: (экзо/эндо)-[2-(3-метоксифенил)-этил]-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
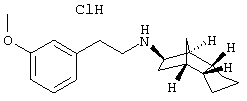
a) (экзо/эндо)-2-(3-метоксифенил)-N-(октагидро-4,7-метано-инден-5-ил)ацетамид
(Экзо/эндо)-2-(3-метоксифенил)-N-(октагидро-4,7-метано-инден-5-ил)ацетамид получали аналогично приведенному в примере 29а) способу из 3-метоксифенилуксусной кислоты, N,N'-карбонилдиимидазола и (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1). Желтое вязкое масло.
MS(CI+): 300,4 (M+H)+
b) (экзо/эндо)-[2-(3-метоксифенил)этил]-(октагидро-4,7- метано-инден-5-ил)амин-гидрохлорид
(Экзо/эндо)-[2-(3-метоксифенил)этил]-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид получали аналогично приведенному в примере 29b) способу восстановлением (экзо/эндо)-2-(3-метоксифенил)-N-(октагидро-4,7-метано-инден-5-ил)ацетамида. Бесцветное кристаллическое твердое вещество, т.пл.: 222-225°С;
MS(ES+): 286,3 (M+H)+
Пример 31: (экзо/эндо)-[3-(3-метоксифенил)-пропил]-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
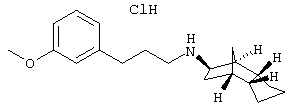
a) (экзо/экзо)-3-(3-метоксифенил)-N-(октагидро-4,7-метано-инден-5-ил)пропионамид
(Экзо/экзо)-3-(3-метоксифенил)-N-(октагидро-4,7-метано-инден-5-ил)пропионамид получали аналогично приведенному в примере 29а) способу из 3-метоксифенилпропионовой кислоты, N,N'-карбонилдиимидазола и (экзо/эндо)-октагидро-4,7-метано-инден-5-иламина (амина 1). Светло-желтый маслянистый продукт.
MS(CI+): 314,0 (M+H)+
b) (экзо/эндо)-[3-(3-метоксифенил)пропил]-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
(Экзо/эндо)-[3-(3-метоксифенил)пропил]-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид получали аналогично приведенному в примере 29b) способу восстановлением (экзо/экэо)-3-(3-метоксифенил)-N-(октагидро-4,7-метано-инден- 5-ил)пропионамида. Бесцветное кристаллическое твердое вещество, т.пл. 186-188°C.
MS(ES+):300,3 (М+Н)+
Пример 32: (экзо/эндо)-(декагидро-1,4-метано-нафталин-2-ил)-(3-метоксибензил)амин-гидрохлорид
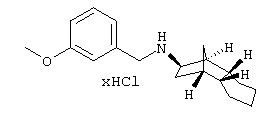
a) N,N'-диоксид бис-(3-хлор-1,2,3,4-тетрагидро-1,4-метано-нафталин-2-ил)диазена
К раствору 3,56 г бензонорборнадиена [L. Friedman и F.M. Logullo, J. Org. Chem. 34: 3089-3092 (1969)] в 6 мл ледяной уксусной кислоты и 6 мл этанола прибавляли 3,34 г изоамилнитрита и затем по каплям 8,5 мл 15%-ного раствора газообразного хлористого водорода в этаноле. Полученную суспензию перемешивали еще 2,5 часа при комнатной температуре и далее смешивали с 20 мг диизопропилового эфира. После дальнейшего перемешивания 30 минут отфильтровывали твердое вещество. Светлое кристаллическое твердое вещество; т.пл. 187-188°С.
MS (FAB (масс-спектрометрия с бомбардировкой ускоренными атомами)): 415,1 (М+Н)+
b) (экзо)-1,2,3,4-тетрагидро-1,4-метано-нафталин-2-иламин
3 г N,N'-диоксида бис-(3-хлор-1,2,3,4-тетрагидро-1,4-метано-нафталин-2-ил)диазена суспендировали в 150 мл метанола и гидрировали с катализатором никелем Ренея в автоклаве под давлением водорода 100 бар При 100°С 20 часов. После отфильтровывания катализатора растворитель упаривали, остаток смешивали с водой, сильно подщелачивали с помощью NaOH и многократно экстрагировали метил-трет-бутиловым эфиром. После высушивания органических фаз получили желаемый амин в виде светло-желтой жидкости.
MS(ES+):160,0 (M+H)+
c) (экзо/эндо)-декагидро-1,4-метано-нафталин-2-иламин
Раствор 1 г экзо-1,2,3,4-тетрагидро-1,4-метано-нафталин-2-иламина в 10 мл метанола и 30 мл 2 н соляной кислоты гидрировали в автоклаве над 0,4 г RuO2 водородом при 100 бар и 90°С 10 часов. После отделения катализатора упаривали наполовину, полученный водный раствор сильно подщелачивали при помощи 10 н NaOH и многократно экстрагировали метил-трет-бутиловым эфиром. После высушивания и упаривания растворителя получили экзо-декагидро-нафталин-2-иламин в виде бесцветного масла, которое предпочтительно хранят под аргоном.
MS(CI+):166,2 (М+Н)+
d) (экзо/эндо)-(декагидро-1,4-метано-нафталин-2-ил)-(3-метоксибензил)амин-гидрохлорид
0,97 г (экзо/эндо)-декагидро-1,4-метано-нафталин-2-иламина растворяли в 25 мл безводного толуола и после прибавления 0,8 г 3-метоксибензальдегида и малого каталитического количества п-толуолсульфокислоты кипятили с обратным холодильником 3 часа. После упаривания растворителя остаток растворяли в 50 мл метанола, порциями прибавляли при перемешивании 0,26 г боргидрида натрия и смесь перемешивали при комнатной температуре около 20 часов. Подкисляли раствор раствором газообразного хлористого водорода в метаноле, перемешивали 30 минут и отфильтровывали выпавшую соль. Фильтрат упаривали и остаток перекристаллизовывали из смеси диизопропилового эфира и этанола. Бесцветное кристаллическое вещество; т.пл. 234-236°С;
MS(ES+): 286,3 (М+Н)+
Последующие описанные соединения получали соответственно приведенным примерам
302,2
(М+Н)+ 302,3
(М+Н)+
290,3
(М+Н)+ 300,3
(М+Н)+ 316,3
296,3
(М+Н)+ 278,2
302,3
(М+Н)+ 333,2
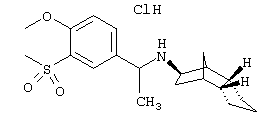
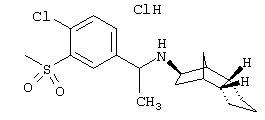
Пример 70: (экзо/эндо)-(3-метансульфонил-бензил)-(октагидро-4,7-метано-инден-5-ил)амин-гидрохлорид
65 мг продукта из примера 61 растворяли в 3 мл метанола. Затем прибавляли 4 мл натрийацетатного буферного раствора и смесь охлаждали до 0°С. После медленного прибавления 617 мг Oxone® перемешивали еще три часа при комнатной температуре. Осадок отфильтровывали и фильтрат концентрировали в вакууме. Остаток смешивали с раствором гидрокарбоната натрия и экстрагировали этилацетатом. После высушивания и фильтрования концентрировали в вакууме. Полученные 60 мг сырого продукта очищали препаративной ВЭЖХ через RP-18 с ацетонитрилом/водой (0,05% трифторуксусной кислоты). Содержащие продукт фракции объединяли, ацетонитрил удаляли на роторном испарителе, карбонатом калия устанавливали рН 11 и добавляли этилацетат. Водную фазу трижды экстрагировали этлацетатом, объединенные фазы сушили и упаривали. Остаток извлекали 2 н соляной кислотой и небольшим количеством ацетонитрила и сушили вымораживанием. После сушки вымораживанием получили 8 мг желаемого продукта.
MS(CI+):320,1 (М+Н)+
Фармакологические данные
Описание испытания диуреза
Испытание салидиуреза проводили на самцах крыс Wistar весом от 155 до 175 г. За 16 часов до начала испытания животных лишали пищи, но не питьевой воды. Крыс сажали без выбора в диурезные клетки. Вещество из примера 5) растворяли в питьевой воде и вводили в дозе 20 мг/кг веса тела перорально в объеме 10 мл/кг. Контрольная группа получала перорально соответствующие объемы питьевой воды в качестве носителя. Выделение мочи каждой группой измеряли в первые 5 часов и в течение 6-24 часов. Электролиты мочи натрий и калий определяли пламенной фотометрией (Flammen-Photometer Eppendorf, Hamburg) и хлорид потенциометрически (Chloridmeter Eppendorf). Осмомолярность мочи устанавливали методом понижения точки замерзания (осмометр Vogel, Giessen). Выделение мочи и электролита, а также осмомолярность даны в мл/кг, ммоль/кг или мосмоль/кг веса тела. Отношение Na+/K+ позволяет распознавать качественную активность диуретика. Результаты в таблице представляют средние арифметические значения со стандартными погрешностями.
Результаты
Оценка: Вещество из примера 5) в дозировке 50 мг/кг не проявляет при пероральном введении крысам салидиуретического действия по сравнению с контролем.
Описание модели Сасо 2
Клеточную линию Сасо 2 приобретали в American Type Culture Collection (ATCC) и в среде Dulbecco's Modified Eagle (высокое содержание глюкозы), дополненной заменимыми аминокислотами, L-глутамином, пенициллином/стрептомицином и 10%-ной плодной сывороткой теленка, выдерживали в инкубаторе под 10%-ной атмосферой CO2 при 95%-ной относительной влажности воздуха и 37°С. Клетки переносили в колбы с культурами клеток (175 см2).
Для изучения транспорта Сасо-2-клетки высевали на поликарбонат слои культур клеток (Costar Transwells®, размер пор 3 мкм, площадь 4,71 см2) с плотностью клеток 6,5×104 клеток/см2 и инкубировали в шестилуночных планшетах с культурами с переменой среды после четырех и восьми дней и затем каждые два дня. Для эксперимента использовали монослои возрастом с 21 по 25 дней.
В каждой серии проб монослои возрастом 21 день испытывали с помощью 3H-декстрана в качестве маркера проницаемости. Значение скорости переноса (кумулятивной) через 120 мин должно было быть в интервале 2%.
После устранения среды роста с апикальной и базолатеральной сторон монослои промывали транспортным буфером (раствором сбалансированной соли Hank's с рН 7,8; содержание глюкозы 2,8 г/л) и клетки уравновешивали 15 мин при 37°С под 10%-ной атмосферой CO2. Затем указанный буферный раствор (HBSS) снова удаляли.
Тестовые соединения растворяли в смеси HBSS-буфера и ДМСО и прибавляли к апикальному буферу, так что получали 1%-ный (об./об.) раствор в ДМСО. Тестовая концентрация в первом опыте составила 1 мМ, во втором 100 мкМ. Опыты проводили при 37°С и начинали с добавления 1,5 мл тестового раствора на донорскую (апикальную) сторону. Транспортный буфер без соединения подавали на принимающую сторону (базолатеральную, 2,5 мл). Через различные промежутки времени отбирали пробы с базолатеральной стороны (1 мл) и замещали свежим теплым, 37°С, буферным раствором. Апикальные пробы отбирали вначале и в конце (120 мин), чтобы определить относительно указанных концентраций и кумулятивных базолатеральных концентраций скорость повторного нахождения соединений.
Соединения анализировали ВЭЖХ.
Видимый коэффициент проницаемости (Рарр) вычисляли по следующему уравнению:
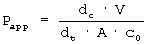
где обозначают dc/dt поток через монослой (мкг или соединение/мл х s), V - объем жидкости в улавливающей камере (мл), А - величина поверхности монослоя (см2) и С0 - начальная концентрация (мкг или соединение/мл) в донорской камере. Поток через монослой вычисляли из кумулятивной базолатеральной концентрации к соответствующему моменту времени c помощью вначале линейной кривой (линейной до 60 мин). Каждое определение производили трижды, так что рассчитанное значение Рарр представляло собой среднее значение из трех измерений. Значения Рарр выбранных соединений коррелировали с известными в литературе значениями абсорбции и представляли сигмоидальную калибровочную кривую. После ислледований Artursson'a (Artursson P., Karlsson J.; Biochem. Biophys. Res. Comm. 1991; 175/3: 880-885) можно заключить, что указанная кривая дает представление об абсорбированном количестве соединения. Результаты
По сравнению с известными в литературе МНЕЗ-активными соединениями ацилгуанидинового типа (J.-R. Schwark и др. Eur. J. Physiol. (1998) 436:797) соединения формулы I или la проявляют заметно превосходящую проницаемость через мембраны.
Описание измерений NHE-активности
Большинство молекулярно-биологических технологий следует протоколам из работ "Current Protocols in Molecular Biology (изд. Ausubel, F.M., Brent, R., Kingston, R.E., Moore, D.D., Seidman, J.G., Smith, J.A. и Struhl, K.; John Wiley & Sons)" или "Molecular Cloning: A Laboratory Manual (Sambrock, J., Fritsch, E.F. и Maniatis, Т.; Cold Spring Harbor Laboratory Press (1989))''.
В рамках работ авторами были получены стабильные клеточные линии, каждая из которых экспрессировала один из следующих NHE-подтипов: NHE1 человека (Sardet и др. (1989) Cell 56, 271-280), NHE2 кролика (Tse и др. (1993) J. Biol. Chem. 268, 11917-11924), NHE3 человека (Brant и др. (1995) Am. J. Physiol. 269 (Cell Physiol. 38), C198-C206) или NHE3 крысы (Orlowski и др.; J. Biol. Chem. 267, 9331-9339 (1992)).
Полученные проф. Pouyssegur кДНК-клоны соответствующего NHE-подтипа после присоединения к подходящей линкерной последовательности клонировали таким образом в экспрессионную плазмиду рМАМпео (полученную, например, через CLONTECH, Heidelberg), чтобы распознающая последовательность для рестрикционной эндонуклеазы NheI плазмиды дала примерно 20-100 основных пар для стартового кодона каждого NHE-подтипа и общая кодирующая последовательность находилась в конструкции. Для полученной через RT-PCR из почки человека NHE3, содержащей мРНК, были выбраны RT-PCR-праймеры таким образом, чтобы полученные кДНК-последовательности содержали на концах сайты, пассивные к рМАМпео.
С помощью так называемого "кальцийфосфатного способа" (описанного в главе 9.1 "Current Protocols in Molecular Biology") NHE-дефицитные клеточные линии LAP1 (Franchi и др.; Proc. Natl. Acad. Sci. USA 83, 9388-9392 (1986)) были трансфицированы плазмидами, которые содержали соответствующие кодирующие последовательности NHE-подтипов. После селекции трансфицированных клеток путем роста в среде, содержащей G418 (только клетки, которые получены трансфекцией нео-гена, могут выжить в указанных условиях) отбирали по функциональным NHE-экспрессиям. Для этого применяли описанную Sardet технологию "кислотной нагрузки" (Sardet и др.; Cell 56, 271-280 (1989)). Клетки, которые экспрессируют способный к функционированию NHE-подтип, могут также при отсутствии СО2 и НСО3 - компенсировать происходящее при указанной пробе подкисление, тогда как нетрансфицированные LAP1-клетки напротив не могут. После многократного повторения селекции "кислотной нагрузкой" выжившие клетки высевали в планшеты для микротитрования таким образом, что статистически на одну лунку приходилась одна клетка. Через микроскоп через примерно 10 дней наблюдали, как в каждой лунке вырасти многие колонии. Популяции клеток из отдельных колоний были затем испытаны пробой ХТТ-пролиферации (Boehringer Mannheim) в отношении стойкости к выживанию по "кислотной нагрузке". Лучшие клеточные линии были использованы для дальнейших проб и культивированы для уменьшения потери трансфицированной последовательности при постоянном давлении селекции в среде, содержащей G418. Для определения значений IC50 для ингибирования отдельных NHE-подтипов специфическими веществами была слегка изменена проба, разработанная S.Faber (Faber и др.; Cell. Physiol. Biochem. 6, 39-49 (1996)), которая основана на технологии "кислотной нагрузки".
В указанной пробе наблюдали восстановление внутриклеточного рН (pHi) после подкисления, которое наступает в случае способных к функционированию NHE также в свободных от бикарбоната условиях. Для этого pHi определяли чувствительным к рН флуоресцентным красителем BCECF (Calbiochem, включен как предварительная стадия BCECF-AM). Клетки сначала загружали BCECF. Флуоресценцию BCECF определяли в "Ratio Fluorescence Spectrometer" (Photon Technology International, South Brunswick, N.J., USA) при длинах волн возбуждения 505 и 440 нм и длине волны эмиссии 535 нм и посредством калибровочной кривой переводили в pHi. В отступление от описанного протокола клетки инкубировали при загрузке BCECF в NH4Cl-буфере (рН 7,4) (NH4Cl-буфер: 115 мМ NaCl, 20мМ NH4Cl, 5 мМ KCl, 1 мМ CaCl2, 1 мМ MgSO4, 20 мМ Hepes (4-(2-гидроксиэтил)-1-пиперазин-этансульфокислоты), 5 мМ глюкозы, 1 мг/мл BSA (N,O-бис(триметил-силил)ацетамида), при помощи 1 М NaOH установлен рН 7,4). Внутриклеточное подкисление индуцировали добавкой 975 мкл не содержащего NH4Cl буфера к 25 мкл аликвотам клеток, инкубированных в NH4Cl-буфере. Последующую скорость восстановления рН регистрировали при NHE1 2 минуты, при NHE2 5 минут и при NHE3 3 минуты. Для расчета ингибирующего потенциала испытуемых веществ клетки сначала испытывали в буфере, при котором имело место полное или вообще отсутствовало восстановление рН. Для полного восстановления рН (100%) клетки инкубировали в Na+-содержащем буфере (133,8 мМ NaCl, 4,7 мМ KCl, 1,25 мМ CaCl2, 1,25 мМ MgCl2, 0,97 мМ Na2HPO4, 0,23 мМ NaH2PO4, 5 мМ Hepes, 5 мМ глюкозы, с помощью 1М NaOH устанавливали рН 7,0). Для определения 0%-ного значения клетки инкубировали в свободном от Na+ буфере (133,8 мМ холинхлорида, 4,7 мМ KCl, 1,25 мМ CaCl2, 1,25 мМ MgCl2, 0,97 мМ K2HPO4, 0,23 мМ KH2PO4, 5 мМ Hepes, 5 мМ глюкозы, при помощи 1М NaOH устанавливали рН 7,0). Испытуемые вещества вносили в Na+-содержащий буфер. Восстановление внутриклеточного рН при каждой испытанной концентрации вещества выражено в процентах к максимальному восстановлению. Из процентных значений восстановления рН посредством программы SigmaPlot вычислены значения IC50 каждого вещества для отдельных NHE-подтипов.
NНЕ3-активность
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕКСАГИДРОПИРИДОИЗОХИНОЛИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ IV (DPP-IV) | 2004 |
|
RU2339636C2 |
| 1,4 ТИАЗЕПИНЫ/СУЛЬФОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ВАСЕ1 И(ИЛИ) ВАСЕ2 | 2012 |
|
RU2600931C2 |
| ИНДОЛ-2-КАРБОКСАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха И/ИЛИ VIIa, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2299881C2 |
| НОВЫЕ СУЛЬФОНАМИДКАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ | 2018 |
|
RU2808572C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОПТЕРИДИНОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2010 |
|
RU2559881C2 |
| N-[3-(5-АМИНО-3,3А,7,7А-ТЕТРАГИДРО-1Н-2,4-ДИОКСА-6-АЗА-ИНДЕН-7-ИЛ)-ФЕНИЛ]-АМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ВАСЕ1 И(ИЛИ) ВАСЕ2 | 2012 |
|
RU2597308C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ СИНТЕЗА | 1993 |
|
RU2119917C1 |
| БИФЕНИЛСУЛЬФОНИЛЦИАНАМИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 1999 |
|
RU2247111C2 |
| СОЛИ ТРИАЗОЛИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PAR1, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2009 |
|
RU2494100C2 |
| ЗАМЕЩЕННЫЕ ЦИКЛОАЛКИЛАМИНОМ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА И ИЗОХИНОЛИНОНА | 2007 |
|
RU2468011C2 |
Изобретение относится к новым замещенным производным норборниламина с экзоконфигурацией азота и эндоаннелированными пяти-шестичленными циклами формулы (I) и с экэо-конфигурацией азота и экзоаннелированными пяти-шестичленными циклами формулы (Ia), а также их фармацевтически приемлемым солям или трифторацетатам, которые могут быть использованы для получения лекарственных средств, пригодных для лечения или профилактики нарушений дыхательного импульса, в частности обусловленных сном нарушений дыхания, таких как временная остановка дыхания во время сна, храпа, для лечения или профилактики острых и хронических почечных заболеваний, в частности острой почечной недостаточности и хронической почечной недостаточности, нарушений функции кишечника, желчного пузыря, ишемических состояний периферической и центральной нервной системы и острых приступов и др. Соединения изобретения являются ингибиторами натрийпротонного обмена, влияют на сывороточный липопротеин и поэтому могут быть использованы для профилактики и для регрессии атеросклеротических изменений.

В соединениях формулы (I) или (Ia) А обозначает (С1-С4)-алкилен; S1 обозначает отсутствует или обозначает (С1-С4)-алкил; S2 обозначает (С1-С4)-алкил или Н; причем, если S1 и S2 обозначают алкил, X- в образующейся группировке [-N+(S1S2)-X-] соответствует фармакологически приемлемому аниону или трифторацетату; В обозначает насыщенный или ненасыщенный углеродный пяти- или шестичленный цикл, и R1, R2, R3, R4 и R5 имеют значения, указанные в описании. Изобретение также относится к способу получения соединений и к лекарственному средству. 3 н. и 18 з.п. ф-лы, 4 табл.
 где
где
А обозначает (С1-С4)-алкилен;
S1 обозначает отсутствует или обозначает (С1-С4)-алкил;
S2 обозначает (С1-С4)-алкил или Н;
причем, если S1 и S2 обозначают алкил, X- в образующейся группировке [-N+(S1S2)-X-] соответствует фармакологически приемлемому аниону или трифторацетату;
В обозначает насыщенный или ненасыщенный углеродный пяти- или шестичленный цикл, который может быть замещен гидроксигруппой;
R1, R2, R3, R4 и R5 независимо друг от друга обозначают Н, ОН, F, Cl, Br, I, CN, NO2, амидиногруппу, -CO2R(11), -CONR(11)R(12), -SOrR(ll), SO2NH2-, (C1-C4)-алкил, (C1-C4)-алкоксигруппу, (C1-C4)-алкокси(C1-C4)-алкил, (C1-C4)-алкокси-(C1-C4)-алкилоксигруппу, гидрокси-(C1-C4)-алкил, (С3-С7)-циклоалкокси;фенокси, при этом фенил незамещен или замещен до трех заместителями, выбраными из F, Cl, Br, J, амино-,(C1-C4)-алкиламино-, ди-(C1-C4)-алкиламиногруппу, амино-(C1-C4)-алкил, ди-(C1-C4)-алкиламино-(C1-C4)-алкил, (C1-C4)-алкиламино-(C1-C4)-алкил, при этом атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
R11 и R12 независимо друг от друга обозначают Н или (C1-C4)-алкил,
при этом атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
r обозначает 0, 1 или 2;
s обозначает 1 или 2;
или R1 и R2, R2 и R3, R3 и R4 или R4 и R5
каждые вместе обозначают группу -O-(СН2)n-O-;
n обозначает 1 или 2;
и каждый из остальных остатков R1, R2, R3, R4 или R5 обозначают независимо друг от друга Н, ОН, F, Cl, Br, I, CN, NO2, амидиногруппу,-CO2R(11),-CONR(11)R(12), -SOrR(11), -SOsNR(11)R(12), (C1-C4)-алкил, (C1-C4)-алкоксигруппу, (C1-C4)-алкокси(C1-C4)-алкил, при этом атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
R11 и R12 независимо друг от друга обозначают Н или (C1-C4)-алкил,
при этом атомы водорода в алкильных остатках полностью или частично могут быть замещены фтором;
r обозначает 0, 1 или 2;
s обозначает 1 или 2;
при этом исключается бензил(октагидро-4,7-метано-инден-5-ил)амин, а также их фармацевтически приемлемые соли или трифторацетаты.
экзо/эндо-(3-хлорбензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-бензо[1,3]диоксол-5-илметил-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(рац)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(+)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(-)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-[1-(3-метоксифенил)этил]-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(3а,4,5,6,7,7а-гексагидро-3Н-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)-(3-метоксибензил)амин,
экзо/эндо-(3а,4,5,6,7,7а-гексагидро-ЗН-4,7-метано-инден-5-ил)-(3-метоксибензил)амин,
экзо/эндо-(декагидро-1,4-метано-нафталин-2-ил)-(3-метоксибензил)амин,
экзо/эндо-(3,5-дифторбензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/экзо-(3-фторбензил)-(октагидро-4,7-метано-инден-5-ил)-амин,
экзо/экзо-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
а также их фармацевтически приемлемые соли или трифторацетаты.
экзо/эндо-(3-хлорбензил)-(октагидро-4,7-метано-инден-5-ил)-амин,
экзо/эндо-(3-фторбензил)-(октагидро-4,7-метано-инден-5-ил)-амин;
экзо/эндо-(3-фторбензил)-(3а,4,5,6,7,7а-гексагидро-1Н-4,7-метано-инден-5-ил)амин,
экзо/эндо-(3-фторбензил)-(3а,4,5,6,7,7а-гексагидро-ЗН-4,7-метано-инден-5-ил)амин,
экзо/эндо-бензо[1,3]диоксол-5-илметил-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(рац)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(+)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин,
экзо/эндо-(декагидро-1,4-метано-нафталин-2-ил)-(3-метоксибензил)амин,
экзо/эндо-(-)-(3-метоксибензил)-(октагидро-4,7-метано-инден-5-ил)амин и
экзо/эндо-(3,5-дифторбензил)-(октагидро-4,7-метано-инден-5-ил)амин,
а также их фармацевтически приемлемые соли или трифторацетаты.

подвергают взаимодействию с соединением формулы III в присутствии подходящего восстановителя и, возможно, также кислоты Льюиса непосредственно с образованием соединений формулы I или Ia,
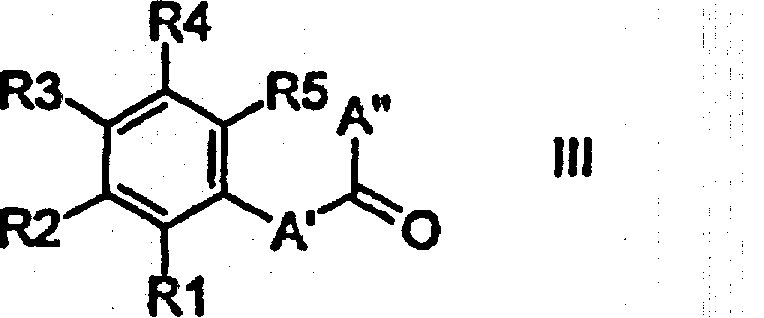
где S1, S2, В, R1, R2, R3, R4 и R5 имеют приведенные выше значения, в то время как независимо друг от друга А' обозначает связь или (С1-С3)-алкил и А'' обозначает Н или (С1-С3)-алкил и А' и А'' вместе с атомом углерода карбонильной группы содержат столько атомов углерода, как указано выше для А.
| РАЦЕМИЧЕСКИЕ ИЛИ ОПТИЧЕСКИ АКТИВНЫЕ ПЕРГИДРО-1H-ПИРИДО(1,2-А) ПИРАЗИНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2090565C1 |
| - М.: Советская энциклопедия, 1983, с.700. | |||
Авторы
Даты
2005-09-20—Публикация
2000-12-01—Подача