Настоящее изобретение относится к новой фармацевтической композиции с замедленным высвобождением, адаптированной для введения путем инъекции, которая содержит соединение 7α-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5-(10)-триен-3,17β-диол, более конкретно к композиции, адаптированной для введения путем инъекции, которая содержит соединение 7α-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5-(10)-триен-3,17β-диол в растворе в рицинолеатном носителе, который дополнительно содержит по меньшей мере один спирт и неводный сложноэфирный растворитель, который способен смешиваться с рицинолеатным носителем.
Эстрогенная депривация является фундаментальным принципом при лечении многих доброкачественных и злокачественных заболеваний молочной железы и половых путей. У женщин в пременопаузе это достигается устранением функции яичников путем хирургическим, радиотерапевтическим или медикаментозным путем, а у женщин в постменопаузе - применением ингибиторов ароматазы.
Альтернативным подходом к выключению эстрогенов является противодействие эстрогенам с помощью антиэстрогенов. Они представляют собой лекарственные средства, которые связываются и конкурируют за рецепторы эстрогенов (ER), которые имеются в ядрах чувствительной к эстрогенам ткани. Обычные нестероидные антиэстрогены, такие как тамоксифен, эффективно конкурируют за связывание с ER, но их эффективность часто ограничена частичным агонизмом, который они демонстрируют, что приводит к неполной блокаде эстрогенопосредованной активности (Furr and Jordan 1984, May and Westley 1987).
Способность нестероидных антиэстрогенов проявлять агонистические свойства навела на мысль о поиске новых соединений, которые связывали бы ER с высокой аффинностью, не активируя никаких нормальных транскрипциональных гормональных ответов и последующих манифестаций эстрогенов. Указанные молекулы должны быть "чистыми" антиэстрогенами, которые четко отличаются от подобных тамоксифену лигандов и способны полностью устранять трофические эффекты эстрогенов. Указанные соединения называют даун-регуляторами рецепторов эстрогенов (E.R.D.). Логическое обоснование для разработки и испытания новых, чистых, антиэстрогенов описано у Bowler et al. 1989, Wakeling 1990a, 1990b, 1990с. Wakeling and Bowler 1987, 1988.
Стероидные аналоги эстрадиола с алкилсульфинильной боковой цепью в положении 7α послужили первыми примерами соединений, лишенных эстрогенной активности (Bowler et al. 1989). Один из них, 7α-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5-(10)-триен-3,17β-диол, был выбран для интенсивного изучения на основании его чистой антагонистической в отношении эстрогенов активности и имел достоверно более высокую антиэстрогенную эффективность по сравнению с другими доступными антиэстрогенами. Исследования in vitro и ранний клинический опыт применения 7α-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5-(10)-триен-3,17β-диола подстегнули интерес к разработке указанного лекарственного средства в качестве терапевтического агента для применения по эстрогензависимым показаниям, таким как рак молочной железы и некоторые доброкачественные гинекологические состояния.
7α-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5-(10)-триен-3,17β-диол, или ICI 182780, получил международное непатентованное название фульвестрант, которое используется далее в настоящем документе. В название фульвестрант авторы настоящего изобретения включают его фармацевтически приемлемые соли и любые возможные сольваты.
Фульвестрант связывается с ER с аффинностью, подобной аффинности эстрадиола, и полностью блокирует действие эстрадиола, стимулирующее рост клеток опухоли молочной железы человека in vitro; он является более мощным и более эффективным, чем тамоксифен, с этой точки зрения. Фульвестрант полностью блокирует утеротропное действие эстрадиола у крыс, мышей и обезьян, а также блокирует утеротропное действие тамоксифена.
Поскольку фульвестрант не имеет эстрогеноподобного стимулирующего действия, которое характерно для клинически доступных антиэстрогенов, таких как тамоксифен или торемифен, он может предложить улучшенное терапевтическое действие, которое отличается более быстрой, полной или продолжительной регрессией опухоли; более низкой частотой или скоростью развития резистентности к лечению и уменьшением инвазивности опухоли.
У интактных взрослых крыс с помощью фульвестранта достигается максимальная регрессия матки при такой дозе, которая не влияет неблагоприятным образом на плотность костей или не ведет к повышению секреции гонадотропина. Если это верно и для людей, эти открытия могут представлять крайнюю важность для клинической практики. Снижение плотности кости ограничивает продолжительность эстрогенной депривации при эндометриозе. Фульвестрант не блокирует ER гипоталамуса. Выключение эстрогенов также вызывает или обостряет приливы и другие симптомы менопаузы; фульвестрант не будет вызывать указанные эффекты, поскольку он не проходит через гематоэнцефалический барьер.
Европейская патентная заявка №0138504 описывает некоторые стероидные производные, которые являются эффективными антиэстрогенными агентами. Описание включает в себя информацию, которая относится к получению стероидных производных. В частности, в примере 35 описано соединение 7α-[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5-(10)-триен-3,17β-диол, которое конкретно указано в п.4 формулы изобретения. Описано также, что соединения указанного изобретения могут изготавливаться для использования в форме фармацевтической композиции, включающей в себя стероидное производное согласно указанному изобретению вместе с фармацевтически приемлемым разбавителем или носителем. Указано, что композиция может быть в форме, подходящей для перорального или парентерального введения.
Фульвестрант демонстрирует, как и другие соединения на стероидной основе, определенные физические свойства, которые могут делать затруднительным изготовление указанных соединений в виде композиции. Фульвестрант является особенно липофильной молекулой, даже по сравнению с другими стероидными соединениями, а его растворимость в воде является крайне низкой и составляет приблизительно 10 нгмл-1 (это оценка по системе смеси вода/растворитель и растворенное вещество, поскольку измерения столь малой величины невозможно осуществить в системе только вода - растворенное вещество).
В настоящее время в продаже имеется ряд композиций стероидов с замедленным высвобождением, предназначенных для инъекций. Обычно в указанных композициях в качестве растворителя используется масло, и могут присутствовать также добавочные наполнители. Ниже, в таблице 1, описано несколько имеющихся в продаже композиций с замедленным высвобождением, предназначенных для инъекций.
В композициях, представленных в таблице 1, используется ряд различных масел для солюбилизации соединения, а также используются добавочные наполнители, такие как бензилбензоат, бензиловый спирт и этанол. Объемы масла, необходимые для солюбилизации стероидного активного ингредиента, небольшие. Достигается продолжительное высвобождение в течение периода времени от 1 до 8 недель.
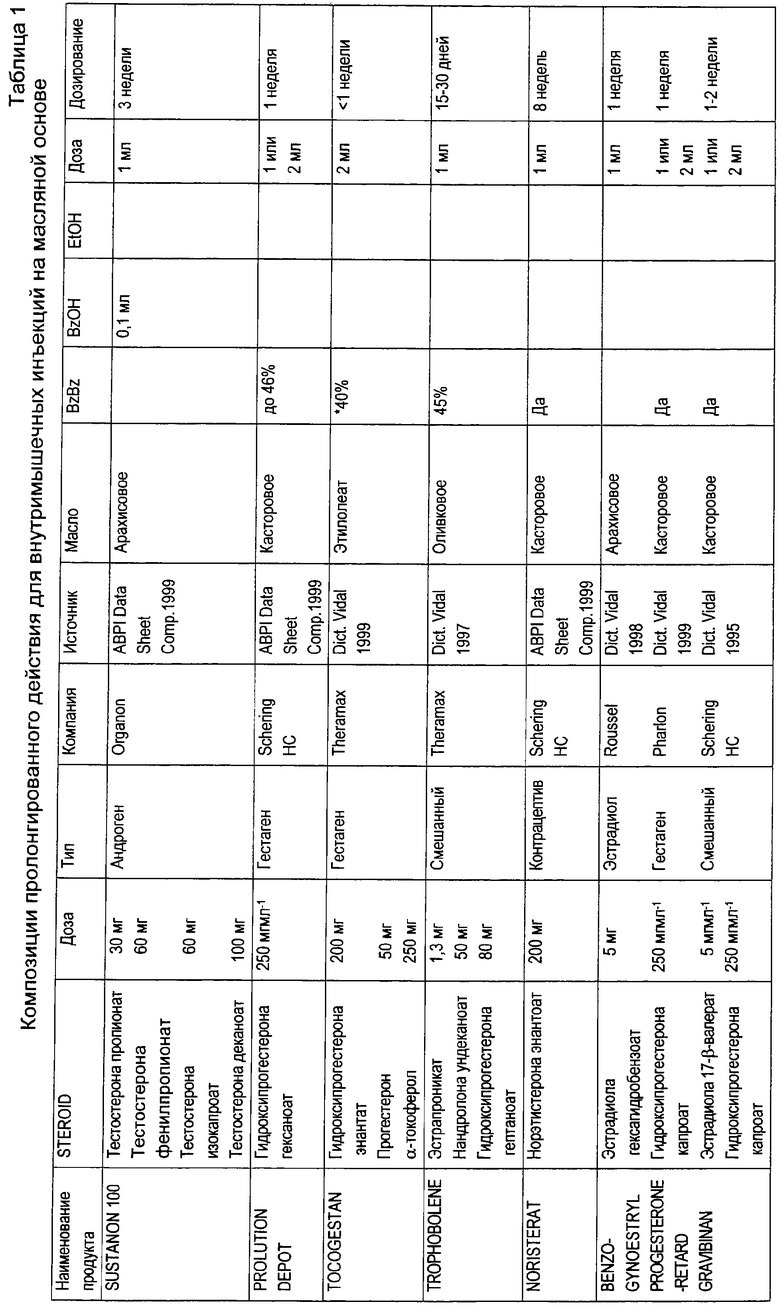

В примере 3 US 5183814 описана композиция фульвестранта для инъекций на масляной основе, которая включает в себя 50 мг фульвестранта, 400 мг бензилового спирта и касторовое масло в количестве, достаточном для доведения объема раствора до 1 мл. Производство композиции, описанной в US 5183814, в промышленном масштабе будет осложнено высокой концентрацией спирта. Таким образом, существует необходимость снижения концентрации спирта в композициях фульвестранта, и, в то же время, необходимость предотвращения осаждения фульвестранта из композиции.
В таблица 2 показана растворимость фульвестранта в ряде различных растворителей.
Растворимость фульвестранта
Как можно видеть, фульвестрант значительно лучше растворяется в касторовом масле, чем в любом из других испытанных масел. Более выраженная растворяющая способность касторового масла в отношении стероидных соединений известна и приписывается большому количеству гидроксильных групп рицинолеиновой кислоты, которая является главной составляющей жирных кислот в триглицеридах, имеющихся в касторовом масле (см. Riffkin et al. J. Pharm. Sci., (1964), 53, 891).
Однако даже при использовании самого лучшего растворителя на масляной основе, касторового масла, авторы настоящего изобретения установили, что невозможно растворить фульвестрант только в растворителе на масляной основе таким образом, чтобы добиться достаточно высокой концентрации для введения пациенту дозы в малом объеме инъекции, а также терапевтически значимой скорости высвобождения. Для того, чтобы добиться терапевтически значимой скорости высвобождения, нужное количество фульвестранта потребует большого объема композиции, по меньшей мере, 10 мл. Это вынуждает врача инъецировать слишком большой объем композиции, чтобы ввести дозу, достаточно высокую, чтобы лечить человека.
Современные руководства рекомендуют внутримышечно инъецировать не более 5 мл жидкости за одну инъекцию. Фармакологически активные дозы, которые требуются для пролонгированной композиции фульвестранта длительного действия, составляют приблизительно 250 мл. Следовательно, при растворении в касторовом масле необходимо вводить фульвестрант по меньшей мере в 10 мл касторового масла.
Можно использовать добавление органических растворителей, в которых фульвестрант легко растворяется и которые способны смешиваться с касторовым маслом, таких как спирт. Путем добавления высоких концентраций спирта можно добиться концентраций фульвестранта в композиции с касторовым маслом >50 мгмл-1, что дает объемы инъекции <5 мл - см. таблицу 3, ниже. Авторы неожиданно установили, что включение неводного сложноэфирного растворителя, который способен смешиваться с касторовым маслом, и спирта удивительным образом облегчает растворение фульвестранта до концентрации по меньшей мере 50 мгмл-1 - см. таблицу 3, ниже. Это открытие удивительно, поскольку растворимость фульвестранта в неводных сложноэфирных растворителях - см. таблицу 2, выше значительно ниже растворимости фульвестранта в спирте. Растворимость фульвестранта также ниже в неводных сложноэфирных растворителях, чем растворимость фульвестранта в касторовом масле.
Таким образом, авторы предлагают в качестве изобретения фармацевтическую композицию, включающую в себя фульвестрант (предпочтительно фульвестрант присутствует в количестве 3-10% мас./об., 4-9% мас./об., 4-8% мас./об., 4-7% мас./об., 4-6% мас./об. и наиболее предпочтительно в количестве приблизительно 5% мас./об.) в рицинолеатном носителе, фармацевтически приемлемый неводный сложноэфирный растворитель и фармацевтически приемлемый спирт; указанная композиция адаптирована для внутримышечного введения и поддерживает терапевтически значимую концентрацию фульвестранта в плазме крови в течение по меньшей мере 2 недель.
Другим аспектом настоящего изобретения является фармацевтическая композиция, включающая в себя фульвестрант, которая адаптирована для внутримышечной инъекции человеку и которая способна после инъекции поддерживать терапевтически значимую концентрацию фульвестранта в плазме крови в течение по меньшей мере 2 недель.
Другие аспекты настоящего изобретения включают в себя фармацевтическую композицию, адаптированную для внутримышечной инъекции, которая включает в себя фульвестрант, 30% или менее массы фармацевтически приемлемого спирта на объем композиции, по меньшей мере 1% массы фармацевтически приемлемого неводного сложноэфирного растворителя, способного смешиваться с рицинолеатным носителем, на объем композиции, и такое количество рицинолеатного носителя, которое достаточно для изготовления композиции, способной после инъекции поддерживать терапевтически значимую концентрацию фульвестранта в плазме крови в течение по меньшей мере 2 недель.
Другие аспекты настоящего изобретения включают в себя фармацевтическую композицию, адаптированную для внутримышечной инъекции, которая включает в себя фульвестрант, 35% (предпочтительно 30% и, в идеале, 25%) или менее массы фармацевтически приемлемого спирта на объем композиции, по меньшей мере 1% (предпочтительно по меньшей мере 5% или, в идеале, 10%) массы фармацевтически приемлемого неводного сложноэфирного растворителя, способного смешиваться с рицинолеатным носителем, на объем композиции, и такое количество рицинолеатного носителя, которое достаточно для изготовления композиции с концентрацией фульвестранта по меньшей мере 45 мгмл-1.
Во избежание любых сомнений при использовании термина "% массы на объем композиции" для составляющих компонентов композиции авторы под указанным термином подразумевают, что в единице объема композиции будет представлен определенный процент составляющего компонента по массе, например, 1% массы на объем композиции будет содержать в 100 мл объема композиции 1 г составляющего компонента. Для иллюстрации:
Предпочтительными фармацевтическими композициями согласно изобретению являются композиции, описанные выше, в которых:
1. Общий объем композиции составляет 6 мл или менее, а концентрация фульвестранта составляет по меньшей мере 45 мгмл-1.
2. Общее количество фульвестранта в композиции составляет 250 мг или более, а общий объем композиции составляет 6 мл или менее.
3. Общее количество фульвестранта в композиции составляет 250 мг, а общий объем композиции составляет 5-5,25 мл.
Ценно, что в композицию можно включить дополнительное количество композиции, чтобы дать возможность лечащему врачу или лицу, осуществляющему уход за больным, вводить требующуюся дозу. Следовательно, когда требуется доза 5 мл, будет оценен тот факт, что в композиции будет также излишек до 0,25 мл, предпочтительно до 0,15 мл. Обычно композиция будет находиться во флаконе или заранее наполненном шприце, предпочтительно в заранее наполненном шприце, содержащем стандартную дозу композиции, как описано в настоящем документе, что также представляет собой аспекты настоящего изобретения.
Предпочтительные концентрации фармацевтически приемлемого спирта, присутствующего в любой из описанных выше композиций, составляют по меньшей мере 3% мас./об., по меньшей мере 5% мас./об., по меньшей мере 7% мас./об., по меньшей мере 10% мас./об., по меньшей мере 11% мас./об., по меньшей мере 12% мас./об., по меньшей мере 13% мас./об., по меньшей мере 14% мас./об., по меньшей мере 15% мас./об. и предпочтительно по меньшей мере 16% мас./об. Предпочтительные максимальные концентрации фармацевтически приемлемого спирта в композиции составляют 28% мас./об. или менее, 22% мас./об. или менее и 20% мас./об. или менее. Предпочтительные пределы концентрации фармацевтически приемлемого спирта, присутствующего в любой из описанных выше композиций, выбираются из любой минимальной или максимальной величины, описанной выше, и предпочтительно составляют 3-35% мас./об., 4-35% мас./об., 5-35% мас./об./ 5-32% мас./об., 7-32% мас./об., 10-30% мас./об./ 12-28% мас./об., 15-25% мас./об., 17-23% мас./об., 18-22% мас./об. и, в идеале, 19-21% мас./об.
Фармацевтически приемлемый спирт может состоять из одного спирта или смеси двух или более спиртов, предпочтительно из смеси двух спиртов. Предпочтительными фармацевтически приемлемыми спиртами для парентерального введения являются этанол, бензиловый спирт или смесь этанола и бензилового спирта; предпочтительно этанол и бензиловый спирт присутствуют в композиции в тех же мас./об. количествах. Предпочтительно смесь спиртов содержит 10% мас./об. этанола и 10% мас./об. бензилового спирта.
Фармацевтически приемлемый неводный сложноэфирный растворитель может состоять из одного или смеси двух или более фармацевтически приемлемых неводных сложноэфирных растворителей, предпочтительно из одного. Предпочтительно фармацевтически приемлемый неводный сложноэфирный растворитель для парентерального введения выбирают из бензилбензоата, этилолеата, изопропилмиристата, изопропилпальмитата или любой их смеси.
Рицинолеатный носитель предпочтительно должен быть представлен в композиции в пропорции по меньшей мере 30% массы на объем композиции, в идеале, по меньшей мере 40% или по меньшей мере 50% массы на объем композиции.
Специалисту будет понятно, что фармацевтически приемлемый спирт должен быть такого качества, которое отвечает стандартам фармакопеи (таким, которые описаны в фармакопеях США, Великобритании, Европы и Японии), и в качестве такового будет содержать некоторое количество воды и, возможно, других органических растворителей, например, этанол в Фармакопее США содержит не менее 94,9% по объему и не более 96,0% по объему этанола, по результатам измерения при 15,56°С. Обезвоженный спирт в Фармакопее США содержит не менее 99,5% этанола по объему, по результатам измерения при 15,56°С.
Предпочтительные концентрации фармацевтически приемлемого неводного сложноэфирного растворителя, присутствующего в любой из описанных выше композиций, составляют по меньшей мере 5% мас./об., по меньшей мере 8% мас./об., по меньшей мере 10% мас./об., по меньшей мере 11% мас./об., по меньшей мере 12% мас./об., по меньшей мере 13% мас./об., по меньшей мере 15% мас./об., по меньшей мере 16% мас./об., по меньшей мере 17% мас./об., по меньшей мере 18% мас. /об., по меньшей мере 19% мас. /об. и по меньшей мере 20% мас./об. Предпочтительные максимальные концентрации фармацевтически приемлемого неводного сложноэфирного растворителя составляют 60% мас./об. или менее, 50% мас./об. или менее, 45% мас./об. или менее, 40% мас./об. или менее, 35% мас./об. или менее, 30% мас./об. или менее и 25% мас./об. или менее. Предпочтительные пределы концентрации фармацевтически приемлемого неводного сложноэфирного растворителя, присутствующего в любой из описанных выше композиций, выбираются из любой минимальной или максимальной величины, описанной выше, и предпочтительно составляют 5-60% мас./об., 7-55% мас./об., 8-50% мас./об., 10-50% мас./об., 10-45% мас./об., 10-40% мас./об., 10-35% мас./об., 10-30% мас./об., 10-25% мас./об., 12-25% мас./об., 12-22% мас./об., 12-20% мас./об., 12-18% мас./об., 13-17% мас./об. и, в идеале, 14-16% мас./об. Предпочтительно сложноэфирный растворитель представляет собой бензилбензоат, наиболее предпочтительно с концентрацией 15% мас./об.
Специалисту будет понятно, что фармацевтически приемлемый неводный сложноэфирный растворитель должен быть такого качества, которое отвечает стандартам фармакопеи (таким, которые описаны в фармакопеях США, Великобритании, Европы и Японии).
Предпочтительные комбинации фармацевтически приемлемого спирта и фармацевтически приемлемого неводного сложноэфирного растворителя в композиции перечислены ниже:
Используя термин "рицинолеатный носитель", авторы подразумевают масло, которое имеет в качестве части (по меньшей мере, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% мас./об.) своего состава триглицериды рицинолеиновой кислоты. Рицинолеатный носитель может представлять собой синтетическое масло или, что удобно, представляет собой касторовое масло, в идеале, соответствующее стандартам фармакопеи, как описано выше.
Авторы настоящего изобретения неожиданно установили, что описанные выше композиции согласно изобретению после внутримышечной инъекции обеспечивают удовлетворительное высвобождение фульвестранта в течение продолжительного периода времени.
Это открытие было неожиданным по следующим причинам.
1. Ранее заявители изучали внутримышечные инъекции фульвестранта в виде водной суспензии. Авторы выявили обширное местное раздражение тканей в месте инъекции, а также плохое высвобождение. Полагают, раздражение/воспаление тканей происходит из-за присутствия фульвестранта в форме твердых частиц. Профиль высвобождения, как представляется, определялся распространенностью воспаления/раздражения в месте инъекции, которая была изменчивой и трудно контролируемой. Также скорость высвобождения фульвестранта была недостаточно высокой, чтобы быть клинически значимой.
2. Исследования авторов с использованием бензилового спирта, меченного 14С, показали, что он быстро рассеивается из места инъекции и удаляется из организма в течение 24 часов после введения.
Ожидалось, что этанол будет по меньшей мере так же быстро рассеиваться, если не быстрее, из места инъекции.
Известно, что бензилбензоат метаболизируется печенью человека путем конъюгации с глицином с образованием гиппуровой кислоты и выделяется с мочой - Martindale: The Extra Pharmacopoeia, 32-e издание, страница 1103, и, следовательно, маловероятно, что бензилбензоат присутствует в месте инъекции в течение всего увеличенного периода высвобождения.
Авторы настоящего изобретения установили, что, несмотря на быструю элиминацию дополнительных солюбилизирующих наполнителей, т.е. спирта и фармацевтически приемлемого неводного сложноэфирного растворителя, из носителя композиции и места инъекции после инъецирования композиции, продленное высвобождение фульвестранта на терапевтически значимых уровнях в течение увеличенного периода времени все равно достигается с помощью композиции по настоящему изобретению.
Используя термин "терапевтически значимые уровни", авторы подразумевают, что у пациента достигаются концентрации фульвестранта в плазме крови по меньшей мере 2,5 нгмл-1, в идеале, по меньшей мере 3 нгмл-1, по меньшей мере 8,5 нгмл-1, и до 12 нгмл-1. Предпочтительные уровни в плазме крови должны составлять менее 15 нгмл-1.
Используя термин "продленное высвобождение", авторы подразумевают, что достигается непрерывное высвобождение фульвестранта в течение по меньшей мере двух недель, по меньшей мере трех недель и предпочтительно по меньшей мере четырех недель. В предпочтительном аспекте настоящего изобретения продленное высвобождение достигается в течение 36 дней. Предпочтительно продленное высвобождение фульвестранта составляет по меньшей мере 2-5 недель, и, более предпочтительно в течение следующих периодов времени (недель) 2,5-5, 2,5-4, 3-4, 3,5-4 и, наиболее предпочтительно в течение по меньшей мере около 4 недель.
Следует понимать, что лечащий врач может пожелать ввести внутримышечную инъекцию разделенными дозами, т.е. 5 мл композиции вводят последовательно в виде двух отдельных инъекций по 2,5 мл, что составляет еще один аспект настоящего изобретения.
Простое растворение фульвестранта в жидкой композиции на масляной основе еще не обеспечивает хороший профиль высвобождения или отсутствие осаждения лекарственного средства после инъекции в месте инъекции.
В таблице 3 показана растворимость фульвестранта в касторовом масле в качестве носителя, который дополнительно содержит спирты этанол и бензиловый спирт, с бензилбензоатом или без него. Результаты ясно показывают положительное влияние бензилбензоата на растворимость фульвестранта в касторовом масле, несмотря на то, что фульвестрант имеет более низкую растворимость в бензилбензоате, чем в спирте или касторовом масле.
Влияние бензилбензоата на растворимость фульвестранта в касторовом масле при 25°С
В следующей таблице 4 показана растворимость фульвестранта в ряде композиций на масляной основе, которые содержат одни и те же количества спирта и бензилбензоата, но в которых содержание масла меняется. Эти данные показывают также растворимость фульвестранта после удаления спиртов.
Сравнение растворимости фульвестранта в композициях на масляной основе, со спиртами и без спиртов
Влияние композиции на осаждение фульвестранта в месте инъекции
а Композиции включали в себя фульвестрант (5%), этанол [96%] (10%), бензиловый спирт (10%) и бензилбензоат (15%), приведенные к определенному объему с помощью указанного масла.
b Главным образом, большие игольчатые кристаллы
с Малые игольчатые кристаллы или пучки кристаллов
Осаждение фульвестранта и профиль высвобождения определяли с использованием указанных выше композиций и исследований на кроликах in vivo.
На чертеже показан профиль высвобождения in vivo четырех композиций из второй части таблицы 4 и показано влияние компонента жирного масла на профиль фульвестранта в плазме крови в течение 5 дней после внутримышечной инъекции кроликам (данные стандартизированы до 50 мг на 3 кг; дана средняя величина; количество животных на каждый отрезок времени = 8; образцы плазмы анализировали на содержание фульвестранта с помощью Ic-ms/ms, с последующей экстракцией растворителя). Как можно видеть, композиция касторового масла показала особенно равномерный профиль высвобождения, без признаков осаждения фульвестранта в месте инъекции.
Таким образом, заявители представляют в качестве еще одного признака настоящего изобретения фармацевтическую композицию с продленным высвобождением, адаптированную для внутримышечной инъекции, которая включает в себя фульвестрант; 35% (предпочтительно 30% и, в идеале, 25%) или менее массы фармацевтически приемлемого спирта на объем композиции, по меньшей мере 1% (предпочтительно по меньшей мере 5% или, в идеале, 10%) массы фармацевтически приемлемого неводного сложноэфирного растворителя, способного смешиваться с рицинолеатным носителем, на объем композиции, и такое количество рицинолеатного носителя, с учетом добавления любых дополнительных необязательных фармацевтически приемлемых наполнителей, которого достаточно для изготовления композиции с концентрацией фульвестранта по меньшей мере 45 мгмл-1.
Еще одним признаком настоящего изобретения является фармацевтическая композиция, адаптированная для внутримышечной инъекции, как описано выше, для использования при лечении человека.
Еще одним признаком настоящего изобретения является способ лечения доброкачественных или злокачественных заболеваний молочной железы или половых путей, предпочтительно лечения рака молочной железы, путем введения человеку, который нуждается в указанном лечении, посредством внутримышечной инъекции, фармацевтической композиции с продленным высвобождением на основе рицинолеатного носителя, включающей в себя по меньшей мере 45 мгмл-1 фульвестранта; 35% (предпочтительно 30% и, в идеале, 25%) или менее массы фармацевтически приемлемого спирта на объем композиции, по меньшей мере 1% (предпочтительно по меньшей мере 5% или, в идеале, 10%) массы фармацевтически приемлемого неводного сложноэфирного растворителя, способного смешиваться с рицинолеатным носителем, на объем композиции.
Предпочтительно при внутримышечной инъекции вводят объем 5 мл.
Еще одним признаком настоящего изобретения является применение фульвестранта для изготовления фармацевтической композиции, как описано выше, для лечения доброкачественного или злокачественного заболевания молочной железы или половых путей, предпочтительно для лечения рака молочной железы.
Для изготовления композиции можно использовать добавочные наполнители, которые обычно используются в данной области, например антиоксидантный консервант, краситель или поверхностно-активный агент. Предпочтительным необязательным наполнителем является поверхностно-активный агент.
Как описано выше, фульвестрант является пригодным для лечения по эстрогензависимым показаниям, таким как рак молочной железы и гинекологические состояния, такие как эндометриоз.
В настоящее время, кроме фульвестранта, на стадии клинического изучения находится другая молекула подобного типа. SH-646 (11β-фтор-7α-(14,14,15,15,15-пентафтор-6-метил-10-тиа-6-азапентадецил)эстра-1,3,5(10)-триен-3,17β-диол) предположительно также представляет собой соединение с тем же действием, что и у фульвестранта, и имеет очень сходное с ним химическое строение. Полагают, что указанное соединение будет также обладать такими же, как у фульвестранта, физическими свойствами, и, следовательно, настоящее изобретение также найдет применение и для этого соединения.
Еще одним признаком настоящего изобретения является фармацевтическая композиция, адаптированная для внутримышечной инъекции, которая включает в себя 11β-фтор-7α-(14,14,15,15,15-пентафтор-6-метил-10-тиа-6-азапентадецил)эстра-1,3,5(10)-триен-3,17β-диол; 35% или менее массы фармацевтически приемлемого спирта на объем композиции, по меньшей мере 1% массы фармацевтически приемлемого неводного сложноэфирного растворителя, способного смешиваться с рицинолеатным носителем, на объем композиции, и такое количество рицинолеатного носителя, которого достаточно для изготовления композиции с концентрацией 11β-фтор-7α-(14,14,15,15,15-пентафтор-6-метил-10-тиа-6-азапентадецил)эстра-1,3,5(10)-триен-3,17β-диола по меньшей мере 45 мгмл-1.
Другие признаки настоящего изобретения такие же, как описано выше, но в них фульвестрант заменен на SH-646.
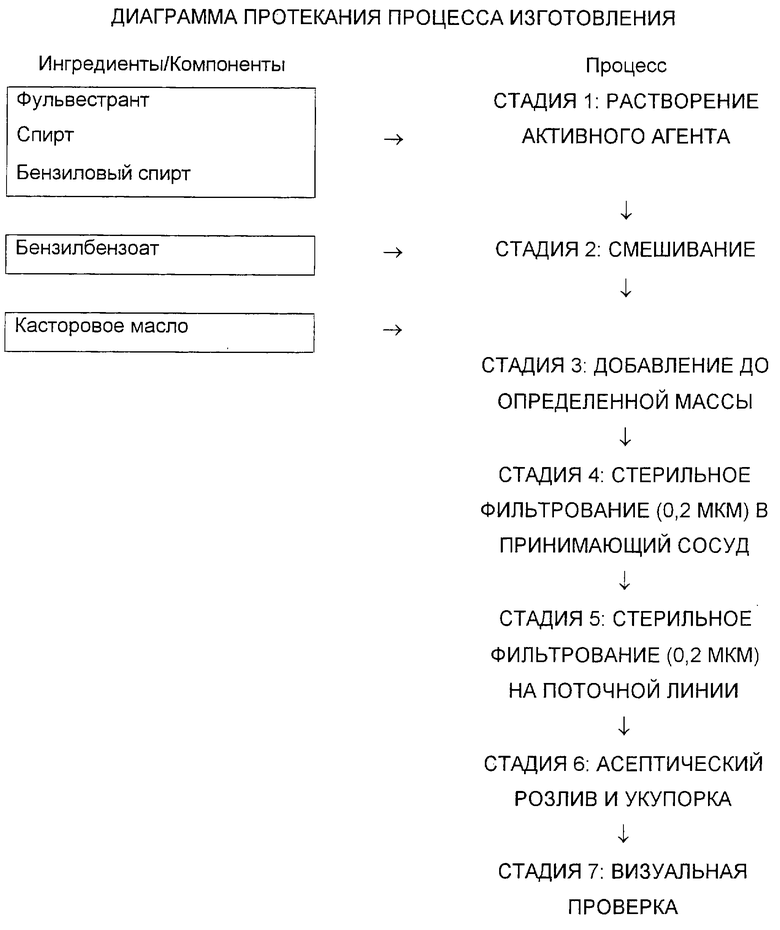
Пример композиции
Фульвестрант смешивали со спиртом и бензиловым спиртом и перемешивали до полного растворения. Добавляли бензилбензоат и до конечной массы раствор доводили касторовым маслом и перемешивали (для удобства использовали массу, а не объем, с использованием соотношения массы и объема). Массу, раствор держали в атмосфере азота. Раствор стерилизовали фильтрованием с использованием одного или двух фильтров с порозностью 0,2 мкм. Стерильный фильтрат держали под слоем азота в течение всего процесса наполнения указанным фильтратом в асептических условиях промытых и депирогенизированных стерильных первичных контейнеров, например флаконов или шприцев. В первичную упаковку помещали избыток содержимого для облегчения забора нужного объема дозы. Перед тем как герметично запечатать первичные упаковки в асептических условиях, их помещали под слой стерильного азота.
См. также диаграмму протекания процесса, ниже.
Количества каждого компонента композиции выбирают в соответствии с описанием нужной композиции; примеры описаны выше. Например, следующие количества каждого компонента добавляют для изготовления композиции, которая содержит
10% массы на объем бензилового спирта
10% массы на объем этанола
15% массы на объем бензилбензоата
250 мг фульвестранта на каждые 5 мл конечной композиции и оставшееся количество в виде касторового масла
Литература
1. Bowler J, Lilley TJ, Pittam JD, Wakeling AE. Novel steroidal pure antioestrogens. Steroids 989; 5471-99.
2. Wakeling AE. Novel pure antioestrogens: mode of action and therapeutic prospects. American New York Academy Science 1990a; 595: 348-56.
3. Wakeling AE. Steroidal pure antioestrogens. In Lippman M, Dickson R, editors. Regulatory mechanisms in breast cancer. Boston: Kluwer Academic, 1990b: 239-57.
4. Wakeling AE. Therapeutic potential of pure antioestrogens in the treatment of breast cancer. Journal Steroid Biochemistry 1990с; 37: 771-5.
5. Wakeling AE, Bowler J. Steroidal pure antioestrogens. Journal Endocrinology 1987; 112: R7-10.
6. Wakeling AE, Bowler J. Biology and mode of action of pure antioestrogens. Journal Steroid Biochemistry 1988; 3: 141-7.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ФУЛЬВЕСТРАНТА ПРИ ЛЕЧЕНИИ РЕЗИСТЕНТНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2001 |
|
RU2265438C2 |
| ПРОЛЕКАРСТВА АБИРАТЕРОНА | 2020 |
|
RU2822219C2 |
| КОМПОЗИЦИИ ФУЛВЕСТРАНТА | 2018 |
|
RU2684330C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ПРОЛОНГИРОВАННОГО ВЫСВОБОЖДЕНИЯ СЕБАКОИЛ-ДИНАЛБУФИНОВОГО ЭФИРА | 2016 |
|
RU2718900C2 |
| СПОСОБЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ДОСТОВЕРНОГО ДОСТИЖЕНИЯ ПРИЕМЛЕМЫХ УРОВНЕЙ ТЕСТОСТЕРОНА В СЫВОРОТКЕ | 2004 |
|
RU2354381C2 |
| ПРЕПАРАТЫ БУПРЕНОРФИНА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ | 2017 |
|
RU2747306C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ БОЛЕУТОЛЯЮЩЕГО СРЕДСТВА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1996 |
|
RU2141845C1 |
| СИСТЕМА КОНТРОЛИРУЕМОЙ ДОСТАВКИ | 2005 |
|
RU2429882C2 |
| Композиции длительного действия на основе кетопрофена | 2014 |
|
RU2646829C1 |
| ЛЕКАРСТВЕННЫЕ СОСТАВЫ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ, ОСНОВАННЫЕ НА БЛОК-СОПОЛИМЕРАХ | 2006 |
|
RU2409348C2 |
Фармацевтическая композиция обладает антиэстрогенным эффектом. Композиция включает фульвестрант в рицинолеатном носителе, фармацевтически приемлемый неводный сложноэфирный растворитель и фармацевтически приемлемый спирт. Композиция адаптирована для внутримышечного введения и поддерживает терапевтически значимую концентрацию фульвестранта в плазме крови в течение по меньшей мере 2 недель. Композиция после внутримышечной инъекции обеспечивает удовлетворительное высвобождение фульвестранта в течение продолжительного времени. 9 н. и 23 з.п. ф-лы, 1 ил., 4 табл.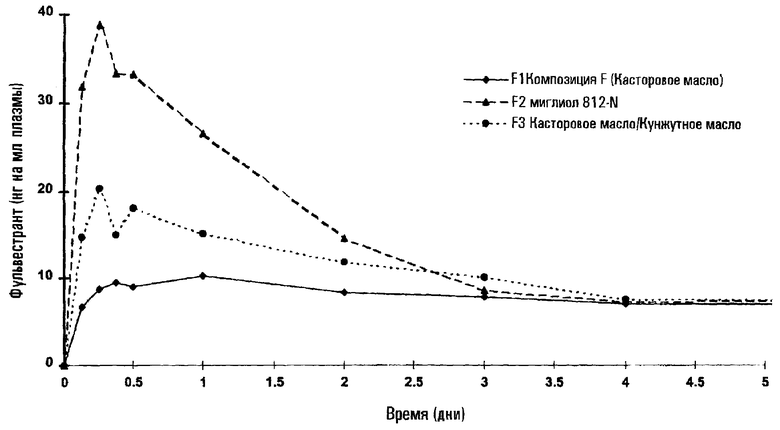
Приоритет по пунктам:
| СПОСОБ ИЗГОТОВЛЕНИЯ ЛИТЕ11НЫХ ФОРЛ\ | 0 |
|
SU346014A1 |
| WO 9619997 A1, 04.07.1996 | |||
| WO 9721440 A1, 19.06.1997 | |||
| ЭНЦИКЛОПЕДИЯ ЛЕКАРСТВ, РЛС | |||
| М.: РЛС, 2000, с.877-878. | |||
Авторы
Даты
2005-11-10—Публикация
2001-01-08—Подача