Изобретение относится к медицине и биологии, а именно к проблемам патогенеза эхинококкоза.
Эхинококкоз - тяжелое паразитарное заболевание, остающееся краевой патологией для некоторых регионов России и других стран Мира. Экспериментальные и клинические исследования по изучению патологии, в частности биологии и эпидемиологии паразита, патогенеза и профилактики заболевания продолжаются.
Одним из малоизученных аспектов патологии является биология микроацефалоцист и их роль в этиологии и патогенезе рецидивов эхинококкоза. Для проведения экспериментальных исследований получение необходимого количества микроацефалоцист представляет определенные трудности. Микроацефалоцисты редко обнаруживаются в материале, взятом интраоперационно из эхинококковой кисты больного [1], или животного. Поэтому чаще для экспериментов используют протосколексы, что не всегда объективно отражают изучаемые аспекты проблемы.
Аналогов получения микроацефалоцист in vitro в доступной литературе не обнаружено.
Наиболее близкой к нашему изобретению является методика Ф.П.Коваленко с соавт. (Коваленко Ф.П., Кротов А.И., Буданова А.С. и др. Экспериментальная терапия эхинококкоза. I. Лабораторная модель эхинококкоза и влияние на развитие ларвоцист Echinococcus granulosus сарколизинакридина, левамизола и мебендазола // Мед.паразитол. и паразитарн. болезни. - 1976 - №5 - С.546-551). Данная методика взята в качестве прототипа.
Методика-прототип заключается в следующем:
Ацефалоцисты гидатидного эхинококка получают следующим образом.
Белых мышей заражают протосколексами E.granulosus. Через 4-5 месяцев после заражения животных вскрывают. Из брюшной полости животных выделяют конгломераты развившихся из протосколексов ацефалоцист, покрытых тонкой соединительной капсулой. Глазными пинцетами и препаровальными иглами тупым путем нарушают целостность фиброзной капсулы в физиологическом растворе и высвобождают ацефалоцисты из конгломератов путем фильтрации. После этого ацефалоцисты промывают физиологическим раствором с антибиотиками и используют в опытах in vitro и для постановки биологической пробы.
К недостаткам прототипа следует отнести следующие моменты:
1. Невозможность получения микроацефалоцист в удобное для проведения экспериментов время.
2. Необходимость использования множества лабораторных животных, их содержания длительное (до 5-6 месяцев) время.
3. Техноемкость методики.
4. Невозможность получения микроацефалоцист с небольшим сроком развития.
Целью изобретения является создание способа получения микроацефалоцист с определенным сроком развития и в необходимых количествах в удобное для проведения экспериментов время.
Сущность изобретения.
Соблюдая стерильность, собирают содержимое гидатидной кисты (или нескольких кист, желательно больших размеров), содержащей бесцветную прозрачную жидкость и гидатидный песок. Для максимального забора зародышевых элементов последней порцией аспирируемой жидкости смывают со стенок хитиновой оболочки остатки зародышевых элементов. Производят микроскопию нативного препарата из осадка. Пригодным для эксперимента считается материал, в котором имеются зрелые протосколексы и выводковые капсулы. После непродолжительного отстаивания (10 минут) осторожно сливают надосадочную жидкость, осадок однократно отмывают физиологическим раствором и полученную взвесь (1 объемная часть осадка + 5 частей надосадочной жидкости) помещают в герметичный флакон с добавлением следов антибиотика (лучше использовать не отмытый флакон из-под пенициллина).
Флакон с взвесью зародышевых элементов помещают в термостат при температуре 32-38°С на 12-48 часов. По истечении срока инкубации оценивается наличие и количество микроацефалоцист в каждом флаконе (фиг.1,: нативный препарат, увеличение 8×8; где поз.1 - протосколекс, поз.2 - микроацефалоциста). Микроацефалоцисты при этом формируются из ножки протосколексов (одиночных и их группы, объединенных одной герминативной ножкой в выводковой капсуле). Начало формирования микроацефалоцист отмечается уже в первые 7-10 часов, становится явно заметным в течение 12-24 часа и прогрессивно увеличиваются в размере в последующие 24-72 часа при поддерживании инкубационных условий. Микроацефалоцисты, формирующиеся из общей ножки группы протосколексов, сравнительно крупнее, чем микроацефалоцисты одиночных протосколексов.
Пример конкретного использования предлагаемого способа.
По предложенному способу полученны микроацефалоцисты, которые были использованы для тестирования антипаразитарной активности гермицидов контактного действия (80% глицерин, 96% этиловый спирт, 20% гипертонический раствор NaCl), а также для моделировния эхинококкоза печени и брюшной полости у белых крыс.
Протокол эксперимента.
Больной Р., 29 лет, и/б 14/0068 от 5.02.03. Диагноз: Солитарный эхинококкоз нижней доли левого легкого, фибринозный плеврит слева. Операция 11.02.03, 12 часов 15 минут: закрытая эхинококкэктомия легкого. Из эхинококковой кисты эвакуировано до 450,0 мл бесцветной прозрачной жидкости с мутной взвесью в последних порциях жидкости. После отстаивания надосадочная жидкость слита. Микроскопия осадка: в осадке большое количество выводковых капсул и единичных протосколексов, при температуре 38°С отмечается двигательная активность наиболее крупных протосколексов, у остальных протосколексов движения еле заметны.
11.02.03, 15 часов 30 минут. Осадок однократно отмыли физиологическим раствором при температуре 37°С и полученную взвесь (1 объемная часть осадка + 5 частей надосадочной жидкости) поместили в герметичный (пустой) не отмытый флакон из-под пенициллина. Далее флакон с взвесью зародышевых элементов поместили в термостат при температуре 38°С на 48 часов.
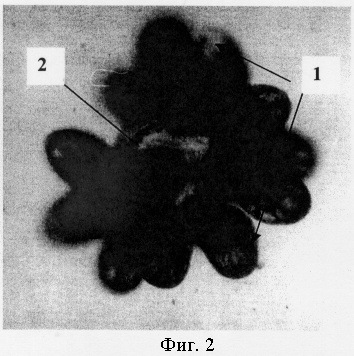
13.02.03, 14 часов. При микроскопии (8×8) в осадке обнаружилось большое количество микроацефалоцист, формирующиеся из герминативных ножек одиночных протосколексов и соразмерные с самими, а также более крупные (до 5-10 раз большего объема, чем протосколексы), формирующиеся из общей ножки протосколексов в выводковых капсулах (фиг.2,: нативный препарат, увеличение 8×8; где поз.1 - протосколекс, поз.2 - микроацефалоциста).
Признаки, отличающиеся от прототипа.
Микроацефалоцисты в предлагаемом способе получают путем инкубациизародышевых элементов (протосколексы и выводковые капсулы) гидатидной кисты in vitro. Получаемый материал содержит микроацефалоцисты примерно одного возраста и в большом количестве. Для получения микроацефалоцист необходимо относительно короткое время и не требуется использование лабораторных животных. По прототипу микроацефалоцисты получают путем заражения (in vivo) экспериментальных животных, сбора конгломератов из паразитарных кист через несколько месяцев после заражения, механического их размельчения и фильтрации из них микроацефалоцист.
Положительный эффект изобретения.
По указанному способу можно получить микроацефалоцисты в любое удобное для экспериментатора время, а также в необходимом количестве, причем с точно известным сроком их развития.
В литературе не описана возможность инкубации зародышевых элементов гидатидного эхинококка. Обнаружение свойства зародышевых элементов эхинококка развиваться in vitro и формировать ацефалоцисты открывает новые возможности по изучению биологии паразита in vitro (разработке оптимальных питательных сред для инкубации эхинококка, определение чувствительности паразита к различным лекарственным препаратам и т.д.).
Источники информации
1. Дадвани С.А., Шкорб О.С., Лотов А.М., Мусаев Г.Х. Лечение гидатидного эхинококкоза.// Хирургия, 2000, №8, с.27-32.
2. Коваленко Ф.П., Кротов А.И., Буданова А.С. и др. Экспериментальная терапия эхинококкоза. I. Лабораторная модель эхинококкоза и влияние на развитие ларвоцист Echinococcus granulosus сарколизинакридина, левамизола и мебендазола //Мед.паразитол. и паразитарн. болезни. - 1976 - №5 - С.546-551 - прототип.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ моделирования однокамерного эхинококкоза | 1990 |
|
SU1745740A1 |
| АНТИГЕЛЬМИНТНОЕ СРЕДСТВО | 2001 |
|
RU2195280C1 |
| СПОСОБ ОЦЕНКИ СОХРАНЕНИЯ ЖИЗНЕСПОСОБНОСТИ ЗАРОДЫШЕВЫХ ЭЛЕМЕНТОВ ЭХИНОКОККА in vitro | 2003 |
|
RU2267786C2 |
| Способ активирования онкосфер цестод для лабораторной наработки антигена | 2020 |
|
RU2725248C1 |
| Способ лечения эхинококкоза | 1987 |
|
SU1796183A1 |
| Способ получения чистой жизнеспособной культуры протосколексов Echinococcus multilocularis | 2017 |
|
RU2665781C1 |
| СПОСОБ ЛЕЧЕНИЯ ЛАРВАЛЬНОГО ЭХИНОКОККОЗА ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2013 |
|
RU2517044C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ЭХИНОКОККОЗА ПЕЧЕНИ | 1999 |
|
RU2140213C1 |
| Способ иммунотерапии вторичного альвеолярного эхинококкоза | 2017 |
|
RU2674767C1 |
| АНТИГЕЛЬМИНТНОЕ СРЕДСТВО | 1998 |
|
RU2153329C2 |
Изобретение относится к области медицины. Свежевзятый осадок гидатидной жидкости инкубируют в физиологическом растворе или питательной среде при температуре 32-38°С в течение 12-48 часов. Способ позволяет получить микроацефалоцисты в любое время, в необходимом количестве, с точно известным сроком их развития. 2 ил.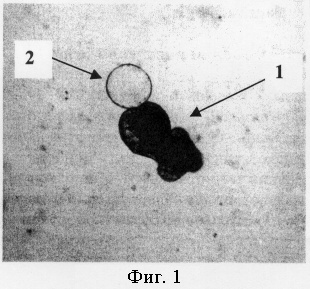
Способ получения микроацефалоцист гидатидного эхинококка in vitro, заключающийся в том, что свежевзятый осадок гидатидной жидкости, состоящий из выводковых капсул и протосколексов, инкубируют в физиологическом растворе или питательной среде при температуре 32-38°С в течение 12-48 ч.
| КОВАЛЕНКО Ф.П., КРОТОВ А.И., БУДАНОВА А.С | |||
| и др | |||
| Экспериментальная терапия эхинококкоза | |||
| I | |||
| Лабораторная модель эхинококкоза и влияние на развитие ларвоцист Echinococcus granulosus сарколизинакридина, левамизола и мебендазола II | |||
| Медицинская паразитология и паразитарные болезни, 1976, №5, с.546-551 | |||
| ДАДВАНИ С.А., ШКОРБ О.С., ЛОТЕВ А.М., МУСАЕВ Г.Х. |
Авторы
Даты
2005-11-20—Публикация
2003-04-04—Подача