Изобретение относится к ветеринарной и медицинской гельминтологии и может быть использовано для иммунотерапии вторичного альвеолярного эхинококкоза.
Возбудитель альвеолярной формы эхинококкоза (гидатидоза) Echinococcus multilocularis относится к числу наиболее патогенных социально опасных гельминтов. Вызываемое им заболевание характеризуется чрезвычайно тяжелым хроническим течением с первичным опухолевидным поражением печени нередко с метастазами в головной мозг, легкие и другие органы. Для лечения больных этим гельминтозом чаще всего применяется хирургический метод, очень трудный и сложный, который в запущенных случаях фактически является бесполезным. Альвеолярный эхинококкоз имеет очаговое географическое распространение. Эндемичными очагами этого гельминтоза являются южные области Германии, Швейцарии и пограничные с ней районы Италии, США, северные районы Канады, Японии, Восточная и Западная Сибирь, области Центральной России, а также Киргизия, Узбекистан, республики Закавказья, Молдова. Наиболее крупным очагом является Саха-Якутия [1, 2]. Эпидемиологическая ситуация по эхинококкозам в РФ по данным Федеральной службы по надзору в сфере прав потребителей и благополучия человека остается сложной. Ежегодно в РФ регистрируется свыше 500 случаев эхинококкоза, причем в структуре заболевания 14,5% составляют дети. С 2013 по 2015 годы зарегистрировано 174 случая эхинококкоза в 31 субъекте РФ. Максимальное число случаев альвеококкоза зарегистрировано в Алтайском крае (34 случая); Республике Башкортостан (16 случаев); Новосибирской (22 случая); Кемеровской (13 случаев) областях и городе Москве (17 случаев) [3]. По мнению исследователей альвеолярный эхинококкоз становится важной проблемой ветеринарии и здравоохранения и требует немедленной организации методов борьбы и профилактики [4, 5, 6].
В борьбе с ларвальной стадией альвеолярного эхинококкоза помимо хирургического метода наиболее приемлемым и применимым является химиотерапия, которая, однако, сопровождается большими дозами химических препаратов и длительным их применением. Но даже в этом случае этот способ малоэффективен, поскольку помимо развития резистентности паразита к лечебному химиопрепарату в процессе лечения происходит только приостановка его развития, а не окончательная гибель, что впоследствии приводит к возобновлению заболевания и возникновению метастазов.
К способам профилактики ларвальной стадии альвеолярного эхинококкоза относится также использование специфических и неспецифических стимуляторов иммунной системы, позволяющих повысить резистентность животных и человека к заражению., подавлять рост метацестод Е. multilocularis и вызывать гибель популяции паразита.
Резистентность к заражению Е. multilocularis может быть неспецифически потенциирована адьювантами Фрейнда, гидроокисью алюминия, вакциной BCG и Bordetella, а также современными иммуностимулирующими препаратами, как тиамин, градекс, вегетан и другие [7].
Установлена значительная эффективность вакцин BCG в дозе 26,4×106 ЕД, которая на 100% убивала ларвоцисты Е. multilocularis, однако при этом происходило развитие туберкулезных гранулом, что требовало уже доработки способа их лечения [8, 9].
Известен также способ профилактики вторичного альвеолярного гидатидоза, предусматривающий использование антигена клеточной культуры протосколексов Е. multilocularis в комплексе с иммуномодулятором риботаном [10], а также использование в качестве профилактического средства клеточного антигена из протосколесов паразита в комплексе с мембранной фракцией клеток эпимастигот Trypanosoma cruzi (патент №2609858) [11].
Все перечисленные способы профилактики ларвальной стадии альвеолярного эхинококкоза, как правило, проводятся до заражения. В то же время наибольшего эффекта можно достичь разработкой иммунотерапевтического способа лечения этого гельминтоза, направленного на усиление как неспецифической резистентности, так и специфического иммунитета, что позволит приостановить развитие паразита, губительно действовать на инвазивные зародышевые элементы и в конечном итоге излечить уже зараженного пациента.
В этой связи одним из самых заманчивых и перспективных методов является иммунотерапия, основанная, в первую очередь, на использовании специфических антигенных препаратов гельминта, которые могут обладать лечебными свойствами. Подобные научные поиски в этом направлении в отношении цистного (Е. granulosus) эхинококкоза человека известны достаточно давно и проводились они как у нас в стране [12, 13], так и за рубежом [14, 15, 16].
В качестве терапевтического средства во всех этих работах использовали антиген эхинококкового пузыря от человека.
Так, с лечебной целью Н.Н. Петров [12] применил антиген, приготовленный из жидкости эхинококковых (Е. granulosus) пузырей человека, больному с эхинококкозом легких, печени и подкожной клетчатки груди. Он вводил подкожно 0.5-1 мл антигена с интервалом 6-10 суток. Через 8 месяцев был проведен второй курс лечения, который состоял из семи введений антигена по 0,5 мл с интервалом 4-5 суток После проведения двух курсов лечения самочувствие больного улучшилось.
А.И. Якимчук [13] аналогичным способом лечил двух больных эхинококкозом легких антигеном из жидкости эхинококкозных пузырей человека и сделал заключение, что эхинококковая «киста» при антигенотерапии подвергается рассасыванию.
По данным Manphredy [16] из Буэнос-Айреса, который лечил антигеном из гидатидной жидкости 510 неоперабельных больных эхинококкозом путем первоначального внутрикожного введения антигена в дозе 0,2 мл и последующих продолжительных введений с промежутками от 3 до 8 суток. Максимальная доза антигена 10 мл, хотя лечение продолжительное, автор считает результаты утешительными.
Представленные работы являются убедительным подтверждением целесообразности проведения исследований по изысканию иммунотерапевтических средств при ларвальных цестодах, а именно при альвеолярном эхинококкозе -наиболее патогенном и социально опасном гельминтозе.
Цель предполагаемого изобретения заключается в создании способа иммунотерапии вторичного альвеолярного эхинококкоза, обеспечивающего не только подавление роста ларвоцист Е. multilocularis, но и губительно действующего на инвазивные зародышевые элементы в развивающихся ларвоцистах паразита. Для выполнения поставленной цели использовали противораковый препарат круцин в комплексе с клеточным антигеном протосколексов Е. multilocularis.
Учитывая серьезную опасность вторичного альвеолярного эхинококкоза для людей и перспективность развития иммунотерапии этой инвазии была проведена работа по разработке способа иммунотерпии вторичного альвеолярного эхинококкоза на модели мышь и крыса - Е. multilocularis с использованием клеточного антигена протосколексов Е. multilocularis и протоворакового препарата круцина. Противоопухолевые свойства круцина с положительным успехом изучены многими исследователями как у нас в стране, так и за рубежом [17].
Препарат круцин представляет собой лиофилизированные одноклеточные организмы - паразитические жгутиковые простейшие Trypanosoma cruzi. Клеточный антиген протосколексов Е. multilocularis - это антигеноактивные метаболиты культивируемых клеток протосколексов Е. multilocularis, которые получают приготовлением первичной клеточной культуры из протосколексов Е. multilocularis, последующего культиворования их в искусственных питательных средах с добавлением необходимых факторов роста, получения перевиваемой клеточной культуры и отбора антигеноактивных серий метаболитов культивируемых клеток иммуноферментной реакцией (патент №2219551) [18].
Иммуногенность клеточного антигена протосколесов Е. multilocularis была проверена иммунизацией кроликов с последующей оценкой полученной от них антисыворотки реакцией иммунодиффузии в агаровом геле, в результате которой было выявлено не менее 5-6 комплексов антиген-антитело в виде проявленных полос преципитации, что подтверждает его высокую иммуноактивность. Непосредственно перед проведением основных экспериментов по оценке иммунотерапевтических свойств испытуемых препаратов была определена доза противоракового препарата круцина в единицах действия (ЕД) и клеточного антигена протосколексов Е. multilocularis по белку. Белок в антигене определяли по методу Layne [19]. Одна ЕД содержит 1000 экземпляров лиофилизированных Т. cruzi.
В результате проведенных исследований установили, что доза противоракового препарата круцина для мышей составила 15 ЕД, а для крыс - 20 ЕД; доза клеточного антигена протосколексов Е. multilocularis для мышей 60 мкг белка, а для крыс - 80 мкг белка в 0,2 мл стерильного физиологического раствора.
Наиболее близким к заявляемому техническому решению является метод иммунотерапии альвеолярного эхинококкоза с использованием комплекса, включающего химический препарат альбендазол и липосомальный мурамилтрипептид фосфатидилэтаколамин в качестве иммуномодулятора. Альбендазол вводится 2 раза в неделю, перорально в дозе 10 мг/кг массы, начиная с 5 недели до 10 недели после заражения одновременно с указанным выше иммуномодулятором, который вводили также 2 раза в неделю до 10-й недели после заражения внутривенно в дозе 1 мг/кг массы тела [20]. В данном случае неспецифическая стимуляция резистентности иммуномодулятором в комплексе с альбендазолом приводила к повышению эффективности антигельминтного препарата, что проявилось снижением роста ларвоцист паразита в течении 3 месяцев после окончания лечения. Этот метод фактически также основан на длительном применении антигельминтного препарата, что не может не отразиться на организме в целом.
Технический результат заявленного изобретения заключается в разработке способа, обладающего высоким иммунотерапевтичеким эффектом против вторичного альвеолярного эхинококкоза, предусматривающего использование противоракового препарата круцина в комплексе с клеточным антигеном протосколексов Е. multilocularis.
Примеры конкретного исполнения.
Пример 1. Оценка иммунотерапевтических свойств противоракового препарата круцина в комплексе с клеточным антигеном протосколексов Е. multilocularis при вторичном альвеолярном эхиноккозе на мышах.
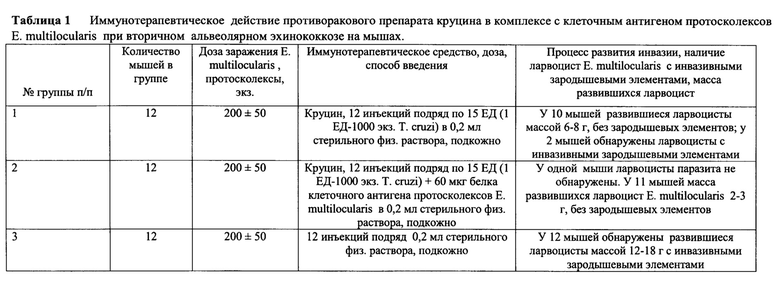
В опыте использовали 36 белых беспородных мышей, массой 18-20 г, распределенных на 3 равноценные группы по 12 мышей в каждой (таблица 1). Все подопытные мыши были заражены внутрибрюшинно протосколексами и ацефалоцистами Е. multilocularis, выделенными от мышей-доноров, в дозе 200±50 экз./мышь
Через 15 дней после заражения мышам 1-й группы в течение 12 суток подряд вводили подкожно противораковый препарат круцин в дозе 15 ЕД (1 ЕД - 1000 экз. Т. cruzi) в 0,2 мл стерильного физиологического раствора. Мышам 2-й группы в эти же сроки подкожно вводили противораковый препарат круцин в дозе 15 ЕД в комплексе с клеточным антигеном протосколексов Е. multilocularis в 0,2 мл стерильного физраствора. Мыши 3-й группы (контроль) в эти же сроки получали подкожно по 0,2 мл стерильного физиологического раствора.
По результатам исследований, проведенных на 122 сутки после заражения установили, что у мышей, получавших в процессе иммунотерапии только противораковый препарат круцин, масса развившихся ларвоцист Е. multilocularis составляла 6-8 г от массы тела, что более чем в 2 раза меньше, чем в контрольной группе. Причем более 75% развившихся ларвоцист паразита не содержала полноценных инвазивных зародышевых элементов, но у 2 мышей из этой группы были обнаружены ларвоцисты с портосколексами и ацефалоцистами, инвазивность которых была впоследствии подтверждена проведенной биопробой на интактных мышах.
Аналогичный анализ, проведенный во 2-й группе мышей, получивших противораковый препарат круцин в комплексе с клеточным антигеном протосколексов Е. multilocularis, показал наибольший терапевтический эффект, поскольку, во-первых, масса развившихся ларвоцист у мышей этой группы не превышала 2-3 г от общей массы тела хозяина, что в 8 раз меньше, чем у животных контрольной группы, а во-вторых, отсутствием в развившихся ларвоцистах паразита инвазивных зародышевых элементов. Одна мышь из этой группы оказалась свободной от инвазии. Последующая проведенная биопроба по проверке инвазивных свойств зародышевых элементов из развившихся ларвоцист показала отрицательный результат.
Мыши контрольной группы оказались все зараженными, а развившиеся у них ларвоцисты составляли 15-20 г от массы тела со сформированными протосколексами, инвазивность которых была впоследствии подтверждена биопробой на мышах.
Полученные данные являются убедительным доказательством значительного терапевтического эффекта при вторичном альвеолярном эхинококкозе, который обеспечивается противораковым препаратом круцин в комплексе с клеточным антигеном протосколексов Е. multilocularis.
Пример 2. Оценка иммунотерапевтического действия противоракового препарата круцин в комплексе с клеточным антигеном протосколексов Е. multilocularis на крысах.
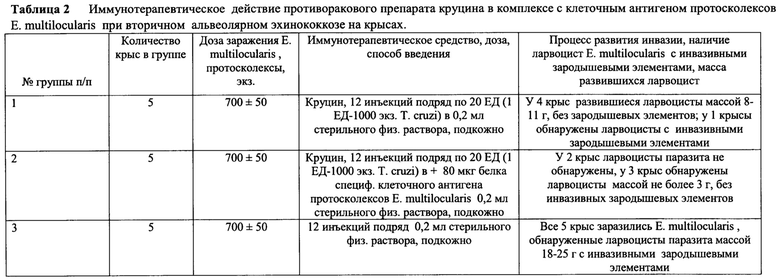
Опыт провели на 15 белых крысах породы Wistar, массой 180-200 г, распределенных на 3 группы по 5 животных в каждой. Все крысы были заражены протосколексами и ацефалоцистами Е. multilocularis в дозе 700±50 экз./крысу (таблица 2).
На 15-й день после заражения крысам 1-й группы вводили в течении 12 суток противораковый препарат круцин в дозе 20 ЕД (1ЕД-1000 экз./ Т. cruzi) в 0,2 мл стерильного физраствора; крысам 2-й группы в те же сроки подкожно вводили также по 20 ЕД Т. cruzi в комплесе со специфическим клеточным антигеном протосколексов Е. multilocularis - в дозе 80 мкг белка/ крысу в 0,2 мл стерильного физраствора. Крысы 3-й группы (контроль) получали в те же сроки подкожно по 0,2 мл стерильного физраствора.
Результаты вскрытия экспериментальных крыс, проведенные также на 122-е сутки после заражения, фактически подтвердили данные первого опыта на мышах. У 4-х крыс первой группы, получавших в качестве иммунопрепарата противораковый круцин, равзвившиеся ларвоцисты, массой 8-11 г были без зародышевых элементов. А у 1-й крысы обнаружены ларвоцисты паразита с инвазивными зародышевыми элементами. Из 5 крыс второй группы, получавших противораковый препарат круцин в комплексе с клеточным антигеном протосколексов Е. multilocularis, у двух - ларвоцисты паразита не регистрировали, а у трех - обнаружены ларвоцисты массой не более 3 г от массы тела без инвазивных зародышевых элементов.
Животные контрольной группы были все заражены, причем масса развившихся ларвоцист паразита составляла 18 - 25 г и все они содержали полноценные зародышевые элементы, инвазивность которых была установлена биопробой.
Источники информации.
1. Лукашенко Н.П. Альвеококкоз. - М. «Медицина». - 1975. - 327 с.
2. Бессонов А.С.Альвеолярный эхинококкоз гитадиоз. - М. - 2003. - 334 с.
3. Письмо 20.06.2016 №01/7782-16-27 «О заболеваемости эхинококкозом и альвеококкозом в Российской Федерации».
4. Маркин А.В. // Теория и практика борьбы с паразитарными болезнями. - 1999. - с. 152-154.
5. Мусаев Г.Х. // Теория и практика борьбы с паразитарными болезнями. - 1999. - с. 170-171.
6. Kovalenko F.P. et.al. // Acta Parasitologica, 8 Europ. Microcolloquium of Parasitologia 2002.- V. 45, №3. - p. 241-242.
7. Lloyd Isot. and Radiat. Parasitol. Proc. Adv. Group Meet. Vienna, 1981 - p. 121-128.
8. Rau M.E., Tanner C.E. // Nature, London. - 1975. - V. 256, №5515. - p. 318-319.
9. Reuben J.M. et al. // Infect. And Immun. - 1978. - V. 21, №1. p. Бессонов A.C., 2003135-139.
10. Бережко В.К., Кленова И.Ф., Руднева О.В., и др. «Способ профилактики вторичного альвеолярного эхинококкоза (гидатидоза).» патент №2279274, - 2006 г., бюл. №19.
11. Бережко В.К., Сасикова М.Р., Написанова Л.А. и др. «Способ профилактики ларвальной стадии альвеолярного эхинококкоза.» патент №2609858 - 2017. - бюл. №4.
12. Петрова Н.Н. Опыт вакцинотерапии эхинококковой болезни. Врач. газета - 1923. 16. 364.
13. Якимчук А.И. Иммунотерапия (консервативное лечение) эхинококкоза легких. // Матералы по борьбе со злокачественными опухолями. - Уфа. - 1955. - в. 7. -с. 10.
14. Deve F. La souris blanche, animal reactif pour les inoculation echinococciques. Un essoi de serotherapie anti-echinococciques aspecifique. // C.R. Soc. Biol. Paris.- 1933. - 43. - 1443.
15. Apphatie I.L. Rev. sud. Amer. Med. Chirurg. - 1931 - 3.-p. 785.
16. Manphready (цитировано по Лукашенко Н.П. «Альвеококкоз». - 1975. - стр. 219)
17. Каллиникова В.Д. Противоопухолевые свойства жгутикового простейшего Trypanosoma cruzi. - М - 2004 - 278 с.
18. Бережко В.К., Кленова И.Ф., Сивкова Т.Н. и др. «Способ получения диагностического антигена цестод», патент №2219551 - 2003. - бюл. №35.
19. Layne Е. // Method Enzymol - 1957.- V. 3- P. 447-454
20. Dvoroznakova E. at al. // Parasitol int. - 2004. - V. 53, №4. p. 315-325.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ профилактики ларвальной стадии альвеолярного эхинококкоза | 2016 |
|
RU2609858C1 |
| СПОСОБ ПРОФИЛАКТИКИ ВТОРИЧНОГО АЛЬВЕОЛЯРНОГО ЭХИНОКОККОЗА (ГИДАТИДОЗА) | 2004 |
|
RU2279274C2 |
| Способ получения чистой жизнеспособной культуры протосколексов Echinococcus multilocularis | 2017 |
|
RU2665781C1 |
| АНТИГЕЛЬМИНТНОЕ СРЕДСТВО | 2001 |
|
RU2195280C1 |
| АДЪЮВАНТНАЯ КОМПОЗИЦИЯ ДЛЯ ИНЪЕКЦИОННЫХ ВАКЦИН ПРОТИВ ТКАНЕВЫХ ГЕЛЬМИНТОЗОВ | 2007 |
|
RU2348427C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИМАГИНАЛЬНОГО АЛЬВЕОКОККОЗА | 2006 |
|
RU2310923C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОГО АНТИГЕНА ЦЕСТОД | 2002 |
|
RU2219551C1 |
| АНТИГЕЛЬМИНТНОЕ СРЕДСТВО | 1998 |
|
RU2153329C2 |
| СПОСОБ ЛЕЧЕНИЯ ЛАРВАЛЬНОГО ЭХИНОКОККОЗА ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2013 |
|
RU2517044C1 |
| Способ активирования онкосфер цестод для лабораторной наработки антигена | 2020 |
|
RU2725248C1 |
Изобретение относится к ветеринарной и медицинской гельминтологии и может быть использовано в иммунотерапии вторичного альвеолярного эхинококкоза. Способ иммунотерапии вторичного альвеолярного эхинококкоза включает введение зараженным протосколексами Е. multilocularis мышам и крысам через 15 суток после заражения подкожно в течение 12 суток подряд противоракового препарата круцина в 0,2 мл стерильного физиологического раствора в эффективной дозе соответственно 15 и 20 ЕД (1 ЕД включает 1000 экземпляров лиофилизированных Trypanosoma cruzi). В комплексе с противораковым препаратом круцином животным в те же сроки одновременно подкожно вводят клеточный антиген протосколексов Е. multilocularis в дозе соответственно 60 и 80 мкг белка. Использование данного способа обеспечивает уменьшение массы развившихся ларвоцист паразита более чем в 8 раз и отсутствие в них полноценных инвазивных зародышевых элементов, способных заражать животных. 2 табл., 1 пр.
Способ иммунотерапии вторичного альвеолярного эхинококкоза, включающий введение зараженным протосколексами Е. multilocularis мышам и крысам через 15 суток после заражения подкожно в течение 12 суток подряд противоракового препарата круцина в 0,2 мл стерильного физиологического раствора в эффективной дозе соответственно 15 и 20 ЕД (1 ЕД включает 1000 экземпляров лиофилизированных Trypanosoma cruzi), отличающийся тем, что в комплексе с противораковым препаратом круцином животным в те же сроки одновременно подкожно вводят клеточный антиген протосколексов Е. multilocularis в дозе соответственно 60 и 80 мкг белка, обеспечивающих уменьшение массы развившихся ларвоцист паразита более чем в 8 раз и отсутствие в них полноценных инвазивных зародышевых элементов, способных заражать животных.
| RU 2007125534 A, 20.01.2009 | |||
| САСИКОВА М.Р | |||
| Физико-химическая характеристика клеточных антигенов эхинококков и разработка иммунопрофилактического средства // Автореферат кбн, Москва, 2009 [он-лайн], [найдено 24.10.2018] | |||
| Найдено из Интернета: URL: https://new-disser.ru/_avtoreferats/01004565234.pdf | |||
| СПОСОБ ПРОФИЛАКТИКИ ВТОРИЧНОГО АЛЬВЕОЛЯРНОГО ЭХИНОКОККОЗА (ГИДАТИДОЗА) | 2004 |
|
RU2279274C2 |
| БЕРЕЖКО В.К | |||
| и др | |||
| Изучение иммунотерапевтического действия иммуномодулятора ронколейкина при вторичном альвеолярном эхинококкозе // ТЕОРИЯ И ПРАКТИКА БОРЬБЫ С ПАРАЗИТАРНЫМИ БОЛЕЗНЯМИ, 2016, 17, стр.58-61 [он-лайн], [найдено 24.10.2018] | |||
| Найдено из Интернета: URL: https://elibrary.ru/download/elibrary_28164078_64745919.pdf | |||
| FR2863499 A1, 17.06.2005. | |||
Авторы
Даты
2018-12-13—Публикация
2017-12-11—Подача