Настоящее изобретение относится к рекомбинантным аллергенам яда насекомых и к способу их целенаправленного получения, причем упомянутые аллергены могут принимать формы, аналогичные природным структурам, или отличающиеся от них в зависимости от способа получения.
Применение форм, которые соответствуют природной молекуле, заключается в моноаллергенной диагностике (in vitro или in vivo) расстройств у лиц, страдающих аллергией, особенно у страдающих аллергией на яд насекомых.
Искусственные формы могут применяться как терапевтические средства для специфической (индивидуальной) иммунотерапии, которая имеет незначительные побочные эффекты. Эти рекомбинантные формы, таким образом, могут обеспечивать более эффективное лечение, чем натуральный продукт. Разработанный способ позволяет реализовывать биотехнологическое производство в условиях, требуемых в фармацевтике (GMP).
Аллергия от жалящих насекомых вызывается преимущественно осами и медоносными пчелами и может приводить к серьезным системным симптомам или даже потенциально фатальной анафилаксии (Müller, U.R., in: Insect sting allergy, Gustav Fischer Verlag; 1990). Веществами, которые вызывают аллергию типа 1, являются протеины, гликопротеины или полипептиды яда насекомых. После инъекции восприимчивым людям, эти аллергены реагируют с молекулами IgE, связанными с поверхностью опорных клеток. Если связанные с FcεRI молекулы IgE этого типа сшиты друг с другом посредством аллергена, то это приводит к высвобождению медиаторов (например, гистамина, лейкотриенов) и цитокинов эффекторной клетки и, таким образом, к соответствующим клиническим симптомам.
Кроме пептида мелитина как аллергенные составляющие пчелиного яда действуют ферменты гиалуронидаза и фосфолипаза А2 (Habermann, E., 1972, Science 177, 314-322). В случае осы основные энзимоактивные аллергены аналогичны гиалуронидазе, которая подобна той, которая входит в состав пчелиного яда (Hoffmann, D.R., 1986, J. Allergy Clin.Immunol. 78, 337-343), и фосфолипазе А1. Важнейшим основным аллергеном яда осы является антиген 5, у которого до настоящего времени энзиматической активности не обнаружено (King и др., 1978, Biochemistry 17, 5165-5174). Все упомянутые аллергены уже охарактеризованы в молекулярной биологии и уже клонированы соответствующие молекулы кДНК (в том числе Fang и др., 1988, PNAS, 895-899; Soldatova и др., 1993, FEBS, 145-149; Kuchler и др., 1989, Eur. J. Biochem. 249-254). С помощью последовательности кДНК можно получать рекомбинантные аллергены, которые могут быть применены в диагностике и лечении аллергии (Scheiner and Kraft, 1995, Allergy 50, 384-391).
По данному изобретению основной антиген 5 аллергена имеет особо важное значение, ниже эта молекула применяется в качестве образца. Эта молекула представляет собой негликозилированный протеин размером около 25 кДа. Первичная последовательность содержит 8 цистеиновых остатков, что свидетельствует о наличии четырех дисульфидных мостиков (Hoffman, D.R., 1993, J. Allergy Clin Immunol. 92: 707-716). Классический подход к эффективной терапии аллергии на яд насекомых состоит в специфической иммунотерапии или гипосенсибилизация (MÜller, U.R., in: Insect sting allergy, Gustav Fisher Verlag; 1990). При этом экстракты природного аллергена вводят пациенту подкожно возрастающими дозами. Однако этот метод влечет за собой риск возникновения аллергических реакций или даже анафилактического шока. Поскольку можно ожидать возникновения сильных реакций, особенно в случае гипосенсибилизации укуса насекомых, то лечение проводится исключительно в условиях стационара.
Оптимизация лечения при помощи аллергенов, получаемых рекомбинантными способами, может быть особенно существенной в случае аллергии на укусы насекомых. Экстракты аллергенов природного происхождения можно заменить определенными коктейлями из аллергенов высокой чистоты, получаемых рекомбинантными методами (Scheiner and Kraft, 1995), которые могут быть подходящими к индивидуальной сенсибилизации пациентов. Реальные перспективы более безопасной гипосенсибилизации открываются в связи с возможностью сознательного видоизменения рекомбинантных аллергенов, в которых антигенные детерминанты IgE удалены специфическим образом без ослабления спаренных Т-клеток антигенных детерминантов, которые восприимчивы к терапии (Schramm и др., 1999, J. Immunol. 162, 2406-2414).
Из гетерологической экспрессии в E.coli известно, что большинство эукариотических протеинов не вырабатываются со структурой, аналогичной природным структурам, или вырабатываются в очень незначительной степени. Результатом этих неправильных форм зачастую является нерастворимость этих протеинов. В частности, это наблюдается в цистеинсодержащих протеинах (Kuchler et al., 1989, Eur. J. Biochem. 184, 249-254). Об антигене 5 сообщается, что экспрессия в бактериях приводит к образованию нерастворимых агрегатов, не соответствующих природной структуре (Monsalve et al., 1999, Protein Express Purif. 16(3): 410-416). Нерастворимые агрегаты этого типа нельзя применять ни для диагностики, ни для терапии.
Протеины, которые нерастворимы в E.coli, часто приготавливают для исследовательских целей в системе эукариотической экспрессии, такой как, например, дрожжи или клетки насекомых (Monsalve et al., 1999, Protein Express Purif. 16(3): 410-416; Soldatova et al., 1998, J Allergy Clin Immunol 101: 691-698). Однако недостатками систем эукариотической экспрессии являются, в частности, возможность протекания процессов гипергликозилирования (Grobe et al., 1999, Eur. J.Biochem 263: 33-40) и протеолитической деградации, а также сравнительно небольшой выход продукции (Glover и Hames (eds.), 1995, Expression Systems, IRL Press, Oxford-New York-Tokyo). Следовательно, протеины этого типа обычно непригодны для аллергологического применения в областях фармацевтическо-медицинской диагностики и терапии.
Продукты, полученные способом по данному изобретению, которые имеют природную структуру, преимущественно можно применять in-vitro и in-vivo для диагностики аллергических расстройств, особенно аллергии на укусы насекомых. Эта природная форма пригодна для обнаружения антител IgE по известным методикам.
С другой стороны, варианты, получаемые по данному изобретению, которые отличаются совершенно неактивными или только частично активными структурами IgE, могут применяться как гипоаллергенные компоненты в препаратах для специфической иммунотерапии. В контексте данного изобретения, упомянутый термин "гипоаллерген" означает пониженную вплоть до отсутствия, предпочтительно от 5 до 95%, в особенности от 20 до 85%, способность вызывать аллергическую реакцию (по сравнению с природным аллергеном) за счет пониженного отклика IgE.
Предметом настоящего изобретения является способ, при помощи которого рекомбинантные аллергены можно получать в бактерии (Е.coli). Первый этап очистки осуществляют при помощи значительного обогащения агрегатами нерастворимых протеинов. Затем эти агрегаты денатурируют без добавления восстанавливающих агентов. В зависимости от условий последующего диализа получаются различные формы. Важно то, что эти молекулы являются мономерными и растворимыми. Активность IgE в первом варианте растворимой формы сравнима с активностью природного аллергена и, следовательно, может быть применена для диагностических целей. Продукт этого типа получают диализом с цистеинсодержащим раствором.
Другие альтернативные варианты растворимой формы структурно отличаются от природного аллергена и определяются пониженной или отсутствующей реакционной способностью IgE. По этой причине продукты этого типа пригодны для содействия усовершенствованной иммунотерапии. Гипоаллергенный продукт этого типа получают по данному изобретению посредством диализа с кислотными буферными растворами, предпочтительно в среде с рН между 3,5 и 6,5, особенно между 4,0 и 5,5.
Таким образом, данное изобретение относится к рекомбинантному аллергену насекомых, который отличается тем, что имеет пониженную активность IgE или пониженную способность вызывать аллергическую реакцию. По данному изобретению способность этих протеинов вызывать аллергическую реакцию является пониженной вплоть до 95% по сравнению с природным аллергеном.
В особенности изобретение относится к соответствующему рекомбинантному аллергену насекомого осы, а именно из Vespula vulgaris и Vespula germanica.
Кроме того, данное изобретение относится к способу выделения достаточно чистого рекомбинантного аллергена яда насекомых, который отличается тем, что аллергенные протеины получают в нерастворимой форме, в качестве "тел внедрения" в клетках бактерий; далее вышеупомянутые нерастворимые агрегаты денатурируют, и эти денатурированные продукты преобразуют посредством диализа в растворимые мономерные аллергены разных структурных форм и затем выделяют. Указанное денатурирование предпочтительно осуществляют с использованием хлорида гуанидиния без добавления восстанавливающих агентов.
Данное изобретение относится в особенности к способу выделения рекомбинантных аллергенов яда насекомых с пониженной аллергенностью или реакционной способностью IgE, по которому диализ проводят с применением кислотного буферного раствора; предпочтительно этим буфером является ацетат натрия с рН между 4,5 и 5,0.
Кроме того, изобретение относится также к способу выделения рекомбинантных аллергенов яда насекомых с обычной аллергенностью или реакционной способностью IgE; в этом случае диализ проводят с применением цистеинсодержащего раствора.
Изобретение относится также к рекомбинантному аллергену яда осы, который можно получить при помощи соответствующего способа, описанного выше и ниже.
Кроме того, данное изобретение относится к фармацевтическим препаратам, содержащим соответствующий рекомбинантный аллерген с пониженной или уменьшенной реакционной способностью IgE и соответствующие вспомогательные лекарственные вещества и вытяжки.
Наконец, данное изобретение относится к применению аллергенов яда насекомых, получаемых при помощи соответствующего способа, описанного выше и ниже, для диагноза аллергии на укусы насекомых in-vivo и in-vitro.
Ниже представлено подробное описание этого способа.
В конкретных примерах антиген 5 аллергенов яда осы из Vespula vulgaris (Ves v 5) и антиген 5 из Vespula germanica (Ves g 5) были клонированы в вектор экспрессии pSE420 и преобразованы в штамм M15 pREP4 бактерии К12. Схема последовательности операций при осуществлении этого способа показана на чертеже.
Рекомбинантные аллергены получают при помощи предварительного выращивания штамма для прививки культуры экспрессии. Экспрессию, индуцированную IPTG, производят во вращающемся контейнере с перемешиванием при 37°С в среде LB с ограниченным доступом кислорода (90 об/мин). Бактерии концентрируют центрифугированием (5000 × g, в течение 10 мин, при 20°С) через 5 часов после экспрессии. Бактериальное дигерирование осуществляют после повторного суспендирования клеток в буферном растворе (50 мМ трис/HCl, 25% (вес/объем) сахарозы, рН 8,0) при помощи добавления лизоцима (10 мг/г мокрого веса). Далее добавляют такой же объем раствора детергента (0,2 М NaCl, 1% (вес/объем) DOC, 1% (вес/объем) Nonidet P40). Этот дигерирующий раствор впоследствии обрабатывают ультразвуком (3 мин на льду, 130 Вт, импульс 0,5 сек). Поскольку продукты экспрессии первоначально находятся в форме нерастворимых агрегатов (тела включения), то благодаря их высокой плотности их можно отделить от большей части остальных компонентов (фрагменты стенок клеток, рибосомы и т.д.) центрифугированием при 3000 × g. Дальнейшая очистка выполняется в три последовательных этапа при помощи детергенсодержащих растворов (1% Triton X-100). Очищенные тела включения впоследствии дигерируют добавлением денатурирующего буферного раствора (6 М хлорида гуанидиния, 20 мМ трис/HCl, рН 8,0) и встряхивают в течение 2 часов в RT.
Для того чтобы выделить формы структур с активной IgE, денатурирующую смесь вводят в диализную трубку (предел дигерирования 12-14 кДа) и диализируют до 100 объемов раствора цистеина (5 мМ цистеина) в течение 12 часов при комнатной температуре, при перемешивании. Далее, для удаления цистеина, проводят диализ до дистиллированной воды.
Для того чтобы получить структуры с пониженной реакционной способностью IgE, сначала проводят диализ до 20 мМ буферного раствора ацетата натрия (рН 5,0). В этом случае тоже требуется проводить последующий диализ до дистиллированной воды. После удаления растворимые в воде аллергены отделяют от осажденных центрифугированием агрегатов. Надосадочная жидкость содержит целевые растворимые рекомбинантные аллергены. Вместо буферного раствора ацетата натрия можно также использовать другие кислотные буферные растворы, обладающие способностью к буферизации в диапазоне от 3,5 до 6,5, предпочтительно от 4,0 до 5,5. Примеры буферных систем этого типа в достаточной мере описаны в литературе.
Осажденные рекомбинантные аллергены, получаемые обоими способами, могут быть повторно денатурированы и очищены по этой же схеме. Это значительно увеличивает выход продукции.
После этапов диализа продукты имеют чистоту около 95%. Дальнейшие этапы очистки базовых аллергенов яда насекомых производят посредством катионообменной хроматографии (буферный раствор рН 7,2), при помощи, например, установки Source S (Pharmacia, Freiburg, Germany) и гель-хроматографии. Помимо удаления присутствующих в небольшом количестве высокомолекулярных и низкомолекулярных примесей гель-хроматография также служит для опреснения.
Контроль качества продукции осуществляют на основе ряда характеристических свойств, которые ниже представлены в табличном виде для антигена 5:
п-антиген=природный антиген
Способ по данному изобретению пригоден для всех типов аллергенов яда насекомых. Используемая методика очистки, рекомбинантного клонирования и методы экспрессии известны специалистам и могут быть заменены другими аналогичными методиками.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения аллергоида на основе пчелиного яда для проведения аллерген-специфической иммунотерапии | 2019 |
|
RU2731509C1 |
| ВАРИАНТЫ ОСНОВНОГО АЛЛЕРГЕНА Phl p 1 ИЗ ТИМОФЕЕВКИ ЛУГОВОЙ | 2003 |
|
RU2323942C2 |
| МОДИФИКАЦИИ АЛЛЕРГЕНОВ ГРУППЫ 6 POACEAE (МЯТЛИКОВЫХ), ИМЕЮЩИХ ПОНИЖЕННУЮ АЛЛЕРГЕННОСТЬ БЛАГОДАРЯ МУТАГЕНЕЗУ ПРОЛИНОВЫХ ОСТАТКОВ | 2010 |
|
RU2607373C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНЫХ ВАРИАНТОВ Bet v 1 | 2001 |
|
RU2299214C2 |
| ВАРИАНТЫ ГРУППЫ 5 АЛЛЕРГЕНОВ ЗЛАКОВЫХ СО СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ ВСЛЕДСТВИЕ МУТАГЕНЕЗА ОСТАТКОВ ПРОЛИНА | 2010 |
|
RU2575606C2 |
| ВАРИАНТЫ ГРУППЫ 5 АЛЛЕРГЕНОВ ЗЛАКОВЫХ СО СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ ВСЛЕДСТВИЕ МУТАГЕНЕЗА ОСТАТКОВ ПРОЛИНА | 2010 |
|
RU2658767C1 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК И ПОЛУЧЕНИЕ АЛЛЕРГЕНА ЗЛАКОВЫХ РЕКОМБИНАНТНЫМ СПОСОБОМ | 2000 |
|
RU2238321C2 |
| КОНЪЮГАТЫ ГИДРОКСИАЛКИЛКРАХМАЛА И АЛЛЕРГЕНА | 2003 |
|
RU2325925C2 |
| ПРОИЗВОДНЫЕ PhI p 5а, ОБЛАДАЮЩИЕ СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ И СОХРАНЕННОЙ Т-КЛЕТОЧНОЙ РЕАКТИВНОСТЬЮ | 2004 |
|
RU2368620C2 |
| ВАРИАНТ АЛЛЕРГЕНА ГРУППЫ I ИЗ Роасеае, ХАРАКТЕРИЗУЮЩИЙСЯ СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ И СОХРАНЕННОЙ Т-КЛЕТОЧНОЙ РЕАКТИВНОСТЬЮ (ВАРИАНТЫ), КОДИРУЮЩАЯ ЕГО МОЛЕКУЛА ДНК И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2409589C2 |
Изобретение относится к рекомбинантным аллергенам яда насекомых и специфическим способам их получения, в частности антигена 5 аллергена осиного яда. Рекомбинантный антиген 5 получают в бактериальных клетках в виде нерастворимых агрегатов с последующей их денатурацией и переводом в растворимый мономерный аллерген. Перевод осуществляют диализом с использованием кислотного буферного раствора (рН 3,5-6,5), в состав которого может входить гуанидин гидрохлорид, или с использованием растворителя, содержащего цистеин. На основе описанных способов выделяют практически чистый рекомбинантный антиген 5 аллергена осиного яда, который используют в фармацевтической композиции для гипосенсибилизации организма к аллергену осиного яда. Изобретение позволяет получить белок, имеющий пониженную реакционную способность JgE, благодаря чему может применяться в иммунотерапии для лечения аллергии. 4 н. И 4 з.п. ф-лы, 1 ил., 1 табл.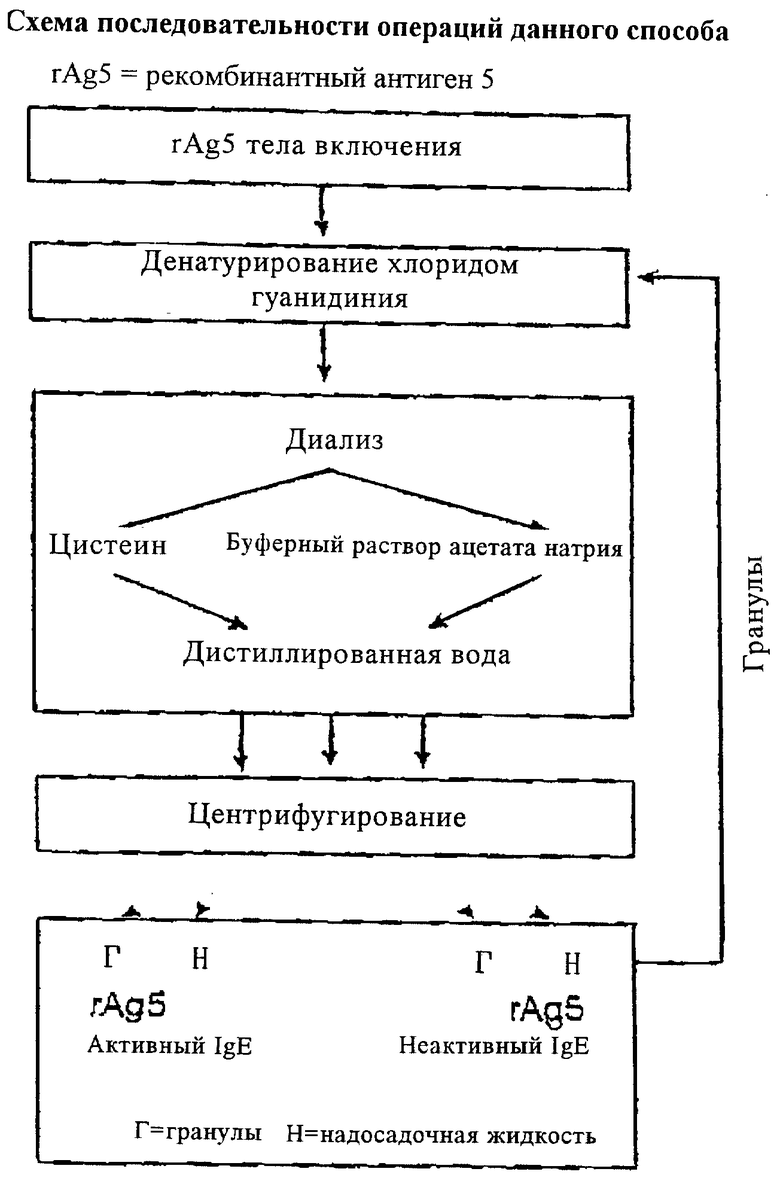
| MONSALVE R.I | |||
| et al | |||
| Expression of recombinant venom allergen, antigen 5 of yellowjacket (Vespula vulgaris) and paper wasp (Polistes annularis), in bacteria and yeast | |||
| Protein Expression and Purification | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| В.А.ФРАДКИН | |||
| Аллергены | |||
| Изд | |||
| Медицина | |||
| - М., 1978, с.167-172. | |||
Авторы
Даты
2005-11-20—Публикация
2000-11-27—Подача