Способ оценки активности эритропоэза относится к биологии, и может быть использован при экспресс-диагностике функционального состояния организма в гематологии и экологии животных, в частности низших позвоночных.
Известные способы определения резистентности эритроцитов к гемолитикам различной природы [1, 2], имеют ряд недостатков: использование в качестве антикоагулянта цитрата натрия может привести к нарушению морфофункциональных характеристик клетки, например эхиноцитозу; требуют больших материальных и временных затрат; при приготовлении эритроцитарной массы может происходить частичное механическое повреждение клеток; кроме того, применение температурной инкубации эритроцитарной массы в одном из способов, приводит к разрушению части клеток, что отражается на результатах исследования.
За прототип выбран наиболее близкий к предлагаемому способ определения функционального состояния организма по стойкости эритроцитарных мембран к гемолитику кислотной природы по скорости гемолиза [3], включающий:
- разведение пробы крови изотоническим раствором хлорида натрия с рН 7,4 в 2001 раз;
- разведение полученной пробы соляной кислотой в объеме 1/20 от разбавленной пробы;
- регистрацию убыли числа клеток (с дискретностью в 1 с) по изменению величины светорассеивания при длинах волн 670-750 нм, против холостой пробы;
- обработку полученных данных с помощью программного обеспечения, включая представление в виде прямых и дифференцированных графиков кинетики кислотного гемолиза, по которым определяют относительное содержание фракций эритроцитов с различной кислотной резистентностью;
- анализ результатов подпрограммой экспертной оценки сравнения полученных величин показателей с нормой.
Однако указанный способ не всегда объективно отражает функциональное состояние эритроцитов, так как о проценте разрушенных клеток судят по величине светорассеивания, изменение значений которой может происходить не только вследствие разрушения клеток, но и их осаждения на дно кюветы (в случае ядерных эритроцитов). Использование в качестве антикоагулянта Трилона Б отражается на достоверности полученных результатов, так как являясь детергентом, он может вступать во взаимодействие с компонентами эритроцитарных мембран, изменяя свойства мембраны, а следовательно и устойчивость клеток. Кроме того, этот способ может давать значительные ошибки при несоблюдении правил приготовления заданной концентрации гемолитика и нарушении изотоничности физиологического раствора, вследствие примесей, содержащихся в хлориде натрия или неудовлетворительной дистилляции воды, что вызывает бактериальное загрязнение раствора и сказывается на скорости гемолиза, а следовательно, интерпретации полученных результатов.
Задачей изобретения является расширение арсенала средств оценки активности эритропоэза.
Для достижения указанного технического результата предлагается в способе, включающем:
- разведение стабилизированной крови (антикоагулянт гепарин или трилон Б) в 2001 раз в изотоническом растворе хлорида натрия (0,85%) с рН 7,4; разделение приготовленной пробы на две части;
- фотометрирование в кювете одной части пробы в диапазоне волн 670-750 нм;
- добавление 1/20 исходного объема 0,1 н. раствора соляной кислоты и измерение убыли оптической плотности через каждую секунду до установления ее постоянного значения;
- инкубирование второй части пробы при комнатной температуре с добавлением 1/20 исходного объема 270 мМ раствора пропранолола и фотометрирование по окончании инкубации в том же режиме;
- оценку функционального состояния организма по прямым и дифференцированным эритрограммам и группам количественных и качественных диагностических показателей;
внести следующие изменения:
- стабилизацию крови производить гепарином в соотношении 0,1 часть антикоагулянта и 1 часть крови;
- готовить опытную и контрольную пробы стабилизированной крови, причем опытную пробу инкубировать в 0,2% растворе хлорида натрия, а контрольную - в 0,65% растворе хлорида натрия в соотношении кровь / инкубационная среда 1:50 в течение часа,
- формировать однослойные препараты из каждой опытной и контрольной проб, в которых через каждые 30 с в течение 10 мин в каждой из двух ортогональных плоскостях регистрировать временную последовательность групп проекций изображений эритроцитов Nk⊥, N0⊥; Nk||, N0||, содержащих по nk⊥, n0⊥; nk||, n0|| - изображений эритроцитов, а затем дополнительно через каждые 10 мин в течение одного часа регистрировать временную последовательность групп проекций изображений эритроцитов Mk⊥, M0⊥; Mk||, M0||, содержащих по mk⊥, m0⊥; mk||, m0|| изображений эритроцитов;
- сохранять полученные изображения временных последовательностей групп проекций изображений эритроцитов Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||;
- измерять габаритные размеры всех эритроцитов Аm - продольная ось эллипса, Вn - поперечная ось эллипса, содержащихся в сохраненных изображениях временных последовательностях групп проекций Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||, принимая клетку как модель эллипсоида вращения в общем случае неасимметричного;
- вычислять по измеренным габаритным размерам эритроцитов соответствующие временные последовательности значений морфометрических индексов для каждой из групп Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||, считая, что каждая из групп регистрировалась в соответствующие моменты времени tm, tn; по формулам:
а) объем: 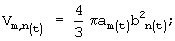
б) толщину: 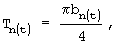 где
где
am=Аm/2 - значение длинной полуоси эллипса,
bn=Bn/2 - значение короткой полуоси эллипса;
- по найденным значениям находить соответствующее значение биометрического индекса для каждой клетки из соответствующей временной группы Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||, по формуле:
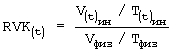
где RVK - регуляторныевозможностиклетки,
V(t)ин/T(t)ин - отношение объема клетки к толщине при инкубации в 0,2% растворе хлорида натрия,
Vфиз/Тфиз - отношение объема клетки к толщине в 0,65% растворе хлорида натрия;
- проводить для каждой временной группы классификацию эритроцитарной популяции на две функциональные группы по рассчитанному значению биометрического индекса RVK:
recytus (рециты) при 0,845<RVK<1,002, (клетки с биометрическим индексом [RVK]t r) (recytus, от лат. re - повторяемость действия) - клетки, способные восстановить исходную форму в условиях гипотонии;
letaliocytus (леталиоциты) при 1,0021<RVK<1,211, (клетки с биометрическим индексом [RVK]t L) (letaliocytus, от лат. letalius) - клетки, неизбежно погибающие в условиях гипотонии;
- оценку активности эритропоэза определяют по временному интервалу, в течение которого происходит переход большей части клеток в класс леталиоцитов, начиная с момента времени, соответствующего началу процедуры инкубации, при этом применяют следующее решающее правило:
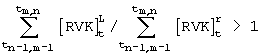
при tm,n≤30 с - затухание эритропоэза,
при 30 с<tm,n≤60 с - равновесное состояние эритропоэза,
при tm,n>60 с - активация эритропоэза.
Отличительными признаками заявленного способа являются:
1) инкубация крови в соотношении 1:50, что позволяет достичь необходимой разряженности клеток в суспензии для их расположения в один слой без наложения друг на друга;
2) регистрация в ортогональных плоскостях временной последовательности групп проекций изображений эритроцитов Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0|| содержащих по nk⊥, n0⊥; nk||, n0||; mk⊥, m0⊥; mk||, m0|| - изображений эритроцитов позволяет измерять габаритные размеры живых клеток, оценивать их целостность или повреждение;
3) использование в качестве гемолитика 0,2% раствора хлорида натрия позволяет проследить реакцию клеток, их поведение при гипотонии без полного разрушения клетки, так как хлорид натрия, в отличие от 0,1 н. раствора соляной кислоты, не повреждает белковую часть бислоя мембраны;
4) наблюдение за процессом нарушения целостности живых клеток в гипотонической среде позволяет точно идентифицировать тени клеток и набухшие клетки;
5) использование анализатора изображений позволяет получать достоверные измерения габаритных размеров изображений клеток, оценивать их морфометрические параметры, динамику их изменения и создавать базу данных для неоднократного использования полученных результатов, что позволяет экономить время исследования;
6) оценка функционального состояния эритропоэза производится по биометрическому индексу RVK, что позволяет классифицировать морфологически однородные популяции клеток для прогноза их поведения в физиологических и экстремальных условиях.
Например, предлагаемый способ может быть использован для биотестирования загрязнения экологических сред обитания низших позвоночных. Так как эритроциты земноводных обладают динамическим старением (регенерация крови происходит очень медленно), то вспышка эритропоэза (его многоочаговость), а следовательно, высокий уровень функциональной гетерогенности эритроцитарной популяции (преобладание леталиоцитов), будет являться показателем кислородного запроса в организме вследствие повышенного загрязнения окружающей среды.
Предлагаемый способ осуществляют следующим образом:
- отбирают периферическую кровь и стабилизируют ее гепарином в соотношении 0,1 часть антикоагулянта и 1 часть крови;
- готовят опытную и контрольную пробы стабилизированной крови, причем опытную пробу инкубируют в 0,2% растворе хлорида натрия, а контрольную - в 0,65% растворе хлорида натрия в соотношении кровь / инкубационная среда 1:50 в течение часа,
- формируют однослойные препараты из каждой опытной и контрольной проб, в которых через каждые 30 с в течение 10 мин в каждой из двух ортогональных плоскостях регистрируют временную последовательность групп проекций изображений эритроцитов Nk⊥, N0⊥; Nk||, N0||, содержащих по nk⊥, n0⊥; nk||, n0|| - изображений эритроцитов, а затем дополнительно через каждые 10 мин в течение одного часа регистрируют временную последовательность групп проекций изображений эритроцитов, Mk⊥, M0⊥; Mk||, M0|| содержащих по mk⊥, m0⊥; mk||, m0| изображений эритроцитов;
- сохраняют полученные изображения временных последовательностей групп проекций изображений эритроцитов Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||
- измеряют габаритные размеры Am и Вn всех эритроцитов, содержащихся в сохраненных изображениях временных последовательностях групп проекций Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||, принимая клетку как модель эллипсоида вращения в общем случае не асимметричного;
- вычисляют для каждого эритроцита временные зависимости их морфометрических индексов (объем, толщина), считая, что каждая из групп регистрировалась в соответствующие моменты времени tm, tn; по формулам:
а) объем: 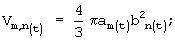
б) толщину: 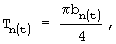 где
где
am=Am/2 - значение длинной полуоси эллипса,
bn=Bn/2 - значение короткой полуоси эллипса;
- рассчитывают соответствующее значение биометрического индекса для каждой клетки из соответствующей временной группы Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||, по формуле:
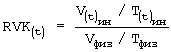 , где
, где
RVK - регуляторные возможности клетки,
v(t)ин/T(t)ин - отношение объема клетки к толщине при инкубации в 0,2% растворе хлорида натрия;
Vфиз/Tфиз - отношение объема клетки к толщине в 0,65% растворе хлорида натрия;
- проводят для каждой временной группы классификацию эритроцитарной популяции на две функциональные группы по рассчитанному значению биометрического индекса:
recytus (рециты) при 0,845<RVK<1,002, (клетки с биометрическим индексом [RVK]t r)
letaliocytus (леталиоциты) при 1,0021<RVK<1,211, (клетки с биометрическим индексом [RVK]t L),
- оценку активности эритропоэза определяют по временному интервалу, в течение которого происходит переход большей части клеток в класс леталиоцитов, начиная с момента времени, соответствующего началу процедуры инкубации, при этом применяют следующее решающее правило:
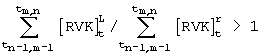
при tm,n≤30 с - затухание эритропоэза,
при 30 с<tm,n≤60 с - равновесное состояние эритропоэза,
при tm,n>60 с - активация эритропоэза.
Пример способа оценки активности эритропоэза лягушки. Отбирают 1 мл периферической крови, которую стабилизируют гепарином в соотношении 0,1 часть антикоагулянта и 1 часть крови; готовят опытную и контрольную пробы стабилизированной крови, причем опытную пробу инкубируют в 0,2% растворе хлорида натрия, а контрольную - в 0,65% растворе хлорида натрия в соотношении кровь / инкубационная среда 1:50 в течение часа. Формируют однослойные препараты из каждой опытной и контрольной проб, в которых через каждые 30 сек в течение 10 минут а затем дополнительно через каждые 10 мин в течение одного часа регистрируют в каждой из двух ортогональных плоскостях регистрируют временную последовательность групп проекций изображений ядерных эритроцитов Nk⊥, N0⊥; Nk||, N0||, Mk⊥, M0⊥; Mk||, M0|| содержащих по nk⊥, n0⊥; nk||, n0||, mk⊥, m0⊥; mk||, m0||; сохраняют полученные изображения, измеряют габаритные размеры Аm и Вn всех ядерных эритроцитов, содержащихся в сохраненных изображениях временных последовательностях групп проекций Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||; вычисляют по измеренным габаритным размерам ядерных эритроцитов всех зарегистрированных групп соответствующие временные последовательности значений морфометрических индексов по формулам:
а) объем: 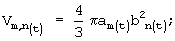
б) толщину: 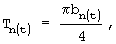 где
где
am=Am/2 - значение длинной полуоси эллипса,
bn=Вn/2 - значение короткой полуоси эллипса.
По найденным значениям находят соответствующее значение биометрического индекса для каждой клетки из соответствующей временной группы Nk⊥, N0⊥; Nk||, N0||; Mk⊥, M0⊥; Mk||, M0||, по формуле:
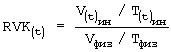
где V(t)ин/T(t)ин - отношение объема клетки к толщине при инкубации в 0,2% растворе хлорида натрия;
Vфиз/Тфиз - отношение объема клетки к толщине в 0,65% растворе хлорида натрия.
Проводят для каждой временной группы классификацию эритроцитарной популяции на две функциональные группы по рассчитанному значению биометрического индекса:
recytus (рециты) при 0,845<RVK<1,002, (клетки с биометрическим индексом [RVK]t r)
letaliocytus (леталиоциты) при 1,0021<RVK<1,211, (клетки с биометрическим индексом [RVK]t L (см. таблицу). Оценку активности эритропоэза лягушки проводят по величине временного интервала, в течение которого происходит переход большей части клеток в класс леталиоцитов, начиная с момента времени, соответствующего началу процедуры инкубации, при этом применяют следующее решающее правило:
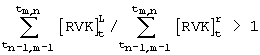
при tm,n≤30 с - затухание эритропоэза,
при 30 с<tm,n≤60 с - равновесное состояние эритропоэза,
при tm,n>60 с - активация эритропоэза
Исследуя кровь лягушки установили, что через 30 сек инкубации соотношение леталиоцитов к рецитам составило 8:22 (RVK<1), соответственно, через 60 с инкубации количество рецитов уменьшилось, но соотношение составило 8:14 (RVK<1), а к 150 с инкубации - 14:9, т.е. выполняется решающее правило (RVK>1). Таким образом, система кроветворения находится в состоянии активации эритропоэза, так как смещение пика на рисунке (повышение процента леталиоцитов над рецитами) относительно равновесного состояния (от 30 до 60 с) наблюдалось на 150 секунде. Смещение пика вправо свидетельствует о наличие более стойких функционально молодых клетках (имеющих достаточный резерв мембранного материала), а следовательно, об активации эритропоэза. В случае смещения пика на 30 с инкубации можно говорить о наличии функционально изношенных или неполноценных клеток (более старых) с ограниченными регуляторными способностями.
Высокая точность предлагаемого способа допускает применение этих диагностических показателей для оценки степени адаптированности животных к условиям среды обитания, а также функциональных резервов организма. Предлагаемый способ технически прост и экономичен. Используя его можно охарактеризовать активность эритропоэза, в частности в гематологии и экологии животных.
Литература
1. Банкова В.В., Юрков Ю.А. Способ определения устойчивости эритроцитов / Патент РФ №1219967.
2. Слобожанина Е.И., Савостьянов В.В., Козлова Н.М., Черницкий Е.А. Способ определения резистентности эритроцитов / Патент РФ №1469464.
3. Голенда И.Л., Голенда А.И., Иванов В.И. и др. Способ определения функционального состояния организма по степени резистентности крови к кислотному гемолизу / Патент РФ №2179315.
Способ оценки активности эритропоэза
Функциональные группы эритроцитарной популяции амфибии, выделенные по биометрическому индексу (RVK)
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ РЕАКТИВНОСТИ ЭРИТРОЦИТОВ КРОВИ | 2007 |
|
RU2350952C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РЕТИКУЛОЦИТОВ В ИНКУБИРОВАННОЙ КРОВИ ПТИЦ | 2002 |
|
RU2227280C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ОРГАНИЗМА ПО СТЕПЕНИ РЕЗИСТЕНТНОСТИ КРОВИ К КИСЛОТНОМУ ГЕМОЛИЗУ | 2000 |
|
RU2179315C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ СУБПОПУЛЯЦИЙ ЭРИТРОЦИТАРНОЙ СИСТЕМЫ | 2002 |
|
RU2234701C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КИСЛОТНОЙ СТОЙКОСТИ ЭРИТРОЦИТОВ | 2003 |
|
RU2242760C2 |
| СПОСОБ ПРОФИЛАКТИКИ ПОВРЕЖДЕНИЯ БИОЛОГИЧЕСКИХ МЕМБРАН | 2013 |
|
RU2549449C2 |
| СПОСОБ ВИЗУАЛИЗАЦИИ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ ПТИЦ НА ОДНОМ МАЗКЕ | 2002 |
|
RU2224235C2 |
| СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ ПУТЕМ ДЕТОКСИКАЦИИ КРОВИ | 2000 |
|
RU2195322C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОСМОТИЧЕСКОЙ СТОЙКОСТИ ЭРИТРОЦИТОВ | 2014 |
|
RU2580300C1 |
| СПОСОБ ДИАГНОСТИКИ МИАСТЕНИИ | 1998 |
|
RU2138811C1 |
Изобретение относится к области биологии. Сущность способа: опытную пробу стабилизированной крови инкубируют 1 ч в 0,2% растворе хлорида натрия, контрольную - в 0,65% растворе NaCl, в соотношении кровь/инкубационная среда 1:50. Из каждой пробы формируют однослойные препараты, в которых через каждые 30 сек в течение 10 мин в каждой из двух ортогональных плоскостях регистрируют временные последовательности групп проекций изображений эритроцитов Nk⊥, N0⊥; Nk||, N0||, содержащие по nk⊥, n0⊥; nk||, n0|| изображений эритроцитов, и сохраняют их. Дополнительно через каждые 10 мин в течение 1 ч регистрируют временные последовательности групп проекций изображений эритроцитов Mk⊥, M0⊥; Mk||, M0||, содержащие по mk⊥, m0⊥; mk||, m0|| изображений эритроцитов, и сохраняют их. Измеряют габаритные размеры Аm и Вn всех эритроцитов, по которым вычисляют значения объема и толщины, и, далее, определяют значения биометрического индекса "RVK" для каждой клетки из соответствующей временной группы, на основании чего эритроцитарную популяцию каждой группы разделяют на рециты и леталиоциты. Активность эритропоэза определяют по времени, за которое происходит переход большей части клеток в класс леталиоцитов, отсчитывая от начала инкубации. При tm,n≤30 с определяют затухание эритропоэза, при 30 с<tm,n≤60 с - равновесное состояние эритропоэза, при tm,n>60 с - активацию эритропоэза. Способ позволяет повысить точность оценки эритропоэза, может быть использован при экспресс-диагностике функционального состояния организма в гематологии и экологии животных, в частности низших позвоночных. 1 з.п. ф-лы, 1 табл., 1 ил.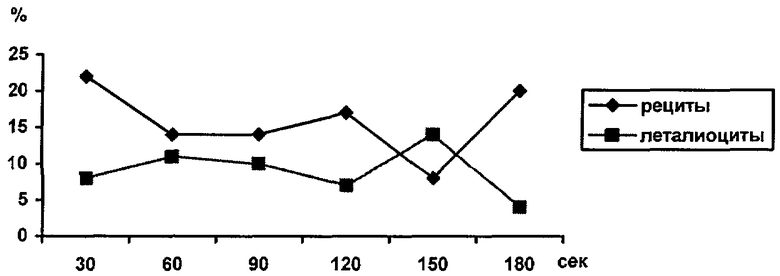
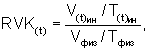
где V(t)ин/T(t)ин - отношение объема клетки к толщине при инкубации в 0,2%-ном растворе хлорида натрия;
Vфиз/Tфиз - отношение объема клетки к толщине в 0,65%-ном растворе хлорида натрия, проводят по рассчитанному значению биометрического индекса для каждой временной группы классификацию эритроцитарной популяции соответствующей временной группы на два функциональных класса:
recytus (рециты) при 0,845<RVK<1,002, (клетки с биометрическим индексом [RVK]tr),
letaliocytus (леталиоциты) при 1,0021<RVK<1,211, (клетки с биометрическим индексом [RVK]t L), а оценку активности эритропоэза определяют по временному интервалу, в течение которого происходит переход большей части клеток в класс леталиоцитов, начиная с момента времени, соответствующего началу процедуры инкубации, при этом применяют следующее решающее правило:
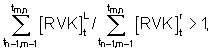
при tm,n≤30 с - затухание эритропоэза;
при 30 с<tm,n≤60 с - равновесное состояние эритропоэза;
при tm,n>60 с - активация эритропоэза.
а) объем:
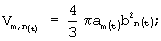
б) толщину:
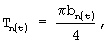
где am=Am/2 - значение длинной полуоси эллипса;
bn=Bn/2 - значение короткой полуоси эллипса.
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ОРГАНИЗМА ПО СТЕПЕНИ РЕЗИСТЕНТНОСТИ КРОВИ К КИСЛОТНОМУ ГЕМОЛИЗУ | 2000 |
|
RU2179315C1 |
| et al | |||
| Quantitative assessment of erythropoiesis and functional classification of anemia based on measurements of serum transferrin receptor and erythropoietin | |||
| Blood | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| СПОСОБ РАДИО - СНОШЕНИЙ | 1924 |
|
SU1067A1 |
Авторы
Даты
2006-01-20—Публикация
2004-04-12—Подача