Изобретение относится к медицине и ветеринарии и может быть использовано для профилактики онкологических заболеваний или инфекций, вызываемых бактериями, грибами и простейшими, или атеросклероза, или сахарного диабета, или заболеваний, связанных с реакцией гиперчувствительности замедленного типа, или заболеваний, развивающихся вследствие мутаций генов соматических клеток.
Перечисленные заболевания являются в совокупности основными причинами, приводящими к инвалидизации и смертности. В настоящее время общепринятой является концепция предпочтительности профилактического вмешательства (предотвращения развития заболевания или его рецидива) по отношению к лечению уже развившегося заболевания или его рецидива. В соответствии с этим интенсивно используются известные и постоянно разрабатываются новые способы лекарственной профилактики развития и рецидивирования перечисленных заболеваний.
Общепризнано, что вакцинация является эффективным и надежным способом профилактики и рецидивирования инфекций, однако эффективные вакцины в настоящий момент удалось создать лишь для профилактики очень ограниченного круга бактериальных, паразитарных и грибковых инфекций, см. G.Ada, A.Ramsey; Vaccines, Vaccination and the Immune Responce; Lippincott-Raven, NY, 1997. В отношении большинства клинически актуальных инфекций единственным способом профилактики в настоящий момент остается способ химиопрофилактики. В качестве примеров можно привести химиопрофилактику широко распространенной инфекции, вызываемой простейшими малярии препаратами хлороквин и мефлоквин, см. Merck Manual of Diagnosis and Therapy; 16th Edition.
Известным способом химиопрофилактики является профилактика антибиотиками и сульфаниламидными препаратами бактериальных инфекций, см. Merck Manual of Diagnosis and Therapy; 16th Edition, а также профилактика грибковых инфекций у больных с иммунодефицитом препаратом Амфотерицин, см. Prophylaxis and treatment of fungal infections associated with haematological malignancies. Sibel Ascioglu et.al., International Journal of Antimicrobial Agents, Volume 15, Issue 3, July 2000, Pages 159-168.
Основным способом лекарственного лечения атеросклероза является терапия препаратами группы статинов - ингибиторами 3-гидрокси-3-метилглютарил коэнзим A(HMGCoA) редуктазы (Ловастатин, Парвастатин и др.), подавляющих синтез холестерина в организме и приводящих к ускорению клиренса липопротеинов низкой плотности из плазмы крови, что замедляет развитие атеросклероза, см. New Concepts and Paradigms in Cardiovascular Medicine: The Noninvasive Management of Coronary Artery Disease, K. Lance Gould, THE AMERICAN JOURNAL OF MEDICINE, Volume 104, June 22, 1998, 2s-17s.
Лекарственные способы первичной профилактики онкологических заболеваний с доказанной эффективностью (за исключением способов первичной профилактики редких специфических форм раковых заболеваний) не разработаны (Enzyme Induction and Dietary Chemicals as Approaches to Cancer Chemoprevention: The Seventh DeWitt S. Goodman Lecture. Allan H. Conney, Cancer Research, vol.63, pp.7005-7031, November 1, 2003). Для предотвращения рецидивирования онкологических заболеваний широко используются способы, основанные на противоопухолевой химиотерапии, иммунотерапии и гормонотерапии, см. Adjuvant treatment for colorectal cancer.,Van Laethem JL, Acta Gastroenterol Beig 2001 Jul-Sep 64: 263-7; Adjuvant therapy for breast cancer patients: treatment decision tree from a French cancer network, Bachelot T, et.al., Bull Cancer, 2002, Oct 89: pp.897-903, используемые в так называемом "адъювантном режиме".
Лекарственных способов профилактики диабета с доказанной эффективностью также не существует. Известны попытки осуществлять профилактику диабета I типа в группах высокого риска с помощью инсулинотерапии, см. Effects of insulin in relatives of patients with type 1 diabetes mellitus., New Engi J Med 2002 May 346: pp.1685-91, и диабета II типа в группах высокого риска препаратами бигуанидов, см. Metfbrmin & lifestyle intervention prevent Type 2 diabetes: lifestyle intervention has the greater effect., Doggrell SA, Expert Opin Pharmacother, 2002, Jul 3: pp.1011-3.
Наиболее распространенным способом профилактики реакций, связанных с гиперчувствительностью замедленного типа, является способ, основанный на терапевтической иммуносупрессии препаратом циклоспорин, см. Therapeutic Immunosupression, ed. A.W.Thomson, Ser. Immunology and Medicine vol.29, Kluwer Acad. Publishers, Dordrecht, 2001.
He существует способов лекарственной профилактики заболеваний, развивающихся вследствие мутаций генов соматических клеток. (Youssoufian H, Pyeritz RE. Mechanisms and Consequences of Somatic Mosaicism in Humans, Nature Reviews Genetics, 2002; 3:748-758).
Анализируя лечебные свойства известных способов профилактики рассматриваемых нами заболеваний, можно выделить следующие основные их недостатки:
1. Рассмотренные способы проявляют токсичность или вызывают развитие осложнений (Адъювантная химиотерапия опухолевых заболеваний, терапевтическая иммуносупрессия циклоспорином, профилактика препаратами статинов).
2. Рассмотренные способы недостаточно эффективны или теряют свою эффективность в процессе длительного применения (инсулинопрофилактика, бигуаниды, статины, противоопухолевые препараты, средства химиопрофилактики инфекций, противоопухолевые препараты, циклоспорин).
3. Рассмотренные способы проявляют активность внутри узкого круга заболеваний или даже в отношении отдельных форм одного и того же заболевания.
В настоящее время отсутствуют какие-либо способы, которые позволяли бы осуществить профилактику указанных выше заболеваний в комплексе, а также предотвращать их рецидивы. В связи с этим отсутствует возможность принять какое-либо известное техническое решение за прототип настоящего изобретения.
В основу всех вариантов настоящего изобретения положено решение задачи создания нетоксичного и эффективного способа для длительного профилактического и противорецидивного применения при заболеваниях, сопровождающихся изменениями качественного и/или количественного состава внеклеточной ДНК крови, а именно: онкологических заболеваний, инфекций, вызываемых бактериями, грибами и простейшими, атеросклероза, сахарного диабета, аллергических заболеваний, связанных с реакцией гиперчувствительности замедленного типа, заболеваний, развивающихся вследствие мутаций генов соматических клеток.
Согласно первому варианту изобретения эта задача решается за счет того, что в кровь вводят агент, разрушающий внеклеточную ДНК крови; агент, разрушающий внеклеточную ДНК крови, может вводиться пожизненно; в качестве агента, разрушающего внеклеточную ДНК крови, может использоваться фермент ДНКаза;
согласно второму варианту изобретения эта задача решается путем введения в кровь агента, связывающего внеклеточную ДНК крови; в качестве агента, связывающего внеклеточную ДНК крови, могут быть использованы анти-ДНК антитела;
согласно третьему варианту изобретения эта задача решается путем введения в кровь фермента, изменяющего химическую структуру внеклеточной ДНК крови;
согласно четвертому варианту изобретения эта задача решается путем введения в кровь агента, стимулирующего синтез и/или активность эндогенной дезоксирибонуклеазы, или агента, стимулирующего синтез антител, связывающих внеклеточную ДНК крови.
Развитие и рецидивирование рассматриваемых заболеваний сопровождается качественными и количественными изменениями внеклеточной ДНК крови, однако в известных заявителю источниках отсутствуют знания о генетическом репертуаре внеклеточной ДНК крови больных при рассматриваемых заболеваниях, биологической роли внеклеточной ДНК крови при рассматриваемых заболеваниях и возможном терапевтическом эффекте ее уничтожения для профилактики развития и рецидивирования этих заболеваний.
Как установили заявители, внеклеточная ДНК крови больных при рассматриваемых заболеваниях содержит уникальный по своему качественному и количественному составу репертуар генов и регуляторных генетических элементов, резко отличающийся от репертуара ДНК, описанного в геноме человека. В отличие от внутриклеточной ДНК, внеклеточная ДНК крови больных рассматриваемыми заболеваниями содержит, в основном, уникальные гены человека. Установлено наличие бактериальной внеклеточной ДНК и внеклеточной ДНК грибов в составе матрикса биопленок и в плазме крови инфицированного человека.
Установлено, что внеклеточная ДНК крови, включая внеклеточную ДНК бактерий, грибов и паразитов, при рассматриваемых заболеваниях способствует их развитию и рецидивированию.
Установлено, что разрушение, а также модификация и связывание внеклеточной ДНК крови при рассматриваемых заболеваниях приводит к профилактическому и противорецидивному эффектам.
Указанные выше новые свойства заявленного изобретения, базирующиеся на принципиально новых представлениях о роли внеклеточной ДНК плазмы крови в развитии рассматриваемых заболеваний и их рецидивировании, позволяют сделать вывод о соответствии заявленного способа критерию "изобретательский уровень".
Заявленный способ реализуется следующим образом.
Материалы и методы.
В первом варианте в качестве агента, разрушающего ДНК, использовалась бычья панкреатическая ДНКаза (Sigma), бычья панкреатическая ДНКаза (Самсон-Мед) и рекомбинантная человеческая ДНКаза I (Дорназа; Genetech). Раствор ДНКазы для введения готовился растворением матричного раствора ДНКазы в стерильном фосфатном буфере непосредственно перед введением.
Во втором варианте в качестве агента, связывающего ДНК, использовали антитела против ДНК, выделяемые из крови больных системной красной волчанкой по методике Shuster A.M. (Shuster A.M. et.al., Science, v.256, 1992, pp.665-667). Подобные анти-ДНК антитела способны не только связывать, но и осуществлять гидролиз ДНК.
В третьем варианте в качестве агента, изменяющего ДНК, использовали бактериальную Sss I Метилазу (CpG Methylase), (New England Biolabs).
В четвертом варианте в качестве агента, стимулирующий синтез и/или активность эндогенных биополимеров, связывающих, или разрушающих, или модифицирующих химический состав, и/или конформацию, и/или полимерность внеклеточной ДНК крови без ее разрушения, использовали антиG-f актин антитела (Calbiochem). G-Актин является ингибитором активности эндогенной ДНКазы I. Связывание актина антителами увеличивает активность эндогенной ДНКазы I.
ДНК плазмы крови выделяли следующим образом: свежую (не более 3-4 часов после забора) плазму крови с добавленным антикоагулянтом (цитрат натрия) откручивали на подушке из Ficoll-Plaque Plus (Amersham-Pharmacia) при 1500 g 20 минут при комнатной температуре. Плазму (1/2 от всего количества) аккуратно отбирали, не задевая остаток клеток на подушке фиколла, и откручивали при 10000 g 30 минут, чтобы избавиться от обломков клеток и дебриса. Супернатант отбирали, не затрагивая осадок, добавляли до 1% саркозила, до 50 мМ трис-HCl, рН 7,6, до 20 мМ ЭДТА, до 400 мМ NaCl и равный объем смеси фенол-хлороформ 1:1. Полученную эмульсию инкубировали при 65°С 2 часа, затем отделяли фенол-хлороформ центрифугированием при 5000 g в течение 20 минут при комнатной температуре. Процедуру депротеинизации фенол-хлороформом повторяли идентичным способом трижды, после чего водную фазу обрабатывали хлороформом, затем диэтиловым эфиром. Отделение от органических растворителей производили центрифугированием при 5000 g в течение 15 минут. К полученной водной фазе добавляли равный объем изопропанола и инкубировали в течение ночи при 0°С. После осаждения нуклеиновые кислоты отделяли центрифугированием при 0°С, 10000 g в течение 30 минут. Осадок нуклеиновых кислот растворяли в буфере, содержащем 10 мМ трис-HCl, рН 7,6, 5 мМ ЭДТА, и наносили на подушку из ступенчатого хлористого цезия (1 М, 2.5 М, 5.7 М) в центрифужной пробирке для ротора SW60Ti. Объем ДНК составлял 2 мл, объем каждой ступеньки CsCl - по 1 мл. Ультрацентрифугирование проводили в приборе L80-80 (Beckman) 3 часа при 250000 g. ДНК отбирали с поверхности ступеньки 5.7М по фракциям. Фракции диализировали 12 часов при 4°С. Наличие ДНК во фракциях определяли агарозным электрофорезом с визуализацией ДНК бромистым этидием. Количество ДНК определяли спектрофотометрически (Beckman DU70) в кювете объемом 100 мкл, снимая спектр от 220 до 320 нм.
Реализация способа поясняется примерами.
Пример 1. Профилактика рецидивирования злокачественной опухоли.
Антитела против ДНК выделяли из крови больных системной красной волчанкой по методике Shuster A.M. (Shuster A.M. et.al., Science, v.256,1992, pp.665-667). Подобные анти-ДНК антитела способны не только связывать, но и осуществлять гидролиз ДНК.
Группа 1 - 10 мышей с привитой карциномой Эрлиха (контроль). На 10-й день после перевивки опухоли мыши получили однократную внутрибрюшинную инъекцию циклофосфана в дозе 200 мг/кг.
Группа 2 - 10 мышей с привитой карциномой Эрлиха. На 10-й день после перевивки опухоли мыши получили однократную внутрибрюшинную инъекцию циклофосфана в дозе 200 мг/кг. На 15-й день после перевивки опухоли мыши получали внутривенную инъекцию фракции человеческих анти-ДНК антител (IgG) по 200 мкг на одно животное.
Группа 3 - 10 мышей с привитой карциномой Эрлиха. На 10-й день после перевивки опухоли мыши получили однократную внутрибрюшинную инъекцию циклофосфана в дозе 200 мг/кг. На 15-й день после перевивки опухоли мыши получали внутривенную инъекцию фракции неспецифического человеческого иммуноглобулина (IgG) по 200 мкг на одно животное.
Группа 4 - 10 мышей с привитой карциномой Эрлиха. На 10-й день после перевивки опухоли мыши получили однократную внутрибрюшинную инъекцию циклофосфана в дозе 200 мг/кг. На 15-й день после перевивки опухоли мыши получали еще одну внутрибрюшинную инъекцию циклофосфана в дозе 200 мг/кг.
Противорецидивный эффект связывания внеклеточной ДНК крови определяли по выживаемости животных на 30-й день после перевивки опухоли. В первой и третьей и четвертой группах все животные погибли. Во второй группе в живых осталось 50% животных.
Таким образом, применение агента, связывающего внеклеточную ДНК плазмы крови, приводит к замедлению рецидивирования злокачественной опухоли согласно заявляемому способу. Эффективность связывания внеклеточной ДНК крови превосходит эффективность противорецидивного повторного курса химиотерапии циклофосфаном.
Пример 2. Профилактика рецидивирования злокачественной опухоли.
Больная 57 лет. Два года назад была выявлена карцинома легкого в IV стадии с метастазами в кости и головной мозг. Больная получила 2 курса химиотерапии таксолом, однако вследствие отсутствия реакции опухоли и выраженной токсичности отказалась от продолжения химиотерапевтического лечения. Больной была осуществлена пневмэктомия, и она была выписана под наблюдение районного онколога. Через 3 месяца у больной появились симптомы компрессии верхней полой вены. При повторной госпитализации был выявлен рецидив опухоли в области культи бронха. От радиологического и химиотерапевтического лечения больная отказалась. С согласия больной ей были прописаны внутримышечные инъекции бычьей панкреатической ДНКазы в дозе 400 мг в сутки (по 2 инъекции в сутки; 2000 ЕД Кунца на 1 мг). Больная была выписана. В течение последующих 2 месяцев постепенно исчезла симптоматика компрессии верхней полой вены. Самочувствие больной улучшилось. При контрольных визитах через 3, 6 и 12 месяцев - отсутствие клинических и рентгенологических признаков прогрессирования заболевания.
Уменьшение содержания внеклеточной ДНК крови (ВДНКК) (нг/мл) больной до начала противорецидивного курса согласно заявляемому способу, через 2, 3, 6 и 12 месяцев после начала противорецидивного курса отражено на графике (фиг.1).
Таким образом, применение ДНКазы согласно заявляемому способу оказывает противорецидивный эффект при злокачественной опухоли.
Пример 3. Профилактика развития аутоиммунного диабета.
Диабет у NOD мышей возникает вследствие развития аутоиммунного поражения в-клеток поджелудочной железы. Мыши 1-й группы (10 самок линии NOD) в возрасте 6 недель получали внутримышечные инъекции дорназы-альфа (Genentech) в дозе 500 мкг/кг (4 раза в день) на протяжении 4 недель. Мыши 2-й группы (10 самок линии NOD) получили внутривенные инъекцию фракции человеческих анти-ДНК антител (IgG) по 200 мкг на мышь в возрасте 6, 7, 8, 9 и 10 недель. 10 мышей контрольной 3-й группы получали четырехкратные внутримышечные инъекции фосфатного буфера с 6 по 10 неделю. Начиная с 15 недели раз в три дня измеряли уровень глюкозы в крови мышей. В случае если уровень глюкозы превышал 250 мг/дл при двух последующих измерениях, констатировалось наличие диабета. Оценивали количество заболевших к 15, 18, 24 и 28 неделе мышей.
Результаты приведены в таблице 1.
Соотношение здоровых и больных мышей (Первая цифра - число здоровых животных в группе; вторая цифра - число больных животных в группе):
Таким образом, разрушение и связывание внеклеточной ДНК плазмы крови оказывает профилактический эффект при развитии аутоиммунного диабета.
Пример 4. Влияние различных способов разрушения связывания и модификации внеклеточной ДНК на ее патогенные свойства.
Мыши С57В1 получили прививку высокометастатического или низкометастатического штамма опухоли LLC. На 9 день после перевивки животных усыпляли и собирали суммарную плазму крови мышей. Суммарная фракция внеклеточной ДНК крови после выделения хранилась при -20°С в фосфатном буфере.
В эксперименте участвовало 7 групп мышей, привитых низкометастатическим штаммом LLC.
Группа 1 - 6 мышей с привитым низкометастатическим штаммом LLC.
Группа 2 - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции внеклеточной ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворялись в 500 мкл свежей гепаринизированой крови).
Группа 3 - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей плазмы). Перед введением образец ДНК подвергали фотохимической дезинфекции (добавление 1 мкМ метиленового синего с последующим облучением красным светом в течение 10 минут (˜60000 Люкс).
Группа 4 - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей плазмы). Перед введением образец ДНК смешивали с 10 мкг анти-ДНК антител.
Группа 5 - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей гепаринизированной крови). Перед введением в образец добавляли 1 мкг фрагмента А растительного токсина Рицина и инкубировали 1 час при 37°С. Рицин является представителем семейства RIP (белки инактивирующие рибосомы) токсинов, широко используемых для создания иммунотоксинов. Кроме способности инактивировать рибосомы эти белки обладают способностью деаденилировать ДНК. Для реализации токсического эффекта каталитическая единица А токсинов RIP II типа должна быть доставлена в клетку субъединицей В. В отсутствие субъединицы В цепь А не токсична, однако полинуклеотид-аденингликозидазная активность цепи А может быть использована для инактивации ДНК, циркулирующей в плазме.
Группа 6 - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей гепаринизированой крови. Образец ДНК перед введением подвергался ферментативному метилированию (I.Muiznieks et.al., FEBS Letters, 1994, v.344, pp.251-254).
Группа 7 - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции внеклеточной ДНК мышей, привитых низкометастатическим штаммом LLC.
8 группа - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей гепаринизированой крови. Образец ДНК перед введением инкубировали в присутствии 200 нг/мл дорназы-альфа 30 минут при 37°С.
Оценивали количество метастатических узлов в легких на 15 день после перевивки.
Результаты эксперимента приведены в таблице 2.
Таким образом, внеклеточная ДНК крови мышей с высокозлокачественным штаммом опухоли усиливает метастазирование менее злокачественной опухоли. Разрушение, связывание и модификация внеклеточной ДНК крови препятствуют этому согласно заявляемому способу.
Пример 5. Профилактика экспериментального атеросклероза.
В эксперименте использовали 18 белых беспородных крыс возрасте 20 месяцев. Под общей анестезией левая наружная сонная артерия канюлировалась эмболоэктомическим катетером и наносилась механическая травма эндотелия общей сонной артерии. В течение последующих 6 дней 6 контрольных крыс получали 4 внутримышечные инъекции фосфатного буфера, 6 крыс в 1 группе получали внутримышечные инъекции дорназы-альфа, а 6 крыс во 2 группе получили 2 внутривенных инъекции анти-ДНК антител в дозе 600 мкг (в первый и третий день после операции).
На 12-й день поврежденные сонные артерии удалялись, фиксировались в формалине и парафинизировались. При серийном анализе гистологических срезов анализировалась интенсивность субэндотелиальных изменений в зоне нанесенной механической травмы. У мышей 1-й и 2-й групп общая площадь сформировавшийся "неоинтимы" была в среднем соответственно на 60% и 40% меньше по сравнению с животными контрольной группы.
Таким образом, разрушение и связывание и модификация внеклеточной ДНК крови препятствуют развитию "ранних" атеросклеротических изменений согласно заявляемому способу.
Пример 6. Профилактика бактериальной и грибковой инфекции.
В эксперименте использовали белых беспородных мышей весом 23-25 грамм.
1 группа (30 мышей) - мышам вводили в ретроорбитальный синус бактерии патогенного штамма Staphylococcus aureus VT-2003R в дозе 1×1010 бактериальных клеток на мышь. Рекомбинантная дорназа-альфа (Geneyech) вводилась в дозе 500 мкг/кг внутрибрюшинно через 2, 6, 10 и 14 часов после инфицирования.
2 группа (10 мышей) - мышам вводили в ретроорбитальный синус бактерии патогенного штамма Staphylococcus aureus VT-2003R в дозе 1×1010 бактериальных клеток на мышь. Фосфатный буфер вводился внутрибрюшинно через 2, 6, 10 и 14 часов после инфицирования.
После последнего введения дорназы из 24 мышей 1 группы были выделены подгруппы 1а и 1б.
Подгруппа 1а (8 мышей) - через 2 часа после последнего введения дорназы мышам вводили внутривенно внеклеточную ДНК крови (0,1 мкг на мышь), полученную от мышей, инфицированных Staphylococcus aureus VT-2003R в дозе 1×1010 бактериальных клеток на мышь через 15 часов после введения бактерий в ретроорбитальный синус.
Подгруппа 1в (8 мышей) - через 2 часа после последнего введения дорназы мышам ввели внутривенно внеклеточную ДНК крови (0,1 мкг на мышь) полученную от мышей, инфицированных Candida Albicans в дозе LD50 на мышь, через 3 дня после внутривенного введения грибов.
Оценивали выживаемость животных через 32 часа после инфицирования.
Результаты приведены в таблице 3.
Выживаемость мышей в различные сроки после инфицирования:
3 группа (10 мышей) - мышам вводили внутривенно грибы, субкультивированные из патогенного клинического изолята Candida Albicans, в дозе LD50. Рекомбинантная дорназа-альфа (Geneyech) вводилась в дозе 1 мг/кг внутрибрюшинно дважды в день на 2, 3 и 4 день после инфицирования.
4 группа (10 мышей) - мышам вводили внутривенно грибы субкультивированные патогенного клинического изолята Candida Albicans в дозе LD50. Амфотерицин В вводился в дозе 20 мкг/кг внутрибрюшинно дважды в день на 2, 3 и 4 день после инфицирования.
5 группа (10 мышей) - мышам вводили внутривенно грибы субкультивированные, полученные из патогенного коинического изолята Candida Albicans, в дозе LD50. В качестве негативного контроля вводился фосфатный буфер внутрибрюшинно дважды в день на 2, 3 и 4 день после инфицирования.
Оценивали выживаемость и массу мышей на 7 день после инфицирования.
Результаты приведены в таблице 4.
Выживаемость мышей в различные сроки после инфицирования:
В группе 4 на 7 день вес животных составлял в среднем на 20% меньше, чем в 3 группе. Это свидетельствует о том, что при равной защитной эффективности дорназы-альфа и амфотерицина В последний проявлял большую токсичность.
Таким образом, внеклеточная ДНК крови инфицированных животных оказывает усиливающее влияние на течение инфекционного процесса, а ее разрушение согласно заявляемому методу оказывает профилактический эффект как при бактериальной так и при грибковой инфекции.
Пример 7. Профилактика аутоиммунного диабета и злокачественных опухолей.
В эксперименте использовали 20 самок мышей линии NOD и 20 самок мышей линии С3Н.
Диабет у NOD мышей возникает вследствие развития аутоиммунного поражения в-клеток поджелудочной железы. Мыши 1-й группы (10 самок линии NOD) получили внутривенные инъекцию фракции мышиных антиG-f актин антител (Calbiochem) по 200 мкг на мышь в возрасте 6, 7, 8, 9 и 10 недель. 10 мышей контрольной 3-й группы получали четырехкратные внутримышечные инъекции фосфатного буфера с 6 по 10 неделю. Начиная с 15 недели раз в три дня измеряли уровень глюкозы в крови мышей. В случае если уровень глюкозы превышал 250 мг/дл при двух последующих измерениях, констатировалось наличие диабета. Оценивали количество заболевших к 15, 18, 24 и 28 неделе мышей
Результаты приведены в таблице 5.
Соотношение здоровых и больных мышей (Первая цифра - число здоровых животных в группе; вторая цифра - число больных животных в группе):
Опухоли индуцировали путем внутрикожной инъекции 3-метилхолантрена (1 мг 3-метилхолантрена, растворенного в 50 мкл оливкового масла, на мышь) в четырехнедельном возрасте. Оценивали количество мышей с развившимися опухолями на 10 неделе после введения канцерогена.
Мыши 3-й группы (10 самок линии СЗН) получили внутривенные инъекции фракции мышиных антиG-f актин антител по 200 мкг на мышь в возрасте 5, 6, 7, 8, 9 и 10 недель.
Мыши 4-й группы (10 самок линии С3Н) получали внутривенные инъекции фосфатного буфера в возрасте 5, 6, 7, 8, 9 и 10 недель.
Определяли наличие опухолей у животных в возрасте 14 недель.
Результаты приведены в таблице 6.
Соотношение здоровых и больных мышей (Первая цифра - число здоровых животных в группе; вторая цифра - число больных животных в группе):
Таким образом, подавление активности собственных ингибиторов эндогенной ДНКазы I оказывает профилактический эффект при развитии аутоиммунного диабета и рака.
Пример 8. Предотвращение распространения мутантного гена. Ряд заболеваний человека возникают вследствие развития состояния соматического мозаицизма - экспансии мутантного гена в популяции соматических клеток (Youssounan H, Pyeritz RE. Mechanisms and Consequences of Somatic Mosaicism in Humans. Nature Reviews Genetics 2002; 3: 748-758).
В качестве модели развития соматического мозаицизма была изучена частота мутаций гена HPRT в Т-лимфоцитах крови. Человеческий HPRT ген (Хромосома Xq26) кодирует конститутивно экспрессируемый, но не эссенциальный фермент, вовлеченный метаболизм пуриновых оснований. Клонирование проводили по методике, описанной Bigbee W (Bigbee W. Et al., Mutation Res., 1998, v.397, pp.119-136). Клонированию подвергались лимфоциты периферической крови 8 больных, получавших курс трехнедельной иммуностимулирующей терапии препаратом Неовир после хирургического удаления опухоли. Из 8 больных 4 пациента дополнительно получали терапию человеческой рекомбинантной ДНКазой I(Genetech) (200 мкг/кг внутривенно, 4 раза в сутки в течение 3 недель). Частота встречаемости HPRT-дефицитных клонов в крови больных, получавших терапию ДНКазой I, в среднем была в 3 раза ниже таковой в крови больных, получавших только иммуностимулирующую терапию. Добавление внеклеточной ДНК крови больных, не получавших ДНКазу, в культуральную среду при клонировании Т-лимфоцитов больных, получавших терапию ДНКазой, повышает частоту встречаемости HPRT-дефицитных клонов при клонировании последних.
Таким образом, разрушение внеклеточной ДНК крови больного ферментом ДНКазой снижает частоту встречаемости мутантного гена в популяции и препятствует развитию соматического мозаицизма согласно заявляемому способу.
Пример 9.
Профилактка рецидивирования болезни Маркиафавы-Микели
Болезнь Маркиафавы-Микели - очень редкое заболевание, связанное с наличием соматической генной мутации в локусе гена PI (phosphatidyl glycan class А).Больная О., 17 лет, страдает данным заболевание в течение 3 лет. В течение последних 2 лет заболевание удавалось компенсировать приемом глюкокортикостероидных гормонов. В течение последнего года вновь появились и стали интенсивно прогрессировать симптомы заболевания: эпизоды гемолиза (2-3 раза в месяц), гемоглобинурии, гепатоспленомегалия, макроцитоз, анизоцитоз. Было произведено 4 гемотрансфузии. Четыре месяца назад у больной развился эпизод острой почечной недостаточности (креатинин - 8,2 мг/дл) вследствие интенсивного эпизода внутрисосудистого гемолиза на фоне перенесенной гнойной ангины. В течение недели больной проводились процедуры гемодиализа. После компенсации функции почек с согласия больной ей были прописаны еженедельные инфузии человеческих донорских ДНК абзимов, выделенных у больных системной красной волчанкой, в разовой дозе 500 мг (1, 2, 3 и 4 недели). В течение этого месяца наблюдался только один пароксизм заболевания (2 неделя) значительно меньшей интенсивности, чем предыдущий. Криз был легко купирован трехдневным курсом преднизолона в дозе 50 мг в сутки. На 5 неделе больной были прописаны ежедневные однократные внутримышечные инъекции ДНКазы I в дозе 2000000 ЕД Кунца в сутки. В течение последующих трех месяцев наблюдения у больной нормализовалась формула крови, исчезла желтушность и гепатоспленомегалия. Пароксизмы заболевания не повторялись (см. фиг.2).
Пример 10. Профилактика прогрессирования одонтогенной инфекции мягких тканей
В исследование включали больных одонтогенными абсцессами и флегмонами мягких тканей, поступавших в клинику челюстно-лицевой хирургии. При поступлении состояние больных оценивали по шкале М.М.Соловьева. Пациенты, имеющие индекс Соловьева от 91 до 159 баллов, имеют 50% вероятность прогрессирования инфекции после начала лечения. Всего для исследования было отобрано 25 больных, имевших индекс Соловьева от 91 до 159 баллов. В контрольную группу, получавшую стандартное хирургическое пособие и антибиотикотерапию, было включено 15 больных. В опытную группу, получавшую дополнительно внутримышечно ДНКазу I в суточной дозе 1020000 ЕД. Кунца, было включено 10 больных. На третий день после начала лечения в контрольной группе у 7 больных была констатирована локальная диссеминация инфекции. Из 10 больных опытной группы ни у одного локальной диссеминации инфекции не произошло.
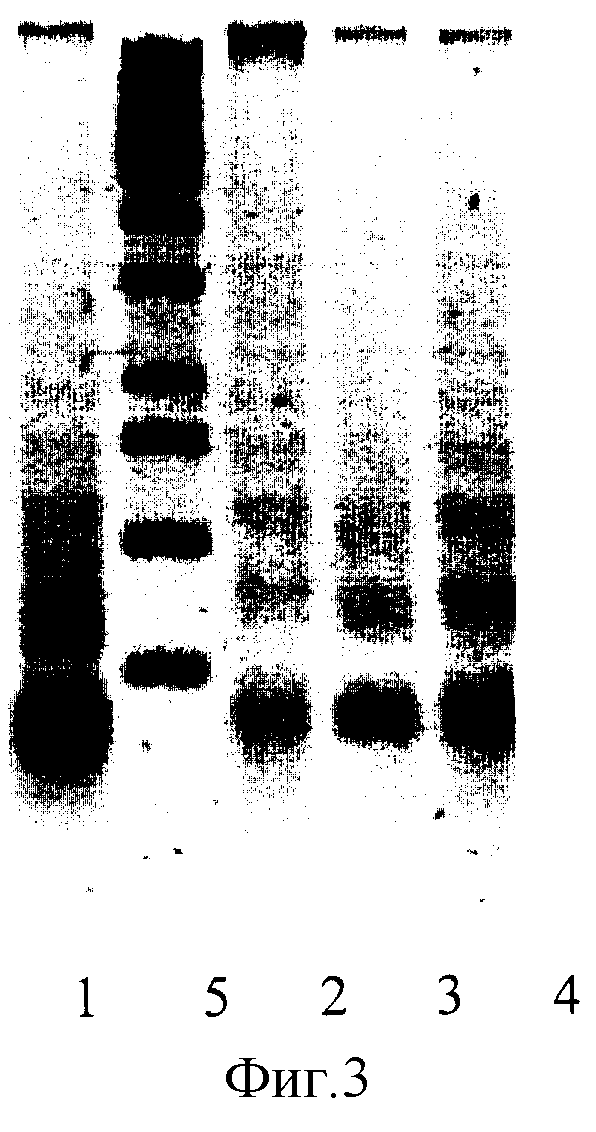
Элетрофорез внеклеточной ДНК крови больных с одонтогенной инфекцией мягких тканей на 3 день от начала лечения (на фиг.3).
Полоса 1 - Больной из контрольной группы с локальной диссеминацией
Полоса 2 - Больной из опытной группы
Полоса 3 - Больной из опытной группы
Полоса 4 - Больной из опытной группы
Полоса 5 - Маркеры молекулярной массы
Профилактика прогрессирования злокачественных опухолей.
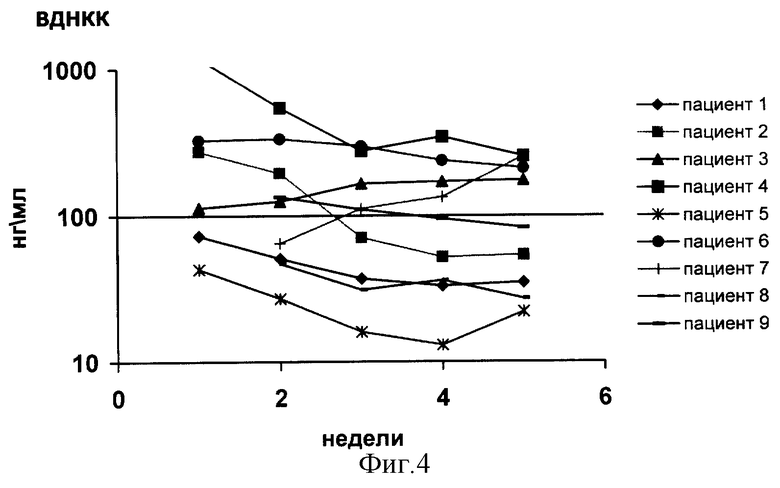
В исследование включили 9 больных различными формами злокачественных опухолей (рак молочной железы - 2; рак желудка - 3; рак легкого - 4), поступивших в клинику торакальной хирургии после предыдущего неэффективного химиолучевого лечения. У всех больных на момент начала лечения имелись признаки быстрого роста метастазов (по данным повторных компьютерных томограмм). Все больные получили 30-дневный курс лечения ДНКазой I ежедневно внутривенно в виде шести 30-минутных инфузий в сутки в суточной дозе 2100000 единиц Кунца. При последующем контрольном компьютерно-томографическом исследовании лишь у двух больных было выявлено прогрессирование заболевания. У этих же больных выявлялось нарастание количества внеклеточной ДНК крови и определялись высокие титры антител к ДНКазе I. У всех остальных больных произошло отчетливое снижение уровня внеклеточной ДНК крови (фиг.4).
Титры антител к дезоксирибонуклеазе у пациентов 3 и 7
Пример 12.
Профилактика прогрессирования сахарного диабета и атеросклероза
В продолжающееся исследование включено 10 больных с установленным диагнозом диабета 2 типа. Все больные ранее были переведены на лечение рекомбинантным человеческим инсулином длительного действия в связи с невозможностью обеспечить нормогликемию с помощью оральных противодиабетических средств. Средний возраст больных составил 54 года. Средняя длительность заболевания от момента постановки диагноза составила 4,5 года. Пятерым больным опытной группы были прописаны внутримышечные инъекции бычьей панкреатической ДНКазы в дозе 200 мг в сутки (две инъекции в сутки) на протяжении 6 месяцев. Исследовали содержание гликозилированного гемоглобина в крови, индекс атерогенности липопротеидов крови (как показатель активности атерогенеза; известно, что сосудистые осложнения диабета закономерно возникают вследствие быстро развивающегося атеросклероза крупных артерий). Вычисляли суточную потребность в инсулине (как показатель активности основного заболевания).
Результаты опыта приведены в Таблице 8
Эффект лечения ДНКазой на метаболические показатели в группе пациентов, получавших лечение по заявляемому способу.
Двум больным опытной группы до начала исследования была произведена перфузионная сцинтиграфия миокарда с таллием 201 в связи с подозрением на коронарный атеросклероз и "безболевую" форму ишемической болезни сердца. У обеих больных были выявлены диффузно-очаговые зоны с нарушенным накоплением радиофармпрепарата, свидетельствующие о наличии коронарного атеросклероза. Больным была прописана стандартная терапия (бета-блокаторы + нитраты). По завершении исследования больные были направлены на повторную перфузионная сцинтиграфию миокарда. В динамике отмечено улучшение картины накопления радиофармпрепарата в миокарде, свидетельствующее об улучшении кровотока в бассейне коронарных артерий.
Пример 13.
Профилактика рецидивирования злокачественных опухолей В сентябре - октябре 2003 года в клинике торакальной хирургии трем больным (2 мужчин в возрасте 47 и 55 лет и одной женщине в возрасте 51 года) с диагнозом рака легкого в стадии T4N2M+ были произведены паллиативные операции удаления пораженного легкого с иссечением одиночных метастатических узлов в противоположном легком. Все больные ранее получали химиотерапевтическое и лучевое лечение. После операции всем больным с их согласия были прописаны ежедневные внутримышечные инъекции депонированной пролонгированной ДНКазы в дозе 5000000 Единиц Кунца в сутки. К настоящему моменту (срок наблюдения - 10 месяцев, контрольные обследования через каждые 2 месяца) ни у одного из наблюдаемых больных не обнаружено признаков рецидивирования рака легкого. В то же время данные ретроспективного контроля свидетельствуют о том, что вероятность развития рецидива к данному сроку и в данной клинической ситуации приближается к 100%.
Пример 14. Профилактика бактериемии.
В исследование было включено 10 больных, обратившихся в стоматологическую клинику по поводу острой зубной боли. Всем больным был установлен диагноз острого гнойного верхушечного периодонтита и показано удаление больного зуба. Больные были разделены на 2 группы по 5 человек. С согласия больных опытной группы за 30 минут до операции им внутривенно однократно вводили ДНКазу I в дозе 2000000 Единиц Кунца. Через 2 часа после операции у всех больных осуществлялся посев крови. У 5 больных опытной группы посев оказался стерильным. У 3 больных контрольной группы из крови был высеян Streptococcus.
Пример 15. Профилактика гиперчувствительности замедленного типа.
30 мышей С57В1 иммунизировали суспензией Mycobacterium Smegmatis (100 мкг антигена в 50 мкл алюминиевых квасцов) подкожно в подушечку лапы. Через 4 недели в подушечку противоположной лапы мышам вводили разрешающую дозу антигена (50 мкг).
Мышам первой группы (10 мышей) за 30 минут до введения разрешающей дозы вводили анти-ДНК антитела внутривенно в дозе 200 мкг на мышь.
Мышам второй группы (10 мышей) за 30 минут до введения разрешающей дозы внутривенно вводили энзаймосомы, содержащие бактериальную Sss I Метилазу (CpG Methylase, NewEngland Biolabs). В экспериментах Sss I Метилазу включали в состав малых однослойных липосом (SUV) в соотношении 1u фермента на 1 мкг липидов (энзаймосомы) в дозе 750 мкг на мышь.
Мышам контрольной группы (10 мышей) за 30 минут до введения разрешающей дозы внутривенно вводили фосфатный буфер.
Оценивали интенсивность отека лапы через 1, 2, 5 и 24 часа после введения разрешающей дозы антигена.
Результаты приведены в таблице 9.
Интенсивность отека лапы в разные сроки после введения разрешающей дозы антигена.
Пример 16. Профилактика рецидивирования злокачественной опухоли у животных
В качестве агента, стимулирующего синтез эндогенной дезоксирибонуклеазы, использовали стволовые клетки пуповинной крови человека (СКПК), трансфецированые in vitro кДНК гена Дезоксирибонуклеазы 1 человека.
Группа 1 - 7 мышей с привитой карциномой Эрлиха - контроль.
Группа 2 - 8 мышей с привитой карциномой Эрлиха, получивших на третий день после перевивки опухоли внутривенную инъекцию 25 миллионов СКПК.
Группа 3 - 8 мышей с привитой карциномой Эрлиха, получивших на третий день после перевивки опухоли внутривенную инъекцию 25 миллионов СКПК, трансфецированных in vitro кДНК гена Дезоксирибонуклеазы 1 человека.
Эффект определяли по величине опухоли на 7 день после перевивки
Размер опухоли через 7 дней после перевивки:
Пример 17.
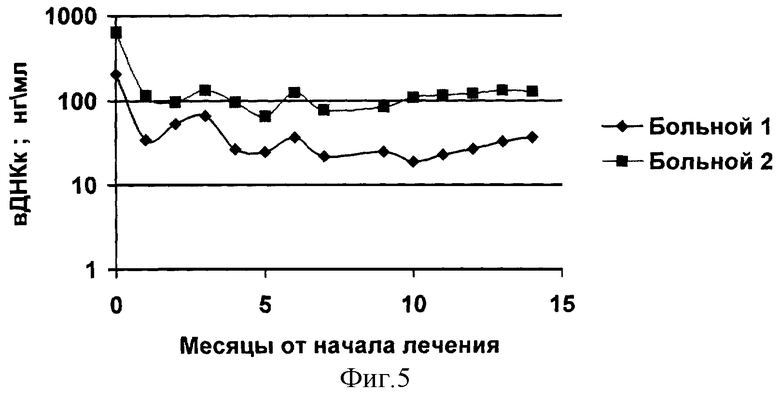
Профилактика рецидивирования злокачественной опухоли. В январе 2004 года в клинике торакальной хирургии двум больным (мужчина в возрасте 57 лет и женщина в возрасте 55 лет) с диагнозом рака легкого в стадии T4N2M+ были произведены паллиативные операции удаления пораженного легкого. Все больные ранее получали химиотерапевтическое и лучевое лечение. После операции больным с их согласия была проведена процедура мобилизации стволовых клеток перифирической крови (ГМ-КСФ по 5 мкг/кг подкожно трехкратно в течении 3 суток) с последующим выделением стволовых клеток методом цитафереза на аппарате Haemonetic. Выделенные клетки были подвергнуты трансфекции кДНК гена человеческой дорназы-альфа (Дезоксирибонуклеазы I) методом катионных липосом и введены больным внутривенно в количестве 50000000 клеток. Процедура была повторена через 3, 6 и 9 месяцев. К настоящему моменту (срок наблюдения - 14 месяцев, контрольные обследования через каждые 3 месяца) ни у одного из наблюдаемых больных не обнаружено признаков прогрессирования заболевания. В то же время данные ретроспективного контроля свидетельствуют о том, что вероятность развития рецидива к данному сроку и в данной клинической ситуации приближается к 100%. На фиг.5 приведены сведения о содержании внеклеточной ДНК крови больных до начала лечения и в период осуществления лечения по заявляемому способу.
Пример 18. Профилактика рецидивирования малярии
Больная Д. 49 лет, поступила в стационар на 20 день от начала заболевания с жалобами на повышение температуры до 40-41°С, потрясающий озноб в утренние и дневные часы, повторяющегося через 48 часа, длительностью 2,5-3 часа, сменяющийся на жар в течение 4 часов, без потливости, слабость, интенсивную диффузную головную боль, плохой аппетит, прерывистый сон. 2 месяца назад приехала из Индии, где проводила отпуск. При микроскопии крови обнаружены Plasmodium Vivax (3-5 в поле зрения). Больной были прописаны Делагил в курсовой дозе 2,5 г и Примаквин по 0,015 г в день в курсовой дозе 0,2 г. На четвертый день от начала лечения при микроскопии в крови сохранялся Plasmodium Vivax, сохранялись приступы лихорадки и гепатоспленомегалия. С согласия больной ей были осуществлены внутрикожные инъекции ДНК из тимуса теленка, смешанной с неполным адъювантом Фрейнда (50 мг/50 мг). Всего 3 инъекции с интервалом 48 часов. В течение 2-х недель осуществлялось симптоматическое лечение. Через 2 недели был назначен повторный курс Делагила, по завершении которого наблюдалась санация крови от паразита, исчезновение приступов лихорадки и нормализация самочувствия.
В таблице приведены сведения о содержании внеклеточной ДНК крови больной и титре анти-ДНК антител в процессе лечения (День 0 - при поступлении в стационар)

Изобретение относится к медицине и ветеринарии и может быть использовано для профилактики развития онкологических заболеваний, или инфекций, вызываемых бактериями, грибами и простейшими, или атеросклероза, или сахарного диабета, или заболеваний, связанных с реакцией гиперчувствительности замедленного типа, или заболеваний, развивающихся вследствие мутаций генов соматических клеток. Согласно первому варианту способа в кровь вводят агент, разрушающий внеклеточную ДНК крови, например ДНКазу. Согласно второму варианту осуществляют введение в кровь агента, связывающего внеклеточную ДНК крови, например анти-ДНК антитела. Согласно третьему варианту в кровь вводят фермент, изменяющий химическую структуру внеклеточной ДНК крови. Согласно четвертому варианту осуществляют введение в кровь агента, стимулирующего синтез и/или активность эндогенной дезоксирибонуклеазы, или агент, стимулирующий синтез антител, связывающих внеклеточную ДНК крови. Способ обеспечивает эффект лечения указанных заболеваний при отсутствии побочных эффектов при длительном использовании препаратов, воздействующих на внеклеточную ДНК крови. 4 н. и 3 з.п. ф-лы, 11 табл., 5 ил.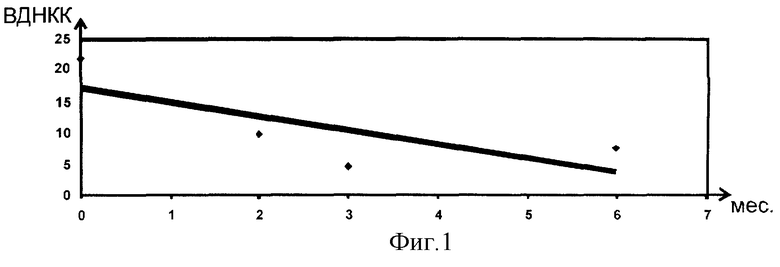
| US 6391607, 21.05.2002 | |||
| US 6521409, 18.02.2003 | |||
| US 5484589, 16.01.1996 | |||
| US 5656589, 12.08.1997 | |||
| RU 2001104426 A, 20.01.2003 | |||
| СЕРГЕЕВА Л.М | |||
| Клинико-лабораторная оценка муколитического эффекта пульмозима у больных муковисцедозом: Дисс | |||
| к.м.н | |||
| Екатеринбург, 1999, с | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| ПЕРЕЛЬМАН М.И | |||
| и др | |||
| Молекулярная медицина и лечение туберкулеза. | |||
Авторы
Даты
2006-02-10—Публикация
2004-03-12—Подача