Изобретение относится к медицине и ветеринарии и может быть использовано для лечения заболеваний, сопровождающихся качественными или количественными изменениями внеклеточной ДНК крови, а именно злокачественных опухолей или инфекций, вызываемых бактериями, грибами и простейшими, или атеросклероза, или сахарного диабета, или заболеваний, связанных с реакцией гиперчувствительности замедленного типа, а также заболеваний, обусловленных мутациями генов соматических клеток.
Перечисленные заболевания согласно современным знаниям представляют собой крайне неоднородные и различающиеся между собой по этиологии и патогенезу болезненные процессы. В соответствии с этими представлениями и лечение этих заболеваний осуществлялось совершенно различными методами. Так, основным способом лекарственного лечения онкологических заболеваний является химиотерапия, см. Merck Manual of Diagnosis and Therapy; 16th Edition.
Основным способом лечения заболеваний, вызываемых бактериями, грибами и простейшими, является антибиотико- и химиотерапия, см. Merck Manual of Diagnosis and Therapy; 16th Edition.
Основным способом лекарственного лечения атеросклероза является терапия препаратами группы статинов, подавляющих синтез холестерина в организме, см. New Concepts and Paradigms in Cardiovascular Medicine: The Noninvasive Management of Coronary Artery Disease, K. Lance Gould, THE AMERICAN JOURNAL OF MEDICINE, Volume 104, June 22, 1998, 2s-17s.
В основе лекарственного лечения сахарного диабета лежат три основных подхода - заместительная терапия препаратами инсулина, лекарственная терапия, направленная на улучшение секреции инсулина поджелудочной железой, лекарственная терапия, направленная на повышение чувствительности тканей к инсулину или ускорение утилизации тканями глюкозы, см. Pharmacological Management of Diabetes: Recent Progress and Future Perspective in Daily Drug Treatment, Gerard Emilien et.al., Pharmacol. Ther. Vol.81, No.1, pp.37-51, 1999.
Основой терапии аллергических заболеваний, связанных с реакциями гиперчувствительности IV типа, является иммуносупрессивная или иммуномодулирующая терапия, см. Therapeutic Immunosupression, ed. A.W.Thomson, Ser.Immunology and Medicine vol.29, Kluwer Acad.Publishers, Dordrecht, 2001.
Заболевания, развивающиеся вследствие мутаций генов соматических клеток и сопровождающиеся развитием соматического мозаицизма, вовсе не имеют средств этиологической терапии, осуществляется лишь симптоматическое лечение (Youssoufian H., Pyeritz RE. Mechanisms and Consequences of Somatic Mosaicism in Humans, Nature Reviews Genetics, 2002; 3:748-758).
Основной проблемой химиотерапии наиболее распространенных онкологических заболеваний считается ее малая эффективность и высокая токсичность (Merck Manual of Diagnosis and Therapy; 16th Edition).
Основной проблемой антибиотикотерапии бактериальных инфекций считается проблема лекарственной резистентности. Циркуляция резистентных к антибиотическим средствам штаммов бактерий и их новообразование в процессе лечения (например, вследствие формирования в организме больного биопленок) являются основной причиной неэффективной терапии (The use and resistance to antibiotics in the community. Cizman M, Int J Antimicrob Agents, 2003, Apr 21: pp.297-307). Общепризнанно, что проблема антибиотикорезистентности микроорганизмов в настоящее время носит характер глобальной угрозы (Mechanisms of antimicrobial resistance: their clinical relevance in the new millennium. Sefton A.M., Drugs, 2002, vol.62:557-66) и требует разработки новых антибиотических препаратов с оригинальными механизмами антибактериального воздействия и новых неантибиотических способов воздействия на инфекционный процесс. В частности, при лечении инфекции, вызванной резистентными к пенициллиновым и цефалоспориновым антибиотикам грамм-положительными кокками, используется антибиотик Ванкомицин. К основным его недостаткам относятся рост количества ванкомицин-резистентных штаммов в циркуляции; высокая токсичность; относительно узкий спектр активности препарата (The threat of vancomycin resistance. PerlTM, Am J Med, 1999, May, 106:26S-37S).
В связи с перечисленным является актуальной задача поиска метода антибактериальной терапии эффективного, малотоксичного, активного в отношении широкого спектра бактерий, в том числе резистентных к антибиотическим препаратам.
Проблемы антибиотико- и химиотерапии инфекций, вызываемых грибами и простейшими, носят в основном тот же характер, что и проблемы антибиотикотерапии бактериальных инфекций; например, при лечении широко распространенным антигрибковым агентом амфотерицином (Antifungal drug resistance to azoles and polyenes. Mar Masia Canuto et.al., The Lancet Infectious Diseases, Volume 2, Issue 9, 1 September 2002, Pages 550-563; A systematic review of the antifungal effectiveness and tolerability of amphotericin В formulations, Jane P. Barrett et.al., Clinical Therapeutics, Volume 25, Issue 5, May 2003, Pages 1295-1320).
Атеросклероз представляет собой системное заболевание, сопровождающееся формированием специфических атеросклеротических бляшек в стенках крупных и средних артерий. В зависимости от места появления, стадии развития и величины атеросклеротических бляшек заболевание имеет различные клинические проявления (ишемическая болезнь сердца, инсульт и др.). Лекарственному и хирургическому лечению подвергаются именно проявления системного атеросклероза на уровне того или иного органа. Атеросклероз как системное заболевание не имеет способов лекарственного лечения. Наиболее распространенным способом профилактики, замедляющим прогрессирование заболевания, является терапия ингибиторами 3-гидрокси-3-метилглютарил коэнзим A(HMGCoA) редуктазы (Ловастатин, Парвастатин и др.), приводящая к подавлению синтеза эндогенного холестерина и ускорению клиренса липопротеинов низкой плотности из плазмы крови, что замедляет развитие атеросклероза (New Concepts and Paradigms in Cardiovascular Medicine: The Noninvasive Management of Coronary Artery Disease, K. Lance Gould, THE AMERICAN JOURNAL OF MEDICINE, Volume 104, June 22, 1998, 2s-17s). Недостатками подобного лечения являются серьезные побочные эффекты (A safety look at currently available statins., Moghadasian MH, Expert Opin Drug Saf, 2002, Sep 1: pp.269-74) и ограниченная эффективность (Statins: balancing benefits, efficacy and safety., Clearfield MB, Expert Opin Pharmacother, 2002, May 3: pp.469-77).
Основной причиной инвалидизации и смерти больных при сахарном диабете 1 и 2 типа являются осложнения, связанные с развитием микро- и макроангиопатий. Считается, что достижение эффективного метаболического контроля (поддержание нормального уровня глюкозы и гликозилированного гемоглобина в физиологических границах в течение длительного времени) препятствует развитию осложнений. Инсулинотерапия, в том числе интенсивная, является методом выбора в ситуациях, когда не удается достичь метаболического контроля с помощью других лекарственных средств (Outpatient insulin therapy in type 1 and type 2 diabetes mellitus: scientific review, DeWitt DE, Hirsch IB, JAMA, 2003, May 289: pp.2254-64). Однако даже при интенсивных режимах терапии риск развития осложнений, в том числе фатальных, остается высоким (Cause-specific mortality in a population with diabetes: South Tees Diabetes Mortality Study., Roper NA, et.al., Diabetes Care, 2002, Jan 25: pp.43-8). В связи с перечисленным является актуальной и общепризнанной задача поиска новых средств для терапии сахарного диабета 1 и 2 типа, в том числе способных предупреждать развитие осложнений.
Одним из наиболее широко применяемых в клинической практике способов, применяемых для лечения состояний, связанных с реакциями гиперчувствительности замедленного типа, является введение пептида Циклоспорина А, см. Therapeutic Immunosupression, ed. A.W.Thomson, Ser.Immunology and Medicine vol.29, Kluwer Acad.Publishers, Dordrecht, 2001. К широко известным недостаткам этого способа относятся серьезные побочные эффекты - нефротоксичность, гипертензия и высокий риск развития инфекций (Cyclosporine: mechanisms of action and toxicity, Graham RM, Cleve Clin J Med, 1994, Jul-Aug 61: pp.308-13). Другой проблемой является потеря эффективности при длительном применении препарата, что проявляется, например, в увеличении вероятности отторжения трансплантата (Renal transplantation, past, present and future, Ponticelli C, et.al. J Nephrol, 1999, Jul-Aug 12, Suppl 2:S105-10).
Таким образом, для лечения заболеваний, сопровождающихся изменениями качественного и/или количественного состава внеклеточной ДНК крови, применяется широкий спектр различных способов, имеющих схожие недостатки:
1) токсичность;
2) развитие побочных эффектов;
3) низкая эффективность терапии.
Между тем, в реальной клинической практике рассматриваемые заболевания часто сопутствуют одно другому. Так, например, терапия иммуносупрессивными препаратами при заболеваниях, связанных с реакцией гиперчувствительности замедленного типа, многократно повышает риск развития инфекционных заболеваний (Recent advances in the diagnosis and management of infection in the organ transplant recipient. Tolkoff-Rubin NE, Rubin RH; Semin Nephrol, 2000, Mar 20:148-63); атеросклероз является частым осложнением диабета (Diabetes and atherosclerosis: epidemiology, pathophysiology and management. Beckman JA, Creager MA, Libby P; JAMA, 2002, May 287:2570-81), и при этом часто его развитию сопутствует системный инфекционный процесс (Infection and atherosclerosis: potential roles of pathogen burden and molecular mimicry, Epstein SE, Zhu J, Bumett MS, Zhou YF, Vercelotti G, Hajjar D, Arterioscler Thromb Vasc Biol, 2000, Jun 20: 1417-20); ряд форм диабета развивается вследствие развития реакции гиперчувствительности замедленного типа (Evidence of islet cell autoimmunity in elderly patients with type 2 diabetes, Pietropaolo M, Barinas-Mitchell E, Pietropaolo SL, Kuller LH, Trucco M, Diabetes, 2000, Jan 49:32-8), или на фоне инфекционного процесса (Systemic diseases caused by oral infection. Li X, Kolltveit KM, Tronstad L, Olsen I, Clin Microbiol Rev 2000 Oct 13:547-58) и, в свою очередь, приводит к высокому риску развития инфекций (Diabetes and the risk of infection-related mortality in the U.S., Bertoni AG, Saydah S, Brancati FL, Diabetes Care, 2001, June, 24:6 1044-9).
В настоящее время отсутствуют какие-либо способы, которые позволяли бы лечить указанные выше заболевания в комплексе. В связи с этим отсутствует возможность принять какое-либо известное техническое решение за прототип настоящего изобретения.
В основу всех вариантов настоящего изобретения положено решение задачи создания высокоэффективного и малотоксичного способа лечения злокачественных опухолей, инфекционных заболеваний, вызываемых бактериями, грибами и простейшими, атеросклероза, сахарного диабета, заболеваний, связанных с реакцией гиперчувствительности замедленного типа, заболеваний, обусловленных мутациями генов соматических клеток.
Согласно первому варианту изобретения эта задача решается за счет того, что для лечения злокачественных опухолей, или инфекционных заболеваний, вызываемых бактериями, грибами и простейшими, или атеросклероза, или сахарного диабета, или аллергических заболеваний, связанных с реакцией гиперчувствительности замедленного типа, или заболеваний, обусловленных мутациями генов соматических клеток, в кровь вводят агент, связывающий внеклеточную ДНК крови.
Согласно второму варианту изобретения эта задача решается за счет того, что в кровь вводят фермент, изменяющий химическую структуру внеклеточной ДНК крови.
Согласно третьему варианту изобретения эта задача решается за счет того, что в кровь вводят агент, стимулирующий синтез или активность эндогенной дезоксирибонуклеазы, или агент, стимулирующий синтез антител, связывающих внеклеточную ДНК крови.
Развитие указанных заболеваний сопровождается качественными и количественными изменениями внеклеточной ДНК крови, однако в известных заявителю источниках отсутствуют знания о генетическом репертуаре внеклеточной ДНК крови больных при рассматриваемых заболеваниях, биологической роли внеклеточной ДНК крови при рассматриваемых заболеваниях и возможном терапевтическом эффекте ее связывания или модификации для лечения этих заболеваний.
Как установили заявители, внеклеточная ДНК крови больных при рассматриваемых заболеваниях содержит уникальный по своему качественному и количественному составу репертуар генов и регуляторных генетических элементов, резко отличающийся от репертуара ДНК, описанного в геноме человека. В отличие от внутриклеточной ДНК внеклеточная ДНК крови больных рассматриваемыми заболеваниями содержит в основном уникальные гены человека. Установлено наличие бактериальной внеклеточной ДНК и внеклеточной ДНК грибов в составе матрикса биопленок и в плазме крови инфицированного человека.
Установлено, что внеклеточная ДНК крови, включая внеклеточную ДНК бактерий, грибов и паразитов при рассматриваемых заболеваниях, способствует их развитию.
Установлено, что связывание и модификация внеклеточной ДНК крови, а также стимуляция синтеза или активности эндогенных биополимеров, связывающих, или разрушающих, или модифицирующих химический состав, и/или конформацию, и/или полимерность внеклеточной ДНК крови без ее разрушения, при рассматриваемых заболеваниях приводит к лечебному эффекту.
Указанные выше новые свойства заявленного изобретения, базирующиеся на принципиально новых представлениях о роли внеклеточной ДНК плазмы крови в развитии рассматриваемых заболеваний, позволяют сделать вывод о соответствии заявленного способа критерию «изобретательский уровень».
Заявленный способ реализуется следующим образом.
Материалы и методы.
В первом варианте в качестве агента, связывающего ДНК, использовали антитела против ДНК, выделяемые из крови больных системной красной волчанкой по методике Shuster A.M. (Shuster A.M. et.al., Science, v.256,1992, pp.665-667). Подобные анти-ДНК антитела способны связывать ДНК.
Во втором варианте в качестве агента, модифицирующего ДНК, использовали бактериальную Sss I Метилазу (CpG Methylase), (NewEngland Biolabs). В экспериментах Sss I Метилазу включали в состав малых однослойных липосом (SUV) в соотношении 1u фермента на 1 мкг липидов (энзаймосомы), а также фермент лигазу Т4 (Fermentas).
В третьем варианте в качестве агента, стимулирующего синтез и/или активность эндогенных биополимеров, связывающих, или разрушающих, или модифицирующих химический состав, и/или конформацию, и/или полимерность внеклеточной ДНК крови без ее разрушения, использовали анти G-f актин антитела (Calbiochem). G-Актин является ингибитором активности эндогенной ДНКазы I. Связывание актина антителами увеличивает активность эндогенной ДНКазы I.
ДНК плазмы крови выделяли следующим образом: свежую (не более 3-4 часов после забора) плазму крови с добавленным антикоагулянтом (цитрат натрия) откручивали на подушке из Ficoll-PlaquePlus (Amersham-Pharmacia) при 1500g 20 минут при комнатной температуре. Плазму (1/2 от всего количества) аккуратно отбирали, не задевая остаток клеток на подушке фиколла, и откручивали при 10000g 30 минут, чтобы избавиться от обломков клеток и дебриса. Супернатант отбирали, не затрагивая осадок, добавляли до 1% саркозила, до 50 мМ трис-HCl, рН 7,6, до 20 мМ ЭДТА, до 400 мМ NaCl и равный объем смеси фенол-хлороформ 1:1. Полученную эмульсию инкубировали при 65°С 2 часа, затем отделяли фенол-хлороформ центрифугированием при 5000g в течение 20 минут при комнатной температуре. Процедуру депротеинизации фенол-хлороформом повторяли идентичным способом трижды, после чего водную фазу обрабатывали хлороформом, затем диэтиловым эфиром. Отделение от органических растворителей производили центрифугированием при 5000g в течение 15 минут. К полученной водной фазе добавляли равный объем изопропанола и инкубировали в течение ночи при 0°С. После осаждения нуклеиновые кислоты отделяли центрифугированием при 0°С, 10000g в течение 30 минут. Осадок нуклеиновых кислот растворяли в буфере, содержащем 10 мМ трис-HCl, рН 7,6, 5 мМ ЭДТА, и наносили на подушку из ступенчатого хлористого цезия (1М, 2.5М, 5.7М) в центрифужной пробирке для ротора SW60Ti. Объем ДНК составлял 2 мл, объем каждой ступеньки CsCl - по 1 мл. Ультрацентрифугирование проводили в приборе L80-80 (Beckman) 3 часа при 250000g. ДНК отбирали с поверхности ступеньки 5.7 М по фракциям. Фракции диализировали 12 часов при 4°С. Наличие ДНК во фракциях определяли агарозным электрофорезом, с визуализацией ДНК бромистым этидием. Количество ДНК определяли спектрофотометрически (Beckman DU70) в кювете объемом 100 мкл, снимая спектр от 220 до 320 нм.
Пример 1. Влияние разрушения, связывания и модификации внеклеточной ДНК на ее патогенные свойства
Мыши С57В1 получили прививку высокометастатического или низкометастатического штамма опухоли LLC. На 9 день после перевивки животных усыпляли и собирали суммарную плазму крови мышей. Суммарная фракция внеклеточной ДНК крови после выделения хранилась при -20°С в фосфатном буфере.
В эксперименте участвовало 7 групп мышей, привитых низкометастатическим штаммом LLC.
Группа 1 - 6 мышей с привитым низкометастатическим штаммом LLC.
Группа 2 - 6 мышей с привитым низкометастатическим штаммом LLC+внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции внеклеточной ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворялись в 500 мкл свежей гепаринизированой крови).
Группа 3 - 6 мышей с привитым низкометастатическим штаммом LLC+внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей плазмы). Перед введением образец ДНК подвергали фотохимической дезинфекции (добавление 1 мкМ метиленового синего с последующим облучением красным светом в течение 10 минут (˜60000 Люкс).
Группа 4 - 6 мышей с привитым низкометастатическим штаммом LLC+внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей плазмы). Перед введением образец ДНК смешивали с 10 мкг анти-ДНК антител.
Группа 5 - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей гепаринизированной крови). Перед введением в образец добавляли 1 мкг фрагмента А растительного токсина Рицина и инкубировали 1 час при 37°С. Рицин является представителем семейства RIP (белки, инактивирующие рибосомы) токсинов, широко используемых для создания иммунотоксинов. Кроме способности инактивировать рибосомы, эти белки обладают способностью деаденилировать ДНК. Для реализации токсического эффекта каталитическая единица А токсинов RIP II типа должна быть доставлена в клетку субъединицей В. В отсутствие субъединицы В цепь А не токсична, однако полинуклеотид-аденингликозидазная активность цепи А может быть использована для инактивации ДНК, циркулирующей в плазме.
Группа 6 - 6 мышей с привитым низкометастатическим штаммом LLC + внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей гепаринизированой крови). Образец ДНК перед введением подвергался ферментативному метилированию (I.Muiznieks et.al., FEBS Letters, 1994, v.344, pp.251-254).
Группа 7 - 6 мышей с привитым низкометастатическим штаммом LLC+внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции внеклеточной ДНК мышей, привитых низкометастатическим штаммом LLC.
Группа 8 - 6 мышей с привитым низкометастатическим штаммом LLC+внутривенное двукратное (на седьмой и восьмой день после перевивки) введение суммарной фракции ДНК мышей с привитым высокометастатическим штаммом (0,05 мкг ДНК перед введением растворяли в 500 мкл свежей гепаринизированой крови. Образец ДНК перед введением инкубировали в присутствии 100U лигазы 30 минут при 37°С.
Оценивали количество метастатических узлов в легких на 15 день после перевивки.
Результаты эксперимента приведены в таблице 1.
Таким образом, внеклеточная ДНК крови мышей с высокозлокачественным штаммом опухоли усиливает метастазирование менее злокачественной опухоли. Связывание и модификация внеклеточной ДНК крови препятствуют этому согласно заявляемому способу.
Пример 2. Влияние связывания и модификации на патогенность внеклеточной ДНК больного атеросклерозом и диабетом
Бета-клетки эмбриональной поджелудочной железы человека и эндотелиальные клетки аорты человека использовали для формирования первичной клеточной культуры. Через 24 часа после пассажа в экспериментальных сериях в клеточные культуры добавляли внеклеточную ДНК, выделенную из плазмы больного тяжелой формой диабета 2 типа и системным атеросклерозом (0,0025 мкг ДНК на 1 мл культуральной среды).
В первой экспериментальной серии дополнительно в культуру добавляли анти-ДНК-антитела в концентрации 5 мкг/мл.
Во второй экспериментальной серии дополнительно в культуру добавляли энзаймосомы в концентрации 20 мкг/мл.
Через 24 часа оценивали содержание жизнеспособных клеток по включению красителя трипанового синего.
Результаты эксперимента приведены в таблице 2.
Процентное содержание жизнеспособных клеток через 48 часов после пассирования:
Таким образом, внеклеточная ДНК крови больного тяжелым диабетом II типа и атеросклерозом оказывает негативное воздействие как на здоровые В-клетки поджелудочной железы, так и на здоровые эндотелиальные клетки. Связывание и модификация внеклеточной ДНК крови больного препятствует этому согласно заявляемому способу.
Пример 3. Лечение злокачественной опухоли.
Группа 1 - 7 мышей с привитой карциномой Эрлиха - контроль.
Группа 2 - 6 мышей с привитой карциномой Эрлиха, получивших на третий день после перевивки опухоли внутривенную инъекцию фракции человеческих анти-ДНК антител по 200 мкг на одно животное.
Группа 3 - 6 мышей с привитой карциномой Эрлиха, получивших на третий день после перевивки опухоли внутривенную инъекцию «энзаймосом» в дозе 700 мкг на одно животное.
Эффект определяли по величине опухоли на 7 день после перевивки.
Размер опухоли через 7 дней после перевивки:
Приведенные данные свидетельствуют, что связывание и модификация внеклеточной ДНК крови оказывает противоопухолевый эффект.
Пример 4. Лечение бактериальной и грибковой инфекции.
В эксперименте использовали белых беспородных мышей весом 23-25 грамм.
Группа 1 (10 мышей) - мышам вводили в ретроорбитальный синус бактерии патогенного штамма Staphylococcus aureus VT-2003R в дозе 1×1010 бактериальных клеток на мышь. Через 2 часа после инфицирования мышам внутривенно вводили анти-ДНК антитела в дозе 300 мкг/мышь.
Группа 2 (10 мышей) - мышам вводили в ретроорбитальный синус бактерии патогенного штамма Staphylococcus aureus VT-2003R в дозе 1×1010 бактериальных клеток на мышь. Через 2 часа после инфицирования мышам внутривенно вводили энзаймосомы в дозе 1000 мкг/мышь.
Группа 3 (10 мышей) - мышам вводили в ретроорбитальный синус бактерии патогенного штамма Staphylococcus aureus VT-2003R в дозе 1×1010 бактериальных клеток на мышь. Фосфатный буфер вводился внутривенно через 2 часа после инфицирования.
Оценивали выживаемость животных через 32 часа после инфицирования.
Результаты приведены в таблице 4.
Выживаемость мышей в различные сроки после инфицирования:
Группа 4 (10 мышей) - мышам вводили внутривенно грибы, субкультивированные из патогенного клинического изолята Candida Albicans в дозе LD50. На третий день после инфицирования мышам внутривенно вводили анти-ДНК антитела в дозе 300 мкг/мышь.
Группа 5 (10 мышей) - мышам вводили внутривенно грибы, субкультивированные из патогенного клинического изолята Candida Albicans в дозе LD50. Мышам внутривенно вводили энзаймосомы в дозе 1000 мкг/ мышь на 3 день после инфицирования.
Группа 6 (10 мышей) - мышам вводили внутривенно грибы, субкультивированные из патогенного клинического изолята Candida Albicans в дозе LD50. В качестве негативного контроля вводился фосфатный буфер внутривенно на 3 день после инфицирования.
Оценивали выживаемость и массу мышей на 7 день после инфицирования.
Результаты приведены в таблице 5.
Выживаемость мышей в различные сроки после инфицирования:
Таким образом, связывание и модификация внеклеточной ДНК крови инфицированных животных оказывает лечебный эффект как при бактериальной, так и при грибковой инфекции.
Пример 5. Лечение аутоиммунного заболевания.
30 мышей С57В1 иммунизировали суспензией Mycobacterium Smegmatis (100 мкг антигена в 50 мкл алюминиевых квасцов) подкожно в подушечку лапы. Через 4 недели в подушечку противоположной лапы мышам вводили разрешающую дозу антигена (50 мкг).
Мышам первой группы (10 мышей) за 30 минут до введения разрешающей дозы вводили анти-ДНК антитела внутривенно в дозе 200 мкг на мышь.
Мышам второй группы (10 мышей) за 30 минут до введения разрешающей дозы внутривенно вводили энзаймосомы в дозе 750 мкг на мышь.
Мышам контрольной группы (10 мышей) за 30 минут до введения разрешающей дозы внутривенно вводили фосфатный буфер.
Оценивали интенсивность отека лапы через 1, 2, 5 и 24 часа после введения разрешающей дозы антигена.
Результаты приведены в таблице 6.
Интенсивность отека лапы в разные сроки после введения разрешающей дозы антигена.
Таким образом, связывание и модификация внеклеточной ДНК крови оказывает подавляющий эффект на развитие реакции гиперчувствительности замедленного типа.
Пример 6. Лечение аутоиммунного диабета и злокачественных опухолей.
В эксперименте использовали 20 самок мышей линии NOD и 20 самок мышей линии С3Н.
Диабет у NOD мышей возникает вследствие развития аутоиммунного поражения в-клеток поджелудочной железы. Мыши первой группы (10 самок линии NOD) получили внутривенные инъекцию фракции мышиных антиG-f актин антител (Calbiochem) по 200 мкг на мышь в возрасте 6, 7, 8, 9 и 10 недель. 10 мышей контрольной третьей группы получали инъекции фосфатного буфера с 6 по 10 неделю. Начиная с 15 недели раз в три дня измеряли уровень глюкозы в крови мышей. В случае, если уровень глюкозы превышал 250 мг/дл при двух последующих измерениях, констатировалось наличие диабета. Оценивали количество заболевших к 15, 18, 24 и 28 неделе мышей.
Результаты приведены в таблице 7.
Соотношение здоровых и больных мышей (Первая цифра - число здоровых животных в группе; вторая цифра - число больных животных в группе):
Опухоли индуцировали путем внутрикожной инъекции 3-метилхолантрена (1 мг 3-метилхолантрена, растворенного в 50 мкл оливкового масла, на мышь) в 4-х-недельном возрасте. Оценивали количество мышей с развившимися опухолями на 10 неделе после введения канцерогена.
Мыши третьей группы (10 самок линии С3Н) получили внутривенные инъекции фракции мышиных анти G-f актин антител по 200 мкг на мышь в возрасте 5, 6, 7, 8, 9 и 10 недель.
Мыши четвертой группы (10 самок линии СЗН) получали внутривенные инъекции фосфатного буфера в возрасте 5, 6, 7, 8, 9 и 10 недель.
Определяли наличие опухолей у животных в возрасте 14 недель. Результаты приведены в таблице 8.
Соотношение здоровых и больных мышей (Первая цифра - число здоровых животных в группе; вторая цифра - число больных животных в группе):
Таким образом, подавление активности собственных ингибиторов эндогенной ДНКазы I оказывает лечебный эффект при развитии аутоиммунного диабета и рака.
Пример 7. Подавление распространения мутантного гена. Ряд заболеваний человека возникают вследствие развития состояния соматического мозаицизма - экспансии мутантного гена в популяции соматических клеток (Youssoufian H, Pyeritz RE. Mechanisms and Consequences of Somatic Mosaicism in Humans. Nature Reviews Genetics 2002; 3:748-758).
В качестве модели развития соматического мозаицизма была изучена частота мутаций гена HPRT в Т-лимфоцитах крови. Человеческий HPRT ген (Хромосома Xq26) кодирует конститутивно экспрессируемый, но не эссенциальный фермент, вовлеченный метаболизм пуриновых оснований. Клонирование проводили по методике, описанной Bigbee W (Bigbee W. Et al., Mutation Res., 1998, v.397, pp.119-136). Клонированию подвергались лимфоциты периферической крови 8 больных, получавших курс трехнедельной иммуностимулирующей терапии препаратом Неовир после хирургического удаления опухоли. Из 8 больных 4 пациента дополнительно получали терапию человеческой рекомбинантной ДНКазой I (Genetech) (200 мкг/кг внутривенно, 4 раза в сутки в течение 3 недель). Частота встречаемости HPRT-дефицитных клонов в крови больных, получавших терапию ДНКазой I, в среднем была в 3 раза ниже таковой в крови больных, получавших только иммуностимулирующую терапию. Добавление внеклеточной ДНК крови больных, не получавших ДНКазу, в культуральную среду при клонировании Т-лимфоцитов больных, получавших терапию ДНКазой, повышает частоту встречаемости HPRT-дефицитных клонов при клонировании последних. Преинкубация внеклеточной ДНК крови больных, не получавших ДНКазу с анти-ДНК антителами или с энзаймосомами (0,1 мкг антител или 5 мкг энзаймосом на 0,1 мкг ДНК в 1 мл плазмы 30 минут при 37°С), перед добавлением в культуральную среду при клонировании лишает ее способности повышать частоту встречаемости HPRT-дефицитных клонов.
Таким образом, связывание и модификация внеклеточной ДНК крови снижает частоту встречаемости мутантного гена в клеточной популяции и препятствует развитию соматического мозаицизма.
Пример 8. Лечение болезни Маркиафавы-Микели
Болезнь Маркиафавы - Микели очень редкое заболевание, связанное с наличием соматической генной мутации в локусе гена PI (phosphatidyl glycan class А). Больная О., 17 лет, страдает данным заболевание в течение 3 лет. В течение последних 2 лет заболевание удавалось компенсировать приемом глюкокортикостероидных гормонов. В течение последнего года вновь появились и стали интенсивно прогрессировать симптомы заболевания: эпизоды гемолиза (2-3 раза в месяц), гемоглобинурии, гепатоспленомегалия, макроцитоз, анизоцитоз. Было произведено 4 гемотрансфузии. Четыре месяца назад у больной развился эпизод острой почечной недостаточности (креатинин - 8, 2 мг\дл) вследствие интенсивного эпизода внутрисосудистого гемолиза на фоне перенесенной гнойной ангины. В течение недели больной проводились процедуры гемодиализа. После компенсации функции почек с согласия больной ей были прописаны еженедельные инфузии человеческих донорских связывающих ДНК антител, выделенных у больных системной красной волчанкой, в разовой дозе 500 мг (1, 2, 3 и 4 недели). В течение этого месяца наблюдался только один пароксизм заболевания (2 неделя) значительно меньшей интенсивности, чем предыдущий. Криз был легко купирован трехдневным курсом преднизолона в дозе 50 мг в сутки. На 5 неделе больной были прописаны ежедневные однократные внутримышечные инъекции ДНКазы I в дозе 2000000 Ед. Кунца в сутки. В течение последующих трех месяцев наблюдения у больной нормализовалась формула крови, исчезла желтушность и гепатоспленомегалия. Пароксизмы заболевания не повторялись (фиг.1).
Пример 9. Лечение сахарного диабета
В исследование включено 2 больных (Больной Ш. и больной И.) с тяжелым инсулин-зависимым сахарным диабетом, с высокой суточной потребностью в инсулине и отсутствием адекватного контроля гликемии, что проявлялось в частых эпизодах гипергликемии. У больного Ш отмечались жалобы на боли за грудиной, слюнотечение, отрыжку и изжогу, не отвечавшие на стандартную антацидную терапию (париет 0,01 г\сутки). При фиброгастродуоденоскопии выявлен кандидоз дистального отдела пищевода.
Больным вводили препарат иммуноглобулина, полученный путем фракционирования плазмы здоровых доноров-добровольцев, 3-кратно иммунизированных ранее ДНК тимуса теленка. Препарат вводился внутривенно 1 раз в неделю в количестве 1000 мг. Всего было осуществлено 4 введения препарата. Вычисляли суточную потребность в инсулине (как показатель активности основного заболевания) и количество еженедельных эпизодов гипергликемии (уровень глюкозы крови контролировался приборным методом 5 раз в день).
Результаты исследования приведены в таблице 9.
Эффект лечения анти-ДНК антителами на течение инсулин-зависимого сахарного диабета.
К концу исследования больной Ш отметил полное исчезновение жалоб на диспептические явления. При повторной фиброгастроскопии признаков кандидозного поражения пищевода не выявлено.
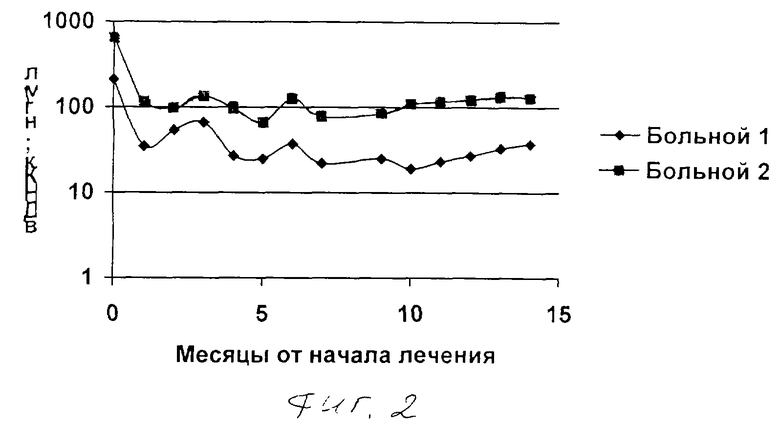
Пример 10. Лечение злокачественной опухоли.
В январе 2004 года в клинике торакальной хирургии двум больным (мужчина в возрасте 57 лет и женщина в возрасте 55 лет) с диагнозом рака легкого в стадии T4N2M+ были произведены паллиативные операции удаления пораженного легкого. Все больные ранее получали химиотерапевтическое и лучевое лечение. После операции больным с их согласия была проведена процедура мобилизации стволовых клеток периферической крови (ГМ-КСФ по 5 мкг\кг подкожно трехкратно в течение 3 суток) с последующим выделением стволовых клеток методом цитафереза на аппарате Haemonetic. Выделенные клетки были подвергнуты трансфекции кДНК гена человеческой дорназы-альфа (Дезоксирибонуклеазы I) методом катионных липосом и введены больным внутривенно в количестве 50000000 клеток. Процедура была повторена через 3, 6 и 9 месяцев. К настоящему моменту (срок наблюдения -14 месяцев, контрольные обследования через каждые 3 месяца) ни у одного из наблюдаемых больных не обнаружено признаков прогрессирования заболевания. В то же время данные ретроспективного контроля свидетельствуют о том, что вероятность развития рецидива к данному сроку и у подобных больных приближается к 100%. На чертеже приведены сведения о содержании внеклеточной ДНК крови больных до начала лечения и в период осуществления лечения по заявляемому способу (фиг.2).
Пример 11. Лечение малярии
Больная Д. 49 лет, поступила в стационар на 20 день от начала заболевания с жалобами на повышение температуры до 40-41°С, потрясающий озноб в утренние и дневные часы, повторяющийся через 48 часов, длительностью 2,5-3 часа, сменяющийся на жар в течение 4 часов, без потливости, слабость, интенсивную диффузную головную боль, плохой аппетит, прерывистый сон. 2 месяца назад приехала из Индии, где проводила отпуск. При микроскопии крови обнаружены Plasmodium Vivax (3-5 в поле зрения). Больной были прописаны Делагил в курсовой дозе 2,5 г и Примаквин по 0,015 г в день в курсовой дозе 0.2 г. На четвертый день от начала лечения при микроскопии в крови сохранялся Plasmodium Vivax, сохранялись приступы лихорадки и гепатоспленомегалия. С согласия больной ей были осуществлены внутрикожные инъекции ДНК из тимуса теленка, смешанной с неполным адъювантом Фрейнда (50 мг\50 мг). Всего 3 инъекции с интервалом 48 часов. В течение 2-х недель осуществлялось симптоматическое лечение. Через 2 недели был назначен повторный курс Делагила, по завершении которого наблюдались санация крови от паразита, исчезновение приступов лихорадки и нормализация самочувствия.
В таблице приведены сведения о содержании внеклеточной ДНК крови больной и титре анти-ДНК антител в процессе лечения.
(День 0 - при поступлении в стационар)
в ДНК крови нг\мл
Пример 12. Лечение сепсиса.
Больной 32 лет доставлен в больницу через 80 часов от начала заболевания с диагнозом острый аппендицит. При осмотре состояние тяжелое, заторможен. Кожа и слизистые бледные. Частота дыхания 25 в минуту. Пульс - 142 уд. в минуту, слабого наполнения, неритмичный. ЦВД отрицательное. АД 70/50 мм рт.ст. Тоны сердца глухие. Живот равномерно вздут, не участвует в акте дыхания. Положительные симптомы раздражения брюшины, перистальтика кишечника отсутствует. Диурез резко снижен. В анализах крови токсические изменения. Больной оперирован по экстренным показаниям. При вскрытии брюшной полости - гангренозный, прободной аппендицит, разлитой гнойный перитонит. Произведена аппенэктомия, санация и дренирование брюшной полости, назогастроинтестинальная интубация. В послеоперационном периоде развился инфекционно-токсический шок. Больному начали проводить антибактериальную терапию: цефепим 100 мг/кг/сут в/в, ванкомицин 60 мг/кг/сут в/в, офлоксацин 20 мг/кг/сут в/в. Поскольку характер изменений в брюшной области не позволял исключить наличие аэробно-анаэробной ассоциации возбудителей, было начато в/в введение метронидазола в дозе 22,5 мг/кг/сут.
Несмотря на проводимое лечение состояние больного продолжало ухудшаться, сохранялись и нарастали проявления интоксикации и дыхательной недостаточности; гипертермия, азотемия.
С учетом тяжести состояния больного и отсутствия реакции на антибактериальную терапию было решено провести гемосорбцию с применением сорбента, содержащего иммобилизованный фермент метилазу. Через 18 часов после хирургического вмешательства проведено 6 гемосорбций с интервалом в 6 часов. Состояние больного после первой гемосорбции несколько улучшилось. Исчезли явления энцефалопатии, снизилась температура тела до 37,3 С, уменьшилась тахикардия, частота дыханий, появилась вялая перистальтика. В анализах крови сохранялся лейкоцитоз с нейтрофильным сдвигом влево, гипопротеинемия с гипоальбуминемией. Отмечено достоверное снижение уровня мочевины.
После проведения повторных процедур состояние больного улучшалось. Стабилизировалась гемодинамика. После 3-й гемосорбции появилась активная перистальтика, был стул. Нормализовался диурез. Отмечена постепенная нормализация общего анализа крови, мочевины, констатировано также увеличение концентрации общего белка и альбумина плазмы крови. Поведение комплексной терапии по описанной схеме привело к быстрой инволюции воспалительного процесса в брюшной полости, восстановлению функций паренхиматозных органов и гомеостаза. Через 3 суток после начала лечения больной в удовлетворительном состоянии был переведен в хирургическое отделение.
На 20-е сутки выписан на амбулаторное лечение
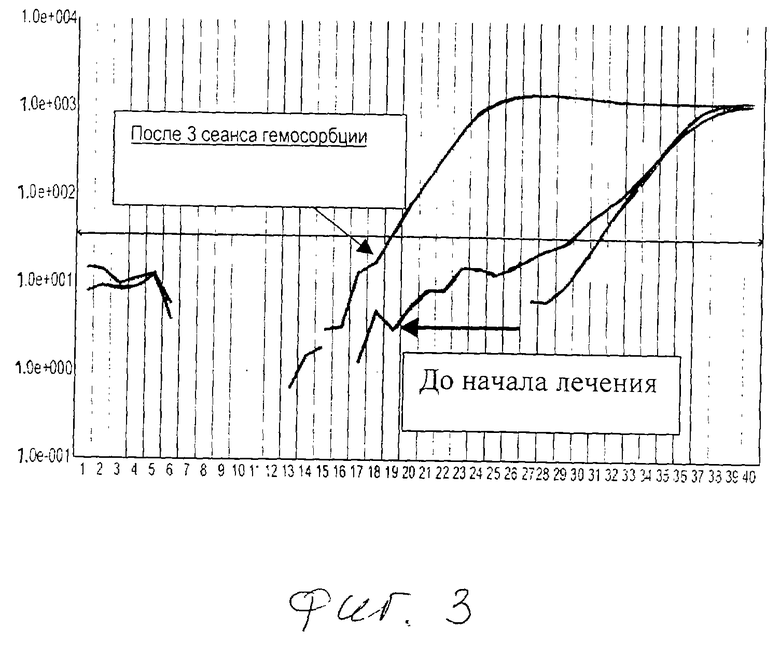
Уровень метилирования внеклеточной ДНК крови измеряли по методике J.Worm (In-Tube DNA Methylation Profiling by Fluorescence Melting Curve Analysis Clinical Chemistry 47: 1183-1189, 2001).
Результаты представлены на фиг.3.
Выявляется значительно более высокий уровень метилирования внеклеточной ДНК крови после начала лечения по заявляемому способу.
Пример 13. Лечение атеросклероза
Пациентка А., 32 лет, с диагнозом наследственной гиперхолестеринемии, перенесла инфаркт миокарда в 24 года, страдает стенокардией напряжения 2-3 функционального класса, находится на инвалидности. На фоне диеты, приема 40 мг ловастатина и холестирамина уровень общего холестерина 450 мг %. Содержание внеклеточной ДНК крови - 64 нг\мл. По данным ВЭМ - проба положительная, депрессия сегмента СТ. По данным коронарографии в 2-х коронарных артериях 3 стеноза 60, 60 и 70%. Больной начали вводить препарат иммуноглобулина, полученный путем фракционирования плазмы здоровых доноров-добровольцев, 3-кратно иммунизированных ранее ДНК тимуса теленка. Препарат вводился внутривенно 1 раз в неделю в количестве 1000 мг. Всего было осуществлено 20 введений препарата. К моменту окончания лечения по заявляемому способу отмечена регрессия ксантом, эпизодов стенокардии нет. Уровень общего холестерина около 160 мг %, содержание внеклеточной ДНК крови - 12 нг\мл. По данным велоэргометрии - проба отрицательная, депрессии сегмента СТ нет. По данным ангиографии отмечено снижение степени стенозирования коронарных артерий (40, 40 и 30%) и отсутствие новых стенозов. Самочувствие пациентки удовлетворительное.
Пример 14. Лечение системной красной волчанки
В исследование было включено 4 пациента с установленным диагнозом системной красной волчанки и лабораторными симптомами гломерулонефрита (протеинурия, микрогематурия). Все пациенты получали стандартную терапию (Нестероидные противовоспалительные средства, хлороквин и ежедневные капельные инфузии 6% раствора DEAE-декстрана (400 мл 6% раствора) на протяжении 15 суток. Изучали концентрацию ДНК в плазме крови до начала лечения и после его окончания. Оценивали состояние больных по шкале SLAM (Sustemic Lupus Activity Measure). Содержание ДНК в плазме у больных снизилось на 50% по окончании 15-дневного курса лечения. Активность заболевания у 4 контрольных больных, получавших только стандартную терапию, снизилась на 20% (среднее значение до начала терапии - 9,7; после окончания терапии - 7,2). Активность заболевания у больных, получавших терапию DEAE-декстраном, снизилась на 40% (среднее значение до начала терапии - 9,2; после окончания терапии - 5,3).
Изобретение относится к медицине и ветеринарии и может быть использовано для лечения злокачественных опухолей, или инфекций, вызываемых бактериями, грибами и простейшими, или атеросклероза, или сахарного диабета, или заболеваний, связанных с реакцией гиперчувствительности замедленного типа, или заболеваний, развивающихся вследствие мутаций генов соматических клеток. Для этого согласно вариантам данного способа в кровь вводят агент, связывающий внеклеточную ДНК крови, или вводят фермент, изменяющий химическую структуру внеклеточной ДНК крови, или в кровь вводят агент, стимулирующий синтез или активность эндогенной дезоксирибонуклеазы, или агент, стимулирующий синтез антител, связывающих внеклеточную ДНК крови. Способ позволяет получить высокую эффективность малотоксичного этиологического лечения указанных заболеваний. 3 н.п. ф-лы, 10 табл., 3 ил.
Приоритет по пунктам:
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СПОСОБ КОМПЛЕКСНО-ИНДИВИДУАЛИЗИРОВАННОГО ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ ПРИ МЕДЛЕННОЙ ВИРУСНОЙ ИНФЕКЦИИ И СПОСОБ ПОДГОТОВКИ ЛАБОРАТОРНОГО ЖИВОТНОГО ДЛЯ ИСПЫТАНИЯ СПОСОБА ТАКОГО ВОЗДЕЙСТВИЯ | 2001 |
|
RU2207876C1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ ВЫЯВЛЕНИЯ СТЕПЕНИ НАРУШЕНИЯ РЕОЛОГИЧЕСКИХ СВОЙСТВ КРОВИ | 2001 |
|
RU2202109C1 |
| KRAPF F | |||
| et al | |||
| The estimation of circulating immune complexes, C3d, and | |||
Авторы
Даты
2006-01-10—Публикация
2004-03-12—Подача