ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США № 62/617879, поданной 16 января 2018 г., содержание которой полностью включено в настоящую заявку посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит Перечень последовательностей, который был представлен в электронном виде в формате ASCII и полностью включен в настоящую заявку посредством ссылки. Указанная копия ASCII, созданная 10 января 2019 г., имеет название 252732.000003_ST25.txt и имеет размер 52177 байт.
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее изобретение относится к печень-специфичной доставке и/или экспрессии фермента, который обладает дезоксирибонуклеазной (ДНКазной) активностью, для повышенного клиренса внеклеточной ДНК (вкДНК), накопленной в портосинусоидальном кровотоке печени, и применению такой печень-специфичной доставки и/или экспрессии для лечения различных заболеваний и состояний, включая рак и нейродегенерацию.
УРОВЕНЬ ТЕХНИКИ
[0004] Пациенты со злокачественными опухолями имеют повышенные уровни циркулирующей внеклеточной ДНК (вкДНК) в плазме и сыворотке по сравнению со здоровыми людьми (Fleischhacker, 2007). У больных, страдающих раком, циркулирующая вкДНК имеет происхождение как из умирающих неопухолевых клеток, так и из опухолевых клеток и нейтрофилов. Опухоли провоцируют высвобождение внеклеточных ловушек ДНК, которые способствуют установлению протромботического состояния, кахексии и органной недостаточности у пациентов, страдающих раком (Demmers, 2012). ВкДНК, происходящая из опухоли, может способствовать развитию метастазов и устойчивости к химиотерапии (García-Olmo, 2013). Количество циркулирующей вкДНК увеличивается по мере прогрессирования опухоли (Sawyers, 2008), достигая максимальных уровней у пациентов с заболеванием на поздней стадии и метастатическим заболеванием (Butt, 2008). Было показано, что более высокие количества циркулирующей вкДНК в значительной степени коррелируют с плохой выживаемостью пациентов (Schwarzenbach, 2008).
[0005] Нейродегенерация представляет собой отдельное клиническое патологическое состояние с прогрессирующей потерей структуры и/или функции нейронов, включая гибель нейронов. Молекулярные пути, ведущие к нейродегенерации, являются очень специфичными в отношении заболевания (например, накопление аномально свернутых беков бета-амилоида и тау в головном мозге у пациентов с болезнью Альцгеймера; накопление альфа-синуклеина при болезни Паркинсона; накопление мутантного хантингтина при болезни Хантингтона; накопление белковых агрегатов TDP-43 и FUS при боковом амиотрофическом склерозе (БАС); накопление мутаций митохондриальной ДНК и нарушение механики деления митохондрий при старении) и приводят к гибели нервных клеток на поздних стадиях прогрессирования заболевания. Запрограммированная гибель клеток, включая апоптоз, по-видимому, играет ключевую роль в прогрессировании нейродегенерации на поздней стадии заболевания, как продемонстрировали исследования на животных моделях и клеточных линиях (Radi E., et al., J Alzheimers Dis. 2014; 42).
[0006] Пациенты с нейродегенеративными заболеваниями имеют повышенные уровни циркулирующей вкДНК, в том числе вкДНК микробного происхождения, что в значительной степени способствует прогрессированию нейродегенерации (см., например, публикацию международной заявки WO2016/190780) посредством различных механизмов, включая передачу через гематоэнцефалический барьер (BBB) и непосредственное повреждение нейронов, высвобождение интрацеребральных нейтрофильных ловушек ДНК (Zenaro, 2015) и инициирование возникновения церебральных тромботических артериопатий.
[0007] Авторы настоящего изобретения ранее продемонстрировали, что системное введение высоких доз белка ДНКазы в кровоток пациента может быть полезным для лечения ряда заболеваний и состояний, связанных с повышенными уровнями вкДНК в крови, включая рак (например, карциному, саркому, лимфому, меланому; см., например, патенты США №№ 7612032; 8710012; 9248166), развитие соматического мозаицизма (см., например, публикацию заявки на патент США № US20170056482), побочные эффекты, связанные с химиотерапией или лучевой терапией (см., например, публикацию заявки на патент США № US20170100463), нейродегенеративные заболевания (см., например, публикацию международной заявки № WO2016/190780), инфекции (см., например, патенты США № 8431123 и 9072733), диабет (см., например, патент США № 8388951), атеросклероз (см., например, патент США № 8388951), инсульт (см., например, патент США № 8796004), стенокардию (см., например, патент США № 8796004), ишемию (см., например, патент США № 8796004), повреждение почек (см., например, патент США № 9770492), реакции гиперчувствительности замедленного типа, такие как, например, болезнь «трансплантат против хозяина» [GVHD]) (см., например, патент США № 8535663), снижение фертильности (см., например, патент США № 8916151), возрастное нарушение подвижности сперматозоидов (см., например, патент США № 8871200) и старение (см., например, публикацию заявки на патент США № US20150110769). Все указанные патенты и заявки полностью включены в настоящую заявку посредством ссылки.
[0008] Другие позже продемонстрировали аналогичные эффекты. (Wen, 2013; Cederval, 2015; Tohme, 2016; Patutina, 2011; Li, 2015). РчДНКаза I также подавляла развитие метастатического заболевания на 60-90% при ежедневном введении в дозе 0,02-2,3 мг/кг на модели метастатического заболевания карциномы легких и гепатомы (Patutina, 2011). Li (Li, 2015) сообщил об успешном применении ДНКазы I для лечения GVHD у мышей.
[0009] Хотя системное введение белка ДНКазы, по-видимому, подходит для лечения заболеваний и состояний, связанных с повышенным количеством циркулирующей вкДНК, в клинических условиях системное лечение белком ДНКазы показало ограниченные эффекты (см., например, публикацию международной заявки № WO2014/020564). Таким образом, существует потребность в более эффективных способах снижения уровней циркулирующей вкДНК, чтобы повысить эффективность лечения заболеваний и состояний, связанных с повышенными уровнями вкДНК в крови, таких как, например, рак, развитие соматического мозаицизма, побочные эффекты, связанные с химиотерапией или лучевой терапией, нейродегенеративные заболевания, инфекции, реакции гиперчувствительности замедленного типа, диабет, атеросклероз, ишемия, инсульт, стенокардия, снижение фертильности, возрастное нарушение подвижности сперматозоидов, старение и т.д.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] Как обсуждалось выше в разделе «Уровень техники», существует потребность в более эффективных способах снижения уровней циркулирующей вкДНК, чтобы повысить эффективность лечения заболеваний и состояний, связанных с повышенными уровнями вкДНК в крови. Настоящее изобретение направлено на эти и другие потребности путем обеспечения способов и композиций для печень-специфичной доставки и/или экспрессии ферментов, обладающих ДНКазной активностью.
[0011] В одном аспекте в настоящем изобретении предложен рекомбинантный вектор экспрессии аденоассоциированного вируса (rAAV), содержащий (i) белок капсида и (ii) нуклеиновую кислоту, содержащую промотор, функционально связанный с нуклеотидной последовательностью, кодирующей фермент, который имеет дезоксирибонуклеазную (ДНКазную) активность, где промотор представляет собой печень-специфичный промотор. В одном варианте реализации печень-специфичный промотор опосредует в значительной степени повышенную экспрессию фермента в печени по сравнению с другими тканями и органами.
[0012] В другом аспекте в настоящем изобретении предложен рекомбинантный вектор экспрессии аденоассоциированного вируса (rAAV), содержащий (i) белок капсида и (ii) нуклеиновую кислоту, содержащую промотор, функционально связанный с нуклеотидной последовательностью, кодирующей фермент, имеющий дезоксирибонуклеазную (ДНКазную) активность, где белок капсида обеспечивает эффективное и/или предпочтительное нацеливание вектора на печень при введении in vivo. В одном варианте реализации белок капсида представляет собой VP3. В одном варианте реализации белок капсида включает одну или более мутаций, которые улучшают эффективность и/или специфичность доставки вектора в печень по сравнению с соответствующим белком капсида дикого типа. В одном конкретном варианте реализации улучшенная эффективность и/или специфичность доставки вектора в печень приводит к существенному увеличению экспрессии фермента в печени по сравнению с другими тканями и органами.
[0013] Неограничивающие примеры ферментов, обладающих ДНКазной активностью, которые можно применять в векторах согласно настоящему изобретению, включают, например, ДНКазу I, ДНКазу X, ДНКазу γ, ДНКазу 1L1, ДНКазу 1L2, ДНКазу 1L3, ДНКазу II, ДНКазу IIα, ДНКазу IIβ, активированную каспазой ДНКазу (CAD), эндонуклеазу G (ENDOG), гранзим B (GZMB), фосфодиэстеразу I, лактоферрин, ацетилхолинэстеразу или их мутанты или производные. В одном варианте реализации фермент, обладающий ДНКазной активностью, представляет собой ДНКазу I (например, человеческую ДНКазу I) или ее мутант или производное. В одном варианте реализации нуклеиновая кислота включает последовательность SEQ ID NO: 30 или SEQ ID NO: 31. В одном варианте реализации мутант ДНКазы I включает одну или более мутаций в сайте связывания актина (например, Gln-9, Glu-13, Thr-14, His-44, Asp-53, Tyr-65, Val-66, Val-67, Glu-69, Asn-74, Ala-114 и любые их комбинации; положения указаны в отношении последовательности зрелого белка, лишенного секреторной сигнальной последовательности). В одном варианте реализации одна из мутаций в актин-связывающем сайте представляет собой мутацию в Ala-114. В одном варианте реализации мутант ДНКазы I включает одну или более мутаций, повышающих ДНКазную активность (например, Q9R, E13R, E13K, T14R, T14K, H44R, H44K, N74K, A114F и любые их комбинации; положения указаны в отношении последовательности зрелого белка, лишенного секреторной сигнальной последовательности). В одном варианте реализации мутант ДНКазы I включает одну или более мутаций, выбранных из группы, состоящей из Q9R, E13R, N74K и A114F и любых их комбинаций. В одном варианте реализации мутант ДНКазы I включает мутацию Q9R. В одном варианте реализации мутант ДНКазы I включает мутацию E13R. В одном варианте реализации мутант ДНКазы I включает мутацию N74K. В одном варианте реализации мутант ДНКазы I включает мутацию A114F.
[0014] В одном варианте реализации мутант ДНКазы I включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности SEQ ID NO: 5. В одном варианте реализации мутант ДНКазы I включает мутации Q9R, E13R, N74K и A114F. В одном варианте реализации мутант ДНКазы I включает последовательность SEQ ID NO: 5.
[0015] В одном варианте реализации мутант ДНКазы I включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности SEQ ID NO: 2. В одном варианте реализации мутант ДНКазы I включает мутации Q9R, E13R, N74K и A114F. В одном варианте реализации мутант ДНКазы I включает последовательность SEQ ID NO: 2.
[0016] В одном варианте реализации мутант ДНКазы I состоит из последовательности SEQ ID NO: 2 или SEQ ID NO: 5.
[0017] В одном варианте реализации мутант ДНКазы I содержит одну или более мутаций, выбранных из группы, состоящей из H44C, H44N, L45C, V48C, G49C, L52C, D53C, D53R, D53K, D53Y, D53A, N56C, D58S, D58T, Y65A, Y65E, Y65R, Y65C, V66N, V67E, V67K, V67C, E69R, E69C, A114C, A114R, H44N:T46S, D53R:Y65A, D53R:E69R, H44A:D53R:Y65A, H44A:Y65A:E69R, H64N:V66S, H64N:V66T, Y65N:V67S, Y65N:V67T, V66N:S68T, V67N:E69S, V67N:E69T, S68N:P70S, S68N:P70T, S94N:Y96S, S94N:Y96T и любых их комбинаций. В одном варианте реализации нуклеотидная последовательность кодирует ДНКазу I, содержащую последовательность SEQ ID NO: 4. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 23. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 23. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 23. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 23. В одном варианте реализации нуклеотидная последовательность кодирует ДНКазу I, содержащую последовательность SEQ ID NO: 1. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 22. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 22. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 22. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 22. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 32. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 32. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 32. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 32. В одном варианте реализации нуклеотидная последовательность кодирует мутант ДНКазы I, содержащий последовательность SEQ ID NO: 24. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 29. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 29. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 29. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 29. В одном варианте реализации нуклеотидная последовательность кодирует мутант ДНКазы I, содержащий последовательность SEQ ID NO: 26. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 28. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 28. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 28. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 28. В одном варианте реализации нуклеотидная последовательность кодирует мутант ДНКазы I, содержащий последовательность SEQ ID NO: 5. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 21. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 21. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 21. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 21. В одном варианте реализации нуклеотидная последовательность кодирует мутант ДНКазы I, содержащий последовательность SEQ ID NO: 2. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 19. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 19. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 19. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 19.
[0018] В одном варианте реализации фермент, обладающий ДНКазной активностью, представляет собой слитый белок, содержащий (i) фермент ДНКазу или его фрагмент, связанный с (ii) альбумином или полипептидом Fc или его фрагментом. В одном варианте реализации последовательность, кодирующая фермент, обладающий ДНКазной активностью, включает последовательность, кодирующую секреторную сигнальную последовательность, где указанная секреторная сигнальная последовательность опосредует эффективную секрецию фермента в синусоидальную систему печени при экспрессии вектора в печени. Неограничивающие примеры подходящих секреторных сигнальных последовательностей включают, например, секреторную сигнальную последовательность ДНКазы I, секреторную сигнальную последовательность IL2, секреторную сигнальную последовательность альбумина, секреторную сигнальную последовательность β-глюкуронидазы, секреторную сигнальную последовательность щелочной протеазы и секреторную сигнальную последовательность фибронектина. В одном конкретном варианте реализации секреторная сигнальная последовательность включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности MRGMKLLGALLALAALLQGAVS (SEQ ID NO: 6). В одном конкретном варианте реализации секреторная сигнальная последовательность включает последовательность MRGMKLLGALLALAALLQGAVS (SEQ ID NO: 6). В одном конкретном варианте реализации секреторная сигнальная последовательность включает последовательность MRGMKLLGALLALAALLQGAVS (SEQ ID NO: 6). В одном конкретном варианте реализации секреторная сигнальная последовательность включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности MYRMQLLSCIALSLALVTNS (SEQ ID NO: 7). В одном конкретном варианте реализации секреторная сигнальная последовательность включает последовательность MYRMQLLSCIALSLALVTNS (SEQ ID NO: 7). В одном конкретном варианте реализации секреторная сигнальная последовательность состоит из последовательности MYRMQLLSCIALSLALVTNS (SEQ ID NO: 7). В одном конкретном варианте реализации последовательность, кодирующая секреторную сигнальную последовательность, включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 20. В одном конкретном варианте реализации последовательность, кодирующая секреторную сигнальную последовательность, включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 20. В одном конкретном варианте реализации последовательность, кодирующая секреторную сигнальную последовательность, включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 20. В одном конкретном варианте реализации последовательность, кодирующая секреторную сигнальную последовательность, включает нуклеотидную последовательность SEQ ID NO: 20.
[0019] В одном конкретном варианте реализации секреторная сигнальная последовательность включает последовательность MRYTGLMGTLLTLVNLLQLAGT (SEQ ID NO: 25). В одном конкретном варианте реализации секреторная сигнальная последовательность состоит из последовательности MRYTGLMGTLLTLVNLLQLAGT (SEQ ID NO: 25). В одном конкретном варианте реализации секреторная сигнальная последовательность содержит последовательность, которая по меньшей мере на 80% идентична последовательности MRYTGLMGTLLTLVNLLQLAGT (SEQ ID NO: 25). В одном конкретном варианте реализации последовательность, кодирующая секреторную сигнальную последовательность, включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 27. В одном конкретном варианте реализации последовательность, кодирующая секреторную сигнальную последовательность, включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 27. В одном конкретном варианте реализации последовательность, кодирующая секреторную сигнальную последовательность, включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 27. В одном конкретном варианте реализации последовательность, кодирующая секреторную сигнальную последовательность, включает нуклеотидную последовательность SEQ ID NO: 27.
[0020] Неограничивающие примеры промоторов, которые можно применять в векторах согласно настоящему изобретению, включают, например, промотор альбумина, промотор α1-антитрипсина (AAT), промотор глобулина, связывающего тироидный гормон, промотор альфа-фетопротеина, промотор алкогольдегидрогеназы, промотор фактора VIII (FVIII), основной промотор HBV (BCP), промотор HBV PreS2, промотор фосфоенолпируваткарбоксикиназы (PEPCK), промотор тироксинсвязывающего глобулина (TBG), гибридный промотор контрольного участка печени (англ. Hepatic Control Region) (HCR)-ApoCII, гибридный промотор HCR-hAAT, промотор аполипопротеина E (ApoE), промотор липопротеина низкой плотности, промотор пируваткиназы, промотор фосфенолпируваткарбоксикиназы, промотор фенилаланингидроксилазы, промотор лецитин-холестерин-ацилтрансферазы (LCAT), промотор аполипопротеина H (ApoH), промотор аполипопротеина A-II (APOA2), промотор трансферрина, промотор транстиретина, промотор α-фибриногена, промотор β-фибриногена, промотор альфа-1-антихимотрипсина, промотор гликопротеина α2-HS, промотор гаптоглобина, промотор церулоплазмина, промотор плазминогена, промотор белка комплемента, промотор α1-кислого гликопротеина, промотор LSP1, промотор ингибитора серпиновой пептидазы, промотор члена 1 клады A (SERPINA1) (hAAT), промотор полипептида 4 подсемейства А семейства 3 цитохрома P450 (CYP3A4), промотор микроРНК 122 (miR-122), печень-специфичный промотор P1 IGF-II, промотор транстиретина (MTTR) и промотор α-фетопротеина (AFP).
[0021] В одном варианте реализации промотор представляет собой промотор альбумина. В одном конкретном варианте реализации промотор альбумина включает последовательность SEQ ID NO: 8. В одном конкретном варианте реализации промотор альбумина состоит из последовательности SEQ ID NO: 8. См. также Frain et al., Mol. Cell Biol., 1990, 10(3):991-999.
[0022] В одном варианте реализации промотор представляет собой промотор α1-антитрипсина (AAT). В одном варианте реализации промотор представляет собой промотор α1-антитрипсина человека (hAAT). В одном конкретном варианте реализации промотор антитрипсина включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности SEQ ID NO: 15. В одном конкретном варианте реализации промотор AAT включает последовательность SEQ ID NO: 15. В одном конкретном варианте реализации промотор AAT состоит из последовательности SEQ ID NO: 15.
[0023] В одном варианте реализации капсидный белок включает одну или более мутаций, выбранных из группы, состоящей из S279A, S671A, K137R, T252A и любых их комбинаций. В одном варианте реализации одна или более мутаций в капсидном белке включает мутацию K137R. В одном варианте реализации капсидный белок включает последовательность SEQ ID NO:3 [Anc80]. В одном варианте реализации капсидный белок состоит из последовательности SEQ ID NO:3 [Anc80]. В одном варианте реализации капсидный белок включает последовательность SEQ ID NO:9 [Anc80]. В одном варианте реализации капсидный белок состоит из последовательности SEQ ID NO:9 [Anc80]. В одном варианте реализации капсидный белок включает последовательность SEQ ID NO:34 [Anc80L65]. В одном варианте реализации капсидный белок состоит из последовательности SEQ ID NO:34 [Anc80L65]. В одном варианте реализации капсидный белок включает последовательность SEQ ID NO:35 [Anc80L65 variant]. В одном варианте реализации капсидный белок состоит из последовательности SEQ ID NO:35 [Anc80L65 variant]. В одном варианте реализации капсидный белок представляет собой мутант капсидного белка AAV8, такой как, например, AAV3G1, AAVT20 или AAVTR1, или другой мутант капсидного белка, описанный в публикации международной заявки на патент № WO2017/180854 (например, содержащий мутации VP3 в аминокислотах 263-267 [например, 263NGTSG267->SGTH или 263NGTSG267->SDTH] и/или аминокислотах 457-459 [например, 457TAN459->SRP], и/или аминокислотах 455-459 [например, 455GGTAN459 ->DGSGL] и/или аминокислотах 583-597).
[0024] Неограничивающие примеры AAV, которые можно применять в векторах согласно настоящему изобретению, включают, например, серотип 1 (AAV1), AAV2, AAV3 (включая AAV3A и AAV3B), AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAVrh10, AAVLK03, AAVhu37, AAVrh64R1, и Anc 80. В одном конкретном варианте реализации AAV принадлежит серотипу 8 или Anc 80.
[0025] В одном варианте реализации нуклеиновая кислота вектора AAV дополнительно включает два инвертированных концевых повтора (ITR) AAV, при этом ITR фланкируют нуклеотидную последовательность, кодирующую фермент, обладающий ДНКазной активностью.
[0026] В одном варианте реализации нуклеиновая кислота вектора AAV дополнительно включает один или более энхансеров, расположенных выше или ниже промотора. В одном варианте реализации энхансер может быть расположен непосредственно выше промотора, например, где 3'-конец энхансерной последовательности слит непосредственно с 5'-концом промоторной последовательности. Неограничивающие примеры подходящих энхансеров включают, например, энхансер аполипопротеина E (ApoE) (например, энхансер ApoE контрольного участка печени-1 (HCR-1) или энхансер ApoE HCR-2), энхансер альфа-фетопротеина, энхансер TTR, энхансер LSP, энхансер α1-микроглобулина/бикунина, энхансер гена альбумина (Ealb) и любую их комбинацию. В одном конкретном варианте реализации энхансер представляет собой энхансер ApoE. В одном конкретном варианте реализации энхансер представляет собой энхансер ApoE, расположенный выше промотора. В одном конкретном варианте реализации энхансер представляет собой энхансер ApoE, слитый с 5'-концом промотора. В одном конкретном варианте реализации энхансер ApoE представляет собой энхансер контрольного участка печени (HCR). В одном конкретном варианте реализации энхансер включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности SEQ ID NO: 17. В одном конкретном варианте реализации энхансер включает последовательность SEQ ID NO: 17. В одном конкретном варианте реализации энхансер состоит из последовательности SEQ ID NO: 17.
[0027] В одном варианте реализации нуклеиновая кислота вектора AAV дополнительно включает сигнал полиаденилирования, функционально связанный с нуклеотидной последовательностью, кодирующей фермент, обладающий ДНКазной активностью.
[0028] В одном варианте реализации нуклеиновая кислота дополнительно содержит последовательность Козака. В одном конкретном варианте реализации последовательность Козака включает последовательность 5′-GCCGCCACC-3′ (SEQ ID NO: 33). В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 80% идентична SEQ ID NO: 30. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 30. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 30. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 30. В одном варианте реализации нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 30.
[0029] В одном варианте реализации нуклеиновая кислота дополнительно содержит посттранскрипционный регуляторный элемент. В одном варианте реализации посттранскрипционный регуляторный элемент представляет собой посттранскрипционный регуляторный элемент вируса гепатита сурка (WPRE). В одном конкретном варианте реализации WPRE не кодирует функциональный X-белок. В одном варианте реализации посттранскрипционный регуляторный элемент включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности SEQ ID NO: 16. В одном конкретном варианте реализации посттранскрипционный регуляторный элемент включает последовательность SEQ ID NO: 16. В одном конкретном варианте реализации посттранскрипционный регуляторный элемент состоит из последовательности SEQ ID NO: 16.
[0030] В одном варианте реализации нуклеиновая кислота вектора rAAV согласно настоящему изобретению включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5%, 99% или 99,5% идентичной последовательности SEQ ID NO: 19. В одном конкретном варианте реализации нуклеиновая кислота включает последовательность SEQ ID NO: 19. В одном конкретном варианте реализации нуклеиновая кислота состоит из последовательности SEQ ID NO: 19. В одном конкретном варианте реализации нуклеиновая кислота имеет карту, представленную на фигуре 10.
[0031] В одном варианте реализации в настоящем изобретении предложен рекомбинантный вектор экспрессии аденоассоциированного вируса (rAAV), содержащий (i) капсидный белок, содержащий последовательность SEQ ID NO: 34, и (ii) нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую фермент дезоксирибонуклеазу (ДНКазу), содержащий последовательность SEQ ID NO: 4, функционально связанную с промотором альбумина или промотором α1-антитрипсина (AAT).
[0032] В одном варианте реализации в настоящем изобретении предложен рекомбинантный вектор экспрессии аденоассоциированного вируса (rAAV), содержащий (i) капсидный белок, содержащий последовательность SEQ ID NO: 34, и (ii) нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую фермент дезоксирибонуклеазу (ДНКазу), содержащий последовательность SEQ ID NO: 5, функционально связанную с промотором альбумина или промотором α1-антитрипсина (AAT).
[0033] В одном варианте реализации в настоящем изобретении предложен рекомбинантный вектор экспрессии аденоассоциированного вируса (rAAV), содержащий (i) капсидный белок, содержащий последовательность SEQ ID NO: 34, и (ii) нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую фермент дезоксирибонуклеазу (ДНКазу), содержащий последовательность SEQ ID NO: 1, функционально связанную с промотором альбумина или промотором α1-антитрипсина (AAT).
[0034] В одном варианте реализации в настоящем изобретении предложен рекомбинантный вектор экспрессии аденоассоциированного вируса (rAAV), содержащий (i) капсидный белок, содержащий последовательность SEQ ID NO: 34, и (ii) нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую фермент дезоксирибонуклеазу (ДНКазу), содержащий последовательность SEQ ID NO: 2, функционально связанную с промотором альбумина или промотором α1-антитрипсина (AAT).
[0035] В одном варианте реализации в настоящем изобретении предложен рекомбинантный вектор экспрессии аденоассоциированного вируса (rAAV), содержащий (i) капсидный белок, содержащий последовательность SEQ ID NO: 34, и (ii) нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 30.
[0036] В одном варианте реализации в настоящем изобретении предложен рекомбинантный вектор экспрессии аденоассоциированного вируса (rAAV), содержащий (i) капсидный белок, содержащий последовательность SEQ ID NO: 34, и (ii) нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 31.
[0037] В связанном аспекте в настоящем изобретении предложены фармацевтические композиции и дозированные формы, содержащие любой из векторов rAAV согласно настоящему изобретению и фармацевтически приемлемый носитель и/или вспомогательное вещество.
[0038] В связанном аспекте в настоящем изобретении предложен способ доставки фермента, обладающего дезоксирибонуклеазной (ДНКазной) активностью, в печень у субъекта, нуждающегося в этом, включающий введение субъекту любого из векторов rAAV или фармацевтических композиций, описанных выше.
[0039] В другом аспекте в настоящем изобретении предложен способ лечения заболевания или состояния (например, рака, нейродегенеративного заболевания, атеросклероза или реакции гиперчувствительности замедленного типа) у субъекта, нуждающегося в этом, при этом заболевание или состояние сопровождается накоплением/повышенными уровнями внеклеточной ДНК (вкДНК) в портосинусоидальном кровотоке печени субъекта, при этом указанный способ включает введение субъекту терапевтически эффективного количества любого из векторов rAAV или фармацевтических композиций, описанных выше.
[0040] В дополнительном аспекте в настоящем изобретении предложен способ лечения рака у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту терапевтически эффективного количества любого из векторов rAAV или фармацевтических композиций, описанных выше. В одном варианте реализации рак возникает и/или метастазирует в органах, тканях и/или структурах, из которых отток происходит в воротную вену. В одном варианте реализации способ эффективен для ингибирования метастазирования. Неограничивающие примеры рака, подлежащего лечению способами согласно настоящему изобретению, включают, например, перитонеальный карциноматоз, лимфому, рак желудка, рак толстой кишки, рак кишечника, колоректальный рак, рак поджелудочной железы, рак печени, рак желчного протока, рак желчного пузыря, саркому и метастатическое заболевание печени любого происхождения.
[0041] В другом аспекте в настоящем изобретении предложен способ лечения нейродегенеративного заболевания у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту терапевтически эффективного количества любого из векторов rAAV или фармацевтических композиций, описанных выше. Неограничивающие примеры нейродегенеративных заболеваний, подлежащих лечению способами согласно настоящему изобретению, включают, например, болезнь Альцгеймера, легкое когнитивное нарушение (MCI), синдром CADASIL, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий надъядерный паралич (PSP), кортикобазальную дегенерацию (CBD), болезнь аргирофильных зерен (AGD), болезнь Пика (PiD), болезнь Хантингтона (HD) и лобно-височную деменцию с паркинсонизмом-17 (FTDP-17). В одном варианте реализации нейродегенеративное заболевание связано с образованием неправильно свернутого белка вследствие присутствия ДНК. В одном конкретном варианте реализации ДНК представляет собой ДНК человека, микробную ДНК, внеклеточную ДНК или внутриклеточную ДНК.
[0042] В одном варианте реализации нейродегенеративное заболевание является вторичным по отношению к диабету, ревматоидному артриту, системной красной волчанке (СКВ), подагре, метаболическому синдрому, амилоидозу, астме или прионной болезни. В одном варианте реализации амилоидоз представляет собой амилоидоз с наследственным кровоизлиянием в мозг, первичный системный амилоидоз, вторичный системный амилоидоз, сывороточный амилоидоз, старческий системный амилоидоз, амилоидоз, связанный с гемодиализом, наследственный системный амилоидоз финского типа, атриальный амилоидоз, лизоцимный системный амилоидоз (англ. Lysozyme systemic amyloidosis), амилоидоз, связанный с инсулином, или амилоидоз, связанный с а-цепью фибриногена.
[0043] В другом аспекте в настоящем изобретении предложен способ лечения реакции гиперчувствительности замедленного типа у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту терапевтически эффективного количества любого из векторов rAAV или фармацевтических композиций, описанных выше. В одном варианте реализации реакция гиперчувствительности замедленного типа представляет собой болезнь «трансплантат против хозяина» (GVHD).
[0044] В дополнительном аспекте в настоящем изобретении предложен способ лечения атеросклероза у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту терапевтически эффективного количества любого из векторов rAAV или фармацевтических композиций, описанных выше.
[0045] В другом аспекте в настоящем изобретении предложен способ предотвращения или устранения одного или более побочных эффектов, связанных с химиотерапией или лучевой терапией у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту терапевтически эффективного количества любого из векторов rAAV или фармацевтических композиций, описанных выше. В одном варианте реализации указанные один или более побочных эффектов химиотерапии выбраны из группы, состоящей из потери массы тела, токсичности в отношении костного мозга, катаболических изменений в биохимии крови, кардиотоксичности (например, некроза миокарда), токсичности в отношении желудочно-кишечного тракта, подавления иммунитета и нейтропении. В одном варианте реализации химиотерапия включает введение одного или более соединений, выбранных из группы, состоящей из антиметаболитов, алкилирующих агентов, противораковых антибиотиков, агентов, нацеленных на микротрубочки, ингибиторов топоизомеразы, алкалоидов и целевых терапевтических средств. В одном варианте реализации химиотерапия включает введение одного или более соединений, выбранных из группы, состоящей из антрациклина, доксорубицина, 5-фторурацила (5-FU), этопозида, таксана и циклофосфамида. В одном варианте реализации указанные один или более побочных эффектов лучевой терапии выбраны из группы, состоящей из потери массы тела, раздражения кожи, повреждения кожи, усталости, тошноты, рвоты, фиброза, повреждения кишечника, потери памяти, бесплодия и вторичного рака. В одном варианте реализации лучевая терапия представляет собой лучевую терапию внешним пучком или системную радиоизотопную терапию. В одном варианте реализации вектор rAAV или векторную композицию вводят во время цикла химиотерапии или лучевой терапии. В другом варианте реализации вектор rAAV или векторную композицию вводят после цикла химиотерапии или лучевой терапии. В одном варианте реализации химиотерапию или лучевую терапию применяют для лечения рака, выбранного из группы, состоящей из перитонеального карциноматоза, лимфомы, рака желудка, рака толстой кишки, рака кишечника, колоректального рака, рака поджелудочной железы, рака печени, рака желчного протока, рака желчного пузыря, саркомы и метастатического заболевания печени любого происхождения.
[0046] В одном варианте реализации любого из вышеупомянутых способов согласно настоящему изобретению введение вектора rAAV или векторной композиции приводит к экспрессии фермента, который обладает ДНКазной активностью, и его секреции в портосинусоидальный кровоток печени субъекта.
[0047] В одном варианте реализации любого из вышеуказанных способов согласно настоящему изобретению вектор rAAV или векторную композицию вводят в дозе и режиме, которые достаточны для снижения уровня внеклеточной ДНК (вкДНК) в портосинусоидальном кровотоке указанного субъекта.
[0048] В одном варианте реализации любого из вышеуказанных способов согласно настоящему изобретению субъектом является человек.
[0049] В другом аспекте в настоящем изобретении предложен способ доставки фермента, обладающего дезоксирибонуклеазной (ДНКазной) активностью, в печень субъекта, нуждающегося в этом, включающий введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей указанный фермент, где промотор представляет собой печень-специфичный промотор.
[0050] В дополнительном аспекте в настоящем изобретении предложен способ доставки фермента, который обладает дезоксирибонуклеазной (ДНКазной) активностью, в печень субъекта, нуждающегося в этом, включающий введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей указанный фермент, при этом вектор включает одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени при введении in vivo.
[0051] В другом аспекте в настоящем изобретении предложен способ лечения заболевания или состояния у субъекта, нуждающегося в этом, где заболевание или состояние сопровождается накоплением/повышенными уровнями внеклеточной ДНК (вкДНК) в портосинусоидальном кровотоке печени субъекта, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом промотор представляет собой печень-специфичный промотор. В одном варианте реализации заболевание выбрано из группы, состоящей из рака (включая метастатическое заболевание печени), нейродегенеративного заболевания, атеросклероза и реакции гиперчувствительности замедленного типа.
[0052] В другом аспекте в настоящем изобретении предложен способ лечения заболевания или состояния у субъекта, нуждающегося в этом, где заболевание или состояние сопровождается накоплением/повышенными уровнями внеклеточной ДНК (вкДНК) в портосинусоидальном кровотоке печени субъекта, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом вектор включает одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени. В одном варианте реализации заболевание выбрано из группы, состоящей из рака (включая метастатическое заболевание печени), нейродегенеративного заболевания, атеросклероза и реакции гиперчувствительности замедленного типа.
[0053] В дополнительном аспекте в настоящем изобретении предложен способ лечения рака у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, который имеет дезоксирибонуклеазную (ДНКазную) активность, где промотор представляет собой печень-специфичный промотор. В одном варианте реализации рак возникает и/или метастазирует в органах, тканях и/или структурах, из которых отток происходит в воротную вену.
[0054] В другом аспекте в настоящем изобретении предложен способ лечения рака у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом вектор включает одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени. В одном варианте реализации рак возникает и/или метастазирует в органах, тканях и/или структурах, из которых отток происходит в воротную вену.
[0055] В другом аспекте в настоящем изобретении предложен способ лечения рака у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом указанный вектор экспрессии обеспечивает синтез фермента ДНКазы в печени указанного субъекта, и при этом рак возникает и/или метастазирует в органах, тканях и/или структурах, из которых отток происходит в воротную вену.
[0056] Неограничивающие примеры рака, подлежащего лечению любым из вышеуказанных способов лечения рака, включают, например, перитонеальный карциноматоз, лимфому, рак желудка, рак толстой кишки, рак кишечника, колоректальный рак, рак поджелудочной железы, рак печени, рак желчного протока, рак желчного пузыря, саркому и метастатическое заболевание печени любого происхождения.
[0057] В одном варианте реализации любого из вышеуказанных способов лечения рака, способ является эффективным для ингибирования метастазирования.
[0058] В другом аспекте в настоящем изобретении предложен способ лечения нейродегенеративного заболевания у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, который имеет дезоксирибонуклеазную (ДНКазную) активность, где промотор представляет собой печень-специфичный промотор.
[0059] В другом аспекте в настоящем изобретении предложен способ лечения нейродегенеративного заболевания у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом вектор включает одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени.
[0060] В другом аспекте в настоящем изобретении предложен способ лечения нейродегенеративного заболевания у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом указанный вектор экспрессии обеспечивает синтез фермента ДНКазы в печени указанного субъекта, и при этом микробная внеклеточная ДНК (вкДНК) кишечного происхождения обнаруживается в крови указанного пациента.
[0061] Неограничивающие примеры нейродегенеративных заболеваний, подлежащих лечению любым из вышеуказанных способов лечения нейродегенеративных заболеваний, включают, например, болезнь Альцгеймера, легкое когнитивное нарушение (MCI), синдром CADASIL, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий надъядерный паралич (PSP), кортикобазальную дегенерацию (CBD), болезнь аргирофильных зерен (AGD), болезнь Пика (PiD), болезнь Хантингтона (HD) и лобно-височную деменцию с паркинсонизмом-17 (FTDP-17). В одном варианте реализации нейродегенеративное заболевание является вторичным по отношению к диабету, ревматоидному артриту, системной красной волчанке (СКВ), подагре, метаболическому синдрому, амилоидозу, астме или прионной болезни. В одном варианте реализации амилоидоз представляет собой амилоидоз с наследственным кровоизлиянием в мозг, первичный системный амилоидоз, вторичный системный амилоидоз, сывороточный амилоидоз, старческий системный амилоидоз, амилоидоз, связанный с гемодиализом, наследственный системный амилоидоз финского типа, атриальный амилоидоз, лизоцимный системный амилоидоз (англ. Lysozyme systemic amyloidosis), амилоидоз, связанный с инсулином, или амилоидоз, связанный с а-цепью фибриногена.
[0062] В другом аспекте в настоящем изобретении предложен способ лечения реакции гиперчувствительности замедленного типа у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, который имеет дезоксирибонуклеазную (ДНКазную) активность, где промотор представляет собой печень-специфичный промотор. В одном варианте реализации реакция гиперчувствительности замедленного типа представляет собой болезнь «трансплантат против хозяина» (GVHD).
[0063] В другом аспекте в настоящем изобретении предложен способ лечения реакции гиперчувствительности замедленного типа у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, который имеет дезоксирибонуклеазную (ДНКазную) активность, при этом вектор включает одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени. В одном варианте реализации реакция гиперчувствительности замедленного типа представляет собой болезнь «трансплантат против хозяина» (GVHD).
[0064] В дополнительном аспекте в настоящем изобретении предложен способ лечения атеросклероза у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, который имеет дезоксирибонуклеазную (ДНКазную) активность, где промотор представляет собой печень-специфичный промотор.
[0065] В другом аспекте в настоящем изобретении предложен способ лечения атеросклероза у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом вектор включает одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени.
[0066] В другом аспекте в настоящем изобретении предложен способ предотвращения или устранения одного или более побочных эффектов, связанных с химиотерапией или лучевой терапией у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, который имеет дезоксирибонуклеазную (ДНКазную) активность, где промотор представляет собой печень-специфичный промотор.
[0067] В другом аспекте в настоящем изобретении предложен способ предотвращения или устранения одного или более побочных эффектов, связанных с химиотерапией или лучевой терапией у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом вектор включает одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени.
[0068] В одном варианте реализации любого из вышеуказанных способов предотвращения или устранения одного или более побочных эффектов, связанных с химиотерапией, указанные один или более побочных эффектов химиотерапии выбраны из группы, состоящей из потери массы тела, токсичности в отношении костного мозга, катаболических изменений в биохимии крови, кардиотоксичности (например, некроза миокарда), токсичности в отношении желудочно-кишечного тракта, подавления иммунитета и нейтропении.
[0069] В одном варианте реализации любого из вышеуказанных способов предотвращения или устранения одного или более побочных эффектов, связанных с химиотерапией, химиотерапия включает введение одного или более соединений, выбранных из группы, состоящей из антиметаболитов, алкилирующих агентов, противораковых антибиотиков, агентов, нацеленных на микротрубочки, ингибиторов топоизомеразы, алкалоидов и целевых терапевтических средств.
[0070] В одном варианте реализации любого из вышеуказанных способов предотвращения или устранения одного или более побочных эффектов, связанных с химиотерапией, химиотерапия включает введение одного или более соединений, выбранных из группы, состоящей из антрациклина, доксорубицина, 5-фторурацила (5-FU), этопозида, таксана и циклофосфамида.
[0071] В одном варианте реализации любого из вышеуказанных способов предотвращения или устранения одного или более побочных эффектов, связанных с лучевой терапией, указанные один или более побочных эффектов лучевой терапии выбраны из группы, состоящей из потери массы тела, раздражения кожи, повреждения кожи, усталости, тошноты, рвоты, фиброза, повреждения кишечника, потери памяти, бесплодия и вторичного рака.
[0072] В одном варианте реализации любого из вышеуказанных способов предотвращения или устранения одного или более побочных эффектов, связанных с лучевой терапией, лучевая терапия представляет собой внешнюю лучевую терапию или системную радиоизотопную терапию.
[0073] В одном варианте реализации любого из вышеуказанных способов предотвращения или устранения одного или более побочных эффектов, связанных с химиотерапией или лучевой терапией, вектор вводят во время цикла химиотерапии или лучевой терапии.
[0074] В одном варианте реализации любого из вышеуказанных способов предотвращения или устранения одного или более побочных эффектов, связанных с химиотерапией или лучевой терапией, вектор вводят после цикла химиотерапии или лучевой терапии.
[0075] В одном варианте реализации любого из способов согласно настоящему изобретению вектор дополнительно содержит одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени.
[0076] В одном варианте реализации любого из способов согласно настоящему изобретению промотор представляет собой печень-специфичный промотор.
[0077] В одном варианте реализации любого из способов согласно настоящему изобретению вектор помещен в липосому или наночастицу.
[0078] В одном варианте реализации любого из способов согласно настоящему изобретению вектор применяют в форме голой ДНК.
[0079] В одном варианте реализации любого из способов согласно настоящему изобретению вектор представляет собой вирусный вектор. Неограничивающие примеры подходящих вирусных векторов включают, например, аденоассоциированные вирусные векторы, аденовирусные векторы, ретровирусные векторы (например, лентивирусные векторы) и гепатотропные вирусные векторы (например, векторы вируса гепатита B (HBV)).
[0080] В одном варианте реализации любого из способов согласно настоящему изобретению фермент, обладающий ДНКазной активностью, выбран из группы, состоящей из ДНКазы I, ДНКазы X, ДНКазы γ, ДНКазы 1L1, ДНКазы 1L2, ДНКазы 1L3, ДНКазы II, ДНКазы IIα, ДНКазы IIβ, активированной каспазой ДНКазы (CAD), эндонуклеазы G (ENDOG), гранзима B (GZMB), фосфодиэстеразы I, лактоферрина, ацетилхолинэстеразы или их мутантов или производных. В одном варианте реализации фермент, ДНКаза представляет собой ДНКазу I (например, человеческую ДНКазу I) или ее мутант или производное. В одном варианте реализации мутант ДНКазы I включает одну или более мутаций в сайте связывания актина (например, Gln-9, Glu-13, Thr-14, His-44, Asp-53, Tyr-65, Val-66, Val-67, Glu-69, Asn-74, Ala-114 и любые их комбинации; положения указаны в отношении последовательности зрелого белка, лишенного секреторной сигнальной последовательности). В одном варианте реализации одна из мутаций в актин-связывающем сайте представляет собой мутацию в Ala-114. В одном варианте реализации мутант ДНКазы I включает одну или более мутаций, повышающих ДНКазную активность (например, Q9R, E13R, E13K, T14R, T14K, H44R, H44K, N74K, A114F и любые их комбинации; положения указаны в отношении последовательности зрелого белка, лишенного секреторной сигнальной последовательности). В одном варианте реализации мутант ДНКазы I включает одну или более мутаций, выбранных из группы, состоящей из Q9R, E13R, N74K и A114F и любых их комбинаций. В одном варианте реализации мутант ДНКазы I включает мутацию Q9R. В одном варианте реализации мутант ДНКазы I включает мутацию E13R. В одном варианте реализации мутант ДНКазы I включает мутацию N74K. В одном варианте реализации мутант ДНКазы I включает мутацию A114F.
[0081] В одном варианте реализации мутант ДНКазы I содержит одну или более мутаций, выбранных из группы, состоящей из H44C, H44N, L45C, V48C, G49C, L52C, D53C, D53R, D53K, D53Y, D53A, N56C, D58S, D58T, Y65A, Y65E, Y65R, Y65C, V66N, V67E, V67K, V67C, E69R, E69C, A114C, A114R, H44N:T46S, D53R:Y65A, D53R:E69R, H44A:D53R:Y65A, H44A:Y65A:E69R, H64N:V66S, H64N:V66T, Y65N:V67S, Y65N:V67T, V66N:S68T, V67N:E69S, V67N:E69T, S68N:P70S, S68N:P70T, S94N:Y96S, S94N:Y96T и любых их комбинаций. В одном варианте реализации мутант ДНКазы I представляет собой форму ДНКазы длительного действия. В одном варианте реализации ДНКаза I включает последовательность SEQ ID NO: 4. В одном варианте реализации ДНКаза I включает последовательность SEQ ID NO: 1. В одном варианте реализации мутант ДНКазы I включает последовательность SEQ ID NO: 5. В одном варианте реализации мутант ДНКазы I включает последовательность SEQ ID NO: 2.
[0082] В одном варианте реализации любого из способов согласно настоящему изобретению последовательность, кодирующая фермент, обладающий ДНКазной активностью, включает секреторную сигнальную последовательность, при этом указанная секреторная сигнальная последовательность опосредует эффективную секрецию фермента в портосинусоидальный кровоток печени при введении вектора субъекту. В одном варианте реализации секреторная сигнальная последовательность выбрана из группы, состоящей из секреторной сигнальной последовательности ДНКазы I, секреторной сигнальной последовательности IL2, секреторной сигнальной последовательности альбумина, секреторной сигнальной последовательности β-глюкуронидазы, секреторной сигнальной последовательности щелочной протеазы и секреторной сигнальной последовательности фибронектина. В одном конкретном варианте реализации секреторная сигнальная последовательность включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности MRGMKLLGALLALAALLQGAVS (SEQ ID NO: 6). В одном варианте реализации секреторная сигнальная последовательность включает последовательность MRGMKLLGALLALAALLQGAVS (SEQ ID NO: 6). В одном варианте реализации секреторная сигнальная последовательность состоит из последовательности MRGMKLLGALLALAALLQGAVS (SEQ ID NO: 6). В одном конкретном варианте реализации секреторная сигнальная последовательность включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной последовательности MYRMQLLSCIALSLALVTNS (SEQ ID NO: 7). В одном варианте реализации секреторная сигнальная последовательность включает последовательность MYRMQLLSCIALSLALVTNS (SEQ ID NO: 7). В одном конкретном варианте реализации секреторная сигнальная последовательность состоит из последовательности MYRMQLLSCIALSLALVTNS (SEQ ID NO: 7).
[0083] В одном варианте реализации любого из способов согласно настоящему изобретению, печень-специфичный промотор опосредует в значительной степени повышенную экспрессию фермента в печени по сравнению с другими тканями и органами. Неограничивающие примеры печень-специфичных промоторов, которые можно применять в способах и векторах согласно настоящему изобретению, включают, например, промотор альбумина, промотор α1-антитрипсина (AAT), промотор глобулина, связывающего тироидный гормон, промотор альфа-фетопротеина, промотор алкогольдегидрогеназы, промотор фактора VIII (FVIII), основной промотор HBV (BCP), промотор HBV PreS2, промотор фосфоенолпируваткарбоксикиназы (PEPCK), промотор тироксинсвязывающего глобулина (TBG), гибридный промотор контрольного участка печени (англ. Hepatic Control Region) (HCR)-ApoCII, гибридный промотор HCR-hAAT, промотор аполипопротеина E (ApoE), промотор липопротеина низкой плотности, промотор пируваткиназы, промотор фосфенолпируваткарбоксикиназы, промотор фенилаланингидроксилазы, промотор лецитин-холестерин-ацилтрансферазы (LCAT), промотор аполипопротеина H (ApoH), промотор аполипопротеина A-II (APOA2), промотор трансферрина, промотор транстиретина, промотор α-фибриногена, промотор β-фибриногена, промотор альфа-1-антихимотрипсина, промотор гликопротеина α2-HS, промотор гаптоглобина, промотор церулоплазмина, промотор плазминогена, промотор белка комплемента, промотор α1-кислого гликопротеина, промотор LSP1, промотор ингибитора серпиновой пептидазы, промотор члена 1 клады A (SERPINA1) (hAAT), промотор полипептида 4 подсемейства А семейства 3 цитохрома P450 (CYP3A4), промотор микроРНК 122 (miR-122), печень-специфичный промотор P1 IGF-II, промотор транстиретина (MTTR) и промотор α-фетопротеина (AFP). В одном варианте реализации печень-специфичный промотор представляет собой промотор альбумина. В одном конкретном варианте реализации промотор альбумина включает последовательность SEQ ID NO: 8. В одном варианте реализации промотор альбумина состоит из последовательности SEQ ID NO: 8. См. также Frain et al., Mol. Cell Biol., 1990, 10(3):991-999.
[0084] В одном конкретном варианте реализации печень-специфичный промотор представляет собой промотор α1-антитрипсина (AAT). В одном конкретном варианте реализации промотор антитрипсина представляет собой промотор α1-антитрипсина человека (AAT). В одном конкретном варианте реализации промотор AAT включает последовательность SEQ ID NO: 15. В одном конкретном варианте реализации промотор AAT включает последовательность SEQ ID NO: 15. В одном конкретном варианте реализации промотор AAT состоит из последовательности SEQ ID NO: 15. В различных вариантах реализации любого из способов согласно настоящему изобретению вектор содержит энхансер. Энхансер может представлять собой энхансер контрольного участка печени, такой как HCR-1 или HCR-2, связанный с геном ApoE, например, геном ApoE человека. В одном конкретном варианте реализации энхансер включает последовательность SEQ ID NO: 17. В одном конкретном варианте реализации энхансер состоит из последовательности SEQ ID NO: 17.
[0085] В различных вариантах реализации любого из способов согласно настоящему изобретению вектор содержит последовательность Козака, расположенную выше последовательности, кодирующей ДНКазу. Последовательность Козака может иметь последовательность 5′-GCCGCCACC-3′ (SEQ ID NO: 33).
[0086] В различных вариантах реализации любого из способов согласно настоящему изобретению вектор включает посттранскрипционный регуляторный элемент, например, WPRE, который не кодирует функциональный белок X. В одном конкретном варианте реализации посттранскрипционный регуляторный элемент включает последовательность SEQ ID NO: 16. В одном конкретном варианте реализации посттранскрипционный регуляторный элемент состоит из последовательности SEQ ID NO: 16.
[0087] В различных вариантах реализации любого из способов согласно настоящему изобретению вектор включает последовательность, которая является по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5%, 99% или 99,5% идентичной последовательности SEQ ID NO: 19. В одном конкретном варианте реализации нуклеиновая кислота включает последовательность SEQ ID NO: 19. В одном конкретном варианте реализации нуклеиновая кислота состоит из последовательности SEQ ID NO: 19. В одном конкретном варианте реализации нуклеиновая кислота имеет карту, представленную на фигуре 10.
[0088] В одном варианте реализации любого из способов согласно настоящему изобретению введение вектора приводит к экспрессии фермента и его секреции в портосинусоидальный кровоток печени субъекта.
[0089] В одном варианте реализации любого из способов согласно настоящему изобретению вектор вводят в дозе и режиме, которые достаточны для снижения уровня внеклеточной ДНК (вкДНК) в портосинусоидальном кровотоке указанного субъекта.
[0090] В одном варианте реализации любого из способов согласно настоящему изобретению субъектом является человек.
[0091] В одном варианте реализации любого из способов согласно настоящему изобретению способ дополнительно включает выбор субъекта с повышенным уровнем внеклеточной ДНК (вкДНК) в кровотоке по сравнению с уровнем вкДНК в кровотоке нормального здорового субъекта.
[0092] В одном варианте реализации любого из способов согласно настоящему изобретению способ дополнительно включает введение субъекту фермента дезоксирибонуклеазы (ДНКазы) (например, ДНКазы I, ДНКазы X, ДНКазы γ, ДНКазы 1L1, ДНКазы 1L2, ДНКазы 1L3, ДНКазы II (включая ДНКазу IIα и ДНКазу IIβ), активированной каспазой ДНКазы (CAD), эндонуклеазы G (ENDOG), гранзима B (GZMB), фосфодиэстеразы I, лактоферрина, ацетилхолинэстеразы или их мутантов или производных). В одном конкретном варианте реализации ДНКаза представляет собой ДНКазу I или ее мутант или производное.
[0093] Данные и другие аспекты настоящего изобретения будут очевидны специалистам в данной области техники из следующего описания, формулы изобретения и чертежей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0094] На фигуре 1 показаны органы и ткани, отток из которых происходит в воротную вену печени. Например, воротная вена отводит кровь из нижней части пищевода, желудка, поджелудочной железы, желчного пузыря, селезенки, тонкой кишки, толстой кишки, верхней части мочевого пузыря и печени.
[0095] На фигурах 2A-2I показаны сводные данные о пациентах и индивидуальные электрофоретические данные крови для девяти пациентов с метастатическим заболеванием на поздней стадии, которые получали лечение внутривенной бычьей ДНКазой I. (A) карцинома прямой кишки, (B) карцинома легкого, (C) карцинома легкого, (D) меланома, (E) рак молочной железы, (F) аденокарцинома, (G) рак почек, (H) рак прямой кишки, (I) рак молочной железы.
[0096] На фигуре 3 показано гамма-иммуноcцинтиграфическое изображение мыши с опухолью, полученное на 15-й день через один час после инъекции меченных 99mTc антител к ДНК, причем в зоне печени (b) в центре/справа наблюдается значительно большая радиоактивность, чем в зоне опухоли (а) слева внизу.
[0097] На фигуре 4 показаны микрофотографии IHC ткани печени из различных групп, перечисленных в таблице 3, и обработанных, как описано в примере 4. Большое количество вкДНК было обнаружено в печени мыши, получавшей гемцитабин (группа 7). Сравнительно небольшое количество вкДНК было обнаружено в печени мыши, получавшей ДНКазу I mAFP/Alb AAV8, вектор AAV8, нацеленный на ген ДНКазы I в клетках печени для экспрессии с промотором альбумина (группа 2).
[0098] На фигуре 5A показана карта вектора mAFP/Alb AAV8 4658_pAAV-AFP-Alb-huDNaseI_mut. Вектор содержит (i) элементы для размножения в бактериях, т.е. маркер AmpR, точки начала репликации colE1, F1 и M13, и (ii) последовательность hDNAseI_mut (SEQ ID NO: 2; гиперактивный актин-устойчивый мутант ДНКазы I), функционально связанную с минимальным промотором альбумина мыши, энхансером II мышиного α-фетопротеина (AFP) (с L-ITR), сигналом hGH polyA, фланкированным AAV8 L-ITR и R-ITR, точкой начала репликации M13 и точкой начала репликации F1. На фигуре 5В показано выравнивание последовательностей белков Anc80, AAV2 и AAV8 VP3 (взято из Zinn et al., Cell Rep., 2015, 12 (67): 1056-1068). На фигуре 5C показана карта вектора ADV-207186 на основе аденовируса человека типа 5 (dE1/E3) с ДНКазой I человека, экспрессируемой под контролем промотора CMV.
[0099] На фигуре 6 показаны данные биолюминесценции, отражающие размер опухоли. Опухоли обеих мышей с ортотопическим опухолевым имплантатом MIA PaCa-2 и мышей с неортотопическим опухолевым имплантатом MIA PaCa-2 уменьшились в размере при лечении посредством hDNaseI_mut (SEQ ID NO: 5; гиперактивный актин-резистентный мутант ДНКазы I) mAFP/Alb AAV8.
[00100] На фигуре 7 представлены данные гистологии печени, показывающие, что животные, получавшие ДНКазу I mAFP/Alb AAV8, имеют гораздо более низкую плотность воспалительных клеток, отсутствие некроза и гораздо меньше нуклеифильного материала на поверхности сосудов при лечении вектором экспрессии ДНКазы I mAFP/Alb AAV8 вместо белка ДНКазы I.
[00101] На фигуре 8 показано значительное снижение общего количества полученных от доноров Т-клеток, полученных от доноров CD4+ и CD8+ Т-клеток в периферических лимфатических узлах, мезентериальных лимфатических узлах и пейеровых бляшках у мышей, обработанных ДНКазой I mAFP/Alb AAV8, по сравнению с мышами, получавшими рекомбинантную ДНКазу I.
[00102] На фигуре 9 показана рестрикционная карта лентивирусного вектора pLV2-IL2ss-DNaseI mut, применяемого для доставки ДНКазы I в примере 7. Вектор включает маркер AmpR и точки начала репликации для F1 и SV40. Вектор включает промотор EF-1a выше лидерной последовательности IL-2 выше ДНКазы I.
[0100] На фигуре 10А показана полная последовательность конструкции энхансер ApoEHCR: промотор hAAT>DNaseI (гиперактивный) правильный лидер-WPRE Xinact или энхансер ApoE-HCR:промотор hAAT>гиперактивный вариант ДНКазы I человека с правильной лидерной последовательностью (секреторная последовательность):посттранскрипционный регуляторный элемент вируса гепатита сурка (WPRE), который не кодирует функциональный белок X. На фигуре 10B показана карта вектора энхансер ApoEHCR:промотор hAAT>hDNaseI (гиперактивный) правильный лидер-WPRE Xinact. На фигуре 10C показана карта вектора энхансер ApoEHCR:промотор hAAT>hDNaseI (дикого типа)-WPRE Xinact.
[0101] На фигуре 11 показана карта вектора pAAV-MCS с экспрессией без промотора, применяемого для получения энхансер ApoEHCR:промотор hAAT>hDNaseI (гиперактивный) правильный лидер-WPRE Xinact.
[0102] На фигуре 12 показаны результаты анализа SDS-PAGE очищенного AAV вектора Anc80 VR-18013AD. Три полосы 60, 72 и 90 кДа наблюдались в соотношении примерно 1:1:10, что соответствует белкам VP1-3.
[0103] Фигуры 13A и 13B иллюстрируют данные, в которых векторы энхансер ApoEHCR-промотор hAAT-hDNaseI (гиперактивный) правильный лидер-WPRE Xinact и энхансер ApoEHCR-промотор hAAT-hDNaseI (дикого типа)-WPRE Xinact эффективно трансдуцируют клетки только гепатоцитарного происхождения и вызывают экспрессию с высоким уровнем и секрецию фермента ДНКазы I или фермента ДНКазы I дикого типа с увеличенной биологическим путем экспрессией из трансдуцированных клеток G2.
[0104] На фигуре 14 показаны результаты поведенческого теста Y лабиринта.
[0105] На фигуре 15 показаны результаты ситуативного теста состояния страха.
[0106] На фигуре 16 показано, что активация микроглии была значительно снижена у мышей 3xTg-AD, получавших VR-18013AD, по сравнению с контрольными мышами 3xTg-AD, особенно в области коры головного мозга.
[0107] На фигуре 17 показаны данные, указывающие на значительное снижение активации микроглии в области коры головного мозга мышей 3xTg-AD, получавших VR-18013AD, по сравнению с контрольными мышами 3xTg-AD.
[0108] На фигуре 18 показаны данные, указывающие на то, что лечение посредством VR-18013AD значительно снижает отложение амилоида у мышей 3xTg-AD, получавших VR-18013AD D, по сравнению с контрольными мышами 3xTg-AD.
[0109] На фигуре 19 показано, что лечение посредством VR-18013AD значительно снижает отложение гиперфосфорилированного тау-белка у мышей 3xTg-AD, получавших VR-18013AD, по сравнению с контрольными мышами 3xTg-AD.
[0110] На фигуре 20 показаны данные, указывающие на значительное уменьшение снижения p-тау в области гиппокампа после лечения посредством VR-18013AD.
[0111] На фигуре 21 показано типичное морфометрическое изображение мышей, которым вводили контроль (однократную внутривенную инъекцию PBS) и VR-18014AD (однократную внутривенную инъекцию VR-18014AD в дозе 1,0 × 1011 GС/мышь).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0112] Настоящее изобретение основано на неожиданном открытии того, что во время заболеваний и состояний, характеризующихся повышением уровня циркулирующей вкДНК (например, рост и прогрессирование опухоли, аутоиммунные и нейродегенеративные заболевания, инфекции и т.д.), значительное количество вкДНК накапливается в печени, преимущественно в периэндотелиальном пространстве и пространстве Диссе. Даже большие количества системно вводимого белка ДНКазы демонстрируют ограниченную эффективность в отношении расщепления вкДНК печени. Данная вкДНК непрерывно поступает из депо печени в воротную вену печени и далее в системный кровоток. Как показано в разделе «Примеры» ниже, трансгенная экспрессия ДНКазы I в печени (например, с применением вирусных векторов экспрессии) приводит к почти полному удалению вкДНК, накопленной в печени и в портосинусоидальном кровотоке, когда ДНКаза секретируется в синусоидальное пространство печени. Такая трансгенная экспрессия ДНКазы в печени приводит к значительному противоопухолевому эффекту (особенно в опухолях органов и тканей, отток из которых происходит в воротную вену), снижению токсичности противоопухолевой химиотерапии, замедлению прогрессирования аутоиммунных и нейродегенеративных заболеваний и т.д. Такая трансгенная экспрессия ДНКазы в печени, когда ДНКаза секретируется в синусоидальное пространство, обеспечивает еще больше преимуществ, когда отток от опухоли происходит в систему воротной вены, и вкДНК, образуемая в области роста опухоли, подвергается «первому прохождению» через портосинусоидальный кровоток. (На фигуре 1 показаны органы и системы, отток из которых происходит в воротную вену.) То же самое относится к нейродегенеративным и аутоиммунным состояниям, которым способствует повышенная кишечная проницаемость микробной ДНК, попадающей в системный кровоток, с соответствующим «первым проходом» через портосинусоидальный кровоток.
[0113] В настоящем изобретении предложены различные векторы для доставки ДНКазы в печень. Конкретные неограничивающие примеры таких векторов включают векторы AAV, аденовирусные векторы, ретровирусные векторы (например, лентивирусные векторы), гепатотропные вирусные векторы (например, векторы вируса гепатита B (HBV)), наночастицы (например, наночастицы фосфорамидита), липосомы (например, катионные липосомы, такие как N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония хлорид (DOTMA)), лактоферрин, поли L-лизин, полиэтиленимин, хитозан и т.д.).
[0114] Фермент, обладающий ДНКазной активностью, может экспрессироваться под контролем печень-специфичного промотора и/или другого печень-специфичного элемента контроля (например, энхансера). Конкретные неограничивающие примеры печень-специфичных промоторов и элементов контроля, включают, например, промотор альбумина; промотор альфа-1 антитрипсина человека (hAAT); TBG (тироксин-связывающий глобулин); аполипопротеин E - контрольный участок печени (англ. apolipoprotein E hepatic control region); промотор аполипопротеина A-II (APOA2); ингибитор серпиновой пептидазы, промотор клады A, члена 1 (SERPINA1) (hAAT); промотор полипептида 4 подсемейства А семейства 3 (CYP3A4) цитохрома Р450; промотор микроРНК 122 (MIR122); печень-специфичный промотор Р1 IGF-II; промотор мышиного транстиретина (MTTR); и промотор альфа-фетопротеина (AFP). Промотор может располагаться выше или ниже энхансера. Промоторная последовательность может быть непосредственно слита с энхансерной последовательностью.
[0115] Конкретные неограничивающие примеры ферментов, обладающих ДНКазной активностью, которые можно применять в композициях и способах согласно настоящему изобретению, включают ДНКазу I, ДНКазу X, ДНКазу γ, ДНКазу 1L1, ДНКазу 1L2, ДНКазу 1L3, ДНКазу II (например, ДНКазу IIα, ДНКазу IIβ), активированную каспазой ДНКазу (CAD), эндонуклеазу G (ENDOG), гранзим B (GZMB), фосфодиэстеразу I, лактоферрин, ацетилхолинэстеразу или их мутанты или производные.
[0116] Если фермент, обладающий ДНКазной активностью, представляет собой ДНКазу I, можно применять различные мутанты, ослабляющие связывание актина. Конкретные неограничивающие примеры остатков в рекомбинантной человеческой ДНКазе I дикого типа (SEQ ID NO: 4), которые могут быть мутированы, включают, например, Gln-9, Glu-13, Thr-14, His-44, Asp-53, Tyr-65, Val-66, Val-67, Glu-69, Asn-74 и Ala-114. В различных вариантах реализации применяют мутацию Ala-114. Например, в гиперактивном мутанте человеческой ДНКазы I, содержащем последовательность SEQ ID NO: 5, остаток Ala-114 мутирован. Комплементарные остатки в других ДНКазах также могут быть мутированы. Конкретные неограничивающие примеры мутаций в рекомбинантной человеческой ДНКазе I дикого типа включают H44C, H44N, L45C, V48C, G49C, L52C, D53C, D53R, D53K, D53Y, D53A, N56C, D58S, D58T, Y65A, Y65E, Y65R, Y65C, V66N, V67E, V67K, V67C, E69R, E69C, A114C, A114R, H44N:T46S, D53R:Y65A, D53R:E69R, H44A:D53R:Y65A, H44A:Y65A:E69R, H64N:V66S, H64N:V66T, Y65N:V67S, Y65N:V67T, V66N:S68T, V67N:E69S, V67N:E69T, S68N:P70S, S68N:P70T, S94N:Y96S, S94N:Y96T.
[0117] Можно применять различные мутанты ДНКазы для увеличения активности ДНКазы. Конкретные неограничивающие примеры мутаций в рекомбинантной человеческой ДНКазе I дикого типа включают, например, Gln-9, Glu-13, Thr-14, His-44, Asp-53, Tyr-65, Val-66, Val-67, Glu-69, Asn-74 и Ala-114. Конкретные неограничивающие примеры мутаций для повышения активности рекомбинантной ДНКазы I дикого типа включают Q9R, E13R, E13K, T14R, T14K, H44R, H44K, N74K и A114F. Например, можно применять комбинацию мутаций Q9R, E13R, N74K и A114F, причем такая комбинация обнаруживается, по меньшей мере, в гиперактивном мутанте ДНКазы I, содержащем последовательность SEQ ID NO: 5.
[0118] Когда для экспрессии ДНКазы применяют векторы AAV, они могут быть получены из любого серотипа, например, из серотипа 1 (AAV1), AAV2, AAV3 (например, AAV3A, AAV3B), AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAVrh10 (как описано, например, в патенте США № 9790472, публикациях международной заявки на патент № WO2017/180857 и WO2017/180861), AAVLK03 (как описано, например, в Wang et al., Mol. Ther., 2015, 23(12):1877-1887), AAVhu37 (как описано, например, в публикации международной заявки на патент № WO2017180857), AAVrh64R1 (как описано, например, в публикации международной заявки на патент № WO2017180857) или Anc80 (Zinn et al., Cell Rep., 2015, 12(67): 1056-1068).
[0119] Точечные мутации могут быть внесены в капсидный белок (например, VP3) для повышения эффективности и/или специфичности печень-специфичной доставки. Конкретные неограничивающие примеры таких точечных мутаций в капсидном белке AAV8 VP3 включают, например, S279A, S671A, K137R и T252A, а также мутации капсида AAV8, описанные в публикации международной заявки на патент № WO2017/180854 (например, AAV3G1, AAVT20 или AAVTR1, VP3 мутации в аминокислотах 263-267 [например, 263NGTSG267->SGTH или 263NGTSG267->SDTH], и/или аминокислотах 457-459 [например, 457TAN459->SRP], и/или аминокислотах 455-459 [например, 455GGTAN459 ->DGSGL] и/или аминокислотах 583-597).
[0120] Векторы и композиции согласно настоящему изобретению могут быть нацелены на печень различными способами. Конкретные неограничивающие примеры путей введения в печень включают внутрипеченочную инъекцию, внутривенную инъекцию и внутриартериальную инъекцию.
Последовательности
SEQ ID NO: 1 - человеческая ДНКаза I дикого типа (WT), предшественник; Регистрационный номер в Genbank NP_005214.2; секреторная сигнальная последовательность подчеркнута:
MRGMKLLGALLALAALLQGAVSLKIAAFNIQTFGETKMSNATLVSYIVQILSRYDIALVQEVRDSHLTAVGKLLDNLNQDAPDTYHYVVSEPLGRNSYKERYLFVYRPDQVSAVDSYYYDDGCEPCGNDTFNREPAIVRFFSRFTEVREFAIVPLHAAPGDAVAEIDALYDVYLDVQEKWGLEDVMLMGDFNAGCSYVRPSQWSSIRLWTSPTFQWLIPDSADTTATPTHCAYDRIVVAGMLLRGAVVPDSALPFNFQAAYGLSDQLAQAISDHYPVEVMLK
SEQ ID NO: 2 - мутант человеческой ДНКазы I, предшественник; мутантные остатки по сравнению с SEQ ID NO: 1 выделены жирным шрифтом и подчеркнуты; секреторная сигнальная последовательность подчеркнута:
MRGMKLLGALLALAALLQGAVSLKIAAFNIRTFGRTKMSNATLVSYIVQILSRYDIALVQEVRDSHLTAVGKLLDNLNQDAPDTYHYVVSEPLGRKSYKERYLFVYRPDQVSAVDSYYYDDGCEPCGNDTFNREPFIVRFFSRFTEVREFAIVPLHAAPGDAVAEIDALYDVYLDVQEKWGLEDVMLMGDFNAGCSYVRPSQWSSIRLWTSPTFQWLIPDSADTTATPTHCAYDRIVVAGMLLRGAVVPDSALPFNFQAAYGLSDQLAQAISDHYPVEVMLK
SEQ ID NO: 3 - Anc80 VP1 капсидный белок:
AADGYLPDWLEDNLSEGIREWDLKPGAPKPKANQQKQDDGRGLVLPGYKYLGPFNGLDKGEPVNAADAAALEHDKAYDQQLKAGDNPYLRYNHADAEFQERLQEDTSFGGNLGRAVFQAKKRVLEPLGLVEEGAKTAPGKKRPVEQSPQEPDSSSGIGKKGQQPAX1KRLNFGQTGDSESVPDPQPLGEPPAAPSGVGSNTMX2AGGGAPMADNNEGADGVGNASGNWHCDSTWLGDRVITTSTRTALPTYNNHLYKQISSQSGX3STNDNTYFGYSTPWGYFDFNRFHCHFSPRDWQRLINNNWGFRPKX4LNFKLFNIQVKEVTTNDGTTTIANNLTSTVQVFTDSEYQLPYVLGSAHQGCLPPFPADVFMIPQYGYLTLNNGSQAVGRSSFYCLEYFPSQMLRTGNNFX5FSYTFEDVPFHSSYAHSQSLDRLNPLIDQYLYYLSRTQTTSGTAGNRX6LQFSQAGPSSMANQAKNWLPGPCYRQQRVSKTX7NQNNNSNFAWTGATKYHLNGRDSLVNPGPAMATHKDDEDKFFPMSGVLIFGKQGAGNSNVDLDNVMITX8EEEIKTTNPVATEX9YGTVATNLQSX10NTAPATGTVNSQGALPGMVWQX11RDVYLQGPIWAKIPHTDGHFHPSPLMGGFGLKHPPPQILIKNTPVPANPPTTFSPAKFASFITQYSTGQVSVEIEWELQKENSKRWNPEIQYTSNYNKSTNVDFAVDTNGVYSEPRPIGTRYLTRNL
X1 = K или R; X2= A или S; X3 = A или G; X4 = R или K; X5 = E или Q; X6 = T или E; X7 = A или T; X8 = S или N; X9 = Q или E; X10 = S или A и X11 = N или D.
SEQ ID NO: 4 - зрелая человеческая ДНКаза I дикого типа (WT) (без секреторной сигнальной последовательности; регистрационный номер в Genbank № 4AWN_A:
LKIAAFNIQTFGETKMSNATLVSYIVQILSRYDIALVQEVRDSHLTAVGKLLDNLNQDAPDTYHYVVSEPLGRNSYKERYLFVYRPDQVSAVDSYYYDDGCEPCGNDTFNREPAIVRFFSRFTEVREFAIVPLHAAPGDAVAEIDALYDVYLDVQEKWGLEDVMLMGDFNAGCSYVRPSQWSSIRLWTSPTFQWLIPDSADTTATPTHCAYDRIVVAGMLLRGAVVPDSALPFNFQAAYGLSDQLAQAISDHYPVEVMLK
SEQ ID NO: 5 - зрелый мутант человеческой ДНКазы I (без секреторной сигнальной последовательности); мутированные остатки по сравнению с SEQ ID NO: 4 выделены жирным шрифтом и подчеркнуты:
LKIAAFNIRTFGRTKMSNATLVSYIVQILSRYDIALVQEVRDSHLTAVGKLLDNLNQDAPDTYHYVVSEPLGRKSYKERYLFVYRPDQVSAVDSYYYDDGCEPCGNDTFNREPFIVRFFSRFTEVREFAIVPLHAAPGDAVAEIDALYDVYLDVQEKWGLEDVMLMGDFNAGCSYVRPSQWSSIRLWTSPTFQWLIPDSADTTATPTHCAYDRIVVAGMLLRGAVVPDSALPFNFQAAYGLSDQLAQAISDHYPVEVMLK
SEQ ID NO: 6 - секреторная сигнальная последовательность человеческой ДНКазы I:
MRGMKLLGALLALAALLQGAVS
SEQ ID NO: 7 - секреторная сигнальная последовательность IL2:
MYRMQLLSCIALSLALVTNS
SEQ ID NO: 8 - промотор альбумина человека:
ACTAGTTCCAGATGGTAAATATACACAAGGGATTTAGTCAAACAATTTTTTGGCAAGAATATTATGAATTTTGTAATCGGTTGGCAGCCAATGAAATACAAAGATGAGTCTAGTTAATAATCTACAATTATTGGTTAAAGAAGTATATTAGTGCTAATTTCCCTCCGTTTGTCCTAGCTTTTCTCTTCTGTCAACCCCACACGCCTTTGGCACC
SEQ ID NO: 9 - Anc80 VP1 капсидный белок:
AADGYLPDWLEDNLSEGIREWDLKPGAPKPKANQQKQDDGRGLVLPGYYLGPFNGLDKGEPVNAADAAALEHDKAYDQQLKAGDNPYLRYNHADAEFQERLQEDTSFGGNLGRAVFQAKKRVLEPLGLVEEGAKTAPGKKRPVEQSPQEPDSSSGIGKKGQQPAX1KRLNFGQTGDSESVPDPQPLGEPPAAPSGVGSNTMX2AGGGAPADNNEGADGVGNASGNWHCDSTWLGDRVITTSTRTALPTYNNHLYKQISSQSGX3STNDNTYFGYSTPWGYFDFNRFHCHFSPRDWQRLINNNWGFRPKX4LNFKLFNIQVKEVTTNDGTTTIANNLTSTVQVFTDSEYQLPYVLGSAHQGCLPPFPADVFMIPQYGYLTLNNGSQAVGRSSFYCLEYFPSQMLRTGNNFX5FSYTFEDVPFHSSYAHSQSLDRLNPLIDQYLYYLSRTQTTSGTAGNRX6LQFSQAGPSSANQAKNWLPGPCYRQQRVSKTX7NQNNNSNFAWTGATKYHLNGRDSLVNPGPAMATHKDDEDKFFPMSGVLIFGKQGAGNSNVDLDNVITX8EEEIKTTNPVATEX9YGTVATNLQSX10NTAPATGTVNSQGALPGVWQX11RDVYLQGPIWAKIPHTDGHFHPSPLMGGFGLKHPPPQILIKNTPVPANPPTTFSPAKFASFITQYSTGQVSVEIEELQKENSKRWNPEIQYTSNYNKSTNVDFAVDTNGVYSEPRPIGTRYLTRNL
X1 = K или R; X2= A или S; X3 = A или G; X4 = R или K; X5 = E или Q; X6 = T или E; X7 = A или T; X8 = S или N; X9 = Q или E; X10 = S или A и X11 = N или D.
SEQ ID NO: 10 - человеческий праймер бета-глобулина:
CAACTTCATCCACGTTCACC
SEQ ID NO: 11 - прямой праймер NLRP3:
GTTCTGAGCTCCAACCATTCT
SEQ ID NO: 12 - обратный праймер NLRP3:
CACTGTGGGTCCTTCATCTTT
SEQ ID NO: 13 - прямой праймер гена 16S универсальной бактериальной РНК:
TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG
SEQ ID NO: 14 - обратный праймер гена 16S универсальной бактериальной РНК:
GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC
SEQ ID NO: 15 - последовательность промотора антитрипсина человека:
gatcttgctaccagtggaacagccactaaggattctgcagtgagagcagagggccagctaagtggtactctcccagagactgtctgactcacgccaccccctccaccttggacacaggacgctgtggtttctgagccaggtacaatgactcctttcggtaagtgcagtggaagctgtacactgcccaggcaaagcgtccgggcagcgtaggcgggcgactcagatcccagccagtggacttagcccctgtttgctcctccgataactggggtgaccttggttaatattcaccagcagcctcccccgttgcccctctggatccactgcttaaatacggacgaggacagggccctgtctcctcagcttcaggcaccaccactgacctgggacagtgaat
SEQ ID NO: 16 - Посттранскрипционный регуляторный элемент вируса гепатита сурка, не кодирующий функциональный белок X:
agtggcggccgctcgagctagcggccgctctagaagataatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaaatcatcgtcctttccttggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcatcggactag
SEQ ID NO: 17 - энхансер аполипопротеина E (ApoE), контрольный участок печени (HCR):
aggctcagaggcacacaggagtttctgggctcaccctgcccccttccaacccctcagttcccatcctccagcagctgtttgtgtgctgcctctgaagtccacactgaacaaacttcagcctactcatgtccctaaaatgggcaaacattgcaagcagcaaacagcaaacacacagccctccctgcctgctgaccttggagctggggcagaggtcagagacctctctgggcccatgccacctccaacatccactcgaccccttggaatttcggtggagaggagcagaggttgtcctggcgtggtttaggtagtgtgagagg
SEQ ID NO: 18 - полинуклеотид, кодирующий гиперактивный вариант человеческой ДНКазы I SEQ ID NO: 5:
atgaagctgctgggggcgctgctggcactggcggccctactgcagggggccgtgtccctgaagatcgcagccttcaacatcaggacatttgggaggaccaagatgtccaatgccaccctcgtcagctacattgtgcagatcctgagccgctatgacatcgccctggtccaggaggtcagagacagccacctgactgccgtggggaagctgctggacaacctcaatcaggatgcaccagacacctatcactacgtggtcagtgagccactgggacggaagagctataaggagcgctacctgttcgtgtacaggcctgaccaggtgtctgcggtggacagctactactacgatgatggctgcgagccctgcgggaacgacaccttcaaccgagagccattcattgtcaggttcttctcccggttcacagaggtcagggagtttgccattgttcccctgcatgcggccccgggggacgcagtagccgagatcgacgctctctatgacgtctacctggatgtccaagagaaatggggcttggaggacgtcatgttgatgggcgacttcaatgcgggctgcagctatgtgagaccctcccagtggtcatccatccgcctgtggacaagccccaccttccagtggctgatccccgacagcgctgacaccacagctacacccacgcactgtgcctatgacaggatcgtggttgcagggatgctgctccgaggcgccgttgttcccgactcggctcttccctttaacttccaggctgcctatggcctgagtgaccaactggcccaagccatcagtgaccactatccagtggaggtgatgctgaagtga
SEQ ID NO: 19 - полинуклеотид, кодирующий мутантный предшественник человеческой ДНКазы I SEQ ID NO: 2 (секреторная сигнальная последовательность подчеркнута):
Atgaggggcatgaagctgctgggggcgctgctggcactggcggccctactgcagggggccgtgtccctgaagatcgcagccttcaacatcaggacatttgggaggaccaagatgtccaatgccaccctcgtcagctacattgtgcagatcctgagccgctatgacatcgccctggtccaggaggtcagagacagccacctgactgccgtggggaagctgctggacaacctcaatcaggatgcaccagacacctatcactacgtggtcagtgagccactgggacggaagagctataaggagcgctacctgttcgtgtacaggcctgaccaggtgtctgcggtggacagctactactacgatgatggctgcgagccctgcgggaacgacaccttcaaccgagagccattcattgtcaggttcttctcccggttcacagaggtcagggagtttgccattgttcccctgcatgcggccccgggggacgcagtagccgagatcgacgctctctatgacgtctacctggatgtccaagagaaatggggcttggaggacgtcatgttgatgggcgacttcaatgcgggctgcagctatgtgagaccctcccagtggtcatccatccgcctgtggacaagccccaccttccagtggctgatccccgacagcgctgacaccacagctacacccacgcactgtgcctatgacaggatcgtggttgcagggatgctgctccgaggcgccgttgttcccgactcggctcttccctttaacttccaggctgcctatggcctgagtgaccaactggcccaagccatcagtgaccactatccagtggaggtgatgctgaagtga
SEQ ID NO: 20 - полинуклеотид, кодирующий секреторную сигнальную последовательность (SEQ ID NO: 6) человеческой ДНКазы I:
atgaggggcatgaagctgctgggggcgctgctggcactggcggccctactgcagggggccgtgtcc
SEQ ID NO: 21 - полинуклеотид, кодирующий мутант зрелой человеческой ДНКазы I (без секреторной сигнальной последовательности) SEQ ID NO: 5:
ctgaagatcgcagccttcaacatcaggacatttgggaggaccaagatgtccaatgccaccctcgtcagctacattgtgcagatcctgagccgctatgacatcgccctggtccaggaggtcagagacagccacctgactgccgtggggaagctgctggacaacctcaatcaggatgcaccagacacctatcactacgtggtcagtgagccactgggacggaagagctataaggagcgctacctgttcgtgtacaggcctgaccaggtgtctgcggtggacagctactactacgatgatggctgcgagccctgcgggaacgacaccttcaaccgagagccattcattgtcaggttcttctcccggttcacagaggtcagggagtttgccattgttcccctgcatgcggccccgggggacgcagtagccgagatcgacgctctctatgacgtctacctggatgtccaagagaaatggggcttggaggacgtcatgttgatgggcgacttcaatgcgggctgcagctatgtgagaccctcccagtggtcatccatccgcctgtggacaagccccaccttccagtggctgatccccgacagcgctgacaccacagctacacccacgcactgtgcctatgacaggatcgtggttgcagggatgctgctccgaggcgccgttgttcccgactcggctcttccctttaacttccaggctgcctatggcctgagtgaccaactggcccaagccatcagtgaccactatccagtggaggtgatgctgaagtga
SEQ ID NO: 22 - полинуклеотид, кодирующий человеческую ДНКазу I, дикого типа (WT), предшественник SEQ ID NO: 1:
atgaggggcatgaagctgctgggggcgctgctggcactggcggccctactgcagggggccgtgtccctgaagatcgcagccttcaacatccagacatttggggagaccaagatgtccaatgccaccctcgtcagctacattgtgcagatcctgagccgctatgacatcgccctggtccaggaggtcagagacagccacctgactgccgtggggaagctgctggacaacctcaatcaggatgcaccagacacctatcactacgtggtcagtgagccactgggacggaacagctataaggagcgctacctgttcgtgtacaggcctgaccaggtgtctgcggtggacagctactactacgatgatggctgcgagccctgcgggaacgacaccttcaaccgagagccagccattgtcaggttcttctcccggttcacagaggtcagggagtttgccattgttcccctgcatgcggccccgggggacgcagtagccgagatcgacgctctctatgacgtctacctggatgtccaagagaaatggggcttggaggacgtcatgttgatgggcgacttcaatgcgggctgcagctatgtgagaccctcccagtggtcatccatccgcctgtggacaagccccaccttccagtggctgatccccgacagcgctgacaccacagctacacccacgcactgtgcctatgacaggatcgtggttgcagggatgctgctccgaggcgccgttgttcccgactcggctcttccctttaacttccaggctgcctatggcctgagtgaccaactggcccaagccatcagtgaccactatccagtggaggtgatgctgaag
SEQ ID NO: 23 - полинуклеотид, кодирующий человеческую зрелую ДНКазу I дикого типа (WT) SEQ ID NO: 4:
ctgaagatcgcagccttcaacatccagacatttggggagaccaagatgtccaatgccaccctcgtcagctacattgtgcagatcctgagccgctatgacatcgccctggtccaggaggtcagagacagccacctgactgccgtggggaagctgctggacaacctcaatcaggatgcaccagacacctatcactacgtggtcagtgagccactgggacggaacagctataaggagcgctacctgttcgtgtacaggcctgaccaggtgtctgcggtggacagctactactacgatgatggctgcgagccctgcgggaacgacaccttcaaccgagagccagccattgtcaggttcttctcccggttcacagaggtcagggagtttgccattgttcccctgcatgcggccccgggggacgcagtagccgagatcgacgctctctatgacgtctacctggatgtccaagagaaatggggcttggaggacgtcatgttgatgggcgacttcaatgcgggctgcagctatgtgagaccctcccagtggtcatccatccgcctgtggacaagccccaccttccagtggctgatccccgacagcgctgacaccacagctacacccacgcactgtgcctatgacaggatcgtggttgcagggatgctgctccgaggcgccgttgttcccgactcggctcttccctttaacttccaggctgcctatggcctgagtgaccaactggcccaagccatcagtgaccactatccagtggaggtgatgctgaag
SEQ ID NO: 24 - ДНКаза I дикого типа Mus musculus, предшественник; Регистрационный номер в Genbank № NP_034191.3; секреторная сигнальная последовательность подчеркнута:
MRYTGLMGTLLTLVNLLQLAGTLRIAAFNIRTFGETKMSNATLSVYFVKILSRYDIAVIQEVRDSHLVAVGKLLDELNRDKPDTYRYVVSEPLGRKSYKEQYLFVYRPDQVSILDSYQYDDGCEPCGNDTFSREPAIVKFFSPYTEVQEFAIVPLHAAPTEAVSEIDALYDVYLDVWQKWGLEDIMFMGDFNAGCSYVTSSQWSSIRLRTSPIFQWLIPDSADTTVTSTHCAYDRIVVAGALLQAAVVPNSAVPFDFQAEYGLSNQLAEAISDHYPVEVTLRKI
SEQ ID NO: 25 - секреторная сигнальная последовательность ДНКазы I дикого типа Mus musculus
MRYTGLMGTLLTLVNLLQLAGT
SEQ ID NO: 26 - зрелая ДНКаза I Mus musculus дикого типа (WT)
LRIAAFNIRTFGETKMSNATLSVYFVKILSRYDIAVIQEVRDSHLVAVGKLLDELNRDKPDTYRYVVSEPLGRKSYKEQYLFVYRPDQVSILDSYQYDDGCEPCGNDTFSREPAIVKFFSPYTEVQEFAIVPLHAAPTEAVSEIDALYDVYLDVWQKWGLEDIMFMGDFNAGCSYVTSSQWSSIRLRTSPIFQWLIPDSADTTVTSTHCAYDRIVVAGALLQAAVVPNSAVPFDFQAEYGLSNQLAEAISDHYPVEVTLRKI
SEQ ID NO: 27 - полинуклеотид, кодирующий секреторную сигнальную последовательность ДНКазы I дикого типа Mus musculus
atgcggtacacagggctaatgggaacactgctcaccttggtcaacctgctgcagctggctgggact
SEQ ID NO: 28 - полинуклеотид, кодирующий зрелую ДНКазу I Mus musculus дикого типа (WT)
ctgagaattgcagccttcaacattcggacttttggggagactaagatgtccaatgctaccctctctgtatactttgtgaaaatcctgagtcgctatgacatcgctgttatccaagaggtcagagactcccacctggttgctgttgggaagctcctggatgaactcaatcgggacaaacctgacacctaccgctatgtagtcagtgagccgctgggccgcaaaagctacaaggaacagtacctttttgtgtacaggcctgaccaggtgtctattctggacagctatcaatatgatgatggctgtgaaccctgtggaaatgacaccttcagcagagagccagccattgttaagttcttttccccatacactgaggtccaagaatttgcgatcgtgcccttgcatgcagccccaacagaagctgtgagtgagatcgacgccctctacgatgtttacctagatgtctggcaaaagtggggcctggaggacatcatgttcatgggagacttcaatgctggctgcagctacgtcacttcctcccagtggtcctccattcgccttcggacaagccccatcttccagtggctgatccctgacagtgcggacaccacagtcacatcaacacactgtgcttatgacaggattgtggttgctggagctctgctccaggctgctgttgttcccaactcggctgttccttttgatttccaagcagaatacggactttccaaccagctggctgaagccatcagtgaccattacccagtggaggtgacactcagaaaaatctga
SEQ ID NO: 29 - полинуклеотид, кодирующий ДНКазу I Mus musculus дикого типа, предшественник
atgcggtacacagggctaatgggaacactgctcaccttggtcaacctgctgcagctggctgggactctgagaattgcagccttcaacattcggacttttggggagactaagatgtccaatgctaccctctctgtatactttgtgaaaatcctgagtcgctatgacatcgctgttatccaagaggtcagagactcccacctggttgctgttgggaagctcctggatgaactcaatcgggacaaacctgacacctaccgctatgtagtcagtgagccgctgggccgcaaaagctacaaggaacagtacctttttgtgtacaggcctgaccaggtgtctattctggacagctatcaatatgatgatggctgtgaaccctgtggaaatgacaccttcagcagagagccagccattgttaagttcttttccccatacactgaggtccaagaatttgcgatcgtgcccttgcatgcagccccaacagaagctgtgagtgagatcgacgccctctacgatgtttacctagatgtctggcaaaagtggggcctggaggacatcatgttcatgggagacttcaatgctggctgcagctacgtcacttcctcccagtggtcctccattcgccttcggacaagccccatcttccagtggctgatccctgacagtgcggacaccacagtcacatcaacacactgtgcttatgacaggattgtggttgctggagctctgctccaggctgctgttgttcccaactcggctgttccttttgatttccaagcagaatacggactttccaaccagctggctgaagccatcagtgaccattacccagtggaggtgacactcagaaaaatctga
SEQ ID NO: 30 - Полная последовательность энхансер ApoEHCR- промотор hAAT -hDNaseI (гиперактивный)правильный лидер-WPRE Xinact (VR-18013AD)
aggctcagaggcacacaggagtttctgggctcaccctgcccccttccaacccctcagttcccatcctccagcagctgtttgtgtgctgcctctgaagtccacactgaacaaacttcagcctactcatgtccctaaaatgggcaaacattgcaagcagcaaacagcaaacacacagccctccctgcctgctgaccttggagctggggcagaggtcagagacctctctgggcccatgccacctccaacatccactcgaccccttggaatttcggtggagaggagcagaggttgtcctggcgtggtttaggtagtgtgagagggatcttgctaccagtggaacagccactaaggattctgcagtgagagcagagggccagctaagtggtactctcccagagactgtctgactcacgccaccccctccaccttggacacaggacgctgtggtttctgagccaggtacaatgactcctttcggtaagtgcagtggaagctgtacactgcccaggcaaagcgtccgggcagcgtaggcgggcgactcagatcccagccagtggacttagcccctgtttgctcctccgataactggggtgaccttggttaatattcaccagcagcctcccccgttgcccctctggatccactgcttaaatacggacgaggacagggccctgtctcctcagcttcaggcaccaccactgacctgggacagtgaatgccgccaccAtgaggggcatgaagctgctgggggcgctgctggcactggcggccctactgcagggggccgtgtccctgaagatcgcagccttcaacatcaggacatttgggaggaccaagatgtccaatgccaccctcgtcagctacattgtgcagatcctgagccgctatgacatcgccctggtccaggaggtcagagacagccacctgactgccgtggggaagctgctggacaacctcaatcaggatgcaccagacacctatcactacgtggtcagtgagccactgggacggaagagctataaggagcgctacctgttcgtgtacaggcctgaccaggtgtctgcggtggacagctactactacgatgatggctgcgagccctgcgggaacgacaccttcaaccgagagccattcattgtcaggttcttctcccggttcacagaggtcagggagtttgccattgttcccctgcatgcggccccgggggacgcagtagccgagatcgacgctctctatgacgtctacctggatgtccaagagaaatggggcttggaggacgtcatgttgatgggcgacttcaatgcgggctgcagctatgtgagaccctcccagtggtcatccatccgcctgtggacaagccccaccttccagtggctgatccccgacagcgctgacaccacagctacacccacgcactgtgcctatgacaggatcgtggttgcagggatgctgctccgaggcgccgttgttcccgactcggctcttccctttaacttccaggctgcctatggcctgagtgaccaactggcccaagccatcagtgaccactatccagtggaggtgatgctgaagtgaagtggcggccgctcgagctagcggccgctctagaagataatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaaatcatcgtcctttccttggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcatcggactag
[0121] (Энхансер APOE HCR: основания 1-320; промотор альфа-1-антитрипсина человека: основания 321-717; последовательность Козака: основания 718-726; гиперактивный вариант ДНКазы I человека с естественной полностью правильной лидерной последовательностью: основания 727-1575; белок WPRE X инактивированный: основания 1576-2212)
SEQ ID NO: 31 - Полная последовательность ApoEHCR энхансер-hAAT промотор-чДНКаза I дикого типа-WPRE Xinact (VR-18014AD)
aggctcagaggcacacaggagtttctgggctcaccctgcccccttccaacccctcagttcccatcctccagcagctgtttgtgtgctgcctctgaagtccacactgaacaaacttcagcctactcatgtccctaaaatgggcaaacattgcaagcagcaaacagcaaacacacagccctccctgcctgctgaccttggagctggggcagaggtcagagacctctctgggcccatgccacctccaacatccactcgaccccttggaatttcggtggagaggagcagaggttgtcctggcgtggtttaggtagtgtgagagggatcttgctaccagtggaacagccactaaggattctgcagtgagagcagagggccagctaagtggtactctcccagagactgtctgactcacgccaccccctccaccttggacacaggacgctgtggtttctgagccaggtacaatgactcctttcggtaagtgcagtggaagctgtacactgcccaggcaaagcgtccgggcagcgtaggcgggcgactcagatcccagccagtggacttagcccctgtttgctcctccgataactggggtgaccttggttaatattcaccagcagcctcccccgttgcccctctggatccactgcttaaatacggacgaggacagggccctgtctcctcagcttcaggcaccaccactgacctgggacagtgaatgccgccaccatgaggggcatgaagctgctgggggcgctgctggcactggcggccctactgcagggggccgtgtccctgaagatcgcagccttcaacatccagacatttggggagaccaagatgtccaatgccaccctcgtcagctacattgtgcagatcctgagccgctatgacatcgccctggtccaggaggtcagagacagccacctgactgccgtggggaagctgctggacaacctcaatcaggatgcaccagacacctatcactacgtggtcagtgagccactgggacggaacagctataaggagcgctacctgttcgtgtacaggcctgaccaggtgtctgcggtggacagctactactacgatgatggctgcgagccctgcgggaacgacaccttcaaccgagagccagccattgtcaggttcttctcccggttcacagaggtcagggagtttgccattgttcccctgcatgcggccccgggggacgcagtagccgagatcgacgctctctatgacgtctacctggatgtccaagagaaatggggcttggaggacgtcatgttgatgggcgacttcaatgcgggctgcagctatgtgagaccctcccagtggtcatccatccgcctgtggacaagccccaccttccagtggctgatccccgacagcgctgacaccacagctacacccacgcactgtgcctatgacaggatcgtggttgcagggatgctgctccgaggcgccgttgttcccgactcggctcttccctttaacttccaggctgcctatggcctgagtgaccaactggcccaagccatcagtgaccactatccagtggaggtgatgctgaagtgaagtggcggccgctcgagctagcggccgctctagaagataatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaaatcatcgtcctttccttggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcatcggactag
[0122] (Энхансер APOE HCR: основания 1-320; промотор альфа-1-антитрипсина человека: основания 321-717; последовательность Козака: основания 718-726; ДНКаза I дикого типа человека с естественной полностью правильной лидерной последовательностью: основания 727-1575; белок WPRE X инактивированный: основания 1576-2212)
SEQ ID NO: 32 - полинуклеотид, кодирующий ДНКазу I человека, дикого типа (WT), предшественник SEQ ID NO: 1 со стоп-кодоном:
atgaggggcatgaagctgctgggggcgctgctggcactggcggccctactgcagggggccgtgtccctgaagatcgcagccttcaacatccagacatttggggagaccaagatgtccaatgccaccctcgtcagctacattgtgcagatcctgagccgctatgacatcgccctggtccaggaggtcagagacagccacctgactgccgtggggaagctgctggacaacctcaatcaggatgcaccagacacctatcactacgtggtcagtgagccactgggacggaacagctataaggagcgctacctgttcgtgtacaggcctgaccaggtgtctgcggtggacagctactactacgatgatggctgcgagccctgcgggaacgacaccttcaaccgagagccagccattgtcaggttcttctcccggttcacagaggtcagggagtttgccattgttcccctgcatgcggccccgggggacgcagtagccgagatcgacgctctctatgacgtctacctggatgtccaagagaaatggggcttggaggacgtcatgttgatgggcgacttcaatgcgggctgcagctatgtgagaccctcccagtggtcatccatccgcctgtggacaagccccaccttccagtggctgatccccgacagcgctgacaccacagctacacccacgcactgtgcctatgacaggatcgtggttgcagggatgctgctccgaggcgccgttgttcccgactcggctcttccctttaacttccaggctgcctatggcctgagtgaccaactggcccaagccatcagtgaccactatccagtggaggtgatgctgaagTGA
SEQ ID NO: 33 - Последовательность Козака
5′-GCCGCCACC-3′
SEQ ID NO: 34 - Anc80L65 VP1 капсидный белок
MAADGYLPDWLEDNLSEGIREWWDLKPGAPKPKANQQKQDDGRGLVLPGYKYLGPFNGLDKGEPVNAADAAALEHDKAYDQQLKAGDNPYLRYNHADAEFQERLQEDTSFGGNLGRAVFQAKKRVLEPLGLVEEGAKTAPGKKRPVEQSPQEPDSSSGIGKKGQQPARKRLNFGQTGDSESVPDPQPLGEPPAAPSGVGSNTMAAGGGAPMADNNEGADGVGNASGNWHCDSTWLGDRVITTSTRTWALPTYNNHLYKQISSQSGGSTNDNTYFGYSTPWGYFDFNRFHCHFSPRDWQRLINNNWGFRPKKLNFKLFNIQVKEVTTNDGTTTIANNLTSTVQVFTDSEYQLPYVLGSAHQGCLPPFPADVFMIPQYGYLTLNNGSQAVGRSSFYCLEYFPSQMLRTGNNFQFSYTFEDVPFHSSYAHSQSLDRLMNPLIDQYLYYLSRTQTTSGTAGNRTLQFSQAGPSSMANQAKNWLPGPCYRQQRVSKTTNQNNNSNFAWTGATKYHLNGRDSLVNPGPAMATHKDDEDKFFPMSGVLIFGKQGAGNSNVDLDNVMITNEEEIKTTNPVATEEYGTVATNLQSANTAPATGTVNSQGALPGMVWQDRDVYLQGPIWAKIPHTDGHFHPSPLMGGFGLKHPPPQILIKNTPVPANPPTTFSPAKFASFITQYSTGQVSVEIEWELQKENSKRWNPEIQYTSNYNKSTNVDFAVDTNGVYSEPRPIGTRYLTRNL
SEQ ID NO: 35- вариант Anc80L65 VP1 капсидного белка
MAADGYLPDWLEDNLSEGIREWWDLKPGAPKPKANQQKQDDGRGLVLPGYYLGPFNGLDKGEPVNAADAAALEHDKAYDQQLKAGDNPYLRYNHADAEFQERLQEDTSFGGNLGRAVFQAKKRVLEPLGLVEEGAKTAPGKKRPVEQSPQEPDSSSGIGKKGQQPARKRLNFGQTGDSESVPDPQPLGEPPAAPSGVGSNTMAAGGGAPADNNEGADGVGNASGNWHCDSTWLGDRVITTSTRTWALPTYNNHLYKQISSQSGGSTNDNTYFGYSTPWGYFDFNRFHCHFSPRDWQRLINNNWGFRPKKLNFKLFNIQVKEVTTNDGTTTIANNLTSTVQVFTDSEYQLPYVLGSAHQGCLPPFPADVFMIPQYGYLTLNNGSQAVGRSSFYCLEYFPSQMLRTGNNFQFSYTFEDVPFHSSYAHSQSLDRLMNPLIDQYLYYLSRTQTTSGTAGNRTLQFSQAGPSSANQAKNWLPGPCYRQQRVSKTTNQNNNSNFAWTGATKYHLNGRDSLVNPGPAMATHKDDEDKFFPMSGVLIFGKQGAGNSNVDLDNVITNEEEIKTTNPVATEEYGTVATNLQSANTAPATGTVNSQGALPGVWQDRDVYLQGPIWAKIPHTDGHFHPSPLMGGFGLKHPPPQILIKNTPVPANPPTTFSPAKFASFITQYSTGQVSVEIEELQKENSKRWNPEIQYTSNYNKSTNVDFAVDTNGVYSEPRPIGTRYLTRNL
Определения
[0123] Термин «фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью» в настоящем документе обозначает фермент, способный к гидролитическому расщеплению фосфодиэфирных связей в основной цепи ДНК.
[0124] В настоящем документе термины «дезоксирибонуклеаза» и «ДНКаза» относятся к любому ферменту, который катализирует гидролитическое расщепление фосфодиэфирных связей в основной цепи ДНК. Известно большое количество дезоксирибонуклеаз, которые можно применять в способах согласно настоящему изобретению. Неограничивающие примеры ДНКаз, применяемых в способах согласно настоящему изобретению, включают, например, ДНКазу I (например, рекомбинантную ДНКазу I человека (рчДНКазу I) или ДНКазу I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (такие как, например, ДНКаза X, ДНКаза гамма и DNAS1L2), ДНКазу II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин и ацетилхолинэстеразу. Настоящее изобретение также охватывает ферменты ДНКазы, которые имеют увеличенный период полужизни (например, слитые альбумин и/или Fc, или защищенные от связывания с актином путем модификации сайта связывания актина; см., например, Gibson et al., (1992) J. Immunol. Methods, 155, 249-256). Актин-связывающий сайт ДНКазы I может быть мутирован, например, по следующим остаткам: Gln-9, Glu-13, Thr-14, His-44, Asp-53, Tyr-65, Val-66, Val-67, Glu-69, Asn-74, Ala-114 рекомбинантной человеческой ДНКазы (SEQ ID NO: 4). Например, в гиперактивном варианте человеческой ДНКазы I, содержащем последовательность SEQ ID NO: 5, остаток Ala-114 мутирован. Примеры мутаций включают H44C, H44N, L45C, V48C, G49C, L52C, D53C, D53R, D53K, D53Y, D53A, N56C, D58S, D58T, Y65A, Y65E, Y65R, Y65C, V66N, V67E, V67K, V67C, E69R, E69C, A114C, H44N:T46S, D53R:Y65A, D53R:E69R, H44A:D53R:Y65A, H44A:Y65A:E69R, H64N:V66S, H64N:V66T, Y65N:V67S, Y65N:V67T, V66N:S68T, V67N:E69S, V67N:E69T, S68N:P70S, S68N:P70T, S94N:Y96S, S94N:Y96T (в последовательности SEQ ID NO: 4). Также охвачены мутации в ДНКазе I с повышенной активностью ДНКазы I. Неограничивающими примерами таких мутаций являются, например, Q9R, E13R, E13K, T14R, T14K, H44R, H44K, N74K, и A114F рекомбинантной человеческой ДНКазы I (SEQ ID NO: 4). Например, комбинация мутаций Q9R, E13R, N74K и A114F, обнаруживается в гиперактивной ДНКазе I, содержащей последовательность SEQ ID NO: 5. ДНКаза I расщепляет ДНК преимущественно по фосфодиэфирным связям, смежным с пиримидиновым нуклеотидом, обеспечивая образование полинуклеотидов с концевыми 5'-фосфатными концевыми группами со свободной гидроксильной группой в положении 3', в среднем образуя тетрануклеотиды. ДНКаза I действует на одноцепочечную ДНК, двухцепочечную ДНК и хроматин.
[0125] Термин «примерно» обозначает пределы допустимого диапазона ошибок для конкретного значения, определенного специалистом в данной области техники, который будет частично зависеть от того, как измерено или определено значение, то есть ограничения измерительной системы. Например, «примерно» может означать в пределах допустимого стандартного отклонения в соответствии с практикой, принятой в данной области техники. В качестве альтернативы «примерно» может означать диапазон не более ± 20%, не более ± 10%, не более ± 5% и не более ± 1% от заданного значения. В качестве альтернативы, особенно в отношении биологических систем или процессов, термин может означать в пределах порядка величины, например, в пределах 2-кратного значения. Если в заявке и формуле изобретения описаны конкретные значения, если не указано иное, термин «примерно» подразумевается и в этом контексте означает в пределах допустимого диапазона ошибок для конкретного значения.
[0126] Термины «внеклеточная ДНК» (англ. extracellular DNA), «внеклеточная ДНК» (англ. cell-free DNA) и «вкДНК» используются взаимозаменяемо для обозначения внеклеточной ДНК (например, эукариотического, архейного или прокариотического происхождения), обнаруженной в крови, спинномозговой жидкости (CSF) или кишечнике пациента.
[0127] Термины «лечить» или «лечение» заболевания, расстройства или состояния включают: (1) предотвращение, отсрочку или снижение частоты и/или вероятности возникновения по меньшей мере одного клинического или субклинического симптома заболевания, расстройства или состояния, развивающегося у субъекта, который может быть поражен или предрасположен к заболеванию, расстройству или состоянию, но еще не испытывает или не проявляет клинических или субклинических симптомов заболевания, расстройства или состояния; или (2) подавление заболевания, расстройства или состояния, то есть остановка, снижение или отсрочка развития заболевания или его рецидива или по меньшей мере одного его клинического или субклинического симптома; или (3) облегчение заболевания, т.е. обеспечение регресса заболевания, расстройства или состояния или по меньшей мере одного из его клинических или субклинических симптомов. Благоприятный эффект для субъекта, подлежащего лечению, является либо статистически значимым, либо, по меньшей мере, ощутимым для пациента или врача.
[0128] Термины «индивидуум», «субъект», «животное», «пациент» и «млекопитающее» используются взаимозаменяемо для обозначения млекопитающих, включая людей, ветеринарных животных (например, кошек, собак, коров, лошадей, овец, свиней, и др.) и экспериментальных животных моделей заболеваний (например, мыши, крысы).
[0129] Термин «эффективный», применяемый к дозе или количеству, относится к тому количеству соединения или фармацевтической композиции, которое достаточно для достижения желаемой активности при введении субъекту, нуждающемуся в этом. Следует обратить внимание, что при введении комбинации активных ингредиентов, эффективное количество комбинации может включать или не включать количества каждого ингредиента, которые были бы эффективными при индивидуальном введении. Точное требуемое количество будет варьироваться от субъекта к субъекту, в зависимости от вида, возраста и общего состояния субъекта, тяжести состояния, подлежащего лечению, конкретного применяемого лекарственного средства или лекарственных средств, способа введения и подобных
[0130] В настоящем документе термин «терапевтически эффективный», применяемый к дозе или количеству, относится к тому количеству соединения или фармацевтической композиции, которое достаточно для достижения желаемой активности при введении субъекту, нуждающемуся в этом. Следует обратить внимание, что при введении комбинации активных ингредиентов (например, комбинации ДНКазы и другого соединения), эффективное количество комбинации может включать или не включать количества каждого ингредиента, которые были бы эффективными при индивидуальном введении.
[0131] В настоящем документе термин «промотор» относится к фрагменту нуклеиновой кислоты, который функционирует, чтобы контролировать транскрипцию одной или более кодирующих последовательностей, и расположен выше относительно направления транскрипции сайта инициации транскрипции кодирующей последовательности, и структурно идентифицируется по наличию сайта связывания ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и любых других последовательностей ДНК, включая, но не ограничиваясь, сайты связывания факторов транскрипции, сайты связывания репрессорных и активаторных белков и любые другие последовательности нуклеотидов, известные специалистам в данной области техники, чтобы оказывать прямое или косвенное воздействие для регуляции уровня транскрипции с промотора. «Тканеспецифичный» промотор может быть предпочтительно активным в определенных типах тканей или клеток.
[0132] В настоящем документе термин «печень-специфичная экспрессия» обозначает преобладающую или исключительную экспрессию в печени, т.е. экспрессию в значительно большей степени, чем в других тканях и органах.
[0133] Термин «печень-специфичный промотор» в настоящем документе обозначает промотор, который является преимущественно или исключительно активным в клетке печени (например, гепатоците) и направляет/инициирует транскрипцию в печени в значительно большей степени, чем в других тканях и органах. В данном контексте термин «преимущественно» означает, что по меньшей мере 50% указанной управляемой промотором экспрессии, более типично, по меньшей мере 90% указанной управляемой промотором экспрессии (например, 100% указанной управляемой промотором экспрессии) происходит в клетках печени. Отношение экспрессии в печени к экспрессии не в печени может варьироваться между различными печень-специфичными промоторами. В некоторых вариантах реализации печень-специфичный промотор может предпочтительно направлять/инициировать транскрипцию в конкретном типе клеток печени (например, гепатоцитах, клетках Купфера, эндотелиальных клетках и т.д.). Некоторые печень-специфичные промоторы, применяемые в кассетах экспрессии согласно настоящему изобретению, включают по меньшей мере один, обычно несколько сайтов связывания ядерного фактора печени. Печень-специфичные промоторы, применяемые в кассетах экспрессии согласно настоящему изобретению, могут представлять собой конститутивные или индуцибельные промоторы. Некоторые неограничивающие примеры печеночных промоторов, применяемых в кассетах экспрессии согласно настоящему изобретению, включают: промотор альбумина (Alb), промотор альфа-1 антитрипсина человека (hAAT), тироксин-связывающий глобулин (TBG), промотор аполипопротеина E- контрольного участка печени, промотор аполипопротеина A-II (APOA2), ингибитор серпиновой пептидазы, промотор клады A, члена 1 (SERPINA1) (hAAT), промотор полипептида 4 подсемейства А семейства 3 (CYP3A4) цитохрома Р450, промотор микроРНК 122 (miR-122), печень-специфичный промотор IGF-II P1, промотор мышиного транстиретина (MTTR), промотор альфа-фетопротеина (AFP), промотор лецитин-холестерин-ацилтрансферазы (LCAT), промотор аполипопротеина H (ApoH) и промотор гена преальбумина мыши.
[0134] Неограничивающие примеры печень-специфичных промоторов, включают, например, промотор альбумина (Alb), промотор альфа-1 антитрипсина человека (hAAT), промотор тироксин-связывающего глобулина (TBG), промотор аполипопротеина E-контрольного участка печени, промотор аполипопротеина A-II (APOA2), ингибитор серпиновой пептидазы, промотор клады A, члена 1 (SERPINA1) (hAAT), промотор полипептида 4 подсемейства А семейства 3 (CYP3A4) цитохрома Р450, промотор микроРНК 122 (miR-122), печень-специфичный промотор IGF-II P1, промотор мышиного транстиретина (MTTR), промотор альфа-фетопротеина (AFP), промотор глобулина, связывающего тироидный гормон, промотор алкогольдегидрогеназы, промотор фактора VIII (FVIII), основной промотор HBV (BCP) и промотор PreS2, промотор фосфоенолпируваткарбоксикиназы (PEPCK), гибридный промотор контрольного участка печени (HCR)-ApoCII, промотор AAT в комбинации с элементом энхансера гена альбумина мыши (Ealb), промотор липопротеина низкой плотности, промотор пируваткиназы, промотор фосфенолпируваткарбоксикиназы, промотор лецитин-холестерин-ацилтрансферазы (LCAT), промотор аполипопротеина H (ApoH), промотор трансферрина, промотор транстиретина, промоторы альфа-фибриногена и бета-фибриногена, промотор альфа-1-антихимотрипсина, промотор альфа-2-HS-гликопротеина, промотор гаптоглобина, промотор церулоплазмина, промотор плазминогена, промоторы белков комплемента (например, Clq, Clr, C2, C3, C4, C5, C6, C8, C9, фактор комплемента I и фактор H), активатор комплемента С3 и промотор [альфа]1-кислого гликопротеина. Дополнительные тканеспецифичные промоторы можно найти в базе данных тканеспецифических промоторов, TiProD (Nucleic Acids Research, J4: D104-D107 (2006).
[0135] В некоторых вариантах реализации, например, когда нацеливание на печень опосредуется капсидным белком, нуклеиновая кислота, кодирующая фермент, обладающий ДНКазной активностью, может быть функционально связана с промотором, обеспечивающим эффективную системную экспрессию (например, промотором CMV, промотором бета-актина курицы (CBA), промотором EF1a).
[0136] Термин «рак воротной вены» в настоящем документе используется для обозначения рака (например, карциномы, саркомы или лимфомы), который возник или метастазировал в орган или ткань, отток из которых происходит в воротную вену. Неограничивающие примеры таких органов и тканей показаны на фигуре 1 и включают, например, печень, толстую кишку, тонкий и толстый кишечник, желудок, селезенку, поджелудочную железу и желчный пузырь.
[0137] Термин «нейродегенерация» в настоящем документе обозначает отдельное клиническое патологическое состояние с прогрессирующей потерей структуры и/или функции нейронов, включая гибель нейронов. Нейродегенерация может быть первичной или вторичной. Неограничивающие примеры заболеваний, включающих первичную нейродегенерацию, включают, например, болезнь Альцгеймера (AD), легкое когнитивное нарушение (MCI), болезнь Паркинсона (PD), болезнь Хантингтона (HD), заболевания, вызванные прионами, лобно-височную деменцию (FTD), лобно-височную деменцию с паркинсонизмом-17 (FTDP-17), деменцию с тельцами Леви, сосудистую деменцию, боковой амиотрофический склероз (БАС), хроническую травматическую энцефалопатию (ХТЭ), прогрессирующий надъядерный паралич (PSP), множественную системную атрофию (MSA), кортикобазальную дегенерацию (CBD), болезнь агирофильных зерен (AGD), болезнь Пика, оливопонтоцеребеллярную атрофию (OPCA), старческое слабоумие типа Альцгеймера, прогрессирующий супрануклеарный паралич (Стила-Ричардсона-Ольшевского), кортикодентатонигральную дегенерацию, болезнь Галлервордена-Шпатца, прогрессирующую семейную миоклоническую эпилепсию, стрионигральную дегенерацию, торсионную дистонию (например, торсионный спазм; деформирующую мышечную дистонию), спастическую кривошею и другие дискинезии, семейный тремор, синдром Жиля де ла Туретта, дегенерацию коры мозжечка, спиноцеребеллярную дегенерацию (например, атаксию Фридрейха и связанные расстройства), синдром Шая-Дрейджера, спинальную мышечную атрофию, первичный латеральный склероз, наследственную спастическую параплегию, перонеальную амиотрофию (Шарко-Мари-Тута), интерстициальную гипертрофическую полиневропатию (Дежерина-Сотта), хроническую прогрессирующую невропатию, пигментную дегенерацию сетчатки (пигментный ретинит) и наследственную атрофию зрительного нерва (болезнь Лебера). Вторичная нейродегенерация вызывается прежде всего некрозом. Неограничивающие примеры состояний, которые могут привести к вторичной нейродегенерации, включают разрушение нейронов новообразованием, отеком, кровоизлиянием, инсультом, травмой, иммунной атакой, гипоксией, отравлением, метаболическими нарушениями и инфекциями.
[0138] Фраза «фармацевтически приемлемый», используемая в связи с композициями согласно изобретению, относится к молекулярным единицам и другим ингредиентам таких композиций, которые являются физиологически переносимыми и обычно не вызывают нежелательных реакций при введении субъекту (например, млекопитающему, такому как человек). В настоящем документе термин «фармацевтически приемлемый» обозначает одобренный регулирующим органом федерального правительства или правительства штата или перечисленный в Фармакопее США или другой общепризнанной фармакопее для применения у млекопитающих и, более конкретно, у людей.
[0139] Термины «цитостатическая и/или цитотоксическая химиотерапия» и «химиотерапия» используются в настоящем документе взаимозаменяемо для обозначения терапии, включающей введение цитостатического и/или цитотоксического агента.
[0140] Термины «противораковый агент» и «противораковый химиотерапевтический агент» в настоящем документе используется для обозначения любого химического соединения, которое применяют для лечения рака. Противораковые химиотерапевтические агенты хорошо известны в данной области (см., например, Gilman A. G., et al., The Pharmacological Basis of Therapeutics, 8th Ed., Sec 12:1202-1263 (1990)). В описании приведены конкретные примеры химиотерапевтических агентов.
[0141] Термин «побочный эффект химиотерапии», используемый в настоящем документе, относится к нежелательному и непреднамеренному, хотя и не обязательно неожиданному результату химиотерапии.
[0142] В настоящем документе термины «лучевая терапия», «радиационная терапия» и «RT» используются взаимозаменяемо для обозначения медицинского применения ионизирующего излучения как части лечения рака для повреждения ДНК злокачественных клеток либо непосредственно, либо путем создания заряженных частиц внутри пораженных клеток, которые повреждают ДНК. Обычно используемые типы лучевой терапии, охватываемые настоящим изобретением, включают, например, лучевую терапию внешним пучком (EBRT или XRT), брахитерапию/лучевую терапию с закрытым источником и лучевую терапию с применением системного радиоизотопа/открытого источника.
[0143] В настоящем документе термины «побочный эффект лучевой терапии» или «побочный эффект радиационной терапии» относятся к нежелательному и непреднамеренному, хотя и не обязательно неожиданному результату лучевой терапии. Развивающиеся побочные эффекты зависят от участка организма, который подлежит лечению, дозы, вводимой в день, общей вводимой дозы, общего состояния здоровья пациента и других видов лечения, проводимых одновременно, и могут включать, например, раздражение или повреждение кожи, усталость, тошноту, рвоту, фиброз, повреждение кишечника, потерю памяти, бесплодие или вторичный рак.
[0144] Термин «катаболическое состояние» в настоящем документе относится к состоянию, характеризующемуся быстрой потерей массы тела и потерей скелетного жира и мышечной массы, которое может возникать на фоне химиотерапии или химиолучевой терапии. Сопутствующие клинические явления включают, например, иммуносупрессию, мышечную слабость, предрасположенность к тромбоэмболии легочной артерии, тромбофлебит и измененную реакцию на стресс.
[0145] В настоящем документе термины «вирусный вектор» и «вирусная конструкция» относятся к рекомбинантной вирусной конструкции, которая включает одну или более гетерологичных нуклеотидных последовательностей (например, нуклеотидную последовательность, кодирующую фермент, обладающий ДНКазной активностью). В некоторых вариантах реализации вирусный вектор представляет собой вектор с дефектом репликации. В некоторых вариантах реализации структурные и неструктурные вирусные кодирующие последовательности не присутствуют в вирусном векторе и обеспечиваются во время продуцирования вирусного вектора при переносе с помощью вектора, такого как плазмида, или путем стабильной интеграции последовательностей в пакующей клеточной линии. В зависимости от вируса вирусный вектор может быть упакован в капсид (например, вектор AAV) и/или липидную оболочку (например, лентивирусный вектор).
[0146] Термин «сигнал полиаденилирования», в настоящем документе относится к последовательности нуклеиновой кислоты, которая опосредует присоединение полиаденинового участка к 3'-концу мРНК. Неограничивающие примеры сигналов полиаденилирования, которые можно применять в экспрессирующих конструкциях согласно настоящему изобретению, включают, например, сигнал раннего полиаденилирования SV40, сигнал позднего полиаденилирования SV40, сигнал полиаденилирования тимидинкиназы HSV, сигнал полиаденилирования гена протамина, сигнал полиаденилирования аденовируса 5 EIb, сигнал полиаденилирования бычьего гормона роста, сигнал полиаденилирования человеческого варианта гормона роста и т.п.
[0147] В настоящем документе и прилагаемой формуле изобретения, артикли единственного числа неопределенной и определенной формы включают множественное число, если контекст явно не предписывает иное.
[0148] В соответствии с настоящим изобретением можно применять традиционные методы фармакологии и молекулярной биологии в пределах квалификации в данной области техники. Такие способы полностью объяснены в литературе. См., например, Sambrook, Fritsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (herein “Sambrook et al., 1989”); DNA Cloning: A Practical Approach, Volumes I and II (D.N. Glover ed. 1985); Oligonucleotide Synthesis (MJ. Gait ed. 1984); Nucleic Acid Hybridization (B.D. Hames & S.J. Higgins eds. (1985)); Transcription and Translation (B.D. Hames & S.J. Higgins, eds. (1984)); Animal Cell Culture (R.I. Freshney, ed. (1986); Immobilized Cells and Enzymes (IRL Press, (1986)); B. Perbal, A Practical Guide To Molecular Cloning (1984); F.M. Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994); среди прочего.
Нацеливание фермента ДНКазы на печень
[0149] Авторы настоящего изобретения неожиданно обнаружили, что нацеливание экспрессии фермента, обладающего ДНКазной активностью, на печень может вызвать увеличенный клиренс ассоциированной с заболеванием вкДНК во всем кровотоке, и особенно в портосинусоидальном кровотоке. Как показано в разделе «Примеры» ниже, вкДНК может накапливаться в печени, особенно в периэндотелиальном пространстве и пространстве Диссе. Распад такого запаса вкДНК посредством локализованной экспрессии фермента, обладающего ДНКазной активностью, может снизить общий уровень вкДНК в кровотоке.
[0150] Как обсуждается на протяжении всей заявки, фермент, обладающий ДНКазной активностью, может быть эффективно экспрессирован в клетках печени с помощью вирусных векторов (например, аденоассоциированных вирусных (AAV) векторов, ретровирусных векторов (например, лентивирусных векторов) или аденовирусных векторов), липосом, наночастиц, несущих трансген ДНКазы, или голую ДНК. Печень взрослого человека получает почти четверть сердечного выброса крови, фильтрует примерно 1 л крови в минуту, и вмещает 10-15% объема крови в любой данный момент. Такой активный кровоток способствует быстрому накоплению высоких уровней векторных частиц в печени. Векторные частицы могут проходить через фенестрированный эндотелий по синусоидам печени непосредственно к гепатоцитам. Такие гепатоциты могут трансфицироваться векторными частицами и продолжать продуцировать ДНКазу. Полученная ДНКаза секретируется в периэндотелиальное пространство и пространство Диссе, где она может эффективно разрушать концентрированный пул вкДНК.
[0151] Авторы настоящего изобретения обнаружили, что трансфекция клеток печени для экспрессии фермента, обладающего ДНКазной активностью, обеспечивает неожиданно большее снижение вкДНК, наряду с существенным и неожиданным улучшением при заболеваниях и состояниях, связанных с высокими уровнями вкДНК в кровотоке.
[0152] В некоторых вариантах реализации экспрессия фермента ДНКазы в печени достигается с применением кассет экспрессии нуклеиновых кислот, которые преимущественно экспрессируются в печени. В некоторых вариантах реализации такие кассеты экспрессии могут содержать один или более из следующих элементов: (а) элемент контроля печеночного локуса; (b) печеночный промотор, расположенный на 3’ конце элемента контроля печеночного локуса; (c) кодирующую последовательность, расположенную на 3’ конце печеночного промотора, при этом указанная кодирующая последовательность кодирует полипептид, например дезоксирибонуклеазу; (d) сигнал полиаденилирования, расположенный на 3’ кодирующей последовательности; и (e) интрон, расположенный на 3’ конце печеночного промотора и 5' конце сигнала полиаденилирования. Элементы (a), (b), (c), (d) и (e) могут быть функционально связаны для экспрессии полипептида, кодируемого кодирующей последовательностью. В некоторых вариантах реализации кассеты экспрессии согласно настоящему изобретению управляют экспрессией терапевтического количества полипептида в клетках печени в течение периода, составляющего по меньшей мере 100 дней (например, по меньшей мере 200 дней, по меньшей мере 300 дней, по меньшей мере 400 дней или по меньшей мере 500 дней). В некоторых вариантах реализации полипептид представляет собой ДНКазу. ДНКаза может представлять собой любую ДНКазу, описанную в настоящем документе, например, ДНКазу I.
[0153] Сигнал полиаденилирования может быть функционально связан с нуклеиновой кислотой, кодирующей ДНКазу. Неограничивающие примеры сигналов полиаденилирования включают, например, сигнал раннего полиаденилирования SV40, сигнал позднего полиаденилирования SV40, сигнал полиаденилирования тимидинкиназы HSV, сигнал полиаденилирования гена протамина, сигнал полиаденилирования аденовируса 5 EIb, сигнал полиаденилирования бычьего гормона роста, сигнал полиаденилирования человеческого варианта гормона роста и т.п.
[0154] В другом аспекте в настоящем изобретении предложены векторы, которые содержат кассету экспрессии нуклеиновой кислоты, которая преимущественно экспрессируется в печени млекопитающих. Такая кассета экспрессии могут содержать, например: (а) элемент контроля печеночного локуса; (b) печеночный промотор, расположенный на 3’ конце элемента контроля печеночного локуса; (c) кодирующую последовательность, расположенную на 3’ конце печеночного промотора, при этом указанная кодирующая последовательность кодирует полипептид, например дезоксирибонуклеазу; (d) сигнал полиаденилирования, расположенный на 3’ кодирующей последовательности; и (e) интрон, расположенный на 3’ конце печеночного промотора и 5' конце сигнала полиаденилирования. Элементы (a), (b), (c), (d) и (e) являются функционально связанными для экспрессии полипептида, кодируемого кодирующей последовательностью. Некоторые векторы согласно настоящему изобретению представляют собой эписомальные векторы, и некоторые векторы согласно настоящему изобретению представляют собой интегрирующие векторы, такие как интегрирующие вирусные векторы. В некоторых вариантах реализации полипептид представляет собой дезоксирибонуклеазу (ДНКазу). ДНКаза может представлять собой любую ДНКазу, описанную в настоящем документе, например, ДНКазу I.
[0155] В другом аспекте настоящее изобретение относится к способам лечения заболевания или состояния, связанного с повышенными уровнями вкДНК. Заболевание или состояние может представлять собой любое заболевание или состояние, описанное в настоящем документе или в любом из патентов США № 7612032; 8388951; 8431123; 8535663; 8710012; 8796004; 8871200; 8916151; 9072733; 9248166; 9770492; публикациях заявок на патенты США № US20170056482, US20170100463, US20150110769 и публикации международной заявки на патент № WO2016/190780, все из которых полностью включены в настоящую заявку посредством ссылки. В одном варианте реализации способ включает стадии: (1) введения в печень субъекта вектора, содержащего кассету экспрессии нуклеиновой кислоты, при этом указанная кассета экспрессии содержит: (а) печень-специфичный промотор; (b) кодирующую последовательность, расположенную на 3’ конце печень-специфичного промотора, при этом указанная кодирующая последовательность кодирует фермент, обладающий ДНКазной активностью (например, любые ДНК, описанные в настоящем документе); (c) сигнал полиаденилирования, расположенный на 3’ конце кодирующей последовательности; и необязательно (d) интрон, расположенный на 3’ конце печеночного промотора и 5' конце сигнала полиаденилирования. Элементы (a), (b), (c) и (d) функционально связаны для экспрессии полипептида, кодируемого кодирующей последовательностью; и (2) экспрессии терапевтического количества указанного полипептида в печени. В некоторых вариантах реализации способов данного аспекта настоящего изобретения терапевтическое количество полипептида экспрессируется в течение по меньшей мере 100 дней (например, по меньшей мере 200 дней, по меньшей мере 300 дней, по меньшей мере 400 дней и по меньшей мере 500 дней).
[0156] Векторы и кассеты экспрессии нуклеиновых кислот согласно данному аспекту настоящего изобретения преимущественно экспрессируются в печени, например, по меньшей мере 50% экспрессии кодируемого полипептида происходит в печени. Преимущественно по меньшей мере 90% экспрессии происходит в печени. Некоторые из векторов и кассет экспрессии согласно данному аспекту настоящего изобретения экспрессируются исключительно в печени.
[0157] Элементы контроля печеночного локуса могут быть включены в кассеты экспрессии согласно настоящему изобретению, которые способны усиливать экспрессию молекул нуклеиновых кислот в клетках печени и обеспечивать зависимую от числа копий, независимую от положения экспрессию в кассете экспрессии. Некоторые области контроля печеночного локуса, применимые в кассетах экспрессии согласно настоящему изобретению, включают, например, участок прикрепления матрицы и/или печень-специфичный энхансерный элемент.
[0158] В дополнение к промотору кассета и/или вектор экспрессии могут содержать одну или более дополнительных последовательностей инициации, терминации и/или энхансера транскрипции; сигналы процессинга РНК (такие как сигналы сплайсинга и полиаденилирования (поли A)); последовательности, стабилизирующие цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (например, консенсусная последовательность Козака, такая как 5'-GCCGCCACC-3 '[SEQ ID NO: 33]); последовательности, повышающие стабильность белка; и последовательности, которые усиливают секрецию кодируемого полипептида. Примеры подходящих последовательностей полиА включают, например, SV40, SV50, бычий гормон роста (bGH), гормон роста человека и синтетические полиА. Примеры подходящих энхансеров включают, например, энхансер альфа-фетопротеина, минимальный промотор/энхансер TTR, LSP (TH-связывающий промотор глобулина/альфа-1-микроглобулин/энхансер бикунина), энхансер Serpin1, среди прочих. В одном варианте реализации кассета экспрессии включала один или более энхансеров экспрессии. В одном варианте реализации кассета экспрессии включала два или более энхансера экспрессии. Эти энхансеры могут быть одинаковыми или могут отличаться друг от друга. Например, энхансер может включать энхансер Alpha mic/bik. Данный энхансер может присутствовать в двух копиях, расположенных рядом друг с другом. В качестве альтернативы, двойные копии энхансера могут быть разделены одной или несколькими последовательностями.
[0159] В еще одном варианте реализации кассета экспрессии дополнительно содержит интрон (например, интрон Promega, усеченный химерный интрон (Т-химерный интрон), интроны, описанные в публикации международной патентной заявки № WO 2011/126808).
[0160] Необязательно одна или более последовательностей могут быть выбраны для стабилизации мРНК. Примером такой последовательности является модифицированная последовательность WPRE, которая может быть сконструирована выше последовательности полиА и ниже кодирующей последовательности (см., например, MA Zanta-Boussif, et al, Gene Therapy (2009) 16: 605-619).
[0161] Энхансер может представлять собой энхансерный элемент ApoE длиной приблизительно 155 п.о., происходящий из аполипопротеина E или ApoE. АпоЕ представляет собой аполипопротеин, который опосредует связывание, интернализацию и катаболизм липопротеиновых частиц, и является лигандом для рецептора липопротеинов низкой плотности (ApoB/E) и для рецептора ApoE в тканях печени. Генетический энхансер, связанный с геном ApoE, является эукариотическим элементом контроля, который может увеличивать транскрипцию нуклеиновой кислоты, особенно в печени.
[0162] Энхансер может включать элемент из контрольного участка печени (например, HCR-1 или HCR-2), связанный с геном ApoE. Например, последовательность из HCR-1 обнаруживается в последовательности SEQ ID NO: 17.
[0163] В еще одном варианте реализации кассета и/или вектор экспрессии дополнительно содержит посттранскрипционный регуляторный элемент (PRE). Примером посттранскрипционного регуляторного элемента является посттранскрипционный регуляторный элемент вируса гепатита сурка (WPRE). Например, последовательность из WPRE показана в SEQ ID NO: 16. WPRE может быть эффективным для увеличения экспрессии белка (например, ДНКазы). WPRE может быть изменен таким образом, что он не образует активную форму усеченного белка X, который кодируется в WPRE. Один такой модифицированный WPRE представлен по меньшей мере в последовательности SEQ ID NO: 16 и в последовательности: энхансер ApoEHCR: промотор hAAT>hDNaseI (гиперактивный) правильный лидер-WPRE Xinact (основания 1576-2212 SEQ ID NO: 30; см. также фигуры 10А и 10B).
[0164] В некоторых вариантах реализации кассеты согласно настоящему изобретению управляют экспрессией терапевтического количества полипептида, кодируемого кодирующей последовательностью, в течение длительного периода, обычно более 200 дней, и в некоторых случаях более 500 дней. Экспрессию полипептида, кодируемого кодирующей последовательностью, можно измерить любыми известными в данной области способами, такими как, например, анализы на основе антител, такие как вестерн-блоттинг или анализ ELISA. Опять же, в качестве неограничивающего примера, экспрессия полипептида, кодируемого кодирующей последовательностью в кассете экспрессии, может быть измерена с помощью биоанализа, который определяет ферментативную или биологическую активность полипептида.
[0165] При попадании в клетки печени (например, гепатоциты) векторы могут оставаться эписомальными (т.е.не интегрироваться в геном клетки-хозяина) или могут интегрироваться в геном клетки-хозяина. Неограничивающие примеры эписомальных векторов включают аденовирусные векторы, и примеры вектора, которые интегрируются в геном клетки-хозяина, включают ретровирусные векторы.
[0166] В некоторых вариантах реализации настоящего изобретения векторы экспрессии, содержащие нуклеотидную последовательность, кодирующую фермент, обладающий ДНКазной активностью, доставляются в клетки в форме липосом, в которых ДНК связана с одним или более липидами, такими как DOTMA (1,2-диолцилоксипропил-3-триметиламмония бромид) и ДОФЭ (диолеоилфосфатидилэтаноламин). В некоторых вариантах реализации катионные липосомы, содержащие DOTMA, эффективны для нацеливания векторов экспрессии согласно настоящему изобретению на печень. В некоторых вариантах реализации лактоферрин и/или поли-L-лизин и/или полиэтиленмин и/или хитозан конъюгированы с вектором экспрессии, причем конъюгат эффективно нацеливается на печень после прямого введения субъекту.
[0167] В некоторых вариантах реализации липосомы имеют размеры меньше, чем фенестрации эндотелиального слоя, выстилающего печеночные синусоиды в печени.
[0168] В некоторых вариантах реализации вектор экспрессии упакован в нановектор или инкапсулирован в нановектор.
[0169] В некоторых вариантах реализации вектор экспрессии упакован в наночастицы фосфорамидита.
[0170] Для увеличения доступности нуклеиновых кислот согласно настоящему изобретению, кодирующих ферменты, обладающие ДНКазной активностью, для клеток-мишеней были разработаны различные устройства, включая, например, катетеры или имплантируемые материалы, содержащие ДНК (G. D. Chapman et al., Circulation Res. 71:27-33 (1992)) и безыгольные струйные инъекционные устройства, которые направляют столб жидкости непосредственно в ткань-мишень под высоким давлением (P. A. Furth et al., Anal Biochem. 20:365-368 (1992); (H. L. Vahlsing et al., J. Immunol. Meth. 175:11-22 (1994); (F. D. Ledley et al., Cell Biochem. 18A:226 (1994)).
[0171] Другой подход к направленной доставке в печень нуклеиновых кислот согласно настоящему изобретению, кодирующих ферменты, обладающие ДНКазной активностью, заключается в применении молекулярных конъюгатов, которые состоят из белка или синтетических лигандов, к которым прикреплен агент, связывающий нуклеиновую кислоту, для специфического нацеливания нуклеиновых кислот в клетки (R. J. Cristiano et al., Proc. Natl. Acad. Sci. USA 90:11548-52 (1993); B. A. Bunnell et al., Somat. Cell Mol. Genet. 18:559-69 (1992); M. Cotten et al., Proc. Natl. Acad. Sci. USA 89:6094-98 (1992)). Было показано, что эта система доставки генов способна осуществлять целевую доставку ко многим типам клеток посредством применения различных лигандов (R. J. Cristiano et al., Proc. Natl. Acad. Sci. USA 90:11548-52 (1993)). Например, липофекция и малярийный циркумспорозоитный белок применяли для печень-специфичной доставки генов (Z. Ding et al., J. Biol. Chem. 270:3667-76 (1995)).
[0172] Предпочтительными путями введения векторов экспрессии согласно настоящему изобретению являются внутрипеченочное, внутривенное и внутриартериальное введение. Однако также можно применять другие пути введения, обеспечивающие нацеливание на печень, такие как, например, энтеральный (например, пероральный), внутримышечный, внутрибрюшинный и т.д.
[0173] Векторы экспрессии согласно настоящему изобретению можно вводить непосредственно в печень любыми признанными в данной области техники способами, такими как инъекция непосредственно в печень, инъекция в воротную вену или инъекция в хвостовую вену.
[0174] Векторы экспрессии согласно настоящему изобретению могут быть доставлены путем (1) создания участка доступа в артерии млекопитающего, (2) введения проводника в артерию, (3) введения интродьюсера через проводник в артерию, (4) продвижения катетера через интродьюсер в печень, (5) введения вектора экспрессии, например, вирионов rAAV, через катетер в печень, (6) удаления катетера и интродьюсера из артерии и (7) восстановления участка доступа. Катетер можно ввести в орган-мишень через соответствующую вену или артерию. Например, можно осуществить доступ к печени через воротную вену или печеночную артерию. Можно осуществить доступ к соответствующей вене или артерии с помощью методов, известных в данной области техники, таких как метод Сельдингера. См., например, Conahan et al., (1977) JAMA 237:446-447, включенную в настоящую заявку посредством ссылки. Известны также другие способы доступа к венам и артериям. См., например, патент США № 5944695, включенный в настоящую заявку посредством ссылки.
[0175] В некоторых других вариантах реализации осуществляют закупоривание одного или более кровеносных сосудов, по которым кровь поступает в печень или выводится из нее. Закупоривающее устройство может представлять собой, например, баллон, прикрепленный к кончику катетера. Все артерии и вены, входящие в печень или выходящие из нее, могут быть закупорены, поэтому вектор экспрессии доставляют посредством бескровной перфузии печени, благодаря чему печень подвергается избирательной перфузии после отключения нормального кровотока печени. Это может быть осуществлено путем пережатия печеночной артерии, воротной вены, надпеченочной полой вены, правой надпочечниковой вены и подпеченочной полой вены для достижения полного отключения сосудов печени. Затем воротную вену канюлируют катетером соответствующего калибра, в то время как в передней стенке подпеченочной полой вены осуществляют разрез, а в полую вену вводят отсасывающую канюлю для сбора оттока. Затем с помощью помпы осуществляют перфузию печени, предпочтительно перфузию за один проход. Скорость потока может варьироваться от 0,1 мл/мин на грамм печени до 10 мл/мин на грамм печени. Скорость 1 мл/мин на грамм печени является предпочтительной и может быть увеличена для обеспечения удовлетворительной перфузии органа. После перфузии разрезы воротной и полой вены зашивают, и осуществляют реваскуляризацию печени. Cardoso, et al., Human Gene Therapy 4:411-418 at 412 (1993).
[0176] В других вариантах реализации векторы экспрессии доставляют в печень путем инъекции в печеночную артерию.
[0177] В органе печени паренхимальные клетки включают гепатоциты, клетки Купфера и эпителиальные клетки, выстилающие желчевыводящие пути и желчные протоки. Основными составляющими паренхимы печени являются многогранные гепатоциты (также известные как клетки печени), которые присутствуют по меньшей мере с одной стороны в печеночном синусоиде и с других сторон в желчном канале. Клетки печени, которые не являются паренхиматозными клетками, включают клетки внутри кровеносных сосудов, такие как эндотелиальные клетки или клетки фибробластов.
[0178] В печени печеночная вена является отводящим кровеносным сосудом, поскольку обычно она переносит кровь от печени в нижнюю полую вену. Также в печени воротная вена и печеночные артерии являются приносящими кровеносными сосудами по отношению к печени, поскольку они обычно переносят кровь к печени.
[0179] Кровеносные сосуды печени включают систему воротной вены, по которой кровь транспортируется из желудочно-кишечного тракта и других внутренних органов (например, селезенки, поджелудочной железы и желчного пузыря) в печень. Еще один кровеносный сосуд печени представляет собой печеночную вену. Печеночной вены также можно достичь через нижнюю полую вену или другой кровеносный сосуд, который в конечном итоге соединяется с печенью. Для введения полинуклеотида в сосудистую систему можно применять иглу или катетер. Инъекцию можно осуществлять под непосредственным наблюдением после разреза и визуализации кровеносных сосудов тканей. В качестве альтернативы катетер можно ввести в удаленном месте и поместить таким образом, чтобы он находился в сосудистой системе, которая соединяется с целевой тканью. В некоторых вариантах реализации осуществляют глубокую инъекцию в полую вену. В другом варианте реализации инъекцию можно осуществлять с применением иглы, которая проходит через неповрежденную кожу и входит в сосуд, который снабжает или отводит кровь от целевой ткани.
[0180] В некоторых вариантах реализации доставку осуществляют следующим образом. Печень и воротную вену визуализируют через вентральный разрез по средней линии. Вектор/липосому/голую ДНК в 1 мл различных растворов, содержащих гепарин для предотвращения свертывания, вводят в воротную вену с помощью иглы в течение примерно 30 секунд.
[0181] Эффективность доставки в печень, экспрессии и секреции фермента, обладающего ДНКазной активностью, может быть определена, например, путем анализа уровня фермента в крови (например, крови, полученной из ретроорбитального венозного синуса), например, с помощью иммунологических анализов (например, анализы с антителами, распознающими фермент, такие как, например, радиоиммунный анализ (RIA) (набор HGH-TGES 100T от Nichols Institute, Сан-Хуан-Капистрано, Калифорния, США)). На экспериментальных моделях животных эффективность доставки в печень, экспрессии и секреции фермента, обладающего ДНКазной активностью, может быть определена, например, путем умерщвления животных посредством смещения шейных позвонков, и разделения печени (средняя масса составляет 1,5 г) на шесть секций, состоящих из двух частей средней доли, двух частей левой боковой доли, правой боковой доли и хвостовой доли с небольшой частью правой боковой доли. Каждая из шести секций может быть помещена отдельно в гомогенизирующий буфер. Гомогенаты можно центрифугировать, и супернатант анализировать на наличие продукта чужеродного гена (т.е. фермента, обладающего ДНКазной активностью). Инъекции в печень могут быть направлены в нижнюю полую вену, которая была зажата в двух местах: проксимально и дистально от входа печеночной вены в нижнюю полую вену. В частности, зажим для нижней полой вены, расположенный ниже по направлению кровотока, можно разместить между диафрагмой и точкой входа печеночной вены. Зажим для нижней полой вены, расположенный выше по направлению кровотока, можно разместить непосредственно перед точкой входа почечных вен. Поскольку вены других органов, таких как почечные вены, входят в нижнюю полую вену в этом месте, не вся инъекцируемая жидкость попадает в печень. У некоторых животных, которым вводят ретроградные инъекции в нижнюю полую вену, печеночная артерия, брыжеечная артерия и воротная вена могут быть зажаты (закупорены).
Парвовирусные векторы, включая аденоассоциированные вирусные векторы
[0182] В некоторых вариантах реализации вектор, применяемый в настоящем изобретении, представляет собой парвовирусный вектор, такой как аденоассоциированный вирусный (AAV) вектор. Термин «парвовирус» в настоящем документе охватывает семейство Parvoviridae, включая автономно реплицирующиеся парвовирусы и депендовирусы. Автономные парвовирусы включают представителей родов Parvovirus, Erythrovirus, Densovirus, Iteravirus и Contravirus. Автономные парвовирусы включают, но не ограничиваясь, минут-вирус мыши, парвовирус крупного рогатого скота, парвовирус собак, парвовирус курицы, вирус панлейкопении кошек, парвовирус кошек, парвовирус гуся, парвовирус H1, парвовирус мускусной утки, вирус B 19 и любые другие автономные парвовирусы, известные в настоящий момент или обнаруженные позже. Другие автономные парвовирусы известны специалистам в данной области техники. См., например, Bernard N. Fields et al., Virology, Vol. 2, Chapter 69 (4th ed., Lippincott-Raven Publishers).
[0183] В некоторых вариантах реализации парвовирусный вектор представляет собой одноцепочечный парвовирусный вектор, такой как вектор AAV. AAV (род Dependovirus) обычно инфицирует людей (например, серотипы 1, 2, 3A, 3B, 4, 5 и 6) или приматов (например, серотипы 1 и 4) или других теплокровных животных (например, AAV крупного рогатого скота, собак, лошадей и овец). Дополнительная информация о парвовирусах и других представителях Parvoviridae представлена, например, в Kenneth I. Berns, “Parvoviridae: The Viruses and Their Replication,” Chapter 69 in Fields Virology (3d Ed. 1996).
[0184] Раскрытые в настоящем документе векторы AAV могут быть получены из любого серотипа AAV, включая комбинации серотипов (например, «псевдотипированный» AAV), или из различных геномов (например, одноцепочечных или самокомплементарных). «Серотип» традиционно определяют на основании отсутствия перекрестной реактивности между антителами к одному вирусу по сравнению с другим вирусом. Такие различия в перекрестной реактивности обычно возникают из-за различий в последовательностях капсидных белков/антигенных детерминантах (например, из-за различий в последовательностях VP1, VP2 и/или VP3). Неограничивающие примеры серотипов AAV, которые можно применять для разработки векторов экспрессии AAV согласно настоящему изобретению, включают, например, серотип 1 AAV (AAV1), AAV2, AAV3 (включая типы 3A и 3B), AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAVrh10 (как описано, например, в патенте США № 9790472, публикации международной заявки на патент № WO2017180857 и WO2017/180861), AAVLK03 (как описано, например, в Wang et al., Mol. Ther., 2015, 23(12):1877-1887), AAVhu37 (как описано, например, в публикации международной заявки на патент № WO2017180857), AAVrh64R1 (как описано, например, в публикации международной заявки на патент № WO2017180857), Anc80 (на основе предсказанного предшественника серотипов AAV1, AAV2, AAV8 и AAV9; см. Zinn et al., Cell Rep., 2015, 12(67): 1056-1068), птичий AAV, бычий AAV, собачий AAV, лошадиный AAV, овечий AAV и любой другой AAV, известный в настоящее время или обнаруженный позже. См., например, Fields et al., Virology, volume 2, chapter 69 (4th ed., Lippincott-Raven Publishers).
[0185] Недавно был идентифицирован ряд предполагаемых новых серотипов и клад AAV (см., например, Gao et al., (2004) J. Virology 78:6381-6388; Moris et al., (2004) Virology 33-:375-383). Геномные последовательности различных серотипов AAV и автономных парвовирусов, а также последовательности концевых повторов, белков Rep и субъединиц капсида известны в данной области техники, например, Srivistava et al., (1983) J. Virology 45:555; Chiorini et al., (1998) J. Virology 71:6823; Chiorini et a1, (1999) J. Virology 73:1309; Bantel-Schaal et al., (1999) J. Virology 73:939; Xiao et al., (1999) J. Virology 73:3994; Muramatsu et al., (1996) Virology 221: 208; Shade et al., (1986) J. Virol. 58:921; Gao et al., (2002) Proc. Nat. Acad. Sci. USA 99:11854; Moris et al., (2004) Virology 33-: 375-383; регистрационный номер в GenBank U89790; регистрационный номер в GenBank J01901; регистрационный номер в GenBank AF043303; регистрационный номер в GenBank AF085716; регистрационный номер в GenBank NC 006152; регистрационный номер в GenBank Y18065; регистрационный номер в GenBank NC 006260; регистрационный номер в GenBank NC_006261; Международные патентные публикации № WO 00/28061, WO 99/61601, WO 98/11244; и Патент США № US 6156303, описание которых включено в настоящую заявку посредством ссылки для изучения последовательностей нуклеиновых кислот и аминокислот парвовируса и AAV.
[0186] Геномная организация всех известных серотипов AAV является очень похожей. Геном AAV представляет собой линейную одноцепочечную молекулу ДНК, длина которой составляет менее 5000 нуклеотидов (nt). Инвертированные концевые повторы (ITR) фланкируют уникальные кодирующие нуклеотидные последовательности для белков неструктурной репликации (Rep) и структурных белков (VP). Белки VP (VP1, VP2 и VP3) образуют капсид. Концевые 145 нуклеотидов являются самокомплементарными и организованы таким образом, что может быть образован энергетически стабильный внутримолекулярный дуплекс, образующий Т-образную шпильку. Эти структуры-шпильки функционируют как исходная точка репликации вирусной ДНК, выступая в качестве праймеров для комплекса клеточной ДНК-полимеразы. После заражения wtAAV в клетках млекопитающих гены Rep (т.е. Rep78 и Rep52) экспрессируются с промотора P5 и промотора P19 соответственно, и оба белка Rep выполняют функцию в репликации вирусного генома.
[0187] В некоторых вариантах реализации рекомбинантные векторы AAV (rAAV) содержат одну или более представляющих интерес нуклеотидных последовательностей, фланкируемых по меньшей мере одной парвовирусной или инвертированной концевой повторяющейся последовательностью AAV (ITR). Такие векторы rAAV можно реплицировать и упаковывать в вирусные частицы при производстве в упаковывающей клетке, которая экспрессирует продукты генов AAV rep и cap (т.е. белки AAV Rep и Cap). Термины «белок AAV Cap» или «белок капсида AAV» в настоящем документе относятся к полипептиду, имеющему по меньшей мере одну функциональную активность нативного белка Cap AAV (например, VP1, VP2, VP3). Примеры функциональных активностей белков Cap (например, VP1, VP2, VP3) включают способность индуцировать образование капсида, способствовать накоплению одноцепочечной ДНК, облегчать упаковку ДНК AAV в капсиды (т.е. инкапсидацию), связываться с клеточными рецепторами и облегчать проникновение вириона в клетки-хозяева.
[0188] В некоторых вариантах реализации векторы AAV могут включать желаемые белки или варианты белков. В настоящем документе термин «вариант» относится к аминокислотной последовательности, которая изменена одной или несколькими аминокислотами. Вариант может иметь «консервативные» изменения, при этом замещенная аминокислота имеет аналогичные структурные или химические свойства, например, замена лейцина изолейцином. Реже вариант может иметь «неконсервативные» изменения, например, замену глицина триптофаном. Аналогичные незначительные вариации могут также включать делеции или вставки аминокислот или и то, и другое.
[0189] Векторы AAV упакованы в вирусные капсиды AAV. Последовательность вирусного капсидного белка AAV определяет многочисленные особенности конкретного вектора AAV. Например, белок капсида влияет на структуру и сборку капсида, взаимодействия с неструктурными белками AAV, такими как белки Rep и AAP, взаимодействия с жидкостями организма хозяина и внеклеточным матриксом, выведение вируса из крови, проницаемость сосудов, антигенность, реактивность на нейтрализующие антитела, тропизм к типу ткани/органа/клетки, эффективность прикрепления и интернализации клеток, внутриклеточные маршруты переноса, скорость раскрытия вирионов и другие. Последовательность капсидного белка (например, VP3) может быть изменена для улучшения доставки в печень.
[0190] Конструкции AAV могут дополнительно содержать последовательность, кодирующую один или более капсидных белков (капсидные белки VP1 и/или VP2 и/или VP3, предпочтительно только капсидный белок VP3), которые упаковывают вышеупомянутую полинуклеотидную последовательность. Последовательности, кодирующие капсидный белок (белки) для применения в контексте настоящего изобретения могут быть взяты из любого из 42 известных серотипов, таких как, например, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, Anc80, или недавно разработанных AAV-подобных частиц, полученных, например, с помощью методик перестановки капсидов и/или применения библиотек капсидов AAV. Некоторые неограничивающие примеры последовательностей капсидных белков см., например, в патентах США № 9790472; 9677089; 7282199; публикациях международных заявок на патент № WO 2015/054653, WO2017/180857 (AAV8, AAV9, AAVrh10, AAVhu37, AAVrh64R1), WO2017/180861 (AAVrh10), WO2017/180854 (AAV8 мутанты), и Wang et al., Mol. Ther., 2015, 23(12):1877-1887 (AAV8, AAVrh10, AAV3B и AAVLK03). Когда последовательности, кодирующие белки капсида, получают из другого серотипа AAV, как ITR, конструкция AAV известна как «гибридный» геном парвовируса (т.е. в котором капсид AAV и концевой повтор(ы) AAV получены от разных AAV), как описано в публикации международной заявки на патент № WO 00/28004 и Chao et al. (2000) Molecular Therapy 2:619.
[0191] В некоторых вариантах реализации капсидный белок (белки) опосредует эффективное нацеливание вектора AAV на печень. В некоторых вариантах реализации капсидный белок (белки) опосредует преимущественное нацеливание вектора AAV на печень. Некоторые капсидные белки (например, VP3 от Anc80, AAV8 и AAV3B) от природы являются специфичными для печени. Настоящее изобретение также охватывает применение мутантов капсида AAV, которые усиливают нацеливание на печень и/или специфичность к печени. Неограничивающие примеры таких точечных мутаций в капсидной последовательности AAV8 включают, например, S279A, S671A, K137R и T252A, а также мутации капсида AAV8, описанные в публикации международной заявки на патент № WO2017/180854 (например, AAV3G1, AAVT20 или AAVTR1, VP3 мутации в аминокислотах 263-267 [например, 263NGTSG267->SGTH или 263NGTSG267->SDTH], и/или аминокислотах 457-459 [например, 457TAN459->SRP], и/или аминокислотах 455-459 [например, 455GGTAN459 ->DGSGL] и/или аминокислотах 583-597).
[0192] Раскрытые AAV-векторы включают нуклеиновую кислоту, кодирующую фермент, обладающий ДНКазной активностью, такой как, например, ДНКаза I. В различных вариантах реализации нуклеиновая кислота также может включать одну или более регуляторных последовательностей, обеспечивающих экспрессию и секрецию кодируемого фермента, такую как, например, промотор, энхансер, сигнал полиаденилирования, участок внутренней посадки рибосомы (IRES), последовательность, кодирующую домен трансдукции белка (PTD), секреторную сигнальную последовательность и т.п. Таким образом, в некоторых вариантах реализации нуклеиновая кислота может содержать промоторный участок, функционально связанный с кодирующей последовательностью, чтобы вызывать или улучшать экспрессию представляющего интерес белка в трансфицированных клетках. Такой промотор может быть универсальным, специфичным для клетки или ткани, сильным, слабым, регулируемым, химерным и т.д., например, для обеспечения эффективного и стабильного продуцирования белка в печени. Промотор может быть гомологичным кодируемому белку или гетерологичным, хотя обычно промоторы, применяемые в раскрытых способах, являются функциональными в клетках человека. Примеры регулируемых промоторов включают, без ограничения, промоторы, содержащие Tet on/off элемент, промоторы, индуцируемые рапамицином, промоторы, индуцируемые тамоксифеном, и промоторы металлотионеина. Другие промоторы, которые можно применять, включают тканеспецифичные промоторы, например, для печени. Неограничивающие примеры печень-специфичных промоторов включают, например, промотор альбумина(Alb), промотор альфа-1 антитрипсина человека (hAAT), тироксин-связывающий глобулин (TBG), промотор аполипопротеина E-контрольного участка печени, промотор аполипопротеина A-II (APOA2), ингибитор серпиновой пептидазы, промотор клады A, члена 1 (SERPINA1) (hAAT), промотор полипептида 4 подсемейства А семейства 3 (CYP3A4) цитохрома Р450; промотор микроРНК 122 (miR-122), печень-специфичный промотор Р1 IGF-II, промотор мышиного транстиретина (MTTR) и промотор альфа-фетопротеина (AFP). Неограничивающие примеры универсальных промоторов включают, например, вирусные промоторы, такие как промотор CMV, промотор RSV, промотор SV40 и т.д., и клеточные промоторы, такие как промотор фосфоглицераткиназы (PGK), промотор EF1a, система промоторов CMVE/CAG и промотор β-актина.
[0193] Конструкции AAV согласно настоящему изобретению могут также содержать неопределяемые концевые повторы. Выражение «неопределяемый концевой повтор» в настоящем документе, относится к концевым повторам, которые не распознаются и не определяются (т. е. «разрываются») белками Rep AAV, так что определение концевого повтора существенно снижается (например, по меньшей мере примерно на 50%, 60%, 70%, 80%, 90%, 95%, 98% или больше по сравнению с определяемым концевым повтором) или исключаются. Такие неопределяемые концевые повторы могут быть встречающимися в природе последовательностями концевых повторов (включая их измененные формы) и, например, могут быть получены из парвовируса, включая AAV, или могут быть получены от другого вируса, или, в качестве дополнительной альтернативы, могут быть частично или полностью синтетическими. Неопределяемый концевой повтор может представлять собой вирусную последовательность, не относящуюся к AAV, которая не распознается белками AAV Rep, или он может представлять собой концевой повтор AAV, который был модифицирован (например, путем вставки, замены и/или делеции), благодаря чему он больше не распознается белками AAV Rep. Кроме того, неопределяемый концевой повтор может представлять собой любой концевой повтор, который не определяется в условиях, применяемых для получения вирусного вектора. Кроме того, концевой повтор AAV может быть модифицирован таким образом, что определение белками AAV Rep существенно снижается или исключается. Неопределяемый концевой повтор может представлять собой любую инвертированную последовательность повтора, которая образует структуру шпильки и не может быть разрезана белками AAV Rep.
[0194] Инвертированные концевые повторы (ITR) обычно присутствуют по меньшей мере в двух копиях в векторе AAV, обычно фланкируя кассету экспрессии, содержащую нуклеотидную последовательность (и), кодирующую фермент, обладающий ДНКазной активностью. ITR обычно находятся на 5'- и 3'-концах нуклеотидной последовательности(ей), кодирующей фермент, обладающий ДНКазной активностью, но не обязательно примыкает к ней. ITR могут быть одинаковыми или отличаться друг от друга. Термин «концевой повтор» включает любой вирусный концевой повтор и/или частично или полностью синтетические последовательности, которые образуют структуры шпильки и функционируют как инвертированный концевой повтор, такие как «последовательность с двойной D», как описано в патентах США № 5478745, Samulski et al. «Конечный повтор AAV» может происходить от любого AAV, включая, не ограничиваясь ими, серотипы 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, Anc80 или любой другой AAV, известный в настоящее время или обнаруженный позже. Концевой повтор AAV не обязательно должен иметь последовательность дикого типа (например, последовательность дикого типа может быть изменена путем вставки, делеции, процессинг или миссенс-мутаций), пока концевой повтор опосредует желаемые функции, например, репликацию, разрезание, упаковку вирусов, интеграцию и/или спасение провирусов и т.п. Векторная конструкция может включать один или более (например, два) концевых повтора AAV, которые могут быть одинаковыми или разными. Кроме того, один или более концевых повторов AAV могут принадлежать к тому же серотипу AAV, что и капсид AAV, или могут быть разными. В конкретных вариантах реализации векторная конструкция включала концевой повтор AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 и/или Anc80.
[0195] Нуклеотидные последовательности ITR парвовирусов обычно представляют собой палиндромные последовательности, содержащие в основном комплементарные, симметрично расположенные последовательности, также называемые областями «А», «В» и «С». ITR функционирует в качестве начала репликации, сайта, играющего "цис"-роль в репликации, т.е. сайта узнавания для транс-действующих белков репликации, таких как, например, Rep78 (или Rep68), которые узнают палиндром и специфичные последовательности, являющиеся внутренними по отношению к палиндрому. Одним исключением с точки зрения симметрии последовательности ITR является область "D" ITR. Она является уникальной (не имеющей комплемента в пределах одного ITR). Образование разрывов одноцепочечной ДНК происходит в месте соединения между областями А и D. В указанном участке инициируется синтез новой ДНК. Участок D обычно находится с одной стороны от палиндрома и обеспечивает направленность к стадии репликации нуклеиновой кислоты. Парвовирус, реплицирующийся в клетке млекопитающего, обычно имеет две последовательности ITR. Однако можно сконструировать ITR так, чтобы сайты связывания были на обеих нитях областей А, и области D были расположены симметрично, по одной с каждой стороны палиндрома. На двунитевой кольцевой матрице ДНК (например, плазмиде), репликация нуклеиновой кислоты, осуществляемая с помощью Rep78 или Rep68, происходит в обоих направлениях, и одного ITR достаточно для парвовирусной репликации кольцевого вектора. Таким образом, в контексте настоящего изобретения можно применять одну нуклеотидную последовательность ITR. Однако можно применять два или другое четное количество стандартных ITR.
[0196] Функциональные последовательности ITR являются необходимыми для репликации, спасения или упаковки вирионов AAV. Последовательности ITR могут представлять собой последовательности дикого типа или могут быть по меньшей мере на 80%, 85%, 90%, 95% или 100% идентичными с последовательностями дикого типа. Последовательности ITR могут быть изменены, например, путем вставки, мутации, делеции или замены нуклеотидов, пока они остаются функциональными. В данном контексте функциональность относится к способности направлять упаковку генома в оболочку капсида и затем обеспечивать трансдукцию экспрессии в клетке-хозяине или клетке-мишени.
[0197] Вектор AAV может состоять из одноцепочечной или двухцепочечной (самокомплементарной) ДНК. Одноцепочечная молекула нуклеиновой кислоты представляет собой либо смысловую, либо антисмысловую цепь, поскольку обе полярности в равной степени способны экспрессировать гены. Вектор AAV может дополнительно содержать маркерный или репортерный ген, такой как, например, кодирующий ген устойчивости к антибиотикам, флуоресцентный белок (например, GFP) или ген, кодирующий химически, ферментативно или иным образом детектируемый и/или селектируемый продукт (например, lacZ, aph и др.), известные в данной области техники.
[0198] Векторы экспрессии AAV могут содержать нуклеиновую кислоту, которая может включать секреторную сигнальную последовательность, обеспечивающую секрецию кодируемого фермента, который обладает ДНКазной активностью, из трансдуцированной клетки. Неограничивающие примеры таких секреторных сигнальных последовательностей включают, например, секреторную сигнальную последовательность ДНКазы I, секреторную сигнальную последовательность IL2, секреторную сигнальную последовательность альбумина, секреторную сигнальную последовательность β-глюкуронидазы, секреторную сигнальную последовательность щелочной протеазы и секреторную сигнальную последовательность фибронектина.
[0199] В некоторых вариантах реализации в качестве вектора экспрессии применяют вектор на основе AAV8 или Anc80. Векторы AAV8 и Anc80 особенно подходят для нацеливания и экспрессии в печени. Например, оба вектора AAV8 и Anc80 могут трансфицировать клетки печени с большей эффективностью по сравнению с вектором AAV2. И AAV8, и Anc80 также индуцируют меньшие количества нейтрализующих антител, чем некоторые другие векторы AAV.
[0200] Вектор AAV8 или вектор Anc80, содержащий нуклеотид, кодирующий фермент, обладающий ДНКазной активностью, можно вводить внутрипеченочно (например, посредством прямой инъекции в орган) или системно, например, путем внутривенной инъекции вектора AAV8 или Anc80, эффективного для трансфекции клеток печени и опосредования эффективного продуцирования кодируемого фермента, обладающего ДНКазной активностью, и его секреции в периэндотелиальном пространстве и пространстве Диссе. В некоторых вариантах реализации капсидный белок Anc80 (например, капсидный белок Anc80 VP1, содержащий последовательность SEQ ID NO: 3 или SEQ ID NO: 9, или капсидный белок Anc80L65 VP1, содержащий последовательность SEQ ID NO: 34, или капсидный белок, вариант Anc80L65 VP1, содержащий последовательность SEQ ID NO: 35), кодируется нуклеотидной последовательностью в векторе экспрессии. В некоторых вариантах реализации капсидный белок AAV8 (например, AAV8 VP1 или AAV8 VP3) кодируется нуклеотидной последовательностью в векторе экспрессии. Периферическое введение векторов AAV согласно настоящему изобретению может включать системные инъекции, такие как, например, внутримышечные, внутривенные, внутрибрюшинные и внутриартериальные инъекции.
[0201] Желаемые дозы фермента ДНКазы, кодирующего векторы AAV согласно настоящему изобретению, могут быть легко адаптированы специалистом в данной области техники, например, в зависимости от состояния заболевания, субъекта, схемы лечения и т.д. В некоторых вариантах реализации вводят от 105 до 1014 рекомбинантных вирусных частиц на дозу, например, от 106 до 1011, от 107 до 1011 или от 108 до 1014. В других вариантах реализации примерные дозы для достижения терапевтических эффектов могут включать титры по меньшей мере примерно 105, 106, 107, 108, 109, 1010 или 1011 рекомбинантных вирусных частиц или более.
[0202] Экзогенная нацеливающая последовательность(и) может замещать или заменять часть или всю основную субъединицу капсида (например, VP3). В качестве дополнительной альтернативы в капсид вириона можно ввести более одной экзогенной нацеливающей последовательности, например, две, три, четыре, пять или более последовательностей. В альтернативных вариантах реализации могут быть осуществлены вставки и замены в минорных субъединицах капсида (например, VP1 и VP2). Для капсидов AAV могут быть осуществлены вставки или замены в VP2 или VP3.
[0203] Тропизм нативного вириона можно снизить или устранить путем вставки или замены аминокислотной последовательности. В качестве альтернативы, вставка или замена экзогенной аминокислотной последовательности может нацелить вирион на конкретный тип(ы) клеток. Экзогенная нацеливающая последовательность может представлять собой любую аминокислотную последовательность, кодирующую белок или пептид, изменяющий тропизм вириона. В конкретных вариантах реализации целевой пептид или белок может быть природным или, в качестве альтернативы, полностью или частично синтетическим. Примеры пептидов и белков включают лиганды и другие пептиды, которые связываются с рецепторами клеточной поверхности, присутствующими в клетках печени, включая лиганды, способные связывать рецептор Sr-B1 аполипротеина E, галактозо- и лактозоспецифичные лектины, лиганды рецепторов липопротеинов низкой плотности, лиганды асиалогликопротеина (галактозо-концевые) и тому подобное.
[0204] В качестве альтернативы, экзогенная нацеливающая последовательность может представлять собой антитело или его антиген-распознающий фрагмент. В настоящем документе термин «антитело» относится ко всем типам иммуноглобулинов, включая IgG, IgM, IgA, IgD и IgE. Антитела могут быть моноклональными или поликлональными и могут быть любого вида происхождения, включая (например) мышь, крысу, кролика, лошадь или человека, или могут быть химерными антителами. Термин «антитело» также охватывает биспецифические или «мостиковые» антитела, известные специалистам в данной области техники. Фрагменты антител в рамках настоящего изобретения включают, например, фрагменты Fab, F(ab′)2 и Fc, и соответствующие фрагменты, полученные из антител, отличных от IgG. Такие фрагменты могут быть получены известными методами. Экзогенная аминокислотная последовательность, вставленная в капсид вириона, может быть такой, которая облегчает очистку или обнаружение вириона. Например, экзогенная аминокислотная последовательность может включать полигистидиновую последовательность, которую можно применять для очистки вириона на никелевой колонке, как известно специалистам в данной области техники, или антигенный пептид или белок, который можно применять для очистки вириона стандартными методами иммуноочистки. В качестве альтернативы, аминокислотная последовательность может кодировать рецепторный лиганд или любой другой пептид или белок, который можно применять для очистки модифицированного вириона посредством аффинной очистки или любыми другими методами, известными в данной области техники (например, методы очистки, основанные на разном размере, плотности, заряде или изоэлектрической точке, ионообменная хроматография или пептидная хроматография).
[0205] В качестве альтернативы, экзогенная нацеливающая последовательность может представлять собой антитело или его антиген-распознающий фрагмент. В настоящем документе термин «антитело» относится ко всем типам иммуноглобулинов, включая IgG, IgM, IgA, IgD и IgE. Антитела могут быть моноклональными или поликлональными и могут быть любого вида происхождения, включая (например) мышь, крысу, кролика, лошадь или человека, или могут быть химерными антителами. Термин «антитело» также охватывает биспецифические или «мостиковые» антитела, известные специалистам в данной области техники. Фрагменты антител в рамках настоящего изобретения включают, например, фрагменты Fab, F(ab′)2 и Fc, и соответствующие фрагменты, полученные из антител, отличных от IgG. Такие фрагменты могут быть получены известными методами.
[0206] Экзогенная аминокислотная последовательность, вставленная в капсид вириона, может быть такой, которая облегчает очистку или обнаружение вириона. Согласно данному аспекту изобретения нет необходимости, чтобы экзогенная аминокислотная последовательность также изменяла вирион модифицированного парвовируса. Например, экзогенная аминокислотная последовательность может включать полигистидиновую последовательность, которую можно применять для очистки вириона на никелевой колонке, как известно специалистам в данной области техники, или антигенный пептид или белок, который можно применять для очистки вириона стандартными методами иммуноочистки. В качестве альтернативы, аминокислотная последовательность может кодировать рецепторный лиганд или любой другой пептид или белок, который можно применять для очистки модифицированного вириона посредством аффинной очистки или любыми другими методами, известными в данной области техники (например, методы очистки, основанные на разном размере, плотности, заряде или изоэлектрической точке, ионообменная хроматография или пептидная хроматография).
Аденовирусные векторы
[0207] Геном аденовируса представляет собой линейную двухцепочечную ДНК размером 36 т.п.о., содержащую множество транскриптов с сильным сплайсингом. На обоих концах генома находятся инвертированные концевые повторы (ITR). Гены делятся на ранние (E1-E4) и поздние (L1-L5) транскрипты.
[0208] В некоторых вариантах реализации рекомбинантные аденовирусные векторы имеют два удаленных гена: E1 и E3 (dE1/E3). Делеция E1 делает вирусный вектор дефектным по репликации. E1 может быть обеспечена линиями упаковывающих аденовирус клеток (например, T 293 или 911). E3 участвует в уклонении от иммунитета хозяина и не является важным для воспроизводства вируса. Удаление E1 и E3 приводит к упаковочной способности трансгена > 8 т.о. В некоторых вариантах реализации конструкции содержат левое и правое плечо для облегчения гомологичной рекомбинации трансгена в аденовирусную плазмиду.
[0209] Можно применять любой из принятых типов аденовируса человека, такой как, например, аденовирусный вектор на основе Ad5. Векторы на основе Ad5 используют рецептор аденовируса Коксаки (CAR) для проникновения в клетки. В некоторых вариантах реализации в качестве вектора применяют аденовирус 5 типа (dE1/E3) человека. Большинство аденовирусных векторов сконструированы таким образом, что трансген заменяет гены Ad E1a, E1b и/или E3; впоследствии дефектный по репликации вектор размножается в человеческих клетках 293, которые обеспечивают функцию удаленного гена при переносе. Аденовирусные векторы могут трансдуцировать различные типы тканей in vivo, включая неделящиеся, дифференцированные клетки, такие как клетки печени. Обычные векторы Ad обладают большой пропускной способностью. Пример применения вектора Ad в клиническом испытании включает полинуклеотидную терапию для противоопухолевой иммунизации с помощью внутримышечной инъекции (Sterman et al., Hum. Gene Ther. 7:1083-9 (1998)). Дополнительные примеры применения аденовирусных векторов для переноса генов в клинических испытаниях включают Rosenecker et al., Infection 24:1 5-10 (1996); Sterman et al., Hum. Gene Ther. 9:7 1083-1089 (1998); Welsh et al., Hum. Gene Ther. 2:205-18 (1995); Alvarez et al., Hum. Gene Ther. 5:597-613 (1997); Topf et al., Gene Ther. 5:507-513 (1998); Sterman et al., Hum. Gene Ther. 7:1083-1089 (1998).
Векторы гепатита В и другие гепатотропные векторы
[0210] В некоторых вариантах реализации печень-специфичная доставка и экспрессия фермента, обладающего ДНКазной активностью, может быть достигнута путем применения вирусных векторов, которые естественным образом нацелены на гепатоциты. Векторы, полученные из гепатотропных вирусов, таких как вирусы гепатита B (HBV) или другие вирусы из семейства hepadnaviridae, можно вводить через кровоток и нацеливать на гепатоциты с применением тех же рецепторов, что и вирусы дикого типа. Вирус гепатита B (HBV) является прототипом hepadnaviridae, семейства небольших ДНК-вирусов с оболочкой с ярко выраженной специфичностью к хозяину и тканям (Ganem, 1996). Гепаднавирусы были обнаружены у млекопитающих, например, человека (HBV), сурка (WHV) и сусликов (GSHV), а также у птиц, например, пекинских уток (DHBV) и серых цапель (HHBV).
[0211] В одном из вариантов реализации настоящего изобретения векторы HBV сохраняют все цис-действующие элементы, необходимые для репликации вирусного генома. Однако настоящее изобретение не ограничивает положение двух новых цис-действующих элементов (то есть, α-элемента и β-элемента) в указанном положении на карте. В одном варианте реализации предполагается, что для размещения более крупной вставки без превышения предельного размера упаковки положение новых цис-действующих элементов может быть изменено без ущерба для векторной функции.
[0212] В одном варианте реализации способа последовательность, кодирующая фермент, обладающий ДНКазной активностью, вставлена между α-элементом и DR2 вектора HBV. В другом варианте реализации способа предполагается, что последовательность, кодирующая фермент, обладающий ДНКазной активностью, вставлена между 5'-эпсилон и α-элементом вектора HBV.
Доставка голой ДНК
[0213] В некоторых вариантах реализации вектор экспрессии, содержащий последовательность, кодирующую фермент, обладающий ДНКазной активностью, вводят субъекту в виде голой ДНК. Такая голая ДНК может быть доставлена, например, в кровеносный сосуд печени в дистальных или проксимальных точках.
Вирусные векторы, заключенные в оболочку
[0214] В различных вариантах реализации настоящего изобретения вирусную частицу в оболочке можно применять для доставки в печень нуклеиновой кислоты, кодирующей фермент, обладающий ДНКазной активностью.
[0215] В некоторых вариантах реализации описанная в настоящем документе вирусная частица получена из вируса семейства Retroviridae. В одном конкретном варианте реализации описанная в настоящем документе вирусная частица представляет собой ретровирусную частицу. В другом конкретном варианте реализации описанная в настоящем документе вирусная частица представляет собой лентивирусную частицу. По сравнению с другими системами переноса генов, лентивирусные и ретровирусные векторы обладают широким спектром преимуществ, включая их способность трансдуцировать различные типы клеток, стабильно интегрировать перенесенный генетический материал в геном целевой клетки-хозяина и экспрессировать трансдуцированный ген на значительных уровнях. Векторы, полученные из гамма-ретровирусов, например, вируса мышиного лейкоза (MLV), применяли в клинических исследованиях генной терапии (Ross et al., Hum. Gen Ther. 7:1781-1790, 1996).
[0216] В одном конкретном варианте реализации по меньшей мере один вирусный элемент, связанный с представляющим интерес нуклеотидом, является ретровирусным элементом. В другом конкретном варианте реализации по меньшей мере один вирусный элемент, связанный с представляющим интерес нуклеотидом, представляет собой лентивирусный элемент. В одном конкретном варианте реализации по меньшей мере один вирусный элемент, связанный с представляющим интерес нуклеотидом, представляет собой сигнал упаковки Psi (ψ).
[0217] В одном конкретном варианте реализации лентивирусная частица не содержит белок поверхностной оболочки gp120 и/или белок трансмембранной оболочки gp41. В другом конкретном варианте реализации лентивирусная частица содержит мутантный белок поверхностной оболочки gp120 и/или мутантный белок трансмембранной оболочки gp41.
[0218] В некоторых вариантах реализации вирусные частицы, описанные в настоящем документе, имеют недостаточную репликацию и содержат только неполный геном вируса, от которого они происходят. Например, в некоторых вариантах реализации лентивирусные и ретровирусные частицы не содержат генетическую информацию генов gag, env или pol (которые могут участвовать в сборке вирусной частицы), что является известным минимальным требованием для успешной репликации лентивируса или ретровируса. В этих случаях минимальный набор вирусных белков, необходимых для сборки векторной частицы, обеспечивается при переносе с помощью пакующей клеточной линии. В одном конкретном варианте реализации гены env, tat, vive, vpu и nef отсутствуют в лентивирусных частицах, полученных из HIV-1, и обеспечиваются при переносе или становятся неактивными в результате использования мутации (мутаций) со сдвигом рамки считывания.
[0219] В некоторых вариантах реализации молекула РНК, включенная в лентивирусные или ретровирусные частицы (и кодирующая фермент, обладающий ДНКазной активностью), включала сигнал упаковки psi и LTR. Для достижения экспрессии нуклеотидной последовательности, кодирующей фермент, обладающий ДНКазной активностью, в клетках печени, такую последовательность обычно помещают под контроль неограничивающими примерами повсеместных промоторов, включая, например, вирусные промоторы, такие как промотор CMV, промотор RSV, промотор SV40 и т.д., и клеточные промоторы, такие как промотор фосфоглицераткиназы (PGK), промотор EF1a, система промоторов CMVE/CAG и промотор β-актина.
[0220] В некоторых вариантах реализации лентивирусных и ретровирусных частиц молекула РНК вместе с белками, кодируемыми gag и pol, обеспечиваются при переносе пакующей линией клеток, затем собираются в векторные частицы, которые затем инфицируют клетки, подвергают обратной транскрипции молекулу РНК, которая включает нуклеотидную последовательность, кодирующую фермент, обладающий ДНКазной активностью под контролем промотора, и либо интегрируют указанную генетическую информацию в геном клеток-мишеней, либо остаются эписомальными (если один или более компонентов, необходимых для интеграции, нарушены). Если генетическая информация для белков, кодируемых gag и pol, отсутствует на трансдуцированной молекуле РНК, векторные частицы имеют дефицит репликации, то есть трансдуцированная клетка, таким образом, не будет генерировать новое поколение указанных векторных частиц, что обеспечивает безопасность применения в клинических условиях.
[0221] В некоторых вариантах реализации любого из вышеуказанных способов один или более вирусных элементов кодируют компонент(ы) вируса иммунодефицита человека (HIV), компонент(ы) вируса иммунодефицита крупного рогатого скота (BIV), компонент(ы) вируса иммунодефицита кошек (FIV), компонент(ы) вируса иммунодефицита обезьян (SIV), компонент(ы) вируса инфекционной анемии лошадей (EIAV), компонент(ы) вируса стволовых клеток мыши (MSCV), компонент(ы) вируса лейкемии мыши (MLV), компонент(ы) вируса лейкоза птиц (ALV), компонент(ы) вируса лейкоза кошек (FLV), компонент(ы) вируса лейкоза крупного рогатого скота (BLV), компонент(ы) Т-лимфотропного вируса человека (HTLV), компонент(ы) вируса саркомы кошек, компонент(ы) вируса ретикулоэндотелиоза птиц, компонент(ы) вируса артрита коз (CAEV) и/или компонент(ы) вируса висна-маэди (VMV).
[0222] В сочетании с описанными в настоящем документе вирусными частицами, в настоящем документе описаны способы обнаружения и/или выделения клеток. В некоторых вариантах реализации в таком способе применяют вирусные частицы, содержащие селектируемый маркер (например, резистентность к неомицину) и/или репортер (например, GFP или eGFP) в качестве представляющей интерес нуклеотидной последовательности, обеспечивающей нацеливание на клетки с применением, например, воздействия соединения для отбора или сортировки активированных флуоресценцией клеток (FACS).
[0223] В некоторых вариантах реализации описанные в настоящем документе ретровирусные векторы получены из вируса лейкемии мыши (MLV). Ретровирусные векторы, кодирующие MLV, широко доступны для специалистов в данной области, например, PINCO (Grignani et al., 1998) или серия векторов pBabe (Morgenstern and Land, 1990).
[0224] В некоторых вариантах реализации описанные в настоящем документе лентивирусные частицы получены из лентивируса, такого как вирус иммунодефицита человека (HIV). Подходящие векторы, кодирующие HIV и другие походящие вирусы, могут быть легко идентифицированы и/или получены квалифицированным специалистом в данной области техники.
[0225] В одном конкретном варианте реализации вектор-переносчик включает энхансер/промоторную последовательность цитомегаловируса (CMV); последовательности R и U5 из HIV 5′ LTR; flap сигнал HIV-1; внутренний энхансер; внутренний промотор; представляющую интерес нуклеотидную последовательность; элемент, реагирующий на вирус гепатита сурков; амбер-супрессорную последовательность тРНК; элемент U3 с делецией его энхансерной последовательности; куриный бета-глобиновый инсулятор; и последовательности R и U5 3′ HIV LTR.
[0226] В настоящем изобретении также рассматриваются вирусные векторы в оболочке, содержащие гетерологичную нацеливающую последовательность или молекулу, вставленную или замещенную в нативную оболочку. Гетерологичная нацеливающая последовательность или молекула может обеспечивать измененный тропизм к печени или повышать эффективность доставки вектора в печень.
Способы и режимы введения векторов экспрессии, кодирующих фермент ДНКазу
[0227] В способах согласно настоящему изобретению векторы экспрессии, содержащие кодирующую нуклеиновую кислоту и фермент, обладающий ДНКазной активностью, могут быть введены пациенту за один раз или в течение ряда курсов лечения; один или несколько раз в день.
[0228] Эффективное количество вводимого вектора экспрессии будет варьироваться от пациента к пациенту. Соответственно, эффективные количества наилучшим образом определяет врач, вводящий композиции, и соответствующие дозировки может легко определить специалист в данной области техники. Посредством анализа крови (сыворотка, плазма) или тканевых уровней фермента, кодируемого вектором, который обладает ДНКазной активностью, и сравнения с исходным уровнем до введения можно определить, является ли вводимое количество слишком низким, в правильном диапазоне или слишком высоким. Подходящие режимы для начального и последующего введения также варьируются, но типичными являются начальное введение, за которым следуют, если необходимо, последующие введения. Последующие введения можно вводить с различными интервалами, от ежедневного до еженедельного, ежемесячного, ежегодного и до одного раза в несколько лет.
[0229] Дозы вектора экспрессии, кодирующего фермент, обладающий ДНКазной активностью, зависят от типа состояния, подлежащего лечению, тяжести и течения данных побочных эффектов, истории болезни пациента, мнения лечащего врача и реакции на предшествующее лечение, такое как, например, химиотерапия или лучевая терапия и терапия белками ДНКазы. В некоторых вариантах реализации эффективное количество вектора экспрессии представляет собой количество, которое приводит к уровню белка ДНКазы в воротной вене печени, составляющему от 0,5 до 100 мг/л или от 1000 до 200000 единиц Кунитца (KU)/л, от 0,5 до 50 мг/л или от 1000 до 100000 единиц Кунитца (KU)/л, от 1,5 до 50 мг/л или от 3000 до 100000 KU/л, от 10 до 50 мг/л или от 20000 до 100000 KU/л.
[0230] Введение вектора экспрессии, например, AAV- или вирусного вектора, кодирующего фермент ДНКазу, и/или фермента ДНКазы в соответствии со способами согласно настоящему изобретению можно осуществлять любым подходящим путем, включая, например, внутривенное, иннтраартериальное и внутрипеченочное введение.
Лечение рака
[0231] В одном аспекте предложен способ лечения или устранения рака у субъекта, страдающего раком, который включает введение субъекту терапевтически эффективного количества вектора экспрессии, кодирующего фермент, который обладает ДНКазной активностью (например, ДНКазу I, такую как, например, рекомбинантная ДНКаза I человека или ДНКаза I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазу II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу). В некоторых вариантах реализации фермент ДНКаза содержит последовательность, изложенную в SEQ ID NO: 1 (последовательность предшественника дикого типа, содержащая секреторную сигнальную последовательность). В некоторых вариантах реализации фермент ДНКаза содержит последовательность, изложенную в SEQ ID NO: 2 (мутантная последовательность предшественника, содержащая секреторную сигнальную последовательность, а также мутации, ослабляющие опосредованное актином ингибирование). В некоторых вариантах реализации фермент ДНКаза включает последовательность, изложенную в SEQ ID NO: 4 (зрелая последовательность дикого типа без секреторной сигнальной последовательности). В некоторых вариантах реализации под ферментом ДНКаза понимается последовательность, представленная в SEQ ID NO: 5 (зрелая мутантная последовательность без секреторной сигнальной последовательности и содержащая мутации, ослабляющие актин-опосредованное ингибирование). В некоторых вариантах реализации фермент ДНКаза экспрессируется под контролем печень-специфичного промотора или печень-специфичного энхансерного элемента.
[0232] Количество и способ введения векторов экспрессии согласно настоящему изобретению должны быть эффективными для лечения рака, например, одним или более из следующих способов: уменьшение размера опухоли, уменьшение скорости роста опухоли, уменьшение скорости метастазирования, усиление терапевтических эффектов химиотерапии и/или лучевой терапии, продление жизни, снижение скорости потери массы тела, связанной с раком или лечением, или увеличение скорости набора массы тела.
[0233] В некоторых вариантах реализации введение вектора экспрессии, кодирующего фермент, обладающий ДНКазной активностью, можно комбинировать с введением того же фермента, что и белок (например, внутривенно, внутриартериально, внутрипеченочно, внутримышечно, интраперитонеально, энтерально и т.д.). Фермент может представлять собой, например, любой из ферментов ДНКаз (например, ДНКазу I (например, рекомбинантную ДНКазу I человека или ДНКазу I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазу II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу).
[0234] Способы лечения с применением векторов согласно настоящему изобретению можно применять у субъектов, страдающих широким спектром типов рака. Настоящее изобретение особенно подходит для лечения «рака воротной вены», который включает любую карциному, саркому, меланому или лимфому, возникающую в органах, тканях и структурах, отток из которых происходит в воротную вену, или метастазы в них (см. фигуру 1). Неограничивающие примеры рака воротной вены включают, например, перитонеальный карциноматоз, лимфомы (например, В-клеточную лимфому, Т-клеточную лимфому, неходжкинские лимфомы, лимфому Ходжкина), рак желудка, рак толстой кишки, рак кишечника, колоректальный рак, рак поджелудочной железы, рак печени, рак селезенки, рак желчного протока, рак желчного пузыря, саркомы в ткани, дренирующей в воротную вену (например, ангиосаркому, эндотелиосаркому, гемангиосаркому, лейомиосаркому, другие саркомы и эпителиальную карциному в таких тканях) , и метастатические заболевания печени любого происхождения.
[0235] Неограничивающие примеры других видов рака, которые можно лечить способами согласно настоящему изобретению, включают, например, рак молочной железы, рак простаты, множественную миелому, переходно-клеточную карциному, рак легкого (например, немелкоклеточный рак легкого (NSCLC)), рак почек, рак щитовидной железы, лейкоз (например, хронический миелоидный лейкоз, острый миелоидный лейкозхронический лимфоцитарный лейкоз, острый лимфоцитарный лейкоз), рак головы и шеи, рак пищевода, рак прямой кишки, рак яичников, рак эндометрия матки, рак влагалища, рак шейки матки, рак мочевого пузыря, нейробластому, саркому, остеосаркому, злокачественную меланому, плоскоклеточный рак, рак костей (включая как первичный рак костей (например, остеосаркому, хондросаркому, саркому Юинга, фибросаркому, злокачественную фиброзную гистиоцитому, адамантиному и гигантоклеточную опухоль), так и вторичный (метастатический) рак костей), саркому мягких тканей, базальноклеточную карциному, ангиосаркому, гемангиосаркому, миксосаркому, липосаркому, остеогенную саркому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, рак яичка, рак матки, мезотелиому, лейомиосаркому, рабдомиосаркому, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, макроглобулинемию Вальденстрема, папиллярные аденокарциномы, цистаденокарциному, бронхогенную карциному, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, эпителиальную карциному, глиому, глиобластому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, акустическую невриному, олигодендроглиому, менингиому, ретинобластому, медуллярную карциному, тимому, саркому и т.д.
[0236] Для комбинированного лечения рака вектор экспрессии, например, вектор AAV, или лентивирусный вектор, или аденовирусный вектор, кодирующий фермент, обладающий ДНКазной активностью, можно вводить до, совместно или после химиотерапевтического агента (или лучевой терапии).
[0237] В некоторых вариантах реализации способы согласно настоящему изобретению применяют для предотвращения рака у пациента, например, пациента с высоким риском предрасположенности к раку.
[0238] В некоторых вариантах реализации способы согласно настоящему изобретению применяют для предотвращения рака после положительного результата скринингового теста ДНК на основе крови (например, жидкая биопсия) для выявления предрасположенности к раку.
[0239] В некоторых вариантах реализации способы согласно настоящему изобретению применяют для предотвращения рака после оценки гена предрасположенности к опухоли. Примеры генов предрасположенности к опухоли включают, но не ограничиваются ими, гены ABL1 (ABL), ABL2(ABLL, ARG), AKAP13 (HT31, LBC. BRX), ARAF1, ARHGEF5 (TIM), ATF1, AXL, BCL2, BRAF (BRAF1, RAFB1), BRCA1, BRCA2(FANCD1), BRIP1, CBL (CBL2), CSF1R (CSF-1, FMS, MCSF), DAPK1 (DAPK), DEK (D6S231E), DUSP6(MKP3,PYST1), EGF, EGFR (ERBB, ERBB1), ERBB3 (HER3), ERG, ETS1, ETS2, EWSR1 (EWS, ES, PNE), FES (FPS), FGF4 (HSTF1,KFGF), FGFR1, FGFR10P (FOP), FLCN, FOS (c-fos), FRAP1, FUS (TLS), HRAS, GLI1, GLI2, GPC3, HER2 (ERBB2, TKR1, NEU), HGF (SF), IRF4 (LSIRF, MUM1), JUNB, KIT(SCFR), KRAS2 (RASK2), LCK, LCO, MAP3K8(TPL2, COT, EST), MCF2 (DBL), MDM2, MET(HGFR, RCCP2), MLH типа, гены MMD, MOS (MSV), MRAS (RRAS3), MSH типа, гены MYB (AMV), MYC, MYCL1 (LMYC), MYCN, NCOA4 (ELE1, ARA70, PTC3), NF1 типа, NMYC, NRAS, NTRK1 (TRK, TRKA), NUP214 (CAN, D9S46E), OVC, TP53 (P53), PALB2, PAX3 (HUP2), STAT1, PDGFB (SIS), PIM гены, PML (MYL), PMS (PMSL) гены, гены PPM1D (WIP1), PTEN (MMAC1), PVT1, RAF1 (CRAF), RB1 (RB), RET, RRAS2 (TC21), ROS1 (ROS, MCF3), SMAD типа, SMARCB1(SNF5, INI1), SMURF1, SRC (AVS), STAT1, STAT3, STAT5, TDGF1 (CRGF), TGFBR2, THRA (ERBA, EAR7 и т.д.), TFG (TRKT3), TIF1 (TRIM24, TIF1A), TNC (TN, HXB), TRK, TUSC3, USP6 (TRE2), WNT1 (INT1), WT1 и VHL.
[0240] Ген предрасположенности можно оценить с помощью одного или более из следующих способов: секвенирование следующего поколения, полногеномное секвенирование, секвенирование экзома, способ на основе ELISA и амплификация ПЦР. Другие способы также можно применять для оценки гена предрасположенности.
[0241] В другом аспекте в настоящем изобретении предложен способ лечения или устранения рака у субъекта, нуждающегося в этом, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом указанный вектор экспрессии обеспечивает синтез фермента ДНКазы в печени указанного субъекта. В некоторых вариантах реализации рак сопровождается увеличением общего уровня или относительного содержания внеклеточной ДНК (вкДНК) микробного происхождения в крови указанного субъекта. В нескольких вариантах реализации способ включает определение уровня вкДНК микробного происхождения или отношения вкДНК микробного происхождения к общему уровню вкДНК в крови субъекта. Неограничивающие примеры способов обнаружения вкДНК микробного происхождения включают, например, ПЦР, ОТ-ПЦР, секвенирование следующего поколения (NGS) и полногеномное секвенирование (WGS). В некоторых вариантах реализации вкДНК микробного происхождения может быть обнаружена, например, посредством ПЦР или ОТ-ПЦР для 16S рибосомальной РНК, 16S рибосомальной ДНК или межгенного спейсерного участка. В некоторых вариантах реализации определение общего уровня или относительного содержания вкДНК микробного происхождения включает сравнение уровня вкДНК микробного происхождения или отношения вкДНК микробного происхождения к общему уровню вкДНК в крови субъекта с контрольным уровнем или соотношением (например, заранее определенным стандартом или соответствующим уровнем или соотношением, определенным для субъектов соответствующего возраста, не страдщих раком).
[0242] В одном варианте реализации любого из способов согласно настоящему изобретению субъектом является человек.
Устранение токсичности противораковой химиотерапии или лучевой терапии
[0243] В одном аспекте в настоящем изобретении предложен способ предотвращения или устранения токсичности или состояния, связанного с цитостатической и/или цитотоксической химиотерапией у субъекта, страдающего раком и получающего или условно получающего указанную терапию, при этом способ включает введение субъекту терапевтически эффективного количества вектора экспрессии, кодирующего фермент, который обладает ДНКазной активностью (например, ДНКазу I, (например, рекомбинантную ДНКазу I человека или ДНКазу I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазу II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу). В некоторых вариантах реализации фермент ДНКаза содержит последовательность, изложенную в SEQ ID NO: 1 (последовательность предшественника дикого типа, содержащая секреторную сигнальную последовательность). В некоторых вариантах реализации фермент ДНКаза содержит последовательность, изложенную в SEQ ID NO: 2 (мутантная последовательность предшественника, содержащая секреторную сигнальную последовательность, а также мутации, ослабляющие опосредованное актином ингибирование). В некоторых вариантах реализации фермент ДНКаза включает последовательность, изложенную в SEQ ID NO: 4 (зрелая последовательность дикого типа без секреторной сигнальной последовательности). В некоторых вариантах реализации под ферментом ДНКаза понимается последовательность, представленная в SEQ ID NO: 5 (зрелая мутантная последовательность без секреторной сигнальной последовательности и содержащая мутации, ослабляющие актин-опосредованное ингибирование). В некоторых вариантах реализации фермент ДНКаза экспрессируется под контролем печень-специфичного промотора и/или печень-специфичного энхансерного элемента.
[0244] Количество и способ введения вектора экспрессии эффективны для устранения по меньшей мере одного побочного эффекта указанной химиотерапии.
[0245] Состояние, связанное с цитостатической и/или цитотоксической химиотерапией, может включать, например, (i) катаболическое состояние, приводящее к потере массы тела, (ii) токсичность для костного мозга и/или катаболические изменения в биохимии крови, (iii) кардиотоксичность (например, некроз миокарда), (iv) токсичность для желудочно-кишечного тракта, (v) подавление иммунитета, (vi) нейтропению и (vii) потерю массы тела.
[0246] В некоторых вариантах реализации рак связан с повышенным уровнем вкДНК в крови или спинномозговой жидкости (CSF) или кишечнике пациента, причем уровень является выше контрольного уровня (например, уровня вкДНК в крови, CSF или кишечнике здорового индивидуума того же возраста или среднего уровня вкДНК в крови, спинномозговой жидкости или кишечнике нескольких здоровых индивидуумов того же возраста).
[0247] В некоторых вариантах реализации эффекты химиотерапии связаны с повышенным уровнем вкДНК в крови или спинномозговой жидкости, асцитической жидкости или кишечнике пациента, уровень которой выше контрольного уровня (например, уровня вкДНК в крови или спинномозговой жидкости или кишечнике индивидуума соответствующего возраста с аналогичным профилем рака, который не получает химиотерапию, или среднего уровня вкДНК в крови, спинномозговой жидкости или кишечнике нескольких индивидуумов соответствующего возраста, которых имеют рак, но не получают химиотерапию).
[0248] В другом аспекте в настоящем изобретении предложен способ увеличения эффективности цитостатической и/или цитотоксической химиотерапии у субъекта, страдающего раком и получающего или условно получающего указанную терапию, при этом способ включает введение субъекту терапевтически эффективного количества вектора экспрессии, (например, вектора Anc80 или AAV8 AAV или лентивирусного вектора или аденовирусного вектора), кодирующего фермент, который обладает ДНКазной активностью (например, ДНКазу I, (например, рекомбинантную ДНКазу I человека или ДНКазу I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазы II (ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу). Количество и способ введения вектора экспрессии эффективны для предотвращения или облегчения по меньшей мере одного побочного эффекта указанной химиотерапии и для предотвращения или облегчения токсичности, связанной с указанной химиотерапией. В некоторых вариантах реализации любой из ферментов ДНКаз (например, ДНКазу I, (например, рекомбинантную ДНКазу I человека или ДНКазу I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (такие как, например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазу II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу) также вводят, например, внутривенно.
[0249] Векторы экспрессии согласно настоящему изобретению можно применять для облегчения токсичности и/или повышения эффективности широкого ряда различных химиотерапевтических агентов. Неограничивающие примеры таких агентов включают антиметаболиты, такие как аналоги пиримидина (например, 5-фторурацил [5-FU], флоксуридин, капецитабин, гемцитабин и цитарабин) и аналоги пурина, антагонисты фолата и родственные ингибиторы (например, меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин (кладрибин)); антипролиферативные/антимитотические агенты, включающие природные продукты, такие как алкалоиды барвинка (например, винбластин, винкристин и винорелбин), средства, разрушающие микротрубочки, такие как таксаны (например, паклитаксел, доксетаксел), винкристин, винбластин, нокодазол, эпотилоны и навелбин, эпидиподофиллотоксины (например, этопозид, тенипозид), средства, разрушающие ДНК (например, актиномицин, амсакрин, антрациклины, блеомицин, бусульфан, камптотецин, карбоплатин, хлорамбуцил, цисплатин, недаплатин, циклофосфамид, цитоксан, дактиномицин, даунорубицин, доксорубицин, эпирубицин, акларубицин, пирарубицин, гексаметилмеламиноксалиплатин, ифосфамид, мелфалан, мерхлорэтамин, митомицин, митоксантрон, нитрозомочевина, нимустин, ранимустин, эстрамустин, пликамицин, прокарбазин, таксол, таксотер, тенипозид, триэтилентиофосфорамид и этопозид (VP16)); антибиотики (например, дактиномицин (актиномицин D), даунорубицин, доксорубицин (адриамицин), идарубицин, антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин), плеомицин, пепломицин, митомицины (например, митомицин С), актиномицины (например, актиномицин D), зиностатин стималамер); ферменты (например, L-аспарагиназа); неокарциностатин; антитромбоцитарные агенты; антипролиферативные/антимитотические алкилирующие агенты, такие как азотистые иприты (например, мехлорэтамин, циклофосфамид и аналоги, имидазол карбоксамид, мелфалан, хлорамбуцил, азотистый иприт-N-оксид гидрохлорид, ифосфамид), этиленимины и метилмеламины (например, гексаметилмеламин, тиотепа, карбоквон, триэтилен тиофосфорамид), алкилсульфонаты (например, бусульфан, изопросульфан тозилат), нитрозомочевины (например, кармустин (BCNU) и его аналоги, стрептозоцин), тразены-дакарбазинин (DTIC); соединения типа эпоксидов (например, митобронитол); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (например, метотрексат); координационные комплексы платины (например, цисплатин, карбоплатин), прокарбазин, гидроксимочевина, митотан, аминоглутетимид; гормоны, аналоги гормонов (например, эстроген, тамоксифен, госерелин, бикалутамид, нилутамид) и ингибиторы ароматазы (например, летрозол, анастрозол); антисекреторные средства (например, бревелдин); иммунодепрессивные средства (например, циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, микофенолята мофетил); антиангиогенные соединения (например, TNP-470, генистеин, бевацизумаб) и ингибиторы факторов роста (например, ингибиторы фактора роста фибробластов (FGF)); блокаторы рецептора ангиотензина; доноры оксида азота; антисмысловые олигоуклеотиды; антитела (например, трастузумаб); ингибиторы клеточного цикла и индукторы дифференцировки (например, третиноин); ингибиторы mTOR, ингибиторы топоизомеразы (например, доксорубицин (адриамицин), амсакрин, кампототецин, даунорубицин, дактиномицин, энипозид, эпирубицин, этопозид, идарубицин, митоксантрон, топотекан, иринотекан); киназные ингибиторы передачи сигнала факторов роста; индукторы митохондриальной дисфункции; средства, разрушающие хроматин; собузоксан; третиноин; пентостатин; флутамид; порфимер натрия; фадрозол; прокарбазин; ацеглатон; соединения для радиоиммунотерапии (RIT) (например, ибритумомаб тиуксетан, йод (131I) тозитумомаб); и соединения для целевой радионуклидной терапии (TRT) (например, самарий-153-EDTMP, стронций-89-хлорид).
[0250] Неограничивающие примеры побочных эффектов цитостатической и/или цитотоксической химиотерапии, которые можно предотвратить или улучшить путем введения вектора экспрессии согласно способам по настоящему изобретению, включают, например, токсичность для костного мозга, нейтропению, миелопатию (например, лейкопению, гранулоцитопению, лимфопению, тромбоцитопению, эритропению); гематопатию (например, фибриногенопению плазмы); катаболические изменения биохимии крови; расстройства желудочно-кишечного тракта (например, тошноту, рвоту, анорексию, потерю массы тела, чувство тяжести в желудке, диарею, запор, стоматит, эзофагит); легочную недостаточность (например, хроническую пневмонию, фиброз легких, ARDS, ALS, эмболию легких); дерматопатию (например, кератинизацию, пахимению, хроматоз, эпиляцию, сыпь, смену ногтей, алопецию, вызванную раком); расстройства нервной системы (например, парестезию, депрессию, глубокую арефлексию, нейропаралич, нарушение слуха, аллолалию, дезориентацию, неврологические проявления, мозжечковую атаксию, сонливость, кому, головокружение, частое мочеиспускание, частые позывы к дефекации); эндокринные расстройства (например, расстройство гипофиза, расстройство надпочечников, гипергликемию, гипогликемию); генитальные расстройства (например, гипосексуальность, олигоспермию, гинекомастию, нарушение менструального цикла); сердечно-сосудистые расстройства (например, некроз миокарда, кардиомиопатию, аритмию, низкое кровяное давление, тахикардию, сердечную недостаточность); гепатопатию, расстройство поджелудочной железы, нефропатию, расстройство мочевого пузыря, гиперурикемию, снижение иммунокомпетентности и инфекции.
[0251] Векторы экспрессии согласно настоящему изобретению также можно применять для облегчения токсичности и повышения эффективности различных типов лучевой терапии, включая, например, лучевую терапию внешним пучком (EBRT или XRT), брахитерапию/лучевую терапию с закрытым источником и системную радиоизотопную терапию/радиотерапию с открытым источником. Неограничивающие примеры побочных эффектов лучевой терапии, которые можно предотвратить или облегчить путем введения вектора экспрессии в соответствии со способами согласно настоящему изобретению, включают, например, раздражение или повреждение кожи, усталость, тошноту, рвоту, фиброз, повреждение кишечника, потерю памяти, бесплодие и вторичный рак.
[0252] Векторы экспрессии согласно настоящему изобретению можно применять для повышения эффективности иммунотерапии рака, включая, например, антитела (голые моноклональные антитела, конъюгированные моноклональные антитела, меченные химическим путем антитела, биспецифические моноклональные антитела), противораковые вакцины, ингибиторы иммунных контрольных точек (лекарственные средства, нацеленные на PD-1 или PD-L1, CTLA-4), неспецифические иммунотерапевтические лекарственные средства и адъюванты, терапии посредством CAR-T.
Лечение нейродегенерации
[0253] В одном аспекте в настоящем изобретении предложен способ лечения или облегчения нейродегенерации. Термин «нейродегенерация» в настоящем документе обозначает отдельное клиническое патологическое состояние с прогрессирующей потерей структуры и/или функции нейронов, включая гибель нейронов. Нейродегенерация может быть первичной или вторичной.
[0254] В некоторых вариантах реализации нейродегенерация связана с повышенным уровнем вкДНК (например, микробной вкДНК или вкДНК человека) в крови или спинномозговой жидкости (CSF) или кишечнике пациента, причем уровень является выше контрольного уровня (например, уровня вкДНК в крови, CSF или кишечнике здорового индивидуума того же возраста или среднего уровня вкДНК в крови или спинномозговой жидкости или кишечнике нескольких здоровых индивидуумов того же возраста). В одном варианте реализации нейродегенерация связана с нейродегенеративным расстройством. Неограничивающие примеры, охватывающие нейродегенеративные заболевания, включают, например, болезнь Альцгеймера (например, позднюю болезнь Альцгеймера), легкое когнитивное нарушение (MCI), болезнь Паркинсона, амиотрофический боковой склероз (ALS) и болезнь Хантингтона (HD), заболевания, вызванные прионами, прогрессирующий надъядерный паралич (PSP), прогрессирующий супрануклеарный паралич (Стила-Ричардсона-Ольшевского), кортикобазальную дегенерацию (CBD), хроническую травматическую энцефалопатию (CTE), множественную системную атрофию (MSA), болезнь агирофильных зерен (AGD), болезнь Пика (PiD), лобно-височную деменцию (FTD), лобно-височную деменцию с паркинсонизмом-17 (FTDP-17), множественный склероз, синдром CADASIL, анкилозирующий спондилит, дентаторубро-паллидолюисову атрофию, болезнь Кеннеди, атаксию Фридрейха, мозжечковую атаксию, спиноцеребеллярную атаксию, деменцию с тельцами Леви, сосудистую деменцию, семейную деменцию датского типа, семейную деменцию британского типа, спиналльную мышечную атрофию, оливопонтоцеребеллярную атрофию (OPCA), старческую деменцию типа Альцгеймера, кортикодентатонигральную дегенерацию, болезнь Галлервордена-Шпатца, прогрессирующую семейную миоклоническую эпилепсию, стрионигральную дегенерацию, торсионную дистонию (например, торсионный спазм; деформирующую мышечную дистонию), спастическую кривошею и другие дискинезии, семейный тремор, синдром Жиля де ла Туретта, дегенерацию коры мозжечка, спиноцеребеллярную дегенерацию (например, атаксию Фридрейха и связанные расстройства), синдром Шая-Дрейджера, первичный латеральный склероз, наследственную спастическую параплегию, перонеальную амиотрофию (Шарко-Мари-Тута), интерстициальную гипертрофическую полиневропатию (Дежерина-Сотта), хроническую прогрессирующую невропатию, пигментную дегенерацию сетчатки (пигментный ретинит) и наследственную атрофию зрительного нерва (болезнь Лебера), вторичную нейродегенерацию, вызванную некрозом (например, разрушение нейронов новообразованием, отеком, кровоизлиянием, инсультом, травмой, иммунной атакой, гипоксией, отравлением, метаболическими нарушениями и инфекциями), и различные таупатии (например, первичную возрастную таупатию (PART)/старческую деменцию с преобладанием нейрофибриллярных клубочков, с NFT, аналогичными AD, но без бляшек, CTE, болезнь Литико-Бодиг, ганглиоглиому и ганглиоцитому, менингиоангиоматоз, постэнцефалитический паркинсонизм, подострый склерозирующий панэнцефалит). В некоторых вариантах реализации нейродегенерация связана с дисфункцией нервной системы, такой как, например, шизофрения или биполярное расстройство, депрессивное расстройство, аутизм, расстройства аутистического спектра, синдром хронической усталости, обсессивно-компульсивное расстройство, генерализованное тревожное расстройство (GAD), большое депрессивное расстройство (MDD) или социальное тревожное расстройство (SAD). В некоторых вариантах реализации нейродегенеративное расстройство вызвано, является вторичным или связано с амилоидозом. В некоторых вариантах реализации нейродегенеративное расстройство представляет собой заболевание, связанное с неправильной упаковкой белка. В некоторых вариантах реализации нейродегенеративное расстройство вызвано, является вторичным или связано с диабетом, ревматоидным артритом, системной красной волчанкой (СКВ), подагрой, метаболическим синдромом, амилоидозом (например, амилоидозом с наследственным кровоизлиянием в мозг, первичным системным амилоидозом, вторичным системным амилоидозом, сывороточным амилоидозом, старческим системным амилоидозом, амилоидозом, связанным с гемодиализом, наследственным системным амилоидозом финского типа, атриальным амилоидозом, лизоцимным системным амилоидозом (англ. Lysozyme systemic amyloidosis), амилоидозом, связанным с инсулином, амилоидозом, связанным с а-цепью фибриногена), астмой или прионной болезнью.
[0255] В некоторых вариантах реализации нейродегенерация вызвана, является вторичной или связана с образованием неправильно свернутого белка вследствие присутствия ДНК (например, человеческой, микробной, внеклеточной или внутриклеточной). В некоторых вариантах реализации нейродегенерация вызвана образованием неправильно свернутого белка вследствие присутствия ДНК (например, человеческой, микробной, внеклеточной или внутриклеточной).
[0256] В некоторых вариантах реализации нейродегенерация вызвана, является вторичной или связана с образованием неправильно свернутого белка, включая, не ограничиваясь, β-амилоид, белок тау, α-синуклеин, SOD1, TDP-43, IAPP, ADan, ABri, слитый белок (FUS) при саркоме, Notch3, глиальный фибриллярный кислый белок, сейпин, транстиретин, серпины, аполипопротеины, амилоидный β-пептид, лактоферрин, галектин-7, корнеодесмозин.
[0257] В некоторых вариантах реализации способы согласно настоящему изобретению можно применять для предотвращения развития нейродегенеративного заболевания или другого заболевания, связанного с неправильным сворачиванием белка, после оценки присутствия или активности гена предрасположенности, связанного с заболеванием. Примеры генов предрасположенности, связанных с заболеванием, включают, но не ограничиваются ими, ADAR1, MDA5 (IFIH1), RNAseH субъединицы, SamHD1, TREX, TBK1, Optineurin, P62 (секвестосома 1), програнулин, TDP43, FUS, VCP, CHMP2B, профилин-1, амилоид-β, Tau, α-синуклеин, PINK, Parkin, LRRK2, DJ-1, GBA, ATPA13A2, EXOSCIII, TSEN2, TBC1D23, аллели фактора риска, PLCG2, TREM2, APOE, TOMM40, IL-33, глюкоцереброзидазу, атаксин2, C9orf72, SOD1 и FUS. Ген предрасположенности можно оценить с помощью одного или более из следующих способов: секвенирование следующего поколения, полногеномное секвенирование, секвенирование экзома, способ на основе ELISA и амплификация ПЦР. Другие способы также можно применять для оценки гена предрасположенности.
[0258] В одном варианте реализации вышеупомянутых способов предотвращение или лечение образования агрегатов неправильно свернутого белка в биологических жидкостях и тканях млекопитающих достигается посредством применения векторов экспрессии, описанных в настоящем документе, включая векторы, содержащие последовательность SEQ ID NO: 30 (энхансер ApoEHCR-hAAT промотор-hDNaseI (гиперактивный) правильный лидер-WPRE Xinact) или SEQ ID NO: 31 (энхансер ApoEHCR-промотор hAAT-hDNaseI дикого типа-WPRE Xinact5653). В последовательности SEQ ID NO: 30 основания 1-320 соответствуют энхансеру APOE HCR, основания 321-717 соответствуют промотору альфа-1-антитрипсина человека, основания 718-726 соответствуют последовательности Козака, основания 727-1575 соответствуют гиперактивному варианту ДНКазы I человека с естественной полностью правильной лидерной последовательностью, и основания 1576-2212 соответствуют инактивированному белку WPRE X. В последовательности SEQ ID NO: 31 основания 1-320 соответствуют энхансеру APOE HCR, основания 321-717 соответствуют промотору альфа-1-антитрипсина человека, основания 718-726 соответствуют последовательности Козака, основания 727-1575 соответствуют человеческой ДНКазе I дикого типа с естественной полностью правильной лидерной последовательностью, и основания 1576-2212 соответствуют инактивированному белку WPRE X.
[0259] Как описано в публикации международной заявки на патент № WO 2016/190780, вкДНК из кишечника, крови и спинномозговой жидкости пациентов, страдающих нейродегенерацией, вызывает гибель нейрональных клеток и апоптоз, и лечение рекомбинантным белком ДНКазой, разрушающим такую вкДНК, улучшает функцию нервной системы у этих пациентов. Как показано в разделе «Примеры» ниже, применение векторов согласно настоящему изобретению для печень-специфичной экспрессии ДНКазы обеспечивает дополнительное улучшение лечения по сравнению с введением белка ДНКазы.
[0260] Оценка эффективности лечения нейродегенерации и нейровоспаления может быть осуществлена с применением любых способов, известных в данной области техники, например, в соответствии с общепризнанными клиническими диагностическими критериями снижения когнитивных функций, таких как MMSE, PANSS, физическая функция и/или функциональные задачи (см., например, Holmes et al., (1999) The British Journal of Psychiatry, 174(1), 45-50; Os et al., (2006) Acta Psychiatrica Scandinavica, 113(2), 91-95; O'Shea et al., (2002) Physical therapy, 82(9), 888-897; Rochester et al., Arch. Phys. Med. Rehabil. (2004) 85(10), 1578- 1585).
[0261] В некоторых вариантах реализации настоящего изобретения нейродегенерация вызвана или усугубляется повышенной проницаемостью кишечника и транслокацией кишечных бактерий и DAMP микробного происхождения, включая микробную вкДНК. Такая вкДНК может вызывать нейровоспаление и целый спектр нейродегенеративных заболеваний. вкДНК, происходящая из микробиоты пищеварительного тракта, подвергается «первому прохождению» через портосинусоидальный кровоток в печени. Инфламмасома NLRP3 считается ключевым фактором развития нейровоспаления. Например, инфламмасома NLRP3 может подвергаться значительной активации в головном мозге, например, в корковой ткани головного мозга. Было продемонстрировано, что аберрантная активация передачи сигналов инфламмасомы NLRP3 вносит свой вклад в патологию широкого спектра неврологических заболеваний (Song, 2017).
[0262] В некоторых вариантах реализации в настоящем изобретении предложен способ лечения нейродегенерации у субъекта, страдающего нейродегенерацией, который включает введение субъекту терапевтически эффективного количества вектора экспрессии, кодирующего фермент, который обладает ДНКазной активностью (например, ДНКазу I, (например, рекомбинантную ДНКазу I человека или ДНКазу I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазу II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу). Количество и способ введения вектора экспрессии (например, вектора AAV, или лентивирусного вектора, или аденовирусного вектора, или липосомы, или голой ДНК) должны быть эффективными для лечения одного или более симптомов или эффектов такой нейродегенерации.
[0263] Не ограничиваясь теорией, после осуществления доставки нуклеиновой кислоты, кодирующей фермент, обладающий ДНКазной активностью, в печень с применением векторов согласно настоящему изобретению, фермент продуцируется клетками печени и секретируется в периэндотелиальное пространство и пространство Диссе, где фермент эффективно разрушает концентрированный пул вкДНК, присутствующий в них.
[0264] В некоторых вариантах реализации применение векторов экспрессии согласно настоящему изобретению скомбинировано с введением (например, внутривенным, внутриартериальным, внутрипеченочным, внутримышечным, внутрибрюшинным или энтеральным введением) белка ДНКазы (например, ДНКазы I, (например, рекомбинантной ДНКазы I человека или ДНКазы I поджелудочной железы крупного рогатого скота), аналогов ДНКазы I (например, ДНКазы X, ДНКазы гамма или DNAS1L2), ДНКазы II (например, ДНКазы II-альфа, ДНКазы II-бета), фосфодиэстеразы I, лактоферрина или ацетилхолинэстеразы). Не ограничиваясь теорией, системное введение белка ДНКазы в сочетании с описанным выше продуцированием ДНКазы в клетках печени с применением векторов экспрессии согласно настоящему изобретению быстрее разрушает вкДНК как в кровотоке, так и в любом концентрированном пуле вкДНК в печени.
[0265] В некоторых вариантах реализации векторы экспрессии, кодирующие фермент, обладающий ДНКазной активностью, можно вводить в комбинации с другими видами лечения, подходящими для лечения нейродегенеративных заболеваний или других охваченных дисфункций нервной системы (например, биполярного расстройства, мигрени, шизофрении, эпилепсии). Неограничивающие примеры такого дополнительного лечения включают, например, активаторы гистонацетилтрансферазы, ингибиторы циклинзависимой протеинкиназы 5, миметики нейротрофина, блокаторы семафорина-4D, микросомальные ингибиторы простагландин E-синтазы-1, леводопа и ингибиторы рецептора N-метил-d-аспартата (NMDA) (например, мемантин).
Лечение реакций гиперчувствительности замедленного типа
[0266] В одном аспекте предложен способ лечения реакции гиперчувствительности замедленного типа (например, болезнь «трансплантат против хозяина» (GVHD)) субъекта, нуждающегося в этом, который включает введение субъекту терапевтически эффективного количества вектора экспрессии, кодирующего фермент, который обладает ДНКазной активностью (например, ДНКазу I, такую как, например, рекомбинантная ДНКаза I человека или ДНКаза I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазу II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу). В некоторых вариантах реализации фермент ДНКаза содержит последовательность, изложенную в SEQ ID NO: 1 (последовательность предшественника дикого типа, содержащая секреторную сигнальную последовательность). В некоторых вариантах реализации фермент ДНКаза содержит последовательность, изложенную в SEQ ID NO: 2 (мутантная последовательность предшественника, содержащая секреторную сигнальную последовательность, а также мутации, ослабляющие опосредованное актином ингибирование). В некоторых вариантах реализации фермент ДНКаза включает последовательность, изложенную в SEQ ID NO: 4 (зрелая последовательность дикого типа без секреторной сигнальной последовательности). В некоторых вариантах реализации под ферментом ДНКаза понимается последовательность, представленная в SEQ ID NO: 5 (зрелая мутантная последовательность без секреторной сигнальной последовательности и содержащая мутации, ослабляющие актин-опосредованное ингибирование). В некоторых вариантах реализации фермент ДНКаза экспрессируется под контролем печень-специфичного промотора или печень-специфичного энхансерного элемента.
[0267] Не желая быть связанными теорией, активация нейтрофилов может высвобождать гранулярные белки вместе с двухцепочечной ДНК (дцДНК) с образованием внеклеточных волокон, известных как NET. Комплемент активируется посредством NET. Активация комплемента может привести к симптомам, наблюдаемым при реакциях гиперчувствительности замедленного типа.
[0268] В некоторых вариантах реализации реакция гиперчувствительности замедленного типа связана с повышенным уровнем вкДНК в крови или CSF или кишечнике пациента, причем уровень является выше контрольного уровня (например, уровня вкДНК в крови или спинномозговой жидкости или кишечнике здорового индивидуума того же возраста или среднего уровня вкДНК в крови или CSF или кишечнике нескольких здоровых индивидуумов того же возраста). Введение вектора экспрессии, кодирующего фермент, обладающий ДНКазной активностью, может ингибировать образование NET и приводить к меньшей активации комплемента.
[0269] Не ограничиваясь теорией, системное введение фермента ДНКазы в сочетании с описанным выше продуцированием ДНКазы в клетках печени с применением векторов экспрессии быстрее разрушает вкДНК как в кровотоке, так и в любом концентрированном пуле вкДНК в печени.
[0270] Вектор экспрессии, кодирующий фермент ДНКазу, также можно вводить в комбинации с одним или более другими видами лечения, подходящими для лечения реакции гиперчувствительности замедленного типа, такими как, например, циклоспорин, такролимус (FK506), метилпреднизолон, преднизон, ATG, сиролимус, микофенолат мофетил, рецептор анти-интерлейкина-2 (IL-2), анти-CD5-специфический иммунотоксин, Т-клеточный иммунотоксин, содержащий А-цепь рицина (XomaZyme), добавление культивированных ex vivo мезенхимальных клеток, полученных от неродственных доноров, к традиционной стероидной терапии, и любые их комбинации.
Лечение атеросклероза
[0271] В одном аспекте предложен способ лечения атеросклероза у субъекта, нуждающегося в этом, который включает введение субъекту терапевтически эффективного количества вектора экспрессии, кодирующего фермент, который обладает ДНКазной активностью (например, ДНКазу I, такую как, например, рекомбинантная ДНКаза I человека или ДНКаза I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазу II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу). В некоторых вариантах реализации фермент ДНКаза содержит последовательность, изложенную в SEQ ID NO: 1 (последовательность предшественника дикого типа, содержащая секреторную сигнальную последовательность). В некоторых вариантах реализации фермент ДНКаза содержит последовательность, изложенную в SEQ ID NO: 2 (мутантная последовательность предшественника, содержащая секреторную сигнальную последовательность, а также мутации, ослабляющие опосредованное актином ингибирование). В некоторых вариантах реализации фермент ДНКаза включает последовательность, изложенную в SEQ ID NO: 4 (зрелая последовательность дикого типа без секреторной сигнальной последовательности). В некоторых вариантах реализации под ферментом ДНКаза понимается последовательность, представленная в SEQ ID NO: 5 (зрелая мутантная последовательность без секреторной сигнальной последовательности и содержащая мутации, ослабляющие актин-опосредованное ингибирование). В некоторых вариантах реализации фермент ДНКаза экспрессируется под контролем печень-специфичного промотора или печень-специфичного энхансерного элемента.
[0272] В некоторых вариантах реализации атеросклероз связан с повышенным уровнем вкДНК в крови или CSF или кишечнике пациента, причем уровень является выше контрольного уровня (например, уровня вкДНК в крови или спинномозговой жидкости или кишечнике здорового индивидуума того же возраста или среднего уровня вкДНК в крови или спинномозговой жидкости или кишечнике нескольких здоровых индивидуумов того же возраста).
[0273] Вектор экспрессии, например, Anc80 или другой AAV- или лентивирусный вектор, кодирующий фермент ДНКазу, можно вводить необязательно с дополнительным ферментом ДНКазой. В некоторых вариантах реализации любой из ферментов ДНКаз (например, ДНКазу I, (например, рекомбинантную ДНКазу I человека или ДНКазу I поджелудочной железы крупного рогатого скота), аналоги ДНКазы I (такие как, например, ДНКазу X, ДНКазу гамма или DNAS1L2), ДНКазы II (например, ДНКазу II-альфа, ДНКазу II-бета), фосфодиэстеразу I, лактоферрин или ацетилхолинэстеразу) также вводят, например, внутривенно. Не ограничиваясь теорией, системное введение фермента ДНКазы в сочетании с описанным выше продуцированием ДНКазы в клетках печени быстрее разрушает вкДНК как в кровотоке, так и в любом концентрированном пуле вкДНК в печени.
[0274] Вектор экспрессии, кодирующий фермент ДНКазу, также можно вводить в комбинации с другими методами лечения, подходящими для лечения атеросклероза.
Фармацевтические композиции, составы и лекарственные формы
[0275] Описанные в настоящем документе векторы AAV можно вводить в любой подходящей форме, например, в форме жидкого раствора или суспензии, в виде твердой формы, подходящей для растворения или суспендирования в жидкости перед инъекцией. Векторы могут быть приготовлены с любым подходящим и фармацевтически приемлемым вспомогательным веществом, носителем, адъювантом, разбавителем и т.д. Например, для инъекции подходящий носитель или разбавитель может представлять собой изотонический раствор, буфер, стерильную апирогенную воду или, например, стерильный апирогенный фосфатно-солевой буферный раствор. Векторы экспрессии могут быть приготовлены в фармацевтических композициях и лекарственных формах. Такие фармацевтические композиции и лекарственные формы могут быть приготовлены любым обычным способом с применением одного или более физиологически приемлемых носителей и/или вспомогательных веществ. Векторные частицы могут быть приготовлены для введения, например, путем инъекции. Фармацевтически приемлемые носители частично определены конкретной вводимой композицией, а также конкретным способом, применяемым для введения композиции. Соответственно, существует широкий спектр доступных подходящих составов фармацевтических композиций, как описано ниже (см., например, Remington's Pharmaceutical Sciences, 17th ed., 1989).
[0276] Составы также включают суспензии в жидких или эмульгированных жидкостях. Активные ингредиенты часто смешивают с вспомогательными веществами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Подходящие вспомогательные вещества включают, например, воду, физиологический раствор, декстрозу, глицерин, этанол и подобные, и их комбинации. Кроме того, композиция может содержать незначительные количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, буферные агенты pH, стабилизирующие агенты или другие реагенты, которые повышают эффективность фармацевтической композиции.
[0277] Составы, применяемые в способах согласно настоящему изобретению, могут быть удобным образом предложены в виде стандартной лекарственной формы и могут быть получены способами, известными в данной области техники. Количество активных ингредиентов, которые можно объединить с материалом носителя для получения однократной лекарственной формы, будет варьироваться в зависимости от пациента, который получает лечение, и конкретного способа введения. Количество активных ингредиентов, которое может быть объединено с материалом носителя для получения однократной лекарственной формы, обычно составляет такое количество соединения, которое оказывает терапевтический эффект.
[0278] Фармацевтические композиции, подходящие для парентерального введения, могут дополнительно содержать один или более дополнительных активных ингредиентов (например, белок ДНКазы или другое активное соединение) в комбинации с одним или более фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, из которых могут быть получены стерильные растворы или дисперсии для инъекций непосредственно перед применением, которые могут содержать антиоксиданты, буферы, бактериостатические вещества, растворенные вещества, придающие составу изотоничность по отношению к крови предполагаемого реципиента, или суспендирующие или загущающие агенты. Примеры подходящих водных и неводных носителей, которые можно применять в фармацевтических композициях согласно настоящему описанию, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное) и их подходящие смеси, растительные масла, такие как оливковое масло, и органические сложные эфиры для инъекций, такие как этилолеат. Надлежащую текучесть можно поддерживать, например, путем применения покрывающих материалов, таких как лецитин, путем поддержания необходимого размера частиц в случае дисперсий и применения поверхностно-активных веществ.
[0279] Эти композиции могут также содержать консерванты, смачивающие агенты, эмульгирующие агенты и диспергирующие агенты. Предотвращение действия микроорганизмов может быть обеспечено включением различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенолсорбиновой кислоты и т.п. Также может быть необходимо включать в композиции изотонические агенты, такие как сахара, хлорид натрия и т.п.
ПРИМЕРЫ
[0280] Настоящее изобретение также описано и продемонстрировано с помощью следующих примеров. Однако использование этих и других примеров где-либо в описании является только иллюстративным и никоим образом не ограничивает объем и значение изобретения или любого приведенного в качестве примера термина. Таким же образом настоящее изобретение не ограничивается какими-либо конкретными предпочтительными вариантами реализации, описанными в настоящем документе. Действительно, многие модификации и вариации настоящего изобретения могут быть очевидны специалистам в данной области техники после прочтения данного описания, и такие изменения могут быть сделаны без отклонения объема и сущности настоящего изобретения. Таким образом, настоящее изобретение должно быть ограничено только условиями прилагаемой формулы изобретения совместно с полным объемом эквивалентов, на которые перечислены в данной формуле изобретения.
ПРИМЕР 1. Ограниченная способность фермента ДНКазы расщеплять циркулирующую внеклеточную ДНК (вкДНК) у пациентов с опухолью
[0281] Девяти пациентам с метастатическим поражением на поздней стадии, поступившим в отделение торакальной хирургии больницы Костюшко (Санкт-Петербург, Россия), был проведен трехнедельный курс внутривенного лечения белком ДНКазы I поджелудочной железы крупного рогатого скота с удельной активностью 2500 KU/мг (Самсон, Россия). Лечение проходило по следующему графику: на I неделе ежедневно вводили 300 мг посредством шести 30-минутных внутривенных инфузий; на II неделе ежедневно вводили 450 мг посредством шести 30-минутных внутривенных инфузий; и на III неделе ежедневно вводили 600 мг посредством шести 30-минутных внутривенных инфузий.
[0282] Электрофоретическое профилирование циркулирующей вкДНК осуществляли для каждого пациента перед первой инфузией белка ДНКазы I, в конце недели II и сразу после последней инфузии белка ДНКазы I. ДНК выделяли из плазмы крови классическим фенол-хлороформным способом. Электрофорез вкДНК крови проводили в 1% агарозном геле. ДНК визуализировали с помощью бромистого этидия. Эффективность лечения оценивали через одну неделю после последней инфузии белка ДНКазы I с применением спиральной компьютерной томографии на основе критериев RECIST (см., например, RECIST 1.1, опубликованный в январе 2009 г., http://www.irrecist.com). Сводные данные о пациентах и индивидуальные электрофоретические данные крови представлены на фигурах 2A-2IJ. В целом, согласно результатам RECIST, отмечалось небольшое уменьшение диаметра солидных опухолей (фигуры 2A-2H). У большинства пациентов после третьей недели в кровотоке все еще присутствовала вкДНК.
[0283] Несмотря на непрерывные внутривенные инфузии высоких доз фермента ДНКазы I с повышением дозы, только у одного пациента с рецидивирующей карциномой прямой кишки (PVIII) был обнаружен полный клиренс циркулирующей вкДНК в плазме, измеренный с помощью гель-электрофореза. Пациент PVIII имел стабильное заболевание без признаков прогрессирования согласно критериям RECIST. Три других пациента, которые были квалифицированы как пациенты со стабильным заболеванием в соответствии с критериями RECIST (PIX, PVII, PI), имели небольшое увеличение циркулирующей вкДНК в плазме или не имели его, как было измерено с помощью гель-электрофореза.
[0284] У пяти пациентов, которые были квалифицированы как пациенты с прогрессирующим заболеванием в соответствии с критериями RECIST (PII, PIII, PIV, PV и PVI) наблюдалось значительное увеличение циркулирующей вкДНК в плазме по результатам гель-электрофореза. Кроме того, у 8 из 9 пациентов (88%) трехнедельные непрерывные внутривенные инфузии высоких доз фермента ДНКазы с повышением дозы не обеспечили терапевтически эффективный клиренс циркулирующей вкДНК в плазме.
ПРИМЕР 2. Накопление внеклеточной ДНК в печени животных, имеющих опухоль
[0285] Приблизительно 12×106 клеток карциномы толстой кишки человека LS174T были привиты подкожно в левый бок каждой из двенадцати самок мышей nu/nu (порода ИБХ РА) в возрасте 8 недель. Мыши получали однократную внутривенную инъекцию 99 mTc-меченых антител к ДНК в соответствии со следующей схемой: три мыши получали инъекцию в D5, три мыши получали инъекцию в D10, три мыши получали инъекцию в D15 и три мыши получили инъекцию в D25. Через два часа после инъекции мышей умерщвляли, и ткани и кровь собирали для проведения гамма-радиометрии.
[0286] ДНК-связывающие антитела AC-30-10 (Genetex) метили посредством 99mTc следующим образом: 0,024 мг/мл раствора антител в 0,3 М цитратном буфере (pH 4,2) смешивали с 1 мКи 99mTc-пертехнетата в 0,25 мл физиологического раствора, и смешивали с раствором 10 мг/мл дигидрата SnCl2 в 0,1 н. HCl. После 5 мин инкубации при комнатной температуре добавляли 1,9 мл физиологического раствора и 825 мкл раствора IgM. Дозы для однократных инъекций готовили следующим образом: 16,6 мкКи (36852000CPM, приблизительно 0,047 мкг 99mTc-IgM) раствора 99mTc-IgM смешивали с 3,3 мкг немеченого IgM и разбавляли физиологическим раствором до объема 100 мкл. Гамма-сигнал количественно определяли в каждой ткани с помощью автоматического гамма-счетчика. Измерения производили в единицах CMP. Концентрации 99mTc IgM определяли количественно на основе данных гамма-радиометрии, массы ткани, удельной радиоактивности вводимых препаратов IgM и периода полувыведения 99mTc.
[0287] Распределение радиоактивности в тканях представлено в таблице 1 ниже:
Таблица 1. Накопление антител к ДНК в тканях мышей, имеющих опухоль (% вводимой посредством инъекции дозы /г ткани)
[0288] На фигуре 3 показано гамма-иммуносцинтиграфическое изображение мыши с опухолью, полученное на 15-й день через один час после инъекции меченных 99mTc антител к ДНК. Зона печени (b) в средней правой части изображения давала более интенсивный радиоактивный сигнал, чем зона опухоли (a) в нижней левой части изображения. Таким образом, в печени наблюдалось наибольшее накопление циркулирующей вкДНК.
ПРИМЕР 3. Поступление вкДНК опухоли из печени в кровь
[0289] Шести 6-недельным самкам голых мышей (порода ИБХ РАН) осуществляли подкожные инъекции 2х106 клеток MCF-7 в левый бок. На 20-й день после инъекции опухоль удаляли хирургическим путем. На 25-й день всем мышам вводили анестезию, и у каждой мыши брали пробы крови по 500 мкл из воротной вены, печеночной артерии и печеночной вены. Плазму отделяли от клеток крови центрифугированием при 2000 g в течение 10 минут; фазу чистой плазмы сверху переносили в новую пробирку и центрифугировали при 14000 g. Супернатант переносили в свежую пробирку для экстракции ДНК. вкДНК экстрагировали из образцов плазмы крови с применением мини-набора QIAamp DNA Blood Mini Kit в соответствии с инструкциями производителя. Последовательность бета-глобина человека во внеклеточной ДНК количественно определяли в каждом образце с помощью ОТ-ПЦР (iCycler iQ5б Bio-Rad) с праймером бета-глобина человека CAACTTCATCCACGTTCACC (SEQ ID NO: 10). Величины Ct последовательности бета-глобина человека в плазме крови, взятой из различных сосудов, представлены в таблице 2 ниже:
Таблица 2
[0290] Несмотря на то, что опухоль была удалена хирургическим путем, только у одной мыши плазма крови не содержала циркулирующей вкДНК человеческого происхождения. Опухоли MCF-7 не вызывают метастазов при подкожном росте. Отсутствие метастатических узелков в печени или легких было дополнительно подтверждено макроскопическим и микроскопическим исследованием. Циркулирующая вкДНК, происходящая из ксенотрансплантата опухоли человека, обнаруживалась в крови мышей, при этом наибольшие количества обнаруживались в печеночной вене. Эти результаты подтверждают, что синусоиды печени являются депо-источником циркулирующей вкДНК.
ПРИМЕР 4. Эффекты трансгенной доставки ДНКазы I и внутривенной доставки рекомбинантного белка ДНКазы I в модели рака поджелудочной железы
[0291] Вектор AAV для печень-специфичной трансгенной экспрессии ДНКазы I (4658_pAAV-AFP-Alb-huDNaseI_mut) был изготовлен по индивидуальному заказу Sirion Biotech (Martinsried, Германия). Векторная карта показана на фигуре 5А. Вектор AAV изготовлен на основе серотипа 8 AAV, который эффективно воздействует на печень. Вектор содержит последовательность, изложенную в SEQ ID NO: 2, которая кодирует мутантный фермент ДНКазу I человека, включающий несколько мутаций, которые делают фермент менее чувствительным к ингибированию актина и более каталитически активным. Кодирующая последовательность ДНКазы I также содержит секреторную сигнальную последовательность. Кодирующая последовательность ДНКазы I функционально связана на 5'-конце с системой mAFP/Alb энхансер/промотор (печень-специфичный энхансер альфа-фетопротеина мыши и печень-специфичный минимальный промотор альбумина мыши), и на 3'-конце - с сигналом hGH полиА. Кассета экспрессии дополнительно фланкирована AA8 L-ITR и R-ITR.
[0292] Кассету экспрессии huDNaseI_mut клонировали в вектор для переноса AAV и продуцировали в клетках 293T посредством котрансфекции вектора для переноса с пакующими плазмидами AAV8. Вирусные частицы очищали и концентрировали до 1×1013 GC/мл и хранили замороженными в PBS.
[0293] Также был получен контрольный вектор, идентичный 4658_pAAV-AFP-Alb-huDNaseI_mut, но с неспецифичной для печени системой CMVE/CAG промотор/энхансер вместо печень-специфичной системы mAFP/Alb-энхансер/промотор.
[0294] Человеческий рекомбинантный белок ДНКаза I (рчДНказа I) произведен компанией Catalent (Мэдисон, США) и хранился замороженным при 10 мг/мл исходного раствора в 1 мМ CaCl2 и 150 мМ NaCl.
[0295] В эксперименте применяли 56 самок голых мышей BALB/c (ИБХ РАН) в возрасте 6-8 недель и массой 18-22 г. Мышей содержали в индивидуальных вентилируемых клетках при контролируемой температуре и влажности по четыре животных в каждой клетке. Каждой мыши в правый бок подкожно вводили опухолевые клетки поджелудочной железы MIA PaCa-2 (1×107) в 0,2 мл PBS с добавлением BD Matrigel (1:1) для развития опухоли. Лечение начинали на 17 день после инокуляции опухоли, когда средний размер опухоли достигал приблизительно 170 мм3. Каждая группа состояла из восьми мышей с опухолями. Тестируемые векторы и композиции вводили мышам в соответствии с заранее установленным режимом, как показано в таблице 3 ниже:
Таблица 3. Дизайн исследования
mAFP/Alb AAV8
+ Гемцитабин
60мг/кг
ИП
BIW*3 недели
+ Гемцитабин
60мг/кг
ИП
BIW*3 недели
+ Гемцитабин
60мг/кг
ИП
BIWx2 недели
+ Гемцитабин
60мг/кг
ИП
BIWx2 недели
+ Гемцитабин
60мг/кг
ИП
BIWx2 недели
[0296] Размер опухоли измеряли дважды в неделю в двух направлениях с помощью штангенциркуля, и объем выражали в мм3 по формуле: V = 0,5 a x b2, где a и b - длинный и короткий диаметры опухоли соответственно. Во время рутинного мониторинга животных ежедневно проверяли на наличие любых эффектов роста опухоли и лечения на нормальное поведение, таких как подвижность, потребление пищи и воды только путем визуального осмотра, потеря или увеличение массы тела (измеряли два раза в неделю), глаза/спутывание шерсти и любые другие аномальные эффекты. На 35 день исследование было прекращено, мышей гуманно умерщвляли с помощью CO2 и брали образцы крови из центральной и печеночной вены. Образцы тканей печени также были взяты и погружены в формалин для фиксации.
[0297] Циркулирующую вкДНК измеряли в плазме с применением способа, описанного в H. Goldstein, “A rapid direct fluorescent assay for cell-free DNA quantification in biological fluids”, Annals of Clinical Biochemistry, Vol 46, Issue 6, pp. 488-494. Золотой гель-краситель нуклеиновых кислот SYBR® Gold Nucleic Acid Gel Stain (Invitrogen) разбавляли сначала в соотношении 1:1000 диметилсульфоксидом, а затем 1:8 в фосфатно-солевом буфере. 10 мкл образцов плазмы наносили на 96-луночные планшеты. В каждую лунку добавляли 40 мкл разбавленного SYBR® Gold (конечное разведение 1:10 000), и флуоресценцию измеряли с помощью 96-луночного флуориметра при длине волны излучения 535 нм и длине волны возбуждения 485 нм.
[0298] Активность сывороточной ДНКазы I измеряли с помощью ORG590 (Orgentec) в соответствии с протоколом производителя. Детектирование проводили с применением фотометра для микропланшетов (Multiscan FC) при 450 нм с длиной волны коррекции 620 нм. вкДНК в ткани печени количественно определяли с помощью иммуногистохимии (IHC) на парафиновых срезах печени с применением IgG-ДНК-связывающих антител мыши AC-30-10 (Sigma) в качестве первичных антител и систем обнаружения полимеров Novolink Novocastra (Leica Biosystems).
[0299] Средний объем опухоли с течением времени у самок голых мышей BALB/c, имеющих ксенотрансплантаты MIA PaCa-2, обработанные тестируемыми векторами и составом (согласно таблице 3), показан в таблице 4 ниже:
Таблица 4. Средний объем опухоли с течением времени
[0300] Количество животных с потерей массы тела на день 35 в каждой группе самок голых мышей BALB/c, имеющих ксенотрансплантаты MIA PaCa-2, обработанные тестируемыми векторами и составом (согласно таблице 3), показано в таблице 5 ниже:
Таблица 5. Количество животных с потерей массы тела на день 35
[0301] Результаты количественного определения циркулирующей вкДНК в крови и ферментативной активности ДНКазы I в центральной и печеночной вене приведены в таблице 6 ниже:
Таблица 6
нг/мл
mKuU/мл
вене
mKuU/мл
[0302] Микрофотографии ИГХ ткани печени разных групп представлены на фигуре 4.
[0303] Данные из Таблиц 4-6 выше и на фигуре 4 ясно показывают, что печень-специфичная трансгенная экспрессия фермента ДНКазы I в комбинации с химиотерапией не только обеспечивает значительно лучшие результаты с точки зрения противоопухолевой эффективности, но также способна полностью уменьшить вызванную химиотерапией потерю массы тела. Рекомбинантный фермент ДНКаза I, вводимый дважды в день в трех возрастающих дозах, а также трансгенная экспрессия ДНКазы I, которая не нацелена на печень, продемонстрировали значительно меньшую противоопухолевую эффективность и уменьшение токсичности, вызванной химиотерапией, чем печень-специфичная трансгенная экспрессия ДНКазы I. Мыши, получавшие лечение вектором ДНКазы mAFP/Alb AAV8, имели наименьшее количество циркулирующей вкДНК, наименьшее количество вкДНК, остающейся в печени, и самую высокую ферментативную активность ДНКазы I в печеночной вене.
ПРИМЕР 5. Влияние трансгенной доставки ДНКазы I на ортотопический и неортотопический рост рака поджелудочной железы
[0304] В эксперименте применяли двенадцать 8-недельных мышей SCID (ИБХ РАН), разделенных на 4 экспериментальные группы. Шесть мышей получали 4×106 клеток рака поджелудочной железы MIA PaCa-2, экспрессирующих люциферазу, подкожно в правое бедро, в 100 мкл матригеля (неортотопическая модель). Шести мышам в хвостовую часть поджелудочной железы имплантировали 4×106 клеток рака поджелудочной железы MIA PaCa-2, экспрессирующих люциферазу, в 100 мкл матригеля (ортотопическая модель). На следующий день 3 мыши с ортотопическим имплантатом MIA PaCa-2 получали внутривенную инъекцию mAFP/Alb AAV8 вектора 4658_pAAV-AFP-Alb-huDNaseI_mut в дозе 1,00×1011 GC/кг, и 3 мыши с ортотопическим имплантатом MIA PaCa-2 получали инъекцию плацебо (PBS). Три мыши с неортотопическим имплантатом MIA PaCa-2 получали внутривенную инъекцию DNaseI mAFP/Alb AAV8 вектора в дозе 1,00×1011 GC/кг, и три мыши с неортотопическим имплантатом MIA PaCa-2 получали инъекцию плацебо (PBS). Через четыре недели, в конце эксперимента, опухоли оценивали с помощью биолюминесцентной визуализации с применением системы визуализации AMI-1000. Данные биолюминесценции обобщены в таблице 7 ниже, а типичные изображения представлены на фигуре 6.
Таблица 7
[0305] Таким образом, трансгенная доставка фермента ДНКазы I в печень полностью блокирует развитие опухолевого роста ортотопическим способом в области, дренируемой воротной веной, то есть в поджелудочной железе. Развитие того же ксенотрансплантата рака поджелудочной железы неортотопическим способом также значительно подавлялось инъекцией ДНКазы I mAFP/Alb AAV8, но не до такой степени, чтобы полностью исключить рост опухоли.
ПРИМЕР 6. Влияние доставки трансгена ДНКазы I в печень и легкие на рост карциномы молочной железы на модели рака молочной железы
[0306] Вектор ADV-207186 был приобретен у Vector Biolabs (Malvern, PA). Векторная карта показана на фигуре 5C. Этот вектор получен на основе аденовируса человека типа 5 (dE1/E3) (который имеет естественный тропизм к печени) и содержит кодирующую последовательность человеческой ДНКазы I дикого типа, которая включает секреторную сигнальную последовательность (SEQ ID NO: 1). Кодирующая последовательность ДНКазы I функционально связана на 5'-конце с неспецифическим печеночным промотором CMV и на 3'-конце с сигналом полиА hGH. Кассета экспрессии дополнительно фланкирована ATT-L1 и ATT-L2.
[0307] Для исследования применяли самок мышей породы ММТВ-PyMT ИБХ РАН. Когда у каждой мыши развивались по меньшей мере три пальпируемые опухоли размером не менее 3 мм × 5 мм, которые обычно возникали в возрасте 8 недель, шести мышам внутривенно вводили 0,2 × 1011 БОЕ на мышь ADV-207186 и шести мышам вводили 0,2 ×1011 БОЕ на мышь ADV-207186 интраназально под анестезией. Мышей умерщвляли в возрасте 14 недель. Шесть мышей применяли в качестве контроля. Размер опухоли измеряли в двух направлениях с помощью штангенциркуля, и объем выражали в мм3 по формуле: V = 0,5 a x b2, где a и b - длинный и короткий диаметры опухоли соответственно. TGI рассчитывали для каждой группы по формуле: TGI (%) = [1-(Ti-T0)/ (Vi-V0)] ×100; Ti - средний объем опухоли в группе лечения в данный день, T0 - средний объем опухоли в группе лечения в день начала лечения, Vi - средний объем опухоли контрольной группы носителя в тот же день с Ti, и V0 - средний объем опухоли в группе носителя в день начала лечения. По окончании исследования кровь брали из центральной вены. Активность циркулирующей вкДНК и сывороточной ДНКазы I измеряли, как описано в примере 4. Данные представлены в таблице 8 ниже.
Таблица 8
mKuU/мл
[0308] Данные показывают, что нацеливание на печень аденовирусного вектора, несущего трансген ДНКазы I, обеспечивает превосходное подавление роста опухоли молочной железы и очищение крови от циркулирующей вкДНК по сравнению с доставкой трансгена ДНКазы I в бронхоальвеолярную систему, несмотря на приблизительно такой же уровень ферментативной активности ДНКазы в крови.
ПРИМЕР 7. Влияние трансгенной экспрессии актин-резистентной гиперактивной ДНКазы I в печени и мышцах на уровень микробной вкДНК и уровень нейровоспаления
[0309] Повышенная кишечная проницаемость и транслокация желудочно-кишечной микробиоты и связанные с повреждениями молекулярные структуры (DAMP) микробного происхождения, включая микробную вкДНК, вызывают нейровоспаление и спектр нейродегенеративных заболеваний. вкДНК, происходящие из микробиоты желудочно-кишечного тракта, подвергаются «первому прохождению» через портосинусоидальный кровоток. Дополнительно были исследованы влияние доставки в мышцы и печень гиперактивного актин-резистентного трансгена ДНКазы I, влияние инъекций белка ДНКазы I дикого типа на уровень микробной вкДНК в головном мозге и печени, а также на уровень нейровоспаления в спинномозговой жидкости и головном мозге после вызванного бактериофагом синдрома повышенной кишечной проницаемости.
[0310] Здоровых взрослых крыс-самцов линии Вистар (n = 24; 12-недельный возраст, 240-280 г) содержали в индивидуальных клетках в комнате P3 при 12-часовом цикле свет/темнота при температуре от 22 до 25°C и 60 ± 5% атмосферной влажности. Все животные имели свободный доступ к пище и воде в соответствии с Руководством по уходу и использованию лабораторных животных.
[0311] Молекула ДНК, кодирующая гиперактивный актин-резистентный мутант ДНКазы I (SEQ ID NO: 5) с секреторной сигнальной последовательностью ДНКазы I, замененной секреторной сигнальной последовательностью IL2, была синтезирована (GeneCust) и клонирована в лентивирусный вектор pLV2 (Clontech) под контролем промотора EF1a (не специфичного для печени). Полученная конструкция представляет собой pLV2-IL2ss-DNaseI mut и показана на фигуре 9. Линию пакующих лентивирусных клеток 293T (Clontech) культивировали в среде DMEM (Gibco). Клетки HEK 293T трансфицировали лентивирусным вектором pLV2-IL2ss-DNAseI mut на основе pLV2 с применением липофектамина 2000 (Life Technology). Через 48 часов после трансфекции собирали 5 мл супернатанта. Лентивирусы собирали фильтрованием через полиэфирсульфоновый мембранный фильтр с размером пор 0,45 мкм (Millipore), центрифугированием в течение 30 минут при 20000 g. Полученный осадок ресуспендировали в 1 мл PBS.
[0312] У 24 крыс была индуцирована повышенная проницаемость кишечника при применении смеси бактериофагов против семейств Enterobacteriaceae, Staphylococcaceae, and Streptococcaceae, чтобы вызвать заболевания микробиоты. Смесь включала смесь бактериофагов Salmonella от Микроген (Москва, Россия), содержащую бактериофаги против S. paratyphi, S. typhimurium, S. heidelberg, S. newport, S. choleraesuis, S. oranienburg, S. infans, S. dublin, S. enteritidis, S. anatum и S. Newlands и смесь фагов Pyobacteriophage от Микроген, содержащую фаги против семи видов бактерий, Staphylococcus aureus, Streptococcus pyogenes, Proteus mirabilis, Proteus vulgaris, Pseudomonas aeruginosa, Klebsiella pneumoniae и Escherichia coli. Фаги (1,5 мл, 1×106 бляшкообразующих единиц/мл каждой смеси фагов) добавляли к питьевой воде в соответствии с инструкциями производителя и вводили перорально в течение 10 дней. На 7-й день обработки фагом крысы были рандомизированы на 4 группы следующим образом: шесть крыс получили внутрипеченочную инъекцию 1,0 × 1012 LVP в объеме 200 мкл; шесть крыс получили инъекцию 1,0 × 1012 LVP в объеме 200 мкл в мышцу бедра; шесть крыс получали дважды в день внутривенные инъекции рекомбинантного белка ДНКазы I в дозе 50 мг/кг в период с 7 по 12 день. Оставшихся шесть крыс применяли в качестве необработанных контрольных животных с повышенной проницаемостью кишечника. Еще шесть здоровых крыс применяли в качестве здорового контроля. На 12 день всех крыс умерщвляли и собирали образцы крови для измерения активности ДНКазы в крови. Для проведения анализа экспрессии инфламмасомы NLRP3 и количественной оценки гена универсальной бактериальной РНК 16S были собраны аутопсии мозга.
[0313] Инфламмасома NLRP3 считается ключевым фактором развития нейровоспаления. Было продемонстрировано, что аберрантная активация передачи сигналов инфламмасомы NLRP3 вносит свой вклад в патологию широкого спектра неврологических заболеваний (Song, 2017). Экспрессию NLRP3 оценивали путем сбора 50 мг образцов кортикальной ткани. РНК выделяли с применением системы выделения общей РНК SV (Promega). Система одностадийной ОТ-ПЦР Superscrit III с ДНК-полимеразой platinum Taq (Invitrogen) была использована для ПЦР с обратной транскриптазой с применением 5′-GTTCTGAGCTCCAACCATTCT-3′ (SEQ ID NO: 11) в качестве прямого праймера NLRP3 и 5′-CACTGTGGGTCCTTCATCTTT-3′ (SEQ ID NO: 12) в качестве обратного праймера NLRP3. 16S универсальные праймеры генов бактериальной РНК (прямой: 5′-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG-3′ (SEQ ID NO: 13); обратный: 5′-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC-3′ (SEQ ID NO: 14)) применяли для количественного определения присутствия ДНК микробного происхождения в печени и головном мозге. Анализ экспрессии генов проводили с применением сравнительного способа Ct.
[0314] Активность сывороточной ДНКазы I измеряли с помощью ORG590 (Orgentec) в соответствии с протоколом производителя. Детектирование проводили с применением фотометра для микропланшетов (Multiscan FC) при 450 нм с длиной волны коррекции 620 нм. Результаты представлены в таблице 9 ниже:
Таблица 9
[0315] Данные показывают, что индукция повышенной проницаемости кишечника привела к подавлению активности фермента эндогенной ДНКазы крови, значительному увеличению присутствия микробной вкДНК в печени и коре головного мозга и значительному усилению активности компонента инфламмасомы NLRP3 в кортикальной ткани мозга. Доставка гиперактивного актин-резистентного лентивирусного трансгена ДНКазы I в печень, по сравнению с доставкой того же трансгена в мышечную ткань или внутривенными инъекциями белка ДНКазы I, почти полностью предотвращала увеличение микробной вкДНК в печени и головном мозге и активацию инфламмасом мозга, несмотря на поддержание сопоставимой ферментативной активности ДНКазы в центральном кровотоке.
ПРИМЕР 8. Влияние трансгенной доставки гиперактивной актин-резистентной ДНКазы I и внутривенной доставки рекомбинантного белка ДНКазы I на GVHD
[0316] Разные модели MHC I и II классов, от C57BL/6 (H-2b) до BALB/c (H-2d), применяли для установления GVHD (реакция «трансплантат против хозяина»). Все реципиенты представляли собой особей женского пола одинакового возраста 2-6 месяцев на момент трансплантации костного мозга (BMT). Одноклеточные суспензии клеток костного мозга и спленоцитов готовили в физиологическом растворе для инъекций. Для создания химер BMT реципиенты BALB/c получали 1200 рад TBI (источник 137Cs), разделенные на 2 дозы. Затем мыши получили клетки от мышей C57BL/6: 5×106 клеток костного мозга и 10×106 спленоцитов.
[0317] Эксперименты были разработаны для сравнения следующих двух обработок: мышиный белок ДНКаза I дикого типа (50 мг/кг) ежедневно и печень-специфичный вектор мышиная ДНКаза I mAFP/Alb AAV8 дикого типа в виде однократной внутривенной инъекции. Начиная с того же дня, что и BMT, реципиентов лечили ДНКазой I интрапенитонеальным путем дважды в день или однократной внутривенной доставкой mAFP/Alb AAV8 в дозе 1,00 × 1011 GC/кг. Для проведения гистопатологии мышей умерщвляли на 16 день после трансплантации. Ткани помещали в 10% формалин, заливали парафином, готовили срезы и окрашивали гематоксилином и эозином. Для количественной оценки полученных от донора Т-клеток селезенку (SP), периферические лимфатические узлы (PLN), брыжеечные лимфатические узлы (MLN) и бляшки Пейера (PP) собирали у мышей-реципиентов на 16 день после трансплантации. Клетки, выделенные из этих тканей, окрашивали антителами к CD3, CD4, CD8 и H-2Db. Количество полученных от донора Т-клеток (H-2Db+) и подмножеств CD4+/H-2Db+ и CD8+/H-2Db+ определяли с помощью FACS.
[0318] Данные по выживаемости представлены в таблице 10 ниже:
Таблица 10
[0319] Данные о гистопатологии печени у мышей-реципиентов, обработанных ДНКазой I, и мышей-реципиентов, обработанных ДНКазой I mAFP/Alb AAV8, представлены на фигуре 7. На левой панели показана лимфоплазмоцитарная инфильтрация портальных трактов, сегментарная потеря эпителиальных клеток желчных протоков, области очагового некроза гепатоцитов и значительное количество нуклеифильного материала на поверхности сосудов у животных, получавших только белок ДНКазы I (а не ДНКазу mAFP/Alb AAV8). На правой панели показано, что печень животных, получавших ДНКазу I mAFP/Alb AAV8, имеет гораздо более низкую плотность воспалительных клеток, отсутствие некроза и гораздо меньше нуклеифильного материала на границе сосудов.
[0320] Данные по донорским Т-клеткам у мышей-реципиентов, обработанных ДНКазой I, и мышей-реципиентов, обработанных ДНКазой I mAFP/Alb AAV8, представлены на фигуре 8. В частности, на фигуре 8 показано значительное снижение общего количества полученных от доноров Т-клеток, полученных от доноров CD4+ и CD8+ Т-клеток в периферических лимфатических узлах (PLN), мезентериальных лимфатических узлах (MLN) и пейеровых бляшках (PP) у реципиентов, обработанных ДНКазой I mAFP/Alb AAV8, по сравнению с реципиентами, получавшими белок ДНКазы I.
[0321 Результаты показывают, что печень-специфичная трансгенная экспрессия фермента ДНКазы I приводит к удвоению выживаемости животных по сравнению с обработкой белком ДНКазой I. Такое улучшение выживаемости сопровождалось значительным сокращением общего количества Т-клеток донорского происхождения, полученных от доноров CD4+ и CD8+ Т-клеток в PLN, MLN и PP у реципиентов, получавших ДНКазу I mAFP/Alb AAV8, по сравнению с реципиентами, получавшими белок ДНКазу I. В печени обработка ДНКазой mAFP/Alb AAV8 привела к значительному снижению лимфоплазмоцитарной инфильтрации портальных трактов, предотвращению потери клеток и очищению сосудистого поверхности от нуклеофильного материала.
ПРИМЕР 9. Клонирование вектора AAV: энхансер ApoEHCR-промотор hAAT-hDNaseI (гиперактивный) правильный лидер-WPRE Xinact (VR-18013AD)
[0322] Вектор экспрессии без промотора AAV pAAV-MCS-Promoterless был получен от Cell Bio labs (№ по каталогу VPK-411; фигура 11). Целостность ITR проверяли путем проведения расщепления рестриктазой SmaI с последующей очисткой из геля для оценки наличия следующих ожидаемых полос: 2681 п.о., 666 п.о. и 112 п.о. Ожидаемая полоса в 11 п.о. не будет видна. Если ожидаемые полосы присутствовали, плазмиду амплифицировали путем выращивания в клетках SURE (Agilent Technologies) или других подобных бактериях. К последовательности SEQ ID NO: 30 добавляли 5'-сайт EcoRI и 3'-сайт HindIII (энхансер ApoEHCR-промотор hAAT-hDNaseI (гиперактивный) правильный лидер-WPRE Xinact). Полинуклеотид SEQ ID NO: 30 (с 5'-сайтами EcoRI и 3' HindIII) синтезировали, и затем расщепляли с помощью EcoRI-HF и HindIII-HF (доступны от NEB). Полосу 2,2 т.п.о. экстрагировали из геля. Вектор pAAV-MCS без промотора расщепляли посредством EcoRI-HF и HindIII-HF с конечной экстракцией геля полосы 3,5 т.п.о. Расщепленный вектор и полинуклеотид SEQ ID NO: 30 (вставка) лигировали в течение одного часа при комнатной температуре в молярном соотношении вставки к вектору 3:1. Лигированную конструкцию трансформировали в электрокомпетентные клетки SURE и высевали на чашки с LB-агаром (Amp). Отбирали колонии, и готовили минипрепараты для скрининга. Сначала осуществляли расщепление SmaI для оценки целостности ITR, чтобы определить, присутствуют ли следующие ожидаемые полосы: 2681 п.о., 1650 п.о. и 1311 п.о. Затем проводили расщепление EcoRI-HF и HindIII-HF для оценки наличия вставки. Если бы вставка присутствовала, были бы видны следующие полосы: 3435 п.о. и 2218 п.о. Карта вектора VR-18013AD показана на фигуре 10B.
[0323] Клоны отбирали, если ожидаемые полосы присутствовали в каждом из гидролизатов SmaI и EcoRI-HF и HindIII-HF. Для выбранных клонов готовили исходный раствор в глицерине для длительного хранения. Плазмиду также амплифицировали и секвенировали. Затем клоны, содержащие плазмиду с правильной последовательностью, культивировали и очищали с помощью endo-free Gigaprep (ALTA Biotech). Очищенная плазмида является подходящей для упаковки с помощью MEE в капсиды AAV.
ПРИМЕР 10. Клонирование вектора AAV: Энхансер ApoEHCR-промотор hAAT-hDNaseI (дикого типа) -WPRE Xinact (VR-18014AD)
[0324] Вектор экспрессии без промотора AAV pAAV-MCS-Promoterless был получен от Cell Bio labs (№ по каталогу VPK-411; фигура 11). Целостность ITR проверяли с помощью проведения расщепления SmaI и очистки из геля, чтобы оценить, продуцирует ли плазмида следующие ожидаемые полосы: 2681 п.о., 666 п.о. и 112 п.о. Ожидаемая полоса в 11 п.о. не будет видна. Если ожидаемые полосы присутствовали, плазмиду амплифицировали путем выращивания в клетках SURE (Agilent Technologies) или других подобных бактериях. К последовательности SEQ ID NO: 31 добавляли 5'-сайт EcoRI и 3'-сайт HindIII (энхансер ApoEHCR-промотор hAAT-hDNaseI (дикого типа)-WPRE Xinact). Полинуклеотид SEQ ID NO: 31 (с 5'-сайтами EcoRI и 3' HindIII) синтезировали, и затем расщепляли с помощью EcoRI-HF и HindIII-HF (доступны от NEB). Полосу 2,2 т.п.о. экстрагировали из геля. Вектор pAAV-MCS без промотора расщепляли посредством EcoRI-HF и HindIII-HF с конечной экстракцией геля полосы 3,5 т.п.о. Расщепленный вектор и полинуклеотид SEQ ID NO: 31 (вставка) лигировали в течение одного часа при комнатной температуре в молярном соотношении вставки к вектору 3:1. Лигированную конструкцию трансформировали в электрокомпетентные клетки SURE и высевали на чашки с LB-агаром (Amp). Отбирали колонии, и готовили минипрепараты для скрининга. Сначала осуществляли расщепление SmaI для оценки целостности ITR, чтобы определить, присутствуют ли следующие ожидаемые полосы: 2681 п.о., 1650 п.о. и 1311 п.о. Затем проводили расщепление EcoRI-HF и HindIII-HF для оценки наличия вставки. Если бы вставка присутствовала, были бы видны следующие полосы: 3435 п.о. и 2218 п.о. Карта вектора VR-18014AD показана на фигуре 10C.
[0325] Клоны отбирали, если ожидаемые полосы присутствовали в каждом из гидролизатов SmaI и EcoRI-HF и HindIII-HF. Для выбранных клонов готовили исходный раствор в глицерине для длительного хранения. Плазмиду также амплифицировали и секвенировали. Затем клоны, содержащие плазмиду с правильной последовательностью, культивировали и очищали с помощью endo-free Gigaprep (ALTA Biotech). Очищенная плазмида является подходящей для упаковки с помощью MEE в капсиды AAV.
ПРИМЕР 11. Получение AAV векторов ApoEHCR энхансер-промотор hAAT-hDNaseI (гиперактивный) правильный лидер-WPRE Xinact (VR-18013AD) и ApoEHCR-энхансер-промотор hAAT-hDNaseI (дикого типа) -WPRE Xinact (VR-18014AD)
[0326] Плазмиды экспрессии VR-18013AD и VR-18014AD были произведены GenScript USA Inc. (Piscataway, NJ 08854, США). Соответствующий AAV вектор hDNAse I (гиперактивная) VR-18013AD и AAV вектор hDNAseI (дикого типа) VR-18014AD были получены с использованием крупномасштабных полиэтилениминных трансфекций Anc80L65 AAV cis, AAV trans, и аденовирусных вспомогательных плазмид в близких к конфлюэнтным монослоях клеток HEK293 с дальнейшей очисткой с помощью градиента йодиксанола в масштабе с применением традиционных протоколов. Очищенные векторы ApoEHCR энхансер-hAAT промотор-hDNaseI (гиперактивный)правильный лидер-WPRE Xinact (кассета трансгена VR-18013AD, содержащая последовательность SEQ ID NO: 30; см. векторную карту на фигуре 10B) и ApoEHCR энхансер-hAAT промотор-hDNaseI (дикого типа)-WPRE Xinact (VR-18014AD (карта, показанная на фигуре 10C, кассета трансгена вектора имеет последовательность (SEQ ID NO: 31) векторы были повторно приготовлены в PBS с добавлением 35 мМ NaCl и 0,001% PF68, который содержал 1,0 x1013 GC/мл (VR-18014AD) и 5,0 x1012 GC/мл (VR-18013AD).
[0327] Очищенный AAV вектор VR-18013AD был проанализирован с помощью SDS-PAGE, результаты показаны на фигуре 12. Три полосы 60, 72 и 90 кДа наблюдались в соотношении примерно 1:1:10, что соответствует белкам VP1-3.
[0328] Для трансдукции VR-18014AD и VR-18013AD были приготовлены в виде стерильных, прозрачных, бесцветных, высокоочищенных растворов рекомбинантных частиц VR-18014AD и VR-18013AD.
ПРИМЕР 12. Печень-специфичная трансдукция векторов AAV: ApoEHCR энхансер-hAAT промотор-hDNaseI (гиперактивный)правильный лидер-WPRE Xinact (VR-18013AD) и ApoEHCR энхансер-hAAT промотор-hDNaseI (дикого типа)-WPRE Xinact (VR-18014AD)
[0329] Изучена эффективность трансдукции следующих двух векторов генной терапии: ApoEHCR энхансер-hAAT промотор-hDNaseI (гиперактивный)правильный лидер-WPRE Xinact и ApoEHCR энхансер-hAAT промотор-hDNaseI (дикого типа)-WPRE Xinact. Эти кандидаты векторов для генной терапии были изучены in vitro с применением клеточной линии, полученной из гепатомы человека HEP G2 (ATCC HB-8065), и аденокарциномы печени человека эндотелиального происхождения SK-HEP1 (ATCC HTB-52).
[0330] Клетки высевали в 48-луночные планшеты при 5х105 клеток/мл и выращивали в среде DMEM Adv, 10% FBS. Через 24 ч после посева в лунки добавляли VR-18013AD или VR-18014AD с применением MOI 104 GC/лунка, 105 GC/лунка и 106 GC/лунка или холостой контроль. Для каждой лунки осуществляли три повтора.
[0331] Активность ДНКазы анализировали с помощью флуоресцентного зонда (Terekhov et al., PNAS 2017; www.pnas.org/content/pnas/114/10/2550.full.pdf), представляющего собой шпильку олигонуклеотида, меченного флуоресцентным красителем и гасителем. За увеличением флуоресценции следили с помощью планшет-ридера Variscan Flash (Thermo Scientific). Культуральную среду разбавляли от 20 до 200 раз реакционным буфером 20 мМ Tris-HCl pH 7,5, 1 мМ MnCl2 и 0,3 мМ CaCl2. Применяли флуоресцентный зонд с концентрацией 0,25 мкМ. Полный гидролиз флуоресцентного зонда в условиях реакции привел к флуоресценции 28 RFU в условиях анализа. Фоновая флуоресценция зонда составляла ниже 0,3 RFU. Калибровочную кривую для оценки концентрации ДНКазы получали с применением серийных разведений чистой ДНКазы I Pulmozyme «Dornase alfa» (Roche). Концентрацию ДНКазы в образцах оценивали с помощью линейной регрессии. Данные показаны на фигурах 13A и 13B.
[0332] Данные на фигурах 13A и 13B показывают, что векторы ApoEHCR энхансер-hAAT промотор-hDNaseI (гиперактивный)правильный лидер-WPRE Xinact (VR-18013AD) и ApoEHCR энхансер-hAAT промотор-hDNaseI (дикого типа)-WPRE Xinact (VR-18014AD) эффективно трансдуцируют только клетки гепатоцитарного происхождения и вызывают экспрессию с высоким уровнем и секрецию фермента ДНКазы I или фермента ДНКазы I дикого типа с увеличенной биологическим путем экспрессией из трансдуцированных клеток G2. Оценка концентрации ДНКазы была получена с применением серийных разведений чистой ДНКазы I Pulmozyme «Dornase alfa» (Roche). Трансдукция, по-видимому, является безопасной для клеток, поскольку в течение 72 часов наблюдения не было никаких признаков гибели клеток даже при самых высоких дозах VR-18013AD и VR-18014AD, равных 106GC/клетка, и отсутствовали морфологические различия между любой из трансдуцированных клеток по сравнению с контрольными клетками.
ПРИМЕР 13. ApoEHCR энхансер-hAAT промотор-hDNaseI (гиперактивный)правильный лидер-WPRE Xinact (VR-18013AD) для лечения болезни Альцгеймера
[0333] Терапевтический эффект однократной внутривенной инъекции VR-18013AD (ApoEHCR энхансер-hAAT промотор-hDNaseI (гиперактивный)правильный лидер-WPRE Xinact) изучали на мышах 3xTg-AD, экспрессирующих три мутантных трансгена человека: пресенилин (PS)1 (M146V), βAPP (шведская мутация) и тау (P301L). У этих трансгенных мышей развиваются патологии как амилоида, так и тау-белка.
[0334] Влияние VR-18013AD на дефицит обучаемости и памяти оценивали с помощью следующих поведенческих тестов: 1) тест чередования Y-лабиринта, который измеряет пространственную рабочую память и зависит от целостности лимбических и не лимбических путей; и 2) ситуативный тест состояния страха (CFC), которое сильно зависит от функции гиппокампа и мозжечковой миндалины, но также и от коры головного мозга.
[0335] Целью исследования являлась количественная оценка влияния одной внутривенной инъекции VR-18013AD на отложение амилоида и фосфорилирование тау в 3xTg-AD с помощью иммуногистохимии. Влияние VR-18013AD на гиперфосфорилирование тау-белка изучали на мышах 3xTg-AD с применением антитела AT8 mAb, специфичного к эпитопам pSer202/Thr205, которые являются одними из самых ранних фосфорилированных эпитопов тау-белка у пациентов с AD. Общий тау-белок также определяли у обработанных и необработанных мышей 3xTg-AD. Гиперактивная микроглия может вызывать крайне пагубные нейротоксические эффекты; следовательно, ослабление микроглиального ответа было предложено как потенциальный терапевтический подход при AD.
[0336] План эксперимента приведен в таблице 11 ниже:
Таблица 11
[0337] В день 0 лечение получали следующие группы мышей: (a) 13 шестимесячным мышам дикого типа (WT) вводили фосфатно-солевой буферный раствор (PBS); (b) 15 шестимесячным мышам 3xTg-AD вводили только фосфатно-солевой буфер (PBS); и (c) 10 шестимесячным мышам 3xTg-AD вводили VR-18013AD в дозе 1,0×1011 GC/мышь. Получены следующие данные. На фигуре 14 поведенческий тест Y-лабиринта показывает небольшое улучшение у мышей 3xTg-AD, получавших VR-18013AD, по сравнению с контрольными мышами 3xTg-AD. На фигуре 15 результаты ситуативного теста состояния страха показывают небольшое улучшение у мышей 3xTg-AD, получавших VR-18013AD, по сравнению с контрольными мышами 3xTg-AD. Данные на фигуре 16 показывают, что активация микроглии была значительно снижена у мышей 3xTg-AD, получавших VR-18013AD, по сравнению с контрольными мышами 3xTg-AD, особенно в области коры головного мозга.
[0338] Данные на фиг. 17 показывают, что наблюдается значительное снижение активации микроглии в области коры головного мозга мышей 3xTg-AD, получавших VR-18013AD, по сравнению с контрольными мышами 3xTg-AD. Данные на фигуре 18 показывают, что обработка VR-18013AD значительно снижает отложение амилоида у мышей 3xTg-AD, получавших VR-18013AD, по сравнению с контрольными мышами 3xTg-AD. Данные на фигуре 19 показывают, что обработка VR-18013AD значительно снижает отложение гиперфосфорилированного тау-белка у мышей 3xTg-AD, обработанных VR-18013AD, по сравнению с контрольными мышами 3xTg-AD. Фотографии на фигуре 20 показывают значительное снижение p-тау в области гиппокампа после обработки VR-18013AD. Таким образом, однократная внутривенная инъекция VR-18013AD показывает значительную терапевтическую активность на мышиной модели болезни Альцгеймера.
ПРИМЕР 14. VR-18014AD для лечения перитонеального карциноматоза
[0339] Двенадцать мышей BALB/c (20-22 г) породы ИБХ РАН содержали при контролируемой температуре 20-22°C. В день 1 мышам внутрибрюшинно вводили 200 мкл клеточной суспензии, содержащей 5 × 105 CT26 NNMU индуцированных недифференцированных клеток карциномы толстой кишки. На 6 день после трансплантации опухоли мышей случайным образом распределяли в контрольную группу (шесть мышей, однократная внутривенная инъекция PBS) или группу лечения (шесть мышей, однократная внутривенная инъекция VR-18014AD в дозе 1,0 × 1011 GC/мышь). Морфометрическую оценку и измерение количества опухолевых узлов в каждой группе проводили на 16 день после инокуляции опухолевых клеток после эвтаназии мышей. У мышей контрольной группы было 14-22 опухолевых узла на мышь, при этом часть узлов образовывала агломераты. Напротив, у мышей, которым вводили VR-18014AD, было всего 2-5 узлов меньшего размера без каких-либо признаков образования агломератов. Типичные морфометрические изображения контрольных мышей и мышей, получавших VR-18014AD, показаны на фигуре 21.
ПРИМЕР 15. ВкДНК, выделенная у мышей с индуцированной проницаемостью кишечника, вызывает агрегацию тау-белка, и перенос печень-специфичного гена ДНКазы подавляет способность вкДНК вызывать агрегацию тау-белка
[0340] Агрегированный тау-белок связан с более чем 20 неврологическими расстройствами, включая болезнь Альцгеймера. У 18 крыс была индуцирована проницаемость кишечника, как указано в примере 7. Тестируемые векторы и композиции вводили мышам в соответствии с заранее определенным режимом, как показано в таблице 12 ниже:
Таблица 12
[0341] Экстракцию вкДНК проводили следующим образом. Образцы периферической крови (5 мл) собирали посредством кардиопункции в пробирки BCT с бесклеточной ДНК. Плазму отделяли от клеточной фракции первым центрифугированием при 800 g при 4 °C в течение 10 мин. Плазму дополнительно центрифугировали при 13000 g при 4°C в течение 10 минут для осаждения и удаления всех оставшихся клеток, а затем хранили в аликвотах по 1 мл при -80°C до экстракции ДНК.
[0342] Для экстракции вкДНК применяли циркулирующую нуклеиновую кислоту QIAamp (Qiagen) в соответствии с протоколом производителя.
[0343] Была проведена оценка вкДНК на агрегацию тау-белка. Применяли тау-белок человека полной длины (4R2N). Для анализа раствор, содержащий 1 мг/мл мономера тау в присутствии 2,5 мкМ гепарина в 100 мМ HEPES, pH 7,4, 100 мМ NaCl, инкубировали в присутствии 25 мкл экстрагированной вкДНК при 20°C с циклическим перемешиванием (1 мин встряхивания при 500 об/мин, затем 29 мин без встряхивания). Общий объем пробы составлял 200 мкл; раствор также содержал 5 мкМ тиофлавина T. Агрегацию с течением времени отслеживали по флуоресценции ThT (возбуждение 435 нм, испускание 485 нм).
[0344] Результаты приведены в таблице 13 ниже, с указанием среднего значения и SEM для трех повторов:
Таблица 13
Однократная ВВ инъекция GC/кг
[0345] Данные таблицы 13 ясно демонстрируют, что печень-специфичная трансгенная экспрессия фермента ДНКазы I в значительной степени подавляет способность вкДНК, выделенной из крови животных с повышенной проницаемостью кишечника, способствовать агрегации тау-белка при инъекциях рекомбинантного фермента ДНКазы I, а также применение неспецифичной для печени трансгенной экспрессии фермента ДНКазы I является гораздо менее эффективным.
Ссылки
Song, L. et al., “NLRP3 Inflammasome in Neurological Diseases, from Functions to Therapies” Front. Cell. Neurosci., 2017, Vol. 11, No. 63.
Fleischhacker M. et al., “Circulating nucleic acids (CNAs) and cancer: a survey” Biochim Biophys Acta, 2007, 1775(1): 181-232.
Demers, M. at al., “Cancers predispose neutrophils to release extracellular DNA traps that contribute to cancer-associated thrombosis” PNAS, 2012, 109(32):13076-13081.
García-Olmo D.C. and García-Olmo, D. “Biological role of cell-free nucleic acids in cancer: the theory of genometastasis” Crit Rev Oncolog., 2013, 18:153-161.
Sawyers 2008 C.L., “The cancer biomarker problem” Nature ,2008, 452(7187):548-552.
Butt A.N. et al. Overview of circulating nucleic acids in plasma/serum. Ann. N.Y. Acad. Sci ., 2008, 1137:236-242.
Schwarzenbach H. et al., “Detection and monitoring of cell-free DNA in blood of patients with colorectal cancer” Ann. N.Y. Acad. Sci., 2008, 1137:190-196.
Zenaro E, et al., Neutrophils promote Alzheimer's disease-like pathology and cognitive decline via LFA-1 integrin. Nat Rev Nephrol., 2015, Author manuscript; available in PMC 2017 Jul 14.
Fushi, W. et al., “Extracellular DNA in Pancreatic Cancer Promotes Cell Invasion and Metastasis” Cancer Res., 2013, 73:4256-4266.
Tohme, S. et al., “Neutrophil Extracellular Traps Promote the Development and Progression of Liver Metastases after Surgical Stress” Cancer Res., 2016 Mar 15, 76(6): 1367-1380.
Patutina, O. et al., Inhibition of metastasis development by daily administration of ultralow doses of RNase A and DNase I. Biochimie., 2011 Apr, 93(4): 689-96.
Dan Li, DNase I Treatment Reduces GVHD in Mice. Biology of Blood and Marrow Transplantation, Volume 21, Issue 2, Page S339.
* * *
[0346] Настоящее изобретение не ограничивается в объеме конкретными вариантами реализации, описанными в настоящем документе. Действительно, различные модификации настоящего изобретения в дополнение к описанным в настоящем документе станут очевидными для специалистов в данной области техники из предшествующего описания. Предполагается, что такие модификации попадают в объем прилагаемой формулы изобретения.
[0347] Все патенты, заявки, публикации, методы испытаний, литература и другие материалы, процитированные в настоящем документе, полностью включены в настоящее описание посредством ссылки, как если бы они физически присутствовали в настоящем описании.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Genkin, Dmitry Dmitrievich
Tets, Georgy Viktorovich
Tets, Viktor Veniaminovich
<120> ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ ПОСРЕДСТВОМ ЭКСПРЕССИИ ФЕРМЕНТА,
ОБЛАДАЮЩЕГО ДЕОКСИРИБОНУКЛЕАЗНОЙ (ДНКазной) АКТИВНОСТЬЮ, В ПЕЧЕНИ
<130> 252732.000003
<150> 62617879
<151> 2018-01-16
<160> 35
<170> PatentIn version 3.5
<210> 1
<211> 282
<212> PRT
<213> Homo sapiens
<400> 1
Met Arg Gly Met Lys Leu Leu Gly Ala Leu Leu Ala Leu Ala Ala Leu
1 5 10 15
Leu Gln Gly Ala Val Ser Leu Lys Ile Ala Ala Phe Asn Ile Gln Thr
20 25 30
Phe Gly Glu Thr Lys Met Ser Asn Ala Thr Leu Val Ser Tyr Ile Val
35 40 45
Gln Ile Leu Ser Arg Tyr Asp Ile Ala Leu Val Gln Glu Val Arg Asp
50 55 60
Ser His Leu Thr Ala Val Gly Lys Leu Leu Asp Asn Leu Asn Gln Asp
65 70 75 80
Ala Pro Asp Thr Tyr His Tyr Val Val Ser Glu Pro Leu Gly Arg Asn
85 90 95
Ser Tyr Lys Glu Arg Tyr Leu Phe Val Tyr Arg Pro Asp Gln Val Ser
100 105 110
Ala Val Asp Ser Tyr Tyr Tyr Asp Asp Gly Cys Glu Pro Cys Gly Asn
115 120 125
Asp Thr Phe Asn Arg Glu Pro Ala Ile Val Arg Phe Phe Ser Arg Phe
130 135 140
Thr Glu Val Arg Glu Phe Ala Ile Val Pro Leu His Ala Ala Pro Gly
145 150 155 160
Asp Ala Val Ala Glu Ile Asp Ala Leu Tyr Asp Val Tyr Leu Asp Val
165 170 175
Gln Glu Lys Trp Gly Leu Glu Asp Val Met Leu Met Gly Asp Phe Asn
180 185 190
Ala Gly Cys Ser Tyr Val Arg Pro Ser Gln Trp Ser Ser Ile Arg Leu
195 200 205
Trp Thr Ser Pro Thr Phe Gln Trp Leu Ile Pro Asp Ser Ala Asp Thr
210 215 220
Thr Ala Thr Pro Thr His Cys Ala Tyr Asp Arg Ile Val Val Ala Gly
225 230 235 240
Met Leu Leu Arg Gly Ala Val Val Pro Asp Ser Ala Leu Pro Phe Asn
245 250 255
Phe Gln Ala Ala Tyr Gly Leu Ser Asp Gln Leu Ala Gln Ala Ile Ser
260 265 270
Asp His Tyr Pro Val Glu Val Met Leu Lys
275 280
<210> 2
<211> 282
<212> PRT
<213> Homo sapiens
<400> 2
Met Arg Gly Met Lys Leu Leu Gly Ala Leu Leu Ala Leu Ala Ala Leu
1 5 10 15
Leu Gln Gly Ala Val Ser Leu Lys Ile Ala Ala Phe Asn Ile Arg Thr
20 25 30
Phe Gly Arg Thr Lys Met Ser Asn Ala Thr Leu Val Ser Tyr Ile Val
35 40 45
Gln Ile Leu Ser Arg Tyr Asp Ile Ala Leu Val Gln Glu Val Arg Asp
50 55 60
Ser His Leu Thr Ala Val Gly Lys Leu Leu Asp Asn Leu Asn Gln Asp
65 70 75 80
Ala Pro Asp Thr Tyr His Tyr Val Val Ser Glu Pro Leu Gly Arg Lys
85 90 95
Ser Tyr Lys Glu Arg Tyr Leu Phe Val Tyr Arg Pro Asp Gln Val Ser
100 105 110
Ala Val Asp Ser Tyr Tyr Tyr Asp Asp Gly Cys Glu Pro Cys Gly Asn
115 120 125
Asp Thr Phe Asn Arg Glu Pro Phe Ile Val Arg Phe Phe Ser Arg Phe
130 135 140
Thr Glu Val Arg Glu Phe Ala Ile Val Pro Leu His Ala Ala Pro Gly
145 150 155 160
Asp Ala Val Ala Glu Ile Asp Ala Leu Tyr Asp Val Tyr Leu Asp Val
165 170 175
Gln Glu Lys Trp Gly Leu Glu Asp Val Met Leu Met Gly Asp Phe Asn
180 185 190
Ala Gly Cys Ser Tyr Val Arg Pro Ser Gln Trp Ser Ser Ile Arg Leu
195 200 205
Trp Thr Ser Pro Thr Phe Gln Trp Leu Ile Pro Asp Ser Ala Asp Thr
210 215 220
Thr Ala Thr Pro Thr His Cys Ala Tyr Asp Arg Ile Val Val Ala Gly
225 230 235 240
Met Leu Leu Arg Gly Ala Val Val Pro Asp Ser Ala Leu Pro Phe Asn
245 250 255
Phe Gln Ala Ala Tyr Gly Leu Ser Asp Gln Leu Ala Gln Ala Ile Ser
260 265 270
Asp His Tyr Pro Val Glu Val Met Leu Lys
275 280
<210> 3
<211> 732
<212> PRT
<213> Искусственная последовательность
<220>
<223> Anc80 AAV капсидный белок
<220>
<221> прочий_признак
<222> (166)..(166)
<223> Xaa представляет собой Lys или Arg
<220>
<221> прочий_признак
<222> (202)..(202)
<223> Xaa представляет собой Ala или Ser
<220>
<221> прочий_признак
<222> (263)..(263)
<223> Xaa представляет собой Ala или Gly
<220>
<221> прочий_признак
<222> (308)..(308)
<223> Xaa представляет собой Arg или Lys
<220>
<221> прочий_признак
<222> (408)..(408)
<223> Xaa представляет собой Glu или Gln
<220>
<221> прочий_признак
<222> (456)..(456)
<223> Xaa представляет собой Thr или Glu
<220>
<221> прочий_признак
<222> (489)..(489)
<223> Xaa представляет собой Ala или Thr
<220>
<221> прочий_признак
<222> (558)..(558)
<223> Xaa представляет собой Ser или Asn
<220>
<221> прочий_признак
<222> (572)..(572)
<223> Xaa представляет собой Gln или Glu
<220>
<221> прочий_признак
<222> (583)..(583)
<223> Xaa может представлять природную амирокислоту
<220>
<221> прочий_признак
<222> (605)..(605)
<223> Xaa представляет собой Asn или Asp
<400> 3
Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser Glu
1 5 10 15
Gly Ile Arg Glu Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro Lys Ala
20 25 30
Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro Gly Tyr
35 40 45
Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro Val Asn
50 55 60
Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp Gln Gln
65 70 75 80
Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala Asp Ala
85 90 95
Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly Asn Leu
100 105 110
Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Leu Gly
115 120 125
Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg Pro Val
130 135 140
Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly Lys Lys
145 150 155 160
Gly Gln Gln Pro Ala Xaa Lys Arg Leu Asn Phe Gly Gln Thr Gly Asp
165 170 175
Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro Ala Ala
180 185 190
Pro Ser Gly Val Gly Ser Asn Thr Met Xaa Ala Gly Gly Gly Ala Pro
195 200 205
Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala Ser Gly
210 215 220
Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile Thr Thr
225 230 235 240
Ser Thr Arg Thr Ala Leu Pro Thr Tyr Asn Asn His Leu Tyr Lys Gln
245 250 255
Ile Ser Ser Gln Ser Gly Xaa Ser Thr Asn Asp Asn Thr Tyr Phe Gly
260 265 270
Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His Cys His
275 280 285
Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp Gly Phe
290 295 300
Arg Pro Lys Xaa Leu Asn Phe Lys Leu Phe Asn Ile Gln Val Lys Glu
305 310 315 320
Val Thr Thr Asn Asp Gly Thr Thr Thr Ile Ala Asn Asn Leu Thr Ser
325 330 335
Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro Tyr Val Leu
340 345 350
Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala Asp Val Phe
355 360 365
Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly Ser Gln Ala
370 375 380
Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro Ser Gln Met
385 390 395 400
Leu Arg Thr Gly Asn Asn Phe Xaa Phe Ser Tyr Thr Phe Glu Asp Val
405 410 415
Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp Arg Leu Asn
420 425 430
Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg Thr Gln Thr Thr
435 440 445
Ser Gly Thr Ala Gly Asn Arg Xaa Leu Gln Phe Ser Gln Ala Gly Pro
450 455 460
Ser Ser Met Ala Asn Gln Ala Lys Asn Trp Leu Pro Gly Pro Cys Tyr
465 470 475 480
Arg Gln Gln Arg Val Ser Lys Thr Xaa Asn Gln Asn Asn Asn Ser Asn
485 490 495
Phe Ala Trp Thr Gly Ala Thr Lys Tyr His Leu Asn Gly Arg Asp Ser
500 505 510
Leu Val Asn Pro Gly Pro Ala Met Ala Thr His Lys Asp Asp Glu Asp
515 520 525
Lys Phe Phe Pro Met Ser Gly Val Leu Ile Phe Gly Lys Gln Gly Ala
530 535 540
Gly Asn Ser Asn Val Asp Leu Asp Asn Val Met Ile Thr Xaa Glu Glu
545 550 555 560
Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Xaa Tyr Gly Thr Val
565 570 575
Ala Thr Asn Leu Gln Ser Xaa Asn Thr Ala Pro Ala Thr Gly Thr Val
580 585 590
Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln Xaa Arg Asp Val
595 600 605
Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His Thr Asp Gly His
610 615 620
Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu Lys His Pro Pro
625 630 635 640
Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala Asn Pro Pro Thr
645 650 655
Thr Phe Ser Pro Ala Lys Phe Ala Ser Phe Ile Thr Gln Tyr Ser Thr
660 665 670
Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln Lys Glu Asn Ser
675 680 685
Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn Tyr Asn Lys Ser
690 695 700
Thr Asn Val Asp Phe Ala Val Asp Thr Asn Gly Val Tyr Ser Glu Pro
705 710 715 720
Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730
<210> 4
<211> 260
<212> PRT
<213> Homo sapiens
<400> 4
Leu Lys Ile Ala Ala Phe Asn Ile Gln Thr Phe Gly Glu Thr Lys Met
1 5 10 15
Ser Asn Ala Thr Leu Val Ser Tyr Ile Val Gln Ile Leu Ser Arg Tyr
20 25 30
Asp Ile Ala Leu Val Gln Glu Val Arg Asp Ser His Leu Thr Ala Val
35 40 45
Gly Lys Leu Leu Asp Asn Leu Asn Gln Asp Ala Pro Asp Thr Tyr His
50 55 60
Tyr Val Val Ser Glu Pro Leu Gly Arg Asn Ser Tyr Lys Glu Arg Tyr
65 70 75 80
Leu Phe Val Tyr Arg Pro Asp Gln Val Ser Ala Val Asp Ser Tyr Tyr
85 90 95
Tyr Asp Asp Gly Cys Glu Pro Cys Gly Asn Asp Thr Phe Asn Arg Glu
100 105 110
Pro Ala Ile Val Arg Phe Phe Ser Arg Phe Thr Glu Val Arg Glu Phe
115 120 125
Ala Ile Val Pro Leu His Ala Ala Pro Gly Asp Ala Val Ala Glu Ile
130 135 140
Asp Ala Leu Tyr Asp Val Tyr Leu Asp Val Gln Glu Lys Trp Gly Leu
145 150 155 160
Glu Asp Val Met Leu Met Gly Asp Phe Asn Ala Gly Cys Ser Tyr Val
165 170 175
Arg Pro Ser Gln Trp Ser Ser Ile Arg Leu Trp Thr Ser Pro Thr Phe
180 185 190
Gln Trp Leu Ile Pro Asp Ser Ala Asp Thr Thr Ala Thr Pro Thr His
195 200 205
Cys Ala Tyr Asp Arg Ile Val Val Ala Gly Met Leu Leu Arg Gly Ala
210 215 220
Val Val Pro Asp Ser Ala Leu Pro Phe Asn Phe Gln Ala Ala Tyr Gly
225 230 235 240
Leu Ser Asp Gln Leu Ala Gln Ala Ile Ser Asp His Tyr Pro Val Glu
245 250 255
Val Met Leu Lys
260
<210> 5
<211> 260
<212> PRT
<213> Homo sapiens
<400> 5
Leu Lys Ile Ala Ala Phe Asn Ile Arg Thr Phe Gly Arg Thr Lys Met
1 5 10 15
Ser Asn Ala Thr Leu Val Ser Tyr Ile Val Gln Ile Leu Ser Arg Tyr
20 25 30
Asp Ile Ala Leu Val Gln Glu Val Arg Asp Ser His Leu Thr Ala Val
35 40 45
Gly Lys Leu Leu Asp Asn Leu Asn Gln Asp Ala Pro Asp Thr Tyr His
50 55 60
Tyr Val Val Ser Glu Pro Leu Gly Arg Lys Ser Tyr Lys Glu Arg Tyr
65 70 75 80
Leu Phe Val Tyr Arg Pro Asp Gln Val Ser Ala Val Asp Ser Tyr Tyr
85 90 95
Tyr Asp Asp Gly Cys Glu Pro Cys Gly Asn Asp Thr Phe Asn Arg Glu
100 105 110
Pro Phe Ile Val Arg Phe Phe Ser Arg Phe Thr Glu Val Arg Glu Phe
115 120 125
Ala Ile Val Pro Leu His Ala Ala Pro Gly Asp Ala Val Ala Glu Ile
130 135 140
Asp Ala Leu Tyr Asp Val Tyr Leu Asp Val Gln Glu Lys Trp Gly Leu
145 150 155 160
Glu Asp Val Met Leu Met Gly Asp Phe Asn Ala Gly Cys Ser Tyr Val
165 170 175
Arg Pro Ser Gln Trp Ser Ser Ile Arg Leu Trp Thr Ser Pro Thr Phe
180 185 190
Gln Trp Leu Ile Pro Asp Ser Ala Asp Thr Thr Ala Thr Pro Thr His
195 200 205
Cys Ala Tyr Asp Arg Ile Val Val Ala Gly Met Leu Leu Arg Gly Ala
210 215 220
Val Val Pro Asp Ser Ala Leu Pro Phe Asn Phe Gln Ala Ala Tyr Gly
225 230 235 240
Leu Ser Asp Gln Leu Ala Gln Ala Ile Ser Asp His Tyr Pro Val Glu
245 250 255
Val Met Leu Lys
260
<210> 6
<211> 22
<212> PRT
<213> Homo sapiens
<400> 6
Met Arg Gly Met Lys Leu Leu Gly Ala Leu Leu Ala Leu Ala Ala Leu
1 5 10 15
Leu Gln Gly Ala Val Ser
20
<210> 7
<211> 20
<212> PRT
<213> Homo sapiens
<400> 7
Met Tyr Arg Met Gln Leu Leu Ser Cys Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser
20
<210> 8
<211> 214
<212> ДНК
<213> Homo sapiens
<400> 8
actagttcca gatggtaaat atacacaagg gatttagtca aacaattttt tggcaagaat 60
attatgaatt ttgtaatcgg ttggcagcca atgaaataca aagatgagtc tagttaataa 120
tctacaatta ttggttaaag aagtatatta gtgctaattt ccctccgttt gtcctagctt 180
ttctcttctg tcaaccccac acgcctttgg cacc 214
<210> 9
<211> 726
<212> PRT
<213> Искусственная последовательность
<220>
<223> Anc80 VP3 капсидный белок
<220>
<221> прочий_признак
<222> (165)..(165)
<223> Xaa представляет собой Lys или Arg
<220>
<221> прочий_признак
<222> (201)..(201)
<223> Xaa представляет собой Ala или Ser
<220>
<221> прочий_признак
<222> (261)..(261)
<223> Xaa представляет собой Ala или Gly
<220>
<221> прочий_признак
<222> (306)..(306)
<223> Xaa представляет собой Arg или Lys
<220>
<221> прочий_признак
<222> (406)..(406)
<223> Xaa представляет собой Glu или Gln
<220>
<221> прочий_признак
<222> (454)..(454)
<223> Xaa представляет собой Thr или Glu
<220>
<221> прочий_признак
<222> (486)..(486)
<223> Xaa представляет собой Ala или Thr
<220>
<221> прочий_признак
<222> (554)..(554)
<223> Xaa представляет собой Ser или Asn
<220>
<221> прочий_признак
<222> (568)..(568)
<223> Xaa представляет собой Gln или Glu
<220>
<221> прочий_признак
<222> (579)..(579)
<223> Xaa представляет собой Ser или Ala
<220>
<221> прочий_признак
<222> (600)..(600)
<223> Xaa представляет собой Asn или Asp
<400> 9
Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser Glu
1 5 10 15
Gly Ile Arg Glu Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro Lys Ala
20 25 30
Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro Gly Tyr
35 40 45
Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro Val Asn Ala
50 55 60
Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp Gln Gln Leu
65 70 75 80
Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala Asp Ala Glu
85 90 95
Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly Asn Leu Gly
100 105 110
Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Leu Gly Leu
115 120 125
Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg Pro Val Glu
130 135 140
Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly Lys Lys Gly
145 150 155 160
Gln Gln Pro Ala Xaa Lys Arg Leu Asn Phe Gly Gln Thr Gly Asp Ser
165 170 175
Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro Ala Ala Pro
180 185 190
Ser Gly Val Gly Ser Asn Thr Met Xaa Ala Gly Gly Gly Ala Pro Ala
195 200 205
Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala Ser Gly Asn Trp
210 215 220
His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile Thr Thr Ser Thr
225 230 235 240
Arg Thr Ala Leu Pro Thr Tyr Asn Asn His Leu Tyr Lys Gln Ile Ser
245 250 255
Ser Gln Ser Gly Xaa Ser Thr Asn Asp Asn Thr Tyr Phe Gly Tyr Ser
260 265 270
Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His Cys His Phe Ser
275 280 285
Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp Gly Phe Arg Pro
290 295 300
Lys Xaa Leu Asn Phe Lys Leu Phe Asn Ile Gln Val Lys Glu Val Thr
305 310 315 320
Thr Asn Asp Gly Thr Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val
325 330 335
Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro Tyr Val Leu Gly Ser
340 345 350
Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala Asp Val Phe Met Ile
355 360 365
Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly Ser Gln Ala Val Gly
370 375 380
Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro Ser Gln Met Leu Arg
385 390 395 400
Thr Gly Asn Asn Phe Xaa Phe Ser Tyr Thr Phe Glu Asp Val Pro Phe
405 410 415
His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp Arg Leu Asn Pro Leu
420 425 430
Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg Thr Gln Thr Thr Ser Gly
435 440 445
Thr Ala Gly Asn Arg Xaa Leu Gln Phe Ser Gln Ala Gly Pro Ser Ser
450 455 460
Ala Asn Gln Ala Lys Asn Trp Leu Pro Gly Pro Cys Tyr Arg Gln Gln
465 470 475 480
Arg Val Ser Lys Thr Xaa Asn Gln Asn Asn Asn Ser Asn Phe Ala Trp
485 490 495
Thr Gly Ala Thr Lys Tyr His Leu Asn Gly Arg Asp Ser Leu Val Asn
500 505 510
Pro Gly Pro Ala Met Ala Thr His Lys Asp Asp Glu Asp Lys Phe Phe
515 520 525
Pro Met Ser Gly Val Leu Ile Phe Gly Lys Gln Gly Ala Gly Asn Ser
530 535 540
Asn Val Asp Leu Asp Asn Val Ile Thr Xaa Glu Glu Glu Ile Lys Thr
545 550 555 560
Thr Asn Pro Val Ala Thr Glu Xaa Tyr Gly Thr Val Ala Thr Asn Leu
565 570 575
Gln Ser Xaa Asn Thr Ala Pro Ala Thr Gly Thr Val Asn Ser Gln Gly
580 585 590
Ala Leu Pro Gly Val Trp Gln Xaa Arg Asp Val Tyr Leu Gln Gly Pro
595 600 605
Ile Trp Ala Lys Ile Pro His Thr Asp Gly His Phe His Pro Ser Pro
610 615 620
Leu Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro Gln Ile Leu Ile
625 630 635 640
Lys Asn Thr Pro Val Pro Ala Asn Pro Pro Thr Thr Phe Ser Pro Ala
645 650 655
Lys Phe Ala Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Ser Val
660 665 670
Glu Ile Glu Glu Leu Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu
675 680 685
Ile Gln Tyr Thr Ser Asn Tyr Asn Lys Ser Thr Asn Val Asp Phe Ala
690 695 700
Val Asp Thr Asn Gly Val Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg
705 710 715 720
Tyr Leu Thr Arg Asn Leu
725
<210> 10
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 10
caacttcatc cacgttcacc 20
<210> 11
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 11
gttctgagct ccaaccattc t 21
<210> 12
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 12
cactgtgggt ccttcatctt t 21
<210> 13
<211> 50
<212> ДНК
<213> Homo sapiens
<220>
<221> прочий_признак
<222> (42)..(42)
<223> n представляет собой a, c, g, или t
<400> 13
tcgtcggcag cgtcagatgt gtataagaga cagcctacgg gnggcwgcag 50
<210> 14
<211> 55
<212> ДНК
<213> Homo sapiens
<400> 14
gtctcgtggg ctcggagatg tgtataagag acaggactac hvgggtatct aatcc 55
<210> 15
<211> 397
<212> ДНК
<213> Homo sapiens
<400> 15
gatcttgcta ccagtggaac agccactaag gattctgcag tgagagcaga gggccagcta 60
agtggtactc tcccagagac tgtctgactc acgccacccc ctccaccttg gacacaggac 120
gctgtggttt ctgagccagg tacaatgact cctttcggta agtgcagtgg aagctgtaca 180
ctgcccaggc aaagcgtccg ggcagcgtag gcgggcgact cagatcccag ccagtggact 240
tagcccctgt ttgctcctcc gataactggg gtgaccttgg ttaatattca ccagcagcct 300
cccccgttgc ccctctggat ccactgctta aatacggacg aggacagggc cctgtctcct 360
cagcttcagg caccaccact gacctgggac agtgaat 397
<210> 16
<211> 637
<212> ДНК
<213> Homo sapiens
<400> 16
agtggcggcc gctcgagcta gcggccgctc tagaagataa tcaacctctg gattacaaaa 60
tttgtgaaag attgactggt attcttaact atgttgctcc ttttacgcta tgtggatacg 120
ctgctttaat gcctttgtat catgctattg cttcccgtat ggctttcatt ttctcctcct 180
tgtataaatc ctggttgctg tctctttatg aggagttgtg gcccgttgtc aggcaacgtg 240
gcgtggtgtg cactgtgttt gctgacgcaa cccccactgg ttggggcatt gccaccacct 300
gtcagctcct ttccgggact ttcgctttcc ccctccctat tgccacggcg gaactcatcg 360
ccgcctgcct tgcccgctgc tggacagggg ctcggctgtt gggcactgac aattccgtgg 420
tgttgtcggg gaaatcatcg tcctttcctt ggctgctcgc ctgtgttgcc acctggattc 480
tgcgcgggac gtccttctgc tacgtccctt cggccctcaa tccagcggac cttccttccc 540
gcggcctgct gccggctctg cggcctcttc cgcgtcttcg ccttcgccct cagacgagtc 600
ggatctccct ttgggccgcc tccccgcatc ggactag 637
<210> 17
<211> 320
<212> ДНК
<213> Homo sapiens
<400> 17
aggctcagag gcacacagga gtttctgggc tcaccctgcc cccttccaac ccctcagttc 60
ccatcctcca gcagctgttt gtgtgctgcc tctgaagtcc acactgaaca aacttcagcc 120
tactcatgtc cctaaaatgg gcaaacattg caagcagcaa acagcaaaca cacagccctc 180
cctgcctgct gaccttggag ctggggcaga ggtcagagac ctctctgggc ccatgccacc 240
tccaacatcc actcgacccc ttggaatttc ggtggagagg agcagaggtt gtcctggcgt 300
ggtttaggta gtgtgagagg 320
<210> 18
<211> 840
<212> ДНК
<213> Homo sapiens
<400> 18
atgaagctgc tgggggcgct gctggcactg gcggccctac tgcagggggc cgtgtccctg 60
aagatcgcag ccttcaacat caggacattt gggaggacca agatgtccaa tgccaccctc 120
gtcagctaca ttgtgcagat cctgagccgc tatgacatcg ccctggtcca ggaggtcaga 180
gacagccacc tgactgccgt ggggaagctg ctggacaacc tcaatcagga tgcaccagac 240
acctatcact acgtggtcag tgagccactg ggacggaaga gctataagga gcgctacctg 300
ttcgtgtaca ggcctgacca ggtgtctgcg gtggacagct actactacga tgatggctgc 360
gagccctgcg ggaacgacac cttcaaccga gagccattca ttgtcaggtt cttctcccgg 420
ttcacagagg tcagggagtt tgccattgtt cccctgcatg cggccccggg ggacgcagta 480
gccgagatcg acgctctcta tgacgtctac ctggatgtcc aagagaaatg gggcttggag 540
gacgtcatgt tgatgggcga cttcaatgcg ggctgcagct atgtgagacc ctcccagtgg 600
tcatccatcc gcctgtggac aagccccacc ttccagtggc tgatccccga cagcgctgac 660
accacagcta cacccacgca ctgtgcctat gacaggatcg tggttgcagg gatgctgctc 720
cgaggcgccg ttgttcccga ctcggctctt ccctttaact tccaggctgc ctatggcctg 780
agtgaccaac tggcccaagc catcagtgac cactatccag tggaggtgat gctgaagtga 840
<210> 19
<211> 849
<212> ДНК
<213> Homo sapiens
<400> 19
atgaggggca tgaagctgct gggggcgctg ctggcactgg cggccctact gcagggggcc 60
gtgtccctga agatcgcagc cttcaacatc aggacatttg ggaggaccaa gatgtccaat 120
gccaccctcg tcagctacat tgtgcagatc ctgagccgct atgacatcgc cctggtccag 180
gaggtcagag acagccacct gactgccgtg gggaagctgc tggacaacct caatcaggat 240
gcaccagaca cctatcacta cgtggtcagt gagccactgg gacggaagag ctataaggag 300
cgctacctgt tcgtgtacag gcctgaccag gtgtctgcgg tggacagcta ctactacgat 360
gatggctgcg agccctgcgg gaacgacacc ttcaaccgag agccattcat tgtcaggttc 420
ttctcccggt tcacagaggt cagggagttt gccattgttc ccctgcatgc ggccccgggg 480
gacgcagtag ccgagatcga cgctctctat gacgtctacc tggatgtcca agagaaatgg 540
ggcttggagg acgtcatgtt gatgggcgac ttcaatgcgg gctgcagcta tgtgagaccc 600
tcccagtggt catccatccg cctgtggaca agccccacct tccagtggct gatccccgac 660
agcgctgaca ccacagctac acccacgcac tgtgcctatg acaggatcgt ggttgcaggg 720
atgctgctcc gaggcgccgt tgttcccgac tcggctcttc cctttaactt ccaggctgcc 780
tatggcctga gtgaccaact ggcccaagcc atcagtgacc actatccagt ggaggtgatg 840
ctgaagtga 849
<210> 20
<211> 66
<212> ДНК
<213> Homo sapiens
<400> 20
atgaggggca tgaagctgct gggggcgctg ctggcactgg cggccctact gcagggggcc 60
gtgtcc 66
<210> 21
<211> 783
<212> ДНК
<213> Homo sapiens
<400> 21
ctgaagatcg cagccttcaa catcaggaca tttgggagga ccaagatgtc caatgccacc 60
ctcgtcagct acattgtgca gatcctgagc cgctatgaca tcgccctggt ccaggaggtc 120
agagacagcc acctgactgc cgtggggaag ctgctggaca acctcaatca ggatgcacca 180
gacacctatc actacgtggt cagtgagcca ctgggacgga agagctataa ggagcgctac 240
ctgttcgtgt acaggcctga ccaggtgtct gcggtggaca gctactacta cgatgatggc 300
tgcgagccct gcgggaacga caccttcaac cgagagccat tcattgtcag gttcttctcc 360
cggttcacag aggtcaggga gtttgccatt gttcccctgc atgcggcccc gggggacgca 420
gtagccgaga tcgacgctct ctatgacgtc tacctggatg tccaagagaa atggggcttg 480
gaggacgtca tgttgatggg cgacttcaat gcgggctgca gctatgtgag accctcccag 540
tggtcatcca tccgcctgtg gacaagcccc accttccagt ggctgatccc cgacagcgct 600
gacaccacag ctacacccac gcactgtgcc tatgacagga tcgtggttgc agggatgctg 660
ctccgaggcg ccgttgttcc cgactcggct cttcccttta acttccaggc tgcctatggc 720
ctgagtgacc aactggccca agccatcagt gaccactatc cagtggaggt gatgctgaag 780
tga 783
<210> 22
<211> 846
<212> ДНК
<213> Homo sapiens
<400> 22
atgaggggca tgaagctgct gggggcgctg ctggcactgg cggccctact gcagggggcc 60
gtgtccctga agatcgcagc cttcaacatc cagacatttg gggagaccaa gatgtccaat 120
gccaccctcg tcagctacat tgtgcagatc ctgagccgct atgacatcgc cctggtccag 180
gaggtcagag acagccacct gactgccgtg gggaagctgc tggacaacct caatcaggat 240
gcaccagaca cctatcacta cgtggtcagt gagccactgg gacggaacag ctataaggag 300
cgctacctgt tcgtgtacag gcctgaccag gtgtctgcgg tggacagcta ctactacgat 360
gatggctgcg agccctgcgg gaacgacacc ttcaaccgag agccagccat tgtcaggttc 420
ttctcccggt tcacagaggt cagggagttt gccattgttc ccctgcatgc ggccccgggg 480
gacgcagtag ccgagatcga cgctctctat gacgtctacc tggatgtcca agagaaatgg 540
ggcttggagg acgtcatgtt gatgggcgac ttcaatgcgg gctgcagcta tgtgagaccc 600
tcccagtggt catccatccg cctgtggaca agccccacct tccagtggct gatccccgac 660
agcgctgaca ccacagctac acccacgcac tgtgcctatg acaggatcgt ggttgcaggg 720
atgctgctcc gaggcgccgt tgttcccgac tcggctcttc cctttaactt ccaggctgcc 780
tatggcctga gtgaccaact ggcccaagcc atcagtgacc actatccagt ggaggtgatg 840
ctgaag 846
<210> 23
<211> 780
<212> ДНК
<213> Homo sapiens
<400> 23
ctgaagatcg cagccttcaa catccagaca tttggggaga ccaagatgtc caatgccacc 60
ctcgtcagct acattgtgca gatcctgagc cgctatgaca tcgccctggt ccaggaggtc 120
agagacagcc acctgactgc cgtggggaag ctgctggaca acctcaatca ggatgcacca 180
gacacctatc actacgtggt cagtgagcca ctgggacgga acagctataa ggagcgctac 240
ctgttcgtgt acaggcctga ccaggtgtct gcggtggaca gctactacta cgatgatggc 300
tgcgagccct gcgggaacga caccttcaac cgagagccag ccattgtcag gttcttctcc 360
cggttcacag aggtcaggga gtttgccatt gttcccctgc atgcggcccc gggggacgca 420
gtagccgaga tcgacgctct ctatgacgtc tacctggatg tccaagagaa atggggcttg 480
gaggacgtca tgttgatggg cgacttcaat gcgggctgca gctatgtgag accctcccag 540
tggtcatcca tccgcctgtg gacaagcccc accttccagt ggctgatccc cgacagcgct 600
gacaccacag ctacacccac gcactgtgcc tatgacagga tcgtggttgc agggatgctg 660
ctccgaggcg ccgttgttcc cgactcggct cttcccttta acttccaggc tgcctatggc 720
ctgagtgacc aactggccca agccatcagt gaccactatc cagtggaggt gatgctgaag 780
<210> 24
<211> 284
<212> PRT
<213> Mus musculus
<400> 24
Met Arg Tyr Thr Gly Leu Met Gly Thr Leu Leu Thr Leu Val Asn Leu
1 5 10 15
Leu Gln Leu Ala Gly Thr Leu Arg Ile Ala Ala Phe Asn Ile Arg Thr
20 25 30
Phe Gly Glu Thr Lys Met Ser Asn Ala Thr Leu Ser Val Tyr Phe Val
35 40 45
Lys Ile Leu Ser Arg Tyr Asp Ile Ala Val Ile Gln Glu Val Arg Asp
50 55 60
Ser His Leu Val Ala Val Gly Lys Leu Leu Asp Glu Leu Asn Arg Asp
65 70 75 80
Lys Pro Asp Thr Tyr Arg Tyr Val Val Ser Glu Pro Leu Gly Arg Lys
85 90 95
Ser Tyr Lys Glu Gln Tyr Leu Phe Val Tyr Arg Pro Asp Gln Val Ser
100 105 110
Ile Leu Asp Ser Tyr Gln Tyr Asp Asp Gly Cys Glu Pro Cys Gly Asn
115 120 125
Asp Thr Phe Ser Arg Glu Pro Ala Ile Val Lys Phe Phe Ser Pro Tyr
130 135 140
Thr Glu Val Gln Glu Phe Ala Ile Val Pro Leu His Ala Ala Pro Thr
145 150 155 160
Glu Ala Val Ser Glu Ile Asp Ala Leu Tyr Asp Val Tyr Leu Asp Val
165 170 175
Trp Gln Lys Trp Gly Leu Glu Asp Ile Met Phe Met Gly Asp Phe Asn
180 185 190
Ala Gly Cys Ser Tyr Val Thr Ser Ser Gln Trp Ser Ser Ile Arg Leu
195 200 205
Arg Thr Ser Pro Ile Phe Gln Trp Leu Ile Pro Asp Ser Ala Asp Thr
210 215 220
Thr Val Thr Ser Thr His Cys Ala Tyr Asp Arg Ile Val Val Ala Gly
225 230 235 240
Ala Leu Leu Gln Ala Ala Val Val Pro Asn Ser Ala Val Pro Phe Asp
245 250 255
Phe Gln Ala Glu Tyr Gly Leu Ser Asn Gln Leu Ala Glu Ala Ile Ser
260 265 270
Asp His Tyr Pro Val Glu Val Thr Leu Arg Lys Ile
275 280
<210> 25
<211> 22
<212> PRT
<213> Mus musculus
<400> 25
Met Arg Tyr Thr Gly Leu Met Gly Thr Leu Leu Thr Leu Val Asn Leu
1 5 10 15
Leu Gln Leu Ala Gly Thr
20
<210> 26
<211> 262
<212> PRT
<213> Mus musculus
<400> 26
Leu Arg Ile Ala Ala Phe Asn Ile Arg Thr Phe Gly Glu Thr Lys Met
1 5 10 15
Ser Asn Ala Thr Leu Ser Val Tyr Phe Val Lys Ile Leu Ser Arg Tyr
20 25 30
Asp Ile Ala Val Ile Gln Glu Val Arg Asp Ser His Leu Val Ala Val
35 40 45
Gly Lys Leu Leu Asp Glu Leu Asn Arg Asp Lys Pro Asp Thr Tyr Arg
50 55 60
Tyr Val Val Ser Glu Pro Leu Gly Arg Lys Ser Tyr Lys Glu Gln Tyr
65 70 75 80
Leu Phe Val Tyr Arg Pro Asp Gln Val Ser Ile Leu Asp Ser Tyr Gln
85 90 95
Tyr Asp Asp Gly Cys Glu Pro Cys Gly Asn Asp Thr Phe Ser Arg Glu
100 105 110
Pro Ala Ile Val Lys Phe Phe Ser Pro Tyr Thr Glu Val Gln Glu Phe
115 120 125
Ala Ile Val Pro Leu His Ala Ala Pro Thr Glu Ala Val Ser Glu Ile
130 135 140
Asp Ala Leu Tyr Asp Val Tyr Leu Asp Val Trp Gln Lys Trp Gly Leu
145 150 155 160
Glu Asp Ile Met Phe Met Gly Asp Phe Asn Ala Gly Cys Ser Tyr Val
165 170 175
Thr Ser Ser Gln Trp Ser Ser Ile Arg Leu Arg Thr Ser Pro Ile Phe
180 185 190
Gln Trp Leu Ile Pro Asp Ser Ala Asp Thr Thr Val Thr Ser Thr His
195 200 205
Cys Ala Tyr Asp Arg Ile Val Val Ala Gly Ala Leu Leu Gln Ala Ala
210 215 220
Val Val Pro Asn Ser Ala Val Pro Phe Asp Phe Gln Ala Glu Tyr Gly
225 230 235 240
Leu Ser Asn Gln Leu Ala Glu Ala Ile Ser Asp His Tyr Pro Val Glu
245 250 255
Val Thr Leu Arg Lys Ile
260
<210> 27
<211> 66
<212> ДНК
<213> Mus musculus
<400> 27
atgcggtaca cagggctaat gggaacactg ctcaccttgg tcaacctgct gcagctggct 60
gggact 66
<210> 28
<211> 789
<212> ДНК
<213> Mus musculus
<400> 28
ctgagaattg cagccttcaa cattcggact tttggggaga ctaagatgtc caatgctacc 60
ctctctgtat actttgtgaa aatcctgagt cgctatgaca tcgctgttat ccaagaggtc 120
agagactccc acctggttgc tgttgggaag ctcctggatg aactcaatcg ggacaaacct 180
gacacctacc gctatgtagt cagtgagccg ctgggccgca aaagctacaa ggaacagtac 240
ctttttgtgt acaggcctga ccaggtgtct attctggaca gctatcaata tgatgatggc 300
tgtgaaccct gtggaaatga caccttcagc agagagccag ccattgttaa gttcttttcc 360
ccatacactg aggtccaaga atttgcgatc gtgcccttgc atgcagcccc aacagaagct 420
gtgagtgaga tcgacgccct ctacgatgtt tacctagatg tctggcaaaa gtggggcctg 480
gaggacatca tgttcatggg agacttcaat gctggctgca gctacgtcac ttcctcccag 540
tggtcctcca ttcgccttcg gacaagcccc atcttccagt ggctgatccc tgacagtgcg 600
gacaccacag tcacatcaac acactgtgct tatgacagga ttgtggttgc tggagctctg 660
ctccaggctg ctgttgttcc caactcggct gttccttttg atttccaagc agaatacgga 720
ctttccaacc agctggctga agccatcagt gaccattacc cagtggaggt gacactcaga 780
aaaatctga 789
<210> 29
<211> 855
<212> ДНК
<213> Mus musculus
<400> 29
atgcggtaca cagggctaat gggaacactg ctcaccttgg tcaacctgct gcagctggct 60
gggactctga gaattgcagc cttcaacatt cggacttttg gggagactaa gatgtccaat 120
gctaccctct ctgtatactt tgtgaaaatc ctgagtcgct atgacatcgc tgttatccaa 180
gaggtcagag actcccacct ggttgctgtt gggaagctcc tggatgaact caatcgggac 240
aaacctgaca cctaccgcta tgtagtcagt gagccgctgg gccgcaaaag ctacaaggaa 300
cagtaccttt ttgtgtacag gcctgaccag gtgtctattc tggacagcta tcaatatgat 360
gatggctgtg aaccctgtgg aaatgacacc ttcagcagag agccagccat tgttaagttc 420
ttttccccat acactgaggt ccaagaattt gcgatcgtgc ccttgcatgc agccccaaca 480
gaagctgtga gtgagatcga cgccctctac gatgtttacc tagatgtctg gcaaaagtgg 540
ggcctggagg acatcatgtt catgggagac ttcaatgctg gctgcagcta cgtcacttcc 600
tcccagtggt cctccattcg ccttcggaca agccccatct tccagtggct gatccctgac 660
agtgcggaca ccacagtcac atcaacacac tgtgcttatg acaggattgt ggttgctgga 720
gctctgctcc aggctgctgt tgttcccaac tcggctgttc cttttgattt ccaagcagaa 780
tacggacttt ccaaccagct ggctgaagcc atcagtgacc attacccagt ggaggtgaca 840
ctcagaaaaa tctga 855
<210> 30
<211> 2212
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 30
aggctcagag gcacacagga gtttctgggc tcaccctgcc cccttccaac ccctcagttc 60
ccatcctcca gcagctgttt gtgtgctgcc tctgaagtcc acactgaaca aacttcagcc 120
tactcatgtc cctaaaatgg gcaaacattg caagcagcaa acagcaaaca cacagccctc 180
cctgcctgct gaccttggag ctggggcaga ggtcagagac ctctctgggc ccatgccacc 240
tccaacatcc actcgacccc ttggaatttc ggtggagagg agcagaggtt gtcctggcgt 300
ggtttaggta gtgtgagagg gatcttgcta ccagtggaac agccactaag gattctgcag 360
tgagagcaga gggccagcta agtggtactc tcccagagac tgtctgactc acgccacccc 420
ctccaccttg gacacaggac gctgtggttt ctgagccagg tacaatgact cctttcggta 480
agtgcagtgg aagctgtaca ctgcccaggc aaagcgtccg ggcagcgtag gcgggcgact 540
cagatcccag ccagtggact tagcccctgt ttgctcctcc gataactggg gtgaccttgg 600
ttaatattca ccagcagcct cccccgttgc ccctctggat ccactgctta aatacggacg 660
aggacagggc cctgtctcct cagcttcagg caccaccact gacctgggac agtgaatgcc 720
gccaccatga ggggcatgaa gctgctgggg gcgctgctgg cactggcggc cctactgcag 780
ggggccgtgt ccctgaagat cgcagccttc aacatcagga catttgggag gaccaagatg 840
tccaatgcca ccctcgtcag ctacattgtg cagatcctga gccgctatga catcgccctg 900
gtccaggagg tcagagacag ccacctgact gccgtgggga agctgctgga caacctcaat 960
caggatgcac cagacaccta tcactacgtg gtcagtgagc cactgggacg gaagagctat 1020
aaggagcgct acctgttcgt gtacaggcct gaccaggtgt ctgcggtgga cagctactac 1080
tacgatgatg gctgcgagcc ctgcgggaac gacaccttca accgagagcc attcattgtc 1140
aggttcttct cccggttcac agaggtcagg gagtttgcca ttgttcccct gcatgcggcc 1200
ccgggggacg cagtagccga gatcgacgct ctctatgacg tctacctgga tgtccaagag 1260
aaatggggct tggaggacgt catgttgatg ggcgacttca atgcgggctg cagctatgtg 1320
agaccctccc agtggtcatc catccgcctg tggacaagcc ccaccttcca gtggctgatc 1380
cccgacagcg ctgacaccac agctacaccc acgcactgtg cctatgacag gatcgtggtt 1440
gcagggatgc tgctccgagg cgccgttgtt cccgactcgg ctcttccctt taacttccag 1500
gctgcctatg gcctgagtga ccaactggcc caagccatca gtgaccacta tccagtggag 1560
gtgatgctga agtgaagtgg cggccgctcg agctagcggc cgctctagaa gataatcaac 1620
ctctggatta caaaatttgt gaaagattga ctggtattct taactatgtt gctcctttta 1680
cgctatgtgg atacgctgct ttaatgcctt tgtatcatgc tattgcttcc cgtatggctt 1740
tcattttctc ctccttgtat aaatcctggt tgctgtctct ttatgaggag ttgtggcccg 1800
ttgtcaggca acgtggcgtg gtgtgcactg tgtttgctga cgcaaccccc actggttggg 1860
gcattgccac cacctgtcag ctcctttccg ggactttcgc tttccccctc cctattgcca 1920
cggcggaact catcgccgcc tgccttgccc gctgctggac aggggctcgg ctgttgggca 1980
ctgacaattc cgtggtgttg tcggggaaat catcgtcctt tccttggctg ctcgcctgtg 2040
ttgccacctg gattctgcgc gggacgtcct tctgctacgt cccttcggcc ctcaatccag 2100
cggaccttcc ttcccgcggc ctgctgccgg ctctgcggcc tcttccgcgt cttcgccttc 2160
gccctcagac gagtcggatc tccctttggg ccgcctcccc gcatcggact ag 2212
<210> 31
<211> 2212
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 31
aggctcagag gcacacagga gtttctgggc tcaccctgcc cccttccaac ccctcagttc 60
ccatcctcca gcagctgttt gtgtgctgcc tctgaagtcc acactgaaca aacttcagcc 120
tactcatgtc cctaaaatgg gcaaacattg caagcagcaa acagcaaaca cacagccctc 180
cctgcctgct gaccttggag ctggggcaga ggtcagagac ctctctgggc ccatgccacc 240
tccaacatcc actcgacccc ttggaatttc ggtggagagg agcagaggtt gtcctggcgt 300
ggtttaggta gtgtgagagg gatcttgcta ccagtggaac agccactaag gattctgcag 360
tgagagcaga gggccagcta agtggtactc tcccagagac tgtctgactc acgccacccc 420
ctccaccttg gacacaggac gctgtggttt ctgagccagg tacaatgact cctttcggta 480
agtgcagtgg aagctgtaca ctgcccaggc aaagcgtccg ggcagcgtag gcgggcgact 540
cagatcccag ccagtggact tagcccctgt ttgctcctcc gataactggg gtgaccttgg 600
ttaatattca ccagcagcct cccccgttgc ccctctggat ccactgctta aatacggacg 660
aggacagggc cctgtctcct cagcttcagg caccaccact gacctgggac agtgaatgcc 720
gccaccatga ggggcatgaa gctgctgggg gcgctgctgg cactggcggc cctactgcag 780
ggggccgtgt ccctgaagat cgcagccttc aacatccaga catttgggga gaccaagatg 840
tccaatgcca ccctcgtcag ctacattgtg cagatcctga gccgctatga catcgccctg 900
gtccaggagg tcagagacag ccacctgact gccgtgggga agctgctgga caacctcaat 960
caggatgcac cagacaccta tcactacgtg gtcagtgagc cactgggacg gaacagctat 1020
aaggagcgct acctgttcgt gtacaggcct gaccaggtgt ctgcggtgga cagctactac 1080
tacgatgatg gctgcgagcc ctgcgggaac gacaccttca accgagagcc agccattgtc 1140
aggttcttct cccggttcac agaggtcagg gagtttgcca ttgttcccct gcatgcggcc 1200
ccgggggacg cagtagccga gatcgacgct ctctatgacg tctacctgga tgtccaagag 1260
aaatggggct tggaggacgt catgttgatg ggcgacttca atgcgggctg cagctatgtg 1320
agaccctccc agtggtcatc catccgcctg tggacaagcc ccaccttcca gtggctgatc 1380
cccgacagcg ctgacaccac agctacaccc acgcactgtg cctatgacag gatcgtggtt 1440
gcagggatgc tgctccgagg cgccgttgtt cccgactcgg ctcttccctt taacttccag 1500
gctgcctatg gcctgagtga ccaactggcc caagccatca gtgaccacta tccagtggag 1560
gtgatgctga agtgaagtgg cggccgctcg agctagcggc cgctctagaa gataatcaac 1620
ctctggatta caaaatttgt gaaagattga ctggtattct taactatgtt gctcctttta 1680
cgctatgtgg atacgctgct ttaatgcctt tgtatcatgc tattgcttcc cgtatggctt 1740
tcattttctc ctccttgtat aaatcctggt tgctgtctct ttatgaggag ttgtggcccg 1800
ttgtcaggca acgtggcgtg gtgtgcactg tgtttgctga cgcaaccccc actggttggg 1860
gcattgccac cacctgtcag ctcctttccg ggactttcgc tttccccctc cctattgcca 1920
cggcggaact catcgccgcc tgccttgccc gctgctggac aggggctcgg ctgttgggca 1980
ctgacaattc cgtggtgttg tcggggaaat catcgtcctt tccttggctg ctcgcctgtg 2040
ttgccacctg gattctgcgc gggacgtcct tctgctacgt cccttcggcc ctcaatccag 2100
cggaccttcc ttcccgcggc ctgctgccgg ctctgcggcc tcttccgcgt cttcgccttc 2160
gccctcagac gagtcggatc tccctttggg ccgcctcccc gcatcggact ag 2212
<210> 32
<211> 849
<212> ДНК
<213> Homo sapiens
<400> 32
atgaggggca tgaagctgct gggggcgctg ctggcactgg cggccctact gcagggggcc 60
gtgtccctga agatcgcagc cttcaacatc cagacatttg gggagaccaa gatgtccaat 120
gccaccctcg tcagctacat tgtgcagatc ctgagccgct atgacatcgc cctggtccag 180
gaggtcagag acagccacct gactgccgtg gggaagctgc tggacaacct caatcaggat 240
gcaccagaca cctatcacta cgtggtcagt gagccactgg gacggaacag ctataaggag 300
cgctacctgt tcgtgtacag gcctgaccag gtgtctgcgg tggacagcta ctactacgat 360
gatggctgcg agccctgcgg gaacgacacc ttcaaccgag agccagccat tgtcaggttc 420
ttctcccggt tcacagaggt cagggagttt gccattgttc ccctgcatgc ggccccgggg 480
gacgcagtag ccgagatcga cgctctctat gacgtctacc tggatgtcca agagaaatgg 540
ggcttggagg acgtcatgtt gatgggcgac ttcaatgcgg gctgcagcta tgtgagaccc 600
tcccagtggt catccatccg cctgtggaca agccccacct tccagtggct gatccccgac 660
agcgctgaca ccacagctac acccacgcac tgtgcctatg acaggatcgt ggttgcaggg 720
atgctgctcc gaggcgccgt tgttcccgac tcggctcttc cctttaactt ccaggctgcc 780
tatggcctga gtgaccaact ggcccaagcc atcagtgacc actatccagt ggaggtgatg 840
ctgaagtga 849
<210> 33
<211> 9
<212> ДНК
<213> Homo sapiens
<400> 33
gccgccacc 9
<210> 34
<211> 736
<212> PRT
<213> Искусственная последовательность
<220>
<223> Anc80L65 VP1 капсидный белок
<400> 34
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Gln Ser Gly Gly Ser Thr Asn Asp Asn Thr
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Lys Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Thr Asn Asp Gly Thr Thr Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Ser Gly Thr Ala Gly Asn Arg Thr Leu Gln Phe Ser
450 455 460
Gln Ala Gly Pro Ser Ser Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Lys Thr Thr Asn Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Gly Ala Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asp Ser Leu Val Asn Pro Gly Pro Ala Met Ala Thr His Lys
515 520 525
Asp Asp Glu Asp Lys Phe Phe Pro Met Ser Gly Val Leu Ile Phe Gly
530 535 540
Lys Gln Gly Ala Gly Asn Ser Asn Val Asp Leu Asp Asn Val Met Ile
545 550 555 560
Thr Asn Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Thr Val Ala Thr Asn Leu Gln Ser Ala Asn Thr Ala Pro Ala
580 585 590
Thr Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asn Pro Pro Thr Thr Phe Ser Pro Ala Lys Phe Ala Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Asn Lys Ser Thr Asn Val Asp Phe Ala Val Asp Thr Asn Gly Val
705 710 715 720
Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 35
<211> 730
<212> PRT
<213> Искусственная последовательность
<220>
<223> Anc80L65 VP1 капсидный белок вариант
<400> 35
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro Val
50 55 60
Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp Gln
65 70 75 80
Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala Asp
85 90 95
Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly Asn
100 105 110
Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Leu
115 120 125
Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg Pro
130 135 140
Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly Lys
145 150 155 160
Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln Thr Gly
165 170 175
Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro Ala
180 185 190
Ala Pro Ser Gly Val Gly Ser Asn Thr Met Ala Ala Gly Gly Gly Ala
195 200 205
Pro Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala Ser Gly
210 215 220
Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile Thr Thr
225 230 235 240
Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu Tyr Lys
245 250 255
Gln Ile Ser Ser Gln Ser Gly Gly Ser Thr Asn Asp Asn Thr Tyr Phe
260 265 270
Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His Cys
275 280 285
His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp Gly
290 295 300
Phe Arg Pro Lys Lys Leu Asn Phe Lys Leu Phe Asn Ile Gln Val Lys
305 310 315 320
Glu Val Thr Thr Asn Asp Gly Thr Thr Thr Ile Ala Asn Asn Leu Thr
325 330 335
Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro Tyr Val
340 345 350
Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala Asp Val
355 360 365
Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly Ser Gln
370 375 380
Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro Ser Gln
385 390 395 400
Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Thr Phe Glu Asp
405 410 415
Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp Arg Leu
420 425 430
Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg Thr Gln
435 440 445
Thr Thr Ser Gly Thr Ala Gly Asn Arg Thr Leu Gln Phe Ser Gln Ala
450 455 460
Gly Pro Ser Ser Ala Asn Gln Ala Lys Asn Trp Leu Pro Gly Pro Cys
465 470 475 480
Tyr Arg Gln Gln Arg Val Ser Lys Thr Thr Asn Gln Asn Asn Asn Ser
485 490 495
Asn Phe Ala Trp Thr Gly Ala Thr Lys Tyr His Leu Asn Gly Arg Asp
500 505 510
Ser Leu Val Asn Pro Gly Pro Ala Met Ala Thr His Lys Asp Asp Glu
515 520 525
Asp Lys Phe Phe Pro Met Ser Gly Val Leu Ile Phe Gly Lys Gln Gly
530 535 540
Ala Gly Asn Ser Asn Val Asp Leu Asp Asn Val Ile Thr Asn Glu Glu
545 550 555 560
Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu Tyr Gly Thr Val
565 570 575
Ala Thr Asn Leu Gln Ser Ala Asn Thr Ala Pro Ala Thr Gly Thr Val
580 585 590
Asn Ser Gln Gly Ala Leu Pro Gly Val Trp Gln Asp Arg Asp Val Tyr
595 600 605
Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His Thr Asp Gly His Phe
610 615 620
His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro
625 630 635 640
Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala Asn Pro Pro Thr Thr
645 650 655
Phe Ser Pro Ala Lys Phe Ala Ser Phe Ile Thr Gln Tyr Ser Thr Gly
660 665 670
Gln Val Ser Val Glu Ile Glu Glu Leu Gln Lys Glu Asn Ser Lys Arg
675 680 685
Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn Tyr Asn Lys Ser Thr Asn
690 695 700
Val Asp Phe Ala Val Asp Thr Asn Gly Val Tyr Ser Glu Pro Arg Pro
705 710 715 720
Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕННАЯ ТЕРАПИЯ ГИПОФОСФАТЕМИЧЕСКИХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 23 | 2020 |
|
RU2815545C2 |
| ВАРИАНТЫ КИСЛОЙ АЛЬФА-ГЛЮКОЗИДАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2780410C2 |
| ГЕННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОФИЛИИ A | 2017 |
|
RU2762257C2 |
| ВАРИАНТЫ КИСЛОЙ АЛЬФА-ГЛЮКОЗИДАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2780329C2 |
| ГЕНОТЕРАПЕВТИЧЕСКИЕ КОНСТРУКЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА | 2020 |
|
RU2807158C2 |
| НОВЫЕ НАЦЕЛИВАЮЩИЕ НА ПЕЧЕНЬ АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ | 2019 |
|
RU2793735C2 |
| Выделенная нуклеиновая кислота, которая кодирует слитый белок на основе FVIII-BDD и гетерологичного сигнального пептида, и ее применение | 2022 |
|
RU2818229C2 |
| ВАКЦИНА ПРОТИВ АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ | 2020 |
|
RU2819672C2 |
| ВАРИАНТЫ, НА ОСНОВЕ АДЕНОАССОЦИИРОВАННОГО ВИРУСА, СОСТАВЫ И СПОСОБЫ ДЛЯ ПУЛЬМОНАЛЬНОЙ ДОСТАВКИ | 2021 |
|
RU2829874C1 |
| СНИЖЕНИЕ ПРЕВРАЩЕНИЯ НИКОТИНА В НОРНИКОТИН В РАСТЕНИЯХ | 2015 |
|
RU2733837C2 |
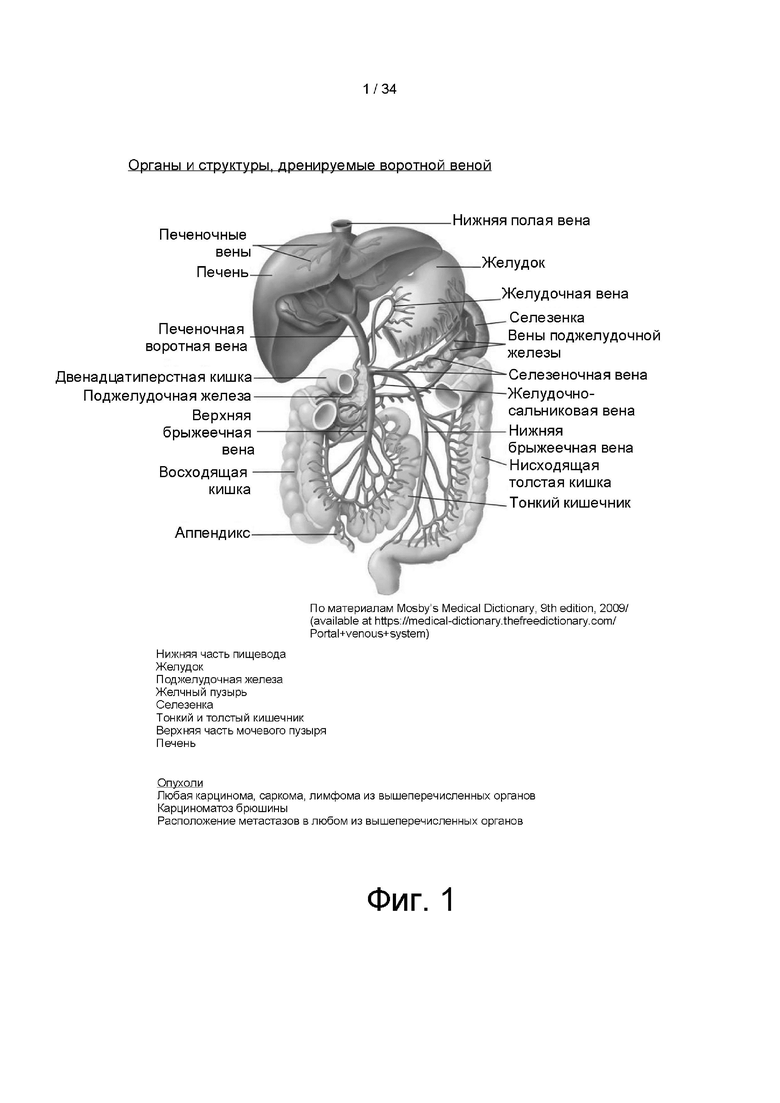
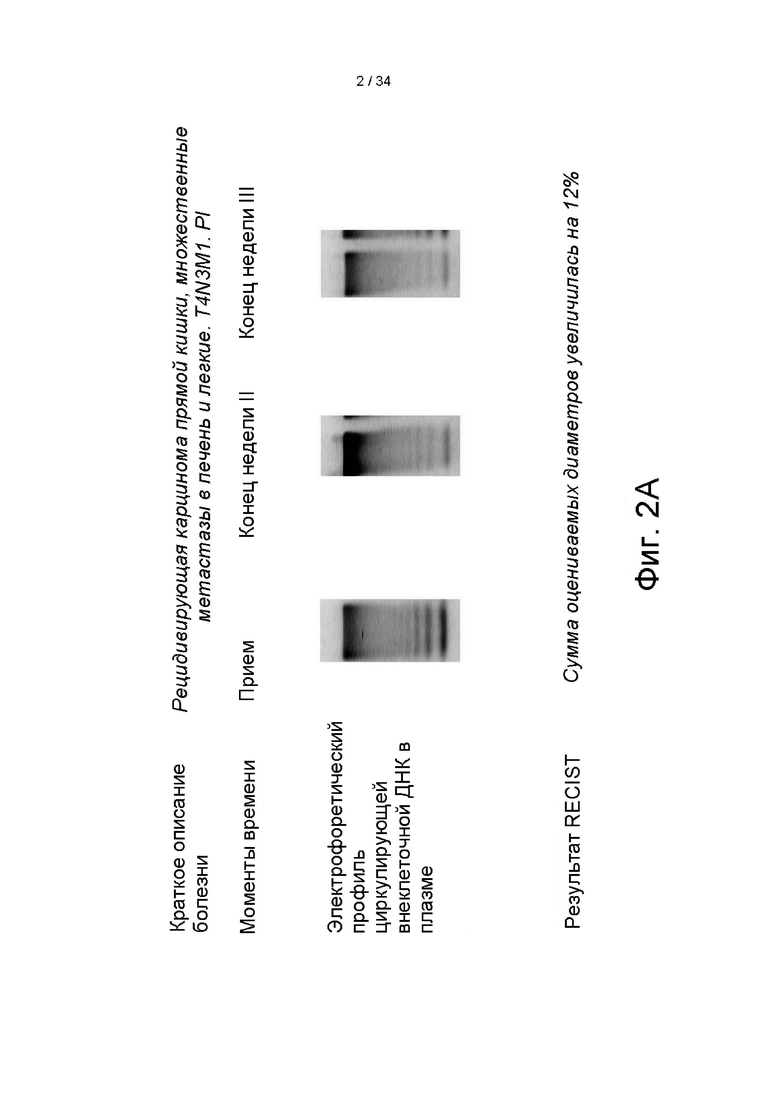








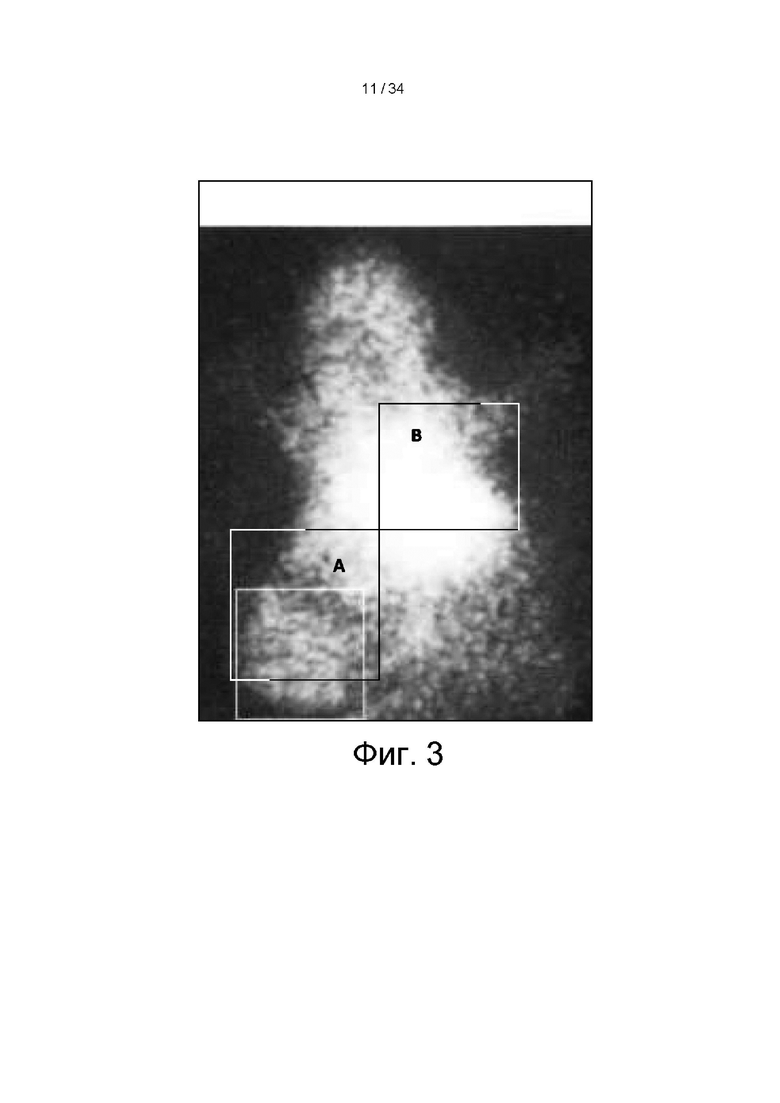
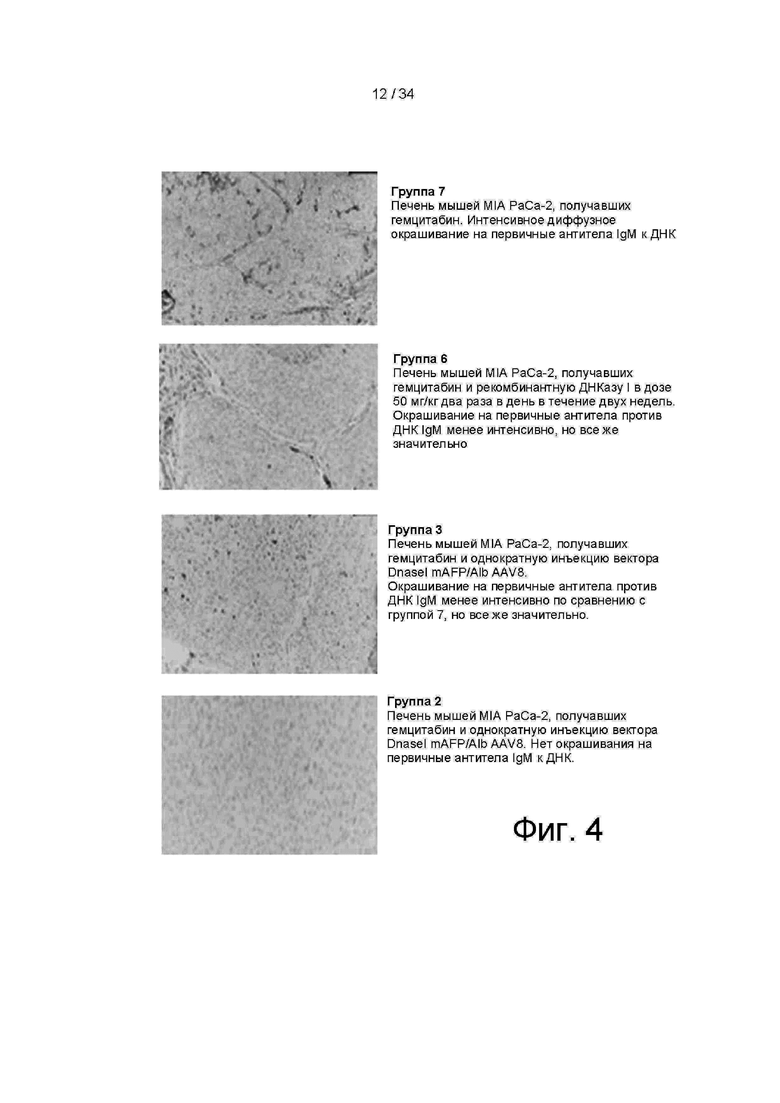
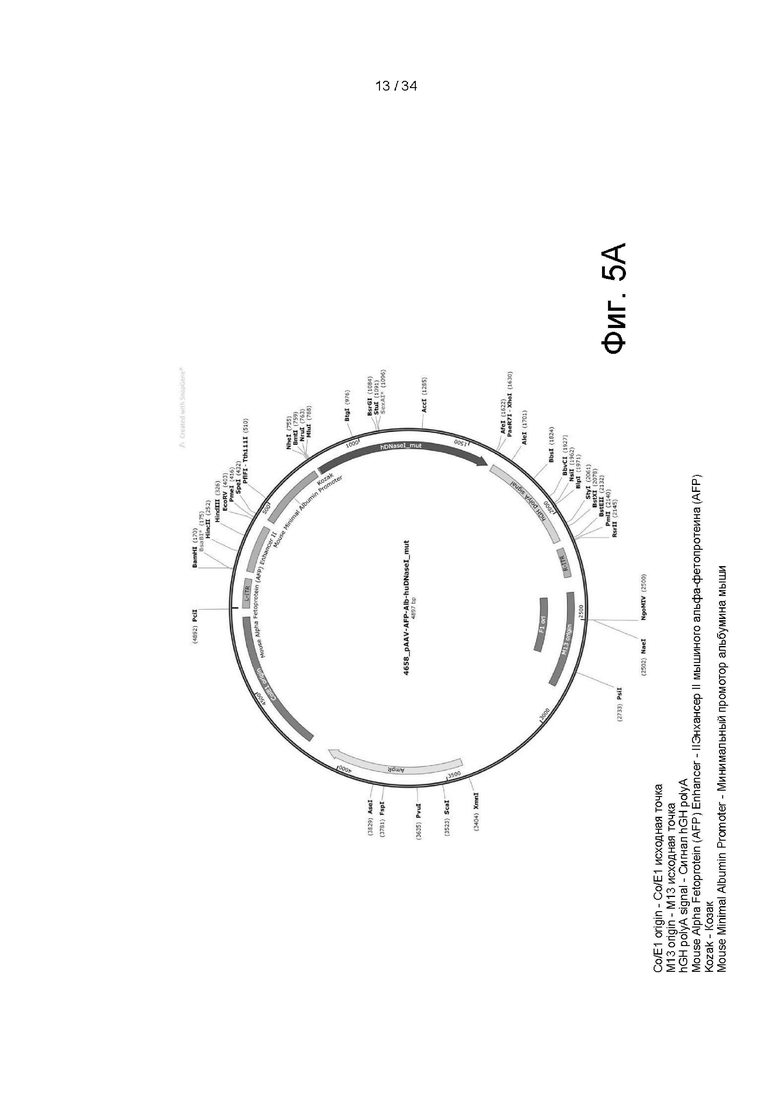

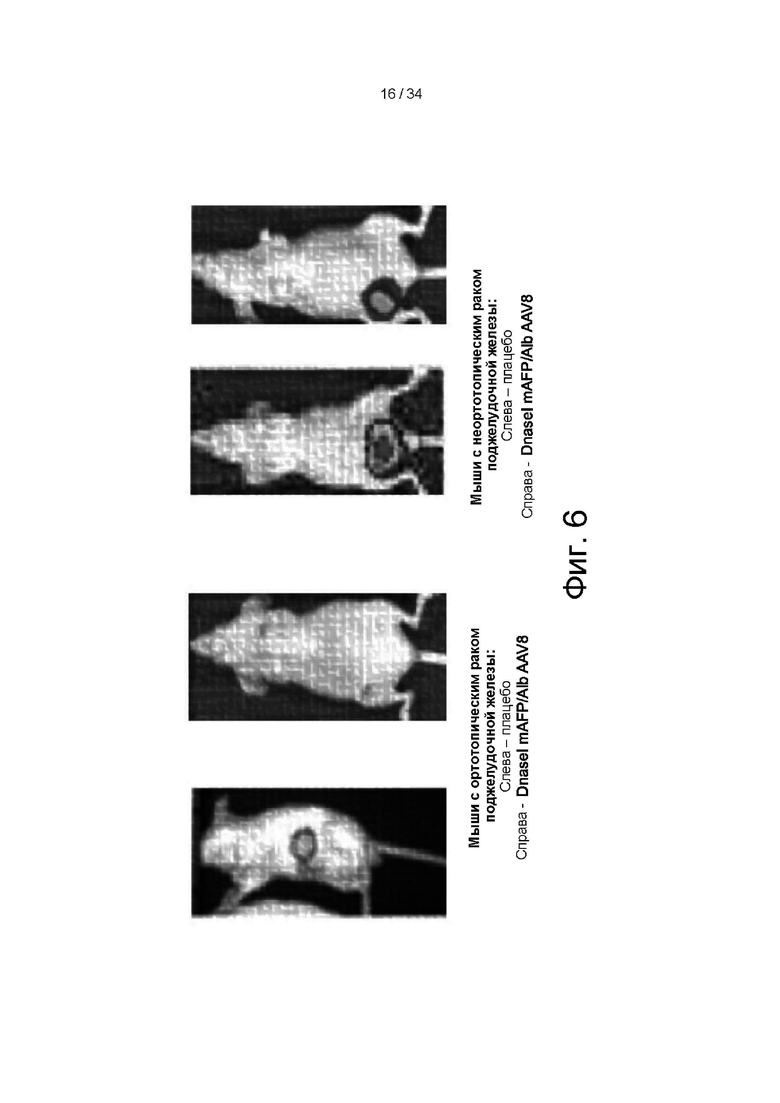
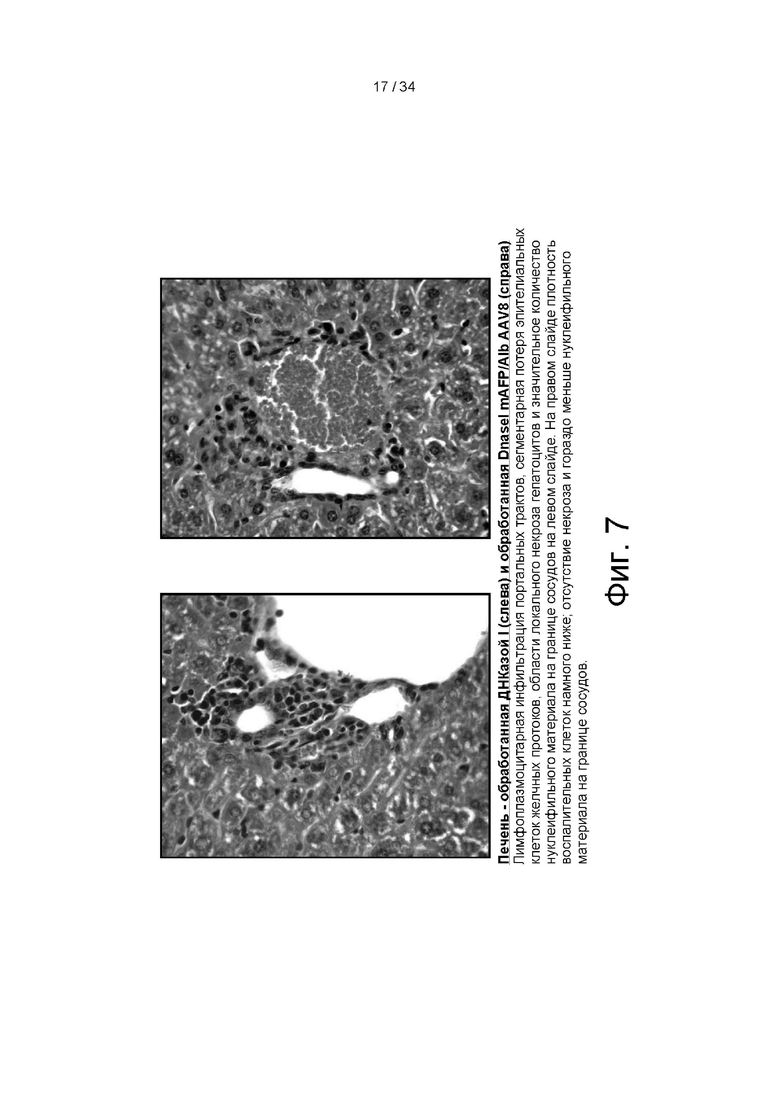
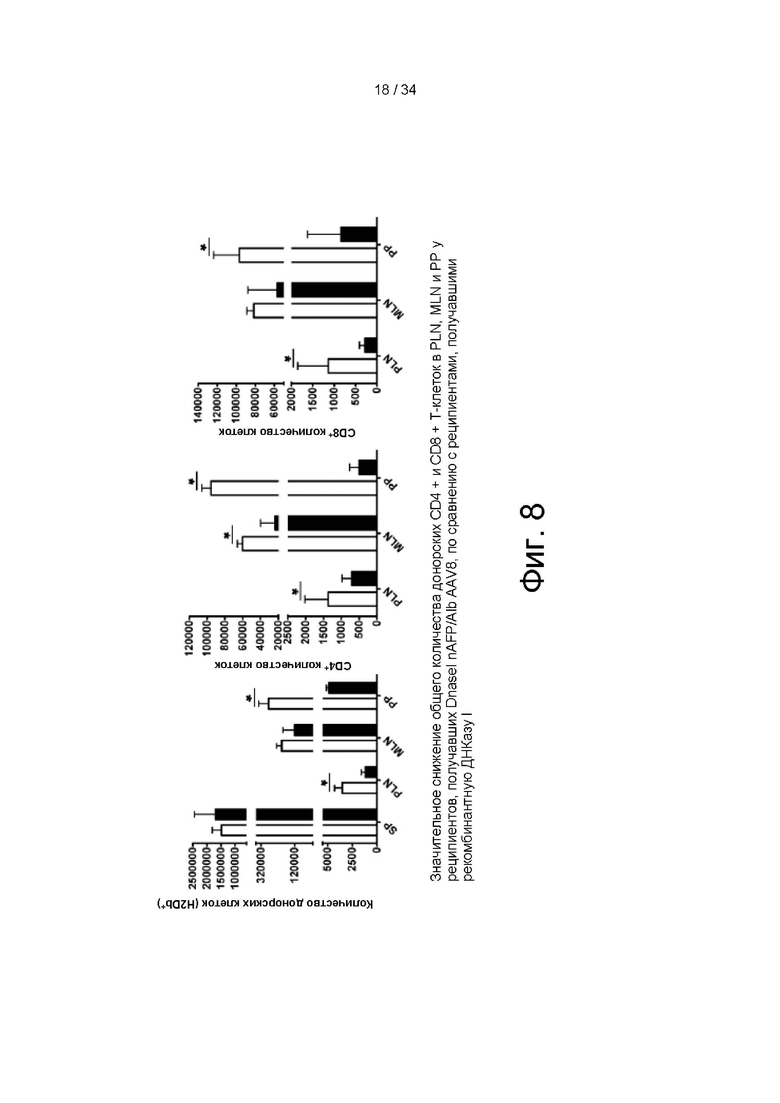
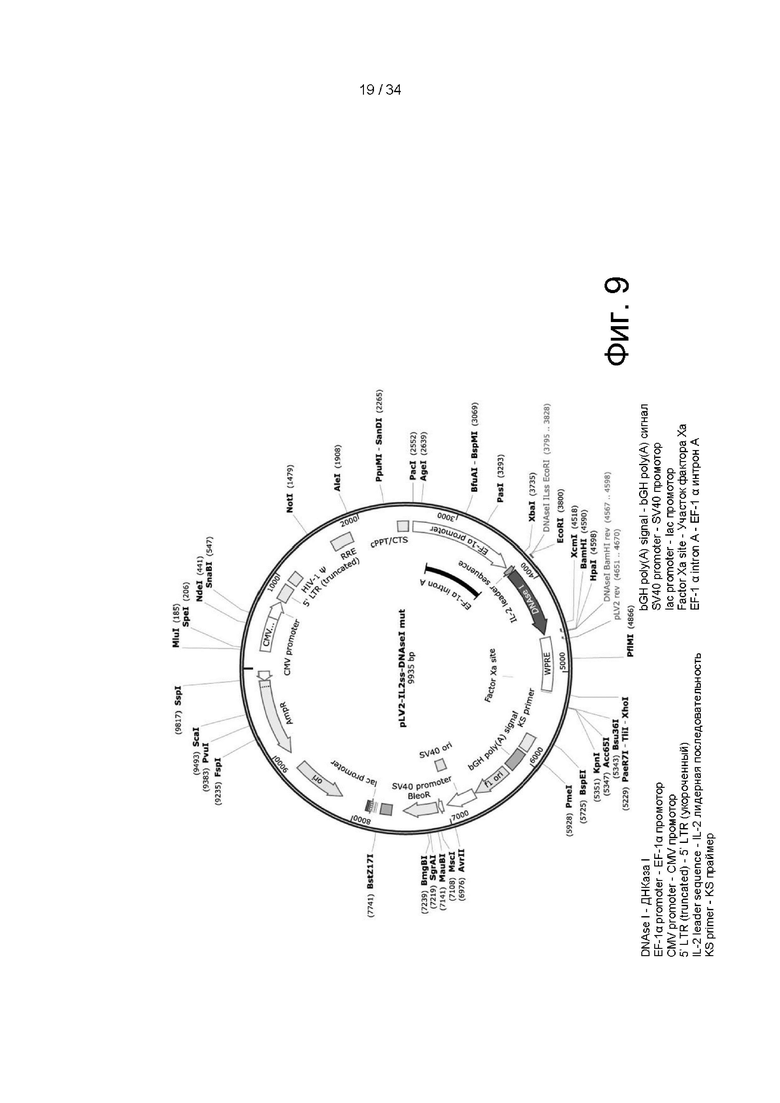

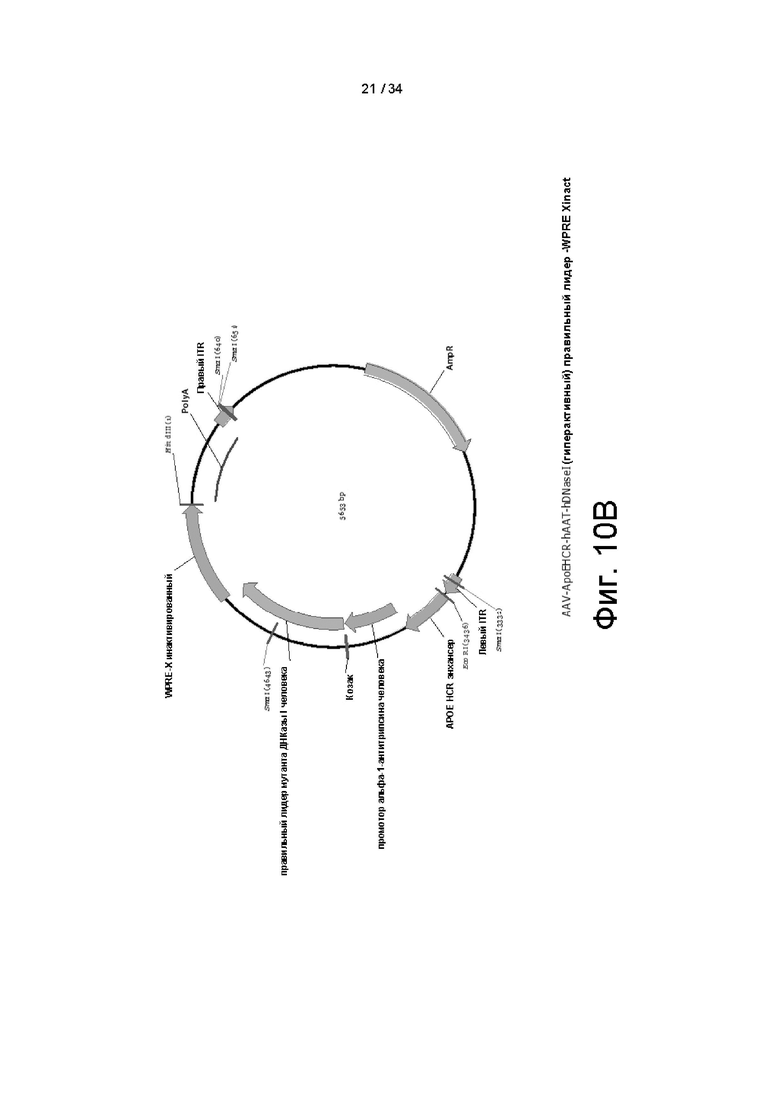
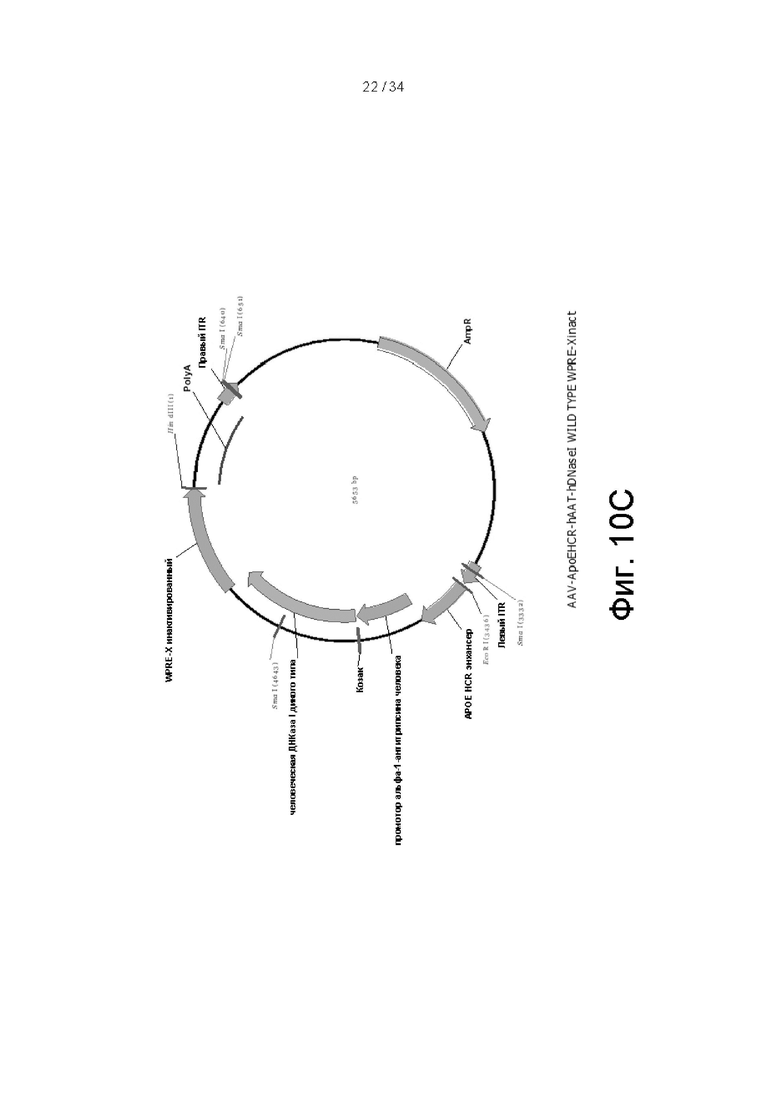
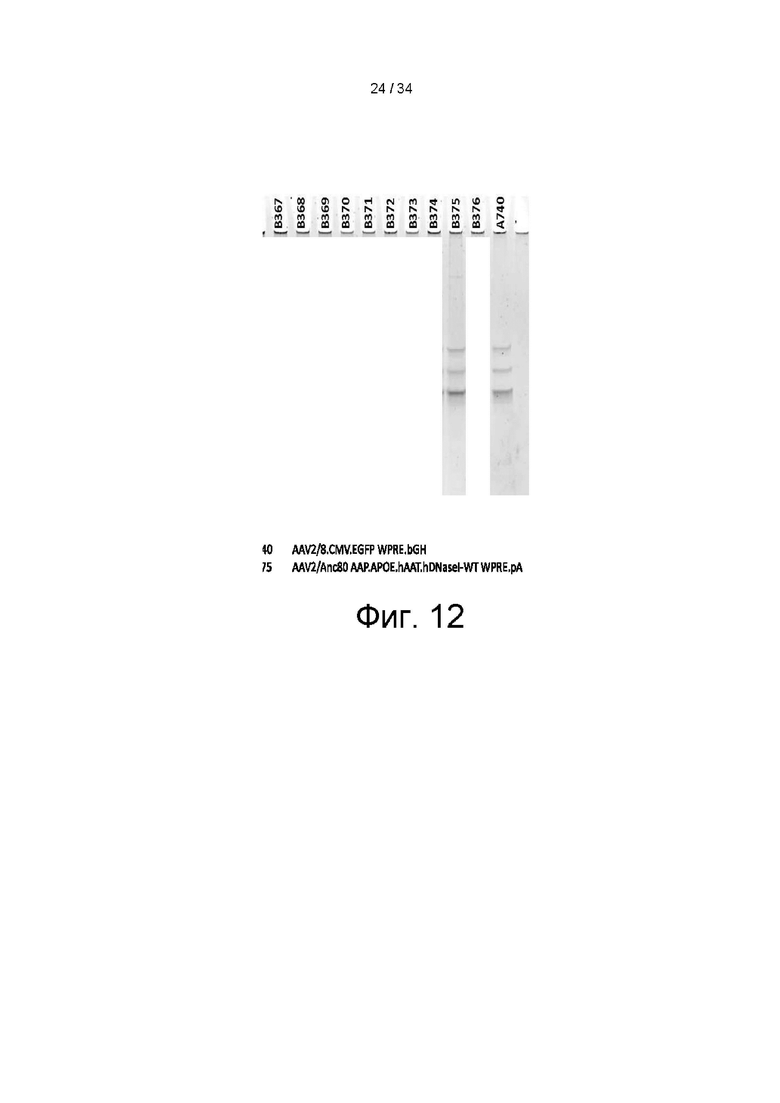
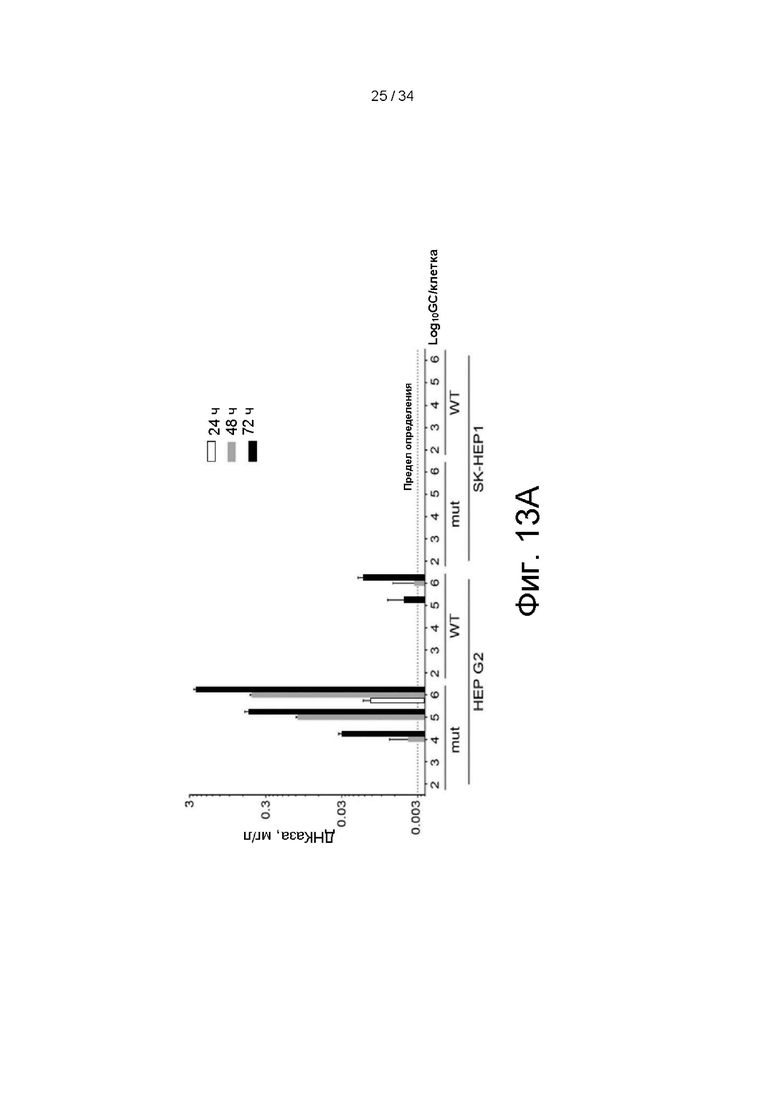

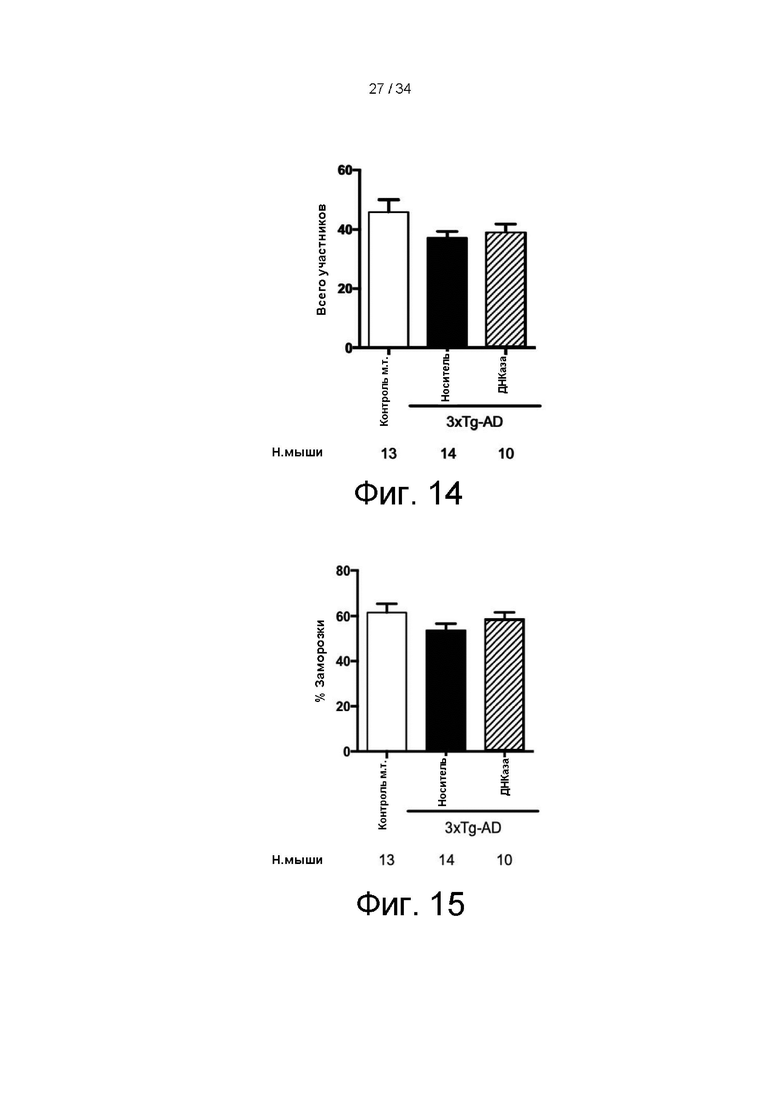
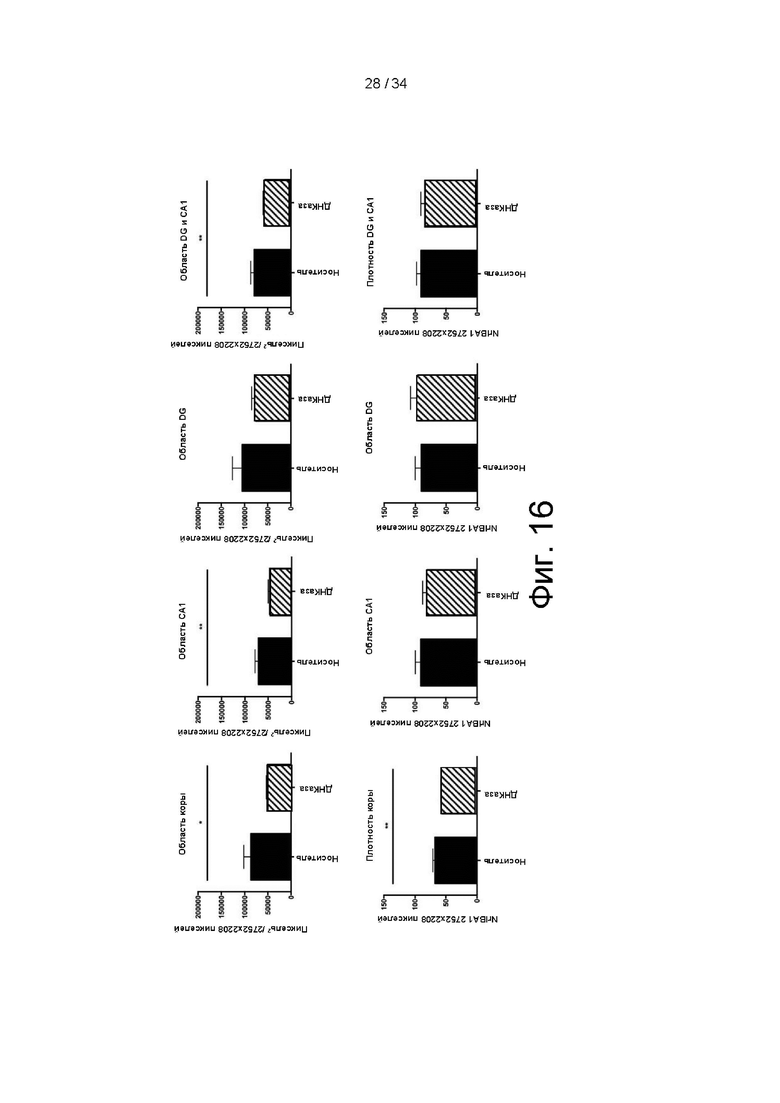

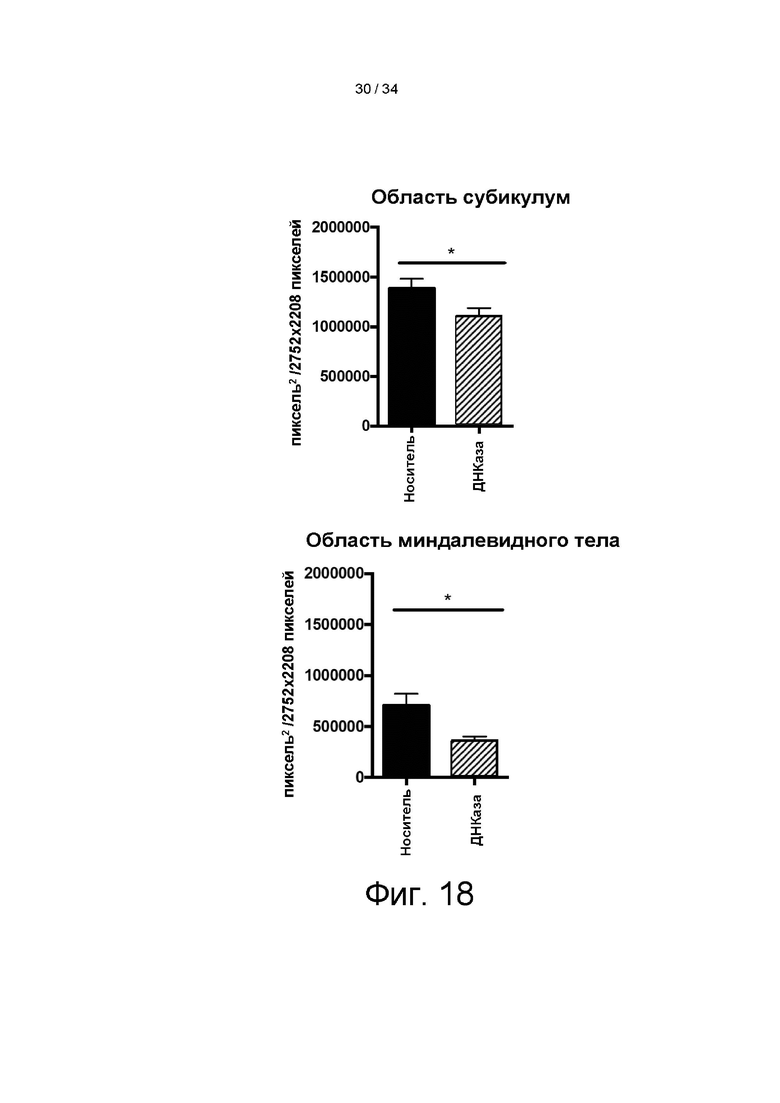
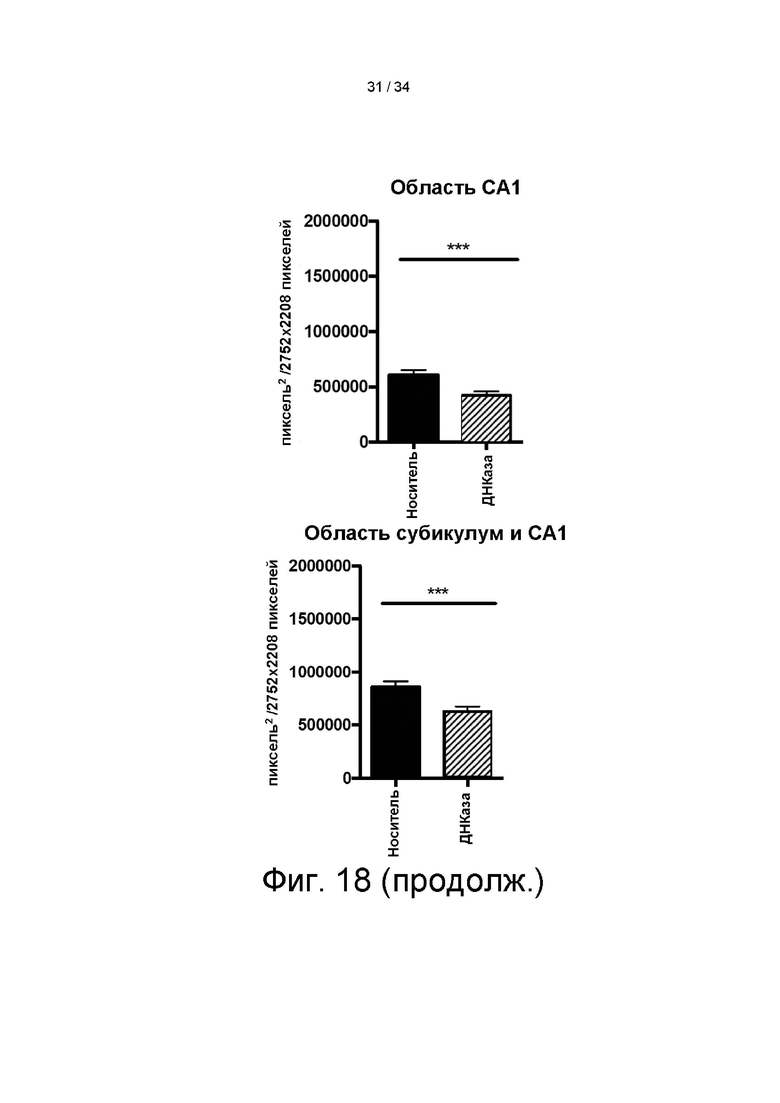
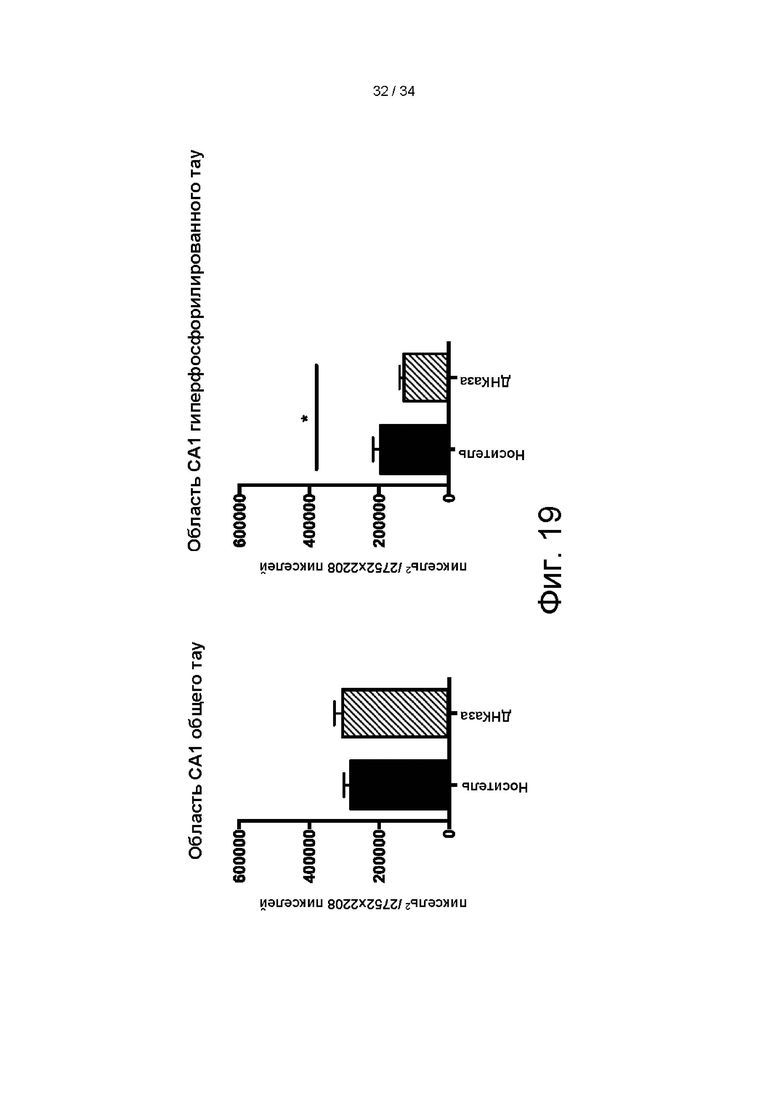
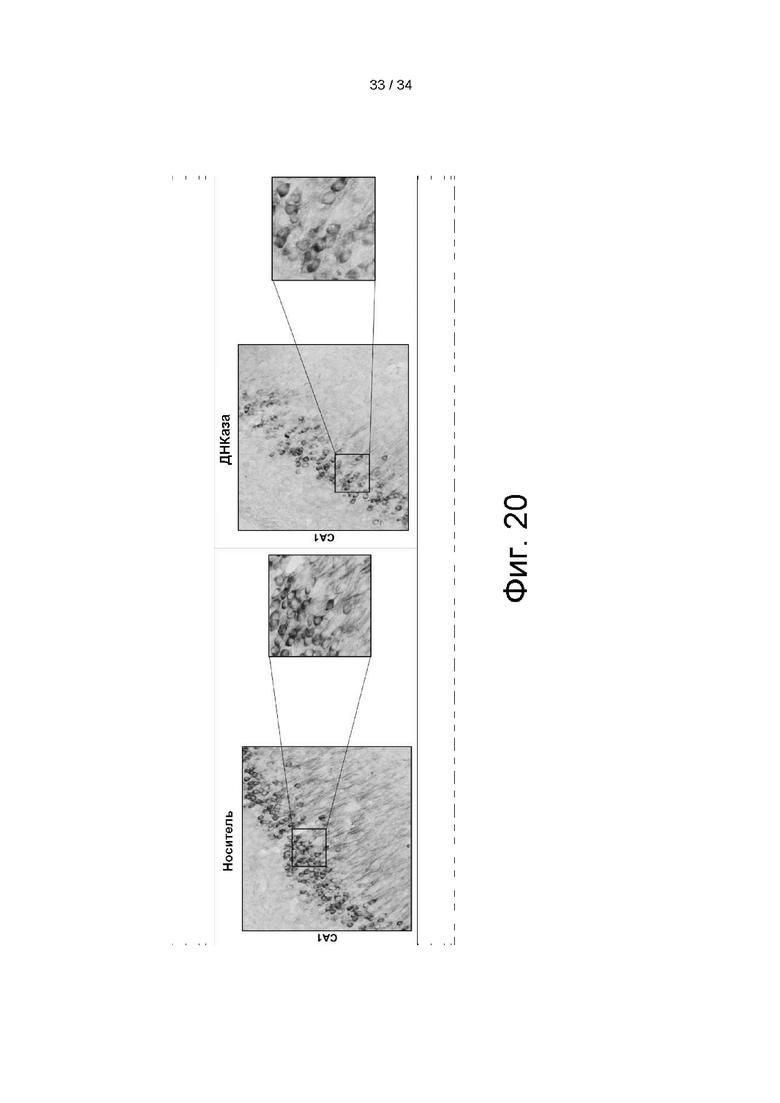
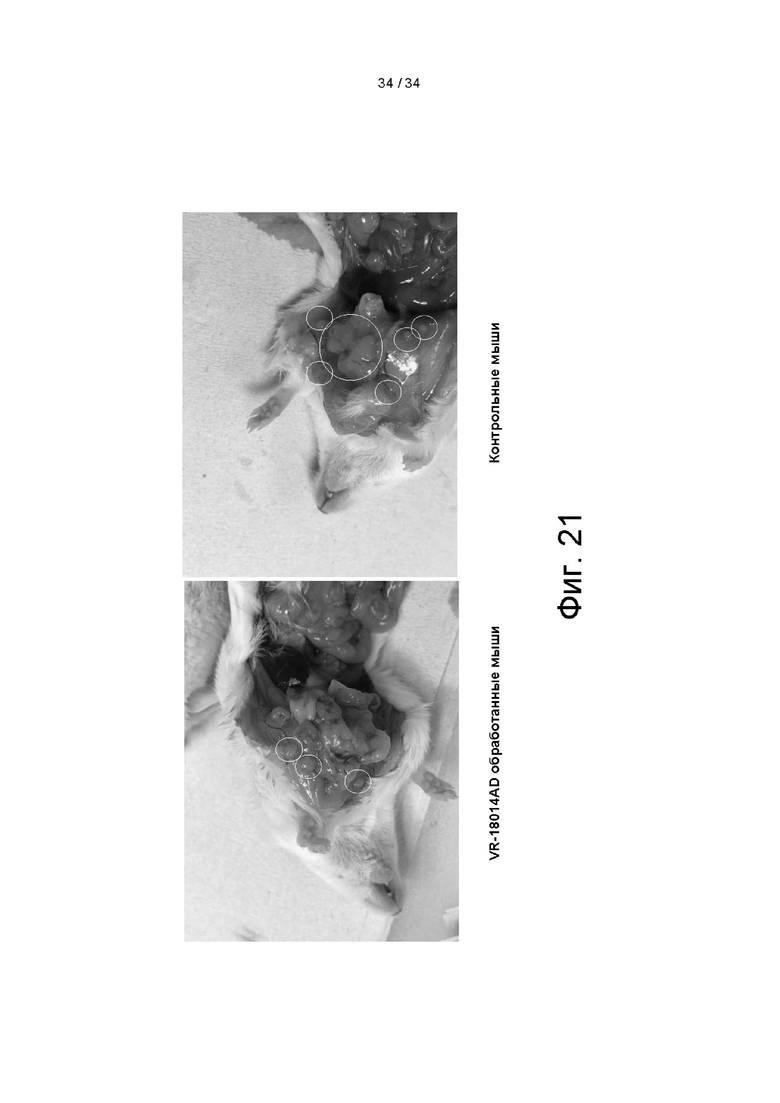
Изобретение относится к лечению заболевания или состояния у субъекта, сопровождающегося накоплением внеклеточной ДНК (вкДНК) в порто-синусоидальном кровотоке печени. Предложен способ лечения вышеуказанного заболевания или состояния у субъекта, включающий введение субъекту терапевтически эффективного количества рекомбинантного вектора экспрессии аденоассоциированного вируса (rAAV), содержащего (i) белок капсида и (ii) нуклеиновую кислоту, содержащую печень-специфичный промотор, функционально связанный с нуклеотидной последовательностью, кодирующей фермент, имеющий дезоксирибонуклеазную (ДНКазную) активность. Также предложен способ лечения вышеуказанного заболевания или состояния у субъекта, включающий введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, имеющий ДНКазную активность, где промотор является печень-специфичным промотором и/или где вектор включает одну или более молекул, нацеливающих нуклеиновую кислоту в клетки печени. Изобретение обеспечивает повышение клиренса вкДНК, накопленной в порто-синусоидальном кровотоке печени. 2 н. и 22 з.п. ф-лы, 21 ил., 13 табл., 15 пр. 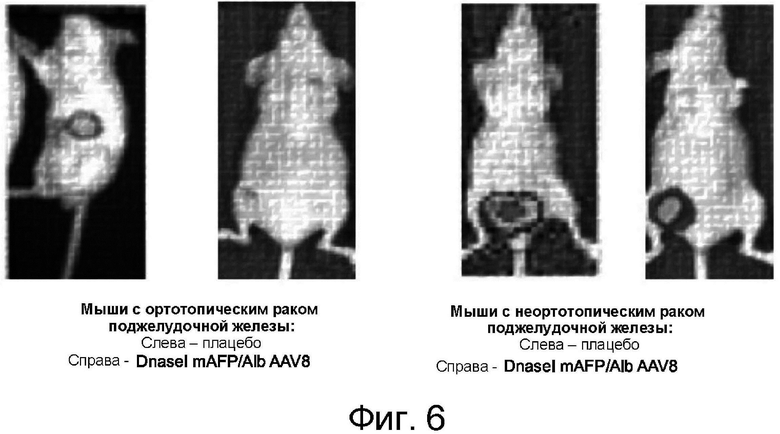
1. Способ лечения заболевания или состояния у субъекта, нуждающегося в этом, отличающийся тем, что заболевание или состояние сопровождается накоплением внеклеточной ДНК (вкДНК) в порто-синусоидальном кровотоке печени субъекта, при этом указанный способ включает введение субъекту терапевтически эффективного количества рекомбинантного вектора экспрессии аденоассоциированного вируса (rAAV), содержащего (i) белок капсида и (ii) нуклеиновую кислоту, содержащую промотор, функционально связанный с нуклеотидной последовательностью, кодирующей фермент, который имеет дезоксирибонуклеазную (ДНКазную) активность, где промотор представляет собой печень-специфичный промотор.
2. Способ по п. 1, отличающийся тем, что печень-специфичный промотор опосредует в значительной степени повышенную экспрессию фермента в печени по сравнению с другими тканями и органами.
3. Способ по п. 1, отличающийся тем, что белок капсида включает одну или более мутаций, которые улучшают эффективность и/или специфичность доставки вектора в печень по сравнению с соответствующим белком капсида дикого типа.
4. Способ по п. 1, отличающийся тем, что фермент, который обладает ДНКазной активностью, представляет собой ДНКазу I или ее мутант, причем указанный мутант ДНКазы I содержит одну или более мутаций, увеличивающих ДНКазную активность.
5. Способ по п. 1, отличающийся тем, что нуклеиновая кислота содержит последовательность SEQ ID NO: 30 или SEQ ID NO: 31.
6. Способ по п. 5, отличающийся тем, что мутант ДНКазы I содержит мутации Q9R, E13R, N74K и A114F.
7. Способ по п. 1, отличающийся тем, что последовательность, кодирующая фермент, обладающий ДНКазной активностью, содержит последовательность, кодирующую секреторную сигнальную последовательность, причем указанная секреторная сигнальная последовательность опосредует эффективную секрецию фермента в синусоидальную систему при экспрессии вектора в печени.
8. Способ по п. 7, отличающийся тем, что секреторная сигнальная последовательность содержит последовательность MRGMKLLGALLALAALLQGAVS (SEQ ID NO: 6), или MYRMQLLSCIALSLALVTNS (SEQ ID NO: 7), или MRYTGLMGTLLTLVNLLQLAGT (SEQ ID NO: 25).
9. Способ по п. 1, отличающийся тем, что промотор представляет собой промотор α1-антитрипсина (AAT) или промотор альбумина.
10. Способ по п. 1, отличающийся тем, что капсидный белок содержит последовательность SEQ ID NO: 34.
11. Способ по п. 1, отличающийся тем, что AAV принадлежит серотипу 8 или Anc 80.
12. Способ по п. 1, отличающийся тем, что нуклеиновая кислота дополнительно содержит один или более энхансеров, расположенных выше или ниже промотора.
13. Способ по п. 12, отличающийся тем, что энхансер представляет собой энхансер аполипопротеина E (ApoE).
14. Способ по п. 12, отличающийся тем, что энхансер содержит последовательность SEQ ID NO: 17.
15. Способ по п. 1, содержащий (i) капсидный белок, содержащий последовательность SEQ ID NO: 34, и (ii) нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 30.
16. Способ по п. 1, отличающийся тем, что заболевание выбрано из группы, состоящей из рака, нейродегенеративного заболевания, атеросклероза и реакции гиперчувствительности замедленного типа.
17. Способ по п. 16, отличающийся тем, что заболевание представляет собой рак, который возникает и/или метастазирует в органах, тканях и/или структурах, из которых отток происходит в воротную вену.
18. Способ по п. 16, отличающийся тем, что рак выбран из группы, состоящей из перитонеального карциноматоза, лимфомы, рака желудка, рака толстой кишки, рака кишечника, колоректального рака, рака поджелудочной железы, рака печени, рака желчного протока, рака желчного пузыря, саркомы и метастатического заболевания печени любого происхождения.
19. Способ по п. 16, отличающийся тем, что реакция гиперчувствительности замедленного типа представляет собой болезнь «трансплантат против хозяина» (GVHD).
20. Способ по п. 1, отличающийся тем, что вектор rAAV или векторную композицию вводят в дозе и режиме, которые достаточны для снижения уровня внеклеточной ДНК (вкДНК) в портосинусоидальном кровотоке указанного субъекта.
21. Способ лечения заболевания или состояния у субъекта, нуждающегося в этом, где заболевание или состояние сопровождается накоплением внеклеточной ДНК (вкДНК) в портосинусоидальном кровотоке печени субъекта, при этом указанный способ включает введение субъекту вектора экспрессии, содержащего нуклеиновую кислоту, содержащую промотор, функционально связанный с последовательностью, кодирующей фермент, обладающий дезоксирибонуклеазной (ДНКазной) активностью, при этом промотор представляет собой печень-специфичный промотор и/или при этом вектор включает одну или более молекул, способных нацеливать нуклеиновую кислоту в клетки печени.
22. Способ по п. 21, отличающийся тем, что заболевание выбрано из группы, состоящей из рака, нейродегенеративного заболевания, атеросклероза и реакции гиперчувствительности замедленного типа.
23. Способ по п. 21, отличающийся тем, что субъектом является человек.
24. Способ по п. 21, отличающийся тем, что указанный способ дополнительно включает выбор субъекта с повышенным уровнем внеклеточной ДНК (вкДНК) в кровотоке по сравнению с уровнем вкДНК в кровотоке нормального здорового субъекта.
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| US 7297526 B2, 20.11.2007 | |||
| WO 2017074211 A1, 04.05.2017 | |||
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА, СОПРОВОЖДАЮЩИХСЯ ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ДЕЗОКСИРИБОНУКЛЕИНОВОЙ КИСЛОТЫ ВО ВНЕКЛЕТОЧНЫХ ПРОСТРАНСТВАХ ТКАНЕЙ, И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2005 |
|
RU2308968C2 |
Авторы
Даты
2022-06-07—Публикация
2019-01-15—Подача