Настоящее изобретение относится к способу получения замещенных пиразолов и их применению в качестве пестицидов.
Такие пиразолы, как 5-амино-1-арил-3-цианопиразол и его производные, например фипронил (Fipronil), образуют важный класс инсектицидов. Как указано в WO 00/35884 и Патенте США №5556873, некоторые замещенные 5-N-алкил-N-алкоксиацетиламино-1-арил-3-цианопиразолы обладают ценными пестицидными свойствами.
В Патенте США №4931461 раскрываются замещенные 5-метиламино-1-арилпиразолы и их применение в качестве средств для борьбы с вредителями. Рассматриваемые замещенные соединения могут быть получены различными методами, но, как было обнаружено, основным способом их получения является реакция пиразола с алкилирующим агентом. Такой способ получения, будучи достаточно эффективным, приводит к образованию побочных продуктов, которые следует отделять от желаемого пестицидного соединения.
Авторы настоящего изобретения обнаружили альтернативный способ получения указанных выше соединений, который обеспечивает уменьшенное образование побочных продуктов или совсем устраняет их присутствие, вследствие чего отпадает необходимость очистки конечного продукта.
Соответственно, настоящее изобретение обеспечивает способ
(А) получения соединения формулы (I)
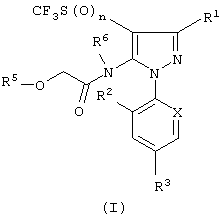
в которой
R1 представляет CN или CSNH2;
X представляет N или CR4;
каждый из радикалов R2 и R4, независимо, представляет водород или хлор;
R3 представляет галоген, галогеналкил, галогеналкокси или -SF5;
каждый из радикалов R5 и R6, независимо, представляет алкильную группу; а
n равно 0, 1 или 2;
который включает взаимодействие соединения формулы (II):

в которой различные символы имеют указанные выше значения, а W представляет Н, с алкилирующим агентом формулы (III):

в которой R6 имеет указанное выше значение, а Y представляет уходящую группу.
Преимущество такого способа над известными состоит в том, что он более эффективен и обеспечивает более прямой путь образования конечного продукта.
Также было обнаружено, что до взаимодействия соединения (II) с алкилирующим агентом можно проводить предварительную реакцию соединения (II) с неорганической солью металла или органическим основанием, в результате чего образуется промежуточная соль, которая далее реагирует с алкилирующим агентом.
Таким образом, в соответствие со вторым аспектом настоящего изобретения, предлагается способ (А) для получения соединения формулы (I)

в которой:
R1 представляет CN или CSNH2;
X представляет N или CR4;
каждый из радикалов R2 и R4, независимо, представляет водород или хлор;
R3 представляет галоген, галогеналкил, галогеналкокси или -SF5;
каждый из радикалов R5 и R6, независимо, представляет алкильную группу; а
n равно 0, 1 или 2;
который включает (а) первую стадию взаимодействия соединения формулы (II):

в которой различные символы имеют указанные выше значения, а W представляет Н, с неорганической солью металла или органическим основанием с образованием промежуточного соединения, (b) вторую стадию взаимодействия промежуточного соединения, полученного на стадии (а), с алкилирующим агентом,

в которой R6 имеет указанные выше значения, а Y представляет собой уходящую группу.
Преимущество способа настоящего изобретения над известными способами состоит в том, что в ходе реакции не образуются побочные продукты, и указанное промежуточное соединение, если желательно, может быть получено и выделено. Было установлено, что промежуточное соединение является устойчивым веществом.
Кроме этого, промежуточное соединение, полученное упомянутым выше способом, представляет новое соединение и тем самым, определяет другой аспект настоящего изобретения.
Способ настоящего изобретения включает взаимодействие соединения общей формулы (II) с алкилирующим агентом или необязательную предварительную стадию, на которой вначале проводят реакцию с неорганической солью или органическим основанием, а затем с алкилирующим агентом. Заместитель R3 в соединении II может представлять галоген, галогеналкил, галогеналкокси или -SF5. Если R3 представляет галогеналкил, то подходящими галогеналкилами могут быть галогенметилы, в особенности трифторметил. Если R3 представляет галогеналкокси, то подходящие галогеналкокси группы включают галогенметокси группу, в частности трифторметокси. Заместитель R5 представляет алкильную группу, например метил, этил или пропил, в особенности этил.
Предпочтительно заместители в соединении общей формулы (II) имеют следующие значения:
R1 представляет CN;
X представляет CR4;
Каждый из R2 и R4 представляет хлор;
R3 представляет трифторметил;
R5 представляет этил;
W представляет Н; а n равно 1.
При взаимодействии соединения общей формулы (II) с алкилирующим агентом подходящие алкилирующие агенты могут быть выбраны из алкилсульфонатов, алкилгалогенидов или алкилсульфатов. Алкильная группа может представлять метил, этил, пропил или изопропил. Если алкилирующий агент представляет галогенид, то предпочтительным агентом является хлорид, бромид или иодид. Если алкилирующий агент представляет сульфонат, то предпочтительно использовать диметилсульфонат или метиларилсульфонат. В случае, когда алкилирующий агент представляет сульфат, предпочтительным сульфатом является диметилсульфат. Предпочтительным алкилирующим агентом является бромистый метил, иодистый метил или их соли, а также диметилсульфат.
Соединение общей формулы (II) реагирует с алкилирующим агентом в количестве до 10 эквивалентов, предпочтительно 1-20, особенно предпочтительно 5-10 эквивалентов.
Реакцию между соединением (II) и алкилирующим агентом можно также проводить в присутствии основания. Подходящие основания включают гидриды щелочных металлов, например гидрид натрия; карбонаты щелочных металлов, такие как карбонат калия или карбонат натрия, либо бикарбонаты; алкоксиды щелочных металлов, например метоксид натрия; гидроксиды щелочных металлов, например гидроксид натрия и гидроксид калия. С другой стороны, рассматриваемую реакцию можно проводить в присутствии такого органического основания, как пиридин или триэтиламин; или соли четвертичного аммония, такой как галогенид бензилтриэтиламмония, например, его хлорид или бромид, или соли R4NOH, R4NOалкил, например Bu4NOH. Предпочтительными основными агентами являются карбонат калия или гидроксид калия.
Рассматриваемую реакцию можно также проводить в присутствии растворителя, предпочтительно полярного органического растворителя, который может быть выбран из простых эфиров, таких как тетрагидрофуран, трет-бутилметиловый эфир, диоксан, диизопропиловый эфир и дибутиловый эфир; галогензамещенных ароматических или алифатических углеводородов, таких как дихлорметан, 1,2-дихлорэтан и монохлорбензол; полярных нитрилов и амидов, таких как ацетонитрил, N,N-диметилформамид и N-метилпирролидинон. Предпочтительными растворителями являются ацетонитрил, N,N-диметилформамид и N-метилпирролидинон. Здесь также могут присутствовать такие неполярные растворители как толуол. Обычно используют избыток растворителя.
В том случае, когда соединение общей формулы (II) вначале взаимодействует с органическим основанием или неорганической солью металла, в качестве последней можно использовать соль металла I или II группы, выбранного из цезия, калия, натрия, кальция и магния. Предпочтительная соль металла представляет соль калия или натрия. Такая соль может использоваться в виде водного раствора или твердого вещества и может представлять гидроксид, карбонат или бикарбонат. В качестве предпочтительной соли в способе настоящего изобретения используют карбонат калия или гидроксид калия. В качестве органического основания можно использовать амин, например, триэтиламин, пиридин и т.п.
Количество соединения общей формулы (II), взаимодействующее с солью металла или органическим основанием, составляет, по крайней мере, 1 грамм-эквивалент, предпочтительно, 2 грамм-эквивалента.
Первую стадию получения промежуточного соединения можно проводить в присутствии растворителя, предпочтительно, полярного органического растворителя, который может быть выбран из простых эфиров, таких как тетрагидрофуран, трет-бутилметиловый эфир, диоксан, диизопропиловый эфир и дибутиловый эфир; галогензамещенных ароматических или алифатических углеводородов, таких как дихлорметан, 1,2-дихлорэтан и монохлорбензол; таких полярных нитрилов и амидов, таких как ацетонитрил, N,N-диметилформамид и N-метилпирролидинон, или их смесей. Предпочтительным растворителем является ацетонитрил, N,N-диметилформамид и N-метилпирролидинон. Здесь также может присутствовать такой неполярный растворитель как толуол. Предпочтительно проводить реакцию в избытке растворителя.
Полученный промежуточный продукт представляет собой новое вещество и, тем самым, представляет другой аспект настоящего изобретения. В особенности это относится к тем случаям, когда соединение общей формулы II взаимодействует с карбонатом калия с образованием калиевой соли или с триэтиламином с образованием соли амина.
После этого проводят реакцию промежуточного соединения с алкилирующим агентом формулы (III). Такой алкилирующий агент может быть выбран из алкилсульфонатов, алкилгалогенидов или алкилсульфатов. Алькильная группа в перечисленных соединениях может представлять метил, этил, пропил или изопропил. В том случае, когда алкилирующий агент представляет собой галоидное соединение, предпочтительным агентом является хлорид, бромид или иодид. Если алкилирующий агент представляет собой сульфонат, то предпочтительно использовать диметилсульфонат или метиларилсульфонат. Если алкилирующий агент представляет собой сульфат, то предпочтительным сульфатом является диметилсульфат. Предпочтительный алкилирующий агент представляет собой бромистый метил, иодистый метил или их соли, а также диметилсульфат.
Количество алкилирующего агента по отношению к промежуточной соли металла составляет до 10 грамм-эквивалентов, предпочтительно 1-20, особенно 5-10 грамм-эквивалентов.
Вторую стадию рассматриваемого способа также можно проводить в присутствии основания. Походящие для использования на второй стадии основания включают гидриды щелочных металлов, например гидрид натрия; карбонаты щелочных металлов, такие как карбонат калия, или карбонат натрия, или бикарбонаты; алкоксиды щелочных металлов, например метоксид натрия; гидроксиды щелочных металлов, например гидроксид натрия и гидроксид калия. С другой стороны, вторую стадию можно осуществлять в присутствии такого органического основания как пиридин или триэтиламин; или такой соли четвертичного аммония как галогенид бензилтриэтиламмония, например, его хлорид или бромид, или соли R4NOH, R4NOалкил, например Bu4NOH. Предпочтительным основанием является карбонат калия или гидроксид калия.
Вторая стадия рассматриваемой реакции также может проводиться в присутствии растворителя, предпочтительно полярного органического растворителя, который может быть выбран из таких простых эфиров как тетрагидрофуран, трет-бутилметиловый эфир, диоксан, диизопропиловый эфир и дибутиловый эфир; галогензамещенных ароматических или алифатических углеводородов, таких как дихлорметан, 1,2-дихлорэтан и хлорбензол; полярных нитрилов и амидов, таких как ацетонитрил, N,N-диметилформамид и N-метилпирролидинон. Предпочтительный растворитель представляет ацетонитрил, N,N-диметилформамид и N-метилпирролидинон. Здесь также может присутствовать такой неполярный растворитель как толуол. Предпочтительно использовать избыток растворителя.
Способ согласно настоящему изобретению можно осуществлять при температуре в интервале от 0 до 150°С, предпочтительно от 20 до 90°С, при атмосферном или повышенном давлении.
Способ настоящего изобретения особенно предпочтителен для получения соединения общей формулы (I), в которой:
R1 представляет CN;
X представляет CR4;
Каждый из R2 и R4 представляет хлор;
R3 представляет трифторметил;
R5 представляет этил;
R6 представляет метил; а n равно 1.
Соединения формулы (II) могут быть получены по способу (В), в котором соединение формулы (IV):
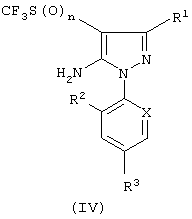
где различные символы имеют указанные выше значения, реагирует с ацилирующим агентом формулы (V) или формулы (VI):

где R5 имеет указанные выше значения, а Y представляет собой галоид, особенно хлор или бром; алкокси, ангидрид, особенно галоидоангидрид, например хлорангидрид, а Z представляет атом галогена, например хлор, бром и иод.
В предпочтительном соединении формулы (V) R5 представляет этил, а Y представляет атом хлора, а в предпочтительном соединении (VI) Z и Y представляют атом хлора.
Способ (В) предпочтительно осуществляют в присутствии растворителя, предпочтительно полярного органического растворителя, который может быть выбран из простых эфиров, таких как тетрагидрофуран, трет-бутилметиловый эфир, диоксан, диизопропиловый эфир и ди-трет-бутиловый эфир; галогензамещенных ароматических или алифатических углеводородов, таких как дихлорметан, 1,2-дихлорэтан и хлорбензол; полярных нитрилов и амидов, таких как ацетонитрил, N,N-диметилформамид и N-метилпиролидинон, или их смесей. Предпочтительным растворителем является ацетонитрил, N,N-диметилформамид и N-метилпиролидинон. Здесь также может присутствовать такой неполярный растворитель как толуол. Желательно, чтобы растворитель использовался в избытке.
Способ (В) также можно осуществлять в присутствии органических или неорганических оснований. Подходящие для этой цели основания включают гидриды щелочных металлов, например гидрид натрия; карбонаты щелочных металлов, такие как карбонат калия или карбонат натрия или их бикарбонаты; алкоксиды щелочных металлов, например метоксид натрия; гидроксиды щелочных металлов, например гидроксид натрия и гидроксид калия. С другой стороны, рассматриваемую реакцию можно проводить в присутствии органического основания, такого как пиридин или триэтиламин; или солей четвертичного аммония, таких как галогенид бензилтриэтиламмония, например, его хлорид или бромид, или солей R4NOH, R4NOалкил, например Bu4NOH. Предпочтительным основанием является гидроксид калия, гидроксид натрия и триэтиламин. Обычно, реакцию проводят при температуре в интервале от минус 20°С до 150°С, предпочтительно при от 20° до 90°С.
В соответствии с частным воплощением настоящего изобретения, при использовании соединения (VI) для получения соединения II и в том случае, когда каждый из заместителей Z и Y представляют хлор, реакцию рассматриваемого соединения проводят в присутствии алкоксида металла, например этоксида натрия.
Соединения формул (III), (IV) и (V), а также (VI) являются известными или могут быть получены известными способами.
Промежуточная соль соединения (II) также может быть получена непосредственно из промежуточной реакционной среды соединения (IV) с соединением (V), которая обсуждалась выше. Выделение такой соли можно осуществлять фильтрацией или путем добавления любого подходящего растворителя.
Далее настоящее изобретение иллюстрируется следующими примерами.
Пример 1
Стадия 1. Получение калиевой соли 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразола.
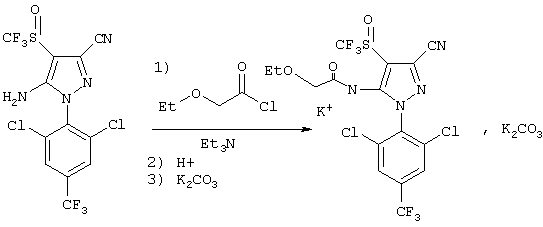
30 г этоксиацетилхлорида (0,233 моль) добавляли к смеси 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-аминопиразола (66 г, 0,145 моль) и триэтиламина (44,5 г, 0,435 моль) в 100 мл тетрагидрофурана.
Реакционную смесь перемешивали в течение 5 часов при 30°С, давали охлаждаться и добавляли 150 мл воды и 150 мл СН2Cl2. рН смеси восстанавливали до рН 2 с помощью концентрированной хлористоводородной кислоты и продукт реакции экстрагировали СН2Cl2. Добавляли раствор карбоната калия (50%) и полученный в результате осадок концентрировали, получая соединение II, в котором W представляет калий (выход=65%, чистота=77%).
Стадия 2. Получение 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидометил)пиразола.

К суспензии калиевой соли 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразола, полученной на стадии 1 (18,9 г, чистота 75,6%, 0,026 моль) в 56,8 г ацетонитрила, добавляли раствор метилбромида в ацетонитриле (86,5 г, концентрация 28%, 0,255 моль). Полученную смесь перемешивали в течение 6 часов при 60°С и затем концентрировали досуха. Остаток растворяли в смеси толуола (100 г) и воды (100 г). Органический слой промывали 100 г воды и концентрировали до 38% раствора, нагревали до 80°С и полученный продукт перекристаллизовывали в растворе толуол/н-гептан, взятых в соотношении 40/60, с образованием 10,3 г белого твердого вещества (выход=64%, чистота=85%).
Пример 2
Стадия 1. Получение ТЕА соли 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразола.
3,32 г хлористого этоксиацетила (0,03 моль) добавляли в смесь 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-аминопиразола (8,74 г, 0,02 моль) и триэтиламина (8,4 мл, 0,06 моль) в 20 мл тетрагидрофурана. Реакционную смесь перемешивали при 60°С в течение 1 часа и добавляли 1,1 г (0,01 ммоль) хлористого этоксиацетила. После перемешивания в течение 30 минут реакционной смеси давали охлаждаться и добавляли 20 мл воды и 20 мл СН2Cl2. Органический слой промывали 10 мл воды и сушили над сульфатом магния. Получали 12,5 г соединения II, в котором W представляет триэтиламин, что соответствовало выходу 90% при чистоте 76%.
Стадия 2. 0,42 моль триэтиламиновой соли 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразола, полученного на стадии 1, растворяли в 5 мл СН2Cl2. Систему подкисляли хлористоводородной кислотой до рН 2 и отделяли органический слой. Затем полученный в результате органический слой обрабатывали концентрированным раствором NaOH (1,5 эквивалента) и йодистым метилом (1,5 эквивалента) с получением соединения I с выходом 40%.
Пример 3
Стадия 1. 3,1 г хлористого этоксиацетила (0,024 моль) в течение 2 часов добавляли в смесь из 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-аминопиразола (10 г, 0,022 моль) и КОН (3,2 г, 0,57 моль) в 7 г CH3CN. Реакционную смесь перемешивали в течение 2 часов при -5°С и полученную смесь фильтровали, в результате чего получали 15 г влажного твердого материала. После сушки получали 12,2 г соединения II, в котором W представляет калий (выход=87%, чистота 82%).
Стадия 2. Получение 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидометил)пиразола.

К суспензии калиевой соли 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразола, (0,251 г, чистота 82%, 0,36 моль) в 1,3 г ацетонитрила добавляли раствор бромистого метила в ацетонитриле (0,7 г, концентрация 28%, 2,1 моль). Полученную смесь перемешивали в течение 6 часов при 60°С в автоклаве. Химический выход конечного продукта составил 85%.
Пример 4
Проводили реакцию между 1 эквивалентом фипронила и 0,65 эквивалентами хлористого этоксиацетила в среде тетрагидрофурана и в присутствии 3 эквивалентов триэтиламина и следового количества 4-диметиламинопиридина с получением 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этоксиацетамидо-4-трифторметилсульфинилпиразола с выходом 75% в расчете на хлористый ацетил.
Затем полученный в результате продукт в течение 4 часов при 25°С обрабатывали эквивалентным количеством диметилсульфата и эквивалентным количеством карбоната калия в среде тетрагидрофурана с образованием 3-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-N-этоксиацетамидо-N-метил-4-трифторметилсульфинилпиразола.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ПИРАЗОЛА, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА, ИНСЕКТИЦИД, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 2000 |
|
RU2256658C2 |
| ПРОИЗВОДНЫЕ N-ФЕНИЛПИРАЗОЛА | 1991 |
|
RU2087470C1 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ПИРАЗОЛА, СРЕДСТВО ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ | 1994 |
|
RU2138485C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, СПОСОБ ЛЕЧЕНИЯ ПАРАЗИТИЧЕСКОГО ЗАРАЖЕНИЯ И СПОСОБ ПОВРЕЖДЕНИЯ ИЛИ УНИЧТОЖЕНИЯ ПАРАЗИТОВ | 1996 |
|
RU2151766C1 |
| СПОСОБ СУЛЬФИНИЛИРОВАНИЯ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, СПОСОБ ПОЛУЧЕНИЯ 4- СУЛЬФИНИЛПИРАЗОЛОВ И СУЛЬФИНАМИДНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2136665C1 |
| ПРОИЗВОДНЫЕ 4-АМИНОФЕНОЛА ИЛИ ИХ N-АЛКИЛЬНЫЕ ИЛИ СОЛЕВЫЕ ПРОИЗВОДНЫЕ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНУЮ АКТИВНОСТЬ | 1990 |
|
RU2049779C1 |
| ПРОИЗВОДНЫЕ 1-АРИЛПИРРОЛОВ, ИНСЕКТОАКАРИЦИДОНЕМАТОЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С НАСЕКОМЫМИ | 1991 |
|
RU2092479C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5-АМИНО-1- АРИЛ-3-ЦИАНОПИРАЗОЛА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2236403C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСИМОВЫХ ЭФИРОВ ВЗАИМОДЕЙСТВИЕМ ОКСАМИНА С ДИАЛКИЛКАРБОНАТАМИ | 1995 |
|
RU2167149C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕСТИЦИДНЫХ СОЕДИНЕНИЙ | 2001 |
|
RU2291863C2 |
Предложен способ получения соединения общей формулы (I)

в которой R1 представляет CN или CSNH2; X представляет N или CR4; каждый из радикалов R2 и R4, независимо, представляет водород или хлор; R3 представляет галоген, галогеналкил, галогеналкокси или -SF5; каждый из радикалов R5 и R6, независимо, представляет алкильную группу; а n равно 0, 1 или 2; который включает реакцию соединения формулы (II)

где различные символы имеют указанные выше значения, a W представляет Н, с неорганической солью металла или органическим амином с образованием соли соединения формулы (II) в качестве промежуточного соединения и взаимодействие указанной соли соединения формулы (II) с алкилирующим агентом формулы (III)

где R6 имеет указанное выше значение, a Y представляет уходящую группу. Предложен также второй вариант способа получения соединения формулы (I), который включает взаимодействие неорганической соли металла или органического основания соединения формулы (II) с вышеуказанным алкилирующим агентом формулы (III). Технический результат - предложенные способы уменьшают образование побочных продуктов или совсем устраняют их образование, вследствие чего совсем отпадает необходимость их очистки. 2 н. и 35 з.п. ф-лы.

в которой
R1 представляет собой CN или CSNH2;
Х представляет собой N или CR4;
каждый из радикалов R2 и R4, независимо друг от друга, представляет собой водород или хлор;
R3 представляет собой галоген, галогеналкил, галогеналкокси или -SF5;
каждый из радикалов R5 и R6, независимо друг от друга, представляет собой алкильную группу;
n равно 0,1 или 2;
причем рассматриваемый способ включает следующие стадии:
а) взаимодействие соединения формулы (II):

в которой R1, R2, R3, X, R5 и n имеют указанные выше значения, a W представляет собой Н, с неорганической солью металла или органическим основанием с образованием соли соединения формулы (II) в качестве промежуточного соединения;
b) взаимодействие указанной соли соединения формулы (II) с алкилирующим агентом формулы (III):

в которой R6 имеет указанное выше значение, a Y представляет собой уходящую группу.

в которой R1 представляет собой CN или CSNH2;
Х представляет собой N или CR4;
каждый из радикалов R2 и R4, независимо друг от друга, представляет собой водород или хлор;
R3 представляет собой галоген, галогеналкил, галогеналкокси или -SF5;
каждый из радикалов R5 и R6, независимо друг от друга, представляет собой алкильную группу;
n равно 0,1 или 2;
который включает взаимодействие неорганической соли металла или органической соли соединения формулы (II):

в которой R1, R2, R3, X, R5 и n имеют указанные выше значения, a W представляет Н, с алкилируюшим агентом формулы (III):
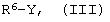
в которой R6 имеет указанное выше значение, a Y представляет собой уходящую группу.
a) первую стадию - взаимодействие 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразол с карбонатом калия с образованием калиевой соли 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразола;
b) вторую стадию - взаимодействие полученной калиевой соли с бромистым метилом с образованием 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(N-м-этилэтоксиацетамидо)пиразола.
а) первую стадию - взаимодействие 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразола с триэтиламином с образованием соли триэтиламина 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(этоксиацетамидо)пиразола; и
b) вторую стадию - взаимодействие полученной соли триэтиламина с йодистым метилом с образованием 1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинил-5-(N-метилэтоксиацетамидо)пиразола.
| US 5556873 А, 17.09.1996, кол.10, строка 29-30, кол.9, строка 27-56, кол.13, строка 43-67, пример 1 | |||
| EP 0811615 A1, 10.12.1997, стр.4, строки 1-45, пример 1 | |||
| RU 94044348 A1, 27.09.1996, п.5 формулы изобретения. |
Авторы
Даты
2006-02-10—Публикация
2001-06-07—Подача