Изобретение относится к 9a-N-[N'-(фенилсульфонил)карбамоил]производным 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А и 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А, новым полусинтетическим макролидным антибиотикам, относящимся к классу азалидов с антибактериальным действием, описываемым общей формулой 1,
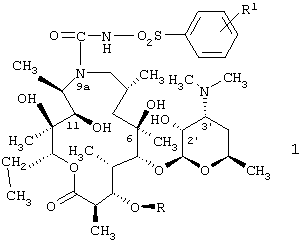
где R обозначает Н или кладинозильный радикал и R1 обозначает Н, C1-C4алкил или галоген, к их фармацевтически приемлемым солям присоединения неорганических или органических кислот, к способу их получения, к способу получения фармацевтических композиций, а также к применению полученных фармацевтических композиций при лечении бактериальных инфекций.
Эритромицин А представляет собой макролидный антибиотик, структура которого характеризуется наличием 14-членного макролактонового кольца с карбонильной группой в положении С-9.
Он был исследован McGuire в 1952 году [Antibiot. Chemother., 2 (1952) 281], и в течение более 40 лет его считали безопасным и активным противомикробным средством при лечении заболеваний, вызванных грамположительными и некоторыми грамотрицательными микроорганизмами. Однако в кислой среде он легко преобразуется в ангидроэритромицин А, неактивный С-6/С-12 метаболит со спирокетальной структурой [P. Kurath et al., Experientia 27 (1971) 362]. Известно, что спироциклизацию агликонового кольца эритромицина А успешно ингибирует химическая трансформация С-9 кетона или гидроксильных групп в положениях С-6 и/или С-12. В результате оксимирования С-9 кетонов [S.  et al., Tetrahedron Lett., 1967: 1945] и последующего модифицирования полученного 9(Е)-оксима с получением 9-[O-(2-метоксиэтокси)метилоксим]эритромицина А (РОКСИТРОМИЦИНА) [G. S. Ambrieres, FR patent 2,473,525, 1981], или 9(S)-эритромициламина [R. S. Egan et al., J. Org. Chem., 39 (1974) 2492]. или его более сложного оксазинового производного 9-дезоксо-11-{имино[2-(2-метоксиэтоксиэтилиден)окси]9,8S}эритромицина А (ДИРИТРОМИЦИНА) [P. Lugar et al., J. Crist. Mol. Struct., 9 (1979) 329] были синтезированы новые полусинтетические макролиды, основные характеристики которых в дополнение к более высокой стойкости в кислотной среде обеспечивают лучшую фармакокинетику и длительный биологический полупериод существования по сравнению с исходным антибиотиком эритромицином А. По третьему пути модифицирования С-9 кетонов используется перегруппировка Бекмана 9(Е)-оксимов и восстановление полученного простого иминоэфира [G. Kobrehel et al., US patent 4,328,334, 1982] с получением 11-аза-10-дезоксо-10-дигидроэритромицина А (9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А) в результате увеличения 14-членного кетолактонового кольца с получением 15-членного азалактонового кольца. В результате восстановительного N-метилирования 9а-аминогруппы в соответствии со способом Эшвайлера-Кларка (Eschweiler-Clark) [G.Kobrehel et al., BE patent 892,397, 1982] или в результате предварительной защиты аминогруппы за счет превращения в соответствующие N-оксиды и последующих алкилирования и восстановления [G.M.Bright, US patent 4,474,768, 1984] был синтезирован N-метил-11-аза-10-дезоксо-10-дигидроэритромицин А (9-дезоксо-9-дигидро-9а-метил-9а-аза-9а-гомоэритромицин А, АЗИТРОМИЦИН) - прототип азалидных антибиотиков, которые помимо наличия у них широкого спектра противомикробного действия, в том числе и на грамотрицательные бактерии и внутриклеточные микроорганизмы, также отличаются и специфическим механизмом транспортировки к месту применения, длительным биологическим полупериодом существования и быстрым временем лечения. В патенте ЕР 0316128 (G.M.Bright) описаны новые 9а-аллильные и 9а-пропаргильные производные 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А, и в патенте US 4492688 (1985, G.M.Bright) описаны синтезы и антибактериальное действие соответствующих циклических простых эфиров. Затем G.Kobrehel et al., J.Antibiot., 46 (1993) 1239-1245 описали синтез и спектр действия новых 9а,11-циклических карбаматов 9-дезоксо-9-дигидро-9а-аза-11-деокси-9а-гомоэритромицина А и их O-метильных производных.
et al., Tetrahedron Lett., 1967: 1945] и последующего модифицирования полученного 9(Е)-оксима с получением 9-[O-(2-метоксиэтокси)метилоксим]эритромицина А (РОКСИТРОМИЦИНА) [G. S. Ambrieres, FR patent 2,473,525, 1981], или 9(S)-эритромициламина [R. S. Egan et al., J. Org. Chem., 39 (1974) 2492]. или его более сложного оксазинового производного 9-дезоксо-11-{имино[2-(2-метоксиэтоксиэтилиден)окси]9,8S}эритромицина А (ДИРИТРОМИЦИНА) [P. Lugar et al., J. Crist. Mol. Struct., 9 (1979) 329] были синтезированы новые полусинтетические макролиды, основные характеристики которых в дополнение к более высокой стойкости в кислотной среде обеспечивают лучшую фармакокинетику и длительный биологический полупериод существования по сравнению с исходным антибиотиком эритромицином А. По третьему пути модифицирования С-9 кетонов используется перегруппировка Бекмана 9(Е)-оксимов и восстановление полученного простого иминоэфира [G. Kobrehel et al., US patent 4,328,334, 1982] с получением 11-аза-10-дезоксо-10-дигидроэритромицина А (9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А) в результате увеличения 14-членного кетолактонового кольца с получением 15-членного азалактонового кольца. В результате восстановительного N-метилирования 9а-аминогруппы в соответствии со способом Эшвайлера-Кларка (Eschweiler-Clark) [G.Kobrehel et al., BE patent 892,397, 1982] или в результате предварительной защиты аминогруппы за счет превращения в соответствующие N-оксиды и последующих алкилирования и восстановления [G.M.Bright, US patent 4,474,768, 1984] был синтезирован N-метил-11-аза-10-дезоксо-10-дигидроэритромицин А (9-дезоксо-9-дигидро-9а-метил-9а-аза-9а-гомоэритромицин А, АЗИТРОМИЦИН) - прототип азалидных антибиотиков, которые помимо наличия у них широкого спектра противомикробного действия, в том числе и на грамотрицательные бактерии и внутриклеточные микроорганизмы, также отличаются и специфическим механизмом транспортировки к месту применения, длительным биологическим полупериодом существования и быстрым временем лечения. В патенте ЕР 0316128 (G.M.Bright) описаны новые 9а-аллильные и 9а-пропаргильные производные 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А, и в патенте US 4492688 (1985, G.M.Bright) описаны синтезы и антибактериальное действие соответствующих циклических простых эфиров. Затем G.Kobrehel et al., J.Antibiot., 46 (1993) 1239-1245 описали синтез и спектр действия новых 9а,11-циклических карбаматов 9-дезоксо-9-дигидро-9а-аза-11-деокси-9а-гомоэритромицина А и их O-метильных производных.
Путем взаимодействия 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А с изоцианатами или изотиоцианатами соответственно  G.Kobrehel,
G.Kobrehel,  HR patent 931480, 1993) были получены 9a-N-(N'-карбамоильные) и 9a-N-(N'-тиокарбамоильные) производные 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А с некоторой антибактериальной активностью.
HR patent 931480, 1993) были получены 9a-N-(N'-карбамоильные) и 9a-N-(N'-тиокарбамоильные) производные 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А с некоторой антибактериальной активностью.
Было обнаружено, - и это представляет собой предмет настоящего изобретения, - что соединения, описываемые общей формулой 1, новые полусинтетические макролидные антибиотики, относящиеся к классу азалидов, и их фармацевтически приемлемые соли присоединения неорганических или органических кислот могут быть получены путем взаимодействия 9-дезоксо-9а-аза-9а-гомоэритромицина А или 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А, описываемых общей формулой 2, с фенилсульфонилизоцианатами, и, если необходимо, путем взаимодействия полученных 9a-N-[N'-(фенилсульфонил)карбамоил]производных 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А и 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А с неорганическими или органическими кислотами.
В соответствии с известным и установленным предшествующим уровнем техники 9a-N-[N'-(фенилсульфонил)карбамоил]производные 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А и 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А и их фармацевтически приемлемые соли прибавления неорганических или органических кислот, способ их получения и способы получения и применения в качестве фармацевтических композиций до настоящего времени описаны не были.
Было обнаружено, что новые 9а-N-[N'-(фенилсульфонил)карбамоил]производные 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А и 5-О-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А, описываемые общей формулой 1,
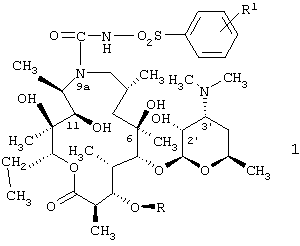
где R и R1 имеют приведенные выше значения, и их фармацевтически приемлемые соли прибавления неорганических или органических кислот могут быть получены путем взаимодействия 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А или 5-О-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А, описываемых общей формулой 2, где R представляет собой Н или кладинозильный радикал,
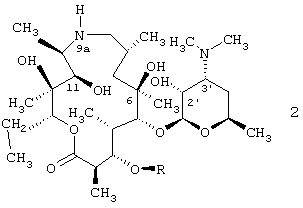
с фенилсульфонилизоцианатами, описываемыми общей формулой 3,
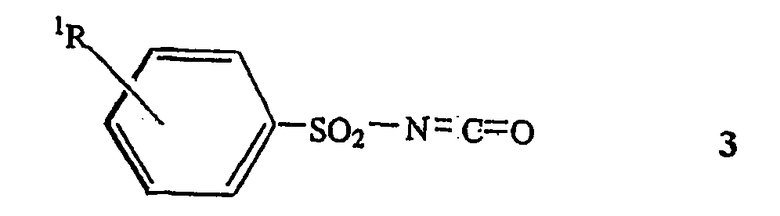
где R1 имеет указанные выше значения, в толуоле, ксилоле или некоторых других апротонных растворителях при температуре в диапазоне от 0 до 110°С в течение времени, необходимого для полного преобразования исходного соединения 2, предпочтительно в интервале от 0,5 до 10 часов.
Фармацевтически приемлемые соли прибавления, которые также являются объектом настоящего изобретения, получают путем взаимодействия 9а-N-[N'-(фенилсульфонил)карбамоил]производных 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А и 5-О-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А, описываемых общей формулой 2, по меньшей мере, с эквимолярным количеством соответствующей неорганической или органической кислоты, такой как хлористоводородная, йодистоводородная, серная, фосфорная, уксусная, трифторуксусная, пропионовая, бензойная, бензолсульфоновая, метансульфоновая, лаурилсульфоновая, стеариновая, пальмитиновая, янтарная, этилянтарная, молочная, щавелевая, салициловая и подобные кислоты, в инертном растворителе. Соли прибавления выделяют путем выпаривания растворителя или же, альтернативно, путем фильтрации после самопроизвольного осаждения, либо путем осаждения при добавлении неполярного сорастворителя.
К 9a-N-[N'-(фенилсульфонил)карбамоил]производные 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А и 5-O- дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А, описываемые общей формулой 1, и их фармацевтически приемлемые соли прибавления неорганических или органических кислот обладают in vitro антибактериальной активностью. Минимальные ингибирующие концентрации (MIC, в мкг/мл) определяли по способу разбавления на микропланшетах в соответствии с рекомендациями National Committee for Clinical Laboratory Standards (NCCLS, M7-A2). Так, например, минимальная ингибирующая концентрация в случае Streptococcus pneumoniae ATCC 6305 для соединений примеров 1 и 4 равна 2 мкг/мл, а для соединений примеров 2 и 3 равна 1 мкг/мл. Следовательно, их можно использовать для дезинфекции помещений, хирургических инструментов и людей, а также в качестве лекарственных средств при лечении инфекционных заболеваний у животных, в особенности у млекопитающих, или у людей, которые вызваны широким спектром грамположительных бактерий, микроорганизмов или, главным образом, патогенных микроорганизмов, которые обладают чувствительностью к соединениям, описываемым формулой 1.
Таким образом, настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение общей формулы 1 или его фармацевтически приемлемую соль добавления кислоты, органической или неорганической, а также фармацевтически приемлемые носители, такие как наполнители или разбавители. Для данной цели приведенные выше соединения или их фармацевтически приемлемые соли кислот можно использовать перорально в обычных дозах в диапазоне от 0,2 мг/кг массы тела в день до приблизительно 250 мг/кг/день, наиболее часто 5-50 мг/кг/день, или парентерально в виде подкожных или внутримышечных инъекций. Носитель может быть «приемлемым» в свете совместимости его с другими компонентами препарата и не оказывающим нежелательного воздействия на реципиента.
Получение фармацевтических композиций по изобретению может включать смешивание, гранулирование, таблетирование или растворение компонентов. Химические носители могут быть в твердом или жидком виде. Твердыми носителями могут быть лактоза, сахароза, тальк, желатин, агар, пектин, стеарат магния, жирные кислоты, без ограничений. Жидкими носителями могут быть сиропы, масла, такие как оливковое, подсолнечное или соевое, вода или физиологический раствор, без ограничений. Кроме того, носители могут также содержать компонент для замедленного высвобождения активного компонента, такой как глицерил моностеарат или глицерил дистеарат. Могут быть получены различные формы фармацевтической композиции. Если используется твердый носитель, такие формы включают таблетки, таблетки в форме капсулы, твердые желатиновые капсулы, порошки или гранулы, без ограничений, которые могут быть введены перорально. Количество твердого носителя может изменяться, но обычно составляет от 25 мг до 1 г. Если используется жидкий носитель, препарат может быть в виде сиропа, эмульсии, мягкой желатиновой капсулы или стерильного раствора для инъекций, или неводных жидких суспензий, вводимых местно или системно, например перорально, парентерально, подкожно, на слизистую, буккально, интраназально, интраректально и интравагинально. «Парентерально» означает внутривенный, внутримышечный или подкожный путь введения.
Фраза «фармацевтически приемлемый», как здесь используется в отношении композиций по изобретению, относится к молекулярным составам и другим элементам таких композиций, которые являются физиологически удовлетворительными и обычно не дают отрицательных реакций при введении млекопитающим (например, человеку). В частности, как здесь используется, термин «фармацевтически приемлемый» подразумевает вещество для применения на млекопитающих, и более конкретно, на людях, которое разрешено регулирующим ведомством федерального или государственного правительства или имеется в списке Фармакопеи США или других обычно известных фармакопей.
Термин «фармацевтически приемлемый», используемый в отношении фармацевтических композиций по изобретению, относится к разбавителю, наполнителю или растворителю, вместе с которым вводится активное соединение. Такими фармацевтическими носителями могут быть стерильные жидкости, такие как вода, физиологические растворы, водные растворы декстрозы, водные растворы глицерина и масла, включая те, которые получены из нефти, или имеют органическую, растительную или синтетическую природу, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Однако, поскольку макролиды являются высокорастворимыми, водные растворы являются предпочтительными. Подходящие фармацевтические носители описаны E.W.Martin в «Remington's Pharmaceutical Sciences», 18th Edition. Особенно предпочтительными в соответствии с настоящим изобретением являются носители, подходящие для немедленного высвобождения, то есть высвобождения большинства всех активных ингредиентов в течение короткого промежутка времени, например 60 минут или меньше, и делающими возможным быструю абсорбцию лекарственного средства.
«Терапевтически эффективное количество» означает такое количество соединения, которое, при введении млекопитающему для лечения состояния, заболевания или положения, является достаточным для осуществления такого лечения.
Способ получения соединений по настоящему изобретению проиллюстрирован следующими далее примерами, которые никоим образом не ограничивают объем изобретения. «Терапевтически эффективное количество» будет зависеть от строения соединения, заболевания, серьезности и возраста, массы, физического состояния и восприимчивости млекопитающего, подвергаемого лечению.
Пример 1
9-Дезоксо-9-дигидро-9а-N-[N'-(4-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицин А
9-Дезоксо-9-дигидро-9а-азагомоэритромицин А (3,38 г, 0,0046 моль) растворяли в толуоле (40 мл) и при температуре от 0 до 5°С добавляли 4-хлорбензолсульфонилизоцианат (около 1,0 г, 0,0046 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 9-дезоксо-9-дигидро-9а-N-[N'-(4-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицина А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид: метанол:аммиак = 90:9:1,5
ИК (KBr)/см-1: 1728, 1579, 1556, 1126, 1013.
1H ЯМР (500 МГц, ДМСО)/δ: 4,46 (1Н, Н-1'), 4,91 (1Н, H-1''), 3,93 (1Н, Н-3), 3,46 (1Н, Н-5), 3,34 (3Н, 3''-ОСН3), 2,91 (1Н, Н-4''), 2,50 (6Н, 3'-N' (СН3)2), 2,26 (1Н, H-2''b), 1,52 (1Н, H-2''a), 1,27 (1Н, H-8), 1,23 (3Н, 10-СН3), 1,14 (3Н, 3''-СН3), 0,96 (3Н, 4-СН3), 0,82 (3Н, Н-5).
13С ЯМР (500 МГц, ДМСО/δ): 177,1 (С-1), 154,6  101,4 (С-1'), 95,8 (С-1''), 82,6 (C-5), 77,2 (C-3), 48,7 (3''-ОСН3), 44,7 (С-2), 25,7 (С-8), 20,9 (8-СН3), 12,2 (10-СН3), 10,7 (С-15).
101,4 (С-1'), 95,8 (С-1''), 82,6 (C-5), 77,2 (C-3), 48,7 (3''-ОСН3), 44,7 (С-2), 25,7 (С-8), 20,9 (8-СН3), 12,2 (10-СН3), 10,7 (С-15).
MC (ES+) m/z (%): 952,5.
Пример 2
9-Дезоксо-9-дигидро-9а-N-[N'-(п-толуолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицин А
Аналогично способу, описанному в примере 1, 9-дезоксо-9-дигидро-9а-азагомоэритромицин А (3,88 г, 0,0051 моль) растворяли в толуоле (40 мл) и при температуре от 0 до 5°С по каплям добавляли п-толуолсульфонилизоцианат (1,04 г, 0,0053 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 9-дезоксо-9-дигидро-9а-N-[N'-(4-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицина А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол = 1:1.
ИК (KBr)/см-1: 1731, 1644, 1556, 1126, 1013.
1H ЯМР (500 МГц, пиридин)/δ: 8,22, 8,15, 7,18 (фенил), 5,70 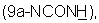 5,40 (1H, H-13), 5,37 (1H, H-1''), 5,01 (1Н, H-1'), 4,81 (1H, Н-3), 4,54 (1H, Н-5''), 4,11 (1H, Н-5), 4,03 (1H, Н-5'), 3,67 (1H, Н-2'), 3,47 (1H, 3''-ОСН3), 3,32 (1H, Н-10), 3,24 (1H, Н-4''), 3,13 (1H, Н-2), 2,42 (1H, 3'-N(CH3)2), 2,18 (3Н, R-СН3), 1,96 (1H, 7а), 1,91 (1H, Н-8), 1,82 (1H, H-7b), 1,51 (3Н, 4-СН3), 1,52 (1H, 5''-CH3), 0,93 (3Н, Н-15).
5,40 (1H, H-13), 5,37 (1H, H-1''), 5,01 (1Н, H-1'), 4,81 (1H, Н-3), 4,54 (1H, Н-5''), 4,11 (1H, Н-5), 4,03 (1H, Н-5'), 3,67 (1H, Н-2'), 3,47 (1H, 3''-ОСН3), 3,32 (1H, Н-10), 3,24 (1H, Н-4''), 3,13 (1H, Н-2), 2,42 (1H, 3'-N(CH3)2), 2,18 (3Н, R-СН3), 1,96 (1H, 7а), 1,91 (1H, Н-8), 1,82 (1H, H-7b), 1,51 (3Н, 4-СН3), 1,52 (1H, 5''-CH3), 0,93 (3Н, Н-15).
13С ЯМР (500 МГц, пиридин/δ): 179,0 (C-1), 142,7 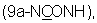 130,1, 127,9, 126,9 (фенил), 103,8 (С-1'), 95,8 (C-1''), 84,7 (C-5), 79,2 (C-4''), 79,0 (C-3), 78,0 (C-13), 75,4 (C-6), 73,7 (C-12), 72,6 (C-11), 71,4 (C-2'), 68,4 (C-5'), 66,5 (C-5''), 58,3 (C-10), 50,0 (3''-ОСН3), 46,5 (C-2), 43,7 (С-7), 27,8 (С-8), 19,3 (5''-CH3), 15,7 (2-СН3), 14,3 (12-СН3), 11,8 (С-15), 10,3 (4-СН3).
130,1, 127,9, 126,9 (фенил), 103,8 (С-1'), 95,8 (C-1''), 84,7 (C-5), 79,2 (C-4''), 79,0 (C-3), 78,0 (C-13), 75,4 (C-6), 73,7 (C-12), 72,6 (C-11), 71,4 (C-2'), 68,4 (C-5'), 66,5 (C-5''), 58,3 (C-10), 50,0 (3''-ОСН3), 46,5 (C-2), 43,7 (С-7), 27,8 (С-8), 19,3 (5''-CH3), 15,7 (2-СН3), 14,3 (12-СН3), 11,8 (С-15), 10,3 (4-СН3).
MC (EI+) m/z (%): 932,5.
Пример 3
9-Дезоксо-9-дигидро-9а-N-[N'-(о-толуолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицин А
Аналогично способу, описанному в примере 1, 9-дезоксо-9-дигидро-9а-азагомоэритромицин А (3,73 г, 0,0051 моль) растворяли в толуоле (40 мл) и при температуре от 0 до 5°С по каплям добавляли о-толуолсульфонилизоцианат (1,0 г, 0,0051 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 9-дезоксо-9-дигидро-9а-N-[N'-(о-толуолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицина А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол:аммиак = 90:9:1,5.
ИК (KBr)/см-1: 1727, 1633, 1556, 1126, 1013.
1H ЯМР (500 МГц, ДМСО)/δ: 7,77, 7,25, 7,14 (фенил), 4,90 (1Н, Н-1'), 4,85 (1Н, Н-13), 4,44 (1Н, Н-1'), 4,01 (1Н, Н-5''), 3,47 (1Н, Н-5), 3,47 (1Н, Н-5), 3,69 (1Н, Н-5'), 3,25 (3Н, 3''-ОСН3), 3,00 (1Н, Н-2'), 2,91 (1Н, Н-4''), 2,37 (3Н, 3'-N(СН3)2), 2,27 (1Н, Н-2''а), 1,95 (1Н, Н-4), 1,52 (1Н, H-2''b), 1,25 (1Н, H-8), 1,17 (3Н, 5''-СН3), 1,09 (3Н, 5'-СН3), 0,96 (3Н, 4-СН3), 0,82 (3Н, Н-15).
13С ЯМР (500 МГц, ДМСО/δ): 178,0 (С-1), 102,7 (С-1'), 95,2 (С-1''), 83,2 (С-5), 78,2 (С-4''), 78,0 (С-3), 75,8 (С-13), 74,4 (С-6), 73,7 (С-12), 73,5 (С-3''), 71,0 (С-2'), 67,7 (С-5'), 65,8 (С-5''), 65,5 (С-3'), 51,6 (3''-ОСН3), 45,7 (С-2), 42,8 (С-4), 40,1 (3'-N(CH3)2), 35,4 (С-2''), 30,9 (С-4'), 25,8 (C-8), 18,3 (5''-СН3), 15,6 (12-СН3), 11,9 (С-15), 10,0 (4-СН3).
MC (EI+) m/z (%): 932,8.
Пример 4
9-Дезоксо-9-дигидро-9а-N-[N'-(бензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицин А
Аналогично способу, описанному в примере 1, 9-дезоксо-9-дигидро-9а-азагомоэритромицин А (4,01 г, 0,0055 моль) растворяли в толуоле (40 мл) и при температуре от 0 до 5°С по каплям добавляли бензолсульфонилизоцианат (1,0 г, 0,0055 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 9-дезоксо-9-дигидро-9а-N-[N'-(бензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицина А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол:аммиак = 90:9:1,5.
ИК (KBr)/см-1: 1719, 1638, 1551, 1126, 1011.
1H ЯМР (500 МГц, ДМСО)/δ: 7,84, 7,71, 7,54, 7,36 (фенил), 4,77 (1Н, Н-1''), 4,44 (1Н, Н-1'), 4,01 (1Н, Н-5''), 3,21 (3Н, 3''-ОСН3), 2,90 (1Н, Н-4''), 2,49 (3Н, 3'N(CH3)2), 2,26 (1Н, H-2''a), 1,76 (1Н, H-14a), 1,51 (1Н, H-2''b), 1,32 (1Н, H-14b), 1,16 (3Н, 5''-СН3), 0,78 (3Н, Н-15).
13С ЯМР (500 МГц, ДМСО/δ): 159,0 (9a-N-CO-NH), 128,8, 127,7, 126,3 (фенил), 77,4 (С-4''), 72,7 (С-3''), 65,0 (С-5''), 49,0 (3''-ОСН3), 39,4 (3'-N(CH3)2), 35,1 (C-2''), 18,7 (5''-СН3), 11,1 (С-15), 9,5 (4-СН3).
MC (ES+) m/z (%): 918,8.
Пример 5
9-Дезоксо-9-дигидро-9а-N-[N'-(2-хлорбензолсульфонил)карбамоил]-9а-аэа-9а-гомоэритромицин А
Аналогично способу, описанному в примере 1, 9-дезоксо-9-дигидро-9а-азагомоэритромицин А (3,38 г, 0,0046 моль) растворяли в толуоле (40 мл) и при температуре от 0 до 5°С по каплям добавляли 2-хлорбензолсульфонилизоцианат (1,0 г, 0,0046 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 9-дезоксо-9-дигидро-9а-N-[N'-(2-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицина А проводили путем хроматографии на колонке с силикагелем сначала в системе растворителей метиленхлорид:метанол = 7:3, а после этого в системе растворителей метиленхлорид:метанол:аммиак = 90:9:1,5.
ИК (KBr)/см-1: 1728, 1579, 1126, 1012.
1H ЯМР (500 МГц, ДМСО)/δ: 7,71 (фенил), 5,08 (1Н, Н-13), 4,80 (1Н, Н-1''), 4,49 (1Н, Н-1'), 4,15 (1Н, Н-3'), 4,03 (1Н, Н-5''), 3,43 (1Н, Н-5), 3,22 (3Н, 3''-ОСН3), 2,91 (1Н, Н-4''), 2,76 (1Н, Н-2), 2,50 (3Н, 3'-N(CH3)2), 2,39 (1Н, Н-2''а), 1,14 (3Н, 3''-СН3), 0,88 (3Н, Н-15), 0,85 (3Н, 12-СН3).
13С ЯМР (500 МГц, ДМСО/δ): 102,0 (С-1'), 97,0 (С-1''), 85,6, (С-5), 78,5 (С-4''), 68,0 (С-3'), 65,8 (С-5''), 45,2 (С-2), 40,5 (3'-N(CH3)2), 45,9 (3''-ОСН3), 35,6 (С-2''), 21,2 (3''-СН3), 18,7 (5''-СН3), 14,3 (12-СН3), 10,8 (С-15).
MC (EI+) m/z (%): 952,9.
Пример 6
9-Дезоксо-9-дигидро-9а-N-[N'-(4-фторбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицин А
Аналогично способу, описанному в примере 1, 9-дезоксо-9-дигидро-9а-азагомоэритромицин А (1,46 г, 0,002 моль) растворяли в толуоле (20 мл) и при температуре от 0 до 5°C по каплям добавляли суспензию 4-фторбензолсульфонилизоцианата (0,4 г, 0,002 моль) в толуоле. После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 9-дезоксо-9-дигидро-9а-N-[N'-(4-фторбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицина А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол = 7:3.
ИК (KBr)/см-1: 1727, 1638, 1593, 1552, 1126, 1013.
1H ЯМР (500 МГц, ДМСО)/δ: 7,74, 7,71, 7,16 (фенил), 4,78 (1Н, Н-1''), 4,45 (1Н, Н-1'), 4,01 (1Н, Н-5''), 3,21 (3Н, 3''-ОСН3), 2,91 (1Н, Н-4''), 2,51 (3Н, 3'-N(СН3)2), 2,27 (1Н, Н-2''а), 1,52 (1Н, H-2''b), 1,17 (3Н, 5''-CH3), 1,14 (3Н, 3''-СН3), 0,94 (3Н, Н-15), 0,81 (3Н, 4-СН3).
13С ЯМР (500 МГц, ДМСО/δ): 177,2 (C-1), 160,6 (9a-NCO), 101,1 (С-1'), 95,8 (C-1''), 84,1 (C-5), 77,2 (C-4''), 72,2 (C-3''), 64,8 (С-5''), 39,9 (3'-N(СН3)2), 49,1 (3''-ОСН3), 44,3 (С-2), 34,8 (С-2''), 29,9 (C-4'), 22,9 (5'-СН3), 18,5 (5''-СН3), 10,0 (С-15), 9,5 (4-СН3).
MC (ES+) m/z (%): 936,3.
Пример 7
5-O-Дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(п-толуолсульфонил)карбамоил]-9а-аэа-9а-гомоэритронолид А
5-О-Дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолид А (1,0 г, 0,00173 моль) растворяли в толуоле (25 мл) и при температуре в диапазоне от 0 до 5°C по каплям добавляли п-толуолсульфонилизоцианат (около 0,34 мг, 0,00173 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре, образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 5-О-дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(п-толуолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолида А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол:аммиак = 90:9:1,5.
ИК (KBr)/см-1: 1726, 1171, 1129, 1075.
MC(ES+) m/z (%): 774,9.
Пример 8
5-O-Дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(4-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолид А
Аналогично способу, описанному в примере 1, 5-О-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолид А (2,54 г, 0,0046 моль) растворяли в толуоле (50 мл) и при температуре в диапазоне от 0 до 5°С по каплям добавляли 4-хлорбензолсульфонилизоцианат (1,0 г, 0,00459 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(4-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолида А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид: метанол = 7:3.
ИК (KBr)/см-1: 1725, 1171, 1133, 1078.
MC (EI+) m/z (%): 784,7.
Пример 9
5-O-Дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(4-фторбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолид А
Аналогично способу, описанному в примере 1, 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолид А (1,0 г, 0,00173 моль) растворяли в толуоле (25 мл) и при температуре в диапазоне от 0 до 5°С по каплям добавляли 4-фторбензолсульфонилизоцианат (0,36 г, 0,00173 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(4-фторбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолида А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол = 7:3.
ИК (KBr)/см-1: 1727, 1174, 1129, 1076.
MC (EI+) m/z (%): 778,8.
Пример 10
5-O-Дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(бензолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолид А
Аналогично способу, описанному в примере 1, 5-О-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолид А (3,055 г, 0,0055 моль) растворяли в толуоле (25 мл) и при температуре в диапазоне от 0 до 5°С по каплям добавляли бензолсульфонилизоцианат (1,0 г, 0,0055 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(бензолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолида А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол = 7:3.
ИК (KBr)/см-1: 1728, 1176, 1128, 1077.
MC (ES+) m/z (%): 760,7.
Пример 11
5-O-Дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(о-толуолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолид А
Аналогично способу, описанному в примере 1, 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолид А (2,84 г, 0,0051 моль) растворяли в толуоле (40 мл) и при температуре в диапазоне от 0 до 5°С по каплям добавляли о-толуолсульфонилизоцианат (1,0 г, 0,0046 моль). После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-N-[N'-(о-толуолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолида А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол = 7:3.
ИК (KBr)/см-1: 1728, 1173, 1129, 1075.
MC (EI+) m/z (%): 774,7.
Пример 12
5-O-Дезозаминил-9-дезоксо-9-дигидро-9a-N-[N'-(2-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолид А
Аналогично способу, описанному в примере 1, 5-О-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолид А (2,65 г, 0,00459 моль) растворяли в толуоле (50 мл) и при температуре в диапазоне от 0 до 5°С по каплям добавляли суспензию 2-хлорбензолсульфонилизоцианата (1,0 г, 0,00459 моль) в толуоле. После перемешивания реакционной смеси в течение одного часа при той же температуре образовавшиеся кристаллы сырого продукта отсасывали. Выделение чистого 5-О-дезозаминил-9-дезоксо-9-дигидро-9a-N-[N'-(2-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритронолида А проводили путем хроматографии на колонке с силикагелем в системе растворителей метиленхлорид:метанол = 7:3.
ИК (KBr)/см-1: 1728, 1170, 1125, 1071.
MC (ES+) m/z (%): 794,1.
Примеры фармацевтических композиций
Пример А: Препарат в виде таблеток
9a-N-[N'-(фенилсульфонил)карбамоил]производное 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А и 5-O-дезозаминил-9-дезоксо-9-дигидро-9а-аза-9а-гомоэритронолида А, такое как 9-дезоксо-9-дигидро-9a-N-[N'-(4-хлорбензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицин А (пример 1), 9-дезоксо-9-дигидро-9а-N-[N'-(п-толуолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицин А (пример 2), 9-дезоксо-9-дигидро-9а-N-[N'-(о-толуолсульфонил)-карбамоил]9а-аза-9а-гомоэритромицин А (пример 3) или 9-дезоксо-9-дигидро-9а-N-[N'-(бензолсульфонил)карбамоил]-9а-аза-9а-гомоэритромицин А (пример 4) гранулируют вместе с крахмалом, микрокристаллической целлюлозой и натрий кроскармеллозой обычными методами гранулирования. Высушенные гранулы гомогенизируют с помощью стеарата магния и таблетируют с помощью обычных машин для изготовления таблеток. Ядра таблеток покрывают покрытием на основе гидроксипропилметилцеллюлозы (НРМС). Состав таблеток массой 150, 200, 250, 300, 500 и 600 мг представлен в таблице 1.
Пример В: Препарат в виде таблеток
Воду, сорастворитель (глицерин, полиэтиленгликоль), консерванты (метил и пропилпарабен), стабилизатор и желирующий полимер гомогенизируют обычным способом с получением водной фазы. К этой водной фазе добавляют соединение 1 и диспергируют его или растворяют. Масляный компонент (такой как жидкий парафин и цетиловый спирт) измельчают с добавлением эмульгатора и после охлаждения смешивают с предварительно приготовленной водной фазой. Заключительную гомогенизацию проводят при пониженном давлении. В последнюю фазу может быть добавлен ароматизатор, т.е. гомогенный гель, и необязательно может быть установлен определенный рН. Типичный препарат, содержащий соединение 1, полученный таким образом, представлен в таблице 2.
Изобретение относится к 9а-N-[N'-(фенилсульфонил)карбамоил]производным 9-дезоксо-9-дигидро-9а-аза-9а-гомоэритромицина А и 5-O-дезозаминил-9-дезоксо-9-дегидро-9а-аза-9а-гомоэритронолида А - новым полусинтетическим макролидным антибиотикам, относящимся к классу азалидов с антибактериальным действием, описываемым общей формулой 1,
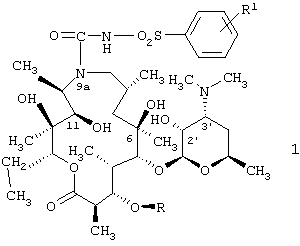
где R1 обозначает Н, С1-С4алкил или галоген и R обозначает Н или кладинозильный радикал, и их фармацевтически приемлемым солям, способу их получения и фармацевтической композиции на их основе. 3 н. и 13 з.п. ф-лы, 2 табл.
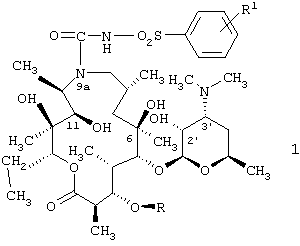
где R1 обозначает Н, C1-C4 алкил или галоген и R обозначает Н или кладинозильный радикал,
и их фармацевтически приемлемые соли присоединения неорганических или органических кислот.
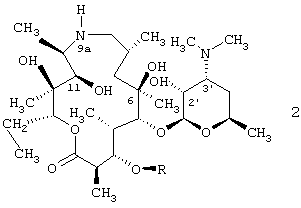
подвергают взаимодействию с фенилсульфонилизоцианатами общей формулы 3
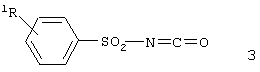
где R1 имеет значения, указанные в п.1,
в толуоле, ксилоле или некоторых других апротонных растворителях при температуре от 0 до 110°С.
| WO 00/66603 A1, 09.11.2000 | |||
| 9А-N-(N'-КАРБАМОИЛ)- ИЛИ 9А-N-(N'-ТИОКАРБАМОИЛ) ПРОИЗВОДНЫЕ 9-ДЕОКСО-9А-АЗА-9А-ГОМОЭРИТРОМИЦИНА А, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2131878C1 |
| US 4826820 A, 02.05.1989. | |||
Авторы
Даты
2006-02-27—Публикация
2002-02-27—Подача