Перекрестная ссылка на родственные заявки
Для данной заявки испрашивается приоритет по патентным заявкам США с регистрационными №№09/470881 подана 22 декабря 1999 г., и 09/538248 подана 29 марта 2000 г., и для обеих этих заявок испрашивается приоритет по международной патентной заявке №PCT/US 99/11780 от 28 мая 1999, в которой указаны Соединенные Штаты Америки, и для нее, в свою очередь, испрашивается приоритет по предварительной заявке США с регистрационным №60/087220, которая подана 29 мая 1998 г.
Утверждение прав правительства
Некоторые из раскрытых работ частично поддерживались грантами от NIH от имени Соединенных Штатов Америки. Следовательно, правительство Соединенных Штатов Америки может иметь определенные права в данном изобретении.
Область изобретения
В широком смысле настоящее изобретение относится к области медицины и конкретно касается способов и композиций для модуляции и ингибирования проницаемости сосудов (VP).
Предпосылки
Ангиогенез представляет собой процесс образования кровеносных сосудов в ткани, который включает рост новых развивающихся кровеносных сосудов в ткани, и также касается новообразования кровеносных сосудов. Данный процесс опосредован инфильтрацией эндотелиальных клеток и клеток гладкой мышцы. Считают, что данный процесс протекает по одному из трех путей: сосуды могут расти из ранее существующих сосудов, развитие новых сосудов может происходить из клеток-предшественников (образование и развитие сосудов) или существующие небольшие сосуды могут увеличиваться в диаметре, Blood и др., Bioch. Biophys. Acta, 1032: 89-118 (1990). Для протекания ангиогенеза эндотелиальные клетки должны сначала деградировать и пересечь основную мембрану кровеносного сосуда аналогично опухолевым клеткам при инвазии и образовании метастазов. Ангиогенез обычно отсутствует во взрослых или зрелых тканях, хотя он происходит при заживлении ран и в цикле роста желтого тела. Смотри, например, Moses и др., Science, 248: 1408-1410 (1990).
Притом, что ангиогенез является важным процессом роста новорожденного, он также важен при заживлении ран и является фактором патогенеза большого количества разнообразных клинических заболеваний, включая воспаление тканей, артриты, рост опухолей, диабетическую ретинопатию, дегенерацию пятна при новообразовании сосудов в сетчатке и подобные состояния. Данные клинические проявления, связанные с ангиогенезом, относятся к ангиогенным заболеваниям, Folkman и др., Science, 235: 442-447 (1987).
Предполагают, что ингибирование ангиогенеза будет полезной терапией для ограничения роста опухолей. Предложено ингибировать ангиогенез посредством (1) ингибирования высвобождения «ангиогенных молекул», таких как bFGF (основной фактор роста фибробластов), (2) нейтрализации ангиогенных молекул, как при использовании анти-βbFGF антител, (3) применения ингибиторов рецептора витронектина αvβ3 и (4) ингибирования реакции эндотелиальных клеток на ангиогенный стимул. Последняя стратегия привлекла внимание. Folkman и др., Cancer Biology, 3: 89-96 (1992) описали несколько ингибиторов реакции эндотелиальных клеток, включая ингибитор коллагеназы, ингибиторы обновления основной мембраны, ангиостатические стероиды, ингибиторы ангиогенеза - производные грибков, тромбоцитарный фактор 4, тромбоспондин, лекарства для артрита, такие как D-пеницилламин и золотой тиомалат, аналоги витамина D3, альфа-интерферон и другие, которые можно использовать для ингибирования ангиогенеза. Дополнительную информацию о предложенных ингибиторах ангиогенеза смотри в работах Blood и др., Bioch. Biophys. Acta, 1032: 89-118 (1990), Moses и др., Science, 248: 1408-1410 (1990), Ingber и др., Lab. Invest., 59: 44-51 (1988) и патентах США №5092885, №5112946, №5192744, №5202352, №5753230 и №5766591. Однако ни один из ингибиторов ангиогенеза, описанных в представленных выше ссылках, не включает белки Src.
Ранее сообщалось, что ангиогенез зависит от взаимодействия между интегринами сосудов и белками внеклеточного матрикса, Brooks и др., Science, 264: 569-571 (1994). Кроме того, сообщалось, что программируемая гибель (апоптоз) ангиогенных клеток сосудов инициируется взаимодействием, которое должны ингибировать некоторые антагонисты сосудистого интегрина αvβ3, Brooks и др., Cell, 79: 1157-1164 (1994). Позднее сообщалось, что связывание металлопротеиназы-2 матрикса (ММР-2) с рецептором витронектина (αvβ5) можно ингибировать, используя антагонисты αvβ5, ингибируя тем самым ферментативную функцию протеиназы. Brooks и др., Cell, 85: 683-693 (1996). Интегрины αv идентифицированы как важные компоненты выживания эндотелиальных клеток в ангиогенных кровеносных сосудах. Специфические антагонисты интегрина αv блокируют пути ангиогенеза, индуцированные конкретным фактором роста. Например, ангиогенез, индуцированный сосудистым эндотелиальным фактором роста (VEGF), блокируется антагонистами интегрина αvβ5, тогда как ангиогенез, индуцированный основным фактором роста фибробластов (bFGF), блокируется антагонистами интегрина αvβ3.
Сосудистая сеть головного мозга характеризуется высоким ограничительным барьером кровь-мозг, который препятствует экстравазации малых молекул в окружающую ткань мозга. Природа барьера кровь-мозг у млекопитающих является предметом специального внимания фармакологических исследований, поскольку высокий ограничительный барьер кровь-мозг мешает многим лекарствам проходить через сосудистую сеть к тканям мозга. Настоящее изобретение включает неожиданное открытие, что VP, измеренную как просачивание крови из сосудов, можно модулировать при помощи Src или Yes. Кроме того, VP связана с ангиогенезом и другими патологиями. Воспаление, индуцированное повышенной проницаемостью сосудов, связано с отеком и опуханием.
Потребность в активности Src-тирозинкиназы для VFGF (но не bFGF)-индуцированного ангиогенеза демонстрирует на обеих моделях, эмбрионах цыплят и мышах, что между этими путями существуют значительные различия в регуляции и активации сигналов, Eliceiri и др., Molecular Cell, 4: 915-924 (1999).
Изменения проницаемости сосудов вследствие ангиогенных сигналов из опухолевых клеток дают модель для проверки путей прохождения сигнала, относящегося к раковой опухоли, однако проницаемость сосудов вследствие травмы, заболевания или другого повреждения кровеносных сосудов является основной причиной протечки сосудов и отека, связанного с поражением ткани. Например, церебрососудистые заболевания, связанные с инсультом (CVA) или другим поражением сосудов головного мозга или спинномозговых тканей, являются наиболее общей причиной неврологических нарушений и основным источником потери трудоспособности. Обычно поражение ткани головного мозга или спинного мозга в области CVA включает проницаемость сосудов и/или отек. Обычно CVA может включать поражение, вызванное ишемией головного мозга, прерыванием нормального тока крови к мозгу; церебральную недостаточность вследствие кратковременных нарушений тока крови; инфаркт вследствие эмболии или тромбоза внутри- или внечерепной артерии; кровоизлияние и артериовенозные пороки. Ишемический удар и мозговое кровоизлияние могут развиваться резко, и тяжесть заболевания обычно отражает область поражения головного мозга (смотри The Merck Manual, 16th ed., Chp.123, 1992).
Отличные от CVA инфекции или заболевания центральной нервной системы (CNS) также могут влиять на кровеносные сосуды головного мозга и позвоночника и могут включать воспаление и отек, как, например, при бактериальном менингите, вирусном энцефалите и образовании абсцесса головного мозга (смотри The Merck Manual, 16th ed., Chp.125, 1992). Общие болезненные состояния, такие как диабет, болезнь почек, атеросклероз и подобные, также могут ослабить кровеносные сосуды и привести к проницаемости сосудов и отеку. Таким образом, проницаемость сосудов и отек являются опасными патологиями, отличными и независимыми от рака, которые нуждаются в эффективном специфическом терапевтическом вмешательстве в сочетании с разнообразными повреждениями, травмами или болезненными состояниями.
Авторы обнаружили, что селективное ингибирование активности тирозинкиназ семейства Src снижает повреждение или травмы, связанные с повышением VP в тканях, и в результате приводит к уменьшению патологии, относящейся к проницаемости кровеносных сосудов и/или отеку.
Краткое содержание изобретения
Целью настоящего изобретения является модуляция проницаемости сосудов (VP) посредством тирозинкиназы Src, также обозначенной здесь родовым термином Src, или тирозинкиназы Yes, также обозначенной здесь родовым термином Yes, или посредством селективного ингибирования активности тирозинкиназ семейства Src.
Таким образом, один аспект данного изобретения включает фармацевтические композиции для модуляции VP в целевой ткани млекопитающего. Композиции данного изобретения включают терапевтически эффективное VP-модулирующее количество смеси белков Src и Yes типа тирозинкиназ в фармацевтически приемлемом носителе.
В композициях, которые включают активные Src и Yes белки типа киназ, ожидаемая модуляция является усилением или увеличением проницаемости кровеносных сосудов в ткани-мишени. Если требуемый белок Src представляет активную киназу, предпочтительным Src является Src-A. Другим предпочтительным активным белком Src является белок, в котором аминокислотный остаток в положении 527 белка Src представляет собой любой аминокислотный остаток за исключением тирозина, серина или треонина. Предпочтительный активный белок Yes будет обладать активностью киназы Yes дикого типа человека, такой как белок Yes-1. Другим предпочтительным активным Yes является белок, в котором сайт инактивирующего киназу фосфорилирования белка Yes мутирован для уничтожения или минимизации инактивирующего фосфорилирования, аналогично мутации аминокислотного остатка 527 Src на любой аминокислотный остаток за исключением тирозина, серина или треонина.
Если композиция включает белки Src и Yes, которые являются неактивными белками киназами, ожидаемая модуляция представляет собой ингибирование или снижение проницаемости кровеносных сосудов в тканях-мишенях. Если требуемый белок Src представляет собой неактивный белок, то предпочтительным Src является Src 251. Еще одним предпочтительным неактивным Src является Src K295M. Предпочтительный неактивный белок Yes будет обладать уменьшенной киназной активностью по сравнению с диким белком.
Еще одним аспектом заявленного изобретения является фармацевтическая композиция, включающая терапевтически эффективное VP-модулирующее количество нуклеиновой кислоты, способной экспрессировать белок Src и Yes типа тирозинкиназы при трансфекции в клетку-мишень, в подходящем фармацевтическом носителе. Экспрессируемые нуклеиновые кислоты, кодирующие белки Src или Yes, могут включать сегменты нуклеиновых кислот, которые кодируют весь белок Src или Yes или его часть. При переносе в клетки-мишени данные клетки-мишени транскрибируют и транслируют последовательность нуклеиновой кислоты, осуществляя экспрессию желаемого белка.
Если модуляция является усилением или увеличением проницаемости кровеносных сосудов в ткани-мишени, Src-кодирующие нуклеиновые кислоты будут кодировать активные формы Src, и Yes-кодирующие нуклеиновые кислоты будут кодировать активные формы белков киназ Yes. Будучи перенесены в целевую клетку-хозяина, нуклеиновые кислоты будут экспрессироваться данной клеткой-хозяином. Предпочтительная Src-кодирующая нуклеиновая кислота кодирует активный белок Src-A. Другая предпочтительная Src-кодирующая нуклеиновая кислота кодирует мутированный активный Src, в котором аминокислотный остаток в положении 527 экспрессированного белка Src представляет собой любой аминокислотный остаток за исключением тирозина, серина или треонина. Предпочтительная Yes-кодирующая нуклеиновая кислота кодирует белок дикого типа или белок, модифицированный с целью уничтожения или ингибирования сайта инактивирующего фосфорилирования белка Yes, аналогично описанной мутации в положении 527 белка Src.
Если описанная модуляция представляет ингибирование или снижение проницаемости кровеносных сосудов в целевых тканях, то предпочтительная нуклеиновая кислота, кодирующая неактивный Src, кодирует белок Src 251. Еще одна предпочтительная нуклеиновая кислота, кодирующая неактивный Src, кодирует неактивный Src K295M. Предпочтительная нуклеиновая кислота, кодирующая неактивный Yes, кодирует белок, который обладает уменьшенной активностью киназы.
Предполагается, что композиции данного изобретения могут включать смесь нуклеиновых кислот, где каждая нуклеиновая кислота может включать экспрессируемый Src или Yes-ген. Кроме того, предполагается, что отдельная нуклеиновая кислота может включать и нуклеиновую кислоту, кодирующую белок Src, и нуклеиновую кислоту, кодирующую белок Yes. Для усовершенствованной модуляции ангиогенеза и VP в тканях-мишенях фармацевтические композиции данного изобретения могут включать смесь активного и неактивного белка Src типа тирозинкиназы, или белка Yes типа тирозинкиназы. Аналогично, фармацевтические композиции данного изобретения могут включать смесь нуклеиновых кислот, способных экспрессировать активный или неактивный белок Src или белок Yes типа тирозинкиназы.
Применяя различные количества первой тирозинкиназы вместе с большим количеством второй тирозинкиназы, можно согласно данному изобретению достичь усовершенствованной модуляции ангиогенеза и VP. В данном варианте, применяя по-разному экспрессируемые промоторы или другие подобные регуляторные элементы, можно согласно данному изобретению совместно вводить первый низко экспрессирующий первую тирозинкиназу ген и второй высоко экспрессирующий вторую тирозинкиназу ген. В данном варианте усиление ангиогенеза можно также достичь, поддерживая, доводя до минимума или снижая VP при использовании первого низкоэкспрессирующего активный Src гена в комбинации со вторым высокоэкспрессирующим неактивный Yes геном. Такое совместное введение можно выполнить, используя отдельные экспрессионные векторы или единую векторную конструкцию для объединенной экспрессии. Аналогично, снижение ангиогенеза можно также достичь, поддерживая, активируя или повышая VP при использовании первого низкоэкспрессирующего неактивный Src гена в комбинации со вторым высокоэкспрессирующим активный Yes геном. Кроме того, можно достичь различных степеней модуляции посредством различных перестановок высоко/низко и Src/Yes в комбинации с выбором активности промоторных элементов и индуцируемых промоторов.
Предполагается, что индивидуальные гены Src или Yes могут находиться под регулирующим контролем одинаковых или разных регуляторных последовательностей нуклеиновых кислот, таких как, но не ограничиваясь ими, энхансерные, репрессорные и промоторные элементы. Если два или более белков экспрессируются из единого вектора, предполагается, что регуляция и контроль транскрипции независимых белковых генов могут находиться под контролем одних и тех же регуляторных элементов. Предполагается также, что на регуляцию и контроль транскрипции могут влиять два или более независимо действующих регуляторных элементов. Регуляторные элементы известны в данной области и могут представлять собой констиционно активные или индуцируемые, энхансерные, промоторные, супрессорные или подобные последовательности нуклеиновых кислот.
Предполагается, что композиции нуклеиновых кислот данного изобретения могут включать вирусный и/или невирусный вектор переноса гена, содержащий сегмент нуклеиновой кислоты, кодирующий белок Src и/или Yes. Ретровирусные и невирусные векторы переноса гена и экспрессии известны в данной области и кратко описаны ниже.
Предпочтительная нуклеиновая кислота кодирует белок Src-A. Другим предпочтительным активным белком Src является тот, в котором аминокислотный остаток в положении 527 белка Src представляет собой любой аминокислотный остаток за исключением тирозина, серина или треонина.
Предполагается, что смесь белков Src и Yes и/или нуклеиновой кислоты, кодирующей такие белки, согласно настоящему изобретению может объединять активные и неактивные формы белка в зависимости от желаемого уровня модуляции и соответствующего желаемого влияния на ангиогенез и VP.
Композиция, обеспечивающая белок Src или Yes, может содержать очищенный белок, биологически активные фрагменты природного белка, рекомбинантно продуцированный белок Src или Yes, или фрагменты белка, или слитые белки, или векторы экспрессии гена/нуклеиновой кислоты для экспрессии белка Src или Yes, или их смеси.
Если белок Src или Yes инактивируют или ингибируют, модуляция представляет собой ингибирование VP. Если белок Src или Yes является активным или его активируют, то модуляция представляет активацию VP.
Настоящее изобретение включает способы обработки тканей млекопитающих композицией, включающей терапевтически эффективное VP-модулирующее количество белка Src или Yes или их комбинации. В способах данного изобретения белки Src или Yes типа тирозинкиназы или векторы экспрессии нуклеиновых кислот, способные обеспечить экспрессию такого белка, вводят в ткань, подверженную болезненному состоянию, которая реагирует на модуляцию VP.
Если желательным терапевтически эффективным VP-модулирующим действием является увеличение или активация VP, предполагают, что можно вводить активные формы белка Src и/или Yes. Аналогично, данные способы включают введение экспрессируемых нуклеиновых кислот, которые кодируют активные или неактивные формы белка Src и/или Yes, соответственно.
Подлежащая обработке ткань может быть любой тканью, в которой желательна модуляция VP. Терапевтическую обработку выполняют посредством контакта "ткани-мишени с эффективным количеством желаемой модулирующей композиции и обеспечивают достаточное время контакта белкового компонента или нуклеиновых кислот фармацевтического препарата для проникания в ткань-мишень. Для ингибирования VP полезно обработать нездоровую ткань, где происходит пагубная протечка сосудов. Примеры тканей включают воспаленную ткань, ткани, связанные с "ударом", инфарктом миокарда или другой блокировкой нормального тока крови, ткани, подверженные рестенозу, и подобные.
Что касается активации, полезно лечить пациентов с ишемическими конечностями, у которых слабое кровообращение в конечностях от диабета или других состояний, или для активации введения лекарственных препаратов в головной мозг через барьер кровь-головной мозг. Можно лечить пациентов с хроническими ранами, которые не заживают, и для которых может быть полезно повышение пролиферации клеток сосудов и новообразование кровеносных сосудов, которые модулируются VP.
Еще одним аспектом настоящего изобретения являются промышленные продукты, которые включают упаковочный материал и фармацевтическую композицию внутри указанного упаковочного материала, причем указанная фармацевтическая композиция способна модулировать проницаемость сосудов в ткани, подверженной болезненному состоянию, указанный упаковочный материал имеет этикетку, на которой указано, что данную фармацевтическую композицию можно применять для лечения болезненных состояний посредством модуляции проницаемости сосудов, и указанная фармацевтическая композиция включает терапевтически эффективное количество белка Yes типа тирозинкиназы в фармацевтически приемлемом носителе. Данный вариант включает белок Yes в активной или неактивной форме, а также нуклеиновые кислоты, кодирующие активный или неактивный белок Yes. Ретровирусные и невирусные векторы переноса/экспрессии гена могут содержать сегмент нуклеиновой кислоты, кодирующий белок Yes, в активной или неактивной форме, или оба. Если присутствуют обе формы гена протеинкиназы, активная и неактивная, то предполагают, что гены находятся под контролем отдельного индуцируемого промотора, допускающего, если требуется, альтернативную экспрессию.
Еще одним аспектом настоящего изобретения являются промышленные продукты, в которых фармацевтическая композиция включает терапевтически эффективное VP-модулирующее количество белка Src и Yes типа тирозинкиназы в фармацевтически приемлемом носителе. Там, где промышленный продукт упакован с указанием активирующего VP-модулирующего действия, Src и Yes находятся в активной форме. Предпочтительным активным Src является белок Src-A. Другим предпочтительным активным белком Src является белок, в котором аминокислотный остаток в положении 527 белка Src представляет собой любой аминокислотный остаток за исключением тирозина, серина или треонина.
Еще одним аспектом настоящего изобретения являются промышленные продукты, которые включают фармацевтическую композицию, причем указанная фармацевтическая композиция содержит терапевтически эффективное VP-модулирующее количество неактивного белка Src и Yes типа тирозинкиназы в фармацевтически приемлемом носителе, где желаемая модуляция является инактивацией или ингибированием VP. Предпочтительным неактивным Src является белок Src 251. Другим предпочтительным неактивным белком Src является Src K295M.
Аналогично, еще одним аспектом настоящего изобретения являются промышленные продукты, в которых фармацевтическая композиция включает нуклеиновую кислоту, способную экспрессировать белок Src и Yes типа тирозинкиназы, в фармацевтически приемлемом носителе. Предпочтительная нуклеиновая кислота-компонент фармацевтической композиции данного промышленного продукта кодирует активный белок Src, при этом желаемая модуляция является увеличением или активацией VP. Еще предусмотрена нуклеиновая кислота, кодирующая активный белок Yes. Предпочтительным активным Src является белок Src-A. Другой предпочтительной нуклеиновой кислотой, кодирующей активный Src, является та, в которой аминокислотный остаток в положении 527 белка Src представляет собой любой аминокислотный остаток за исключением тирозина, серина или треонина. Предполагается также, что можно сконструировать отдельную нуклеиновую кислоту, которая обеспечит экспрессию обоих белков Src и Yes, или регулируемых независимо или под транскрибционным контролем одного и того же промотора, энхансера, супрессора, репрессора или другой подходящей регуляторной последовательности нуклеиновой кислоты.
Поражение ткани, связанное с протечкой сосудов, и/или отек вследствие пагубных изменений в проницаемости сосудов можно уменьшить при помощи ингибиторов тирозинкиназ семейства Src. С этой целью в нуждающуюся в таком лечении ткань вводят эффективное модулирующее проницаемость сосудов количество ингибиторов тирозинкиназ семейства Src. Таким образом можно уменьшить поражение ткани вследствие протечки сосудов или отека.
В частности, настоящее изобретение обеспечивает способ ингибирования увеличения проницаемости сосудов в ткани, подверженной болезненному состоянию, которое связано с протечкой сосудов и/или отеком, посредством контакта указанной ткани с терапевтически эффективным ингибирующим проницаемость сосудов количеством ингибитора тирозинкиназ семейства Src вместе с фармацевтически приемлемым носителем. В предпочтительном варианте в ткань вводят специфический ингибитор тирозинкиназы Src.
Данным способом можно лечить любые патологии, которые включают вызванное травмами губительное повышение проницаемости сосудов и поражение тканей вследствие протечки сосудов или отека. Патологические случаи могут включать травмы кровеносных сосудов, такие как физическое лигирование, блокада, отделение, закупорка, травма и подобное. Другие общие патологические случаи, такие как атеросклероз, диабетическая ретинопатия, воспалительные заболевания вследствие заражения микробными агентами, артрит и подобные, также подходят для лечения способом данного изобретения.
Способы данного изобретения полезны для лечения церебрососудистого заболевания или травмы посредством уменьшения поражения ткани, вызванного увеличением протечки сосудов и/или связанным с ним отеком. В частности, способы настоящего изобретения полезны для уменьшения поражения ткани, связанного с индуцированным сосудистым эндотелиальным фактором роста (VEGF) Src-опосредованным увеличением проницаемости сосудов. Однако способы данного изобретения не ограничены VEGF-индуцированными увеличениями проницаемости сосудов, а подходят также для модуляции увеличения проницаемости сосудов, опосредованного тирозинкиназой семейства Src, в ответ на другие регуляторные сигналы.
В частности, путем ингибирования тирозинкиназы Src (также обозначенной здесь родовым термином Src) и близкородственной тирозинкиназы Yes (также обозначенной здесь родовым термином Yes) обработанные ткани можно специфически модулировать с ингибированием в них повышения проницаемости сосудов, связанного с повреждением или заболеванием.
Подходящим для целей настоящего изобретения ингибитором тирозинкиназы семейства Src является химический ингибитор, выбранный из группы, включающей РР1, РР2, PD173955, AGL1872, PD162531, радицикол R2146 и гелданамицин. Другие химические ингибиторы тирозинкиназ семейства Src также подходят для применения в способах данного изобретения.
Проницаемость сосудов в ткани можно также модулировать, вводя в ткань ингибитор тирозинкиназы семейства Src, который представляет собой белок-ингибитор, такой как неактивный белок Src, например, Src K295M или Src 251, или неактивный белок Yes, или активный белок С-концевой Src-киназы (CSK).
Для модуляции проницаемости сосудов в ткани подходит также нуклеиновая кислота, кодирующая белковый ингибитор тирозинкиназы семейства Src, такой как неактивный Src, неактивный Yes или активный белок CSK. Такие нуклеиновые кислоты-ингибиторы активности тирозинкиназ семейства Src могут включать один или более ретровирусных векторов экспрессии, невирусных векторов экспрессии или подобных. Данные нуклеиновые кислоты-ингибиторы могут содержать подходящие регуляторные сигналы, такие как промоторы или энхансеры для одного или большего количества экспрессируемых сегментов нуклеиновой кислоты на любой данной нуклеиновой кислоте.
Еще в одном аспекте настоящего изобретения промышленные препараты включают упаковочный материал и фармацевтическую композицию внутри указанного упаковочного материала, причем указанная фармацевтическая композиция способна модулировать проницаемость сосудов в ткани, подверженной болезненному состоянию. Упаковочный материал имеет этикетку, на которой указано, что данную фармацевтическую композицию можно применять для лечения проницаемости сосудов или отеков, связанных с болезненными состояниями, и указанная фармацевтическая композиция включает терапевтически эффективное количество ингибитора тирозинкиназы семейства Src в фармацевтически приемлемом носителе.
Промышленный препарат данного изобретения может содержать в качестве части фармацевтической композиции ингибитор тирозинкиназы семейства Src, который является химическим ингибитором. В частности, предпочтительный химический ингибитор тирозинкиназы семейства Src выбирается из группы, включающей РР1, РР2, PD173955, AGL1872, PD162531, радицикол R2146 и гелданамицин, или соединений с аналогичной Src-ингибирующей активностью. Наиболее предпочтительным ингибитором является РР1.
Промышленный препарат данного изобретения включает также указанную фармацевтическую композицию, содержащую белковый ингибитор тирозинкиназы семейства Src, который представляет собой неактивный белок Src, такой как Src K295M или Src 251, неактивный белок Yes или активный белок CSK.
В противоположном варианте, фармацевтическая композиция включает нуклеиновую кислоту, кодирующую ингибитор тирозинкиназы семейства Src, в фармацевтически приемлемом носителе. В такой фармацевтической композиции ингибитор, который кодирует указанная нуклеиновая кислота, может быть неактивным белком Src, таким как Src K295M или Src 251, неактивным белком Yes или активным белком CSK.
Промышленные препараты могут включать одну- или более фармацевтических композиций, которые содержат терапевтические количества ингибиторов тирозинкиназ семейства Src или субтерапевтические количества более чем одного ингибитора тирозинкиназ семейства Src в фармацевтически приемлемом носителе.
Фармацевтические композиции промышленных препаратов данного изобретения могут включать смесь одного или более субтерапевтически эффективных VP-модулирующих количеств ингибитора тирозинкиназы семейства Src, которые действуют вместе, обеспечивая эффект снижения VP в обработанной ткани. Фармацевтическую композицию промышленного препарата можно изменять в зависимости от желаемого модуляторного действия, и также соответственно меняют этикетку на упаковке.
Фармацевтическую композицию промышленного препарата можно менять в зависимости от желаемого модуляторного или ингибирующего действия, и также соответственно меняют этикетку на упаковке.
Краткое описание чертежей
На чертежах, составляющих часть данного описания:
На ФИГ.1 приведена последовательность кДНК c-Src цыпленка, которая представляет полную кодирующую последовательность с удаленными интронами, как впервые было описано Takeya и др., Cell, 32: 881-890 (1983). Данная последовательность доступна от GenBank, номер доступа J00844. Последовательность содержит 1759 нуклеотидов, кодирующая белок часть начинается и заканчивается, соответственно, в положениях нуклеотидов 112 и 1713 (SEQ ID NO: 2).
На ФИГ.2 приведена последовательность аминокислотных остатков c-Src цыпленка, кодированная последовательностью, показанной на ФИГ.1 (SEQ ID NO: 3).
На ФИГ.3 приведена последовательность кДНК c-Src человека, которая впервые была описана Braeuninger и др., Proc. Natl. Acad. Sci., USA, 88: 10411-10415 (1991). Данная последовательность доступна от GenBank, номер доступа Х59932 Х71157. Последовательность содержит 2187 нуклеотидов, кодирующая белок часть начинается и заканчивается, соответственно, в положениях нуклеотидов 134 и 1486 (SEQ ID NO: 4).
На ФИГ.4 приведена последовательность аминокислотных остатков c-Src человека, кодированная последовательностью, показанной на ФИГ.3 (SEQ ID NO: 5).
ФИГ.5 иллюстрирует активацию эндогенного Src посредством bFGF или VEGF, как описано в примере 4. Верхняя часть фигуры показывает результаты in vitro исследования киназы с кратной активацией эндогенного c-Src посредством bFGF или VEGF. Нижняя часть фигуры представляет блот исследования киназы с использованием в качестве зонда анти-Src антитела как контроля загрузки на эквивалентное содержание Src и IgG.
ФИГ.6 иллюстрирует влияние ретровирус-опосредованной генной экспрессии c-Src А на ангиогенез в САМ цыпленка, как описано в примере 4. САМ девятидневных цыплят подвергали воздействию ретровирусов RCAS-Src А (активный мутированный с-Src), или контрольного RCAS-GFP (зеленый флуоресцентный белок; белок-индикатор флуоресценции), или буфера в течение 72 час. Количественно определяли степень ангиогенеза, как показано на ФИГ.6А, с типичными микрофотографиями (4х) на ФИГ.6В, соответствующими каждой обработке с применением стереомикроскопа.
ФИГ.7 иллюстрирует ретровирусную экспрессию c-Src А при активации фосфорилирования сосудистой киназы MAP. На ФИГ.7А показаны экстракты тканей САМ 10-дневных цыплят, которые были подвержены действию VEGF или РМА в течение 30 минут или инфицированы ретровирусом c-Src А в течение 48 час. NT обозначает отсутствие обработки. Src подвергают иммунопреципитации из эквивалентных количеств общего белкового экстракта и проводят иммунное комплексное исследование киназы in vitro, используя слитый белок FAK-GST в качестве субстрата, проводят электрофорез и переносят на нитроцеллюлозу. Аликвоты описанных выше лизатов ткани также оценивали на фосфорилирование эндогенного ERK посредством иммуноблоттинга с анти-фосфо-ERK антителом. На ФИГ.7В показаны 10-дневные САМ, которые инфицированы либо фиктивными RCAS, либо RCAS, содержащим Src А. Через два дня САМ иссекали, криоконсервировали в ОСТ и делали срезы по 4 мкм. Проводили иммуноокрашивание срезов антителом против фосфорилированного ERK (New England Biolabs), промывали и детектировали, используя антикроличье FITS конъюгированное вторичное антитело козы. Флуоресцентные изображения, получали при помощи охлажденной CCD-камеры (Princeton Inst.).
ФИГ.8 иллюстрирует селективную потребность в Src-активности для VEGF, но не bFGF-индуцированного ангиогенеза. САМ девятидневных цыплят подвергали действию ретровирусов RCAS-Src 251 или контрольного RCAS-GFP или буфера в течение 20 часов и затем инкубировали еще 72 часа в присутствии или в отсутствие bFGF или VEGF. Степень ангиогенеза определяли количественно, как описано выше (ФИГ.8А), и при помощи стереомикроскопа получали типичные микрофотографии (6х), показанные на ФИГ.8В. На ФИГ.8С показан блот с использованием в качестве зонда анти-Src антитела для подтверждения экспрессии Src 251 в трансфецированных клетках по сравнению с фиктивными обработками.
ФИГ.9 иллюстрирует результаты ретровирусной доставки RCAS-Src 251 к опухолям человека. На ФИГ.9А представлена микрофотография, которая показывает фрагмент опухоли медуллобластомы человека, инфицированной RCAS-GFP (RCAS-зеленый флуоресцентный белок), экспрессирующим GFP исключительно в кровеносных сосудах опухоли (стрелка), как определяют по оптическим сечениям при помощи лазерного конфокального сканирующего микроскопа Bio Rad (полоса=500 мкм). На ФИГ.9В изображены данные от опухолей, обработанных путем локального нанесения ретровируса, которые оставляют расти в течение 3 или 6 дней, после чего их иссекают и определяют вес во влажном состоянии. Данные выражены как среднее изменение массы опухоли (от исходной массы опухоли 50 мг) +/- среднеквадратичное отклонение из 2 повторов. На ФИГ.9С на представленных микрофотографиях изображены опухоли медуллобластомы, хирургически удаленные из эмбрионов (полоса = 500 мкм). Нижние картинки - это изображения каждой из опухолей с большим увеличением, подробно показывающие сосудистую систему каждой опухоли (полоса = 350 мкм). Стрелка показывает разрыв кровеносного сосуда в опухолях, обработанных RCAS-Src 251.
На ФИГ.10 представлена диаграмма, иллюстрирующая карту рестрикции векторной конструкции RCASBP (RCAS) (SEQ ID NO: 1).
На ФИГ.11 изображена кодированная последовательность аминокислотных остатков белка c-Yes человека с обозначением аминокислот одной буквой (SEQ ID NO: 8).
На ФИГ.12 изображена нуклеотидная последовательность кДНК, кодирующая белок c-Yes человека. Данная последовательность доступна от GenBank, номер доступа М15990. Последовательность содержит 4517 нуклеотидов, кодирующая белок часть начинается и заканчивается, соответственно, в положениях нуклеотидов 208 и 1839 и транслируется в аминокислотную последовательность, изображенную на ФИГ.11 (SEQ ID NO: 7).
На ФИГ.13 представлены результаты ретровирусной доставки Src 251 и CSK на подкожной мышиной модели ангиогенеза. ФИГ.13А иллюстрирует результаты иммуноблоттинга по детектированию экспрессии flk. ФИГ.13В иллюстрирует результаты иммуноблоттинга из исследования flk в условиях VFGF- и bFGF-стимулирования. На ФИГ.13С представлена диаграмма, которая показывает количество CD34-положительных кровеносных сосудов (среднее значение из трех случайно выбранных областей при 20х) при обработке с VEGF- и bFGF-стимулированием в присутствии ретровируса GFP, Src 251 или CSK.
ФИГ.14 иллюстрирует результаты модифицированного исследования Майлса для VP VEGF в коже мышей с дефицитом Src, fyn и Yes. На ФИГ.14А показаны фотографии обработанных ушей. На ФИГ.14В приведены диаграммы экспериментальных результатов для стимуляции мышей с различным дефицитом. На ФИГ.14С показано количество элюированного синего красителя Эвана при обработке.
На ФИГ.15 представлена диаграмма, обозначающая относительный объем инфаркта у мышей Src +/-, Src -/-, дикого типа (WT) и дикого типа, обработанных РР1. Обработка РР1 составляла 1,5 мг/кг массы тела.
На ФИГ.16 показаны последовательные MRI-сканирования головного мозга мышей, обработанных контролем и РР1, показывающие меньший объем инфаркта головного мозга у животных, обработанных РР1 (справа), чем у контрольных животных (слева).
Подробное описание изобретения
А. Определения
Аминокислотный остаток: аминокислота, полученная путем химического расщепления (гидролиза) полипептида по его пептидным связям. Описанные здесь аминокислотные остатки предпочтительно находятся в виде "L"-изомерной формы. Однако любые L-аминокислотные остатки могут быть заменены "D"-изомерными формами до тех пор, пока полипептид сохраняет желаемые функциональные свойства. NH2 обозначает свободную аминогруппу, присутствующую на амино-конце полипептида. СООН обозначает свободную карбоксильную группу, присутствующую на карбокси-конце полипептида. Согласно стандартной номенклатуре полипептидов, описанной в J. Biol. Chem., 243: 3552-59 (1969) и адаптированной в 37 CFR 1.822(b) (2).
Следует отметить, что все последовательности аминокислотных остатков представлены здесь формулами, в которых левая и правая ориентация находятся в обычном направлении от амино-конца к карбокси-концу. Кроме того, необходимо отметить, что тире в начале или в конце аминокислотной последовательности указывает пептидную связь с другой последовательностью из одного или большего количества аминокислотных остатков.
Полипептид: обозначает линейные серии аминокислотных остатков, связанных друг с другом пептидными связями между альфа-аминогруппой и карбоксильной группой смежных аминокислотных остатков.
Пептид: термин использован здесь для обозначения линейных серий не более 50 аминокислотных остатков, связанных друг с другом как в полипептиде.
Циклический пептид: обозначает соединения, имеющие гетероатомную кольцевую структуру, которая включает несколько амидных связей как в типичном пептиде. Циклический пептид может быть гомодетичным «голова к хвосту» циклизованным линейным полипептидом, в котором N-конец линейного пептида образует амидную связь с С-концевым карбоксилатом линейного пептида, или он может содержать кольцевую структуру, в которой полимер является гетеродетичным и включает амидные связи и/или другие связи для замыкания цикла, такие как дисульфидные мостики, тиоэфиры, тиоамиды, гуанидино и подобные связи.
Белок: обозначает линейные серии более 50 аминокислотных остатков, связанных друг с другом как в полипептиде.
Слитый белок: обозначает полипептид, содержащий, по меньшей мере, два различных полипептидных домена, оперативно связанных типичной пептидной связью («слитый»), где два домена соответствуют пептидам, не обнаруженным в природе в слитом виде.
Синтетический пептид: обозначает химически полученную цепь аминокислотных остатков, связанных друг с другом пептидными связями, которая представляет свободные или встречающиеся в природе белки и их фрагменты.
В. Общее обсуждение
В целом настоящее изобретение касается: (1) открытия, что VEGF-индуцированная VP специфически опосредована белками Src и Yes типа тирозинкиназы, и что VP можно модулировать, обеспечивая активные или неактивные белки Src или Yes для активации или ингибирования ангиогенеза, соответственно; (2) еще одного открытия, что протечку сосудов и/или отек, связанный с травмой, заболевание от вызванного поражением увеличения проницаемости сосудов можно специфически модулировать и облегчать посредством ингибирования активности тирозинкиназ семейства Src; (3) открытия, что in vivo введение ингибитора тирозинкиназы семейства Src снижает поражение ткани вследствие вызванного заболеванием или повреждением увеличения проницаемости сосудов, не связанной с раком или ангиогенезом.
Данное открытие является важным из-за роли, которую проницаемость сосудов играет в разнообразных болезненных процессах, и в связи с ангиогенезом, образованием новых кровеносных сосудов. Если тканям, связанным с болезненным состоянием, требуется ангиогенез для роста ткани, желательно ингибировать ангиогенез и тем самым ингибировать рост больной ткани. Ангиогенез можно более эффективно ингибировать при одновременном ингибировании VP. Если поврежденной ткани требуется ангиогенез для роста и заживления, желательно активировать или стимулировать VP и, следовательно, ангиогенез и тем самым стимулировать заживление и рост ткани.
Если рост новых кровеносных сосудов является причиной патологии, связанной с заболеванием ткани, или вносит вклад в указанную патологию, то ингибирование VP и, следовательно, ангиогенеза будет снижать вредные эффекты заболевания. Путем ингибирования VP, связанной с ангиогенезом, можно влиять на болезнь, облегчать симптомы и в некоторых случаях вылечить заболевание.
В некоторых случаях повышенная VP желательна для увеличения эффективности доставки лекарства путем системного введения. Термин «барьер кровь-головной мозг» используют для описания жесткой регуляции VP и, следовательно, минимального доступа лекарств, даже в виде малых молекул, к мозгу из системы кровообращения. Способность селективно и специфически модулировать проницаемость кровь-головной мозг посредством модуляции VP вовлеченных кровеносных сосудов позволит осуществить введение лекарственных препаратов, которые никак иначе не могут попасть из системы кровообращения в ткани головного мозга.
Аналогично, многие вызванные "ударом" патологии и поражениях, провоцируются внезапным повышением VP и, следовательно, способность специфически модулировать VP даст новые и эффективные способы лечения по снижению нежелательных эффектов "удара".
Способы настоящего изобретения эффективны отчасти вследствие высокой селективности данной терапии относительно VP, но не других биологических процессов.
Настоящее изобретение частично касается открытия, что ангиогенез опосредован белком Src типа тирозинкиназы, и что ангиогенез можно модулировать, обеспечивая активные или неактивные белки Src, соответственно, для активации или ингибирования ангиогенеза.
Данное открытие важно, благодаря роли, которую ангиогенез, образование новых кровеносных сосудов, играет в различных болезненных процессах. Если тканям, связанным с болезненным состоянием, требуется ангиогенез для роста ткани, необходимо ингибировать ангиогенез и тем самым ингибировать рост больной ткани. Если поврежденной ткани требуется ангиогенез для роста и заживления, желательно активировать или стимулировать ангиогенез и тем самым стимулировать заживление и рост ткани.
Если рост новых кровеносных сосудов является причиной патологии, связанной с заболеванием ткани, или вносит вклад в указанную патологию, то ингибирование ангиогенеза будет снижать вредные эффекты заболевания. Путем ингибирования ангиогенеза можно влиять на болезнь, облегчать симптомы и в некоторых случаях вылечить заболевание.
Примеры тканей, связанных с заболеванием и новообразованием сосудов, которые получают пользу от ингибирующей модуляции ангиогенеза, включают ревматоидный артрит, диабетическую ретинопатию, воспалительные заболевания, рестеноз и подобные. Если рост новых кровеносных сосудов требуется для поддержания роста пагубной ткани, то ингибирование ангиогенеза будет снижать кровоснабжение ткани и тем самым способствовать снижению массы ткани на основе требований кровоснабжения. Примеры включают рост опухолей, где новообразование сосудов является постоянным требованием разрастания опухоли до толщины свыше нескольких миллиметров и образования твердых метастазов опухоли.
Если полагают, что рост новых кровеносных сосудов способствует излечению ткани, то активация ангиогенеза будет способствовать выздоровлению. Примеры включают лечение пациентов с ишемическими конечностями, у которых слабое кровообращение в конечностях вследствие диабета или других состояний. Также подразумеваются пациенты с хроническими ранами, которые не заживают, и, таким образом, можно получить пользу от повышения пролиферации клеток сосудов и новообразования кровеносных сосудов.
Способы настоящего изобретения эффективны отчасти, благодаря высокой селективности данной терапии относительно ангиогенеза, но не других биологических процессов.
Как описано ранее, ангиогенез включает разнообразные процессы, включающие новообразование сосудов ткани, в том числе «образование отростков», возникновение сосудов или увеличение сосудов, на все из перечисленных процессов ангиогенеза влияет белок Src. Считают, что большинство процессов ангиогенеза связано с болезненными процессами, за исключением заживления травматических ран, образования желтого тела и эмбриогенеза, и, следовательно, применение данных терапевтических способов является селективным относительно заболевания и не имеет вредных побочных эффектов.
Настоящее изобретение отчасти касается также открытия, что протечку сосудов и/или отек, связанный с травмой, заболевание от вызванного поражением увеличения проницаемости сосудов можно специфически модулировать и облегчать посредством ингибирования активности тирозинкиназ семейства Src. В частности, настоящее изобретение касается открытия, что in vivo введение ингибитора тирозинкиназы семейства Src снижает повреждение ткани вследствие вызванного заболеванием или повреждением увеличения проницаемости сосудов, не связанного с раком или ангиогенезом.
При том, что введение ингибитора тирозинкиназы семейства Src модулирует VEGF-индуцированное увеличение VP, специфическое ингибирование активности тирозинкиназ семейства Src снижает поражение окружающих тканей, вызванное протечкой сосудов и/или отеком, однако сигнал киназы семейства Src активируется.
Проницаемость сосудов вовлечена в разнообразные болезненные процессы, независимо ни от каких прямых связей с ангиогенезом. Например, причиной многих патологий и поражений, вызванных "ударом", является резкое повышение VP вследствие травмы кровеносного сосуда и, следовательно, способность специфически модулировать VP даст новые и эффективные способы лечения по снижению нежелательных эффектов "удара".
Примеры тканей, связанных с вызванной заболеванием или поражением протечкой сосудов и/или отеком, которые получат пользу от специфической ингибирующей модуляции с использованием ингибитора киназы семейства Src, включают ревматоидный артрит, диабетическую ретинопатию, воспалительные заболевания, рестеноз и подобные.
Травма головы или позвоночника и другие цереброваскулярные инциденты, обычно вызванные ишемическими или геморрагическими случаями, являются основной причиной неврологических нарушений или связанных с этим поражений. Отек головного мозга или протечка сосудов в результате таких поражений представляют угрожающую жизни патологию, которая вызывает общее или диссеминированное поражение головного мозга и спинного мозга (центральной нервной системы; CNS), и способность специфически модулировать эффекты поражения ткани при протечке сосудов и/или отеке в таких случаях очень полезна.
Инфекции CNS, менингит, воспаление головного мозга, энцефалит могут давать нежелательную патологию, включая отек головного мозга. Лечение указанной инфекции можно дополнить специфической терапией по снижению протечки сосудов или отека.
Сообщалось, что общая нейтрализация белка VEGF с использованием VEFG-рецептор-IgG слитого белка снижает объем инфаркта после церебральной ишемии, данный эффект приписан снижению VEGF-опосредованной проницаемости сосудов, N. van Bruggen и др., J. Clin. Inves., 104: 1613-1620 (1999). Однако VEGF не является критичным медиатором повышения проницаемости сосудов, как теперь обнаружено, им является Src.
Другие заболевания и состояния, в которые вовлечено Src-опосредованное повышение проницаемости сосудов, и которые, таким образом, являются подходящими мишенями для лечения данными способами с применением композиций настоящего изобретения, могут включать: церебральное кровоизлияние, травмы головного и спинного мозга, вызванное гипоксией поражение головного и спинного мозга; воспалительные заболевания CNS: вирусные или бактериальные инфекции (например, менингит, ВИЧ-энцефалопатия), аутоиммунные нарушения (например, множественный склероз); заболевания с хроническим повышением проницаемости барьера кровь-головной мозг (например, болезнь Альцгеймера); как защитный агент при хирургических операциях, где необходимо временное уменьшение перфузии или оксигенации ткани; респираторный дистресс-синдром взрослых (ARDS); ревматоидный артрит и диабетическую ретинопатию.
С. Белки типа тирозинкиназ семейства Src
Белок типа тирозинкиназы для применения в настоящем изобретении может варьировать в зависимости от предназначения. Термины «белок Src» или «Src» использованы для обозначения в целом различных форм описанного здесь белка Src типа тирозинкиназы или в активной, или неактивной формах. Термины «белок Yes» или «Yes» использованы для обозначения в целом различных форм описанного здесь белка Yes типа тирозинкиназы или в активной, или неактивной формах. В контексте описания также сделана ссылка на Src- или Yes-кодирующие генетические последовательности нуклеиновых кислот или гены. Термин «семейство Src» относится к группе тирозинкиназ, которые родственны Src по функции и аминокислотной последовательности.
Термин «активный белок Src» относится к любой из разнообразных форм белка Src, которая активирует ангиогенез или VP. Термин «активный белок Yes» относится к любой из разнообразных форм белка Yes, которая активирует VP. Описанные здесь исследования по определению активации ангиогенеза или VP не должны рассматриваться как ограничивающие. Белок считается активным, если степень ангиогенеза или VP, по меньшей мере, на 10% больше, предпочтительно на 25% больше и более предпочтительно на 50% больше контрольного уровня, когда к исследуемой системе не добавляют белок.
Предпочтительным исследованием для определения активации ангиогенеза является исследование САМ с использованием вирусного вектора RCAS, как описано в примерах, где рассчитывают ангиогенный индекс путем подсчета точек разветвления.
Предпочтительным исследованием для определения активации VP является исследование Майлса с использованием синего красителя Эвана на мышах, как описано в примерах, где VP определяют по количеству синего красителя Эвана, просочившегося из кровеносных сосудов.
Предпочтительный активный белок Src или Yes демонстрирует, кроме того, активность тирозинкиназы. Примеры активных белков Src или Yes описаны в примерах и включают Src-A и Yes-1.
Термин «неактивный белок Src» относится к любой из разнообразных форм белка Src, которая ингибирует ангиогенез или VP. Термин «неактивный белок Yes» относится к любой из разнообразных форм белка Yes, которая ингибирует VP. Описанные здесь исследования по определению ингибирования повышения VP не должны рассматриваться как ограничивающие. Белок Src считается неактивным, если степень ангиогенеза, по меньшей мере, на 10% ниже, предпочтительно на 25% ниже и более предпочтительно на 50% ниже контрольного уровня, когда к исследуемой системе не добавляют экзогенный белок Src.
Белок Src или Yes считается неактивным, если степень VP является, по меньшей мере, той же самой или на 10% ниже, предпочтительно на 25% ниже и более, предпочтительно на 50% ниже контрольного уровня, когда к системе для исследования не добавлен экзогениал Src или Yes.
Предпочтительным исследованием для определения ингибирования ангиогенеза является исследование САМ с использованием вирусного вектора RCAS, как описано в примерах, где рассчитывают ангиогенный индекс путем подсчета точек разветвления.
Предпочтительным исследованием для определения ингибирования VP является исследование Майлса с использованием синего красителя Эвана на мышах, как описано в примерах, где VP определяют по количеству синего красителя Эвана, просочившегося из кровеносных сосудов.
Предпочтительный неактивный белок Src или Yes, кроме того, демонстрирует пониженную активность тирозинкиназы. Примеры неактивных белков Src описаны в примерах и включают Src 251 и Src K295M.
Белок Src, полезный в настоящем изобретении, можно получить любым из разнообразных способов, включая выделение из природных источников, включающих ткани, получение путем экспрессии рекомбинантной ДНК и очистки и др. Белок Src и/или Yes можно также обеспечить in situ посредством введения в интересующую ткань системы генной терапии, которая затем экспрессирует белок в данной ткани.
Ген, кодирующий белок Src или Yes, можно получить разнообразными способами, известными в данной области, и в этом отношении данное изобретение не дает ограничений. Например, хорошо известно, что природная история Src включает разнообразные гомологи из млекопитающих, птичьих, вирусных и других видов, и ген можно легко клонировать, применяя способы клонирования кДНК, из любой ткани, экспрессирующей белок. Предпочтительным Src для применения в данном изобретении является клеточный белок, такой как гомологи млекопитающих или птиц, обозначенные c-Src. В частности, предпочтительным является c-Src человека. Предпочтительным Yes для применения в данном изобретении является клеточный белок человека c-Yes. В частности, предпочтительным является c-Yes-1 человека, кодирующий аминокислотную последовательность, представленную на ФИГ.11. Белок Yes-1 с ФИГ.11 кодирован сегментом последовательности нуклеиновой кислоты, представленным на ФИГ.12 и идентифицированным как кодирующий сегмент домена.
D. Молекулы рекомбинантной ДНК и экспрессионные системы для экспрессии белка Src или Yes
Данное изобретение описывает несколько нуклеотидных последовательностей, особо применимых в настоящем изобретении. Такие последовательности включают последовательности, которые кодируют белок Src, полезный в данном изобретении, и различные сегменты ДНК, молекулы рекомбинантной ДНК (рДНК) и векторы, предназначенные для экспрессии белка Src. Такие последовательности включают также последовательности, которые кодируют белок Yes, полезный в данном изобретении, и различные сегменты ДНК, молекулы рекомбинантной ДНК (рДНК) и векторы, предназначенные для экспрессии белка Yes.
Таким образом, молекулы ДНК (сегменты) данного изобретения могут включать последовательности, которые кодируют целиком структурные гены, фрагменты структурных генов или комбинации генов и транскрипционные единицы, как описано здесь далее.
Предпочтительным сегментом ДНК является последовательность нуклеотидов, которая кодирует белок Src или Yes или оба, которые здесь определены, или его биологически активный фрагмент.
Последовательность аминокислотных остатков и последовательность нуклеотидов предпочтительных Src и Yes описана в примерах.
Предпочтительный сегмент ДНК кодирует последовательность аминокислотных остатков по существу ту же самую (и предпочтительно состоящую, главным образом, из нее) как и последовательность аминокислотных остатков, соответствующая описанным здесь белкам Src или Yes, или ее части. Кроме того, типичные и предпочтительные сегменты ДНК описаны в примерах.
Последовательность аминокислотных остатков белка или полипептида имеет непосредственное отношение через генетический код к последовательности дезоксирибонуклеиновой кислоты (ДНК) структурного гена, который кодирует белок. Таким образом, структурный ген или сегмент ДНК можно определить с точки зрения последовательности аминокислотных остатков, то есть белка или полипептида, который он кодирует.
Важным и хорошо известным свойством генетического кода является его избыточность. То есть для большинства аминокислот, используемых для получения белков, более одного кодирующего триплета нуклеотидов (кодон) могут кодировать или определять конкретный аминокислотный остаток. Следовательно, ряд различных последовательностей нуклеотидов могут кодировать конкретную последовательность аминокислотных остатков. Такие последовательности нуклеотидов считают функционально эквивалентными, так как в результате они могут продуцировать одну и ту же последовательность аминокислотных остатков во всех организмах. Изредка в данную последовательность нуклеотидов может быть включен метилированный вариант пурина или пиримидина. Однако такое метилирование никоим образом не влияет на кодирующие взаимоотношения.
Нуклеиновая кислота представляет собой любой полинуклеотид или фрагмент нуклеиновой кислоты, будь то полирибонуклеотид или полидезоксирибонуклеотид, то есть РНК или ДНК или их аналоги. В предпочтительном варианте молекула нуклеиновой кислоты находится в виде сегмента дуплексной ДНК, то есть сегмента ДНК, хотя для некоторых молекулярно-биологических методологий предпочтительна однонитевая ДНК или РНК.
Сегменты ДНК получают рядом способов, включая способы химического синтеза и рекомбинантные подходы, предпочтительно путем клонирования или полимеразной цепной реакции (РЦР). Сегменты ДНК, которые кодируют части белка Src, можно легко синтезировать химическими способами, например, способом с фосфотриэфиром, Matteucci и др., J. Am. Chem. Soc., 103: 3185-3191 (1981), или применяя способы автоматического синтеза. Кроме того, сегменты ДНК большего размера можно легко получить хорошо известными способами, такими как синтез группы олигонуклеотидов, которые определяют сегмент ДНК, с последующей гибридизацией и лигированием олигонуклеотидов с построением полного сегмента. Альтернативные способы включают выделение предпочтительного сегмента ДНК посредством ПЦР с парой олигонуклеотидных праймеров, используемых для библиотеки кДНК, содержащей, как считают, члены, которые кодируют белок Src.
Конечно, химическим синтезом можно получить любые желаемые модификации просто путем замещения подходящими основаниями оснований, кодирующих природные последовательности аминокислотных остатков. Этот способ хорошо известен, и его можно легко применять для получения описанных здесь разных «модифицированных» белков Src.
Кроме того, сегменты ДНК, состоящие в основном из структурных генов, кодирующих белок Src или Yes, можно последовательно модифицировать посредством сайт-направленного или случайного мутагенеза, вводя любые необходимые замены.
1. Клонирование гена Src или Yes
Ген Src или Yes данного изобретения можно клонировать из подходящего источника геномной ДНК или матричной РНК (мРНК) различными биохимическими способами. Клонирование таких генов можно проводить согласно общим способам, описанным в примерах и известным в данной области.
Источники нуклеиновых кислот для клонирования гена Src или Yes, подходящие для применения в способах данного изобретения, могут включать геномную ДНК или матричную РНК (мРНК) в виде библиотеки кДНК из ткани, которая, как считают, экспрессирует данные белки. Предпочтительной тканью является ткань легких человека, хотя можно использовать любую другую подходящую ткань.
Предпочтительный способ клонирования включает получение библиотеки кДНК с использованием стандартных способов и выделение Src-кодирующей или Yes-кодирующей нуклеотидной последовательности путем ПЦР-амплификации с использованием пары олигонуклеотидных праймеров на основе описанных здесь последовательностей нуклеотидов. Альтернативно, желаемые клоны кДНК можно идентифицировать и выделить из кДНК или геномной библиотеки обычными способами гибридизации нуклеиновых кислот с использованием гибридизационного зонда на основе описанных здесь последовательностей нуклеиновых кислот. Специалисту в данной области ясны и другие способы выделения и клонирования подходящих Src- или Yes-кодирующих нуклеиновых кислот.
2. Векторы переноса и/или экспрессии гена
Данное изобретение предусматривает молекулу рекомбинантной ДНК (рДНК), содержащую, как здесь описано, сегмент ДНК, кодирующий белок Src или Yes или оба. Экспрессируемую рДНК можно получить посредством оперативного (в рамке, экспрессируемую) сшивания вектора с Src- или Yes-кодирующим сегментом ДНК настоящего изобретения. Таким образом, молекула рекомбинантной ДНК представляет гибрид молекулы ДНК, включающий, по меньшей мере, две последовательности нуклеиновых кислот, обычно не находящихся вместе в природе.
Выбор вектора, с которым оперативно сшивают сегмент ДНК настоящего изобретения, непосредственно зависит, что хорошо известно в данной области, от желаемых функциональных свойств, например, экспрессии белка и клетки-хозяина, подлежащей трансформации (типичные соображения в области конструирования молекул рекомбинантных ДНК). Предусматриваемый настоящим изобретением вектор способен, по меньшей мере, направлять репликацию и предпочтительно также экспрессию структурного гена, включенного в сегменты векторной ДНК, с которыми он оперативно связан.
Если вектор экспрессии содержит обе экспрессируемые Src-или Yes-последовательности нуклеиновых кислот, то оба гена можно регулировать одними и теми же регуляторными элементами, расположенными выше первого гена, или каждый регулировать индивидуально отдельными регуляторными элементами.
Оба вектора экспрессии, прокариотический и эукариотический, знакомы специалисту в области векторных конструкций и описаны у Ausebel и др., Current Protocols in Molecular Biology, Wiley and Sons, New York (1993) и Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory (1989). В данных источниках также описаны многие общие способы с рекомбинантными ДНК, которые упоминаются в данной заявке.
В одном варианте вектор, предусмотренный настоящим изобретением, включает прокариотический репликон, то есть последовательность ДНК, обладающую способностью прямой автономной репликации и сохранения молекулы рекомбинантной ДНК экстрахромосомно в прокариотической клетке-хозяине, такой как бактериальная клетка-хозяин, трансформированная им. Такие репликоны хорошо известны в данной области. Кроме того, варианты, которые включают прокариотический репликон, также включают ген, экспрессия которого придает трансформируемому или бактериальному хозяину устойчивость в отношении лекарственных препаратов. Типичными бактериальными генами устойчивости к действию лекарств являются те, которые сообщают устойчивость к ампициллину или тетрациклину.
Те векторы, которые включают прокариотический репликон, могут также включать прокариотический промотор, способный направлять экспрессию (транскрипцию и трансляцию) структурного гена в бактериальной клетке-хозяине, такой как Е.coli, трансформированной им. Промотор является элементом контроля экспрессии, образованным последовательностью ДНК, которая позволяет происходить связыванию РНК-полимеразы и транскрипции. Промоторные последовательности, совместимые с бактериальными хозяевами, обычно обеспечены в плазмидных векторах, содержащих подходящие рестрикционные сайты для вставки сегмента ДНК настоящего изобретения. Среди таких векторных плазмид типичными являются pUC8, pUC9, pBR322 и pBR329, доступные от Biorad Laboratories (Richmond, CA), pRSET, доступные от Invitrogen (San Diego, CA), и pPL и pKK223, доступные от Pharmacia, Piscataway, N.J.
Для получения рекомбинантных молекул ДНК настоящего изобретения можно также использовать векторы экспрессии, совместимые с эукариотическими клетками, предпочтительно совместимые с клетками позвоночных. Векторы экспрессии эукариотических клеток хорошо известны в данной области и доступны из нескольких коммерческих источников. Обычно обеспечивают такие векторы, содержащие подходящие рестрикционные сайты для вставки желаемого сегмента ДНК. Среди таких векторов типичными являются pSVL и pKSV-10 (Pharmacia), pBPV-1/pML2d (International Biotechnologies, Inc.), pTDT1 (ATCC, #31255), pRc/CMV (Invitrogen, Inc.), предпочтительный вектор, описанный в примерах, и подобные эукариотические векторы экспрессии.
Особо предпочтительная система для экспрессии гена в контексте данного изобретения включает компонент доставки гена, то есть способность доставить ген к интересующей ткани. Подходящими векторами являются «инфекционные» векторы, такие как рекомбинантные ДНК-вирусные, аденовирусные или ретровирусные векторы, которые созданы для экспрессии требуемого белка и обладают свойствами, которые допускают инфицирование предварительно выбранных тканей-мишеней. Особо предпочтительным является описанный здесь репликационный компетентный вирус саркомы птиц (RCAS).
Можно сконструировать системы клеток млекопитающих, которые используют рекомбинантные вирусы или вирусные элементы для направления экспрессии. Например, если используют аденовирусные векторы экспрессии, кодирующую последовательность полипептида можно лигировать с аденовирусным комплексом, контролирующим транскрипцию/трансляцию, например, поздним промотором и тройственной лидерной последовательностью. Данный химерный ген можно затем вставить в аденовирусный геном путем in vitro или in vivo рекомбинации. Вставка в несущественную область вирусного генома (например, область Е1 или Е3) даст в результате рекомбинантный вирус, который жизнеспособен и способен экспрессировать полипептид в инфицированных хозяевах (например, смотри Logan и др., Proc. Natl. Acad. Sci., USA, 81: 3655-3659 (1984)). Альтернативно, можно использовать промотор вируса осповакцины 7.5К (смотри, например, Mackett и др., Ргос. Natl. Acad. Sci., USA, 79: 7415-7419 (1982); Mackett и др., J. Virol., 49: 857-864 (1984); Panicali и др., Proc. Natl. Acad. Sci., USA, 79: 4927-4931 (1982)). Особый интерес представляют векторы на основе вируса бычьей папилломы, которые обладают способностью к репликации как экстрахромосомные элементы (Sarver и др., Mol. Cell. Biol., 1: 486 (1981)). Вскоре после ввода данной ДНК в клетки-мишени плазмида реплицируется примерно до 100-200 копий на клетку. Транскрипция введенной кДНК не требует интеграции плазмиды в хромосому хозяина, тем самым обеспечивает высокий выход экспрессии. Такие векторы можно использовать для стабильной экспрессии путем включения в плазмиду селектируемого маркера, такого как neo-ген. Альтернативно, ретровирусный геном можно модифицировать для использования в качестве вектора, способного проводить и направлять экспрессию полипептид-кодирующей нуклеотидной последовательности в клетках-хозяевах (Cone и др., Proc. Natl. Acad. Sci., USA, 81: 6349-6353 (1984)). Высокого уровня экспрессии можно также достичь, используя индуцибельные промоторы, включая (но не ограничиваясь этим) металлотиониновый промотор IIA и промоторы теплового шока.
Недавно на «голых» мышах, несущих рак яичников человека, изучена продолжительная генная терапия тимидинкиназой (ТК), управляемая промотором цитомегаловируса (CMV) по сравнению с промотором вируса саркомы Рауса (PSV). Обнаружено, что эффективность аденовирус-опосредованной CMV промотер-управляемой ТК-генной терапии по уничтожению вируса герпеса в 2-10 раз выше, чем RSV-управляемая терапия (Tong и др., 1999, Hybridoma 18 (1): 93-97). Описана также разработка химерных промоторов для применений в генной терапии, которые предусматривают низкий уровень экспрессии с последующим индуцируемым высоким уровнем экспрессии (Suzuki и др., 1996, Human Gene Therapy 7: 1883-1893).
Для длительного производства рекомбинантных белков с высоким выходом предпочтительна стабильная экспрессия. Предпочтительнее, чем использовать векторы экспрессии, которые содержат вирусное начало репликации, клетки-хозяева можно трансформировать кДНК, контролируемой подходящими элементами контроля экспрессии (например, промоторными и энхансерными последовательностями, терминаторами транскрипции, сайтами полиаденилирования и др.), и селектируемого маркера. Как упоминалось выше, селектируемый маркер в рекомбинантной плазмиде сообщает устойчивость к отбору и позволяет клеткам стабильно интегрировать плазмиду в свои хромосомы и расти с образованием центров, которые, в свою очередь, можно клонировать и размножать в клеточные линии.
Например, после введения чужой ДНК сконструированным клеткам можно позволить расти в течение 1-2 дней в обогащенной среде и затем переключить на селективную среду. Можно использовать ряд селекционных систем, включая (но не ограничиваясь этим) гены тимидинкиназы вируса простого герпеса (Wigler и др., Cell, 11:223 (1977)), гипоксантин-гуанин-фосфорибозилтрансферазы (Szybalska и др., Proc. Natl. Acad. Sci., USA, 48: 2026 (1962)) и аденин-фосфорибозилтрансферазы (Lowy и др., Cell, 22: 817 (1980)), которые можно применять в tk-, hgprt- или aprt-клетках, соответственно. В качестве основы отбора можно также использовать гены, сообщающие антиметаболитную устойчивость, например, ген для dhfr, который сообщает устойчивость к метотрексату (Wigler и др., Proc. Natl. Acad. Sci., USA, 77: 3567 (1980)), (O'Hare и др., Proc. Natl. Acad. Sci., USA, 78:1527 (1981)), gpt, который сообщает устойчивость к микофенольной кислоте (Mulligan и др., Proc. Natl. Acad. Sci., USA, 78:2072 (1981)), neo, который сообщает устойчивость к аминогликозиду G-418 (Colberre-Garapin и др., J. Mol. Biol., 150:1 (1981)) и hygro, который сообщает устойчивость к гигромицину (Santerre и др., Gene, 30: 147 (1984)). Недавно были еще описаны селектируемые гены, а именно, trpB, который позволяет клеткам использовать индол вместо триптофана; hisD, который позволяет клеткам использовать гистинол вместо гистидина (Hartman и др., Proc. Natl. Acad. Sci., USA, 85:804 (1988)); и ODC (орнитиндекарбоксилаза), который сообщает устойчивость к ингибитору орнитиндекарбоксилазы 2-(дифторметил)-DL-орнитину, DFMO (McConlogue L., в Current Communications in Molecular Biology, Cold Spring Harbor Laboratiry ed., (1987)).
Принципиальные векторы, предусмотренные для генной терапии человека происходят из ретровирусных источников (Wilson, 1997, Clin. Exp. Immunol. 107 (Sup.1): 31-32; Bank и др., 1996, Bioessays 18 (12): 999-1007; Robbins и др., 1998, Pharmacol. Ther. 80 (1): 35-47). Терапевтические возможности генного переноса и антисмысловой терапии стимулировали развитие многих векторных систем для обработки разных тканей (сосудов: Stephan и др., 1997, Fundam. Clin. Pharmacol. 11 (2): 97-110; Feldman и др., 1997, Cardiovasc. Res. 35 (3): 391-404; Vassalli и др., 1997, Cardiovasc. Res. 35 (3): 459-69; Baek и др., 1998, Circ. Res. 82 (3): 295-305; почек: Lien и др., 1997, Kidney Int. Suppl. 61: S85-8; печени: Ferry и др., 1998, Hum Gene Ther. 9 (14): 1975-81; мышц: Marshall и др., 1998, Curr. Opn. Genet. Dev. 8 (3): 360-5). Кроме данных тканей крайне необходимой мишенью генной терапии человека является рак, сама опухоль или связанные с ней ткани (Runnebaum, 1997, Anticancer Res. 17 (4В): 2887-90; Spear и др., 1998, J. Neurovirol. 4 (2):133-47).
Ниже кратко описаны специфические примеры вирусных векторных систем для генной терапии, легко адаптируемых для использования в способах настоящего изобретения. Обзор ретровирусной доставки генов недавно сделан в работе Federspiel and Hughes, 1998, Methods in Cell Biol., 52: 179-214, где описано, в частности, ретровирусное семейство вируса лейкоза птиц (ALV) (Federspiel и др., Proc. Natl. Acad. Sci., USA, 93: 4931 (1996); Federspiel и др., Proc. Natl. Acad. Sci., USA, 91: 11241 (1994)). Кроме того, ретровирусные векторы, включающие ALV и вирус лейкемии крыс (MLV), описаны в работе Svoboda, 1998, Gene 206: 153-163).
Модифицированные ретровирусные/аденовирусные экспрессионные системы можно легко адаптировать для применения в способах настоящего изобретения. Например, системы вируса лейкемии крыс (MLV) рассмотрены Karavanas и др., 1998, Crit. Rev. in Oncology/Hematology, 28: 7-30. Аденовирусные экспрессионные системы рассмотрены Von Seggern and Nemerow в Gene Expression Systems (ed. Fernandes & Hoeffler, Academic Press, San Diego, CA, 1999, глава 5, страницы 112-157).
Показано, что белковые экспрессионные системы имеют эффективное применение и in vivo, и in vitro. Например, описан эффективный перенос гена в плоскоклеточную карциному человека с помощью вектора ампликона вируса простого герпеса человека (HSV) типа 1 (Carew и др., 1998, Amer. J. Surg., 176: 404-408). Вирус простого герпеса использован для переноса гена в нервную систему (Goins и др., 1997, J. Neurovirol., 3 (Sup.1): S80-8). Целевые векторы-самоубийцы, использующие HSV-ТК, исследованы на твердых опухолях (Smiley и др., 1997, Hum. Gene Ther., 8 (8): 965-77). Вектор вируса простого герпеса человека типа 1 использован для генной терапии рака на клетках карциномы толстой кишки (Yoon и др., 1998, Ann. Surg., 228 (3): 366-74). Разработаны гибридные векторы для продления времени трансфекции, включающие гибриды HSV/AAV (аденоассоциированный вирус) для обработки гепатоцитов (Fraefel и др., 1997, Mol. Med., 3 (12): 813-825).
Разработан вирус осповакцины для генной терапии человека, благодаря его длинному геному (Peplinski и др., 1998, Surg. Oncol. Clin. N. Am., 7 (3): 575-88). Тимидинкиназа-удаляющий вирус осповакцины, экспрессирующий пурин-нуклеозид-пирофосфорилазу, описан для применения в качестве вектора для генной терапии опухоли (Puhlman и др., 1999, Human Gene Therapy, 10: 649-657).
Аденоассоциированный вирус 2 (AAV) описан для применения в генной терапии человека, однако AAV нуждается в хелперном вирусе (таком как аденовирус или вирус герпеса) для оптимальной репликации и упаковки в клетках млекопитающих (Snoeck и др., 1997, Exp. Nephrol., 5 (6): 514-20; Rabinowitz и др., 1998, Curr. Opn. Biotechnol., 9 (5): 470-5). Однако описана in vitro упаковка инфекционного рекомбинантного AAV, делающая данную систему значительно более перспективной (Ding и др., 1997, Gene Therapy, 4: 1167-1172). Показано, что AAV-опосредованный перенос кДНК рецептора экотропического ретровируса допускает экотропическую ретровирусную трансдукцию полученных клеток и в первую очередь клеток человека (Qing и др., 1997, J. Virology, 71 (7): 5663-5667). Продемонстрирована генная терапия рака с использованием вектора AAV, экспрессирующего р53 дикого типа человека (Qazilbash и др., 1997, Gene Therapy, 4: 675-682). Показан также перенос гена в клетки сосудов с использованием векторов AAV (Maeda и др., 1997, Cardiovascular Res., 35: 514-521). Показан AAV как подходящий вектор генной терапии, направленной на печень (Xiao и др., 1998, J. Virol., 72 (12): 10222-6). Показаны векторы AAV для применения в генной терапии тканей головного мозга и центральной нервной системы (Chamberlin и др., 1998, Brain Res., 793 (1-2): 169-75; During и др., 1998, Gene Therapy, 5 (6): 820-7). Векторы AAV также сравнивали с аденовирусными векторами (AdV) для генной терапии легких и переноса в эпителиальные клетки кистозного фиброза человека (Teramoto и др., 1998, J. Virol., 72 (11): 8904-12).
Химерные AdV/ретровирусные векторные системы для генной терапии, которые включают полезные качества каждого вируса для создания неинтегрирующего AdV, который превращается в функционально интегрирующий через промежуточную генерацию ретровирусной продуцирующей клетки (Feng и др., 1997, Nat. Biotechnology, 15 (9): 866-70; Bilbao и др., 1997, FASEB J., 11 (8): 624-34). Это мощное новое поколение векторов для генной терапии адаптировано для целенаправленной генной терапии рака (Bilbao и др., 1998, Adv. Exp. Med. Biol., 451: 365-74). Разовая инъекция AdV, экспрессирующего р53, ингибировала рост узелков подкожной опухоли из клеток рака предстательной железы человека (Asgari и др., 1997, Int. J. Cancer, 71 (3): 377-82). Описан AdV-опосредованный перенос гена р53 дикого типа у пациентов с прогрессирующим раком легких немалых клеток (Schuler и др., 1998, Human Gene Therapy, 9: 2075-2082). Тот же рак являлся предметом р53-генной заместительной терапии, опосредованной векторами AdV (Roth и др., 1998, Semin. Oncol., 25 (3 Suppl 8): 33-7). AdV-опосредованный перенос гена р53 ингибирует дифференцировку эндотелиальных клеток и ангиогенез in vivo (Riccioni и др., 1998, Gene Ther., 5 (6): 747-54). Описана также аденовирус-опосредованная экспрессия антигена меланомы gр75 в качестве иммунотерапии для метастатической меланомы (Hirschowitz и др., 1998, Gene Therapy, 5: 975-983). AdV способствует инфицированию клеток человека экотропическим ретровирусом и повышает эффективность ретровирусного инфицирования (Scott-Taylor и др., 1998, Gene Ther., 5 (5): 621-9). Векторы AdV использованы для переноса гена в клетки гладких мышц сосудов (Li и др., 1997, Chin. Med. J. (Enql), 110 (12): 950-4), клетки плоскоклеточной карциномы (Goebel и др., 1998, Otolarynol Head Neck Surq., 119 (4): 331-6), клетки рака пищевода (Senmaru и др., 1998, Int. J. Cancer, 78 (3): 366-71), мезангиальные клетки (Nahman и др., 1998, J. Investig. Med., 46 (5): 204-9), глиальные клетки (Chen и др., 1998, Cancer Res., 58 (16): 3504-7) и в суставы животных (Ikeda и др., 1998, J. Reumatol., 25 (9): 1666-73). Позже показан перикардиальный генный перенос на основе катетера, опосредованный векторами AcV (March и др., 1999, Clin. Cardiol., 22 (1 Suppl 1):123-9). Манипуляции AdV-системы подходящими контролирующими генетическими элементами допускают AdV-опосредованную регулируемую экспрессию гена-мишени in vivo (Burcin и др., 1999, PNAS (USA), 96 (2): 355-60).
Разработаны векторы альфа-вирусов для применений в генной терапии человека с клеточными линиями со способностью к упаковке, подходящими для трансформации экспрессирующими кластерами, подходящими для использования с векторами вируса Sindbis и вируса Semliki Forest (Polo и др., 1999, Proc. Natl. Acad. Sci., USA, 96: 4598-4603). Разработаны также нецитопатические системы на основе РНК репликона флавивируса (Varnavski и др., 1999, Virology, 255 (2): 366-75). Векторы вируса-самоубийцы Синдбис, содержащие HSV-TK, использовали для клеточно-специфической доставки в опухолевые клетки (Iijima и др., 1998, Int. J. Cancer, 80 (1): 110-8).
Ретровирусные векторы на основе пенящего вируса человека (HFV) являются также перспективными в качестве векторов для генной терапии (Trobridge и др., 1998, Human Gene Therapy, 9: 2517-2525). Векторы пенящих вирусов предназначены для терапии геном-самоубийцей (Nestler и др., 1997, Gene Ther., 4 (11): 1270-7). Рекомбинантный крысиный цитомегаловирус и промоторные системы также использовали в качестве векторов для экспрессии в высокой степени (Manning и др., 1998, J. Virol. Meth. 73 (1): 31-9; Tong и др., 1998, Hybridoma, 18 (1): 93-7).
Доставка генов в неделящиеся клетки стало возможной с помощью генерации вируса Сендаи на основе векторов (Nakanishi и др., 1998, J. Controlled Release, 54 (1): 61-8).
В других попытках сделать возможной трансформацию неделящихся соматических клеток изучены лентивирусные векторы. Описана генная терапия кистозного фиброза с использованием вектора на основе репликационно-дефектного вируса иммунодефицита человека (ВИЧ) (Goldman и др., 1997, Human Gene Therapy, 8: 2261-2268). Показана длительная экспрессия генов, доставляемых в печень и мышцы лентивирусными векторами (Kafri и др., 1997, Nat. Genet., 17 (3): 314-7). Однако забота о безопасности является преобладающей, и развитие усовершенствованных векторов происходит быстро (Kim и др., 1998, J. Virol., 72 (2): 994-1004). Исследование LTR и Tat HIV дали важную информацию об организации генома для развития векторов (Sadaie и др., 1998, J. Med. Virol., 54 (2): 118-28). Таким образом, теперь более понятны генетические требования для эффективного вектора на основе ВИЧ (Gasmi и др., 1999, J. Virol., 73 (3): 1828-34). Описаны векторы самоинактивации или клеточные линии с кондиционной упаковкой (например, Zuffery и др., 1998, J. Virol., 72 (12): 9873-80; Miyoshi и др., 1998, J. Virol., 72 (10): 8150-7; Dull и др., 1998, J. Virol., 72 (11): 8463-71 и Kaul и др., 1998, Virology, 249 (1): 167-74). Показана эффективная трансдукция лимфоцитов человека и клеток CD34+ ВИЧ-векторами (Douglas и др., 1999, Hum. Gene Ther., 10 (6): 935-45; Miyoshi и др., 1999, Science, 283 (5402): 682-6). Описана эффективная трансдукция неделящихся клеток человека лентивирусными векторами кошачьего вируса иммунодефицита (FIV), которая сводит к минимуму заботу о безопасности при использовании векторов на основе ВИЧ (Poeschla и др., 1998, Nature Medicine, 4 (3): 354-357). Показано продуктивное инфицирование кровяных мононуклеарных клеток человека векторами FIV (Johnston и др., 1999, J. Virol., 73 (3): 2491-8).
Поскольку со многими вирусными векторами трудно обращаться, и размер вставки ДНК ограничен, на такие ограничения и неудобства было обращено внимание. Например, в дополнение к вирусным клеточным линиям с упрощенной упаковкой разработаны минивирусные векторы, производные вируса герпеса человека, вируса простого герпеса типа 1 (HSV-1) и вируса Эпштейна-Барра (EBV), для упрощения манипуляций с генетическим материалом и генерации вирусных векторов (Wang и др., 1996, J. Virology, 70 (12): 8422-8430). Ранее показано, что адаптерные плазмиды упрощают вставку чужеродной ДНК в хелпер-независимые ретровирусные векторы (1987, J. Virology, 61 (10): 3004-3012).
Вирусные векторы не являются единственными средствами проведения генной терапии, поскольку описаны также несколько невирусных векторов. Показано, что невирусный вектор для целенаправленной доставки гена на основе использования полиплекса эпидермальный фактор роста/ДНК (EGF/DNA) обеспечивает эффективную и специфическую доставку гена (Cristiano и др., 1998, Anticancer Res., 18: 3241-3246). Продемонстрирована генная терапия сосудов и CNS с использованием катионных липосом (Yang и др., 1997, J. Neurotrauma, 14 (5): 281-97). Также используя катионные липосомы, проводили заместительную генную терапию панкреатита (Denham и др., 1998, Ann. Surge., 227 (6): 812-20). Показано, что эффективными для доставки генов являются комплексы на основе хитозана вектор/ДНК (Erbacher и др., 1998, Pharm. Res., 15 (9): 1332-9). Описан невирусный вектор доставки ДНК на основе триплексной системы (Kim и др., 1998, 53 (1-3): 175-82). Вирусные частицы, покрытые липосомными комплексами, также использовали для осуществления переноса гена (Hirai и др., 1997, Biochem. Biophys. Res. Commun., 241 (1): 112-8).
Показана генная терапия посредством прямых инъекций в опухоль невирусного вектора Т7, кодирующего ген тимидинкиназы (Chen и др., 1998, Human Gene Therapy, 9: 729-736). Получение плазмидной ДНК является важным для генного переноса путем прямой инъекции (Horn и др., 1995, Hum. Gene Ther., 6 (5): 656-73). Специально для прямой инъекции адаптированы модифицированные плазмидные векторы (Hartikka и др., 1996, Hum. Gene Ther., 7 (10): 1205-17).
Таким образом, в данной области известно широкое разнообразие векторов и конструкций для переноса генов/генной терапии. Данные векторы легко адаптировать для применения в способах настоящего изобретения. Путем соответствующей манипуляции с использованием рекомбинантной ДНК/приемов молекулярной биологии, чтобы встроить оперативно связанные Src или Yes или оба (активные или неактивные) в выбранный вектор экспрессии/доставки, можно генерировать многие эквивалентные векторы для осуществления настоящего изобретения на практике.
Е. Способы модуляции проницаемости сосудов (VP)
Данное изобретение обеспечивает способ модуляции проницаемости кровеносных сосудов (VP) в ткани, связанной с болезненным процессом или состоянием, и тем самым влияние на состояние дел в ткани, которая зависит от VP. Обычно данный способ включает введение в ткань, связанную с болезненным процессом или состоянием, композиции, содержащей VP-модулирующее количество белка Src или Yes, или их смеси, или НК-вектора, экспрессирующего активный или неактивный Src или Yes, или оба, или ингибитора тирозинкиназы семейства Src, такого как химический ингибитор Src, белок-ингибитор Src или нуклеиновая кислота-ингибитор Src, согласно способам настоящего изобретения.
Как здесь описано, при болезненных состояниях любая из разнообразных тканей или органов, составленных из образующих органы тканей может быть местом VP, включая головной мозг, кожу, мышцы, кишечник, соединительную ткань, суставы, кости и подобные ткани, в которых присутствуют кровеносные сосуды.
Пациент, подвергаемый лечению по настоящему изобретению во многих его вариантах, желательно является человеком, хотя должно быть понятно, что принципы данного изобретения указывают, что оно эффективно в отношении всех млекопитающих, которые включены в термин «пациент». В данном контексте считают, что млекопитающее включает любой вид млекопитающего, для которого желательна обработка ткани, связанной с заболеваниями, затрагивающими ангиогенез, в частности, виды сельскохозяйственных и домашних млекопитающих.
Таким образом, данный способ включает введение пациенту терапевтически эффективного количества физиологически переносимой композиции, содержащей белок Src или Yes, или их смесь, или ДНК-вектор для экспрессии белка Src или Yes или обоих, или ингибитор тирозинкиназы семейства Src, такой как химический ингибитор Src, белок-ингибитор Src или нуклеиновая кислота-ингибитор Src.
Диапазоны доз для введения белка Src или Yes зависят от формы белка и его активности, как описано здесь далее, и представляют количества, достаточно большие для производства желаемого эффекта, при которых улучшается VP и симптомы заболевания, опосредованного VP. Доза не должна быть слишком большой, чтобы не вызывать нежелательные побочные эффекты, такие как синдромы гипервязкости, отек легких, застойная сердечная недостаточность и подобные. Обычно дозу варьируют в зависимости от возраста, состояния, пола пациента и продолжительности болезни, и специалист в данной области может ее определить. Также дозу может регулировать лечащий врач в случае какого-либо осложнения.
Терапевтически эффективным VP-модулирующим количеством является количество белка Src или Yes, или их смеси, или нуклеиновой кислоты, кодирующей белок Src или Yes, достаточное для вызова измеримой модуляции VP в обрабатываемой ткани, то есть VP-модулирующее количество. Модуляцию VP можно определить описанным здесь способом или другими методами, известными специалистам в данной области. Модуляцию VP можно определить посредством исследования Миллера, которое здесь описано, или другими способами, известными специалистам в данной области.
Белок Src или Yes или вектор нуклеиновой кислоты, экспрессирующий белок Src или Yes или оба, можно вводить парентерально путем инъекции или посредством постепенного вливания в течение некоторого времени. Хотя подлежащая обработке ткань обычно может быть доступна в организме при системном введении и, следовательно, наиболее часто на нее воздействуют посредством внутривенного введения терапевтических композиций, предусмотрены и другие ткани и средства доставки, где существует вероятность, что ткань-мишень содержит молекулы-мишени. Таким образом, композиции данного изобретения можно вводить внутривенно, внутрибрюшинно, внутримышечно, подкожно, внутрь полостей, трансдермально и можно доставлять перистальтическими способами.
Терапевтические композиции, содержащие белок Src или Yes или вектор нуклеиновой кислоты, экспрессирующий белок Src или Yes, обычно можно вводить внутривенно, например, как инъекцию стандартной дозы. Термин «стандартная доза», используемый по отношению к терапевтической композиции настоящего изобретения, обозначает физически дискретные единицы, подходящие в качестве унифицированной дозировки для пациента, причем каждая единица содержит предварительно определенное количество активного вещества, рассчитанное для производства желательного терапевтического эффекта, в сочетании с необходимым разбавителем, то есть носителем или наполнителем.
В одном предпочтительном варианте реагент вводят внутривенно в виде разовой дозы. Можно производить локальное введение путем прямой инъекции или, воспользовавшись анатомически изолированными участками, путем выделения микроциркуляции рассматриваемой системы органов, реперфузии в систему кровообращения, или посредством временной окклюзии с применением катетера рассматриваемой области сосудистой системы, связанной с больными тканями.
Композиции вводят способом, совместимым с дозированным препаратом, и в терапевтически эффективном количестве. Подлежащее введению количество и выбор времени зависят от подлежащего лечению субъекта, способности системы субъекта утилизовать активный ингредиент и степени требуемого терапевтического эффекта. Точные количества активного ингредиента, необходимые для введения, зависят от заключения лечащего врача и являются специфическими для каждого индивида.
Однако подходящие диапазоны доз для системного применения здесь раскрыты и зависят от способа введения. Подходящие схемы приема также различны, но типично начальное введение с последующими повторными дозами с интервалом в один или более часов посредством последовательных инъекций или других введений. Альтернативно, предусматривается непрерывное внутривенное вливание, достаточное для поддержания концентраций в крови в диапазоне, определенном для in vivo терапии.
Существуют разнообразные заболевания, при которых считается важным ингибирование ангиогенеза, называемые ангиогенными заболеваниями, включая (но не ограничиваясь этим) воспалительные заболевания, такие как иммунные и неиммунные воспаления, хронический суставной ревматизм и псориаз, нарушения, связанные с несвойственной или несвоевременной инвазией сосудов, такие как диабетическая ретинопатия, неоваскулярная глаукома, рестеноз, капиллярная пролиферация в атеросклеротических бляшках и остеопороз, и заболевания, связанные с раком, такие как твердые опухоли, метастазы твердых опухолей, ангиофиброма, ретролентальная фиброплазия, гемангиомы, саркома Капоши и подобные раковые заболевания, которые нуждаются в новообразовании сосудов для поддержания роста опухолей.
Аналогично, проницаемость сосудов является важным компонентом ангиогенеза и сама связана с вредными патологиями. Например, поражение вследствие "удара", индуцированного проницаемостью сосудов, вызывает воспалительное поражение.
Таким образом, способы, которые ингибируют проницаемость сосудов в ткани, связанной с болезненным состоянием, облегчают симптомы данного заболевания и в зависимости от заболевания могут содействовать излечению заболевания. В одном варианте данное изобретение предусматривает ингибирование проницаемости сосудов по существу в ткани, связанной с болезненным состоянием. Степень проницаемости сосудов в ткани и, следовательно, степень ингибирования, достигаемую настоящими способами, можно оценить разнообразными способами.
Таким образом, в одном близком варианте подлежащая обработке ткань является воспаленной тканью, и подлежащая ингибированию проницаемость сосудов вызвана VEGF-опосредованной стимуляцией. В данном классе способ предусматривает ингибирование VP в артритных тканях, таких как у пациента с хроническим ревматизмом суставов, в тканях с иммунным или неиммунным воспалением, в псориатической ткани и подобных.
В другом близком варианте подлежащая обработке ткань является тканью сетчатки пациента с заболеванием сетчатки, таким как диабетическая ретинопатия, дегенерация желтого пятна или неоваскулярная глаукома, и подлежащая ингибированию VP представляет VP ткани сетчатки, где происходит новообразование кровеносных сосудов ткани сетчатки.
Данный способ также особо эффективен против образования метастазов, так как (1) их образование нуждается в образовании кровеносных сосудов первичной опухоли, так что метастатические раковые клетки могут выйти из первичной опухоли, и (2) их учреждение на вторичном месте нуждается в новообразовании кровеносных сосудов для поддержания роста метастазов.
В близком варианте данное изобретение предусматривает практическое применение способа в сопряжении с другими способами лечения, такими как обычная химиотерапия, направленная против твердых опухолей и предназначенная для контроля образования метастазов. Введение VP-ингибитора обычно проводят во время или после химиотерапии, хотя предпочтительно ингибировать VP после курса химиотерапии, когда опухолевая ткань будет отвечать на токсический штурм, индуцируя VP для восстановления кровоснабжения с обеспечением опухолевой ткани питательными веществами. Кроме того, можно применять способы ингибирования проницаемости сосудов после хирургической операции, когда удалены твердые опухоли, как профилактику против метастазов.
В той степени, в которой настоящие способы применяют для ингибирования проницаемости сосудов, затронутых метастазами, данные способы можно также применять для ингибирования образования метастазов и регрессии сформированных опухолей.
Рестеноз представляет процесс миграции клеток гладкой мышцы (SMC) и пролиферации в ткань на месте чрескожной транслюминальной коронарной ангиопластики, который мешает успеху ангиопластики. Миграцию и пролиферацию SMC при рестенозе можно считать процессом VP, который ингибируется настоящими способами. Следовательно, данное изобретение предусматривает также ингибирование рестеноза путем ингибирования в соответствии с настоящими способами проницаемости сосудов у пациента после процедуры ангиопластики. Для ингибирования рестеноза инактивированную тирозинкиназу обычно вводят после процедуры ангиопластики, так как стенка коронарного сосуда находится под угрозой рестеноза обычно примерно от 2 до 28 дней, и более типично в течение первых 14 дней после процедуры.
Настоящий способ ингибирования проницаемости сосудов в ткани, связанной с болезненным состоянием, и, следовательно, практическое осуществление способов лечения заболеваний, связанных с проницаемостью сосудов, включает взаимодействие ткани, в которой случается повышенная проницаемость сосудов или которая находится под угрозой этого, с композицией, включающей терапевтически эффективное количество инактивированного белка Src и/или Yes или вектора, экспрессирующего данный белок.
В случаях, когда требуется стимулировать или активировать VP, полезно введение в ткань активного белка Src и/или Yes. Способы и выбор времени введения совместимы со способами ингибирования, описанными здесь выше.
Например, рассмотрена манипуляция с проницаемостью барьера кровь-головной мозг для модуляции доступа лекарственных препаратов к ткани головного мозга. Повышение проницаемости сосудов барьера кровь-головной мозг позволит лекарствам, которые обычно не могут перейти данный барьер, проникать в ткани головного мозга.
Может потребоваться тонкая модуляция ангиогенеза в сопряжении с VP, и тогда можно вводить смесь активных и неактивных форм белка Src, белка Yes или экспрессируемых нуклеиновых кислот, кодирующих белок Src или Yes.
Ингибирование или активация ангиогенеза четко происходит через 5-7 дней после начального взаимодействия с терапевтическими композициями данных примеров. Аналогично, модуляция VP может происходить в тех же временных рамках. Эффекты могут быть и через более короткий промежуток времени после введения терапевтической композиции. Ограничивающие время факторы включают скорость абсорбции ткани, клеточное поглощение, транслокацию белка или трансляцию нуклеиновой кислоты (в зависимости от терапии) и белок-мишень. Таким образом, эффекты модуляции VP могут происходить самое малое через час после момента введения.
Можно также производить дополнительное или пролонгированное воздействие неактивным белком Src и/или Yes, применяя соответствующие условия. Таким образом, модифицируя такие параметры, можно обеспечить разнообразие требуемых терапевтических временных рамок.
Способы данного изобретения включают также введение в ткань, связанную с болезненным процессом, поражением кровеносного сосуда или травматическим состоянием, композиции, включающей ингибитор тирозинкиназы семейства Src. Ингибитор тирозинкиназы семейства Src может быть химическим ингибитором Src, белковым ингибитором Src или нуклеиновой кислотой - ингибитором Src.
Примеры подходящих химических ингибиторов тирозинкиназ семейства Src включают (но не ограничены этим) РР1, РР2, PD173955, AGL1872, PD162531, радицикол R2146, гелданамицин и подобные.
РР1 (от Biomol по лицензии Pfizer) представляет синтетический ингибитор Src, применяемый для данных исследований. РР1 является членом пиразолопиримидинового семейства ингибиторов Src. Другие синтетические ингибиторы Src включают РР2 (от Calbiochem по лицензии Pfizer), который по структуре близок РР1, и также показано, что он блокирует активность киназ семейства Src (Hanke и др., 199-6, J. Biol. Chem., 271 (2): 695-701). Другие специфические ингибиторы Src-киназ включают PD173955 (Moasser и др., 1999, Cancer Res., 59: 6145-6152; Parke Davis), структура которого опубликована. PD162531 (Owens и др., 2000, Mol. Biol. Cell, 11: 51-64) также является специфическим ингибитором киназы Src от Parke Davis, но его структура не найдена в литературе. Гелданамицин также представляет ингибитор киназы Src, доступный от Life Technologies. Радицикол, который коммерчески предлагают многие компании (например, Calbiochem, RBI, Sigma), является противогрибковым макроциклическим лактонным антибиотиком, который действует также как неспецифический белковый ингибитор тирозинкиназы, и показано, что он ингибирует активность Src-киназ. Предпочтительными химическими ингибиторами являются РР1 и РР2 или подобные, причем наиболее предпочтительным химическим ингибитором является РР1.
Подходящие ингибиторы тирозинкиназ семейства Src можно дополнительно идентифицировать и характеризовать, применяя стандартные исследования, известные в данной области. Например, выполнен скрининг химических соединений на активное и селективное ингибирование Src или других тирозинкиназ, в результате которого проведена идентификация химических частей, полезных в сильнодействующих ингибиторах тирозинкиназ семейства Src.
Например, катехолы были идентифицированы как важные составные элементы для ряда ингибиторов тирозинкиназ, полученных из природных продуктов, и обнаружены в соединениях, выбранных путем комбинаторного целенаправленного отбора селективных ингибиторов c-Src (Maly и Др., 2000, «Combinatorial target-guided ligand assembly: Identification of potent subtype-selective c-Src inhibitors» PNAS (USA), 97 (6): 2419-2424). Скрининг кандидатов в ингибиторные соединения на основе комбинаторной химии с использованием в качестве отправной точки частей, которые, как известно, являются важными для ингибирования Src, является действенным и эффективным средством выделения и характеристики других химических ингибиторов тирозинкиназ семейства Src.
Однако для проведения комбинаторного скрининга активных ингибиторов можно применять даже тщательный отбор потенциальных составных элементов, основанный на способности имитировать широкий диапазон функциональностей, присутствующих в полипептидах и нуклеиновых кислотах. Например, для этой цели чрезвычайно подходят библиотеки O-метилоксимов, при условии, что библиотеку легко получить конденсацией O-метилгидроксиламина с любым из большого числа коммерчески доступных альдегидов. Образование O-алкилоксима совместимо с широким диапазоном функциональностей, которые стабильны при физиологических рН (Malay и др., см. выше).
Как описано, подходящие ингибиторы киназ семейства Src включают также VP-ингибирующее количество неактивного белка Src или Yes, или их смеси, или вектор нуклеиновой кислоты, экспрессирующий неактивный Src или Yes, или оба, согласно способам данного изобретения.
Другие подходящие ингибиторы киназ семейства Src включают CSK или вектор нуклеиновой кислоты, экспрессирующий инактивирующие количества CSK, согласно способам данного изобретения.
Как здесь описано, при болезненных состояниях любая из разнообразных тканей или органов, составленных из образующих органы тканей, может быть местом VP, включая головной мозг, кожу, мышцы, кишечник, соединительную ткань, суставы, кости и подобные ткани, в которых присутствуют кровеносные сосуды.
Пациент, подвергаемый лечению способом, воплощающим настоящее изобретение, желательно является человеком, хотя должно быть понятно, что принципы данного изобретения указывают, что настоящие методы эффективны в отношении всех млекопитающих, обозначенных использованным здесь термином «пациент». В данном контексте считают, что млекопитающее включает любые виды млекопитающих, которым требуется лечение протечки сосудов или вызванного отеком поражения ткани, в частности, виды сельскохозяйственных и домашних млекопитающих.
Способ, воплощающий данное изобретение на практике, включает введение пациенту-млекопитающему терапевтически эффективного количества физиологически переносимой композиции, содержащей химический ингибитор тирозинкиназы семейства Src, неактивный белок Src или Yes, активный белок CSK, нуклеиновую кислоту, кодирующую такой белок, или их смесь.
Диапазоны доз для введения химических ингибиторов тирозинкиназы семейства Src, таких как РР1 могут составлять примерно от 0,1 до 10 мг/кг массы тела или соответствовать пределу растворимости активного агента в фармацевтическом носителе. Предпочтительно типичные дозы могут составлять примерно от 1 до 9 мг/кг массы тела. Для многократного введения при лечении хронических состояний может быть оптимальной меньшая дозировка, такая как от 0,1 до 1 мг/кг массы тела. Обычные дозы для лечения острых состояний, которые являются менее тяжелыми и легкодоступными, и где способ введения более прямой, могут составлять примерно от 1 до 3 мг/кг массы тела. В зависимости от тяжести поражения, локализации или способа введения можно применять более высокие дозы примерно от 3 до 10 мг/кг массы тела (или равные пределу растворимости активного агента в фармацевтическом носителе), если сталкиваются с более тяжелым поражением, труднодоступной локализацией или если возможен только непрямой системный способ введения.
В случае острого поражения или травмы наилучшим является по возможности более быстрое введение препарата после инцидента. Однако время эффективного введения ингибиторов тирозинкиназ семейства Src может составлять примерно 48 часов от момента получения поражения или травмы при острых случаях. Предпочтительно произвести введение в течение 24 часов после инцидента, лучше в течение 12 часов и наиболее предпочтительно произвести введение в течение 6 часов после инцидента. Введение через 48 часов после начального поражения может быть полезным для облегчения дополнительного поражения ткани в результате дальнейшей протечки сосудов или отека, однако влияние на первоначальное поражение ткани может быть сильно снижено.
Если выполняют профилактическое введение для предупреждения протечки сосудов или отека, связанного с хирургической операцией, или с точки зрения диагностического критерия предрасположенности, введение можно проводить до любого действительного повышения VP или во время такого вызывающего событие повышения VP. Для лечения хронических состояний, которые ведут к повышению VP и связанным с этим протечке сосудов и отеку, введение ингибиторов тирозинкиназ семейства Src можно проводить в режиме непрерывного дозирования.
Диапазоны доз для введения неактивного белка Src или Yes или активного белка CSK зависят от формы белка и его активности, как описано здесь далее, и представляют количества, достаточно большие для производства желаемого эффекта, при которых улучшается VP и облегчаются симптомы заболевания, опосредованного VP. Доза не должна быть слишком большой, чтобы не вызывать нежелательные побочные эффекты, такие как синдромы гипервязкости, отек легких, застойная сердечная недостаточность и подобные.
Терапевтически эффективным VP-модулирующим количеством является количество активного белка CSK, или неактивного белка Src или Yes, или их смеси, или нуклеиновой кислоты, кодирующей такой белок, достаточное для производства измеримой модуляции VP в обработанной ткани, то есть VP-модулирующее количество. Модуляцию VP можно определить описанным здесь способом или другими методами, известными специалистам в данной области. Модуляцию VP можно определить посредством исследования Миллера, которое здесь описано, или другими способами, известными специалистам в данной области.
Обычно дозу варьируют в зависимости от возраста, состояния, пола пациента и продолжительности болезни, и специалист в данной области может ее определить. Также дозу может регулировать лечащий врач в случае какого-либо осложнения.
Фармацевтические композиции данного изобретения можно вводить парентерально путем инъекции или постепенного вливания в течение некоторого времени. Хотя подлежащая обработке ткань обычно может быть доступна в организме при системном введении и, следовательно, наиболее часто на нее воздействуют посредством внутривенного введения терапевтических композиций, предусмотрены и другие ткани и средства доставки, где существует вероятность, что ткань-мишень содержит молекулы-мишени. Таким образом, композиции данного изобретения можно вводить внутривенно, внутрибрюшинно, внутримышечно, подкожно, внутрь полостей, трансдермально и можно доставлять перистальтическими способами.
Внутривенное введение выполняют, например, путем инъекции стандартной дозы. Термин «стандартная доза», используемый по отношению к терапевтической композиции настоящего изобретения, обозначает физически дискретные единицы, подходящие в качестве унифицированной дозировки для пациента, причем каждая единица содержит предварительно определенное количество активного вещества, рассчитанное для производства желательного терапевтического эффекта, в сочетании с необходимым разбавителем, то есть носителем или наполнителем.
В одном предпочтительном варианте активный агент вводят внутривенно в виде разовой дозы. Можно выполнить локальное введение путем прямой инъекции или, воспользовавшись анатомически изолированными участками, путем выделения микроциркуляции рассматриваемой системы органов, реперфузии в систему кровообращения, или посредством временной окклюзии с применением катетера рассматриваемой области сосудистой системы, связанной с больными тканями.
Композиции вводят способом, совместимым с дозированным препаратом, и в терапевтически эффективном количестве. Подлежащее введению количество и выбор времени зависят от подлежащего лечению субъекта, способности системы субъекта утилизовать активный ингредиент и степени требуемого терапевтического эффекта. Точные количества активного ингредиента, необходимые для введения, зависят от заключения лечащего врача и являются специфическими для каждого индивида. Однако подходящие диапазоны доз для системного применения раскрыты здесь и зависят от способа введения. Подходящие схемы введения также различны, но типично начальное введение с последующими повторными дозами с интервалом в один или более часов посредством последовательных инъекций или других введений. Альтернативно, предполагается непрерывное внутривенное вливание, достаточное для поддержания концентраций в крови в диапазоне, определенном для in vivo терапии.
Способы данного изобретения, облегчающие поражение тканей в результате протечки сосудов или отека, связанного с болезненным состоянием, поражением или травмой, ослабляют симптомы заболевания и в зависимости от заболевания могут содействовать излечению заболевания. Степень проницаемости сосудов в ткани и, следовательно, степень ингибирования, достигаемую настоящими методами, можно оценить разнообразными способами. В частности, данные методы подходят для облегчения состояния при "ударе" или в других церебрососудистых случаях, относящихся к поражению CNS, которые происходят в результате индуцированного поражением увеличения VP и последующей протечки сосудов и/или отека в связанных тканях.
В одном близком варианте подлежащая обработке ткань является воспаленной тканью, и подлежащая ингибированию проницаемость сосудов вызвана VEGF-опосредованной стимуляцией. Для данного типа страданий настоящий способ предусматривает ингибирование VP в артритных тканях, таких как у пациента с хроническим ревматизмом суставов, в тканях с иммунным или неиммунным воспалением, в псориатической ткани и подобных.
В другом близком варианте подлежащая обработке ткань является тканью сетчатки пациента с заболеванием сетчатки, таким как диабетическая ретинопатия, дегенерация желтого пятна или неоваскулярная глаукома, и подлежащая ингибированию VP представляет VP ткани сетчатки, где происходит новообразование кровеносных сосудов ткани сетчатки.
Настоящий способ ингибирования проницаемости сосудов в ткани, связанной с поражением или болезненным состоянием, и, следовательно, применение на практике методов лечения заболеваний, связанных с проницаемостью сосудов, включает взаимодействие ткани, в которой случается повышенная проницаемость сосудов или которая находится под угрозой этого, с композицией, включающей терапевтически эффективное количество ингибитора тирозинкиназы семейства Src.
Модуляция VP и облегчение поражения тканей в результате протечки сосудов и отека может происходить в течение короткого промежутка времени после введения терапевтической композиции. Наибольшие терапевтические эффекты можно наблюдать на протяжении 3 дней после введения в случае острого поражения или травмы. Обычно эффекты постоянного введения не будут столь заметны.
Ограничивающие время факторы включают скорость абсорбции ткани, клеточное поглощение, транслокацию белка или трансляцию нуклеиновой кислоты (в зависимости от терапии) и белок-мишень. Таким образом, эффекты модуляции поражения ткани могут происходить самое малое через час после момента введения ингибитора. Можно также производить дополнительное или пролонгированное воздействие ингибиторами тирозинкиназ семейства Src, применяя соответствующие условия. Таким образом, модифицируя такие параметры, можно обеспечить разнообразие требуемых терапевтических временных рамок.
F. Терапевтические композиции (общее обсуждение)
Настоящее изобретение предусматривает терапевтические композиции, полезные для применения на практике описанных здесь терапевтических способов. Терапевтические композиции настоящего изобретения содержат физиологически переносимый носитель вместе с белком Src и Yes или вектором, способным экспрессировать белок Src и/или Yes, который здесь описан, или ингибитором тирозинкиназы семейства Src, который здесь описан, таким как химический ингибитор Src, белок-ингибитор Src или нуклеиновая кислота-ингибитор Src, растворенным или диспергированным в нем в качестве активного ингредиента. В предпочтительном варианте терапевтическая композиция не является иммуногенной, если ее вводят пациенту млекопитающему или человеку для терапевтических целей.
Белок Src и Yes может быть активным, неактивным или представлять их смесь в зависимости от желаемой модуляции. Предпочтительные формы Src и Yes описаны выше. Белок CSK включает активную форму.
Используемые здесь выражения «фармацевтически приемлемый», «физиологически переносимый» и их грамматические вариации, касающиеся композиций, носителей, разбавителей и реагентов, используются равнозначно и указывают, что вещества можно вводить млекопитающему без получения нежелательных физиологических эффектов, таких как тошнота, головокружение, расстройство желудка и подобные.
Приготовление фармакологической композиции, которая содержит активные ингредиенты в растворенном или диспергированном виде, хорошо понятно специалисту в данной области и не нуждается в ограничениях по составлению. Обычно такие композиции получают в виде жидких растворов или суспензий для инъекций, однако можно также получать твердые формы, подходящие для растворения или суспендирования в жидкости перед применением. Препарат также может быть эмульгирован или представлен в виде липосомной композиции.
Активный ингредиент можно смешать с наполнителями, которые являются фармацевтически приемлемыми и совместимы с активным ингредиентом, в количестве, подходящем для применения в описанных здесь терапевтических способах. Подходящими наполнителями являются, например, вода, физиологический раствор, декстроза, глицерин, этанол или подобные и их комбинации. Кроме того, если требуется, композиция может содержать небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, рН-буферные агенты и подобные, которые повышают эффективность активного ингредиента.
Терапевтическая композиция настоящего изобретения может включать фармацевтически приемлемые соли компонентов. Фармацевтически приемлемые соли включают аддитивные соли кислот (образованные со свободными аминогруппами полипептида), которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислота, или с органическими кислотами, такими как уксусная, винная, миндальная и подобные. Соли, образованные со свободными карбоксильными группами, также могут быть производными неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и органических оснований, таких как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и подобные.
Физиологически переносимые носители хорошо известны в данной области. Примерами жидких носителей являются стерильные водные растворы, которые не содержат других веществ кроме активных ингредиентов и воды или содержат буфер, такой как фосфат натрия с физиологическим значением рН, физиологический раствор, или оба, такие как физиологический раствор, забуференный фосфатом. Кроме того, водные носители могут еще содержать более одной буферной соли, а также такие соли как хлориды натрия и калия, декстрозу, полиэтиленгликоль и другие растворенные вещества.
Жидкие композиции могут также содержать жидкие фазы в дополнение или за исключением воды. Примерами таких дополнительных жидких фаз являются глицерин, растительные масла, такие как хлопковое масло, и эмульсии вода-масло.
F(i). VP-модулирующие терапевтические композиции настоящего изобретения
В одном варианте настоящего изобретения терапевтическая композиция содержит модулирующее проницаемость сосудов количество белка Src и/или Yes или количество вектора экспрессии рекомбинантной ДНК, достаточное для экспрессии эффективного количества белка Src и/или Yes, обычно композиция составлена так, что содержит, по меньшей мере, 0,1% масс. белка Src или Yes от общей массы терапевтической композиции. Массовый процент представляет отношение массы белка Src или Yes к общей массе композиции. Таким образом, например, 0,1% масс. представляет 0,1 г белка Src или Yes на 100 г композиции в целом. Для экспрессионных ДНК-векторов вводимое количество зависит от свойств вектора экспрессии, подлежащей обработке ткани и подобных соображений.
F(ii). Ингибиторы тирозинкиназ семейства Src
Терапевтические композиции настоящего изобретения
Химические терапевтические композиции настоящего изобретения содержат физиологически переносимый носитель вместе с ингибитором тирозинкиназы семейства Src, растворенным или диспергированным в нем в качестве активного ингредиента.
Белковые терапевтические композиции настоящего изобретения содержат физиологически переносимый носитель вместе с неактивным Src, неактивным Yes или активным CSK, растворенным или диспергированным в нем в качестве ингибитора тирозинкиназы семейства Src.
Терапевтические композиции настоящего изобретения с нуклеиновыми кислотами содержат физиологически переносимый носитель вместе с нуклеиновой кислотой, которая кодирует неактивный Src, неактивный Yes или активный белок CSK, растворенной или диспергированной в нем в качестве ингибитора тирозинкиназы семейства Src.
Подходящие ингибиторы тирозинкиназ семейства Src специфически ингибируют биологическую активность тирозинкиназ семейства Src. Наиболее подходящий ингибитор тирозинкиназы семейства Src обладает в первую очередь специфичностью по ингибированию активности белка pp60Src и второстепенно ингибирует наиболее близкородственные тирозинкиназы семейства Src, такие как Yes. Примеры особо подходящих ингибиторов тирозинкиназ семейства Src включают РР1, РР2, PD173955, AGL1872, PD162531, радицикол R2146, гелданамицин и подобные. Дополнительные подходящие химические ингибиторы тирозинкиназ семейства Src можно идентифицировать и охарактеризовать, применяя стандартные исследования, известные в данной области.
Мутации в Src, которые, как показано, дают ингибирование VP вместо его стимулирования, обозначены как неактивные мутации Src. Белки, имеющие мутации, которые придают такую ингибиторную активность, обозначены как доминантно отрицательные белки Src, которые ингибируют VP, включая VP в результате эндогенной активности Src, а также усиленной активности Src в результате стимуляции фактором роста. Таким образом, некоторые мутации c-Src дикого типа настоящего изобретения могут также действовать как доминантно отрицательные в отношении их способности блокировать рост кровеносных сосудов и VP и, следовательно, например, снижать VP in vivo. Таким образом, другие подходящие ингибиторы тирозинкиназ семейства Src могут включать неактивные формы белков Src и Yes, которые противодействуют активности Src или Yes, давая в результате ингибирование или снижение проницаемости кровеносных сосудов в тканях-мишенях. Предпочтительным неактивным белком Src является Src 251. Другим предпочтительным неактивным белком Src является Src К295М. Предпочтительный неактивный белок Yes будет иметь уменьшенную активность киназы по сравнению с белком дикого типа.
Другими ингибиторами тирозинкиназ семейства Src могут быть антисмысловые нуклеиновые кислоты, аналоги нуклеиновых кислот или белково-нуклеиновые кислоты, которые ингибируют экспрессию генов Src или Yes в клетках-мишенях. Антисмысловые молекулы могут быть терапевтически эффективными VP-модулирующими, если указанная антисмысловая нуклеиновая кислота, способная гибридизоваться с мРНК, кодирующей белок Src или Yes, может гибридизоваться с такой мРНК и в результате обеспечить ингибирование клеточной экспрессии тирозинкиназного белка Src или Yes при трансфекции в клетку-мишень в подходящем фармацевтическом носителе.
Как описано, предпочтительный ингибирующий белок c-Src включает Src 251, в котором только первые 251 аминокислот Src экспрессируются. Данная конструкция не имеет полного домена киназы и, следовательно, обозначена как белок Src «мертвая киназа». Вторая конструкция представляет мутацию Src (K259M), в которой лизиновый аминокислотный остаток 295 мутирован в метионин. Данная точковая мутация в домене киназы предотвращает связывание АТФ и также блокирует киназа-зависимые функции Src, касающиеся сигналов и пролиферации клеток сосудов и клеток опухолей.
Что касается точковых мутаций, любая мутация, дающая желаемую ингибирующую активность, предусматривается для использования в данном изобретении. Слитые белковые конструкции, объединяющие желаемый белок Src (его мутацию или фрагмент) с экспрессированными аминокислотными метками, антигенными эпитопами, флуоресцентным белком или другим подобным белком или белками, также предусматриваются до тех пор, пока не затрагивается требуемый модулирующий эффект белка Src.
Аналогично, добавление экзогенного ингибитора активности белка Src или стимуляция экспрессии такого ингибитора в тканях-мишенях, такого как CSK (С-концевая Src-киназа), также являются средствами ингибирования активности Src. Фосфорилирование тирозина, инактивирующее Src, является средством отрицательной регуляции посредством С-концевой Src-киназы, обозначенной CSK (Nada и др., 1991, Nature, 351: 69-71; Okada и др., 1991, J. Biol. Chem., 266 (36): 24249-24252). Если CSK фосфорилирует аа527 в Src дикого типа, то белок Src инактивируется. Таким образом, CSK является полезным и сильнодействующим ингибитором активности Src. Последовательность белка CSK человека из 450 аминокислот идентифицирована под номером доступа Р41240 и может быть найдена в Шведской базе данных белков. Кодирующая CSK человека последовательность нуклеиновой кислоты мРНК идентифицирована под номером доступа NM 004383 в базе данных GenBank.
В одном варианте данного изобретения фармацевтическая композиция содержит модулирующее проницаемость сосудов количество белка Src, Yes и/или CSK или количество вектора экспрессии, достаточное для экспрессии эффективного количества неактивного Src, Yes или активного белка CSK, обычно композиция составлена так, что содержит, по меньшей мере, 0,1% масс. белка от общей массы терапевтической композиции. Таким образом, например, 0,1% масс. представляет 0,1 г белка на 100 г композиции в целом. Для векторов экспрессии вводимое количество зависит от свойств вектора экспрессии, подлежащей обработке ткани и подобных соображений. Таким образом, эффективное количество ингибитора тирозинкиназы семейства Src в фармацевтической композиции представляет такое количество, которое обеспечивает в результате терапевтически эффективную модуляцию Src-регулируемой проницаемости сосудов. Терапевтическое количество любой фармацевтической композиции соответствует такому количеству, которое самостоятельно обеспечивает в результате уменьшение протечки сосудов или отека, вызванных поражением ткани.
G(i). Общее обсуждение; промышленный продукт
Используемое здесь выражение «упаковочный материал» относится к материалу, такому как стекло, пластик, бумага, фольга и подобные, способному содержать фармацевтический агент внутри твердых упаковок. Таким образом, упаковочный материал может представлять, например, пластиковые или стеклянные пузырьки, ламинированные обертки и подобные контейнеры, используемые для содержания в них фармацевтической композиции, включающей фармацевтический агент.
В предпочтительных вариантах упаковочный материал включает этикетку, которая является материальным воплощением для описания содержания промышленного продукта и использования фармацевтического агента, содержащегося в нем.
G(ii). VP-модулирующие терапевтические композиции; промышленный продукт
Данное изобретение предусматривает промышленный продукт, включающий контейнер с этикеткой для обеспечения терапевтически эффективного количества смеси белка Src и белка Yes. Промышленный продукт включает упаковочный материал и фармацевтический агент, содержащийся внутри упаковочного материала.
Фармацевтический агент в промышленном продукте является любой композицией настоящего изобретения, подходящей для обеспечения белка Src и белка Yes, представленных в фармацевтически приемлемой форме, как здесь описано в соответствии с раскрытыми указаниями. Таким образом, композиция может включать белок Src и Yes, или молекулу ДНК, которая способна экспрессировать белок Src, ДНК, способную экспрессировать белок Yes, или ДНК, способную экспрессировать оба белка. Промышленный продукт содержит количество фармацевтического агента, достаточное для применения при лечении указанных здесь состояний, в виде единой дозы или многих доз.
Белок Src или Yes может быть активным или неактивным или представлять их смесь в зависимости от желаемой степени модуляции. Предпочтительные формы активных и неактивных Src и Yes описаны выше.
Упаковочный материал включает этикетку, на которой указано применение содержащегося внутри фармацевтического агента, например, для лечения состояний, которым помогает ингибирование или активация проницаемости сосудов, и раскрытых здесь подобных состояний. Кроме того, этикетка может включать инструкции по применению и соответствующую информацию, которая может потребоваться для продажи. Упаковочный материал может включать контейнер (контейнеры) для хранения фармацевтического агента.
G(iii). Композиции ингибитора тирозинкиназы семейства Src; промышленный продукт
Данное изобретение предусматривает также промышленный продукт, который представляет собой контейнер с этикеткой для обеспечения терапевтически эффективного количества ингибитора тирозинкиназы семейства Src. Ингибитор может быть упакованным химическим ингибитором, белком-ингибитором или нуклеиновой кислотой-ингибитором тирозинкиназы семейства Src, комбинацией из нескольких или их смесью. Промышленный продукт включает упаковочный материал и содержащийся внутри упаковочного материала фармацевтический агент. Промышленный образец может также содержать два или более субтерапевтически эффективных количеств фармацевтической композиции, которые вместе действуют синергически, обеспечивая в результате облегчение поражения ткани вследствие протечки сосудов или отека.
Фармацевтический агент в промышленном продукте является любой композицией настоящего изобретения, подходящей для обеспечения ингибитора тирозинкиназы семейства Src и представленной в фармацевтически приемлемой форме, как здесь описано в соответствии с раскрытыми указаниями. Таким образом, композиция может включать химические ингибиторы, такие как РР1, РР2, PD173955, AGL1872, PD162531, радицикол R2146 и гелданамицин, белки-ингибиторы, такие как неактивный Src, неактивный Yes, активный белок CSK, или молекулы нуклеиновых кислот, которые способны экспрессировать такие белки или комбинации белков. Промышленный продукт содержит количество фармацевтического агента, достаточное для применения при лечении указанных здесь состояний, в виде единой дозы или многих доз.
Упаковочный материал включает этикетку, на которой указано применение содержащегося внутри фармацевтического агента, например, для лечения состояний, которым помогает ингибирование повышения проницаемости сосудов, и раскрытых здесь подобных состояний. Кроме того, этикетка может включать инструкции по применению и соответствующую информацию, которая может потребоваться для продажи. Упаковочный материал может включать контейнер (контейнеры) для хранения фармацевтического агента.
Примеры
Следующие примеры, относящиеся к данному изобретению, являются иллюстративными и, конечно, их не следует толковать как конкретные ограничения данного изобретения. Кроме того, авторы полагают, что такие вариации данного изобретения, известные сейчас или разработанные позже, которые находятся в компетенции специалистов в данной области, входят в объем настоящего изобретения, заявляемого здесь далее.
1. Получение c-Src- или c-Ves-экспрессионных конструкций
Для получения экспрессионных конструкций, полезных при модуляции VP и ангиогенеза способами настоящего изобретения, проводят манипуляции с кДНК c-Src и вставляют в экспрессионную конструкцию/вектор.
Последовательность кДНК, кодирующая c-Src дикого типа (то есть эндогенного) цыпленка, показана на ФИГ.1 (SEQ ID NO: 2) с кодированной последовательностью аминокислотных остатков, показанной на ФИГ.2 (SEQ ID NO: 3). Кодированная белковая последовательность транслируется из нуклеотидных положений с 112 по 1713 кДНК. Последовательность нуклеиновой кислоты, соответствующая последовательности нуклеиновой кислоты кДНК c-Src человека (SEQ ID NO: 4), и кодированные последовательности аминокислотных остатков (SEQ ID NO: 5) представлены, соответственно, на ФИГ.3 и ФИГ.4. Для последовательности белка человека кодирующая последовательность начинается с положения нуклеотида 134 и заканчивается положением 1486 кДНК.
Дикий тип получали наряду с рядом кДНК мутированных c-Src. Мутированные c-Src-конструкции получали посредством сайт-направленного мутагенеза, как описано в работе Kaplan и др., ЕМВО J., 13: 4745-4756 (1994). Мутированные c-Src-конструкции для кодирования мутированных белков Src с целью использования в способах настоящего изобретения описаны в Kaplan и др., там же. Kaplan и др. описывают различные мутированные c-Src-конструкции и кодированные белки, полезные для практического осуществления данного изобретения. Например, в своей работе на фигуре 1 Kaplan и др. изображают несколько аллельных продуктов c-Src цыпленка, включая Src А и Src 251.
Настоящее изобретение описывает две категории функции c-Src по модуляции VP. Как выше обсуждалось, одна категория содержит молекулы Src, которые повышают VP и, следовательно, считаются активными белками. В настоящем изобретении показано, что Src дикого типа наряду с различными мутациями индуцирует VP. Одна мутация c-Src дикого типа, функцией которой в данном контексте в отношении способности является индуцировать рост кровеносных сосудов и VP, представляет мутант Src А, имеющий точковую мутацию по аминокислотному (аа) остатку в положении 527 с заменой тирозина 527 на фенилаланин. Данный сайт обычно представляет сайт для отрицательной регуляции c-Src-киназой, обозначенной как киназа CSK. Если CSK фосфорилирует аа527 в Src дикого типа, то белок Src инактивируется. Однако в мутированном Src A по аа527 регуляторный тирозин превращен в фенилаланин, что в результате делает белок постоянно активным белком, не подверженным инактивации фосфорилированием.
Здесь показано, что другие мутации в Src имеют противоположный модулирующий эффект на VP, ингибируя VP вместо стимулирования. Такие мутации обозначены как неактивные Src-мутации. Белки, имеющие мутацию, которая придает такую ингибирующую активность, также обозначены как доминантно отрицательные белки Src, так что они ингибируют VP, включая VP в результате эндогенной активности Src, а также усиленной активности Src вследствие стимуляции фактора роста. Таким образом, определенные мутации c-Src дикого типа настоящего изобретения могут также работать как доминантно отрицательные в отношении их способности блокировать рост кровеносных сосудов и VP и тем самым, например, снижать VP in vivo.
Такой предпочтительный ингибиторный белок c-Src включает Src 251, в котором экспрессируются только первые 251 аминокислот Src. Данная конструкция не имеет полного домена киназы и, следовательно, обозначена как белок Src «мертвая киназа». Вторая конструкция представляет мутацию Src (K259M), в которой лизиновый аминокислотный остаток 295 мутирован в метионин. Данная точковая мутация в домене киназы предотвращает связывание АТФ и также блокирует киназа-зависимые функции Src, касающиеся сигналов и пролиферации клеток сосудов и клеток опухолей.
Что касается точковых мутаций, любая мутация, дающая необходимую ингибирующую или стимулирующую активность, предусматривается для использования в данном изобретении. Слитые белковые конструкции, объединяющие необходимый белок Src (его мутацию или фрагмент) с экспрессированными аминокислотными метками, антигенными эпитопами, флуоресцентным белком или другим подобным белком или белками, также предусматривается до тех пор, пока не затрагивается требуемый модулирующий эффект белка Src.
Например, для активации мутации Src по остатку 527, пока полученный мутированный аминокислотный остаток не является тирозином, серином или треонином, настоящее изобретение предусматривает, что присутствие альтернативной аминокислоты по требуемому положению даст в результате белок Src с требуемой активностью, VP-стимулирующей модуляторной активностью.
Киназа Yes семейства Src описана ранее, но не многое известно о ее клеточной функции (Burck и др., 1988, The Oncogenes, Springer-Verlag, New York, pp.133-155; Marth и др., 1985, Cell, 43-393; Semba и др., 1986, PNAS (USA), 83-5459; Shibuya и др., 1982, J. Virol., 42-143; Yoshida и др., 1985, Jpn. J. Cancer Res., 76-559). Предпочтительный активный белок Yes человека кодирован нуклеиновой кислотой, описанной в работе Sukegawa и др., 1987, Mol. Cell Biol., 7: 41-47. Инактивирующие модификации белка Yes человека и кодирующих Yes нуклеиновых кислот можно выполнить, как описано для Src.
Одной предпочтительной экспрессионной конструкцией для применения в настоящем изобретении является конструкция RCASBP(A) (SEQ ID NO: 1). Данный вектор экспрессии основан на сериях, компетентных по репликации вирусов саркомы птиц, с усиленной полимеразой Бриана (ВР) для улучшения титра и специфичен для гликопротеина оболочки типа А, экспрессированного на обычных клетках птиц (рассмотрено в Methods in Cell Biology, 52: 179-214 (1997); смотри также Hughes и др., 1987, J. Virol., 61: 3004-3012; Fekete & Cepko, 1993, Mol. Cellular Biol., 13 (4): 2604-2613; Itoh и др., 1996, Development, 122: 291-300 и Stott и др., 1998, Biotechniques, 24: 660-666). Полная последовательность RCASBP(A) (SEQ ID NO: 1) приведена в списке последовательностей, а рестрикционная карта конструкции изображена на ФИГ.10, обозначена здесь как RCAS.
Исходная конструкция Src 251 субклонирована доктором Pam Schwartzberg в NIH в лаборатории доктора Harold Varmus. Излагая кратко, клонирование последовательности кДНК Src для экспрессии осуществляли, вставляя линкер, содержащий рестрикционные Not I-BstB1-Not-сайты I в уникальный сайт Not I на 5'-конце Src 251. Src имеет уникальный сайт Cla I на 3'-конце. Расщепление Src 251 посредством BstB1 и Cla I генерировало BstB1-ClaI-фрагмент, который затем лигировали к сайту Cla I на RCASBP(A). Выступ BstB1 позволяет лигирование с выступом Cla I, которое не будет снова разрезаться Cla I.
Src-конструкции, подходящие для использования при осуществлении настоящего изобретения, легко получить в описанном выше векторе, сначала расщепляя вектор RCAS, содержащий Src 251 посредством Not I и Cla I (в среде DAM+), разрешая вставку аналогично расщепленной кДНК Src. Таким образом, данную начальную конструкцию RCASBP(А), содержащую Src 251, затем использовали для субклонирования всех других Src-конструкций, как описано выше и в работе Kaplan и др., 1994, EMBO J., 13 (20): 4745-4756, в RCASBP(А) через Not I-Cla I-фрагмент, генерированный посредством Src 251-конструкции. Для получения требуемых мутаций c-Src в кДНК применяли стандартные методики сайт-направленного мутагенеза, знакомые специалистам в данной области. ПЦР-праймеры, предназначенные для включения требуемых мутаций, были также разработаны с сайтами рестрикции для облегчения последующих стадий клонирования. Целые сегменты Src-кодирующих последовательностей нуклеиновых кислот удаляют из конструкций нуклеиновых кислот посредством техники ПЦР-амплификации на основе известных последовательностей кДНК цыпленка, человека и других гомологов Src и последующего образования новых конструкций.
В одном варианте данного изобретения 3' ПЦР-праймер, используемый для амплификации Src-нуклеиновых кислот, также кодирует последовательность в рамке. Применение данного праймера добавляет метку эпитопа 9Е10-mус к карбоксильному концу последующей Src-конструкции. Следующие аминокислоты добавляли после аминокислоты 251 Src для генерирования векторной конструкции, содержащей эпитопную метку 9Е10-mус: VDMEQKLIAEEDLN (SEQ ID NO: 6). Две отдельные ПЦР были выполнены для каждой конструкции и получены схожие результаты. Все мутантные конструкции, сконструированные при помощи ПЦР, секвенировали также посредством ПЦР для подтверждения предсказанной последовательности ДНК клонов. кДНК дикого и мутированного Src для использования в экспрессионных системах настоящего изобретения доступны также от Upstate Biotech Laboratories, Lake Placid, NY, которая продает Src птиц и человека, несколько мертвых киназ и активированные мутированные формы.
Альтернативные векторы экспрессии для применения при экспрессии белков Src или Yes настоящего изобретения, также включают аденовирусные векторы, как описано в патентах США №№4797368, 5173414, 5436146, 5589377 и 5670488. Альтернативные способы доставки модуляторных белков Src или Yes включают доставку кДНК Src или Yes невирусной векторной системой, как описано в патенте США №5675954, и доставку самой кДНК в виде "голой" ДНК, как описано в патенте США №5589466. Доставка конструкций данного изобретения также не ограничена локальным применением вирусного вектора, как описано ниже в системе исследований САМ. Например, препараты вирусного вектора также вводят внутривенно для системной доставки в русло сосуда. Эти векторы также целенаправлены на места повышенного новообразования кровеносных сосудов при локализованной инъекции в опухоль, как в примере.
Белки, экспрессированные in vitro, также предусматриваются для их доставки после экспрессии и очистки селектированного белка Src способами, полезными для доставки белков или полипептидов. Один такой способ включает липосомные системы доставки, такие как описанные в патентах США №№4356167, 5580575, 5542935 и 5643599. Специалистам в данной области хорошо известны другие системы доставки векторов и белков для применения при экспрессии и/или доставке белков Src или Yes настоящего изобретения.
2. Характеристика необработанной хориоаллантоидной мембраны цыпленка (САМ)
А. Получение САМ
Ангиогенез можно индуцировать в хориоаллантоидной мембране (САМ) цыпленка после того, как в результате нормального эмбрионального ангиогенеза образуются зрелые кровеносные сосуды. Показано, что ангиогенез индуцируется в ответ на специфические цитокины или фрагменты опухолей, как описано в работах Leibovich и др., Nature, 329: 630 (1987) и Ausprunk и др., Am. J. Pathol., 79: 597 (1975). САМ получали из эмбрионов цыплят для последующего индуцирования ангиогенеза и его ингибирования. Десятидневные эмбрионы цыплят получали от McIntyre Poultry (Lakeside, CA) и инкубировали при 37°С и влажности 60%. Используя небольшое специальное сверло (Dremel, Division of Emerson Electric Co. Racine WI), делали небольшое отверстие в скорлупе на конце яйца непосредственно над воздушным мешком. Второе отверстие делали в широком конце яйца в области, лишенной эмбриональных кровеносных сосудов, определенной заранее путем проверки яйца на свет. К первому отверстию прикладывали отрицательное давление, в результате чего САМ (хориоаллантоидная мембрана) вытягивается из скорлупы и создается фальшивый воздушный мешок над САМ. При помощи небольшого точильного колеса (Dremel) в скорлупе прорезали окошко площадью 1,0 см × 1,0 см над выпавшей САМ. Данное небольшое окошко давало прямой доступ к лежащей под ним САМ.
Полученный препарат САМ затем использовали для 6-дневного эмбриогенеза, стадии, заметной по активному новообразованию кровеносных сосудов без дополнительной обработки САМ, отражающей модель, использованную для оценки влияний на эмбриональное новообразование кровеносных сосудов, или использовали для 10-дневного эмбриогенеза, где ангиогенез убывает. Последний препарат использовали таким образом в данном изобретении для индуцирования повторного ангиогенеза в ответ на обработку цитокинами или контакт с опухолью, как описано ниже.
3. Исследование ангиогенеза САМ
А. Ангиогенез, индуцированный факторами роста
Показано, что ангиогенез индуцируется цитокинами или факторами роста. Ангиогенез индуцировали, помещая фильтровальный диск Ватмана размером 5 мм × 5 мм (Whatman Filter paper №1), насыщенный сбалансированным солевым раствором Хенкса (HBSS, GIBCO, Grand Island, NY) или HBSS, содержащими 2 мкг/мл рекомбинантного основного фактора роста фибробластов (bFGF) или фактора роста эндотелиальных клеток сосудов (VEGF) (Genzyme, Cambridge, MA), на САМ 9- или 10-дневного зародыша цыпленка в области, не содержащей кровеносных сосудов, и затем закрывали окошки скотчем. Другие концентрации факторов роста также эффективны в индуцировании роста кровеносных сосудов. Для исследований, где оценивают ингибирование ангиогенеза с помощью внутривенного введения антагонистов, сначала индуцируют ангиогенез при воздействии 1-2 мкг/мл bFGF или VEGF в питательной среде фибробластов. Ангиогенез контролировали при помощи фотомикроскопии через 72 час.
В. Эмбриональный ангиогенез
Препарат САМ для оценки эффекта ингибирования ангиогенеза на примере естественного формирования новообразующихся кровеносных сосудов эмбриона представляет, как описано выше, 6-дневный эмбрион цыпленка. На этой стадии развития кровеносные сосуды претерпевают рост de novo и, следовательно, обеспечивают полезную систему для исследования модуляции ангиогенеза белками Src настоящего изобретения. Систему САМ получают, как описано выше, за исключением того, что исследование предпочтительнее проводить на 6-дневных эмбрионах, чем 9- или 10-дневных.
4. Модуляция ангиогенеза, определенная в исследовании САМ
Для оценки влияния белков Src на ангиогенез проводили следующие исследования на препаратах САМ 10-дневных цыплят. Пять мкг конструкций RCAS, полученных, как описано в примере 1, трансфицировали в линию иммортализованных фибробластов цыпленка DF-1 (подарок Doug Foster, U. of Minn). Данная клеточная линия, а также первичные фибробласты эмбрионов цыплят способны продуцировать вирус, однако клеточная линия DF-1 давала более высокие титры. Вирусные супернатанты собирали из субконфлюэнтных клеточных линий DF-1-продуцента в среде CLM, не содержащей сыворотки (состав: основа - среда F-10, снабженная ДМСО, фолиевой кислотой, глутаминовой кислотой и раствором витамина MEM). 35 мл вирусного супернатанта концентрировали ультрацентрифугированием при 4°С и 22000 об./мин в течение 2 час. Концентрированный вирусный осадок повторно суспендировали в 1/100 исходного объема в среде CLM, не содержащей сыворотки, делили на аликвоты и хранили при 80°С. Титр оценивали путем серийных разведений контрольного вирусного вектора, содержащего нуклеотидную последовательность, кодирующую зеленый флуоресцентный белок (GFP), обозначенного как RCAS-GFP, инфицирование проводили на первичных фибробластах эмбрионов цыплят, которые инкубировали в течение 48-72 час. Полученные титры вирусного штамма обычно превышали концентрацию 108 I.U./мл. Для исследования САМ, применяющего вирусные линии, готовили фильтровальные диски Ватмана диаметром 6 мм, пропитанные кортизонацетатом путем помещения в раствор 3 мг/мл кортизонацетата в 95% этаноле на 30 минут. Диски сушили в вытяжном шкафу в ламинарном потоке и затем пропитывали 20 мкл вирусного штамма на диск в течение 10 мин. Данные диски накладывали на САМ 9- или 10-дневных эмбрионов цыплят, закрывали целлофановой лентой и инкубировали при 37°С в течение 18-24 час. Затем добавляли только PBS или факторы роста при концентрации 5 мкг/мл к САМ в 20 мкл подходящего вирусного штамма в качестве дополнительной помощи вирусам в ткани САМ. Через 72 часа САМ собирали и исследовали на изменения ангиогенного индекса, что определяли двойным слепым подсчетом количества точек разветвления в лежащей под диском САМ. Для исследования киназы лежащую под диском ткань собирали в RIPA, гомогенизировали в моторизованном измельчителе, Src подвергали иммунопреципитации из эквивалентных количеств общего белка и подвергали исследованию киназы in vitro с использованием слитого белка FAK-GST в качестве субстрата. Для иммунофлуоресцентных исследований лежащую под диском ткань САМ замораживали в ОСТ, криоконсервировали, делали срезы по 4 мкм, фиксировали в ацетоне в течение 1 мин, инкубировали в 3% нормальной козьей сыворотке в течение 1 час, затем инкубировали в первичном кроличьем антителе против фосфорилированного ERK, как описано ранее (Eliceiri и др., J. Cell. Biol., 140: 1255-1263 (1998)), промывали PBS и детектировали, используя флуоресцентное вторичное антитело.
А. Активация эндогенного Src посредством bFGF и VEGF
Для оценки эффекта факторов роста на активность Src в модуляции ангиогенеза проводили следующие исследования. Экстракты ткани САМ 10-дневных цыплят, которые подвергали действию bFGF или VEGF (2 мкг/мл) в течение 2 часов, лизировали. Эндогенный Src подвергали иммунопреципитации из эквивалентных количеств общего белка, подвергали иммунному комплексному исследованию киназы in vitro, используя слитый белок FAK-GST в качестве субстрата, проводили электрофорез и переносили на нитроцеллюлозу.
Результаты данного исследования представлены на ФИГ.5, где повышение активности Src очевидно из увеличенной плотности геля при обработке bFGF или VEGF по сравнению с необработанными (фиктивными) образцами, которые указывают исходный уровень активности Src в исследовании САМ. Оба bFGF и VEGF давали в результате примерно 2-кратное увеличение активности эндогенного Src, присутствующего в САМ. Также зондировали блот описанного выше исследования киназы с использованием анти-Src антитела в качестве контроля загрузки эквивалентного содержания Src и IgG.
В. Влияние ретровирус-опосредованной генной экспрессии Src А на ангиогенез в САМ цыпленка
Для оценки эффекта мутированных белков Src на ангиогенез в препаратах САМ проводили следующее исследование. Для исследования САМ 9-дневных цыплят подвергали воздействию экспрессирующих ретровирусов RCAS-Src А или RCAS-GFP или буфера в течение 72 час, следуя описанному выше протоколу.
Результаты данного исследования показаны на ФИГ.6А, где степень ангиогенеза определяли количественно, как описано выше. На стереомикроскопе получали типичные микрофотографии (4х), показанные на ФИГ.6В. Исходный уровень активности эндогенного Src имеет ангиогенный индекс примерно 50. В противоположность этому, САМ, обработанные ретровирусным вектором RCAS-Src А с точковой мутацией по аминокислотному остатку в положении 527 с тирозина на фенилаланин, давали в результате усиление (индуцирование) ангиогенеза с ангиогенным индексом примерно 90. Усиление Src А-опосредованного ангиогенеза также очевидно из фотографий, показанных на ФИГ.6В.
С. Ретровирусная экспрессия Src А активирует фосфорилирование сосудистой киназы MAP
Оценивали также эффект Src А по сравнению с факторами роста VEGF и РМА на фосфорилирование сосудистой киназы MAP в соответствии со способами исследования, описанными выше и здесь. Экстракты тканей САМ 10-дневных цыплят, подверженные действию VEGF или РМА (другой митоген при сравнимой концентрации) в течение 30 минут, сравнивали с экстрактами, инфицированными ретровирусом, экспрессирующим Src А, в течение 48 час. Затем Src подвергали иммунопреципитации из эквивалентных количеств общего белкового экстракта и проводили иммунное комплексное исследование киназы in vitro, используя слитый белок FAK-GST в качестве субстрата, проводили электрофорез и переносили на нитроцеллюлозу.
Результаты данного исследования показаны на ФИГ.7А, где необработанные САМ (NT) демонстрируют исходное опосредованное эндогенным Src фосфорилирование сосудистой киназы MAP. Оба VEGF и РМА давали в результате примерно 2-кратное увеличение от исходного значения. В противоположность этому, Src A усиливал активность примерно в 5-10 раз по сравнению с необработанными образцами.
Аликвоты описанных выше лизатов ткани также оценивали на фосфорилирование эндогенного ERK посредством иммуноблоттинга с анти-фосфо-ЕРК-антителом, как показано на ФИГ.7В. Для такой оценки 10-дневные САМ инфицировали либо фиктивным RCAS, либо RCAS, который экспрессирует Src А. Через два дня САМ иссекали, криоконсервировали в ОСТ и делали срезы по 4 мкм. Срезы иммуноокрашивали антителом против фосфорилированного ERK (New England Biolabs), промывали и детектировали, используя антикроличье FITS-конъюгированное вторичное антитело козы. Флуоресцентные изображения получали при помощи охлажденной CCD-камеры (Princeton Inst.). Микрофотографии показывают усиление иммунофлуоресценции в препаратах, обработанных Src А, по сравнению с mock-контролями.
D. Селективная потребность в активности Src при VEGF (но не bFGF)-индуцированном ангиогенезе
Для оценки влияния Src-модуляторной активности на индуцированный фактором роста ангиогенез проводили следующие исследования. САМ девятидневных цыплят подвергали воздействию препарата ретровирусного вектора, который экспрессировал доминантно отрицательную мутацию Src, относительно Src 251 или Src К295М, как описано ранее. Ретровирусные RCAS-Src 251, или контрольные RCAS-GFP, или буферные САМ обрабатывали в течение 20 час и затем инкубировали еще 72 час в присутствии или в отсутствие bFGF или VEGF.
Степень ангиогенеза, определенная количественно, как описано выше, показана на ФИГ.8А. При помощи стереомикроскопа получали типичные микрофотографии (6х), показанные на ФИГ.8В. На ФИГ.8С показан блот с использованием в качестве зонда анти-Src антитела для подтверждения экспрессии Src 251 в трансфицированных клетках по сравнению с фиктивными обработками.
Результаты описанных выше исследований показывают, что обе bFGF- и VEGF-обработанные САМ в присутствии контрольных RCAS-GFP индуцировали ангиогенез выше Src-опосредованного исходного уровня ангиогенеза, наблюдаемого с обработанных буфером или в необработанных препаратах САМ. Экспрессированный доминантно отрицательный мутант Src 251 эффективен при ингибировании VEGF-индуцированного ангиогенеза обратно до исходного уровня и неэффективен при ингибировании bFGF-опосредованного ангиогенеза. Микрофотографии, показанные на ФИГ.8В, иллюстративно подтверждают данные, представленные на ФИГ.8А. Таким образом, экспрессированный ретровирусом Src 251 является эффективным ингибитором ангиогенеза, если ангиогенез индуцирован VEGF.
В настоящем изобретении предусматривается применение белков Src данного изобретения на других моделях ангиогенеза, как описано в примерах ниже.
5. Регрессия роста опухолевой ткани Src-модуляторами, определенная в исследовании in vivo на модели глаза кролика
Влияние Src-модуляторов на индуцированный факторами роста ангиогенез можно наблюдать в естественно прозрачных структурах, как, например, на роговице глаза. Новые кровеносные сосуды растут из края роговицы, который имеет богатое кровоснабжение, по направлению к центру роговицы, который обычно не снабжается кровью. Стимуляторы ангиогенеза, такие как bFGF, при применении на роговице индуцируют рост новых кровеносных сосудов от края к центру роговицы. Антагонисты ангиогенеза при применении на роговице ингибируют рост новых кровеносных сосудов от края к центру роговицы. Таким образом, роговица испытывает ангиогенез посредством инвазии эндотелиальных клеток от края роговицы в плотную заполненную коллагеном ткань роговицы, что легко видеть. Таким образом, исследование на глазу кролика обеспечивает in vivo модель для прямого наблюдения стимуляции и ингибирования ангиогенеза после имплантации соединений непосредственно в роговицу глаза.
Исследование in vivo на модели глаза кролика демонстрирует индуцированный факторами роста ангиогенез
Ангиогенез индуцируют в исследовании in vivo на модели глаза кролика факторами роста bFGF или VEGF, это описано в следующих разделах.
Полимерные гранулы из гидрона (Hydron), содержащие фактор роста, получают, как описано в работе D'Amato и др., Proc. Natl. Acad. Sci., USA, 91: 4082-4085 (1994). Индивидуальные гранулы содержат 650 нг факторов роста, отдельно связанных с сукралфатом (Carafet, Marion Merrell Dow Corporation) для стабилизации фактора роста, и обеспечивают их медленное высвобождение в окружающую ткань. Кроме того, получаемые из гидрона гранулы содержат требуемый Src-экспрессирующий ретровирус, который описан ранее. Данные гранулы отливают в специально приготовленных тефлоновых стержнях, которые имеют 2,5 мм ядро, просверленное на поверхности. В каждый стержень помещают примерно по 12 мкл заливочного материала и полимеризуют в течение ночи в стерильном вытяжном шкафу. Затем гранулы стерилизуют ультрафиолетовым облучением. Далее оценивают эффекты белков Src, как описано ранее.
6. Регрессия in vivo роста опухолевой ткани Src-модуляторами, определенная в исследовании с химерными мышами:человеком
In vivo модель «химерная мышь:человек» генерируют путем замещения части кожи мыши SCID неонатальной крайней плотью человека. In vivo модель «химерная мышь:человек» получают, по существу, как описано в работе Yan и др., J. Clin. Invest., 91: 986-996 (1993). Кратко говоря, кусочек кожи площадью 2 см2 удаляли хирургически с мыши SCID (возраст 6-8 недель) и заменяли крайней плотью человека. Мыши делали анестезию и сбривали шерсть с площади 5 см2 на каждой стороне боковой брюшной области. Готовили две круглых области для трансплантатов площадью 2 см2, удаляя кожу на полную толщину до фасции. Трансплантаты кожи человека полной толщины того же размера, взятые с крайней плоти новорожденного, помещают на области ран и пришивают на место. Трансплантат покрывают пластырем, который пришивают к коже. Рану также покрывают микропористой тканью.
Для образования твердых опухолей человека в трансплантатах кожи человека на мыши SCID используют клеточную линию меланомы человека M21-L или клеточную линию карциномы молочной железы MDA 23.1 (АТСС НТВ 26; αvβ3 отрицательные по иммунореактивности срезов ткани с mAb LM609). Суспензию одиночных клеток 5×106 M21-L или MDA 23.1 вводят внутридермально в трансплантат кожи человека. Затем наблюдают мышей в течение 2-4 недель, позволяя опухолям вырасти до измеримых размеров.
После учреждения измеримых опухолей в хвостовую вену мыши вводят ретровирусные препараты настоящего изобретения. Через 2-3-недельный период опухоль иссекают и анализируют по массе и гистологии. Затем оценивают влияние экспрессированных белков Src настоящего изобретения на опухоли.
7. Регрессия роста опухолевой ткани человека in vitro Src-модуляторами, определенная в исследовании САМ
Рост опухоли зависит от ангиогенеза (Folkman, 1992, J. Biol. Chem., 267: 10931-10934; Weidner и др., 1991, N.E. J. Med., 324: 1-8; Brooks и др., 1994, Cell, 79: 1157-1164). Фактически последние сообщения говорят, что рост опухоли чувствителен к анти-ангиогенным эффектам антагонистов рецепторов VEGF (Kim и др., 1993, Nature, 362: 8451-844). Следовательно, авторы исследовали, будет ли подавление ангиогенеза путем доставки киназа-утраченного Src 251 влиять на рост медуллобластомы человека (DAOY), высоко ангиогенной опухоли, продуцирующей, как известно, VEGF и немного bFGF.
Исследование роста опухоли 3- и 6-дневной медуллобластомы DAOY проводили на САМ цыплят, по существу, как описано ранее (Brooks и др., 1994, см. выше). Клетки DAOY 5×106, культивированные в RPMI 1640, содержащей 10% фетальную телячью сыворотку, промывали и засевали на САМ 10-дневного эмбриона для получения фрагментов опухоли DAOY. Через 7 дней иссекали 50 мг фрагментов опухоли и повторно засевали на другой 10-дневный эмбрион и инкубировали еще 3 или 6 дней при локальном применении (25 мкл) контрольного ретровируса RCAS-GFP, RCAS-Src 251 или обработки mock. Используя в качестве ориентира конфокальное изображение ткани инфицированной опухоли целиком, при таком локальном подходе авторы имели возможность определить, что вокруг и внутри фрагментов опухоли происходит существенная экспрессия RCAS-конструкций. Производили повторное иссечение опухоли и взвешивание двойным слепым способом, удаляя только легко определяемую массу твердой опухоли (Brooks и др., 1994, см. выше). Массу опухоли во влажном состоянии через 3 или 6 дней сравнивали с начальной массой и определяли процентное изменение массы опухоли для каждой группы.
Данные опухоли легко растут на САМ и продуцируют активный ангиогенез (ФИГ.9), предоставляя авторам селективную мишень - сосудистую сеть опухолей птиц при использовании специфических для птиц ретровирусов RCAS.
На ФИГ.9 представлены результаты, которые показывают, что ретровирусная доставка RCAS-Src 251 к опухолям человека, растущим на САМ цыплят, дает регрессию опухоли. На ФИГ.9А показаны медуллобластомы человека, которые выращены на САМ эмбрионов цыплят, как описано выше. Ретровирус, содержащий RCAS-GFP или RCAS-Src 251, применяли локально на предварительно развившихся опухолях больше 50 мг. Типичная микрофотография фрагмента опухоли медуллобластомы, инфицированной посредством RCAS-GFP, экспрессирующим GFP, обнаруживает экспрессию исключительно в кровеносных сосудах опухоли (стрелка), как определяют по оптическим сечениям при помощи лазерного конфокального сканирующего микроскопа Bio Rad (полоса=500 мкм). На ФИГ.9В показаны результаты от опухолей, обработанных, как описано выше, которые оставляли расти в течение 3 или 6 дней, после чего их иссекали и определяли массу во влажном состоянии. Данные выражают как среднее изменение массы опухоли (от исходной массы опухоли 50 мг) +/- среднеквадратичное отклонение из 2 повторов. RCAS-Src 251 показывал существенный перелом в росте опухоли через 3 дня (*, Р<0,002) и 6 дней (**, Р<0,05). На ФИГ.9С показаны типичные микрофотографии опухолей медуллобластом, хирургически удаленных из эмбрионов, полученные при помощи стереомикроскопа Olympus (полоса = 350 мкм). (Нижняя панель) Микрофотографии каждой опухоли с сильным увеличением, показывающие подробно сосудистую сеть каждой опухоли (полоса = 350 мкм). Стрелка указывает разрыв кровеносного сосуда в опухолях, обработанных RCAS-Src 251.
Результаты показывают, что доставка RCAS, содержащего Src 251, к предварительно установившимся медуллобластомам дает в результате селективную вирусную экспрессию в связанных с опухолью кровеносных сосудах (ФИГ.9А), и это, в конечном счете, ведет к регрессии данных опухолей за 6 дней (ФИГ.9В). Важно, что связанные с опухолью кровеносные сосуды у животных, обработанных вирусом, содержащим Src 251, сильно разрушены и количество их меньше по сравнению с сосудами опухолей у контрольных животных (ФИГ.9С). Тот факт, что RCAS-GFP-инфицированные опухоли показывали локализацию GFP только в сосудистой сети опухоли, предполагает, что противоопухолевые эффекты, наблюдаемые при ретровирусной доставке Src 251, обусловлены анти-ангиогенными свойствами.
8. Src-потребность для выживания эндотелиальных клеток при VGEF (но не bFGF)-опосредованном ангиогенезе
Последние доказательства предполагают, что рецепторы факторов роста (Choi and Ballermann, 1995, J. Biol. Chem., 270: 21144-21150; Satake и др., 1998, Biochem. Biophys. Res. Comm, 244: 642-646) и интегрины (Meredith и др., 1993, Mol. Biol. Cell, 4: 953-961; Brooks и др., 1994а, Science, 264: 569-571) стимулируют выживание ангиогенных эндотелиальных клеток. Тот факт, что и факторы роста, и рецепторы адгезии также регулируют активность Src, подсказало проверку роли Src в выживании эндотелиальных клеток при ангиогенезе. САМ, стимулированные bFGF или VEGF, инфицировали ретровирусом, содержащим Src 251, и криостатические срезы данных тканей проверяли на присутствие клеток с апоптозом.
Кратко говоря, криосрезы САМ, обработанных RCAS-GFP или RCAS-Src 251, обработанные bFGF или VEGF, анализировали на клетки с апоптозом, используя набор Apoptag Kit (Oncor, Gaithersburg, MD). Проводили иммуноокрашивание срезов поликлональным анти-vWf кролика (Biogenix, San Ramon, CA) и контрастное окрашивание 1 мкг/мл DAPI. Флуоресцентные изображения получали при помощи охлажденной CCD-камеры (Roper, Trenton, NJ), обрабатывали и сопоставляли вид между экспериментальными обработками, как описано ранее (Ellcelri и др., 1998, см. выше).
Для определения коэффициента апоптоза ретровирус-инфицированных тканей САМ использовали FITC-конъюгированный аннексин V (Clontec, Palo Alto, CA) для окрашивания клеточных суспензий и промытые клетки анализировали проточной цитометрией. Суспензию клеток САМ получали из mock- или вирус-инфицированных САМ путем расщепления 0,1% (масс./об.) коллагеназой типа IV (Wortington Biochemicals, Lakewood, NJ) в RPMI 1640 размельченной ткани САМ, качающейся в течение 1 часа при 37°С, как описано ранее (Brooks и др., 1994b), и фильтровали через 100 мкМ нейлоновое сито (Becton Dickinson, Fountain Lakes, NJ). Флуоресценция, измеренная на FAC-проточном цитометре (Becton Dickinson), дает 10000 клеток.
Измерение окрашивания vWf с помощью FAC выполняли с параллельными клеточными препаратами расщепленной коллагеназой ткани САМ, которые фиксировали в 1,8% параформальдегиде, пропитывали в 70% этаноле, инкубировали с анти-vWf антителом и детектировали FITC-конъюгированным вторичным антителом.
Доставка Src 251 стимулировала обширное TUNEL-окрашивание среди фактор VIII-родственных антиген (фактор фон Виллебранда [vWf])-положительных кровеносных сосудов в VEGF (но не bFGF)-стимулированных САМ. Фактически минимальный апоптоз наблюдался среди других типов клеток в данных САМ, предполагая специфическую для эндотелиальных клеток потребность в Src-киназной активности для выживания клеток в VEGF-активированных кровеносных сосудах. Во второй серии экспериментов ретровирус-инфицированные САМ, стимулированные VEGF или bFGF, подвергали ограниченному расщеплению коллагеназой с целью получения суспензии одиночных клеток. Показано, что такие САМ-производные клетки содержали примерно 20-50% эндотелиальных клеток (vWf-положительных), и их анализировали на апоптоз посредством проточного цитометрического детектирования аннексин V-положительных клеток, индикаторов раннего апоптоза. Клетки, производные VEGF-стимулированных САМ, инфицированных Src 251, имели значительно увеличенное аннексин V-окрашивание относительно клеток mock RCAS-GFP-инфицированных САМ, обработанных VEGF. В противоположность этому, клетки, производные mock-инфицированных САМ, или инфицированные RCAS-Src 251, и стимулированные bFGF, продемонстрировали меньшее аннексин V-окрашивание или его отсутствие. Кроме того, отсутствие аннексин V-окрашивания детектировали среди клеток, производных не стимулированных или bFGF-стимулированных САМ. Эти данные показывают, что активность Src-киназы селективно требуется для выживания эндотелиальных клеток во время VEGF (но не bFGF)-опосредованного ангиогенеза в САМ.
9. Селективная потребность в активности Src-киназы на подкожной мышиной модели ангиогенеза
С целью дополнительного исследования роли Src в ангиогенезе использовали мышиную модель. В данном случае ангиогенез индуцировали путем подкожной инъекции фактор роста недостаточного матригеля (Matrigel), снабженного bFGF (100 нг/мл) или VEGF (400 нг/мл), бестимусным «голым» (nu/nu) взрослым мышам и анализировали через 5 дней (Passanity и др., 1992). Ангиогенез определяли количественно, удаляя и гомогенизируя ткани, выделяя белки и проводя иммуноблоттинг с антителом против рецептора VEGF (flk-1) (ФИГ.13А), которое специфично для эндотелиальных клеток. Как наблюдалось у цыплят, экспрессия кДНК киназа-недостаточного Src 251 блокировала VFGF-индуцированный ангиогенез на данной мышиной модели и не влияла на bFGF-индуцированный ангиогенез (ФИГ.13В). Для определения роли эндогенного Src в данной модели ткани инфицировали ретровирусом, экспрессирующим Cak, который ингибирует активность эндогенного Src посредством фосфорилирования С-концевого регуляторного сайта (Nada и др., 1991, Nature, 361:68-72). Экспрессия Cak блокировала VFGF- (но не bFGF)-индуцированный ангиогенез (ФИГ.13), подтверждая роль эндогенной активности Src в VFGF-опосредованном ангиогенезе. Новообразование кровеносных сосудов данных вирус-инфицированных VFGF-стимулированных тканей подтверждали прямой иммунофлуоресценцией с FITC-конъюгированным анти-DС34 антителом (ФИГ.13) или анти-flk-1 антителом и определяли количественно, пересчитывая число положительно окрашенных CD34 кровеносных сосудов в каждом криосрезе (ФИГ.13С).
Кратко говоря, ангиогенез индуцировали путем подкожной инъекции фактор роста-недостаточного матригеля, содержащего физиологический раствор или VFGF (400 нг/мл) с 2×106 экотропически упакованных клеток, экспрессирующих ретровирус GFP, в бок у бестимусных «голых» (nu/nu) мышей и анализировали через 5 дней инкубации. Новообразование кровеносных сосудов определяли количественно посредством иммуноблоттинга с антителом против рецептора VEGF (flk-1), которое специфично относительно эндотелиальных клеток. На ФИГ.13А изображены результаты иммуноблоттинга. Эффекты киназа-недостаточного Src- 251-, Csk- или GFP-ретровирусов на VFGF- (400 нг/мл) или bFGF-(400 нг/мл)-индуцированный ангиогенез анализировали посредством иммуноблоттинга лизатов тканей с анти-flk-1-антителом. Пример таких результатов представлен на ФИГ.13В. Влияние Src-251- и Csk-экспрессирующих-ретровирусов на VFGF-индуцированное новообразование кровеносных сосудов определяли количественно пересчетом числа CD34-положительных сосудов в поперечных срезах ткани путем непрямой иммунофлуоресценции при троекратном слепом выборе областей с 20х. Криосрезы пробок подвергали также иммунофлуоресцентному окрашиванию анти-СD34-антителом или анти-flk-1-антителом, фотографировали и определяли количественно, как описано выше для исследования ангиогенеза в САМ.
Прямую флуоресценцию всего предметного стекла с фрагментом RCAS-GFP-инфицированной опухоли выполняли, иссекая фрагмент опухоли и изображая нефиксированную ткань прямо на слайде при помощи лазерного конфокального микроскопа (MRC 1024: Bio-Rad, Hercules, CA).
10. Влияние внутрикожной экспрессии VEGF на ушах мышей src-/- или src+/-
В продолжение результатов, полученных на моделях ангиогенеза у цыплят и мышей, использовали прямой генетический подход для исследования внутрикожного VEGF-индуцированного ангиогенеза у мышей src-/-. Также исследовали влияния на проницаемость сосудов, так как известно, что VEGF инициирует рост новых кровеносных сосудов и может стимулировать проницаемость сосудов (Senger и др., 1983, Science, 218: 983-985; Ferra and Davis-Smyth, 1997, Endocr. Rev., 16: 4-25).
Мышам src-/- и src+/- делали в уши внутрикожные инъекции аденовируса, экспрессирующего кДНК VEGF человека, при этом в противоположное ухо каждой мыши делали инъекцию контрольного аденовируса, экспрессирующего β-галактозидазу. Первый VEGF-зависимый рост новых кровеносных сосудов в ушах src+/- детектировался через 48 час, и новообразование кровеносных сосудов анализировали через 5 дней.
Говоря кратко, рр60c-src, рр60c-yes, рр60c-fyn-дефицитных мышей (129/8v/Ev × C57B16/J) генерировали, как описано ранее (Soriano и др., 1991, Cell, 64: 693-702). Дополнительные группы получали от Jackson labs. Инъекцию в уши делали внутрикожно (Eriksson и др, 1980, Microvasc. Res., 19: 374-378), вводя 5 мкл аденовируса, экспрессирующего VEGF или β-галактозидазу, и уши фотографировали через 5 дней при помощи стереоскопа.
Обнаружено, что уровни вирусной экспрессии идентичны у src+/- и src-/-, как определяли посредством X-gal-окрашивания введенного в уши β-галактозидаза-аденовируса. В ушах src-/- при VEGF-инъекции не было существенного снижения ангиогенеза, что определяли подсчетом точек разветвления (р<0,05). Однако удивительно, что наибольший очевидный фенотип данных животных демонстрировал полную блокаду протечки сосудов по сравнению с ушами src+/- при VEGF-инъекции. Проверка ушей с инъекцией VEGF подтверждает степень протечки сосудов у мышей src+/-, которая по существу отсутствует у мышей src-/-. Протечка сосудов у данных животных предполагает, что VP-активность, которая связана с ангиогенезом in vivo (Dvorak и др., 1995, Am. J. Pathol., 148: 1029-1039), можно селективно нарушить у рр60c-src-дефицитных мышей.
11. Неудачи VEGF в попытках снижения барьера кровь-головной мозг у мышей с дефицитом рр60c-src
Сосудистая сеть головного мозга характеризуется высоким ограничительным барьером кровь-головной мозг, который препятствует экстравазации малых молекул в окружающую ткань головного мозга. Рост опухоли в головном мозге может снизить этот барьер частично вследствие производства ангиогенных факторов роста, таких как VEGF. Следовательно, авторы исследовали природу барьера кровь-головной мозг у мышей src+/- или src-/-. В данном случае стереотактически вводили VEGF или физиологический раствор в правую или левую полусферу головного мозга, соответственно. Всем мышам делали общие инъекции синего красителя Эвана для контроля VP-активности.
Кратко говоря, стереотактически вводили физиологический раствор или VEGF (200 нг в 2 мкл) в левую, или правую фронтальную долю на 92 мм влево/вправо от средней линии, на 0,5 мм к носу от брегмы и на 3 мм вглубь от твердой мозговой оболочки, соответственно. Через 30 мин после инъекции животным вводили внутривенно раствор синего красителя Эвана, как описано выше. Еще через 30 мин мышей перфузировали и удаляли головной мозг. Наблюдали флуоресценцию синего красителя Эвана, применяя конфокальную лазерную микроскопию свежих нефиксированных криосрезов головного мозга.
Протечка кровеносных сосудов локализовалась в полусфере с VEGF-инъекцией у мышей src+/-, но полностью отсутствовала у мышей src-/-. Это также, если исследовать VP, измеряя аккумуляцию синего красителя Эвана, что детектировали посредством исследования эпифлуоресценции криостатических срезов головного мозга. Таким образом, VEGF снижает барьер кровь-головной мозг способом, который зависит от активного рр60c-src.
12. VEGF-опосредованная VP, но не VP, связанная с воспалением, зависит от рр60c-src
С целью дальнейшего исследования и количественного определения эффекта VEGF как фактора VP у мышей src+/- или src-/- применяли исследование Майлса (Miles & Miles, 1952) для количественного измерения проницаемости сосудов в коже данных животных. VEGF вводили внутрикожно мышам src+/- или src-/-, которым вводили внутривенно синий краситель Эвана. В течение 15 минут после инъекции VEGF происходило 3-кратное увеличение VP у мышей src+/-. Однако у мышей src-/- не наблюдалось детектируемой VP-активности. Определяли количественно элюирование красителя с подверженных инъекции участков кожи и сравнивали с контрольным физиологическим раствором и bFGF. Контроль bFGF или физиологический раствор, введенный рядом с VRGF, не показывал существенного увеличения VP.
Говоря кратко, исследование Майлса (Miles и др., 1962) адаптировано для мышей путем введения 10 мкл VEGF (400 нг/мл), аллилизотиоцианата (горчичное масло, 20% масс./об. в минеральном масле) или физиологического раствора внутрикожно мышам, которым предварительно сделаны внутривенные инъекции 100 мкл 0,5% синего красителя Эвана. Через 15 мин участки кожи иссекали, фотографировали, элюировали при 58°С формалином и проводили количественные измерения на спектрофотометре.
Известно также, что протечка/проницаемость сосудов происходит при воспалении, которое позволяет аккумулироваться в тканях примесному к сыворотке адгезионному белку и воспалительным клеткам. Фактически сами медиаторы воспаления непосредственно стимулируют протечку сосудов. Поэтому один такой медиатор воспаления аллилизотиоцианат, известный также как горчичное масло (Inoue и др., 1997, см. выше), проверяли на мышах src+/- или src-/- на его способность продуцировать VP. В отличие от эффекта, наблюдаемого у VEGF-стимулированных src-/--животных, не детектировали увеличения VP, продуцируемого введением медиатора воспаления аллилизотиоцианата. Таким образом, можно сделать вывод, что Src играет селективную роль в VP-активности, индуцированной VEGF, и не влияет на VP, связанную с воспалительными процессами.
13. VEGF-опосредованная VP-активность зависит от Src и Yes, но не Fyn
Специфичность потребности в Src для VP изучали путем исследования VEGF-индуцированной VP-активности, связанной с SFK, такими как Fyn и Yes, которые, как известно, подобно Src экспрессируются в эндотелиальных клетках (Bull и др., 1994, FEBS Letters, 361: 41-44; Kiefer и др., 1994, Curr. Biol., 4: 100-109). Подтверждено, что эти три SFK экспрессировались эквивалентно в аортах мышей дикого типа. Подобно мышам src-/-, животные с дефицитом Yes также дефектны в отношении VEGF-индуцированной VP. Однако, неожиданно, мыши с дефицитом Fyn сохраняли высокую VP в ответ на VEGF, которая не существенно отличалась от контрольных животных. Нарушение VEGF-индуцированной VP у мышей src-/- или yes-/- показывает, что активность киназы специфических SFK существенна для VEGF-опосредованного сигнального события, ведущего к VP-активности, но не к ангиогенезу.
Свойства по проницаемости сосудов VEGF определяли в коже мышей src+/- (ФИГ.14А, левая панель) или src-/- (ФИГ.14А, правая панель) при внутрикожной инъекции физиологического раствора или VEGF (400 нг) мышам, которым ввели внутривенно синий краситель Эвана. Через 15 мин участки кожи фотографировали (1 мм шкала). Звездочки указывают места инъекций. Области, окружающие места инъекций VEGF, bFGF или физиологического раствора, иссекали и количественно определяли VP посредством элюирования синего красителя Эвана в формамиде при 58°С в течение 24 час и измерения поглощения при 500 нм (ФИГ.14В, левая графа). Известную способность медиатора воспаления (аллилизотиоцианата) индуцировать связанную с воспалением VP исследовали на мышах src+/- или src-/- (ФИГ.14В, справа).
Способность VEGF индуцировать VP сравнивали у мышей src-/-, fyn-/- или yes-/- в исследовании Майлса (ФИГ.14С). Данные для каждого исследования Майлса представлены средним для трех животных значением ± среднеквадратичное отклонение. Дефекты VP у src-/- и yes-/- по сравнению с контрольными животными являлись статистически значимыми (*р<0,05, парный t-тест), тогда как ни дефекты VP у VEGF-обработанных мышей fyn-/-, ни у обработанных аллилизотиоцианатом мышей src+/- не являлись статистически значимыми (**р<0,05).
14. Мыши, обработанные ингибитором тирозинкиназы семейства Src, и мыши Src -/- показывают меньшее поражение тканей, связанное с травмой или повреждением кровеносных сосудов, чем необработанные мыши дикого типа
Специфическое введение ингибиторов киназ семейства Src действует как ингибиторы патологической протечки и проницаемости сосудов при повреждении сосудов или нарушениях, таких как удар. Эндотелий сосудов представляет динамический тип клеток, который по многим указаниям отвечает за регулировку процессов, таких как отрастание новых кровеносных сосудов при ангиогенезе опухоли, за регуляцию проницаемости стенок сосудов при индуцированном ударом отеке и поражении тканей.
Снижение проницаемости сосудов на двух моделях удара у мышей при ингибировании лекарствами Src-пути является достаточным для ингибирования поражения головного мозга посредством снижения индуцированной ишемией протечки сосудов. Кроме того, у мышей с генетическим дефицитом Src, которые имеют пониженную протечку/проницаемость сосудов, также снижен размер инфаркта. Комбинация данных по синтетическим ингибиторам Src с подкрепляющим генетическим доказательством снижения протечки сосудов на модели удара и других родственных моделях демонстрирует физиологическую уместность данного подхода в снижении поражений головного мозга после ударов. Ингибирование данных путей при использовании диапазона доступных ингибиторов киназ семейства Src этих сигнальных каскадов имеет терапевтическую пользу, смягчая поражение головного мозга от связанного с проницаемостью сосудов поражения тканей.
Использовали два различных способа индуцирования локальной церебральной ишемии. Обе животных модели локальной церебральной ишемии хорошо известны и широко используются при исследовании удара. Обе модели раньше использовались для исследования патофизиологии церебральной ишемии, а также для проверки новых лекарственных препаратов против удара.
а) Мышей подвергали анестезии авертином и поддерживали температуру тела, содержа животных на нагреваемой подушке. Делали разрез между правым ухом и правым глазом. Открывали череп посредством сокращения височной мышцы и сверлили небольшое отверстие в области над средней церебральной артерией (МСА). Удаляли мозговую оболочку и правую МСА закрывали путем коагуляции, применяя нагревательную нить. Животным давали прийти в себя и возвращали в их клетки. Через 24 час головной мозг перфузировали, удаляли и делали поперечные срезы по 1 мм. Срезы погружали в 2% 2,3,5-трифенилтетразолийхлорид (ТТС) и подверженную инфаркту область головного мозга идентифицировали как неокрашенную (белую) ткань, окруженную жизнеспособной (красной) тканью.
Объем инфаркта определяли как сумму неокрашенных областей срезов, помноженную на их толщину.
Для исследования роли Src в церебральной ишемии использовали мышей с дефицитом Src (src-/-). Мыши src+/- служили контролем. Авторы обнаружили, что у мышей src-/- объем инфаркта снижен от 26±10 мм3 до 16±4 мм3 через контрольные 24 час после инсульта. Эффект может быть даже более резко выражен, если мышам дикого типа С57В16 вводили 1,5 мг/кг РР1 внутрибрюшинно (i.p.) через 30 мин после окклюзии сосудов. Размер инфаркта снижался от 31±12 мм3 у необработанных животных до 8±4 мм3 в группе PP1-обработанных животных.
b) Во второй модели локальной церебральной ишемии МСА закрывали, помещая в начало МСА эмбол. Один целый обогащенный фибрином 24-часовой гомологичный сгусток помещали в начало МСА, используя модифицированный катетер РЕ-50. Индуцирование церебральной ишемии доказывали по снижению тока церебральной крови в ипсилатеральной полусфере по сравнению с противоположной полусферой. Через 24 час головной мозг удаляли, готовили серийные срезы и окрашивали гематоксилиномэозином (НЕ). Объем инфаркта определяли, складывая площади инфаркта в серийных НЕ-срезах и умножая на расстояние между каждым срезом.
Дозу РР1, используемую в данном исследовании (1,5 мг/кг, внутрибрюшинно), выбирали эмпирически. Известно, что экспрессия VEGF начинается примерно через 3 час после церебральной ишемии в головном мозге при максимуме через 12-24 час. В данном исследовании РР1 вводили через 30 мин после начала инфаркта для полной блокировки VEGF-индуцированного увеличения проницаемости сосудов. Согласно временному течению типичной VEGF-экспрессии потенциальное терапевтическое окно для введения Src-ингибиторов составляет до 12 часов после кровоизлияния. При заболеваниях, связанных с длительным увеличением проницаемости сосудов, полезно постоянное введение Src-ингибирующего лекарственного препарата.
На ФИГ.15 представлена диаграмма, которая изображает сравнительные результаты по среднему объему инфаркта (мм3) в головном мозге мышей после поражения, где мыши являются гетерогенными по Src (Src +/-), доминантно отрицательными мутантами Src (Src -/-), мышами дикого типа (WT) или мышами дикого типа, обработанными 1,5 мг/кг РР1 (РР1).
На ФИГ.16 показаны последовательные MRI-сканирования выделенного перфузированного головного мозга мышей после обработки с целью индуцирования поражения CNS, где прогрессия изображения у PP1-обработанных животных (справа) ясно показывает меньший размер инфаркта, чем прогрессия изображения у контрольных необработанных животных (слева).
Способы настоящего изобретения особо подходят для специфического вмешательства в VP-индуцированное поражение ткани, так как целенаправленное ингибирование действия тирозинкиназ семейства Src фокусирует ингибирование на VP без продолжительных эффектов на другие VEGF-индуцируемые реакции, которые могут быть полезны для восстановления после поражения.
В противоположность нейтрализации белка VEGF ингибирование Src не мешает кумулятивному ангиогенному эффекту VEGF, который может быть полезен на более поздней стадии заболевания.
Применение синтетических малых молекул-ингибиторов обычно более безопасно и больше поддается управлению, чем применение больших белков. Применение рекомбинантных белков, таких как слитый белок рецептор VEGF-мышиный иммуноглобулин, потенциально вредно и не допускает повторного введения из боязни провокации аллергической реакции при использовании на людях (то есть анти-мышиное антитело человека, НАМА).
В заключение, VEGF не единственный активатор нижерасположенного Src, в патофизиологию церебральной ишемии включены другие цитокины, которые могут влиять на проницаемость сосудов, такие как IL-6 и TNF-α. Таким образом, ингибирование VEGF не может ингибировать все последующие поражения, связанные с активацией Src. Фактически уменьшение размера инфаркта посредством РР1 более резко выражено, чем при VEGF-антагонизме, указывая, что другие пути могут активировать Src-киназы, способствуя повышению проницаемости.
Считают, что приведенное выше описание достаточно, чтобы дать возможность специалисту в данной области применить на практике данное изобретение. Настоящее изобретение не ограничивает свой объем какими-либо депозитами клеточных линий, так как любой депонированный вариант рассматривают как отдельную иллюстрацию одного из аспектов данного изобретения, и любая клеточная линия, которая функционально эквивалентна, входит в объем данного изобретения. Депозит материала не является допущением, что приведенное здесь описание недостаточно для осуществления на практике какого-либо аспекта данного изобретения, включая лучшие его варианты, и не предусматривается как ограничивающий объем притязаний представленными конкретными иллюстрациями. Действительно, различные модификации данного изобретения кроме тех, которые здесь показаны и описаны, ясны специалисту в данной области из предыдущего описания и включены в объем приложенной формулы изобретения.





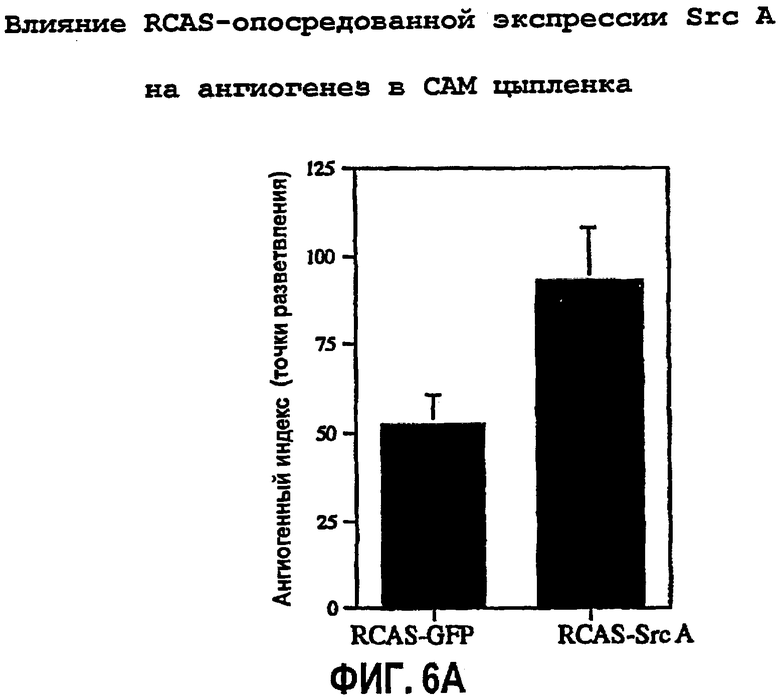
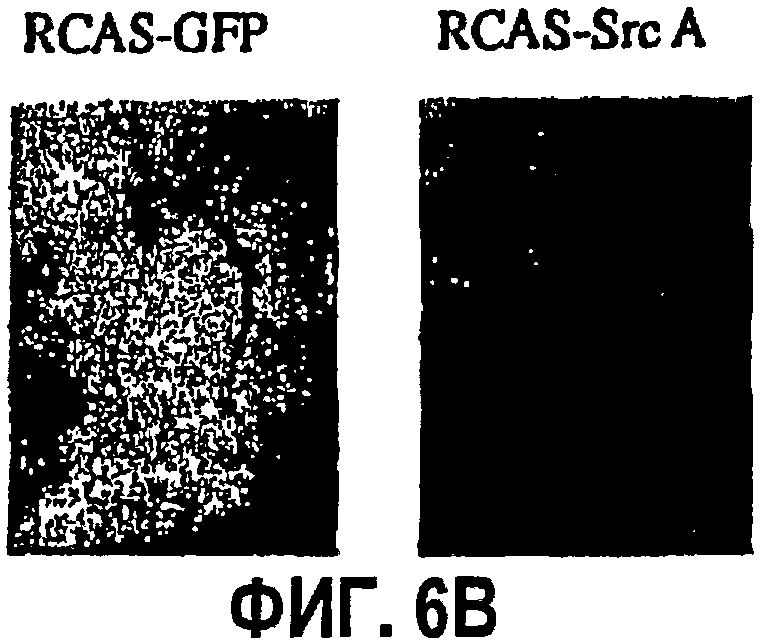

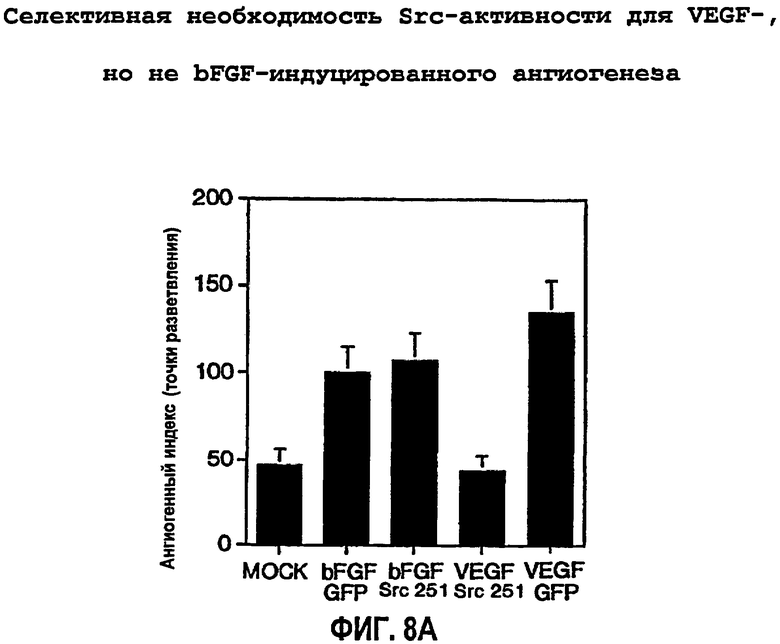
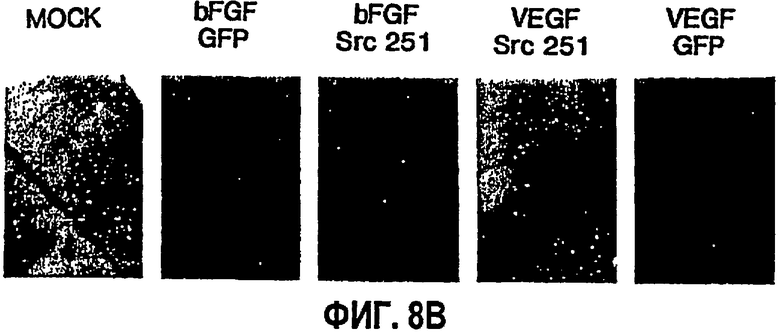
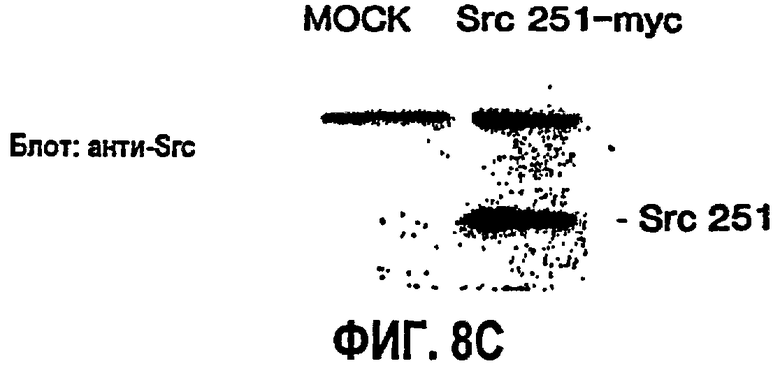

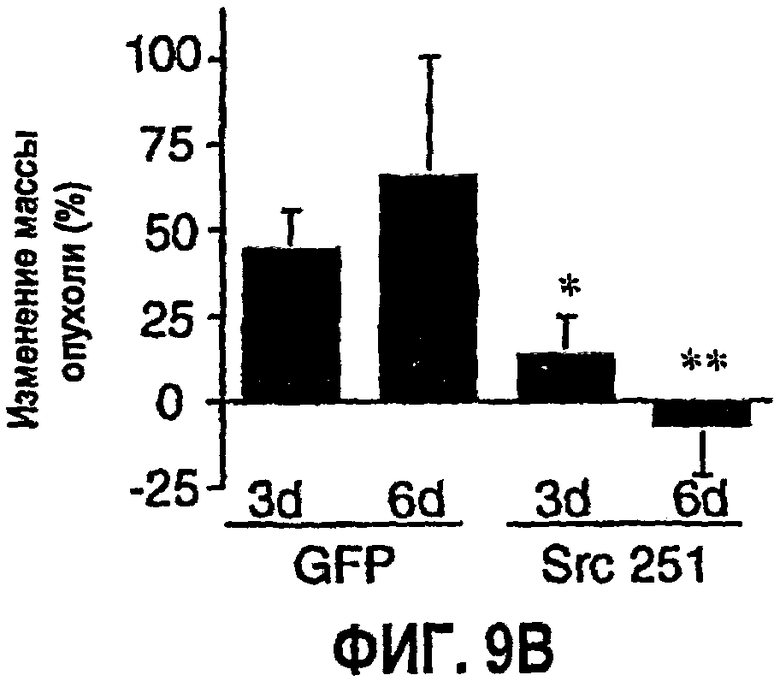
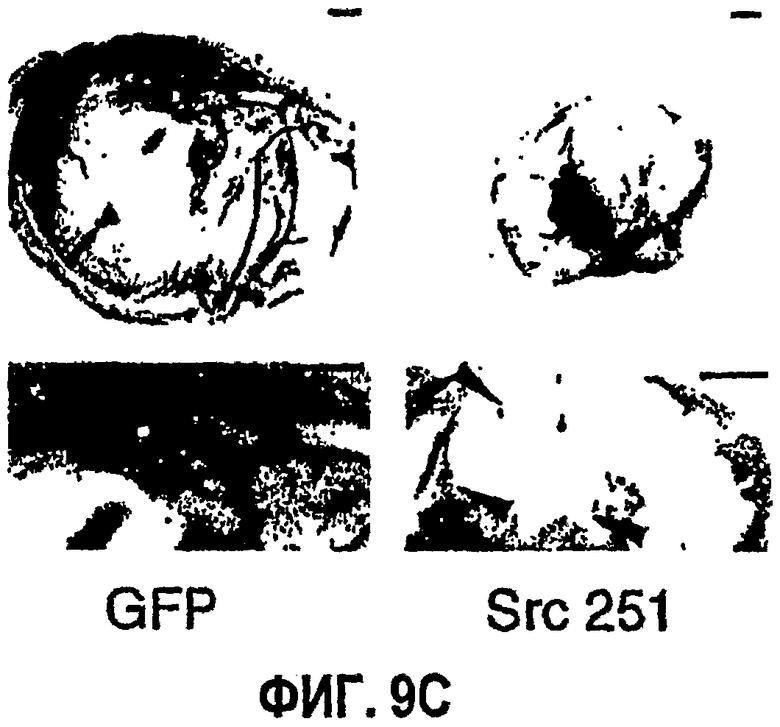



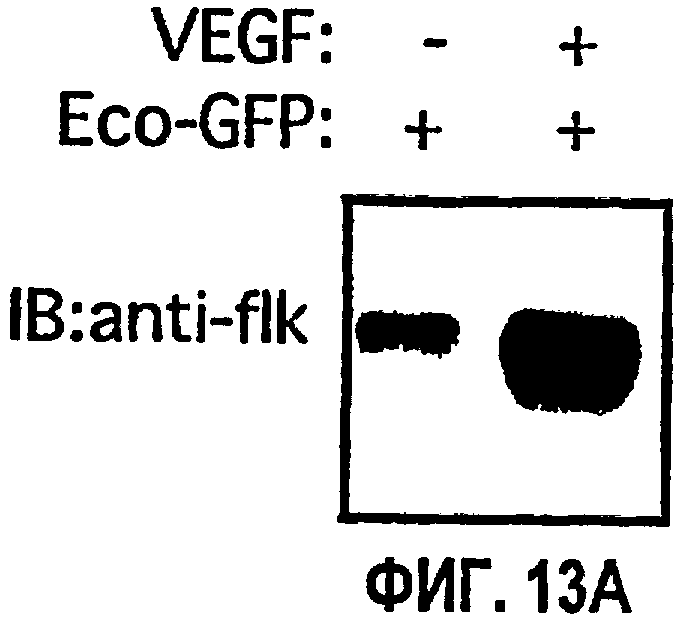
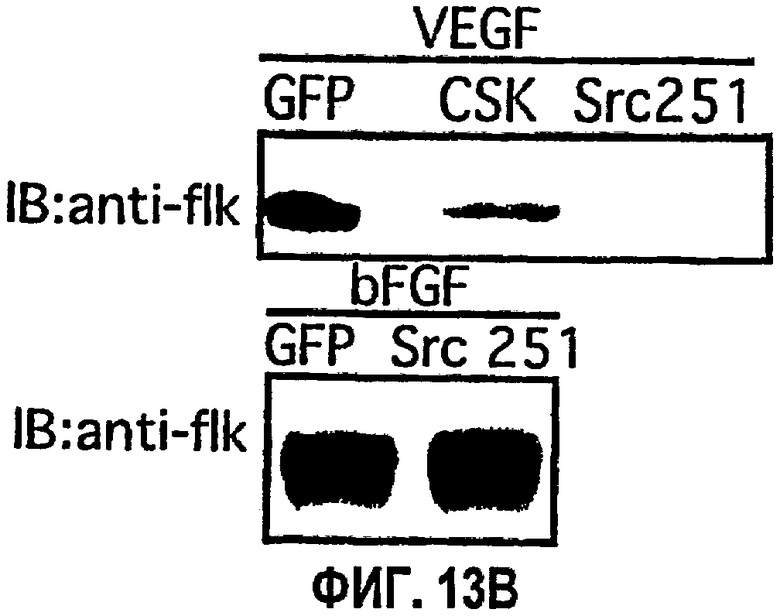
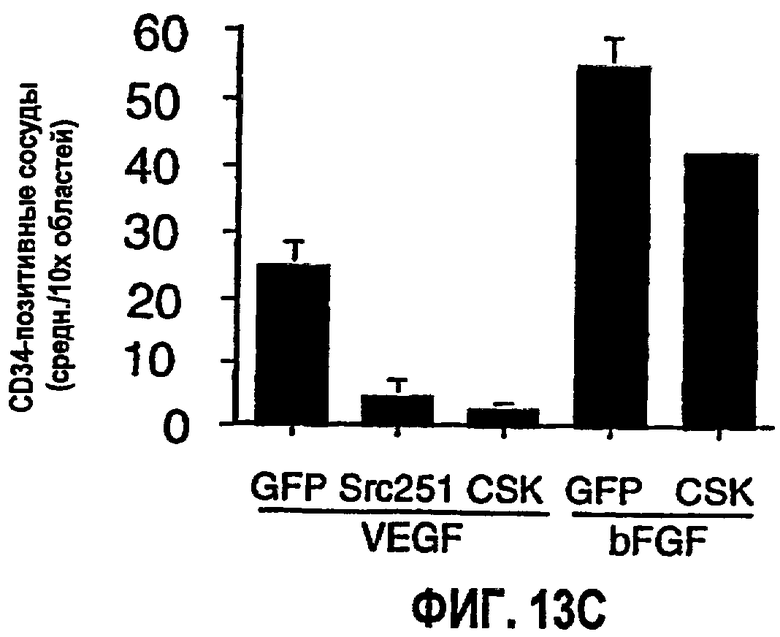
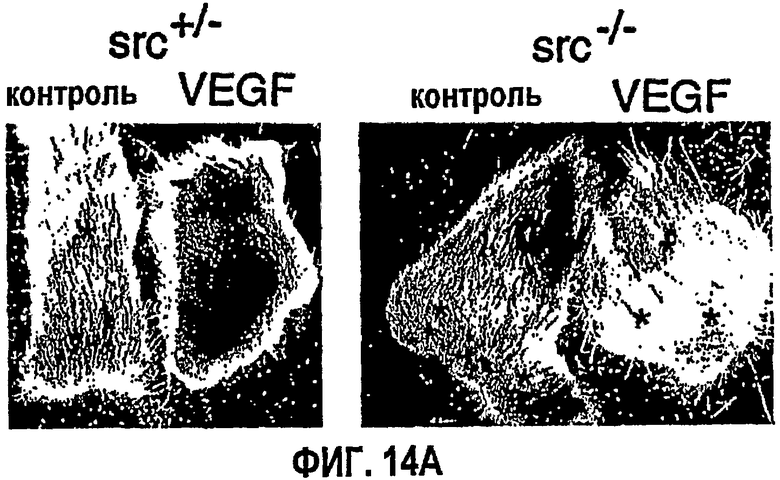
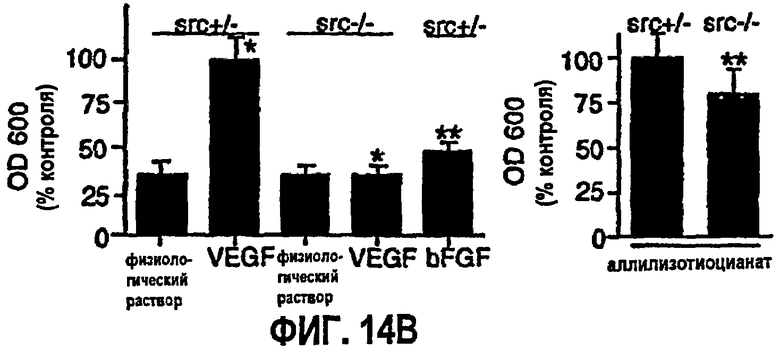

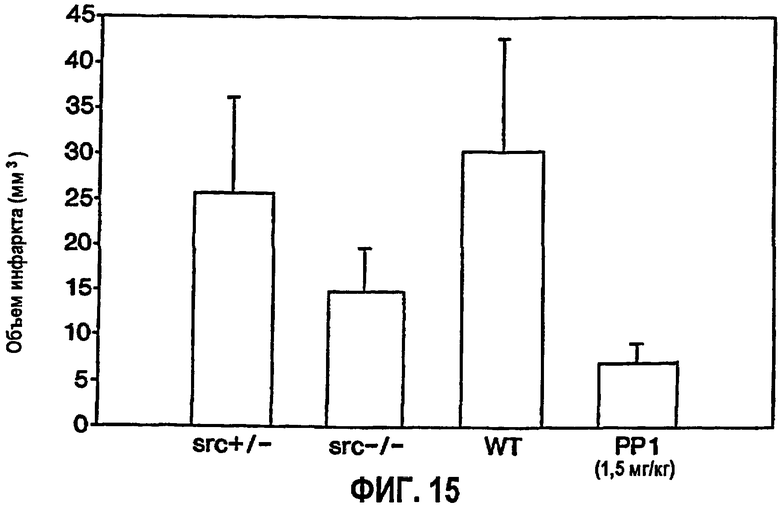
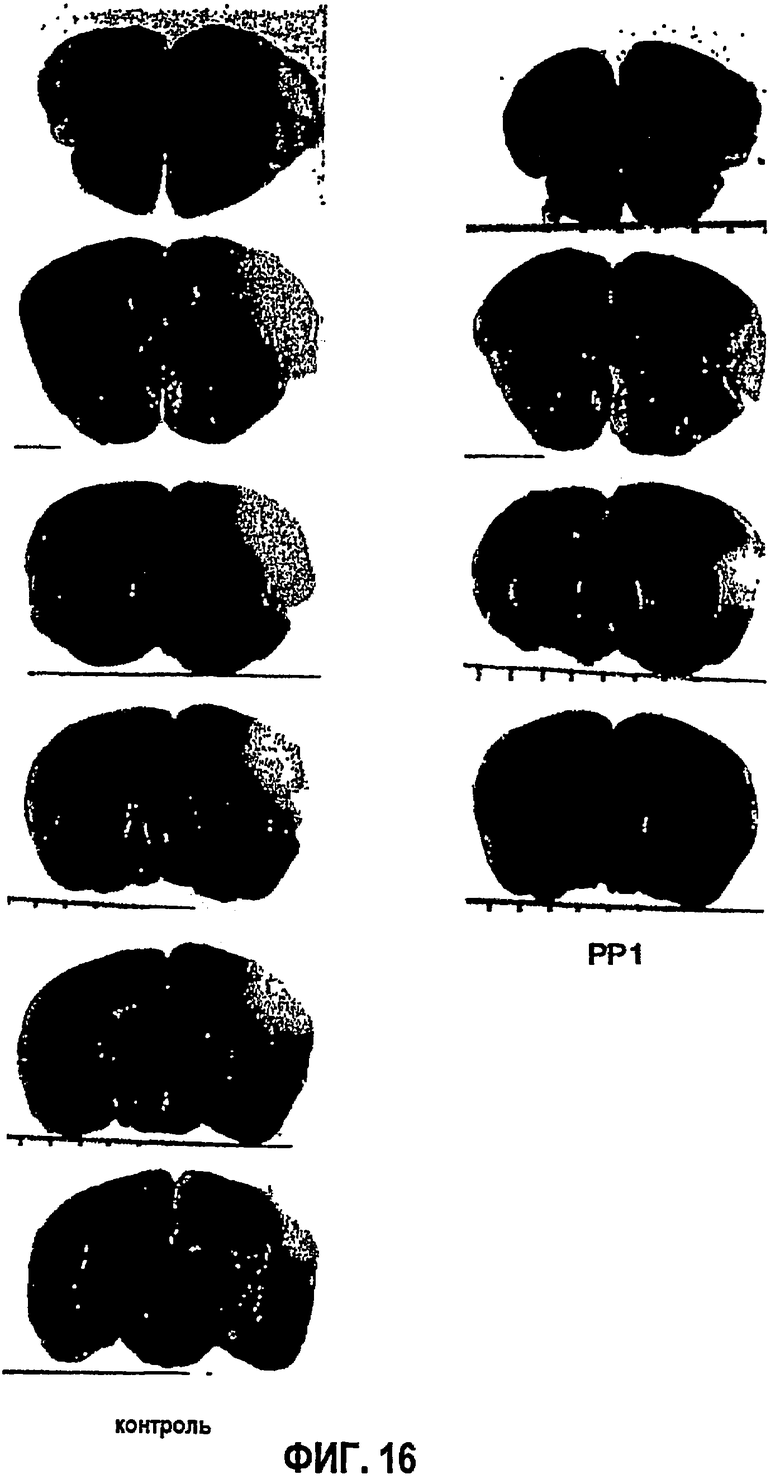
Изобретение относится к медицине и фармакологии, и касается фармацевтической композиции и промышленного продукта, содержащих белки Src и Yes типа тирозинкиназы, вместе с фармацевтически приемлемым носителем, где по меньшей мере один из белка Src и белка Yes является активной киназой, и по меньшей мере один из белка Src и белка Yes является неактивной киназой, а также их аминокислотным последовательностям. Изобретение обеспечивает селективное ингибирование активности тирозинкиназ снижает повреждение или травмы, связанные с повышением проницаемости сосудов в тканях. 2 н. и 14 з.п. ф-лы, 16 ил., 1 табл.
| US 5766591, 16.06.1998 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Eliceiri В Р et.al | |||
| "Mol | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| RU 97104482 A, 10.05.1999 | |||
| RU 97115895 A, 20.06.1999. | |||
Авторы
Даты
2006-03-10—Публикация
2000-12-22—Подача