ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США 62/025861, поданной 17 июля 2015 года, которая полностью включена в настоящий документ в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам для лечения рака у пациента. Более конкретно, настоящее изобретение относится к способам лечения рака комбинацией лучевой терапии, наночастиц оксида церия и химиотерапевтического средства.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
Облучение является хорошо известной терапией для уничтожения раковых клеток и сокращения объема злокачественных опухолей у пациента. Облучение обычно генерирует ионизирующие реакции, которые образуют свободные радикалы, реагирующие с ДНК, и РНК-опосредованную программируемую гибель клеток (апоптоз) в раковых клетках. Образование свободных радикалов от облучения также является повреждающим для нормальных клеток и физиологии органов на пути лечения лучевой терапией раковой опухоли у пациента.
Одним из наиболее видимых побочных эффектов лучевой терапии у пациентов с раковыми опухолями является лучевой дерматит (воспаление кожи) по траектории облучения во время лучевой терапии опухоли ракового пациента. Тяжесть повреждения кожи прямо пропорциональна числу доз и частоте лучевой обработки.
В области радиационной онкологии в течение последнего десятилетия велась усердная работа для улучшения способов доставки облучения, чтобы избавить чувствительные структуры от воздействия ионизирующего излучения. Эти способы привели к улучшению функциональных результатов по сравнению с предыдущими, более элементарными, способами облучения. Однако необходимость достижения адекватного покрытия опухоли и сильная чувствительность к облучению определенных нормальных структур в голове и шее являются внутренними ограничениями для величины функции и качества жизни, которые могут быть сохранены при помощи этих способов. Даже при самых лучших условиях, многие раковые пациенты после лучевой терапии для лечения злокачественной опухоли испытывают значительную токсичность от лучевой терапии.
Химиотерапия является еще одним подходом, который используют для лечения раковых опухолей у пациента. Химиотерапия представляет собой практический подход, при котором противораковые лекарственные средства вводят пациенту для того чтобы помешать жизнеспособности злокачественных клеток в опухоли. Определенные химиотерапевтические препараты можно давать в конкретном порядке в зависимости от типа раковой опухоли, которую лечат. Хотя химиотерапия может быть весьма эффективной для лечения определенных раковых опухолей, химиотерапевтические препараты могут достигать всех частей организма, не только злокачественных клеток. Из-за такого распределения, могут присутствовать масштабные побочные эффекты во время системного химиотерапевтического лечения. Часто пробуют сочетание химиотерапевтических препаратов, чтобы улучшить лечение раковых опухолей у пациента, однако, комбинированная химиотерапия необязательно уменьшает токсичность терапии.
Раковые клетки не похожи на клетки нормальной ткани, у них отсутствуют нормальные клеточные механизмы и поведение, делая выбор терапии и итоговую эффективность менее предсказуемыми. Живые клетки имеют множество сложных параллелей и серий клеточных путей передачи сигнала и генетических путей. Одна из трудностей состоит в том, что злокачественные клетки очень дисфункциональны, плохо регулируются и обладают генетической изменчивостью, и таким образом, сложно выявить ключевые генетические мутации, обеспечивающие успешность злокачественной опухоли. Изыскание и тестирование противораковых препаратов активно нацелены на ключевые изменения в злокачественных клетках, которые наиболее критически влияют на распространение, агрессивность, формирование и жизнеспособность злокачественных опухолей. Если бы биологию злокачественной опухоли можно было бы так упростить, тогда, теоретически, смесь селективных химиотерапевтических препаратов могла бы быть очень эффективной для уничтожения злокачественной опухоли. Однако раковые клетки в опухоли содержат мутантные клоны, где каждая субпопуляция злокачественных клеток имеет различные генотипы и, возможно, различные фенотипы. Устойчивость к лекарственным препаратам является проблемой, и некоторые злокачественные клетки могут пережить химиотерапию, поскольку они более устойчивы к противораковому препарату. Устойчивость к противораковому препарату может возникать из-за повышенного метаболизма противоракового препарата злокачественной клеткой или за счет повышенной скорости транспорта противоракового препарата из злокачественной клетки при помощи мембранного транспортера противоракового препарата, таким образом, внутриклеточная концентрация противоракового препарата остается для злокачественной клетки субтоксической.
Кроме того, тканевые механизмы могут влиять на эффективность лечения и поздний рецидив. Злокачественные клетки размножаются без контактного торможения нормальных клеток, регулирующего их мультиклеточный рост, и, в основном, растут, выходя за пределы существующего кровоснабжения. Опухоль остается гипоксической до некоторой степени и метаболически в большей степени зависит от гликолиза, чем нормальные клетки. Как правило, злокачественные клетки менее зависимы от аэробного метаболизма, чем нормальные клетки. Для того чтобы компенсировать ограничивающее воздействие гипоксии на рост, злокачественные опухоли имеют генетически развившиеся способы для выращивания дополнительного кровеносного русла по мере необходимости. Это дополнительное кровоснабжение называется гиперваскуляризацией, поскольку оно имеет выраженную аномальную васкуляризацию, и она является полезным маркером для детекции развивающихся злокачественных опухолей с использованием контрастного вещества для получения изображения кровотока. Гистология стенок гиперваскуляризованного кровеносного сосуда показывает, что стенки содержат смесь из очевидно нормальных клеток сосудистого эндотелия и дисфункциональных злокачественных клеток. Функционально, гиперваскулярный кровоток имеет такую повышенную проницаемость, что регуляция Гиббса-Донана не работает. Части растущей опухоли остаются гипоксическими. Это создает давление отбора таким образом, что подгруппа клеток в опухоли становится более устойчивой к гипоксии. Кровоснабжение для злокачественных опухолей никогда не будет адекватным.
Известно, что лечение облучением и/или химиотерапией является очень агрессивной терапией в отношении злокачественных клеток с непредсказуемой эффективностью лечения. Возможно, что лучевая терапия и химиотерапия могут предупреждать некоторые злокачественные клетки, что они подверглись нападению. Такие злокачественные клетки, которые могут быть встроены в сосудистый эндотелий новых кровеносных сосудов в злокачественной опухоли, могут затем выделиться из опухоли и уйти в кровеносное русло, чтобы мигрировать от злокачественной опухоли. Такие выделившиеся злокачественные клетки могут дать начало новой опухоли, которая также может иметь повышенную устойчивость к гипоксии и противораковым препаратам.
Кроме того, облучение и химиотерапия могут позволить выжить самым выносливым субпопуляциям злокачественных клеток. Часто приходится слышать, что пациент, казалось бы, пережил изначальный вызов от злокачественной опухоли, только для того, чтобы быстро поддаться, когда злокачественная опухоль очень агрессивно вернулась. Полагают, что это происходит из-за выживания субпопуляции смертельной злокачественной опухоли, которой нужно время, чтобы дорасти до опухолевой массы, смертельной для пациента.
Настоящее изобретение относится к преодолению трудностей и сложностей предшествующего уровня техники при лечении злокачественной опухоли.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В основном, настоящее изобретение относится к способам для лечения злокачественной опухоли путем введения комбинации лучевой терапии, наночастиц оксида церия (CONP) и химиотерапевтического средства.
В первом аспекте изобретение представляет собой способ лечения злокачественной опухоли у нуждающегося в этом пациента, включающий:
введение эффективной дозы наночастиц оксида церия пациенту;
введение терапевтически эффективной дозы облучения пациенту; и
введение терапевтически эффективной дозы химиотерапевтического средства пациент и тем самым лечение злокачественной опухоли.
В одном из вариантов осуществления терапевтически эффективная доза облучения представляет собой дозу, которая убивает злокачественные клетки.
В одном из вариантов осуществления терапевтически эффективная доза химиотерапевтического средства представляет собой дозу, которая убивает злокачественные клетки.
В одном из вариантов осуществления эффективная доза наночастиц оксида церия представляет собой дозу, которая уменьшает терапевтически эффективную дозу облучения и/или химиотерапевтического средства, по сравнению с терапевтически эффективной дозой облучения и/или химиотерапевтического средства в отсутствие наночастиц.
В различных вариантах осуществления доза облучения и/или химиотерапевтического средства составляет приблизительно от 1% и до 90%, или приблизительно от 1% и до 80%, или приблизительно от 1% и до 70%, или приблизительно от 1% и до 60%, или приблизительно от 1% и до 50%, или приблизительно от 1% и до 40%, или приблизительно от 1% и до 30%, или приблизительно от 1% и до 20%, или приблизительно от 1% и до 10% или от (i) дозы, используемой в существующем стандарте лечения в отсутствие CONP или от (ii) эффективного количества для лечения опухоли в отсутствие CONP.
В одном из вариантов осуществления лучевую терапию проводят после введения наночастиц оксида церия.
В другом варианте осуществления лучевую терапию проводят перед введением наночастиц оксида церия.
В одном из вариантов осуществления химиотерапевтическое средство вводят до наночастиц оксида церия и/или лучевой терапии.
В другом варианте осуществления химиотерапевтическое средство вводят одновременно с наночастицами оксида церия и/или лучевой терапией.
В другом варианте осуществления химиотерапевтическое средство вводят после наночастиц оксида церия и/или лучевой терапии.
В другом варианте осуществления наночастицы оксида церия имеют размер частиц приблизительно от 1 нанометра до приблизительно 20 нанометров.
В другом варианте осуществления наночастицы оксида церия имеют размер частиц приблизительно от 3 нанометров до приблизительно 15 нанометров.
В другом варианте осуществления наночастицы оксида церия имеют размер частиц приблизительно от 3 нанометров до приблизительно 10 нанометров.
В другом варианте осуществления наночастицы оксида церия имеют размер частиц приблизительно от 3 нанометров до приблизительно 5 нанометров.
В другом варианте осуществления эффективная доза наночастиц оксида церия составляет приблизительно от 1 нанограмма на килограмм массы тела пациента до приблизительно 50 миллиграммов на килограмм массы тела пациента; или приблизительно от 1 нанограмма на килограмм массы тела пациента до приблизительно 5 миллиграммов на килограмм массы тела пациента; или приблизительно от 1 нанограмма на килограмм массы тела пациента до приблизительно 0,5 миллиграммов на килограмм массы тела пациента; или приблизительно от 10 нанограммов на килограмм массы тела пациента до приблизительно 0,5 миллиграммов на килограмм массы тела пациента; или приблизительно от 20 нанограммов на килограмм массы тела пациента до приблизительно 100 микрограммов на килограмм массы тела пациента; или приблизительно от 10 нанограммов на килограмм массы тела пациента до приблизительно 10 микрограммов на килограмм массы тела пациента.
В одном из вариантов осуществления наночастицы оксида церия предлагаются в форме композиции, содержащей наночастицы оксида церия и фармацевтический носитель. Композицию с наночастицами оксида церия можно вводить, например, путем местного, перорального, парентерального (например, внутривенного), буккального, сублингвального, назального, ректального введения, при помощи пластыря, помпы или трансдермального введения, и композиция сформулирована соответствующим образом.
В иллюстративных вариантах осуществления, композиция с наночастицами оксида церия представляет собой композицию для местного введения. В одном из вариантов осуществления композиция для местного введения содержит CONP, поверхностно-активное вещество, масло и воду. В иллюстративных вариантах осуществления, композиция с наночастицами оксида церия представляет собой микроэмульсию. В иллюстративных вариантах осуществления, композицию с наночастицами оксида церия вводят путем наложения на область кожи пациента.
В другом варианте осуществления общая концентрация наночастиц оксида церия в плазме крови пациента после введения составляет приблизительно от 5 наномоль до приблизительно 200 микромоль; или приблизительно от 10 наномоль до приблизительно 100 микромоль; или приблизительно от 20 наномоль до приблизительно 10 микромоль.
Пациенту может быть поставлен диагноз рака поджелудочной железы, рака легких, рака молочной железы, рака толстого кишечника, рака печени, рака кожи, рака головного мозга, рака кости, рака почки, рака яичников, рака матки, рака предстательной железы, или рака головы и шеи.
В одном из вариантов осуществления химиотерапевтическое средство выбрано из группы, состоящей из сорафениба, регорафениба, иматиниба, эрубилина, гемцитабина, капецитабина, пазопаниба, лапатиниба, дафрафениба, сутиниба малата, кризотиниба, эверолимуса, торисиролимуса, сиролимуса, акситиниба, гефитиниба, анастрола, бикалутамида, фулвестранта, ралитрекседа, пеметрекседа, госерилина ацетата, эрлотиниба, вемурафениба, визиодегиба, тамоксифена цитрата, паклитаксела, доцетаксела, кабазитаксела, оксалиплатина, зив-афлиберцепта, бевацизумаба, трастузумаба, пертузумаба, пантиумумаба, таксана, блеомицина, мелфалена, плумбагина, камптосара, митомицина-C, митоксантрона, SMANCS, доксорубицина, пегилированного доксорубицина, Фолфори (комбинация препаратов), 5-фторурацила, темозоламида, пасиреотида, тегафура, гимерацила, отерацила, итраконазола, бортезомиба, леналидомида, иринтотекана, эпирубицина и ромидепсина. Предпочтительными химиотерапевтическими средствами являются карбоплатин, фторурацил, винбластин, гемцитабин, циклофосфамид, доксорубицин, метотрексат, паклитаксел, топотекан, этопозид, метотрексат, сорафениб, иринотекан, тарцева или их сочетание.
В одном из вариантов осуществления любое химиотерапевтическое средство или дополнительное средство, которое будет повышать активность или эффективность химиотерапевтического средства, подходит для способов, предлагаемых в настоящем документе.
В одном из вариантов осуществления способ практического осуществления изобретения включает введение пациенту пролекарственного химиотерапевтического средства, выбранного из группы, состоящей из пролекарства, активируемого гипоксией, эвофосфамида, TH-302, AQN4, баноксатрона, пролекарства азотистого иприта, PR-104, апазиквона, EO-9, CB1954, 5-(азиридин-1-ил)-4-гидроксиламино-2-нитробензамида, канофосфамида, TLK286, TER286, JS-K и Boc-KAc-Puro.
В одном из вариантов осуществления способ практического осуществления изобретения включает введение пациенту пептидомиметического ингибитора GSH или GHT-π, например, пептидомиметического ингибитора, выбранного из группы, состоящей из диэтилового эфира γ-глутамил-S-(бензил)цистинеил-R-фенилглицина, TLK199, телинтры и NOV-002. Пептидомиметический ингибитор GSH или GHT-π снижает уровни GSH (глутатиона) в злокачественных клетках или активность GHT-π (глутатион-S-трансферазы-π), и это может усиливать токсичность вводимого противоракового препарата за счет предотвращения его метаболизма. Также лечение пациента со злокачественной опухолью при помощи TLK-199, который также является ингибитором белка, ассоциированного с множественной устойчивостью к лекарственным препаратам, который известен как мультилекарственный эффлюксный переносчик, можно использовать для повышения уровней химиотерапевтического средства в злокачественных клетках.
В одном из вариантов осуществления противоопухолевое химиотерапевтическое средство представляет собой пролекарство, которое активируется GSH. В одном из вариантов осуществления способ практического осуществления изобретения включает введение пациенту пролекарства, активируемого GSH, которое выбрано из группы, состоящей из цис-6-(2-ацетилвинилтио)пурина (cis-AVTP), и транс-6-(2-ацетилвинилтио)гуанина (trans-AVTP). Этот способ практического осуществления изобретения может включать лечение пациента со злокачественной опухолью пролекарством, активируемым GSH, которое выбрано из группы, состоящей из γ-глутамил-α-амино-β(2-этил-N,N,Nʹ,Nʹ-тетракис(2-хлорэтил)фосфодиамидат)-сульфонил)-пропионил-(R)-фенилглицина (TLK286) и O2-[2,4-динитро-5-(N-метил-N-4-карбоксифениламино)фенил]1-N,N-диметиламино)диазен-1-иум-1,2-диолата (PABA/NO).
В другом аспекте изобретение относится к способу уменьшения токсичности лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства, вводимого пациенту, который проходит лечение от злокачественных опухолей, способу, включающему:
(i) введение эффективной дозы CONP пациенту,
(ii) введение дозы лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства,
где введение эффективной дозы CONP уменьшает токсичность лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства, вводимого пациенту.
В дополнительном аспекте, изобретение относится к способу снижения дозы лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства, вводимых пациенту и необходимых для эффективного лечения злокачественной опухоли, способу, включающему:
(i) введение эффективной дозы CONP пациенту,
(ii) введение дозы лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства,
где введение эффективной дозы CONP снижает дозу лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства, необходимых для эффективного лечения злокачественной опухоли.
Химиотерапевтическое средство можно выбирать в зависимости от его специфичности и активности ингибирования мишени в пути клеточного метаболизма, к которой могут быть чувствительны злокачественные клетки у пациента. В практическом осуществлении изобретения, химиотерапевтическое средство можно выбирать по его способности ингибировать мишень в пути клеточного метаболизма, выбранную из группы, состоящей из mTORC, RAF-киназы, MEK-киназы, фосфоинозитолкиназы 3, рецептора фактора роста фибробластов, множества тирозинкиназ, рецептора эпидермального фактора роста человека, фактора роста эндотелия сосудов, других факторов ангиогенеза, белка теплового шока; рецептора Smo (smooth), рецептора FMS-подобной тирозинкиназы 3, ингибитора белков апоптоза, циклин-зависимых киназ, деацетилазы, рецептора тирозинкиназы ALK, серин/треониновой протеинкиназы Pim-1, ацилтрансферазы Поркупин, сигнального пути Хеджхог (hedgehog), протеинкиназы C, mDM2, глипикана 3, ChK1, MET-рецептора фактора роста гепатоцитов, белка 7, подобного домену эпидермального фактора роста, сигнального пути Нотч (Notch), киназы семейства Src, ДНК-метилтрансферазы, интеркаляторов ДНК, тимидинсинтазы, разобщителя функции микротрубочек, кросслинкеров ДНК, агентов, разрывающих цепи ДНК, алкиляторов ДНК, индуктора JNK-зависимого фосфорилирования p53 по Ser15, ингибиторов ДНК-топоизомеразы, Bcl-2, и генераторов свободных радикалов.
В иллюстративных вариантах осуществления, способ дополнительно содержит проведение хирургической операции в месте локализации злокачественной опухоли.
В одном из вариантов осуществления хирургическую операцию проводят в месте локализации злокачественной опухоли до проведения лучевой терапии.
В одном из вариантов осуществления хирургическую операцию проводят в месте локализации злокачественной опухоли после проведения лучевой терапии.
В одном из вариантов осуществления хирургическую операцию проводят в месте локализации злокачественной опухоли до введения химиотерапевтического средства.
В одном из вариантов осуществления хирургическую операцию проводят в месте локализации злокачественной опухоли после введения химиотерапевтического средства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1 и 2 представляют собой диаграммы результатов 24-часового (фиг. 1) и 48-часового (фиг. 2) анализов MTT для определения воздействия наночастиц оксида церия на клетки рака поджелудочной железы человека L3.6pl.
ФИГ. 3 и 4 представляют собой диаграммы для нормальной hTERT HPNE (фиг. 3) и раковой L3.6pl клеточных линий поджелудочной железы через 48 часов после радиационного поражения (следует отметить, что h-TERT HPNE относится к иммортализованной линии клеток протока поджелудочной железы человека, несущей ген белковой субъединицы теломеразы человека).
ФИГ. 5 и 6 представляют собой диаграммы результатов 24-часового (фиг. 5) и 48-часового (фиг. 6) анализов MTT для определения влияния оксида церия на клетки рака поджелудочной железы человека Panc-1.
ФИГ. 7 представляет собой диаграмму результатов 48-часового исследования количества клеток на клетках рака поджелудочной железы человека L3.6pl.
ФИГ. 8 и 9 представляют собой диаграммы результатов 6-недельного исследования массы (фиг. 8) и объема опухоли (фиг. 9) на облученных «голых» мышах, с растущими внутри них клетками рака поджелудочной железы человека.
ФИГ. 10A и 10B представляют собой предметные гистологические стекла с тканью опухоли поджелудочной железы только с лучевой терапией (фиг. 10A) и лучевой терапией плюс CONP (фиг. 10B).
ФИГ. 11 представляет собой график влияния инъекций CONP на коэффициент выживаемости «голых» мышей без опухоли.
ФИГ. 12 и 13 представляют собой диаграммы влияния гипоксии на клетки рака поджелудочной железы L3.6pl с использованием HIF1a (фиг. 12) и HIF2a (фиг. 13) в качестве индикатора, где ФИГ. 13 также содержит фотографию геля из анализа уровня белков при помощи Вестерн-блоттинга.
ФИГ. 14 и 15 представляют собой диаграммы влияния оксида церия на выработку VEGF клетками рака поджелудочной железы человека L3.6pl через 24 часа (фиг. 14) и 48 часов (фиг. 15) после облучения.
ФИГ. 16 и 17 представляют собой диаграммы результатов 48-часового исследования подсчета клеток на необлученных (фиг. 16) и облученных (фиг. 17) злокачественных клетках человеческого легкого A549.
ФИГ. 18 представляет собой диаграмму результатов 48-часового исследования ЛДГ на облученных злокачественных клетках человеческого легкого A549.
ФИГ. 19 и 20 иллюстрируют результаты, полученные на модели ортотопического рака легких, где на график нанесены число опухолевых узлов у мышей Nu/Nu (фиг. 19) и масса легкого целиком (фиг. 20).
ФИГ. с 21A по 21C иллюстрируют противолучевое воздействие наночастиц оксида церия на фибробласты здорового легкого, включая график жизнеспособности клеток в зависимости от дозы облучения (фиг. 21A), жизнеспособности клеток при дозе 20 Гр с наночастицами оксида церия и без них (фиг. 21B), и апоптоз при дозе 20 Гр с наночастицами оксида церия и без них (фиг. 21C).
ФИГ. с 22A по 22E иллюстрируют пневмонит, вызванный облучением, и устойчивость для наночастиц оксида церия у мышей при различных уровнях облучения: 0 Гр (фиг. 22A), 12 Гр (фиг. 228), 15 Гр (фиг. 22C) и 18 Гр (фиг. 220), и выживаемость при различных условиях при наличии и отсутствии облучения, наночастиц оксида церия и амифостина (фиг. 22E).
ФИГ. с 23A по 23H иллюстрируют тканевые срезы при различных условиях при наличии и отсутствии облучения, наночастиц оксида церия и амифостина.
ФИГ. 24 представляет собой графики рентгеновских фотоэлектронных спектров для Ce+3 и Ce+4 в наночастицах диоксида церия (частицы CeO2 нанометрового размера, CONP) и микрочастицах диоксида церия (частицы CeO2 микронного размера) с врезкой изображения наночастицы диоксида церия, полученного при помощи высокоразрешающей трансимиссионной электронной микроскопии.
ФИГ. 25A и 25B показывают, что наночастицы оксида церия (CONP) избирательно повышают АФК, индуцированные лучевой терапией, в клетках рака поджелудочной железы, где ФИГ. 25A показывает клетки L3.6pl и hTERT-HPNE, предварительно инкубированные с CONP. ФИГ. 25B иллюстрирует CONP, добавленные после облучения, и ФИГ. 25C до 25D иллюстрируют изменения в уровне АФК.
ФИГ. с 26A по 26D иллюстрируют, что CONP избирательно повышает чувствительность клеток рака поджелудочной железы к облучению in vitro, где ФИГ. 26A иллюстрирует предварительную обработку клеток L3.6pl 10 мкМ CONP, ФИГ. 26B показывает предварительную обработку здоровых клеток поджелудочной железы (HPNE) 10 мкМ CONP, ФИГ. 26C иллюстрирует предварительную обработку клеток L3.6pl 10 мкМ CONP, и ФИГ. 26D иллюстрирует изменения в образовании колоний.
ФИГ. 27 показывает, что CONP управляют апоптозом, индуцированным облучением, in vivo.
ФИГ. с 28A по 28C иллюстрируют физико-химические свойства синтезированных наночастиц, где ФИГ. 28A иллюстрирует изображение наночастицы диоксида церия, полученное при помощи HRTEM, которое показывает диапазон размера наночастиц 3-5 нм, на врезке изображение наночастицы с большим увеличением, ФИГ. 28B иллюстрирует паттерн дифракции электронов в выбранной области (SAED) в кристаллической структуре флюорита, где A, B, C и D соответствует различным паттернам решетки 111, 200, 220 и 311, соответственно, и ФИГ. 28C иллюстрирует гидродинамический радиус наночастицы в диапазоне размеров приблизительно от 3 нанометров до приблизительно 20 нанометров (мода распределения размеров CONP составляет приблизительно 10 нанометров).
ФИГ. с 29A по 29C иллюстрируют влияние облучения на выработку слюны в отсутствие и присутствии наночастиц оксида церия, где ФИГ. 29A иллюстрирует стимулированный сиалометрический анализ функции слюнной железы через шесть недель после однократной фракционной дозы облучения в области головы и шеи (12,5 Гр, 15 Гр, 17,5 Гр или 20 Гр), ФИГ. 29B показывает воздействие наночастиц диоксида церия на защиту потока слюны после воздействия облучения, и ФИГ. 29C показывает воздействия наночастиц диоксида церия на гиперпигментацию кожи после воздействия облучения с использованием терминологии общих критериев Национального института исследования рака (NCI) для побочных эффектов (CTCAE v.3.0).
ФИГ. 30 иллюстрирует макроскопическую оценку радиационного дерматита у бестимусных мышей, которые получили до 30 Гр в 6 фракционных дозах в области головы и шеи.
ФИГ. 31A и 31 B иллюстрируют воздействия CONP на индекс апоптоза паренхимальных клеток слюнных желез после облучения области головы и шеи, где ФИГ. 31A иллюстрирует апоптоз паренхимальных клеток слюнных желез, индуцированный облучением, и ФИГ. 31B показывает дополнительный анализ воздействий CONP в сочетании с облучением на все основные слюнные железы, который в результате привел к ответу, аналогичному тому, что показан на ФИГ. 31A.
ФИГ. 32 иллюстрирует анализ с окраской гематоксилином и эозином (Г-Э) повреждения архитектуры паренхимальных клеток слюнных желез, индуцированного облучением.
ФИГ. 33 предоставляет диаграмму, демонстрирующую воздействие CONP в комбинации с облучением и паклитакселом на жизнеспособность злокачественных клеток легкого после курса в 96 часов. Описание: черные столбцы - контроль (без лечения), заштрихованные столбцы - облучение, серые столбцы - паклитаксел, столбцы с точками - CONP+облучение+паклитаксел.
ФИГ. 34 предоставляет серии микрофотографий, демонстрирующих патологию мышиной печени, забранной через 2 недели после лучевой терапии. Описание: 1) печень без лечения, 2) CONP, 3) CONP+облучение, 4) облучение 30 Гр, 5) CONP+паклитаксел, 6) CONP+паклитаксел+облучение, 7) паклитаксел, 8) облучение+паклитаксел.
ФИГ. 35 предоставляет диаграмму, показывающую воздействие CONP в комбинации с гемцитабином и облучением на жизнеспособность клеток рака поджелудочной железы. Описание: черные столбцы - облучение; серые столбцы - гемцитабин, белые столбцы - облучение и гемцитабин.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лечению злокачественной опухоли у нуждающегося в этом пациента при помощи комбинации лучевой терапии, наночастиц оксида церия (CONP), и, по меньшей мере, одного химиотерапевтического средства. Изобретение представляет собой способ лечения злокачественной опухоли у нуждающегося в этом пациента, включающий: введение эффективной дозы наночастиц оксида церия пациенту; введение терапевтически эффективной дозы лучевой терапии пациенту и введение терапевтически эффективной дозы химиотерапевтического средства пациенту, и, таким образом, лечение злокачественной опухоли. Введение CONP повышает эффективность лучевой терапии и/или химиотерапевтического лечения, снижает терапевтически эффективную дозу облучения и/или снижает терапевтически эффективную дозу одного или нескольких химиотерапевтических средств, необходимых для лечения злокачественной опухоли у пациента. При введении CONP оптимальный терапевтический исход достигается даже с меньшими дозами облучения и химиотерапии, чем те, которые обычно используют без CONP. Таким образом, введение CONP будет прямо или опосредованно снижать токсичность, связанную с более высокими дозами облучения и химиотерапии, которые наиболее часто используют при введении без CONP.
I. Определения
Если термин используют в единственном числе, авторы изобретения также подразумевают аспекты изобретения, которые описываются множественным числом этого термина. Применяемые в этом описании и в прилагаемой формуле изобретения, формы единственного числа включают ссылку на множественное число, если из контекста явно не следует иное, например, «наконечник» включает множество наконечников. Таким образом, например, ссылка на «способ» включает один или несколько способов, и/или этапов из типа, описываемого в настоящем документе, и/или которые будут ясны специалистам в данной области после прочтения этого описания.
Термин «вводить», «введение» или «введенный» относится к действию введения агента или терапевтического лечения в физиологическую систему (например, индивидууму или клеткам, тканям и органам in vivo, in vitro, или ex vivo).
Термин «диагностированный», «диагностический» или «поставлен диагноз» означает выявление наличия или природы патологического состояния. Диагностические способы отличаются по их чувствительности и специфичности. «Чувствительность» диагностического анализа представляет собой процент больных индивидуумов, которые дали положительный ответ на тест (процент «истинно-положительных»). Больные индивидуумы, которые не были выявлены путем анализа, являются «ложно-отрицательными». Индивидуумы, которые не являются больными и которые показали отрицательный результат при анализе, называются «истинно-отрицательными». «Специфичность» диагностического анализа равна единице минус доля ложно-положительных, где долю «ложно-положительных» определяют как долю здоровых, которые дали положительный результат в тесте. Хотя конкретный диагностический способ может не обеспечивать окончательный диагноз состояния, достаточно, если способ обеспечивает положительный признак, который помогает при диагностике.
Применяемые в настоящем документе, термины «лечить» и «лечение» относятся к уменьшению или облегчению прогрессирования, тяжести и/или длительности злокачественной опухоли, в частности, солидной опухоли, или одного или нескольких ее симптомов, что происходит при введении одной или нескольких терапий (например, одного или нескольких профилактических и/или терапевтических средств). В иллюстративных вариантах осуществления, лечение солидной опухоли относится к одному или нескольким признакам из: (i) уменьшение числа злокачественных клеток; (ii) усиление апоптоза опухолевых клеток; (iii) уменьшение размера опухоли; (iv) уменьшение объема опухоли; (v) ингибирование, торможение, замедление в некоторой стенени, и, предпочтительно, остановка инфильтрации злокачественными клетками периферических органов; (vi) ингибирование (например, замедление в некоторой стенени, и, предпочтительно, остановка) метастазирования опухоли; (vii) ингибирование роста опухоли; (viii) предотвращение или замедление появления и/или рецидива опухоли; (ix) снижение опухолевого маркера, который ассоциирован с присутствием злокачественной опухоли; и/или (ix) облегчение в некоторой степени одного или нескольких симптомов, ассоциированных со злокачественной опухолью. «Лечение» может также означать продление выживаемости по сравнению с ожидаемой выживаемостью без получения лечения. В некоторых вариантах осуществления способ по настоящему изобретению достаточен для снижения размера опухоли, уменьшения числа злокачественных клеток, или уменьшения скорости роста опухоли, по меньшей мере, приблизительно на любые из 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% по сравнению с соответствующим размером опухоли, числом злокачественных клеток или скоростью роста опухоли в сравнении с лечением в отсутствие CONP. Для измерения величины этого эффекта можно использовать стандартные способы, такие как анализы in vitro с очищенным ферментом, клеточные анализы, модели на животных, или тестирование человека. Например, иммуногистохимический анализ злокачественной опухоли пациента может показать значительное увеличение апоптоза опухолевых клеток, когда настоящее изобретение вводят пациенту. Химический анализ злокачественной опухоли пациента может показать значительное повышение уровней активных форм кислорода в злокачественных клетках, когда пациенту со злокачественной опухолью вводят CONP и лучевую терапию.
Применяемый в настоящем документе, термин «эффективное количество» относится к количеству терапии (например, профилактическому или терапевтическому средству), которого достаточно для того чтобы оказать благоприятные или желаемые результаты, в том числе, клинические результаты. Эффективное количество можно вводить в одном или нескольких введениях. При использовании по отношению к наночастицам оксида церия или их композиции, «эффективное количество» относится к количеству, необходимому чтобы позволить уменьшить терапевтически эффективное количество облучения и/или химиотерапевтического средства, вводимых пациенту, и/или количество по отношению к количеству наночастиц оксида церия или их композиции, необходимому для оказания желаемого терапевтического эффекта (например, лечение радиационного повреждения).
Применяемый в настоящем документе, термин «терапевтически эффективное количество» относится к такому количеству терапии, которого достаточно для разрушения, модификации, контроля или удаления первичной, регионарной или метастатической ткани злокачественной опухоли, облегчения злокачественной опухоли или одного или нескольких ее симптомов, или профилактики прогрессирования злокачественной опухоли, вызывания регрессии злокачественной опухоли, или усиление или улучшение терапевтического эффекта/эффектов другой терапии (например, профилактического или терапевтического средства). Терапевтически эффективное количество можно вводить в одном или нескольких введениях.
Применяемый в настоящем документе термин «индивидуум» или «пациент» или их синоним включает всех членов животного царства, особенно млекопитающих, в том числе человека. Индивидуум или пациент предпочтительно является человеком.
Термин «фармацевтически приемлемый носитель» относится к любым таким носителям, которые известны специалистам в данной области как подходящие для конкретного способа введения. Например, термин «фармацевтически приемлемый носитель» включает любой и каждый из растворителей, диспергирующих сред, покрытий, антибактериальных и противогрибковых средств, агентов, придающих изотоничность, и агентов, замедляющих абсорбцию, и т.п., которые можно использовать в качестве среды для фармацевтически приемлемого вещества. Кроме того, активные материалы также можно смешивать с другими активными материалами, которые не мешают желаемому действию, или с материалами, которые дополняют желаемое действие или оказывают другое воздействие.
Применяемые в настоящем документе, термины «злокачественная опухоль», «опухоль» и «неоплазия» используют взаимозаменяемо, и в форме единственного или множественного числа они относятся к клеткам, подвергшиеся злокачественной трансформации, которая сделала их патологическими по отношению к организму-хозяину. Первичные злокачественные клетки (то есть клетки, полученные рядом с участком злокачественной трансформации) можно легко отличить от не-злокачественных клеток общепринятыми способами, в частности, гистологическим исследованием. Определение злокачественной клетки, применяемое в настоящем документе, включает не только первичную злокачественную клетку, но также любую клетку, полученную из злокачественной клетки-предшественника. Оно включает метастазировавшие злокачественные клетки, и клеточные линии и культуры in vitro, полученные из злокачественных клеток. По отношению к типу злокачественной опухоли, которая обычно манифестирует в виде солидной опухоли, «клинически определяемая» опухоль представляет собой опухоль, которая выявляется на основании массы опухоли, например, при помощи таких способов, как сканирование при помощи компьютерной томографии, магнитно-резонансная томография, рентгенография, ультразвук или пальпация, и/или опухоль, которая выявляется из-за экспрессии одного или нескольких опухоль-специфических антигенов в образце, полученном от пациента.
Как применяют в настоящем документе, термины «метастазирование», «метастазы», «метастатический» и другие грамматические эквиваленты, применяемые в настоящем документе, относятся к злокачественным клеткам, которые распространяются или переносятся от места происхождения (например, первичной опухоли) к другим областям организма с развитием аналогичного злокачественного очага в новом месте. «Метастатическая» или «метастазирующая» клетка представляет собой клетку, которая потеряла адгезивные контакты с соседними клетками и мигрирует через кровоток или лимфу от первичного очага заболевания для проникновения в соседние структуры тела. Термины также относятся к процессу метастазирования, который в качестве неограничивающих примеров включает отделение злокачественных клеток от первичной опухоли, проникновение опухолевых клеток в кровоток или лимфоток, их выживание и миграцию в отдаленное место, прикрепление и выход из сосуда в новое место, и образование микроколонии в удаленном месте, и рост и прогрессирование опухоли в удаленном месте.
II. Наночастицы оксида церия
Наночастицы оксида церия (CONP) представляют собой кристаллы оксида церия нанометрового размера, как правило, в диапазоне приблизительно от одного нанометра до приблизительно 20 нанометров в размере в самом длинном измерении. Кристаллы оксида церия имеют кристаллическую решетку флюоритного типа, и атомы церия присутствуют в валентных состояниях +3 или +4. Относительное преобладание валентных состояний +3 или +4 может зависеть от окислительно-восстановительных условий и многих других факторов. В настоящем изобретении, CONP применяют для усиления гибели злокачественных клеток, вызванной облучением и химиотерапией. CONP повышает уровень свободных радикалов в злокачественных клетках и повышает уровни свободных радикалов в злокачественных клетках выше уровня, который индуцируется только облучением. Кроме того, также было обнаружено, что комбинация наночастиц оксида церия с облучением контролирует и/или снижает до минимума индекс метастазирования в исследованиях злокачественных опухолей на животных. Индекс метастазирования представляет собой показатель тяжести злокачественной опухоли у пациента, и его оценка включает в себя число и размер метастазов в зависимости от идентификации метастатических очагов. В сочетании с химиотерапией, комбинация повышает эффективность лечения.
Дозу CONP, которую можно вводить пациенту, можно тестировать путем измерения фармакокинетических параметров плазмы крови с использованием образцов плазмы крови пациента. Можно измерять переменные для концентрации CONP в плазме крови пациента, такие как пиковая концентрация CONP (Cmax), время достижения Cmax (Tmax) минимальная концентрация CONP (Cmin), T1/2 до снижения концентрации CONP в плазме крови пациента, средние концентрации CONP (среднее на основе интеграции уровней CONP в течение нескольких T1/2 для CONP или в течение недели лечения).
Например, в практическом осуществлении настоящего изобретения, доза CONP, которую можно вводить пациенту для обеспечения эффективной противоопухолевой концентрации CONP в плазме крови у пациента, может быть приблизительно от 1 наномоль до приблизительно 500 микромоль, или приблизительно от 5 наномоль до приблизительно 250 микромоль, или приблизительно от 10 наномоль до приблизительно 100 микромоль, или приблизительно от 10 наномоль до приблизительно 50 микромоль, или приблизительно от 10 наномоль до приблизительно 10 микромоль, или приблизительно от 10 наномоль до приблизительно 1 микромоль, или приблизительно от 10 наномоль до приблизительно 500 наномоль, или приблизительно от 10 наномоль до приблизительно 100 наномоль.
Что касается дозы CONP, вводимой пациенту, на основании нанограммов (нг) CONP на килограмм массы тела пациента (нг/кг CONP), доза CONP, которую можно вводить пациенту, может находиться в диапазоне приблизительно от 1 нанограмма/кг до приблизительно 50 миллиграммов/кг, или приблизительно от 1 нанограмма/кг до приблизительно 10 миллиграммов/кг, или приблизительно от 1 нг/кг до приблизительно 1 мг/кг, или приблизительно от 1 нг/кг до приблизительно 500 микрограммов/кг, или приблизительно от 1 нг/кг до приблизительно 100 микрограммов/кг, или приблизительно от 1 нг/кг до приблизительно 10 микрограммов/кг, или приблизительно от 10 нг/кг до приблизительно 10 микрограммов/кг, или приблизительно от 10 нг/кг до приблизительно 1 микрограммов/кг, или приблизительно от 25 нг/кг до приблизительно 500 нг/кг, или приблизительно от 25 нг/кг до приблизительно 250 нг/кг, или приблизительно от 0,01 нг/кг до приблизительно 1 микрограмма/кг, или приблизительно от 0,1 нг/кг до приблизительно 500 нг/кг, или приблизительно от 25 нг/кг до приблизительно 150 нг/кг.
В одном из аспектов, способ позволяет уменьшить дозу лучевой терапии или химиотерапии по сравнению или с (i) существующим стандартом лечения в отсутствие CONP или с (ii) эффективным количеством для лечения опухоли в отсутствие CONP. В различных вариантах осуществления доза лучевой терапии или химиотерапевтического средства составляет приблизительно от 1% и до 90%, или приблизительно от 1% и до 80%, или приблизительно от 1% и до 70%, или приблизительно от 1% и до 60%, или приблизительно от 1% и до 50%, или приблизительно от 1% и до 40%, или приблизительно от 1% и до 30%, или приблизительно от 1% и до 20%, или приблизительно от 1% и до 10% от или (i) дозы, применяемой в существующем стандарте лечения в отсутствие CONP или (ii) эффективного количества для лечения опухоли в отсутствие CONP. В других вариантах осуществления доза лучевой терапии или химиотерапии составляет приблизительно от 10% и до 90%, или приблизительно от 20% и до 80%, или приблизительно от 30% и до 70%, или приблизительно от 40% и до 60%, или приблизительно от 10% и до 50%, или приблизительно от 10% и до 30%, или приблизительно от 50% и до 90%, или приблизительно от 70% и до 90%.
Предпочтительно используют CONP, которые имеют размер измерения приблизительно от 1 нанометра до приблизительно 3 нанометров, или приблизительно от 1 нанометра до приблизительно 10 нанометров, или приблизительно от 3 нанометров до приблизительно 10 нанометров, или приблизительно от 3 нанометров до приблизительно 7 нанометров, или приблизительно от 3 нанометров до приблизительно 5 нанометров, или приблизительно от 3 нанометров до приблизительно 20 нанометров, или приблизительно от 0,1 нанометра до приблизительно 100 нанометров, или приблизительно от 0,1 нанометра до приблизительно 5 нанометров, или приблизительно от 3 нанометров до приблизительно 50 нанометров. Размер CONP можно определять при помощи известных способов, и определение может включать измерение размеров в зависимости от различных микроскопических способов, способов светорассеяния или способов дифракции рентгеновских лучей.
Для получения наночастиц оксида церия(CONP) можно использовать любой известный способ, или их можно приобретать у различных производителей. Чистоту и степень кристаллизации CONP можно корректировать при помощи способов, известных в данной области. CONP могут иметь примеси различных ионов, например, таких как катионы золота, серебра, титана, кальция, магния, цезия, железа, марганца, меди, цинка, стронция, лантана, углерода, селена, хрома, алюминия, калия, натрия, свинца, органических аминов; и, например, анионы атомов азота, серы, фтора, хлора, брома, йода, углерода и, например, анионы органических кислот. CONP могут быть покрыты полимерами, углеводами, белками, полимерами пассивным образом, или посредством химической связи, в том числе ковалентной, ионной, полярной ковалентной, при помощи координационных комплексов, образованием водородных связей, ван-дер-ваальсовых сил, электростатической, магнитной или любого их сочетания.
Кроме того, CONP можно создавать химическим путем при различных условиях pH для сдвига относительных количеств Ce+3 и Ce+4 в кристаллах CONP. Для CONP, которые кристаллизуются или присутствуют в виде кристаллов от субнанометровых до мультимикронных размеров, предполагают, что в присутствии восстановителей соотношение Ce+3 к Ce+4 в CONP увеличивается. Аналогично, предполагают, что это соотношение Ce+3 к Ce+4 повышается от щелочного pH к pH 6,5. Напротив, когда CONP кристаллизуются или присутствуют в виде кристаллов от субнанометровых до мультимикронных размеров, предполагают, что в присутствии окислителей, соотношение Ce+3 к Ce+4 в CONP снижается. Аналогично, предполагают, что это соотношение Ce+3 к Ce+4 снижается при кислом pH к pH 6,5.
CONP могут улавливать свободные радикалы, чтобы защитить кожу от радиационного дерматита и усилить гибель злокачественных клеток, вызванную облучением, одновременно защищая здоровую ткань от облучения. CONP защищают от воспаления здоровую ткань, которая подверглась облучению, и защищают клетки от активных форм кислорода (АФК). Кроме того, CONP могут уничтожать злокачественные клетки за счет повышения уровней свободных радикалов в злокачественных клетках.
Принципы настоящего изобретения предлагают новый способ лечения злокачественной опухоли с использованием CONP в комбинации с химиотерапией и лучевой терапией с одновременным снижением до минимума повреждения здоровой неопухолевой ткани. Как таковое, использование CONP в комбинации с лечением химиотерапией/облучением обеспечивает более эффективное лечение, или, альтернативно, равное по эффективности лечение с использованием сниженных доз лучевой терапии/химиотерапии, чем дозы, которые применяют в отсутствие CONP. CONP были исследованы на их способность служить ловушкой для свободных радикалов для оказания защиты против химических, биологических и радиационных повреждений, которые способствуют выработке свободных радикалов. Без связи с конкретным механизмом, полагают, что CONP, в отношении валентности и дефектов кислорода, способствуют продолжительности жизни клеток и уменьшают токсические повреждения благодаря своим антиоксидантным свойствам, предотвращают накопление активных форм кислорода (АФК), и, таким образом, предотвращают активацию апоптотического ответа и гибель клеток.
На мышиной модели были протестированы безопасность CONP и их способность обеспечивать противолучевую защиту. CONP хорошо переносятся и, по-видимому, снижают частоту возникновения пневмонита у бестимусных «голых» мышей. Примеры наночастиц оксида церия описаны в патенте США 8048523 и патенте США 8703200, которые включены в настоящий документ в полном объеме посредством ссылки.
Наночастицы оксида церия можно вводить в виде композиции, содержащей наночастицы оксида церия и фармацевтически приемлемый носитель, как описано в разделе IV, ниже.
III. Лучевая терапия
Способы лечения злокачественной опухоли облучением известны специалистам в данной области. Облучение или лучевая терапия представляет собой медицинское использование ионизирующего излучения, в основном, как часть лечения злокачественных опухолей для контроля или уничтожения злокачественных клеток. Лучевая терапия может быть радикальным лечением для ряда типов злокачественных опухолей, если они локализованы в одной области организма. Ее также можно использовать как часть адъювантной терапии для профилактики рецидива опухоли после операции удаления первичной злокачественной опухоли (например, ранних стадий рака молочной железы). Лучевая терапия синергична с химиотерапией, и используется до, во время и после химиотерапии у восприимчивых злокачественных опухолей.
Количество радиации при фотонной лучевой терапии измеряют в грэях (Гр), и оно варьирует в зависимости от типа и стадии злокачественной опухоли, подлежащей лечению. Для лечебных случаев, обычная доза для солидных эпителиальных опухолей находится в диапазоне от 60 до 80 Гр, хотя лимфомы обрабатывают от 20 до 40 Гр.
В способах по настоящему изобретению, использование CONP обеспечивает эффективное лечение с более низкой дозой облучения. В другом варианте осуществления использование CONP обеспечивает повышение эффективности лечения с тем же самым уровнем дозы облучения, который используется в настоящее время в отсутствие CONP. В одном из вариантов осуществления использование CONP обеспечивает противолучевую защиту для здоровых не-злокачественных клеток во время лечения и снижает побочные эффекты лучевой терапии/химиотерапии.
Общую дозу облучения часто фракционируют (распределяют по времени) по нескольким важным причинам. Фракционирование дает нормальным клеткам время для восстановления, в то время как опухолевые клетки, как правило, менее эффективно восстанавливаются между фракциями. Фракционирование также дает возможность опухолевым клеткам, которые были в относительно устойчивой к облучению фазе клеточного цикла во время одной обработки, перейти в чувствительную фазу цикла до получения следующей фракции. Аналогично, опухолевые клетки, которые были хронически или остро гипоксичными (и, таким образом, более устойчивыми к облучению) могут восстановить оксигенацию между фракциями, что улучшит гибель опухолевых клеток.
Фракционные схемы лечения индивидуализированы в различных центрах лучевой терапии и даже у отдельных терапевтов. В Северной Америке, Австралии и Европе типичная схема фракционирования для взрослых составляет от 1,8 до 2 Гр в сутки, пять суток в неделю. При некоторых типах злокачественных опухолей, продление схемы фракционирования на слишком долгий срок может позволить опухоли начать восстановление популяции, и для этих типов опухолей, включая злокачественные опухоли головы и шеи и плоскоклеточные опухоли шейки матки, лучевую терапию предпочтительно завершить в определенный промежуток времени. Для детей, типичная величина фракции может быть от 1,5 до 1,8 Гр в сутки, поскольку более малые величины фракции ассоциированы со сниженной встречаемостью и тяжестью поздних побочных эффектов в нормальных тканях.
В некоторых случаях, ближе к концу курса лечения используют две фракции в сутки. Эту схему, известную как сопутствующая очаговая схема или гиперфракционирование, применяют на опухолях, которые регенерируют тем быстрее, чем они меньше. В частности, опухоли головы и шеи демонстрируют такое поведение.
Одной из схем фракционирования, которую используют все чаще и продолжают исследовать, является гипофракционирование. Это лучевая терапия, при которой общая доза облучения делится на большие дозы. Обычные дозы значительно варьируют по типу злокачественной опухоли, от 2,2 Гр/фракцию до 20 Гр/фракцию. Логика гипофракционирования состоит в том, чтобы уменьшить вероятность рецидива злокачественной опухоли, не давая клеткам достаточно времени для размножения, а также используя уникальную биологическую чувствительность к радиации у некоторых опухолей. Один из наиболее часто обрабатываемых участков, где есть очень хорошие результаты для такого лечения, находится в раке молочной железы. Было показано, что короткие курсы гипофракционного лечения в течение 3-4 недель, например, 40 Гр в 15 фракциях или 42,5 Гр в 16 фракциях, являются такими же эффективными, как и более длительное 5-6 недельное лечение, как в отношении контроля злокачественной опухоли, так и в отношении косметического результата (восстановление внешнего вида пациента). Специалистам в данной области будут ясны схемы лечения и как изменять дозировки и схемы лечения в комбинации со способами по настоящему изобретению.
Профилактические (адъювантные) дозы (означающие терапию, которую применяют после начального лечения злокачественной опухоли), как правило, составляют приблизительно 45-60 Гр в фракциях по 1,8-2 Гр (для злокачественных опухолей молочной железы, головы и шеи). Радиационные онкологи рассматривают много других факторов при выборе дозы, включая, получал ли пациент химиотерапию, сопутствующие заболевания у пациента, будет ли лучевая терапия вводиться до или после операции, и степень успешности операции.
Параметры доставки предписанной дозы определяют во время планирования лечения (часть дозиметрии). Планирование лечения, как правило, проводят на специально выделенных компьютерах с использованием специализированного программного обеспечения для планирования лечения. В зависимости способа доставки облучения, можно использовать несколько углов или несколько источников для получения общей необходимой дозы. Профессионал разрабатывает план, который доставит однородную предписанную дозу к опухоли и сведет к минимуму побочные эффекты и дозу для окружающих здоровых тканей.
IV. Противоопухолевые химиотерапевтические средства
Для некоторых вариантов осуществления настоящего изобретения, предполагают, что доставку химиотерапевтического препарата можно контролировать для оптимизации противоопухолевой терапии и для сведения к минимуму побочных эффектов для пациента со злокачественной опухолью, которого лечат химиотерапевтическим средством. Лечение злокачественных опухолей требует оптимизации уничтожения популяции злокачественных клеток или оно может причинить больше вреда и стимулировать пролиферацию злокачественных клеток. Переменные для введения лекарственного средства включают: (a) расчет времени для введения химиотерапии; (b) дозировки лекарственного средства; (c) типы вводимых противоопухолевых препаратов; и (d) длительность терапии лекарственным средством.
Существует важный вариант осуществления настоящего изобретения для применения противоопухолевого лечения у пациента, который представляет собой введение дозы наночастиц оксида церия (CONP) отдельно, или в комбинации с дозой второго химиотерапевтического средства, или дополнительно включает лучевую терапию пациента, для лечения злокачественной опухоли или риска развития злокачественной опухоли.
Настоящее изобретение рассматривает сочетание CONP, лучевой противоопухолевой терапии и противоопухолевого химиотерапевтического средства в качестве эффективного противоопухолевого лечения у пациента. Кроме того, противоопухолевое лечение пациента, у которого может быть злокачественная опухоль, или в профилактических целях, или которому был поставлен диагноз злокачественной опухоли, может включать в соответствии с настоящим изобретением, введение CONP с химиотерапевтическим средством в комбинации с лучевой терапией. Дозировка этих агентов можно производиться в соответствии со схемами введения отдельных доз. Доза и частота дозировки для каждого противоопухолевого агента могут быть адаптированы на основании массы тела пациента, типа злокачественной опухоли, клеточной мишени, которую ингибирует агент, или с намерением достигнуть выбранного уровня противоопухолевого агента в плазме крови, который, как полагают, необходим для эффективного лечения злокачественных опухолей у пациента при помощи противоопухолевого агента. Такую дозу можно определять с использованием опубликованных руководств по расчет дозы химиотерапевтического средства (См. Gurney, H., Br J Злокачественная опухоль. 22 Apr 2002 года; 86(8): 1297-1302).
Противоопухолевые лекарственные средства и противоопухолевые химиотерапевтические средства представляют собой общие термины со значение, которое включает термины противораковый препарат, противоопухолевые химиотерапевтические препараты, противоопухолевый агент, противоопухолевая химиотерапия, химиотерапевтическое лекарственное средство, химиотерапевтическое средство, химиотерапия, химиотерапевтический препарат, противоопухолевое соединение, терапия противоопухолевым соединением, химиотерапевтическое соединение, и терапия противораковыми препаратами. Такие химиотерапии будут также означать субстанции, которые: могут ингибировать сигнальные пути злокачественных клеток; которые можно использовать для уничтожения злокачественных клеток in vitro; которые можно использовать для уничтожения злокачественных клеток in vivo, как в злокачественной опухоли; и в некоторых случаях, можно использовать для лечения индивидуума с диагнозом злокачественная опухоль для защиты жизнеспособности здоровых клеток пациента со злокачественной опухолью или атаки жизнеспособности злокачественных клеток у пациента со злокачественной опухолью.
Следующие примеры и применение химиотерапевтических агентов приведены только в качестве примеров и без ограничения объема настоящего изобретения, и для более конкретного указания на практическое осуществление настоящего изобретения. Также будет описан ряд клеточных сигнальных путей, которые могут быть мишенями для противоопухолевых химиотерапевтических препаратов. В основном, противоопухолевое химиотерапевтическое средство применяют в форме фармацевтической композиции, для фармацевтического применения, или в способе лечения пациента.
Примеры противоопухолевых химиотерапевтических лекарственных средств/агентов/соединений
Таблица 1 представляет примеры распространенных химиотерапевтических агентов, применяемых для лечения шести распространенных типов злокачественных опухолей у пациента-человека.
Примеры противоопухолевых лекарственных средств, одобренных FDA (по международному непатентованному названию), которые можно использовать в настоящем изобретении в качестве неограничивающих примеров включают: сорафениба, регорафениба, иматиниба, эрубилина, гемцитабина, капецитабина, пазопаниба, лапатиниба, дафрафениба, сутиниба малата, кризотиниба, эверолимуса, торисиролимуса, сиролимуса, акситиниба, гефитиниба, анастрола, бикалутамида, фулвестранта, ралитрекседа, пеметрекседа, госерилина ацетата, эрлотиниба, вемурафениба, визиодегиба, тамоксифена цитрата, паклитаксела, доцетаксела, кабазитаксела, оксалиплатина, зив-афлиберцепта, бевацизумаба, трастузумаба, пертузумаба, пантиумумаба, таксана, блеомицина, мелфалена, плумбагина, камптосара, митомицина-C, митоксантрона, SMANCS, доксорубицина, пегилированного доксорубицина, Фолфори (комбинация препаратов), 5-фторурацила, темозоламида, пасиреотида, тегафура, гимерацила, отерацила, итраконазола, бортезомиба, леналидомида, иринтотекана, эпирубицина и ромидепсина.
Международные непатентованные названия противоопухолевых химиотерапевтических препаратов, которые применяли для пациентов со злокачественными опухолями, в качестве неограничивающих примеров включают: доксорубицин, эпирубицин; 5-фторурацил, паклитаксел, доцетаксел, цисплатин, блеомицин, мелфален, плумбагин, иринотекан, митомицин-C и митоксантрон. В качестве примера, некоторые другие противоопхолевые химиотерапевтические лекарственные средства, которые можно использовать и которые могут находиться на стадиях клинических испытаний, включают: ресминостат, тасквинимод, рефаметиниб, лапатиниб, тиверб, Аренигир, пазиреотид, Сигнифор, тицилимумаб, тремелимумаб, лансопразол, ПревОнко, ABT-869, линифаниб, тивантиниб, Тарцева, эрлотиниб, Стиварга, регорафениб, фтор-сорафениб, бриваниб, липосомальный доксорубицин, ленватиниб, рамуцирумаб, перетиноин, Ручико, мупарфостат, Тейсуно, тегафур, гимерацил, отерацил и орантиниб.
Клеточные мишени химиотерапевтических лекарственных средств/агентов/соединений
Химиотерапевтические средства можно выбирать на основании типа злокачественной опухоли, от которой страдает пациент, для того чтобы уничтожить эту злокачественную опухоль у пациента. Можно выбирать противоопухолевые химиотерапевтические препараты, которые ингибируют конкретную мишень клеточного сигнального пути или несколько мишеней. Противораковый препарат по настоящему изобретению относится к молекулам, которые представляют собой малые органические молекулы, соли, ионы, газы, жидкости, пептиды, даже большие белки, такие как антитела.
Примеры клеточных мишеней, на которые может оказывать воздействие противораковый препарат, перечислены в настоящем документе, но не являются ограничивающими. Клеточные мишени противоопухолевых лекарственных средств включают следующие идентифицированные мишени: mTORC, RAF-киназу, MEK-киназу, фосфоинозитолкиназу 3, рецептор фактора роста фибробластов, множество тирозинкиназ, рецептор эпидермального фактора роста человека, фактор роста эндотелия сосудов, другие факторы ангиогенеза, белок теплового шока; рецептор Smo (smooth), рецептор FMS-подобной тирозинкиназы 3, ингибитор белков апоптоза, циклин-зависимые киназы, деацетилазу, рецептор тирозинкиназы ALK, серин/треониновая протеинкиназа Pim-1, ацилтрансфераза Поркупин, сигнальный путь Hedgehog, протеинкиназа C, mDM2, глипикан 3, ChK1, MET-рецептор фактора роста гепатоцитов, белок 7, подобный домену эпидермального фактора роста, сигнальный путь Notch, киназа семейства Src, ДНК-метилтрансфераза, интеркаляторы ДНК, тимидинсинтаза, разобщитель функции микротрубочек, кросслинкеры ДНК, агенты, разрывающие цепи ДНК, алкиляторы ДНК, индуктор JNK-зависимого фосфорилирования p53 по Ser15, ингибиторы ДНК-топоизомеразы, Bcl-2, и генераторы свободных радикалов.
1. Химиотерапия с использованием ингибиторов mTOR, ингибиторов PI3K, ингибиторов нескольких киназ
Существуют ингибиторы mTORC для лечения злокачественной опухоли. Ингибитор комплекса мишени для рапамицина у млекопитающих (mTORC) может ингибировать mTOR, mTORC1, и/или mTORC2. Некоторые ингибиторы mTORC также ингибируют другие клеточные ферменты, например, такие как PI3K (фосфоинозитол-3-киназа). Комплекс 1 mTOR (mTORC1) состоит из mTOR, регуляторного белка mTOR (Raptor); летали млекопитающих с белком 8 семейства SEC13 (MLST8); PRAS40; и DEPTOR. Каталитической субъединицей двух молекулярных комплексов, mTORC1 и mTORC2, является mTOR, который принадлежит к белковому семейству киназ, родственных фосфатидилинозитол 3-киназе. mTORC1 представляет собой пищевой/энергетический/окислительно-восстановительный сенсор и контролирует синтез белков. Когда есть адекватные клеточные уровни энергии, питательных веществ, кислорода и клеточных факторов роста, тогда активируется mTORC1. Активация mTORC1 активирует синтез белков. Некоторые типы злокачественных клеток имеют аномально функционирующие белки mTOR, mTORC1 или mTORC2.
Примеры ингибиторов mTORC включают AP23573 (дефоролимус, ридафоролимус), AZD2014, AZD8055, CCL-779 (темсиролимус, NSC-683864), CH5132799, GDC-0941, GDC-0349, GSK2126458 (GSK458), GSK2126458 (GSK458), GSK1059615, INK128, Ku-0063794, NVP-BEZ235, NVP-BGT226, OSI-027 (ASP4786), Паломид 529 (P529), PI-103, PP121, PP242, PK1587, PF04691502, PF-05212384 (PKI-587), рапамицин (сиролимус), RAD001 (эверолимус), RG7422 (GDC0980), RG7321 (пиктилисиб, SAR245409, XL-765), RG7440, SF1126, SF1101, Торин 1, Торин 2, WAY-600, WYE-125132 (WYE-132), WYE-354, и WYE-687. Рапамицин (сиролимус) (Rapaimmune, Wyeth-Ayerst) ингибирует mTORC1 за счет ассоциации с его внутриклеточным рецептором FKBP12. Комплекс FKBP12-рапамицин связывается непосредственно с FKBP12-Рапамицин связывающим (FRB) доменом mTOR, ингибируя его активность.
Ингибиторы mTORC второго поколения способны связываться с АТФ-связывающим мотивом на киназном домене корового белка mTOR, и это связывание блокирует активность как mTORC1, так и mTORC2. Поскольку белки mTOR и PI3K относятся к киназам, родственным фосфатидилинозитол 3-киназе (PIKK), некоторые ингибиторы mTORC второго поколения действуют более прямо при ингибировании mTOR, mTORC1 или mTORC2. Некоторые из этих соединений также ингибируют PI3K (фосфатидилинозитол 3-киназу), которая действует «выше» mTORC1 в сигнальном пути.
Эверолимус (Afinotor, Novartis) является ингибитором mTORC1/2. CCL-779 (темсиролимус, NSC-683864) (Torisel, Wyeth-Ayerst/Pfizer) представляет собой ингибитор mTORC1/2. AP23573 (дефоролимус, ридафоролимус, MK-8669) (Ariad/Merck) представляет собой ингибитор mTORC1/2. PI-103 представляет собой ингибитор mTORC1, mTORC2 и PI3K/Akt. PP121 представляет собой многоцелевой ингибитор PDGFR, Hck, mTOR, VEGFR2, Src, Abl, и ДНК-PK. BEZ235 представляет собой ингибитор PI3K/mTOR. GSK2126458 (GSK458) представляет собой ингибитор PI3K/mTOR. GSK2126458 (GSK458) представляет собой ингибитор mTORC1 и mTORC2. Ku-0063794 представляет собой ингибитор mTORC1 и mTORC2. SAR245409 (XL-765) представляет собой ингибитор PI3K/mTOR. SF1126 (SF обозначает Semafore Pharmaceutics) представляет собой пролекарственное средство, содержащее пан-ингибитор PI3K/mTOR LY294002/SF1101, который конъюгирован с RGD-содержащим тетрапептидом SF1174. Нацеливающая пептидная группа SF1174 пан-ингибитора PI3K/mTOR SF1126 селективно связывается с интегринами клеточной поверхности и, после входа в клетку, агент гидролизуется до активного лекарственного средства SF1101. SF-1101 (LY294002) представляет собой ингибитор PI3K/mTOR. PP242 представляет собой АТФ-конкурентный ингибитор против и mTORC1, и mTORC2. INK-128 (MLN-0128) (IN обозначает Intellikine) представляет собой ингибитор mTORC1/2, ингибитор raptor-mTOR (комплекс 1 TOR или TORC1) и rictor-mTOR (следует заметить, что mTOR также является частью отдельного комплекса, определяемого новым белком rictor (нечувствительный к рапамицину спутник mTOR), который модулирует фосфорилирование протеинкиназы C альфа (PKCalpha) и актиновый цитоскелет. AZD-8055 (AZ означает Astra-Zeneca) представляет собой ингибитор mTOR. NVP-BGT226 представляет собой новый двойной ингибитор PI3K/mTOR. RG7666 (GDC-0084) представляет собой ингибитор PI3 киназы из сигнального пути PI3K/Akt /mTOR. RG7422 (GNE 390; GDC-0980) представляет собой двойной ингибитор PI3K/mTOR. PF-05212384 (PKI-587) представляет собой ингибитор PI3K/mTOR. PF04691502 представляет собой ингибитор mTOR и PI3K. RG7321 (Пиктилисиб, GDC-0941) представляет собой ингибитор P13K/mTOR. GDC-0349 представляет собой ингибитор mTOR. Torin 1 представляет собой ингибитор mTORC1 и mTORC2. Torin 2 представляет собой ингибитор mTOR и представляет собой ингибитор ATM/ATR/DNA-PK. AZD2014 представляет собой двойной ингибитор mTORC1 и mTORC2. CH5132799 представляет собой ингибитор mTOR и PI3K. WAY-600 представляет собой ингибитор mTORC. WYE-125132 (WYE-132) представляет собой ингибитор mTORC. WYE-687 представляет собой ингибитор mTORC. Паломид 529 (P529) представляет собой ингибитор PI3K/Akt/mTOR для VEGF-A и bFGF. GSK1059615 представляет собой новый двойной ингибитор PI3Kα, PI3Kβ, PI3Kδ, PI3Kγ и mTOR. WYE-354 представляет собой ингибитор mTOR.
2. Химиотерапия с использованием ингибиторов киназы RAF из сигнального пути RAS-RAF-MEK-ERK (MAPK/ERK)
Сигнальный путь RAS-RAF-MEK-ERK (MAPK/ERK) представляет собой цепь взаимодействующих белков, которые переносят активность рецепторов клеточной поверхности для индуцирования активности ДНК в клеточном ядре для получения белков и способствуют изменениям в клетке, таким как клеточное деление. MAPK (митоген-активируемые протеинкиназы) ранее назывались ERK (киназы, регулируемые внеклеточным сигналом). MAPK фосфорилирует белки сигнального пути RAS-RAF-MEK, и это изменение может переключать сигнальный путь в положения «включено» и «выключено». Белки сигнального пути Ras-Raf-MEK-ERK могут быть мутированы, а затем функционально застрять или на "включено" или "выключено". Такое нарушение функционирования наблюдают у предшественника клетки злокачественной опухоли. RAS представляет собой семейство из пяти ГТФаз. Приблизительно 20% злокачественных опухолей человека (до 90% в специфических злокачественных опухолях) имеют мутации белка Ras, связанные с онкогеном, который вызывает постоянную активацию протеинкиназы Ras, фосфорилирующей белок RAF (https://en.wikipedia.org/wiki/Ras_subfamily). RAF включает семейство из трех серин-треонин-специфических протеинкиназ A, B и C; известных как ARAF, BRAF, CRAF. Один мутант BRAF известен как V600E. Конкретные примеры ингибиторов киназ RAF включают Сорафениб, RAF265, LGX818, SB590885, PLX4720, XL-281 и вемурафениб. Сорафениб (Нексавар, Bayer) является ингибитором нескольких тирозинпротеинкиназ (VEGFR и PDGFR) и киназ Raf, C-Raf и B-Raf. RAF265 представляет собой ингибитор киназ B-Raf и VEGFR2. LGX818, SB590885, PLX4720, XL281, и вемурафениб (PLX-4032, Zelboraf) являются ингибиторами B-RAF.
3. Химиотерапия с использованием ингибиторов киназы MEK из сигнального пути [RAS-RAF-MEK-ERK (MAPK/ERK)]
Активированные киназы RAF фосфорилируют и активируют киназы MEK: MEK1 и MEK2. MEK также известна как MAPKK. MEK представляет собой тирозин/треониновую киназу, которая после активации может фосфорилировать и активировать митоген-активируемую протеинкиназу (MAPK). MAPK представляет собой селективную серин/треониновую протеинкиназу. Конкретные примеры ингибиторов MEK включают CI-1040, MEK162, PD035901, селуметиниб, рефаметиниб, BAY-86-9766, RDEA119, траметиниб (GSK1120212), и XL518, RG7167, RG7420.
4. Химиотерапия с использованием ингибиторов PI3K (фосфоинозитол 3-киназы)
Сигнальный путь PI3K представляет собой важный путь передачи сигнала для множества клеточных функций, таких как контроль роста, метаболизм и инициация трансляции. Ингибитор PI3K часто в результате приводит к подавлению опухоли. Существует ряд различных классов и изоформ PI3K. PI3K класса I имеют каталитическую субъединицу, известную как p110, четырех типов (изоформ) - p110 альфа, p110 бета, p110 гамма и p110 дельта. Ингибиторы, которые исследуют для лечения различных злокачественных опухолей, ингибируют одну или несколько изоформ PI3K класса I. Конкретные примеры ингибиторов PI3K (фосфоинозитол 3-киназы) включают BEZ235, BYL719, бупарлисиб, BKM120, INC280, RG7440, RG7604, RG7666(GDC-0084), RG7321, RG7422, PF-05212384 (PKI-587), и PF-04449913.
5. Химиотерапия с использованием ингибиторов FGFR (рецептора фактора роста фибробластов (FGFR)
Факторы роста фибробластов (FGF) представляют собой семейство факторов роста, участвующих в ангиогенезе, заживлении ран и эмбриональном развитии. FGF представляют собой гепарин-связывающие белки, и было показано, что взаимодействия с гепаринсульфатпротеогликанами на поверхности клетки необходимы для трансдукции сигнала FGF. FGF являются ключевыми участниками в процессах пролиферации и дифференцировки широкого многообразия клеток и тканей. Рецепторы факторов роста фибробластов (FGFR) на поверхности клеток могут передавать сигнал через цепь белков сигнального пути MAPK/ERK в клетке к ДНК в ядре клетки. Семейство FGFR состоит из четырех членов, FGFR1, FGFR2, FGFR3, и FGFR4. FGFR состоят из трех внеклеточных доменов иммуноглобулинового типа (D1-D3), односпирального трансмембранного домена и внутриклеточного разделенного тирозинкиназного домена. Примерами ингибиторов FGRF являются BGJ398 и довитиниб.
6. Химиотерапия с использованием ингибиторов нескольких тирозинкиназ (TKI)
Тирозинкиназы представляют собой ферменты, которые отвечают за активацию множества белков посредством каскадов передачи сигнала. Белки активируются путем добавления фосфатной группы к белку (фосфорилирование). Ингибиторы тирозинкиназ (TKI), как правило, применяют в качестве проивоопухолевых лекарственных средств. TKI работают с четырьмя различными механизмами: они могут конкурировать с аденозинтрифосфатом (АТФ), фосфорилирующей основой, субстратом или и с тем, и с другим, или могут действовать в аллостерической манере, а именно связываться с участком вне активного центра, влияя на его деятельность за счет конформационного изменения. TKI представляют собой ингибиторы фосфорилирования тирозина с малой молекулярной массой, которые не ингибируют протеинкиназы, фосфорилирующие остатки серина или треонина и которые могут различать киназные домены EGFR и рецептора инсулина. Дополнительно было показано, что, несмотря на консервативность тирозин-киназных доменов, можно сконструировать и синтезировать TKI, которые различают даже близкородственные тирозинкиназные белки, такие как EGFR и его близкий родственник HER2.
Конкретные примеры ингибиторов тирозинкиназ включают нексавар, Стриваргу, Сутент, Ирессу и Инлиту, сунитиниба малат.
7. Химиотерапия с использованием ингибиторов HER (рецептора эпидермального фактора роста человека)
Пути передачи сигнала, которые активирует HER2, включают: митоген-активируемую протеинкиназу (MAPK), фосфоинозитид-3-киназу (PI3K/Akt), фосфолипазу Cγ, протеинкиназу C (PKC) и трансдуктор сигнала и активатор транскрипции (STAT). Передача сигнала через семейство рецепторов ErbB способствует клеточной пролиферации и препятствует апоптозу, и, таким образом, должна жестко регулироваться, чтобы предотвратить возникновение неконтролируемого клеточного роста. Амплификация или гиперэкспрессия гена ERBB2 тесно связана с повышенной частотой рецидивов заболевания и неблагоприятным прогнозом. Также известно, что гиперэкспрессия встречается в молочной железе, яичнике, желудке, и при агрессивных формах рака матки, таких как серозная карцинома эндометрия матки. HER2 расположен рядом, и, большинство времени, амплифицируется совместно с геном GRB7, который является протоонкогеном, ассоциированным с опухолями молочной железы, половых клеток яичка, желудка и пищевода. Было показано, что белки HER2 формируют кластеры в клеточных мембранах, которые могут играть роль в образовании опухоли. Конкретные примеры ингибиторов HER (рецептора эпидермального фактора роста человека) включают RG7116, RG1273 (пертузумаб, Perjeta®), RG3502 (трастузумаб эманастин, T-DMI), RG597 (трастузумаб, ГЕРЦЕПТИН), RGA201 (RG7160), эрлотиниб (Тарцева®), дакомитиниб (PF-00299804), PF-05280014 (МАТ фирмы Pfizer, биоэквивалентное RG597).
8. Химиотерапия с использованием ингибиторов VEGF (фактора роста эндотелия сосудов)
Для того чтобы вырасти больше, опухолям нужны собственные кровеносные сосуды, которые они создают при помощи промоторов ангиогенеза, таких как VEGF. Лекарственные средства, которые прерывают процесс ангиогенеза в опухоли (ингибиторы ангиогенеза) показывают многообещающие результаты при лечении злокачественной опухоли. Когда блокирован один промотор ангиогенеза, злокачественные опухоли, в конечном итоге, выращивают кровеносные сосуды при помощи другого промотора ангиогенеза. Опухоль представляет собой популяцию быстро делящихся и растущих злокачественных клеток. Мутации быстро накапливаются в популяции. Эти мутации обеспечивают функциональное разнообразие, которое позволяет злокачественным клеткам или субпопуляции злокачественных клеток в опухоли развивать устойчивость к лекарственному средству и/или избегать терапии. Когда солидные злокачественные опухоли невелики, они снабжаются питательными веществами за счет диффузии из близлежащих кровеносных сосудов. Опухоли не могут вырасти больше чем 2 мм без ангиогенеза, который приносит им кислород, приносит им питательные вещества и служит в качестве пути для отходов, чтобы убирать конечные биологические продукты, которые выделяют быстро делящиеся злокачественные клетки. Ангиогенез также необходим для распространения опухоли, или метастазирования. Одиночные злокачественные клетки могут оторваться от сформировавшейся солидной опухоли, попасть в кровеносный сосуд, и перенестись в отдаленное место, где они могут имплантироваться и начать рост вторичной опухоли. Существуют доказательства того, что кровеносный сосуд в данной солидной опухоли может представлять собой мозаичный сосуд, состоящий из эндотелиальных клеток и опухолевых клеток. Мозаичный сосуд может слущивать опухолевые клетки в сосудистую систему, чтобы они избежали воспаления или ишемии, вызванных облучением.
Конкретные примеры ингибиторов VEGF (фактора роста эндотелия сосудов) включают Стриваргу (регорафениб), бевацизумаб (Авастин), Инлюту, итраконазол и XL184 (кабозантиниб). Регорафениб демонстрирует антиангиогенную активность за счет ингибирования двух мишеней тирозинкиназ VEGFR2-TIE2. Инлюта (акситиниб) представляет собой ингибитор тирозинкиназы VEGF. Природные и синтетические ингибиторы ангиогенеза включают ангиостатин, эндостатин и тумстатин. Антиангиогенный механизм для бевацизумаба и итраконазола представляет собой прямое связывание с VEGF. Итраконазол также ингибирует фосфорилирование VEGFR, гликозилирование, передачу сигнала mTOR, эндотелиальную клеточную пролиферацию, клеточную миграцию, формирование просвета и ангиогенез, ассоциированный с опухолью. XL184 (кабозантиниб) является ингибитором тирозинкиназ Met и VEGFR2, и было показано, что он подавляет рост опухоли, метастазирование и ангиогенез.
9. Химиотерапия с использованием других ингибиторов ангиогенеза
Существуют другие соединения и ингибиторы VEGF, которые могут ингибировать некоторые формы ангиогенеза. Антиангиогенные соединения включают: карбоксиамидотриазол, TNP-470, CM101, IFN-α, IL-12, тромбоцитарный фактор 4, ангиостатические стероиды плюс гепарин, ингибиторы матриксных металлопротеиназ, ангиостатин, эндостатин, 2-метоксиэстрадиол, текогалан, тетратиомолибдат, талидомид, тромбоспондин, пролактин, ингибиторы αVβ3 и линомид. Карбоксиамидотриазол ингибирует клеточную пролиферацию и клеточную миграцию эндотелиальных клеток. TNP-470 и CM101 активируют иммунную систему. IFN-α подавляет стимуляторы ангиогенеза и ингибирует клеточную миграцию эндотелиальных клеток. IL-12 (интерлейкин-12) стимулирует образование ингибиторов ангиогенеза. Тромбоцитарный фактор 4 ингибирует связывание стимуляторов ангиогенеза. Ангиостатические стероиды плюс гепарин, и ингибиторы матриксных металлопротеиназ ингибируют разрушение базальной мембраны. Ангиостатин ингибирует клеточную пролиферацию и вызывает апоптоз эндотелиальных клеток. Эндостатин ингибирует клеточную миграцию, клеточную пролиферацию и выживание эндотелиальных клеток. Стероид 2-метоксиэстрадиол ингибирует клеточную пролиферацию и клеточную миграцию и вызывает апоптоз эндотелиальных клеток. Текогалан ингибирует клеточную пролиферацию эндотелиальных клеток. Тетратиомолибдат вызывает хелацию меди, которая ингибирует рост кровеносных сосудов. Талидомид ингибирует клеточную пролиферацию эндотелиальных клеток. Тромбоспондин ингибирует клеточную миграцию, клеточную пролиферацию, клеточную адгезию и выживание эндотелиальных клеток. Пролактин ингибирует bFGF и VEGF. Ингибиторы αVβ3 вызывают апоптоз эндотелиальных клеток. Линомид ингибирует клеточную миграцию эндотелиальных клеток.
10. Химиотерапия с использованием ингибиторов HSP (белка теплового шока)
Белок теплового шока 90 (HspP90) представляет собой молекулярный шаперон, который регулирует фолдинг и деградацию множества белков. Конкретные примеры ингибиторов HSP (белка теплового шока) включают AUY922.
11. Химиотерапия с использованием ингибиторов рецептора Smo (smooth)
Рецептор Smoothened (SMO) является частью пути передачи сигнала Нedgehog. Ингибирование SMO заставляет факторы транскрипции GLI1 и GLI2 оставаться неактивными, что предотвращает экспрессию генов, регулирующих опухоли, в пределах сигнального пути Нedgehog. Sonic Нedgehog является одним из трех белков в семействе пути передачи сигнала у млекопитающих, называемом Hedgehog, остальными являются белки Desert Hedgehog (DHH) и Indian Hedgehog (IHH). SHH является наиболее хорошо изученным лигандом сигнального пути Hedgehog. Он играет ключевую роль в регуляции органогенеза у позвоночных, такого как рост пальцев на конечностях и организация головного мозга. Sonic Hedgehog является морфогеном, который представляет собой молекулу, диффундирующую для образования градиента концентрации и оказывающую различное воздействие на клетки развивающегося эмбриона в зависимости от ее концентрации. SHH сохраняет свою значимость у взрослых. Он контролирует деление стволовых клеток у взрослых и был вовлечен в развитие некоторых злокачественных опухолей.
Конкретные примеры ингибиторов рецептора Smo (smooth) включают Эриведж (висмодегиб), эрисмодегиб (LDE225) и LEQ506. Эриведж представляет собой ингибитор рецептора Smo, одобренный FDA для базально-клеточной карциномы, и он также проходит клинические испытания для метастатического колоректального рака, мелкоклеточного рака легких, прогрессирующего рака желудка, рака поджелудочной железы, медуллобластомы и хондросаркомы. Эриведж действует как конкурирующий с циклопамином антагонист рецептора Smoothened (SMO), который является частью сигнального пути Hedgehog. Ингибирование SMO заставляет факторы транскрипции GLI1 и GLI2 оставаться неактивными, что предотвращает экспрессию генов, регулирующих опухоли, в пределах сигнального пути Hedgehog.
12. Химиотерапия с использованием ингибиторов CD135 (рецептора FMS-подобной тирозинкиназы 3)
CD135 представляет собой рецептор тирозин киназы типа III. Антиген кластера дифференцировки 135 (CD135) также известный как Fms-подобная тирозинкиназа 3 (FLT-3), тирозин-протеинкиназа FLT3 рецепторного типа, или киназа-2 печени плода (Flk2), представляет собой белок, который у людей кодируется геном FLT3. Flt3 представляет собой цитокиновый рецептор, который относится к рецептору тирозинкиназы класса III. CD135 представляет собой рецептор для лиганда цитокина Flt3 (Flt3L). CD135 экспрессируется на поверхности множества гематопоэтических клеток-предшественников. Передача сигнала Flt3 важна для нормального развития гематопоэтических стволовых клеток и клеток-предшественников. Когда этот рецептор связывается с Flt3L, он обазует димер сам с собой (гомодимер), который активирует присущую ему тирозинкиназную активность, которая в свою очередь фосфорилирует и активирует молекулы трансдукции сигнала, распространяющие сигнал в клетке. Передача сигнала посредством CD135 играет роль в выживании клеток, пролиферации и дифференцировке. CD135 важен для развития лимфоцитов (B-клетки и T-клетки). Конкретные примеры ингибиторов FLT-3 (тирозинкиназный рецептор 3) включают INC280 (INCB028060) и мидостаурин (PKC412). INC280 (INCB028060) ингибирует c-Met (рецептор фактора роста гепатоцитов [HGFR])-зависимую передачу сигнала PI3K и RAS.
Мидостаурин (PKC412) применяют для ингибирования мутированного CD135 (рецептора FMS-подобной тирозинкиназы 3).
13. Химиотерапия с использованием ингибиторов белков апоптоза
Ингибиторы апоптоза (IAP) преставляют собой семейство функционально и структурно родственных белков, которые служат в качестве эндогенных ингибиторов программируемой гибели клеток (апоптоза). Общей чертой всех IAP является наличие BIR (бакуловирусного повтора IAP, домена примерно из 70-ти аминокислот) в количестве от одной до трех копий. Семейство IAP человека состоит из 8 членов, и у многих организмов были идентифицированы гомологи IAP. Первые выявленные члены IAP были из IAP бакуловируса, Cp-IAP и Op-IAP, которые связываются с каспазами и ингибируют их в качестве механизма, который участвует в эффективном заражении цикле репликации у хозяина. Еще пять человеческих IAP представляют собой XIAP, c-IAP1, C-IAP2, NAIP, и сурвивин. XIAP связывается с каспазой-9, каспазой-3 и каспазой 7, тем самым ингибируя их активацию и предотвращая апоптоз. Следует отметить, что cIAP1 и cIAP2 связываются с каспазами, хотя как IAP ингибируют апоптоз механически на молекулярном уровне остается непонятным. Примером ингибитора белков апоптоза является LCL161.
14. Химиотерапия с использованием ингибиторов CDK 4/6 (циклин-зависимых киназ 4 и 6)
Циклин-зависимые киназы (CDKs) представляют собой семейство протеинкиназ, участвующих в регуляции транскрипции, процессинге мРНК и дифференцировке. Присутствующие у всех известных эукариот, CDK представляют собой малые киназные белки, которые связываются с регуляторным белком под названием циклин. Комплекс циклин-CDK представляет собой активную серин-треониновую киназу, которая фосфорилирует свои субстраты по серинам и треонинам. Циклин-зависимая киназа 4, также известная как протеинкиназа 4 клеточного деления, представляет собой фермент, который у людей кодируется геном CDK4. Для всех мутаций в этом гене, а также в родственных белках, включая циклины D-типа, p16(INK4a) и Rb была обнаружена ассоциация с образованием опухоли для ряда злокачественных опухолей. Известно о существовании 13 CDK, перечисленных в настоящем документе с регуляторным циклиновым белком в скобках: CDK1 (циклин A, циклин B); CDK2 (циклин A, циклин E); CDK3 ( циклин C); CDK4 (циклин D1, циклин D2, циклин D3); CDK5 (CDK5R1, CDK5R2); CDK6 (циклин D1, циклин D2, циклин D3); CDK7 (циклин H); CDK8 (циклин C); CDK9 (циклин T1, циклин T2a, циклин T2b, циклин K); CDK10; CDK11, также известная как CDC2L2 (циклин L): CDK12, также известная как CRKRS (циклин L); и CDK13, также известная как CDC2L5 (циклин L). Конкретные примеры ингибиторов CDK 4/6 (циклин-зависимых киназ 4 и 6) включают LEE011, PD-0332991 (палбоциклиб, PD-0332991-0054, PD-332991 и PF-00080665-73. Другие ингибиторы CDK включают флавопиридол (алвоцидиб) [ингибирует CDK 1, 2, 4, 6, 7, 9]; оломуцин [ингибирует CDK 1, 2, 5]; росковитин [ингибирует CDK 1, 2, 5]; пурваланол [ингибирует CDK 1, 2, 5]; пауллонес [ингибирует CDK 1, 2, 5]; бутриолактон [ингибирует CDK 1, 2, 5]: тио/оксофлавопиридолы [ингибирует CDK 1]; оксиндолы [ингибирует CDK 2]; аминотиазолы [ингибирует CDK 4]; бензокарбазолы [ингибирует CDK 4]; пиримидины [ингибирует CDK 4]; и селициклиб.
15. Химиотерапия с использованием ингибиторов DAC (деацетилазы)
Ингибиторы деацетилазы гистонов (ингибиторы HDAC, HDI) представляют собой класс соединений, которые препятствуют функции деацетилазы гистонов. Ингибиторы деацетилазы гистонов представляют собой новый класс цитостатических агентов, которые ингибируют пролиферацию опухолевых клеток в культуре и in vivo, индуцируя арест клеточного цикла, дифференцировку и/или апоптоз. Для проведения экспрессии гена, клетка должна контролировать наматывание и разматывание ДНК вокруг гистонов. Это проводят при помощи ацетилаз гистонов (HAT), которые ацетилируют остатки лизина в коровых гистонах, что приводит к менее компактному и более транскрипционно активному хроматину, и, напротив, действия деацетилаз гистонов (HDAC), которые удаляют ацетильные группы с лизиновых остатков, приводят к образованию конденсированного и транскрипционно неактивного хроматина. Обратимая модификация конечных хвостов коровых гистонов составляет основной эпигенетический механизм для ремоделирования структуры хроматина высшего порядка и контроля экспрессии гена. Ингибиторы HDAC (HDI) блокируют это действие и могут приводить к гиперацетилированию гистонов, тем самым влияя на экспрессию гена.
Ресминостат (4SC-201) представляет собой пероральный пан-HDACi. Конкретные ингибиторы DAC (деацетилазы) включают панобиностат (LBH589), вориностат, ромидепсин (Истодакс), Вальпроевую кислоту (в виде вальпроата магния), Белиностат (PXD101), Моцетиностат (MGCD0103), абексиностат (PCI-24781), Энтиностат (MS-275), SB939, Ресминостат (4SC-201, пероральный пан-HDACi [тестирован для применения при печеночноклеточной карциноме], Гивиностат (ITF2357), Квизиностат (JNJ-26481585), CUDC-101 (также ингибирует EGFR и HER2), AR-42, CHR-2845, CHR-3996, 4SC-202, CG200745 для солидных опухолей, ACY-1215, селективный для HDAC6 с бортезомибом (Велкейдом) и с леналидомидом (Ревлимидом), ME-344, для невосприимчивых солидных опухолей, сулфорафан, и Кеветрин, селективный для HDAC2.
16. Химиотерапия с использованием ингибиторов ALK
Киназа анапластической лимфомы (ALK), также известная как тирозинкиназный рецептор ALK или CD246 (кластер дифференцировки 246) представляет собой фермент, который у людей кодируется геном ALK. Ген ALK может стать онкогенным тремя путями - за счет формирования слитого гена с любым из нескольких других генов, путем добавления дополнительных копий гена или при помощи мутаций фактического кода ДНК для самого гена. Слитый ген EML4-ALK отвечает приблизительно за 3-5% немелкоклеточных раков легких (NSCLC). Подавляющее большинство случаев представляют собой аденокарциномы. Почечноклеточная карцинома является результатом такой перестановки генов и сверхэкспрессии. Конкретные примеры ингибиторов ALK (анапластической лимфомы) включают LDK378, RG7853, кризотиниб (Ксалкори), и МАТ PF-03446962.
17. Химиотерапия с использованием ингибиторов PIM
Протоонкогенная серин/треонин-протеинкиназа Pim-1 представляет собой фермент, который у людей кодируется геном PIM1. Протоонкогенная серин/треонин-протеинкиназа Pim-1 представляет собой фермент, который у людей кодируется геном PIM1 для серин/треониновой киназы PIM. Онкоген вовлечен во множество злокачественных опухолей человека, и высоко экспрессируется в клеточных культурах, выделенных из опухолей человека. Pim-1, в основном, участвует в прохождении клеточного цикла, апоптозе и активации транскрипции, а также в более общих путях передачи сигнала, и был вовлечен в множество сигнальных путей. Поскольку трансляцию Pim-1 инициируют STAT3 и STAT5, его продукция регулируется цитокинами, которые регулируют сигнальный путь STAT, или факторами STAT. Эти цитокины включают, среди прочих, интерлейкины (IL-2, IL-3,IL-5, IL-6, IL-7, IL12, IL-15), пролактин, TNFα, EGF и IFNγ. Конкретные примеры ингибиторов PIM (протоонкогенной серин/треонин-протеинкиназы) включают LGH447.
18. Химиотерапия с использованием ингибитора ацилтрансферазы Поркупин
Поркупин является членом семейства мембраносвязанных O-ацилтрансфераз (MBOAT), которые добавляют пальмитоильную группу к белкам Wnt для секреции белков Wnt и их способности передавать сигнал. Также было замечено, что раки молочной железы метастазируют из-за участия Wnt в эпителиально-мезенхимальном переходе (EMT). Процесс EMT позволяет эпителиальным клеткам трансформироваться в мезенхимальные клетки, так что они больше не удерживаются на месте у ламинина. Процесс включает в себя негативную регуляцию кадгеринов, и таким образом клетки открепляются от ламинина и мигрируют. Подавление передачи сигнала через Wnt/β-катенин может предотвратить EMT, что может ингибировать метастазирование. Сигнальный путь Wnt также вовлечен в развитие гораздо большего типа злокачественных опухолей, а не только в опухоли молочной железы. Изменения в экспрессии CTNNB1, гена, кодирующего β-катенин, можно измерять не только в раке молочной железы, но также в колоректальном раке, меланоме, раке предстательной железы, раке легких, и некоторых других типах злокачественных опухолей. Конкретные примеры ингибиторов Поркупин включают LGK974, XAV939, IWR-1, и IXP-2. BHQ880 представляет собой полученное из фага нейтрализующее антитело к DKK1 (иммуноглобулин человека G1 (IgG1)) и антагонист пути Wnt.
19. Химиотерапия с использованием ингибиторов сигнального пути Hedgehog
Наиболее распространенное нацеливание на сигнальный путь Hedgehog модулирует SMO (рецептор с семью трансмембранными доменами, называемый Smoothened). Антагонист и агонисты SMO влияют на регуляцию нижележащего пути. Наиболее успешные в клинике агенты, нацеленные на SMO, являются конкурентами циклопамина. Также было показано, что итраконазол (Споранокс) нацелен на SMO через механизм, отличный от циклопамина и висмодегиба. Итраконазол ингибирует SMO в присутствии мутации, придающей устойчивость к висмодегибу и другим циклопамин-конкурентным антагонистам, таким как IPI-926 и LDE-225 от Novartis. Антитела к PTCH и Gli3 (5E1) также регулируют сигнальный путь. Нижерасположенный эффектор и сильный активатор транскрипции миРНК Gli1 был использован для ингибирования клеточного роста и активации апоптоза. Также было показано, что триоксид мышьяка (Трисенокс) ингибирует передачу сигнала через Hedgehog, препятствуя функции Gli и транскрипции.
Метастазирование активируется посредством активации пути Hedgehog, поскольку она приводит к повышению экспрессии белка Snail и уменьшению E-кадгерина и плотных контактов. Передача сигнала посредством Hedgehog является важным регулятором ангиогенеза и, таким образом, метастазирования. Регулирование опухоли зависит от активации пути Hedgehog, которая приводит к повышению ангиогенных факторов (ангиопоэтина-1 и ангиопоэтина-2), повышению циклинов (циклинов D1 и B1), повышению противоапоптотических генов и снижению апоптотических генов (Fas). Конкретные примеры ингибиторов пути Hedgehog включают Эриведж (RG3616), IPI-926, Споронокс (итраконазол), Трисенокс (триоксид мышьяка), LDE-225, антитела PTCH и Gli3 (5E1), и PF-04449913.
20. Химиотерапия с использованием ингибиторов PKC (протеинкиназы C)
Протеинкиназа C, которая активируется активатором развития опухоли - сложным форболовым эфиром, может фосфорилировать мощные активаторы транскрипции, и, таким образом, приводить к повышенной экспрессии онкогенов, способствуя прогрессированию злокачественной опухоли. Протеинкиназа C типа йота представляет собой фермент, который у людей кодируется геном PRKCI. Этот ген кодирует член семейства протеинкиназы C (PKC) из серин/треониновых протеинкиназ. Семейство PKC состоит, по меньшей мере, из восьми членов, которые различно экспрессируются и вовлечены в широкое разнообразие клеточных процессов, таких как динамика микротрубочек в раннем секреторном сигнальном пути. Обнаружено, что эта киназа необходима для опосредованной BCL-ABL устойчивости к апоптозу, индуцированному лекарственными средствами. Конкретные примеры ингибиторов протеинкиназы C включают AEB071, рубоксистаурин, и ингенол мебутат.
21. Химиотерапия с использованием ингибиторов MDM2
Гомолог 2 мышиной минихромосомы (MDM2), также известный как E3 убиквитинпротеинлигаза Mdm2, представляет собой белок, который у людей кодируется геном HDM2. Mdm2 является важным негативным регулятором опухолевого супрессора p53. Белок Mdm2 функционирует и как убиквитинлигаза E3, которая распознает N-концевой домен транс-активации (TAD) опухолевого супрессора p53, и как ингибитор транскрипционной активности p53. Конкретные примеры ингибиторов MDM2 включают RG7112 и RG7388. Ингибиторы взаимодействия MDM2-p53 включают аналог цис-имидазолина, нутлин.
22. Химиотерапия с использованием ингибиторов глипикана-3
Глипикан-3 представляет собой белок, который у людей кодируется геном GPC3. Белок, кодируемый этим геном, является членом глипиканового семейства. Гепаринсульфатпротеогликаны клеточной поверхности состоят из белковой сердцевины, ассоциированной с мембраной и замещенной различным числом гепаринсульфатных цепей. Члены семейства интегральных мембранных протеогликанов, родственных глипикану (GRIPS), содержат коровый белок, закрепленный на цитоплазматической мембране через гликозил-фосфатидилинозитольную связь. Эти белки могут играть роль в контроле клеточного деления и регуляции роста. Иммуноокрашивание глипикана 3 полезно для дифференциации печеночноклеточной карциномы (HCC) и диспластических изменений в циррозной печени; HCC окрашивается с глипиканом 3, в то время как печень с диспластическими изменениями и/или циррозными изменениями не окрашивается. Конкретные примеры ингибиторов глипикана включают RG7687.
23. Химиотерапия с использованием ингибиторов ChK1
Киназа 1 контрольной точки человека (Chk1) является необходимой киназой для сохранения стабильности генома. Chk1 необходима во время нормальной фазы S, чтобы избежать ненормально повышенной инициации репликации ДНК, тем самым защищая ДНК от повреждений. Ингибирование или нехватка Chk1 вызывает быстрое и сильное фосфорилирование мишеней ATR в клетках с фазой S, которое ассоциировано с повышенной инициацией репликации ДНК, массированной индукцией одноцепочечной ДНК, и генерацией разрывов цепей ДНК. Конкретные примеры ингибиторов ChK1 включают RG7602, RG7741, CEP-3891 и UCN-01.
24. Химиотерапия с использованием ингибиторов HGF/MET
Ингибиторы c-Met ингибируют ферментативную активность тирозинкиназы c-Met, и имеют терапевтическое применение для лечения различных типов злокачественных опухолей. Тирозинкиназа Met представляет собой рецептор для фактора роста гепатоцитов (HGF также известный как рассеивающий фактор, SF). HGF в основном экспрессируется на эпителиальных клетках и мезенхимальных клетках (например, гладкомышечных клетках и фибробластах). HGF в норме активен при заживлении ран, регенерации печени, эмбриональном развитии и нормальном развитии млекопитающих и морфогенезе органов. Нарушение регуляции c-Met может быть вызвано сверхэкспрессией, амплификацией гена, мутацией, лиганд-зависимой ауто- или паракринной петлей или несвоевременной активацией рецептора тирозинкиназы (RTK). Все эти факторы влияют на выживаемость клеток, их пролиферацию и подвижность. Они также приводят к злокачественным опухолям и устойчивости к терапиям, которые нацелены на их лечение. Пациенты с нарушенной активностью c-Met, как правило, имеют неблагоприятный прогноз, агрессивное течение заболевания, повышенное метастазирование и укороченную выживаемость. Конкретные примеры ингибиторов HGF/MET включают RG3638 (онартузумаб, METMAB), кабозантиниб, AM7, SU11274, BMS-777607, PF-02341066, AMG-458, GSK 1363089 (XL880, форетиниб), MK-2461. PF-04217903, и JNJ-38877605.
25. Химиотерапия с использованием ингибиторов EGFL7 (белка 7, подобного домену эпидермального фактора роста)
Белок 7, содержащий EGF-подобный домен, представляет собой белок, который у людей кодируется геном EGFL7. Белок 7, подобный домену эпидермального фактора роста (Egfl7), также известный как статин сосудистого эндотелия (VE-статин), кодируется геном, в основном экспрессирующимся в эндотелиальных клетках. Положительную регуляцию egfl7 наблюдают в эндотелиальных клетках во время сосудистого восстановления тканей, таких как растущие опухоли. Экспрессия egfl7 является эндотелиально-специфичной в физиологических условиях, однако он может аномально экспрессироваться опухолевыми клетками в злокачественных опухолях человека. При колоректальном раке высокие уровни egfl7 соответствуют опухолям с более прогрессирующими патологическими стадиями и присутствию метастазов в лимфоузлах. Egfl7 также сверхэкспрессируется опухолевыми клетками при печеночноклеточной карциноме человека, и сверхэкспрессия значительно выше в опухолях с множественными узлами, без капсулы и с венозной инвазией. Таким образом, уровни egfl7 коррелируют с маркерами метастазирования и с неблагоприятным прогнозом. Подавление экспрессии egfl7 ингибирует миграцию клеток печеночноклеточной карциномы при помощи пути EGFR/FAK. In vivo, было описано, что нокдаун экспрессии egfl7 в клетках печеночноклеточной карциномы снижает число внутрипеченочных и легочных метастазов. У мышей, ингибирование egfl7 в клетках печеночноклеточной карциномы уменьшает рост опухоли и плотность микрососудов. Было описано, что сверхэкспрессия Egfl7 в опухолевых клетках, имплантированных мышам, усиливает рост опухоли и метастазирование. Внутри опухоли Egfl7 повышает потность микрососудов, гипоксию, некроз и проницаемость сосудов. Egfl7 помогает опухоли избежать иммунной системы за счет подавления адгезии лейкоцитарных молекул на эндотелиальные клетки кровеносных сосудов опухоли. Таким образом, опухоли, сверхэкспрессирующие Egfl7, гораздо меньше инфильтрированы иммунными клетками. Конкретным примером ингибитора EGFL7 (белка 7, подобного домену эпидермального фактора роста) является моноклональное антитело парсатузумаб (MEGF0444A, RG7414).
26. Химиотерапия с использованием ингибиторов пути Notch
Эндотелиальные клетки используют сигнальный путь Notch для координации клеточного поведения во время прорастания кровеносных сосудов, происходящего при ангиогенезе. Активация Notch первично имеет место в "соединительных" клетках и клетках, которые выстилают открытые стабильные кровеносные сосуды, через прямое взаимодействие с лигандом Notch, дельта-подобным лигандом 4 (Dll4), который экспрессируется в эндотелиальных клетках. Передача сигнала VEGF, который является важным фактором для миграции и пролиферации эндотелиальных клеток, может быть снижена в клетках с активированным сигнальным путем Notch за счет снижения уровней транскрипта рецептора Vegf. Конкретным примером ингибиторов пути Notch является PF-03084014 (гамма-секретазный ингибитор протеолитической активации рецепторов Notch). Перорально биодоступным, низкомолекулярным гамма-секретазным (GS) ингибитором с потенциальной противоопухолевой активностью, является RO4929097, который блокирует активацию рецепторов Notch.
27. Химиотерапия с использованием ингибиторов киназ семейства Src
Протонкогенная тирозин-протеинкиназа Src, также известная как протонкоген c-Src или просто c-Src, представляет собой нерецепторный тирозинкиназный белок, который у людей кодируется геном SRC. Этот белок фосфорилирует специфические остатки тирозина на других белках. Предполагают, что повышенный уровень активности тирозинкиназы c-Src связан с прогрессированием злокачественных опухолей, поскольку он способствует другим сигналам. c-Src может быть активирована многими трансмембранными белками, которые включают: рецепторы адгезии, рецептор тирозинкиназ, рецепторы, сопряженные с G-белком и цитокиновые рецепторы. Большинство исследований рассматривали рецептор тирозинкиназ, и примерами этих рецепторов являются рецептор пути фактора роста тромбоцитов (PDGFR) и рецептор эпидермального фактора роста (EGFR). Когда src активирована, она способствует сигнальным путям для выживаемости, ангиогенеза, пролиферации и инвазии. Активность c-Src была наилучшим образом охарактеризована при раке толстого кишечника. Исследователи, показали, что экспрессия Src от 5 до 8 раз выше в предраковых полипах, чем в нормальной слизистой [15][16][17]. Также было показано, что повышенные уровни c-Src коррелируют с поздними стадиями опухоли, размером опухоли, и метастатическим потенциалом опухолей. Конкретные примеры ингибиторов киназ семейства Src включают босутиниб (SKI-606), бафетиниб, AZD-530, XLl-999, KX01, дазатиниб и XL228.
28. Химиотерапия с использованием ингибиторов ДНК-метилтрансферазы
Злокачественная опухоль обусловлена эпигенетическими изменениями. Эпигенетические изменения относятся к функционально несущественным модификациям генома, которые не включают в себя изменение в нуклеотидной последовательности. Примерами таких модификаций являются изменения в метилировании ДНК (гиперметилирование и гипометилирование). Ферменты ДНК-метилтрансферазы (DNMT) катализируют перенос метильной группы на ДНК. Метилирование ДНК используется для широкого ряда биологических функций. Все известные ДНК-метилтрансферазы используют в качестве донора метильной группы S-аденозилметионин (SAM). Эти ферменты отвечают за метилирование специфических последовательностей ДНК для того чтобы защитить хозяина от расщепления его собственного генома ферментами рестрикции. Избыток метилированного цитозина в генах-супрессорах опухолей является отличительным признаком злокачественных опухолей человека. Изменения в паттерне метилирования ДНК, или усиление (гиперметилирование) или ослабление (гипометилирование), были выявлены во всех типах злокачественных клеток, исследованных к настоящему моменту. Конкретные примеры ингибиторов ДНК-метилтрансфераз включают Дакоген® (EU) (децитабин, 2'-Дезокси-5-азацитидин, 5-Аза-2'-дезоксицитидин, NSC 127716), 5-азацитидин, зебуларин, (-)-эпигаллокатехин-3-галлат, прокаин, псаммаплины, и MG98.
Опубликовано, что устойчивость ксенотрансплантатов опухолей человека к лечению цисплатином, карбоплатином, темозоломидом и эпирубицином снижалась при добавлении нетоксических доз децитабина. Важно то, что, расписание введения лекарственного средства, по-видимому, ассоциировано с терапевтическим ответом. Для эффективности децитабин следует давать за 6-12 суток до цитотоксического препарата; если децитабин вводили одновременно или после цитотоксического препарата, чувствительность была потеряна. Это наблюдение обеспечивает сильную поддержку мнению, что децитабин повышает чувствительность опухолей за счет эпигенетической реактивации проапоптотических генов, которые усиливают воздействие цитотоксических лекарственных средств.
29. Химиотерапия с использованием интеркаляторов ДНК
Молекулы (также известные как лиганды) могут взаимодействовать с ДНК. Лиганды могут взаимодействовать с ДНК за счет ковалентного связывания, электростатического связывания, или интеркаляции. Интеркаляция происходит, когда лиганды подходящего размера и хмической природы устраивают себя между пар оснований ДНК. Интеркаляторы ДНК применяют в химиотерапевтическом лечении для ингибирования репликации ДНК в быстро растущих злокачественных клетках. Эти лиганды в большинстве своем являются полициклическими, ароматическими, и двухмерными. Конкретные примеры интеркаляторов ДНК включают берберин, бромистый этидий, профлавин, дауномицин, доксорубицин (Адриамицин, Доксил), и талидомид.
30. Химиотерапия с использованием суицидных ингибиторов тимидинсинтазы
Ингибиторы тимидилатсинтазы представляют собой химические вещества, которые ингибируют фермент тимидилатсинтазу и имеют потенциал для противоопухолевой химиотерапии. Это ингибирование называют суицидным ингибированием, и оно необратимо. Фермент связывается с аналогом субстрата и образует с ним необратимый комплекс посредством ковалентной связи во время "нормальной" реакции катализа. Конкретные примеры препаратов-суицидных ингибиторов, которые ингибируют тимидинсинтазу, включают 5-фторурацил (5-ФУ, Ефудекс), ралтитрексед, пеметрексед, нолатрексед, ZD9331, и GS7904L. Ралтитрексед и фторурацил применяют для лечения колоректального рака.
31. Химиотерапия с использованием ингибитора митоза (разобщителя функции микротрубочек)
Ингибитор митоза блокирует деление клеток за счет разрыва микротрубочек, которые структурно растягивают клетку в разные стороны, когда она делится. Ингибиторы митоза применяют для лечения злокачественных опухолей, поскольку злокачественные клетки способны к росту и, в конце концов, распространяются по всему телу (метастазируют) за счет непрерывного митотического деления, и они более чувствительны к ингибированию митоза, чем нормальные клетки. Конкретные примеры препаратов-прерывателей митоза включают Таксол (паклитаксел), Таксотер (доцетаксил), Абраксан, Халавен, Джевтану, винбластин, винкристин, и винорелбин.
32. Химиотерапия с использованием агентов, образующих поперечные сшивки в ДНК (кросслинкеров ДНК)
Поперечные сшивки в ДНК образуются, когда различные экзогенные или эндогенные агенты, реагируют с двумя различными положениями в ДНК. Это может происходить в одной цепи (внутрицепочечная поперечная сшивка) или на противоположных цепях ДНК (межцепочечная поперечная сшивка). Поперечные сшивки также происходят между ДНК и белком. Репликация ДНК блокируется поперечными сшивками, что приводит к аресту репликации и гибели клеток, если не исправить поперечное сшивание. Алкилирующие средства, такие как 1,3-бис(2-хлорэтил)-1-нитрозомочевина (BCNU, кармустин)) и азотистый иприт, которые применяют в химиотерапии, могут поперечно сшивать ДНК по гуанину в положении N7 на противоположных цепях, образуя межчепочечную поперечную сшивку. Цисплатин (цис-диаминдихлор-платина(II)) и его производное образуют поперечные сшивки ДНК в виде моно-аддукта, межцепочечной, внутрицепочечной поперечной сшивки или поперечной сшивки ДНК-белок (в основном, на прилегающем N-7 гуанине, образуя 1,2 внутрицепочечную поперечную сшивку). Митомицин C является мощным кросслинкером ДНК путем N-алкилирования сиквенс-специфических гуаниновых оснований. Конкретные примеры кросслинкеров ДНК также включают Параплатин и Элоксатин.
33. Химиотерапия с использованием агентов, повреждающих цепи ДНК
Способы противоопухолевой терапии, такие как химиотерапия и лучевая терапия, работают путем подавления способности клетки восстанавливать повреждения ДНК, что приводит к гибели клеток. Преимущественно затрагиваются клетки, которые наиболее быстро делятся, т.е. злокачественные клетки. Процесс репарации ДНк постоянно активен, поскольку он отвечает на повреждения в структуре ДНК. Когда нормальные процессы репарации терпят неудачу, и когда не происходит апоптоз клеток, могут случаться неисправимые повреждения ДНК, в том числе двухцепочечные разрывы и поперечные сшивки ДНК (внутрицепочечные поперечные сшивки или ICL). Если в клетке сохраняется повреждение ДНК, транскрипция гена может не происходить, и, таким образом, трансляция белка тоже блокируется. Репликация может быть тоже блокирована, и клетка может умереть. Конкретным примером лекарственного средства, которое индуцирует разрывы цепей ДНК, является блеомицин.
34. Химиотерапия с использованием алкиляторов ДНК
Алкилирование ДНК применяют в химиотерапии для повреждения ДНК злокачественных клеток. Алкилированная ДНК или не скручивается или не раскручивается должным образом, или не может процессироваться ферментами, декодирующими информацию. Это приводит к цитотоксичности с эффектами ингибирования роста клетки, инициации программируемой гибели клеток или апоптоза. Однако также запускаются мутации, в том числе карциногенные мутации, что объясняет высокую встречаемость злокачественных опухолей после воздействия. Конкретным примером лекарственного средства, алкилирующего ДНК, является мефален (Алтеран).
35. Химиотерапия с использованием индукторов JNK-зависимого фосфорилирования p53 по Ser15
Многие ферменты и рецепторы "включаются" или "выключаются" путем фосфорилирования и дефосфорилирования. Опухолевый супрессор, белок p53, серьезно регулируется и содержит более чем 18 различных участков фосфорилирования. Через JNK-зависимое фосфорилирование p53 по Ser15, активация p53 может приводить к аресту клеточного цикла или апоптотической гибели клеток. Конкретным примером такого лекарственного средства является плумбагин, который продемонстрировал индукцию ареста клеточного цикла и апоптоза в многочисленных линиях злокачественных клеток.
36. Химиотерапия с использованием ингибиторов ДНК- топоизомеразы
Иринотекан предотвращает раскручивание ДНК путем ингибирования топоизомеразы 1. Иринотекан (кампостар, CPT-111) применяют для лечения рака толстого кишечника, в частности, в комбинации с другими химиотерапевтическими агентами. Такие агенты включают схему лечения FOLFIRI, которая состоит из инфузионного 5-фторурацила, лейковорина, и иринотекана.
37. Химиотерапия с использованием ингибиторов Bcl-2
Bcl-2, который кодируется геном BCL2, является одним из основателей семейства регуляторных белков Bcl-2, которые регулируют гибель клеток (апоптоз). Повреждение гена Bcl-2 является причиной ряда злокачественных опухолей и вызывает устойчивость к лечению злокачественных опухолей. Сверхэкспрессия противоапоптотических генов, и сниженная экспрессия проапоптотических генов может приводить к утрате гибели клеток, что характерно для злокачественной опухоли. Конкретные примеры ингибиторов BCl включают RG7601 (ABT-199, GDC-0199), обатоклакс (GX15-070), ABT-737, RG7601 (ABT-199; ABT199; ABT 199; и GDC-0199).
38. Химиотерапия с использованием генераторов свободных радикалов.
Ряд противоопухолевых химиотерапевтических средств повышают уровни свободных радикалов. Примеры включают сорафениб и Адриамицин.
39. Химиотерапевтические пролекарственные средства
В одном из вариантов осуществления любое химиотерапевтическое средство или пролекарственное средство, которое повышает активность или эффективность химиотерапевтического средства, подходит для способов, предлагаемых в настоящем документе.
В одном из вариантов осуществления способ практического осуществления изобретения включает введение пациенту химиотерапевтического средства в форме пролекарства, выбранного из группы, состоящей из пролекарства, активируемого гипоксией, эвофосфамида, TH-302, AQN4, баноксатрона, пролекарства азотистого иприта, PR-104, апазиквона, EO-9, CB1954, 5-(азиридин-1-ил)-4-гидроксиламино-2-нитробензамида, канофосфамида, TLK286, TER286, JS-K и Boc-KAc-Puro.
В одном из вариантов осуществления способ практического осуществления изобретения включает введение пациенту пептидомиметического ингибитора GSH или GHT-π, например, пептидомиметического ингибитора, выбранного из группы, состоящей из простого диэтилового эфира γ-глутамил-S-(бензил)цистинеил-R-фенилглицина, TLK199, телинтры и NOV-002. Пептидомиметический ингибитор GSH или GHT-π снижает уровни GSH (глутатиона) в злокачественных клетках или активность GHT-π (глутатион-S-трансферазы-π) и это может усиливать токсичность вводимого противоракового препарата за счет предотвращения его метаболизма. Также лечение пациента со злокачественной опухолью при помощи TLK-199, который также является ингибитором белка, ассоциированного с множественной устойчивостью к лекарственным препаратам, который известен как мультилекарственный эффлюксный переносчик, можно использовать для повышения уровней химиотерапевтического средства в злокачественных клетках.
В одном из вариантов осуществления противоопухолевое химиотерапевтическое средство представляет собой пролекарство, которое активируется GSH. В одном из вариантов осуществления способ практического осуществления изобретения включает введение пациенту пролекарства, активируемого GSH, которое выбрано из группы, состоящей из цис-6-(2-ацетилвинилтио)пурина (cis-AVTP), и транс-6-(2-ацетилвинилтио)гуанина (trans-AVTP). Этот способ практического осуществления изобретения может включать лечение пациента со злокачественной опухолью пролекарством, активируемым GSH, которое выбрано из группы, состоящей из γ-глутамил-α-амино-β(2-этил-N,N,Nʹ,Nʹ-тетракис(2-хлорэтил)фосфодиамидат)-сульфонил)-пропионил-(R)-фенилглицина (TLK286) и O2-[2,4-динитро-5-(N-метил-N-4-карбоксифениламино)фенил]1-N,N-диметиламино)диазен-1-иум-1,2-диолата (PABA/NO).
V. Способы лечения
Без связи с каким-либо конкретным механизмом, полагают, что CONP особенно подходят в отношении противоопухолевого лечения, поскольку CONP причиняют минимальный вред здоровым не злокачественным клеткам пациента. Было обнаружено, что во время лучевой терапии, CONP защищают облученные нормальные клетки от радиации и улучшают эффективность комбинированной лучевой терапии/химиотерапии.
В первом аспекте изобретение включает способ лечения злокачественной опухоли у нуждающегося в этом пациента, включающий:
введение эффективной дозы наночастиц оксида церия пациенту;
введение терапевтически эффективной дозы облучения пациенту; и
введение терапевтически эффективной дозы химиотерапевтического средства пациенту, и тем самым, лечение злокачественной опухоли.
В одном из вариантов осуществления CONP вводят перед облучением. Без связи с какой-либо теорией, полагают, что CONP повышает чувствительность злокачественные клетки к лучевой терапии и предотвращает повреждение нормальных клеток.
В одном из вариантов осуществления CONP вводят после лучевой терапии. Без связи с какой-либо теорией, полагают, что CONP лечат острое повреждение и/или хроническое повреждение от лучевой терапии. Этот подход имеет преимущество над существующим клиническим стандартом лечения, при котором токсичное защитное вещество вводят за 30 минут до лучевой терапии, но оно не защищает от хронического повреждения, происходящего в течение 6 месяцев, 12 месяцев после лучевой терапии.
В одном из вариантов осуществления введение наночастиц оксида церия улучшает эффективность лечения комбинацией лучевой терапии/химиотерапии.
В одном из вариантов осуществления введение наночастиц оксида церия снижает терапевтически эффективную дозу лучевой терапии и/или снижает терапевтически эффективную дозу химиотерапевтического средства, по сравнению с терапевтически эффективной дозой в отсутствие наночастиц.
В одном из вариантов осуществления введение наночастиц оксида церия снижает терапевтически эффективную дозу лучевой терапии и снижает терапевтически эффективную дозу химиотерапевтического средства, по сравнению с эффективной дозой в отсутствие наночастиц.
В одном из вариантов осуществления введение наночастиц оксида церия снижает терапевтически эффективную дозу лучевой терапии и снижает терапевтически эффективную дозу химиотерапевтического средства, по сравнению с эффективной дозой в отсутствие наночастиц и/или лучевой терапии.
В одном из вариантов осуществления введение наночастиц оксида церия снижает терапевтически эффективную дозу лучевой терапии и снижает терапевтически эффективную дозу химиотерапевтического средства, по сравнению с эффективной дозой в отсутствие наночастиц и/или химиотерапии.
В одном из вариантов осуществления доза облучения и/или химиотерапии составляет приблизительно от 1% и до 90%, или приблизительно от 1% и до 80%, или приблизительно от 1% и до 70%, или приблизительно от 1% и до 60%, или приблизительно от 1% и до 50%, или приблизительно от 1% и до 40%, или приблизительно от 1% и до 30%, или приблизительно от 1% и до 20%, или приблизительно от 1% и до 10% или от (i) дозы, используемой в существующем стандарте лечения в отсутствие CONP или от (ii) терапевтически эффективной дозы в отсутствие CONP.
В одном из вариантов осуществления доза лучевой терапии или химиотерапии составляет приблизительно от 10% и до 90%, или приблизительно от 20% и до 80%, или приблизительно от 30% и до 70%, или приблизительно от 40% и до 60%, или приблизительно от 10% и до 50%, или приблизительно от 10% и до 30%, или приблизительно от 50% и до 90%, или приблизительно от 70% и до 90%.
В одном из вариантов осуществления лучевую терапию проводят после введения наночастиц оксида церия.
В другом варианте осуществления лучевую терапию проводят перед введением наночастиц оксида церия.
В одном из вариантов осуществления химиотерапевтическое средство вводят до наночастиц оксида церия и/или лучевой терапии.
В другом варианте осуществления химиотерапевтическое средство вводят одновременно с наночастицами оксида церия и/или лучевой терапией.
В другом варианте осуществления химиотерапевтическое средство вводят после наночастиц оксида церия и/или лучевой терапии.
В другом варианте осуществления способ дополнительно включает хирургическое удаление злокачественной опухоли (т.е. опухоли) до проведения лучевой терапии.
В другом варианте осуществления способ дополнительно включает хирургическое удаление злокачественной опухоли (т.е. опухоли) после проведения лучевой терапии.
В другом варианте осуществления способ дополнительно включает хирургическое удаление злокачественной опухоли (т.е. опухоли) до введения химиотерапевтического средства.
В другом варианте осуществления способ дополнительно включает хирургическое удаление злокачественной опухоли (т.е. опухоли) после введения химиотерапевтического средства.
В иллюстративных вариантах осуществления, пациента успешно «лечат» в соответствии со способами по настоящему изобретению, если пациент демонстрирует один или несколько из следующих признаков: (i) уменьшение числа или полное отсутствие злокачественных клеток; (ii) уменьшение размера или объема опухоли; (iii) замедление или прекращение роста опухоли; (iv) ингибирование, например, подавление, предотвращение, торможение, уменьшение размеров, замедление, или обратное развитие метастазов, например, инфильтрации злокачественными клетками периферических органов, включая, например, распространение злокачественной опухоли в мягкие ткани и кости; (v) ингибирование, например, подавление, торможение, предотвращение, уменьшение размеров, обратное развитие, замедление, или отсутствие опухолевых метастазов; (vi) ингибирование, например, подавление, замедление, предотвращение, уменьшение размеров, обратное развитие, замедление или отсутствие роста опухоли; (vii) облегчение одного или нескольких симптомов, ассоциированных с конкретной злокачественной опухолью; (viii) предотвращение или замедление появления и/или рецидива опухоли; (ix) уменьшение осложнений и смертности; и/или (x) улучшение качества жизни.
Благоприятные или желаемые клинические результаты в качестве неограничивающих примеров включают, облегчение симптомов, уменьшение степени заболевания, стабилизацию (т.е. отсутствие ухудшение) состояния заболевания, отсрочку или замедление прогрессирования заболевания, улучшение или временное облегчение состояния болезни, и ремиссию (частичная или полная), выявляемую или невыявляемую.
В другом аспекте предлагается способ лечения злокачественной опухоли у пациента, включающий:
введение эффективной дозы наночастиц оксида церия пациенту;
введение терапевтически эффективной дозы облучения пациенту;
введение терапевтически эффективной дозы первого химиотерапевтического средства пациенту; и
введение терапевтически эффективной дозы второго противоопухолевого химиотерапевтического средства пациенту.
В другом варианте осуществления введение наночастиц оксида церия снижает терапевтически эффективную дозу лучевой терапии и/или снижает терапевтически эффективную дозу химиотерапевтического средства/средств, по сравнению с эффективной дозой в отсутствие наночастиц.
В другом аспекте изобретение относится к способу уменьшения токсичности лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства, вводимого пациенту, который проходит лечение от злокачественных опухолей, способу, включающему:
(i) введение эффективной дозы CONP пациенту,
(ii) введение дозы лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства,
где введение эффективной дозы CONP уменьшает токсичность лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства, вводимого пациенту.
В другом аспекте изобретение относится к способу снижения дозы лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства, вводимых пациенту и необходимых для эффективного лечения злокачественной опухоли, способу, включающему:
(i) введение эффективной дозы CONP пациенту,
(ii) введение дозы лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства,
где введение эффективной дозы CONP снижает дозу лучевой терапии и/или, по меньшей мере, одного химиотерапевтического средства, необходимых для эффективного лечения злокачественной опухоли.
В одном из вариантов осуществления способ позволяет снизить дозу лучевой терапии или химиотерапии по сравнению с существующим стандартом лечения в отсутствие CONP или эффективным количеством для лечения опухоли. В различных вариантах осуществления доза облучения или химиотерапии составляет приблизительно от 1% и до 90%, или приблизительно от 1% и до 80%, или приблизительно от 1% и до 70%, или приблизительно от 1% и до 60%, или приблизительно от 1% и до 50%, или приблизительно от 1% и до 40%, или приблизительно от 1% и до 30%, или приблизительно от 1% и до 20%, или приблизительно от 1% и до 10% или от (i) дозы, используемой в существующем стандарте лечения в отсутствие CONP или от (ii) эффективного количества для лечения опухоли в отсутствие CONP.
В других вариантах осуществления доза лучевой терапии или химиотерапии составляет приблизительно от 10% и до 90%, или приблизительно от 20% и до 80%, или приблизительно от 30% и до 70%, или приблизительно от 40% и до 60%, или приблизительно от 10% и до 50%, или приблизительно от 10% и до 30%, или приблизительно от 50% и до 90%, или приблизительно от 70% и до 90%.
В одном из вариантов осуществления пациенту со злокачественной опухолью для лечения злокачественной опухоли вводят дозу второго противоопухолевого химиотерапевтического средства, более низкую, чем стандарт лечения, из-за противоопухолевой эффективности лечения злокачественной опухоли пациента с использованием вводимых CONP.
В одном из вариантов осуществления химиотерапевтическое средство вводят перед наночастицами и/или лучевой терапией.
В другом варианте осуществления химиотерапевтическое средство вводят одновременно с наночастицами и/или лучевой терапией.
В другом варианте осуществления химиотерапевтическое средство вводят после наночастиц и/или лучевой терапии.
В другом варианте осуществления CONP можно вводить пациенту в дозе приблизительно от 1 нанограмма на килограмм массы тела пациента до приблизительно 50 миллиграммов на килограмм массы тела пациента; или приблизительно от 1 нанограмма на килограмм массы тела пациента до приблизительно 5 миллиграммов на килограмм массы тела пациента; или приблизительно от 1 нанограмма на килограмм массы тела пациента до приблизительно 0,5 миллиграммов на килограмм массы тела пациента; или приблизительно от 10 нанограммов на килограмм массы тела пациента до приблизительно 0,5 миллиграммов на килограмм массы тела пациента; или приблизительно от 20 нанограммов на килограмм массы тела пациента до приблизительно 100 микрограммов на килограмм массы тела пациента; или приблизительно от 10 нанограммов на килограмм массы тела пациента до приблизительно 10 микрограммов на килограмм массы тела пациента.
Путь введения CONP или другого химиотерапевтического средства или другого вещества может быть любым известным путем, включая пероральный, внутривенный, местный, подкожный, внутримышечный, интраперитонеальный, внутриуретральный, в мочевой пузырь, посредством любого катетера или канюли для достижения области клеток или области ткани у пациента. Другие пути введения включают инъекционный, интратекальный, в цереброспинальную жидкость, внутрибронхиальный, интраназальный, в стекловидное тело, в опухоль, в лимфатическую систему, в лимфоузел, в артерию, питающую опухоль, в нервную оболочку, внутрисердечный, легочный, ректальный, внутриматочный, вагинальный, при помощи ингалятора, при помощи трансдермального пластыря, или при помощи помпы с использованием любого из вышеуказанных путей введения.
В иллюстративных вариантах осуществления, CONP предоставляются в виде фармацевтической композиции, содержащей наночастицы оксида церия и фармацевтически приемлемый носитель, наполнитель или разбавители.
В иллюстративных вариантах осуществления, композицию с CONP можно формулировать при необходимости для любого пути введения, включая в качестве неограничивающих примеров пероральный, внутривенный, местный, подкожный, внутримышечный, интраперитонеальный, внутриуретральный, в мочевой пузырь, посредством любого катетера или канюли для достижения области клеток или области ткани у пациента. Наиболее эффективный способ введения и режим дозирования зависят от расположения, объема или типа злокачественной опухоли, подлежащей лечению, здоровья индивидуума и ответа на лечение, и мнения лечащего врача.
В одном из вариантов осуществления композиция с CONP представляет собой композицию для местного введения. Составы, подходящие для местного введения включают жидкие или полужидкие препараты, подходящие для проникновения через кожу к месту, которому требуется лечение, такие как линименты, лосьоны, кремы, мази или пасты, эмульсии и капли, подходящие для введения в глаз, ухо или нос.
В случае композиции для местного введения, CONP можно вводить путем наложения на область кожи пациента. Составы предпочтительно вводят на область, подлежащую лечению, или рядом с ней.
В одном из вариантов осуществления предпочтительным путем введения CONP для защиты здоровой кожи и тканей у пациентов с раком молочной железы, которых лечат лучевой терапией, является местное введение CONP.
В конкретном варианте осуществления композиция для местного введения содержит CONP, поверхностно-активное вещество, масло и воду.
Термин "поверхностно-активное вещество" относится веществу, которое помогает образованию эмульсии, и включает эмульгаторы, детергенты и другие поверхностно-активные средства. Поверхностно-активные вещества, подходящие для использования, включают любой тип поверхностно-активного вещества, который был использован для фармацевтических составов, включая без ограничений, анионные поверхностно-активные вещества, неионные поверхностно-активные вещества, катионные поверхностно-активные вещества, и амфотерные поверхностно-активные вещества. Примеры анионных поверхностно-активных веществ в качестве неограничивающих примеров включают, лаурилсульфат аммония, лаурилсульфат натрия, лауретсульфат аммония, лауретсульфат натрия, сульфонат алкилглицеринового эфира, триэтиламина лаурилсульфат, триэтиламина лауретсульфат, триэтаноламина лаурилсульфат, триэтаноламина лауретсульфат, моноэтаноламина лаурилсульфат, моноэтаноламина лауретсульфат, диэтаноламина лаурилсульфат, диэтаноламина лауретсульфат, сульфат лауринового моноглицерида натрия, лаурилсульфат калия, лауретсульфат калия, лаурилсаркозинат натрия, лауроилсаркозинат натрия, лаурилсаркозин, кокоилсаркозин, кокоил сульфат аммония, лауроилсульфат аммония, кокоилсульфат натрия, лауроилсульфат натрия, кокоилсульфат калия, лаурилсульфат калия, триэтаноламина лаурилсульфат, триэтаноламина лаурилсульфат, моноэтаноламина кокоилсульфат, моноэтаноламина лаурилсульфат, тридецилбензолсульфонат натрия, додецилбензолсульфонат натрия, натриевые и аммонийные соли сульфата алкилтриэтиленгликолевого эфира кокосового масла; сульфат алкилтриэтиленгликолевого эфира говяжьего сала, алкилгексаоксиэтилена сульфат говяжьего сала, динатриевый N-октадецилсульфосукцинат, динатриевый лаурилсульфосукцинат, лаурилсульфосукцинат диаммония, тетранатриевый N-(1,2-дикарбоксиэтил)-N-октадецилсульфосукцинат, натриевый диамиловый сложный эфир сульфоянтарной кислоты, натриевый дигексиловый сложный эфир сульфоянтарной кислоты, натриевые диоктиловые сложные эфиры сульфоянтарной кислоты, докузат натрия, и их сочетания.
Примеры неионных поверхностно-активных веществ в качестве неограничивающих примеров включают, полиоксиэтиленовый сложные эфиры жирных кислот, сорбитановые сложные эфиры, цетилоктаноат, кокамид DEA, кокамид MEA, кокамидопропил диметиламиноксид, диэтаноловый амид жирных кислот кокосового масла, моноэтаноловый амид жирных кислот кокосового масла, диглицерилдиизостеарат, диглицерилмоноизостеарат, диглицерилмонолаурат, диглицерилмоноолеат, этиленгликоль дистеарат, этиленгликоль моностеарат, этоксилированное касторовое масло, глицерилмоноизостеарат, глицерилмонолаурат, глицерилмономиристат, глицерилмоноолеат, глицерилмоностеарат, глицерил трикаприлат/капрат, глицерилтриизостеарат, глицерилтриолеат, гликоль дистеарат, гликоль моностеарат, изооктил стеарат, лаурамид DEA, диэтаноловый амид лауриновой кислоты, моноэтаноловый амид лауриновой кислоты, диэтаноловый амид лауриновой/миристиновой кислоты, лаурилдиметиламиноксид, лаурил/миристиламид DEA, лаурил/миристилдиметиламиноксид, метилглюцет, метил глюкоза сесквистеарат, олеамид DEA, ПЭГ-дистеарат, бутиловый эфир полиоксиэтилена, цетиловый эфир полиоксиэтилена, полиоксиэтилен лауриламин, лауриловый сложный эфир полиоксиэтилена, лауриловый эфир полиоксиэтилена, нонилфениловый эфир полиоксиэтилена, октиловый эфир полиоксиэтилена, октилфениловый эфир полиоксиэтилена, полиоксиэтилен олеиламин, олеилцетиловый эфир полиоксиэтилена, олеиловый сложный эфир полиоксиэтилена, олеиловый эфир полиоксиэтилена, полиоксиэтилен стеариламин, стеариловый сложный эфир полиоксиэтилена, стеариловый эфир полиоксиэтилена, полиоксиэтилен амин говяжьего сала, тридециловый эфир полиоксиэтилена, пропиленгликоль моностеарат, сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат, сорбитанмоностеарат, сорбитансесквиолеат, триолеат сорбитана, стеарамид DEA, диэтаноловый амид стеариновой кислоты, моноэтаноловый амид стеариновой кислоты, лаурет-4, и их сочетания.
Примеры амфотерных поверхностно-активных веществ в качестве неограничивающих примеров включают, натрий N-додецил-аланин, N-лаурил-иминодипропионат натрия, миристоамфоацетат, лаурилбетаин, лаурилсульфобетаин, 3-додецил-аминопропионат натрия, 3-додециламинопропансултанат натрия, лауроамфоацетат натрия, кокодиметилкарбоксиметил бетаин, кокоамидопропилбетаин, кокобетаин, лауриламидопропилбетаин, олеилбетаин, лаурилдиметилкарбоксиметил бетаин, лаурилдиметил альфакарбоксиэтил бетаин, цетилдиметилкарбоксиметил бетаин, лаурил бис-(2-гидроксиэтил)карбоксиметил бетаин, стеарил бис-(2-гидроксипропил)карбоксиметил бетаин, олеилдиметил гамма-карбоксипропил бетаин, лаурил бис-(2-гидроксипропил)альфа-карбоксиэтил бетаин, олеамидопропил бетаин, кокадиметилсульфопропил бетаин, стеарилдиметилсульфопропил бетаин, лаурилдиметилсульфоэтил бетаин, лаурил бис-(2-гидроксиэтил)сульфопропил бетаин, и их сочетания.
Примеры катионных поверхностно-активные веществ в качестве неограничивающих примеров включают, бехенилтриметилхлорид аммония, бис(ацилоксиэтил)гидроксиэтилметиламмония метосульфат, цетримония бромид, цетримония хлорид, цетилтриметилхлорид аммония, кокамидопропиламиноксид, дистеарилдиметилхлорид аммония, диталодимония хлорид, гуаровый гидроксипропилтримоний хлорид, лауралкония хлорид, лаурилдиметиламиноксид, лаурил диметилбензилхлорид аммония, лаурилполиоксиэтилен диметиламиноксид, лаурилтриметилхлорид аммония, лаутримония хлорид, метил-1-олеиламид этил-2-олеил имидазолиния метилсульфат, пиколинбензилхлорид аммония, поликватерний, стеарилалкония хлорид, стеарилдиметилбензилхлорид аммония, стеарилтриметилхлорид аммония, триметилглицин, и их сочетания.
Подходящие масла являются физиологически приемлемыми и в качестве неограничивающих примеров включают: простые липиды, производные липидов, сложные липиды, которые получены из натурального растительного масла и жира, животное масло и жир, и минеральное масло, или их смесь.
Можно включать другие подходящие эксципиенты, в том числе, например, антиоксиданты, поглотители УФ, ловушки для радикалов, хелатирующие средства, витамины и их производные, абразивные вещества, вяжущие вещества, отдушку, структурирующие вещества, эмульгаторы, солюбилизаторы, буферные средства, загустители, регуляторы pH, пигменты или красители, и консерванты. Можно использовать консерванты можно использовать для профилактики роста грибов и других микроорганизмов. Подходящие консерванты в качестве неограничивающих примеров включают бензойную кислоту, бутилпарабен, этилпарабен, метилпарабен, пропилпарабен, бензоат натрия, пропионат натрия, хлорид бензалкония, хлорид бензетония, бензиловый спирт, хлорид цетилпиридина, хлорбутанол, фенол, фенилэтиловый спирт, тимеросал и их сочетания. В иллюстративных вариантах осуществления, композицию для местного применения упаковывают в дозы для однократного применения.
В одном из вариантов осуществления предпочтительным путем введения CONP является внутривенное введение.
В одном из вариантов осуществления предпочтительным путем введения CONP для защиты нормальных тканей у пациентов с раком поджелудочной железы, которых лечат лучевой терапией, является внутривенное введение CONP.
В конкретном варианте осуществления CONP формулируют в виде микроэмульсии. В иллюстративных вариантах осуществления, микроэмульсия представляет собой микроэмульсию типа масло-в-воде. В иллюстративных вариантах осуществления, представляет собой микроэмульсию типа вода-в-масле.
Хотя количество CONP, содержащихся в композиции, конкретно не ограничено, например, содержание CONP в композиции составляет приблизительно от 0,0001 до приблизительно 10% по массе состава целиком, или приблизительно от 0,001 до 1% по массе, или приблизительно от 0,01 до 0,5% по массе.
Во время лечения злокачественных опухолей или после введения, общая концентрация наночастиц оксида церия в плазме крови пациента может составлять приблизительно от 5 наномоль до приблизительно 200 микромоль, или приблизительно от 10 наномоль до приблизительно 100 микромоль, или приблизительно от 20 наномоль до приблизительно 10 микромоль.
В одном из вариантов осуществления пациенту, которого лечат по настоящему изобретению, поставлен диагноз рака поджелудочной железы, рака легких, рака молочной железы, рака толстого кишечника, рака печени, рака кожи, рака головного мозга, рака кости, рака почки, рака яичников, рака матки, рака предстательной железы, или злокачественной опухоли головы и злокачественной опухоли шеи.
В иллюстративных вариантах осуществления, злокачественная опухоль, которую лечат способом по настоящему изобретению, представляет собой солидную опухоль. Неограничивающие примеры подходящих солидных опухолей включают опухоли нервной системы, ретинобластому, нейробластому, опухоли у детей, раки почки, почечноклеточную аденокарциному, пищеводно-желудочный рак, печеночноклеточную карциному, панкреобилиарную неоплазию, аденокарциномы, опухоли клеток островка, колоректальный рак, рак шейки матки, рак анального канала, рак матки, злокачественную опухоль репродуктивного тракта, злокачественную опухоль мочевыводящих путей, злокачественную опухоль мочеточника, рак мочевого пузыря, герминогенную опухоль, герминогенную опухоль яичка, герминогенную опухоль яичника, рак яичников, эпителиальный рак яичника, карциному неизвестного происхождения, опухоли, ассоциированные с иммунодефицитом человека, саркому Капоши, лимфому, лейкоз, злокачественную меланому, саркому, эндокринную опухоль, опухоль щитовидной железы, мезотелиому, или другую плевральную опухоль, перитонеальную опухоль, нейроэндокринную опухоль или карциноидную опухоль.
Общую концентрацию наночастиц оксида церия (CONP) в плазме крови пациента определяют как концентрацию CONP, связанных с белком плазмы, плюс концентрация свободных CONP в плазме крови.
1. Схемы лечения
Лучевую терапию вводят при помощи общепринятых способов и устройств в подходящих дозах, фракционированных соответствующим образом, для того чтобы обеспечить подходящую дозу облучения на области, нуждающейся в лечении.
Пациенты, как правило, получают дистанционную лучевую терапию во время ежедневных сессий лечения в течение курса из нескольких недель. Число сессий лечения зависит от многих факторов, включая общую дозу облучения, которая будет дана.
Для дистанционного облучения областей лимфоузлов и областей, таких как молочная железа, пациенты могут получать лечение раз в сутки, пять суток в неделю, от трех до семи недель. Внутреннее облучение, например, при лечении рака молочной железы, как правило, дают дважды в сутки в течение одной недели. Дистанционное частичное облучение молочной, при использовании, проводят дважды в сутки в течение одной недели. Для лечения областей, куда распространилась злокачественная опухоль, обычным является ежедневное лечение в течение от двух до трех недель.
Химиотерапевтические средства можно вводить любым общепринятым способом введения, например, теми путями, которые описаны в настоящем документе. Опытный практикующий врач знает способы определения дозы и схему введения химиотерапии.
В зависимости от принимаемого лекарственного средства/средств, существуют различные пути для определения доз химиотерапии. Общая доза может быть основана на массе тела пациента в килограммах, в то время как некоторые дозы химиотерапии определяют на основании площади поверхности тела (BSA), которую врачи рассчитывают с использованием роста и массы.
Химиотерапию обычно дают через одинаковые промежутки времени или циклами. Цикл может включать дозу одного или нескольких лекарственных средств, за которой следует несколько суток или недель без лечения, чтобы дать нормальным клеткам время для восстановления от побочных эффектов лекарственного средства. Дозы можно давать определенное количество суток подряд, или через сутки в течение нескольких суток, с последующим периодом отдыха. Некоторые лекарственные средства работают лучше, когда их дают непрерывно в течение заданного количества суток.
Химиотерапией лечат раз в неделю, раз в каждые 10 суток или раз в две или три недели.
В различных вариантах осуществления курс химиотерапии состоит из X числа циклов химиотерапии, где каждый цикл дают приблизительно каждое Y число суток.
При этом X выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, или более чем 10 циклов, и Y выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 14, или 21 суток.
В качестве неограничивающего примера, предлагаемая схема для химиотерапии и лучевой терапии осуществляется следующим образом:
Пример схемы:
Химиотерапевтическое средство #1 - дают в/в в понедельник недели 1, недели 5
Химиотерапевтическое средство #2 - дают перорально во вторник-пятницу недели 1, недели 3
Лучевая терапия - дают в понедельник-пятницу недели 1, недели 2, недели 3, недели 4, недели 5, недели 6.
ПРИМЕРЫ
ПРИМЕР 1: ПРИМЕНЕНИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В КОМБИНАЦИИ С ЛУЧЕВОЙ ТЕРАПИЕЙ ДЛЯ ЛЕЧЕНИЯ КЛЕТОК РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
В некоторых вариантах осуществления настоящего изобретения, CONP представляют собой неагломерированные кристаллы размером от 3 до 5 нанометров, которые можно получать при помощи способа микроэмульгирования, известного в данной области.
ФИГ. 1 и 2 иллюстрируют результаты присутствия наночастиц оксида церия на клетках рака поджелудочной железы человека L3.6pl, которые обрабатывали облучением. Белые столбцы представляют необлученные клетки, в то время как серые столбцы представляют клетки, облученные 12 Гр. Анализ на основе MTT (колориметрический анализ жизнеспособности клеток) проводили через 24 часа (фиг.1) и 48 часов (фиг. 2) после облучения для определения противолучевой защиты и/или цитотоксичности CONP. CONP в концентрации от 25 до 200 мкМ повышают смерть клеток рака поджелудочной железы, индуцированную облучением, в клеточной культуре. Цитотоксичность 200 мкМ CONP была более значимой через 48 часов (фиг. 2) после облучения, чем через 24 часа (фиг. 1).
Исследование гибели клеток, индуцированной облучением, проводили на нормальных клетках поджелудочной железы (клеточная линия hTERT HPNE) (фиг. 3) и на клеточной линии рака поджелудочной железы L3.6PL (фиг. 4), высеивая клетки в 96-луночные планшеты с белыми стенками (20,000/лунку) на ночь. Через 24 часа некоторые клетки обрабатывали физиологическим раствором, а некоторые - раствором наночастиц, содержащим 10 нМ CONP, и оставляли инкубироваться при 5% CO2, 37°C, в течение 24 часов. После инкубаций некоторые из планшетов облучали однократной дозой 20 Гр, и возвращали планшеты в инкубатор. Через 48 часов, оценивали клеточную пролиферацию при помощи анализа люминесценции АТФ. Повышенную гибель клеток наблюдают в контроле с 20 Гр для здоровых клеток клетки, с противолучевой защитой, выявленной в присутствии CONPs.
ФИГ. 5 и 6 иллюстрируют воздействия противолучевой защиты и/или цитотоксичности CONPs на клетках рака поджелудочной железы человека Panc-1. Проведенные анализы представляли собой анализы с MTT через 24 часа (фиг. 5) и 48 часов (фиг. 6). Выявлено, что CONP во всех концентрациях были цитотоксичными для клеток Panc-1, как в присутствии, так и в отсутствие облучения. Не было значимого повышения гибели, индуцированной облучением, через 24 часа, но был усиление гибели, индуцированной облучением, через 48 часов. Таким образом, CONP не защищает клетки рака поджелудочной железы человека от гибели, индуцированной облучением.
ФИГ. 7 представляет собой диаграмму, иллюстрирующую результаты 48-часового исследования по подсчету клеток на клетках рака поджелудочной железы человека L3.6pl, для того чтобы определить цитотоксичность CeO2. Выявлено, что не было значимых отличий в индукции цитотоксичности между 15 нМ и 150 нМ. Аналогичные результаты получили с линией злокачественных клеток молочной железы человека MCF-7.
Другой эксперимент иссследовал воздействия CONPs на облученных «голых» мышей с инъецированными им клетками рака поджелудочной железы человека. Мышей инъецировали дважды в неделю внутривенно 100 мкл 15 нМ (0,00001 мг/кг) CeO2, и облучали раз в неделю фракционированной дозой 5 Гр в течение шести недель. ФИГ. 8 представляет собой диаграмму результатов этого эксперимента, показывающую, что облучение по отдельности не уменьшает массу опухоли поджелудочной железы после шести недель лучевой терапии (всего 35 Гр). В присутствии облучения, мыши, получавшие CONP, имели 37% снижение массы опухоли, по сравнению с облученными мышами.
В аналогичном эксперименте (фиг. 9) были исследованы воздействия CONP на объем опухоли на облученных «голых» мышей с инъецированными им клетками рака поджелудочной железы человека. Опять, мышей инъецировали дважды в неделю внутривенно 100 мкл 15 нМ (0,00001 мг/кг) CONP, и облучали раз в неделю фракционированной дозой 5 Гр в течение шести недель. Выявлено, что радиация по отдельности уменьшила объем опухоли поджелудочной железы после шести недель лучевой терапии (всего 35 Гр), и что CONP в качестве единственного агента уменьшили объем опухоли поджелудочной железы. В присутствии радиация, мыши, получавшие CONP, имели 50% уменьшение объема опухоли, по сравнению с облученными мышами.
Таблица 2 содержит данные по результатам лечения ионизирующим излучением и наночастицами оксида церия (CONP) ортотопически имплантированных клеток рака поджелудочной железы L3.6pl.
1Клетки рака поджелудочной железы человека L3.6pl (1×106) инъецировали в поджелудочную железу «голых» мышей. Через десять суток группы мышей обрабатывали раствором носителя, ионизирующим излучением 5 Гр раз в неделю (30 Гр), дважды в неделю интраперитонеально (и./п.) 15 нМ CONP, и комбинацией ионизирующего излучения 5 Гр раз в неделю (30 Гр), дважды в неделю интраперитонеально (и./п.) 15 нМ наночастиц оксида церия. Всех мышей забивали на сорок пятые сутки.
2Число «положительных» мышей/число инъецированных мышей.
3P<0,005 по сравнению с контролем.
4P<0,01 по сравнению с контролем.
ФИГ. 10A и 10B представляют собой изображения гистологических предметных стекол с тканью опухоли поджелудочной железы с облучением отдельно (фиг.10A) и облучение плюс CONP (фиг. 10B). Здесь показано, что CONP повышают чувствительность опухолевых клеток к лучевой терапии и одновременно защищают здоровую ткань. ФИГ. 10A показывает облученную опухоль поджелудочной железы, окруженную нефункциональной тканью поджелудочной железы. ФИГ. 10B показывает облученную опухоль, окруженную функциональной нормальной тканью поджелудочной железы. ФИГ. 11 представляет собой график воздействия инъекций оксида церия на коэффициент выживаемости «голых» мышей без опухоли. Как и выше, мышей инъецировали дважды в неделю внутривенно 100 мкл 15 нМ (0,00001 мг/кг) CONP и облучали раз в неделю фракционированной дозой 5 Гр в течение 7 недель. Здесь показано, что CONP хорошо переносятся мышами, и что никаких вредных воздействий не наблюдали в группе, получавшей CONP. Было выявлено, что мыши, которые получали только облучение (кривая b) погибли от облучения, но все мыши, получавшие CONP (кривые c и d), пережили лучевую терапию. Также проводили эксперименты с гипоксией, поскольку известно, что CONP действуе как кислородный буфер в условиях нехватки кислорода. Опухоли гипоксичны по своей природе; и таким образом гипоксическое микроокружение опухоли делает ее устойчивой к лучевой терапии, поскольку кислород необходим для выработки супероксидных радикалов. Для этого исследования, клетки рака поджелудочной железы человека L3.6pl подвергали воздействию гипоксического окружения в течение 5 часов, и экстрагировали мРНК через 2 и 24 часа после индукции гипоксии. Результаты ОТ-ПЦР для HIF1a (фиг. 12) и HIF2a (фиг. 13) демонстрируют, что клетки, обработанные CeO2 (CONP) сохраняли исходные уровни мРНК через 24 часа после воздействия гипоксии. Ниже на ФИГ. 13 показаны результаты анализа Вестерн-блоттинга для доказательства того, что одинаковое количество белка наносили на гель, и что, таким образом, измеренные изменения в HIF отражают влияния наночастиц оксида церия (CONP), а не загрузки на гель. Предположили, что CONP могут оксигенировать микроокружение опухоли, усиливая чувствительность опухоли к облучению. HIF1a и HIF2a сверхэкспрессируются в клетках в условиях гипоксии, и являются факторами транскрипции, важными для развития сосудов. Также известно, что гипоксия вносит значительный вклад в патофизиологию основных категорий заболеваний человека, включая инфаркт миокарда и ишемию головного мозга, злокачественную опухоль, легочную гипертензию, врожденный порок сердца и хроническое обструктивное заболевание легких.
ФИГ. 14 и 15 представляют собой диаграммы воздействий оксида церия на выработку VEGF клетками рака поджелудочной железы человека L3.6pl через 24 часа (фиг. 14) и 48 часов (фиг. 15) после облучения. В этом исследовании, определяли концентрацию VEGF в супернатанте клеточной культуры и выявили, что CONP незначительно повысил концентрацию VEGF как в необлученных (контрольных), так и в облученных клетках. Также было выявлено, что облучение 12 Гр повысило выработку VEGF в контроле с носителем, и что CONP подавили выработку VEGF после радиационного повреждения.
ПРИМЕР 2: ПРИМЕНЕНИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В КОМБИНАЦИИ С ЛУЧЕВОЙ ТЕРАПИЕЙ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ КЛЕТОК ЛЕГКОГО
Воздействия CONP на злокачественные клетки человеческого легкого A549 проиллюстрированы на ФИГ. 16. Проводили анализ количества клеток через 48 часов для определения цитотоксичности, и получили результаты, что, в высокой концентрации, CONP цитотоксичны для этой клеточной линии в зависимости от дозы. ФИГ. 17 также иллюстрирует результаты 48-часового исследования количества клеток на облученных злокачественных клетках человеческого легкого A549. Здесь показано, что, для этих клеток, воздействие CONP было наиболее значительным при 15 мкМ, и что CONP повышают гибель, индуцированную облучением, в зависимости от дозы. Кроме того, ФИГ. 18 дополнительно иллюстрирует результаты воздействий CONP на облученные злокачественные клетки человеческого легкого A549. Исследование в течение 48 часов включало тестирование супернатанта клеточной культуры на наличие лактатдегидрогеназы (ЛДГ), по которой отслеживают гибель клеток. Снова, как на ФИГ. 18, было выявлено, что 15 мкМ CONP является наиболее значимой концентрацией в присутствии облучения.
Модель ортотопического рака проиллюстрирована на ФИГ. 19 и 20, где на график нанесено количество опухолевых узлов у мышей Nu/Nu (фиг. 19) и масса целого легкого (фиг. 20) для условий в присутствии и в отсутствие облучения, и в присутствии и в отсутствие CONP. Можно видеть, что количество опухолевых узлов значительно снижено в присутствии наночастиц оксида церия(CONP).
Другим вредным воздействием лучевой терапии для рака легких является пневмонит, воспаление легочной ткани. Проводили эксперименты in vitro (с использование нормальных фибробластных клеток легкого CCL135) и in vivo (с использованием ткани легкого безтимусных «голых» мышей) для исследования эффективности CONP для противолучевой защиты ткани легкого.
Для исследований in vitro, клетки трипсинизировали путем краткой обработки 0,25% трипсином и 0,02% EDTA, и 20,000 клеток переносили в 96-луночные планшеты в минимальную питательную среду Игла в модификации Дульбекко (OMEM), дополненную 10% эмбриональной телячьей сывороткой. В первом наборе исследований, клетки подвергали облучению в 0, 5, 10, 15, 20, 25, 30 Гр в течение 48 часов. Облучение проводили на 160 кВ облучателе (аппарате для облучения) для клеточных культур и небольших животных от Kimtron Inc. (Woodbury, CT). Жизнеспособность клеток определяли по измерению наличия АТФ, что является сигналом присутствия метаболически активных клеток (фиг. 21A). АТФ измеряют с использованием люминесцентного анализа выживаемости клеток CellTiter-Glo (Promega, Madison, WI). Существует прямая взаимосвязь между люминесценцией, измеренной в анализе CellTiter-Glo, и количеством клеток в культуре; таким образом, количество АТФ прямо пропорционально числу присутствующих клеток. Детекцию люминесценции (относительные световые единицы, RLU) проводят на люминометре.
В следующем наборе экспериментов клетки обрабатывали предопределенной оптимальной концентрацией в 10 нМ CONP и подвергали однократной дозе облучения (20 Гр). Через сорок восемь часов, определяли жизнеспособность клеток (фиг. 21 B), измеряя количество присутствующего АТФ с использованием люминесцентного анализа выживаемости клеток CellTiter-Glo (Promega, Madison, WI). Кроме того, измеряли величину активности каспазы 3/7 (фиг. 21C) при помощи анализа Caspase-Glo 3/7 (Promega, Madison, WI), и величина люминесценция пропорциональна активности каспазы 3/7.
Для исследований in vivo, бестимусных «голых» мышей помещали в свободный от патогенной микрофлоры (SPF) виварий Научно-исследовательского онкологического института, который превосходит национальные требования по уходу за животными, с двумя комнатами для обычных мышей, двумя комнатами для «голых» мышей и одной комнатой для карантина. Облучение проводили при помощи рентгеновской системы для облучения клеточных культур и небольших животных IC160 (Kimtron Inc., Woodbury, Connecticut, USA), расположенной внутри вивария. Через девять недель после облучения мышей умерщвляли, выделяли легкие и окрашивали гематоксилином и эозином (Г-Э). Для иммуногистохимии и окрашивания гематоксилином-эозином, одну часть опухолевой ткани фиксировали в формалине и погружали в парафин, а другую часть погружали в реагент OCT (Miles, Inc., Elkhart, IN), быстро замораживали в жидком азоте и хранили при -200°C для приготовления срезов. Имммунофлуоресцентную микроскопию проводят с использованием 20× объектива на эпифлуоресцентном микроскопе, оборудованном фильтрами возбуждения с узкой полосой пропускания, которые установлены в диск со светофильтрами (Ludl Electronic Products, Hawthorne, NY).
Для получения результатов, приведенных на ФИГ. 21A-21C, нормальные фибробластные клетки легкого (CCL135) подвергали повышающимся дозам облучения (5, 10, 15, 20, 25, 30 Гр). Жизнеспособность клеток измеряли количественной оценкой наличия АТФ, который сигнализирует о наличии метаболически активных клеток. Как и ожидалось, результаты показывают снижение жизнеспособности нормальных клеток, зависимое от дозы (фиг. 21A).
В следующем наборе экспериментов, измеряли защитное воздействие CONP на нормальные клетки против повреждения клеток, индуцированного облучением. Нормальные фибробластные клетки легкого CCL135 обрабатывали предопределенной оптимальной концентрацией в 10 нМ CONP и подвергали однократной дозе облучения (20 Гр). Результаты показывают, что когда облучение вводили в качестве единственной терапии, количество жизнеспособных клеток в культуре значительно снижалось, по измерениям люминесцентного анализа выживаемости клеток Titer-Glo (который указывает на присутствие метаболически активных клеток). Однако когда вводили CONP за 24 часа до облучения, CONP значительно защищали здоровые фибробластные клетки легкого от гибели клеток, индуцированной облучением (фиг. 21B).
В последующих экспериментах, нормальные фибробластные клетки легкого CCL135 обрабатывали концентрацией в 10 нМ CONP и подвергали однократной дозе облучения (20 Гр).
Через сорок восемь часов, измеряли активность каспазы 3/7 (которая сигнализирует о наличии апоптоза) (фиг. 21C). Когда облучение вводили в качестве единственной терапии (20 Гр), уровни активности каспазы 3/7 значительно повышались по сравнению с контрольными клетками (без облучения). Однако в присутствии CONP нормальные клетки, подвергшиеся облучению, были существенно защищены, а активность каспазы 3/7 была значительно снижена по сравнению с контрольными клетками, и с клетками, обработанными только CONP, или только облучением (фиг. 21C).
Лучевой пневмонит и последующий легочный фиброз могут значительно снижать качество жизни у облученных людей. Таким образом, в другом наборе экспериментов, была создана мышиная модель пневмонита, вызванного облучением. Однократную дозу облучения (контроль, ФИГ. 22A; 12 Гр, ФИГ. 238; 15 Гр, ФИГ. 22C; и 18 Гр, ФИГ. 220) вводили на грудную вентральную область бестимусным «голым» мышам без опухоли. Через девять недель после облучения мышей умерщвляли, выделяли легкие и окрашивали гематоксилином и эозином (Г-Э). Результаты указывают на то, что была разработана успешная мышиная модель пневмонита, вызванного облучением, и гистологические анализы показали хронический пневмонит в легких тех мышей, которые получили 15 и 18 Гр облучения (ФИГ. 22C и 22D).
В попытках ввести наночастицы живым животным и для оценки противолучевого защитного действия CONP, измеряли выживаемость бестимусных «голых» мышей без опухоли. Бестимусные «голые» мыши без опухоли получали фракционированную дозу облучения 30 Гр (ежедневное введение 5 Гр) в присутствии или отсутствие внутривенных (в/в) инъекций CeO2 или интраперитонеальных (и/п) инъекций Амифостина дважды в неделю за 30 минут до облучения. Амифостин является ловушкой для свободных радикалов. «Голые» мыши (25 г) были случайным образом распределены по следующим группам: (1) еженедельные в/в инъекции физиологического раствора (n=10, контрольная группа); (2) трижды в неделю введение облучения 5 Гр (n=10); (3) дважды в неделю в/в инъекции 15 нМ (0,00001 мг/кг) CONP (n=5); (4) трижды в неделю и/п инъекции 150 мг/кг Амифостина (n= 5); (5) введение облучения в комбинации с в/в инъекциями CONP дважды в неделю (n=10); и (6) введение облучения в комбинации с и/п инъекциями Амифостина за 30 минут до облучения (n=10). Лечение продолжали в течение двух недель до общей дозы облучения 30 Гр. Мышей умерщвляли и вскрывали только тогда, когда они начинали умирать или эксперимент был завершен. Массу и смертность каждой мыши измеряли на всем протяжении эксперимента и определяли медиану и процент выживаемости, как показано на ФИГ. 22E.
Результаты демонстрируют, что CONP хорошо переносятся бестимусными «голыми» мышами и защищают мышей от гибели, индуцированной облучением. Все контрольные мыши жили до даты окончания, 207 суток. Интересно, что 80% мышей, получавших только CONP, были живыми к моменту даты окончания, 207 суток. После лечения только облучением, только Амифостином, и комбинацией облучения и CONP, или облучения и Амифостина, медиана времени выживания составила 132, 119, 210 и 81 день, соответственно (контроль по сравнению с облучением, P<0,019; контроль по сравнению с CeO2, P<0,66; контроль по сравнению с Амифостином, P<0,0370; облучение по сравнению с облучением и CONP, P<0,0041; облучение по сравнению с облучением и Амифостином, P<0,0432).
Амифостин был высокотоксичным для мышей, как это видно по значимому отличию в медиане времени выживания (по сравнению с контрольными мышами). По существу, эти результаты позволяют предположить, что наночастицы CONP хорошо переносятся мышами и имеют значительное преимущество над Амифостином.
Для определения степени лучевого пневмонита, легкие собирали и обрабатывали для гистологии и окрашивания Г-Э (ФИГ. 23A-23D), и измеряли величину фиброза и отложения коллагена, указывающие на хроническое заболевание легких, с использованием трихромного окрашивания по Массону (ФИГ. 23E-23H). Группы включают контроль (ФИГ. 23A, 23E), только облучение (ФИГ. 23B, 23F), облучение плюс CONP (ФИГ. 23C, 23G), и облучение плюс Амифостин (ФИГ. 230, 23H).
Легкие от мышей в контрольной группе (только облучение, ФИГ. 23B) демонстрировали видимый пневмонит, с обширной инвазией макрофагами, в то время как легкие от облученных мышей, получавших CONP, не показали видимого пневмонита и выглядели здоровыми (фиг. 23C).
В экспериментах с использованием трихромного окрашивания по Массону, иммуногистохимический анализ показал, что фиброз и отложения колагена были распространены в облученных легких мышей, получавших только облучение (фиг. 23F), и мышей, получавших предварительное лечение Амифостином (фиг. 23H). Кроме того, иммуногистохимический анализ указывает на то, что отложения коллагена были относительно недавними, из-за слабой синевы по сравнению темно-синим окрашиванием старого, с большим количесвом поперечных сшивок коллагена, наблюдаемого при хронических заболеваниях легких человека. Наоборот, никакого значительного трихромного окрашивания не наблюдали в нормальных легких (контроль, ФИГ. 23E) или в облученных легких мышей, получавших CONP (фиг. 23G).
Сравнительные 3d-спектры рентгеновской фотоэлектронной спектроскопии (РФЭС) для Ce микронного размера и синтезированных наночастиц оксида церия (CONP) показаны на ФИГ. 24. РФЭС показывает высокую концентрацию Ce+3 в CONP по сравнению с частицами оксида церия микронного размера. Пики при 882,1 и 886 эВ соответствуют пикам Ce+4 и Ce+3. Пики при 918 эВ соответствуют сателлитным пикам, указывающим на присутствие пика Ce+4.
Врезка B на ФИГ. 24 представляет собой изображение синтезированных CONP (наночастиц диоксида церия, наночастиц CeO2, наночастиц оксида церия), полученное путем высокоразрешающей трансмиссионной электронной микроскопии, (HRTEM), указывающее на частицы размером 3-5 нанометров с флюоритовой кристаллической решеткой.
Было показано, что CONP придают защиту против повреждения, индуцированного облучением, у фибробластных клеток здорового легкого (CCL 135), и это позволяет предположить, что CONP являются эффективной противолучевой защитой для нормальных тканей. Кроме того, CONP, по-видимому, хорошо переносятся обработанными животными, и, по-видимому, защищают бестимусных «голых» мышей от гибели, индуцированной облучением, приводя к новому подходу для противолучевой защиты.
Из приведенных выше результатов можно видеть, что CONP хорошо переносятся мышами, и не вызывают токсичности у здоровых мышей. CONP также усиливают гибель злокачественных клеток, индуцированную облучением, и защищают здоровую ткань от облучения. Кроме этого, CONP плюс облучение контролируют/сводят до минимума метастатический индекс.
Одним из вариантов осуществления настоящего изобретения является композиция крема с CONP для местного применения. Было разработано множество композиций, каждая из которых использовала "наноактивный раствор" CONP. Композиции CONP для местного применения были изготовлены следующим образом: Суспензию формировали из смеси 12% масс./об. диоксида церия (CONP) с 2% масс./об. даксада, поверхностно-активного вещества на основе кислоты и метакрилата натрия. Эту суспензию перемешивают с ингредиентами, перечисленными в таблице 2 для формирования гладко размазывающегося геля для размазывания по коже. В этих композициях, Карбопол представляет собой редкосшитую акриловую кислоту; Tween 80 представляет собой полисорбат 80, и кокосовое масло представляет собой фракцию цельного масла, в которой удалены длинноцепочечные жирные кислоты, таким образом, что остались только среднецепочечные насыщенные жирные кислоты. Центрифугирование проводили в течение 15 минут при 1380G.
2,53 при 37°C
0,41 при 37°C
0,07 при 37°C
2,47 при 37°C
2,92 при 37°C
1,38 при 37°C
2,74 при 37°C
2,50 при 37°C
1,93 при 37°C
Композиция образца № 9 в таблице 3 имеет высокую вязкость и хорошее "ощущение на коже", наблюдаемые при равномерном распределении по коже человека. Эта композиция также имеет хорошую стабильность и умеренный pH. Эта композиция представляет собой эмульсию воды и масляной фазы. Масляная фаза содержит сафлоровое масло и фракционированное кокосовое масло, которые находятся вжидкой фазе при комнатной температуре, вместе с маслом какао и эмульгирующим воском, которые твердые при комнатной температуре. Компоненты масляной фазы нагревали до разжижения. Водную фазу наноактивного раствора диоксида церия и глицерин также нагревали до 35°C. Масляную фазу добавляли к водной фазе и перемешивали шпателем. Перемешивание раствора продолжали в течение приблизительно 5 минут для образования эмульсии и гарантии, что фазы не разделятся при охлаждении. Предпочтительным путем введения CONP для защиты здоровой кожи и тканей у пациентов с раком молочной железы, которых лечат облучением, является местное введение CONP. Состав CONP для местного введения в этом случае может быть эмульсия вода-масло, как описано выше.
Предварительные исследования позволяют предположить, что эти наночастицы могут быть терапевтическим регенеративным материалом, который будет улавливать активные формы кислорода (АФК), ответственные за повреждение клеток, индуцированное облучением. Когда биологические системы подвергаются воздействию высоких энергий, таких как при длительном исследовании космоса и работе вне космического корабля, на астронавтов воздействуют множественные источники окислительного стресса, включая радиацию, повышенное воздействие кислорода во время работы вне космического корабля, и физический и психологический стресс. Когда АФК вырабатываются в больших количествах, могут повреждаться компоненты клеток. Эти АФК могут использоваться биологическими системами в качестве защитного механизма против микроорганизмов и могут действовать в качестве агентов для трансдукции сигнала и транскрипции при развитии, ответах на стресс и программируемой гибели клеток. Окислительный стресс возникает из-за сильного окислительного потенциала клеток от избытка АФК, или свободных радикалов. Кроме того, повышенные уровни окислительного повреждения связаны с увеличенными рисками катаракты, сердечно-сосудистого заболевания и злокачественной опухоли. Таким образом, потенциальная выгода предложенного иследования противолучевой защиты имеет большое значение на нескольких уровнях, одним из которых является его потенциальное влияние на жизнь человека. Это изобретение имеет отношение к здоровью и качеству жизни людей во всем мире, которые подвергаются воздействию радиационного окружения, такие как, но не ограничиваясь ими, астронавты в NASA, подвергающиеся воздействию излучения частиц; военные и гражданские лица, потенциально подвергающиеся воздействию облучения в бою, при терроризме, или на производстве; и пациенты, получающие лучевую терапию для злокачественной опухоли.
ПРИМЕР 3: ПРИМЕНЕНИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ ДЛЯ ПОВЫШЕНИЯ ЧУВСТВИТЕЛЬНОСТИ К ОБЛУЧЕНИЮ КЛЕТОК РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Еще дополнительно определяли, повышают ли наночастицы оксида церия (CONP), улавливающие свободные радикалы, в оптимальной биологической дозе чувствительность клеток рака поджелудочной железы к облучению. Выработка H2O2, индуцированная облучением, была существенно повышена в присутствии <10 или =10мкМ CONP, в то время как выработка H2O2 была существенно снижена в присутствии >20 мкМ (0,013 мг/кг) CONP. Выработка АФК, индуцированная облучением, была повышена в злокачественных клетках L3.6pl, предварительно обработанных CONP, что коррелировало с существенным снижением жизнеспособности клеток и клоногенности по сравнению с облучением по отдельности. Напротив, АФК были снижены в нормальных клетках hTERT-HPNE без влияния на жизнеспособность клеток. Объем опухолей поджелудочной железы уменьшился на 48% у мышей, получавших комбинированное лечение в сравнении с облучением по отдельности. Иммуногистохимический анализ показал, что комбинированное лечение приводит к существенному увеличению апоптоза опухолевых клеток. В совокупности, наши результаты показывают, что CONP повышают чувствительность злокачественных клеток к облучению и могут обеспечить новый сенсибилизирующий агент для облучения для лечения рака поджелудочной железы человека.
Как показано со ссылкой на ФИГ. 25A и 25B, CONP селективно повышают АФК, индуцированные лучевой терапией, в клетках рака поджелудочной железы. Со ссылкой на A, в клетках L3.6pl и hTERTHPNE, предварительно инкубированных с CONP, CONP повысил выработку АФК в клетках рака поджелудочной железы (L3.6pl), длящуюся до 24 часов, с одновременным временным снижением выработки АФК в нормальных клетках поджелудочной железы (HPNE). Как показано на B, CONP, добавленные после облучения, не влияют на выработку АФК в клетках L3.6pl, но временно снижают выработку АФК в клетках HPNE. Еще дополнительно ФИГ. 25C и 25D иллюстрируют результаты с ФИГ. 25A и 25B, количественно определенные и нанесенные на диаграмму для иллюстрации изменений в уровнях АФК.
ФИГ. с 26A по 26D показывают, что CONP селективно повышают чувствительность клеток рака поджелудочной железы к облучению in vitro. A. Предварительная обработка клеток L3.6pl 10 мкМ (0,0067 мг/кг) CONP повысила сниженную из-за облучения жизнеспособность клеток в 1,7 раз. B. Предварительная обработка нормальных клеток поджелудочной железы (HPNE) 10 мкМ (0,0067 мг/кг) CONP не оказала существенного влияния на сниженную из-за облучения жизнеспособность клеток. C. Предварительная обработка клеток L3.6pl 10 мкМ (0,0067 мг/кг) CONP уменьшила образование колоний, индуцированное облучением, в 2,4 раза. D. Результаты с ФИГ. 26C определяли количественно и наносили на график для иллюстрации изменений в образовании колоний.
ФИГ. 27 показывает, что CONP управляют апоптозом, индуцированным облучением, in vivo. Окрашивание Г-Э и терминальное дезоксиуридиновое мечение концов на тканевых срезах, полученных от мышей, показало, что лечение CONP и, даже еще более резко, лечение комбинацией (CONP и лучевая терапия) увеличило количество присутствующей нормальной ткани и количество вызванного облучением апоптоза к моменту завершения.
Подробное вскрытие выявило, что все мыши имели опухоли в поджелудочной железе. Данные, обобщенные в таблице 4, показывают, что комбинация CONP с облучением производит наибольшее снижение массы опухоли по сравнению с облучением по отдельности (0,97 г и 1,31 г, соответственно; P<0,005). Масса тела не изменила среди всех групп лечения по сравнению с контрольными мышами. Не было никаких видимых метастазов печени (подсчитывали с помощью препаровальной лупы) ни в одной из групп лечения.
Как рассматривалось выше, принципы настоящего изобретения направлены на новый подход для защиты нормальной ткани от повреждения, вызванного облучением, при помощи наночастиц оксида церия (CeO2). Наночастицы CeO2 (CONP) были исследованы на их способность служить в качестве ловушек для свободных радикалов для оказания защиты от химических, биологических и лучевых повреждений, которые способствуют выработке свободных радикалов. Было высказано мнение, что уникальная структура наночастиц CeO2, в отношении валентности и дефектов кислорода, способствует более длинной жизни клетки и уменьшает токсические повреждения благодаря своим антиоксидантным свойствам, предотвращая накопление активных форм кислорода (АФК), и, таким образом, предотвращая апоптотический ответ и гибель клеток.
ПРИМЕР 4: ПРИМЕНЕНИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ ДЛЯ ЗАЩИТЫ ТКАНИ СЛЮННЫХ ЖЕЛЕЗ И КОЖИ ОТ ПОВРЕЖДЕНИЯ, ВЫЗВАННОГО ОБЛУЧЕНИЕМ
Предыдущая работа исследовала безопасность и способность CONP придавать противолучевую защиту на мышиной модели. CONPs хорошо переносятся и, по видимому, снижают заболеваемость пневмонитом у бестимусных «голых» мышей. В настоящем описании, предполагают, что CONP представляет новый подход для защиты ткани слюнных желез и кожи от повреждения, вызванного облучением, и исследуют их эффективность в качестве нового соединения противолучевой защиты на бестимусных «голых» мышах, получающих лучевую терапию в область головы и шеи.
Синтез CONP и определение характеристик:
Наночастицы оксида церия синтезировали при помощи способа микроэмульгирования, как описано ранее. Синтезированный диоксид церия был исследован при помощи высокоразрешающей трансмиссионной электронной микроскопии (HRTEM) для выявления размера отдельных частиц и агломератов. Физико-химические свойства синтезированных наночастиц показаны на ФИГ. 28A-28C. ФИГ. 28A показывает изображение HRTEM нанодиоксида церия (CONP), демонстрируя диапазон размеров наночастиц CeO2 3-5 нм, во врезке - высокое увеличение наночастицы. ФИГ. 28B иллюстрирует паттерн дифракции электронов в выбранной области (SAED) флюоритовой кристаллической структуры, где A, B, C и D соответствуют различному паттерну решетки 111, 200, 220 и 311, соответственно. ФИГ. 28A и 28C совместно иллюстрируют радиус CONP в диапазоне размеров от 5 нанометров до приблизительно 20 нанометров.
Животные: Самок бестимусных «голых» мышей (NCI-nu) приобретали в питомнике Национального института рака Центра разработки и исследования злокачественных опухолей Фредерика (Frederick, MD). Бестимусные «голые» мыши были поселены и содержались в аккредитованном виварии Американской Ассоциации для аккредитации по уходу за лабораторными животными (AAALAC) Института исследования злокачественных опухолей, который превосходит национальные требования по уходу за животными, с двумя комнатами для обычных мышей, двумя комнатами для «голых» мышей и одной комнатой для карантина. Использование животных было одобрено и утверждено при помощи доктора Андерсона (MD Anderson) Институциональным комитетом по содержанию и использованию лабораторных животных (IACUC) Центра ииследования рака в Орландо с номером протокола IACUC 09.06.01. Мышей использовали в соответствии с институциональными указаниями, когда они были в возрасте 8-12 недель.
Облучение и лечение CONP области головы и шеи бестимусных «голых» мышей:
Систему для ренгеновского облучения IC160 (Kimtron Inc., Woodbury, Connecticut, USA) использовали для облучения области головы и шеи у мышей. Животных обезболивали и помещали в положение лежа на спине под фокальное пятно рентгеновской трубки. Облучение проводили при комнатной температуре с использованием генератора рентгеновских лучей 160 кВ, работающего при 18,5 мА со скоростью 2,74 Гр/сек. Наночастицы CeO2 вводили в 100 мкл физиологического раствора путем интраперинеальной (и/п) инъекции, как описано ранее. Проводили пилотное исследование для того чтобы охарактеризовать воздействия облучения на область головы и шеи по слюноотделению. Бестимусные мыши были случайным образом распределены в 5 групп (N=10/группу). 1) без облучения (контрольная группа); 2) одна доза облучения 12,5 Гр; 3) одна доза облучения 15 Гр; 4) одна доза облучения 17,5 Гр; 5) одна доза облучения 20 Гр. Через шесть недель после завершения лучевой терапии проводили сиалометрический анализ.
В последующих экспериментах, когорты бестимусных «голых» мышей проходили две или три рандомизации. Мыши изначально были случайным образом распределены в две когорты (N=30/когорте): A) без облучения (мышей обезболивали и помещали в излучатель, но они не получали облучение); B) 30 Гр облучения, фракционированного на 6 доз (5 Гр/доза) давали через сутки в течение курса из двух недель. Затем каждую когорту случайным образом распределяли в три группы (N=10/группе): 1) дважды в неделю интраперитонеальные (и/п) инъекции физиологического раствора в течение двух недель перед лучевой терапией и во время курса лучевой терапии (контрольная группа); 2) дважды в неделю и/п инъекции 15 нМ (0,00001 мг/кг) наночастиц CeO2 в течение двух недель перед лучевой терапией и во время курса лучевой терапии; 3) дважды в неделю и/п инъекции 15 мкМ (0,01 мг/кг) наночастиц CeO2 в течение двух недель перед лучевой терапией и во время курса лучевой терапии. Всего делали 8 инъекций наночастиц CeO2; четыре инъекции в течение двух недель до облучения и четыре инъекции в течение двух недель лучевой терапии (т.е. две инъекции в неделю).
Повреждение, вызванное облучением - Критерии оценки:
Два независимых исследователя оценивали лучевой дерматит и гиперпигментацию двойным слепым образом через 1, 4 и 12 недель после лучевой терапии в соответствии с общими критериями токсичности (CTC v.3.0 Таблица 3) Национального института рака (NCI).
Анестезия:
Во время оценки лучевого дерматита и сбора слюны мышей обезболивали при помощи и/п инъекции коктейля кетамина (100 мг/мл) и ксилазина (20 мг/мл) (1 мкл/г массы тела).
Сиалометрический анализ:
В первом наборе экспериментов, во время которого мыши получали повышающиеся дозы однофракционного облучения (12,5, 15, 17,5 и 20 Гр) без введения наночастиц, мышей умерщвляли через шесть недель после окончания облучения. В следующем наборе экспериментов, в котором мыши получали 30 Гр фракционированного облучения (5 Гр/дозу) с наночастицами и без них, мышей умерщвляли через 90 суток после окончания облучения. После анестезии, мышей взвешивали и стимулировали функцию слюнной железы при помощи подкожной инъекции раствора пилокарпина (50 мг/мл) по 2 мг/кг массы тела. Начинали сбор слюны через 10 минут после введения пилокарпина. Животных помещали на затылок мордой вверх, и помещали в полость рта предварительно взвешенную 75-мм гепаринизированную капиллярную трубку для гематокрита (Drummond, Broomall, PA). Цельную слюну собирали в течение десяти минутного периода, и определяли количество собранной слюны гравиметрически.
Процедура вскрытия и гистологические исследования:
После завершения анализов лучевого дерматита и стимулированного слюноотделения, всех мыши умерщвляли с использованием камеры с CO2. После умерщвления регистрировали массу тела животных. Все патологоанатомические исследование тканей, окрашивание гематоксилином-эозином (Г-Э), и анализы TUNEL проводили на мышах, которые получили 30 Гр фракционированного облучения (т.е. с наличием и отсутствием 15 нМ (0,00001 мг/кг) и 15 мкМ (0,01 мг/кг) наночастиц CeO2). Собранные образцы из полости рта и шеи включали язык и прилежащие мягкие ткани, околоушные железы, сублингвальные железы, подчелюстные железы, и регионарные лимфоузлы. Для окрашивания Г-Э, эти ткани фиксировали в формалине, погружали в парафин, и делали серии срезов по 200 мкм.
Погруженные в парафин ткани применяли для окрашивания TUNEL. TUNEL-положительные клетки выявляли с использованием DeadEnd Colorimetric TUNEL System (Promega, Madison, WI).
Иммуногистологическую микроскопию проводили при помощи 40× объектива на микроскопе Nikon E400 (Nikon Instruments, Melville, NY). Использовали стандартные процедуры получения изображений, которые обрабатывали в Adobe Photoshop. Гистологический анализ проводили в сотрудничестве с командой патологов доктора Андерсона (MD Anderson) в Орландо. Подсчитывали клетки, иммуноположительные по экспрессии TUNEL, на каждое животное с использованием 40× объектива на десяти отдельных срезах и рассчитывали средние значения.
Статистический анализ:
Эксперименты с лучевым дерматитом и сиалометрию проводили в трех повторениях, и данные были представлены в виде среднего±стандартная ошибка среднего (SEM). Статистический анализ производили с использованием критерия Стъюдента, исходя из равенства дисперсий, и значение P рассчитывали на основании двустороннего критерия. Значение p<0,05 считали статистически значимым.
Результаты включают:
Проверка модели ксеростомии, индуцированной облучением:
Бестимусных «голых» мышей подвергали различным дозам однофракционного облучения (12,5 Гр, 15 Гр, 17,5 Гр или 20 Гр) и проводили сиалометрический анализ (ФИГ 29A-29C). Результаты указывают на дозо-зависимое снижение функции слюнных желез, которое соответствует клиническим наблюдениям, описанным для людей-пациентов, получавших лучевую терапию в область головы и шеи.
ФИГ. 29A-29C иллюстрируют воздействия облучения на выработку слюны в отсутствие и в присутствии CONP. (фиг. 29A) Стимулированный сиалометрический анализ функции слюнных желез через шесть недель после однофракционного облучения в область головы и шеи (12,5 Гр, 15 Гр, 17,5 Гр или 20 Гр). Результаты указывают на дозо-зависимое снижение функции слюнных желез с наибольшим снижением стимулированного потока слюны после 15-17,5 Гр однофракционного облучения (фиг. 29B). Влияние CONP на выработку слюны после воздействия облучения. Результаты демонстрируют статистически значимое отличие в выработке слюны между контрольной группой, которая получала 30 Гр/6 фракций облучения, и мышами, получавшими 30 Гр/6 фракций облучения плюс сопутствующие CONP. (фиг. 29C) Воздействия CONP на гиперпигментацию кожи после воздействия облучения с использованием общих терминологических критериев NCI для побочных эффектов (CTCAE v.3.0). Мыши, получавшие 15 нМ (0,00001 мг/кг) CONP, демонстрировали более низкую встречаемость дерматита степени II (33,33%) и более высокую встречаемость дерматита степени I (66,67%). Напротив, мыши, получавшие 15 мкМ (0,01 мг/кг) CONP, имели равную встречаемость гиперпигментации степеней I и II (50% каждой).
Наибольшее снижение стимулированного потока слюны наблюдали после 15-17,5 Гр однофракционного облучения. Для того чтобы смоделировать более клинически значимый сценарий, была разработана фракционированная схема биологически эквивалентная этой однофракционной схеме лечения. По ряду расчетов биологически эффективной дозы (БЭД) [25], в последующих экспериментах использовали 30 Гр в 6 фракциях по 5 Гр. Эта схема лечения имеет БЭД 45,0 Гр для острых воздействий и 80 Гр для отсроченных воздействий, которая благоприятно сравнима с БЭД для 15-17,5 Гр однофракционной схемы лечения.
Кроме того, 30 Гр в 6 фракциях будут приводить к достаточным воздействиям на мягкие ткани и к нарушению функции слюнной железы, позволяя адекватно тестировать и оценивать радиозащитные свойства наночастиц CeO2.
Воздействия наночастиц оксида церия функцию слюнных желез в отсутствие облучения:
Сиалометрический анализ на необлученных бестимусных «голых» мышах, предварительно получивших и/п инъекции CONP в концентрациях 15 нМ (0,00001 мг/кг) и 15 мкМ (0,01 мг/кг) не выявил статистического различия в объеме слюны, собранной в течение 10 минут по сравнению с контролем без наночастиц (физиологический раствор) [Группа с физиологическим раствором по сравнению с группой с 15 нМ (0,00001 мг/кг) - значение p: 0,1007; группа с физиологическим раствором по сравнению с группой 15 мкM (0,01 мг/кг) - значение p: 0,9856; группа с 15 нМ (0,00001 мг/кг) по сравнению с группой 15 мкM (0,01 мг/кг) - значение p: 0,1159]. В то время как контрольная группа с физиологическим раствором имела средний объем 313 мкл/10 минут, группы, получавшие 15 нМ (0,00001 мг/кг) и 15 мкМ (0,01 мг/кг) наночастиц CeO2, имели средние объемы 286 мкл/10 минут и 312 мкл/10 минут, соответственно.
Воздействия наночастиц оксида церия на бестимусных «голых» мышей, получавших облучение в область головы и шеи: Облученные группы, которые получали или низкую концентрацию (15 нМ; 0,00001 мг/кг) CONP или высокую концентрацию (15 мкМ; 0,01 мг/кг) CONP имели повышенную выработку слюны по сравнению с облученной группой "без наночастиц" через 12 недель после облучения. Сиалометрический анализ демонстрирует статистически значимое отличие в выработке слюны между контрольной группой, которая получала 30 Гр/6 фракций облучения, и мышами, получавшими 30 Гр/6 фракций облучения, которые получали сопутствующее лечение CONP.
Когда облученные группы с 15 нМ (0,00001 мг/кг) и 15 мкМ (0,01 мг/кг) CONP по отдельности сравнивали с облученной контрольной группой "без наночастиц", не было статистически значимого отличия в стимулированном потоке слюны, с предпочтением группе с 15 мкМ (0,01 мг/кг) CeO2 (значение P: 0,0003, 95% ДИ: -128,0 до -52,90).
Все кожные гиперпигментации, наблюдаемые у мышей, которых только облучали, были зарегистрированы как степень II. В сравнении с этим, мыши, получавшие 15 нМ CONP, демонстрировали более низкую встречаемость степени II (33,33%) и более высокую встречаемость степени I (66,67%) гиперпигментации. Мыши, получавшие 15 мкМ (0,01 мг/кг) наночастиц CeO2, имели равную встречаемость гиперпигментации степеней I и II (50% каждой).
Обратную корреляцию наблюдали между встречаемостью степени 3 лучевого дерматита и концентрацией введенных наночастиц CeO2 (фиг. 30). Встречаемость дерматита степени 3 через неделю после облучения после облучения была снижена в группе с 15 мкМ (0,01 мг/кг) CONP по сравнению с контролями без CONPs (10% по сравнению 100% встречаемостью дерматита степени 3, соответственно). Это воздействие не наблюдали на группе с 15 нМ CONP. Кроме того, животные, получавшие облучение, и или 15 нМ (0,00001 мг/кг) или 15 мкМ (0,01 мг/кг) концентрацию CONP показали более быструю регрессию лучевого дерматита по сравнению с облученной контрольной группой "без наночастиц". Например, полное исцеление наблюдали у 60% животных, получавших предварительно 15 мкМ (0,01 мг/кг) CONP до облучения, по сравнению с 10% в облученной контрольной группе, через 12 недель после облучения (см. ФИГ. 30).
Воздействия наночастиц оксида церия (CONP) на апоптотический индекс паренхимальных клеток слюнных желез после облучения области головы и шеи:
Околоушные, сублингвальные и подчелюстные железы анализировали независимо и определяли апоптотический индекс ациноцитов при помощи анализа TUNEL. Наши результаты указывают на дозо-зависимое снижение апоптотического индекса для отдельных желез после облучения, что свидетельствует о противолучевых защитных свойствах наночастиц (см. ФИГ. 31A и 31B).
ФИГ. 31A и 31 B иллюстрируют воздействия наночастиц оксида церия (CONP) на апоптотический индекс паренхимальных клеток слюнных желез после облучения области головы и шеи. (фиг. 31A) Апоптоз паренхимальных клеток слюнных желез (околоушных, сублингвальных и подчелюстных), индуцированный облучением. Околоушные железы мышей, которые получали облучение без лечения CONP, показали повышение апоптотического индекса (22%) по сравнению с необлученными мышами (2,2%) и с железами мышей, которые получали или 15 нМ (0,00001 мг/кг) или 15 мкМ (0,01 мг/кг) CONP плюс облучение (5,32% и 4,25%, соответственно). Необлученные сублингвальные железы имели исходный апоптотический индекс 1,87%, который повысился до 26% после облучения. Предварительное лечение или 15 нМ (0,00001 мг/кг) или 15 мкМ (0,01 мг/кг) CONP привело к снижению величины повышения апоптотического индекса до 11,8% и 7,2%, соответственно после облучения. Необлученные подчелюстные железы имели исходный апоптотический индекс 0,2%. Хотя облучение повысило индекс до 12,2%, за счет предварительного лечения CONP (15 нМ (0,00001 мг/кг) или 15 мкМ (0,01 мг/кг)) величина повышения была снижена до 7,4% и 2,6%, соответственно (фиг. 31B). Дополнительный анализ воздействий CONP в сочетании с облучением на все основные слюнные железы, выявил ответ, аналогичный тому, что показан на ФИГ. 31A.
Дополнительный анализ воздействий CONP в сочетании с облучением на все основные слюнные железы, выявил аналогичный ответ. Общий исходный апоптотический индекс ациноцитов для необлученной группы составил 1,43%, в то время как повреждение, индуцированное облучением, повысило степень апоптоза до 19,91%. При этом, после облучения, обе группы, получавшие CONP (15 нМ и 15 мкМ; 0,00001 мг/кг и 0,01 мг/кг) демонстрировали апоптотический индекс 8,17% и 4,67%, соответственно. Статистический анализ показал значимое отличие между облученной группой "без наночастиц" и группой, получавшей 15 мкМ (0,01 мг/кг) CeO2 (значение p: 0,0270, 95% ДИ: от 2,77 до 27,03). И наконец, проводили сравнение между группой, получавшей комбинацию наночастиц+облучение, и контрольной группой (т.е. контроли "без наночастиц" и "без облучения") для количественной оценки степени противолучевой защиты от апоптотической гибели по сравнению с нетронутой тканью слюнных желез. Сравнение апоптотического индекса группы с 15 мкМ (0,01 мг/кг) CONP, которая получала облучение, с контрольной группой "без наночастиц" и "без облучения" не выявило статистического различия (значение p: 0,1155, 95% ДИ: от -8,534 до 1,378).
С другой стороны, апоптотический индекс группы, получавшей 15 мкМ (0,01 мг/кг) CONP и не получавшей облучения, и необлученной контрольной группы "без наночастиц" не показал статистического различия между ними. Эти результаты позволяют предположить, что обработка наночастицы CeO2 не приводит к неблагоприятным воздействиям на ациноциты.
Оценка повреждения архитектуры клеток слюнных желез, вызванного облучением, при помощи Г-Э:
Для определения степени повреждения, вызванного облучением, слюнных желез, языка, регионарных лимфоузлов и мягких тканей шеи, эти ткани собирали и обрабатывали окраской Г-Э. Железы от мышей из облученной контрольной группы (только облучение) демонстрировали видимое повреждение морфологической архитектуры, с усиленной инвазией макрофагов и лимфоцитов. Напротив, образцы из шеи от облученных мышей, получавших или 15 нМ (0,00001 мг/кг) (данные не показаны) или 15 мкМ (0,01 мг/кг) CONP, демонстрировали вакуолизацию ациноцитов, но в целом морфология ацинарной ткани и число ядер ациноцитов, по-видимому, были сохранены (см. ФИГ. 32). ФИГ. 32 иллюстрирует Г-Э анализ повреждения архитектуры клеток слюнных желез, вызванного облучением. Показаны гистологические оценки при помощи окрашивания гематоксилин-эозином собранных образцов необлученных слюнных желез (A,D,G) [при 40× увеличении]; образцов желез, облученных 30 Гр в 6 фракциях (B,E [при 40× увеличении]; и образцов, предварительно обработанных 15 мкМ (0,01 мг/кг) CONP и затем облученных (C,F,I) [при 40× увеличении]. Морфологический анализ околоушных желез (Панель A: нелеченная, необлученная группа [желтый круг]) показал сохранение серозной ацинарной архитектуры в облученной группе с 15 мкМ (0,01 мг/кг) CONP (Панель C, желтый круг) в отличие образцов, только с облучением (Панель B, желтый круг), которые показали разрушение (желтая стрелка) и гипертрофию серозного ацинуса. Анализ сублингвальных желез не показал изменений между структурой серозного ацинуса нелеченной, необлученной группы и облученной группы с 15 мкМ (0,01 мг/кг) CONP (Панель D и F, желтый круг) по сравнению с фиброзными изменениями, вторичными по отношению к лучевому повреждению, наблюдаемыми в группе только с облучением (Панель E, желтые стрелки). Хотя архитектура серозного ацинуса была сохранена в подчелюстных образцах, воспалительные клетки встречались чаще (желтый круг) в группе только с облучением. При этом, число междольковых протоков было значительно снижено в группе только с облучением (Панель H, желтые стрелки) по сравнению с нелеченной, необлученной группой и облученной группой с 15 мкМ (0,01 мг/кг) CONP (Панель G и I, желтые стрелки).
Ксеростомия, дерматит, фиброз, и мукозит, индуцированные облучение, являются распространенными и зачастую тяжелыми осложнениями лучевой терапии для рака головы и шеи. В настоящее время, Амифостин является единственным агентом для клинического применения. К сожалению, его короткий период полувыведения, ежедневная необходимость дозирования и стоимость является препятствиями для широкого использования Амифостина во время лучевой терапии для рака головы и шеи. В результате остается клиническая потребность в хорошо переносимых, не требующих усилий, длительно действующих и экономически эффективных радиозащитных средствах; остается найти «панацею» противолучевой защиты.
Предшествующая работа продемонстрировала способность наночастиц CeO2 обеспечивать противолучевую защиту здоровым клеткам молочной железы (CRL-8798), но не клеткам рака молочной железы человека (MCF-7) в концентрациях, больших чем 50 нМ. Продолжение этой работы показало, что наночастицы CeO2 защищают желудочно-кишечный эпителий от повреждения, индуцированного радиацией.
Эта работа также позволяет предположить, что CONP придают противолучевую защиту, действуя как ловушки для свободных радикалов и за счет повышения выработки супероксиддисмутазы 2. Исследования на животных продемонстрировали, что CONPs хорошо переносятся живыми животными. Кроме того, ткани легкого, полученные после облучения легкого целиком, не продемонстрировали гистологических признаков пневмонита и фиброза у бестимусных мышей, получавших 15 нМ CONP, по сравнению с контролями "без наночастиц". Эти результаты показывают, что CONP могут играть ключевую роль в защите тканей головы и шеи против повреждения, вызванного облучением, что возможно зависит от концентрации.
В этом исследовании, оценка стимулированной сиалометрии убедительно продемонстрировала улучшенную выработку слюны во всех группах, получавших CONP, сравнению с облученной группой "без наночастиц". В группе, получавшей 15 мкМ (0,01 мг/кг) CONP, среднее слюновыделение после облучения составило 65% от необлученного контроля, в то время как в группе, получавшей 15 нМ (0,00001 мг/кг) CONP, стимулированное выделение составило приблизительно 50% от необлученного контроля. Таким образом, CONP, по всей видимости, в некоторой степени сохраняют функцию стимулированного слюноотделения после облучения.
Стоит отметить, что скорости потока слюны в когорте мышей, участвовавших в однофракционном эксперименте (см. ФИГ. 29A) были выше (даже после однофракционной дозы 15-20 Гр), чем скорости потока в фракционированном эксперименте (см. ФИГ. 298). Можно привести довод, что гипосаливация увеличится через три месяца по сравнению с шестью неделями после облучения. Однако, это не то, что предполагают в клинической литературе.
Клинические исследования позволяют предположить, что ксеростомия наиболее интенсивна сразу после облучения и начинает улучшаться через несколько месяцев.
Объяснение этому несовпадению с клиническими данными у людей является неясным. Мыши в первом эксперименте получили одну фракцию облучения, которая может отличаться по биологической значимости от фракционированного курса во втором эксперименте. Таким образом, сложно сравнивать результаты сиалометрии между двумя группами.
Была пониженная заболеваемость лучевым дерматитом у мышей, получавших 15 мкМ (0,01 мг/кг) CONP, которой не наблюдали в группе с 15 нМ (0,00001 мг/кг) CONP. Однако восстановление от острого лучевого дерматита, по всей видимости, происходило быстрее во всех группах, предварительно получавших CONP.
Анализ TUNEL продемонстрировал снижение гибели клеток, которое было обратно пропорционально концентрации CONP. И наконец, судя по всему, архитектура ткани слюнных желез была сохранена после облучения у мышей, получавших самую высокую концентрацию (15 мкМ; 0,01 мг/кг) наночастиц.
ПРИМЕР 5: ВОЗДЕЙСТВИЯ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В КОМБИНАЦИИ С ОБЛУЧЕНИЕМ+ПАКЛИТАКСЕЛОМ НА КЛЕТКИ РАКА ЛЕГКИХ CRL5803
Комбинированное лечение наночастицами оксида церия с облучением и химиотерапевтическим средством Паклитаксел анализировали на линии злокачественных клеток легкого.
Дизайн эксперимента
Клетки рака легких CRL5803 высевали в 96-луночный планшет на 24 часа (плотность ~2000 клетки/лунку). В момент=0, меняли среды для культивирования, и клетки подвергали следующим условиям лечения.
- Контроль
- Облучение 5 Гр
- 100 мкг Паклитаксела
- 10 нМ наночастицы оксида церия в комбинации с облучением и паклитакселом
Через 24 часа, 48 часов, 72 часа и 96 часов после лечения, жизнеспособность клеток измеряли при помощи люминесцентного анализа жизнеспособности клеток Cell-Titer Glo, и планшеты читали при помощи микроспектрофотометра для чтения планшетов Optima.
Результаты, представленные на ФИГ. 33, показывают эффективность комбинированного лечения по отношению к жизнеспособности злокачественных клеток легкого, измеренной при помощи относительных световых единиц (RLU) на Optima.
ПРИМЕР 6: ПИЛОТНОЕ ИССЛЕДОВАНИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В КОМБИНАЦИИ С ИЗЛУЧЕНИЕМ И ХИМИОТЕРАПИЕЙ НА МЫШИНОЙ МОДЕЛИ ГЕПАТИТА
Воздействие комбинированного лечения (CONP, облучение, химиотерапия) изучали на мышиной модели гепатита.
Мышей распределили по следующим группам лечения.
Наночастицы вводили за 2 недели до лучевой терапии, во время лучевой терапии и две недели лучевой терапии. Наночастицы оксида церия (100 мкл и/п из 15 мкМ раствора на сутки 1 и 3). Облучение (30 Гр) давали в виде однократной дозы на сутки 2 лечебной недели. Паклитаксел (100 мкл и/п из 100 мкг раствора) вводили дважды на сутки 2 и 4.
Через две недели после лучевой терапии, извлекали печень на вскрытии, анализировали на гистологические изменения и фотографировали для анализа.
Результаты:
Как показано на ФИГ. 34, для каждого лечения наблюдали следующие гистологические результаты.
ПРИМЕР 7: ВОЗДЕЙСТВИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В КОМБИНАЦИИ С ОБЛУЧЕНИЕМ+ГЕМЦИТАБИНОМ НА КЛЕТКИ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ L3.6PL
Комбинированное лечение наночастицами оксида церия с облучением и химиотерапевтическим средством Гемцитабин анализировали на линии клеток рака поджелудочной железы.
Дизайн эксперимента
Клетки рака поджелудочной железы L3.6PL высевали в 96-луночный планшет на 24 часа (плотность ~2000 клетки/лунку). В момент=0, меняли среды для культивирования, и клетки подвергали следующим условиям лечения.
- Контроль
- Облучение 5 Гр
- 50 нг/мл Гемцитабина
- Различные концентрации наночастиц оксида церия (0, 10 нМ, 100 нМ, 1 мкМ, и 100 мкМ) анализировали в комбинации с облучением и Гемцитабином
Через 96 часов после лечения, жизнеспособность клеток измеряли при помощи при помощи люминесцентного анализа жизнеспособности клеток Cell-Titer Glo, и планшеты читали при помощи микроспектрофотометра для чтения планшетов Optima.
Результаты, показанные на ФИГ. 35, демонстрируют эффективность комбинированного лечения по отношению к жизнеспособности клеток рака поджелудочной железы, измеренной при помощи относительных световых единиц (оптическая плотность 562 нм) на Optima. Черные столбцы показывают облучение с наночастицами. Серые столбцы показывают Гемцитабин с наночастицами. Белые столбцы показывают комбинацию облучения+Гемцитабин с наночастицами.
ПРИМЕР 8: ВОЗДЕЙСТВИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В КОМБИНАЦИИ С ОБЛУЧЕНИЕМ+ГЕМЦИТАБИНОМ НА КЛЕТКИ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ MDA-231
Комбинированное лечение наночастицами оксида церия с облучением и химиотерапевтическим средством Паклитаксел анализировали на линии злокачественных клеток молочной железы MDA-231. Также можно использовать другие клеточные линии MDA-431, MDA-435, A431. Эти клеточные линии являются человеческими по происхождению и используются в клеточных исследованиях для определения эффективности наночастиц оксида церия с химиотерапией и радиацией или без них.
Дизайн эксперимента
Клетки рака молочной железы MDA-231 высевают в 96-луночный планшет на 24 часа (плотность ~2000 клетки/лунку). В момент=0, меняют среды для культивирования, и клетки подвергают следующим условиям лечения.
- Контроль
- Облучение 5 Гр
- 100 мкг Паклитаксела
- Различные концентрации наночастиц оксида церия (0, 10 нМ, 100 нМ, 1 мкМ, и 100 мкМ) анализировали в комбинации с облучением и Паклитакселом
Через 96 часов после лечения, жизнеспособность клеток измеряют при помощи люминесцентного анализа жизнеспособности клеток Cell-Titer Glo, и планшеты читают при помощи микроспектрофотометра для чтения планшетов Optima.
Ортотопические модели на животных, таких как бестимусные «голые» мыши, которые переносят имплантацию или инъекцию клеток человека используют для подтверждения результатов, полученных на клеточных культурах. После того как клеточные линии инъецируют в тот орган мышам, из которого они получены у человека (т.е. жировую ткань молочной железы или ткань легкого), мыши затем лечат аналогичным образом. Измеряют рост опухоли/объем опухоли/массу опухоли (для определения эффективности агентов на рост опухоли), массу тела (для определения токсичности) и выживаемость (для определения переносимости). На ортотопической ткани злокачественной опухоли и окружающей нормальной ткани проводят гистологическое и патологическое исследование для определения гибели клеток, клеточной пролиферации, защиты для внешней ткани по кожным ожогам, фиброза для ткани легкого, изменений в белках и изменений в гибели клеток или путях выживания при помощи хорошо известных способов.
ПРИМЕР 9: ВОЗДЕЙСТВИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В КОМБИНАЦИИ С ОБЛУЧЕНИЕМ+ГЕМЦИТАБИНОМ НА КЛЕТКИ РАКА ЛЕГКИХ H226
Комбинированное лечение наночастицами оксида церия с облучением и химиотерапевтическим средством Паклитаксел анализировали на линии злокачественных клеток легкого H226. Также можно использовать другие клеточные линии, такие как PC14/PE6, A549, или H441. Эти клеточные линии являются человеческими по происхождению и используются в клеточных исследованиях для определения эффективности наночастиц оксида церия с химиотерапией и радиацией или без них.
Дизайн эксперимента
Рак легких H226 клетки высевают в 96-луночный планшет на 24 часа (плотность ~2000 клетки/лунку). В момент=0, меняют среды для культивирования, и клетки подвергают следующим условиям лечения.
- Контроль
- Облучение 5 Гр
- 100 мкг Паклитаксела
- Различные концентрации наночастиц оксида церия (0, 10 нМ, 100 нМ, 1 мкМ, и 100 мкМ) анализировали в комбинации с облучением и Гемцитабином
Через 96 часов после лечения, жизнеспособность клеток измеряют при помощи люминесцентного анализа жизнеспособности клеток Cell-Titer Glo, и планшеты читают при помощи микроспектрофотометра для чтения планшетов Optima.
Ортотопические модели на животных, таких как бестимусные «голые» мыши, которые переносят имплантацию или инъекцию клеток человека используют для подтверждения результатов, полученных на клеточных культурах. После того как клеточные линии инъецируют в тот орган мышам, из которого они получены у человека (т.е. жировую ткань молочной железы или ткань легкого), мыши затем лечат аналогичным образом. Измеряют рост опухоли/объем опухоли/массу опухоли (для определения эффективности агентов на рост опухоли), массу тела (для определения токсичности) и выживаемость (для определения переносимости). На ортотопической ткани злокачественной опухоли и окружающей нормальной ткани проводят гистологическое и патологическое исследование для определения гибели клеток, клеточной пролиферации, защиты для внешней ткани по кожным ожогам, фиброза для ткани легкого, изменений в белках и изменений в гибели клеток или путях выживания при помощи хорошо известных способов.
ПРИМЕР 10: ВОЗДЕЙСТВИЕ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В КОМБИНАЦИИ С ОБЛУЧЕНИЕМ+ГЕМЦИТАБИНОМ НА КЛЕТКИ РАКА ТОЛСТОГО КИШЕЧНИКА COLO 320
Комбинированное лечение наночастицами оксида церия с облучением и химиотерапевтическим средством Паклитаксел анализировали на клеточной линии рака толстого кишечника COLO 320. Также можно использовать другие клеточные линии, такие как Caco-2, DLD-1, HCT-15, HCT-116, HT-29, SW620, WiDr, и LS174T и TC71. Эти клеточные линии являются человеческими по происхождению и используются в клеточных исследованиях для определения эффективности наночастиц оксида церия с химиотерапией и радиацией или без них.
Дизайн эксперимента
Клетки рака толстого кишечника COLO 320 высевают в 96-луночный планшет на 24 часа (плотность ~2000 клетки/лунку). В момент=0, меняют среды для культивирования, и клетки подвергают следующим условиям лечения.
- Контроль
- Облучение 5 Гр
- 100 мкМ Иринотекан
- Различные концентрации наночастиц оксида церия (0, 10 нМ, 100 нМ, 1 мкМ, и 100 мкМ) анализировали в комбинации с облучением и Гемцитабином
Через 96 часов после лечения, жизнеспособность клеток измеряют при помощи люминесцентного анализа жизнеспособности клеток Cell-Titer Glo, и планшеты читают при помощи микроспектрофотометра для чтения планшетов Optima.
Ортотопические модели на животных, таких как бестимусные «голые» мыши, которые переносят имплантацию или инъекцию клеток человека используют для подтверждения результатов, полученных на клеточных культурах. После того как клеточные линии инъецируют в тот орган мышам, из которого они получены у человека (т.е. жировую ткань молочной железы или ткань легкого), мыши затем лечат аналогичным образом. Измеряют рост опухоли/объем опухоли/массу опухоли (для определения эффективности агентов на рост опухоли), массу тела (для определения токсичности) и выживаемость (для определения переносимости). На ортотопической ткани злокачественной опухоли и окружающей нормальной ткани проводят гистологическое и патологическое исследование для определения гибели клеток, клеточной пролиферации, защиты для внешней ткани по кожным ожогам, фиброза для ткани легкого, изменений в белках и изменений в гибели клеток или путях выживания при помощи хорошо известных способов.
Если не определено иначе, все технические и научные термины, применяемые в настоящем документе, имеют то же значение, как их обычно понимает специалист в области, к которой принадлежит это изобретение. Хотя в практическом осуществлении или тестировании по настоящему изобретению можно использовать любые способы и материалы, аналогичные или эквивалентные тем, что описаны в настоящем документе, здесь описаны предпочтительные способы, контсрукции иматериалы. Все публикации, упомянутые в настоящем документе, включены в настоящий документ в качестве ссылки в полном объеме. Там, где есть расхождения в терминах и определениях, применяемых в источниках, которые включены посредством ссылки, термины, применяемые в настоящей заявке, должны иметь определения, которые даны в настоящем документе.
Специалистам в данной области понятно, что могут быть сделаны изменения в вышеописанных вариантах осуществления в пределах широкой идеи изобретения. Следует понимать, таким образом, что это изобретение не ограничено конкретными описанными вариантами осуществления, но предназначено для охвата модификаций в пределах сущности и объема настоящего изобретения, определенных в формуле изобретения.
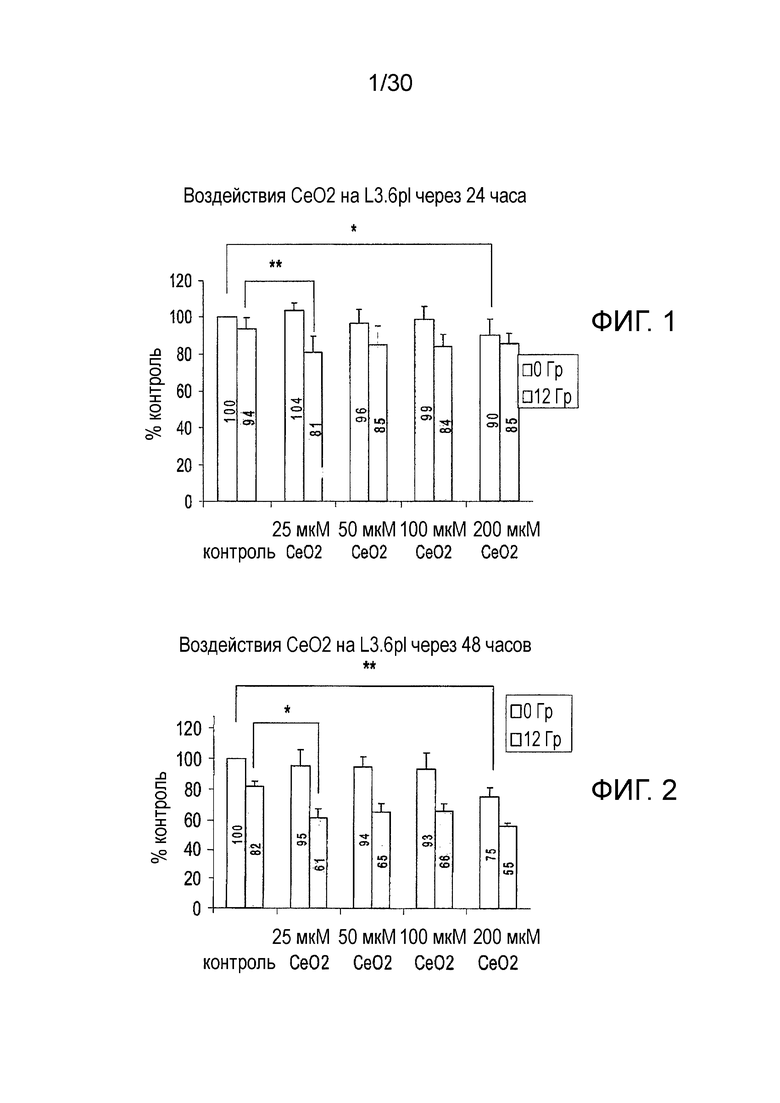
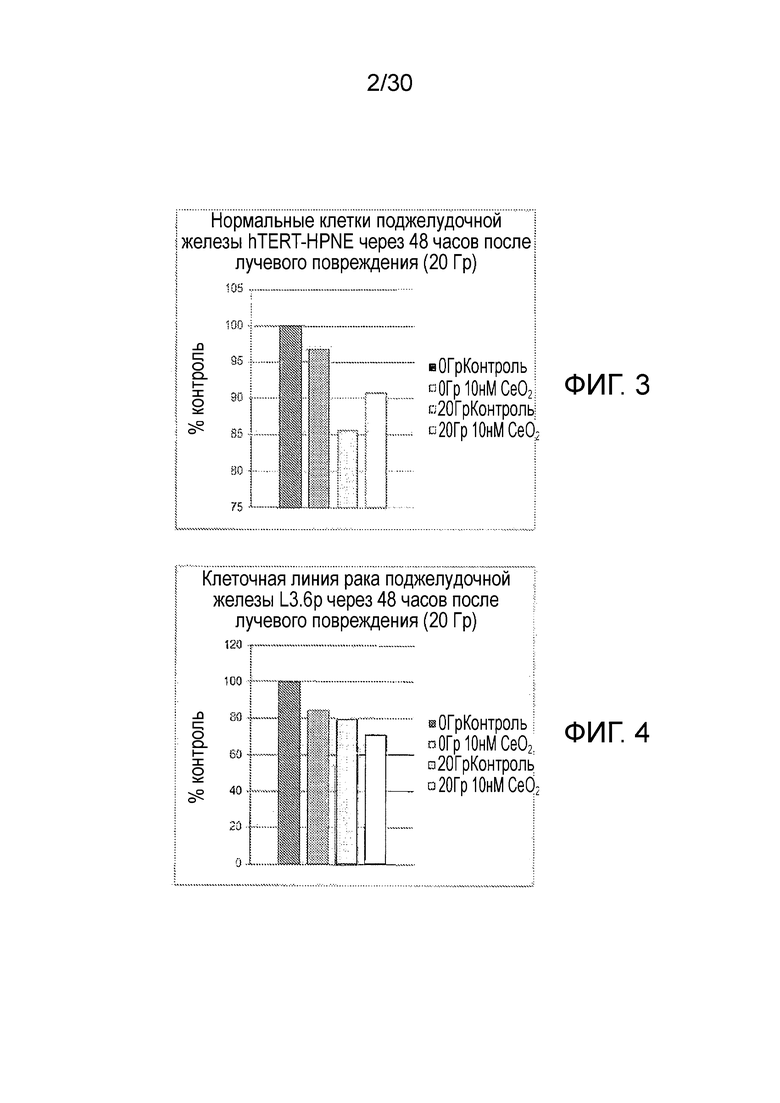
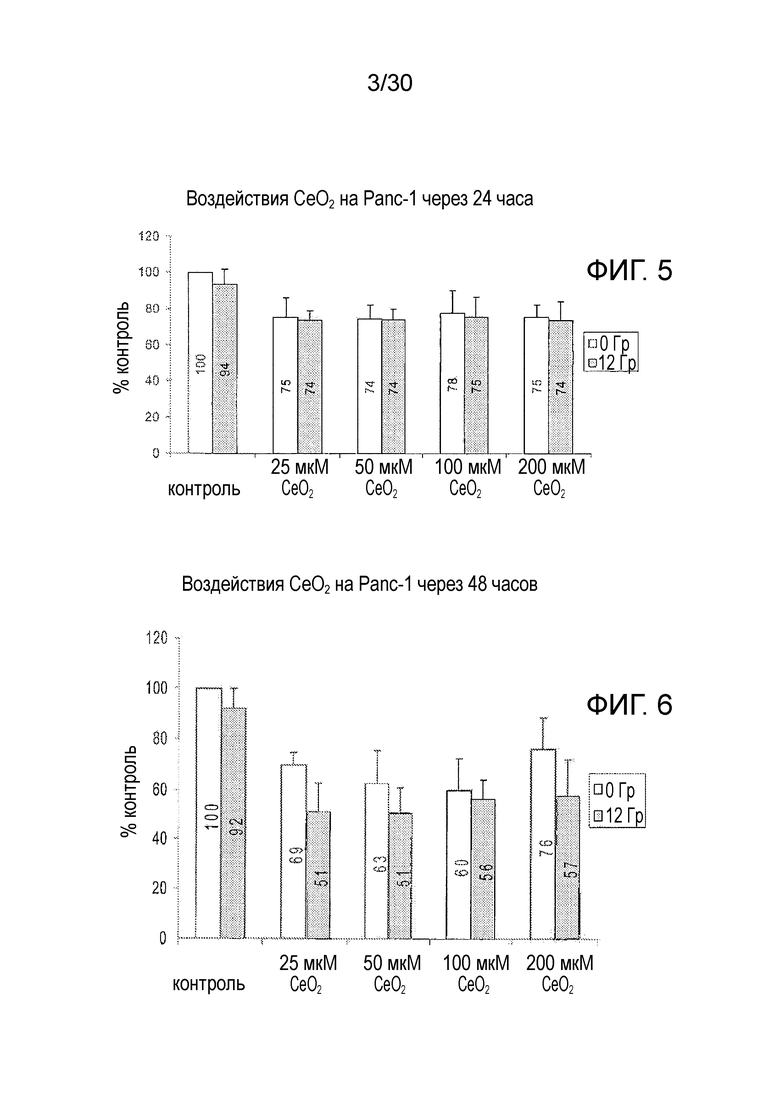
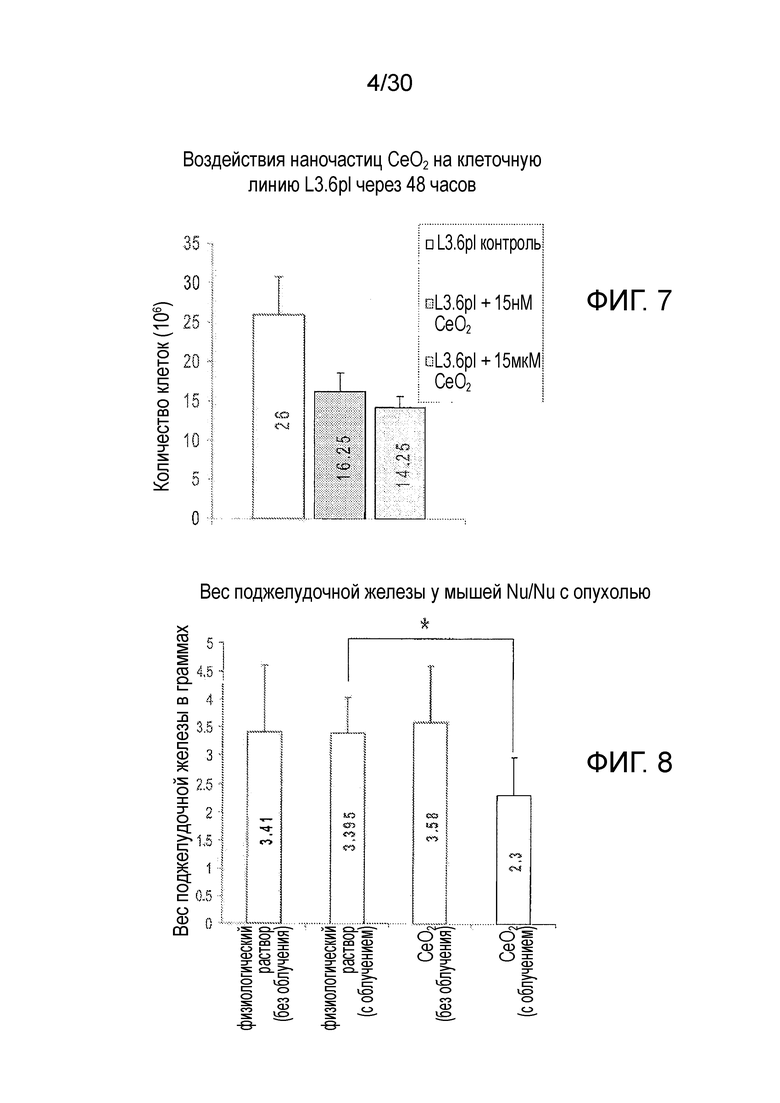
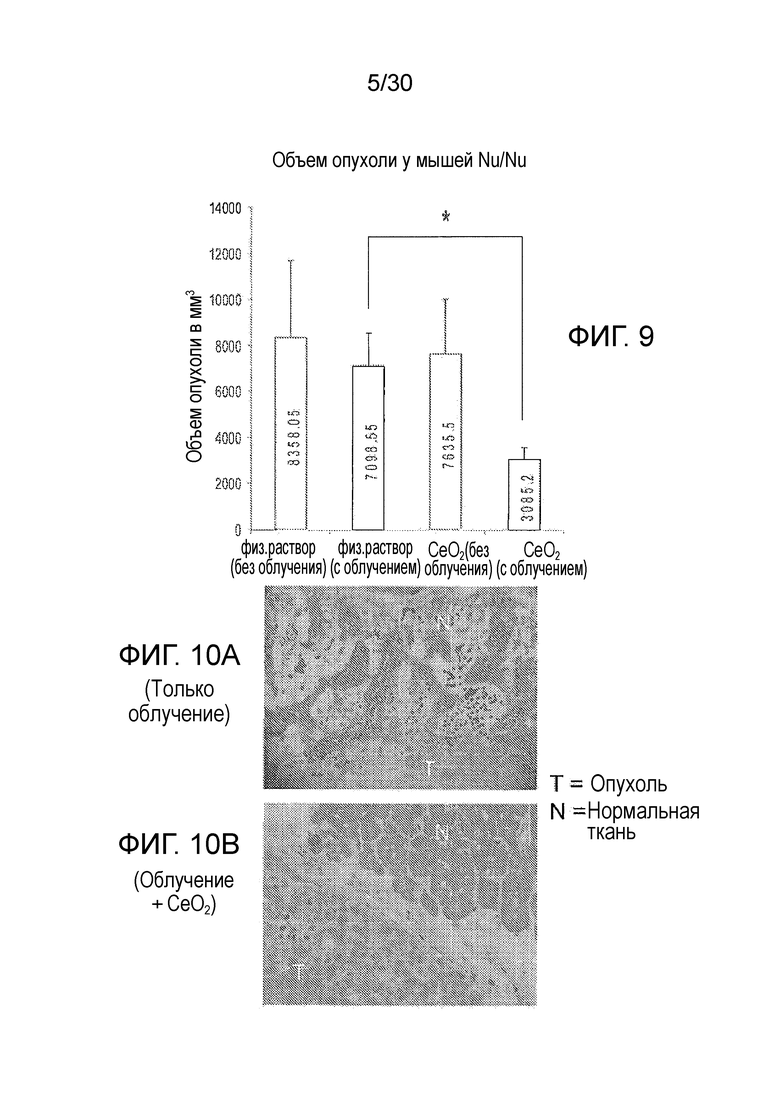
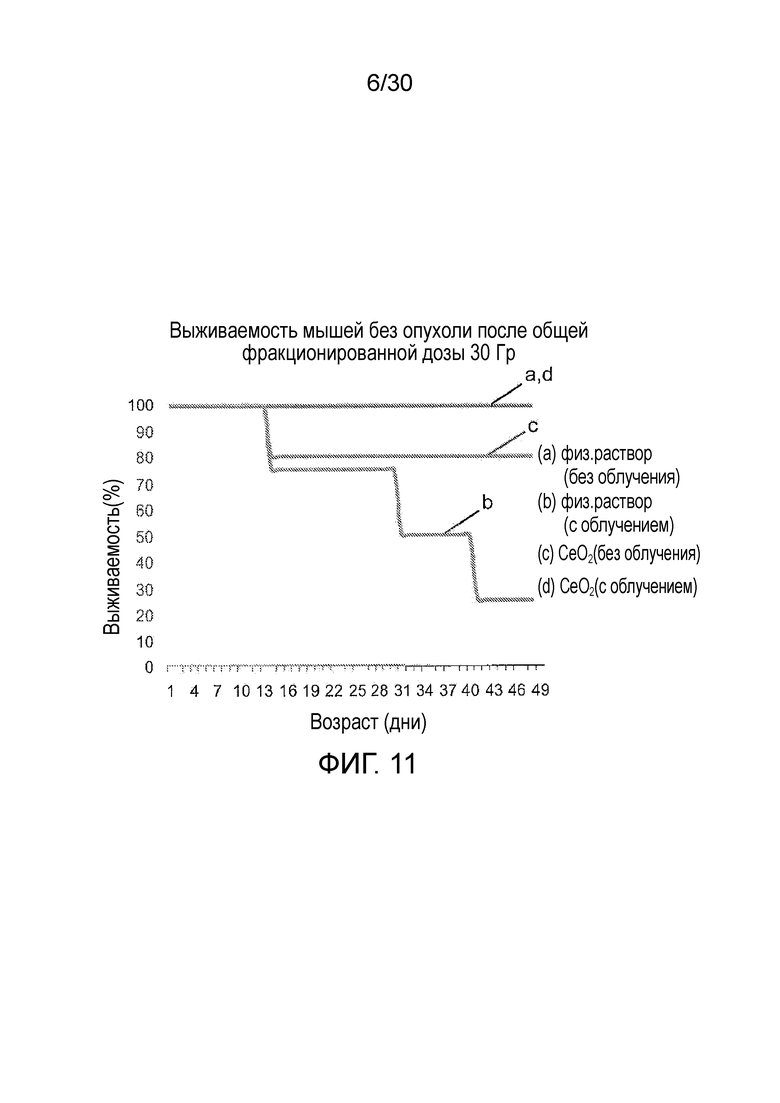
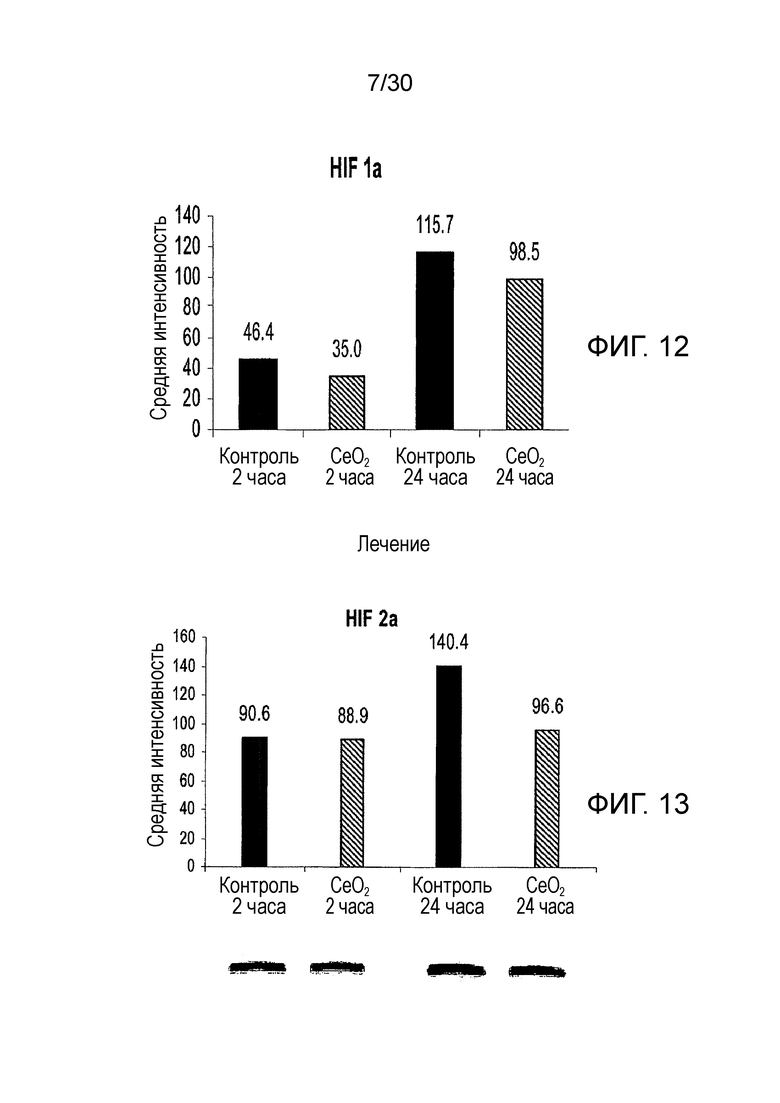
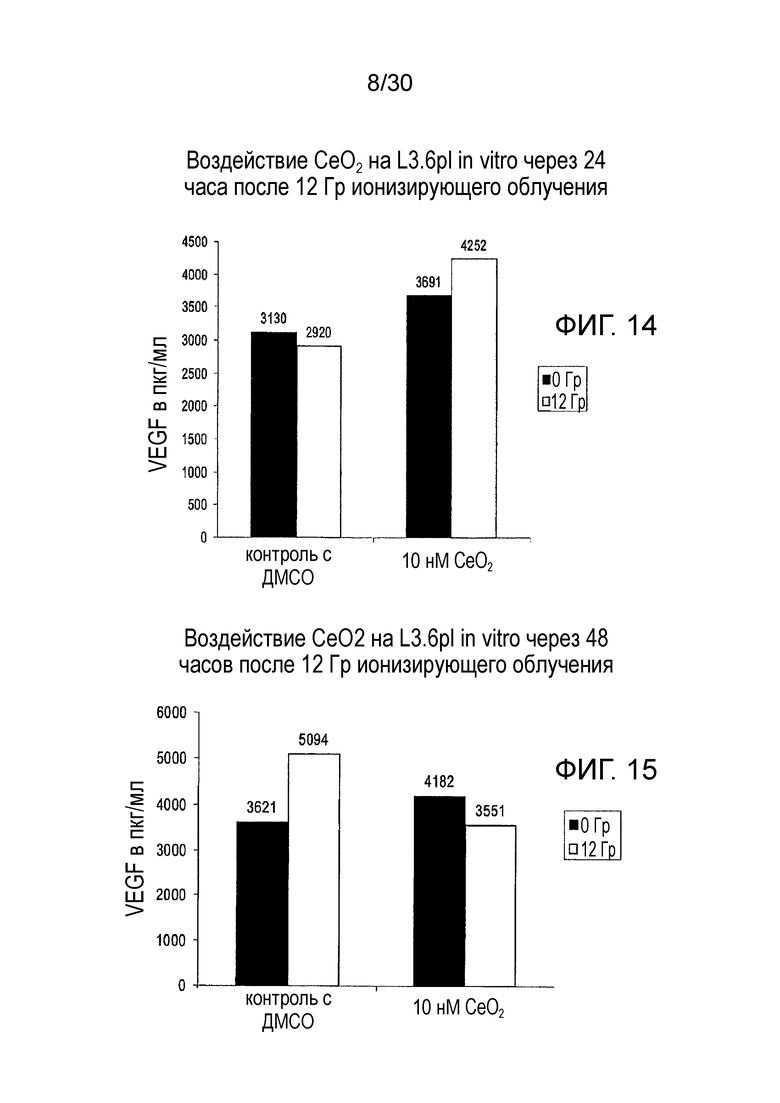
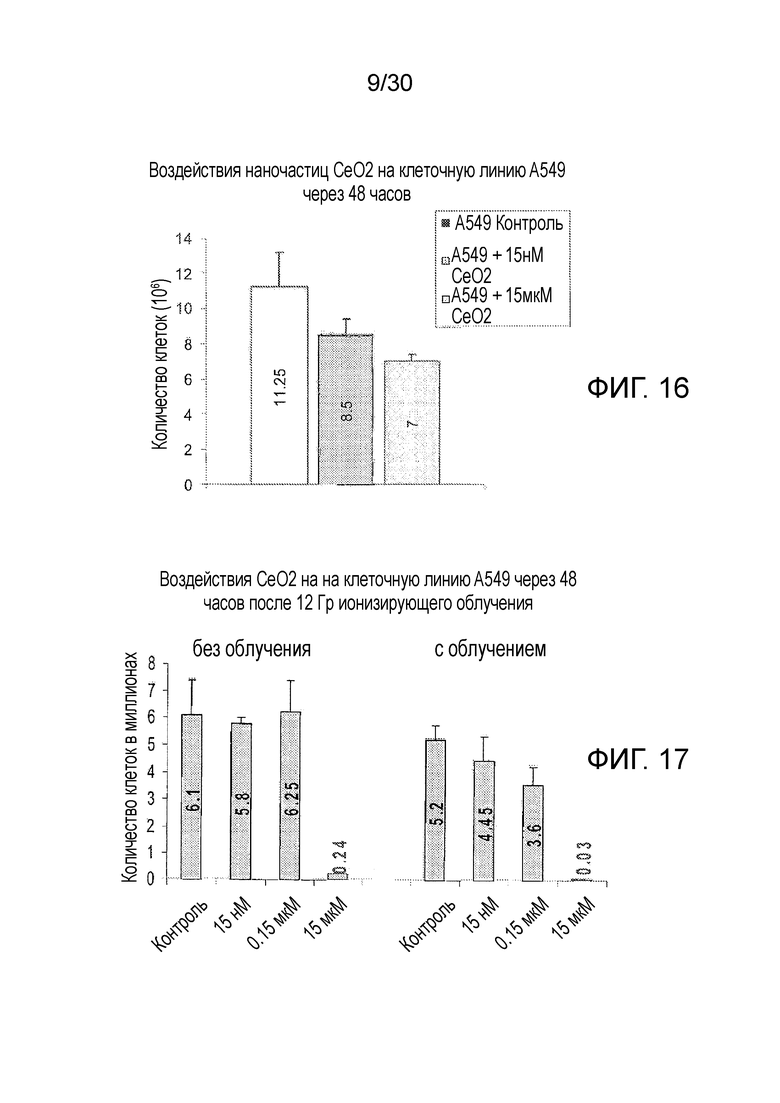
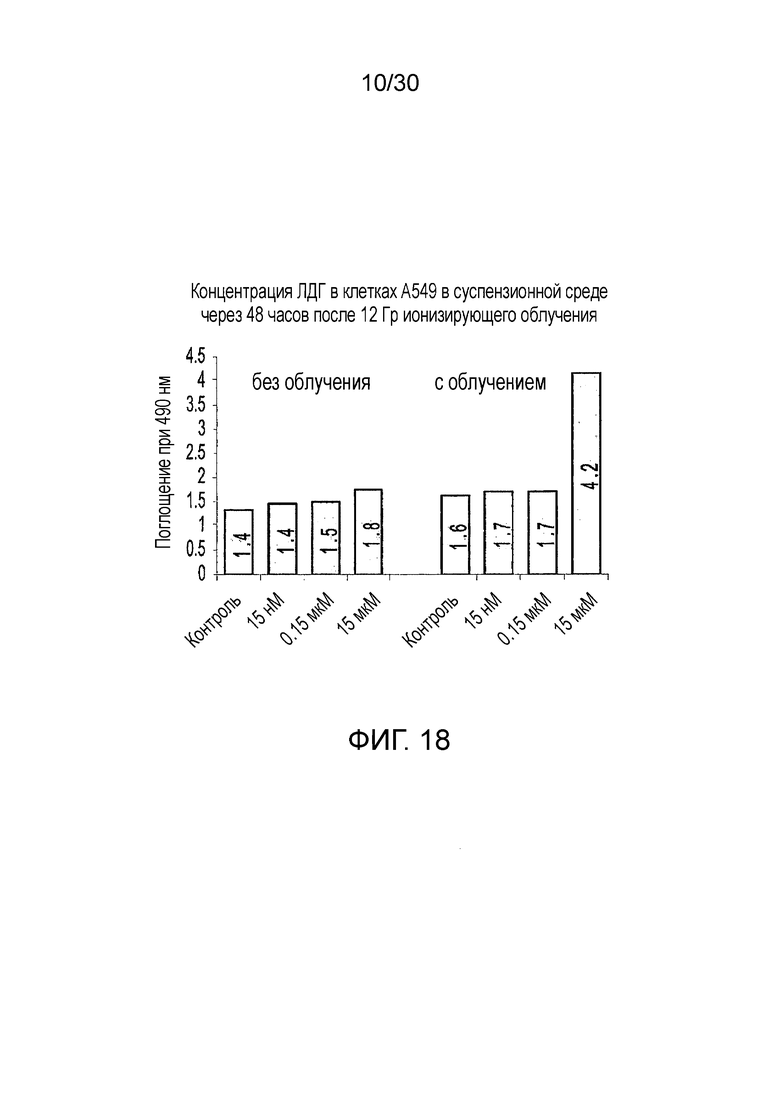
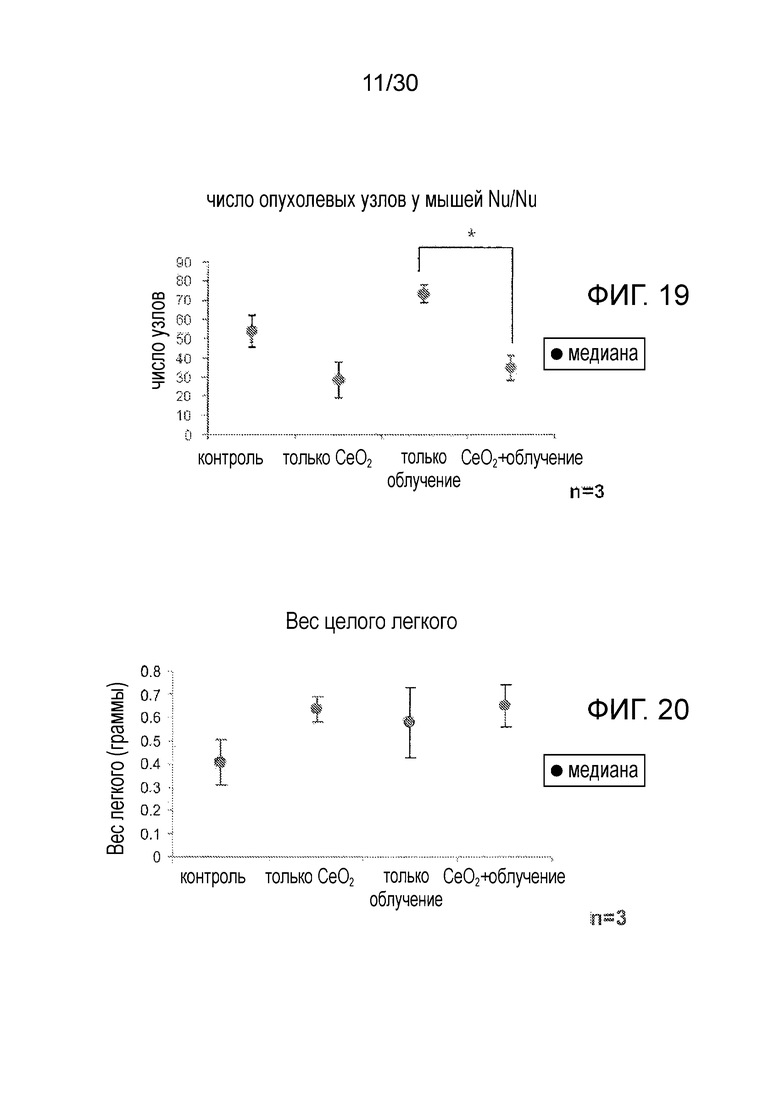
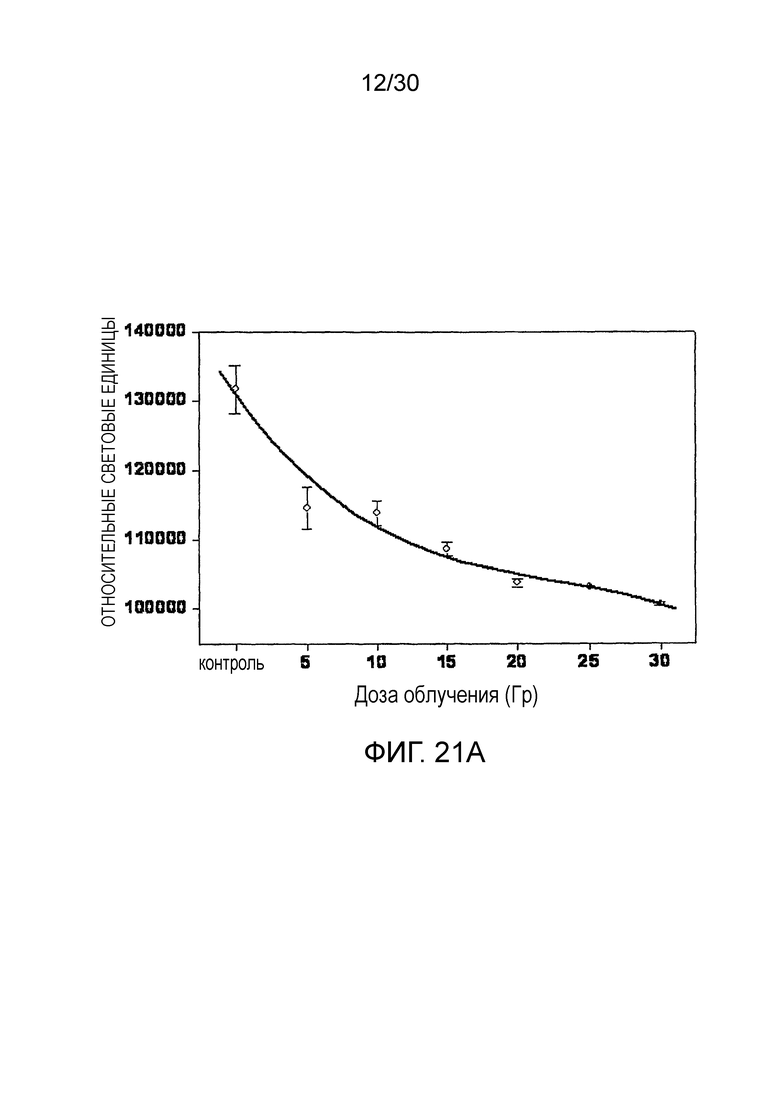
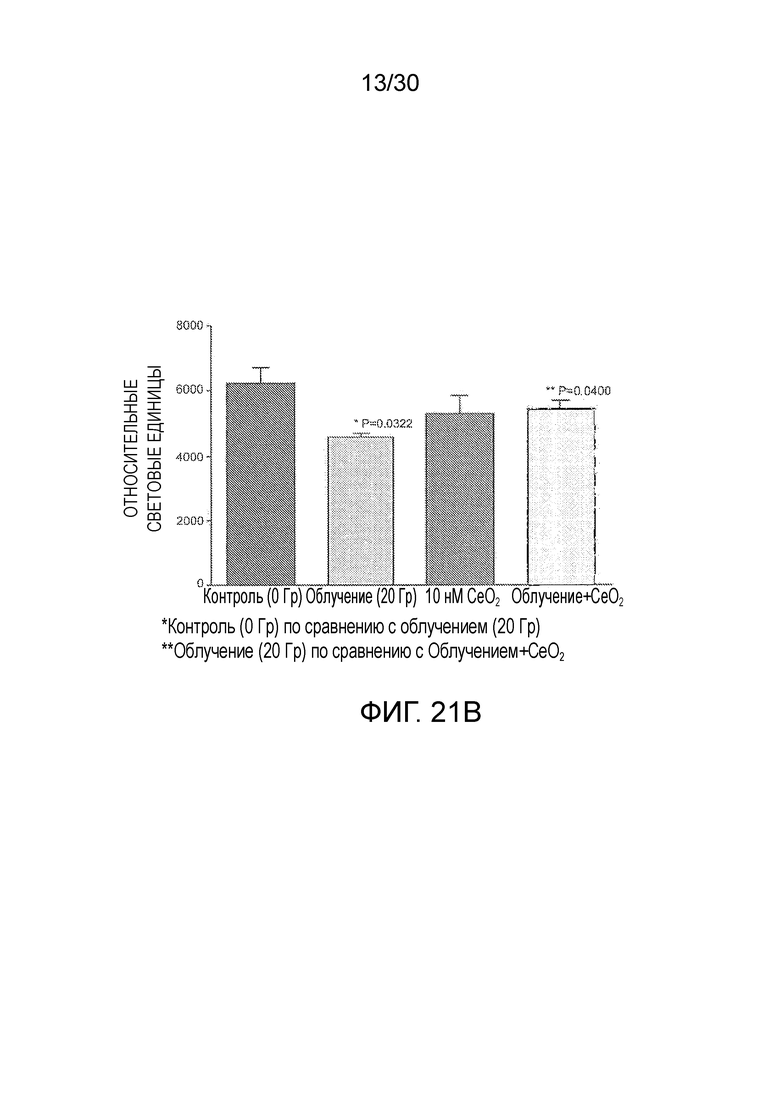
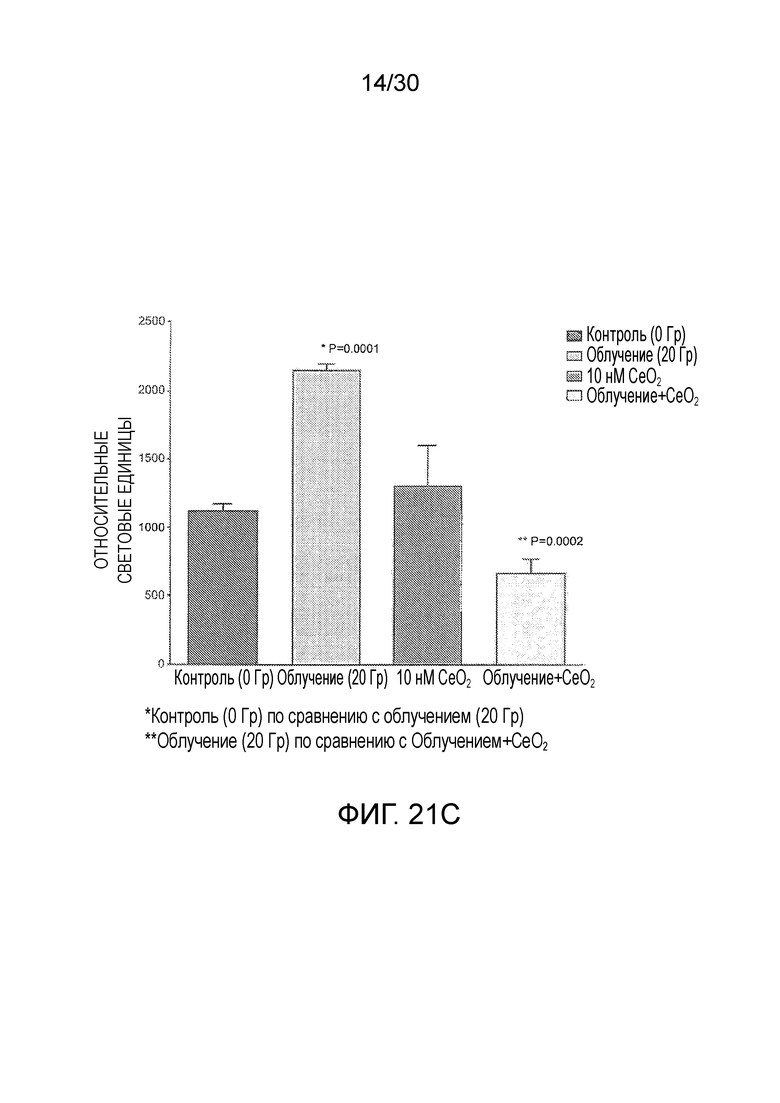
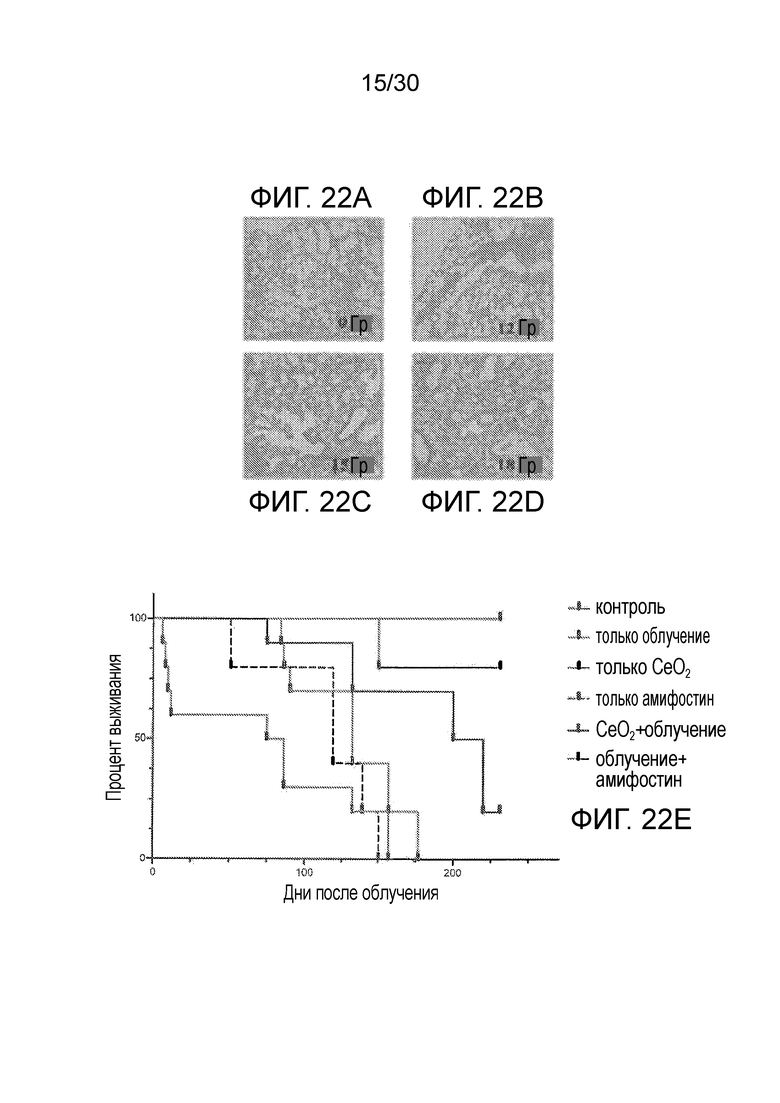
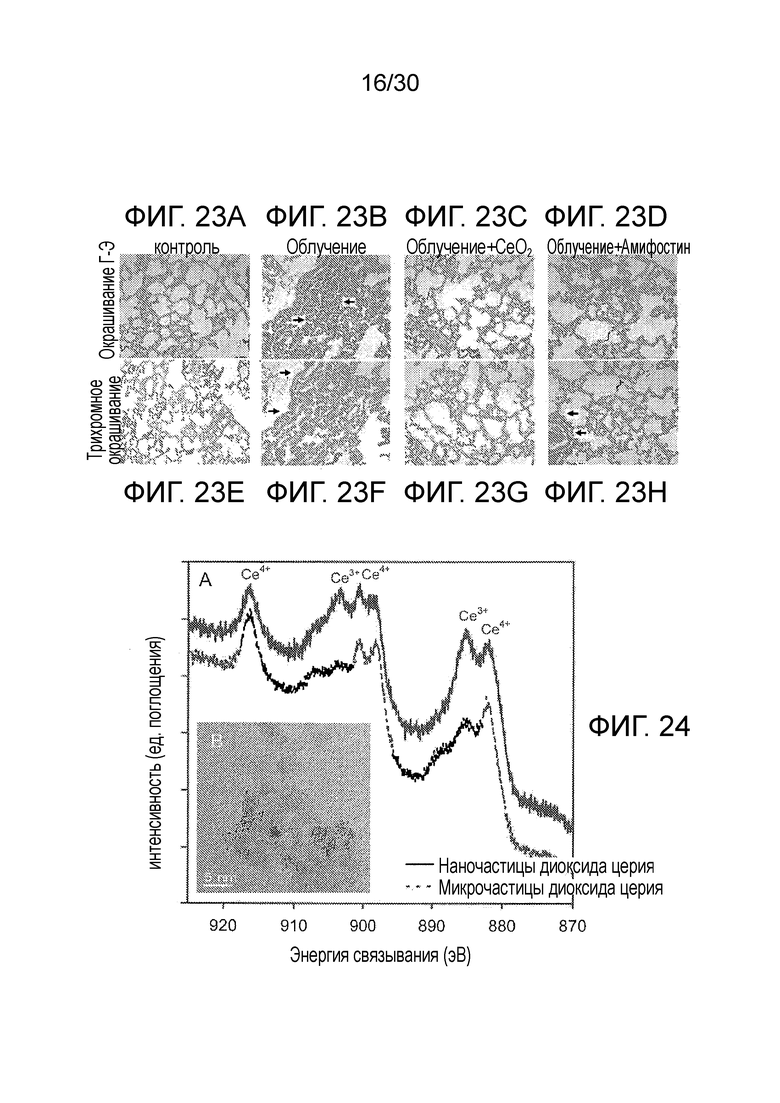
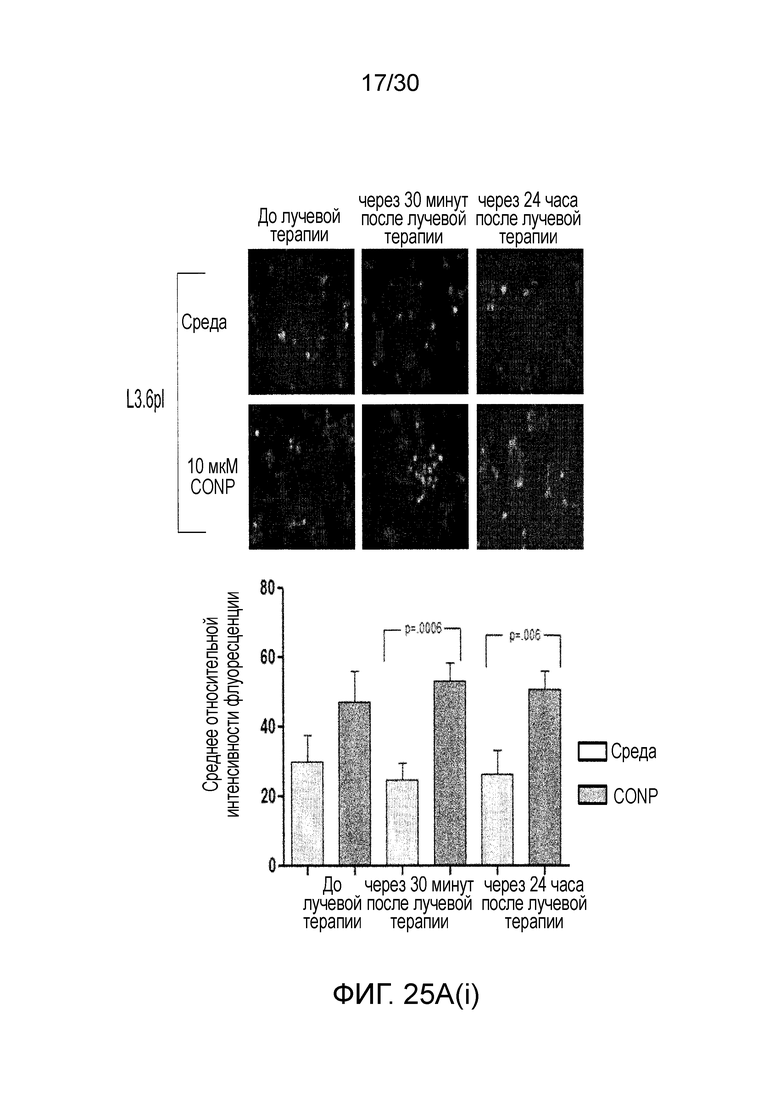
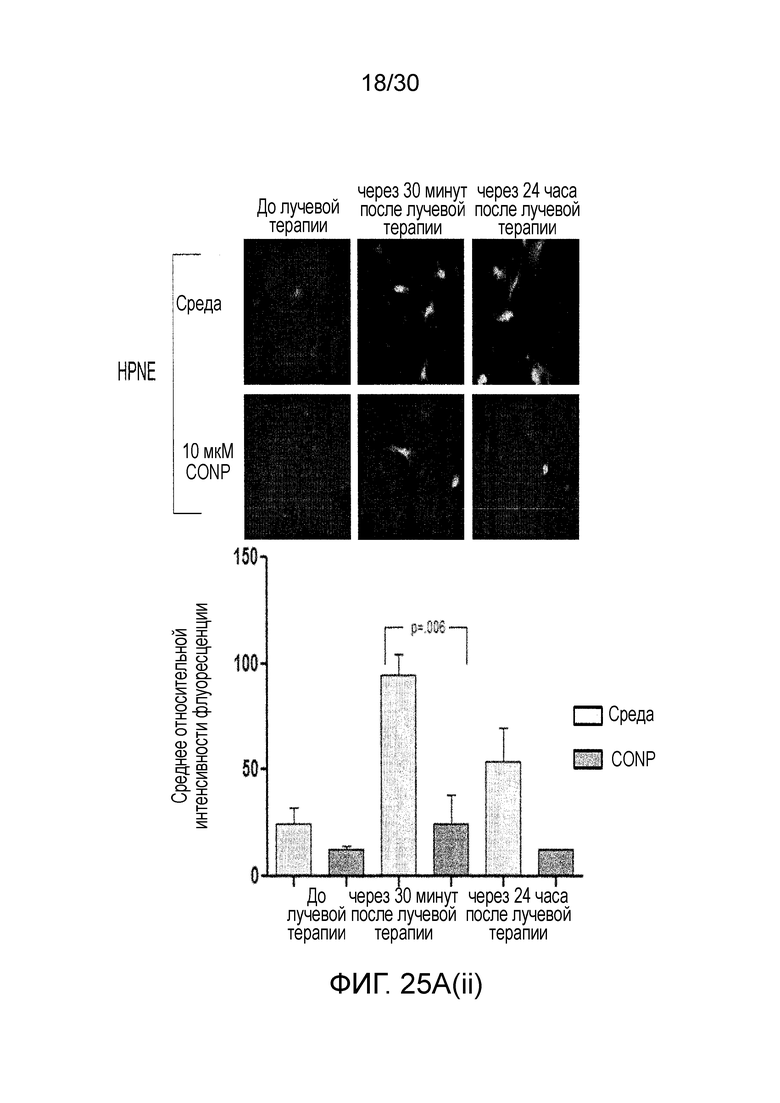
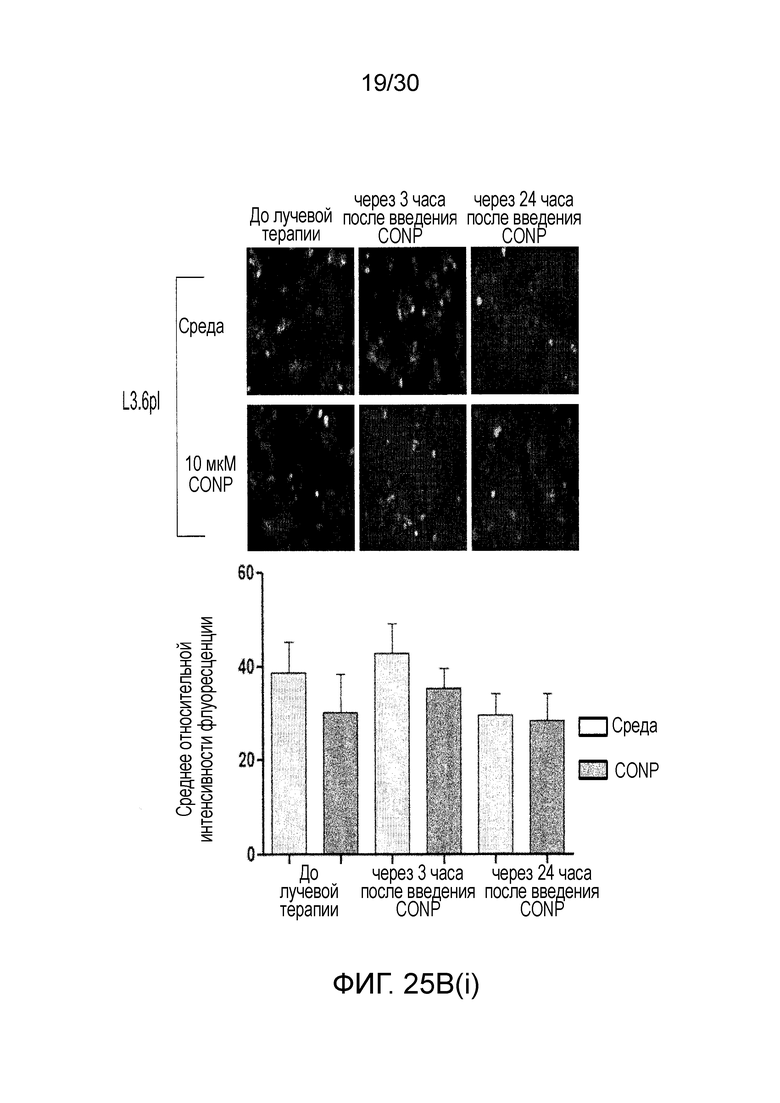
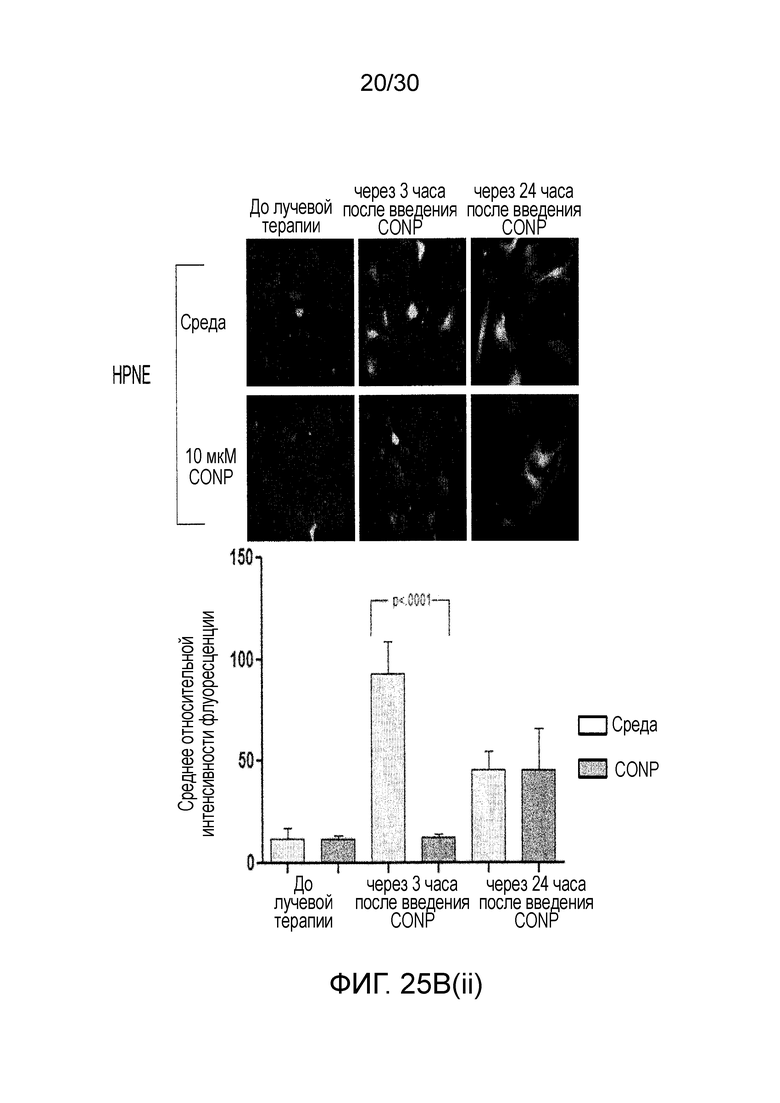
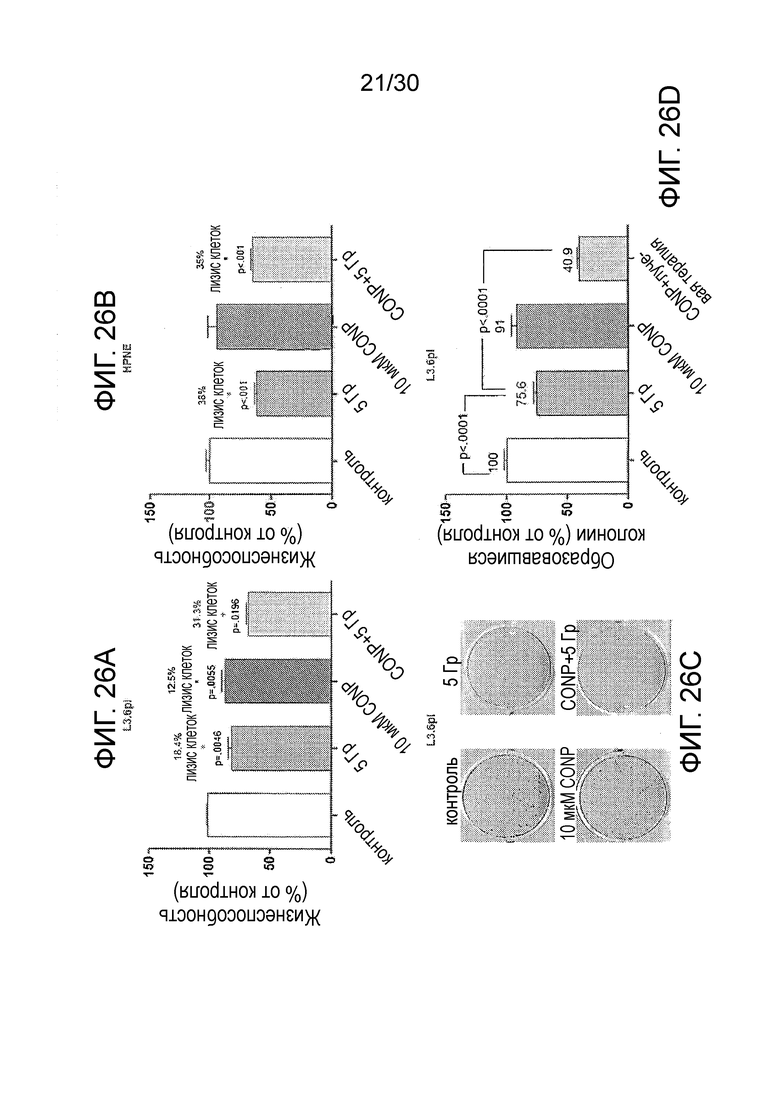

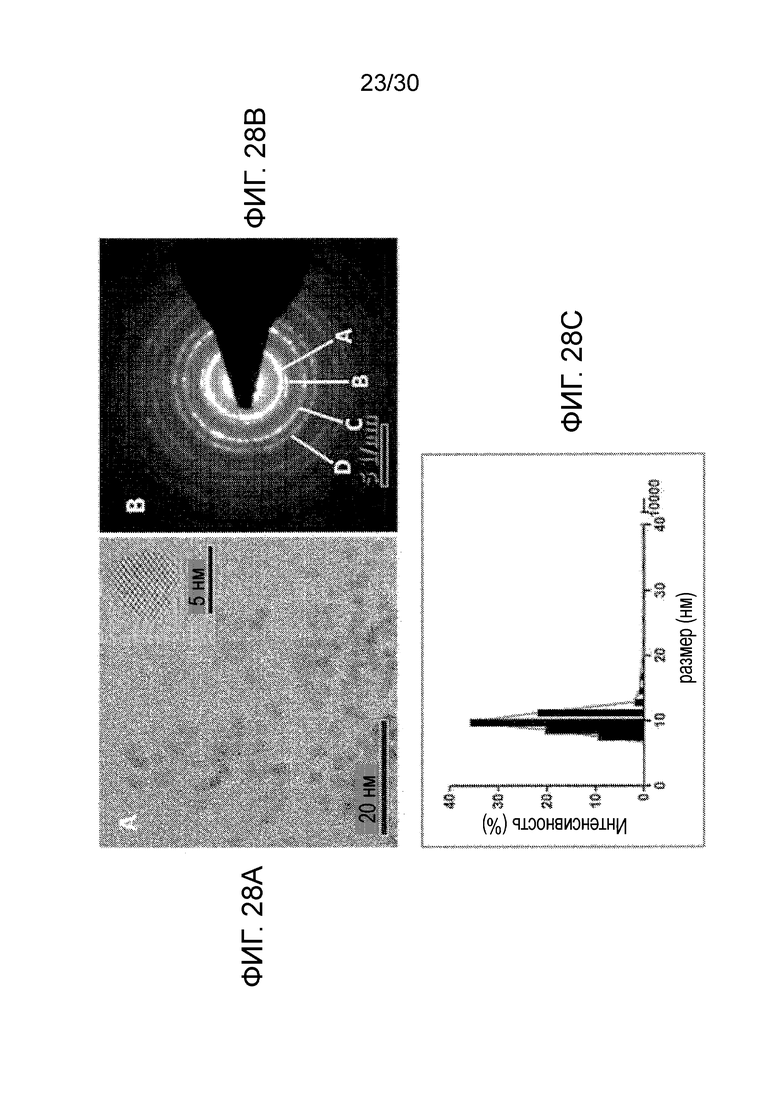
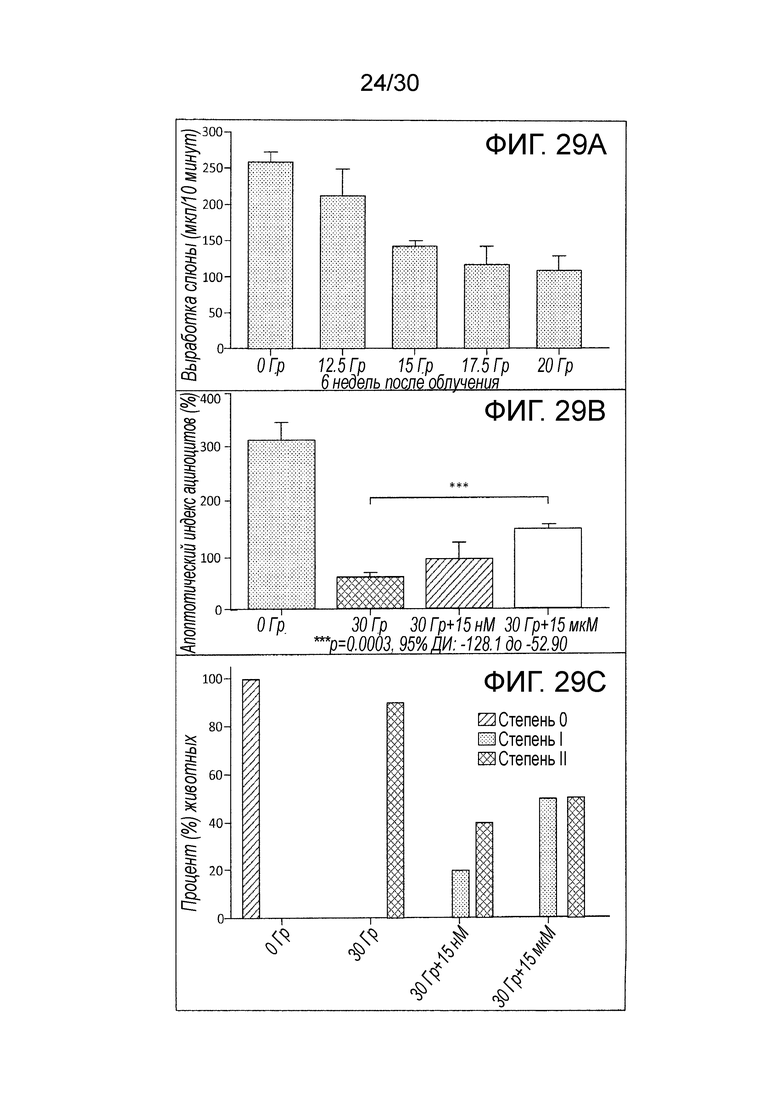
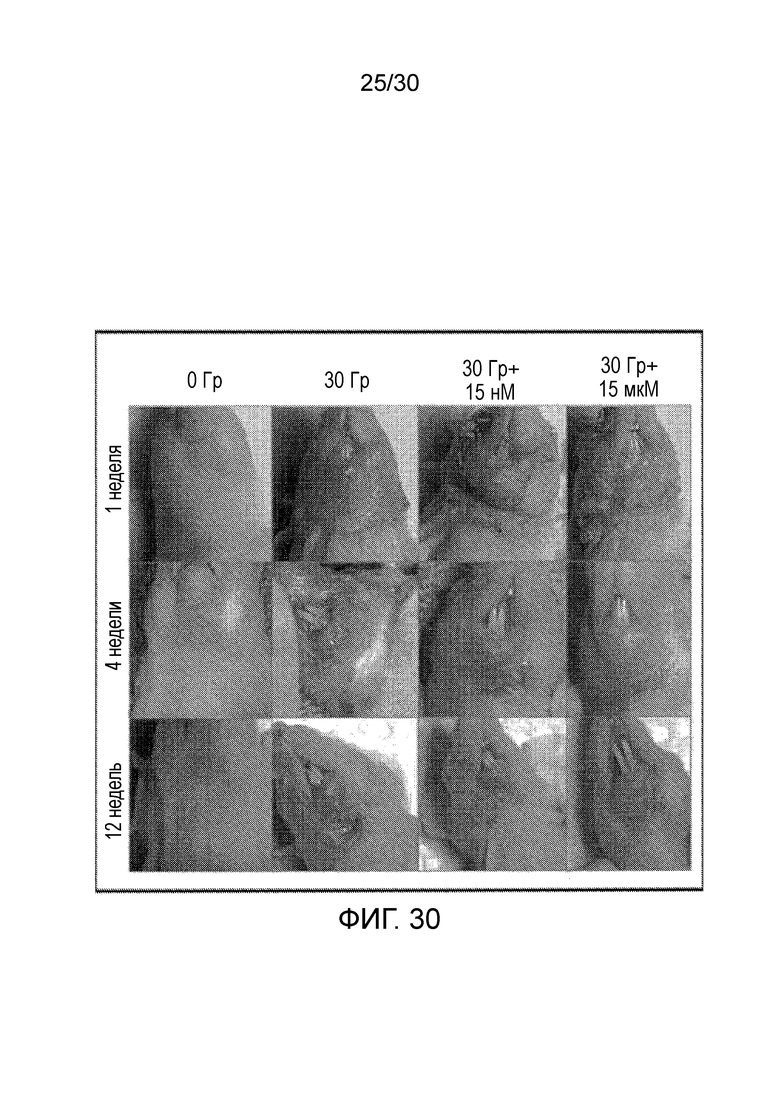
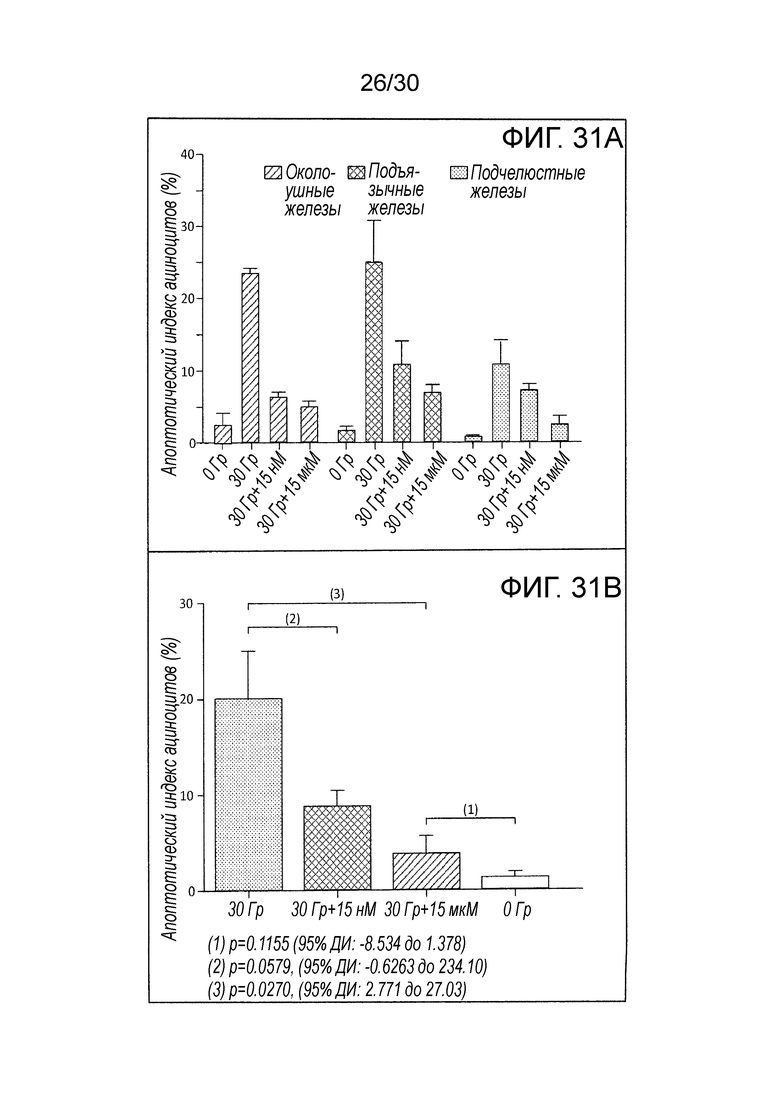
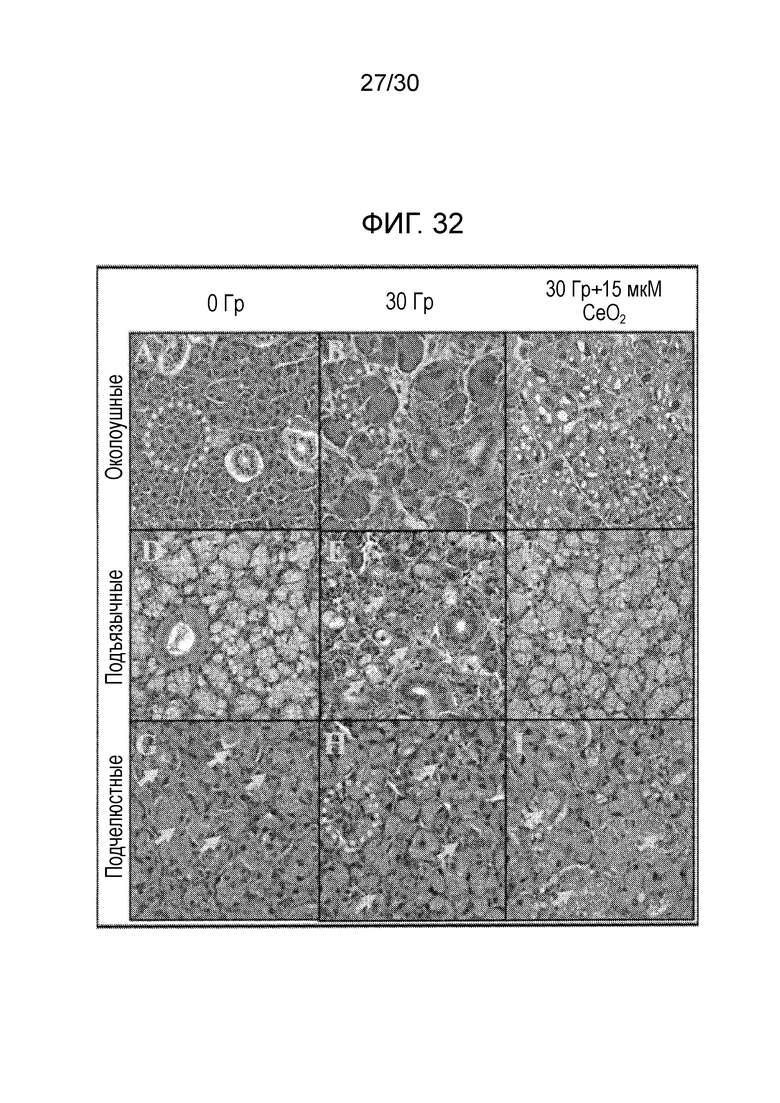
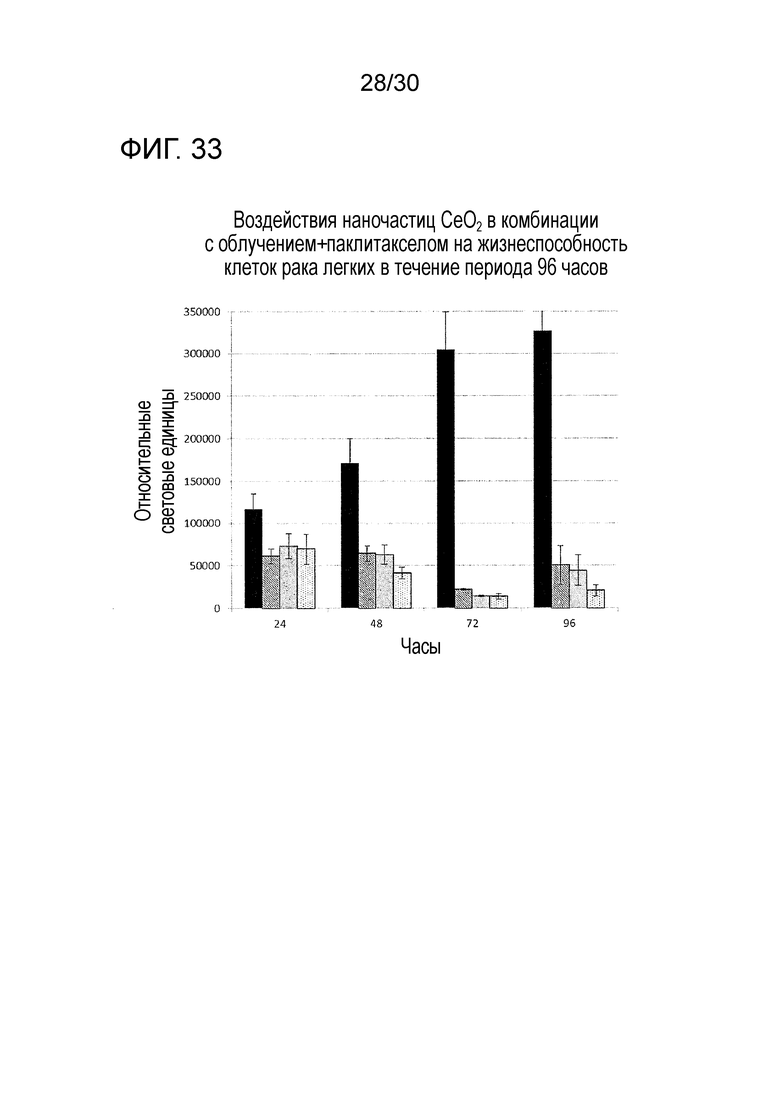

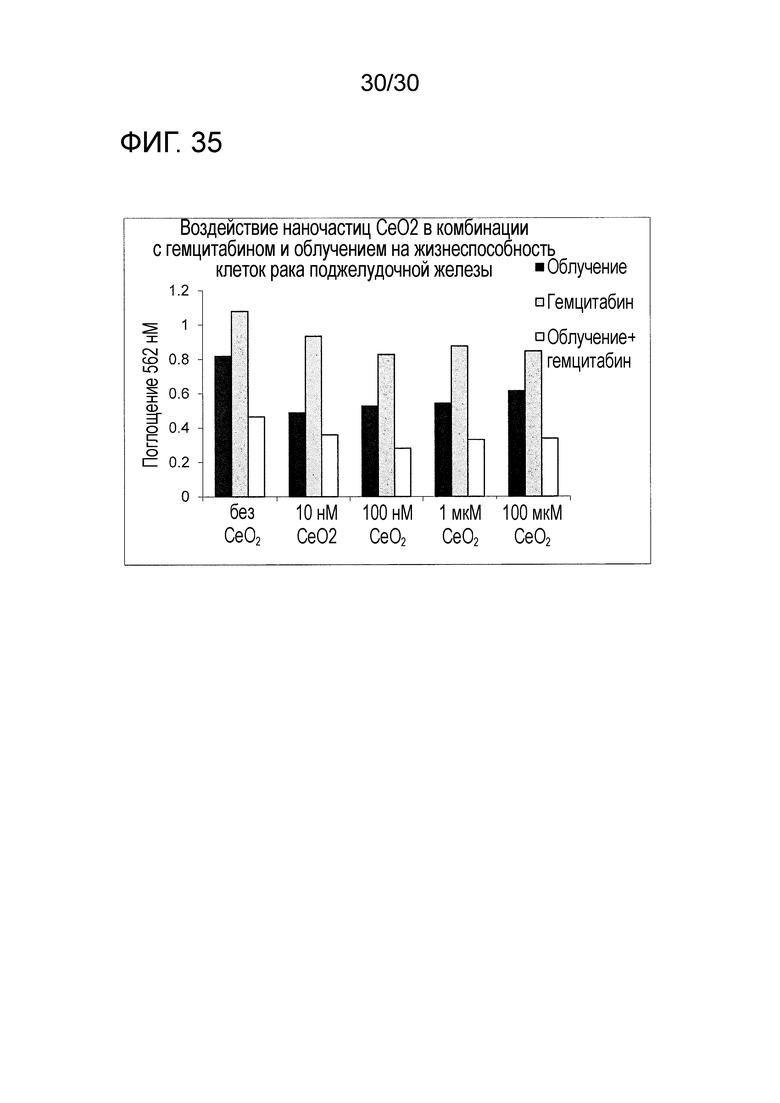
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована при лечении рака. Способы включают введение эффективной дозы наночастиц оксида церия (CONP) пациенту в сочетании с облучением и/или химиотерапевтическим средством. Использование изобретений позволяет повысить эффективность лечения за счет повышения чувствительности раковых клеток к лучевой терапии под действием CONP, уменьшения дозы лучевой терапии и химиотерапии, снижения токсичности, ассоциированной с лучевой терапией и химиотерапией. 2 н. и 23 з.п. ф-лы, 4 табл., 35 ил., 10 пр.
1. Способ лечения рака поджелудочной железы у нуждающегося в этом пациента, включающий: введение эффективной дозы наночастиц оксида церия пациенту, где эффективная доза наночастиц оксида церия (CONP) представляет собой дозу, которая уменьшает терапевтически эффективную дозу облучения и/или химиотерапевтического средства, по сравнению с терапевтически эффективной дозой облучения и/или химиотерапевтического средства в отсутствие наночастиц; введение терапевтически эффективной дозы облучения пациенту; и введение терапевтически эффективной дозы химиотерапевтического средства гемцитабина пациенту.
2. Способ по п. 1, где терапевтически эффективная доза облучения представляет собой дозу, которая убивает раковые клетки.
3. Способ по п. 1, где терапевтически эффективная доза гемцитабина представляет собой дозу, которая убивает раковые клетки.
4. Способ по п. 1, где доза облучения и/или гемцитабина составляет от 1% и до 90%, или от 1% и до 80%, или от 1% и до 70%, или от 1% и до 60%, или от 1% и до 50%, или от 1% и до 40%, или от 1% и до 30%, или от 1% и до 20%, или от 1% и до 10% или от (i) дозы, используемой в существующем стандарте лечения в отсутствие CONP или от (ii) эффективного количества для лечения опухоли в отсутствие CONP.
5. Способ по п. 1, где лучевую терапию проводят после введения наночастиц оксида церия.
6. Способ по п. 1, где лучевую терапию проводят перед введением наночастиц оксида церия.
7. Способ по п. 1, где гемцитабин вводят до наночастиц оксида церия и/или лучевой терапии.
8. Способ по п. 1, где гемцитабин вводят одновременно с наночастицами оксида церия и/или лучевой терапией.
9. Способ по п. 1, где гемцитабин вводят после наночастиц оксида церия и/или лучевой терапии.
10. Способ по п. 1, где наночастицы оксида церия имеют размер частиц от 1 нанометра до 20 нанометров.
11. Способ по п. 1, где наночастицы оксида церия имеют размер частиц от 3 нанометров до 15 нанометров.
12. Способ по п. 1, где наночастицы оксида церия имеют размер частиц от 3 нанометров до 10 нанометров.
13. Способ по п. 1, где наночастицы оксида церия имеют размер частиц от 3 нанометров до 5 нанометров.
14. Способ по п. 1, где эффективная доза наночастиц оксида церия составляет от 1 нанограмма на килограмм массы тела пациента до 50 миллиграммов на килограмм массы тела пациента; или от 1 нанограмма на килограмм массы тела пациента до 5 миллиграммов на килограмм массы тела пациента; или от 1 нанограмма на килограмм массы тела пациента до 0,5 миллиграммов на килограмм массы тела пациента; или от 10 нанограммов на килограмм массы тела пациента до 0,5 миллиграммов на килограмм массы тела пациента; или от 20 нанограммов на килограмм массы тела пациента до 100 микрограммов на килограмм массы тела пациента; или от 10 нанограммов на килограмм массы тела пациента до 10 микрограммов на килограмм массы тела пациента.
15. Способ по п. 1, где наночастицы оксида церия представлены в форме композиции, содержащей наночастицы оксида церия и фармацевтический носитель, где композицию с наночастицами оксида церия вводят путем местного, перорального, парентерального (например, внутривенного), буккального, сублингвального, назального, ректального введения, при помощи пластыря, помпы или трансдермального введения и композиция составлена соответствующим образом.
16. Способ по п. 1, где композиция с наночастицами оксида церия представляет собой композицию для местного введения.
17. Способ по п. 16, где композиция для местного введения содержит CONP, поверхностно-активное вещество, масло и воду.
18. Способ по п. 1, где композиция с наночастицами оксида церия представляет собой микроэмульсию.
19. Способ по п. 1, где общая концентрация наночастиц оксида церия в плазме крови пациента после введения составляет от 5 наномоль до 200 микромоль; или от 10 наномоль до 100 микромоль; или от 20 наномоль до 10 микромоль.
20. Способ снижения проявления токсического гепатита у пациента, который проходит лечение от рака, включающий:
(i) введение эффективной дозы CONP пациенту,
(ii) введение дозы лучевой терапии и/или паклитаксела.
21. Способ по п. 1 или 10, дополнительно включающий проведение хирургической операции в месте локализации злокачественной опухоли.
22. Способ по п. 21, где хирургическую операцию проводят в месте локализации злокачественной опухоли до проведения лучевой терапии.
23. Способ по п. 21, где хирургическую операцию проводят в месте локализации злокачественной опухоли после проведения лучевой терапии.
24. Способ по п. 21, где хирургическую операцию проводят в месте локализации злокачественной опухоли до введения химиотерапевтического средства.
25. Способ по п. 21, где хирургическую операцию проводят в месте локализации злокачественной опухоли после введения химиотерапевтического средства.
| US 20120093931, 19.04.2012 | |||
| US 20120282185, 08.11.2012 | |||
| US 20130004584, 03.01.2013 | |||
| А | |||
| Б | |||
| ЩЕРБАКОВ и др | |||
| Наноматериалы на основе диоксида церия: свойства и перспективы использования в биологии и медицине//Бiотехнологiя, 2011 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2019-10-31—Публикация
2015-07-17—Подача