ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к композициям и способам для лечения малярии. В особенности, данное изобретение относится к фармацевтическим композициям, включающим спиро- и диспиротриоксоланы, способам их применения и производства.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Малярия представляет собой острое, а зачастую и хроническое инфекционное заболевание, обусловленное присутствием относящихся к простейшим паразитов в красных кровяных клетках. Вызываемая одноклеточными паразитами рода Plasmodium малярия переносится от субъекта к субъекту через укус самки комара.
Хотя ранее малярия была широко распространена в Северной Америке и других областях мира с умеренным климатом, сегодня она в основном встречается в тропических и субтропических странах. Каждый год от 400 до 600 миллионов людей заражаются данной болезнью и от 1,5 до 2,7 миллионов умирают от нее.
В целом, за малярию ответственны четыре вида простейших паразитов Plasmodium, включая Plasmodium vivax, Plasmodium falciparum, Plasmodium malariae и Plasmodium ovale. Из четырех наиболее опасным является Plasmodium falciparum, являющийся причиной половины всех клинических случаев малярии и 90% смертей от данной болезни.
Передача малярии начинается, когда самка комара кусает человека, уже инфицированного малярийным паразитом. Если инфицированный комар кусает другого человека, спорозоиты со слюной комара переносятся в кровь, которая затем попадает в печень. В печени спорозоиты быстро делятся, затем поступают в кровоток, где они внедряются в красные кровяные клетки. Внутри указанных кровяных клеток мерозоиты быстро делятся до тех пор, пока они не вызовут разрушения красных кровяных клеток с высвобождением в кровоток нового поколения мерозоитов, которые затем инфицируют другие красные кровяные клетки.
Связанные с малярией симптомы, как правило, обусловлены разрушением красных кровяных клеток. В результате разрушения красных кровяных клеток происходит выброс в кровь загрязняющих веществ, токсина и других продуктов разрушения. Это, в свою очередь, вызывает сильный жар, который делает инфицированного субъекта изнуренным и обессиленным. Более тяжелые симптомы, связанные с повторяющимися инфекциями и/или инфекцией Plasmodium falciparum, включают анемию, тяжелые головные боли, судороги, делириозный синдром и, в некоторых случаях, смерть.
Лечение малярии является особенно сложным из-за способности малярийных паразитов развивать устойчивость к лекарственным средствам. Хинин - противомалярийное соединение, которое экстрагируют из коры южноамериканского хинного дерева, - является одним из наиболее старых и наиболее эффективных из существующих фармацевтических препаратов. Недостатком хинина является кратковременность действия и неспособность предотвратить рецидив заболевания. Кроме того, хинин обладает побочными эффектами, варьирующими от головокружения до глухоты.
Хлорохин является синтетическим химическим препаратом, подобным хинину. Он стал препаратом, избранным для лечения малярии, когда он был разработан в 1940-х годах благодаря его эффективности, простоте получения и, как правило, отсутствию побочных эффектов. Однако на протяжении нескольких последних десятилетий малярийные паразиты во многих областях мира стали устойчивыми к хлорохину.
Мефлохин является другим синтетическим аналогом хинина, применявшимся для лечения малярии. Однако у малярийных паразитов также развилась устойчивость и к мефлохину. Кроме того, в некоторых случаях мефлохин также имеет нежелательные побочные эффекты, связанные с центральной нервной системой, включая галлюцинации и образные ночные кошмары.
Антифолатные лекарственные средства действуют против малярийных паразитов, ингибируя их репродуктивные функции. Хотя у паразитов развивается устойчивость и к антифолатным лекарственным средствам, данные лекарственные средства еще можно эффективно использовать в сочетании с другими типами противомалярийных препаратов. Однако применение сочетанных терапий для лечения малярии имеет недостатки, а именно оно является неудобным и дорогим.
Разработки, проводимые в последнее время в области лечения малярии, включают применение пероксидной функциональной группы, присутствующей, например, в лекарственном средстве артемизинине, который содержит уникальный 1,2,4-триоксановый гетероциклический фармакофор. Противомалярийная активность артемизинина обусловлена его способностью взаимодействовать с железом молекул свободного гема малярийного паразита с образованием свободных радикалов, приводящих к разрушению клетки.
Открытие артемизинина (хингхаосу (qinghaosu)), встречающегося в природе эндопероксидного сесквитерпенового лактона (Meshnick et al., 1996; Vroman et al., 1999; Dhingra et al., 2000), положило начало интенсивным попыткам выяснить молекулярный механизм его действия (Jefford, 1997; Cumming et al., 1997) и идентифицировать новые противомалярийные пероксиды (Dong and Vennerstrom, 2001). Были получены многочисленные синтетические 1,2,4-триоксаны, 1,2,4,5-тетраоксаны и другие эндопероксиды.
Хотя применимые в клинике полусинтетические производные артемизинина являются быстродействующими и сильными противомалярийными средствами, они имеют несколько недостатков, включая возобновляемость заболевания, нейротоксичность (Wesche et al., 1994) и метаболическую нестабильность (White, 1994). Значительное количество данных соединений является весьма активным in vitro, но большинство из них обладает низкой активностью при пероральном применении (White, 1994; van Agtmael et al., 1999). Хотя позже были получены многочисленные противомалярийные 1,2,4-триоксаны (Cumming et al., 1996; Jefford, 1997), в данной области существует потребность в идентификации новых пероксидных противомалярийных агентов, особенно таких, которые можно легко синтезировать, которые не являются нейротоксичными и которые обладают улучшенными фармакокинетическими свойствами, например улучшенной стабильностью, абсорбцией при пероральном применении и др.
Соответственно, первой целью настоящего изобретения является предоставление композиций и способов, предназначенных для профилактики и лечения малярии с использованием спиро- и диспиро-1,2,4-триоксоланов.
Другой целью настоящего изобретения является предоставление композиции и способа, предназначенных для профилактики и лечения малярии с использованием нетоксичных спиро- и диспиро-1,2,4-триоксоланов.
Следующей целью настоящего изобретения является предоставление композиции и способа, предназначенных для профилактики и лечения малярии с использованием метаболически стабильных и активных при пероральном применении спиро- и диспиро-1,2,4-триоксоланов.
Очередной целью настоящего изобретения является предоставление композиции и способа, предназначенных для профилактики и экономически выгодного лечения малярии с использованием спиро- и диспиро-1,2,4-триоксоланов, которые не сопряжены с режимом лечения продолжительностью более чем 3 дня.
Следующей целью настоящего изобретения является предоставление композиций и способов, предназначенных для профилактики и лечения малярии с использованием спиро- и диспиро-1,2,4-триоксоланов, которые можно использовать либо как самостоятельные лекарственные средства, либо в сочетании с другими агентами.
Еще одной целью настоящего изобретения является предоставление новых промежуточных соединений для синтеза композиций, предназначенных для профилактики и лечения малярии.
Способ и средства осуществления каждой из упомянутых выше целей, также как и других, станут очевидны из приведенного ниже подробного описания изобретения.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение описывает способ и композицию для лечения малярии с помощью спиро- и диспиро-1,2,4-триоксоланов, их пролекарств и аналогов. Триоксоланы данного изобретения являются стерически затрудненными с одной стороны триоксоланового гетероцикла для обеспечения химической и метаболической стабильности триоксоланового цикла для лучшей активности in vivo. В одном воплощении спиро- и диспиротриоксоланы стерически затрудняют с помощью незамещенной, моно-, ди- или полизамещенной С5-С12-спироциклоалкильной группы, которая может являться спироадамантаном. В данном воплощении спиро- и диспиротриоксоланы могут включать спироциклогексил, который функционализирован или замещен по 4-положению или спиропиперидильное кольцо, которое функционализировано или замещено по атому азота. Еще в одном воплощении триоксоланы данного изобретения включают алкильный мостик от 4-положения спироциклогексильного цикла, связывающий заместитель, который наиболее предпочтительно представляет собой слабое основание. Изобретение охватывает ахиральные диастереомеры, рацемические смеси, а также энантиомерные формы соединений.
Триоксоланы данного изобретения обладают превосходной активностью и эффективностью против паразитов Plasmodium и низкой степенью нейротоксичности. Дополнительно некоторые триоксоланы являются пригодными как для перорального, так и неперорального введения. Кроме того, в сравнении с полусинтетическими производными артемизинина соединения данного изобретения являются простыми в структурном отношении, их легко и экономично синтезировать и они могут эффективно применяться отдельно или в сочетании с другими противомалярийными средствами.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВОПЛОЩЕНИЯ
Настоящее изобретение относится к разработке спиро- и диспиро-1,2,4-триоксоланов для применения в профилактике и лечении малярии. Настоящее изобретение основано на неожиданном открытии, что триоксоланы, которые являются относительно стерически затрудненными, по меньшей мере, по одной стороне триоксоланового гетероцикла, обеспечивают метаболическую и химическую стабильность триоксоланового цикла, таким образом обеспечивая лучшую активность in vivo, особенно по отношению к пероральному введению.
Как он использован в настоящем описании, термин "профилактически эффективное количество" относится к концентрации соединения данного изобретения, которая эффективна при ингибировании или профилактике инфекции и последующего заболевания, вызванного малярийными паразитами. Аналогично термин "лечебно-эффективное количество" относится к концентрации соединения, которая эффективна при лечении малярии с точки зрения предотвращения увеличения концентрации малярийных паразитов, уменьшения концентрации малярийных паразитов и/или "лечения" малярийной инфекции, т.е. обеспечения выживания в течение 30 дней после инфицирования.
Четырехзамещенные триоксоланы являются относительно стабильными пероксидными соединениями, исходя из предшествующей литературы (Griesbaum et al., 1997a; 1997b). Данный эффект может быть частично обусловлен недостатком α-водородных атомов. Авторы настоящего изобретения синтезировали новые соединения в классе триоксоланов, обладающие как превосходной противомалярийной активностью, так и эффективностью при пероральном введении. Кроме того, соединения данного изобретения имеют низкую токсичность, и периоды полураспада, пригодные для лечения малярии, которые, как полагают, позволяют осуществлять непродолжительные режимы лечения, что является благоприятным фактором при сравнении с другими лекарствами, подобными артемизинину. Данные соединения можно также применять для профилактики малярии.
В предыдущей заявке авторы настоящего изобретения раскрыли некоторые новые четырехзамещенные триоксоланы, имеющие следующую структурную формулу:

где R1, R2, R3 и R4 представляют комбинации циклических систем, ациклических систем и функциональных групп, которые обеспечивают достаточное стерическое затруднение вокруг триоксоланового цикла для придания циклу химической и метаболической стабильности. R1, R2, R3 и R4 могут быть одинаковыми или различными и могут представлять собой линейную или разветвленную алкильную, арильную и алкарильную группу, которая необязательно является замещенной. Альтернативно, R1 и R2, взятые вместе, и/или R3 и R4, взятые вместе, могут образовывать алициклическую группу, которая необязательно прерывается одним или несколькими атомами кислорода, серы или азота и является необязательно замещенной. Ни в каком случае любой из R1, R2, R3 или R4 не может представлять собой водород.
В одном воплощении соединения включают такие соединения, где R1 и R2, взятые вместе, и/или R3 и R4, взятые вместе, представляют собой моно- или дизамещенную C5-C12-спироциклоалкильную группу, которая необязательно прерывается одним или несколькими атомами кислорода, серы или азота и является необязательно замещенной. В другом воплощении R1 и R2, взятые вместе, или R3 и R4 представляют собой спироадамантан.
Настоящее изобретение раскрывает новое воплощение триоксолановых соединений, имеющих следующую структуру:
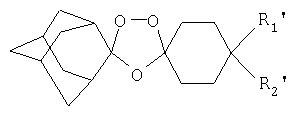
Спироциклогексильный цикл может необязательно прерываться одним или несколькими атомами кислорода, серы или азота. В данном случае R1' и R2' могут быть одинаковыми или различными и могут представлять собой водород, замещенные или незамещенные линейные или разветвленные алкильную, арильную и алкарильную группы, гидроксильную группу, галоген или замещенные либо незамещенные алициклические группы, или же замещенные или незамещенные ароматические или гетероциклические группы, где данные гетероароматические и гетероциклические группы содержат в цикле один или два атома, выбранных из кислорода, серы или азота. В одном воплощении R1' и R2' представляют собой функциональную группу, являющуюся амидом. Авторы неожиданно обнаружили, что амидсодержащие заместители по 4-положению обеспечивают противомалярийным соединениям хорошую абсорбцию при пероральном введении, хорошую противомалярийную активность и хорошую фармакокинетику, т.е. степени абсорбции, метаболизма и выведения, которые являются подходящими и благоприятными для профилактики и лечения малярии.
Еще в одном воплощении соединения данного изобретения имеют следующую структурную формулу:
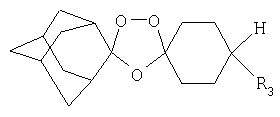
где R3 представляет собой (CH2)n-Y. В данной формуле Y представляет собой функциональную группу, которая в одном воплощении является не кислотной, а в еще одном воплощении является слабым основанием. Функциональная группа Y может представлять собой алкил, кетон, кислоту, спирт, амин, амид, сульфонамид, гуанидин, простой эфир, сложный эфир, оксим, мочевину, оксимный эфир, сульфон, лактон, карбамат, семикарбазон, фенил или гетероцикл. В одном воплощении n=1. Было обнаружено, что алкильная "мостиковая" группа улучшает метаболическую стабильность (т.е. пероральную активность и фармакокинетику) противомалярийных соединений по данному изобретению.
В еще одном воплощении данного изобретения такие триоксолановые соединения представляют собой слабые основания, которые предоставляют идеальное сочетание высокой характеристической активности и хорошей пероральной активности. Два перспективных структурных подтипа триоксолана представляют собой слабоосновные амиды, образуемые амином триоксолана OZ209 и триоксолановой кислотой OZ78. Данные соединения имеют одну из следующих двух структурных формул:

Возможны также другие заместители по 4-положению спироциклогексильного цикла, которые попадают в объем данного изобретения. Спироциклогексильный цикл может также быть замещен по другим положениям, кроме 4-положения. Например, авторы синтезировали несколько соединений, замещенных по 2-положению спироциклогексильного цикла, которые проявляют превосходную противомалярийную активность.
В еще одном воплощении предпочтительные соединения данного изобретения включают алкильную группу, связывающую заместитель по 4-положению со спироциклогексильным циклом. В одном воплощении алкильная группа представляет собой метил или этил. Еще в одном воплощении алкильная группа с метилом представляет предпочтительный вариант. Алкильная "мостиковая" группа, также непосредственно присоединенная к 4-положению, улучшает метаболическую стабильность (т.е. пероральную активность и фармакокинетику) спироциклогексильного цикла противомалярийных соединений данного изобретения.
Авторы настоящего изобретения идентифицировали два активных при пероральном введении ведущих диспиро-1,2,4-триоксолана, OZ03 и OZ05:
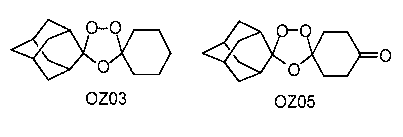
Данные триоксоланы имеют значения IC50S против P. Falciparum in vitro между 1 и 5 нг/мл и, по-видимому, обладают хорошими терапевтическими показателями при том, что не наблюдали очевидной токсичности для соединений как на клеточной линии нейробластомы, так и при однократных дозах 640 мг/кг на мышах в тесте Рэйна. Данные результаты противоречат опубликованным данным (de Almeida Barbosa et al., 1992; 1996), раскрывающим слабую противомалярийную активность in vitro для нескольких трициклических триоксоланов, лучший из которых имел значение IC50 против P. Falciparum in vitro, равное 2000 нг/мл.
Отличительным признаком данных триоксоланов в сравнении с полусинтетическими производными артемизинина является их структурная простота. Возможным преимуществом триоксоланов перед как триоксанами (Jefford, 1997; Cumming et al., 1997), так и тетраоксанами (Vennerstrom et al., 2000) является более удобный доступ к структурно разнообразным, несимметричным и, во многих случаях, ахиральным соединениям.
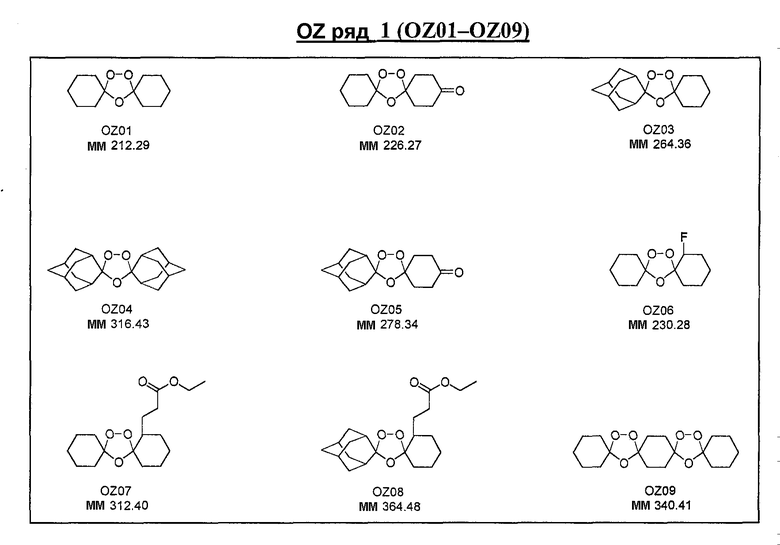
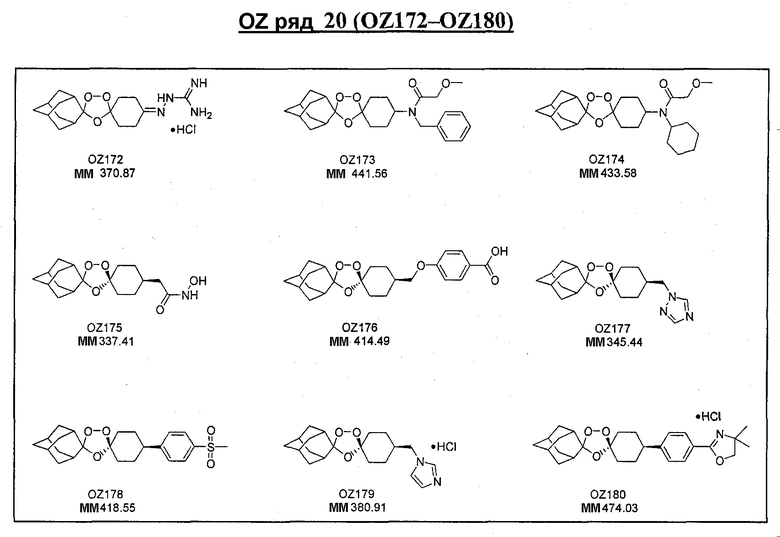
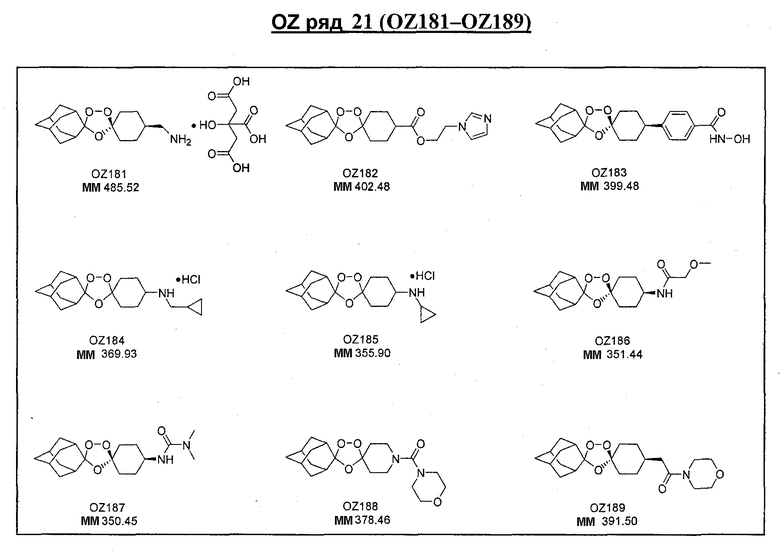
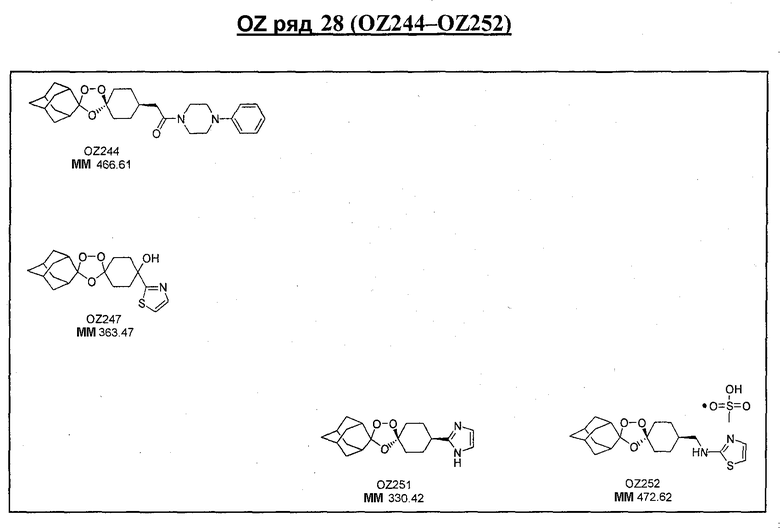
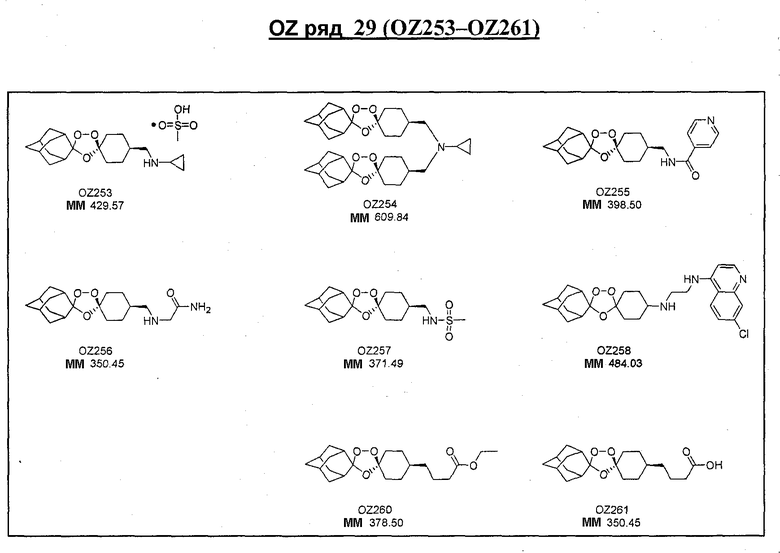
Ниже приведены некоторые диспиро-1,2,4-триоксоланы, синтезированные в соответствии с указаниями данного изобретения. "OZ" является внутренним обозначением для данных соединений, которое будет использовано во всей остальной части заявки для удобства.
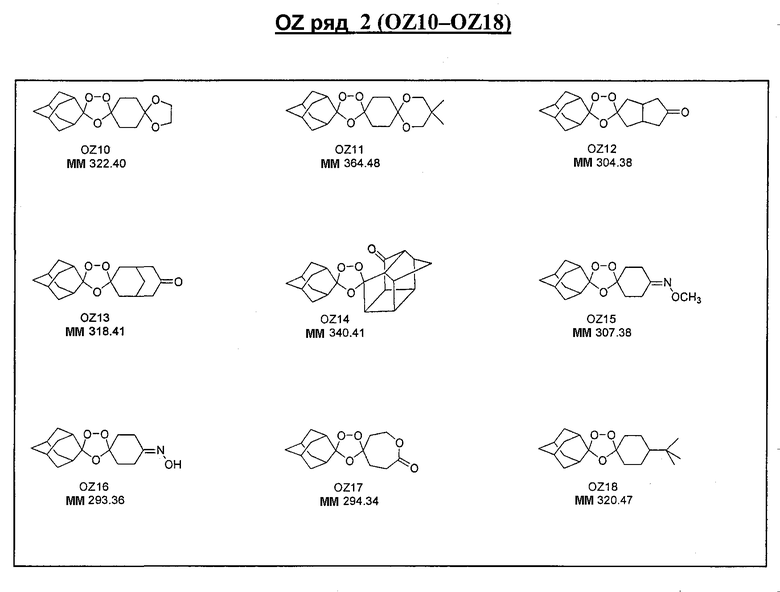
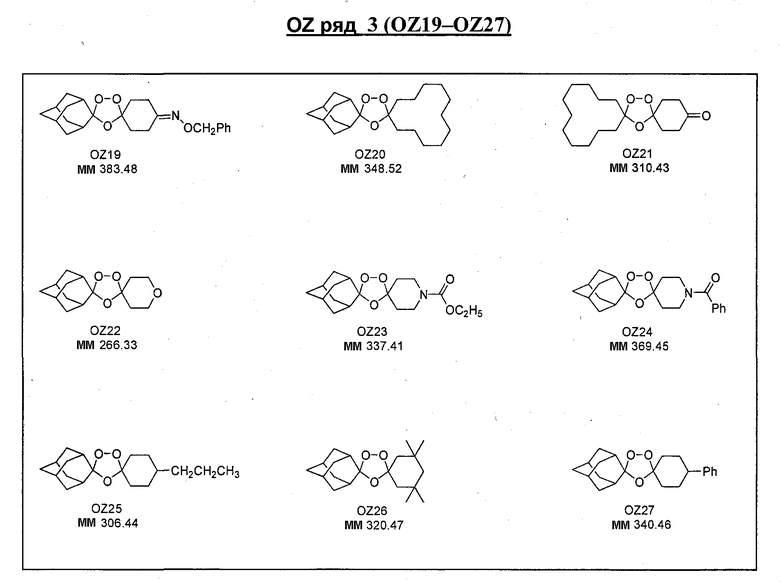
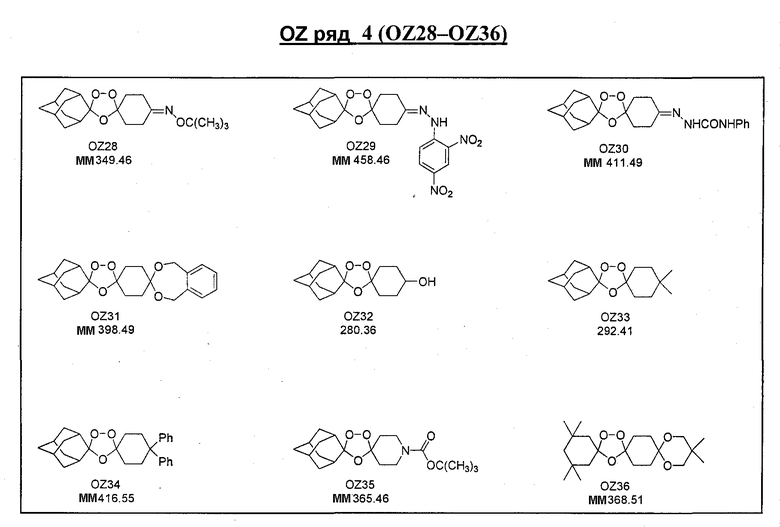
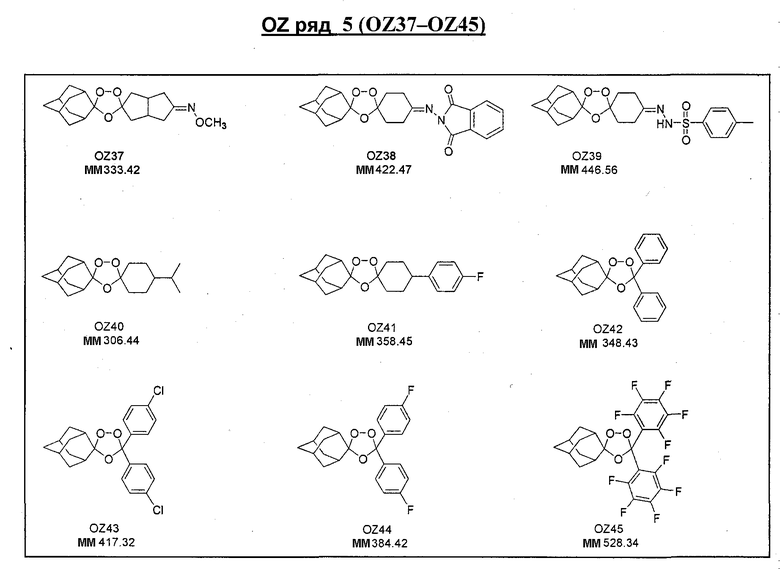

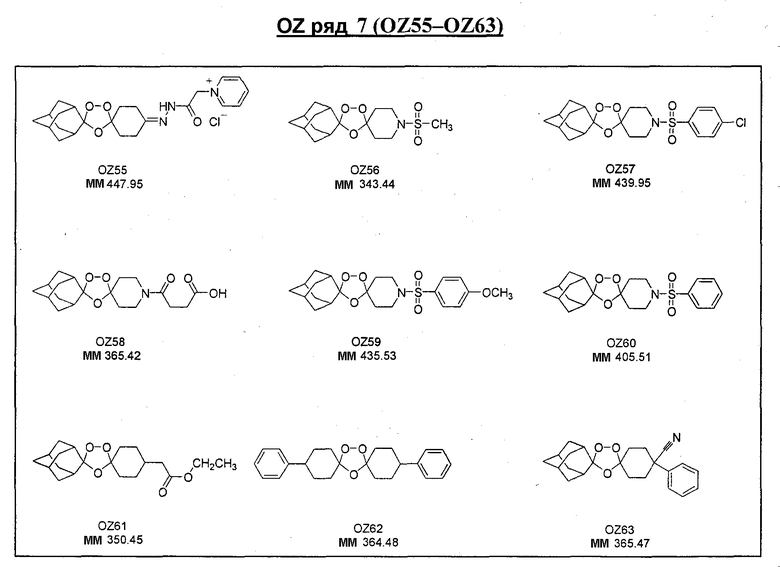
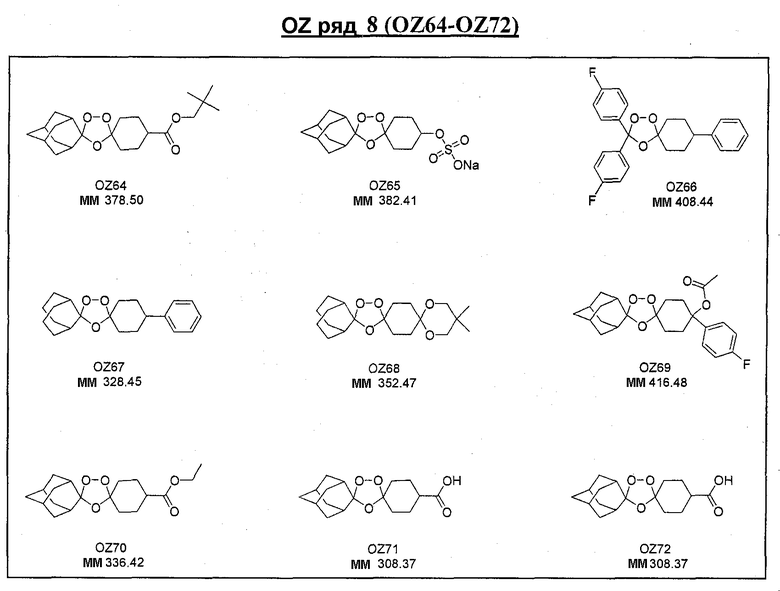
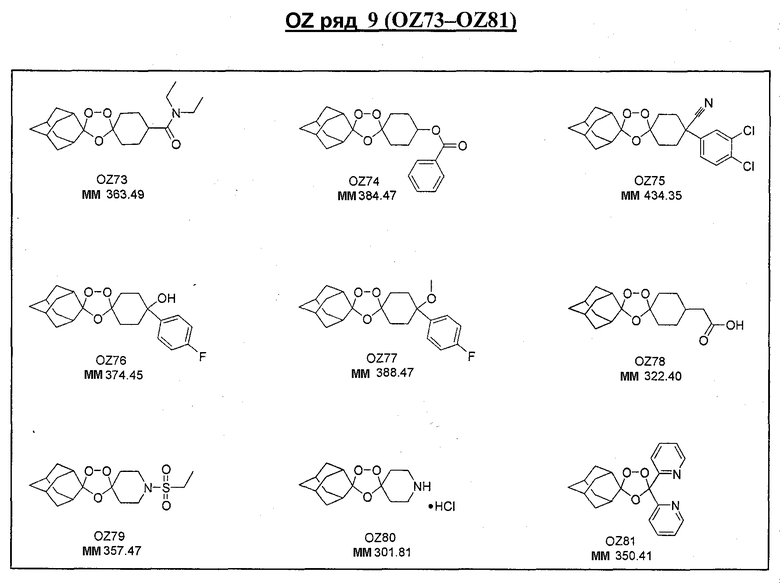
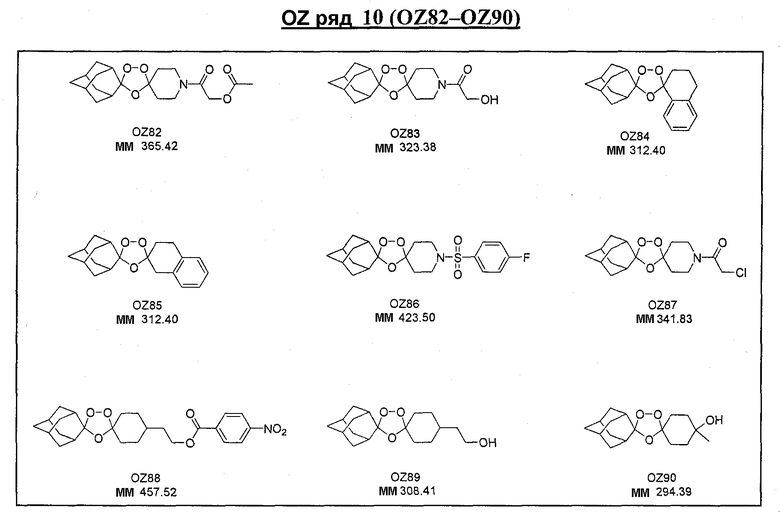
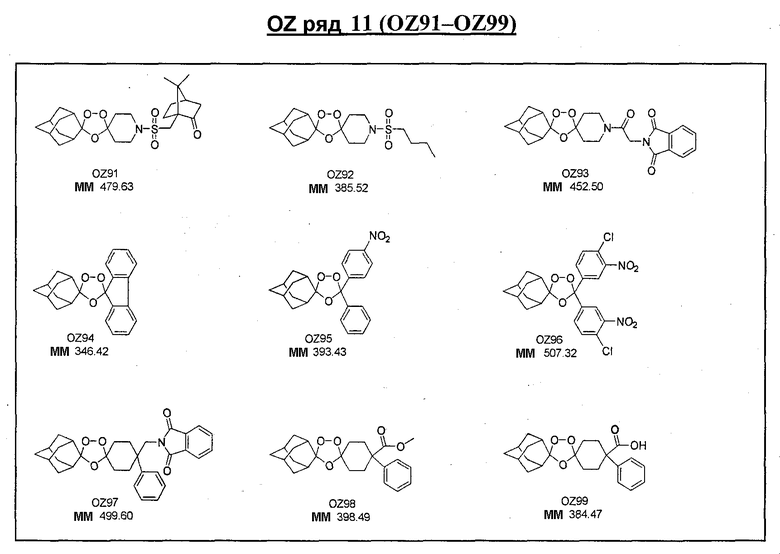
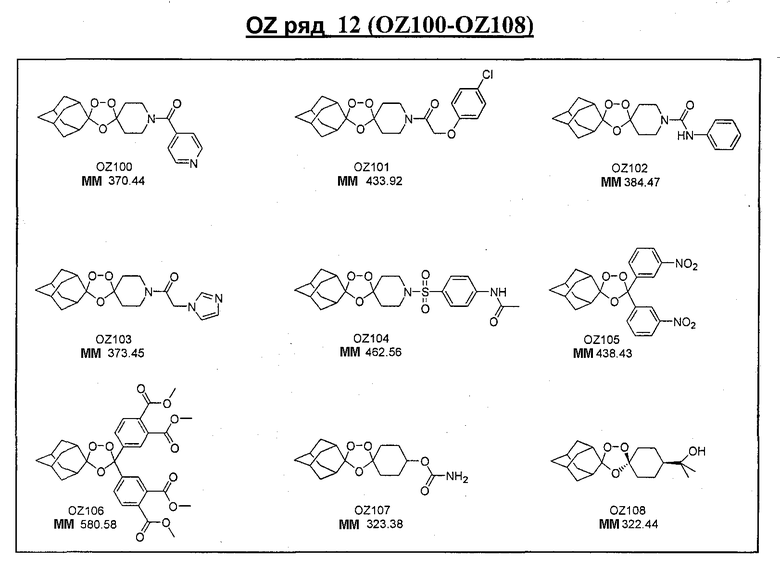
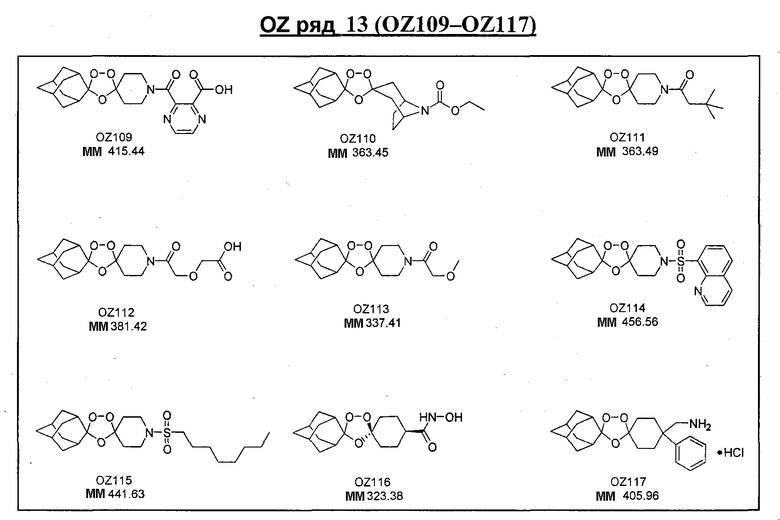
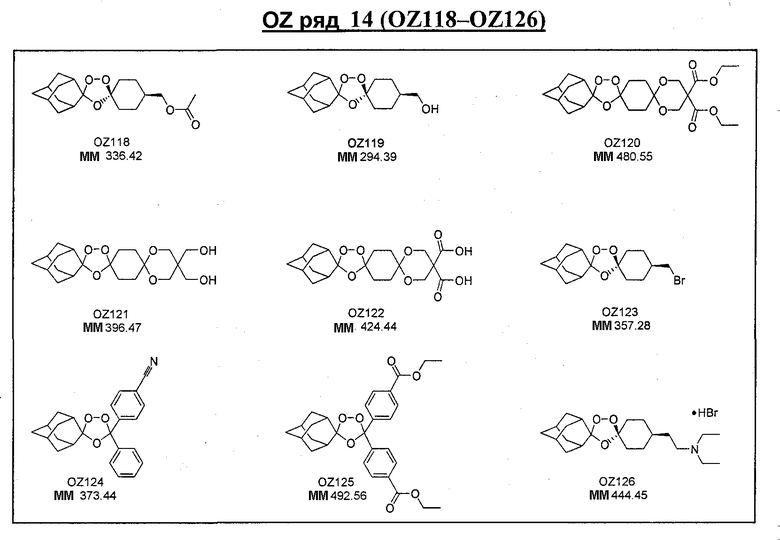
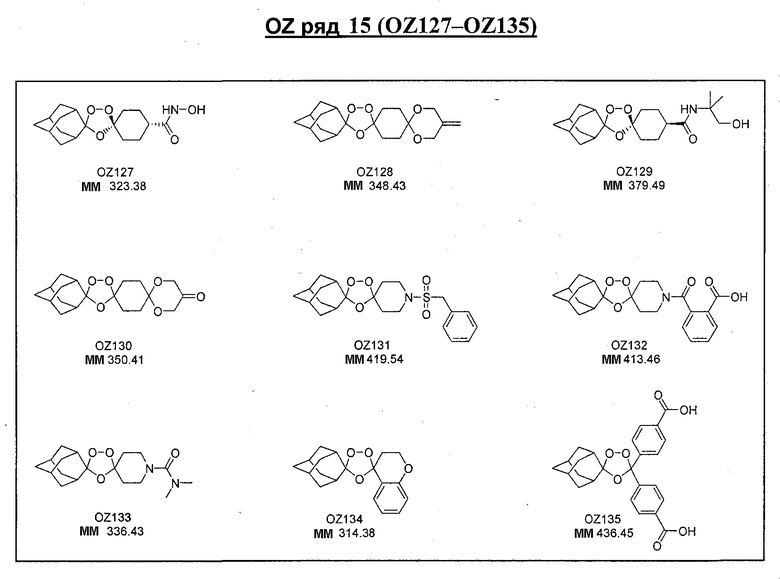

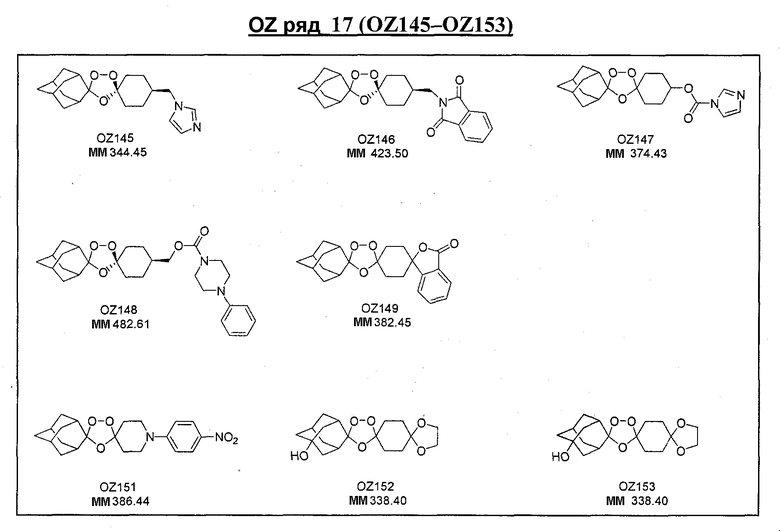
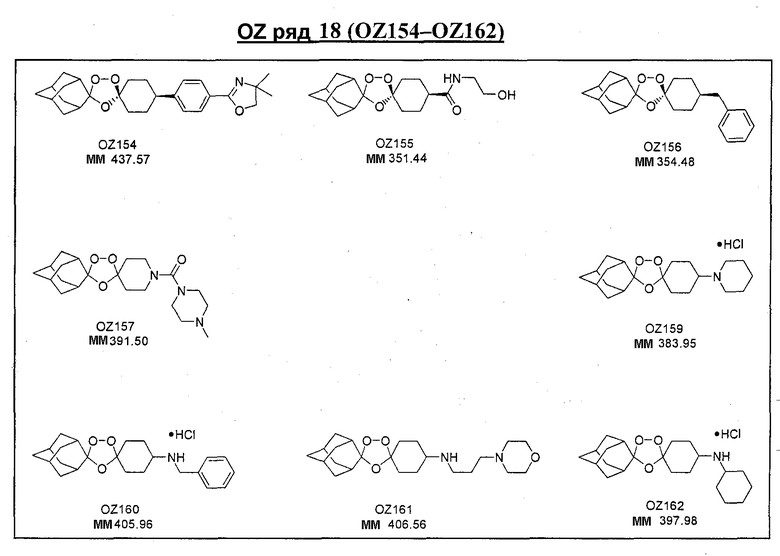
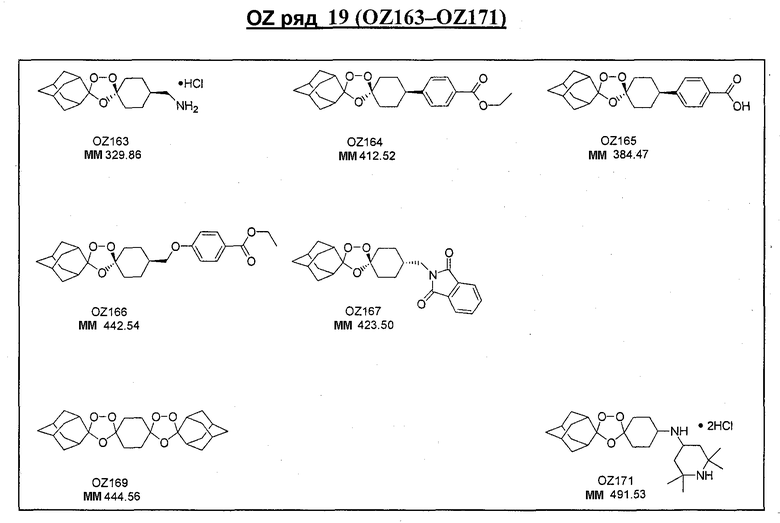






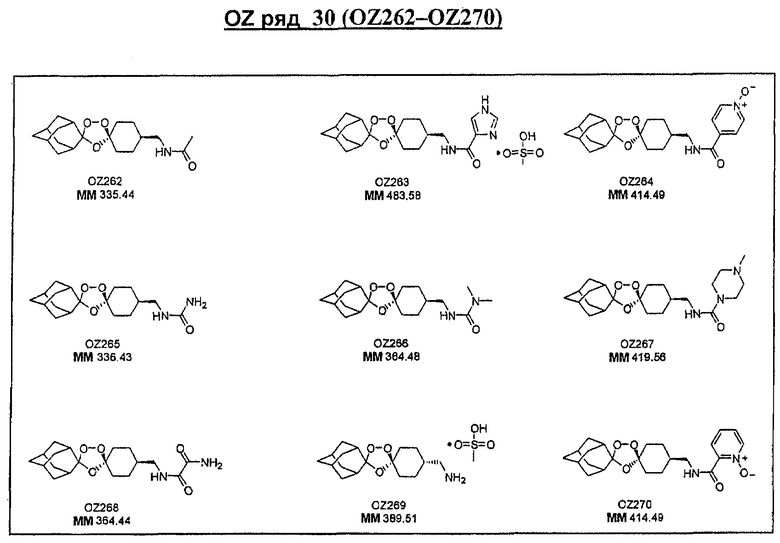
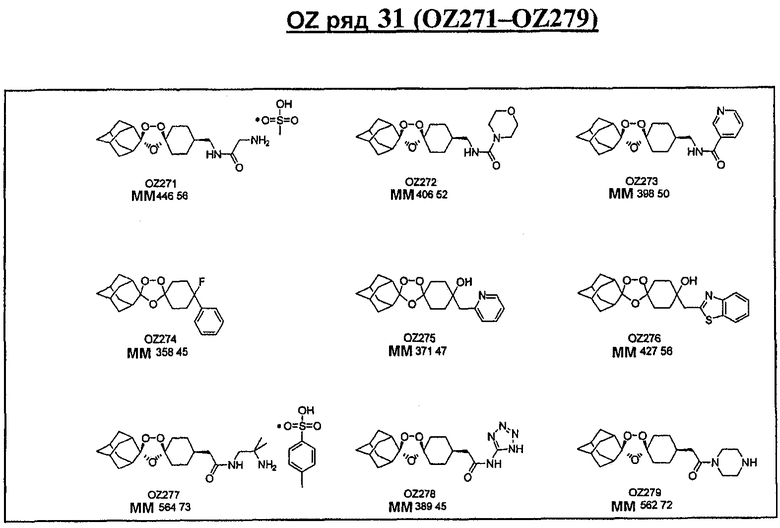

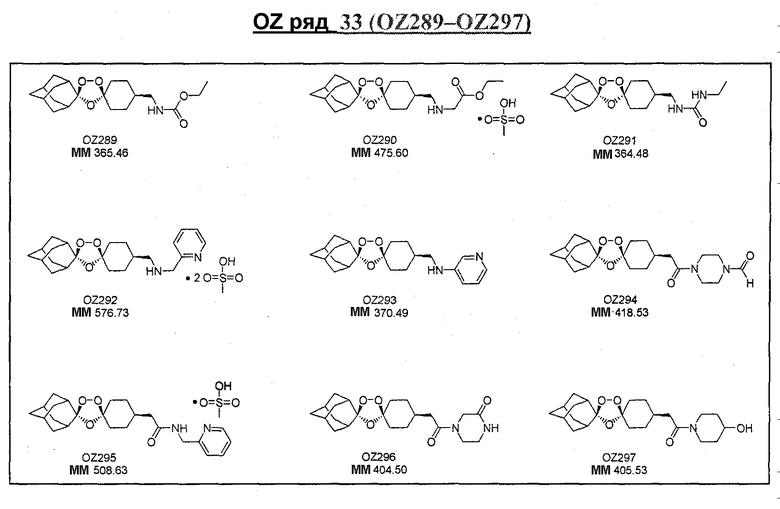
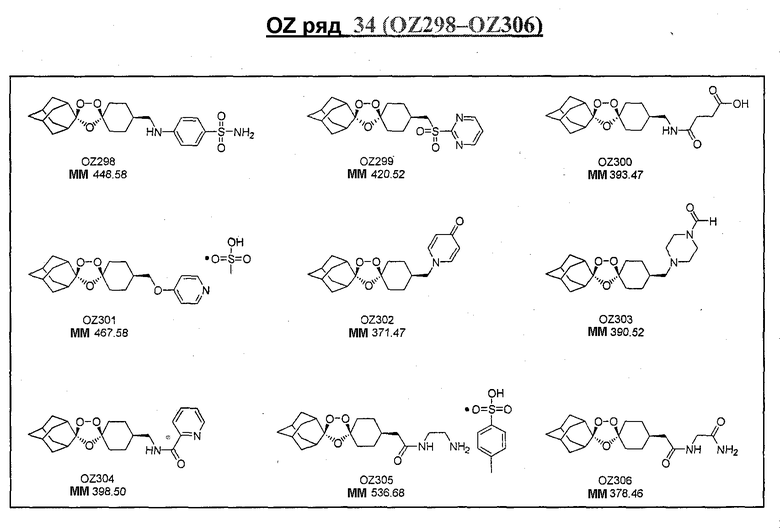
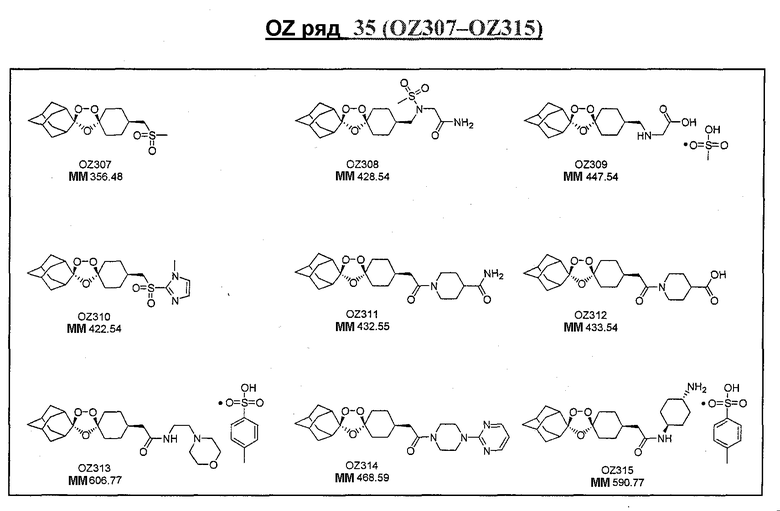
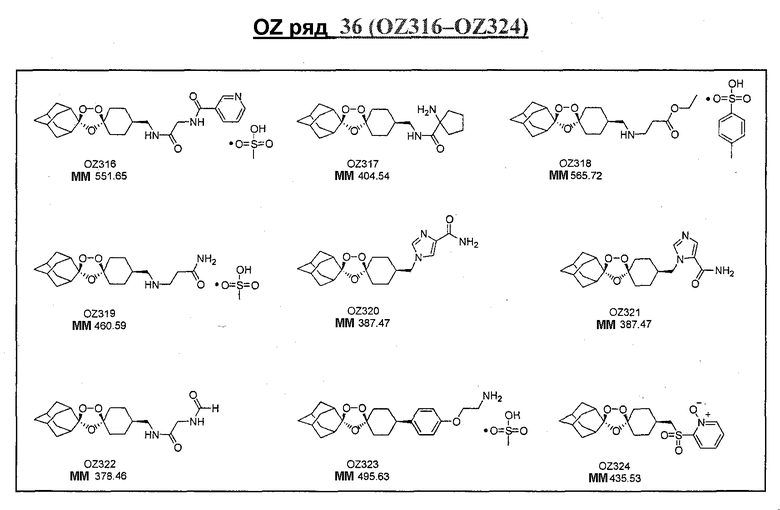 \
\
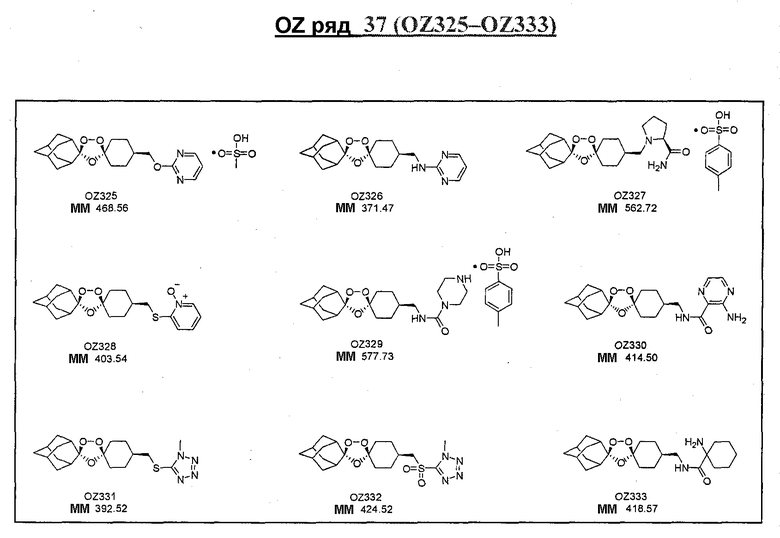
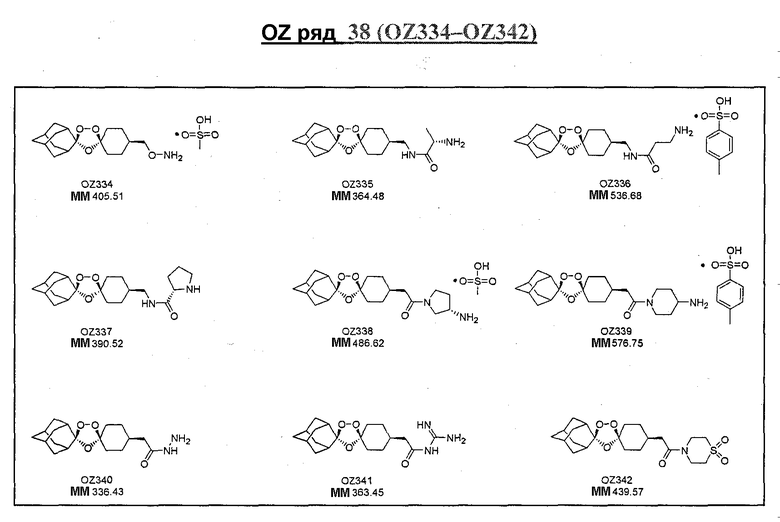
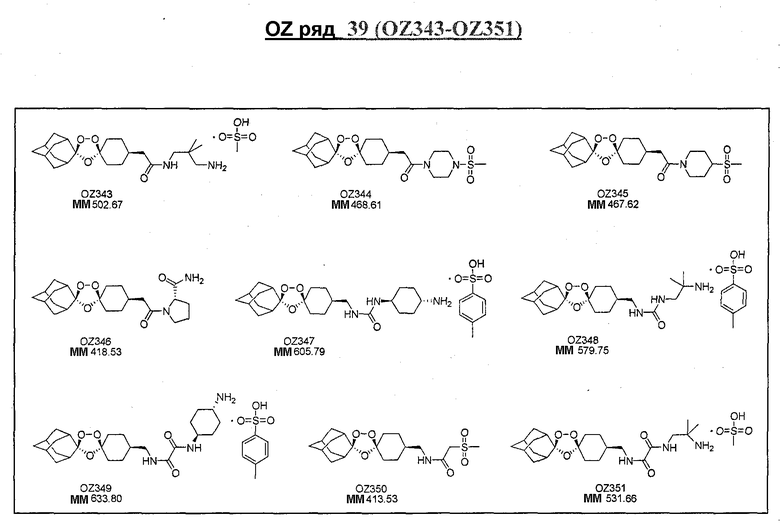
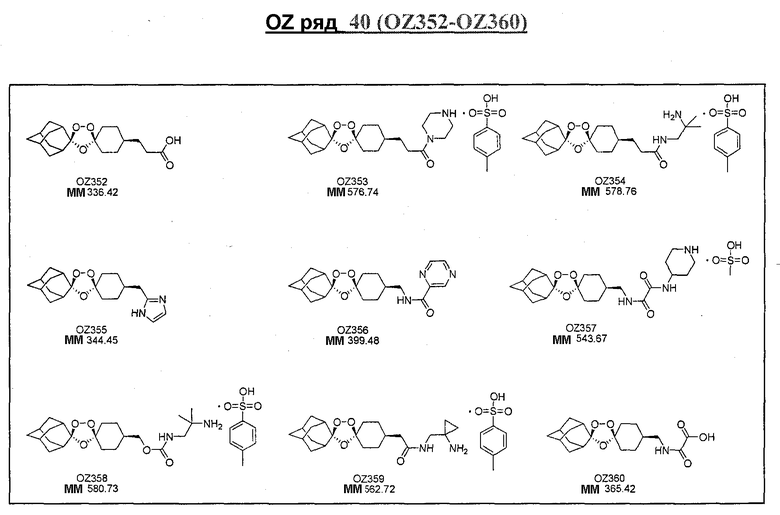
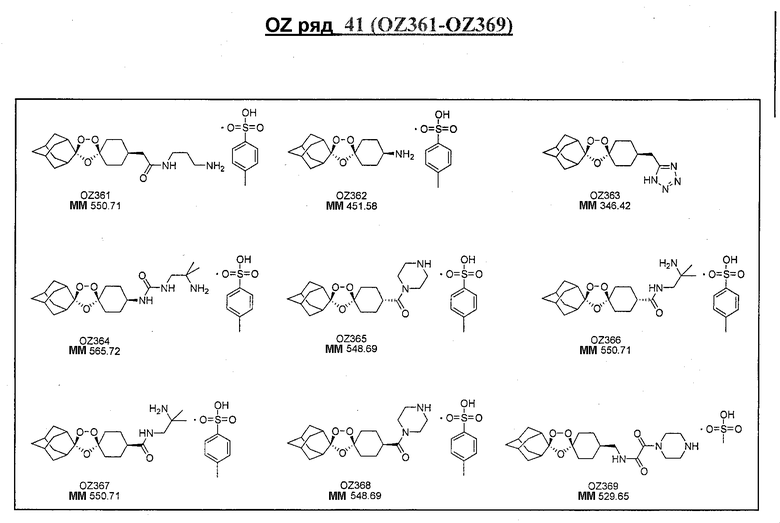
Прототипными триоксоланами данного изобретения являются OZ03 и OZ05. Предпочтительные соединения, идентифицированные до настоящего времени, включают OZ03, OZ05, OZ11, OZ25, OZ27, OZ61, OZ71, OZ78, OZ127, OZ145, OZ156, OZ163, OZ175, OZ177, OZ179, OZ181, OZ189, OZ205, OZ207, OZ209, 0Z210, OZ219, OZ227, OZ229, OZ235, OZ255, OZ256, OZ257, OZ263, OZ264, OZ265, OZ266, OZ267, OZ268, OZ269, OZ270, OZ271, OZ277, OZ279, OZ281, OZ288, OZ289, OZ290, OZ296, OZ297, OZ298, OZ301, OZ305, OZ309, OZ315, OZ317, OZ319, OZ320, OZ323, OZ329, OZ333, OZ335, OZ336, OZ337, OZ338, OZ339, OZ343, OZ349, OZ351, OZ353, OZ354, OZ357, OZ358, OZ359, OZ365 и OZ368. Наиболее предпочтительными соединениями являются OZ78, OZ163, OZ181, OZ207, OZ209, OZ255, OZ256, OZ257, OZ263, OZ264, OZ267, OZ271, OZ277, OZ279, OZ301, OZ305, OZ315, OZ317, OZ319, OZ323, OZ329, OZ338, OZ339, OZ349, OZ351, OZ354, OZ357, OZ359 и OZ368, причем наилучшими из данных соединений, идентифицированных таким образом, являются OZ277 и OZ279. В общем случае, наибольшую активность in vitro против малярийных паразитов получают для триоксоланов, функционализированных или замещенных по 4-положению спироциклогексильного цикла. Как правило, также предпочтительными являются несимметричные, ахиральные триоксоланы.
Отличительными признаками данных спиро- и диспиро-1,2,4-триоксоланов по сравнению с полусинтетическими производными артемизинина являются их структурная простота и легкость синтеза. Например, диспиротриоксоланы могут быть легко синтезированы посредством соозонолиза O-метилоксимов циклоалканонов в присутствии необходимых производных циклоалканона в соответствии со способом Griesbaum et al. (1997a; 1997b), как проиллюстрировано ниже для симметричного диспироциклогексилтриоксолана:
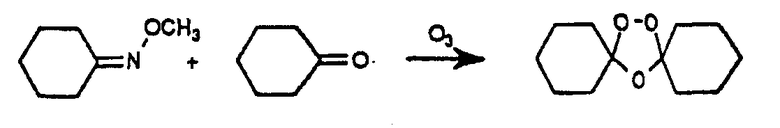
Если в данной реакции соозонолиза выходы являются низкими, то их можно значительно увеличить, когда O-метилоксим и кетон "обращаются". Новая методика обеспечивает исключительно удобный способ для синтеза спиро- и диспиротриоксоланов. Преимущества оксим-эфирного пути перед алкеновым подходом включают удобный синтез исходных веществ (оксимных простых эфиров по сравнению с четырехзамещенными алкенами), более высокие выход и селективность целевых триоксоланов за счет целенаправленного выбора парных реакционных субстратов. Триоксоланы можно очищать кристаллизацией или колоночной флэш-хроматографией. Их структуры и чистоту можно подтвердить аналитической ВЭЖХ, 1Н- и 13С-ЯМР, ИК, температурой плавления и элементным анализом.
Недавно Griesbaum et al. (1997b) обнаружили, что четырехзамещенные 1,2,4-триоксоланы удобно получать озонолизом O-алкилоксимов кетона в присутствии карбонильных соединений.
Предполагают, что образование триоксолана из оксимного простого эфира и кетона является трехстадийным процессом. Последовательность начинается электрофильным присоединением озона к двойной связи оксима с образованием первичного озонида. На втором этапе очень нестабильный первичный аддукт фрагментируется до реакционноспособного оксида карбонила, что частично сопровождается попутным выделением относительно стабильного метилнитрита. На третьем этапе оксид карбонила претерпевает [3+2]циклоприсоединение с кетоном с образованием вторичного озонида или 1,2,4-триоксолана. Остается определить, является ли данный рекомбинационный процесс постадийным или протекающим одновременно.
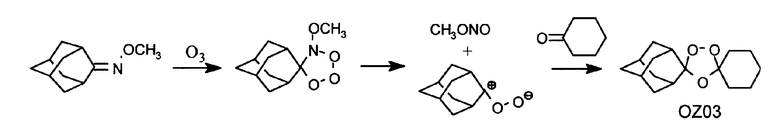
Как продемонстрировано выше синтезом OZ03, наибольшая часть новых диспиротриоксоланов содержит спироадамантан и может быть синтезирована соозонолизом O-метилоксима адамантанона в присутствии необходимого производного циклоалканона. Предпочтительными реакционными растворителями для реакций соозонолиза являются углеводородные растворители, такие как пентан или циклогексан; более полярные растворители имеют тенденцию уменьшать выход реакции. Когда кетоны не являются легко растворимыми в пентане или циклогексане, можно применять смешанный растворитель (пентан/метиленхлорид) или один метиленхлорид. Несколько факторов определяют отношение оксимного простого эфира к кетону. В некоторых реакциях, чтобы избежать образования дипероксида (1,2,4,5-тетраоксана), предотвратить образование диозонида из дикетонов и активизировать реакцию с кетонами, легко растворимыми в пентане, применяют избыток кетона (2:1). В самом общем случае, на стадии исследовательского синтеза и особенно в случаях, когда кетоны не являются легко растворимыми в пентане, являются дорогими или трудноудалимыми, при обработке реакционной смеси можно использовать отношение кетона к оксимному простому эфиру 1:1. При крупномасштабных триоксолановых синтезах можно использовать 1,5-кратный избыток оксимного простого эфира для достижения более высоких степеней конверсии кетонов в целевые триоксолановые продукты, не создавая проблем с очисткой.
Существует несколько примеров, где применяют превращения после озонолиза для получения целевых триоксолановых соединений, которые трудно или в некоторых случаях невозможно получать непосредственно (Kashima et al., 1987) способом соозонолиза.
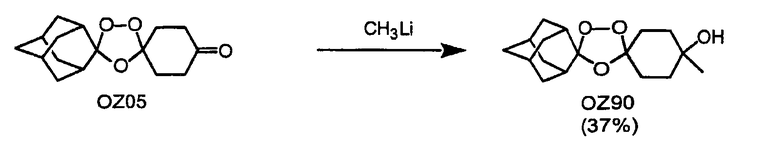
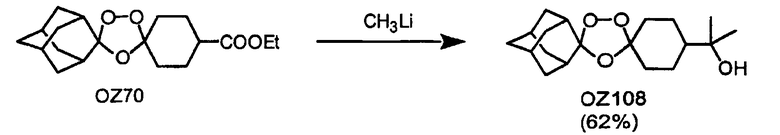
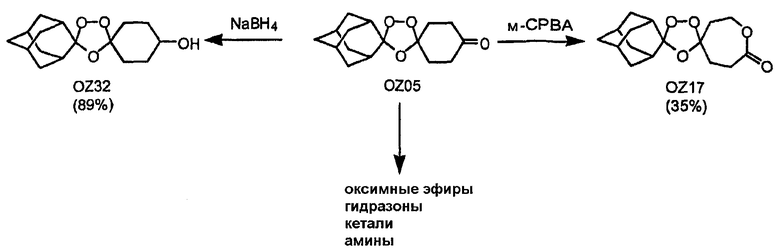
Триоксолановые третичные спирты OZ90 и OZ108 могут быть получены обработкой метиллитием триоксоланового кетона OZ05 и триоксоланового сложного эфира OZ70 соответственно. В других реакциях триоксолановый лактон OZ17 и триоксолановый спирт OZ32 получают обработкой OZ05 м-CPBA (мета-хлопербензойная кислота) и боргидридом натрия, соответственно. Кроме того, различные оксимные простые эфиры, гидразоны, кетали и амины (восстановительное аминирование с триацетоксиборгидридом натрия) также получают из триоксоланового кетона OZ05 с хорошими и отличными выходами. В примерах, отмеченных выше, является очевидным, что триоксолановый кетон OZ05 представляет собой ключевой интермедиат, так как его кетоновая функциональная группа предоставляет удобное средство для трансформации функциональной группы.
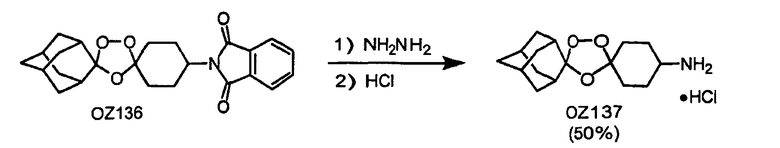
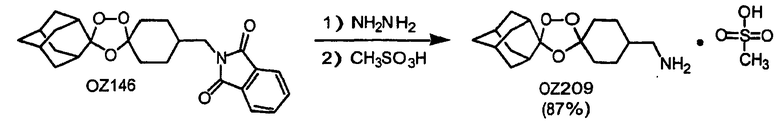
Дальнейшее очевидное свидетельство устойчивости данных триоксоланов к восстанавливающим агентам продемонстрировано восстановлением сложных триоксолановых эфиров OZ70 и OZ61 в их соответствующие триоксолановые спирты OZ119 и OZ89 смесью боргидрида лития и триэтилборгидрида лития и гидразинолизом триоксолановых фталимидов OZ136 и OZ146 в их соответствующие амины OZ137 и OZ209.
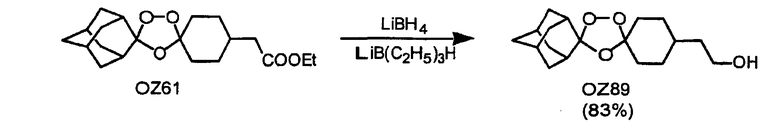
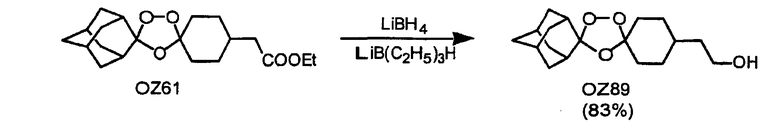
Как показано ниже в примерах, триоксолановые сложные эфиры можно удобным образом превратить в их соответствующие триоксолановые кислоты.
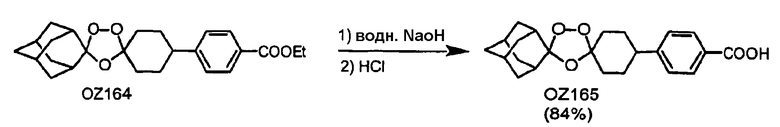
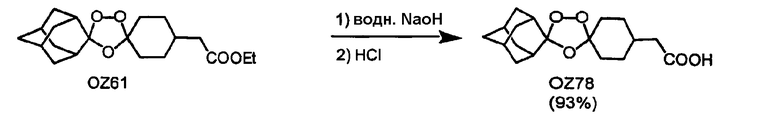
В дополнение к триоксолановому кетону OZ05, триоксолановому амину мезилата OZ209, триоксолановому сложному эфиру OZ61 и триоксолановой кислоте OZ78 триоксолановые спирты OZ119 и OZ89 должны и будут являться ключевыми интермедиатами для синтетических превращений после озонолиза. Недавним примером является синтез триоксоланового триазола OZ177 в реакции между мезилатным производным OZ119 и натриевой солью 1,2,4-триазола.
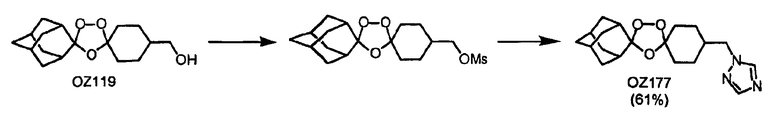
Было обнаружено, что способ соозонолиза с использованием эфиров метилоксима предоставляет быстрый, гибкий и предсказуемый доступ к структурно разнообразным триоксоланам. Фактически некоторые ключевые триоксоланы, которые служили важными билдинг-блоками, были получены в большом масштабе, включая OZ05 (100 ммоль), OZ61 (100 ммоль), OZ146 (60 ммоль), без уменьшения реакционных выходов по сравнению с обычным масштабом 5-10 ммоль. Кроме того, как OZ61, так и OZ146 могут быть удобным образом выделены в виде белых твердых веществ добавлением этанола к неочищенным реакционным смесям.
Эксперименты с дифференциальной сканирующей калориметрией (ДСК) (Cammenga and Epple, 1995) демонстрируют, что данные соединения обладают хорошей термической стабильностью, сравнимой с артемизинином. Средняя т.пл. с разложением составляет 160+15°С по сравнению с т.пл. с разложением 181°С для артемизинина. Предполагают, что термическое разложение данных триоксоланов инициируется образованием 1,5-дирадикала, образуемого гомолитическим расщеплением пероксидной связи триоксоланового цикла.Так как большая часть целевых триоксоланов содержит симметричный спироадамантановый структурный каркас, их стереохимия в значительной степени является функцией структуры кетона исходного вещества или реагентов, применяемых для реакций после озонолиза. Для OZ27 и других аналогичных 1,4-замещенных триоксоланов возможно наличие двух ахиральных диастереомеров. Однако, как продемонстрировано примером с OZ27, большую часть данных триоксоланов выделяют в виде единственных ахиральных диастереомеров в большей степени, чем в виде смесей двух ахиральных диастереомеров. Например, для OZ27 хиральность отсутствует, так как триоксолановый цикл и фенильный заместитель находятся в 1,4-взаиморасположении в шестичленном цикле. Такие соединения имеют плоскость симметрии.
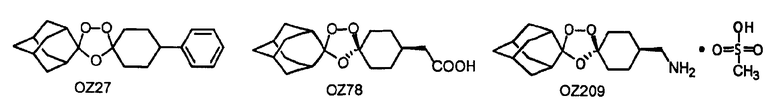
Как определяют методом рентгеновской кристаллографии, OZ78, OZ209 и их производные имеют цис-конфигурацию в тех случаях, когда пероксидные кислороды находятся в аксиальном положении.
Исходное вещество, 2-адамантанон, может быть получен от Aldrich Chemical Co. или от TCI American Organic Chemicals или может также быть синтезировано. Специалисты в данной области могут легко предложить другие подходящие средства для синтеза исходных веществ и соединений в соответствии с данным изобретением.
Спиро- и диспиротриоксолановые композиции настоящего изобретения в основном могут быть использованы для профилактики и лечения малярии. Триоксолановые композиции настоящего изобретения вводят вместе с фармацевтически приемлемым носителем. Как правило, для данной цели можно использовать любой фармацевтически приемлемый носитель при условии, что носитель не оказывает значительного неблагоприятного влияния на стабильность или биодоступность триоксолановых соединений данного изобретения.
Триоксоланы данного изобретения можно вводить теплокровным животным, включая человека и других животных, в любой эффективной фармацевтически приемлемой форме, например в виде лекарственных форм для местного введения, промывания, перорального введения, парентерального введения, в виде свечей или в виде лекарственных форм для инфузии, таких как средства для местного, щечного, подъязычного введения или назальный спрей, или любым другим способом, обеспечивающим эффективную доставку этих средств. Предпочтительно способ введения должен обеспечивать оптимизацию доставки и/или локализацию средств в направлении клеток-мишеней.
В добавление к активным соединениям, т.е. триоксоланам, фармацевтические композиции данного изобретения могут содержать подходящие среды для лекарств и вспомогательные средства, облегчающие получение препаратов на основе активных соединений, которые могут использоваться как фармацевтические препараты. Лекарственные формы для перорального введения включают таблетки, капсулы и гранулы.
Препараты, которые могут быть введены ректально, включают свечи. Другие лекарственные формы включают растворы, подходящие для парентерального или перорального введения, а также композиции, которые могут быть введены щечным или подъязычным способом.
Фармацевтические композиции настоящего изобретения получают таким путем, который сам по себе хорошо известен в данной области. Например, фармацевтические композиции могут быть получены с помощью традиционных способов смешивания, гранулирования, получения драже, растворения, лиофилизации. В конечном итоге, способ выбирают в зависимости от физических свойств используемого активного ингредиента.
Подходящими средами для лекарств являются, в частности, наполнители, такие как сахара, например лактоза или сахароза, маннит или сорбит, целлюлозные препараты и/или фосфаты кальция, например трикальция фосфат или гидрофосфат кальция, а также связующие средства, такие как крахмал, паста, полученная, например, с использованием кукурузного крахмала, пшеничного крахмала, рисового крахмала, картофельного крахмала, желатина, трагакантовой камеди, метилцеллюлозы, гидроксипропилметилцеллюлозы, натрийкарбоксиметилцеллюлозы и/или поливинилпирролидона. По желанию могут быть добавлены дезинтегрирующие средства, такие как вышеупомянутые крахмалы, а также карбоксиметилкрахмал, поперечно сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, например альгинат натрия. Вспомогательными средствами являются средства, регулирующие текучесть, а также смазывающие средства, например, такие как диоксид кремния, тальк, стеариновая кислота или ее соли, например стеарат магния или стеарат кальция, и/или полиэтиленгликоль. Лекарственные формы для перорального введения могут быть снабжены подходящими покрытиями, которые по желанию могут быть устойчивыми к желудочным сокам.
Для данной цели можно использовать концентрированные растворы сахаров, которые необязательно могут содержать гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органические растворители или смеси растворителей. Для получения покрытий, устойчивых к желудочному соку, к покрытиям таблеток могут быть добавлены растворы подходящих целлюлозных препаратов, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы, красящие средства и пигменты, например, для идентификации или для характеристики разных сочетаний доз соединений.
Другие фармацевтические композиции, которые могут использоваться для перорального введения, включают плотно набитые капсулы из желатина, мягкие, герметично запечатанные капсулы из желатина, а также пластификатор, такой как глицерин или сорбит. Плотно набитые капсулы могут содержать активные соединения в виде гранул, которые могут быть смешаны с наполнителями, такими как лактоза, связующими средствами, такими как крахмалы, и/или смазывающими средствами, такими как тальк или стеарат магния, и необязательно со стабилизиаторами. В мягких капсулах активные соединения предпочтительно растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Возможные фармацевтические препараты, которые могут применяться путем ректального введения, включают, например, свечи, которые состоят из сочетания активных соединений и основы свечей. Подходящими основами для свечей являются, например, природные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие алканолы. Кроме того, можно также использовать желатиновые ректальные капсулы, которые состоят из сочетания активных соединений и основы. Возможные вещества для основы включают, например, жидкие триглицериды, полиэтиленгликоли или парафиновые углеводороды.
Подходящие композиции для парентерального введения включают водные растворы активных соединений в водорастворимой или вододиспергируемой форме. Кроме того, могут быть введены суспензии активных соединений в виде соответствующих масляных суспензий, предназначенных для инъекций.
Подходящие липофильные растворители или среды включают жирные масла, например кунжутное масло, или синтетические эфиры жирных кислот, например этилолеат или триглицериды. Водные суспензии для инъекций могут содержать вещества, которые увеличивают вязкость суспензии, включающие, например, натрийкарбоксиметилцеллюлозу, сорбит и/или декстран. Такие композиции могут также включать вспомогательные средства, такие как консервирующие, увлажняющие, эмульгирующие и диспергирующие средства. Их также можно стерилизовать, например, фильтрацией через фильтр, задерживающий бактерии, или путем включения в композицию стерилизующих средств. Они могут быть также получены в виде стерильных твердых композиций, которые перед введением можно растворить или суспендировать в стерильной воде, физиологическом растворе или в другой среде для инъекций. В добавление к введению с традиционными носителями активные ингредиенты могут быть введены с помощью ряда специализированных способов доставки лекарственных средств, известных специалистам в данной области, таких как способ с использованием портативных инфузионных насосов.
Триоксолановые композиции настоящего изобретения вводят вместе с фармацевтически приемлемым носителем в количестве, достаточном для предотвращения малярийной инфекции и/или лечения активной инфекции. Триоксолановые соединения данного изобретения даже в высоких дозах обладают предельно низкой токсичностью и низкой степенью побочных эффектов. Дозировочный интервал для триоксолановых композиций зависит от ряда факторов, таких как цель их применения, а именно профилактика или лечение активной инфекции, способ введения, дозировочный режим и др. Как правило, терапевтическая доза триоксолана может варьировать в интервале приблизительно 0,1-1000 мг/кг в день, предпочтительно приблизительно 1-100 мг/кг в день. Вышеуказанные дозы можно вводить в виде однократной дозы или они могут быть разделены для введения в нескольких дозах. Триоксолановые композиции можно вводить от одного до нескольких раз в день. Для профилактики малярии обычный дозировочный режим может включать, например, 2,0-1000 мг/кг в неделю, начиная за 1-2 недели до контакта с источником заражения и вплоть до 1-2 недель после контакта.
Спиро- и диспиротриоксоланы данного изобретения могут быть введены в виде любой фармацевтически эффективной солевой формы. Такие соли хорошо известны в данной области и включают, не ограничиваясь ими, соли ацетата, адипата, альгината, цитрата, аспартата, бензоата, бензолсульфоната, бисульфата, бутирата, камфората, камфорсульфоната, диглюконата, глицерофосфата, гемисульфата, гептаноата, гексаноата, фумарата, гидрохлорида, гидробромида, гидроиодида, 2-гидроксиэтансульфоната (изотионата), лактата, малеата, метансульфоната, никотината, 2-нафталинсульфоната, оксалата, пальмитоата, пектината, персульфата, 3-фенилпропионата, пикрата, пивалата, пропионата, сукцината, тартрата, тиоцианата, фосфата, глутамата, бикарбоната, п-толуолсульфоната и ундеканоата. Предпочтительными солями являются соли, увеличивающие биодоступность триоксолановых соединений. Это будет зависеть от ряда факторов, включающих химическую структуру триоксолана, носитель, в который он включен, путь введения и т.д.
Было обнаружено, что спиро- и диспиротриоксоланы данного изобретения являются эффективными при лечении шистосомоза. Шистосомоз занимает второе место после малярии по значимости в социоэкономической области и в области здравоохранения в тропических и субтропических районах. Данное заболевание является эндемическим в 74 развивающихся странах, поражая более 200 миллионов человек в сельских земледельческих и примыкающих к городам районах. По оценкам 500-600 миллионов человек во всем мире имеют риск заразиться данной болезнью.
Основные виды человеческого шистосомоза вызываются пятью видами плоского червя, передающимися через воду, или кровяными глистами, называемыми шистосомами. Одним из упомянутых видов является Schistosoma mansoni, который был обнаружен в 53 странах Африки, в Восточном районе Средиземного моря, в районе Карибского моря и в Южной Америке. Паразиты проникают в организм при контакте с поверхностью инфицированной воды в основном людей, занятых в сельском хозяйстве и рыболовстве. Паразиты обычно инфицируют хозяина в форме церкарий или на стадии личинки. Находясь внутри хозяина, церкария развивается во взрослые особи, или шистосомы.
В настоящее время лечение шистосомоза в основном сфокусировано на профилактике, т.е. предотвращении инфицирования хозяина церкариями. Сейчас наиболее широко используемым лекарственным средством для лечения шистосомоза является празиквантел. Хотя артеметер проявляет активность при профилактике шистосомоза, не было показано, что он обладает активностью против взрослых S. mansoni.
Неожиданно было обнаружено, что спиро- и диспиротриоксоланы данного изобретения являются активными как против церкарий, так и против взрослых S. mansoni и S. japonicum при введении в соответствии с дозами и способами, описанными выше в связи с лечением малярии. Также полагают, что триоксоланы данного изобретения являются активными против S. haematobium. Предпочтительные соединения, определенные для применения для лечения шистосомоза, включают OZ05, OZ11, OZ23, OZ25, OZ28, OZ32, OZ71, OZ78, OZ89, OZ90, OZ119, OZ145, OZ163, OZ179, OZ205, OZ207, OZ209, OZ219, OZ227 и OZ229. Наиболее предпочтительными соединениями являются OZ78, OZ163, OZ207 и OZ209. Предпочтительные дозировочные уровни спиро- и диспиротриоксоланов при пероральном введении составляют приблизительно 100-200 мг/кг в день. Опытными образцами триоксоланов данного изобретения являются OZ03 и OZ05.
Спиро- и диспиротриоксоланы данного изобретения также могут быть эффективными при лечении рака. Как показано, соединения, включающие эндопероксидный фрагмент, способный взаимодействовать с гемом и железом, обладают способностью убивать раковые клетки (см., например, патент США № 5578637, раскрытие которого включено в данное описание в качестве ссылки). Как отмечено в связи с артемизинином, механизм действия триоксоланов против малярийных паразитов основан на способности триоксолановых соединений взаимодействовать с железом свободных молекул гема малярийных паразитов с образованием свободных радикалов, приводящих к разрушению клетки. Аналогично триоксоланы обладают избирательной активностью против раковых клеток вследствие повышенной концентрации рецепторов трансферрина на мембранах раковых клеток, которые поглощают железо в более высокой степени, чем нормальные клетки. В присутствии триоксоланов данного изобретения раковые клетки накапливают свободные радикалы в высоких концентрациях, что приводит к гибели клетки. Для лечения рака триоксоланы данного изобретения могут быть введены в соответствии с дозами и способами, описанными выше.
В носитель также могут быть включены другие лекарственные средства, помимо триоксолана, совместимые с ингредиентами носителя. Рядовой специалист в данной области может легко определить такие лекарственные средства и может включить, например, антибиотики, другие противомалярийные средства, противовоспалительные средства и др.
Следует понимать, что настоящее изобретение предполагает применение не только самих вышеуказанных триоксолановых соединений, но и их пролекарственных форм, которые в результате метаболизма превращаются в данные соединения, их аналогов и биологически активных солевых форм, а также оптических изомеров, обладающих такой же фармацевтической активностью.
Нижеследующие примеры служат для иллюстрации, но не для ограничения изобретения. Таким образом, они представлены с пониманием того, что могут быть осуществлены различные модификации состава и способа доставки, которые также будут соответствовать сущности изобретения.
Пример 1
Общая методика получения 1,2,4-триоксоланов
Синтез О-метилоксима 2-адамантанона (типичная методика). К раствору 2-адамантанона (4,51 г, 30 ммоль) в метаноле (30 мл) добавляют пиридин (4,5 мл) и гидрохлорид метоксиламина (3,76 г, 45,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 48 час, концентрируют в вакууме и разбавляют СН2Cl2 (50 мл) и водой (50 мл). Органический слой отделяют и водный слой экстрагируют СН2Cl2 (30 мл). Объединенные органические экстракты промывают 1 М HCl (30 мл × 2) и насыщенным водным раствором NaCl (30 мл) и сушат над MgSO4. Упариванием в вакууме получают О-метилоксим 2-адамантанона (4,77 г, 89%) в виде бесцветного твердого вещества. Т.пл. 70-71°С. 1H ЯМР (300 МГц, CDCl3) δ 1,60-2,10 (м, 12H), 2,54 (с, 1H), 3,47 (с, 1H), 3,82 (с, 3H).
Ссылка: Corey, E.J.; Niimura, K.; Konishi, Y.; Hashimoto, S.; Hamada,Y. A New Synthetic Route to Prostaglandins. Tetrahedron Lett., 1986, 27, 2199-2202.
О-Метилоксим циклогексанона. Выход 76%; бесцветное масло. 1H ЯМР (300 МГц, CDCl3) δ 1,40-1,80 (м, 6H), 2,20 (т, J=6,0 Гц, 2H), 2,45 (т, J=6,1 Гц, 2H), 3,81 (с, 3H).
О-Метилоксим циклододеканона. Выход 98%; бесцветное масло. 1H ЯМР (500 МГц, CDCl3) δ 1,20-1,49 (м, 14H), 1,50-1,60 (м, 2H), 1,61-1,70 (м, 2H), 2,22 (т, J=6,8 Гц, 2H), 2,35 (т, J=6,6 Гц, 2H), 3,81 (с, 3H).
О-Метилоксим 3,3,5,5-тетраметилциклогексанона. Выход 91%; бесцветное масло. 1H ЯМР (500 МГц, CDCl3) δ 0,96 (с, 6H), 0,97 (с, 6H), 1,33 (с, 2H), 1,95 (с, 2H), 2,20 (с, 2H), 3,80 (с, 3H).
О-Метилоксим 4-фенилциклогексанона. Выход 92%; бесцветное твердое вещество. Т.пл. 45-47°С. 1H ЯМР (500 МГц, CDCl3) δ 1,57-1,76 (м, 2H), 1,82-1,92 (м, 1H), 1,99-2,13 (м, 2H), 2,19-2,30 (м, 1H), 2,47-2,56 (м, 1H), 2,72-2,81 (м, 1H), 3,32-3,42 (м, 1H), 3,85 (с, 3H), 7,17-7,34 (м, 5H).
О-Метилоксим бицикло[3.3.1]нонан-9-она. Выход 96%; бесцветное масло. 1H ЯМР (500 МГц, CDCl3) δ 1,46-1,62 (м, 2H), 1,72-2,11 (м, 10H), 2,47 (уш.с, 1H), 3,40 (уш.с, 1H), 3,82 (с, 3H).
1-(п-Толуолсульфонил)-4-пиперидон. К раствору гидрохлорида моногидрата 4-пиперидона (7,68 г, 50 ммоль) в метиленхлориде (50 мл) добавляют последовательно п-толуолсульфонилхлорид (10,50 г, 55,07 ммоль) и триэтиламин (21 мл). Смесь перемешивают при комнатной температуре в течение 16 час перед гашением водой (100 мл). Органический слой промывают 1 М HCl (100 мл) и насыщенным раствором соли (100 мл) и сушат над сульфатом натрия. Упариванием растворителя получают целевой кетон (8,60 г, 68%) в виде бесцветного твердого вещества. Т.пл. 130-132°С. 1H ЯМР (500 МГц, CDCl3) δ 2,40 (с, 3H), 2,58 (т, J=6,4 Гц, 4H), 3,38 (т, J=6,4 Гц, 4H), 7,35 (д, J=7,8 Гц, 2H), 7,68 (д, J=8,3 Гц, 2H).
1-[3-(Этоксикарбонил)пропионил]-4-пиперидон. К раствору гидрохлорида моногидрата 4-пиперидона (7,68 г, 50 ммоль) и триэтиламина (21 мл) в метиленхлориде (100 мл) добавляют 3-(этоксикарбонил)пропионилхлорид (9,87 г, 60 ммоль) при 0°С в течение периода, равного 10 мин. Смесь перемешивают при комнатной температуре в течение 16 час перед гашением водой (100 мл). Органический слой отделяют и водный слой экстрагируют метиленхлоридом (100 мл). Объединенные органические слои промывают 1 М HCl (100 мл), насыщенным водным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл), сушат над сульфатом натрия и концентрируют. Очисткой флэш-хроматографией (силикагель, 30% эфир в гексанах) получают целевой кетон (3,80 г, 33%) в виде светло-желтого масла. 1H ЯМР (500 МГц, CDCl3) δ 1,27 (т, J=7,3 Гц, 3H), 2,48 (т, J=6,4 Гц, 2H), 2,53 (т, J=6,4 Гц, 2H), 2,68 (с, 4H), 3,82 (т, J=6,3 Гц, 2H), 3,82 (т, J=6,3 Гц, 2H), 4,16 (кв, J=7,3 Гц, 2H).
1,1-Диоксотетрагидротиопиран-4-он. К раствору тетрагидротиопиран-4-она (400 мг, 3,45 ммоль) в ацетонитриле (5 мл) добавляют водный раствор Na2EDTA (3 мл, 0,0004 М). Смесь оксона (6,30 г, 10,30 ммоль) и бикарбоната натрия (2,70 г, 32 ммоль) добавляют небольшими порциями к вышеуказанному раствору в течение периода, равного 20 мин. Взвесь перемешивают в течение 1 час перед гашением метиленхлоридом. Органический растворитель декантируют и твердый остаток растирают в этилацетате (3×25 мл). Объединенные органические слои сушат над сульфатом натрия и концентрируют с получением целевого кетона (0,37 г, 73%) в виде бесцветного твердого вещества. Т.пл. 170-172°С (лит. 168-170°С). 1H ЯМР (500 МГц, CDCl3) δ 2,99 (т, J=6,8 Гц, 4H), 3,39 (т, J=6,8 Гц, 4H). Ссылка: Yang, D.; Yip, Y.-C.; Jiao, G.-S.; Wong, M.-K. Design of Efficient Ketone Catalysts for Epoxidation by Using the Field Effect. J. Org. Chem., 1998, 63, 8952-8956.
Синтез 1-бензолсульфонил-4-пиперидона (типичная методика). К раствору гидрохлорида моногидрата 4-пиперидона (4,59 г, 30 ммоль), триэтиламина (12,5 мл, 90 ммоль) в CH2Cl2 (50 мл) добавляют бензолсульфонилхлорид (5,30 г, 30 ммоль). Смесь перемешивают при 25°С в течение 16 час. После упаривания растворителей остаток растирают в воде (100 мл), фильтруют и далее очищают перекристаллизацией из смеси гексаны/CH2Cl2 (3:1) с получением целевого кетона (5,97 г, 83%) в виде бесцветного твердого вещества. Т.пл. 116-118°С. 1H ЯМР (500 МГц, CDCl3) δ 2,54 (т, J=6,4 Гц, 4H), 3,41 (т, J=6,4Гц, 4H), 7,58 (д, J=7,8 Гц, 2H), 7,63 (т, J=7,0 Гц, 1H), 7,81 (д, J=7,8 Гц, 2H).
1-(4-Метоксибензолсульфонил)-4-пиперидон. Выход 77%; бесцветное твердое вещество. Т.пл. 130-132°С. 1H ЯМР (500 МГц, CDCl3) δ 2,56 (т, J=6,4 Гц, 4H), 3,38 (т, J=6,3 Гц, 4H), 3,95 (с, 3H), 7,00 (д, J=8,2 Гц, 2H), 7,75 (д, J=8,2 Гц, 2H).
1-(4-Хлорбензолсульфонил)-4-пиперидон. Выход 73%; бесцветное твердое вещество. Т.пл. 166-168°С. 1H ЯМР (500 МГц, CDCl3) δ 2,55 (т, J=6,4 Гц, 4H), 3,41 (т, J=6,4 Гц, 4H), 7,54 (д, J=8,3 Гц, 2H), 7,81 (д, J=8,4 Гц, 2H).
1-Метансульфонил-4-пиперидон. К суспензии гидрохлорида моногидрата 4-пиперидона (2,0 г, 13 ммоль) и K2CO3 (9,0 г, 65,2 ммоль) в ацетоне (40 мл) добавляют метансульфонилхлорид (5,96 г, 52,1 ммоль) при 0-5°С. Смесь перемешивают при 25°С в течение 24 час. Твердое вещество удаляют фильтрацией и фильтрат концентрируют досуха. Остаток очищают флэш-хроматографией (силикагель, 80% эфир в гексанах) с получением целевого кетона (1,20 г, 52%) в виде бесцветного твердого вещества. Т.пл. 102-104°С. 1H ЯМР (500 МГц, CDCl3) δ 2,58 (т, J=6,4 Гц, 4H), 2,90 (с, 3H), 3,60 (т, J=6,4 Гц, 4H).
Трифенилфосфоран этоксикарбонилметилена. К раствору трифенилфосфина (26,20 г, 100 ммоль) в бензоле (150 мл) добавляют этилбромацетат (16,70 г, 100 ммоль) при 0-5°С. Смесь выдерживают при комнатной температуре в течение 16 час. Полученную фосфониевую соль фильтруют, промывают бензолом (100 мл) и сушат. К раствору твердого вещества в воде (200 мл) добавляют бензол (200 мл) с последующим добавлением 10% раствора NaOH (100 мл). Органический слой отделяют и водный слой экстрагируют бензолом (200 мл). Объединенные органические слои промывают водой (100 мл) и насыщенным раствором соли (100 мл), концентрируют до 50 мл в вакууме и выливают в гексан (200 мл). Преципитат фильтруют и сушат с получением целевого фосфорана (28,00 г, 80%) в виде бесцветного твердого вещества. Т.пл. 128-130°С.
Этиловый эфир 4-оксоциклогексилиденуксусной кислоты. К раствору 1,4-циклогександиона (5,00 г, 44,64 ммоль) в бензоле (100 мл) добавляют илид (15,55 г, 44,68 моль). Смесь нагревают при кипячении с обратным холодильником в течение 12 час. После удаления растворителя упариванием остаток очищают флэш-хроматографией (силикагель, 5% этилацетата в гексанах) с получением сложного эфира кетона (5,80 г, 71%) в виде бесцветного масла. 1H ЯМР (500 МГц, CDCl3) δ 1,26 (т, J=6,4 Гц, 3H), 2,42-2,50 (м, 4H,), 2,60-2,66 (м, 2H), 3,12-3,20 (м, 2H), 4,16 (кв, J=6,4 Гц, 2H), 5,86 (с, 1H).
Этиловый эфир 4-оксоциклогексануксусной кислоты. К раствору ненасыщенного сложного эфира (2,50 г, 13,74 ммоль) в этаноле (25 мл) добавляют никель Ренея (1,0 г). Смесь перемешивают при комнатной температуре в атмосфере Н2 (баллон) в течение 24 час. После удаления катализатора фильтрованием фильтрат концентрируют с получением сложного эфира спирта, который применяют для окисления по Джонсу без дальнейшей очистки. К раствору вышеуказанного остатка в ацетоне (20 мл) при 0°С добавляют реагент Джонса (6 мл), полученный растворением CrO3 (27,20 г) в концентрированной серной кислоте (25 мл) и дальнейшим разбавлением раствора до 100 мл водой. Реакционную смесь перемешивают при 0°С в течение 2 час перед гашением изопропанолом (3 мл). Органический растворитель удаляют в вакууме и остаток разбавляют эфиром (100 мл) и промывают водой (50 мл) и насыщенным раствором соли (50 мл). Органический слой сушат над MgSO4 и концентрируют с получением сложного эфира кетона (1,80 г, 71%) в виде бесцветного масла. 1H ЯМР (500 МГц, CDCl3) δ 1,26 (т, J=6,4 Гц, 3H), 1,44-1,48 (м, 3H), 2,08-2,10 (м, 2H), 2,29-2,31 (д, J=8,3 Гц, 2H), 2,39-2,40 (м, 4H), 4,18 (кв, J=6,4 Гц, 2H).
4-Оксоциклогексанкарбоновая кислота. Смесь этил-4-оксоциклогексанкарбоксилата (1,74 г, 10 ммоль), метанола (25 мл) и 17% водного КОН (5 мл) нагревают при 50°С в течение 1,5 час. После охлаждения до комнатной температуры реакционную смесь подкисляют до рН 3 концентрированной HCl, концентрируют до 10 мл при пониженном давлении и экстрагируют хлороформом (3×15 мл). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют с получением целевой кетокислоты (1,30 г, 91%) в виде бесцветного твердого вещества. Т.пл. 62-64°С. 1H ЯМР (500 МГц, CDCl3) δ 2,05-2,10 (м, 2H), 2,23-2,27 (м, 2H), 2,35-2,41 (м, 2H), 2,49-2,54 (м, 2H), 2,80-2,84 (м, 1H).
Неопентил-4-оксоциклогексанкарбоксилат. К раствору 4-оксоциклогексанкарбоновой кислоты (852 мг, 6 ммоль), трифенилфосфина (1,59 г, 6 ммоль) и неопентилового спирта (635 мг, 7,2 ммоль) в сухом ТГФ (18 мл) при 0°С по каплям добавляют раствор диэтилазодикарбоксилата (0,96 мл, 6 мл) в сухом ТГФ (7,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи перед гашением посредством добавления насыщенного водного раствора NaHCO3 (50 мл). Водную фазу отделяют и экстрагируют CH2Cl2 (2×30 мл). Органические экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме. Остаток разбавляют эфиром (10 мл) и петролейным эфиром (20 мл) и фильтруют для удаления оксида трифенилфосфина. Растворитель удаляют в вакууме и остаток очищают хроматографией (20% эфир в петролейном эфире) с получением целевого сложного эфира кетона (820 мг, 65%) в виде бесцветного масла. 1H ЯМР (500 МГц, CDCl3) δ 0,96 (с, 9H), 2,04-2,07 (м, 2H), 2,22-2,25 (м, 2H), 2,34-2,40 (м, 2H), 2,46-2,50 (м, 2H), 2,80 (м, 1H), 3,82 (с, 2H).
Кеталь 4-гидрокси-4-(4-фторфенил)циклогексанонэтилена. В круглодонную колбу объемом 500 мл, снабженную механической мешалкой, холодильником и воронкой для добавления, добавляют магниевые стружки (3,50 г, 140 ммоль) и достаточно ТГФ для покрытия Mg. Раствор 1-бром-4-фторбензола (12,45 г, 70,43 ммоль) в ТГФ (90 мл) добавляют по каплям с такой скоростью, чтобы в реакционной смеси поддерживалось слабое кипячение с обратным холодильником с последующей инициацией реакции (инициация может сопровождаться нагревом колбы). После кипячения смеси с обратным холодильником в течение дополнительных 2,5 час по каплям добавляют раствор кеталя 1,4-циклогександионмоноэтилена (10,00 г, 64,03 ммоль) в ТГФ (75 мл). Смесь поддерживают в состоянии кипячения с обратным холодильником в течение дополнительных 2 час перед гашением насыщенным раствором хлорида аммония (7 мл). После удаления солей магния фильтрацией фильтрат концентрируют досуха. Осадок растворяют в CHCl3 и промывают водой и насыщенным раствором соли. Органический слой отделяют, сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией (30% эфир в петролейном эфире) с получением целевого спирта (13,50 г, 87%) в виде бесцветного твердого вещества. Т.пл. 133-134°С. 1H ЯМР (500 МГц, CDCl3) δ 1,69 (д, J=11,7 Гц, 2H), 1,79 (д, J=12,2 Гц, 2H), 2,05-2,18 (м, 4H), 3,98 (м, 4H), 7,02 (т, J=8,3,2H), 7,47-7,50 (м, 2H).
4-Гидрокси-4-(4-фторфенил)циклогексанон. Смесь кеталя 4-гидрокси-4-(4-фторфенил)циклогексанонэтилена (7,20 г, 28,6 ммоль), ТГФ (125 мл) и 5% водной HCl (65 мл) кипятят с обратным холодильником в течение 14 час. Реакционную смесь охлаждают до комнатной температуры, концентрируют до 60 мл и экстрагируют CH2Cl2 (3×60 мл). Объединенные органические слои сушат над MgSO4 и концентрируют в вакууме. Остаток очищают кристаллизацией из гексанов с получением целевого спиртового кетона (5,30 г, 89%) в виде бесцветного твердого вещества. Т.пл. 111-114°С (лит. 115-117оС). 1H ЯМР (500 МГц, CDCl3) δ 2,17-2,20 (м, 2H), 2,23-2,29 (м, 2H), 2,32-2,37 (м, 2H), 2,87-2,94 (м, 2H), 7,04-7,07 (м, 2H), 7,48-7,51 (м, 2H).
4-Ацетокси-4-(4-фторфенил)циклогексанон. К раствору 4-гидрокси-4-(4-фторфенил)циклогексанона (520 мг, 2,5 ммоль), пиридина (2 мл) и 4-диметиламинопиридина (46 мг) в CH2Cl2 (25 мл) при 0°С по каплям добавляют раствор уксусного ангидрида (1 мл) в CH2Cl2 (5 мл). Смесь нагревают до комнатной температуры и перемешивают в течение 28 час перед гашением водой (30 мл). Органическую фазу промывают 1 М HCl (2×30 мл) и насыщенным раствором соли (30 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают флэш-хроматографией (25% эфир в петролейном эфире) с получением целевого кетона (510 мг, 82%) в виде бесцветного твердого вещества. Т.пл. 113-115°С. 1H ЯМР (500 МГц, CDCl3) δ 2,11 (с, 3H), 2,20 (м, 2H), 2,43 (м, 2H), 2,68 (м, 2H), 2,86 (м, 2H), 7,05 (т, J=8,3, 2H), 7,35-7,38 (м, 2H).
Общая методика для получения 1,2,4-триоксоланов. Озон получают с помощью генератора озона OREC (0,6 л/мин О2, 60 В), пропускают его через пустую бутыль для промывки газа, которую охлаждают до -78°С, и барботируют через раствор О-метилоксима кетона и кетона в смеси пентан/CH2Cl2 при 0°С. О-Метилоксимы циклогексанона, 2-адамантанона и 3,3,5,5- тетраметилциклогексанона (1 ммоль) расходуются в пределах 3 мин, в то время как для исчезновения О-метилоксима циклододеканона (1 ммоль) требуется 6 мин. После завершения раствор продувают кислородом в течение 5 мин перед концентрированием в вакууме при комнатной температуре для получения остатка, который очищают флэш-хроматографией.
7,14,15-Триоксадиспиро[5.1.5.2]пентадекан (OZ01). Раствор О-метилоксима циклогексанона (1,27 г, 10 ммоль) и циклогексанона (1,96 г, 20 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ01 (1,23 г, 58%) в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ 1,20-2,00 (м, 20H). 13C ЯМР (75 МГц, CDCl3) δ 23,80, 24,91, 34,65, 108,84.
3-Оксо-7,14,15-триоксадиспиро[5.1.5.2]пентадекан (OZ02). Раствор О-метилоксима циклогексанона (1,27 г, 10 ммоль) и 1,4-циклогександиона (2,24 г, 20 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в петролейном эфире) с получением триоксолана OZ02 (0,88 г, 39%) в виде бесцветного твердого вещества. Т.пл. 52-54°С (лит. 53°С); 1H ЯМР (300 МГц, CDCl3) δ 1,30-1,90 (м, 10H), 2,16 (т, J=7,0 Гц, 4H), 2,53 (т, J=7,0 Гц, 4H). 13C ЯМР (75 МГц, CDCl3) δ 23,77, 24,81, 32,97, 34,41, 37,78, 106,89, 110,03, 203,07. Ссылка: Griesbaum, K.; Liu, X.; Kassiaris, A.; Scherer, M. Ozonolyses of O-Alkylated Ketoximes in the Presence of Carbonyl Groups: A Facile Access to Ozonides. Libigs Ann./Recueil, 1997, 1381-1390.
Адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан (OZ03). Раствор О-метилоксима циклогексанона (1,27 г, 10 ммоль) и 2-адамантанона (3,00 г, 20 ммоль) в пентане (200 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ03 (1,55 г, 46%) в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ 1,30-2,10 (м, 24H); 13C ЯМР (75 МГц, CDCl3) δ 23,84, 24,97, 26,48, 26,89, 34,73, 34,77, 34,81, 36,40, 36,79, 108,85, 111,15. Ссылка: Keul, H. Über Konstitution und Entstehung der Ozonide von Bis-adamantyliden und von Bis-bicyclo[3.3.1]non-9-yliden. Chem. Ber., 1975, 108, 1207-1217.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-2''-адамантан (OZ04). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и 2-адамантанона (3,00 г, 20 ммоль) в пентане (200 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ04 (1,38 г, 40%) в виде бесцветного твердого вещества. Т.пл. 150°С, разл. (лит. 140-144°С, разл.). 1H ЯМР (300 МГц, CDCl3) δ 1,50-2,20 (м, 28H); 13C ЯМР (75 МГц, CDCl3) δ 26,52, 26,97, 34,70, 34,95, 36,58, 36,81, 111,19. Ссылка: Keul, H. Über Konstitution und Entstehung der Ozonide von Bis-adamantyliden und von Bis-bicyclo[3.3.1]non-9-yliden. Chem. Ber. 1975, 108, 1207-1217.
Адамантан-2-спиро-3'-8'-оксо-1',2',4'-триоксаспиро[4.5]декан (OZ05). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и 1,4-циклогександиона (2,24 г, 20 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в петролейном эфире) с получением триоксолана OZ05 (1,23 г, 44%) в виде бесцветного твердого вещества. Т.пл. 126-128°С (этанол/H2O 1:1). 1H ЯМР (300 МГц, CDCl3) δ 1,70-2,05 (м, 14H), 2,16 (т, J=7,2 Гц, 4H), 2,53 (т, J=7,2 Гц, 4H); 13C ЯМР (75 МГц, CDCl3) δ 26,38, 26,79, 33,08, 34,74, 34,84, 36,26, 36,67, 37,84, 106,94, 112,43, 209,36. Анал. рассч. для C16H22О4: C 69,04; H 7,97. Обнаружено: C 68,53; H 7,97.
1-Фтор-7,14,15-триоксадиспиро[5.1.5.2]пентадекан (OZ06). Раствор О-метилоксима циклогексанона (0,64 г, 5 ммоль) и 2-фторциклогексанона (0,58 г, 5 ммоль) в пентане (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ06 (0,68 г, 59%, смесь двух диастереомеров 2,4:1) в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ 1,30-2,20 (м, 18H), 4,54 (ддд, J=48,9, 5,6, 2,9 Гц, 1H); 13C ЯМР (75 МГц, CDCl3) δ 19,48 (д, J=3,9 Гц), 22,67, 23,55, 23,82, 24,78, 29,36 (д, J=20,4 Гц), 30,97, 33,76, 34,75, 89,86 (д, J=179,8 Гц), 106,38 (д, J=20,3 Гц), 110,24 отнесен к основному изомеру; 19,12 (д, J=3,3 Гц), 22,73, 23,44, 23,93, 24,80, 28,31 (д, J=20,2 Гц), 29,13, 33,47, 34,91, 88,06 (д, J=180,0 Гц), 106,45 (д, J=23,0 Гц), 109,68 отнесен к изомеру в малом количестве; 19F ЯМР (282 МГц, CDCl3) δ -19,2 (уш.с, 2,4F) отнесен к основному изомеру; -13,2 (т, J=43,5 Гц, 1F) отнесен к изомеру в малом количестве. Анал. рассч. для C12H19FO3: C 62,59; H 8,32. Обнаружено: C 62,59; H 8,21.
1-[2-(Этоксикарбонил)этил]-7,14,15-триоксадиспиро[5.1.5.2]пентадекан (OZ07). Раствор О-метилоксима циклогексанона (1,27 г, 10 ммоль) и 2-[2-(этоксикарбонил)этил]циклогексанона (3,96 г, 20 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 6% эфира в петролейном эфире) с получением триоксолана OZ07 (1,77 г, 57%, смесь двух диастереомеров 1:1) в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ 1,27 (т, J=7,2 Гц, 3H), 1,20-1,89 (м, 19H), 1,90-2,20 (м, 2H), 2,21-2,50 (м, 2H), 4,14 (кв, J=7,1 Гц, 2H); 13C ЯМР (75 МГц, CDCl3) δ 14,16, 22,74, 23,35, 23,48, 23,56, 23,63, 23,92, 23,95, 24,80, 24,84, 28,52, 28,81, 32,59, 32,65, 33,85, 34,14, 34,62, 34,68, 34,74, 41,14, 42,00, 60,14, 108,84, 108,95, 110,38, 110,53, 173,63, 173,67. Анал. рассч. для C17H28О5: C 65,36; H 9,03. Обнаружено: C 65,60; H 8,94.
Адамантан-2-спиро-3'-6'-[2'-(этоксикарбонил)этил]-1',2',4'-триоксаспиро[4.5]декан (OZ08). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и 2-[2-(этоксикарбонил)этил]циклогексанона (3,96 г, 20 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 6% эфира в петролейном эфире) с получением триоксолана OZ08 (2,10 г, 58%, смесь двух диастереомеров 4:3) в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ 1,26 (т, J=7,2 Гц, 3H), 1,20-2,19 (м, 25H), 2,21-2,49 (м, 2H), 4,13 (кв, J=7,2 Гц, 2H); 13C ЯМР (75 МГц, CDCl3) δ 14,08, 22,93, 23,37, 23,46, 23,48, 23,65, 23,89, 26,29, 26,34, 26,71, 28,42, 28,89, 32,46, 32,52, 34,06, 34,20, 34,31, 34,60, 34,67, 35,18, 35,25, 35,74, 35,99, 36,63, 36,80, 41,15, 42,00, 60,01, 110,34, 110,47, 111,07, 111,13, 173,49, 173,56. Анал. рассч. для C21H32О5: C 69,20; H 8,85. Обнаружено: C 68,34; H 8,39.
7,12,19,20,23,24-Гексаоксатетраспиро[5.1.2.1.5.2.2.2]тетракозан (OZ09). Раствор О-метилоксима циклогексанона (1,27 г, 10 ммоль) и 1,4-циклогександиона (0,37 г, 3,3 ммоль) в пентане (40 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ09 (0,56 г, 50%, смесь двух диастереомеров 1:1) в виде бесцветного твердого вещества. Т.пл. 83-84°С (лит. 83,5°С). 1H ЯМР (300 МГц, CDCl3) δ 1,25-1,83 (м, 20H), 1,92 (с, 8H); 13C ЯМР (75 МГц, CDCl3) δ 23,75, 24,83, 24,86, 31,38, 34,46, 107,50, 107,57, 109,34. Ссылка: Griesbaum, K.; Liu, X.; Dong,Y. Diozonides from Coozonolyses of Suitable O-Methyl Oximes and Ketoses. Tetrahedron, 1997, 53, 5463-5470.
Адамантан-2-спиро-3'-1',2',4',9',12'-пентаоксадиспиро[4.2.4.2]тетрадекан (OZ10). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и 1,4-диоксаспиро[4.5]декан-8-она (1,56 г, 10 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ10 (1,06 г, 33%) в виде бесцветного твердого вещества. Т.пл. 84-85°С (этанол). 1H ЯМР (300 МГц, CDCl3) δ 1,64-2,13 (м, 22H), 3,97 (с, 4H); 13C ЯМР (75 МГц, CDCl3) δ 26,39, 26,80, 31,66, 32,01, 34,68, 34,77, 36,26, 36,70, 64,30, 107,78, 107,97, 111,4. Анал. рассч. для C18H26О5: C 67,06; H 8,13. Обнаружено: C 67,28; H 8,35.
Адамантан-2-спиро-3'-11',11'-диметил-1',2',4',9',13'-пентаоксадиспиро[4.2.5.2]пентадекан (OZ11). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и 3,3-диметил-1,5-диоксаспиро[5.5]ундекан-9-она (1,98 г, 10 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ11 (1,43 г, 39%) в виде бесцветного твердого вещества. Т.пл. 123-125°С (этанол). 1H ЯМР (300 МГц, CDCl3) δ 0,99 (с, 6H), 1,61-2,14 (м, 22H), 3,51 (с, 4H); 13C ЯМР (75 МГц, CDCl3) δ 22,66, 26,43, 26,84, 29,41, 30,16, 30,46, 34,73, 34,82, 36,30, 36,75, 70,24, 70,19, 96,67, 108,47, 111,51. Анал. рассч. для C21H32О5: C 69,20; H 8,85. Обнаружено: C 69,17; H 8,97.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-3''-7''-оксо-цис-бицикло[3.3.0]октан (OZ12). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и цис-бицикло[3.3.0]октан-3,7-диона (2,76 г, 20 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 15% эфир в петролейном эфире) с получением триоксолана OZ12 (0,51 г, 17%) в виде бесцветного твердого вещества. Т.пл. 122-124°С (этанол/H2O 4:1). 1H ЯМР (300 МГц, CDCl3) δ 1,60-2,05 (м, 16H), 2,13-2,41 (м, 4H), 2,43-2,62 (м, 2H), 2,70-2,93 (м, 2H); 13C ЯМР (75 МГц, CDCl3) δ 26,43, 26,79, 34,71, 34,84, 35,96, 36,72, 36,97, 41,42, 44,15, 111,82, 117,66, 219,55. Анал. рассч. для С18Н24О4: C 71,03; H 7,95. Обнаружено: C 71,18; H 7,80.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-3''-7''-оксобицикло[3.3.1]нонан (OZ13). Раствор О-метилоксима 2-адамантанона (0,64 г, 3,55 ммоль) и бицикло[3.3.1]нонан-3,7-диона (1,08 г, 7,10 ммоль) в пентане (45 мл) и CH2Cl2 (45 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 30% эфира в петролейном эфире) с получением триоксолана OZ13 (0,10 г, 9%) в виде бесцветного твердого вещества. Т.пл. 153-155°С (этанол/H2O 1:1). 1H ЯМР (300 МГц, CDCl3) δ 1,55-2,10 (м, 20H), 2,32-2,70 (м, 6H); 13C ЯМР (75 МГц, CDCl3) δ 26,45, 26,66, 28,87, 31,30, 34,32, 34,80, 36,15, 36,79, 39,94, 45,89, 107,15, 113,66, 208,12. Анал. рассч. для C19H26О4: C 71,67; H 8,23. Обнаружено: C 71,68; H 8,19.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-8''-11''-оксопентацикло[5.4.0.02'',6''.03'',10''.05'',9'']ундекан (OZ14). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и пентацикло[5.4.0.02,6.03,10.05,9]ундекан-8,11-диона (3,48 г, 20 ммоль) в CH2Cl2 (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 20% эфира в петролейном эфире) с получением триоксолана OZ14 (0,77 г, 23%) в виде бесцветного твердого вещества. Т.пл. 106°С, разл. (этанол). 1H ЯМР (300 МГц, CDCl3) δ 1,45-2,15 (м, 16H), 2,45-3,05 (м, 8H); 13C ЯМР (75 МГц, CDCl3) δ 26,36, 26,63, 34,53, 34,56, 35,10, 36,05, 36,33, 36,54, 38,94, 41,07, 41,16, 41,98, 42,52, 45,14, 50,81, 51,80, 112,91, 113,01, 213,36. Анал. рассч. для C21H24О4: C 74,09; H 7,11. Обнаружено: C 74,00; H 7,29.
Адамантан-2-спиро-3'-8'-метоксиимино-1',2',4'-триоксаспиро[4.5]декан (OZ15). К раствору OZ05 (0,557 г, 2,0 ммоль) в CH2Cl2 (5 мл) и метаноле (5 мл) добавляют пиридин (0,30 мл) и гидрохлорид метоксиламина (0,250 г, 3,0 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 24 час. Реакционную смесь концентрируют в вакууме с получением неочищенного остатка, который очищают перекристаллизациями из смеси этанол/Н2О (20 мл, 1:1) и из смеси этанол/Н2О (15 мл, 2:1) с получением триоксолана OZ15 (0,51 г, 83%) в виде бесцветного твердого вещества. Т.пл. 97-99°С (этанол/Н2О 2:1). 1H ЯМР (300 МГц, CDCl3) δ 1,60-2,10 (м, 18H), 2,30-2,81 (м, 4H), 3,84 (с, 3H); 13C ЯМР (75 МГц, CDCl3) δ 21,54, 26,40, 26,81, 28,74, 32,59, 33,85, 34,72, 34,77, 34,84, 36,28, 36,70, 61,15, 107,92, 112,00, 156,93. Анал. рассч. для C17Н25NO4: C 66,43; H 8,20; N 4,56. Обнаружено: C 66,58; H 8,29; N 4,41.
Адамантан-2-спиро-3'-8'-гидроксиимино-1',2',4'-триоксаспиро[4.5]декан (OZ16). К раствору OZ05 (0,557 г, 2,0 ммоль) в CH2Cl2 (5 мл) и метаноле (5 мл) добавляют пиридин (0,30 мл) и гидрохлорид гидроксиламина (0,210 г, 3,0 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 24 час. Реакционную смесь концентрируют в вакууме с получением неочищенного остатка, который очищают перекристаллизацией из смеси этанол/Н2О (20 мл, 1:1) с получением триоксолана OZ16 (0,43 г, 73%) в виде бесцветного твердого вещества. Т.пл. 137-139°С (этанол/Н2О 1:1). 1H ЯМР (300 МГц, CDCl3) δ 1,62-2,10 (м, 18H), 2,32-2,88 (м, 4H), 8,60-8,95 (уш.с, 1H); 13C ЯМР (75 МГц, CDCl3) δ 20,97, 26,41, 26,81, 28,72, 32,48, 33,74, 34,74, 34,80, 34,84, 36,29, 36,70, 107,91, 112,06, 157,94. Анал. рассч. для C16H23NO4: C 65,51; H 7,90; N 4,77. Обнаружено: C 65,65; H 7,96; N 4,75.
Адамантан-2-спиро-3'-9'-оксо-1',2',4',8'-тетраоксаспиро[4.6]ундекан (OZ17). К раствору OZ05 (0,84 г, 3,0 ммоль) в CH2Cl2 (70 мл) добавляют NaHCO3 (0,51 г, 6,0 ммоль) и 3-хлорпероксибензойную кислоту (1,20 г). Реакционную смесь перемешивают при комнатной температуре в течение 46 час перед гашением H2O (60 мл). Водный слой экстрагируют CH2Cl2 (10 мл × 2), объединенные экстракты промывают H2O, сушат над MgSO4 и концентрируют с получением неочищенного остатка, который очищают флэш-хроматографией (силикагель, 40% эфира в петролейном эфире) с получением триоксолана OZ17 (0,31 г, 35%) в виде бесцветного твердого вещества. Т.пл. 116-118°С (этанол). 1H ЯМР (300 МГц, CDCl3) δ 1,62-2,10 (м, 18H), 2,32-2,88 (м, 4H), 8,60-8,95 (уш.с, 1H); 13C ЯМР (75 МГц, CDCl3) δ 26,25, 26,65, 28,54, 31,87, 34,62, 34,64, 34,67, 34,71, 36,19, 36,50, 38,35, 63,86, 107,60, 112,89, 174,63. Анал. рассч. для C16Н22O5: C 65,29; H 7,53. Обнаружено: C 65,48; H 7,80.
цис-Адамантан-2-спиро-3'-8'-трет-бутил-1',2',4'-триоксаспиро[4.5]декан (OZ18). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и 4-трет-бутилциклогексанона (3,09 г, 20 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ18 (1,68 г, 52%) в виде бесцветного твердого вещества. Т.пл. 123-124°С (этанол). 1H ЯМР (300 МГц, CDCl3) δ 0,84 (с, 9H), 0,89-1,10 (м, 1H), 1,14-1,35 (м, 2H), 1,55-1,85 (м, 12H), 1,86-2,10 (м, 8H); 13C ЯМР (75 МГц, CDCl3) δ 24,71, 26,49, 26,89, 27,57, 32,27, 34,79, 36,38, 36,82, 46,66, 108,95, 111,12. Анал. рассч. для C20Н32O3: C 74,96; H 10,06. Обнаружено: C 75,25; H 10,06.
Адамантан-2-спиро-3'-8'-бензилоксиимино-1',2',4'-триоксаспиро[4.5]декан (OZ19). К раствору OZ05 (0,56 г, 2,0 ммоль) в CH2Cl2 (5 мл) и метаноле (5 мл) добавляют пиридин (0,30 мл) и гидрохлорид О-бензилгидроксиламина (0,48 г, 3,0 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 24 час. Реакционную смесь концентрируют в вакууме с получением неочищенного остатка, который очищают перекристаллизациями из смеси этанол/Н2О (20 мл, 1:1) и из смеси этанол/Н2О (15 мл, 2:1) с получением триоксолана OZ19 (0,66 г, 86%) в виде бесцветного твердого вещества. Т.пл. 62-64°С (этанол/Н2О 2:1). 1H ЯМР (300 МГц, CDCl3) δ 1,60-2,10 (м, 18H), 2,32-2,50 (м, 2H), 2,53-2,67 (м, 1H), 2,72-2,86 (м, 1H), 5,08 (с, 2H), 7,25-7,42 (м, 5H); 13C ЯМР (75 МГц, CDCl3) δ 21,87, 26,41, 26,81, 28,76, 32,61, 33,87, 34,72, 34,74, 34,79, 34,85, 36,29, 36,70, 75,36, 107,94, 111,99, 127,67, 127,90, 128,31, 137,99, 157,57. Анал. рассч. для C23Н29NO4: C 72,04; H 7,62; N 3,65. Обнаружено: C 72,30; H 7,49; N 3,77.
Адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.11]гексадекан (OZ20). Раствор О-метилоксима циклододеканона (2,11 г, 10 ммоль) и 2-адамантанона (3,0 г, 20 мл) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфир в петролейном эфире) с получением триоксолана OZ20 (1,88 г, 54%) в виде бесцветного твердого вещества. Т.пл. 73-75°С (этанол/H2O 3:1). 1H ЯМР (300 МГц, CDCl3) δ 1,18-1,60 (м, 18H), 1,62-2,10 (м, 18H); 13C ЯМР (75 МГц, CDCl3) δ 20,07, 22,05, 22,37, 25,81, 26,07, 26,49, 26,88, 31,37, 34,76, 34,86, 36,38, 36,79, 111,33, 112,59. Анал. рассч. для С22H36O3: C 75,82; H 10,41. Обнаружено: C 75,65; H 10,69.
3-Оксо-7,20,21-триоксадиспиро[5.1.11.12]генэйкозан (OZ21). Раствор О-метилоксима циклододеканона (2,11 г, 10 ммоль) и 1,4-циклогександиона (2,24 г, 20 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфир в петролейном эфире) с получением триоксолана OZ21 (1,29 г, 42%) в виде бесцветного твердого вещества. Т.пл. 78-80°С. 1H ЯМР (300 МГц, CDCl3) δ 1,10-1,65 (м, 18H), 1,70-1,90 (м, 4H), 2,15 (т, J=7,0 Гц, 4H), 2,52 (т, J=7,1 Гц, 4H); 13C ЯМР (75 МГц, CDCl3) δ 20,03, 22,04, 22,39, 25,76, 26,03, 31,12, 32,92, 37,80, 107,00, 113,73, 209,29. Анал. рассч. для C18H30О4: C 69,64; H 9,74. Обнаружено: C 69,49; H 9,81.
Адамантан-2-спиро-3'-1',2',4',8'-тетраоксаспиро[4.5]декан (OZ22). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и тетрагидро-4Н-пиран-4-она (1,00 г, 10 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, с 2 до 10% эфира в петролейном эфире) с получением триоксолана OZ22 (0,87 г, 65%) в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ 1,20-2,30 (м, 18H), 3,50-4,10 (м, 4H); 13C ЯМР (75 МГц, CDCl3) δ 26,33, 26,73, 34,60, 34,68, 35,43, 36,30, 36,60, 65,67, 105,91, 111,76. Анал. рассч. для С15Н22О4: C 67,64; H 8,33. Обнаружено: C 67,83; H 8,21.
Адамантан-2-спиро-3'-8'-этоксикарбонил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ23). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-этоксикарбонил-4-пиперидона (1,71 г, 10 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, с 10 до 20% эфира в петролейном эфире) с получением триоксолана OZ23 (0,43 г, 26%) в виде бесцветного твердого вещества. Т.пл. 44-46°С (этанол/H2O 5:2). 1H ЯМР (300 МГц, CDCl3) δ 1,27 (т, J=7,0 Гц, 3H), 1,60-2,10 (м, 18H), 3,40-3,75 (м, 4H), 4,14 (кв, J=7,1 Гц, 2H); 13C ЯМР (75 МГц, CDCl3) δ 14,66, 26,40, 26,79, 34,35, 34,71, 34,79, 36,35, 36,68, 41,69, 61,42, 106,88, 112,06, 155,33. Анал. рассч. для C18H27NO5: C 64,07; H 8,07; N 4,15. Обнаружено: C 63,96; H 7,73; N 4,15.
Адамантан-2-спиро-3'-8'-бензоил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ24). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-бензоил-4-пиперидона (2,03 г, 10 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, с 30 до 50% эфира в петролейном эфире) с получением триоксолана OZ24 (0,61 г, 33%) в виде бесцветного твердого вещества. Т.пл. 130-132°С (этанол/H2O 1:1). 1H ЯМР (300 МГц, CDCl3) δ 1,60-2,15 (м, 18H), 3,51 (уш.с, 2H), 3,77 (уш.с, 1H), 3,96 (уш.с, 1H), 7,30-7,50 (м, 5H); 13C ЯМР (75 МГц, CDCl3) δ 26,35, 26,75, 34,20 (уш.), 34,69, 34,77, 35,03 (уш.), 36,30, 36,62, 40,01 (уш.), 45,41 (уш.), 106,75, 112,25, 126,77, 128,49, 129,71, 135,74, 170,39. Анал. рассч. для C22H27NO4: C 71,52; H 7,37; N 3,79. Обнаружено: C 71,63; H 7,24; N 3,95.
цис-Адамантан-2-спиро-3'-8'-пропил-1',2',4'-триоксаспиро[4.5]декан (OZ25). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4-пропилциклогексанона (1,40 г, 10 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ25 (0,89 г, 58%) в виде бесцветного твердого вещества. Т.пл. 49-51°С (этанол/Н2О 2:1). 1H ЯМР (300 МГц, CDCl3) δ 0,88 (т, J=7,2 Гц, 3H), 1,05-1,45 (м, 7H), 1,50-2,10 (м, 20H); 13C ЯМР (75 МГц, CDCl3) δ 14,31, 20,18, 26,49, 26,89, 30,12, 34,29, 34,78, 35,83, 36,39, 36,82, 38,52, 109,15, 111,07. Анал. рассч. для C19H30O3: C 74,47; H 9,87. Обнаружено: C 74,44; H 10,02.
Адамантан-2-спиро-3'-7',9'-тетраметил-1',2',4'-триоксаспиро[4.5]декан (OZ26). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 3,3,5,5-тетраметилциклогексанона (1,54 г, 10 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ26 (0,77 г, 48%) в виде бесцветного твердого вещества. Т.пл. 71-72°С (этанол/Н2О 1:1). 1H ЯМР (300 МГц, CDCl3) δ 1,03 (с, 6H), 1,07 (с, 6H), 1,24 (с, 1H), 1,25 (с, 1H), 1,59 (с, 4H), 1,61-2,10 (м, 14H); 13C ЯМР (75 МГц, CDCl3) δ 26,50, 26,91, 31,47, 31,69, 32,36, 34,77, 34,92, 36,38, 36,83, 45,70, 51,46, 110,26, 110,96. Анал. рассч. для C20H32О3: C 74,96; H 10,06. Обнаружено: C 75,06; H 9,96.
цис-Адамантан-2-спиро-3'-8'-фенил-1',2',4'-триоксаспиро[4.5]декан (OZ27). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4-фенилциклогексанона (1,74 г, 10 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в петролейном эфире) с получением триоксолана OZ27 (0,83 г, 49%) в виде бесцветного твердого вещества. Т.пл. 103-105°С (этанол/Н2О 2:1). 1H ЯМР (300 МГц, CDCl3) δ 1,55-2,20 (м, 22H), 2,45-2,65 (м, 1H), 7,10-7,40 (м, 5H); 13C ЯМР (75 МГц, CDCl3) δ 26,47, 26,87, 31,42, 34,58, 34,72, 34,79, 36,39, 36,79, 42,93, 108,39, 111,37, 126,14, 126,75, 128,37, 146,14. Анал. рассч. для C22H28О3: C 77,61; H 8,29. Обнаружено: C 77,81; H 8,17.
Адамантан-2-спиро-3'-8'-трет-бутилоксиимино-1',2',4'-триоксаспиро[4.5]декан (OZ28). К раствору OZ05 (0,557 г, 2,0 ммоль) в CH2Cl2 (5 мл) и метаноле (5 мл) добавляют пиридин (0,30 мл) и гидрохлорид О-(трет-бутил)гидроксиламина (0,356 г, 3,0 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 24 час. Реакционную смесь концентрируют в вакууме с получением неочищенного остатка, который очищают перекристаллизациями из смеси этанол/Н2О (20 мл, 1:1) и из смеси этанол/Н2О (14 мл, 2,5:1) с получением триоксолана OZ28 (0,63 г, 90%) в виде бесцветного твердого вещества. Т.пл. 68-70°С (этанол/Н2О 2,5:1). 1H ЯМР (500 МГц, CDCl3) δ 1,26 (с, 9H), 1,60-2,10 (м, 18H), 2,32-2,45 (м, 2H), 2,50-2,60 (м, 1H), 2,65-2,76 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 21,54, 26,50, 26,91, 27,54, 28,97, 32,77, 34,13, 34,78, 34,80, 34,86, 34,91, 36,39, 36,80, 77,38, 108,31, 111,87, 155,29. Анал. рассч. для C20H31NO4: C 68,74; H 8,94; N 4,01. Обнаружено: C 68,75; H 8,74; N 4,00.
2,4-Динитрофенилгидразон адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-она (OZ29). Раствор OZ05 (0,28 г, 1,0 ммоль) в этаноле (5 мл) и CH2Cl2 (1,5 мл) добавляют к раствору 2,4-динитрофенилгидразина (0,30 г, 1,5 ммоль), серной кислоты (1,5 мл) и Н2О (2,3 мл) в этаноле (7,5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 10 мин перед гашением этанолом (20 мл). Полученный осадок немедленно отфильтровывают, промывают этанолом и перекристаллизовывают из этанола (20 мл) с получением триоксолана OZ29 (0,39 г, 85%) в виде твердого вещества желтого цвета. Т.пл. 142-144°С, разл. (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,20 (м, 18H), 2,45-2,85 (м, 4H), 7,94 (д, J=9,8 Гц, 1H), 8,27 (дд, J=9,8, 2,0 Гц, 1H), 9,09 (д, 2,9 Гц, 1H), 11,12 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 23,54, 26,44, 26,85, 31,89, 32,40, 33,59, 34,73, 34,80, 35,01, 36,34, 36,37, 36,70, 107,41, 112,50, 116,27, 123,45, 129,18, 129,98, 137,91, 145,22, 157,65. Анал. рассч. для C22H26N4О7: C 57,63; H 5,72; N 12,22. Обнаружено: C 57,74; H 5,65; N 12,02.
4-Фенилсемикарбазон адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-она (OZ30). К раствору OZ05 (0,28 г, 1,0 ммоль) в этаноле (5 мл) и CH2Cl2 (1,5 мл) добавляют раствор 4-фенилсемикарбазида (0,17 г, 1,1 ммоль) в этаноле (5 мл) и CH2Cl2 (2 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 час перед нагревом до 50°С в течение 30 мин. Раствор охлаждают до комнатной температуры и полученный осадок отфильтровывают, промывают этанолом и сушат с получением триоксолана OZ30 (0,37 г, 90%) в виде бесцветного твердого вещества. Т.пл. 161-163°С, разл. (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,10 (м, 18H), 2,48-2,61 (м, 3H), 2,62-2,69 (м, 1H), 7,02-7,09 (м, 1H), 7,23-7,35 (м, 2H), 7,48-7,54 (м, 2H), 8,24 (с, 1H), 9,11 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 23,17, 26,46, 26,87, 31,88, 32,57, 33,92, 34,75, 34,79, 34,93, 36,35, 36,37, 36,75, 107,75, 112,17, 119,33, 123,10, 128,84, 138,26, 150,83, 154,31. Анал. рассч. для C23H29N3О4: C 67,13; H 7,10; N 10,21. Обнаружено: C 66,86; H 6,92; N 10,04.
Адамантан-2-спиро-3'-11',12'-бензо-1',2',4',9',14'-пентаоксадиспиро[4.2.6.2]гексадекан (OZ31). К раствору OZ05 (0,28 г, 1,0 ммоль) в 1,2-диметоксиэтане (10 мл) добавляют 1,5-дигидро-3-метокси-2,4-бензодиоксепин (0,20 г, 1,1 ммоль) и моногидрат п-толуолсульфоновой кислоты (38 мг) и реакционную смесь перемешивают при комнатной температуре в течение 30 мин перед гашением посредством добавления насыщенного раствора NaHCO3 (1,0 мл). Реакционную смесь концентрируют в вакууме с получением неочищенного остатка, который очищают перекристаллизациями из смеси этанол/Н2О (15 мл, 2:1) и из этанола (10 мл) с получением триоксолана OZ31 (0,22 г, 56%) в виде бесцветного твердого вещества. Т.пл. 149-151°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,20 (м, 22H), 4,80-4,94 (м, 4H), 7,02-7,09 (м, 2H), 7,13-7,22 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,53, 26,94, 29,46, 31,12, 34,81, 34,91, 36,42, 36,84, 64,65, 101,38, 108,42, 111,65, 126,09, 126,15, 126,75, 138,01, 138,09. Анал. рассч. для C24H30O5: C 72,34; H 7,59. Обнаружено: C 72,51; H 7,70.
Адамантан-2-спиро-3'-8'-гидрокси-1',2',4'-триоксаспиро[4.5]декан (OZ32). Раствор NaBH4 (42 мг, 1,1 ммоль) в этаноле (10 мл), содержащий 3 капли 1,0 M водного NaOH, добавляют к раствору OZ05 (0,277 г, 1,0 ммоль) в ТГФ (5 мл) при 0°С в течение периода, равного 5 мин. Реакцию перемешивают при комнатной температуре в течение 1 час перед гашением этилацетатом (10 мл). Растворитель удаляют упариванием на роторном испарителе и неочищенный продукт растворяют в этилацетате (50 мл) и промывают насыщенным водным бикарбонатом (10 мл), водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой сушат над MgSO4, фильтруют и концентрируют с получением триоксолана OZ32 (0,25 г, 89%, смесь двух диастереомеров 1:1) в виде бесцветного твердого вещества. Т.пл. 100-106°С. 1H ЯМР (500 МГц, CDCl3) δ 1,45-2,20 (м, 22H), 3,70-3,80 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,52, 26,94, 30,76, 31,26, 31,59, 32,07, 34,80, 34,88, 34,92, 36,38, 36,46, 36,83, 67,46, 68,06, 108,09, 108,19, 111,50, 111,68. Анал. рассч. для C16H24О4: C 68,54; H 8,63. Обнаружено: C 68,36; H 8,44.
Адамантан-2-спиро-3'-8',8'-диметил-1',2',4'-триоксаспиро[4.5]декан (OZ33). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4,4-диметилциклогексанона (1,26 г, 10 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ33 (0,72 г, 49%) в виде бесцветного твердого вещества. Т.пл. 125-127°С (этанол/Н2О 3:1). 1H ЯМР (500 МГц, CDCl3) δ 0,92 (с, 3H), 0,95 (с, 3H), 1,42 (т, J=6,4 Гц, 4H), 1,62-2,10 (м, 18H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,72 (уш.), 26,87, 28,87 (уш.), 29,41, 30,80, 34,75, 34,83, 36,37, 36,52, 36,79, 109,07, 111,19. Анал. рассч. для C18Н28O3: C 73,93; H 9,65. Обнаружено: C 74,16; H 9,55.
Адамантан-2-спиро-3'-8',8'-дифенил-1',2',4'-триоксаспиро[4.5]декан (OZ34). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4,4-дифенилциклогексанона (1,25 г, 5 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в петролейном эфире) с получением триоксолана OZ34 (0,48 г, 23%) в виде бесцветного твердого вещества. Т.пл. 155-157°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,40-2,20 (м, 18H), 2,32-2,65 (м, 4H), 7,00-7,42 (м, 10H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,52, 26,91, 31,51, 34,05, 34,79, 34,87, 36,45, 36,83, 45,47, 108,66, 111,46, 125,79, 125,88, 126,72, 127,17, 128,30, 128,46, 145,94, 147,63. Анал. рассч. для C28H32О3: C 80,73; H 7,74. Обнаружено: C 80,95; H 7,61.
Адамантан-2-спиро-3'-8'-трет-бутоксикарбонил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ35). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-трет-бутоксикарбонил-4-пиперидона (1,99 г, 10 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 15% эфира в петролейном эфире) с получением триоксолана OZ35 (0,73 г, 40%) в виде бесцветного твердого вещества. Т.пл. 82-84°С (этанол/H2O 2:1). 1H ЯМР (500 МГц, CDCl3) δ 1,46 (с, 9H), 1,62-2,10 (м, 18H), 3,40-3,70 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,48, 26,88, 28,41, 34,45, 34,76, 34,85, 36,43, 36,76, 41,60 (уш.), 79,73, 107,07, 112,01, 154,60. Анал. рассч. для C20H21NO5: C 65,73; H 8,55; N, 3,83. Обнаружено: C 65,52; H 8,39; N 3,80.
2,2,4,4,14,14-Гексаметил-7,12,16,19,20-пентаоксатриспиро[5.1.2.5.2.2]икозан (OZ36). Раствор О-метилоксима 3,3,5,5-тетраметилциклогексанона (0,92 г, 5 ммоль) и 3,3-диметил-1,5-диоксаспиро[5.5]ундекан-9-она (1,98 г, 10 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ36 (0,70 г, 38%) в виде бесцветного твердого вещества. Т.пл. 95-97°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 0,97 (с, 6H), 1,03 (с, 6H), 1,04 (с, 6H), 1,20-1,29 (м, 2H), 1,55 (д, J=3,2 Гц, 2H), 1,63 (д, J=3,7 Гц, 2H), 1,83 (т, J=6,4 Гц, 4H), 1,86-2,04 (м, 4H), 3,50 (с, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 22,68, 29,47, 30,20, 30,40, 30,91, 32,21, 32,30, 45,59, 51,43, 70,29, 96,70, 107,94, 110,58. Анал. рассч. для C21H36О5: C 68,44; H 9,85. Обнаружено: C 68,24; H 9,70.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-3''-7''-метоксиимино-цис-бицикло[3.3.0]октан (OZ37). К раствору OZ12 (0,304 г, 1,0 ммоль) в CH2Cl2 (5 мл) и этаноле (5 мл) добавляют пиридин (0,15 мл) и гидрохлорид метоксиламина (0,125 г, 1,5 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 24 час. Реакционную смесь концентрируют в вакууме с получением неочищенного остатка, который очищают перекристаллизацией из смеси этанол/Н2О (15 мл, 2:1) с получением триоксолана OZ37 (0,32 г, 96%) в виде бесцветного твердого вещества. Т.пл. 118-120°С (этанол/Н2О 2:1). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,05 (м, 16H), 2,14-2,25 (м, 2H), 2,33-2,42 (м, 2H), 2,55-2,74 (м, 4H), 3,84 (с, 3H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,49, 26,88, 33,23, 34,73, 34,85, 34,89, 35,99, 36,17, 36,79, 39,21, 39,33, 40,62, 41,42, 61,40, 111,54, 118,11, 165,40. Анал. рассч. для C19H27NO4: C 68,44; H 8,16; N 4,20. Обнаружено: C 68,54; H 7,96; N 4,29.
Адамантан-2-спиро-3'-8'-(N-фталимидо)имино-1',2',4'-триоксаспиро[4.5]декан (OZ38). К раствору OZ05 (0,454 г, 1,63 ммоль) и N-аминофталимида (0,290 г, 1,79 ммоль) в CH2Cl2 (5 мл) и этаноле (5 мл) добавляют уксусную кислоту (0,5 мл) и реакционную смесь нагревают до 50°С в течение 2 час. Реакционную смесь охлаждают до комнатной температуры, фильтруют через целит, промывают CH2Cl2 и растворитель удаляют в вакууме. Остаток очищают перекристаллизацией из этанола (10 мл) с получением триоксолана OZ38 (0,45 г, 65%) в виде бесцветного твердого вещества. Т.пл. 146-148°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,65-2,07 (м, 16H), 2,10-2,19 (м, 2H), 2,43-2,58 (м, 2H), 2,78-2,90 (м, 2H), 7,70-7,79 (м, 2H), 7,84-7,90 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,43, 26,82, 28,12, 32,41, 33,15, 33,81, 34,72, 34,76, 34,79, 34,88, 36,30, 36,32, 36,70, 107,20, 112,28, 123,54, 131,08, 134,20, 164,32, 180,89. Анал. рассч. для C24H26N2О5: C 68,23; H 6,20; N 6,63. Обнаружено: C 68,12; H 6,03; N 6,57.
Тозилгидразон адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-она (OZ39). К раствору OZ05 (0,28 г, 1,0 ммоль) и п-толуолсульфонгидразида (0,21 г, 1,1 ммоль) в CH2Cl2 (5 мл) и этаноле (5 мл) добавляют уксусную кислоту (0,5 мл) и реакционную смесь нагревают до 50°С в течение 2 час. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Остаток очищают перекристаллизацией из смеси этанол/Н2О (15 мл, 2:1) с получением триоксолана OZ39 (0,26 г, 58%) в виде бесцветного твердого вещества. Т.пл. 137°С, разл. (этанол/Н2О 2:1). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,52-2,10 (м, 18H), 2,15-2,65 (м, 4H), 2,38 (с, 3H), 7,39 (д, J=7,8 Гц, 2H), 7,72 (д, J=7,8 Гц, 2H), 10,23 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 20,92, 23,84, 25,72, 26,12, 31,05, 31,80, 33,09, 34,17, 34,29, 35,58, 35,97, 107,55, 111,19, 127,44, 129,31, 136,28, 143,01, 158,63. Анал. рассч. для C23H30N2О5S: C 61,86; H 6,77; N 6,27. Обнаружено: C 61,71; H 6,81; N 6,53.
цис-Адамантан-2-спиро-3'-8'-изопропил-1',2',4'-триоксаспиро[4.5]декан (OZ40). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4-изопропилциклогексанона (1,40 г, 10 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфир в петролейном эфире) с получением триоксолана OZ40 (0,47 г, 31%) в виде бесцветного твердого вещества. Т.пл. 67-69°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 0,85 (д, J=6,8 Гц, 6H), 1,02-1,13 (м, 1H), 1,17-1,32 (м, 2H), 1,40-1,52 (м, 1H), 1,60-2,10 (м, 20H); 13C ЯМР (125,7 МГц, CDCl3) δ 19,82, 26,54, 26,85, 26,94, 32,12, 34,54, 34,81, 34,83, 36,44, 36,87, 42,57, 109,11, 111,10. Анал. рассч. для С19Н30O3: C 74,47; H 9,87. Обнаружено: C 74,21; H 9,86.
цис-Адамантан-2-спиро-3'-8'-(4'-фторфенил)-1',2',4'-триоксаспиро[4.5]декан (OZ41). Раствор О-метилоксима 2-адамантанона (0,36 г, 2 ммоль) и 4-(4-фторфенил)циклогексанона (0,38 г, 2 ммоль) в пентане (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфир в петролейном эфире) с получением триоксолана OZ41 (0,36 г, 50%) в виде бесцветного твердого вещества. Т.пл. 103-106°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,58-2,25 (м, 22H), 2,43-2,70 (м, 1H), 6,90-7,02 (м, 2H), 7,11-7,22 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,43, 26,84, 31,57, 34,63, 34,76, 36,36, 36,75, 42,15, 108,24, 111,41, 115,06 (д, J=21,4 Гц), 128,03 (д, J=7,4 Гц), 141,75 (д, J=3,0 Гц), 161,26 (д, J=244,1 Гц). Анал. рассч. для C22Н27FO3: C 73,72; H 7,59. Обнаружено: C 73,65; H 7,66.
Адамантан-2-спиро-3'-5',5'-дифенил-1',2',4'-триоксолан (OZ42). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и бензофенона (0,91 г, 5 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ42 (0,55 г, 32%) в виде бесцветного твердого вещества. Т.пл. 105-107°С (этанол/Н2О 2:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,10 (м, 12H), 2,16-2,30 (м, 2H), 7,25-7,42 (м, 6H), 7,45-7,60 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,56, 26,98, 34,86, 35,07,36,21, 36,88, 109,68, 113,92, 126,97, 128,05, 128,56, 140,06. Анал. рассч. для C23H24О3: C 79,28; H 6,94. Обнаружено: C 79,32; H 6,96.
Адамантан-2-спиро-3'-5',5'-бис(4'-хлорфенил)-1',2',4'-триоксолан (OZ43). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4,4'-дихлорбензофенона (1,26 г, 5 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% эфира в петролейном эфире) с получением триоксолана OZ43 (0,55 г, 26%) в виде бесцветного твердого вещества. Т.пл. 128-130°С (этанол/Н2О 5:2). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 12H), 2,10-2,30 (м, 2H), 7,20-7,60 (м, 8H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,88, 34,80, 35,00, 36,17, 36,74, 108,78, 114,42, 128,33, 128,43, 134,93, 138,20. Анал. рассч. для C23H22Cl2О3: C 66,19; H 5,31. Обнаружено: C 66,37; H 5,12.
Адамантан-2-спиро-3'-5',5'-бис(4'-фторфенил)-1',2',4'-триоксолан (OZ44). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4,4'-дифторбензофенона (1,09 г, 5 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в петролейном эфире) с получением триоксолана OZ44 (0,87 г, 45%) в виде бесцветного твердого вещества. Т.пл. 86-89°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 12H), 2,06-2,40 (м, 2H), 6,90-7,20 (м, 4H), 7,35-7,65 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,41, 26,84, 34,77, 34,96, 36,17, 36,71, 108,95, 114,21, 115,06 (д, J=21,3 Гц), 128,96 (д, J=8,4 Гц), 135,56, 162,95 (д, J=248,0 Гц). Анал. рассч. для C23H22F2О3: C 71,86; H 5,77. Обнаружено: C 71,78; H 5,87.
Адамантан-2-спиро-3'-5',5'-бис(2',3',4',5',6'-пентафторфенил)-1',2',4'-триоксолан (OZ45). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и декафторбензофенона (1,81 г, 5 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% эфира в петролейном эфире) с получением триоксолана OZ45 (0,60 г, 23%) в виде бесцветного твердого вещества. Т.пл. 92-95°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,03 (м, 12H), 2,06-2,20 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,37, 26,70, 34,78, 34,83, 35,91, 36,50, 103,85 (м), 113,07 (м), 115,63, 136,83 (м), 138,84 (м), 140,95 (м), 143,00 (м), 143,54 (м), 145,54 (м). Анал. рассч. для C23H14F10О3: C 52,29; H 2,67. Обнаружено: C 52,31; H 2,77.
Адамантан-2-спиро-3'-5',5'-бис[3'-(трифторметил)фенил]-1',2',4'-триоксолан (OZ46). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 3,3'-бис(трифторметил)бензофенона (1,59 г, 5 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% эфира в петролейном эфире) с получением триоксолана OZ46 (0,62 г, 26%) в виде бесцветного твердого вещества. Т.пл. 60-62°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 12H), 2,10-2,30 (м, 2H), 7,40-7,57 (м, 2H), 7,59-7,75 (м, 4H), 7,82 (с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,85, 34,82, 34,94, 36,13, 36,71, 108,36, 114,99, 123,53 (кв, J=3,8 Гц), 123,93 (кв, J=272,4 Гц), 125,84 (кв, J=3,8 Гц), 128,93, 130,17, 130,98 (кв, J=32,8 Гц), 140,60. Анал. рассч. для C25H22F6О3: C 61,98; H 4,58. Обнаружено: C 61,70; H 4,71.
цис-Адамантан-2-спиро-3'-8'-(4'-хлорфенил)-1',2',4'-триоксаспиро[4.5]декан (OZ47). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4-(4-хлорфенил)циклогексанона (1,05 г, 5 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ47 (0,68 г, 36%) в виде бесцветного твердого вещества. Т.пл. 122-124°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,18 (м, 22H), 2,40-2,60 (м, 1H), 7,05-7,30 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,59, 26,99, 31,43, 34,68, 34,86, 36,53, 36,89, 42,40, 108,22, 111,48, 128,12, 128,52, 131,84, 144,63. Анал. рассч. для C22H27ClO3: C 70,48; H 7,26. Обнаружено: C 70,50; H 7,38.
цис-Адамантан-2-спиро-3'-8'-[4'-(трифторметил)фенил]-1',2',4'-триоксаспиро[4.5]декан (OZ48). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4-[4-(трифторметил)фенил]циклогексанона (1,21 г, 5 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ48 (0,96 г, 47%) в виде бесцветного твердого вещества. Т.пл. 115-117°С (этанол/Н2О 2:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,20 (м, 22H), 2,50-2,70 (м, 1H), 7,26-7,65 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,60, 27,01, 31,26, 34,64, 34,88, 36,56, 36,90, 42,91, 108,13, 111,57, 124,33 (кв, J=269,3 Гц), 125,38 (кв, J=3,8 Гц), 127,14, 128,67 (кв, J=32,8 Гц), 150,21. Анал. рассч. для C23H27F3О3: C 67,63; H 6,66. Обнаружено: C 67,41; H 6,48.
Адамантан-2-спиро-3'-8'-ацетил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ49). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-ацетил-4-пиперидона (0,71 г, 5 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, эфир) с получением триоксолана OZ49 (0,22 г, 14%) в виде бесцветного твердого вещества. Т.пл. 77-79°С (этанол/Н2О 1:2). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 18H), 2,11 (с, 3H), 3,45-3,70 (м, 3H), 3,72-3,86 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 21,22, 26,51, 26,91, 34,14, 34,74, 34,83, 35,00, 35,16, 36,44, 36,51, 36,76, 39,42, 44,15, 106,75, 112,26, 168,77. Анал. рассч. для C17H25NO4: C 66,43; H 8,20; N 4,56. Обнаружено: C 66,18; H 7,96; N 4,47.
8',8'-Диоксид адамантан-2-спиро-3'-1',2',4'-триокса-8'-тиаспиро[4.5]декана (OZ50). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1,1-диоксатетрагидротиопиран-4-она (0,74 г, 5 ммоль) в пентане (25 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 50% эфира в гексанах) с получением триоксолана OZ50 (0,23 г, 15%) в виде бесцветного твердого вещества. Т.пл. 128-129°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 14H), 2,38 (т, J=6,3 Гц, 4H), 3,10-3,30 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,36, 26,76, 32,31, 34,74, 34,84, 36,31, 36,59, 48,81, 104,97, 113,33. Анал. рассч. для C15Н22О5S: C 57,30; H 7,05. Обнаружено: C 57,44; H 6,97.
Адамантан-2-спиро-3'-8'-(п-толуолсульфонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ51). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-(п-толуолсульфонил)-4-пиперидона (1,30 г, 5 ммоль) в пентане (45 мл) и CH2Cl2 (25 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) с получением триоксолана OZ51 (0,33 г, 16%) в виде бесцветного твердого вещества. Т.пл. 124-125°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 18H), 2,44 (с, 3H), 2,85-3,02 (м, 2H), 3,27-3,42 (м, 2H), 7,32 (д, J=8,3 Гц, 2H), 7,64 (д, J=8,3 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 21,47, 26,48, 26,87, 34,06, 34,76, 34,79, 36,42, 36,73, 44,26, 106,00, 112,34, 127,62, 129,71, 133,94, 143,60. Анал. рассч. для C22H29NO5S: C 62,98; H 6,97; N 3,34. Обнаружено: C 62,99; H 6,88; N 3,12.
Адамантан-2-спиро-3'-5',5'-дибензил-1',2',4'-триоксолан (OZ52). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1,3-дифенилацетона (1,10 г, 5 ммоль) в пентане (60 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% эфира в гексанах) с получением триоксолана OZ52 (1,10 г, 58%) в виде бесцветного твердого вещества. Т.пл. 86-88°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,40-2,10 (м, 14H), 2,93 (д, J=4,2 Гц, 2H), 3,04 (д, J=4,2 Гц, 2H), 7,10-7,40 (м, 10H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,49, 26,93, 34,81, 34,90, 36,13, 36,80, 41,92, 110,37, 112,48, 126,58, 127,89, 130,89, 135,70. Анал. рассч. для C25H28О3: C 79,75; H 7,50. Обнаружено: C 79,57; H 7,39.
Адамантан-2-спиро-3'-8'-[3'-(этоксикарбонил)пропионил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ53). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-[3-(этоксикарбонил)пропионил]-4-пиперидона (1,20 г, 5 ммоль) в пентане (45 мл) и CH2Cl2 (15 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) с получением триоксолана OZ53 (0,60 г, 30%) в виде бесцветного твердого вещества. Т.пл. 116-117°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,26 (т, J=7,1 Гц, 3H), 1,60-2,10 (м, 18H), 2,55-2,75,(м, 4H), 3,45-3,70 (м, 3H), 3,72-3,87 (м, 1H), 4,15 (кв, J=7,2 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,17, 26,50, 26,90, 27,84, 29,45, 34,17, 34,74, 34,98, 35,06, 36,48, 36,76, 39,81, 43,10, 60,51, 106,80, 112,26, 169,60, 173,02. Анал. рассч. для C21H21NO6: C 64,10; H 7,94; N 3,56. Обнаружено: C 63,96; H 7,81; N 3,40.
Адамантан-2-спиро-3'-8'-карбоксиметоксиимино-1',2',4'-триоксаспиро[4.5]декан (OZ54). К раствору OZ05 (0,278 г, 1,0 ммоль) в метаноле (5 мл) добавляют пиридин (0,16 г, 2,0 ммоль) и гемигидрохлорид карбоксиметоксиламина (0,262 г, 1,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 час. После удаления растворителя в вакууме неочищенный остаток подкисляют 2 М HCl (25 мл) и экстрагируют CH2Cl2 (3×20 мл). Объединенные экстракты сушат над Na2SO4 и концентрируют с получением остатка, который растирают в гексанах с получением триоксолана OZ54 (0,30 г, 85%) в виде бесцветного твердого вещества. Т.пл. 126-128°С (гексаны). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,10 (м, 18H), 2,33-2,50 (м, 2H), 2,59-2,70 (м, 1H), 2,72-2,90 (м, 1H), 4,62 (с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 22,08, 26,52, 26,92, 28,55, 32,54, 33,76, 34,80, 34,87, 34,92, 36,41, 36,79, 69,71, 107,77, 112,15, 160,04, 174,84. Анал. рассч. для C18Н25NO6: C 61,52; H 7,17; N 3,99. Обнаружено: C 61,48; H 7,16; N 3,84.
Хлорид пиридиниоацетилгидразона адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-она (OZ55). К раствору OZ05 (278 мг, 1 ммоль) в этаноле (10 мл) и уксусной кислоте (1 мл) добавляют реагент Жирара Р (190 мг, 1 ммоль). Смесь перемешивают при 25°С в течение 24 час. Растворитель удаляют в вакууме и остаток очищают перекристаллизацией из смеси эфир/метанол (95:5) с получением триоксолана OZ55 (140 мг, 31%, смесь двух таутомеров 2:1) в виде желтоватого твердого вещества. Т.пл. 88-90°С (эфир/метанол 9:1). 1H ЯМР (500 МГц, CD3OD) δ 1,58-2,39 (м, 18H), 2,43-2,92 (м, 4H), 5,72 (с, изомер в малом количестве), 5,94 (с, основной изомер), 8,10-8,28 (м, 2H), 8,61-8,78 (м, 1H), 8,90-9,14 (м, 2H); 13C ЯМР (125,7 МГц, CD3OD) δ 21,36, 24,51, 25,72, 27,88, 28,29, 29,00, 29,08, 31,93, 32,59, 32,80, 32,87, 33,58, 33,68, 33,89, 34,83, 35,73, 35,77, 35,92, 36,63, 37,22, 37,72, 38,78, 39,02, 40,18, 40,25, 41,08, 61,72 (м), 62,77 (м), 108,80, 108,92, 113,21, 128,86, 129,00, 129,20, 147,46, 147,66, 157,71, 163,30, 167,86, 175,75. Анал. рассч. для C23H30ClN3О4·H2О: C 59,28; H 6,92; N 9,02. Обнаружено: C 58,88; H 7,24; N 8,83.
Адамантан-2-спиро-3'-8'-метансульфонил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ56). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-метансульфонил-4-пиперидона (0,90 г, 5,1 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 20% эфира в гексанах) с получением триоксолана OZ56 (0,33 г, 19%) в виде бесцветного твердого вещества. Т.пл. 146-148°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,08 (м, 18H), 2,81 (с, 3H), 3,26-3,34 (м, 2H), 3,38-3,47 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,50, 26,90, 34,28, 34,79, 34,87, 35,56, 36,47, 36,75, 44,07, 106,02, 112,48. Анал. рассч. для C16Н25NO5S: C 55,95; H 7,34; N 4,08. Обнаружено: C 56,06; H 7,33; N 3,91.
Адамантан-2-спиро-3'-8'-(4'-хлорбензолсульфонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ57). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-(4-хлорбензолсульфонил)-4-пиперидона (1,37 г, 5 ммоль) в пентане (25 мл) и CH2Cl2 (75 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) с получением триоксолана OZ57 (0,19 г, 9%) в виде бесцветного твердого вещества. Т.пл. 142-144°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,09 (м, 18H), 2,96-3,05 (м, 2H), 3,27-3,36 (м, 2H), 7,52 (д, J=8,8 Гц, 2H), 7,70 (д, J=8,8 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,45, 26,83, 34,05, 34,74, 34,78, 36,40, 36,70, 44,26, 105,79, 112,46, 128,93, 129,46, 135,55, 139,45. Анал. рассч. для C21H26ClNO5S: C 57,33; H 5,96; N 3,18. Обнаружено: C 57,59; H 6,00; N 3,08.
Адамантан-2-спиро-3'-8'-(3'-карбоксипропионил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ58). К суспензии OZ53 (500 мг, 1,27 ммоль) в этаноле (5 мл) добавляют KOH (225 мг, 4 ммоль), растворенный в воде (5 мл). Смесь нагревают при 50°С в течение 4 час. Этанол удаляют в вакууме и остаток промывают CH2Cl2 (2×10 мл). Водные слои подкисляют до рН 2 3 М водной HCl и экстрагируют CH2Cl2 (2×10 мл). Объединенные органические экстракты сушат над MgSO4 и концентрируют в вакууме. Остаток очищают перекристаллизацией из этанола с получением триоксолана OZ58 (200 мг, 43%) в виде бесцветного твердого вещества. Т.пл. 124-126°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,10 (м, 18H), 2,60-2,80 (м, 4H), 3,50-3,70 (м, 3H), 3,72-3,89 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,51, 26,90, 27,95, 29,57, 34,13, 34,75, 34,83, 35,00, 36,45, 36,50, 36,76, 40,04, 43,27, 106,62, 112,37, 170,20, 176,15. Анал. рассч. для C19Н27NO6: C 62,45; H 7,45; N 3,83. Обнаружено: C 62,60; H 7,53; N 3,70.
Адамантан-2-спиро-3'-8'-(4'-метоксибензолсульфонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ59). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-(4-метоксибензолсульфонил)-4-пиперидона (1,35 г, 5 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 20% эфира в гексанах) с получением триоксолана OZ59 (0,40 г, 18%) в виде бесцветного твердого вещества. Т.пл. 116-118°С. 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 18H), 2,89-3,01 (м, 2H), 3,28-3,41 (м, 2H), 3,88 (с, 3H), 6,99 (д, J=9,3 Гц, 2H), 7,69 (д, J=8,8 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,85, 34,02, 34,74, 34,78, 36,40, 36,71, 44,27, 55,60, 105,99, 112,32, 114,32, 128,45, 129,68, 163,13. Анал. рассч. для C22Н29NO6S: C 60,67; H 6,71; N 3,33. Обнаружено: C 60,81; H 6,79; N 3,10.
Адамантан-2-спиро-3'-8'-бензолсульфонил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ60). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 1-бензолсульфонил-4-пиперидона (1,20 г, 5 ммоль) в пентане (40 мл) и CH2Cl2 (60 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 20% эфира в гексанах) с получением триоксолана OZ60 (0,20 г, 10%) в виде бесцветного твердого вещества. Т.пл. 130-132°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,09 (м, 18H), 2,92-3,05 (м, 2H), 3,29-3,42 (м, 2H), 7,50-7,57 (м, 2H), 7,58-7,64 (м, 1H), 7,73-7,81 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,85, 34,07, 34,75, 34,79,36,41, 36,72, 44,28, 105,95, 112,38, 127,55, 129,10, 132,79, 136,96. Анал. рассч. для C21Н27NO5S: C 62,20; H 6,71; N 3,45. Обнаружено: C 62,38; H 6,88; N 3,44.
цис-Адамантан-2-спиро-3'-8'-этоксикарбонилметил-1',2',4'-триоксаспиро[4.5]декан (OZ61). Раствор О-метилоксима 2-адамантанона (0,90 г, 5 ммоль) и 4-(этоксикарбонилметил)циклогексанона (1,00 г, 5,4 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в гексанах) с получением триоксолана OZ61 (0,35 г, 20%) в виде бесцветного твердого вещества. Т.пл. 62-64°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,25 (т, J=7,1 Гц, 3H), 1,20-1,32 (м, 2H), 1,60-2,10 (м, 21H), 2,20 (д, J=6,8 Гц, 2H), 4,12 (кв, J=7,1 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,23, 26,59, 26,99, 29,94, 33,24, 33,99, 34,84, 34,86, 36,50, 36,90, 40,92, 60,16, 108,48, 111,31, 172,67. Анал. рассч. для C20H30О5: C 68,54; H 8,63. Обнаружено: C 68,63; H 8,62.
3,11-Дифенил-7,14,15-триоксадиспиро[5.1.5.2]пентадекан (OZ62). Раствор О-метилоксима 4-фенилциклогексанона (1,02 г, 5 ммоль) и 4-фенилциклогексанона (0,87 г, 5 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в гексанах) с получением триоксолана OZ62 (0,45 г, 25%, смесь двух диастереомеров 1:1) в виде бесцветного твердого вещества. Т.пл. 136-138°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,65-2,20 (м, 16H), 2,52-2,62 (м, 2H), 7,16-7,35 (м, 10H); 13C ЯМР (125,7 МГц, CDCl3) δ 31,14, 31,46, 34,53, 34,64, 42,99, 43,27, 108,43, 108,86, 126,19, 126,79, 126,86, 128,39, 128,41, 146,08, 146,11. Анал. рассч. для C24Н28О3: C 79,09; H 7,74. Обнаружено: C 79,22; H 7,68.
Адамантан-2-спиро-3'-8'-циано-8'-фенил-1',2',4'-триоксаспиро[4.5]декан (OZ63). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 4-циано-4-фенилциклогексанона (2,00 г, 10 ммоль) в пентане (60 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ63 (1,85 г, 51%) в виде бесцветного твердого вещества. Т.пл. 137-138°С (этанол/H2O 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,38 (м, 22H), 7,25-7,55 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,55, 26,92, 31,92, 34,84, 34,89, 36,53, 36,81, 43,21, 106,90, 112,14, 121,71, 125,53, 128,13, 129,02, 139,88. Анал. рассч. для C23H27NO3: C 75,59; H 7,45; N 3,83. Обнаружено: C 75,46; H 7,39; N 3,86.
цис-Адамантан-2-спиро-3'-8'-неопентилоксикарбонил-1',2',4'-триоксаспиро[4.5]декан (OZ64). Раствор О-метилоксима 2-адамантанона (0,54 г, 3 ммоль) и 4-(неопентилоксикарбонил)циклогексанона (0,64 г, 3 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% эфира в петролейном эфире) с получением триоксолана OZ64 (0,70 г, 62%, смесь двух диастереомеров 4:1). Перекристаллизацией из 95% этанола получают аналитически чистый цис-изомер (0,20 г, 18%) в виде бесцветного твердого вещества. Т.пл. 84-86°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 0,93 (с, 9H), 1,60-2,10 (м, 22H), 2,32-2,44 (м, 1H), 3,76 (с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,32, 26,45, 26,57, 26,98, 31,41, 33,42, 34,83, 34,88, 36,50, 36,87, 41,69, 73,70, 107,98, 111,54, 174,76. Анал. рассч. для C22H34О5: C 69,81; H 9,05. Обнаружено: C 70,00; H 8,98.
Сульфат натрия адамантан-2-спиро-3'-,1',2',4'-триоксаспиро[4.5]декан-8'-ила (OZ65). Смесь OZ32 (0,42 г, 1,5 ммоль), комплекса триоксида серы с пиридином (0,60 г, 3,8 ммоль), пиридина (0,75 мл) и уксусного ангидрида (0,75 мл) нагревают при 50°С при перемешивании в течение 30 мин. Реакционную смесь охлаждают до комнатной температуры, разбавляют петролейным эфиром (30 мл) и выдерживают при -20°С в течение ночи. Осадок собирают фильтрацией, промывают смесью петролейный эфир/бензол (5:1) и сушат в вакуум-сушильном шкафу. Высушенный твердый остаток растворяют в хлороформе (12 мл), охлаждают на бане со льдом и фильтруют для удаления нерастворимого комплекса триоксида серы с пиридином. Фильтрат концентрируют с получением сульфата пиридиния OZ32 (0,65 г, 100%). К суспензии вышеуказанной соли пиридиния (0,50 г) в воде (6 мл) добавляют 10% водный карбонат натрия (6 мл) при встряхивании. Реакционную смесь выдерживают при -20°С в течение 4 час. Осадок отфильтровывают, промывают холодной водой (2 мл) и сушат в вакуум-сушильном шкафу с получением триоксолана OZ65 (0,35 г, 61%, смесь двух диастереомеров 2:1) в виде бесцветного твердого вещества. Т.пл. 154°С, разл. (вода). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,50-2,02 (м, 22H), 4,12-4,22 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 25,88, 26,28, 28,84, 29,24, 30,26, 30,68, 34,30, 34,36, 35,78, 35,89, 36,17, 70,66, 71,08, 108,05, 108,09, 110,68, 110,72. Анал. рассч. для C16H23NaO7S·H2О: C 47,99; H 6,29. Обнаружено: C 47,67; H 6,59.
3,3-Бис(4-фторфенил)-8-фенил-1,2,4-триоксаспиро[4.5]декан (OZ66). Раствор О-метилоксима 4-фенилциклогексанона (1,02 г, 5 ммоль) и 4,4'-дифторбензофенона (1,09 г, 5 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 3% эфира в петролейном эфире) с получением триоксолана OZ66 (0,56 г, 27%, смесь двух диастереомеров 3:1) в виде бесцветного твердого вещества. Т.пл. 87-90°С (этанол/H2O 2,5:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,15 (м, 8H), 2,51-2,70 (м, 1H), 6,99-7,09 (м, 4H), 7,16-7,36 (м, 5H), 7,44-7,53 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 31,23, 31,34, 34,20, 34,48, 42,85, 43,01, 108,84, 109,29, 111,20, 111,29, 115,15 (д, J=21,4 Гц), 115,18 (д, J=21,4 Гц), 126,29, 126,33, 126,74, 126,83, 128,47, 128,95 (д, J=8,4 Гц), 129,01 (д, J=6,1 Гц), 135,33, 135,36, 145,74, 145,79, 163,05 (д, J=248,0 Гц). Анал. рассч. для C25H22F2О3: C 73,52; H 5,43. Обнаружено: C 73,53; H 5,51.
цис-Бицикло[3.3.1]нонан-9-спиро-3'-8'-фенил-1',2',4'-триоксаспиро[4.5]декан (OZ67). Раствор О-метилоксима бицикло[3.3.1]нонан-9-она (0,84 г, 5 ммоль) и 4-фенилциклогексанона (0,87 г, 5 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 3% эфира в петролейном эфире) с получением триоксолана OZ67 (0,54 г, 33%) в виде бесцветного твердого вещества. Т.пл. 120-122°С (этанол/H2O 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,41-1,60 (м, 2H), 1,61-2,20 (м, 20H), 2,49-2,60 (м, 1H), 7,14-7,35 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 20,51, 20,93, 29,47, 29,68, 31,49, 34,88, 36,44, 43,05, 108,32, 111,35, 126,16, 126,78, 128,40, 146,22. Анал. рассч. для C21H28О3: C 76,79; H 8,59. Обнаружено: C 76,90; H 8,39.
Бицикло[3.3.1]нонан-9-спиро-3'-11',11'-диметил-1',2',4',9',13'-пентаоксадиспиро[4.2.5.2]пентадекан (OZ68). Раствор О-метилоксима бицикло[3.3.1]нонан-9-она (0,84 г, 5 ммоль) и 3,3-диметил-1,5-диоксаспиро[5.5]ундекан-9-она (0,99 г, 5 ммоль) в пентане (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в петролейном эфире) с получением триоксолана OZ68 (0,72 г, 41%) в виде бесцветного твердого вещества. Т.пл. 122-124°С (этанол/H2O 5:1). 1H ЯМР (500 МГц, CDCl3) δ 0,97 (с, 6H), 1,40-1,56 (м, 2H), 1,62-2,16 (м, 20H), 3,49 (с, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 20,48, 20,91, 22,71, 29,40, 29,54, 29,73, 30,21, 30,64, 36,34, 70,30, 70,33, 96,76, 108,46, 111,50. Анал. рассч. для C20H32О5: C 68,15; H 9,15. Обнаружено: C 68,25; H 9,06.
Адамантан-2-спиро-3'-8'-ацетокси-8'-(4'-фторфенил)-1',2',4'-триоксаспиро[4.5]декан (OZ69). Раствор О-метилоксима 2-адамантанона (0,36 г, 2 ммоль) и 4-ацетокси-4-(4-фторфенил)циклогексанона (0,50 г, 2 ммоль) в пентане (100 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в петролейном эфире) с получением триоксолана OZ69 (0,44 г, 53%) в виде бесцветного твердого вещества. Т.пл. 147-149°С (этанол/H2O 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,19 (м, 20H), 2,07 (с, 3H), 2,53 (каж. д, J=12,2 Гц, 2H), 6,96-7,04 (м, 2H), 7,27-7,33 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 21,93, 26,57, 26,98, 30,31, 33,71, 34,86, 34,88, 36,51, 36,87, 80,67, 107,76, 111,82, 115,20 (д, J=21,4 Гц), 128,30 (д, J=8,4 Гц), 139,92 (д, J=3,1 Гц), 161,95 (д, J=245,7 Гц), 169,43. Анал. рассч. для C24H29FO5: C 69,21; H 7,02. Обнаружено: C 68,98; H 7,09.
Адамантан-2-спиро-3'-8'-этоксикарбонил-1',2',4'-триоксаспиро[4.5]декан (OZ70). Раствор О-метилоксима 2-адамантанона (3,58 г, 20 ммоль) и 4-(этоксикарбонил)циклогексанона (3,40 г, 20 ммоль) в пентане (160 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в петролейном эфире) с получением триоксолана OZ70 (3,10 г, 46%, смесь двух диастереомеров 2,5:1) в виде бесцветного масла. Два аналитически чистых диастереомера получают последовательной флэш-хроматографией (силикагель, 3% эфира в петролейном эфире). Для транс-изомера (минорного): выход 9%; бесцветное масло. 1H ЯМР (500 МГц, CDCl3) δ 1,26 (т, J=7,1 Гц, 3H), 1,58-2,10 (м, 22H), 2,34 (м, 1H), 4,14 (кв, J=7,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,15, 25,99, 26,50, 26,90, 33,10, 34,72, 34,84, 36,41, 36,79, 41,15, 60,20, 107,93, 111,66, 174,74. Для цис-изомера (основной): выход 14%; бесцветное масло. т.пл. 38-39°C (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,25 (т, J=7,1 Гц, 3H), 1,58-2,10 (м, 22H), 2,32 (м, 1H), 4,12 (кв, J=7,1 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,13, 26,18, 26,51, 26,92, 33,31, 34,76, 34,81, 36,42, 36,81, 41,38, 60,22, 107,90, 111,40, 174,70. Анал. рассч. для C19H28О5: C 67,83; H 8,39. Обнаружено: C 68,06; H 8,50.
транс-Адамантан-2-спиро-3'-8'-карбокси-1',2',4'-триоксаспиро[4.5]декан (OZ71). Смесь транс-OZ70 (0,34 г, 1 ммоль), метанола (10 мл) и КОН (0,2 г), растворенную в воде (1,2 мл), нагревают при 50°С в течение 1,5 час и далее охлаждают до комнатной температуры. Реакционную смесь подкисляют концентрированной HCl (0,5 мл) и охлаждают до -20°С. Осадок фильтруют и промывают холодной смесью этанол/Н2О (1:1). Фильтрат разбавляют водой и экстрагируют хлороформом (2×10 мл). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют в вакууме. Перекристаллизацией объединенных твердых веществ из смеси этанол/Н2О (1:1) получают триоксолан OZ71 (0,25 г, 81%) в виде бесцветного твердого вещества. Т.пл. 158-159°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,58-2,12 (м, 22H), 2,42 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 25,84, 26,54, 26,94, 33,02, 34,79, 34,92, 36,46, 36,84, 40,78, 107,86, 111,85, 180,61. Анал. рассч. для C17H24O5: C 66,21; H 7,84. Обнаружено: C 66,12; H 7,60.
цис-Адамантан-2-спиро-3'-8'-карбокси-1',2',4'-триоксаспиро[4.5]декан (OZ72). Смесь цис-OZ70 (0,40 г, 1,2 ммоль), метанола (12 мл) и КОН (0,2 г), растворенную в воде (1,2 мл), нагревают при 50°С в течение 1,5 час и далее охлаждают до комнатной температуры. Реакционную смесь подкисляют концентрированной HCl (0,6 мл) и охлаждают до -20°С. Осадок фильтруют и промывают холодной смесью этанол/Н2О (1:1). Фильтрат разбавляют водой и экстрагируют хлороформом (2×10 мл). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют в вакууме. Перекристаллизацией объединенных твердых веществ из смеси этанол/Н2О (1:1) получают триоксолан OZ72 (0,33 г, 89%) в виде бесцветного твердого вещества. Т.пл. 148-150°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,10 (м, 22H), 2,38 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,00, 26,55, 26,96, 33,25, 34,82, 34,87, 36,47, 36,85, 40,99, 107,80, 111,58, 180,51. Анал. рассч. для C17Н24O5: C 66,21; H 7,84. Обнаружено: C 66,13; H 7,68.
цис-Адамантан-2-спиро-3'-8'-диэтиламинокарбонил-1',2',4'-триоксаспиро[4.5]декан (OZ73). Раствор О-метилоксима 2-адамантанона (1,43 г, 8 ммоль) и N,N-диэтил-4-оксо-циклогексанкарбоксамида (1,61 г, 8 ммоль) в пентане (100 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, от 10 до 35% эфира в гексанах) с получением триоксолана OZ73 (1,00 г, 34%). Перекристаллизацией из смеси гексаны/CH2Cl2 (9:1) получают аналитически чистый цис-изомер (0,60 г, 21%)в виде бесцветного твердого вещества. Т.пл. 115-117°С (гексаны/CH2Cl2 9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,09 (т, J=7,3 Гц, 3H), 1,19 (т, J=7,3 Гц, 3H), 1,60-2,14 (м, 22H), 2,36-2,46 (м, 1H), 3,32 (кв, J=7,3 Гц, 2H), 3,36 (кв, J=7,3 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 13,09, 14,95, 26,53, 26,96, 27,08, 33,81, 34,78, 34,85, 36,45, 36,85, 39,16, 40,08, 41,74 107,92, 111,21, 174,14. Анал. рассч. для C21H33NO4: C 69,39; H 9,15; N 3,85. Обнаружено: C 69,17; H 9,03; N 3,80.
Адамантан-2-спиро-3'-8'-бензоилокси-1',2',4'-триоксаспиро[4.5]декан (OZ74). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и 4-бензоилоксициклогексанона (2,18 г, 10 ммоль) в пентане (120 мл) и CH2Cl2 (30 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 6% эфира в петролейном эфире) с получением триоксолана OZ74 (2,00 г, 52%, смесь двух диастереомеров 2:1) в виде бесцветного твердого вещества. Т.пл. 103-106°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,18 (м, 22H), 5,12-5,21 (м, 1H), 7,40-7,48 (м, 2H), 7,52-7,61 (м, 1H), 8,01-8,09 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,57, 26,99, 28,23, 28,50, 30,62, 31,01, 34,84, 34,92, 34,94, 36,45, 36,53, 36,87, 69,91, 70,45, 107,88, 107,98, 111,74, 111,80, 128,33, 129,57, 130,75, 130,80, 132,83, 165,84, 165,91. Анал. рассч. для C23Н25O5: C 71,85; H 7,34. Обнаружено: C 71,65; H 7,45.
Адамантан-2-спиро-3'-8'-циано-8'-(3',4'-дихлорфенил)-1',2',4'-триоксаспиро[4.5]декан (OZ75). Раствор О-метилоксима 2-адамантанона (0,85 г, 4,7 ммоль) и 4-циано-4-(3,4-дихлорфенил)циклогексанона (1,30 г, 4,7 ммоль) в пентане (50 мл) и CH2Cl2 (70 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 8% эфира в гексанах) с получением триоксолана OZ75 (0,62 г, 30%) в виде бесцветного твердого вещества. Т.пл. 143-145°С (этанол/H2O 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,33 (м, 22H), 7,33 (дд, J=8,3, 2,4 Гц, 1H), 7,47 (д, J=8,3 Гц, 1H), 7,57 (д, J=2,4 Гц, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,52, 26,90, 31,78, 34,84, 34,87, 36,52, 36,78, 42,75, 106,54, 112,38, 120,85, 125,00, 127,87, 130,99, 132,63, 133,42, 140,09. Анал. рассч. для C23H25Cl2NO3: C 63,60; H 5,80; N 3,22. Обнаружено: C 63,70; H 5,80; N 3,22.
Адамантан-2-спиро-3'-8'-(4'-фторфенил)-8'-гидрокси-1',2',4'-триоксаспиро[4.5]декан (OZ76). Смесь OZ69 (2,40 г, 5,76 ммоль), метанола (56 мл) и 17% водного КОН (5,6 мл) нагревают при 50°С в течение 2 час. Реакционную смесь охлаждают до комнатной температуры, концентрируют до 10 мл, разбавляют водой (40 мл) и экстрагируют хлороформом (40 мл × 3). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают перекристаллизацией из смеси этанол/Н2О (1:1) с получением OZ76 (1,87 г, 87%) в виде бесцветного твердого вещества. Т.пл. 122-124°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,18 (м, 20H), 2,25 (тд, J=13,7, 4,4 Гц, 2H), 6,98-7,14 (м, 2H), 7,38-7,56 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,54, 26,94, 30,25, 34,84, 36,49, 36,53, 36,84, 71,85, 108,22, 111,62, 115,02 (д, J=21,1 Гц), 126,17 (д, J=7,8 Гц), 144,03 (д, J=3,2 Гц), 161,87 (д, J=245,4 Гц). Анал. рассч. для C22H27FO4: C 70,57; H 7,27. Обнаружено: C 70,37; H 7,27.
Адамантан-2-спиро-3'-8'-(4'-фторфенил)-8'-метокси-1',2',4'-триоксаспиро[4.5]декан (OZ77). Раствор О-метилоксима 2-адамантанона (0,63 г, 3,5 ммоль) и 4-(4-фторфенил)-4-метоксициклогексанона (0,78 г, 3,5 ммоль) в пентане (100 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ77 (0,34 г, 25%) в виде бесцветного твердого вещества. Т.пл. 121-123°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,27 (м, 22H), 2,97 (с, 3H), 6,97-7,14 (м, 2H), 7,30-7,45 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 26,98, 30,04, 32,80, 34,86, 34,88, 36,52, 36,88, 49,89, 75,82, 108,38, 111,51, 115,08 (д, J=21,1 Гц), 127,66 (д, J=7,8 Гц), 140,33, 161,98 (д, J=245,5 Гц). Анал. рассч. для C23H29FO4: C 71,11; H 7,52. Обнаружено: C 70,90; H 7,50.
цис-Адамантан-2-спиро-3'-8'-карбоксиметил-1',2',4'-триоксаспиро[4.5]декан (OZ78). К раствору OZ61 (998 мг, 2,85 ммоль) в 95% этаноле (10 мл) добавляют 15% водный NaOH (10 мл). Смесь нагревают при 60-65°С в течение 2 час, охлаждают до комнатной температуры и подкисляют 6 М HCl (10 мл). Суспензию выдерживают при 0-5°С в течение 1 час и фильтруют. Перекристаллизацией твердого вещества из 95% этанола получают триоксолан OZ78 (700 мг, 76%) в виде бесцветного твердого вещества. Т.пл. 146-148°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,19-1,41 (м, 2H), 1,60-2,05 (м, 21H), 2,27 (д, J=6,8 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 26,97, 29,91, 33,00, 33,95, 34,86, 36,49, 36,89, 40,39, 108,38, 111,40, 177,75. Анал. рассч. для C18H26О5: C 67,06; H 8,13. Обнаружено: C 67,20; H 8,13.
Адамантан-2-спиро-3'-8'-этансульфонил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ79). Раствор О-метилоксима 2-адамантанона (895 мг, 5,0 ммоль) и 1-этансульфонил-4-пиперидона (955 мг, 5,0 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 20% эфира в гексанах) с получением триоксолана OZ79 (700 мг, 39%) в виде бесцветного твердого вещества. Т.пл. 110-112°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,37 (т, J=7,3 Гц, 3H), 1,62-2,08 (м, 18H), 2,97 (кв, J=7,5 Гц, 2H), 3,28-3,41 (м, 2H), 3,43-3,56 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 7,91, 26,48, 26,88, 34,70, 34,78, 34,86, 36,46, 36,74, 44,00, 44,85, 106,20, 112,40. Анал. рассч. для C17H27NO5S: C 57,12; H 7,61; N 3,92. Обнаружено: C 56,94; H 7,52; N 3,89.
Гидрохлорид адамантан-2-спиро-3'-1',2',4'-триокса-8'-азаспиро[4.5]декана (OZ80). К раствору OZ35 (1,41 г, 3,86 ммоль) в эфире (10 мл) добавляют 1 М HCl в эфире (40 мл). Смесь перемешивают при комнатной температуре в течение 16 час и полученный осадок фильтруют и промывают эфиром (2×5 мл) с получением триоксолана OZ80 (400 мг, 34%) в виде бесцветного твердого вещества. Т.пл. 138-140°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,61-2,05 (м, 14H), 2,19 (уш.с, 4H), 2,34 (уш. с, 4H), 9,72 (уш.с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,37, 26,74, 31,35, 34,70, 34,79, 36,32, 36,60, 42,31, 104,12, 113,08. Анал. рассч. для C15H24ClNO3: C 59,69; H 8,02; N 4,64. Обнаружено: C 59,78; H 7,89; N 4,70.
Адамантан-2-спиро-3'-5',5'-бис(2'-пиридил)-1',2',4'-триоксолан (OZ81). Раствор О-метилоксима 2-адамантанона (716 мг, 4,0 ммоль) и ди-2-пиридилкетона (777 мг, 4,2 ммоль) в пентане (70 мл) и CH2Cl2 (30 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 4% этанола в эфире) с получением триоксолана OZ81 (620 мг, 44%) в виде бесцветного твердого вещества. Т.пл. 135-136°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,10 (м, 12H), 2,27 (д, J=12 Гц, 2H), 7,21 (ддд, J=8,5, 5,0, 1,0 Гц, 2H), 7,76 (ддд, J=8,0, 8,0, 2,0 Гц, 2H), 7,95 (д, J=8,0 Гц, 2H), 8,55 (дд, J=4,5, 1,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,50, 26,86, 34,81, 34,88, 35,93, 36,74, 107,92, 114,58, 121,16, 123,16, 136,38, 149,12, 158,20. Анал. рассч. для C21H22N2О3: C 71,98; H 6,33; N 7,99. Обнаружено: C 71,94; H 6,30; N 7,91. Реакцией с использованием 2 экв. кетона при тех же условиях получают после очистки OZ81 (680 мг, 49%).
Адамантан-2-спиро-3'-8'-ацетоксиацетил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ82). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 1-ацетоксиацетил-4-пиперидона (3,82 г, 20 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 80% эфира в гексанах) с получением триоксолана OZ82 (1,82 г, 50%) в виде бесцветного твердого вещества. Т.пл. 112-114°С. 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,06 (м, 18H), 2,19 (с, 3H), 3,39-3,55 (м, 2H), 3,60-3,69 (м, 1H), 3,73-3,87 (м, 1H), 4,73 (AB система, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 20,54, 26,46, 26,85, 34,00, 34,76, 34,96, 36,43, 36,71, 40,06, 42,41, 61,27, 106,49, 112,41, 164,85, 170,43. Анал. рассч. для C19H27NO6: C 62,45; H 7,45; N 3,83. Обнаружено: C 62,20; H 7,48; N 3,84.
Адамантан-2-спиро-3'-8'-гидроксиацетил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ83). К раствору OZ82 (600 мг, 1,64 ммоль) в ТГФ (5 мл) добавляют воду (3 мл) и 15% водный NaOH (3 мл). Смесь перемешивают при комнатной температуре в течение 16 час и экстрагируют CH2Cl2 (3×10 мл). Объединенные экстракты сушат над MgSO4 и концентрируют. Кристаллизацией остатка из метанола получают триоксолан OZ83 (360 мг, 68%) в виде бесцветного твердого вещества. Т.пл. 152-154°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,61-2,07 (м, 18H), 3,28-3,43 (м, 2H), 3,64-3,79 (м, 1H), 3,80-3,91 (м, 1H), 4,18 (д, J=4,4 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,43, 26,83, 33,99, 34,71, 34,79, 34,95, 36,38, 36,43, 36,68, 40,39, 41,22, 59,69, 106,37, 112,49, 170,03. Анал. рассч. для C17H25NO5: C 63,14; H 7,79; N 4,33. Обнаружено: C 63,20; H 7,85; N 4,26.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-1''-3'',4''-дигидро-2''H-нафталин (OZ84). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и α-тетралона (710 мг, 5 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% эфира в гексанах) с получением триоксолана OZ84 (360 мг, 23%) в виде бесцветного твердого вещества. Т.пл. 90-92°С (метанол/эфир 9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,64-2,22 (м, 16H), 2,37-3,53 (м, 2H), 2,72-3,89 (м, 2H), 7,12 (д, J=7,3 Гц, 1H), 7,19-7,35 (м, 2H), 7,65 (д, J=7,3 Гц, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 20,63, 26,65, 27,09, 29,24, 34,09, 34,14, 34,99, 35,00, 35,78, 36,43, 37,00, 37,22, 107,73, 112,40, 126,23, 127,97, 128,69, 129,36, 131,93, 140,70. Анал. рассч. для C20H24О3: C 76,89; H 7,74. Обнаружено: C 76,77; H 8,00.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-2'-'3'',4''-дигидро-1''H-нафталин (OZ85). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и β-тетралона (710 мг, 5 ммоль) в пентане (90 мл) и CH2Cl2 (10 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в гексанах) с получением триоксолана OZ85 (400 мг, 26%) в виде бесцветного твердого вещества. Т.пл. 64-66°С. 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,18 (м, 16H), 2,96 (т, J=6,6 Гц, 2H), 3,12 (AB система, 2H), 7,02-7,21 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,59, 26,97, 27,72, 31,78, 34,78, 34,83, 34,86, 34,99, 36,53, 36,55, 36,88, 38,19, 108,44, 112,02, 125,95, 126,10, 128,32, 129,08, 133,89, 135,51. Анал. рассч. для C20H24О3: C 76,89; H 7,74. Обнаружено: C 76,77; H 7,61.
Адамантан-2-спиро-3'-8'-(4'-фторбензолсульфонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ86). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 1-(4-фторбензолсульфонил)-4-пиперидона (1,22 г, 5 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) с получением триоксолана OZ86 (450 мг, 21%) в виде бесцветного твердого вещества. Т.пл. 122-124°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 18H), 2,92-3,06 (м, 2H), 3,25-3,38 (м, 2H), 7,16-7,28 (м, 2H), 7,74-7,84 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,85, 34,05, 34,76, 34,80, 36,42, 36,71, 44,29, 105,83, 112,46, 116,39 (д, J=22,9 Гц), 130,23 (д, J=9,2 Гц), 133,03, 165,30 (д, J=254,8 Гц). Анал. рассч. для C21H26FNO5S: C 59,56; H 6,19; N 3,31. Обнаружено: C 59,75; H 6,40; N 3,27.
Адамантан-2-спиро-3'-8'-хлорацетил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ87). Раствор О-метилоксима 2-адамантанона (2,01 мг, 11,17 ммоль) и 1-хлорацетил-4-пиперидона (3,02 г, 17,09 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) с получением триоксолана OZ87 (1,60 г, 42%) в виде бесцветного твердого вещества. Т.пл. 112-114°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,10 (м, 18H), 3,51-3,72 (м, 3H), 3,74-3,88 (м, 1H), 4,07 (AB система, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,43, 26,82, 33,96, 34,72, 34,92, 36,41, 36,68, 40,24, 40,83, 40,88, 40,94, 44,15, 50,73, 106,43, 112,38, 164,98. Анал. рассч. для C17H24ClNO4: C 59,73; H 7,08; N 4,10. Обнаружено: C 59,60; H 7,23; N 4,06.
цис-Адамантан-2-спиро-3'-8'-[2'-(4'-нитробензоилокси)этил]-1',2',4'-триоксаспиро[4.5]декан (OZ88). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 4-[2-(4-нитрофенилокси)этил]циклогексанона (1,45 г, 5 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в петролейном эфире) с получением триоксолана OZ88 (1,10 г, 48%) в виде бесцветного твердого вещества. Т.пл. 124-126°С. 1H ЯМР (500 МГц, CDCl3) δ 1,22-1,39 (м, 2H), 1,41-1,58 (м, 2H), 1,62-2,11 (м, 21H), 4,41 (т, J=6,6 Гц, 2H), 8,19 (д, J=8,3 Гц, 2H), 8,28 (д, J=8,8 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 26,98, 30,05, 33,42, 34,12, 34,85, 36,52, 36,89, 64,26, 108,61, 111,40, 123,55, 130,67, 135,84, 150,67, 164,71. Анал. рассч. для С25H31NO7: C 65,63; H 6,83; N 3,06. Обнаружено: C 65,76; H 6,90; N 3,18.
цис-Адамантан-2-спиро-3'-8'-(2'-гидроксиэтил)-1',2',4'-триоксаспиро[4.5]декан (OZ89). К раствору OZ88 (610 мг, 1,33 ммоль) в ТГФ (10 мл) при комнатной температуре добавляют раствор NaOH (400 мг, 10 ммоль) в воде (5 мл). Смесь перемешивают при комнатной температуре в течение 6 час, концентрируют и экстрагируют CH2Cl2 (2×20 мл). Органические слои объединяют, промывают водой (10 мл) и насыщенным раствором соли (10 мл), сушат над MgSO4 и упаривают. Остаток перекристаллизовывают из смеси этанол/вода (2:1) с получением триоксолана OZ89 (220 мг, 54%) в виде бесцветного твердого вещества. Т.пл. 88-90°С (этанол/вода 2:1). 1H ЯМР (500 МГц, CDCl3) δ 1,09-2,15 (м, 25H), 3,61-3,79 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 26,97, 30,15, 32,72, 34,20, 34,84, 34,86, 36,49, 36,89, 39,12, 60,85, 108,89, 111,25. Анал. рассч. для C18H28О4: C 70,10; H 9,15. Обнаружено: C 70,24; H 9,24.
Адамантан-2-спиро-3'-8'-гидрокси-8'-метил-1',2',4'-триоксаспиро[4.5]декан (OZ90). К раствору метиллития (1,85 мл, 1,4 М в эфире, 2,4 ммоль) и перхлората лития (0,26 г, 2,4 ммоль) в ТГФ (2 мл) при -78°С добавляют раствор OZ05 (556 мг, 2 ммоль) в ТГФ (20 мл). Реакционную смесь перемешивают при -78°С в течение 2 час перед гашением метанолом (2 мл). Смеси дают нагреться до комнатной температуры и концентрируют в вакууме. Остаток растворяют в CH2Cl2 и промывают 1 М HCl (20 мл), водой (20 мл) и насыщенным раствором соли (20 мл). Органический слой сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в петролейном эфире) с получением триоксолана OZ90 (215 мг, 37%, смесь двух диастереомеров 1,4:1) в виде бесцветного твердого вещества. Т.пл. 91-94°С (гексаны/CH2Cl2 9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,29 (с, 3H), 1,60-2,12 (м, 22H) отнесен к основному изомеру; 1,25 (с, 3H), 1,60-2,12 (м, 22H) отнесен к изомеру в малом количестве; 13C ЯМР (125,7 МГц, CDCl3) δ 26,54, 26,56, 26,95, 26,97, 29,37, 30,05, 30,31, 30,54, 34,79, 34,83, 34,87, 34,96, 36,44, 36,46, 36,49, 36,73, 36,86, 68,57, 68,96, 108,52, 108,57, 111,42, 111,51. Анал. рассч. для C17H26О4: C 69,36; H 8,90. Обнаружено: C 69,19; H 8,82.
Адамантан-2-спиро-3'-8'-[(1'S)-10'-камфорсульфонил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ91). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 1-[(1S)-10-камфорсульфонил]-4-пиперидона (1,56 г, 4,98 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 30% эфира в гексанах) с получением триоксолана OZ91 (860 мг, 36%) в виде бесцветного твердого вещества. Т.пл. 72-74°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 0,88 (с, 3H), 1,13 (с, 3H), 1,38-1,51 (м, 1H), 1,55-2,21 (м, 22H), 2,32-2,46 (м, 1H), 2,47-2,61 (м, 1H), 2,76 (д, J=14,6 Гц, 1H), 3,35 (д, J=14,6 Гц, 1H), 3,34-3,59 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 19,72, 19,94, 25,12, 26,46, 26,84, 26,89, 34,49, 34,72, 34,80, 36,40, 36,71, 42,54, 42,91, 43,84, 43,86, 45,84, 47,82, 58,25, 106,16, 112,26, 214,78. Анал. рассч. для C25H37NO6S: C 62,60; H 7,78; N 2,92. Обнаружено: C 62,80; H 7,60; N 2,92.
Адамантан-2-спиро-3'-8'-(1'-бутансульфонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ92). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 1-(1-бутансульфонил)-4-пиперидона (1,12 г, 5,11 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 30% эфира в гексанах) с получением триоксолана OZ92 (700 мг, 36%) в виде бесцветного твердого вещества. Т.пл. 62-64°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 0,95 (т, J=7,6 Гц, 3H), 1,32-1,57 (м, 2H), 1,59-2,21 (м, 20H), 2,81-3,02 (м, 2H), 3,22-3,59 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 13,48, 21,68, 25,24, 26,50, 26,90, 34,67, 34,78, 34,87, 36,48, 36,75, 43,94, 50,09, 106,20, 112,38. Анал. рассч. для C19H31NO5S: C 59,19; H 8,10; N 3,63. Обнаружено: C 59,38; H 7,99; N 3,45.
Адамантан-2-спиро-3'-8'-(фталимидоацетил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ93). К раствору OZ87 (342 мг, 1 ммоль) в ацетонитриле (10 мл) добавляют фталимид калия (200 мг, 1,08 ммоль). Реакционный раствор нагревают при 60-65°С в течение 36 час и охлаждают до комнатной температуры. Растворитель удаляют упариванием и остаток растирают в воде (20 мл) и фильтруют. Перекристаллизацией твердого вещества из метанола получают триоксолан OZ93 (379 мг, 84%) в виде бесцветного твердого вещества. Т.пл. 152-154°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,11 (м, 18H), 3,45-3,71 (м, 3H), 3,72-3,89 (м, 1H), 4,51 (с, 2H), 7,65-7,79 (м, 2H), 7,82-7,97 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,47, 26,86, 33,94, 34,75, 36,44, 36,72, 38,96, 40,38, 42,62, 106,49, 112,36, 123,43, 132,38, 133,93, 163,88, 167,87. Анал. рассч. для C25H28N2О6: C 66,36; H 6,24; N 6,19. Обнаружено: C 66,19; H 6,07; N 6,19.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-9''-флуорен (OZ94). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 9-флуоренон (1,80 г, 10 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% эфира в гексанах) с получением триоксолана OZ94 (650 мг, 38%) в виде бесцветного твердого вещества. Т.пл. 150-152°С (метанол/эфир 9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,25 (м, 12H), 2,47 (с, 2H), 7,27 (дд, J=7,6, 7,6 Гц, 2H), 7,38 (дд, J=7,6, 7,6 Гц, 2H), 7,53 (д, J=7,3 Гц, 2H), 7,57 (д, J=7,3 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 26,99, 34,89, 35,10, 36,51, 36,87, 111,76, 112,99, 120,02, 125,22, 128,42, 130,81, 140,29, 140,99. Анал. рассч. для C23H22О3: C 79,74; H 6,40. Обнаружено: C 79,56; H 6,23.
Адамантан-2-спиро-3'-5'-(4'-нитрофенил)-5'-фенил-1',2',4'-триоксолан (OZ95). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 4-нитробензофенона (2,27 г, 10 ммоль) в пентане (70 мл) и CH2Cl2 (80 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ95 (1,60 г, 41%) в виде бесцветного твердого вещества. Т.пл. 114-116°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,26 (м, 14H), 7,32-7,41 (м, 3H), 7,42-7,49 (м, 2H), 7,75 (д, J=8,8 Гц, 2H), 8,22 (д, J=8,8 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,88, 34,61, 34,78, 34,81, 35,42, 36,04, 36,24, 36,71, 108,77, 114,65, 123,37, 126,86, 127,62, 128,43, 129,39, 137,62, 148,00, 148,26. Анал. рассч. для C23H23NO5: C 70,21; H 5,89; N 3,56. Обнаружено: C 70,12; H 5,66; N 3,58.
Адамантан-2-спиро-3'-5',5'-бис(4'-хлор-3'-нитрофенил)-1',2',4'-триоксолан (OZ96). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 4,4'-дихлор-3,3'-динитробензофенона (2,09 г, 10 ммоль) в пентане (80 мл) и CH2Cl2 (75 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ96 (2,03 г, 40%) в виде бледно-желтого твердого вещества. Т.пл. 113-115°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,25 (м, 14H), 7,50-7,71 (м, 4H), 8,04 (д, J=2,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,30, 26,68, 34,75, 34,92, 36,06, 36,49, 106,72, 116,10, 123,73, 128,27, 131,00, 132,31, 139,19, 148,02. Анал. рассч. для C23Н20Cl2N2O7: C 54,45; H 3,97; N 552. Обнаружено: C 54,46; H 4,09; N 5,53.
Адамантан-2-спиро-3'-8'-фенил-8'-фталимидометил-1',2',4'-триоксаспиро[4.5]декан (OZ97). Раствор О-метилоксима 2-адамантанона (0,75 г, 4,2 ммоль) и 4-фенил-4-фталимидометилциклогексанона (1,40 г, 4,2 ммоль) в пентане (100 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 12% этилацетата в гексанах) с получением триоксолана OZ97 (0,62 г, 30%) в виде бесцветного твердого вещества. Т.пл. 150-152°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,50-1,99 (м, 20H), 2,40 (каж. д, J=14,2 Гц, 2H), 3,63 (с, 2H), 7,18-7,30 (м, 1H), 7,31-7,40 (м, 2H), 7,41-7,50 (м, 2H), 7,65-7,72 (м, 2H), 7,73-7,85 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,52, 26,88, 30,80, 30,88, 34,79, 36,43, 36,82, 43,90, 108,57, 111,33, 123,22, 126,67, 127,10, 128,78, 132,02, 133,84, 141,13, 168,44. Анал. рассч. для C31H33NO5: C 74,53; H 6,66; N 2,80. Обнаружено: C 74,54; H 6,71; N 2,80.
Адамантан-2-спиро-3'-8'-метоксикарбонил-8'-фенил-1',2',4'-триоксаспиро[4.5]декан (OZ98). Раствор О-метилоксима 2-адамантанона (2,15 г, 12 ммоль) и 4-метоксикарбонил-4-фенилциклогексанона (2,79 г, 12 ммоль) в пентане (100 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ98 (1,07 г, 22%) в виде бесцветного твердого вещества. Т.пл. 127-129°С (этанол/CH2Cl2 9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,15 (м, 20H), 2,53 (каж. д, J=13,2 Гц, 2H), 3,67 (с, 3H), 7,20-7,44 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,54, 26,94, 31,93, 31,98, 34,82, 34,87, 36,48, 36,85, 50,06, 52,22, 108,03, 111,58, 125,78, 127,06, 128,59, 142,39, 174,86. Анал. рассч. для C24H30О5: C 72,34; H 7,59. Обнаружено: C 72,12; H 7,48.
Адамантан-2-спиро-3'-8'-карбокси-8'-фенил-1',2',4'-триоксаспиро[4.5]декан (OZ99). Смесь OZ98 (0,42 г, 1,05 ммоль), КОН (1,00 г, 17,85 ммоль), этанола (30 мл), ТГФ (25 мл) и воды (10 мл) нагревают при 50°С в течение 5 час. Реакционную смесь охлаждают до комнатной температуры, концентрируют до 10 мл, разбавляют водой (20 мл), подкисляют концентрированной HCl (2,0 мл) и экстрагируют CHCl3 (3×25 мл). Объединенные экстракты сушат над MgSO4, фильтруют и концентрируют. Перекристаллизацией остатка из смеси гексаны/CH2Cl2 (7:3) получают триоксолан OZ99 (0,31 г, 77%) в виде бесцветного твердого вещества. Т.пл. 153-156°С (гексаны/CH2Cl2 7:3). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,19 (м, 20H), 2,54 (каж. д, J=11,7 Гц, 2H), 7,20-7,53 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 26,98, 31,54, 31,83, 34,84, 34,90, 36,51, 36,88, 49,62, 107,96, 111,67, 126,04, 127,34, 128,68, 141,44, 180,55. Анал. рассч. для C23H28О5: C 71,85; H 7,34. Обнаружено: C 71,66; H 7,32.
Адамантан-2-спиро-3'-8'-(4'-пиридинилкарбонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ100). К раствору OZ80 (225 мг, 0,85 ммоль) в CH2Cl2 (10 мл) добавляют триэтиламин (258 мг, 2,55 ммоль). Раствор далее охлаждают до 0-5°С и добавляют гидрохлорид изоникотиноилхлорида (180 мг, 1,01 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед упариванием досуха. Остаток растирают в воде и фильтруют. Перекристаллизацией твердого вещества из метанола при -20°С получают триоксолан OZ100 (190 мг, 69%) в виде бесцветного твердого вещества. Т.пл. 140-142°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,58-2,16 (м, 18H), 3,31-3,58 (м, 2H), 3,68-3,85 (м, 1H), 3,86-4,06 (м, 1H), 7,19-7,37 (м, 2H), 8,60-8,80 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,47, 26,87, 34,13, 34,76, 34,87, 35,18, 36,45, 36,71, 40,03, 45,20, 106,47, 112,49, 120,96, 143,47, 150,37, 167,77. Анал. рассч. для C21H26N2О4: C 68,09; H 7,07; N 7,56. Обнаружено: C 68,22; H 7,06; N 7,68.
Адамантан-2-спиро-3'-8'-(4'-хлорфеноксиацетил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ101). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 1-(4-хлорфеноксиацетил)-4-пиперидон (1,34 г, 5 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 30% эфира в гексанах) с получением триоксолана OZ101 (300 мг, 14%) в виде бесцветного твердого вещества. Т.пл. 148-150°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,19 (м, 18H), 3,48-3,71 (м, 3H), 3,72-3,87 (м, 1H), 4,67 (AB система, 2H), 6,80-6,95 (м, 2H), 7,15-7,35 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,47, 26,86, 34,15, 34,75, 34,93, 35,19, 36,43, 36,71, 40,21, 43,13, 68,16, 106,54, 112,38, 115,99, 126,80, 129,55, 156,57, 166,03. Анал. рассч. для C23H28ClNO5: C 63,66; H 6,50; N 3,23. Обнаружено: C 63,82; H 6,46; N 3,30.
Адамантан-2-спиро-3'-8'-(фениламинокарбонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ102). К раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (101 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0-5°С добавляют фенилизоцианат (140 мг, 1,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 час, разбавляют CH2Cl2 (10 мл) и промывают водой (10 мл), 10% водным NaHCO3 (10 мл), 2 М HCl (10 мл), водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой сушат над MgSO4 и концентрируют. Остаток растирают в гексанах (20 мл), фильтруют и сушат с получением триоксолана OZ102 (370 мг, 96%) в виде бесцветного твердого вещества. Т.пл. 146-148°С (гексаны). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,11 (м, 18H), 3,42-3,76 (м, 4H), 6,46 (с, 1H), 7,04 (дд, J=7,3, 7,3 Гц, 1H), 7,15-7,44 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,52, 26,91, 34,42, 34,80, 34,89, 36,49, 36,77, 42,44, 106,80, 112,28, 120,13, 123,29, 128,91, 139,00, 154,88. Анал. рассч. для C22H28N2О4: C 68,73; H 7,34; N 7,29. Обнаружено: C 68,78; H 7,14; N 7,50.
Адамантан-2-спиро-3'-8'-(1'H-имидазол-1'-илацетил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ103). К раствору OZ87 (342 мг, 1 ммоль) в ацетонитриле (10 мл) добавляют имидазол (201 мг, 3 ммоль). Смесь нагревают при 60-65°С в течение 36 час перед упариванием досуха. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% метанола в дихлорметане) и последовательной перекристаллизацией из смеси гексаны/эфир (9:1) с получением триоксолана OZ103 (132 мг, 35%) в виде бесцветного твердого вещества. Т.пл. 138-140°С (гексаны/эфир 9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,21 (м, 18H), 3,43-3,60 (м, 2H), 3,61-3,72 (м, 1H), 3,73-3,91 (м, 1H), 4,79 (с, 2H), 6,97 (уш.с, 1H), 7,12 (уш.с, 1H), 7,52 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,86, 33,98, 34,76, 34,95, 36,44, 36,70, 40,41, 43,02, 48,09, 106,22, 112,54, 120,04 (уш.с), 129,67, 138,10 (уш.с), 164,47. Анал. рассч. для C20H27N3О4: C 64,32; H 7,29; N 11,25. Обнаружено: C 64,12; H 7,02; N 11,09.
Адамантан-2-спиро-3'-8'-[[4-(ацетиламино)фенил]сульфонил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ104). К раствору OZ80 (300 мг, 1 ммоль) в CH2Cl2 (10 мл) добавляют триэтиламин (303 мг, 3 ммоль). Раствор далее охлаждают до 0-5°С и добавляют 4-ацетамидобензолсульфонилхлорид (280 мг, 1,2 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед упариванием досуха. Остаток растирают в воде (15 мл) и фильтруют. Перекристаллизацией твердого вещества из смеси метанол/CH2Cl2 (9:1) при -20°С получают триоксолан OZ104 (300 мг, 65%) в виде бесцветного твердого вещества. Т.пл. 122-124°С (метанол/CH2Cl2). 1H ЯМР (500 МГц, CDCl3) δ 1,50-2,12 (м, 18H), 2,19 (с, 3H), 2,90-3,08 (м, 2H), 3,15-3,37 (м, 2H), 7,65 (д, J=8,8 Гц, 2H), 7,68 (д, J=8,8 Гц, 2H), 7,93-8,16 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 24,51, 26,46, 26,83, 34,05, 34,74, 34,76, 36,39, 36,70, 44,26, 105,86, 112,41, 119,44, 128,73, 131,51, 142,35, 168,72. Анал. рассч. для C23H30N2О6S: C 59,72; H 6,54; N 6,06. Обнаружено: C 59,58; H 6,60; N 5,81.
Адамантан-2-спиро-3'-5',5'-бис(3'-нитрофенил)-1',2',4'-триоксолан (OZ105). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 3,3'-динитробензофенона (2,72 г, 10 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 90% эфира в гексанах) с получением триоксолана OZ105 (0,90 г, 21%) в виде бесцветного твердого вещества. Т.пл. 131-134°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,45 (м, 14H), 7,59 (дд, J=7,8, 7,8 Гц, 2H), 7,81-7,88 (м, 2H), 8,22-8,28 (м, 2H), 8,41 (дд, J=2,0, 2,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,37, 26,76, 34,77, 34,95, 36,09, 36,58, 107,55, 115,64, 121,71, 124,10, 129,67, 132,47, 141,33, 148,46. Анал. рассч. для C23H22N2О7: C 63,01; H 5,06; N 6,39. Обнаружено: C 63,26; H 5,00; N 6,47.
Адамантан-2-спиро-3'-5',5'-бис[3',4'-ди(метоксикарбонил)фенил]-1',2',4'-триоксолан (OZ106). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 3,3',4,4'-тетра(метоксикарбонил)бензофенона (4,14 г, 10 ммоль) в пентане (70 мл) и CH2Cl2 (80 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 80% эфира в гексанах) с получением триоксолана OZ106 (2,03 г, 35%) в виде бесцветного твердого вещества. Т.пл. 52-54°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,35 (м, 14H), 3,907 (с, 6H), 3,909 (с, 6H), 7,66 (дд, J=8,0, 1,5 Гц, 2H), 7,70 (д, J=8,0 Гц, 2H), 7,87 (д, J=1,5 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,38, 26,77, 34,75, 34,91, 35,99, 36,62, 52,64, 52,66, 107,85, 115,18, 127,10, 129,03, 129,29, 132,05, 132,71, 142,41, 167,29, 167,55. Анал. рассч. для C31H32O11: C 64,13; H 5,56. Обнаружено: C 64,28; H 5,46.
Адамантан-2-спиро-3'-8'-[(аминокарбонил)окси]-1',2',4'-триоксаспиро[4.5]декан (OZ107). Раствор трихлорацетилизоцианата (0,44 г, 2,25 ммоль) и OZ32 (0,42 г, 1,50 ммоль) в CH2Cl2 (5 мл) перемешивают при 0°С в течение 4 час. Реакционную смесь нагревают до комнатной температуры, концентрируют, растворяют в метаноле (20 мл) и охлаждают до 0°С. К данному охлажденному раствору добавляют 5% водный раствор Na2CO3 (20 мл). Полученную смесь перемешивают при 0°С в течение 1 час, нагревают до комнатной температуры и перемешивают при данной температуре в течение ночи. Реакционный раствор разбавляют водой (50 мл) и экстрагируют CHCl3 (3×40 мл). Объединенные органические слои промывают водой (30 мл) и насыщенным раствором соли (30 мл), сушат над MgSO4 и концентрируют. Перекристаллизацией остатка из смеси гексаны/хлороформ (3:1) получают триоксолан OZ107 (250 мг, 52%, смесь двух диастереомеров 10:1) в виде бесцветного твердого вещества. Т.пл. 160-162°С (гексаны/хлороформ 3:1). 1H ЯМР (500 МГц, CDCl3) δ 1,50-2,25 (м, 22H), 4,72-4,98 (м, 3H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,52, 26,93, 28,60, 31,01, 34,80, 34,88, 36,39, 36,82, 70,81, 107,85, 111,69, 156,34. Анал. рассч. для C17Н25NO5: C 63,14; H 7,79; N 4,33. Обнаружено: C 62,91; H 7,56; N 4,31.
цис-Адамантан-2-спиро-3'-8'-(1'-гидрокси-1'-метилэтил)-1',2',4'-триоксаспиро[4.5]декан (OZ108). К раствору метиллития (3,80 мл, 1,4 М в эфире, 5,4 ммоль) в эфире (5 мл) при -78°С добавляют раствор OZ70 (0,70 г, 2,1 ммоль) в эфире (20 мл). Реакционную смесь перемешивают при -78°С в течение 3 час перед гашением насыщенным раствором хлорида аммония (20 мл). Смесь экстрагируют эфиром (3×30 мл) и органические слои промывают водой (30 мл) и насыщенным раствором соли (30 мл), сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 20% эфира в гексанах) с получением триоксолана OZ108 (0,42 г, 62%) в виде бесцветного твердого вещества. Т.пл. 126-128°С (этанол/H2O 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,17 (с, 6H), 1,06-1,55 (м, 3H), 1,58-2,30 (м, 20H); 13C ЯМР (125,7 МГц, CDCl3) δ 24,85, 26,59, 26,99, 27,02, 34,50, 34,85, 36,50, 36,90, 47,76, 72,51, 108,70, 111,28. Анал. рассч. для C19Н30О4: C 70,77; H 9,38. Обнаружено: C 70,64; H 9,15.
Адамантан-2-спиро-3'-8'-[(3'-карбоксипиразинил)карбонил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ109). К раствору OZ80 (301 мг, 1 ммоль) в CH2Cl2 (5 мл) при 0-5°С добавляют триэтиламин (101 мг, 1 ммоль) и 2,3-пиразиндикарбоновый ангидрид (156 мг, 1 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед упариванием досуха. Остаток растирают в воде (10 мл) и фильтруют. Перекристаллизацией твердого вещества из метанола получают триоксолан OZ109 (300 мг, 72%) в виде бесцветного твердого вещества. Т.пл. 128-130°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,52-2,21 (м, 18H), 3,21-3,43 (м, 2H), 3,79-3,96 (м, 1H), 3,97-4,14 (м, 1H), 8,71 (с, 1H), 8,79 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,54, 26,92, 33,73, 34,32, 34,78, 34,83, 34,84, 34,96, 36,48, 36,52, 36,79, 39,94, 44,80, 106,79, 112,42, 140,16, 143,16, 146,96, 151,73, 163,03, 165,23. Анал. рассч. для C21Н25N3O6: C 60,71; H 6,07; N 10,11. Обнаружено: C 60,46; H 5,93; N 9,96.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-3''-8''-этоксикарбонил-8''-азабицикло[3.2.1]октан (OZ110). Раствор О-метилоксима 2-адамантанона (895 мг, 5,0 ммоль) и N-карбоэтоксипропинона (1,01 г, 5,2 ммоль) в пентане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 15% эфира в гексанах) с получением триоксолана OZ110 (300 мг, 17%, смесь двух диастереомеров 2:1) в виде бесцветного твердого вещества. Т.пл. 98-100°С. 1H ЯМР (500 МГц, CDCl3) δ 1,27 (т, J=7,1 Гц, 3H), 1,58-2,39 (м, 22H), 4,15 (кв, J=6,8 Гц, 2H), 4,18-4,45 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,67, 26,45, 26,50, 26,86, 26,89, 27,16, 27,60 (уш.с), 33,22, 34,68, 34,82, 35,06, 36,37, 36,41, 36,74, 36,77, 37,05, 40,42 (уш.с), 52,44, 52,75, 52,78, 60,88, 60,93, 60,96, 106,98, 107,71, 110,39, 112,46, 153,70. Анал. рассч. для C20H29NO5: C 66,09; H 8,04; N 3,85. Обнаружено: C 66,12; H 7,90; N 3,82.
Адамантан-2-спиро-3'-8'-(3',3'-диметилбутаноил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ111). К раствору OZ80 (302 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0-5°С добавляют триэтиламин (303 мг, 3 ммоль) и триметилацетилхлорид (185 мг, 1,5 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час, далее разбавляют CH2Cl2 (10 мл) и промывают водой (10 мл) и насыщенным раствором соли (10 мл). Органическую фазу отделяют, сушат над MgSO4 и концентрируют. Кристаллизацией остатка из метанола получают триоксолан OZ111 (140 мг, 39%) в виде бесцветного твердого вещества. Т.пл. 98-100°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,05 (с, 9H), 1,58-2,11 (м, 18H), 2,27 (AB система, 2H), 3,46-3,69 (м, 3H), 3,75-3,90 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,60, 26,99, 30,06, 31,39, 34,37 (уш.с), 34,85, 35,34 (уш.с), 36,57, 36,85, 39,44 (уш.с), 44,40 (уш.с), 44,75, 106,92, 112,25, 170,30. Анал. рассч. для C21H33NO4: C 69,39; H 9,15; N 3,85. Обнаружено: C 69,52; H 8,89; N 3,72.
Адамантан-2-спиро-3'-8'-[(карбоксиметокси)ацетил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ112). К раствору OZ80 (302 мг, 1 ммоль) в CH2Cl2 (10 мл) добавляют триэтиламин (101 мг, 1 ммоль). Раствор далее охлаждают до 0-5°С и добавляют дигликолевый ангидрид (116 мг, 1 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед упариванием досуха. Остаток растирают в воде (10 мл) и фильтруют. Перекристаллизацией твердого вещества из метанола получают триоксолан OZ112 (250 мг, 66%) в виде бесцветного твердого вещества. Т.пл. 126-128°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,18 (м, 18H), 3,29-3,49 (м, 2H), 3,63-3,77 (м, 1H), 3,79-3,91 (м, 1H), 4,22 (с, 2H), 4,42 (с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,44, 26,84, 33,91, 34,72, 34,80, 34,97, 36,45, 36,68, 40,56, 42,21, 70,94, 72,00, 106,08, 112,64, 169,20, 171,40. Анал. рассч. для C19H27NO7: C 59,83; H 7,14; N 3,67. Обнаружено: C 59,67; H 7,16; N 3,56.
Адамантан-2-спиро-3'-8'-метоксиацетил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ113). К раствору OZ80 (301 мг, 1 ммоль) в CH2Cl2 (10 мл) добавляют триэтиламин (303 мг, 3 ммоль). Раствор далее охлаждают до 0-5°С и добавляют метоксиацетилхлорид (163 мг, 1,5 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час и промывают водой (5 мл) и насыщенным раствором соли (5 мл). Органическую фазу отделяют, сушат над MgSO4 и концентрируют с получением триоксолана OZ113 (325 мг, 96%) в виде бесцветного твердого вещества. Т.пл. 76-78°С. 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,17 (м, 18H), 3,42 (с, 3H), 3,43-3,73 (м, 3H), 3,75-3,89 (м, 1H), 4,11 (AB система, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,57, 26,97, 34,32 (уш.с), 34,83, 34,92, 35,25 (уш.с), 36,55, 36,82, 39,98 (уш.с), 42,87 (уш.с), 58,96, 72,21, 106,78, 112,30, 167,54. Анал. рассч. для C18H27NO5: C 64,07; H 8,07; N 4,15. Обнаружено: C 63,94; H 8,03; N 4,30.
Адамантан-2-спиро-3'-8'-(8'-хинолинсульфонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ114). К раствору OZ80 (151 мг, 0,5 ммоль) в CH2Cl2 (5 мл) добавляют триэтиламин (150 мг, 1,49 ммоль). Раствор далее охлаждают до 0-5°С и добавляют 8-хинолинсульфонилхлорид (115 мг, 0,5 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 12 час перед упариванием досуха. Остаток растирают в воде (5 мл) и фильтруют. Перекристаллизацией твердого вещества из метанола получают триоксолан OZ114 (215 мг, 94%) в виде бесцветного твердого вещества. Т.пл. 142-144°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,55-2,21 (м, 18H), 3,40-3,61 (м, 2H), 3,62-3,85 (м, 2H), 7,51 (дд, J=8,2, 3,9 Гц, 1H), 7,61 (дд, J=8,2, 8,2 Гц, 1H), 8,02 (д, J=7,8 Гц, 1H), 8,23 (дд, J=8,3, 1,5 Гц, 1H), 8,47 (дд, J=7,3, 1,5 Гц, 1H), 9,05 (дд, J=3,9, 1,5 Гц, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 26,97, 34,82, 34,88, 34,90, 36,54, 36,83, 44,37, 106,74, 112,16, 121,98, 125,47, 129,12, 132,68, 133,24, 136,30, 137,86, 144,33, 151,10. Анал. рассч. для C24H28N2О5S: C 63,14; H 6,18; N 6,14. Обнаружено: C 62,94; H 6,16; N 6,00.
Адамантан-2-спиро-3'-8'-(1'-октансульфонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ115). К раствору OZ80 (200 мг, 0,66 ммоль) и триэтиламина (200 мг, 1,98 ммоль) в CH2Cl2 (5 мл) при 0-5°С добавляют 1-октансульфонилхлорид (170 мг, 0,8 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 12 час перед упариванием досуха. Остаток растирают в воде (10 мл) и фильтруют. Перекристаллизацией твердого вещества из метанола получают триоксолан OZ115 (160 мг, 55%) в виде бесцветного твердого вещества. Т.пл. 54-56°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 0,88 (т, J=6,8 Гц, 3H), 1,17-1,49 (м, 10H), 1,61-2,21 (м, 20H), 2,90 (т, J=8,1 Гц, 2H), 3,24-3,39 (м, 2H), 3,41-3,57 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 13,95, 22,56, 23,26, 26,55, 26,95, 28,49, 28,93, 29,04, 31,71, 34,71, 34,82, 34,91, 36,53, 36,79, 43,97, 50,46, 106,24, 112,41. Анал. рассч. для C23H39NO5S: C 62,55; H 8,90; N 3,17. Обнаружено: C 62,38; H 8,76; N 3,25.
цис-Адамантан-2-спиро-3'-8'-[(гидроксиамино)карбонил)]-1',2',4'-триоксаспиро[4.5]декан (OZ116). Раствор этилхлорформиата (0,26 г, 2,4 ммоль), OZ72 (0,62 г, 2,0 ммоль) и триэтиламина (0,27 г, 2,6 ммоль) в эфире (6 мл) перемешивают при 0°С в течение 10 мин. Твердое вещество удаляют фильтрацией и фильтрат добавляют к свежеприготовленному раствору гидроксиламина. [К суспензии КОН (168 мг, 3,0 ммоль) в метаноле (1 мл) при 0°С добавляют раствор гидрохлорида гидроксиламина (0,20 г, 3 ммоль) в метаноле (3 мл). Реакционную смесь перемешивают при 0оС в течение 15 мин и фильтруют для удаления твердых побочных продуктов. Фильтрат используют как таковой]. Полученную смесь перемешивают в течение 1 час и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 8% метанола в хлороформе) с получением триоксолана OZ116 (0,23 г, 36%) в виде бесцветного твердого вещества. Т.пл. 130-132°С (этанол/вода 1:2). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,40-2,19 (м, 23H), 8,60 (с, 1H), 10,35 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,87, 26,27, 26,50, 33,03, 34,28, 34,30, 35,84, 36,15, 39,04, 107,85, 110,64, 171,30. Анал. рассч. для C17Н25NO5: C 63,14; H 7,79; N 4,33. Обнаружено: C 62,97; H 7,57; N 4,26.
Гидрохлорид адамантан-2-спиро-3'-8'-(аминометил)-8'-фенил-1',2',4'-триоксаспиро[4.5]декана (OZ117). Раствор OZ97 (1,60 г, 3,2 ммоль) и моногидрата гидразина (325 мг, 6,5 ммоль) в хлороформе (27 мл) и метаноле (3 мл) нагревают при 50°С в течение 36 час. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления твердых побочных продуктов. Фильтрат промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над MgSO4, фильтруют и концентрируют. Твердое вещество растворяют в эфире (30 мл), обрабатывают 1 М эфирным HCl (6 мл) и фильтруют. Перекристаллизацией из смеси гексаны/хлороформ (2:1) получают триоксолан OZ117 (0,22 г, 17%) в виде бесцветного твердого вещества. Т.пл. 156°С, разл. (гексаны/хлороформ 2:1). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,42-2,05 (м, 20H), 2,32 (каж. д, J=13,7 Гц, 2H), 2,89 (с, 2H), 7,26-7,39 (м, 1H), 7,41-7,62 (м, 4H), 7,80 (уш.с, 3H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,82, 26,19, 30,08, 34,24, 35,76, 36,09, 49,37, 107,89, 110,70, 126,97, 127,14, 128,98, 139,82. Анал. рассч. для C23H32ClNO3: C 68,05; H 7,95; N 3,45. Обнаружено: C 67,92; H 7,69; N 3,72.
цис-Адамантан-2-спиро-3'-8'-ацетоксиметил-1',2',4'-триоксаспиро[4.5]декан (OZ118). Раствор О-метилоксима 2-адамантанона (1,34 г, 7,5 ммоль) и 4-ацетоксиметилциклогексанона (1,28 г, 7,5 ммоль) в пентане (100 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ118 (1,15 г, 46%) в виде бесцветного твердого вещества. Т.пл. 39-41°С (этанол/Н2О 7:3). 1H ЯМР (500 МГц, CDCl3) δ 1,18-1,31 (м, 2H), 1,59-2,19 (м, 21H), 2,05 (с, 3H), 3,90 (д, J=6,3 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 20,77, 26,62, 26,77, 27,02, 33,71, 34,86, 34,88, 35,67, 36,54, 36,91, 68,49, 108,57, 111,40, 170,90. Анал. рассч. для C19H28О5: C 67,83; H 8,39. Обнаружено: C 67,70; H 8,32.
цис-Адамантан-2-спиро-3'-8'-гидроксиметил-1',2',4'-триоксаспиро[4.5]декан (OZ119). Раствор OZ70 (0,81 г, 2,4 ммоль), боргидрида лития (1,2 мл, 2,4 ммоль, 2 М в ТГФ) и триэтилборгидрида лития (0,24 мл, 0,24 ммоль, 1 М в ТГФ) в эфире (2,5 мл) перемешивают при комнатной температуре в течение 3 час. Реакционную смесь разбавляют эфиром (5 мл), промывают 3 М водным NaOH (2×5 мл), водой (2×5 мл) и насыщенным раствором соли (5 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме с получением триоксолана OZ119 (0,68 г, 96%) в виде бесцветного твердого вещества. Т.пл. 97-99°С (этанол/Н2О 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,09-1,27 (м, 2H), 1,42-2,19 (м, 21H), 3,47 (д, J=6,5 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,63, 26,66, 27,03, 33,86, 34,87, 34,90, 36,56, 36,93, 38,97, 67,63, 108,91, 111,32. Анал. рассч. для C17H26О4: C 69,36; H 8,90. Обнаружено: C 69,58; H 8,63.
Адамантан-2-спиро-3'-11',11'-бис(этоксикарбонил)-1',2',4',9',13'-пентаоксадиспиро[4.2.5.2]пентадекан (OZ120). Раствор О-метилоксима 2-адамантанона (2,69 г, 15 ммоль) и 3,3-бис(этоксикарбонил)-1,5-диоксаспиро[5.5]ундекан-9-она (4,71 г, 15 ммоль) в пентане (100 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в петролейном эфире) с получением триоксолана OZ120 (3,60 г, 50%) в виде бесцветного твердого вещества. Т.пл. 74-77°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,27 (т, J=7,1 Гц, 6H), 1,61-2,18 (м, 22H), 4,24 (кв, J=7,2 Гц, 4H), 4,28 (с, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 13,91, 26,55, 26,95, 29,35, 30,45, 34,77, 34,87, 36,43, 36,83, 39,26, 53,95, 61,77, 62,10, 97,54, 108,22, 111,56, 167,84. Анал. рассч. для C25H36О9: C 62,48; H 7,55. Обнаружено: C 62,62; H 7,32.
Адамантан-2-спиро-3'-11',11'-бис(гидроксиметил)-1',2',4',9',13'-пентаоксадиспиро[4.2.5.2]пентадекан (OZ121). Раствор OZ120 (1,00 г, 2,18 ммоль), боргидрида лития (2,10 мл, 4,20 ммоль, 2 М в ТГФ) и триэтилборгидрида лития (0,42 мл, 0,42 ммоль, 1 М в ТГФ) в эфире (5 мл) перемешивают при комнатной температуре в течение 3 час. Реакционную смесь разбавляют эфиром (10 мл), промывают 3 М водным NaOH (2×10 мл), водой (2×10 мл) и насыщенным раствором соли (10 мл). Объединенные водные слои экстрагируют CHCl3 (3×50 мл) и хлороформный экстракт промывают водой (2×50 мл) и насыщенным раствором соли (50 мл). Эфирный экстракт и хлороформный экстракт объединяют, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией (силикагель, 5% метанола в хлороформе) с получением триоксолана OZ121 (0,40 г, 46%) в виде бесцветного твердого вещества. Т.пл. 146-148°С (этанол/Н2О 3:2). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,60-2,15 (м, 22H), 3,36 (д, J=4,9 Гц, 4H), 3,61 (с, 2H), 3,62 (с, 2H), 4,49 (т, J=5,4 Гц, 2H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,86, 26,26, 29,34, 30,21, 34,27, 34,36, 35,77, 36,13, 39,07, 60,69, 61,44, 61,48, 96,00, 108,15, 110,84. Анал. рассч. для C21H32О7·0,077CHCl3: C 62,40; H 7,97. Обнаружено: C 62,76; H 7,77.
Адамантан-2-спиро-3'-11',11'-дикарбокси-1',2',4',9',13'-пентаоксадиспиро[4.2.5.2]пентадекан (OZ122). Раствор OZ120 (0,73 г, 1,5 ммоль), 15% водного КОН (4,2 мл) в метаноле (30 мл) нагревают при 50°С в течение 2 час. После охлаждения до комнатной температуры реакционную смесь концентрируют до 5 мл, подкисляют концентрированной HCl и экстрагируют CHCl3 (5×50 мл). Объединенные органические слои промывают водой (2×50 мл) и насыщенным раствором соли (50 мл), сушат над MgSO4, фильтруют и концентрируют с получением триоксолана OZ122 (0,38 г, 58%) в виде бесцветного твердого вещества. Т.пл. 151-153°С (вода). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,51-2,14 (м, 22H), 4,13 (с, 2H), 4,15 (с, 2H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,86, 26,26, 29,16, 30,16, 34,27, 34,37, 35,77, 36,13, 52,89, 61,65, 96,49, 107,99, 110,92, 169,11. Анал. рассч. для C21H28О9: C 59,43; H 6,65. Обнаружено: C 59,42; H 6,66.
цис-Адамантан-2-спиро-3'-8'-бромметил-1',2',4'-триоксаспиро[4.5]декан (OZ123). Раствор О-метилоксима 2-адамантанона (2,15 г, 12 ммоль) и 4-бромметилциклогексанона (2,30 г, 12 ммоль) в пентане (100 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 3% эфира в гексанах) с получением триоксолана OZ123 (1,62 г, 38%) в виде бесцветного твердого вещества. Т.пл. 138-140°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,21-1,41 (м, 2H), 1,51-2,21 (м, 21H), 3,28 (д, J=6,3 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,64, 27,04, 28,83, 33,73, 34,88, 34,90, 36,55, 36,93, 38,63, 38,76, 108,41, 111,47. Анал. рассч. для C17Н25BrO3: C 57,15; H 7,05. Обнаружено: C 57,20; H 6,99.
Адамантан-2-спиро-3'-5'-(4'-цианофенил)-5'-фенил-1',2',4'-триоксолан (OZ124). Раствор О-метилоксима 2-адамантанона (0,86 г, 4,80 ммоль) и 4-цианобензофенона (1,00 г, 4,80 ммоль) в пентане (50 мл) и CH2Cl2 (60 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ124 (0,30 г, 17%) в виде бесцветного твердого вещества. Т.пл. 136-137°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,35 (м, 14H), 7,31-7,39 (м, 3H), 7,40-7,48 (м, 2H), 7,62-7,73 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,50, 26,92, 34,70, 34,80, 34,84, 35,39, 36,08, 36,25, 36,76, 108,84, 112,50, 114,57, 118,43, 126,85, 127,42, 128,38, 129,27, 131,97, 137,97, 146,30. Анал. рассч. для C24H23NO3: C 77,19; H 6,21; N 3,75. Обнаружено: C 77,58; H 6,32; N 3,76.
Адамантан-2-спиро-3'-5',5'-бис[4'-(этоксикарбонил)фенил]-1',2',4'-триоксолан (OZ125). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 4,4'-бис(этоксикарбонил)бензофенона (3,26 г, 10 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ125 (1,77 г, 36%) в виде бесцветного твердого вещества. Т.пл. 143-145°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,38 (т, J=7,1 Гц, 6H), 1,60-2,07 (м, 12H), 2,20 (каж. д, J=12,2 Гц, 2H), 4,37 (кв, J=7,2 Гц, 4H), 7,58 (д, J=8,3 Гц, 4H), 8,03 (д, J=8,3 Гц, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,28, 26,52, 26,94, 34,84, 35,06, 36,17, 36,78, 61,01, 108,84, 114,60, 126,69, 129,52, 131,10, 144,22, 166,06. Анал. рассч. для C29H32О7: C 70,71; H 6,55. Обнаружено: C 70,52; H 6,32.
Гидробромид цис-адамантан-2-спиро-3'-8'-[2'-(диэтиламино)этил]-1',2',4'-триоксаспиро[4.5]декана (OZ126). Стадия 1. Раствор О-метилоксима 2-адамантанона (716 мг, 4 ммоль) и 4-(2-бромэтил)циклогексанона (820 мг, 4 ммоль) в пентане (72 мл) и CH2Cl2 (8 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% эфира в гексанах) с получением цис-адамантан-2-спиро-3'-8'-[2'-бромэтил)]-1',2',4'-триоксаспиро[4.5]декана (800 мг, 54%) в виде бесцветного твердого вещества. Т.пл. 62-64°С. 1H ЯМР (500 МГц, CDCl3) δ 1,18-1,22 (м, 2H), 1,72-2,10 (м, 23H), 3,42 (т, 2Н, J=6,8 Гц). Стадия 2. К раствору вышеуказанного бромида (371 мг, 1 ммоль) в ацетонитриле (5 мл) добавляют диэтиламин (140 мг, 2 ммоль) и триэтиламин (101 мг, 1 ммоль). Смесь нагревают при 60-65°С в течение 60 час перед удалением растворителей. Остаток растирают с водой (5 мл) и фильтруют. Перекристаллизацией твердого вещества из этанола получают триоксолан OZ126 (170 мг, 43%) в виде бесцветного твердого вещества. Т.пл. 152-154°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,20-1,34 (м, 2H), 1,41 (т, J=7,3 Гц, 6H), 1,60-2,25 (м, 23H), 2,95-3,04 (м, 2H), 3,05-3,19 (м, 4H), 12,17 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 8,69, 26,61, 27,00, 29,13, 29,84, 33,90, 34,34, 34,86, 34,88, 36,54, 36,90, 46,55, 49,51, 108,27, 111,54. Анал. рассч. для C22H37NO3·0,5НBr: C 65,41; H 9,36; N 3,47. Обнаружено: C 65,24; H 9,54; N 3,46.
транс-Адамантан-2-спиро-3'-8'-[(гидроксиамино)карбонил]-1',2',4'-триоксаспиро[4.5]декан (OZ127). Раствор этилхлорформиата (0,13 г, 1,2 ммоль), OZ71 (0,31 г, 1,0 ммоль) и триэтиламина (0,13 г, 1,3 ммоль) в эфире (5 мл) перемешивают при 0°С в течение 10 мин. Твердое вещество удаляют фильтрацией и фильтрат добавляют к свежеприготовленному раствору гидроксиламина. [К суспензии КОН (84 мг, 1,5 ммоль) в метаноле (1 мл) при 0°С добавляют раствор гидрохлорида гидроксиламина (0,10 г, 1,5 ммоль) в метаноле (2 мл). Реакционную смесь перемешивают при 0°С в течение 15 мин и фильтруют для удаления твердых побочных продуктов. Фильтрат используют как таковой]. Полученную смесь перемешивают при комнатной температуре в течение 1 час и концентрируют. Неочищенный продукт очищают кристаллизацией из смеси гексаны/хлороформ (5:1) с получением триоксолана OZ127 (0,15 г, 47%) в виде бесцветного твердого вещества. Т.пл. 136-138°С (гексаны/хлороформ 5:1). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,42-2,23 (м, 23H), 8,60 (с, 1H), 10,36 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,87, 26,26, 26,40, 32,95, 34,26, 34,42, 35,81, 36,13, 39,26, 107,88, 110,95, 171,35. Анал. рассч. для C17H25NO5: C 63,14; H 7,79; N 4,33. Обнаружено: C 62,89; H 7,59; N 4,40.
Адамантан-2-спиро-3'-11'-метилен-1',2',4',9',13'-пентаоксадиспиро[4.2.5.2]пентадекан (OZ128). Стадия 1. Смесь OZ05 (1,12 г, 4 ммоль), ТФУ (0,70 мл), CH2Cl2 (10 мл) и метанола (70 мл) перемешивают при комнатной температуре в течение 16 час. Реакционную смесь гасят NaHCO3 (2,0 г) и перемешивают в течение дополнительного 1 час перед упариванием досуха. Остаток растворяют в CH2Cl2 (20 мл), промывают водой и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют с получением диметилкеталя OZ05 (1,31 г, 100%) в виде бесцветного масла. 1H ЯМР (500 МГц, CDCl3) δ 1,66-2,02 (м, 22H), 3,18 (с, 3H), 3,19 (с, 3H). Стадия 2. Смесь вышеуказанного кеталя (1,30 г, 4 ммоль), 2-метилен-1,3-пропандиола (0,70 г, 8 ммоль) и п-TsOH (0,5 г) в CH2Cl2 (70 мл) и ТГФ (10 мл) перемешивают при комнатной температуре в течение 16 час. Реакционную смесь гасят NaHCO3 (1,0 г), перемешивают в течение дополнительного 1 час и разбавляют водой (70 мл). После отделения органического слоя водный слой экстрагируют CH2Cl2 (2×50 мл). Объединенные органические слои промывают водой и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 8% эфира в гексанах) с получением триоксолана OZ128 (0,87 г, 63%) в виде бесцветного твердого вещества. Т.пл. 58-59°С (гексаны). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,21 (м, 22H), 4,31 (с, 4H), 4,86 (с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,60, 27,02, 29,97, 30,69, 34,84, 34,94, 36,49, 36,90, 63,63, 97,60, 107,92, 108,38, 111,59, 141,15. Анал. рассч. для C20H28О5: C 68,94; H 8,10. Обнаружено: C 68,77; H 7,93.
цис-Адамантан-2-спиро-3'-8'-[(2'-гидрокси-1',1'-(диметилэтиламино)карбонил]-1',2',4'-триоксаспиро[4.5]декан (OZ129). Раствор OZ72 (0,77 г, 2,50 ммоль), DCC (0,78 г, 3,75 ммоль), HOBT (0,51 г, 3,75 ммоль) и 2-амино-2-метил-1-пропанола (0,33 г, 3,75 ммоль) в ДМФА (20 мл) нагревают при 50-60°С в течение 6 час. После охлаждения до комнатной температуры реакционную смесь подкисляют 1 М водной HCl (100 мл) и экстрагируют этилацетатом (4×60 мл). Объединенные экстракты промывают водой и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 50% этилацетата в гексанах) с получением триоксолана OZ129 (0,44 г, 46%) в виде бесцветного твердого вещества. Т.пл. 163-164°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,27 (с, 6H), 1,60-2,24 (м, 23H), 3,56 (с, 2H), 4,80 (с, 1H), 5,47 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 24,77, 26,62, 27,03, 27,21, 33,64, 34,86, 34,90, 36,55, 36,91, 44,24, 55,95, 70,66, 107,78, 111,60, 175,63. Анал. рассч. для C21H33NO5: C 66,46; H 8,76; N 3,69. Обнаружено: C 66,41; H 8,56; N 3,76.
Адамантан-2-спиро-3'-11'-оксо-1',2',4',9',13'-пентаоксадиспиро[4.2.5.2]пентадекан (OZ130). Раствор OZ128 (0,65 г, 1,9 ммоль) в CH2Cl2 (80 мл) при -78°С обрабатывают озоном в течение 10 мин, продувают кислородом в течение 5 мин перед добавлением трифенилфосфина (0,49 г, 1,9 ммоль). Реакционную смесь нагревают до комнатной температуры и перемешивают при данной температуре в течение 1 час перед упариванием досуха. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ130 (0,37 г, 57%) в виде бесцветного твердого вещества. Т.пл. 76-79°С (гексаны). 1H ЯМР (500 МГц, CDCl3) δ 1,61-2,21 (м, 22H), 4,17 (с, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 27,03, 29,80, 30,81, 34,85, 34,96, 36,52, 36,89, 66,92, 66,94, 99,14, 107,96, 111,82, 207,00. Анал. рассч. для C19H26О6: C 65,13; H 7,48. Обнаружено: C 65,38; H 7,58.
Адамантан-2-спиро-3'-8'-фенилметансульфонил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ131). К раствору OZ80 (301 мг, 1,0 ммоль) и п-толуолсульфонилхлорида (192 мг, 1,0 ммоль) в CH2Cl2 (10 мл) при 0-5°С добавляют триэтиламин (303 мг, 3,0 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед упариванием досуха. Остаток растирают в воде, фильтруют и кристаллизуют из этанола с получением триоксолана OZ131 (320 мг, 76%) в виде бесцветного твердого вещества. Т.пл. 148-150°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,21 (м, 18H), 3,06-3,24 (м, 2H), 3,25-3,41 (м, 2H), 4,22 (с, 2H), 7,27-7,60 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,53, 26,94, 34,77, 34,79, 34,89, 36,50, 36,78, 44,20, 57,79, 106,20, 112,28, 128,79, 129,12, 130,67. Анал. рассч. для C22H29NO5S: C 62,98; H 6,97; N 3,34. Обнаружено: C 63,16; H 6,79; N 3,46.
Адамантан-2-спиро-3'-8'-(2'-карбоксибензоил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ132). К раствору OZ80 (301 мг, 1,0 ммоль) и триэтиламина (101 мг, 1,0 ммоль) в CH2Cl2 (10 мл) при 0-5°С добавляют фталевый ангидрид (148 мг, 1,0 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 24 час перед упариванием досуха. Остаток растирают в воде, фильтруют и кристаллизуют из этанола с получением триоксолана OZ132 (285 мг, 69%) в виде бесцветного твердого вещества. Т.пл. 162-164°С (этанол). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,57-2,21 (м, 18H), 3,01-3,32 (м, 2H), 3,35-4,04 (м, 2H), 7,33 (д, J=7,3 Гц, 1H), 7,52 (дд, J=7,8, 7,8 Гц, 1H), 7,64 (дд, J=7,3, 7,3 Гц, 1H), 7,93 (д, J=7,8 Гц, 1H), 13,14 (уш.с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,84, 26,23, 33,29, 33,54, 34,25, 34,34, 35,74, 35,79, 36,07, 38,82, 44,26, 107,05, 111,35, 126,62, 128,43, 128,63, 130,03, 132,42, 138,38, 166,90, 168,45, Анал. рассч. для C23H27NO6: C 66,81; H 6,58; N 3,39. Обнаружено: C 67,02; H 6,65; N 3,40.
Адамантан-2-спиро-3'-8'-[(диметиламино)карбонил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ133). К раствору OZ80 (301 мг, 1,0 ммоль) и триэтиламина (101 мг, 1,0 ммоль) в CH2Cl2 (10 мл) при 0-5°С добавляют диметилкарбамоилхлорид (115 мг, 1,07 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед упариванием досуха. Остаток растирают, фильтруют и кристаллизуют из метанола с получением триоксолана OZ133 (260 мг, 77%) в виде бесцветного твердого вещества. Т.пл. 106-108°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,11 (м, 18H), 2,82 (с, 6H), 3,21-3,47 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 27,01, 34,52, 34,84, 34,94, 36,59, 36,87, 38,53, 44,69, 107,28, 111,95, 164,66. Анал. рассч. для C18H28N2О4: C 64,26; H 8,39; N 8,33. Обнаружено: C 64,49; H 8,36; N 8,42.
Адамантан-2-спиро-3'-1',2',4'-триоксолан-5'-спиро-4''-2'',3''-дигидро-4''H-1''-бензопиран (OZ134). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 4-хроманона (740 мг, 5 ммоль) в циклогексане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% эфира в гексанах) с получением триоксолана OZ134 (590 мг, 38%) в виде бесцветного твердого вещества. Т.пл. 136-138°С (метанол). 1Н ЯМР (500 МГц, CDCl3) δ 1,61-2,38 (м, 14H), 2,39-2,61 (м, 2H), 4,23-4,51 (м, 2H), 6,83 (д, J=8,3 Гц, 1H), 6,96 (дд, J=8,3, 8,3 Гц, 1H), 7,27 (ддд, J=8,6, 8,6, 1,6 Гц, 1H), 7,53 (дд, J=7,8, 1,6 Гц, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 27,03, 33,46, 33,97, 34,89, 34,94, 35,78, 36,43, 36,91, 37,08, 64,65, 103,93, 112,95, 117,04, 120,68, 128,26, 131,42, 157,71. Анал. рассч. для C19H22О4: C 72,59; H 7,05. Обнаружено: C 72,48; H 6,87.
Адамантан-2-спиро-3'-5',5'-бис(4'-карбоксифенил)-1',2',4'-триоксолан (OZ135). Смесь OZ125 (0,44 г, 0,89 ммоль), ТГФ (7 мл) и 40% водного КОН (4,5 мл) нагревают при 50°С в течение 5 дней. Реакционную смесь охлаждают до комнатной температуры и экстрагируют эфиром (5×20 мл). Водный слой подкисляют до рН=3 концентрированной HCl. Полученный осадок фильтруют и перекристаллизовывают из смеси этанол/вода (2:1) с получением триоксолана OZ135 (0,35 г, 90%) в виде бесцветного твердого вещества. Т.пл. 170°С (этилацетат), разл. 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,05 (м, 12H), 2,13 (каж. д, J=11,7 Гц, 2H), 7,60 (д, J=8,8 Гц, 4H), 7,98 (д, J=8,8 Гц, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 25,79, 26,19, 34,25, 34,42, 35,56, 35,99, 108,40, 113,95, 126,42, 129,46, 131,47, 143,44, 166,69. Анал. рассч. для C25H24О7: C 68,80; H 5,54. Обнаружено: C 68,64; H 5,34.
цис-Адамантан-2-спиро-3'-8'-фталимидо-1',2',4'-триоксаспиро[4.5]декан (OZ136). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 4-фталимидоциклогексанона (2,43 г, 10 ммоль) в пентане (60 мл) и CH2Cl2 (80 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 80% эфира в гексанах) с получением триоксолана OZ136 (1,20 г, 29%) в виде бесцветного твердого вещества. Т.пл. 156-158°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,19 (м, 20H), 2,45-2,63 (м, 2H), 4,18 (тт, J=12,4, 3,9 Гц, 1H), 7,64-7,76 (м, 2H), 7,77-7,89 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,60, 26,89, 27,00, 33,81, 34,85, 36,45, 36,89, 49,35, 107,43, 111,50, 123,06, 132,13, 133,75, 168,01. Анал. рассч. для C24H27NO5: C 70,40; H 6,65; N 3,42. Обнаружено: C 70,16; H 6,43; N 3,43.
Гидрохлорид цис-адамантан-2-спиро-3'-8'-амино-1',2',4'-триоксаспиро[4.5]декана (OZ137). Раствор OZ136 (0,81 г, 1,98 ммоль) и моногидрата гидразина (198 мг, 3,96 ммоль) в хлороформе (16 мл) и метаноле (2 мл) нагревают в атмосфере азота при 50°С в течение 24 час. Реакционную смесь охлаждают до комнатной температуры, фильтруют для удаления твердых побочных продуктов и концентрируют. Твердый остаток растворяют в CHCl3, промывают водой и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Маслянистый амин растворяют в эфире (2 мл), обрабатывают 1 М эфирной HCl (7 мл) и фильтруют с получением триоксолана OZ137 (0,31 г, 50%) в виде бесцветного твердого вещества. Т.пл. 132°С, разл. (эфир). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,41-1,59 (м, 2H), 1,60-2,15 (м, 20H), 3,10 (уш.с, 1H), 8,12 (уш.с, 3H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,83, 26,23, 27,46, 31,33, 34,27, 34,30, 35,73, 36,10, 47,31, 107,24, 110,96. Анал. рассч. для C16Н26ClNO3: C 60,85; H 8,30; N 4,43. Обнаружено: C 60,64; H 8,16; N 4,70.
Адамантан-2-спиро-3'-5'-[4'-(метоксикарбонил)фенил]-5'-фенил-1',2',4'-триоксолан (OZ138). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 4-(метоксикарбонил)бензофенона (2,40 г, 10 ммоль) в пентане (40 мл) и CH2Cl2 (90 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ138 (1,00 г, 25%) в виде бесцветного твердого вещества. Т.пл. 144-146°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,29 (м, 14H), 3,91 (с, 3H), 7,31-7,39 (м, 3H), 7,43-7,52 (м, 2H), 7,63 (д, J=8,3 Гц, 2H), 8,03 (д, J=8,5 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 26,99, 33,32, 34,86, 34,88, 35,31, 36,13, 36,31, 36,86, 51,99, 109,28, 114,26, 126,76, 126,96, 128,22, 128,97, 129,42, 130,37, 138,83, 145,73, 166,69. Анал. рассч. для C25H26О5: C 73,87; H 6,45. Обнаружено: C 74,07; H 6,55.
Гидрохлорид цис-адамантан-2-спиро-3'-8'-[(4'-фенил-1'-пиперазинил)карбонил]-1',2',4'-триоксаспиро[4.5]декана (OZ140). Раствор OZ72 (0,31 г, 1,0 ммоль), DCC (0,27 г, 1,3 ммоль) и HOBT (0,16 г, 1,3 ммоль) в CHCl3 (15 мл) перемешивают при 0°С в течение 15 мин перед добавлением 1-фенилпиперазина (0,21 г, 1,3 ммоль). Смесь далее нагревают до комнатной температуры, перемешивают в течение ночи и концентрируют. Остаток очищают флэш-хроматографией (силикагель, 1% метанола в хлороформе) с получением твердого вещества, которое растворяют в хлороформе (20 мл) и фильтруют. Фильтрат концентрируют, перерастворяют в хлороформе (15 мл) и эфире (30 мл) и фильтруют. Фильтрат обрабатывают 1 М эфирной HCl (1,5 мл) с получением триоксолана OZ140 (0,36 г, 74%) в виде бесцветного твердого вещества. Т.пл. 155-158°С (хлороформ/эфир, 1:2). 1H ЯМР (500 МГц, CDCl3) δ 1,42-2,23 (м, 22H), 2,44-2,62 (м, 1H), 3,51 (уш.с, 4H), 4,28 (уш.с, 4H), 7,42-7,60 (м, 3H), 7,79-7,95 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,59, 26,80, 27,01, 33,54, 34,84, 34,89, 36,54, 36,87, 38,53, 39,32, 55,25, 107,61, 111,61, 121,22, 130,05, 130,57, 142,36, 173,49. Анал. рассч. для C27H37ClN2О4: C 66,31; H 7,63; N 5,73. Обнаружено: C 66,26; H 7,45; N 5,83.
Имидазол-1-карбоксилат цис-адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-метила (OZ141). К раствору OZ119 (0,29 г, 1 ммоль) в CH3CN (10 мл) и ТГФ (3 мл) добавляют 1,1'-карбонилдиимидазол (0,21 г, 1,3 ммоль). Смесь перемешивают при комнатной температуре в течение 2 час перед гашением холодной водой (50 мл). Полученный осадок собирают фильтрацией, промывают водой и сушат с получением триоксолана OZ141 (0,34 г, 91%) в виде бесцветного твердого вещества. Т.пл. 110-112°С (вода). 1H ЯМР (500 МГц, CDCl3) δ 1,25-1,50 (м, 2H), 1,51-2,21 (м, 21H), 4,25 (д, J=6,3 Гц, 2H), 7,07 (с, 1H), 7,42 (с, 1H), 8,13 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 27,02, 33,54, 34,86, 34,88, 35,66, 36,57, 36,90, 72,07, 108,17, 111,59, 117,03, 130,76, 137,07, 148,71. Анал. рассч. для C21H28N2О5: C 64,93; H 7,27; N 7,21. Обнаружено: C 65,12; H 7,12; N 7,25.
Адамантан-2-спиро-3'-8'-(п-толиламинокарбонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ142). К раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (101 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют п-толилизоцианат (133 мг, 1 ммоль). Смесь перемешивают при комнатной температуре в течение 3 час перед удалением растворителей. Остаток растирают в воде (10 мл) и фильтруют. Перекристаллизацией твердого вещества из 95% этанола получают триоксолан OZ142 (280 мг, 70%) в виде бесцветного твердого вещества. Т.пл. 150-152°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,61-2,19 (м, 18H), 2,29 (с, 3H), 3,43-3,71 (м, 4H), 6,44 (с, 1H), 7,08 (д, J=8,0 Гц, 2H), 7,21 (д, J=8,3 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 20,65, 26,60, 26,99, 34,46, 34,84, 34,94, 36,58, 36,84, 42,46, 106,90, 112,25, 120,44, 129,40, 132,85, 136,53, 155,13. Анал. рассч. для C23H30N2О4: C 69,32; H 7,59; N 7,03. Обнаружено: C 69,10; H 7,50; N 7,08.
Адамантан-2-спиро-3'-8'-(трет-бутиламинокарбонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ143). К раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (101 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют трет-бутилизоцианат (100 мг, 1 ммоль). Смесь перемешивают при комнатной температуре в течение 6 час перед удалением растворителей. Остаток растирают в воде (10 мл) и фильтруют. Перекристаллизацией твердого вещества из 95% этанола получают триоксолан OZ143 (185 мг, 51%) в виде бесцветного твердого вещества. Т.пл. 142-144°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,35 (с, 9H), 1,62-2,09 (м, 18H), 3,35-3,59 (м, 4H), 4,34 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,60, 27,00, 29,51, 34,38, 34,84, 34,93, 36,57, 36,86, 42,22, 50,82, 107,13, 112,08, 156,72. Анал. рассч. для C20H32N2О4: C 65,91; H 8,85; N 7,69. Обнаружено: C 66,19; H 8,50; N 7,62.
Адамантан-2-спиро-3'-8'-(фениламинотиокарбонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ144). К раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (101 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют фенилизотиоцианат (135 мг, 1 ммоль). Смесь перемешивают при комнатной температуре в течение 6 час перед удалением растворителей. Остаток растирают в воде (10 мл) и фильтруют. Перекристаллизацией твердого вещества из 95% этанола получают триоксолан OZ144 (224 мг, 56%) в виде бесцветного твердого вещества. Т.пл. 136-138°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,19 (м, 18H), 3,78-4,05 (м, 4H), 7,07-7,18 (м, 3H), 7,32 (с, 1H), 7,28-7,37 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,56, 26,96, 34,09, 34,82, 34,92, 36,52, 36,81, 47,59, 106,54, 112,45, 122,59, 125,13, 129,27, 140,42, 184,18. Анал. рассч. для C22H28N2О3S: C 65,97; H 7,05; N 6,99. Обнаружено: C 65,93; H 7,15; N 7,13.
цис-Адамантан-2-спиро-3'-8'-(1'H-имидазол-1'илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ145). Стадия 1. К раствору OZ119 (0,29 г, 1 ммоль) и триэтиламина (0,15 г, 1,5 ммоль) в CH2Cl2 (5 мл) при 0°С добавляют по каплям раствор метансульфонилхлорида (0,14 г, 1,2 ммоль) в CH2Cl2 (1 мл). Смесь перемешивают при комнатной температуре в течение 1 час перед гашением водой (5 мл). После отделения водного слоя органический слой промывают водой (5 мл), насыщенным раствором соли (5 мл), сушат над MgSO4, фильтруют и концентрируют с получением метансульфоната (0,34 г, 92%) в виде бесцветного твердого вещества. Т.пл. 82-84°С (75% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,25-1,34 (м, 2H), 1,66-2,02 (м, 21H), 3,00 (с, 3H), 4,04 (д, J=6,3 Гц, 2H). Стадия 2. К суспензии 60% NaH (0,08 г, 2 ммоль) в ДМФА (4 мл) в атмосфере азота при 0°С добавляют раствор имидазола (0,14 г, 2 ммоль) в ДМФА (4 мл). Смесь перемешивают в течение 30 мин перед добавлением по каплям раствора вышеупомянутого метансульфоната (0,34 г, 0,9 ммоль) в ДМФА (4 мл). Смесь нагревают при 50°С в течение 2 час перед гашением водой (40 мл) и далее экстрагируют этилацетатом (3×30 мл). Объединенные экстракты промывают насыщенным раствором соли (3×30 мл), сушат над MgSO4, фильтруют и концентрируют. Кристаллизацией остатка из смеси гексаны/CH2Cl2 (4:1) получают триоксолан OZ145 (0,17 г, 55%) в виде бесцветного твердого вещества. Т.пл. 125-128°С (гексаны/CH2Cl2 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,17-1,39 (м, 2H), 1,55-2,18 (м, 21H), 3,77 (д, J=7,3 Гц, 2H), 6,86 (с, 1H), 7,05 (с, 1H), 7,42 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,59, 26,99, 27,70, 33,58, 34,85, 34,87, 36,53, 36,88, 37,97, 52,49, 108,25, 111,60, 119,16, 129,55, 137,43. Анал. рассч. для C20H28N2О3·0,2H2О: C 69,02; H 8,22; N 8,05. Обнаружено: C 68,81; H 8,11; N 7,96.
цис-Адамантан-2-спиро-3'-8'-фталимидометил-1',2',4'-триоксаспиро[4.5]декан (OZ146). Раствор О-метилоксима 2-адамантанона (2,23 г, 12,4 ммоль) и 4-фталимидометилциклогексанона (3,20 г, 12,4 ммоль) в пентане (100 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) с получением триоксолана OZ146 (1,66 г, 32%) в виде бесцветного твердого вещества. Т.пл. 147-150°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,23-1,44 (м, 2H), 1,45-2,08 (м, 21H), 3,56 (д, J=7,0 Гц, 2H), 7,69-7,74 (м, 2H), 7,81-7,89 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 27,01, 27,88, 33,66, 34,85, 34,87, 35,70, 36,51, 36,92, 43,12, 108,52, 111,35, 123,22, 132,20, 133,86, 168,47. Анал. рассч. для C25H29NO5: C 70,90; H 6,90; N 3,31. Обнаружено: C 71,16; H 6,75; N 3,21.
Имидазол-1-карбоксилат адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-ила (OZ147). К раствору OZ32 (0,28 г, 1 ммоль) в CH3CN (10 мл) и ТГФ (3 мл) добавляют 1,1'-карбонилдиимидазол (0,21 г, 1,3 ммоль). Смесь перемешивают при 60-70°С в течение 2 час перед охлаждением до комнатной температуры и разбавлением холодной водой (50 мл). Полученный осадок собирают фильтрацией, промывают водой и сушат с получением триоксолана OZ147 (0,32 г, 90%, смесь двух диастереомеров, 1:1) в виде бесцветного твердого вещества. Т.пл. 116-118°С (вода). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,21 (м, 22H), 5,05-5,22 (м, 1H), 7,07 (с, 0,5H), 7,08 (с, 0,5H), 7,41 (с, 0,5H), 7,43 (с, 0,5H), 8,13 (с, 0,5H), 8,15 (с, 0,5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 27,00, 28,05, 28,32, 30,53, 30,88, 34,83, 34,94, 36,48, 36,56, 36,85, 74,61, 75,01, 107,24, 107,30, 112,01, 112,11, 117,01, 117,04, 130,74, 137,08, 148,09, 148,14. Анал. рассч. для C20H26N2О5: C 64,15; H 7,00; N 7,48. Обнаружено: C 64,22; H 7,00; N 7,30.
4-Фенилпиперазин-1-карбоксилат цис-адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-метила (OZ148). К раствору OZ141 (310 мг, 0,86 ммоль) в ТГФ (10 мл) при 0°С добавляют метилтрифлат (метилтрифторметилсульфонат) (142 мг, 0,86 ммоль). Смесь перемешивают при 0°С в течение 30 мин перед добавлением 1-фенилпиперазина (140 мг, 0,86 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 час перед удалением растворителей. Кристаллизацией остатка из смеси этанол/вода (3:1) получают триоксолан OZ148 (323 мг, 83%) в виде бесцветного твердого вещества. Т.пл. 145-146°С (этанол/вода 3:1). 1H ЯМР (500 МГц, CDCl3) δ 1,21-1,42 (м, 2H), 1,58-2,10 (м, 21H), 3,15 (уш.с, 4H), 3,63 (уш.с, 4H), 3,96 (д, J=6,2 Гц, 2H), 6,90 (дд, J=7,5, 7,5 Гц, 1H), 6,93 (д, J=7,8 Гц, 2H), 7,28 (дд, J=8,6, 7,4 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 26,79, 27,01, 33,77, 34,87, 34,88, 36,03, 36,55, 36,91, 43,81, 49,46, 69,57, 108,61, 111,39, 116,71, 120,40, 129,20, 151,27, 155,45. Анал. рассч. для C28H38N2О5: C 69,68; H 7,94; N 5,80. Обнаружено: C 69,83; H 7,98; N 5,86.
Адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-спиро-1''-3''-оксо-3''Н-изобензофуран (OZ149). Раствор О-метилоксима 2-адамантанона (0,54 г, 3 ммоль) и спиро[циклогексан-1,1'(3'H)-изобензофуран]-3',4-диона (0,65 г, 3 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) с получением триоксолана OZ149 (0,50 г, 44%) в виде бесцветного твердого вещества. Т.пл. 160-162°С (этанол/вода, 3:1). 1H ЯМР (500 МГц, CDCl3) δ 1,65-2,12 (м, 18H), 2,21 (ддд, J=13,8, 13,8, 3,9 Гц, 2H), 2,31 (ддд, J=13,7, 13,7, 4,0 Гц, 2H), 7,38 (д, J=7,5 Гц, 1H), 7,52 (дд, J=7,5, 7,5 Гц, 1H), 7,67 (дд, J=7,5, 7,5 Гц, 1H), 7,88 (д, J=7,5 Гц, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 26,97, 30,73, 34,27, 34,85, 34,88, 36,60, 36,86, 84,97, 107,56, 112,05, 120,85, 124,64, 125,96, 129,25, 134,08, 153,70, 169,43. Анал. рассч. для C23H26О5: C 72,23; H 6,85. Обнаружено: C 72,12; H 6,65.
Адамантан-2-спиро-3'-8'-(4'-нитрофенил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ151). К раствору OZ80 (301 мг, 1,0 ммоль) и триэтиламина (101 мг, 1 ммоль) в CH3CN(10 мл) добавляют 4-нитрофенилтрифлат (271 мг, 1 ммоль). Смесь перемешивают при 65°С в течение 64 час перед удалением растворителей. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в гексанах) и последовательной кристаллизацией из метанола с получением триоксолана OZ151 (120 мг, 31%) в виде желтоватого твердого вещества. Т.пл. 140-142°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,61-2,19 (м, 18H), 3,48-3,75 (м, 4H), 6,83 (д, J=9,3 Гц, 2H), 8,11 (д, J=9,3 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,54, 26,94, 33,84, 34,82, 34,92, 36,55, 36,79, 45,57, 106,63, 112,40, 112,93, 126,05, 138,63, 154,14. Анал. рассч. для C21H26N2О5: C 65,27; H 6,78; N 7,25. Обнаружено: C 65,40; H 6,66; N 7,29.
5-Гидроксиадамантан-2-спиро-3'-1',2',4',9',12'-пентаоксадиспиро[4.2.4.2]тетрадекан (OZ152). Стадия 1. Раствор О-метилоксима 5-ацетокси-2-адамантанона (1,18 г, 5,0 ммоль) и 1,4-диоксаспиро[4.5]декан-8-она (790 мг, 5,0 ммоль) в пентане (20 мл) и CH2Cl2 (100 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 30% эфира в петролейном эфире) с получением 5-ацетоксиадамантан-2-спиро-3'-1',2',4',9',12'-пентаоксадиспиро[4.2.4.2]тетрадекана (0,61 г, 32%) в виде бесцветного масла. 1H ЯМР (500 МГц, CDCl3) δ 1,78-2,28 (м, 24H), 3,95 (с, 4H). Стадия 2. Смесь вышеупомянутого ацетата триоксолана (1,30 г, 3,42 ммоль), этанола (7 мл) и 30% водного КОН (6 мл) нагревают при 50°С в течение 2 час. После удаления растворителя остаток разбавляют водой и экстрагируют эфиром. Органический слой промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 80% эфира в гексанах) с получением триоксолана OZ152 (100 мг, 9%, минорный изомер, элюируют первым) в виде бесцветного твердого вещества и триоксолана OZ153 (414 мг, 36%, основной изомер, элюируют вторым) в виде бесцветного твердого вещества. Для OZ152 т.пл. 132-134°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,56-2,19 (м, 21H), 3,95 (с, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 29,27, 31,65, 32,11, 33,52, 38,10, 42,13, 44,59, 64,39, 67,01, 107,84, 108,47, 110,40. Анал. рассч. для C18H26О6: C 63,89; H 7,74. Обнаружено: C 64,02; H 7,81.
5-Гидроксиадамантан-2-спиро-3'-1',2',4',9',12'-пентаоксадиспиро[4.2.4.2]тетрадекан (OZ153). Для получения см. OZ152. Т.пл. 112-114°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,54-2,22 (м, 21H), 3,98 (с, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 28,85, 31,72, 32,09, 33,40, 38,31, 42,11, 44,54, 64,36, 67,37, 107,80, 108,50, 110,36. Анал. рассч. для C18Н26O6: C 63,89; H 7,74. Обнаружено: C 64,03; H 7,66.
цис-Адамантан-2-спиро-3'-8'-[4'-(4',5'-дигидро-4',4'-диметил-2'-оксазолил)фенил]-1',2',4'-триоксаспиро[4.5]декан (OZ154). Раствор О-метилоксима 2-адамантанона (1,32 г, 7,4 ммоль) и 4-[4-(4,5-дигидро-4,4-диметил-2-оксазолил)фенил]циклогексанона (2,00 г, 7,4 ммоль) в пентане (100 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, от 10 до 30% эфира в гексанах) с получением триоксолана OZ154 (0,80 г, 25%) в виде бесцветного твердого вещества. Т.пл. 138-140°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,37 (с, 6H), 1,59-2,16 (м, 22H), 2,51-2,68 (м, 1H), 4,08 (с, 2H), 7,24 (д, J=8,0 Гц, 2H), 7,85 (д, J=8,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,63, 27,03, 28,38, 31,29, 34,70, 34,88, 34,90, 36,56, 36,93, 42,98, 67,52, 79,15, 108,26, 111,46, 126,22, 126,70, 128,44, 149,58, 162,01. Анал. рассч. для C27H35NO4: C 74,11; H 8,06; N 3,20. Обнаружено: C 74,35; H 8,08; N 3,18.
цис-Адамантан-2-спиро-3'-8'-[[(2'-гидроксиэтил)амино]карбонил]-1',2',4'-триоксаспиро[4.5]декан (OZ155). Раствор OZ72 (0,31 г, 1,0 ммоль), гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (0,29 г, 1,5 ммоль), HOBT (0,20 г, 1,5 ммоль) и 2-аминоэтанола (0,09 г, 1,5 ммоль) в ДМФА (10 мл) перемешивают при комнатной температуре в течение 18 час перед гашением 2 М водной HCl (30 мл). Смесь экстрагируют этилацетатом (4×30 мл) и объединенные экстракты промывают водой (2×30 мл) и насыщенным раствором соли (30 мл), сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией (силикагель, 5% метанола в CH2Cl2) с получением триоксолана OZ155 (0,16 г, 46%) в виде бесцветного твердого вещества. Т.пл. 114-116°С (эфир/CH2Cl2 2:1). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,08 (м, 22H), 2,17 (уш.с, 1H), 3,38-3,45 (м, 2H), 3,71 (т, J=4,8 Гц, 2H), 6,13 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,44, 26,84, 26,99, 33,58, 34,75, 34,78, 36,35, 36,75, 42,27, 43,58, 62,31, 107,77, 111,53, 176,04. Анал. рассч. для C19Н29NO5: C 64,93; H 8,32; N 3,99. Обнаружено: C 64,68; H 8,11; N 3,93.
цис-Адамантан-2-спиро-3'-8'-бензил-1',2',4'-триоксаспиро[4.5]декан (OZ156). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 4-бензилциклогексанона (940 мг, 5 ммоль) в циклогексане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в гексанах) и последовательной перекристаллизацией из смеси этанол/CH2Cl2 (19:1) с получением триоксолана OZ156 (825 мг, 47%) в виде бесцветного твердого вещества. Т.пл. 87-89°С (этанол/CH2Cl2 19:1). 1H ЯМР (500 МГц, CDCl3) δ 1,18-1,37 (м, 2H), 1,49-2,20 (м, 21H), 2,50 (д, J=7,2 Гц, 2H), 7,09-7,40 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,49, 26,88, 29,93, 34,15, 34,78, 34,79, 36,39, 36,81, 38,16, 42,89, 108,94, 111,19, 125,78, 128,16, 129,07, 140,86. Анал. рассч. для C23H30О5: C 77,93; H 8,53. Обнаружено: C 78,17; H 8,45.
Адамантан-2-спиро-3'-8'-[(4'-метил-1'-пиперазинил)карбонил)]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ157). К раствору OZ80 (301 мг, 1,0 ммоль) и триэтиламина (404 мг, 4 ммоль) в CH2Cl2 (7 мл) при 0°С добавляют гидрохлорид 4-метил-1-пиперазинкарбонилхлорида (220 мг, 1,1 ммоль). Смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл), промывают водой (2×10 мл), насыщенным раствором соли (10 мл), сушат над MgSO4 и концентрируют. Кристаллизацией остатка из этанола получают триоксолан OZ157 (105 мг, 27%) в виде бесцветного твердого вещества. Т.пл. 146-148°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,61-2,09 (м, 18H), 2,30 (с, 3H), 2,31-2,48 (м, 4H), 3,21-3,47 (м, 8H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 27,01, 34,52, 34,85, 34,95, 36,59, 36,87, 44,77, 46,14, 46,87, 54,91, 107,24, 112,04, 163,68. Анал. рассч. для C21H33N3О4: C 64,42; H 8,50; N 10,73. Обнаружено: C 64,34; H 8,37; N 10,61.
Гидрохлорид адамантан-2-спиро-3'-8'-(1'-пиперидинил)-1',2',4'-триоксаспиро[4.5]декана (OZ159). К раствору OZ05 (555 мг, 2 ммоль) в 1,2-дихлорэтане (10 мл) добавляют пиперидин (187 мг, 2,2 ммоль) и уксусную кислоту (10 капель). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин перед добавлением триацетоксиборгидрида натрия (677 мг, 3,2 ммоль). Смесь перемешивают в течение 5 час перед гашением 1 М водным NaOH (2 мл). Полученную смесь экстрагируют CH2Cl2 (40 мл), промывают водой (2×10 мл) и насыщенным раствором соли (2×10 мл), сушат над MgSO4 и концентрируют. Остаток растворяют в эфире (2 мл), обрабатывают избытком 2 М эфирной HCl и фильтруют с получением триоксолана OZ159 (460 мг, 60%, смесь двух диастереомеров, 1:1) в виде бесцветного твердого вещества. Т.пл. 128°С, разл. (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,39 (уш.с, 1H), 1,58-2,20 (м, 23H), 2,21-2,60 (м, 4H), 2,78 (уш.с, 2H), 3,11 (уш.с, 1H), 3,28-3,59 (м, 2H), 11,94 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 22,53, 22,69, 22,73, 23,33, 23,43, 26,37, 26,40, 26,78, 32,65, 32,81, 34,66, 34,69, 34,72, 34,91, 36,28, 36,64, 49,77, 49,98, 63,81, 64,20, 106,50, 106,56, 112,20, 112,37. Анал. рассч. для C21H34ClNO3·0,25H2О: C 64,93; H 8,95; N 3,61. Обнаружено: C 64,48; H 8,59; N 3,63.
Гидрохлорид адамантан-2-спиро-3'-8'-(бензиламино)-1',2',4'-триоксаспиро[4.5]декана (OZ160). К раствору OZ05 (555 мг, 2 ммоль) в 1,2-дихлорэтане (10 мл) добавляют бензиламин (236 мг, 2,2 ммоль) и уксусную кислоту (10 капель). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин перед добавлением триацетоксиборгидрида натрия (677 мг, 3,2 ммоль). Смесь перемешивают в течение 5 час перед гашением 1 М водным NaOH (2 мл). Полученную смесь экстрагируют CH2Cl2 (40 мл), промывают водой (2×10 мл) и насыщенным раствором соли (2×10 мл), сушат над MgSO4 и концентрируют. Остаток растворяют в эфире (2 мл), обрабатывают избытком 2 М эфирной HCl и фильтруют с получением триоксолана OZ160 (567 мг, 70%, смесь двух диастереомеров, 2:1) в виде бесцветного твердого вещества. Т.пл. 160°С, разл. (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,42-2,31 (м, 22H), 2,78-2,89 (м, 1H), 3,91-4,19 (м, 2H), 7,31-7,46 (м, 3H), 7,59-7,71 (м, 2H), 10,00 (уш.с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 25,95, 26,53, 26,89, 32,21, 34,78, 34,92, 36,38, 36,45, 36,81, 47,82, 53,65, 106,71, 106,79, 111,72, 112,33, 129,07, 129,12, 129,30, 129,35, 130,25, 130,51, 130,57. Анал. рассч. для C23H32ClNO3: C 68,05; H 7,95; N 3,45. Обнаружено: C 67,89; H 7,71; N 3,35.
Адамантан-2-спиро-3'-8'-[[3'-(4'-морфолинил)пропил]амино]-1',2',4'-триоксаспиро[4.5]декан (OZ161). К раствору OZ05 (555 мг, 2 ммоль) в 1,2-дихлорэтане (10 мл) добавляют 4-(3-аминопропил)морфолин (317 мг, 2,2 ммоль) и уксусную кислоту (10 капель). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин перед добавлением триацетоксиборгидрида натрия (677 мг, 3,2 ммоль). Смесь перемешивают в течение 5 час перед гашением 1 М водным NaOH (2 мл). Полученную смесь экстрагируют CH2Cl2 (40 мл), промывают водой (2×10 мл) и насыщенным раствором соли (2×10 мл), сушат над MgSO4 и концентрируют. Остаток растворяют в эфире (2 мл), обрабатывают избытком 2 М эфирной HCl и фильтруют с получением триоксолана OZ161 (552 мг, 68%, смесь двух диастереомеров, 1:1) в виде бесцветного твердого вещества. Т.пл. 70-72°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,31-2,20 (м, 24H), 2,32-2,60 (м, 7H), 2,61-2,78 (м, 2H), 3,62-3,83 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,29, 26,70, 26,77, 26,81, 29,61, 30,02, 31,97, 32,42, 34,55, 34,59, 34,63, 34,70, 36,16, 36,20, 36,61, 43,27, 45,76, 46,00, 53,62, 53,64, 54,62, 54,86, 57,31, 57,42, 66,80, 108,35, 108,39, 111,05, 111,34. Анал. рассч. для C23H38N2О4: C 67,95; H 9,42; N 6,89. Обнаружено: C 67,84; H 9,30; N 6,68.
Гидрохлорид адамантан-2-спиро-3'-8'-(циклогексиламино)-1',2',4'-триоксаспиро[4.5]декана (OZ162). К раствору OZ05 (555 мг, 2 ммоль) в 1,2-дихлорэтане (10 мл) добавляют циклогексиламин (218 мг, 2,2 ммоль) и уксусную кислоту (10 капель). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин перед добавлением триацетоксиборгидрида натрия (677 мг, 3,2 ммоль). Смесь перемешивают в течение 5 час перед гашением 1 М водным NaOH (2 мл). Полученную смесь экстрагируют CH2Cl2 (40 мл), промывают водой (2×10 мл) и насыщенным раствором соли (2×10 мл), сушат над MgSO4 и концентрируют. Остаток растворяют в эфире (2 мл), обрабатывают избытком 2 М эфирной HCl и фильтруют с получением триоксолана OZ162 (516 мг, 65%, смесь двух диастереомеров, 1:1) в виде бесцветного твердого вещества. Т.пл. 240°С, разл. (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,26 (уш.с, 2H), 1,55-2,42 (м, 30H), 2,97-3,21 (м, 2H), 9,33 (уш.с, 1H), 9,37 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 24,83, 24,87, 26,56, 26,90, 26,97, 29,45, 32,58, 34,80, 34,82, 34,94, 36,39, 36,51, 36,85, 52,70, 54,89, 55,12, 106,82, 106,91, 111,67, 112,32. Анал. рассч. для C22H36ClNO3: C 66,39; H 9,12; N 3,52. Обнаружено: C 66,28; H 8,97; N 3,54.
Гидрохлорид цис-адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (OZ163). Раствор OZ146 (423 мг, 1 ммоль) и моногидрата гидразина (150 мг, 3 ммоль) в хлороформе (9 мл) и метаноле (1 мл) нагревают при 55°С в течение 48 час. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления твердых побочных продуктов. Фильтрат промывают водой (10 мл) и насыщенным раствором соли (10 мл), сушат над MgSO4, фильтруют и концентрируют. Твердое вещество растворяют в эфире (10 мл), обрабатывают 1 М эфирной HCl (1,2 мл) и фильтруют. Перекристаллизацией из эфира получают триоксолан OZ163 (80 мг, 24%) в виде желтоватого твердого вещества Т.пл. 146°С, разл. (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,23-1,42 (м, 2H), 1,59-2,20 (м, 21H), 2,86 (уш.с, 2H), 8,35 (уш.с, 3H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,45, 26,86, 27,61, 33,27, 34,45, 34,76, 36,37, 36,77, 39,25, 44,88, 107,92, 111,52. Анал. рассч. для C17Н28ClNO3: C 61,90; H 8,56; N 4,25. Обнаружено: C 59,83; H 8,21; N 5,07.
цис-Адамантан-2-спиро-3'-8'-[4'-(этоксикарбонил)фенил]-1',2',4'-триоксаспиро[4.5]декан (OZ164). Раствор О-метилоксима 2-адамантанона (1,10 г, 6,2 ммоль) и 4-[4-(этоксикарбонил)фенил]циклогексанона (1,70 г, 6,2 ммоль) в пентане (100 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ164 (1,60 г, 63%) в виде бесцветного твердого вещества. Т.пл. 129-132°С (гексаны/эфир9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,38 (т, J=7,2 Гц, 3H), 1,63-2,22 (м, 22H), 2,56-2,71 (м, 1H), 4,36 (кв, J=7,2 Гц, 2H), 7,27 (д, J=7,8 Гц, 2H), 7,96 (д, J=8,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,34, 26,49, 26,89, 31,18, 34,59, 34,80, 36,42, 36,80, 42,99, 60,76, 108,18, 111,51, 126,77, 128,54, 129,74, 151,39, 166,57. Анал. рассч. для C25H32О5: C 72,79; H 7,82. Обнаружено: C 72,83; H 7,90.
цис-Адамантан-2-спиро-3'-8'-(4'-карбоксифенил)-1',2',4'-триоксаспиро[4.5]декан (OZ165). Смесь OZ164 (1,38 г, 3,35 ммоль), КОН (1,13 г), ТГФ (30 мл), метанола (30 мл) и воды (6 мл) нагревают при 50°С в течение 2 час. Смесь концентрируют до 10 мл, разбавляют водой (50 мл) и экстрагируют этилацетатом. Водный слой подкисляют 1 М водной HCl до рН=2 и полученное твердое вещество собирают фильтрацией с получением триоксолана OZ165 (1,08 г, 84%) в виде бесцветного твердого вещества Т.пл. 157°С, разл. 1H ЯМР (500 МГц, CDCl3) δ 1,63-2,22 (м, 22H), 2,57-2,72 (м, 1H), 7,31 (д, J=8,3 Гц, 2H), 8,03 (д, J=8,1 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,49, 26,90, 31,14, 34,58, 34,81, 36,43, 36,80, 43,10, 108,14, 111,54, 126,99, 127,23, 130,46, 152,54, 171,45. Анал. рассч. для C23H28О5: C 71,85; H 7,34. Обнаружено: C 71,68; H 7,33.
цис-Адамантан-2-спиро-3'-8'-[[4'-(этоксикарбонил)фенокси]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ166). К раствору OZ119 (0,59 г, 2,0 ммоль), трифенилфосфина (0,63 г, 2,4 ммоль) и этил-4-гидроксибензоата (0,50 г, 3,0 ммоль) в ТГФ (12 мл) при 0°С по каплям добавляют раствор диизопропилазодикарбоксилата (0,65 г, 3,2 ммоль) в ТГФ (0,5 мл). Смесь далее нагревают до комнатной температуры и нагревают при данной температуре в течение 2 час перед удалением растворителей. Неочищенный продукт очищают флэш-хроматографией (силикагель, 20% эфира в гексанах) с получением триоксолана OZ166 (0,65 г, 73%) в виде бесцветного твердого вещества. Т.пл. 142-143°С (гексаны/эфир9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,38 (т, J=7,2 Гц, 3H), 1,30-1,58 (м, 2H), 1,60-2,21 (м, 21H), 3,82 (д, J=5,9 Гц, 2H), 4,34 (кв, J=7,2 Гц, 2H), 6,88 (д, J=9,0 Гц, 2H), 7,97 (д, J=8,8 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,35, 26,48, 26,85, 26,87, 33,72, 34,78, 34,80, 36,14, 36,40, 36,79, 60,58, 72,43, 108,64, 111,41, 113,97, 122,84, 131,50, 162,75, 166,38. Анал. рассч. для С26Н34О6: C 70,56; H 7,74. Обнаружено: C 70,72; H 7,76.
транс-Адамантан-2-спиро-3'-8'-фталимидометил-1',2',4'-триоксаспиро[4.5]декан (OZ167). Для основного изомера (цис) см. OZ146. Раствор О-метилоксима 2-адамантанона (2,23 г, 12,4 ммоль) и 4-фталимидометилциклогексанона (3,20 г, 12,4 ммоль) в пентане (100 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах и 40% CH2Cl2 в гексанах) с получением триоксолана OZ167 (0,16 г, 3%) в виде бесцветного твердого вещества. Т.пл. 140-142°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,40-2,17 (м, 23H), 3,60 (д, J=7,5 Гц, 2H), 7,68-7,75 (м, 2H), 7,82-7,88 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,63, 27,03, 27,69, 33,46, 34,83, 34,99, 35,71, 36,51, 36,93, 42,98, 108,58, 111,74, 123,25, 132,19, 133,91, 168,52. Анал. рассч. для C25H29NO5: C 70,90; H 6,90; N 3,31. Обнаружено: C 70,75; H 7,03; N 3,25.
Адамантан-2-спиро-3'-1',2',4',9',10',12'-гексаоксадиспиро[4.2.4.2]тетрадекан-11'-спиро-2''-адамантан (OZ169). Раствор О-метилоксима 2-адамантанона (1,80 г, 10 ммоль) и 1,4-циклогександиона (2,24 г, 20 ммоль) в пентане (60 мл) и CH2Cl2 (40 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ169 (346 мг, 16%, смесь двух диастереомеров, 2:1) в виде бесцветного твердого вещества. Т.пл. 156-158°С (гексаны). 1H ЯМР (500 МГц, CDCl3) δ 1,92 (с, 8H), 1,60-2,25 (м, 28H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,45, 26,83, 26,86, 31,57, 34,72, 34,75, 34,80, 34,84, 36,29, 36,31, 36,74, 107,65, 107,71, 111,72. Анал. рассч. для C26H36О6: C 70,24; H 8,16. Обнаружено: C 70,18; H 8,28.
Дигидрохлорид адамантан-2-спиро-3'-8'-[(2',2',6',6'-тетраметил-4'-пиперидинил)амино]-1',2',4'-триоксаспиро[4.5]декана (OZ171). К раствору OZ05 (555 мг, 2 ммоль) в 1,2-дихлорэтане (10 мл) добавляют 4-амино-2,2,6,6-тетраметилпиперидин (344 мг, 2,2 ммоль) и уксусную кислоту (10 капель). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин перед добавлением триацетоксиборгидрида натрия (677 мг, 3,2 ммоль). Смесь перемешивают в течение 5 час перед гашением 1 М водным NaOH (2 мл). Полученную смесь экстрагируют CH2Cl2 (40 мл), промывают водой (2×10 мл) и насыщенным раствором соли (2×10 мл), сушат над MgSO4 и концентрируют. Остаток растворяют в эфире (2 мл), обрабатывают избытком 2 М эфирной HCl и фильтруют с получением триоксолана OZ171 (650 мг, 66%, смесь двух диастереомеров, 1:1) в виде бесцветного твердого вещества. Т.пл. 165°С, разл. (эфир). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,43 (с, 6H), 1,45 (с, 6H), 1,46-2,37 (м, 26H), 3,14-3,40 (м, 1H), 3,55-3,79 (м, 1H), 8,28-8,45 (м, 1H), 9,25-9,47 (м, 2H), 9,55-9,72 (м, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 24,03, 24,07, 25,96, 26,38, 29,78, 31,70, 34,38, 34,43, 34,55, 35,81, 35,88, 36,22, 37,00, 45,66, 45,71, 50,74, 50,93, 56,22, 56,26, 107,42, 107,46, 111,13, 111,41. Анал. рассч. для C25Н44Cl2N2O3·1,5 H2O: C 57,90; H 9,14; N 5,40. Обнаружено: C 57,65; H 8,74; N 5,36.
Гидрохлорид аминогидразона адамантан-2-спиро-3'-8'-оксо-1',2',4'-триоксаспиро[4.5]декана (OZ172). К раствору OZ05 (555 мг, 2 ммоль) в ТГФ (11 мл), воде (3 мл) и этаноле (3,5 мл) добавляют 2 М водную HCl (1,5 мл) и бикарбонат аминогуанидина (299 мг, 2,2 ммоль). Смесь перемешивают при комнатной температуре в течение 30 час перед удалением растворителей. Остаток растирают в этаноле (10 мл) и полученный осадок собирают фильтрацией и промывают ТГФ с получением триоксолана OZ172 (476 мг, 64%) в виде бесцветного твердого вещества. Т.пл. 150°С, разл. (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,46-2,27 (м, 18H), 2,42-2,61 (м, 2H), 2,62-2,83 (м, 2H), 6,34 (с, 1H), 7,63 (уш.с, 2H), 7,91 (с, 1H), 10,95 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 24,83, 26,37, 26,77, 31,72, 32,49, 33,62, 34,70, 34,74, 34,84, 36,23, 36,26, 36,65, 107,26, 112,27, 156,57, 157,93. Анал. рассч. для C17Н27ClN4O3: C 55,05; H 7,34; N 15,11. Обнаружено: C 55,14; H 7,51; N 15,30.
Адамантан-2-спиро-3'-8'-[(метоксиацетил)бензиламино]-1',2',4'-триоксаспиро[4.5]декан (OZ173). К раствору OZ160 (342 мг, 0,84 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (255 мг, 2,53 ммоль) и метоксиацетилхлорид (137 мг, 1,26 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл) и промывают водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой отделяют, сушат над MgSO4 и концентрируют. Остаток растирают в эфире с получением триоксолана OZ173 (110 мг, 30%, смесь двух диастереомеров, 3:2) в виде бесцветного твердого вещества. Т.пл. 132-134°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,47-2,20 (м, 22H), 3,38 (с, 1,8H), 3,48 (с, 1,2H), 3,99 (с, 1,2H), 4,23 (с, 0,8H), 4,46 (с, 1,2H), 4,55 (с, 0,8H), 4,42-4,58 (м, 1H), 7,09-7,46 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,41, 26,80, 26,87, 27,11, 28,74, 33,31, 33,54, 34,67, 34,74, 34,93, 36,29, 36,72, 44,76, 45,52, 51,71, 55,36, 59,20, 71,54, 72,30, 107,56, 111,65, 125,61, 126,74, 127,10, 127,30, 128,33, 128,78, 137,93, 139,04, 169,30, 169,82. Анал. рассч. для С26H35NO5: C 70,72; H 7,99; N 3,17. Обнаружено: C 70,76; H 8,02; N 3,08.
Адамантан-2-спиро-3'-8'-[(метоксиацетил)циклогексиламино]-1',2',4'-триоксаспиро[4.5]декан (OZ174). К раствору OZ162 (330 мг, 0,83 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (251 мг, 2,49 ммоль) и метоксиацетилхлорид (135 мг, 1,24 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл) и промывают водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой отделяют, сушат над MgSO4 и концентрируют. Остаток растирают в эфире с получением триоксолана OZ174 (109 мг, 30%, смесь двух диастереомеров, 4:1) в виде бесцветного твердого вещества. Т.пл. 140-142°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,02-2,20 (м, 30H), 2,32-2,72 (м, 2H), 2,81-3,05 (м, 1H), 3,40 (с, 2,4H), 3,42 (с, 0,6H), 3,48-3,69 (м, 1H), 4,02 (с, 1,6H), 4,03 (м, 0,4H); 13C ЯМР (125,7 МГц, CDCl3) δ 25,25, 26,00, 26,44, 26,84, 27,89, 29,77, 33,50, 34,21, 34,77, 36,32, 36,73, 55,51, 56,10, 58,84, 73,12, 73,71, 107,39, 107,52, 111,83, 168,17. Анал. рассч. для C25H39NO5: C 69,25; H 9,07; N 3,23. Обнаружено: C 69,12; H 9,06; N 3,23.
цис-Адамантан-2-спиро-3'-8'-(2'-гидроксиамино-2'-оксоэтил)-1',2',4'-триоксаспиро[4.5]декан (OZ175). К раствору OZ78 (322 мг, 1,0 ммоль) в эфире (10 мл) при 0°С добавляют триэтиламин (202 мг, 2 ммоль) и этилхлорформиат (217 мг, 2 ммоль). Смесь перемешивают при 0°С в течение 15 мин перед добавлением свежеприготовленного раствора гидроксиламина. [Суспензию гидрохлорида гидроксиламина (170 мг, 2,48 ммоль) и бикарбоната натрия (203 мг, 2,48 ммоль) в метаноле (5 мл) перемешивают при комнатной температуре в течение 15 мин. Супернатант используют как таковой]. Полученную смесь перемешивают при комнатной температуре в течение 12 час, разбавляют эфиром (10 мл), промывают водой (10 мл), сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% метанола в CH2Cl2) и последовательной перекристаллизацией из этанола с получением триоксолана OZ175 (95 мг, 28%) в виде бесцветного твердого вещества. Т.пл. 138-140°С (этанол). 1H ЯМР (500 МГц, ДМСО-d6) δ 0,81-1,27 (м, 3H), 1,40-2,19 (м, 22H), 8,65 (с, 1H), 10,33 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,84, 26,25, 29,40, 32,60, 33,35, 34,26, 35,81, 36,13, 38,68, 108,33, 110,44, 167,91. Анал. рассч. для C18H27NO5: C 64,07; H 8,07; N 4,15. Обнаружено: C 64,11; H 8,10; N 3,97.
цис-Адамантан-2-спиро-3'-8'-[(4'-карбоксифенокси)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ176). Смесь OZ166 (0,30 г, 0,68 ммоль), КОН (0,38 г), ТГФ (10 мл), метанола (10 мл) и воды (2 мл) нагревают при 50°С в течение 3 час. Смесь концентрируют до 5 мл, разбавляют водой (15 мл) и подкисляют 1 М водной HCl (1 мл). Полученное твердое вещество собирают фильтрацией с получением триоксолана OZ176 (0,21 г, 75%) в виде бесцветного твердого вещества. Т.пл. 165-168°С. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,15-1,27 (м, 2H), 1,50-2,17 (м, 21H), 3,88 (д, J=6,2 Гц, 2H), 7,00 (д, J=8,8 Гц, 2H), 7,87 (д, J=8,3 Гц, 2H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,99, 26,40, 26,53, 33,27, 34,45, 35,35, 35,95, 36,26, 72,09, 108,70, 110,71, 114,41, 123,04, 131,50, 162,47, 167,15. Анал. рассч. для C24H30О6: C 69,54; H 7,30. Обнаружено: C 69,67; H 7,21.
цис-Адамантан-2-спиро-3'-8'-(1'Н-1',2',4'-триазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ177). К суспензии 60% NaH (0,08 г, 2 ммоль) в ДМФА (4 мл) в атмосфере азота при 0°С добавляют раствор 1,2,4-триазола (0,14 г, 2 ммоль) в ДМФА (4 мл). Смесь перемешивают в течение 30 мин перед добавлением по каплям раствора метансульфоната OZ119 (0,37 г, 1,0 ммоль) в ДМФА (4 мл). Смесь нагревают при 50°С в течение 2 час перед гашением водой (40 мл) и далее экстрагируют этилацетатом (3×30 мл). Объединенные экстракты промывают насыщенным раствором соли (3×30 мл), сушат над MgSO4, фильтруют и концентрируют. Кристаллизацией остатка из смеси гексаны/эфир (4:1) получают триоксолан OZ177 (0,21 г, 61%) в виде бесцветного твердого вещества. Т.пл. 123-124°С (гексаны/эфир 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,17-1,42 (м, 2H), 1,50-2,19 (м, 21H), 4,02 (д, J=7,0 Гц, 2H), 7,95 (с, 1H), 8,02 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,43, 26,82, 27,48, 33,43, 34,75, 36,35, 36,47, 36,73, 54,84, 108,19, 111,57, 143,35, 152,10. Анал. рассч. для C19Н27N3O3: C 66,06; H 7,88; N 12,16. Обнаружено: C 65,86; H 8,06; N 11,89.
цис-Адамантан-2-спиро-3'-8'-[(4'-метилсульфонил)фенил]-1',2',4'-триоксаспиро[4.5]декан (OZ178). Раствор О-метилоксима 2-адамантанона (0,54 г, 3 ммоль) и 4-[4-(метилсульфонил)фенил]циклогексанона (0,75 г, 3 ммоль) в пентане (50 мл) и CH2Cl2 (50 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 30% этилацетата в гексанах) с получением триоксолана OZ178 (0,22 г, 18%) в виде бесцветного твердого вещества. Т.пл. 132-135°С (гексаны/CH2Cl2 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,19 (м, 22H), 2,60-2,74 (м, 1H), 3,04 (с, 3H), 7,40 (д, J=8,3 Гц, 2H), 7,86 (д, J=8,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,48, 26,88, 31,14, 34,48, 34,80, 36,43, 36,78, 42,94, 44,53, 107,95, 111,64, 127,59, 127,80, 138,45, 152,59. Анал. рассч. для C23H30О5S: C 66,00; H 7,22. Обнаружено: C 66,08; H 7,16.
Гидрохлорид цис-адамантан-2-спиро-3'-8'-(1'Н-имидазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декана (OZ179). К раствору OZ145 (1,08 г, 3,1 ммоль) в эфире (80 мл) добавляют 1 М эфирной HCl (3,5 мл). Полученный осадок собирают фильтрацией с получением триоксолана OZ179 (1,14 г, 97%) в виде бесцветного твердого вещества. Т.пл. 153-156°С. 1H ЯМР (500 МГц, CDCl3) δ 1,19-1,46 (м, 2H), 1,50-2,19 (м, 21H), 4,24 (уш.с, 2H), 7,15 (с, 1H), 7,42 (с, 1H), 9,70 (с, 1H), 15,94 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,38, 26,77, 27,26, 33,20, 34,71, 36,29, 36,68, 37,17, 54,75, 107,85, 111,62, 119,72, 121,22, 135,82. Анал. рассч. для C20H29ClN2О3: C 63,06; H 7,67; N 7,35. Обнаружено: C 63,21; H 7,63; N 7,30.
Гидрохлорид цис-адамантан-2-спиро-3'-8'-[4'-(4',5'-дигидро-4',4'-диметил-2'-оксазолил)фенил]-1',2',4'-триоксаспиро[4.5]декана (OZ180). К раствору OZ154 (0,21 г, 0,48 ммоль) в эфире (9 мл) и CH2Cl2 (1 мл) добавляют 1 М эфирной HCl (0,5 мл). Полученный осадок собирают фильтрацией с получением триоксолана OZ180 (0,20 г, 88%) в виде бесцветного твердого вещества. Т.пл. 143-145°С. 1H ЯМР (500 МГц, CDCl3) δ 1,58-2,25 (м, 28H), 2,58-2,80 (м, 1H), 4,69 (уш.с, 2H), 7,44 (уш.с, 2H), 8,40 (уш.с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,44, 26,84, 27,19, 30,87, 34,37, 34,76, 36,39, 36,74, 43,21, 63,92, 83,36, 107,83, 111,59, 117,60, 128,16, 131,38, 156,27, 168,98. Анал. рассч. для C27H36ClNO4: C 68,41; H 7,65; N 2,95. Обнаружено: C 68,26; H 7,80; N 2,90.
Цитрат цис-адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (OZ181). Стадия 1. Раствор OZ146 (1,00 г, 2,36 ммоль) и моногидрата гидразина (0,50 г, 10 ммоль) в хлороформе (22,5 мл) и метаноле (2,5 мл) нагревают в атмосфере азота при 55°С в течение 25 час. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления твердых побочных продуктов. Фильтрат промывают водой (10 мл) и насыщенным раствором соли (10 мл), сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, CHCl3/MeOH/Et3N, 90:10:1) с получением цис-адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (0,63 г, 91%) в виде бесцветного твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,14-1,22 (м, 2H), 1,30-1,40 (м, 2H), 1,60-2,10 (м, 21H), 2,55 (д, J=6,6 Гц, 2H). Стадия 2. К раствору вышеуказанного амина (0,40 г, 1,36 ммоль) в ацетоне (10 мл) добавляют раствор лимонной кислоты (0,25 г, 1,30 ммоль) в ацетоне (10 мл). Смесь перемешивают при комнатной температуре в течение 30 мин и фильтруют. Фильтрат концентрируют и обрабатывают эфиром (25 мл). Полученный остаток собирают фильтрацией, перерастворяют в метаноле (5 мл) и концентрируют с получением триоксолана OZ181 (0,30 г, 45%) в виде бесцветного твердого вещества. Т.пл. 76-77°С. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,04-1,21 (м, 2H), 1,56-2,04 (м, 21H), 2,53 (AB система, 4H), 2,69 (д, J=7,3 Гц, 2H), 7,78 (уш.с, 3H), 11,50 (уш.с, 2H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,95, 26,37, 27,10, 33,01, 33,88, 34,40, 34,42, 35,90, 36,23, 43,61, 44,43, 71,35, 108,29, 110,81, 171,39. Анал. рассч. для C23H35NO10·0,4H2О: C 55,52; H 7,36; N 2,82. Обнаружено: C 55,25; H 7,25; N 2,66.
Адамантан-2-спиро-3'-8'-[[2'-(1'Н-имидазол-1'-ил)этокси]карбонил]-1',2',4'-триоксаспиро[4.5]декан (OZ182). К раствору OZ72 (0,31 г, 1,0 ммоль), трифенилфосфина (0,26 г, 1,0 ммоль) и 1-(2-гидроксиэтил)имидазола (0,11 г, 1,0 ммоль) в ТГФ (10 мл) при 0°C добавляют по каплям раствор диизопропилазодикарбоксилата (0,20 г, 1,0 ммоль) в ТГФ (2 мл). Смесь далее нагревают до комнатной температуры и перемешивают при данной температуре в течение 16 час перед удалением растворителей. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% метанол в метиленхлориде) с получением триоксолана OZ182 (0,21 г, 52%, смесь двух диастереомеров, 3:1) в виде бесцветного твердого вещества. Т.пл. 75-76°С (эфир/гексаны 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,18 (м, 22H), 2,25-2,48 (м, 1H), 4,20 (т, J=5,3 Гц, 2H), 4,33 (т, J=5,1 Гц, 2H), 6,94 (с, 1H), 7,09 (с, 1H), 7,57 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,11, 26,27, 26,44, 26,47, 26,84, 26,87, 33,21, 33,40, 34,75, 34,76, 34,78, 34,81, 36,35, 36,37, 36,75, 36,78, 41,15, 45,87, 63,06, 107,65, 108,11, 111,38, 111,61, 119,02, 129,31, 137,33, 174,34. Анал. рассч. для C22H30N2О5: C 65,65; H 7,51; N 6,96. Обнаружено: C 65,86; H 7,58; N 6,78.
цис-Адамантан-2-спиро-3'-8'-[[4'-(гидроксиамино)карбонил]фенил]-1',2',4'-триоксаспиро[4.5]декан (OZ183). Смесь этилхлорформиата (0,13 г, 1,2 ммоль), OZ165 (0,41 г, 1,0 ммоль) и триэтиламина (0,13 г, 1,3 ммоль), эфира (5 мл), ТГФ (5 мл) и ДМФА (5 мл) перемешивают при 0°С в течение 1 час. Твердое вещество удаляют фильтрацией и фильтрат добавляют к свежеприготовленному раствору гидроксиламина. [К суспензии КОН (84 мг, 1,5 ммоль) в метаноле (1 мл) при 0°C добавляют раствор гидрохлорида гидроксиламина (0,10 г, 1,5 ммоль) в метаноле (2 мл). Реакционную смесь перемешивают при 0°С в течение 15 мин и фильтруют для удаления твердых побочных продуктов. Фильтрат используют как таковой]. Полученную смесь перемешивают при комнатной температуре в течение 1 час и концентрируют. Неочищенный продукт растирают в хлороформе (6 мл) при 45°С в течение 10 мин и охлаждают до комнатной температуры. Осадок собирают фильтрацией и перекристаллизовывают из смеси хлороформ/метанол (2:1) с получением триоксолана OZ183 (0,13 г, 33%) в виде бесцветного твердого вещества. Т.пл. 167-168°С (хлороформ/метанол 2:1). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,40-2,17 (м, 22H), 2,57-2,80 (м, 1H), 7,29 (д, J=7,8 Гц, 2H), 7,67 (д, J=7,8 Гц, 2H), 8,95 (с, 1H), 11,14 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 26,03, 26,44, 31,06, 34,21, 34,48, 36,01, 36,30, 41,61, 108,26, 110,83, 126,82, 127,25, 130,92, 149,41, 164,47. Анал. рассч. для C23H29NO5: C 69,15; H 7,32; N 3,51. Обнаружено: C 68,89; H 7,30; N 3,70.
Гидрохлорид адамантан-2-спиро-3'-8'-[(циклопропилметил)амино]-1',2',4'-триоксаспиро[4.5]декана (OZ184). К раствору OZ05 (555 мг, 2 ммоль) в 1,2-дихлорэтане (10 мл) добавляют циклопропанметиламин (156 мг, 2,2 ммоль) и уксусную кислоту (10 капель). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин перед добавлением триацетоксиборгидрида натрия (677 мг, 3,2 ммоль). Смесь перемешивают в течение 5 час перед гашением 1 М водным NaOH (2 мл). Полученную смесь экстрагируют CH2Cl2 (40 мл), промывают водой (2×10 мл) и насыщенным раствором соли (2×10 мл), сушат над MgSO4 и концентрируют. Остаток растворяют в эфире (2 мл), обрабатывают избытком 2 М эфирной HCl и фильтруют с получением триоксолана OZ184 (401 мг, 54%, смесь двух диастереомеров, 1:1) в виде бесцветного твердого вещества. Т.пл. 110°С, разл. (эфир). 1H ЯМР (500 МГц, CDCl3) δ 0,39-0,60 (м, 2H), 0,61-0,85 (м, 2H), 1,22-1,43 (м, 1H), 1,59-2,45 (м, 22H), 2,76-3,02 (м, 2H), 3,08-3,35 (м, 1H), 9,65 (уш.с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 4,83, 4,87, 7,06, 7,13, 25,87, 25,94, 26,37, 26,73, 26,77, 32,29, 34,67, 34,70, 34,79, 36,20, 36,28, 36,66, 48,93, 49,25, 54,42, 54,60, 106,74, 106,75, 111,77, 112,28. Анал. рассч. для C20H32ClNO3: C 64,94; H 8,72; N 3,79. Обнаружено: C 65,18; H 8,56; N 3,83.
Гидрохлорид адамантан-2-спиро-3'-8'-(циклопропиламино)-1',2',4'-триоксаспиро[4.5]декана (OZ185). К раствору OZ05 (555 мг, 2 ммоль) в 1,2-дихлорэтане (10 мл) добавляют циклопропиламин (125 мг, 2,2 ммоль) и уксусную кислоту (10 капель). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин перед добавлением триацетоксиборгидрида натрия (677 мг, 3,2 ммоль). Смесь перемешивают в течение 5 час перед гашением 1 М водным NaOH (2 мл). Полученную смесь экстрагируют CH2Cl2 (40 мл), промывают водой (2×10 мл) и насыщенным раствором соли (2×10 мл), сушат над MgSO4 и концентрируют. Остаток растворяют в эфире (2 мл), обрабатывают избытком 2 М эфирной HCl и фильтруют с получением триоксолана OZ185 (348 мг, 49%, смесь двух диастереомеров, 1:1) в виде бесцветного твердого вещества. Т.пл. 102-103°С, разл. (эфир). 1H ЯМР (500 МГц, CDCl3) δ 0,69-1,05 (м, 2H), 1,20-1,45 (м, 2H), 1,59-2,21 (м, 20H), 2,22-2,45 (м, 2H), 2,46-2,69 (м, 1H), 3,01-3,39 (м, 1H), 9,62 (уш.с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 3,85, 26,21, 26,24, 26,40, 26,76, 26,80, 27,49, 27,94, 32,35, 34,70, 34,73, 34,86, 36,24, 36,32, 36,70, 56,85, 57,19, 106,76, 106,78, 111,84, 112,34. Анал. рассч. для C19Н30ClNO3: C 64,12; H 8,50; N 3,94. Обнаружено: C 64,00; H 8,38; N 3,84.
цис-Адамантан-2-спиро-3'-8'-[(метоксиацетил)амино]-1',2',4'-триоксаспиро[4.5]декан (OZ186). К раствору OZ137 (550 мг, 1,74 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (350 мг, 3,48 ммоль) и метоксиацетилхлорид (198 мг, 1,82 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл) и промывают водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой отделяют, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 85% эфира в гексанах) с получением триоксолана OZ186 (379 мг, 62%) в виде бесцветного твердого вещества. Т.пл. 105-106°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,40-1,61 (м, 2H), 1,62-2,21 (м, 20H), 3,41 (с, 3H), 3,86 (с, 2H), 3,80-3,96 (м, 1H), 6,35-6,49 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,34, 26,72, 29,67, 32,56, 34,64, 36,20, 36,63, 45,84, 58,94, 71,83, 107,53, 111,47, 168,65. Анал. рассч. для C19H29NO5: C 64,93; H 8,32; N 3,99. Обнаружено: C 64,81; H 8,31; N 3,91.
цис-Адамантан-2-спиро-3'-8'-[[(диметиламино)карбонил]амино]-1',2',4'-триоксаспиро[4.5]декан (OZ187). К раствору OZ137 (550 мг, 1,74 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (352 мг, 3,48 ммоль) и диметилкарбамоилхлорид (197 мг, 1,82 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл) и промывают водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой отделяют, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 90% эфира в гексанах) с получением триоксолана OZ187 (346 мг, 57%) в виде бесцветного твердого вещества. Т.пл. 142-144°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,32-1,55 (м, 2H), 1,62-2,21 (м, 20H), 2,88 (с, 6H), 3,62-3,85 (м, 1H), 4,15-4,29 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,42, 26,79, 30,67, 32,86, 34,72, 36,07, 36,28, 36,72, 47,91, 107,94, 111,45, 157,69. Анал. рассч. для C19Н30N2O4: C 65,12; H 8,63; N 7,99. Обнаружено: C 65,30; H 8,68; N 8,06.
Адамантан-2-спиро-3'-8'-(4'-морфолинилкарбонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ188). К раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (202 мг, 2 ммоль) в CH2Cl2 (7 мл) при 0°С добавляют 4-морфолинкарбонилхлорид (170 мг, 1,1 ммоль). Смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл) и промывают водой (2×10 мл) и насыщенным раствором соли (10 мл), сушат над MgSO4 и концентрируют. Кристаллизацией остатка из этанола получают триоксолан OZ188 (310 мг, 82%) в виде бесцветного твердого вещества. Т.пл. 132-134°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,21 (м, 18H), 3,18-3,28 (м, 4H), 3,29-3,58 (м, 4H), 3,60-3,82 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,42, 26,82, 34,37, 34,73, 34,82, 36,39, 36,70, 44,59, 47,41, 66,62, 107,03, 112,04, 163,66. Анал. рассч. для C20H30N2О5: C 63,47; H 7,99; N 7,40. Обнаружено: C 63,24; H 7,84; N 7,44.
цис-Адамантан-2-спиро-3'-8'-[2'-(4'-морфолинил)-2'-оксоэтил]-1',2',4'-триоксаспиро[4.5]декан (OZ189). К раствору OZ78 (322 мг, 1,0 ммоль) в эфире (10 мл) при 0°С добавляют триэтиламин (202 мг, 2 ммоль) и этилхлорформиат (217 мг, 2 ммоль). Смесь перемешивают при 0°С в течение 15 мин перед добавлением морфолина (175 мг, 2 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 12 час, разбавляют эфиром (10 мл), промывают водой (10 мл), сушат над MgSO4 и концентрируют. Неочищенный продукт очищают кристаллизацией из этанола с получением триоксолана OZ189 (290 мг, 74%) в виде бесцветного твердого вещества. Т.пл. 118-120°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,16-1,35 (м, 2H), 1,60-2,16 (м, 21H), 2,21 (д, J=6,9 Гц, 2H), 3,38-3,54 (м, 2H), 3,55-3,82 (м, 6H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,48, 26,86, 30,28, 33,26, 34,05, 34,79, 36,39, 36,79, 39,01, 41,93, 46,18, 66,66, 66,97, 108,58, 111,35, 170,67. Анал. рассч. для C22H33NO5: C 67,49; H 8,50; N 3,58. Обнаружено: C 67,46; H 8,39; N 3,34.
Адамантан-2-спиро-3'-8'-(диметиламиносульфонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ190). К перемешиваемому раствору OZ80 (301 мг, 1 ммоль) в CH2Cl2 (10 мл) при комнатной температуре добавляют триэтиламин (0,4 мл, 3 ммоль) и диметиламиносульфонилхлорид (0,13 мл, 1,2 ммоль). Смесь перемешивают при комнатной температуре в течение 3 час перед удалением растворителя. Остаток разбавляют эфиром(15 мл), промывают водой (2×10 мл), сушат над MgSO4 и концентрируют. Кристаллизацией остатка из смеси эфир/гексаны (1:1) получают триоксолан OZ190 (301 мг, 81%) в виде бесцветного твердого вещества. Т.пл. 104-106°С (эфир/гексаны 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,62-2,17 (м, 18H), 2,82 (с, 6H), 3,29-3,53 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,40, 26,79, 34,24, 34,71, 34,80, 36,36, 36,67, 38,18, 44,51, 106,23, 112,25. Анал. рассч. для C17H28N2О5С: C 54,82; H 7,58; N 7,52. Обнаружено: C 54,70; H 7,38; N 7,50.
Гидрохлорид адамантан-2-спиро-3'-8'-амидино-1',2',4'-триокса-8'-азаспиро[4.5]декана (OZ191). К перемешиваемому раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (202 мг, 2 ммоль) в ДМФА (2 мл) и CH2Cl2 (2 мл) при комнатной температуре добавляют N,N-диизопропилэтиламин (130 мг, 2 ммоль). После добавления гидрохлорида 1Н-пиразола-1-карбоксамидина (147 мг, 1 ммоль) реакционная смесь становится мутной суспензией. Перемешивание продолжают в течение 3 час, во время данного периода реакционная смесь превращается в прозрачный раствор. Добавление сухого эфира (15 мл) к вышеуказанному раствору приводит к получению бесцветного осадка, который далее фильтруют и промывают эфиром (3×5 мл). Собранное твердое вещество перекристаллизовывают из смеси эфир/CH2Cl2 (3:1), получают триоксолан OZ191 (302 мг, 88%) в виде бесцветного твердого вещества. Т.пл. 144-148°С (эфир/CH2Cl2 3:1). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,57-2,17 (м, 18H), 3,41-3,69 (м, 4H), 7,72 (с, 4H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,93, 26,31, 33,61, 34,38, 34,43, 35,76, 36,15, 43,39, 106,29, 111,74, 156,36. Анал. рассч. для C16Н26ClN3O3: C 55,89; H 7,62; N 12,22. Обнаружено: C 55,73; H 7,54; N 12,23.
Адамантан-2-спиро-3'-8'-[(4'-хлорфениламино)карбонил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ192). К раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (202 мг, 2 ммоль) в CH2Cl2 (7 мл) при 0-5°С добавляют 4-хлорфенилизоцианат (154 мг, 1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл), промывают водой (2×10 мл) и насыщенным раствором соли (10 мл). Органический слой сушат над MgSO4 и концентрируют. Остаток очищают кристаллизацией из метанола с получением триоксолана OZ192 (346 мг, 83%) в виде бесцветного твердого вещества. Т.пл. 132-134°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,61-2,17 (м, 18H), 3,42-3,77 (м, 4H), 6,43 (с, 1H), 7,17-7,37 (м, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,41, 26,81, 34,34, 34,73, 34,82, 36,38, 36,67, 42,34, 106,65, 112,32, 121,19, 128,20, 128,86, 137,53, 154,46. Анал. рассч. для C22H27ClN2О4: C 63,08; H 6,50; N 6,69. Обнаружено: C 62,95; H 6,36; N 6,65.
Адамантан-2-спиро-3'-8'-(4'-фторфенокси)-1',2',4'-триоксаспиро[4.5]декан (OZ193). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 4-(4-фторфенокси)циклогексанона (950 мг, 5,1 ммоль) в циклогексане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в гексанах) и последовательной кристаллизацией из смеси этанол/CH2Cl2 (19:1) с получением триоксолана OZ193 (250 мг, 13%) в виде бесцветного твердого вещества. Т.пл. 102-104°С (этанол/CH2Cl2 19:1). 1H ЯМР (500 МГц, CDCl3) δ 1,57-2,21 (м, 22H), 4,29-4,41 (м, 1H), 6,79-6,89 (м, 2H), 6,91-7,05 (м, 2H); 13С ЯМР (125,7 МГц, CDCl3) δ 26,48, 26,88, 27,82, 30,06, 34,79, 34,85, 36,43, 36,79, 72,54, 108,22, 111,71, 115,87 (д, J=23,3 Гц), 117,44 (д, J=8,2 Гц), 153,44, 157,34 (д, J=239,0 Гц). Анал. рассч. для C22H27FO4: C 70,57; H 7,27. Обнаружено: C 70,71; H 7,33.
Адамантан-2-спиро-3'-8'-[(диизопропиламино)карбонил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ194). К раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (303 мг, 3 ммоль) в CH2Cl2 (10 мл) при 0-5°С добавляют диизопропилкарбамоилхлорид (164 мг, 1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл), промывают водой (2×10 мл) и насыщенным раствором соли (10 мл). Органический слой сушат над MgSO4 и концентрируют. Остаток очищают кристаллизацией из метанола с получением триоксолана OZ194 (290 мг, 74%) в виде бесцветного твердого вещества. Т.пл. 114-116°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,27 (д, J=6,8 Гц, 12H), 1,60-2,21 (м, 18H), 3,11-3,39 (м, 4H), 3,60 (септет, J=6,6 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 21,57, 26,44, 26,84, 34,39, 34,72, 34,81, 36,40, 36,73, 45,26, 47,52, 107,29, 111,79, 163,59. Анал. рассч. для C22H36N2О4: C 67,32; H 9,24; N 7,14. Обнаружено: C 67,14; H 9,13; N 7,11.
цис-Адамантан-2-спиро-3'-8'-[(трет-бутилацетил)амино]-1',2',4'-триоксаспиро[4.5]декан (OZ195). К раствору OZ137 (550 мг, 1,74 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (529 мг, 5,22 ммоль) и трет-бутилацетилхлорид (304 мг, 2,26 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл) и промывают водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой отделяют, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 75% эфира в гексанах) с получением триоксолана OZ195 (335 мг, 51%) в виде бесцветного твердого вещества. Т.пл. 142-144°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,02 (с, 9H), 1,30-1,51 (м, 2H), 1,52-1,99 (м, 20H), 1,96 (с, 2H), 3,79-3,95 (м, 1H), 5,23-5,28 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,44, 26,82, 29,77, 30,00, 30,79, 32,76, 34,76, 36,31, 36,74, 46,45, 50,69, 107,76, 111,63, 170,97. Анал. рассч. для C22H35NO4: C 69,99; H 9,34; N 3,71. Обнаружено: C 70,15; H 9,38; N 3,65.
цис-Адамантан-2-спиро-3'-8'-[(3'-карбокси-1'-оксопропил)амино]-1',2',4'-триоксаспиро[4.5]декан (OZ196). К раствору OZ137 (550 мг, 1,74 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (350 мг, 3,48 ммоль) и янтарный ангидрид (176 мг, 1,74 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 24 час, концентрируют и растирают в воде (3×10 мл), гексанах (2×10 мл) и ТГФ (5 мл) с получением триоксолана OZ196 (350 мг, 53%) в виде бесцветного твердого вещества. Т.пл. 122-124°С (ТГФ). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,33-1,57 (м, 2H), 1,62-2,19 (м, 20H), 2,31-2,41 (м, 2H), 2,42-2,57 (м, 2H), 3,65-3,82 (м, 1H), 7,83-7,87 (м, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 26,00, 26,39, 29,34, 29,43, 32,20, 34,43, 35,88, 36,26, 45,65, 108,07, 110,81, 170,41, 173,99. Анал. рассч. для C20H29NO6: C 63,31; H 7,70; N 3,69. Обнаружено: C 63,46; H 7,68; N 3,84.
цис-Адамантан-2-спиро-3'-8'-[(2',5'-диоксо-1'-пирролидинил)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ197). К раствору OZ119 (0,29 г, 1 ммоль), трифенилфосфина (0,42 г, 1,6 ммоль) и сукцинимида (0,11 г, 1,1 ммоль) в ТГФ (6 мл) при 0°С добавляют раствор DIPAD (0,32 г, 1,6 ммоль) в ТГФ (1 мл). Смесь нагревают до комнатной температуры и перемешивают в течение ночи. После удаления растворителя неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) и последовательной перекристаллизацией из смеси гексаны/CH2Cl2 (3:1) с получением триоксолана OZ197 (0,30 г, 80%) в виде бесцветного твердого вещества. Т.пл. 147-148°С (гексаны/CH2Cl2 3:1). 1H ЯМР (500 МГц, CDCl3) δ 1,37-1,59 (м, 2H), 1,61-2,35 (м, 21H), 2,92 (с, 4H), 3,59 (д, J=7,1 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,39, 26,79, 27,70, 28,02, 33,46, 34,69, 34,71, 34,74, 36,28, 36,71, 43,75, 108,32, 111,25,177,26. Анал. рассч. для C21H29NO5: C 67,18; H 7,79; N 3,73. Обнаружено: C 67,12; H 7,81; N 3,63.
цис-Адамантан-2-спиро-3'-8'-(3'-карбоксифенил)-1',2',4'-триоксаспиро[4.5]декан (OZ198). Смесь OZ208 (0,38 г, 0,92 ммоль), КОН (0,36 г), ТГФ (10 мл), метанола (10 мл) и воды (2 мл) нагревают при 50°С в течение 2 час. Смесь концентрируют, разбавляют водой (10 мл) и подкисляют 1 М водной HCl до рН=2. Полученное твердое вещество собирают фильтрацией и промывают смесью гексаны/эфир (10 мл, 2:1) с получением триоксолана OZ198 (0,28 г, 79%) в виде бесцветного твердого вещества. Т.пл. 150-152°С. 1H ЯМР (500 МГц, CDCl3) δ 1,63-2,22 (м, 22H), 2,58-2,73 (м, 1H), 7,40 (дд, J=7,7, 7,7 Гц, 1H), 7,46 (д, J=7,4 Гц, 1H), 7,95 (д, J=7,7 Гц, 1H), 7,97 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,51, 26,91, 31,31, 34,63, 34,82, 36,43, 36,82, 42,72, 108,21, 111,49, 128,13, 128,60, 128,75, 129,46, 132,06, 146,59, 171,58. Анал. рассч. для C23H28О5: C 71,85; H 7,34. Обнаружено: C 71,74; H 7,30.
Адамантан-2-спиро-3'-8'-карбамоил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ199). К раствору OZ80 (450 мг, 1,49 ммоль) в CH2Cl2 (12 мл) при комнатной температуре добавляют пиридин (1,2 мл,14,9 мл), НОАс (0,82 мл, 14,9 ммоль), триэтиламин (0,4 мл, 2,98 ммоль) и цианат калия (243 мг, 2,98 ммоль). После перемешивания в течение 35 час реакционную смесь выливают в смесь эфира (50 мл) и воды (50 мл). Органический слой отделяют, промывают насыщенным раствором соли (15 мл), сушат над MgSO4 и концентрируют. Кристаллизацией остатка из смеси эфир/CH2Cl2 (3:1) получают триоксолан OZ199 (449 мг, 98%) в виде бесцветного твердого вещества. Т.пл. 140-142°С (эфир/CH2Cl2, 3:1). 1H ЯМР (500 МГц, CDCl3) δ 1,57-2,21 (м, 18H), 3,31-3,69 (м, 4H), 4,55 (с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,41, 26,81, 34,27, 34,73, 34,81, 36,37, 36,69, 42,25, 106,72, 112,21, 157,65. Анал. рассч. для C16H24N2О4·0,4H2О: C 60,89; H 7,92; N 8,88. Обнаружено: C 60,86; H 7,60; N 8,84.
Адамантан-2-спиро-3'-8'-[2'-(этилсульфонил)этил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ200). К раствору OZ80 (450 мг, 1,49 ммоль) в CH2Cl2 (10 мл) и метаноле (10 мл) при комнатной температуре добавляют триэтиламин (0,4 мл, 2,98 мл) с последующим добавлением этилвинилсульфона (0,15 мл, 1,49 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 3 час перед удалением растворителей. Остаток разбавляют эфиром (15 мл), промывают водой (2×10 мл), сушат (MgSO4) и концентрируют. Кристаллизацией неочищенного продукта из смеси эфир/гексаны (1:1) получают триоксолан OZ200 (415 мг, 72%) в виде бесцветного твердого вещества. Т.пл. 105-107°С (эфир/гексаны 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,39 (т, J=7,6 Гц, 3H), 1,57-2,21 (м, 18H), 2,41-2,59 (м, 2H), 2,60-2,78 (м, 2H), 2,89 (т, J=6,5 Гц, 2H), 3,09 (т, J=6,5 Гц, 2H), 3,14 (кв, J=7,4 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 6,59, 26,40, 26,80, 34,33, 34,71, 34,79, 36,34, 36,69, 48,56, 49,74, 50,94, 51,10, 106,54, 111,85. Анал. рассч. для C19Н31NO5S: C 59,19; H 8,10; N 3,63. Обнаружено: C 58,98; H 7,95; N 3,65.
цис-Адамантан-2-спиро-3'-8'-[(4'-фторфенил)амино]-1',2',4'-триоксаспиро[4.5]декан (OZ201). К раствору OZ05 (555 мг, 2 ммоль) в 1,2-дихлорэтане (10 мл) добавляют 4-фторанилин (236 мг, 2,12 ммоль) и уксусную кислоту (10 капель). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин перед добавлением триацетоксиборгидрида натрия (677 мг, 3,2 ммоль). Смесь перемешивают в течение 5 час перед гашением 1 М водным NaOH (2 мл). Полученную смесь экстрагируют CH2Cl2 (40 мл), промывают водой (2×10 мл) и насыщенным раствором соли (2×10 мл), сушат над MgSO4 и концентрируют с получением масла (517 мг, 69%, смесь двух диастереомеров 2:1). Растиранием в эфире и гексанах получают триоксолан OZ201 (280 мг, 37%) в виде бесцветного твердого вещества. Т.пл. 118-120°С (гексаны). 1H ЯМР (500 МГц, CDCl3) δ 1,37-1,52 (м, 2H), 1,53-2,21 (м, 20H), 3,19-3,27 (м, 1H), 3,28-3,49 (м, 1H), 6,41-6,63 (м, 2H), 6,77-6,99 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,87, 30,10, 32,75, 34,77, 34,81, 36,34, 36,76, 50,92, 108,08, 111,58, 114,14 (д, J=7,3 Гц), 115,71 (д, J=22,4 Гц), 143,44, 155,70 (д, J=234,9 Гц). Анал. рассч. для C22H28FNO3: C 70,75; H 7,56; N 3,75. Обнаружено: C 70,85; H 7,42; N 3,76.
цис-Адамантан-2-спиро-3'-8'-[(2'-ацетокси-2'-метилпропионил)амино]-1',2',4'-триоксаспиро[4.5]декан (OZ202). К раствору OZ137 (550 мг, 1,74 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (529 мг, 5,22 ммоль) и 2-ацетокси-2-метилпропионилхлорид (430 мг, 2,61 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл) и промывают водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой отделяют, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают растиранием в гексанах с получением триоксолана OZ202 (350 мг, 49%) в виде бесцветного твердого вещества. Т.пл. 130-132°С (гексаны). 1H ЯМР (500 МГц, CDCl3) δ 1,35-1,52 (м, 2H), 1,61 (с, 6H), 1,62-2,06 (м, 20H), 2,07 (с, 3H), 3,75-3,95 (м, 1H), 5,77-5,93 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 21,87, 24,29, 26,43, 26,81, 29,73, 32,68, 34,75, 36,30, 36,73, 46,51, 81,35, 107,66, 111,65, 169,15, 172,35. Анал. рассч. для С22H33NO6: C 64,84; H 8,16; N 3,44. Обнаружено: C 64,80; H 7,93; N 3,52.
Адамантан-2-спиро-3'-8'-(1'-пирролидинилкарбонил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ203). К раствору OZ80 (301 мг, 1 ммоль) и триэтиламина (303 мг, 3 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют 1-пирролидинкарбонилхлорид (118 мг, 1 ммоль). Смесь перемешивают при комнатной температуре в течение 16 час, разбавляют CH2Cl2 (10 мл), промывают водой (2×10 мл) и насыщенным раствором соли (10 мл). Органический слой отделяют, сушат над MgSO4 и концентрируют. Кристаллизацией остатка из метанола получают триоксолан OZ203 (152 мг, 42%) в виде бесцветного твердого вещества. Т.пл. 130-132°С (метанол). 1H ЯМР (500 МГц, CDCl3) δ 1,61-2,15 (м, 22H), 3,23-3,57 (м, 8H); 13C ЯМР (125,7 МГц, CDCl3) δ 25,53, 26,44, 26,83, 34,51, 34,73, 34,82, 36,40, 36,72, 43,94, 48,38, 107,26, 111,90, 162,56. Анал. рассч. для C20H30N2О4: C 66,27; H 8,34; N 7,73. Обнаружено: C 66,33; H 8,30; N 7,60.
цис-Адамантан-2-спиро-3'-8'-[(4'-метоксикарбонилфенил)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ204). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 4-[(4-метоксикарбонилфенил)метил]циклогексанона (1,27 г, 5 ммоль) в циклогексане (80 мл) и CH2Cl2 (20 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в гексанах) и последовательной перекристаллизацией из смеси этанол/CH2Cl2 (19:1) с получением триоксолана OZ204 (950 мг, 46%) в виде бесцветного твердого вещества. Т.пл. 104-106°С (этанол/CH2Cl2 19:1). 1H ЯМР (500 МГц, CDCl3) δ 1,19-1,37 (м, 2H), 1,49-2,07 (м, 21H), 2,56 (д, J=6,9 Гц, 2H), 3,90 (с, 3H), 7,20 (д, J=7,9 Гц, 2H), 7,95 (д, J=7,9 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,48, 26,87, 29,90, 34,08, 34,78, 36,38, 36,80, 38,00, 42,86, 51,95, 108,76, 111,28, 127,91, 129,08, 129,57, 146,42, 167,12. Анал. рассч. для C25H32О5: C 72,79; H 7,82. Обнаружено: C 72,72; H 7,85.
цис-Адамантан-2-спиро-3'-8'-(2'-гидрокси-2'-метилпропил)-1',2',4'-триоксаспиро[4.5]декан (OZ205). К раствору OZ61 (350 мг, 1 ммоль) в CH2Cl2 при -78оС добавляют метиллитий (3 мл, 1,6 М в эфире, 4,8 ммоль). Реакционную смесь перемешивают при -78°С в течение 2 час перед гашением водой. Органический слой отделяют и водный слой экстрагируют CH2Cl2 (2×10 мл). Объединенные органические слои промывают водой (10 мл) и насыщенным раствором соли (10 мл), сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают кристаллизацией из этанола с получением триоксолана OZ205 (262 мг, 78%) в виде бесцветного твердого вещества. Т.пл. 96-98°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,23 (с, 6H), 1,21-1,37 (м, 2H), 1,40 (д, J=5,5 Гц, 2H), 1,43-1,61 (м, 1H), 1,62-2,09 (м, 20H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,49, 26,89, 30,03, 31,99, 32,47, 34,31, 34,78, 34,80, 36,40, 36,82, 49,76, 71,39, 108,62, 111,17. Анал. рассч. для C20H32О4: C 71,39; H 9,59. Обнаружено: C 71,44; H 9,39.
цис-Адамантан-2-спиро-3'-8'-[(2',4'-диоксо-3'-имидазолидинил)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ206). К раствору OZ119 (0,29 г, 1 ммоль), трифенилфосфина (0,42 г, 1,6 ммоль) и гидантоина (0,11 г, 1,1 ммоль) в ДМФА (6 мл) и ТГФ (6 мл) при 0°С добавляют раствор DIPAD (0,32 г, 1,6 ммоль) в ТГФ (1 мл). Смесь нагревают до комнатной температуры и перемешивают в течение ночи. После удаления растворителей неочищенный продукт очищают флэш-хроматографией (силикагель, 25% ацетона в гексанах) и последовательной перекристаллизацией из смеси гексаны/CH2Cl2 (5:1) с получением триоксолана OZ206 (0,21 г, 56%) в виде бесцветного твердого вещества. Т.пл. 158-160°С (гексаны/CH2Cl2 5:1). 1H ЯМР (500 МГц, CDCl3) δ 1,21-1,41 (м, 2H), 1,58-2,19 (м, 21H), 3,40 (д, J=6,9 Гц, 2H), 3,99 (с, 2H), 5,81 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,47, 26,87, 27,69, 33,54, 34,77, 34,79, 35,10, 36,36, 36,79, 43,76, 46,27, 108,43, 111,36, 158,35, 171,31. Анал. рассч. для C20H28N2О5: C 63,81; H 7,50; N 7,44. Обнаружено: C 63,68; H 7,31; N 7,39.
п-Тозилат цис-адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (OZ207). К раствору цис-адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (1,465 г, 5 ммоль) в эфире (60 мл) и CH2Cl2 (20 мл) добавляют раствор п-TsOH (0,96 г, 5 ммоль) в эфире (80 мл). Полученную смесь помещают при -20°С в течение ночи. Твердое вещество собирают фильтрацией с получением триоксолана OZ207 (2,24 г, 96%) в виде бесцветного твердого вещества. Т.пл. 162-164°С. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,01-1,23 (м, 2H), 1,51-2,07 (м, 21H), 2,29 (с, 3H), 2,68 (каж. т, J=5,7 Гц, 2H), 7,12 (д, J=7,8 Гц, 2H), 7,48 (д, J=8,3 Гц, 2H), 7,68 (уш.с, 3H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 20,93, 25,95, 26,36, 27,08, 32,99, 33,86, 34,40, 34,41, 35,89, 36,22, 43,63, 108,28, 110,80, 125,65, 128,21, 137,77, 145,87. Анал. рассч. для C24H35NO6S: C 61,91; H 7,58; N 3,01. Обнаружено: C 61,78; H 7,38; N 2,97.
цис-Адамантан-2-спиро-3'-8'-[(3'-этоксикарбонил)фенил]-1',2',4'-триоксаспиро[4.5]декан (OZ208). Раствор О-метилоксима 2-адамантанона (0,65 г, 2,6 ммоль) и 4-[(3-этоксикарбонил)фенил]циклогексанона (0,47 г, 2,6 ммоль) в пентане (50 мл) и CH2Cl2 (25 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% эфира в гексанах) с получением триоксолана OZ208 (0,50 г, 47%) в виде бесцветного твердого вещества. Т.пл. 72-73°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,39 (т, J=7,1 Гц, 3H), 1,61-2,21 (м, 22H), 2,55-2,69 (м, 1H), 4,37 (кв, J=7,1 Гц, 2H), 7,35 (дд, J=7,6, 7,6 Гц, 1H), 7,39 (д, J=7,7 Гц, 1H), 7,88 (д, J=7,7 Гц, 1H), 7,89 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,35, 26,50, 26,90, 31,33, 34,64, 34,81, 36,43, 36,81, 42,78, 60,90, 108,24, 111,47, 127,48, 127,98, 128,41, 130,62, 131,21, 146,38, 166,70. Анал. рассч. для C25H32О5: C 72,79; H 7,82. Обнаружено: C 72,61; H 7,60.
Мезилат цис-адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (OZ209). К раствору цис-адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (0,30 г, 1,02 ммоль) в эфире (10 мл) и CH2Cl2 (5 мл) добавляют раствор метансульфоновой кислоты (0,10 г, 1,04 ммоль) в эфире (30 мл). Полученную смесь концентрируют до 10 мл и помещают при -20°С в течение ночи. Твердое вещество собирают фильтрацией с получением триоксолана OZ209 (0,34 г, 86%) в виде бесцветного твердого вещества. Т.пл. 146-148°С. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,01-1,23 (м, 2H), 1,51-2,07 (м, 21H), 2,34 (с, 3H), 2,69 (каж. т, J=6,0 Гц, 2H), 7,70 (уш.с, 3H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,95, 26,36, 27,09, 33,01, 33,85, 34,39, 34,41, 35,89, 36,22, 43,61, 108,28, 110,79. Анал. рассч. для C18H31NO6S: C 55,50; H 8,02; N 3,60. Обнаружено: C 55,41; H 7,94; N 3,58.
цис-Адамантан-2-спиро-3'-8'-[(фенилсульфонил)метил]-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ210). Раствор О-метилоксима 2-адамантанона (1,79 г, 10 ммоль) и 4-[(фенилсульфонил)метил]циклогексанона (1,20 г, 4,76 ммоль) в пентане (50 мл) и CH2Cl2 (25 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 33% эфира в гексанах) с получением триоксолана OZ210 (0,78 г, 39%) в виде бесцветного твердого вещества. Т.пл. 120-122°С (эфир/гексаны 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,25-1,46 (м, 2H), 1,60-2,21 (м, 21H), 2,99 (д, J=6,3 Гц, 2H), 7,54-7,62 (м, 2H), 7,63-7,70 (м, 1H), 7,88-7,96 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,44, 26,83, 30,11, 31,19, 33,69, 34,75, 34,76, 36,35, 36,75, 61,79, 107,77, 111,53, 127,73, 129,32, 133,63, 140,21. Анал. рассч. для C23H30О5S: C 66,00; H 7,22. Обнаружено: C 66,15; H 7,10.
цис-Адамантан-2-спиро-3'-8'-(1'Н-пиразол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ211). К суспензии 60% NaH (0,08 г, 2 ммоль) в ДМФА (4 мл) в атмосфере азота при 0°С добавляют раствор пиразола (0,14 г, 2 ммоль) в ДМФА (4 мл). Смесь перемешивают в течение 30 мин перед добавлением по каплям раствора метансульфоната OZ119 (0,37 г, 1,0 ммоль) в ДМФА (4 мл). Реакционную смесь нагревают при 50°С в течение 2 час, гасят водой (40 мл) и далее экстрагируют этилацетатом (3×30 мл). Объединенные экстракты промывают насыщенным раствором соли (3×30 мл), сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 33% эфира в гексанах) с получением триоксолана OZ211 (0,28 г, 81%) в виде бесцветного твердого вещества. Т.пл. 103-106°С (гексаны/CH2Cl2 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,19-1,37 (м, 2H), 1,53-2,18 (м, 21H), 3,77 (д, J=7,1 Гц, 2H), 6,22 (с, 1H), 7,33 (с, 1H), 7,51 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,47, 26,85, 27,63, 33,60, 34,77, 36,37, 36,78, 37,16, 57,46, 105,02, 108,52, 111,43, 129,63, 139,41. Анал. рассч. для C20H28N2О3: C 69,74; H 8,19; N 8,13. Обнаружено: C 69,88; H 8,18; N 8,17.
цис-Адамантан-2-спиро-3'-8'-(1',1'-диоксидо-3'-оксо-1',2'-бензизотиазол-2'-(3'H)-ил)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ212). К раствору OZ119 (0,29 г, 1 ммоль), трифенилфосфина (0,42 г, 1,6 ммоль) и сахарина (0,20 г, 1,1 ммоль) в ТГФ (10 мл) при 0°С добавляют раствор DIPAD (0,32 г, 1,6 ммоль) в ТГФ (1 мл). Смесь нагревают до комнатной температуры и перемешивают в течение ночи. После удаления растворителя неочищенный продукт очищают флэш-хроматографией (силикагель, 25% эфира в гексанах) и последовательной перекристаллизацией из смеси гексаны/CH2Cl2 (4:1) с получением триоксолана OZ212 (0,17 г, 37%) в виде бесцветного твердого вещества. Т.пл. 152-155°С (гексаны/CH2Cl2 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,23-1,45 (м, 2H), 1,59-2,18 (м, 21H), 3,63 (д, J=7,4 Гц, 2H), 7,80-7,90 (м, 2H), 7,93 (д, J=7,1 Гц, 1H), 8,06 (д, J=7,4 Гц, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,49, 26,88, 27,79, 33,50, 34,79, 34,80, 35,14, 36,39, 36,81, 44,49, 108,43, 111,39, 120,93, 125,22, 127,33, 134,31, 134,73, 137,64, 159,26. Анал. рассч. для C24H29NO6S: C 62,73; H 6,36; N 3,05. Обнаружено: C 62,74; H 6,18; N 3,02.
цис-Адамантан-2-спиро-3'-8'-[[(метоксиамино)карбонил]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ213). К раствору OZ78 (322 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (202 мг, 2 ммоль) и этилхлорформиат (217 мг, 2 ммоль). После перемешивания смеси при 0°С в течение 15 мин добавляют метоксиламин. [К суспензии гидрохлорида метоксиламина (167 мг, 2 ммоль) в метаноле (5 мл) добавляют NaHCO3 (164 мг, 2 ммоль). Смесь перемешивают при комнатной температуре в течение 15 мин]. Полученную смесь перемешивают при комнатной температуре в течение 12 час, разбавляют CH2Cl2 (10 мл), промывают водой (10 мл), сушат над MgSO4 и концентрируют. Неочищенный продукт очищают кристаллизацией из метанола с получением триоксолана OZ213 (0,17 г, 48%) в виде бесцветного твердого вещества. Т.пл. 72-74°С (метанол). 1H ЯМР (500 МГц, ДМСО-d6) δ 0,99-1,21 (м, 2H), 1,45-2,11 (м, 23H), 3,56 (с, 3H), 10,93 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,96, 26,37, 29,54, 32,64, 33,50, 34,40, 35,91, 36,25, 38,86, 63,34, 108,49, 110,64, 168,09. Анал. рассч. для C19H29NO5: C 64,93; H 8,32; N 3,99. Обнаружено: C 64,79; H 8,13; N 3,76.
цис-Адамантан-2-спиро-3'-8'-[(4'-карбоксифенил)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ214). Смесь OZ204 (412 мг, 1 ммоль), NaOH (120 мг, 3 ммоль), метанола (10 мл) и воды (10 мл) перемешивают при комнатной температуре в течение 16 час. После удаления растворителей остаток подкисляют 6 М водной HCl (4 мл) до рН=2 и полученный осадок собирают фильтрацией и далее кристаллизуют из 95% этанола с получением триоксолана OZ214 (182 мг, 46%) в виде бесцветного твердого вещества. Т.пл. 160-162°С (95% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,09-1,39 (м, 2H), 1,43-2,22 (м, 21H), 2,59 (д, J=7,1 Гц, 2H), 7,25 (д, J=7,9 Гц, 2H), 8,04 (д, J=7,9 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,49, 26,88, 29,92, 34,08, 34,79, 36,39, 36,80, 38,00, 42,95, 108,74, 111,31, 126,98, 129,23, 130,24, 147,48, 171,61. Анал. рассч. для C24H30О5: C 72,34; H 7,59. Обнаружено: C 72,16; H 7,37.
цис-Адамантан-2-спиро-3'-8'-фталимидоэтил-1',2',4'-триоксаспиро[4.5]декан (OZ215). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 4-фталимидоэтилциклогексанона (1,35 г, 5 ммоль) в циклогексане (85 мл) и CH2Cl2 (15 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 15% эфира в гексанах) и последующей кристаллизацией из этанола с получением триоксолана OZ215 (1,33 г, 61%) в виде бесцветного твердого вещества. Т.пл. 136-138°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,15-1,43 (м, 3H), 1,49-2,21 (м, 22H), 3,70 (д, J=7,5 Гц, 2H), 7,62-7,78 (м, 2H), 7,79-7,97 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,48, 26,87, 29,81, 33,78, 34,04, 34,76, 34,79, 36,05, 36,38, 36,80, 108,73, 111,18, 123,14, 132,16, 133,84, 168,33. Анал. рассч. для C26H31NO5: C 71,37; H 7,14; N 3,20. Обнаружено: C 71,50; H 6,93; N 3,16.
Адамантан-2-спиро-3'-8'-(4'-пиридинилметил)-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ216). К перемешиваемому раствору OZ80 (200 мг, 0,66 ммоль) в 1,2-дихлорэтане (5 мл) при комнатной температуре добавляют триэтиламин (0,2 мл, 1,2 ммоль) с последующим добавлением 4-пиридинкарбоксальдегида (71 мг, 0,66 ммоль) и триацетоксиборгидрида натрия (197 мг, 0,924 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 2 час, гасят насыщенным водным растворм NaHCO3 (5 мл) и экстрагируют этилацетатом (3×10 мл). Объединенные органические экстракты сушат над MgSO4, фильтруют и концентрируют. Кристаллизацией неочищенного продукта из смеси эфир/метанол (3:1) получают триоксолан OZ216 (167 мг, 71%) в виде бесцветного твердого вещества. Т.пл. 124-126°С (эфир/метанол 3:1). 1H ЯМР (500 МГц, CDCl3) δ 1,59-2,19 (м, 18H), 2,37-2,51 (м, 4H), 3,52 (с, 2H), 7,27 (д, J=4,9 Гц, 2H), 8,54 (д, J=5,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,45, 26,87, 34,45, 34,74, 34,83, 36,40, 36,75, 51,24, 61,20, 106,94, 111,70, 123,63, 148,00, 149,81. Анал. рассч. для C21H28N2О3: C 70,76; H 7,92; N 7,86. Обнаружено: C 70,80; H 7,77; N 7,65.
цис-Адамантан-2-спиро-3'-8'-[[[(2'-тиазолил)амино]карбонил]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ217). К раствору OZ78 (322 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (303 мг, 3 ммоль) и этилхлорформиат (217 мг, 2 ммоль). Смесь перемешивают при 0°С в течение 15 мин перед добавлением 2-аминотиазола (100 мг, 1 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 12 час, концентрируют и растирают в воде. Неочищенный продукт очищают кристаллизацией из этанола с получением триоксолана OZ217 (0,29 г, 72%) в виде бесцветного твердого вещества. Т.пл. 160-162°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,19-1,47 (м, 2H), 1,51-2,18 (м, 21H), 2,46 (д, J=6,9 Гц, 2H), 7,02 (д, J=3,6 Гц, 1H), 7,42 (д, J=3,6 Гц, 1H), 12,51 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,84, 30,10, 33,23, 33,91, 34,77, 36,37, 36,77, 42,81, 108,35, 111,45, 113,68, 136,10, 159,96, 170,18. Анал. рассч. для C21Н28N2О4S: C 62,35; H 6,98; N 6,93. Обнаружено: C 62,28; H 6,92; N 6,87.
цис-Адамантан-2-спиро-3'-8'-[(1'-пиперидинилкарбонил)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ218). К раствору OZ78 (322 мг, 1,0 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (202 мг, 2 ммоль) и этилхлорформиат (217 мг, 2 ммоль). Смесь перемешивают при 0°С в течение 15 мин перед добавлением пиперидина (100 мг, 1,2 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 12 час, концентрируют и растирают в воде. Неочищенный продукт очищают кристаллизацией из этанола с получением триоксолана OZ218 (0,24 г, 62%) в виде бесцветного твердого вещества. Т.пл. 98-100°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,15-1,39 (м, 2H), 1,43-2,17 (м, 27H), 2,21 (д, J=6,8 Гц, 2H), 3,30-3,49 (м, 2H), 3,50-3,65 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 24,57, 25,66, 26,49, 26,60, 26,87, 30,31, 33,43, 34,11, 34,79, 36,39, 36,81, 39,26, 42,69, 46,87, 108,72, 111,29, 170,28. Анал. рассч. для C23H35NO4: C 70,92; H 9,06; N 3,60. Обнаружено: C 70,83; H 8,99; N 3,60.
цис-Адамантан-2-спиро-3'-8'-(1'Н-имидазол-1'-илэтил)-1',2',4'-триоксаспиро[4.5]декан (OZ219). Стадия 1. К раствору OZ89 (924 мг,3 ммоль) и триэтиламина (606 мг, 6 ммоль) в CH2Cl2 (30 мл) при 0°С добавляют метансульфонилхлорид (516 мг, 4,5 ммоль). Смесь перемешивают при комнатной температуре в течение 1 час, разбавляют CH2Cl2 (20 мл) и промывают водой (2×10 мл) и насыщенным раствором соли (10 мл). Органический слой сушат над MgSO4, фильтруют и концентрируют с получением метансульфоната (1,16 г, 100%) в виде бесцветного твердого вещества. Стадия 2. К раствору имидазола (100 мг, 1,5 ммоль) в ДМФА (5 мл) добавляют 60% NaH (75 мг, 1,9 ммоль). Смесь перемешивают в течение 15 мин перед добавлением по каплям раствора вышеуказанного метансульфоната (0,40 г, 1 ммоль) в ДМФА (2 мл). Смесь нагревают при 50оС в течение 3 час, гасят водой (15 мл) и далее экстрагируют эфиром (3×20 мл). Объединенные экстракты сушат над MgSO4, фильтруют и концентрируют. Кристаллизацией остатка из смеси гексаны/эфир (19:1) получают триоксолан OZ219 (0,22 г, 61%) в виде бесцветного твердого вещества. Т.пл. 116-118°С (гексаны/эфир 19:1). 1H ЯМР (500 МГц, CDCl3) δ 1,11-1,39 (м, 3H), 1,51-2,18 (м, 22H), 3,95 (т, J=8,0 Гц, 2H), 6,89 (с, 1H), 7,06 (с, 1H), 7,46 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,85, 29,80, 33,26, 33,93, 34,77, 36,38, 36,77, 37,35, 44,81, 108,48, 111,40, 118,65, 129,52, 136,95. Анал. рассч. для С21H30N2O3: C 70,36; H 8,44; N 7,81. Обнаружено: C 70,14; H 8,27; N 7,81.
Адамантан-2-спиро-3'-8'-бензил-1',2',4'-триокса-8'-азаспиро[4.5]декан (OZ220). К перемешиваемому раствору OZ80 (200 мг, 0,66 ммоль) в 1,2-дихлорэтане (5 мл) при комнатной температуре добавляют триэтиламин (0,2 мл, 1,2 ммоль) с последующим добавлением бензальдегида (70 мг, 0,66 ммоль) и триацетоксиборгидрида натрия (197 мг, 0,924 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 2 час, гасят насыщенным водным раствором NaHCO3 (5 мл) и экстрагируют этилацетатом (3×10 мл). Объединенные органические экстракты сушат над MgSO4, фильтруют и концентрируют. Кристаллизацией неочищенного продукта из смеси эфир/метанол (3:1) получают триоксолан OZ220 (177 мг, 75%) в виде бесцветного твердого вещества. Т.пл. 108-110°С (эфир/метанол 3:1). 1H ЯМР (500 МГц, CDCl3) δ 1,58-2,21 (м, 18H), 2,38-2,52 (м, 2H), 2,53-2,69 (м, 2H), 3,51 (с, 2H), 7,18-7,45 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,47, 26,88, 34,46, 34,75, 34,83, 36,40, 36,78, 51,09, 62,50, 107,26, 111,56, 126,99, 128,21, 128,96, 138,63. Анал. рассч. для C22H29NO3: C 74,33; H 8,22; N 3,94. Обнаружено: C 74,52; H 8,17; N 4,03.
цис-Адамантан-2-спиро-3'-8'-[(аминокарбонил)амино]-1',2',4'-триоксаспиро[4.5]декан (OZ221). К раствору OZ137 (550 мг, 1,74 ммоль) в CH2Cl2 (10 мл) при комнатной температуре добавляют пиридин (1,38 г, 17,4 ммоль), уксусную кислоту (1,01 г, 16,8 ммоль), триэтиламин (349 мг, 3,45 ммоль) и KCN (278 мг, 3,45 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 48 час, разбавляют эфиром (100 мл) и промывают водой (100 мл) и насыщенным раствором соли (25 мл). Органический слой отделяют, сушат над MgSO4 и концентрируют с получением триоксолана OZ221 (166 мг, 30%) в виде бесцветного твердого вещества. Т.пл. 140-142°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 1,35-1,52 (м, 2H), 1,62-2,21 (м, 20H), 3,51-3,54 (м, 1H), 4,70 (с, 2H), 4,58-5,03 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,43, 26,80, 30,34, 32,61, 34,76, 36,30, 36,73, 47,41, 107,88, 111,66, 158,32. Анал. рассч. для C17H26N2О4: C 63,33; H 8,13; N 8,69. Обнаружено: C 63,06; H 8,29; N 8,49.
цис-Адамантан-2-спиро-3'-8'-[[(трет-бутиламино)карбонил]амино]-1',2',4'-триоксаспиро[4.5]декан (OZ222). К раствору OZ137 (315 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (350 мг, 3,48 ммоль) и трет-бутилизоцианат (100 мг, 1 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 7 час перед удалением растворителей. Остаток растирают в воде (10 мл) и далее очищают кристаллизацией из 95% этанола с получением триоксолана OZ222 (300 мг, 79%) в виде бесцветного твердого вещества. Т.пл. 130°С разл. (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,32 (с, 9H), 1,22-2,21 (м, 22H), 3,64 (с, 1H), 4,28 (с, 1H), 4,37 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,44, 26,81, 29,54, 30,64, 32,83, 34,75, 36,30, 36,74, 47,05, 50,29, 108,01, 111,53. Анал. рассч. для C21H34N2О4: C 66,64; H 9,05; N 7,40. Обнаружено: C 66,65; H 9,01; N 7,22.
цис-Адамантан-2-спиро-3'-8'-(5'-метоксикарбонил-1'Н-имидазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ223). К суспензии 60% NaH (0,24 г, 6 ммоль) в ДМФА (5 мл) в атмосфере азота при 0°С добавляют раствор метил-4-имидазолкарбоксилата (0,76 г, 6 ммоль) в ДМФА (18 мл). Смесь перемешивают в течение 30 мин перед добавлением по каплям раствора метансульфоната OZ119 (0,96 г, 2,6 ммоль) в ДМФА (6 мл). Реакционную смесь нагревают при 55°С в течение ночи, гасят водой (100 мл) и далее экстрагируют CH2Cl2 (3×50 мл). Объединенные экстракты промывают водой и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 40% этилацетата в гексанах, далее 5% метанол в CH2Cl2) с получением триоксолана OZ223 (0,21 г, 20%, элюируют первым) в виде бесцветного твердого вещества и триоксолана OZ224 (0,36 г, 47%, элюируют вторым) в виде бесцветного твердого вещества. Для OZ223 т.пл. 148-150°С (гексаны/CH2Cl2 4:1). 1H ЯМР (500 МГц, CDCl3) δ 1,17-1,41 (м, 2H), 1,55-2,18 (м, 21H), 3,85 (с, 3H), 4,13 (д, J=7,0 Гц, 2H), 7,52 (с, 1H), 7,75 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,43, 26,83, 27,43, 33,45, 34,74, 36,34, 36,74, 36,96, 51,43, 52,08, 108,33, 111,48, 122,20, 138,15, 142,54, 160,70. Анал. рассч. для C22H30N2О5: C 65,65; H 7,51; N 6,96. Обнаружено: C 65,78; H 7,41; N 6,97.
цис-Адамантан-2-спиро-3'-8'-(4'-метоксикарбонил-1'Н-имидазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ224). Для получения OZ224 см. OZ223. Т.пл. 150-152оС (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,15-1,39 (м, 2H), 1,49-2,15 (м, 21H), 3,81 (д, J=7,4 Гц, 2H), 3,89 (с, 3H), 7,44 (с, 1H), 7,57(с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,42, 26,81, 27,53, 33,39, 34,75, 36,34, 36,72, 37,73, 51,66, 52,95, 108,01, 111,68, 125,29, 133,99, 138,15, 163,25. Анал. рассч. для C22H30N2О5: C 65,65; H 7,51; N 6,96. Обнаружено: C 65,79; H 7,34; N 6,85.
цис-Адамантан-2-спиро-3'-8'-(4'-карбокси-1'Н-имидазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ225). Смесь OZ224 (0,16 г, 0,4 ммоль), 15% KOH (1,5 мл) и метанола (15 мл) нагревают при 55°С в течение 4 час. После охлаждения до комнатной температуры смесь концентрируют до 3 мл, разбавляют водой (15 мл) и подкисляют уксусной кислотой до рН=5. Твердое вещество собирают фильтрацией с получением триоксолана OZ225 (0,10 г, 64%) в виде бесцветного твердого вещества. Т.пл. 162°С, разл. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,01-1,23 (м, 2H), 1,40-2,05 (м, 21H), 3,87 (д, J=7,3 Гц, 2H), 7,64 (с, 1H), 7,71 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,96, 26,37, 27,05, 33,03, 34,42, 35,90, 36,25, 36,66, 51,32, 108,54, 110,75, 125,80, 134,59, 138,63, 164,23. Анал. рассч. для C21H28N2О5·H2О: C 62,05; H 7,44; N 6,89. Обнаружено: C 62,36; H 7,16; N 6,50.
Адамантан-2-спиро-3'-8'-фенил-1',2',4'-триоксаспиро[4.5]дец-7'-ен (OZ226). Стадия 1. Добавление фениллития к OZ05. К перемешиваемому раствору OZ05 (1,10 г, 4,0 ммоль) в эфире (50 мл) при -78оС добавляют фениллитий (2,6 мл, 1,8 М, 4,40 ммоль). Реакционной смеси дают достичь комнатной температуры в течение 3 час и гасят насыщенным водным раствором NH4Cl (30 мл). После отделения эфирного слоя водный слой экстрагируют эфиром (3×40 мл). Объединенные органические экстракты промывают насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% этилацетата в гексанах) с получением промежуточного карбинола триоксолана (923 мг, 65%, смесь двух диастереомеров 1:1) в виде бесцветного масла. 1H ЯМР (500 МГц, CDCl3) δ 1,58-2,39 (м, 22H), 7,19-7,28 (м, 1H), 7,29-7,40 (м, 2H), 7,42-7,55 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,64, 26,66, 27,06, 27,08, 30,36, 30,46, 34,84, 34,90, 34,91, 35,10, 36,45, 36,51, 36,57, 36,63, 36,92, 36,95, 72,08, 72,38, 108,39, 108,41, 111,52, 111,64, 124,41, 124,57, 126,98, 127,07, 128,32, 128,35, 148,11, 148,30. Стадия 2. Дегидратация промежуточного карбинола. К перемешиваемому раствору вышеуказанного карбинола (550 мг, 1,54 ммоль) в CH2Cl2 (10 мл) при -10°С добавляют триэтиламин (1,0 мл, 7,75 ммоль) с последующим добавлением раствора метансульфонилхлорида (0,25 мл, 3,10 мл) в CH2Cl2 (5 мл). Полученную смесь перемешивают при 0°С в течение 8 час и выливают в воду (10 мл). После отделения органического слоя водный слой экстрагируют CH2Cl2 (3×15 мл). Объединенные органические экстракты сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 1% эфира в гексанах) и последующей перекристаллизацией из смеси эфир/гексаны (1:1) с получением триоксолана OZ226 (435 мг, 83%) в виде бесцветного твердого вещества. Т.пл. 62-64°С (эфир/гексаны 1:1). 1H ЯМР (500 МГц, CDCl3) δ 1,42-2,21 (м, 16H), 2,40-2,73 (м, 4H), 5,73-5,99 (м, 1H), 7,02-7,45 (м, 5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,54, 26,71, 27,10, 31,36, 34,81, 34,88, 34,95, 35,12, 35,23, 36,64, 36,70, 36,98, 107,80, 111,81, 120,95, 125,27, 126,96, 128,25, 136,69, 141,52. Анал. рассч. для C22Н26О3: C 78,07; H 7,74. Обнаружено: C 78,28; H 7,81.
цис-Адамантан-2-спиро-3'-8'-[[(4'-метил)-1'-пиперазинилкарбонил]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ227). К раствору OZ78 (322 мг, 1,0 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют триэтиламин (303 мг, 3 ммоль) и этилхлорформиат (217 мг, 2 ммоль). Смесь перемешивают при 0°С в течение 15 мин перед добавлением 1-метилпиперазина (110 мг, 1,1 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 12 час, разбавляют CH2Cl2 (10 мл), промывают водой (10 мл), сушат над MgSO4 и концентрируют. Неочищенный продукт очищают кристаллизацией из этанола с получением триоксолана OZ227 (0,19 г, 47%) в виде бесцветного твердого вещества. Т.пл. 96-98°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,15-1,37 (м, 2H), 1,59-2,18 (м, 21H), 2,21 (д, J=6,9 Гц, 2H), 2,29 (с, 3H), 2,30-2,58 (м, 4H), 3,40-3,57 (м, 2H), 3,58-3,78 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,64, 27,02, 30,34, 33,41, 34,13, 34,87, 36,56, 36,93, 39,18, 41,62, 45,75, 45,94, 54,89, 55,31, 108,66, 111,32, 170,46. Анал. рассч. для C23H36N2О4: C 68,29; H 8,97; N 6,92. Обнаружено: C 68,07; H 8,69; N 6,81.
цис-Адамантан-2-спиро-3'-8'-(азидоэтил)-1',2',4'-триоксаспиро[4.5]декан (OZ228). Для получения мезилата OZ89 см. OZ219. К раствору NaN3 (375 мг, 5 ммоль) в ДМФА (5 мл) добавляют мезилат (760 мг, 2 ммоль) в ДМФА (2 мл). Смесь перемешивают при 50-55°С в течение 16 час перед гашением водой (15 мл). После отделения органического слоя водный слой экстрагируют эфиром (3×20 мл). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют. Остаток очищают кристаллизацией из этанола с получением триоксолана OZ228 (618 мг, 93%) в виде бесцветного твердого вещества. Т.пл. 58-60°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,11-1,37 (м, 2H), 1,38-1,48 (м, 1H), 1,49-1,61 (м, 2H), 1,62-2,18 (м, 20H), 3,29 (т, J=7,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,69, 27,10, 29,91, 33,63, 34,13, 34,92, 34,94, 35,02, 36,62, 36,99, 49,44, 108,69, 111,37. Анал. рассч. для C18H27N3О3: C 64,84; H 8,16; N 12,60. Обнаружено: C 64,68; H 7,94; N 12,47.
Гидрохлорид цис-адамантан-2-спиро-3'-8'-(аминоэтил)-1',2',4'-триоксаспиро[4.5]декана (OZ229). К раствору OZ228 (333 мг, 1 ммоль) в ТГФ (7 мл) добавляют трифенилфосфин (262 мг, 1 моль) и воду (1 мл). Смесь перемешивают при комнатной температуре в течение 16 час и разбавляют 2 М водной HCl (5 мл). Осадок фильтруют и промывают CH2Cl2 (10 мл) и сушат с получением триоксолана OZ229 (194 мг, 56%) в виде бесцветного твердого вещества. Т.пл. 150-152°С. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,00-1,19 (м, 2H), 1,25-2,08 (м, 23H), 2,67-2,89 (м, 2H), 8,04 (с, 3H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,83, 26,23, 29,33, 32,40, 33,02, 33,37, 34,24, 34,26, 35,81, 36,11, 36,81, 108,36, 110,45. Анал. рассч. для C18H30ClNO3: C 62,87; H 8,79; N 4,07. Обнаружено: C 63,00; H 8,58; N 4,34.
N,N'-Бис[цис-[адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]дец-8'-ил]метил]-1,2-бензолдикарбоксамид (OZ230). Раствор OZ146 (10,40 г, 24,60 ммоль) и моногидрата гидразина (5,00 г, 50 ммоль) в хлороформе (180 мл) и метаноле (20 мл) нагревают в атмосфере азота при 55°С в течение 24 час. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления твердых побочных продуктов. Фильтрат промывают водой (100 мл) и насыщенным раствором соли (100 мл), сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, CHCl3/MeOH/Et3N, 90:10:1) c получением триоксолана OZ230 (1,60 г, 20%, элюируют первым) и цис-[адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (5,10 г, 71%, элюируют вторым). OZ230 получают в виде бесцветного твердого вещества. Т.пл. 164-166°С (CHCl3/этанол 9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,19-1,39 (м, 4H), 1,59-2,11 (м, 42H), 3,19-3,35 (м, 4H), 6,75-6,88 (м, 2H), 7,41-7,52 (м, 2H), 7,53-7,65 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) 26,48, 26,88, 27,81, 33,77, 34,79, 36,29, 36,39, 36,80, 45,39, 108,54, 111,38, 128,51, 130,27, 134,51, 169,27. Анал. рассч. для C42H56N2О8: C 70,37; H 7,87; N 3,91. Обнаружено: C 70,50; H 7,81; N 3,99.
цис-Адамантан-2-спиро-3'-8'-(5'-карбокси-1'Н-имидазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ231). Смесь OZ223 (0,10 г, 0,25 ммоль), 15% KOH (1,0 мл), метанола (10 мл) и ТГФ (2 мл) нагревают при 55°С в течение 4 час. После охлаждения до комнатной температуры смесь концентрируют до 3 мл, разбавляют водой (15 мл) и подкисляют уксусной кислотой до рН=5. Твердое вещество собирают фильтрацией с получением триоксолана OZ231 (77 мг, 79%) в виде бесцветного твердого вещества. Т.пл. 164-166°С. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,03-1,37 (м, 2H), 1,38-2,18 (м, 21H), 4,16 (д, J=6,7 Гц, 2H), 7,58 (с, 1H), 7,89 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,86, 26,26, 26,88, 32,92, 34,29, 35,81, 36,14, 36,44, 50,38, 108,39, 110,62, 122,87 (уш.с), 137,04 (уш. с), 143,25 (уш.с), 161,10. Анал. рассч. для C21H28N2О5·0,5H2О: C 63,46; H 7,35; N 7,05. Обнаружено: C 63,41; H 7,11; N 6,71.
Мезилат цис-адамантан-2-спиро-3'-8'-[(диметиламино)метил]-1',2',4'-триоксаспиро[4.5]декана (OZ232). Раствор цис-адамантан-2-спиро-3'-8'-(аминометил]-1',2',4'-триоксаспиро[4.5]декана (293 мг, 1 ммоль), формальдегида (162 мг, 37% водный раствор, 2 ммоль), триацетоксиборгидрида натрия (612 мг, 2,8 ммоль) в 1,2-дихлорэтане (15 мл) перемешивают при комнатной температуре в течение 4 час перед гашением насыщенным водным NaHCO3 (10 мл). После отделения органического слоя водный слой экстрагируют CH2Cl2 (2×20 мл). Объединенные органические слои промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Полученный неочищенный продукт растворяют в смеси CH2Cl2/эфир (1:5, 10 мл) и обрабатывают раствором метансульфоновой кислоты (96 мг, 1 ммоль) в эфире (2 мл). Осадок собирают фильтрацией с получением триоксолана OZ232 (230 мг, 55%) в виде бесцветного твердого вещества. Т.пл. 130°С, разл. 1H ЯМР (500 МГц, ДМСО-d6) δ 1,25-1,45 (м, 2H), 1,59-2,16 (м, 21H), 2,82 (с, 3H), 2,87 (каж. т, J=6,2 Гц, 2H), 2,91 (каж. д, J=4,6 Гц, 6H), 10,61 (с, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 26,57, 26,96, 28,20, 32,46, 33,37, 34,84, 36,50, 36,85, 39,25, 44,35, 64,04, 107,55, 111,77. Анал. рассч. для C20H35NO6S·0,6H2О: C 55,92; H 8,53; N 3,26. Обнаружено: C 55,71; H 8,08; N 3,12.
цис-Адамантан-2-спиро-3'-8'-(5'-метоксикарбонил-1'Н-1',2',4'-триазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ233). К суспензии 60% NaH (0,20 г, 5 ммоль) в ДМФА (5 мл) в атмосфере азота при 0°С добавляют раствор метил-1Н-1,2,4-триазол-3-карбоксилата (0,64 г, 5 ммоль) в ДМФА (5 мл). Смесь перемешивают в течение 1 час перед добавлением по каплям раствора метансульфоната OZ119 (0,93 г, 2,5 ммоль) в ДМФА (5 мл). Реакционную смесь нагревают при 55°С в течение ночи, гасят водой (60 мл) и далее экстрагируют CH2Cl2 (3×40 мл). Объединенные экстракты промывают водой и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, от 33 до 66% этилацетата в гексанах) с получением триоксолана OZ233 (0,27 г, 27%, элюируют первым) в виде бесцветного твердого вещества и триоксолана OZ234 (0,21 г, 21%, элюируют вторым) в виде бесцветного твердого вещества. Для OZ233 т.пл. 120-122°С. 1H ЯМР (500 МГц, CDCl3) δ 1,29-1,49 (м, 2H), 1,52-2,16 (м, 21H), 3,99 (с, 3H), 4,50 (д, J=7,1 Гц, 2H), 7,96 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,64, 27,04, 27,46, 33,59, 34,89, 36,57, 36,94, 37,15, 52,90, 55,75, 108,32, 111,53, 150,78, 158,49, 181,90. Анал. рассч. для C21H29N3О5: C 62,51; H 7,24; N 10,41. Обнаружено: C 62,40; H 7,11; N 10,51.
цис-Адамантан-2-спиро-3'-8'-(3'-метоксикарбонил-1'Н-1',2',4'-триазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан (OZ234). Для получения OZ234 см. OZ233. Т.пл. 144-146°С. 1H ЯМР (500 МГц, CDCl3) δ 1,23-1,41 (м, 2H), 1,52-2,16 (м, 21H), 3,99 (с, 3H), 4,07 (д, J=7,2 Гц, 2H), 8,08 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,61, 27,00, 27,55, 33,45, 34,87, 36,50, 36,55, 36,89, 52,55, 55,73, 108,07, 111,70, 144,75, 155,30, 160,13. Анал. рассч. для C21H29N3О5: C 62,51; H 7,24; N 10,41. Обнаружено: C 62,62; H 7,17; N 10,52.
Мезилат цис-адамантан-2-спиро-3'-8'-(1'Н-1',2',4'-триазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декана (OZ235). К раствору OZ177 (1,20 г, 3,5 ммоль) в эфире (10 мл) добавляют раствор метансульфоновой кислоты (0,40 г, 4,2 ммоль) в эфире (10 мл). Полученную смесь помещают при -20°С на ночь. Твердое вещество собирают фильтрацией и сушат в вакууме с получением триоксолана OZ235 (1,48 г, 96%) в виде бесцветного твердого вещества. Т.пл. 139-142°С. 1H ЯМР (500 МГц, CDCl3) δ 1,26-1,44 (м, 2H), 1,58-2,19 (м, 21H), 2,86 (с, 3H), 4,33 (д, J=7,1 Гц, 2H), 8,54 (с, 1H), 10,04 (с, 1H), 12,85 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,58, 26,97, 27,29, 33,34, 34,85, 36,21, 36,51, 36,86, 39,65, 56,71, 107,92, 111,69, 142,30, 144,05. Анал. рассч. для C20H31N3О6S: C 54,40; H 7,08; N 9,52. Обнаружено: C 54,28; H 6,92; N 9,33.
цис-Адамантан-2-спиро-3'-8'-[[бис(2'-амино-2'-оксоэтил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ236). Смесь цис-адамантан-2-спиро-3'-8'-аминометил-1',2',4'-триоксаспиро[4.5]декана (293 мг, 1 ммоль), 2-бромацетамида (138 мг, 1 ммоль) и карбоната калия (276 мг, 2 ммоль) в ацетонитриле (18 мл) нагревают при 50°С в течение 16 час перед разбавлением водой (25 мл). Полученную смесь экстрагируют хлороформом (3×18 мл). Объединенные экстракты промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 18% метанола в CH2Cl2) и перекристаллизацией из CHCl3 с получением триоксолана OZ236 (180 мг, 44%) в виде бесцветного твердого вещества. Т.пл. 157-159°С (CHCl3). 1H ЯМР (500 МГц, ДМСО-d6) δ 0,89-1,16 (м, 2H), 1,38-2,09 (м, 21H), 2,25 (д, J=7,1 Гц, 2H), 2,97 (с, 4H), 7,13 (с, 2H), 7,50 (с, 2H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,96, 26,36, 28,13, 33,51, 33,54, 34,40, 34,42, 35,92, 36,25, 59,21, 61,26, 108,90, 110,57, 172,79. Анал. рассч. для C21H33N3О5: C 61,90; H 8,16; N 10,31. Обнаружено: C 62,04; H 7,91; N 10,12.
Гидрохлорид цис-адамантан-2-спиро-3'-8'-[[(аминоиминометил)амино]метил]-1',2',4'-триоксаспиро[4.5]декана (OZ237). Смесь цис-адамантан-2-спиро-3'-8'-аминометил-1',2',4'-триоксаспиро[4.5]декана (293 мг, 1 ммоль), гидрохлорид 1Н-пиразол-1-карбоксамидина (147 мг, 1 ммоль), N,N-диизопропилэтиламина (129 мг, 1 ммоль) в ДМФА (5 мл) перемешивают при комнатной температуре в течение 16 час перед разбавлением эфиром (50 мл). Твердое вещество собирают фильтрацией и перекристаллизовывают из 30% водного этанола с получением триоксолана OZ237 (210 мг, 56%) в виде бесцветного твердого вещества. Т.пл. 146-149°С (30% водный этанол). 1H ЯМР (500 МГц, ДМСО-d6) δ 0,99-1,21 (м, 2H), 1,39-2,05 (м, 21H), 2,98 (каж. т, J=6,0 Гц, 2H), 6,50-7,89 (м, 5H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,86, 26,27, 27,00, 33,05, 34,31, 35,28, 35,83, 36,14, 45,59, 108,41, 110,61, 157,17. Анал. рассч. для C18H30ClN3O3: C 58,13; H 8,13; N 11,30. Обнаружено: C 58,31; H 8,27; N 10,96.
цис-Адамантан-2-спиро-3'-8'-(2'-амино-2'-оксоэтил)-1',2',4'-триоксаспиро[4.5]декан (OZ243). К раствору OZ78 (322 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют ТЭА (202 мг, 2 ммоль) с последующим добавлением этилхлорформиата (217 мг, 2 ммоль). После 15 мин добавляют аммиак (7 н. в метаноле, 3 мл) и перемешивание продолжают в течение 12 час. Осадок фильтруют и сушат с получением триоксолана OZ243 (210 мг, 65%) в виде бесцветного твердого вещества. Т.пл. 140-142°С. 1H ЯМР (500 МГц, CDCl3) δ 1,09-1,43 (м, 3H), 1,45-2,15 (м, 20H), 2,11 (д, J=7,1 Гц, 2H), 5,48 (с, 1H), 5,66 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,47, 26,85, 29,97, 33,32, 33,95, 34,77, 36,38, 36,78, 42,55, 108,50, 111,35, 174,39. Анал. рассч. для C18Н27NO4: C 67,26; H 8,47; N 4,36. Обнаружено: C 67,40; H 8,47; N 4,39.
цис-Адамантан-2-спиро-3'-8'-[[(4'-фенил-1'-пиперазинил)карбонил]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ244). К раствору OZ78 (322 мг, 1 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют ТЭА (202 мг, 2 ммоль) с последующим добавлением этилхлорформиата (217 мг, 2 ммоль). После 15 мин добавляют 1-фенилпиперазин (162 мг, 1 ммоль) и перемешивание продолжают в течение 12 час. Реакционную смесь концентрируют, разбавляют водой и фильтруют. Неочищенный продукт очищают перекристаллизацией из этанола с получением триоксолана OZ244 (280 мг, 60%) в виде бесцветного твердого вещества. Т.пл. 140-142°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,18-1,38 (м, 2H), 1,55-2,18 (м, 21H), 2,26 (д, J=6,9 Гц, 2H), 3,02-3,29 (м, 4H), 3,55-3,70 (м, 2H), 3,71-3,89 (м, 2H), 6,81-7,02 (м, 3H), 7,20-7,38 (м, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,48, 26,86, 30,30, 33,34, 34,06, 34,78, 36,39, 36,79, 39,18, 41,51, 45,69, 49,47, 49,77, 108,59, 111,33, 116,58, 120,51, 129,22, 150,91, 170,50. Анал. рассч. для C28H38N2О4: C 72,07; H 8,21; N 6,00. Обнаружено: C 72,22; H 8,16; N 5,99.
Адамантан-2-спиро-3'-8'-гидрокси-8'-(2'-тиазолил)-1',2',4'-триоксаспиро[4.5]декан (OZ247). К перемешиваемому раствору 2-бромтиазола (246 мг, 1,5 ммоль) в сухом ТГФ (4 мл) в атмосфере N2 при -78°С добавляют н-BuLi (1,6 М в гексанах, 1 мл, 1,5 ммоль). Полученный ярко-желтый раствор перемешивают в течение 1 час при той же температуре и далее добавляют раствор OZ05 (415 мг, 1,5 ммоль) в сухом ТГФ (10 мл). Смеси дают достичь 0°С, выливают в смесь воды со льдом (15 мл) и экстрагируют эфиром (3×25 мл). Объединенные органические экстракты промывают насыщенным раствором соли (25 мл), сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 10% этилацетата в гексанах) с последующей перекристаллизацией из смеси гексаны/эфир (9:1) с получением триоксолана OZ247 (202 мг, 37%, смесь 2 диастереомеров, 1:1) в виде бесцветного твердого вещества. Т.пл. 64-66°С (гексаны/эфир (9:1). 1H ЯМР (500 МГц, CDCl3) δ 1,60-2,42 (м, 22H), 3,18 (с, 0,5H), 3,40 (с, 0,5H), 7,28 (д, J=3,0 Гц, 0,5H), 7,30 (д, J=3,0 Гц, 0,5H), 7,69 (д, J=3,3 Гц, 0,5H), 7,72 (д, J=3,0 Гц, 0,5H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,45, 26,46, 26,85, 29,98, 30,09, 34,73, 34,77, 34,79, 34,86, 36,34, 36,40, 36,48, 36,75, 36,77, 72,44, 73,00, 107,91, 107,97, 111,61, 111,84, 119,02, 141,95, 142,16, 177,99, 178,23. Анал. рассч. для C19H25NO4S: C 62,78; H 6,93; N 3,85. Обнаружено: C 62,94; H 7,01; N 3,89.
цис-Адамантан-2-спиро-3'-8'-(1'Н-имидазол-2'-ил)-1',2',4'-триоксаспиро[4.5]декан (OZ251). Стадия 1. К раствору оксалилхлорида (0,99 г, 7,8 ммоль) в CH2Cl2 (50 мл) при -78°С добавляют по каплям метилсульфоксид (1,41 г, 18 ммоль). Смесь перемешивают при -78°С в течение 30 мин перед добавлением OZ119 (1,76 г, 6 ммоль) в CH2Cl2 (5 мл). После перемешивания полученной смеси в течение 45 мин добавляют триэтиламин (3,03 г, 30 ммоль). Смесь нагревают до комнатной температуры в течение 2 час и гасят водой (50 мл). Органический слой промывают водой (2×30 мл) и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт (1,80 г) кристаллизуют из 50% этанола с получением целевого альдегида, цис-адамантан-2-спиро-3'-8'-формил-1',2',4'-триоксаспиро[4.5]декана (0,82 г, 47%) в виде бесцветного твердого вещества. Т.пл. 74-76°С (50% этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,64-2,02 (м, 22 H), 2,20-2,30 (м, 1 H), 9,63 (д, J=1,1 Гц, 1H). Стадия 2. К раствору вышеуказанного альдегида (292 мг, 1 ммоль) и 40% глиоксаля (145 мг, 1 ммоль) в метаноле (12 мл) при 0°С добавляют аммиак (0,45 мл, 7 н. в метаноле). Полученную смесь перемешивают при комнатной температуре в течение ночи и концентрируют. Неочищенный продукт кристаллизуют из смеси гексаны/CH2Cl2 (3:2) с получением триоксолана OZ251 (240 мг, 73%) в виде бесцветного твердого вещества. Т.пл. 138-140°С (гексаны/CH2Cl2, 3:2). 1H ЯМР (500 МГц, CDCl3) δ 1,58-2,23 (м, 22H), 2,75-2,98 (м, 1H), 6,96 (с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,54, 26,94, 29,11, 33,92, 34,82, 34,86, 36,23, 36,47, 36,84, 108,00, 111,54, 121,10 (уш.с), 151,00. Анал. рассч. для C19H26N2О3: C 69,06; H 7,93; N 8,48. Обнаружено: C 69,04; H 7,93; N 8,60.
цис-Адамантан-2-спиро-3'-8'-[(2'-тиазолиламино)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ252). Смесь цис-адамантан-2-спиро-3'-8'-формил-1',2',4'-триоксаспиро[4.5]декана (292 мг, 1,0 ммоль), 2-аминотиазола (150 мг, 1,5 ммоль) и уксусной кислоты (240 мг, 4,0 ммоль) в CH2Cl2 (10 мл) и ClCH2CH2Cl (10 мл) перемешивают при комнатной температуре в течение 2,5 час перед добавлением триацетоксиборгидрида натрия (422 мг, 2,0 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи и далее гасят насыщенным водным NaHCO3 (50 мл). Органический слой отделяют и промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 2% CH3OH в CH2Cl2). Обогащенный продукт растворяют в смеси эфир/CH2Cl2 (4:1, 20 мл), обрабатывают метансульфоновой кислотой (40 мг, 0,4 ммоль) и помещают при -20°С на ночь. После декантации растворителя остаток промывают эфиром и сушат в вакууме с получением триоксолана OZ252 (110 мг, 23%) в виде бесцветного твердого вещества. Т.пл. 136-138°С. 1H ЯМР (500 МГц, CDCl3) δ 1,20-1,41 (м, 2H), 1,50-2,21 (м, 21H), 2,88 (с, 3H), 3,11 (каж. т, J=6,1 Гц, 2H), 6,54 (д, J=4,1 Гц, 1H), 7,05 (д, J=4,1 Гц, 1H), 10,51 (с, 1H), 14,17 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,84, 27,88, 33,44, 34,77, 35,66, 36,38, 36,76, 39,45, 54,26, 104,97, 108,18, 111,57, 127,14, 170,79. Анал. рассч. для C21H32N2О6S2: C 53,37; H 6,82; N 5,93. Обнаружено: C 53,16; H 6,76; N 5,91.
Мезилат цис-адамантан-2-спиро-3'-8'-[(циклопропиламино)метил]-1',2',4'-триоксаспиро[4.5]декана (OZ253). К раствору цис-адамантан-2-спиро-3'-8'-формил-1',2',4'-триоксаспиро[4.5]декана (292 мг, 1,0 ммоль), циклопропиламина (57 мг, 1,0 ммоль) и уксусной кислоты (90 мг, 1,5 ммоль) в 1,2-дихлорэтане (10 мл) добавляют триацетоксиборгидрид натрия (295 мг, 1,4 ммоль). Смесь перемешивают в течение 2 час и далее гасят насыщенным водным NaHCO3 (20 мл). Органический слой отделяют и водный слой экстрагируют CH2Cl2 (2×20 мл). Объединенные органические экстракты промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 20% эфира в гексанах, 400 мл; далее 10% метанолом в CH2Cl2, 300 мл) с получением двух фракций. Первую фракцию (130 мг) кристаллизуют из смеси СН3ОН/CH2Cl2 (6:1) с получением триоксолана OZ254 (96 мг, 31%) в виде бесцветного твердого вещества. Вторую фракцию (160 мг) растворяют в эфире (3 мл) и обрабатывают раствором метансульфоновой кислоты (46 мг) в эфире (3 мл). Осадок собирают фильтрованием и сушат в вакууме с получением триоксолана OZ253 (160 мг, 37%) в виде бесцветного твердого вещества. Для OZ253 т.пл. 144-147°С (эфир). 1H ЯМР (500 МГц, CDCl3) δ 0,77-0,95 (м, 2H), 1,10-1,22 (м, 2H), 1,23-1,41 (м, 2H), 1,50-2,19 (м, 21H), 2,50-2,69 (м, 1H), 2,73 (с, 3H), 2,82-3,02 (м, 2H), 8,63 (с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 3,70, 26,46, 26,86, 27,89, 31,23, 33,10, 33,43, 34,77, 36,38, 36,77, 39,51, 54,07, 107,97, 111,50. Анал. рассч. для C21H35NO6S: C 58,72; H 8,21; N 3,26. Обнаружено: C 58,65; H 8,15; N 3,35.
N,N-Бис(цис-адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-метил)циклопропиламин (OZ254). Для получения OZ254 см. OZ253. Т.пл. 138-140°С (СН3ОН/CH2Cl2 6:1). 1H ЯМР (500 МГц, CDCl3) δ 0,22-0,35 (м, 2H), 0,36-0,48 (м, 2H), 0,97-1,15 (м, 4H), 1,45-2,15 (м, 43H), 2,28 (д, J=7,1 Гц, 4H); 13C ЯМР (125,7 МГц, CDCl3) δ 6,80, 26,52, 26,92, 28,68, 34,09, 34,43, 34,80, 34,82, 36,42, 36,85, 38,74, 63,12, 109,31, 111,15. Анал. рассч. для C37H55NO6: C 72,87; H 9,09; N 2,30. Обнаружено: C 72,83; H 8,95; N 2,33.
цис-Адамантан-2-спиро-3'-8'-[[(4'-пиридинилкарбонил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ255). К раствору OZ209 (389 мг, 1,0 ммоль) и триэтиламина (0,6 г, 6 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют раствор гидрохлорида изоникотиноилхлорида (267 мг, 1,5 ммоль) в CH2Cl2 (10 мл). Полученную смесь перемешивают при комнатной температуре в течение ночи перед гашением водой (20 мл). После отделения органической фазы водный слой экстрагируют CH2Cl2 (20 мл). Объединенные органические экстракты промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт кристаллизуют из 40% водного этанола с получением триоксолана OZ255 (410 мг, 103%) в виде бесцветного твердого вещества. Т.пл. 145-146°С (40% водный этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,19-1,41 (м, 2H), 1,55-2,19 (м, 21H), 3,34 (каж. т, J=6,3 Гц, 2H), 6,36 (уш.с, 1H), 7,61 (д, J=4,4 Гц, 2H), 8,75 (уш.с, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,46, 26,85, 27,82, 33,71, 34,78, 36,21, 36,38, 36,76, 45,41, 108,46, 111,49, 120,87, 141,70, 150,57, 165,63. Анал. рассч. для C23H30N2О4: C 69,32; H 7,59; N 7,03. Обнаружено: C 69,18; H 7,43; N 7,04.
цис-Адамантан-2-спиро-3'-8'-[[(2'-амино-2'-оксоэтил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ256). Смесь OZ209 (389 мг, 1 ммоль) и триэтиламина (101 мг, 1 ммоль) в ацетонитриле (40 мл) перемешивают в течение 15 мин перед добавлением 2-бромацетамида (138 мг, 1 ммоль) и карбоната калия (276 мг, 2 ммоль). Смесь нагревают при 50°С в течение 16 час, далее разбавляют водой (25 мл) и экстрагируют CH2Cl2 (3×20 мл). Объединенные органические экстракты промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 6% CH3OH в CH2Cl2) с получением триоксолана OZ256 (90 мг, 26%) в виде бесцветного твердого вещества. Т.пл. 136-138°С. 1H ЯМР (500 МГц, CDCl3) δ 1,05-1,31 (м, 2H), 1,37-2,19 (м, 22H), 2,49 (д, J=6,4 Гц, 2H), 3,25 (с, 2H), 5,95 (с, 1H), 7,04 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,43, 26,83, 28,07, 33,86, 34,74, 34,76, 36,35, 36,52, 36,75, 52,52, 55,72, 108,73, 111,31, 174,84. Анал. рассч. для C19H30N2О4·0,25H2О: C 63,80; H 8,68; N 7,83. Обнаружено: C 63,68; H 8,25; N 7,82.
цис-Адамантан-2-спиро-3'-8'-[[(метансульфонил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ257). К раствору OZ209 (389 мг, 1 ммоль) и триэтиламина (404 мг, 4 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют раствор метансульфонилхлорида (171 мг, 1,5 ммоль) в CH2Cl2 (1,5 мл). Смесь перемешивают при комнатной температуре в течение 16 час, промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% CH3OH в CH2Cl2) с получением триоксолана OZ257 (290 мг, 78%) в виде бесцветного твердого вещества. Т.пл. 124-126°С. 1H ЯМР (500 МГц, CDCl3) δ 1,15-1,33 (м, 2H), 1,45-2,17 (м, 21H), 2,95 (с, 3H), 2,99 (каж. т, J=6,7 Гц, 2H), 4,31 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,47, 26,86, 27,55, 33,60, 34,78, 34,79, 36,38, 36,77, 40,36, 48,54, 108,40, 111,50. Анал. рассч. для C18H29NO5S: C 58,20; H 7,87; N 3,77. Обнаружено: C 58,32; H 7,74; N 3,83.
Адамантан-2-спиро-3'-8'-[[2'-[(7'-хлор-4'-хинолинил)амино]этил]амино]-1',2',4'-триоксаспиро[4.5]декан (OZ258). К перемешиваемому раствору OZ05 (75 мг, 0,27 ммоль) в CH2Cl2 (5 мл) при комнатной температуре в атмосфере N2 добавляют N2-(7-хлор-4-хинолинил)-1,2-диаминоэтан (176 мг, 0,34 ммоль) с последующим добавлением триацетоксиборгидрида натрия (72 мг, 0,34 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 24 час перед выливанием в воду (10 мл). Органический слой отделяют, сушат и концентрируют. Перекристаллизацией неочищенного продукта из этанола получают триоксолан OZ258 (86 мг, 66%) в виде бесцветного твердого вещества. Т.пл. 146-148°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,42-2,21 (м, 23H), 2,55-2,77 (м, 1H), 3,05 (т, J=5,6 Гц, 2H), 3,34 (уш.с, 2H), 5,90 (уш.с, 1H), 6,39 (д, J=5,2 Гц, 1H), 7,37 (дд, J=8,8, 1,9 Гц, 1H), 7,70 (д, J=8,8 Гц, 1H), 7,96 (д, J=1,9 Гц, 1H), 8,53 (д, J=5,2 Гц, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,65, 27,08, 30,17, 32,23, 34,86, 35,06, 36,60, 36,94, 42,89, 45,17, 54,43, 99,36, 108,36, 111,80, 121,09, 125,40, 125,46, 128,93, 134,98, 149,20, 150,00, 152,06. Анал. рассч. для C27H34ClN3О3: C 67,00; H 7,08; N 8,68. Обнаружено: C 67,18; H 7,12; N 8,49.
Адамантан-2-спиро-3'-8'-(3'-пиридиниламино)-1',2',4'-триоксаспиро[4.5]декан (OZ259). Т.пл. 132-134°С. 1H ЯМР (500 МГц, CDCl3) δ 1,42-2,23 (м, 22H), 3,25-3,49 (м, 1H), 3,59-3,83 (м, 1H), 6,82-6,90 (м, 1H), 7,02-7,12 (м, 1H), 7,90-7,96 (м, 1H), 7,98-8,04 (м, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,40, 26,81, 26,83, 29,40, 29,86, 32,16, 32,60, 34,69, 34,72, 34,76, 34,87, 36,29, 36,32, 36,71, 49,54, 49,87, 107,86, 111,60, 111,81, 118,78, 118,85, 123,67, 136,22, 136,45, 138,57, 138,61, 143,06. Анал. рассч. для C21H28N2О3: C 70,76; H 7,92; N 7,86. Обнаружено: C 70,88; H 7,91; N 7,84.
цис-Адамантан-2-спиро-3'-8'-[3'-(этоксикарбонил)пропил]-1',2',4'-триоксаспиро[4.5]декан (OZ260). Раствор О-метилоксима 2-адамантанона (895 мг, 5 ммоль) и 4-[3-(этоксикарбонил)пропил]циклогексанона (710 мг, 3,35 ммоль) в циклогексане (85 мл) и CH2Cl2 (15 мл) обрабатывают озоном в соответствии с общей методикой. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% эфира в петролейном эфире) и последующей кристаллизацией из этанола с получением триоксолана OZ260 (660 мг, 52%) в виде бесцветного твердого вещества. Т.пл. 52-54°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,01-1,37 (м, 5H), 1,25 (т, J=7,1 Гц, 3H), 1,47-2,21 (м, 22H), 2,27 (т, J=7,6 Гц, 2H), 4,12 (кв, J=7,1 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 14,24, 22,63, 26,51, 26,90, 30,01, 34,19, 34,55, 34,79, 34,81, 35,66, 35,90, 36,41, 36,83, 60,18, 108,99, 111,17, 173,68. Анал. рассч. для C22H34О5: C 69,81; H 9,05. Обнаружено: C 69,82; H 8,96.
цис-Адамантан-2-спиро-3'-8'-(3'-карбоксипропил)-1',2',4'-триоксаспиро[4.5]декан (OZ261). К раствору OZ260 (250 мг, 0,66 ммоль) в 95% этаноле (5 мл) добавляют 15% раствор NaOH (1 мл). Смесь перемешивают при 25оС в течение 24 час перед концентрированием и подкислением 6 М водной HCl (3 мл). Осадок фильтруют, промывают водой и кристаллизуют из этанола с получением триоксолана OZ261 (186 мг, 81%) в виде бесцветного твердого вещества. Т.пл. 156-158°С (этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,03-1,39 (м, 5H), 1,45-2,20 (м, 22H), 2,27 (т, J=7,4 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 22,33, 26,50, 26,90, 29,98, 34,06, 34,17, 34,81, 35,55, 35,87, 36,40, 36,83, 108,96, 111,19, 179,14. Анал. рассч. для C20H30О5: C 68,54; H 8,63. Обнаружено: C 68,41; H 8,49.
цис-Адамантан-2-спиро-3'-8'-[(ацетиламино)метил]-1',2',4'-триоксаспиро[4.5]декан (OZ262). К раствору OZ209 (389 мг, 1 ммоль) и триэтиламина (505 мг, 5 ммоль) в CH2Cl2 (10 мл) при 0°С по каплям добавляют раствор ацетилхлорида (140 мг, 1,9 ммоль) в CH2Cl2 (5 мл). Смесь перемешивают при комнатной температуре в течение 16 час, промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт очищают флэш-хроматографией (силикагель, 5% CH3OH в CH2Cl2) и последующей кристаллизацией из смеси гексаны/CH2Cl2 (3:1) с получением триоксолана OZ262 (150 мг, 45%) в виде бесцветного твердого вещества. Т.пл. 102°С, разл. (гексаны/CH2Cl2 3:1). 1H ЯМР (500 МГц, CDCl3) δ 1,15-1,37 (м, 2H), 1,41-2,09 (м, 21H), 1,98 (с, 3H), 3,11 (каж. т, J=6,3 Гц, 2H), 5,52 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 23,34, 26,46, 26,85, 27,72, 33,73, 34,76, 34,77, 36,16, 36,37, 36,77, 44,87, 108,60, 111,38, 170,03. Анал. рассч. для C19H29NO4: C 68,03; H 8,71; N 4,18. Обнаружено: C 68,26; H 8,70; N 4,18.
Мезилат цис-адамантан-2-спиро-3'-8'-[[[(1'H-имидазол-4'-ил)карбонил]амино]метил]-1',2',4'-триоксаспиро[4.5]декана (OZ263). К раствору 4-имидазолкарбоновой кислоты (134 мг, 1,2 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (290 мг, 1,5 ммоль) и 1-гидроксибензотриазола (200 мг, 1,5 ммоль) в ДМФА (40 мл) в атмосфере N2 добавляют раствор OZ209 (389 мг, 1,0 ммоль) и триэтиламин (101 мг, 1,0 ммоль) в ДМФА (5 мл). Полученную смесь перемешивают при комнатной температуре в течение 48 час перед гашением водой (120 мл). Смесь экстрагируют CH2Cl2 (3×40 мл). Объединенные органические экстракты промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт растворяют в CH2Cl2 (10 мл) и обрабатывают метансульфоновой кислотой (90 мг). Твердое вещество собирают фильтрацией и перекристаллизовывают из смеси эфир/CH2Cl2/CH3OH (3:1:1) с получением триоксолана OZ263 (72 мг, 15%) в виде бесцветного твердого вещества. Т.пл. 161-162°С (эфир/CH2Cl2/CH3OH 3:1:1). 1H ЯМР (500 МГц, ДМСО-d6) δ 1,02-1,23 (м, 2H), 1,45-2,09 (м, 21H), 2,32 (с, 3H), 3,13 (каж. т, J=6,3 Гц, 2H), 8,12 (с, 1H), 8,73 (уш.с, 1H), 9,03 (с, 1H), 14,47 (уш.с, 2H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,96, 26,36, 27,64, 33,34, 34,41, 35,77, 35,90, 36,23, 44,06, 108,68, 110,66, 119,91, 120,22, 128,13, 128,22, 135,92, 136,09, 157,40. Анал. рассч. для C22H33N3О7S: C 54,64; H 6,88; N 8,69. Обнаружено: C 54,72; H 6,76; N 8,90.
цис-Адамантан-2-спиро-3'-8'-[[[(1'-оксидо-4'-пиридинил)карбонил]амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ264). К раствору N-оксида изоникотиновой кислоты (167 мг, 1,2 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (290 мг, 1,5 ммоль) и 1-гидроксибензотриазола (200 мг, 1,5 ммоль) в ДМФА (10 мл) в атмосфере N2 добавляют раствор OZ209 (389 мг, 1,0 ммоль) и триэтиламин (101 мг, 1,0 ммоль) в ДМФА (5 мл). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед гашением водой (50 мл). Осадок собирают фильтрацией с получением триоксолана OZ264 (340 мг, 82%) в виде бесцветного твердого вещества. Т.пл. 152-154°С. 1H ЯМР (500 МГц, CDCl3) δ 1,21-1,43 (м, 2H), 1,49-2,11 (м, 21H), 3,33 (каж. т, J=6,2 Гц, 2H), 6,54 (уш.с, 1H), 7,69 (д, J=6,3 Гц, 2H), 8,20 (д, J=6,0 Гц, 2H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,44, 26,84, 27,82, 33,69, 34,77, 36,18, 36,37, 36,75, 45,56, 108,43, 111,52, 124,32, 131,08, 139,29, 163,52. Анал. рассч. для C23H30N2О5: C 66,65; H 7,30; N 6,76. Обнаружено: C 66,81; H 7,18; N 6,55.
цис-Адамантан-2-спиро-3'-8'-[[(аминокарбонил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ265). Смесь OZ209 (389 мг, 1,0 ммоль), пиридина (790 мг, 10 ммоль), уксусной кислоты (600 мг, 10 ммоль), триэтиламина (303 мг, 3 ммоль) и цианата калия (164 мг, 2 ммоль) в CH2Cl2 (10 мл) перемешивают при комнатной температуре в течение 38 час. Смесь далее промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт перекристаллизовывают из 40% водного этанола с получением триоксолана OZ265 (250 мг, 74%) в виде бесцветного твердого вещества. Т.пл. 138-140°С (40% водный этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,11-1,33 (м, 2H), 1,41-2,18 (м, 21H), 3,02 (каж. т, J=5,5 Гц, 2H), 4,64 (уш.с, 2H), 5,09 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,45, 26,84, 27,66, 33,75, 34,76, 36,36, 36,65, 36,76, 45,85 (уш.с), 108,69, 111,35, 158,96. Анал. рассч. для C18H28N2О4: C 64,26; H 8,39; N 8,33. Обнаружено: C 64,40; H 8,15; N 8,46.
цис-Адамантан-2-спиро-3'-8'-[[[(диметиламино)карбонил]амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ266). К раствору OZ209 (389 мг, 1,0 ммоль) и триэтиламина (202 мг, 2,0 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют диметилкарбамоилхлорид (120 мг, 1,1 ммоль). Смесь перемешивают при комнатной температуре в течение 16 час перед промывкой водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт кристаллизуют из 50% водного этанола с получением триоксолана OZ266 (270 мг, 74%) в виде бесцветного твердого вещества. Т.пл. 153-155°С (50% водный этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,14-1,33 (м, 2H), 1,44-2,17 (м, 21H), 2,91 (с, 6H), 3,09 (каж. т, J=6,2 Гц, 2H), 4,46 (уш.с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,49, 26,88, 27,77, 33,84, 34,79, 36,19, 36,39, 36,61, 36,80, 46,25, 108,85, 111,30, 158,43. Анал. рассч. для C20H32N2О4: C 65,91; H 8,85; N 7,69. Обнаружено: C 66,16; H 8,80; N 7,90.
цис-Адамантан-2-спиро-3'-8'-[[[(4'-метил-1'-пиперазинил)карбонил]амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ267). К раствору OZ209 (389 мг, 1,0 ммоль) и триэтиламина (404 мг, 4,0 ммоль) в CH2Cl2 (10 мл) при 0°С добавляют гидрохлорид 4-метил-1-пиперазинкарбонилхлорида (240 мг, 1,2 ммоль). Смесь перемешивают при комнатной температуре в течение 16 час перед промывкой водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Неочищенный продукт кристаллизуют из 60% водного этанола с получением триоксолана OZ267 (280 мг, 67%) в виде бесцветного твердого вещества. Т.пл. 82°С, разл. (60% водный этанол). 1H ЯМР (500 МГц, CDCl3) δ 1,11-1,30 (м, 2H), 1,43-2,15 (м, 21H), 2,31 (с, 3H), 2,39 (т, J=5,1 Гц, 4H), 3,09 (каж. т, J=6,2 Гц, 2H), 3,38 (т, J=5,1 Гц, 4H), 4,59 (каж. т, J=5,5 Гц, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,45, 26,84, 27,77, 33,78, 34,76, 36,35, 36,48, 36,76, 43,71, 46,08, 46,18, 54,64, 108,77, 111,29, 157,69. Анал. рассч. для C23H37N3О4: C 65,84; H 8,89; N 10,02. Обнаружено: C 65,91; H 8,64; N 10,07.
N-(цис-Адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-метил)оксамид (OZ268). К раствору оксамовой кислоты (107 мг, 1,2 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (290 мг, 1,5 ммоль) и 1-гидроксибензотриазола (200 мг, 1,5 ммоль) в ДМФА (15 мл) в атмосфере N2 добавляют раствор OZ209 (389 мг, 1,0 ммоль) и триэтиламина (101 мг, 1,0 ммоль) в ДМФА (5 мл). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед гашением водой (80 мл). Осадок собирают фильтрацией с получением триоксолана OZ268 (320 мг, 88%) в виде бесцветного твердого вещества Т.пл. 152-155°С. 1H ЯМР (500 МГц, ДМСО-d6) δ 0,95-1,23 (м, 2H), 1,39-2,13 (м, 21H), 2,97 (каж. т, J=6,5 Гц, 2H), 7,74 (с, 1H), 7,80 (с, 1H), 8,67 (каж. т, J=6,2 Гц, 1H); 13C ЯМР (125,7 МГц, ДМСО-d6) δ 25,97, 26,38, 27,55, 33,30, 34,41, 35,47, 35,91, 36,25, 44,03, 108,70, 110,62, 160,50, 162,38. Анал. рассч. для C19Н28N2О5: C 62,62; H 7,74; N 7,69. Обнаружено: C 62,80; H 7,55; N 7,89.
Мезилат транс-адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декана (OZ269). Смесь OZ167 (2,54 г, 6,0 ммоль) и моногидрата гидразина (1,80 г, 36,0 ммоль) в смеси хлороформ/метанол (7:3, 60 мл) нагревают при 55-65°С в течение 24 час. После охлаждения до комнатной температуры твердый побочный продукт отфильтровывают и фильтрат промывают водой (2×40 мл) и насыщенным раствором соли (20 мл). Объединенные водные слои экстрагируют CH2Cl2 (3×30 мл). CH2Cl2 экстракты промывают водой (50 мл) и насыщенным раствором соли (50 мл). Объединенные органические растворы сушат над MgSO4 и концентрируют. Остаток перерастворяют в CH2Cl2 (10 мл) и обрабатывают раствором метансульфоновой кислоты (0,6 г) в CH2Cl2 (2 мл). Продукт осаждают добавлением эфира (40 мл) и собирают фильтрацией с получением триоксолана OZ269 (1,80 г, 77%) в виде бесцветного твердого вещества Т.пл. 140-141°С. 1H ЯМР (500 МГц, CDCl3) δ 1,32-1,52 (м, 2H), 1,54-2,15 (м, 21H), 2,76 (с, 3H), 2,87 (каж. т, J=6,3 Гц, 2H), 7,60 (с, 3H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,44, 26,86, 27,24, 33,23, 34,56, 34,71, 34,90, 36,33, 36,74, 39,29, 44,63, 108,06, 111,81. Анал. рассч. для C18H31NO6S·0,4Н2О: C 53,84; H 8,12; N 3,49. Обнаружено: C 53,51; H 7,64; N 3,66.
цис-Адамантан-2-спиро-3'-8'-[[[(1'-оксидо-2'-пиридинил)карбонил]амино]метил]-1',2',4'-триоксаспиро[4.5]декан (OZ270). К раствору N-оксида пиколиновой кислоты (167 мг, 1,2 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (290 мг, 1,5 ммоль) и 1-гидроксибензотриазола (200 мг, 1,5 ммоль) в ДМФА (10 мл) в атмосфере N2 добавляют раствор OZ209 (389 мг, 1,0 ммоль) и триэтиламина (101 мг, 1,0 ммоль) в ДМФА (5 мл). Полученную смесь перемешивают при комнатной температуре в течение 16 час перед гашением водой (80 мл). Осадок собирают фильтрацией с получением триоксолана OZ270 (338 мг, 82%) в виде бесцветного твердого вещества. Т.пл. 140-143°С. 1H ЯМР (500 МГц, CDCl3) δ 1,22-1,45 (м, 2H), 1,46-2,15 (м, 21H), 3,36 (каж. т, J=6,4 Гц, 2H), 7,35-7,43 (м, 1H), 7,44-7,50 (м, 1H), 8,26 (д, J=6,3 Гц, 1H), 8,44 (дд, J=8,2, 1,9 Гц, 1H), 11,35 (с, 1H); 13C ЯМР (125,7 МГц, CDCl3) δ 26,45, 26,84, 27,96, 33,75, 34,75, 34,76, 36,18, 36,34, 36,77, 44,97, 108,64, 111,30, 127,15, 127,26, 128,89, 140,50, 140,69, 159,64. Анал. рассч. для C23H30N2О5: C 66,65; H 7,30; N 6,76. Обнаружено: C 66,47; H 7,12; N 6,75.
Пример 2
Противомалярийная активность OZ01-OZ369
Анализ противомалярийной активности
Различные OZ соединения тестируют методом полуавтоматического анализа с микроразбавлением на активность против внутриэритроцитных форм Plasmodium falciparum, полученных от асинхронных культур на хранении. В качестве среды для культуры применяют RPMI 1640, дополненную 10% сывороткой типа А+ человека, 25 мМ HEPES, 25 мМ NaHCO3 (рН 7,3). Эритроциты человека типа А+ служат клетками хозяина. Культуру выдерживают при 37°С в атмосфере из 3% О2, 4% СО2 и 93% N2 в увлажненных модульных камерах.
Соединения растворяют в ДМСО (10 мг/мл), предварительно разбавляют в полной культуральной среде и титруют с дублированием при серийном двукратном разбавлении в 64-кратном масштабе в 96-луночных планшетах для микротитрования. После добавления культур паразитов с начальной паразитемией (выраженной как процентное содержание инфицированных эритроцитов), равной 0,75% в 2,5% суспензии эритроцитов, тестируемые планшеты инкубируют в условиях, описанных выше, в течение 72 час. Рост культур паразитов определяют по внедрению радиоактивно меченного [3H]-гипоксантина, добавленного за 16 час до окончания теста. Концентрацию, соответствующую пятидесяти процентам ингибирования (IC50), оценивают с помощью регрессионного анализа Logit. Испытывают действие соединений против ссылочных штаммов P. Falciparum, штамма К1 (из Таиланда, устойчивый к хлорохину) и штамма NF54 (встречающийся в аэропортах штамм неизвестного происхождения, который является чувствительным к стандартным противомалярийным средствам).
В анализе in vivo с использованием однократной дозы STI мышей Moro SPF или NMRI, инфицированных штаммом ANKA P. berghei (группы из 3-5 мышей), на следующий день после инъекции обрабатывают триоксоланами, растворенными или суспендированными в 3% этаноле и 7% твине 80. Триоксоланы вводят в виде однократных доз 10 мг/кг пк (подкожно) и по (перорально). Триоксоланы также вводят в виде однократных доз 3 мг/кг и 10 мг/кг в стандартной суспендирующей среде (SSV). SSV содержит 0,5% (мас./об.) карбоксиметилцеллюлозы (СМС), 0,5% (об./об.) бензилового спирта, 0,4% (об./об.) твина 80 и 0,9% (мас./об.) хлорида натрия в воде. Противомалярийную активность оценивают по процентному уменьшению паразитемии на третий день после инфекции и по времени выживания по сравнению с необработанной контрольной группой. Животное, выжившее на 30-й день после инфекции, считается вылеченным. В патенте США № 6486199 таблица 1 представляет данные для триоксоланов OZ01-OZ90, а также контрольных соединений (контролей) - фенозана, артемизинина, артитера, артеметера и артесуната. Данные показывают, что противомалярийная активность снижается как в том случае, когда пероксидная связь триоксолана является слишком открытой, так и в том случае, когда она стерически недоступна для железа (II). Другие факторы, влияющие на противомалярийную активность, включают стабильность углеродных радикалов, образовавшихся в результате β-расщепления после инициирующего переноса электрона на пероксидную связь, и влияние стерических эффектов, удаленных от пероксидной связи, на взаимодействие углеродных радикалов с потенциальными мишенями лекарственного средства. Данные также демонстрируют, что триоксолановые карбоновые кислоты обычно менее активны, чем их соответствующие углеводородные, сложноэфирные и гидроксамовые производные.
Ниже приведены данные по активности для OZ91-OZ369.
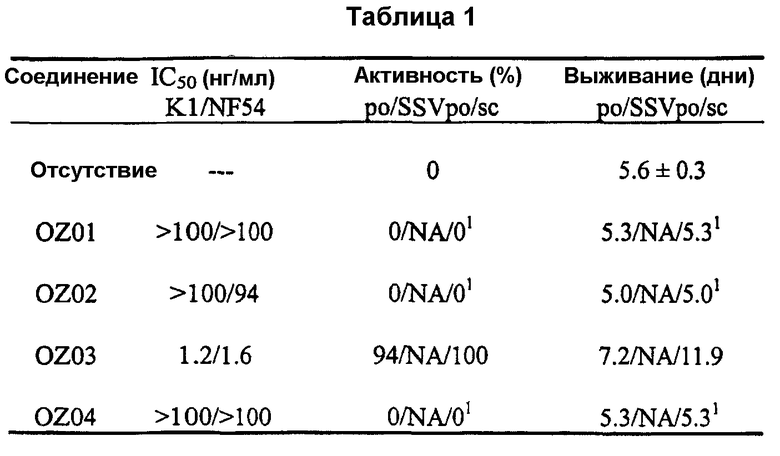
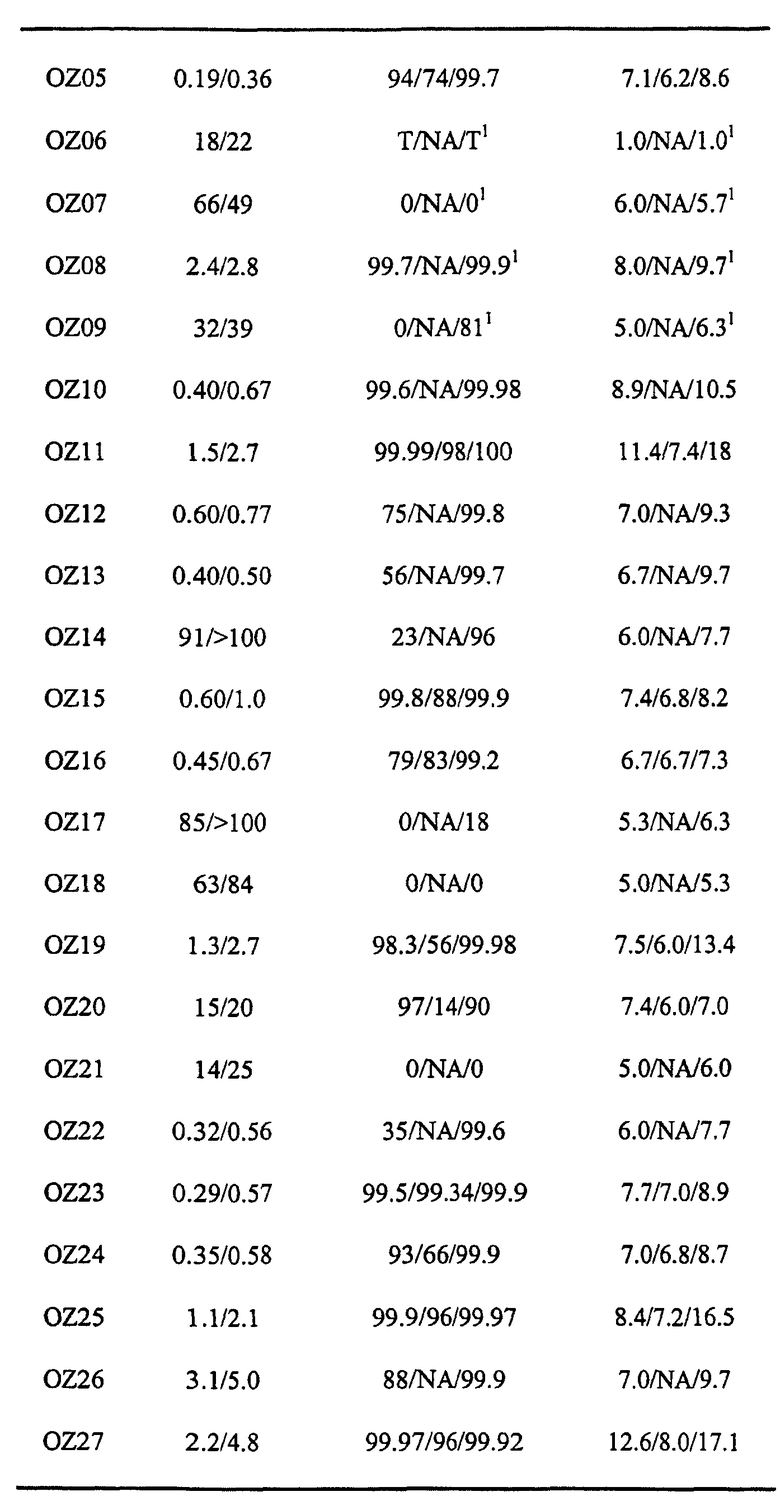
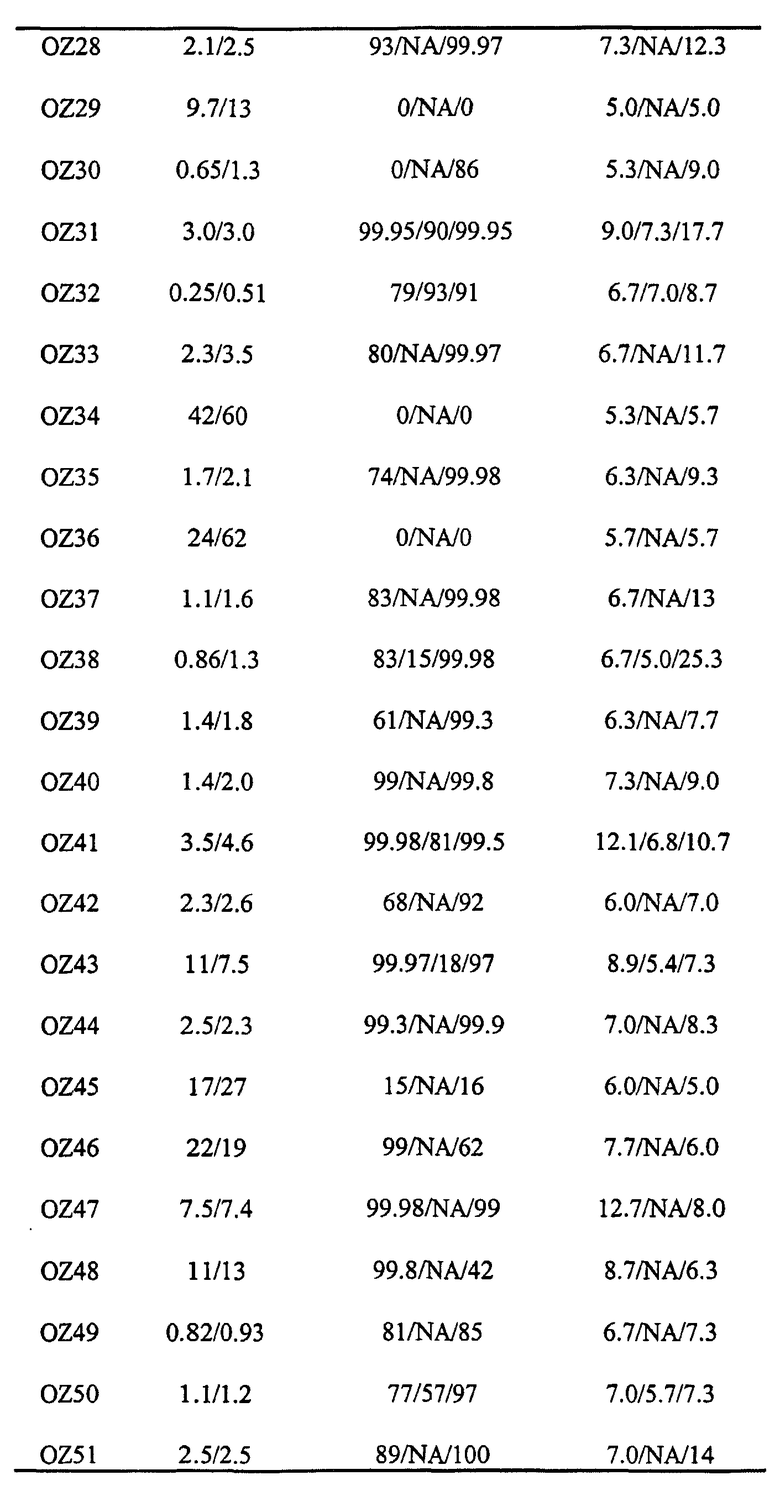
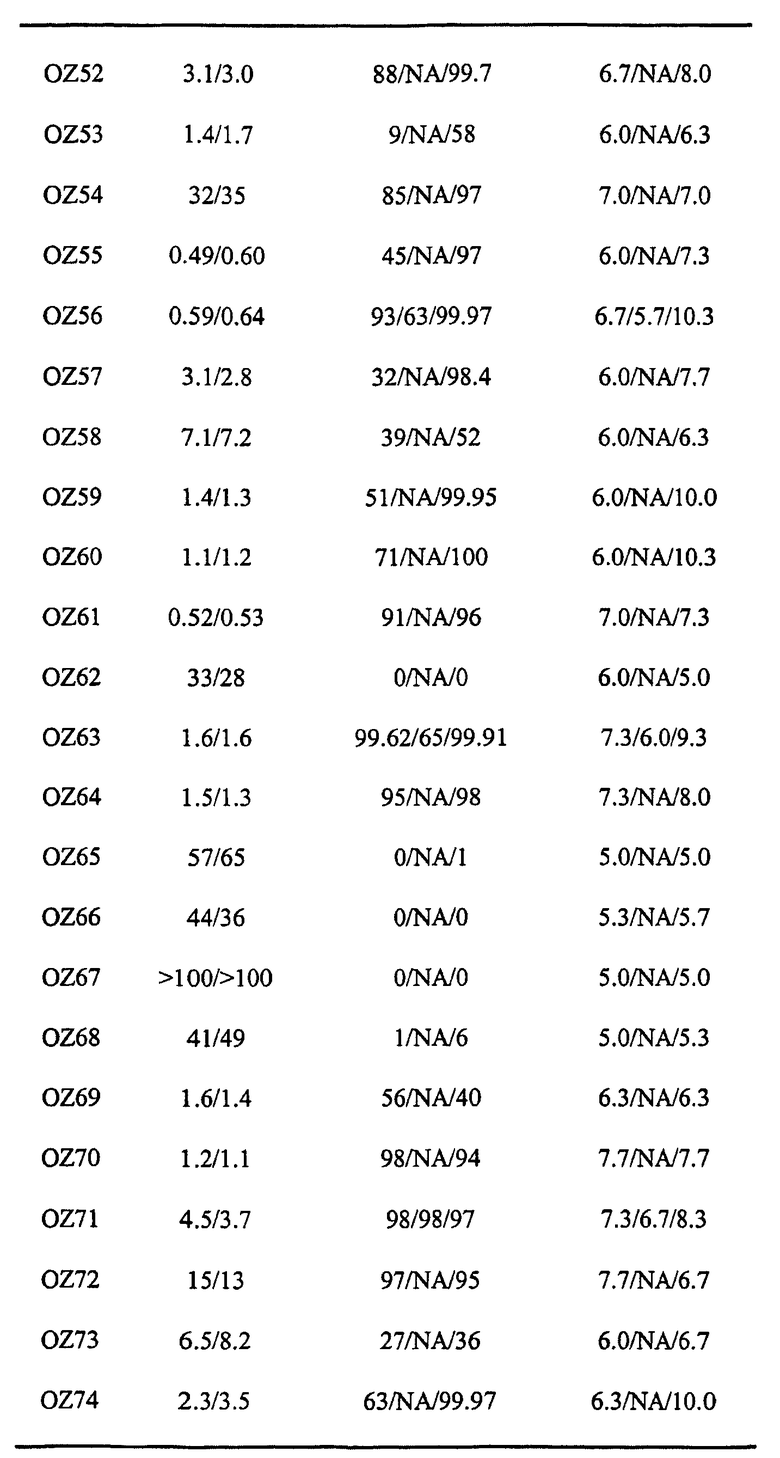
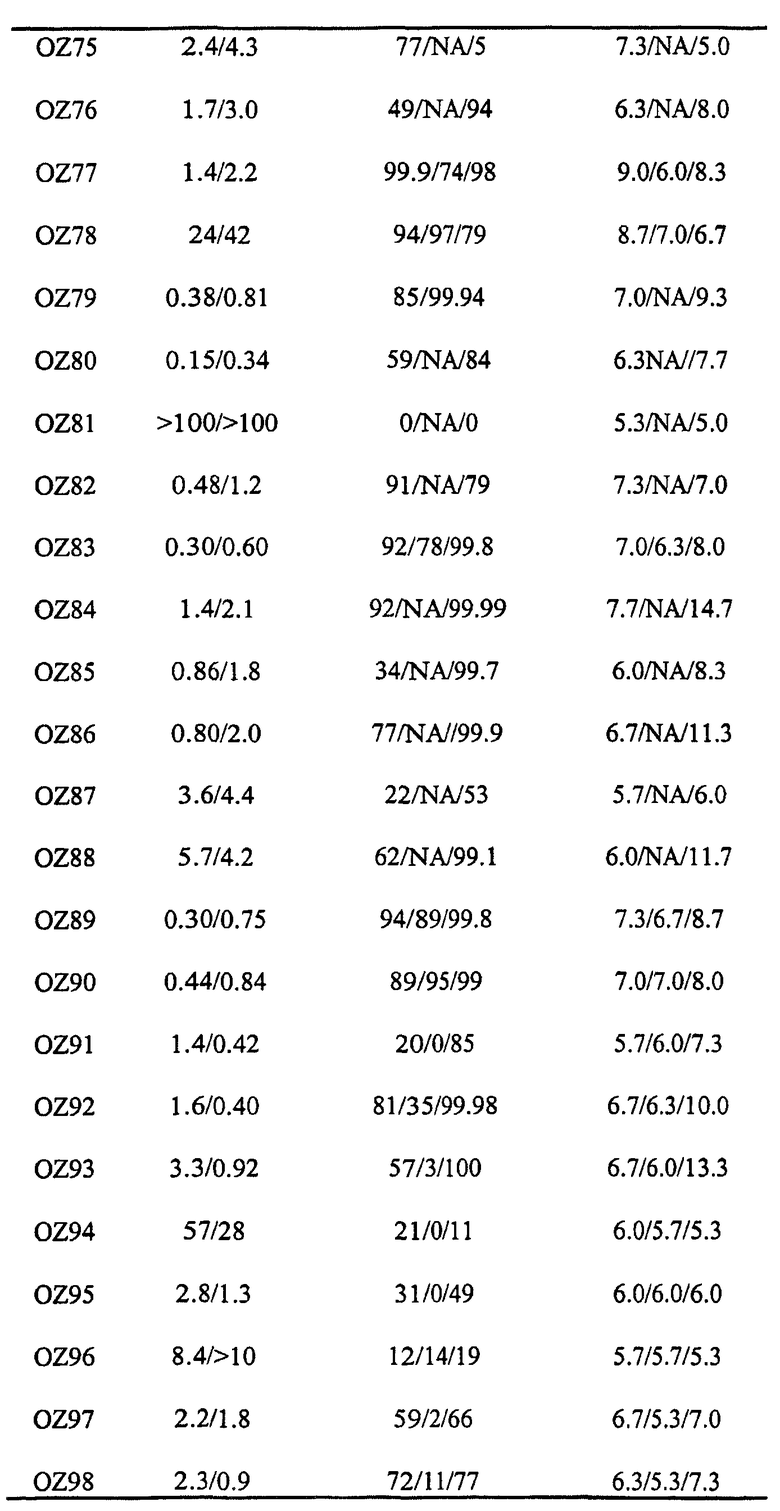
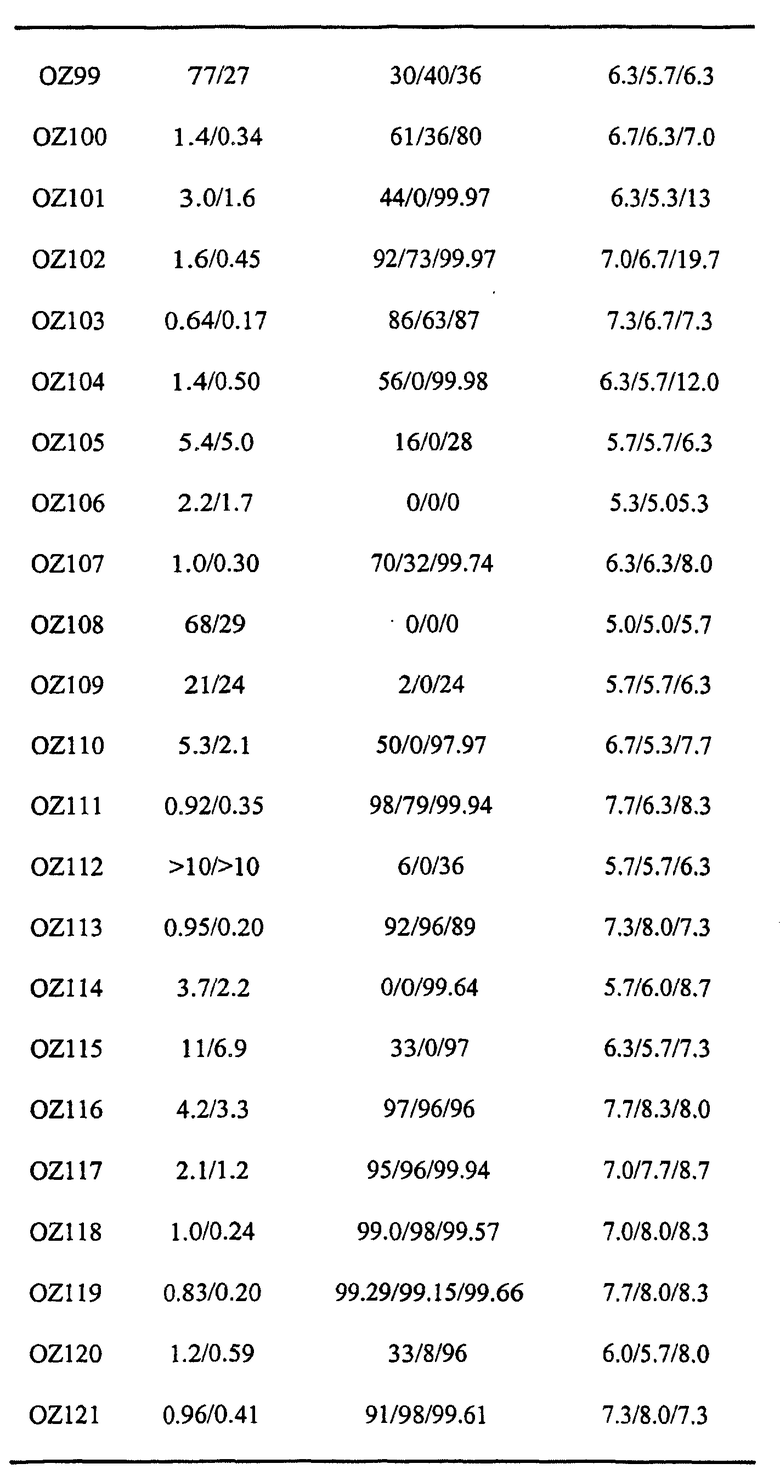
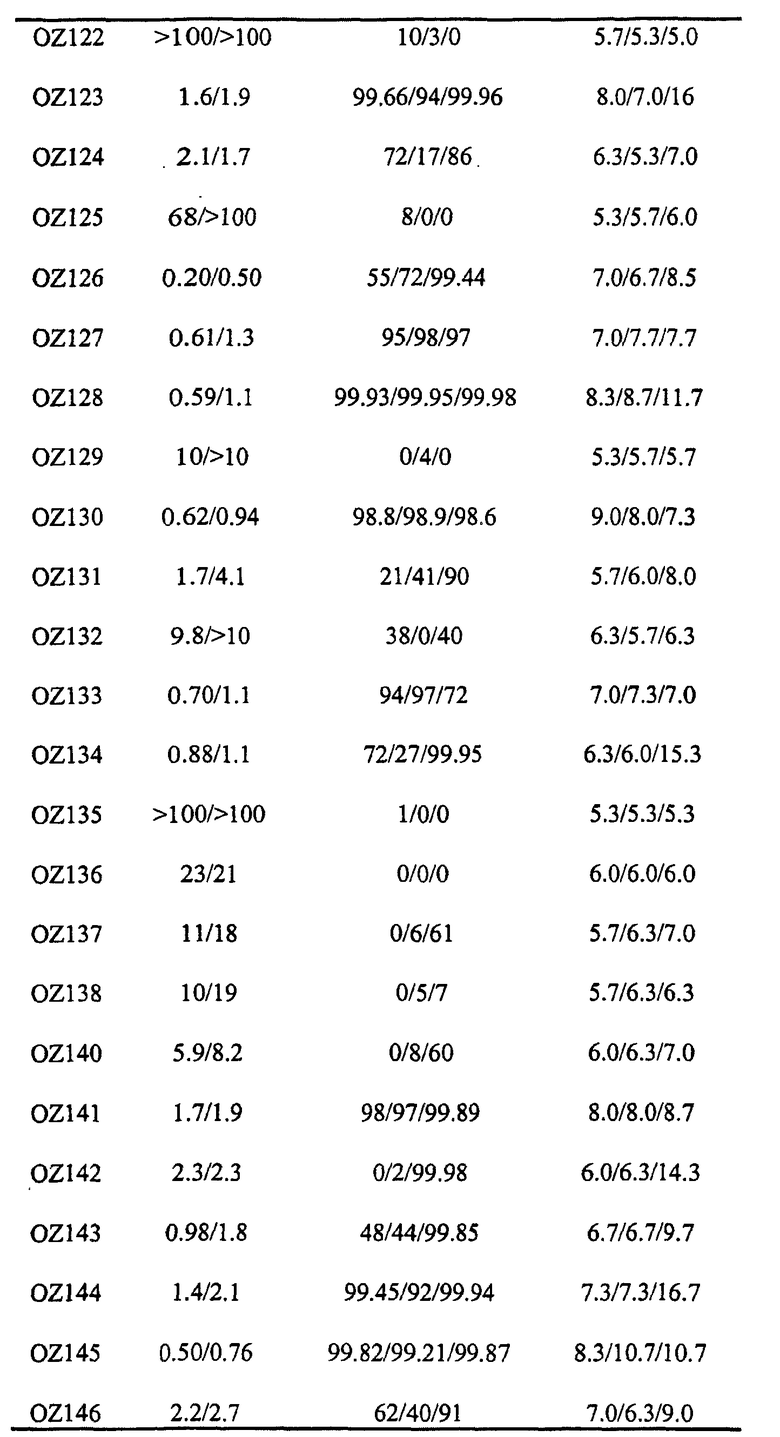

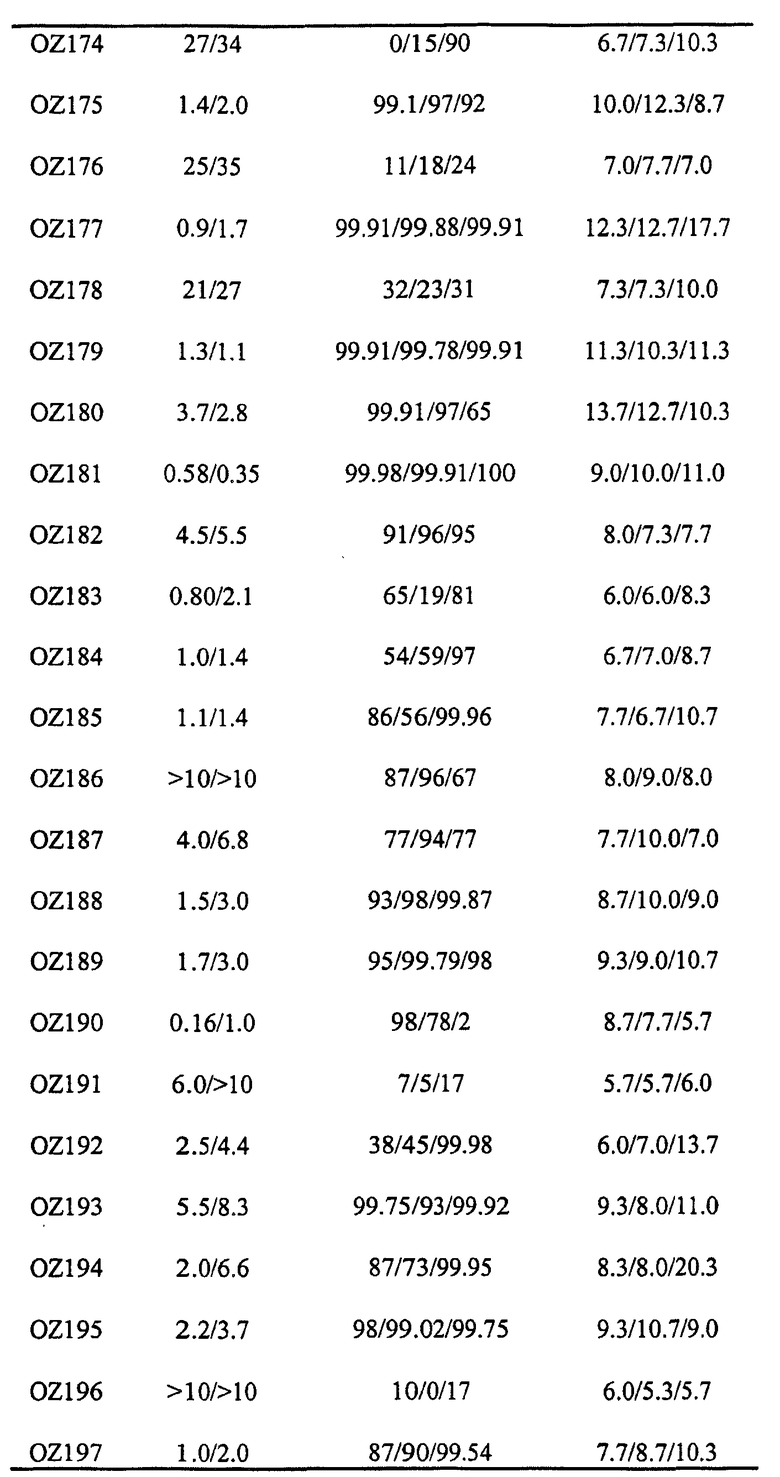
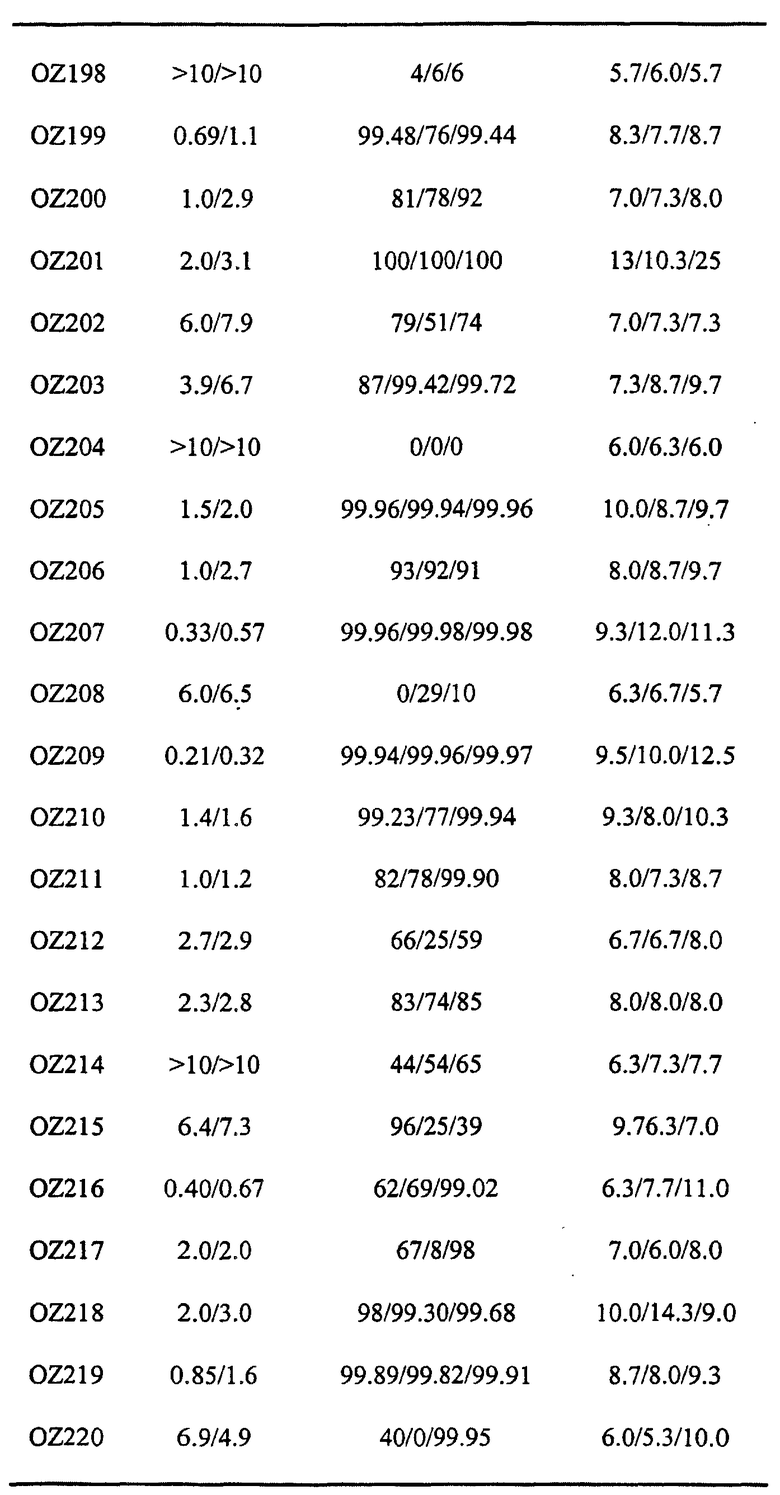
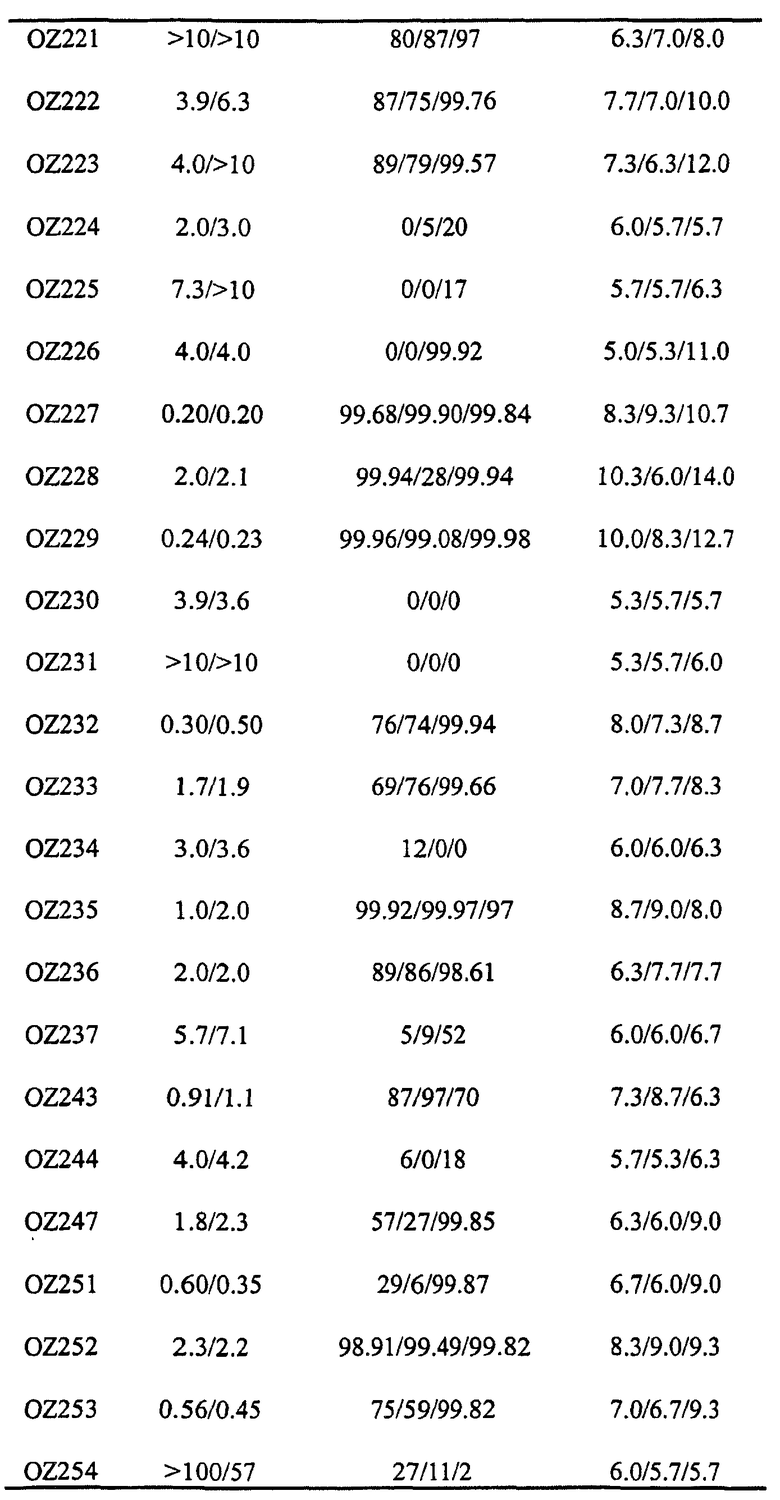
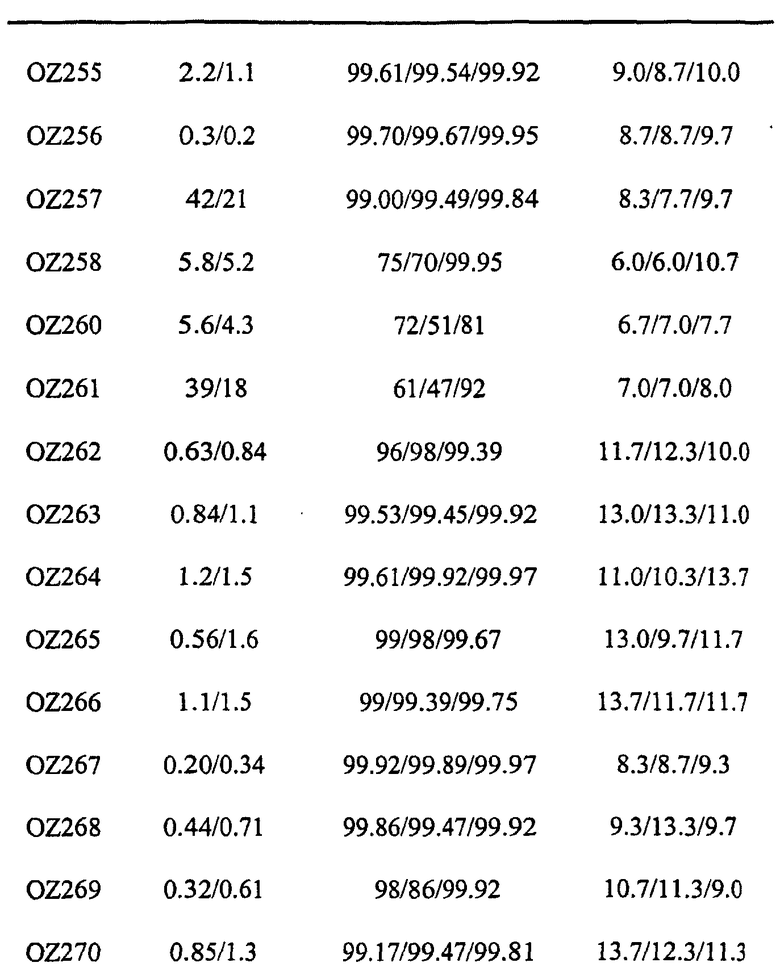
K1/NF54
10/3 мг/кг
SSV po
10/3 мг/кг
SSV po
Для сравнительного анализа также представлены данные для контроля.
1Данные для однократной дозы 100 мг/кг.
Как показано выше, противомалярийные лекарственные средства представлены артеметером (АМ), артесунатом (АС), хлорохином (ХХ) и мефлохином (МФХ).
Противомалярийная активность снижается, когда пероксидная связь триоксолана является слишком открытой или она стерически недоступна для железа (II). Другие факторы, влияющие на противомалярийную активность, включают стабильность углеродных радикалов, образовавшихся в результате β-расщепления после инициирующего переноса электрона на пероксидную связь, и влияние стерических эффектов, удаленных от пероксидной связи, на взаимодействие углеродных радикалов с потенциальными мишенями лекарственного средства. Новые данные по активности демонстрируют, что триоксолановые карбоновые кислоты обычно менее активны, чем соответствующие углеводородные, сложноэфирные, амидные и гидроксамовые производные. Положение ионизуемых функциональных групп, таких как карбоновые кислоты и амины, также является критическим для активности. Наилучшее сочетание высокой характеристической активности и хорошей активности при пероральном введении обнаруживают, когда присутствует функциональная группа слабого основания.
Пример 3
Начало действия и возобновление заболевания для OZ11, OZ27, OZ78, OZ156, OZ175, OZ177, OZ207, OZ209, OZ277 и OZ279
Исследование начала действия и возобновления заболевания
Начало действия лекарственного средства определяют после перорального введения однократной фиксированной дозы 100 мг/кг (среда SSV) группам из пяти животных на +3 день после инъекции (0 день). Паразитемия в данный момент обычно находится в интервале 25-40%. Инфицированные контрольные животные не выживают после +6 дня после инъекции. Уменьшение паразитемии регистрируют через 12, 24 и 48 часов после обработки, а для оценки времени, необходимого для возобновления заболевания (>5% паразитемии), в течение 14 дней ежедневно берут мазки крови и затем периодически проводят оценку в течение 60 дней.
Первая часть данного эксперимента показывает, насколько быстро соединение уменьшает количество паразита; часть эксперимента, относящаяся к возобновлению заболевания, предоставляет информацию об эффективности противопаразитарного соединения. Длительная задержка рецидива может быть обусловлена очень хорошим противопаразитарным действием соединения или продолжительным периодом полужизни соединения.
И триоксоланы, и артемизинины вызывают быстрое уменьшение паразитемии, подтверждая, что они являются быстродействующими противомалярийными агентами. В противоположность и хлорохину, и упомянутым пероксидным противомалярийным средствам мефлохин начинает действовать медленно. При применении артемизина и артесуната возобновление заболевания (>5% паразитемии) происходит очень быстро. Время начала рецидива увеличивается для более липофильных производных артемизина, а именно артеметера и артитера.
В отличие от артеметера при применении липофильных триоксоланов OZ11 и OZ27 возобновление заболевания происходит гораздо медленнее; особенно отмечается, что OZ27 по времени возникновения рецидива превосходит мефлохин. Однако время возникновения рецидива при применении относительно полярных триоксоланов OZ78, OZ175 и OZ277 почти такое же, как при применении артеметера. Более липофильный триоксолан (OZ156) из пары OZ156/OZ177 обеспечивает наиболее длительную задержку рецидива, более длительную, чем хлорохин, но менее длительную, чем мефлохин. Время возникновения рецидива при применении OZ177 и OZ279 приблизительно такое же, как при применении хлорохина.
Удивительно, что при применении OZ207 и OZ209 - двух различных солевых форм (OZ207 - тозилат, OZ209 - мезилат) аминометилтриоксолана OZ163 (гидрохлорида) не наблюдается возобновления заболевания. Полученные данные позволяют предположить, что по сравнению с любым из полусинтетических артемизининов два упомянутых триоксолана либо являются более активными противомалярийными средствами, либо имеют более продолжительные периоды полужизни.
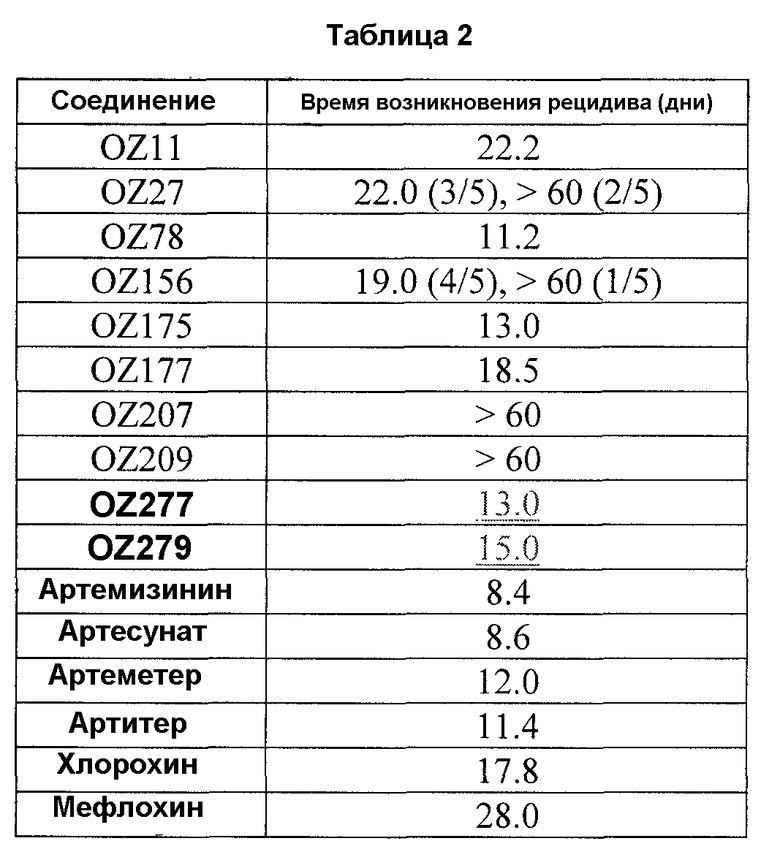
Пример 4
Действие триоксоланов на виды Schistosoma
Действие триоксолана OZ207 на Schistosoma japonicum
Таблица 3
Сравнительное действие OZ207 и артеметера на мышей, инфицированных Schistosoma japonicum
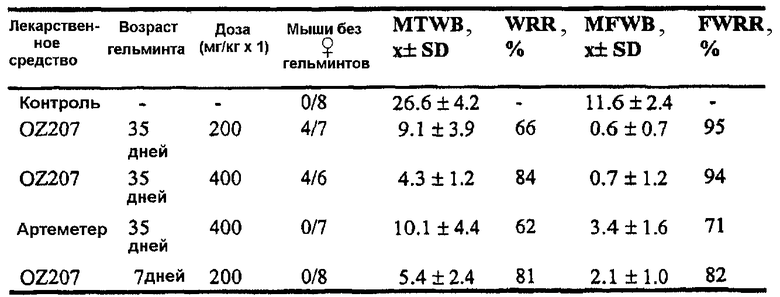
MTWB (mean total worm burden) - среднее общее количество гельминтов; WRR (worm reduction rate) - степень уменьшения количества гельминтов; MFWB (mean female worm burden) - среднее количество женских особей гельминтов; FWRR (female worm reduction rate) - степень уменьшения количества женских особей гельминтов.
Таблица 3 показывает, что среднее общее количество гельминтов и среднее количество женских особей гельминтов в группе, обработанной OZ207, 400 мг/кг, было значительно ниже, чем в группе, обработанной артеметером, 400 мг/кг (P<0,01). Среднее количество женских особей гельминтов в группе, обработанной OZ207, 200 мг/кг, также было значительно ниже, чем в группе, обработанной артеметером (P<0,01).
Действие триоксоланов на шистосомы c возрастом 21 день
Мышей инфицируют 100 церкариями Schistosoma mansoni на 21 день после обработки. Каждой группе перорально вводят однократную дозу триоксоланов 200 мг/кг. Необработанные мыши служат контролем. Все группы умерщвляют через 4 недели после обработки, печень и кишечник извлекают и выделяют. Печень и кишечник сдавливают, при этом можно наблюдать живые мужские и женские особи гельминтов и подсчитать их количество. Действие соединений оценивают по общему количеству гельминтов и количеству женских особей гельминтов. Результаты приведены в таблице 4.
Действие триоксоланов на взрослые шистосомы (возраст 49 дней)
Мышей инфицируют 100 церкариями Schistosoma mansoni на 49 день после обработки. Каждой группе перорально вводят однократные дозы OZ соединений 200, 400 и 600 мг/кг. Необработанные мыши служат контролем. Все группы умерщвляют через 4 недели после обработки, печень и кишечник извлекают и выделяют. Печень и кишечник сдавливают, при этом можно наблюдать живые мужские и женские особи гельминтов и подсчитать их количество. Действие соединений оценивают по общему количеству гельминтов и количеству женских особей гельминтов, результаты приведены в таблице 4.
Таблица 4
Активность против Schistosoma mansoni in vivo
(инфицированы самки мышей)
Пример 5
Активность триоксоланов против P. berghei
При определении ED50/ED90/ED99 с применением однократной дозы мышей Moro SPF или NMRI (группа из трех животных), инфицированных штаммом ANKA вида Plasmodium berghei, обрабатывают в первый день после инфицирования. Триоксоланы растворяют или суспендируют в стандартной суспендирующей среде (SSV) и вводят одноразовыми дозами 10, 6, 3, 1, 0,3 и 0,1 мг/кг перорально и подкожно. SSV содержит 0,5% мас./об. карбоксиметилцеллюлозы, 0,5% об./об. бензилового спирта, 0,4% об./об. твина 80 и 0,9% мас./об. хлорида натрия в воде. Противомалярийную активность оценивают по процентному уменьшению паразитемии на третий день после инъекции. Значения ED50/ED90 рассчитывают, используя нелинейный подбор кривой по точкам.
В таблице 5 приведены значения ED50/ED90/ED99, полученные в результате перорального введения триоксоланов в составе композиции, содержащей SSV. Относительно липофильный артеметер является существенно более активным, чем более полярные артесунат и артелинат. Напротив, наиболее активные триоксоланы (OZ181, OZ207, OZ209) - различные солевые формы того же аминотриоксолана, а также амино- и амидотриоксоланы OZ277 и OZ279 представляют собой относительно полярные соединения.
Пример 6
Дозировка OZ279, OZ277, OZ256 и OZ209
На основании результатов дозирования OZ279, OZ277, OZ256 и OZ209 в экспериментах на крысах и собаках авторы определили предполагаемую оптимальную дозировку тех же соединений для применения на людях. Артесунат приведен в качестве эталонного соединения.
10 мг/кг
25 мг/кг
>30%
>20%
21 (DHA)
71,1
44,1
51,9
22,4
10 мг/кг
25 мг/кг
>30%
>20%
Не сделан
55,7(V)
96,1
38,3(V)
15,9(V)
Пример 7
Эффективность выбранных OZ соединений при лечении и профилактике малярийных инфекций
Самцов мышей Moro NMRI (Fü Albino, свободных от конкретного патогена), имеющих массу 18+2 г, инфицируют внутривенно (в.в.) 2×107 эритроцитами от донорных мышейштаммом ANKA вида P. Berghei, инфицированными на день 0 эксперимента. От донорных мышей с приблизительно 30% паразитемией забирали гепаринизированную кровь и разбавляли в физиологическом растворе до 108 паразитированных эритроцитов на 1 мл. Аликвоту (0,2 мл) данной суспензии инъецировали в.в. экспериментальным и контрольным группам мышей. У необработанных контрольных мышей паразитемия росла регулярно от 40 до 50% на день 3 после инфицирования и от 70 до 80% на день 4 после инфицирования. Мыши умирали между 5 и 7 днями после инфицирования. В течение экспериментов мышей содержали группами по 3 или 5 животных в клетках типа Makrolon II в кондиционируемой воздухом комнате для животных при 22-23°С. Корм с п-аминобензойной кислотой (РАВА) из 45 мг (NAFAG FUTTER food No 9009 PAB-45) на 1 кг массы тела и питьевая вода были доступны ad libitum.
Соединения OZ получают при соответствующей концентрации в виде либо раствора, либо суспензии, содержащих SSV (0,5% мас./об. СМС, 0,5% об./об. бензилового спирта, 0,4% об./об. твина 80 и 0,9% мас./об. хлорида натрия в воде). Их вводят per os (п.о.) в полном объеме из расчета 0,01 мл на грамм массы мыши. Активность соединения определяют разнообразными способами, описанными в последующих разделах. Также регистрируют время выживания, и выживание на 30-й день после инфицирования считают излечением.
Первый проводимый эксперимент состоит из введения разделенной дозы 3×10 мг/кг п.о., вводимой в дни 1, 2 и 3 после инфицирования против однократной дозы 1×30 мг/кг п.о., вводимой в день 1 после инфицирования. На день 4 после инфицирования получают препараты крови всех животных и окрашивают их с помощью красителя Giemsa. Паразитемию определяют с помощью микроскопа, рассчитывают разницу между средним значением для контрольной группы (берется за 100%) и средними значениями для экспериментальных групп и выражают ее в виде процента снижения. Соединения вводят перорально в среде SSV. Результаты показаны в таблице 7.
Как показано в таблице 7, дозы 3×10 мг/кг данных триоксоланов излечивают от 3/5 до 5/5 инфицированных мышей. При той же дозе ни одно из стандартных противомалярийных средств не излечивает ни одной инфицированной мыши. При дозе 1×30 мг/кг все тестируемые триоксоланы проявляют активности ≥99,9% на 3 день после обработки.
Второй эксперимент состоит из введения разделенных доз 3×3 мг/кг п.о. и 3×1 мг/кг п.о., вводимых в дни 1, 2 и 3 после инфицирования. На день 4 после инфицирования получают препараты крови всех животных и окрашивают их с помощью Giemsa. Паразитемию определяют с помощью микроскопа, рассчитывают разницу между средним значением для контрольной группы (берется за 100%) и средними значениями для экспериментальных групп и выражают ее в виде процента снижения. Соединения вводят перорально в среде SSV. Результаты показаны в таблице 8.
Как показано в таблице 8, при дозе 3×3 мг/кг четырнадцать триоксоланов имеют активности, равные 100%, и обеспечивают высокие показатели выживания. Из них OZ301, OZ329, OZ339, OZ349 и OZ357 излечивают 1/5, 2/5, 3/5, 2/5 и 1/5 инфицированных мышей соответственно. При дозе 3×1 мг/кг большинство триоксоланов является более активными, чем эталонные противомалярийные средства; шестнадцать из них имеют активности ≥90%. OZ209, OZ329 и OZ336 являются единственными триоксоланами с активностями, большими чем 99% при дозе 3×1 мг/кг. Все из тестированных соединений OZ343-OZ368 являются более активными, чем ссылочные противомалярийные средства.
Профилактические активности соединений сравнивают после введения п.о. однократной дозы 100 мг/кг различным группам из пяти животных в различное время после инфицирования. Все группы, включающие необработанную контрольную группу, далее инфицируют в одно и то же время. Паразитемию определяют для каждого животного на день 3 после инфицирования и определяют процент восстановления уровня паразитемии по сравнению с уровнями для животных, не получавших лекарства. Результаты приведены в таблице 9.
Уникальное профилактическое свойство OZ209 (3-дневная защита, аналогично МФХ) обнаружено также для OZ271.
Пример 8
Химические свойства солей OZ277
Синтезируют следующие тозилатные, малеатные, гидрохлоридные, тартратные и сукцинатные соли OZ277:
п-тозилат цис-адамантан-2-спиро-3'-8'-[[[(2'-амино-2'-метилпропил)амино]карбонил]метил]-1',2',4'-триоксаспиро[4.5]декана;
гидромалеат цис-адамантан-2-спиро-3'-8'-[[[(2'-амино-2'-метилпропил)амино]карбонил]метил]-1',2',4'-триоксаспиро[4.5]декана;
гидрохлорид цис-адамантан-2-спиро-3'-8'-[[[(2'-амино-2'-метилпропил)амино]карбонил]метил]-1',2',4'-триоксаспиро[4.5]декана;
гидротартрат цис-адамантан-2-спиро-3'-8'-[[[(2'-амино-2'-метилпропил)амино]карбонил]метил]-1',2',4'-триоксаспиро[4.5]декана;
гидросукцинат цис-адамантан-2-спиро-3'-8'-[[[(2'-амино-2'-метилпропил)амино]карбонил]метил]-1',2',4'-триоксаспиро[4.5]декана.
Их свойства показаны в таблице 10.
Пример 9
Получение малеатной соли OZ277
Исходные вещества:
Способ осуществляют следующим образом.
Загружают этанол (150 мл) при 20-25°С;
загружают OZ277 (60 г) при 20-25°С при перемешивании;
перемешивают при 20-25°С в течение 10 мин с получением прозрачного раствора;
добавляют раствор малеиновой кислоты (17,4 г в 90 мл этанола) по каплям при 20-25°С при перемешивании в течение 1 час;
загружают гептан (720 мл) при 20-25°С при перемешивании;
перемешивают в течение 4 час при 20-25°С;
фильтруют твердое вещество и промывают гептаном (60 мл);
аспирируют продукт досуха;
сушат продукт в вакууме при 20-25°С.
Полученный продукт имеет массу, равную 65-70 г.
Пример 10
Получение фармацевтических составов, содержащих в качестве активного ингредиента соединение OZ271
Согласно приведенным ниже технологическим схемам процессов готовили следующие фармацевтические составы, содержащие в качестве активного ингредиента соединение OZ271 по настоящему изобретению:
- таблетки;
- стерильный порошок для восстановления в виде водного раствора;
- лиофилизованный порошок для восстановления в виде водного раствора.
Приведенные схемы иллюстрируют стандартные методики получения фармацевтических препаратов, применимые ко всем соединениям, описываемым в настоящем изобретении.
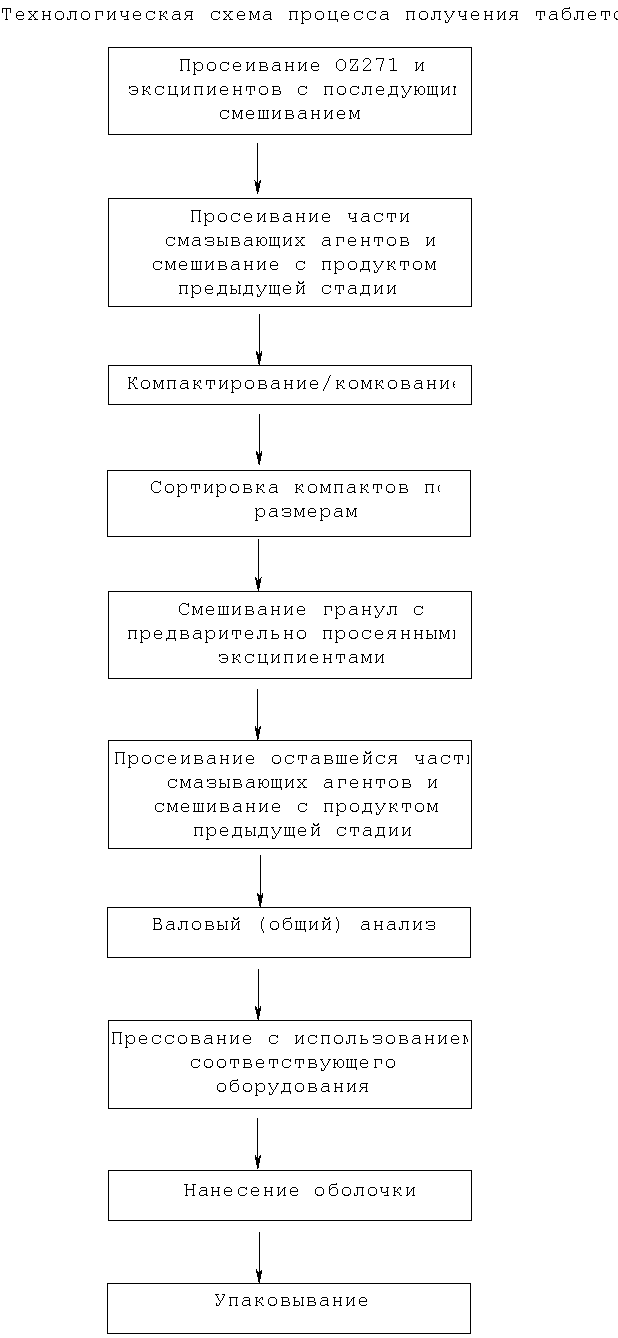
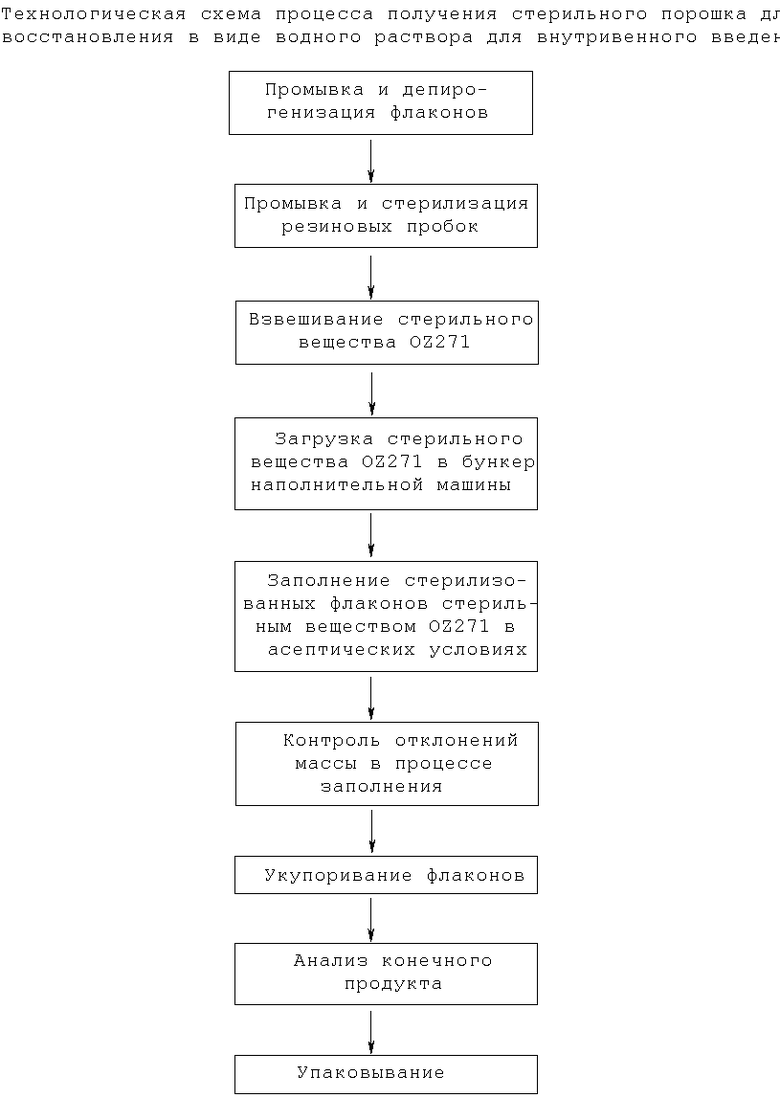
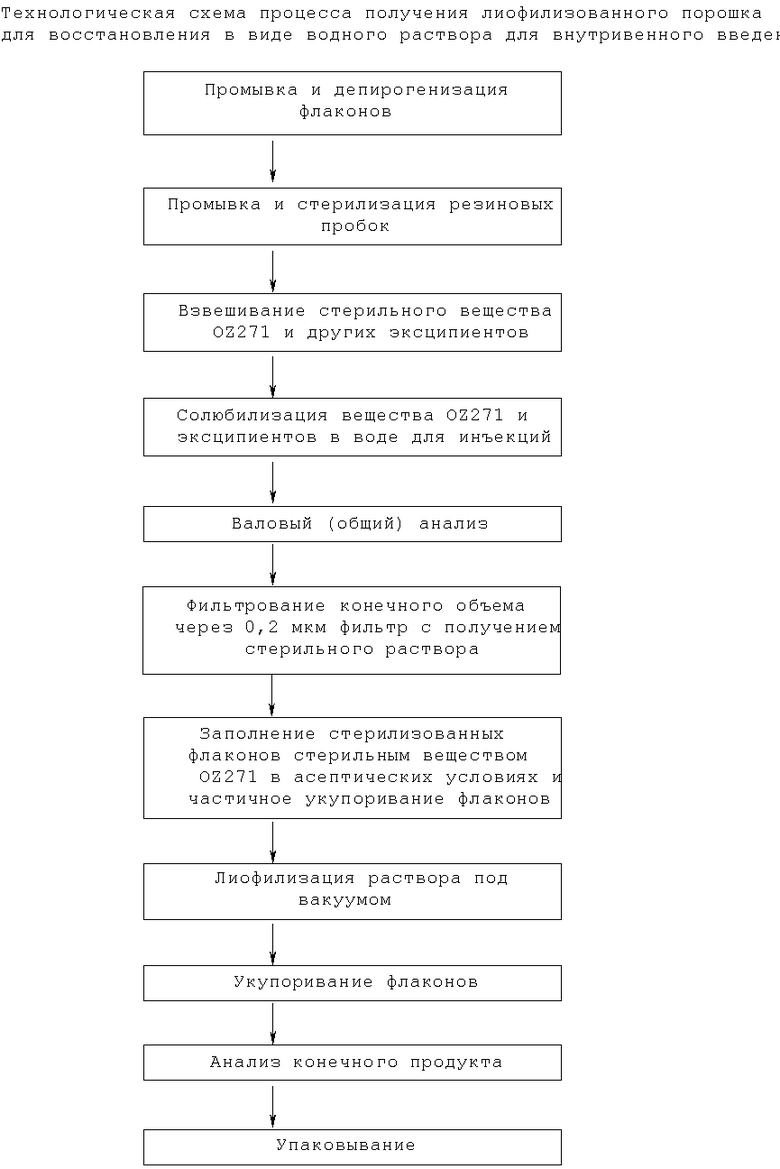
Следует учесть, что композиции данного изобретения, включающие спиро- и диспиро-1,2,4-триоксоланы, могут содержать триоксоланы, входящие в объем описанных выше формул, или пролекарственные формы или аналоги указанных соединений, либо рацемическую смесь или D- либо L-форму. Также подразумевают, что изобретение включает все биологически активные солевые формы соединений. Кроме того, могут быть осуществлены незначительные модификации количественного и качественного состава композиции, а также интервалов, приведенных в данном описании, которые все же будут соответствовать объему и сущности настоящего изобретения.
Из описания данного изобретения со ссылкой на конкретные композиции, концепции эффективности и т.п. специалистам в данной области станет понятно, что не предполагается ограничивать данное изобретение такими иллюстративными воплощениями или механизмами и что модификации могут быть осуществлены без отступления от объема и сущности данного изобретения, которые определены в прилагаемой формуле изобретения. Предполагается, что все такие очевидные модификации и изменения могут быть включены в объем настоящего изобретения, который определяется прилагаемой формулой изобретения. Подразумевается, что формула изобретения охватывает заявляемые компоненты и стадии в любой последовательности при условии, что такая последовательность удовлетворяет предполагаемым целям, если только из контекста не следует противоположного указания.
Все статьи, цитирующиеся в данном описании и приведенные в нижеследующем списке, специально включены в данное описание в качестве ссылок во всей их полноте.
ЛИТЕРАТУРНЫЕ ССЫЛКИ
de Almeida Barbosa, L.-C. et al., The Design, Synthesis and Biological Evaluation of Some Stable Ozonides With Anti-malarial Activity. J. Chem. Soc. Perkin Trans. I, 1996, 1101-1105.
de Almeida Barbosa, L.-C. et al., Synthesis of Some Stable Oozonides With Anti-malarial Activity. J. Chem. Soc. Perkin Trans. I, 1992, 3251-3252.
Cammenga, H.K. et al., Basic principles of thermoanalytical techniques and their applications in preparative chemistry. Angew. Chem. Int. Ed. Engl. 1995, 34, 1171-1187.
Cumming, J.N. et al., Antimalarial activity of artemisinin (qinghaosu) and related trioxanes: mechanism(s) of action. Adv. Pharmacol. 1997, 37, 254-297.
Dhingra, V.K. et al., Current Status of Artemisinin and Its Derivatives As Antimalarial Drugs. Life Sci. 2000, 66, 279-300.
Dong, Y.; Vennerstrom, J.L Peroxidic Antimalarials. Expert Opin. Ther. Patents 2001, 11, 1753-1760.
Fishwick, J., et al., The Toxicity of Artemisinin and Related Compounds on Neuronal and Glial Cells in Culture. Chem.-Biol. Interact. 1995, 96, 263-271.
Griesbaum, K. et al., Diozonides from coozonolyses of suitable O-methyl oximes and ketones. Tetrahedron 1997a, 53, 5463-5470.
Griesbaum, K. et al., Ozonolyses of O-alkylated ketoximes in the presence of carbonyl groups: a facile access to ozonides. Liebigs Ann./Recueil. 1997b, 1381-1390.
Jefford, C. Peroxidic Antimalarials. Adv. Drug Res. 1997, 29, 271-325.
Kashima, C. et al., Ozonolysis of Five-Membered Heterocycles. J. Het. Chem. 1987, 24, 637-639.
Meshnick, S.R. et al., Artemisinin and the antimalarial endoperoxides: from herbal remedy to targeted chemotherapy. Microbiol. Rev. 1996, 60, 301-315.
Park, B.K. et al., Safety Assessment of Peroxide Antimalarials: Clinical and Chemical Perspectives. Br. J. Clin. Pharmacol. 1998, 46, 521-529.
Titulaer, H.A.C., Zuidema, J. and Lugt, C.B. Formulation and pharmacokinetics of artemisinin and its derivatives. Int. J. Pharmaceut. 1991, 69, 83-92.
van Agtmael, M.A. et al., Artemisinin Drugs In the Treatment of Malaria: From Medicinal Herb to Registered Medication. Trends Pharmacol. Sci. 1999, 20, 199-205.
Vennerstrom, J.L. et al., Synthesis and Antimalarial Activity of Sixteen Dispiro-1,2,4,5-tetraoxane Analogs of WR 148999: Alkyl Substituted 7,8,15,16-Tetraoxadispiro[5.2.5.2]hexadecanes. J. Med. Chem. 2000, 43, 2753-2758.
Vroman, J.A. et al., Current Progress in the Chemistry, Medicinal Chemistry and Drug Design of Artemisinin Based Antimalarials. Curr. Pharm. Design 1999, 5, 101-138.
Wesche, D.L. et al., Neurotoxicity of artemisinin analogs in vitro. Antimicrob. Agents. Chemother. 1994, 38, 1813-1819.
White, N.J. Clinical pharmacokinetics and pharmacodynamics of artemisinin and derivatives. Trans. R. Soc. Trop. Med. Hyg. 1994, 88, 41-43.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИСПИРО 1,2,4-ТРИОКСОЛАНЫ КАК ПРОТИВОМАЛЯРИЙНЫЕ СРЕДСТВА | 2008 |
|
RU2493159C2 |
| ПРОИЗВОДНЫЕ ЦИКЛОПРОПИЛ-β-АМИНОКИСЛОТЫ | 2004 |
|
RU2312853C2 |
| ПРОИЗВОДНЫЕ РЕТИНОИДА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2748838C2 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ПИКОЛИНАМИДА С ФУНГИЦИДНЫМ ДЕЙСТВИЕМ | 2015 |
|
RU2704867C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2013 |
|
RU2651369C1 |
| СПИРОСОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ПЯТИЧЛЕННЫЕ КОЛЬЦА, ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ | 1994 |
|
RU2129555C1 |
| ЛЕЧЕНИЕ ИНФЕКЦИЙ H. PYLORI С ПРИМЕНЕНИЕМ ИНГИБИТОРОВ MTAN | 2015 |
|
RU2663803C2 |
| ГИДРОКСИПУРИНОВЫЕ СОЕДИНЕНИЯ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2673458C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗОЛО-[3,4-B]-1,3,4-ТИАДИАЗОЛА | 2017 |
|
RU2765180C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ АРИЛКОНДЕНСИРОВАННЫХ АЗАПОЛИЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2282619C9 |
Настоящее изобретение относится к спиро- или диспиро-1,2,4-триоксолану общей формулы I
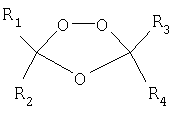
где R1 и R2, взятые вместе, представляют собой спироадамантил, 3,3,5,5-тетраметилспироциклогексил, спироциклододеканил;
R3 и R4 являются одинаковыми или различными и выбраны из замещенной или незамещенной ароматической или пиридильной группы, где ни один из R3 и R4 не может представлять водород, и, кроме того, R3 и R4, взятые вместе, могут образовывать замещенную или незамещенную алициклическую группу, которая необязательно прерывается одним атомом кислорода, серы или азота. Соединения данного изобретения являются структурно простыми, легкими для синтеза, нетоксичными и активными против малярийных паразитов. Описана также фармацевтическая композиция на основе соединений I и способ лечения малярии и шистосомоза. 7 н. и 12 з.п. ф-лы, 10 табл.
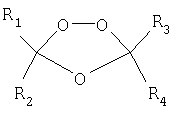
где R1 и R2, взятые вместе, представляют собой спироадамантил, 3,3,5,5-тетраметилспироциклогексил, спироциклододеканил;
R3 и R4 являются одинаковыми или различными и выбраны из замещенной или незамещенной ароматической или пиридильной группы, где ни один из R3 и R4 не может представлять водород; кроме того, R3 и R4, взятые вместе, могут образовывать замещенную или незамещенную алициклическую группу, которая необязательно прерывается одним атомом кислорода, серы или азота.
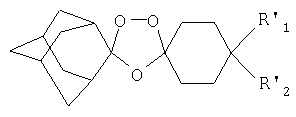 ,
,
где R1' и R2' являются одинаковыми или различными и выбраны из группы, состоящей из водорода, замещенных или незамещенных линейных или разветвленных алкильных, арильных и алкарильных групп, гидроксигруппы, галогена, и замещенных или незамещенных алициклических групп, замещенных или незамещенных гетероароматических групп и замещенных или незамещенных гетероциклических групп, где данные гетероароматические и гетероциклические группы содержат в цикле один или два атома, выбранных из кислорода, серы или азота, и далее при условии, что спироциклогексильное кольцо, к которому присоединены R1' и R2', необязательно прерывается одним атомом кислорода, серы или азота.
Адамантан-2-спиро-3'-8'-оксо-1',2',4'-триоксаспиро[4.5]декан;
Адамантан-2-спиро-3'-11',11'-диметил-1',2',4',9',13'-пентаоксадиспиро[4.2.5.2]пентадекан;
Адамантан-2-спиро-3'-8'-пропил-1',2',4'-триоксаспиро[4.5]декан;
Адамантан-2-спиро-3'-8'-фенил-1',2',4'-триоксаспиро[4.5]декан;
Адамантан-2-спиро-3'-8'-этоксикарбонилметил-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-карбокси-1',2',4'-триоксаспиро[4.5]декан;
Адамантан-2-спиро-3'-8'-карбоксиметил-1',2',4'-триоксаспиро[4.5]декан;
транс-Адамантан-2-спиро-3'-8'-[(гидроксиамино)карбонил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[1'Н-имидазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-бензил-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-(аминометил)-1',2,4'-триоксаспиро[4.5]декан гидрохлорид;
цис-Адамантан-2-спиро-3'-8'-(2'-гидроксиамино-2'-оксоэтил)-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-(1'Н-1',2',4'-триазол-1'-илметил)-1',2',4-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-(1'Н-имидазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан гидрохлорид;
цис-Адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декан цитрат;
цис-Адамантан-2-спиро-3'-8'-[2'-(4'-морфолинил)-2'-оксоэтил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-(2'-гидрокси-2'-метилпропил)-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декан п-тозилат;
цис-Адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декан мезилат;
цис-Адамантан-2-спиро-3'-8'-[(фенилсульфонил)метил]-1',2',4'-триокса-8'-азаспиро [4.5]декан;
цис-Адамантан-2-спиро-3'-8'-(1'Н-имидазол-1-илэтил)-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[[4'-метил-1'-пиперазинил)карбонил]метил]-1',2',4'-триоксаспиро [4.5]декан;
цис-Адамантан-2-спиро-3'-8'-(аминоэтил)-1',2',4'-триоксаспиро[4.5]декан гидрохлорид;
цис-Адамантан-2-спиро-3'-8'-(1'Н-1',2',4'-триазол-1'-илметил)-1',2',4'-триоксаспиро[4.5]декан мезилат;
цис-Адамантан-2-спиро-3'-8'-[[(4'-пиридинилкарбонил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[[(2'-амино-2'-оксоэтил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[[(метансульфонил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[[[(1'Н-имидазол-4'-ил)карбонил]-амино]метил]-1',2',4'-триоксаспиро[4.5]декан мезилат;
цис-Адамантан-2-спиро-3'-8'-[[[(1'-оксидо-4'-пиридинил)карбонил]амино]метил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[[(аминокарбонил)амино]метил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[[[(диметиламино)карбонил]-амино]метил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[[[(4'-метил-1'-пиперазинил)-карбонил]амино]метил]-1',2',4'-триоксаспиро[4.5]декан;
N-(цис-Адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-метил)оксамид;
транс-Адамантан-2-спиро-3'-8'-(аминометил)-1',2',4'-триоксаспиро[4.5]декан мезилат;
цис-Адамантан-2-спиро-3'-8'-[[[(1'-оксидо-2'-пиридинил)карбонил] амино] метил]-1',2',4'-триоксаспиро[4.5]декан;
цис-Адамантан-2-спиро-3'-8'-[[[(2'-амино-2'-метилпропил)-амино]карбонил]метил]-1',2',4'-триоксаспиро[4.5]декан;
N-(цис-Адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-метил)-N'-(транс-4-аминоциклогексил)оксамид п-тозилат;
N-(цис-Адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-метил)-N'-(2-амино-2-метилпропил)транс-4-аминоциклогексил)оксамид мезилат;
цис-Адамантан-2-спиро-3'-8'-[2'-[[(2'-амино-2'-метилпропил)амино]карбонил]этил-1',2',4'-триоксаспиро[4.5]декан п-тозилат;
N-(цис-Адамантан-2-спиро-3'-1',2',4'-триоксаспиро[4.5]декан-8'-метил)-N'-(4-пиперидинил)оксамид мезилат;
цис-Адамантан-2-спиро-3'-8'-[[[[(1'-аминоциклопропил)метил]амино]карбонил]метил]-1',2',4'-триоксаспиро[4.5]декан п-тозилат; и цис-Адамантан-2-спиро-3'-8'-(1-пиперазинилкарбонил)-1',2',4'-триоксаспиро[4.5]декан п-тозилат.
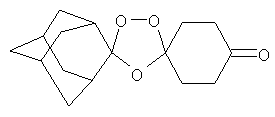
окислителем, с образованием диспиро 1,2,4-триоксолана, включающего структуру лактона.
| Способ получения 11-нитро-12- @ (2-метокси)-этокси @ -бензо-9-краун-3 | 1987 |
|
SU1421743A1 |
| US 5414093 А, 09.05.1995 | |||
| 0 |
|
SU331576A1 | |
Авторы
Даты
2006-03-10—Публикация
2002-06-21—Подача