Область и предпосылки изобретения
Заявка является продолжением заявки США 08/094855, опубликованной 20 июля 1993, по которой испрашивается приоритет.
Настоящее изобретение относится к пятичленным кольцевым соединениям, в которых к указанному пятичленному кольцу, как это описано ниже, спирообразом присоединено кольцо, имеющее или не имеющее перемычку и содержащее один атом азота, а также фармацевтическому составу, включающему в себя указанные спиросоединения.
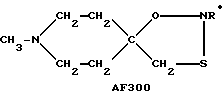
Известны (US 4104397) спиросоединения, в которых 1,3-диоксолан и хинуклидин связаны обычным спироуглеродным атомом. Описаны синтез и характеристики (активность и избирательность связывания между сайтами M1 и M2) оптических изомеров одного подобного соединения ("AF30") (Saunders J. et al., J. Med. Chem. 30: 969 (1987)); опубликован синтез спиродиоксолан/пиперидиновых аналогов AF30 и их агонистический эффект по отношению к холинэргической мускариновой активности (Saunders J. et al., 3. Med. Chem. 31: 486 (1988)); кроме того известны спирооксалан/хинуклидиновые аналоги, проявляющие очевидную мускариновую активность (Nordvall et al., J. Med. Chem. 35: 1541 (1992)).
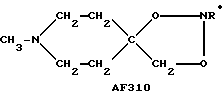
Обнаружены спиросоединения, проявляющие активность по меньшей мере по отношению к центральной нервной системе, в которых оксатиолановые кольца спирообразом соединены с хинуклидиновыми кольцами (см. ЕР-А-0205247, US 4855290, ЕР-А-0303391, US 4981858, где описаны четыре различных оптических изомера одного соединения такого рода, а также (ЕР-А-0314444, US 4900830, US 4876260, где рассматриваются дальнейшие спирооксатиоланы и изотопически замещенные аналоги). Кроме того, описаны некоторые спирооксазолины (US 5053412) и спиротиазолины (ЕР-А-0452101). Следует подчеркнуть, что все содержание вышеупомянутых патентов и опубликованных патентных заявок, в которых по меньшей мере один из заявителей входит в число заявителей настоящего изобретения, а также все содержание других патентов, опубликованных патентных заявок и научных статей, цитируемых в настоящем описании, равно как и содержание заявки (WO 95/03303) (поскольку оно не упоминается в исправленной версии настоящей заявки) включено в настоящую заявку в виде ссылок. Проведены широкомасштабные исследования биологической активности 2-метилспиро(1,3-оксатиолан-5,3')хинуклидина, который существует в виде геометрических цис- и транс-изомеров в зависимости от того, расположена ли 2-метильная группа на той же стороне оксатиоланового кольца, что и атом азота, входящий в состав хинукдинового кольца (цис-), либо на противоположной стороне от указанного атома азота (транс-); на основании доклинических тестов показано, что указанное цис-соединение (условно обозначаемое AF102B) представляется особо многообещающим в плане контроля старческого слабоумия по типу Альцгеймера (ССТА). Каждый из вышеупомянутых цис- и транс-изомеров может быть подвергнут оптическому разделению, кроме того, можно исследовать биологическую активность каждого из упомянутых оптических изомеров.
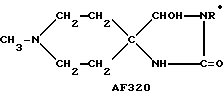
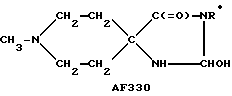
Показано, что соединения, в которых системы насыщенного N-гетероциклического кольца спирообразом соединены с оксолановыми, тиолановыми, оксатиолановыми, диоксолановыми или дитиолановыми кольцами, являются агонистами холинэргической активности или проявляют терапевтическую активность (ЕР-А-0311313, EP-A-0189370). Известны соединения, в которых насыщенные N-гетероциклические кольца спирообразом присоединены к 2-положению 1,3-оксатиолан-4-(или 5-)онов, либо их диоксолановых или дитиолановых аналогов, проявляющие мускариновую агонистическую активность по отношению к рецепторам M1 (JР-А-02/247183); другие соединения, в которых системы насыщенного N-гетероциклического кольца спирообразом присоединены к оксо- или тионо-оксалидинам, либо к оксо- или тионо-изоксазолидинам, обладают активностью по отношению к ЦНС или могут быть использованы при лечении психических заболеваний (JР-А-6З/208590, JР-А-02/164882).
Опубликовано получение более чем 50 спиропиперидин (или пирролидин)/гидантоинов и некоторых их тионовых аналогов, проявляющих противовоспалительные свойства (Winters et al., Farmco, Ed. Sci. 25(9): 681-93 (1970)). Имеется сообщение о получении группы спиропиперидин (или тетрагидропиран, или тиопиран)/гидантоинов, обладающих ингибирующей активностью по отношению к ферменту, но не оказывающих существенного противоспазматического действия (Courtoison J. С. et al., in Farmaco, Ed.Sci., 43(2): 153-60 (1988)).
Основной задачей настоящего изобретения является получение новых спиросоединений. Другая задача, предусматривающая приемлемый фармацевтический состав, содержащий эти соединения, будет очевидна из приведенного ниже описания.
Описание изобретения
Один из аспектов настоящего изобретения предусматривает спиросоединения, отвечающие приведенной ниже формуле (АА)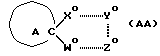
в том числе их фармацевтически приемлемые соли, энантиомеры, рацематы и четвертичные соединения, представляющие собой производные указанных соединений, содержащих третичный атом азота, которые содержат пятичленную группировку, в которой спиросвязь реализуется атомом углерода, входящим как в состав пятичленной группировки, так и в состав насыщенной кольцевой системы, содержащей один атом азота, причем
указанный пятичленный остаток выбирают из группы, включающей 3-этилгидантоин; 1-ацетилгидантоин; 3-метилгидантоин; 3-пропаргилгидантоин; 2,4-дитиогидантоин; 2-тиогидантоин; оксазолидин-2- тион; 3-этилоксазолидин-2-он; оксазолидин2,4-дион; 3-этилоксазолидин-2,4-дион; 2-метил-1,4-оксазолидин-3-он; 2-метил-1,4-тиазолидин-3-он; 2,4-диметил-1,4-тиазолидин-3-он; 2-этил-1,4- тиазолидин-3-он; 2-этил-4-метил-1,4-тиазолидин-3-он; 3-метил-1,4- оксатиолан-2-он; 2-этил-1,4-тиазолидин-3-он; 5-метил-1,3- оксазолидин; 4-этил-1,3-оксазолидин; 3-этил-1,4-оксатиолан-2-он; 5-метил-1,3-диоксолан-4-он; N-метилсукцинимид; N-этил-сукцинимид; 3-трет-бутилгидантоин; 3-(4-пирролидино-2-бутинил)-гидантоин; 3-(2- бутинил)-гидантоин; 2,5-бис(метилтио)-4Н-имидазол; 3-этил-4- тиогидантоин; 4-метилтиоимидазолин-2-тион; 3-этил-2,4- дитиогидантоин; 4-этилтио-3-имидазолин-2-тион; 1-этил-2-этилтио-2- имидазолин-5-тион; 2-тио-4 -β- гидроксиэтилиминогидантоин; 2,5- бис(аминометил)-4Н-имидазол; 2-метил-2-тиазолин; 2-метил-2- имидазолин; 2-метил-2-оксазолин-4-он; 2-метил-4Н(5Н)-имидазол-5(4)-он; 2-метилтио-5-метокси-4Н-имидазол; 2-метилтио-5-амино-4Н- имидазол; 2-метилтио-5-аминометил-4Н-имидазол; 2-тион-3-этилгидантоин; 2-тион-3-трет-бутилгидантоин; 2-метилтио-2-имидазолин-5(4)-он; 1-этил-2-этилтио-2-имидазолин-5-он и 1-этил-2-имидазолин-5-он;
указанную насыщенную кольцевую систему А, содержащую один атом азота, выбирают из числа групп, включающих в себя группировки К, М, N: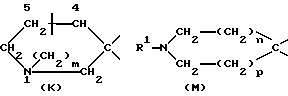
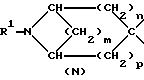
в структуре К мостик одним концом присоединен к положению 1, а другим концом - к положению 4 или 5;
m равно 2;
n и p независимо друг от друга равны 1, причем n + p = 2;
R1 обозначает группу, выбранную из числа следующих: атом водорода, C1-6-алкил, С2-6-алкинил.
Один из вариантов настоящего изобретения предусматривает спиросоединения, в которых указанную насыщенную кольцевую систему, содержащую один атом азота, выбирают из группы, включающей в себя: пиперидин, 1-метилпиперидин, 1-пропаргилпиперидин, N-метилнортропан и хинуклидин.
К числу конкретных спиросоединений по изобретению относятся следующие:
1-метилпиперидин-4-спиро-4'-(2',5'-бис(метилтио)-4Н'-имидазол);
1-метилпиперидин-4-спиро-5'-(3'-этил-4'-тиогидантоин);
1-метилпиперидин-4-спиро-5'-(4'-метилтиоимидазолин-2'-тион);
1-метилпиперидин-4-спиро-5'-(3'-этил-2',4'-дитиогидантоин);
1-метилпиперидин-4-спиро-5'-(4'-этилтио-3'-имидазолин-2'-тион);
1-метилпиперидин-4-спиро-4'-(1'-этил-2'-этилтио-2' -имидазолин-5'-тион);
1-метилпиперидин-4-спиро-5'-(2'-тио-4' β -гидрокси- этилиминогидантоин);
1-метилпиперидин-4-спиро-4'-(2',5'-бис(аминометил)-4'H- имидазол);
1-метилпиперидин-4-спиро-5'-(3'-этилоксазолидин-2'-он)
1-метилпиперидин-4'-спиро-4'-(2'-метил-2'-тиазолин);
1-метилпиперидин-4-спиро-4'(5')-(2'-метил-2'-имидазолин);
1-метилпиперидин-4-спиро-5'-(2'-метил-2'-оксазолин-4'-он);
1-метилпиперидин-4-спиро-4'(5')-[2'-метил-4'H(5'Н)- имидазол-5'(4')-он];
1-метилпиперидин-4-спиро-4'-(2'-метилтио-5'-метокси-4'H-имидазол);
1-метилпиперидин-4-спиро-4'-(2'-метилтио-5'-амино-4'Н-имидазол);
1-метилпиперидин-4-спиро-4'-(2'-метилтио-5'-аминометил-4'Н-имидазол);
1-метилпиперидин-4-спиро-5'-(3'-этилгидантоин);
1-метилпиперидин-4-спиро-5'-(1'-ацетилгидантоин);
пиперидин-4-спиро-5'-(3'-этилгидантоин);
1-метилпиперидин-4-спиро-5'-(3'-метилгидантоин);
пиперидин-4-спиро-5'-(3'-метилгидантоин);
1-метилпиперидин-4-спиро-5'-(3'-пропаргилгидантоин);
N-метилнортропан-3-спиро-5'-гидантоин;
N-мeтилнортропан-3-cпиpo-5'-(3'-метилгидантоин);
N-метилнортропан-3-спиро-5'-(3'-метилгидантоин);
1-метилпиперидин-4-спиро-5'-(2',4'-дитиогидантоин);
1-метилпиперидин-4-спиро-5'-(2'-тиогидантоин);
1-метилпиперидин-4-спиро-5'-(оксазолидин-3'-тион);
1-метилпиперидин-4-спиро-4'-(3'-этилоксазолидин-2',4'-он);
1-метилпиперидин-4-спиро-5'-(оксазолидин-2',4'-дион);
1-метилпиперидин-4-спиро-5'-(3'-этилоксазолидин-2',4'-дион);
1-метилпиперидин-4-спиро-5'-(2'-метил-1',4'-оксазолидин-3'-он);
1-метилпиперидин-4-спиро-5'-(2'-метил-1',4'-тиазолидин-3'-он);
1-метилпиперидин-4-спиро-5'-(2',4'-диметил-1',4'-тиазолидин-3'-он);
1-метилпиперидин-4-спиро-5'-(2'-этил-1',4'-тиазолидин-3'-он);
1-метилпиперидин-4-спиро-5'-(2'-этил-4-метил-1',4'- тиазолидин-3'-он);
пиперидин-4-спиро-5'-(3'-метил-1',4'-оксатиолан-2'-он);
пиперидин-4-спиро-5'-(2'-метил-1',4'-тиазолидин-3'-он);
1-метилпиперидин-4-спиро-5'-(3'-метил-1',4'- оксатиолан-2'-он);
1-метилпиперидин-4-спиро-2'-(5'-метил-1',3'-оксазолидин);
1-метилпиперидин-4-спиро-2'-(4'-этил-1',3'-оксазолидин);
1-метилпиперидин-4-спиро-5'-(3'-этил-1',4'-оксатиолан-2'-он);
1-метилпиперидин-4-спиро-5'-(2'-метил-1',4'-тиазолидин-3'-он);
2-метилпиперидин-4-спиро-5'-(2'-этил-1',4'-тиазолидин-3'-он);
1-метилпиперидин-4-спиро-2'-(5'-метил-1',3'-диоксолан-4'-он);
1-метилпиперидин-4-спиро-5'-(2'-метил-1',4'- тиазолидин-3'-тион);
2-N-метилспиро-(1,3-сукцинимид-4,3')хинуклидин;
2-N-этилспиро-(1,2-сукцинимид-4,3')хинуклидин;
1-метилпиперидин-4-спиро-5'-[3'-(4-пирролидино-2-бутинил) -гидантоин];
1-метилпиперидин-4-спиро-5'-(3'-трет-бутилгидантоин);
1-пропаргилпиперидин-4-спиро-5'-(3'-этилгидантоин);
1-метилпиперидин-4-спиро-5'-[3'-(2-бутинил)-гидантоин];
пиперидин-4-спиро-5'-(3'-пропаргилгидантоин);
2-метил-1,4-тиазолидин-3-он-спиро[5, 3']-хинуклидин;
1-метилпиперидин-4-спиро-5'-(2'-тион-3'-этилгидантоин);
1-метилпиперидин-4-спиро-4'-(2'-тион-3'-трет-бутилгидантоин);
1-метилпиперидин-4-спиро-4'(5')-(2'-метилтио-2'-имидазолин-5'(4')-он);
1-метилпиперидин-4-спиро-4'-(1'-этил-2'-этилтио-2'-имидазолин-5'-он);
1-метилпиперидин-4-спиро-4'-(1'-этил-2'-имидазолин-5'-он).
Особо следует отметить любые (одно или несколько) выделенные право- и лево-вращающие энантиомеры, выбранные из числа следующих:
d- и l-1-метилпиперидин-4-спиро-5'-(2'-метил-1',4'- тиазолидин-3'-он), и
d- и l-1-метилпиперидин-4-спиро-5'-(2'-этил-1', 4'- тиазолидин-3'-он), включая их фармацевтически приемлемые соли и четвертичные соединения.
Предусмотренные настоящим изобретением соединения проявляют фармакологическую активность и поэтому могут быть использованы в качестве фармацевтических средств, например, при терапии. Конкретнее, предусмотренные настоящим изобретением спиросоединения влияют на функционирование центральной и/или периферической нервной системы. Общей характерной особенностью указанных соединений является их активность по отношению к холинэргической системе, причем рассматриваемые соединения представляют собой лиганды мускариновых рецепторов. Таким образом, еще один аспект настоящего изобретения предусматривает спиросоединения формулы АА, обладающие мускариновой активностью. Соединения по изобретению, как было установлено авторами заявки, дополнительно обладают биологической активностью одного из следующих типов:
нейротрофо-подобная или синергическая активность при совместном действии с ФРН,
активность, вызывающая секрецию белка-предшественника амилоида (БПА) и снижающая токсичность β -амилоидов,
активность, повышающая долю дефосфорилированных τ -белков, и ФРН-подобная активность.
Такие соединения составляют еще один аспект изобретения.
Тесты, использованные для оценки биологической активности соединений, предусмотренных настоящим изобретением, детально описаны ниже.
Еще один вариант воплощения настоящего изобретения предусматривает соединения, отвечающие формуле АА с учетом нижеперечисленных молекулярных характеристик,
где r обозначает относительное положение, определяемое по расположению аниона по отношению к катионной форме атома азота (обозначаемого N*), который связан не двойной связью и находится в составе кольца А (или А') при наиболее стабильной конформации рассматриваемого соединения;
X* представляет собой гетероатом, входящий в состав изображенного 5-членного кольца, причем указанный гетероатом находится в соседнем положении по отношению к соответствующему спироатому углерода;
Z* обозначает атом, следующий в изображенном 5-членном кольце через 1 от атома X*;
Q* является атомом С или N, расположенным на конце боковой цепи, которая присоединена к атому, находящемуся в составе изображенного кольца между атомами X* и Z*; при этом атомы водорода, входящие в состав боковой цепи, не принимаются в расчет;
указанные молекулярные характеристики могут принимать следующие конкретные значения:
плоский угол r-X*-Q*-Z* в пределах от -54o до -170o;
молекулярные расстояния: r-N* = 3,0 ангстремов (относительное расстояние);
r-X* = 5,7-6,75 ангстремов;
r-Q* = 7,9-8,90 ангстремов;
x-Q* = 2,4-2,8 ангстремов;
показано, что соответствующие соединения, имеющие перечисленные выше молекулярные характеристики, проявляют агонистическую активность по отношению к мускарину. Указанная закономерность, выведенная на основании молекулярных характеристик, подтверждена приведенными ниже биологическими тестами (особо см. Таблицу 1).
Кроме того, предложен фармацевтический состав, предназначенный для использования при лечении заболеваний центральной и периферической нервной системы у млекопитающих; рассматриваемый состав включает в себя эффективное для лечения вышеупомянутого заболевания количество по меньшей мере одного соединения, отвечающего формуле (АА), в том числе фармацевтически приемлемые соли, энантиомеры и рацематы указанных соединений. Состав может содержать по меньшей мере один фармацевтически приемлемый разбавитель, носитель или добавку. В предпочтительном случае указанный состав находится либо в форме, приемлемой для перорального, ректального, парентерального или подкожного введения (в этом случае рассматриваемый состав может дополнительно включать в себя низкомолекулярные жирные кислоты), либо в форме, предназначенной для вдувания или впрыскивания в нос, а также может находится в форме единицы дозирования. По меньшей мере одно соединение, предусмотренное настоящим изобретением, может входить в состав указанной единицы дозирования в количестве приблизительно от 0,5 до 100 мг, в предпочтительном случае - приблизительно от 5 до 100 мг, в более предпочтительном случае - приблизительно от 10 до 50 мг.
В соответствии с одним из вариантов воплощения настоящего изобретения, фармацевтический состав, описанный в предыдущем абзаце, может дополнительно включать в себя по меньшей мере еще одно фармацевтически активное соединение, выбранное из числа следующих: физостигмин, тетрагидроаминоакридин, холин, лецитин, пирацетам, анирацетам, прамирацетам, оксирацетам, 4-аминопиридин, 3,4-диаминопиридин, соматостатин, пирензепин, N-метилатропин, N-бутилскополамин, скополамин, клонидин, кванфамицин, пропантелин, метантелин, гликопирролат, тропенцилиум, нортриптилин, амитриптилин, имипрамин, минаприн, сековерин, AFDX-116, никотин, алапроклат, зимелидин, депренил, а также Фактор Роста Нервов.
Еще один вариант воплощения настоящего изобретения предусматривает фармацевтический состав, который включает в себя по меньшей мере одно соединение формулы АА, а также Фактор Роста Нервов (ФРН), причем предусмотренное настоящим изобретением соединение (соединения) содержится в таком количестве, которое стимулирует рост нервов, обусловленный активностью ФРН. Большинство соединений, предусмотренных настоящим изобретением, в отличие от уже известных конкретных соединений, оказывающих эффект на центральную или периферическую нервную систему, не способны самостоятельно вызывать рост нервов в отсутствие ФРН, что обеспечивает лучший контроль в том случае, если в результате терапии желают стимулировать рост нервов. Тем не менее, некоторые наиболее активные соединения, предусмотренные настоящим изобретением, способны вызывать рост нервов независимо от ФРН.
Предусмотренные настоящим изобретением соединения могут применяться для лечения заболеваний у млекопитающих, если указанные заболевания подвержены лечению под действием эффективного количества соединения (соединений), проявляющего мускариновую активность; рассматриваемые соединения могут быть использованы в форме фармацевтических составов, включающих в себя эффективное количество указанных соединений и соответствующих по другим параметрам приведенному выше описанию.
Кроме того, настоящее изобретение предусматривает использование соединения, отвечающего приведенной выше формуле (АА), включая фармацевтически приемлемые соли, четвертичные соединения, представляющие собой структурные производные указанных соединений, имеющих третичный атом азота, а также энантиомеры и рацематы указанных соединений, для получения медикамента, обладающего мускариновой активностью.
Методы, используемые для получения соединений, предусмотренных настоящим изобретением, хорошо известны специалистам в области органической химии в качестве методов получения пятичленных колец, замещения по кольцу, изменения степени насыщенности/ненасыщенности кольца, внутренней перегруппировки солей и оснований, образования четвертичной соли и так далее. Таким образом, несмотря на то, что в дальнейшем описании будут перечислены определенные методы получения конкретных соединений, предусмотренных настоящим изобретением, для получения указанных соединений также могут быть использованы и другие методы, очевидные для специалиста.
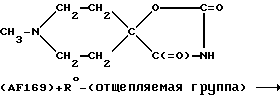
В том случае, если желаемое пятичленное кольцо представляет собой, например, гидантоин, указанное кольцо может быть получено при взаимодействии соответствующего насыщенного N-гетероциклического кетона (например 1-метилпиперидин-4-она) с (NH4)2CO3 + CN-, после чего атом азота, находящийся в 3'-положении рассматриваемого кольца, может быть замещен известным способом. Указанные реакции могут быть проиллюстрированы следующим образом: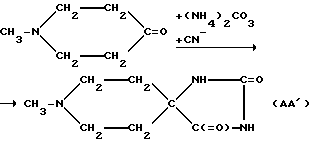
(АА') + R0 - (отщепляемая группа)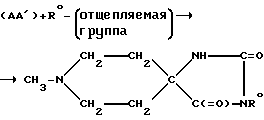
в том числе: AF160 (R0=Et); AF178 (R0=Me); AF185 (R0=пропаргил); AF167 (R0= Me, аналог*); AF168 (R0=Et, аналог*); символом * обозначены соответствующие N-метилпиперидиновые остатки, содержащие 2-6 этиленовую перемычку, т. е. аналоги N-метилнортропана.
Отщепляемая группа, входящая в состав указанного реагента "R0-(отщепляемая группа)", может представлять собой атом брома, атом хлора, либо остаток п-толуолсульфоновой кислоты, в то время как группа R0 соответствует использованному выше обозначению за исключением атома водорода, алкокси и алканоила. Рассматриваемая реакция замещения может быть осуществлена при хорошо известных условиях, в том числе при взаимодействии 3'-незамещенного гидантоина в присутствии щелочи (такой как КОН), а также при использовании растворителя, такого как этанол. Соответствующее 1',3'-двузамещенное соединение можно получить в результате вышеописанной реакции при использовании избытка указанного реагента "R0-(отщепляемая группа)", либо при взаимодействии соединения (Б) с реагентом "R0-(отщепляемая группа)",
1-метильную группу, входящую в состав структуры (Б), можно удалить в результате реакции с деметилирующим агентом, таким как CH3CH(Cl)OCOCl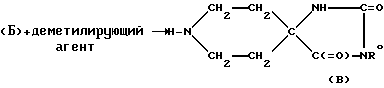
в том числе AF160(Des) (R0=Et); AF179 (R0=Me).
Структуру (Б) также можно получить следующим образом: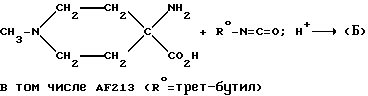
При замещении соединения R0-N=C=S в ходе аналогичной реакции получают (Б)-3-тион, в том числе AF181 (R=Et), AF184 (R=трет-бутил).
Взаимодействие между соединением (АА) и алканоил галогенидом, либо алканоильным ангидридом, осуществляемое при стандартных условиях, вызывает следующее замещение по указанному 1'-положению: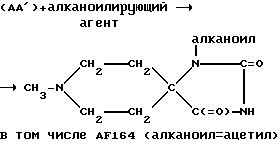
В том случае, если желаемое пятичленное кольцо представляет собой дитиогидантоин, указанные соединения можно получить, например, посредством образования вышеупомянутого кольца в результате взаимодействия между соответствующим насыщенным N-гетероциклическим кетоном и CN-, NH4Cl и CS2. Если гидантоины замещают (например с помощью алкилирования) по соответствующим атомам азота, то на основе тиогидантоинов получают продукты, замещенные по атомам азота и/или серы. Приведенные ниже Примеры иллюстрируют условия реакции, способствующие образованию разных продуктов, либо смеси продуктов, которые в дальнейшем могут быть разделены. Указанные реакции могут быть проиллюстрированы следующим образом (примером соответствующего N-гетероциклического кетона является 1-метилпиперидин-4-он):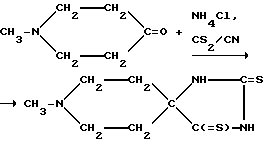
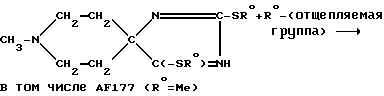
и/или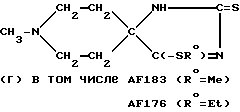
и/или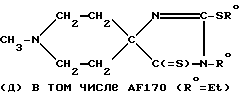
Указанная отщепляемая группа, а также группа R0, входящие в состав реагента "R0-(отщепляемая группа)", могут соответствовать аналогичным группам, описанным выше в случае гидантоинов. Реакции замещения можно осуществлять при хорошо известных условиях.
Обычно дигидантоины также можно получать с помощью реакций между соответствующими гидантоинами и R2S2, в результате чего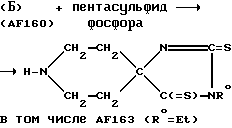
В том случае, если соединение (Д) приводят во взаимодействие с 20%-ной HCl соответствующая связь S-R0 гидролизуется с получением следующего соединения: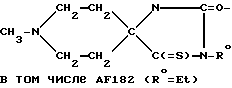
Сходная реакция между соединением (Г) и 20%-ной HCl приводит к образованию соединения, имеющего следующую структуру (см. в частности Пример 12):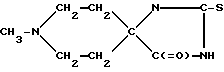
Указанное соединение также образуется в результате гидролиза соответствующего аналога, несущего остаток =NR0 вместо остатка =O; рассматриваемый аналог можно получить, приводя соединение AF173 во взаимодействие с реагентом R0NH2 (см. в частности Пример 13, где R°=β- гидроксиэтил).
Предусмотренные настоящим изобретением соединения, представляющие собой оксо- или тионо-замещенные оксазолидины, можно получить, например, следующим образом: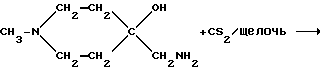
Как указанная отщепляемая группа, так и группа R0, входящие в состав реагента "R0-(отщепляемая группа)", могут соответствовать аналогичным группам, описанным выше в случае гидантоинов. Реакции замещения можно осуществлять при хорошо известных условиях.
Предусмотренные настоящим изобретением соединения, в которых соответствующее пятичленное кольцо представлено сукцинимидом, могут быть получены, например, следующим образом: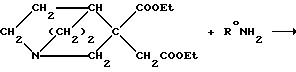
3-карбоэтокси-3-карбоэтоксиметилхинуклидин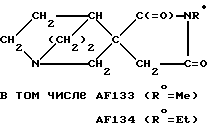
Предусмотренные настоящим изобретением тиазолины могут быть синтезированы, например, следующим образом: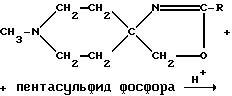
Следует отметить, что соединение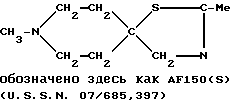
в то время как соединения, отвечающие формуле (Е), не были приведены в указанной заявке в качестве конкретных примеров. Тем не менее, в настоящее время неожиданно выяснилось, что соединения, предусмотренные формулой (Е), в частности соединение AF151(S), являются много более обещающими с фармакологической точки зрения по сравнению с классом соединений, к числу которых относится соединение AF150(S).
Предусмотренные настоящим изобретением имидазолины можно получить, например, в соответствии со следующей схемой: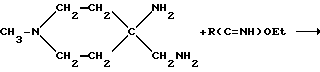
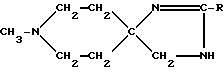
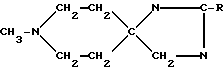
В этом случае получаемый продукт, в частности AF190 (R=Me), может находится в виде таутомерной смеси соединений (Ж) и (З).
Предусмотренные настоящим изобретением оксазолидины и тиазолидины, такие как соединения (И), в частности AF264 (R=Me, R'=H) и AF268 (R=H, R'=Et), а также соединения (К), в частности AF261 (R=Me, R0=H), AF267 (R=Et, R0=H) и AF266 (R=R0=Me), можно получить, например, описанным ниже способом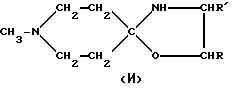
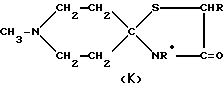
Для иллюстрации следует отметить, что соединения (И) или (К) получают, приводя N-метилпиперидон во взаимодействие с, соответственно, HOCHRCHR'NH2 или HSCHRCO2H + R0NH2.
Приведенные ниже соединения, в которых R и R0 соответствуют использованным выше обозначениям, однако преимущественно являются метилом или этилом, также представляют собой предпочтительные соединения, предусмотренные настоящим изобретением.
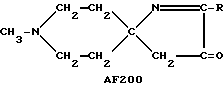
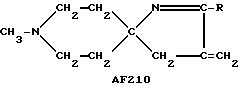
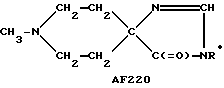
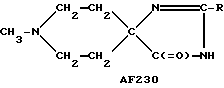
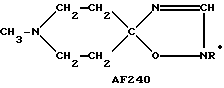
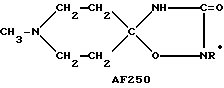
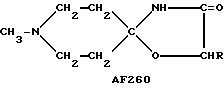
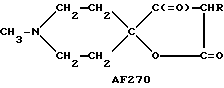
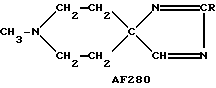
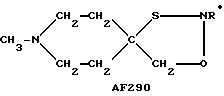
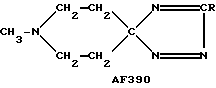
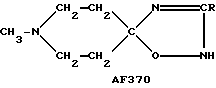
Следует подчеркнуть, что в том случае, если в приведенном ниже описании в качестве примера соединения, предусмотренного настоящим изобретением, рассматривается соединение, включающее в свой состав пиперидиновые, нортропиновые и хинуклидиновые кольца, любое азот- содержащее гетероциклическое кольцо, упомянутое в настоящем описании как удобное для образования спироконфигурации с перечисленным спиропятичленным кольцом, может быть замещенным. Аналогичное уточнение справедливо по отношению к конкретным Примерам, которые носят в основном иллюстративный, а не ограничивающий характер.
Предусмотренные настоящим изобретением спиросоединения потенциально пригодны в основном для лечения пресенильного и старческого слабоумия, старческого слабоумия типа болезни Альцгеймера (ССТА), нетипичной болезни Альцгеймера (Perry et al., Advances in Neurology, eds. R.J.Wurtman et al. 51: 41 (1990)), вызванного множественными инфарктами слабоумия совместно с болезнью Альцгеймера, возрастных расстройств памяти (ВРП), приступов острой дезориентации, расстройств психики и внимания, мании, медлительности, гиперподвижности, смешанных болезней Альцгеймера и Паркинсона, афазии, галлюцинаторно-параноидальных состояний, синдрома пост энцефалической амнезии, симптомов алкогольного опьянения, Хантингтоновой трясучки, болезни Пика, атаксии Фредерика, болезни Жилля де-ла Турэ, а также синдрома Дауна, поскольку все перечисленные заболевания представляют собой нарушения, при которых имеет место по меньшей мере некоторое снижение функции центральной холинэргической активности. Кроме того, предусмотренные настоящим изобретением соединения потенциально пригодны для лечения прогрессирующей наднуклеарного паралича; указанные соединения также являются потенциальными обезболивающими агентами, а потому могут быть использованы при лечении тяжелых болезненных состояний, таких как ревматизм, артрит и заболевания нервных окончаний.
Как уже было вкратце отмечено выше, предусмотренные настоящим изобретением спиросоединения могут быть использованы в комбинации с по меньшей мере одним дополнительным фармакологически активным соединением, например ингибиторами ацетилхолинэстеразы, такими как фитостигмин или тетрагидроаминоакридин; в комбинации с предшественниками ацетилхолина, такими как холин или лецитин; совместно с "ноотропными" медикаментами, такими как пирацетам, анирацетам, оксирацетам или прамирацетам; совместно с соединениями, воздействующими на Ca2+-каналы, такими как 4-аминопиридин или 3,4-диаминопиридин; либо совместно с пептидами, способными оказывать регуляторный эффект на выделение ацетилхолина, такими как соматостатин; совместно с периферическим агентом, проявляющим антимускариновую активность (таким как пирензепин, N-метилатропин, N-бутилскополамин, пропантелин, метантелин, гликопирролат или тропензилиум), для предотвращения нежелательных периферических эффектов, таких как слюнотечение, диаррея, выделение желудочного сока или рвота, которые могут быть вызваны высокими дозами указанного агента, либо в комбинации с подкожно вводимым скополамином, таким как Scopoderm(R), для предотвращения тошноты и/или рвоты; в комбинации с антидепрессантами, такими как нортриптилин, амитриптилин, имипрамин, минаприн, для облегчения как умственных расстройств, так и симптомов депрессии, иногда связанных с ССТА, ВРП и смешанной болезнью ССТА/Паркинсона (ССТА/БП); в комбинации с агентами, проявляющими М2-антимускариновую активность, такими как сековерин и AFDX-116 (Hammer et al. , Life Sci. 38: 1653 (1986)) для предотвращения нежелательных побочных периферических эффектов, которые могут ожидаться при использовании высоких доз соответствующих агентов, для предотвращения ингибиторных эффектов, оказываемых рассматриваемыми агонистами на ингибируемые пресинаптические и постсинаптические рецепторы М2-типа в центральной нервной системе, а также для усиления выработки ацетилхолина в результате подавления ингибируемых авторецепторов М2-типа в интактных нервных окончаниях; в комбинации с никотиновыми агонистами, такими как никотин, для стимуляции никотиновых и мускариновых рецепторов мозга; в комбинации с агонистом адренэргической активности (клонидином или кванфамицином) для облегчения умственных и прочих расстройств, связанных со смешанной холинэргической и норадренэргической недостаточностью при ССТА; в комбинации с ингибиторами повторного поглощения серотонина нейронами (алапроклат, зимелидин) для облегчения умственных и прочих эмоциональных функций при ССТА; в комбинации с ингибиторами моноамин оксидазы-В, такими как депренил, для облегчения умственных и прочих локомоторных расстройств, связанных со смешанными заболеваниями типа ССТА/БП; в комбинации с Фактором роста нервов (ФРН), вводимым либо посредством впрыскивания в нос, либо в желудочек головного мозга.
Предусмотренные настоящим изобретением спиросоединения, как в присутствии, так и в отсутствие, вышеупомянутых дополнительных активных агентов, могут применяться, например, посредством инъекции в приемлемом разбавителе или носителе, перорально, ректально в форме суппозиториев, с помощью вдувания или впрыскивания в нос, посредством вливания или подкожно при использовании приемлемого носителя в присутствии или в отсутствие фитостигмина или тетрагидроаминоакридина.
Предусмотренные настоящим изобретением спиросоединения также могут представлять интерес в плане лечения заболеваний, требующих применения долго действующих холинэргических агентов, обладающих мягкой локальной активностью. Подобный агент необходим при лечении заболеваний, таких как глаукома; поскольку указанное спиросоединение не разрушается ферментом, инактивирующим ацетилхолин (в частности, ацетил- и бутирил-холинэстеразой), оно также может быть использовано для лечения периферических холинэргических заболеваний, таких как миастения беременных, нарушение функции мочевого пузыря, болезнь Эйди и болезнь Итона-Ламберта. Указанные соединения также могут использоваться при заболеваниях, где снижение холинэргической активности вызвано лекарственными препаратами.
В том случае, если предусмотренные настоящим изобретением спиросоединения являются агентами, проявляющими антихолинэргическую активность (что может быть без труда определено специалистом), указанные соединения могут найти применение при лечении заболеваний, обусловленных гиперфункцией холинэргической активности, независимо от того, является ли рассматриваемая гиперфункция спонтанной или же она вызвана лекарственными препаратами. Кроме того, предусмотренные настоящим изобретением соединения могут быть использованы при лечении различных заболеваний, таких как БП, псевдо-БП, смешанные СС/БП, первичные дистонии, спастическая кривошея, черепные дистонии, депрессия, пониженная подвижность, акатизия (возникающая после нейролептического опьянения), опосредованное центральной нервной системой повышенное напряжение, черепно-мозговая травма человека, смешанная умственная недостаточность и БП, маниакально-депрессивный синдром; в качестве вспомогательных средств при хирургии (вместо атропина, скополамина и тому подобного); при отравлениях, вызванных избытком ацетилхолина, возникающим, например, при подавлении ацетилхолинэстеразы. Кроме того, указанные соединения могут использоваться в офтальмологии, если необходим долгосрочный или кратковременный мидриаз.
Предусмотренные настоящим изобретением спиросоединения также могут потенциально быть использованы для лечения заболеваний, сопровождающихся повышенной активностью, сходной с активностью периферической нервной системы; к числу указанных заболеваний относятся астма, хронические заболевания легочной недостаточности, пептическая язва. В случае перечисленных заболеваний периферической системы особенно рекомендуется использовать четвертичные соли соединений, предусмотренных настоящим изобретением.
В настоящее время четвертичные соли аммония широко используются в терапии. В частности, к числу такого рода агонистов холинэргической активности относятся ацетилхолин хлорид, бета-нехол хлорид, а также карбохол (Goodman & Gilman's "The Pharmacological Basis of Therapeutics", Seventh Edition. Macmillan Publishing Co. (1985), p. 104). Четвертичными агентами, проявляющими антихолинэстеразную активность, служат неостигмин бромид, амбенониум хлорид, пиридостигмин бромид, эндофониум хлорид, демекариум бромид, а также эхотифат иодид; пралидоксим хлорид используется в качестве реактиватора холинэстеразы (Goodman & Gilman's "The Pharmacological Basis of Therapeutics". Seventh Edition. Macmillan Publishing Co. (1985), p.122-123).
Четвертичные производные алкалоидов беладонны (в том числе, метскополамин бромид и гоматропин метилбромид), а также синтетические четвертичные соединения (в том числе, метантелин бромид и пропантелин бромид) используют для лечения желудочно-кишечных заболеваний (Goodman & Gilman's "The Pharmacological Basis of Therapeutics", Seventh Edition. Macmillan Publishing Co. (1985), p.139-140).
На основании химической структуры четвертичных ионов аммония предсказано, что указанные ионы могут вызывать паралич, сходный с параличом, обусловленным ядом кураре (Burger A. "Medicinal Chemistry". Second Edition. Interscience Publishers (1960), p.497). Эту особенность четвертичных соединений используют при анестезии, например, в качестве дополнительной меры при хирургической анестезии для расслабления скелетной мышцы (Goodman & Gilman, "The Pharmacological Basis of Therapeutics", Seventh Edition. Macmillan Publishing Co. (1985), p.222-235).
Вышеупомянутая активность четвертичных соединений, вызывающая нейромускульную блокаду, не остановила разработку и клиническое применение четвертичных соединений в последующие годы. Специалист должен твердо знать, что на выбор любого соединения (включая четвертичное соединение) для использования в клинической терапии влияет множество факторов, в том числе, эффективность в плане желаемого назначения, безопасность, возможные побочные эффекты, а также терапевтический индекс. Таким образом, опытный специалист должен хорошо понимать, что означает выражение "фармацевтически приемлемые четвертичные соединения", представляющие собой структурные производные предусмотренных настоящим изобретением соединений, содержащих третичный атом азота, если приведенное выражение используется в настоящем описании и формуле изобретения в плане соответствующих имеющихся знаний.
В дальнейшем настоящее изобретение будет проиллюстрировано следующими Примерами, не имеющими ограничительного характера.
Пример 1: 1-Метилпиперидин-4-спиро-5'-(3'-этилгидантоин) AF160
а) 1-Метилпиперидин-4-спиро-5'-гидантоин
Смесь растворов 1-метилпиперидин-4-она (36,44 г, 0,322 М) в этаноле (150 мл), карбоната аммония (93,0 г; 0,968 М) в воде (400 мл) и цианида калия (25,8 г; 0,396 М) в воде (82 мл) выдерживали при температуре 60oC в течение 2,5 ч, после чего оставляли на ночь при комнатной температуре. Отфильтровывали выпавший в осадок 1-метилпиперидин-4-спиро-5'-гидантоин и промывали его небольшими количествами холодной воды, этанола и эфира с получением кристаллического порошка (27,0 г). Концентрируя полученный фильтрат и промывочные жидкости, выделяли вторую порцию продукта (20,0 г). Выделенный продукт кристаллизовали из метанола, т.пл. 265-276oC (с разложением).
ИК (KBr) 3170 (NH); 1700 (С=O) см-1.
Масс-спектроскопия m/z 183 (М+, 38%); 71 (100%).
1H-ЯМР (D2O) 1,8 (2H); 1,06 (секстет, 2H); 2,49 (s, -CH3); 2,58 (t, 2H); 3,14 (t, 1H); 3,20 (t, 1H) ppm.
б) 4-Амино-1-метилпиперидин-4-карбоновая кислота
Смесь 1-метилпиперидин-4-спиро-5'-гидантоина (9,75 г; 0,0533 М) и октагидрата гидроксида бария (28,8 г; 0,0913 М) в воде (150 мл) выдерживали в бомбе при температуре 160oC в течение 3 ч. Объединяли содержимое четырех указанных емкостей и отфильтровывали выпавший в осадок карбонат бария. Полученный фильтрат нейтрализовали твердым CO2, а образовавшийся при этом осадок отбирали с помощью фильтрации. Концентрировали выделенный фильтрат с получением 4-амино-1-метилпиперидин-4-спиро-карбоновую кислоту (32,0 г, 95%), т.пл. 275-280oC (с разложением).
ИР (KBr) 3300, 1655, 1580 см-1.
Macс-Спектроскопия m/z 183 (M+, 90%); 141 (98%, M-OH); 113 (12%, M-CO2H); 96 (100%); 71 (52%).
1H-ЯМР (C5D5N+D2O) 1,2 (m, 2H); 1,46 (секстет, CH3N-); 1,7 (m, 2Н); 1,9 (m, 2H); 2,0 (m, 2H) ppm.
в) 1-Метилпиперидин-4-спиро-5'-(3'-этилгидантоин), AF160
К смеси 1-метилпиперидин-4-спиро-5'-гидантоина (5 г; 27 мМ) и гидроксида калия (2,08 г; 37 мМ) в 100 мл абсолютного этанола добавляли этил бромид (15 г; 137 мМ). Полученную смесь нагревали до температуры 80oC, через каждые 0,5 ч отбирали образцы и сравнивали их методом ГЖХ с внутренним стандартом (дифенилметаном). Для поддержания щелочности раствора проводили титрование (1 н. HCl), после чего добавляли гидроксид калия (всего - 2,1 г). Получив максимальный выход (через 2,5 ч), выпаривали указанный раствор, добавляли воду (50 мл), а образовавшийся водный раствор экстрагировали хлороформом и подвергали хроматографии на силикагельной колонке с использованием смеси хлороформа, метанола и нашатырного спирта в соотношении 80:20:1 в качестве элюента. Полученный продукт растворяли в эфире и, добавляя HCl в изопропаноле, осаждали соответствующую соляно-кислую соль, т.пл. 278-280oC.
Масс-спектроскопия m/z 211 (М+, 45%); 71 (100%).
1H-ЯМР (свободное основание, CDCl3) 1,2 (t, J=6 Гц, 2Н); 1,6-1,7 (m, 2Н); 1,9-1,95 (m, 2Н); 2,1-2,2 (m, 2Н); 2,34 (s, 3H); 2,85-2,95 (m, 2Н); 3,5 (q, J=6 Гц, 2H);
1H-ЯМР (соль HCl, D2O) 1,1 (t, J=6 Гц, 3H); 1,95-2,05 (m, 2Н); 2,2-2,3 (m, 2Н); 2,85 (s, 3H); 3,0-3,2 (m, 2Н); 3,4-3,5 (m, 2Н); 3,5 (q, J=6 Гц, 2Н) ppm.
13C-ЯМР (свободное основание, CDCl3) 14,0; 33,1; 33,1; 46,0; 52,8; 59,9; 157,0; 177,0 ppm.
УФ (свободное основание, H2O) λmax208 нм (ε 3500).
Пример 2: 1-Метилпиперидин-4-спиро-5'-(1'-ацетилгидантоин) AF164
a) AF164A. Смесь 1-метилпиперидин-4-спиро-5'- гидантоина (3,25 г) в уксусном ангидриде (50 мл), выдерживали при температуре дефлегмации в течение 3 ч. При пониженном давлении отбирали избыток указанного реагента с получением твердого вещества, которое диспергировали в эфире и отфильтровывали с выделением белого твердого вещества (3,75 г), кристаллизующегося из смеси метанола и дихлорметана, т.пл. 250-254oC (с разложением) AF164A.
1H-ЯМР (D2O) 1,89 (m, 2Н); 2,44 (s, CH3CO-); 2,86 (s, CH3N-); 2,98 (m, 2Н); 3,41 (m, 2Н); 3,67 (m, 2Н) ppm.
13C-ЯМР (D2), диоксан в качестве внутреннего стандарта) 26,6 (С3 и C5); 26,9 (CH3CO-); 43,8 (CH3N-); 51,4 (C2 и C6); 62,0 (C4); 67,3 (диоксан); 166,0 (C2'); 173,8 (CH3CO-); 189,2 (C4') ppm.
MC m/z 255 (M+); 210; 166; 155; 123; 95; 71 (100%); 70.
б) AF164B. Часть соединения AF164A (1,10 г) подщелачивали насыщенным водным раствором Na2CO3 и экстрагировали смесью метанола и дихлорметана, выпаривали полученный экстракт, а образовавшийся остаток вновь экстрагировали той же смесью растворителей, фильтровали экстракт, выпаривали соответствующий фильтрат, а выделенный остаток (1,0 г) растирали с ацетоном с выходом соединения AF164B в виде белого твердого вещества, т.пл. 225-230oC (с разложением) (кристаллизация из CH2Cl2-CH3-CH3CN).
1H-ЯМР (D2O) 1,53 (m, 2Н); 2,21 (s, CH3CO-); 2,39 (s, CH3N-); 2,65-2,80 (m, 6H) ppm.
13C-ЯМР (D2O, с диоксаном в качестве внутреннего стандарта) 26,9 (CH3CO-); 28,3 (С3 и C5); 45,0 (CH3N-); 50,9 (C2 и C6); 64,9 (C4); 67,3 (диоксан); 168,8 (C2'); 173,6 (CH3CO-); 193,9 (C4') ppm.
MC m/z 225 (М+); 183 (M+-CH2=C=0); 166; 154; 123; 95; 71 (100%).
в) AF164 (гидрохлорид). Для того, чтобы получить гидрохлорид соединения AF164, раствор соединения AF164A или AF164B в метаноле обрабатывали HCl, растворенной в изопропаноле, до кислого pH (pH 1-2). Через короткий промежуток времени гидрохлорид соединения AF164 выпадал в осадок в виде белого твердого вещества, т. пл. 301-302oC (с разложением).
1H-ЯМР (D2O) 2,17 (m, 2H); 2,50 (s, CH3CO-); 2,93 (s, CH3N-); 3,10 (m, 2H); 3,48 - 3,71 (m, 4H) ppm.
13C-ЯМР (D2O, с диоксаном в качестве внутреннего стандарта) 26,7 (C3 и C5); 26,9 (CH3CO-); 43,9 (CH3N-); 51,1 (C2 и C6); 61,8 (C4); 67,3 (диоксан); 154,8 (C2'); 173,4 (CH3CO-); 176,0 (C4') ppm.
Гидролиз соединения AF164:
Соединения AF164A и AF164B в течение 1-2 ч гидролизовали при температуре дефлегмации в 0,2 н. водном растворе NaOH с получением 1-метилпиперидин-4-спиро-5'-гидантоина, идентифицированного по сопоставлению его методами ТСХ и 1H-ЯМР с аутентичным образцом.
Пример 3: Пиперидин-4-спиро-5'-(3'-этилгидантоин) AF164(Des)
К раствору высушенного соединения AF160 (2,0 г; 9,5 мМ) в дихлорэтане (25 мл, высушен над молекулярным ситом) при комнатной температуре добавляли α- хлорэтилхлороформиат (1,0 мл; 9,3 мМ), а образовавшуюся смесь выдерживали при температуре 60oC в течение 1 ч. В вакууме удаляли дихлорэтан, выделенное при этом твердое вещество растворяли в 20 мл метанола, а полученный раствор выдерживали при температуре 60oC в течение еще 30 мин. Затем в вакууме удаляли метанол, а выделенное маслянистое твердое вещество растворяли в водном растворе карбоната натрия и промывали эфиром. Соответствующую водную фракцию экстрагировали хлороформом, а полученный экстракт выпаривали с выходом грубо очищенного масла, которое дополнительно очищали с помощью хроматографии на силикагельной колонке. Элюцию проводили смесью хлороформа, метанола и нашатырного спирта в соотношении 4:1:0,1 с выделением соединения AF160 (Des) (1,12 г; 60%-ный выход) в виде белого порошка, т.пл. 225-227oC.
МС m/z 197 (М+, основной пик); 57.
1H-ЯМР (CDCl3) 1,17 (t, J=6 Гц, 3H); 1,65-1,7 (m, 2Н); 1,85-2,0 (m, 2Н); 2,75-2,85 (m, 2Н); 3,05-3,15 (m, 2Н); 3,5 (q, J=6 Гц, 2Н) ppm.
Пример 4: 1-Метилпиперидин-4-спиро-5'-(3'-метилгидантоин) AF178
К смеси 1-метилпиперидин-4-спиро-5'-гидантоина (5,0 г; 27,3 мМ) и гидроксида натрия (2,0 г; 50 мМ) в 120 мл метанола добавляли метил тозилат (11,2 г; 60 мМ). Полученную реакционную среду перемешивали в течение ночи при комнатной температуре, с помощью выпаривания удаляли метанол, а выделенный маслянистый остаток растворяли в водном растворе карбоната калия и экстрагировали хлороформом. Выпаривали соответствующий органический экстракт, а полученный при этом грубо очищенный продукт дополнительно очищали с помощью хроматографии на силикагельной колонке, элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 9:1:0,1 с выделением 1,2 г (22%) белого твердого вещества, т.пл. 229-231oC.
МС m/z 197(М+, 30%); 71 (100%).
1H-ЯМР (свободное основание, CDCl3) 1,6-1,7 (m, 2Н); 2,1-2,3 (m, 4Н); 2,34 (s, 3H); 2,85-2,95 (m, 2Н); 3,02 (s, 3H) ppm.
Пример 5: Пиперидин-4-спиро-5'-(3-метилгидантоин) AF179
Белый порошкообразный продукт, полученный таким же способом, как это описано в Примере 3, растворяли в изопропаноле и подкисляли соляной кислотой до получения белого осадка. Т.пл. выше 320oC (с разложением).
МС m/z 183 (М+, основной пик); 57.
1H-ЯМР (гидрохлорид, D2O) 2,0 (m, 2Н); 2,2 (m, 2H); 2,96 (s, 3H); 3,3 (m, 2Н); 3,6 (m, 2Н).
Пример 6: Синтез 1-метилпиперидин-4-спиро-5'- (3'-пропаргилгидантоина) AF185
Суспензию KH (11 г; 0,1 М; 35%-ная суспензия в минеральном масле) и 1-метилпиперидин-4-спиро-5'-гидантоина (25 г; 0,13 М; высушен над P2O5) перемешивали при комнатной температуре в сухом ДМФ (500 мл). Добавляли пропаргил хлорид и выдерживали образовавшуюся реакционную смесь при температуре 50oC в течение 20 мин. Указанную смесь охлаждали, подкисляли водной соляной кислотой до pH 3, после чего удаляли ДМФ, экстрагируя его смесью масляного эфира и эфира в соотношении 1:1, а затем - эфиром. Соответствующую водную фазу подщелачивали карбонатом натрия до pH 10 и дважды экстрагировали хлороформом. Объединяли полученные хлороформные экстракты, высушивали их и выпаривали с выходом грубо очищенного масла (27 г), которое подвергали хроматографии на силикагельной колонке. Элюцию проводили смесью хлороформа, метанола и нашатырного спирта в соотношении 80:19:1 с выделением 3,0 г очищенного соединения AF185, а также нескольких фракций (в сумме 10 г), содержащих небольшое количество примесей. Соответствующее свободное основание осаждали в виде гидрохлорида; с помощью кристаллизации из метанола получали 3,2 г белой негигроскопичной соли.
1H-ЯМР (D2O, гидрохлорид) δ 2,0-2,35 (m, 4Н); 2,64 (t, 1Н, J=3,5 Гц); 2,91 (s, CH3N-); 3,1-3,2 (m, 2Н); 3,5-3,7 (m, 2Н); 4,27 (bs, 2H) ppm.
1H-ЯМР (D2), избыток карбоната натрия) δ 1,65-1,75 (m, 2Н); 1,9-2,05 (m, 2Н); 2,25 (s, CH3N-); 2,2-2,3 (m, 4Н); 2,8-2,9 (m, 4Н); 4,25 (s, 2Н) ppm.
1H-ЯМР (CDCl3, свободное основание) δ 1,85-1,95 (m, 4Н); 2,2 (m, 2Н); 2,23 (t, 1Н, J=3,5 Гц); 2,4 (s, CH3N-); 2,9-2,95 (m, 2Н); 4,3 (d, 2Н, J=3,5 Гц); 6,4 (bs, 1H) ppm.
MC m/z 221 (M+, основной пик); 206 (М-15); 149.
Пример 7: 1-Метидпиперидин-4-спиро-4'-(2',5'-бис (метилтио)-4'H-имидазол) AF177
К раствору 1-метилпиперидин-4-спиро-5'-(2',4'-дитиогидантоина (1,00 г; 4,65 мМ; см. Пример 11) в метаноле (15 мл) добавляли NaOH (0,30 г; 7,50 мМ), а затем постепенно - раствор метил иодида (1,00 г; 7,04 мМ) в метаноле (3,0 мл), а полученную смесь перемешивали при комнатной температуре в течение 1,5 ч. Проводили осаждение с помощью NaBr, отфильтровывали образовавшийся осадок и промывали его метанолом. Объединяли соответствующий фильтрат и промывочные жидкости, после чего удаляли растворитель; выделенный остаток подщелачивали с помощью K2CO3 и экстрагировали эфиром. Полученный органический экстракт высушивали на Na2SO4 и удаляли растворитель с выделением остатка, который подвергали хроматографии на силикагельной колонке. Элюцию проводили смесью эфира, хлороформа, метанола и нашатырного спирта в соотношении 78:18:3:1 с выделением соединения AF177 (465 мг); после кристаллизации из гексана т.пл. 101-102oC.
1H-ЯМР (CDCl3) 1,33 (m, 2Н); 1,98 (m, 2Н); 2,39 (s, CH3N-); 2,56 (s, CH3S-); 2,59 (s, CH3S-); 2,48-2,64 (m, 2H); 2,82 (m, 2H) ppm.
13C-ЯМР (CDCl3) 14,1 (CH3S-); 14,2 (CH3S-); 34,9 (C3 и C5); 46,1 (CH3N-); 52,2 (C2 и C6); 83,0 (C4); 171,6 (C2'-); 203,5 (C5') ppm.
MC m/z 244 (M++1); 185; 149; 93; 75.
ИК (KBr) 2920; 2797; 1535; 1477; 1565; 1452; 1378; 1316; 1286; 1210; 1108; 1054; 1000; 965; 942; 900; 776; 696 см-1.
УФ (EtOH) λmax257 нм (ε 16100).
Пример 8: 1-Метилпиперидин-4-спиро-5'-(3'-этил-4'-тиогидантоин) AF182
Аликвоту 1-метилпиперидин-4-спиро-4'-(1'-этил-2'-этилтио- 2'-имидазолин-5'-тиона) (100 мг; соединение AF170, см. Пример 12) растворяли в 20%-ной HCl (1 мл), а образовавшийся раствор подвергали дефлегмации в течение 1,5 ч. С помощью концентрированного раствора NaOH подщелачивали указанную реакционную смесь до pH 14, после чего экстрагировали ее дихлорметаном. Полученный органический экстракт высушивали над Na2SO4 и удаляли растворитель с выделением 1-метилпиперидин-4-спиро-5'-(3'-этил-4'-тиогидантоина) в виде белого твердого вещества (74 мг), кристаллизующегося из смеси петролейного эфира и дихлорметана, т. пл. 176-178oC.
1H-ЯМР (CDCl3) 12,5 (t, J=7,2 Гц, CH3CH2-); 1,54 (m, 2Н); 2,10 (m, 2H); 2,36 (s, CH3N-); 2,41 (m, 2Н); 2,96 (m, 2Н); 3,94 (q, J=7,2 Гц, -CH2CH3); 7,23 (NH) ppm.
13C-ЯМР (CDCl3) 11,8 (CH3CH2-); 36,9 (C3 и C5); 37,4 (-CH2CH3); 46,1 (CH3N-); 51,2 (C2 и C6); 68,1 (C4); 157,1 (C2'); 208,1 (C4') ppm
MC m/z 227 (M+); 211 (М+-О); 194 (M+-SH); 170 (M+-C3H7N); 71; 70 (100%).
УФ (EtOH) λmax280 нм (ε 13600), 229 нм (ε 4400).
Пример 9: 1-Метилпиперидин-4-спиро-5'-(4'-метилтио-3'- имидазолин-2'-тион) AF183
Воспроизводя Пример 7, но используя при этом эквивалентные количества метил иодида, гидроксида натрия и дитиогидантоина, дополнительно к бис-(метилтио)-производному соединения AF177 получали 1-метилпиперидин-4-спиро-5'-(4'-метилтио-2'- имидазолин-2'-тион), соединение AF183, т.пл. 218-220oC (с разложением) (из смеси CH2Cl2 и ацетона).
1H-ЯМР (CDCl3) 1,74 (m, 2Н); 2,07 (m, 2Н); 2,37 (m, 2H); 2,39 (s, CH3N-); 2,69 (s, CH3S-); 2,95 (m, 2Н); 10,3 (brs, -NH-) ppm.
MC m/z 229 (M+); 182 (M+-CH3S); 123; 122; 70.
УФ (EtOH) λmax312 нм (ε 12000), 280 нм (ε 15300).
Пример 10: 1-Метилпиперидин-4-спиро-5'-(3'-этил-2',4'- дитиогидантоин) AF 163
Тщательно смешивали порошки 1-метилпиперидин-4-спиро-5'-(3'- этилгидантоина) (0,570 г) и пентасульфида фосфора (0,570 г), а полученную смесь подвергали дефлегмации в тетралине (15 мл) в течение 2 ч. Указанной реакционной смеси позволяли остыть до комнатной температуры, после чего образовывался плотный коричневый осадок; при пониженном давлении удаляли тетралин, дезинтегрировали выделенный осадок и промывали его эфиром. Полученную смесь подщелачивали концентрированным водным раствором NaOH и экстрагировали дихлорметаном. Соответствующий экстракт высушивали над Na2SO4 и выпаривали с выделением остатка (0,250 г), который подвергали хроматографии на колонке силикагеля (Merck, 60,15 г). Элюцию проводили смесью хлороформа, эфира, метанола и нашатырного спирта в соотношении 78:18:4:1 с выходом чистого соединения AF163 (50 мг), кристаллизующегося из смеси CH2Cl2 и эфира, т.пл. 223-225oC (с разложением).
1H-ЯМР (CDCl3) 1,27 (t, J=7,2 Гц, CH3CH2-); 1,55-1,67 (m, 2Н); 2,03-2,19 (m, 2H); 2,26-2,46 (m, 2H); 2,36 (s, CH3N-); 2,89-3,04 (m, 2Н); 4,27 (q, J= 7,2 Гц, -CH2CH3); 8,25 (brs. -NH-) ppm.
13C-ЯМР (DMSO-d6) 11,6 (CH3CH2-); 36,9 (C3 и C5); 39,9 (-CH2-CH3; 45,9 (CH3N-); 49,9 (C2 и C6); 72,9 (C4); 179,8 (C2'); 207,8 (C4') ppm.
MC m/z 243 (M+); 186 (М+-C3H7N); 149; 71; 70 (100%); 57.
ИК (KBr) 3177 (NH); 2930; 2778; 1513; 1434; 1357; 1231; 1116; 1090; 1070; 1040; 961; 801; 780; 626; 546; 457 см-1.
УФ (EtOH) λmax302 нм (ε 34200), 226 нм (ε 7700).
Синтез виннокислой соли соединения AF163
К раствору свободного основания соединения AF163 (0,735 г; 3,025 мМ) в смеси метилен хлорида (15 мл) и метанола (5 мл) добавляли раствор L(+)-винной кислоты (0,214 г; 1,427 мМ) в метаноле (2,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 0,5 ч, после чего выпаривали указанные растворители, а выделенный остаток суспендировали в смеси эфира и метилен хлорида, фильтровали и промывали смесью вышеупомянутых растворителей с выходом желтого твердого вещества, представляющего собой винно-кислую соль соединения AF163 (0,923 г; 96%-ный выход), т.пл. 221-225oC.
1H-ЯМР (D2O) 1,27 (t, J=7,2 Гц, CH3CH2-); 2,08 (m, 2Н); 2,49 (m, 2Н); 3,01 (s, CH3N-); 3,31 (m, 2Н); 3,76 (m, 2Н); 4,26 (q, J=7,2 Гц, -CH2CH3); 4,37 (s, -CHCHOH) ppm.
Пример 11: 1-Метилпиперидин-4-спиро-5'-(2',4'- дитиогидантоин) AF173
Раствор 1-метил-4-пиперидона (29,35 г; 0,260 М), KCN (26,57 г; 0,408 М), NH4Cl (21,00 г; 0,393 М) и CS2 (26 мл) в смеси метанола (200 мл) и воды (50 мл) выдерживали при температуре дефлегмации (50-55oC) в течение 8 ч. Указанную реакционную среду оставляли на ночь при комнатной температуре, отфильтровывали образующийся при этом осадок, промывали его водой, а затем - этанолом с выходом желтого твердого вещества (26,3 г; 47,0%-ный выход), кристаллизующегося из метанола, т.пл. 252-254oC (с разложением).
1H-ЯМР (DMSO-d6) 1,43-1,56 (m, 2Н); 1,89-2,05 (m, 2H); (C3 и C5); 2,21 (s, CH3N-); 2,26-2,40 (m, 2Н); 2,64-2,79 (m, 2Н); 11,14 (brs., -NH-) ppm.
13C-ЯМР (DMSO-d6) 36,2 (C3 и C5); 45,5 (CH3N-); 49,9 (C2 и C6); 74,8 (C4); 181,5 (C2'); 212,0 (C4') ppm.
MC m/Z 215 (M+); 183 (M+-S); 182 (M+-SH); 181; 158 (М+-C3H7N); 123; 102; 77; 71; 70 (100%).
ИК (KBr) 3130 (NH); 1484; 1449; 1350; 1259; 1231; 1198; 1176; 1145; 1083; 1062; 957; 721; 545; 504 см-1.
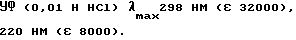
Пример 12: 1-Метилпиперидин-4-спиро-5'-(3'-этил-2', 4'-дитиогидантоин) AF163; 1-Метилпиперидин-4-спиро-5'-(4' -этилтио-3'-имидазолин-2'-тион) AF176; 1-Метилпиперидин-4-спиро-4'- (1'-этил-2'-этилтио-2'-имидазолин-5'-тион) АF170
К суспензии 1-метилпиперидин-4-спиро-5'-(2', 4'-дитиогидантоина) (соединение AF173; 3,30 г; 15,3 мМ) в сухом ДМФ (30 мл) добавляли NaOH (0,760 г; 60%-ная смесь в минеральном масле; 19,0 мМ) и перемешивали полученную смесь при температуре 50oC в течение 1,5 ч. К указанной смеси постепенно добавляли раствор EtBr (1,85 г; 17,0 мМ) в ДМФ (6 мл) и перемешивали при температуре 75-80oC в течение 4 ч. После того, как рассматриваемую смесь выдерживали в течение ночи при комнатной температуре, образовывался осадок (NaBr), который отфильтровывали и промывали эфиром. Объединяли соответствующий фильтрат и промывочные жидкости и высушивали их с получением масла, от которого отделяли нерастворимое в дихлорметане твердое вещество (1,5 г), оказавшееся исходным соединением (идентифицировано с использованием ЯМР и ТЖХ). Полученный остаток подвергали хроматографии на силикагельной колонке. Элюцию проводили смесью эфира, хлороформа, метанола и нашатырного спирта в соотношении 68: 27:4:1 с выходом вначале 1- метилпиперидин-4-спиро-5'-(3'-этил-2', 4'-дитиогидантоина) (соединение AF163; 0,95 г), идентичного продукту, полученному ранее в результате реакции между соединением AF160 и P2S5. Продолжали элюцию с выходом 1-метилпиперидин-4-спиро-5'-(4'-этилтио-3'- имидазолин-2'-тиона) (соединение AF176; 0,15 г). Кристаллизуется из смеси гексана и CH2Cl2, т.пл. 212- 215oC (с разложением).
1H-ЯМР (CDCl3) 1,42 (t, J=7,2 Гц, CH3CH2-); 1,73 (m, 2H); 2,06 (m, 2Н); 2,31 (m, 2H); 2,38 (s, CH3N-); 2,95 (m, 2H); 3,33 (q, J=7,2 Гц, -CH2CH3); 10,0 (br. -NH-) ppm.
13C-ЯМР (DMSO-d6) 14,2 (CH3CH2-); 25,6 (-CH2CH3); 35,0 (C3 и C5); 45,8 (CH3N-); 50,5 (C2 и C6); 74,3 (C4); 192,1 (C2'); 198,1 (C4') ppm.
MC m/z 243 (M+); 182 (M+-EtS, 100%); 156 (M+-EtSCN); 123; 124; 71; 70; 57.
ИК (KBr) 3135 (NH); 2930; 2788; 1476; 1463; 1446; 1281; 1257; 1232; 1158; 1141; 1121; 1096; 958; 711; 674; 535 см-1.
УФ (EtOH) λmax314 нм (ε 5400), 282 нм (ε 6700).
Повторяя вышеописанные реакции с 1,5-молярным избытком EtBr по отношению к соединению AF173, дополнительно к вышеописанным моноэтильным производным получают диэтильное производное: 1-метилпиперидин-4-спиро-4'-(1'-этил-2'-этилтио-2'- имидазолин-5'-тион) (соединение AF170), т.пл. 66-67oC (кристаллизуется из гексана).
1H-ЯМР (CDCl3) 1,24 (t, J=7,2 Гц, CH3CH2-); 1,24 (m, 2H); 1,44 (t, J=7,2 Гц, CH3CH2-); 2,27 (m, 2H); 2,39 (s, CH2N-); 2,52 (m, 2H); 2,81 (m, 2H); 3,24 (q, J=7,2 Гц, -CH2CH3); 3,93 (q, J=7,2 Гц, -CH2CH3) ppm.
13C-ЯМР (DMSO-d6) 14,2 (CH3CH2-); 13,9 (CH3CH2-); 25,7 (-CH2CH3); 36,8 (C3 и C5); 39,0 (-CH2CH3); 46,1 (CH3N-); 51,5 (С2 и С6); 82,2 (C4); 158,5 (C2'); 216,7 (C5') ppm.
MC m/z 271 (M+); 242 (M+-Et); 214 (M+-C3H7N); 185; 165; 75; 71; 70 (100%); 57.
ИК (KBr) 1574 (C=N); 1446; 1372; 1354; 1212; 1071; 1060; 936 см-1.
УФ (EtOH) λmax296 (ε 22000), 252 нм (ε 17700).
Кислотный гидролиз соединения AF176
К соединению AF176 (48 мг) добавляли 20%-ный водный раствор соляной кислоты (1 мл). Сразу же ощущался запах меркаптана. Указанный раствор перемешивали при комнатной температуре в течение 1 ч, после чего выпаривали при температуре 50oC и пониженном давлении с получением гидрохлорида 1-метилпиперидин-4-спиро-5'-(2'-тионгидантоина) (X).
1H-ЯМР (D2O) 2,10-2,43 (m, 4Н); 2,94 (s, CH3N-); 3,20 (m, 1H); 3,47-3,78 (m, 3H) ppm.
MC m/z 199 (M+); 181; 171 (M+-CO); 156 (M+-HNCO); 142 (M+-С3H7N); 111; 96; 75; 71; 70; 57.
УФ (H2O) λmax264 нм (ε 20400), 224 нм (ε 8600).
Пример 13: 1-Метилпиперидин-4-спиро-5'-(2'-тиогидантоин) AF195
а) Раствор 1-метилпиперидин-4-спиро-5'-(2',4'-дитиогидантоина) (соединение AF173; 10,0 г) в смеси этаноламина (40 мл) и воды (75 мл) подвергали дефлегмации в течение 1,5 ч. При пониженном давлении удаляли использованный растворитель и избыток реагента. В результате последовательных кристаллизаций выделенного остатка из:
- смеси ацетонитрила и дихлорметана,
- ацетона и
- смеси этанола и ацетонитрила получали чистый 1-метилпиперидин- 4-спиро-5'-(2'-тио-4'- (8β- гидроксиэтилиминогидантоин), т. пл. 230-231oC (с разложением).
1H-ЯМР (D2O) 11,74 (m, 2Н) 1,94 (m, 2H); 2,26 (s, CH3N-); 2,17-2,34 (m, 2Н); 2,92 (m, 2Н); 3,54 (q, J=5,4 Гц, -CH2OH); 3,74 (q, J=5,4 Гц, =NCH2-) ppm.
13C-ЯМР (DMSO-d6) 33,7 (С3 и C5); 45,4 (-CH2-); 45,9 (CH3N-); 50,6 (C2 и C6); 59,2 (-CH2-); 66,3 (C4); 182,5 (-C=S); 195,0 (-C=N- ) ppm.
MC m/z 242 (M+); 224 (M+-H2O); 199; 185; 172 (M+-70); 154 (M+-H2O); 71; 70.
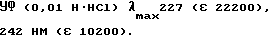
Указанное производное иминогидантоина (1,40 г) растворяли в водной 50%-ной HCl (5,0 мл) и подвергали дефлегмации в течение 1 ч. Полученную реакционную смесь выпаривали при пониженном давлении, а выделенный остаток кристаллизовали из метанола с выходом гидрохлорида 1-метилпиперидин-4-спиро-5'-(2'-тиогидантоина) (0,756 г), идентичного продукту, который был получен в результате гидролиза соединения AF176 (см. Пример 12).
б) Раствор 1-метилпиперидин-4-спиро-5'-(2',4'-дитиогидантоина) (соединение AF173; 10,0 г; 0,0465 M) и н-бутиламина (17,0 г; 0,233 M) в этаноле (80 мл) выдерживали при температуре дефлегмации в течение 1,5 ч. Из охлажденной реакционной смеси отфильтровывали выпавшее в осадок кристаллическое твердое вещество, промывали его небольшим количеством этанола, затем - эфиром, а затем - петролейным эфиром с получением 1-метилпиперидин-4-спиро-5'-(2'-тио-4'-этилиминогидантоина) (соединение AF189; 11,1 г; 0,0437 М; 94%-ный выход). Выделенный продукт кристаллизовали из смеси дихлорметана и метанола с выходом игольчатых кристаллов, т.пл. 236-239oC (с разложением).
1H-ЯМР (CDCl3+CD3OD) 0,94 (t, J=7,2 Гц, CH3CH2-); 1,38 (m, 2H); 1,60 (m, 2H); 1,69 (m, 2Н); 1,89 (m, 2H); 2,40 (m, 2H); 2,41 (s, CH3N-); 2,91 (m, 2H); 3,47 (t, J=7,2 Гц, -CH2-N-) ppm.
MC m/z 254 (M+); 197 (M+-C4H9); 184 (M+-70); 149; 128; 71; 70; 57 (C4H9 +).
Указанное производное иминогидантоина (соединение AF189; 10,45 г) растворяли в водной 16%-ной HCl (15,0 мл) и подвергали дефлегмации в течение 1 ч. Полученную реакционную смесь перегоняли до тех пор, пока не оставалось небольшое количество жидкости. К выделенному остатку добавляли этанол (50 мл) и охлаждали образовавшуюся смесь, что приводило к выпадению осадка, который отфильтровывали и промывали небольшим количеством этанола, а затем - эфиром с получением гидрохлорида 1-метилпиперидин-4-спиро-5'- (2'-тиогидантоина) (соединение AF195; 8,42 г; 87%-ный выход), т.пл. > 295oC (с разложением), идентичного ранее выделенному продукту.
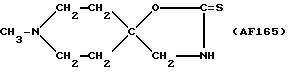
Пример 14: 1-Метилпиперидин-4-спиро-5'-(оксазолидин-2'- тион) AF165
К перемешиваемому безводному ДМСО (10 мл), содержащему небольшое количество порошкообразного КОН, добавляли 4-аминометил- 4-гидрокси-1-метилпиперидин (0,595 г; 4,13 мМ), а затем - дисульфид углерода (0,340 г; 4,47 мМ). Полученную реакционную смесь выдерживали при температуре 50oC в течение 2 ч. Использованный растворитель удаляли в вакууме, а выделенный остаток несколько раз кристаллизовали из метанола, ацетона и CH2Cl2 с выходом кристаллического твердого вещества, т.пл. 190-195oC (21 мг).
1H-ЯМР (CDCl3) 1,80-1,98 (m, 2Н); 2,03-2,16 (m, 2H); 2,32 (s, CH3N-); 2,44-2,72 (m, 2Н); 3,51 (s, -CH2N-C=S) ppm.
13C-ЯМР (DMSO-d6) 35,1 (C3Cl5); 45,7 (CH3N-); 51,5 (C2Cl C6); 53,1 (-CH2NH-); 86,4 (C4); 187,2 (-C=S) ppm.
Пример 15: N-Метилнортропан-3-спиро-5'-(3'-метилгидантоин) AF167 и N-Метилнортропан-3-спиро-5'-(3'- этилгидантоин) AF168
а) N-метилнортропан-3-спиро-5'-гидантоин
Смесь тропинона (45 г; 0,32 M) в этаноле (160 мл), карбоната аммония (93 г; 0,96 M) в воде (400 мл), а также KCN (25,8 г; 0,40 M) в воде (84 мл) выдерживали при температуре 60oC в течение 2 ч, а затем - при комнатной температуре в течение 16 ч. Выделенный N-метилнортропан-3-спиро-5'-гидантоин (61,33 г; 0,29 M; 92%-ный выход) высушивали в эксикаторе, т.пл. 330oC.
Масс-спектроскопия m/z 209 (M+).
1H-ЯМР (CD3COOD) 2,1 (m, 2H, H6=H7 (α)); ); 2,3 (m, 2H, H2=H4 (β)); 2,4 (m, 2H, H2=H4 (α)); 2,7 (m, 2Н, H6=H7 (β)); 2,9 (s, 3H); 3,0 (bs, NH); 4,1 (bs, 2Н, H1=H5) ppm.
1H-ЯМР (DCl, D2O) 2,3 (m, 4H, Н6=Н7( α) и H2=H4( β)) ; 2,5 (m, 2Н, H2=H4 (α)); 2,7 (m, 2Н, H6=H7 (β)); 2,9 (s, 3H); 4,15 (bs, 2Н, H1=H5) ppm.
13C-ЯМР (DCl, D2O) 25,5 (C6=C7, t); 33,5 (C2=C4, t); 39,7 (CH3, q); 59,3 (C3-C5', s); 63,0 (C1=C5, d); 159,3 (C2', s); 180,2 (C4', s) ppm.
б) Соединения AF167 и AF168
М-Метилнортропан-3-спиро-5'-гидантоин (1 часть) и КОН (1 часть) смешивали в воде при комнатной температуре в течение нескольких минут. К полученному водному раствору по каплям добавляли метил иодид или этил бромид (2 части) в метаноле. Указанную реакционную смесь экстрагировали хлороформом и высушивали над сульфатом магния, после чего выпаривали. Искомые продукты (соединения AF167 и AF168) получали приблизительно с 10%-ным выходом.
Соединение AF167.
1H-ЯМР (DCI, D2O) 1,65 (m, 2H, H6=H7 (α)); 1,8 (m, H2=H4 (β)); 2,2 (m, 2H, Н2= Н4 (α)); 2,4 (m, 2H, Н6=Н7 (β)); 2,55 (s, 3H); 2,85 (s, 3H); 3,25 (bs, 2H, H1=H5) ppm.
1H-ЯМР (CDCl3) 1,55 (m, 2H, H6=H7 (α)); 1,75 (m, 2H, H2=H4 (β)); ; 2,2 (m, 2H, Н2=Н4 (α)); 2,4 (s, 3H); 2,45 (m, 2H, H6=H7 (β)); 3,0 (s, 3H); 3,3 (bs, 2H, H1=H5); 6,3 (bs, NH) ppm.
Масс-спектроскопия m/z 223 (M+).
Соединение AF168.
1H-ЯМР (CDCl3, CD3OD) 1,1 (t, 3H); 1,6 (m, 2H, H6-H7 (α)); ; 1,75 (m, H2= H4 (β)); 2,2 (m, 2H, H2=H4 (α)); 2,35 (s, 3H); 2,4 (m, 2H, H6=H7 (β)); 3,25 (bs, 2H, H1=H5); 3,55 (q, 2H) ppm.
1H-ЯМР (CDCl3) 1,2 (t, 3H); 1,6 (19, 2H, H6=H7 (α)); 1,75 (m, H2=H4 (β)); 2,2 (m, 2H, Н2=Н4 (α)); 2,4 (s, 3H); 2,45 (m, 2H, Н6=Н7 (β)); 3,3 (bs, 2H, H1=H5); 3,55 (q, 2H); 6,3 (bs, NH) ppm.
13C-ЯМР (CDCl3, δ) 13 (CH3CH2), 25 (С6=С7); 35 (C2=C4); 40 (N-СН3); 40,5 (N-CH2); 59 (C3-C5'); 60 (C1=C5); 159,3 (C2'); 180 (C4') ppm.
Macс-спектроскопия m/z 237 (M).
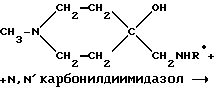
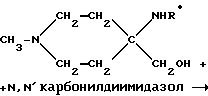
Пример 16: 1-Метилпиперидин-4-спиро-5'-(3'- этилоксазолидин-2'-он) AF172
а) 4-Ацетамидометил-4-гидрокси-1-метилпиперидин
При комнатной температуре в течение 2 ч смешивали 4-аминометил- 4-гидрокси-1-метилпиперидин (2,95 г; 0,02 M), карбонат калия (6,5 г; 0,047 M) и уксусный ангидрид (8,5 г; 0,08 M) в метаноле. Для нейтрализации полученной смеси добавляли гидроксид натрия и экстрагировали указанный раствор хлороформом. Выпаривая соответствующий экстракт, выделяли желтое масло, которое было идентифицировано как 4-ацетамидометил-4-гидрокси-1-метилпиперидин (3,4 г; 0,018 М; 91%-ный выход).
б) 4-Этиламинометил-4-гидрокси-1-метилпиперидин
Раствор 4-ацетамидометил-4-гидрокси-1-метилпиперидина (3,4 г; 0,018 М) в сухом ТГФ подвергали дефлегмации в присутствии гидрида лития-алюминия (4 г). Через 3 дня образовавшуюся смесь выливали в смесь воды и льда и фильтровали через Celite. Выпаривали растворитель, добавляли воду, экстрагировали полученный раствор хлороформом, а соответствующий экстракт высушивали над сульфатом магния и выпаривали с выходом 1,03 г (33%-ный выход) грубо очищенного вещества. Полученный таким образом 4-этиламинометил-4- гидрокси-1-метилпиперидин использовали без дополнительной очистки.
в) 1-Метилпиперидин-4-спиро-5'-(3'-этилоксазолидин-2'-он) AF172
4-Этиламинометил-4-гидрокси-1-метилпиперидин (16,8 г; 0,1 М) в атмосфере азота смешивали с N',N'-карбодиимидазолом (32 г; 0,2 М) в 400 мл хлороформа. Выпаривая указанную смесь, получали 50 г грубо очищенного вещества, которое интенсивно промывали гексаном, а затем выпаривали с выходом искомого соединения AF172 - 1-метилпиперидин- 4-спиро-5'-(3'-этилоксазолидин-2'-она) в виде желтоватого масла (16,8 г; 0,085 М; 85%-ный выход).
1H-ЯМР (CDCl3) δ 1,15 (t, 3H); 1,8 (m, 2H); 1,95 (m, 2Н); 2,3 (s, 3H); 2,55 (m, 2Н); 3,28 (s, 2Н); 3,32 (q, 2Н); ppm.
13C-ЯМР (CDCl3) 13 (CH3CH2); 22 (CH3CH2); 37 (CH3CH2N); 39 (CH2NEt); 52 (NCH2CH2); 55 (C-O); 157,5 (C=O) ppm.
Масс-спектроскопия m/z 198 (M+).
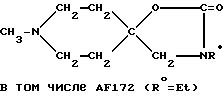
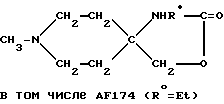
Пример 17: 1-Метилпиперидин-4-спиро-4'-(3'- этилоксазолидин-2'-он) AF174
а) 4-Ацетамидо-4-гидроксиметил-1-метилпиперидин
При комнатной температуре в течение 2 ч перемешивали 4-амино- 4-гидроксиметил-1-метилпиперидин (2,95 г; 0,02 М), карбонат калия (6,5 г; 0,047 М) и уксусный ангидрид (8,5 г; 0,08 М) в метаноле. Для нейтрализации полученной меси добавляли гидроксид натрия и экстрагировали указанный раствор хлороформом. Выпарив соответствующий экстракт, получали белое твердое вещество, которое кристаллизовали теплым ацетоном с выходом 4-ацетамидо-4- гидроксиметил-1-метилпиперидина (1,67 г; 0,009 М; 45%-ный выход).
б) 4-Этиламино-4-гидроксиметил-1-метилпиперидин
Раствор 4-ацетамидо-4-гидроксиметил-1-метилпиперидина (1,6 г; 8,6 мМ) в сухом ТГФ подвергали дефлегмации в присутствии алюмогидрид лития (3 г). Через 4 дня образовавшуюся смесь выливали в смесь воды и льда и фильтровали через Celite. Выпаривали растворитель, после испарения большей части воды экстрагировали полученный раствор хлороформом, а соответствующий экстракт высушивали над сульфатом магния и выпаривали с выходом 1,13 г (77%-ный выход) довольно грубо очищенного вещества. Полученный таким образом 4-этиламино-4-гидроксиметил-1-метилпиперидин использовали без дополнительной очистки.
в) 1-Метилпиперидин-4-спиро-4'-(3'-этилоксазолидин-2'-он) AF174
Смесь 4-этиламино-4-гидроксиметил-1-метилпиперидина (172 мг; 1 мМ) и N', N'-карбодиимидазола (486 мг; 3 мМ) в течение 3 ч перемешивали в хлороформе в атмосфере азота. Выпаривая указанную смесь, получали грубо очищенное вещество, которое интенсивно промывали гексаном, а затем выпаривали с выходом искомого соединения AF172 - 1-метилпиперидин-4-спиро-4'-(3'- этилоксазолидин-2'-она) в виде белого твердого вещества (140 мг; 0,71 мМ; 71%-ный выход).
1H-ЯМР (CDCl3) δ 1,10 (t, 3H); 1,6 (m, 2H); 1,95 (m, 4Н); 2,25 (s, 3H); 2,85 (m, 2H); 3,2 (q, 2H); 4,1 (s, 2H) ppm.
Масс-спектроскопия m/z 198 (M+).
Пример 18: 2-N-Метилспиро-(1,3-сукцинимид-4,3')хинуклидин AF133
а) Этил (3-хинуклидилиден)-цианоацетат
Смесь 3-хинуклидинона (30 г; 0,24 М), этил цианоацетата (40 г; 0,35 М), ацетата аммония (3,8 г), уксусной кислоты (11 г) и 120 мл бензола выдерживали при температуре дефлегмации, после чего с помощью азеотропной перегонки удаляли воду (всего 4 мл). Охлаждали полученный бензольный раствор, добавляли карбонат калия (30 г) в 120 мл воды, а образовавшуюся смесь трижды экстрагировали 500 мл толуола. Объединяли и высушивали соответствующие толуольные экстракты, а выделенный таким образом продукт осаждали в виде гидрохлорида с выходом 63 г (95%-ный выход) грубо очищенного продукта.
ТЖХ на силикагеле Art 5735 (Merck), 2%-ная смесь (объемное соотношение) 25%-ного водного раствора гидроксида аммония в метаноле: Rf 0,67.
Указанный продукт может быть дополнительно очищен с помощью кристаллизации в этаноле или изопропаноле.
1H-ЯМР δ (CDCl3-TMS) свободное основание: 1,29 (t, 3H, CH3); 4,2 (q, 2Н, CH2); 1,7-1,9; 2,8-3,2 (m, хинуклидиновый скелет).
13C-ЯМР δ (CDCl3-TMS): 14 (CH3); 62 (CH2); 189 (C=O); 162 (C=N); 115 (C-CN); 100 (C=C); 33,7 (C-H).
б) 3-Карбоэтокси-3-карбоэтоксиметилхинуклидин
Смесь этил (3-хинуклидилен)-цианоацетата (64 г; 0,24 М) и цианида калия (17 г; 0,26 М), растворенного в 25 мл воды, растворяли в 125 мл этанола. Указанную смесь в течение 20 мин подвергали дефлегмации, охлаждали, фильтровали для удаления хлорида калия, а отфильтрованный хлорид калия дважды промывали 50 мл этанола. Объединяли и выпаривали соответствующие спиртовые растворы, а полученный масляный остаток растворяли в 250 мл концентрированной соляной кислоты и подвергали дефлегмации в течение 24 ч. Затем выпаривали указанный раствор, а выделенный остаток несколько раз промывали ацетоном и высушивали. Высушенное твердое вещество растворяли в этаноле, насыщенном соляной кислотой, и подвергали дефлегмации в течение 20 ч. После этого удаляли использованный этанол, а полученный остаток осторожно подщелачивали карбонатом натрия и экстрагировали хлороформом. Высушивали и выпаривали соответствующий хлороформный раствор, а выделенный при этом грубо очищенный диэфир дополнительно очищали с помощью хроматографии на колонке с использованием 2%-ного раствора метанола в хлороформе в качестве элюента.
МС m/z 2,69 (М+); основной пик m/z 196 (M-C-OEt).
1H-ЯМР δ (CDCl3-TMS): 1,2 (dt, 6H, CH3); 4,2-4,3 (dt, 4H, CH2O); 1,3-1,6; 2,6-3,1 (m, хинуклидиновый скелет).
в) 2-N-Метилспиро-(1,3-сукцинимид-4,3')хинуклидин AF133
3-Карбоэтокси-3-карбоэтоксиметилхинуклидин (3,35 г; 12 мМ) растворяли в 4,5 г метиламина и в течение 90 ч выдерживали при температуре 190oC и повышенном давлении. Охлаждали и выпаривали указанную реакционную смесь, а полученный твердый остаток очищали с помощью силикагельной хроматографии, элюция 2%-ным раствором метанола в хлороформе, содержащем 0,2 мл аммиака. Соединение AF133 выделяли в виде 1,2 г (5,7 мМ) белого твердого вещества, т. пл. 94-96oC.
МС 209 (M+).
1H-ЯМР δ (CDCl3-TMS) 3,4 (d, 1H) (H2); 2,96 (s, 3H) (CH3); 2,5 (d, 1H) (H2); 1,5-1,9 (m, хинуклидиновый скелет).
Пример 19: 2-N-Этил-спиро-(1,3-сукцинимид-4,3')хинуклидин AF134
Грубо очищенный 3-карбоэтокси-3-карбоэтоксиметилхинуклидин (20 г) растворяли в 70%-ном этил амине и в течение 7 ч выдерживали полученную смесь при температуре 140oC и высоком давлении. За протеканием реакции следили с помощью ГХ. Образовавшийся грубо очищенный продукт экстрагировали хлороформом, а соответствующую хлороформную фракцию затем высушивали и выпаривали. Полученный маслянистый остаток очищали с помощью хроматографии на силикагеле, элюция смесью хлороформа, петролейного эфира, этанола и водного нашатырного спирта в соотношении 17:13:3:0,4. Соответствующее свободное основание осаждали в виде гидрохлорида с выходом 6,6 г белого твердого вещества, т. пл. 270-272oC. ТЖХ на силикагеле Art 5735 (Merck), 2%-ная смесь (объемное соотношение) 25%-ного водного раствора гидроксида аммония в метаноле: Rf 0,47.
МС 222 (М+).
1H-ЯМР δ (CDCl3-TMS) свободное основание: 1,5 (dt, 3H, CH3); 3,5 (q, 2Н, N-CH2); 1,6-3,3 (m, хинуклидиновый скелет).
Пример 20: 1-Метидпиперидин-4-спиро-5'-(оксазолидин-2',4'-дион) AF169 и 1-Метилпиперидин-4-спиро-5'-(3'-этилоксазолидин-2',4'-дион) AF180
а) 4-Гидрокси-4-циано-1-метилпиперидин
К свежеперегнанному 1-метилпиперидин-4-ону (81,72 г; 0,72 М) в воде (200 мл) добавляли приблизительно 100 мл 37%-ной HCl до pH 3. Указанную реакционную среду охлаждали на ледяной бане, а затем постепенно добавляли раствор цианида калия (49 г; 0,75 М) в воде (200 мл) так, чтобы температура в среде поддерживалась на уровне приблизительно 10oC. После этого рассматриваемую реакционную смесь перемешивали в течение 2 ч, а затем фильтровали. Отфильтрованный продукт промывали водой и высушивали с получением 4-гидрокси-4- циано-1-метилпиперидина (67 г; 0,48 М; 67%-ный выход) в виде белого порошка, т.пл. 135oC.
1H-ЯМР (CDCl3) δ 1,9 (m, 2Н); 2,2 (m, 2Н); 2,4 (s, 3H); 2,45 (m, 2Н); 2,75 (m, 2Н); 2-3,5 (bm, 1H, ОН) ppm.
б) 4-Гидрокси-4-карбамоил-1-метилпиперидин
К серной кислоте (80 мл) в условиях внешнего охлаждения постепенно добавляли 4-гидрокси-4-циано-1-метилпиперидин (36,4 г; 0,26 М). Указанную смесь в течение 41 ч выдерживали при комнатной температуре, после чего добавляли к ней измельченный лед (30 г). Образовавшийся раствор нейтрализовали карбонатом бария (376 г) до pH 8-9, добавляли воду, отфильтровывали выпавший в осадок сульфат бария и промывали его метанолом. Соответствующий фильтрат концентрировали при пониженном давлении. Искомый продукт 4-гидрокси-4-карбамоил-1-метилпиперидин (28,16 г; 0,18 М; 69%-ный выход) кристаллизовали из этанола в виде белого твердого вещества, т.пл. 180oC.
1H-ЯМР (CD3OD) δ 1,51 (m, 2H); 2,15 (m, 2Н); 2,25 (s, 3H); 2,4 (m, 2Н); 2,7 (m, 2Н) ppm.
Масс-спектроскопия m/z 158 (M+).
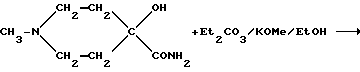
г) 1-Метилпиперидин-4-спиро-5'-(оксазолидин-2',4'-дион) AF169
К раствору метоксида калия (9,8 г; 0,14 М) в сухом этаноле (60 мл) добавляли раствор 4-гидрокси-4-карбоксамид-N-метил пиперидина (27,5 г; 0,17 М) и диэтил карбоната (26,23 г; 0,22 М) в этаноле (300 мл). Образовавшуюся смесь в течение 60 ч подвергали дефлегмации при температуре 80oC. Выпаривали указанную реакционную смесь, выделенный остаток встряхивали в холодной воде (70 мл) и нейтрализовали 2 н. HCl до pH 7. Полученный раствор концентрировали в 2 раза и отфильтровывали образовавшийся белый осадок. Растирая указанный осадок в этаноле, получали 1-метил-пиперидин-4-спиро- 5'-(оксазолидин-2', 4'-дион) (соединение AF169; 22 г; 0,12 М; 70-ный выход) в виде белого твердого вещества, т.пл. 285oC (с разложением).
1H-ЯМР (D2O, pH 7) 2,07 (m, 2Н); 2,27 (m, 2Н); 2,95 (s, 3H); 3,30 (m, 2Н); 3,60 (m, 2Н) ppm.
Масс-спектроскопия (pH соединения равен 7) m/z 185 и 184 (М++1 и М+).
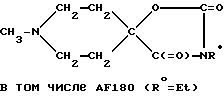
в) 1-Метилпиперидин-4-спиро-5'-(3'-этилоксазолидин-2',4'-дион) AF169
К раствору 1-Метилпиперидин-4-спиро-5'-(оксазолидин-2',4'-диона) (2,8 г; 0,015 М) в сухом ДМФ (100 мл) медленно добавляли гидрид калия (65%-ную масляную смесь) до тех пор, пока реакционная среда не переставала нагреваться (использовали 4,9 г). Образовавшуюся белую суспензию в течение 1 ч подвергали дефлегмации, после чего охлаждали. Затем по каплям добавляли этил бромид (4,6 г, 0,04 М). При этом полученная реакционная среда спонтанно разогревалась. Указанную реакционную среду вновь охлаждали до комнатной температуры и подвергали дефлегмации в течение 2 ч. Затем из охлажденной реакционной среды отфильтровывали белое твердое вещество и промывали его этанолом. Выпаривали растворители, а выделенный грубо очищенный продукт подвергали хроматографии на силикагельной колонке, элюция смесью хлороформа и метанола. Выпаривали фракцию, содержащую искомый продукт. Указанный продукт выделяли и идентифицировали в виде свободного основания. В целях практического использования вышеупомянутое основание обрабатывали смесью HCl, эфира и этанола, превращая его в гидрохлорид, выпадавший в осадок из указанной смеси в виде гидрохлорида 1-метилпиперидин-4-спиро-5'-(3'-этил-оксазолидин-2',4'-диона) (0,746 г; 0,003 М; 21%-ный выход), т.пл. 305oC (с разложением).
1H-ЯМР (CDCl3, свободное основание) δ 1,2 (t, 3H); 1,75 (m, 2Н); 2,15 (m, 2H); 2,3 (s, 3H); 2,32 (m, 2H); 2,80 (m, 2Н); 3,55 (q, 2Н) ppm.
13C-ЯМР (CDCl3, свободное основание) δ 13 (CH3CH2); 32 (CH2CH3); 35 (CH2-CH2-C); 46 (N-CH3); 50 (CH2-N-CH3); 85 (С спиро); 155 (OC=O); 175 (O=C= O) ppm.
Масс-спектроскопия (свободное основание) m/z 212 (M+).
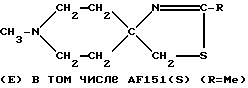
Пример 21: 1-Метилпиперидин-4-спиро-4'-(2'-метил-2'-тиазолин) AF151(S)
а) Смесь 1-метилпиперидин-4-спиро-4'-(2'-метил-2'-оксазолина) (соединение AF151; 1,85 г; 11,01 мМ), пентасульфида фосфора (1,83 г; 8,23 мМ) и моногидрата п-толуолсульфоновой кислоты (4,20 г; 22,08 мМ) в ксилоле (70 мл) в течение 3 ч повергали дефлегмации при перемешивании на магнитной мешалке. Азеотропно отгоняли использованный растворитель, а образовавшийся остаток подщелачивали концентрированным водным раствором NaOH, а затем экстрагировали дихлорметаном. Соответствующий органический экстракт высушивали над Na2SO4 и удаляли растворитель с получением коричневого масла (2,10 г), которое подвергали хроматографии на силикагельной колонке (Kieselgel S; 0,032-0,063 мм; Riedel De-Наеn, 70 г). Элюируя смесью хлороформа и метанола в соотношении 97: 3, содержащей 10 М аммония, получали фракции, содержащие чистое соединение AF151(S) (0,90 г).
б) Порошки 4-ацетамидо-4-гидроксиметил-1-метилпиперидина (8,00 г; 0,043 М) и пентасульфида фосфора (6,10 г; 0,0275 М) в течение 6 ч тщательно перемешивали в ксилоле (120 мл) на магнитной качалке при дефлегмации. Указанную реакционную смесь оставляли на ночь при комнатной температуре, отфильтровывали образовавшийся при этом осадок и промывали его масляным эфиром (40-60oC) с получением серого порошка (13,0 г). Охлаждали выделенный порошок и подщелачивали его концентрированным водным раствором NaOH, после чего несколько раз экстрагировали дихлорметаном. Объединяли соответствующие экстракты, высушивали их над Na2SO4 и выпаривали. Полученный остаток экстрагировали гексаном, затем удаляли гексан с выходом красного масла (3,53 г), которое подвергали перегонке с образованием бесцветного масла (2,40 г), т. кип. 60-68oC (при 0,4 мм рт. ст.), которое в свою очередь подвергали хроматографии на силикагельной колонке (Merck, 100 г). Элюцию проводили смесью хлороформа, эфира, метанола и нашатырного спирта в соотношении 70:25:4:1 с выходом чистого соединения AF151(S) (1,71 г).
1H-ЯМР (CDCl3) 1,65-1,78 (m, 2Н); 1,90-2,04 (m, 2Н); 2,19 (s, CH3С=N-); 2,32 (s, CH3N-); 2,30-2,43 (m, 2Н); 2,60-2,75 (m, 2H); 3,11 (s, -CH2S-) ppm.
13C-ЯМР (CDCl3) 19,9 (CH3С= N-); 35,8 (C3 и C5); 43,1 (-CH2S-); 45,6 (CH3N-); 52,1 (C2 и C6); 78,5 (C4); 161,0 (S-C=N-) ppm.
MC m/Z 184 (M+, 100%); 110 (26%); 109 (56%); 72 (93%); 71 (24%).
Пример 22: 1-Метилпиперидин-4-спиро-4'(5)'-(2'-метил-2' -имидазолин) AF190
а) 4-амино-4-циано-1-метилпиперидин
Смесь 1-метилпиперидин-4-она (33,0 г; 0,292 M), цианида калия (19,5 г; 0,299 М) и хлорида аммония (16,5 г; 0,308 M) суспендировали в смеси метанола (225 мл) и воды (150 мл), а полученную суспензию перемешивали при комнатной температуре в течение 12 дней. Отфильтровывали образовавшийся осадок, а соответствующий фильтрат выпаривали при пониженном давлении. Для удаления воды, возможно присутствующей в выделенном остатке, к указанному остатку добавляли этанол, после чего осуществляли азеотропную перегонку. К полученному остатку вновь добавляли этанол, а после частичного растворения в нем рассматриваемого остатка отфильтровывали нерастворившиеся неорганические соединения и промывали их этанолом. Объединяли соответствующий фильтрат и промывочные жидкости и удаляли растворитель с выделением густого масла (35,5 г), которое, будучи исследовано с помощью ТЖХ (смесь хлороформа, метанола и нашатырного спирта в соотношении 17:2:1 на силикагеле), приводило к появлению двух пятен. Вышеупомянутое масло кристаллизовали из эфира с получением твердого вещества, которое еще раз подвергали кристаллизации из указанного растворителя с выходом 4-циано-4-гидрокси-1-метилпиперидина в виде кристаллов, т.пл. 130-133oC. При концентрации оставшегося маточного раствора получали еще одну порцию кристаллического твердого вещества, которое преимущественно представляло собой 4-амино-4-циано-1-метилпиперидин.
1H-ЯМР (CDCl3) 1,72-1,88 (m, 2Н); 2,01 (m, 2Н); 2,25-2,37 (m, 2H); 2,32 (s, CH3N-); 2,74-2,83 (m, 2H) ppm.
MC m/z 139 (M+); 112 (M+-HCN); 71; 70.
Подвергая выделенный 4-амино-4-циано-1-метилпиперидин ацетилированию с помощью уксусного ангидрида и пиридина, получали 4-ацетамидо-4-циано-1-метилпиперидин, который кристаллизовали из смеси масляного эфира и дихлорметана, т.пл. 143-144oC.
1H-ЯМР (CDCl3) 1,78-1,96 (m, 2H); 2,04 (s, CH3CON-); 2,32 (s, CH3N-); 2,35-2,50 (m, 4Н); 2,66-2,84 (m, 2H); 6,22 (s, -NHCO-) ppm.
MC m/z 271 (M+); 181 (M+); 122 (М+-C3CONH2).
ИР (CHCl3) 3438; 3303; 2940; 2804; 2242 (C=N); 1670 (амид) см-1.
Подвергая выделенный 4-амино-4-циано-1-метилпиперидин кислому гидролизу с помощью H2SO4, получали 4-амино-4-карбамоил-1- метилпиперидин (т.пл. 145-147oC), который кристаллизовали из смеси этилацетата и дихлорметана.
1H-ЯМР (CDCl3) 1,44 (m, 2Н); 1,68 (br-NH2); 2,12-2,34 (m, 4H); 2,30 (s, CH3N-); 2,70-2,82 (m, 2H); 5,47 (br, -NH-); 7,39 (br,-NH-) ppm.
MC m/z 158 (M++1); 157 (M+); 140 (М+-NH3, 100%); 113 (M+-CONH2); 96; 71.
б) 4-Амино-4-аминометил-1-метилпиперидин
Раствор 4-амино-4-циано-1-метилпиперидина (3,60 г) в сухом диметоксиэтане добавляли в атмосфере азота к механически перемешиваемой суспензии гидрида лития-алюминия (3,0 г) в диэтоксиэтане таким образом, чтобы температура не превышали 50oC. По окончании указанного добавления образовавшуюся смесь выдерживали при температуре дефлегмации в течение 6 ч. Для того, чтобы разрушить избыток LiAlH4 к вышеупомянутой смеси, охлажденной до 0oC, при перемешивании в атмосфере азота последовательно добавляли 4М NaOH (10 мл), воду (3 мл), насыщенный раствор NaOH (10 мл) и опять воду (5 мл). Отделяли органический растворитель, а соответствующую водную фазу несколько раз экстрагировали ТГФ. Объединяли образовавшиеся ТГФ-экстракты и ранее отобранный органический растворитель, высушивали над Na2SO4 и удаляли использованные растворители с выходом поименованного соединения в виде вязкого масла (3,17 г; т.пл. 60-62oC), которое очищали с помощью перегонки при 0,08 мм ртутного столба).
1H-ЯМР (CDCl3) 1,43 (m, 2Н); 1,58 (m, 2Н); 2,15 (br. -NH2); 2,30 (s, CH3N-); 2,30 (m, 2Н); 2,56 (s, -CH2NH2); 2,56 (m, 2H) ppm.
Ацетилируя указанный диамин, получали диацетамид в виде твердого вещества (т.пл. 175-176oC), кристаллизующегося из ацетонитрила.
1H-ЯМР (CDCl3) 1,74 (m, 2Н); 1,96-2,10 (m, 2Н); 1,99 (s, CH3CON-); 2,02 (s, CH3CON-); 2,21 (m, 2H); 2,28 (s, CH3N-); 2,51- 2,61 (m, 2H); 3,50 (d, J= 5,7 Гц, -CH2NH-); 5,62 (s, -NHCO-); 7,18 (t, -CH2NHCO-) ppm.
MC m/z 227 (M+); 184 (М+-CH3CO); 169 (М+-CH3CONH); 168 (М+-CH3CONH2); 167; 155; 112; 109 (100%); 96; 71; 70.
Указанный диацетамид получали также, гидрируя 4-амино-4-циано- 1-метилпиперидин водородом (50 пси) при использовании в качестве катализатора никеля Ренея в горячем (60oC) уксусном ангидриде, содержащем ацетат натрия.
в) 1-Метилпиперидин-4-спиро-4'(5)'-(2'-метил-2'-имидазолин) AF190
К раствору 4-амино-4-аминометил-1-метилпиперидина (0,248 г; 1,734 мМ) в дихлорметане (5 мл) добавляли гидрохлорид этил ацетимидата (0,282 г; 2,282 мМ), а образовавшуюся смесь перемешивали при комнатной температуре в течение 3 ч. При пониженном давлении удаляли использованный растворитель, выделенный остаток подщелачивали с помощью концентрированного раствора Na2CO3, а затем экстрагировали дихлорметаном. Соответствующий экстракт высушивали над Na2CO3 и удаляли растворитель с получением бесцветного масла (191 мг), которое подвергали хроматографии на силикагельной колонке. Элюцию осуществляли смесью метанола, хлороформа, и 1%-ного нашатырного спирта; при увеличении концентрации метанола от 10 до 99% получали чистое соединение AF190 в виде масла, затвердевающего при замораживании.
1H-ЯМР (CDCl3) 1,57-1,84 (m, 4Н); 1,93 (s, CH3C=N-); 2,17-2,33 (m, 2H); 2,29 (s, CH3N-); 2,56 (m, 2H); 3,37 (s, -CH2-N-) ppm.
13C-ЯМР (CDCl3) 15,2 (CH3С=N-); 37,3 (C3 и C5); 46,1 (CH3N-); 52,5 (C2 и С6); 59,7 (С4); 63,7 (-CH2N-); 162,1 (-C=N-) ppm.
MC m/z 167 (M+); 152 (M-CH3); 138; 109 (100%); 97; 96; 72; 71; 70.
ИК (чистый) 3260; 2933; 2852; 2800; 1620 (-C=N-) см-1.
Пример 23: 1-Метилпиперидин-4-спиро-4'(5')-[2-метил-4'H(5'Н)- имидазол-5'(4')'-он] AF230
4-Ацетамидо-4-циано-1-метилпиперидин (1,03 г) растворяли в концентрированной серной кислоте (4,0 мл) и выдерживали при комнатной температуре в течение 4 дней. Образовавшуюся реакционную среду вносили в холодную воду (10 мл), а затем к указанной смеси добавляли карбонат бария до тех пор, пока соответствующая реакция уже не наблюдалась. Выпавший в осадок сульфат бария отфильтровывали и промывали водой и этанолом. Объединяли полученный фильтрат и промывочные жидкости, с помощью концентрированного раствора NaOH доводили pH до 13 и удаляли растворители при пониженном давлении. Выделенный остаток экстрагировали этанолом, выпаривали соответствующий экстракт, образовавшийся остаток экстрагировали дихлорметаном, а полученный при этом экстракт выпаривали с выходом масла (0,75 г), которое подвергали хроматографии на колонке силикагеля 60 (Merck 0,040-0,063 мм, 32 г). Элюцию проводили смесью метанола (содержащего 15 весовых процентов нашатырного спирта) и хлороформа в соотношении 1: 9 с получением чистого соединения AF230 (0,185 г; т.пл. 231-234oC), кристаллизующегося из смеси дихлорметана и эфира.
1H-ЯМР (CDCl3) δ 1,49 (m, 2Н); 1,97 (m, 2H); 2,20 (s, CH3-); 2,34 (s, CH3-); 2,48 (m, 2Н); 2,80 (m, 2Н); 9,83 (br. -NH-) ppm.
1H-ЯМР (D2O) δ 1,55 (m, 2Н) 1,88 (m, 2Н); 2,22 (s, CH3-); 2,29 (s, CH3-); 2,33 (m, 2Н); 2,90 (m, 2Н) ppm.
MC m/z 181 (M+); 111 (M+-70); 104; 94; 77; 71 (100%); 70.
УФ (EtOH) λmax 224 нм ( ε 4650), 248 нм (ε 2450).
ИК (KBr) 3140; 2795; 2540; 1665; 1540 см-1.
Кроме того, в основной среде можно получить циклизацию 4-ацетамидо-4-циано-1-метилпиперидина. Так, подвергая указанное соединение дефлегмации в присутствии 1 н. раствора КОН в этаноле, либо 1 н. раствора NaOH в воде, также можно получить соединение AF230. В последнем случае, дополнительно образовывался 4-ацетамидо- 4-карбамоил-1-метилпиперидин (т.пл. 207-208oC, с разложением), кристаллизующийся из смеси дихлорметана и метанола.
1H-ЯМР (CDCl3) δ 2,05 (s, CH3CO-); 2,08-2,30 (m,6H); 2,28 (s, CH3N-); 2,36 (m, CH2-); 5,40 (brs, -NH-); 5,56 (brs, -NH-); 7,04 (brs, -NH-) ppm.
MC m/z 199 (M+); 181 (M+-H2O); 155 (M+-CONH2); 140 (М+-CH2CO-NH2); 122; 112; 111; 96; 71 (100%); 70.
Соединение AF230 может существовать в виде таутомеров, что показано в его названии.
Пример 24: 1-Метилпиперидин-4-спиро-5'-(2-метил-2'- оксазолин-4'-он) AF238
а) 4-Ацетамидокарбонил-4-ацетокси-1-метилпиперидин
К смеси 4-циано-4-гидрокси-1-метилпиперидина (2,55 г; 18 мМ) и уксусного ангидрида (11 мл; 108 мМ) в трехгорлой колбе по каплям добавляли 5,1 г (2 эквивалента) 60%-ного раствора хлорной кислоты (HClO4). Осуществлялась экзотермическая реакция, однако, через 20 мин температура полученной смеси уменьшалась. Указанный раствор перемешивали в течение 2 ч, после чего выдерживали при комнатной температуре в течение ночи. Отфильтровывали образовавшийся белый осадок и промывали его эфиром и масляным эфиром. В результате получали практически количественный выход перхлорно-кислой соли 4-ацетамидокарбонил-4-ацетокси-1-метилпиперидина.
1H-ЯМР [перхлорат] (D2O) δ 2,2-2,4 (m, 2Н); 2,26 (m, 3H); 2,27 (s, 3H); 2,5 (m, 2Н); 2,95 (s, 3H); 3,32 (m, 2Н); 2,58 (m, H) ppm.
1H-ЯМР [свободное основание] (CDCl3) δ 2,05-2,27 (m, 4Н); 2,13 (s, 3H); 2,28 (s, 3H); 2,67-2,75 (m, 4Н); 8,4 (bs, 1H, NH) ppm.
MC m/z 242 (M+); 182; 167; 139; 123 (100%); 114; 96; 82; 70; 60.
УФ (H2O) λmax206 нм (ε 20400).
ИК (KBr) 3380; 3020; 1740; 1670 (sh); 1550; 1400; 1380; 1250 см-1.
б) 1-Метилпиперидин-4-спиро-5'-(2-метил-2'-оксазолин-4'-он) AF238
Смесь перхлорнокислой соли 4-ацетамидокарбонил-4-ацетокси-1- метилпиперидина (70 мг; 0,25 мМ) в ксилоле выдерживали при температуре 172oC (температура бани на силиконовом масле) до тех пор, пока белое суспендированное твердое вещество не становилось желтым. В течение реакции ощущался сильный запах уксусной кислоты. С помощью ТЖХ продемонстрировали полное превращение исходного соединения в 1-метилпиперидин-4-спиро-5'-(2- метил-2'-оксазолин-4'-он] (соединение AF238), охарактеризованный как соответствующая соль хлорной кислоты.
1H-ЯМР (D2O) δ 2,2 (m, 3H); 2,25 (m, 2H); 2,45 (m, 2Н); 2,8 (s, 3H); 3,25 (m, 2Н); 2,5 (m, H) ppm.
МС m/z 182 (M+); 140; 123; 112; 104; 96; 77; 70 (100%).
Пример 25: 1-Метилпиперидин-4-спиро-5'-(1'-метил-3'- этилгидантоин) AF161
К смеси соединения AF160 (100 мг; 0,47 мМ) и KH (100 мг; 35% по весу в минеральном масле) в 5 мл ДМФ добавляли метил п-толуолсульфонат (0,4 г, 1 мМ), полученный раствор перемешивали в течение 10 мин при комнатной температуре и подкисляли с помощью щавелевой кислоты в эфире. Образовавшийся осадок растворяли в воде, подщелачивали и экстрагировали петролейным эфиром, а соответствующие экстракты концентрировали и подвергали хроматографии на силикагеле, элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 90:10:1. Объединяли и выпаривали чистые фракции, а выделенный остаток растворяли в эфире и осаждали в виде гидрохлорида (85 мг; 72%-ный выход).
1H-ЯМР (свободное основание, CDCl3) δ 1,2 (t, J=6 Гц, 3H); 1,6-1,65 (m, 2Н); 2,0-2,1 (m, 2Н); 2,39 (s, 3H); 2,75-2,85 (m, 4H); 2,86 (s, 3H); 3,55 (q, J=6 Гц, 2H) ppm.
1H-ЯМР (гидрохлорид, D2O) δ 1,2 (t, J=6 Гц, 3H); 2,1-2,15 (m, 2Н); 2,3-2,4 (m, 2Н); 2,95 (s, 3H); 3,0 (s, 3H); 3,5 (q, J=6 Гц, 2Н) ppm.
МС m/z 225 (M+ 18%); 71 (100%).
Пример 26: 1-Метилпиперидин-4-спиро-5'-(1',3'- диэтилгидантоин) AF162
К смеси 1-метилпиперидин-4-спиро-5'-гидантоина (110 мг; 0,6 мМ) и KH (0,2 г; 35% по массе в минеральном масле) в 3 мл ДМФ добавляли этил бромид (0,5 г, 4,6 мМ), полученный раствор перемешивали в течение 30 мин при комнатной температуре, разбавляли эфиром и подкисляли с помощью избытка щавелевой кислоты. Образовавшийся осадок растворяли в воде, подщелачивали и несколько раз экстрагировали хлороформом, объединяли соответствующие экстракты, концентрировали их и подвергали хроматографии на силикагеле с использованием градиента хлороформа и смеси хлороформа, метанола и нашатырного спирта в соотношении 90:10:1, с выходом чистого соединения AF162 (60 мг; 42%-ный выход). 1H-ЯМР (свободное основание, CDCl3) δ 1,2 (t, J=6 Гц, 6Н); 1,65-1,7 (m, 2Н); 1,96-2,15 (m, 2Н); 2,4 (s, 3H); 2,5-2,6 (m, 4Н); 3,3 (q, J=6 Гц, 2Н) ppm.
1H-ЯМР (гидрохлорид, D2O) δ 1,15 (t, J=6 Гц, 6Н); 2,05-2,15 (m, 2Н); 2,25-2,35 (m, 2Н); 2,9 (s, 3H); 3,3 (q, J=6 Гц, 3H) ppm.
13C-ЯМР (гидрохлорид, D2O) δ 14,0; 28,6; 35,0; 44,0; 52,7; 59,2; 157,0; 177,0 ppm.
MC m/z 239 (M+ 75%); 71 (100%).
Пример 27 ; 1-Метилпиперидин-4-спиро-4'-(2',5'-диметилтио- 4'H-имидазол) AF191
Смесь 1-метилпиперидин-4-спиро-4'-(2', 5'-диметилтио-4'Н- имидазола (0,700 г; 2,881 мМ) и метоксида натрия (0,360 г; 6,667 мМ) выдерживали при температуре дефлегмации в метаноле (15 мл) в течение 3,5 ч. При этом наблюдалось выделение газа. Из образовавшейся реакционной среды удаляли растворитель, а полученный остаток экстрагировали дихлорметаном. Соответствующий органический экстракт выпаривали с выделением твердого остатка (0,613 г), который экстрагировали масляным эфиром. Из указанного экстракта выпаривали растворитель с выходом остатка (0,263 г), который кристаллизовали из масляного эфира с получением чистого соединения AF191, т.пл. 84-85oC.
1H-ЯМР (CDCl3) 1,40 (m, 2Н); 1,97 (m, 2Н); 2,36 (s, CH3N-); 2,52 (s, CH3S-); 2,53 (m, 2H); 2,70-2,80 (m, 2Н); 4,10 (s, CH3О-) ppm.
13C-ЯМР (CDCl3) 13,6 (CH3S-); 32,3 (C3); 46,2 (CH3N-); 51,9 (C2); 57,9 (CH3O-); 74,2 (C4); 171,6 (-N=C-SCH3); 196,0 (-N=C-OCH3) ppm.
MC m/z 228 (M++1).
Пример 28: 1-Метилпиперидин-4-спиро-4'-(2'-метилтио-5'- амино-4'H-имидазол) AF192
Раствор соединения AF177 (0,411 г) в реагенте (15 мл), полученном в результате растворения аммиака (15% по весу) в нашатырном спирте, перемешивали в течение 3 дней при комнатной температуре. Выпаривали образовавшуюся реакционную смесь, к выделенному остатку добавляли 15 мл свежего указанного реагента и повторяли вышеописанную реакцию еще два раза. Наконец, рассматриваемую реакционную среду выпаривали при пониженном давлении, а полученный остаток промывали ацетоном с выходом соединения AF192 (0,266 г) в виде белого твердого вещества (т.пл. > 240oC, с разложением), кристаллизующегося из этанола.
1H-ЯМР (D2O) δ 1,48 (m, 2Н) 1,89 (m, 2Н); 2,29 (s, CH3N-); 2,46 (m, 2Н); 2,48 (s, CH3S-); 2,86 (m, 2Н) ppm.
MC m/z 212 (M+); 142 (M+-70); 70.
Пример 29: 1-Meтилпиперидин-4-спиро-4'-(2'-метилтио-5'- аминометил-4'H-имидазол) AF193 и 1-метилпиперидин-4-спиро-4'- (2',5'-бис(аминометил)-4'H-имидазол) AF194
Раствор соединения AF177 (0,338 г) в водном растворе метиламина (35%; 5 мл) выдерживали при температуре 80oC в течение 2 ч. С помощью выпаривания при пониженном давлении удаляли воду и избыток реагента, а полученный остаток подвергали хроматографии на силикагельной колонке (Merck 60; 0,040-0,063 мм). Элюцию проводили смесью хлороформа, метанола и нашатырного спирта в соотношении 80:20:1 с получением чистого соединения AF193 (0,061 г; т.пл. 193-194oC), кристаллизующегося из ацетонитрила.
1H-ЯМР (CDCl3) 1,44 (m, 2Н); 1,85 (m, 2Н); 2,38 (s, CH3N-); 2,52 (s, CH3S-); 2,66 (m, 2Н); 2,81 (m, 2H); 3,06 (s, CH3NH-); 6,47 (-NH-) ppm.
MC m/z 226 (M+); 179 (М+-CH3S); 170 (M+-CH3NHCN); 169; 156 (M+-70).
Осуществляя элюцию смесью хлороформа, метанола и нашатырного спирта в соотношении 50: 50:1, получали соединение AF194 (0,130 г; т.пл. 113-114oC в виде белого вещества, кристаллизующегося из ацетонитрила.
1H-ЯМР (CDCl3 + СО3OD) 1,44 (m, 2Н); 1,81 (m, 2Н); 2,37 (s, CH3N-); 2,57 (m, 2Н); 2,80 (m, 2Н); 2,95 (s, CH3NH-); 2,96 (m, CH3N-) ppm.
MC m/z 209 (M+); 152; 139 (M+-70).
Повторяя вышеописанную реакцию при использовании 2 M метиламина на каждый М соединения AF194, основным образующимся продуктом являлось соединение AF193 при наличии лишь следов соединения AF194.
Пример 30: 1-Метилпиперидин-4-спиро-4'-(2'-метил-2'- оксазолин) AF150
а) Гидрохлорид 1-метил-4-нитрометилпиперидин-4-ола
Указанное исходное соединение синтезировали с использованием незначительно модифицированного способа А.Д.Кейла (US 4746655). К интенсивно перемешиваемому 20%-ному раствору этоксида натрия (1,28 М) в этаноле, температуру которого поддерживали на уровне 5-8oC, добавляли смесь N-метилпиперидина (142 г; 1,28 М) и нитрометана (78,1 г; 1,28 М). Образовывался белый осадок, перемешивание продолжали в течение 20 мин, а затем - в течение еще 40 мин при комнатной температуре. Полученный раствор подкисляли с помощью 500 мл 7,2 н. HCl в изопропиловом спирте. Соответствующий гидрохлорид, а также неорганические соли экстрагировали тремя порциями метанола (по 300 мл), а использованный растворитель удаляли в вакууме с выходом поименованного соединения, т. пл. 180-182oC (не гигроскопично), m/z 174 (М+ свободного основания, 100%); 157 (M-OH, 20%); 127 (M-H-NO2, 25%); 113 (M-NO2-CH3, 40%).
б) К раствору 1-метил-4-нитрометилпиперидин-2-ола (133,5 г) в метаноле (1500 мл) по частям добавляли палладиево-угольный катализатор (10%, 4 г). Указанное соединение в течение 48 ч подвергали гидрированию в аппарате Парра при давлении 55 пси и комнатной температуре. Полученный раствор осторожно фильтровали, обрабатывали активированным углем, удаляли растворитель, а выделенный остаток растирали с этанолом (200 мл) с выходом поименованного соединения, т. пл. 177-179oC. m/z 144 (М+ свободного основания, 15%); 127 (M-OH, 25%); 114 (M-CH2-NH2, 100%).
в) 1-Метилпиперидин-4-спиро-4'-(2'-метил-2'-оксазолин) AF150
К раствору гидрохлорида 4-аминометил-1-метилпиперидин-4-ола (3,61 г; 0,02 М) в абсолютном метаноле (50 мл) добавляли раствор КОН (1,43 г или 86%) в метаноле (50 мл). Перемешивали полученную смесь в течение 10 мин, после чего добавляли раствор гидрохлорида этил ацетимидата (2,7 г) в 20 мл абсолютного метанола и продолжали перемешивание в течение еще 30 мин. Удаляли использованный растворитель, выделенный остаток, представляющий собой твердое вещество, растворяли в растворе 2,8 г Na2CO3 в 50 мл воды, а затем концентрировали полученную смесь в вакууме до сухого состояния. Выделенное белое твердое вещество дважды экстрагировали 50 мл хлороформа, обрабатывали активированным углем, высушивали, над Na2SO4 и удаляли растворитель с выходом поименованного соединения (62,5%-ный выход; т.пл. 45oC; сублимация при температуре 40oC и 0,05 мм ртутного столба), образующего одно пятно при ТЖХ на силикагеле, элюция 2%-ным NH3 в CH3ОН, Rf=0,4.
m/z 168 (М свободного основания, 100% при 7,5 эв).
1H-ЯМР (300 мГц, CDCl3): δ 3,56 (2Н, q, J=1,5 Гц); 2,53 (4Н, m); 2,34 (3H, s); 1,96 (3H, t, J=1,5 Гц); 1,82 (4Н, m).
Заменив в вышеописанном Примере КОН на эквивалентное количество NaOH или Et3N, получали аналогичные результаты.
г) Дибензоил-D-тартрат соединения AF150
К перемешиваемому раствору соединения AF150 (5,5 г; 32 мМ) в 200 мл сухого толуола добавляли горячий раствор дибензоил-D-винной кислоты. Образующемуся при этом осадку позволяли осесть, после чего сливали надосадочную жидкость. Оставшееся твердое вещество трижды промывали 100 мл сухого толуола и высушивали при пониженном давлении с получением 8,4 г (80%-ный выход) белого слегка гигроскопичного твердого вещества.
ТЖХ, смесь хлороформа и оксида алюминия (Merck Art 5581) Rf=0,4. m/z: 168 (М+). 1H-ЯМР (300 мГц; D2O, содержащая 1,5 мг Na2CO3/0,5 мл D2O)): δ 1,95 (s, 6H, CH3-С); 2,35 (s, 6Н, CH3-N); 3,5 (s, 4H, CH2); 5,7 (s, 2H); 7,5-8,2 (m, 10Н, ароматические водороды).
Пример 31: 1-Метилпиперидин-4-спиро-4'-(2'-этил-2'- оксазолин) (2'-этиловый аналог соединения AF150)
Указанное соединение получали сходным образом с соединением из Примера 31, используя эквивалентное количество гидрохлорида этил пропионимидата вместо гидрохлорида этил ацетимидата. Соответствующий продукт выделяли в виде жидкости, т. кип. 53oC/0,03 мм ртутного столба (65%-ный выход).
1H-ЯМР (300 мГц; CDCl3): δ 3,52 (2Н, t, J=1,5 Гц); 2,47 (4H, m); 2,30 (3H, s); 2,26 [2Н, квартет (J=7 Гц), триплеты (J=1,5 Гц)]; 1,86 (2Н, m); 1,72 (2Н, m); 1,18 (3H, t).
Пример 32: 1-Метилпиперидин-4-спиро-5'-(2'-метил-2'-оксазолин) AF151
а) 1-Метилпиперидин-4-спиро-5'-гидантоин
Смесь растворов 1-метилпиперидин-4-она (36,44 г; 0,322 M) в этаноле (150 мл), карбоната аммония (930 г; 0,968 M) в воде (400 мл) и цианида калия (25,8 г; 0,396 M) в воде (82 мл) выдерживали при температуре 60oC в течение 2,5 ч, а затем оставляли на ночь при комнатной температуре, в результате чего происходило осаждение 1-метилпиперидин-4-спиро-5'-гидантоина. Отфильтровывали указанный осадок, промывали его небольшими количествами холодной воды, этанола и эфира с выходом кристаллического порошка (27,0 г). Концентрируя соответствующие фильтраты и промывочные жидкости, получали еще одну порцию рассматриваемого продукта (20,0 г). Выделенный продукт кристаллизовали из метанола, т.пл. 265-276oC (с разложением).
ИК (KBr) 3170 (NH); 1700 (С=0) см-1.
m/z: 183 (M+, 38%); 71 (100%).
1H-ЯМР (300 мГц; D2O): δ 1,8 (2Н); 2,06 (секстет, 2Н); 2,49 (s, CH3); 2,58 (t, 2Н); 3,14 (t, 1H); 3,20 (t, 1H).
б) 4-Амино-1-метилпиперидин-4-карбоновая кислота
Смесь 1-метилпиперидин-4-спиро-5'-гидантоина (9,75 г; 0,0533 M) и оксагидрата гидроксида бария (28,8 г; 0,00913 M) в воде (150 мл) выдерживали в автоклаве при температуре 160oC в течение 3 ч. Объединяли содержимое четырех указанных емкостей и отфильтровывали выпавший в осадок карбонат бария. Соответствующий фильтрат нейтрализовали с помощью твердой двуокиси углерода, а образующийся при этом осадок удаляли посредством фильтрации. Полученный фильтрат концентрировали до небольшого объема с выходом 4-амино-1- метилпиперидин-4-карбоновой кислоты (32,0 г; 95%-ный выход), т.пл. 275-280oC (с разложением).
ИК (KBr) 3300; 1655; 1580 см-1.
m/z 158 (M+, 90%); 141 (90%, M-OH); 113 (12%, M-CO2H); 96 (100%); 71 (52%).
1H-ЯМР (300 МГц; C5D5N + D2O): δ 1,2 (m, 2Н); 1,48 (s, CH3N-); 1,7 (m, 2H); 1,9 (m, 2Н); 2,0 (m, 2H).
в) 4-Амино-4-гидроксиметил-1-метилпиперидин
Порошок алюмогидрида лития (15,62 г; 0,412 M) в сухом тет рагидрофуране (ТГФ; 600 мл) выдерживали при температуре дефлегмации в течение 15 мин, после чего в атмосфере азота при эффективном перемешивании по частям добавляли 4-амино-1-метилпиперидин-4- карбоновую кислоту (31,6 г; 0,196 M) в форме сухого порошка. По завершении добавления образовавшуюся реакционную смесь выдерживали при температуре дефлегмации в течение 4 ч, затем охлаждали до температуры 0oC при эффективном перемешивании в атмосфере азота и останавливали реакцию, осторожно добавляя воду (20 мл), 15%-ный нашатырный спирт (20 мл) и снова воду (10 мл). Фильтровали указанную реакционную среду, а выделенный осадок трижды экстрагировали 150 мл кипящего ТГФ. Объединяли соответствующий ТГФ-фильтрат и экстракты, а растворитель удаляли при 25 мм ртутного столба с получением желтого густого масла (28,0 г; 98,9%-ный выход).
ИК (чистый) 3320 (NH); 3200 (br. ОН); 1587 (NH2); 1468; 1448 см-1.
m/z 144 (M+, 15%); 127 (M-OH); 113 (M-CO2H); 96 (100%); 71 (41%).
1H-ЯМР (300 мГц; CDCl3): δ 1,41 (m, 2Н); 1,60 (m, 2H); 2,24 (s, CH3N-); 2,9 (m, 2Н); 2,48 (m, 2Н); 2,50 (br., -NH2); 3,29 (s, -CH2OH).
г) 1-Метилпиперидин-4-спиро-5'-(2'-метил-2'-оксазолин) АF151
Смесь 4-амино-4-гидроксиметил-1-метилпиперидина (1,80 г), уксусной кислоты (20 мл) и ксилола (20 мл) подвергали азеотропной перегонке в течение 28 ч. Оставшуюся уксусную кислоту и ксилол удаляли при пониженном давлении (25 мм ртутного столба) с получением остатка в виде густого масла, которое подщелачивали до pH 11 с помощью водного раствора Na2CO3. Экстрагируя указанный остаток хлороформом и выпаривая соответствующий экстракт, выделяли небольшое количество остатка в виде коричневого масла (0,27 г). Для удаления воды выпаривали водный раствор, оставшийся после экстракции хлороформом, полученное при этом твердое вещество экстрагировали хлороформом, а соответствующий экстракт высушивали над Na2SO4 и выпаривали с выходом остатка в виде очень гигроскопичного твердого вещества (3,0 г). Используя ТЖХ, показали, что указанное твердое вещество дает преимущественно одно пятно, более полярное по сравнению с исходным аминоспиртом. При нагревании порции этого гигроскопичного твердого вещества (т.пл. 150-160oC) в вакууме оно практически сразу начинало перегоняться в виде бесцветного масла при температуре 45oC и давлении 0,15 мм ртутного столба. При хранении рассматриваемого масла в морозильной камере оно образовывало кристаллические иглы, плавящиеся при комнатной температуре. Продуктом перегонки являлась уксусно-кислая соль поименованного соединения.
ИК (чистый) 1664 (-C=N); 1565 и 1398 (CO2 --); 1256 (C-O) см-1.
m/z 168 (М+ свободного основания); 109; 70.
1H-ЯМР (300 мГц, CDCl3) δ 1,77 (m, 2Н); 1,96 (m, 2H); 1,98 (s, CH3-); 2,0 (s, CH3-); 2,49 (s, CH3N-); 2,91 (m, 4H); 3,95 (s, CH2O-); 9,30 (br.s, -CO2H).
13C-ЯМР (300 мГц, CDCl3) δ 14,0 (CH3CO2-); 22,9 (CH3С=N-); 35,6 (C3 и C5); 44,4 (CH3N+); 51,1 (C2 и C6); 67,0 (C4); 77,4 (C5'); 164,3 (C=N); 176,7 (-CO2-).
MC m/z 167 (M+); 152 (M-CH3); 138; 109 (100%); 97; 96; 72; 71; 70.
1H-ЯМР свободного основания (300 мГц; CDCl3): δ 1,64 (m, 2Н); 1,84 (m, 2Н); 1,98 (s, CH3-); 2,26 (m, 2Н); 2,30 (s, CH3-); 2,69 (m, 2Н); 3,94 (s, -CH2-).
Пример 33: 1-Метилпиперидин-4-спиро-5'-(2'-этил-2'- оксазолин) (2'-этиловый аналог соединения AF151)
Смесь 4-амино-4-гидроксиметил-1-метилпиперидина (3,0 г), пропионовой кислоты (50 мл) и ксилола (90 мл) подвергали азеотропной перегонке в течение 5 ч. Образовавшийся остаток (7 мл) подщелачивали до pH 11-12 с помощью водного раствора Na2CO3. Экстрагируя указанный остаток хлороформом и выпаривая соответствующий экстракт, выделяли смесь неполярных соединений (0,80 г). Для удаления воды выпаривали водный раствор, оставшийся после экстракции хлороформом, полученное при этом твердое вещество экстрагировали хлороформом, а соответствующий экстракт высушивали над Na2SO4 и выпаривали с выходом остатка в виде гигроскопичного твердого вещества (3,6 г). Используя ТЖХ (силикагель, элюция смесью метанола, хлороформа и нашатырного спирта в соотношении 40:58:2), показали, что указанное твердое вещество дает преимущественно одно пятно, более полярное по сравнению с исходным амино-спиртом. При нагревании порции этого гигроскопичного твердого вещества (1,5 г) в вакууме оно практически сразу начинало перегоняться в виде густого бесцветного масла при температуре 50oC и давлении 0,1 мм ртутного столба. Продуктом перегонки являлась пропионово-кислая соль поименованного соединения.
m/z 182 (М+ свободного основания, 14%); 167 (5%); 154 (71%); 125 (9%); 109 (100%); 96 (45%); 81 (30%); 74 (57%); 70 (89%); 57 (64%).
1H-ЯМР (300 мГц, CDCl3) δ 1,12 (t, J=7,5 Гц, CHCH2-); 1,17 (t, J=7,6 Гц, CH3CH2-); 1,75 (m, 2Н); 2,00 (m, 2Н); 2,29 (q, J=7,5 Гц, CH3CH2-); 2,30 (q, J= 7,6 Гц, CH3CH2-); 2,56 (s, CH3N-); 3,02 (m, 2 -CH2-); 3,95 (s, -CH2O-); 7,25 (br. -CO2H).
К перемешиваемому раствору вышеупомянутой пропионово-кислой соли (700 мг) в CHCl3 добавляли насыщенный водный раствор K2CO3 до тех пор, пока не прекращалось выделение CO2. Затем полученную смесь перемешивали в течение 0,5 ч и разделяли образовавшиеся фазы. Соответствующую водную фазу экстрагировали CHCl3, объединяли ранее отобранную CHCl3-фазу и экстракты, высушивали их над Na2SO4 и выпаривали с выделением поименованного соединения (свободное основание) в виде остатка бесцветного масла (550 мг), которое при анализе с помощью ТЖХ давало одно пятно.
1H-ЯМР (300 мГц, CDCl3) δ 1,17 (t, J=7,6 Гц, CHCH2-); 1,61 (m, -CH2-); 1,86 (m, -CH2-); 2,18 (m, -CH2-); 2,29 (q, J=7,6 Гц, CH3CH2-); 2,30 (s, CH3N-); 2,71 (m, -CH2-); 3,94 (s, -CH2O-).
m/z 182 (M+ 25%); 167 (9%); 154 (78%); 125 (17%); 109 (100%); 96 (65%); 81 (54%); 74 (96%); 57 (77%).
Альтернативный способ получения соединений AF150 и AF151 состоит в циклодегидрировании соответствующих амидов. В качестве дегидрирующих агентов в рассматриваемых реакциях могут быть использованы такие соединения, как P2O5, серная кислота, BF3-эфират, CaCl2, а также молекулярные сита. Получение соответствующих тиазолинов вместо оксазолинов можно осуществить с помощью аналогичных реакций с использованием P2S5.
Пример 34: 1-Метилпиперидин-4-спиро-5'-(2'-метил-2'-тиазолин) AF150 (S)
а) 4 -Ацетамидометил-4-гидрокси-1-метилпиперидин
4-Аминометил-4-гидрокси-1-метилпиперидин (0,83 г; 5,7 мМ) растворяли в 10 мл CHCl3, после чего к полученному раствору добавляли уксусный ангидрид (0,58 г; 5,7 мМ). Через 30 мин выпаривали использованный растворитель, а выделенный грубо очищенный остаток подвергали хроматографии на силикагельной колонке (Merck 7734), элюция смесью 2%-ного нашатырного спирта и метанола в соотношении 33:67.
m/z 186 (М+)
1H-ЯМР (300 мГц, CDCl3) δ 1,60 (множественный, 4Н, H3 и Н4); 2,01 (синглетный, 3H, CH3-С); 2,29 (синглетный, 3H, CH3-N); 2,38 (множественный, 2Н, H1); 2,55 (множественный, 2Н, Н2); 2,98 (множественный, 1H, NH); 3,26 (двойной, 2Н, Н5) ppm.
1H-ЯМР (300 мГц, D2O) δ 1,42 (множественный, 4Н, H3 и Н4); 1,81 (синглетный, 3H, CH3-С); 2,08 (синглетный, 3H, CH3-N); 2,27 (множественный, 2Н, H1); 2,46 (множественный, 2Н, Н2); 3,03 (синглетный, 2Н, Н) ppm.
Примеси дают пик при 3,44 ppm.
б) 1-Метилпиперидин-4-спиро-5'-(2'-метил-2'-тиазолин) AF150(S)
Смесь 4-ацетамидометил-4-гидрокси-1-метилпиперидина (6,5 г; 35 мМ) и пентасульфида фосфора (10 г; 22 мМ) выдерживали при температуре 220oC в течение 30 мин, после чего охлаждали и растворяли в 30 мл концентрированного водного раствора HCl. Полученный раствор смешивали со 100 мл холодного концентрированного водного раствора NaOH, дважды экстрагировали 100 мл CHCl3, объединяли соответствующие экстракты, высушивали их и выпаривали с выделением 5 г черного маслянистого остатка, который очищали с помощью перегонки при температуре 75oC и давлении 1 мм ртутного столба с выходом 1,8 г прозрачной жидкости.
m/z 184 (М+)
1H-ЯМР (300 мГц, CDCl3) δ 1,8-2,0 (m, 4Н); 2,17 (t, 3H, CH3-С); 2,2 (s, 3H, CH3-N); 3,2 (q, 2Н, CH2-тиазолиновое кольцо).
Пример 35: 1-Метилпиперидин-4-спиро-5'-(2'-тион-3'-этилгидантоин) AF181
К раствору 4-амино-1-метилпиперидин-4-карбоновой кислоты (1,78 г; 0,0113 M) и гидроксида натрия (0,47 г; 0,0118 M) в воде (3,0 мл) добавляли этил изоцианат (1,00 г; 0,0111 М), а полученную смесь выдерживали при температуре дефлегмации в течение 6,5 ч. С помощью концентрированной соляной кислоты указанную реакционную смесь подкисляли до pH 1 и продолжали дефлегмацию в течение еще 1,5 ч. В дальнейшем рассматриваемую реакционную смесь выдерживали при комнатной температуре, в результате чего образовывалось твердое вещество (0,61 г), которое кристаллизовали из метанола с получением кристаллов (83 мг), т.пл. > 260oC. Анализ спектра 1H-ЯМР указанного твердого вещества показал, что оно представляет собой гидрохлорид соединения AF181.
1H-ЯМР (D2O) δ 1,16 (t, J=7,2 Гц, CH3CH2-); 2,0-2,4 (m, 4H); 2,94 (s, CH3N-); 3,20 (m, 1H); 3,4-3,74 (m, 3H); 3,80 (q, J=7,2 Гц, CH3CH2-) ppm.
Объединяли маточные растворы, оставшиеся после выделения и кристаллизации вышеупомянутой соли, с помощью концентрированного водного раствора гидроксида натрия подщелачивали их до pH 13, после чего экстрагировали дихлорметаном. Соответствующий экстракт высушивали над Na2CO3 и выпаривали с получением желтоватого твердого вещества, которое подвергали хроматографии на силикагельной колонке (Merck 60; 0,04-0,06 мм). Элюцию осуществляли смесью хлороформа, метанола и нашатырного спирта в соотношении 96:3:1 с выходом сначала 1,3-диэтил-2-мочевины (0,287 г; т.пл. 76-78oC; кристаллизация из эфира), а затем - 8-метил-3-этил-1,3,8- триазаспиро[4,5]декан-4-он-2-тиона (AF181; 135 мг) в виде свободного основания. Указанное соединение кристаллизовали из смеси эфира и дихлорметана с получением игольчатых кристаллов, т. пл. 180oC
1H-ЯМР (CDCl3) δ 1,24 (t, J=7,2 Гц, CH3CH2-); 1,69 (m, 2Н); 2,05-2,30 (m, 4Н); 2,35 (s, CH3N-); 2,90 (m, 2Н); 3,87 (q, J=7,2 Гц, CH3CH2-) ppm.
МС m/z 227 (М+); 71; 70.
Пример 36: 1-Метилпиперидин-4-спиро-5'-(2'-тион-3'- трет-бутил-гидантоин) AF184
Смесь 4-амино-1-метилпиперидин-4-карбоновой кислоты (1,80 г; 0,0114 М) т-бутилизоцианата (1,00 г; 0,0087 М) в воде (3,0 мл) выдерживали при температуре 80oC в течение 5 ч. Так как, судя по результатам ТЖХ, соответствующая реакция не была завершена, к рассматриваемой реакционной смеси добавляли этанол (4,0 мл) и выдерживали ее при температуре дефлегмации в течение еще 1 ч. С помощью концентрированной соляной кислоты указанную реакционную смесь подкисляли до pH 1 и продолжали дефлегмацию в течение еще 1 ч. В дальнейшем рассматриваемую реакционную смесь в течение ночи выдерживали при комнатной температуре, в результате чего образовывался твердый осадок, который отфильтровывали с получением исходной иминокислоты (0,60 г). Выпаривали оставшийся маточный раствор, подщелачивали с помощью концентрированного раствора гидроксида натрия, после чего экстрагировали дихлорметаном. Соответствующий экстракт высушивали над Na2SO4 и удаляли растворитель с получением кристаллического твердого вещества (0,101), образующего игольчатые кристаллы при кристаллизации из смеси эфира и дихлорметана, т.пл. 200-201oC.
1H-ЯМР (CDCl3) δ 1,63 (m, 2Н); 1,81 [s, (CH3)3-]; 2,00-2,21 (m, 4H); 2,33 (s, CH3N-); 2,87 (m, 2Н); 7,82 (bs, -NH-) ppm.
MC m/z 255 (M+); 199 (М+-С4Н8); 96; 71; 70; 57.
Пример 37: 1-Метилпиперидин-4-спиро-5'-(3'-трет-бутилгидантоин) AF213
Поименованное соединение синтезировали таким же образом, как и соединение AF181. Соответствующий продукт получали в виде гидрохлорида 1-метилпиперидин-4-спиро-5'-(3'-т-бутилгидантоина) (соединения AF213), которое кристаллизовали из метанола, т.пл. 300-303oC (с разложением).
1H-ЯМР (D2O) δ 1,55 [s, (CH3)3-]; 2,01 (m, 2Н); 2,22 (m, 2H); 2,92 (s, CH3N-); 2,97-3,5 (m, 2H); 3,62 (m, 2Н) ppm.
Выделенное свободное основание кристаллизовали из смеси эфира и дихлорметана, т.пл. 221-223oC.
1H-ЯМР (CDCl3) δ1,57 (m, 2Н); 1,60 [S, (CH3)3-]; 2,01- 2,18 (m, 4Н); 2,31 (s, CH3N-); 2,88 (m, 2H); 4,77 (bs, -NH-) ppm.
13C-ЯМР (CDCl3) δ 28,6 [(CH3)3C-]; 33,5 (C6 и С10); 46,2 (CH3N-); 51,0 (C7 и C9); 57,5 и 58,1 [(C5 и (CH3)3C-]; 158,4 (С2); 177,4 (C4) ppm.
MC m/z 239 (M+); 237; 224 (M-CH3); 194; 181; 155; 110; 104; 71; 56; 43.
Пример 38: 1-Пропаргилпиперидин-4-спиро-5'-(3'-этилгидантоин) AF196
Смесь пиперидин-4-спиро-5'-(3'-этилгидантоина) (соединения AF160-DES; 40,9 r; 0,21 мМ) и пропаргилбромида (24,7 мг; 0,21 мМ; 80%-ный по весу раствор в толуоле) перемешивали в метаноле (1,0 мл) при температуре 25oC в течение 24 ч. С помощью струи азота удаляли использованный метанол, а оставшуюся массу подщелачивали водным раствором карбоната натрия и экстрагировали хлороформом. Выпаривали соответствующие хлороформные экстракты, а выделенный остаток очищали на пластине силикагеля для препаративной хроматографии (элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 90: 10: 1) и осаждали избытком щавелевой кислоты с получением кристаллического твердого вещества (29 мг).
1H-ЯМР (D2O) δ 1,12 (t, 3H, J=6 Гц, CH3CH2-); 2,1-2,35 (m, 6Н); 3,12 (t, 2Н, J=3,5 Гц); 3,5 (q, J=7,2 Гц, CH3CH2-); 3,7-3,85 (m, 2Н); 4,12 (d, J=3,5 Гц) ppm.
MC m/z 235 (M+); 196 (М+-C3H3); 95; 80; 67; 56.
Пример 39: 1-Метилпиперидин-4-спиро-5'-[3'-(4-пирролидино-2-бутинил) гидантоин] AF197
Смесь 1-метилпиперидин-4-спиро-5'-(3'-пропаргилгидантоина) (соединения AF185; 204 мг; 0,92 мМ), пирролидина (88 мг; 1,23 мМ) и хлорида меди (4,2 мг) перемешивали в диоксане (10 мл) при комнатной температуре в течение 70 ч. С помощью струи азота удаляли использованный диоксан, а оставшуюся массу подщелачивали водным раствором карбоната натрия и экстрагировали хлороформом. Выпаривали соответствующие хлороформные экстракты, а 50% (по массе) выделенного остатка очищали на пластине силикагеля для препаративной хроматографии (элюция смесью хлороформа, метанола, эфира и нашатырного спирта в соотношении 150: 20: 100: 6) и дважды кристаллизовали из эфира с получением кристаллического твердого вещества (25 мг).
1H-ЯМР (CDCl3, свободное основание) δ 1,12 (m); 2,1-2,2 (m); 2,35 (s, 3H); 2,6 (m); 2,9-2,95 (m); 3,4 (t, 2Н, J=3,5 Гц); 4,15 (t, 2Н, J=3,5 Гц); 5,9 (bs, 1H) ppm.
MC m/z 304 (M+); 234 (M+-C4H8N); 71 (C4H9N+).
Пример 40: 1-Метилпиперидин-4-спиро-5'-(2'-метил-1', 4'- оксазолидин-3'-он) AF260
Смесь 1-метил-4-пиперидона (5,0 г; 44,2 мМ), этил-(s)-лактата (5,75 г; 48,8 мМ), карбоната аммония (6,38 г) и п-толуолсульфоновой кислоты (2,1 г) в толуоле (100 мл) вводили в стальной сосуд, предназначенный для высокого давления, и выдерживали при температуре 107oC и перемешивании в течение 24 ч. Из образовавшейся реакционной среды с помощью перегонки удаляли толуол, а полученный остаток подвергали хроматографии на силикагельной колонке (Merck 60). Элюцию осуществляли смесью хлороформа, метанола и нашатырного спирта в соотношении 92:7:1 с получением фракции (1,01 г), которую дополнительно разделяли с помощью хроматографии на силикагельной колонке. Элюируя смесью хлороформа, эфира, метанола и нашатырного спирта в соотношении 54:37:7:2, получали грубо очищенный продукт (0,441 г), который кристаллизовали из смеси эфира и петролейного эфира, а затем - из толуола с выходом 1-метилпиперидин-4-спиро-5'-(2'-метил- 1',4'-оксазолидин-3'-он) (соединения AF260) в виде игольчатых кристаллов (85 мг), т.пл. 148-150oC.
1H-ЯМР (CDCl3) δ 1,42 (d, J=6,6 Гц, CH3CH-); 1,85 (m, 4Н); 2,31 (s, CH3N-); 2,52 (m, 4H); 4,40 (q, J=6,6 Гц, CH3CH-); 7,64 (bs, -NH-) ppm.
MC m/z 184 (M+); 156; 126; 114; 84; 71; 70; 43 (100%).
Пример 41: 1-Метилпиперидин-4-спиро-5'-(2'- метил-1',4'-тиазолидин-3'-он) AF261
Пример 42: 1-Метилпиперидин-4-спиро-5'-(2', 4'-диметил-1', 4'-тиазолидин-3'-он) AF266
Смесь 1-метил-4-пиперидона (5,65 г; 0,050 M), тиомолочной кислоты (6,37 г; 0,060 М) и карбоната аммония (7,20 г) в бензоле (150 мл) выдерживали при температуре дефлегмации в течение 16 ч, в ходе которой сублимировало твердое вещество (карбонат аммония), оседавшее вне реакционной колбы. Время от времени сублимировавшее твердое вещество вновь добавляли в реакционную колбу вместе с новой добавочной порцией карбоната аммония (всего 6,2 г). Наконец, с помощью перегонки удаляли использованный бензол, а полученный остаток промывали эфиром с разделением растворимого в эфире вещества (0,76 г) и нерастворимого в эфире вещества (12,9 г), которое растворяли в небольшом объеме метанола и подщелачивали с помощью раствора аммиака в метаноле. Выпаривали полученный раствор и подвергали его хроматографии на силикагельной колонке (Merck 60). Элюируя смесью хлороформа, метанола и нашатырного спирта в соотношении 89:10:1, получали фракцию (0,61 г), которая была идентифицирована как 1-метилпиперидин-4-спиро-5'-(2', 4'-диметил- 1', 4'-тиазолидин-3'-он) (соединение AF266). Указанное соединение представляет собой гигроскопическое твердое вещество, характеризующееся низкой температурой плавления.
1H-ЯМР (CDCl3) δ 1,53 (d, J=7 Гц, CH3CH-); 1,69 (m, 2H); 2,16-2,44 (m, 4H); 2,32 (s, CH3N-); 2,87 (m, 2H); 2,90 (s, CH3NCO-); 3,79 (q, J=7 Гц, CH3CH-) ppm.
13C-ЯМР (CDCl3) δ 19,7 (CH3CH-); 27,2 (CH3NCO-); 36,0 и 37,3 (С6 и С10); 39,7 (С2); 45,3 (CH3N-); 51,8 и 52,2 (С7 и С9); 68,5 (С5); 172,8 (C3) ppm.
Гидрохлорид соединения AF266 получали, обрабатывая раствор соответствующего свободного основания в эфире раствором соляной кислоты в изопропиловом спирте, в результате чего выделяли гигроскопичное твердое вещество, которое кристаллизовали из изопропилового спирта, т.пл. 238-240oC (с разложением).
1H-ЯМР (D2O, гидрохлорид) δ 1,48 (d, J=7,2 Гц, CH3CH-); 2,05 (m, 2H); 2,57 (m, 2H); 2,89 и 2,91 (2s, CH3N+- и CH3NCO-); 3,31 (m, 2H); 3,61 (m, 2H); 4,04 (q, J=7,2 Гц, CH3CH-) ppm.
МС m/z 214 (М+); 181; 156; 125; 124; 96; 71; 70; 57 (100%); 43.
Продолжая элюцию указанной колонки смесью хлороформа, метанола и нашатырного спирта в соотношении 85:14:1, получали фракцию (3,50 г), которую кристаллизовали из смеси эфира и дихлорметана с выходом 1-метилпиперидин-4-спиро-5'-(2'-метил-1', 4'-тиазолидин-3'-она) (соединение AF261; 1,83 г) в виде игольчатых кристаллов, т.пл. 133-134oC.
1H-ЯМР (CDCl3) δ 1,53 (d, J=7 Гц, CH3CH-); 1,9-2,20 (m, 4Н); 2,20-2,42 (m, 2H); 2,30 (s, CH3N-); 2,68 (m, 2H); 3,85 (q, J=7 Гц, CH3CH-); 6,90 (bs, -NH-) ppm.
13C-ЯМР (CDCl3) δ 19,9 (CH3CH-); 41,0 и 41,3 (С6 и С10); 41,3 (С2); 45,7 (CH3N-); 52,5 и 52,8 (С7 И С9); 63,6 (С5); 176,3 (C3) ppm.
Гидрохлорид соединения AF261 (т.пл. 285-287oC) получали, обрабатывая раствор соответствующего свободного основания в эфире раствором соляной кислоты в изопропиловом спирте.
1H-ЯМР (гидрохлорид в D2O) δ 1,50 (d, J=7,1 Гц, CH3CH-); 2,17- 2,44 (m, 4Н); 2,89 (s, CH3N-); 3,24 (m, 2H); 3,59 (m, 2H); 4,10 (q, J=7,1 Гц, CH3CH-) ppm.
б) Смесь 1-метил-4-пиперидона (5,65 г; 0,050 M), тиомолочной кислоты (6,37 г; 0,060 M) и карбоната аммония (7,20 г) в бензоле (100 мл) вводили в стальной сосуд, предназначенный для высокого давления, и выдерживали при температуре 95oC и перемешивании с помощью магнита. Из образовавшейся реакционной среды с помощью перегонки удаляли растворитель, а полученный остаток растворяли в небольшом объеме метанола и наносили на сухую силикагельную колонку (Merck 60; 200 г). Элюцию осуществляли смесью хлороформа, метанола и нашатырного спирта в соотношении 94:5:1 с выходом сначала соединения AF266 (0,71 г), а затем - соединения AF261 (3,02 г).
в) Смесь 1-метил-4-пиперидона (2,50 г; 22,1 мМ), тиомолочной кислоты (2,81 г; 26,5 мМ) и метиламина (0,90 г; 29,0 мМ) в толуоле (60 мл) вводили в стальной сосуд, предназначенный для высокого давления, и выдерживали при температуре 96oC и перемешивании в течение 24 ч. Образовавшаяся реакционная среда представляла собой густое масло, которое разделялось на осадок и толуольный раствор. Отбирали указанный раствор и с помощью перегонки удаляли растворитель. Полученный остаток (1,68 г) подвергали перегонке при пониженном давлении с выходом чистого 1-метилпиперидин-4-спиро-5'- (2',4'-диметил-1', 4'-тиазолидин-3'-она) (соединения AF266) в виде твердого вещества (1,02 г; т.пл. 43-45oC; т. кип. 100oC при давлении 0,35 мм ртутного столба).
Пример 43: 1-Метилпиперидин-4-спиро-5'-(2'-этил-1',4'- тиазолидин-3'-он) AF267
Пример 44: 1-Метилпиперидин-4-спиро-5'-(2'-этил-4'- метил-1',4'-тиазолидин-3'-он) AF272
Поименованное соединение AF267 получали таким же образом, как в случае соединения AF261, используя 2-меркаптобутановую кислоту вместо 2-меркаптопропионовой (тиомолочной) кислоты. Указанное соединение кристаллизовали из ацетона, т.пл. 140-141oC.
1H-ЯМР (CDCl3) δ 1,02 (t, J=7,2 Гц, CH3CH2-); 1,75 и 2,06 (m, CH3CH2-); 1,98 (m, 4H); 2,30 (s, CH3N-); 2,32 (m, 2H); 2,67 (m, 2Н); 3,81 (dd, -CHS-); 6,35 (bs, -NH-) ppm.
13C-ЯМР (CDCl3) δ 11,4 (CH3CH2-); 27,1 (CH3CH2-); 41,5 (C6 и С10); 45,8 (CH3N-); 49,0 (C2); 52,7 и 52,9 (C7 и C9); 63,7 (C5); 175,5 (C3) ppm.
МС m/z 214 (M+); 181; 140; 71; 57.
Гидрохлорид соединения AF267 характеризовался т.пл. 267-269oC (с разложением). В качестве побочного продукта образовывался 1-метилпиперидин-4-спиро-5'-(2'-этил-4'-метил-1',4'- тиазолидин-3'-он) (соединение AF272) в виде густого масла.
1H-ЯМР (CDCl3) δ 1,00 (t, J=7,4 Гц, CH3CH2-); 1,67 (m, 2Н); 1,58-1,78 (m) и 2,13 (m, CH3CH2-); 2,20-2,42 (m, 4H); 2,32 (s, CH3N); 2,89 (s, CH3NCO-); 2,90 (m, 2Н); 3,76 (dd, J1=3,6 Гц, J2=9,0 Гц, CH3CH2CH-) ppm.
MC m/z 228 (M+); 195; 170; 138; 125; 96; 71; 70; 57.
Пример 45: 1-Метилпиперидин-4-спиро-5'-(1'-сульфокси-4'-аза-2'- метил-3'-он) AF262
Смесь 1-метилпиперидин-4-спиро-5'-(2'-метил-1', 4'- тиазолидин-3'-она) (соединение AF261; 48,4 мг; 0,24 мМ) в 2,0 мл уксусной кислоты и 0,5 мл водной 32%-ной перекиси водорода перемешивали при температуре 25oC в течение 20 мин. Указанную реакционную среду подкисляли избытком соляной кислоты и разбавляли 20 мл смеси петролейного эфира и эфира в соотношении 4:1. Образующийся при этом осадок растворяли в водном растворе карбоната натрия, а полученный раствор экстрагировали хлороформом. Выпаривали соответствующий хлороформный экстракт, а образовавшуюся массу подвергали препаративной хроматографии на пластине силикагеля (элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 80:20:1) с выходом 3,3 г масла, которое с помощью щавелевой кислоты осаждали из эфира с выходом одного изомера (более чем с 90%-ной чистотой) в виде твердого вещества.
1H-ЯМР (CDCl3, свободное основание) δ 1,52 (d, 3H, J=7 Гц, CH3CH-); 1,85-2,7 [m, 8Н] ; 2,36 (s, CH3-N); 3,55 (q, J=6 Гц, CH3CH-); 7,0 (bs, 1H) ppm.
MC m/z 216 (M+); 199; 167; 149; 125; 111.
Пример 46: Пиперидин-4-спиро-5'-(2'-метил-1',4'- тиазолидин-3'-он) AF263
Смесь 1-метилпиперидин-4-спиро-5'-(2'-метил-1', 4'- тиазолидин-3'-она) (соединение AF261; 250 мг; 1,25 мМ) и α хлорэтил хлороформиата (0,15 мл; 1,4 мМ) в 5 мл дихлорэтана выдерживали при температуре 60oC в течение 90 мин. С помощью струи азота удаляли использованный дихлорэтан, а полученный маслянистый остаток растворяли в метаноле и выдерживали при температуре 60oC в течение 1 ч. Выпаривали метанол, выделенный остаток растворяли в водном растворе карбоната натрия, экстрагировали хлороформом и разделяли на пластине силикагеля для препаративной хроматографии (элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 80:20:1) с выходом 20 мг чистого основания, которое осаждали в виде кристаллической щавелевокислой соли.
1H-ЯМР (D2O, щавелевокислая соль) δ 1,51 (d, J=6 Гц, CH3CH-); 2,2-2,35 (m, 4Н); 3,1-3,6 (m, 4Н); 4,1 (q, J=6 Гц, CH3CH-) ppm.
MC m/z 186 (М+); 153; 126; 57.
Пример 47: 1-Метилпиперидин-4-спиро-5'-(3'-метил-1',4'- оксатиолан-2'-он) AF265
Раствор 1-метил-4-пиперидона (11,3 г; 0,1 М), тиомолочной кислоты (15 мл) и п-толуолсульфоновой кислоты в ацетонитриле подвергали дефлегмации в течение 24 ч, а затем - ТЖХ на силикагеле (элюция 20%-ным метанолом в хлороформе). Выпаривали указанный раствор, растворяли в хлороформе и промывали раствором бикарбоната натрия, а затем - водой. Соответствующую органическую фазу высушивали над сульфатом натрия и выпаривали. Выделенный продукт очищали на силикагельной колонке (Merck 60). Элюцию осуществляли смесью хлороформа, метанола и нашатырного спирта с выходом 10,27 г масла, кристаллизующегося при стоянии при комнатной температуре. Указанное масло было идентифицировано как 1-метилпиперидин-4-спиро-5'-(3'-метил-1', 4'-оксатиолан-2'-он) (соединение AF265; т.пл. 92oC).
1H-ЯМР (CDCl3) δ 11,6 (d, 3H); 1,98-2,12 (m, 2Н); 2,13-2,3 (m, 2Н); 2,34-2,55 (m, 2Н); 2,55-2,72 (m, 2Н); 2,30 (s, 2Н); 4,06 (q, 1H) ppm.
13C-ЯМР (CDCl3) δ 18 (CH3CH, квартет); 39 (С6 и С10, один триплет); 40 (CH3CH, дуплет); 45,5 (CH3-N, квартет); 51,8 и 52 (С7 и С9, два различных триплета); 87 (С5, синглет); 175,5 (С=O) ppm.
МС m/z 201 (М+).
Выделенное соединение AF265 (свободное основание) растворяли в ацетоне и добавляли щавелевую кислоту (1 М на 2 М свободного основания). Через несколько секунд после этого образовывался белый осадок. Отфильтровывали указанный осадок, промывали его ацетоном, хлороформом и эфиром, после чего высушивали в эксикаторе. Рассматриваемый осадок был идентифицирован как щавелевокислая соль соединения AF265. Стабильность этой соли исследуется в настоящее время. Часть указанной соли разлагалась в воде, возможно в результате гидролиза соответствующего лактона; свидетельства наличия продуктов, образующихся в результате раскрытия кольца, можно обнаружить в спектре 13C-ЯМР, снятого в D2O в течение по меньшей мере 3 ч скановой аккумуляции. В соответствующем спектре 1H-ЯМР, измеренном непосредственно после растворения, выявляется только исходное спиросоединение. Обнаружено, что через неделю приблизительно треть молекул соединения AF265, растворенных в воде, характеризуется открытым кольцом; т.пл. 120oC.
1H-ЯМР (D2O) δ 1,55 (d, 3H); 2,3-2,6 (m, 4H); 2,9 (s, 3H); 3,2-3,4 (m, 2Н); 3,4-3,7 (m, 2H); 4,4 (q, 1H) ppm.
13C-ЯМР (D2O) δ 17,5 (CH3CH); 36 и 36,5 (C6 И С10); 41,5 (CH3CH); 43 (CH3-N); 51 (С7 и C9); 84 (C5); 167 (CO в составе щавелевой кислоты); 177 (С=O) ppm.
Пример 48: Пиперидин-4-спиро-5'-(3'-метил-1',4'- оксатиолан-2'-он) AF269
Используемый в качестве исходного вещества 1-метилпиперидин- 4-спиро-5'-(3'-метил-1', 4'-оксатиолан-2'-он) (соединение AF265; 80 мг) растворяли в бензоле, а полученный раствор выпаривали до сухого состояния для уверенности в отсутствии влаги. В атмосфере азота добавляли дихлорметан (приблизительно 4 мл), высушенный над молекулярным ситом, а затем - 1-хлорэтилхлороформиат (56 мг). Полученную реакционную смесь выдерживали при температуре 100oC приблизительно в течение 1 ч, после чего выпаривали. Добавляли хлороформ, отфильтровывали образовавшееся при этом белое твердое вещество, промывали его тетрахлоридом углерода, а затем высушивали. Выделенный продукт был идентифицирован как гидрохлорид пиперидин-4- спиро-5'-(3'-метил-1',4'-оксатиолан-2'-она) (соединения AF265).
1H-ЯМР (D2O) δ 1,55 (d, CH3CH); 2,25-2,55 (m, 4H); 3,3-3,42 (m, 4H); 4,4 (q, CH3CH) ppm.
MC m/z 187 (M+).
Пример 49: 1-Метилпиперидин-4-спиро-2'-(5'-метил-1', 3' -оксазолидин) AF264
Смесь 1-метил-4-пиперидона (11,30 г; 0,10 M) и DL-1-амино-2-пропанола (9,75 г; 0,3 М) выдерживали при температуре дефлегмации в течение 1,5 ч. Полученную реакционную среду подвергали перегонке при пониженном давлении. Удалив фракцию, перегоняющуюся при температуре 30-110oC (давление 18 мм ртутного столба) и содержащую воду, избыток соответствующего аминоспирта и искомый продукт, перегонку чистого 1-метилпиперидин-4-спиро-2'- (5'-метил-1', 3'-оксазолидина) (соединения AF264; 10,70 г) вели при температуре 110-115oC (давление 18 мм ртутного столба).
1H-ЯМР (CDCl3) δ 1,22 (d, J= 7 Гц, CH3CH-); 1,75 (m, 4Н); 2,30 (s, CH3N-); 2,49 (m, 4Н); 2,70 (dd) и 3,27 (dd) (J1=6,6 Гц, J2=12 Гц, -CH2NH-); 4,04 (m, J1=6,6 Гц, J2=6 Гц, CH3CHO-) ppm.
13C-ЯМР (CDCl3) δ 20,3 (CH3CHO-); 35,3 и 36,7 (С6 и С10); 45,5 (CH3N-); 51,7 (-CH2NH-); 52,8 (C7 и C9); 71,8 (CH3CHO-); 93,3 (C5) ppm.
MC m/z 170 (M+); 169 (M+-1); 123; 112; 85; 83 (100%); 71; 70; 58.
Пример 50: 1-Метилпиперидин-4-спиро-2'-(4'-этил-1', 3' -оксазолидин) AF268
Смесь 1-метил-4-пиперидона (5,65 г; 0,05 М) и DL-2-амино-1- бутанола (6,24 г; 0,07 М) выдерживали при температуре дефлегмации в течение 3 ч. Полученную реакционную среду подвергали перегонке при пониженном давлении. Удалив фракцию, перегоняющуюся при температуре 30-128oC (давление 19 мм ртутного столба) и содержащую преимущественно искомый продукт, а также меньшие количества воды и исходных реагентов, перегонку чистого 1-метилпиперидин-4-спиро-2' -(4'-этил-1', 3'-оксазолидина) (соединения AF268; 4,5 г) вели при температуре 129-130oC (давление 19 мм ртутного столба).
1H-ЯМР (CDCl3) δ 0,97 (t, J=7,5 Гц, CH3CH2-); 1,45 и 1,69 (m, CH3CH2-); 1,70-1,89 (m, 4Н); 2,30 (s, CH3N-); 2,32-2,62 (m, 4Н); 3,25 и 3,96 (m, -CH2O-); 3,29 (m, -CH2CH3) ppm.
13C-ЯМР (CDCl3) δ 10,7 (CH3CH2-); 26,1 (CH3CH2-); 34,9 и 36,3 (C6 и С10); 45,3 (CH3N-); 52,5 и 52,7 (C7 и C9); 58,5 (C3); 69,5 (C2); 93,1 (C5); ppm.
Пример 51: 1-Метилпиперидин-4-спиро-5' -(3'-этил-1',4'- оксатиолан-2'-он) AF271
Раствор 1-метилпиперидона (1,921 г; 0,017 М), 2-меркаптобутаноловой кислоты (2 г; 0,0167 М) и п-толуолсульфоновой кислоты (300 мг) в ацетонитриле подвергали дефлегмации в течение 36 ч. Затем выпаривали указанный раствор, растворяли в метаноле и выделяли искомый продукт на силикагельной колонке, элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 97: 2,5: 0,5. Дополнительную очистку проводили на силикагельной колонке, элюция смесью хлороформа и метанола в соотношении 95:5.
1H-ЯМР (CDCl3) δ 1,0 (t, CH3CH2); 1,6 (m, 3H); 2,1 (m, 1H, CH3CH2); 2,25-2,4 (m, 4H); 2,3 (s, 3H); 2,8-2,95 (m, 2H); 3,75 (dd, CH2CH) ppm.
MC m/z 215 (M+).
Пример 52: Синтез пиперидин-4-спиро-5'-(3'- пропаргилгидантоин)а AF186
Соединение AF185 деметилировали в соответствии с методом, разработанным применительно к соединению AF160(Des) (см. Пример 3), после чего очищали с помощью хроматографии на силикагельной колонке (элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 80:19:1). Соответствующее свободное основание выпадало в осадок в виде белого негигроскопичного гидрохлорида.
1H-ЯМР (D2O, гидрохлорид) δ 2,0-2,15 (m, 2H); 2,2-2,35 (m, 2H); 2,68 (t, 1H, J= 3,5 Гц); 2,91 (s, CH3N-); 3,25-3,35 (m, 2H); 3,55-3,65 (m, 2H); 4,3 (d, 2H, J=3,5 Гц) ppm.
MC m/z 207 (M+ основной пик); 179; 151; 113.
Пример 53: Синтез 1-метилпиперидин-4-спиро-5'-[3'-(2- бутинил)гидантоин)]а AF199
Соединение AF199 синтезировали в соответствии с методом, разработанным применительно к соединению AF185 (см. Пример 50), после чего очищали с помощью хроматографии на силикагельной колонке (элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 80:19:1). Соответствующее свободное основание выпадало в осадок в виде белого негигроскопичного гидрохлорида.
1H-ЯМР (CDCl3, свободное основание) δ 1,65-1,8 (m, 2Н); 1,78 (t, 3H, J= 1,7 Гц); 1,9-2,25 (m, 4H); 2,33 (s, CH3N-); 2,8-2,95 (m, 2Н); 4,22 (q, 2H, J=1,7 Гц); 6,7 (bs, 1H) ppm.
MC m/z 207 (M+); 165; 154; 71 (основной пик).
Пример 54: 1-Метилпиперидин-4-спиро-5'-(2'-метил-1',4'- тиазолидин-3'-он) AF261 и его оптические изомеры (+)AF261 и (-)AF261
В колбу емкостью 250 мл вносили соединение AF261 в виде свободного основания (3,23 г; 16 мМ) и ди-п-толуол-D-винную кислоту (5,8 г; 15 мМ), добавляли изоамиловый спирт (28 г) и толуол (130 г), а полученную смесь подвергали дефлегмации в течение 5 мин. Образовавшийся при этом прозрачный раствор частично выпаривали в ходе дефлегмации в струе азота до слабого помутнения, после чего оставляли на ночь. Затем отфильтровывали выпавший осадок и несколько раз перекристаллизовывали его из смеси изоамилового спирта и толуола до получения более чем 98%-ной чистоты энантиомера, судя по результатам ГХ и ЯМР. Подщелачивали выделенный твердый продукт и осаждали его в виде гидрохлорида с выходом 207 мг белого негигроскопичного твердого вещества. [α]
Выпаривали маточную жидкость, подщелачивали ее, обрабатывали ди-п-толуол-L-винной кислотой и несколько раз перекристаллизовывали из смеси изоамилового спирта и толуола до получения более чем 98%-ной чистоты энантиомера, судя по результатам ГХ и ЯМР. Подщелачивали выделенный твердый продукт и осаждали его в виде гидрохлорида с выходом 207 мг белого негигроскопичного твердого вещества. [α]
Определение оптической чистоты осуществляли с помощью ЯМР при использовании (R)-(-)-2,2,2-трифтор-1-(9-антрил)этанола в качестве ресольвента. 7,5 мг указанного соединения вместе с 2,5 мг каждого из энантиомеров в C6D6 показывали присутствие только одного энантиомера. Спектр ЯМР вышеупомянутого гидрохлорида был идентичен таковому в случае (±) AF261.
Чистоту каждого энантиомера определяли с помощью ГХ при использовании капиллярной колонки Chrompack XE-60-S-Val-S -α- PEA; WCOT-присоединенный оксид кремния 50 м; внутренний диаметр 0,26 мм; внешний диаметр 0,35 мм; поток 0,9 мл N2; температура 175o; время удержания 64 мин и 65 мин. Спектр ЯМР вышеупомянутого гидрохлорида был идентичен таковому в случае (±) AF269.
Пример 55: 1-Метилпиперидин-4-спиро-5'-(2'-этил-1',4'-тиазолидин-3'- он) AF267 и его оптические изомеры (+)AF267 и (-)AF267
Соединение AF267 в виде свободного основания и ди-п-толуол-D- винно-кислой соли обрабатывали в соответствии со способом, разработанным применительно к соединению AF261 (см. Пример 53) до получения более чем 90%-ной чистоты энантиомера, судя по результатам ГХ. Подщелачивали выделенный твердый продукт и осаждали его в виде гидрохлорида с выходом 207 мг белого негигроскопичного твердого вещества. [α]
Чистоту каждого энантиомера определяли с помощью ГХ при использовании капиллярной колонки Chrompack XE-60-S-Val-S -α- PEA; WCOT-присоединенный оксид кремния 50 м; внутренний диаметр 0,26 мм; внешний диаметр 0,35 мм; поток 0,9 мл N2; температура 175o; время удержания 83 мин и 88 мин. Спектр ЯМР вышеупомянутого гидрохлорида был идентичен таковому в случае (±) AF267.
Пример 56: Синтез 1-метилпиперидин-4-спиро-2'-(5'- метил-1',3'-диоксолан-4'-он) AF274
8 мл молочной кислоты азеотропно высушивали в бензоле. К высушенной и еще горячей молочной кислоте добавляли дополнительное количество сухого бензола, а затем - п-толуолсульфоновую кислоту (300 мг) и 1-метилпиперидон (5,00 г; 0,027 М). Полученную смесь подвергали дефлегмации до тех пор, пока не переставала отделяться вода. После этого выпаривали указанный раствор, выделенный остаток растворяли в хлороформе и промывали насыщенным раствором бикарбоната натрия (25 мл). Соответствующую водную фазу промывали хлороформом (25 мл), объединяли органические фазы и дважды промывали их водой (10 мл). Промытые органические фазы высушивали над сульфатом натрия, смешанным с активированным углем, после чего фильтровали и выпаривали с выходом 8,7 г грубо очищенного маслянистого продукта. Растерев указанное масло в смеси гексана, эфира и петролейного эфира (40-60), оставшееся масло растворяли в ацетоне, а затем к образовавшемуся раствору добавляли щавелевую кислоту (1 экв. ). Через некоторое время выпадал белый осадок, который был идентифицирован как щавелевокислая соль 1-метилпиперидин-4-спиро-2'-(5'-метил-1',3'-диоксолан-4'-она) (соединения AF274).
1H-ЯМР (щавелевокислая соль, CDCl3+DMSO-d6), δ 1,5 (d, 3H, J=7 Гц); 2,15 (m, 4Н); 2,63 (s, 3H); 2,9 (m, 2Н); 3,05 (m, 2H); 4,55 (q, 1H, J=7 Гц) ppm.
1H-ЯМР (свободное основание, CDCl3) δ 1,5 (d, 3H, J=7 Гц); 1,95 (m, 4H); 2,32 (s, 3H); 2,5 (m, 2H); 2,6 (m, 2Н); 4,5 (q, 1H, J=7 Гц) ppm.
Macс-спектрометрия m/z 185 (M+).
Пример 57: 2-Метил-1,4-тиазолидин-3-он-спиро[5,3']хинуклидин AF273
Смесь 3-хинуклидинона (2,50 г; 20,0 мМ), тиомолочной кислоты (2,55 г; 24,0 мМ) и карбоната аммония (2,9 г) в толуоле (100 мл) вводили в стальной сосуд, предназначенный для высокого давления, и выдерживали при температуре 108oC и перемешивании в течение 28 ч. Из образовавшейся реакционной среды удаляли образовавшееся в ней масло, а оставшийся толуольный раствор выпаривали с выделением 2,5 г остатка. Указанный остаток кристаллизовали из ацетона с выходом кристаллического твердого вещества, которое в основном представляло собой одну энантиомерную пару соединения AF273. Выделенное твердое вещество еще раз кристаллизовали из ацетонитрила, а затем - из дихлорметана с выходом одной чистой энантиомерной пары (±) соединения AF273 (0,210 г; т. пл. 201- 202oC). 1H-ЯМР (CDCl3) δ 1,53 (d, J=7,2 Гц, CH3CH-); 1,65 (m, 2Н); 1,92 (m, 2Н); 2,03 (m, 1H); 2,83 (m, 4H); 3,18 и 3,32 (dd, J= 15 Гц, NCH2CNH-); 3,89 (q, J=7,2 Гц, CH3CH-); 8,58 (bs, -NH-) ppm.
MC m/z 212 (M+); 155; 142 (M+-70); 123; 96; 71; 70 (100%); 58.
Маточную жидкость, оставшуюся после первой кристаллизации и обогащенную другой энантиомерной парой, подвергали хроматографии на силикагельной колонке (Merck 60). Элюцию осуществляли смесью хлороформа, метанола и нашатырного спирта в соотношении 96:3:1 с выходом сначала второй энантиомерной пары соединения (±) AF273B (0,106 г; т.пл. 181-182oC), кристаллизация из ацетонитрила.
1H-ЯМР (CDCl3) δ 1,52 (d, J=7 Гц, CH3CH-); 1,64 (m, 2Н); 1,93 (m,2H); 2,03 (m, 1H); 2,70-2,98 (m, 4H); 3,19 (s, NCH2CNH-); 3,85 (q, J= 7 Гц, CH3CH-); 8,60 (bs, -NH-) ppm.
MC аналогична таковой в случае соединения (±) AF273A.
В дальнейшем получали смесь всех энантиомеров и, наконец, - еще одну чистую энантиомерную пару. (±) AF273A.
Пример 58: 1-Метилпиперидин-4-спиро-5'-(2'-метил-1',4'- тиазолидин-3'-тион) AF275
Суспензию 1-метилпиперидин-4-спиро-5'-(2'-метил-1', 4'- тиазолидин-3'-она) (соединение AF261; 1,00 г; 5,00 мМ) и реагента Лэйвсона (1,40 г; 3,46 мМ) в сухом толуоле (25 мл) перемешивали при температуре 100oC в течение 3 ч. Из образовавшейся реакционной среды удаляли растворитель, а полученный остаток очищали на сухой силикагельной колонке (Merck 60; 0,040-0,065). Элюцию осуществляли смесью хлороформа, метанола и нашатырного спирта в объемном соотношении 96: 3: 1 с выходом чистого 1-метилпиперидин-4-спиро-5'- (2'-метил-1', 4'-тиазолидин-3'-тиона) (соединение AF275; 0,81 г) в виде игольчатых кристаллов, образующихся при кристаллизации из ацетона, т.пл. 171-172oC (с разложением).
1H-ЯМР (CDCl3) 1,69 (d, J=7,1 Гц, CH3CH-); 2,00 (m, 2Н); 2,00-2,35 (m, 4Н); 2,30 (s, CH3N-); 2,80 (m, 2Н); 4,26 (q, J=7,1 Гц, CH3CH-); 8,74 (bs, -NH-) ppm.
MC m/z 216 (M+); 156; 98; 97; 96 (100%); 70.
Пример 59: 1-метилпиперидин-4-спиро-4'(5')-(2'-метилтио-2'- имидазолин-5'(4')-он) AF187
а) К перемешиваемому раствору гидроксида натрия (0,36 г; 9,00 мМ) в метаноле (30 мл) добавляли гидрохлорид 1-метилпиперидин-4- спиро-5'-(2'-тиогидантоин)а (гидрохлорид соединения AF195; 1,00 г; 4,25 мМ). Образовывался осадок (NaCl). К указанной смеси при комнатной температуре добавляли метилиодид (0,664 г; 4,68 мМ) и продолжали перемешивание в течение еще 1,3 ч. Полученную реакционную смесь выпаривали при пониженном давлении, а выделенный при этом остаток экстрагировали дихлорметаном. Удалив использованный дихлорметан, получали остаток (0,58 г), который очищали на силикагельной колонке (Merck 60; 0,040-0,065). Элюцию осуществляли смесью хлороформа, метанола и нашатырного спирта в объемном соотношении 89:10:1 с выходом 1-метил-пиперидин- 4-спиро-4'(5')-(2'-метилтио-2'-имидазолин-5'(4')-она) (соединение AF187; 0,23 г; т.пл. 176-177oC), кристаллизация из ацетона.
1H-ЯМР (CDCl3) 1,57 (m, 2Н); 2,00 (m, 2Н); 2,35 (s, CH3N-); 2,52 (m, 2Н); 2,56 (s, CH3S-); 2,84 (m, 2H); 6,73 (bs, -NH-) ppm.
13C-ЯМР (CDCl3) 12,6 (s, CH3S-); 32,7 (C3); 45,8 (CH3N-); 50,8 (C2); 68,3 (C4); 163,8 (-C-SCH3); 188,1 (-C=O) ppm.
MC m/z 213 (M+); 198 (М+-CH3); 143 (M+-70); 71.
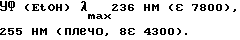
б) Раствор 1-метилпиперидин-4-спиро-4'-(2'-метилтио-5'- аминометил-4'-имидазола) (соединение AF193; 30 мг) в водной 16%-ной соляной кислоте (0,5 мл) выдерживали при комнатной температуре в течение 3 дней. Затем при пониженном давлении удаляли растворитель, а полученный остаток подщелачивали с помощью концентрированного водного раствора гидроксида натрия, после чего экстрагировали смесью дихлорметана и метанола. Соответствующий экстракт высушивали над Na2SO4 и удаляли растворитель с выделением остатка, который очищали на пластине тонкослойного силикагеля (Merck Kieselgel 60 F254), обработанной смесью хлороформа, метанола и нашатырного спирта в объемном соотношении 79: 20: 1 с выходом соединения AF187 (8 мг), сходного с аутентичным образцом.
Пример 60: 1-Метилпиперидин-4-спиро-4'-(1'-этил-2'- этилтио-5'-инидазолин-5'-он) AF188
К суспензии гидрохлорида 1-метилпиперидин-4-спиро-5'-(2'- тиогидинтоина) (соединения AF195; 4,04 г; 0,0172 М) и гидроксида калия (3,85 г; 0,0686 М) в этаноле (100 мл) добавляли этил бромид (5,60 г; 0,0514 М), а полученную смесь подвергали дефлегмации при перемешивании. После 2-часовой дефлегмации основным продуктом реакции оставалось моноэтильное производное указанного соединения, поэтому к рассматриваемой реакционной смеси добавляли дополнительное количество гидроксида калия (0,95 г; 0,0196 М) и этил бромида (2,00 г; 0,0184 М) и продолжали дефлегмацию в течение еще 3 ч. Затем при пониженном давлении выпаривали растворитель, к полученному остатку добавляли воду (20 мл) и экстрагировали его эфиром. Соответствующий экстракт высушивали над Na2SO4 и удаляли растворитель с выделением остатка (0,973 г), который кристаллизовали из петролейного эфира с получением чистого 1-метилпиперидин-4-спиро-4'-(1'-этил-2'-этилтио-2'-имидазолин-5'- она) (соединение AF188; 0,513 мг; т.пл. 95-96oC). Оставшийся маточный раствор после удаления из него растворителя подвергали хроматографии на сухой силикагельной колонке (20 г; Merck 60, 0,40-0,065 мм), элюция смесью хлороформа, метанола и нашатырного спирта в соотношении 84: 5:1 с выходом дополнительного количества чистого соединения AF188 (0,310 г).
1H-ЯМР (CDCl3) 1,19 (t, J= 7,2 Гц, CH3CH2N-); 1,40 (t, J=7,2 Гц, CH3CH2S-); 1,43 (m, 2H); 1,99 (m, 2Н); 2,36 (s, CH3N-); 2,51 (m, 2Н); 2,77 (m, 2Н); 3,18 (q, J=7,2 Гц, CH3CH2S-); 3,49 (q, J=7,2 Гц, CH3CH2N-); ppm.
13C-ЯМР (CDCl3) 14,1 (2 CH3CH2-); 24,4 (CH3CH2S-); 33,0 (C6); 35,1 (CH3CH2N-); 46,2 (CH3N-); 51,0 (C7); 68,6 (C5); 158,8 (-N=C-); 183,9 (-C=O) ppm.
MC m/z 255 (M+); 226 (M+-Et); 185 (M+-70); 71; 70.
Пример 61: 1-Метилпиперидин-4-спиро-4'-(1'-этил-2'- имидазолин-5'-он) AF220
К раствору 1-метилпиперидин-4-спиро-4'-(1'-этил- 2'-этилтио-2'-имидазолин-5'-он) (соединение AF188; 0,214 г) в этаноле (10 мл) добавляли никель Ренея (0,30 г), а полученную смесь подвергали дефлегмации в течение 4 ч. Так как по истечении этого времени соответствующая реакция еще не закончилась, добавляли дополнительное количество никеля Ренея (0,30 г) и продолжали дефлегмацию в течение еще 4 ч. Фильтровали указанную реакционную среду, а выделенный катализатор промывали метанолом и дихлорметаном. Объединяли соответствующие фильтраты и промывочные жидкости, после чего выпаривали их с выходом 1-метилпиперидин-4- спиро-4'-(1'-этил-2'-имидазолин-5'-он) (соединение AF220; 0,160 г) в виде масла.
1H-ЯМР (CDCl3) 1,27 (t, J=7,3 Гц, CH3CH2-); 1,46 (m, 2Н); 2,03 (m, 2Н); 2,36 (s, CH3N-); 2,48 (m, 2Н); 2,82 (m, 2Н); 3,53 (q, J=7,3 Гц, CH3CH2-); 7,72 (s, -CH=N-) ppm.
13C-ЯМР (CDCl3) 13,9 (CH3CH2-); 32,2 (C6); 35,3 (CH3CH2-); 45,7 (CH3N-); 50,5 (C7); 68,2 (C5); 151,6 (-N=C-); 183,9 (-C=O) ppm.
Пытаясь очистить указанный продукт с помощью хроматографии на сухой силикагельной колонке (20 г; Merck 60, 0,40-0,065 мм, элюция смесью хлороформа, эфира, метанола и нашатырного спирта в объемном соотношении 25:17:3: 1), в качестве основного соединения получили продукт, образующийся в результате гидролиза с раскрытием соответствующего кольца: 1-метилпиперидин-4-формиламино-4-N- этилкарбоксамид (соединение AF221; т.пл. 108-109oC), кристаллизующийся из смеси эфира и дихлорметана.
1H-ЯМР (CDCl3) 1,13 (t, J=7,2 Гц, CH3CH2-); 2,04-2,32 (m, 6Н); 2,28 (s, CH3N-); 2,65 (m, 2Н); 3,28 (dq, CH3CH2-); 5,73 (s, HCONH-); 6,97 (bs, EtNHCO-); 8,18 (s, HCON-) ppm.
Образовавшийся в результате гидролиза продукт AF221 может быть вновь циклизован в соединение AF220 при нагревании до температуры 150oC в вакууме.
Вышеупомянутые агонистические или антагонистические способности рассматриваемых соединений исследовали в серии тестов, включающих в себя компьютерный молекулярный анализ, а также биологическое тестирование in vivo и in vitro.
Компьютерный молекулярный анализ
Для изучения агонистической активности по отношению к мускарину была разработана фармакофорическая модель, основанная на тестировании нескольких агонистов. Эта модель предусматривает:
- выявление структурных участков указанных агонистов, необходимых для проявления активности;
- анализ их взаимного пространственного, расположения, а также
- (в некоторой степени) определение наибольшего количества, при котором лиганд является агонистом.
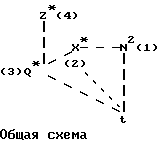
В приведенных выше формулах точка r обозначает отрицательный заряд, взаимодействующий с катионной частью агониста. Рассматриваемая модель определяет положение этой точки по отношению к соответствующему атому азота. Существенными расстояниями (D) являются следующие: D(r-N*) = 3,0; D(r-X*) = 6,50; D(r-Q*) = 8,70; D(x*-Q*) = 2,45. Оптимальный плоский угол r-х* - Q*-z* = -85. Отклонения от приведенных оптимальных модельных показателей в определенных пределах не приводит к нарушению соответствующей активности (Таблица 1).
Ниже перечислены конкретные существенные особенности рассматриваемой модели:
1. Указанная модель позволяет различать частичные и полные агонисты мускарина. Это различение основано на корреляции между расстоянием r-Х* и агонистической активностью.
2. В пределах одного класса мускариновых агонистов атом, находящийся в положении 4 и соответствующий карбонильному атому кислорода в составе ацетилхолина, может быть различным, так же как и плоский угол r-х* - Q*-z*.
3. В том случае, если расстояние r-Q* становится слишком велико для проявления агонистической активности, имеют место слабо связывающиеся агонисты.
На основании этой модели, исходя из структурной стабильности конкретного агониста, природы группы Z* и модельных параметров, можно предсказывать специфичность мускаринового агониста по отношению к подтипам рецептора.
Описанная фармакофорная модель может быть следующим образом использована для скрининга новых соединений, потенциально обладающих мускариновой активностью:
а) оптимизация новой структуры для выявления ее низкоэнергетичных конформеров;
б) исследование указанных конформеров в плане правильного расположения фармакофорных элементов. В альтернативном случае фармакофорная конформация может быть придана новой структуре с помощью одного из традиционных способов. В дальнейшем полученную конформацию сравнивают с низкоэнергетической конформацией, характерной для такой же структуры. Использование описанного способа дало реальный результат во всех исследованных случаях (Таблица 1). Несмотря на то, что нет возможности предсказать, должна ли мускариновая активность проявляться только теми соединениями, которые отвечают рассматриваемой модели, все соединения, отвечающие этой модели, являются активными агонистами.
Пределы размеров катионного участка в составе мускариновых агонистов исследовали в экспериментах по укорачиванию соответствующих структур (см. Таблицу 1) входящих в состав молекулярной модели трансмембранного домена мускаринового рецептора m1. Соединения, размер которых превышает производные хинуклидина, не могут распознаваться макромолекулярным сайтом связывания.
Соединения, перечисленные в Таблице 1 (см. в конце описания) подразделены на 4 группы. Первая группа включает в себя несколько хорошо известных агонистов мускарина. Их структура характеризуется оптимальными фармакофорными параметрами. Ко второй группе относятся агонисты, отличающиеся субоптимальными фармакофорными показателями и потому преимущественно являющиеся частичными агонистами. Структура соединений, входящих в состав третьей группы, характеризуется измененными фармакофорными параметрами по сравнению с вышеописанными группами соединений, проявляющих мускариновую активность. Подобные соединения либо являются антагонистами мускариновой активности, либо лишены ее. В четвертой группе перечислены некоторые потенциальные агонисты мускарина, предсказанные на основании их фармакофорных параметров.
Биологические тесты
Тест N.1. Препарат изолированной подвздошной кишки морской свинки.
У предусмотренных настоящим изобретением соединений исследовали их агонистическую и антагонистическую активности, проявляемые на препаратах изолированной подвздошной кишки (Fisher et al. , J. Pharm. Exp. Therap. 257: 394-403 (1991). Данные, полученные для некоторых соединений, представлены в Таблице 2 (см. в конце описания).
Тест N. 2. Связывание с мускариновыми рецепторами мозга; конкуренция с [3H] QNB, [3H] NMS и [3H]OXO-M на мембранах, выделенных из коры и мозжечка крыс.
Для тестирования новых соединений (Таблицы 3 и 4) (см. в конце описания) использовали препараты мембран коры и мозжечка крыс, а также лиганды [3HNMS, [3H]пирензепин и [3H]оксотреморин-M.
Величина соотношений KiPZ/KiNMS, либо KiPZ/KiQNB (Таблица 3) является типичным показателем селективности мускариновых лигандов по отношению к рецепторам М1, при этом низкие величины указанных соотношений свидетельствуют о большей селективности. Кроме того, величина соотношений KiPZ/KiQNB, определенных для мембранных препаратов коры и мозжечка головного мозга крыс, также являются показателями селективности мускариновых лигандов по отношению к рецепторам М1; значения менее 1 свидетельствуют об указанной селективности (Fisher et al., J. Pharm. Exp. Therap. 257: 394-403 (1991)). Используя эти методы, мы смогли продемонстрировать, что некоторые соединения, предусмотренные настоящим изобретением, характеризуются относительно высокой предпочтительностью по отношению к мускариновым рецепторам М1. К числу такого рода соединений относятся следующие: AF133, AF134, AF160, AF160(Des), AF177, AF178, AF181-AF185, AF261, AF265, AF267.
В частности, соединение AF185 проявляло в 3 раза более высокое сродство к сайтам конкурентного связывания с [3H]PZ по сравнению с сайтами конкурентного связывания с [3H]NMS (Ki = 1,4 0,15 мкМ и 5 1 мкМ, соответственно; Таблица 3). Эти данные резко отличаются от результатов, полученных для соединения AF102B (Патент США), которое характеризовалось почти одинаковыми уровнями сродства к сайтам конкурентного связывания обоих лигандов (Ki = 1,43 0,2 мкМ и 1,86 0,43 мкМ, соответственно; Таблица 3). Так как [3H]PZ принято считать специфическим маркером рецепторов M1AChR на мембранах коры головного мозга крыс, полученные нами новые данные свидетельствуют о том, что соединение AF185 является более специфичным лигандом по отношению к рецепторам М1, нежели соединение AF102B.
Кривые связывания [3H]NMS, определенные для мембран коры головного мозга при использовании некоторых новых соединений, указывает на взаимодействие с двумя сайтами: приблизительно четверть указанных сайтов связывания проявляла высокое сродство к рассматриваемым соединениям. Этот факт может свидетельствовать о высокой агонистической активности соединений в вышеупомянутых препаратах. К соединениям такого рода относились следующие: AF260, AF261, AF263 И AF265.
Некоторые из рассматриваемых новых соединений неожиданно характеризовались двухсайтовыми кривыми конкурентного связывания [3H]PZ в коре головного мозга крыс (Таблица 3). К числу подобных соединений относятся следующие: AF160, AF160(Des), AF260, AF261, AF265. Двухсайтовые кривые конкурентного связывания [3H] PZ, полученные для указанных соединений, были переведены в простые кривые "доза-эффект" в присутствии стабильного аналога ГТФ: GppNHp (данные не представлены). Сходные наблюдения за чувствительностью к GppNHp были проведены в случае конкуренции с [3H]NMS (данные не представлены). Полученные результаты свидетельствовали о том, что указанные соединения ведут себя как эффективные агонисты по отношению к рецепторам М1 в коре головного мозга крыс. Этот вывод отличается от результатов, полученных в конкурентных тестах с использованием соединения AF102B, которое характеризуется типичными кривыми "доза-эффект". Приведенные данные по-видимому свидетельствуют о неких различиях между соединением AF102B и вышеупомянутыми новыми соединениями в распознавании рецепторов М1 в коре головного мозга крыс.
Соединение AF267 характеризовалось односайтовыми кривыми конкурентного связывания как [3H]NMS, так и [3H]PZ на мембранах коры головного мозга крыс. Описанное ниже изучение гидролиза фосфоинозитидов (ФИ) и высвобождения арахидоновой кислоты показали, что рассматриваемое соединение является частичным агонистом. Поэтому закономерности связывания типа "доза-эффект" были сходными с таковыми в случае использования соединения AF102B, являющегося селективным агонистом по отношению к рецепторам М1, применительно к мускариновым рецепторам рассматриваемого препарата. Ранее мы показали, что обработка мембран коры головного мозга крыс 0,1 мМ CuSO4 может выявлять скрытые агонистические особенности связывания соединения AF102B (Fisher et al. , J. Pharm. Exp. Therap. 257: 392-403 (1991)); опубликованные данные основаны на конкуренции соединения AF102B и [3H]QNB, однако сходные наблюдения получены при использовании [3H]NMS и [3H]PZ). Кроме того, указанная обработка может повышать долю сайтов, проявляющих высокое сродство по отношению к определенным агонистам (например соединению AF160), которые выявляют наличие сайтов высокого сродства и в отсутствие обработки ионами Cu2+. Поэтому мы исследовали особенности связывания соединения AF267 после обработки ионами Cu2+. Указанная обработка, после которой осуществляли тест на конкурентное связывание [3H]PZ, выявила 18% сайтов, проявляющих высокое сродство к соединению AF267 (KH = 22 нМ, т.е. приблизительно в 100 раз более высокое сродство по сравнению с KL = 2,5 мкМ) без существенного изменения количества сайтов, характеризующихся низким сродством. Приведенные данные свидетельствуют о том, что соединение AF267 может связываться с мускариновыми рецепторами в коре головного мозга крыс так же, как и соединение AF102B. Способность ионов Ca2+ выявлять сайты, обладающие высоким сродством к определенным частичным агонистам, может быть обусловлена стабилизацией взаимодействия между рецептором и G-белком за счет координирующих комплексов между ионами металлов и необходимыми сульфгидрильными группами в составе указанных макромолекул (Gurwitz et al., BBRC 120: 271-277 (1984)). На контрольных мембранах подобное взаимодействие определенно не усиливается в присутствии частичных агонистов, которые, таким образом, не проявляют высокого сродства в конкурентных тестах с использованием меченых антагонистов.
Способность соединений модифицировать связывание [3H]оксо- треморина-M ([3H] OXO-M) позволяет измерять степень сродства соответствующего рецептора, находящегося в состоянии высокого сродства к агонисту. Соотношение величин Ki замещения [3H]NMS или [3H]QNB и [3H]OXO-M используется в литературе для предсказания эффективности. Величины соотношений, превышающие 100, свойственны полным агонистам; для антагонистов характерны соотношения, близкие к 1; промежуточные значения типичны для частичных агонистов (Orlek et al., J. Med. Chem. 34: 2726 (1991)).
Вышеописанные новые соединения исследовали в тесте на конкурентное связывание меченого, неселективного мускаринового агониста [3H]OXO-M с использованием мембран коры головного мозга крыс; высокие агонистические свойства соединений AF179 и AF160 отражены в относительно высоких значениях KiNMS/KiOXO-M, свойственных этим соединениям (Таблица 4).
Соединения AF160(Des) и AF185 неожиданно оказались единственными исследованными агентами, характеризующимися нелинейной зависимостью "доза-эффект" при использовании [3H]OXO-M и мембран коры головного мозга крыс (Таблица 4). Исключительно эффективная конкуренция указанных соединений с субфракцией рецепторов, расположенных на мембранах коры головного мозга крыс и меченых с помощью [3H] OXO-M, по-видимому? свидетельствует о том, что рассматриваемые соединения являются высокоспецифичными по отношению к определенному подтипу рецепторов. Так, рассчитанные соотношения KiNMS/KHOXO-M (Таблица 4) позволяют предположить, что соединение AF160(Des) представляет собой эффективный агонист подсемейства мускариновых рецепторов коры головного мозга крыс по сравнению с другими агентами, родственными соединению AF160, а также с соединением AF102B. Однако данные такого рода не были получены: кривые конкуренции как соединения AF160(Des), так и соединения AF185 с [3H]NMS показывают простую линейную зависимость "доза-эффект". Таким образом, предположение о гетерогенности подсемейства рецепторов, которая выявляется исключительно при изучении связывания [3H]OXO-M, но не [3H]NMS, не представляется убедительным. Альтернативная интерпретация может предполагать наличие некого взаимодействия с аллостерическими сайтами соответствующих мускариновых рецепторов, которое не реализуется при связывании рецептора с такими антагонистами, как [3H]NMS, но проявляется при использовании агониста [3H]-OXO-M. Еще одно возможное объяснение слабых показателей конкуренции в тесте на связывание [3H] OXO-M состоит в том, что используемая система не достигала равновесия. В тестах на конкуренцию с использованием соединения AF160(Des) или AF185 равновесие не достигалось в течение 30 мин, поскольку характеристики связывания через 30 и 60 мин при температуре 25oC оказались различными. В том случае, если рассматриваемые тесты прерывали по истечении 30 мин, слабые показатели конкуренции с [3H] OXO-M были характерны как для соединения AF160(Des), так и для соединения AF185. Правдоподобное объяснение этого факта состоит в том, что соединениям AF160(Des) и AF185 свойственна относительно медленная кинетика (низкие коэффициенты как ассоциации, так и диссоциации) по сравнению соединением AF102B. Этот факт может приводить к очень медленному установлению равновесия в тестах на конкуренцию, вызывая четкое выявление двухсайтовых изотерм связывания в неравновесных условиях. Следует учитывать, что коэффициенты и ассоциации, и диссоциации относительно низки: в том случае, если бы только коэффициенты ассоциации соединений AF160(Des) и AF185 были низкими по сравнению с соединением AF102B, указанные соединения характеризовались бы много меньшим сродством по сравнению с соединением AF102B. С другой стороны, если бы ниже были только коэффициенты диссоциации указанных соединений, соответствующие показатели сродства были бы значительно выше, чем у соединения AF102B.
Мозжечок крыс является относительно гомогенным в плане экспрессирующихся подтипов рецепторов mAChR (в особенности М2). Соединение AF102B проявляет сходную эффективность конкуренции с [3H]OXO-M как в коре, так и в мозжечке крыс. Напротив, соединения AF160(Des) и AF185 более активны по отношению к мембранам коры, нежели мозжечка; этот факт был выявлен, судя по наличию двухсайтового характера конкуренции только в случае мембран коры (см. также Таблицу 4, Кора). Кроме того, вышеупомянутый результат может свидетельствовать о различной кинетике рассматриваемых соединений в коре по сравнению с мозжечком.
Тест N. 3. Активация вторичных мессенджеров в срезах мозга и культурах клеток.
Для проведения теста по измерению эффективности исследуемых соединений в качестве агонистов мускариновых рецепторов М1 получали срезы коры головного мозга крыс (200 мкм3). Для тестирования метаболизма фосфоинозитидов (ФИ) указанные срезы мозга обрабатывали [3H]инозитолом (4 мкКи/мл), инкубируя их в буферном солевом растворе Кребса, содержащем меченый лиганд, в течение 1 ч при температуре 37oC и подаче кислорода. Затем промывали вышеописанные срезы и добавляли аликвоты в 50 мкл в каждую пробирку, содержащую 10 мМ LiCl в свежем растворе Кребса в присутствии или в отсутствие исследуемого соединения. Инкубировали в течение 20 мин при температуре 37oC, после чего останавливали реакцию и выделяли меченные продукты на колонках AG-1-X8 (Berridge, Biochem. J. 258: 849-858 (1983)). В зависимости от используемого соединения, частичные агонисты вызывали менее чем 80%-ную активацию гидролиза ФИ по сравнению с ЦХ (полный агонист). Так, соединение AF160 приводило к существенному увеличению концентрации ИФ3 (в 1,6 раза). По сравнению с ЦХ, соединение AF160 являлось частичным агонистом, проявляющим 50% от активности указанного соединения. Соединение AF160(Des) также было активным, однако, в меньшей степени, нежели соединение AF160. Являясь еще одним агонистом рецепторов М1, соединение AF102B оказалось менее активным, чем соединение AF160, в то время как соединение AF178 было неактивным в рассматриваемом тесте.
Для того, чтобы измерить увеличение активации вторичных мессенджеров под действием исследуемых соединений, использовали культуры клеток, обогащенные одной субпопуляцией мускариновых рецепторов. Для изучения метаболизма ФИ применяли метод Берриджа (Berridge, Biochem. J. 258: 849-858 (1983)); для исследования мобилизации арахидоновой кислоты клетки в течение 16 ч метили [3H] арахидоновой кислотой (0,2 мкКи/мл) в оригинальных ростовых средах. Перед исследованием клетки 6 раз промывали бессывороточной средой DME, содержащей HEPES (20 мМ) и альбумин сыворотки крови (1 мг/мл). После указанной промывки добавляли 0,5 мл такой же среды с добавкой исследуемого лиганда. Для остановки тестирования вышеупомянутые среды переносили в пробирки Eppendorf и центрифугировали в течение 10 мин при 6000 g. Определяли радиоактивность супернатанта и выражали ее в dpm высвобожденной [3H]арахидоновой кислоты на лунку. Накопление циклической АМФ в интактных клетках оценивали в соответствии с (Pinkas-Kramarski et al., Neurosci. Lett. 108: 335-340 (1990)), в то время как активность аденилил циклазы на выделенных мембранах определяли по Джонсону и Соломону (Johnson and Salomon, Methods in Enzymology. Vol. 195. Eds. R.A. Johnson and 3. D. Corbin. Academic Press: 3-21 (1991)).
Предпочтительными являются соединения, отвечающие формуле АА и характеризующиеся наивысшим показателем (более 25%) метаболизма ФИ и/или мобилизации арахидоновой кислоты (но не существенной активацией аденилил циклазы). К числу соединений такого рода могут быть отнесены следующие: AF160, AF160(Des), AF179, AF180, AF185, AF260, AF261, AF263, AF265, AF266, AF267. Перечисленные соединения способны активировать мускариновые рецепторы М1.
В отличие от ацетилхолина, ЦХ, оксотреморина-M и других классических полных агонистов, перечисленные выше соединения вызывают селективную активацию передачи различных сигналов через мускариновые рецепторы М1 (или М3). В частности, селективная активация гидролиза ФИ при отсутствии (или минимальном уровне) активации накопления цАМФ является общей характеристикой активности, присущей рассматриваемым новым соединениям. Указанные свойства указанных селективных мускариновых лигандов могут основываться на их способности индуцировать связывание мускаринового рецептора М1 с различными G-белками. Таким образом, дополнительно к активации рецепторов М1, рассматриваемые соединения также могут проявлять селективность на уровне различных вторичных мессенджеров. Эта гипотеза, предполагающая селективную активацию разных G-белков за счет действия селективных мускариновых лигандов на один и тот же мускариновый рецептор, недавно описана авторами настоящего изобретения в виде концепции передачи сигнала за счет селективного лиганда при использовании клеток CHO, трансфецированных геном m1AChR крысы (Fisher et al. , Biorganic & Medicinal Chem. Lett. 2: 839 - 844 (1992)), а также при использовании клеточных линий нейронного типа, в частности, клеточной линии РС12М1 (Soc. Neuroci. Abs., November, 1993). Судя по обнаружению повышенного уровня G-белков у пациентов, страдающих болезнью Альцгеймера (БА), а также в стареющем мозге (Harrison et al., Mol. Brain Res. 10: 71 (1991); Young et al. , Dev. Brain Res. 61: 243 (1991)), очевидна возможность применения указанного пути передачи сигнала в разработке лечения БА, основанного на замене холинергетика. Таким образом, предусмотренные настоящим изобретением соединения могут быть полезны при лечении болезни Альцгеймера.
Некоторые из рассматриваемых соединений являются полными агонистами, в то время как другие представляют собой частичные агонисты при сравнении с ЦХ в плане стимуляции гидролиза ФИ в клетках, трансфецированных геном m1AChR. К числу частичных агонистов относятся следующие соединения: AF160, AF160(Des), AF178, AF180, AF181, AF265 и AF267. Соединения AF260, AF261, AF263 и AF266 проявили в указанном тесте полную агонистическую активность. Кривые "доза-эффект", построенные для соединений AF260 и AF261, свидетельствуют о том, что максимальные активности наблюдаются при концентрациях 10 мкМ и 100 мкМ, соответственно. Соединения AF265 и AF267 вели себя в этом тесте как частичные агонисты. Соединение AF181 проявило в рассматриваемом тесте слабую активность частичного агониста. Так, при концентрации 1 мМ указанное соединение активировало гидролиз ФИ, но при этом ослабляло вызываемый ЦХ гидролиз ФИ, что предполагается в случае частичного агониста. Судя по тому, что соединения AF213 и AF184 блокировали опосредованный ЦХ гидролиз ФИ, указанные соединения проявляют антагонистическую активность. Среди энантиомеров соединения AF267 наибольшая активность характерна для соединения AF267B, представляющего собой (-)-энантиомер; указанное соединение активирует гидролиз ФИ в клетках, трансфецированных геном, кодирующим рецептор m1, даже в концентрации 10 мкМ (40% от ЦХ) и 100 мкМ (80% от ЦХ).
Мы исследовали способность новых спиросоединений вызывать десенсибилизацию к сигналу, представляющему собой обусловленный ЦХ гидролиз ФИ. Соединение AF261 вызывало меньший эффект нечувствительности по сравнению с ЦХ: после 24-часовой обработки 100 мкМ или 1 мМ соединения AF261 гидролиз ФИ в ответ на добавление 1 мМ ЦХ уменьшался на 45% по сравнению с 60%-ным снижением в случае пре-инкубации с 1 мМ ЦХ. Соединение AF267, проявляющее частичную агонистическую активность в плане индукции гидролиза ФИ, оказалось менее способным вызывать десенсибилизацию. Так, после ночной инкубации в присутствии 1 мМ соединения AF267 обусловленный ЦХ ответ (гидролиз ФИ) уменьшался в среднем на 29%.
Мы также тестировали новые спиросоединения по их способности вызывать гидролиз ФИ в клетках временно трансформированных генами m1AChR, m3AChR или m5AChR человека в параллельных экспериментах, описанных Питтелом и Вессом (Pittel & Wess, Mol. Pharmacol. 45: 61- 64 (1994)). Соединение AF267 проявляло наивысшую селективность по отношению к рецепторам подтипа m1AChR, оказавшись при этом приблизительно в 100 раз более активным в случае клеток, трансформированных геном m1AChR, нежели m3AChR (значения ED50 равны 1,5 и 150 мкМ, соответственно). Эта закономерность особенно ярко видна при сравнении сигнала, вызванного 10 мкМ соединения AF267; указанный сигнал уже достигает максимального значения в случае клеток, трансформированных геном m1AChR, но равен лишь 15% максимального сигнала, обусловленного ЦХ в клетках, трансформированных геном m3AChR. Соединение AF265 оказалось несколько более активным и эффективным в случае клеток, трансформированных геном m1AChR, нежели m3AChR, и существенно менее активным при использовании гена m5AChR. Сходные результаты были получены для соединения AF267, особенно для его наиболее активного энантиомера, (-)-энантиомера, в случае культур клеток, стабильно трансформированных генами m1AChR или m3AChR.
Высвобождение арахидоновой кислоты (АК) является еще одним биохимическим процессом, активирующимся агонистами рецепторов m1AChR. Так как указанный биохимический процесс может быть связан с рецепторами m1AChR посредством G-белков, отличающихся от тех, которые принимают участие в гидролизе ФИ, мы исследовали новые спиросоединения и в этом тесте, используя культуры клеток, стабильно трансфецированных геном m1AChR крысы. Соединения AF263, AF265, AF266 и AF267 (в концентрации 1 мМ) проявили в вышеупомянутом тесте частичные агонистические активности. Среди энантиомеров соединения AF267 активным является (-)-энантиомер, который при использовании в концентрации 0,1 и 1 мМ представляет собой полный агонист высвобождения АК. Соединения AF260 и AF261 обладали полными агонистическими активностями при сопоставлении с 1 мМ ЦХ, что согласуется с обнаружением гидролиза ФИ в этой же клеточной линии. Мы обнаружили склонность указанных агонистов вызывать более интенсивное высвобождение АК по сравнению с ЦХ. Этот факт может свидетельствовать о том, что в течение тестирования (20 мин при температуре 37oC) вызываемый ЦХ сигнал уже претерпевает десенсибилизацию. Представляется правдоподобным, что степень указанной десенсибилизации уменьшается при использовании исследуемых соединений. В альтернативном случае определенные исследуемые соединения могут быть более эффективны в качестве агонистов М1, чем ЦХ, т.е. представлять собой "супер-агонисты". В этом случае остается неясным, почему рассматриваемое свойство не наблюдается в тесте на гидролиз ФИ при использовании соединений AF260 и AF261. Проводя 3-часовую пре-инкубацию клеточных культур, трансфецированных геном m1AChR, в присутствии 1 мМ ЦХ с последующей экстенсивной отмывкой использованного лиганда (6 х 1 мл), достигают, существенного снижения высвобождения АК. Базальный уровень высвобождения АК оказывается слабо измененным, что свидетельствует об отсутствии следов ЦХ после отмывки. Для сравнения, проводя в аналогичном эксперименте пре-инкубацию с 1 мМ соединения AF265 или AF102B, получали ослабление вызванного 1 мМ ЦХ высвобождения АК только до половины исходного ответа. В случае более длительных периодов инкубации мы предпочитали концентрации агента в 100 мкМ, поскольку концентрации 1 мМ не оказывали физиологического эффекта при длительных воздействиях. После 24- часовой пре-инкубации в присутствии 100 мкМ ЦХ соответствующий АК-ответ утрачивался практически полностью. Мы сравнили способность новых спиросоединений вызывать десенсибилизацию сигнала, вызванного ЦХ и приводящего к высвобождению АК. 24-часовая пре-инкубация в присутствии 100 мкМ соединения AF265 неожиданно не приводила к какому-либо ослаблению соответствующего АК-ответа. Этот факт заслуживает особого внимания, свидетельствуя о том, что указанное соединение является частичным агонистом в рассматриваемом тесте. Напротив, стимуляция соединениями AF260, AF261 и AF263 (при их использовании в течение 24 ч в концентрации 100 мкМ) существенно ослабляла сигнал, вызываемый ЦХ и приводящий к высвобождению АК. Аналогичные пре-инкубации в присутствии соединений AF102B и AF267 вызывали относительно слабый эффект на последующий сигнал, сигнал, вызываемый ЦХ и приводящий к высвобождению АК, что еще раз указывало на сходство двух этих соединений.
Тест N. 4: Нейротрофно-подобные эффекты в культурах клеток
Активация рецепторов М1 агонистами и действие Фактора Роста Нервов (ФРН) могут приводить к синергидным эффектам в определенных культурах клеток, обогащенных рецепторами m1, в том числе клеток РС12 (клеток феохромацитомы крыс), трансфецированных геном m1AChR крысы (клеток РС12М1) (Pinkas-Kramarski et al., J. Neurochem. 59: 2158-2166 (1992)).
В соответствии с еще одним аспектом настоящего изобретения показано, что соединения, отвечающие формуле АА и вызывающие более чем 25%-ный метаболизм ФИ, способны приводить к синергидному эффекту на обусловленный ФНР рост аксонов. Среди соединений, предусмотренных настоящим изобретением, можно выделить два класса:
1. соединение, такие как AF260, AF261 и AF263, которые в отсутствие ФРН способны вызывать удлинение аксона почти так же, как ЦХ; и
2. соединения, резко отличающиеся от оксотреморина и не способные вызывать удлинение аксонов, либо индуцировать даже минимальные морфологические изменения в отсутствие ФРН.
Оба указанных класса пригодны для лечения БА. В случае второго класса, не может иметь место неконтролируемый рост аксонов. Поэтому предпочтительный кандидат на роль лекарственного агента при лечении БА должен, например, вызывать образование аксонов только под жестким контролем со стороны локально синтезирующихся и высвобождающихся ростовых факторов, таких как ФРН, нервный фактор мозгового происхождения (НФМП), NT-3 и т.п. Примеры подобной уникальной активности можно обнаружить в случае таких соединений, как AF160, AF160(Des) и AF165, которые по меньшей мере столь же эффективно оказывают синергидный эффект на опосредованный ФРН рост аксонов, как и соединение AF102B. Аксоны, удлинение которых было вызвано комбинированным воздействием ФРН и новых спиросоединений, оказались стабильными в течение длительных периодов культивирования. На основании этого можно сделать вывод о том, что пути передачи сигнала, используемые рассматриваемыми соединениями при индукции роста аксонов, не подвержены быстрой десенсибилизации. Эта закономерность очень характерна для самого ФРН, вызывающего очень стабильные и длительные эффекты стимуляции аксонов в клетках РС12, а также в первичных культурах симпатических нейронов. Однако следует отметить, что старые не подвергнутые обработке культуры исследуемых клеток претерпевали вырождение и содержали множество мертвых клеток, отделяющихся от поверхности чашки. Интересно, что указанный феномен смертности клеток был ослаблен в культурах, предварительно обработанных комбинацией новых спиросоединений и ФРН. Хорошо известно, что ФРН спасает клетки РС12 от запрограммированной смерти (Rukenstein et al., J. Neuroscience, 11: 2552-2563 (1991)). Таким образом, вышеупомянутое наблюдение свидетельствует о возможной способности соединений, предусмотренных настоящим изобретением, оказывать сходные эффекты, благоприятствующие выживанию клеток. Все указанные особенности обуславливают дополнительный интерес к рассматриваемым соединениям в плане их потенциального использования для лечения пациентов, страдающих болезнью Альцгеймера.
Нейротрофно-подобная активность, которая проявляется предусмотренными настоящим изобретением агонистами по отношению к нервным клеткам, а также зависит от присутствия ФРН, по-видимому свидетельствует о том, что вышеупомянутые соединения оказывают свой нейротрофный эффект за счет взаимодействия с некоторыми сигналами, опосредованными рецепторами ФРН. Одно из возможных объяснений состоит в том, что указанные эффекты являются косвенными за счет усиленного высвобождения белков-предшественников амилоидов (БПА), обусловленного рецепторами m1AChR. Следует подчеркнуть, что эндогенные БПА необходимы для нормального роста фибробластных клеток, а экзогенные БПА способны стимулировать пролиферацию этих клеток (Saitoh et al.. Cell, 58: 615 (1989); Mattson et al., TINS, 16: 409-414 (1993)). Интересно, что среди других активностей, присущих секретируемым формам БПА, хорошо известна способность регулировать рост аксонов, а также обеспечивать выживание нервных клеток (Mattson et al., TINS, 16: 409-414 (1993)). Смертность нервных клеток при БА по-видимому приводит к уменьшению образования и/ или жизнеспособности нейротрофинов, что в свою очередь оказывает воздействие на жизнеспособность холинергических нейронов. В том случае, если вышеупомянутые нейротрофоподобные события индуцируются агонистами рецепторов М1, также присутствующими в мозгу, это обстоятельство может иметь наиболее важное клиническое значение и, таким образом, отражать новый способ лечения БА.
Тест N. 5; Секреция белков-предшественников амилоидов (БПА) в срезах мозга и клеточных культурах.
Имеются множащиеся свидетельства участия β- амилоидов в патологических процессах, приводящих к возникновению БА. На основании "Гипотезы амилоидного каскада", БА возникает в результате ошибочного метаболизма белков-предшественников амилоида (БПА) (Mattson et al., TINS, 16: 409-414 (1993)). Активация рецепторов m1AChR, особенно m1-типа, приводит к усилению секреции БПА in vitro (Nitsch et al.. Science, 258: 304 (1992); Buxbaum et al., PNAS US, 89: 10075 (1992); Lahiri et al., Biochem. Int. 28: 853 (1992)). Таким образом, в соответствии с еще одним аспектом настоящего изобретения, соединения, отвечающие формуле АА, в особенности те из них, которые проявляют селективную агонистическую активность по отношению к рецепторам m1, а также усиливают высвобождение БПА, могут быть пригодны не только для лечении БА, но и для отсрочивания ее прогрессии, либо даже для предотвращения БА.
Для количественной оценки секреции БПА применяют метод иммуноблоттинга по Вестерну (Nitsch et al., PNAS US, 90: 5191-5193 (1993)). Мы использовали моноклональные антитела к БПА (22С11), которые широко применяются для выявления БПА. Указанные антитела получены непосредственно на амино-терминальный участок БПА и выявляют все известные к настоящему времени изоформы БПА. Рассматриваемые антитела не реагируют на амилоидный или С-терминальный участки БПА, образующиеся после секреции БПА. Исследуя влияние новых спиросоединений на высвобождение БПА, линии клеток, трансфецированные геном рецептора m1, культивировали в 12-луночных чашках (в некоторых экспериментах - в 6-луночных чашках) в соответствии с (Pinkas-Kramarski et al., J. Neurochem. 59: 2158 (1992)). На определенные промежутки времени в указанные лунки добавляли лиганды из стерильного 100-кратного сток-раствора. Останавливали эксперименты, дважды промывая вышеупомянутые лунки бессывороточной средой. Клетки отделяли от указанных чашек в холодном забуференном фосфатом физиологическом растворе (pH 7,4; PBS). После центрифугирования (10 мин при 10000 д) сливали супернатант, а полученные осадки суспендировали в 0,1 мл холодного лизисного буфера, содержащего смесь ингибиторов протеаз (50 мМ TRIS-HCl (pH 7,4); 150 мМ EDTA; 1% Triton X-100; 0,1 мМ PMSF; 5 ед/мл апротинина; 5 мкг/мл пепстатина А; 5 мкг/мл лейпептина). Затем указанные осадки в течение 5 с подвергали обработке ультразвуком при максимальной интенсивности (Branson sonicator, модель 130) и еще раз центрифугировали. Полученные супернатанты (экстракты клеточных мембран) переносили в чистые пробирки. Образцы этих супернатантов отбирали для выявления белка с помощью метода Лоури.
Для проведения теста на БПА равные количества белка (обычно 100 мкг на дорожку) разводили в аликвоте буфера, содержащего 0,6% SDS и 1% 2-меркаптоэтанола, после чего наносили ее на 10%-ные акриламидные/SDS минигели (Hoeffer Scientific). На каждый гель наносили предварительно окрашенные стандарты молекулярного веса (Sigma). Электрофорез проводили с использованием переменного тока 25 мА/гель при температуре 4oC. Гибридизацию осуществляли на нитроцеллюлозной мембране при 100 мА в течение 16-18,ч при температуре 4oC. Следующие этапы проводили при комнатной температуре. Мембраны в течение 1 ч фиксировали с помощью иммерсии в PBS, содержащем 10% обезжиренного молока. После этого этапа проводили 3x5-минутные промывки в PBS, содержащем 0,05% Tween-20 и 0,1% BSA (PBST). Добавляли моноклональные антитела (клон 22С11; Boehringer Mannheim, #1285-262); разведение 1:200 (0,25 мкг/мл IgG) в буфере PBST; инкубация в течение 2 ч при комнатной температуре, либо 18 ч при температуре 4oC. В случае некоторых экспериментов, аналогичную гибридизацию проводили с использованием контрольных IgG мыши в той же концентрации. После указанного этапа осуществляли 3х5-минутные промывки в PBST. Использовали вторичные антитела к IgG мыши, присоединенные к пероксидазе хрена; разведение 1: 2000 в PBST; время инкубации 1 ч; после чего проводили вышеописанную промывку. Окрашивание иммуноблотов осуществляли при комнатной температуре в течение 15-30 мин с использованием свежеприготовленного раствора 4- хлоронафтола (0,2 мг/мл в TBS, содержащем 16% этанола) и H2O2 (0,01%). Фотографировали окрашенные фильтры (негативная пленка Kodak ТМАХ) и сканировали лазерным сканнером LKB Ultro-Scan KL при размере вертикального интервала в 40 мкм и ширине горизонтального пробега в 2,4 мм. Каждую дорожку сканировали трижды при слегка различных положениях; представленные данные являются усредненными значениями оптической плотности для 3 измерений.
С помощью вышеописанного метода мы измеряли количество БПА, оставшегося во фракции клеточных мембран после инкубации (обычно 24-часовой) в присутствии исследуемых соединений. Небольшие количества БПА, оставшиеся на мембранах после указанной инкубации в присутствии агонистов, рассматривали как свидетельство того, что большая часть БПА была секретирована соответствующими клетками. Подобный способ учета приемлем в том случае, если предполагается способность мускариновых агонистов ослаблять накопление β- амилоидов при болезни Альцгеймера, поскольку, в отличие от секретируемых форм БПА, только связанные с мембраной БПА могут приводить к образованию β- амилоида. Для измерения количества БПА, секретированных клетками в культуральную среду ("кондиционированную среду"), указанную среду концентрировали с использованием мембран для микрофильтрации (Amicon, задержка молекул весом более 30 кДа). Сконцентрировав рассматриваемую среду, в полученных образцах с помощью метода Брэдфорда (Bio-Rad kit #500-0006) определяли количество белка с использованием гамма-глобулина быка в качестве стандарта. Равные количества белка исследовали методом электрофореза в поли-акриламидном геле (ЭПАГ). Количество БПА в исследуемых образцах выявляли с помощью иммуноблоттинга с моноклональными антителами к БПА (см. выше). Определение молекулярного веса проводили с использованием предварительно окрашенных стандартов (Sigma), наносимых на каждый гель.
Предпочтительными являются соединения, отвечающие формуле АА и характеризующиеся наивысшими показателями секреции БПА в клеточных культурах (125% по сравнению со 100%-ным базальным уровнем). К числу соединений, проявляющих активность такого рода, относятся следующие соединения: AF160(Des), AF179, AF185, AF261, AF263, AF265 И AF267.
Для того, чтобы анализировать большое количество образцов одновременно, некоторые исследования были проведены с использованием метода дот-блота (одновременно анализировали 96 пятен на одном фильтре). В этом случае, среду, кондиционированную стимулированными клетками РС12М1, наносили в вакууме непосредственно на нитроцеллюлозные фильтры (без предварительного концентрирования). Затем указанные фильтры обрабатывали в соответствии с методикой иммуноблоттинга. Кроме того, осуществляя разделение секретированных БПА с помощью ЭПАГ, проводили детальный анализ зависимости "доза- ответ", а также временной зависимости. Результаты, полученные в описанных экспериментах и дот-блот тестах, хорошо согласуются друг с другом. Таким образом, новые спиросоединения были исследованы в плане их влияния на секрецию БПА клетками, трансфецированными геном m1AChR, также с использованием метода блот-доттинга и инкубации в течение 1 часа. Некоторые соединения, такие как AF261, AF263, AF265 и AF267, являются полными агонистами в указанном тесте.
Десенсибилизация секреции БПА, опосредованной рецепторами m1AChR, оказывается более сильной в случае продолжительной инкубации в присутствии ЦХ, нежели частичных агонистов, предусмотренных настоящим изобретением. Этот вывод представляется особо привлекательным при рассмотрении полученных данных о десенсибилизации сигналов, приводящих к высвобождению арахидоновой кислоты (АК), в комплексе с недавно выдвинутым предположением о том, что высвобождение АК задействовано в стимуляции секреции БПА (Emmerling et al., BBRC, 197: 292-297 (1993)). Полученные нами данные по-видимому свидетельствуют о том, что некоторые из новых спиросоединений более предпочтительны, чем высокоэффективные агонисты, для клинического использования с целью длительного снижения количества связанных с клетками БПА. К числу соединений, характеризующихся наименьшим уровнем десенсибилизации в тесте на высвобождение АК, относятся соединения AF265 и AF267. Измерение количества БПА, связанных с клетками после 24-часовой инкубации в присутствии соединений AF265 или AF267 (каждое в концентрации 100 мкМ), показало снижение уровня БПА; причем указанное снижение было более сильным в случае соединения AF267 (почти соответствовало эффекту, вызываемому ЦХ), в то время как соединение AF265 оказывало более слабое действие.
Данные по секреции БПА культурами клеток, стабильно трансфецированных геном m1AChR, четко свидетельствуют о том, что некоторые из новых спиросоединений могут стимулировать секрецию БПА, а потому способствовать ослаблению аккумуляции амилоида in vivo. Однако для того, чтобы экстраполировать данные, полученные на клеточных культурах, на ситуацию in vivo, следует продемонстрировать способность указанных соединений стимулировать секрецию БПА в мозгу. В связи с этим исследовали секрецию БПА в срезах коры головного мозга крыс. Обычно срезы коры головного мозга крыс (300х300 мкм) получали немедленно из свежепрепарированной ткани, рассеченной по двум перпендикулярным направлениям с помощью McIlwain Tissue Chopper и трижды ополоснутой буфером Кребса, насыщенным кислородом. Промытые срезы насыщали указанным буфером до равновесного состояния в течение 50 мин при температуре 37oC. После указанного насыщения (которое необходимо для удаления остатков клеток, образующихся в ходе разрезания ткани) использованный, буфер заменяли на буфер Кребса, содержащий 50 мкг/мл BSA (в качестве носителя белка) и смесь ингибиторов протеаз (0,1 мМ PMSF, а также по 5 мкг/мл лейпептина, пепстатина и апротинина-А). Обработанные срезы распределяли по пластиковым пробиркам и стимулировали определенными концентрациями исследуемых соединений в течение 1 ч (в одном эксперименте - 2ч) при температуре 37oC. По окончании периода инкубации объединяли образцы буфера, центрифугировали, анализировали на содержание белка, отбирали равные аликвоты белка и исследовали их методом иммуноблоттинга с моноклональными антителами на БПА (22С11) при использовании ЭПАГ (см. эксперименты с культивируемыми клетками). Секретируемые БПА были представлены двумя белковыми полосами, характеризующимися молекулярным весом 117 кДа (основная полоса) и 90 кДа (минорная полоса). Указанные полосы БПА могут соответствовать секретируемым формам БПА751 и БПА695 (основным Kunitz-содержащей и Kunitz-несодержащей формам БПА). В альтернативном случае указанные полосы могут соответствовать зрелым и незрелым (негликозилированным) формам секретируемого БПА751. В настоящее время нет данных, достаточных для предпочтения одной из приведенных выше интерпретаций, поскольку моноклональные антитела 22С11 взаимодействуют в этом тесте со всеми формами секретируемых БПА. Секреция БПА срезами коры головного мозга крыс увеличивалась по сравнению с контрольным уровнем секреции БПА в 2-3 раза при действии как ЦХ, так и, например, соединения AF267 (оба в концентрации 0,1 мМ). Эта закономерность выполнялась для обеих белковых полос (117 кДа и 90 кДа).
Проведенные наблюдения за секрецией БПА, осуществляемой срезами коры головного мозга, являются уникальными. В настоящее время единственные свидетельства секреции БПА тканью мозга получены in vitro (Nitsch et al., PNAS US, 90: 5191-5193 (1993)), при этом показано, что электростимуляция срезов гиппокампа крыс приводит к росту высвобождения БПА. Следует подчеркнуть, что в рассматриваемом исследовании не использовали стимуляцию с помощью агонистов рецепторов. Таким образом, полученные нами данные являются оригинальными и новыми, поскольку они впервые демонстрируют регуляцию секреции БПА в ткани мозга посредством рецепторного лиганда, в особенности такого агониста рецептора М1, как соединение AF267. Предпочтительными являются соединения, способные стимулировать секрецию БПА срезами коры головного мозга крыс. В качестве такого рода соединений можно рассматривать все предусмотренные настоящим изобретением агонисты, стимулирующие вторичные мессенджеры (типа ФИ) более чем на 25% по сравнению с контролем. Эти уникальные наблюдения по-видимому свидетельствуют о том, что некоторые из вышеупомянутых соединений способны замедлять выделение А4-амилоидных пептидов в мозгу пациентов, страдающих болезнью Альцгеймера.
Тест N. 6: Фосфорилирование Тау-белка в культурах клеток, трансфецированных геном miAChR, а также в срезах коры головного мозга крыс.
Тау-белок (τ) представляет собой нейрон-специфический, ассоциированный с микротрубочками белок, обычный для аксонов. Тау-белок экспрессируется в виде нескольких изоформ, каждая из которых является производной альтернативного сплайсинга одного и того же гена (тау-белок человека имеет 6 изоформ, состоящих из 352-441 аминокислот). Функция тау-белка состоит в стабилизации микротрубочек аксона нервной клетки; связывание указанного белка с микротрубочками регулируется посредством его фосфорилирования по разным сайтам (Mandelkow & Mandelkow, TIBS, 18: 480-483 (1993)). В свою очередь, указанное фосфорилирование регулирует рост и стабильность аксона (Baas et al., J. Cell. Bi-ol. 115: 1333-1344 (1991). 55. Mattson, Brain Res. 582: 107-118 (1992)). Наряду с выделением амилоида в бляшках, одной из характерных отличительных особенностей болезни Альцгеймера является накопление тау-белка или его производных в нейрофибриллярных узлах (НФУ). Наличие такого рода узлов по-видимому отражает конечный продукт, образующийся в результате смерти нервной клетки в пораженной нервной ткани. В нескольких исследованиях показаны изменения фосфорилирования тау-белка в образцах мозга, взятых после смерти у пациентов, страдавших БА. Этот факт лучше всего документирован усилением иммунореактивности с моноклональными антителами ALZ-50, что отражает наличие гипер-фосфорилированных форм тау-белка в указанных образцах мозга (Vincent & Davies, PNAS US, 87: 4840-4844 (1990); Vincent & Davies, Brain Res. 531: 127-135 (1990)). В связи с этим было выдвинуто предположение, что изменения тонкого баланса между тау-специфическими киназами и фосфорилазами может приводить к смерти нервных клеток при БА, а потому коррекция подобного гипотетического дисбаланса может иметь существенное терапевтическое значение.
В соответствии с этим анализировали степень фосфорилирования тау-белков в культурах клеток, стабильно трансформированных геном m1AChR, после стимуляции с помощью ЦХ или одного из исследуемых соединений. Указанный анализ проводили с использованием моноклональных тел tau-1, для которых показана их способность узнавать только дефосфорилированные, а не фосфорилированные изоформы тау-белков (Mandelkow & Mandelkow, TIBS, 18: 480-483 (1993)). Проведя инкубацию клеток или срезов коры головного мозга крыс в присутствии соответствующих агонистов в течение различных промежутков времени, указанные клетки или срезы трижды промывали PBS, отбирали в PBS, содержащий 0,2 мМ EDTA, и центрифугировали в течение 5 мин при 10000 g. Полученные осадки мембран анализировали на содержание белка, равные количества белка использовали в ЭПАГ для иммуноблоттинга с антителами tau-1. Измерения иммуно-реактивности проводили так же, как и в случае БПА (с помощью видеоденситометрии), за исключением того, что присоединенное к пероксидазе вторичное антитело выявляли с использованием метода Усиления ХемоЛюминисценции (УХЛ) (RPN-2109; Amersham, UK).
Следует подчеркнуть, что и ЦХ, и исследуемые агонисты приводили к усилению иммуно-реактивности по отношению к tau-1, указанное усиление полностью блокировалось атропином. Резкое усиление иммуно-реактивности к антителам tau-1, вызванное ЦХ, наблюдали в клетках, культивированных в присутствии ФРН (50 нг/мл) в течение 3 дней перед стимуляцией мускариновыми лигандами. Как показали аналогичные эксперименты, проведенные с использованием различных концентраций ЦХ или исследуемого агониста, для усиления иммуно-реактивности по отношению к tau-1 требуются относительно высокие концентрации лиганда (10-100 мкМ).
Кроме того, измеряли степень фосфорилирования тау-белка в срезах коры головного мозга крыс при стимуляции ЦХ по сравнению с действием соединений, предусмотренных настоящим изобретением. Исследованные мускариновые агонисты вновь неожиданно оказались способными ослаблять степень фосфорилирования тау-белка.
Итак, мускариновые агонисты способны понижать степень фосфорилирования тау-белка за счет активации рецептора m1AChR в культивируемых клетках, трансфецированных соответствующим геном, а также, что более важно, в срезах мозга. Кроме того, действие указанных агонистов по-видимому является длительным, что проявляется даже после инкубации соответствующих клеток в присутствии 100 мкМ лигандов в течение по меньшей мере 3 дней. Приведенные факты могут свидетельствовать о том, что селективные агонисты рецепторов М1 способны ослаблять фосфорилирование тау-белка.
Перечисленные наблюдения являются новыми, насколько мы знаем, до настоящего времени не продемонстрировано какой-либо зависимости между холинергической недостаточностью при болезни Альцгеймера и накоплением, а также фосфорилированием изоформ тау-белка в нейрофибриллярных узлах, типичных для мозга, страдающего указанным заболеванием. Эти новые факты могут найти применение при замедлении прогресса болезни Альцгеймера с использованием агонистов рецепторов М1.
Выводы:
Агонисты рецепторов m1 могут оказывать различные эффекты. Так, механизм действия агонистов рецепторов m1 неожиданно оказался более сложным по сравнению с традиционными представлениями. Показано, что агонистам рецепторов m1 присущи следующие активности in vitro (а возможно и in vivo):
1. Связывание с рецепторами m1 и их активация;
2. Дифференциальная активация некоторых G-белков (в частности, Gq, но не Gs;
3. Нейротрофо-подобные и синергидные эффекты при совместном действии с ФРН;
4. Секреция белка-предшественника амилоидов (БПА), а также ослабление синтеза β- амилоидов;
5. Увеличение доли дефосфорилированных тау-белков;
6. ФРН-подобные эффекты.
Все вышеперечисленные эффекты могут быть объяснены с помощью модели, в соответствии с которой активация рецепторов m1AChR приводит к каскаду сходных событий. Такого рода сложные механизмы, основанные на действии агонистической активности по отношению к рецепторам m1, могут быть связаны с общим сценарием, предполагающим ненормальный процессинг БПА, дефицит ФРН-подобных белков, а также дефицит холинергетиков при ССТА и БА. В соответствии с этим, агонисты рецепторов m1, сходные с соединениями, предусмотренными настоящим изобретением, вызывая селективную и позитивную активацию секреторного пути процессинга БПА, могут иметь значение при предотвращении образования амилоида; кроме того, благодаря синергидному эффекту, производимому совместно с ФРН, указанные соединения могут усиливать действие нейтрофинов при БА. Таким образом, агонисты рецепторов m1 могут быть применимы при использовании стратегии замены холинергетиков, а также при отсрочивании прогреса БА. Предусмотренные настоящим изобретением соединения, являющиеся агонистами рецепторов m1, в отличие от пептидов представляют собой относительно небольшие молекулы, способные проявлять нейтрофо-подобные эффекты, вызывать высвобождение и нормальный процессинг БПА, а также усиливать дефосфорилирование (или ослаблять фосфорилирование) тау-белков. Таким образом, обработка клеток агонистами рецепторов m1 по-видимому может переключать процессинг БПА с амилоидогенного лизосомного пути на нормальный секреторный путь, а соответствующая холинергическая терапия БА может характеризоваться более продолжительными эффектами на образование β- амилоида (Lahiri et al., Biochem. Int. 28: 853-860 (1992)). Более того, так как некоторые агонисты, предусмотренные настоящим изобретением, проявляют ФРН-подобные эффекты контролируемым образом, в особенности в присутствии ФРН, указанные соединения могут иметь существенное значение при лечении БА/ССТА в будущем. В этом случае, рост аксонов может контролироваться лучше. Кроме того, новые спиросоединения оказывают длительный благоприятный эффект на рост аксонов в присутствии ФРН. Таким образом, можно предположить, что возможное в будущем лечение пациентов, страдающих БА/ССТА, с использованием таких ростовых факторов, как ФРН, может требовать менее частого применения соответствующего ростового фактора при его введении совместно с агонистом рецептора m1. Следует отметить, что введение ФРН в мозг является наиболее сложной проблемой, поскольку указанное соединение не способно пересекать границу кровеносных сосудов. Даже если эта проблема будет решена (например, с использованием специальных систем введения), повторные введения ФРН-подобных соединений будут все равно необходимы. В связи с этим, агонисты рецепторов m1 могут уменьшать количество необходимых повторных применений ФРН, поскольку указанные агонисты пролонгируют эффекты, обуславливаемые ФРН (по меньшей мере in vitro). Интересно, что клинические испытания ФРН (icv), проведенные на 2 пациентах, показали наличие серьезных побочных эффектов (сильная боль, дезориентация, нарушения устного счета) (3rd Springfield Symposium on Aizheimer's Desease, May 11 - 15, 1994, Springfield, Il., USA). Использование агонистов рецепторов m1, сходных с соединениями, предусмотренными настоящим изобретением, а также способных оказывать синергидный эффект при совместном применении с ФРН, может иметь большое значение для уменьшения побочных эффектов, обусловленных введением человеку ФРН, благодаря возможности использовать меньшие дозы ФРН.
Тест N. 7. Фармакологические и токсикологические свойства.
Для проведения анализа наблюдали за животными, которым внутривенно или перорально (в случае мышей), либо перорально (внутрижелудочно в случае крыс) вводили 3-6 дозовых уровней каждого соединения. Полученные результаты приведены в Таблице 5.
Через различные промежутки времени после введения соединения (10, 20, 30, 45, 60, 120, 240 мин и 24 ч) обработанных животных подвергали детальному исследованию в плане изменения общего поведения, рефлексов и автономных эффектов. Через 24 ч после введения тестируемого соединения учитывали жизнеспособность подопытных животных. Температуру тела крыс измеряли с помощью теле-термометра (Модель 46 TUC). В число анализируемых фармакологических и поведенческих параметров входили: слюноотделение, покраснения вокруг носа и рта, хромодакриорея, степень спокойствия, атаксия, отравление, тремор, конвульсии, пониженная температура, опистонус, затрудненное дыхание, диаррея, постоянное движение челюстей, напряжение кишечника, смертность, изменения диаметра зрачка, верчение, гипо- и гиперактивность, а также издавание звуков. Некоторые из тестированных соединений оказались нетоксичными в концентрации вплоть до 500 мг/кг (в случае как мышей, так и крыс; перорально).
Обсуждение результатов:
Соединение AF160
Соединение AF160 представляет собой достаточно эффективный мускариновый агонист, оказывающий влияние в большей степени на центральную, нежели на периферическую нервную систему (например, вызывает пониженную температуру, а не слюноотделение), а также по меньшей мере в 5 раз менее токсичный по сравнению с соединением AF102B. Характерной особенностью указанного соединения служит отсутствие тремора у крыс вплоть до наивысшей тестированной дозы (500 мг/кг перорально), а также некоторых треморов у мышей при использовании в дозах > 125 мг/кг перорально. Сходные особенности продемонстрированы для метилированного аналога соединения AF160 (AF178), при введении которого в дозах вплоть до 500 мг/кг (перорально) не возникает каких-либо треморов ни у крыс, ни у мышей. Мыши более чувствительны к этому соединению, чем крысы, так как побочные эффекты на периферическую и центральную нервную систему возникают у мышей при меньших дозах.
У крыс соединение AF160 проявляет себя как эффективный агонист. Четкие свидетельства этому были обнаружены для дозы 25 мг/кг. Для эффекта пониженной температуры и постоянных погрызов были рассчитаны соответствующие значения ED50. Продолжительность и степень тяжести симптомов зависели от дозы. Эффект понижения температуры оказался длительным, более 4 ч.
Для соединения AF160 характерны 4 особенности:
1. Соединение четко проявляет большую активность по отношению к ЦНС, чем к ПНС (в частности, понижение температуры возникает при меньшей дозе, чем слюноотделение).
2. Имеется селективность по отношению к ЦНС, поскольку наблюдаются не все связанные с ЦНС эффекты (в частности, понижение температуры, но отсутствие треморов).
3. Продолжительность обнаруженных эффектов - велика.
4. Даже при наивысших уровнях доз (500 мг/кг) нет смертности мышей и крыс.
Соединение AF160(Des)
У одной из четырех подопытных крыс через 45 мин после введения 125 мг/кг обнаружены слюноотделение, понижение температуры, а также диаррея. При увеличении дозы до 500 мг/кг возрастало количество животных в группе, проявляющих указанные симптомы, кроме того, становились заметными напряжение кишечника и успокоенность. Эффект понижения температуры не зависел от дозы. Рассматриваемое соединение не вызывало какие-либо другие ЦНС-опосредованные или автономные эффекты. Данное соединение относительно неактивно в плане побочных холинергических эффектов. В случае соединения AF160(Des) побочные эффекты возникают при использовании доз > 246 мг/кг (перорально на крысах).
При введении мышам 240 мг/кг соединения AF160(Des) наблюдали слезотечение, диаррею и мидриаз. При использовании больших доз вплоть до 1000 мг/кг четко проявлялись дополнительные симптомы: слюноотделение, успокоенность и понижение температуры. Продолжительность и степень тяжести указанных симптомов (за исключением слезотечения) зависели от дозы. Даже при наивысших уровнях дозы (1000 мг/кг) не наблюдали смертности. Местное введение 1 мг (порогового уровня) соединения AF160(Des) в глаз вызывало мидриаз через 15 мин. Напротив, атропин, используемый в качестве контрольного агента ввиду хорошо известного вызываемого им локального мидриастического эффекта, индуцировал мидриаз через 45 мин при введении 40 мкг. Приведенные данные свидетельствуют о том, что вызываемый соединением AF160(Des) мидриаз обусловлен эффектами ЦНС.
Соединение AF163
Рассматриваемое соединение, вводимое в дозах от 50 до 400 мг/кг, вызывало у крыс только слюноотделение, а также покраснение вокруг носа и рта. Перечисленные эффекты быстро появлялись (через 10 мин) и были непродолжительными (20 мин). В то время, как количество животных, проявляющих слюноотделение, зависело от дозы, покраснение вокруг носа и рта было отмечено только у 1 животного при использовании дозы 100 мг/кг. Таким образом, при введении указанного соединения наблюдались только автономные эффекты.
У мышей рассматриваемое соединение не вызывало никаких побочных эффектов при использовании в наивысшей исследованной дозе (400 мг/кг), за исключением 1 животного, издававшего звуки. При введении мышам соединения AF163 вплоть до наивысшей исследованной дозы (400 мг/кг перорально) не наблюдали никаких побочных эффектов, связанных с центральной или периферической нервной системой. Соединение AF163 можно рассматривать в качестве предшественника лекарственного агента AF160, как в случае дитио-аналога соединения RS86 (Bolliger et al., in: Aizheimer's and Parkinson's Desease; Strategies in R& D. Eds. Fisher et al. Plenum Press, pp. 585 (1986).
Соединение AF177
Через 10 мин после введения мышам 31 мг/кг наблюдались понижение температуры, гипоактивность, а также треморы. При увеличении дозы до 62 мг/кг росло и количество симптомов. Через 20 мин у всех 4 мышей были отмечены успокоенность, атаксия, Straub-tail и падения от верчения. Через 30 мин после введения у 1 из 4 мышей наступила смерть. При увеличении дозы до 125, 250 и 500 мг/кг наблюдали слюноотделение, конвульсии и смерть всех 4 мышей, однако при этом время наступления указанных симптомов прогрессивно сокращалось, а степень их тяжести росла. Расчет значений ED50 показал, что соединение AF177 преимущественно оказывает влияние на ЦНС. Соединение AF177 можно рассматривать в качестве предшественника лекарственного агента, активного по отношению к ЦНС и являющегося эффективным мускариновым агонистом.
Соединение AF178
В течение 1 ч после введения мышам 60 мг/кг указанного соединения отмечали пониженную моторную активность, слюноотделение, слезотечение, а также диаррею. При увеличении дозы до 500 мг/кг проявлялись дополнительные симптомы: затрудненное дыхание, ослабленное верчение, треморы и мидриаз. Продолжительность и степень тяжести большинства из перечисленных симптомов зависели от дозы. В целом, увеличение дозы приводило к более длительному эффекту. В частности, диаррея, треморы, мидриаз и т.п. продолжались в течение приблизительно 4 ч. Следует подчеркнуть, что через 20 мин после введения 500 мг/кг одно из животных проявило общую дрожь, продолжавшуюся в течение 10 мин. Несмотря на то, что доза в 500 мг/кг вызывала типичные токсикологические симптомы, не отмечено смерти животных. Таким образом, предположительное значение ED50 должно превышать уровень 500 мГ/кг.
Слюноотделение было единственным побочным эффектом, выявленным при введении крысам 62,5 мг/кг соединения AF178. При увеличении дозы до 125 мг/кг четко проявлялись и другие эффекты: хромодакриоррея, понижение температуры, диаррея, а также постоянные погрызы. Продолжительность и степень тяжести перечисленных симптомов возрастали с увеличением дозы. Затрудненное дыхание было четким только у 1 животного через 5 мин после инъекции дозы 500 мг/кг. Рассматриваемое соединение характеризуется достаточно широкими пределами безопасного использования.
Соединение AF180
Соединение AF180, вводимое в дозе 125 мг/кг, вызывало у крыс только слюноотделение. Указанный эффект проявлялся через 20 мин после применения и продолжался в течение 40 мин. Дальнейшее увеличение дозы до 500 мг/кг приводило к росту продолжительности слюноотделения вплоть до 230 мин. При использовании этой дозы у 3 животных было отмечено понижение температуры, длившееся с 15 по 240 мин после инъекции. Указанная доза не вызывала никаких других опосредованных ЦНС или автономных эффектов.
Через 20 мин после введения мышам 125 мг/кг наблюдались понижение температуры, а также мидриаз. При увеличении дозы до 500 мг/кг увеличивалось количество животных, проявлявших указанные симптомы, кроме того, четко выявлялись слюноотделение, слезотечение и успокоенность. При введении 500 мг/кг перечисленные симптомы продолжались в течение более чем 1,5 ч. Рассматриваемое соединение не вызывало никаких других опосредованных ЦНС или автономных эффектов.
Соединение AF185
При введении мышам 62,5 мг/кг соединения AF185 наблюдали мидриаз. При более высоких дозах указанного соединения вплоть до 500 мг/кг четко выявлялись дополнительные симптомы: слюноотделение и понижение температуры. Наивысшая доза (500 мг/ кг) не вызывала смерти.
У крыс наивысшая доза рассматриваемого соединения (500 мг/ кг) не вызывала никаких видимых эффектов за исключением покраснения вокруг носа и рта, отмеченного у 1 животного. Можно предположить, что соединение AF185 является в высокой степени безопасным.
Соединение AF261
Снижение температуры (типичный эффект, опосредованный ЦНС) был единственным симптомом, вызванным у крыс применением 7,5 мг/кг соединения AF261. Указанный эффект становился заметным через 10 мин после введения и продолжался в течение 50 мин. При увеличении дозы до 15,5 мг/кг через 10 мин после введения отмечали дополнительные симптомы: слюноотделение, хромодакриоррею, гипоактивность, атаксию и диаррею. При использовании наивысшей дозы вплоть до 250 мг/кг четко проявлялись дополнительные симптомы: покраснение вокруг носа и рта, треморы, конвульсии, опистотонус, постоянное движение челюстей и напряжение кишечника. Перечисленные эффекты наблюдали через 5-10 мин после введения. Степень тяжести и продолжительность большинства указанных симптомов зависели от дозы. Через 45 мин после введения наивысшей дозы (250 мг/кг) была отмечена смерть всех 4 крыс.
Соединение AF265
Снижение температуры (типичный эффект, опосредованный ЦНС) был единственным симптомом, вызванным у крыс введением 250 мг/ кг соединения AF265. Указанный эффект становился заметным через 10 мин после введения и продолжался в течение 110 мин. При использовании указанного соединения не было отмечено каких-либо других опосредованных ЦНС или автономных эффектов. Рассматриваемое соединение характеризуется действием только на ЦНС.
Тест N.8; Действие соединения AF134 на необученных крыс
Применяя пассивный шаговый тест избежания, исследовали влияние соединения AF134 на память и способность к обучению необученных крыс. Идеология теста и используемое оборудование описаны в (Fisher et al., Neurosci Lett. 102: 325 (1989)). 4 группы (по 20 крыс в каждой группе) необученных 3-4-месячных самцов крыс линии Sprague-Dawley, весом 200 - 300 г (Charles River Breeding, UK) обрабатывали одной из нижеперечисленных доз соединения AF134: 1, 5, 10 мг/кг при внутрибрюшинном введении (в.б.), в то время как одна группа получала физиологический раствор (1 мл/кг, в.6.).
У крыс, обработанных соединением AF134, не было отмечено существенных отклонений в плане скрытого сохранения рефлекса при предварительном обучении шоком, если указанное соединение вводили за 30 мин или через 60 мин после шока.
В другой экспериментальной модели действие соединения AF134 сравнивали с эффектами, производимыми скополамином (анти-мускариновое соединение), на необученных крыс в 8-лучевом радиальном лабиринте (Fisher et al., Neurosci Lett. 102: 325 (1989)). Группу из 14 необученных крыс обрабатывали скополамином (0,2 мг/кг, в. б.), либо физиологическим раствором (1 мл/кг, в. б.) за 20 мин до начала теста. Во всех лучах находилась приманка. Каждая крыса подвергалась обоим типам обработки с трехдневными интервалами между обработками. (После 10 дней обучения следовали 10 дней тестирования.) На тех же крысах проводили аналогичный эксперимент с использованием соединения AF134 (5 мг/кг, в. 6. ), либо физиологического раствора (1 мл/кг, в. б.). Как и ожидалось, указанная доза скополамина вызывала типичный "амнезический" эффект. Вместе с тем, соединение AF134 не приводило к каким-либо изменениям в поведении крыс.
Соединение AF134, проявляя антагонистическую активность по отношению к мускариновым рецепторам m1 (судя по анализу связывания), а также m3 (судя по препаратам подвздошной кишки морской свинки), не приводит к нарушению познавательных эффектов и, таким образом, может быть пригодно для лечения пониженной подвижности, болезни Паркинсона, смешанной болезни Паркинсона и Альцгеймера, маниакально-депрессивного состояния, последствий черепно-мозговой хирургии человека, а также для лечения острых ринитов, пептической язвы и астмы при различных расстройствах периферической нервной системы.
Тест N. 9; Анализ поведенческих эффектов на животных моделях
Соединения AF160 и AF102B - Тест в радиальной лучевой лабиринте
Исследовали возможный благоприятный эффект, оказываемый дозами соединений AF160 (3 и 5 мг/кг перорально) и AF102B (3 мг/кг перорально) на обращение расстройства памяти у крыс, инъецированных соединением AF64A (1,5 нМ/2 мкл на сторону). Описанная животная модель в некоторой степени напоминает холинергическую гипофункцию, наблюдаемую при ССТА (Fisher et а1., J. Pharmacol. Expl. Therap. 257: 392-403 (1991)). В указанном тесте использовали 80 4-6-месячных самцов крыс линии Sprague-Daw-ley (340-580 г). Промежуток времени между операцией и поведенческим тестом составлял 2-3 месяца. За 1 неделю до начала поведенческого теста крыс переводили в индивидуальные клетки и ограничивали в пище до достижения ими приблизительно 85% от веса, характерного для свободного кормления. Затем крысы получали по 5-6 кусочков Altromin (15 г) в день для поддержания веса на одном уровне. Крысы имели свободный доступ к воде. Помещение освещали в течение 12 ч в день (6:00-18: 00), поведенческие тесты проводили утром.
Поведенческий тест
2 группы по 40 крыс инъецировали соответственно соединением AF64A и физиологическим раствором, после чего каждую группу случайным образом подразделяли на 4 подгруппы, которые обрабатывали соединениями AF160 (3 мг/кг), AF160 (5 мг/кг), AF102B крыс к указанному лабиринту, а также к регулярно вводимой приманке (по 45 мг). На этом этапе крыс помещали в центральную часть лабиринта и предоставляли им свободный доступ во все 8 лучей, снабженные приманкой. Каждую серию завершали при сборе всех 8 приманок, либо по истечении 15 мин в зависимости от того, какое из событий происходило раньше. В течение 3-го и 4-го дней приманку помещали только в конце лучей. Все остальные процедуры были аналогичны использовавшимся на начальном этапе тренировки. При этом в течение 5 дней за 60 мин до начала теста крысам ежедневно однократно вводили соединения AF160, AF102B или DDW (в качестве контроля).
Учет данных
Отмечали все перемещения по лабиринту, затрачиваемое время, а также правильные и неправильные ответы. Для того, чтобы оценить эффект, оказываемый соединением AF160 или AF102B в течение периода тестирования, по сравнению с тренировочным периодом (который принимали за базовый уровень поведения), использовали 3-мерный факторный анализ (2х4х2) с наличием повторяющегося варьирования (сменяющие друг друга блоки тренировочных дней и дней тестирования), а также неповторяющегося варьирования (инъекция соединения AF64A или физиологического раствора, либо обработка различными дозами соединения AF160, AF102B или DDW). Сравнения проводили по разнице между основными эффектами.
Результаты
При анализе правильного выбора из 8 посещений обнаружена достоверная связь между параметрами группа х обработка х неделя [F(2/48) = 3,95; P < 0,025] . Конкретнее, в течение как тренировки, так и применения лекарственного агента, крысы, инъецированные соединением AF64A, делали достоверно меньше правильных выборов, нежели крысы, инъецированные физиологическим раствором (P < 0,001). Оба лекарственных агента: и соединение AF102B (3 мг/кг), и соединение AF160 (3 мг/кг) улучшали поведение крыс, инъецированных соединением AF64A, в течение второй недели по сравнению с тренировочным периодом (P < 0,001, соответственно). В течение второй недели обе группы крыс, обработанных соединениями AF160 (3 мг/кг) и AF102B (3 мг/кг), показывали одинаковый уровень поведения, достоверно превышавший аналогичный уровень в случае крыс, инъецированных соединением AF64A, но обработанных водой (P < 0,05). Соединение AF160 в концентрации 5 мг/кг не оказывало достоверного эффекта на этот параметр. По сравнению с крысами, инъецированными физиологическим раствором, поведение крыс, обработанных водой, улучшалось (на 5%) в течение второй недели по сравнению с первой неделей (P < 0,01). Сходное улучшение (на 7,5%) было отмечено также в случае крыс, обработанных соединением AF160 (3 мг/кг; P < 0,001). Соединение AF102B (3 мг/кг) не оказывало влияния на этот параметр у крыс, инъецированных физиологическим раствором.
При анализе полных ошибок обнаружена достоверная связь между параметрами группа х обработка х неделя [F(3/64) = 3,49; P < 0,025]. В течение обеих недель количество полных ошибок, произведенных крысами, инъецированными соединением AF64A, достоверно превышало соответствующий показатель в случае крыс, инъецированных физиологическим раствором (P < 0,001). Количество ошибок во всех четырех группах крыс, инъецированных соединением AF64A, достоверно уменьшалось в течение второй недели по сравнению с первой неделей: AF64A + вода - 20% (P < 0,01); AF160 (3 мг/кг) - 16% (P < 0,001); AF64A + AF160 (5 мг/кг) - 15% (P < 0,02); AF64A + AF102B (3 мг/кг) - 30% (P < 0,001). Несмотря на улучшение поведения всех четырех групп, только при использовании соединения AF102B (3 мг/кг) поведенческие показатели превышали таковые в случае применения соединения AF64A в комбинации с водой. Среди крыс, инъецированных физиологическим раствором, использование соединения AF160 (3 и 5 мг/кг) приводило к достоверному улучшению поведения в течение второй недели по сравнению с первой неделей (P < 0,01; P < 0,001; соответственно). Применение соединения AF102B вызывало нарушение поведения, рассматриваемая группа крыс производила больше ошибок в течение второй недели по сравнению с первой неделей (P < 0,001).
При анализе затрачиваемого времени выявлена достоверная связь между параметрами группа х обработка х неделя [F(2/48) = 3,29; P < 0,05]. Улучшение временных показателей наблюдали в случае подгрупп, инъецированных соединением AF64A (за исключением варианта обработки AF64A + AF160 [5 мг/кг]): AF64A + вода - 31% (P < 0,01); AF64A + AF160 (3 мг/кг)- 47% (P < 0,001), а также AF64A + AF102B (3 мг/кг) - 21% (P < 0,01). В случае крыс, инъецированных физиологическим раствором, отмечено достоверное улучшение временных показателей при следующих вариантах обработки: физ.раствор + вода - 54% (P < 0,001); физ. раствор + AF160 (3 мг/кг) - 37% (P < 0,001). Соединение AF102B не оказывало в этом плане влияния на крыс, инъецированных физиологическим раствором, возможно, в результате "порогового эффекта". Несмотря на наличие некоторой тенденции, соединение AF160 (5 мг/кг) не вызывало достоверных изменений поведения крыс, инъецированных физиологическим раствором).
Выводы
1. Крысы, инъецированные соединением AF64A (1,5 нМ/2 мкл на сторону) проявили достоверные нарушения в плане правильного выбора, количества ошибок, а также затрачиваемого времени по сравнению с крысами, инъецированными физиологическим раствором.
2. Соединение AF160 (3 мг/кг) приводило к достоверному улучшению поведения крыс, инъецированных соединением AF64A (по сравнению с контрольной обработкой) в плане правильного выбора, а также затрачиваемого времени. Более высокая доза (5 мг/кг) оказалась эффективной только по отношению к количеству ошибок по сравнению с базальным уровнем (но не с контролем).
AF160(Des) - Тест в лабиринте Морриса Уотера (ЛМУ)
Цель данного теста заключалась в использовании теста в ЛМУ (Fisher et al., J. Pharmacol. Expl. Therap. 257: 392-403 (1991)) для изучения способности исследуемого соединения AF160 (Des) обращать нарушения познавательной деятельности у крыс, инъецированных соединением AF64A. Соединение AF160(Des) применяли в двух дозах: 1 и 3 мг/кг перорально. Две группы крыс (38 и 42 животных) инъецировали, соответственно, соединением AF64A (3 нМ/2 мкл на сторону) и физиологическим раствором, после чего каждую группу случайным образом подразделяли на 4 подгруппы, которые обрабатывали различными дозами соединения AF160(Des) (1 или 3 мг/кг перорально), либо DDW (10 мл/кг перорально). Лекарственный агент ежедневно однократно применяли за 60 мин до начала тестирования в течение 5 дней.
При учете поведения не было отмечено значительных побочных эффектов. При этом получены следующие результаты:
1. Судя по анализу таких параметров, как латентность реакции избегания и длина пробега, инъекция соединения AF64A (3 нМ/2 мкл на сторону) приводило к достоверному нарушению поведения.
2. Соединение AF160(Des) (3 мг/кг) улучшало поведенческие показатели в случае крыс, инъецированных как соединением AF64A, так и физиологическим раствором, в ходе третьего блока тренировки.
2. Соединение AF160(Des) (3 мг/кг) улучшало поведенческие показатели в случае крыс, инъецированных как соединением AF64A, так и физиологическим раствором, в ходе третьего блока тренировки.
Полученный положительный результат позволяет предположить возможность тестирования в будущем различных доз указанного соединения для изучения оказываемых ими благоприятных эффектов по отношению к нарушениям обучения и памяти.
Соединение AF185 - Тест на пассивное избегание (ПИ)
В ходе данного теста исследовали эффекты, оказываемые различными дозами соединения AF185 на сохранение реакции пассивного избегания у крыс, обработанных соединением AF64A.
Методы
Соединение AF64A инъецировали билатерально (3 нМ/2 мкл на сторону, icv) для создания исходной животной модели (Fisher et al., J. Pharmacol. Expl. Therap. 257: 392-403 (1991)). Через четыре недели после указанной операции две группы крыс, инъецированных соответственно соединением AF64A и физиологическим раствором, случайным образом подразделяли на 4 подгруппы по 10-11 крыс; три подгруппы обрабатывали различными концентрациями соединения AF185 (1, 5 и 10 мг/кг перорально), в то время как одна подгруппа получала DDW (10 мл/кг). Соединение AF185 вводили непосредственно после шока, а еще через 72 ч проводили тестирование крыс. Описание деталей рассматриваемого метода - см. (Fisher et al., J. Pharmacol. Expl. Therap. 257: 392-403 (1991)).
Результаты
Оценку исходной и остаточной латентности проводили с использованием 2-мерного факторного анализа (2х4): инъекция соединения AF64A или физиологического раствора по отношению к дозе соединения AF185 или DDW.
В плане исходной латентности между любыми группами не было обнаружено достоверных отличий.
В плане остаточной латентности выявлена связь между группами и характером обработки (F(3/75) = 22,31; P < 0,001). На основании простых различий между главными эффектами показано, что период остаточной латентности, свойственный крысам, обработанным соединением AF64A, короче, чем аналогичный показатель, характерный для крыс, инъецированных физиологическим раствором и обработанных DDW (P < 0,001). Период остаточной латентности у крыс, обработанных соединением AF185 (1,5 или 10 мг/кг), оказался достоверно короче по сравнению с крысами, обработанных соединением AF64A + DDW (P < 0,001). Не было обнаружено каких-либо других достоверных различий.
Выводы
1. Крысы, инъецированные соединением AF64A, обнаруживают достоверные нарушения периода остаточной латентности по сравнению с крысами, инъецированными физиологическим раствором.
2. Крысы, инъецированные соединением AF64A и обработанные соединением AF185 (1,5 и 10 мг/кг) характеризуются показателями сохранения реакции, сходными с таковыми в случае контрольных животных.
3. Соединение AF185 может представлять собой соединение, эффективное при лечении нарушений памяти, подобных тем, которые обнаруживаются в случае болезни Альцгеймера.
Для конкретных соединений, предусмотренных настоящим изобретением, соблюдается следующая взаимосвязь между использованными номерами указанных соединений и их названиями в соответствии с систематической номенклатурой IUPAC:
2,8-диметил-1-оксо-1-тиа-4,8-диаза-спиро[4.5]декан-3-он AF262;
3-этил-8-метил-1-оксо-1-тиа-4,8-диаза-спиро[4.5]декан AF268;
2, 8-диметил-1-оксо-4, 8-диаза-спиро[4.5]декан AF264;
3,8-диметил-1,4-диоксо-8-аза-спиро[4.5]декан-3-он AF274;
2-этил-4,8-диметил-1-тиа-4, 8-диаза-спиро[4.5]декан-3-он AF272;
3-метил-1-оксо-4-тиа-8-аза-спиро[4.5]декан-2-он AF269;
3-этил-8-метил-1-оксо-4-тиа-8-аза-спиро[4.5]декан-2-он AF262;
2-метил-1-тиа-4,8-диаза-спиро[4.5]декан-3-он AF263;
3,8-диметил-1-оксо-4-тиа-8-аза-спиро[4.5]декан-2-он AF265;
2,8-диметил-1-оксо-4,8-диаза-спиро[4.5]декан-3-он AF260;
2,4,8-триметил-1-тиа-4,8-диаза-спиро[4.5]декан-3-он AF266;
2-этил-8-диметил-1-тиа-4,8-диаза-спиро[4.5]декан-3-он AF267;
2,8-диметил-1-тиа-4, 8-диаза-спиро[4.5]декан-3-он AF261;
2,8-диметил-1-оксо-3,8-диаза-спиро[4.5]дек-2-ен-4-он AF238;
2,8-диметил-1,3,8-диаза-спиро[4.5]дек-1-ен-4-он AF230;
3-этил-8-метил-1,3,8-диаза-спиро[4.5]дек-1-ен-4-он AF220;
1-этил-8-метил-3-оксо-4,8-диаза-спиро[4.5]декан-2-он AF174;
8-метил-1-оксо-3,8-диаза-спиро[4.5]декан-2-тион AF165;
3-этил-8-метил-1-оксо-3,8-диаза-спиро[4.5]декан-2-он AF172;
8-метил-1-оксо-3,8-диаза-спиро[4.5]декан-2,4-дион AF169;
3-этил-8-метил-1-оксо-3,8-диаза-спиро[4.5]декан-2,4-дион AF180;
4-бутилимино-8-метил-1,3,8-триаза-спиро[4.5] дека-1,3-диен-2,4-диамин AF194;
метил-(8-метил-2-метилсульфанил-1,3,8-триаза-спиро[4.5] дека-1,3-диен-4-ил)-амин AF193;
8-метил-2-метилсульфанил-1,3,8-триаза-спиро[4.5] дека-1,3- диен-4-иламин AF192;
4-метокси-8-метил-2-метилсульфанил-1,3,8-триаза-спиро[4.5] дека-1,3-диен AF191;
2,8-диметил-1,3,8-триаза-спиро[4.5]дек-1-ен AF190;
3-этил-2-этилсульфанил-8-метил-1,3,8-триаза-спиро[4.5] дек-1-ен- 4-тион AF170;
3-этил-2-этилсульфанил-8-метил-1,3,8-диаза-спиро[4.5] дек-1-ен- 4-он AF188;
8-метил-2-метилсульфанил-1,3,8-триаза-спиро[4. 5]дек-1-ен-4-он AF187;
8-метил-2, 4-бис-метилсульфанил-1,3,8-триаза-спиро[4. 5] дека-1,3-диен AF177;
8-метил-4-метилсульфанил-1,3,8-триаза-спиро[4. 5]дек-3-ен-2-тион AF183;
4-этилсульфанил-8-метил-1,3,8-триаза-спиро[4.5]дек- 3-ен-2-тион AF176;
3-этил-8-метил-1,3,8-триаза-спиро[4.5]декан-2,4-дитион AF163;
8-метил-1,3,8-триаза-спиро[4.5]декан-2,4-дитион AF173;
1-ацетил-8-метил-1,3,8-триаза-спиро[4.5]декан-2,4-дион AF164;
3-метил-1,3,8-триаза-спиро[4.5]декан-2, 4-дион AF179;
3,8-диметил-1,3,8-триаза-спиро[4.5]декан-2, 4-дион AF178;
3-этил-1,3,8-диаза-спиро[4.5]декан-2,4-дион AF160(Des);
3-этил-8-метил-1,3,8-триаза-спиро[4.5]декан-2,4-дион AF160;
3-этил-8-метил-4-тиоксо-1,3,8-триаза-спиро[4.5]декан-2-он AF182;
8-метил-3-(4-пирролидин-1- ил-бут-2-инил)-1,3,8-триаза-спиро[4.5] декан-2,4-дион AF197;
3-проп-2-инил-1,3,8-диаза-спиро[4.5]декан-2,4-дион AF186;
3-трет-бутил-8-метил-1,3,8-диаза-спиро[4.5]декан-2,4-дион AF213;
8-метил-3-проп-2-инил-1,3,8-триаза-спиро[4.5]декан-2,4-дион AF185;
3-трет-бутил-8-метил-2-тиоксо-1,3,8-триаза-спиро[4. 5]декан-4-он AF184;
3-этил-8-метил-2-тиоксо-1,3,8-триаза-спиро[4.5]декан-4-он AF181;
3-этил-8-проп-2-инил-1,3,8-триаза-спиро[4.5]декан-2,4- дион AF196;
5-(1-метил-пиперидин-4-ил)-2-тиоксо-имидазолин-4-он AF195;
5-метил-2-(1-метил-пиперидин-4-ил)-тиазолидин-4-тион AF275;
3-бут-2-инил-8-метил-1,3,8-триаза-спиро[4.5]декан-2,4-дион AF199.
Хотя настоящее изобретение подробно описано в настоящей заявке с использованием специальных ссылок на непосредственно перечисленные и другие подразумеваемые способы воплощения настоящего изобретения, специалист в этой области должен понимать возможность многочисленных вариаций и модификаций. В соответствии с этим, настоящее изобретение не имеет ограничивающего характера и не должно сводится лишь к непосредственно перечисленным вариантам воплощения, если только идеология, область и суть настоящего изобретения соответствуют приведенной ниже формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СПИРОСОЕДИНЕНИЯ | 2010 |
|
RU2506266C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДИНА В КАЧЕСТВЕ АГОНИСТОВ PPAR | 2017 |
|
RU2711991C1 |
| ТЕТРАГИДРОИМИДАЗО[1,5-d][1,4]ОКСАЗЕПИНОВОЕ ПРОИЗВОДНОЕ | 2014 |
|
RU2659219C2 |
| СПИРО-АМИНОСОЕДИНЕНИЯ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ СНА И ЛЕКАРСТВЕННОГО ПРИВЫКАНИЯ | 2010 |
|
RU2562609C2 |
| Четвертичные аммониевые соединения на основе 3-гидроксипиридина, обладающие антибактериальной активностью | 2021 |
|
RU2778507C1 |
| КАТИОННЫЙ ЛИПИД | 2017 |
|
RU2740921C2 |
| МОНОЦИКЛИЧЕСКОЕ ПИРИДИНОВОЕ ПРОИЗВОДНОЕ | 2014 |
|
RU2645352C2 |
| Новые модулирующие регуляцию дыхания соединения и способы их получения и применения | 2016 |
|
RU2734506C2 |
| ЗАМЕЩЕННЫЕ ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2840772C1 |
| АЗАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ОПОСРЕДОВАННЫХ СЕРОТОНИНОМ ЗАБОЛЕВАНИЙ | 2001 |
|
RU2398765C1 |
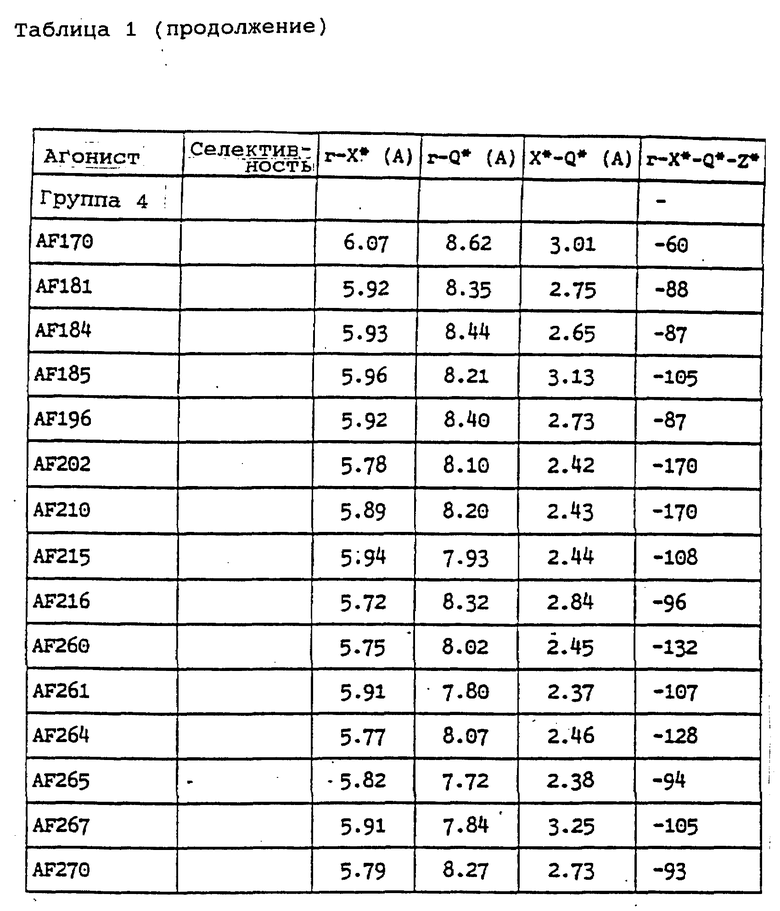
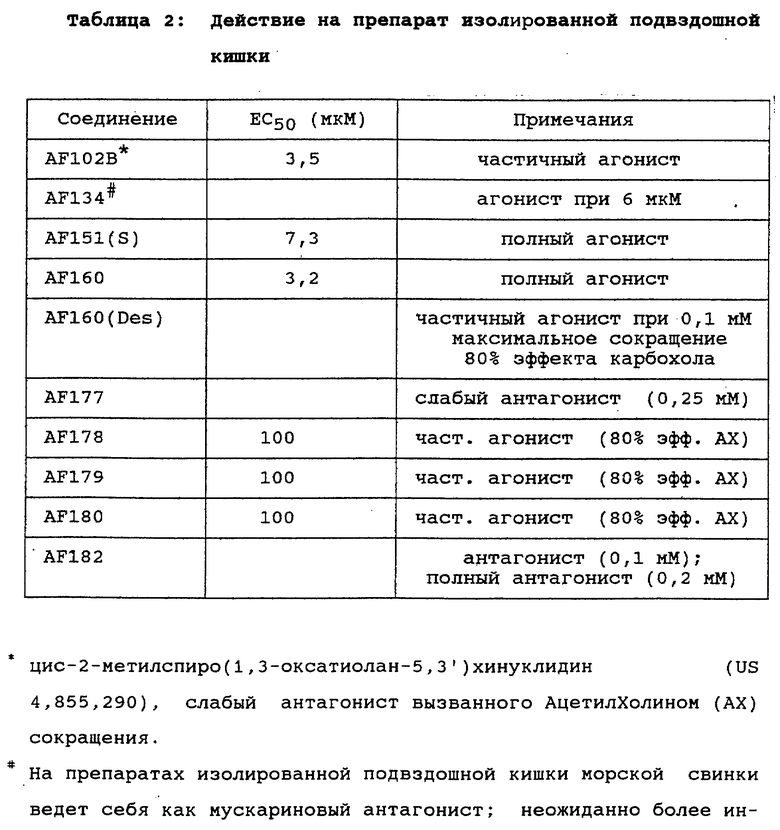
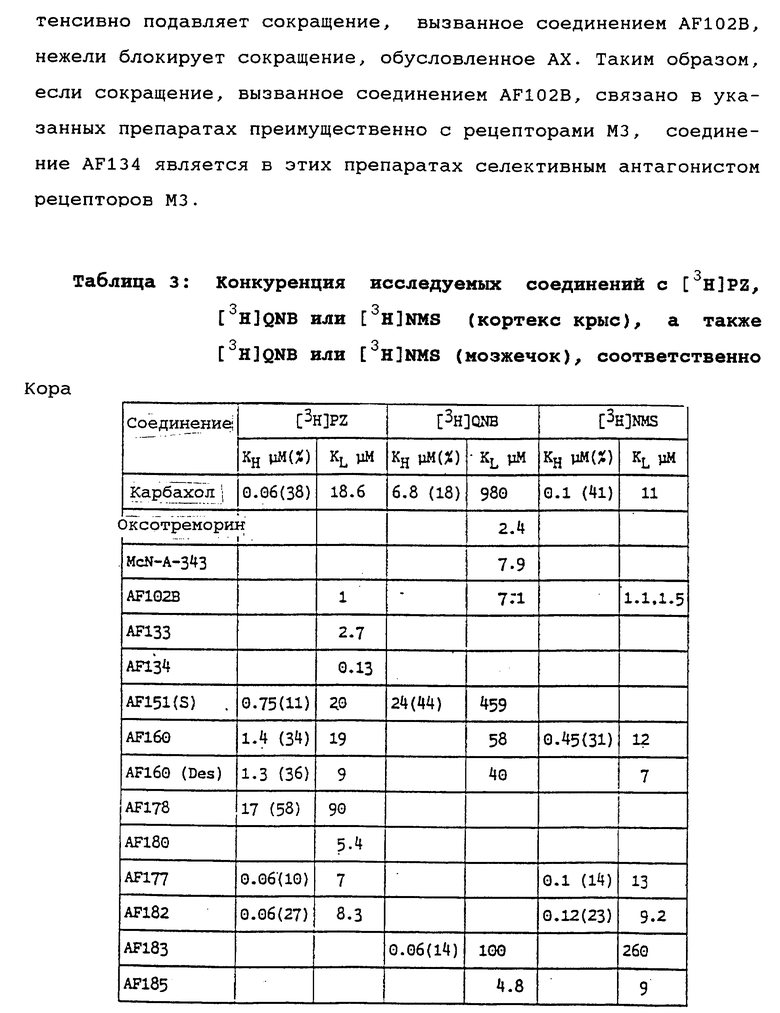
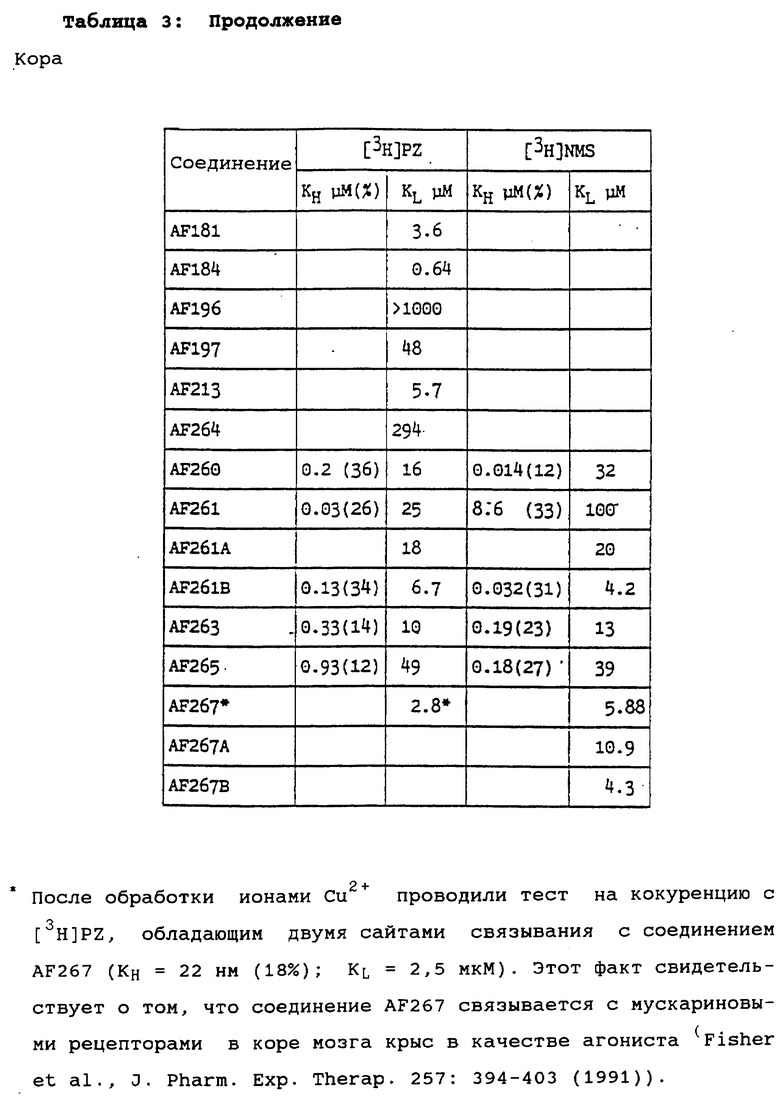
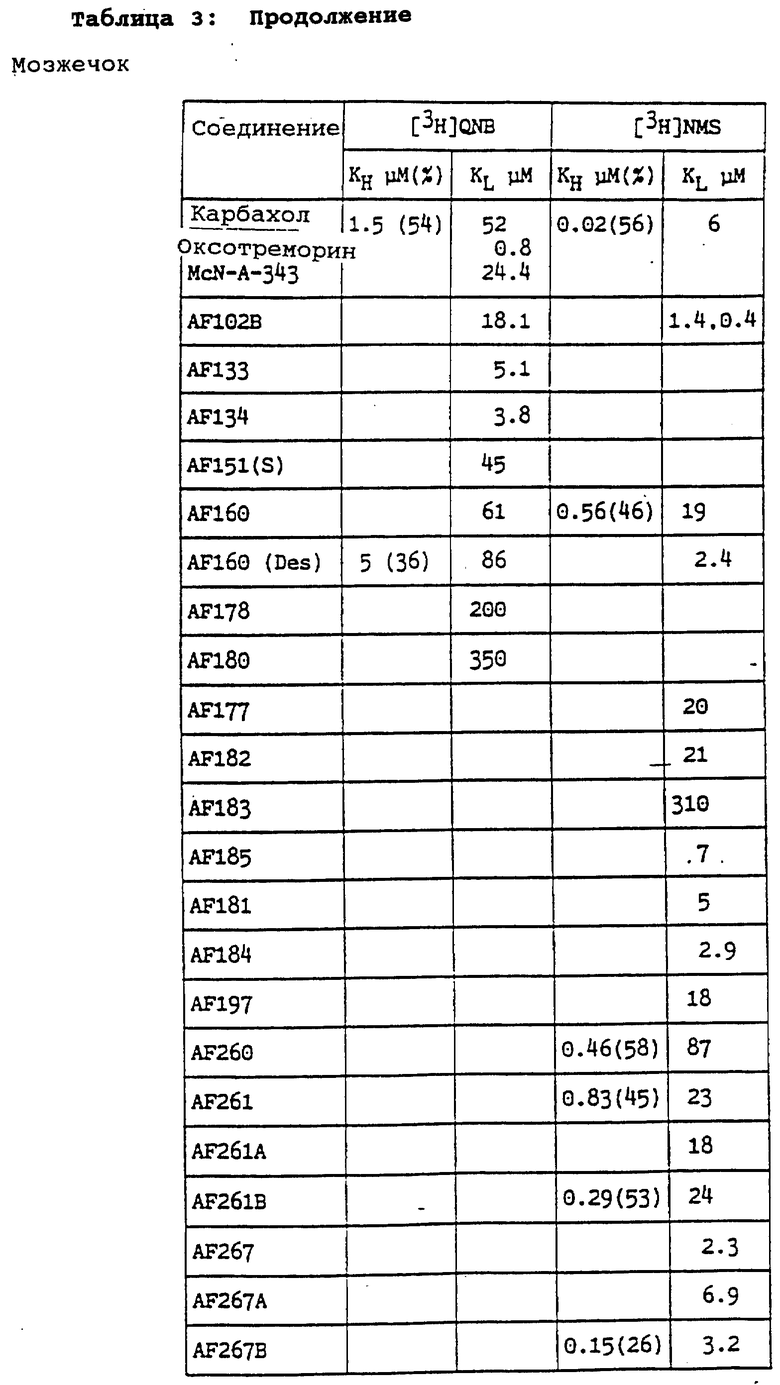
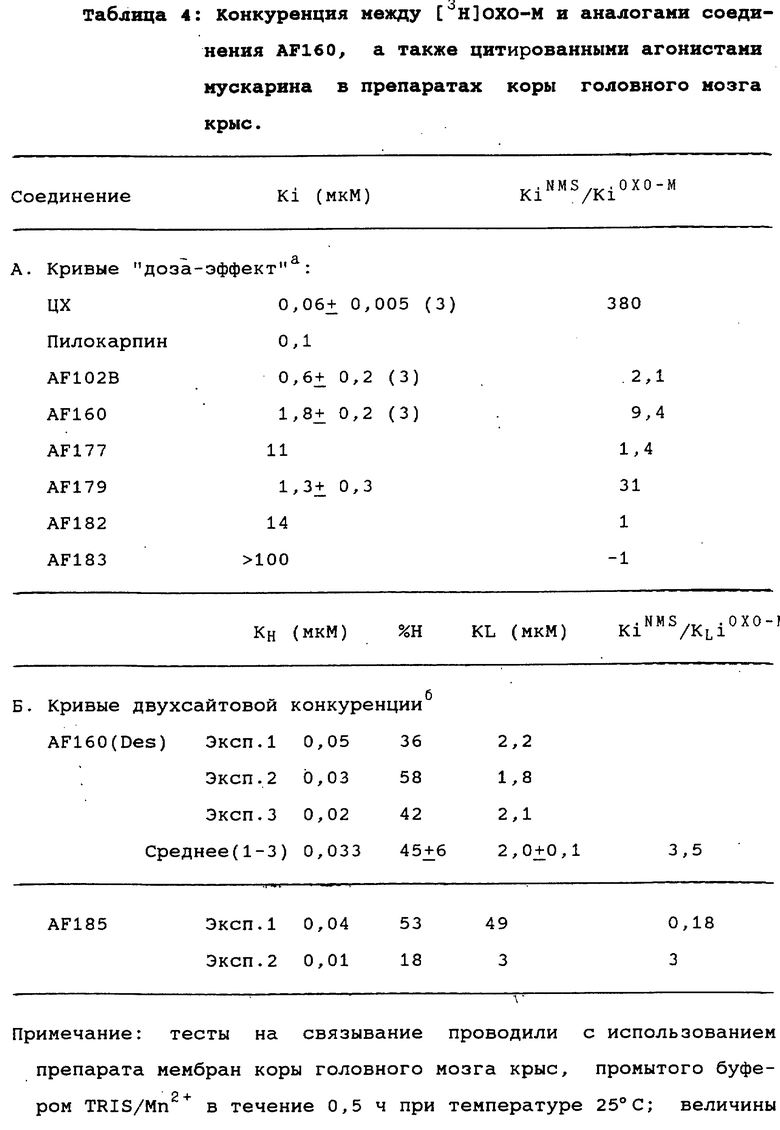

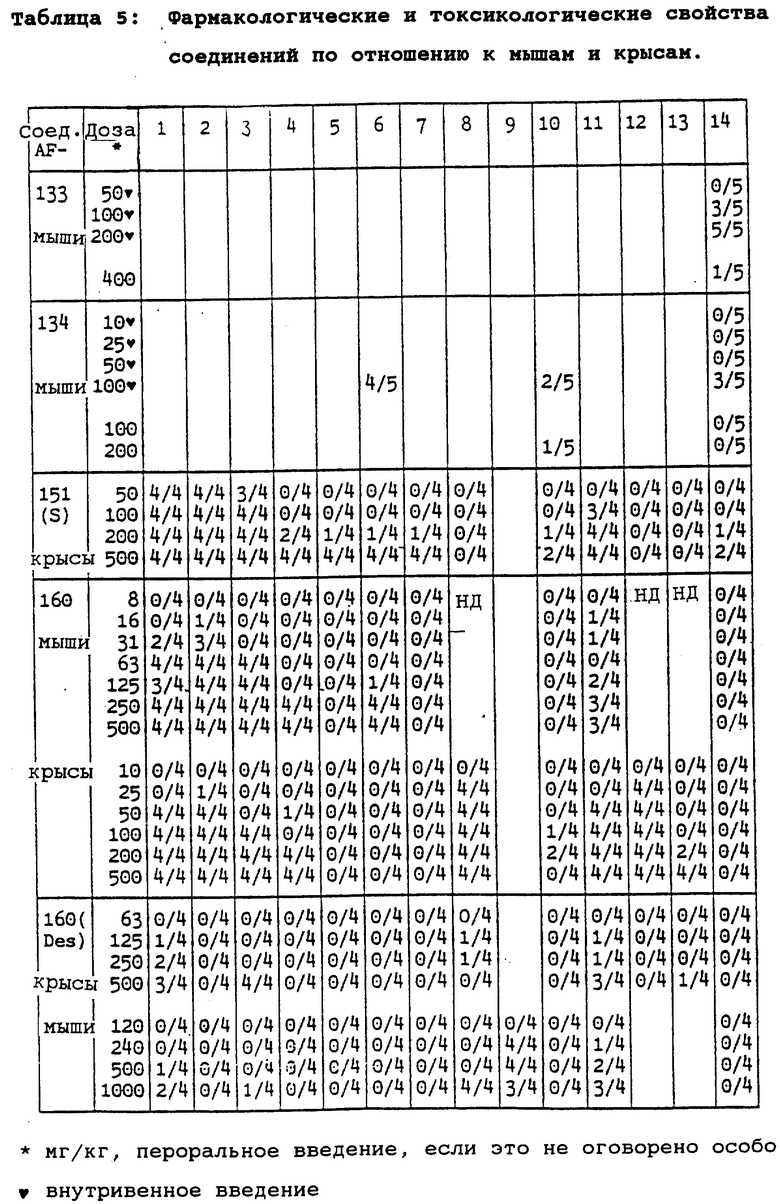
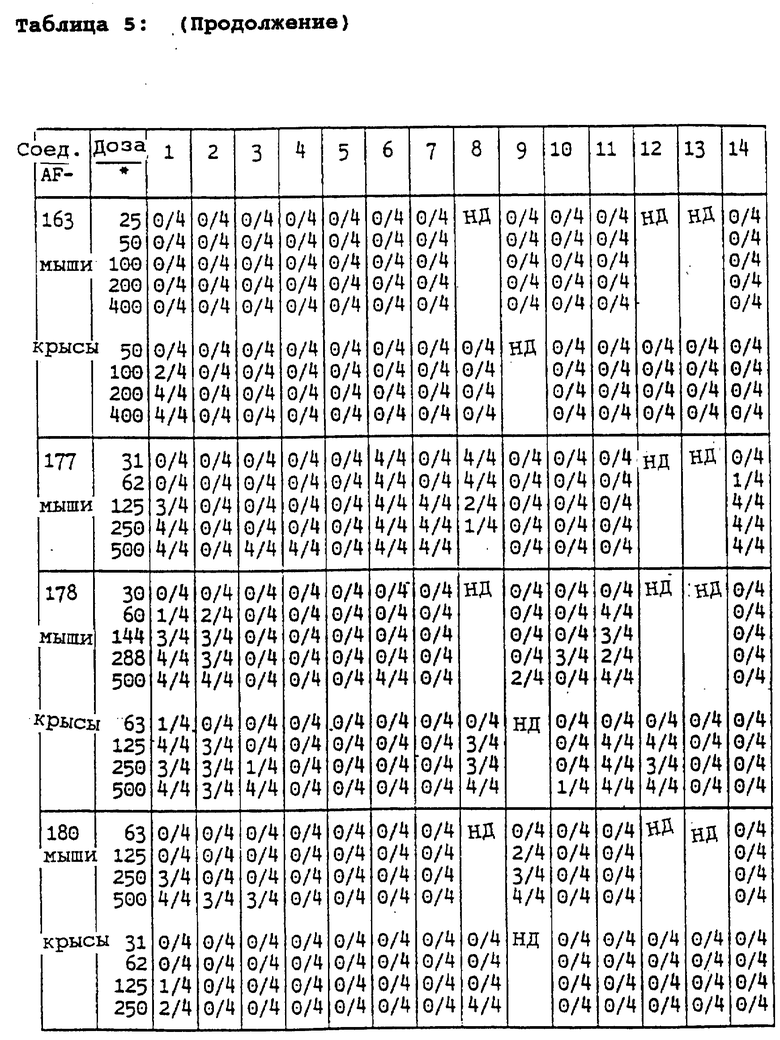

Спиросоединения общей формулы (1), их фармацевтически приемлемые соли, энантиомеры, рацематы и четвертичные соединения, представляющие собой производные указанных соединений, содержащих третичный атом азота, которые содержат пятичленную группировку, в которой спиросвязь реализуется атомом углерода, входящим как в состав пятичленной группировки, так и в состав насыщенной кольцевой системы, содержащей один атом азота, кольцевая система A - остаток формулы (а-в), в структуре (а) мостик одним концом присоединен к положению 1, а другим концом - к положению 4 или 5, m = 2, n и p = 1, причем n+p= 2; R1 - H, С1-6алкил, С2-6алкинил; указанный пятичленный остаток 3-этилгидантоин, 1-ацетилгидантоин, 3-метилгидантоин и другие, указанные в п.1 формулы изобретения. Соединения 1 проявляют активность по отношению к центральной и периферической нервной системе, в частности агонистическую активность по отношению к мускарину. 3 с. и 7 з.п. ф-лы, 1 ил., 5 табл.
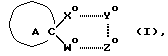
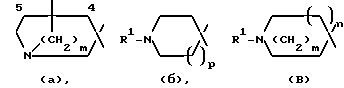
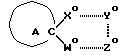
в том числе их фармацевтически приемлемые соли, энантиомеры, рацематы и четвертичные соединения, представляющие собой производные указанных соединений, содержащих третичный атом азота, которые содержат пятичленную группировку, в которой спиросвязь реализуется атомом углерода, входящим как в состав пятичленной группировки, так и в состав насыщенной кольцевой системы, содержащей один атом азота, причем указанный пятичленный остаток выбирают из группы, включающей 3-этилгидантоин, 1-ацетилгидантоин, 3-метилгидантоин, 3-пропаргилгидантоин, 2,4-дитиогидантоин, 2-тиогидантоин, оксазолидин-2-тион, 3-этилоксазолидин-2-он, оксазолидин 2,4-дион, 3-этилоксазолидин-2,4-дион, 2-метил-1,4-оксазолидин-3-он, 2-метил-1,4-тиазолидин-3-он, 2,4-диметил-1,4-тиазолидин-3-он, 2-этил-1,4-тиазолидин-3-он, 2-этил-4-метил-1,4-тиазолидин-3-он, 3-метил-1,4-оксатиолан-2-он, 2-этил-1,4-тиазолидин-3-он, 5-метил-1,3-оксазолидин, 4-этил-1,3-оксазолидин, 3-этил-1,4-оксатиолан-2-он, 5-метил-1,3-диоксолан-4-он, N-метилсукцинимид, N-этилсукцинимид, 3-трет-бутилгидантоин, 3-(4-пирролидино-2-бутинил)-гидантоин, 3-(2-бутинил-)-гидантоин, 2,5-бис(метилтио)-4Н-имидазол, 3-этил-4-тиогидантоин, 4-метилтиоимидазолин-2-тион, 3-этил-2,4-дитиогидантоин, 4-этилтио-3-имидазолин-2-тион, 1-этил-2-этилтио-2-имидазолин-5-тион, 2-тио-4-β-гидроксиэтилиминогидантоин, 2,5-бис(аминометил)-4Н-имидазол, 2-метил-2-тиазолин, 2-метил-2-имидазолин, 2-метил-2-оксазолин-4-он, 2-метил-4Н(5Н)-имидазол-5(4)-он, 2-метилтио-5-метокси-4Н-имидазол, 2-метилтио-5-амино-4Н-имидазол, 2-метилтио-5-аминометил-4Н-имидазол, 2-тион-3-этилгидантоин, 2-тион-3-трет-бутилгидантоин, 2-метилтио-2-имидазолин-5(4)-он, 1-этил-2-этилтио-2-имидазолин-5-он и 1-этил-2-имидазолин-5-он, указанную насыщенную кольцевую систему А, содержащую один атом азота, выбирают из числа групп, включающих в себя группировки К, М, N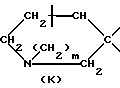
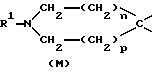
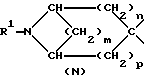
в структуре К мостик одним концом присоединен к положению 1, а другим концом - к положению 4 или 5; m равно 2, n и p независимо друг от друга равны 1, причем n + p = 2; R1 обозначает группу, выбранную из числа следующих: атом водорода, C1-6-алкил, C2-6-алкинил.
1-метилпиперидин-4-спиро-4' -(2',5' -бис(метилтио)-4Н-имидазол),
1-метилпиперидин-4-спиро-5'-(3'-этил-4'-тиогидантоин),
1-метилпиперидин-4-спиро-5'-(4'-метилтиоимидазолин-2'-тион),
1-метилпиперидин-4-спиро-5'-(3'-этил-2',4'-дитиогидантоин),
1-метилпиперидин-4-спиро-5'-(4'-этилтио-3'-имидазолин-2-тион),
1-метилпиперидин-4-спиро-4'-(1'-этил-2'-этилтио-2'-имидазолин-5'-тион),
1-метилпиперидин-4-спиро-5'-(2'-тио-4′-β-гидрокси-этилиминогидантоин),
1-метилпиперидин-4-спиро-4'-(2',5'-бис(аминометил)-4Н-имидазол),
1-метилпиперидин-4-спиро-5'-(3'-этилоксазолидин-2'-он),
1-метилпиперидин-4-спиро-4'-(2'-метил-2'-тиазолин),
1-метилпиперидин-4-спиро-4'(5')-(2'-метил-2'-имидазолин),
1-метилпиперидин-4-спиро-5'-(2'-метил-2'-оксазолин-4'-он),
1-метилпиперидин-4-спиро-4'-(5')-(2'-метил-4'Н(5'Н)-имидазол 5'(4')-он),
1-метилпиперидин-4-спиро-4'-(2'-метилтио-5'-метокси-4'Н-имидазол),
1-метилпиперидин-4-спиро-4'-(2'-метилтио-5'-амино-4'Н-имидазол),
1-метилпиперидин-4-спиро-4'-(2'-метилтио-5'-аминометил-4'Н-имидазол).
1-метилпиперидин-4-спиро-5'-(3'-этилгидантоин),
1-метилпиперидин-4-спиро-5'-(1'-ацетилгидантоин),
пиперидин-4-спиро-5'-(3'-этилгидантоин),
1-метилпиперидин-4-спиро-5'-(3'-метилгидантоин),
пиперидин-4-спиро-5'-(3'-метилгидантоин),
1-метилпиперидин-4-спиро-5'-(3'-пропаргилгидантоин),
N-метилнортропан-3-спиро-5'-гидантоин,
N-метилнортропан-3-спиро-5'-(3'-метилгидантоин),
N-метилнортропан-3-спиро-5'-(3'-метилгидантоин),
1-метилпиперидин-4-спиро-5'-(2', 4'-дитиогидантоин),
1-метилпиперидин-4-спиро-5'-(2'-тиогидантоин),
1-метилпиперидин-4-спиро-5'-(оксазолидин-3'-тион),
1-метилпиперидин-4-спиро-4'-(3'-этилоксазолидин-2', 4'-он),
1-метилпиперидин-4-спиро-5'-(оксазолидин-2',4'-дион),
1-метилпиперидин-4-спиро-5'-(3'-этилоксазолидин-2',4'-дион),
1-метилпиперидин-4-спиро-5'-(2'-метил-1',4'-оксазолидин-3-он),
1-метилпиперидин-4-спиро-5'-(2'-метил-1',4'-тиазолидин-3'-он),
1-метилпиперидин-4-спиро-5'-(2',4'-диметил-1',4'-тиазолидин-3'-он),
1-метилпиперидин-4-спиро-5'-(2'этил-1', 4'-тиазолидин-3'-он),
1-метилпиперидин-4-спиро-5'-(2'этил-4-метил-1', 4'-тиазолидин-3'-он),
пиперидин-4-спиро-5'-(3'-метил-1',4'-оксатиолан-2'-он),
пиперидин-4-спиро-5'-(2'-метил-1',4'-тиазолидин-3'-он),
1-метилпиперидин-4-спиро-5'-(3'-метил-1',4'-оксатиолан-2'-он),
1-метилпиперидин-4-спиро-2'-(5'-этил-1',3'-оксазолидин),
1-метилпиперидин-4-спиро-2'-(4'-этил-1',3'-оксазолидин),
1-метилпиперидин-4-спиро-5'-(3'-этил-1',4'-оксатиолан-2'-он),
1-метилпиперидин-4-спиро-5'-(2'-метил-1',4'-тиазолидин -3'-он),
2-метилпиперидин-4-спиро-5'-(2'-этил-1',4'-тиазолидин -3'-он),
1-метилпиперидин-4-спиро-2'-(5'-метил-1', 3'-диоксолан-4'-он),
1-метилпиперидин-4-спиро-5'-(2'-метил-1', 4'-тиазолидин-3'-тион),
2-N-метилспиро-(1,3-сукцинимид-4,3')хинуклидин,
2-N-этилспиро-(1,2-сукцинимид-4,3')хинуклидин.
1-метилпиперидин-4-спиро-5'-(3'-(4-пирролидино-2-бутинил)-гидантоин),
1-метилпиперидин-4-спиро-5'-(3'-трет-бутилгидантоин),
1-пропаргилпиперидин-4-спиро-5'-(3'-этилгидантоин),
1-метилпиперидин-4-спиро-5'-(3'-(2-бутинил)-гидантоин), пиперидин-4-спиро-5'-(3'-пропаргилгидантоин),
2-метил-1,4-тиазолидин-3-он-спиро(5,3')-хинуклидин.
1-метилпиперидин-4-спиро-5'-(2'-тион-3'-этилгидантоин),
1-метилпиперидин-4-спиро-4'-(2'-тион-3'-трет-бутилгидантоин),
1-метилпиперидин-4-спиро-4'-(5')-(2'-метилтио-2'-имидазолин-5'(4')-он),
1-метилпиперидин-4-спиро-4'-(1'-этил-2'-этилтио-2'-имидазолин-5'-он),
1-метилпиперидин-4-спиро-4'-(1'-этил-2'-имидазолин-5'-он).
| Способ получения полимеров и сополимеров ненасыщенных соединений | 1971 |
|
SU452101A3 |
| EP 0314444 A, 03.05.89 | |||
| РЕЛЕ НАПРЯЖЕНИЯ | 0 |
|
SU311313A1 |
| РАБОЧИЙ ОРГАН ГРУНТОСМЕСИТЕЛЬНОЙ МАШИНЫ | 0 |
|
SU303391A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1986, ч.1, с.155-165. | |||
Авторы
Даты
1999-04-27—Публикация
1994-07-15—Подача