Настоящее изобретение относится к новым, обладающим действием в качестве антагонистов рецепторов нейрокинина производным 2-индолилметил-пиперазина, замещенным у атома азота пиперазинового скелета триазолилметильной группой. Изобретение относится далее к лекарственным средствам, содержащим эти новые производные N-триазолилметилпиперазина. Кроме того, изобретение относится к способу получения этих новых производных пиперазина, а также к промежуточным продуктам, получаемым по этому способу.
Из заявки WO 98/57954 уже известны сходные с предлагаемыми соединениями по их структуре соединения, которым приписывают общие, оказывающие антагонистическое действие на тахикинин, нейрокинин А или также на нейрокинин В свойства и которые способны воздействовать на центральную нервную систему (ЦНС).
В ЕР 0899270 А1 описываются производные 2-индолилметилпиперазина с отличным от предлагаемых в настоящем изобретении соединений образцом замещения, которые обладают свойствами антагонистов рецепторов нейрокинина.
Известны далее описанные в ЕР 0655442 А1 другие производные 2-индолилметилпиперазина с отличным от предлагаемых в настоящем изобретении соединений образцом замещения, которым приписывают в принципе свойства антагонистов тахикинина, нейрокинина А или также нейрокинина В и которые считают пригодными для воздействия на ЦНС.
С учетом вышеизложенного в основу настоящего изобретения была положена задача получить новые активные вещества со свойствами антагонистов рецепторов нейрокинина (NK-рецепторов) и с более совершенным механизмом действия, которые могли бы применяться прежде всего для лечения периферических расстройств, таких как функциональные и вызываемые воспалениями расстройства желудочно-кишечного тракта.
Неожиданным образом было установлено, что группа новых производных N-триазолилметилпиперазина отличается наличием специфических свойств, присущих антагонистам NK-1-рецепторов, и проявляет свое действие предпочтительно в периферической области. Тем самым группа соединений по изобретению, как очевидно, пригодна прежде всего для лечения индуцированных NK-1 периферических расстройств, в частности для лечения функциональных и вызываемых воспалениями расстройств желудочно-кишечного тракта.
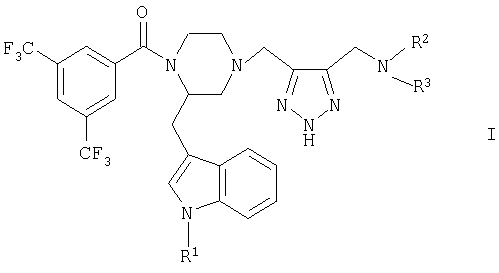
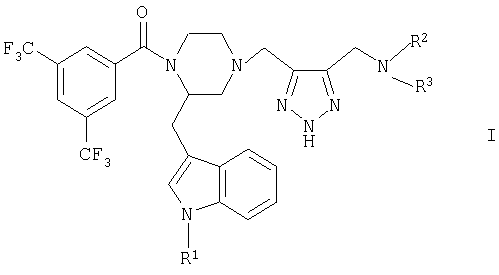
Объектом изобретения в соответствии с этим являются новые соединения общей формулы I
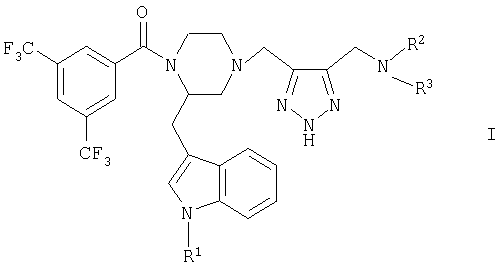
в которой
R1 обозначает водород или (низш.)алкил,
R2 обозначает (низш.)алкил, ди(низш.)алкиламино(низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил, необязательно одно- либо двузамещенный (низш.)алкилом цикло(гетеро)алкил с 5-6 атомами цикла, содержащий необязательно 1-2 двойные связи, необязательно одно- либо двузамещенный в гетерофенильном кольце галогеном, (низш.)алкилом и/или (низш.)алкоксигруппой (гетеро)фенил(низш.)алкил, (низш.)алкильная цепь которого необязательно одно- либо двузамещена (низш.)алкилом или спиро-С4-С5алкиленом, или обозначает необязательно одно- либо двузамещенную в фенильном кольце галогеном, (низш.)алкилом и/или (низш.)алкоксигруппой фенил (низш.)алкоксигруппу и
R3 обозначает (низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил или необязательно одно- либо двузамещенный (низш.)алкилом цикло(гетеро)алкил с 5-6 атомами цикла, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют циклическую группу формулы а

в которой
А обозначает азот, кислород, метилен или метилиден, двойная связь которого образуется вместе со смежным атомом углерода в положении 3 группы а,
n обозначает целое число от 1 до 3,
R4 обозначает водород, (низш.)алкил, (низш.)алкокси(низш.)алкил, (низш.)алкоксикарбонил, (низш.)алкоксикарбонил(низш.)алкил, ди(низш.)алкиламино(низш.)алкил, необязательно одно- либо двузамещенный галогеном, (низш.)алкилом и/или (низш.)алкоксигруппой (гетеро)финил, необязательно одно- либо двузамещенный в (гетеро)финильном кольце галогеном, (низш.)алкилом и/или (низш.)алкоксигруппой (гетеро)фенил(низш.)алкил, (низш.)алкильная цепь которого необязательно одно- либо двузамещена (низш.)алкилом, цикло(гетеро)алкил с 5-6 атомами цикла или цикло(гетеро)алкил(низш.)алкил, цикло(гетеро)алкильная группа которого содержит 5-6 атомов цикла, и
R5 обозначает водород, (низш.)алкил или (низш.)алкокси(низш.)алкил, или
R4 и R5 оба вместе обозначают связанную с атомом углерода группы а спироэтилендиоксигруппу, связанный с двумя смежными атомами группы а С3-С4алкилен или аннелированный с помощью двух смежных атомов углерода группы а фенил, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют пирролидиновое кольцо, двузамещенное С4алкиленом, связанным соответственно через два смежных атома углерода,
а также физиологически приемлемые кислотно-аддитивные соли соединений формулы I.
Еще одним объектом изобретения являются содержащие соединения формулы I лекарственные средства.
Объектом изобретения являются далее способ получения соединений формулы I, а также промежуточные продукты, получаемые по этому способу.
Если заместители в соединениях формулы I представляют собой либо содержат низшие алкильные или алкоксигруппы, то эти группы могут быть прямоцепочечными или разветвленными и могут содержать от 1 до 4 атомов углерода. Если же заместители содержат галоген, то таковым может быть прежде всего фтор, хлор либо бром, предпочтительно фтор либо хлор.
Если заместители в соединениях формулы I представляют собой либо содержат цикло(гетеро)алкил, то таковым могут быть чистые карбоциклы или же карбоциклы, в которых соответственно 1-3 углеродных атома цикла заменены на азот, кислород и/или серу. В качестве гетероатомов предпочтительны азот и кислород. Если заместители в соединениях формулы I представляют собой либо содержат (гетеро) фенил, то таковым может быть фенил или же фенил, где соответственно 1-3 углеродных атома цикла заменены на азот.
R1 обозначает предпочтительно водород. Если же R1 представляет собой (низш.)алкил, то предпочтителен метил.
R2 обозначает предпочтительно (низш.)алкил, прежде всего метил, этил, изопропил или трет-бутил; ди(низш.)алкиламино(низш.)алкил, прежде всего диметиламиноэтил или диметиламино-н-пропил; (низш.)алкоксикарбонил(низш.)алкил, прежде всего этоксикарбонилметил; необязательно однозамещенный (низш.)алкилом, прежде всего метилом, цикло (гетеро) алкил с 5-6 атомами цикла, прежде всего необязательно замещенный циклопентил, циклогексил или пиперидинил; необязательно одно- либо двузамещенный в гетерофенильном кольце (низш.)алкилом, прежде всего метилом, или (низш.)алкоксигруппой, прежде всего метоксигруппой, гетерофенил(низш.)алкил, прежде всего необязательно замещенный пиридил; или одно- либо двузамещенный в фенильном кольце (низш.)алкилом, прежде всего метилом, или (низш.)алкоксигруппой, прежде всего метоксигруппой, фенил С2-С4алкил.
R3 обозначает предпочтительно (низш.) алкил, прежде всего метил, этил или изопропил; или (низш.)алкоксикарбонил(низш.)алкил, прежде всего этоксикарбонилметил.
Предпочтительными являются такие соединения формулы I, в которых R2 и R3 не обозначают одновременно изобутил.
Если R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют группу формулы а, то предпочтительными значениями R являются водород; (низш.)алкил, прежде всего метил или изопропил; (низш.)алкокси(низш.)алкил, прежде всего метоксиметил; (низш.)алкоксикарбонил(низш.)алкил, прежде всего этоксикарбонилметил; ди(низш.)алкиламино(низш.)алкил, прежде всего диметиламиноэтил; необязательно однозамещенный (низш.)алкилом, прежде всего метилом, или (низш.)алкоксигруппой, прежде всего метоксигруппой, (гетеро) фенил, прежде всего необязательно замещенный фенил, пиридил, пиримидил или пиразолил; необязательно однозамещенный в (гетеро) фенильном кольце галогеном, (низш.)алкилом, прежде всего метилом, или (низш.)алкоксигруппой, прежде всего метоксигруппой, (гетеро) фенил (низш.)алкил, прежде всего необязательно замещенный бензил или пиридил(низш.)алкил; цикло (гетеро) алкил с 5-6 атомами цикла, прежде всего циклогексил, пирролидинил или пиперидинил; или цикло(гетеро)алкил(низш.)алкил, цикло (гетеро) алкильное кольцо которого содержит 5-6 атомов цикла, прежде всего пирролидинил-С1-С2алкил, морфолиноэтил или циклогексилметил.
При наличии группы формулы а R5 обозначает предпочтительно водород; (низш.)алкил, прежде всего метил; или (низш.)алкокси(низш.)алкил, прежде всего метоксиметил.
К предпочтительным относятся такие соединения формулы I, в которых при наличии группы формулы а R4 и R5 не связаны с одним и тем же атомом группы а, за исключением указанных в качестве предпочтительных соединений формулы I, где R4 и R5 оба вместе обозначают связанную с атомом углерода группы а спироэтилендиоксигруппу. Предпочтительными являются также соединения формулы I, где R4 и R5 обозначают связанный с двумя смежными атомами циклической группы а С3-С4алкилен.
При наличии группы формулы а n обозначает целое число от 1 до 3. Если же R4 и R5 оба вместе обозначают водород и А одновременно представляет собой метилен, то n предпочтительно обозначает 2 или 3.
В принципе заместители R4 и R5 в группе а могут быть связаны с любым атомом этой группы, включая образованные с помощью А атомы цикла, которые в рассматриваемом случае не являются кислородом. Если один из кольцевых атомов группы а замещен R4 или R5, то либо R4, либо R5 заменяет на том же самом месте атом водорода, присутствующий в других случаях на этом месте, что позволяет таким образом сохранить ковалентность кольцевых атомов группы а. Если А представляет собой метилиден, то его двойная связь образуется предпочтительно со смежным атомом углерода в положении 3 группы а, который в этом случае также образует метилиденовую группу.
К предпочтительным относятся далее такие соединения формулы I, где необязательно присутствующая группа а представляет собой замещенный заместителями R4 и R5 пирролидин, при этом оба заместителя R4 и R5 не обозначают одновременно водород, или где необязательно присутствующая группа а представляет собой замещенный соответственно заместителями R4 и R5 2,5-дигидропиррол, пиперидин, пиперазин, морфолин или диазепан.
Особенно предпочтительным является соединение формулы I (2R)-1[3,5-бис(трифторметил)бензоил]-2(1H-индол-3-илметил)-4[[5(морфолинометил)-2Н-1,2,3-триазол-4-ил]метил}пиперазин.
Соединения формулы I, равно как и их кислотно-аддитивные соли, могут быть получены следующим образом:
а) соединение общей формулы II

где R1 имеет указанные выше значения, подвергают взаимодействию с соединением общей формулы III
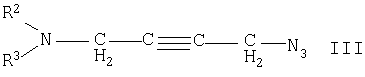
где R2 и R3 имеют указанные выше значения и где присутствующие реакционноспособные группы блокированы соответствующими защитными группами, или
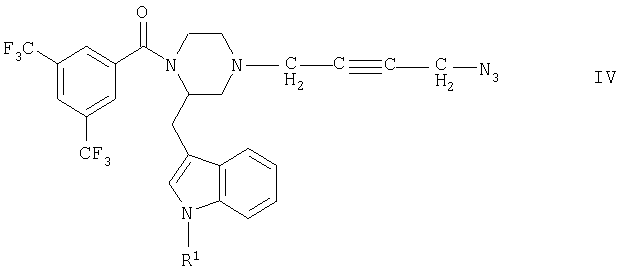
б) соединение общей формулы IV
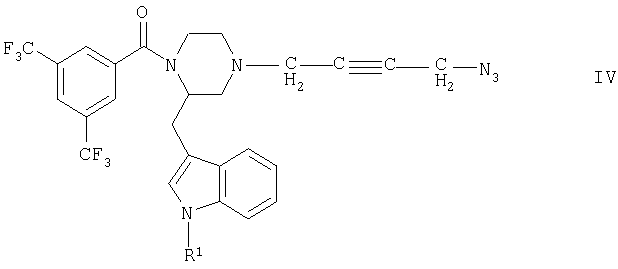
где R1 имеет указанные выше значения, подвергают взаимодействию с соединением общей формулы V
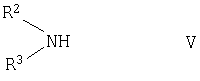
где R2 и R3 имеют указанные выше значения и где присутствующие реакционноспособные группы блокированы соответствующими защитными группами,
и затем необязательно используемые защитные группы снова отщепляют, после чего полученное соединение формулы при необходимости переводят в его кислотно-аддитивную соль или кислотно-аддитивную соль переводят в свободное соединение формулы I.
Согласно варианту а) способа с целью получить соединение формулы I вторичную аминофункцию замещенного производного пиперазина формулы II можно подвергать взаимодействию с N,N-двузамещенным азидобутинамином формулы III. Эту реакцию можно проводить в инертном в условиях реакции растворителе, таком как диполярно-апротонный растворитель, например этилацетат или диметилформамид (ДМФ), либо предпочтительно в смеси таких растворителей. Особенно предпочтительна смесь из этилацетата и ДМФ. Реакцию рекомендуется проводить при температурах в интервале от комнатной температуры до температуры кипения растворителя, соответственно смеси растворителей. При использовании соединений формулы III, содержащих дополнительные, реакционноспособные в условиях реакции функциональные группы, эти последние целесообразно блокировать известными защитными группами. Пригодными в этих целях защитными группами, которые вводят по известным методам и затем снова отщепляют также по известным методам, являются, например, группы, известные из публикаций J.A.W.McOmie «Protective Groups in Organic Chemistry», изд-во Plenum Press (1973) или T.W.Green и P.G.M.Wuts «Protective Groups in Organic Synthesis», изд-во Wiley and Sons (1991). Специалист может сам, руководствуясь обычными методами, выбрать соответствующие защитные группы.
Соединения формулы II и их стереоизомерные формы известны из ЕР 0655442 А1 и могут быть получены с помощью описанных в этой заявке способов либо аналогичных им.
Соединения формулы III можно получать, подвергая обычным путем соединение общей формулы VI

где R2 и R3 имеют указанные выше значения и где Y обозначает отщепляемую уходящую группу, взаимодействию с азидом щелочного металла, предпочтительно азидом натрия, с образованием азидной связи. В качестве уходящей группы Y могут рассматриваться прежде всего галоген, предпочтительно хлор, либо сульфонилоксигруппы, образующие легко отщепляемые уходящие группы, например (низш.)алкансульфонилоксигруппа, такая как метансульфонилоксигруппа, либо необязательно замещенная в бензольном кольце галогеном или (низш.)алкилом бензолсульфонилоксигруппа, такая как п-толуолсульфонилоксигруппа.
Соединения формулы VI можно получать, подвергая обычным путем соединения формулы V взаимодействию с соединением формулы VII

где Y имеет указанное выше значение. Полученные соединения формулы VI при необходимости можно подвергать очистке. Для такой очистки соединения формулы VI можно, например, переводить в соответствующие соли, такие как оксалаты, и затем очищать с помощью известных методов кристаллизации. Вместе с тем вышеназванные соли соединений формулы VI могут непосредственно использоваться в последующих реакциях.
Вторичные амины формулы V в принципе известны, равно как и соединения формулы VII. В качестве соединения формулы VII предпочтительно использовать 1,4-дихлор-2-бутин.
Согласно варианту б) способа с целью получить соединение формулы I пиперазин-N-бутиназид формулы IV можно подвергать взаимодействию с вторичным амином формулы V. Эту реакцию можно осуществлять известным образом, например, по описанному K.Banert в Chemische Berichte 122, стр.1963-1967 (1989) методу или по аналогичным ему методам в инертном в условиях реакции растворителе, таком как этилацетат или простой эфир, например в тетрагидрофуране (ТГФ) или диоксане. Согласно одному из предлагаемых предпочтительных вариантов способа вторичный амин формулы V, например морфолин, можно как таковой использовать в качестве растворителя. Соответствующую температуру реакции следует выбирать в зависимости от используемого вторичного амина формулы V. Если амин формулы V представлен при комнатной температуре в жидком или твердом виде, то, как правило, работают при температурах в интервале от комнатной температуры до температуры кипения обычных растворителей, например до порядка 100° С. При использовании легколетучих аминов формулы V, например диметиламина или диэтиламина, целесообразно работать при низких температурах, например в интервале от -78 до -10°С, и предпочтительно при повышенном давлении, например от 1,5 до 3 бар. Реакции при повышенном давлении осуществляют в автоклавах известной конструкции. Если применяют амины формулы V, содержащие дополнительные, реакционноспособные в условиях реакции функциональные группы, например еще одну вторичную аминофункцию, в частности при использовании пиперазина, то эти дополнительные функциональные группы целесообразно блокировать известными защитными группами. Пригодные в этих целях защитные группы, которые можно вводить по известным методам и затем снова отщеплять также по известным методам, известны, например, из публикаций, указанных выше в варианте а) способа. При использовании в качестве амина формулы V пиперазина предпочтительна в качестве защитной группы трет-бутоксикарбонильная группа. Специалист, руководствуясь обычными методами, может сам выбрать соответствующие защитные группы.
Соединения формулы IV являются новыми соединениями, которые могут использоваться в качестве промежуточных продуктов для получения новых активных веществ, в частности для получения соединений формулы I. Одна из возможностей получения соединений формулы IV состоит в том, что соединения общей формулы VIII

где R1 и Y имеют указанные выше значения, подвергают обычным путем взаимодействию с азидом щелочного металла, предпочтительно азидом натрия, с образованием азидной связи.
Соединения формулы VIII могут быть получены осуществляемым по обычной технологии взаимодействием соединений формулы II с соединениями формулы VII.
Соединения формулы I можно обычным путем выделять из реакционной смеси и очищать. Кислотно-аддитивные соли можно обычным образом переводить в свободные основания и эти последние при необходимости также известным путем можно переводить в физиологически приемлемые кислотно-аддитивные соли.
В качестве физиологически приемлемых солей соединений формулы I могут рассматриваться их соли с неорганическими кислотами, такими, например, как серная кислота, фосфорные кислоты или галогеноводородные кислоты, предпочтительно хлористоводородная кислота, либо с органическими кислотами, например низшими алифатическими моно-, ди- или трикарбоновыми кислотами, такими как малеиновая кислота, фумаровая кислота, молочная кислота, винная кислота, лимоновая кислота, или с сульфокислотами, например с (низш.)алкансульфокислотами, такими как метансульфокислота, либо необязательно замещенными в бензольном кольце галогеном или низшим алкилом бензосульфокислотами, такими как п-толуолсульфокислота. Предпочтительной солью соответствующего соединения формулы I является дигидрохлорид (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-ил]метил)-4-{[5-(морфолинометил)-2-Н-1,2,3-триазол-4-ил]метил}пиперазина, поскольку эта соль способна относительно хорошо растворяться в воде.
Соединения формулы I содержат в любом случае хиральный атом углерода, а именно, несущий 1H-индол-3-илметильную группу атом углерода в положении 2 пиперазинового скелета. Тем самым соединения формулы I могут быть представлены в нескольких стереоизомерных формах. Настоящее изобретение включает как смеси оптических изомеров, так и чистые изомеры соединений формулы I. К предпочтительным относятся соединения формулы I, где индолилметильная группа находится в 2R-положении пиперазинового кольца. Если при синтезе соединений формулы I применяют смеси оптических изомеров исходного соединения, например соединений формулы II или соединений формулы IV, то и соединения формулы I получают также в виде смесей оптических изомеров. Используя однородные в стереохимическом отношении формы исходного соединения, можно получать также стереохимически однородные соединения формулы I. Стереохимически однородные соединения формулы I могут быть получены из смесей оптических изомеров по известной технологии, например путем хроматографического разделения с использованием хиральных разделительных материалов или взаимодействием с соответствующими оптически активными кислотами, например винной кислотой или камфор-10-сульфокислотой, и последующим разделением на оптически активные антиподы путем фракционной кристаллизации полученных диастереомерных солей.
В соединениях формулы I 1,2,3-триазольное кольцо может быть представлено в нескольких таутомерных формах, вследствие чего атом водорода может быть связан с разными атомами 1,2,3-триазольного кольца. Согласно изобретению соединения формулы I включают все возможные таутомеры триазольного кольца.
Соединения формулы I, равно как и их кислотно-аддитивные соли, обладают свойствами антагонистов рецепторов нейрокинина (NK-рецепторов) и пригодны для лечения болезненных состояний у крупных млекопитающих, прежде всего человека, при которых нейрокинины играют роль медиаторов. При этом группа предлагаемых в изобретении соединений отличается особенно эффективным механизмом действия, характеризующимся прежде всего высоким селективным сродством с NK-1-рецепторами. Кроме того, группа соединений по изобретению отличается также хорошей совместимостью при их применении в течение длительного периода времени и сравнительно высокой биодоступностью при оральном введении.
Благодаря механизму их действия и их избирательной и обратимой способности связываться с NK-1-рецепторами группа соединений по изобретению может применяться прежде всего для подавления процессов, в которых участвуют связывающиеся с NK-1-рецепторами нейрокинины, такие как вещество П. Тем самым указанные соединения пригодны для применения при избирательном лечении болезненных состояний, связанных с участием вещества Р. Так, например, вещество Р играет определенную роль при передаче болей, рвоте, нейрогенных воспалениях, воспалениях мочевого пузыря, воспалительных заболеваниях суставов и астматических жалобах. Благодаря их свойствам соединениями по изобретению удается целенаправленно и эффективно воздействовать на соответствующую область организма и поэтому они могут применяться для лечения периферических патологических расстройств, прежде всего для лечения функциональных и связанных с воспалениями расстройств желудочно-кишечного тракта. К таким функциональным расстройствам, при лечении которых можно использовать предлагаемые соединения, относятся прежде всего расстройства нижних областей кишечника, известные как так называемый синдром раздражимого кишечника (СРК). Характерными симптомами СРК являются боли подчревной области, обусловленные предположительно сверхчувствительностью висцеральной афферентной нервной системы, и расстройства стула, прежде всего аномально ускоренная дефекация из прямой кишки. Повышенная чувствительность к висцеральным болям по сравнению с механическими или химическими раздражениями в желудочно-кишечном тракте приводит к тому, что пациенты, страдающие СРК, даже при незначительных расширениях прямой кишки, связанных с процессом нормального пищеварения, например, уже при незначительном газообразовании и легких вздутиях, на которые здоровый человек практически не реагирует, испытывают сильные висцеральные боли. К обусловленным воспалениями расстройствам в желудочно-кишечном тракте, на которые эффективно можно воздействовать соединениями по изобретению, относятся воспалительные расстройства в области тонкого и толстого кишечника, принятые под общим названием «воспалительное заболевание кишечника» (ВЗК), в частности язвенный колит и болезнь Крона. В отличие от других терапевтических средств, целенаправленно применяемых прежде всего для лечения соответствующей периферической области и вызывающих нежелательные побочные эффекты, механизм действия соединений по изобретению отличается их сравнительно высокой оральной биодоступностью при одновременно эффективной избирательности антагонистического по отношению к рецепторам нейрокинина воздействия. Так, в частности, при фармакологических исследованиях с использованием соединений в различных дозировках, блокировавших NK-1-рецептор, не было выявлено никакого антагонистического по отношению к кальцию действия в сердечно-сосудистой системе. Кроме того, можно предположить, что предлагаемые в изобретении соединения не оказывают сколько-нибудь заметных побочных действий на центральную нервную систему.
Описание методов фармакологических исследований
Указанные номера примеров соединений, применявшихся в фармакологических исследованиях в качестве тестируемых веществ, относятся к описанным ниже примерам получения.
1. Определение in vitro связываемости исследуемых веществ с NK-1-рецепторами
Сродство исследуемых веществ к NK-1-рецепторам человека определяли in vitro. При этом выявляли ингибирование связывания физиологического нейрокинина (вещества Р) с рецепторами нейрокинина 1.
Исследования по связыванию с рецепторами проводили с использованием [3Н]-вещества Р в качестве лиганда. В опыте на связывание различные образцы препаратов мембран клеток яичника китайского хомячка, экспрессирующих NK-1-рецептор человека (регистрационный номер соответствующей нуклеотидной последовательности в нуклеиновых кислотах М74290; регистрационный номер соответствующей аминокислотной последовательности белка Р25103; (ср. Y.Takeda; K.B.Chou, J.Takeda; B.S.Sachais и J.E.Krause, Biochemical and Biophysical Research Communications, 179 (3), стр.1232-1240 (1991)), инкубировали в растворе меченого лиганда, при этом инкубируемые смеси не содержали исследуемое вещество либо содержали добавки последнего в различных концентрациях. Затем связанные в образцах и свободные лиганды разделяли соответственно путем фильтрации через стекловолокнистый фильтр. Осадок на фильтре несколько раз промывали буферным раствором, после чего с помощью сцинтиляционного счетчика β-излучения измеряли радиоактивность этого осадка на фильтре.
Сродство соединений из примеров 1 и 8-65 к NK-1-рецепторам человека определяли соответственно путем однократного измерения на исследуемых веществах, взятых в концентрации 10-7 моль/л. Выявленная в этих исследованиях степень вытеснения физиологического лиганда NK-рецепторов, вещества Р, всеми вышеназванными исследуемыми веществами составляла ≥75%. У соединений из примеров 1, 8-15, 17-29, 34-47, 49-55, 57, 59-60 и 62-65 этот показатель вытеснения составлял соответственно ≥90%.
Значение IC50 для каждого из исследуемых веществ из примеров 2 и 4-6 определяли по концентрации, которая обеспечивает 50%-ное вытеснение связанного лиганда от максимального. Исходя из этого для исследуемого вещества рассчитывали соответствующую константу ингибирования (Кi-значение), которую выражали в виде десятичного кологарифма Кi-значения (рКi-значение). рКi-Значение является мерой определения сродства исследуемых веществ к NK-1-рецепторам человека. Для использовавшихся в исследованиях соединений, указанных ниже в таблице 1, были получены следующие рКi-значения, приведенные в табл.1.
Сродство исследуемых веществ к NK-1-рецепторам человека
2. Определение in vitro функционального NK-1-антагонизма исследуемых веществ на выделенной ткани морской свинки
Действие исследуемых веществ в качестве антагонистов NK-1-рецепторов определяли in vitro на выделенных, выдержанных в оксигенированном питательном растворе колечках из аорты морских свинок линии Pirbright-White. На этих препаратах выявляли эффективность исследуемых веществ по ингибированию релаксации тонуса, вызванной после стимуляции NK-1-агонистом, веществом Р.
Для измерения сократительной способности мышц гладкой мускулатуры сосудов препараты закрепляли на крючке и соединяли нитью с динамометром, показания которого регистрировали в каждом случае с помощью самописца. Препараты тонизировали фенилэфрином. Затем NK-1-рецепторы препаратов стимулировали до и после введения исследуемого вещества 0,01 мкмоля вещества Р, что вызывало релаксацию тонуса. Количественное соотношение между релаксацией до и после введения исследуемого вещества выражали в процентах. Далее рассчитывали эффективную концентрацию, которая обеспечивает 50%-ное ингибирование релаксации тонуса от максимального (ЕС50). В качестве показателя использовали десятичный кологарифм значения ЕС50 (рЕС50). Это значение рЕС50 является мерой определения функциональной эффективности исследуемых веществ по отношению к NK-1-рецепторам.
Для использовавшихся в исследованиях соединений, указанных ниже в таблице 2, были получены следующие рЕС50-значения.
Функциональный NK-1-антагонизм исследуемых веществ на выделенной ткани морской свинки
3. Определение in vivo действия исследуемых веществ в качестве антагонистов вещества Р
С целью выявить антагонистическое по отношению к веществу Р действие исследуемых веществ в качестве стандартной тестовой модели для достижения индуцированных веществом Р фармакологических эффектов использовали морских свинок, которым внутривенно вводили вещество Р, вызывая тем самым временную гипотензию. При этом определяли ингибирующее действие исследуемых веществ, сравнивая понижение кровяного давления, индуцированное веществом Р после внутривенного введения с одной стороны, и после орального введения исследуемых субстанций с другой стороны.
Самцам морских свинок под наркозом (кетамин 67 мг/кг, ксилазин 13 мг/кг) имплантировали соответственно катетер в общую сонную артерию и в яремную вену. Артериальный катетер служил для измерения кровяного давления, тогда как венозный катетер использовали для введения вещества Р, соответственно для внутривенного введения и тестируемой субстанции. После 20-минутной равновесной фазы в качестве стимула (раздражителя) вводили вещество Р в количестве 50 пмоль/животное (струйное введение внутривенно). Через минуту после введения исследуемого раздражителя в каждом случае определяли индуцированное им максимальное понижение кровяного давления, служившее контролем при последующей стимуляции NK-1-рецепторов исследуемым веществом. После этого вводили исследуемую субстанцию. При внутривенном применении исследуемое вещество вводили в дозах от 0,01 до 0,1 мкмоля/кг. При пероральном применении тестируемое вещество вводили в дозах от 0,1 до 3,2 мкмоля/кг. В качестве инертного наполнителя при пероральном введении служили тилоза, соответственно спиртовой раствор тилозы (в этаноле). Затем, начиная с 1ой и кончая 90ой минутой после введения тестируемого вещества, с интервалами по 15 минут каждый измеряли степень понижения кровяного давления, индуцированного соответствующим тестируемым веществом. На основании полученных данных выявляли те дозировки, при которых в зависимости от времени введения исследуемого вещества достигалось 50%-ное ингибирование понижения кровяного давления, индуцированного веществом Р, и исходя из этого, определяли ED50-значения, которые выражали в виде десятичного кологарифма ED50 (pED50).
В этой тестовой модели pED50-значение вещества из примера 1 через час после внутривенного введения составляло 7,6: pED50-Значение того же вещества из примера 1 через час после перорального введения составляло 6,2. pED50-Значение соединения из примера 6 через час после внутривенного введения составляло 7,0. Эти значения подтверждают высокую фармакологическую эффективность соединений формулы I, прежде всего при их оральном применении.
В аналогичных исследованиях предлагаемые соединения тестировали также на их понижающее кровяное давление действие, основанное на их свойствах как антагонистов кальция. С этой целью исследовали возможное влияние тестируемых веществ на базальное кровяное давление. При применении соединения из примера 1 в исследовавшемся диапазоне дозировок (внутривенно вводили дозы вплоть до 0,1 мкмоля/кг и перорально вводили дозы вплоть до 3,2 мкмоля/кг) не наблюдалось сколько-нибудь заметного понижения давления. Это свидетельствует об отсутствии побочных действий со стороны предлагаемых соединений при их использовании в указанном диапазоне дозировок, которые они могли бы в противном случае проявлять в качестве антагонистов кальция. Отсутствие при применении соединений по изобретению указанных побочных эффектов в отношении кальция может быть подтверждено и на стандартной in vitro-модели, где используют, например, ткань, выделенную из подвздошной кишки морских свинок.
В стандартном тесте по выявлению способных проникать в ЦНС соединений, обладающих действием антагонистов NK-1-рецепторов («gerbil foot tapping test», см. N.M.Rupniak, A.R.Williams, European Journal of Pharmacology 265, стр.179-183 (1994)), соединение из примера 1 даже при введении в высоких дозах вплоть до 30 мг/кг перорально не проявило никаких эффектов, типичных для способных проникать в ЦНС антагонистов NK-1-рецепторов.
Соединения формулы I могут применяться в виде обычных фармацевтических композиций. Они могут назначаться в индивидуально подобранной дозировке, зависящей от состояния пациента, которое требует данной терапии, и от применяемой субстанции. Как правило, однако, при введении человеку и крупным млекопитающим рекомендуются лекарственные формы с содержанием активного вещества от 0,1 до 80 мг, прежде всего от 1 до 10 мг на одну разовую дозу.
Согласно изобретению соединения формулы I могут включаться в состав твердых или жидких фармацевтических композиций совместно с обычными фармацевтическими вспомогательными веществами и/или носителями. В качестве твердых лекарственных форм можно назвать предназначенные для орального применения препараты, такие как таблетки, драже, капсулы, порошки или грануляты, а также суппозитории. Такие препараты наряду с обычными фармацевтическими вспомогательными веществами, например замасливателями или разрыхлителями (в таблетках) могут содержать в своем составе обычные неорганические и/или органические носители, такие, например, как тальк, молочный сахар или крахмал. Жидкие препараты, такие как суспензии или эмульсии активных веществ, могут содержать обычные разбавители, такие как вода, масла и/или суспендирующие агенты, например полиэтиленгликоли и т.п. В состав препаратов могут дополнительно добавляться другие вспомогательные вещества, такие, например, как консерванты, вкусовые добавки и т.п.
Активные вещества можно по обычной технологии смешивать с фармацевтическими вспомогательными веществами и/или носителями и затем изготавливать соответствующие композиции. Так, в частности, для изготовления твердых лекарственных форм, например, после смешения активных веществ обычным путем с вспомогательными веществами и/или носителями эти смеси можно мокрым либо сухим методом гранулировать. Полученный гранулят или порошок можно непосредственно использовать при изготовлении капсул или по обычной технологии таблетировать. При необходимости возможно изготовление также по известной технологии драже.
Ниже изобретение более подробно поясняется на примерах, которые никоим образом не ограничивают его объем.
Пример 1
(2R)-1[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-{[5(морфолинометил)-2Н-1,2,3-триазол-4-ил]метил}пиперазин
Вариант 1 синтеза
А) К суспензии из 43 г К2СО3 в 100 мл ДМФ при 20°С в атмосфере защитного газа добавляли 22 мл 1.4-дихлор-2-бутина. Смесь нагревали до 50°С, после чего к ней добавляли по каплям 50 г (2R)-1[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазина в 200 мл ДМФ. Полученную смесь в течение 5 ч перемешивали при 50°С. Перемешивание продолжали в течение ночи при комнатной температуре, затем отфильтровывали от нерастворившегося осадка и этот осадок дважды промывали порциями по 200 мл этилацетата соответственно. Объединенные фильтраты упаривали досуха под вакуумом и полученное масло очищали посредством колоночной хроматографии (силикагель; элюенты: н-гексан/этилацетат в соотношении 60:40-30:70). Объединенные продуктовые фракции повторно упаривали досуха. В результате получили 40,4 г (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(4-хлор-2-бутин-1-ил)пиперазина в виде аморфного твердого вещества желтоватого цвета, которое без дальнейшей очистки использовали на последующей стадии синтеза.
Б) К раствору из 40,0 г полученного на стадии 1А) производного хлорбутинилпиперазина в 200 мл диметилсульфоксида (ДМСО) добавляли при комнатной температуре и в атмосфере защитного газа 5,76 г NaN3. Образовавшуюся смесь в течение 24 ч продолжали перемешивать в атмосфере защитного газа при комнатной температуре. Затем к ней добавляли раствор из 50 г хлорида аммония в 300 мл воды, после чего водную фазу экстрагировали 500 мл метил-трет-бутилового эфира (МТБЭ). Органическую фазу последовательно промывали 200 мл насыщенного раствора поваренной соли и 200 мл воды, сушили над сульфатом натрия и в завершение упаривали досуха под вакуумом. Остаток пенистое вещество желтоватого цвета очищали посредством колоночной хроматографии (силикагель; элюенты, этилацетат/н-гексан в соотношении 65:35-80:20). Объединенные продуктовые фракции повторно упаривали досуха. В результате получили 33,2 г (2R)-1-13,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(4-азидо-2-бутин-1-ил)пиперазина в виде желтоватого твердого вещества, которое без дальнейшей очистки использовали на последующей стадии синтеза.
В) 25,5 г полученного на стадии 1Б) азидного производного растворяли в 10 мл морфолина и в течение 4 ч нагревали в атмосфере защитного газа до 80°С. Перемешивание продолжали далее при комнатной температуре в течение ночи, после чего упаривали досуха под вакуумом. Остаток растворяли в 500 мл этилацетата и повторно упаривали досуха под вакуумом. Полученное пенистое вещество очищали посредством колоночной хроматографии (силикагель; элюенты: этилацетат/этанол в соотношении 100:0-85:15). Объединенные продуктовые фазы упаривали досуха, получив в результате 22,0 г указанного в заголовке соединения в виде аморфного твердого вещества желтоватого цвета, tпл 92-98°С (переходная температура стеклования), [α]D 20=5°(с=1,0 в метаноле).
Г) К раствору из 39,0 г полученного на стадии 1В) соединения, указанного в заголовке, в 100 мл МТБЭ в атмосфере защитного газа добавляли 20 мл абс. этанола. Полученную реакционную смесь нагревали до 40-50°С, после чего к ней добавляли 81 мл 1,6н. HCl в изопропаноле. Смесь в течение последующих 10 мин перемешивали при 50°С. Затем медленно добавляли 1000 мл МТБЭ, после чего началось выпадение соли в осадок. Для более полного осаждения перемешивание продолжали еще в течение 2 ч при комнатной температуре, затем отфильтровывали от жидкой фазы и соль дважды промывали МТБЭ. После сушки под вакуумом получили 39,5 г твердого соединения, указанного в заголовке, в виде дигидрохлорида, окрашенного в белый до бежевого цвет, tпл 213-216°С; [α]D 20=-3,6° (с=1,0 в метаноле).
Вариант 2 синтеза
А) 17,0 мл 1,4-дихлор-2-бутина в атмосфере защитного газа растворяли в 100 мл толуола и к раствору примешивали 42,6 г К2СО3. После нагревания образовавшейся суспензии до 50°С к ней медленно добавляли по каплям раствор из 10 мл морфолина в 100 мл толуола. Образовавшуюся реакционную смесь сначала перемешивали еще в течение 5 ч при 50°С, а затем в течение ночи при комнатной температуре. Далее отфильтровывали от К2СО3, дважды промывали порциями по 100 мл толуола соответственно и объединенные фильтраты концентрировали под вакуумом. Остаток растворяли в приблизительно 100 мл толуола и органическую фазу последовательно промывали насыщенными водными растворами NaHCOз и NaCl. Затем органическую фазу упаривали досуха под вакуумом. В результате получили 14,3 г сырого 1-(4-хлор-2-бутин-1-ил)морфолина в виде масла, которое с целью очистки переводили в монооксалат.
Для очистки 14,0 г полученного выше сырого соединения растворяли в 80 мл МТБЭ, после чего отфильтровывали от выпавшего осадка и дважды промывали порциями по 100 мл МТБЭ соответственно. Объединенные фильтраты нагревали в атмосфере защитного газа до 50°С. Затем к этой смеси добавляли нагретый до 50°С раствор из 10,0 г щавелевой кислоты в 40 мл этанола. После охлаждения до комнатной температуры реакционную смесь перемешивали еще в течение ночи, затем образовавшийся оксалат отфильтровывали и твердое вещество трижды промывали порциями по 20 мл МТБЭ соответственно. В результате получили 13,0 г [1-(4-хлор-2-бутин-1-ил)морфолин]монооксалата, tпл 144-146°С.
Б) 510 мг полученной на предыдущей стадии 2А) соли щавелевой кислоты растворяли при комнатной температуре в атмосфере защитного в 10 мл ДМФ. К этому раствору добавляли 154 мг NaN3 и перемешивали в течение 10 мин. Затем 0,6 мл триэтиламина. Образовавшуюся суспензию продолжали перемешивать в течение последующих 15 ч и полученный таким путем 1-(4-азидо-2-бутин-1-ил)морфолин без дальнейшей переработки или определения свойств использовали на последующей стадии синтеза.
В) Полученную на предыдущей стадии 2Б) суспензию азидного соединения разбавляли 60 мл этилацетата. Затем к ней добавляли 1,5 мл 55 мас. %-ного раствора (2R)-1[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)пиперазина в ТГФ, образовавшуюся смесь нагревали в течение 15 ч до кипения, после чего продолжали перемешивание в течение 3 дней при комнатной температуре. Образовавшийся в результате раствор трижды промывали порциями по 50 мл воды соответственно и органическую фазу сушили над сульфатом натрия. Образовавшийся после упаривания и сушки под вакуумом остаток с помощью комбинированной жидкостной хроматографии и масс-спектроскопии (ЖХ/МС) идентифицировали как соединение, указанное в заголовке.
Пример 2
(2R)-1[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-{[5(пиперазинометил)-2Н-1,2,3-триазол-4-ил)]метил}пиперазин
А) 1,0 г (2R)-1-13,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(4-азидо-2-бутин-1-ил)пиперазина (получение см. пример 1/вариант 1Б) синтеза) в атмосфере защитного газа растворяли в 50 мл этилацетата. К этому раствору добавляли 0,4 г трет-бутоксикарбонилпиперазина и образовавшуюся реакционную смесь нагревали в течение 8 ч при охлаждении обратным холодильником до 80°С. Затем перемешивали в течение ночи при комнатной температуре, после чего органическую фазу трижды промывали порциями по 10 мл воды соответственно. Органическую фазу сушили над сульфатом натрия и упаривали досуха под вакуумом. В результате получили 1,4 г (2R)-1[3,5-бис(трифторметил)бензоил]-2-(1-метилиндол-3-илметил)-4-{[5(4-трет-бутоксикарбонилпиперазин-1-ил)-2Н-1,2,3-триазол-4-ил]метил}пиперазина в виде желто-коричневого пенистого вещества, которое без дальнейшей очистки непосредственно использовали на последующей стадии синтеза.
Б) 330 мг полученного на предыдущей стадии 2А) соединения растворяли в 10 мл метанола, после чего к этому раствору добавляли 10 мл 1,5н. HCl в изопропаноле и образовавшуюся смесь в течение ночи перемешивали при комнатной температуре. Затем добавляли раствор из 0,4 г NaOH в 10 мл воды. Далее упаривали под вакуумом почти досуха и остаток экстрагировали 50 мл CH2Cl2. Органическую фазу промывали 100 мл воды и упаривали досуха под вакуумом. В результате получили 270 мг солянокислой соли указанного в заголовке соединения в виде пенистого вещества, tпл>200°С.
Пример 3
(2R)-1[3,5-бис(трифторметил)бензоил]-2-(1-метилиндол-3-метил)-4-{[5(морфолинометил)-2Н-1,2,3-триазол-4-ил)]метил}пиперазин
А) К суспензии из 7,4 г К2СО3 в 150 мл ТГФ сначала добавляли 50 мл 55 мас. %-ного раствора (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил) пиперазина в ТГФ, а затем 25 мл воды. К этой смеси добавляли раствор из 12,2 г трет-бутоксикарбонилангидрида в 50 мл ТГФ и в течение 12 ч перемешивали при комнатной температуре. После концентрирования реакционной смеси под вакуумом остаток растворяли в 300 мл МТБЭ и органическую фазу последовательно дважды промывали порциями по 100 мл воды, один раз 50 мл 15 мас.%-ного водного раствора винной кислоты и повторно четырежды порциями по 100 мл воды соответственно и затем сушили над сульфатом натрия/SiO2. После отфильтровывания от сушильного агента фильтрат концентрировали под вакуумом и остаток растворяли в 20 мл МТБЭ. После нагревания до 60°С добавляли 120 мл лигроина и объем снижали затем путем вакуумной перегонки примерно на 100 мл. После повторного добавления 100 мл лигроина выдерживали с целью осаждения в течение 3 дней. Затем выпавшее в осадок твердое вещество отфильтровывали, трижды промывали порциями по 30 мл лигроина соответственно и проводили под вакуумом сушку при 60°С. В результате получили 82,0 г (2R)-1-[3,5-бис(трифторметил)бензоил]-2(1H-индол-3-илметил)-4-(трет-бутоксикарбонил)пиперазина в виде твердого вещества, tпл 155-156°С.
Б) 5,0 г полученного на предыдущей стадии 3А) производного пиперазина с защитной БОК-группой растворяли при комнатной температуре в атмосфере защитного газа в 100 мл сухого ДМФ. К этому раствору добавляли 0,2 г NaH (60%-ного в минеральном масле) и продолжали перемешивание в течение 10 мин. Затем по каплям добавляли раствор из 1,9 мл CH3I в 5 мл ДМФ и по завершении процесса добавления перемешивали еще в течение 4 ч при комнатной температуре. После этого реакционную смесь сливали на смесь из 100 г льда, 18 г Na2S2О3 и 50 мл воды. Водную фазу экстрагировали смесью из 200 мл этилацетата и 100 мл МТБЭ, а органическую фазу промывали один раз водой и упаривали досуха под вакуумом. Маслянистый остаток растворяли в 100 мл метанола, промывали 50 мл диэтилового эфира и повторно упаривали досуха. В результате получили 5,5 г (2R)-1[3,5-бис(трифторметил)бензоил]-2-(1-метилиндол-3-илметил)-4-(трет-бутоксикарбонил)пиперазина в виде стекловатого твердого вещества, которое без дальнейшей очистки и определения свойств непосредственно использовали на последующей стадии синтеза.
В) 5,9 г полученного на предыдущей стадии 3Б) индолил-N-метилированного производного пиперазина растворяли в 60 мл метанола. К этому раствору медленно добавляли в общей сложности 10 мл 1H. водного HCl и в течение 48 ч перемешивали при комнатной температуре. Затем реакционную смесь растворяли в 100 мл метанола и дважды промывали порциями по 20 мл н-гексана соответственно. Метанольную фазу концентрировали под вакуумом и остаток растворяли в смеси из 100 мл воды и 100 мл МТБЭ, после чего выдерживали в течение ночи. Затем органическую фазу в виде надосадочной жидкости отделяли от водной фазы путем декантации и трижды экстрагировали порциями по 30 мл 0,1н. водного HCl соответственно. Далее органическую фазу нейтрализовывали насыщенным водным раствором K2CO3, после чего в осадок выпадала первая фракция (2R)-1[3,5-бис(трифторметил)бензоил]-2-(1-метилиндол-3-илметил)пиперазина в виде аморфного твердого вещества, которое за счет перевода в оксалат и последующей нейтрализации очищали с получением первоначального основания. Нейтрализацией водной фазы получали еще одну фракцию твердого вещества. Объединенные фракции вышеназванных твердых веществ, полученные путем фильтрации из органической и водной фаз, сушили под высоким вакуумом, получив в результате в общей сложности 4,6 г указанного выше индолил-N-метилированного производного пиперазина без защитных групп.
Г) 0,52 мл 1,4-дихлор-2-бутина подвергали взаимодействию с 1,2 г полученного на предыдущей стадии 3В) индолил-N-метилированного производного пиперазина аналогично описанному в примере 1 варианту 1А) синтеза. После хроматографии (силикагель; элюенты: этилацетат/н-гексан в соотношении 65:35 80:20) получили 840 мг (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1-метилиндол-3-илметил)-4-(4-хлор-2-бутин-1-ил)пиперазина в виде пенистого вещества, которое без дальнейшей очистки использовали на последующей стадии синтеза.
Д) 820 мг полученного на предыдущей стадии 3Г) производного хлорбутинилпиперазина подвергали аналогично описанному в примере 1 варианту 1Б) синтеза взаимодействию со 130 мг NaN3, получив в результате 760 мг (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1-метилиндол-3-илметил)-4-(4-азидо-2-бутин-1-ил)пиперазина в виде пенистого вещества, которое без дальнейшей очистки использовали на последующей стадии синтеза.
Е) 740 мг полученного на предыдущей стадии 3Д) азидосоединения растворяли в 15 мл морфолина. Затем реакционную смесь перерабатывали аналогично описанному в примере 1 варианту 1В) синтеза. После хроматографии (силикагель; элюенты: СН2Cl2/этанол) получили 470 мг указанного в заголовке соединения в виде белого твердого вещества, которое без дальнейшей очистки использовали на последующей стадии синтеза.
Ж) 440 мг соединения, полученного на предыдущей стадии 3Е) синтеза, с помощью 1 мл 1,6 н. HCl в изопропаноле аналогично описанному в примере 1 варианту 1Г) переводили в HCl-соль, получив в результате 425 мг указанного в заголовке соединения в форме дигидрохлорида и моногидрата в виде твердого вещества, tпл 192-200°С.
Пример 4
(2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-{[5(диметиламинометил)-2Н-1,2,3-триазол-4-ил]метил}пиперазин 660 мг (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1Н-индол-3-илметил)-4-(4-азидо-2-бутин-1-ил)пиперазина (получение см. в примере 1, вариант 1Б) синтеза) помещали в предварительно охлажденный до -20°С автоклав. Затем добавляли охлажденный до -20°С раствор из 2 молей диметиламина в 30 мл ТГФ. После герметизации автоклава перемешивали в течение одного дня при 70°С и при давлении 2,0-2,2 бара. Далее в тех же условиях продолжали перемешивание в течение ночи при комнатной температуре. В завершение проводили упаривание досуха, получив в результате 700 мг указанного в заголовке соединения в виде пенистого вещества.
Для образования соли 680 мг указанного в заголовке соединения растворяли в 10 мл метанола. К этому раствору добавляли 1,5 мл 1,5н. HCl в изопропаноле, после чего упаривали досуха под вакуумом. Остаток дважды растворяли в 20 мл метанола соответственно и оба раза повторно упаривали досуха. Остаток - твердое вещество - суспендировали в 10 мл МТБЭ и в течение 2 ч нагревали с обратным холодильником до кипения. После охлаждения до комнатной температуры и последующей фильтрации твердый осадок трижды промывали порциями по 10 мл МТБЭ соответственно и сушили под высоким вакуумом. Таким путем получили 670 мг указанного в заголовке соединения в виде дигидрохлорида и дигидрата, охарактеризованного, в частности, по результатам элементного анализа как аморфное твердое вещество.
С помощью описанных выше в примерах способов или аналогичных им могут быть получены также соединения формулы I, представленные в нижеследующей таблице 3. Если в этой таблице 3, равно как и далее в таблице 4, заместители R2 и R3 вместе обозначают группу «а», то оба они вместе с атомом азота, с которым они связаны, образуют описанную выше на стр. 3 циклическую группу формулы а, где R4, R5, А и n имеют соответственно значения, указанные в этих таблицах.
Другие соединения общей формулы I
Используемые сокращения: и-Pr = изопропил; Et = этил.
Представленные далее соединения из примеров 8-65 получали по автоматизированному способу.
В этих целях на каждую порцию смеси использовали раствор 0,03 ммоля (2R)-1-[3,5-бис(трифторметил)бензоил]-2(1H-индол-3-илметил)-4-(4-азидо-2-бутин-1-ил)пиперазина формулы IV (получение см. пример 1/вариант 1Б) синтеза) в 1 мл этилацетата и осуществляли соответственно взаимодействие с раствором 0,03 ммоля, предусмотренного в качестве сокомпонента реакции вторичного амина формулы V в 1 мл этилацетата, после чего разбавляли 3 мл этилацетата. Через реакционную смесь пропускали газообразный азот и каждый раз в течение 6 ч перемешивали при 70°С. Завершение реакции определяли посредством тонкослойной хроматографии. По завершении обменной реакции каждую из реакционных смесей упаривали досуха под вакуумом. Из образовавшегося остатка без дальнейшей очистки отбирали соответственно пробу, которую подвергали жидкостной хроматографии высокого разрешения (ЖХВР) и автоматической масс-спектроскопии с целью определить степень чистоты соответственно для подтверждения полученной структуры.
С помощью вышеназванного автоматизированного способа могут быть получены соединения формулы I, представленные ниже в таблице 4. Все эти соединения формулы I в таблице 4 у несущего индолилметильную группу углерода С-2 пиперазинового скелета имеют R-конфигурацию.
Другие соединения общей формулы I
№
Пример I: Капсулы, содержащие в своем составе (2R)-1-[3,5-бис(трифторметил)бензоил]-2-(1H-индол-3-илметил)-4-[(5-(морфолинометил)-2Н-1,2,3-триазол-4-ил)метил]пиперазин
Изготавливают капсулы следующего состава, каждая из которых содержит
Активное вещество, кукурузный крахмал и молочный сахар совместно с этилацетатом перерабатывают соответствующим образом с получением в результате гомогенной пастообразной смеси. Затем эту пасту измельчают и полученный гранулят помещают на металлический поддон и с целью удалить растворитель сушат при 45°С. Высушенный гранулят пропускают через дробилку, после чего в соответствующем смесителе смешивают с другими вспомогательными веществами, в качестве которых используют
и в завершение инкапсулируют, изготавливая капсулы объемом 400 мг (размер капсул 0).
Описываются новые производные N-триазолилметилпиперазина общей формулы I

где R1 обозначает водород или (низш.)алкил,
R2 обозначает (низш.)алкил, ди(низш.)алкиламино(низш.)алкил, (низш.) алкоксикарбонил(низш.)алкил, циклоалкил с 5-6 атомами углерода в цикле, пиридинил(низш.)алкил, возможно замещенный, возможно двузамещенный фенил (низш.)алкил, фенилокси(низш.)алкил, замещенный в фенильном кольце галогеном, и
R3 обозначает (низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил или С5-6циклоалкил или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют замещенное пирролидиновое кольцо или циклическую группу формулы (а)
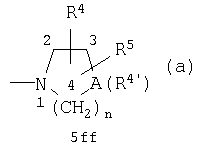
где А обозначает азот, кислород, метилен или метилиден, двойная связь которого образуется вместе со смежным атомом углерода в положении 3 группы (а), и если А обозначает азот, то этот атом азота имеет заместитель R4', в этом случае n обозначает 2 или 3, а R4' обозначает (низш.)алкил, возможно замещенный фенил(низш.)алкил, возможно замещенный пиридил, пиридил(низш.)алкил, (низш.) алкоксикарбонил(низш.)алкил, пиримидил C5-6циклоалкил, С5-6циклоалкил(низш.)алкил, или морфолинил(низш.)алкил, а R4 и R5 обозначают атом водорода, во всех других случаях n обозначает целое число от 1 до 2,
R4 обозначает водород, (низш.)алкил, (низш.)алкокси(низш.)алкил, (низш.)алкоксикарбонил, (низш.)алкоксикарбонил(низш.)алкил, ди(низш.) алкиламино(низш.)алкил, фенил, пирролидинил, пирролидинил(низш.)алкил, пиридил или пиперидинил, циклогексил, циклогексил(низш.)алкил, фенил(низш.)алкил, пиридил, однозамещенный (низш.)алкилом, фенил (низш.)алкил, однозамещенный (низш.)алкилом, пиримидил, пиридил (низш.)алкил, морфолинил (низш.)алкил,
R5 обозначает водород, (низш.)алкил или (низш.)алкокси(низш.)алкил,
или
R4 и R5 вместе взятые обозначают связанную с атомом углерода группы (а) спироэтилендиоксигруппу, связанный с двумя смежными атомами группы (а) С3-С4алкилен или аннелированный с помощью двух смежных атомов углерода группы (а) фенил,
а также их физиологически приемлемые кислотно-аддитивные соли, способы их получения, лекарственное средство на их основе и промежуточное соединение в синтезе новых соединений. Новые соединения являются антагонистами рецепторов нейрокинина и проявляют свое действие предпочтительно, в периферической области и могут быть пригодны для лечения функциональных и воспалительных расстройств желудочно-кишечного тракта. 5 н. и 5 з.п. ф-лы, 4 табл.
в которой R1 обозначает водород или (низш.)алкил,
R2 обозначает (низш.)алкил, ди(низш.)алкиламино(низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил, циклоалкил с 5-6 атомами углерода в цикле, пиридинил(низш.)алкил, возможно замещенный (низш.)алкилом в гетероциклическом ядре, возможно двузамещенный (низш.)алкоксигруппой в фенильном кольце фенил (низш.)алкил, фенилокси(низш.)алкил, замещенный в фенильном кольце галогеном, и
R3 обозначает (низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил или циклоалкил с 5-6 атомами углерода в цикле, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют пирролидиновое кольцо, замещенное (низш.)алкилом, алкокси(низш.)алкилом, пиридилом или (низш.)алкилпиридилом, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют циклическую группу формулы (а)
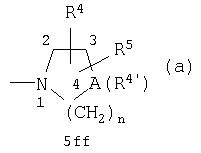
в которой А обозначает азот, кислород, метилен или метилиден, двойная связь которого образуется вместе со смежным атомом углерода в положении 3 группы (а), и если А обозначает азот, то этот атом азота имеет заместитель R4', в этом случае n обозначает 2 или 3, а R4' обозначает (низш.)алкил, возможно замещенный (низш.)алкилом фенил(низш.)алкил, возможно замещенный (низш.)алкилом пиридил, пиридил(низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил, пиримидил, циклоалкил с 5-6 атомами углерода в цикле, циклоалкил(низш.)алкил с 5-6 атомами углерода в цикле или морфолинил(низш.)алкил, а R4 и R5 обозначают атом водорода, во всех других случаях n обозначает целое число от 1 до 2,
R4 обозначает водород, (низш.)алкил, (низш.)алкокси(низш.)алкил, (низш.)алкоксикарбонил, (низш.)алкоксикарбонил(низш.)алкил, ди(низш.) алкиламино(низш.)алкил, фенил, пирролидинил, пирролидинил(низш.)алкил, пиридил или пиперидинил, циклоалкил с 6 атомами углерода в цикле, циклоалкил с 6 атомами углерода в цикле-(низш.)алкил, фенил(низш.)алкил, пиридил, однозамещенный (низш.)алкилом, фенил(низш.)алкил, однозамещенный (низш.)алкилом, пиримидил, пиридил(низш.)алкил, морфолинил (низш.) алкил,
R5 обозначает водород, (низш.)алкил или (низш.)алкокси (низш.)алкил, или
R4 и R5 вместе взятые обозначают связанную с атомом углерода группы (а) спироэтилендиоксигруппу, связанный с двумя смежными атомами группы (а) С3-С4алкилен или аннелированный с помощью двух смежных атомов углерода группы (а) фенил, а также их физиологически приемлемые кислотно-аддитивные соли.
R1 обозначает водород,
R2 обозначает (низш.)алкил, ди(низш.)алкиламино(низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил, циклоалкил с 5-6 атомами углерода в цикле, пиридинил(низш.)алкил, возможно замещенный (низш.)алкилом в гетероциклическом ядре, возможно двузамещенный (низш.)алкоксигруппой в фенильном кольце фенил (низш.)алкил, фенилокси(низш.)алкил, замещенный в фенильном кольце галогеном, и
R3 обозначает (низш.)алкил или (низш.)алкоксикарбонил(низш.)алкил, при условии, что R2 и R3 не представляют собой одновременно изобутил, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют пирролидиновое кольцо, замещенное (низш.)алкилом, алкокси(низш.)алкилом, пиридилом или (низш.)алкилпиридилом, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют циклическую группу формулы (а),
в которой
R4 обозначает водород, (низш.)алкил, (низш.)алкокси(низш.)алкил, (низш.)алкоксикарбонил, (низш.)алкоксикарбонил(низш.)алкил, ди(низш.) алкиламино(низш.)алкил, фенил, пирролидинил, пирролидинил(низш.)алкил, пиридил или пиперидинил, циклоалкил с 6 атомами углерода в цикле, циклоалкил с 6 атомами углерода в цикле-(низш.)алкил, фенил(низш.)алкил, пиридил, однозамещенный (низш.)алкилом, фенил(низш.)алкил, однозамещенный (низш.)алкилом, пиримидил, пиридил(низш.)алкил, морфолинил (низш.)алкил, а
R5 обозначает водород, (низш.)алкил или (низш.)алкокси (низш.)алкил, или
R4 и R5 оба вместе обозначают связанную с атомом углерода группы (а) спироэтилендиоксигруппу или связанный с двумя смежными кольцевыми атомами группы (а) С3-С4алкилен, или аннелированный с помощью двух смежных атомов углерода группы (а) фенил.
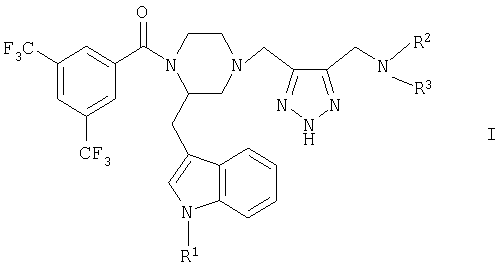
в которой R1 обозначает водород или (низш.)алкил,
R2 обозначает (низш.)алкил, ди(низш.)алкиламино(низш.)алкил, (низш.)алкоксикарбонил (низш.)алкил, циклоалкил с 5-6 атомами углерода в цикле, пиридинил(низш.)алкил, возможно замещенный (низш.)алкилом в гетероциклическом ядре, возможно двузамещенный (низш.)алкоксигруппой в фенильном кольце фенил (низш.)алкил, фенилокси(низш.)алкил, замещенный в фенильном кольце галогеном, и
R3 обозначает (низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил или циклоалкил с 5-6 атомами углерода в цикле, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют пирролидиновое кольцо, замещенное (низш.)алкилом, алкокси(низш.)алкилом, пиридилом или (низш.)алкилпиридилом, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют циклическую группу формулы (а)

в которой
А обозначает азот, кислород, метилен или метилиден, двойная связь которого образуется вместе со смежным атомом углерода в положении 3 группы а, и если А обозначает азот, то этот атом азота имеет заместитель R4', в этом случае n обозначает 2 или 3, а R4' обозначает (низш.)алкил, возможно замещенный (низш.)алкилом фенил (низш.)алкил, возможно замещенный (низш.)алкилом пиридил, пиридил(низш.)алкил, (низш.)алкоксикарбонил (низш.)алкил, пиримидил, циклоалкил с 5-6 атомами углерода в цикле, циклоалкил (низш.)алкил с 5-6 атомами углерода в цикле или морфолинил (низш.) алкил, а R4 и R5 обозначают атом водорода, во всех других случаях n обозначает целое число от 1 до 2,
R4 обозначает водород, (низш.)алкил, (низш.)алкокси(низш.)алкил, (низш.)алкоксикарбонил, (низш.)алкоксикарбонил(низш.)алкил, ди(низш.) алкиламино(низш.)алкил, фенил, пирролидинил, пирролидинил(низш.)алкил, пиридил или пиперидинил, циклоалкил с 6 атомами углерода в цикле, циклоалкил с 6 атомами углерода в цикле-(низш.)алкил, фенил (низш.)алкил, пиридил, однозамещенный (низш.)алкилом, фенил (низш.)алкил, однозамещенный (низш.)алкилом, пиримидил, пиридил(низш.)алкил, морфолинил (низш.)алкил, R5 обозначает водород, (низш.)алкил или (низш.)алкокси(низш.)алкил,
или
R4 и R5 вместе взятые обозначают связанную с атомом углерода группы (а) спироэтилендиоксигруппу, связанный с двумя смежными атомами группы (а) С3-С4алкилен или аннелированный с помощью двух смежных атомов углерода группы (а) фенил,
а также их физиологически приемлемых кислотно-аддитивных солей, отличающийся тем, что соединение общей формулы II

где R1 имеет указанные выше значения, подвергают взаимодействию с соединением общей формулы III

где R2 и R3 имеют указанные выше значения и где присутствующие реакционноспособные группы блокированы соответствующими защитными группами, и затем необязательно используемые защитные группы снова отщепляют, после чего полученное соединение формулы I при необходимости переводят в его кислотно-аддитивную соль или кислотно-аддитивную соль переводят в свободное соединение формулы I.
в которой
R1 обозначает водород или (низш.)алкил,
R2 обозначает (низш.)алкил, ди(низш.)алкиламино(низш.)алкил,
(низш.)алкоксикарбонил(низш.)алкил, циклоалкил с 5-6 атомами углерода в цикле, пиридинил(низш.)алкил, возможно замещенный (низш.)алкилом в гетероциклическом ядре, возможно двузамещенный (низш.)алкоксигруппой в фенильном кольце фенил (низш.)алкил, фенилокси(низш.)алкил, замещенный в фенильном кольце галогеном, и
R3 обозначает (низш.)алкил, (низш.)алкоксикарбонил(низш.)алкил или циклоалкил с 5-6 атомами углерода в цикле, или R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют пирролидиновое кольцо, замещенное (низш.)алкилом, алкокси(низш.)алкилом, пиридилом или (низш.) алкилпиридилом, или
R2 и R3 оба вместе с атомом азота, с которым они связаны, образуют циклическую группу формулы (а)

в которой
А обозначает азот, кислород, метилен или метилиден, двойная связь которого образуется вместе со смежным атомом углерода в положении 3 группы а, и если А обозначает азот, то этот атом азота имеет заместитель R4', в этом случае n обозначает 2 или 3, а R4' обозначает (низш.)алкил, возможно замещенный (низш.)алкилом фенил (низш.)алкил, возможно замещенный (низш.)алкилом пиридил, пиридил(низш.)алкил, (низш.)алкоксикарбонил (низш.)алкил, пиримидил, циклоалкил с 5-6 атомами углерода в цикле, циклоалкил(низш.)алкил с 5-6 атомами углерода в цикле или морфолинил (низш.)алкил, а R4 и R5 обозначают атом водорода, во всех других случаях n обозначает целое число от 1 до 2,
R4 обозначает водород, (низш.)алкил, (низш.)алкокси(низш.)алкил, (низш.)алкоксикарбонил, (низш.)алкоксикарбонил(низш.)алкил, ди(низш.) алкиламино(низш.)алкил, фенил, пирролидинил, пирролидинил(низш.) алкил, пиридил или пиперидинил, циклоалкил с 6 атомами углерода в цикле, циклоалкил с 6 атомами углерода в цикле-(низш.)алкил, фенил(низш.)алкил, пиридил, однозамещенный (низш.)алкилом, фенил(низш.)алкил, однозамещенный (низш.)алкилом, пиримидил, пиридил(низш.)алкил, морфолинил(низш.)алкил,
R5 обозначает водород, (низш.)алкил или (низш.)алкокси(низш.)алкил, или
R4 и R5 вместе взятые обозначают связанную с атомом углерода группы (а) спироэтилендиоксигруппу, связанный с двумя смежными атомами группы (а) С3-С4алкилен или аннелированный с помощью двух смежных атомов углерода группы (а) фенил,
а также их физиологически приемлемых кислотно-аддитивных солей, отличающийся тем, что соединение общей формулы IV

где R1 имеет указанные выше значения, подвергают взаимодействию с соединением общей формулы V

где R2 и R3 имеют указанные выше значения и где присутствующие реакционноспособные группы блокированы соответствующими защитными группами и затем необязательно используемые защитные группы снова отщепляют, после чего полученное соединение формулы I при необходимости переводят в его кислотно-аддитивную соль или кислотно-аддитивную соль переводят в свободное соединение формулы I.
где R1 имеет значения, указанные в п.1.
| Установка для футеровки сталеразливочных ковшей | 1979 |
|
SU899270A1 |
| Устройство для регулирования толщины прокатываемого металла | 1976 |
|
SU655442A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ АЗОЛОНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1995 |
|
RU2152392C1 |
| RU 94042252 A1, 10.10.1996 | |||
| RU 98115953 A1, 20.02.2003. | |||
Авторы
Даты
2006-12-10—Публикация
2001-07-27—Подача