Изобретение относится к органической химии и сельскому хозяйству и касается нового производного хиназолина, а именно З-гидрокси-2-тиоксо-4(3Н)хиназолинона (I), следующей формулы:
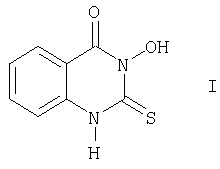
и обладающего фунгицидными и рострегулирующими свойствами, и способа его получения.
Известно, что 2-тиоксо-4(3Н)хиназолиноны показали широкий спектр биологической активности. Известны многочисленные примеры активности и предложений по применению соединений этого класса как биологически-активных соединений в различных областях, например в фармакологии и в сельском хозяйстве:
1. М.А.Е. Shaban et al., Adv. In Heterocyclic Chem., 1991, Vol.52, p.1.
2. P.S. Reddy, P.P. Reddy, T. Vasanta, Heterocycles, 2003, Vol.60, №1, p.183.
Производные 3-гидрокси-2-тиоксо-4(3Н)хиназолинонов с заместителями у гидроксильной группы также обладают различный видами активности. Так 3-трет-бутилокси- и 3-бензокси-2-тиоксо-4(3Н)хиназолиноны, которые являются промежуточными продуктами при получении противоастматических и противоаллергических соединений, были синтезированны циклизацией соответствующих амидов антраниловой кислоты с помощью сероуглерода в щелочной среде.
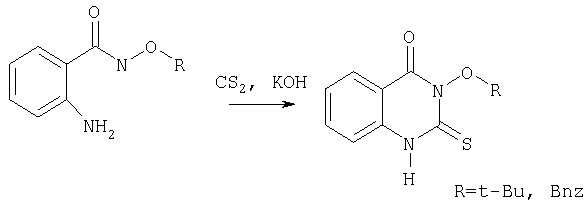
4. WO 01/70737 A1 (Sepracor Inc., US) 27.09.2001.
4-Оксо-2-тиоксозиназолин-3-илоксиуксусная кислота, обладающая фунгицидными свойствами, была получена взаимодействием соответствующего амида антраниловой кислоты с тиофосгеном:

5. DD 249910 A (A.Shahs, S. Johne, M. Sube) 23.09.1987.
Известен синтез кислородного аналога заявляемого соединения I - 3-гидрокси-2,4-диоксотетрагидрохиназолина, основанный на взаимодействии N-(алкил- или арилсульфонилокси)фталимидов с гидроксиламином.

6. Aly N.F., El-Komy M., Aly N.J., Orabi M.O A. Indian J. Chem. 1983, В 22, N 5, р.471.
7. DM 1068263 A (Bayer AG) 05.11.1959.
Однако синтез и свойства незамещенного 3-гидрокси-2-тиоксо-4(3Н)хиназолинона в литературе не описаны, а приведенные выше методы не подходят для получения заявляемого соединения.
Таким образом, описывается новое химическое соединение 3-гидрокси-2-тиоксо-4(3Н)хиназолинон следующего строения:
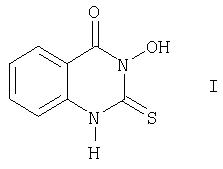
обладающее фунгицидной и рострегулирующей активностью.
Описываемый 3-гидрокси-2-тиоксо-4(3Н)хиназолинон может находиться в
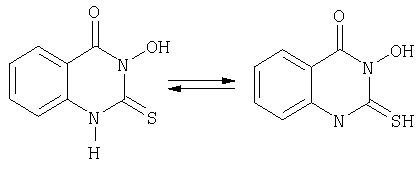
двух таутомерных формах, что характерно для всех 2-тиоксо-4(3Н)хиназолинонов.
Заявляемое соединение может найти применение в сельском хозяйстве для защиты растений от грибных болезней и для повышения продуктивности растений.
Заявляемое соединение обладает высокой фунгицидной активностью и эффективно как при обработке семян, так и при опрыскивании вегетирующих растений.
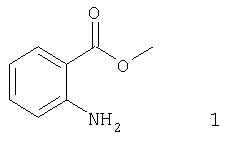
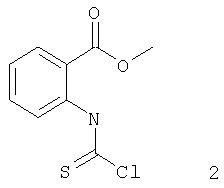
Описывается также способ получения 3-гидрокси-2-тиоксо-4(3Н)хиназолинона путем последовательного взаимодействия эфира антраниловой кислоты с тиофосгеном, ацетатом натрия и затем с гидроксиламином согласно представленной схеме:
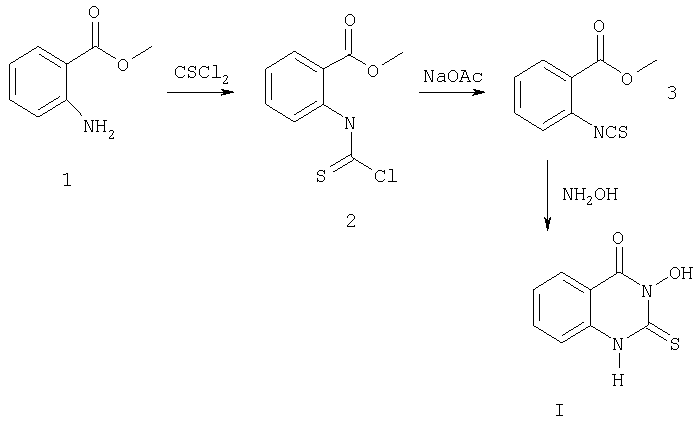
В качестве органического растворителя в реакции используется инертный апротонный растворитель, несмешивающийся с водой, например: хлористый метилен, хлороформ, дихлорэтан, бензол, толуол, ксилол, этилацетат и т.п. (лучше хлористый метилен или хлороформ). Прибавление раствора тиофосгена к смеси метилантранилата 1, органического растворителя и воды проводится при интенсивном перемешивании и охлаждении до 0-10°С. Смесь перешивают еще 2 часа при этой температуре, водный слой отделяют и к полученному раствору соединения 2 в органическом растворителе прибавляют водный раствор ацетата натрия. Перемешивают 1 час при комнатной температуре. После отделения водной фазы получают раствор метил-2-изотиоцианатобензоата 3 в органическом растворителе, который при охлаждении до 0-10°С и интенсивном перемешивании прибавляют к раствору хлоргидрата гидроксиламина и гидроксида натрия в значительном количестве воды (примерно 500-600 мл на 0,2 моля загрузки). Выпавший в результате реакции осадок 3-гидрокси-2-тиоксо-4(3Н)хиназолинона I отфильтровывают, промывают водой, растворителем, применявшимся в реакции, и высушивают при 80-90°С.
Метил-2-изотиоцианатобензоат 3, как описано выше, вводился в последующую стадию без выделения. Также можно выделить метил-2-изотиоцианатобензоат 3 из реакционной массы или использовать коммерчески доступный продукт метил-2-изотиоцианатобензоат (например, Acros Organics, Kat. №23530), а также использовать метил-2-изотиоцианатобензоат, полученный любым другим способом. В этом варианте получают 3-гидрокси-2-тиоксо-4(3Н)хиназолинон в одну стадию: раствор метил-2-изотиоцианатобензоата 3 в органическом растворителе при охлаждении до 0-10°С и интенсивном перемешивании прибавляют к раствору хлоргидрата гидроксиламина и гидроксида натрия в значительном количестве воды (примерно 500-600 мл на 0,2 моля загрузки). Выпавший в результате реакции осадок 3-гидрокси-2-тиоксо-4(3Н)хиназолинона I отфильтровывают, промывают водой, растворителем, применявшимся в реакции, и высушивают при 80-90°С.
Примеры осуществления изобретения
Пример 1
К смеси 30 г (0,2 моля) метилантранилата, 150 мл хлористого метилена и 100 мл воды 0-10°С и при интенсивном перемешивании прибавляют раствор 24 г (0,21 моля) тиофосгена в 50 мл хлористого метилена. После прибавления перемешивают еще 2 часа при 10°С, водный слой отделяют, органический слой промывают 50 мл воды. К органическому слою при 20°С и перемешивании прибавляют раствор 30 г ацетата натрия в 50 мл воды. Перемешивают 1 час при этой температуре. Органический слой отделяют, промывают 50 мл воды и затем прикалывают к раствору 13,9 г (0,2 моля) хлоргидрата гидроксиламина и 8 г (0,2 моля) гидроксида натрия в 500 мл воды при 5-10°С и интенсивном перемешивании. После прибавления температуру доводят до комнатной и перемешивают 2 часа. Отфильтровывают осадок, промывают на фильтре 100 мл хлористого метилена и 2×100 мл воды. Сушат при 80-90°С. Получают соединение I в виде белого порошка. Выход 31 г (80%). Т. пл. 252-254°С (этанол). Спектр 1Н ЯМР (ДМСО-d6, δ): 12,75 (s, 1H), 10,80 (s, 1H), 8,0 (d, 1H, J=9 Hz), 7,65 (t, 1H, J=9 Hz), 7,40 (d, 1H, J=9 Hz), 7,22 (t, 1H, J=9 Hz). Масс-спектр [M+, m/z]: 194. Элементный анализ: Найдено, %: С 48,56; Н 3,10; N 14,49. Вычислено, %: С 48,45; Н 3,12; N 14,43.
Пример 2
Раствор 38,4 г (0,2 моля) метил-2-изотиоцианатобензоата 3 в 50 мл этилацетата прикалывают к раствору 13,9 г (0,2 моля) хлоргидрата гидроксиламина и 8 г (0,2 моля) гидроксида натрия в 500 мл воды при 5-10°С и интенсивном перемешивании. После прибавления температуру доводят до комнатной и перемешивают 2 часа. Отфильтровывают осадок, промывают на фильтре 100 мл этилацетата и 2×100 мл воды. Сушат при 80-90°С. Получают белый порошок соединения I. Выход 35 г (90%). Т. пл. 252-254°С (этанол). Элементный анализ: Найдено, %: С 48,54; Н 3,11; N 14,47. Вычислено, %: С 48,45; Н 3,12; N 14,43. Спектральные данные соединения I аналогичны приведенным в примере 1.
Пример 3
Результаты биологических испытаний 3-гидрокси-2-тиоксо-4(3Н)хиназолинона.
1. Результаты испытаний in vitro
В постановке опыта определялась активность препаратов против патогенных микроорганизмов на чистой культуре патогена в условиях культивирования на агарозной среде, содержащей крахмал. Активность определялась как процент подавления развития микроорганизма по отношению к контрольному образцу.
4.2 Результаты испытаний in vivo.
Оценка биологической эффективности соединения I, против гельминтоспорозной гнили (Bipolaris sor.). Для установления фунгицидной активности семена ярового ячменя сорта Зазерский 85 протравливали на установке HEGE-11 (Германия) при норме расхода 10 л/т семян 1% к.с.препарата соединения I. В качестве эталона использовали препараты ПремикС Двести, Витавакс 200 ФФ, В.С.К., Колфуго супер колор, К.С.
Протравленные семена высевали в поле на опытных делянках. Учет проводили в фазу начала колошения (фаза 51 по Задоксу) (искусственный инфекционный фон). Результаты приведены в таблице 3.
4.3 Оценка рострегулирующей и фунгицидной активности.
Оценка рострегулирующей активности соединения I. Испытания проводили в тепличном комбинате СХПК агрофирмы "Павловская" по влиянию препарата на фотосинтез. Результаты испытаний приведены в таблице 4.
Соединение I показало не только фунгицидную активность против антракноза, аскохитоза, фузариоза; но и стимулировало рост и развитие растений. Так растения огурца под воздействием соединения I начали плодоношение раньше контрольных растений на 4 дня. Распространение болезни было снято однократной обработкой в 0.2%-ой концентрации, тогда как при использовании промышленных фунгицидов требуется 2-3 кратная обработка. При однократной обработке растений огурца заявляемое соединение в концентрации 0.2% защищало растения от антракноза.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-(2,5-ДИМЕТИЛ)ПИРАЗОЛИЛ-3-ГИДРОКСИ-4(3H)-ХИНАЗОЛИНОН, ОБЛАДАЮЩИЙ АНТИВИРУСНОЙ, АНТИБАКТЕРИАЛЬНОЙ И ФУНГИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2451683C1 |
| Способ получения гидроксамовых кислот, производных 2-арил-2,3-дигидрохиназолин-4(1Н)-онов | 2020 |
|
RU2744750C1 |
| Способ получения N-((гидроксиамино)-оксоалкил)-2-(хиназолин-4-иламино)-бензамидов | 2019 |
|
RU2722694C1 |
| ЗАМЕЩЕННЫЕ АЗАДИОКСОЦИКЛОАЛКЕНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ, ФУНГИЦИДНЫЕ СРЕДСТВА И СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ БОРЬБЫ С НЕЖЕЛАТЕЛЬНЫМИ ГРИБАМИ | 1994 |
|
RU2258066C2 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛИДИНОНА, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С ГРИБКОВЫМИ ЗАБОЛЕВАНИЯМИ | 1990 |
|
RU2092051C1 |
| Замещенные 4-нитропиразолин-5-оны, способ их получения и их применение в качестве фунгицидных средств | 2019 |
|
RU2709732C1 |
| БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА, ПОДАВЛЯЮЩИЕ ПАТОГЕННЫЕ БАКТЕРИИ | 2008 |
|
RU2402531C2 |
| ЗАМЕЩЕННЫЕ 4-ГИДРОКСИ-6-НИТРО-2-ФЕНИЛИНДОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ ИХ В КАЧЕСТВЕ ФУНГИЦИДНЫХ СРЕДСТВ И ФУНГИЦИДНЫЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2007 |
|
RU2333907C9 |
| ЦИКЛИЧЕСКИЕ АМИДЫ ИЛИ ИХ СЕЛЬСКОХОЗЯЙСТВЕННО ПРИГОДНЫЕ СОЛИ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ БОРЬБЫ С БОЛЕЗНЯМИ РАСТЕНИЙ, ВЫЗВАННЫМИ ФИТОПАТОГЕННЫМИ ГРИБАМИ | 1994 |
|
RU2126392C1 |
| Производные 4-((арил)(метил)амино)хиназолин-7-карбоновой кислоты с противоопухолевым действием и способ их получения | 2024 |
|
RU2834688C1 |
Изобретение относится к новому химическому соединению 3-гидрокси-2-тиоксо-4(3Н)хиназолинону формулы I
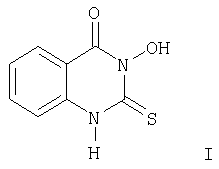
Указанное соединение обладает фунгицидной и росторегулирующей активностью. Объектом изобретения также является и способ получения указанного соединения, который заключается в том, что проводят последовательное взаимодействие эфира антраниловой кислоты с тиофосгеном, ацетатом натрия и затем гидроксиламином. 2 н.п. ф-лы, 4 табл.

обладающий фунгицидной и росторегулирующей активностью.
с тиофосгеном с получением соединения формулы 2
 ,
,
которое подвергают последующему взаимодействию с ацетатом натрия и полученное при этом соединение формулы 3

затем подвергают взаимодействию с гидроксиамином с получением соединения формулы I.
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| ЗАМЕЩЕННЫЕ 4(3Н)-ХИНАЗОЛИНОНЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНЫМИ СВОЙСТВАМИ, КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБЫ БОРЬБЫ С МУЧНИСТОЙ РОСОЙ | 1994 |
|
RU2139862C1 |
| RU 99118765 A, 27.05.2001. | |||
Авторы
Даты
2006-04-27—Публикация
2004-05-14—Подача