Настоящее изобретение относится к новым соединениям, которые могут использоваться для лечения различных нарушений клеточной пролиферации, таких как рак.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Широкий диапазон факторов роста координируют клеточную пролиферацию и дифференциацию. Злокачественные клетки появляются в результате ступенчатой прогрессии событий, которые включают нерегулируемую экспрессию факторов роста или компонентов их сигнальных путей. Случаи фосфорилирования тирозина, инициированные киназами рецепторов, цитоплазмы и ядер и регулируемые фосфатазами, являются центральными в данном процессе. Мутация, гиперактивация, транслокация и чрезмерная экспрессия тирозинкиназы белков - все они ассоциированы с образованием опухолей. Помимо увеличения скоростей пролиферации, а также иммортализации клеток, чрезмерная экспрессия тирозинкиназы может приводить к морфологической трансформации и вызывать прочную независимость, вносящую вклад в усиление миграторной способности и возможности индукции метастазов.
Было показано, что некоторые соединения со структурами, базирующимися на мимикрии АТФ, или фософотирозин являются эффективными ингибиторами. Было показано, что структуры, базирующиеся на фософотирозине, являются более избирательными ингибиторами тирозинкиназы. Ввиду их способности ингибировать фософорилирование тирозина, данные соединения могут изменять реакции клеток, факторы роста или другой процесс, управляемый активностью тирозинкиназы, включая нерегулируемый рост в результате чрезмерной экспрессии, мутации или транслокации тирозинкиназы. Ингибирование тирозинкиназы, играющее центральную роль в пролиферативных сигнальных путях метаболизма или в путях метаболизма, регулирующих структуру клеточного цитоскелета, даже временное или неполное ингибирование, может быть достаточным для перевода раковой клетки из цикла пролиферации в запрограммированную смерть клетки или апоптоз. Смерть путем апоптоза наиболее часто наблюдается при эффективном воздействии ингибиторами тирозинкиназы.
Избирательное ингибирование конкретной тирозинкиназы предполагает способ роста мишеневых раковых клеток с высокой степенью специфичности и минимальной токсичности по отношению к нормально растущим клеткам и тканям. Таким образом, специфичные ингибиторы тирозинкиназы весьма перспективны в качестве противораковых лекарственных средств. Было идентифицировано некоторое количество малых молекул, которые действуют как ингибиторы тирозинкиназы. Например, некоторые фенилакрилонитрильные соединения были описаны как ингибиторы тирозинкиназы, эффективные в отношении ингибирования клеточной пролиферации (см., например, US 5891917, US 5217999, US 5773476, US 5935993, US 5656655, US 5677329 и US 5789427).
Ингибирование тирозинкиназы предполагает один механизм, с помощью которого клеточная пролиферация может быть ингибирована. Специалисту в данной области понятно, что другие механизмы ингибирования также могут быть включены.
Имеется потребность в разработке соединения, которое бы ингибировало клеточную пролиферацию.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящее время были идентифицированы некоторые новые соединения, которые ингибируют аномальную клеточную пролиферацию, например, рост раковых клеток. Данные соединения не ингибируют рост нормальных клеток.
Соответственно, настоящее изобретение включает соединения формулы I и их соли, сольваты и гидраты:
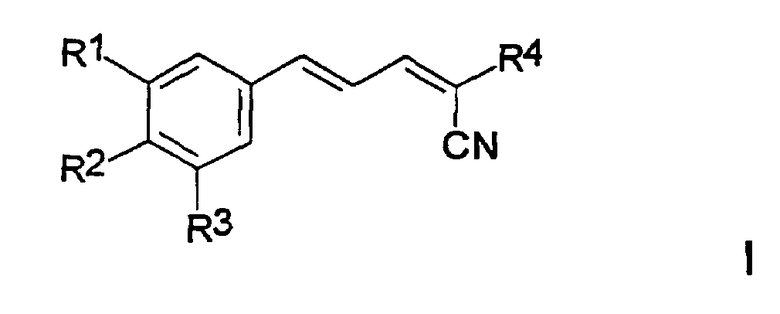
где
R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6 алкил)(C1-6алкил), SH, S-C1-6алкил, O-Si(C1-6алкил)(C1-6алкил)(C1-6 алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6 алкокси, NH2,NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
R4 выбран из группы, включающей C(X)R5, SO3Ar, NH2, NH-C1-6 алкил, N(C1-6алкил)(C1-6алкил), P(O)(OH)2, P(O)(OC1-6алкил)2 и C(NH2)=C(CN)2;
X выбран из O, S, NH и N-C1-6алкила;
R5 выбран из группы, включающей NH2, OH, NH(CH2)pAr, NH(CH2)pOH, (CH2)pOC1-6алкил, C1-6алкил, C1-6алкокси, NHNH2, NHC(O)NH2, NHC(O)C1-6алкокси, N-морфолино и N-пирролидино;
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
n равно 0-4; и
p равно 1-4.
Настоящее изобретение далее включает соединения формулы II и их соли, сольваты и гидраты:
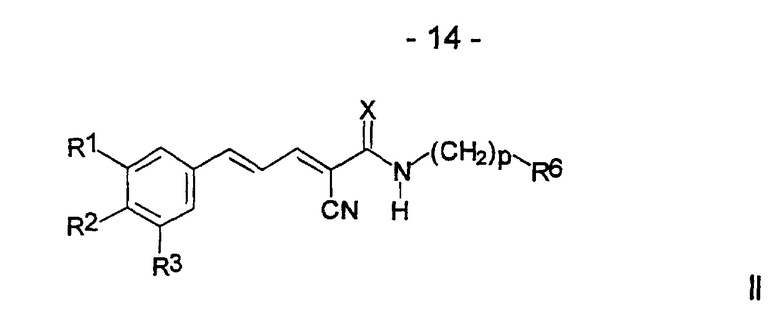
где
R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6 алкил), SH, S-C1-6алкил, O-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6 алкокси, NH2,NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
R6 выбран из группы, включающей Ar, OH и OC1-6алкил;
X выбран из О и S;
n равно 0-4; и
p равно 1-4.
Настоящее изобретение также относится к соединениям формулы III и их солям, сольватам и гидратам:
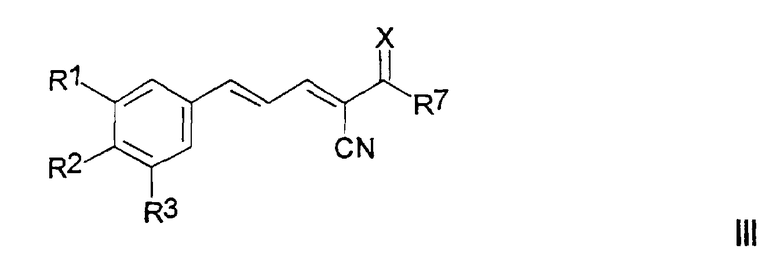
где
R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6 алкил), SH, S-C1-6алкил, O-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6 алкокси, NH2,NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
R7 выбран из группы, включающей OH, NH2 и OC1-6алкил;
X выбран из 0 и S; и
n равно 0-4.
В соответствии с другим аспектом настоящего изобретения, предложена фармацевтическая композиция, содержащая соединение по изобретению и фармацевтически приемлемый носитель или разбавитель.
В соответствии со следующим аспектом настоящего изобретения, предложен способ модулирования клеточной пролиферации, предпочтительно, ингибирования клеточной пролиферации, включающий введение эффективного количества соединения по изобретению в клетку или животному, нуждающемуся в этом. Изобретение также включает применение соединения по изобретению для модуляции клеточной пролиферации, предпочтительно, ингибирования клеточной пролиферации. Изобретение далее включает применение соединения по изобретению для получения лекарственного средства для модуляции клеточной пролиферации, предпочтительно, ингибирования клеточной пролиферации.
В предпочтительном осуществлении настоящее изобретение относится к способу ингибирования пролиферации раковой клетки путем введения эффективного количества соединения по изобретению в клетку или животному, нуждающемуся в этом. Обработанная раковая клетка может быть любого типа рака, включая лейкемию, лимфому, миелому, метастазированную карциному, саркому или любое другого вида злокачественное преобразование или какую-либо другую злокачественность. Изобретение также включает применение соединения по изобретению для модуляции пролиферации раковых клеток, предпочтительно, ингибирования пролиферации раковых клеток. Изобретение далее включает применение соединения по изобретению для получения лекарственного средства для модуляции пролиферации раковых клеток, предпочтительно, ингибирования пролиферации раковых клеток.
В другом аспекте, изобретение относится к способу модулирования активности тирозинкиназы в клетке путем введения эффективного количества соединения по изобретению. В следующем аспекте, изобретение относится к способу ингибирования активности тирозининазы в клетке путем введения эффективного количества соединения по изобретению. Настоящее изобретение также относится к применению соединения по изобретению для модуляции, предпочтительно, ингибирования активности тирозинкиназы. Настоящее изобретение далее относится к применению соединения по изобретению для получения лекарственного средства для модуляции активности тирозинкиназы, предпочтительно, ингибирования активности тирозинкиназы. Должно быть понятно, что ингибирование клеточного роста с помощью соединений по изобретению может быть осуществлено и по другим механизмам.
Другие признаки и преимущества настоящего изобретения будут понятны из следующего подробного описания. Следует учесть, однако, что подробное описание и конкретные примеры, иллюстрирующие предпочтительные осуществления изобретения, даны только в целях иллюстрации, поскольку различные изменения и модификации сущности и объема изобретения будут понятны специалисту в данной области исходя из данного подробного описания.
Краткое описание чертежей
Изобретение далее проиллюстрировано чертежами, в которых:
Фигура 1 представляет собой гистограмму, на которой показан эффект CR4 на дифференцировку клеток нормального костного мозга в культуре.
Фигура 2 представляет собой гистограмму, на которой показан лизис клеток острой лимфобластной лейкемии, положительных по филадельфийской хромосоме, в культуре при действии низких доз CR4.
Фигура 3 представляет собой гистограмму, на которой показан лизис Z119 клеток острой лимфобластной лейкемии, положительных по филадельфийской хромосоме, в культуре при действии низких доз CR4.
Фигура 4 представляет собой гистограмму, на которой показан лизис AML-3 клеток острой миелоидной лейкемии в культуре при действии низких доз CR4.
Фигура 5 представляет собой гистограмму, на которой показан лизис Ly-MN клеток лимфомы в культуре при действии низких доз CR4.
Фигура 6 представляет собой гистограмму, на которой показан лизис клеток первичной ювенильной миело-моноцитарной лейкемии при действии низких доз CR4.
Фигура 7 представляет собой гистограмму, на которой показан лизис OCI-LY2 клеток лимфомы в культуре при действии низких доз CR4.
Фигура 8 представляет собой гистограмму, на которой показан лизис ALL клеток, положительных по филадельфийской хромосоме, в культуре при действии CR17 и CR21.
Фигура 9 представляет собой гистограмму, на которой показан эффект CR17 и CR21.
Фигура 10 представляет собой гистограмму, на которой показан лизис ALL клеток, положительных по филадельфийской хромосоме, в культуре при действии CR24.
Фигура 11 представляет собой гистограмму, на которой показан лизис ALL клеток, положительных по филадельфийской хромосоме, в культуре при действии CR19.
Фигура 12 представляет собой гистограмму, на которой показан эффект CR19 на дифференцировку клеток нормального костного мозга в культуре.
Фигура 13 представляет собой гистограмму, на которой показан эффект CR24, CR17 и CR21 на дифференцировку клеток нормального костного мозга в культуре.
Фигура 14 представляет собой гистограмму, на которой показан эффект очистки in vitro нормального костного мозга с помощью CR4.
Фигура 15 представляет собой гистограмму, на которой показан эффект очистки in vitro от Z119 клеток острой лимфобластной лейкемии с помощью CR4.
Фигура 16 представляет собой гистограмму, на которой показан эффект очистки in vitro от OCI-Ly2 клеток лимфомы с помощью CR4.
Фигура 17 представляет собой гистограмму, на которой показан эффект очистки in vitro от OCI-AML-3 клеток острой миелоидной лейкемии с помощью CR4.
Фигура 18 представляет собой гистограмму, на которой показан эффект очистки in vitro от Рамос В клеток лимфомы Беркитта с помощью CR4.
Фигура 19 представляет собой гистограмму, на которой показан лизис HuNS1 клеток множественной миеломы в культуре при действии низких доз CR4.
Фигуры 20A и В представляют собой гистограмму, на которых показано клеточное окрашивание после лечения острой лимфобластной лейкемии с положительной филадельфийской хромосомой in vivo уNOD-SCID мышей.
Фигура 21 представляет собой гистограмму, на которой показан эффект очистки in vitro клеток нормальной костной ткани с помощью CR11.
Фигура 22 представляет собой гистограмму, на которой показан эффект очистки in vitro от клеток острой лимфобластной лейкемии, положительных по филадельфийской хромосоме, с помощью CR11.
Фигура 23 представляет собой авторадиограф, на котором показаны ALL клетки линии Z119 и Z181, положительные по филадельфийской хромосоме (Ph+), (5x106 клеток/точка), иммунопреципитированные антителами Bcr-Abl.
Фигура 24 представляет собой авторадиограф, на котором показаны ALL клетки линии Z119, положительные по филадельфийской хромосоме (Ph+), (5x106 клеток/точка), иммунопреципитированные антителами Jak2.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
I. Определения
Термин "C1-6алкил", как здесь используется, означает, если не указано иного, алкильные радикалы с прямой или разветвленной цепью, содержащие от одного до шести атомов углерода, и включает метил, этил, пропил, изопропил, трет-бутил и тому подобное.
Термин "C1-6алкокси", как здесь используется, означает, если не указано иного, алкокси радикалы с прямой или разветвленной цепью, содержащие от одного до шести атомов углерода, и включает метокси, этокси, пропилокси, изопропилокси, трет-бутокси и тому подобное.
Термин "C1-4алкил", как здесь используется, означает, если не указано иного, алкильные радикалы с прямой или разветвленной цепью, содержащие от одного до четырех атомов углерода, и включает метил, этил, пропил, изопропил, трет-бутил и тому подобное.
Термин "C1-4алкокси", как здесь используется, означает, если не указано иного, алкокси радикалы с прямой или разветвленной цепью, содержащие от одного до четырех атомов углерода, и включает метокси, этокси, пропилокси, изопропилокси, трет-бутокси и тому подобное.
Термин "Ar", как здесь используется, означает незамещенную или замещенную арильную и/или гетероарильную группу, которая в случае гетероарила может содержать до двух гетероатомов, где заместители независимо выбраны из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген, и включает незамещенный или замещенный фенил, фурил, тиенил, индолил, нафтил, хинолил и тому подобное.
Термин "галоген", как здесь используется, означает галоген и включает хлор, фтор, бром, йод и тому подобное.
Термин "фармацевтически приемлемая соль" означает соль добавления кислоты или соль добавления основания, которая является подходящей или совместимой для лечения пациентов.
Термин "соединение по изобретению", как здесь используется, включает любое соединение формулы I, II или III, как здесь указано (включая все его соли, сольваты или гидраты), а также конкретное соединение, обозначаемое здесь как CR1, CR2, CR3, CR4, CR5, CR8, CR9, CR11, CR12, CR13, CR14, CR15, CR16, CR17, CR18, CR19, CR20, CR21, CR24, CR27, CR28 и CR29 (включая все его соли, сольваты или гидраты).
Термин "фармацевтически приемлемая соль добавления кислоты", как здесь используется, означает любую нетоксичную органическую или неорганическую соль любого основного соединения, представленного формулами I, II и/или III, или любое из его промежуточных соединений. Иллюстративные неорганические кислоты, которые образуют подходящие соли, включают соли хлористоводородной, бромистоводородной, серной и фософорной кислот, а также соли металлов, такие как моногидроортофосфат натрия и гидросульфат калия. Иллюстративные органические кислоты, которые образуют подходящие соли, включают моно-, ди- и трикарбоновые кислоты, такие как гликолевая, молочная, пировиноградная, малоновая, янтарная, глутаровая, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, бензойная, фенилуксусная, коричная и салициловая кислоты, а также сульфоновые кислоты, такие как п-толуолсульфоновая и метансульфоновая кислоты. Могут быть получены соли либо моно, либо дикислот, и такие соли могут существовать либо в гидратированной, сольватированной, либо по существу безводной форме. Обычно, соли добавления кислот соединения формул I, II и/или III более растворимы в воде и различных гидрофильных органических растворителях и обычно характеризуются более высокой точкой плавления по сравнению с их свободно-основными формами. Выбор подходящей соли понятен специалисту в данной области. Другие не-фармацевтически приемлемые соли, например, оксалаты, могут быть использованы, например, для выделения соединений формул I, II и/или III при лабораторном применении, или для последующего преобразования в фармацевтически приемлемую соль добавления кислоты.
Термин "фармацевтически приемлемая соль добавления основания", как здесь используется, означает любую нетоксичную органическую или неорганическую соль любого кислотного соединения, представленного формулами I, II и/или III, или любое из его промежуточных соединений. Иллюстративные неорганические основания, которые образуют подходящие соли, включают гидроксид лития, натрия, калия, кальция, магния или бария. Иллюстративные органические основания, которые образуют подходящие соли, включают алифатические, алициклические или ароматические органические амины, такие как метиламин, триметиламин и пиколин или аммиак. Выбор подходящей соли понятен специалисту в данной области.
Термин "сольват", как здесь используется, означает соединение формул I, II и/или III, или фармацевтически приемлемую соль соединения формул I, II и/или III, где молекулы подходящего растворителя включены в кристаллическую решетку. Подходящий растворитель является физиологически приемлемым в назначаемых дозах. Примерами подходящего растворителя является этанол, вода и тому подобное. Когда растворителем является вода, молекулу указывают как "гидрат".
Термин "эффективное количество" или "достаточное количество" средства, как здесь используется, означает количество, достаточное для достижения успешных или желаемых результатов, включая клинические результаты, и как таковое "эффективное количество" зависит от условия, при котором его используют. Например, в случае введения средства, которое ингибирует пролиферации раковых клеток, эффективным количеством средства является, например, количество, которое достаточно для достижения уменьшения пролиферации раковых клеток в сравнении с эффектом, получаемым без введения данного средства.
Как здесь используется и как хорошо известно в данной области, "лечение" представляет собой подход к достижению успешных или желаемых результатов, включая клинические результаты. Успешные или желаемые клинические результаты могут включать, но не ограничиваются ими, ослабление или улучшение одного или нескольких симптомов или состояний, уменьшение продолжительности заболевания, стабилизированное (то есть отсутствие ухудшения) состояние заболевания, предотвращение расширения заболевания, остановку или замедление развития заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (либо частичную, либо полную), как определяемую, так и не определяемую. "Лечение" может также означать увеличение длительности жизни по сравнению с ожидаемым, если лечение не проводить.
"Временное облегчение" заболевания или нарушения означает, что продолжительность и/или нежелательные клинические проявления заболевания или нарушения уменьшены и/или время развития замедлено или продлено в сравнении с тем, если бы лечение не проводилось.
Термин "модуляция", как здесь используется, включает ингибирование или подавление действия или активности (такой как клеточная пролиферация), а также усиление действия или активности.
"Ингибировать", или "подавлять", или "уменьшать" действие или активность, такие как пролиферации раковых клеток, значит уменьшать действие или активность в сравнении с другими подобными состояниями, за исключением интересующего состояния или параметра, или, альтернативно, в сравнении с другими состояниями.
Термин "животное", как здесь используется, включает всех представителей животного мира, включая человека. Предпочтительно, животным является человек.
Термин "клетка", как здесь используется, включает разнообразные клетки. Введение соединения в клетку включает in vivo, ex vivo и in vitro обработку.
Термин "раковые клетки", как здесь используется, включает все виды раковых заболеваний или новообразований.
II. Соединения по изобретению
Были получены новые соединения, которые могут использоваться в модулировании клеточной пролиферации. Как таковые соединения могут использоваться при лечении клеточных пролиферативных заболеваний, таких как рак.
Соответственно, настоящее изобретение относится к соединениям формулы I и их солям, сольватам или гидратам:

где
R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6 алкил), SH, S-C1-6алкил, O-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6 алкокси, NH2,NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
R4 выбран из группы, включающей C(X)R5, SO3Ar, NH2, NH-C1-6 алкил, N(C1-6алкил)(C1-6алкил), P(O)(OH)2, P(O)(OC1-6алкил)2 и C(NH2)=C(CN)2;
X выбран из O, S, NH и N-C1-6алкила;
R5 выбран из группы, включающей NH2, OH, NH(CH2)pAr, NH(CH2)pOH, (CH2)pOC1-6алкил, C1-6алкил, C1-6алкокси, NHNH2, NHC(O)NH2, NHC(O)C1-6алкокси, N-морфолино и N-пирролидино;
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
n равно 0-4;
m равно 1-4; и
p равно 1-4.
В вариантах осуществления изобретения соединения формулы I являются такими, в которых R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, O-Si(C1-6 алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген. В предпочтительных вариантах осуществления изобретения R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-4 алкил, C1-4алкокси, NH2, NH-C1-4алкил, SH, S-C1-4алкил, O-Si(C1-4 алкил)(C1-4алкил)(C1-4алкил), NO2, CF3, OCF3 и галоген. В более предпочтительных вариантах осуществления изобретения R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, OCH3, O-Si(CH3)2(tBu), S-Me, SH и NO2. В наиболее предпочтительных вариантах осуществления настоящего изобретения R1 и R2 оба представляют собой OH или OCH3, или R1 представляет собой OCH3, и R2 представляет собой OH.
В следующих вариантах осуществления настоящего изобретения соединения формулы I являются такими, в которых R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2,NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, О-Si(C1-6 алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr (где n равно 0-4). В предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, OH, C1-4алкил, C1-4алкокси, NH2,NH-C1-4алкил, N(C1-4алкил)(C1-4алкил), SH, S-C1-4 алкил, NO2 и галоген. В более предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, OH, OCH3, SH, SMe, NO2 и галоген. В наиболее предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, OH и OCH3.
Варианты осуществления изобретения включают соединения формулы I, где R4 выбран из группы, включающей C(X)R5, SO3Ar, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), P(O)(OH)2, P(O)(OC1-6 алкил)2 и C(NH2)=C(CN)2 (где m равно 1-4). В предпочтительных вариантах осуществления R4 выбран из группы, включающей C(X)R5 и C(NH2)=C(CN)2. Более предпочтительно, R4 представляет собой C(X)R5. Когда R4 представляет собой C(X)R5, варианты осуществления изобретения включают соединения, где X выбран из О, S, NH и N-C1-6алкила и R5 выбран из группы, включающей NH2, OH, NH(CH2)pAr, NH(CH2)pOH, (CH2)pOC1-6алкил, C1-6алкил, C1-6 алкокси, NHNH2, NHC(O)NH2, NHC(O)C1-6алкокси, N-морфолино и N-пирролидино (где p равно 1-4). В предпочтительном осуществлении, X представляет собой О или S и R5 выбран из группы, включающей NH2, OH, NH(CH2)pAr, (CH2)POH и C1-4 алкокси, (где p равно 1-3). Наиболее предпочтительными являются соединения формулы I, где X представляет собой О и R5 выбран из группы, включающей NH2, OH, NH(CH2)pAr, NH(CH2)POH и OCH3, (где p равно 1-2).
Настоящее изобретение включает соединения формулы I, где термин "Ar" означает незамещенную или замещенную арильную и/или гетероарильную группу, которая, в случае гетероарила может содержать до двух гетератомов, где необязательные заместители независимо выбран из группы, включающей OH, C1-6 алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген; включает незамещенные или замещенные фенил, фурил, тиенил, индолил, нафтил, хинолил и тому подобное. В вариантах осуществления настоящего изобретения Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-4 заместителями, необязательно выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, NO2, CF3, OCF3 и галоген. В предпочтительных вариантах осуществления Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-2 заместителями, необязательно выбранными из группы, включающей OH, C1-4алкил, C1-4алкокси, NH2, NH-C1-4алкил, N(C1-4алкил)(C1-4алкил), SH, S-C1-4 алкил, NO2, CF3, OCF3 и галоген. В более предпочтительных вариантах осуществления Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-2 заместителями, необязательно выбранными из группы, включающей OH, OCH3, NH2, NHCH3, N(CH3)2, SH, SCH3, CF3, OCF3 и галоген. В наиболее предпочтительных вариантах осуществления Ar выбран из группы, включающей фенил и 3,4-дигидроксифенил.
Настоящее изобретение далее включает соединения формулы II и их соли, сольваты и гидраты:

где
R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6 алкил), SH, S-C1-6алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6 алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
R6 выбран из группы, включающей Ar, OH и OC1-6алкил;
X выбран из О и S;
n равно 0-4; и
p равно 1-4.
В вариантах осуществления изобретения соединения формулы II являются такими, в которых R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, О-Si(C1-6 алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген. В предпочтительных вариантах осуществления R1 и R2 каждый, независимо, выбран из группы, включающей H, OH, C1-4алкил, C1-4 алкокси, NH2, NH-C1-4алкил, SH, S-C1-4алкил, О-Si(C1-4алкил)(C1-4 алкил)(C1-4алкил), NO2, CF3, OCF3 и галоген. В более предпочтительных вариантах осуществления R1 и R2 каждый, независимо, выбран из группы, включающей H, ОН, ОСН3, О-Si(СН3)2(tBu), S-Me, SH и NO2. В наиболее предпочтительных вариантах осуществления настоящего изобретения R1 и R2 оба представляют собой OH или OCH3, или R1 представляет собой OCH3 и R2 представляет собой OH.
В следующих вариантах осуществления настоящего изобретения соединения формулы II являются такими, в которых R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr (где n равно 0-4). В предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, OH, C1-4алкил, C1-4алкокси, NH2, NH-C1-4алкил, N(C1-4алкил)(C1-4алкил), SH, S-C1-4 алкил, NO2 и галоген. В более предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, ОН, ОСН3, SH, SMe, NO2 и галоген. В наиболее предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, OH и OCH3.
Настоящее изобретение далее включает соединения формулы II, где термин "Ar" представляет собой незамещенную или замещенную арильную или гетероарильную группу, которая, в случае гетероарила может содержать до двух гетератомов, где необязательные заместители независимо выбраны из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6 алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген, и включает незамещенные или замещенные фенил, фурил, тиенил, индолил, нафтил, хинолил и тому подобное. В вариантах осуществления настоящего изобретения Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-4 заместителями, необязательно выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6 алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген. В предпочтительных вариантах осуществления Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-2 заместителями, необязательно выбранными из группы, включающей OH, C1-4алкил, C1-4алкокси, NH2, NH-C1-4алкил, N(C1-4 алкил)(C1-4алкил), SH, S-C1-4алкил, NO2, CF3, OCF3 и галоген. В более предпочтительных вариантах осуществления изобретения Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-2 заместителями, необязательно выбранными из группы, включающей OH, OCH3, NH2, NHCH3, N(CH3)2, SH, SCH3, CF3, OCF3 и галоген. В наиболее предпочтительных вариантах осуществления изобретения Ar выбран из группы, включающей фенил и 3,4-дигидроксифенил.
Соединения формулы II включают такие, в которых R6 выбран из группы, включающей Ar, OH и OC1-6алкил и p равно 1-4. В предпочтительных вариантах осуществления R6 выбран из группы, включающей Ar и OH и p равно 1-2. Наиболее предпочтительно, когда R6 представляет собой Ar, p равно 1 и когда R6 представляет собой OH, p равно 2. Когда R6 представляет собой Ar, Ar представляет собой незамещенную или замещенную арильную или гетероарильную группу, которая, в случае гетероарила может содержать до двух гетератомов, где необязательные заместители независимо выбраны из группы, включающей OH, C1-6алкил, C1-6 алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, NO2, CF3, OCF3 и галоген, и включает незамещенные или замещенные фенил, фурил, тиенил, индолил, нафтил, хинолил и тому подобное. В вариантах осуществления настоящего изобретения Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-4 заместителями, необязательно выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, NO2, CF3, OCF3 и галоген. В предпочтительных вариантах осуществления Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-2 заместителями, необязательно выбранными из группы, включающей OH, C1-4алкил, C1-4алкокси, NH2, NH-C1-4алкил, N(C1-4алкил)(C1-4алкил), SH, S-C1-4 алкил, NO2, CF3, OCF3 и галоген. В более предпочтительных вариантах осуществления изобретения Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-2 заместителями, необязательно выбранными из группы, включающей OH, OCH3, NH2, NHCH3, N(CH3)2, SH, SCH3, CF3, OCF3 и галоген. В наиболее предпочтительных вариантах осуществления изобретения Ar выбран из группы, включающей фенил и 3,4-дигидроксифенил.
Соединения формулы II далее включают такие, в которых X выбран из О и S. В вариантах предпочтительного осуществления X представляет собой O.
Настоящее изобретение также относится к соединению формулы III и его солям, сольватам и гидратам:

где
R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6 алкил), SH, S-C1-6алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6 алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
R7 выбран из группы, включающей OH, NH2 и OC1-6алкил;
X выбран из О и S; и
n равно 0-4.
В вариантах осуществления изобретения соединения формулы III являются такими, в которых R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, О-Si(C1-6 алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген. В предпочтительных вариантах осуществления R1 и R2 каждый, независимо, выбран из группы, включающей H, OH, C1-4алкил, C1-4 алкокси, NH2, NH-C1-4алкил, SH, S-C1-4алкил, О-Si(C1-4алкил)(C1-4 алкил)(C1-4алкил), NO2, CF3, OCF3 и галоген. В более предпочтительных вариантах осуществления R1 и R2 каждый, независимо, выбран из группы, включающей H, ОН, ОСН3, О-Si(СН3)2(tBu), S-Me, SH и NO2. В наиболее предпочтительных вариантах осуществления настоящего изобретения R1 и R2 оба представляют собой OH или OCH3, или R1 представляет собой OCH3 и R2 представляет собой OH.
В следующих вариантах осуществления настоящего изобретения соединения формулы III являются такими, в которых R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr (где n равно 0-4). В предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, OH, C1-4алкил, C1-4алкокси, NH2, NH-C1-4алкил, N(C1-4алкил)(C1-4алкил), SH, S-C1-4 алкил, NO2 и галоген. В более предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, ОН, ОСН3, SH, SMe, NO2 и галоген. В наиболее предпочтительных вариантах осуществления изобретения R3 выбран из группы, включающей H, OH и OCH3.
Настоящее изобретение далее включает соединения формулы III, где термин "Ar" означает незамещенную или замещенную арильную или гетероарильную группу, которая, в случае гетероарила может содержать до двух гетероатомов, где необязательные заместители независимо выбраны из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6 алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген, и включает незамещенные или замещенные фенил, фурил, тиенил, индолил, нафтил, хинолил и тому подобное. В вариантах осуществления настоящего изобретения Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-4 заместителями, необязательно выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6 алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген. В предпочтительных вариантах осуществления Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-2 заместителями, необязательно выбранными из группы, включающей OH, C1-4алкил, C1-4алкокси, NH2, NH-C1-4алкил, N(C1-4 алкил)(C1-4алкил), SH, S-C1-4алкил, NO2, CF3, OCF3 и галоген. В более предпочтительных вариантах осуществления изобретения Ar представляет собой незамещенную фенильную группу или фенильную группу, замещенную 1-2 заместителями, необязательно выбранными из группы, включающей OH, OCH3, NH2, NHCH3, N(CH3)2, SH, SCH3, CF3, OCF3 и галоген. В наиболее предпочтительных вариантах осуществления изобретения Ar выбран из группы, включающей фенил и 3,4-дигидроксифенил.
Соединения формулы III включают такие, в которых R7 выбран из группы, включающей OH, NH2 и OC1-6алкил. В предпочтительных вариантах осуществления R7 выбран из группы, включающей OH и NH2.
Соединения формулы III далее включают такие, в которых X выбран из О и S. В предпочтительных вариантах осуществления X представляет собой O.
В конкретных вариантах осуществления настоящего изобретения соединения по изобретению включают:
(Е,Е)-3-(бензиламидо)-3-стирилакрилонитрил (CR1);
(Е,Е)-2-(бензиламидо)-3-(3,4-диметоксистирил)акрилонитрил (CR2);
(Е,Е)-2-(бензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR3);
(Е,Е)-2-(бензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR4);
(Е,Е)-2-(фенилэтиламидо)-3-(3,4-диметоксистирил)акрилонитрил (CR5);
(Е,Е)-2-(фенилэтиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR8);
(Е,Е)-2-(фенилпропиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR9);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR11);
(Е,Е)-2-тиоацетамидо-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR12);
(Е,Е)-2-ацетамидо-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR13);
(Е,Е)-2-карбокси-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR14);
(Е,Е)-2-карбометокси-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR15);
(Е,Е)-2-ацетамидо-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR16);
(Е,Е)-2-ацетамидо-3-(3,4-дигидроксистирил)акрилонитрил (CR17);
(Е,Е)-2-(бензиламидо)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR18);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-стирилакрилонитрил (CR19);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR20);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR21);
(Е,Е)-2-(β-этаноламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR24);
(Е,Е)-2-(бензиламидо)-3-(4-нитростирил)акрилонитрил (CR27);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-(4-нитростирил)акрилонитрил (CR28) и
(Е,Е)-2-(1-амино-2,2-дицианоэтенил)-3-(4-нитростирил)акрилонитрил(CR29).
В предпочтительных вариантах осуществления настоящего изобретения соединения по изобретению включают:
(Е,Е)-2-(бензиламидо)-3-стирилакрилонитрил (CR1);
(Е,Е)-2-(бензиламидо)-3-(3,4-диметоксистирил)акрилонитрил (CR2);
(Е,E)-2-(бензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR3);
(Е,Е)-2-(бензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR4);
(Е,Е)-2-(фенилэтиламидо)-3-(3,4-диметоксистирил)акрилонитрил (CR5);
(E,E)-2-(фенилпропиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR9);
(E,E)-2-(3,4-дигидроксибензиламидо)-3-(3,5-диметокси-4-
гидроксистирил)акрилонитрил (CR11);
(E,E)-2-тиоацетамидо-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR12);
(Е,Е)-2-ацетамидо-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR13);
(Е,Е)-2-карбокси-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR14);
(Е,Е)-2-карбометокси-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR15);
(Е,Е)-2-ацетамидо-3-(3,4-дигидроксистирил)акрилонитрил (CR17);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-стирилакрилонитрил (CR19);
(E,E)-2-(3,4-дигидроксибензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR21) и
(Е,Е)-2-(β-этаноламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR24).
В более предпочтительных вариантах осуществления настоящего изобретения соединения по изобретению включают:
(Е,Е)-2-(бензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR4);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR11);
(Е,E)-2-ацетамидо-3-(3,4-дигидроксистирил)акрилонитрил (CR17);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-стирилакрилонитрил (CR19);
(E,E)-2-(3,4-дигидроксибензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR21) и
(Е,Е)-2-(β-этаноламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR24).
Настоящее изобретение охватывает пролекарства соединений по изобретению. Обычно, такие пролекарства представляют собой функциональные производные соединения по изобретению, которые легко преобразуются in vivo в соединение, производным которого они являются. Обычные методы отбора и получения подходящих пролекарств описаны, например, в "Design of Prodrugs" ed. Н. Bundgaard, Elsevier, 1985.
Некоторые из соединений по изобретению могут содержать по меньшей мере один центр асимметрии. Когда соединения в соответствии с изобретением содержат по меньшей мере один центр асимметрии, они могут существовать в виде энантиомеров. Когда соединения по изобретению обладают двумя или более центрами асимметрии, они могут, кроме того, существовать в виде диастереомеров. Следует учесть, что все такие изомеры и их смеси в любом соотношении входят в объем настоящего изобретения.
Настоящее изобретение включает радиомеченные формы соединений по изобретению, например, соединения по изобретению, меченные путем введения в структуру 3H или 14C или радиоактивного галогена, такого как 125I.
Соединения по изобретению могут, например, быть получены из активированного циннамильного соединения и активированного цианозамещенного метиленового соединения. Специалист в данной области, таким образом, может дать общее название соединениям по изобретению, беря за основу циннамильную часть. Однако, более подходящей могла бы быть общая номенклатура на базе акрилонитрильной группы, например, стирилакрилонитрил.
III. Способы получения соединений по изобретению
В соответствии с другим аспектом настоящего изобретения соединения по изобретению могут быть получены способами, аналогичными тем, которые известны в данной области. Таким образом, соединения по настоящему изобретению могут быть получены при осуществлении последовательности реакций, показанных на схеме 1:
Схема 1
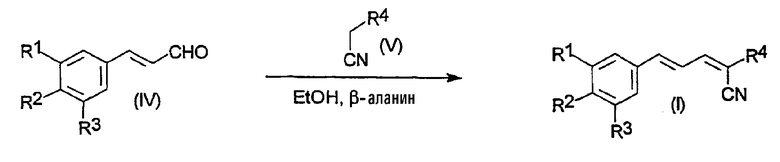
Соединения общих Формул I, II и/или III, используемые при осуществлении настоящего изобретения, могут быть получены путем конденсации по Кновенагелю α,β-ненасыщенных альдегидов, таких как циннамальдегид или его различные арил-замещенные гомологи (IV), с соединением, содержащим α-метиленовую группу (V). Подобные конденсации по Кновенагелю, использующие илиденмалононитрилы в качестве компонентов с активной α-метиленовой группой, были описаны в обзоре (F. Freeman. Chem. Rev. 1980, V. 80, P. 329-350). Например, такие конденсации могут быть осуществлены в полярном растворителе, таком как этанол, в присутствии каталитических количеств слабого основания, такого как β-аланин. Температура реакции может быть в диапазоне от 20 до 100°C, в зависимости от стабильности реагентов, используемых в реакции конденсации.
Соединения формул IV и/или V могут быть коммерчески доступными, такие как циннамальдегид, и его 3,5-диметокси-4-гидроксипроизводное. Другие соединения формул IV и/или V могут быть получены прямыми способами получения. Например, различные R1, R2, R3-гидроксизамещенные циннамальдегиды могут быть получены из соответствующих коммерчески доступных арилзамещенных циннамовых кислот. На схеме 2 представлен пример получения защищенного 3,4-дигидроксициннамальдегида (IVa), исходя из 3,4-дигидроксициннамовой кислоты (VI). В конце последовательных реакций защитные группы могут быть удалены обычными способами, хорошо известными специалистам в данной области.
Схема 2
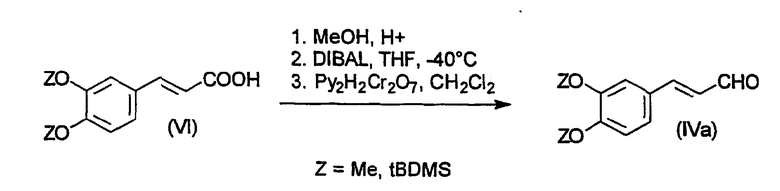
Заместители R1, R2, R3 также могут быть преобразованы из одной функциональной группы в другую, например, с помощью известной реакции восстановления нитрогрупп в аминогруппы и последующего преобразования в диалкиламиногруппы, или с помощью известного преобразования гидроксигрупп в группы галогена.
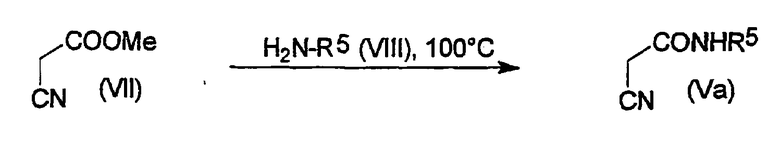
α-Цианамиды, содержащие реакционноактивную метиленовую группу (Va), могут быть получены, например, как описано A. Gazit et al. J. Med. Chem., 1991, V. 34, P. 1896-1907. Например, путем нагревания метилцианоацетата (VII) и подходящего коммерчески доступного амина (VIII) при 100°C без растворителя в течение 12-15 час с последующей вакуумной отгонкой прямо из смеси (например, используя аппарат Кугельрора), могут быть получены желаемые продукты (Схема 3).
Схема 3
В некоторых случаях химические реагенты, схематически описанные выше, могут быть модифицированы, например, с помощью использования защитных групп, для предотвращения побочных реакций, в которых участвуют реакционноспособные группы, такие как реакционноспособные группы, присоединенные в качестве заместителей. Это может быть осуществлено с помощью обычных защитных групп, например, как описано в "Protective Groups in Organic Chemistry" McOmie, J.F.W. Ed., Plenum Press, 1973, и Greene, T.W. and Wuts, P.G.M., "Protective Groups in Organic Synthesis", John Wiley & Sons, 1991.
Получение желаемой соли соединения осуществляют обычными методами. Например, нейтральное соединение обрабатывают кислотой или основанием в подходящем растворителе и образовавшуюся соль выделяют фильтрацией, экстракцией или любым другим подходящим способом.
Образование сольватов соединения по изобретению зависит от соединения и сольвата. Обычно, сольваты образуются при растворении соединения в подходящем растворителе и выделение сольвата осуществляют охлаждением или при использовании антирастворителя. Сольват обычно сушат или подвергают азеотропной перегонке в условиях окружающей среды.
Пролекарства соединения по изобретению могут представлять собой общеизвестные сложные эфиры с соответствующей гидрокси, амино или карбоксигруппой. Например, когда R1, R2 или R3 представляют собой OH в соединении формул I, II и/или III, оно может быть ацилировано с использованием активированной кислоты в присутствии основания и, необязательно, в инертном растворителе (например, хлорангидрид кислоты в пиридине). Некоторые общеизвестные сложные эфиры, которые используются в качестве пролекарств, представляют собой фениловые сложные эфиры, алифатические (C8-C24) сложные эфиры, ацилоксиметиловые сложные эфиры, карбаматы и сложные эфиры аминокислот.
Радиомеченное соединение по изобретению может быть получено обычными способами, известными в данной области. Например, тритий может быть введен в соединение по изобретению обычными способами, например, гидрированием подходящего предшественника соединения по изобретению при использовании газообразного трития и катализатора. Альтернативно, соединение по изобретению, содержащее радиоактивный йод, может быть получено из производного соответствующего триалкилолова (преимущественно, триметилолова) в обычных условиях йодирования, таких как йодид натрия [125I] в присутствии хлорамина-T в подходящем растворителе, таком как диметилформамид. Соединение триалкилолова может быть получено из соответствующего соединения не-радиоактивного галогена, преимущественно йода, в обычных условиях катализируемого палладием станнилирования, например гексаметилдиолово в присутствии тетракис(трифенилфосфин)палладия (0) в инертном растворителе, таком как диоксан, и при повышенной температуре, преимущественно, при 50-100°C.
IV. Применения
Как здесь указано, были синтезированы новые соединения формул I, II и III. Соответственно, настоящее изобретение включает все применения соединений по изобретению, включая их применение в способах лечения и композициях для модулирования клеточной пролиферации, их применение в диагностических анализах и их применение в качестве инструмента исследований.
В одном аспекте, настоящее изобретение относится к способу модулирования клеточной пролиферации, заключающемуся в введении эффективного количества соединения по изобретению в клетку или животному, нуждающемуся в этом. Предпочтительно, изобретение относится к способу ингибирования клеточной пролиферации путем введения эффективного количества соединения по изобретению в клетку или животному, нуждающемуся в этом. В частности, способ по изобретению может быть использован при ингибировании пролиферации анормальной, но не нормальной клетки. Анормальные клетки включают клетку любого типа, которая вызывает или участвует в заболевании или состоянии, и где желательно модулировать или ингибировать пролиферацию анормальной клетки для лечения заболевания или состояния. Примеры анормальной клетки включают злокачественные или раковые клетки, а также клетку, которая чрезмерно экспрессирует при состояниях воспаления.
Было установлено, что некоторые соединения по изобретению являются очень эффективными при лизисе раковой клетки, в то же самое время они не убивают нормальные клетки. Эти свойства делают соединения по изобретению весьма полезными в качестве противораковых средств. Соответственно, в одном варианте осуществления, настоящее изобретение относится к способу ингибирования пролиферации раковой клетки, заключающемуся в введении эффективного количества соединения по изобретению в клетку или животному, нуждающемуся в этом.
Раковые клетки, которые могут быть подвергнуты лечению соединением по изобретению, могут относиться к любому виду рака, включая, но не ограничиваясь этим, злокачественное гематопоэтическое новообразование, включающее лейкемию, лимфому и миелому, а также другие виды рака, включая саркому, карциному, меланому, аденому, рак нервной системы и рак мочеполовой системы. Примеры лейкемий включают острую лимфобластную лейкемию (ALL), острую миелоцитарную лейкемию (AML), хроническую миелоидную лейкемию (CML), хроническую лимфоцитарную лейкемию (CLL) и ювенильную миело-моноцитарную лейкемию (JMML). Виды ALL, которые могут быть подвергнуты лечению соединениями по изобретению, включают клетки, которые экспрессируют конъюгированный bcr-abl белок, такие как ALL клетки положительные по Филадельфийской хромосоме, а также ALL клетки отрицательные по Филадельфийской хромосоме. Примеры лимфом включают B-клеточную лимфому Беркитта, лимфомы Ходжкина, не Ходжинские лимфомы, включая Ki-1 позитивные анапластические крупноклеточные лимфомы, Т клеточные лимфомы и редкие лимфомы, такие как гистиоцитарные лимфомы. Примеры миеломы включают множественную миелому.
В конкретных вариантах осуществления настоящее изобретение относится к способу ингибирования пролиферации раковой клетки путем введения эффективного количества соединения, выбранного из группы соединений:
(Е,Е)-3-(бензиламидо)-3-стирилакрилонитрил (CR1);
(Е,Е)-2-(бензиламидо)-3-(3,4-диметоксистирил)акрилонитрил (CR2);
(Е,Е)-2-(бензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR3);
(Е,Е)-2-(бензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR4);
(Е,Е)-2-(фенилэтиламидо)-3-(3,4-диметоксистирил)акрилонитрил (CR5);
(Е,Е)-2-(фенилэтиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR8);
(Е,Е)-2-(фенилпропиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR9);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR11);
(Е,Е)-2-тиоацетамидо-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR12);
((Е,Е)-2-ацетамидо-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR13);
(Е,Е)-2-карбокси-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR14);
(Е,Е)-2-карбометокси-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR15);
(Е,Е)-2-ацетамидо-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR16);
(Е,Е)-2-ацетамидо-3-(3,4-дигидроксистирил)акрилонитрил (CR17);
(Е,Е)-2-(бензиламидо)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR18);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-стирилакрилонитрил (CR19);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR20);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR21);
(Е,Е)-2-(β-этаноламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR24);
(Е,Е)-2-(бензиламидо)-3-(4-нитростирил)акрилонитрил (CR27);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-(4-нитростирил)акрилонитрил (CR28) и
(Е,Е)-2-(1-амино-2,2-дицианоэтенил)-3-(4-нитростирил)акрилонитрил (CR29).
В предпочтительном осуществлении, настоящее изобретение относится к способу ингибирования пролиферации раковой клетки, заключающемуся в введении эффективного количества соединения, выбранного из группа соединений:
(Е,Е)-2-(бензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR4);
(E,E)-2-(3,4-дигидроксибензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR11);
(Е,Е)-2-ацетамидо-3-(3,4-дигидроксистирил)акрилонитрил (CR17);
(Е,Е)-2-(3,4-дигидроксибензиламидо)-3-стирилакрилонитрил (CR19);
(E,E)-2-(3,4-дигидроксибензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR21) и
(Е,Е)-2-(β-этаноламидо)-3-(3,5-диметокси-4-гидроксистирилакрилонитрил (CR24).
Специалист в данной области может определить, какие соединения по изобретению могут быть использованы для лечения, например, для ингибирования клеточной пролиферации при любом типе рака или нарушении клеточной пролиферации. Соединения могут быть исследованы на эффективность ингибирования клеточного роста при анализах клеточной пролиферации, таких как описано в примерах 35-56. Таким образом, настоящее изобретение включает в себя только те способы, применения и композиции, которые обладают желаемым эффектом.
Способность соединения по данному изобретению ингибировать рост раковых клеток, в особенности злокачественных гемопоэтических клеток, оценивали in vitro и in vivo. Было обнаружено, что несколько исследуемых соединений в субмикромолярных дозах ликвидируют рост раковых клеток в культуре. В частности, было показано, что CR4, CR11 и CR19 являются высокоэффективными против различных клеточных типов, таких как острая лимфобластная лейкемия, лейкемия с положительной филадельфийской хромосомой и острая миелоидная лейкемия. Низкие наномолярные дозы как CR4, так и CR19 были высокотоксичны в отношении раковых клеток, и при этом не влияли на рост и дифференцировку нормальных клеток. Такое действие было обнаружено при долговременной инкубации с низкими дозами соединений. Таким образом, в первом аспекте настоящее изобретение относится к способу ингибирования пролиферации гемопоэтических раковых клеток путем введения в клетку или в организм животного, нуждающегося в таком введении, эффективного количества соединения по настоящему изобретению, предпочтительно, CR4 или CR11 или CR19.
Было показано, что соединение CR4 способно эффективно лизировать клетки острой лимфобластной лейкемии человека с положительной филадельфийской хромосомой in vivo на мышиной модели. CR4 эффективно снижает опухолевую нагрузку и инфильтрацию органов ALL клетками. Дозы, необходимые для уничтожения раковых клеток, не причиняют заметный вред организму животного.
Также было показано, что соединения по настоящему изобретению, такие как CR4 и CR11, эффективны в качестве ex vivo агентов для очистки. Для введения ex vivo клетки костной ткани могут быть взяты у пациента с раком и очищены ex vivo соединением по настоящему изобретению. Такая очистка уничтожает опухолевые клетки, оставляя нормальные клетки костной ткани интактными. После очистки клетки могут быть промыты и снова введены пациенту.
В процессе ex vivo очистки клетки инкубируют с относительно высокими дозами соединения (50 мкМ-100 мкМ) в течение короткого промежутка времени (1-24 часа), что приводит к прекращению роста раковых клеток, при этом нормальные клетки костного мозга при тех же дозах и за тот же период времени остаются относительно неповрежденными. Смерть раковых клеток индуцируется апоптозом. Таким образом, в соответствии с другим аспектом настоящее изобретение относится к способу, включающему лизирование раковых клеток при ex vivo обработке костного мозга, взятого у пациента с раком, соединением по изобретению, предпочтительно CR4 и CR11, и затем введение обработанной (или очищенной) костной ткани пациенту.
Кроме рака соединения по изобретению могут использоваться для лечения других состояний, связанных с абберантной или ненормальной клеточной пролиферацией. Другие нарушения клеточной пролиферации, которые могут подвергаться лечению по настоящему изобретению, включают воспалительные заболевания, аллергии, аутоиммунные заболевания, отторжение трансплантата, псориаз, рестеноз, артериосклероз и любые другие расстройства, при которых необходимо ингибировать, предупредить или подавить клеточный рост. Соединения по изобретению могут быть исследованы на эффективность при конкретных расстройствах клеточной пролиферации, используя способы и методики, известные специалистам в данной области. Например, в следующих ссылках представлены способы анализа различных состояний. Ревматоидный артрит: "Regulation of IL-15 - Simulated TNF-alpha Production by Rolipram", Journal of Immunology (1999), volume 163, page 8236, by C. S. Kasyapa et al. Аллергия: "A novel Lyn-Binding Peptide Ingibitor Blocks Eosinophil Differentiation, Survival, and Airway eosinophilic inflammation", Journal of Immunology (1999), volume 163, page 939, by T. Adachi et al. Псориаз: Journal of Immunology (2000), volume 165, page 224, "Inhibition of Keratinocyte apoptosis by IL-15: a new paramete in the pathegenosis of psoriasis", by R. Bchert. Псориаз: International Archives of allergy and Immunology (2000), volume 123, страница 275, "T-cell receptor mimic peptides and their potential application in T-cell mediated disease", by A. Н. Enk.
Соединения по изобретению являются тирозинкиназными модуляторами и могут использоваться для модулирования активности тирозинкиназы, в том числе для ингибирования активности тирозинкиназы, при лечении различных состояний, таких как указанные выше пролиферативные нарушения. Таким образом, изобретение относится к способу модулирования активности тирозинкиназы путем введения эффективного количества соединения по настоящему изобретению в клетку или в организм животного, нуждающегося в таком введении. В соответствии с другими аспектами, настоящее изобретение относится к способу ингибирования активности тирозинкиназы путем введения эффективного количества соединения по настоящему изобретению в клетку или в организм животного, нуждающегося в таком введении.
Так как соединения по настоящему изобретению могут ингибировать активность тирозинкиназы, то специалисту в данной области будет понятно, что возможны другие способы или механизмы действия соединений по настоящему изобретению.
Соединения по изобретению предпочтительно получают в виде фармацевтических композиций для введения человеку в биологически сочетаемой форме, подходящей для введения in vivo. Таким образом, в соответствии с другим аспектом, настоящее изобретение относится к фармацевтической композиции, которая включает в себя соединение по изобретению в смеси с подходящим разбавителем или носителем.
Композиции, содержащие соединения по изобретению, могут быть получены известными способами для получения фармацевтически приемлемых композиций, которые могут быть введены субъектам, с эффективным количеством активного вещества в сочетании со смесью фармацевтически приемлемого носителя. Подходящие носители описаны, например, в Remington's Pharmaceutical Sciences (Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., USA 1985). Основываясь на этих принципах, композиции включают в себя, но не ограничиваются этим, растворы веществ в смеси с одним или несколькими фармацевтически приемлемыми носителями или разбавителями, находятся в буферных растворах с подходящим pH и имеют изоосмотичность физиологических жидкостей.
Соединения настоящего изобретения могут быть использованы в форме свободного основания, в форме солей, сольватов или в виде гидратов. Все формы включены в объем настоящего изобретения. Могут быть получены соли добавления кислот, которые представляют собой более удобную форму для применения; в частности, применение в форме соли главным образом относится к использованию формы основной соли. Кислоты, которые могут использоваться для получения солей добавления кислот, предпочтительно включают в себя такие кислоты, которые при объединении со свободным основанием образуют фармацевтически приемлемые соли, которые представляют собой соли анионов, нетоксичные для животного организма в фармацевтических дозах солей, и таким образом, побочные эффекты, приписываемые анионам, не влияют на полезные свойства, присущие свободному основанию. Хотя предпочтительными являются фармацевтически приемлемые соли основных соединений, в качестве источника свободного основания могут использоваться все соли добавления кислот, даже если конкретная соль по существу необходима лишь в качестве промежуточного продукта, как, например, в том случае, когда соль получают для очистки и идентификации или когда ее используют в качестве промежуточного соединения для получения фармацевтически приемлемой соли ионно-обменными способами.
Фармацевтически приемлемые соли, входящие в объем настоящего изобретения, включают в себя производные, полученные из перечисленных далее кислот: минеральных кислот, таких как хлористоводородная кислота, серная кислота, фосфорная кислота и сульфаминовая кислота; и органических кислот, таких как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, циклогексилсульфамовая кислота, хинная кислота и тому подобное.
В соответствии со способами по настоящему изобретению, описанные соединения или их соли, или сольваты могут вводиться пациенту в виде различных форм, в зависимости от выбранного пути введения, что будет понятно специалисту в данной области. Композиции данного изобретения могут вводиться перорально или парентерально. Парентеральный путь введения включает в себя внутривенное, внутрибрюшинное, подкожное, внутримышечное, чрескожное, назальное, внутрилегочное, интратрахеальное, ректальное и местное введение. Парентеральное введение может быть продолжительной инфузией в течение выбранного периода времени.
Соединение по изобретению или его соль, или сольват может вводиться перорально, например, с инертным разбавителем или съедобным усваивающимся носителем, или соединение может находиться в твердой или мягкой желатиновой капсуле, или быть спрессовано в таблетку, или может вводиться непосредственно в пищу. Для перорального введения при лечении, соединение по данному изобретению может вводиться вместе с наполнителем и использоваться в форме таблеток, покрытых рассасываемой оболочкой, буккальных таблеток, троше, капсул, эликсиров, суспензий, сиропа, пластыря и тому подобное.
Соединение по данному изобретению может также вводиться парентерально или интраперитонеально. Растворы соединений по настоящему изобретению в виде свободного основания или фармацевтически приемлемой соли или сольвата могут быть подходящим образом разведены в воде, смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии также могут быть получены в глицерине, жидких полиэтиленгликолях, ДМСО и их смесях, вместе со спиртом или без него и в маслах. В обычных условиях хранения и применения данные препараты включат в себя консерванты для предотвращения роста микроорганизмов. Специалисту в данной области будет понятно, как получить соответствующие препараты. Традиционные методики и ингредиенты для выбора и приготовления соответствующих препаратов описаны, например, в Remington's Pharmaceutical Sciences (1990 - 18 издание) и в The United States Pharmacopeia: The National Formulary (USP 24 NF19), опубликованной в 1999.
Фармацевтические формы, подходящие для применения в виде инъекции, включают стерильные водные растворы или дисперсии, и стерильные порошки для приготовления стерильных растворов и дисперсий для инъекции непосредственно перед введением. Во всех случаях форма должна быть стерильна и до определенной степени жидкая для легкости введения через шприц.
Соединения по настоящему изобретению могут вводиться животному как таковые или в сочетании с фармацевтически приемлемыми носителями, указанными выше, пропорция которых определяется растворимостью и химической природой соединения, выбранного пути введения и стандартным фармацевтическим способом.
Доза соединения и/или композиции по настоящему изобретению при введении животному, которое подвергается лечению, может изменяться в зависимости от многих факторов, таких как фармакодинамические свойства соединения, способа введения, возраста, общего самочувствия и веса реципиента, природы и выраженности симптомов, частоты лечения и типа сопутствующего лечения, если таковое проводится, от степени чистоты соединения. Основываясь на вышеперечисленных факторах, специалист в данной области может определить подходящую дозу. Соединения по настоящему изобретению могут вводиться сначала в подходящей дозе, которая при необходимости может быть увеличена в зависимости от ответа организма. Так, например, соединение по настоящему изобретению может вводиться в пределах от около 1 наномоля до около 100 микромолей, предпочтительно от 50 наномолей до 50 микромолей. При обработке клеток ex vivo за короткий период времени, например, за период от 30 минут до 1 часа или дольше, могут вводиться более высокие дозы соединения, чем за продолжительный период при лечении in vivo; например, могут применяться концентрации 50 мкМ или выше.
Настоящее изобретение также относится к применению соединения или композиции по данному изобретению для ингибирования клеточной пролиферации, предпочтительно, для ингибирования пролиферации раковых клеток. Настоящее изобретение, кроме того, относится к применению соединения или композиции по настоящему изобретению для получения лекарственного средства для ингибирования клеточной пролиферации, предпочтительно пролиферации раковых клеток.
Соединения по данному изобретению могут использоваться самостоятельно или в сочетании с другими агентами, которые модулируют активность тирозинкиназы или в сочетании с другими видами лечения (которые могут или не могут модулировать активность тирозинкиназы) при нарушении клеточной пролиферации. Известные в данной области агенты, которые ингибируют активность тирозинкиназы, включают в себя, но не ограничиваются ими, антисмысловую нуклеиновую кислоту и рибосомы, нацеленные на нуклеиновую кислоту, кодирующую рецептор тирозинкиназы, антитела, способные модулировать активность тирозинкиназы, и другие низкомолекулярные ингибиторы тирозинкиназы, такие как описанные в патентах США 5891917, 5217999, 5773476, 5935993, 5656655, 5677329 и 5789427. Существуют различные примеры других видов лечения нарушений клеточной пролиферации, применяемых в настоящее время для лечения различных типов злокачественных опухолей. Основные способы лечения основаны на типе рака и специфически не нацелены на активность тирозинкиназы. В частном аспекте настоящего изобретения, соединения по данному изобретению могут применяться в сочетании с другими способами лечения лейкемии.
В дополнение к указанным выше способам терапевтического использования, соединения по данному изобретению также могут быть использованы в диагностических целях, методах скринирования и как инструмент для исследований.
В диагностических целях соединения по данному изобретению могут быть использованы для идентификации и обнаружения нарушений клеточной пролиферации. В таком воплощении соединения по данному изобретению могут быть радиоактивно мечены (как описано выше) и взаимодействовать с популяцией клеток. Присутствие радиометки в клетках может указывать на нарушение клеточной пролиферации. В отдельном воплощении, радиомеченные соединения по данному изобретению могут быть использованы для определения наличия клеточной экспрессии конъюгированного bcr-abl белка.
В методах сканирования, соединения по изобретению могут быть использованы для идентификации других соединений, которые модулируют клеточную пролиферацию или активность тирозинкиназы. В качестве инструмента для исследований, соединения по данному изобретению могут быть использованы в методах рецепторного связывания и методах для исследования локализации тирозинкиназы. В таких методах соединения могут также радиоактивно метиться.
Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его:
ПРИМЕРЫ
Материалы и способы для примеров 1-34
1H ЯМР спектр получали на спектрометре Varian Unity Plus (USA) при 500 МГц с тетраметилсиланом (TMS, Me4Si) в качестве внутреннего стандарта (δ=0). Спектр электронной масс-спектрометрии записывали на триплетном четырехполюсном масс-спектрометре API III Plus (USA), при непосредственном введении образцов в источник ионизации. Тонкослойную хроматографию проводили на пластинах UV-254 для ТСХ со стороной, покрытой алюминием, и толщиной 0,25 мм (Kieselgel 60 F254, Merck, Germany). ВЭЖХ для выделения соединения примера 13 проводили на хроматографе Waters 600 (USA), колонке Nova-Pak C18 3,9 x 300 мм (Waters, USA). Вакуумную дистилляцию проводили, используя устройство Kugelrohr (Aldrich, USA) при установленных температурах в термостате.
3,5-Диметокси-4-гидроксициннамальдегид, 4-нитроциннам-альдегид, 3,4-диметоксициннамовую кислоту, 3,4-дигидроксициннамовую кислоту, 3,4-диметоксибензиламин, бензиламин, фенилэтиламин, фенилпропиламин, метилцианоацетат, 2-цианотиоацетамид, 2-цианоацетамид, цианоуксусную кислоту, β-этаноламин, 2-амино-1-пропен-1,1,3-трикарбонитрил приобретали у Aldrich (USA) и использовали, следуя общепринятым правилам. Реагенты были получены у Aldrich (USA). Растворители приобретали у Caledon (Canada).
Пример 1: N-(Цианоацетил)-3,4-диметоксибензиламид (A1)
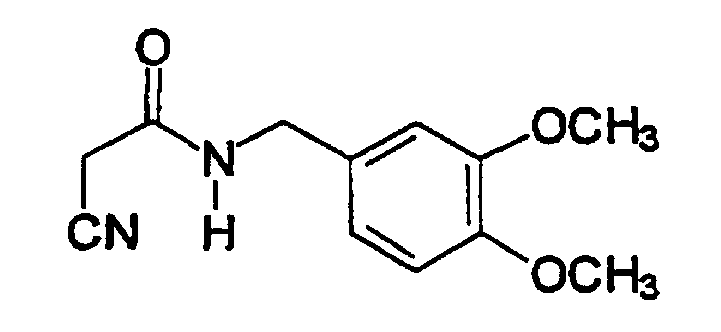
К 3,4-диметоксибензиламину (2,7 мл, 18 ммоль) добавляют метилцианоацетат (1,6 мл, 18 ммоль). Реакционную смесь нагревают в течение 14 час при 100°C. При охлаждении образуется твердое вещество темно-коричневого цвета, который перекристаллизовывают из этанола с получением 2,90 г твердого вещества (69% выход). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 3,62 (с, 2H, CH2CN), 3,78 (с, 6H, (OMe)2), 4,34 (уш.с, 2H, NHCH2Ph), 6,84 (дд, 1H, J 1,95 и 8,1 Гц, H6), 6,88 (д, 1H, J 8,1 Гц, H5), 6,93 (д, 1H, J 1,95 Гц, H2), 7,80 (уш.с, 1H, NH).
MS, m/e (отн. интенсивность, %): 235 (19) [M+H]+, 252 (100) [М+NH4]+, 257 (33) [M+Na]+.
Пример 2: N-(Цианоацетил)-3,4-дигидроксибензиламид (A2)
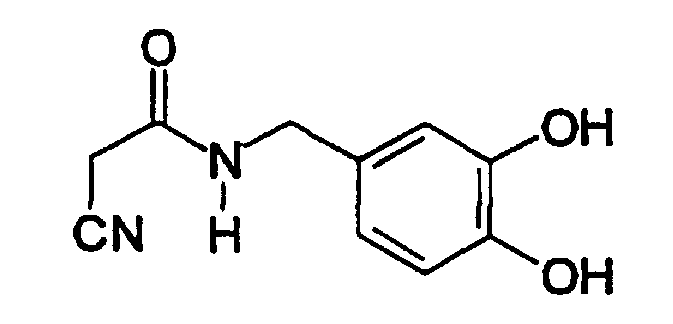
К N-(цианоацетил)-3,4-диметоксибензиламиду (пример 1, 0,2 г, 0,85 ммоль) в 20 мл CH2Cl2 в атмосфере аргона добавляют трибромид при -78°C (0,24 мл, 2,56 ммоль) в 2,5 мл CH2Cl2. Через 2 час реакционную смесь нагревают до комнатной температуры и перемешивают в течение ночи. Реакционную смесь охлаждают до 0°C, добавляют 10 мл 1н. HCl, раствор экстрагируют 3 x 50 мл этилацетата, органическую фазу промывают до нейтрального pH, сушат MgSO4 и обрабатывают досуха. Остаток очищают хроматографией на силикагеле (CHCl3-MeOH, 20:1) с получением твердого вещества желтого цвета (0,07 г, 40% выход). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,83 (с, (OH)2), 3,60 (с, 2H, CH2CN), 4,25 (уш.с, 2H, NHCH2Ph), 6,63 (дд, 1H, J 1,95 и 8,1 Гц, H6), 6,75 (д, 1H, J 8,1 Гц, H5), 6,79 (д, 1H, J 1,95 Гц, H2), 7,71 (уш.с, 1H, NH).
MS, m/e (отн. интенсивность, %): 207 (38) [М+NH4]+, 224 (100) [М+NH4]+, 229 (2,6) [M+Na]+.
Пример 3: (E,E)-2-(3,4-Дигидроксибензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR11)
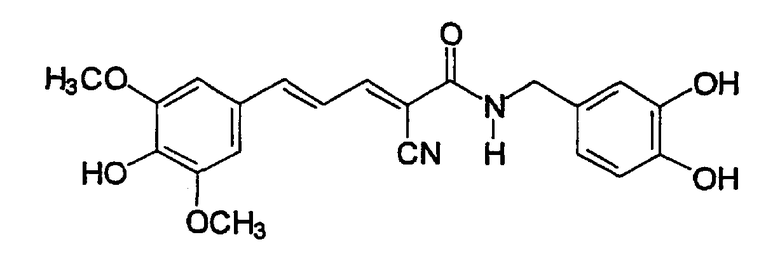
К 3,5-диметокси-4-гидроксициннамальдегиду (0,042 г, 0,2 ммоль) и N-(цианоацетил)-3,4-дигидроксибензиламиду (пример 2, 0,042 г, 0,2 ммоль) в 10 мл этанола добавляют 3 мг β-аланина и реакционную смесь кипятят с обратным холодильником в течение 6 час. Добавляют воду и твердое вещество дважды перекристаллизовывают из 5 мл этанола с получением 0,06 г (75%) твердого вещества красного цвета. Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,81 (с, (OH)2), 3,89 (с, 6H, (OMe)2), 4,39 (уш.с, 2H, NHCH2Ph), 6,68 (дд, 1H, J 1,95 и 8,1 Гц, H6'), 6,76 (д, 1H, J 8,1 Гц, H5'), 6,86 (д, 1H, J 1,95 Гц, H2'), 7,07 (уш.с, 2H, H2+6), 7,16 (дд, 1H, J 11,7 и 15,1 Гц, олефиновые PhCCHCCN), 7,37 (д, 1H, J 15,1 Гц, олефиновые PhCH), 7,70 (уш.с, 1H, NH), 7,98 (дд, 1H, J 0,75 и 11,7 Гц, олефиновые CHCN). MS, m/e (отн. интенсивность, %): 397 (100) [M+H]+, 414 (14) [M+NH4]+.
Пример 4: N-(Цианоацетил)бензиламид (А3)
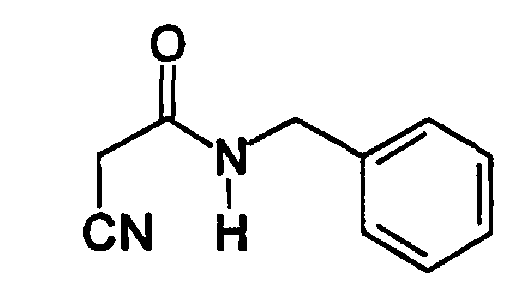
Соединение получают, как описано в примере 1, путем прибавления метилцианоацетата (1,3 мл, 14 ммоль) к бензиламину (1,5 мл, 14 ммоль). Соединение отгоняют в вакууме прямо из реакционной смеси (аппарат Кугельрора (Kugelrohr apparatus (Aldrich) при 0,1 мм ртутного столба. Т. бани 180-190°C) с получением не совсем белого твердого вещества (2,34 г, 95%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 3,39 (с, 2H, CNCH2), 4,46 (д, 2H, J 5,4 Гц, NHCH2Ph), 6,40 (уш.с, 1H, NH), 7,24-7,36 (м, 5H, Ph).
MS, m/e (отн. интенсивность, %): 175 (64) [M+Н]+, 192 [M+NH4]+.
Пример 5: 3,4-Диметоксициннамиловый спирт (A6)
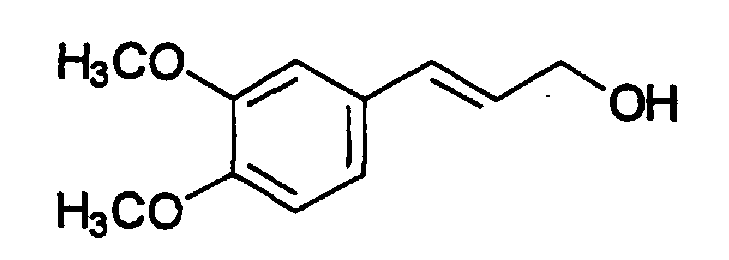
К раствору 0,42 г (2,0 ммоль) 3,4-диметоксициннамовой кислоты в 50 мл MeOH добавляют SOCl2 (50 мкл) и смесь перемешивают при 60°C в течение 5 час. Метанол упаривают досуха и полученный метиловый эфир 3,4-диметоксициннамовой кислоты восстанавливают в абсолютном ТГФ (50 мл) при 20°C 1M раствором диизобутилалюминийгидрида в ТГФ (8,0 ммоль) в течение 1 час. Добавляют воду, смесь экстрагируют EtOAc, сушат MgSO4 и отгоняют в вакууме (аппарат Кугельрора (Aldrich) при 0,1 мм ртутного столба. T. бани 185-190°C) с получением не совсем белого твердого вещества, выход 0,36 г (92%), т. пл. 70-71°C. Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 3,77, 3,82 (2 x с, 2 x 3H, OMe + OMe), 4,19 (д, 2H, J 5,0 Гц, CH2OH), 6,25 (дт, 1H, J 5,0 и 15,5 Гц, олефиновые PhCCH), 6,51 (д, 1H, J 15,5 Гц, олефиновые PhCH), 6,89 (м, 2H, H5+6), 7,05 (уш.с, 1H, H2).
MS, m/e (отн. интенсивность, %): 177 (100) [M-OH]+, 195 (4) [M+H]+, 212 (59) [M+NH4]+, 217 (26) [M+Na]+.
Пример 6: 3,4-Диметоксициннамальдегид (A7)
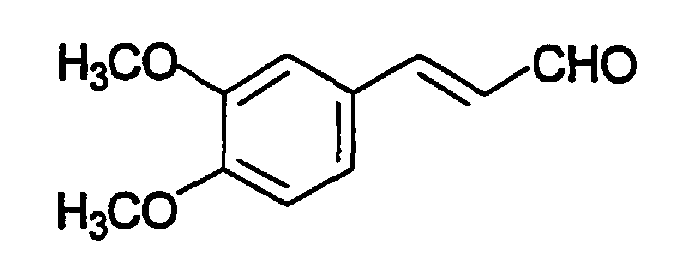
К смеси пиридиний дихромата (3,88 г, 10,3 ммоль) и 4 г тщательно отшлифованных свежеактивированных молекулярных сит 3A в 20 мл CH2Cl2 добавляют 3,4-диметоксициннамилового спирта в 10 мл CH2Cl2 (пример 5, 1,00 г, 5,1 ммоль). Реакционную смесь перемешивают в течение 2 час, добавляют 0,5 мл метанола, остаток пропускают через силикагель и промывают 300 мл этилацетата. После упаривания соединение очищают хроматографией на силикагеле (гексан-EtAc, 5:1), что приводит к получению кристаллизующегося масла (0,62 г, 63%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 3,90 (2 x с, 2 x 3H, OCH3 + OCH3), 6,70 (дд, 1H, J 7,6 и 16,0 Гц, PhC=CH олефиновые), 7,05 (д, 1H, J 8,3 Гц, H5), 7,28 (дд, 1H, J 1,4 и 8,3 Гц, H6), 7,37 (д, 1H, J 1,4 Гц, H2), 7,60 (д, 1H, J 16,0 Гц, PhCH олефиновые), 9,65 (д, 1H, J 7,6 Гц, CHO).
MS, m/e (отн. интенсивность, %): 193 (100) [M+H]+, 210 (26) [M+NH4]+.
Пример 7: (E,E)-2-(Бензиламидо)-3-(3,4-диметоксистирил) акрилонитрил (CR2)
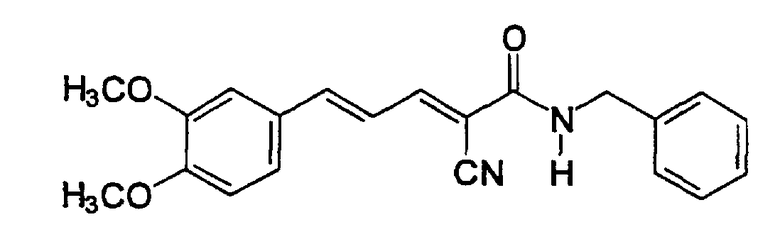
Соединение получают, как описано в примере 3, путем прибавления 3,4-диметоксициннамальдегида (пример 6, 0,04 г, 0,2 ммоль) к N-(цианоацетил)бензиламиду (пример 4, 0,036 г, 0,2 ммоль). После кипячения с обратным холодильником в течение 1 час и перекристаллизации из этанола получают твердое вещество желтого цвета (0,045 г, 62%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 3,90 (с, 2 x 3H, OMe + OMe), 4,57 (д, 2H, J < 2 Гц, NHCH2Ph), 7,08 (уш.с, 1H, H2), 7,17 (дд, 1H, J 11,5 и 15,2 Гц, олефиновые PhCCHCCN), 7,23-7,42 (м, 8H, ароматические + H5 + H6 + олефиновые PhCH), 7,90 (уш.т, 1H, NH), 8,05 (дд, 1H, J 0,55 и 11,5 Гц, CHCN олефиновые).
Пример 8: (E,E)-2-(Бензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR4) - Способ A
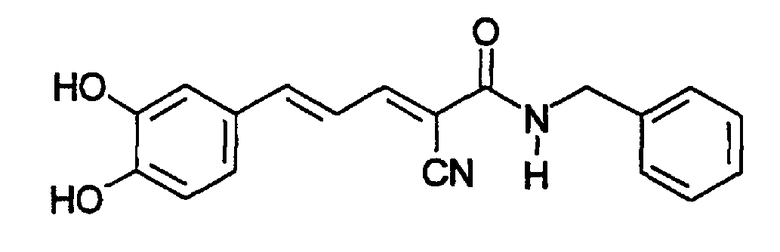
К (E,E)-2-(бензиламидо)-3-(3,4-диметоксистирил) акрилонитрилу (пример 7, 0,04 г, 0,11 ммоль) добавляют трибромид бора (0,033 мл, 0,34 ммоль). Остаток очищают хроматографией на силикагеле (CHCl3-MeOH, 10:1) с получением твердого вещества оранжевого цвета (0,02 г, 55% выход). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,86 (уш.с, 2H, (OH)2), 4,55 (м, 2H, NHCH2Ph), 6,90-7,42 (м, 10H, Ph + Ph' + олефиновые), 7,87 (уш.с, 1H, NH), 8,02 (дд, 1H, J < 0,5 и 11,4 Гц, олефиновые CHCN).
MS, m/e (отн. интенсивность, %): 295 (61) [M+H-CN]+, 321 (100) [M+H]+, 338 (30) [M+NH4]+.
Пример 9: Метиловый эфир 3,4-бис(трет-бутилдиметилсилилокси)циннамовой кислоты (A8)
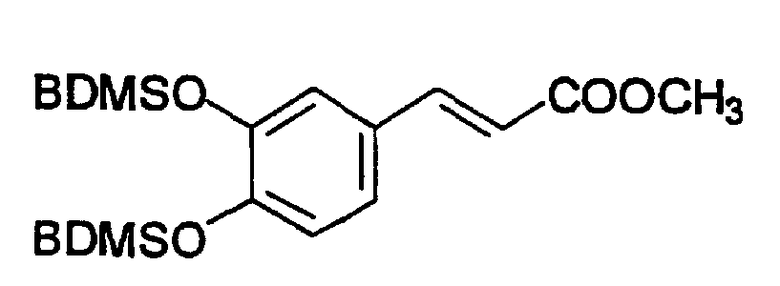
К раствору 3,6 г (20 ммоль) 3,4-дигидроксициннамовой кислоты в 300 мл MeOH добавляют SOCl2 (100 мкл) и смесь перемешивают при 60°C в течение 5 час. Метанол упаривают досуха и полученный метиловый эфир обрабатывают 10,2 г (68 ммоль) t-BuMe2SiCl и 9,2 г (136 ммоль) имидазола в 100 мл ДМФ при 50°C в течение 0,5 час. Смесь разбавляют водой и экстрагируют гексаном. Гексан упаривают досуха. Остаток отгоняют в вакууме (аппарат Кугельрора (Aldrich) при 0,1 мм ртутного столба. T. бани 200-210°C) с получением белого твердого вещества, выход 7,5 г (89%), т. пл. 57-58°C. Продукт охарактеризован следующими аналитическими данными:
MS, m/e (отн. интенсивность, %): 423 (100) [M+H]*, 440 (98) [M+NH4]+.
Пример 10: 3,4-Бис(трет-бутилдиметилсилилокси)циннамиловый спирт (A9)
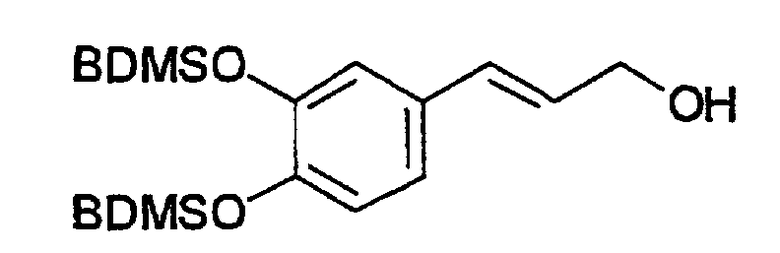
Соединение получают, как описано в примере 5, путем обработки 3,4-дигидроксициннамовой кислоты бис(BDMS)эфиром метилового сложного эфира (пример 9, 0,42 г, 1,0 ммоль) в абсолютном ТГФ (25 мл) при 20°C 1M раствором диизобутилалюминийгидрида в ТГФ (4,0 ммоль) в течение 1 час. После отгонки в вакууме (аппарат Кугельрора (Aldrich) при 0,1 мм ртутного столба. T. бани 185-200°C) получают белое вязкое масло, выход 0,33 г (85%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 0,23, 0,24 (2 x с, 2 x 6H, Me2Si + Me2Si), 1,00, 1,02 (2 x с, 2 x 9H, t-BuSi + t-BuSi), 4,19 (д, 2H, J 4,9 Гц, CH2OH), 6,22 (дт, 1H, J 4,9 и 16,0 Гц, олефиновые PhCCH), 6,49 (д, 1H, J 16,0 Гц, олефиновые PhCH), 6,85 (д, 1H, J 8,2 Гц, H5), 6,92 (дд, 1H, J 2,1 и 8,2 Гц, H6), 6,97 (д, 1H, J 2,1 Гц, H2).
MS, m/e (отн. интенсивность, %): 377 (100) [M-OH]+, 395 (2) [M+H]+, 412 (15) [M+NH4]+.
Пример 11: 3,4-Бис(трет-бутилдиметилсилилокси)циннамальдегид (А10)
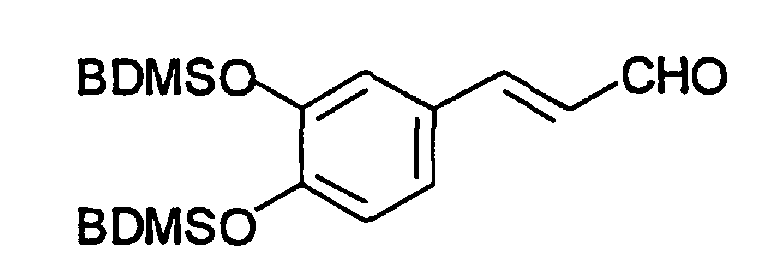
Соединение получают, как описано в примере 6, путем прибавления 3,4-бис(трет-бутилдиметилсилилокси)циннамилового спирта (пример 10, 0,2 г, 0,5 ммоль) в 5 мл CH2Cl2 к смеси пиридинийдихромата (0,38 г, 1 ммоль) и 1 г молекулярных сит 3A в 20 мл CH2Cl2. Остаток пропускают через силикагель и промывают 300 мл EtOAc-гексана, 1:1. После упаривания соединение очищают хроматографией на силикагеле (гексан-EtOAc, 5:1), что приводит к получению масла (0,15 г, 76%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 0,26 и 0,28 (2 x с, 2 x 6H, Me2Si + Me2Si), 1,01 и 1,02 (2 x с, 2 x 9H, t-BuSi + t-BuSi), 6,60 (дд, 1H, J 7,7 и 15,9 Гц, PhCCH олефиновые), 7,01 (дд, 1H, J < 0,5 и 8,9 Гц, H6), 7,27 (м, 2H, H2+5), 7,60 (д, 1H, J 15,9 Гц, PhCH олефиновые), 9,65 (д, 1H, J 7,7 Гц, CHO).
MS, m/e (отн. интенсивность, %): 367 (3) [M+H-CN]+, 393 (100) [M+H]+, 410 (10) [M+NH4]+.
Пример 12: (E,E)-2-(Бензиламидо)-3-(3,4-бис(трет-бутилдиметилсилилоксистирил))акрилонитрил (CR18)
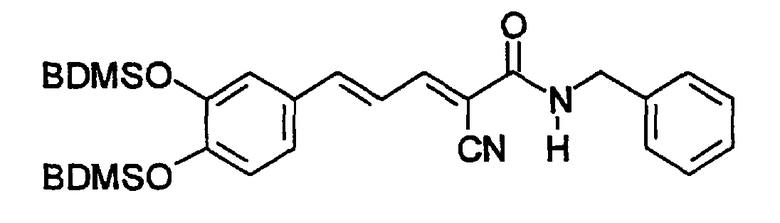
Соединение получают, как описано в примере 3, путем прибавления 3,4-бис(трет-бутилдиметилсилилокси)циннамальдегида (пример 11, 0,100 г, 0,26 ммоль) к N-(цианоацетил)бензиламиду (пример 4, 0,044 г, 0,26 ммоль). После кипячения с обратным холодильником в течение 2,5 час очистка с помощью хроматографии на силикагеле (гексан-EtOAc, 15:1) дает твердое вещество желтого цвета (0,090 г, 64%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 0,24 и 0,25 (2 x с, 2 x 6H, Me2Si + Me2Si), 1,01 и 1,02 (2 x с, 2 x 9H, t-BuSi + t-BuSi), 4,55 (уш.с, 2H, NHCH2Ph), 7,00 (д, 1H, J 8,5 Гц, H4), 7,12 (дд, 1H, J 11,7 и 15,6 Гц, PhCCHCCN олефиновые), 7,24-7,43 (м, 8H, ароматические и олефиновые протоны), 7,93 (уш.с, 1H, NH), 8,02 (дд, 1H, J < 0,5 и 11,7 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 523 (30) [M+H-CN]+, 540 (24) [M+NH4-CN]+, 549 (89) [M+H]+, 566 (100) [M+NH4]+.
Пример 13: (E,E)-2-(Бензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил (CR4) - Способ В
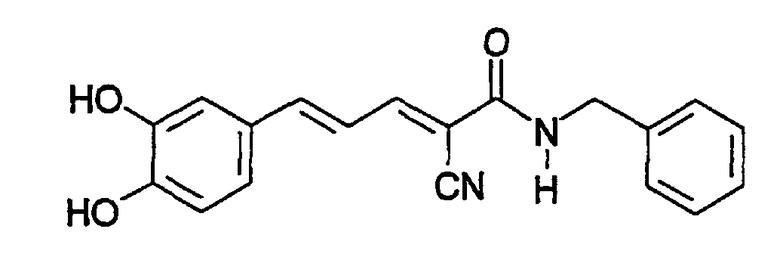
(E,E)-2-Бензиламидо-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (пример 12, 0,028 г, 0,052 ммоль) обрабатывают 60 мкл 1M раствора в ТГФ тетра-н-бутиламмонийфторида в 2 мл сухого ТГФ в течение 0,5 час при 20°C. После упаривания соединение растворяют в 5 мл смеси хлороформ-метанол, 20:1, пропускают через силикагель и промывают смесью хлороформ-метанол, 20:1. Остаток очищают ВЭЖХ хроматографией (MeCN-Н20, 60:40, УФ-определение при 340 нм), что приводит к получению твердого вещества оранжевого цвета (0,010 г, 62%). Аналитические данные идентичны соединению, полученному, как описано в примере 8.
Пример 14: (E,E)-2-(3,4-Дигидроксибензиламидо)-3-стирилакрилонитрил (CR19)
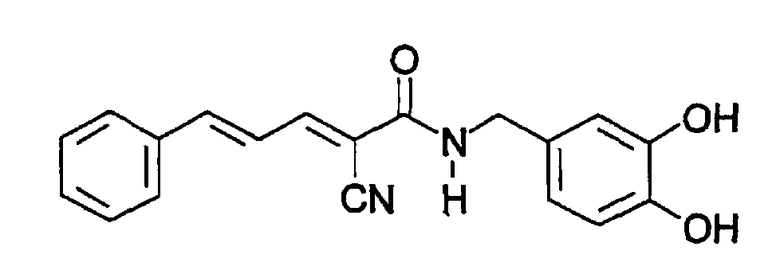
Соединение получают, как описано в примере 3, путем прибавления циннамальдегида (0,018 мл, 0,14 ммоль) к N-(цианоацетил)-3,4-дигидроксибензиламиду (пример 2, 0,03 г, 0,14 ммоль). После кипячения с обратным холодильником в течение 2 ч и перекристаллизации из этанола получают твердое вещество желтого цвета (0,027 г, 59%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,82 (уш.с, 2H, (OH)2), 4,39 (уш.с, 2H, NHCH2Ph), 6,70 (дд, 1H, J 1,9 и 8,2 Гц, H6'), 6,76 (д, 1H, J 8,2 Гц, H5'), 6,87 (д, 1H, J 1,9 Гц, H2'), 7,30 (дд, 1H, J 11,3 и 15,7 Гц, PhCCHCCN олефиновые), 7,47 и 7,73 (2 x м, 6H, ароматические протоны и PhCH олефиновые), 7,82 (уш.с, 1H, NH), 8,04 (дд, 1H, J < 0,5 и 11,3 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 321 (100) [M+H]+, 338 (65) [M+NH4]+.
Пример 15: (E,E)-2-(3,4-Дигидроксибензиламидо)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR20)
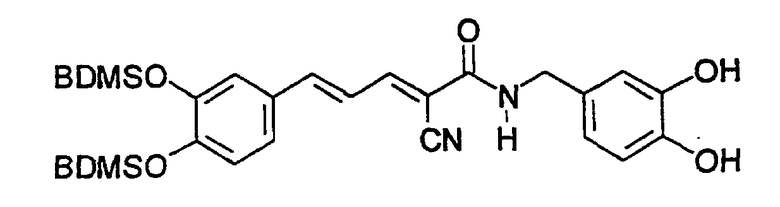
Соединение получают, как описано в примере 3, путем прибавления 3,4-бис(трет-бутилдиметилсилилокси)циннамальдегида (пример 11, 0,015 г, 0,038 ммоль) к N-(цианоацетил)-3,4-дигидроксибензиламиду (пример 2, 0,0079 г, 0,038 ммоль). После кипячения с обратным холодильником в течение 2 час и перекристаллизации из этанола получают твердое вещество желтого цвета (0,014 г, 64%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 0,22 и 0,24 (2 x с, 2 x 6H, Me2Si + Me2Si), 1,01 и 1,03 (2 x с, 2 x 9H, t-BuSi + t-BuSi), 2,72 (уш.с, 2H, (OH)2), 4,41 (уш.с, 2H, NHCH2Ph), 6,68-7,42 (м, BH, ароматические и олефиновые протоны), 7,75 (уш.с, 1 час, NH), 8,00 (дд, 1 час, J <0,5 и 12,0 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 555 (5) [M+H-CN]+, 572 (8) [M+NH4-CN]+, 581 (46) [M+H]+, 598 (100) [M+NH4]+.
Пример 16: (E,E)-2-(3,4-Дигидроксибензиламидо)-3-(3,4-дигидроксистирил)акрилонитрил(CR21)
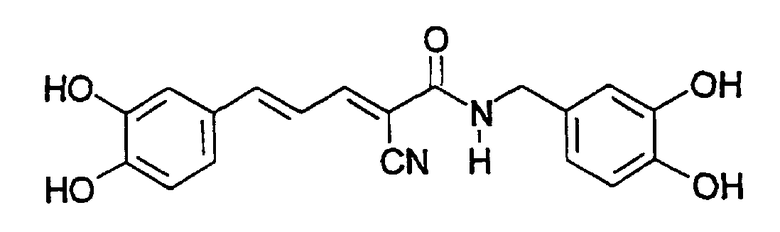
(E,E)-2-(3,4-Дигидроксибензиламидо)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (пример 15, 0,026 г, 0,044 ммоль) обрабатывают 60 мкл 1M раствора в ТГФ тетра-н-бутиламмонийфторида в 1,5 мл сухого ТГФ в течение 0,5 час при 20°C, как описано в примере 13. После очистки получают твердое вещество желтого цвета (0,006 г, 43%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 4,38 (с, 1H, NHCH2Ph), 6,67-7,22 (м, 6H, Ph + Ph'), 7,05 (дд, 1H, J 11,8 и 15,5 Гц, PhC=CH олефиновые), 7,34 (д, 1H, J 15,5 Гц, PhCH олефиновые), 7,70 (уш.с, 1H, NH), 8,00 (д, 1H, J 11,8 Гц, CH=CCN олефиновые).
MS, m/e (отн. интенсивность, %): 186 (86) [(HO)2C6H3CH=CHCH=CCN]+, 202 (28), 242 (100) [М+Н-С6Н3(ОН)2]+, 353 (13) [M+H]+, 370 (6) [M+NH4]+.
Пример 17: (E,E)-2-(Бензиламидо)-3-стирилакрилонитрил (CR1)
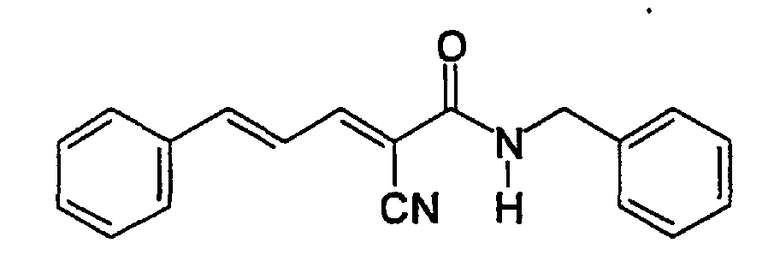
Соединение получают, как описано в примере 3, путем прибавления циннамальдегида (0,048 мл, 0,38 ммоль) к N-(цианоацетил)бензиламиду (пример 4, 0,066 г, 0,38 ммоль). После кипячения с обратным холодильником в течение 1 час и перекристаллизации из этанола получают белое твердое вещество (0,074 г, 68%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 4,55 (с, 1H, NHCH2Ph), 7,24-7,51 (м, 11H, Ph + Ph' + PhCCHCCN олефиновые), 7,72 (уш.д, 1H, J 6,5 Гц, CHCN олефиновые), 7,98 (уш.с, 1H, NH), 8,05 (д, 1H, J 11,7 Гц, PhCH олефиновые).
MS, m/e (отн. интенсивность, %): 289 (100) [M+H]+, 306 (92) [M+NH4]+.
Пример 18: (E,E)-2-(Бензиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR3)
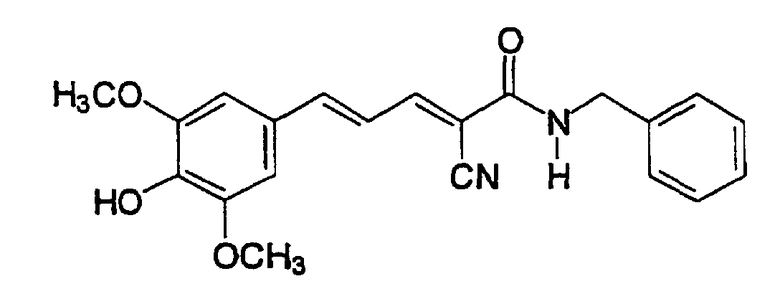
Соединение получают, как описано в примере 3, путем прибавления 3,5-диметокси-4-гидроксициннамальдегида (0,10 г, 0,48 ммоль) к N-(цианоацетил)бензиламиду (Пример 4, 0,084 г, 0,48 ммоль). После кипячения с обратным холодильником в течение 3 час и перекристаллизации из этанола получают твердое вещество желтого цвета (0,10 г, 57%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 3,90 (с, 6H, (OMe)2), 4,55 (м, 2H, NHCH2Ph), 7,08 (уш.с, 2H, H2+6), 7,17 (дд, 1H, J 11,5 и 15,2 Гц, PhCCHCCN олефиновые), 7,22-7,41 (м, 6H, Ph' + PhCH олефиновые), 7,90 (уш.с, 1H, NH), 8,01 (дд, 1H, J 0,55 и 11,7 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 275 (14) [M+H-CN-MeOH-MeOH]+, 307 (9) [M+H-CN-MeOH]+, 339 (4) [M+H-CN]+, 365 (100) [M+H]+, 382 (16) [M+NH4]+.
Пример 19: N-(Цианоацетил)фенилпропиламид (A5)
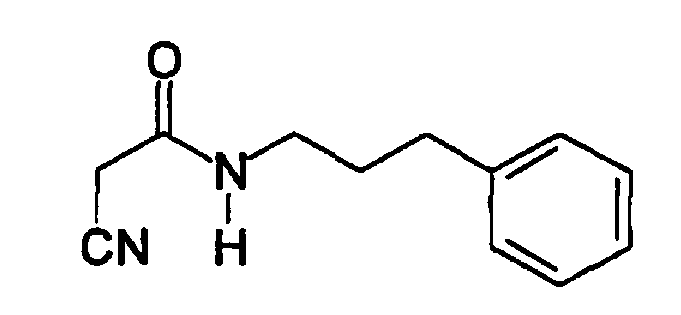
Соединение получают, как описано в примере 1, путем прибавления метилцианоацетата (0,98 мл, 11,1 ммоль) к фенилпропиламину (1,58 мл, 11,1 ммоль). Соединение отгоняют в вакууме прямо из реакционной смеси (аппарат Кугельрора (Aldrich), 0,1 мм ртутного столба, T. бани 195-200°C) с получением не совсем белого твердого вещества (2,18 г, 97%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 1,88 (кв, 2H, J 7,3 Гц, PhCCH2), 2,66 (т, 2H, J 7,3 Гц, PhCH2), 3,28 (с, 2H, CNCH2), 3,33 (дт, 2H, J 7,3 и 6,6 Гц, PhCCCH2), 6,02 (уш.с, 1H, NH), 7,15-7,30 (м, 5H, Ph).
MS, m/e (отн. интенсивность, %): 203 (88) [M+H]+, 220 (100) [M+NH4]+.
Пример 20: N-(Цианоацетил)фенилэтиламид (A4)
Соединение получают, как описано в примере 1, путем прибавления метилцианоацетата (1,1 мл, 12,4 ммоль) к фенилэтиламину (1,55 мл, 12,4 ммоль). Соединение отгоняют в вакууме прямо из реакционной смеси (аппарат Кугельрора (Aldrich), 0,1 мм ртутного столба, T. бани 190-195°C) с получением не совсем белого твердого вещества (2,14 г, 91%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,80 (т, 2H, J 7,6 Гц, PhCH2), 3,46 (уш.т, 2H, J 7,6 Гц, PhCCH2), 3,54 (с, 2H, CNCH2), 7,20-7,31 (м, 5H, Ph), 7,51 (уш.с, 1H, NH).
MS, m/e (отн. интенсивность, %): 189 (100) [M+H]+, 206 (99) [M+NH4]+.
Пример 21: (E,E)-2-(Фенилэтиламидо)-3-(3,4-диметоксистирил)акрилонитрил (CR5)
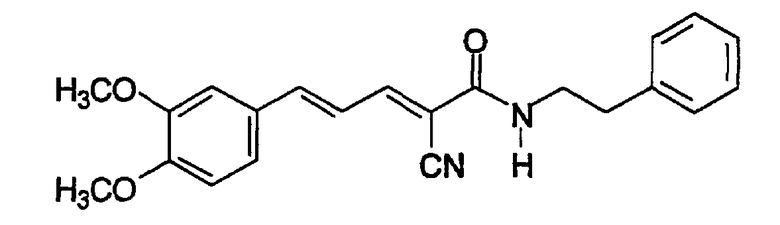
Соединение получают, как описано в примере 3, путем прибавления 3,4-диметоксициннамальдегида (пример 6, 0,1 г, 0,52 ммоль) к N-(цианоацетил)фенилэтиламиду (пример 20, 0,1 г, 0,52 ммоль). После кипячения с обратным холодильником в течение 1 час и перекристаллизации из этанола получают твердое вещество желтого цвета (0,12 г, 63%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2.91 (т, 2H, J 7,5 Гц, Ph'CH), 3,59 (уш.т, 2H, J 7,5 Гц, Ph'CCH), 3,88, 3,89 (2 x с, 2 x 3H, OCH3 + OCH3), 7,04 (д, 1H, J 8,6 Гц, H5), 7,16 (дд, 1H, J 11,8 и 15,0 Гц, PhC=CH олефиновые), 7,20-7,42 (м, 9H, ароматические + олефиновые), 7,97 (д, 1H, J 11,8 Гц, CH=CCN олефиновые). MS, m/e (отн. интенсивность, %): 363 (100) [M+Hf, 380 (34) [M+NH4]+.
Пример 22: (E,E)-2-(Фенилэтиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR8)
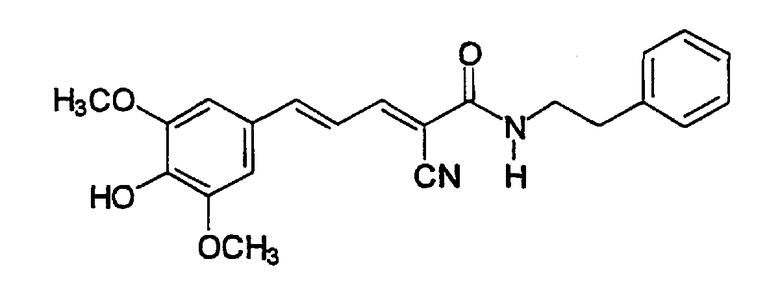
Соединение получают, как описано в примере 3, путем прибавления 3,5-диметокси-4-гидроксициннамальдегида (0,1 г, 0,48 ммоль) к N-(цианоацетил)фенилэтиламиду (пример 20, 0,091 г, 0,48 ммоль). Остаток очищают хроматографией на силикагеле (CHCl3-гексан, 1:1) с получением твердого вещества желтого цвета (0,15 г, 83% выход). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,95 (т, 2H, J 7,6 Гц, CH2Ph'), 3,62 (м, 2H, CH2CPh'), 3,94 (с, 6H, (OMe)2), 7,11 (с, 2H, H2+6), 7,19 (дд, 1H, J 11,7 и 15,3 Гц, PhCCHCCN олефиновые), 7,23-7,36 (м, 5H, Ph'), 7,41 (д, 1H, J 15,3 Гц, PhCH олефиновые), 7,45 (уш.с, 1H, NH), 7,99 (д, 1H, J 11,7 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 379 (100) [M+H]+, 396 (7) [M+NH4]+.
Пример 23: (E,E)-2-(Фенилпропиламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR9)
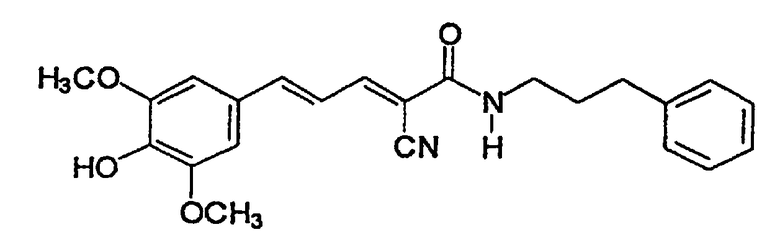
Соединение получают, как описано в примере 3, путем прибавления 3,5-диметокси-4-гидроксициннамальдегида (0,10 г, 0,48 ммоль) к N-(цианоацетил)фенилпропиламиду (пример 19, 0,097 г, 0,48 ммоль). После кипячения с обратным холодильником в течение 3 час остаток очищают хроматографией на силикагеле (CHCl3-гексан, 1:1) с получением коричневого твердого вещества (0,17 г, 90% выход). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,09 (кв, 2H, J 7,5 Гц, NHCCH2CPh'), 2,85 (т, 2H, J 7,5 Гц, CH2Ph'), 3,57 (м, 2H, CH2CPh'), 4,06 (с, 6H, (OMe)2), 7,24 (с, 2H, H2+6), 7,32 (дд, 1H, J 11,7 и 15,3 Гц, PhCCHCCN олефиновые), 7,33-7,46 (м, 5H, Ph'), 7,53 (д, 1H, J 15,3 Гц, PhCH олефиновые), 7,58 (уш.с, 1H, NH), 8.11 (д, 1H, J 11,7 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 331 (40), 348 (30), 359 (34), 376 (32), 393 (100) [М+Н]+, 410 (24) [М+NH4]+.
Пример 24: (E,E)-2-Тиоацетамидо-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR12)
Соединение получают, как описано в примере 3, путем прибавления 3,5-диметокси-4-гидроксициннамальдегида (0,15 г, 0,72 ммоль) к 2-цианотиоацетамиду (0,073 г, 0,72 ммоль). После кипячения с обратным холодильником в течение 1 час остаток очищают на пластинках ТСХ в смеси гексан-этилацетат, 1:1 с получением красного твердого вещества (0,10 г, 52%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,85 (уш.с, OH + NH2), 3,91 (с, 6H, (OMe)2), 7,11 (с, 2H, H2+6), 7,20 (дд, 1H, J 1,6 и 15,1 Гц, PhCCHCCN олефиновые), 7,46 (д, 1H, J 15,1 Гц, PhCH олефиновые), 8,22 (дд, 1H, J 0,73 и 11,6 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 289 (100), 291 (60) [M+H]+, 312 (8) [M+Na]+.
Пример 25: (E,E)-2-Ацетамидо-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR13)
Соединение получают, как описано в примере 3, путем прибавления 3,5-диметокси-4-гидроксициннамальдегида (0,1 г, 0,48 ммоль) к 2-цианоацетамиду (0,04 г, 0,48 ммоль). После кипячения с обратным холодильником в течение 3 час и перекристаллизации из этанола получают твердое вещество оранжевого цвета (0,083 г, 63%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,82-2,88 (уш.с, OH + NH2), 3,90 (с, 6H, (OMe)2), 7,08 (с, 2H, H2+6), 7,16 (дд, 1H, J 11,6 и 15,1 Гц, PhCCHCCN олефиновые), 7,38 (д, 1H, J 15,1 Гц, PhCH олефиновые), 7,96 (дд, 1H, J 0,73 и 11,6 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 275 (100) [M+H]+, 292 (28) [M+NH4]+.
Пример 26: (E,E)-2-Карбокси-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR14)
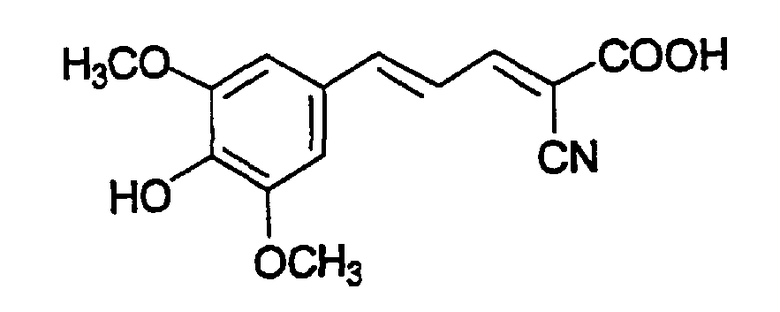
Соединение получают, как описано в примере 3, путем прибавления 3,5-диметокси-4-гидроксициннамальдегида (0,15 г, 0,72 ммоль) к цианоуксусной кислоте (0,061 г, 0,72 ммоль). После кипячения с обратным холодильником в течение 1 час и перекристаллизации из этанола получают твердое вещество желтого цвета (0,15 г, 75%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 3.00 (уш.с, OH), 3,91 (с, 6H, (OMe)2), 7,12 (с, 2H, H2+6), 7,21 (дд, 1H, J 11,6 и 15,1 Гц, PhCCHCCN олефиновые), 7,50 (д, 1H, J 15,1 Гц, PhCH олефиновые), 8,04 (дд, 1H, J 0,73 и 11,6 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 276 (66) [M+H]+, 293 (100) [M+NH4]+.
Пример 27: (E,E)-2-Карбометокси-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR15)
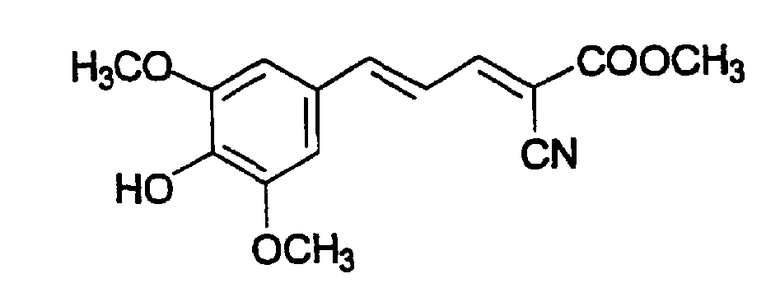
Соединение получают, как описано в примере 3, путем прибавления 3,5-диметокси-4-гидроксициннамальдегида (0,15 г, 0,72 ммоль) к метилцианоацетату (0,064 мл, 0,72 ммоль). После кипячения с обратным холодильником в течение 1 час и перекристаллизации из этанола получают твердое вещество оранжевого цвета (0,2 г, 90%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,84 (уш.с, OH), 3,84 (с, 3H, COOMe), 3,91 (с, 6H, (OMe)2), 7,12 (с, 2H, H2+6), 7,21 (дд, 1H, J 11,6 и 15,1 Гц, PhCCHCCN олефиновые), 7,53 (д, 1H, J 15,1 Гц, PhCH олефиновые), 8,05 (дд, 1H, J 0,73 и 11,6 Гц, CHCN олефиновые).
MS, m/e (отн. интенсивность, %): 290 (100) [M+H]+, 307 (99) [M+NH4]+.
Пример 28: (E,E)-2-Ацетамидо-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR16)
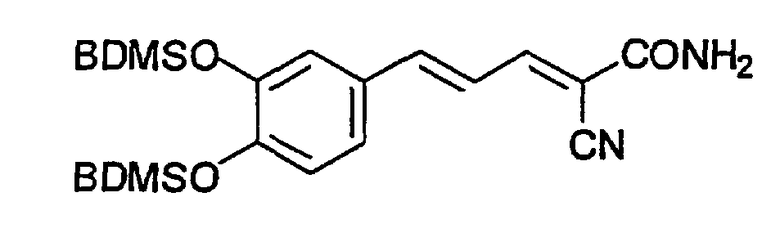
Соединение получают, как описано в примере 3, путем прибавления 3,4-бис(трет-бутилдиметилсилилокси)-циннамальдегида (пример 11, 0,15 г, 0,38 ммоль) к 2-цианоацетамиду (0,032 г, 0,38 ммоль). После кипячения с обратным холодильником в течение 0,5 час, очистка хроматографией на силикагеле (гексан-EtOAc, 5:1) дает кристаллизующееся масло (0,10 г, 57%).
ЯМР (CD3COCD3, δ, м.д.): 0,22 и 0,24 (2 x с, 2 x 6H, Me2Si + Me2Si), 1,01 и 1,03 (2 x с, 2 x 9H, трет-BuSi + t-BuSi), 7,01, 7,23-7,29 (м, 3H, ароматические), 7,11 (дд, 1H, J 11,9 и 15,3 Гц, PhC=CH олефиновые), 7,40 (д, 1H, J 15,3 Гц, PhCH олефиновые), 7,98 (д, 1H, J 11,9 Гц, CH=CCN олефиновые).
MS, m/e (отн. интенсивность, %): 459 (100) [M+H]+, 476 (89) [M+NH4]+.
Пример 29: (E,E)-2-Ацетамидо-3-(3,4-дигидроксистирил)акрилонитрил (CR17)
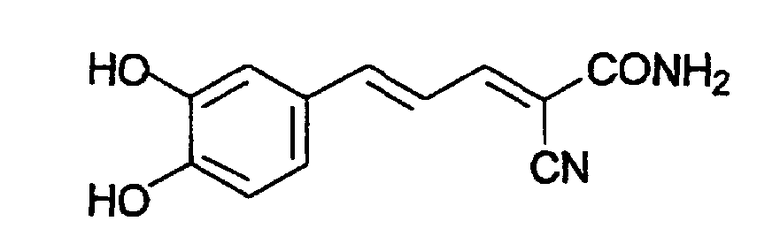
(E,E)-2-Ацетамидо-3-(3,4-бис(трет-бутилдиметилсилилоксистирил))акрилонитрил (пример 28, 0,1 г, 0,22 ммоль) обрабатывают избытком 1M раствора в ТГФ тетра-н-бутиламмонийфторида в бензоле в течение 0,5 час при 20°C, как описано в примере 13. После очистки получают твердое вещество желтого цвета (0,04 г, 85%). Продукт охарактеризован следующими аналитическими данными:
MS, m/e (отн. интенсивность, %): 231 (83) [M+H]+, 248 (100) [M+NH4]+.
Пример 30: N-(Цианоацетил)-β-этаноламид (A11)
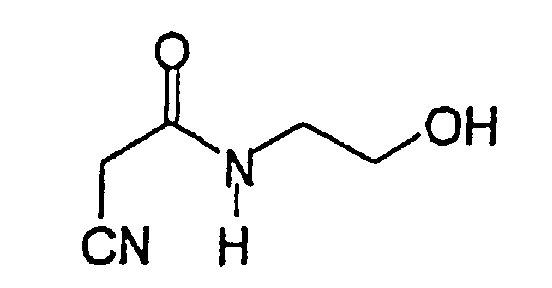
К β-этаноламину (1,37 мл, 22,6 ммоль) добавляют метилцианоацетат (2,0 мл, 22,6 ммоль). Реакционную смесь нагревают в течение 30 час при 100°C. При охлаждении образуется коричневое твердое вещество, которое перекристаллизовывают из этанола с получением 2,10 г твердого продукта (71%). Продукт охарактеризован следующими аналитическими данными:
MS, m/e (отн. интенсивность, %): 129 (30) [M+H]+, 146 (100) [M+NH4]+.
Пример 31: (E,E)-2-(β-Этаноламидо)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR24)
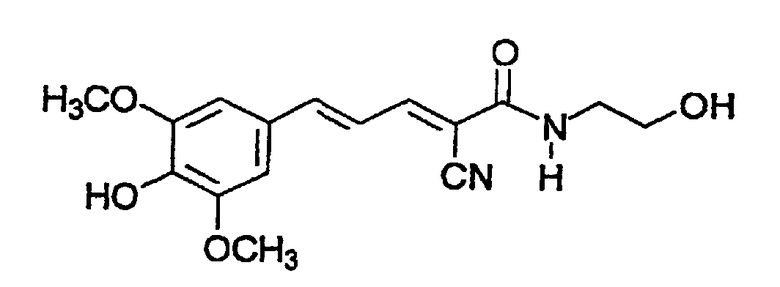
К 3,5-диметокси-4-гидроксициннамальдегиду (0,018 г, 0,086 ммоль) добавляют N-(цианоацетил)-β-этаноламид (пример 30, 0,010 г, 0,086 ммоль). После кипячения с обратным холодильником в течение 2 час и очистки на силикагеле, CHCl3-MeOH, 5:1, получают твердое вещество желтого цвета (0,024 г, 87%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 3,47, 3,67 (2 x m, 4H, NHCH2 + CH2OH), 3,90 (с, 6H, OCH3 + ОСН3), 7,07 (уш.с, 2H, H2+6), 7,16 (дд, 1H, J 11,7 и 15,2 Гц, PhC=CH олефиновые), 7,31 (уш.с, 1H, NH), 7,38 (д, 1H, J 15,2 Гц, PhCH олефиновые), 7,97 (д, 1H, J 1,7 Гц, CH=CCN олефиновые).
MS, m/e (отн. интенсивность, %): 319 (70) [M+H]+, 341 (100) [M+Na]+.
Пример 32: (E,E)-2-(Бензиламидо)-3-(4-нитростирил)акрилонитрил (CR27)
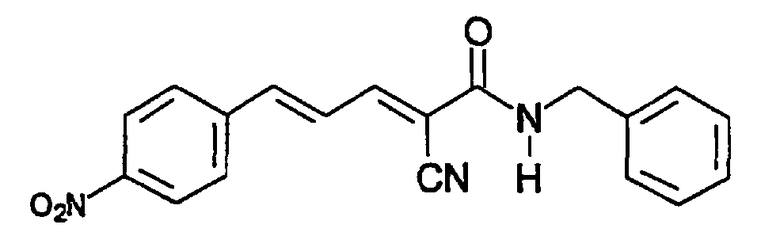
Соединение получают, как описано в примере 3, путем прибавления 4-нитроциннамальдегида (0,022 г, 0,12 ммоль) к N-(цианоацетил)бензиламиду (пример 4, 0,022 г, 0,12 ммоль). После кипячения с обратным холодильником в течение 1 час продукт очищают хроматографией на силикагеле (CHCl3-MeOH, 5:1) с получением твердого вещества желтого цвета (0,033 г, 81%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 4,56 (уш.с, 2H, NHCH2), 7,24-7,38 (м, 6H, Ph' + NH), 7,47 (дд, 1H, J 11,1 и 15,2 Гц, PhC=CH олефиновые), 7,62 (д, 1H, J 15,2 Гц, PhCH олефиновые), 8,02, 8,32 (2 x уш.д, 4H, J 8,8 и 8,3 Гц, Ph), 8,08 (д, 1H, J 11,1 Гц, CH=CCN олефиновые).
MS, m/e (отн. интенсивность, %): 334 (100) [M+H]+, 351 (16) [M+NH4]+, 356 (28) [M+Na]+.
Пример 33: (E,E)-2-(3,4-Дигидроксибензиламидо)-3-(4-нитростирил)акрилонитрил (CR28)
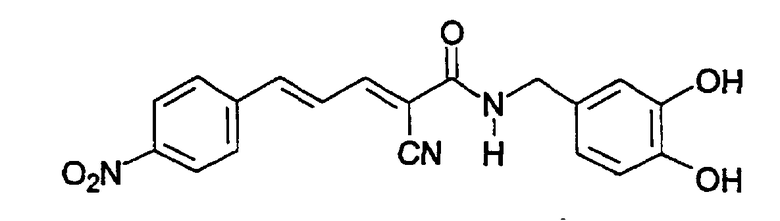
Соединение получают, как описано в примере 3, путем прибавления 4-нитроциннамальдегида (0,009 г, 0,05 ммоль) к N-(цианоацетил)-3,4-дигидроксибензиламиду (пример 2, 0,010 г, 0,05 ммоль). После кипячения с обратным холодильником в течение 2 час и перекристаллизации из этанола получают твердое вещество желтого цвета (0,007 г, 39%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 2,81, 2,83 (2 x уш.с, 2H, OH + OH), 4,39 (уш.с, 2H, NHCH2), 6,69 (уш.д, 1H, J < 0,5 и 7,6 Гц, H6'), 6,76 (д, 1H, J 7,6 Гц, H5'), 6,86 (уш.д, 1H, J < 0,5 Гц, H2'), 7,47 (дд, 1H, J 11,7 и 15,2 Гц, PhC=CH олефиновые), 7,61 (д, 1H, J 15,2 Гц, PhC олефиновые), 7,91 (уш.с, 1H, NH), 8,02, 8,31 (2 x уш.д, 4H, J 8,2 и 8,8 Гц, Ph), 8,06 (д, 1H, J 11,7 Гц, CH=CCN олефиновые).
MS, m/e (отн. интенсивность, %): 331 (21) [M-OH-OH]+, 348 (47) [M-OH]+, 366 (100) [M+H]+, 383 (97) [M+NH4]+.
Пример 34: (E,E)-2-(1-Амино-2,2-дицианоэтенил)-3-(4-нитростирил)акрилонитрил (CR29)
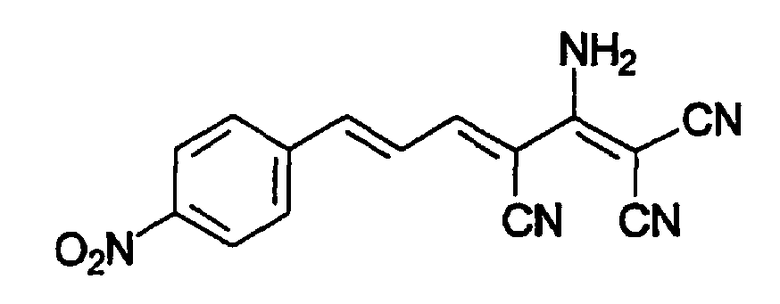
Соединение получают, как описано в примере 3, путем прибавления 4-нитроциннамальдегида (0,051 г, 0,29 ммоль) к 2-амино-1-пропен-1,1,3-трикарбонитрилу (0,038 г, 0,29 ммоль). После кипячения с обратным холодильником в течение 4 час и перекристаллизации из этанола получают твердое вещество желтого цвета (0,08 г, 51%). Продукт охарактеризован следующими аналитическими данными:
ЯМР (CD3COCD3, δ, м.д.): 7,54 (дд, 1H, J 11,1 и 15,8 Гц, PhC=CH олефиновые), 7,67 (д, 1H, J 15,8 Гц, PhCH олефиновые), 7,99 (д, 1H, J 11,1 Гц, CH=CCN олефиновые), 8,08, 8,32 (2 x уш.д, 4H, J 8,8 и 8,8 Гц, Ph).
MS, m/e (отн. интенсивность, %): 309 (100) [M+NH4]+, 314 (67) [M+Na]+.
Пример 35: Действие CR4 на нормальную дифференцировку клеток костного мозга в культуре
Анализ CFU-GEMM проводили в соответствии с методикой Fauser и Messner (1978, Blood, 52(6) 143-8) и методикой Messner и Fausser (1980, Blut, 41(5) 327-33), вводя некоторые изменения. Описывая кратко, для удаления нейтрофилов и эритроцитов клетки костного мозга, обработанные гепарином, наслаивали на Percoll (1,077 г/мл) (Pharmacia Fine Chemical, Piscataway NJ) и центрифугировали при 400 g при 4°C в течение 10 минут. Разделенные на фракции клетки костного мозга в количестве 2x105 клеток/мл культурировали в IMDM (OCI, Toronto), содержащей 0,9% (об/об) метилцеллюлозу, с добавлением 30% FCS (Cansera Rexdale, ON.) или нормальной плазмы человека, смесь цитокинов, состоящую из G-CSF (10 нг/мл, Amgen), IL-3 (40 ед/мл, Immunex), MGF (50 нг/мл, Immunex), эритропоэтин (2 ед/мл, Epprex) или TPO (10 нг/мл, Amgen), 5 x 10-5M β-2-меркаптоэтанол и определенные концентрации CR4. В 35 мм-овые чашки Петри высевали 1 мл культуральной смеси и инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 14 день во всех культурах оценивали число BFU-E колоний (определенные как агрегаты более 500 клеток, содержащих гемоглобин, или 3 или более эритроидных субколоний), CFU-GM колоний (определенные как гранулоцитарные или моноцитарно-макрофагальные клетки или их смесь), CFU-Meg колоний (включающие 4 или более мегакариоцитов) и CFU-GEMM колоний (смешенная популяция, включающая все элементы).
Результаты, представленные на фигуре 1, показывают, что при дозах вплоть до 5 мкМ CR4 проявляет незначительную токсичность в отношении нормальных клеток костного мозга. При дозе 10 мкМ CR4 начинает ингибировать образование BFU-E колоний, при этом значительно стимулируя число CFU-GM колоний.
Пример 36: Лизис клеток острой лимфобластной лейкемии, положительных по филадельфийской хромосоме, низкими дозами СR4 в культуре.
Ph+ ALL клетки высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем альфа MEM (Gibco), а также 10% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации CR4, в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 12 день или раньше подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 2, показывают, что CR4 значительно ингибирует пролиферацию и жизнеспособность Ph+ ALL клеток при низких наномолярных дозах (35-100). При тех же концентрациях CR4 не влияет на нормальные клетки.
Пример 37: Лизис Z119 клеток острой лимфобластной лейкемии, положительных по филадельфийской хромосоме, низкими дозами СR4 в культуре.
Z119 клетки с плотностью 1х104 клеток/мл высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем альфа IMDM (OCI, Toronto), а также 20% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации CR4, в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 7 день или раньше подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 3, показывают, что CR4 значительно ингибирует пролиферацию и жизнеспособность Z119 ALL клеток при низких наномолярных дозах. При тех же концентрациях CR4 не влияет на нормальные клетки.
Пример 38: Лизис AML-3 клеток острой миелоидной лейкемии низкими дозами СR4 в культуре.
OCI-AML-3 клетки с плотностью 3,3х103 клеток/мл высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем альфа МЕМ, а также 20% PCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации CR4, в отсутствие экзогенных факторов роста. Клеточные культуры инкубировали в атмосфере 5% CO2 с повышенной влажностью при 37°C. На 5-6 день подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 4, показывают, что CR4 полностью ингибирует пролиферацию и жизнеспособность AML-3 клеток при наномолярных концентрациях (300-600 нМ). При тех же концентрациях CR4 не влияет на выживаемость нормальных клеток.
Пример 39: Лизис Ly-MN клеток лимфомы низкими дозами СR4 в культуре.
Ly-MN клетки высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем IMDM (OCI, Toronto), а также 20% плазмы крови из пуповины человека в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации CR4, в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 5 день или раньше подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 5, показывают, что CR4 значительно ингибирует клеточную пролиферацию и жизнеспособность при наномолярных дозах и ингибирует при 2,5 мкМ. При тех же концентрациях CR4 не влияет на нормальные клетки.
Пример 40: Лизис клеток первичной ювенильной миело-моноцитарной лейкемии (JMML) под действием СR4 в культуре.
Клетки костного мозга, полученные у пациентов с JMML и обработанные гепарином, наслаивали на Percoll (1,077 г/мл) (Pharmacia Fine Chemical, Piscataway NJ) и центрифугировали для удаления нейтрофилов и эритроцитов при 400 g при 4°C в течение 10 минут. Клетки затем фракционировали и очищали на колонках Miltenyi MS (Miltenyi Biotec GmbH, Germany) с получением популяции CD34+ ранних клеток-предшественников. Фракционированные CD34+ клетки костного мозга с плотностью 1 x 104 клеток/мл культурировали в IMDM (OCI, Toronto), содержащей 0,9% (об/об) метилцеллюлозу, с добавлением 30% FCS (Cansera Rexdale, ON.) с определенной концентрацией CR4. Культурную смесь высевали на 35 мм-ые чашки Петри в объеме 1 мл и инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 12 день или ранее подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 6, показывают, что CR4 обладает умеренной способностью лизировать первичные JMML клетки, 80-90 процентное ингибирование достигается при концентрации 5 мкМ.
Пример 41: Лизис OCI-LY2 клеток лимфомы низкими дозами СR4 в культуре.
OCI-LY2 клетки высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем IMDM (OCI, Toronto), а также 20% плазмы крови из пуповины человека в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные дозы CR4, в отсутствие экзогенных факторов ростов. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 5 день или раньше подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 7, показывают, что CR4 значительно ингибирует клеточную пролиферацию и жизнеспособность при дозах от высоких наномолярных до низких микромолярных (90% при 2,5 мкМ). При тех же концентрациях CR4 не влияет на нормальные клетки.
Пример 42: Лизис ALL клеток, положительных по филадельфийской хромосоме, под действием СR17 и CR21 в культуре.
ALL клетки высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем альфа MEM (Gibco), а также 20% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации соединения, в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 12 день или ранее подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 8, показывают, что CR17 значительно ингибирует рост клеток при концентрациях 1-2,5 мкМ. CR21 ингибирует рост клеток при 5 мкМ.
Пример 43: Лизис ALL клеток, положительных по филадельфийской хромосоме, под действием СR17 и CR21 в культуре.
ALL клетки высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем альфа MEM (Gibco), а также 20% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации соединения, в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 12 день или раньше подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 9, показывают, что как CR17, так и CR21 значительно ингибируют рост клеток при концентрациях 1-2,5 мкМ.
Пример 44: Лизис ALL клеток, положительных по филадельфийской хромосоме, под действием CR24 в культуре
ALL клетки высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем альфа MEM (Gibco), а также 20% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации CR24, в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 9 день или раньше подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 10, показывают, что CR24 эффективен в отношении Ph+ ALL клеток при концентрациях ниже 0,5 мкМ и практически полностью ингибирует рост клеток при концентрациях 2,5-5 мкМ.
Пример 45: Лизис ALL клеток, положительных по филадельфийской хромосоме, под действием СR19 в культуре.
ALL клетки высевали на 35 мм-ые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем альфа MEM (Gibco), а также 20% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации CR19, в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 9 день или раньше подсчитывали количество колоний, содержащих более 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 11, показывают, что CR19 высокоэффективен в отношении Ph+ ALL клеток при наномолярных концентрациях от 250 до 500 нМ.
Пример 46: Действие CR19 на дифференцировку нормальных клеток костного мозга в культуре.
Анализ CFU-GEMM проводили в соответствии с методикой Fauser и Messner (1978, Blood, 52(6) 1243-8) и Messner и Fausser (1980, Blut, 41(5) 327-33), вводя некоторые изменения. Описывая кратко, клетки костного мозга, обработанные гепарином, наслаивали на Percoll (1,077 г/мл) (Pharmacia Fine Chemical, Piscataway NJ) и центрифугировали для удаления нейтрофилов и эритроцитов при 400 g при 4°C в течение 10 минут. Фракционированные клетки костного мозга с плотностью 2x105 клеток/мл культивировали в IMDM (OCI, Toronto), содержащей 0,9% (об/об) метилцеллюлозу с добавлением 30% FCS (Cansera Rexdale, ON.) или нормальной плазмы человека, смесь цитокинов, состоящую из G-CSF (10 нг/мл, Amgen), IL-3 (40 ед/мл, Immunex), MGF (50 нг/мл, Immunex), эритропоэтина (2 ед/мл, Epprex) или TPO (10 нг/мл, Amgen), 5x10-5M β-2-меркаптоэтанол и определенные концентрации CR19. Культурную смесь высевали на 35 мм-ые чашки Петри в объеме 1 мл и инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 14 день во всех колониях подсчитывали число BFU-E колоний (определенные как агрегаты из более 500 клеток, содержащих гемоглобин, или 3 или более эритроидных субколоний) и CFU-C колоний (определенные как агрегаты гранулоцитов или моноцит-макрофаговых клеток или их смесь).
Результаты, представленные на фигуре 12, показывают, что при 2,5 мкМ CR19 значительно ингибирует развитие BFU-E колоний, хотя при этой концентрации он также усиливает образование CFU-С колоний. При концентрации 5 мкМ стимулирующий эффект исчезает и BFU-E колонии практически отсутствуют.
Пример 47: Действие CR24, CR17 и CR21 на дифференцировку нормальных клеток костного мозга.
Анализ CFU-GEMM проводили в соответствии с методикой Fauser и Messner (1978, Blood, 52(6) 1243-8) и Messner и Fausser (1980, Blut, 41(5) 327-33), вводя некоторые изменения (British Journal of Haematology, 1992, 80, p40-48). Описывая кратко, клетки костного мозга, обработанные гепарином, наслаивали на Percoll (1,077 г/мл) (Pharmacia Fine Chemical, Piscataway NJ) и центрифугировали для удаления нейтрофилов и эритроцитов при 400 g при 4°C в течение 10 минут. Фракционированные клетки костного мозга с плотностью 2x105 клеток/мл культивировали в IMDM (OCI, Toronto), содержащей 0,9% (об/об) метилцеллюлозу с добавлением 30% FCS (Cansera Rexdale, ON.) или нормальной плазмы человека, смесь цитокинов, состоящую из G-CSF (10 нг/мл, Amgen), IL-3 (40 ед/мл, Immunex), MGF (50 нг/мл, Immunex), эритропоэтина (2 ед/мл, Epprex) или TPO (10 нг/мл, Amgen), 5x10-5M β-2-меркаптоэтанол и определенную концентрацию исследуемого соединения. Культуральную смесь высевали на 35 мм-ые чашки Петри в объеме 1 мл и инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 14 день во всех колониях подсчитывали количество BFU-E колоний (определенные как агрегаты из более 500 клеток, содержащих гемоглобин, или 3 или более эритроидных субколоний) и CFU-C колоний (определенные как агрегаты гранулоцитов или моноцит-макрофаговых клеток или их смесь).
Результаты, представленные на фигуре 13, показывают, что CR24 минимально ингибируют колониеобразование клеток костного мозга либо при концентрации 10, либо 20 мкМ, при этом как СR17, и СR21 ингибировали образование BFU-E колоний при более высокой дозе 20 мкМ.
Пример 48: Очистка in vitro нормальных клеток костного мозга с помощью CR4.
Клетки костного мозга, обработанные гепарином, наслаивали на Percoll (1,077 г/мл) (Pharmacia Fine Chemical, Piscataway NJ) и центрифугировали для удаления нейтрофилов и эритроцитов при 400 g при 4°C в течение 10 минут.
Для процесса очистки клетки с плотностью 1x106/мл ресуспендировали в полной среде с или без 50 мкМ CR4. Клетки инкубировали с CR4 два с половиной часа при 37°C, 5% CO2. После этого для удаления CR4 клетки тщательно промывали средой и затем культивировали с плотностью 2x105 клеток/мл в IMDM (OCI, Toronto), содержащей 0,9% (об/об) метилцеллюлозу с добавлением 30% FCS (Cansera Rexdale, ON.) или нормальной плазмы человека, смесь цитокинов, состоящей из G-CSF (10 нг/мл, Amgen), IL-3 (40 ед/мл, Immunex), MGF (50 нг/мл, Immunex), эритропоэтина (2 ед/мл, Epprex) или TPO (10 нг/мл, Amgen), и 5x10-5M β-2-меркаптоэтанол. Культуральную смесь высевали на 35 мм-ые чашки Петри в объеме 1 мл и инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 14 день во всех колониях подсчитывали количество BFU-E колоний (определенные как агрегаты из более 500 клеток, содержащих гемоглобин, или 3 или более эритроидных субколоний), CFU-C колоний (определенные как агрегаты гранулоцитов или моноцит-макрофаговых клеток или их смесь) и CFU-GEMM колоний (смешанная популяция всех элементов).
Результаты, представленные на фигуре 14, показывают, что инкубирование с 50 мкМ CR4 в течение двух с половиной часов не привело к значительному ингибированию колониеобразования. Наряду с незначительным образованием BFU-E колоний, значительно увеличивается число CFU-C колоний.
Пример 49: Очистка in vitro от Z119 клеток острой лимфобластной лейкемии с помощью CR4.
Для процесса очистки клетки ресуспендировали в полной среде с или без CR4, как показано, и инкубировали при 37°C, 5% CO2 в течение 0-5 часов. После этого для удаления CR4 клетки тщательно промывали средой и высевали на 35 мм-ые чашки Петри, в объеме 1 мл, содержащем альфа MEM (Gibco), а также 20% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland), в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 9 день или раньше подсчитывали количество колоний, содержащих боле 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 15, показывают, что CR4 быстро убивает Z119 клетки в рассмотренных концентрациях. При концентрации CR4 50 мкМ полное ингибирование наблюдалось только через 2,5 часа инкубирования, тогда как 85% лизис может быть достигнут за тот же период времени при концентрации CR4 25 мкМ. Инкубирование с клетками более пяти часов при концентрации CR4 25 мкМ приводит к полному исчезновению последующего клеточного роста.
Пример 50: Очистка in vitro от OCI-Ly2 клеток лимфомы с помощью CR4.
Для процесса очистки клетки ресуспендировали в полной среде с или без CR4, как показано, и инкубировали при 37°C, 5% CO2 в течение 0-5 часов. После этого для удаления CR4 клетки тщательно промывали средой, ресуспендировали и высевали с плотностью клеток 1 х 103клеток/мл на 35 мм-ые чашки Петри в объеме 1 мл, содержащем альфа IMDM (OCI, Toronto), а также 20% кордовую плазму крови человека в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland), в отсутствие экзогенных факторов роста. Культуру инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 5 день или раньше подсчитывали количество колоний, содержащих боле 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 16, показывают, что CR4 существенно лизирует (90%) OCI-Ly2 клетки при 25-50 мкМ только после 5 часов инкубирования. При более низкой исследованной дозе, 12,5 мкМ, также достигается значительный лизис за тот же период времени.
Пример 51: Очистка in vitro от OCI-AML-3 клеток острой меилоидной лейкемии с помощью CR4.
Для процесса очистки клетки ресуспендировали в полной среде с или без CR4, как показано, и инкубировали при 37°C, 5% CO2 в течение 0-5 часов. После этого для удаления CR4 клетки тщательно промывали средой, ресуспендировали и высевали с плотностью 5х103 клеток/мл на 35 мм-ые чашки Петри в объеме 1 мл, содержащем альфа MEM (Gibco) и 20% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland), в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 5 день или ранее подсчитывали количество колоний, содержащих боле 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 17, показывают, что CR4 существенно лизирует OCI-AML-3 клетки при концентрации 50 мкМ только через 2,5-5 часов инкубирования. При более низких исследованных дозах, 25 мкМ, также достигается значительный лизис за тот же период времени.
Пример 52: Очистка in vitro от Рамос В клеток лимфомы Беркитта с помощью CR4.
Для процесса очистки клетки ресуспендировали в полной среде с или без CR4, как показано, и инкубировали при 37°C, 5% CO2 в течение 0-5 часов. После этого для удаления CR4 клетки тщательно промывали средой, ресуспендировали и высевали на 35 мм-ые чашки Петри в объеме 1 мл, содержащем RPMI 1640 (Gibco), а также 10% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland), в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 12 день или раньше подсчитывали количество колоний, содержащих боле 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 18, показывают, что CR4 существенно лизирует (70%) Рамос клетки при концентрации 50 мкМ через 5 часов инкубирования.
Пример 53: Лизинг клеток HuNS1 множественной миеломы с помощью CR4.
HuNS1 клетки с плотностью 1x104 клеток/мл высевали на 35 мм-овые чашки Петри (Nunc, Gibco) в объеме 1 мл, содержащем альфа MEM, а также 20% FCS (Cansera, Rexdale Ont) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland) и определенные концентрации CR4, в отсутствие экзогенных факторов роста выливали. Клеточные культуры инкубировали в атмосфере с повышенной влажностью при 37°C с 5% CO2. На 5-6 день подсчитывали количество колоний, содержащих боле 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 19, показывают, что CR4 значительно ингибирует клеточную пролиферацию и жизнеспособность при дозах от высоких наномолярных до низко микромолярных (>90% при 2,5 мкМ). CR4 не действует на нормальные клетки при тех же концентрациях.
Пример 54: Лечение острой лимфобластной лейкемии с положительной филадельфийской хромосомой in vivo уNOD-SCID мышей.
NOD-SCID мышей облучали (350 рад) и вводили Z119 клетки острой лимфобластной лейкемии, положительные по филадельфийской хромосоме с плотностью 5x106. Через 24 часа подкожно имплантировали Alzet микроосмотические наносы (Alza Corp. Paolo Alto, CA), содержащие либо 20 мМ раствор CR4 в 50% ДМСО/среда, либо только 50% ДМСО/среда. Насосы Alzet 2001 использовали в течение 7-10 дней, поддерживая общий объем 200 мкл и высвобождая 1 мкл в час. Через 7 дней насосы вынимали. Каждая мышь получала ежедневную дозу CR4, равную 0,154 мг.
Через 14 (фиг. 20A) и 21 (фиг. 20B) день мышей умерщвляли и из передних и задних конечностей экстрагировали костный мозг. Получали общую клеточную суспензию, лизировали эритроциты и образцы окрашивали PE-меченными изотипами, антителами против CD19 человека и HLA-DR человека для определения присутствия Z119 клеток. Данные антитела не обладают перекрещивающейся реакцией с мышиными клетками.
При d14, культуры клеток костного мозга также оценивали на наличие Z119 клеток. Клетки костного мозга с плотностью 5x104 культурировали в IMDM (OCI, Toronto), содержащей 0,9% (об/об) метилцеллюлозу с добавлением 30% сыворотки, содержащей 1:1 смесь FCS (Cansera Rexdale, ON.) и нормальную плазму человека. Цитокины не добавляли. Мышиные клетки в таких условиях не росли. Культуральную смесь высевали на 35 мм-овые чашки Петри в объеме 1 мл и инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 9 день все колонии оценивали на число ALL колоний.
Результаты, представленные на фигурах 20A и 20B, показывают, что как на 14, так и на 21 день умерщвления наблюдалось значительное снижение ALL инфильтрации костной ткани у всех мышей, обработанных CR4, по сравнению с контрольными мышами, обработанными ДМСО.
У контрольных мышей наблюдалась сильная инфильтрация селезенки, печени и почек, а также ALL клетки присутствовали в периферической крови. Кроме 90% снижения ALL клеточной инфильтрации в костной ткани, обработка CR4 снижала ALL инфильтрацию органов и крови ниже определяемых уровней.
Таким образом, CR4 был высокоэффективным против различных раковых клеток, включая острую лимфобластную лейкемию, ALL с положительной филадельфийской хромосомой, острую миелоидную лейкемию, миелому и B-клеточную лимфому, при концентрациях в области от 50 нМ до 5 мкМ. В то же время, при инкубировании нормальных клеток в присутствии CR4 до концентраций 10-20 мкМ или более наблюдалась минимальная токсичность. CR4 был, в частности, активен в отношении bcr-abl трансформированных клеток, положительных по филадельфийской хромосоме, и при концентрациях ниже 40 нМ достигалась >90% потеря. CR4 также был высокоэффективен при высоких дозах (25-50 мкМ) в способах удаления in vitro по отношению к ALL клеткам, положительным по филадельфийской хромосоме, AML клеткам и клеткам лимфомы, вызывая >90% ингибирование роста при 2,5-5 часовом инкубировании. При дозах и времени выше указанных нормальный рост и дифференцировка клеток костного мозга не изменялись. CR4 показал сочетание высокого уровня токсичности по отношению к раковым клеткам и минимального неспецифического цитотоксического повреждения.
CR4 также был высокоэффективен в эксперименте на животной модели (пример 54). Соединение показало хорошие характеристики задержания в крови и определялось в крови через 30 минут после внутривенного введения. На мышиной модели Ph+ ALL клеток человека, CR4 вызывал более 90 процентов снижения ALL инфильтрации костной ткани в течение двухнедельного периода, снижение инфильтрации ALL клеток в печени, почках, селезенки и периферической крови ниже определяемого уровня. Напротив, у контрольных мышей, обработанных одним только носителем, наблюдалась сильная инфильтрация всех этих органов. Не наблюдалось случаев неспецифической токсичности.
Пример 55: Очистка нормальных клеток костного мозга in vitro с помощью CR11.
Клетки костного мозга, обработанные гепарином, наслаивали на Percoll (1,077 г/мл) (Pharmacia Fine Chemical, Piscataway NJ) и центрифугировали для удаления нейтрофилов и эритроцитов при 400 g при 4°C в течение 10 минут.
Для процесса очистки клетки с плотностью 1x106 клеток/мл ресуспендировали в полной среде без или с 50 мкМ CR11. Клетки инкубировали с трирфостином в течение семи часов при 37°C, 5% CO2. После этого для удаления CR11 клетки тщательно промывали средой и затем культивировали с плотностью 2x105 клеток/мл в IMDM (OCI, Toronto), содержащей 0,9% (об/об) метилцеллюлозу с добавлением 30% FCS (Cansera Rexdale, ON.) или нормальной плазмы человека, смесь цитокинов, состоящей из G-CSF (10 нг/мл, Amgen), IL-3 (40 ед/мл, Immunex), MGF (50 нг/мл, Immunex), эритропоэтина (2 ед/мл, Epprex) или TPO (10 нг/мл, Amgen), и 5x10-5 M β-2-меркаптоэтанол. Культурную смесь высевали на 35 мм-ые чашки Петри в объеме 1 мл и инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 14 день во всех колониях подсчитывали количество BFU-E колоний (определенные как агрегаты из более 500 клеток, содержащих гемоглобин, или 3 или более эритроидных субколоний), CFU-C колоний (определенные как агрегаты гранулоцитов или моноцит-макрофаговых клеток или их смесь) и CFU-GEMM колоний (смешанная популяция всех элементов).
Результаты, представленные на фигуре 21, показывают, что семь часов инкубирования 50 мкМ CR11 не привели к значительному ингибированию колониеобразования. BFU-E, CFU-GEMM и CFU-C колонии были нормальные.
Пример 56: Удаление клеток острой лимфобластной лейкемии, положительных по филадельфийской хромосоме, с помощью CR11 in vitro.
Для процесса очистки клетки ресуспендировали в полной среде без или с CR11, как показано, и инкубировали при 37°C, 5% CO2 в течение 0-5 часов. После этого для удаления CR11 клетки тщательно промывали средой, ресуспендировали и высевали на 35 мм-ые чашки Петри в объеме 1 мл, содержащем MEM (Gibco) и 20% FCS (Cansera Rexdale, ON.) в 0,9% (об/об) метилцеллюлозе (Fluka, Switzerland), в отсутствие экзогенных факторов роста. Культуры инкубировали при 37°C, в атмосфере 5% CO2 с повышенной влажностью. На 9 день или ранее подсчитывали количество колоний, содержащих боле 20 клеток, используя инвертированный микроскоп.
Результаты, представленные на фигуре 22, показывают, что CR11 значительно лизирует Ph+ ALL клетки при 50 мкМ после 7 часов инкубирования.
Пример 57: ALL клетки линий Z119 и Z181 (5x106 клеток/точка), положительные по филадельфийской хромосоме (Ph+), лизировали и иммунопреципитировали с Bcr-Abl антителом.
Преципитаты дважды промывали буфером для лизиса и один раз буфером для киназного анализа и ресуспендировали в том же буфере, содержащем различные концентрации CR4. Преципитаты инкубировали с лекарственным средством в течение 10 минут при комнатной температуре, затем добавляли 10μCi33PγATP. Реакцию останавливали через 20 минут, добавляя SDS-PAGE восстанавливающий буфер для образцов, и разделяли на 8-16% SDS-PAGE геле. Продукты переносили на нитроцеллюлозную мембрану и визуализировали авторадиографией.
Результаты, представленные на фигуре 23, показывают что Bcr-Abl киназная активность эффективно блокируется при концентрациях от 1 до 10 мкМ соединением CR4 как в ALL клетках линии Z199, так и Z181.
Пример 58: ALL линии клеток Z119 (5x106 клеток/точка), положительные по филадельфийской хромосоме (Ph+), были преинкубированы в течение 5 часов с различными концентрациями CR4 и иммунопреципитированы с Jak2 антителом.
Клетки лизировали в буфере для лизиса и иммунопреципитировали с Jak2 антителами. Преципитаты дважды промывали буфером для лизиса и один раз буфером для киназного анализа, затем добавляли 10μCi33PγATP. Реакцию останавливали через 20 минут, добавляя SDS-PAGE восстанавливающий буфер для образцов, и разделяли на 8-16% SDS-PAGE геле. Продукты переносили на нитроцеллюлозную мембрану и визуализировали авторадиографией.
Результаты, представленные на фиг. 24, показывают, что Jak2 киназа эффективно блокируется при концентрациях 6 мкМ и, кроме того, блокируется при более высоких концентрациях.
Хотя настоящее изобретение описано со ссылкой на предпочтительные примеры, понятно, что изобретение не ограничивается этими представленными примерами. Напротив, изобретение предполагает возможность различных модификаций и эквивалентных дополнений, охватываемых сущностью и объемом прилагаемой формулы изобретения.
Все публикации, патенты и патентные заявки включены здесь в качестве ссылок в том объеме, как если бы каждая отдельная публикация, патент или патентная заявка была бы специально указана как включенная в виде ссылки во всей своей полноте.
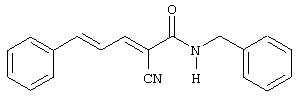
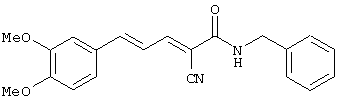
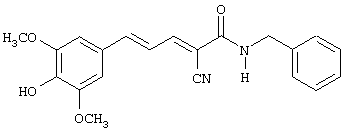
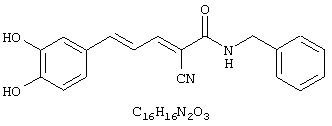
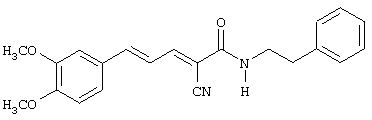
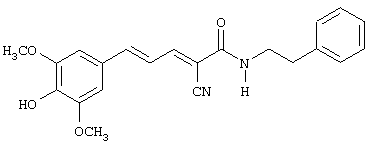
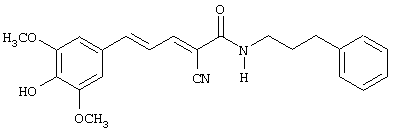
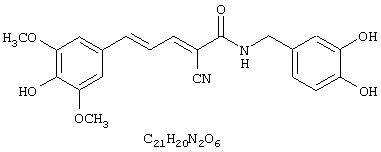
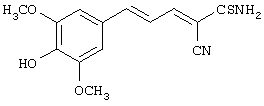
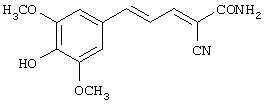
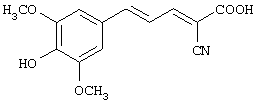
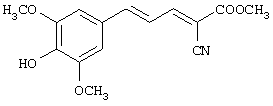
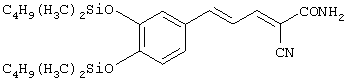
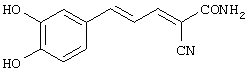
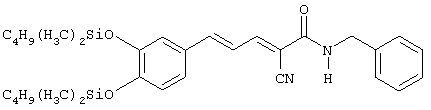
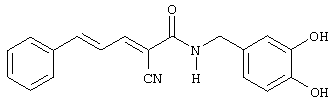


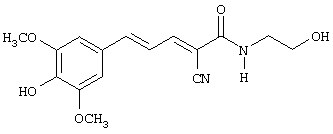
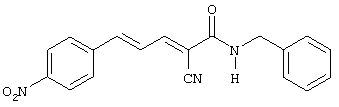
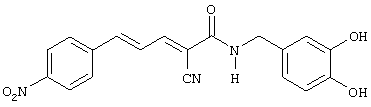
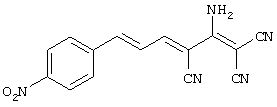
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806625C2 |
| Необязательно конденсированные гетероциклилзамещенные производные пиримидина, пригодные для лечения воспалительных, метаболических, онкологических и аутоиммунных заболеваний | 2015 |
|
RU2734261C2 |
| НОВЫЕ СОЕДИНЕНИЯ МИМЕТИКИ ОБРАТНОГО ПОВОРОТА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2457210C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ АЗАИНДОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ NIK | 2018 |
|
RU2780577C2 |
| ЗАМЕЩЕННЫЕ БЕНЗОПИРАЗИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ FGFR-КИНАЗ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2602233C2 |
| Необязательно конденсированные гетероциклил-замещенные производные пиримидина, пригодные для лечения воспалительных, метаболических, онкологических и аутоиммунных заболеваний | 2015 |
|
RU2815636C1 |
| Необязательно конденсированные гетероциклил-замещенные производные пиримидина, пригодные для лечения воспалительных, метаболических, онкологических и аутоиммунных заболеваний | 2015 |
|
RU2719422C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2654857C2 |
| СОЕДИНЕНИЯ ТИЕНОПИРИДИНОНА | 2019 |
|
RU2827549C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ РЕЦЕПТОРА CCR5, СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2002 |
|
RU2345990C2 |
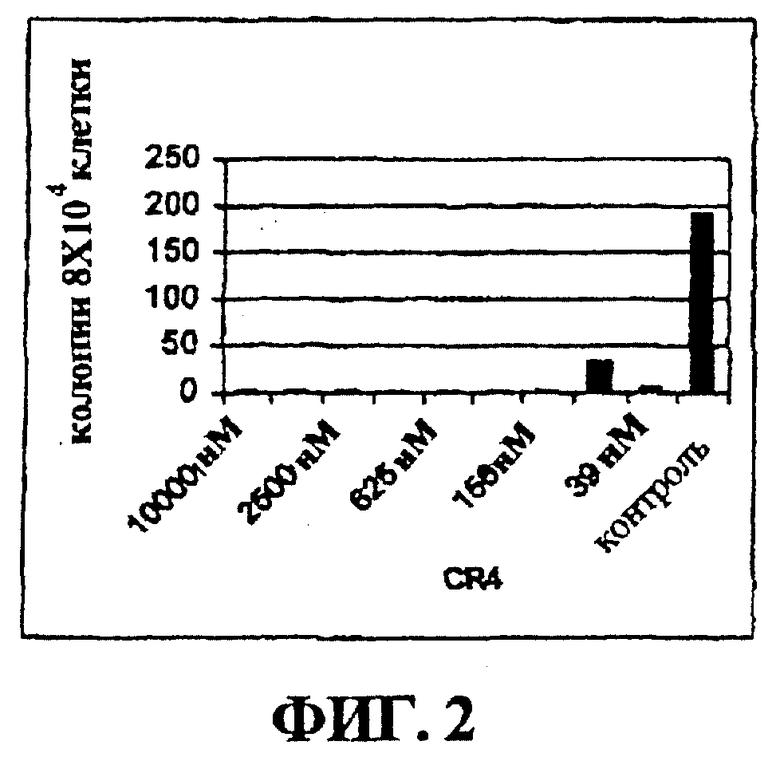
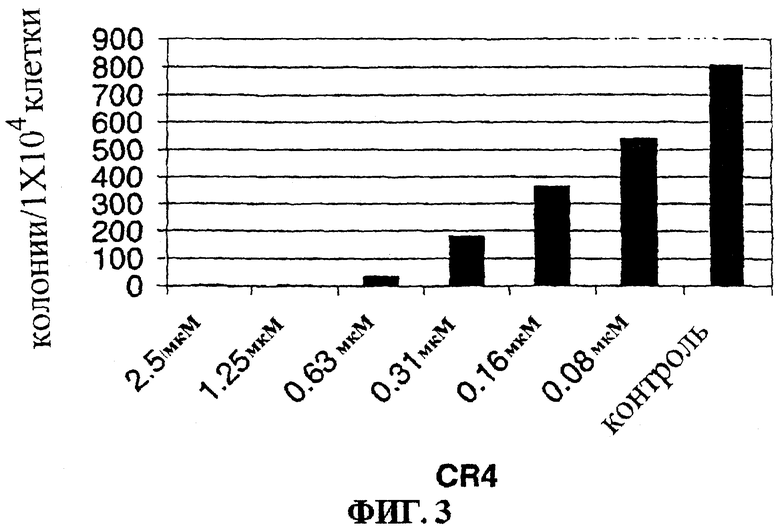
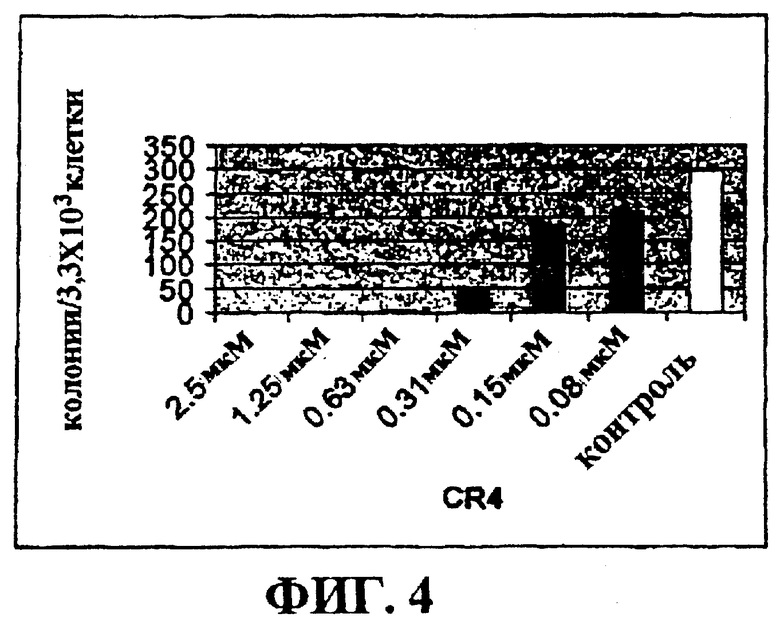
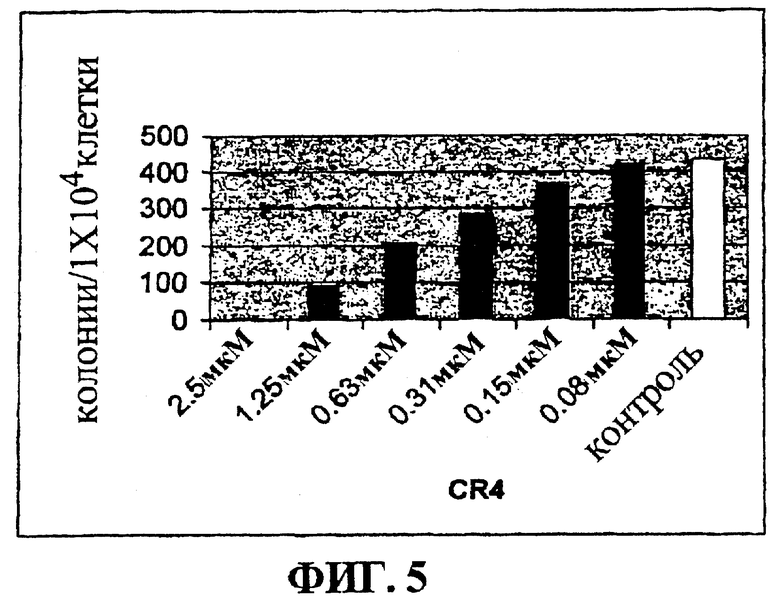
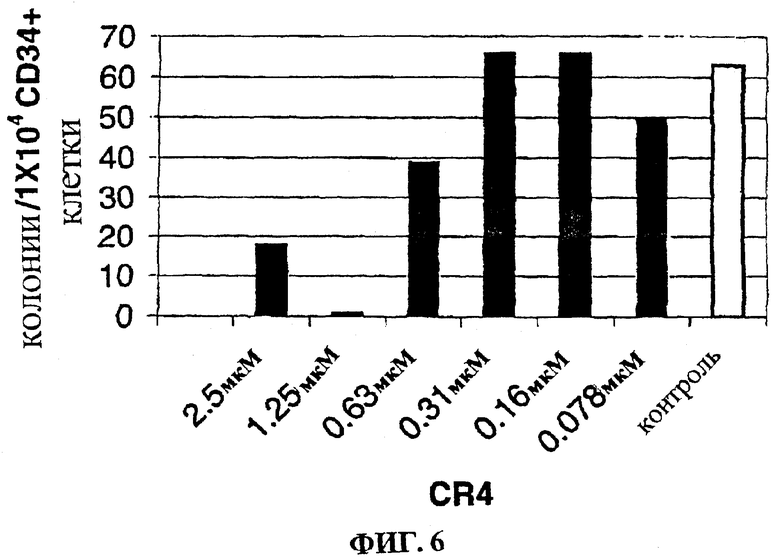
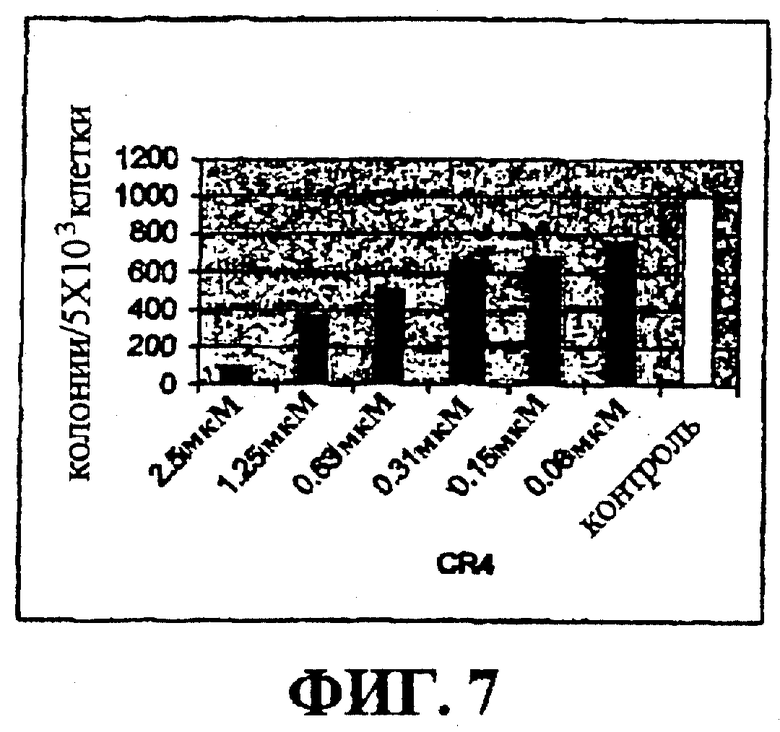
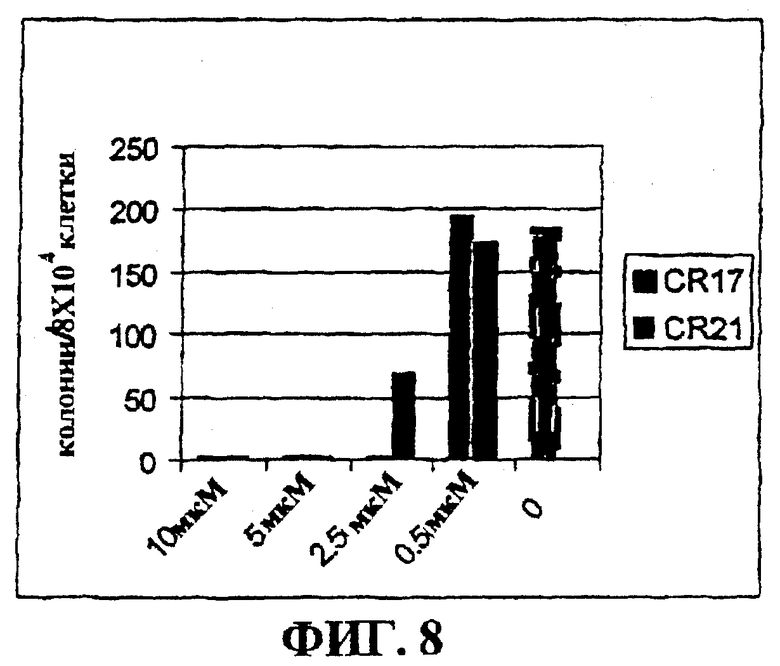
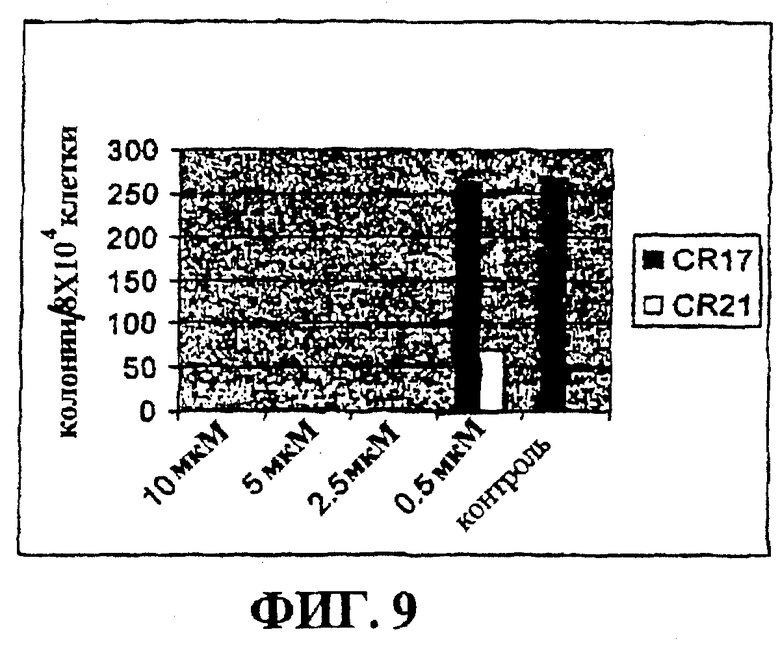
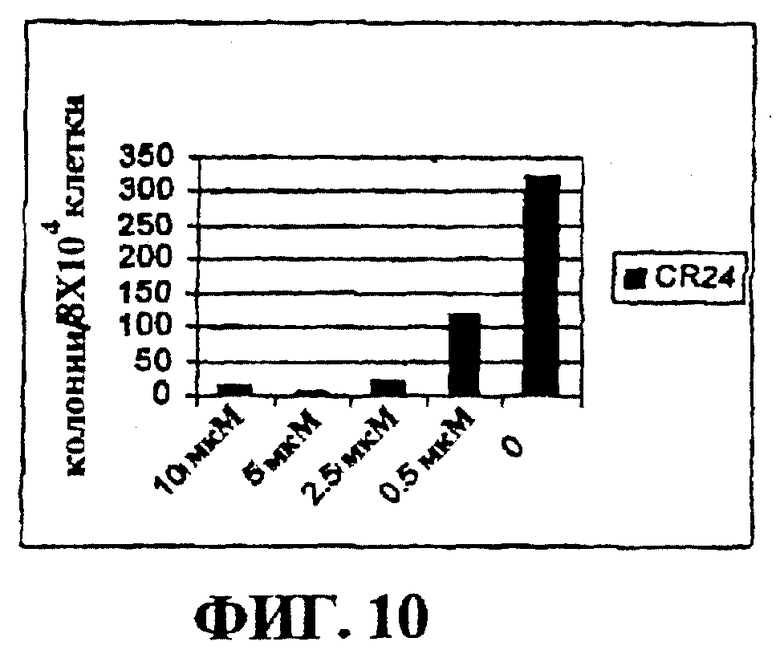

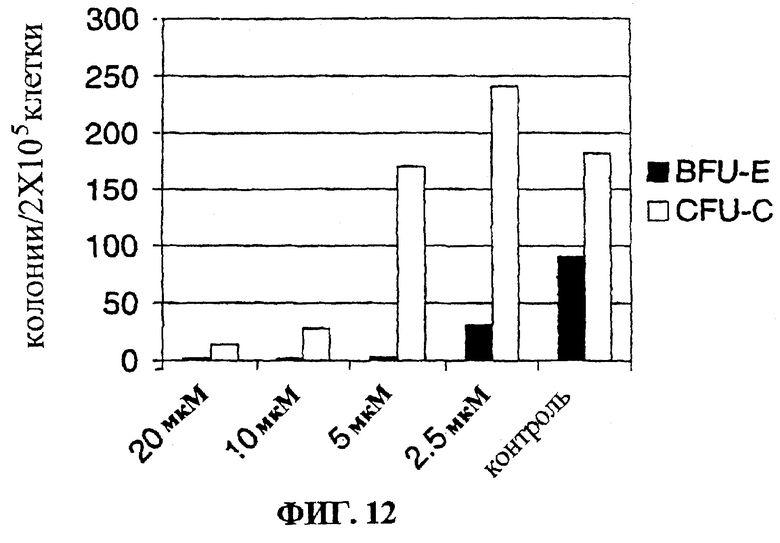
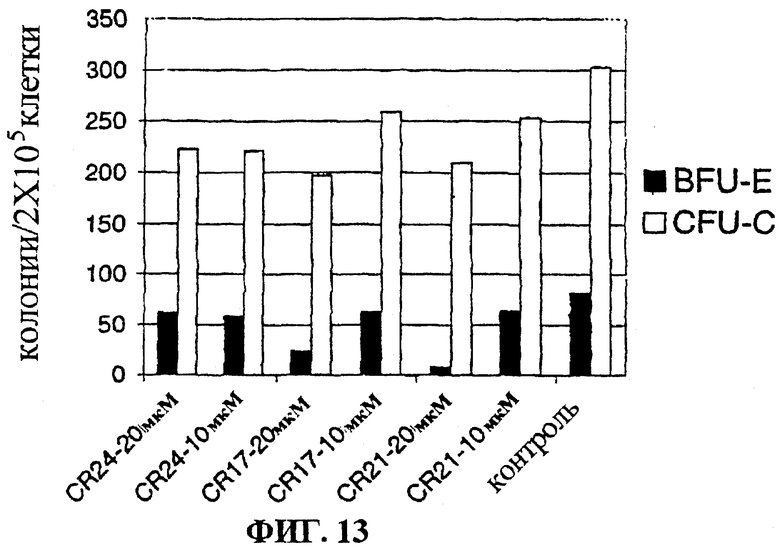
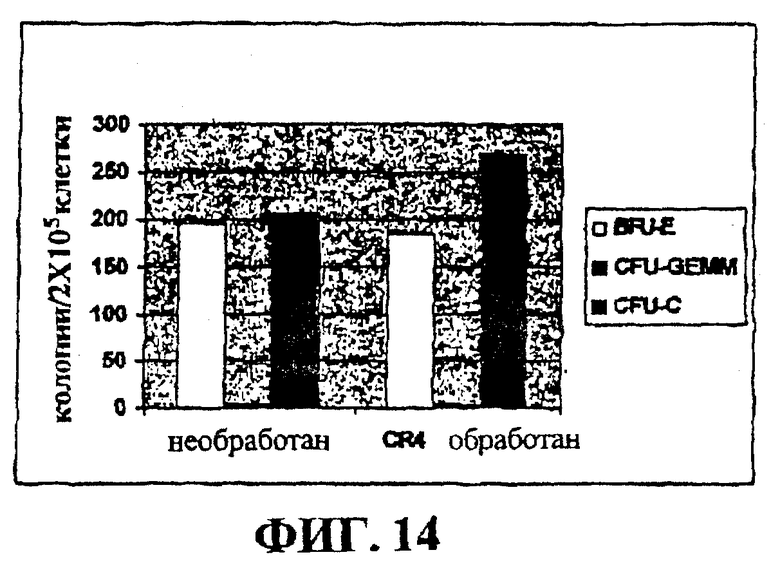

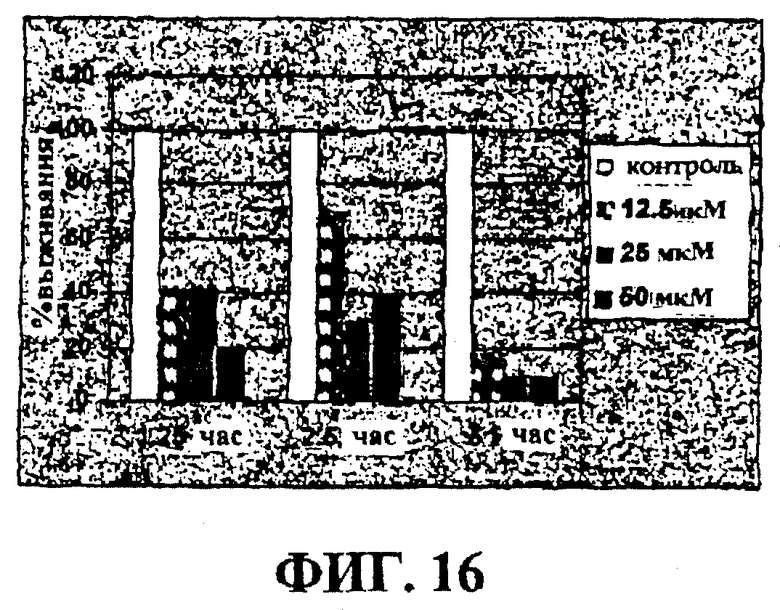
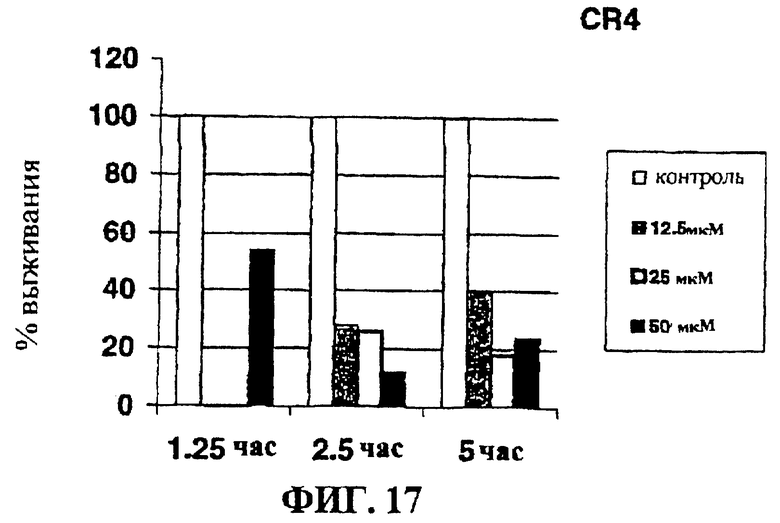
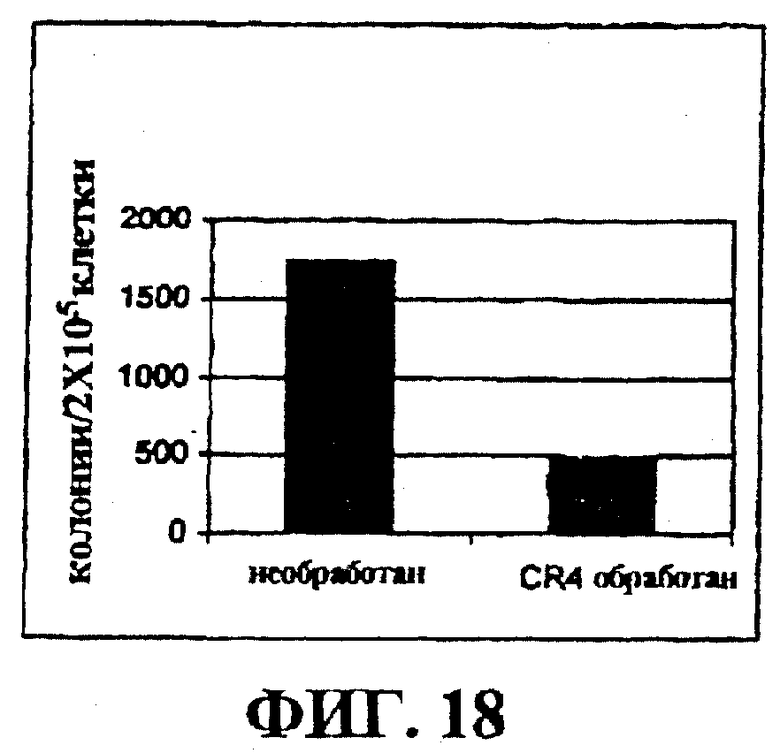
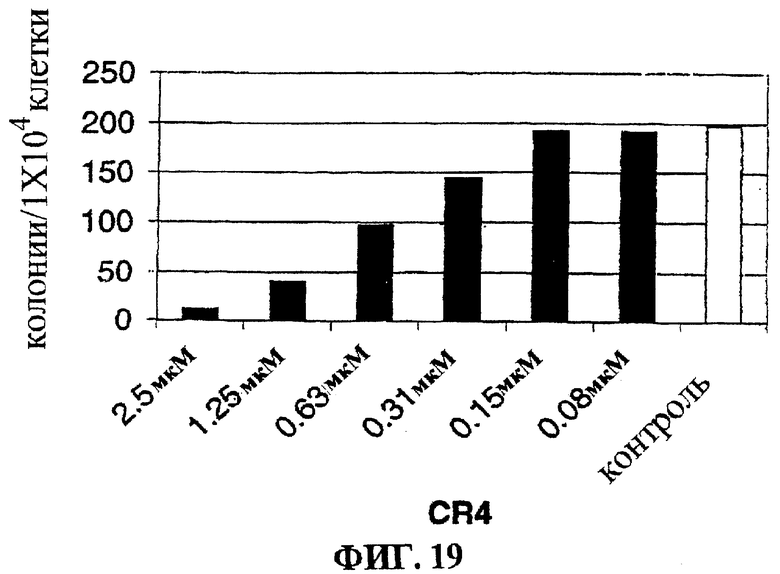
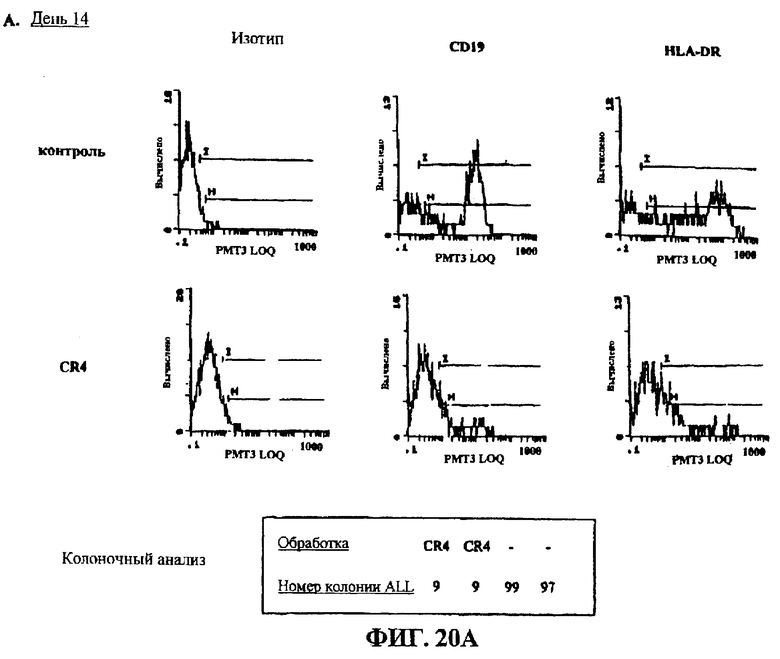
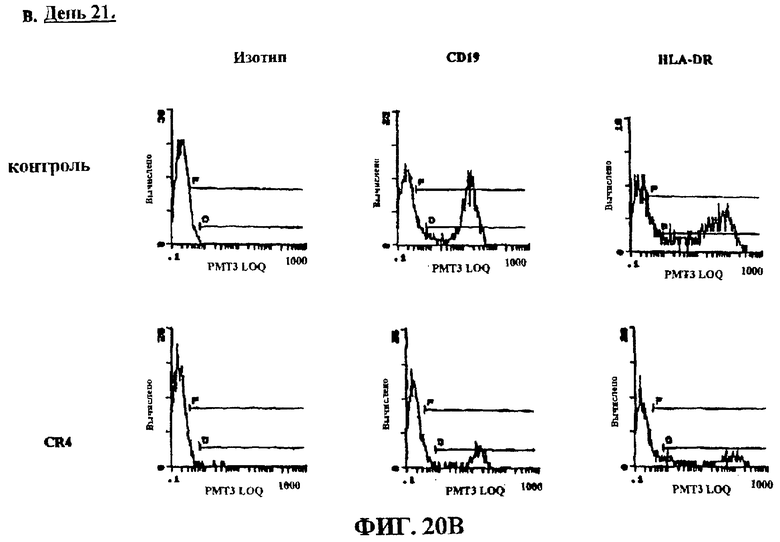
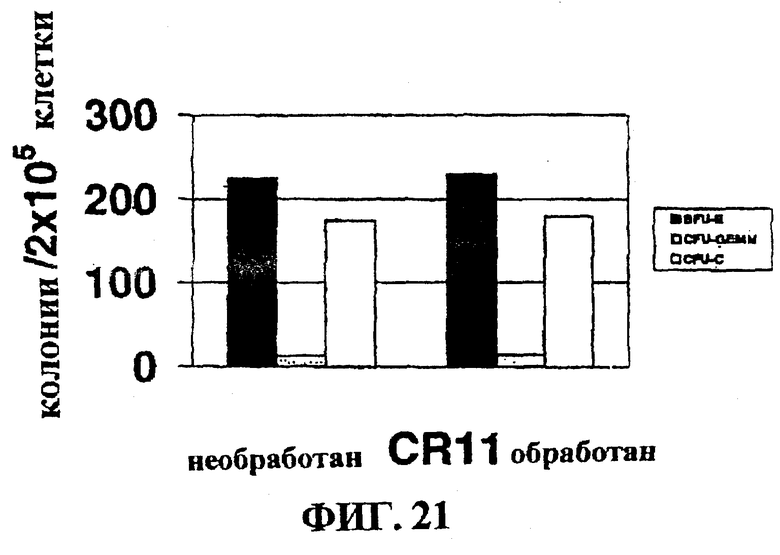
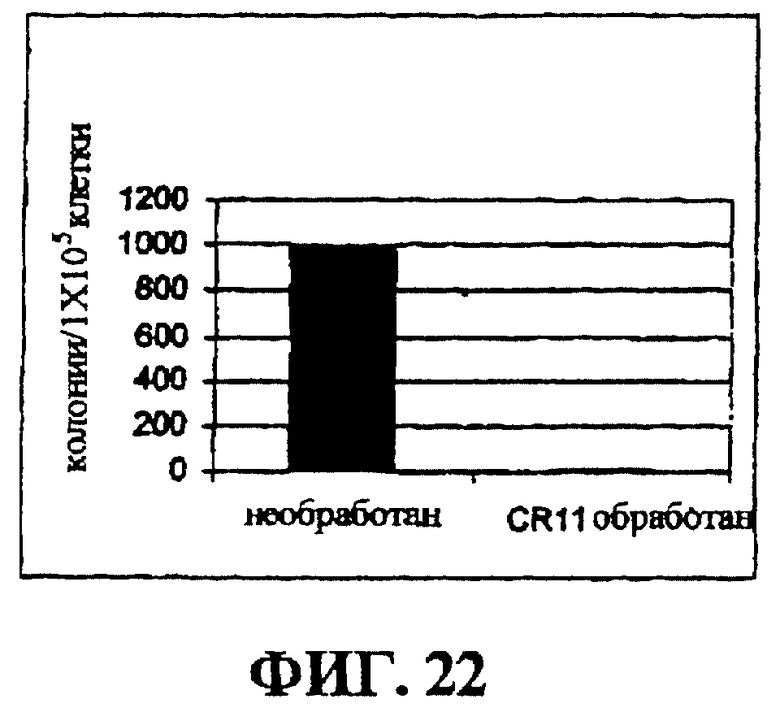
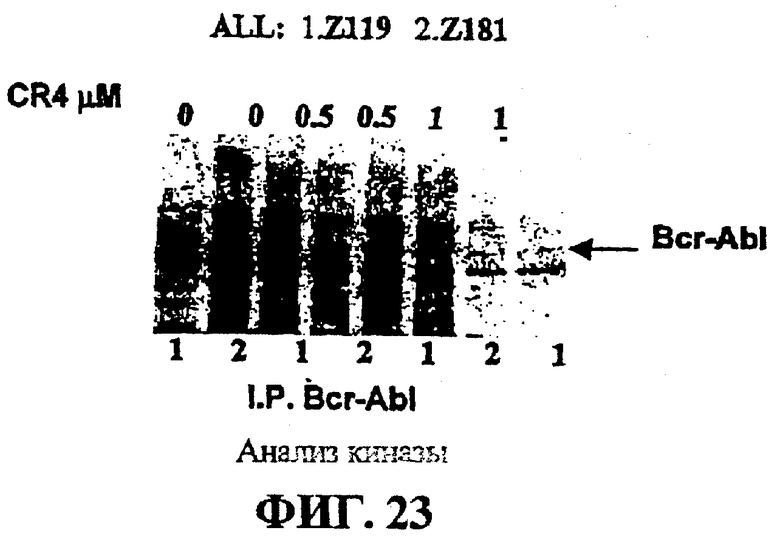
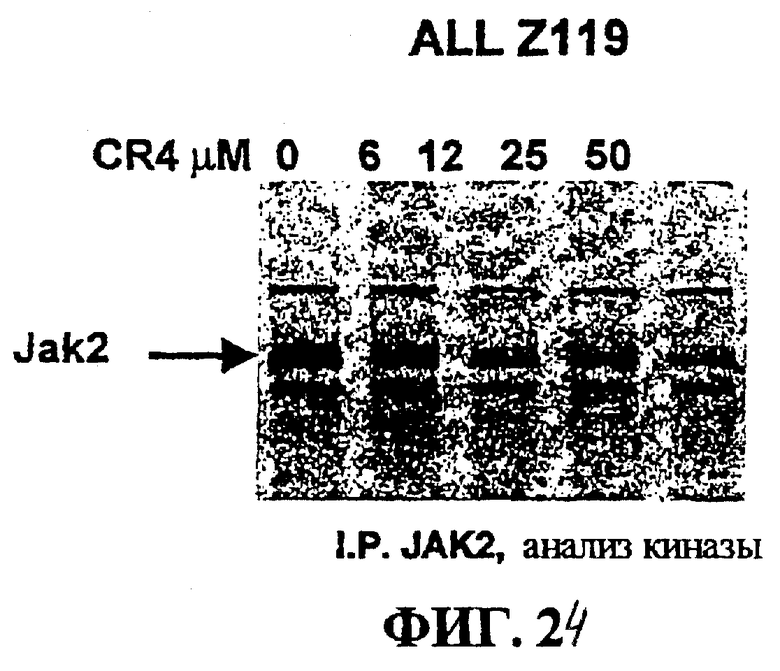
Изобретение относится к новым соединениям формулы I
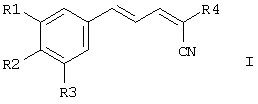
и формулы II
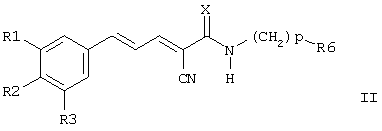
а также их эфирам, которые могут использоваться для лечения нарушений клеточной пролиферации. Кроме того, изобретение относится к фармацевтической композиции для модуляции клеточной пролиферации, содержащей соединение формулы I или его эфир. 7 н. и 55 з.п. ф-лы, 2 табл., 25 ил.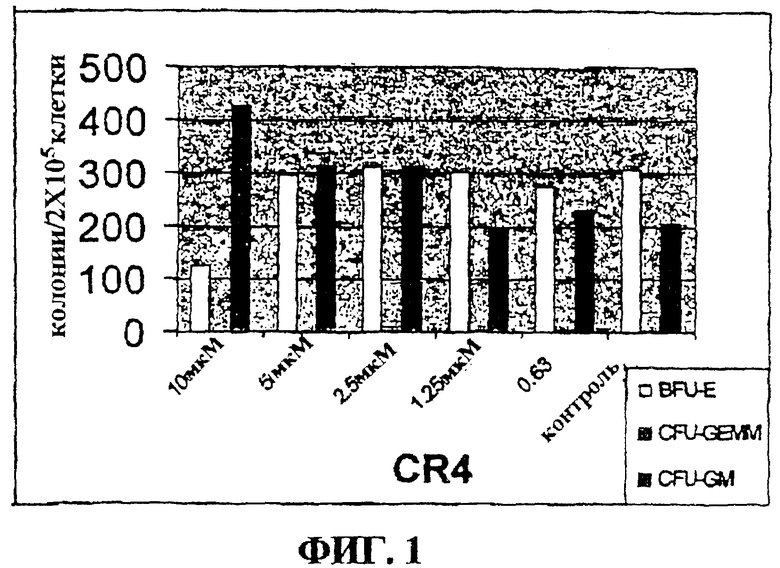
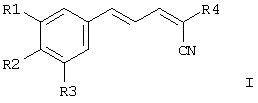
где
R1 и R2, каждый, независимо, выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6 алкил), SH, S-C1-6алкил, O-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6 алкокси, NH2,NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6 алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
R4 выбран из группы, включающей C(X)R5 и C(NH2)=C(CN)2;
X выбран из O и S;
R5 выбран из группы, включающей NH2, NH(CH2)pAr, NH(CH2)pOH, (CH2)pOC1-6алкил, C1-6алкил, NHC(O)NH2, NHC(O)C1-6алкокси, N-морфолино и N-пирролидино; и
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6 алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
n равно 0-4; и
р равно 1-4,
в смеси с фармацевтически приемлемым разбавителем или носителем.
(Е,Е)-2-(фенилэтиламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR8);
(Е,Е)-2-аминокарбонил-3-[3,4-бис(трет-бутилдиметилсилилокси)стирил)]акрилонитрил (CR16);
(Е,Е)-2-(бензиламинокарбонил)-3-[3,4-бис(трет-бутилдиметилсилилокси)стирил)]акрилонитрил (CR18);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR20);
(Е,Е)-2-(бензиламинокарбонил)-3-(4-нитростирил)акрилонитрил (CR27);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-(4-нитростирил)акрилонитрил (CR28) и
(Е,Е)-2-(1-амино-2,2-дицианоэтенил)-3-(4-нитростирил)акрилонитрил (CR29).
(Е,Е)-2-(бензиламинокарбонил)-3-стирилакрилонитрил (CR1);
(Е,Е)-2-(бензиламинокарбонил)-3-(3,4-диметоксистирил)акрилонитрил (CR2);
(Е,Е)-2-(бензиламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR3);
(Е,Е)-2-(фенилэтиламинокарбонил)-3-(3,4-диметоксистирил)акрилонитрил (CR5);
(Е,Е)-2-(фенилпропиламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR9);
(Е,Е)-2-аминотиокарбонил-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR12);
(Е,Е)-2-ацетаминокарбонил-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR13).
(Е,Е)-2-(бензиламинокарбонил)-3-(3,4-дигидроксистирил)акрилонитрил (CR4);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR11);
(Е,Е)-2-аминокарбонил-3-(3,4-дигидроксистирил)акрилонитрил (CR17);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-стирилакрилонитрил (CR19);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-(3,4-дигидроксистирил)акрилонитрил (CR21) и
(Е,Е)-2-(β-этаноламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR24).

где
R1 и R2 каждый независимо выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, O-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей H, OH, C1-6алкил, C1-6алкокси, NH2,NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, О-Si(C1-6алкил)(C1-6алкил)(C1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
R4 выбран из группы, включающей C(X)R5 и C(NH2)=C(CN)2;
X выбран из O и S;
R5 выбран из группы, включающей NH2, NH(CH2)pAr, NH(CH2)pOH, (CH2)pOC1-6алкил, C1-6алкил, C1-6алкокси, NHC(O)NH2, NHC(O)C1-6алкокси, N-морфолино и N-пирролидино; и
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей OH, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
n равно 0-4;
р равно 1-4, при условии, что
(i) когда R1, R2 и R3 все представляют собой Н, тогда R4 не означает С(O)ОС1-2алкил, C(O)NH2, C(S)NH2, C(O)Me, С(O)изо-Bu, С(O)(СН2)4СН3,
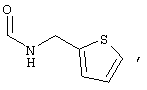
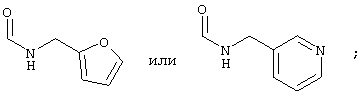
(ii) когда R1 и R3 представляют собой Н и R2 представляет собой NMe2, тогда R4 не означает С(O)ОС1-2алкил, C(O)NH2 или P(O)(OEt)2;
(iii) когда R1 и R3 представляют собой Н и R2 представляет собой NEt2, тогда R4 не означает C(NH2)=C(CN)2 или C(O)OEt;
(iv) когда R1 и R3 представляют собой Н и R2 представляет собой NO2, тогда R4 не означает C(S)NH2;
(v) когда R1 и R3 представляют собой Н и R2 представляет собой ОМе, тогда R4 не означает С(O)ОС1-2алкил;
(vi) когда R2 представляет собой трет-Bu, Cl или Me, и R1 и R3 представляют собой Н, тогда R4 не означает C(O)OEt;
(vii) когда R1 представляет собой ОМе, и R2 и R3 представляют собой Н, тогда R4 не означает C(O)OEt; и
(viii) когда R3 представляет собой ОМе, и R1 и R2 представляют собой Н, тогда R4 не означает C(O)OEt.
(Е,Е)-2-(фенилэтиламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CRS);
(Е,Е)-2-аминокарбонил-3-[3,4-бис(трет-бутилдиметилсилил-оксистирил)]акрилонитрил (CR16);
(Е,Е)-2-(бензиламинокарбонил)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR18);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-[3,4-бис(трет-бутилдиметилсилилоксистирил)]акрилонитрил (CR20);
(Е,Е)-2-(бензиламинокарбонил)-3-(4-нитростирил)акрилонитрил (CR27);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-(4-нитростирил)-акрилонитрил (CR28) и
(Е,Е)-2-(1-амино-2,2-дицианоэтенил)-3-(4-нитростирил)-акрилонитрил (CR29).
(Е,Е)-2-(бензиламинокарбонил)-3-(4-нитростирил)акрилонитрил (CR1);
(Е,Е)-2-(бензиламинокарбонил)-3-(3,4-диметоксистирил)-акрилонитрил (CR2);
(Е,Е)-2-(бензиламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR3);
(Е,Е)-2-(фенилэтиламинокарбонил)-3-(3,4-диметоксистирил)-акрилонитрил (CR5);
(Е,Е)-2-(фенилпропил)аминокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR9);
(Е,Е)-2-аминотиокарбонил-3-(3,5-диметокси-4-гидроксистирил)-акрилонитрил (CR12);
(Е,Е)-2-аминокарбонил-3-(3,5-диметокси-4-гидроксистирил)-акрилонитрил (CR13); и
(Е,Е)-2-карбометокси-3-(3,5-диметокси-4-гидроксистирил)-акрилонитрил (CR15).
(Е,Е)-2-(бензиламинокарбонил)-3-(3,4-дигидроксистирил)-акрилонитрил (CR4);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR11);
(Е,Е)-2-аминокарбонил-3-(3,4-дигидроксистирил)акрилонитрил (CR17);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-стирилакрилонитрил (CR19);
(Е,Е)-2-(3,4-дигидроксибензиламинокарбонил)-3-(3,4-дигидроксистирил)акрилонитрил (CR21) и
(Е,Е)-2-(β-этаноламинокарбонил)-3-(3,5-диметокси-4-гидроксистирил)акрилонитрил (CR24).

где
R1 и R2 каждый независимо выбран из группы, включающей ОН, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, O-Si(С1-6алкил)(С1-6алкил)(С1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей Н, ОН, С1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6алкил, O-Si(C1-6алкил)(C1-6алкил)(С1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
R4 выбран из группы, включающей C(X)R5 и C(NH2)=C(CN)2;
Х выбран из О и S;
R5 выбран из группы, включающей NH2, NH(CH2)pAr, NH(CH2)pOH, (СН2)рОС1-6алкил, С1-6алкил, С1-6алкокси, NHC(O)NH2, NHC(O)С1-6алкокси, N-морфолино и N-пирролидино; и
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей ОН, C1-6алкил, С1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
n равно 0-4; и
р равно 1-4.

где
R1 и R2 каждый независимо выбран из группы, включающей Н, ОН, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, O-Si(С1-6алкил)(С1-6алкил)(С1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей Н, ОН, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6 алкил, O-Si(C1-6алкил)(C1-6алкил)(С1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
R4 представляет собой C(X)R5;
Х выбран из О и S;
R5 выбран из группы, включающей NH(CH2)pAr, NH(СН2)рОН, (СН2)рОС1-6алкил, NHC(O)NH2, NHC(O)С1-6алкокси, N-морфолино и N-пирролидино;и
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей ОН, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
n равно 0-4; и
р равно 1-4.
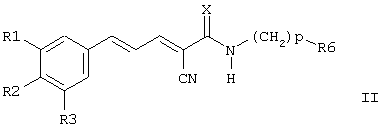
где
R1 и R2 каждый независимо выбран из группы, включающей Н, ОН, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, O-Si(С1-6алкил)(С1-6алкил)(С1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей Н, ОН, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6алкил, O-Si(С1-6алкил)(С1-6алкил)(С1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
R6 выбран из группы, включающей Ar, ОН и OC1-6алкил;
Ar представляет собой ароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей ОН, С1-6алкил, С1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(C1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
Х выбран из О и S;
n равно 0-4; и
р равно 1-4.

где
R1 выбран из группы, включающей Н, ОН, С1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6алкил, O-Si(C1-6алкил)(C1-6алкил)(С1-6алкил), NO2, CF3, OCF3 и галоген;
R2 выбран из группы, включающей O-Si(С1-6алкил)(С1-6алкил)(С1-6алкил), CF3, OCF3 и галоген;
R3 выбран из группы, включающей Н, ОН, C1-6алкил, С1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6 алкил, O-Si(C1-6алкил)(C1-6алкил)(С1-6алкил), NO2, галоген и CH2-S-(CH2)nAr;
R4 представляет собой СО2Н;
Ar представляет собой ароматическую или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей ОН, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген;
n равно 0-4;
р равно 1-4;
при условии, что
(i) R1, R2 и R3 все не означают Н;
(ii) когда R1 и R3 представляют собой Н, тогда R2 не означает NMe2;
(iii) когда R1 и R3 представляют собой Н, тогда R2 не означает NO2;
(iv) когда R1 и R3 представляют собой Н, тогда R2 не означает ОМе;
(v) когда R1 и R2 представляют собой ОМе, тогда R3 не означает Н;
(vi) когда R2 и R3 представляют собой ОМе, тогда R1 не означает Н.

где
R1 и R2 каждый независимо выбран из группы, включающей Н, ОН, C1-6алкил, C1-6алкокси, NH2, NH-C1-6алкил, N(С1-6алкил)(С1-6алкил), SH, S-C1-6алкил, O-Si(С1-6алкил)(С1-6алкил)(С1-6алкил), NO2, CF3, OCF3 и галоген;
R3 выбран из группы, включающей O-Si(С1-6алкил)(С1-6алкил)(С1-6алкил), галоген и CH2-S-(CH2)nAr;
R4 представляет собой СО2Н;
Ar представляет собой ароматическую группу или гетероароматическую группу, незамещенную или замещенную 1-4 заместителями, независимо выбранными из группы, включающей ОН, C1-6алкил, С1-6алкокси, NH2, NH-C1-6алкил, N(C1-6алкил)(С1-6алкил), SH, S-C1-6алкил, NO2, CF3, OCF3 и галоген; и
n равно 0-4.
| СПОСОБ ОПТИЧЕСКОЙ ОБРАБОТКИ СЕЙСМИЧЕСКОЙИНФОРМАЦИИ | 0 |
|
SU335641A1 |
| Yanchang Shen et al | |||
| Synthesis of α, β-unsaturated cyanoesters promoted by tri-N-butylarsine | |||
| Synthetic Communications | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
Авторы
Даты
2006-06-10—Публикация
2001-04-12—Подача