Настоящее изобретение относится к группе новых энантиомеров производных 4,5-дигидро-1Н-пиразола, имеющих S-конфигурацию в положении 4 своего 4,5-дигидропиразольного кольца, к способам получения указанных соединений, а также к фармацевтическим композициям, содержащим одно или несколько указанных соединений в качестве активного компонента.
Вышеупомянутые (4S)-4,5-дигидро-1Н-пиразолы являются сильными антагонистами рецептора каннабис-1 (СВ1), способными лечить психиатрические и неврологические нарушения.
Каннабиноиды, присутствующие в индийской конопле Cannabis Sativa L., применялись в качестве медицинских средств на протяжении многих веков (Mechoulam, R.; Feigenbaum, J.J. Prog. Med. Chem. 1987, 24, 159). Однако только в течение последних десяти лет исследования в области каннабиноидов позволили получить основную информацию о каннабиноидных рецепторах и их (эндогенных) агонистах и антагонистах. Открытие и последующее клонирование двух различных подтипов каннабиноидных рецепторов (СВ1 и СВ2) стимулировали поиски новых антагонистов (Munro, S.; Thomas, K.L.; Abu-Shaar, M. Nature 1993, 365, 61. Matsuda, L.A.; Bonner, T.I. Cannabinoid Receptors, Pertwee, R.G. Ed. 1995, 117, Academic Press, London). Кроме того, фармацевтические компании проявили интерес к развитию каннабиноидных лекарственных препаратов для лечения заболеваний, связанных с нарушениями каннабиноидной системы. Широкое распределение рецепторов СВ1 в мозгу в сочетании со строго периферической локализацией рецептора СВ2 делает рецептор СВ1 весьма интересной молекулярной мишенью для ЦНС-направленной разработки лекарственных препаратов в области как психиатрических, так и неврологических нарушений (Consroe, P. Neurobiology of Disease 1998, 5. 534. Pop, E. Curr. Opin. In CPNS Investigational Drugs 1999, 1, 587. Greenberg, D.A. Drug News Perspect. 1999, 12, 458). До настоящего времени было известно три вида различных антагонистов рецепторов СВ1. Sanofi описывает их родственные диарилпиразолы как селективные антагонисты рецепторов СВ1. Характерным примером является SR-141716 А, в настоящее время проходящий фазу II клинической разработки для лечения психотических нарушений (Dutta, A.K.; Sard, H.; Ryan, W.; Razdan, R.K.; Compton, D.R.; Martin, B.R. Med. Chem. Res. 1994, 5, 54. Lan, R.; Liu, Q.; Fan, P.; Lin, S.; Fernando, S.R.; McCallion, D.; Pertwee, R.; Makriyannis, A. J. Med. Chem. 1999, 42, 769. Nakamura-Palacios, E.M.; Moerschbaecher, J.M.; Barker, L.A. CNS Drug Rev. 1999, 5, 43). В качестве антагонистов рецепторов СВ1 были описаны аминоалкилиндолы. Характерным примером является иодоправадолин (АМ-630), разработанный в 1995 г. АМ-630 является антагонистом рецептора СВ1, однако иногда он ведет себя как слабый частичный агонист (Hosohata, K.; Quock, R.M.; Hosohata, Y.; Burkey, T.H.; Makriyannis, A.; Consroe, P.; Roeske, W.R.; Yamamura, H.I. Life Sc. 1997, 61, PL115). Позднее исследователи из Eli Lilly описали арил-ароил-замещенные бензофураны в качестве селективных антагонистов рецептора СВ1 (например, LY-320135) (Felder, C.C.; Joyce, K.E.; Briley, E.J.; Glass, M.; Mackie, K.P.; Fahey, K.J.; Cullinan, G.J.; Hunden, D.C.; Johnson, D.W.; Chaney, M.O.; Koppel, G.A.; Brownstein, M. J. Pharmacol. Exp. Ther. 1998, 284, 291). Недавно в качестве лигандов каннабиноидных рецепторов были описаны 3-алкил-5,5'-дифенилимидазолидиндионы, названные каннабиноидными антагонистами (Kanyonyo, M.; Govaerts, S.J.; Hermans, E.; Poupaert, J.H.; Lambert, D.M. Biorg. Med. Chem. Lett. 1999, 9, 2233). Интересно, что, в соответствии с описаниями, антагонисты рецептора СВ1 ведут себя in vitro как инверсивные агонисты (Landsman, R.S.; Burkey, T.H.; Consroe, P.; Roeske, W.R.; Yamamura, H.I.; Eur. J. Pharmacol. 1997, 334, R1). Недавно опубликованные обозрения содержат полные обзоры о современном состоянии дел в области исследования каннабиноидов (Mechoulam, R.; Hanus, L.; Fride, E. Prog. Med. Chem. 1998, 35,199. Lambert, D.M. Curr. Med. Chem. 1999, 6, 635. Mechoulam, R.; Fride, E.; Di Marzo, V. Eur. J. Pharmacol. 1998, 359, 1).
Неожиданно было обнаружено, что новые энантиомеры производных 4,5-дигидро-1Н-пиразола, имеющих S-конфигурацию в положении 4 своего 4,5-дигидропиразольного кольца формулы (I), их пролекарства, таутомеры и соли
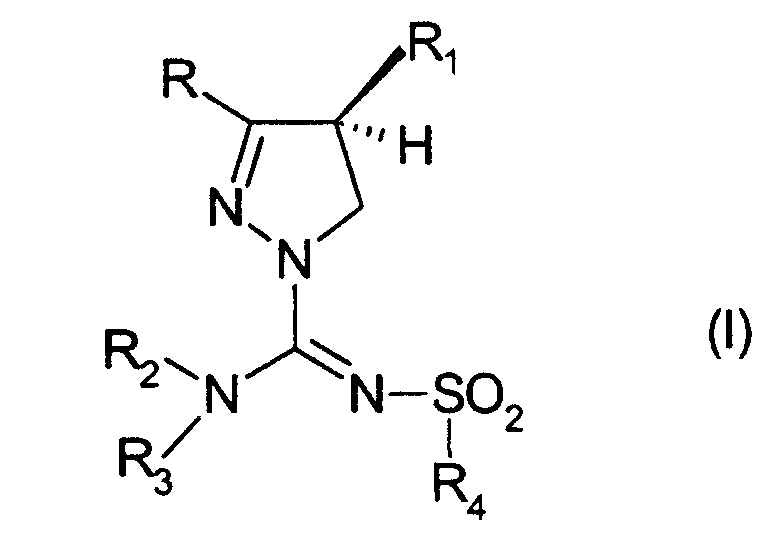
в которой R и R1, одинаковые или различные, представляют 3-пиридил или 4-пиридил, или фенил, который может быть замещен галогеном или метоксилом,
R2 и R3, одинаковые или различные, представляют водород, алкил (1-3С) или диметиламино,
R4 представляет фенил, который может быть замещен 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, трифторметил, метоксил и алкил (1-3 С),
являются намного более сильными и селективными антагонистами СВ1-рецептора каннабиса, чем соответствующий R-энантиомер.
Благодаря высокой антагонистической активности соединения СВ1 в соответствии с данным изобретением могут быть использованы для лечения психиатрических расстройств, таких как психоз, тревога, депрессия, дефицит внимания, нарушения памяти и аппетита, ожирение, неврологические расстройства, такие как слабоумие, дистония, болезнь Паркинсона, болезнь Альцгеймера, эпилепсия, болезнь Гентингтона, синдром Туретта, церебральная ишемия, а также для лечения болевых расстройств и других заболеваний ЦНС, включая каннабиноидную нейротрансмиссию, равно как и для лечения желудочно-кишечных и сердечно-сосудистых нарушений.
Аффинность соединений в соответствии с данным изобретением по отношению к каннабиноидным рецепторам СВ1 определяют, применяя мембранные препараты клеток яичника китайского хомячка (СНО), в которых каннабиноидный рецептор СВ1 человека устойчиво трансфицируют в сочетании с [3H]CP-55,940 в качестве радиолиганда. После инкубирования свежеприготовленного препарата из клеточных мембран вместе с [3H]-лигандом с добавлением соединений в соответствии с данным изобретением или без них, осуществляют разделение связанных и свободных лигандов путем их фильтрации через фильтры из стекловолокна. Радиоактивность на фильтре определяют при помощи жидкостного сцинтилляционного подсчета.
Каннабиноидную антагонистическую активность СВ1 соединений в соответствии с данным изобретением определяют в результате функциональных исследований клеток СНО, в которых устойчиво экспрессированы каннабиноидные рецепторы СВ1 человека. Аденилилциклазу стимулируют при помощи форсколина и измеряют путем количественного определения аккумулированного циклического АМФ. Одновременная активация рецепторов СВ1 при помощи агонистов данных рецепторов (например, СР-55,940 или (R)-WIN-55,212-2) может аттенюировать индуцированную форсколином аккумуляцию цАМФ зависимым от концентрации образом. Подобный опосредованный рецепторами СВ1 ответ может быть антагонизирован антагонистами рецепторов СВ1, такими как соединения в соответствии с данным изобретением.
Данное изобретение относится как к Е-изомеру, Z-изомеру, так и E/Z смесям соединений, имеющих формулу (I).
Соединениям может быть придана форма, подходящая для введения обычными способами с применением вспомогательных веществ и/или жидких или твердых материалов-носителей.
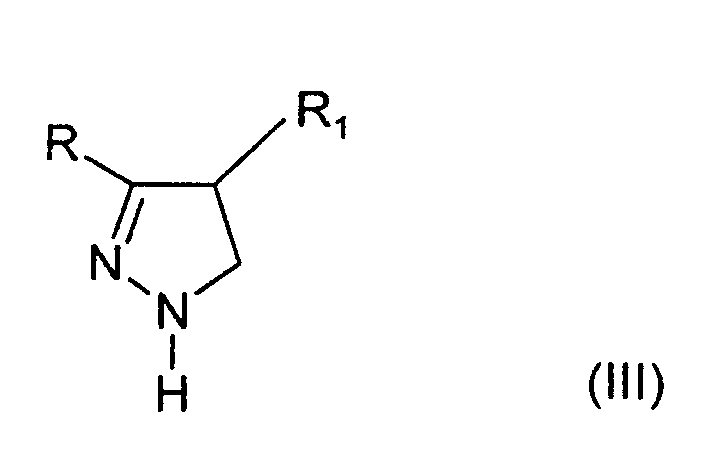
Соединения в соответствии с данным изобретением, имеющие формулу (III) (vide infra), могут быть получены согласно известным способам, например: а) ЕР 0021506; d) DE 2529689.
Подходящими способами синтеза для рацемических соединений в соответствии с настоящим изобретением являются следующие способы:
Способ синтеза А
Стадия 1 способа А
Взаимодействие соединения формулы (III)

с соединением формулы (IV)

в которой R5 представляет низшую алкилгруппу, например, такую как 2-метил-2-тиопсевдомочевина, либо с подходящим типом его соли в присутствии основания. Такое взаимодействие приводит к получению производного 4,5-дигидро-1Н-пиразол-карбоксамидина, имеющего формулу (V)

в которой символы имеют вышеуказанные значения. Соединения формулы (V), в которой R, R1, R2 и R3 имеют значения, указанные выше в данном описании для соединения (I), являются новыми.
Альтернативно, соединение, имеющее формулу (III), подвергают взаимодействию с так называемым гуанилирующим агентом. Примерами таких гуанилирующих агентов являются 1Н-пиразол-1-карбоксамидин и его соли (например, хлористоводородная соль), а также 3,5-диметил-1Н-пиразол-1-карбоксамидин и его соли (например, нитратная соль) и т.п. Данное взаимодействие приводит к получению производного карбоксамидина, имеющего формулу (V).
Альтернативно соединение, имеющее формулу (III), подвергают взаимодействию с так называемым защищенным гуанилирующим агентом. Примерами таких защищенных гуанилирущих агентов являются N-(бензилоксикарбонил)-1Н-пиразол-1-карбоксамидин, N-(трет-бутоксикарбонил)-1Н-пиразол-1-карбоксамидин и N,N'-бис-(трет-бутоксикарбонил)-1Н-пиразол-1-карбоксамидин и т.п. После снятия защиты данное взаимодействие приводит к получению соединения формулы (V).
Стадия 2 способа А
Соединение формулы (V) подвергают взаимодействию с необязательно замещенным соединением формулы R4-SO2Х, в которой R4 имеет вышеуказанное значение, а Х представляет атом галогена. Эту реакцию предпочтительно осуществляют в присутствии основания, такого как триэтиламин, в апротонном растворителе, таком как ацетонитрил.
Способ синтеза А1
Стадия 1 способа А1
Взаимодействие соединения формулы (III)

с производным тиоизоцианата формулы (VI)

Данное взаимодействие предпочтительно осуществляют в инертном органическом растворителе, например, таком как ацетонитрил.
Данное взаимодействие приводит к получению производного тиокарбоксамида формулы (VII). Соединения, имеющие формулу (VII), в которой R, R1 и R4 имеют значения, указанные выше для соединения (I), являются новыми.

Стадия 2 способа А1
Взаимодействие соединения формулы (VII) с амином в присутствии соли ртути (II), например, такой как HgCl2, приводит к получению соединения формулы (I). Данное взаимодействие предпочтительно осуществляют в полярном органическом растворителе, например, таком как ацетонитрил.
Способ синтеза А2
Стадия 1 способа А2
Взаимодействие соединения формулы (III)

с производным сложного эфира карбамата формулы (VIII)

в которой R6 представляет низшую алкилгруппу, например, метил.
Данное взаимодействие предпочтительно осуществляют в инертном органическом растворителе, например, таком как 1,4-диоксан.
Данное взаимодействие приводит к получению производного 4,5-дигидропиразол-1-карбоксамида формулы (IX). Соединения формулы (IX), в которой R, R1 и R4 имеют значения, указанные выше для соединения (I), являются новыми.

Стадия 2 способа А2
Взаимодействие соединения формулы (IX) с галогенирующим агентом, например, таким как PCl5, приводит к получению производного галогенида 4,5-дигидропиразол-1-карбоксимидоила формулы (Х)

в которой R7 представляет атом галогена, например, такой как хлор. Данное взаимодействие предпочтительно осуществляют в инертном органическом растворителе, например, таком как хлорбензол.
Соединения формулы (Х), в которых R, R1 и R4 имеют значения, указанные выше для соединения (I), и в которых R7 представляет атом галогена, являются новыми.
Стадия 3 способа А2
Взаимодействие соединения формулы (Х) с амином приводит к получению соединения формулы (I).
Данное взаимодействие предпочтительно осуществляют в инертном органическом растворителе, например, таком как дихлорметан.
Способ синтеза А3
Стадия 1 способа А3
Взаимодействие соединения, имеющего формулу III
с производным сложного эфира дитиоимидокарбоновой формулы (XI)
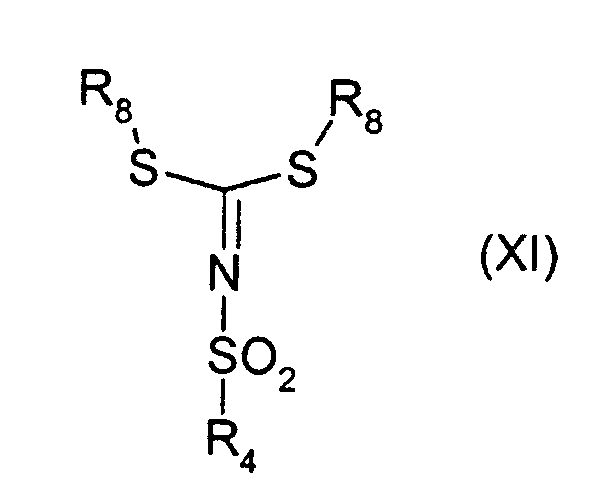
в которой R8 представляет С1-3 алкилгруппу.
Данное взаимодействие предпочтительно осуществляют в полярном органическом растворителе, например, таком как ацетонитрил.

Данное взаимодействие приводит к получению производного сложного эфира карбоксимидотиокислоты формулы (XII).
Соединения формулы (XII), в которых R, R1 и R4 имеют значения, указанные выше для соединения (I), и в которых R8 представляет С1-3 алкилгруппу, являются новыми.
Стадия 2 способа А3
Взаимодействие соединения формулы (XII) с амином приводит к получению соединения формулы (I).
Данное взаимодействие предпочтительно осуществляют в полярном органическом растворителе, например, таком как метанол.
Пример I
3-(4-Хлорфенил)-4,5-дигидро-N-((4-фторфенил)сульфонил)-4-
фенил-1Н-пиразол-1-карбоксамидин
Часть А: Перемешиваемую смесь 3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразола (5,13 г, 20,0 ммоль), гидроиодид 2-метил-2-тиопсевдомочевины (5,00 г, 23,0 ммоль) и пиридин (10 мл) нагревают при 110°С в течение часа. После отстаивания в течение ночи при комнатной температуре добавляют простой диэтиловый эфир, а осадок собирают фильтрацией. Полученный осадок трижды промывают порциями простого диэтилового эфира, получая твердое вещество (9 г). Температура плавления:˜230°С. Полученное твердое вещество растворяют в метаноле (20 мл). К полученному раствору последовательно добавляют 2 н. раствор гидроксида натрия (12 мл) и воду (200 мл). Образующийся осадок собирают фильтрацией, дважды промывают простым диэтиловым эфиром и, последовательно, простым диизопропиловым эфиром. Полученное твердое вещество сушат в вакууме, получая в результате 3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин (5,1 г, выход 88%). Температура плавления: 187-189°С.
Часть В: К перемешиваемой смеси 3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидина (0,50 г, 1,68 ммоль) и 4-фторфенилсульфонилхлорида (0,34 г, 1,75 ммоль) в ацетонитриле (10 мл) добавляют N,N-диметил-4-аминопиридин (0,020 г, 0,175 ммоль) и триэтиламин (1 мл). Полученный раствор перемешивают при комнатной температуре в течение 30 минут. После добавления 2 н. раствора гидроксида натрия и экстрагирования этилацетатом (400 мл), слой этилацетата концентрируют в вакууме. Получаемый сырой остаток далее очищают с помощью флэш-хроматографии (петролейный эфир/ простой диэтиловый эфир = 1/1 (об./об.), а затем этилацетат). В результате последующей концентрации в вакууме получают твердый 3-(4-хлорфенил)-4,5-дигидро-N-((4-фторфенил)сульфонил)-4-фенил-1Н-пиразол-1-карбоксамидин (0,55 г, выход 72%). Температура плавления: 214-215°С.
Аналогичным способом получают перечисленные ниже соединения, имеющие формулу (I):
4,5-дигидро-N-((4-фторфенил)сульфонил)-3-(4-метоксифенил)-4-(4-метоксифенил)-1Н-пиразол-1-карбоксамидин: температура плавления: 155-156°С;
4,5-дигидро-3-(4-метоксифенил)-4-(4-метоксифенил)-N-((4-метоксифенил)сульфонил)-1Н-пиразол-1-карбоксамидин: температура плавления: 148-150°С;
3-(4-хлорфенил)-4,5-дигидро-4-фенил-N-((2,4,6-триметилфенил)сульфонил)-1Н-пиразол-1-карбоксамидин: температура плавления: 221-222°С.
Пример II
N1,N1-Диметил-N2-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-
4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин
Часть А: Перемешиваемую смесь 3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразола (12,0 г, 46,8 ммоль), сложного диметилового эфира [(4-хлорфенил)сульфонил]дитиоимидокарбоновой кислоты (CAS: 13068-12-7) (9,20 г, 31,1 ммоль) и триэтиламина (15 мл) в ацетонитриле (200 мл) нагревают при температуре кипения в течение 20 часов. Добавляют дополнительную порцию 3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразола (12,0 г, 46,8 ммоль) и полученную смесь нагревают при температуре кипения в течение еще 16 часов. После концентрации в вакууме добавляют дихлорметан, а полученный раствор дважды промывают водой и сушат над безводным Na2SO4. После фильтрации и выпаривания в вакууме остаток подвергают очистке флэш-хроматографией (простой диэтиловый эфир/петролейный эфир = 1/1 (об./об.)), получая сложный метиловый эфир 3-(4-хлорфенил)-N-((4-хлорфенил)сульфонил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксимидотиокислоты (12,5 г, выход составляет 80% от сложного диметилового эфира [(4-хлорфенил)-сульфонил]дитиоимидокарбоновой кислоты) в виде аморфного твердого вещества.
Часть В: К перемешиваемой смеси сложного метилового эфира 3-(4-хлорфенил)-N-((4-хлорфенил)сульфонил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксимидотиокислоты (4,20 г, 8,30 ммоль) в метаноле (75 мл) добавляют диметиламин (10 мл) и дихлорметан (75 мл) и полученный раствор перемешивают при комнатной температуре в течение 6 часов. Выпаривание в вакууме и последующая флэш-хроматографическая очистка (простой диэтиловый эфир/петролейный эфир = 1/1 (об./об.), а затем простой диэтиловый эфир) приводят к получению вещества, которое затем подвергают очистке перекристаллизацией из простого диизопропилового эфира, получая N1-диметил-N2-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин (2,63 г, выход 63%). Температура плавления: 182°С.
Аналогичным способом получают перечисленные ниже соединения формулы (I):
N-метил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-(3-пиридил)-1Н-пиразол-1-карбоксамидин. Температура плавления: 101-105°С.
N-метил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-(4-пиридил)-1Н-пиразол-1-карбоксамидин. Температура плавления: 112-115°С.
Пример III
N-Метил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин
Часть А: К раствору сложного метилового эфира N-((4-хлорфенил)сульфонил)карбаминовой кислоты (CAS: 34543-04-9) (2,99 г, 12,0 ммоль) и пиридина (4 мл) в 1,4-диоксане (20 мл) добавляют 3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол (3,39 г, 13,2 ммоль) и полученную смесь перемешивают в течение 4 часов при 100°С. После концентрации в вакууме остаток растворяют в дихлорметане, последовательно промывают водой, 1 н. HCl и водой, сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме до объема, составляющего 20 мл. Добавляют простой метил-трет-бутиловый эфир (60 мл) и полученный раствор концентрируют до объема, составляющего 20 мл. Полученные кристаллы собирают фильтрацией и перекристаллизовывают из простого метил-трет-бутилового эфира, получая 3-(4-хлорфенил)-N-((4-хлорфенил)сульфонил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамид (4,75 г, выход составляет 76%). Температура плавления: 211-214°С.
Часть В: Смесь 3-(4-хлорфенил)-N-((4-хлорфенил)сульфонил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамида (3,67 г, 7,75 ммоль) и пентахлорида фосфора (1,69 г, 8,14 ммоль) в хлорбензоле (40 мл) нагревают при кипении с обратным холодильником в течение часа. После тщательной концентрации в вакууме полученный N-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксимидоилхлорид суспендируют в дихлорметане и подвергают взаимодействию с холодным метиламином (1,5 мл). После перемешивания при комнатной температуре в течение часа смесь концентрируют в вакууме. Остаток кристаллизуют из простого диэтилового эфира, получая N-метил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин (2,29 г, выход составляет 61%). Температура плавления:96-98°С (разл.).
Аналогичным способом получают перечисленные ниже соединения формулы (I):
N-метил-N'-((3-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 156-160°С.
N-пропил-N'-((4-фторфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 129-138°С.
N-(2-пропил)-N'-((4-фторфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 110-112°С.
N-(2-пропил)-N'-((4-фторфенил)сульфонил)-3-(4-пиридил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: аморфное вещество.
N1-этил-N1-метил-N2-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 184°С.
N1-этил-N1-метил-N2-((4-фторфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 173-176°С.
N1,N1-диметил-N2-((4-трифторметил)фенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 195-196°С.
N1,N1-диметил-N2-((3-метилфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 195-198°С.
N1,N1-диметил-N2-((3-метоксифенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 204-206°С.
N-этил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: аморфное вещество.
N-диметиламино-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 155-159°С.
N-метил-N'-((4-трифторметил)фенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: аморфное вещество.
N1,N1-диметил-N2-((2-метилфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 148-151°С.
N-метил-N'-((2,4-дифторфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин. Температура плавления: 85°С.
Пример IV
(-)-(4S)-N-метил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин
(-)-(4S)-N-метил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин (7,16 г, 0,0147 мол)) ([α25 D] = -150°, c = 0,01, MeOH) (температура плавления: 169-170°С) получают в результате хирального хроматографического разделения рацемического N-метил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидина (18 г, 0,037 мол), применяя Chiralpak AD с 20-мкм хиральной неподвижной фазой. Подвижная фаза состоит из смеси гексана/этанола (80/20 (об./об.)) и 0,1% гидроксида аммония (25% водный раствор).
Аналогичным способом из соответствующих рацематов получают перечисленные ниже оптически чистые соединения:
(-)-(4S)-N-этил-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин ([α25 D] = -126°, c = 0,01, CHCl3); температура плавления: 172-175°С. Неподвижная фаза: Chiralcel OD. Подвижная фаза: смесь гептана/2-пропанола (85/15 (об./об.)).
(-)-(4S)-N-диметиламино-N'-((4-хлорфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин ([α25 D] = -132°, c = 0,01, CHCl3); температура плавления: 218-224°С. Неподвижная фаза: Chiralcel OD. Подвижная фаза: смесь гептана/2-пропанола (85/15 (об./об.)).
(-)-(4S)-N-метил-N'-((4-(трифторметил)фенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин ([α25 D] = -131°, c = 0,01, CHCl3); температура плавления: 157-160°С. Неподвижная фаза: Chiralcel OD. Подвижная фаза: смесь гептана/2-пропанола (85/15 (об./об.)).
(-)-(4S)-N1,N1-диметил-N2-((2-метилфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин ([α25 D] = -88°, c = 0,01, MeOH); температура плавления: аморфное вещество. Неподвижная фаза: Chiralpak AD. Подвижная фаза: этанол.
(-)-(4S)-N-метил-N'-((2,4-дифторфенил)сульфонил)-3-(4-хлорфенил)-4,5-дигидро-4-фенил-1Н-пиразол-1-карбоксамидин ([α25 D] = -129°, c = 0,01, MeOH); температура плавления: аморфное вещество. Chiralpak AD. Подвижная фаза: метанол.
Изобретение относится к энантиомеру, имеющего S-конфигурацию в положении 4 своего 4,5-дигидропиразольного кольца, соединения формулы (I):

в которой R и R1, одинаковые или различные, представляют 3-пиридил или 4-пиридил, или фенил, который может быть замещен галогеном или метоксигруппой; R2 и R3, одинаковые или различные, представляют водород, алкил (1-3С) или диметиламино; R4 представляет фенил, который может быть замещен 1, 2 или 3 заместителями, выбранными из группы, включающей атомы галогена, трифторметил, метоксигруппу и алкил (1-3С), а также его таутомерам и солям. Соединения обладают антагонистической активностью в отношении CB1-каннабиса. Объектами изобретения также являются фармацевтическая композиция, обладающая указанной выше активностью, способ получения фармацевтической композиции, способ получения соединений формулы (I), способ антагонистического воздействия на CB1-рецептор и способ лечения сердечно-сосудистых заболеваний. 6 н. и 1 з.п. ф-лы.

в которой R и R1, одинаковые или различные, представляют 3-пиридил или 4-пиридил, или фенил, который может быть замещен галогеном или метоксигруппой;
R2 и R3, одинаковые или различные, представляют водород, алкил (1-3С) или диметиламино;
R4 представляет фенил, который может быть замещен 1, 2 или 3 заместителями, выбранными из группы, включающей атомы галогена, трифторметил, метоксигруппу и алкил (1-3С), а также его таутомеры и соли.
| ЗАМЕЩЕННЫЙ N-ПИПЕРИДИНО-5-(4-ХЛОРФЕНИЛ)-1-(2,4-ДИХЛОРФЕНИЛ)-4-МЕТИЛПИРАЗОЛ-3-КАРБОКСАМИД ИЛИ ЕГО СОЛИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2141479C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ СИНТЕЗА | 1993 |
|
RU2119917C1 |
| US 4070365 A, 24.01.1978 | |||
| СПОСОБ МНОГОШПУЛЬНОЙ НАМОТКИ г ^А' Va;;A МНОГОСЛОЙНЫХ БЕСКАРКАСНЫХ L-...Ji-:::-^~'^-^ | 0 |
|
SU173323A1 |
Авторы
Даты
2006-08-20—Публикация
2002-03-18—Подача