Изобретение относится к новым водорастворимым производным N-(4-карбамимидоилфенил)глицина формулы (I)
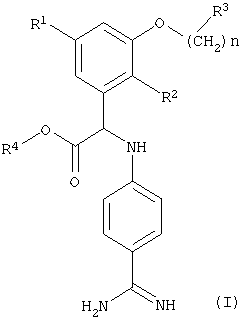
где
R1 означает (низш.)алкокси,
R2 означает галоген,
R3 означает пиперидинил, необязательно замещенный группой (низш.)алкил, гидрокси((низш.)алкил, карбокси(низш.)алкил или (низш.)алкоксикарбонил(низш.)алкил,
R4 означает водород или (низш.)алкил,
n равно 0-3, а группа -(СН2)n- необязательно замещена группой (низш.)алкил, и к их фармацевтически приемлемым солям. Кроме того, изобретение относится к способу получения указанных соединений, фармацевтическим препаратам, содержащим указанные соединения, а также к применению указанных соединений для получения фармацевтических препаратов.
Соединения формулы (I) являются активными соединениями и ингибируют образование факторов коагуляции Ха, IXa и тромбина, индуцированное фактором VIIa и тканевым фактором, или представляют собой производные, которые в физиологических условиях превращаются в такие активные соединения. Поэтому указанные соединения влияют на агрегацию тромбоцитов, которая индуцируется указанными факторами, и на коагуляцию в плазме (крови). Следовательно, эти соединения ингибируют образование тромба и могут использоваться для лечения и/или профилактики заболеваний, таких как артериальный и венозный тромбоз, глубокий венозный тромбоз, эмболия сосудов легких, стенокардия, инфаркт, инсульт из-за фибрилляции предсердия, воспаление и артериосклероз. Кроме того, эти соединения оказывают влияние на опухолевые клетки и предотвращают метастазирование. Следовательно, их можно также использовать в качестве противоопухолевых агентов.
Ингибиторы фактора VIIa ранее предлагались для ингибирования образования тромба и для лечения соответствующих заболеваний (WO 00/35858). Однако соединения, описанные в WO 00/35858, обладают рядом недостатков. Поэтому существует необходимость в ингибиторах фактора VIIa, которые обладают более высокой растворимостью в воде, пригодны для подкожного введения и вместе с тем обладают более высокой ингибирующей активностью.
Настоящее изобретение относится к новым соединениям формулы (I), которые являются ингибиторами фактора VIIa и неожиданно обладают более высокой растворимостью в воде и более высокой ингибирующей активностью по сравнению с соединениями, описанными в WO 00/35858. Кроме того, соединения по настоящему изобретению проявляют улучшенные фармакологические свойства по сравнению с известными соединениями.
Если не указано иное, термины, используемые в описании для иллюстрации и определения сущности и объема изобретения, имеют следующие значения.
Термин «низш.», используемый в описании, означает группу, содержащую от одного до семи, предпочтительно от одного до четырех атомов углерода.
Термин «галоген» означает фтор, хлор, бром и иод, предпочтительно фтор, хлор и бром.
Термин «алкил», используемый отдельно или в комбинации с другими группами, означает разветвленный или прямой одновалентный насыщенный алифатический углеводородный радикал, содержащий от 1 до 20 атомов углерода, предпочтительно от 1 до 16 атомов углерода, более предпочтительно от 1 до 10 атомов углерода. Группы (низш.)алкил, описанные ниже, также означают предпочтительные алкильные группы.
Термин «(низш.)алкил», используемый отдельно или в комбинации с другими группами, означает разветвленный или прямой одновалентный алкильный радикал, содержащий от 1 до 7 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Примеры (низш.)алкильных радикалов включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и т.п.
Термин «алкокси» означает группу R'-O-, где R' означает алкил. Термин «(низш.)алкокси» означает группу R'-O-, где R' означает (низш.)алкил.
Соединения формулы (I) образуют фармацевтически приемлемые кислотно-аддитивные соли. Примерами таких фармацевтически приемлемых кислотно-аддитивных солей являются соли соединений формулы (I) и физиологически приемлемых неорганических кислот, таких как хлористоводородная кислота, серная кислота, сернистая кислота или фосфорная кислота, или органических кислот, таких как метансульфоновая кислота, пара-толуолсульфоновая кислота, уксусная кислота, молочная кислота, трифторуксуная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота. Термин «фармацевтически приемлемые соли» относится к указанным солям. Кроме того соединения формулы (I) могут образовывать соли с основаниями. Примерами таких солей являются соли щелочных, щелочно-земельных металлов и соли аммония, такие, например, как соли Na, К, Са и триметиламмония. Термин «фармацевтически приемлемые соли» также относится к указанным солям.
Более подробно настоящее изобретение относится к соединеням формулы (I)

где R1 означает (низш.)алкокси,
R2 означает галоген,
R3 означает пиперидинил, необязательно замещенный группой (низш.)алкил, гидрокси((низш.)алкил, карбокси(низш.)алкил или (низш.)алкоксикарбонил(низш.)алкил,
R4 означает водород или (низш.)алкил,
n равно 0-3, а группа -(СН2)n- необязательно замещена группой (низш.)алкил, и к их фармацевтически приемлемым солям.
Соединения формулы (I) содержат по меньшей мере один асимметрический атом углерода и, следовательно, могут существовать в форме смеси энантиомеров, диастереомерной смеси или оптически чистых соединений. Соединения формулы (I) могут существовать в таутомерных формах и изобретение включает все таутомерные формы.
Предпочтительны соединения формулы (I) и их физиологически приемлемые соли в отдельности, прежде всего предпочтительны соединения формулы (I).
Предпочтительны соединения формулы (I), в которых R1 означает этокси. Другим предпочтительным вариантом настоящего изобретения являются соединения, описанные выше, в которых R2 означает фтор.
Еще одним предпочтительным вариантом соединений, описанных выше, в которых R3 означает пиперидинил, необязательно замещенный группой метил или гидроксиэтил. Более предпочтительны соединения, в которых R3 означает 1-метилпиперидин-3-ил, 1-(2-гидроксиэтил)пиперидин-4-ил, 1-(2-гидроксиэтил)пиперидин-3-ил, пиперидин-4-ил или 1-метилпиперидин-4-ил.
Изобретение прежде всего включает соединения, указанные выше, в которых R4 означает водород или этил, более предпочтительны соединения, в которых R4 означает водород.
Более того, изобретение прежде всего включает соединения, указанные выше, в которых n равно 0-2, прежде всего где n равно 0.
Среди соединений формулы (I), указанных выше, предпочтительны R-энантиомеры формулы (Ia). Следовательно, предпочтительны также соединения, указанные выше, которые характеризуются формулой (Ia)
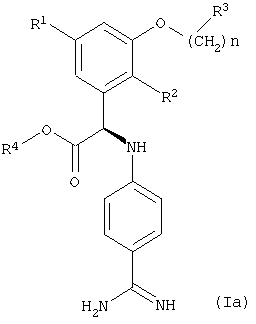
где R1, R2, R3 и R4 и n имеют значения, указанные выше.
Предпочтительны прежде всего соединения формулы (I), описанные в примерах в качестве индивидуальных соединений в форме свободных кислот, их сложных эфиров, а также гидратов или сольватов и их фармацевтически приемлемых солей.
Препочтительными соединениями формулы (I) являются соединения, выбранные из группы, включающей
гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илметокси]фенил]уксусной кислоты,
(RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илметокси]фенил]уксусная кислота,
гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусной кислоты,
(RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусная кислота,
гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-1-илэтокси)фенил]уксусной кислоты,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-1-илэтокси)фенил]уксусная кислота,
гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-4-илэтокси)фенил]уксусной кислоты,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-4-илэтокси)фенил]уксусная кислота,
гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метил-2-пиперидин-1-илэтокси]фенил]уксусной кислоты,
(RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метил-2-пиперидин-1-илэтокси]фенил]уксусная кислота,
ацетат этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илметокси)фенил]уксусной кислоты,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илметокси)фенил]уксусная кислота,
ацетат этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илметокси)фенил]уксусной кислоты,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илметокси)фенил]уксусная кислота,
гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-3-(1-этоксикарбонилметилпиперидин-4-илокси)-2-фторфенил]уксусной кислоты,
(RS)-(4-карбамимидоилфениламино)[3-(1-карбоксиметилпиперидин-4-илокси)-5-этокси-2-фторфенил]уксусная кислота,
гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси]фенил}уксусной кислоты,
(RS)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси]фенил}уксусная кислота,
гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-3-[(RS)-1-этоксикарбонилметилпиперидин-3-илокси]-2-фторфенил]уксусной кислоты,
(RS)- и (SR)-(4-карбамимидоилфениламино)[3-[(RS)-1-карбоксиметилпиперидин-3-илокси]-5-этокси-2-фторфенил]уксусная кислота,
гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусной кислоты,
(RS)- и (SR)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусная кислота,
гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусной кислоты,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусная кислота,
гидрохлорид (1:2) этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусная кислота,
(S)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусная кислота и
(R)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусная кислота, и их фармацевтически приемлемые соли.
Предпочтительны прежде всего соединения формулы (I), выбранные из группы, включающей
(RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусная кислота,
(RS)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси]фенил}уксусная кислота,
(RS)- и (SR)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусная кислота,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусная кислота,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусная кислота и
(R)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусная кислота и их фармацевтически приемлемые соли.
Предполагается, что соединения общей формулы (I) можно модифицировать по функциональным группам с образованием производных, которые способны превращаться в исходное соединение in vivo.
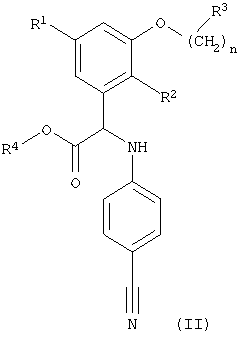
Кроме того, изобретение относится к способу получения соединений формулы (I), указанных выше, включающему превращение нитрильной группы в соединении формулы (II)
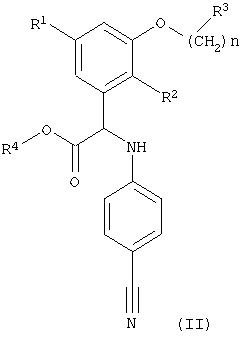
где R1, R2, R3, R4 и n имеют значения, указанные выше, в карбамимидоилгруппу и при необходимости превращение полученного соединения формулы (I) в фармацевтически приемлемую соль или превращение соли соединения формулы (I) в соответствующее соединение формулы (I). Предпочтительный способ, описанный выше, включает превращение нитрильной группы в карбамимидоилгруппу и при необходимости превращение полученного соединения формулы (I) в фармацевтически приемлемую соль, более предпочтительно превращение нитрильной группы в карбамимидоилгруппу.
Превращение нитрильной группы в соединении формулы (II) в карбамимидоилгруппу -C(NH)NH2 проводят известными методами.
Превращение нитрильной группы в карбамимидоилгруппу можно проводить, например, обработкой соединения формулы (II) в растворителе, таком как этанол или метанол, или в смеси растворителей, такой как хлороформ и метанол или хлороформ и этанол, в потоке сухого газообразного хлористого водорода, обычно при температуре ниже 10°С, и последущей обработкой реакционной смеси растворителем, таким как диэтиловый эфир, и отделением фильтрованием выпавшего в осадок иминоэфира. Полученный материал растворяют в растворителе, таком как метанол или этанол, и обрабатывают газообразным аммиаком или солью аммония, такой как ацетат аммония, обычно при температуре вплоть до 80°С. В другом варианте раствор иминоэфира упаривают, а остаток обрабатывают газообразным аммиаком или солью аммония в метаноле или этаноле.
Превращение нитрильной группы в соединении формулы (II) в карбамимидоилгруппу можно также проводить превращением нитрильной группы в N-гидроксикарбамимидоилгруппу и последующим восстановлением, Например, для превращения нитрильной группы в N-гидроксикарбамимидоилгруппу соединение формулы (II) растворяют в растворителе, таком как ДМФА, этанол или метанол, обрабатывают раствором гидроксиламина или солью гидроксиламина и неорганической кислоты, такой как гидрохлорид гидроксиламина, а затем обрабатывают основанием, таким как диизопропилэтиламин или триэтиламин, гидрид натрия или метанолят натрия, обычно при температуре вплоть до 80°С. При превращении N-гидроксикарбамимидоилгруппы в карбамимидоилгруппу соединение гидрируют в растворителе, таком как этанол, метанол, диоксан, ТГФ или ледяная уксусная кислота, или в смеси растворителей, такой как этанол и ледяная уксусная кислота, водородом в присутствии катализатора, такого как палладий, платина или никель. При этом проводят модификацию других реакционноспособных групп, присутствующих в соединении формулы I и чувствительных к действию восстановителя.
Сложноэфирную группу (R4 означает (низш.)алкил) можно превратить в карбоксильную группу известными методами, например гидролизом гидроксидом натрия в воде или в воде/ТГФ при температуре от 0°С до 30°С в течение 1-5 ч.
Соединение формулы (II) можно получить известными методами, например, как описано ниже и/или, как описано в примерах или аналогичными методами. Например, соединение формулы (III)
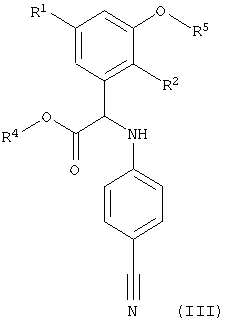
где R1, R2 и R4 имеют значения, указанные выше, а R5 означает водород, вводят в реакцию
- с алкилирующим агентом, таким как соответственно замещенный алкилбромид, алкилиодид или алкилмезилат, в присутствии основания, такого, как карбонат калия или карбонат цезия, в растворителе, таком как ДМФА или ацетон, или
- в реакцию Мицунобу с соответствуюшим замещенным спиртом в присутствии DEAD, DIAD или ди-трет-бутилазодикарбоксилата и трифенилфосфина в растворителе, таком как ТГФ или диоксан, с образованием соединений формулы II.
Пригодные пиперидинил-замещенные галоидные алкилы или спирты, которые являются в указанной реакции исходными материалами, представляют собой коммерческие препараты или их можно получить известными методами или аналогично методам, описанным в примерах.
Соединения формулы (III), в которых R5 означает водород, получают из соединений формулы (III), в которых R5 означает защитную группу (например, бензильную группу, изопропильную группу или трет-бутилдиметилсилильную группу), известными методами, см. T.W.Greene и P.G.M.Wuts, Protective Groups in Organic Synthesis, 2 ed., John Wiley & Sons, Inc., New York (Chichester/Brisbane/Toronto/Singapore) (1991).
Соединения формулы (III) получают известными методами, например, как описано ниже и/или как описано в примерах или аналогичными методами. Например, альдегид формулы (IV)
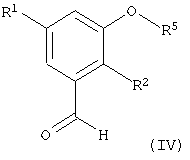
где R1 и R2 имеют значения, указанные выше, a R5 означает водород или защитную группу (например, бензильную группу, изопропильную группу или трет-бутилдиметилсилильную группу), вводят в реакцию с пара-аминобензонитрилом формулы (V)
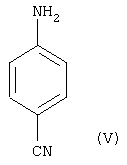
и бензонитрилом, толуолсульфонилметилизонитрилом или морфолиноэтилизоцианидом и первичным спиртом, таким как метанол или этанол, в присутствии эфирата трехфтористого бора. После гидролиза полученного иминоэфира водой получают соединение формулы (III), в котором R4 означает метил или этил, а R5 означает водород или защитную группу (например, бензильную группу, изопропильную группу или трет-бутилдиметилсилильную группу). После гидролиза сложноэфирной группы R4, например обработкой LiOH в тетрагидрофуране, получают соединение формулы (III), в котором R4 означает водород.
Соединения формулы (IV) представляют собой известные соединения или их можно получить известными методами, например, как описано ниже и/или как описано в примерах или аналогичными методами.
Исходные материалы для получения соединений формулы (IV) являются коммерческими препаратами или их можно получить известными методами.
Получение соединений формул (I), (II), (III) и (IV) не описано в примерах, однако их можно получить аналогичными методами или методами, указанными выше.
Кроме того, изобретение относится к соединениям формулы (I), указанным выше, полученным способом, описанным выше. В другом варианте изобретение относится к промежуточным соединениям формулы (II)

где R1, R2, R3, R4 и n имеют значения, указанные выше.
Как указано выше, соединения формулы (I) являются активными соединениями и ингибируют образование факторов коагуляции Ха, IXa и тромбина, индуцированное фактором VIIa и тканевым фактором, или представляют собой производные, которые в физиологических условиях превращаются в такие активные соединения. Поэтому указанные соединения влияют на агрегацию тромбоцитов, которая индуцируется указанными факторами, и на коагуляцию в плазме (крови). Следовательно, эти соединения ингибируют образование тромба и могут использоваться для лечения и/или профилактики заболеваний, таких как артериальный и венозный тромбоз, глубокий венозный тромбоз, эмболия сосудов легких, стенокардия, инфаркт, инсульт из-за фибрилляции предсердия, воспаление и артериосклероз. Кроме того, эти соединения оказывают влияние на опухолевые клетки и предотвращают метастазирование. Следовательно, их можно также использовать в качестве противоопухолевых агентов. Предпочтительным показанием является профилактика и/или лечение тромбоза.
Изобретение также относится к фармацевтическим композициям, включающим соединение, указанное выше, и фармацевтически приемлемый носитель и/или адъювант.
Изобретение также включает соединения, описанные выше, для применения в качестве терапевтически активных веществ, прежде всего в качестве терапевтически активных соединений для лечения и/или профилактики заболеваний, ассоциированных с образованием факторов коагуляции Ха, IXa и тромбина, индуцированным фактором VIIa и тканевым фактором, прежде всего в качестве терапевтически активных соединений для лечения и/или профилактики артериального и венозного тромбоза, глубокого венозного тромбоза, эмболии сосудов легких, стенокардии, инфаркта, инсульта из-за фибрилляции предсердия, воспаления, артериосклероза и/или опухолевых заболеваний.
В другом предпочтительном варианте изобретение относится к способу терапевтического и/или профилактического лечения заболеваний, ассоциированных с образованием факторов коагуляции Ха, IXa и тромбина, индуцированным фактором VIIa и тканевым фактором, прежде всего к способу лечения и/или профилактики артериального и венозного тромбоза, глубокого венозного тромбоза, эмболии сосудов легких, стенокардии, инфаркта, инсульта из-за фибрилляции предсердия, воспаления, артериосклероза и/или опухолевых заболеваний, причем указанный способ включает введение соединения, указанного выше, человеку или животному.
Изобретение также включает применение соединений, указанных выше, для терапевтического и/или профилактического лечения заболеваний, ассоциированных с образованием факторов коагуляции Ха, IXa и тромбина, индуцированным фактором VIIa и тканевым фактором, прежде всего для лечения и/или профилактики артериального и венозного тромбоза, глубокого венозного тромбоза, эмболии сосудов легких, стенокардии, инфаркта, инсульта из-за фибрилляции предсердия, воспаления, артериосклероза и/или опухолевых заболеваний.
Изобретение также относится к применению соединений, указанных выше, для получения лекарственных средств, предназначенных для терапевтического и/или профилактического лечения заболеваний, ассоциированных с образованием факторов коагуляции Ха, IXa и тромбина, индуцированным фактором VIIa и тканевым фактором, прежде всего для лечения и/или профилактики артериального и венозного тромбоза, глубокого венозного тромбоза, эмболии сосудов легких, стенокардии, инфаркта, инсульта из-за фибрилляции предсердия, воспаления, артериосклероза и/или опухолевых заболеваний. Такие лекарственные средства включают соединения, описанные выше.
Ингибирование амидолитической активности комплекса фактор VIIa/тканевой фактор соединениями по изобретению можно продемострировать при использовании в качестве субстрата хромогенного пептида, как описано ниже.
Измерения проводят в микротитрационных планшетах при комнатной температуре. Для этого в каждую лунку планшета, содержащую 25 мкл раствора ингибитора в буферном растворе (100 мМ, рН 7,5, содержащего 0,14 М NaCl, 0,1 М N-(2-гидроксиэтил)пиперазин-N'-(2-этансульфоновой кислоты) (HEPES), 0,5 мг/л БСА, не содержащего жирных кислот и 0,05% NaN3), добавляют по 100 мкл раствора, содержащего 26 нМ тканевого фоактора, 9 нМ растворимого фактора VIIa и 8 мМ хлорида кальция. Смесь инкубировали в течение 15 мин и реакцию инициировали добавлением 50 мкл хромогенного субстрата хромозин-tPA (3,5 мМ, MeSO2-D-Phe-Gly-Arg-пара-нитроаналид) и регистрировали гидролиз субстрата спекрофотометрически в течение 10 мин на планшет-ридере для регистрации кинетики. Затем строили графики ингибирования и определяли значения Кi методом, описанным в Biochem. J., 55, 170-171 (1953).
Более того, активность низкомолекулярных веществ можно охарактеризовать "протромбиновым временем" (РТ) при испытании на свертываемость крови. Соединения растворяют в ДМСО или ДМСО/0,1 М HCl (DHCl), а затем проводят серийные разведения исходного 10 мМ раствора в том же растворителе. Затем в штатив прибора помещают порции по 0,25 мл плазмы (крови) человека (полученной из цельной крови, содержащей 0,1 объема 108 мМ раствора цитрата натрия для предотвращения коагуляции). В каждый образец плазмы (крови) добавляют по 5 мкл разбавленных растворов анализируемых соединений и смесь инкубируют при 37°С в течение 2 мин. Затем из каждого образца отбирают по 50 мкл смеси плазма/ингибитор и помещают в полуавтоматическое устройство (ACL, Automated Cjoagulation Laboratory, Instrument Laboratory) в штативе для измерений. Реакцию свертывания крови инициируют добавлением 0,1 мл реактива Innovin® (рекомбинантный тканевой фактор человека в комбинации с кальцийсодержащим буферным раствором и синтетическими фосфолипидами (фирма Dade Behring®, Inc.). Продолжительность образования сгустка фибрина определяли фотометрически в приборе ACL. Концентрацию ингибитора, которая приводит к дублированию протромбинового времени (РТ), определяют графически.
Для активных соединений по настоящему изобретению значения Кi составляют от приблизительно от 0,1 до 500 нМ, прежде всего приблизительно от 0,1 до 150 нМ. Значения РТ предпочтительно составляют от приблизительно 0,1 до 10 мкМ, прежде всего приблизительно от 0,1 до 5 мкМ.
Соединения формулы (I) и/или их фармацевтически приемлемые соли можно использовть в качестве лекарственных средств, например в форме фармацевтических препаратов для энтерального, парентерального или местного введения. Указанные препараты можно вводить, например, пероральным способом в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, или ректальным способом в форме суппозиториев, парентеральным способом, например, в форме инъекционных растворов или суспензий или растворов для вливания, или местным способом, например, в форме мазей, кремов или масел. Предпочтительно парентеральное введение.
Фармацевтические препараты получают известными методами, например соединения формулы I и/или их фармацевтически приемлемые соли перерабатывают необязательно в комбинации с другими терапевтически ценными веществами, в галеновую готовую форму в смеси с пригодными, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и при необходимости с обычными фармацевтическими адъювантами.
Пригодными носителями являются неорганические и органические материалы. При получении таблеток, таблеток с покрытием, драже или твердых желатиновых капсул в качестве таких носителей используются, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в зависимости от природы активного соединения в случае мягких желатиновых капсул обычно не требуется никаких носителей). Пригодными носителями для растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар и т.п. Пригодными носителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Пригодными носителями для суппозиториев являются природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Пригодными носителями для местных препаратов являются глицериды, полусинтетические и синтетические глицериды, гидрогенированные масла, жидкие воски, вазелиновое масло, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
В качестве фармацевтических адъювантов используются обычные стабилизирующие, смачивающие, консервирующие и эмульгирующие агенты загустители, ароматизаторы, соли для регуляции осмотического давления, буферные вещества, солюбилизирующие агенты, красители, маскирующие агенты и антиоксиданты.
Дозы соединений формулы I могут изменяться в широком интервале в зависимости от излечиваемого заболевания, возраста и относительного состояния здоровья пациента, способа введения, и от индивидуальных требований в каждом конкретном случае. Для взрослых пациентов достаточной является суточная доза от приблизительно 1 до 1000 мг, прежде всего от приблизительно 1 до 100. В зависимости от тяжести заболевания и точного фармакокинетического профиля соединение можно вводить в виде одной или нескольких стандартных доз, например от 1 до 3 доз.
Фармацевтические препараты обычно содержат приблизительно 1-500 мг, предпочтительно 1-100 мг соединения формулы I.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Примеры
ДМА N,N-диметилацетамид, EtOAc этилацетат, EtOH этанол, КТ комнатная температура, ДМФА N,N-диметилформамид, ч = час, МеОН метанол
Пример 1
1.1. Раствор 56,3 г 4-этоксифторфенола в 200 мл ТГФ обрабатывали 84,0 мл пентаметилдиэтилентриамина, охлажденного до -78°С, а затем медленно добавляли 251 мл 1,6 М раствора н-бутиллития в гексане. Реакционную смесь перемешивали при -78°С в течение 3 ч, а затем медленно добавляли 89,7 мл триметилбората. Раствор перемешивали при -78°С в течение 15 мин, затем нагревали до КТ, перемешивали в течение 2 ч и охлаждали до 0°С. К раствору добавляли по каплям 63,2 мл уксусной кислоты, перемешивали в течение 30 мин, а затем медленно добавляли 68,3 мл 30%-ного раствора перекиси водорода. Реакционную смесь нагревали до КТ, перемешивали в течение ночи, добавляли 200 мл насыщенного раствора сульфита натрия, разбавляли водой и экстрагировали гексаном. Органический слой промывали водой, солевым раствором, сушили над MgSO4, фильтровали и концентрировали, при этом получали 60,3 г 5-этокси-2-фторфенола в виде жидкости светло-коричневого цвета, которую использовали на следующей стадии без дополнительной очистки.
1.2. К раствору 75,5 г 5-этокси-2-фторфенола, полученного на стадии 1.1, в 250 мл ДМА при 0°С добавляли 80,2 г трет-бутилового эфира диметилхлорсилана и 36,2 г имидазола и реакционную смесь нагревали до КТ. Через 4 ч добавляли 400 мл воды и смесь экстрагировали гексаном. Органический слой промывали водой, 10%-ным раствором Na2СО3, водой, солевым раствором, сушили над MgSO4, фильтровали и концентрировали, при этом получали 127,0 г трет-бутил(5-этокси-2-фторфенокси)диметилсилана в виде жидкости светло-коричневого цвета, которую использовали на следующей стадии без дополнительной очистки.
1.3. К раствору трет-бутил(5-этокси-2-фторфенокси)диметилсилана, полученного на стадии 1.2, в 160 мл ТГФ добавляли 66,9 мл пентаметилдиэтилентриамина и реакционную смесь охлаждали до -78°С. Затем добавляли по каплям 200 мл 1,6 М раствора н-бутиллития в гексане. Вязкую суспензию светло-коричневого цвета перемешивали при температуре от -50°С до -60°С в течение 5 ч, а затем обрабатывали 24,7 мл ДМФА в течение 20 мин. Прозрачный раствор желтого цвета нагревали до КТ в течение ночи. Реакцию останавливали добавлением льда и реакционную смесь экстрагировали EtOAc. Органический слой сушили над MgSO4, фильтровали и упаривали, при этом получали 51,4 г 3-(трет-бутилдиметилсиланилокси)-5-этокси-2-фторбензальдегида в виде жидкости коричневого цвета, которую использовали на следующей стадии без дополнительной очистки.
1.4. К раствору 16,9 г 3-(трет-бутилдиметилсиланилокси)-5-этокси-2-фторбензальдегида, полученного на стадии 1.3, и 6,68 г 4-аминобензонитрила в 300 мл EtOH добавляли 7,79 мл 2-морфолинэтилизоцианида, реакционную смесь охлаждали до 0°С и по каплям добавляли 28,4 мл эфирата трехфтористого бора, поддерживая температуру смеси не выше 10°С. Раствор перемешивали при 0°С в течение 15 мин и при КТ в течение 3 ч, затем добавляли 20 мл волы и нагревали при 50°С в течение ночи. Реакционную смесь упаривали, остаток переносили в воду и экстрагировали EtOAc. Органический слой сушили над MgSO4. Неочищенный продукт очищали хроматографией на диоксиде кремния (элюент:циклогексан/EtOAc, 2:1), при этом получали 12,9 г этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты в виде пены светло-коричневого цвета. МС: 357,1 [М-Н]-.
1.5. К раствору 269 мг этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты в 10 мл ТГФ добавляли 0,115 мл 1-метил-3-пиперидинметанола и 236 мг трифенилфосфина. Реакционную смесь охлаждали до 0°С и добавляли 207 мг ди-трет-бутилового эфира азодикарбоновой кислоты. Раствор перемешивали при КТ в течение 6 ч, а затем концентрировали. Продукт выделяли хроматографией на диоксиде кремния (элюент: дихлорметан/метанол, 9:1), при этом получали 212 мг этилового эфира (RS)- и (SR)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илметокси]фенил]уксусной кислоты в виде твердого вещества белого цвета. МС: 470,3 [М+Н]+.
1.6. Через раствор 212 мг этилового эфира (RS)- и (SR)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илметокси]фенил]уксусной кислоты в 5 мл CHCl3/EtOH (3:1) при -10°С в течение 20 мин пропускали газообразный HCl. Реакционную смесь выдерживали при 4°С в течение ночи, затем концентрировали, высушивали в высоком вакууме, добавляли 2 мл 2 М раствора NH3 в EtOH и нагревали при 60°С в течение 3 ч. Суспензию концентрировали, неочищенный продукт выделяли хроматографией на диоксиде кремния (элюент:дихлорметан/МеОН, 4:1), при этом получали 229 мг гидрохлорида этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илметокси]фенил]уксусной кислоты в виде твердого вещества грязно-белого цвета. МС: 487,3 [М+Н]+.
1.7. К раствору 174 мг гидрохлорида этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илметокси]фенил]уксусной кислоты в 3,5 мл ТГФ при 0°С добавляли 1,7 мл 1 н. раствора LiOH. Реакционную смесь перемешивали при КТ в течение 2 ч, затем нейтрализовали добавлением 1 н. раствора HCl. Осадок отделяли фильтрованием, промывали водой, ацетонитрилом и пентаном, при этом получали 97 мг (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илметокси]фенил]уксусной кислоты в виде твердого вещества светло-желтого цвета. МС: 459,3 [М+Н]+.
Пример 2
2.1. Исходное соединение, этиловый эфир (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты, описанное в примере 1.4, вводили в реакцию с 3-гидрокси-1-метилпиперидином аналогично тому, как описано в примере 1.5, при этом получали этиловый эфир (RS)- и (SR)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусной кислоты. МС: 456,5 [М+Н]+.
2.2. Гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусной кислоты, МС: 473,3 [М+Н]+, получали из этилового эфира (RS)- и (SR)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусной кислоты аналогично тому, как описано в примере 1.6.
2.3. (RS)- и (SR)-(4-Карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусную кислоту, МС: 445,4 [М+Н]+, получали из гидрохлорида этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусной кислоты аналогично тому, как описано в примере 1.7.
Пример 3
3.1. Исходное соединение, этиловый эфир (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты, описанное в примере 1.4, сначала обрабатывали 1-(2-гидрокси)пиперидином, диэтиловым эфиром азодикарбоновой кислоты и трифенилфосфином аналогично тому, как описано в примере 1.5. Из полученного продукта получали гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-1-илэтокси)фенил]уксусной кислоты в виде аморфного твердого вещества грязно-белого цвета, МС: 487,3 [М+Н]+, аналогично тому, как описано в примере 1.6.
3.2. (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-1-илэтокси)фенил] уксусную кислоту получали в виде бесцветного твердого вещества, МС: 459,5 [М+Н]+, из гидрохлорида этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-1-илэтокси)фенил]уксусной кислоты, описанного в примере 3.1, аналогично тому, как описано в примере 1.7.
Пример 4
4.1. трет-Бутиловый эфир (RS)-4-(2-{3-[(4-цианофениламино)этоксикарбонилметил]-5-этокси-2-фторфенокси}этил)пиперидин-1-карбоновой кислоты получали в виде бесцветного твердого вещества, МС: 570,2 [М+Н]+, из этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты, описанного в примере 1.4, трет-бутилового эфира 4-(2-гидроксиэтил)пиперидин-1-карбоновой кислоты, диэтилового эфира азодикарбоновой кислоты и трифенилфосфина аналогично тому, как описано в примере 1.5.
4.2. Гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-4-илэтокси)фенил]уксусной кислоты получали в виде бесцветного аморфного твердого вещества, МС: 486,3 [М+Н]+, из трет-бутилового эфира (RS)-4-(2-{3-[(4-цианофениламино)этоксикарбонилметил]-5-этокси-2-фторфенокси}этил)пиперидин-1-карбоновой кислоты, описанного в примере 4.1, аналогично тому, как описано в примере 1.6.
4.3. (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-4-илэтокси)фенил]уксусную кислоту получали в виде твердого вещества грязно-белого цвета, МС: 459,6 [М+Н]+, из гидрохлорида этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(2-пиперидин-4-илэтокси)фенил]уксусной кислоты, описанного в примере 4,2, аналогично тому, как описано в примере 1.7.
Пример 5
5.1. Этиловый эфир (RS)- и (SR)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)-1-метил-2-пиперидин-1-илэтокси]фенил]уксусной кислоты, МС: 484,5 [М+Н]+, получали из этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты, описанного в примере 1.4, и α-метил-1-пиперидинэтанола аналогично тому, как описано в примере 1.5.
5.2. Гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метил-2-пиперидин-1-илэтокси] фенил] уксусной кислоты, МС: 501,4 [М+Н]+, получали из этилового эфира (RS)- и (SR)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)-1-метил-2-пиперидин-1-илэтокси]фенил]уксусной кислоты аналогично тому, как описано в примере 1.6.
5.3. (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метил-2-пиперидин-1-илэтокси]фенил]уксусную кислоту, МС: 473,4 [М+Н]+, получали из гидрохлорида этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метил-2-пиперидин-1-илэтокси]фенил]уксусной кислоты аналогично тому, как описано в примере 1.7
Пример 6
6.1. Этиловый эфир (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илметокси)фенил]уксусной кислоты получали в виде твердого вещества светло-коричневого цвета, МС: 470 [М+Н]+, при взаимодействии этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты, (1-метилпиперидин-4-ил)метанола, трифенилфосфина и диэтилового эфира азодикарбоновой кислоты аналогично тому, как описано в примере 1,5.
6.2 Через раствор 362 мг этилового эфира (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илметокси)фенил]уксусной кислоты в 15 мл хлористого метилена и 3 мл этанола при 0°С в течение 30 мин пропускали газообразный хлористый водород и смесь медленно нагревали до комнатной температуры в течение ночи. Растворитель упаривали в вакууме и остаток высушивали. Затем добавляли 238 мг ацетата аммония и 8 мл этанола и смесь нагревали при 65°С в течение 4 ч. Растворитель выпаривали в вакууме, остаток очищали на короткой колонке с силикагелем, при этом получали 348 мг ацетата этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илметокси)фенил]уксусной кислоты в виде твердого вещества светло-коричневого цвета. МС: 487 [М+Н]+.
6.3. К раствору 340 мг ацетата этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илметокси)фенил]уксусной кислоты в 5 мл ТГФ добавляли 2,8 мл 1н. LiOH и смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь охлаждали, нейтрализовали уксусной кислотой и упаривали в вакууме. Остаток перемешивали в 1,5 мл воды, отделяли фильтрованием в вакууме и высушивали, при этом получали 173 мг (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илметокси)фенил]уксусной кислоты в виде твердого вещества светло-коричневого цвета. tпл. 232°С. МС: 459 [М+Н]+.
Пример 7
7.1. трет-Бутиловый эфир (RS)-4-{3-[(4-цианофениламино)этоксикарбонилметил]-5-этокси-2-фторфеноксиметил}пиперидин-1-карбоновой кислоты получали в виде пены светло-желтого цвета, МС: 556 [М+Н]+, при взаимодействии этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты, трет-бутилового эфира 4-гидроксиметилпиперидин-1-карбоновой кислоты, трифенилфосфина и диэтилового эфира азодикарбоновой кислоты аналогично тому, как описано в примере 1.5.
7.2. Ацетат этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илметокси)фенил]уксусной кислоты получали в виде твердого вещества грязно-белого цвета, МС: 473 [М+Н]+, из трет-бутилового эфира (RS)-4-{3-[(4-цианофениламино)этоксикарбонилметил]-5-этокси-2-фторфеноксиметил}пиперидин-1-карбоновой кислоты аналогично тому, как описано в примере 6.2.
7.3. (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илметокси)фенил]уксусную кислоту получали в виде твердого вещества белого цвета, tпл. 262°C, МС: 445 [М+Н]+, из ацетата этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илметокси)фенил]уксусной кислоты аналогично тому, как описано в примере 6.3.
Пример 8
8.1. Трет-бутиловый эфир (RS)-4-{3-[(4-цианофениламино)этоксикарбонилметил]-5-этокси-2-фторфенокси}пиперидин-1-карбоновой кислоты, МС: 559,5 [М+Н]+, получали из этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты, описанного в примере 1.4, и 1-трет-бутилоксикарбонил-4-гидроксипиперидина аналогично тому, как описано в примере 1.5.
8.2. Раствор 2,30 г трет-бутилового эфира (RS)-4-{3-[(4-цианофениламино)этоксикарбонилметил]-5-этокси-2-фторфенокси}пиперидин-1-карбоновой кислоты в 40 мл дихлорметана охлаждали до 0°С и к раствору по каплям добавляли 3,25 мл трифторуксусной кислоты. Реакционную смесь нагревали до КТ в течение 3 ч, затем снова охлаждали до 0°С и добавляли 20 мл 10%-ного раствора Na2СО3. Продукт экстрагировали дихлорметаном, органический слой сушили над MgSO4, фильтровали и упаривали, при этом получали 1,55 г этилового эфира (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусной кислоты в виде твердой пены грязно-белого цвета, МС: 442,3 [М+Н]+, которую использовали на следующей стадии без дополнительной очистки.
8.3. Раствор 300 мг этилового эфира (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусной кислоты в 10 мл ТГФ охлаждали до 0°С, добавляли 0,14 мл триэтиламина, 0,90 мл этилового эфира бромуксусной кислоты и реакционную смесь перемешивали при КТ в течение ночи. Затем смесь упаривали, остаток переносили в воду и экстрагировали EtOAc. Органический слой сушили над MgSO4, неочищенный продукт очищали хроматографией на диоксиде кремния (элюент: циклогексан/EtOAc, 1:2), при этом получали 215 мг этилового эфира (RS)-(4-цианофениламино)[5-этокси-3-(1-этоксикарбонилметилпиперидин-4-илокси)-2-фторфенил]уксусной кислоты в виде бесцветной пены. МС: 528,3 [М+Н]+.
8.4. Гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-3-(1-этоксикарбонилметилпиперидин-4-илокси)-2-фторфенил]уксусной кислоты, МС: 545,2 ([М+Н]+), получали из этилового эфира (RS)-(4-цианофениламино)[5-этокси-3-(1-этоксикарбонилметилпиперидин-4-илокси)-2-фторфенил]уксусной кислоты аналогично тому, как описано в примере 1.6.
8.5. (RS)-(4-карбамимидоилфениламино)[3-(1-карбоксиметилпиперидин-4-илокси)-5-этокси-2-фторфенил]уксусную кислоту, МС: 489,3 ([М+Н]+), получали из гидрохлорида этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-3-(1-этоксикарбонилметилпиперидин-4-илокси)-2-фторфенил]уксусной кислоты аналогично тому, как описано в примере 1.7.
Пример 9
9.1. К раствору этилового эфира 300 мг (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусной кислоты, описанного в примере 11.2, в 10 мл ТГФ добавляли 0,19 мл триэтиламина, 0,82 мл 2-бромэтанола и 25 мг иодида тетрабутиламмония. Реакционную смесь нагревали при 50°С в течение 6 ч, а затем упаривали. Остаток переносили в воду и экстрагировали EtOAc. Неочищенный продукт очищали хроматографией на диоксиде кремния (элюент: дихлорметан/МеОН, 9:1), при этом получали 175 мг этилового эфира (RS)-(4-цианофениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси]фенил}уксусной кислоты. МС: 486,4 [М+Н]+.
9.2. Гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси]фенил}уксусной кислоты, МС: 503,4 [М+Н]+, получали из этилового эфира (RS)-(4-цианофениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси]фенил}уксусной кислоты аналогично тому, как описано в примере 1.6.
9.3. (RS)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси] фенил} уксусную кислоту, МС: 475,3 [М+Н]+, получали из гидрохлорида этилового эфира (RS)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси]фенил}уксусной кислоты аналогично тому, как описано в примере 1.7.
Пример 10
10.1. трет-Бутиловый эфир (SR)- и (RS)-3-[3-[(RS)-(4-цианофениламино)этоксикарбонилметил]-5-этокси-2-фторфенокси]пиперидин-1-карбоновой кислоты, МС: 542,2 [М+Н]+ получали из этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты, описанного в примере 1.4, и (RS)-1-трет-бутилоксикарбонил-3-гидроксипиперидина аналогично тому, как описано в примере 1.5.
10.2. Этиловый эфир (SR)- и (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)-пиперидин-3-илокси]фенил]уксусной кислоты, МС: 442,3 [М+Н]+, получали из трет-бутилового эфира (SR)- и (RS)-3-[3-[(RS)-(4-цианофениламино)этоксикарбонилметил]-5-этокси-2-фторфенокси]пиперидин-1-карбоновой кислоты аналогично тому, как описано в примере 8.2.
10.3. Этиловый эфир (RS)- и (8Р)-(4-цианофениламино)[5-этокси-3-[(RS)-1-этоксикарбонилметилпиперидин-3-илокси]-2-фторфенил]уксусной кислоты, МС: 528,3 [М+Н]+, получали из этилового эфира (SR)- и (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)пиперидин-3-илокси]фенил]уксусной кислоты и этилового эфира бромуксусной кислоты аналогично тому, как описано в примере 8.3.
10.4. Гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-3-[(RS)-1-этоксикарбонилметилпиперидин-3-илокси]-2-фторфенил]уксусной кислоты, МС: 545,2 [М+Н]+, получали из этилового эфира (RS)- и (SR)-(4-цианофениламино)[5-этокси-3-[(RS)-1-этоксикарбонилметилпиперидин-3-илокси]-2-фторфенил]уксусной кислоты аналогично тому, как описано в примере 1.6.
10.5. (RS)- и (SR)-(4-карбамимидоилфениламино)[3-[(RS)-1-карбоксиметилпиперидин-3-илокси]-5-этокси-2-фторфенил]уксусную кислоту, МС: 489,3 [М+Н]+ получали из гидрохлорида этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-3-[(RS)-1-этоксикарбонилметилпиперидин-3-илокси]-2-фторфенил]уксусной кислоты аналогично тому, как описано в примере 1.7.
Пример 11
11.1. Этиловый эфир (RS)- и (SR)-(4-цианофениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусной кислоты, МС: 486,4 [М+Н]+ получали из этилового эфира (SR)- и (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-[(RS)-пиперидин-3-илокси]фенил]уксусной кислоты, описанного в примере 10.2, и 2-бромэтанола аналогично тому, как описано в примере 9.1.
11.2. Гидрохлорид этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусной кислоты, МС: 503,3 [М+Н]+, получали из этилового эфира (RS)- и (SR)-(4-цианофениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусной кислоты аналогично тому, как описано в примере 1.6.
11.3. (RS)- и (SR)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусную кислоту, МС: 475,3 [М+Н]+, получали из гидрохлорида этилового эфира (RS)- и (SR)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусной кислоты аналогично тому, как описано в примере 1.7.
Пример 12
12.1. Гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусной кислоты, МС: 459,5 [М+Н]+, получали из этилового эфира (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусной кислоты, описанного в примере 11.2, аналогично тому, как описано в примере 1.6.
12.2. (RS)-(4-карбамимидоилфениламино) [5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусную кислоту, МС: 431,5 [М+Н]+, получали из гидрохлорида этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусной кислоты аналогично тому, как описано в примере 1.7.
Пример 13
13.1. Этиловый эфир (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты получали в виде твердой пены светло-коричневого цвета, МС: 456 [М+Н]+, из этилового эфира (RS)-(4-цианофениламино)(5-этокси-2-фтор-3-гидроксифенил)уксусной кислоты и 4-гидрокси-1-метилпиперидина аналогично тому, как описано в примере 1.5.
13.2. Гидрохлорид этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты (1:2) получали в виде вязкого масла, МС: 473 [М+Н]+, из этилового эфира (RS)-(4-цианофениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты аналогично тому, как описано в примере 6,2.
13.3. (RS)-(4-Карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусную кислоту получали в виде твердого вещества грязно-белого цвета, tпл. 270°C, МС: 445 [М+Н]+, из гидрохлорида этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты аналогично тому, как описано в примере 6.3.
13.4. К раствору 2,5 г гидрохлорида этилового эфира (RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты, описанного в примере 13.2, в 50 мл дихлорметана добавляли 1,1 г ди-трет-бутилового эфира дикарбоновой кислоты, 25 мл воды и 25 мл насыщенного раствора карбоната натрия. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, экстрагировали этилацетатом, водой и солевым раствором. Продукт очищали хроматографией на силикагеле (элюент: дихлорметан/метанол), при этом получали 2,3 г этилового эфира (RS)-[4-(трет-бутоксикарбониламиноиминометил)фениламино][5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты в виде пены светло-желтого цвета. МС: 573 [М+Н]+.
13.5. К раствору 2,3 г этилового эфира (RS)[4-(трет-бутоксикарбониламиноиминометил)фениламино][5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты в 23 мл этанола добавляли 6,06 мл 1н. раствора гидроксида натрия. Через 1 ч добавляли 2,6 мл 1н. раствора соляной кислоты до рН 8. Растворитель выпаривали, остаток высушивали до постоянного веса, растворяли в абсолютном этаноле, фильтровали, раствор упаривали в вакууме. Остаток высушивали и растирали в эфире, при этом получали 2,3 г (RS)-[4-(трет-бутоксикарбониламиноиминометил)фениламино][5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты в виде твердого вещества грязно-белого цвета. МС: 545 [М+Н]+.
13.6. Рацемическую смесь (RS)[4-(трет-бутоксикарбониламиноиминометил)фениламино][5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты разделяли на энантиомеры препаративной ЖХВР на колонке с хиральным сорбентом (Chiralpack AD, элюент: н-гептан/этанол/диэтиламин, 78:22:0,2), при этом в первом пике элюировалась (S)[4-(трет-бутоксикарбониламиноиминометил)фениламино][5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусная кислота, МС: 545 (М+Н)+, во втором пике элюировалась (R)[4-(трет-бутоксикарбониламиноиминометил)фениламино][5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусная кислота, МС: 545 [М+Н]+. Оба соединения представляли собой твердую пену светло-желтого цвета.
13.7. Раствор 5,1 г (5)-[4-(трет-бутоксикарбониламиноиминометил)фениламино][5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты в 102 мл воды/муравьиной кислоты (1:1) нагревали при 40°С в течение 2,5 ч. Затем растворитель выпаривали в вакууме, остаток растворяли в воде и раствор упаривали (процедуру повторяли дважды). Остаток растворяли в метаноле и добавляли 7 н. раствор аммиака в метаноле до рН 9, при этом образовывался осадок. Смесь охлаждали до 0°С, осадок отделяли фильтрованием в вакууме и высушивали. Затем осадок суспендировали в воде, добавляли конц. раствор аммиака до рН 9, продукт отделяли фильтрованием в вакууме и высушивали, при этом получали 3 г (S)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты в виде твердого вещества белого цвета. tпл. 269°C. МС: 445 [М+Н]+.
13.8. (R)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусную кислоту получали в виде твердого вещества белого цвета, tпл. 267°С, МС: 445 [М+Н]+, из (R)[4-(трет-бутоксикарбониламиноиминометил)фениламино][5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусной кислоты аналогично тому, как описано в примере 13.7.
Пример А
Таблетки следующего состава с покрытием получали стандартным способом:
Активный ингредиент просеивали и смешивали с микрокристаллической целлюлозой, затем смесь гранулировали в смеси с раствором поливинилпирролидона в воде. Гранулят смешивали с натрий гликолятом крахмала и стеаратом магния и прессовали для образования ядер таблеток массой 120 или 350 мг соответственно. Ядра покрывали водным раствором/суспензией покрытия указанного состава.
Пример Б
Капсулы следующего состава получали стандартным способом:
Компоненты просеивали, смешивали и смесью заполняли капсулы размера 2.
Пример В
Растворы для инъекций следующего состава получали стандартным способом:
Активный компонент растворяли в смеси полиэтиленгликоля 400 и порции воды для инъекции. Затем добавляли уксусную кислоту до рН 5,0, объем - доводили до 1,0 мл добавлением остального количества воды. Раствор фильтровали, разливали во флаконы с необходимым излишком и стерилизовали.
Пример Г
Мягкие желатиновые капсулы следующего состава получали стандартным способом:
Активный компонент растворяли в теплой расплавленной смеси других ингредиентов и смесь разливали в мягкие желатиновые капсулы пригодного размера. Заполненные мягкие желатиновые капсулы обрабатывали стандартные способом.
Пример Д
Пакетики следующеего состава получали стандартным способом:
Активный ингредиент смешивали с лактозой, микрокристаллической целлюлозой и натриевой солью карбоксиметилцеллюлозы, гранулировали со смесью поливинилпирролидона в воде. Гранулят смешивали со стеаратом магния и ароматизаторами, а затем расфасовывали в пакетики.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕНИЛГЛИЦИНОВЫЕ ПРОИЗВОДНЫЕ | 1999 |
|
RU2198871C1 |
| ПРОИЗВОДНЫЕ ФЕНИЛГЛИЦИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2268257C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА | 2005 |
|
RU2391338C2 |
| ПРОИЗВОДНЫЕ УКСУСНОЙ КИСЛОТЫ | 1994 |
|
RU2151768C1 |
| ПРОИЗВОДНЫЕ НАФТАЛИНА, ПРИГОДНЫЕ В КАЧЕСТВЕ ЛИГАНДОВ РЕЦЕПТОРОВ 3 ГИСТАМИНА | 2005 |
|
RU2387638C2 |
| ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА И ЛЕКАРСТВЕННОЕ СРЕДСТВО, ИХ СОДЕРЖАЩЕЕ | 2000 |
|
RU2259360C2 |
| БЕНЗИМИДАЗОЛЬНЫЕ, БЕНЗТИАЗОЛЬНЫЕ И БЕНЗОКСАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ LTA4H | 2004 |
|
RU2373204C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, БЕНЗОТИАЗОЛА И БЕНЗОКСАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ LTA4H | 2004 |
|
RU2359970C2 |
| ПРОИЗВОДНЫЕ ТИАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 1999 |
|
RU2166503C2 |
| ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2001 |
|
RU2276151C2 |
Изобретение относится к соединениям формулы (I)
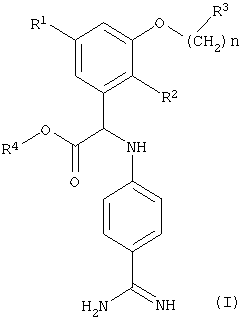
где R1 означает (низш.)алкокси, R2 означает галоген, R3 означает пиперидинил, необязательно замещенный группой (низш.)алкил, гидрокси(низш.)алкил, карбокси(низш.)алкил или (низш.)алкоксикарбонил(низш.)алкил, R4 означает водород или (низш.)алкил, n равно 0-3, а группа -(СН2)n- необязательно замещена группой (низш.)алкил, и их фармацевтически приемлемые соли. Предложен способ получения соединений формулы (I). Предложено соединение формулы (II). Также предложена фармацевтическая композиция, обладающая ингибирующей активностью в отношении образования факторов коагуляции Ха, IXa и тромбина, включающая соединение формулы (I) и фармацевтически приемлемый носитель и/или адьювант. Технический результат - водорастворимые производные фенилглицина, ингибирующие образование факторов коагуляции Ха, IXa и тромбина, индуцированное фактором VIIa и тканевым фактором. 4 н. и 11 з.п. ф-лы.
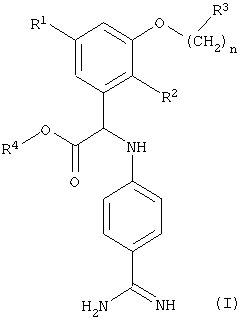
где R1 означает (низш.)алкокси,
R2 означает галоген,
R3 означает пиперидинил, необязательно замещенный группой (низш.)алкил,
гидрокси(низш.)алкил, карбокси(низш.)алкил или
(низш.)алкоксикарбонил(низш.)алкил,
R4 означает водород или (низш.)алкил,
n равно 0-3, а группа -(СН2)n- необязательно замещена группой (низш.)алкил,
и их фармацевтически приемлемые соли.
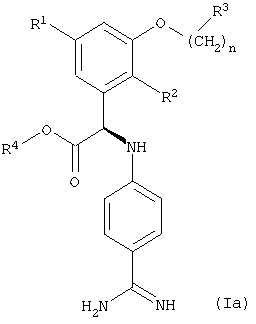
где R1, R2, R3, R4 и n имеют значения, указанные в пп.1-9.
(RS)- и (SR)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-[(RS)-1-метилпиперидин-3-илокси]фенил]уксусную кислоту,
(RS)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[1-(2-гидроксиэтил)пиперидин-4-илокси]фенил}уксусную кислоту,
(RS)- и (SR)-(4-карбамимидоилфениламино){5-этокси-2-фтор-3-[(RS)-1-(2-гидроксиэтил)пиперидин-3-илокси]фенил}уксусную кислоту,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(пиперидин-4-илокси)фенил]уксусную кислоту,
(RS)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусную кислоту и
(R)-(4-карбамимидоилфениламино)[5-этокси-2-фтор-3-(1-метилпиперидин-4-илокси)фенил]уксусную кислоту,
и их фармацевтически приемлемые соли.
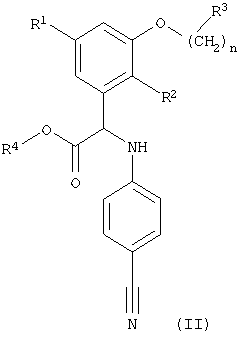
где R1, R2, R3, R4 и n имеют значения, указанные в пп.1-11, в карбамимидоил группу, и при необходимости превращение полученного соединения формулы (I) в фармацевтически приемлемую соль или превращение соли соединения формулы (I) в соответствующее соединение формулы (I).
где R1 означает (низш.)алкокси,
R2 означает галоген,
R3 означает пиперидинил, необязательно замещенный группой (низш.)алкил, гидрокси((низш.)алкил, карбокси(низш.)алкил или (низш.)алкоксикарбонил(низш.)алкил,
R4 означает водород или (низш.)алкил,
n = 0-3, а группа -(СН2)n- необязательно замещена группой (низш.)алкил.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| WO 00/35858 A1, 22.06.2001 | |||
| ПРОИЗВОДНЫЕ АМИДИНОНАФТИЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2154633C2 |
Авторы
Даты
2006-09-10—Публикация
2003-01-30—Подача