Область, к которой относится изобретение
Настоящее изобретение относится к ингибиторам лейкотриен А4-гидролазы (LТА4Н), используемым для лечения воспаления. Более конкретно, настоящее изобретение относится к некоторым бензоксазол-2-ильным, бензотиазол-2-ильным и 1Н-бензоимидазол-2-ильным соединениям, используемым в качестве селективных ингибиторов фермента LТА4Н для лечения воспалительных состояний.
Предшествующий уровень техники
Обычно, воспаление представляет собой острую реакцию иммунной системы на инвазию микробных патогенов, на воздействие химических веществ или на физическое повреждение. Однако в некоторых случаях, воспалительный ответ может переходить в хроническое состояние и вызывать воспалительное заболевание. Терапевтическое лечение такого хронического воспаления при различных заболеваниях представляет собой серьезную медицинскую проблему.
Лейкотриены (LТ) представляют собой биологически активные метаболиты арахидоновой кислоты (B. Samuelsson, Science 1983, 220(4597):568-575), которые участвуют в развитии воспалительных заболеваний, включая астму (D.A. Munafo et al., J. Clin. Invest. 1994, 93(3):1042-1050), воспалительное заболевание кишечника (ВЗК)(P.Sharon & W.F. Stenson, Gastroenterology 1984, 86(3):453-460), хроническую обструктивную болезнь легких (ХОБЛ) (P.J. Barnes, Respiration 2001, 68(5):441-448), артрит (R.J. Griffiths et al., Proc. Natl. Acad. Sci., USA, 1995, 92(2):517-521; F. Tsuji et al., Life Sci. 1998, 64(3):L51-L56), псориаз (K. Ikai, J. Dermatol. Sci. 1999, 21(3):135-146; Y.I. Zhu & M.J. Stiller, Skin Pharmacol. Appl. Skin Physiol. 2000, 13(5):235-245) и атеросклероз (Friedrich E.B. et al., Arterioscler. Thromb. Vasc. Biol. 23, 1761-7(2003); Subbarao K. et al., Arterioscler. Thromb. Vasc. Biol. 24, 369-75 (2004); Helgadottir A. et al., Nat. Genet. 36, 233-9 (2004); Jala V.R. et al., Trends in Immun. 25, 315-322 (2004)). Синтез лейкотриенов инициируется преобразованием арахидоновой кислоты в нестабильное эпоксидное промежуточное соединение, лейкотриен А4 (LТА4), под действием 5-липоксигеназы (5-LО) (A.W. Ford-Hutchinson et al., Annu. Rev. Biochem. 1994, 63:383-347). Этот фермент экспрессируется преимущественно клетками миелоидного происхождения, и в частности, нейтрофилами, эозинофилами, моноцитами/макрофагами и тучными клетками (G.K. Reid et al., J. Biol. Chem. 1990, 265(32):19818-19823). LТА4 может быть либо конъюгирован с глутатионом под действием лейкотриен С4 (LТС4)-синтазы с продуцированием цистеинил-лейкотриена, LТС4, либо гидролизован с образованием диола, лейкотриена В4 (LТВ4) (B. Samuelsson, Science 1983, 220(4597):568-575). LТС4 и его метаболиты, LТD4 и LТЕ4, индуцируют сокращение гладкой мышцы, бронхостеноз и проницаемость сосудов, и LТВ4 является сильным хемоаттрактантом и активатором нейтрофилов.
Стереоспецифический гидролиз LТА4Н с образованием LТВ4 катализируется лейкотриен-А4-гидролазой (LТА4Н), цинксодержащим цитозольным ферментом. Этот фермент экспрессируется во всех тканях, причем, высокие уровни его экспрессии наблюдаются в эпителиальных клетках тонкого кишечника, в легких и в аорте (B. Samuellson & C.D. Funk, J. Biol. Chem. 1989, 264(33):19469-19472). Умеренная экспрессия LТА4Н наблюдается в лейкоцитах, и в частности, в нейтрофилах (T. Yokomizo et al., J. Lipid Mediators Cell Signaling 1995, 12(2,3):321-332).
Лейкотриен В4 является ключевым провоспалительным медиатором, способствующим рекрутингу воспалительных клеток, таких как нейтрофилы и эозинофилы, а также активации нейтрофилов (F.A. Fitzpatrick et al., Ann. N.Y. Acad. Sci. 1994, 714:64-74; S.W. Crooks & R.A. Stockley, Int. J. Biochem. Cell. Biol. 1998, 30(2):173-178; A. Klein et al., J. Immunol. 2000, 164:4271-4276). LТВ4 опосредует провоспалительные эффекты путем связывания с рецепторами, сопряженными с G-белком, то есть, с рецептором лейкотриена В4 (BLT1) 1 и рецептором лейкотриена В4 (BLT2) 2 (T. Yokomizo et al., Arch. Biochem. Biophys. 2001, 385(2):231-241). Первый из идентифицированных рецепторов, ВLТ1, связывается с LТВ4 с высокой аффинностью, что приводит к продуцированию внутриклеточного сигнала и к хемотаксису. ВLТ1 экспрессируется, главным образом, в периферических лейкоцитах, и в частности, в нейтрофилах, эозинофилах, макрофагах (Huang W.W. et al., J. Exp. Med. 188, 1063-74 (1998)) и моноцитах (Yokomizo T. Izumi T. & Shimizu, T. Life Sci 68, 2207-12 (2001)). Мышиный рецептор также экспрессируется на эффекторных Т-клетках и недавно было показано, что он опосредует LТВ4-зависимую миграцию эффекторных CD8+-Т-клеток (Goodarzi K., Goodarzi M. Tager, A.M., Luster, A.D. & von Andrian, U.H. Nat. Immunol, 4, 965-73 (2003), Ott, V.L., Cambier, J.C. Kappler, J., Marrack, P. & Swanson, B.J. Nat. Immunol, 4, 974-81 (2003)) и ранний хемотаксис эффекторных CD4+-Т-клеток-хелперов типа 1 (TН1) и (TН2) и их адгезию к эндотелиальным клеткам, а также ранний рекрутинг эффекторных CD4+- и CD8+-Т-клеток у животных-моделей с астмой (Tager A.M. et al., Nat. Immunol, 4, 982-90 (2003)). LТВ4-рецептор ВLТ2 (S. Wang et al., J. Biol. Chem. 2000, 275(52):40686-40694; T. Yokomizo et al., J. Exp. Med. 2000, 192(3):421-431) имеет 42%-ную гомологию с рецептором ВLТ1 в аминокислотной последовательности, но обнаруживает более широкий спектр экспрессии в тканях, включая такие периферические ткани, как селезенка, яичник и печень, а также в лейкоцитах. ВLТ2 связывается с LТВ4 с более низкой аффинностью, чем ВLТ1, опосредует хемотаксис при более высоких концентрациях LТВ4 и отличается от ВLТ1 своей аффинностью по отношению к некоторым антагонистам. Хотя антагонисты рецептора LТВ4 могут отличаться своей аффинностью к ВLТ1 и ВLТ2, однако, предполагается, что блокирование продуцирования LТВ4 с использованием ингибиторов LТА4Н будет приводить к подавлению последующих событий, опосредуемых как ВLТ1, так и ВLТ2.
Исследования показали, что введение экзогенного LТВ4 в нормальные ткани может индуцировать воспалительные симптомы (R.D.R. Camp et al., Br. J. Pharmacol. 1983, 80(3):497-502; R. Camp et al., J. Invest. Dermatol. 1984, 82(2):202-204)). Повышенные уровни LТВ4 наблюдались при различных воспалительных заболеваниях, включая ВЗК, ХОБЛ, псориаз, ревматоидный артрит (РА), кистозный фиброз и астму (S.W. Crooks & R.A. Stockley, Int. J. Biochem. Cell Biol. 1998, 30(2):173-178). Поэтому, можно предположить, что снижение уровня продуцирования LТВ4 под действием ингибитора LТА4Н-активности будет оказывать терапевтическое действие на заболевания широкого ряда.
Эту идею подтвердило исследование, проводимое на LТА4Н-дефицитных мышах-моделях, у которых, если и не наблюдалось полного выздоровления, все же обнаруживалось заметное снижение притока нейтрофилов в область воспаления уха, индуцированного арахидоновой кислотой, и в область перитонита, индуцированного цимозаном (R.S. Byrum et al., J. Immunol. 1999, 163(12):6810-6819). В преклинических исследованиях было показано, что ингибиторы LТА4Н являются эффективными противовоспалительными агентами. Так, например, пероральное введение ингибитора LТА4Н SС57461 приводило к ингибированию индуцированного ионофором продуцирования LТВ4 в крови мышей ex vivo и в брюшине крыс in vivo (J.K. Kachur et al., J. Pharm. Exp. Ther. 2002, 300(2), 583-587). После 8-недельной обработки тем же самым соединением-ингибитором наблюдалось значительное ослабление симптомов колита у эдипова тамарина (игрунки) (T.D. Penning, Curr. Pharm. Des. 2001, 7(3):163-179). Спонтанный колит, который развивался у этих животных, очень напоминает ВЗК у человека. Следовательно, эти результаты указывают на то, что ингибиторы LТА4Н должны оказывать терапевтическое действие на это заболевание и другие воспалительные заболевания.
События, индуцирующие воспалительный ответ, включают образование провоспалительного медиатора лейкотриена В4. Гидролаза LТА4Н катализирует образование этого медиатора, и ингибиторы LТА4Н блокируют продуцирование провоспалительного медиатора LТВ4, что позволяет предотвращать состояния, опосредованные лейкотриеном, такие как воспаление, и/или проводить их эффективное лечение. Воспалительный ответ характеризуется болями, повышенной температурой, покраснением, опуханием или снижением функции ткани, либо комбинациями двух или более из таких симптомов. Что касается начала и последующего развития воспаления, то воспалительные заболевания или опосредуемые воспалением заболевания или состояния включают, но не ограничиваются ими, острые воспаления, аллергические воспаления и хронические воспаления.
Описание воспалений у субъектов можно найти, например, в руководствах: J.I. Gallin & R. Snyderman, Inflammation: Basic Principles and Clinical Correlates, 3rd Edition (Lippincott Williams & Wilkins, Philadelphia, 1999); V. Stvrtinova, J. Jakubovsky & I. Hulin, “Inflammation and Fever”, Pathophysiology Principles of Diseases (Textbook for Medial Students, Academic Press, 1995); Cecil et al., Textbook Of Medicine, 18th Edition (W.B. Saunders Company, 1988) и Steadmans Medical Dictionary.
Известные данные и обзор имеющихся данных, относящихся к воспалению и ассоциированным с воспалением состояний, можно найти в следующих работах: C. Nathan, Points of control in inflammation, Nature 2002, 420:846-852; K.J. Tracey, The inflammatory reflex, Nature 2002, 420:853-859; L.M. Coussens & Z. Werb, Inflammation and Cancer, Nature 2002, 420:860-867; P.Libby, Inflammation in atherosclerosis, Nature 2002, 420:868-874; C. Benoist & D. Mathis, Mast cells in autoimmune disease, Nature 2002, 420:875-878; H.L. Weiner & D.J. Selkoe, Inflammation and therapeutic vaccination in CNS diseases, Nature 2002, 420:879-884; J. Cohen, The immunopathogenesis of sepsis, Nature 2002, 420:885-891; D. Steinberg, Atherogenesis in perspective: Hypercholesterolemia and inflammation as parthers in crime, Nature Medicine 2002, 8(11):1211-1217. Все цитируемые в настоящем описании работы введены в виде ссылки.
Воспаление вызывается любым из множества состояний, таких как астма, хроническая обструктивная болезнь легких (ХОБЛ), атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительные заболевания кишечника (включая болезнь Крона и язвенный колит), или псориаз, каждое из которых характеризуется сильной или продолжительной воспалительной реакцией на определенных стадиях данного заболевания.
Авторами были получены бензоксазол-2-иловые, бензотиазол-2-ильные и 1Н-бензоимидазол-2-ильные соединения и их производные, и было обнаружено, что они могут быть использованы в качестве ингибиторов действия ферментов, таких как фермент LТА4Н, участвующих в продуцировании провоспалительных медиаторов, таких как медиатор LТВ4, и что они могут быть также использованы для лечения воспалительных состояний и получения фармацевтических композиций для лечения воспаления.
Описание сущности изобретения
Настоящее изобретение относится к ингибиторам фермента LТА4Н, которые имеют следующую общую формулу (I):

где:
Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3;
Y выбран из группы, состоящей из СН2 и О;
Z выбран из группы, состоящей из О и связи;
W выбран из группы, состоящей из СН2 и СНR1-СН2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном СНR1-СН2 не связана непосредственно с атомом азота, с которым связан указанный W;
R4 выбран из группы, состоящей из Н, ОСН3, Cl, F, Br, I, ОН, NH2, СN, СF3 и СН3;
R6 представляет собой Н или F; и
R2 и R3 каждый независимо выбран из группы, состоящей из:
А) Н, С1-7алкила, С3-7алкенила, где атом углерода в указанном алкениле, который связан с атомом азота, имеет только простые связи; С3-7алкинила, где атом углерода в указанном алкиниле, который связан с атомом азота, имеет только простые связи; С3-7циклоалкила, необязательно бензоконденсированного; С5-7циклоалкенила; -С3-7циклоалкил-С1-7алкила; -С1-7алкил-С3-7циклоалкила и фенила, где каждый из заместителей (А) независимо замещен 0, 1 или 2 RQ, где каждый из указанных RQ является заместителем у атома углерода, который представляет собой, по крайней мере, один атом углерода, удаленный от атома азота;
В) заместителя НеtRа;
С) -С1-7алкил-С(О)Rх, необязательно замещенного СН2RAr или СН2RAr';
D) -С2-5алкил-С(О)Rх, где два атома углерода с допустимой валентностью в -С2-5алкиле указанного -С2-5алкил-С(О)ОRx являются частью насыщенного С3-6карбоцикла;
Е) -С2-5алкил-ОН, где два атома углерода с допустимой валентностью в -С2-5алкиле указанного -С2-5алкил-С(О)ОН являются частью насыщенного С3-6карбоцикла;
F) -С0-4алкилфенила, где фенил в указанном -С0-4алкилфениле конденсирован с Rf по двум смежным атомам углерода в указанном фениле, или является бензоконденсированным;
G) -С0-4алкил-Аr6, где Ar6 представляет собой 6-членный гетероарил, который имеет атом углерода в месте присоединения и один или два -N= гетероатома, и является бензоконденсированным;
Н) -С0-4алкил-Аr5, где Ar5 представляет собой 5-членный гетероарил, который имеет один гетероатом, выбранный из группы, состоящей из О, S и >NRY, и 0 или 1 дополнительный гетероатом -N=, и необязательно содержит две карбонильные группы, и необязательно бензоконденсирован;
I) -С0-4алкил-Аr5', где Ar5' представляет собой 5-членный гетероарил, который содержит 3 или 4 атома азота, необязательно замещен RY и имеет разрешаемое валентностью положение присоединения;
J) -С0-4алкил-Аr6-6, где Ar6-6 представляет собой С0-4алкил-замещенный фенил, конденсированный с 6-членным гетероарилом в допускаемом валентностью положении, где указанный 6-членный гетероарил имеет один или два -N= гетероатома;
K) -С0-4алкил-Аr6-5, где Ar6-5 представляет собой С0-4алкил-замещенный фенил, конденсированный с 5-членным гетероарилом в допускаемых валентностью положениях, где указанный 5-членный гетероарил имеет один гетероатом, выбранный из группы, состоящей из О, S и >NRY, и где указанный 5-членный гетероарил имеет 0 или 1 дополнительный гетероатом, которым является -N=,
L) одного из 2-(4-этилфенокси)бензотиазола, 2-(4-этилфенокси)бензооксазола и 2-(4-этилфенокси)-1Н-бензоимидазола,
М) SО2С1-4алкила;
и альтернативно, R2 и R3, взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее, по крайней мере, один гетероатом, которым является присоединенный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из
i) 4-7-членного гетероциклического кольца HetRb, где указанное 4-7-членное гетероциклическое кольцо HetRb имеет один гетероатом, который представляет собой указанный связанный атом азота, и замещено 0, 1 или 2 одинаковыми или различными заместителями, где указанные заместители выбраны из группы, состоящей из -RY, -CN, -C(O)RY, -С0-4алкил-СО2RY,
-С0-4алкил-С(О)СО2RY, -С0-4алкил-ОRY, -С0-4алкил-С(О)NRYRz-,
-С0-4алкил-NRYC(O)RZ-, -С(О)NRZORY, -С0-4алкил-NRYC(O)СH2ORY,
-С0-4алкил-NRYC(O)СH2С(О)RY, -С0-4алкил-NRYCО2RY,
-С0-4алкил-NRYC(O)NRYRY, -С0-4алкил-NRYC(S)NRYRZ, -NRYC(O)CO2RY,
-NRYRZ, -С0-4алкил-NRWSO2RY, 1,3-дигидроиндол-2-он-1-ила,
1,3-дигидробензоимидазол-2-он-1-ила, тетразол-5-ила,
1-RY-1H-тетразол-5-ила, RY-триазолила, 2-RY-2H-тетразол-5-ила,
пирролидин-2-тион-1-ила, пиперидин-2-тион-1-ила,
-С0-4алкил-C(O)N(RY)(SO2RY), -С0-4алкил-N(RY)(SO2)NRYRY,
-С0-4алкил-N(RY)(SO2)NRYCO2RY, галогена, 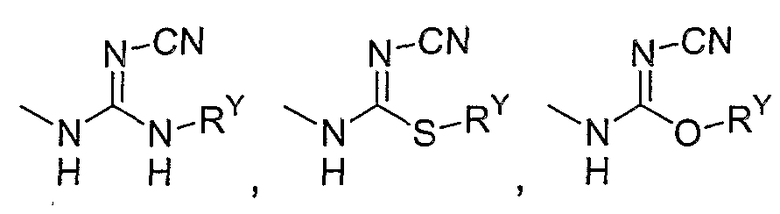 ,
,  ,
,  и
и 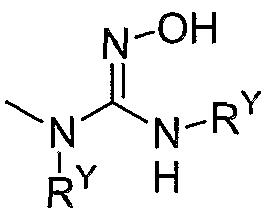 ;
;
ii) 5-7-членного гетероциклического кольца HetRс, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота, по крайней мере, одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=О)0-2 и >NRМ, где указанное 5-7-членное гетероциклическое кольцо НеtRС имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -С(О)RY, -CO2RY, -С3-4алкил-СО2RY и RZ;
(iii) одного из имидазолидин-1-ила, 2-имидазолин-1-ила, пиразол-1-ила, имидазол-1-ила, 2Н-тетразол-2-ила, 1Н-тетразол-1-ила, пиррол-1-ила, 2-пирролин-1-ила и 3-пирролин-1-ила, где каждый из указанных 2Н-тетразол-2-ила и 1Н-тетразол-1-ила замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-SRY, -С0-4алкил-СО2RY и заместителем HetRa; и
iv) одного из 1,2,3,4-тетрагидрохинолин-1-ила,
1,2,3,4-тетрагидроизохинолин-2-ила, индол-1-ила, изоиндол-2-ила,
индолин-1-ила, бензимидазол-1-ила,
2,8-диаза-спиро[4.5]декан-1-он-8-ила,
4-{[(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил}пиперидин-1-ила,
4-{[(2-аминоциклобутанкарбонил)амино]метил}пиперидин-1-ила,
9-ил-трет-бутилового эфира 3,9-диаза-спиро[5.5]ундекан-3-карбоновой кислоты,
4-оксо-1-фенил-1,3,8-триаза-спиро[4.5]дек-8-ила и
4-оксо-1,3,8-триазаспиро[4.5]дек-8-ила,
где заместитель HetRа представляет собой 4-7-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения, по крайней мере, 1 дополнительным атомом углерода;
RK выбран из группы, состоящей из Н, -С1-4алкила, -С0-4алкил-RAr, каждый из которых необязательно замещен 1, 2 или 3 заместителями RN;
RL выбран из группы, состоящей из -CO2RS и -С(О)NRSRS';
RM выбран из группы, состоящей из RZ, индол-7-ила, -SО2RY, -С3-4алкил-СО2RY, -CO2RY, -C(O)NRZORY, -С(O)RY, -С(О)С0-4алкил-ОRY, -С0-4алкил-С(О)NRSRS', -С0-4алкил-С(О)СО2RY, 1,3-дигидроиндол-2-он-1-ила, 1,3-дигидробензимидазол-2-он-1-ила, тетразол-5-ила, 1-RY-1H-тетразол-5-ила, RY-триазолила, 2-RY-2Н-тетразол-5-ила и -С0-4алкил-С(О)N(RY)(SО2RY), каждый из которых необязательно замещен 1, 2 или 3 заместителями RN;
RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, OH, NH2, CN, CF3, CH3, OC(O)СН3 и NO2;
RР выбран из группы, состоящей из RY, -С2-4алкил-ОRY, RAr, -С1-2алкил-СО2RY, -С1-2алкил-СОNRSRS', индол-7-ила и -SО2С1-4алкила;
RQ выбран из группы, состоящей из фтора, хлора, брома, иода, трифторметила, трихлорметила, -CN, -С1-4алкила, -С0-4алкил-RAr, -С0-4алкил-RAr', -С0-4алкил-ОRY, -С0-4алкил-СО2RY, -С0-4алкил-NRYRY, -С0-4алкил-NRYCORY, -С0-4алкил-NRYCONRYRZ, -С0-4алкил-NRYSО2RY и -С0-4алкил-SRY;
RS и RS' независимо выбраны из группы, состоящей из Н, С1-4алкила и С0-4алкилфенила; альтернативно, RS и RS', взятые вместе с атомом азота, с которым они связаны, образуют 4-7-членное гетероциклическое кольцо, имеющее 0 или 1 дополнительный гетероатом, выбранный из группы, состоящей из O, S и >NRY, при условии, что указанный дополнительный гетероатом отделен от указанного атома азота, с которым связаны указанные RS и RS', по крайней мере, двумя атомами углерода, и при условии, что если RY представляет собой -С0-4алкил-RY, то RAr не замещен RL;
RW выбран из группы, состоящей из RY и С3-7циклоалкила;
RХ выбран из группы, состоящей из -ОRY, -NRYRZ, -С1-4алкила и -С0-4алкил-RAr;
RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1, 2 или 3 заместителями RN;
RZ выбран из группы, состоящей из RY, -С2-4алкил-ОRY, -С1-2алкил-CO2RY, -С1-2алкил-С(О)NRSRS' и -С2-4алкил-NRSRS';
причем, если RY и RZ связаны с атомом азота, то указанные RY и RZ выбраны так, как определено выше, или RY и RZ, взятые вместе с атомом азота, с которым они связаны, образуют 4-7-членное гетероциклическое кольцо HetRd, имеющее 0 или 1 дополнительный гетероатом, выбранный из группы, состоящей из O, S и >NRM, где указанное 4-7-членное гетероциклическое кольцо HetRd имеет 0 или 1 карбонильную группу, и где указанное 4-7-членное гетероциклическое кольцо HetRd, имеет 0 или 1 атом углерода с допустимой валентностью, замещенный, по крайней мере, одним из RM, -CO2Н и -С0-1алкил-ОRY;
RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила, пиримидила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен, по крайней мере, 0, 1, 2 или 3 RN или 0 или 1 RL;
RAr' представляет собой 3-8-членное кольцо, которое имеет 0, 1 или 2 гетероатома, выбранных из группы, состоящей из O, S, N и >NRY, и имеет 0, 1 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RК; и
Rf представляет собой линейную 3-5-членную углеводородную группу, имеющую 0 или 1 ненасыщенную углерод-углеродную связь и 0 или 1 карбонильную группу;
или к их энантиомерам, диастереомерам, рацематам, таутомерам, гидратам, сольватам или к их фармацевтически приемлемым солям, сложным эфирам или амидам.
В одном из вариантов настоящее изобретение относится к новым соединениям, которые представляют собой ингибиторы фермента LTA4H, и которые имеют общую формулу (II):

или к их энантиомерам, диастереомерам, рацематам, таутомерам, гидратам, сольватам или к их фармацевтически приемлемым солям, сложным эфирам или амидам,
где R4, R6, Х, Y, Z и W являются такими, как определено для соединения формулы (I), R2' является таким, как R2 в соединении формулы (I), и R3' является таким, как R3 в соединении формулы (I), при условии, что:
(а) по крайней мере, один из указанных R2' и R3' не является этилом, если имеет место одна из комбинаций (s1), (s2), (s3) и (s4), где каждая из указанных комбинаций определена следующим образом:
(s1): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой S;
(s2): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой NH;
(s3): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой О, и Х представляет собой S;
(s4): R4 представляет собой 5-хлор, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой S;
(b) далее при условии, если Z представляет собой связь, Y представляет собой СН2, W представляет собой СНR1-СН2, R1 представляет собой Н, и один из R2' и R3' представляет собой 1Н-имидазол-2-ил, то другой из R2' и R3' выбран из А1), В)-L), где В)-L) определены выше для соединения формулы (I), и А1) состоит из Н, С3-7алкенила, где атом углерода в указанном С3-7алкениле, который связан с атомом азота, имеет только простые связи; С3-7алкинила, где атом углерода в указанном алкиниле, который связан с атомом азота, имеет только простые связи; С3-7циклоалкила, необязательно бензоконденсированного; С5-7циклоалкенила; С3-7циклоалкил-С1-7алкила; -С1-7алкил-С3-7циклоалкила, и
(с) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2' и R3' не является ХCG, если другой представляет собой С1-6алкил, где XCG представляет собой группу:

где HC16 представляет собой один из Н, С1-6алкила, галоген-С1-6алкила, аллила и С1-6алкоксиметила, и GO представляет собой группу, связанную через атом углерода, которая имеет заместитель =О, образующий амидогруппу (>N-C(O)-) с атомом азота, к которому присоединена указанная группа GO.
В других своих вариантах, настоящее изобретение относится к новым соединениям, которые представляют собой ингибиторы фермента LTA4H и имеют общую формулу (III):
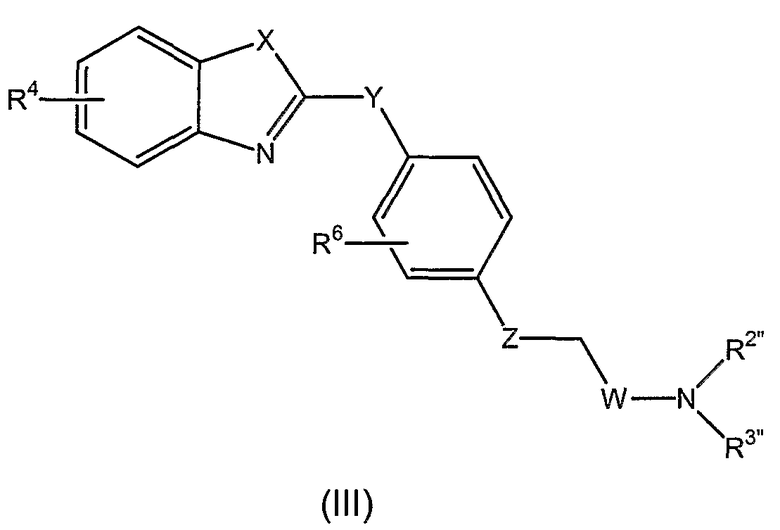
или к их энантиомерам, диастереомерам, рацематам, таутомерам, гидратам, сольватам или к их фармацевтически приемлемым солям, сложным эфирам или амидам, где:
R4, R6, X, Y, Z и W являются такими, как определено для соединения формулы (I), R2” является таким, как R2 в соединении формулы (I), и R3” является таким, как R3 в соединении формулы (I), при условии, что:
(а) указанные R2” и R3”, далее удовлетворяют одному из следующих условий:
(е1): по крайней мере, один из указанных R2” и R3” не является С1-5алкилом, если Z представляет собой О, и Х представляет собой S;
(е2): ни один из R2” и R3” не является -С1-4алкил-С(О)RХ, где RХ представляет собой один из С1-4алкила, ОН, -ОС1-4алкила, -ОС0-4алкил-RAr или -NRYRY, если Y представляет собой О, Z представляет собой связь, и R2” отличается от R3”; и
(е3) ни один из R2” и R3” не является -С1-4алкил-СN, если Y представляет собой О, Z представляет собой связь, и R2” отличается от R3”; и
(b) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2” и R3” не является XCG, если другой представляет собой С1-6алкил, где XCG представляет собой группу:
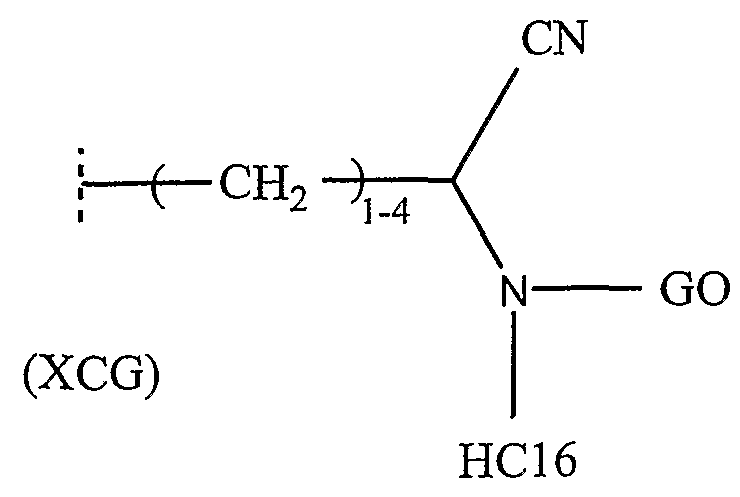
где HC16 представляет собой один из Н, С1-6алкила, галоген-С1-6алкила, аллила и С1-6алкоксиметила, и GO представляет собой группу, связанную посредством атома углерода, которая имеет заместитель =О, образующий амидогруппу (>N-C(O)-) с атомом азота, к которому присоединена указанная группа GO.
Изомерные формы соединений вышеуказанных формул и их фармацевтически приемлемых солей, амидов и сложных эфиров входят в объем настоящего изобретения, и приводимая в данном описании ссылка на одну из таких изомерных форм относится, по крайней мере, к одной из указанных изомерных форм. Специалисту в данной области будет очевидно, что соединения настоящего изобретения могут существовать, например, в одной изомерной форме, и другие соединения могут существовать в форме региоизомерной смеси.
Следует отметить, что в любой части описания изобретения и формулы изобретения, каждое определение заместителя и члена структуры в контексте настоящего изобретения является независимым от определения другого члена структуры и заместителя, если не оговорено особо. В качестве первого примера терминологии определения заместителей могут быть рассмотрены следующие условия: если заместителем S1 пример является один из S1 и S2, и заместителем S2 пример является один из S3 и S4, то такие определения заместителей, входящие в объем настоящего изобретения, означают следующие варианты: S1 пример представляет собой S1, и S2 пример представляет собой S3; S1 пример представляет собой S1, и S2 пример представляет собой S4; S1 пример представляет собой S2, и S2 пример представляет собой S3; S1 пример представляет собой S2, и S2 пример представляет собой S4; и эквиваленты каждого из таких вариантов. В соответствии с этим, используемая в данном описании более сокращенная терминология “S1 пример представляет собой один из S1 и S2, и S2 пример представляет собой один из S3 и S4” приводится лишь для краткости, и не рассматривается как ограничение объема изобретения. Первый вышеописанный пример терминологии, принятой для обозначения заместителей, которая представляет собой общие термины, относится к описываемым определениям различных заместителей R. Вышеописанная терминология, принятая для обозначения заместителей, распространяется и на другие группы, если они присутствуют, например, такие как X, Y, Z и W, и на индекс n.
Кроме того, если для любого элемента структуры или заместителя приводится более чем одно определение, то варианты настоящего изобретения включают различные комбинации групп, которые могут быть составлены исходя из перечисленных выше определений, сделанных независимо друг от друга, и их эквиваленты. В качестве второго примера терминологии определения заместителей, могут быть рассмотрены следующие условия: если заместителем S1 пример является один из S1, S2 и S3, то такие определения заместителей, входящие в объем настоящего изобретения, означают следующие варианты: Sпример представляет собой S1; Sпример представляет собой S2; Sпример представляет собой S3; Sпример представляет собой один из S1 и S2; Sпример представляет собой один из S1 и S3; Sпример представляет собой один из S2 и S3; Sпример представляет собой один из S1, S2 и S3; и Sпример представляет любой эквивалент каждого из таких вариантов. В соответствии с этим, используемая в данном описании более сокращенная терминология “Sпример представляет собой один из S1, S2 и S3” приводятся лишь для краткости и не рассматривается как ограничение объема изобретения. Первый вышеописанный пример терминологии, принятой для обозначения заместителей, которая представляет собой общие термины, относится к описываемым определениям различных заместителей R. Вышеописанная терминология, принятая для обозначения заместителей, распространяется и на другие группы, если они присутствуют, такие как, например, X, Y, Z и W, и на индекс n.
Номенклатура “Сi-j”, где j>i, если она применяется для класса заместителей, используется только для тех вариантов настоящего изобретения, в которых независимо используются все атомы и каждый атом углерода, обозначаемый i-j, включая i и j. Так, например, термин С1-3 независимо означает варианты, которые имеют один атом углерода (С1); варианты, которые имеют два атома углерода (С2) и варианты, которые имеют три атома углерода (С3).
Термин Сn-mалкил означает прямую или разветвленную алифатическую цепь, где общее число (N) атомов углерода цепи удовлетворяет условиям n≤N≤m, где m>n.
Если любое значение, относящееся к заместителю, члену соединения или к индексу, встречается в описании более чем один раз, то полный интервал определений означает, что оно применяется к каждому объекту, независимо от конкретного(ых) определения(й), приписываемых другому объекту.
Что касается вышеприведенных интерпретаций определений и номенклатуры, то в этой связи следует отметить, что конкретная приводимая в данном описании ссылка на определенное множество значений, если оно относится к химическим символам, и если не оговорено особо, означает независимую ссылку на варианты такого множества, и ссылку на каждый один из возможных вариантов подмножеств указанного точно определенного множества.
Настоящее изобретение также относится к способам ингибирования активности фермента LTA4H с использованием таких соединений, к фармацевтическим композициям, содержащим такие соединения, и к способам применения таких композиций для лечения или предупреждения состояний, опосредуемых ферментативной активностью LTA4H.
Фармацевтические композиции настоящего изобретения включают, по крайней мере, одно из соединений настоящего изобретения. Если в композицию включены более чем одно из таких соединений, то терапевтически эффективное количество может быть аддитивным эффективным количеством. В качестве таких ингибиторов ферментов LТА4Н могут быть использованы соединения и композиции настоящего изобретения, предназначенные для предупреждения, подавления или лечения воспалений.
Настоящее изобретение также относится к фармацевтической композиции для лечения и предупреждения опосредованного LТА4Н состояния у субъекта, которая включает терапевтически эффективное количество, по крайней мере, одного LТА4Н-модулятора, выбранного из соединений формулы (I), (II) и (III), их энантиомеров, диастереомеров, рацематов, фармацевтически приемлемых солей, амидов и сложных эфиров. Кроме того, настоящее изобретение относится к фармацевтической композиции для ингибирования иммунного ответа у субъекта, и содержащей терапевтически эффективное количество, по крайней мере, одного ингибитора LТА4Н, выбранного из соединений формулы (I), (ii) и (III), их энантиомеров, диастереомеров, рацематов, фармацевтически приемлемых солей, амидов и сложных эфиров. Настоящее изобретение также относится к противовоспалительной композиции, содержащей терапевтически эффективное количество, по крайней мере, одного противовоспалительного соединения, выбранного из соединений формулы (I), (ii) и (III), их энантиомеров, диастереомеров, рацематов, фармацевтически приемлемых солей, амидов и сложных эфиров.
Настоящее изобретение относится к способам лечения или предупреждения воспаления у субъекта, предусматривающим введение данному субъекту фармацевтической композиции, содержащей терапевтически эффективное количество, по крайней мере, одного противовоспалительного соединения, выбранного из соединений формулы (I), (ii) и (III), их энантиомеров, диастереомеров, рацематов, фармацевтически приемлемых солей, амидов и сложных эфиров, для вырабатывания у данного субъекта противовоспалительного ответа. Настоящее изобретение также относится к способам лечения или предупреждения LТА4Н-опосредуемого состояния у субъекта, предусматривающим введение данному субъекту фармацевтической композиции, содержащей терапевтически эффективное количество, по крайней мере, одного модулятора LТА4Н, выбранного из соединений формулы (I), (ii) и (III), их энантиомеров, диастереомеров, рацематов, фармацевтически приемлемых солей, амидов и сложных эфиров. Кроме того, настоящее изобретение относится к способам подавления воспаления у субъекта, предусматривающим введение данному субъекту фармацевтической композиции, содержащей терапевтически эффективное количество, по крайней мере, одного ингибитора LТА4Н, выбранного из соединений формулы (I), (ii) и (III), их энантиомеров, диастереомеров, рацематов, фармацевтически приемлемых солей, амидов и сложных эфиров.
Настоящее изобретение относится к способам лечения, предупреждения и/или ослабления состояний, которые ассоциируются с воспалением и/или вызывают воспаление, таких как, например, одно или несколько из следующих состояний: астма, хроническая обструктивная болезнь легких (ХОБЛ), атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительные заболевания кишечника (включая болезнь Крона и язвенный колит) или псориаз, каждое из которых характеризуется сильной или продолжительной воспалительной реакцией на определенных стадиях данного заболевания.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего описания, включая примеры и прилагаемую ниже формулу изобретения.
Подробное описание изобретения
Настоящее изобретение относится к соединениям формулы (I), (ii) или (III), определенным выше, к их энантиомерам, диастереомерам, рацематам, фармацевтически приемлемым солям, амидам и сложным эфирам; к фармацевтическим композициям, содержащим, по крайней мере, одно из указанных соединений, к способам их применения, включая лечение и/или предупреждение таких состояний, как LТА4Н-опосредованные состояния, и к способам получения таких фармацевтических композиций.
Ниже приводятся определения терминов, используемых в описании изобретения.
“Алкил” означает углеводород с прямой и разветвленной цепью, из которой удален, по крайней мере, один атом водорода с образованием радикальной группы. Алкильными группами являются метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, 1-метилпропил, пентил, изопентил, втор-пентил, гексил, гептил, октил и т.п. Указанные алкильные группы не включают циклоалкил.
“Алкенил” означает углеводородные радикалы с прямой и разветвленной цепью, указанные выше, которые имеют, по крайней мере, одну углерод-углеродную двойную связь (sp2). Если не оговорено особо, то указанный префикс означает число атомов углерода, и примерами алкенилов являются этенил (или винил), проп-1-енил, проп-2-енил (или аллил), изопропенил (или 1-метилвинил), бут-1-енил, бут-2-енил, бутадиенилы, пентенилы, гекса-2,4-диенил и т.п.
“Алкинил” означает углеводородные радикалы с прямой и разветвленной цепью, указанные выше, которые имеют, по крайней мере, одну углерод-углеродную тройную связь (sp). Если не оговорено особо, то указанный префикс означает число атомов углерода, и примерами алкинилов являются этинил, пропинил, бутинил и пентинил. В настоящем описании, углеводородные радикалы, имеющие смесь двойных и тройных связей, такие как 2-пентен-4-инил, относят к группе алкинилов.
“Алкокси” означает углеводородную алкильную группу с прямой и разветвленной цепью, имеющую концевой кислород, связывающий алкильную группу с остатком данной молекулы. Алкоксигруппами являются метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, пентокси и т.п. Группы “аминоалкил”, “тиоалкил” и “сульфонилалкил” являются аналогами алкокси, за исключением того, что концевой атом кислорода алкоксигруппы заменен, соответственно NН (или NR), S и SО2.
Если не оговорено особо, то префикс указывает на число атомов углерода. Примерами “циклоалкила” являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п.
Если не оговорено особо, то префикс указывает на число членов в данной циклической структуре, и примерами “гетероциклила”, “гетероциклической группы” или “гетероцикла” являются 3-8-членная ароматическая, насыщенная или частично насыщенная единичная или конденсированная кольцевая система, которая содержит атомы углерода, где гетероатомы выбраны из N, О и S. Примерами гетероциклилов являются тиазоилил, фурил, пиранил, изобензофуранил, пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, индолил, индазолил, пуринил, хинолил, фуразанил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперазинил, индолинил и морфолинил. Так, например, предпочтительными гетероциклилами или гетероциклическими радикалами являются морфолинил, пиперазинил, пирролидинил, пиридил, циклогексилимино, циклогептилимино, и более предпочтительным является пиперидил.
Положения замещения определяются стандартными терминами. Так, например, положения замещения в пиперидиновой и пиперазиновой группах указаны ниже:

“Карбоцикл” представляет собой циклоалкил или частично насыщенный циклоалкил, который не является бензо 
Термин “арил” включает фенил, нафтил, бифенилил, тетрагидронафтил и т.п., каждый из которых может быть необязательно замещен. “Арил” также означает арилалкильные группы, такие как бензил, фенетил и фенилпропил. “Арил” включает кольцевую систему, содержащую необязательно замещенную 6-членное карбоциклическое ароматическое кольцо, где указанная система может быть бициклической, мостиковой и/или конденсированной. Такая система может включать кольца, которые являются ароматическими, либо частично или полностью насыщенными. Примеры кольцевых систем включают инденил, пенталенил, 1,4-дигидронафтил, инданил, бензимидазолил, бензотиофенил, индолил, бензофуранил, изохинолинил и т.п. Иллюстративными примерами гетероарила являются тиенил, фуранил, пирролил, имидазолил, оксазолил, тиазолил, бензотиенил, бензофуранил, бензимидазолил, бензоксазолил, бензотиазолил.
Термин “галоген” включает хлор, фтор, бром и иод, предпочтительно, фтор или хлор.
Термин “карбонил” означает группу >С=О, и характеризуется частью цепи или циклической структуры, где атом углерода в карбонильной группе взят как один из атомов углерода такой цепи или циклической структуры.
Как и в стандартной химической номенклатуре, в настоящем описании, фенильная группа называется “фенилом” и обозначается “Рh”.
Следует отметить, что, если не оговорено особо, то используемые термины “замещения” и “комбинации замещений” означают замещения, которые соответствуют валентности замещаемого члена. Термины “положение, допускаемое валентностью”, “атом с допустимой валентностью” и их морфологические варианты используются в настоящем описании в их общепринятом смысле. Так, например, если термин “допустимая валентность” относится к атому углерода, то имеется в виду, что С является четырехвалентным; если этот термин относится к атому азота, то имеется в виду, что N является трехвалентным, и если этот термин относится к четырем связям атома азота, то это означает, что данный атом азота имеет положительный электрический заряд. Определение допустимой валентности являются частью компетенции среднего специалиста в данной области.
Термины “пациент” или “субъект” включают млекопитающих, таких как человек и животные (например, собаки, кошки, лошади, крысы, кролики, мыши, и приматы, не являющиеся человеком), нуждающихся в проведении наблюдений, экспериментов, лечения или предупреждения соответствующего заболевания или состояния. Предпочтительно, пациентом является человек.
Термин “композиция” означает продукт, содержащий конкретно определенные ингредиенты в конкретно определенных количествах, включая эффективные количества, а также любой продукт, который получают, прямо или опосредованно, из комбинаций конкретно определенных ингредиентов в конкретно определенных количествах.
Термины “терапевтически эффективное количество” или “эффективное количество” и их грамматические формы означают количество активного соединения или фармацевтического средства, вырабатывающее биологический или клинический ответ в тканевой системе и в организме животного или человека, который предусматривается исследователем, ветеринаром, лечащим врачом или другим клиницистом, где указанный ответ включает ослабление симптомов заболевания или расстройства, подвергаемого лечению.
Соединениями формулы (I), (ii) или (III): являются соединения, которые удовлетворяют любой из приводимых комбинаций определений и их эквивалентов.
Следует отметить, что некоторыми описываемыми соединениями являются соединения, имеющие хиральные и/или геометрические изомерные центры, например, Е- и Z-изомеры. Настоящее изобретение охватывает все указанные оптические изомеры, включая диастереоизомеры и рацемические смеси, и геометрические изомеры, обладающие активностью, которая характеризует соединения настоящего изобретения. Кроме того, некоторые описываемые соединения могут присутствовать в сольватированной, а также в несольватированной форме. Следует также отметить, что настоящее изобретение включает все указанные сольватированные и несольватированные формы, обладающие активностью, которая характеризует соединения настоящего изобретения. Соединения настоящего изобретения, которые были модифицированы так, чтобы они могли быть детектированы некоторыми аналитическими методами, также входят в объем настоящего изобретения. Примерами таких соединений являются меченые изотопами соединения, такие как соединение, меченое изотопом 18F, которое может быть использовано в качестве зонда в методах детекции и/или визуализации, таких как позитронная эмиссионная томография (РЕТ) и однофотонная эмиссионная компьютерная томография (SPECT). Другим примером таких соединений является меченое изотопом соединение, такое как меченое дейтерием и/или тритием соединение, которое может быть использовано в исследованиях кинетики реакции.
Следует также отметить, что описываемые замещения и комбинации замещений, независимо от того, имеется ли на это прямое или косвенное указание, относятся к замещениям, которые соответствуют валентности замещаемого атома. Так, например, если замещение применяется к атому углерода, то имеется в виду, что этот С является четырехвалентным, если замещение применяется к атому азота, то имеется в виду, что этот N трехвалентным, и если оно относится к четырем связям атома азота, то это означает, что данный атом азота имеет положительный электрический заряд. Определение допустимой валентности являются частью компетенции среднего специалиста в данной области.
Термин “фармацевтически приемлемые соли, их амиды или сложные эфиры” означает соли, амиды и сложные эфиры соединений настоящего изобретения и понятен любому химику-фармацевту, то есть, этот термин означает соединения, которые являются нетоксичными и придают указанным соединениям настоящего изобретения благоприятные фармакологические свойства. Термин “соединения изобретения, обладающие благоприятными фармакологическими свойствами” понятен любому химику-фармацевту, то есть, он означает соединения, которые являются нетоксичными и обладают такими фармакологическими свойствами, как приемлемые вкусовые качества, хорошая абсорбируемость, нужное распределение в тканях и желательные параметры метаболизма и экскреции. Другими факторами, которые являются более важными с практической точки зрения и которые следует учитывать при выборе данных соединений, являются стоимость исходных веществ, легкость их кристаллизации, выход, стабильность, гигроскопичность и текучесть полученной лекарственной массы.
Характерными кислотами и основаниями, которые могут быть использованы для получения фармацевтически приемлемых солей, являются следующие кислоты: уксусная кислота, 2,2-дихлормолочная кислота, ацетилированные аминокислоты, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, L-аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, (+)-камфорная кислота, камфорсульфоновая кислота, (+)-(1S)-камфор-10-сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, коричная кислота, лимонная кислота, цикламиновая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактуроновая кислота, гентизиновая кислота, глюкогептоновая кислота, D-глюконовая кислота, D-глюкуроновая кислота, L-глутаминовая кислота, α-оксоглутаровая кислота, гликолевая кислота, гиппуровая кислота, бромистоводородная кислота, хлористоводородная кислота, (+)-L-молочная кислота, (±)-DL-молочная кислота, лактобионовая кислота, малеиновая кислота, (-)-L-яблочная кислота, малоновая кислота, (±)-DL-миндальная кислота, метансульфоновая кислота, нафталин-2-сульфоновая кислота, нафталин-1,5-дисульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, азотная кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, фосфорная кислота, L-пироглутаминовая кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, серная кислота, дубильная кислота, (+)-L-винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота и ундециленовая кислота; и
следующие основания, включая аммиак, L-аргинин, бенетамин, бензатин, гидроксид кальция, холин, деанол, диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин, 1Н-имидазол, L-лизин, гидроксид магния, 4-(2-гидроксиэтил)морфолин, пиперазин, гидроксид калия, 1-(2-гидроксиэтил)пирролидин, вторичный амин, гидроксид натрия, триэтаноламин, трометамин и гидроксид цинка.
См., например, работу S.M. Berge et al. “Pharmaceutical Salts”, J. Pharm. Sci. 1977, 66:1-19, которая введена в настоящее описание в виде ссылки. Подходящими примерами сложных эфиров являются С1-7алкиловый, С5-7циклоалкиловый, фениловый, замещенный фениловый и фенил-С1-6алкиловый эфиры. Предпочтительными сложными эфирами являются метиловые эфиры.
В объем настоящего изобретения также входят пролекарства соединений настоящего изобретения. Обычно такими пролекарствами могут быть функциональные производные соединений, которые легко преобразуются в нужное соединение in vivo. Так, например, в способах лечения настоящего изобретения термин “введение” включает лечение различных описанных расстройств с использованием описываемых конкретных соединений или соединений, которые конкретно не описаны, но которые, после их введения пациенту, могут превращаться в данное конкретное соединение in vivo. Стандартные методики по выбору и получению подходящих пролекарственных производных описаны, например, в “Design of Prodrugs”, ed. H. Bundgaard, Elsevier, 1985.
Соединения некоторых вариантов настоящего изобретения, где Х представляет собой О, полученные способами синтеза, представленными на схемах А-D и F-L, обладают LТА4Н-ингибирующей активностью, и выбраны из группы, состоящей из нижеследующих соединений.
Соединения других вариантов настоящего изобретения, где Х представляет собой S, полученные способами синтеза, представленными на схемах А-G и I-L, обладают LТА4Н-ингибирующей активностью, и выбраны из группы, состоящей из нижеследующих соединений.
Соединения дополнительных вариантов настоящего изобретения, где Х представляет собой NR5, где R5 представляет собой один из Н и СН3, полученные способами синтеза, представленными на схемах А-С, F, G и J-L, обладают LТА4Н-ингибирующей активностью, и выбраны из группы, состоящей из нижеследующих соединений:
Соединения настоящего изобретения могут быть получены в соответствии с реакционными схемами, описанными ниже. Эти схемы основаны на двух прямых способах синтеза целевых соединений, где синтез начинают с конца синтезируемой молекулы. Специалисту в данной области будет очевидно, что синтез некоторых соединений более предпочтительно осуществлять в соответствии с какой-либо одной из представленных схем.
Для получения различных описываемых соединений могут быть использованы исходные соединения, которые, в конечном счете, имеют нужные заместители, хотя, при необходимости, реакционная схема может быть проведена с использованием защиты или без. Исходные соединения могут быть получены из коммерческих источников или они могут быть синтезированы способами, известными специалистам в данной области. Альтернативно, может оказаться необходимым, вместо окончательного требуемого заместителя, использовать подходящую группу, которая может присутствовать в данной реакционной схеме и которая может быть затем заменена нужным заместителем. Любой продукт, содержащий хиральный центр, может быть разделен на его энантиомеры стандартными методами.
Варианты проиллюстрированных в данном описании способов включают, если это химически целесообразно, одну или несколько стадий, таких как гидролиз, галогенирование, введение защитной группы и снятие защитной группы. Эти стадии могут быть осуществлены в свете представленных в данном описании способов и способами, известными среднему специалисту в данной области.
Во время одной из методик получения соединений настоящего изобретения может оказаться необходимым и/или желательным защитить “чувствительную” или реакционноспособную группу на любой из рассматриваемых молекул. Кроме того, соединения настоящего изобретения могут быть модифицированы с использованием защитных групп, и такие соединения, его предшественники или пролекарства также входят в объем настоящего изобретения. Это может быть достигнуто с использованием стандартных защитных групп, таких как описано в “Protective Groups in Organic Chemistry”, ed. J.F.W. McOmie, Plenum Press, 1973 и T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd ed., John Wiley & Sons, 1999. Эти защитные группы могут быть удалены на соответствующей последующей стадии методами, известными в данной области.
Схема А

На схеме А, где n равно 1 или 2, коммерчески доступный 4-бензилоксифенол А1, алкилируют аминоалкилгалогенидами А2; при этом, некоторые аминоалкилхлориды являются коммерчески доступными. Данные реакции могут быть осуществлены при широких интервалах температур, включая комнатную температуру и более высокие температуры, в присутствии неорганического основания, которое, как известно, облегчает О-алкилирование, такого как, но не ограничивающегося ими, К2СО3, Cs2CO3 и их смеси (J. Med. Chem., 1997, 40, 1407-1416). Подходящие растворители включают, но, не ограничиваясь ими, ДМФА. Удаление бензильной группы соединения А3 может быть осуществлено в условиях каталитического гидрирования, хорошо известных в данной области (T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, 3кd ed., John Wiley & Sons: New York, 1999). Подходящие катализаторы включают, но, не ограничиваясь ими, Pd на угле (Pd/С) в растворителях, таких как этилацетат, спирты и их смеси. Примерами спиртов являются, но не ограничиваются ими, СН3ОН, этанол, i-PrОН. Такие реакции обычно проводят при комнатной температуре. В некоторых вариантах изобретения, удаление бензильной группы соединения А3 может быть осуществлено путем восстановления металлом в растворе или гидрирования в условиях межфазного переноса при подходящих температурах. Так, например, реакции восстановления металлом в растворе обычно осуществляют при температурах ниже комнатной температуры (-33°С). Реакцию соединения А4 с ароматической бициклической системой А5, которая, если это необходимо, является соответствующим образом защищенной, может быть осуществлена в широком интервале температур, включая комнатную температуру и более высокие температуры, в присутствии подходящего основания, включая, но, не ограничиваясь ими, амин или неорганическое основание, определенные выше. Подходящие аминные основания включают, но, не ограничиваясь ими, триэтиламин (ТЕА), N,N-диизопропилэтиламин, 1,8-диазабицикло[5.4.0]ундек-7-ен (DBU), связанные со смолой аминные основания и их смеси. Если Х представляет собой кислород или серу, то защитные группы не вводят. Подходящие растворители включают, но, не ограничиваясь ими, ДМФА, СН3CN, ацетон и их смеси. Если Х представляет собой NR5, где R5 представляет собой подходящую кремнийсодержащую защитную группу, такую как SEM (триметилсилилэтоксиметил), то удаление указанной кремнийсодержащей защитной группы на NR5 может быть осуществлено в условиях, хорошо известных в данной области (см. Greene et al., указанную выше). Типичные условия реакции включают, но, не ограничиваясь ими, использование фторида тетрабутиламмония (TBAF) в подходящих растворителях, таких как, ТГФ, при повышенных температурах.
Схема В

На схеме В, коммерчески доступный 4-бензилоксифенол А1, алкилируют дигалогеналканами, предпочтительно, дибромалканами, такими как 1,2-дибромэтан и 1,3-дибромпропан, В1, оба из которых являются коммерчески доступными, в широком интервале температур, при этом, предпочтительными являются повышенные температуры (Zhou, Z.-L. et al., J. Med. Chem., 1999, 42, 2993-3000). Такие реакции проводят в присутствии неорганического основания, которое, как известно, облегчает О-алкилирование, такого как, но не ограничивающегося ими, К2СО3, Cs2CO3 и их смеси. Подходящие растворители включают, но, не ограничиваясь ими, СН3СN и ДМФА. Соединения структуры В2 обрабатывают аминами В3 в отсутствии или в присутствии подходящего аминного основания, описанного выше, в широком интервале температур, при этом, предпочтительными являются повышенные температуры. Подходящие растворители включают СН3СN, СН2Cl2 и ДМФА. Последующее преобразование полученных продуктов структуры А3 в соединения структуры А6 проводят, как подробно описано выше для схемы А.
Схема С

На схеме С бензильная группа соединений структуры В2 может быть удалена в условиях каталитического гидрирования, хорошо известного в данной области (Greene et al., см. выше). Подходящие катализаторы включают, но, не ограничиваясь ими, Pd/С в растворителях, таких как ТГФ и смеси ТГФ/этанол. Такие реакции обычно проводят при комнатной температуре. Удаление бензильной группы соединения В2 может быть осуществлено путем гидрирования в условиях межфазного переноса с использованием подходящих растворителей и при подходящих температурах. Соединения общей структуры С1 обрабатывают аминами структуры В3, в отсутствии или в присутствии подходящего аминного основания, описанного выше, в широком интервале температур, при этом, предпочтительными являются повышенные температуры. Подходящие растворители включают СН3СN, СН2Cl2 и ДМФА. Последующее преобразование полученных продуктов структуры А4 в соединения А6 проводят, как подробно описано выше для схемы А.
Схема D
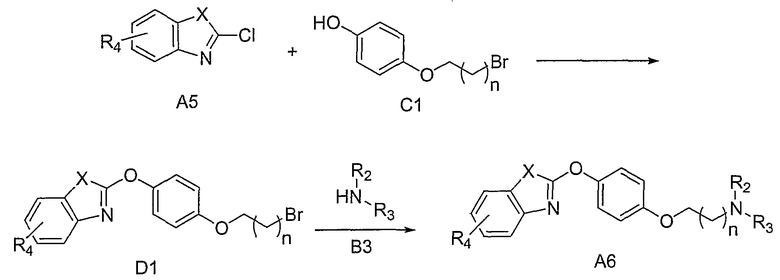
На схеме D соединения структуры А6 могут быть также получены путем обработки соединений структуры С1 ароматическими бициклическими соединениями А5, где Х=S и О, в присутствии подходящего неорганического основания, определенного выше, и в широком интервале температур, при этом, предпочтительными являются повышенные температуры. Подходящие растворители включают, но, не ограничиваясь ими, ДМФА, СН3СN и их смеси. Преобразование соединений структуры D1 в соединения структуры А6 может быть осуществлено путем обработки соединениями структуры В3. Такие реакции могут быть осуществлены в отсутствии или в присутствии подходящего аминного основания, определенного выше, либо неорганического основания, такого как, но не ограничивающегося ими, К2СО3, Cs2CO3 и их смеси, как описано выше, в широком интервале температур, при этом, предпочтительными являются повышенные температуры. Подходящие растворители включают, но, не ограничиваясь ими, СН3СN и ДМФА.
При этом предусматривается, что если Х представляет собой NR5, где R5 представляет собой подходящую кремнийсодержащую защитную группу, то в этом случае, синтез осуществляют в соответствии с методикой, описанной выше. Удаление кремнийсодержащей защитной группы на конце синтетической последовательности может быть затем осуществлено в условиях, описанных в литературе (Greene et al., см. выше).
Схема Е
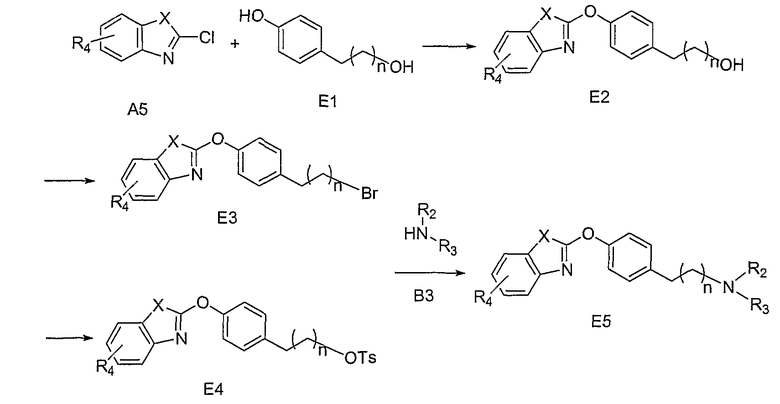
На схеме Е соединения структуры Е1 обрабатывают ароматическими бициклическими соединениями А5, где Х=S (а почему также не О?), в присутствии подходящего неорганического основания, определенного выше, в широком интервале температур, при этом, предпочтительными являются повышенные температуры. Подходящие растворители включают, но, не ограничиваясь ими, ДМФА, СН3СN и их смеси. Соединения структуры Е2 могут быть преобразованы в соединения структуры Е3 в обычных условиях бромирования, включая, но, не ограничиваясь ими, использование РВr3 при повышенных температурах. Подходящий растворитель включает, но, не ограничиваясь им, бензол. Соединения структуры Е2 могут быть также преобразованы в соединения структуры Е4 в стандартных условиях сульфирования, хорошо известных в данной области. Такие условия включают, но, не ограничиваясь ими, использование TsCl для получения тозилатов, как показано на схеме, в присутствии аминного основания и в СН2Cl2, при комнатной температуре. Преобразование соединения структуры Е3 в соединения структуры Е5 может быть также осуществлено путем обработки соединениями структуры В3. Такие реакции могут быть проведены в отсутствии или в присутствии подходящего аминного основания, описанного выше, или неорганического основания, такого как, но не ограничивающегося ими, К2СО3, Cs2CO3 и их смеси, в широком интервале температур, при этом, предпочтительными являются повышенные температуры. Подходящие растворители включают, но, не ограничиваясь ими, СН3СN и ДМФА. Соединения структуры Е4 могут быть преобразованы в соединения структуры Е5 путем обработки соединениями структуры В3. Такие реакции могут быть проведены в отсутствии или в присутствии подходящего аминного основания, описанного выше, в широком интервале температур. Подходящие растворители включают, но, не ограничиваясь ими, СН3СN и ДМФА.
При этом предусматривается, что если Х представляет собой NR5, где R5 представляет собой подходящую кремнийсодержащую защитную группу, то в этом случае, синтез осуществляют в соответствии с методикой, описанной выше. Удаление кремнийсодержащей защитной группы в конечной стадии синтеза может быть затем осуществлено в условиях, описанных в литературе (Greene et al., см. выше).
Схема F

На схеме F коммерчески доступные 4-(2-гидроксиэтил)фенол и 4-(2-гидроксипропил)фенол преобразуют в соответствующие алкилгалогениды F1, где НАL представляет собой хлорид или бромид, в стандартных условиях бромирования или хлорирования. Такие условия включают, но не ограничиваются ими, обработку 48% раствором НBr при повышенной температуре. Затем полученные бромфенолы структуры F1 обрабатывают аминами структуры В3, в отсутствии или в присутствии подходящего аминного основания, описанного выше, в широком интервале температур. Подходящие растворители включают, но, не ограничиваясь ими, СН3СN и ДМФА. Реакция соединения F2 с ароматической бициклической системой А5, которая, если это необходимо, является соответствующим образом защищенной, может быть осуществлена в широком интервале температур, включая комнатную температуру и более высокие температуры, в присутствии подходящего аминного или неорганического основания, определенного выше. Подходящие растворители включают, но, не ограничиваясь ими, ДМФА, СН3СN, ацетон и их смеси. Если Х представляет собой О или S, то защитные группы не вводят. Если Х представляет собой NR5, где R5 представляет собой подходящую кремнийсодержащую защитную группу, такую как SEM (триметилсилилэтоксиметил), то удаление указанной кремнийсодержащей защитной группы на NR5 может быть осуществлено в условиях, хорошо известных в данной области (см. Greene et al., указанную выше). Типичные реакционные условия включают, но, не ограничиваясь ими, использование TBAF в подходящих растворителях, таких как, ТГФ, при повышенных температурах.
Схема G
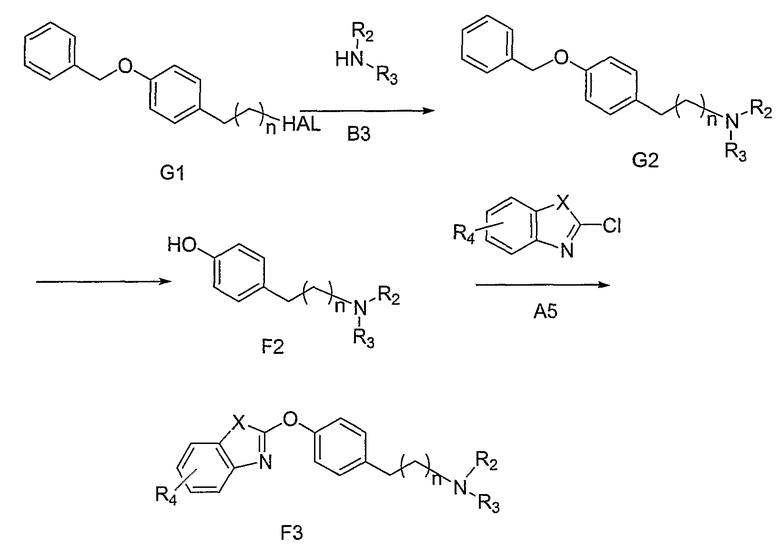
На схеме G соединение G1, где n равно 1 или 2, и НАL представляет собой бромид или хлорид, является коммерчески доступным соединением, либо оно может быть получено из соединения, отмеченного **, и соединение G1, где n равно 1, может быть получено из 4-(2-гидроксиэтил)фенола и бензилбромида в стандартных условиях алкилирования. Бензильная группа в G1 служит в качестве защитной группы. В этой последовательности реакций может быть использована и другая совместимая защитная группа, известная в данной области. Соединения общей структуры G2 могут быть получены путем обработки аминами общей структуры В3, в отсутствии или в присутствии подходящего аминного основания, описанного выше, в широком интервале температур. Подходящие растворители включают, но, не ограничиваясь ими, СН3СN и ДМФА. Удаление бензила может быть осуществлено в условиях каталитического гидрирования, хорошо известного в данной области (Greene et al., см. выше). Подходящие катализаторы включают, но, не ограничиваясь ими, Pd/С в растворителях, таких как этилацетат, спирты и их смеси. Примеры спиртов включают, но, не ограничиваясь ими, СН3ОН, этанол, i-PrОН. Такие реакции обычно проводят при комнатной температуре. В некоторых вариантах изобретения, удаление бензильной группы соединения G2 может быть осуществлено путем гидрирования в условиях межфазного переноса при подходящих температурах. Последующее преобразование полученных продуктов F2 в конечные целевые соединения F3 проводят, как подробно описано выше для схемы F.
Схема Н
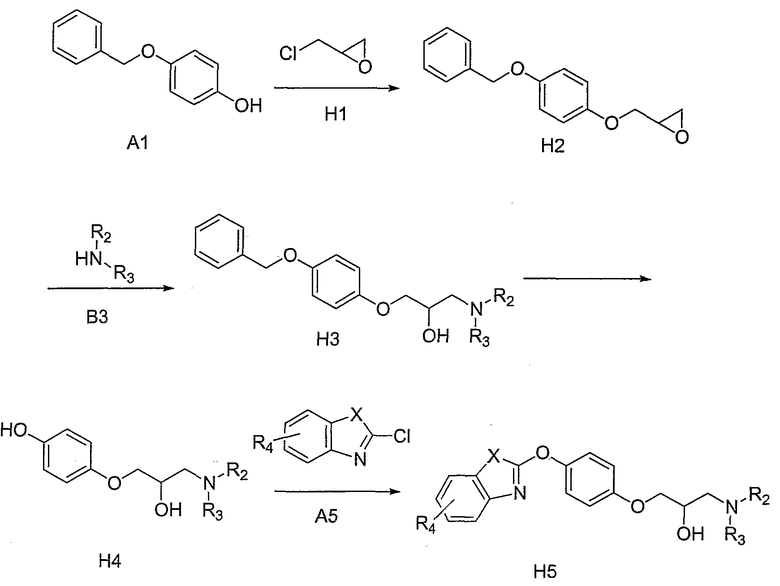
На схеме Н коммерчески доступный 4-бензилоксифенол А1, обрабатывают эпихлоргидрином Н1, оба из которых являются коммерчески доступными. Данная реакция может быть осуществлена в широком интервале температур, при этом, предпочтительной является повышенная температура, и в присутствии неорганического основания, такого как, но не ограничивающегося ими, К2СО3, Cs2CO3 и их смеси. Подходящий растворитель включает, но, не ограничиваясь им, ДМФА. Преобразование соединений структуры Н2 в соединения структуры Н3 может быть осуществлено путем обработки аминами общей структуры В3, в отсутствии или в присутствии подходящего аминного основания, описанного выше, или неорганического основания, такого как, но не ограничивающегося ими, К2СО3, Cs2CO3 и их смеси, в широком интервале температур, при этом, предпочтительной является повышенная температура. Подходящие растворители включают, но, не ограничиваясь ими, СН3СN и ДМФА. Удаление бензильной группы на Н3 может быть проведено в условиях каталитического гидрирования, хорошо известного в данной области (Greene et al., см. выше). Подходящие катализаторы включают, но, не ограничиваясь ими, Pd/С в растворителях, таких как этилацетат, спирты и их смеси. Примеры спиртов включают, но, не ограничиваясь ими, этанол, СН3ОН и i-PrОН. Такие реакции обычно проводят при комнатной температуре. В некоторых вариантах изобретения, удаление бензильной группы на В2 может быть осуществлено путем гидрирования в условиях межфазного переноса с использованием подходящих растворителей и при подходящих температурах. Преобразование соединений структуры Н4 в конечные целевые соединения Н5 может быть осуществлено путем обработки ароматической бициклической системой А5, где Х представляет собой О, в присутствии подходящего неорганического основания, определенного выше, в широком интервале температур, при этом, предпочтительной является пониженная температура. Подходящий растворитель включает, но, не ограничиваясь им, ацетон.
При этом предусматривается, что если Х представляет собой NR5, где R5 представляет собой подходящую кремнийсодержащую защитную группу, то в этом случае, синтез осуществляют в соответствии с методикой, описанной выше. Удаление кремнийсодержащей защитной группы на конечной стадии синтеза может быть затем осуществлено в условиях, описанных в литературе (Greene et al., см. выше).
Схема I
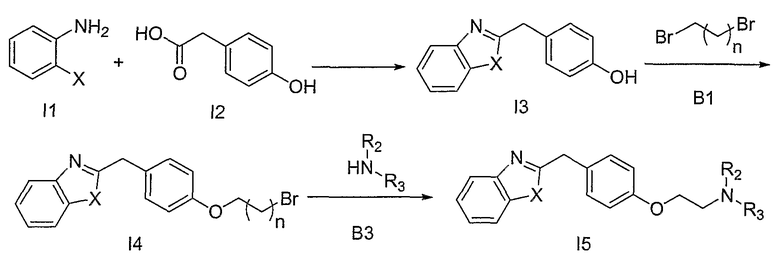
На схеме I соединения типа I5 получают путем нагревания коммерчески доступной 4-гидроксифенилуксусной кислоты с 2-аминотиофенолом, в случае, если Х представляет собой S. В случае, если Х представляет собой О, используют 2-аминофенол. Два исходных соединения нагревают в отсутствии растворителя, и полученные фенолы I3 обрабатывают дигалогеналканами, предпочтительно, дибромалканами, такими как 1,2-дибромэтан и 1,3-дибромпропан, В1, оба из которых являются коммерчески доступными, в широком интервале температур, при этом, предпочтительной является повышенная температура (Zhou, Z.-L. et al., см. выше). Такие реакции проводят в присутствии неорганического основания, которое, как известно, облегчает О-алкилирование, например, такого как, но не ограничивающегося ими, К2СО3, Cs2CO3 и их смеси. Подходящие растворители включают, но, не ограничиваясь ими, СН3СN и ДМФА. Соединения структуры I4 обрабатывают аминами В3, в отсутствии или в присутствии подходящего аминного основания, описанного выше, в широком интервале температур, при этом, предпочтительными являются повышенные температуры. Подходящие растворители включают СН3СN, СН2Cl2 и ДМФА.
Схема J

На схеме J соединения структуры J1 могут быть дополнительно улучшены в пределах заявленных притязаний с получением целевых соединений с большим числом функциональных групп. Так, например, это может быть осуществлено методами гидролиза, хорошо известными в данной области, такими как, но не ограничивающимися ими, методы с использованием водных растворов LiОН, КОН или NаОН, или водных растворов HCl или СН3CO2Н, либо методы с использованием (СН3)3SiОК. Кроме того, специалисту в данной области будет очевидно, что некоторые соединения более предпочтительно получать каким-либо одним из имеющихся способов, и что в начальной стадии могут быть получены соли желаемых соединений. Соединения структуры J2 могут быть затем модифицированы с получением амидов хорошо известными методами, включая, но, не ограничиваясь ими, метод с использованием (СОСL2)2 для преобразования в промежуточный хлорангидрид с последующей обработкой аминами структуры В3. Альтернативно, могут быть проведены стандартные реакции с образованием амидных связей, включая, но, не ограничиваясь ими, реакции с использованием 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЕDCI), без добавления или с добавлением НОВТ, и аминов структуры В3. Соединения структуры J4 могут быть затем модифицированы путем восстановительного аминирования в стандартных условиях, хорошо известных в данной области, включая, но, не ограничиваясь ими, использование амина структуры В3 и NаВН(ОАс)3 в соответствующем растворителе, таком как СН2Cl2 в соответствующем растворителе, таком как СН2Cl2, ClСН2Cl2Cl или СF3СН2ОН.
Схема К

На схеме К коммерчески доступную 3-фтор-4-гидроксибензойную кислоту К11, преобразуют в амиды К2, в стандартных условиях реакции сочетания пептиднов, хорошо известных в данной области, с использованием аминов структуры В3, таких как, но не ограничивающихся ими, гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЕDCI), 1,3-дициклогексилкарбодиимид (DСС), гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (НАТU), гексафторфосфат О-бензотриазол-1-N,N,N',N'-тетраметилурония (НВТU) и их смеси,. Подходящие растворители включают, но, не ограничиваясь ими, СН2Cl2 и ТГФ. Полученные амиды структуры К2 восстанавливают до аминов формулы К3 в условиях восстановления, хорошо известных в данной области, включая, но, не ограничиваясь ими, использование алюмогидрида лития в подходящем растворителе, таком как, но не ограничивающимся им, ТГФ. Преобразование бензиламинов К3 в конечные целевые соединения К4 может быть осуществлено путем обработки ароматической бициклической системой А5, где Х представляет собой S или О, в присутствии подходящего неорганического основания и в широком интервале температур, при этом, предпочтительными являются повышенные температуры. Подходящие неорганические основания включают, но, не ограничиваясь ими, К2СО3, Cs2CO3 и их смеси. Подходящие растворители включают, но, не ограничиваясь ими, ацетон и СН3СN.
При этом предусматривается, что если Х представляет собой NR5, где R5 представляет собой подходящую кремнийсодержащую защитную группу, то в этом случае, синтез осуществляют в соответствии с методикой, описанной выше. Удаление кремнийсодержащей защитной группы на конечной стадии синтеза может быть затем осуществлено в условиях, описанных в литературе (Greene et al., см. выше).
Схема L

На схеме L проиллюстрирован альтернативный вариант получения соединений формулы (I), где n равно 0. Исходное соединение L1, 4-гидроксибензальдегид, преобразуют в простые эфиры формулы L2 путем обработки ароматической бициклической системой А5, где Х представляет собой S или О, в присутствии подходящего неорганического основания в широком интервале температур, при этом, предпочтительной является повышенная температура. Подходящие неорганические основания включают, но, не ограничиваясь ими, К2СО3, Cs2CO3 и их смеси. Подходящие растворители включают, но, не ограничиваясь ими, ацетон и СН3СN. При этом предусматривается, что если Х представляет собой NR5, где R5 представляет собой подходящую кремнийсодержащую защитную группу, то в этом случае, синтез осуществляют в соответствии с методикой, описанной выше. Удаление кремнийсодержащей защитной группы в конечной стадии синтеза может быть затем осуществлено в условиях, описанных в литературе (Greene et al., см. выше). Альдегиды формулы L2 преобразуют в амины формулы L3 в условиях восстановительного аминирования с использованием аминов формулы В3. Подходящие восстановители включают Nа(ОАс)3ВН и NаСNВН3, используемые без добавления или с добавлением активирующих агентов, таких как уксусная кислота или ZnCl2. Подходящие растворители включают ТГФ и метанол, и температура реакции может находиться в пределах от 0°С до 70°С. Предпочтительные реакционные условия включают присутствие Nа(ОАс)3ВН в ТГФ при комнатной температуре.
Выражение “фармацевтически приемлемые соли, их сложные эфиры и амиды соединений настоящего изобретения” означает соли, амиды и сложные эфиры соединений настоящего изобретения, которое понятно химику-фармацевту, то есть, оно означает соединения, которые являются нетоксичными и придают указанным соединениям настоящего изобретения благоприятные фармакокинетические свойства. Выражение “соединения, обладающие благоприятными фармакологическими свойствами” понятно химику-фармацевту и означает соединения, которые являются нетоксичными и обладают такими фармакокинетическими свойствами, как приемлемые вкусовые качества, хорошая абсорбируемость, нужное распределение в тканях и желательные параметры метаболизма и экскреции. Другими факторами, которые являются более важными с практической точки зрения, и которые следует учитывать при выборе данных соединений являются стоимость исходных веществ, легкость их кристаллизации, выход, стабильность, гигроскопичность и текучесть полученной лекарственной массы.
Кроме того, приемлемые соли карбоксилатов включают натриевую, калиевую, кальциевую и магниевую соли. Примеры подходящих катионных солей включают соли бромистоводородной, иодистоводородной, хлористоводородной, перхлорной, серной, малеиновой, фумаровой, яблочной, винной, лимонной, бензойной, миндальной, метансульфоновой, гидротансульфоновой, бензолсульфоновой, щавелевой, пальмитиновой, 2-нафталинсульфоновой, п-толуолсульфоновой, циклогексансульфамовой и сахарной кислоты.
Представленный ниже более полный перечень кислот и оснований, которые могут быть использованы для получения фармацевтически приемлемых солей, включает кислоты, такие как уксусная кислота, 2,2-дихлормолочная кислота, ацетилированные аминокислоты, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, L-аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, (+)-камфорная кислота, камфорсульфоновая кислота, (+)-(1S)-камфор-10-сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, коричная кислота, лимонная кислота, цикламиновая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактуроновая кислота, гентизиновая кислота, глюкогептоновая кислота, D-глюконовая кислота, D-глюкуроновая кислота, L-глутаминовая кислота, α-оксоглутаровая кислота, гликолевая кислота, гиппуровая кислота, бромистоводородная кислота, хлористоводородная кислота, (+)-L-молочная кислота, (±)-DL-молочная кислота, лактобионовая кислота, малеиновая кислота, (-)-L-яблочная кислота, малоновая кислота, (±)-DL-миндальная кислота, метансульфоновая кислота, нафталин-2-сульфоновая кислота, нафталин-1,5-дисульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, азотная кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, фосфорная кислота, L-пироглутаминовая кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, серная кислота, дубильная кислота, (+)-L-винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота и ундециленовая кислота; и основания, такие как, аммиак, L-аргинин, бенетамин, бензатин, гидроксид кальция, холин, деанол, диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин, 1Н-имидазол, L-лизин, гидроксид магния, 4-(2-гидроксиэтил)морфолин, пиперазин, гидроксид калия, 1-(2-гидроксиэтил)пирролидин, вторичные амины, гидроксид натрия, триэтаноламин, трометамин и гидроксид цинка. См., например, S.M. Berge et al. “Pharmaceutical Salts”, J. Pharm. Sci. 1977, 66:1-19, введенная в настоящее описание в виде ссылки.
Подходящие примеры сложных эфиров включают такие эфиры, в которых один или несколько карбоксильных заместителей заменены п-метоксибензилоксикарбонилом,
2,4,6-триметилбензилоксикарбонилом, 9-антрилоксикарбонилом,
СН3SCH2COO-, тетрагидрофур-2-илоксикарбонилом,
тетрагидропиран-2-илоксикарбонилом, фур-2-илоксикарбонилом,
бензоилметоксикарбонилом, п-нитробензилоксикарбонилом,
4-пиридилметоксикарбонилом, 2,2,2-трихлорэтоксикарбонилом,
2,2,2-трибромэтоксикарбонилом, трет-бутилоксикарбонилом,
трет-амилоксикарбонилом, дифенилметоксикарбонилом,
трифенилметоксикарбонилом, адамантилоксикарбонилом,
2-бензилоксифенилоксикарбонилом, 4-метилтиофенилоксикарбонилом
или тетрагидропиран-2-илоксикарбонилом.
Соединения настоящего изобретения могут быть использованы в фармацевтических композициях для лечения пациентов (человека и других млекопитающих), страдающих расстройствами, опосредуемых действием фермента LТА4Н. В частности, соединения настоящего изобретения могут быть использованы в фармацевтических композициях, предназначенных для лечения воспалений. Более конкретно, соединения настоящего изобретения могут быть использованы в фармацевтических композиций, предназначенных для лечения таких воспалительных состояний, как воспалительное заболевание кишечника (ВЗК) (например, болезнь Крона и язвенный колит), хроническая обструктивная болезнь легких (ХОБЛ), артрит, псориаз, астма, кистозный фиброз, атеросклероз, ревматоидный артрит и рассеянный склероз.
Настоящее изобретение относится к фармацевтическим композициям, содержащим указанные соединения, и к способам применения таких композиций для лечения или предупреждения состояний, опосредуемых действием фермента LТА4Н. Соответственно, настоящее изобретение также относится к фармацевтической композиции, содержащей, по крайней мере, одно соединение настоящего изобретения, предпочтительно диспергированное в фармацевтически приемлемом носителе. В соответствии с настоящим изобретением, в такой композиции присутствует, по крайней мере, одно соединение в количестве, достаточном для ингибирования ферментативной активности LТА4Н. Более конкретно, в соответствии с настоящим изобретением, в такой композиции присутствует, по крайней мере, одно соединение в количестве, достаточном для достижения противоспалительного эффекта.
Соответственно, в настоящем изобретении также рассматривается фармацевтическая композиция, включающая, по крайней мере, одно соединение настоящего изобретения в фармацевтически приемлемом носителе, где указанное соединение присутствует в количестве, обеспечивающем противовоспалительное действие. Такая композиция включает единичную дозированную форму, содержащую, по крайней мере, одно соединение настоящего изобретения. В предпочтительном варианте осуществления изобретения указанное, по крайней мере, одно соединение настоящего изобретения, содержащееся в указанной фармацевтической композиции, способно ингибировать ферментативную активность LТА4Н в количестве, в котором это соединение присутствует в данной фармацевтической композиции, если такая фармацевтическая композиция вводится данному пациенту или субъекту в виде единичной дозированной формы.
Используемый термин “единичная дозированная форма” и его грамматически эквивалентные формы означают физически дискретные формы, подходящие для введения человеку и другим животным в качестве унифицированных доз, где каждая такая доза содержит предварительно определенное фармакологически эффективное количество активного ингредиента, рассчитанное так, что оно продуцирует нужный фармакологический эффект. Конкретный состав новых единичных дозированных форм настоящего изобретения определяется свойствами активного ингредиента и непосредственно зависит от этих свойств и от ограничений существующих методов смешивания компонентов, таких как активные ингредиенты, предназначенные для терапевтического лечения человека и других животных.
Фармацевтические композиции могут быть получены с использованием стандартных фармацевтических эксципиентов и стандартных методов приготовления лекарственных средств. Примерами подходящих единичных дозированных форм являются таблетки, капсулы, драже, упакованные в пакеты порошки, гранулы, облатки и т.п., упаковки с множеством отдельных единичных дозированных форм для многократного приема, а также жидкие растворы и суспензии. Пероральными дозированными формами могут быть эликсиры, сиропы, капсулы, таблетки и т.п. Примеры твердых носителей включают вещества, обычно используемые для приготовления драже или таблеток, такие как лактоза, крахмал, глюкоза, метилцеллюлоза, стеарат магния, дикальцийфосфат, маннит и т.п.; и загустители, такие как трагакантовая камедь и метилцеллюлоза USР, тонкодисперсный SiO2, поливинилпирролидон, стеарат магния и т.п. Стандартными жидкими эксципиентами для пероральных препаратов являются этанол, глицерин, вода и т.п. Все эксципиенты, если это необходимо, могут быть смешаны с инертными разбавителями (например, карбонатами натрия и кальция, фосфатами натрия и кальция и лактозой), дезинтегрирующими агентами (например, кукурузным крахмалом и альгиновой кислотой), разбавителями, гранулирующими агентами, лубрикантами (например, стеаратом магния, стеариновой кислотой и тальком), связующими агентами (например, крахмалом и желатином), загустителями (например, парафином, восками и вазелиновым маслом), ароматизаторами, красителями, консервантами и т.п., в соответствии со стандартными методами приготовления лекарственных форм, известными в данной области. Могут присутствовать покрытия, и такие покрытия включают, например, глицерилмоностеарат и/или глицерилдистеарат. Капсулы для перорального введения включают жесткие желатиновые капсулы, в которых активный ингредиент смешан с твердым разбавителем, и мягкие желатиновые капсулы, в которых активный ингредиент смешан с водой и маслом, таким как арахисовое масло, жидкое вазелиновое масло или оливковое масло.
Парентеральные дозированные формы могут быть приготовлены с использованием воды или другого стерильного носителя. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного введения соединения настоящего изобретения обычно приготавливают в виде стерильных водных растворов или суспензий, забуференных до достижения соответствующего рН и изотоничности. Подходящими водными носителями являются раствор Рингера и изотоничный хлорид натрия. Водные суспензии могут включать суспендирующие агенты, такие как производные целлюлозы, альгинат натрия, поливинилпирролидон и трагакантовая камедь, а также смачивающий агент, такой как лецитин. Подходящими консервантами для водных суспензий являются этил- и н-пропил-п-гидроксибензоат.
Физиологически приемлемые носители хорошо известны в данной области. Примерами жидких носителей являются растворы, в которых соединения настоящего изобретения образуют растворы, эмульсии и дисперсии. В твердых и жидких композициях могут присутствовать совместимые антиоксиданты, такие как метилпарабен и пропилпарабен, и такие антиоксиданты могут служить в качестве подсластителей.
Фармацевтические композиции настоящего изобретения могут включать подходящие эмульгаторы, обычно используемые в эмульсионных композициях. Такие эмульгаторы описаны в известных публикациях, таких как H.P. Fiedler, 1989, Lexikon der Hilfsstoffe fur Pharmazie, Kosmetic und agrenzende Gebiete, Cantor ed., Aulendorf, Germany, и в руководствах Handbook of Pharmaceutical Excipients, 1986, American Pharmaceutical Association, Washington, DC; и Pharmaceutical Society of Great Britain, London, UK, которые введены в настоящее описание в виде ссылки. В композиции настоящего изобретения могут быть также добавлены гелеобразующие агенты. Примерами гелеобразующих агентов являются производные полиакриловой кислоты, такие как карбомеры, и более конкретно, карбополы различных типов, которые обычно присутствуют в количестве примерно от 0,2% до 2%. Суспензии могут быть получены в виде крема, мази, включая мазь, не содержащую воды; эмульсию типа “вода в масле”, эмульсию типа “масло в воде”, эмульсионный гель или гель.
Предусматривается, что соединения настоящего изобретения могут быть введены перорально или парентерально, а именно, внутривенно, внутримышечно, внутрибрюшинно, подкожно, ректально и местно, а также путем ингаляции. Для перорального введения, соединения настоящего изобретения обычно приготавливают в форме таблеток, капсул, растворов или суспензий.
Термины “терапевтически эффективное количество” или “эффективное количество” и их грамматически эквивалентные формы означают количество активного соединения или фармацевтического средства, которое вырабатывает биологический или клинический ответ у животного или человека, предусматриваемый исследователем, ветеринаром, лечащим врачом или другим клиницистом, где указанный ответ включает ослабление симптомов заболевания или расстройства, подвергаемого лечению. Термины “пациент” или “субъект” включают млекопитающих, таких как человек и животные (например, собаки, кошки, лошади, крысы, кролики, мыши, и приматы, не являющиеся человеком), нуждающихся в наблюдении, в проведении экспериментов, лечения или предупреждения соответствующего заболевания или состояния. Предпочтительно, пациентом является человек.
Эффективные дозы соединений настоящего изобретения могут быть определены стандартными методами. Конкретный уровень дозы, необходимый для каждого конкретного пациента зависит от ряда факторов, включая тяжесть состояния, способ введения и массу тела пациента.
Обычно предусматривается, что суточная доза соединения (независимо от того, вводится ли оно в виде разовой дозы или дробных доз) находится в пределах примерно от 0,01 мг до 1000 мг в день, предпочтительно, примерно от 1 мг до 500 мг в день, и наиболее предпочтительно, примерно от 10 мг до 200 мг в день. Если доза выражена в единицах на массу тела, то такая доза будет составлять примерно от 0,0001 мг/кг до 15 мг/кг, предпочтительно, примерно от 0,01 мг/кг до 7 мг/кг, и наиболее предпочтительно, примерно от 0,15 мг/кг до 2,5 мг/кг.
Предполагаемая пероральная доза составляет примерно от 0,01 мг/кг до 500 мг/кг, более предпочтительно, примерно от 0,05 мг/кг до 100 мг/кг, и вводится в виде 1-4 разделенных доз. Некоторые соединения настоящего изобретения могут введены перорально в дозах примерно от 0,05 мг/кг до 50 мг/кг в день, хотя другие соединения могут быть введены в дозах от 0,05 мг/кг до примерно 20 мг/кг в день. Дозы для вливания могут находиться в пределах примерно от 1,0 до 1,0×104 мкг/(кг/мин) ингибитора, смешанного с фармацевтически приемлемым носителем, при времени вливания от нескольких минут до нескольких дней. Для местного введения соединения настоящего изобретения могут быть смешаны с фармацевтически приемлемым носителем при концентрации лекарственного средства примерно от 0,1 до примерно 10% по отношению к носителю.
В настоящем описании также рассматривается способ лечения воспаления у пациентов, страдающих или восприимчивых к воспалительным состояниям. Также рассматривается способ лечения LТА4Н-опосредованного состояния. Данные способы предусматривают введение пациенту эффективного количества фармацевтической композиции, включающей единичную дозу активного ингредиента, которым является, по крайней мере, одно из соединений настоящего изобретения, диспергированных в фармацевтически приемлемом носителе.
Для краткости, в настоящем описании, некоторые количественные величины приведены без слова “примерно”. При этом, понятно, что каждая приводимая количественная величина, независимо от того сопровождается ли она словом “примерно” или нет, означает фактическую величину, а также означает приблизительное значение для данной величины, которое может быть определено специалистом в данной области, включая приблизительное значение, полученное в экспериментальных условиях и/или в условиях измерений данной величины. Если выход приводится в процентах, то такой выход означает массу полученного вещества по сравнению с максимальным количеством того же самого вещества, которое может быть получено в конкретных стехиометрических условиях. Концентрации, выраженные в процентах, означают массовые отношения, если не оговорено особо.
ПРИМЕРЫ
Ниже приводятся примеры, иллюстрирующие настоящее изобретение. Данные примеры не должны рассматриваться как ограничение настоящего изобретения. Они иллюстрируют лишь один из возможных методов осуществления изобретения. Специалист в данной области сможет найти и другие методы осуществления настоящего изобретения, которые, на его взгляд, кажутся ему подходящими. Однако, очевидно, что эти методы также входят в объем настоящего изобретения.
Общие экспериментальные методики
ЯМР-спектры были получены на спектрометре модели Bruker DРХ400 (400 МГц) или DРХ500 (500 МГц). Представленные ниже данные 1Н-ЯМР приведены в следующем формате: химический сдвиг в м.д. находится в области нижнего поля по отношению к сигналу тетраметилсилана в качестве эталона (мультиплетность, константа взаимодействия J в Гц, интеграция).
Масс-спектры были получены на оборудовании Agilent, серия 1100 MSD посредством ионизации электрораспылением (ESI), в положительных или отрицательных модах. Термин “вычисленная масса” для молекулярной формулы означает массу моноизотопа соединения.
При ВЭЖХ с обращенной фазой, время удерживания выражено в минутах и определено с использованием методов и условий, приведенных ниже:
Оборудование: Gilson 215
Растворитель: СН3CN (0,05% трифторуксусная кислота, TFA)/H2O (0,05% TFA)
Скорость потока: 25 мл/мин.
Градиент: 0 мин при 10% СН3CN; 20 минут, линейный градиент до 99% СН3CN;
Колонка: YMC-Pack ODS-A AA 12505-1530WT SH-362-5 (S-5 мкм, 12 нМ, 150×30 мм)
Температура: 25°С
Длина волны: двойная детекция при 220 и 254 нМ.
Колоночную флэш-хроматографию проводили с использованием систем ISCO Foxy 200 или ISCO OPTIX 10X на одной из нижеследующих коммерчески доступных предварительно упакованных колонок: Biotage 40S (SiО2, 40 г), Biotage 40M (SiО2, 90 г), Biotage 40L (SiО2, 120 г), Biotage 65M (SiО2, 300 г) или ISCO Redisep (SiО2, 10 г, 12 г, 35 г, 40 г или 120 г).
Пример 1
2-(4-бензилоксифенокси)этилбромид
К перемешиваемому раствору 4-бензилоксифенола (72 г, 359,6 ммоль) в СН3СN (600 мл) добавляли дибромэтан (155 мл, 1,80 моль) и К2СО3 (105 г, 759,9 ммоль). Коричневую суспензию кипятили с обратным холодильником и оставляли перемешиваться в течение 96 часов. Полученную суспензию охлаждали до комнатной температуры, разбавляли ацетоном (250 мл) и фильтровали через кизельгур, затем промывали дополнительным количеством ацетона. Фильтрат концентрировали при пониженном давлении. Полученное масло растворяли в СН3ОН (500 мл) и раствор перемешивали в течение 2 часов. После фильтрования и сушки воздухом получали 70 г указанного в заголовке соединения (228 ммоль, выход 63%) в виде твердого вещества коричневато-желтого цвета. 1H ЯМР (400 МГц, CDCl3): 7,60-7,30 (м, 5H), 6,88 (д, J=8,4, 2H), 6,80 (д, J=8,4, 2H), 4,70 (с, 2H), 3,79 (т, J=5,8, 2H), 3,07 (т, J=5,8, 2H).
Пример 2

1-[3-(4-бензилоксифенокси)пропил]бромид
К перемешиваемому раствору 4-бензилоксифенола (25 г, 124,9 ммоль) в СН3СN (125 мл) добавляли дибромпропан (63 мл, 624 ммоль) и К2СО3 (34,5 г, 250 ммоль). Коричневую суспензию кипятили с обратным холодильником и оставляли перемешиваться в течение 66 часов. Затем суспензию охлаждали до комнатной температуры и два раза фильтровали через слои кизельгура. Слои промывали СН3CN и объединенные фильтраты концентрировали при пониженном давлении. Полученное масло очищали на SiО2 (300 г; 33% СН2Cl2/гексан) с получением 35,4 г (110 ммоль, выход 88%) твердого вещества коричневого цвета. 1H ЯМР (400 МГц, CDCl3): 7,46-7,29 (м, 5H), 6,85 (кв, J=8,1, 2H), 6,82 (кв, J=7,2, 2H), 5,03 (с, 2H), 4,06 (т, J=5,8, 2H), 3,61 (т, J=6,5, 2H), 2,39 (м, J=6,2, 2H).
Пример 3
4-(2-бромэтокси)фенол
2-(4-бензилоксифенокси)этилбромид (пример 1; 70 г, 227 ммоль) растворяли в ТГФ (500 мл). К раствору добавляли Pd на угле (10 мас.%, 7 г) в виде суспензии в этаноле (50 мл). Полученную суспензию помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 и перемешивали в течение ночи. Реакционную смесь фильтровали через слой кизельгура и фильтрат концентрировали при пониженном давлении с получением 48,5 г (224 ммоль, выход 99%) твердого вещества коричневато-желтого цвета. 1H ЯМР (400 МГц, CDCl3): 6,83 (д, J=9,1, 2H), 6,77 (д, J=9,1, 2H), 4,51 (с, 1H), 4,24 (т, J=6,3, 2H), 3,62 (т, J=6,3, 2H).
Пример 4

4-(3-бромпропокси)фенол
[3-(4-бензилоксифенокси)пропил]бромид (10 г, 31,1 ммоль) растворяли в ТГФ (100 мл). К раствору добавляли 10% палладий на угле (1 г) в виде суспензии в ТГФ (20 мл). Полученную суспензию помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 и перемешивали в течение ночи. Реакционную смесь фильтровали через слой кизельгура и фильтрат концентрировали при пониженном давлении с получением 7 г (30,5 ммоль, выход 98%) твердого вещества коричневато-желтого цвета. 1H ЯМР: (400 МГц, CDCl3) 6,76 (д, J=9,1, 2H), 6,69 (д, 9,1, 2H), 4,00 (т, J=5,9, 2H), 3,60 (т, J=6,6, 2H), 2,23 (м, J=6,1, 2H).
Пример 5

4-(2-бромэтил)фенол
4-(2-гидроксиэтил)фенол (50 г, 362 ммоль) растворяли в 48 мас.% HBr (250 мл). Светло-желтый раствор нагревали до 80°С и перемешивали в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и экстрагировали СН2Cl2 (3×50 мл). Объединенные экстракты сушили, фильтровали и концентрировали при пониженном давлении с получением 72 г (выход неочищенного вещества 100%) твердого вещества коричневато-желтого цвета. 1H ЯМР (400 МГц, CDCl3): 9,25 (с, 1H), 7,04 (д, J=8,4, 2H), 6,67 (д, J=8,4, 2H), 3,62 (т, J=7,4, 2H), 2,97 (т, J=7,4, 2H).
Пример 6
4-(3-бромпропил)фенол
Смесь 4-(3-гидроксипропил)фенола (52,7 г, 346,3 ммоль) в 48 мас.% HBr (265 мл) перемешивали при 80°С в течение 20 ч и затем охлаждали до комнатной температуры. Добавляли воду (400 мл) и продукт экстрагировали СН2Cl2 (500 мл). Экстракт сушили (MgSO4) и концентрировали при пониженном давлении с получением требуемого продукта в виде твердого вещества бежевого цвета (69 г, выход 92%). ТСХ (SiO2, CH2Cl2): Rf=0,37. 1H ЯМР (400 МГц, ДМСО-d 6): 9,18 (с, 1H), 6,99 (д, J=8,3, 2H), 6,67 (д, J=8,4, 2H), 3,47 (т, J=6,6, 2H), 2,58 (т, J=7,2, 2H), 2,05-1,95 (м, 2H).
Пример 7

2-хлор-1-(2-триметилсиланилэтоксиметил)-1Н-бензоимидазол
К суспензии гидрида натрия (6,2 г, 245 ммоль) в ДМФА (275 мл) при 5°С добавляли 2-хлорбензимидазол (37 г, 243 ммоль) через капельную воронку для твердых веществ в течение 30 минут, поддерживая внутреннюю температуру смеси ниже 10°С. Добавляли дополнительно 25 мл ДМФА и ледяную баню удаляли. Через 2 ч в течение 5 минут по каплям добавляли 2-(триметилсилил)этоксиметилхлорид (SЕМ-СI). В результате образовывался белый осадок. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. К смеси добавляли H2O (500 мл) и этилацетат (750 мл). Органический слой промывали дополнительным количеством H2O (500 мл), сушили (MgSO4) и концентрировали при пониженном давлении, получая 65,8 г (выход 96%) требуемого продукта в виде прозрачного масла золотистого цвета, которое отверждалось при стоянии с образованием твердого вещества бежевое цвета. ТСХ (SiО2, 5% ацетон/СН2Cl2): Rf=0,64. Масс-спектр (ESI): масса, вычисленная для С13Н19ClN2OSi; 282,10; m/z найдено 283,1. 1H ЯМР (400 МГц, CDCl3): 7,70 (д, J=7,3, 1H), 7,46 (д, J=7,6, 1H), 7,40-7,25 (м, 2H), 3,58 (т, J=7,9, 2H), 0,92 (т, J=8,3, 2H), 0,04 (с, 9H).
Пример 8
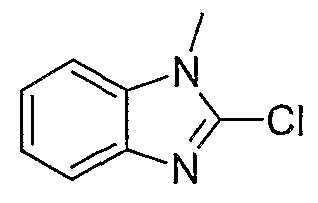
2-хлор-1-метил-1Н-бензоимидазол
Диметилсульфат (11,0 мл, 116 ммоль) добавляли к раствору 2-хлорбензимидазола (10,6 г, 70 ммоль) в 2,5М NаОН (70 мл, 175 ммоль) и смесь перемешивали при 23°С в течение 2 ч. Реакционную смесь фильтровали, твердый продукт промывали H2O (6×50 мл) и сушили в вакууме с получением твердого вещества светло-коричневого цвета (9,4 г, выход 81%). Масс-спектр (ESI): масса, вычисленная для С8Н7ClN2; 166,03; m/z найдено 167,0 [М+Н]+. 1Н-ЯМР (400 МГц, CDCl3): 7,75-7,70 (м, 1Н), 7,35-7,29 (м, 3Н), 3,82 (с, 3Н).
Пример 9

2-[4-(2-бромэтокси)фенокси]бензотиазол
Раствор 4-(2-бромэтокси)фенола (пример 3; 8,7 г, 40,1 ммоль) и 2-хлорбензотиазола (12 мл, 92 ммоль) в СН3СN обрабатывали тонкодисперсным порошком Cs2CO3 (26 г, 80 ммоль) и полученную смесь перемешивали при 23°С в течение 30 ч. Реакционную смесь фильтровали через кизельгур и фильтрат концентрировали при пониженном давлении. Неочищенное твердое вещество очищали на SiО2 (100 г; 0-40% этилацетат/гексан) с получением 6,7 г (выход 47%) в виде твердого вещества белого цвета. Масс-спектр (ESI): масса, вычисленная для С15Н12BrNO2S; 348,98; m/z найдено 350,0 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78, (дд, J=8,0, 0,4, 1H), 7,70 (дд, J=8,0, 0,7, 1H), 7,42 (дт, J=7,5, 1,3, 1H), 7,34 (дд, J=9,1, 2H), 7,01 (дд, J=9,1, 2H), 4,34 (т, J=6,2, 2H), 3,70 (т, J=6,2, 2H).
Пример 10
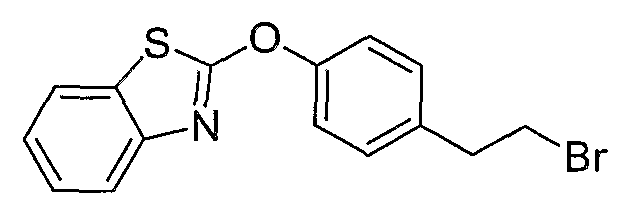
2-[4-(2-бромэтил)фенокси]бензотиазол
А. 2-[4-(бензотиазол-2-илокси)фенил]этанол.
Раствор 4-гидроксифенетилового спирта (867 мг, 6,3 ммоль) и 2-хлорбензотиазола (0,82 мл, 6,3 ммоль) в СН3СN обрабатывали тонкодисперсным порошком Cs2CO3 (4,1 г, 12,5 ммоль) и полученную суспензию перемешивали в течение 40 ч при 70°С. Реакционную смесь фильтровали через кизельгур и фильтрат концентрировали с получением неочищенного масла, которое очищали на SiО2 (40 г; 0-50% этилацетат/гексан), получая 940 мг (выход 55%) прозрачного масла. Масс-спектр (ESI): масса, вычисленная для С15Н13NO2S; 271,07; m/z найдено 272,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78 (дд, J=7,9, 0,4, 1H), 7,75 (дд, J=7,9, 0,7, 1H), 7,46 (дт, J=7,4, 1,3, 1H), 7,38-7,29 (м, 3H), 3,93 (кв, J=6,4, 2H), 2,94, (т, J=6,5, 2H), 1,50 (м, 1H).
В. 2-[4-(2-бромэтил)фенокси]бензотиазол.
Раствор 2-[4-(бензотиазол-2-илокси)фенил]этанола (174 мг, 0,64 ммоль) в бензоле (3 мл) обрабатывали РBr3 (0,060 мл, 0,64 ммоль) и полученную суспензию нагревали до 70°С в течение 90 минут. Реакционную смесь охлаждали и разбавляли этилацетатом (30 мл). Раствор промывали H2O (10 мл), затем насыщенным раствором соли (10 мл), сушили и концентрировали при пониженном давлении. Неочищенный продукт очищали на SiО2 (12 г; 0-50% этилацетат/гексан) и получали 120 мг масла светло-желтого цвета. Масс-спектр (ESI): масса, вычисленная для С15Н12BrNOS; 332,98; m/z найдено 335,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,79 (дд, J=8,0, 0,3, 1H), 7,76 (дд, J=8,0, 0,6, 1H), 7,42 (дт, J=7,4, 1,2, 1H), 7,38-7,29 (м, 3H), 3,62 (т, J=7,5, 2H), 3,25 (т, J=7,5, 2H).
Пример 11
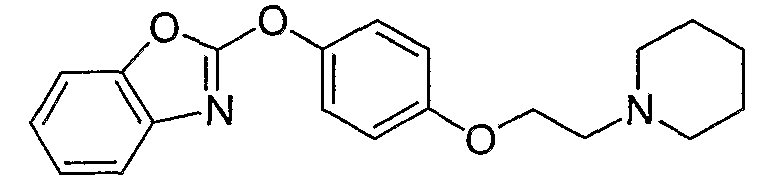
2-[4-(2-пиперидин-1-илэтокси)фенокси]бензооксазол
А. 1-[2-(4-(бензилоксифенокси)этил]пиперидин.
К смеси 4-(бензилокси)фенола (24,6 г, 123 ммоль) и гидрохлорида 1-(2-хлорэтил)пиперидина (20,6 г, 112 ммоль) в ДМФА (175 мл) добавляли К2СО3 (25 г, 181 ммоль) и Cs2CO3 (40 г, 123 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. К смеси добавляли H2O (300 мл) и СН2Cl2. Органический слой промывали 10% NаОН, затем насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением 33 г прозрачной темно-пурпурной жидкости. Жидкость очищали на SiО2 (300 г; 0-50% этилацетат/гексан) и получали 23,4 г (выход 67%) твердого вещества светло-желтого цвета. ТСХ (SiО2, 50% гексан/этилацетат): Rf=0,11. Масс-спектр (ESI): масса, вычисленная для С20Н25NO2; 311,19; m/z найдено 312,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50-7,26 (м, 5H), 6,91 (д, J=9,2, 2H,), 6,85 (д, J=9,2, 2H), 5,02 (с, 2H), 4,06 (т, J=6,1, 2H), 2,76 (т, J=6,1, 2H), 2,51 (шир.с, 4H), 1,65-1,55 (м, 4H), 1,45 (шир.с, 2H).
В. 4-(2-пиперидин-1-илэтокси)фенол.
К раствору 1-[2-(4-(бензилоксифенокси)этил]пиперидина (15,0 г, 48,2 ммоль) в смеси этанол/этилацетат, 1:1 (400 мл) добавляли Pd на угле (10 мас.%, 1,5 г). Смесь помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 на 20 часов. Реакционную смесь фильтровали через слой кизельгура и фильтрат концентрировали при пониженном давлении с получением 9,4 г (выход 88%) требуемого продукта в виде твердого вещества светло-серого цвета. ТСХ (SiО2, 50% ацетон/СН2Cl2): Rf=0,16. Масс-спектр (ESI): масса, вычисленная для С13Н19NO2; 221,14; m/z найдено 222,1 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,88 (с, 1H), 6,73 (д, J=6,6, 2H), 6,65 (д, J=6,6, 2H), 3,93 (т, J=6,0, 2H), 2,58 (т, J=6,0, 2H), 2,40 (с, 4H), 1,51-1,45 (м, 4H), 1,35 (шир.с, 2H).
С. 2-[4-(2-пиперидин-1-илэтокси)фенокси]бензооксазол.
К перемешиваемому раствору 4-(2-пиперидин-1-илэтокси)фенола (1,5 г, 6,8 ммоль) в ацетоне (20 мл) при 5°С добавляли К2СО3 (1,0 г, 7,2 ммоль). К полученной смеси добавляли 2-хлорбензооксазол (0,5 мл, 4,4 ммоль) при 5°С. Полученную смесь нагревали до комнатной температуры в течение ночи. Через 20 часов смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением твердого вещества коричневого цвета, которое очищали на SiО2 (35 г; 50% ацетон/СН2Cl2). Нужные фракции объединяли и концентрировали при пониженном давлении с получением 1,2 г (выход 80%) требуемого продукта в виде твердого вещества белого цвета. ТСХ (SiО2, 50% ацетон/СН2Cl2): Rf=0,18. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О3; 338,16; m/z найдено 339,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,52 (д, J=7,2, 1H), 7,41 (д, J=7,2, 1H), 7,35-7,20 (м, 4H), 6,97 (д, J=9,1, 2H), 4,12 (т, J=6,1, 2H), 2,79 (т, J=6,0, 2H), 2,52 (с, 4H), 1,67-1,55 (м, 4H), 1,50-1,40 (м, 2H).
Пример 12

{2-[4-(6-хлорбензотиазол-2-илокси)фенокси]этил}диэтиламин
А. [2-(4-(бензилоксифенокси)этил]диэтиламин.
К смеси 4-(бензилокси)фенола (51 г, 255 ммоль) и гидрохлорида (2-хлорэтил)диэтиламина (41,6 г, 242 ммоль) в ДМФА (400 мл) добавляли К2СО3 (37 г, 268 ммоль) и Cs2CO3 (87 г, 267 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17 дней. К смеси добавляли H2O (600 мл) и СН2Cl2. Органический слой промывали H2O, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением 33 г прозрачной темно-пурпурной жидкости, которую очищали на SiО2 (300 г; этилацетат), получая масло светло-желтого цвета (34,5 г, выход 48%). ТСХ (SiО2, 50% гексан/этилацетат): Rf=0,10. Масс-спектр (ESI): масса, вычисленная для С19Н25NO2; 299,19; m/z найдено 300,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50-7,28 (м, 5H), 6,89 (д, J=9,2, 2H), 6,85 (д, J=9,2, 2H), 5,02 (с, 2H), 4,00 (т, J=6,4, 2H), 2,86 (т, J=6,4, 2H), 2,63 (кв, J=7,2, 4H), 1,08 (т, J=7,1, 6H).
В. 4-(2-диэтиламиноэтокси)фенол.
К раствору [2-(4-(бензилоксифенокси)этил]диэтиламина (21 г, 70 ммоль) в смеси этанол/этилацетат, 1:1 (500 мл) добавляли Pd на угле (10 мас.%, 1,5 г). Смесь помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 на 20 часов. Реакционную смесь фильтровали через слой кизельгура и фильтрат концентрировали при пониженном давлении с получением 13,1 г (выход 89%) требуемого продукта в виде прозрачного масла коричневого цвета. Масс-спектр (ESI): масса, вычисленная для С12Н19NO2; 209,14; m/z найдено 210,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 6,68 (с, 4H,), 3,99 (т, J=6,2, 2H), 2,88 (т, J=6,2, 2H), 2,69 (кв, J=7,2, 4H), 1,09 (т, J=7,1, 6H).
С. {2-[4-(6-хлорбензотиазол-2-илокси)фенокси]этил]диэтиламин.
К раствору 4-(2-диэтиламиноэтокси)фенола (500 мг, 2,39 ммоль) в ацетоне (7 мл), содержащему Cs2CO3 (876 мг, 2,69 ммоль), добавляли 2,6-дихлорбензотиазол (365 мг, 1,79 ммоль). Полученную смесь кипятили с обратным холодильником в течение 3 дней. Реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении и получали масло коричневого цвета, которое очищали на SiО2 (35 г; ацетон) с получением 624 мг (выход 76%) требуемого продукта. ТСХ (SiО2, ацетон): Rf=0,23. Масс-спектр (ESI): масса, вычисленная для С19Н21ClN2О2S; 376,10; m/z найдено 377,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,64 (д, J=8,5, 2H), 7,34 (д, J=8,8, 1H), 7,25 (д, J=6,8, 2H), 6,96 (д, J=9,1, 2H).
Пример 13

(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол
А. 4-[2-(4-гидроксиметилпиперидин-1-ил)этокси]фенол.
Раствор 4-(2-бромэтокси)фенола (пример 3, 7 г, 32,2 ммоль), пиперидинметанола (5,2 г, 45,3 ммоль) и N,N-диизопропилэтиламина (7,9 мл, 45,3 ммоль) в СН3СN (100 мл) перемешивали при 65°С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и перемешивали дополнительно 48 ч. Растворитель удаляли при пониженном давлении и получали черное полутвердое вещество. Полученное вещество растворяли в СН2Cl2 (200 мл) и раствор промывали H2O (2×50 мл). Водную фазу подвергали обратной экстракции 10% СН3ОН/СН2Cl2 (100 мл). Органические слои объединяли, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением масла черного цвета, которое очищали на SiО2 (120 г; 0-100% ацетон/СН2Cl2), получая требуемый продукт в виде масла коричневого цвета. К маслу, для осаждения продукта, добавляли диэтиловый эфир. После фильтрования получали указанное в заголовке соединение в виде твердого вещества коричневато-желтого цвета (1,9 г, выход 23%). ТСХ (SiО2, 5% 2М NH3 в СН3ОН/СН2Cl2): Rf=0,09. Масс-спектр (ESI): масса, вычисленная для С14Н21NО3; 251,15; m/z найдено 252,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 6,69 (с, 4H), 4,03 (т, J=5,9, 2H), 3,51 (д, J=6,5, 2H), 3,09 (д, J=11,6, 2H), 2,79 (т, J=5,9, 2H), 2,18-2,11 (м, 2H), 1,79 (д, J=16,2, 2H), 1,49-1,62 (м, 1H), 1,36 (д.кв, J=3,6, 12,3, 2H), 1,23 (шир.с, 2H).
В. (1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол.
Смесь 4-[2-(4-гидроксиметилпиперидин-1-ил)этокси]фенола (0,5 г, 1,98 ммоль), 2-хлорбензооксазола (205 мкл, 1,8 ммоль) и Cs2CO3 (1,35 г, 4,15 ммоль) в ацетоне (8,0 мл) перемешивали при комнатной температуре в течение 48 ч. Полученную смесь фильтровали через кизельгур и слой промывали СН2Cl2. Объединенные фильтраты концентрировали при пониженном давлении и получали масло желтого цвета. Масло очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) и получали твердое вещество, которое растворяли в СН2Cl2 (100 мл). Раствор промывали 1н. NаОН (3×5 мл) и затем H2O (5 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества белого цвета (424 мг, выход 64%). ТСХ (SiО2, 5% 2М NH3 в СН3ОН/СН2Cl2): Rf=0,17. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О4; 368,17; m/z найдено 369,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,53-7,50 (м, 1H), 7,44-7,42 (м, 1H), 7,34-7,21 (м, 4H), 7,00-6,96 (м, 2H), 4,13 (т, J=6,0, 2H,), 3,55-3,48 (м, 2H), 3,02-3,09 (м, 2H), 2,82 (т, J=6,0, 2H), 2,13 (дт, J=2,4, 11,8, 2H), 1,78-1,75 (м, 2H), 1,59-1,48 (м, 2H), 1,33 (д.кв, J=3,7, 12,4, 2H).
Пример 14

1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ол
А. 1-[2-(4-гидроксифенокси)этил]пиперидин-4-ол.
К перемешиваемому раствору 4-(2-бромэтокси)фенола (пример 3, 9 г, 42 ммоль) в СН3СN (150 мл) добавляли 4-гидроксипиперидин (5,3 г, 52,5 ммоль) и затем N,N-диизопропилэтиламин (6,7 г, 52,5 ммоль). Полученный раствор перемешивали в течение ночи при комнатной температуре с получением суспензии. Суспензию фильтровали и фильтрат концентрировали при пониженном давлении. К полученному маслу добавляли диэтиловый эфир и смесь нагревали до 45°С в течение 2 минут с образованием белого осадка. Полученную суспензию перемешивали при комнатной температуре в течение 2 часов, затем фильтровали и получали 7,9 г (33 ммоль, выход 79%) не совсем белого твердого вещества. Масс-спектр (ESI): масса, вычисленная для С13Н19NО3; 237,14; m/z найдено 238,2 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,10 и 7,02 (кв, J=32,3, 9,0, 2H), 4,35 (т, J=5,7, 2H), 3,59 (м, 1H), 3,26-3,19 (м, 2H), 3,07 (т, J=5,7, 2H), 2,60 (т, J=9,9, 2H), 2,20-2,12 (м, 2H), 1,94-1,82 (м, 2H).
В. 1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ол.
К перемешиваемому раствору 1-[2-(4-гидроксифенокси)этил]пиперидин-4-ола (500 мг, 2,1 ммоль) в ацетоне (10 мл) добавляли Cs2CO3 (1,4 г, 4,41 ммоль). Полученную суспензию охлаждали до 0°С и по каплям добавляли 2-хлорбензооксазол (388 мг, 2,5 ммоль, 0,29 мл). Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи, затем фильтровали и концентрировали при пониженном давлении. Полученное масло очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) и получали 400 мг (1,1 ммоль, выход 54%) твердого вещества белого цвета. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О4; 354,16; m/z найдено 355,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,55 (дд, J=7,2, 1,8, 1H), 7,46 (дд, J=7,3, 2,0, 1H), 7,36 (д, J=9,1, 2H), 7,32-7,25 (м, 2H), 7,01 (д, J=9,1, 2H), 4,18 (т, J=5,4, 2H), 3,80 (м, 1H), 3,01-2,86 (м, 4H), 2,40 (шир.с, 1H), 1,99 (м, 2H), 1,74-1,65 (м, 2H), 1,48 (д, J=4,1, 1H).
Пример 15

1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ол
К перемешиваемому раствору 1-[2-(4-гидроксифенокси)этил]пиперидин-4-ола (пример 14, стадия А; 500 мг, 1,25 ммоль) в ДМФА (10 мл) добавляли Cs2CO3 (1,4 г, 4,41 ммоль) и 2-хлорбензотиазол (0,33 мл, 2,5 ммоль). Суспензию нагревали до 80°С и перемешивали в течение ночи. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем фильтровали через кизельгур. Фильтрат концентрировали при пониженном давлении и остаток очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2), получая 321 мг (0,86 ммоль, выход 69%) твердого вещества коричневато-желтого цвета. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О3S; 370,14; m/z найдено 371,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,64 (д, J=8,0, 1H), 7,56 (д, J=7,8, 1H), 7,30 (т, J=7,2, 1H), 7,21-7,14 (м, 3H), 6,87 (д, J=9,1, 2H), 4,05 (т, J=5,8, 2H), 3,67 (шир.с, 1H), 2,82 (м, 2H), 2,76 (т, J=5,8, 2H), 2,27 (т, J=9,5, 2H), 2,01 (шир.с, 1H), 1,90-1,82 (м, 2H), 1,64-1,52 (м, 2H).
Пример 16
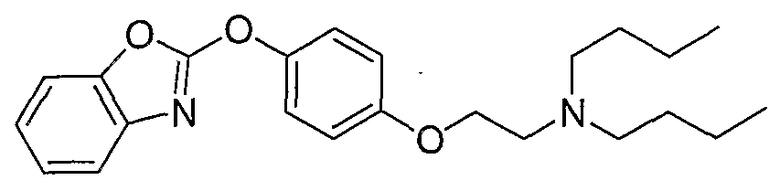
{2-[4-(бензооксазол-2-илокси)фенокси]этил}дибутиламин
А. 4-(2-дибутиламиноэтокси)фенол.
К перемешиваемому раствору 4-(2-бромэтокси)фенола (пример 3, 8,2 г, 37 ммоль) в СН3СN (150 мл) добавляли дибутиламин (5,98 г, 46,3 ммоль) и N,N-диизопропилэтиламин (5,98 г, 46,3 ммоль). Смесь перемешивали в течение ночи при 75°С. Полученную суспензию фильтровали и фильтрат концентрировали при пониженном давлении. Образовавшееся масло очищали на SiО2 (110 г; 0-100% ацетон/СН2Cl2), получая 7,7 г (29 ммоль, выход 78%) твердого вещества коричневого цвета. Масс-спектр (ESI): масса, вычисленная для С16Н27NО2; 265,2; m/z найдено 266,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 6,81 (д, J=7,0, 2H), 6,63 (д, J=6,0, 2H), 4,22 (шир.с, 2H), 3,25 (шир.с, 2H), 2,93 (шир.с, 4H), 2,16 (шир.с, 2H), 1,88 (шир.с, 1H), 1,68 (шир.с, 4H), 1,33 (д, J=5,7, 4H), 0,94 (шир.с, 6H).
В. {2-[4-(бензооксазол-2-илокси)фенокси]этил}дибутиламин.
К перемешиваемому раствору 4-(2-дибутиламиноэтокси)фенола (500 мг, 1,9 ммоль) в ацетоне (9,4 мл) добавляли Cs2CO3 (1,3 г, 3,9 ммоль). Полученную суспензию охлаждали до 0°С и по каплям добавляли 2-хлорбензооксазол (346 мг, 2,2 ммоль, 0,26 мл). Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2), получая 180 мг (0,47 ммоль, выход 25%) твердого вещества белого цвета. Масс-спектр (ESI): масса, вычисленная для С23Н30N2О3; 382,23; m/z найдено 383,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50 (д, J=7,2, 2H), 7,41 (д, J=7,3, 2H), 7,31 (д, J=9,1, 2H), 7,28-7,19 (м, 2H), 6,96 (д, J=9,1, 2H), 4,13 (м, 2H), 2,88 (м, 2H), 2,54 (м, 4H), 1,47 (м, 4H), 1,32 (м, 4H), 0,92 (т, J=7,3, 6H).
Пример 17
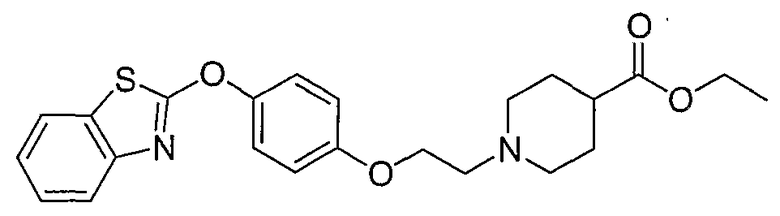
Этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты
А. Этиловый эфир 1-[2-(4-гидроксифенокси)этил]пиперидин-4-карбоновой кислоты.
К перемешиваемому раствору 4-(2-бромэтокси)фенола (пример 3, 5 г, 23,1 ммоль) в СН3СN (200 мл) добавляли этилизонипекотат (5,3 мл, 34,7 ммоль). Реакционную смесь нагревали до 84°С, перемешивали в течение 16 часов, затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (300 г; 0-25% ацетон/СН2Cl2), получая твердое вещество белого цвета (6,3 г, выход 93%). Масс-спектр (ESI): масса, вычисленная для С16Н23NО4; 293,16; m/z найдено 294,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 6,63 (м, 4H), 4,07 (кв, J=7,2, 2H), 3,96 (т, J=5,7, 2H), 2,96 (м, 2H), 2,74 (т, J=5,6, 2H), 2,26-2,23 (м, 3H), 1,88-1,77 (м, 5H), 1,17 (т, J=7,2, 3H).
В. Этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты.
К перемешиваемому раствору этилового эфира 1-[2-(4-гидроксифенокси)этил]пиперидин-4-карбоновой кислоты (2,5 г, 6,8 ммоль) в СН3СN (34 мл) добавляли Cs2CO3 (5 г, 14,3 ммоль) и 2-хлорбензотиазол (1,26 мл, 10,2 ммоль). Реакционную смесь нагревали до 75°С в течение 3 ч, затем охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток растворяли в СН2Cl2 и очищали на SiО2 (40 г; 0-25% ацетон/СН2Cl2), получая твердое вещество белого цвета (2,94 г, выход 100%). Масс-спектр (ESI): масса, вычисленная для С23Н26N2О4S; 426,16; m/z найдено 427,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (д, J=8,0, 1H), 7,64 (т, J=8,1, 1H), 7,41 (т, J=8,4, 1H), 7,30 (д, J=9,0, 3H), 7,05 (д, J=6,8, 2H), 4,19 (т, J=5,5, 2H), 4,12 (кв, J=7,1, 2H), 3,02 (м, 2H), 2,83 (т, J=5,5, 2H), 2,37 (м, 1H), 2,25 (т, J=11,6, 2H), 1,93 (м, 2H), 1,79 (м, 2H), 1,24 (т, J=7,2, 3H).
Пример 18
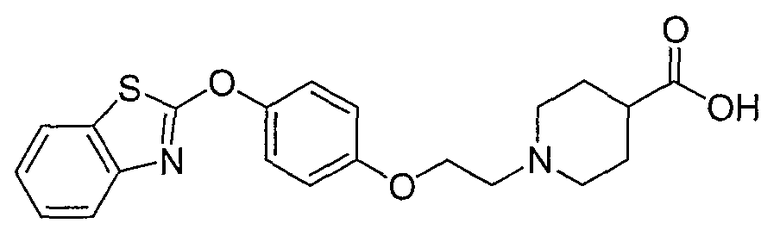
Калиевая соль 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты
К перемешиваемому раствору этилового эфира 1-{2-[4-бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты (пример 17; 235 мг, 0,5 ммоль) в ТГФ (2,5 мл) добавляли триметилсиланоат калия (282 мг, 2,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали при пониженном давлении. Полученное масло растворяли в H2O и раствор обрабатывали 1М HCl до рН 9. Полученный раствор экстрагировали смесью изопропиловый спирт/хлороформ, 1:3 (3×25 мл). Объединенные экстракты концентрировали при пониженном давлении и получали коричневато-желтое твердое вещество, которое растирали с диэтиловым эфиром. После фильтрования суспензии получали твердое вещество коричневато-желтого цвета (140 мг, выход 64%). Масс-спектр (ESI): масса, вычисленная для С21Н22N2О4S (свободная кислота), m/z, вычислено 398,13; m/z найдено 399,1 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d6): 8,01 (д, J=7,3, 1H), 7,76 (д, J=7,5, 1H), 7,51 (т, J=8,4, 1H), 7,45 (д, J=9,0, 2H), 7,40 (т, J=7,2, 1H), 7,14 (д, J=9,0, 2H), 4,18 (т, J=5,5, 2H), 2,95 (м, 2H), 2,74 (т, J=5,8, 2H), 2,10 (т, J=10,5, 2H), 1,81 (м, 2H), 1,59 (м, 2H).
Пример 19
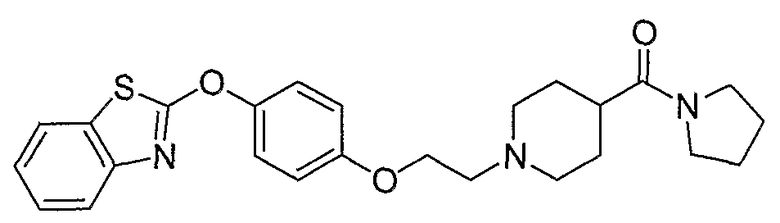
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-1-илметанон
К суспензии 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты (пример 18; 100 мг, 0,25 ммоль) в СНCl3 (2 мл) добавляли оксалилхлорид (132 мкл, 1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и затем концентрировали при пониженном давлении. Полученное твердое вещество ресуспендировали в CHCl3 (2 мл) и добавляли пирролидин (100 мкл, 1,2 ммоль). Образовавшийся раствор перемешивали в течение 1 часа, затем разбавляли СН2Cl2 (10 мл) и промывали насыщенным водным NaНСО3 (10 мл). Органический слой сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением желтого масла. Неочищенное масло очищали на SiО2 (10 г; 0-100% ацетон/СН2Cl2), получая требуемый продукт в виде бесцветного масла (71 мг, выход 63%). Масс-спектр (ESI): масса, вычисленная для С23Н29N3О3S; 451,19; m/z найдено 452,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=7,6, 1H), 7,66 (дд, J=8,0, 0,8, 1H), 7,41-7,37 (м, 1H), 7,29-7,24 (м, 3H), 6,99-6,96 (м, 2H), 4,13 (т, J=6,0, 2H), 3,50-3,45 (м, 4H), 3,10-3,04 (м, 2H), 2,83 (т, J=6,0, 2H), 2,38-2,31 (м, 1H), 2,21-2,14 (м, 2H), 1,98-1,84 (м, 6H), 1,74-1,71 (м, 2H).
Пример 20

Этиловый эфир 3-[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амино]пропионовой кислоты
Гидрат 1-гидроксибензотриазола (НОВТ; 1,0 мл, 0,5М в ДМФА, 0,5 ммоль), этиловый эфир 3-аминопропионовой кислоты (120 мг, 0,785 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI; 150 мл, 0,785 ммоль) последовательно с интервалами в 5 минут добавляли к перемешиваемой суспензии 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты (пример 18; 210 мг, 0,53 ммоль) в СН2Cl2 (3 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли СН2Cl2 (10 мл), промывали насыщенным водным NaНСО3 (10 мл) и затем H2O (10 мл). Органический слой сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением не совсем белого твердого вещества. Неочищенный остаток очищали на SiО2 (35 г; 0-5% 2М NH3 в СН3ОН/СН2Cl2), получая требуемый продукт в виде твердого вещества белого цвета (186 мг, выход 48%). Масс-спектр (ESI): масса, вычисленная для С25Н31N3О5S; 497,20; m/z найдено 498,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (дд, J=8,1, 0,6, 1H), 7,66 (дд, J=8,1, 0,8, 1H), 7,39 (дт, J=7,4, 1,3, 1H), 7,29-7,24 (м, 3H), 7,01-6,94 (м, 2H), 6,18-6,15 (м, 1H), 4,19-4,11 (м, 4H), 3,53 (кв, J=6,0, 2H), 3,06-3,04 (м, 2H), 2,81 (т, J=5,9, 2H), 2,53 (т, J=6,0, 2H), 2,18-2,06 (м, 3H), 1,88-1,72 (м, 4H), 1,28 (т, J=7,2, 3H).
Пример 21
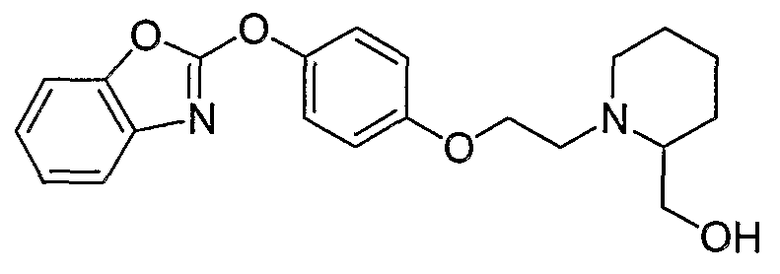
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-2-ил)метанол
А. {1-[2-(4-(бензилоксифенокси)этил]пиперидин-2-ил}метанол.
К перемешиваемому раствору 2-(4-бензилоксифенокси)этилбромида (пример 1; 7,0 г, 22,8 ммоль) и пиперидин-2-илметанола (3,3 г, 28,7 ммоль) в СН3CN (100 мл) добавляли К2СО3 (7,1 г, 51,4 ммоль). Смесь кипятили с обратным холодильником в течение 20 часов и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением прозрачного масла золотистого цвета, которое очищали на SiО2 (120 г; 0-100% ацетон/СН2Cl2), получая 6,0 г (выход 77%) твердого вещества белого цвета. ТСХ (SiО2, ацетон): Rf=0,15. Масс-спектр (ESI): масса, вычисленная для С21Н27NO3; 341,20; m/z найдено 342,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,48-7,25 (м, 5H), 6,92 (д, J=9,1, 2H), 6,85 (д, J=9,1, 2H), 5,02 (с, 2H), 4,38 (т, J=5,3, 2H), 3,96 (т, J=6,2, 2H), 3,55-3,48 (м, 1H), 3,43-3,32 (м, 1H), 3,15-3,00 (м, 1H), 2,88-2,85 (м, 1H), 2,75-2,62 (м, 1H), 2,30-2,22 (м, 2H), 1,61 (д, J=9,4, 2H), 1,52-1,44 (м, 1H), 1,44-1,31 (м, 1H), 1,30-1,17 (м, 2H).
В. 4-[2-(2-гидроксиметилпиперидин-1-ил)этокси]фенол.
К раствору {1-[2-(4-(бензилоксифенокси)этил]пиперидин-2-ил}метанола (6,0 г, 17,6 ммоль) в смеси этанол/этилацетат, 1:1, (75 мл) добавляли Pd на угле (10 мас.%, 614 мг). Смесь помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 на 20 часов. Реакционную смесь фильтровали через кизельгур и фильтрат концентрировали при пониженном давлении с получением 4,5 г (выход 100%) требуемого продукта в виде прозрачного и бесцветного масла. ТСХ (SiО2, ацетон): Rf=0,29. Масс-спектр (ESI): масса, вычисленная для С14Н21NO3; 251,15; m/z найдено 252,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 6,77 (д, J=6,6, 2H), 6,68 (д, J=6,6, 2H), 4,06-4,01 (м, 2H), 3,70-3,55 (м, 2H), 3,22-3,10 (м, 1H), 3,05-2,96 (м, 1H), 2,88-2,79 (м, 1H), 2,47-2,36 (м, 2H), 1,76-1,70 (м, 2H), 1,63-1,32 (м, 4H).
С. (1-{2-[4-(бензооксазол-2-илокси)фенокси]этокси}пиперидин-2-ил)метанол.
Смесь 4-[2-(2-гидроксиметилпиперидин-1-ил)этокси]фенола (197 мг, 0,78 ммоль), 2-хлорбензооксазола (116 мкл, 1,02 ммоль) и Cs2CO3 (700 мг, 2,15 ммоль) в ацетоне (10 мл) перемешивали при комнатной температуре в течение 20 ч. Полученную смесь фильтровали через кизельгур. Слой промывали ацетоном и объединенные фильтраты концентрировали при пониженном давлении, получая золотистое масло. Масло очищали на SiО2 (10 г; 0-100% ацетон/СН2Cl2) с получением требуемого продукта в виде прозрачного и бесцветного масла (202 мг, 70%). ТСХ (SiО2, ацетон): Rf=0,17. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О3S; 384,15; m/z найдено 369,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,61 (д, J=7,0, 2H), 7,50 (д, J=7,0, 2H), 7,41 (д, J=9,1, 4H), 7,35-7,30 (м, 4H), 7,03 (д, J=9,1, 4H,), 4,41 (т, J=5,3, 2H), 4,07 (т, J=6,2, 4H), 3,60-3,52 (м, 2H), 3,44-3,35 (м, 2H), 3,18-3,08 (м, 2H), 2,90-2,85 (м, 2H), 2,78-2,72 (м, 2H), 2,35-2,28 (м, 4H), 1,62 (д, J=9,2, 4H), 1,53-1,47 (м, 2H), 1,47-1,34 (м, 2H), 1,32-1,18 (м, 4H).
Пример 22

Амид 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты
Суспензию 2-[4-(2-бромэтокси)фенокси]бензотиазола (пример 9; 200 мг, 0,57 ммоль), изонипекотамида (73 мг, 0,57 ммоль) и диметиламиновой смолы Silicycle® (800 мг, 1,14 ммоль) в СН3CN нагревали до 70°С в течение 18 ч. Реакционную смесь фильтровали и собранную смолу промывали СН3CN. Объединенные фильтраты концентрировали при пониженном давлении и получали неочищенное твердое вещество, которое очищали на SiО2 (10 г; 0-100% 10% [2М NH3 в СН3ОН] в СН2Cl2/СН2Cl2) с получением 142 мг (выход 63%) твердого вещества белого цвета. Масс-спектр (ESI): масса, вычисленная для С21Н23N3О3S; 397,15; m/z найдено 398,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,85 (дд, J=8,0, 0,3, 1H), 7,75 (дд, J=8,0, 0,6, 1H), 7,42 (дд, J=7,4, 1,1, 1H), 7,32-7,22 (м, 3H), 7,02-6,91 (м, 2H), 5,67 (шир.д, J=47, 2H), 4,15 (т, J=5,8, 2H), 3,09 (шир.д, J=8,8, 2H), 2,85 (т, J=5,7, 2H), 2,28-2,12 (м, 3H), 2,00-1,88 (м, 2H), 1,87-1,72 (м, 2H).
Пример 23

1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-он
Суспензию 2-[4-(2-бромэтокси)фенокси]бензотиазола (пример 9; 200 мг, 0,57 ммоль), гидрохлорида 1-пиперидин-4-илпирролидин-2-она (117 мг, 0,57 ммоль) и диметиламиновой смолы Silicycle® (800 мг, 1,14 ммоль) в СН3CN нагревали до 70°С в течение 18 ч. Реакционную смесь фильтровали и собранную смолу промывали СН3CN. Объединенные фильтраты концентрировали при пониженном давлении и получали неочищенное твердое вещество, которое очищали на SiО2 (10 г; 0-100% 10% [2М NH3 в СН3ОН] в СН2Cl2/СН2Cl2) с получением клейкого не совсем белого твердого вещества (142 мг, выход 63%). Масс-спектр (ESI): масса, вычисленная для С24Н27N3О3S; 337,18; m/z найдено 348,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,85 (дд, J=8,0, 0,5, 1H), 7,75 (дд, J=8,0, 0,8, 1H), 7,41 (дт, J=7,3, 1,5, 1H), 7,34-7,22 (м, 3H), 7,02-6,92 (м, 2H), 4,15 (шир.д, J=48,8, 2H), 3,80-3,65 (м, 1H), 3,40 (т, J=7,0, 1H), 3,30-3,10 (шир.с, 1H), 3,15, (кв, J=7,2, 1H), 2,96 {шир.с, 1H), 2,42, (т, J=7,9, 2H), 2,10-1,99 (м, 1H), 1,81-1,70 (м, 1H) 1,68-1,52 (м, 4H), 1,50 (д, J=6,5, 3H).
Пример 24
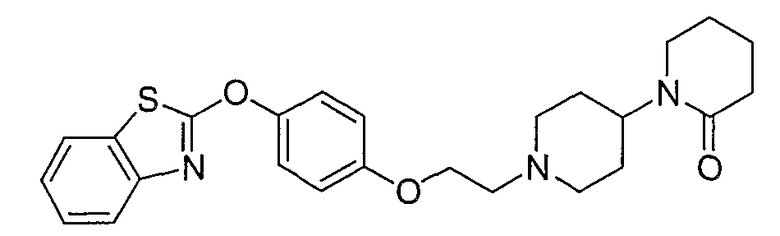
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-2-он
К перемешиваемому раствору 2-[4-(2-бромэтокси)фенокси]бензотиазола (пример 9; 542 мг, 1,55 ммоль) и гидрохлорида [1,4']бипиперидин-2-она (371 мг, 1,69 ммоль) в СН3CN (20 мл) добавляли К2СО3 (517 мг, 3,74 ммоль). Смесь кипятили с обратным холодильником в течение 20 часов и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением прозрачного масла золотистого цвета, которое очищали на SiО2 (10 г; 0-100% ацетон/СН2Cl2), получая 294 мг (выход 42%) в виде твердого вещества белого цвета. ТСХ (SiО2, ацетон): Rf=0,15. Масс-спектр (ESI): масса, вычисленная для С25Н29N3O3S; 451,19; m/z найдено 452,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=1,1, 2H), 7,90 (д, J=1,1, 2H), 7,42 (т, J=7,3, 2H), 7,37 (д, J=9,0, 2H), 7,31 (т, J=7,3 2H), 7,06 (д, J=9,0, 2H), 4,32-4,21 (м, 1H), 4,10 (т, J=5,7, 2H), 3,15 (т, J=5,3, 2H), 3,00 (д, J=11,5, 2H), 2,71 (т, J=5,7, 2H), 2,21 (т, J=6,5, 2H), 2,10 (т, J=11,4, 2H), 1,75-1,58 (м, 6H), 1,43 (д, J=10,0, 2H).
Пример 25
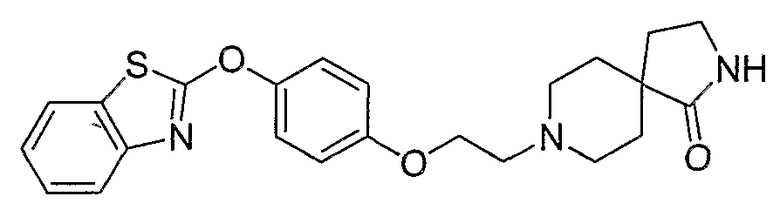
8-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-2,8-диаза-спиро[4.5]декан-1-он
Суспензию 2-[4-(2-бромэтокси)фенокси]бензотиазола (пример 9; 257 мг, 0,73 ммоль), гидрохлорида 2,8-диаза-спиро[4.5]декан-1-она (153 мг, 0,80 ммоль) и диметиламиновой смолы Silicycle® (1,7 г, 2,4 ммоль) в СН3CN нагревали до 80°С в течение 18 ч. Реакционную смесь фильтровали и собранную смолу промывали СН3CN. Объединенные фильтраты концентрировали при пониженном давлении и получали неочищенное твердое вещество, которое очищали на SiО2 (10 г; 0-100% 10% [2М NH3 в СН3ОН] в СН2Cl2/СН2Cl2) с получением не совсем белого твердого вещества (152 мг, выход 49%). Масс-спектр (ESI): масса, вычисленная для С23Н25N3О3S; 423,16; m/z найдено 424,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78 (дд, J=8,1, 0,6, 1H), 7,69 (дд, J=8,0, 0,8, 1H), 7,41 (дт, J=7,5, 1,3, 1H), 7,32-7,27 (м, 3H), 7,00 (м, 2H), 6,36 (шир.с, 1H), 4,15 (т, J=5,9, 2H), 3,36 (т, J=7,0, 2H), 3,00, (дт, J=11,9, 3,9, 2H), 2,87 (т, J=5,8, 2H), 2,32 (дт, J=11,5, 2,4, 2H), 2,10-1,98 (м, 2H), 2,07 (т, J=7,0, 2H), 1,50 (шир.д, J=13,3, 2H).
Пример 26

2-[4-(3-пирролидин-1-илпропокси)фенокси]бензотиазол
А. 1-[3-(4-(бензилоксифенокси)пропил]пирролидин.
К смеси 1-[3-(4-бензилоксифенокси)пропил]бромида (пример 2; 1,50 г, 4,7 ммоль) добавляли пирролидин (2,0 мл, 24,0 ммоль) в СН3CN. Смесь перемешивали в течение 20 ч и затем концентрировали при пониженном давлении с получением желтого масла, которое очищали на SiО2 (35 г; ацетон), получая 1,2 г (выход 80%) требуемого продукта в виде твердого вещества белого цвета. ТСХ (SiО2, ацетон): Rf=0,05. Масс-спектр (ESI): масса, вычисленная для С20Н25NO2; 311,19; m/z найдено 312,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50-7,30 (м, 5H), 6,90 (д, J=9,1, 2H), 6,82 (д, J=9,1, 2H), 5,02 (с, 2H), 4,00 (т, J=6,1, 2H), 3,0-2,75 (м, 6H), 2,15 (д, J=6,2, 2H), 1,94 (шир.с, 4H).
В. 4-(3-пирролидин-1-илпропокси)фенол.
К раствору 1-[3-(4-(бензилоксифенокси)пропил]пирролидина (1,2 г, 3,9 ммоль) в смеси этанол/этилацетат, 1:1, (65 мл) добавляли Pd на угле (10 мас.%, 206 мг). Смесь помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 на 20 часов. Реакционную смесь фильтровали через кизельгур и фильтрат концентрировали при пониженном давлении с получением 875 мг (выход 100%) требуемого продукта в виде коричневого твердого вещества. Масс-спектр (ESI): масса, вычисленная для С13Н19NO2; 221,14; m/z найдено 222,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,90 (с, 1H), 6,74 (д, J=9,0, 2H), 6,65 (д, J=9,0, 2H), 3,90 (т, J=6,3, 2H), 2,72 (шир.с, 6H), 1,90 (квинтет, J=7,4, 2H), 1,76 (с, 4H).
С. 2-[4-(3-пирролидин-1-илпропокси)фенокси]бензотиазол.
К перемешиваемому раствору 4-(3-пирролидин-1-илпропокси)фенола (100 мг, 0,45 ммоль) в ацетоне (10 мл), содержащему Cs2CO3 (213 мг, 0,65 ммоль), добавляли 2-хлорбензтиазола (65 мкл, 0,50 ммоль). Смесь кипятили с обратным холодильником в течение 24 ч и затем фильтровали. Фильтрат концентрировали при пониженном давлении и получали прозрачное масло золотистого цвета, которое очищали на SiО2 (10 г; 0-100% ацетон) с получением 97 мг (выход 61%) требуемого продукта. ТСХ (SiО2, ацетон): Rf=0,02. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О2S; 354,14; m/z найдено 355,1 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,73 (д, 1H), 6,95 (д, 1H), 7,39 (м, 1H), 7,26 (м, 3H), 6,96 (д, J=9,1, 2H), 4,06 (т, J=6,4, 2H), 2,65 (т, J=7,3, 2H), 2,55 (шир.с, 4H), 2,04 (квинтет, J=6,5, 2H), 1,82 (шир.с, 4H).
Пример 27
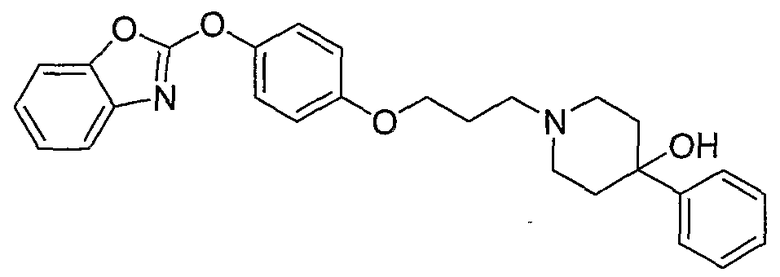
1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол
А. Гидробромид 1-[3-(4-(гидроксифенокси)пропил]-4-фенилпиперидин-4-ола.
4-(3-бромпропокси)фенол (пример 4; 3 г, 13 ммоль) растворяли в СН3CN (65 мл). К раствору добавляли 4-гидрокси-4-фенилпиперидин (6,8 г, 39 ммоль) и смесь перемешивали при комнатной температуре в течение ночи, получая белый осадок. Суспензию фильтровали и получали указанное в заголовке соединение в виде твердого вещества белого цвета (5 г, 11,9 ммоль, выход 91%). Масс-спектр (ESI): масса, вычисленная для С20Н25NO3 (свободное основание), m/z, вычислено 327,18; m/z найдено 328,2 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,49 (д, J=7,5, 2H), 7,32 (т, J=7,5, 2H), 7,21 (т, J=7,2, 1H), 6,73 (кв, J=12,3, 4H), 3,96 (т, J=6,1, 2H), 2,85 (д, J=11,3, 2H), 2,64-2,54 (м, 4H), 2,13 (дт, J=9,0, 3,9, 2H), 2,00 (м, 2H), 1,75 (д, J=12,2, 2H).
В. 1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол.
К перемешиваемому раствору гидробромида 1-[3-(4-гидроксифенокси)пропил]-4-фенилпиперидин-4-ола (500 мг, 1,5 ммоль) в ацетоне (7 мл) добавляли Cs2CO3 (1,03 г, 3,15 ммоль). Полученную суспензию охлаждали до 0°С и по каплям добавляли 2-хлорбензооксазол (276 мг, 1,8 ммоль, 0,2 мл). Реакционную смесь нагревали до комнатной температуры в течение ночи, затем фильтровали и концентрировали при пониженном давлении. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) с получением 450 мг (1,05 ммоль, выход 70%) твердого вещества белого цвета. Масс-спектр (ESI): масса, вычисленная для С25Н26N2O4; 444,20; m/z найдено 445,20 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,47-7,43 (м, 3H), 7,36-7,11 (м, 8H), 6,90 (д, J=9,1, 2H), 3,99 (т, J=5,8, 2H), 2,80 (д, J=9,5, 2H), 2,56 (т, J=6,8 Гц, 2H), 2,44 (т, J=10,9, 2H), 2,13 (т, J=11,0, 2H), 1,98 (м, J=6,8, 2H), 1,71 (д, J=6,9, 2H).
Пример 28
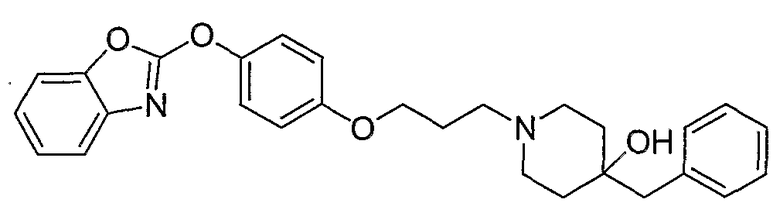
1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-бензилпиперидин-4-ол
А. 4-бензил-1-[3-(4-(гидроксифенокси)пропил]пиперидин-4-ол.
4-бензил-4-гидроксипиперидин (750 мг, 3,9 ммоль) добавляли к раствору 4-(3-бромпропокси)фенола (пример 4; 300 мг, 1,31 ммоль) в СН3CN (6 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи и получали белый осадок. Суспензию фильтровали и фильтрат концентрировали при пониженном давлении. Полученное масло очищали на SiО2 (10 г; 0-100% ацетон/СН2Cl2) с получением 110 мг (0,32 ммоль, выход 25%) твердого вещества белого цвета. Масс-спектр (ESI): масса, вычисленная для С21Н22NO3; 341,20; m/z найдено 342,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,36-7,24 (м, 3H), 7,22 (д, J=6,9, 2H), 6,7 (м, 4H), 4,07 (т, J=6,5, 2H), 3,41 (д, J=11,7, 2H), 3,19 (т, J=7,8, 2H), 3,11 (т, J=11,8, 4H), 2,84 (шир.с, 2H), 2,34 (шир.с, 4H), 2,18 (шир.с, 1H), 1,72 (д, 14,5, 2H).
В. 1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-бензилпиперидин-4-ол.
К перемешиваемому раствору 4-бензил-1-[3-(4-(бензилоксифенокси)пропил]пиперидин-4-ола (2,5 г, 7,3 ммоль) в ацетоне (37 мл) добавляли Cs2CO3 (4,99 г, 15,3 ммоль). Полученную суспензию охлаждали до 0°С и по каплям добавляли 2-хлорбензооксазол (1,1 мл, 9,5 ммоль). Реакционную смесь нагревали до комнатной температуры в течение ночи, затем фильтровали и концентрировали при пониженном давлении. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (110 г; 0-100% ацетон/СН2Cl2) с получением 310 мг (0,67 ммоль, выход 9%) твердого вещества белого цвета. Масс-спектр (ESI): масса, вычисленная для С28Н30N2O4; 458,2; m/z найдено 459,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,49 (д, J=7,2, 1H), 7,41 (д, J=7,2, 1H), 7,35-7,18 (м, 9H), 6,94 (д, J=9,1, 2H), 4,04 (т, J=6,5, 2H), 2,93-2,45 (м, 7H), 2,16 (с, 4H), 1,60 (д, J=13,0, 2H), 1,29 (шир.с, 1H).
Пример 29
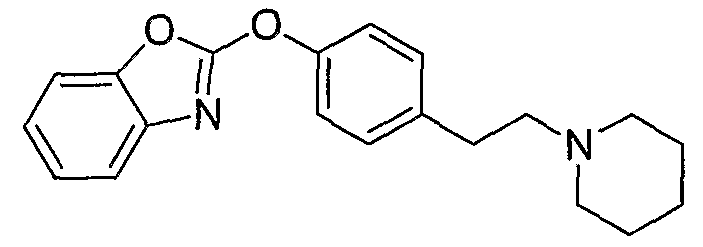
2-[4-(2-пиперидин-1-илэтил)фенокси]бензооксазол
А. 4-(2-пиперидин-1-илэтил)фенол.
Раствор 4-(2-бромэтил)фенола (пример 5, 4,5 г, 22,4 ммоль), пиперидина (3,3 мл, 33,5 ммоль) и N,N-диизопропилэтиламина (5,8 мл, 33,5 ммоль) в СН3СN (100 мл) перемешивали при 60°С в течение 18 ч. Полученный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением светло-оранжевого твердого вещества. Добавляли диэтиловый эфир (100 мл) и указанное в заголовке соединение собирали фильтрованием в виде не совсем белого твердого вещества (4,6 г, выход неочищенного вещества 100%). ТСХ (SiО2, 5% 2М NH3 в СН3ОН/СН2Cl2): Rf=0,19. Масс-спектр (ESI): масса, вычисленная для С13Н19NО2; 205,15; m/z найдено 206,1 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,07-7,04 (м, 2H), 6,74-6,71 (м, 2H), 3,32-3,30 (м, 2H), 3,14-3,11 (м, 3H), 2,87-2,80 (м, 1H), 1,82-1,67 (м, 6H), 1,65-1,55 (м, 2H).
В. 2-[4-(2-пиперидин-1-илэтил)фенокси]бензооксазол.
Смесь 4-(2-пиперидин-1-илэтил)фенола (0,5 г, 2,43 ммоль), 2-хлорбензооксазола (304 мкл, 2,67 ммоль) и Cs2CO3 (1,8 г, 5,62 ммоль) в ацетоне (10 мл) перемешивали при комнатной температуре в течение 48 ч. Реакционную смесь фильтровали через кизельгур и слой промывали СН2Cl2. Объединенные фильтраты концентрировали при пониженном давлении и получали оранжевое масло, которое очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) с получением требуемого продукта в виде твердого вещества белого цвета (325 мг, выход 42%). ТСХ (SiО2, 5% 2М NH3 в СН3ОН/СН2Cl2): Rf=0,36. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О2; 322,17; m/z найдено 323,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,53-7,51 (м, 1H), 7,44-7,42 (м, 1H), 7,34-7,20 (м, 6H), 2,87-2,83 (м, 2H), 2,60-2,56 (м, 2H), 2,48 (шир.с, 2H), 1,66-1,59 (м, 6H), 1,50-1,43 (м, 2H).
Пример 30

{2-[4-(бензотиазол-2-илокси)фенил]этил}циклогексилэтиламин
А. 4-[2-(циклогексилэтиламино)этил]фенол.
К перемешиваемому раствору 4-(2-бромэтил)фенола (пример 5, 4,48 г, 22,3 ммоль) в СН3СN (100 мл) добавляли циклогексилэтиламин (5,0 мл, 33,4 ммоль) и затем N,N-диизопропилэтиламин (7,76 мл, 44,6 ммоль). Полученный раствор перемешивали при 60°С в течение 16 ч и получали суспензию. Полученную суспензию оставляли охлаждаться до комнатной температуры и фильтровали. Отфильтрованное твердое вещество промывали этилацетатом (2×20 мл) и сушили с получением твердого вещества белого цвета (4,8 г, выход 87%). Масс-спектр (ESI): масса, вычисленная для С16Н25NО; 247,19; m/z найдено 248,2 [М+Н]+. 1H ЯМР: (400 МГц, CDCl3): 7,01 (д, J=8,6, 2H), 6,87 (д, J=8,6, 2H), 3,32-3,17 (м, 2H), 3,15-2,98 (м, 4H), 2,30-2,21 (м, 2H), 1,77-1,59 (м, 2H), 1,57-1,46 (м, 5H), 1,40-1,10 (м, 3H).
В. {2-[4-(бензотиазол-2-илокси)фенил]этил}циклогексилэтиламин.
К перемешиваемому раствору 1-[2-(4-(гидроксифенокси)этил]пиперидин-4-ола (495 мг, 2,0 ммоль) в ДМФА (10 мл) добавляли Cs2CO3 (1,3 г, 4,0 ммоль) и 2-хлорбензотиазол (0,33 мл, 2,5 ммоль). Суспензию перемешивали при 80°С в течение ночи. Реакционную смесь оставляли охлаждаться до комнатной температуры и фильтровали через кизельгур. Фильтрат концентрировали при пониженном давлении и остаток очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) с получением 548 мг (выход 72%) твердого вещества коричневато-желтого цвета. Масс-спектр (ESI): масса, вычисленная для С23Н28N2ОS; 380,19; m/z найдено 381,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,0, 1H), 7,63 (д, J=8,0, 1H), 7,30 (т, J=8,0, 1H), 7,29-7,20 (м, 5H), 2,78-2,68 (м, 4H), 2,62 (дд, J=6,8, 7,4, 2H), 2,56-2,46 (м 1H), 1,83-1,74 (м, 4H), 1,66-1,57 (м, 1H), 1,21 (дд, J=9,0, 8,6, 4H), 1,15-1,11 (м, 1H), 1,06 (т, J=7,2, 3H).
Пример 31
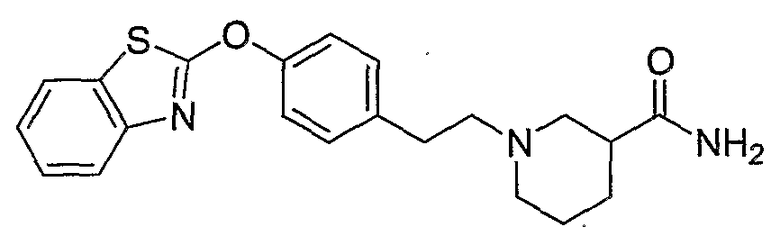
Амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновой кислоты
Суспензию 2-[4-(2-бромэтил)фенокси]бензотиазола (пример 10; 250 мг, 0,75 ммоль), нипекотамида (96 мг, 0,75 ммоль) и диметиламиновой смолы Silicycle® (1,1 г, 1,50 ммоль) в СН3CN нагревали до 70°С в течение 18 ч. Реакционную смесь фильтровали и собранную смолу промывали СН3CN. Объединенные фильтраты концентрировали при пониженном давлении и получали неочищенное твердое вещество, которое очищали на SiО2 (10 г; 0-100% 10% [2М NH3 в СН3ОН] в СН2Cl2/СН2Cl2) с получением 135 мг (выход 47%) твердого вещества белого цвета. Масс-спектр (ESI): масса, вычисленная для С21Н23N3О2S; 381,15; m/z найдено 382,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,10 (д, J=8,1, 1H), 7,75 (дд, J=8,0, 0,8, 1H), 7,42 (дт, J=7,4, 1,3, 1H), 7,21 (шир.с, 1H) 6,42 (шир.с, 1H), 3,05 (шир.д, J=10,3, 1H), 2,95-2,80 (м, 3H), 2,80-2,62 (м, 2H), 2,47-2,40 (м, 1H), 2,36 (д, J=11,5, 1H), 2,08 (т, J=10,5, 1H), 1,98 (д, J=11,0, 1H), 1,76-1,63 (м, 1H), 1,63-1,50 (м, 2H).
Пример 32

1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-метил-1,3-дигидробензоимидазол-2-он
А. 2-[4-(бензотиазол-2-илокси)фенил]этиловый эфир толуол-4-сульфоновой кислоты.
К перемешиваемому раствору 2-[4-(2-бензотиазол-2-илокси)фенил]этанола (пример 10; 12,25 г, 45,2 ммоль) в СН2Cl2 (225 мл) добавляли п-толуолсульфонилхлорид (17,23 г, 90 ммоль) и ТЕА (31 мл, 225 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 72 ч. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в этилацетате (400 мл). Раствор промывали насыщенным водным NaНСО3 (3×200 мл), сушили (Na2SO4) и концентрировали при пониженном давлении. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (300 г; СН2Cl2) с получением твердого вещества коричневато-желтого цвета (8,8 г, выход 45%). Масс-спектр (ESI): масса, вычисленная для С22Н19N3О4S2; 425,08; m/z найдено 426,0 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,70 (кв, J=9,7, 4H), 7,39 (т, J=7,8, 1H), 7,32-7,17 (м, 8H), 4,23 (т, J=6,9, 2H), 2,99 (д, J=6,9, 2H), 2,43 (с, 3H).
В. 1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-метил-1,3-дигидробензоимидазол-2-он.
К перемешиваемому раствору 2-[4-(бензотиазол-2-илокси)фенил]этилового эфира толуол-4-сульфоновой кислоты (400 мг, 0,94 ммоль) в СН3CN (5 мл) добавляли 1-метил-3-пиперидин-4-ил-1,3-дигидробензимидазол-2-он (653 мг, 2,82 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали при пониженном давлении и очищали на SiО2 (12 г; 50% ацетон/СН2Cl2) с получением прозрачного масла (16 мг, выход 3,3%). Масс-спектр (ESI): масса, вычисленная для С28Н28N4О2S; 484,19; m/z найдено 485,5 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,75 (д, J=7,9, 1H), 7,65 (д, J=8,1, 1H), 7,41-7,29 (м, 7H), 7,13 (м, 3H), 4,37 (м, 1H), 3,40 (с, 3H), 3,25 (д, J=11,8, 2H), 2,94 (м, 2H), 2,75 (м, 2H), 2,57 (кв.д, J=12,6, 3,7, 2H), 2,33 (т, J=11,3, 2H), 1,81 (д, J=12,2, 2H).
Пример 33
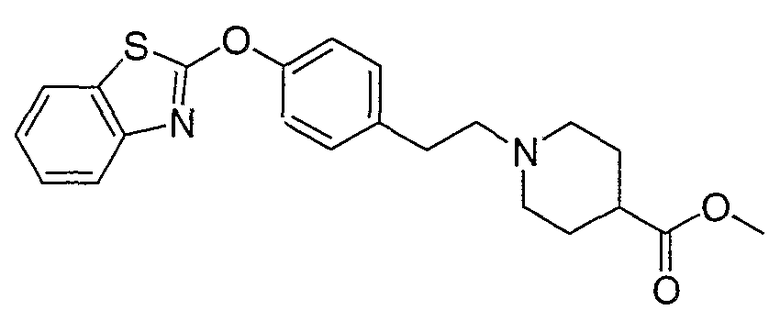
Метиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
А. Метиловый эфир 1-[2-(4-гидроксифенил)этил]пиперидин-4-карбоновой кислоты.
К перемешиваемому раствору 4-(2-бромэтил)фенола (пример 5, 5,05 г, 25 ммоль) в СН3СN (100 мл) добавляли метиловый эфир пиперидин-4-карбоновой кислоты (5,07 мл, 37,5 ммоль) и затем N,N-диизопропилэтиламин (8,7 мл, 50 ммоль). Реакционную смесь перемешивали при 60°С в течение 16 ч и затем оставляли охлаждаться до комнатной температуры. Добавляли СН2Cl2 (250 мл) и полученный раствор промывали H2O (2×30 мл), сушили, фильтровали и концентрировали при пониженном давлении с получением 5,2 г (79%) твердого вещества коричневато-желтого цвета. Масс-спектр (ESI): масса, вычисленная для С15Н21NО3; 263,15; m/z найдено 264,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 6,97 (д, J=8,2, 2H), 6,70 (д, J=8,6, 2H), 3,67 (с, 3H), 2,99 (д, J=11,5, 2H), 2,76-2,68 (м, 2H), 2,60-2,54 (м, 2H), 2,40-2,30 (м, 1H), 2,18 (т, J=10,8, 2H), 1,99-1,90 (м, 2H), 1,90-1,78 (м, 2H).
В. Метиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты.
К перемешиваемому раствору метилового эфира 1-[2-(4-гидроксифенил)этил]пиперидин-4-карбоновой кислоты (790 мг, 3,0 ммоль) в ДМФА (15 мл) добавляли Cs2CO3 (1,95 г, 6,0 ммоль) и 2-хлорбензотиазол (0,47 мл, 3,9 ммоль). Суспензию нагревали до 100°С и перемешивали в течение ночи. Реакционную смесь оставляли охлаждаться до комнатной температуры и фильтровали через кизельгур. Фильтрат концентрировали при пониженном давлении и остаток очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) с получением 1,04 г (выход 87%) твердого вещества коричневато-желтого цвета. Масс-спектр (ESI): масса, вычисленная для С23Н24N2О3S; 396,15; m/z найдено 397,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=7,8, 1H), 7,65 (д, J=7,8, 1H), 7,38 (т, J=7,6, 1H), 7,28-7,25 (м, 5H), 3,69 (с, 3H), 3,00-2,93 (м, 2H), 2,83 (дд, J=7,6, 3,0, 2H), 2,61 (дд, J=7,6, 3,0, 2H), 2,38-2,28 (м, 1H), 2,11 (т, J=10,4, 2H), 1,98-1,89 (м, 2H), 1,87-1,74 (м, 2H).
Пример 34
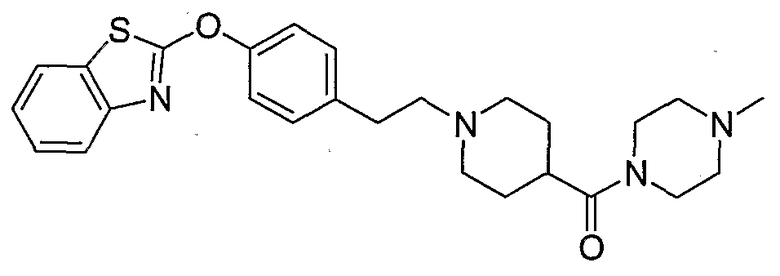
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-(4-метилпиперазин-1-ил)метанон
А. Трифторацетатная соль 1-
{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты.
К раствору метилового эфира 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты (пример 33; 4,6 г, 11,7 ммоль) в смеси ТГФ/СН3ОН, 3:1 (100 мл) добавляли гидроксид лития (1,1 г, 46,6 ммоль) в H2O (25 мл). Темно-желтый раствор перемешивали при комнатной температуре в течение 16 ч и затем концентрировали при пониженном давлении. Остаток растворяли в СН3ОН и очищали ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде твердого вещества светло-желтого цвета (3,9 г, выход 68%). Масс-спектр (ESI): масса, вычисленная для С21Н22N2О3S; 382,14; m/z найдено 383,4 [М+Н]+.
В. (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-(4-метилпиперазин-1-ил)метанон.
К смеси ТFA-соли 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты (300 мг, 0,6 ммоль) в СН2Cl2 (15 мл) и одной капли ДМФА добавляли оксалилхлорид (0,11 мл, 1,2 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Полученную смесь концентрировали при пониженном давлении. Остаток растворяли в СН2Cl2 (15 мл) и добавляли N-метилпиперазин (0,2 мл, 1,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, разбавляли СН2Cl2 (100 мл), промывали H2O, насыщенным водным NaНСО3 (10 мл) и затем насыщенным раствором соли, сушили (Na2SO4) и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали на SiО2 (40 г; 0-10% 2М NH3 в СН3ОН/СН2Cl2), получая указанное в заголовке соединение (240 мг, 86%). Масс-спектр (ESI): масса, вычисленная для С26Н32N2О3S; 464,22; m/z найдено 465,5 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,72 (д, J=7,6, 1H), 7,65 (д, J=7,6, 1H), 7,37 (т, J=7,6, 1H), 7,29-7,22 (м, 5H), 3,64 (шир.с, 2H), 3,51 (шир.с, 2H), 3,06 (д, J=11,4, 2H), 2,83 (дд, J=7,3, 3,5, 2H), 2,60 (дд, J=7,3, 3,5, 2H), 2,51-2,43 (м 1H), 2,42-2,33 (м, 4H), 2,30 (с, 3H), 2,06 (т, J=12,1, 2H), 1,99-1,84 (м, 2H), 1,72 (д, J=13,1, 2H).
Пример 35
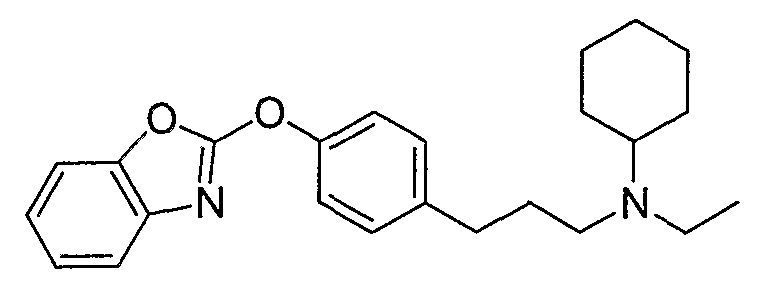
{3-[4-(бензооксазол-2-илокси)фенил]пропил}циклогексилэтиламин
А. [3-(4-бензилоксифенил)пропил]циклогексилэтиламин.
К раствору 3-(4-бензилоксифенил)пропил-1-бромида (504 мг, 1,65 ммоль) и N-этилциклогексиламина (497 мкл, 3,30 ммоль) в СН3CN (15 мл) добавляли К2СО3 (510 мг, 3,69 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 20 часов. Смесь фильтровали и затем концентрировали при пониженном давлении с получением золотистого масла, которое очищали на SiО2 (10 г; 50% ацетон/СН2Cl2), получая 484 мг (выход 83%) требуемого продукта в виде прозрачного и бесцветного масла. ТСХ (SiО2, ацетон): Rf=0,13. Масс-спектр (ESI): масса, вычисленная для С24Н33NO; 351,26; m/z найдено 352,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50-7,28 (м, 5H), 7,12 (д, J=8,6, 2H), 6,90 (д, J=8,6, 2H), 5,06 (с, 2H), 2,60-2,45 (м, 7H), 1,78 (шир.с, 6H), 1,20 (шир.с, 4H), 1,05 (т, J=7,1, 4H).
В. 4-[3-(циклогексилэтиламино)пропил]фенол.
К раствору [3-(4-(бензилоксифенил)пропил]циклогексилэтиламина (420 мг, 1,19 ммоль) в смеси этанол/этилацетат, 1:1, (16 мл) добавляли Pd на угле (10 мас.%, 46 мг). Смесь помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 на 20 часов. Полученную смесь фильтровали через кизельгур и фильтрат концентрировали при пониженном давлении с получением 308 мг (выход 99%) требуемого продукта в виде масла золотистого цвета. ТСХ (SiО2, ацетон): Rf=0,18. Масс-спектр (ESI): масса, вычисленная для С17Н27NO; 261,21; m/z найдено 262,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,00 (д, J=8,5, 2H), 6,75 (д, J=8,5, 2H), 2,65 (шир.с, 5H), 2,54 (т, J=7,6, 2H), 1,82 (шир.с, 6H), 1,30-1,05 (м, 8H).
С. {3-[4-(бензооксазол-2-илокси)фенил]пропил}циклогексилэтиламин.
К смеси 4-[3-(циклогексилэтиламино)пропил]фенола (283 мг, 1,08 ммоль) и Cs2CO3 (885 мг, 2,72 ммоль) в ацетоне (15 мл) при 5°С добавляли 2-хлорбензооксазол (155 мкл, 1,36 ммоль). Реакционную смесь оставляли медленно нагреваться до комнатной температуры в течение ночи и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением золотистого масла, которое очищали на SiО2 (10 г; ацетон) с получением 333 мг (выход 81%) требуемого продукта в виде масла золотистого цвета. ТСХ (SiО2, ацетон): Rf=0,12. Масс-спектр (ESI): масса, вычисленная для С24Н30N2О2; 378,23; m/z найдено 379,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,61 (д, J=7,3, 1H), 7,49 (д, J=7,8, 1H), 7,39 (д, J=8,6, 2H), 7,38-7,25 (м, 4H), 2,62 (т, J=7,5, 2H), 2,65-2,35 (м, 8H), 1,67 (шир.с, 5H), 1,19-1,10 (м, 4H), 0,95 (т, J=7,1, 3H).
Пример 36

1-{3-[4-(бензооксазол-2-илокси)фенил]пропил}пиперидин-4-ол
А. 1-[3-(4-гидроксифенил)пропил]пиперидин-4-ол.
Раствор 4-(3-бромпропил)фенола (пример 6, 1,42 г, 6,6 ммоль), гидрохлорида 4-гидроксипиперидина (908 мг, 6,6 ммоль) и N,N-диизопропилэтиламина (2,2 мл, 12,3 ммоль) в СН3СN (20 мл) перемешивали при 60°С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении с получением не совсем белого твердого вещества. Полученное вещество растворяли в СН2Cl2 (200 мл), раствор промывали H2O (2×50 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением твердого вещества белого цвета. Добавляли диэтиловый эфир и указанное в заголовке соединение собирали фильтрованием (1,4 г, выход 90%). ТСХ (SiО2, 5% 2М NH3 в СН3ОН/СН2Cl2): Rf=0,05. Масс-спектр (ESI): масса, вычисленная для С14Н21NО2; 235,16; m/z найдено 236,2 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 6,96-6,94 (м, 2H), 6,64-6,61 (м, 2H), 3,89-3,82 (м, 1H), 3,29-3,20 (м, 4H), 3,02-2,95 (м, 4H), 2,52 (т, J=7,4, 2H), 1,95-1,87 (м, 4H), 1,68-1,60 (м, 2H).
В. 1-{3-[4-(бензооксазол-2-илокси)фенил]пропил}пиперидин-4-ол.
Смесь 1-[3-(4-гидроксифенил)пропил]пиперидин-4-ола (0,4 г, 1,69 ммоль), 2-хлорбензооксазола (176 мкл, 1,54 ммоль) и Cs2CO3 (1,45 г, 4,45 ммоль) в ацетоне (8,0 мл) перемешивали при комнатной температуре в течение 48 ч. Полученную смесь фильтровали через кизельгур и затем промывали СН2Cl2. Объединенные фильтраты концентрировали при пониженном давлении и получали масло желтого цвета. Масло очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) и получали твердое вещество белого цвета, которое растворяли в СН2Cl2. Полученный раствор промывали 1М NаОН (3×5 мл) и затем H2O (5 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества белого цвета (98 мг, выход 16,4%). ТСХ (SiО2, 5% 2М NH3 в СН3ОН/СН2Cl2): Rf=0,14. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О3; 352,18; m/z найдено 363,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,66-7,51 (м, 1H), 7,44-7,42 (м, 1H), 7,34-7,21 (м, 6H), 3,72-3,69 (м, 1H), 2,79-2,76 (м, 2H), 2,67 (т, J=7,8, 2H), 2,38 (т, J=7,6, 2H), 2,15-2,11 (м, 2H), 1,98-1,80 (м, 3H), 1,65-1,55 (м, 3H), 1,42 (м, 1H).
Пример 37

1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол
А. 1-[2-(4-гидроксифенокси)этил]-4-фенилпиперидин-4-ол.
К раствору 4-(2-бромэтокси)фенола (пример 3, 8,0 г, 36,8 ммоль) и 4-гидрокси-4-фенилпиперидина (8,2 г, 46,3 ммоль) в СН3СN (150 мл) добавляли DIEA (7,0 мл, 40,2 ммоль). Смесь перемешивали в течение 20 часов при комнатной температуре и дополнительно 4 часа при 65°С и затем смесь концентрировали при пониженном давлении, получая твердое вещество коричневого цвета. Твердое вещество растворяли в этилацетате (250 мл), раствор промывали H2O (250 мл, 100 ммоль), сушили (MgSO4) и концентрировали при пониженном давлении с получением коричневого твердого вещества. Твердое вещество очищали на SiО2 (120 г; 0-100% ацетон/СН2Cl2) и получали 8,9 г (выход 77%) требуемого продукта в виде твердого вещества коричневато-желтого цвета. ТСХ (SiО2, ацетон): Rf=0,42. Масс-спектр (ESI): масса, вычисленная для С19Н23NO3; 313,17; m/z найдено 314,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,52 (д, J=8,6, 2H), 7,37 (т, J=7,3, 2H), 7,27 (м, 1H), 6,75 (с, 4H), 4,08 (т, J=5,8, 2H), 3,05-2,90 (м, 2H), 2,88 (т, J=5,8, 2H), 2,80-2,62 (м, 2H), 2,31-2,18 (м, 2H), 1,81 (д, J=11,8, 2H).
В. 4-фенил-1-(2-{4-[1-(2-триметилсиланилэтоксиметил)-1Н-бензоимидазол-2-илокси]фенокси}этил)пиперидин-4-ол.
К смеси 2-хлор-1-(2-триметилсиланилэтоксиметил)-1Н-бензоимидазола (пример 7; 630 мг, 2,2 ммоль) и 1-[2-(4-гидроксифенокси)этил]-4-фенилпиперидин-4-ола (690 мг, 2,2 ммоль) в ДМФА (10 мл) добавляли Cs2CO3 (1,5 г, 4,6 ммоль). Реакционную смесь перемешивали при 100°С в течение 18 ч и затем распределяли в смеси этилацетат/H2O, 1:1, (50 мл). Органический слой собирали, сушили (MgSO4) и концентрировали при пониженном давлении с получением прозрачного масла коричневого цвета, которое очищали на SiО2 (35 г; ацетон), получая 867 мг (выход 70%) требуемого продукта в виде прозрачного масла золотистого цвета. ТСХ (SiО2, ацетон): Rf=0,38. Масс-спектр (ESI): масса, вычисленная для С32Н41N3О4Si, m/z, вычислено 559,29; m/z найдено 560,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,55 (м, 3H), 7,38 (м, 3H), 7,30-7,20 (м, 5H), 6,99 (д, J=9,0, 2H), 5,55 (с, 2H), 4,17 (т, J=5,9, 2H), 6,37 (м, 2H), 2,92 (м, 5H), 2,65 (т, J=12,4, 2H), 2,21 (т, J=15,9, 2H), 1,81 (д, J=12,1, 2H), 0,96 (т, J=8,1, 2H).
С. 1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол.
К раствору 4-фенил-1-(2-{4-[1-(2-триметилсиланилэтоксиметил)-1Н-бензоимидазол-2-илокси]фенокси}этил)пиперидин-4-ола (816 мг, 1,46 ммоль) в ТГФ (5 мл), содержащему N,N,N,N-тетраметилэтилендиамин (TMEDA, 2,2 мл, 14,6 ммоль), добавляли 1М раствор фторида тетрабутиламмония в ТГФ (TBAF, 15 мл, 15 ммоль). Смесь перемешивали при 55°С в течение 5 часов и затем концентрировали при пониженном давлении. Полученное масло растворяли в диэтиловом эфире (100 мл), раствор промывали H2O (3×75 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением твердого вещества белого цвета. Добавляли диэтиловый эфир и после фильтрования получали требуемый продукт в виде твердого вещества белого цвета (155 мг, выход 25%). ТСХ (SiО2, ацетон): Rf=0,16. Масс-спектр (ESI): масса, вычисленная для С25Н27N3О3, m/z, вычислено 429,21; m/z найдено 430,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,23 (шир.с, 1H), 7,48 (д, J=7,3, 2H), 7,35-7,25 (м, 6H), 7,20 (т, J=7,4, 1H), 7,10-7,04 (м, 2H), 7,00 (д, J=9,0, 2H), 4,80 (с, 1H), 4,13 (т, J=5,8, 2H), 2,76 (т, J=5,8, 2H), 2,58-2,48 (м, 2H), 1,94 (дт, J=12,7, 4,0, 2H), 1,58 (д, J=12,1, 2H).
Пример 38

2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклопропилметилпропиламин
А. 4-[2-(циклопропилметилпропиламино)этил]фенол.
К раствору 4-(2-бромэтил)фенола (пример 5; 5,0 г, 25,0 ммоль) в СН3СN (100 мл) добавляли циклопропилметилпропиламин (5,4 мл, 37,5 ммоль) и затем N,N-диизопропилэтиламин (8,70 мл, 50,0 ммоль). Полученный раствор перемешивали при 60°С в течение 16 ч и получали суспензию, которую охлаждали до комнатной температуры и фильтровали. Отфильтрованное твердое вещество промывали этилацетатом (2×20 мл) и сушили, получая твердое вещество белого цвета (5,7 г, выход 98%). Масс-спектр (ESI): масса, вычисленная для С15Н23NО; 233,18; m/z найдено 234,1 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,01 (д, J=8,6, 2H), 6,87 (д, J=8,6, 2H), 3,34-3,30 (м, 2H), 3,19-3,04 (м, 2H), 2,94-2,75 (м, 4H), 1,75-1,56 (м, 2H), 1,16-0,99 (м, 1H), 0,95-0,87 (м, 3H), 0,68-0,53 (м, 2H), 0,44-0,32 (м, 2H).
В. {2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклопропилметилпропиламин.
Смесь 2-хлор-1-(2-триметилсиланилэтоксиметил)-1Н-бензоимидазола (пример 7; 707 мг, 2,5 ммоль), 4-[2-(циклогексилметиламино)этил]фенола (467 мг, 2,0 ммоль) и Cs2CO3 (1,3 г, 4,0 ммоль) в ДМФА (10 мл) перемешивали при 100°С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и затем распределяли в смеси этилацетат/H2O, 1:1 (200 мл). Органический слой собирали, сушили (MgSO4) и концентрировали при пониженном давлении с получением прозрачного масла коричневого цвета, которое очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2), получая 729 мг (выход 76%) прозрачного масла золотистого цвета. Масс-спектр (ESI): масса, вычисленная для С28Н41N3О2Si, m/z, вычислено 479,30; m/z найдено 480,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,63-7,58 (м, 1H), 7,49-7,39 (м, 1H), 7,31 (с, 4H), 7,26-7,22 (м, 2H), 5,58 (с, 2H), 3,69 (т, J=8,2, 2H), 2,89-2,79 (м, 4H), 22,63-2,58 (м, 2H), 2,48 (д, J=6,5, 2H), 1,61-1,50 (м, 2H), 1,01-0,91 (м, 6H), 0,59-0,53 (м, 2H), 0,20-0,15 (м, 2H), 0,1 (с, 9H).
С. 2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклопропилметилпропиламин.
К раствору циклопропилметилпропил(2-{4-[1-(2-триметилсиланилэтоксиметил)-1Н-бензоимидазол-2-илокси]фенил}этил)амина (411 мг, 0,87 ммоль) в ТГФ (5 мл) шприцем добавляли TBAF (1М в ТГФ, 2,57 мл, 2,57 ммоль) и смесь перемешивали при кипячении с обратным холодильником в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученное масло очищали на SiО2 (40 г; 0-20% СН3ОН/СН2Cl2) и получали 284 мг (выход 95%) прозрачного масла. Масс-спектр (ESI): масса, вычисленная для С22Н27N3О, m/z, вычислено 349,22; m/z найдено 350,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,34 (шир.с, 2H), 7,18-7,05 (м, 6H), 2,82-2,70 (м, 4H), 2,69-2,62 (м, 2H), 2,52 (д, J=6,8, 2H), 1,61-1,50 (м, 2H), 0,91 (т, J=6,8, 4H), 0,57-0,51 (м, 2H), 0,16 (дд, J=5,3, 5,1, 2H).
Пример 39

Циклогексилэтил{2-[4-(1-метил-1Н-бензоимидазол-2-илокси)фенил]этил}амин
Смесь 4-[2-(циклогексилэтиламино)этил]фенола (247 мг, 1,0 ммоль), N-метилбензимидазола (пример 8; 200 мг, 1,2 ммоль) и Cs2CO3 (652 мг, 2,0 ммоль) в ДМФА (3 мл) перемешивали при 100°С в течение 16 ч. Реакционную смесь охлаждали, фильтровали через кизельгур и затем промывали этилацетатом (30 мл). Объединенные фильтраты промывали H2O (3×10 мл), затем насыщенным раствором соли (10 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали на SiО2 (10 г; 0-100%, 10% [2М NH3 в СН3ОН] в СН2Cl2/СН2Cl2) и получали 105 мг (выход 28%) масла коричневого цвета. Масс-спектр (ESI): масса, вычисленная для С24Н31N3О; 377,53; m/z найдено 378,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,52 (д, J=7,2, 1H), 7,63-7,58 (м, 1H), 7,33-7,18 (м, 7H), 3,75 (с, 3H), 2,81-2,70, м, 4H), 2,68 (кв, J=7,1, 2H), 2,60-2,50 (м, 1H), 1,90-1,80 (м, 4H), 1,67 (д, J=12,3, 1H), 1,35-1,18 (м, 4H), 1,15-1,05 (м, 1H), 1,12 (т, J=7,1, 3H).
Пример 40

1-{3-[4-(бензооксазол-2-илокси)фенокси]-2-гидроксипропил}-4-фенилпиперидин-4-ол
А. 2-(4-(бензилоксифеноксиметил)оксиран.
К раствору 4-(бензилокси)фенола (15,0 г, 74,9 ммоль) и эпихлоргидрина (30 мл, 384 ммоль) в ДМФА (200 мл) добавляли Cs2CO3 (51,2 г, 157 ммоль). Смесь нагревали до 75°С в течение 3 дней. Реакционную смесь охлаждали до комнатной температуры и затем распределяли в смеси этилацетат/H2O, 1:1, (600 мл). Органический слой собирали, промывали H2O (3×250 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением 38 г прозрачной темно-коричневой жидкости. Полученную жидкость очищали на SiО2 (300 г, 50-100% СН2Cl2/гексан) и получали требуемый продукт в виде твердого вещества белого цвета (13 г, выход 68%). ТСХ (SiО2, СН2Cl2): Rf=0,64. 1H ЯМР (400 МГц, CDCl3): 7,55-7,28 (м, 5H), 6,91 (д, J=9,3, 2H), 6,86 (д, J=9,3, 2H), 5,03 (с, 2H), 4,17 (дд, J=11,0, 3,2, 1H), 3,95-3,88 (м, 1H), 3,36-3,33 (м, 1H), 2,91 (т, J=4,8, 1H), 2,75 (дд, J=4,9, 2,6, 1H).
В. 1-[3-(4-(бензилоксифенокси)-2-гидроксипропил]-4-фенилпиперидин-4-ол.
К раствору 2-(4-(бензилоксифеноксиметил)оксирана (1,50 г, 5,85 ммоль) и 4-гидрокси-4-фенилпиперидина (1,30 г, 7,33 ммоль) в СН3СN (50 мл) добавляли К2СО3 (1,0 г, 7,23 ммоль). Смесь кипятили с обратным холодильником в течение 20 ч. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением твердого вещества белого цвета, которое очищали на SiО2 (40 г; ацетон), получая 1,4 г (выход 56%) требуемого продукта в виде твердого вещества белого цвета. ТСХ (SiО2, ацетон): Rf=0,36. Масс-спектр (ESI): масса, вычисленная для С27Н31NO4; 433,23; m/z найдено 434,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,56-7,23 (м, 10H), 6,93 (д, J=9,2, 2H), 6,88 (д, J=9,2, 2H), 5,03 (с, 2H), 4,77 (с, 2H), 3,93 (шир.д, J=10,8, 2H), 3,81 (т, J=7,2, 1H), 2,80-2,60 (м, 2H), 2,50-2,35 (м, 4H), 1,97-1,90 (м, 2H), 1,60-1,50 (д, J=13,4, 2H).
С. 1-[2-гидрокси-3-(4-гидроксифенокси)пропил]-4-фенилпиперидин-4-ол.
К раствору 1-[3-(4-(бензилоксифенокси)-2-гидроксипропил]-4-фенилпиперидин-4-ола (1,3 г, 3,0 ммоль) в смеси этанол/этилацетат, 1:1, (50 мл) добавляли Pd на угле (10 мас.%, 165 мг). Смесь помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 на 20 часов. Реакционную смесь фильтровали через кизельгур и фильтрат концентрировали при пониженном давлении с получением 1,0 г (выход 100%) требуемого продукта в виде твердого вещества белого цвета. ТСХ (SiО2, ацетон): Rf=0,27. Масс-спектр (ESI): масса, вычисленная для С20Н25NO4; 343,18; m/z найдено 344,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,61 (д, J=8,1, 2H), 7,42 (т, J=7,4, 2H), 7,30 (т, J=7,3, 1H), 6,90 (д, J=9,0, 2H), 6,81 (д, J=9,0, 2H), 4,25 (шир.с, 1H), 4,05-3,95 (м, 2H), 3,10-2,92 (м, 2H), 2,80-2,60 (м, 4H), 2,30-2,20 (м, 2H), 1,81 (д, J=11,8, 2H).
D. 1-{3-[4-(бензооксазол-2-илокси)фенокси]-2-гидроксипропил}-4-фенилпиперидин-4-ол.
К смеси 1-[2-гидрокси-3-(4-гидроксифенокси)пропил]-4-фенилпиперидин-4-ола (251 мг, 0,73 ммоль) и Cs2CO3 (667 мг, 2,05 ммоль) в ацетоне (10 мл) при 5°С добавляли 2-хлорбензооксазол (108 мкл, 0,95 ммоль). Реакционную смесь оставляли на льду, нагревали в течение ночи до комнатной температуры и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением золотистого масла, которое очищали на SiО2 (10 г; ацетон) с получением 127 мг (выход 38%) требуемого продукта в виде твердого вещества белого цвета. ТСХ (SiО2, ацетон): Rf=0,27. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О5; 460,20; m/z найдено 461,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,60 (д, J=6,6, 1H), 7,55-7,35 (м, 5H), 7,32-7,25 (м, 4H), 7,20 (т, J=7,3, 1H), 7,06 (д, J=9,1, 2H), 4,78 (с, 1H), 4,10-3,85 (м, 3H), 2,80-2,65 (м, 2H), 2,55-2,35 (м, 4H), 1,95 (т, J=13,1, 2H), 1,59 (д, J=13,2, 2H).
Пример 41

Этиловый эфир 1-[2-(4-бензооксазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты
А. 4-бензооксазол-2-илметилфенол.
Смесь 4-гидроксифенилуксусной кислоты (35 г, 230 ммоль) и 2-аминофенола (43 г, 400 ммоль) нагревали при 180°С в течение 3 часов и затем охлаждали до комнатной температуры. Полученное твердое вещество измельчали, растворяли в ТГФ (200 мл) и затем добавляли карбонилдиимидазол (27 г, 170 ммоль). Раствор перемешивали при 60°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и распределяли между этилацетатом (400 мл) и H2O (300 мл). Органический слой концентрировали при пониженном давлении. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (200 г; 0-50% ацетон/СН2Cl2), получая твердое вещество коричневого цвета (31 г, выход 40%). Масс-спектр (ESI): масса, вычисленная для С14Н11NО2; 225,08; m/z найдено 226,1 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,62 (м, 1H), 7,53 (м, 1H), 7,32 (м, 2H), 7,17 (д, J=8,5, 2H), 6,75 (д, J=8,5, 2H), 4,18 (с, 2H).
В. 2-[4-(2-бромэтокси)бензил]бензооксазол.
К перемешиваемому раствору 4-бензооксазол-2-илметилфенола (5 г, 22,2 ммоль) в СН3СN (100 мл) добавляли Na2СO3 (6,4 г, 46,6 ммоль) и дибромэтан (7,9 мл, 88,8 ммоль). Полученную суспензию нагревали до 70°С в течение 72 часов и фильтровали в горячем состоянии. Фильтрат концентрировали при пониженном давлении. Полученное твердое вещество суспендировали в диэтиловом эфире, фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (110 г; СН2Cl2), получая не совсем белое твердое вещество (1 г, выход 13,7%). Масс-спектр (ESI): масса, вычисленная для С16Н14BrNО2; 331,02; m/z найдено 332,0 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,62 (м, 1H), 7,53 (м, 1H), 7,34 (м, 2H), 7,29 (д, J=8,6, 2H), 6,92 (д, J=8,7, 2H), 4,28 (т, J=5,9, 2H), 4,23 (с, 2H), 3,67 (т, J=5,9, 2H).
С. Этиловый эфир 1-[2-(4-бензооксазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты.
К перемешиваемому раствору 2-[4-(2-бромэтокси)бензил]бензооксазола (0,5 г, 1,5 ммоль) в СН3СN (7,5 мл) добавляли этилизонепикотат (0,7 мл, 4,5 ммоль). Смесь перемешивали при комнатной температуре в течение 48 часов и затем концентрировали при пониженном давлении. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (40 г; 0-25% ацетон/СН2Cl2), получая твердое вещество не совсем белого цвета (275 мг, выход 45%). Масс-спектр (ESI): масса, вычисленная для С24Н28N2О4; 408,20; m/z найдено 409,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,67 (м, 1H), 7,45 (м, 1H), 7,28 (д, J=9,0, 4H), 6,88 (д, J=8,7, 2H), 4,20 (с, 2H), 4,12 (кв, J=7,1, 2H), 4,08 (т, J=5,9, 2H), 2,95 (д, J=11,5, 2H), 2,77 (т, J=5,9, 2H), 2,24 (м, 1H), 2,16 (м, 2H), 1,84 (м, 2H), 1,76 (м, 2H), 1,24 (т, J=7,2, 3H).
Пример 42

Метиловый эфир 1-[2-(4-бензотиазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты
А. 4-бензотиазол-2-илметилфенол.
Смесь 4-гидроксифенилуксусной кислоты (15,2 г, 100 ммоль) и 2-аминобензолтиола (10,7 мл, 100 ммоль) нагревали при 150°С в течение 16 часов и затем охлаждали до комнатной температуры. Полученное твердое вещество измельчали и растворяли в СН2Cl2 (400 мл). Раствор промывали 1н. HCl (2×50 мл), затем насыщенным водным NaНСО3 (2×50 мл), сушили, фильтровали и концентрировали при пониженном давлении. Остаток очищали на SiО2 (0-50% этилацетат/гексан), получая твердое вещество белого цвета (10,5 г, выход 44%). Масс-спектр (ESI): масса, вычисленная для С14Н11NОS; 241,06; m/z найдено 342,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,89 (дд, J=8,6, 4,8, 2H), 7,47 (т, J=7,8, 1H), 7,31 (т, J=7,8, 1H), 7,18 (д, J=8,3, 2H), 6,77 (д, J=8,6, 2H), 4,89 (с, 1H), 4,33 (с, 2H).
В. 2-[4-(2-бромэтокси)бензил]бензотиазол.
К перемешиваемому раствору 4-бензотиазол-2-илметилфенола (10,5 г, 43,5 ммоль) в СН3СN (100 мл) добавляли Cs2CO3 (28,3 г, 87 ммоль) и дибромэтан (18,7 мл, 21,8 ммоль). Полученную суспензию нагревали до 70°С в течение 16 часов, охлаждали до комнатной температуры и затем растворяли в СН2Cl2 (400 мл). Раствор промывали H2O (2×50 мл), сушили и концентрировали. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (0-50% этилацетат/гексан), получая твердое вещество белого цвета (7,5 г, выход 49,5%). Масс-спектр (ESI): масса, вычисленная для С16Н14BrNОS; 347,00; m/z найдено 348,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,99 (д, J=8,1, 1H), 7,79 (д, J=8,1, 1H), 7,45 (т, J=7,6, 1H), 7,36-7,25 (м, 3H), 6,89 (д, J=8,8, 2H), 4,38 (с, 2H), 4,28 (т, J=6,3, 2H), 3,63 (т, J=6,3, 2H).
С. Метиловый эфир 1-[2-(4-бензотиазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты.
К перемешиваемому раствору 2-[4-(2-бромэтокси)бензил]бензотиазола (1,0 г, 2,9 ммоль) в СН3СN (20 мл) добавляли метилизонепикотат (0,7 мл, 55,7 ммоль) и N,N-диизопропилэтиламин (1,5 мл, 8,6 ммоль). Смесь нагревали до 60°С в течение 16 ч, охлаждали до комнатной температуры и затем растворяли в СН2Cl2 (100 мл). Раствор промывали H2O (2×20 мл), сушили и концентрировали. Полученное масло растворяли в СН2Cl2 и очищали на SiО2 (0-15% СН3ОН/СН2Cl2), получая твердое вещество белого цвета (1,1 г, выход 92%). Масс-спектр (ESI): масса, вычисленная для С23Н26N2О3S; 410,17; m/z найдено 411,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,98 (д, J=8,3, 1H), 7,76 (д, J=8,3, 1H), 7,42 (т, J=7,8, 1H), 7,33-7,24 (м, 3H), 6,88 (д, J=8,8, 2H), 4,36 (с, 2H), 4,07 (т, J=6,1, 2H), 3,66 (с, 3H), 2,97-2,90 (м, 2H), 2,76 (т, J=6,1, 2H, 2,33-2,24 (м 1H), 2,15 (т, J=11,4, 2H), 1,93-1,86 (м, 2H), 1,83-1,72 (м, 2H).
Пример 43
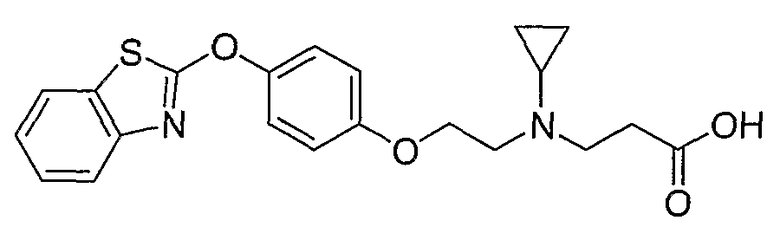
Трифторацетатная соль 3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)пропионовой кислоты
А. Этиловый эфир 3-[2-(4-гидроксифенокси)этиламино]пропионовой кислоты.
К перемешиваемому раствору 4-(2-бромэтокси)фенола (пример 3, 2,4 г, 11 ммоль) в СН3СN (50 мл) добавляли гидрохлорид этилового эфира 3-аминопропионовой кислоты (3,4 г, 22 ммоль) и затем N,N-диизопропилэтиламин (7,7 мл, 44 ммоль). Смесь перемешивали при 60°С в течение 16 часов, оставляли охлаждаться до комнатной температуры и затем растворяли в СН2Cl2 (100 мл). Полученный раствор промывали H2O (2×15 мл), сушили, фильтровали и концентрировали при пониженном давлении с получением масла коричневого цвета, которое использовали на следующей стадии.
В. Этиловый эфир 3-{2-(4-бензотиазол-2-илокси)фенокси]этиламино}пропионовой кислоты.
К перемешиваемому раствору этилового эфира 3-[2-(4-гидроксифенокси)этиламино]пропионовой кислоты (11 ммоль) в ДМФА (30 мл) добавляли Cs2CO3 (10,8 г, 33 ммоль) и 2-хлорбензотиазол (2,72 мл, 22 ммоль). Суспензию перемешивали при 100°С в течение ночи. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем фильтровали через кизельгур. Фильтрат концентрировали при пониженном давлении и очищали на SiО2 (100 г; 0-100% СН3ОН/СН2Cl2), получая 1,9 г (выход 45%) масла светло-коричневого цвета. Масс-спектр (ESI): масса, вычисленная для С22Н22N2О4S, m/z, вычислено 386,13; m/z найдено 387,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,66 (д, J=8,1, 1H), 7,58 (д, J=8,3, 1H), 7,30 (д, J=7,8, 1H), 7,22-7,15 (м, 3H), 6,86 (д, J=9,1, 2H), 4,09 (дд, J=7,1, 7,1, 2H), 4,01 (т, J=5,3, 2H), 2,98 (т, J=5,3, 2H), 2,92 (т, J=6,6, 2H), 2,49 (т, J=6,6, 2H), 2,20 (шир.с, 1H), 1,20 (т, J=7,1,3H).
С. Этиловый эфир 3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)пропионовой кислоты.
К раствору этилового эфира 3-{2-(4-бензотиазол-2-илокси)фенокси]этиламино}пропионовой кислоты (500 мг, 1,29 ммоль) в СН3ОН (15 мл) добавляли уксусную кислоту (0,73 мл, 12,9 ммоль), молекулярные сита 3Å и [(1-этоксициклопропил)окси]триметилсилан (1,55 мл, 7,7 ммоль). Добавляли цианоборогидрид натрия (365 мг, 5,8 ммоль) и смесь кипятили с обратным холодильником в течение ночи. Смесь охлаждали, фильтровали и концентрировали. Остаток растворяли в СН2Cl2, полученный раствор промывали насыщенным водным NaНСО3 и затем насыщенным раствором соли, сушили и концентрировали. Остаток очищали на SiО2 (40 г; 10-50% этилацетат/гексан) и получали 374 мг (выход 68%) бесцветного масла. Масс-спектр (ESI): масса, вычисленная для С23Н26N2О4S, m/z, вычислено 426,16; m/z найдено 427,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,3, 1H), 7,64 (д, J=8,1, 1H), 7,38 (д, J=7,8, 1H), 7,29-7,22 (м, 3H), 6,94 (д, J=9,1, 2H), 4,14 (дд, J=7,1, 7,1, 2H), 4,10 (т, J=6,1, 2H), 3,07 (т, J=7,1, 2H), 3,05 (т, J=6,1, 2H), 2,58 (т, J=7,3, 2H), 1,92-1,86 (м, 1H), 1,26 (т, J=7,1, 3H), 0,54-0,43 (м, 4H).
D. Трифторацетатная соль 3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино]пропионовой кислоты.
К раствору этилового эфира 3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)пропионовой кислоты (355 мг, 11,7 ммоль) в ТГФ (15 мл) и СН3ОН (5 мл) добавляли гидроксид лития (80 мг, 3,3 ммоль) в H2O (10 мл). Смесь перемешивали при комнатной температуре в течение 16 ч и затем концентрировали при пониженном давлении. Остаток растворяли в СН3ОН и очищали ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (391 мг, выход 92%). Масс-спектр (ESI): масса, вычисленная для С21Н22N2О4S; 398,13; m/z найдено 399,1 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,73 (д, J=8,3, 1H), 7,64 (д, J=8,1, 1H), 7,48 (д, J=7,8, 1H), 7,35-7,25 (м, 3H), 7,11 (д, J=9,1, 2H), 5,17 (шир.с, 1H), 4,48 (т, J=4,6, 2H), 3,81 (т, J=4,6, 2H), 3,76 (т, J=7,1, 2H), 3,04-2,93 (м, 3H), 1,17-1,10 (м, 2H), 1,05-0,97 (м, 2H).
Пример 44

2-[4-(2-пирролидин-1-илэтокси)фенокси]бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 11, с использованием 1-(2-хлорэтил)пирролидина. Масс-спектр (ESI): масса, вычисленная для С19Н20N2О3; 324,15; m/z найдено 325,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,75 (д, J=8,1, 1H), 7,66 (д, J=8,0, 1H), 7,40 (дт, J=7,4, 1,3, 1H), 7,31-7,23 (м, 3H), 6,98 (д, J=6,8, 2H), 4,08 (т, J=6,3, 2H), 2,91 (т, J=6,3, 2H), 2,67 (кв, J=7,2, 4H), 1,10 (т, J=7,2, 6H).
Пример 45

{3-[4-(бензооксазол-2-илокси)фенокси]пропил}диметиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 11, с использованием гидрохлорида (2-хлорпропил)диметиламина. Масс-спектр (ESI): масса, вычисленная для С18Н20N2О3; 312,15; m/z найдено 313,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,48-7,45 (м, 1H), 7,40-7,38 (м, 1H), 7,30 (д, J=7,9, 2H), 7,23-7,18 (м, 2H), 6,91 (д, J=8,3, 2H), 4,09 (шир.с, 2H), 3,23 (шир.с, 2H), 2,85 (шир.с, 6H), 2,42 (шир.с, 2H).
Пример 46
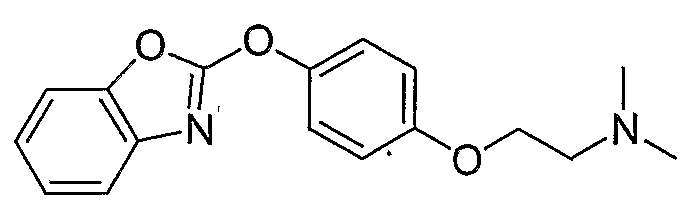
{2-[4-(бензооксазол-2-илокси)фенокси]этил}диметиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 11, с использованием гидрохлорида (2-хлорэтил)диметиламина. Масс-спектр (ESI): масса, вычисленная для С17Н18N2О3; 298,13; m/z найдено 299,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,49-7,47 (м, 1H), 7,41-7,38 (м, 1H), 7,32-7,27 (м, 2H), 7,26-7,18 (м, 2H), 6,98-6,95 (м, 2H), 4,05 (т, J=5,7, 2H), 2,72 (т, J=5,7, 2H), 2,32 (с, 6H).
Пример 47

2-[4-(2-азепан-1-илэтокси)фенокси]бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 11, с использованием гидрохлорида 1-(2-хлорэтил)азепана. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О3; 352,18; m/z найдено 353,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,49-7,47 (м, 1H), 7,41-7,38 (м, 1H), 7,31-7,27 (м, 2H), 7,26-7,18 (м, 2H), 6,97-6,93 (м, 2H), 4,06 (т, J=6,2, 2H), 2,94 (т, J=6,2, 2H), 2,77-2,75 (м, 4H), 1,65-1,58 (м, 8H).
Пример 48
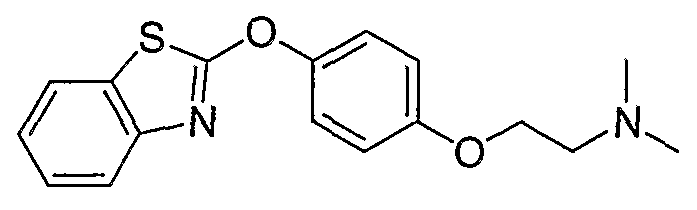
{2-[4-(бензотиазол-2-илокси)фенокси]этил}диметиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 12, с использованием гидрохлорида (2-хлорэтил)диметиламина и 2-хлорбензотиазола. Масс-спектр (ESI): масса, вычисленная для С17Н18N2О2S; 314,11; m/z найдено 315,1 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,79-7,77 (м, 1H), 7,65-7,63 (м, 1H), 7,45-7,29 (м, 4H), 7,18-7,14 (м, 2H), 4,41 (т, J=4,9, 2H), 3,63 (т, J=4,9, 2H), 3,04 (с, 6H).
Пример 49

2-[4-(2-пирролидин-1-илэтокси)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 12, с использованием гидрохлорида 1-(2-хлорэтил)пирролидина и 2-хлорбензотиазола. Масс-спектр (ESI): масса, вычисленная для С19Н20N2О2S; 340,12; m/z найдено 341,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=7,6, 1H), 7,66 (д, J=8,6, 1H), 7,41 (т, J=7,4, 1H), 7,32-7,25 (м, 3H), 7,00 (д, J=9,0, 2H), 4,16 (т, J=6,0, 2H), 2,96 (т, J=6,0, 2H), 2,67 (т, J=6,6, 4H), 1,86 (квинтет, J=3,5, 4H).
Пример 50

{3-[4-(бензотиазол-2-илокси)фенокси]пропил}диметиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 12, с использованием гидрохлорида (2-хлорпропил)диметиламина и 2-хлорбензотиазола. Масс-спектр (ESI): масса, вычисленная для С18Н20N2О2S; 328,12; m/z найдено 329,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,64 (д, J=7,9, 1H), 7,37 (т, J=7,5, 1H), 7,31-7,20 (м, 3H), 6,92 (д, J=7,9, 2H), 4,11 (с, 2H), 3,25 (с, 2H), 2,85 (с, 6H), 2,43 (с, 2H).
Пример 51

2-[4-(2-азепан-1-илэтокси)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 12, с использованием гидрохлорида 1-(2-хлорэтил)азепана и 2-хлорбензотиазола. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О2S; 368,16; m/z найдено 369,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,70 (д, J=7,5, 1H), 7,65 (д, J=7,9, 1H), 7,38-7,34 (м, 1H), 7,29-7,23 (м, 3H), 6,97 (шир.д, 2H), 4,59 (шир.с, 2H), 3,64 (шир.с, 2H), 3,46 (шир.с, 2H), 3,13 (шир.с, 3H), 2,19 (шир.с, 2H), 1,87 (шир.с, 2H), 1,72-1,58 (м, 2H).
Пример 52

2-[4-(2-азепан-1-илэтокси)фенокси]-6-метоксибензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 12, с использованием гидрохлорида (2-хлорэтил)азепана и 2-хлор-6-метоксибензотиазола. Масс-спектр (ESI): масса, вычисленная для С2Н26N2О3S; 398,17; m/z найдено 399,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,75 (д, J=8,9, 1H), 7,37-7,35 (м, 2H), 7,26 (шир.д, 2H), 7,09-7,05 (м, 3H), 4,19 (т, J=6,1, 2H), 3,95 (с, 3H), 3,08 (т, J=6,1, 2H), 2,91-2,88 (м, 4H), 1,76 (шир.д, 8H).
Пример 53

1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 4-фенилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С25Н26N2О4; 430,19; m/z найдено 431,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,60-7,45 (м, 3H), 7,40-7,18 (м, 8H), 7,00 (д, J=9,1, 2H), 4,18 (т, J=5,9, 2H), 2,92 (т, J=5,9, 2H), 2,66 (дт, J=12,1, 2,4, 2H), 2,22 (дт, J=13,4, 4,5, 2H), 1,80 (дд, J=14,1, 2,4, 2H).
Пример 54
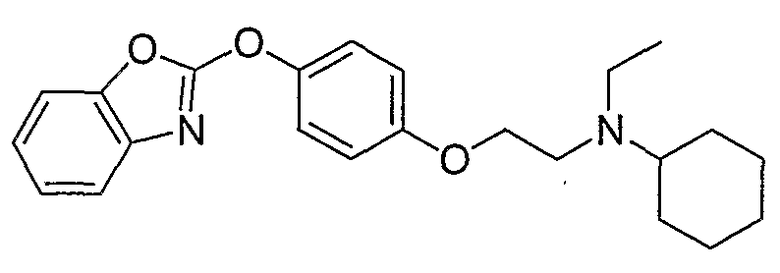
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклогексилэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием циклогексилэтиламина. Масс-спектр (ESI): масса, вычисленная для С23Н28N2О3; 380,21; m/z найдено 381,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,51 (д, J=8,4, 1H), 7,42 (д, J=7,5, 1H), 7,35-7,18 (м, 4H), 6,97 (д, J=9,1, 2H), 3,98 (т, J=6,9, 2H), 2,88 (т, J=6,9, 2H), 2,67 (кв, J=7,1, 2H), 2,55-2,50 (м, 1H), 1,82 (т, J=7,4, 4H), 1,64 (д, J=12,4, 1H), 1,21 (т, J=7,9, 4H), 1,08 (т, J=7,1, 4H).
Пример 55
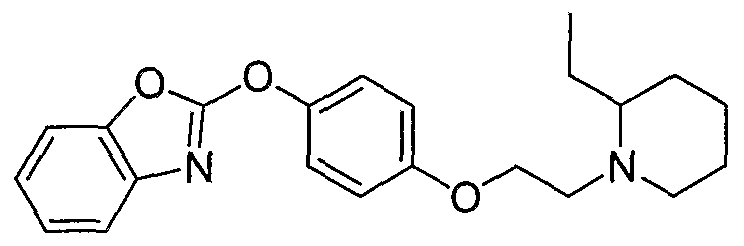
2-{4-[2-(2-этилпиперидин-1-ил)этокси]фенокси}бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 2-этилпиперидина. Масс-спектр (ESI): масса, вычисленная для С22Н26N2О3; 366,19; m/z найдено 367,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,51 (д, J=7,4, 1H), 7,42 (д, J=7,4, 1H), 7,31 (д, J=9,1, 2H), 7,30-7,20 (м, 2H), 6,97 (д, J=9,1, 2H), 4,09 (т, J=6,4, 2H), 3,15-3,05 (м, 1H), 3,00-2,92 (м, 1H), 2,88-2,80 (м, 1H), 2,48-2,37 (м, 1H), 2,30-2,25 (м, 1H), 1,75-1,65 (м, 4H), 1,60-1,54 (м, 2H), 1,52-1,42 (м, 1H), 1,38-1,24 (м, 2H), 0,92 (т, J=7,4, 3H).
Пример 56
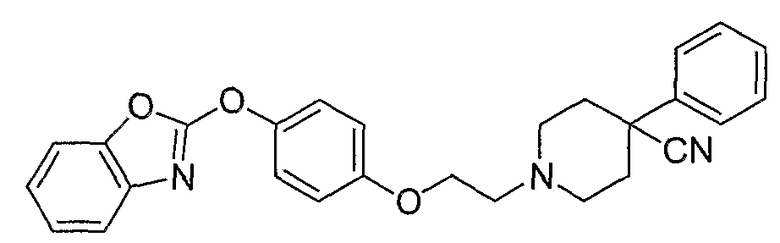
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-карбонитрил
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 4-фенилпиперидин-4-карбонитрила. Масс-спектр (ESI): масса, вычисленная для С27Н25N2О5; 439,19; m/z найдено 440,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,61-7,49 (м, 3H), 7,43-7,38 (м, 3H), 7,36-7,29 (м, 3H), 7,28-7,20 (м, 3H), 7,03-6,96 (м, 2H), 4,15 (т, J=5,6, 2H), 3,18 (шир.д, 2H), 2,93 (т, J=5,6, 2H), 2,71-2,61 (м, 2H), 2,22-2,10 (м, 8H).
Пример 57

1-(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ил)этанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 1-(4-фенилпиперидин-4-ил)этанона. Масс-спектр (ESI): масса, вычисленная для С28Н28N2О4; 456,20; m/z найдено 457,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,52-7,49 (м, 1H), 7,43-7,40 (м, 1H), 7,37-7,16 (м, 9H), 6,99-6,92 (м, 2H), 4,10 (т, J=5,8, 2H), 2,87-2,82 (м, 2H), 2,78 (т, J=5,8, 2H), 2,51-2,47 (м, 2H), 2,39 (шир.т, 2H), 2,17-2,05 (м, 2H), 1,92 (с, 3H).
Пример 58
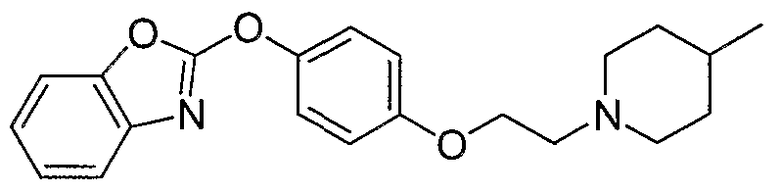
2-{4-[2-(4-метилпиперидин-1-ил)этокси]фенокси}бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 4-метилпиперидина. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О3; 352,18; m/z найдено 353,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50 (д, J=6,8, 1H), 7,42 (д, J=6,8, 1H), 7,31 (д, J=9,0, 2H), 7,30-7,20 (м, 2H), 6,97 (д, J=9,0, 2H), 4,13 (т, J=6,0, 2H), 2,97 (д, J=11,7, 2H), 2,80 (т, J=6,0, 2H), 2,11 (дт, J=11,7, J=2,2, 2H), 1,67 (с, 2H), 1,34 (шир.с, 1H), 1,28 (дт, J=12,2, J=3,4, 2H), 0,94 (д, J=6,2, 3H).
Пример 59

1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 4-(4-хлорфенил)пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С26Н25ClN2О4; 464,15; m/z найдено 465,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,54-7,42 (м, 4H), 7,37-7,31 (м, 4H), 7,29-7,21 (м, 2H), 7,03-6,98 (м, 2H), 4,16 (т, J=5,8, 2H), 2,93-2,89 (м, 4H), 2,62 (дт, J=12,2, 2,4, 2H), 2,21-2,14 (м, 2H), 1,78-1,74 (м, 2H), 1,56 (шир.с, 1H).
Пример 60

1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 4-(4-бромфенил)пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С26Н25BrN2О4; 508,10; m/z найдено 509,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,55-7,47 (м, 3H), 7,44-7,39 (м, 3H), 7,37-7,31 (м, 2H), 7,30-7,19 (м, 2H), 7,02-6,98 (м, 2H), 4,17 (т, J=5,7, 2H), 2,94-2,89 (м, 4H), 2,62 (дт, J=12,2, 2,4, 2H), 2,21-2,13 (м, 2H), 1,78-1,74 (м, 2H), 1,56 (шир.с, 1H).
Пример 61

1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-хлор-3-трифторметилфенил)пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 4-(4-хлор-3-трифторметилфенил)пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С27Н24ClF3N2О4; 532,14; m/z найдено 533,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,89 (д, J=2,1, 1H), 7,62 (дд, J=8,4, 2,1, 1H), 7,51-7,41 (м, 3H), 7,33-7,21 (м, 4H), 6,99-6,95 (м, 2H), 4,14 (т, J=5,7, 2H), 2,94-2,89 (м, 4H), 2,65-2,59 (м, 2H), 2,21-2,13 (м, 4H), 1,74 (шир.с, 1H).
Пример 62
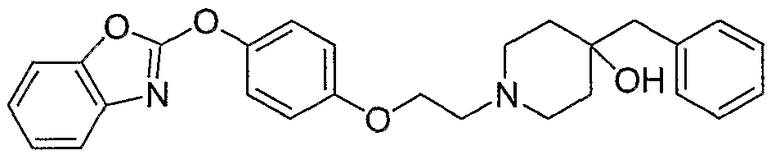
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 4-бензилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О4; 444,20; m/z найдено 445,1 [М+Н]+. 1H ЯМР: (400 МГц, CDCl3) 7,53-7,50 (м, 1H), 7,43-7,40 (м, 1H), 7,53-7,21 (м, 10H), 7,01-6,95 (м, 2H), 4,12 (т, J=5,9, 2H), 2,84 (т, J=5,8, 2H), 2,78-2,76 (м, 4H), 2,47 (дт, J=11,6, 2,4, 2H), 1,83-1,75 (м, 2H), 1,59-1,53 (м, 2H).
Пример 63

{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклогексилметиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием циклогексилметиламина. Масс-спектр (ESI): масса, вычисленная для С22Н26N2О3; 366,19; m/z найдено 367,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,62 (дд, J=6,2, J=2,0, 1H), 7,50 (дд, J=6,1, 2,1, 1H), 7,42 (д, J=9,1, 2H), 7,35-7,25 (м, 2H), 7,03 (д, J=9,1, 2H), 4,04 (т, J=6,1, 2H), 2,79 (т, J=6,1, 2H), 2,45-2,32 (м, 1H), 1,73(д, J=7,9, 4H), 1,57 (д, J=12,2, 2H), 1,30-1,12 (м, 4H), 1,10-1,00 (м, 1H).
Пример 64

{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклопропилметилпропиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием циклопропилметилпропиламина. Масс-спектр (ESI): масса, вычисленная для С22Н26N2О3; 366,19; m/z найдено 367,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,52-7,50 (м, 1H), 7,44-7,41 (м, 1H), 7,33-7,21 (м, 4H), 6,99-6,95 (м, 2H), 4,09 (т, J=6,2, 2H), 3,01 (т, J=6,2, 2H), 2,64-2,59 (м, 2H), 2,49 (д, J=J 6,3, 2H), 1,60-1,50 (м, 2H), 0,92 (т, J=7,3, 4H), 0,55-0,52 (м, 2H), 0,16-0,13 (м, 2H).
Пример 65
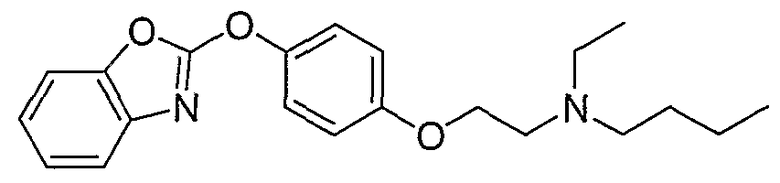
{2-[4-(бензооксазол-2-илокси)фенокси]этил}бутилэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием бутилэтиламина. Масс-спектр (ESI): масса, вычисленная для С21Н26N2О3; 354,19; m/z найдено 355,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,41 (д, J=7,2, 1H), 7,32 (дд, J=7,3, 1,6, 1H), 7,22 (д, J=9,1, 1H), 7,18-7,10 (м, 2H), 6,87 (д, J=9,1, 2H), 4,02 (шир.с, 2H), 2,85 (шир.с, 2H), 2,61 (шир.с, 2H), 2,49 (шир.с, 2H), 1,42 (шир.с, 2H), 1,31-1,19 (м, 2H), 1,05 (шир.с, 3H), 0,83 (т, J=7,3, 3H).
Пример 66

2-({2-[4-(бензооксазол-2-илокси)фенокси]этил}бензиламино)этанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием бензиламиноэтанола. Масс-спектр (ESI): масса, вычисленная для С24Н24N2О4; 404,17; m/z найдено 405,2 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,46-7,37(м, 3H), 7,33 (д, J=16,9, 2H), 7,29-7,00 (м, 6H), 6,95 (д, J=6,9, 2H), 4,06 (т, J=5,8, 2H), 3,76 (с, 2H), 3,64 (т, J=6,2, 2H), 2,95 (д, J=5,8, 2H), 2,76 (т, J=6,1, 2H).
Пример 67
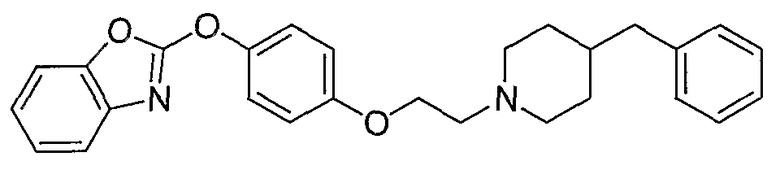
2-{4-[2-(4-бензилпиперидин-1-ил)этокси]фенокси}бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 4-бензилпиперидина. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О3; 428,21; m/z найдено 429,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,53-7,50 (м, 1H), 7,44-7,41 (м, 1H), 7,33-7,15 (м, 9H), 6,98-6,95 (м, 2H), 4,11 (т, J=6,0, 2H), 3,01-2,96 (м, 2H), 2,79 (т, J=6,0, 2H), 2,55 (д, J=7,0, 2H), 2,09-2,02 (м, 2H), 1,67-1,64 (м, 2H), 1,59-1,51 (м, 1H) 1,40-1,29 (м, 2H).
Пример 68

(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-3-ил)метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием пиперидин-3-илметанола. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О4; 368,17; m/z найдено 369,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,55-7,52 (м, 1H), 7,48-7,44 (м, 1H), 7,38-7,23 (м, 4H), 7,05-6,99 (м, 2H), 4,23 (т, J=5,6, 2H), 3,71 (дд, J=10,7, 5,1, 1H), 3,59 (дд, J=10,6, 6,4, 1H), 3,09 (шир.д, J=9,7, 1H), 2,94 (т, J=5,6, 2H), 2,42 (т, J=9,1, 1H), 2,29 (т, J=9,3, 1H), 2,24-1,98 (м, 2H), 2,00-1,90 (м, 1H), 1,90-1,80 (м, 1H), 1,80-1,71 (м, 2H), 1,20-1,10 (м, 1H).
Пример 69
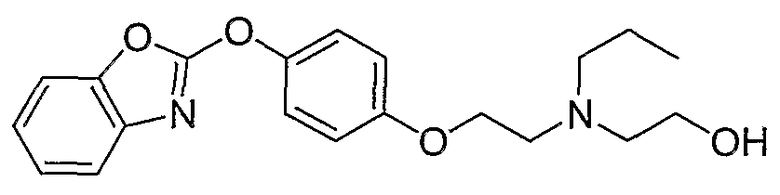
2-({2-[4-(бензооксазол-2-илокси)фенокси]этил}пропиламино)этанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, с использованием 2-пропиламиноэтанола. Масс-спектр (ESI): масса, вычисленная для С20Н24N2О4; 356,17; m/z найдено 357,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,62 (дд, J=6,2, 2,0, 1H), 7,50 (дд, J=6,1, 2,1, 1H), 7,42 (д, J=9,1, 2H), 7,35-7,25 (м, 2H), 7,03 (д, J=9,1, 2H), 4,31 (т, J=5,4, 1H), 4,04 (т, J=6,0, 2H), 3,46 (кв, J=6,4, 2H), 2,85 (т, J=6,0, 2H), 2,59 (т, J=6,5, 2H), 2,51-2,48 (м, 2H), 1,41 (кв, J=7,4, 2H), 0,84 (т, J=7,3, 3H).
Пример 70

1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-фенилфенилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, с использованием 4-фенилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С26Н26N2О3S; 446,17; m/z найдено 447,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,1, 1H), 7,66 (д, J=7,4, 1H), 7,54 (д, J=7,6, 2H), 7,42-7,35 (м, 3H), 7,33-7,22 (м, 4H), 6,99 (д, J=9,0, 2H), 4,19 (т, J=5,8, 2H), 2,98-2,86 (м, 4H), 2,65 (дт, J=13,8, 2,1, 2H), 2,24 (дт, J=13,4, 4,5, 2H), 1,80 (дд, J=14,1, 2,2, 2H).
Пример 71

{2-[4-(бензотиазол-2-илокси)фенокси]этил}циклогексилэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, с использованием циклогексилэтиламина. Масс-спектр (ESI): масса, вычисленная для С23Н28N2О2S; 396,19; m/z найдено 397,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,1, 1H), 7,65 (д, J=7,9, 1H), 7,39 (т, J=7,9, 4H), 7,30-7,20 (м, 4H), 6,96 (д, J=8,9, 2H), 3,98 (т, J=6,8, 2H), 2,89 (т, J=6,8, 2H), 2,66 (кв, J=7,1, 2H), 2,55-2,50 (м, 1H), 1,82 (т, J=7,7, 4H), 1,65 (д, J=11,9, 1H), 1,30-1,18 (м, 4H), 1,09 (т, J=7,2, 4H).
Пример 72

1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, с использованием 4-(4-хлорфенил)пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С26Н25ClN3О3S; 480,13; m/z найдено 481,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=7,6, 1H), 7,66 (дд, J=7,9, 0,8, 1H), 7,49-7,45 (м, 2H), 7,41-7,22 (м, 6H), 7,01-6,97 (м, 2H), 4,18 (т, J=5,8, 2H), 2,96-2,89 (м, 4H), 2,63 (дт, J=12,1, 2,4, 2H), 2,21-2,14 (м, 2H), 1,79-1,74 (м, 2H), 1,56 (шир.с, 1H).
Пример 73
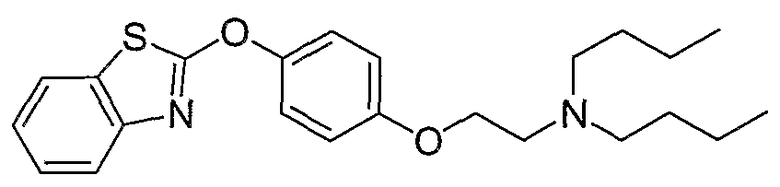
{2-[4-(бензотиазол-2-илокси)фенокси]этил}дибутиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, с использованием дибутиламина. Масс-спектр (ESI): масса, вычисленная для С23Н30N2О2S; 398,20; m/z найдено 399,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,63 (д, J=8,1, 1H), 7,55 (д, J=7,9, 1H), 7,28 (тт, J=7,7, 1,3, 1H), 7,20-7,13 (м, 3H), 6,85 (д, J=12,8, 2H), 3,96 (т, J=5,6, 2H), 2,80 (м, 2H), 2,43 (м, 4H), 1,38 (м, 4H), 1,22 (м, 4H), 0,83 (т, J=7,3 Гц, 6H).
Пример 74

1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, с использованием 4-(4-бромфенил)пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С26Н25BrN2О3S; 524,08; m/z найдено 525,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (дд, J=8,0, 0,6, 1H), 7,67 (дд, J=8,0, 0,8, 1H), 7,53-7,47 (м, 2H), 7,43-7,37 (м, 3H), 7,30-7,22 (м, 3H), 7,01-6,98 (м, 2H), 4,17 (т, J=5,8, 2H), 2,94-2,89 (м, 4H), 2,63 (дт, J=12,1, 2,5, 2H), 2,21-2,14 (м, 2H), 1,76 (дд, J=14,2, 2,6, 2H), 1,56 (шир.с, 1H).
Пример 75

1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-хлор-3-трифторметилфенил)пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, с использованием 4-(4-хлор-3-трифторметилфенил)пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С27Н24ClF3N2О3S; 548,11; m/z найдено 549,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,89 (д, J=2,1, 1H), 7,62-7,48 (м, 4H), 7,41-7,37 (м, 1H), 7,30-7,24 (м, 3H), 7,01-6,97 (м, 2H), 4,17 (т, J=5,8, 2H), 2,94-2,91 (м, 6H), 2,66-2,59 (м, 2H), 2,22-2,15 (м, 2H), 1,83 (шир.с, 1H).
Пример 76

1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, с использованием 4-бензилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О3S; 460,18; m/z найдено 461,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,66 (д, J=7,7, 1H), 7,41-7,23 (м, 9H), 6,99-6,94 (м, 2H), 4,13 (т, J=5,9, 2H), 4,84 (т, J=5,9, 2H), 2,78 (м, 4H), 2,50-2,45 (м, 2H), 1,83-1,76 (м, 2H), 1,59-1,52 (м, 2H), 1,23 (шир.с, 1H).
Пример 77
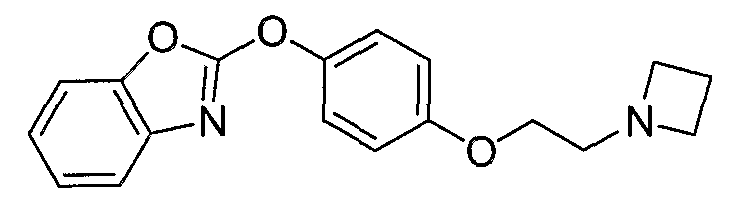
2-[4-(2-азетидин-1-илэтокси)фенокси]бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 21, с использованием азетидина. Масс-спектр (ESI): масса, вычисленная для С18Н18N2О3; 310,13; m/z найдено 311,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,61 (д, J=7,0, 2H), 7,48 (д, J=7,0, 2H), 7,41 (д, J=9,1, 2H), 7,32-7,24 (м, 2H), 7,00 (д, J=6,9, 2H), 3,93 (т, J=5,6, 2H), 3,18 (т, J=6,9, 4H), 2,70 (т, J=5,6, 2H), 1,97 (т, J=6,9, 2H).
Пример 78
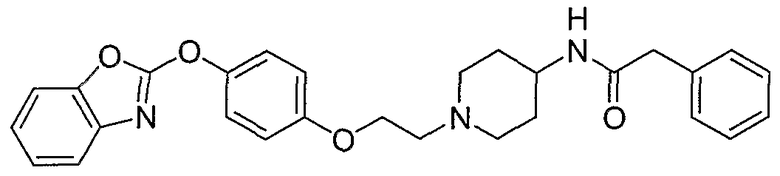
N-(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)-2-фенилацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 22, с использованием 2-фенил-N-пиперидин-4-илацетамида и 2-хлорбензоксазола. Масс-спектр (ESI): масса, вычисленная для С28Н29N3О4; 471,22; m/z найдено 472,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,55-7,51 (м, 1H), 7,47-7,43 (м, 1H), 7,41-7,23 (м, 9H), 7,00-6,95 (м, 2H), 5,28 (шир.д, J=7,8, 1H), 4,10 (т, J=5,7, 2H), 3,90-3,80 (м, 1H), 3,60 (с, 2H), 2,89 (шир.д, J=11,5, 2H), 2,81 (т, J=5,8, 2H), 2,28 (дт, J=11,6, 2,2, 2H), 1,92 (шир.дд, J=12,6, 2,3, 2H), 1,46-1,37 (м, 2H).
Пример 79
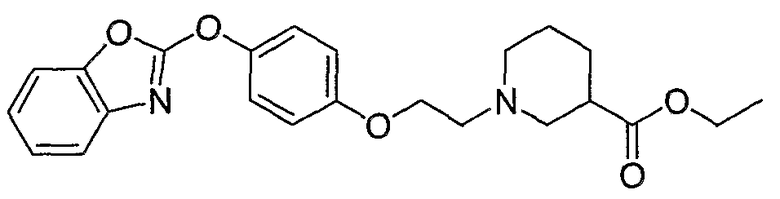
Этиловый эфир 1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-3-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 22, с использованием этилового эфира пиперидин-3-карбоновой кислоты и 2-хлорбензоксазола. Масс-спектр (ESI): масса, вычисленная для С23Н26N2О5; 410,18; m/z найдено 411,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,56-7,52 (м, 1H), 7,47-7,43 (м, 1H), 7,37-7,32 (м, 2H), 7,32-7,23 (м, 2H), 7,02-6,98 (м, 2H), 4,18 (кв, J=7,1, 2H), 4,15 (т, J=5,9, 2H), 3,14 (шир.д, J=8,2, 1H), 2,96-2,82 (м, 3H), 2,65 (тт, J=10,6, 3,7, 1H), 2,37 (т, J=10,7, 1H), 2,20 (дт, J=10,9, 2,7, 1H), 2,03-1,97 (м, 1H), 1,82-1,75 (м, 1H), 1,73-1,60 (м, 1H), 1,54-1,45 (м, 1H) 1,30 (т, J=7,2, 3H).
Пример 80

1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 22, с использованием 4-пиперидинилпиперидина. Масс-спектр (ESI): масса, вычисленная для С25Н31N3О2S; 437,21; m/z найдено 438,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=8,0, 1H), 7,69 (д, J=7,0, 1H), 7,42 (дт, J=7,1, 1,1, 1H), 7,35-7,26 (м, 3H), 7,04-6,97 (м, 2H), 4,15 (т, J=5,9, 2H), 3,11 (шир.д, J=11,7, 2H), 2,84 (т, J=6,0, 2H), 2,57 (шир.с, 2H), 2,40-2,30 (м, 1H), 2,16 (дт, J=11,7, 1,6, 1H), 1,85 (шир.д, J=12,1, 2H), 1,75-1,59 (м, 8H), 1,52-1,40 (м, 2H).
Пример 81

(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, с использованием пиперидиннил-4-илметанола. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О3S; 384,15; m/z найдено 385,1 [М+Н]+. 1H ЯМР (500 МГц, CDCl3): 7,75-7,73 (м, 1H), 7,67-7,65 (м, 1H), 7,41-7,37 (м, 1H), 7,31-7,36 (м, 3H), 6,98-6,95 (м, 2H), 4,13 (т, J=5,9, 2H), 3,52 (т, J=5,4, 2H), 3,10-3,03 (м, 2H), 2,83 (т, J=5,9, 2H), 2,14 (дт, J=11,8, 2,4, 2H), 1,78-1,75 (м, 2H), 1,58-1,52 (м, 2H), 1,37-1,30 (м, 2H).
Пример 82

N-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-2-фенилацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 22, с использованием 2-фенил-N-пиперидин-4-илацетамида. Масс-спектр (ESI): масса, вычисленная для С28Н29N3О3S; 487,19; m/z найдено 488,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78 (дд, J=8,0, 0,6, 1H), 7,69 (дд, J=7,9, 0,7, 1H), 7,45-7,24 (м, 9H), 7,00-6,88 (м, 2H), 5,33 (д, J=7,9, 1H), 4,10 (т, J=5,8, 2H), 3,90-3,79 (м, 1H), 3,60 (с, 2H), 2,88 (д, J=11,7, 2H), 2,80 (т, J=5,7, 2H), 2,27 (дт, J=11,6, 2,2, 2H), 1,92 (дд, J=12,7, 3,6, 2H), 1,39 (д.кв, J=11,1, 3,8, 2H).
Пример 83
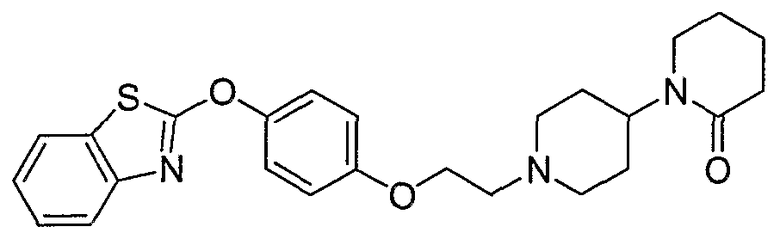
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 22, с использованием [1,4']бипиперидинил-2-она. Масс-спектр (ESI): масса, вычисленная для С25Н29N3О3S; 451,59; m/z найдено 452,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,91 (д, J=7,4, 1H), 7,67 (д, J=7,4, 1H), 7,45-7,32 (м, 4H), 7,06 (д, J=9,0, 2H), 4,35-4,15 (м, 1H), 4,10 (т, J=5,7, 2H), 3,15 (т, J=5,3, 2H), 3,00 (д, J=11,5, 2H), 2,71 (т, J=5,7, 2H), 2,21 (т, J=6,5, 2H), 2,10 (т, J=11,5, 2H), 1,75-1,60 (м, 6H), 1,43 (д, J=10,0, 2H).
Пример 84

2-(4-{2-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]этокси}фенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 22, с использованием 4-(2-пиперазин-1-илэтил)морфолина. Масс-спектр (ESI): масса, вычисленная для С25Н32N4О3S; 468,22; m/z найдено 469,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,91 (д, J=7,9, 1H), 7,67 (д, J=7,9, 1H), 7,45-7,32 (м, 4H), 7,06 (д, J=9,1, 2H), 4,09 (т, J=5,8, 2H), 3,54 (т, J=4,6, 2H), 2,68 (т, J=5,7, 2H), 2,50-2,20 (шир.с, 16H).
Пример 85
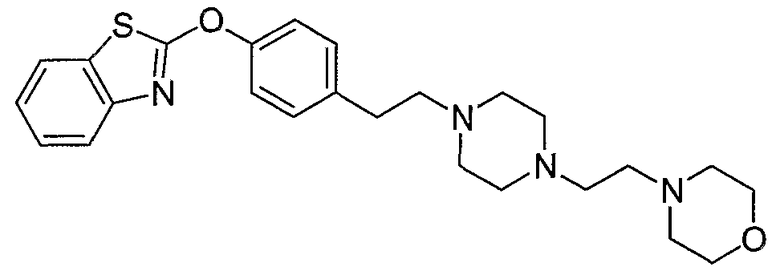
2-(4-{2-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]этил}фенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 32, с использованием 4-(2-пиперазин-1-илэтил)морфолина. Масс-спектр (ESI): масса, вычисленная для С25Н32N4О2S; 452,22; m/z найдено 453,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=8,0, 1H), 7,68 (д, J=8,0, 1H), 7,45-7,30 (м, 6H), 3,54 (т, J=4,5, 4H), 2,75 (т, J=8,3, 4H), 2,50-2,20 (шир.с, 16H).
Пример 86

2-{4-[3-(4-фенилпиперидин-1-ил)пропокси]фенокси}бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 27, с использованием 4-фенилпиперидина. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О3; 428,21; m/z найдено 429,2 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,40-7,38 (м, 1H), 7,34-7,32 (м, 1H), 7,24 (д, J=9,1, 2H), 7,22-7,12 (м, 4H), 7,07 (т, J=7,0, 1H), 6,94 (д, J=9,1, 2H), 3,99 (т, J=6,1, 2H), 3,06 (д, J=11,7, 2H), 2,57 (т, J=7,6, 2H), 2,49 (м, 1H), 2,13 (т, J=11,6, 2H), 1,97(м, 2H), 1,73 (м, 4H).
Пример 87

1-{3-[4-(бензотиазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 27, с использованием 2-хлорбензотиазола. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О3S; 460,18; m/z найдено 461,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,65 (д, J=7,8, 1H), 7,53 (д, J=8,2, 2H), 7,39-7,35 (м, 3H), 7,29-7,23 (м, 5H), 6,96 (д, J=9,1, 2H), 4,08 (т, J=6,2, 2H), 2,92 (м, 2H), 2,72-2,49 (м, 4H), 2,34-2,02 (м, 4H), 1,81 (д, J=12,3, 2H).
Пример 88
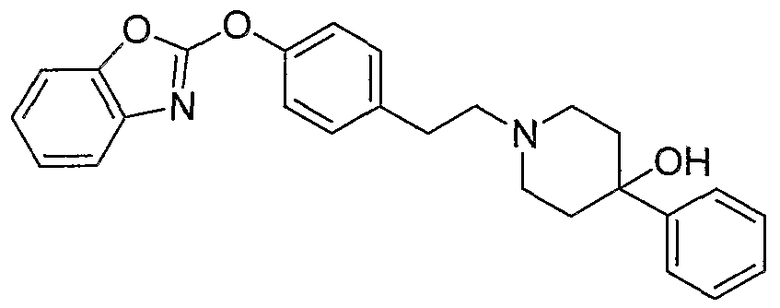
1-{2-[4-(бензооксазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 29, с использованием 4-фенилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О3; 414,51; m/z найдено 415,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,56-7,51 (м, 3H), 7,45-7,32 (м, 6H), 7,30-7,22 (м, 4H), 2,96-2,89 (м, 2H), 2,74-2,69 (м, 2H), 2,61-2,54 (м, 2H), 2,26-2,18 (м, 2H), 1,84-1,79 (м, 2H), 1,62 (шир.с, 1H).
Пример 89

{2-[4-(бензооксазол-2-илокси)фенил]этил}циклогексилэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 29, с использованием циклогексилэтиламина. Масс-спектр (ESI): масса, вычисленная для С23Н28N2О2; 364,22; m/z найдено 365,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,51 (д, J=7,8, 1H), 7,41 (д, J=7,6, 1H), 7,33-7,18 (м, 6H), 2,80-2,68 (м, 4H), 2,64 (дд, J=6,8, 7,04, 2H), 2,58-2,50 (м, 1H), 1,80 (т, J=8,8, 4H), 1,63 (д, J=12,3, 1H), 1,22 (дд, J=9,8, 8,4, 4H), 1,08 (т, J=7,0, 4H).
Пример 90
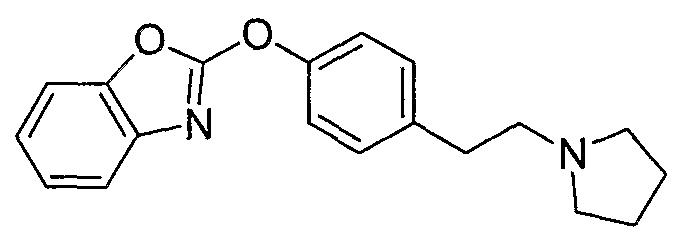
2-[4-(2-пирролидин-1-илэтил)фенокси]бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 29, с использованием пирролидина. Масс-спектр (ESI): масса, вычисленная для С19Н20N2О2; 308,15; m/z найдено 309,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,51 (д, J=7,6, 1H), 7,42 (д, J=7,2, 1H), 7,35-7,20 (м, 6H), 2,90-2,84 (м, 2H), 2,75-2,68 (м, 2H), 2,62-2,55 (м, 4H), 1,85-1,79 (м, 4H).
Пример 91
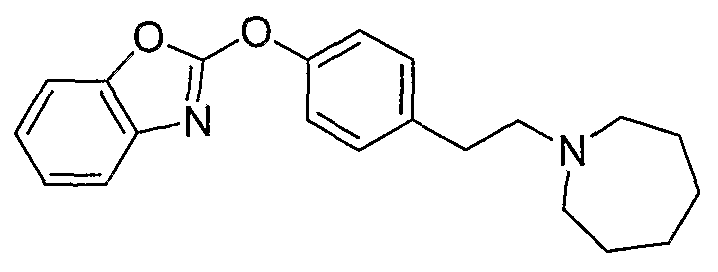
2-[4-(2-азепан-1-илэтил)фенокси]бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 29, с использованием азепана. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О2; 336,18; m/z найдено 337,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50 (д, J=7,6, 1H), 7,39 (д, J=7,8, 1H), 7,33-7,17 (м, 6H), 2,84-2,73 (м, 4H), 2,71 (т, J=5,3, 4H), 1,71-1,57 (м, 8H).
Пример 92

{2-[4-(бензооксазол-2-илокси)фенил]этил}циклопропилметилпропиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 29, с использованием циклопропилметилпропиламина. Масс-спектр (ESI): масса, вычисленная для С22Н26N2О2; 350,20; m/z найдено 351,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50 (д, J=7,6, 1H), 7,39 (д, J=7,8, 1H), 7,33-7,17 (м, 6H), 2,85-2,74 (м, 4H), 2,56 (т, J=7,6, 2H), 2,43 (д, J=6,5, 2H), 1,56-1,44 (м, 2H), 0,90 (т, J=7,2, 4H), 0,51 (дд, J=7,8, 5,5, 2H), 0,13 (дд, J=7,8, 5,5, 2H).
Пример 93
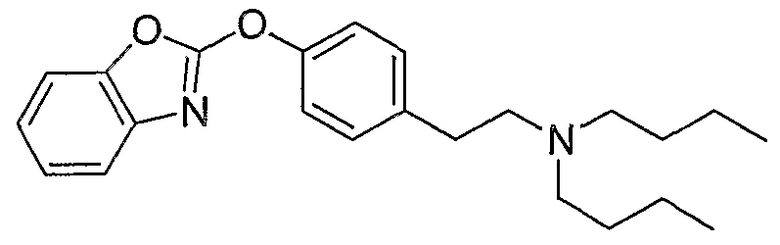
{2-[4-(бензооксазол-2-илокси)фенил]этил}дибутиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 29, с использованием дибутиламина. Масс-спектр (ESI): масса, вычисленная для С23Н30N2О2; 366,23; m/z найдено 367,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,51 (д, J=7,4, 1H), 7,39 (д, J=7,6, 1H), 7,33-7,17 (м, 6H), 2,80-2,66 (м, 4H), 2,49 (т, J=7,3, 4H), 1,50-1,40 (м, 4H), 1,37-1,26 (м, 4H), 0,93 (т, J=7,2, 6H).
Пример 94
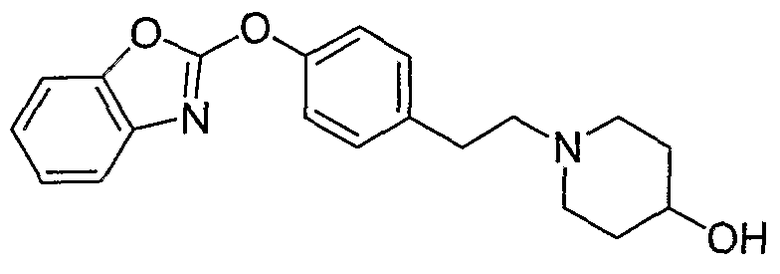
1-{2-[4-(бензооксазол-2-илокси)фенил]этил}пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 29, с использованием 4-гидроксипиперидина. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О3; 338,16; m/z найдено 339,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50 (д, J=7,6, 1H), 7,39 (д, J=7,6, 1H), 7,34-7,16 (м, 6H), 3,72-3,63 (м, 1H), 3,29 (шир.с, 1H), 2,91-2,78 (м, 4H), 2,63-2,56 (м, 2H), 2,21 (т, J=10,0, 2H), 1,96-1,86 (м, 2H), 1,70-1,57 (м, 2H).
Пример 95
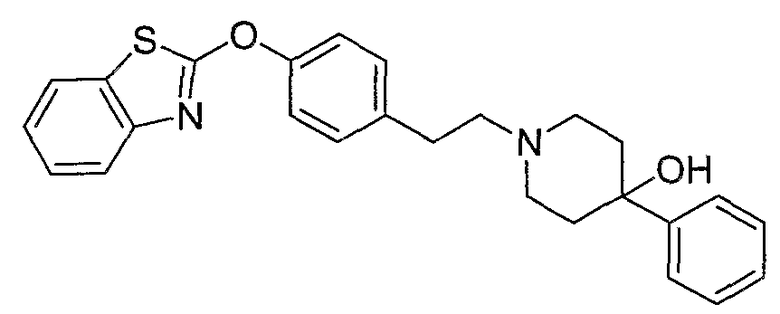
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 30, с использованием 4-фенилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С26Н26N2О3S; 430,57; m/z найдено 431,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76-7,74 (м, 1H), 7,67 (дд, J=8,0, 0,7, 1H), 7,56-7,53 (м, 2H), 7,42-7,36 (м, 3H), 7,33-7,26 (м, 6H), 2,96-2,86 (м, 4H), 2,75-7,71 (м, 2H), 2,64-2,56 (м, 2H) 2,27-2,18 (м, 2H), 1,86-1,80 (м, 2H), 1,67-1,66 (шир.м, 2H).
Пример 96
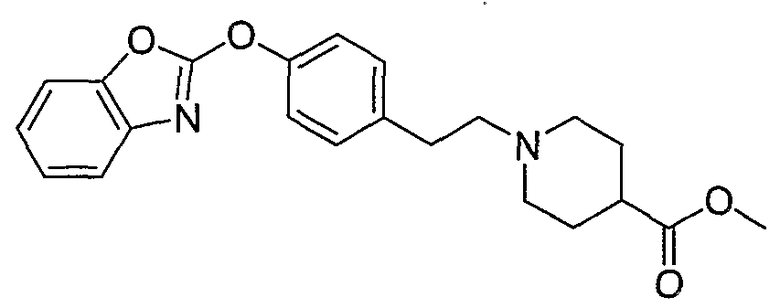
Метиловый эфир 1-{2-[4-(бензооксазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 29, с использованием метилового эфира пиперидин-4-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С22Н24N2О4; 380,17; m/z найдено 381,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,50 (д, J=8,1, 1H), 7,39 (д, J=8,1, 1H), 7,34-7,16 (м, 6H), 3,67 (с, 3H), 2,97-2,90 (м, 2H), 2,84-2,78 (м, 2H), 2,60-2,55 (м, 2H), 2,35-2,25 (м, 1H), 2,10 (т, J=11,4, 2H), 1,96-1,88 (м, 2H), 1,84-1,73 (м, 2H).
Пример 97

2-[4-(2-пирролидин-1-илэтил)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 30, с использованием пирролидина. Масс-спектр (ESI): масса, вычисленная для С19Н20N2ОS; 324,13; m/z найдено 325,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,0, 1H), 7,65 (д, J=8,0, 1H), 7,38 (т, J=7,2, 1H), 7,31-7,22 (м, 5H), 2,91-2,83 (м, 2H), 2,77-2,69 (м 2H), 2,64-2,55 (м, 4H), 1,87-1,77 (м, 4H).
Пример 98

2-[4-(2-азепан-1-илэтил)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 30, с использованием азепана. Масс-спектр (ESI): масса, вычисленная для С21Н24N2ОS; 352,16; m/z найдено 353,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,0, 1H), 7,65 (д, J=8,0, 1H), 7,37 (т, J=7,4, 1H), 7,30-7,22 (м, 5H), 2,87-2,70 (м, 8H), 1,73-1,57 (м, 8H).
Пример 99
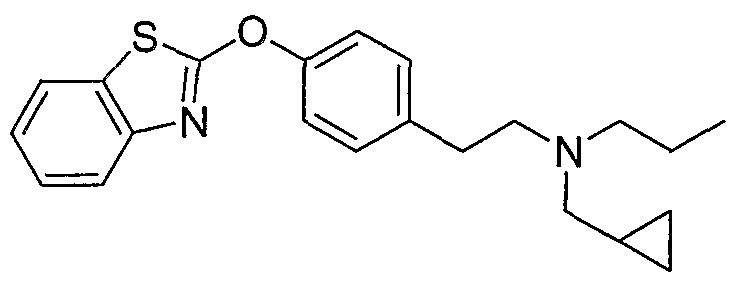
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметилпропиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 30, с использованием циклопропилметилпропиламина. Масс-спектр (ESI): масса, вычисленная для С22Н26N2ОS; 366,18; m/z найдено 367,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,6, 1H), 7,65 (д, J=8,2, 1H), 7,38 (т, J=8,6, 1H), 7,30-7,22 (м, 5H), 2,87-2,76 (м, 4H), 2,57 (т, J=7,6, 2H), 2,44 (д, J=6,5, 2H), 1,56-1,45 (м, 2H), 0,90 (т, J=7,4, 4H), 0,52 (дд, J=7,8, 5,5, 2H), 0,14 (дд, J=5,7, 5,1, 2H).
Пример 100

{2-[4-(бензотиазол-2-илокси)фенил]этил}дибутиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 30, с использованием дибутиламина. Масс-спектр (ESI): масса, вычисленная для С3Н30N2ОS; 382,21; m/z найдено 383,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,2, 1H), 7,65 (д, J=8,2, 1H), 7,38 (т, J=8,2, 1H), 7,30-7,22 (м, 5H), 2,82-2,67 (м, 4H), 2,51 (т, J=7,2, 4H), 1,50-1,40 (м, 4H), 1,37-1,25 (м, 4H), 0,93 (т, J=7,2, 6H).
Пример 101

2-[4-(2-пиперидин-1-илэтил)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 30, с использованием пиперидина. Масс-спектр (ESI): масса, вычисленная для С20Н22N2ОS; 338,48; m/z найдено 339,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,76-7,73 (м, 1H), 7,64-7,61 (м, 1H), 7,42-7,25 (м, 6H), 2,88-2,83 (м, 2H), 2,60-2,52 (м, 6H), 1,66-1,61 (м, 4H), 1,53-1,45 (м, 2H).
Пример 102

1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 30, с использованием 4-гидроксипиперидина. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О2S; 354,14; m/z найдено 355,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,2, 1H), 7,64 (д, J=8,0, 1H), 7,37 (т, J=8,2, 1H), 7,29-7,20 (м, 5H), 3,75-3,65 (м, 1H), 2,92-2,79 (м, 4H), 2,76 (шир.с, 1H), 2,65-2,55 (м, 2H), 2,21 (т, J=10,0, 2H), 1,98-1,87 (м, 2H), 1,70-1,57 (м, 2H).
Пример 103

Метиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 30, с использованием метилового эфира пиперидин-4-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С22Н24N2О2S; 396,15; m/z найдено 397,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,3, 1H), 7,66 (д, J=8,3, 1H), 7,38 (т, J=8,3, 1H), 7,29-7,23 (м, 5H), 3,69 (с, 3H), 3,00-2,93 (м, 2H), 2,87-2,80 (м, 2H), 2,63-2,56 (м, 2H), 2,38-2,28 (м, 1H), 2,11 (т, J=11,1, 2H), 1,98-1,91 (м, 2H), 1,86-1,74 (м, 2H).
Пример 104
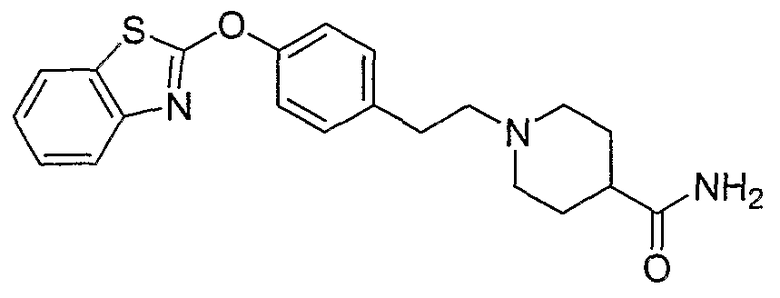
Амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием амида пиперидин-4-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С21Н23N3О2S; 381,15; m/z найдено 382,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78 (дд, J=8,1, 0,4, 1H), 7,71 (дд, J=7,9, 0,7, 1H), 7,43 (дт, J=7,5, 2,3, 1H), 7,35-7,25 (м, 5H), 5,51 (шир.д, J=26,0, 1H), 3,09 (шир.д, J=11,7, 2H), 2,87, (дд, J=8,3, 7,6, 2H), 2,65 (дд, J=8,5, 5,4, 2H), 2,29-2,18 (м, 1H), 2,13 (т, J=11,4, 2H), 1,98 (шир.д, J=11,2, 2H), 1,87-1,77 (м, 2H).
Пример 105
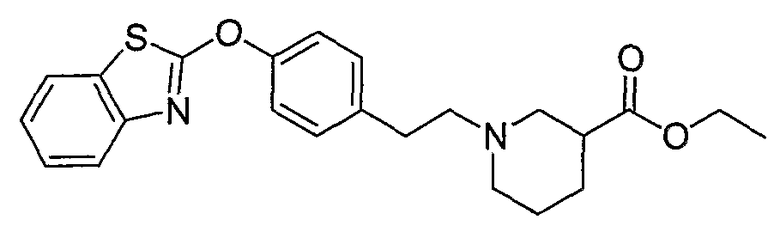
Этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием этилового эфира пиперидин-3-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С23Н26N3О2S; 410,17; m/z найдено 411,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=8,0, 1H), 7,70 (дд, J=7,9, 0,5, 1H), 7,42 (дт, J=7,5, 1,3, 1H), 7,34-7,27 (м, 5H), 4,18 (кв, J=7,1, 2H), 3,13 (шир.д, J=8,8, 1H), 2,92-2,85 (м, 2H), 2,70-2,59 (м, 2H), 2,30 (т, J=10,7, 1H), 2,13 (дт, J=10,9, 2,7, 1H), 2,04-1,97 (м, 1H), 1,84-1,76 (м, 1H), 1,71-1,59 (м, 1H), 1,57-1,45 (м, 1H) 1,30 (т, J=7,2, 3H).
Пример 106

Этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием этилового эфира 4-фенилпиперидин-4-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С29Н30N3О2S; 486,20; m/z найдено 487,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78 (дд, J=8,1, 0,5, 1H), 7,70 (дд, J=7,9, 0,7, 1H), 7,46-7,24 (м, 11H), 4,19 (кв, J=7,1, 2H), 3,06 (шир.д, J=10,1, 2H), 2,96-2,90 (м, 2H), 2,75-2,64 (м, 4H), 2,35 (т, J=11,0, 2H), 2,14, (т, J=11,3, 2H), 1,24, (т, J=7,3, 3H).
Пример 107
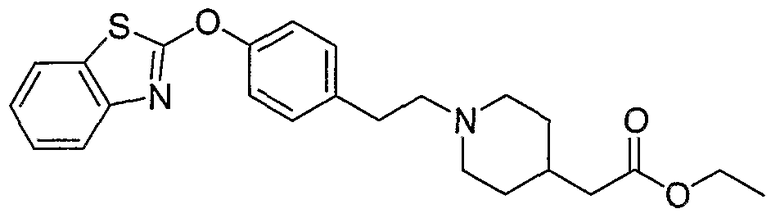
Этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)уксусной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием этилового эфира пиперидин-4-илуксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С24Н28N3О3S; 424,18; m/z найдено 425,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (д, J=7,8, 1H), 7,70 (дд, J=7,9, 0,6, 1H), 7,41 (дт, J=7,2, 1,2, 1H), 7,36-7,27 (м, 5H), 4,18 (кв, J=5,3, 2H), 3,21 (д, J=11,3, 2H), 3,03-2,99, (м, 2H), 2,83-2,78 (м, 2H), 2,33-2,25 (м, 4H), 2,00-1,87 (м, 1H), 1,86 (д, J=14,3, 2H), 1,67-1,55 (м, 2H), 1,29 (т, J=7,1, 3H).
Пример 108
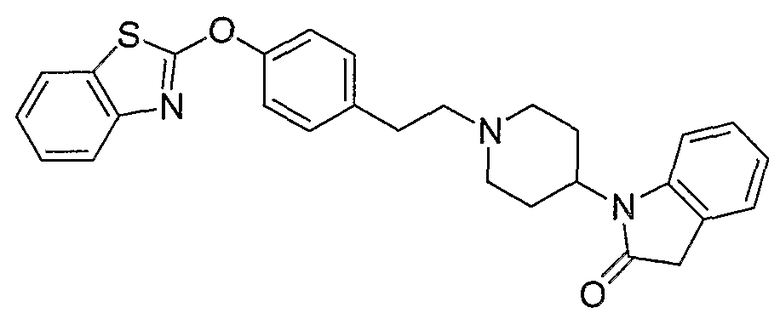
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-1,3-дигидроиндол-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием 1-пиперидин-4-ил-1,3-дигидроиндол-2-она. Масс-спектр (ESI): масса, вычисленная для С28Н27N3О2S; 469,18; m/z найдено 470,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,75 (дд, J=8,1, 0,4, 1H), 7,68 (дд, J=7,9, 0,6, 1H), 7,40 (дт, J=7,5, 1,2, 1H), 7,36-7,23 (м, 8H), 7,04 (дт, J=7,3, 1,7, 1H), 4,57-4,45 (м, 1H), 3,54 (с, 2H), 3,36 (шир.д, J=10,9, 2H), 3,00 (дд, J=11,4, 6,3, 1H), 2,88 (дд, J=8,8, 4,5, 2H), 2,75-2,62 (м, 2H), 2,45 (т, J=11,5, 2H), 1,80 (дд, J=12,3, 2,1, 2H).
Пример 109
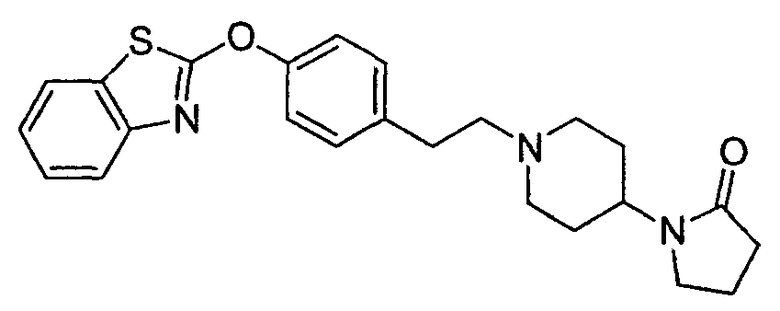
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)пирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием 1-пиперидин-4-илпирролидин-2-она. Масс-спектр (ESI): масса, вычисленная для С24Н27N3О2S; 421,18; m/z найдено 422,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (д, J=8,0, 1H), 7,69 (дд, J=8,0, 0,9, 1H), 7,41 (дт, J=7,5, 1,2, 1H), 7,32-7,27 (м, 5H), 4,05 (дт, J=11,9, 4,5, 1H), 3,40 (т, J=7,0, 2H), 3,10 (шир.д, J=11,7, 2H), 2,86 (дд, J=11,0, 7,7, 2H), 2,66 (дд, J=8,8, 5,3, 2H), 2,43 (т, J=8,1, 2H), 2,19 (дт, J=11,6, 2,8, 2H), 2,09-2,00 (м, 2H), 1,85-1,69 (м, 4H).
Пример 110

N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-2-фенилацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием 2-фенил-N-пиперидин-4-илацетамида. Масс-спектр (ESI): масса, вычисленная для С28Н29N3О2S; 471,20; m/z найдено 472,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд J=8,1, 0,5, 1H), 7,70 (дд, J=7,8, 0,7, 1H), 7,45-7,37 (м, 3H), 7,36-7,26 (м, 8H), 5,39 (шир.д, J=7,9, 1H), 3,93-3,82 (м, 1H), 3,60 (с, 2H), 2,93 (шир.д, J=11,1, 2H), 2,86 (дд, J=10,9, 7,6, 2H), 2,65 (дд, J=8,5, 5,2, 2H), 2,25 (т, J=11,2, 2H), 1,95 (дд, J=12,8, 3,3, 2H), 1,47 (м, 2H).
Пример 111

8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-2,8-диаза-спиро[4.5]декан-1-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием 2,8-диаза-спиро[4.5]декан-1-она. Масс-спектр (ESI): масса, вычисленная для С23Н25N3О2S; 407,17; m/z найдено 408,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78 (д, J=8,1, 1H), 7,70 (дд, J=7,8, 0,6, 1H), 7,42 (дт, J=7,6, 1,3, 1H), 7,35-7,25 (м, 5H), 6,40 (шир.с, 1H), 3,40 (т, J=6,9, 2H), 3,00 (дт, J=11,6, 3,6, 2H), 2,88 (дд, J=10,3, 7,4, 2H), 2,67 (дд, J=8,5, 5,7, 2H), 2,23 (т, J=10,7, 2H), 2,10-2,00 (м, 4H), 1,52 (шир.д, J=13,1, 2H).
Пример 112

1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием 3-гидроксипиперидина. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О2S; 354,14; m/z найдено 355,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=7,6, 1H), 7,70 (дд, J=8,0, 0,8, 1H), 7,42 (дт, J=7,5, 1,2, 1H), 7,35-7,28 (м, 5H), 3,89 (м, 1H), 2,89 (дд, J=10,1, 7,3, 2H), 2,71-2,65 (м, 2H), 2,64-2,54 (м, 2H), 2,53-2,36 (м, 3H), 1,92-1,80 (м, 1H), 1,74-1,55 (м, 3H).
Пример 113
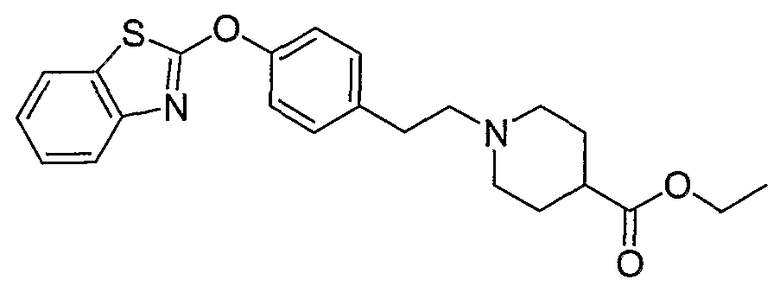
Этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием этилового эфира пиперидин-3-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С23Н26N2О3S; 410,17; m/z найдено 411,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=8,0, 1H), 7,69 (дд, J=7,9, 0,7, 1H), 7,41 (дт, J=7,5, 1,2, 1H), 7,32-7,27 (м, 5H), 4,18 (кв, J=7,1, 2H), 3,00 (шир.д, J=11,5, 2H), 2,88 (дд, J=10,9, 7,7, 2H), 2,64 (дд, J=8,5, 5,3, 2H), 2,35 (тт, J=10,9, 4,3, 1H), 2,14, (т, J=10,9, 2H), 2,02-1,94 (м, 2H), 1,90-1,78 (м, 2H), 1,30 (т, J=7,3, 3H).
Пример 114

1'-{2-[4-(бензотиазол-2-илокси)фенил]этил}-[1,4']бипиперидин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 31, с использованием 4-пиперидинилпиперидина. Масс-спектр (ESI): масса, вычисленная для С25Н31N3ОS; 421,22; m/z найдено 422,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,75 (д, J=7,8, 1H), 7,69 (дд, J=7,8, 0,6, 1H), 7,41 (дт, J=7,6, 1,2, 1H), 7,33-7,25 (м, 5H), 3,15 (шир.д, J=11,6, 2H), 2,90-2,70 (м, 7H) 2,65 (дд, J=8,5, 5,3, 2H), 2,18-2,06 (м, 4H), 1,99-1,87 (м, 4H), 1,85-1,75 (м, 2H), 1,64-1,56 (м, 2H).
Пример 115

2-{4-[2-(4-метилпиперазин-1-ил]этил}фенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 32, с использованием 1-метилпиперазина. Масс-спектр (ESI): масса, вычисленная для С20Н23N3ОS; 353,16; m/z найдено 354,1 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,77 (д, J=8,01, 1H), 7,64 (д, J=8,1, 1H), 7,41 (т, J=8,2, 1H), 7,37 (д, J=8,6, 2H), 7,32-7,28 (м, 3H), 2,81-2,35 (м, 8H), 2,87 (м, 2H), 2,65 (м, 2H), 2,30 (с, 3H).
Пример 116

1-{3-[4-(бензооксазол-2-илокси)фенил]пропил}-4-фенилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 35, с использованием 4-фенилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О3; 428,21; m/z найдено 429,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,48 (д, J=8,4, 1H), 7,45 (м, 11H), 7,19 (т, J=8,3, 1H), 4,76 (с, 1H), 2,66 (т, J=7,6, 4H), 2,45 (м,4H), 1,92 (т, J=7,1, 2H), 1,78 (т, J=7,1, 2H), 1,58 (д, J=12,3, 2H).
Пример 117

1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 37, с использованием 4-(4-бромфенил)пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С26Н26BrN3О3; 507,12; m/z найдено 508,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,43-7,07 (м, 10H), 6,94-6,89 (м, 2H), 4,11 (т, J=5,8, 2H), 2,87-2,83 (м, 4H), 2,65-2,58 (м, 2H), 2,13-2,05 (м, 2H), 1,75-1,68 (м, 2H).
Пример 118
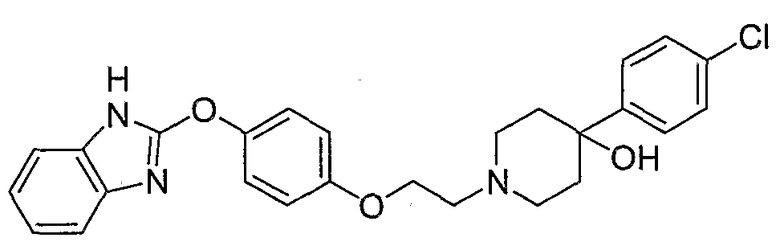
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 37, с использованием 4-(4-хлорфенил)пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С26Н28ClN3О3; 463,17; m/z найдено 464,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,38-7,22 (м, 6H), 7,17-7,12 (м, 2H), 7,09-7,04 (м, 2H), 6,91-6,81 (м, 2H), 4,08 (т, J=5,6, 2H), 2,84-2,80 (м, 4H), 2,62 (т, J=11,8, 2H), 2,09-2,02 (м, 2H), 1,70-1,65 (м, 2H).
Пример 119
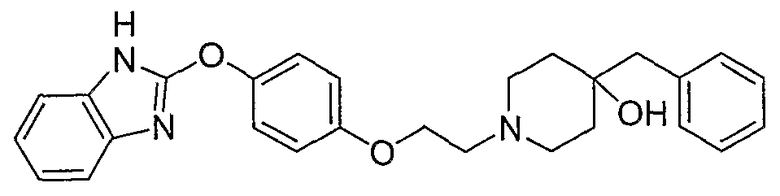
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 37, с использованием 4-бензилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С27Н29N3О3; 443,22; m/z найдено 444,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,53 (шир.с, 1H), 7,34-7,24 (м, 4H), 7,26-7,16 (м, 7H), 6,91-6,85 (м, 2H), 4,08 (т, J=5,8, 2H), 2,85-2,77 (м, 6H), 2,48 (дт, J=2,5, 11,7, 2H), 1,84-1,76 (м, 2H), 1,56 (м, 2H).
Пример 120

2-[4-(3-пиперидин-1-илпропил)фенокси]бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 35, с использованием пиперидина. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О2; 336,18; m/z найдено 337,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,62 (дд, J=5,7, 2,1, 1H), 7,50 (дд, J=6,1, 2,1, 1H), 7,45-7,35 (м, 2H), 7,35-7,25 (м, 4H), 2,62 (т, J=7,6, 2H), 2,30 (с, 4H), 2,25 (т, J=7,4, 2H), 1,80-1,70 (м, 2H), 1,55-1,45 (м, 4H), 1,42-1,35 (м, 2H).
Пример 121
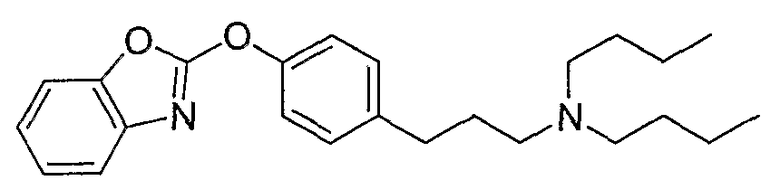
{3-[4-(бензооксазол-2-илокси)фенил]пропил}дибутиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 35, с использованием дибутиламина. Масс-спектр (ESI): масса, вычисленная для С24Н32N2О2; 380,25; m/z найдено 381,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,63 (дд, J=6,1, 2,1, 1H), 7,50 (дд, J=6,1, 2,1, 1H), 7,40 (д, J=8,6, 2H), 2,63 (т, J=7,7, 2H), 2,50-2,30 (м, 6H), 1,70 (квинтет, J=7,2, 2H), 1,40-1,20 (м, 8H), 0,88 (т, J=7,1, 6H).
Пример 122
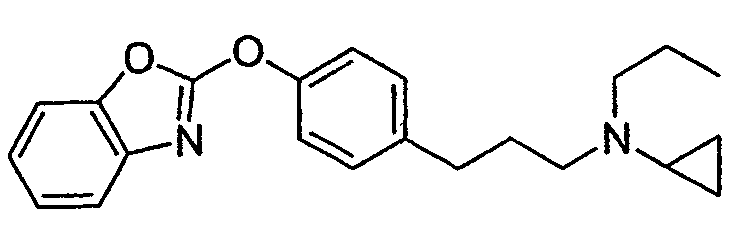
{3-[4-(бензооксазол-2-илокси)фенил]пропил}циклопропилметилпропиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 35, с использованием циклопропилметилпропиламина. Масс-спектр (ESI): масса, вычисленная для С23Н28N2О2; 364,22; m/z найдено 365,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d6): 7,63 (д, J=8,6, 1H), 7,40 (д, J=8,6, 1H), 7,32 (д, J=8,5, 2H), 7,30-7,25 (м, 4H), 2,63 (т, J=7,6, 2H), 2,41 (т, J=7,2, 2H), 2,28 (д, J=6,3, 2H), 1,71 (квинтет, J=7,2, 2H), 1,38 (кв, J=7,2, 2H), 0,85 (т, J=7,3, 2H), 0,88-0,77 (м, 2H), 0,42 (д, J=4,2, 2H), 0,05 (д, J=4,8, 2H).
Пример 123
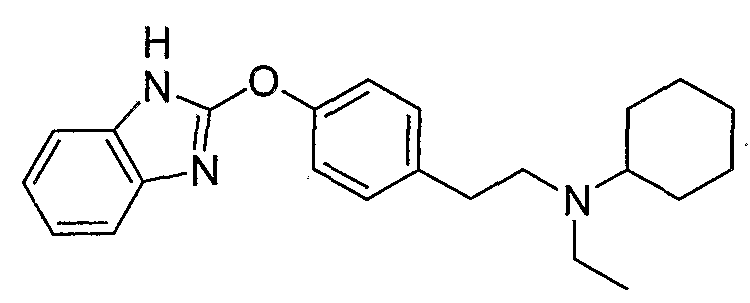
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклогексилэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 38, с использованием циклогексилэтиламина. Масс-спектр (ESI): масса, вычисленная для С23Н29N3О; 363,23; m/z найдено 364,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 11,44(шир.с, 1H), 7,43-7,33 (м, 2H), 7,13-7,05 (м, 6H), 3,17 (т, J=11,7, 1H), 3,10 (дд, J=7,0, 7,0, 2H), 2,99-2,83 (м, 4H), 2,06 (д, J=9,8, 2H), 1,89 (д, J=12,5, 2H), 1,69(д, J=12,5, 1H), 1,49-1,22 (м, 7H), 1,19-1,05 (м, 1H).
Пример 124

2-[4-(2-пирролидин-1-илэтил)фенокси]-1Н-бензоимидазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 38, с использованием пирролидина. Масс-спектр (ESI): масса, вычисленная для С19Н21N3О; 307,17; m/z найдено 308,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,35-7,22 (м, 2H), 7,14-7,04 (м, 6H), 2,79-2,72 (м, 2H), 2,67-2,57 (м, 6H), 1,87-1,77 (м, 4H).
Пример 125

2-[4-(2-азепан-1-илэтил)фенокси]-1Н-бензоимидазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 38, с использованием азепана. Масс-спектр (ESI): масса, вычисленная для С21Н25N3О; 335,20; m/z найдено 336,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,38 (дд, J=3,1, 2,7, 2H), 7,11 (дд, J=3,1, 2,9, 2H), 7,10-7,00 (м, 4H), 3,25-3,15 (м, 4H), 3,06 (дд, J=6,3, 5,3, 2H), 2,93 (дд, J=6,1, 4,3, 2H), 2,00-1,91 (м, 4H), 1,75-1,67 (м, 4H).
Пример 126

{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}дибутиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 38, с использованием дибутиламина. Масс-спектр (ESI): масса, вычисленная для С23Н31N3О; 365,5; m/z найдено 366,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,40-7,29 (м, 2H), 7,17-7,06 (м, 6H), 2,83-2,60 (м, 8H), 1,59-1,47 (м, 4H), 1,38-1,26 (м, 4H), 0,93 (т, J=7,2, 6H).
Пример 127

1-{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 38, с использованием 4-гидроксипиперидина. Масс-спектр (ESI): масса, вычисленная для С20Н23N3О2; 337,18; m/z найдено 338,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 11,70 (шир.с, 1H), 7,50-7,44 (м, 1H), 7,33-7,27 (м, 1H), 7,24 (шир.с, 4H), 7,14-7,07 (м, 2H), 3,93 (шир.с, 1H), 3,68-3,58 (м, 1H), 2,97-2,75 (м, 4H), 2,63-2,52 (м, 2H), 2,19 (т, J=9,8, 2H), 1,94-1,84 (м, 2H), 1,65-1,54 (м, 2H).
Пример 128

Метиловый эфир 1-{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 38, с использованием метилового эфира пиперидин-4-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С22Н25N3О3; 379,19; m/z найдено 380,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 11,76 (шир.с, 1H), 7,50-7,44 (м, 1H), 7,24-7,06 (м, 7H), 3,68 (с, 3H), 3,00-2,92 (м, 2H), 2,77-2,70 (м, 2H), 2,53-2,46 (м, 2H), 2,38-2,28 (м, 1H), 2,10 (т, J=11,1, 2H), 1,98-1,90 (м, 2H), 1,86-1,74 (м, 2H).
Пример 129

{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}циклогексилэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 37, с использованием циклогексилэтиламина. Масс-спектр (ESI): масса, вычисленная для С23Н29N3О2; 379,23; m/z найдено 380,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,23 (с, 1H), 7,34-7,25 (м, 4H), 7,07 (д, J=3,5, 2H), 6,98 (д, J=9,0, 2H), 3,94 (т, J=6,4, 2H), 2,80 (т, J=6,4, 2H), 2,57 (д, J=7,1, 2H), 2,50 (с, 2H), 1,72 (д, J=7,8, 2H), 1,55 (с, 1H), 1,20 (т, J=9,0, 4H), 0,99 (т J=7,1, 3H).
Пример 130

2-{4-[2-(4-метилпиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 35, с использованием 4-метилпиперидина. Масс-спектр (ESI): масса, вычисленная для С21Н25N3О2; 351,19; m/z найдено 352,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,30 (с, 1H), 7,34-7,25 (м, 4H), 7,08 (д, J=3,8, 2H), 6,99 (д, J=9,0, 2H), 4,08 (т, J=5,8, 2H), 2,89 (д, J=11,4, 2H), 2,67 (т, J=5,8, 2H), 2,00 (т, J=11,4, 2H), 1,56 (д, J=11,5, 2H), 1,36-1,25 (м, 1H), 1,21-1,08 (м, 2H), 0,88 (д, J=6,4, 3H).
Пример 131
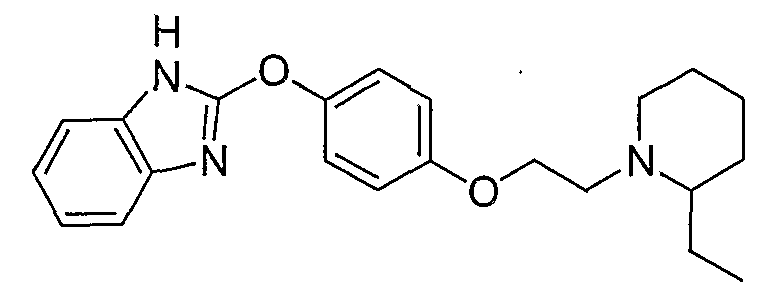
2-{4-[2-(4-этилпиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 37, с использованием 2-этилпиперидина. Масс-спектр (ESI): масса, вычисленная для С22Н27N3О2; 365,21; m/z найдено 366,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,28 (с, 1H), 7,32-7,25 (м, 4H), 7,08 (д, J=3,8, 2H), 6,99 (д, J=8,4, 2H), 4,05 (т, J=6,1, 2H), 3,00-2,92 (м, 1H), 2,91-2,85 (м, 1H), 2,72-2,64 (м, 1H), 2,38-2,20 (м, 2H), 1,67-1,36 (м, 6H), 1,35-1,19 (м, 2H), 0,84 (т, J=7,5, 3H).
Пример 132
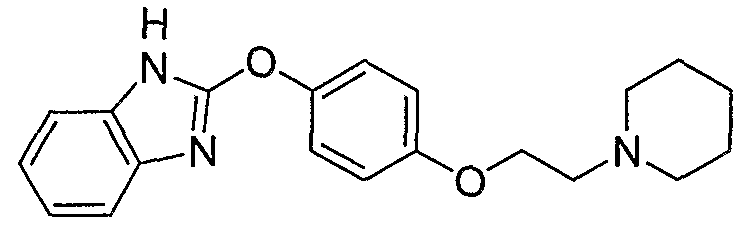
2-[4-(2-пиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 37, с использованием пиперидина. Масс-спектр (ESI): масса, вычисленная для С20Н23N3О2; 337,18; m/z найдено 338,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,25 (шир.с, 1H), 7,35-7,25 (м, 4H), 7,10-7,00 (м, 2H), 6,99 (д, J=9,0, 2H), 4,07 (т, J=5,9, 2H), 2,79 (т, J=5,9, 2H), 2,43 (с, 4H), 1,55-1,45 (м, 4H), 1,38 (с, 2H).
Пример 133

(1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 35, с использованием пиперидин-4-илметанола. Масс-спектр (ESI): масса, вычисленная для С21Н25N3О3; 367,19; m/z найдено 368,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,24 (с, 1H), 7,35-7,25 (м, 4H), 7,01 (с, 2H), 6,99 (д, J=7,1, 2H), 4,40 (с, 1H), 4,10 (т, J=5,7, 2H), 3,25 (т, J=5,4, 2H), 2,93 (д, J=11,1, 2H), 2,67 (т, J=5,6, 2H), 1,98(т, J=11,6, 2H), 1,63(д, J=11,6, 2H), 1,28(с, 1H), 1,12 (д, J=9,1, 2H).
Пример 134
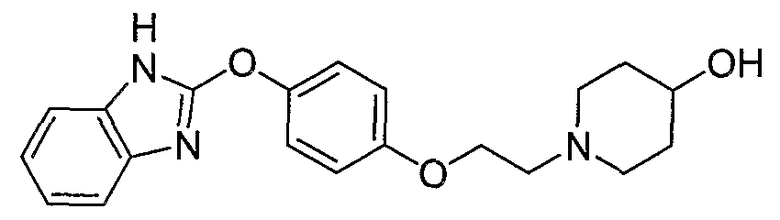
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 37, с использованием 4-гидроксипиперидина. Масс-спектр (ESI): масса, вычисленная для С20Н23N3О3; 353,17; m/z найдено 354,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,24 (с, 1H), 7,35-7,25 (м, 4H), 7,07 (д, J=9,0, 2H), 6,99 (д, J=9,0, 2H), 4,40 (с, 1H), 4,08 (т, J=5,8, 2H), 2,53 (с, 1H), 2,78 (д, J=11,2, 2H), 2,66 (т, J=5,8, 2H), 2,12 (т, J=10,3, 2H), 1,70 (д, J=9,1, 2H), 1,38 (д, J=9,9, 2H).
Пример 135

1-[4-(бензооксазол-2-илокси)фенокси]-3-пирролидин-1-илпропан-2-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 40, с использованием пирролидина. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О4; 354,16; m/z найдено 355,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,62 (дд, J=6,2, 2,0, 1H), 7,50 (дд, J=6,1, 2,1, 1H), 7,42 (д, J=9,1, 2H), 7,35-7,25 (м, 2H), 7,03 (д, J=9,1, 2H), 4,91 (д, J=4,5, 1H), 4,05-4,00 (м, 1H), 4,00-3,85 (м, 2H), 2,70 (м, 1H), 2,50-2,40 (м, 5H), 1,68 (с, 4H).
Пример 136
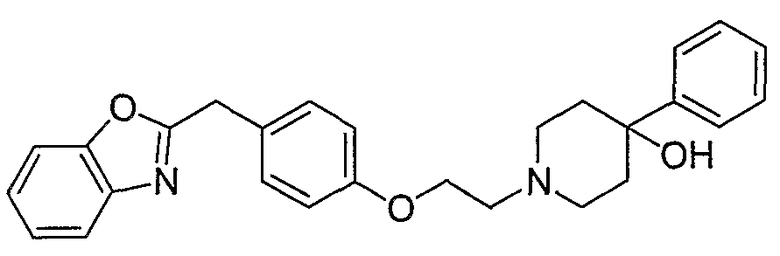
1-[2-(4-бензооксазол-2-илметилфенокси)этил]-4-фенилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 41, с использованием 4-фенилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С27Н28N2О3; 428,21; m/z найдено 429,2 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,62-7,58 (м, 1H), 7,54-7,45 (м, 3H), 7,33-7,25 (м, 6H), 7,20-7,15 (м, 1H), 6,91 (д, J=8,6, 2H), 4,20 (с, 2H), 4,13 (т, J=5,5, 2H), 2,87 (м, 4H), 2,66 (т, J=11,4, 2H), 2,13 (дт, J=12,8, 3,6, 2H), 1,72 (д, J=12,6, 2H).
Пример 137

Амид 1-[2-(4-бензооксазол-2-илметилфенокси)этил]-4-фенилпиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 41, с использованием амида пиперидин-4-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С22Н25N3О3; 379,19; m/z найдено 380,4 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,64-7,60 (м, 1H), 7,56-7,52 (м, 1H), 7,36-7,31 (м, 2H), 7,28 (д, J=8,7, 2H), 6,92 (д, J=8,7, 2H), 4,22 (с, 2H), 4,11 (т, J=5,6, 2H), 3,07 (д, J=12,0, 2H), 2,79 (т, J=5,6, 2H), 2,18-2,15 (м, 3H), 1,80-1,70 (м, 4H).
Пример 138

2-[4-(2-азепан-1-илэтокси)фенокси]-1Н-бензоимидазоламид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 11, стадии А и В, и в примере 37, стадии В и С, с использованием гидрохлорида 1-(2-хлорэтил)азепана. Масс-спектр (ESI): масса, вычисленная для С21Н25N3О2; 351,19; m/z найдено 352,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,28 (с, 1H), 7,35-7,25 (м, 4H), 7,07 (д, J=9,1, 2H), 7,00 (д, J=9,1, 2H), 4,05 (т, J=6,0, 2H), 2,86 (т, J=6,0, 2H), 2,70 (т, J=5,1, 4H), 1,65-1,50 (м, 8H).
Пример 139

{3-[4-(1Н-бензоимидазол-2-илокси)фенокси]пропил}диметиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 11, стадии А и В, и в примере 37, стадии В и С, с использованием гидрохлорида (2-хлорпропил)диметиламина. Масс-спектр (ESI): масса, вычисленная для С18Н21N3О2; 311,16; m/z найдено 312,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,32-7,23 (м, 2H), 7,21-7,14 (м, 4H), 6,89-6,83 (м, 2H), 3,99-3,91 (м, 2H), 2,51 (т, J=7,2, 2H), 2,31 (с, 6H) 2,02-1,95 (м, 2H).
Пример 140

2-[4-(2-пирролидин-1-ил)этокси]фенокси}-1Н-бензоимидазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 21, стадии А и В, и в примере 35, стадии В и С, с использованием пирролидина. Масс-спектр (ESI): масса, вычисленная для С19Н21N3О2; 323,16; m/z найдено 324,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,27 (шир.с, 2H), 7,15 (д, J=9,1, 4H), 6,81 (д, J=6,8, 2H) 4,16 (т, J=5,5, 2H), 3,05 (т, J=5,5, 2H), 2,86 (шир.с, 4H), 1,92 (шир.с, 4H).
Пример 141

{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}диэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 21, стадии А и В, и в примере 35, стадии В и С, с использованием диэтиламина. Масс-спектр (ESI): масса, вычисленная для С19Н23N3О2; 326,18; m/z найдено 326,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,29 (шир.с, 2H), 7,18 (д, J=9,0, 2H), 7,10-7,05 (м, 2H), 6,98 (д, J=9,0, 2H), 4,03 (т, J=6,2, 2H), 2,78 (т, J=6,1, 2H), 2,55 (кв, J=7,1, 4H), 0,98 (т, J=7,1, 6H).
Пример 142

2-[4-(2-морфолин-4-ил)этокси]фенокси}-1Н-бензоимидазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 21, стадии А и В, и в примере 37, стадии В и С, с использованием морфолина. Масс-спектр (ESI): масса, вычисленная для С19Н21N3О3; 339,16; m/z найдено 340,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,40-7,25 (м, 4H), 7,12-7,08 (м, 2H), 7,00 (д, J=9,0, 2H), 4,10 (т, J=5,7, 2H), 3,58 (т, J=4,5, 4H), 2,70 (т, J=5,7, 2H), 2,52-2,46 (м, 4H).
Примеры 143-202 и 204-229
Соединения настоящего изобретения, конкретное описание которых не приводится в данной заявке, могут быть получены в соответствии с методиками, аналогично описанным в настоящем изобретении, и проводимым по усмотрению специалистов в данной области и в соответствии с описываемыми способами. Так, например, перечисленные в данном описании бензотиазольные производные, имеющие номера 143-202 и 204-229, могут быть получены в соответствии с методиками, аналогично описанным для получения родственных соединений.
Пример 203

[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)метиламино]уксусная кислота
Указанное в заголовке соединение получали в соответствии с процедурами, описанными в примере 20 и в примере 18, с использованием гидрохлорида этилового эфира саркозина. Масс-спектр (ESI): масса, вычисленная для С24Н27N3О5S; 469,56; m/z найдено 470,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,02, 1H), 7,65 (д, J=8,02, 1H), 7,34-7,40 (м, 1H), 7,23-7,30 (м, 3H), 6,92-6,98 (м, 2H), 4,34-4,44 (м, 2H), 3,92 (шир.с, 2H), 3,45-3,54 (м, 3H), 3,35 (шир.с, 1H), 3,25 (шир.с, 1H), 3,12 (с, 2H), 2,96 (с, 1H), 2,76 (шир.с, 2H), 1,92-2,08 (м, 4H).
Примеры 230-231 и 485
Как видно из контекста описания настоящего изобретения, соединения настоящего изобретения, конкретное описание которых не приводится в данной заявке, могут быть получены в соответствии с методиками, аналогично описанным в настоящем изобретении и проводимым по усмотрению специалистов в данной области и в соответствии с описываемыми способами. Так, например, перечисленные в данном описании бензоимидазольные производные, имеющие номера 230-231 и 485, могут быть получены в соответствии с методиками, аналогично описанным для получения родственных соединений.
Пример 250

1-[4-(бензотиазол-2-илокси)фенил]пиперидин-4-карбоновая кислота
А. Этиловый эфир 1-(4-(бензилоксибензил)пиперидин-4-карбоновой кислоты.
Смесь 4-бензилоксибензилхлорида (15,2 г, 65,3 ммоль), этилового эфира изонипекотиновой кислоты (15 мл, 97 ммоль) и К2СО3 (13,5 г, 97,6 ммоль) в СН3CN (300 мл) перемешивали при кипячении с обратным холодильником в течение 20 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Растворитель удаляли при пониженном давлении и получали прозрачное масло золотистого цвета. Масло разбавляли iPrOH (100 мл) и смесь фильтровали. Твердое вещество сушили на воздухе и получали твердое вещество белого цвета (19,7 г, выход 85%). ТСХ (SiО2, 15% ацетон/СН2Cl2): Rf=0,32. Масс-спектр (ESI): масса, вычисленная для С22Н27NO3; 353,2; m/z найдено 354,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,44 (д, J=7,1, 2H), 7,39 (т, J=7,1, 2H), 7,33 (д, J=7,2, 1H), 7,18 (д, J=8,2, 2H), 6,94 (2H, J=8,6, 2H), 5,08 (с, 2H), 4,04 (кв, J=7,09, 2H), 2,72 (д, J=11,5, 2H), 2,32-2,18 (м, 1H), 1,94 (т, J=11,6, 2H), 1,76 (д, J=10,2, 2H), 1,59-1,48(м, 2H), 1,17 (т, J=7,1, 3H).
В. Этиловый эфир 1-(4-гидроксибензил)пиперидин-4-карбоновой кислоты.
Этиловый эфир 1-(4-(бензилоксибензил)пиперидин-4-карбоновой кислоты (10,0 г, 28,3 ммоль) растворяли в смеси этанол/этилацетат, 1:1, (150 мл). К раствору добавляли Pd на угле (10 мас.%, 503 мг) в виде суспензии в этаноле (5,0 мл). Полученную суспензию помещали в гидрогенизатор Парра под давлением 40 фунт/кв.дюйм Н2 и встряхивали в течение ночи. Реакционную смесь фильтровали через слой кизельгура и фильтрат концентрировали при пониженном давлении с получением прозрачного масла золотистого цвета. Масло очищали на SiО2 (90 г; 50% ацетон/СН2Cl2) и получали твердое вещество белого цвета (2,0 г, выход 27%). ТСХ (SiО2, 50% ацетон/СН2Cl2): Rf=0,32. Масс-спектр (ESI): масса, вычисленная для С15Н21NO3; 263,2; m/z найдено 264,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 9,25 (с, 1H), 7,05 (д, J=8,4, 2H), 6,68 (д, J=8,4, 2H), 4,04 (кв, J=7,1, 2H), 3,34 (с, 2H), 2,71 (д, J=11,5, 2H), 2,32-2,18 (м, 1H), 1,92 (т, J=11,6, 2H), 1,76 (д, J=10,2, 2H), 1,59-1,48 (м, 2H), 1,17 (т, J=7,1, 3H).
С. Этиловый эфир 1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-карбоновой кислоты.
К перемешиваемому раствору этилового эфира 1-(4-гидроксибензил)пиперидин-4-карбоновой кислоты (508 мг, 1,93 ммоль) в СН3СN (15 мл) добавляли К2СО3 (564 мг, 4,1 ммоль) и 2-хлорбензотиазол (0,50 мл, 4,0 ммоль). Суспензию нагревали до 80°С и перемешивали в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем фильтровали через слой кизельгура. Фильтрат концентрировали при пониженном давлении и остаток очищали на SiО2 (12 г; 0-15% ацетон/СН2Cl2) с получением прозрачного, бесцветного клейкого масла (717 мг, выход 94%). ТСХ (SiО2, 15% ацетон/СН2Cl2): Rf=0,5. Масс-спектр (ESI): масса, вычисленная для С22Н24N2О3S; 396,2; m/z найдено 397,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=8,0, 1H), 7,68 (д, J=8,0, 1H), 7,48-7,33 (м, 5H), 7,33 (т, J=7,1, 1H), 4,06 (кв, J=7,1, 2H), 3,49 (с, 2H), 2,76 (д, J=11,5, 2H), 2,34-2,22 (м, 1H), 2,02 (т, J=11,6, 2H), 1,80 (д, J=10,2, 2H), 1,64-1,54 (м, 2H), 1,18 (т, J=7,1, 3H).
D. 1-[4-(бензотиазол-2-илокси)фенил]пиперидин-4-карбоновая кислота.
К перемешиваемому раствору этилового эфира 1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-карбоновой кислоты (663 мг, 1,7 ммоль) в 25% iPrOH/H2O (20 мл) добавляли гидроксид калия (206 мг, 3,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч и раствор обрабатывали 1М HCl до рН 5,5. Полученный раствор экстрагировали 10% iPrOH/CHCl3 (3×50 мл). Объединенные экстракты сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением твердого вещества белого цвета (561 мг, выход 91%). Масс-спектр (ESI): масса, вычисленная для С20Н20N2О3S; 368,1; m/z найдено 369,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=7,6, 1H), 7,69 (д, J=7,6, 1H), 7,48-7,34 (м, 5H), 7,33 (т, J=7,1, 1H), 3,49 (с, 2H), 2,76 (д, J=11,4, 2H), 2,22-2,11 (м, 1H), 2,02 (т, J=11,2, 2H), 1,80 (д, J=13,2, 2H), 1,62-1,48 (м, 2H), 1,18 (т, J=7,1, 3H).
Пример 251

1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}пирролидин-2-он
А. 4-(бензотиазол-2-илокси)бензальдегид.
К смеси 4-гидроксибензальдегида (1 г, 8,2 ммоль) и 2-хлорбензотиазола (2,03 мл, 16,4 ммоль) в СН3CN (100 мл) добавляли Cs2CO3 (5,5 г, 17,2 ммоль). Реакционную смесь перемешивали при 60°С в течение 24 ч. Полученную смесь охлаждали до комнатной температуры, фильтровали через слой кизельгура и концентрировали при пониженном давлении с получением неочищенного продукта в виде оранжевого масла. Масло растирали со смесью гексан/СН2Cl2 (100 мл), затем слой растворителя декантировали и смесь концентрировали при пониженном давлении с получением оранжевого масла, которое затем очищали на SiО2 (120 г; 0-50% этилацетат/гексан), получая твердое вещество белого цвета (853 мг, выход 41%). 1H ЯМР (400 МГц, CDCl3): 10,1 (с, 1H), 7,97-7,78 (м, 2H), 7,78-7,70 (м, 2H), 7,60-7,50 (м, 2H), 7,48-7,38 (м, 1H), 7,36-7,30 (м, 1H).
В. 1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}пирролидин-2-он.
Смесь 4-(бензотиазол-2-илокси)бензальдегида (500 мг, 1,9 ммоль), гидрохлорида 1-пиперидин-4-илпирролидин-2-она (440 мг, 2,2 ммоль), Et3N (300 мкл, 2,2 ммоль) и молекулярных сит (500 мг, измельченных, 4Å) в ClСН2СН2Cl (10 мл) перемешивали при комнатной температуре в течение 1 ч. К полученной смеси добавляли NаВН(ОАс)3 (830 мг, 3,92 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали через слой кизельгура, промывали СН2Cl2 (50 мл) и концентрировали при пониженном давлении с получением неочищенного продукта в виде желтого масла. Неочищенный продукт очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) и получали прозрачное масло, которое кристаллизовалось при стоянии (287 мг, выход 36%). Масс-спектр (ESI): масса, вычисленная для С23Н25N3О2S; 407,5; m/z найдено 408,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (д, J=8,0, 1H), 7,69 (д, J=8,0, 1H), 7,41-7,30 (м, 3H), 7,35-7,27 (м, 3H), 4,46-3,98 (м, 1H), 3,71 (с, 2H), 3,36 (т, J=6,9, 2H), 2,97 (д, J=11,7, 2H), 2,40 (т, J=8,1, 2H), 2,17-1,97 (м, 4H), 1,81-1,62 (м, 4H).
Пример 252
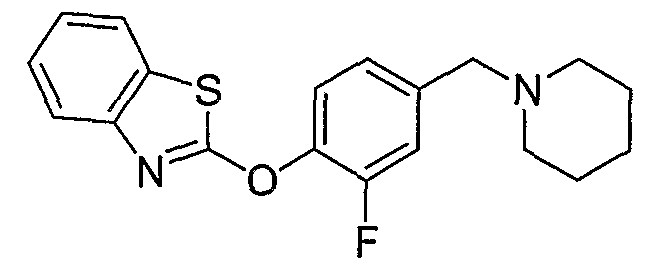
2-(2-фтор-4-пиперидин-1-илметилфенокси)бензотиазол
А. (3-фтор-4-гидроксифенил)пиперидин-1-илметанон.
Раствор 3-фтор-4-гидроксибензойной кислоты (5,0 г, 32 ммоль), пиперидина (5 мл, 51 ммоль) и EDCI (9,3 г, 49 ммоль) в СН2Cl2 (100 мл) перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь добавляли к СН2Cl2 (200 мл) и промывали 1М HCl (2×100 мл). Органический слой объединяли, сушили (MgSO4) и концентрировали при пониженном давлении с получением прозрачного масла золотистого цвета. Масло очищали на SiО2 (120 г; 0-15% ацетон/СН2Cl2) и получали твердое вещество белого цвета (2,4 г, выход 34%). ТСХ (SiО2, 15% ацетон/СН2Cl2): Rf=0,35. Масс-спектр (ESI): масса, вычисленная для С12Н14FNO2; 223,1; m/z найдено 224,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 10,26(с, 1H), 7,18 (д, J=11,6, 1H), 7,00 (д, J=8,3, 1H), 6,98 (т, J=8,5, 1H), 3,42 (шир.с, 4H), 1,65-1,45 (м, 6H).
В. 2-фтор-4-пиперидин-1-илметилфенол.
Раствор алюмогидрида лития (1,9 г, 50 ммоль) в ТГФ (40 мл) перемешивали при 5°С. К смеси в течение 15 минут добавляли (3-фтор-4-гидроксифенил)пиперидин-1-илметанон (2,3 г, 10,4 ммоль) в ТГФ (10 мл) и затем смесь нагревали до 60°С. Через 20 часов смесь охлаждали до 5°С, добавляли насыщенный NН4Cl (200 мл) и затем СН2Cl2 (200 мл). Органический слой отделяли, сушили (MgSO4) и концентрировали при пониженном давлении с получением твердого вещества белого цвета (812 мг, выход 37%). ТСХ (SiО2, ацетон): Rf=0,22. Масс-спектр (ESI): масса, вычисленная для С12Н16FNO; 209,1; m/z найдено 210,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 6,58 (д, J=13,4, 1H), 6,48 (д, J=8,2, 1H), 6,40 (т, J=9,9, 1H), 3,14 (с, 2H), 2,24 (шир.с, 4H), 1,54-1,30 (м, 6H).
С. 2-(2-фтор-4-пиперидин-1-илметилфенокси)бензотиазол.
К перемешиваемому раствору 2-фтор-4-пиперидин-1-илметилфенола (152 мг, 0,73 ммоль) в СН3СN (10 мл) добавляли К2СО3 (201 мг, 1,5 ммоль) и 2-хлорбензотиазол (0,14 мл, 1,1 ммоль). Суспензию нагревали до 80°С и перемешивали в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем фильтровали через кизельгур. Фильтрат концентрировали при пониженном давлении и остаток очищали на SiО2 (12 г; 0-50% ацетон/СН2Cl2) с получением прозрачного масла золотистого цвета (142 мг, выход 57%). ТСХ (SiО2, 50% ацетон/СН2Cl2): Rf=0,44. Масс-спектр (ESI): масса, вычисленная для С19Н19FN2ОS; 342,1; m/z найдено 343,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,95 (д, J=7,9, 1H), 7,69 (д, J=7,5, 1H), 7,56 (т, J=8,2, 1H), 7,47-7,32 (м, 3H), 7,44 (д, J=15,4, 1H), 3,48 (с, 2H), 2,36 (с, 4H), 1,63-1,37 (м, 6H).
Пример 253
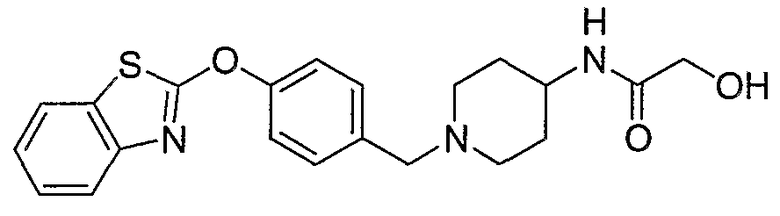
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-2-гидроксиацетамид
А. Трет-бутиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}карбаминовой кислоты.
Смесь (4-(бензотиазол-2-илокси)бензальдегида (Пример 251, стадия А, 500 мг, 1,9 ммоль), трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (785 мг, 3,9 ммоль) и молекулярных сит (500 мг, измельченных, 4Å) в ClСН2СН2Cl (10 мл) перемешивали при комнатной температуре в течение 40 мин. К полученной реакционной смеси порциями в течение 1,5 часа добавляли NаВН(ОАс)3 (4×207 мг, 3,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали через слой кизельгура и промывали СН2Cl2 (50 мл). Фильтрат промывали насыщенным водным NaНСО3 (1×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде масла светло-желтого цвета. Неочищенный продукт очищали на SiО2 (40 г; 0-5% 2М NH3 в СН3ОН/СН2Cl2) и получали белую пену (504 мг, выход 59%). Масс-спектр (ESI): масса, вычисленная для С24Н29N3О3S; 439,6; m/z найдено 440,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,42-7,36 (м, 3H), 7,32-7,24 (м, 3H), 4,44 (шир.с, 1H), 3,50 (с, 2H), 2,82-2,76 (м, 2H), 2,16-2,06 (м, 2H), 1,96-1,88 (м, 2H), 1,45 (с, 9H), 1,48-1,38 (м, 2H).
В. 1-[4-бензотиазол-2-илокси)бензил]пиперидин-4-иламин.
К раствору трет-бутилового эфира {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}карбаминовой кислоты (200 мг, 0,45 ммоль) в СН2Cl2 (2 мл) при 0°С по каплям добавляли 4н HCl в диоксане (1,8 мл, 7,2 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Требуемый продукт выделяли фильтрованием и промывали Et2О (50 мл) с получением порошка белого цвета (187 мг, выход 100%). Масс-спектр (ESI): масса, вычисленная для С19Н21N3OS; 339,5; m/z найдено 340,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,68-7,64 (м, 1H), 7,58-7,52 (м, 2H), 7,48-7,44 (м, 1H), 7,40-7,35 (м, 2H), 7,30-7,24 (м, 1H), 7,20-7,14 (м, 1H), 4,25 (с, 2H), 3,52-3,46 (м, 2H), 3,36-3,28 (м, 1H), 3,08-2,99 (м, 2H), 2,16-2,08 (м, 2H), 1,92-1,80 (м, 2H).
С. {1-[4-(Бензотиазол-2-илокси)бензил]пиперидин-4-илкарбамоил}метиловый эфир уксусной кислоты.
К раствору дигидрохлорида {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-иламина (413 мг, 1,0 ммоль) в СН2Cl2 (20 мл) при комнатной температуре добавляли ТЕА (0,70 мл, 5,0 ммоль) и затем ацетоксиацетилхлорид (0,16 мл, 1,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь растворяли в СН2Cl2 (100 мл), промывали насыщенным водным NaНСО3 (1×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2) и получали твердое вещество белого цвета (410 мг, выход 93%). Масс-спектр (ESI): масса, вычисленная для С23Н25N3О4S; 439,2; m/z найдено 440,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=7,8, 1H), 7,65 (д, J=8,1, 1H), 7,40-7,35 (м, 3H), 7,32-7,23 (м, 3H), 6,11 (д, J=8,3, 1H), 4,53, (с, 2H), 3,93-3,82 (м, 1H), 3,50 (с, 2H), 2,83 (д, J=11,9, 2H), 2,15 (с, 3H), 2,14 (т, J=11,9, 2H), 1,93 (д, J=12,1, 2H), 1,56-1,45 (м, 2H).
D. N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-2-гидроксиацетамид.
К раствору {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илкарбамоил}метилового эфира уксусной кислоты (368 мг, 0,84 ммоль) в ТГФ (30 мл), СН3ОН (10 мл) и H2O (10 мл) добавляли гидроксид лития (80,2 мг, 3,34 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь экстрагировали СН2Cl2 (30 мл×3). Объединенные органические фазы концентрировали при пониженном давлении и получали неочищенный продукт в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2), получая твердое вещество белого цвета (297 мг, выход 82%). Масс-спектр (ESI): масса, вычисленная для С21Н23N3О3S; 397,2; m/z найдено 398,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=7,8, 1H), 7,65 (д, J=8,1, 1H), 7,40-7,35 (м, 3H), 7,31-7,23 (м, 3H), 6,83 (д, J=8,1, 1H), 5,33 (шир.с, 1H), 3,99 (с, 2H), 3,87-3,75 (м, 1H), 3,50 (с, 2H), 2,85 (д, J=11,4, 2H), 2,14 (т, J=10,9, 2H), 1,92 (д, J=12,6, 2H), 1,56-1,43 (м, 2H).
Пример 254
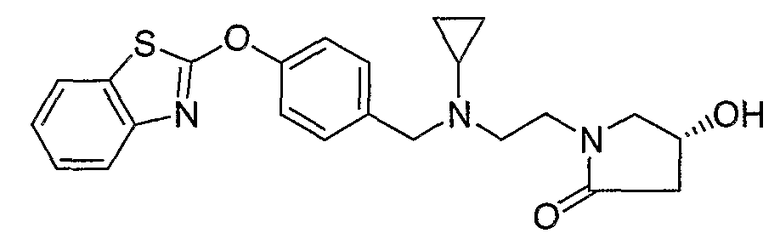
1-(2-{[4-(бензотиазол-2-илокси)бензил]циклопропиламино}этил)-4-гидроксипирролидин-2-он
А. [4-(бензотиазол-2-илокси)бензил]циклопропиламин.
Смесь 4-(бензотиазол-2-илокси)бензальдегида (5,0 г, 19,6 ммоль) и циклопропиламина (3,35 г, 58,7 ммоль) в ClСН2СН2Cl (80 мл) перемешивали при комнатной температуре в течение 40 мин. К полученной реакционной смеси порциями в течение 1,5 часа добавляли NаВН(ОАс)3 (4×2,1 г, 39,2 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали через кизельгур и промывали СН2Cl2 (500 мл). Фильтрат промывали насыщенным водным NaНСО3 (1×250 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде светло-желтого масла. Неочищенный продукт очищали на SiО2 (330 г; 0-5% СН3ОН/СН2Cl2) и получали твердое вещество белого цвета (3,95 г, выход 68%). Масс-спектр (ESI): масса, вычисленная для С17Н16N2ОS; 296,1; m/z найдено 297,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,40-7,33 (м, 3H), 7,32-7,27 (м, 2H), 7,24 (т, J=8,1, 1H), 3,85 (с, 2H), 2,19-2,12 (м, 1H), 1,86 (шир.с, 1H), 0,48-0,35 (м, 4H).
В. Трет-бутиловый эфир (2-{[4-(бензотиазол-2-илокси)бензил]циклопропиламино}этил)карбаминовой кислоты.
К раствору [4-(бензотиазол-2-илокси)бензил]циклопропиламина (2,96 г, 10 ммоль) в СН3СN (40 мл) при комнатной температуре добавляли N,N-диизопропилэтиламин (3,48 мл, 20 ммоль) и затем трет-бутиловый эфир (2-бромэтил)карбаминовой кислоты (3,36 г, 15 ммоль). Полученную смесь нагревали при 60°С в течение ночи. Смесь охлаждали и растворяли в СН2Cl2 (200 мл), затем промывали насыщенным водным NaНСО3 (1×25 мл) и H2O (2×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде твердого вещества светло-желтого цвета. Неочищенный продукт очищали на SiО2 (120 г; 0-50% этилацетат/гексан) с получением твердого вещества белого цвета (3,44 г, выход 78%). Масс-спектр (ESI): масса, вычисленная для С4Н29N3O3S; 439,2; m/z найдено 440,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,39-7,22 (м, 6H), 4,75 (шир.с, 1H), 3,74 (с, 2H), 3,25 (дд, J=5,8, 6,1, 2H), 2,65 (т, J=6,3, 2H), 1,82-1,75 (м, 1H), 1,43 (с, 9H), 0,54-0,48 (м,' 2H), 0,43-0,37 (м, 2H).
С. N1-[4-(бензотиазол-2-илокси)бензил]-N1-циклопропилэтан-1,2-диамин.
К раствору трет-бутилового эфира (2-{[4-(бензотиазол-2-илокси)бензил]циклопропиламино}этил)карбаминовой кислоты в СН2Cl2 (16 мл) при 0°С по каплям добавляли трифторуксусную кислоту в диоксане (4 мл). Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали при пониженном давлении с получением неочищенного продукта в виде светло-желтого масла. Масло растворяли в СН2Cl2 (100 мл), промывали насыщенным водным NaНСО3 (1×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением продукта в виде прозрачного масла. Масс-спектр (ESI): масса, вычисленная для С19Н21N3ОS; 339,1; m/z найдено 340,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,61 (д, J=8,1, 1H), 7,37-7,18 (м, 6H), 3,75 (с, 2H), 2,76 (т, J=6,3, 2H), 2,60 (т, J=6,3, 2H), 1,98 (с, 2H), 1,79-1,73 (м, 1H), 0,51-0,45 (м, 2H), 0,42-0,37 (м, 2H).
D. 1-(2-{[4-(бензотиазол-2-илокси)бензил]циклопропиламино}этил)-4-гидроксипирролидин-2-он.
К раствору N1-[4-(бензотиазол-2-илокси)бензил]-N1-циклопропилэтан-1,2-диамина (1,5 г, 4,4 ммоль) в СН3СN (18 мл) при комнатной температуре добавляли N,N-диизопропилэтиламин (1,15 мг, 6,63 ммоль) и затем этиловый эфир 4-(R)-бром-3-гидроксимасляной кислоты (1,11 г, 5,3 ммоль). Полученную смесь нагревали при 60°С в течение ночи. Смесь охлаждали и растворяли в СН2Cl2 (100 мл), затем промывали насыщенным водным NaНСО3 (1×10 мл) и H2O (2×10 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде масла светло-коричневого цвета. Неочищенный продукт очищали ВЭЖХ с обращенной фазой (0-99%, 0,05% ТFA в H2O/СН3СN) и получали прозрачное масло (435 мг, выход 18,3%). Масс-спектр (ESI): масса, вычисленная для С23Н25N3O3S; 423,2; m/z найдено 424,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,64 (д, J=8,1, 1H), 7,58-7,54 (м, 2H), 7,49 (д, J=8,1, 1H), 7,37-7,33 (м, 2H), 7,26 (т, J=7,6, 1H), 7,16 (т, J=7,6, 1H), 4,48 (дд, J=8,8, 12,9, 2H), 4,32 (т, J=5,8, 1H), 3,84-3,75 (м, 1H), 3,64-3,56 (м, 2H), 3,38 (т, J=6,3, 2H), 3,24 (т, J=10,9, 1H), 2,73-2,66 (м, 1H), 2,59 (дд, J=6,3, 11,1, 1H), 2,15 (д, J=17,2, 1H), 0,79 (д, J=6,6, 4H).
Пример 255

1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-N-метилметансульфонамид
А. Трет-бутиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метилкарбаминовой кислоты.
Смесь 4-(бензотиазол-2-илокси)бензальдегида (4,4 г, 17,2 ммоль), трет-бутилового эфира метилпиперидин-4-илкарбаминовой кислоты (4,06 г, 18,9 ммоль) в ClСН2СН2Cl (172 мл) перемешивали при комнатной температуре в течение 40 мин. К полученной реакционной смеси порциями в течение 1,5 часа добавляли NаВН(ОАс)3 (4×1,82 г, 34,4 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали через кизельгур и промывали СН2Cl2 (300 мл). Фильтрат промывали насыщенным водным NaНСО3 (1×50 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде светло-желтого масла. Неочищенный продукт очищали на SiО2 (330 г; 0-100% этилацетат/гексан) и получали пену светло-желтого цвета (3,75 г, выход 48%). Масс-спектр (ESI): масса, вычисленная для С25Н31N3О3S; 453,2; m/z найдено 454,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,41-7,35 (м, 3H), 7,33-7,23 (м, 3H), 4,13-3,94 (м, 1H), 3,53 (с, 2H), 2,93 (д, J=11,6, 2H), 2,74 (с, 3H), 2,08 (т, J=11,6, 2H), 1,81-1,69 (м, 2H), 1,65-1,57 (м, 2H), 1,46 (с, 9H).
В. {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метиламин.
К раствору трет-бутилового эфира {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метилкарбаминовой кислоты (3,7 г, 8,2 ммоль) в СН2Cl2 (41 мл) при 0°С по каплям добавляли 4н. HCl в диоксане (8,2 мл, 32,6 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Требуемый продукт выделяли фильтрованием и промывали Et2О (150 мл) с получением порошка белого цвета (3,38 г, выход 97%). Масс-спектр (ESI): масса, вычисленная для С20Н23N3OS; 353,2; m/z найдено 354,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,92 (шир.с, 1H), 7,72 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,39-7,33 (м, 3H), 7,30-7,21 (м, 3H), 3,49 (с, 2H), 2,98-2,86 (м, 3H), 2,63 (с, 3H), 2,08-1,98 (м, 4H), 1,84-1,71 (м, 2H).
С. N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-N-метилметансульфонамид.
К раствору дигидрохлорида {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метиламина (354 мг, 1,0 ммоль) в СН2Cl2 (20 мл) при комнатной температуре добавляли ТЕА (0,70 мл, 5,0 ммоль) и затем метансульфонилхлорид (0,12 мл, 1,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь растворяли в СН2Cl2 (100 мл), промывали насыщенным водным NaНСО3 (1×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде твердого вещества светло-желтого цвета. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2) с получением твердого вещества белого цвета (378 мг, выход 88%). Масс-спектр (ESI): масса, вычисленная для С21Н25N3О3S2; 431,1; m/z найдено 432,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,41-7,35 (м,3H), 7,33-7,23 (м, 3H), 3,80-3,70 (м, 1H), 3,50 (с, 2H), 2,96 (д, J=11,6, 2H), 2,82 (с, 3H), 2,80 (с, 3H), 2,08 (т, J=11,6, 2H), 1,89-1,77 (м, 2H), 1,70-1,60 (м, 2H).
Пример 256
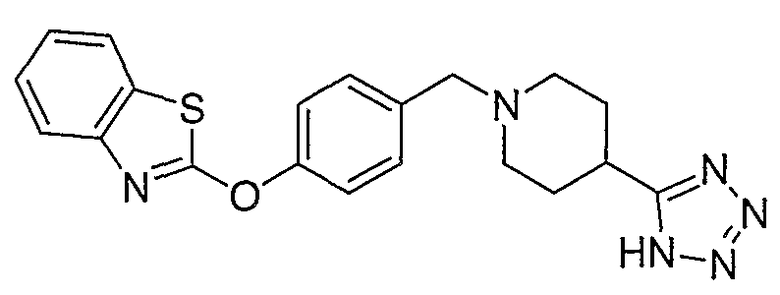
2-{4-[4-(1Н-тетразол-5-ил)пиперидин-1-илметил]фенокси}бензотиазол
Раствор 4-(бензотиазол-2-илокси)бензальдегида (Пример 251, стадия А; 620 мг, 2,4 ммоль), гидрохлорида 4-(1Н-тетразол-5-ил)пиперидина (565 мг, 3,0 ммоль) и Et3N (0,43 мл, 3,1 ммоль) в 30% ТГФ/СН2Cl2 (35 мл) перемешивали при комнатной температуре в течение 30 минут. К перемешиваемой смеси добавляли Nа(АсО)3ВН (787 мг, 3,7 ммоль). Через 20 часов реакционную смесь добавляли к 10% iPrOH/H2O (50 мл), органический слой отделяли и сушили (MgSO4). Растворитель удаляли при пониженном давлении и получали прозрачное клейкое масло желтого цвета. Полученное вещество разбавляли этанолом (10 мл), нагревали до 80°С и фильтровали в горячем состоянии. К фильтрату добавляли Et2О (10 мл) и колбу охлаждали на льду. Образовавшееся твердое вещество фильтровали и получали твердое вещество белого цвета (48 мг, выход 5%). Масс-спектр (ESI): масса, вычисленная для С20Н20N6ОS; 392,1; m/z найдено 393,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,95 (д, J=7,9, 1H), 7,70 (д, J=7,9, 1H), 7,53-7,35 (м, 5H), 7,33 (т, J=7,9, 1H), 3,59 (с, 2H), 3,09-3,00 (м, 1H), 2,91 (д, J=10,8, 2H), 2,22 (т, J=9,8, 2H), 1,85-1,72 (м, 2H).
Пример 257

1-{4-[4-(бензотиазол-2-илокси)бензил]пиперазин-1-ил}-2-гидроксиэтанон
А. Трет-бутиловый эфир 4-[4-(бензотиазол-2-илокси)бензил]пиперазин-1-карбоновой кислоты.
Смесь (4-(бензотиазол-2-илокси)бензальдегида (2,5 г, 9,8 ммоль), трет-бутилового эфира пиперазин-2-он-1-карбоновой кислоты (3,7 г, 19,6 ммоль) и молекулярных сит (2,5 г, измельченных, 4Å) в ClСН2СН2Cl (25 мл) перемешивали при комнатной температуре в течение 40 мин. К полученной реакционной смеси порциями в течение 1,5 часа добавляли NаВН(ОАс)3 (4×504 мг, 19,6 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали через слой кизельгура и промывали СН2Cl2 (200 мл). Фильтрат промывали насыщенным водным NaНСО3 (1×50 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде полутвердого вещества желтого цвета. Неочищенный продукт очищали на SiО2 (120 г; 0-100% ацетон/СН2Cl2) и получали не совсем белое твердое вещество (1,72 г, выход 42%). Масс-спектр (ESI): масса, вычисленная для С23Н27N3О3S; 423,5; m/z найдено 426,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,2, 1H), 7,67 (д, J=8,2, 1H), 7,42-7,37 (м, 3H), 7,4-7,25 (м, 3H), 3,53 (с, 2H), 3,45 (шир.т, J=4,9, 4H), 2,41 (шир.т, J=4,5, 4H), 1,46 (с, 9H).
В. 2-(4-пиперазин-1-илметилфенокси)бензотиазол.
К раствору трет-бутилового эфира 4-[4-(бензотиазол-2-илокси)бензил]пиперазин-1-карбоновой кислоты (1,7 г, 4,0 ммоль) в СН2Cl2 (20 мл) при 0°С по каплям добавляли 4н. HCl в диоксане (5 мл, 20 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали при пониженном давлении с получением неочищенного продукта в виде твердого вещества белого цвета. Неочищенный продукт растирали с Et2О (50 мл) и выделяли фильтрованием с получением требуемого продукта в виде порошка белого цвета (1,37 г, выход 87%). Масс-спектр (ESI): масса, вычисленная для С18Н19N3OS; 325,4; m/z найдено 326,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,81 (д, J=8,0, 1H), 7,77-7,72 (м, 2H), 7,62 (д, J=8,2, 1H), 7,57-7,53 (м, 2H), 7,45-7,40 (м, 1H), 7,35-7,31 (м, 1H), 4,45 (с, 2H), 3,62 (шир.с, 8H).
С. 1-{4-[4-(бензотиазол-2-илокси)бензил]пиперазин-1-ил}-2-гидроксиэтанон.
К смеси гликолевой кислоты (47 мг, 0,62 ммоль) и НОВТ (1,25 мл, 0,62 ммоль, 0,5М в ДМФА) в СН2Cl2 (25 мл) добавляли 2-(4-пиперазин-1-илметилфенокси)бензотиазол (150 мг, 0,42 ммоль) и затем EDCI (150 мг, 0,79 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 ч, разбавляли СН2Cl2 (50 мл) и промывали насыщенным водным NaНСО3 (1×20 мл). Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде бледно-желтого масла. Неочищенный продукт очищали на SiО2 (40 г; 0-3% 2М NH3 в СН3ОН/СН2Cl2) с получением пены белого цвета (93 мг, выход 59%). Масс-спектр (ESI): масса, вычисленная для С20Н21N3О3S; 383,5; m/z найдено 384,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,68 (д, J=8,0, 1H), 7,45-7,25 (м, 6H), 4,16 (д, J=4,1, 2H), 3,71-3,68 (м, 2H), 3,64-3,61 (м, 1H), 3,55 (с, 2H), 3,32-3,25 (м, 2H), 2,53-2,44 (м, 4H).
Пример 258

N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}метансульфонамид
А. Трет-бутиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}карбаминовой кислоты.
Смесь 4-(бензотиазол-2-илокси)бензальдегида (1,0 г, 3,9 ммоль), трет-бутилового эфира пиперидин-4-илметилкарбаминовой кислоты (1,3 г, 5,9 ммоль) и молекулярных сит (1,0 г, измельченных, 4Å) в ClСН2СН2Cl (15 мл) перемешивали при комнатной температуре в течение 40 мин. К полученной реакционной смеси порциями в течение 1,5 часа добавляли NаВН(ОАс)3 (4×412 мг, 7,8 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали через кизельгур и промывали СН2Cl2 (100 мл). Фильтрат промывали насыщенным водным NaНСО3 (1×50 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде желтого полутвердого вещества. Неочищенный продукт очищали на SiО2 (40 г; 0-100% ацетон/СН2Cl2) и получали пену белого цвета (890 мг, выход 50%). Масс-спектр (ESI): масса, вычисленная для С25Н31N3О3S; 453,6; m/z найдено 454,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,41-7,36 (м, 3H), 7,32-7,24 (м, 3H), 4,59 (шир.с, 1H), 3,50 (с, 2H), 3,06-3,00 (м, 2H), 2,94-2,88 (м, 2H), 1,97 (т, J=11,4, 2H), 1,68 (д, J=11,4, 2H), 1,44 (с, 9H), 1,22-1,33(м, 2H).
В. С-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метиламин.
К раствору трет-бутилового эфира {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}карбаминовой кислоты (866 мг, 1,9 ммоль) в СН2Cl2 (5 мл) при 0°С по каплям добавляли 4н. HCl в диоксане (2,4 мл, 9,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 ч и концентрировали при пониженном давлении с получением неочищенного продукта в виде твердого вещества белого цвета. Неочищенный продукт растирали с Et2О (50 мл) и выделяли фильтрованием с получением требуемого продукта в виде порошка белого цвета (813 мг, выход 100%). Масс-спектр (ESI): масса, вычисленная для С20Н23N3OS; 353,5; m/z найдено 354,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,80 (д, J=8,0, 1H), 7,69 (д, J=8,6, 2H), 7,60 (д, J=8,0, 1H), 7,51 (д, J=8,6, 1H), 7,42-7,38 (м, 1H), 7,33-7,28 (м, 1H), 4,37 (с, 2H), 3,78 (шир.д, J=12,7, 1H), 2H), 3,13-3,04 (м, 2H), 2,89 (д, J=6,6, 2H), 2,08-1,92 (м, 3H), 1,68-1,56 (м, 2H).
С. N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}метансульфонамид.
К смеси С-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метиламина (150 мг, 0,39 ммоль) в СН2Cl2 (5 мл) добавляли Et3N (400 мкл, 2,86 ммоль). Смесь охлаждали до 0°С и шприцем добавляли СН3SО2Cl (41 мкл, 0,52 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч, разбавляли СН2Cl2 (10 мл) и промывали насыщенным водным NaНСО3 (1×5 мл). Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде твердого вещества белого цвета. Неочищенный продукт очищали на SiО2 (10 г; 0-3% 2М NH3 в СН3ОН/СН2Cl2) с получением твердого вещества белого цвета (112 мг, выход 67%). Масс-спектр (ESI): масса, вычисленная для С21Н25N3О3S2; 431,6; m/z найдено 432,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,42-7,36 (м, 3H), 7,33-7,25 (м, 3H), 4,25 (шир.т, J=6,6, 1H), 3,51 (с, 2H), 3,04 (д, J=6,6, 2H), 2,96 (с, 3H), 2,91-2,84 (м, 2H), 1,98 (т, J=11,7, 2H), 1,74 (шир.д, J=12,7, 2H), 1,60-1,48 (м, 2H), 1,36-1,24 (м, 2H).
Пример 259
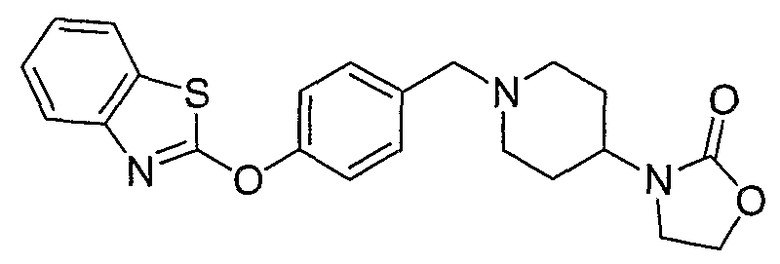
3-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}оксазолидин-2-он
А. Гидрохлоридная соль 3-пиперидин-4-илоксазолидин-2-она.
К раствору 1-бензил-4-пиперидинона (10,3 г, 54 ммоль) и этаноламина (13,2 мг, 218 ммоль) в СН3СN (20 мл) добавляли цианоборогидрид натрия (10,2 г, 163 ммоль) и трифторметансульфоновую кислоту (5 мл) и реакционную смесь перемешивали при 23°С в течение 3 дней. Смесь охлаждали до 0°С, медленно добавляли 12н. HCl до прекращения выделения газа и полученную смесь перемешивали дополнительно 3 часа. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенное масло снова растворяли в H2O (50 мл) и раствор подщелачивали добавлением 10н. NаОН. Смесь экстрагировали СН2Cl2 (8×70 мл). Объединенные СН2Cl2-экстракты сушили и концентрировали при пониженном давлении с получением неочищенного продукта (12,0 г, 95%). Раствор 2-(1-бензилпиперидин-1-иламино)этанола (3,6 г, 15,3 ммоль) в ClСН2СН2Cl (5 мл) обрабатывали карбонилдиимидазолом (СDI) (2,6 г, 16 ммоль) и смесь перемешивали при 23°С в течение 30 минут. Смесь разбавляли СН2Cl2 (100 мл), промывали H2O (1×50 мл) и насыщенным водным NaНСО3 (1×50 мл), сушили и концентрировали при пониженном давлении с получением 2,85 г (65%) 3-(1-бензилпиперидин-4-ил)оксазолидин-2-она. К раствору 3-(1-бензилпиперидин-4-ил)оксазолидин-2-она (2,3 г, 8,8 ммоль) в ClСН2СН2Cl (40 мл) добавляли α-хлорэтилацетилхлорид (1,5 г, 10,6 ммоль) и смесь нагревали до 100°С в течение 90 минут. Смесь охлаждали до 23°С и концентрировали при пониженном давлении. Неочищенный остаток растворяли в СН3ОН и кипятили с обратным холодильником в течение 1 ч. Смесь охлаждали до 0°С и концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,89 г, 99%). Масс-спектр (ESI): точная масса, вычисленная для С8Н14N2О2, m/z, вычислено 170,1; m/z найдено 171,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,97 (шир.с, 2H), 4,27 (дд, J=9,1, 7,8, 2H), 3,80 (тт, J=11,8, 4,2, 1H), 3,49 (дд, J=8,0, 6,6, 1H), 3,30 (шир.д, J=12,7, 2H), 2,97 (дт, J=12,6, 2,3, 2H), 1,90 (ддд, J=16,6, 13,0, 4,1, 2H), 1,86-1,75 (м, 2H).
В. [4-(бензотиазол-2-илокси)фенил]метанол.
К смеси 4-гидроксибензилового спирта (12 г, 97 ммоль) в СН3СN (200 мл), содержащей К2СО3 (22 г, 159 ммоль), добавляли 2-хлорбензотиазол (22 г, 130 ммоль) и смесь кипятили с обратным холодильником в течение 72 ч. Смесь охлаждали до комнатной температуры, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта в виде золотистого масла. Неочищенное масло очищали на SiО2 (300 г; 5% ацетон/СН2Cl2) с получением прозрачного и бесцветного масла (15 г, выход 60%). Масс-спектр (ESI): точная масса, вычисленная для С14Н11NO2S; 257,1; m/z найдено 258,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=7,4, 1H), 7,69 (д, J=8,0, 1H), 7,50-7,31 (м, 5H), 7,32 (т, J=7,5, 1H), 5,32 (т, J=5,7, 1H), 4,55 (д, J=5,7, 2H).
С. 2-(4-хлорметилфенокси)бензотиазол.
К смеси [4-(бензотиазол-2-илокси)фенил]метанола (11 г, 43 ммоль) в СН2Cl2 (100 мл), содержащей триэтиламин (9 мл, 65 ммоль), при 5°С в течение 15 минут по каплям добавляли тионилхлорид (4 мл/г, 55 ммоль). Ледяную баню удаляли, смесь нагревали до комнатной температуры и перемешивали 24 часа. Смесь один раз промывали насыщенным К2СО3 (100 мл), сушили (MgSO4) и концентрировали при пониженном давлении с получением черного масла. Неочищенное масло очищали на SiО2 (300 г; 100% СН2Cl2) и получали прозрачное масло оранжевого цвета (10 г, выход 84%). Масс-спектр (ESI): точная масса, вычисленная для С14Н10ClNOS; 275,0; m/z найдено 276,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,95 (д, J=7,3, 1H), 7,70 (д, J=7,6, 1H), 7,59 (д, J=8,6, 2H), 7,47 (д, J=8,6, 2H), 7,37 (т, J=7,4, 1H), 7,33 (т, J=7,5, 1H), 4,84 (с, 2H).
D. 3-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}оксазолидин-2-он.
К смеси 2-(4-хлорметилфенокси)бензотиазола (670 мг, 2,4 ммоль) в СН3СN (15 мл), содержащей К2СО3 (544 мг, 3,9 ммоль), добавляли гидрохлоридную соль 3-пиперидин-4-илоксазолидин-2-она (355 мг, 1,7 ммоль) и смесь нагревали до 60°С в течение 24 ч. Смесь охлаждали до комнатной температуры, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта в виде золотистого масла. Неочищенное масло очищали на SiО2 (12 г; ацетон) и получали твердое вещество белого цвета (591 мг, выход 84%). Масс-спектр (ESI): точная масса, вычисленная для С22Н23N3O3S; 409,2; m/z найдено 410,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=8,7, 1H), 7,70 (д, J=7,5, 1H), 7,48-7,37 (м, 5H), 7,33 (д, J=8,0, 1H), 4,25 (т, J=7,7, 2H), 3,60-3,42 (м, 5H), 2,85 (д, J=11,5, 2H), 2,04 (т, J=11,4, 2H), 1,78-1,58 (м, 4H).
Пример 260
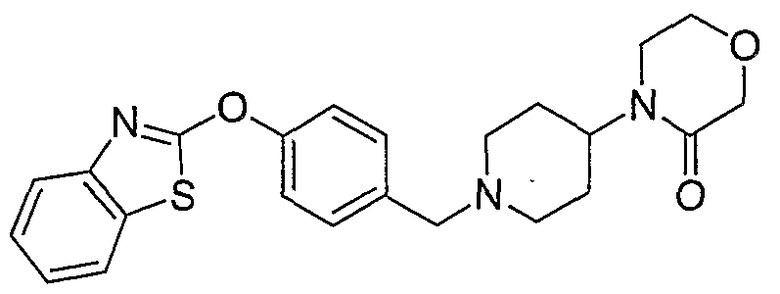
4-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}морфолин-3-он
А. 4-пиперидин-4-илморфолин-3-он.
К раствору 1-бензил-4-пиперидинона (10,3 г, 54 ммоль) и этаноламина (13,2 мг, 218 ммоль) в СН3СN (20 мл) добавляли цианоборогидрид натрия (10,2 г, 163 ммоль) и трифторметансульфоновую кислоту (5 мл) и реакционную смесь перемешивали при 23°С в течение 3 дней. Смесь охлаждали до 0°С, медленно добавляли 12н. HCl до прекращения выделения газа и полученную смесь перемешивали дополнительно 3 часа. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенное масло снова растворяли в H2O (50 мл) и раствор подщелачивали добавлением 10н. NаОН. Смесь экстрагировали СН2Cl2 (8×70 мл). Объединенные СН2Cl2 экстракты сушили и концентрировали при пониженном давлении с получением 12,0 г (выход 95%) неочищенного продукта. Раствор (0°С) 2-(1-бензилпиперидин-4-иламино)этанола (2,13 г, 9,1 ммоль) в этаноле (11 мл) и H2O (5 мл) одновременно обрабатывали хлорацетилхлоридом (1,8 мл, 22,7 ммоль) и 35% водным раствором NaOH и смесь перемешивали при температуре ниже 20°С в течение 3 часов. Реакционную смесь разбавляли H2O (20 мл) и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали насыщенным раствором соли, сушили и концентрировали с получением 1,83 г (выход 66%) 4-(1-бензилпиперидин-4-ил)морфолин-3-она. К раствору 4-(1-бензилпиперидин-4-ил)морфолин-3-она (1,1 г, 3,9 ммоль) в ClСН2СН2Cl (20 мл) добавляли α-хлорэтилацетилхлорид (660 мг, 4,6 ммоль) и реакционную смесь нагревали до 100°С в течение 16 ч. Смесь охлаждали до 23°С и концентрировали при пониженном давлении. Полученное неочищенное вещество очищали на SiО2 (12 г; 0-10% 2М аммиак в СН3ОН/СН2Cl2) с получением 282 мг (выход 53%) 4-пиперидин-4-илморфолин-3-она. Масс-спектр (ESI): точная масса, вычисленная для С8Н14N2О2, m/z, 184,1; m/z найдено 185,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 3,72 (с, 2H), 2,94 (т, J=6,6, 2H), 2,55 (т, J=3,6, 2H), 2,46 (тт, J=10,3, 3,7, 1H), 1,92 (дд, J=12,3, 2,3, 2H), 1,82-1,70 (м, 2H), 1,70-1,60 (м, 1H), 1,40-1,02 (м, 4H).
В. 4-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}морфолин-3-он.
Указанное в заголовке соединение получали, как описано в примере 259, стадия D. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O3S1; 423,16; m/z найдено 424,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,6, 1H), 7,70 (дд, J=7,9, 0,7, 1H), 7,45-7,40 (м, 2H), 7,36-7,28 (м, 4H), 4,57 (тт, J=12,1, 4,2, 1H), 4,22 (с, 2H), 3,90 (т, J=4,9, 2H), 3,56 (с, 2H), 3,34 (т, J=5,1, 2H), 3,01 (шир.д, J=11,6, 2H), 2,18 (ддд, J=11,7, 11,7, 2,2, 2H), 1,79 (дддд, J=12,1, 12,1, 12,0, 3,8, 2H), 1,72-1,65 (м, 2H).
Пример 261

(R)-1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он
А. Ацетатная соль (R)-4-гидрокси-1-пиперидин-4-илпирролидин-2-она.
Раствор 4-амино-1-бензилпиперидина (1,0 г, 5,2 ммоль) и N,N-диизопропилэтиламина (2,3 мг, 13,1 ммоль) в СН3СN (12 мл) обрабатывали (R)-4-бром-3-гидроксибутиратом (1,4 г, 6,8 ммоль) и смесь нагревали при 65°С в течение 48 ч. Смесь охлаждали, разбавляли этилацетатом (70 мл) и промывали H2O (20 мл). Органический слой сушили, концентрировали при пониженном давлении и затем неочищенный остаток очищали на SiО2 (12 г; 0-5% 2М аммиак в СН3ОН/СН2Cl2). Продукт растворяли в этаноле (20 мл) и нагревали до 80°С в течение 48 ч. Смесь концентрировали при пониженном давлении и неочищенный остаток очищали на SiО2 (12 г; 0-5% 2М аммиак в СН3ОН/СН2Cl2) с получением 346 мг (выход 25%) 1-(1-бензилпиперидин-4-ил)-4-гидроксипирролидин-2-она. Раствор 1-(1-бензилпиперидин-4-ил)-4-гидроксипирролидин-2-она (346 мг, 1,3 ммоль) в этаноле (7 мл) обрабатывали Pd(ОН)2 (60 мг), смесь загружали в аппарат Парра под давлением водорода 50 фунт/кв.дюйм и перемешивали в течение 5 дней. Смесь фильтровали через кизельгур и концентрировали с получением 280 мг (выход 92%) указанного в заголовке соединения, которое использовали в последующих реакциях без очистки. Масс-спектр (ESI): точная масса, вычисленная для С9Н16N2О2, 184,1; m/z найдено 185,2 [М+Н]+.
В. (R)-1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он.
Указанное в заголовке соединение получали, как описано в примере 24, с использованием ацетатной соли (R)-4-гидрокси-1-пиперидин-4-илпирролидин-2-она. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O4S1: 453,2; m/z найдено 454,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,5, 1H), 7,69 (дд, J=8,0, 0,7, 1H), 7,42 (дт, J=8,5, 1,3, 1H), 7,34-7,27 (м, 5H), 7,02-6,97 (м, 2H), 4,58-4,53 (м, 1H), 4,18-4,04 (м, 3H), 3,62 (дд, J=10,7, 5,6, 1H), 3,34 (дд, J=10,7, 2,2, 1H), 3,15-3,08 (м, 1H), 2,87 (т, J=5,7, 2H), 2,75 (дд, J=17,2, 6,6, 1H), 2,44 (дд, J=17,2, 2,6, 1H), 2,34-2,24 (м, 2H), 1,90-1,68 (м, 3H).
Пример 262
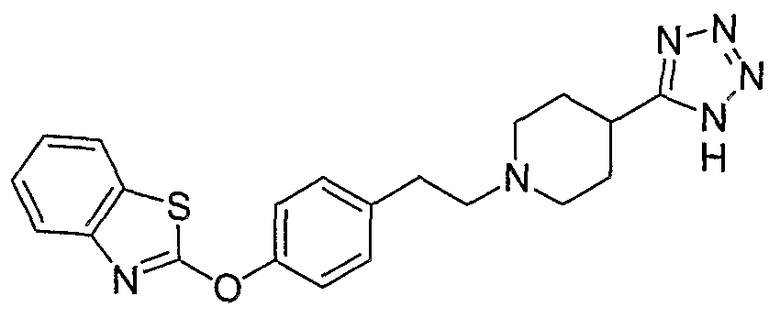
2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол
А. [4-(бензотиазол-2-илокси)фенил]ацетальдегид.
Раствор метилового эфира (4-гидроксифенил)уксусной кислоты (11,2 г, 62 ммоль) и 2-хлорбензотиазола (9,5 г, 56 ммоль) в СН3СN обрабатывали тонкодисперсным порошком Cs2CO3 (27 г, 84 ммоль) и полученную смесь перемешивали при 40°С в течение 17 ч и при 60°С в течение 2 ч. Реакционную смесь фильтровали через кизельгур и фильтрат концентрировали при пониженном давлении. Неочищенное твердое вещество очищали растворением в этилацетате (350 мл) и промывкой 10% NаОН (3×30 мл), 0,5М лимонной кислотой (1×30 мл), насыщенным водным NaНСО3 (1×30 мл) и насыщенным раствором соли (1×30 мл), затем сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 16 г (выход 95%) метилового эфира [4-(бензотиазол-2-илокси)фенил]уксусной кислоты в виде твердого вещества белого цвета. Раствор метилового эфира [4-(бензотиазол-2-илокси)фенил]уксусной кислоты (5,4 г, 18 ммоль) в 80 мл толуола при -90°С по каплям обрабатывали 1,0М раствором гидрида диизобутилалюминия в гексане (27 мл, 27 ммоль). Реакционную смесь медленно нагревали в течение 30 минут до -68°С и затем реакцию гасили добавлением метанола (2,0 мл). Реакционную смесь нагревали до -20°С, разбавляли диэтиловым эфиром (100 мл) и 2,0М HCl (60 мл) и затем интенсивно перемешивали в течение 30 минут. Органический слой отделяли, промывали насыщенным водным NaНСО3, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения (4,84 г, выход 99%).
В. 2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этил}-фенокси)бензотиазол.
Раствор [4-(бензотиазол-2-илокси)фенил]-ацетальдегида (628 мг, 2,3 ммоль) и 4-(1Н-тетразол-5-ил)пиперидина (443 мг, 2,34 ммоль) в СН2Cl2 (10 мл), содержащий триэтиламин (360 мкл, 2,6 ммоль), обрабатывали триацетоксиборогидридом натрия (599 мг, 2,7 ммоль) и смесь перемешивали при комнатной температуре в течение 24 ч. Смесь промывали насыщенным водным NaНСО3 (15 мл), сушили (MgSO4) и концентрировали при пониженном давлении с получением твердого вещества белого цвета. Твердое вещество промывали диэтиловым эфиром и сушили на воздухе с получением продукта в виде твердого вещества белого цвета (214 мг, выход 23%). Масс-спектр (ESI): масса, вычисленная для С21Н22N6OS; 406,2; m/z найдено 407,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,93 (д, J=7,9, 1H), 7,69 (д, J=7,7, 1H), 7,48-7,30 (м, 6H), 3,10 (д, J=11,6, 2H), 3,08-2,97 (м, 1H), 2,87 (т, J=6,7, 2H), 2,72 (т, J=8,6, 2H), 2,34 (т, J=11,0, 2H), 2,01 (д, J=11,2, 2H), 1,79 (кв, J=9,9, 2H).
Пример 263
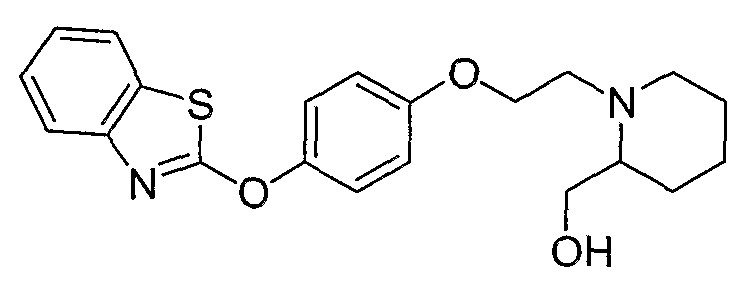
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-2-ил)метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 24, с использованием пиперидин-2-илметанола. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О3S; 384,2; m/z найдено 385,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,91 (д, J=7,9, 1H), 7,68 (д, J=8,0, 1H), 7,42 (т, J=7,3, 1H), 7,37 (д, J=9,0, 2H), 7,31 (т, J=8,1, 1H), 7,05 (д, J=9,1, 2H), 4,43 (т, J=5,3, 1H), 4,08 (т, J=6,2, 2H), 3,60-3,51 (м, 1H), 3,48-3,39 (м, 1H), 3,17-3,09 (м, 1H), 2,94-2,84 (м, 1H), 2,80-2,70 (м, 1H), 2,33 (т, J=10,4, 2H), 1,62 (д, J=9,3, 2H), 1,58-1,47 (м, 1H), 1,47-1,35 (м, 1H), 1,35-1,20 (м, 2H).
Пример 264
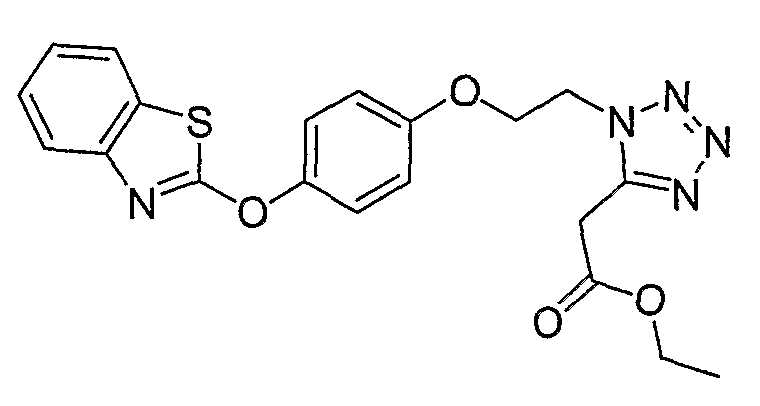
Этиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1Н-тетразол-5-ил)уксусной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 24, с использованием этилового эфира (1Н-тетразол-5-ил)уксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С20Н19N5О4S; 425,1; m/z найдено 426,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,91 (д, J=8,0, 1H), 7,67 (д, J=7,6, 1H), 7,46-7,36 (м, 3H), 7,32 (т, J=8,4, 1H), 7,03 (д, J=9,1, 2H), 4,88 (т, J=5,0, 2H), 4,43 (т, J=5,0, 2H), 4,35 (с, 2H), 4,14 (кв, J=7,1, 2H), 1,20 (т, J=7,1, 3H).
Пример 265
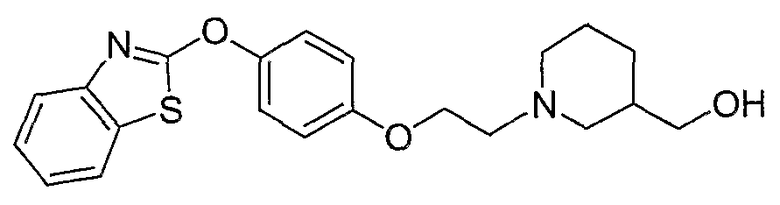
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-3-ил)метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 24, с использованием пиперидин-3-илметанола. Масс-спектр (ESI): точная масса, вычисленная для С21Н24N2О3S1; 384,2; m/z найдено 385,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=8,1, 1H), 7,68 (д, J=7,9, 1H), 7,42 (дт, J=8,4, 1,2, 1H), 7,34-7,26 (м, 3H), 7,02-6,97 (м, 2H), 4,15 (т, J=5,9, 2H), 3,68 (дд, J=10,6, 5,2, 1H), 3,56 (дд, J=10,4, 6,3, 1H), 3,00 (д, J=5,3, 1H), 2,84 (т, J=5,9, 2H), 2,83-2,79 (м, 1H), 2,75-2,60 (м, 1H), 2,30 (т, J=9,5, 1H), 2,16 (т, J=9,5, 1H), 1,92-1,78 (м,2H), 1,77-1,68 (м, 1H), 1,68-1,60 (м, 1H), 1,24-1,12 (м, 1H).
Пример 266
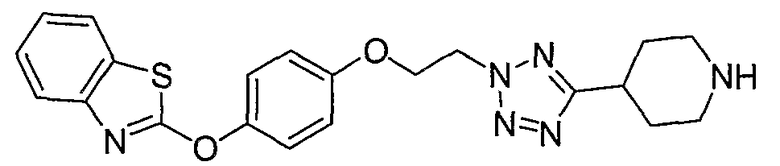
Гидрохлорид 2-{4-[2-(5-пиперидин-4-илтетразол-2-ил)этокси]фенокси}бензотиазола
А. Трет-бутиловый эфир 4-(2-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-2Н-тетразол-5-ил)пиперидин-1-карбоновой кислоты.
К перемешиваемому раствору 2-[4-(2-бромэтокси)фенокси]бензотиазола (Пример 9; 500 мг, 1,4 ммоль) и трет-бутилового эфира 4-(2Н-тетразол-5-ил)пиперидин-4-карбоновой кислоты (404 мг, 1,6 ммоль) в СН3СN (10 мл) добавляли Cs2CO3 (543 мг, 1,7 ммоль). Смесь нагревали при 60°С в течение 20 ч и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением прозрачного масла золотистого цвета, которое очищали на SiО2 (40 г; 0-15% ацетон/СН2Cl2), получая твердое вещество белого цвета (483 мг, выход 65%). ТСХ (SiО2, 15% ацетон/СН2Cl2): Rf=0,84. Масс-спектр (ESI): масса, вычисленная для С26Н30N6О4S; 522,2; m/z найдено 523,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,90 (д, J=7,7, 1H), 7,67 (д, J=7,9, 1H), 7,42 (т, J=7,1, 1H), 7,36 (д, J=6,8, 2H), 7,31 (т, J=8,1, 1H), 7,01 (д, J=6,9, 2H), 5,05 (т, J=4,7, 2H), 4,57 (т, J=4,8, 2H), 3,92 (д, J=12,4, 2H), 3,20-3,12 (м, 1H), 2,96 (шир.с, 2H), 1,97 (дд, J=13,3, 3, 2H), 1,65-1,52 (м, 2H), 1,40 (с, 9H).
В. Гидрохлорид 2-{4-[2-(5-пиперидин-4-илтетразол-2-ил)этокси]фенокси}бензотиазола.
К перемешиваемому раствору трет-бутилового эфира 4-(2-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-2Н-тетразол-5-ил)пиперидин-1-карбоновой кислоты (440 мг, 0,84 ммоль) в 88% муравьиной кислоте (7,5 мл) добавляли концентрированную HCl (75 мкл, 0,009 ммоль). Смесь перемешивали при комнатной температуре в течение 20 ч и концентрировали при пониженном давлении с получением прозрачного бесцветного масла. Масло сушили в условиях высокого вакуума в течение 2 ч и получали твердое вещество белого цвета (337 мг, выход 99%). Масс-спектр (ESI): масса, вычисленная для С21Н22N6O2S; 422,2; m/z найдено 423,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=7,9, 1H), 7,67 (д, J=8,0, 1H), 7,42 (т, J=7,8, 1H), 7,39 (д, J=9,4, 2H), 7,32 (т, J=7,4, 1H), 5,08 (т, J=4,7, 2H), 4,58 (т, J=4,8, 2H), 3,40-3,22 (м, 4H), 3,03 (кв, J=15,1, 2H), 2,16 (д, J=14,1, 2H), 1,92 (кв, J=14,3, 2H).
Пример 267
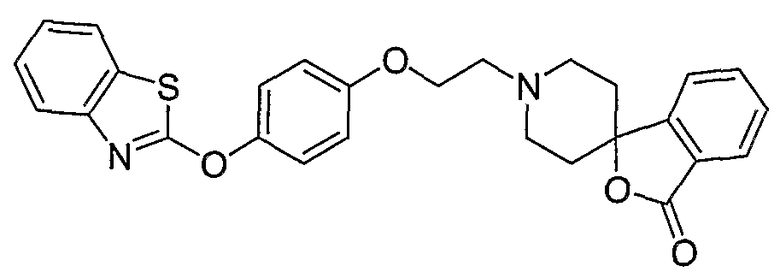
7-{2-[4-(бензотиазол-2-илокси)фенокси]этил]-4-спиро[3-фталид]пиперидин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 24, с использованием 4-спиро[3-фталид]пиперидина. Масс-спектр (ESI): масса, вычисленная для С27Н24N2О4S; 472,2; m/z найдено 473,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=7,9, 1H), 7,83 (д, J=7,7, 1H), 7,82-7,75 (м, 2H), 7,70 (д, J=10,2, 1H), 7,61 (т, J=11,6, 1H), 7,48-7,38 (м, 3H), 7,32 (т, J=8,2, 1H), 7,10 (д, J=9,1, 2H), 4,19 (т, J=5,7, 2H), 3,05 (д, J=13,0, 2H), 2,86 (т, J=5,6, 2H), 2,50-2,44 (м, 2H), 2,28 (т, J=13,5, 2H), 1,65 (д, J=12,5, 2H).
Пример 268

Этиловый эфир 1-{3-[4-(бензотиазол-2-илокси)фенил]пропил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 35, с использованием этилового эфира пиперидин-4-карбоновой кислоты для стадии А и 2-хлорбензотиазола для стадии С. Масс-спектр (ESI): масса, вычисленная для С24Н28N2О3S; 424,2; m/z найдено 425,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d6): 7,92 (д, J=7,9, 1H), 7,68 (д, J=8,0, 1H), 7,43 (т, J=8,1, 1H), 7,38-7,28 (м, 5H), 4,05 (кв, J=7,1, 2H), 2,78 (д, J=11,3, 2H), 2,63 (т, J=7,5, 2H), 2,25 (т, J=7,0, 3H), 1,93 (т, J=13,2, 2H), 1,84-1,68 (м, 4H), 1,54 (кв, J=14,9, 2H), 1,18 (т, J=7,1, 3H).
Пример 269

Гидрохлорид 2-[4-(бензотиазол-2-илокси)фенил]этиламина
А. Трет-бутиловый эфир [2-(4-гидроксифенил)этил]карбаминовой кислоты.
К перешиваемому раствору ди-трет-бутилдикаробоната (34,2 г, 157 ммоль) в ТГФ (200 мл) добавляли тирамин (21,3 г, 155 ммоль) в ТГФ (100 мл) в течение 1 ч. Смесь перемешивали в течение 2,5 ч и концентрировали при пониженном давлении с получением прозрачного масла золотистого цвета, которое очищали на SiО2 (300 г; 0-25% ацетон/СН2Cl2). Нужные фракции объединяли и концентрировали при пониженном давлении с получением продукта в виде прозрачного масла розового цвета (37 г, выход 100%). ТСХ (SiО2, 5% ацетон/СН2Cl2): Rf=0,31. Масс-спектр (ESI): масса, вычисленная для С13Н19NО3; 237,1; m/z найдено 260,2 [М+Nа]+. 1H ЯМР (400 МГц, ДМСО-d 6): 9,16 (с, 1H), 6,96 (д, J=8,4, 2H), 6,82 (с, 1H), 6,66 (д, J=8,4, 2H), 3,05 (кв, J=8,3, 2H), 2,56 (т, J=8,1, 2H), 1,37 (с, 9H).
В. Трет-бутиловый эфир {2-[4-(бензотиазол-2-илокси)фенил]этил}карбаминовой кислоты.
Указанное в заголовке соединение получали в виде твердого вещества белого цвета (9 г, выход 56%) в соответствии с методикой, описанной в примере 30, стадия В, с использованием трет-бутилового эфира [2-(4-гидроксифенил)этил]карбаминовой кислоты. ТСХ (SiО2, СН2Cl2): Rf=0,19. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О3S; 370,1; m/z найдено 371,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=7,9, 1H), 7,68 (д, J=8,0, 1H), 7,48-7,30 (м, 6H), 7,34 (т, J=7,8, 1H), 3,09 (д, J=7,1, 2H), 2,75 (т, J=7,4, 2H), 1,38 (с, 9H).
С. Гидрохлорид 2-[4-(бензотиазол-2-илокси)фенил]этиламина.
Указанное в заголовке соединение получали в виде твердого вещества белого цвета (6,4 г, выход 100%) в соответствии с методикой, описанной в примере 266, стадия В. Масс-спектр (ESI): масса, вычисленная для С15Н14N2ОS; 270,1; m/z найдено 271,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,05 (шир.с, 2H), 7,94 (д, J=7,8, 1H), 7,68 (д, J=7,8, 1H), 7,53-7,39 (м, 5H), 7,34 (т, J=7,9, 1H), 3,09 (т, J=6,9, 2H), 2,95 (т, J=8,6, 2H).
Пример 270
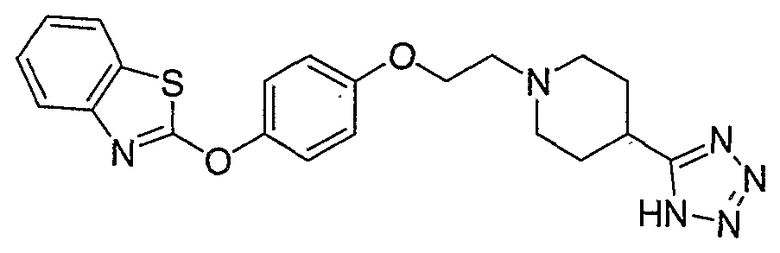
2-(4-{2-[4-(1H-тетразол-5-ил)пиперидин-1-ил]этокси]фенокси)бензотиазол
А. Метиловый эфир [4-(бензотиазол-2-илокси)фенокси]уксусной кислоты.
К перемешиваемой смеси гидрида натрия (7,5 г, 187,5 ммоль) в ДМСО (100 мл) в течение 30 минут добавляли гидрохинон (10,0 г, 91,2 ммоль). Затем смесь нагревали до 80°С в течение 2 часов и охлаждали до комнатной температуры. К перемешиваемой смеси в течение 30 минут добавляли 2-хлорбензотиазол (11,3 мл, 91,3 ммоль) и смесь перемешивали при комнатной температуре в течение 24 ч. К смеси добавляли метил-2-бромацетат (86 мл, 90,8 ммоль) в течение 30 минут и смесь перемешивали в течение 24 ч. К смеси добавляли H2O (1 л) и продукт экстрагировали Et2О (2×500 мл), сушили (MgSO4) и концентрировали при пониженном давлении с получением бежевого твердого вещества. Твердое вещество перемешивали в СН2Cl2 (200 мл) и фильтровали с получением продукта в виде твердого вещества белого цвета (24,2 г, выход 84%). Масс-спектр (ESI): масса, вычисленная для С16Н13N2O4S; 315,1; m/z найдено 316,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,92 (д, J=8,0, 1H), 7,66 (д, J=8,1, 1H), 7,47-7,40 (м, 3H), 7,32 (т, J=7,5, 1H), 7,07 (д, J=8,6, 2H), 4,87 (с, 2H), 3,73 (с, 3H).
В. [4-(бензотиазол-2-илокси)фенокси]ацетальдегид.
К перемешиваемому раствору метилового эфира [4-(бензотиазол-2-илокси)фенокси]уксусной кислоты (1,0 г, 3,17 ммоль) в ТГФ (15 мл) при -78°С добавляли DIBAL-Н (5 мл, 5 ммоль), поддерживая температуру ниже -75°С. Смесь перемешивали при -72°С в течение 4 ч, реакцию гасили добавлением H2O (10 мл), затем смесь экстрагировали СН2Cl2 (2×10 мл), сушили (MgSO4) и концентрировали при пониженном давлении, получая прозрачное масло золотистого цвета (708 мг, выход 78%). Масс-спектр (ESI): масса, вычисленная для С15Н11NO3S; 285,1; m/z найдено 286,3 [М+Н]+.
С. 2-(4-{2-[4-(1H-тетразол-5-ил)пиперидин-1-ил]этокси]-фенокси)бензотиазол.
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия В с использованием 4-(1Н-тетразол-5-ил)пиперидина. Масс-спектр (ESI): масса, вычисленная для С21Н22N6О2S; 422,2; m/z найдено 422,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,93 (д, J=7,8, 1H), 7,68 (д, J=7,9, 1H), 7,49-7,40 (м, 3H), 7,33 (т, J=7,3, 1H), 7,14 (д, J=9,0, 2H), 4,43 (т, J=4,3, 2H), 3,62-3,43 (м, 4H), 3,25-3,10 (м, 3H), 2,25 (д, J=12,0, 2H), 2,18-2,02 (м, 2H).
Пример 271

2-(4-пиперидин-1-илметилфенокси)бензооксазол
А. 4-пиперидин-1-илметилфенол.
Смесь 4-гидроксибензальдегида (10 г, 82 ммоль), пиперидина (16 мл, 164 ммоль) и молекулярных сит (10 г, измельченных, 4Е) в ClСН2СН2Cl (150 мл) перемешивали при комнатной температуре в течение 40 мин. К полученной смеси порциями в течение 1,5 часа добавляли NаВН(ОАс)3 (7×5 г, 164 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Полученную смесь разбавляли СН2Cl2 (300 мл), фильтровали через кизельгур и снова промывали СН2Cl2 (100 мл). Фильтрат промывали насыщенным водным NaНСО3 (3×150 мл), экстрагировали смесью 25% изопропанол/CHCl3, затем сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде полутвердого вещества оранжевого цвета. Неочищенный продукт очищали на SiО2 (120 г; 0-100% ацетон/СН2Cl2) и получали твердое вещество желтого цвета (3,08 г, выход 48%). Масс-спектр (ESI): масса, вычисленная для С12Н17NО; 191,1; m/z найдено 192,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,18 (д, J=8,4, 2H), 6,75 (д, J=8,4, 2H), 3,83 (с, 2H), 2,81 (шир.с, 4H), 1,77 (квинтет, J=5,7, 4H), 1,54 (шир.с, 2H).
В. 2-(4-пиперидин-1-илметилфенокси)бензооксазол.
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 13, стадия В, с использованием 4-пиперидин-1-илметилфенола. Масс-спектр (ESI): масса, вычисленная для С19Н20N2О2S; 308,2; m/z найдено 309,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,64 (д, J=3,1 Гц, 1H), 7,52 (д, J=8,9 Гц, 1H), 7,3 (кв, J=8,3 Гц, 4H), 7,34-7,26 (м, 2H), 3,45 (с, 2H), 2,33 (шир.с, 4H), 1,57-1,46 (м, 4H), 1,44-1,32 (м, 2H).
Пример 272

[4-(бензотиазол-2-илокси)бензил}циклогексилэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием циклогексилэтиламина. Масс-спектр (ESI): масса, вычисленная для С22Н26N2ОS; 366,2; m/z найдено 367,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,93 (д, J=8,5, 1H), 7,70 (д, J=8,0, 1H), 7,45 (т, J=8,5, 3H), 7,37 (д, J=8,6, 2H), 7,33 (т, J=8,3, 1H), 3,63 (с, 2H), 2,58-2,41 (м, 3H), 1,76 (т, J=11,9, 4H), 1,58 (д, J=12,1, 1H), 1,32-1,01 (м, 5H), 0,95 (т, J=7,1, 3H).
Пример 273
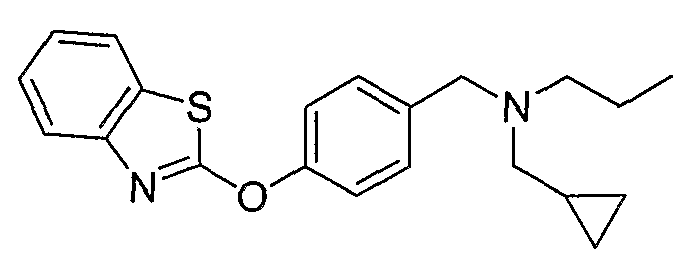
[4-(бензотиазол-2-илокси)бензил]циклопропилметилпропиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием (2-циклопропилметил)этиламина. Масс-спектр (ESI): масса, вычисленная для С21Н24N2ОS; 352,2; m/z найдено 353,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d6): 7,94 (д, J=8,0, 1H), 7,70 (д, J=8,1, 1H), 7,45 (т, J=8,5, 3H), 7,39 (д, J=8,6, 2H), 7,33 (т, J=8,0, 1H), 3,66 (с, 2H), 2,53-2,44 (м, 3H), 2,32 (д, J=6,5, 2H), 1,54-1,42 (м, 2H), 1,32-1,01 (м, 5H), 0,85 (д, J=7,3, 4H), 0,45 (д, J=9,7, 2H), 0,06 (т, J=6,2, 2H).
Пример 274
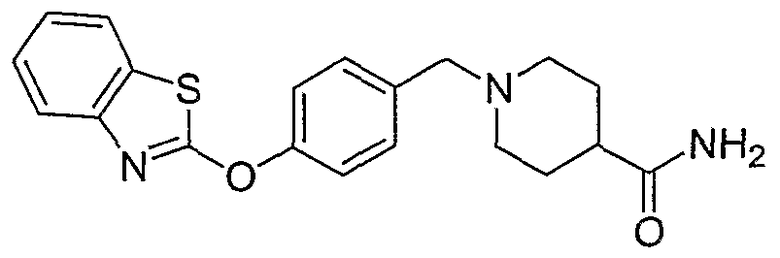
Амид 1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием амида пиперидин-4-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С20Н21N3О2S; 367,1; m/z найдено 368,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,4, 1H), 7,70 (д, J=7,9, 1H), 7,48-7,38 (м, 5H), 7,33 (д, J=7,1, 1H), 7,22 (с, 1H), 6,73 (с, 1H), 3,49 (с, 2H), 2,83 (д, J=11,4, 2H), 2,14-2,02 (м, 1H), 2,00-1,93 (м, 2H), 1,73-1,62 (м, 2H), 1,58 (т, J=15,4, 2H).
Пример 275
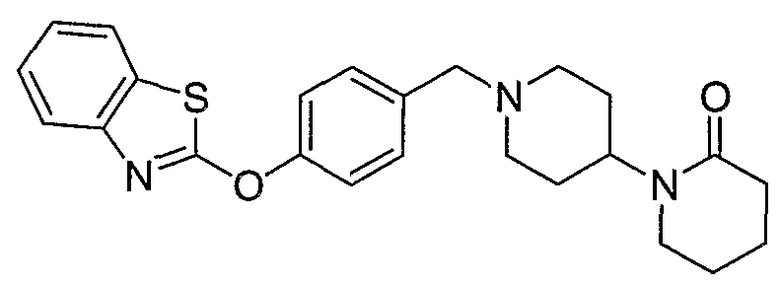
1'-[4-(бензотиазол-2-илокси)бензил]-[1,4']бипиперидинил-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием [1,4']бипиперидинил-2-она. Масс-спектр (ESI): масса, вычисленная для С24Н27N3О2S; 421,2; m/z найдено 422,5 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=8,8, 1H), 7,70 (д, J=8,6, 1H), 7,48-7,38 (м, 5H), 7,33 (д, J=9,0, 1H), 4,37-4,25 (м, 1H), 3,52 (с, 2H), 3,16 (т, J=5,2, 2H), 2,89 (д, J=11,2, 2H), 2,22 (т, J=6,6, 2H), 2,03 (т, J=11,1, 2H), 1,78-1,58 (м, 6H), 1,45 (д, J=10,8, 2H).
Пример 276

{4-[4-(бензотиазол-2-илокси)бензил}пиперазин-1-ил}пиридин-3-илметанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием пиперазин-1-илпиридин-3-илметанона. Масс-спектр (ESI): масса, вычисленная для С24Н22N4О2S; 430,2; m/z найдено 431,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,65 (д, J=4,8, 1H), 8,61 (д, J=1,9, 1H), 7,94 (д, J=7,9, 1H), 7,84 (д, J=7,8, 1H), 7,69 (д, J=,8,0, 1H), 7,60-7,40 (м, 6H), 7,33 (д, J=8,3, 1H), 3,64 (шир.с, 2H), 3,58 (с, 2H), 3,37 (шир.с, 2H), 2,41 (шир.с, 4H).
Пример 277

Трет-бутиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием трет-бутилового эфира пиперидин-4-илметилкарбаминовой кислоты. Масс-спектр (ESI): масса, вычисленная для С25Н32N3О3S; 453,2; m/z найдено 454,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,3, 1H), 7,70 (д, J=7,9, 1H), 7,48-7,37 (м, 5H), 7,33 (д, J=8,2, 1H), 6,85 (т, J=5,9, 1H), 3,48 (с, 2H), 2,86-2,76 (м, 4H), 1,90(т, J=11,1, 2H), 1,56 (д, J=11,8, 2H), 1,37 (с, 10H), 1,11 (т, J=9,9, 2H).
Пример 278
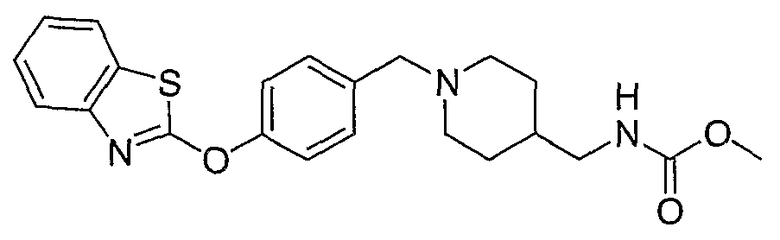
Метиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 258, стадия С, с использованием метилхлорформиата. Масс-спектр (ESI): масса, вычисленная для С22Н25N3О3S; 411,2; m/z найдено 412,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,9, 1H), 7,70 (д, J=8,0, 1H), 7,48-7,36 (м, 5H), 7,33 (д, J=8,0, 1H), 7,17 (т, J=5,6, 1H), 3,51 (с, 3H), 3,48 (с, 2H), 2,87 (т, J=6,2, 2H), 2,80 (д, J=11,1, 2H), 1,90 (т, J=10,5, 2H), 1,60 (т, J=12,8, 2H), 1,38 (шир.с, 1H), 1,20-1,06 (м, 2H).
Пример 279
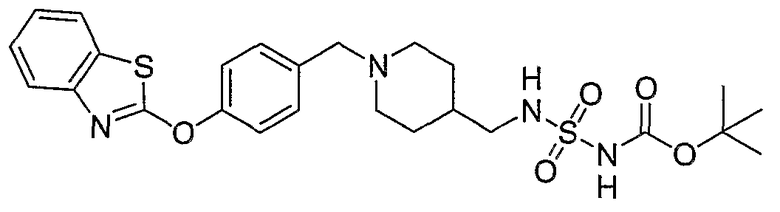
Трет-бутиловый эфир N-{C-[[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил]метиламиносульфонил}карбаминовой кислоты
К перемешиваемому раствору С-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метиламина (Пример 258, стадия В, 657 мг, 1,5 ммоль) в СН2Cl2 (15 мл), содержащему триэтиламин (1 мл, 7,2 ммоль), добавляли трет-бутиловый эфир N-(сульфонилхлорид)карбаминовой кислоты (440 мг, 2,1 ммоль). Смесь перемешивали в течение 48 часов, растворяли в СН2Cl2 (50 мл), затем один раз промывали H2O (75 мл), сушили (MgSO4) и концентрировали при пониженном давлении с получением прозрачного, бесцветного масла. Масло очищали на SiО2 (12 г; 0-50% ацетон/СН2Cl2) и нужные фракции объединяли и концентрировали при пониженном давлении с получением твердого вещества белого цвета (112 мг, выход 14%). ТСХ (SiО2, 50% ацетон/СН2Cl2): Rf=0,40. Масс-спектр (ESI): масса, вычисленная для С25Н32N4O5S2; 532,2; m/z найдено 533,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 10,74 (шир.с, 1H), 7,90 (д, J=7,9, 1H), 7,66 (д, J=8,0, 1H), 7,54 (шир.с, 1H), 7,44-7,34 (м, 5H), 7,30 (д, J=8,3, 1H), 3,48 (с, 2H), 2,84-2,70 (м, 4H), 1,90 (т, J=10,4, 2H), 1,64 (д, J=11,4, 2H), 1,38(с, 10H), 1,16-1,02 (м, 2H).
Пример 280
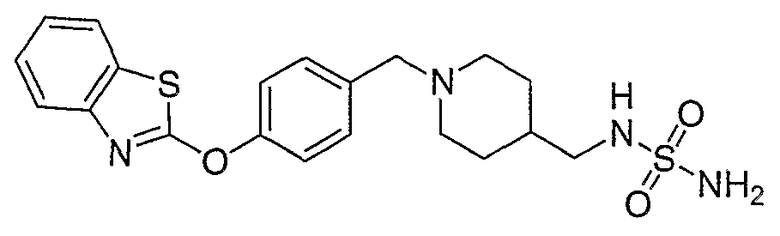
Гидрохлорид N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}сульфамида
Указанное в заголовке соединение получали из соединения примера 279 в соответствии с методикой, описанной в примере 266, стадия В. Масс-спектр (ESI): масса, вычисленная для С20Н24N4О3S2; 432,1; m/z найдено 433,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 10,08 (шир.с, 1H), 7,80 (д, J=8,2, 1H), 7,76-7,68 (м, 3H), 7,58 (д, J=8,6, 2H), 7,45 (т, J=8,4, 2H), 7,36 (т, J=8,8, 2H), 6,70-6,50 (шир.с, 2H), 4,33 (д, J=5,4, 2H), 3,00-2,86 (шир.с, 1H), 2,77 (т, J=6,2, 2H), 1,91 (д, J=13,4, 2H), 1,71 (шир.с, 1H), 1,50-1,36 (м, 2H), 1,34-1,26 (м, 1H).
Пример 281
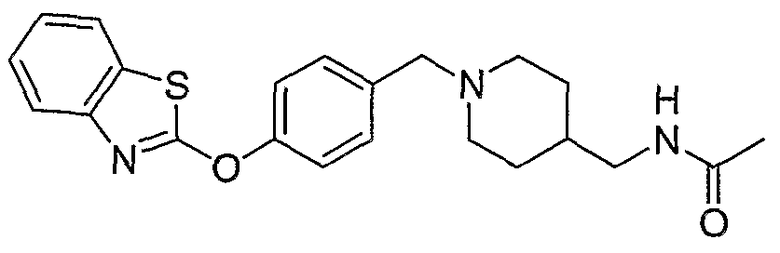
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}ацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 258, стадия С, с использованием ацетилхлорида. Масс-спектр (ESI): масса, вычисленная для С22Н25N3О2S; 395,2; m/z найдено 396,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,8, 1H), 7,83 (т, J=5,5, 1H), 7,70 (д, J=8,0, 1H), 7,48-7,36 (м, 5H), 7,33 (д, J=8,2, 1H), 3,48 (с, 2H), 2,93 (т, J=6,2, 2H), 2,81 (д, J=11,4, 2H), 1,91 (т, J=11,3, 2H), 1,80 (с, 3H), 1,61 (д, J=11,0, 2H), 1,38 (шир.с, 1H), 1,20-1,06 (м, 2H).
Пример 282
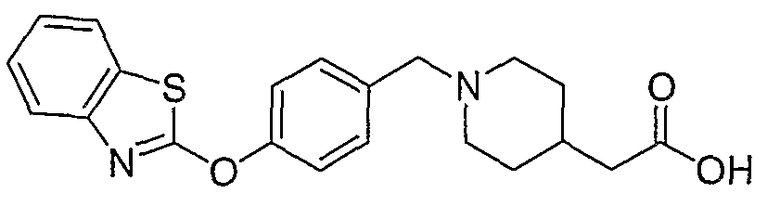
{1-[4-(бензотиазол-2-илокси)бензил}пиперидин-4-ил}уксусная кислота
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием этилового эфира пиперидин-4-илуксусной кислоты, и в примере 250, стадия D. Масс-спектр (ESI): масса, вычисленная для С21Н22N2О3S; 382,1; m/z найдено 383,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 10,1 (шир.с, 1H), 7,97 (д, J=7,9, 1H), 7,70 (д, J=7,6, 3H), 7,58 (шир.с, 2H), 7,45 (т, J=7,2, 1H), 7,36 (т, J=7,3, 1H), 4,31 (шир.с, 1H), 2,98 (шир.с, 3H), 2,20 (д, J=5,6, 3H), 1,87 (шир.с, 4H), 1,51 (шир.с, 2H).
Пример 283

({1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}карбамоил)метиловый эфир уксусной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 258, стадия D, с использованием [(пиперидин-4-илметил)карбамоил]метилового эфира уксусной кислоты и в соответствии с методикой, описанной в примере 253, стадия D. Масс-спектр (ESI): масса, вычисленная для С24Н27N3О4S; 453,2; m/z найдено 454,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,01 (т, J=5,8, 1H), 7,94 (д, J=7,5, 1H), 7,70 (д, J=8,0, 1H), 7,80-7,36 (м, 5H), 7,33 (т, J=7,2, 1H), 4,43 (с, 2H), 3,48 (с, 2H), 2,98 (т, J=6,3, 2H), 2,81 (д, J=11,4, 2H), 2,08 (с, 3H), 1,91 (т, J=11,2, 2H), 1,60 (д, J=11,2, 2H), 1,42 (шир.с, 1H), 1,20-1,08 (м, 2H).
Пример 284

Трет-бутиловый эфир [2-({1-[4-(бензотиазол-2-илокси)бензил}пиперидин-4-илметил}карбамоил)циклобутил]карбаминовой кислоты
Указанное в заголовке соединение получали из соединения примера 258, стадия В, в соответствии с методикой, описанной в примере 257, стадия С, с использованием 2-трет-бутоксикарбониламиноциклобутанкарбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С30Н38N4О4S; 550,3; m/z найдено 551,5 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,9, 1H), 7,70 (д, J=8,0, 1H), 7,47-7,35 (м, 7H), 7,33 (т, J=7,3, 1H), 3,47 (с, 2H), 2,95 (т, J=6,1, 2H), 2,78 (т, J=9,6, 2H), 2,45-2,35 (м, 2H), 2,13 (с, 1H), 2,05-1,95 (м, 2H), 1,93-1,70 (м, 4H), 1,59 (д, J=10,9, 2H), 1,38 (с, 9H), 1,20-1,05 (м, 2H).
Пример 285

Дигидрохлорид {1-[4-(бензотиазол-2-илокси)бензил}пиперидин-4-илметил}амида 2-аминоциклобутанкарбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 266, стадия В. Масс-спектр (ESI): масса, вычисленная для С25Н30N4О2S; 450,2; m/z найдено 451,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,78-8,55 (м, 4H), 7,97 (д, J=8,1, 1H), 7,78 (д, J=8,6, 3H), 7,71 (д, J=7,8, 1H), 7,45 (т, J=8,5, 1H), 7,36 (т, J=7,1, 1H), 4,32 (с, 2H), 3,20-3,05 (м, 2H), 3,00-2,85 (м, 2H), 2,472 (д, J=4,7, 2H), 2,62-2,50 (м, 2H), 2,65-2,42 (м, 2H), 2,38-2,05 (м, 1H), 2,02-1,70 (м, 6H), 1,68-1,50 (с, 2H).
Пример 286
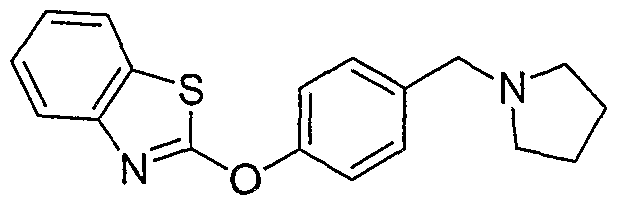
2-(4-пирролидин-1-илметилфенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием пирролидина. Масс-спектр (ESI): масса, вычисленная для С18Н18N2ОS; 310,1; m/z найдено 311,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=9,0, 1H), 7,70 (д, J=8,0, 1H), 7,48-7,37 (м, 5H), 7,33 (т, J=7,7, 1H), 3,62 (с, 2H), 2,49-2,40 (м, 4H), 1,78-1,65 (м, 4H).
Пример 287
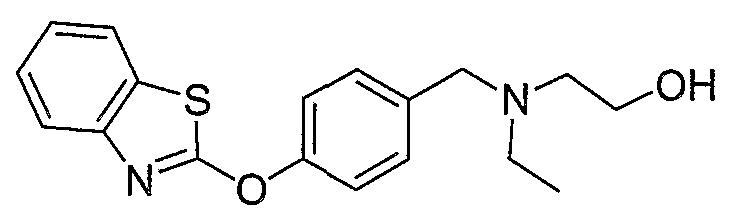
2-{[4-(бензотиазол-2-илокси)бензил]этиламино}этанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием 2-этиламиноэтанола. Масс-спектр (ESI): масса, вычисленная для С18Н20N2О2S; 328,1; m/z найдено 329,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d6): 7,94 (д, J=8,0, 1H), 7,70 (д, J=7,7, 1H), 7,50-7,36 (м, 5H), 7,33 (т, J=7,7, 1H), 4,39 (т, J=5,4, 1H), 3,63 (с, 2H), 3,49 (кв, J=6,4, 2H), 2,57-2,45 (м, 4H), 1,00 (т, J=7,1, 3H).
Пример 288
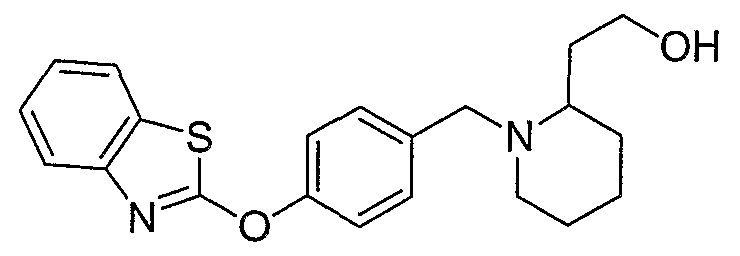
2-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-2-ил}этанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием 2-пиперидин-2-илэтанола. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О2S; 368,2; m/z найдено 369,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,93 (д, J=8,0, 1H), 7,70 (д, J=7,7, 1H), 7,48-7,36 (м, 5H), 7,33 (т, J=6,9, 1H), 4,42 (с, 1H), 3,92 (д, J=14,0, 1H), 3,50 (шир.с, 2H), 3,31 (д, J=6,4, 1H), 2,70-2,60 (м, 1H), 2,14-2,03 (м, 1H), 1,87-1,75 (м, 1H), 1,70-1,55 (м, 3H), 1,53-1,27 (м, 5H).
Пример 289
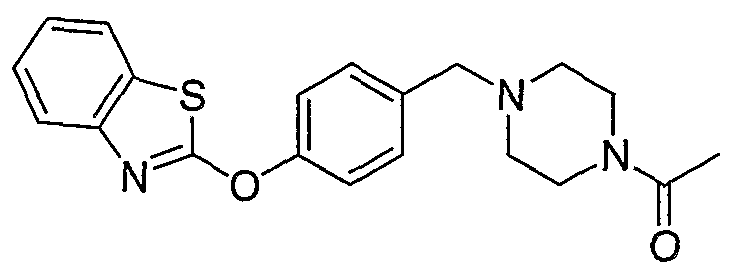
1-{4-[4-(бензотиазол-2-илокси)бензил]пиперазин-1-ил}этанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием 1-пиперазин-1-илэтанона. Масс-спектр (ESI): масса, вычисленная для С20Н21N3О2S; 367,1; m/z найдено 368,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=8,0, 1H), 7,70 (д, J=7,5, 1H), 7,48-7,39 (м, 5H), 7,33 (т, J=7,7, 1H), 3,55 (с, 2H), 3,50-3,40 (м, 4H), 2,40 (т, J=4,9, 2H), 2,33 (т, J=5,0, 2H), 1,99 (с, 3H).
Пример 290
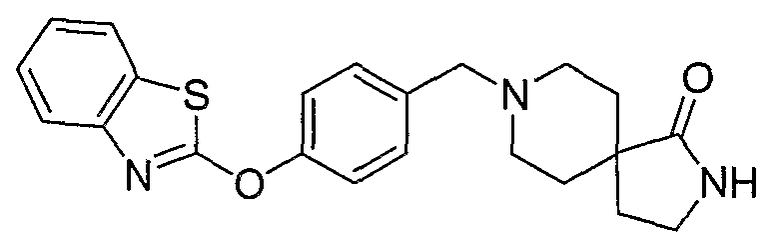
8-[4-(бензотиазол-2-илокси)бензил]-2,8-диаза-спиро[4.5]декан-1-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием 2,8-диаза-спиро[4.5]декан-1-она. Масс-спектр (ESI): масса, вычисленная для С22Н23N3О2S; 393,2; m/z найдено 394,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,4, 1H), 7,70 (д, J=8,0, 1H), 7,54 (с, 1H), 7,48-7,36 (м, 5H), 7,33 (т, J=8,2, 1H), 3,51 (с, 2H), 3,15 (т, J=6,8, 2H), 2,75(д, J=11,6, 2H), 2,05 (т, J=10,0, 2H), 1,91 (т, J=6,8, 2H), 1,70 (т, J=12,6, 2H), 1,33 (д, J=12,8, 2Н).
Пример 291
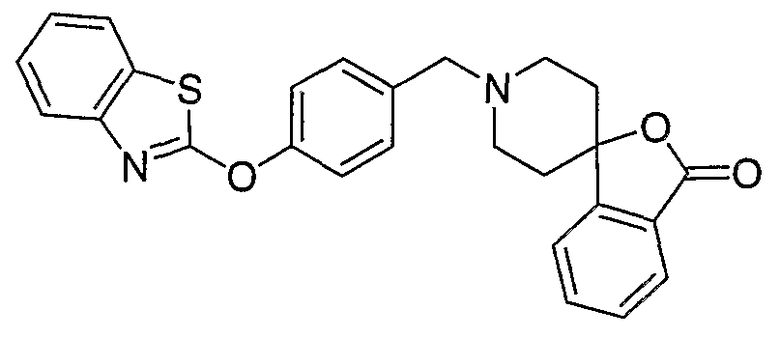
Спиро[изобензофуран-1(3Н),4'-пиперидин]-3-он, 1'-[4-бензотиазол-2-илокси)бензил]
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием спиро[изобензофуран-1(3Н),4'-пиперидин]-3-она. Масс-спектр (ESI): масса, вычисленная для С26Н22N2О3S; 442,1; m/z найдено 443,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,95 (д, J=7,9, 1H), 7,83 (д, J=7,6, 1H), 7,82-7,76 (м, 2H), 7,70 (д, J=8,0, 1H), 7,61 (т, J=7,8, 1H), 7,56-7,48 (м, 2H), 7,47-7,40 (м, 3H), 7,33 (т, J=7,4, 1H), 3,66 (с, 2H), 2,90 (д, J=11,1, 2H), 2,41 (т, J=11,0, 2H), 2,28 (т, J=13,3, 2H), 1,66 (д, J=12,6, 2H).
Пример 292
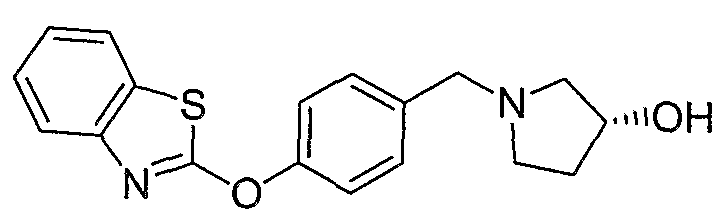
(R)-1-[4-(бензотиазол-2-илокси)бензил]пирролидин-3-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием (R)пирролидин-3-ола. Масс-спектр (ESI): масса, вычисленная для С18Н18N2О2S; 326,1; m/z найдено 327,2 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=8,0, 1H), 7,70 (д, J=8,1, 1H), 7,48-7,36 (м, 5H), 7,33 (т, J=7,2, 1H), 4,72 (д, J=4,5, 1H), 4,27-4,16 (м, 1H), 3,60 (кв, J=13,2, 2H), 2,73-2,65 (м, 1H), 2,60 (кв, J=8,1, 1H), 2,47-2,38 (м, 1H), 2,36-2,30 (м, 1H), 2,07-1,95 (м, 1H), 1,62-1,50 (м, 1H).
Пример 293

2-[4-(2-метилпиперидин-1-илметил)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием 2-метилпиперидина. Масс-спектр (ESI): масса, вычисленная для С20Н22N2ОS; 338,2; m/z найдено 339,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=8,0, 1H), 7,70 (д, J=8,1, 1H), 7,30-7,33 (м, 5H), 7,33 (т, J=7,9, 1H), 3,96 (д, J=13,9, 1H), 3,19 (д, J=13,9, 1H), 2,70-2,60 (м, 1H), 2,40-2,30 (м, 1H), 1,98 (т, J=13,0, 1H), 1,68-1,56 (м, 2H), 1,54-1,34 (м, 2H), 1,32-1,24 (м, 2H), 1,11 (д, J=6,2, 3H).
Пример 294

[4-(бензотиазол-2-илокси)бензил]диэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием диэтиламина. Масс-спектр (ESI): масса, вычисленная для С18Н20N2ОS; 312,1; m/z найдено 313,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,9, 1H), 7,70 (д, J=8,0, 1H), 7,48-7,36 (м, 5H), 7,33 (т, J=7,2, 1H), 3,57 (с, 2H), 2,48 (кв, J=7,1, 4H), 1,00 (т, J=7,1, 6H).
Пример 295
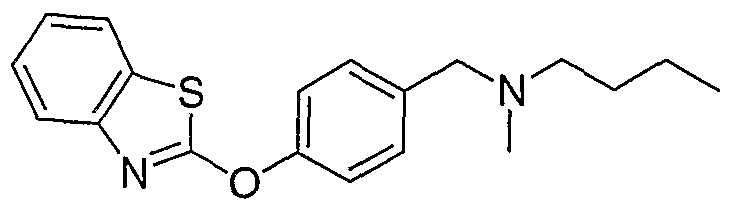
[4-(бензотиазол-2-илокси)бензил}бутилметиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием бутилметиламина. Масс-спектр (ESI): масса, вычисленная для С19Н22N2ОS; 326,2; m/z найдено 327,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,9, 1H), 7,70 (д, J=7,5, 1H), 7,48-7,36 (м, 5H), 7,33 (т, J=8,0, 1H), 3,49 (с, 2H), 2,34 (т, J=7,1, 2H), 2,13 (с, 3H), 1,50-1,40 (м, 2H), 1,38-1,24 (м, 2H), 0,88 (т, J=7,3, 3H).
Пример 296

2-{1-[4-(бензотиазол-2-илокси)бензил}пиперидин-4-ил}этанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием 2-пиперидин-2-илэтанола. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О2S; 368,2; m/z найдено 369,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d6): 7,74 (д, J=7,9, 1H), 7,49 (д, J=8,0, 1H), 7,30-7,16 (м, 5H), 7,13 (т, J=7,9, 1H), 4,13 (т, J=5,1, 1H), 3,27 (с, 2H), 3,23 (кв, J=6,2, 2H), 2,59 (д, J=11,1, 2H), 1,72(т, J=10,3, 2H), 1,42 (д, J=12,1, 2H), 1,16 (т, J=3,8, 3H), 1,00-0,85 (м, 2H).
Пример 297

1-[4-(бензотиазол-2-илокси)бензил}пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием пиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С19Н20N2О2S; 340,1; m/z найдено 341,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,9, 1H), 7,68 (д, J=8,0, 1H), 7,46-7,36 (м, 5H), 7,32 (т, J=8,1, 1H), 4,60 (д, J=4,9, 1H), 3,58-3,40 (м,3H), 2,80 (д, J=9,9, 1H), 2,65 (д, J=10,7, 1H), 1,87 (т, J=9,2, 1H), 1,80 (д, J=8,6, 1H), 1,71 (т, J=9,8, 1H), 1,62 (д, J=13,3, 1H), 1,48-1,38 (м, 1H), 1,12-1,00 (м, 1H).
Пример 298

{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-2-ил}метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием пиперидин-2-илметанола. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О2S; 354,1; m/z найдено 355,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,98 (д, J=7,2, 1H), 7,74 (д, J=8,0, 1H), 7,53-7,42 (м, 5H), 7,37 (т, J=8,3, 1H), 4,60 (т, J=5,2, 1H), 4,18 (д, J=14,1, 1H), 3,75-3,65 (м, 1H), 3,56-3,46 (м, 1H), 3,37 (д, J=3,8, 1H), 2,72 (д, J=11,9, 1H), 2,36 (д, J=4,8, 1H), 2,07 (т, J=9,7, 1H), 1,72 (т, J=13,2, 2H), 1,58-1,26 (м, 4H).
Пример 299

(R)-{1-[4-(бензотиазол-2-илокси)бензил]пирролидин-2-ил}метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием (R)пирролидин-2-илметанола. Масс-спектр (ESI): масса, вычисленная для С19Н20N2О2S; 340,1; m/z найдено 340,1 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,97 (д, J=7,2, 1H), 7,73 (д, J=7,8, 1H), 7,50-7,38 (м, 5H), 7,36 (т, J=7,9, 1H), 4,90 (т, J=5,4, 1H), 4,14 (д, J=13,4, 1H), 3,55-3,48 (м, 1H), 3,42 (д, J=13,4, 2H), 2,84 (т, J=6,6, 1H), 2,68-2,58 (м, 1H), 2,20 (кв, J=8,6, 1H), 1,95-1,83 (м, 1H), 1,72-1,55 (м, 3H).
Пример 300
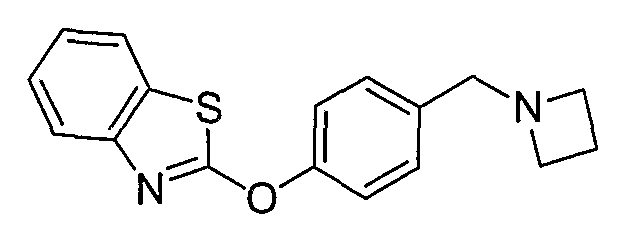
2-(4-азетидин-1-илметилфенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием азетидина. Масс-спектр (ESI): масса, вычисленная для С17Н16N2О2S; 296,1; m/z найдено 297,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,80 (д, J=8,5, 1H), 7,56 (д, J=8,0, 1H), 7,35-7,24 (м, 5H), 7,19 (т, J=7,3, 1H), 3,43 (с, 2H), 3,02 (т, J=7,0, 4H), 1,92-1,80 (м, 2H).
Пример 301
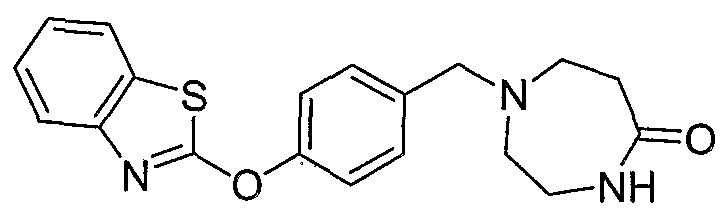
1-[4-(бензотиазол-2-илокси)бензил]-[1,4]диазепан-5-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием [1,4]диазепан-5-она. Масс-спектр (ESI): масса, вычисленная для С19Н19N3О2S; 353,1; m/z найдено 354,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,94 (д, J=7,9, 1H), 7,69 (д, J=7,9, 1H), 7,57 (т, J=5,4, 1H), 7,44-7,33 (м, 5H), 7,33 (т, J=8,2, 1H), 3,62 (с, 2H), 3,18-3,10 (м, 2H), 2,58-2,40 (м, 6H).
Пример 302

{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-3-ил}метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием пиперидин-3-илметанола. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О2S; 354,1; m/z найдено 355,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,98 (д, J=7,2, 1H), 774 (д, J=7,9, 1H), 7,50-7,42 (м, 5H), 7,38 (т, J=8,2, 1H), 4,46 (т, J=5,3, 1H), 3,52 (д, J=3,4, 2H), 3,36-3,29 (м, 1H), 3,27-3,18 (м, 1H), 2,92 (д, J=8,1, 1H), 2,77 (д, J=10,8, 1H), 1,96 (д, J=12,8, 1H), 1,75-1,60 (м, 4H), 1,58-1,45 (м, 1H), 1,00-0,85 (м, 1H).
Пример 303
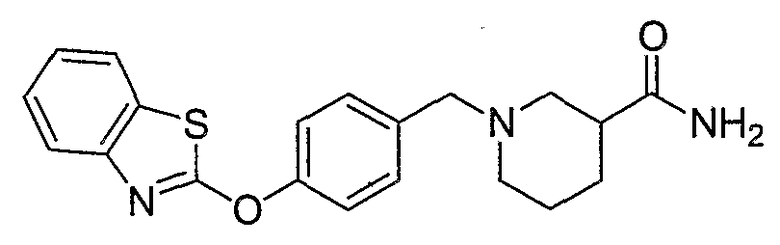
Амид 1-[4-(бензотиазол-2-илокси)бензил]пиперидин-3-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием амида пиперидин-3-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С20Н21N3О2S; 367,1; m/z найдено 368,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d6): 7,70 (д, J=7,8, 1H), 7,46 (д, J=8,0, 1H), 7,25-7,00 (м, 7H), 6,53 (с, 1,H), 3,26 (д, J=2,9, 2H), 2,57 (д, J=10,3, 1H), 2,49 (д, J=11,3, 1H), 2,15-2,00 (м, 1H), 1,78 (т, J=10,7, 1H), 1,69 (т, J=9,4, 1H), 1,51 (д, J=10,0, 1H), 1,40 (д, J=12,9, 1H), 1,22 (кв, J=12,6, 1H), 1,09 (кв, J=12,2, 1H).
Пример 304

Трет-бутиловый эфир 9-[4-(бензотиазол-2-илокси)бензил]-3,9-диаза-спиро[5.5]ундекан-3-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием трет-бутилового эфира 3,9-диаза-спиро[5.5]ундекан-3-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С28Н35N3О3S; 493,2; m/z найдено 494,5 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,13 (д, J=7,9, 1H), 7,89 (д, J=8,0, 1H), 7,68-7,56 (м, 5H), 7,53 (т, J=7,1, 1H), 3,70 (с, 2H), 3,51-3,45 (м, 4H), 2,60-2,50 (м, 4H), 1,66 (т, J=5,3, 4H), 1,58 (с, 9H), 1,54 (т, J=5,4, 4H).
Пример 305
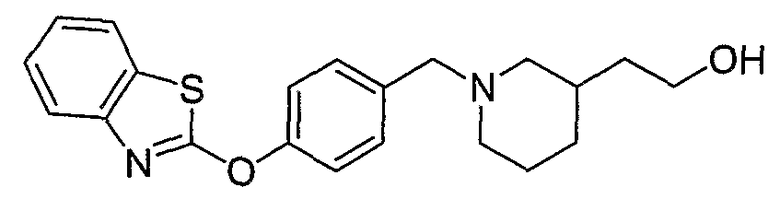
2-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-3-ил}этанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадия D, с использованием 2-пиперидин-3-илэтанола. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О2S; 368,2; m/z найдено 369,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 7,71 (д, J=8,4, 1H), 7,47 (д, J=7,9, 1H), 7,25-7,15 (м, 5H), 7,10 (т, J=8,1, 1H), 4,12 (т, J=5,1, 1H), 3,33-3,15 (м, 4H), 2,58-2,42 (м, 2H), 1,67 (т, J=9,6, 1H), 1,53-1,33 (м, 4H), 1,30-1,00 (м, 3H), 0,70-0,58 (м, 1H).
Пример 306
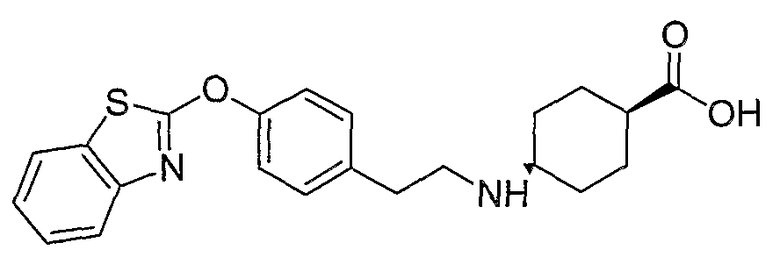
Трифторметансульфонатная соль цис-4-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанкарбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия В, с использованием цис-4-аминоциклогексанкарбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С22Н24N2О3S; 396,2; m/z найдено 397,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 9,15, (с, 1H), 7,75 (д, J=7,6, 1H), 7,72 (дд, J=8,0, 0,7, 1H), 7,43 (дт, J=7,2, 1,2, 1H), 7,37-7,29 (м, 5H), 5,10 (шир.с, 1H), 3,29 (шир.с, 2H), 3,10 (т, J=7,4, 3H), 2,73 (шир.с, 1H), 2,24 (шир.д, J=10,6, 2H), 2,09 (шир.д, J=9,3, 2H), 1,72-1,52 (м,3H).
Пример 307

(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон
А. Бис-трифторметансульфонат 2-[4-(2-пиперазин-1-илэтил)фенокси]бензотиазола.
Трет-бутиловый эфир 4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-карбоновой кислоты получали в соответствии с методикой, описанной в примере 262, стадия В, с использованием трет-бутилового эфира пиперазин-1-карбоновой кислоты. Раствор трет-бутилового эфира 4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-карбоновой кислоты (3,9 г, 8,9 ммоль) в СН2Cl2 (5 мл) и раствор 50% трифторметансульфоновой кислоты в СН2Cl2 (35 мл) перемешивали при 23°С в течение 4 ч. Реакционную смесь концентрировали, остаток суспендировали в диэтиловом эфире, фильтровали и сушили с получением указанного в заголовке соединения в виде твердого вещества белого цвета (5,4 г, выход 94%). Масс-спектр (ESI): точная масса, вычисленная для С19Н21N3О1S1; 339,1; m/z найдено 340,4 [М+Н]+. 1H ЯМР (400 МГц, D6-ДМСО): 9,50-9,30 (шир., с, 1H), 7,94 (дд, J=7,9, 0,6, 1H), 7,68 (д, J=7,6 Гц, 1H), 7,48-7,41 (м, 5H), 7,39-7,30 (м, 1H), 4,15-3,50 (шир.с, 1H), 3,45-3,32 (м, 8H), 3,32-3,20 (м, 2H), 3,01 (дд, J=8,8, 5,2 Гц, 2H).
В. (4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон.
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 257, стадия С, с использованием тетрагидрофуран-2-карбоновой кислоты и триэтиламина. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3О3S; 437,2; m/z найдено 438,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=7,3, 1H), 7,71 (дд, J=7,8, 0,8, 1H), 7,42 (дт, J=7,3, 1,2, 1H), 7,33-7,26 (м, 5H), 4,65 (дд, J=7,0, 5,3, 1H), 3,99 (ддд, J=7,7, 7,1, 6,7, 1H), 3,92-3,86 (м, 1H), 3,82-3,72 (м, 2H), 3,76 (с, 1H), 3,70-3,58 (м, 2H), 2,90 (дд, J=10,3, 7,3, 2H), 2,70 (дд, J=8,6, 5,6, 2H), 2,64-2,54 (м, 3H), 2,38-2,28 (м, 1H), 2,14-1,90 (м, 4H).
Пример 308

(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амид пропан-2-сульфоновой кислоты
Раствор амида 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты (пример 22, 197 мг, 0,5 ммоль) в ТГФ (5 мл) обрабатывали NаН (14 мг, 0,6 ммоль) и изопропилсульфонилхлоридом (86 мг, 0,6 ммоль) и реакционную смесь перемешивали при 60°С в течение 16 ч. Реакционную смесь охлаждали, реакцию гасили добавлением СН3ОН (5 мл), затем H2O (5 мл) и рН доводили до 7. Раствор экстрагировали этилацетатом (2×25 мл) и этилацетатный раствор промывали 1М NаОН (2×30 мл). Объединенные щелочные промывки нейтрализовали добавлением 2М HCl и экстрагировали хлороформом (2×30 мл). Растворы хлороформа сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали на SiО2 (4 г; 0-10% 2М NH3/СН3ОН:СН2Cl2) с получением указанного в заголовке соединения в виде твердого вещества (45 мг, выход 18%). Масс-спектр (ESI): точная масса, вычисленная для С24Н28N3О5S2; 503,2; m/z найдено 504,5 [М+Н]+. 1H ЯМР (400 МГц, C6D6): 7,77 (д, J=7,8, 1H), 7,20 (дд, J=8,0, 0,8, 1H), 7,16-7,10 (м, 2H), 7,07 (дт, J=8,3, 1,0, 1H), 6,90 (дт, J=8,0, 1,0, 1H), 6,76 (д, J=8,8, 1H), 6,13 (с, 1H), 3,98 (шир.с, 2H), 3,51 (септ, J=6,8, 2H), 3,20 (шир.с, 2H), 2,82 (шир.с, 1H), 2,37-2,00 (м, 4H), 1,96-1,84 (м, 2H), 1,33 (д, J=6,6, 6H) 1,38-1,28 (м, 2H).
Пример 309

Метиловый эфир (4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)оксоуксусной кислоты
Раствор бис-трифторметансульфоната 2-[4-(2-пиперазин-1-илэтил)фенокси]бензотиазола (296 мг, 0,52 ммоль) в СН2Cl2 (3 мл) обрабатывали триэтиламином (0,25 мл, 1,8 ммоль), затем добавляли метилхлороксоацетат (0,07 мл, 0,8 ммоль) и реакционную смесь перемешивали при 23°С в течение 20 минут. Реакционную смесь разбавляли СН2Cl2 (10 мл) и промывали насыщенным водным NaНСО3 (10 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (234 мг, выход 99%). Масс-спектр (ESI): точная масса, вычисленная для С22Н23N3О4S; 425,1; m/z найдено 426,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (д, J=7,6, 0,5, 1H), 7,70 (д, J=7,8, 1H), 7,41 (дт, J=7,3, 1,0, 1H), 7,34-7,26 (м, 5H), 3,91 (с, 3H), 3,72 (т, J=4,8, 2H), 3,51 (т, J=4,8, 2H), 2,86, (дд, J=10, 6,8, 2H), 2,70, (дд, J=8,6, 5,6, 2H), 2,62-2,57 (м, 4H).
Пример 310

Трифторметансульфонатная соль N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)бензолсульфонамида
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 34, стадия В, с использованием бензолсульфонамида. Масс-спектр (ESI): точная масса, вычисленная для С27Н27N3О4S2; 521,1; m/z найдено 522,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 8,60-8,00 (м, 2H), 7,82-7,76 (м, 1H), 7,73-7,57 (м, 4H), 7,48-7,28 (м, 5H), 3,70 (шир.с, 1H), 3,41-3,34 (м, 2H), 3,14-2,98 (м, 3H), 2,60 (шир.с, 1H), 2,08 (шир.д, J=13,6, 2H), 1,86 (шир.с, 2H) 1,30 (шир.с, 2H), 0,94-0,88 (м, 2H).
Пример 311
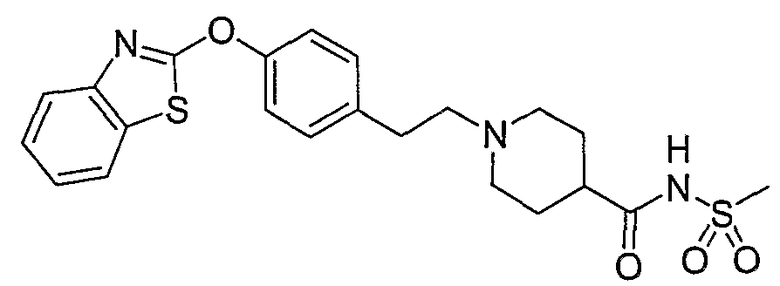
Трифторметансульфонатная соль N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)метансульфонамида
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 34, стадия В, с использованием метансульфонамида. Масс-спектр (ESI): точная масса, вычисленная для С22Н25N3О4S2; 459,1; m/z найдено 460,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,81 (д, J=7,8, 1H), 7,62 (д, J=8,1, 1H) 7,49-7,43 (м, 3H), 7,43-7,38 (м, 2H), 7,34 (т, J=7,8, 1H), 3,80 (шир.д, J=10,4, 1H), 3,48-3,40 (м, 2H), 3,33 (с, 3H), 3,28 (с, 2H), 3,20-3,04 (м, 3H), 2,70-2,60 (м, 1H), 2,21 (шир.д, J=12,4, 2H), 2,06-1,93 (м, 2H).
Пример 312
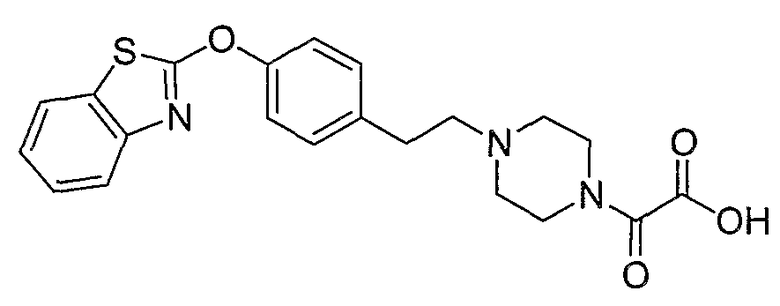
Трифторметансульфонатная соль (4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)оксоуксусной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия D. Масс-спектр (ESI): точная масса, вычисленная для С21Н21N3О4S; 411,1; m/z найдено 412,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,75 (т, J=8,3, 2H), 7,70 (дт, J=8,0, 0,8, 1H), 7,28-7,22 (м, 5H), 4,28-3,88 (шир.м, 4H), 3,58-3,20 (шир.м, 6H), 3,16-3,04 (шир.м, 2H).
Пример 313
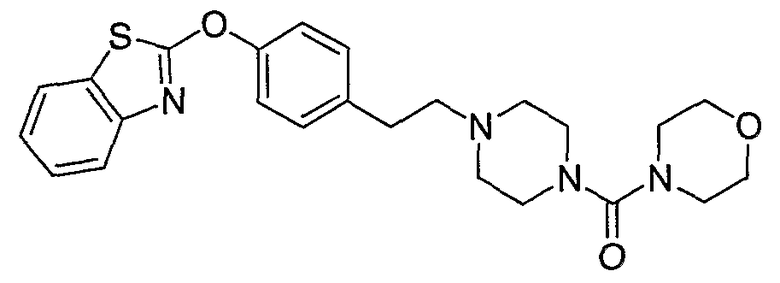
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)морфолин-4-илметанон
Раствор бис-трифторметансульфоната 2-[4-(2-пиперазин-1-илэтил)фенокси]бензотиазола примера 307, стадия А (268 мг, 0,47 ммоль) в СН2Cl2 (6 мл) обрабатывали РS-диметиламиновой смолой (1,3 г, 0,90 ммоль), затем 4-морфолинкарбонилхлоридом (0,07 мл, 0,6 ммоль) и реакционную смесь перемешивали в течение 1 часа. Реакционную смесь обрабатывали РS-изоцианатной смолой для удаления избытка изоцианата и, спустя 15 минут, реакционную смесь фильтровали и концентрировали, получая указанное в заголовке соединение (225 мг, выход 99%). Масс-спектр (ESI): точная масса, вычисленная для С24Н28N4О3S1; 452,2; m/z найдено 453,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,0, 0,5, 1H), 7,71 (дд, J=7,8, 0,5, 1H), 7,42 (дт, J=7,3, 1,2, 1H), 7,34-7,28 (м, 5H), 3,78-3,70 (м, 4H), 3,39 (шир.т, J=4,3, 4H), 3,31 (т, J=4,8, 4H), 2,90 (дд, J=10,4, 7,3, 2H), 2,70 (дд, J=8,3, 7,3, 2H), 2,59 (шир.с, 4H).
Пример 314

1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-тиофен-2-илэтанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 313, с использованием 2-тиофенацетилхлорида. Масс-спектр (ESI): точная масса, вычисленная для С25Н25N3О3S2; 463,1; m/z найдено 464,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,0, 0,5, 1H), 7,71 (дд, J=7,8, 0,8, 1H), 7,43 (дт, J=7,3, 1,2, 1H), 7,34-7,28 (м, 5H), 7,25 (дд, J=5,3, 1,2, 1H), 7,00 (дд, J=5,0, 3,2, 1H), 6,96-6,93 (м, 1H), 3,96 (д, J=0,8, 2H), 3,74 (т, J=4,8, 2H), 3,59 (т, J=4,8, 2H), 2,86 (дд, J=10,4, 7,6, 2H), 2,66 (дд, J=8,3, 5,6, 2H), 2,55 (т, J=5,3, 2H), 2,47 (т, J=5,0, 2H).
Пример 315

(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пиридин-3-илметанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 313, с использованием гидрохлорида 2-никотонилхлорида. Масс-спектр (ESI): точная масса, вычисленная для С25Н24N4О2S; 444,2; m/z найдено 445,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,73-8,70 (м, 2H), 7,81 (дт, J=7,9, 1,9, 1H), 7,77 (дд, J=8,1, 0,5, 1H), 7,71 (ддд, J=7,9, 0,7, 0,4, 1H), 7,45-7,39 (м, 2H), 7,34-7,28 (м, 5H), 3,90 (шир.с, 2H), 3,52 (шир.с, 2H), 2,92-2,85 (м, 2H), 2,71 (дд, J=8,9, 5,6, 2H), 2,74-2,60 (м, 2H), 2,54 (шир.с, 2H).
Пример 316

(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)циклопропилметанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 313, с использованием циклопропанкарбонилхлорида. Масс-спектр (ESI): точная масса, вычисленная для С23Н25N3О2S; 407,2; m/z найдено 408,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,5, 1H), 7,71 (дд, J=7,9, 0,8, 1H), 7,43 (дт, J=7,4, 1,3, 1H), 7,34-7,28 (м, 5H), 3,74 (д, J=16,0, 4H), 2,89 (дд, J=9,4, 6,5, 2H), 2,70 (дд, J=9,4, 6,5, 2H), 2,58 (шир.д, J=20,8, 4H), 1,78 (тт, J=8,0, 4,7, 1H), 1,06-1,01 (м, 2H), 0,83-0,78 (м, 2H).
Пример 317

1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-метоксиэтанон
Раствор бис-трифторметансульфоната 2-[4-(2-пиперазин-1-илэтил)фенокси]бензотиазола примера 307, стадия А (200 мг, 0,35 ммоль) в CHCl3 (14 мл) обрабатывали РS-диметиламиновой смолой (740 мг, 1,0 ммоль) и реакционную смесь перемешивали в течение 1 часа. Затем смолу фильтровали, полученный раствор свободного основания обрабатывали метоксиуксусной кислотой (0,04 мл, 0,5 ммоль) и РS-карбонилдиимидазоловой смолой (500 мг, 0,6 ммоль) и реакционную смесь перемешивали в течение 1 часа. Реакционную смесь фильтровали, концентрировали и неочищенный продукт очищали на SiО2 (12 г, 0-10% 2М NH3/МеОН:СН2Cl2), получая указанное в заголовке соединение (143 мг, выход 99%). Масс-спектр (ESI): точная масса, вычисленная для С22Н25N3О2S; 411,2; m/z найдено 412,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,6, 1H), 7,71 (дд, J=7,9, 0,8, 1H), 7,42 (дт, J=7,5, 1,3, 1H), 7,35-7,28 (м, 5H), 4,14 (с, 2H), 3,72 (т, J=4,8, 2H), 3,58 (т, J=4,8, 2H), 3,47 (с, 3H), 2,89 (дд, J=10,6, 7,3, 2H), 2,70 (дд, J=8,5, 5,6, 2H), 2,58 (т, J=5,1, 4H).
Пример 318

1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2,2,2-трифторэтанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 317, с использованием трифторметансульфоновой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С21Н20F3N3O2S; 435,1; m/z найдено 436,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,2, 0,5, 1H), 7,71 (дд, J=7,9, 0,7, 1H), 7,43 (дт, J=8,5, 1,2, 1H), 7,35-7,28 (м, 5H), 4,14 (с, 2H), 3,76 (т, J=4,8, 2H), 3,68 (т, J=4,7, 2H), 2,88 (дд, J=10,0, 7,0, 2H), 2,70 (дд, J=8,7, 5,6, 2H), 2,62 (т, J=4,6, 4H).
Пример 319
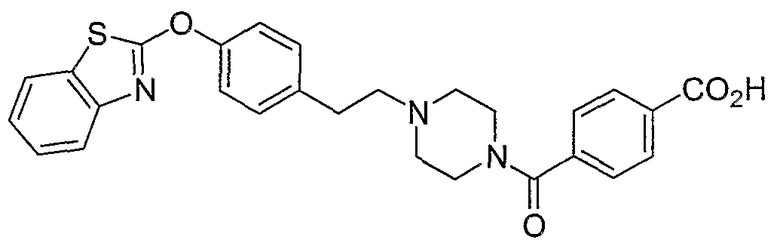
4-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-карбонил)бензойная кислота
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием монометилового эфира терефталевой кислоты, и в примере 250, стадия D. Масс-спектр (ESI): точная масса, вычисленная для С27Н25N3O4S; 487,2; m/z найдено 488,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 8,00 (д, J=8,3, 2H), 7,93 (дд, J=8,0, 0,8, 1H), 7,69 (дд, J=8,0, 0,4, 1H), 7,50 (д, J=8,3, 2H), 7,43 (дт, J=7,5, 1,3, 1H), 7,40-7,29 (м, 5H), 3,66 (шир.с, 2H), 3,30 (шир.с, 2H), 2,88 (дд, J=7,0, 7,0, 2H), 2,60 (дд, J=8,3, 8,3, 2H), 2,55 (шир.с, 2H), 2,44 (шир.с, 2H).
Пример 320

(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пиридин-4-илметанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 317, с использованием изоникотиновой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С25Н24N4O2S; 444,2; m/z найдено 445,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,74 (дд, J=4,4, 1,6, 1H), 7,77 (дд, J=8,1, 0,5, 1H), 7,71 (дд, J=7,9, 0,8, 1H), 7,43 (дт, J=7,4, 1,3, 1H), 7,45-7,39 (м, 2H), 7,35-7,28 (м, 7H), 3,87 (шир.с, 2H), 3,44 (шир.т, J=3,9, 2H), 2,88 (дд, J=10,1, 6,9, 2H), 2,71 (дд, J=8,8, 5,5, 2H), 2,70-2,64 (м, 2H), 2,54-2,49 (м, 2H).
Пример 321
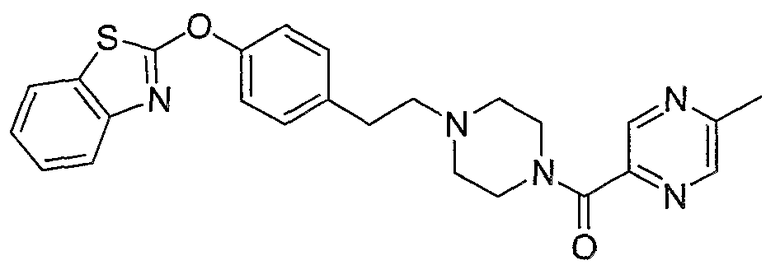
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(5-метилпиразин-2-ил)метанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 317, с использованием 5-метилпиразин-2-карбоновой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С25Н25N5O2S; 444,2; m/z найдено 445,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,89 (д, J=1,4, 1H), 8,45 (д, J=1,0, 1H), 7,76 (дд, J=8,1, 0,5, 1H), 7,70 (дд, J=8,0, 0,8, 1H), 7,43 (дт, J=7,4, 1,3, 1H), 7,33-7,28 (м, 5H), 3,90 (шир.т, J=4,7, 2H), 3,77 (шир.т, J=4,8, 2H), 2,92 (дд, J=10,5, 6,5, 2H), 2,80-2,72 (м, 2H), 2,69-2,64 (м, 2H), 2,66 (с, 3H).
Пример 322

(R)-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 317, с использованием 5-(R)-тетрагидрофуран-2-карбоновой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O3S; 437,2; m/z найдено 438,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=7,3, 1H), 7,71 (дд, J=7,8, 0,8, 1H), 7,42 (дт, J=7,3, 1,2, 1H), 7,33-7,26 (м, 5H), 4,65 (дд, J=7,0, 5,3, 1H), 3,99 (ддд, J=7,1, 6,7, 6,7, 1H), 3,92-3,86 (м, 1H), 3,82-3,72 (м, 2H), 3,76 (с, 1H), 3,70-3,58 (м, 2H), 2,90 (дд, J=10,3, 7,3, 2H), 2,70 (дд, J=8,6, 5,6, 2H), 2,64-2,54 (м, 3H), 2,38-2,28 (м, 1H), 2,14-1,90 (м, 4H).
Пример 323

(S)-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 317, с использованием 5-(S)-тетрагидрофуран-2-карбоновой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O3S; 437,2; m/z найдено 438,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=7,3, 1H), 7,71 (дд, J=7,8, 0,8, 1H), 7,42 (дт, J=7,3, 1,2, 1H), 7,33-7,26 (м, 5H), 4,65 (дд, J=7,0, 5,3, 1H), 3,99 (ддд, J=7,1, 6,7, 6,7, 1H), 3,89 (ддд, J=7,7, 7,5, 5,8, 1H), 3,82-3,72 (м, 2H), 3,76 (с, 1H), 3,70-3,58 (м, 2H), 2,90 (дд, J=10,3, 7,3, 2H), 2,70 (дд, J=8,6, 5,6, 2H), 2,64-2,54 (м, 3H), 2,38-2,28 (м, 1H), 2,14-1,90 (м, 4H).
Пример 324

(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-3-ил)метанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 317, с использованием 5-тетрагидрофуран-3-карбоновой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O3S; 437,2; m/z найдено 438,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,5, 1H), 7,71 (дд, J=7,9, 0,8, 1H), 7,42 (дт, J=7,5, 1,3, 1H), 7,33-7,26 (м, 5H), 4,06 (т, J=8,2, 1H), 3,97-3,87 (м, 3H), 3,77-3,67 (м, 2H), 3,59 (т, J=5,1, 1H), 3,35-3,24 (м, 1H), 2,88 (дд, J=10,2, 7,3, 2H), 2,79 (дд, J=8,5, 5,7, 2H), 2,60-2,50 (м, 4H), 2,29 (дддд, J=12,6, 7,6, 6,4, 6,4, 1H), 2,17-2,08 (м, 1H).
Пример 325

1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-гидроксиэтанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 317, с использованием гликолевой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С21Н23N3O3S; 397,2; m/z найдено 398,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,5, 1H), 7,71 (дд, J=8,0, 0,7, 1H), 7,43 (дт, J=7,5, 1,3, 1H), 7,35-7,28 (м, 5H), 4,21 (с, 2H), 3,75 (т, J=5,0, 2H), 3,68 (шир.с, 1H), 3,35 (т, J=5,0, 2H), 2,88 (дд, J=10,1, 7,0, 2H), 2,70 (дд, J=8,6, 5,6, 2H), 2,58 (ддд, J=8,4, 8,3, 5,2, 1H).
Пример 326

2-[2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-оксоэтил]циклопентанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 317, с использованием 5-(2-оксоциклопентил)уксусной кислоты. Масс-спектр (ESI): точная масса, вычисленная для С26Н29N3O3S; 463,2; m/z найдено 464,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (д, J=7,7, 1H), 7,71 (дд, J=7,9, 0,7, 1H), 7,42 (дт, J=7,5, 1,2, 1H), 7,33-7,28 (м, 5H), 3,80-3,64 (м, 2H), 3,54 (дд, J=9,2, 3,9, 1H), 2,92-2,84 (м, 3H), 2,88 (дд, J=10,1, 7,0, 2H), 2,68 (дд, J=8,5, 5,6, 2H), 2,60-2,25 (м, 2H), 2,15-2,06 (м, 1H), 1,93-1,80 (м, 1H), 1,78-1,64 (м, 2H).
Пример 327
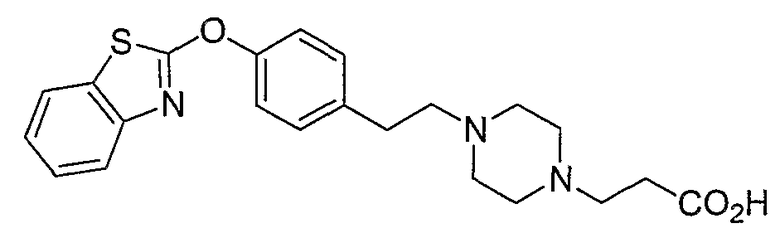
Трифторметансульфонатная соль 3-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пропионовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием 3-пиперазин-1-илпропионовой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С21Н23N3O3S1; 411,2; m/z найдено 412,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 11,25 (шир.с, 1H), 7,76 (дд, J=8,0, 0,5, 1H), 7,69 (дд, J=7,8, 0,6, 1H), 7,42 (дт, J=7,4, 1,2, 1H), 7,35-7,28 (м, 5H), 3,76 (с, 1H), 3,04 (т, J=6,4, 4H), 2,91 (дд, J=10,3, 5,4, 4H), 2,86-2,79 (м, 2H), 2,63 (т, J=6,4, 1H), 2,08 (с, 4H).
Пример 328
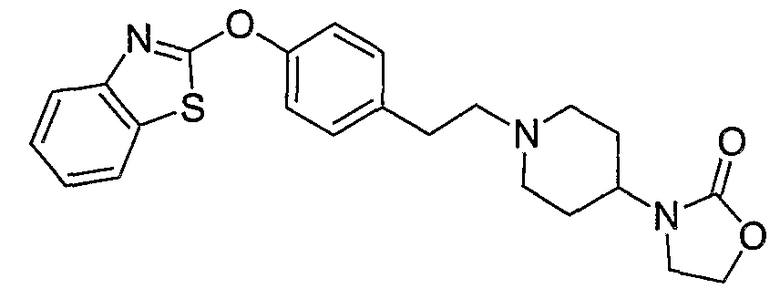
3-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)оксазолидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием гидрохлоридной соли 3-пиперидин-4-илоксазолидин-2-она, и в примере 259, стадия А. Масс-спектр (ESI): точная масса, вычисленная для С23Н25N3O3S1; 423,2; m/z найдено 424,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,5, 1H), 7,69 (дд, J=7,9, 1,1, 1H), 7,41 (дт, J=8,5, 1,2, 1H), 7,35-7,28 (м, 5H), 4,36, (т, J=7,8, 2H), 3,72 (т, J=4,8, 2H), 3,86-3,76 (м, 1H), 3,57 (т, J=8,1, 2H), 3,11 (шир.д, J=11,8, 2H), 2,86 (дд, J=11,0, 7,6, 2H), 2,66 (дд, J=8,6, 5,2, 2H), 2,18 (дт, J=11,7, 2,7, 2H), 1,89-1,72 (м, 4H).
Пример 329

4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)морфолин-3-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием пиперидин-4-илморфолин-3-она, и в примере 260, стадия А. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O3S1; 437,2; m/z найдено 438,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (д, J=8,0, 1H), 7,70 (дд, J=7,9, 0,7, 1H), 7,42 (дт, J=7,4, 1,2, 1H), 7,33-7,28 (м, 5H), 4,57 (тт, J=11,9, 4,3, 1H), 4,23 (с, 2H), 3,91, (т, J=4,9, 2H), 3,34 (т, J=5,1, 2H), 3,12 (шир.д, J=11,6, 2H), 2,87 (дд, J=10,9, 7,6, 2H), 2,67 (дд, J=8,7, 5,2, 2H), 2,23 (ддд, J=11,7, 11,6, 2,5, 2H), 1,82 (ддд, J=24,1, 12,1, 3,8, 2H), 1,76-1,70 (м, 2H).
Пример 330

4-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)морфолин-3-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, стадия А, с использованием пиперидин-4-илморфолин-3-она, и в примере 260, стадия А. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O4S1; 453,2; m/z найдено 454,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (дд, J=8,1, 0,5, 1H), 7,68 (дд, J=7,9, 0,7, 1H), 7,40 (дт, J=7,4, 1,3, 1H), 7,31-7,28 (м, 3H), 7,02-6,96 (м, 2H), 4,57 (тт, J=12,1, 4,2, 1H), 4,22 (с, 2H), 4,14 (т, J=5,6, 2H), 3,90 (т, J=5,0, 2H), 3,33 (т, J=5,1, 2H), 3,12 (шир.д, J=11,7, 2H), 2,87 (т, J=5,7, 2H), 2,32 (ддд, J=11,8, 11,8, 2,4, 2H), 1,82 (дддд, J=12,2, 12,1, 12,1, 3,8, 2H), 1,75-1,68 (м, 2H).
Пример 331
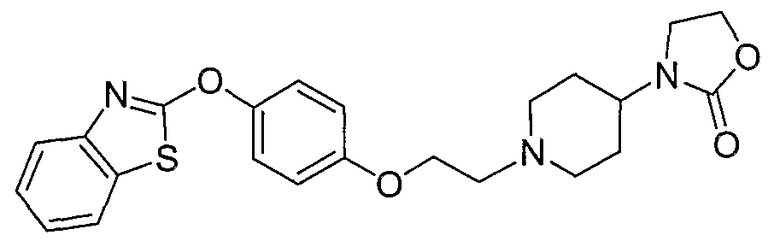
3-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)оксазолидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 17, стадия А, с использованием гидрохлоридной соли 3-пиперидин-4-илоксазолидин-2-она, и в примере 259, стадия А. Масс-спектр (ESI): точная масса, вычисленная для С23Н25N3O4S1; 439,2; m/z найдено 440,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (дд, J=8,1, 0,7, 1H), 7,69 (дд, J=8,0, 0,7, 1H), 7,42 (дт, J=8,6, 1,3, 1H), 7,35-7,26 (м, 3H), 7,02-6,97 (м, 2H), 4,36 (дд, J=8,7, 7,3, 2H), 4,14 (т, J=5,7, 2H), 3,80 (ддд, J=16,4, 11,0, 5,6, 1H), 3,60-3,53 (м, 2H), 3,12 (шир.д, J=12,0, 2H), 2,87 (д, J=5,7, 2H), 2,28 (ддд, J=11,7, 11,6, 3,8, 2H), 1,90-1,74 (м, 4H).
Пример 332

Бензилоксиамид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Раствор 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты примера 34, стадия А (383 мг, 1,0 ммоль) в СН2Cl2 (10 мл) обрабатывали N-метилморфолином (0,24 мл, 2,2 ммоль) и хлорангидридом циануровой кислоты (61 мг, 0,3 ммоль), полученный раствор перемешивали в течение 1 часа, затем реакционную смесь обрабатывали О-бензилгидроксиламином и перемешивали в течение 16 ч. Реакционную смесь фильтровали через слой кизельгура, концентрировали и очищали на SiО2 (12 г, 0-10% 2М NH3/МеОН:СН2Cl2), получая указанное в заголовке соединение (81 мг, выход 17%). Масс-спектр (ESI): точная масса, вычисленная для С28Н29N3О3S1; 487,2; m/z найдено 488,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,34 (шир.с, 1H), 7,76 (дд, J=8,1, 0,5, 1H), 7,70 (дд, J=7,9, 0,7, 1H), 7,45-7,39 (м, 6H), 7,34-7,28 (м, 4H), 4,96 (шир.с, 2H), 3,05 (шир.д, J=11,6, 2H), 2,85 (дд, J=10,6, 7,6, 2H), 2,63 (дд, J=8,5, 5,5, 2H), 2,04 (ддд, J=11,0, 11,0, 2,8, 2H), 1,91-1,76 (м, 2H).
Пример 333

(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)уксусная кислота
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием этилового эфира пиперидин-4-илуксусной кислоты, и в примере 250, стадия D. Масс-спектр (ESI): точная масса, вычисленная для С22Н24N2O3S1; 396,2; m/z найдено 397,4 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 8,34 (шир.с, 1H), 7,82 (дд, J=7,9, 0,6, 1H), 7,67 (дд, J=8,1, 0,5, 1H), 7,53-7,33 (м, 6H), 3,78-3,66 (м, 2H), 3,46-3,38 (м, 2H), 3,22-3,14 (м, 2H), 3,14-3,07 (м, 2H), 2,39 (шир.д, J=6,1, 1H), 2,20-2,08 (шир.с, 1H), 2,11 (шир.д, J=13,5, 1H), 1,72-1,54 (м, 2H).
Пример 334
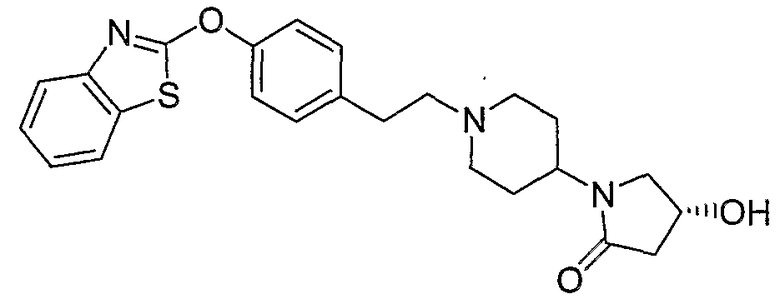
(R)-1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием ацетатной соли (R)-4-гидрокси-1-пиперидин-4-илпирролидин-2-она, и в примере 261, стадия А. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O3S1; 437,2; m/z найдено 438,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,5, 1H), 7,66 (дд, J=7,9, 0,7, 1H), 7,40 (дт, J=7,7, 1,3, 1H), 7,28-7,24 (м, 5H), 4,52 (ддд, J=8,5, 5,9, 2,4, 1H), 4,11-4,00 (м, 1H), 3,60 (дд, J=10,7, 5,6, 1H), 3,31 (дд, J=10,7, 2,2, 1H), 3,12-3,04 (м, 2H), 2,83 (дд, J=9,7, 6,5, 2H), 2,72 (дд, J=17,2, 6,6, 1H), 2,63 (дд, J=9,8, 6,4, 2H), 2,72 (дд, J=17,2, 2,6, 1H), 2,21-2,12 (м, 2H), 1,85-1,67 (м, 4H).
Пример 335
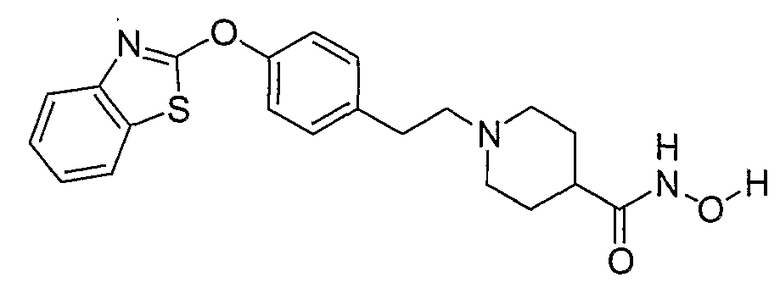
Гидроксиамид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием гидроксиамида пиперидин-4-карбоновой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С21Н23N3O3S1; 397,2; m/z найдено 398,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73-7,60 (м, 2H), 7,40-7,30 (м, 1H), 7,30-7,16 (м, 5H), 3,48-3,36 (шир.с, 2H), 3,10-2,95 (м, 4H), 2,80-2,50 (шир.м, 3H), 2,23-1,96 (шир.м, 5H).
Пример 336

(S)-1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием ацетатной соли (S)-4-гидрокси-1-пиперидин-4-илпирролидин-2-она, и в примере 261, стадия А, с использованием (S)-4-бром-3-гидроксибутирата. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3O3S1; 437,2; m/z найдено 438,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,77 (дд, J=8,1, 0,5, 1H), 7,66 (дд, J=7,9, 0,7, 1H), 7,40 (дт, J=7,7, 1,3, 1H), 7,28-7,24 (м, 5H), 4,52 (ддд, J=8,5, 5,9, 2,4, 1H), 4,11-4,00 (м, 1H), 3,60 (дд, J=10,7, 5,6, 1H), 3,31 (дд, J=10,7, 2,2, 1H), 3,12-3,04 (м, 2H), 2,83 (дд, J=9,7, 6,5, 2H), 2,72 (дд, J=17,2, 6,6, 1H), 2,63 (дд, J=9,8, 6,4, 2H), 2,72 (дд, J=17,2, 2,6, 1H), 2,21-2,12 (м, 2H), 1,85-1,67 (м, 4H).
Пример 337
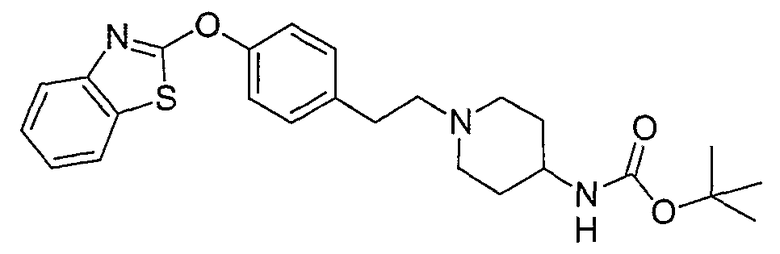
Трет-бутиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С25Н31N3O3S1; 453,2; m/z найдено 454,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,2, 0,6, 1H), 7,65 (дд, J=7, 9, 0,7, 1H), 7,39 (дт, J=7,4, 1,3, 1H), 7,29-7,23 (м, 5H), 4,47 (шир.д, J=6,6, 1H), 3,55-3,45 (м, 1H), 2,93 (шир.д, J=11,3, 2H), 2,82 (дд, J=11,0, 7,7, 2H), 2,60 (дд, J=8,6, 5,3, 2H), 2,16 (т, J=11,3, 2H), 1,97 (шир.д, J=11,1, 2H), 1,45 (с, 9H).
Пример 338
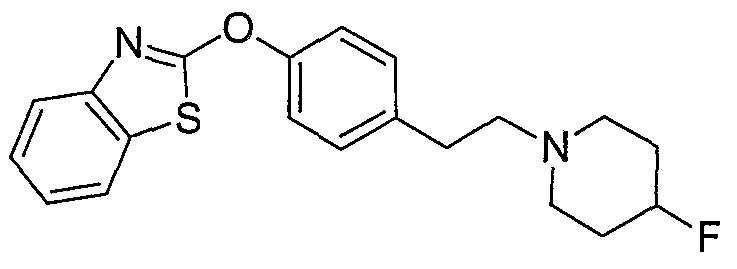
2-{4-[2-(4-фторпиперидин-1-ил)этил]фенокси}бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием 4-фторпиперидина. Масс-спектр (ESI): точная масса, вычисленная для С20Н21F1N3O1S1; 356,1; m/z найдено 357,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,1, 0,5, 1H), 7,65 (дд, J=8,0, 0,7, 1H), 7,41-7,36 (м, 1H), 7,28-7,24 (м, 5H), 4,70 (дм, J=48,6, 1H), 2,85 (дд, J=10,9, 7,7, 2H), 2,71-2,63 (м, 2H), 2,62 (дд, J=8,3, 5,4, 2H), 2,52-2,44 (м, 2H), 2,03-1,86 (м, 4H).
Пример 339
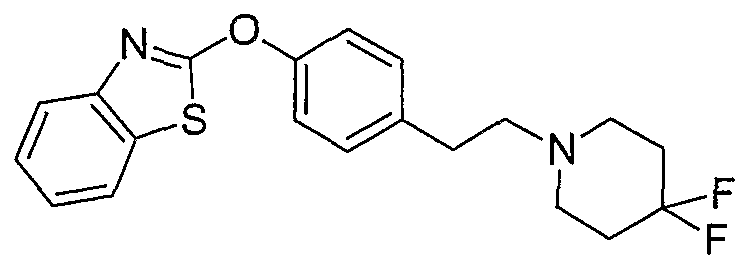
2-{4-[2-(4,4-дифторпиперидин-1-ил)этил]фенокси}бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием 4,4-дифторпиперидина. Масс-спектр (ESI): точная масса, вычисленная для С20Н20F2N3O1S1; 374,1; m/z найдено 375,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,1, 0,6, 1H), 7,65 (дд, J=8,0, 0,7, 1H), 7,41-7,36 (м, 1H), 7,28-7,24 (м, 5H), 2,82 (дд, J=10,2, 6,4, 2H), 2,71-2,60 (м, 6H), 2,09-1,97 (м, 4H).
Пример 340
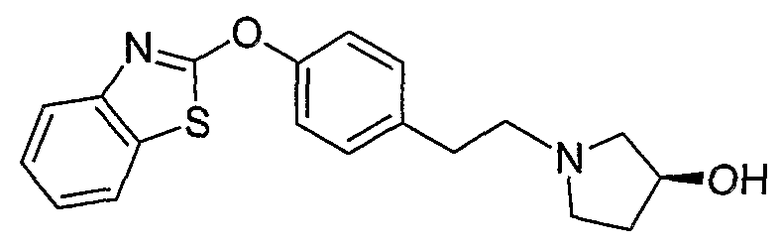
(R)-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пирролидин-3-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием (R)-3-гидроксипирролидина. Масс-спектр (ESI): точная масса, вычисленная для С19Н20N2O2S1; 340,1; m/z найдено 341,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,0, 0,4, 1H), 7,66 (дд, J=7,9, 0,8, 1H), 7,39 (дт, J=7,4, 1,2, 1H), 7,31-7,24 (м, 5H), 4,36 (дддд, J=7,3, 4,8, 2,2, 2,2, 1H), 2,96 (ддд, J=8,5, 8,5, 5,1, 1H), 2,90-2,83 (м, 2H), 2,79-2,70 (м, 3H), 2,58 (дд, J=10,0, 5,2, 2H), 2,36 (ддд, J=8,8, 8,8, 6,5, 1H), 2,21 (дддд, J=13,7, 8,6, 7,2, 5,1, 1H), 1,82-1,73 (м, 1H).
Пример 341
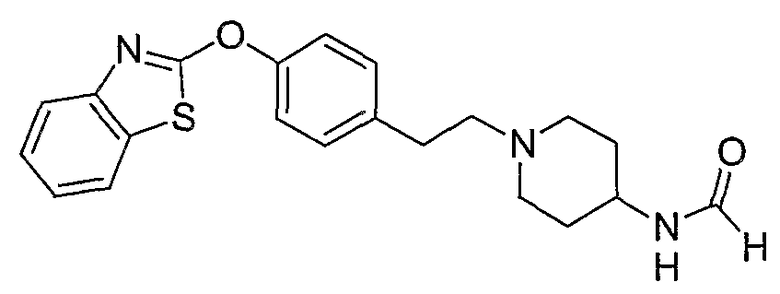
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)формамид
Указанное в заголовке соединение получали из соединения примера 337 в соответствии с методиками, описанными в примере 266, стадия В, и в примере 317. Масс-спектр (ESI): точная масса, вычисленная для С21Н23N3O2S1; 381,2; m/z найдено 382,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,16 (с, 1H), 7,72 (д, J=8,6, 1H), 7,65 (дд, J=7,9, 0,7, 1H), 7,42-7,36 (м, 1H), 7,31-7,23 (м, 5H), 4,03-3,93 (м, 1H), 3,13-3,03 (м, 2H), 2,90 (дд, J=11,1, 7,2, 2H), 2,75-2,69 (м, 2H), 2,34 (т, J=9,2, 2H), 2,08-2,00 (м, 2H), 1,72-1,60 (м, 2H).
Пример 342
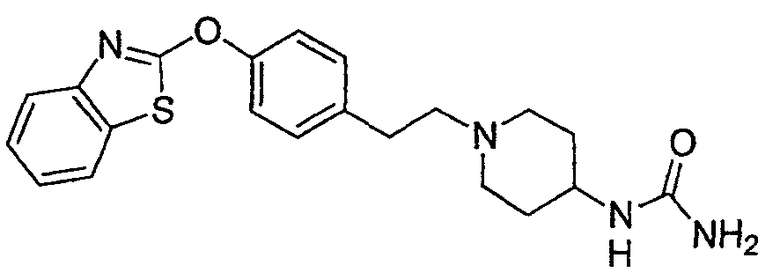
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)мочевина
Гидрохлорид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-иламина получали из трет-бутилового эфира (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)карбаминовой кислоты примера 337 в соответствии с методикой, описанной в примере 266, стадия В. Полученный гидрохлорид амина (227 мг, 0,58 ммоль) в СН2Cl2 (5 мл) обрабатывали пиридином (0,14 мл, 1,7 ммоль), триметилизоцианатом (0,09 мл, 0,64 ммоль) и триэтиламином (0,08 мл, 0,58 ммоль) и реакционную смесь перемешивали в течение 16 ч. Реакционную смесь разбавляли СН2Cl2 (25 мл) и промывали NaНСО3 (30 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали на SiО2 (12 г; 0-10% [2М NH3] СН3ОН/СН2Cl2) с получением указанного в заголовке соединения (134 мг, выход 58%). Масс-спектр (ESI): точная масса, вычисленная для С21Н24N4О2S1; 396,2; m/z найдено 397,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,7, 1H), 7,65 (дд, J=7,9, 0,7, 1H), 7,42-7,36 (м, 1H), 7,31-7,23 (м, 5H), 4,93 (д, J=8,0, 1H), 4,78 (с, 2H), 3,93 (шир.д, J=11,7, 1H), 2,82 (дд, J=10,7, 7,6, 2H), 2,60 (дд, J=8,5, 5,4, 2H), 2,16 (т, J=11,3, 2H), 1,97 (дд, J=12,7, 3,1, 2H), 1,47 (дддд, J=12,8, 12,6, 12,6, 3,7, 2H).
Пример 343

1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-фенилизомочевина
Гидрохлорид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-иламина получали из трет-бутилового эфира (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)карбаминовой кислоты примера 337 путем удаления Вос-группы в соответствии с методикой, описанной в примере 266, стадия В. Свободное основание получали суспендированием гидрохлорида 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-иламина (1,3 г, 3,3 ммоль) в СН2Cl2 (20 мл) и промывкой раствором насыщенного NaНСО3 (20 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 1,0 г (выход 83%) 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-иламинного свободного основания. Раствор 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-иламина (145 мг, 0,4 ммоль) в этаноле (5 мл) обрабатывали дифенилцианокарбодиимидатом (319 мг, 1,34 ммоль) и нагревали до 80°С в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и очищали на SiО2 (12 г; 0-10% [2М NH3] СН3ОН/СН2Cl2) с получением указанного в заголовке соединения (173 мг, выход 85%). Масс-спектр (ESI): точная масса, вычисленная для С28Н27N5О2S1; 496,2; m/z найдено 498,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,7, 1H), 7,66 (дд, J=7,9, 0,7, 1H), 7,45-7,36 (м, 4H), 7,31-7,24 (м, 5H), 7,08 (д, J=7,8, 2H), 6,36 (шир.д, J=6,5, 1H), 3,87-3,76 (м, 1H), 3,02 (шир.д, J=11,2, 2H), 2,83 (дд, J=8,4, 7,3, 2H), 2,64 (дд, J=8,6, 5,4, 2H), 2,21 (т, J=11,1, 2H), 2,07 (д, J=11,0, 2H), 1,76 (дд, J=20,7, 10,4, 2H).
Пример 344
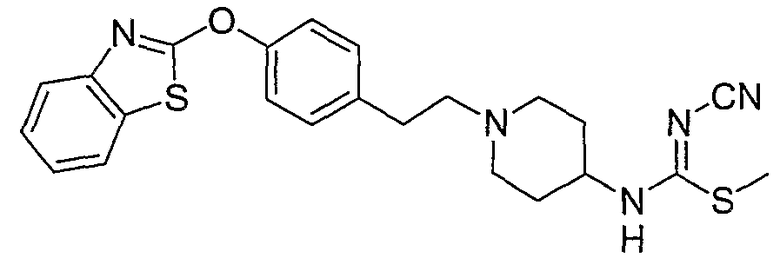
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-метилизотиомочевина
Гидрохлорид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-иламина получали из трет-бутилового эфира (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)карбаминовой кислоты примера 337 путем удаления Вос-группы в соответствии с методикой, описанной в примере 266, стадия В. Свободное основание получали, как описано в примере 343. Раствор 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-иламина (145 мг, 0,4 ммоль) в этаноле (5 мл) обрабатывали диметил-N-цианодитиоиминокарбонатом (180 мг, 1,34 ммоль) и нагревали до 80°С в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и очищали на SiО2 (12 г; 0-10% 2М NH3 /СН3ОН/СН2Cl2) с получением указанного в заголовке соединения (143 мг, выход 69%). Масс-спектр (ESI): точная масса, вычисленная для С23Н25N5О1S2; 451,2; m/z найдено 452,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,1, 0,5, 1H), 7,66 (дд, J=7,9, 0,7, 1H), 7,41-7,36 (м, 2H), 7,29-7,24 (м, 5H), 6,13 (шир.д, J=196, 2H), 2,97 (шир.д, J=12,0, 2H), 2,82 (дд, J=10,3, 7,3, 2H), 2,62 (дд, J=8,5, 5,5, 2H), 2,60-2,44 (шир.с, 3H), 2,18 (т, J=11,5, 2H), 2,03 (д, J=13,5, 2H), 1,7-1,55 (м, 2H).
Пример 345

N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метансульфонамид
Гидрохлорид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-иламина получали из трет-бутилового эфира (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)карбаминовой кислоты примера 337 путем удаления Вос-группы в соответствии с методикой, описанной в примере 266, стадия В. Свободное основание получали, как описано в примере 343. Свободное основание (240 мг, 0,68 ммоль) в СН2Cl2 (7 мл) обрабатывали триэтиламином (142 мкл, 1,0 ммоль), затем метансульфонилхлоридом (77 мкл, 1,0 ммоль) и раствор перемешивали в течение 16 ч. Реакционную смесь разбавляли СН2Cl2 (20 мл) и промывали раствором NaНСО3 (30 мл). Органический слой сушили, концентрировали при пониженном давлении и затем очищали на SiО2 (12 г; 0-10% 2М NH3/СН3ОН:СН2Cl2), получая 168 мг (выход 57%) указанного в заголовке соединения. Масс-спектр (ESI): точная масса, вычисленная для С21Н25N3О3S2; 431,1; m/z найдено 432,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,0, 1H), 7,65 (дд, J=7,9, 0,7, 1H), 7,42-7,36 (м, 1H), 7,29-7,24 (м, 5H), 4,45 (д, J=7,6, 1H), 3,42-3,31 (м, 1H), 2,99 (с, 3H), 2,93 (шир.д, J=12,0, 2H), 2,81 (дд, J=10,6, 7,5, 2H), 2,60 (дд, J=8,5, 5,4, 2H), 2,18 (т, J=11,0, 2H), 2,02 (д, J=12,5, 2H), 1,47 (дддд, J=11,2, 11,1, 11,1, 3,7, 2H).
Пример 346

1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-метилгуанидин
Раствор 1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-фенилизомочевины примера 343 (76 мг, 0,15 ммоль) в этаноле (3 мл) обрабатывали раствором 40% метиламина в воде (0,2 мл) и раствор перемешивали при 80°С в течение 1 часа. Реакционную смесь охлаждали до 23°С и концентрировали при пониженном давлении с получением неочищенного твердого вещества, которое очищали на SiО2 (4 г; 0-10% 2М NH3/СН3ОН:СН2Cl2), получая 50 мг (выход 76%) указанного в заголовке соединения. Масс-спектр (ESI): точная масса, вычисленная для С23Н26N6О1S1; 434,2; m/z найдено 435,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,67 (дд, J=7,9, 0,7, 1H), 7,42-7,36 (м, 2H), 7,29-7,24 (м, 5H), 5,67 (шир.с, 1H), 4,75 (шир.с, 1H), 3,63 (шир.с, 1H), 2,94 (шир.д, J=11,9, 2H), 2,86 (д, J=4,9, 2H), 2,82 (дд, J=10,4, 7,4, 2H), 2,61 (дд, J=8,5, 5,5, 2H), 2,18 (т, J=11,4, 2H), 2,05-1,96 (м, 2H), 2,61 (дддд, J=12,3, 12,3, 12,3, 3,6, 2H).
Пример 347

8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-1-фенил-1,3,8-триаза-спиро[4.5]декан-4-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием 1-фенил-1,3,8-триаза-спиро[4.5]декан-2,4-она. Масс-спектр (ESI): точная масса, вычисленная для С28Н28N4О2S1; 484,2; m/z найдено 485,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (дд, J=8,0, 0,5, 1H), 7,66 (дд, J=7,9, 0,7, 1H), 7,52 (с, 1H), 7,42-7,36 (м, 1H), 7,34-7,24 (м, 6H), 6,91 (д, J=8,0, 1H), 6,87 (т, J=7,3, 1H), 4,75 (с, 2H), 2,95-2,85 (м, 4H), 2,76-2,66 (м, 4H), 1,76 (д, J=13,9, 2H).
Пример 348
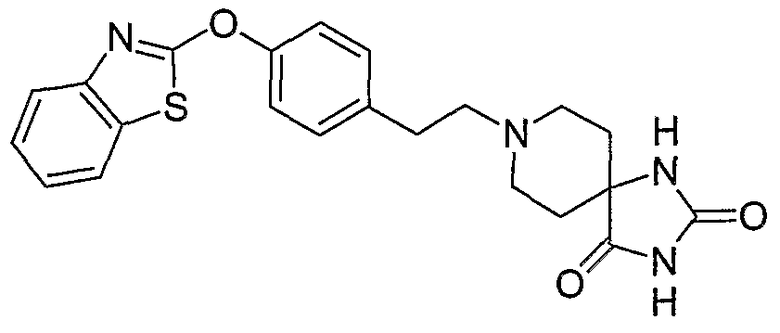
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-1,3,8-триаза-спиро[4.5]декан-2,4-дион
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием 1,3,8-триаза-спиро[5.5]декан-2,4-диона. Масс-спектр (ESI): точная масса, вычисленная для С22Н22N4О3S1; 422,1; m/z найдено 423,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,1, 0,5, 1H), 7,67 (дд, J=7,9, 1,1, 1H), 7,42-7,36 (м, 1H), 7,34-7,24 (м, 5H), 3,0 (ддд, J=9,2, 4,3, 4,3, 2H), 2,86 (дд, J=10,6, 6,9, 2H), 2,69 (дд, J=9,0, 5,3, 2H), 2,72 (т, J=10,2, 2H), 2,19-2,10 (м, 2H), 1,75 (д, J=13,6, 2H).
Пример 349

Трет-бутиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метилкарбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием трет-бутилового эфира метилпиперидин-4-илкарбаминовой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С26Н23N3О3S1: 467,2; m/z найдено 468,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,1, 0,5, 1H), 7,66 (дд, J=7,9, 0,7, 1H), 7,41-7,36 (м, 1H), 7,29-7,25 (м, 5H), 4,10-3,95 (шир.м, 1H), 3,07 (д, J=11,6, 2H), 2,83 (дд, J=11,1, 7,8, 2H), 2,75 (с, 3H), 2,61 (д, J=8,6, 5,2, 2H), 2,11 (т, J=10,9, 2H), 2,19-2,10 (м, 2H), 1,77 (дддд, J=12,1, 12,0, 12,0, 3,3, 2H), 1,70-1,64 (м, 2H), 1,47 (с, 9H).
Пример 350

N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-метилацетамид
Указанное в заголовке соединение получали из соединения 349 в соответствии с методикой, описанной в примере 266, стадия В, в примере 343 и примере 345, с использованием ацетилхлорида. Масс-спектр (ESI): точная масса, вычисленная для С23Н27N3О2S1, 409,2; m/z найдено 410,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,1, 0,6, 1H), 7,66 (дд, J=8,0, 1,1, 1H), 7,41-7,36 (м, 1H), 7,31-7,25 (м, 5H), 4,53 (тт, J=12,0, 4,2, 0,5H), 3,54 (тт, J=11,7, 4,0, 0,5H), 3,15-3,04 (м, 2H), 2,90-2,78 (м, 5H), 2,70-2,58 (м, 2H), 2,24-2,06 (м, 5H), 2,00-1,96 (м, 1H), 1,82-1,60 (м, 3H).
Пример 351
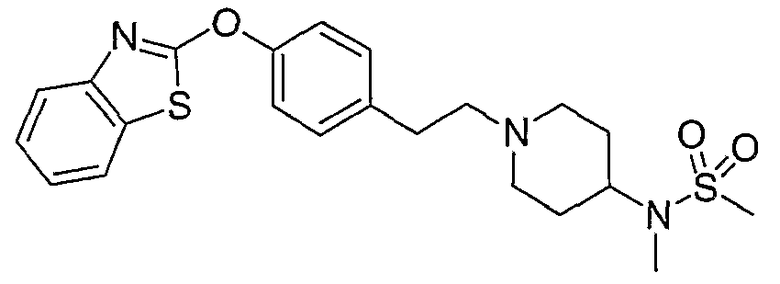
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-метилметансульфонамид
Указанное в заголовке соединение получали из соединения примера 349 в соответствии с методикой, описанной в примере 266, стадия В, в примере 343 и в примере 345, с использованием метансульфонилхлорида. Масс-спектр (ESI): точная масса, вычисленная для С25Н29N3О4S; 467,2; m/z найдено 468,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (дд, J=7,9, 0,7, 1H), 7,42-7,36 (м, 1H), 7,29-7,24 (м, 5H), 3,78 (тт, J=11,9, 4,2, 1H), 3,08 (дд, J=9,6, 2,1, 1H), 2,84 (с, 3H), 2,82 (с, 3H), 2,83-2,79 (м, 2H), 2,61 (дд, J=8,5, 5,3, 2H), 2,18 (ддд, J=11,8, 11,8, 2,2, 2H), 1,86 (дддд, J=12,2, 12,0, 12,0, 3,4, 2H), 1,76-1,69 (м, 2H).
Пример 352

[(1-{2-[4-(Бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метилкарбамоил]метиловый эфир уксусной кислоты
Указанное в заголовке соединение получали из соединения примера 349 в соответствии с методикой, описанной в примере 266, стадия В, в примере 343 и в примере 345, с использованием хлоркарбонилметилового эфира уксусной кислоты. Масс-спектр (ESI): точная масса, вычисленная для С23Н27N3О2S1; 467,2; m/z найдено 468,4 [М+Н]+. 1H ЯМР (400 МГц, CDbl3): 7,73 (дд, J=8,1, 0,5, 1H), 7,66 (д, J=7,9, 1H), 7,42-7,36 (м, 1H), 7,29-7,24 (м, 5H), 4,76 (с, 0,6H), 4,71 (с, 1,4H), 4,48 (тт, J=12,0, 4,3, 0,7H), 3,36 (тт, J=11,6, 4,4, 0,3H), 3,16-3,04 (м, 2H), 2,90-2,78 (м, 5H), 2,68-2,58 (м, 2H), 2,19 (с, 3H), 2,19-2,05 (м, 2H), 2,01-1,84 (м, 1H), 1,82-1,60 (м, 3H).
Пример 353

N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-ацетамид
Указанное в заголовке соединение получали из соединения примера 337 в соответствии с методикой, описанной в примере 266, стадия В, в примере 343 и в примере 345, с использованием ацетилхлорида. Масс-спектр (ESI): точная масса, вычисленная для С25Н29N3О4S; 395,2; m/z найдено 396,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,0, 1H), 7,66 (дд, J=7,9, 0,6, 1H), 7,42-7,36 (м, 1H), 7,29-7,24 (м, 5H), 5,48 (д, J=7,8, 1H), 3,87-3,77 (м 1H), 2,95 (дд, J=11,6, 2H), 2,83 (дд, J=10,8, 7,6, 2H), 2,62 (дд, J=8,5, 5,3, 2H), 2,18 (д, J=11,4, 2H), 2,00-1,94 (м, 2H), 1,98 (м, 2H), 1,49 (дддд, J=12,3, 12,2, 12,2, 3,6, 2H).
Пример 354
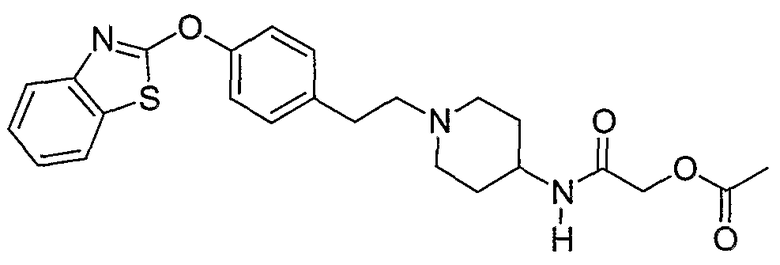
(1-{2-[4-(Бензотиазол-2-илокси)фенил]этил}пиперидин-4-илкарбамоил]метиловый эфир уксусной кислоты
Указанное в заголовке соединение получали из соединения примера 337 в соответствии с методикой, описанной в примере 266, стадия В, в примере 343 и в примере 354, с использованием хлоркарбонилметилового эфира уксусной кислоты. Масс-спектр (ESI): точная масса, вычисленная для С24Н27N3О4S; 453,2; m/z найдено 454,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (дд, J=8,2, 0,6, 1H), 7,67 (дд, J=7,9, 0,7, 1H), 7,42-7,36 (м, 1H), 7,29-7,24 (м, 5H), 6,05 (д, J=8,0, 1H), 4,54 (с, 2H), 3,96-3,85 (м 1H), 3,00 (д, J=8,2, 0,6, 2H), 2,85 (дд, J=10,6, 7,4, 2H), 2,85 (дд, J=10,6, 7,4, 2H), 2,66 (дд, J=8,6, 5,3, 2H), 2,23 (т, J=11,4, 2H), 2,18 (с, 3H), 1,98 (д, J=9,7, 2H), 1,57 (дддд, J=12,4, 12,4, 12,3, 3,6, 2H).
Пример 355
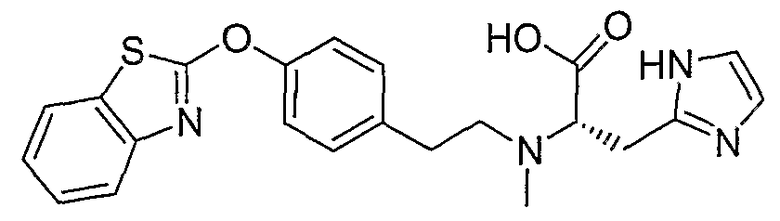
(S)-2-({2-[4-(бензотиазол-2-илокси)фенил]этил}метиламино)-3-(1Н-имидазол-2-ил)пропионовая кислота
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием (S)-3-(1Н-имидазол-2-ил)-2-метиламинопропионовой кислоты. Масс-спектр (ESI): точная масса, вычисленная для С22Н22N4О3S1: 422,1; m/z найдено 423,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 8,85, (с, 1H), 7,81 (дд, J=7,9, 0,6, 1H), 7,72 (дд, J=8,1, 0,5, 1H), 7,58-7,42 (м, 4H), 7,39-7,34 (м, 3H), 4,34, (дд, J=9,3, 4,9, 3H), 3,71-3,42, (м, 4H), 3,35-3,32 (м, 2H), 3,20 (д, J=8,6, 2H), 3,08 (с, 3H).
Пример 356
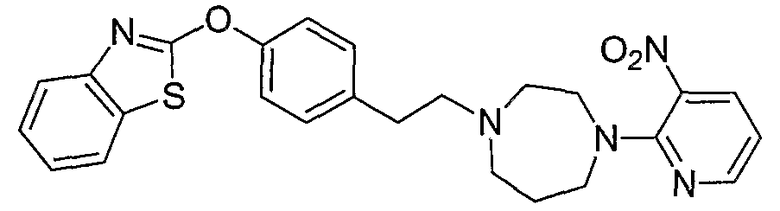
2-(4-{2-[4-(3-нитропиридин-2-ил)-[1,4]диазепан-1-ил]этил}фенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, стадия А, с использованием 1-(3-нитропиридин-2-ил)-[1,4]диазепана. Масс-спектр (ESI): точная масса, вычисленная для С25Н25N2О3S1: 457,2; m/z найдено 476,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,36 (дд, J=4,5, 1,7, 1H), 8,14 (дд, J=8,1, 1,7, 1H), 7,77 (дд, J=8,1, 0,5, 1H), 7,70 (дд, J=8,0, 0,7, 1H), 7,45-7,40 (м, 1H), 7,29-7,24 (м, 5H), 6,73 (дд, J=8,0, 4,4, 1H), 3,80-3,75 (шир.с, 2H), 3,47-3,40 (шир.с, 2H), 3,07-3,01 (шир.с, 2H), 2,95-2,88 (м, 2H), 2,86-2,79 (м, 4H), 2,20-2,10 (шир.с, 2H).
Пример 357

2-(4-пиперидин-1-илметилфенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 251, стадия В, с использованием пиперидина. Масс-спектр (ESI): масса, вычисленная для С19Н20N2ОS: 324,4; m/z найдено 325,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,75 (д, J=8,2, 1H), 7,73 (д, J=8,2, 1H), 7,36-7,42 (м, 3H), 7,24-7,32 (м, 3H), 3,49 (с, 2H), 2,39 (шир.с, 3H), 1,56-1,64 (м, 5H), 1,40-1,48 (м, 2H).
Пример 358
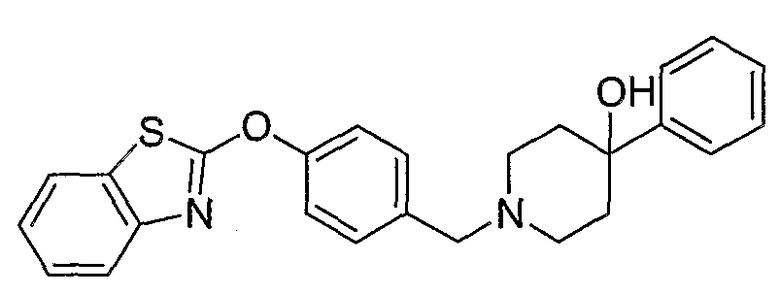
1-[4-(бензотиазол-2-илокси)бензил]-4-фенилпиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 251, стадия В, с использованием 4-фенилпиперидин-4-ола. Масс-спектр (ESI): масса, вычисленная для С25Н24N2О3S, 416,5; m/z, найдено 417,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,75 (д, J=8,0, 1H), 7,66 (д, J=8,0, 1H), 7,55-7,51 (м, 2H), 7,47-7,25 (м, 9H), 3,63 (с, 2H), 2,85-2,77 (м, 2H), 2,50 (дт, J=11,8, 2,5, 2H), 2,18 (дт, J=13,0, 4,4, 2H), 1,80-1,74 (м, 2H), 1,55 (шир.с, 1H).
Пример 359
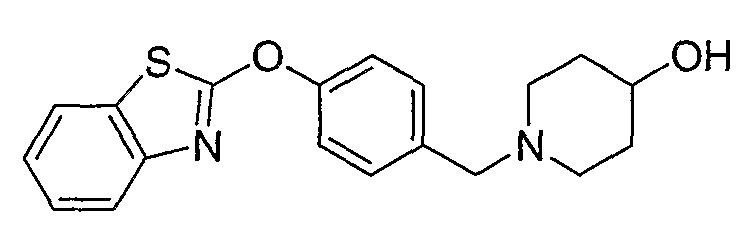
1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 251, стадия В, с использованием 4-пиперидинола. Масс-спектр (ESI): масса, вычисленная для С19Н20N2О3S, 340,4; m/z, найдено 341,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,42-7,36 (м, 3H), 7,32-7,24 (м, 3H), 3,68-3,64 (м, 1H), 3,46 (с, 2H), 2,81-2,25 (м, 2H), 2,20-2,15 (м, 2H), 1,95-1,90 (м, 2H), 1,67-1,58 (м, 3H).
Пример 360

{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 251, стадия В, с использованием пиперидин-4-илметанола. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О2S, 354,5; m/z, найдено 355,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,42-7,37 (м, 3H), 7,32-7,25 (м, 3H), 3,54 (с, 2H), 3,51 (д, J=6,5, 2H), 2,97-2,90 (м, 2H), 2,01 (дт, J=11,6, 2,4, 3H), 1,73 (д, J=12,1,2H), 1,58-1,47 (м, 1H), 1,37-1,26 (м, 2H).
Пример 361
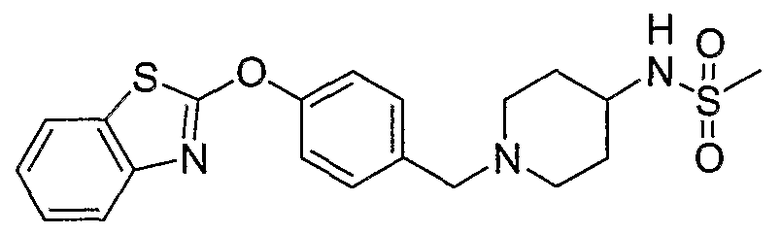
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метансульфонамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадии А и В, и затем в примере 258, стадия С. Масс-спектр (ESI): масса, вычисленная для С20Н23N3О3S2, 417,6; m/z, найдено 418,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,68 (д, J=8,0, 1H), 7,42-7,36 (м, 3H), 7,35-7,25 (м, 3H), 4,32-4,5 (м, 1H), 3,58 (с, 2H), 3,43-3,32 (м, 1H), 2,99 (с, 3H), 2,87-2,80 (м, 2H), 2,18-2,10 (м, 2H), 2,04-1,96 (м, 2H), 1,64-1,54 (м, 2H).
Пример 362

{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}-2-гидроксиацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 258, стадии А и В, и затем в примере 253, стадия С, с использованием гликолевой кислоты. Масс-спектр (ESI): масса, вычисленная для С22Н26N3О3S, 411,5; m/z, найдено 412,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,2, 1H), 7,67 (д, J=8,2, 1H), 7,42-7,37 (м, 3H), 7,32-7,25 (м, 3H), 4,11 (с, 2H), 3,51 (с, 2H), 3,24 (т, J=6,3, 2H), 2,88-2,94 (м, 2H), 2,20 (д, J=11,5, 1H), 2,02-1,92 (м, 2H), 1,72-1,65 (м, 2H), 1,62-1,50 (м, 2H), 1,36-1,26 (м, 2H).
Пример 363

Метиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадии А и В, и затем в примере 258, стадия С, с использованием метилизоцианата. Масс-спектр (ESI): масса, вычисленная для С21Н23N3О3S, 397,5; m/z, найдено 398,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,42-7,36 (м, 3H), 7,32-7,24 (м, 3H), 4,57 (шир.с, 1H), 3,66 (с, 3H), 3,51 (с, 2H), 2,85-2,79 (м, 2H), 2,18-2,09 (м, 2H), 1,98-1,90 (м, 2H), 1,51-1,40 (м, 2H).
Пример 364
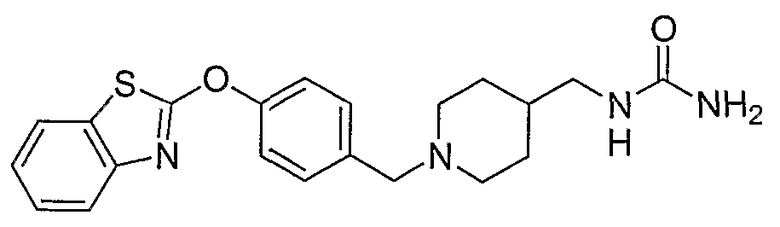
{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}мочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 258, стадии А, В и С, с использованием триметилсилилизоцианата. Масс-спектр (ESI): масса, вычисленная для С21Н24N4О2S, 396,5; m/z, найдено 397,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,42-7,36 (м, 3H), 7,32-7,24 (м, 3H), 4,64 (шир.с, 1H), 4,35 (с, 2H), 3,50 (с, 2H), 3,07 (шир.т, J=6,3, 2H), 2,94-2,88 (м, 2H), 1,86-2,01 (м, 2H), 1,72-1,66 (м, 2H), 1,56-1,44 (с, 1H), 1,24-1,23 (м, 2H).
Пример 365
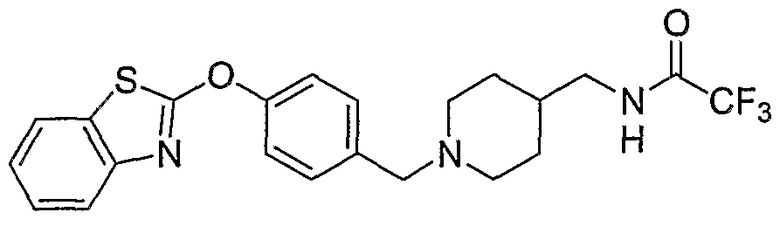
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илметил}-2,2,2-трифторацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 258, стадии А и В, и в примере 257, стадия С, с использованием трифторуксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С22Н22F3N3O2S, 449,5; m/z, найдено 450,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,42-7,36 (м, 3H), 7,32-7,24 (м, 3H), 6,41 (шир.с, 1H), 3,51 (с, 2H), 3,28 (т, J=6,46, 2H), 2,92 (д, J=11,5, 2H), 2,02-1,94 (м, 2H), 1,74-1,54 (м, 3H), 1,38-1,27 (м, 2H).
Пример 366

{4-[4-(бензотиазол-2-илокси)бензил]пиперазин-1-ил}уксусная кислота
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадии С и D, и в примере 250, стадия D, с использованием пиперазин-1-илуксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С20Н21N3O3S, 383,5; m/z, найдено 384,4 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,77 (д, J=8,0, 1H), 7,62 (д, J=8,0, 1H), 7,50-7,46 (м, 2H), 7,42-7,26 (м, 4H), 6,67 (с, 2H), 3,60 (с, 2H), 3,34 (шир.с, 4H), 2,77 (шир.с, 4H).
Пример 367
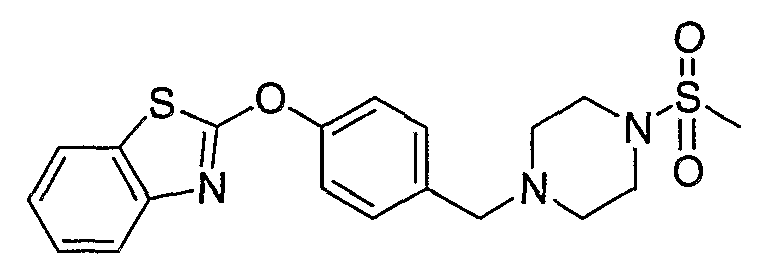
2-[4-(4-метансульфонилпиперазин-1-илметил)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 257, стадии А и В, и в примере 258, стадия С. Масс-спектр (ESI): масса, вычисленная для С19Н21N3O3S2, 403,53; m/z, найдено 404,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,68 (д, J=8,0, 1H), 7,42-7,36 (м, 3H), 7,35-7,26 (м, 3H), 3,57 (с, 2H), 3,26 (шир.т, J=4,7, 4H), 2,79 (с, 3H), 2,58 (шир.т, J=4,7, 4H).
Пример 368
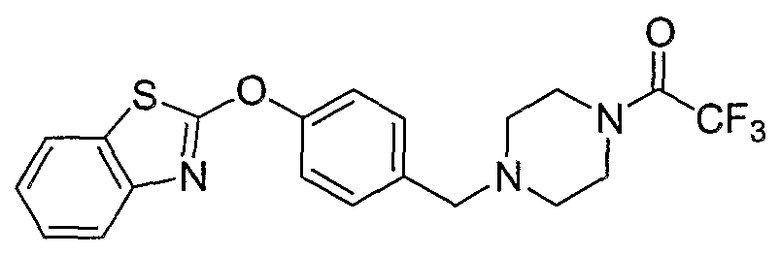
1-{4-[4-(бензотиазол-2-илокси)бензил]пиперазин-1-ил}-2,2,2-трифторэтанон
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 257, стадии А, В и С, с использованием трифторуксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С20Н18F3N3O2S, 421,44; m/z, найдено 422,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,68 (д, J=8,0, 1H), 7,42-7,27 (м, 6H), 3,74-3,70 (м, 2H), 3,65-3,60 (м, 2H), 3,57 (с, 2H), 2,56-2,50 (м, 4H).
Пример 369
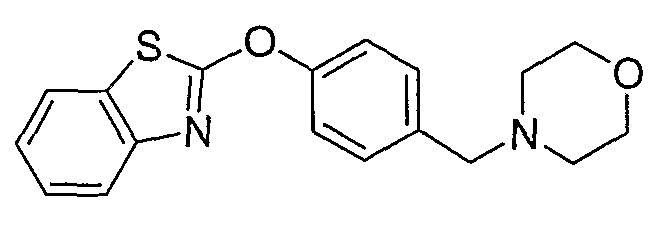
2-(4-морфолин-4-илметилфенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 259, стадии С и D, с использованием морфолина. Масс-спектр (ESI): масса, вычисленная для С18Н18N2O2S, 326,42; m/z, найдено 327,4 [М+Н]+. 1H ЯМР (500 МГц, CDCl3): 7,74 (д, J=7,7, 1H), 7,67 (д, J=7,7, 1H), 7,42-7,37 (м, 3H), 7,33-7,25 (м, 3H), 3,72 (т, J=3,7, 4H), 3,52 (с, 2H), 2,46 (шир.с, 4H).
Пример 370

Фениловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадии А и В, и затем в примере 258, стадия С, с использованием фенилизоцианата. Масс-спектр (ESI): масса, вычисленная для С28Н25N3О3S, 459,57; m/z, найдено 460,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,42-7,10 (м, 11H), 4,95 (шир.д, J=7,8, 1H), 3,67-3,58 (м, 1H), 3,53 (с, 2H), 2,88-2,82 (м, 2H), 2,21-2,06 (м, 2H), 2,03-1,99 (м, 2H), 1,61-1,44 (м, 2H).
Пример 371

N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}бензолсульфонамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадии А и В, и затем в примере 258, стадия С, с использованием бензолсульфонилхлорида. Масс-спектр (ESI): масса, вычисленная для С25Н25N3О3S2, 479,62; m/z, найдено 480,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,86-7,84 (м, 2H), 7,75 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,60-7,48 (м, 3H), 7,41-7,24 (м, 6H), 4,56 (шир.д, J=7,8, 1H), 3,48 (с, 2H), 3,26-3,16 (м, 1H), 2,76-2,68 (м, 2H), 2,06-1,97 (м, 2H), 1,78-1,70 (м, 1H), 1,52-1,42 (м, 2H).
Пример 372

Этиловый эфир 3-[4-(бензотиазол-2-илокси)бензиламино]пропионовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 251, стадии А и В, с использованием этилового эфира 3-аминопропионовой кислоты. Масс-спектр (ESI): масса, вычисленная для С19Н20N2О3S, 356,45; m/z, найдено 357,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,0, 1H), 7,67 (д, J=8,0, 1H), 7,44-7,25 (м, 6H), 4,21 (шир.с, 1H), 4,15 (кв, J=7,2, 2H), 3,87 (с, 2H), 2,95 (т, J=6,3, 2H), 2,58 (т, J=6,3, 2H), 1,26 (т, J=7,2, 3H).
Пример 373

3-[4-(бензотиазол-2-илокси)бензиламино]пропионовая кислота
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 372, и в примере 250, стадия D. Масс-спектр (ESI): масса, вычисленная для С17Н16N2О3S, 328,39; m/z, найдено 329,3 [М+Н]+. 1H ЯМР (400 МГц, ДМСО): 7,87 (д, J= 8,0, 1H), 7,62 (д, J=8,0, 1H), 7,44-7,23 (м, 6H), 3,77 (с, 2H), 2,72 (т, J=6,6, 2H), 2,29 (т, J=6,6, 2H).
Пример 374

Этиловый эфир [(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)метиламино]уксусной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 18, стадия А, и в примере 20, с использованием этилового эфира 3-метиламинопропионовой кислоты. Масс-спектр (ESI): масса, вычисленная для С26Н31N3О5S, 497,62; m/z, найдено 498,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,0, 1H), 7,65 (д, J=8,0, 1H), 7,41-7,35 (м, 1H), 7,28-7,23 (м, 3H), 6,99-6,94 (м, 2H), 4,28-4,08 (м, 5H), 3,12 (с, 3H), 3,10-3,04 (м, 1H), 2,98-2,81 (м, 4H), 2,62-2,53 (м, 1H), 2,24-2,12 (м, 2H), 1,97-1,83 (м, 2H), 1,81-1,64 (м, 2H), 1,32-1,24 (м, 3H).
Пример 376

Этиловый эфир 1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 9 и в примере 24, с использованием этилового эфира [1,4']бипиперидинил-4-карбоновой кислоты. Масс-спектр (ESI): масса, вычисленная для С28Н35N3О4S, 509,67; m/z, найдено 510,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,0, 1H), 7,65 (д, J=8,0, 1H), 7,41-7,35 (м, 1H), 7,29-7,23 (м, 3H), 6,99-6,92 (м, 2H), 4,16-4,08 (м, 4H), 3,10-3,04 (м, 2H), 2,92-2,86 (м, 2H), 2,80 (т, J=5,9, 1H), 2,36-2,20 (м, 4H), 2,16-2,07 (м, 2H), 1,95-1,87 (м, 2H), 1,82-1,57 (м, 7H), 1,24 (т, J=7,0, 3H).
Пример 377

1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-4-карбоновая кислота
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 376 и в примере 250, стадия D. Масс-спектр (ESI): масса, вычисленная для С26Н31N3О4S, 481,62; m/z, найдено 482,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (д, J=8,0, 1H), 7,64 (д, J=8,0, 1H), 7,44-7,38 (м, 1H), 7,32-7,27 (м, 3H), 7,08-7,03 (м, 2H), 4,17 (т, J=5,4, 2H), 3,44-3,36 (м, 2H), 3,24-3,19 (м, 2H), 3,05-2,84 (м, 5H), 2,40-2,20 (м, 3H), 2,14-2,04 (м, 4H), 1,86-1,72 (м, 4H).
Пример 378
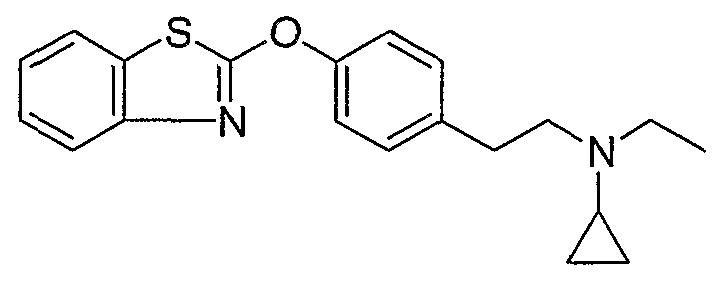
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилэтиламин
А. {2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламин.
Смесь [4-(бензотиазол-2-илокси)фенил]ацетальдегида (пример 262, стадия А, 4,2 г, 15,6 ммоль), циклопропиламина (5,4 мл, 78,0 ммоль) и уксусной кислоты (4,5 мл, 78 ммоль) в СН2Cl2 (156 мл) перемешивали при комнатной температуре в течение 1 часа. К полученной смеси добавляли NaВН(ОАс)3 (6,61 г, 31,2 ммоль). Смесь перемешивали при комнатной температуре в течение 24 часов, фильтровали через слой кизельгура, промывали СН2Cl2 (200 мл), затем 1н. NаОН (3×50 мл) и концентрировали при пониженном давлении, получая неочищенный продукт в виде желтого масла. Неочищенный продукт очищали на SiО2 (330 г; 0-10% СН3ОН/СН2Cl2) и получали прозрачное масло, которое кристаллизовалось при стоянии (3,4 г, выход 71%). Масс-спектр (ESI): масса, вычисленная для С18Н18N2ОS; 310,11; m/z найдено 311,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,76 (д, J=8,1, 1H),7,62 (д, J=8,1, 1H), 7,46-7,27 (м, 6H), 3,41 (т, J=7,6, 2H), 3,08 (т, J=7,6, 2H), 2,38-2,76 (м, 1H), 0,95-0,89 (м, 4H).
В. {2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилэтиламин.
Смесь ацетальдегида (180 мкл, 3,2 ммоль), {2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламина (500 мг, 1,6 ммоль) в СН2Cl2 (32 мл) перемешивали при комнатной температуре в течение 1 часа. К полученной смеси добавляли NaВН(ОАс)3 (1,02 г, 4,8 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали через слой кизельгура, промывали СН2Cl2 (100 мл) и концентрировали при пониженном давлении, получая неочищенный продукт в виде масла желтого цвета. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2) и получали прозрачное масло (465 мг, выход 86%). Масс-спектр (ESI): масса, вычисленная для С20Н22N2ОS; 338,15; m/z найдено 339,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,66 (д, J=8,1, 1H), 7,58 (д, J=8,1, 1H), 7,31 (т, J=8,1, 1H), 7,23-7,15 (м, 5H), 2,80 (с, 4H), 2,72 (дд, J=7,3, 7,1, 2H), 1,78-1,70 (м, 1H), 1,05 (т, J=7,1, 3H), 0,50-0,36 (м, 4H).
Пример 379

Трифторметансульфонатная соль 3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропионовой кислоты
А. Метиловый эфир 3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропионовой кислоты.
К раствору {2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламина (500 мг, 1,6 ммоль) в СН3СN (10 мл) при комнатной температуре добавляли N,N-диизопропилэтиламин (349 мкл, 2 ммоль) и затем метиловый эфир 3-бром-2-метилпропионовой кислоты (362 мг, 2 ммоль). Полученную смесь нагревали при 60°С в течение ночи. Смесь охлаждали, растворяли в СН2Cl2 (100 мл), затем промывали насыщенным водным NaНСО3 (1×25 мл) и H2O (2×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2) и получали светлое твердое вещество не совсем белого цвета (158 мг, выход 39%). Масс-спектр (ESI): масса, вычисленная для С23Н26N2О3S; 410,17; m/z найдено 411,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,73 (д, J=8,3, 1H), 7,65 (д, J=8,3, 1H), 7,38 (т, J=8,1, 1H), 7,28-7,23 (м, 5H), 3,66 (с, 3H), 3,01 (дд, J=8,8, 3,8, 1H), 2,89-2,76 (м, 5H), 3,60 (дд, J=6,6, 6,1, 1H), 1,84-1,78 (м, 1H), 1,12 (д, J=7,1, 3H), 0,51-0,30 (м, 4H).
В. Трифторметансульфонатная соль 3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропионовой кислоты.
К раствору метилового эфира 3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропионовой кислоты (158 мг, 0,38 ммоль) в смеси ТГФ/СН3ОН, 3:1:1 (13 мл) добавляли раствор гидроксида лития (37 мг, 1,54 ммоль) в H2O (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч и затем концентрировали при пониженном давлении. Остаток растворяли в СН3ОН и очищали ВЭЖХ с обращенной фазой. Нужные фракции собирали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде прозрачного масла (179 мг, выход 92%). Масс-спектр (ESI): масса, вычисленная для С22Н24N2О3S; 396,15; m/z найдено 397,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,78 (д, J=8,3, 1H), 7,64 (д, J=8,1, 1H), 7,51-7,27 (м, 6H), 3,83 (т, J=12,4, 1H), 3,55 (т, J=8,1, 2H), 3,37 (д, J=13,1, 1H), 3,25 (т, J=8,8, 2H), 3,21-3,11 (м, 1H), 2,99-2,90 (м, 1H), 1,33 (д, J=7,3, 3H), 1,17-0,97 (м, 4H).
Пример 380
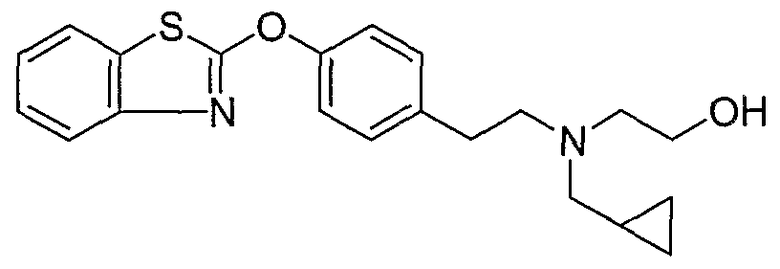
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)этанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 378, стадия А, с использованием циклопропилметиламина, и в примере 379, стадия А, с использованием 2-бромэтанола. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О2S, 368,16; m/z, найдено 369,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,70 (д, J=8,1, 1H), 7,62 (д, J=8,1, 1H), 7,34 (т, J=7,3, 1H), 7,27-7,18 (м, 5H), 3,56 (т, J=5,3, 2H), 2,92-2,86 (м, 2H), 2,84-2,73 (м, 4H), 2,49 (д, J=6,6, 2H), 0,92-0,81 (м, 1H), 0,55-0,49 (м, 2H), 0,16-0,09 (м, 2H).
Пример 381

2-[2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)этокси]этанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 380. Масс-спектр (ESI): масса, вычисленная для С23Н28N2О3S, 412,18; m/z, найдено 413,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,64 (д, J=8,3, 2H), 7,41 (д, J=8,3, 2H), 7,31 (т, J=8,3, 1H), 7,25-7,17 (м, 3H), 4,08 (шир.с, 1H), 3,84-3,68 (м, 6H), 3,59-3,49 (м, 2H), 3,26-3,16 (м, 2H), 1,11-0,99 (м, 1H), 0,79-0,70 (м, 2H), 0,55-0,48 (м, 2H).
Пример 382
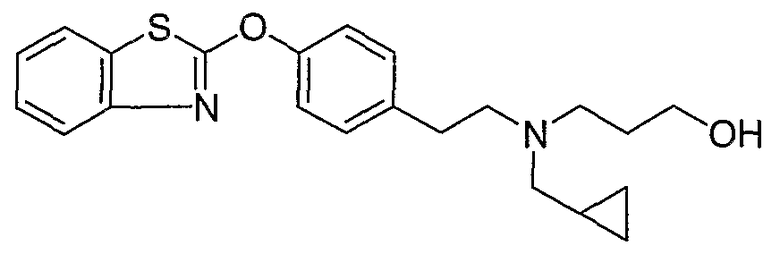
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропан-1-ол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 378, стадия А, с использованием циклопропилметиламина, и в примере 379, стадия А, с использованием 3-бромпропан-1-ола. Масс-спектр (ESI): масса, вычисленная для С22Н26N2О2S, 382,17; m/z, найдено 383,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,70 (д, J=8,1, 1H), 7,62 (д, J=8,1, 1H), 7,34 (т, J=8,1, 1H), 7,27-7,18 (м, 5H), 3,77 (т, J=5,3, 2H), 2,84-2,76 (м, 6H), 2,43 (д, J=6,6, 2H), 1,72-1,65 (м, 2H), 0,94-0,83 (м, 1H), 0,57-0,49 (м, 2H), 0,18-0,11 (м, 2H).
Пример 383

Трифторметансульфонатная соль {2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил(3-тетразол-2-илпропил)амина
К раствору 3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропан-1-ола (пример 382, 220 мг, 0,58 ммоль) и 2Н-тетразола (61 мг, 0,87 ммоль) в СН2Cl2 (12 мл) добавляли нанесенный на полимер трифенилфосфин (290 мг, 0,87 ммоль) и ди-трет-бутилазодикарбоксилат (200 мг, 0,87 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, фильтровали и собранные твердые вещества промывали СН2Cl2 (10 мл). Фильтрат концентрировали при пониженном давлении и получали неочищенный продукт в виде светло-желтого масла. Неочищенный продукт растворяли в СН3ОН и очищали ВЭЖХ с обращенной фазой. Нужные фракции собирали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде прозрачного масла (100 мг, выход 40%). Масс-спектр (ESI): масса, вычисленная для С23Н26N6ОS; 434,19; m/z найдено 435,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,75 (с, 1H), 7,75 (д, J=8,1, 1H), 7,60 (д, J=8,1, 1H), 7,45-7,32 (м, 5H), 7,28 (т, J=8,1, 1H), 3,54-3,40 (м, 4H), 3,29-3,25 (м, 2H), 3,19 (д, J=7,3, 2H), 3,09 (т, J=8,6, 2H), 2,56-2,47 (м, 2H), 1,16-1,05 (м, 1H), 0,78-0,71 (м, 2H), 0,46-0,40 (м, 2H).
Пример 384

{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропил(3-пиррол-1-илпропил)амин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 379, стадия А, с использованием 1-(3-бромпропил)-1Н-пиррола. Масс-спектр (ESI): масса, вычисленная для С25Н27N3ОS, 417,19; m/z, найдено 418,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,65 (д, J=7,6, 1H), 7,57 (д, J=8,1, 1H), 7,30 (т, J=8,1, 1H), 7,21-7,13 (м, 5H), 6,57 (т, J=2,0, 2H), 6,07 (т, J=2,0, 2H), 3,80 (т, J=7,1, 2H), 2,80-2,69 (м, 4H), 2,57 (т, J=7,1, 2H), 1,98-1,88 (м, 2H), 1,74-1,67 (м, 1H), 0,47-0,40 (м, 2H), 0,37-0,31 (м, 2H).
Пример 385

4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)бутиронитрил
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 378, стадия А, с использованием циклопропилметиламина, и в примере 319, стадия А, с использованием 4-бромбутиронитрила. Масс-спектр (ESI): масса, вычисленная для С23Н25N3ОS, 391,17; m/z, найдено 392,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,70 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,35 (т, J=8,1, 1H), 7,27-7,20 (м, 5H), 2,77-2,73 (м, 4H), 2,64 (т, J=6,6, 2H), 2,39 (д, J=6,3, 2H), 2,29 (т, J=6,8, 2H), 1,74-1,66 (м, 2H), 0,89-0,78 (м, 1H), 0,55-0,48 (м, 2H), 0,13-0,08 (м, 2H).
Пример 386
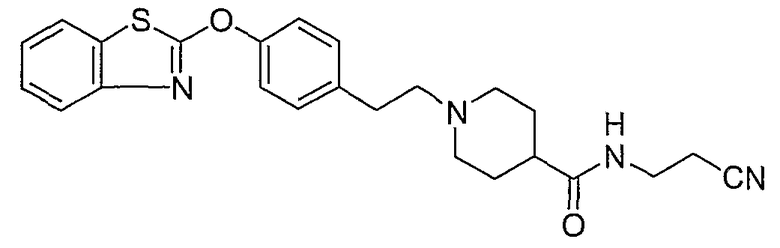
(2-цианоэтил)амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 33, стадия В, с использованием 3-аминопропионитрила. Масс-спектр (ESI): масса, вычисленная для С24Н26N4О2S, 434,18; m/z, найдено 435,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,3, 1H), 7,67 (д, J=8,1, 1H), 7,40 (т, J=8,1, 1H), 7,32-7,24 (м, 5H), 6,39 (т, J=6,6, 1H), 3,51(дд, J=6,3, 6,1, 2H), 3,11-3,00 (м, 2H), 2,89-2,82 (м, 2H), 2,69-2,58 (м, 4H), 2,23-2,13 (м, 1H), 2,08 (т, J=12,1, 2H), 1,94-1,76 (м, 4H).
Пример 387
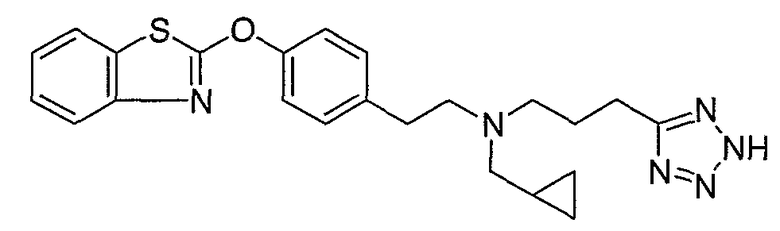
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(2Н-тетразол-5-ил)пропил]амин
К раствору 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)бутиронитрила (пример 385, 250 мг, 0,6 ммоль) в толуоле (32 мл) при комнатной температуре добавляли триметилалюминий (2,0М раствор в толуоле, 1,53 мл, 3,08 ммоль) и затем азидотриметилсилан (404 мкл, 3,08 ммоль). Полученную смесь нагревали при 80°С в течение 18 ч. Смесь охлаждали до комнатной температуры, разбавляли СН2Cl2 (200 мл), затем промывали насыщенным водным NaНСО3 (1×25 мл) и H2O (2×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении, получая неочищенный продукт в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (40 г; 0-20% СН3ОН/СН2Cl2) и получали не совсем белое твердое вещество (246 мг, выход 88%). Масс-спектр (ESI): масса, вычисленная для С23Н26N6ОS; 434,19; m/z найдено 435,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 11,25 (шир.с, 1H), 7,54 (дд, J=7,8, 5,0, 2H), 7,23 (дд, J=8,1, 7,3, 1H), 7,19-7,09 (м, 5H), 3,23-3,11 (м, 4H), 3,01-2,90 (м, 4H), 2,83 (д, J=7,3, 2H), 2,18-2,07 (м, 2H), 1,01-0,91 (м, 1H), 0,57-0,50 (м, 2H), 0,25-018 (м, 2H).
Пример 388
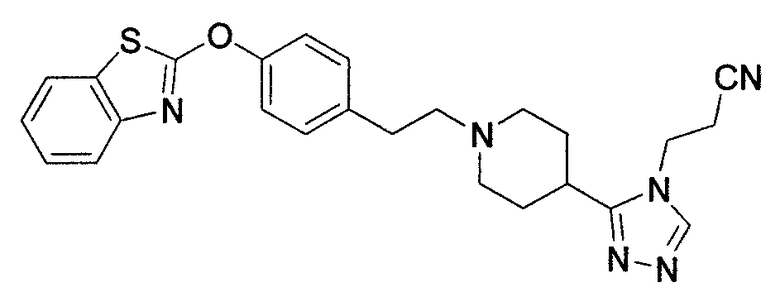
3-[5-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)тетразол-1-ил]пропионитрил
К перемешиваемой суспензии (2-цианоэтил)амида 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты (пример 386, 500 мг, 1,15 ммоль) и трифенилфосфина (755 мг, 2,88 ммоль) в безводном СН3СN (10 мл) при 0°С добавляли диизопропилазодикарбоксилат (567 мкл, 2,88 ммоль), спустя 2 минуты, в течение 20 минут добавляли азотриметилсилан (399 мкл, 3,04 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 30 минут и затем перемешивали дополнительно 14 часов. Реакционную смесь добавляли в воду со льдом (20 мл) и экстрагировали СН2Cl2 (2×25 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали. Остаток очищали на SiО2 (40 г; 0-15% СН3ОН/СН2Cl2) и получали не совсем белое твердое вещество (439 мг, выход 83%). Масс-спектр (ESI): масса, вычисленная для С24Н25N7ОS; 459,18; m/z найдено 460,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,38 (т, J=7,8, 1H), 7,31-7,23 (м, 5H), 4,62 (т, J=6,8, 2H), 3,20-3,10 (м, 4H), 3,04-2,94 (м, 1H), 2,91-2,82 (м, 2H), 2,73-2,64 (м, 2H), 2,25 (т, J=10,9, 2H), 2,18-2,05 (м, 2H), 2,04-1,95 (м, 2H).
Пример 389
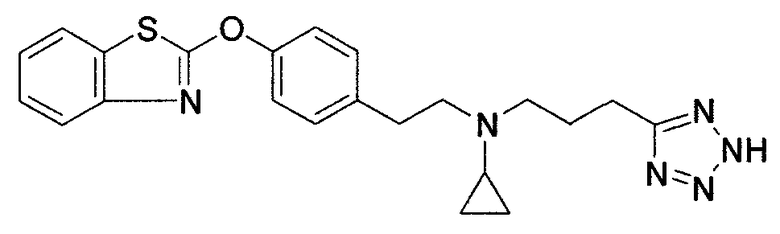
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропил[3-(2Н-тетразол-5-ил)пропил]амин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 387. Масс-спектр (ESI): масса, вычисленная для С20Н24N6ОS, 420,17; m/z, найдено 421,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 13,02 (шир.с, 1H), 7,50 (дд, J=8,1, 3,5, 2H), 7,20 (т, J=8,1, 1H), 7,12-7,04 (м, 5H), 2,95-2,77 (м, 8H), 2,06-1,93 (м, 3H), 0,60-0,48 (м, 4H).
Пример 390

(2-гидрокси-1,1-диметилэтил)амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 33, стадии В и С, с использованием 2-амино-2-метилпропан-1-ола. Масс-спектр (ESI): масса, вычисленная для С25Н31N3О3S, 453,21; m/z, найдено 454,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,75 (д, J=8,1, 1H), 7,68 (д, J=8,1, 1H), 7,40 (т, J=8,1, 1H), 7,32-7,25 (м, 5H), 5,83 (с, 1H), 5,06 (шир.с, 1H), 3,59 (с, 2H), 3,14-3,06 (м, 2H), 2,91-2,84 (м, 2H), 2,70-2,63 (м, 2H), 2,20-2,10 (м, 3H), 1,95-1,74 (м, 4H), 1,32 (с, 6H).
Пример 391

Трифторметансульфонатная соль {2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(1Н-[1,2,4]триазол-3-ил)пропил]амина
А. Гидрохлоридная соль этилового эфира 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)бутиримидиновой кислоты.
Раствор 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)бутиронитрила (пример 385, 932 мг, 2,38 ммоль) в абсолютном этаноле (5 мл) и диэтиловый эфир (10 мл) барботировали газообразным хлористым водородом в течение 1 часа. Полученную суспензию фильтровали и промывали эфиром с получением указанного в заголовке соединения (1,12 г, выход 92%). Из-за нестабильности, полученный неочищенный продукт использовали без очистки.
В. Трифторметансульфонатная соль {2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(1Н-[1,2,4]триазол-3-ил)пропил]амина.
К раствору гидрохлоридной соли этилового эфира 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)бутиримидиновой кислоты (511 мг, 1 ммоль) в этаноле (4,5 мл) добавляли триэтиламин (375 мкл, 2,7 ммоль) и затем раствор гидразида муравьиной кислоты (60 мг, 1 ммоль) в этаноле (4,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 ч и затем кипятили с обратным холодильником в течение 1 ч. Смесь охлаждали и разбавляли СН2Cl2 (1500 мл), затем промывали насыщенным водным NaНСО3 (1×25 мл) и H2O (2×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении, получая неочищенный продукт в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (40 г; 0-15% СН3ОН/СН2Cl2) и получали не совсем белое твердое вещество (317 мг, выход 73%). Масс-спектр (ESI): масса, вычисленная для С24Н27N5ОS; 433,19; m/z найдено 434,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,91 (с, 1H), 7,68 (д, J=7,8, 1H), 7,63 (д, J=8,1, 1H), 7,34 (т, J=8,1, 1H), 7,25-7,19 (м, 5H), 2,90-2,76 (м, 6H), 2,72 (т, J=6,3, 2H), 2,46 (д, J=6,6, 2H), 2,00-1,90 (м, 2H), 0,93-0,82 (м, 1H), 0,56-0,49 (м, 2H), 0,16-0,10 (м, 2H).
Пример 392

{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(5-метил-1Н-[1,2,4]триазол-3-ил)пропил]амин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 391, стадия В, с использованием гидразида уксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С25Н29N5ОS, 447,21; m/z, найдено 448,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,65 (дд, J=8,1, 8,1, 2H), 7,35 (т, J=8,1, 1H), 7,27-7,21 (м, 5H), 3,01-2,94 (м, 2H), 2,93-2,84 (м, 4H), 2,81 (т, J=6,6, 2H), 2,61 (д, J=6,8, 2H), 2,37 (с, 3H), 2,07-1,97 (м, 2H), 1,01-0,89 (м, 1H), 0,62-0,53 (м, 2H), 0,25-0,17 (м, 2H).
Пример 393
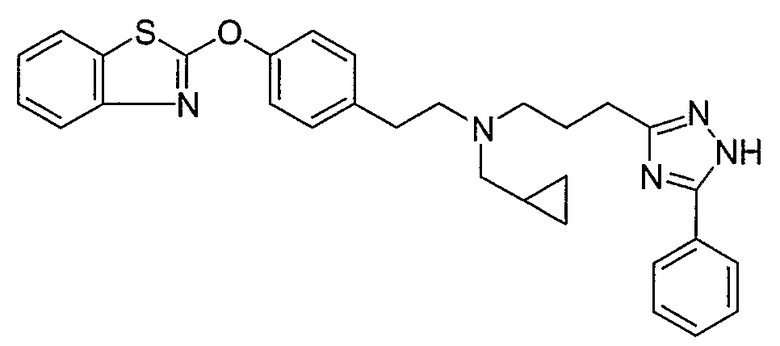
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(5-фенил-1Н-[1,2,4]триазол-3-ил)пропил]амин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 391, стадия В, с использованием гидразида бензойной кислоты. Масс-спектр (ESI): масса, вычисленная для С30Н31N5ОS, 509,22; m/z, найдено 510,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 8,06 (дд, J=16,8, 0,5, 2H), 7,70 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,42-7,30 (м, 4H), 7,28-7,20 (м, 5H), 2,99-2,87 (м, 6H), 2,85 (т, J=6,6, 2H), 2,58 (д, J=6,8, 2H), 2,09-2,00 (м, 2H), 1,00-0,89 (м, 1H), 0,61-0,53 (м, 2H), 0,23-0,16 (м, 2H).
Пример 394
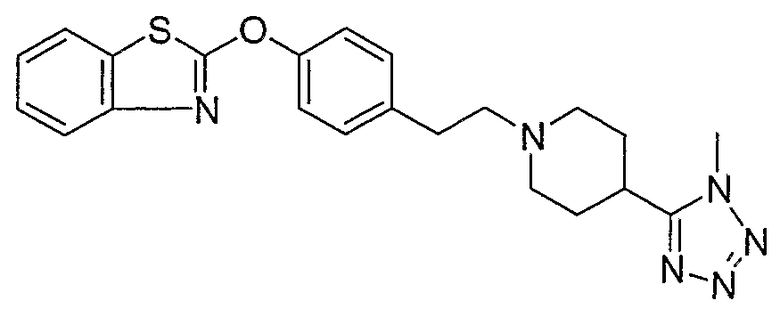
Трифторацетатная соль 2-(4-{2-[4-(1-метил-1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазола
К раствору 2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазола (пример 262, 80 мг, 1,97 ммоль) в ДМФА (20 мл) добавляли К2СО3 (256 мг, 1,85 ммоль) и диметилкарбонат (360 мкл, 4,27 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт растворяли в СН3ОН и очищали ВЭЖХ с обращенной фазой. Нужные фракции собирали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде бесцветного масла (289 мг, выход 27%). Масс-спектр (ESI): масса, вычисленная для С22Н24N6ОS; 420,17; m/z найдено 421,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,72 (д, J=7,8, 1H), 7,58 (д, J=7,8, 1H), 7,44-7,28 (м, 5H), 7,25 (т, J=8,1, 1H), 4,06 (с, 3H), 3,80 (д, J=12,1, 1H), 3,66-3,35 (м, 4H), 3,28-3,17 (м, 2H), 3,16-3,08 (м, 2H), 2,33-2,23 (м, 2H), 2,22-2,07 (м, 2H).
Пример 395
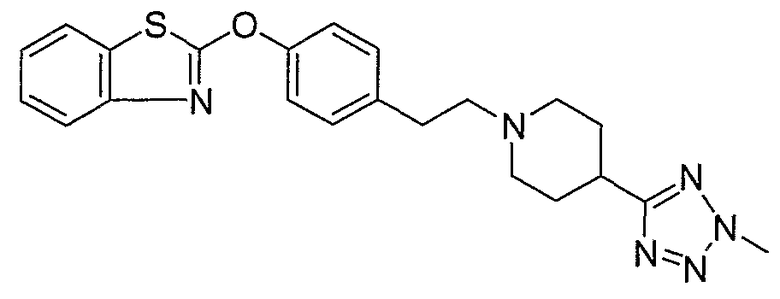
2-(4-{2-[4-(2-метил-2Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 394. Масс-спектр (ESI): масса, вычисленная для С22Н24N6ОS, 420,17; m/z, найдено 421,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,75 (д, J=7,8, 1H), 7,60 (д, J=7,8, 1H), 7,46-7,33 (м, 5H), 7,28 (т, J=7,8, 1H), 4,31 (с, 3H), 3,79 (д, J=13,4, 1H), 3,62-3,06 (м, 8H), 2,48-2,30 (м, 2H), 2,15-2,02 (м, 2H).
Пример 396
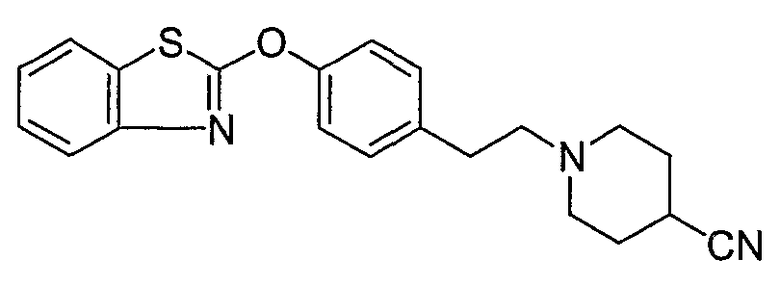
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонитрил
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 262, с использованием пиперидин-4-карбонитрила. Масс-спектр (ESI): масса, вычисленная для С21Н21N3ОS, 363,14; m/z, найдено 364,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,63 (д, J=7,6, 1H), 7,55 (д, J=7,6, 1H), 7,28 (т, J=8,1, 1H), 7,20-7,12 (м, 5H), 2,71 (дд, J=7,1, 3,3, 2H), 2,68-2,55 (м, 3H), 2,52 (дд, J=7,1, 3,3, 2H), 2,37-2,25 (м, 2H), 1,91-1,73 (м, 2H).
Пример 397

2-(4-{2-[4-(1Н-[1,2,3]триазол-4-ил]этил}фенокси)бензотиазол
К раствору триметилсилилдиазометана (1,8 мл, 3,6 ммоль) в диэтиловом эфире (30 мл) при 0°С в атмосфере азота по каплям добавляли н-бутиллитий (2,5М в гексане) (1,44 мл, 3,6 ммоль) и смесь перемешивали при 0°С в течение 20 минут. К полученному раствору по каплям добавляли раствор 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонитрила (пример 396, 1,09 г, 3,0 ммоль) в ТГФ (10 мл) при 0°С. Полученную смесь перемешивали при 0°С в течение 3 ч. Смесь обрабатывали насыщенным водным NН4Cl и экстрагировали СН2Cl2 (2×100 мл). Экстракты промывали H2O (2×25 мл), сушили (Na2SO4) и концентрировали при пониженном давлении, получая неочищенный продукт в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2) и получали не совсем белое твердое вещество (768 мг, выход 54%). Масс-спектр (ESI): масса, вычисленная для С22Н23N5ОS; 405,16; m/z найдено 406,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,63 (д, J=8,1, 1H), 7,56 (д, J=8,1, 1H), 7,42 (с, 1H), 7,29 (т, J=7,8, 1H), 7,23-7,14 (м, 5H), 4,67 (шир.с, 1H), 3,04 (д, J=11,9, 2H), 2,84-2,70 (м, 3H), 2,63-2,56 (м, 2H), 2,16 (т, J=11,1, 2H), 1,97 (д, J=12,6, 2H), 1,82-1,70 (м, 2H).
Пример 398

Этиловый эфир 4-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}масляной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 378, стадия А, с использованием этилового эфира 4-аминомасляной кислоты. Масс-спектр (ESI): масса, вычисленная для С21Н24N2О3S, 384,15; m/z, найдено 385,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,38 (т, J=8,1, 1H), 7,31-7,22 (м, 5H), 6,67 (шир.с, 1H), 4,12 (дд, J=7,3, 7,1, 2H), 2,95-2,80 (м, 2H), 2,69 (т, J=6,8, 2H), 2,35 (т, J=7,3, 2H), 2,29 (т, J=7,3, 2H), 1,86-1,77 (м, 2H), 1,25 (т, J=7,1, 3H).
Пример 399
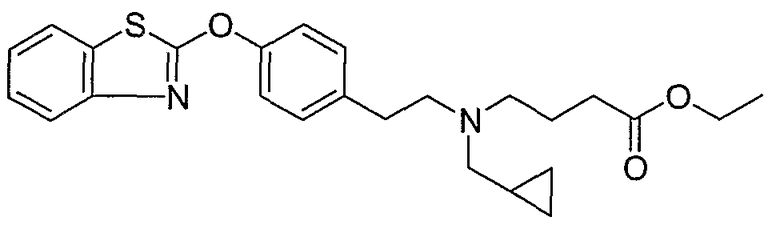
Этиловый эфир 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)масляной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 378, стадия А, с использованием циклопропилметиламина, и в примере 379, стадия А, с использованием этилового эфира 4-броммасляной кислоты. Масс-спектр (ESI): масса, вычисленная для С25Н30N2О3S, 438,20; m/z, найдено 439,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,35 (т, J=8,1, 1H), 7,27-7,20 (м, 5H), 6,67 (шир.с, 1H), 4,10 (дд, J=7,1, 7,1, 2H), 2,83-2,71 (м, 4H), 2,60 (т, J=7,1, 2H), 2,40 (т, J=6,6, 2H), 2,31 (т, J=7,3, 2H), 1,81-1,72 (м, 2H), 1,23 (т, J=7,1, 3H), 0,88-0,79 (м, 1H), 0,52-0,45 (м, 2H), 0,13-0,07 (м, 2H).
Пример 400
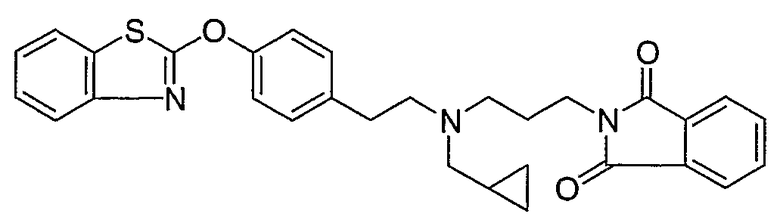
2-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]изоиндол-1,3-дион
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 378, стадия А, с использованием циклопропилметиламина, и в примере 379, стадия А, с использованием 2-(3-бромпропил)изоиндол-1,3-диона. Масс-спектр (ESI): масса, вычисленная для С30Н29N3О3S, 511,19; m/z, найдено 512,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,84-7,77 (м, 2H), 7,72-7,63 (м, 3H), 7,60 (д, J=7,8, 1H), 7,34 (т, J=8,1, 1H), 7,27-7,18 (м, 5H), 3,71 (т, J=7,1, 2H), 2,82-2,70 (м, 4H), 2,65 (т, J=7,6, 2H), 2,39 (д, J=6,6, 2H), 1,88-1,79 (м, 2H), 0,87-0,76 (м, 1H), 0,50-0,42 (м, 2H), 0,12-0,06 (м, 2H).
Пример 401
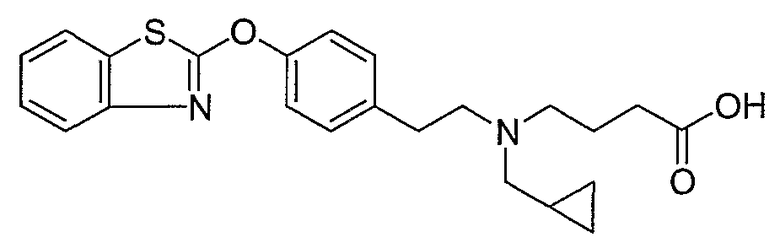
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)масляная кислота
Указанное в заголовке соединение получали из соединения примера 399 в соответствии с методикой, описанной в примере 379, стадия В. Масс-спектр (ESI): масса, вычисленная для С23Н26N2О3S, 410,17; m/z, найдено 411,4 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,42 (д, J=7,8, 1H), 7,31 (д, J=7,8, 1H), 7,16-7,10 (м, 2H), 7,07 (т, J=7,8, 1H), 7,04-7,00 (м, 2H), 6,96 (т, J=7,8, 1H), 3,23-3,11 (м, 2H), 3,07 (т, J=7,8, 2H), 2,91-2,77 (м, 4H), 2,19 (т, J=7,1, 2H), 1,78-1,68 (м, 2H), 0,91-0,82 (м, 1H), 0,49-0,41 (м, 2H), 0,20-0,13 (м, 2H).
Пример 402

1-(3-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}пропил)пирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 378, стадия А, с использованием 1-(3-аминопропил)пирролидин-2-она. Масс-спектр (ESI): масса, вычисленная для С22Н25N3О2S, 395,17; m/z, найдено 396,4 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,67 (д, J=8,1, 1H), 7,60 (д, J=8,1, 1H), 7,32 (т, J=7,8, 1H), 7,28-7,15 (м, 5H), 5,61 (шир.с, 1H), 3,34-3,25 (м, 4H), 2,94-2,81 (м, 4H), 2,65 (т, J=7,3, 2H), 2,32 (т, J=7,8, 2H), 1,94 (т, J=7,3, 2H), 1,79-1,69 (м, 2H).
Пример 403

N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилметилпропан-1,3-диамин
К раствору 2-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]изоиндол-1,3-диона (пример 400, 3,0 г, 5,86 ммоль) в EtOН (12 мл) добавляли гидразин (220 мкл, 7,03 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Смесь растворяли в СН2Cl2 (200 мл), промывали насыщенным NaНСО3 (2×20 мл) и H2O (1×20 мл), сушили (Na2SO4) и концентрировали при пониженном давлении, получая неочищенный продукт в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (330 г; 0-10% 2М NH3 в СН3ОН/СН2Cl2) и получали прозрачное масло (2,13 г, выход 96%). Масс-спектр (ESI): масса, вычисленная для С22Н27N3ОS; 381,2; m/z найдено 382,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,68 (д, J=8,1, 1H), 7,58 (д, J=8,1, 1H), 7,31 (т, J=8,1, 1H), 7,24-7,16 (м, 5H), 2,79-2,71 (м, 4H), 2,67 (т, J=6,8, 2H), 2,59 (т, J=6,8, 2H), 2,37 (д, J=6,6, 2H), 2,07 (с, 2H), 1,62-1,52 (м, 2H), 0,87-0,77 (м, 1H), 0,50-0,44 (м, 2H), 0,12-0,06 (м, 2H).
Пример 404
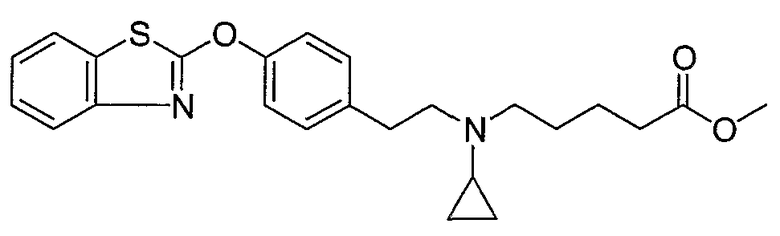
Метиловый эфир 5-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пентановой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 379, стадия А, с использованием метилового эфира 5-бромпентановой кислоты. Масс-спектр (ESI): масса, вычисленная для С24Н28N2О3S, 424,18; m/z, найдено 425,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,36 (т, J=8,1, 1H), 7,27-7,20 (м, 5H), 3,65 (с, 3H), 2,85-2,80 (м, 4H), 2,66 (т, J=7,6, 2H), 2,33 (т, J=7,6, 2H), 1,81-1,75 (м, 1H), 1,67-1,50 (м, 4H), 0,52-0,40 (м, 2H), 0,43-0,37 (м, 2H).
Пример 405
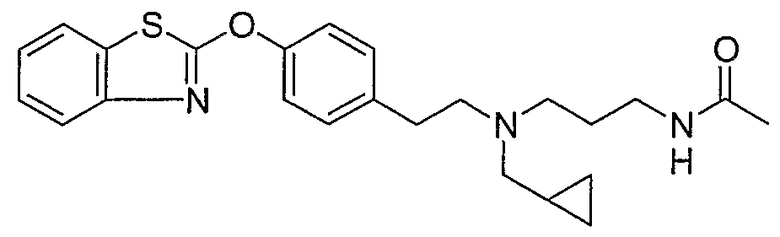
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]ацетамид
К раствору N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1- циклопропилметилпропан-1,3-диамина (пример 403, 180 мг, 0,47 ммоль) в СН2Cl2 (10 мл) добавляли триэтиламин (131 мкл, 0,94 ммоль) и затем ангидрид уксусной кислоты (76 мкл, 0,71 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Смесь растворяли в СН2Cl2 (100 мл), промывали насыщенным NaНСО3 (2×15 мл) и H2O (1×15 мл), сушили (Na2SO4) и концентрировали при пониженном давлении, получая неочищенный продукт в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (12 г; 0-10% СН3ОН/СН2Cl2) и получали твердое вещество белого цвета (154 мг, выход 77%). Масс-спектр (ESI): масса, вычисленная для С24Н29N3ОS; 423,2; m/z найдено 424,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 9,69 (шир.с, 1H), 7,67 (д, J=8,1, 1H), 7,62 (д, J=8,1, 1H), 7,33 (т, J=8,1, 1H), 7,27-7,17 (м, 5H), 3,27 (дд, J=6,6, 5,6, 2H), 2,96-2,89 (м, 2H), 2,87-2,81 (м, 2H), 2,78 (т, J=6,8, 2H), 2,53 (д, J=6,8, 2H), 1,88 (с, 3H), 1,76-1,67 (м, 2H), 0,94-0,83 (м, 1H), 0,60-0,53 (м, 2H), 0,21-0,15 (м, 2H).
Пример 406

[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]амид морфолин-4-карбоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 405, с использованием морфолин-4-карбонилхлорида. Масс-спектр (ESI): масса, вычисленная для С28Н34N4О3S, 494,24; m/z, найдено 495,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,69 (т, J=8,5, 2H), 7,41-7,23 (м, 6H), 6,85 (шир.с, 1H), 3,68-3,60 (м, 4H), 3,51-3,40 (м, 6H), 3,39-3,27 (м, 4H), 3,26-3,17 (м, 2H), 3,09-3,01 (м, 2H), 2,19-2,06 (м, 2H), 1,25-1,14 (м, 1H), 0,85-0,76 (м, 2H), 0,53-0,45 (м, 2H).
Пример 407

N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]метинсульфонамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 405, с использованием метансульфонилхлорида. Масс-спектр (ESI): масса, вычисленная для С23Н29N3О3S2, 459,17; m/z, найдено 460,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,67 (т, J=8,6, 2H), 7,39-7,17 (м, 6H), 7,06 (шир.с, 1H), 3,43-3,09 (м, 8H), 3,07-2,98 (м, 2H), 2,96 (с, 3H), 2,20-2,07 (м, 2H), 1,23-1,11 (м, 1H), 0,79-0,67 (м, 2H), 0,49-0,41 (м, 2H).
Пример 408

5-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пентановая кислота
Указанное в заголовке соединение получали из соединения примере 379 в соответствии с методикой, описанной в примере 404, стадия В. Масс-спектр (ESI): масса, вычисленная для С23Н26N2О3S, 410,17; m/z, найдено 411,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 12,39 (шир.с, 1H), 7,71 (д, J=7,8, 1H), 7,62 (д, J=7,8, 1H), 7,35 (т, J=7,8, 1H), 7,31-7,20 (м, 5H), 3,04-2,90 (м, 4H), 2,82 (т, J=7,8, 2H), 2,30 (т, J=6,8, 2H), 1,98-1,91 (м, 1H), 1,72-1,54 (м, 4H), 0,83-0,76 (м, 2H), 0,63-0,55 (м, 2H).
Пример 409
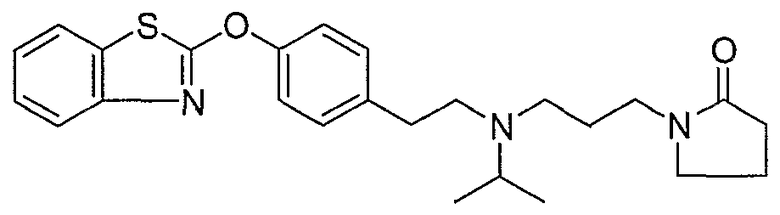
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}изопропиламино)пропил]пирролидин-2-он
Смесь 1-(3-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}пропил)пирролидин-2-она (пример 402, 500 мг, 1,26 ммоль) и ацетона (185 мкл, 2,52 ммоль) в СН2Cl2 (25 мл) перемешивали при комнатной температуре в течение 1 часа. К полученной смеси добавляли NаВН(ОАс)3 (536 мг, 2,52 ммоль). Смесь перемешивали при комнатной температуре в течение 16 ч, фильтровали через слой кизельгура, промывали СН2Cl2 (100 мл) и концентрировали при пониженном давлении с получением неочищенного продукта в виде желтого масла. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2). Нужные фракции объединяли и концентрировали при пониженном давлении с получением прозрачного масла, которое кристаллизовалось при стоянии (290 мг, выход 53%). Масс-спектр (ESI): масса, вычисленная для С25Н31N3О2S; 437,21; m/z найдено 438,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,3, 1H), 7,66 (д, J=8,3, 1H), 7,38 (т, J=8,3, 1H), 7,28-7,23 (м, 5H), 3,35 (т, J=6,8, 2H), 3,27 (т, J=7,3, 2H), 3,05-2,95 (м, 1H), 2,78-2,70 (м, 2H), 2,69-2,61 (м, 2H), 2,47 (т, J=7,3, 2H), 2,37 (т, J=8,1, 2H), 2,04-1,94 (м, 2H), 1,69-1,58 (м, 2H), 0,99 (д, J=6,8, 6H).
Пример 410

1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]пирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 409, с использованием циклопропанкарбальдегида. Масс-спектр (ESI): масса, вычисленная для С26Н31N3О3S, 449,21; m/z, найдено 450,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,70 (д, J=7,8, 1H), 7,64 (д, J=8,1, 1H), 7,36 (т, J=7,8, 1H), 7,32-7,21 (м, 5H), 3,38 (т, J=7,1, 2H), 3,31 (т, J=7,1, 2H), 3,09-3,02 (м, 2H), 2,95-2,83 (м, 4H), 2,72 (д, J=7,1, 2H), 2,37 (т, J=7,8, 2H), 2,05-1,95 (м, 2H), 1,92-1,82 (м, 2H), 1,02-0,91 (м, 1H), 0,66-0,59 (м, 2H), 0,29-0,23 (м, 2H).
Пример 411

1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]пирролидин-2-он
К раствору 1-(3-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}пропил)пирролидин-2-она (пример 402, 500 мг, 1,26 ммоль) в EtOН (20 мл) добавляли уксусную кислоту (716 мкл, 1,26 ммоль), молекулярные сита (500 мг, 3Е), (1-этоксициклопропокси)триметилсилан (1,51 мл, 7,58 ммоль) и цианоборогидрид натрия (357 мг, 5,69 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 16 ч, охлаждали, фильтровали через слой кизельгура, затем промывали СН2Cl2 (100 мл) и концентрировали при пониженном давлении с получением неочищенного продукта в виде прозрачного масла. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2). Нужные фракции объединяли и концентрировали при пониженном давлении с получением твердого вещества белого цвета (434 мг, выход 66%). Масс-спектр (ESI): масса, вычисленная для С25Н29N3О2S; 435,2; m/z найдено 436,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=7,8, 1H), 7,64 (д, J=7,8, 1H), 7,36 (т, J=7,8, 1H), 7,28-7,19 (м, 5H), 3,36 (т, J=7,1, 2H), 3,28 (т, J=7,1, 2H), 2,87-2,80 (м, 4H), 2,67 (т, J=7,3, 2H), 2,37 (т, J=7,8, 2H), 2,03-1,94 (м, 2H), 1,82-1,70 (м, 3H), 0,53-0,47 (м, 2H), 0,43-0,38 (м, 2H).
Пример 412
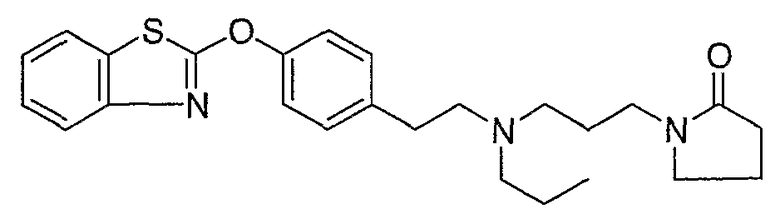
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}пропиламино)пропил]пирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 409, с использованием пропиональдегида. Масс-спектр (ESI): масса, вычисленная для С25Н31N3О2S, 437,21; m/z, найдено 438,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,38 (т, J=8,1, 1H), 7,29-7,24 (м, 5H), 3,39 (т, J=7,1, 2H), 3,30 (т, J=7,1, 2H), 2,86-2,80 (м, 4H), 2,64 (т, J=7,6, 2H), 2,58 (т, J=7,6, 2H), 2,42-2,35 (м, 2H), 2,07-1,97 (м, 2H), 1,80-1,71 (м, 2H), 1,59-1,47 (м, 2H), 0,92 (д, J=7,3, 3H).
Пример 413
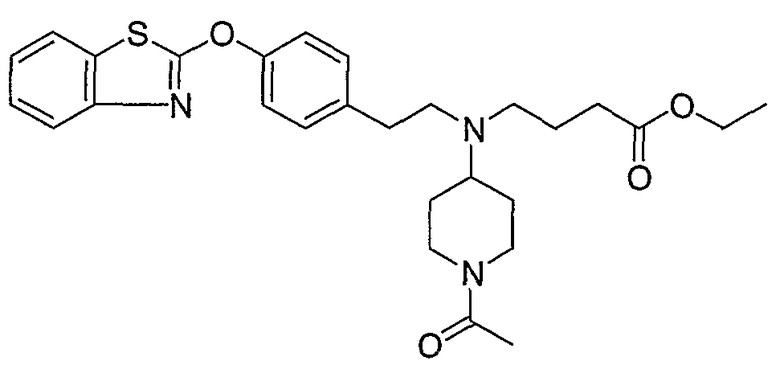
Этиловый эфир 4-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)масляной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 409, с использованием 1-ацетилпиперидин-4-она. Масс-спектр (ESI): масса, вычисленная для С28Н35N3О4S, 509,23; m/z, найдено 510,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,38 (т, J=8,1, 1H), 7,29-7,23 (м, 5H), 4,69 (д, J=13,1, 1H), 4,13 (дд, J=7,8, 6,8, 2H), 3,85 (д, J=13,4, 1H), 3,09-2,98 (м, 2H), 2,79-2,74 (м, 4H), 2,60 (т, J=6,8, 2H), 2,52-2,44 (м, 3H), 2,04 (с, 3H), 1,85-1,73 (м, 4H), 1,48-1,35 (м, 2H), 1,26 (т, J=7,1, 3H).
Пример 414
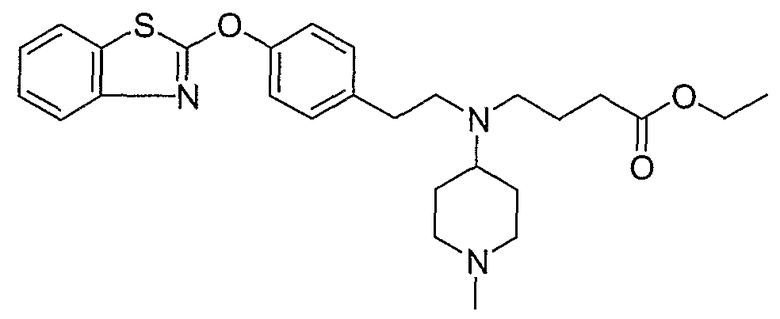
Этиловый эфир 4-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)масляной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 409, с использованием 1-метилпиперидин-4-она. Масс-спектр (ESI): масса, вычисленная для С27Н35N3О3S, 481,2; m/z, найдено 482,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,37 (т, J=8,1, 1H), 7,28-7,19 (м, 5H), 4,12 (дд, J=7,3, 7,1, 2H), 3,11 (д, J=12,1, 2H), 2,75-2,69 (м, 4H), 2,58-2,50 (м, 3H), 2,38 (с, 3H), 2,29 (т, J=7,1, 2H), 2,24-2,15 (м, 2H), 2,03-1,97 (м, 2H), 1,73 (т, J=6,3, 4H), 1,25 (т, J=7,1, 3H).
Пример 415

4-({2-[4-(бензотиазол-2-илокси)фенил]этил}метансульфониламино)масляная кислота
Указанное в заголовке соединение получали из соединения примере 398 в соответствии с методикой, описанной в примере 407 и в примере 379, стадия В. Масс-спектр (ESI): масса, вычисленная для С20Н22N2О5S2, 434,1; m/z, найдено 435,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,38 (т, J=8,1, 1H), 7,33-7,24 (м, 5H), 3,48 (т, J=7,6, 2H), 3,20 (т, J=7,6, 2H), 2,96 (т, J=7,3, 2H), 2,77 (с, 3H), 2,37 (т, J=6,6, 2H), 1,91-1,81 (м, 2H).
Пример 416
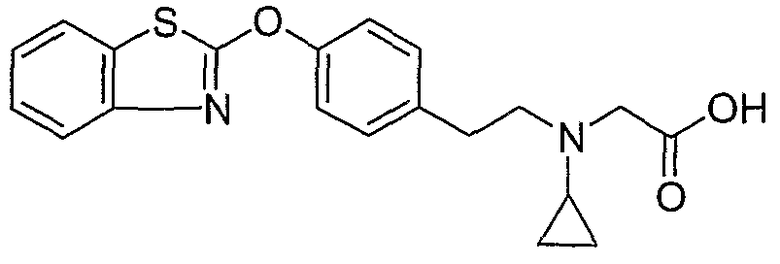
({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)уксусная кислота
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 379, стадии А и В, с использованием метилового эфира бромуксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С20Н20N2О3S, 368,12; m/z, найдено 369,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,70 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,37 (т, J=8,1, 1H), 7,31-7,22 (м, 5H), 3,64 (с, 2H), 3,26 (дд, J=7,6, 3,3, 2H), 2,98 (дд, J=7,6, 3,3, 2H), 2,50-2,43 (м, 1H), 0,84-0,79 (м, 2H), 0,71-0,65 (м, 2H).
Пример 417
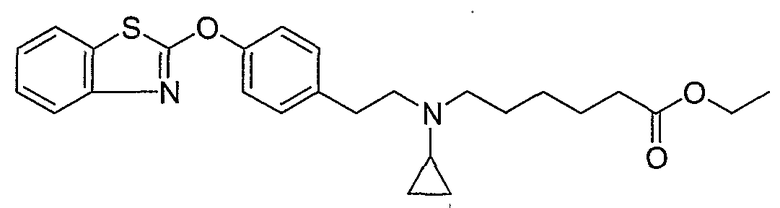
Этиловый эфир 6-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гексановой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 379, стадия А, с использованием этилового эфира 6-бромгексановой кислоты. Масс-спектр (ESI): масса, вычисленная для С26Н32N2О3S, 452,21; m/z, найдено 453,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,36 (т, J=8,1, 1H), 7,28-7,20 (м, 5H), 4,12 (дд, J=7,3, 7,1, 2H), 2,87-2,81 (м, 4H), 2,65 (т, J=7,8, 2H), 2,30 (т, J=7,6, 2H), 1,81-1,74 (м, 1H), 1,69-1,60 (м, 2H), 1,59-1,50 (м, 2H), 1,37-1,27 (м, 2H), 1,24 (т, J=7,1, 3H), 0,52-0,46 (м, 2H), 0,43-0,37 (м, 2H).
Пример 418

Этиловый эфир 7-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гептановой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 379, стадия А, с использованием этилового эфира 7-бромгептановой кислоты. Масс-спектр (ESI): масса, вычисленная для С27Н34N2О3S, 466,23; m/z, найдено 467,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,60 (д, J=8,1, 1H), 7,34 (т, J=8,1, 1H), 7,27-7,18 (м, 5H), 4,10 (дд, J=7,1, 7,1, 2H), 2,86-2,79 (м, 4H), 2,63 (т, J=7,6, 2H), 2,28 (т, J=7,6, 2H), 1,80-1,74 (м, 1H), 1,67-1,58 (м, 2H), 1,57-1,47 (м, 2H), 1,38-1,25 (м, 4H), 1,23 (т, J=7,1, 3H), 0,50-0,44 (м, 2H), 0,43-0,37 (м, 2H).
Пример 419

6-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гексановая кислота
Указанное в заголовке соединение получали из соединения примера 417 в соответствии с методикой, описанной в примере 379 стадия В. Масс-спектр (ESI): масса, вычисленная для С24Н26N2О3S, 424,18; m/z, найдено 425,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 11,17 (шир.с, 1H), 7,69 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,39-7,21 (м, 6H), 3,35-3,28 (м, 2H), 3,24-3,10 (м, 4H), 2,53-2,45 (м, 1H), 2,31 (т, J=7,1, 2H), 1,92-1,81 (м, 2H), 1,70-1,61 (м, 2H), 1,44-1,34 (м, 4H), 0,91-0,83 (м, 2H).
Пример 420

7-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гептановая кислота
Указанное в заголовке соединение получали из соединения примера 418 в соответствии с методикой, описанной в примере 379 стадия В. Масс-спектр (ESI): масса, вычисленная для С25Н30N2О3S, 438,2; m/z, найдено 439,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 12,57 (шир.с, 1H), 7,72 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,36 (т, J=8,1, 1H), 7,31-7,20 (м, 5H), 3,02-2,90 (м, 4H), 2,78 (т, J=7,8, 2H), 2,26 (т, J=7,6, 2H), 1,97-1,90 (м, 1H), 1,67-1,56 (м, 4H), 1,41-1,26 (м, 4H), 0,80-0,73 (м, 2H), 0,62-0,55 (м, 2H).
Пример 421

N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилпропан-1,3-диамин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 378, стадия А, с использованием циклопропиламина, в примере 379, стадия А, с использованием 2-(3-бромпропил)изоиндол-1,3-диона, и в примере 403. Масс-спектр (ESI): масса, вычисленная для С21Н25N3ОS, 367,17; m/z, найдено 468,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=7,6, 1H), 7,65 (д, J=7,8, 1H), 7,38 (т, J=7,6, 1H), 7,29-7,23 (м, 5H), 2,89-2,82 (м, 4H), 2,71 (т, J=7,1, 4H), 1,83-1,77 (м, 1H), 1,72-1,64 (м, 2H), 1,55 (шир.с, 2H), 0,54-0,48 (м, 2H), 0,44-0,39 (м, 2H).
Пример 422

N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]ацетамид
Указанное в заголовке соединение получали из соединения примера 421 в соответствии с методикой, описанной в примере 405. Масс-спектр (ESI): масса, вычисленная для С23Н27N3О2S, 409,18; m/z, найдено 410,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,36 (т, J=8,0118, 1H), 7,28-7,21 (м, 5H), 6,77 (шир.с, 1H), 3,26 (дд, J=6,1, 5,8, 2H), 2,89-2,83 (м, 4H), 2,75 (т, J=6,8, 2H), 1,89 (с, 3H), 1,84-1,78 (м, 1H), 1,75-1,67 (м, 2H), 0,57-0,51 (м, 2H), 0,47-0,42 (м, 2H).
Пример 423
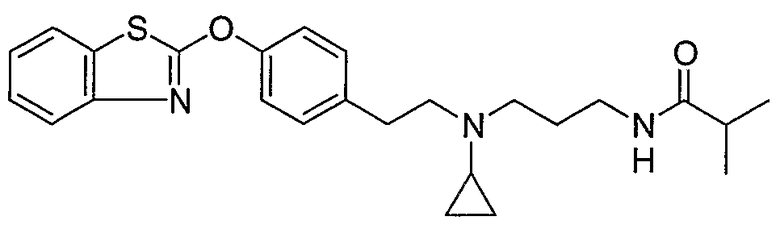
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]изобутирамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 421, с использованием изобутирилхлорида. Масс-спектр (ESI): масса, вычисленная для С25Н31N3О2S, 437,21; m/z, найдено 438,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,37 (т, J=8,1, 1H), 7,30-7,23 (м, 5H), 6,54 (шир.с, 1H), 3,30 (дд, J=6,1, 5,8, 2H), 2,90-2,83 (м, 4H), 2,77 (т, J=6,3, 2H), 2,31-2,19 (м, 1H), 1,85-1,78 (м, 1H), 1,75-1,67 (м, 2H), 1,12 (д, J=6,8, 6H), 0,58-0,52 (м, 2H), 0,45-0,40 (м, 2H).
Пример 424
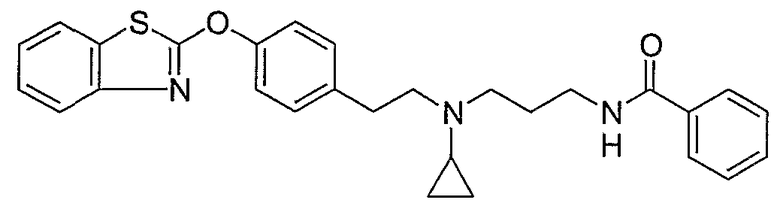
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]бензамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 422, с использованием бензоилхлорида. Масс-спектр (ESI): масса, вычисленная для С28Н29N3О2S, 471,20; m/z, найдено 472,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78-7,67 (м, 4H), 7,61 (д, J=7,8, 1H), 7,44-7,39 (м, 1H), 7,38-7,31 (м, 3H), 7,25-7,13 (м, 5H), 3,50 (дд, J=6,1, 5,6, 2H), 2,89-2,77 (м, 6H), 1,85-1,75 (м, 3H), 0,56-0,49 (м, 2H), 0,45-0,38 (м, 2H).
Пример 425

N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-4-хлорбензамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 422, с использованием 4-хлорбензоилхлорида. Масс-спектр (ESI): масса, вычисленная для С28Н28ClN3О2S, 505,16; m/z, найдено 506,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,80 (т, J=5.0, 1H), 7,68 (д, J=7,6, 1H), 7,65-7,59 (м, 3H), 7,37-7,29 (м, 3H), 7,25-7,15 (м, 5H), 3,47 (дд, J=6,1, 5,31, 2H), 2,89-2,77 (м, 6H), 1,84-1,75 (м, 3H), 0,57-0,51 (м, 2H), 0,42-0,36 (м, 2H).
Пример 426

N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]метансульфонамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 422, с использованием метансульфонилхлорида. Масс-спектр (ESI): масса, вычисленная для С22Н27N3О3S2, 445,15; m/z, найдено 446,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=7,8, 1H), 7,64 (д, J=7,8, 1H), 7,36 (т, J=7,8, 1H), 7,28-7,21 (м, 5H), 6,03 (шир.с, 1H), 3,15 (т, J=6,1, 2H), 2,88 (с, 3H), 2,87-2,82 (м, 4H), 2,78 (т, J=6,1, 2H), 1,82-1,71 (м, 3H), 0,58-0,52 (м, 2H), 0,49-0,43 (м, 2H).
Пример 427
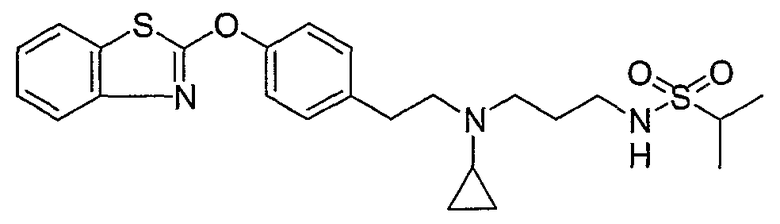
Трифторметансульфонатная соль [3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]амида пропан-2-сульфоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 422, с использованием пропан-2-сульфонилхлорида. Масс-спектр (ESI): масса, вычисленная для С24Н31N3О3S2, 473,18; m/z, найдено 474,4 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,65 (д, J=7,8, 1H), 7,53 (д, J=8,1, 1H), 7,39-7,16 (м, 6H), 3,44 (т, J=8,3, 2H), 3,37 (т, J=8,3, 2H), 3,24-3,19 (м, 2H), 3,16-3,06 (м, 4H), 2,87-2,78 (м, 1H), 2,07-1,94 (м, 2H), 1,67 (д, J=4,04, 3H), 1,23 (д, J=6,1, 3H), 1,07-1,00 (м, 2H), 0,98-0,91 (м, 2H).
Пример 428
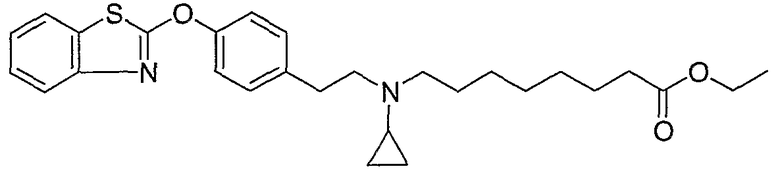
Этиловый эфир 8-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)октановой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 379, стадия А, с использованием этилового эфира 8-бромоктановой кислоты. Масс-спектр (ESI): масса, вычисленная для С28Н36N2О3S, 480,43; m/z, найдено 481,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,36 (т, J=8,1, 1H), 7,27-7,20 (м, 5H), 4,11 (дд, J=7,3, 7,1, 2H), 2,87-2,81 (м, 4H), 2,64 (т, J=7,3, 2H), 2,28 (т, J=7,1, 2H), 1,82-1,75 (м, 1H), 1,66-1,58 (м, 2H), 1,56-1,47 (м, 2H), 1,36-1,27 (м, 6H), 1,24 (т, J=7,1, 3H), 0,51-0,45 (м, 2H), 0,43-0,38 (м, 2H).
Пример 429
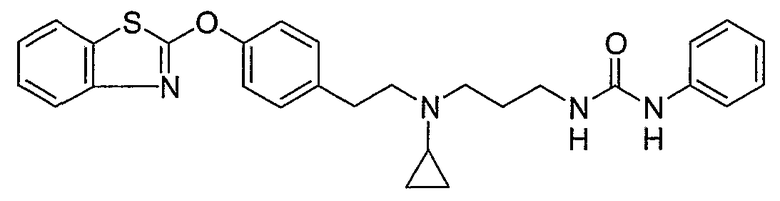
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-3-фенилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 422, с использованием фенилизоцианата. Масс-спектр (ESI): масса, вычисленная для С28Н30N4О2S, 486,21; m/z, найдено 487,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,61 (д, J=8,1, 1H), 7,57 (д, J=8,1, 1H), 7,28 (т, J=8,1, 1H), 7,20-7,09 (м, 10H), 6,89 (т, J=7,3, 1H), 5,64 (шир.с, 1H), 3,16-3,09 (м, 2H), 2,70-2,64 (м, 4H), 2,57 (т, J=7,1, 2H), 1,67-1,60 (м, 1H), 1,60-1,52 (м, 2H), 0,39-0,33 (м, 2H), 0,25-0,20 (м, 2H).
Пример 430
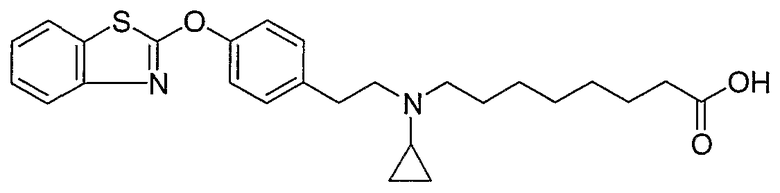
8-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)октановая кислота
Указанное в заголовке соединение получали из соединения примера 428 в соответствии с методикой, описанной в примере 379, стадия В. Масс-спектр (ESI): масса, вычисленная для С26Н32N2О3S, 452,21; m/z, найдено 453,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 12,76 (шир.с, 1H), 7,72 (д, J=7,6, 1H), 7,63 (д, J=7,8, 1H), 7,36 (т, J=7,6, 1H), 7,30-7,21 (м, 5H), 3,01-2,88 (м, 4H), 2,77 (т, J=8,1, 2H), 2,27 (т, J=7,8, 2H), 1,96-1,88 (м, 1H), 1,66-1,54 (м, 4H), 1,38-1,23 (м, 6H), 0,77-0,70 (м, 2H), 0,61-0,54 (м, 2H).
Пример 431

[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]амид тетрагидрофуран-2-карбоновой кислоты
К раствору N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилпропан-1,3-диамина (пример 421, 330 мг, 0,9 ммоль) в СН2Cl2 (18 мл) добавляли 2-тетрагидрофуроевую кислоту (129 мкл, 1,35 ммоль) и Si-карбодиимид (1,05 ммоль/г, 1,71 г, 1,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, фильтровали и концентрировали. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2) и получали твердое вещество белого цвета (267 мг, выход 64%). Масс-спектр (ESI): масса, вычисленная для С26Н31N3О3S; 465,21; m/z найдено 466,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,36 (т, J=8,1, 1H), 7,32 (шир.с, 1H), 7,29-7,21 (м, 5H), 4,32 (дд, J=6,1, 2,3, 1H), 3,93-3,81 (м, 2H), 3,41-3,31 (м, 1H), 3,30-3,21 (м, 1H), 2,90-2,80 (м, 4H), 2,75 (т, J=6,8, 2H), 2,32-2,21 (м, 1H), 2,08-1,97 (м, 1H), 1,92-1,77 (м, 3H), 1,76-1,67 (м, 2H), 0,56-0,49 (м, 2H), 0,48-0,41 (м, 2H).
Пример 432

N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-2-гидроксиацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 431, с использованием гликолевой кислоты. Масс-спектр (ESI): масса, вычисленная для С23Н27N3О3S, 425,18; m/z, найдено 426,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73-7,63 (м, 2H), 7,44 (шир.с, 1H), 7,40-7,33 (м, 1H), 7,29-7,18 (м, 5H), 4,21 (с, 1H), 3,91 (с, 2H), 3,37-3,28 (м, 2H), 2,90-2,82 (м, 4H), 2,75 (т, J=6,1, 2H), 1,85-1,78 (м, 1H), 1,77-1,70 (м, 2H), 0,58-0,38 (м, 4H).
Пример 433

4-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)масляная кислота
А. {2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламин.
К перемешиваемому раствору 2-[4-(2-бромэтокси)фенокси]бензотиазола (пример 9; 1,1 г, 3,14 ммоль) в СН3СN (31 мл) добавляли циклопропиламин (1,09 мл, 15,7 ммоль) и N,N-диизопропилэтиламин (1,1 мл, 6,28 ммоль). Смесь нагревали до 60°С в течение 16 ч, затем охлаждали до комнатной температуры и растворяли в СН2Cl2 (100 мл). Раствор промывали H2O (2×20 мл), сушили и концентрировали. Полученное масло очищали на SiО2 (40 г; 0-15% СН3ОН/СН2Cl2) и получали прозрачное масло (999 мг, выход 98%). Масс-спектр (ESI): масса, вычисленная для С18Н18N2О2S; 326,11; m/z найдено 327,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,59 (д, J=8,1, 1H), 7,33 (т, J=8,1, 1H), 7,27-7,17 (м, 3H), 6,95-6,89 (м, 2H), 4,03 (т, J=5,3, 2H), 3,06 (т, J=5,3, 2H), 2,20-2,14 (м, 1H), 2,02 (шир.с, 1H), 0,47-0,41 (м, 2H), 0,39-0,34 (м, 2H).
В. Этиловый эфир 4-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)масляной кислоты.
К перемешиваемому раствору {2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламина (950 мг, 2,91 ммоль) в СН3СN (29 мл) добавляли этиловый эфир 4-броммасляной кислоты (625 мкл, 4,37 ммоль) и N,N-диизопропилэтиламин (1,0 мл, 5,82 ммоль). Смесь нагревали до 60°С в течение 16 ч, охлаждали до комнатной температуры и растворяли в СН2Cl2 (100 мл). Раствор промывали H2O (2×20 мл), сушили и концентрировали. Полученное масло очищали на SiО2 (40 г; 0-50% EtOAc/гексан) с получением бесцветного масла (1,0 г, выход 78%). Масс-спектр (ESI): масса, вычисленная для С24Н28N2O4S; 440,18; m/z найдено 441,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,61 (д, J=8,1, 1H), 7,34 (т, J=8,1, 1H), 7,28-7,18 (м, 3H), 6,95-6,90 (м, 2H), 4,14-4,04 (м, 4H), 3,00 (т, J=6,3, 2H), 2,71 (т, J=7,1, 2H), 2,31 (т, J=7,1, 2H), 1,90-1,80 (м, 3H), 1,23 (т, J=7,1, 3H), 0,51-0,44 (м, 2H), 0,43-0,38 (м, 2H).
С. 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)масляная кислота.
К раствору этилового эфира 4-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)масляной кислоты (970 мг, 2,2 ммоль) в смеси ТГФ/СН3ОН, 3:1, (80 мл) добавляли гидроксид лития (211 мг, 8,8 ммоль) в воде (20 мл). Раствор перемешивали при комнатной температуре в течение 16 ч. и затем рН доводили до 7 добавлением 1н. водной HCl. Смесь экстрагировали СН2Cl2 (2×100 мл). Объединенную органическую фазу концентрировали при пониженном давлении. Полученное масло очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2) и получали твердое вещество белого цвета (877 мг, выход 97%). Масс-спектр (ESI): масса, вычисленная для С22Н24N2О4S; 412,15; m/z найдено 413,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 11,44 (шир.с, 1H), 7,68 (д, J=8,1, 1H), 7,62 (д, J=8,1, 1H), 7,35 (т, J=8,1, 1H), 7,27-7,20 (м, 3H), 7,01-6,95 (м, 2H), 4,44 (т, J=5,0, 2H), 3,56 (т, J=5,005, 2H), 3,32 (т, J=8,1, 2H), 2,67-2,60 (м, 1H), 2,46 (т, J=6,8, 2H), 2,18-2,09 (м, 2H), 1,32-1,25 (м, 2H), 0,88-0,81 (м, 2H).
Пример 434
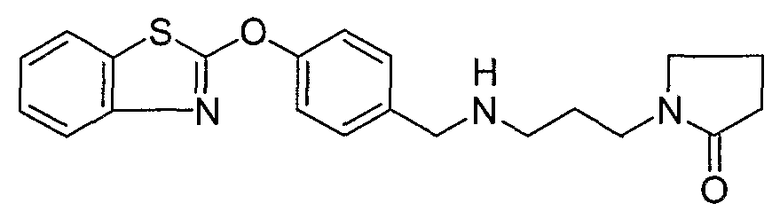
1-{3-[4-(бензотиазол-2-илокси)бензиламино]пропил}пирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 251, стадия В, с использованием 1-(3-аминопропил)пирролидин-2-она. Масс-спектр (ESI): масса, вычисленная для С21Н23N3О2S, 381,15; m/z, найдено 382,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,45-7,41 (м, 2H), 7,36 (т, J=8,1, 1H), 7,32-7,28 (м, 2H), 7,24 (т, J=8,1, 1H), 3,81 (с, 2H), 3,38-3,27 (м, 5H), 3,63 (т, J=6,8, 2H), 3,35 (т, J=7,6, 2H), 2,02-1,93 (м, 2H), 1,82-1,73 (м, 2H).
Пример 435

1-(3-{[4-(бензотиазол-2-илокси)бензил]метиламино}пропил)пирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 409, с использованием формальдегида. Масс-спектр (ESI): масса, вычисленная для С22Н25N3О2S, 395,17; m/z, найдено 396,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,43-7,27 (м, 5H), 7,24 (т, J=8,1, 1H), 3,54 (с, 2H), 3,32 (дд, J=7,1, 7,1, 4H), 2,43 (т, J=7,1, 2H), 2,34 (т, J=7,1, 2H), 2,23 (с, 3H), 2,00-1,91 (м, 2H), 1,80-1,70 (м, 2H).
Пример 436
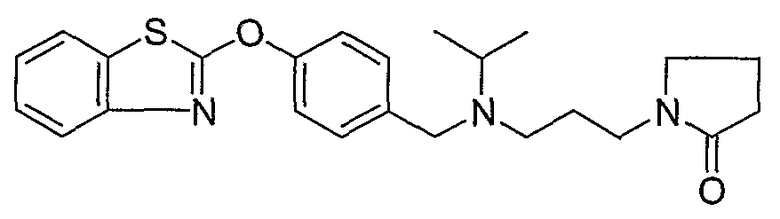
1-(3-{[4-(бензотиазол-2-илокси)бензил]изопропиламино}пропил)пирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 409, с использованием ацетона. Масс-спектр (ESI): масса, вычисленная для С24Н29N3О2S, 423,20; m/z, найдено 424,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,45-7,40 (м, 2H), 7,37 (т, J=7,8, 1H), 7,30-7,21 (м, 3H), 3,55 (с, 2H), 3,29-3,20 (м, 4H), 3,01-2,90 (м, 1H), 2,42 (т, J=7,1, 2H), 2,32 (т, J=7,8, 2H), 1,97-1,83 (м, 2H), 1,63-1,53 (м, 2H), 1,02 (д, J=6,6, 6H).
Пример 437
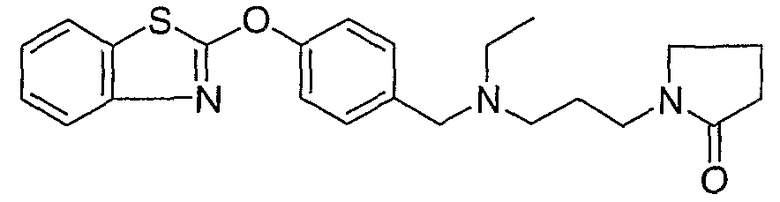
1-(3-{[4-(бензотиазол-2-илокси)бензил]этиламино}пропил)пирролидин-2-он
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 409, с использованием ацетальдегида. Масс-спектр (ESI): масса, вычисленная для С23Н27N3О2S, 409,18; m/z, найдено 410,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,43-7,34 (м, 3H), 7,32-7,23 (м, 3H), 3,56 (с, 2H), 3,30 (дд, J=7,1, 7,1, 4H), 2,53 (дд, J=7,1, 7,1, 2H), 2,45 (т, J=7,1, 2H), 2,34 (т, J=7,8, 2H), 2,00-1,91 (м, 2H), 1,73-1,64 (м, 2H), 1,04 (т, J=7,1, 3H).
Пример 438
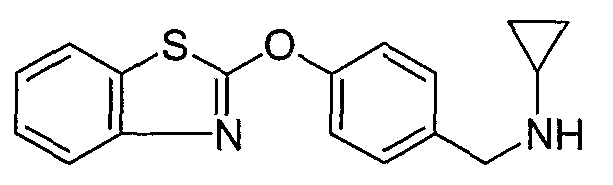
[4-(бензотиазол-2-илокси)бензил]циклопропиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 251, стадия В, с использованием циклопропиламина. Масс-спектр (ESI): масса, вычисленная для С17Н16N2ОS, 296,10; m/z, найдено 297,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,40-7,33 (м, 3H), 7,32-7,27 (м, 2H), 7,24 (т, J=8,1, 1H), 3,85 (с, 2H), 2,19-2,12 (м, 1H), 1,86 (шир.с, 1H), 0,48-0,35 (м, 4H).
Пример 439
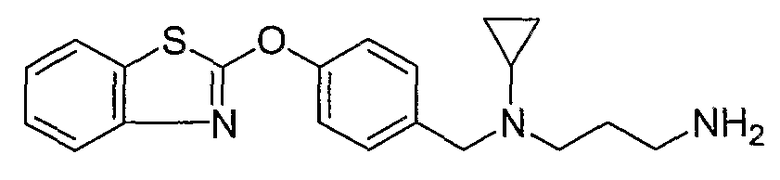
N-1-[4-(бензотиазол-2-илокси)бензил]-N1-циклопропилпропан-1,3-диамин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 421, с использованием соединения примера 438. Масс-спектр (ESI): масса, вычисленная для С20Н23N3ОS, 353,16; m/z, найдено 354,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,41-7,32 (м, 3H), 7,30-7,23 (м, 3H), 3,75 (с, 2H), 2,67 (т, J=7,1, 2H), 2,58 (т, J=7,1, 2H), 1,80-1,73 (м, 1H), 1,72-1,64 (м, 2H), 1,19 (шир.с, 2H), 0,52-0,46 (м, 2H), 0,42-0,36 (м, 2H).
Пример 440

N-[3-({4-(бензотиазол-2-илокси)бензил]циклопропиламино}пропил)изобутирамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 422, с использованием изобутирилхлорида. Масс-спектр (ESI): масса, вычисленная для С24Н29N3О2S, 423,20; m/z, найдено 424,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,40-7,22 (м, 6H), 6,26 (шир.с, 1H), 3,73 (с, 2H), 3,23 (дд, J=6,3, 5,8, 2H), 2,61 (т, J=6,6, 2H), 2,29-2,18 (м, 1H), 1,79-1,68 (м, 3H), 1,09 (д, J=6,8, 6H), 0,54-0,47 (м, 2H), 0,43-0,37 (м, 2H).
Пример 441
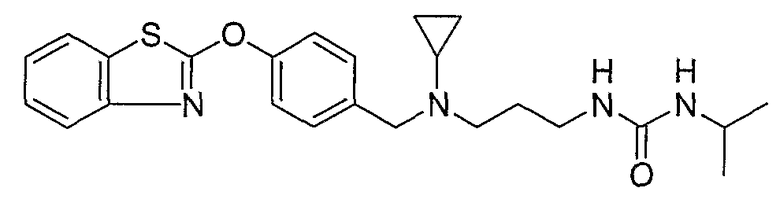
1-(3-{[4-(бензотиазол-2-илокси)бензил]циклопропиламино}пропил)-2-изопропилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 422, с использованием изопропилизоцианата. Масс-спектр (ESI): масса, вычисленная для С24Н30N4О2S, 438,21; m/z, найдено 439,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,69 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,38-7,29 (м, 3H), 7,27-7,20 (м, 3H), 5,44 (шир.с, 1H), 5,15 (д, J=7,8, 1H), 3,87-3,76 (м, 1H), 3,70 (с, 2H), 3,12 (дд, J=6,3, 6,1, 2H), 2,56 (т, J=7,1, 2H), 1,76-1,67 (м, 3H), 1,07 (д, J=6,3, 6H), 0,49-0,42 (м, 2H), 0,40-0,34 (м, 2H).
Пример 442

1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-3-изопропилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием изопропилизоцианата. Масс-спектр (ESI): масса, вычисленная для С23Н28N4О2S, 424,19; m/z, найдено 425,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,67 (д, J=8,1, 1H), 7,41-7,35 (м, 3H), 7,32-7,24 (м, 3H), 4,77 (дд, J=8,1, 7,8, 1H), 3,88-3,78 (м, 1H), 3,66-3,55 (м, 1H), 3,51 (с, 2H), 2,82 (д, J=11,6, 2H), 2,13 (т, J=10,9, 2H), 1,94 (д, J=11,9, 2H), 1,69 (шир.с, 1H), 1,48-1,36 (м, 2H), 1,14 (д, J=6,6, 6H).
Пример 443
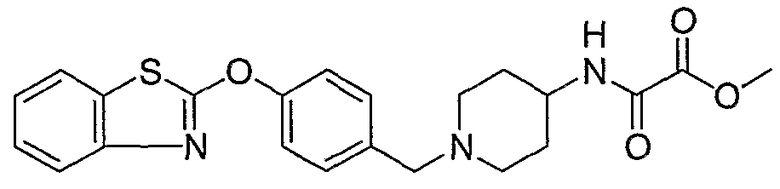
Метиловый эфир N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}оксаламовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием метилового эфира хлороксоуксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С22Н23N3О4S, 425,14; m/z, найдено 426,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,78 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,55-7,50 (м, 2H), 7,44-7,36 (м, 3H), 7,31 (т, J=8,1, 1H), 3,84 (с, 2H), 3,81-3,72 (м, 1H), 3,41 (с, 3H), 3,11 (д, J=10,9, 2H), 2,59-2,47 (м, 2H), 2,00-1,91 (м, 2H), 1,79-1,66 (м, 2H).
Пример 444
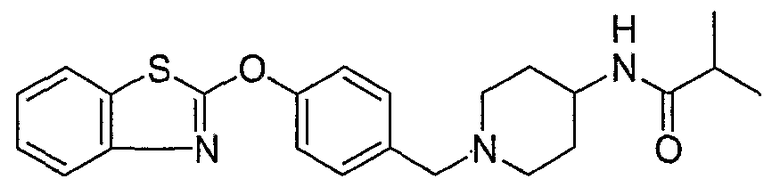
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}изобутирамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, с использованием изобутирилхлорида. Масс-спектр (ESI): масса, вычисленная для С23Н27N3О2S, 409,18; m/z, найдено 410,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,84 (д, J=8,6, 2H), 7,69 (т, J=7,8, 2H), 7,44 (д, J=8,6, 2H), 7,41-7,33 (м, 2H), 7,27 (т, J=8,1, 1H), 4,33 (с, 2H), 4,16-4,00 (м, 1H), 3,57-3,42 (м, 2H), 3,31-3,16 (м, 2H), 2,58-2,45 (м, 1H), 2,31-2,07 (м, 4H), 1,10 (д, J=6,8, 6H).
Пример 445

{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}амид тетрагидрофуран-2-карбоновой кислоты
Указанное в заголовке соединение получали из соединения примера 253, стадия D, в соответствии с методикой, описанной в примере 431. Масс-спектр (ESI): масса, вычисленная для С24Н27N3О3S, 437,18; m/z, найдено 438,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 11,03 (шир.с, 1H), 7,73 (д, J=7,8, 1H), 7,67 (д, J=7,8, 1H), 7,46-7,42 (м, 2H), 7,41-7,32 (м, 3H), 7,27 (д, J=7,8, 1H), 4,31 (т, J=8,34, 1H), 3,98-3,89 (м, 1H), 3,84 (с, 2H), 3,19 (д, J=11,6, 2H), 2,43 (т, J=10,4, 2H), 2,34-2,21 (м, 2H), 2,08-1,69 (м, 8H).
Пример 446
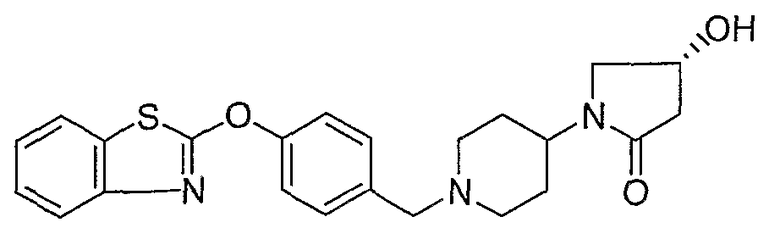
1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-4-гидроксипирролидин-2-он
Указанное в заголовке соединение получали из соединения примера 253, стадия D, в соответствии с методикой, описанной в примере 254, стадия D. Масс-спектр (ESI): масса, вычисленная для С23Н25N3О3S, 423,16; m/z, найдено 424,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,80 (д, J=8,1, 1H), 7,68-7,62 (м, 3H), 7,53-7,49 (м, 2H), 7,42 (т, J=8,1, 1H), 7,32 (т, J=8,3, 1H), 4,44 (т, J=6,3, 1H), 4,38 (с, 2H), 4,25-4,15 (м, 1H), 3,68-3,57 (м, 3H), 3,33-3,13 (м, 3H), 2,71 (дд, J=10,9, 6,3, 1H), 2,28 (т, J=17,7, 1H), 2,13-2,02 (м, 2H), 2,01-1,92 (м, 2H).
Пример 447

1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-4-гидроксипирролидин-2-он
Указанное в заголовке соединение получали из соединения примера 253, стадия D, в соответствии с методикой, описанной в примере 254, стадия D. Масс-спектр (ESI): масса, вычисленная для С23Н25N3О3S, 423,16; m/z, найдено 424,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,80 (д, J=8,1, 1H), 7,68-7,62 (м, 3H), 7,53-7,49 (м, 2H), 7,42 (т, J=8,1, 1H), 7,32 (т, J=8,3, 1H), 4,44 (т, J=6,3, 1H), 4,38 (с, 2H), 4,25-4,15 (м, 1H), 3,68-3,57 (м, 3H), 3,33-3,13 (м, 3H), 2,71 (дд, J=10,9, 6,3, 1H), 2,28 (т, J=17,7, 1H), 2,13-2,02 (м, 2H), 2,01-1,92 (м, 2H).
Пример 448
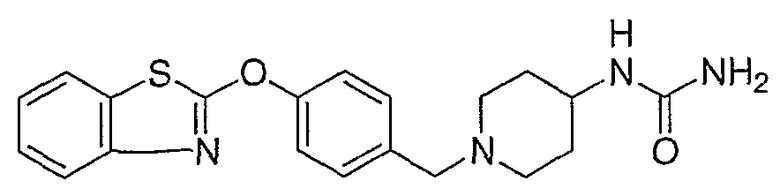
{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}мочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием триметилсилилизоцианата. Масс-спектр (ESI): масса, вычисленная для С20Н22N4О2S, 382,15; m/z, найдено 383,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=7,8, 1H), 7,63 (д, J=7,8, 1H), 7,40-7,33 (м, 3H), 7,30-7,21 (м, 3H), 5,82 (д, J=7,8, 1H), 5,10 (д, J=4,6, 1H), 3,84 (с, 1H), 3,56 (шир.с, 1H), 3,49 (с, 2H), 2,81 (д, J=11,6, 2H), 2,12 (т, J=11,1, 2H), 1,90 (д, J=11,9, 2H), 1,51-1,39 (м, 2H).
Пример 449

N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}оксаламовая кислота
Указанное в заголовке соединение получали из соединения примера 443 в соответствии с методикой, описанной в примере 433, стадия С. Масс-спектр (ESI): масса, вычисленная для С21Н21N3О4S, 411,13; m/z, найдено 412,3 [М+Н]+. 1H ЯМР (400 МГц, CD3OD): 7,78 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,55-7,50 (м, 2H), 7,44-7,36 (м, 3H), 7,31 (т, J=8,1, 1H), 3,84 (с, 2H), 3,81-3,72 (м, 1H), 3,11 (д, J=10,9, 2H), 2,59-2,47 (м, 2H), 2,00-1,91 (м, 2H), 1,79-1,66 (м, 2H).
Пример 450

N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-2-гидроксиацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 431, с использованием гликолевой кислоты. Масс-спектр (ESI): масса, вычисленная для С21Н23N3О3S, 397,15; m/z, найдено 398,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=7,8, 1H), 7,65 (д, J=8,1, 1H), 7,40-7,35 (м, 3H), 7,31-7,23 (м, 3H), 6,83 (д, J=8,1, 1H), 5,33, (шир.с, 1H), 3,99 (с, 2H), 3,87-3,75 (м, 1H), 3,50 (с, 2H), 2,85 (д, J=11,4, 2H), 2,14 (т, J=10,9, 2H), 1,92 (д, J=12,6, 2H), 1,56-1,43 (м, 2H).
Пример 451
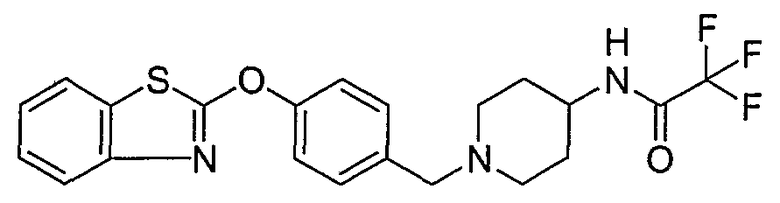
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-2,2,2-трифторацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 431, с использованием трифторуксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С21Н20F3N3O2S, 435,12; m/z, найдено 436,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,3, 2H), 7,54 (д, J=8,6, 2H), 7,47 (д, J=8,8, 2H), 7,41 (т, J=8,3, 1H), 7,34-7,28 (м, 1H), 4,24 (с, 2H), 4,15-4,02 (м, 1H), 3,59 (д, J=12,1, 2H), 3,40, (шир.с, 1H), 2,87 (т, J=11,9, 2H), 2,22-2,02 (м, 4H).
Пример 452
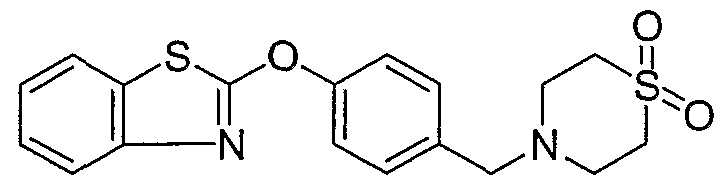
2-[4-(1,1-диоксо-1|6-тиоморфолин-4-илметил)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 251, с использованием тиоморфолин-1,1-диоксида. Масс-спектр (ESI): масса, вычисленная для С18Н18N3O3S2, 374,08; m/z, найдено 375,2 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,67 (д, J=8,1, 1H), 7,42-7,31 (м, 5H), 7,27 (т, J=7,8, 1H), 3,66 (с, 2H), 3,03 (д, J=26,3, 8H).
Пример 453
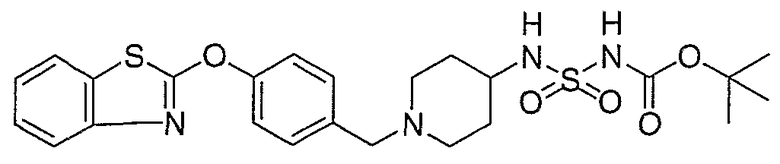
Трет-бутиловый эфир N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-аминосульфонил}карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, с использованием трет-бутилового эфира N-(сульфонилхлорид)карбаминовой кислоты. Масс-спектр (ESI): масса, вычисленная для С24Н30N4O5S2, 518,17; m/z, найдено 519,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,2, 1H), 7,67 (д, J=8,2, 1H), 7,42-7,35 (м, 3H), 7,34-7,24 (м, 3H), 5,18 (шир.с, 1H), 3,55 (с, 2H), 3,39-3,29 (м, 1H), 2,83 (д, J=11,7, 2H), 2,31-2,18 (м, 2H), 1,98 (д, J=11,7, 2H), 1,72-1,59 (м, 2H), 1,47 (с, 9H).
Пример 454
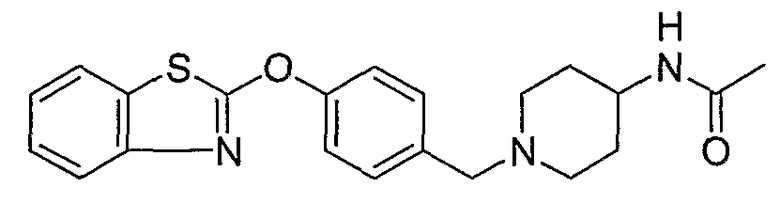
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}ацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием ацетилхлорида. Масс-спектр (ESI): масса, вычисленная для С21Н23N3O2S, 381,15; m/z, найдено 382,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=7,8, 1H), 7,67 (д, J=8,1, 1H), 7,43-7,36 (м, 3H), 7,33-7,24 (м, 3H), 5,65 (шир.с, 1H), 3,87-3,76 (м, 1H), 3,54 (с, 2H), 2,86 (д, J=12,1, 2H), 2,17 (т, J=11,4, 2H), 1,97(8, 3H), 1,93 (д, J=11,9, 2H), 1,56-1,44 (м, 2H).
Пример 455
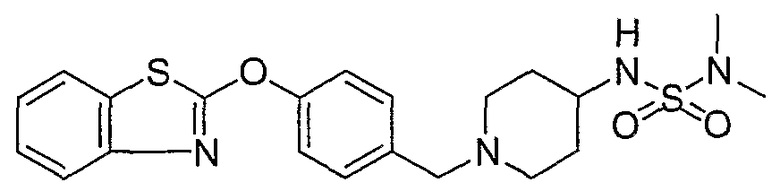
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-N,N-диметилсульфамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием N,N-диметилсульфамоилхлорида. Масс-спектр (ESI): масса, вычисленная для С21Н26N4O3S2, 446,14; m/z, найдено 447,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,41-7,35 (м, 3H), 7,32-7,23 (м, 3H), 4,37 (д, J=7,8, 1H), 3,49 (с, 2H), 3,28-3,17 (м, 1H), 2,81 (д, J=10,9, 2H), 2,78 (с, 6H), 2,11 (т, J=11,1, 2H), 1,98 (д, J=10,9, 2H), 1,61-1,50 (м, 2H).
Пример 456
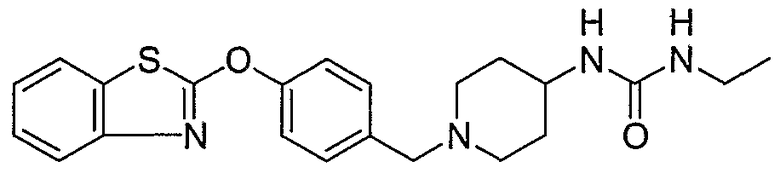
1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-3-этилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием этилизоцианата. Масс-спектр (ESI): масса, вычисленная для С22Н26N4O2S, 410,18; m/z, найдено 411,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,42-7,34 (м, 3H), 7,32-7,23 (м, 3H), 4,54 (шир.с, 1H), 4,45 (д, J=7,6, 1H), 3,67-3,55 (м, 1H), 3,50 (с, 2H), 3,23-3,14 (м, 2H), 2,80 (д, J=11,9, 2H), 2,13 (т, J=11,4, 2H), 1,93 (д, J=12,6, 2H), 1,48-1,36 (м, 2H), 1,12 (т, J=7,3, 3H).
Пример 457
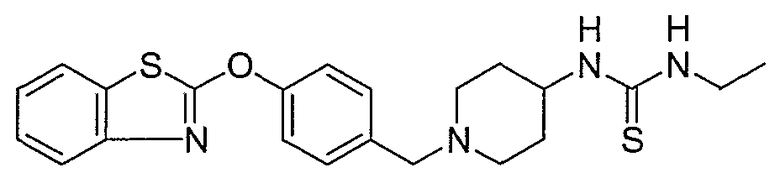
1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-3-этилтиомочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием этилизотиоцианата. Масс-спектр (ESI): масса, вычисленная для С22Н26N4OS2, 426,15; m/z, найдено 427,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=7,8, 1H), 7,67 (д, J=8,1, 1H), 7,41-7,34 (м, 3H), 7,32-7,24 (м, 3H), 6,03 (шир.с, 1H), 5,74 (шир.с, 1H), 4,20-4,00 (м, 1H), 3,51 (с, 2H), 3,47-3,35 (м, 2H), 2,82 (д, J=11,6, 2H), 2,05 (т, J=11,1, 2H), 2,05 (д, J=11,9, 2H), 1,57-1,45 (м, 2H), 1,21 (т, J=7,3, 3H).
Пример 458

{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}амид пропан-1-сульфоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием 1-пропансульфонилхлорида. Масс-спектр (ESI): масса, вычисленная для С22Н27N3O3S2, 445,15; m/z, найдено 446,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,40-7,34 (м, 3H), 7,32-7,22 (м, 3H), 4,85 (д, J=8,1, 1H), 3,48 (с, 2H), 3,36-3,24 (м, 1H), 3,02-2,94 (м, 2H), 2,81 (д, J=11,9, 2H), 2,11 (т, J=10,6, 2H), 1,95 (д, J=12,6, 2H), 1,89-1,78 (м, 2H), 1,65-1,54 (м, 2H), 1,04 (т, J=7,3, 3H).
Пример 459

{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}амид пропан-2-сульфоновой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием 2-пропансульфонилхлорида. Масс-спектр (ESI): масса, вычисленная для С22Н27N3O3S2, 445,15; m/z, найдено 446,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,41-7,35 (м, 3H), 7,32-7,24 (м, 3H), 3,79 (д, J=5,6, 1H), 3,51 (с, 2H), 3,38-3,27 (м, 1H), 2,89-2,78 (м, 2H), 2,19-1,94 (м, 5H), 1,76 (д, J=30,8, 6H), 1,69-1,55 (м, 2H).
Пример 460
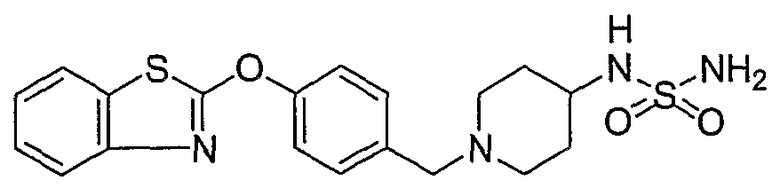
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}сульфамид
Указанное в заголовке соединение получали из соединения примера 453 в соответствии с методикой, описанной в примере 253, стадия В. Масс-спектр (ESI): масса, вычисленная для С19Н22N4О3S2, 418,11; m/z, найдено 419,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 10,68 (шир.с, 1H), 7,60 (д, J=8,3, 1H), 7,56 (д, J=8,3, 1H), 7,48-7,38 (м, 2H), 7,32-7,24 (м, 3H), 7,18 (т, J=7,8, 1H), 6,24 (шир.с, 2H), 4,10 (с, 2H), 3,80-3,66 (м, 1H), 3,57-3,10 (м, 2H), 3,04-2,61 (м, 2H), 2,41-1,61 (м, 4H).
Пример 461

N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}формамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 431, с использованием муравьиной кислоты. Масс-спектр (ESI): масса, вычисленная для С20Н21N3O2S, 367,14; m/z, найдено 368,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 12,28 (шир.с, 1H), 7,73 (д, J=7,8, 1H), 7,68 (д, J=7,8, 1H), 7,47-7,24 (м, 6H), 6,33 (д, J=7,3, 1H), 4,05-3,94 (м, 1H), 3,80 (с, 2H), 3,14 (д, J=11,6, 2H), 2,41 (т, J=11,9, 2H), 1,99 (д, J=13,1,2H), 1,83-1,70 (м, 2H).
Пример 462

Этиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием этилхлорформиата. Масс-спектр (ESI): масса, вычисленная для С22Н25N3O3S, 411,16; m/z, найдено 412,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,41-7,34 (м, 3H), 7,32-7,22 (м, 3H), 4,62 (шир.с, 1H), 4,10 (дд, J=7,3, 6,8, 2H), 3,59-3,51 (м, 1H), 3,49 (с, 2H), 2,80 (д, J=11,6, 2H), 2,12 (т, J=11,6, 2H), 1,93 (д, J=12,1, 2H), 1,51-1,39 (м, 2H), 1,23 (т, J=7,1,3H).
Пример 463
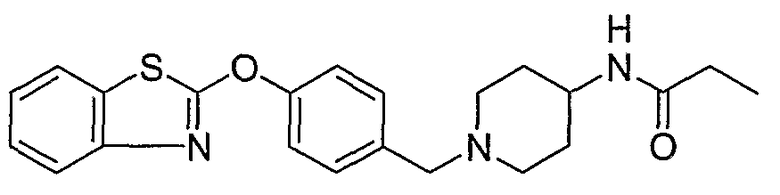
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}пропионамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием пропионилхлорида. Масс-спектр (ESI): масса, вычисленная для С22Н25N3O2S, 395,17; m/z, найдено 396,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,41-7,34 (м, 3H), 7,32-7,22 (м, 3H), 5,61 (д, J=8,1, 1H), 3,87-3,76 (м, 1H), 3,49 (с, 2H), 2,82 (д, J=11,9, 2H), 2,22-2,07 (м, 4H), 1,90 (д, J=13,1, 2H), 1,51-1,39 (м, 2H), 1,14 (т, J=7,6, 3H).
Пример 464

N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}бутирамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием бутирилхлорида. Масс-спектр (ESI): масса, вычисленная для С23Н27N3O2S, 409,18; m/z, найдено 410,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,40-7,35 (м, 3H), 7,31-7,23 (м, 3H), 5,64 (д, J=8,1, 1H), 3,87-3,77 (м, 1H), 3,49 (с, 2H), 2,81 (д, J=11,6, 2H), 2,16-2,07 (м, 4H), 1,91 (д, J=12,9, 2H), 1,71-1,60 (м, 2H), 1,51-1,39 (м, 2H), 0,93 (т, J=7,3, 3H).
Пример 465

1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-3-пропилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием пропилизоцианата. Масс-спектр (ESI): масса, вычисленная для С23Н28N4O2S, 424,19; m/z, найдено 425,5 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,70 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,39-7,33 (м, 3H), 7,28-7,21 (м, 3H), 5,54 (шир.с, 1H), 5,37 (д, J=8,1, 1H), 3,66-3,56 (м, 1H), 3,48 (с, 2H), 3,11 (дд, J=7,1, 6,8, 2H), 2,80 (д, J=11,1, 2H), 2,11 (т, J=11,1, 2H), 1,91 (д, J=11,1, 2H), 1,54-1,38 (м, 4H), 0,91 (т, J=7,3, 3H).
Пример 466

Пропиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием пропилхлорформиата. Масс-спектр (ESI): масса, вычисленная для С23Н27N3O3S, 425,18; m/z, найдено 426,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,39-7,33 (м, 3H), 7,31-7,21 (м, 3H), 4,83 (д, J=7,6, 1H), 4,00 (т, J=6,6, 2H), 3,58-3,49 (м, 1H), 3,47 (с, 2H), 2,79 (д, J=11,6, 2H), 2,10 (т, J=10,9, 2H), 1,91 (д, J=11,1, 2H), 1,67-1,56 (м, 2H), 1,52-1,40 (м, 2H), 0,92 (т, J=7,6, 3H).
Пример 467

1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-3-метилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием метилизоцианата. Масс-спектр (ESI): масса, вычисленная для С21Н24N4O2S, 396,16; m/z, найдено 397,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,45-7,34 (м, 3H), 7,33-7,22 (м, 3H), 5,71 (шир.с, 2H), 3,69-3,59 (м, 1H), 3,56 (с, 2H), 2,87 (д, J=11,9, 2H), 2,73 (д, J=4,8, 3H), 2,21 (т, J=10,1, 2H), 1,93 (д, J=10,4, 2H), 1,58-1,45 (м, 2H).
Пример 469
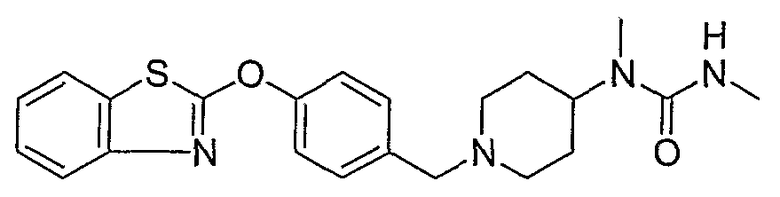
1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-1,3-диметилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 255, стадия С, с использованием метилизоцианата. Масс-спектр (ESI): масса, вычисленная для С22Н26N4O2S, 410,18; m/z, найдено 411,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,41-7,34 (м, 3H), 7,31-7,22 (м, 3H), 4,63 (дд, J=4,6, 4,6, 1H), 4,21-4,11 (м, 1H), 3,49 (с, 2H), 2,93 (д, J=11,9, 2H), 2,79 (д, J=4,8, 3H), 2,71 (с, 3H), 2,08 (т, J=11,9, 2H), 1,76-1,64 (м, 2H), 1,63-1,54 (м, 2H).
Пример 470

1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-1-метилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 255, стадия С, с использованием триметилсилилизоцианата. Масс-спектр (ESI): масса, вычисленная для С21Н24N4O2S, 396,16; m/z, найдено 397,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,42-7,34 (м, 3H), 7,32-7,21 (м, 3H), 4,93 (с, 2H), 4,16-4,03 (м, 1H), 3,50 (с, 2H), 2,94 (д, J=11,4, 2H), 2,76 (с, 3H), 2,09 (т, J=11,4, 2H), 1,79-1,66 (м, 2H), 1,65-1,56 (м, 2H).
Пример 471
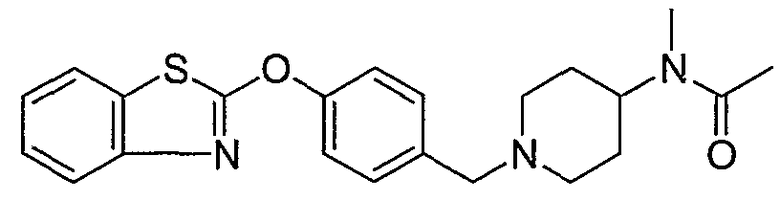
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-N-метилацетамид
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 255, стадия С, с использованием ацетилхлорида. Масс-спектр (ESI): масса, вычисленная для С22Н25N3O2S, 395,17; m/z, найдено 396,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,65 (д, J=8,1, 1H), 7,41-7,34 (м, 3H), 7,31-7,22 (м, 3H), 4,55-4,44 (м, 1H), 3,49 (с, 2H), 3,01-2,90 (м, 2H), 2,84 (с, 3H), 2,15-2,09 (м, 2H), 2,07 (с, 3H), 1,77-1,65 (м, 2H), 1,64-1,53 (м, 2H).
Пример 472
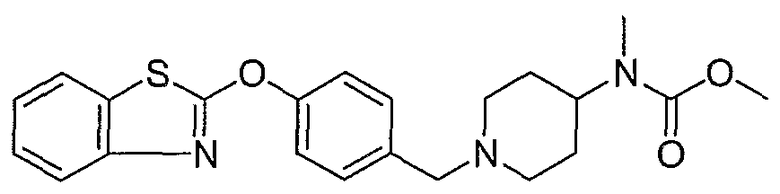
Метиловый эфир {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}метилкарбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 255, стадия С, с использованием метилхлорформиата. Масс-спектр (ESI): масса, вычисленная для С21Н25N3O3S, 411,16; m/z, найдено 412,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,42-7,35 (м, 3H), 7,33-7,24 (м, 3H), 4,16-3,96 (м, 1H), 3,69 (с, 3H), 3,51 (с, 2H), 2,95 (д, J=11,4, 2H), 2,78 (с, 3H), 2,08 (т, J=10,9, 2H), 1,82-1,69 (м, 2H), 1,65-1,57 (м, 2H).
Пример 473

Метиловый эфир N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-N-метилоксаламовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 255, стадия С, с использованием метилового эфира хлороксоуксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С23Н25N3O4S, 439,16; m/z, найдено 440,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,73 (д, J=8,1, 1H), 7,66 (д, J=8,1, 1H), 7,41-7,34 (м, 3H), 7,33-7,23 (м, 3H), 4,41-4,32 (м, 1H), 3,87 (с, 3H), 3,51 (с, 2H), 2,97 (д, J=11,9, 2H), 2,88 (с, 3H), 2,13 (т, J=11,9, 2H), 1,95-1,83 (м, 2H), 1,72-1,62 (м, 2H).
Пример 474

N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-N-метилоксаламовая кислота
Указанное в заголовке соединение получали из соединения примера 473 в соответствии с методикой, описанной в примере 433, стадия С. Масс-спектр (ESI): масса, вычисленная для С22Н23N3О4S, 425,14; m/z, найдено 426,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,68 (д, J=8,1, 1H), 7,59 (д, J=8,1, 1H), 7,37-7,28 (м, 3H), 7,27-7,16 (м, 3H), 4,27-4,16 (м, 1H), 3,43 (с, 2H), 2,93 (д, J=11,897, 2H), 2,75 (с, 3H), 2,01 (т, J=11,9, 2H), 1,82-1,65 (м, 2H), 1,58-1,47 (м, 2H).
Пример 475
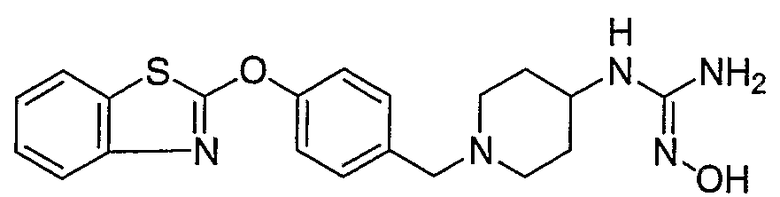
N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-N'-гидроксигуанидин
А. 1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илцианамид.
К суспензии 1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-иламина (339 мг, 1,0 ммоль) в СН3ОН (2,0 мл) добавляли ацетат натрия (180 мг, 2,2 ммоль) при комнатной температуре. Суспензия превращалась в прозрачный раствор. Затем раствор охлаждали до 0°С. По каплям добавляли бромциан (159 мг, 1,5 ммоль) в СН3ОН (0,7 мл). Реакционную смесь перемешивали при 5°С в течение 2 ч и затем при комнатной температуре в течение ночи. Смесь фильтровали через воронку с фриттой, фильтрат абсорбировали на силикагеле (40 г) и очищали (0-10% СН3ОН/СН2Cl2) с получением нестабильного масла (123 мг, выход 34%). Масс-спектр (ESI): масса, вычисленная для С20Н20N2ОS; 364,14; m/z найдено 365,3 [М+Н]+.
В. N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-N'-гидроксигуанидин.
К раствору 1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-илцианамида (123 мг, 0,34 ммоль) в ДМФА (2 мл) небольшими порциями добавляли гидрохлорид гидроксиламина (41,5 мг, 0,60 ммоль) и затем карбонат натрия (119 мг, 1,12 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и распределяли между EtOAc (20 мл) и H2O (20 мл). Органическую фазу промывали насыщенным раствором соли, сушили и концентрировали при пониженном давлении с получением неочищенного продукта в виде светлого твердого вещества. Неочищенный продукт очищали на SiО2 (12 г; 0-10% СН3ОН/СН2Cl2) с получением твердого вещества белого цвета (117 мг, выход 86%). Масс-спектр (ESI): масса, вычисленная для С20Н23N5O4S; 397,16; m/z найдено 398,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,38-7,32 (м, 3H), 7,28-7,21 (м, 3H), 4,69 (шир.с, 2H), 3,46 (с, 2H), 3,27-3,16 (м, 1H), 2,78 (д, J=10,9, 2H), 2,04 (т, J=11,1, 2H), 1,92 (д, J=11,1, 2H), 1,51-1,38 (м, 2H).
Пример 476
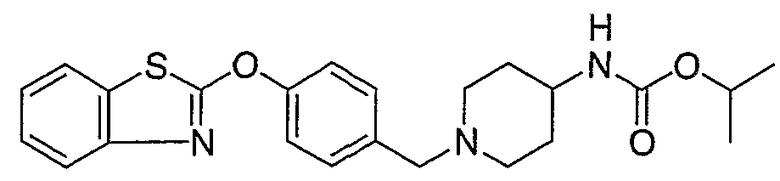
Изопропиловый эфир N-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}карбаминовой кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием изопропилизоцианата. Масс-спектр (ESI): масса, вычисленная для С23Н27N3O3S, 425,18; m/z, найдено 426,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,63 (д, J=8,1, 1H), 7,38-7,33 (м, 3H), 7,31-7,21 (м, 3H), 4,95-4,85 (м, 1H), 4,75 (д, J=7,1, 1H), 3,58-3,49 (м, 1H), 3,47 (с, 2H), 2,79 (д, J=11,6, 2H), 2,09 (т, J=11,4, 2H), 1,91 (д, J=11,9, 2H), 1,50-1,39 (м, 2H), 1,21 (д, J=6,5, 6H).
Пример 477

3-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-1,1-диметилмочевина
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием N,N-диметилкарбамоилхлорида. Масс-спектр (ESI): масса, вычисленная для С22Н26N4O2S, 410,18; m/z, найдено 411,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,71 (д, J=8,1, 1H), 7,64 (д, J=8,1, 1H), 7,39-7,33 (м, 3H), 7,30-7,21 (м, 3H), 4,41 (д, J=7,8, 1H), 3,73-3,62 (м, 1H), 3,48 (с, 2H), 2,87 (с, 6H), 2,81 (д, J=11,6, 2H), 2,11 (т, J=11,9, 2H), 1,93 (д, J=11,6, 2H), 1,50-1,38 (м, 2H).
Пример 478
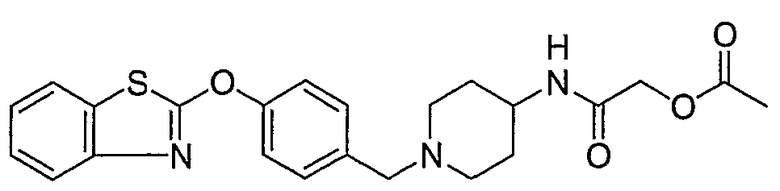
{1-[4-(Бензотиазол-2-илокси)бензил]пиперидин-4-илкарбамоил}метиловый эфир уксусной кислоты
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием хлоркарбонилметилового эфира уксусной кислоты. Масс-спектр (ESI): масса, вычисленная для С23Н25N3O4S, 439,16; m/z, найдено 440,4 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=7,8, 1H), 7,65 (д, J=8,1, 1H), 7,40-7,35 (м, 3H), 7,32-7,23 (м, 3H), 6,11 (д, J=8,3, 1H), 4,53, (с, 2H), 3,93-3,82 (м, 1H), 3,50 (с, 2H), 2,83 (д, J=11,9, 2H), 2,15 (с, 3H), 2,14 (т, J=11,9, 2H), 1,93 (д, J=12,1,2H), 1,56-1,45 (м, 2H).
Пример 479
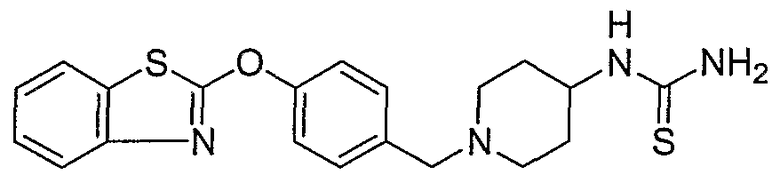
{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}тиомочевина
А. 1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-3-бензоилтиомочевина.
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 253, стадия С, с использованием бензоилизоцианата. Масс-спектр (ESI): масса, вычисленная для С27Н26N4O2S2, 502,15; m/z, найдено 503,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 10,80 (д, J=8,1, 1H), 9,06 (с, 1H), 7,81 (д, J=8,3, 2H), 7,72 (д, J=8,3, 1H), 7,65 (д, J=7,8, 1H), 7,59 (т, J=7,6, 1H), 7,50-7,45 (м, 2H), 7,42-7,34 (м, 3H), 7,33-7,22 (м, 3H), 4,40-4,29 (м, 1H), 3,53 (с, 2H), 2,80 (д, J=11,1, 2H), 2,26 (т, J=10,1, 2H), 2,12 (д, J=11,9, 2H), 1,76-1,64 (м, 2H).
В. {1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}тиомочевина.
К 1-{1-[4-(бензотиазол-2-илокси)бензил]пиперидин-4-ил}-3-бензоилтиомочевине (300 мг, 0,60 ммоль) добавляли 10% водный гидроксид натрия (10 мл). Реакционную смесь кипятили с обратным холодильником в течение 1 ч. Полученную белую суспензию охлаждали до комнатной температуры и экстрагировали 10% СН3ОН/СН2Cl2 (3×50 мл). Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта в виде не совсем белого твердого вещества. Неочищенный продукт очищали на SiО2 (40 г; 0-10% СН3ОН/СН2Cl2) с получением указанного в заголовке соединения в виде твердого вещества белого цвета (219 мг, выход 92%). Масс-спектр (ESI): масса, вычисленная для С20Н22N4OS2; 398,12; m/z найдено 399,3 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,72 (д, J=8,1, 1H), 7,68 (д, J=8,1, 1H), 7,42-7,36 (м, 3H), 7,34-7,26 (м, 3H), 6,09 (м, 1H), 4,29-4,02 (м, 1H), 3,57 (с, 2H), 2,88 (д, J=11,1, 2H), 2,29 (с, 2H), 2,20 (т, J=11,1, 2H), 2,04 (д, J=10,1, 2H), 1,60-1,45 (м, 2H).
Пример 480

(1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 37, с использованием пиперидин-4-илметанола. Масс-спектр (ESI): масса, вычисленная для С21Н25N3O3, 367,19; m/z, найдено 368,4 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d 6): 12,24 (с, 1H), 7,32 (с, 2H), 7,27 (д, J=8,9, 2H), 7,08 (с, 2H), 7,00 (д, J=8,9, 2H), 4,41 (с, 1H), 4,09 (с, 2H), 3,24 (с, 2H), 2,92 (д, J=11,1, 2H), 2,68 (с, 2H), 1,98 (т, J=11,6, 2H), 1,62 (д, J=11,6, 2H), 1,24 (шир.с, 1H), 1,11 (д, J=9,2, 2H).
Пример 481

2-[4-(2-морфолин-4-илэтокси)фенокси]бензооксазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 11, с использованием 4-(2-хлорэтил)морфолина. Масс-спектр (ESI): масса, вычисленная для С19Н20N2O4, 340,14; m/z, найдено 341,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,51 (д, J=7,1, 1H), 7,42 (д, J=7,2, 1H), 7,36-7,30 (м, 2H), 7,29-7,20 (м, 2H), 7,03-6,95 (м, 2H), 4,14 (т, J=5,7, 2H), 3,80-3,72 (м, 4H), 2,83 (т, J=5,7, 2H), 2,60 (т, J=4,6, 4H).
Пример 482

2-[4-(2-морфолин-4-илэтокси)фенокси]бензотиазол
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 12, с использованием 4-(2-хлорэтил)морфолина и 2-хлорбензотиазола. Масс-спектр (ESI): масса, вычисленная для С19Н20N2O3S, 356,24; m/z, найдено 341,1 [М+Н]+. 1H 6,12 ЯМР (400 МГц, CDCl3): 7,74 (д, J=7,6, 1H), 7,66 (д, J=7,3, 1H), 7,39 (т, J=7,3, 1H), 7,31-7,20 (м, 3H), 7,00-6,93 (м, 2H), 4,14 (т, J=5,7, 2H), 3,80-3,72 (м, 4H), 2,83 (т, J=5,7, 2H), 2,60 (т, J=4,6, 4H).
Пример 483
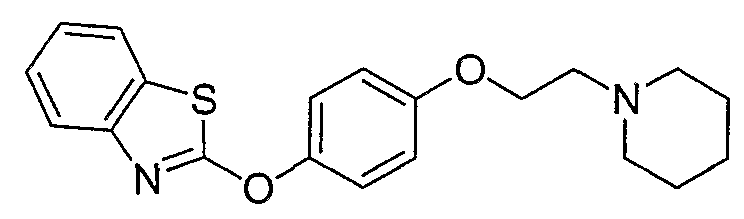
2-[4-(2-пиперидин-1-илэтокси)фенокси]бензотиазол.
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 12, с использованием 4-(2-хлорэтил)пиперидина и 2-хлорбензотиазола. Масс-спектр (ESI): масса, вычисленная для С20Н22N2O2S, 354,14; m/z, найдено 355,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,74 (д, J=8,1, 1H), 7,65 (д, J=8,0, 1H), 7,39 (т, J=7,3, 1H), 7,30-7,22 (м, 3H), 7,00-6,92 (м, 2H), 4,13 (т, J=6,0, 2H), 2,81 (т, J=6,0, 2H), 2,58-2,48 (шир.с, 4H), 1,68-1,58 (м, 4H), 1,52-1,42 (м, 2H).
Пример 484
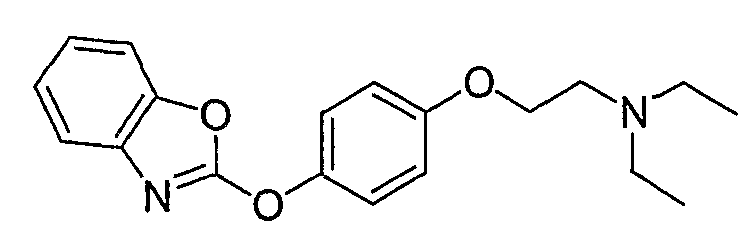
{2-[4-(бензооксазол-2-илокси)фенокси]этил}диэтиламин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 11, с использованием (2-хлорэтил)диэтиламина. Масс-спектр (ESI): масса, вычисленная для С19Н22N2O3, 326,16; m/z, найдено 327,1 [М+Н]+. 1H ЯМР (400 МГц, CDCl3): 7,51 (д, J=7,6, 1H), 7,42 (д, J=7,2, 1H), 7,36-7,29 (м, 2H), 7,28-7,19 (м, 2H), 7,02-6,94 (м, 2H), 4,07 (т, J=6,3, 2H), 2,90 (т, J=6,3, 2H), 2,65 (кв, J=7,2, 4H), 1,09(т, J=7,1, 6H).
Методы проведения анализов
Ниже проиллюстрированы результаты анализа, которые были проведены для оценки соединений настоящего изобретения.
Анализ рекомбинантной человеческой LТА4-гидролазы на активность ингибитора LТА4-гидролазы
Соединения настоящего изобретения тестировали на их ингибирующую активность, направленную против рекомбинантной человеческой LТА4-гидролазы (rhLTA4H). Получали векторы и использовали для экспрессии rhLTA4H, в основном, следующим образом: ДНК, кодирующую LТА4-гидролазу, амплифицировали с помощью полимеразной цепной реакции (ПЦР), где в качестве матрицы использовали библиотеку кДНК человеческой плаценты. Олигонуклеотидные праймеры для ПЦР-реакции конструировали на основе 5'-конца и комплемента 3'-конца известной нуклеотидной последовательности, кодирующей область человеческого гена LТА4-гидролазы (C.D. Funk et al., Proc. Natl. Acad. Sci., USA, 1987, 84:6677-6681). Амплифицированный 1,9 т.п.н. ДНК-фрагмент, кодирующий LТА4-гидролазу, выделяли и клонировали в вектор pFastBac1 (Invitrogen). Рекомбинантный бакуловирус генерировали в соответствии с инструкциями производителя и использовали для инфицирования клеток Spodoptera frugipedra (Sf-9). Рекомбинантный фермент LТА4-гидролазу выделяли из инфицированных клеток Sf-9, в основном, как описано J.K. Gierse et al. (Protein Expression and Purification 1993, 4:358-366). Очищенный раствор фермента корректировали таким образом, чтобы он содержал 0,29 мг/мл LТА4-гидролазы, 50 мМ трис (рН 8,0), 150 мМ NаСl, 5 мМ дитиотреитола, 50% глицерина и коктейль полного набора ингибиторов протеазы, не содержащий EDTA (Roche). Удельная активность фермента составляла примерно 3,8 мкмоль/мин/мг.
Субстрат LТА4 получали из метилового эфира LТА4 (Cayman Chemical) путем обработки 67 эквивалентами NаОН в атмосфере азота при комнатной температуре в течение 40 минут. Субстрат LТА4 в форме свободной кислоты замораживали при -80°С и хранили до использования. Каждое соединение разводили до различных концентраций в аналитическом буфере (0,1М фосфат калия (рН 7,4), 5 мг/мл ВSA, без жирной кислоты), содержащем 10% ДМСО. 25 мкл аликвоту каждого разведения соединения инкубировали в течение 10 минут при комнатной температуре с равным объемом аналитического буфера, содержащего 36 нг рекомбинантного человеческого LТА4Н. Затем раствор доводили до 200 мкл аналитическим буфером. LТА4 (свободную кислоту) оттаивали, разводили в аналитическом буфере до концентрации 357 нг/мл и затем добавляли 25 мкл (9 нг) субстрата LТА4 к реакционной смеси (общий объем=225 мкл) на время 0. Каждую реакцию проводили при комнатной температуре в течение 10 минут. Реакцию прекращали путем разведения 10 мкл реакционной смеси 200 микролитрами аналитического буфера. LTА4 количественно оценивали в разведенном образце с помощью коммерчески доступного твердофазного иммуноферментного анализа (Cayman Chemical Co.) в соответствии с рекомендациями производителя. Каждый эксперимент проводили в соответствии с рутинными процедурами, с использованием положительного контроля, который анализировали в идентичных условиях, но без добавления соединения-ингибитора, и отрицательного контроля, содержащего все компоненты анализа, за исключением фермента. Величины IC50 определяли с помощью кривой активности при различных концентрациях соединения, построенной по 4-парметрическому уравнению с использованием компьютерной программы Grafit (Erithacus).
Очевидно, что величины IC50, представленные в нижеследующих таблицах, должны быть в пределах типичного трехмерного многообразия анализов такого типа. Представленные ниже величины, в основном, представляют собой среднее значение для 1-3 измерений.
Продуцирование LТB4 в стимулированной ионофором кальция мышиной крови для оценки ингибирующей активности LТА4Н
Мышей CD-1 умерщвляли и кровь собирали в гепаринсодержащие шприцы путем сердечной пункции. Полученную кровь разводили 1:15 средой RPMI 1640 и 200 мкл аликвоты разведенной крови добавляли в лунки 96-луночного микротитрационного планшета. Тестируемые соединения-ингибиторы LТА4Н получали в различных концентрациях в среде RPMI 1640, содержащей 1% ДМСО, и 20 мкл каждого тест-раствора добавляли в лунку, содержащую разведенную цельную кровь (конечная концентрация ДМСО 0,1%). Содержимое микротитрационного планшета инкубировали в течение 15 минут при 37оС в инкубаторе с повышенной влажностью и затем в каждую лунку с образцами добавляли кальциевый ионофор А23187 ((Sigma Chemical Co., St. Louis, MO) (конечная концентрация=20 нг/мл). Инкубирование продолжали в тех же условиях еще 10 минут для образования LТВ4. Реакцию прекращали путем центрифугирования (833×g, 10 минут при 4°С) и супернатанты анализировали на LТВ4 с использованием коммерчески доступного набора для твердофазного иммуноферментного анализа (Cayman Chemical Co.) в соответствии с инструкциями производителя. Каждый эксперимент проводили в соответствии с рутинными процедурами с использованием положительного контроля, который анализировали в идентичных условиях, но без добавления соединения-ингибитора, и отрицательного контроля, содержащего все компоненты анализа, за исключением фермента. Величины IC50 определяли с помощью кривой активности при различных концентрациях соединения, построенной по 4-парметрическому уравнению с использованием компьютерной программы Grafit (Erithacus).
Мышиная модель воспаления, индуцированного арахидоновой кислотой
Соединения-ингибиторы LТА4Н настоящего изобретения разводили смесью 20% циклодекстрана/H2O в концентрации 3 мг/мл. Полученные растворы через желудочный зонд вводили самкам мышей Balb/с массой примерно 20 граммов каждая (0,2 мл/мышь, 30 мг LТА4Н-ингибирующего соединения на кг массы тела). Через 60 минут после введения LТА4-ингибитора каждую мышь обрабатывали путем нанесения 20 мкл арахидоновой кислоты (100 мг/мл в ацетоне) на левое ухо и 20 мкл одного ацетона на правое ухо. Через 3 часа мышей умерщвляли, кровь собирали в гепаринизированные шприцы и из уха брали биопсию 8 мм. Биоптаты уха взвешивали для определения уровня отека, затем замораживали при -80°С и хранили до проведения анализа на приток нейтрофилов.
100 мкл аликвоты гепаринизированной крови добавляли в лунки микротитрационного планшета вместе с равными объемами среды RPMI 1640 и в каждую лунку с образцом добавляли кальциевый ионофор А23187 (конечная концентрация=20 нг/мл). Содержимое микротитрационного планшета инкубировали в течение 10 минут при 37оС. Реакцию прекращали путем центрифугирования (833×g, 10 минут при 4°С). Супернатанты анализировали на LТВ4 с использованием коммерчески доступного набора для твердофазного иммуноферментного анализа (Cayman Chemical Co.) в соответствии с инструкциями производителя. Процент ингибирования ex vivo стимулированного продуцирования LТВ4 (% инг. LТВ4) определяли по сравнению с животными, обработанными аналогичным способом, за исключением того, что раствор, вводимый через желудочный зонд, не содержал соединения-ингибитора.
Приток нейтрофилов оценивали путем измерения активности миелопероксидазы (МРО), нейтрофил-специфического фермента. Ушные биоптаты гомогенизировали в 0,5 мл буфера для экстракции (0,3М сахарозы, 0,22% (масс/об) гексадецилтриметилбромида аммония (СТАВ) и 2,5 мМ цитрата, полученного из 0,5М маточного раствора цитрата (рН 5,0)). Дебрис удаляли путем центрифугирования при 14000×g в течение 10 минут. 10 мкл аликвоты полученного супернатанта добавляли в лунки микротитрационного планшета вместе с 90 мкл аликвотами буфера для разведения (10 мМ цитрат, 0,22% СТАВ) и затем добавляли 20 мкл жидкой субстратной системы ТМВ (Sigma Chemical Co.) Содержимое микротитрационного планшета выдерживали при комнатной температуре в течение 1 часа. Реакцию прекращали путем добавления 100 мкл 1М Н2SO4 в каждую лунку с образцом и миелопероксидазную активность в каждом образце определяли, исходя из оптической плотности при 405 нм. Для каждого животного фоновое значение, полученное для правого уха, обработанного лишь одним ацетоном, вычитали из значения, полученного для левого уха, обработанного арахидоновой кислотой. Процент ингибирования притока нейтрофилов (% инг. МРО) соединениями настоящего изобретения определяли по сравнению с процентом ингибирования, полученного для животных, обработанных аналогичным образом, за исключением того, что этим животным через желудочный зонд был введен раствор, который не содержал соединения-ингибитора.
Хотя в описании настоящего изобретения проиллюстрированы отдельные детали его осуществления, однако, специалистам в данной области будет очевидно, что настоящее изобретение может иметь бесчисленное множество вариантов, применений, модификаций и дополнений, которые могут быть внесены в соответствии с основными принципами настоящего изобретения, и которые не должны отходить от существа и объема изобретения. При этом следует отметить, что представленное выше описание изобретения приводится лишь в иллюстративных целях и не ограничивается конкретной формой или порядком изложения частей раскрытых и показанных в данном описании.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, БЕНЗОТИАЗОЛА И БЕНЗОКСАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ LTA4H | 2004 |
|
RU2359970C2 |
| БЕНЗОИМИДАЗОЛЫ КАК ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ | 2009 |
|
RU2531354C2 |
| ИНГИБИТОРЫ ГЛИКОЛАТОКСИДАЗЫ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2805308C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ПРИМЕНЕНИЯ | 2009 |
|
RU2525116C2 |
| НОВЫЕ КОНДЕНСИРОВАННЫЕ ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ ТИРОЗИНКИНАЗНОЙ АКТИВНОСТИ | 2011 |
|
RU2585177C2 |
| ИНГИБИТОРЫ БРОМДОМЕНА | 2012 |
|
RU2671571C1 |
| ИНГИБИТОРЫ БРОМДОМЕНА | 2012 |
|
RU2647592C2 |
| ХИНАЗОЛИНОНЫ КАК ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ | 2010 |
|
RU2528412C2 |
| 2,5-ДИЗАМЕЩЕННЫЕ 3-МЕРКАПТОПЕНТАНОВЫЕ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2365583C2 |
| АЗААДАМАНТАНОВЫЕ ПРОИЗВОДНЫЕ И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2450002C2 |
Изобретение относится к ингибиторам лейкотриен А4-гидролазы (LTA4H) формулы (II) их энантиомерам, рацематам и фармацевтически приемлемым солям, а также фармацевтической композиции на их основе и способу лечения, предупреждения или подавления воспаления и других состояний, опосредованных активностью лейкотриен А4-гидролазы. В общей формуле (II)

Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3; Y представляет собой О; Z выбран из группы, состоящей из О и связи; W выбран из группы, состоящей из СН2 и CHR1-CH2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-CH2 не связана непосредственно с атомом азота, с которым связан указанный W; R4 выбран из группы, состоящей из Н, ОСН3 и Cl; R6 представляет собой Н или F; и R2' и R3', каждый независимо, выбран из группы, состоящей из: А) Н, С1-7алкила, С3-7циклоалкила, С3-7циклоалкил-С1-7алкила, где каждый из заместителей (А) независимо замещен 0 или 1 RQ, где каждый из указанных RQ является заместителем у атома углерода, который представляет собой по меньшей мере один атом углерода, удаленный от атома азота; В) заместителя HetRa; С) -С1-7алкил-С(O)Rx; Н) -С0-4алкил-Ar5, где Ar5 представляет собой 5-членный гетероарил, который имеет один гетероатом, выбранный из группы >NRY, и 0 или 1 дополнительный гетероатом -N=, и необязательно содержит две карбонильные группы, и необязательно бензоконденсирован; I) -С0-4алкил-Ar5', где Ar5' представляет собой 5-членный гетероарил, который содержит 3 или 4 атома азота; М) SO2C1-4алкила; альтернативно, R2' и R3', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, которым является указанный присоединенный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из i) 4-7-членного гетероциклического кольца HetRb, где указанное 4-7-членное гетероциклическое кольцо HetRb имеет один гетероатом, который представляет собой указанный связанный атом азота, и замещено 0, 1 или 2 одинаковыми или различными заместителями, где указанные заместители выбраны из группы, состоящей из -RY, -CN, -С(O)RY -С0-4алкил-CO2RY, -С0-4алкил-С(O)CO2RY, -С0-4алкил-ORY-, -С0-4алкил-С(O)NRYRz-, -С0-4алкил-NRYC(О)RZ-, -С(O)NRZORY -C0-4алкил-NRYCO2RY, -С0-4алкил-NRYC(O)NRYRY, -C0-4алкил-NRYC(S)NRYRZ, -NRYC(O)CO2RY, -C0-4aлкил-NRWSO2RY, 1,3-дигидробензоимидазол-2-он-1-ила, 1-RY-1Н-тетразол-5-ила, RY-триазолила, 2-RY-2Н-тетразол-5-ила, -С0-4алкил-С(O)N(RY)(SO2RY), -C0-4aлкил-N(RY)(SO2)NRYRY, -С0-4алкил-N(RY)(SO2)NRYCO2RY, галогена,  ,
,  и
и  ; ii) 5-7-членного гетероциклического кольца HetRc, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота по меньшей мере одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=O)2 и >NRM, где указанное 5-7-членное гетероциклическое кольцо HetRC имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -C(O)RY и RZ; iii) одного из 1Н-тетразол-1-ила, где 1H-тетразол-1-ил замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-CO2RY; и iv) одного из бензимидазол-1-ила, 2,8-диазаспиро[4.5]декан-1-он-8-ила, 4-{ [(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил} пиперидин-1-ила, 4-{[(2-аминоциклобутанкарбонил)амино]метил} пиперидин-1-ила, 9-ил-трет-бутилового эфира 3,9-диазаспиро[5.5]ундекан-3-карбоновой кислоты, 4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дек-8-ила, и где заместитель HetRa представляет собой 6-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения по меньшей мере 1 дополнительным атомом углерода; RK выбран из группы, состоящей из Н и -С1-4алкила; RL выбран из группы, состоящей из -CO2RS; RS представляет собой водород; RM выбран из группы, состоящей из RZ, -C(O)RY; RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, ОН, NH2, CN, CF3, СН3 и NO2; RQ выбран из группы, состоящей из -CN, -С0-4алкил-ORY, С0-4алкил-CO2RY, -С0-4алкил-NRYRY, -С0-4алкил-NRYCORY, -C0-4алкил-NRYCONRYRZ, -C0-4алкил-NRYSO2RY; RW выбран из группы, состоящей из RY; RX выбран из группы, состоящей из -ORY, -NRYRZ, -С1-4алкила и -С0-4алкил-RAr; RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1 или 2 заместителями RN; RZ выбран из группы, состоящей из RY, -C1-2aлкил-CO2RY; RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен по меньшей мере 0, 1 или 2 RN или 0 или 1 RL; RAr' представляет собой 5-6-членное кольцо, которое имеет 1 или 2 гетероатома, выбранных из группы, состоящей из О, S, N и >NRY, и имеет 0 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RK; Описаны ингибиторы лейкотриен А4-гидролазы (LTA4H) формулы (II), композиции, содержащие эти ингибиторы, и их применение для ингибирования активности фермента LTA4H, а также для лечения, предупреждения или ослабления воспаления и/или состояний, ассоциированных с таким воспалением. В указанной формуле (I): Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3; Y выбран из группы, состоящей из СН2 и О; W выбран из группы, состоящей из СН2 и CHR1-CH2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-CH2 не связана непосредственно с атомом азота; R4 выбран из группы, состоящей из Н, ОСН3, Cl, F, Br, ОН, NH2, CN, CF3 и СН3; R6 представляет собой Н или F; и R2 и R3 каждый независимо выбран из различных групп. 6 н. и 37 з.п. ф-лы, 9 табл.
; ii) 5-7-членного гетероциклического кольца HetRc, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота по меньшей мере одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=O)2 и >NRM, где указанное 5-7-членное гетероциклическое кольцо HetRC имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -C(O)RY и RZ; iii) одного из 1Н-тетразол-1-ила, где 1H-тетразол-1-ил замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-CO2RY; и iv) одного из бензимидазол-1-ила, 2,8-диазаспиро[4.5]декан-1-он-8-ила, 4-{ [(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил} пиперидин-1-ила, 4-{[(2-аминоциклобутанкарбонил)амино]метил} пиперидин-1-ила, 9-ил-трет-бутилового эфира 3,9-диазаспиро[5.5]ундекан-3-карбоновой кислоты, 4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дек-8-ила, и где заместитель HetRa представляет собой 6-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения по меньшей мере 1 дополнительным атомом углерода; RK выбран из группы, состоящей из Н и -С1-4алкила; RL выбран из группы, состоящей из -CO2RS; RS представляет собой водород; RM выбран из группы, состоящей из RZ, -C(O)RY; RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, ОН, NH2, CN, CF3, СН3 и NO2; RQ выбран из группы, состоящей из -CN, -С0-4алкил-ORY, С0-4алкил-CO2RY, -С0-4алкил-NRYRY, -С0-4алкил-NRYCORY, -C0-4алкил-NRYCONRYRZ, -C0-4алкил-NRYSO2RY; RW выбран из группы, состоящей из RY; RX выбран из группы, состоящей из -ORY, -NRYRZ, -С1-4алкила и -С0-4алкил-RAr; RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1 или 2 заместителями RN; RZ выбран из группы, состоящей из RY, -C1-2aлкил-CO2RY; RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен по меньшей мере 0, 1 или 2 RN или 0 или 1 RL; RAr' представляет собой 5-6-членное кольцо, которое имеет 1 или 2 гетероатома, выбранных из группы, состоящей из О, S, N и >NRY, и имеет 0 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RK; Описаны ингибиторы лейкотриен А4-гидролазы (LTA4H) формулы (II), композиции, содержащие эти ингибиторы, и их применение для ингибирования активности фермента LTA4H, а также для лечения, предупреждения или ослабления воспаления и/или состояний, ассоциированных с таким воспалением. В указанной формуле (I): Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3; Y выбран из группы, состоящей из СН2 и О; W выбран из группы, состоящей из СН2 и CHR1-CH2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-CH2 не связана непосредственно с атомом азота; R4 выбран из группы, состоящей из Н, ОСН3, Cl, F, Br, ОН, NH2, CN, CF3 и СН3; R6 представляет собой Н или F; и R2 и R3 каждый независимо выбран из различных групп. 6 н. и 37 з.п. ф-лы, 9 табл.
1. Способ лечения или предупреждения LTA4H-опосредованного состояния у субъекта, предусматривающий введение субъекту терапевтически эффективного количества по меньшей мере одного модулятора LTA4H, выбранного из соединений формулы (II)
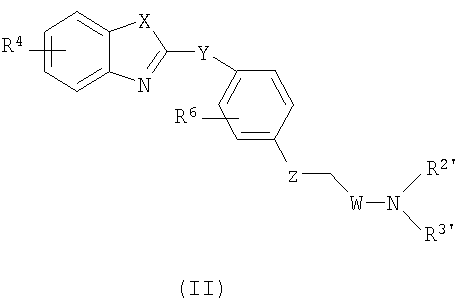
или их энантиомеров, рацематов или их фармацевтически приемлемых солей
где Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3;
Y представляет собой О;
Z выбран из группы, состоящей из О и связи;
W выбран из группы, состоящей из СН2 и CHR1-CH2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-CH2 не связана непосредственно с атомом азота, с которым связан указанный W;
R4 выбран из группы, состоящей из Н, ОСН3 и Cl;
R6 представляет собой Н или F; и
R2' и R3', каждый независимо, выбран из группы, состоящей из:
A) Н, С1-7алкила, С3-7циклоалкила, С3-7циклоалкил-С1-7алкила, где каждый из заместителей (А) независимо замещен 0 или 1 RQ, где каждый из указанных RQ является заместителем у атома углерода, который представляет собой по меньшей мере один атом углерода, удаленный от атома азота;
B) заместителя HetRa;
C) -С1-7алкил-С(O)Rx;
Н) -С0-4алкил-Ar5, где Ar5 представляет собой 5-членный гетероарил, который имеет один гетероатом, выбранный из группы >NRY, и 0 или 1 дополнительный гетероатом -N=, и необязательно содержит две карбонильные группы, и необязательно бензоконденсирован;
I) -С0-4алкил-Ar5', где Ar5' представляет собой 5-членный гетероарил, который содержит 3 или 4 атома азота;
М) SO2C1-4алкила;
альтернативно, R2' и R3', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, которым является указанный присоединенный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из
i) 4-7-членного гетероциклического кольца HetRb, где указанное 4-7-членное гетероциклическое кольцо HetRb имеет один гетероатом, который представляет собой указанный связанный атом азота, и замещено 0, 1 или 2 одинаковыми или различными заместителями, где указанные заместители выбраны из группы, состоящей из -RY, -CN, -C(O)RY, -С0-4алкил-CO2RY,
-С0-4алкил-С(O)CO2RY -С0-4алкил-ORY, -С0-4алкил-С(O)NRYRz-,
-С0-4алкил-NRYC(О)RZ-, -С(O)NRZORY,
-С0-4алкил-NRYCO2RY,
-С0-4алкил-NRYC(О)NRYRY, -C0-4алкил-NRYC(S)NRYRZ -NRYC(O)CO2RY,
-С0-4алкил-NRWSO2RY,
1,3-дигидробензоимидазол-2-он-1-ила,
1-RY-1H-тетразол-5-ила, RY-триазолила, 2-RY-2Н-тетразол-5-ила,
-C0-4алкил-C(O)N(RY)(SO2RY), -C0-4алкил-N(RY)(SO2)NRYRY,
-С0-4алкил-N(RY)(SO2)NRYCO2RY, галогена,  ,
,  и
и 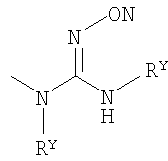 ;
;
ii) 5-7-членного гетероциклического кольца HetRc, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота по меньшей мере одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=O)2 и >NRM, где указанное 5-7-членное гетероциклическое кольцо HetRC имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -С(O)RY и RZ;
iii) одного из 1H-тетразол-1-ила, где 1H-тетразол-1-ил замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-CO2RY и
iv) одного из бензимидазол-1-ила,
2,8-диазаспиро[4.5]декан-1-он-8-ила,
4-{[(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил} пиперидин-1-ила,
4-{[(2-аминоциклобутанкарбонил)амино]метил}пиперидин-1-ила,
9-ил-трет-бутилового эфира 3,9-диазаспиро[5.5]ундекан-3-карбоновой кислоты,
4-оксо-1-фенил-1,3,8-триазаепиро[4.5]дек-8-ила, и
где заместитель HetRa представляет собой 6-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения по меньшей мере 1 дополнительным атомом углерода;
RK выбран из группы, состоящей из Н и -С1-4алкила;
RL выбран из группы, состоящей из -CO2RS;
RS представляет собой водород;
RM выбран из группы, состоящей из RZ, -C(O)RY;
RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, ОН, NH2, CN, CF3, СН3 и NO2;
RQ выбран из группы, состоящей из -CN, -С0-4алкил-ORY -С0-4алкил-CO2RY, -С0-4алкил-NRYRY, -C0-4алкил-NRYCORY, -C0-4алкил-NRYCONRYRZ, -C0-4алкил-NRYSO2RY;
RW выбран из группы, состоящей из RY;
RX выбран из группы, состоящей из -ORY, -NRYRZ, -С1-4алкила и -С0-4алкил-RAr;
RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1 или 2 заместителями RN;
RZ выбран из группы, состоящей из RY, -С1-2алкил-CO2RY;
RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен по меньшей мере 0,1 или 2 RN или 0 или 1 RL;
RAr' представляет собой 5-6-членное кольцо, которое имеет 1 или 2 гетероатома, выбранных из группы, состоящей из О, S, N и >NRY, и имеет 0 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RK; и
при условии, что
(а) по меньшей мере один из указанных R2' и R3' не является этилом, если имеет место одна из комбинаций (s1), (s2), (s3) и (s4), где каждая из указанных комбинаций определена следующим образом:
(s1): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой S;
(s2): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой NH;
(s3): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой О, и Х представляет собой S;
(s4): R4 представляет собой 5-хлор, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой S;
(b) далее при условии, если Z представляет собой связь, Y представляет собой СН2, W представляет собой CHR1-CH2, R1 представляет собой Н, и один из R2' и R3' представляет собой 1H-имидазол-2-ил, то другой из R2' и R3' выбран из A1), B)-L), где B)-L) определены выше для соединения формулы (II), и Al) состоит из Н, С3-7алкенила, где атом углерода в указанном С3-7алкениле, который связан с атомом азота, имеет только простые связи; С3-7алкинила, где атом углерода в указанном алкиниле, который связан с атомом азота, имеет только простые связи; С3-7циклоалкила, необязательно бензоконденсированного; С5-7циклоалкенила; С3-7циклоалкил-С1-7алкила; -С1-7алкил-С3-7циклоалкила, и
(c) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2' и R3' не является XCG, если другой представляет собой C1-6алкил, где XCG представляет собой группу

где НС16 представляет собой один из Н, C1-6алкила, галоген-С1-6алкила, аллила и C1-6алкоксиметила, и GO представляет собой группу, связанную через атом углерода, которая имеет заместитель =O, образующий амидогруппу с атомом азота, к которому присоединена указанная группа GO.
2. Способ по п.1, где по меньшей мере один модулятор LTA4H выбран из соединений формулы (III) R” c

или их энантиомеров, рацематов или их фармацевтически приемлемых солей, где
Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3;
Y представляет собой О;
Z выбран из группы, состоящей из О и связи;
W выбран из группы, состоящей из СН2 и CHR1-CH2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-CH2 не связана непосредственно с атомом азота, с которым связан указанный W;
R4 выбран из группы, состоящей из Н, ОСН3 и Cl;
R6 представляет собой Н или F; и
R2'' и R3'', каждый независимо, выбран из группы, состоящей из:
A) Н, С1-7алкила, С3-7циклоалкила, С3-7циклоалкил-С1-7алкила, где каждый из заместителей (А) независимо замещен 0 или 1 RQ, где каждый из указанных RQ является заместителем у атома углерода, который представляет собой по меньшей мере один атом углерода, удаленный от атома азота;
B) заместителя HetRa
C) -С1-7алкил-С(O)Rx;
Н) -С0-4алкил-Ar5, где Ar5 представляет собой 5-членный гетероарил, который имеет один гетероатом, выбранный из группы >NRY, и 0 или 1 дополнительный гетероатом -N=, и необязательно содержит две карбонильные группы, и необязательно бензоконденсирован;
I) -С0-4алкил-Ar5', где Ar5' представляет собой 5-членный гетероарил, который содержит 3 или 4 атома азота;
М) SO2C1-4алкила;
альтернативно, R2'' и R3'', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, которым является указанный присоединенный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из
i) 4-7-членного гетероциклического кольца HetRb, где указанное 4-7-членное гетероциклическое кольцо HetRb имеет один гетероатом, который представляет собой указанный связанный атом азота, и замещено 0, 1 или 2 одинаковыми или различными заместителями, где указанные заместители выбраны из группы, состоящей из -RY, -CN, -C(O)RY, -С0-4алкил-CO2RY,
-С0-4алкил-С(O)CO2RY, -С0-4алкил-ORY, -С0-4алкил-С(О)NRYRz-,
-C0-4алкил-NRYC(O)RZ-, -C(O)NRZORY,
-C0-4алкил-NRYCO2RY,
-C0-4алкил-NRYC(O)NRYRY, -C0-4алкил-NRYC(S)NRYRZ, -NRYC(O)CO2RY,
-C0-4алкил-NRWSO2RY,
1,3-дигидробензоимидазол-2-он-1-ила,
1-RY-1H-тетразол-5-ила, RY-триазолила, 2-RY-2H-тeтpaзoл-5-илa,
-C0-4алкил-C(O)N(RY)(SO2RY), -C0-4алкил-N(RY)(SO2)NRYRY,
-С0-4алкил-N(RY)(SO2)NRYCO2RY, галогена,  ,
,  и
и ;
;
ii) 5-7-членного гетероциклического кольца HetRc, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота по меньшей мере одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=O)2 и >NRM, где указанное 5-7-членное гетероциклическое кольцо HetRc имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -С(O)RY и RZ;
iii) одного из 1H-тетразол-1-ила, где 1Н-тетразол-1-ил замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-CO2RY; и
iv) одного из бензимидазол-1-ила,
2,8-диазаспиро[4.5]декан-1-он-8-ила,
4-{[(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил} пиперидин-1-ила,
4-{[(2-аминоциклобутанкарбонил)амино] метил} пиперидин-1-ила,
9-ил-трет-бутилового эфира 3,9-диазаспиро[5.5]ундекан-3-карбоновой кислоты,
4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дек-8-ила, и
где заместитель HetRa представляет собой 6-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения по меньшей мере 1 дополнительным атомом углерода;
RK выбран из группы, состоящей из Н и -С1-4алкила;
RL выбран из группы, состоящей из -CO2RS;
RS представляет собой водород;
RM выбран из группы, состоящей из RZ, -C(O)RY;
RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, ОН, NH2, CN, CF3, СН3 и NO2;
RQ выбран из группы, состоящей из -CN, -С0-4алкил-ORY, -С0-4алкил-CO2RY, -С0-4алкил-NRYRY, -C0-4алкил-NRYCORY, -C0-4алкил-NRYCONRYRZ, -C0-4алкил-NRYSO2RY;
RW выбран из группы, состоящей из RY;
RX выбран из группы, состоящей из -ORY, -NRYRZ, -С1-4алкила и -С0-4алкил-RAr;
RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1 или 2 заместителями RN;
RZ выбран из группы, состоящей из RY, -С1-2алкил-CO2RY;
RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен по меньшей мере 0,1 или 2 RN или 0 или 1 RL;
RAr' представляет собой 5-6-членное кольцо, которое имеет 1 или 2 гетероатома, выбранных из группы, состоящей из О, S, N и >NRY, и имеет 0 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RK; и
при условии, что
(a) указанные R2'' и R3'', далее удовлетворяют одному из следующих условий:
(е1): по меньшей мере один из указанных R2'' и R3'' не является С1-5алкилом, если Z представляет собой О, и Х представляет собой S;
(е2): ни один из R2'' и R3'' не является -С1-4алкил-С(O)RX, где RX представляет собой один из С1-4алкила, ОН, -ОС1-4алкила, -ОС0-4алкил-RAr или -NRYRY, если Y представляет собой О, Z представляет собой связь, и R2'' отличается от R3''; и
(е3) ни один из R2'' и R3'' не является -C1-4алкил-CN, если Y представляет собой О, Z представляет собой связь, и R2'' отличается от R3''; и
(b) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2'' и R3'' не является XCG, если другой представляет собой C1-6алкил, где XCG представляет собой группу

где HC16 представляет собой один из Н, C1-6алкила,
галоген-С1-6алкила, аллила и C1-6алкоксиметила, и GO представляет собой группу, присоединенную посредством атома углерода, которая имеет заместитель =O, образующий амидогруппу с атомом азота, к которому присоединена указанная группа GO.
3. Способ по п.1, где указанный R4 представляет собой Н.
4. Способ по п.1, где указанные R2' и R3', каждый независимо, выбран из группы, состоящей из А), В), С) и I), как определено в п.1.
5. Способ по п.1, где указанные R2' и R3', взятые вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.1.
6. Способ по п.1, где указанным LTA4H-опосредованным состоянием является воспаление, ассоциированное по меньшей мере с одним заболеванием, таким как астма, хроническая обструктивная болезнь легких, атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника и псориаз.
7. Способ по п.1 или 2, где указанным по меньшей мере одним модулятором LTA4H является одно из следующих соединений:
2-[4-(2-пиперидин-1-илэтокси)фенокси]бензооксазол;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил }пиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}дибутиламин;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-2-ил)метанол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-бензилпиперидин-4-ол;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенил]пропил} циклогексилэтиламин;
1-{3-[4-(бензооксазол-2-илокси)фенил]пропил} пиперидин-4-ол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]-2-гидроксипропил}-4-фенилпиперидин-4-ол;
этиловый эфир 1-[2-(4-бензооксазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
2-[4-(2-пирролидин-1-илэтокси)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенокси]пропил}диметиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}диметиламин;
2-[4-(2-азепан-1-илэтокси)фенокси]бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклогексилэтиламин;
2- {4-[2-(2-этилпиперидин-1-ил)этокси]фенокси} бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-карбонитрил;
1-(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ил)этанон;
2-{4-[2-(4-метилпиперидин-1-ил)этокси]фенокси} бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-хлор-3-трифторметилфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклогексилметиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклопропилметилпропиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}бутилэтиламин;
2-({2-[4-(бензооксазол-2-илокси)фенокси]этил}бензиламино)этанол;
2-{4-[2-(4-бензилпиперидин-1-ил)этокси]фенокси}бензооксазол;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-3-ил)метанол;
2-({2-[4-(бензооксазол-2-илокси)фенокси]этил}пропиламино)этанол;
2-[4-(2-азетидин-1-илэтокси)фенокси]бензооксазол;
N-(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)-2-фенилацетамид;
этиловый эфир 1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-3-карбоновой кислоты;
2-{4-[3-(4-фенилпиперидин-1-ил)пропокси]фенокси}бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенил]этил}циклогексилэтиламин;
2-[4-(2-пирролидин-1-илэтил)фенокси]бензооксазол;
2-[4-(2-азепан-1-илэтил)фенокси]бензооксазол;
{2-[4-(бензооксазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
{2-[4-(бензооксазол-2-илокси)фенил]этил}дибутилэтиламин;
1-{2-[4-(бензооксазол-2-илокси)фенил]этил}пиперидин-4-ол;
метиловый эфир 1-{2-[4-(бензооксазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
1-{3-[4-(бензооксазол-2-илокси)фенил]пропил}-4-фенилпиперидин-4-ол;
2-[4-(3-пирролидин-1-илпропил)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенил]пропил}дибутиламин;
{3-[4-(бензооксазол-2-илокси)фенил]пропил}циклопропилметилпропиламин;
1-[4-(бензооксазол-2-илокси)фенокси]-3-пирролидин-1-илпропан-2-ол;
1-[2-(4-бензооксазол-2-илметилфенокси)этил]-4-фенилпиперидин-4-ол;
амид 1-[2-(4-бензооксазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
2-[4-(2-морфолин-4-илэтокси)фенокси)бензооксазол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}диэтиламин;
{2-[4-(6-хлорбензотиазол-2-илокси)фенокси]этил}диэтиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ол;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-1-илметанон;
этиловый эфир 3-[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амино]пропионовой кислоты;
амид 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-он;
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-2-он;
8-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-2,8-диазаспиро[4.5]декан-1-он;
2-[4-(3-пирролидин-1-илпропокси)фенокси)бензотиазол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклогексилэтиламин;
амид 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил} пиперидин-3-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-метил-1,3-дигидробензоимидазол-2-он;
метиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-(4-метилпиперазин-1-ил)метанон;
метиловый эфир 1-[2-(4-бензотиазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)пропионовая кислота;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}диметиламин;
2-[4-(2-пирролидин-1-илэтокси)фенокси]бензотиазол;
{3-[4-(бензотиазол-2-илокси)фенокси]пропил}диметиламин;
2-[4-(2-азепан-1-илэтокси)фенокси]бензотиазол;
2-[4-(2-азепан-1-илэтокси)фенокси]-6-метоксибензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}циклогексилэтиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}дибутиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-хлор-3-трифторметилфенил)пиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидин;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-2-фенилацетамид;
2-(4-{2-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]этокси}-фенокси)бензотиазол;
2-(4-{2-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]этил}фенокси)бензотиазол;
1-{3-[4-(бензотиазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-ол;
2-[4-(2-пирролидин-1-илэтил)фенокси]бензотиазол;
2-[4-(2-азепан-1-илэтил)фенокси]бензотиазол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}дибутиламин;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ол;
амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил }пиперидин-3-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)уксусной кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-1,3-дигидроиндол-2-он;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)пирролидин-2-он;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-2-фенилацетамид;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-2,8-диазаспиро[4.5]декан-1-он;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ол;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
1'-{2-[4-(бензотиазол-2-илокси)фенил]этил}-[1,4'] бипиперидин;
2-{4-[2-(4-метилпиперазин-1-ил)этил]фенокси}бензотиазол;
2-(4-{2-[4-(1-бензил-1Н-тетразол-5-ил)пиперидин-1-ил]этокси}фенокси)бензотиазол;
трет-бутиловый эфир 4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил} пиперидин-4-карбонил)пиперазин-1-карбоновой кислоты;
амид 1-[2-(4-{бензотиазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
1-{1-[2-(4-бензотиазол-2-илметилфенокси)этил]пиперидин-4-ил}пирролидин-2-он;
1-[4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)пиперазин-1-ил]этанон;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновая кислота;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-тион;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)этанол;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)-1-пирролидин-1-илэтанон;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)-1-морфолин-4-илэтанон;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновая кислота;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-2-карбоновая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ил)уксусная кислота;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)уксусной кислоты;
трет-бутиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил }пиперидин-4-ил)карбаминовой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)уксусная кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ил)метанол;
метиловый эфир ({2-[4-(бензотиазол-2-илокси)фенил]этил}циклогексиламино)уксусной кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-1-ил)уксусная кислота;
этиловый эфир 1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-5-оксопирролидин-2-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-5-оксопирролидин-2-карбоновая кислота;
4-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)фенол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-хлор-N-циклопропилбензолсульфонамид;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропилметиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}изопропиламино)пропионовая кислота;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-иламин;
3-[{2-[4-(бензотиазол-2-илокси)фенокси]этил}-(1-метилпиперидин-4-ил)амино]пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}бензиламино)пропионовая кислота;
3-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенокси]этил}амино)пропионовая кислота;
трет-бутиловый эфир 4-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1H-тетразол-5-ил)пиперидин-1-карбоновой кислоты;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропионовая кислота;
3-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)пропионовая кислота;
3-[{2-[4-(бензотиазол-2-илокси)фенил]этил}(1-метилпиперидин-4-ил)амино]пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}-изопропиламино)пропионовая кислота;
2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-1-пирролидин-1-илэтанон;
(R)-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновая кислота;
1-(1-[2-(4-бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-1,3-дигидробензоимидазол-2-он;
2-(4-{2-[4-(6-метилпиридин-2-ил]пиперазин-1-ил]этил}фенокси)бензотиазол;
2-{4-[2-(4-этансульфонилпиперазин-1-ил]этил]фенокси}бензотиазол;
2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-1-морфолин-4-илэтанон;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}метиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопентиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклобутиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}бензиламино)пропионовая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-(4-гидроксиметилпиперидин-1-ил)метанон;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламин;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-[4-(2-гидроксиэтил)пиперазин-1-ил]метанон;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-[4-(2-гидроксиэтил)пиперидин-1-ил]метанон;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)этанол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-1-ол;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)масляная кислота;
3-[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амино]пропионовая кислота;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)бутиронитрил;
3-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)пропионовая кислота;
[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)метиламино]уксусная кислота;
3-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)фенол;
2-(4-{2-[4-(4-метоксифенил)пиперазин-1-ил]этокси}фенокси)бензотиазол;
2-{4-[2-(5-пиперидин-4-илтетразол-1-ил)этокси]фенокси}бензотиазол;
(S)-1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламин;
этиловый эфир 2-[({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)метил]циклопропанкарбоновой кислоты;
этиловый эфир 4-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-карбонил)бензойной кислоты;
2-[({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)метил]циклопропанкарбоновая кислота;
1-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-2-ол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-1,1,1-трифторпропан-2-ол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропионамид;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-1,2-диол;
2-{4-[2-(5-фенилтетразол-2-ил)этокси]фенокси}бензотиазол;
2-{4-[2-(5-фенилтетразол-1-ил)этокси]фенокси}бензотиазол;
N-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N-циклопропил-2-(2Н-тетразол-5-ил)ацетамид;
(S)-3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропан-1-ол;
(R)-3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропан-1-ол;
2-{4-[2-(5-метилсульфанилтетразол-2-ил)этокси]фенокси}бензотиазол;
2-{4-[2-(5-метилсульфанилтетразол-1-ил)этокси]фенокси}бензотиазол;
2-[4-(2-тетразол-2-илэтокси)фенокси]бензотиазол;
2-[4-(2-тетразол-1-илэтокси)фенокси]бензотиазол;
(1R,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанкарбоновая кислота;
(1S,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанкарбоновая кислота;
(1R,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанол;
(1S,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанол;
4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)масляная кислота;
(R)-1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-2-ил)метанол;
этиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1Н-тетразол-5-ил)уксусной кислоты;
этиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1Н-тетразол-5-ил)уксусной кислоты;
гидрохлорид 2-{4-[2-(5-пиперидин-4-илтетразол-2-ил)этокси]фенокси}бензотиазола;
7-{2-[4-(бензотиазол-2-илокси)фенокси]этил]-4-спиро[3-фталид]пиперидин;
этиловый эфир 1-{3-[4-(бензотиазол-2-илокси)фенил]пропил}пиперидин-4-карбоновой кислоты;
гидрохлорид 2-[4-(бензотиазол-2-илокси)фенил]этиламина;
2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этокси]фенокси)бензотиазол;
трифторметансульфонатная соль цис-4-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанкарбоновой кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амид пропан-2-сульфоновой кислоты;
метиловый эфир (4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)оксоуксусной кислоты;
трифторметансульфонатная соль N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)бензолсульфонамида;
трифторметансульфонатная соль N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)метансульфонамида;
трифторметансульфонатная соль (4-{2-[4-(бензотиазол-2-илокси)фенил]этил }пиперазин-1-ил)оксоуксусной кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)морфолин-4-илметанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-тиофен-2-илэтанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пиридин-3-илметанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)циклопропилметанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-метоксиэтанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2,2,2-трифторэтанон;
4-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-карбонил)бензойная кислота;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пиридин-4-илметанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(5-метилпиразин-2-ил)метанон;
(R)-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(S)-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-3-ил)метанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-гидроксиэтанон;
2-[2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-оксоэтил]циклопентанон;
трифторметансульфонатная соль 3-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пропионовой кислоты;
3-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)оксазолидин-2-он;
4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)морфолин-3-он;
4-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)морфолин-3-он;
3-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)оксазолидин-2-он;
бензилоксиамид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)уксусная кислота;
(R)-1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
гидроксиамид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(S)-1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
трет-бутиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-илкарбаминовой кислоты;
2-{4-[2-(4-фторпиперидин-1-ил)этил]фенокси}бензотиазол;
2-{4-[2-(4,4-дифторпиперидин-1-ил)этил]фенокси}бензотиазол;
(R)-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пирролидин-3-ол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)формамид;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)мочевина;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-фенилизомочевина;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-метилизомочевина;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метансульфонамид;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-метилгуанидин;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-1,3,8-триазаспиро[4.5]декан-2,4-дион;
трет-бутиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метилкарбаминовой кислоты;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-метилацетамид;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-метилметансульфонамид;
метиловый эфир [(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метилкарбамоил] уксусной кислоты;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-ацетамид;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-илкарбамоил)метиловый эфир уксусной кислоты;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}метиламино)-3-(1Н-имидазол-2-ил)пропионовая кислота;
2-(4-{2-[4-(3-нитропиридин-2-ил)-[1,4]диазепан-1-ил]этил}фенокси)бензотиазол;
этиловый эфир [(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)метиламино]уксусной кислоты;
этиловый эфир 1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4'] бипиперидинил-4-карбоновой кислоты;
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-4-карбоновая кислота;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилэтиламин;
трифторметансульфонатная соль 3-({2-[4-(бензотиазол-2-илокси)фенил]этил }циклопропиламино)-2-метилпропионовой кислоты;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)этанол;
2-[2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)этокси]этанол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропан-1-ол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил(3-тетразол-1-илпропил)амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропил(3-пиррол-1-илпропил)амин;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)бутиронитрил
(2-цианоэтил)амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(2Н-тетразол-5-ил)пропил]амин;
3-[5-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)тетразол-1-ил]пропионитрил;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропил[3-(2Н-тетразол-5-ил)пропил]амин;
(2-гидрокси-1,1-диметилэтил)амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(1Н-[1,2,4]триазол-5-ил)пропил]амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(5-метил-1Н-[1,2,4]триазол-3-ил)пропил]амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(5-фенил-1Н-[1,2,4]триазол-3-ил)пропил]амин;
2-(4-{2-[4-(1-метил-1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
2-(4-{2-[4-(2-метил-2Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонитрил;
2-(4-{2-[4-(1Н-[1,2,3]триазол-4-ил]этил}фенокси)бензотиазол;
этиловый эфир 4-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}масляной кислоты;
этиловый эфир 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)масляной кислоты;
2-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]изоиндол-1,3-дион;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)масляная кислота;
1-(3-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}пропил)пирролидин-2-он;
N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилметилпропан-1,3-диамин;
метиловый эфир 5-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пентановой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]ацетамид;
[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]амид морфолин-4-карбоновой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]метилсульфонамид;
5-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пентановая кислота;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}изопропиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}пропиламино)пропил]пирролидин-2-он;
этиловый эфир 4-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)масляной кислоты;
этиловый эфир 4-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)масляной кислоты;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}метансульфониламино)масляная кислота;
({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)уксусная кислота;
этиловый эфир 6-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гексановой кислоты;
этиловый эфир 7-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гептановой кислоты;
6-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гексановая кислота;
7-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гептановая кислота;
N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилпропан-1,3-диамин;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил] ацетамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]изобутирамид;
N-[3-({2-[4-(бeнзoтиaзoл-2-илoкcи)фeнил]этил}циклoпpoпилaминo)пpoпил]бeнзaмид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-4-хлорбензамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]метансульфонамид;
трифторметансульфонатная соль [3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]амида пропан-2-сульфоновой кислоты;
этиловый эфир 8-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)октановой кислоты;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-3-фенилмочевина;
8-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)октановая кислота;
[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]амид тетрагидрофуран-2-карбоновой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-2-гидроксиацетамид;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)масляная кислота;
2-[4-(2-морфолин-4-илэтокси)фенокси]бензотиазол;
2-[4-(2-пиперидин-1-илэтокси)фенокси]бензотиазол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
циклогексилэтил {2-[4-(1-метил-1Н-бензоимидазол-2-илокси)фенил]этил}амин;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклогексилэтиламин;
2-[4-(2-пирролидин-1-илэтил)фенокси]-1Н-бензоимидазол;
2-[4-(2-азепан-1-илэтил)фенокси]-1H-бензоимидазол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}дибутиламин;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}пиперидин-4-ол;
метиловый эфир 1-{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}циклогексэтиламин;
2-{4-[2-(4-метилпиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол;
2-{4-[2-(2-этилпиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол;
2-[2-(4-пиперидин-1-илэтокси)фенокси]-1Н-бензоимидазол;
(1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ол;
1-[4-(2-азепан-1-илэтокси)фенокси]-1Н-бензоимидазоламид;
{3-[4-(1Н-бензоимидазол-2-илокси)фенокси]пропил]диметиламин;
2-[4-(2-пирролидин-1-илэтокси)фенокси]-1Н-бензоимидазол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил]диметиламин;
2-[4-(2-морфолин-4-ил)этокси]фенокси}-1Н-бензоимидазол;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензотиазол;
1-(1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-он и
этиловый эфир 1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты.
8. Способ по п.2, где указанный R4 представляет собой Н.
9. Способ по п.2, где указанные R2'' и R3'', каждый независимо, выбран из группы, состоящей из А), В), С) и I), как определено в п.2.
10. Способ по п.2, где указанные R2'' и R3'', взятые вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.2.
11. Способ по п.2, где указанным LTA4H-опосредованным состоянием является воспаление, ассоциированное по меньшей мере с одним заболеванием, таким как астма, хроническая обструктивная болезнь легких, атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника и псориаз.
12. Способ лечения, предупреждения или подавления воспаления у субъекта, предусматривающий введение субъекту терапевтически эффективного количества по меньшей мере одного модулятора LTA4H, выбранного из соединений формулы (II)

или их энантиомеров, рацематов или их фармацевтически приемлемых солей
где X выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3;
Y представляет собой О;
Z выбран из группы, состоящей из О и связи;
W выбран из группы, состоящей из СН2 и CHR1-CH2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-CH2 не связана непосредственно с атомом азота, с которым связан указанный W;
R4 выбран из группы, состоящей из Н, ОСН3 и Cl;
R6 представляет собой Н или F; и
R2' и R3', каждый независимо, выбран из группы, состоящей из:
A) Н, С1-7алкила, С3-7циклоалкила, С3-7циклоалкил-С1-7алкила, где каждый из заместителей (А) независимо замещен 0 или 1 RQ, где каждый из указанных RQ является заместителем у атома углерода, который представляет собой по меньшей мере один атом углерода, удаленный от атома азота;
B) заместителя HetRa;
C) -С1-7алкил-С(O)Rx;
Н) -С0-4алкил-Ar5, где Ar5 представляет собой 5-членный гетероарил, который имеет один гетероатом, выбранный из группы >NRY, и 0 или 1 дополнительный гетероатом -N=, и необязательно содержит две карбонильные группы, и необязательно бензоконденсирован;
I) -С0-4алкил-Ar5', где Ar5' представляет собой 5-членный гетероарил, который содержит 3 или 4 атома азота;
М) SO2C1-4алкила;
альтернативно, R2' и R3', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, которым является указанный присоединенный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из
i) 4-7-членного гетероциклического кольца HetRb, где указанное 4-7-членное гетероциклическое кольцо HetRb имеет один гетероатом, который представляет собой указанный связанный атом азота, и замещено 0, 1 или 2 одинаковыми или различными заместителями, где указанные заместители выбраны из группы, состоящей из -RY -CN, -C(O)RY, -С0-4алкил-CO2RY,
-С0-4алкил-С(O)CO2RY, -С0-4алкил-ORY, -С0-4алкил-С(O)NRYRz-,
-C0-4алкил-NRYC(O)RZ, -C(O)NRZORY,
-С0-4алкил-NRYCO2RY,
-С0-4алкил-NRYC(O)NRYRY, -C0-4алкил-NRYC(S)NRYRZ, -NRYC(O)CO2RY,
-C0-4алкил-NRWSO2RY,
1,3-дигидробензоимидазол-2-он-1-ила,
1-RY-1H-тетразол-5-ила, RY-триазолила, 2-RY-2H-тeтpaзoл-5-илa,
-C0-4алкил-C(O)N(RY)(SO2RY), -C0-4алкил-N(RY)(SO2)NRYRY,
-C0-4алкил-N(RY)(SO2)NRYCO2RY, галогена,  ,
,  и
и 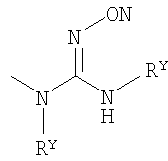 ;
;
ii) 5-7-членного гетероциклического кольца HetRc, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота по меньшей мере одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=O)2 и >NRM, где указанное 5-7-членное гетероциклическое кольцо HetRc имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -С(O)RY и RZ;
iii) одного из 1H-тетразол-1-ила, где 1H-тетразол-1-ил замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-CO2RY; и
iv) одного из бензимидазол-1-ила,
2,8-диазаспиро[4.5]декан-1-он-8-ила,
4-{[(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил}пиперидин-1-ила,
4-{[(2-аминоциклобутанкарбонил)амино]метил}пиперидин-1-ила,
9-ил-трет-бутилового эфира 3,9-диазаспиро[5.5]ундекан-3-карбоновой кислоты,
4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дек-8-ила, и
где заместитель HetRa представляет собой 6-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения по меньшей мере 1 дополнительным атомом углерода;
RK выбран из группы, состоящей из Н и -С1-4алкила;
RL выбран из группы, состоящей из -CO2RS;
RS представляет собой водород;
RM выбран из группы, состоящей из RZ, -C(O)RY;
RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, ОН, NH2, CN, CF3, СН3 и NO2;
RQ выбран из группы, состоящей из -CN, -С0-4алкил-ORY, -С0-4алкил-CO2RY, -С0-4алкил-NRYRY, -C0-4алкил-NRYCORY, -C0-4алкил-NRYCONRYRZ, -C0-4алкил-NRYSO2RY;
RW выбран из группы, состоящей из RY;
RX выбран из группы, состоящей из -ORY, -NRYRZ, -С1-4алкила и -С0-4алкил-RAr;
RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1 или 2 заместителями RN;
RZ выбран из группы, состоящей из RY, -С1-2алкил-CO2RY;
RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен по меньшей мере 0,1 или 2 RN или 0 или 1 RL;
RAr' представляет собой 5-6-членное кольцо, которое имеет 1 или 2 гетероатома, выбранных из группы, состоящей из О, S, N и NRY, и имеет 0 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RK; и
при условии, что:
(а) по меньшей мере один из указанных R2' и R3' не является этилом, если имеет место одна из комбинаций (s1), (s2), (s3) и (s4), где каждая из указанных комбинаций определена следующим образом:
(s1): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой CH2, и Х представляет собой S;
(s2): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой NH;
(s3): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой О, и Х представляет собой S;
(s4): R4 представляет собой 5-хлор, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой S;
(b) далее при условии, если Z представляет собой связь, Y представляет собой СН2, W представляет собой CHR1-CH2, R1 представляет собой Н, и один из R2' и R3' представляет собой 1H-имидазол-2-ил, то другой из R2' и R3' выбран из A1), B)-L), где B)-L) определены выше для соединения формулы (II), и A1) состоит из Н, С3-7алкенила, где атом углерода в указанном С3-7алкениле, который связан с атомом азота, имеет только простые связи; С3-7алкинила, где атом углерода в указанном алкиниле, который связан с атомом азота, имеет только простые связи; С3-7циклоалкила, необязательно бензоконденсированного; С5-7циклоалкенила; С3-7циклоалкил-С1-7алкила; -С1-7алкил-С3-7циклоалкила, и
(с) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2' и R3' не является XCG, если другой представляет собой C1-6алкил, где XCG представляет собой группу

где НС16 представляет собой один из Н, C1-6алкила,
галоген-С1-6алкила, аллила и C1-6алкоксиметила, и GO представляет собой группу, связанную через атом углерода, которая имеет заместитель =O, образующий амидогруппу с атомом азота, к которому присоединена указанная группа GO.
13. Способ по п.12, где указанный R4 представляет собой Н.
14. Способ по п.12, где указанные R2' и R3', каждый независимо, выбран из группы, состоящей из А), В), С) и I) как определено в п.12.
15. Способ по п.12, где указанные R2' и R3', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.12.
16. Способ по п.12, где указанным LTA4H-опосредованным состоянием является воспаление, ассоциированное по меньшей мере с одним заболеванием, таким как астма, хроническая обструктивная болезнь легких, атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника и псориаз.
17. Способ по п.16, где по меньшей мере один указанный модулятор LTA4H выбран из соединений формулы (III)

или их энантиомеров, рацематов или их фармацевтически приемлемых солей, где
Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3;
Y представляет собой О;
Z выбран из группы, состоящей из О и связи;
W выбран из группы, состоящей из СН2 и CHR1-СН2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-CH2 не связана непосредственно с атомом азота, с которым связан указанный W;
R4 выбран из группы, состоящей из Н, ОСН3 и Cl;
R6 представляет собой Н или F; и
R2'' и R3'', каждый независимо, выбран из группы, состоящей из:
A) Н, С1-7алкила, С3-7циклоалкила, С3-7циклоалкил-С1-7алкила, где каждый из заместителей (А) независимо замещен 0 или 1 RQ, где каждый из указанных RQ является заместителем у атома углерода, который представляет собой по меньшей мере один атом углерода, удаленный от атома азота;
B) заместителя HetRa;
C) -С1-7алкил-С(O)Rx;
Н) -С0-4алкил-Ar5, где Ar5 представляет собой 5-членный гетероарил, который имеет один гетероатом, выбранный из группы >NRY, и 0 или 1 дополнительный гетероатом -N=, и необязательно содержит две карбонильные группы, и необязательно бензоконденсирован;
I) -С0-4алкил-Ar5', где Ar5' представляет собой 5-членный гетероарил, который содержит 3 или 4 атома азота;
М) SO2C1-4алкила;
альтернативно, R2'' и R3'', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, которым является указанный присоединенный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из
i) 4-7-членного гетероциклического кольца HetRb, где указанное 4-7-членное гетероциклическое кольцо HetRb имеет один гетероатом, который представляет собой указанный связанный атом азота, и замещено 0, 1 или 2 одинаковыми или различными заместителями, где указанные заместители выбраны из группы, состоящей из -RY -CN, -С(O)RY, -С0-4алкил-CO2RY,
-С0-4алкил-С(O)CO2RY, -С0-4алкил-ORY, -С0-4алкил-С(O)NRYRz-,
-С0-4алкил-NRYC(О)RZ-, -C(O)NRZORY,
-С0-4алкил-NRYCO2RY,
-С0-4алкил-NRYC(О)NRYRY, -С0-4алкил-NRYC(S)NRYRZ, -NRYC(O)CO2RY,
-С0-4алкил-NRWSO2RY,
1,3-дигидробензоимидазол-2-он-1-ила,
1-RY-1H-тетразол-5-ила, RY-триазолила, 2-RY-2H-тeтpaзoл-5-илa,
-C0-4алкил-C(O)N(RY)(SO2RY), -C0-4алкил-N(RY)(SO2)NRYRY,
-C0-4алкил-N(RY)(SO2)NRYCO2RY, галогена,  ,
,  и
и 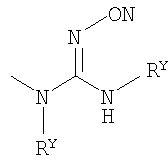 ;
;
ii) 5-7-членного гетероциклического кольца HetRc, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота по меньшей мере одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=O)2 и >NRM, где указанное 5-7-членное гетероциклическое кольцо HetRC имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -С(O)RY и RZ;
hi) одного из 1H-тетразол-1-ила, где 1H-тетразол-1-ил замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-CO2RY; и
iv) одного из бензимидазол-1-ила,
2,8-диазаспиро[4.5]декан-1-он-8-ила,
4-{[(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил}пиперидин-1-ила,
4-{[(2-аминоциклобутанкарбонил)амино]метил} пиперидин-1-ила,
9-ил-трет-бутилового эфира 3,9-диазаспиро[5.5]ундекан-3-карбоновой кислоты,
4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дек-8-ила, и
где заместитель HetRa представляет собой 6-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения по меньшей мере 1 дополнительным атомом углерода;
RK выбран из группы, состоящей из Н и -С1-4алкила;
RL выбран из группы, состоящей из -CO2RS;
RS представляет собой водород;
RM выбран из группы, состоящей из RZ, -C(O)CRY;
RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, ОН, NH2, CN, CF3, СН3 и NO2;
RQ выбран из группы, состоящей из -CN, -С0-4алкил-ORY, -С0-4алкил-CO2RY, -С0-4алкил-NRYRY, -С0-4алкил-NRYCORY -C0-4алкил-NRYCONRYRZ,
-C0-4алкил-NRYSO2RY;
RW выбран из группы, состоящей из RY;
RX выбран из группы, состоящей из -ORY, -NRYRZ, -С1-4алкила и -С0-4алкил-RAr;
RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1 или 2 заместителями RN;
RZ выбран из группы, состоящей из RY, -C1-2алкил-CO2RY;
RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен по меньшей мере 0,1 или 2 RN или 0 или 1 RL;
RAr' представляет собой 5-6-членное кольцо, которое имеет 1 или 2 гетероатома, выбранных из группы, состоящей из О, S, N и >NRY, и имеет 0 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RK; и
при условии, что:
(a) указанные R2'' и R3'', далее удовлетворяют одному из следующих условий:
(е1): по меньшей мере один из указанных R2'' и R3'' не является С1-5алкилом, если Z представляет собой О, и Х представляет собой S;
(е2): ни один из R2'' и R3'' не является -С1-4алкил-С(O)RX, где RX представляет собой один из С1-4алкила, ОН, -ОС1-4алкила, -ОС0-4алкил-RAr или -NRYRY, если Y представляет собой О, Z представляет собой связь, и R2'' отличается от R3''; и
(е3) ни один из R2'' и R3'' не является -С1-4алкил-CN, если Y представляет собой О, Z представляет собой связь, и R2′′ отличается от R3′′; и
(b) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой CH2, то один из R2'' и R3'' не является XCG, если другой представляет собой C1-6алкил, где XCG представляет собой группу

где НС16 представляет собой один из Н, C1-6алкила,
галоген-С1-6алкила, аллила и C1-6алкоксиметила, и GO представляет собой группу, присоединенную посредством атома углерода, которая имеет заместитель =O, образующий амидогруппу с атомом азота, к которому присоединена указанная группа GO.
18. Способ по п.17, где указанные R2'' и R3'', каждый независимо, выбран из группы, состоящей из А), В), С) и I), как определено в п.17.
19. Способ по п.17, где указанные R2'' и R3'', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.17.
20. Способ по п.17, где указанным LTA4H-опосредованным состоянием является воспаление, ассоциированное по меньшей мере с одним заболеванием, таким как астма, хроническая обструктивная болезнь легких, атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника и псориаз.
21. Способ ингибирования HTА4Н-ферментативной активности, предусматривающий обработку фермента LTA4H ингибирующим количеством по меньшей мере одного модулятора LTA4H, выбранного из соединений формулы (II)

или их энантиомеров, рацематов или их фармацевтически приемлемых солей,
где R2', R3', R4, R6, X, Y, Z и W являются такими, как определено для соединения формулы (II) по п.1, при условии, что:
(a) по меньшей мере один из указанных R2' и R3' не является этилом, если имеет место одна из комбинаций (s1), (s2), (s3) и (s4), где каждая из указанных комбинаций определена следующим образом:
(s1): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН3, и Х представляет собой S;
(s2): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой NH;
(s3): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой О, и Х представляет собой S;
(s4): R4 представляет собой 5-хлор, Z представляет собой О, W представляет собой СН2, Y представляет собой CH2, и Х представляет собой S; и
(b) далее при условии, если Z представляет собой связь, Y представляет собой СН2, W представляет собой CHR1-CH2, R1 представляет собой Н, и один из R2' и R3' представляет собой 1H-имидазол-2-ил, то другой из R2' и R3' выбран из A1), B)-L), где B)-L) определены выше для соединения формулы (II), и А1) состоит из Н, С3-7алкенила, где атом углерода в указанном С3-7алкениле, который связан с атомом азота, имеет только простые связи; С3-7алкинила, где атом углерода в указанном алкиниле, который связан с атомом азота, имеет только простые связи; С3-7циклоалкила, необязательно бензоконденсированного; С5-7циклоалкенила; С3-7циклоалкил-С1-7алкила; -С1-7алкил-С3-7циклоалкила, и
(с) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2' и R3' не является XCG, если другой представляет собой C1-6алкил, где XCG представляет собой группу

где НС16 представляет собой один из Н, C1-6алкила,
галоген-С1-6алкила, аллила и C1-6алкоксиметила, и GO представляет собой группу, связанную через атом углерода, которая имеет заместитель =O, образующий амидогруппу (>N-C(O)-) с атомом азота, к которому присоединена указанная группа GO.
22. Способ по п.21, где указанный R4 представляет собой Н.
23. Способ по п.21, где указанные R2' и R3', каждый независимо, выбран из группы, состоящей из А), В), С) и I), как определено в п.21.
24. Способ по п.21, где указанные R2' и R3', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.21.
25. Способ по п.21, где указанным LTA4H-опосредованным состоянием является воспаление, ассоциированное по меньшей мере с одним заболеванием, таким как астма, хроническая обструктивная болезнь легких, атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительное заболевание кишечника и псориаз.
26. Фармацевтическая композиция обладающая свойством ингибитора лейкотриен А4-гидролазы (LTA4H), содержащая терапевтически эффективное количество, по меньшей мере, одного из соединений формулы (II)

или их энантиомеров, рацематов или их фармацевтически приемлемых солей,
где R2', R3', R4, R6, X, Y, Z и W являются такими, как определено для соединения формулы (II) по п.1, при условии, что:
(a) по меньшей мере один из указанных R2' и R3' не является этилом, если имеет место одна из комбинаций (s1), (s2), (s3) и (s4), где каждая из указанных комбинаций определена следующим образом:
(s1): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой S;
(s2): R4 представляет собой Н, Z представляет собой О, W представляет собой CH2, Y представляет собой СН2, и Х представляет собой NH;
(s3): R4 представляет собой Н, Z представляет собой О, W представляет собой CH2, Y представляет собой О, и Х представляет собой S;
(s4): R4 представляет собой 5-хлор, Z представляет собой О, W представляет собой СН2, Y представляет собой CH2, и Х представляет собой S;
(b) далее при условии, если Z представляет собой связь, Y представляет собой CH2, W представляет собой CHR1-CH2, R1 представляет собой Н, и один из R2' и R3' представляет собой 1H-имидазол-2-ил, то другой из R2' и R3' выбран из A1), B)-L), где B)-L) определены выше для соединения формулы (II), и Al) состоит из Н, С3-7алкенила, где атом углерода в указанном С3-7алкениле, который связан с атомом азота, имеет только простые связи; С3-7алкинила, где атом углерода в указанном алкиниле, который связан с атомом азота, имеет только простые связи; С3-7циклоалкила, необязательно бензоконденсированного; С5-7циклоалкенила; С3-7циклоалкил-С1-7алкила; -С1-7алкил-С3-7циклоалкила, и
(c) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2′ и R3′ не является XCG, если другой представляет собой C1-6алкил, где XCG представляет собой группу

где HC16 представляет собой один из Н, C1-6алкила, галоген-С1-6алкила, аллила и C1-6алкоксиметила, и GO представляет собой группу, связанную через атом углерода, которая имеет заместитель=O, образующий амидогруппу с атомом азота, к которому присоединена указанная группа GO, и
фармацевтически приемлемый носитель, наполнитель или разбавитель.
27. Фармацевтическая композиция по п.26, где указанный R4 представляет собой Н.
28. Фармацевтическая композиция по п.26, где указанные R2' и R3', каждый независимо, выбран из группы, состоящей из А), В), С) и I), как определено в п.26.
29. Фармацевтическая композиция по п.26, где указанные R2' и R3', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.26.
30. Фармацевтическая композиция по п.26, где указанным соединением формулы (II)
является по меньшей мере одно из следующих соединений:
2-[4-(2-пиперидин-1-илэтокси)фенокси]бензооксазол;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}дибутиламин;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-2-ил)метанол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-бензилпиперидин-4-ол;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенил]пропил}циклогексилэтиламин;
1-{3-[4-(бензооксазол-2-илокси)фенил]пропил}пиперидин-4-ол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]-2-гидроксипропил}-4-фенилпиперидин-4-ол;
этиловый эфир 1-[2-(4-бензооксазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
2-[4-(2-пирролидин-1-илэтокси)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенокси]пропил} диметиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}диметиламин;
2-[4-(2-азепан-1-илэтокси)фенокси]бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклогексилэтиламин;
2-{4-[2-(2-этилпиперидин-1-ил)этокси]фенокси}бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-карбонитрил;
1-(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ил)этанон;
2-{4-[2-(4-метилпиперидин-1-ил)этокси]фенокси}бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-хлор-3-трифторметилфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклогексилметиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклопропилметилпропиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}бутилэтиламин;
2-({2-[4-(бензооксазол-2-илокси)фенокси]этил}бензиламино)этанол;
2-{4-[2-(4-бензилпиперидин-1-ил)этокси]фенокси}бензооксазол;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-3-ил)метанол;
2-({2-[4-(бензооксазол-2-илокси)фенокси]этил}пропиламино)этанол;
2-[4-(2-азетидин-1-илэтокси)фенокси] бензооксазол;
N-(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)-2-фенилацетамид;
этиловый эфир 1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-3-карбоновой кислоты;
2-{4-[3-(4-фенилпиперидин-1-ил)пропокси]фенокси}бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенил]этил}циклогексилэтиламин;
2-[4-(2-пирролидин-1-илэтил)фенокси]бензооксазол;
2-[4-(2-азепан-1-илэтил)фенокси]бензооксазол;
{2-[4-(бензооксазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
{2-[4-(бензооксазол-2-илокси)фенил]этил}дибутилэтиламин;
1-{2-[4-(бензооксазол-2-илокси)фенил]этил}пиперидин-4-ол;
метиловый эфир 1-{2-[4-(бензооксазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
1-{3-[4-(бензооксазол-2-илокси)фенил]пропил}-4-фенилпиперидин-4-ол;
2-[4-(3-пирролидин-1-илпропил)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенил]пропил}дибутиламин;
{3-[4-(бензооксазол-2-илокси)фенил]пропил}циклопропилметилпропиламин;
1-[4-(бензооксазол-2-илокси)фенокси]-3-пирролидин-1-илпропан-2-ол;
1-[2-(4-бензооксазол-2-илметилфенокси)этил]-4-фенилпиперидин-4-ол;
амид 1-[2-(4-бензооксазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
2-[4-(2-морфолин-4-илэтокси)фенокси)бензооксазол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}диэтиламин;
{2-[4-(6-хлорбензотиазол-2-илокси)фенокси]этил}диэтиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ол;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-1-илметанон;
этиловый эфир 3-[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амино]пропионовой кислоты;
амид 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-он;
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-2-он;
8-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-2,8-диазаспиро[4.5]декан-1-он;
2-[4-(3-пирролидин-1-илпропокси)фенокси)бензотиазол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклогексилэтиламин;
амид 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-3-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-метил-1,3-дигидробензоимидазол-2-он;
метиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-(4-метилпиперазин-1-ил)метанон;
метиловый эфир 1-[2-(4-бензотиазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)пропионовая кислота;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}диметиламин;
2-[4-(2-пирролидин-1-илэтокси)фенокси]бензотиазол;
{3-[4-(бензотиазол-2-илокси)фенокси]пропил}диметиламин;
2-[4-(2-азепан-1-илэтокси)фенокси]бензотиазол;
2-[4-(2-азепан-1-илэтокси)фенокси]-6-метоксибензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}циклогексилэтиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}дибутиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-хлор-3-трифторметилфенил)пиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидин;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-2-фенилацетамид;
2-(4-{2-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]этокси}-фенокси)бензотиазол;
2-(4-{2-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]этил}фенокси)бензотиазол;
1-{3-[4-(бензотиазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-ол;
2-[4-(2-пирролидин-1-илэтил)фенокси]бензотиазол;
2-[4-(2-азепан-1-илэтил)фенокси]бензотиазол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}дибутиламин;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ол;
амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил }пиперидин-4-ил)уксусной кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-1,3-дигидроиндол-2-он;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)пирролидин-2-он;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-2-фенилацетамид;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-2,8-диазаспиро[4.5]декан-1-он;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ол;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
1'-{2-[4-(бензотиазол-2-илокси)фенил]этил}-[1,4']бипиперидин;
2-{4-[2-(4-метилпиперазин-1-ил)этил]фенокси}бензотиазол;
2-(4-{2-[4-(1-бензил-1Н-тетразол-5-ил)пиперидин-1-ил]этокси}фенокси)бензотиазол;
трет-бутиловый эфир 4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)пиперазин-1-карбоновой кислоты;
амид 1-[2-(4-{бензотиазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
1-{1-[2-(4-бензотиазол-2-илметилфенокси)этил]пиперидин-4-ил}пирролидин-2-он;
1-[4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)пиперазин-1-ил]этанон;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновая кислота;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-тион;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)этанол;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)-1-пирролидин-1-илэтанон;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)-1-морфолин-4-илэтанон;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновая кислота;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-2-карбоновая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ил)уксусная кислота;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)уксусной кислоты;
трет-бутиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил }пиперидин-4-ил)карбаминовой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)уксусная кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ил)метанол;
метиловый эфир ({2-[4-(бензотиазол-2-илокси)фенил]этил}циклогексиламино)уксусной кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-1-ил)уксусная кислота;
этиловый эфир 1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-5-оксопирролидин-2-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-5-оксопирролидин-2-карбоновая кислота;
4-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)фенол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-хлор-N-циклопропилбензолсульфонамид;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропилметиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}изопропиламино)пропионовая кислота;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-иламин;
3-[{2-[4-(бензотиазол-2-илокси)фенокси]этил}-(1-метилпиперидин-4-ил)амино]пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}бензиламино)пропионовая кислота;
3-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенокси]этил}амино)пропионовая кислота;
трет-бутиловый эфир 4-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1H-тетразол-5-ил)пиперидин-1-карбоновой кислоты;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропионовая кислота;
3-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)пропионовая кислота;
3-[{2-[4-(бензотиазол-2-илокси)фенил]этил}(1-метилпиперидин-4-ил)амино]пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}-изопропиламино)пропионовая кислота;
2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-1-пирролидин-1-илэтанон;
(R)-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновая кислота;
1-(1-[2-(4-бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-1,3-дигидробензоимидазол-2-он;
2-(4-{2-[4-(6-метилпиридин-2-ил]пиперазин-1-ил]этил}фенокси)бензотиазол;
2-{4-[2-(4-этансульфонилпиперазин-1-ил]этил]фенокси}бензотиазол;
2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-1-морфолин-4-илэтанон;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}метиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопентиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклобутиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}бензиламино)пропионовая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-(4-гидроксиметилпиперидин-1-ил)метанон;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламин;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-[4-(2-гидроксиэтил)пиперазин-1-ил]метанон;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-[4-(2-гидроксиэтил)пиперидин-1-ил]метанон;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)этанол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-1-ол;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)масляная кислота;
3-[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амино]пропионовая кислота;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)бутиронитрил;
3-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)пропионовая кислота;
[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)метиламино]уксусная кислота;
3-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)фенол;
2-(4-{2-[4-(4-метоксифенил)пиперазин-1-ил]этокси}фенокси)бензотиазол;
2-{4-[2-(5-пиперидин-4-илтетразол-1-ил)этокси]фенокси}бензотиазол;
(S)-1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламин;
этиловый эфир 2-[({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)метил]циклопропанкарбоновой кислоты;
этиловый эфир 4-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-карбонил)бензойной кислоты;
2-[({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)метил]циклопропанкарбоновая кислота;
1-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-2-ол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-1,1,1-трифторпропан-2-ол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропионамид;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-1,2-диол;
2-{4-[2-(5-фенилтетразол-2-ил)этокси]фенокси}бензотиазол;
2-{4-[2-(5-фенилтетразол-1-ил)этокси]фенокси}бензотиазол;
N-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N-циклопропил-2-(2Н-тетразол-5-ил)ацетамид;
(S)-3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропан-1-ол;
(R)-3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропан-1-ол;
2-{4-[2-(5-метилсульфанилтетразол-2-ил)этокси]фенокси}бензотиазол;
2-{4-[2-(5-метилсульфанилтетразол-1-ил)этокси]фенокси}бензотиазол;
2-[4-(2-тетразол-2-илэтокси)фенокси]бензотиазол;
2-[4-(2-тетразол-1-илэтокси)фенокси]бензотиазол;
(1R,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанкарбоновая кислота;
(1S,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанкарбоновая кислота;
(1R,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанол;
(1S,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанол;
4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)масляная кислота;
(R)-1-(l-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-2-ил)метанол;
этиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1Н-тетразол-5-ил)уксусной кислоты;
этиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1Н-тетразол-5-ил)уксусной кислоты;
гидрохлорид 2-{4-[2-(5-пиперидин-4-илтетразол-2-ил)этокси]фенокси}бензотиазола;
7-{2-[4-(бензотиазол-2-илокси)фенокси]этил]-4-спиро[3-фталид]пиперидин;
этиловый эфир 1-{3-[4-(бензотиазол-2-илокси)фенил]пропил}пиперидин-4-карбоновой кислоты;
гидрохлорид 2-[4-(бензотиазол-2-илокси)фенил]этиламина;
2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этокси]фенокси)бензотиазол;
трифторметансульфонатная соль цис-4-{2-[4-(бензотиазол-2-илокси)фенил]этиламино }циклогексанкарбоновой кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амид пропан-2-сульфоновой кислоты;
метиловый эфир (4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)оксоуксусной кислоты;
трифторметансульфонатная соль N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)бензолсульфонамида;
трифторметансульфонатная соль N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)метансульфонамида;
трифторметансульфонатная соль (4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)оксоуксусной кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)морфолин-4-илметанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-тиофен-2-илэтанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пиридин-3-илметанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)циклопропилметанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-метоксиэтанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2,2,2-трифторэтанон;
4-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-карбонил)бензойная кислота;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пиридин-4-илметанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(5-метилпиразин-2-ил)метанон;
(R)-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(S)-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-3-ил)метанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-гидроксиэтанон;
2-[2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-оксоэтил]циклопентанон;
трифторметансульфонатная соль 3-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пропионовой кислоты;
3-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)оксазолидин-2-он;
4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)морфолин-3-он;
4-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)морфолин-3-он;
3-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)оксазолидин-2-он;
бензилоксиамид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)уксусная кислота;
(R)-1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
гидроксиамид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(S)-1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
трет-бутиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-илкарбаминовой кислоты;
2-{4-[2-(4-фторпиперидин-1-ил)этил]фенокси}бензотиазол;
2-{4-[2-(4,4-дифторпиперидин-1-ил)этил]фенокси}бензотиазол;
(R)-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пирролидин-3-ол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)формамид;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)мочевина;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-фенилизомочевина;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-метилизомочевина;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метансульфонамид;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-метилгуанидин;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-1,3,8-триазаспиро[4.5]декан-2,4-дион;
трет-бутиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метилкарбаминовой кислоты;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-метилацетамид;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-метилметансульфонамид;
метиловый эфир [(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метилкарбамоил]уксусной кислоты;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-ацетамид;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-илкарбамоил)метиловый эфир уксусной кислоты;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}метиламино)-3-(1Н-имидазол-2-ил)пропионовая кислота;
2-(4-{2-[4-(3-нитропиридин-2-ил)-[1,4]диазепан-1-ил]этил}фенокси)бензотиазол;
этиловый эфир [(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)метиламино]уксусной кислоты;
этиловый эфир 1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-4-карбоновой кислоты;
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-4-карбоновая кислота;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилэтиламин;
трифторметансульфонатная соль 3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропионовой кислоты;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)этанол;
2-[2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)этокси]этанол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропан-1-ол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил(3-тетразол-1-илпропил)амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропил(3-пиррол-1-илпропил)амин;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)бутиронитрил (2-цианоэтил)амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(2Н-тетразол-5-ил)пропил]амин;
3-[5-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)тетразол-1-ил]пропионитрил;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропил[3-(2Н-тетразол-5-ил)пропил]амин;
(2-гидрокси-1,1-диметилэтил)амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(1Н-[1,2,4]триазол-5-ил)пропил]амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(5-метил-1Н-[1,2,4]триазол-3-ил)пропил]амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(5-фенил-1Н-[1,2,4]триазол-
3-ил)пропил] амин;
2-(4-{2-[4-(1-метил-1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
2-(4-{2-[4-(2-метил-2Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонитрил;
2-(4-{2-[4-(1Н-[1,2,3]триазол-4-ил]этил}фенокси)бензотиазол;
этиловый эфир 4-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}масляной кислоты;
этиловый эфир 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)масляной кислоты;
2-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]изоиндол-1,3-дион;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)масляная кислота;
1-(3-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}пропил)пирролидин-2-он;
N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилметилпропан-1,3-диамин;
метиловый эфир 5-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пентановой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]ацетамид;
[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]амид морфолин-4-карбоновой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]метилсульфонамид;
5-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пентановая кислота;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}изопропиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}пропиламино)пропил]пирролидин-2-он;
этиловый эфир 4-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)масляной кислоты;
этиловый эфир 4-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)масляной кислоты;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}метансульфониламино)масляная кислота;
({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)уксусная кислота;
этиловый эфир 6-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гексановой кислоты;
этиловый эфир 7-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гептановой кислоты;
6-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гексановая кислота;
7-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гептановая кислота;
N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилпропан-1,3-диамин;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]ацетамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил] изобутирамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]бензамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-4-хлорбензамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]метансульфонамид;
трифторметансульфонатная соль [3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]амида пропан-2-сульфоновой кислоты;
этиловый эфир 8-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)октановой кислоты;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-3-фенилмочевина;
8-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)октановая кислота;
[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]амид тетрагидрофуран-2-карбоновой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-2-гидроксиацетамид;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)масляная кислота;
2-[4-(2-морфолин-4-илэтокси)фенокси]бензотиазол;
2-[4-(2-пиперидин-1 -илэтокси)фенокси]бензотиазол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
циклогексилэтил {2-[4-(1-метил-1Н-бензоимидазол-2-илокси)фенил]этил}амин;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклогексилэтиламин;
2-[4-(2-пирролидин-1-илэтил)фенокси]-1Н-бензоимидазол;
2-[4-(2-азепан-1-илэтил)фенокси]-1Н-бензоимидазол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}дибутиламин;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}пиперидин-4-ол;
метиловый эфир 1-{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}циклогексэтиламин;
2-{4-[2-(4-метилпиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол;
2-{4-[2-(2-этилпиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол;
2-[2-(4-пиперидин-1-илэтокси)фенокси]-1Н-бензоимидазол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ол;
1-[4-(2-азепан-1-илэтокси)фенокси]-1Н-бензоимидазоламид;
{3-[4-(1Н-бензоимидазол-2-илокси)фенокси]пропил]диметиламин;
2-[4-(2-пирролидин-1-илэтокси)фенокси]-1H-бензоимидазол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил]диметиламин;
2-[4-(2-морфолин-4-ил)этокси]фенокси}-1Н-бензоимидазол;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензотиазол;
1-(1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-он;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол и этиловый эфир 1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил} пиперидин-4-карбоновой кислоты.
31. Фармацевтическая композиция по п.26, где указанным соединением формулы (II) является по меньшей мере одно из соединений (III)

или их энантиомеров, рацематов или их фармацевтически приемлемых солей, где
R2'', R3'', R4, R6, X, Y, Z и W являются такими, как определено для соединения формулы (III) по п.2, при условии, что:
(a) указанные R2'' и R3'', далее удовлетворяют одному из следующих условий:
(е1): по меньшей мере один из указанных R2'' и R3'' не является С1-5алкилом, если Z представляет собой О, и Х представляет собой S;
(е2): ни один из R2'' и R3'' не является -С1-4алкил-С(O)RX, где RX представляет собой один из С1-4алкила, ОН, -ОС1-4алкила, -ОС0-4алкил-RAr или -NRYRY, если Y представляет собой О, Z представляет собой связь, и R2'' отличается от R3''; и
(е3) ни один из R2'' и R3'' не является -С1-4алкил-CN, если Y представляет собой О, Z представляет собой связь, и R2'' отличается от R3''; и
(b) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2'' и R3'' не является XCG, если другой представляет собой С1-6алкил, где XCG представляет собой группу

где НС16 представляет собой один из Н, C1-6алкила, галоген-С1-6алкила, аллила и
C1-6алкоксиметила, и GO представляет собой группу, связанную посредством атома углерода, которая имеет заместитель =O, образующий амидогруппу с атомом азота, к которому присоединена указанная группа GO,
32. Фармацевтическая композиция по п.31, где указанный R4 представляет собой Н.
33. Фармацевтическая композиция по п.31, где указанные R2'' и R3'', каждый независимо, выбран из группы, состоящей из А), В), С) и I), как определено в п.31.
34. Фармацевтическая композиция по п.31, где указанные R2'' и R3'', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.31.
35. Соединение формулы (II)

и его энантиомер, рацемат или их фармацевтически приемлемая соль, где
Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3;
Y представляет собой О;
Z выбран из группы, состоящей из О и связи;
W выбран из группы, состоящей из СН2 и CHR1-CH2, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-CH2 не связана непосредственно с атомом азота, с которым связан указанный W;
R4 выбран из группы, состоящей из Н, ОСН3 и Cl;
R6 представляет собой Н или F; и
R2' и R3', каждый независимо, выбран из группы, состоящей из:
A) Н, С1-7алкила, С3-7циклоалкила, С3-7циклоалкил-С1-7алкила, где каждый из заместителей (А) независимо замещен 0 или 1 RQ, где каждый из указанных RQ является заместителем у атома углерода, который представляет собой по меньшей мере один атом углерода, удаленный от атома азота;
B) заместителя HetRa;
C) -С1-7алкил-С(O)Rx;
Н) -С0-4алкил-Ar5, где Ar5 представляет собой 5-членный гетероарил, который имеет один гетероатом, выбранный из группы >NRY, и 0 или 1 дополнительный гетероатом -N=, и необязательно содержит две карбонильные группы, и необязательно бензоконденсирован;
I) -С0-4алкил-Ar5', где Ar5' представляет собой 5-членный гетероарил, который содержит 3 или 4 атома азота;
М) SO2C1-4алкила;
альтернативно, R2' и R3', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, которым является указанный присоединенный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из
i) 4-7-членного гетероциклического кольца HetRb, где указанное 4-7-членное гетероциклическое кольцо HetRb имеет один гетероатом, который представляет собой указанный связанный атом азота, и замещено 0, 1 или 2 одинаковыми или различными заместителями, где указанные заместители выбраны из группы, состоящей из -RY, -CN, -С(O)RY, -С0-4алкил-CO2RY,
-С0-4алкил-С(O)CO2RY, -С0-4алкил-ORY, -С0-4алкил-С(O)NRYRz-,
-С0-4алкил-NRYC(О)RZ-, -C(O)NRZRY,
-С0-4алкил-NRYCO2RY,
-С0-4алкил-NRYC(O)NRYRY, -C0-4алкил-NRYC(S)NRYRZ, -NRYC(O)CO2RY,
-C0-4алкил-NRWSO2RY,
1,3-дигидробензоимидазол-2-он-1-ила,
1-RY-1H-тетразол-5-ила, RY-триазолила, 2-RY-2H-тeтpaзoл-5-илa,
-C0-4алкил-C(O)N(RY)(SO2RY), -C0-4алкил-N(RY)(SO2)NRYRY,
-C0-4алкил-N(RY)(SO2)NRYCO2RY, галогена,  ,
,  и
и  ;
;
ii) 5-7-членного гетероциклического кольца HetRc, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота по меньшей мере одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=O)2 и >NRM, где указанное 5-7-членное гетероциклическое кольцо HetRc имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -С(O)RY и RZ;
iii) одного из 1H-тетразол-1-ила, где 1H-тетразол-1-ил замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-CO2RY; и
iv) одного из бензимидазол-1-ила,
2,8-диазаспиро[4.5]декан-1-он-8-ила,
4-{[(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил}пиперидин-1-ила,
4-{[(2-аминоциклобутанкарбонил)амино] метил} пиперидин-1-ила,
9-ил-трет-бутилового эфира 3,9-диазаспиро[5.5]ундекан-3-карбоновой кислоты,
4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дек-8-ила, и
где заместитель HetRa представляет собой 6-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения по меньшей мере 1 дополнительным атомом углерода;
RK выбран из группы, состоящей из Н и -С1-4алкила;
RL выбран из группы, состоящей из -CO2RS;
RS представляет собой водород;
RM выбран из группы, состоящей из RZ, -C(O)RY;
RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, ОН, NH2, CN, CF3, СН3 и NO2;
RQ выбран из группы, состоящей из -CN,
-С0-4алкил-ORY -С0-4алкил-CO2RY, -С0-4алкил-NRYRY, -С0-4алкил-NRYCORY, -C0-4алкил-NRYCONRYRZ -C0-4алкил-NRYSO2RY;
RW выбран из группы, состоящей из RY;
RX выбран из группы, состоящей из -ORY -NRYRZ, -С1-4алкила и -С0-4алкил-RAr;
RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1 или 2 заместителями RN;
RZ выбран из группы, состоящей из RY, -С1-2алкил-CO2RY;
RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен по меньшей мере 0,1 или 2 RN или 0 или 1 RL;
RAr' представляет собой 5-6-членное кольцо, которое имеет 1 или 2 гетероатома, выбранных из группы, состоящей из О, S, N и >NRY, и имеет 0 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RK; и
при условии, что:
(a) по меньшей мере один из указанных R2' и R3' не является этилом, если имеет место одна из комбинаций (s1), (s2), (s3) и (s4), где каждая из указанных комбинаций определена следующим образом:
(s1): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой S;
(s2): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой СН2, и Х представляет собой NH;
(s3): R4 представляет собой Н, Z представляет собой О, W представляет собой СН2, Y представляет собой О, и Х представляет собой S;
(s4): R4 представляет собой 5-хлор, Z представляет собой О, W представляет собой CH2, Y представляет собой СН2, и Х представляет собой S;
(b) далее при условии, если Z представляет собой связь, Y представляет собой СН2, W представляет собой CHR1-CH2, R1 представляет собой Н, и один из R2' и R3' представляет собой 1H-имидазол-2-ил, то другой из R2' и R3' выбран из A1), B)-L), где B)-L) определены выше для соединения формулы (II), и A1) состоит из Н, С3-7алкенила, где атом углерода в указанном С3-7алкениле, который связан с атомом азота, имеет только простые связи; С3-7алкинила, где атом углерода в указанном алкиниле, который связан с атомом азота, имеет только простые связи; С3-7циклоалкила, необязательно бензоконденсированного; С5-7циклоалкенила; С3-7циклоалкил-С1-7алкила; -С1-7алкил-С3-7циклоалкила, и
(c) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2' и R3' не является XCG, если другой представляет собой C1-6алкил, где XCG представляет собой группу

где НС16 представляет собой один из Н, С1-6алкила, галоген-С1-6алкила, аллила и
C1-6алкоксиметила, и GO представляет собой группу, связанную через атом углерода, которая имеет заместитель =O, образующий амидогруппу с атомом азота, к которому присоединена указанная группа GO.
36. Соединение по п.35, где указанный R4 представляет собой Н.
37. Соединение по п.35, где указанные R2' и R3', каждый независимо, выбран из группы, состоящей из А), В), С) и I), как определено в п.35.
38. Соединение по п.35, где указанные R2' и R3', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.35.
39. Соединение по п.35, где указанным соединением формулы (II) является одно из следующих соединений:
2-[4-(2-пиперидин-1-илэтокси)фенокси]бензооксазол;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил }дибутиламин;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-2-ил)метанол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]пропил}-4-бензилпиперидин-4-ол;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенил]пропил}циклогексилэтиламин;
1-{3-[4-(бензооксазол-2-илокси)фенил]пропил}пиперидин-4-ол;
1-{3-[4-(бензооксазол-2-илокси)фенокси]-2-гидроксипропил}-4-фенилпиперидин-4-ол;
этиловый эфир 1-[2-(4-бензооксазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
2-[4-(2-пирролидин-1-илэтокси)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенокси]пропил}диметиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}диметиламин;
2-[4-(2-азепан-1-илэтокси)фенокси]бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклогексилэтиламин;
2-{4-[2-(2-этилпиперидин-1-ил)этокси]фенокси}бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-карбонитрил;
1-(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ил)этанон;
2-{4-[2-(4-метилпиперидин-1-ил)этокси]фенокси}бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-(4-хлор-3-трифторметилфенил)пиперидин-4-ол;
1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклогексилметиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}циклопропилметилпропиламин;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}бутилэтиламин;
2-({2-[4-(бензооксазол-2-илокси)фенокси]этил}бензиламино)этанол;
2-{4-[2-(4-бензилпиперидин-1-ил)этокси]фенокси}бензооксазол;
(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-3-ил)метанол;
2-({2-[4-(бензооксазол-2-илокси)фенокси]этил}пропиламино)этанол;
2-[4-(2-азетидин-1-илэтокси)фенокси]бензооксазол;
N-(1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-4-ил)-2-фенилацетамид;
этиловый эфир 1-{2-[4-(бензооксазол-2-илокси)фенокси]этил}пиперидин-3-карбоновой кислоты;
2-{4-[3-(4-фенилпиперидин-1-ил)пропокси]фенокси}бензооксазол;
1-{2-[4-(бензооксазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензооксазол-2-илокси)фенил]этил}циклогексилэтиламин;
2-[4-(2-пирролидин-1-илэтил)фенокси]бензооксазол;
2-[4-(2-азепан-1-илэтил)фенокси]бензооксазол;
{2-[4-(бензооксазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
{2-[4-(бензооксазол-2-илокси)фенил]этил}дибутилэтиламин;
1-{2-[4-(бензооксазол-2-илокси)фенил]этил}пиперидин-4-ол;
метиловый эфир 1-{2-[4-(бензооксазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
1-{3-[4-(бензооксазол-2-илокси)фенил]пропил}-4-фенилпиперидин-4-ол;
2-[4-(3-пирролидин-1-илпропил)фенокси]бензооксазол;
{3-[4-(бензооксазол-2-илокси)фенил]пропил}дибутиламин;
{3-[4-(бензооксазол-2-илокси)фенил]пропил}циклопропилметилпропиламин;
1-[4-(бензооксазол-2-илокси)фенокси]-3-пирролидин-1-илпропан-2-ол;
1-[2-(4-бензооксазол-2-илметилфенокси)этил]-4-фенилпиперидин-4-ол;
амид 1-[2-(4-бензооксазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
2-[4-(2-морфолин-4-илэтокси)фенокси)бензооксазол;
{2-[4-(бензооксазол-2-илокси)фенокси]этил}диэтиламин;
{2-[4-(6-хлорбензотиазол-2-илокси)фенокси]этил}диэтиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ол;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-1-илметанон;
этиловый эфир 3-[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амино]пропионовой кислоты;
амид 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-он;
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-2-он;
8-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-2,8-диазаспиро[4.5]декан-1-он;
2-[4-(3-пирролидин-1-илпропокси)фенокси)бензотиазол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклогексилэтиламин;
амид 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-3-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-метил-1,3-дигидробензоимидазол-2-он;
метиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-(4-метилпиперазин-1-ил)метанон;
метиловый эфир 1-[2-(4-бензотиазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропиламино)пропионовая кислота;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}диметиламин;
2-[4-(2-пирролидин-1-илэтокси)фенокси]бензотиазол;
{3-[4-(бензотиазол-2-илокси)фенокси]пропил}диметиламин;
2-[4-(2-азепан-1-илэтокси)фенокси]бензотиазол;
2-[4-(2-азепан-1-илэтокси)фенокси]-6-метоксибензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}циклогексилэтиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
{2-[4-(бензотиазол-2-илокси)фенокси]этил}дибутиламин;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-(4-хлор-3-трифторметилфенил)пиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол;
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидин;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)метанол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-2-фенилацетамид;
2-(4-{2-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]этокси}-фенокси)бензотиазол;
2-(4-{2-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]этил}фенокси)бензотиазол;
1-{3-[4-(бензотиазол-2-илокси)фенокси]пропил}-4-фенилпиперидин-4-ол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-ол;
2-[4-(2-пирролидин-1-илэтил)фенокси]бензотиазол;
2-[4-(2-азепан-1-илэтил)фенокси]бензотиазол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}дибутиламин;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ол;
амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-4-фенилпиперидин-4-карбоновой кислоты;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)уксусной кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-1,3-дигидроиндол-2-он;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)пирролидин-2-он;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-2-фенилацетамид;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-2,8-диазаспиро[4.5]декан-1-он;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ол;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
1'-{2-[4-(бензотиазол-2-илокси)фенил]этил}-[1,4']бипиперидин;
2-{4-[2-(4-метилпиперазин-1-ил)этил]фенокси}бензотиазол;
2-(4-{2-[4-(1-бензил-1Н-тетразол-5-ил)пиперидин-1-ил]этокси}фенокси)бензотиазол;
трет-бутиловый эфир 4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)пиперазин-1-карбоновой кислоты;
амид 1-[2-(4-{бензотиазол-2-илметилфенокси)этил]пиперидин-4-карбоновой кислоты;
1-{1-[2-(4-бензотиазол-2-илметилфенокси)этил]пиперидин-4-ил}пирролидин-2-он;
1-[4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)пиперазин-1-ил]эталон;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновая кислота;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-тион;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)этанол;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)-1-пирролидин-1-илэтанон;
2-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)-1-морфолин-4-илэтанон;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновая кислота;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-2-карбоновая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ил)уксусная кислота;
этиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)уксусной кислоты;
трет-бутиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)карбаминовой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)уксусная кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-ил)метанол;
метиловый эфир ({2-[4-(бензотиазол-2-илокси)фенил]этил}циклогексиламино)уксусной кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-1-ил)уксусная кислота;
этиловый эфир 1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил }пиперидин-4-ил)-5-оксопирролидин-2-карбоновой кислоты;
1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-5-оксопирролидин-2-карбоновая кислота;
4-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)фенол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-хлор-N-циклопропилбензолсульфонамид;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}циклопропилметиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}изопропиламино)пропионовая кислота;
1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-иламин;
3-[{2-[4-(бензотиазол-2-илокси)фенокси]этил}-(1-метилпиперидин-4-ил)амино]пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенокси]этил}бензиламино)пропионовая кислота;
3-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенокси]этил} амино)пропионовая кислота;
трет-бутиловый эфир 4-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1Н-тетразол-5-ил)пиперидин-1-карбоновой кислоты;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропионовая кислота;
3-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)пропионовая кислота;
3-[{2-[4-(бензотиазол-2-илокси)фенил]этил}(1-метилпиперидин-4-ил)амино]пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}-изопропиламино)пропионовая кислота;
2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-1-пирролидин-1-илэтанон;
(R)-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-3-карбоновая кислота;
1-(1-[2-(4-бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-1,3-дигидробензоимидазол-2-он;
2-(4-{2-[4-(6-метилпиридин-2-ил]пиперазин-1-ил]этил}фенокси)бензотиазол;
2-{4-[2-(4-этансульфонилпиперазин-1-ил]этил]фенокси}бензотиазол;
2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-1-морфолин-4-илэтанон;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}метиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопентиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклобутиламино)пропионовая кислота;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}бензиламино)пропионовая кислота;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-(4-гидроксиметилпиперидин-1-ил)метанон;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламин;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-[4-(2-гидроксиэтил)пиперазин-1-ил]метанон;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-[4-(2-гидроксиэтил)пиперидин-1-ил]метанон;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)этанол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-1-ол;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)масляная кислота;
3-[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амино]пропионовая кислота;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)бутиронитрил;
3-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)пропионовая кислота;
[(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)метиламино]уксусная кислота;
3-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-ил)фенол;
2-(4-{2-[4-(4-метоксифенил)пиперазин-1-ил]этокси}фенокси)бензотиазол;
2-{4-[2-(5-пиперидин-4-илтетразол-1-ил)этокси]фенокси}бензотиазол;
(S)-1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламин;
этиловый эфир 2-[({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)метил]
циклопропанкарбоновой кислоты;
этиловый эфир 4-(4-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперазин-1-карбонил)бензойной кислоты;
2-[({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)метил]циклопропанкарбоновая кислота;
1-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-2-ол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-1,1,1-трифторпропан-2-ол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропионамид;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропан-1,2-диол;
2-{4-[2-(5-фенилтетразол-2-ил)этокси]фенокси}бензотиазол;
2-{4-[2-(5-фенилтетразол-1-ил)этокси]фенокси}бензотиазол;
N-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N-циклопропил-2-(2Н-тетразол-5-ил)ацетамид;
(S)-3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропан-1-ол;
(R)-3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропан-1-ол;
2-{4-[2-(5-метилсульфанилтетразол-2-ил)этокси]фенокси}бензотиазол;
2-{4-[2-(5-метилсульфанилтетразол-1-ил)этокси]фенокси}бензотиазол;
2-[4-(2-тетразол-2-илэтокси)фенокси]бензотиазол;
2-[4-(2-тетразол-1-илэтокси)фенокси]бензотиазол;
(1R,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанкарбоновая кислота;
(1S,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанкарбоновая кислота;
(1R,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанол;
(1S,2R)-2-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}циклогексанол;
4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)масляная кислота;
(R)-1-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-2-ил)метанол;
этиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1Н-тетразол-5-ил)уксусной кислоты;
этиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-1Н-тетразол-5-ил)уксусной кислоты;
гидрохлорид 2-{4-[2-(5-пиперидин-4-илтетразол-2-ил)этокси]фенокси}бензотиазола;
7-{2-[4-(бензотиазол-2-илокси)фенокси]этил]-4-спиро[3-фталид]пиперидин;
этиловый эфир 1-{3-[4-(бензотиазол-2-илокси)фенил]пропил}пиперидин-4-карбоновой кислоты;
гидрохлорид 2-[4-(бензотиазол-2-илокси)фенил]этиламина;
2-(4-{2-[4-(1Н-тетразол-5-ил)пиперидин-1-ил]этокси]фенокси)бензотиазол;
трифторметансульфонатная соль цис-4-{2-[4-(бензотиазол-2-илокси)фенил]этиламино }циклогексанкарбоновой кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)амид пропан-2-сульфоновой кислоты;
метиловый эфир (4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)оксоуксусной кислоты;
трифторметансульфонатная соль N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)бензолсульфонамида;
трифторметансульфонатная соль N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонил)метансульфонамида;
трифторметансульфонатная соль (4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)оксоуксусной кислоты;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)морфолин-4-илметанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-тиофен-2-илэтанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пиридин-3-илметанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)циклопропилметанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-метоксиэтанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2,2,2-трифторэтанон;
4-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-карбонил)бензойная кислота;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пиридин-4-илметанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(5-метилпиразин-2-ил)метанон;
(R)-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(S)-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-2-ил)метанон;
(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-(тетрагидрофуран-3-ил)метанон;
1-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-гидроксиэтанон;
2-[2-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)-2-оксоэтил]циклопентанон;
трифторметансульфонатная соль 3-(4-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперазин-1-ил)пропионовой кислоты;
3-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)оксазолидин-2-он;
4-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)морфолин-3-он;
4-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)морфолин-3-он;
3-(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-ил)оксазолидин-2-он;
бензилоксиамид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)уксусная кислота;
(R)-1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
гидроксиамид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
(S)-1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-4-гидроксипирролидин-2-он;
трет-бутиловый эфир 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-илкарбаминовой кислоты;
2-{4-[2-(4-фторпиперидин-1-ил)этил]фенокси}бензотиазол;
2-{4-[2-(4,4-дифторпиперидин-1-ил)этил]фенокси}бензотиазол;
(R)-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пирролидин-3-ол;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)формамид;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)мочевина;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-фенилизомочевина;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-метилизомочевина;
N-(1-{2-[4-(бeнзoтиaзoл-2-илoкcи)фeнил]этил}пипepидин-4-ил)мeтaнcyльфoнaмид;
1-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-3-циано-2-метилгуанидин;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он;
8-{2-[4-(бензотиазол-2-илокси)фенил]этил}-1,3,8-триазаспиро[4.5]декан-2,4-дион;
трет-бутиловый эфир (1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метилкарбаминовой кислоты;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-метилацетамид;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)-N-метилметансульфонамид;
метиловый эфир [(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)метилкарбамоил] уксусной кислоты;
N-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пипepидин-4-ил)-N-aцeтaмид;
(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-илкарбамоил)метиловый эфир уксусной кислоты;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}метиламино)-3-(1Н-имидазол-2-ил)пропионовая кислота;
2-(4-{2-[4-(3-нитропиридин-2-ил)-[1,4]диазепан-1-ил]этил}фенокси)бензотиазол;
этиловый эфир [(1-{2-[4-(бензотиазол-2-илокси)фенокси]этил}пиперидин-4-карбонил)метиламино]уксусной кислоты;
этиловый эфир 1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-4-карбоновой кислоты;
1'-{2-[4-(бензотиазол-2-илокси)фенокси]этил}-[1,4']бипиперидинил-4-карбоновая кислота;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилэтиламин;
трифторметансульфонатная соль 3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)-2-метилпропионовой кислоты;
2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)этанол;
2-[2-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)этокси]этанол;
3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропан-1-ол;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил(3-тетразол-1-илпропил)амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропил(3-пиррол-1-илпропил)амин;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)бутиронитрил (2-цианоэтил)амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(2Н-тетразол-5-ил)пропил] амин;
3-[5-(1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-ил)тетразол-1-ил]пропионитрил;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропил[3-(2Н-тетразол-5-ил)пропил]амин;
(2-гидрокси-1,1-диметилэтил)амид 1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(1Н-[1,2,4]триазол-5-ил)пропил]амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(5-метил-1Н-[1,2,4]триазол-3-ил)пропил]амин;
{2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметил[3-(5-фенил-1Н-[1,2,4]триазол-3-ил)пропил]амин;
2-(4-{2-[4-(1-метил-1Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
2-(4-{2-[4-(2-метил-2Н-тетразол-5-ил)пиперидин-1-ил]этил}фенокси)бензотиазол;
1-{2-[4-(бензотиазол-2-илокси)фенил]этил}пиперидин-4-карбонитрил;
2-(4-{2-[4-(1Н-[1,2,3]триазол-4-ил]этил}фенокси)бензотиазол;
этиловый эфир 4-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}масляной кислоты;
этиловый эфир 4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)масляной кислоты;
2-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]изоиндол-1,3-дион;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)масляная кислота;
1-(3-{2-[4-(бензотиазол-2-илокси)фенил]этиламино}пропил)пирролидин-2-он;
N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилметилпропан-1,3-диамин;
метиловый эфир 5-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пентановой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]ацетамид;
[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]амид морфолин-4-карбоновой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]метинсульфонамид;
5-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пентановая кислота;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}изопропиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропилметиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]пирролидин-2-он;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}пропиламино)пропил]пирролидин-2-он;
этиловый эфир 4-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)масляной кислоты;
этиловый эфир 4-((1-ацетилпиперидин-4-ил)-{2-[4-(бензотиазол-2-илокси)фенил]этил}амино)масляной кислоты;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}метансульфониламино)масляная кислота;
({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)уксусная кислота;
этиловый эфир 6-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гексановой кислоты;
этиловый эфир 7-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гептановой кислоты;
6-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гексановая кислота;
7-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)гептановая кислота;
N-1-{2-[4-(бензотиазол-2-илокси)фенил]этил}-N1-циклопропилпропан-1,3-диамин;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]ацетамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]изобутирамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]бензамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-4-хлорбензамид;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]метансульфонамид;
трифторметансульфонатная соль [3-({2-[4-(бензотиазол-2-илокси)фенил]этил }циклопропиламино)пропил]амида пропан-2-сульфоновой кислоты;
этиловый эфир 8-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)октановой кислоты;
1-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-3-фенилмочевина;
8-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)октановая кислота;
[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]амид тетрагидрофуран-2-карбоновой кислоты;
N-[3-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)пропил]-2-гидроксиацетамид;
4-({2-[4-(бензотиазол-2-илокси)фенил]этил}циклопропиламино)масляная кислота;
2-[4-(2-морфолин-4-илэтокси)фенокси]бензотиазол;
2-[4-(2-пиперидин-1-илэтокси)фенокси]бензотиазол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-фенилпиперидин-4-ол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклопропилметилпропиламин;
циклогексилэтил {2-[4-(1-метил-1Н-бензоимидазол-2-илокси)фенил]этил}амин;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-(4-бромфенил)пиперидин-4-ол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-(4-хлорфенил)пиперидин-4-ол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}-4-бензилпиперидин-4-ол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}циклогексилэтиламин;
2-[4-(2-пирролидин-1-илэтил)фенокси]-1H-бензоимидазол;
2-[4-(2-азепан-1-илэтил)фенокси]-1Н-бензоимидазол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}дибутиламин;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}пиперидин-4-ол;
метиловый эфир 1-{2-[4-(1Н-бензоимидазол-2-илокси)фенил]этил}пиперидин-4-карбоновой кислоты;
{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}циклогексэтиламин;
2-{4-[2-(4-метилпиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол;
2-{4-[2-(2-этилпиперидин-1-ил)этокси]фенокси}-1Н-бензоимидазол;
2-[2-(4-пиперидин-1-илэтокси)фенокси]-1Н-бензоимидазол;
1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ол;
1-[4-(2-азепан-1-илэтокси)фенокси]-1Н-бензоимидазоламид;
{3-[4-(1Н-бензоимидазол-2-илокси)фенокси]пропил]диметиламин;
2-[4-(2-пирролидин-1-илэтокси)фенокси]-1Н-бензоимидазол;
{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил]диметиламин;
2-[4-(2-морфолин-4-ил)этокси]фенокси}-1Н-бензоимидазол;
2-[4-(2-пиперидин-1-илэтил)фенокси]бензотиазол;
1-(1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-ил)пирролидин-2-они
этиловый эфир 1-{2-[4-(1Н-бензоимидазол-2-илокси)фенокси]этил}пиперидин-4-карбоновой кислоты.
40. Соединение формулы (III)

и его энантиомер, рацемат или их фармацевтически приемлемая соль, где
Х выбран из группы, состоящей из NR5, О и S, где R5 представляет собой один из Н и СН3;
Y представляет собой О;
Z выбран из группы, состоящей из О и связи;
W выбран из группы, состоящей из CH2 и CHR1-CH3, где R1 представляет собой Н или ОН, и где связанная с R1 углеродная группа в указанном CHR1-СН2 не связана непосредственно с атомом азота, с которым связан указанный W;
R4 выбран из группы, состоящей из Н, ОСН3 и Cl;
R6 представляет собой Н или F; и
R2'' и R3'', каждый независимо, выбран из группы, состоящей из:
A) Н, С1-7алкила, С3-7циклоалкила, С3-7циклоалкил-С1-7алкила, где каждый из заместителей (А) независимо замещен 0 или 1 RQ, где каждый из указанных RQ является заместителем у атома углерода, который представляет собой по меньшей мере один атом углерода, удаленный от атома азота;
B) заместителя HetRa;
C) -С1-7алкил-С(О)Rx;
Н) -С0-4алкил-Ar5, где Ar5 представляет собой 5-членный гетероарил, который имеет один гетероатом, выбранный из группы >NRY, и 0 или 1 дополнительный гетероатом -N=, и необязательно содержит две карбонильные группы, и необязательно бензоконденсирован;
I) -С0-4алкил-Ar5', где Ar5' представляет собой 5-членный гетероарил, который содержит 3 или 4 атома азота;
М) SO2C1-4алкила;
альтернативно, R2'' и R3'', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, которым является указанный присоединенный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из
i) 4-7-членного гетероциклического кольца HetRb, где указанное 4-7-членное гетероциклическое кольцо HetRb имеет один гетероатом, который представляет собой указанный связанный атом азота, и замещено 0, 1 или 2 одинаковыми или различными заместителями, где указанные заместители выбраны из группы, состоящей из -RY -CN, -C(O)RY, -С0-4алкил-CO2RY,
-С0-4алкил-С(O)CO2RY, -С0-4алкил-ORY, -С0-4алкил-С(O)NRYRZ-,
-С0-4алкил-NRYCORZ-, -C(O)NRZRY,
-C0-4алкил-NRYCO2RY,
-C0-4алкил-NRYC(O)NRYRY, -C0-4алкил-NRYC(S)NRYRZ, -NRY(CO)CO2RY,
-C0-4алкил-NRWSO2RY,
1,3-дигидробензоимидазол-2-он-1-ила,
1-RY-1H-тeтpaзoл-5-илa, RY-триазолила, 2-RY-2H-тeтpaзoл-5-илa,
-C0-4алкил-C(O)N(RY)(SO2RY),-C0-4алкил-N(RY)(SO2)NRYRY,
-С0-4алкил-N(RY)(SO2)NRYCO2RY, галогена,  ,
,  и
и  ;
;
ii) 5-7-членного гетероциклического кольца HetRc, имеющего один дополнительный гетероатом, отделенный от указанного присоединенного азота по меньшей мере одним атомом углерода, где указанный дополнительный гетероатом выбран из группы, состоящей из О, S(=O)2 и >NRM, где указанное 5-7-членное гетероциклическое кольцо HetRc имеет 0 или 1 карбонильную группу и замещено 0, 1 или 2 заместителями у одинаковых или различных замещаемых атомов углерода, где указанные заместители выбраны из группы, состоящей из -С(O)RY и RZ;
iii) одного из 1H-тетразол-1-ила, где 1H-тетразол-1-ил замещен у атома углерода 0 или 1 заместителем, таким как -С0-4алкил-RZ, -С0-4алкил-CO2RY; и
iv) одного из бензимидазол-1-ила,
2,8-диазаспиро[4.5]декан-1-он-8-ила,
4-{[(2-трет-бутоксикарбониламиноциклобутанкарбонил)амино]метил}пиперидин-1-ила,
4-{[(2-аминоциклобутанкарбонил)амино]метил}пиперидин-1-ила,
9-ил-трет-бутилового эфира 3,9-диазаспиро[5.5]ундекан-3-карбоновой кислоты,
4-оксо-1-фенил-1,3,8-триазаспиро[4.5]дек-8-ила,и
где заместитель HetRa представляет собой 6-членное гетероциклическое кольцо, имеющее атом углерода в месте присоединения и содержащее группу >NRM в качестве гетероатома, где указанный гетероатом отделен от указанного атома углерода в месте присоединения по меньшей мере 1 дополнительным атомом углерода;
RK выбран из группы, состоящей из Н и -С1-4алкила;
RL выбран из группы, состоящей из -CO2RS;
RS представляет собой водород;
RM выбран из группы, состоящей из RZ, -С(O)RY;
RN выбран из группы, состоящей из ОСН3, Cl, F, Br, I, ОН, NH2, CN, CF3, СН3 и NO2;
RQ выбран из группы, состоящей из -CN, -С0-4алкил-ORY, -С0-4алкил-NRYRY, -С0-4алкил-NRYCORY, -С0-4алкил-NRYCONRYRZ, C0-4алкил-NRYSO2RY,
RW выбран из группы, состоящей из RY;
RX выбран из группы, состоящей из -ORY, -NRYRZ, -С1-4алкила и -С0-4алкил-RAr;
RY выбран из группы, состоящей из Н, С1-4алкила, -С0-4алкил-RAr и -С0-4алкил-RAr', каждый из которых замещен 1 или 2 заместителями RN;
RZ выбран из группы, состоящей из RY, -C1-2алкил-CO2RY;
RAr представляет собой радикал, имеющий атом углерода в положении присоединения, где указанный радикал выбран из группы, состоящей из фенила, пиридила и пиразинила, где каждый атом углерода с допустимой валентностью в каждой из указанных групп независимо замещен по меньшей мере 0,1 или 2 RN или 0 или 1 RL;
RAr' представляет собой 5-6-членное кольцо, которое имеет 1 или 2 гетероатома, выбранных из группы, состоящей из О, S, N и >NRY, и имеет 0 или 2 ненасыщенные связи и 0 или 1 карбонильную группу, где каждый член с допустимой валентностью в каждом из указанных колец независимо замещен 0 или 1 или 2 RK и
при условии, что:
(a) указанные R2'' и R3'', далее удовлетворяют одному из следующих условий:
(е1): по меньшей мере один из указанных R2'' и R3'' не является С1-5алкилом, если Z представляет собой О, и Х представляет собой S;
(е2): ни один из R2'' и R3'' не является -С1-4алкил-С(O)RX, где RX представляет собой один из С1-4алкила, ОН, -ОС1-4алкила, -ОС0-4алкил-RAr или -NRYRY, если Y представляет собой О, Z представляет собой связь, и R2'' отличается от R3''; и
(е3) ни один из R2'' и R3'' не является -С1-4алкил-CN, если Y представляет собой О, Z представляет собой связь, и R2'' отличается от R3''; и
(b) далее при условии, если Х представляет собой S, Y представляет собой О, Z представляет собой связь, и W представляет собой СН2, то один из R2'' и R3'' не является XCG, если другой представляет собой C1-6алкил, где XCG представляет собой группу

где HC16 представляет собой один из Н, C1-6алкила, галоген-С1-6алкила, аллила и C1-6алкоксиметила, и GO представляет собой группу, присоединенную посредством атома углерода, которая имеет заместитель =O, образующий амидогруппу с атомом азота, к которому присоединена указанная группа GO.
41. Соединение по п.40, где указанный R4 представляет собой Н.
42. Соединение по п.40, где указанные R2'' и R3'', каждый независимо, выбран из группы, состоящей из А), В), С) и I), как определено в п.40.
43. Соединение по п.40, где указанные R2'' и R3'', взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, который представляет собой указанный связанный атом азота, где указанное гетероциклическое кольцо выбрано из группы, состоящей из (i) и (ii), как определено в п.40.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Вентиль запорный | 1984 |
|
SU1221441A1 |
| Способ получения производных N-(бензтиазолил-2)амидов бензойной или тиазол-4-карбоновой кислоты | 1989 |
|
SU1681728A3 |
Авторы
Даты
2009-11-20—Публикация
2004-07-27—Подача