Изобретение относится к медицине, а именно к онкологии, и заключается в применении нового пентапептида формулы Val-Val-Tyr-Pro-Asp и приготовленного на его основе лекарственного средства в комплексной терапии рака при лечении и последующей профилактике.
Известно, что опухолевые клетки независимо от их природы выделяют вещества, угнетающие или нарушающие нормальное функционирование иммунной системы [Miescher S., Whiteside T.L., Carrel., Eliender V.. J. Immuol., 1986, Functional properties of tumor-infiltrating and blood lymphocytes in patients with solid tumors: effects of tumor cells and their supernatants on proliferative responses of lymphocytes v.136, №5, p. 1899-1907]. Показано, например, что характерная для острых миелоидных лейкозов (ОМЛ) дисфункция Т-лимфоцитов связана с супрессивным действием на них продуктов лейкозных клеток [Chiao J.W., Heil M., Arlin Z., Lutton J.D., Choi Y.S., Leung K.. Proc. Natl. Acad. Sci., 1986, Suppression of Lymphocyte Activation and Functions by a Leukemia Cell-Derived Inhibitor v.83, p.3432-3446]. Введение в организм известных медиаторов иммунной системы (интерферонов, интерлейкинов, колониестимулирующих факторов), являющихся естественными продуктами иммунокомпетентных клеток, оказывает в ряде случаев выраженный противоопухолевый эффект [Mule J.J., Rosenberg S.A.. Int. J. Cancer-1987, Immune response following intravesical metastases of a mouse carcinoma after in vitro treatment with murine interferon v.40, 830-834]. Используемые в онкологической практике полипептиды (цитокины), такие как интерферон, колониестимулирующие факторы, интерлейкин-2, имеют молекулярную массу 15-70 кДа, их получают, как правило, генно-инженерным способом. Введение в организм больного этих высокомолекулярных веществ в лечебных дозах вызывает тяжелые побочные эффекты. Поскольку терапевтическое, противоопухолевое действие большинства цитокинов основано на восполнении их сниженной в организме опухоленосителей активности, положительный эффект от их использования носит кратковременный, обратимый характер, и для его поддержания требуется многократное введение препарата, что повышает вероятность неблагоприятного, порой летального исхода. Необходимо также учесть, что время полужизни большинства цитокинов в организме составляет минуты, и для достижения лечебного эффекта требуется увеличение вводимых доз препарата, особенно, если необходим повторный курс лечения, что для большинства онкологических больных, как правило, имеет место. Гораздо предпочтительней использовать в качестве лечебных средств низкомолекулярные пептидные соединения, особенно эндогенной природы. Они эффективны в чрезвычайно малых дозах и производят регуляторное, корригирующее влияние на иммунологические сдвиги, не оказывая вредных для организма воздействий.
Наиболее близким аналогом данного изобретения является патент RU 2172322 С1 от 20.08.2001. В нем описываются иммуномодулирующие олигопептиды - аллофероны, индуцирующие синтез эндогенного интерферона. В приведенных примерах показана антивирусная активность аллоферонов и их свойство стимулировать цитотоксическую активность лимфоцитов человека и животных.
Задача изобретения - выявление низкомолекулярного иммуномодулирующего пептида с противоопухолевым действием и создание на его основе лекарственного средства. Поставленная задача достигается тем, что пентапептид формулы Val-Val-Tyr-Pro-Asp обладает способностью восстанавливать функциональную активность Т-лимфоцитов, подавленную продуктами жизнедеятельности опухолевых клеток, и, как следствие этого, тормозит рост ряда мышиных перевиваемых опухолей. Созданное на основе пентапептида лекарственное средство, представляющее собой лиофильно высушенную смесь пентапептида в широком диапазоне доз с наполнителем или водный раствор пептида, также обладает этим свойством и противоопухолевой активностью.
Пентапептид был впервые обнаружен и выделен нами из супернатанта кратковременной культуры клеток костного мозга свиньи методом твердофазной экстракции и последующей очисткой методом офВЭЖХ. Проведенное впоследствии определение первичной структуры методом сиквенирования позволило определить аминокислотную последовательность Val-Val-Tyr-Pro-Asp. Поиск по банку данных пептидных и белковых аминокислотных последовательностей показал уникальность данной структуры и отсутствие подобных последовательностей среди известных белков и пептидов. Пентапептид получают как твердофазным методом на полимерном носителе, так и классическим пептидным синтезом в растворе. Пентапептид Val-Val-Tyr-Pro-Asp является иммуномодулирующим пептидом, стимулирующим противоопухолевую активность иммунной системы человека. Он отличается от ближайших аналогов аллоферонов (патент RU 2172322 C1 от 20.08.2001) как первичной структурой, так и механизмом действия. В отличие от аллоферонов, пентапептид Val-Val-Tyr-Pro-Asp стимулирует выработку эндогенного интерлейкина-2. Механизм противоопухолевого эффекта пентапептида Val-Val-Tyr-Pro-Asp основан на восстановлении функциональной активности Т-лимфоцитов, подавленной продуктами опухолевых клеток в организме опухоленосителя. Пентапептид не оказывает цитостатического действия на опухолевую клетку, а способствует восстановлению противоопухолевого иммунитета, подавленного опухолевыми клетками в организме опухоленосителя.
Нижеприведенные примеры иллюстрируют предлагаемое изобретение
Пример 1.
Синтез пентапептида Val-Val-Tyr-Pro-Asp проводили твердофазным методом на автоматическом синтезаторе пептидов Biosearch 9600 (США) на РАМ-полимере. Синтез осуществлялся Fmoc/DIPCDI-методом. Защищенные аминокислоты присоединяли карбодиимидным методом, для подавления рацемизации добавляли эквимолярные количества 1-оксибензтриазола. При синтезе МП-5 на промежуточных стадиях синтеза альфа-аминогруппы защищали Fmoc-защитой, N-концевой валин присоединяли в виде Вос-производного, ОН-группу тирозина защищали третбутиловым эфиром, а β-СООН группу аспарагиновой кислоты защищали с помощью ОВu t-эфира. Fmoc-группу на промежуточных стадиях синтеза отщепляли смесью пиперидин-толуол-диметилформамид, после окончания синтеза пептид отщепляли от полимера (с одновременным удалением всех защитных групп) водной трифторуксусной кислотой. Полученный пептид выделяли и очищали методом оф ВЭЖХ на колонке Диасорб-130 С-16Т. Гомогенность пептида подтверждалась данным аналитической ВЭЖХ на колонке Ultrasphere ODS C18. Методом масс-спектрометрии и данными сиквенирования показана идентичность синтезированного пептида нативной структуре. Синтезированный пептид имел молекулярный ион [МН]+=591. Определение проводилось масс-спектрометрически на приборе Thermo Bioanalysis Vision 2000 (Англия) с УФ лазером при 337 нм и импульсе 33 нсек. В качестве матрицы использовалась 2,5 дигидробензойная кислота в соотношении вещество - матрица (1:1). На матрицу наносилось 100 рм пептида. Аминокислотную последовательность пептида определяли на газофазном секвенаторе (модель 477А фирмы Applied Biosystem, США), соединенном с автоматическим анализатором фенилтиогидантоинов аминокислот (модель 120А той же фирмы). На стеклянный фильтр реактора секвенатора наносили 25 мкл водного раствора, содержащего 3 мг полибрена, высушивали фильтр в токе аргона и проводили три цикла отщепления для очистки фильтра от фона аминокислот. Далее наносили раствор 100 пмоль пептида в 25% TFA (3×30 мкл), высушивая каждую аликвоту в токе аргона. Проводили 6 циклов анализа, используя стандартные программы отщепления, разделения и идентификации фенилтиогидантоинов аминокислот.
Пример 2.
Известно, что опухолевые клетки больных ОМЛ, а также клетки линии HL-60, ведущей происхождение от лейкозных клеток костного мозга этих больных, продуцируют белки, сопрессирующие функции Т-лимфоцитов, что выражается в резком снижении их способности отвечать пролиферацией на воздействие митогена (фитогемагглютинина, ФГА) [Chiao J.W., Heil M., Arlin Z., Lutton J.D., Choi Y.S., Leung K.. Proc. Natl. Acad. Sci., 1986, Suppression of Lymphocyte Activation and Functions by a Leukemia Cell-Derived Inhibitor v.83, p.3432-3446].
Свежевыделенные Т-лимфоциты из периферической крови здоровых доноров, полученные центрифугированием в градиенте плотности фиколла-урографина, культивировались по 150×103 кл/лунка в стандартной среде в течение 72 ч в присутствии ФГА (Difco, USA) в субоптимальной дозе 2.5 мкг/мл. Одновременно с ФГА в опытные лунки вносились кондиционная среда (КС) от лейкозных клеток HL-60 в различных объемах и пентапептид в широком диапазоне концентраций (1×10-1-1×10-7 г/мл). Для определения уровня пролиферации клеток в лунки вносился раствор [3Н]-тимидина (1 мкКи/мл) за 4 часа до окончания инкубации (37°С+CO2). Радиоактивность каждой пробы определяли на сцинтиляционном счетчике (LKB), а для количественной оценки реакции использовали абсолютную величину включения метки (число импульсов в минуту). Введение в инкубационную смесь 5% КС приводило к снижению уровня пролиферации до 38% по сравнению с контролем (100%, инкубация без КС HL-60 (таблица 1)). Как показано в работе [Chiao J.W., Heil M., Arlin Z., Lutton J.D., Choi Y.S., Leung К.. Proc. Natl. Acad. Sci., 1986, Suppression of Lymphocyte Activation and Functions by a Leukemia Cell-Derived Inhibitor v.83, p.3432-3446] такая супрессия Т-лимфоцитов человека, вызванная действием на них продуктов лейкозных клеток, сопровождается резким спадом продукции Т-лимфоцитами интерлекина-2 и других лимфокинов.
В Таблице 1 представлены результаты по оценке влияния пентапептида на восстановление пролиферативного ответа Т-лимфоцитов, полученных в одном из экспериментов. Установлено, что пентапептид в широком диапазоне концентраций способен восстанавливать пролиферативный ответ на 60-99%.
Пример 3.
Штамм рака шейки матки (РШМ-5) был пассирован на соответствующих линейных мышах для поддержания in vivo. Последующую перевивку опухоли и методику постановки экспериментов осуществляли в соответствии с требованиями, предъявляемыми к изучению новых фармакологических веществ в РФ [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ", МЗ РФ, Департамент контроля качества, эффективности и безопасности лекарственных средств, М., 2000 г., стр.319-325]. Эксперименты проводились на мышах-самкам линии СВА. После перевивки опухоли мышей делили на группы, в каждой группе не менее 10 мышей. Одну группу оставляли без специфического лечения и считали контрольной. Экспериментальным группам животных вводили пентапептид в разовых дозах 1 мг/кг, 500 и 250 мкг/кг подкожно ежедневно в течение 5 дней, начиная со срока 72 часа после перевивки опухоли. Измерения объемов опухолей проводили на 4, 9 и 13 сутки после окончания введения пентапептида. Контрольная группа мышей получала подкожные инъекции физиологического раствора хлористого натрия. За мышами наблюдали в течение 15 дней после окончания лечения, после чего мышей забивали эфирным наркозом. Противоопухолевый эффект пентапептида оценивали по стандартному показателю: торможению роста опухоли (ТРО, %), которое рассчитывается как разница средних объемов опухолей в леченой и контрольной группах по отношению к объему опухолей в контрольной группе и выражается в процентах. Статистическую обработку полученных данных проводили по методу Стьюдента в модификации Р.Б.Стрелкова. В таблице 2 представлены результаты экспериментов, показывающие значимый и достоверный противоопухолевый эффект пентапептида. В ходе эксперимента ни в одном случае введения пентапептида не было отмечено гибели мышей от токсичности пептида, а также изменения поведенческих реакций, внешнего вида мышей и их внутренних органов.
Пример 4.
Штамм опухоли меланома В-16 перевивали и поддерживали на мышах C57BL/6j. Эксперименты проводили на мышах-гибридах лини 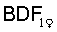 [DBA2xC57BL/6j] с массой тела 18-20 г, которым прививали измельченную опухолевую ткань по 50 мг на мышь. Пентапептид вводился подкожно через 48 часов после перевивки опухоли в разовой дозе 500 мкг/кг ежедневно в течение 5-ти дней. После перевивки опухоли мыши были разделены на группы по 10 особей, контрольная группа мышей получала подкожные инъекции физиологического раствора. Противоопухолевый эффект пентапептида оценивали по стандартному показателю: торможению роста опухоли (ТРО, %). Результаты опытов приведены в таблице 3.
[DBA2xC57BL/6j] с массой тела 18-20 г, которым прививали измельченную опухолевую ткань по 50 мг на мышь. Пентапептид вводился подкожно через 48 часов после перевивки опухоли в разовой дозе 500 мкг/кг ежедневно в течение 5-ти дней. После перевивки опухоли мыши были разделены на группы по 10 особей, контрольная группа мышей получала подкожные инъекции физиологического раствора. Противоопухолевый эффект пентапептида оценивали по стандартному показателю: торможению роста опухоли (ТРО, %). Результаты опытов приведены в таблице 3.
Показано, что введение пентапептида приводит к достоверному противоопухолевому эффекту в 74% торможения роста опухоли на 7-й день после окончания курса лечения, и этот эффект сохраняется в течение двух недель после окончания курса лечения. Как и в примере 2, пептид нетоксичен при использованных дозах введения.
[638-1332]
[1456-8670]
[4118-12435]
[175-347]
[597-1825]
[2205-4641]
Пример 5.
На основе пентапептида была разработана и приготовлена лекарственная форма препарата, которая представляет собой лиофильно высушенную смесь (1:1) глицина и пентапептида Val-Val-Tyr-Pro-Asp (по 1 мг). Препарат имел вид белого или желтоватого аморфного порошка или пористой массы и был расфасован во флаконы из нейтрального стекла, укупоренные резиновыми пробками и обкатанные алюминиевыми колпачками.
В экспериментах использовались мыши линии СВА с подкожно перевитым РШМ-5. После перевивки опухоли мышей делили на группы, в каждой группе не менее 10 мышей. Контрольной группе вводили пентапептид Val-Val-Tyr-Pro-Asp в разовой дозе 1 мг/кг. Экспериментальным группам животных вводили лекарственную форму препарата в разовой дозе 1 мг/кг подкожно ежедневно в течение 5 дней, начиная со срока 72 часа после перевивки опухоли. Противоопухолевый эффект пентапептида оценивали по стандартному показателю: торможению роста опухоли (ТРО, %). В таблице 3 приведены результаты экспериментов. Показано, что и пентапептид, и "сухая" лекарственная форма пентапептида оказались практически равноэффективными по противоопухолевой активности и вызывали достоверное торможение РШМ-5.
Пример 6.
На основе пентапептида была разработана и приготовлена жидкая лекарственная форма препарата, которая является прозрачным водным (специальная деминерализованная и апирогенная вода) раствором пентапептида Val-Val-Tyr-Pro-Asp, разлитым в стерильные флаконы из нейтрального стекла, укупоренные резиновыми пробками и обкатанные алюминиевыми колпачками.
В экспериментах использовались мыши линии СВА с подкожно перевитым РШМ-5. После перевивки опухоли мышей делили на группы, в каждой группе не менее 10 мышей. Контрольной группе вводили пентапептид Val-Val-Tyr-Pro-Asp в разовой дозе 1 мг/кг. Экспериментальным группам животных вводили жидкую лекарственную форма препарата в разовой дозе 1 мг/кг подкожно ежедневно в течение 5 дней, начиная со срока 72 часа после перевивки опухоли. Противоопухолевый эффект МП-5 оценивали по стандартному показателю: торможению роста опухоли (ТРО, %). В таблице 4 приведены результаты экспериментов. Результаты экспериментов подтверждают то, что жидкая лекарственная форма препарата вызывает достоверное и значимое ТРО в той же степени, что и пентапептид.
Таким образом, приведенные примеры доказывают, что открытый и синтезированный нами пентапептид Val-Val-Tyr-Pro-Asp обладает иммуномодулирующими свойствами, восстанавливая подавленную опухолевыми клетками функциональную активность Т-лимфоцитов, и, как следствие, обладает противоопухолевой активностью, подавляя рост различных опухолей (РШМ-5 и меланома В-16 и др.). Созданные на основе пентапептида различные виды лекарственной формы препарата оказались практически равноэффективными по противоопухолевой активности и вызывали достоверное торможение опухоли.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1993 |
|
RU2067870C1 |
| ПРОТИВООПУХОЛЕВЫЕ И АНТИВИРУСНЫЕ ПЕПТИДЫ | 2004 |
|
RU2267496C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ПЕПТИДА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2362579C1 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕЙ | 2012 |
|
RU2530592C2 |
| ВЫСОКОЭФФЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОЙ ФОРМЫ АДРЕСНОГО ДЕЙСТВИЯ ДЛЯ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2019 |
|
RU2727924C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ | 2003 |
|
RU2254139C1 |
| Пептид, обладающий противоопухолевой и антиметастатической активностью, и готовая лекарственная форма на его основе | 2018 |
|
RU2682039C1 |
| ПЕПТИД С АНТИПРОЛИФЕРАТИВНОЙ АКТИВНОСТЬЮ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2446174C2 |
| АЛЛОФЕРОНЫ-ИММУНОМОДУЛИРУЮЩИЕ ПЕПТИДЫ | 1999 |
|
RU2172322C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2292209C2 |
Изобретение относится к медицине, а именно к онкологии, и касается иммуномодулятора с противоопухолевой активностью и лекарственного средства на его основе. Сущность: изобретение включает иммуномодулятор, представляющий собой пентапептид формулы Val-Val-Tyr-Pro-Asp, и лекарственное средство на его основе (жидкая и сухая форма). Как сам пентапептид, так и его лекарственная форма обладают противоопухолевой активностью, вызывая в малых дозах достоверное торможение опухоли, и при этом не оказывают вредных для организма воздействий. Преимущество изобретения заключается в выявлении нового низкомолекулярного пептида, обладающего иммуномодулирующей активностью, и создании на его основе противоопухолевого препарата. 2 н.п. ф-лы, 4 табл.
| АЛЛОФЕРОНЫ-ИММУНОМОДУЛИРУЮЩИЕ ПЕПТИДЫ | 1999 |
|
RU2172322C1 |
| ПЕПТИД, ОБЛАДАЮЩИЙ ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ, И ПРЕПАРАТ НА ЕГО ОСНОВЕ | 1997 |
|
RU2142958C1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 6767890 А, 27.07.2004 | |||
| US 6136781 А, 24.10.2000 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| JP 4089433 А, 23.03.1992. | |||
Авторы
Даты
2006-09-20—Публикация
2005-04-27—Подача