Настоящее изобретение касается способа получения соединений, содержащих две нитрильные функциональные группы.
Более конкретно, оно касается способа получения динитрильных соединений, исходя из соединений, содержащих одну нитрильную группу и одну ненасыщенную двойную связь.
Динитрильные соединения, в частности адипонитрил, представляют собой важные промежуточные химические продукты для синтеза многих соединений. Так, адипонитрил используют для получения гексаметилендиамина, одного из мономеров полиамидов. Равным образом, он может быть использован для получения аминокапронитрила или капролактама, важных мономеров для производства различных полиамидов.
Среди способов, предлагаемых для синтеза адипонитрила, способ, в котором используют бутадиен в качестве исходного продукта и реакцию гидроцианирования с цианистым водородом, является наиболее разработанным с промышленной точки зрения.
Способ заключается в том, что на первой стадии осуществляют гидроцианирование олефина, такого как бутадиен, с получением соединений, содержащих одну нитрильную группу и одну ненасыщенную двойную связь. Обычно эту стадию осуществляют в присутствии каталитической системы, содержащей металлорганическое комплексное соединение, образованное металлом, таким как никель, и фосфорорганическим лигандом.
После разделения ненасыщенных мононитрильных соединений и, в случае необходимости, очистки их превращают в динитрильные соединения второй реакцией гидроцианирования, осуществляемой также в присутствии каталитической системы, содержащей металлорганическое комплексное соединение, образованное металлом, таким как никель, и фосфорорганическим лигандом. Кроме того, каталитическая система содержит сокатализатор, представляющий собой обычно кислоту Льюиса.
Под кислотой Льюиса подразумевают, согласно обычному определению, соединения, являющиеся акцепторами электронных пар. Обычно кислоты Льюиса представляют собой соли металлических элементов, как это описано ниже.
В современных способах кислоту Льюиса сохраняют в реакционной среде, в частности, во время стадии экстракции динитрилов. Затем кислоту Льюиса удаляют с кубовым остатком дистилляции, в частности, когда она не выделяется из среды совместно с металлорганическим комплексным соединением, используемым в качестве каталитической системы.
Присутствие кислоты Льюиса во время дистилляции динитрила может содействовать образованию примесей в среде, примесей, которые могут присутствовать в перегнанном динитриле. Кроме того, удаление кислоты Льюиса и ее выброс как эффлюента могут быть вредными для экономики способа и окружающей среды. Одной из целей настоящего изобретения является предложить способ получения динитрильных соединений, не содержащий упомянутых неудобств.
С этой целью, согласно изобретению предлагается способ получения динитрильных соединений гидроцианированием цианистым водородом соединений, содержащих одну нитрильную функциональную группу и одну ненасыщенную двойную связь, в присутствии каталитической системы, содержащей металлорганическое комплексное соединение и сокатализатор, образованный соединением металла.
Согласно изобретению способ включает в себя, после осуществления стадии гидроцианирования, следующие последовательные стадии:
I. Обработка реакционной среды Е1, полученной после стадии гидроцианирования ненасыщенных нитрильных соединений, для того, чтобы выделить из вышеупомянутой среды, по меньшей мере, металлорганическое комплексное соединение и получить вторую среду Е2;
II. Обработка вышеупомянутой второй среды Е2 пропусканием через ионообменную смолу для того, чтобы извлечь, по меньшей мере, металл, образующий сокатализатор, и получить третью среду Е3, и
III. Выделение образовавшихся динитрилов из вышеупомянутой среды Е3,
при этом порядок стадий II) и III) может быть обратным.
Согласно предпочтительной характеристике изобретения катализатор представляет собой кислоту Льюиса. Более конкретно, кислоты Льюиса, названные в работе, изданной G.A. OLAH "Friedel-Crafts and related Reactions", том 1, стр. 191-197 (1953), являются подходящими для изобретения.
Кислоты Льюиса, которые могут быть использованы в настоящем изобретении в качестве сокатализаторов, выбраны среди соединений элементов Iб, IIб, IIIa, IIIб, IVa, IVб, Va, Vб, VIб, VIIб или VIII групп Периодической системы элементов. Данные соединения, чаще всего, представляют собой соли, в частности галогениды, такие как хлориды или бромиды, сульфаты, сульфонаты, галогеналкилсульфонаты, пергалогеналкилсульфонаты, в частности фторалкилсульфонаты или перфторалкилсульфонаты, галогенацетаты, пергалогенацетаты, карбоксилаты и фосфаты.
В качестве примеров таких кислот Льюиса, не носящих ограничительного характера, можно назвать хлорид цинка, бромид цинка, йодид цинка, хлорид марганца, бромид марганца, хлорид кадмия, бромид кадмия, хлорид олова (II), бромид олова (II), сульфат олова (II), тартрат олова (II), хлорид индия, трифторметилсульфонат индия, трифторацетат индия, хлориды или бромиды редкоземельных элементов, таких как лантан, церий, празеодим, неодим, самарий, европий, гадолиний, тербий, диспрозий, гафний, эрбий, таллий, иттербий и лютеций, хлорид кобальта, хлорид железа (II), хлорид иттрия.
Равным образом, в качестве кислоты Льюиса можно использовать такие соединения, как трифенилборан, изопропилат титана.
Разумеется, можно использовать смеси из нескольких кислот Льюиса.
Из кислот Льюиса особенно предпочтительны хлорид цинка, бромид цинка, хлорид олова (II), бромид олова (II), трифенилборан, трифторметилсульфонат индия, трифторацетат индия и смеси хлорид цинка/хлорид олова (II).
Кислота Льюиса, используемая в качестве сокатализатора, присутствует обычно в количестве от 0,01 до 50 моль на моль соединения переходного металла, более конкретно, соединения никеля.
Согласно предпочтительному варианту осуществления изобретения стадию II) обработки на ионообменных смолах осуществляют перед выделением динитрильных соединений из среды Е3.
В самом деле, выделение динитрильных соединений осуществляют обычно дистилляцией, следовательно, при нагреве среды Е3, содержащей эти соединения. Предпочтительно удаляют металлические элементы, содержащиеся в среде Е3, перед тем, как осуществлять такой нагрев, для того, чтобы не дать им способствовать протеканию побочных реакций или реакций разложения динитрилов. Упомянутые побочные реакции или реакции разложения порождают побочные продукты со структурой, близкой к структуре динитрилов, трудно отделяемые от них.
Так, в случае адипонитрила, могут быть получены некоторые примеси, такие как 1-имино-2-цианоциклопентен (ИЦЦП) (ICCP). Эти примеси обнаруживаются, частично, в перегнанном адипонитриле. Примеси и продукты их гидрирования могут также обнаруживаться в гексаметилендиамине (ГМД) (HMD), полученном гидрированием упомянутого адипонитрила, и даже в полиамиде, полученном исходя из ГМД.
Таким образом, упомянутые примеси могут приводить к появлению аномалий в процессах переработки упомянутых полиамидов, в частности, в процессах прядения (увеличение числа обрывов волокон), или в стабильности и окраске полиамида.
Согласно предпочтительной характеристике изобретения металлорганическое комплексное соединение, образующее каталитическую систему, представляет собой обычно координационный комплекс между металлическим элементом, выбранным среди переходных металлов, и лигандами, обычно фосфорорганическими лигандами.
Такие металлорганические комплексные соединения описаны в многочисленных публикациях и многочисленных патентах, таких как US 3496215, DE 19953058, FR 1529134, FR 2069411, US 3631191, US 3766231, FR 2523974, WO 9906355, WO 9906356, WO 9906357, WO 9906358, WO 9952632, WO 9965506, WO 9962855, US 5693843, WO 961182, WO 9622968, US5981772, WO 0136429, WO 9964155, WO 0213964.
Металлические элементы выбирают обычно из группы, включающей в себя никель, кобальт, железо, рутений, родий, палладий, осмий, иридий, платину, медь, серебро, золото, цинк, кадмий, ртуть. Среди перечисленных металлов никель является предпочтительным металлом.
В вышеупомянутых комплексных соединениях металлов металл находится в особенной степени окисления, в частности нулевой, например, для никеля.
В ходе реакции гидроцианирования часть металлического элемента (например, никеля) может быть окислена до более высокой степени окисления, например, 1 или 2, и, следовательно, более не являться экстрагируемой из реакционной среды Е1 во время стадии I) способа согласно изобретению. Ее присутствие в реакционных средах Е2 или Е3 может породить неудобства, подобные возникающим с металлическими элементами, происходящими из сокатализатора.
Упомянутое неудобство устраняется способом согласно изобретению, который позволяет, согласно предпочтительной характеристике, совместно экстрагировать указанные металлические элементы в ходе стадии (II) обработки на ионообменных смолах, выбирая смолу и соответствующие условия экстракции. Равным образом, можно, не выходя из объема патентной охраны настоящего изобретения, использовать две или несколько смол, в сочетании или последовательно, для того, чтобы обеспечить возможность экстракции указанных металлических элементов совместно или последовательным образом.
В качестве металлорганических комплексных соединений, подходящих для изобретения, можно назвать металлорганические комплексные соединения, полученные исходя из соединений никеля и фосфорорганических соединений, принадлежащих к семействам монодентантных или полидентантных органофосфитов, органофосфинитов, органофосфонитов и органофосфинов. Равным образом, можно использовать металлорганические комплексные соединения, полученные на основе стильбина или арсина в сочетании с никелем или одним из металлов, названных ранее. Примеры фосфорорганических соединений описаны в многочисленных публикациях и многочисленных патентах. Например, можно назвать в качестве примера монодентантных соединений трифенилфосфит, тритолилфосфит, тритимолфосфит, трифенилфосфинит, тритолилфосфинит, тритимолфосфинит, трифенилфосфонит, тритолилфосфонит, тритимолфосфонит, трифенилфосфин, тритолилфосфин, тритимолфосфин.
В качестве бидентантных соединений можно привести, в качестве примера, следующие структуры, в которых Ph обозначает фенил:

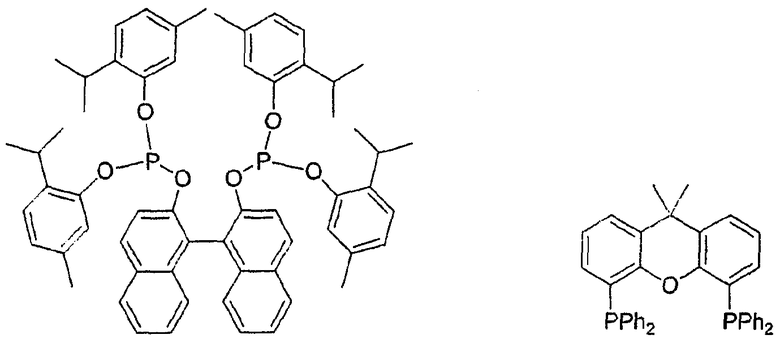
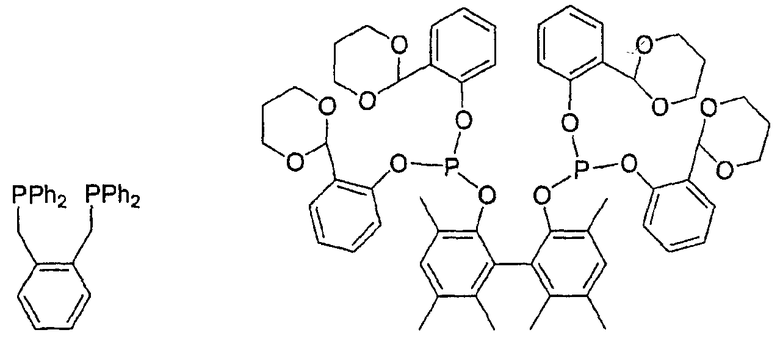
Вообще, все фосфорорганические лиганды являются подходящими для изобретения.
В качестве примера можно также назвать лиганды и каталитические системы, описанные в патентах WO 95/30680, WO 96/11182, WO 99/06358, WO 99/13983, WO 99/64155, WO 01/21579, WO 01/21580.
Металлорганические комплексные соединения могут быть получены перед их добавлением в реакционную среду или in situ.
Получение металлорганических комплексных соединений может быть осуществлено приведением в контакт соединения выбранного металла с раствором фосфорорганического соединения.
Соединение металла может быть растворено в растворителе.
Металл может находиться в используемом соединении либо в степени окисления, в которой он будет в металлорганическом комплексном соединении, либо в высшей степени окисления.
В качестве примера можно указать, что в металлорганических комплексных соединениях согласно изобретению родий находится в степени окисления (I), рутений - в степени окисления (II), платина - в степени окисления (0), палладий - в степени окисления (0), осмий - в степени окисления (II), иридий - в степени окисления (I), никель - в степени окисления (0).
Если при получении металлорганического комплексного соединения металл используют в более высокой степени окисления, он должен быть восстановлен in situ.
В качестве примера, не носящего ограничительного характера, соединений металлов, используемых для получения упомянутых комплексных соединений, можно назвать металлические порошки, такие как порошок никеля, и следующие соединения:
- соединения, в которых никель находится в степени окисления ноль, такие как тетрацианоникелят калия K4[Ni(CN4], бис(акрилонитрил)никель(0), бис(циклооктадиен-1,5)никель (называемый также Ni(cod)2), и производные, содержащие лиганды, такие как тетракис(трифенилфосфин)никель(0);
- соединения никеля, такие как карбоксилаты (в частности, ацетат), карбонат, бикарбонат, борат, бромид, хлорид, цитрат, тиоцианат, цианид, формиат, гидроксид, гидрофосфит, фосфит, фосфат и производные, йодид, нитрат, сульфат, сульфит, арил- и алкилсульфонаты.
Когда используемое соединение никеля соответствует степени окисления никеля больше 0, в реакционную среду добавляют восстановитель никеля, взаимодействующий предпочтительно с ним в условиях реакции. Упомянутый восстановитель может быть органическим или минеральным. В качестве примеров, не носящих ограничительного характера, можно назвать боргидриды, такие как BH4Na, BH4K, порошок Zn, магний или водород.
Когда используемое соединение никеля соответствует степени окисления никеля 0, равным образом, можно добавить восстановитель типа упомянутых выше, но упомянутая добавка не является обязательной.
Когда используют соединение железа, подходят те же самые восстановители.
В случае палладия восстановителями могут быть, кроме того, элементы реакционной среды (фосфин, растворитель, олефин).
Сокатализатор или кислота Льюиса присутствует в каталитической системе в количестве, находящемся в интервале от 0,01 до 50 моль кислоты Льюиса на моль металлического элемента металлорганического комплексного соединения, как, например, никеля, и предпочтительно от 0,05 до 10 моль/моль. Кислота Льюиса может быть добавлена в реакционную среду непосредственно или с металлорганическим комплексным соединением.
Реакцию гидроцианирования осуществляют обычно при температуре в интервале от 10°C до 200°C, предпочтительно от 30°C до 120°C.
Реакция гидроцианирования может быть проведена без растворителя, но может быть выгодно добавить инертный органический растворитель. Данный растворитель может быть растворителем каталитической системы, который является смешивающимся с фазой или со средой, содержащей соединение, подлежащее гидроцианированию, по меньшей мере, при температуре гидроцианирования.
Упомянутая реакция, а также способ согласно изобретению, могут быть осуществлены непрерывным или периодическим образом.
Эта реакция может быть также осуществлена в присутствии двухфазной системы, содержащей, в частности, водную фазу, в которой растворимо металлорганическое комплексное соединение. В данном варианте осуществления водную фазу с наибольшей частью металлорганического комплексного соединения по окончании реакции отделяют, органическая фаза, содержащая динитрилы и ненасыщенные нитрилы, которые не прореагировали, представляет собой, с точки зрения настоящего изобретения, среду Е1. В самом деле, интересно очистить полученную органическую фазу способом согласно изобретению с извлечением небольшой части металлорганического комплексного соединения и кислоты Льюиса, содержащихся в вышеупомянутой фазе.
Реакционную среду Е1, полученную на выходе из реактора гидроцианирования, подают, согласно предпочтительному варианту осуществления изобретения, на стадию I) экстракции металлорганического комплексного соединения.
Эта стадия может заключаться в экстракции вышеупомянутого комплексного соединения растворителем в установке для жидкофазной экстракции. В качестве экстрагирующего растворителя, в порядке примера, можно назвать алканы, содержащие от 5 до 9 атомов углерода, такие как пентан, гексан, гептан, циклоалканы, содержащие от 5 до 8 атомов углерода, такие как циклогексан, метилциклогексан, циклооктан, галогенсодержащие углеводороды, содержащие от 1 до 5 атомов углерода, такие как хлороформ, дихлорэтан, тетрахлорид углерода, хлорпропан, дихлорметан, замещенные или незамещенные ароматические соединения, содержащие от 6 до 9 атомов углерода, такие как бензол, толуол, ксилол, этилбензол, изопропилбензол.
Упомянутое разделение, равным образом, может быть достигнуто дистилляцией ненасыщенных динитрилов и получением двухфазной системы, одна из фаз которой содержит металлорганическое комплексное соединение, при этом другая фаза содержит, главным образом, динитрилы. Последняя фаза может быть подвергнута жидкофазной экстракции с использованием растворителей, описанных выше, для того, чтобы извлечь следовые количества металлорганического комплексного соединения.
Экстрагированное таким образом металлорганическое комплексное соединение может быть возвращено в реакцию гидроцианирования. По окончании стадии I) получают реакционную среду Е2, которая более не содержит металлорганического комплексного соединения. Под термином «более не содержит» надо понимать, что максимальное количество металлорганического комплексного соединения было экстрагировано, но в среде могут оставаться следовые количества вышеупомянутого комплексного соединения, что не приводит к выходу из объема патентной охраны изобретения.
Полученная реакционная среда Е2 содержит образовавшиеся динитрилы, а также кислоту Льюиса и, в известных случаях, соединения металлического элемента, происходящего из металлорганического комплексного соединения, подвергшегося или не подвергшегося окислению.
Согласно предпочтительному способу осуществления изобретения упомянутую реакционную среду Е2 подвергают обработке на ионообменных смолах, позволяющей связать и извлечь металлические ионы кислоты Льюиса и, в известных случаях, окисленные металлические ионы, происходящие из металлорганического комплексного соединения, находящиеся в вышеупомянутой среде Е2.
Ионообменные смолы, подходящие для настоящего изобретения, выбирают в зависимости от природы металлических элементов, подлежащих извлечению. Так, упомянутые смолы могут представлять собой одну из смол, принадлежащих к группе, включающей в себя сильные или слабые катионообменные смолы, адсорбирующие смолы, хелатирующие смолы и каталитические смолы. В качестве примеров смол можно назвать сульфоновые смолы, карбоксильные смолы, иминодиуксусные смолы, смолы, поставляемые под товарными названиями AMBERLITE и AMBERLYST фирмой ROHM & HAAS, DOWEX фирмой DOW, LEVATITE или IONAC фирмой BAYER.
Упомянутая стадия II) может быть осуществлена в любом устройстве, известном специалисту. Так, можно использовать колонки, содержащие вышеупомянутые смолы в форме неподвижного слоя или псевдоожиженного слоя, или в системах с мембраной, сформированной из вышеупомянутой смолы.
После обработки на смоле получают реакционную среду Е3, которая содержит, по существу, образовавшиеся динитрильные органические соединения. Эти различные соединения будут разделены преимущественно на стадии (III) дистилляции. Однако другие способы разделения могли бы быть использованы, не выходя при этом из объема патентной охраны изобретения.
С другой стороны, стадия II) обработки на смолах содержит также стадию элюирования смол, нагруженных экстрагированными металлическими элементами, для того, чтобы таким образом регенерировать смолы и извлечь упомянутые металлические элементы.
Упомянутое элюирование представляет собой классическую и обычную стадию способов обработки на ионообменных смолах. Оно может быть осуществлено, в частности, с использованием сильных кислот, таких как серная и соляная кислоты, или сильных органических кислот и, предпочтительно, кислоты, соответствующей аниону регенерируемой кислоты Льюиса.
В объеме настоящего изобретения эта стадия элюирования может дать возможность выделить и регенерировать кислоту Льюиса и, таким образом, дать возможность ее повторного использования на стадии гидроцианирования. Эта возможность является важным преимуществом для того, чтобы обеспечить экономичное использование способа и сохранение окружающей среды, в частности, когда соединение, используемое в качестве кислоты Льюиса, является дорогостоящим и/или обладает свойством, вредным для окружающей среды.
Способ согласно изобретению применим, в частности, к алифатическим нитрилам, содержащим ненасыщенную двойную связь, и, более конкретно, линейным пентеннитрилам, таким как пентен-3-нитрил, пентен-4-нитрил.
Упомянутые пентеннитрилы могут содержать небольшие количества других соединений, таких как 2-метилбутен-3-нитрил, 2-метилбутен-2-нитрил, пентен-2-нитрил, валеронитрил, адипонитрил, 2-метилглутаронитрил, 2-этилсукцинонитрил. Указанные соединения присутствуют в пентеннитрилах, в частности, когда эти последние происходят с первой стадии гидроцианирования бутадиена в ненасыщенные мононитрилы.
Обычно упомянутую первую стадию осуществляют в присутствии катализатора, содержащего металлорганическое комплексное соединение, но в отсутствие сокатализатора. Металлорганическое комплексное соединение, используемое на упомянутой первой стадии, может быть отличным или идентичным металлорганическому соединению, используемому в способе согласно изобретению. В случае, когда оно является идентичным, металлорганическое комплексное соединение, извлекаемое на стадии I) способа согласно изобретению, может быть возвращено в реактор гидроцианирования первой стадии гидроцианирования бутадиена.
Мононитрилы, вводимые в способ согласно изобретению, могут также происходить со стадии изомеризации, обычно связанной с первой стадией, упомянутой выше, которая заключается в выдерживании соединений, полученных на первой стадии, упомянутой выше, в присутствии каталитической системы, содержащей металлорганическое комплексное соединение, преимущественно идентичное металлорганическому комплексному соединению первой стадии, в отсутствие цианистого водорода.
Указанная стадия изомеризации имеет целью улучшить селективность процесса по ненасыщенным линейным мононитрилам.
Другие преимущества и детали изобретения проявятся более ясно при рассмотрении примеров, представленных ниже только для сведения и для иллюстрации.
Пример 1
Готовят раствор трифторацетата индия (0,5 г, 1,10 ммоль) в смеси 3-пентеннитрила (36,4 г, 448 ммоль) и адипонитрила (63,6 г, 588 ммоль). Состав среды определяют методом элементного анализа.
Части по 4 мл полученного раствора приводят в контакт с 2 мл каждой из следующих смол, поставляемых в продажу фирмой Rohm & Haas под товарными названиями, указанными ниже:
- сульфоновая смола (Amberlite 252H),
- хелатирующая смола (IRC 748),
- адсорбирующая смола (Amberlite XAD7)
- и катионная смола (IRC 50).
Каждую из сред перемешивают 4 ч при комнатной температуре (20°С). Смолу отделяют фильтрованием и состав фильтрата определяют методом элементного анализа.
Составы исходных сред и фильтратов представлены в таблице I, следующей ниже:
Пример 2
Стеклянную колонку заполняют 100 мл сульфоновой смолы (Amberlite 252H). В верхнюю часть колонки с производительностью 340 г/ч непрерывно подают раствор 3-пентеннитрила и адипонитрила (30/70 в молях), содержащий трифторацетат индия, концентрация которого, выраженная в расчете на элемент индий, равна 3300 ч/млн. Пробы отбирают на выходе из колонки каждые 10 минут. Концентрацию индия в пробах измеряют методом элементного анализа. В течение трех часов работы разделительной колонки концентрация смолы в пробах всегда была ниже 20 ч/млн.
Пример 3
Готовят раствор хлорида цинка (0,1 г, 0,73 ммоль) в смеси 3-пентеннитрила (36,4 г, 448 ммоль) и адипонитрила (63,6 г, 588 ммоль). Состав среды определяют методом элементного анализа.
Четыре миллилитра (4 мл) полученного раствора перемешивают в течение 4 ч при комнатной температуре (20°С) в присутствии 2 мл сульфоновой смолы (Amberlite 252H). Анализ раствора до и после обработки на смоле показывает, что концентрация Zn в растворе изменяется от 480 ч/млн. до 8 ч/млн.
Пример 4
Осуществляют реакцию гидроцианирования 3-пентеннитрила в адипонитрил, катализируемую системой Ni°/фосфорорганический лиганд/кислота Льюиса (In). Фосфорорганический лиганд представляет собой соединение следующей формулы:
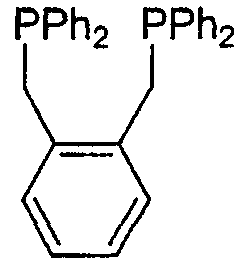
Части по 3 мл полученной реакционной среды перемешивают в течение 4 ч при комнатной температуре (около 20°С) в присутствии 3 мл одной из следующих смол:
- сульфоновая смола (Amberlite 252H),
- хелатирующая смола (IRC 748),
- адсорбирующая смола (Amberlite XAD7).
Состав реакционной среды до и после обработки на смоле представлен в таблице II, следующей ниже:
после
обработки
Проведенные испытания показывают, что можно извлекать индий, происходящий из кислоты Льюиса, но, равным образом, в определенных условиях, окисленный никель, происходящий из металлорганического комплексного соединения, используемого в качестве катализатора.
Изобретение относится к способу получения динитрильных соединений гидроцианированием мононитрильных соединений, содержащих ненасыщенную двойную связь, путем взаимодействия с цианистым водородом в присутствии каталитической системы, содержащей металлорганическое комплексное соединение и сокатализатор. При этом способ содержит следующие последовательные стадии: (I) обработку реакционной среды E1, полученной после гидроцианирования ненасыщенных нитрильных соединений, для того, чтобы отделить металлорганическое комплексное соединение каталитической системы путем жидкофазной экстракции и получить вторую среду Е2; (II) обработку вышеупомянутой второй среды E2 ионообменной смолой для того, чтобы, по меньшей мере, извлечь металлические ионы, происходящие из сокатализатора, и получить третью среду Е3; (III) выделение образовавшихся динитрилов из третьей среды Е3, причем металлорганическое комплексное соединение получено из соединений никеля и фосфорорганического лиганда, а сокатализатор представляет собой кислоту Льюиса. Способ позволяет выделить и регенерировать кислоту Льюиса из реакционной среды с последующей возможностью повторного использования ее на стадии гидроцианирования. 11 з.п. ф-лы, 2 табл.
(I) обработка реакционной среды E1, полученной после гидроцианирования ненасыщенных нитрильных соединений, для того чтобы отделить металлорганическое комплексное соединение каталитической системы путем жидкофазной экстракции и получить вторую среду Е2;
(II) обработка вышеупомянутой второй среды Е2 ионообменной смолой, для того чтобы, по меньшей мере, извлечь металлические ионы, происходящие из сокатализатора, и получить третью среду Е3;
(III) выделение образовавшихся динитрилов из третьей среды Е3,
причем металлорганическое комплексное соединение получено из соединений никеля и фосфорорганического лиганда, а сокатализатор представляет собой кислоту Льюиса.
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ К ПИЩЕ | 2002 |
|
RU2212155C1 |
| US 6207851 B1, 27.03.2001 | |||
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ПОЛУЧЕНИЯ КАТАЛИЗАТОРА НА ОСНОВЕ ПЕРЕХОДНОГО МЕТАЛЛА И ФОСФИНА | 1996 |
|
RU2167716C2 |
| US 3766241 А, 16.10.1973 | |||
| WO 9906356 А, 11.02.1999 | |||
| Способ получения адипонитрила | 1977 |
|
SU677650A3 |
Авторы
Даты
2006-10-27—Публикация
2004-01-22—Подача