Данная заявка заявляет приоритет Патентной заявки США №09/732234, поданной 7 декабря 2000 года, и Предварительной заявка США №60/244665, поданной 31 октября 2000 года. Во всей данной заявке делаются ссылки на различные публикации. Описания этих публикаций в их полном виде включены тем самым в качестве ссылки в данную заявку.
Область изобретения
Областью данного изобретения является способ конструирования и использования больших ДНК-векторов для нацеливания, через гомологичную рекомбинацию, на эндогенные гены и хромосомные локусы в эукариотических клетках и модификации этих генов и локусов любым желаемым образом. Эти большие нацеливающие на ДНК векторы для эукариотических клеток, названные LTVEC, получают из фрагментов клонированной геномной ДНК, более крупных, чем фрагменты, обычно используемые в других подходах, предназначенных для выполнения гомологичного нацеливания в эукариотических клетках. Кроме того, область данного изобретения обеспечивает быстрый и удобный способ обнаружения эукариотических клеток, в которых этот LTVEC был правильно нацелен, и модифицировал желательный эндогенный ген (гены) или хромосомный локус (локусы). Эта область включает в себя также применение этих клеток для генерирования организмов, несущих данную генетическую модификацию, сами эти организмы и способы их применения.
Введение
Применение LTVEC обеспечивает существенные преимущества над существующими в настоящее время способами. Например, поскольку их получают из ДНК-фрагментов, более крупных, чем фрагменты, используемые в настоящее время для генерирования нацеливающих векторов, LTVEC могут быть более быстро и более удобным образом генерированы из доступных библиотек больших геномных ДНК-фрагментов (таких как библиотека ВАС, библиотека бактериальных искусственных хромосом и библиотека РАС), чем нацеливающие векторы, полученные с использованием существующих в настоящее время технологий. Кроме того, могут быть генерированы более удобным образом, чем при использовании существующих в настоящее время технологий, большие модификации, а также модификации, охватывающие большие районы генома.
Кроме того, данное изобретение использует преимущество длинных районов гомологии для увеличения частоты нацеливания на "трудные для нацеливания" локусы, а также уменьшает выгоду, если она вообще имеется, использования изогенной ДНК в этих нацеливающих векторах.
Таким образом, данное изобретение обеспечивает быстрый, удобный и улучшенный способ для системной модификации фактически всех эндогенных генов и хромосомных локусов конкретного организма.
Предпосылки изобретения
Было показано, что нацеливание на гены посредством гомологичной рекомбинации между гомологичной экзогенной ДНК и эндогенными хромосомными последовательностями является чрезвычайно ценным путем создания делеций, инсерций, сконструированных мутаций, точных мутаций генов, введения трансгенов или создания других генетических модификаций у мышей. Существующие в настоящее время способы включают в себя применение стандартных нацеливающих векторов, причем их районы гомологии относительно эндогенной ДНК обычно имеют общую длину менее чем 10-20 т.п.н., для введения желаемой генетической модификации в мышиные эмбриональные стволовые (ES) клетки с последующей инъекцией этих измененных ES-клеток в мышиные эмбрионы для передачи этих сконструированных генетических модификаций в мышиную зародышевую линию (Smithies et al., Nature, 317:230-234, 1985; Thomas et al., Cell, 51:503-512, 1987; Koller et al., Proc Natl Acad Sci USA, 86:8927-8931, 1989; Kuhn et al., Science, 254:707-710, 1991; Thomas et al., Nature, 346:847-850, 1990; Schwartzberg et al., Science, 246:799-803, 1989; Doetschman et al., Nature, 330:576-578, 1987; Thomson et al., Cell, 5:313-321, 1989; DeChiara et al., Nature, 345:78-80, 1990; U.S. Patent No. 5789215, issued August 4, 1998 in the name of GenPhann International). В этих существующих в настоящее время способах обнаружение редких ES-клеток, в которых стандартные нацеливающие векторы были правильно нацелены и модифицировали желаемый эндогенный ген (гены) или хромосомный локус (локусы), требует информации последовательности вне гомологичных нацеливающих последовательностей, содержащихся в данном нацеливающем векторе. Анализы на успешное нацеливание включают в себя стандартный блоттинг по Саузерну или продолжительную ПЦР (Cheng, et al., Nature, 369:684-5, 1994; Foord and Rose, PCR Methods Appl, 3:S149-61, 1994; Ponce and Micol, Nucleic Acids Res, 20:623, 1992; U.S. Patent No. 5436149 issued to Takara Shuzo Co., Ltd.) от последовательностей вне нацеливающего вектора и простирающихся на все плечо гомологии (см. раздел Определения); таким образом, вследствие соображений по поводу размеров, которые ограничивают эти способы, размеры плеч гомологии ограничиваются размерами, меньшими, чем 10-20 т.п.н., в целом (Joyner, The Practical Approach Series, 293, 1999).
Чрезвычайно полезной была бы возможность использовать нацеливающие векторы с плечами гомологии, большими, чем используемые в существующих способах. Например, такие нацеливающие векторы можно было бы более быстро и более удобным образом генерировать из доступных библиотек, содержащих большие геномные инсерты (например, библиотек ВАС или РАС), чем нацеливающие векторы, получаемые с использованием существующих в настоящее время технологий, в которых такие геномные инсерты должны быть широко охарактеризованы и приведены в порядок ("подрезаны") перед применением. Кроме того, большие модификации, а также модификации, включающие в себя большие геномные районы, могли бы быть более легко генерированы и с меньшим количеством стадий, чем при использовании существующих в настоящее время технологий. Кроме того, применение длинных районов гомологии могло бы увеличивать частоту нацеливания на "трудные для нацеливания" локусы в эукариотических клетках, так как нацеливание гомологичной рекомбинации в эукариотических клетках является, по-видимому, связанным с общей гомологией, содержащейся в нацеливающем векторе (Deng and Capecchi, Mol Cell Biol, 12:3365-71, 1992). Кроме того, увеличенная частота нацеливания, получаемая с использованием длинных плеч гомологии, могла бы уменьшать любую потенциальную пользу, которая может быть получена из использования изогенной ДНК в этих нацеливающих векторах.
Проблема конструирования точных модификаций в очень больших геномных фрагментах, таких как фрагменты, клонированные в библиотеках ВАС, была в значительной степени решена посредством использования гомологичной рекомбинации в бактериях (Zhang, et al., Nat Genet, 20:123-8, 1998; Yang, et al., Nat Biotechnol, 15:859-65, 1997; Angrand, et al., Nucleic Acids Res, 27:e16, 1999; Muyrers, et al., Nucleic Acids Res, 27:1555-7, 1999; Narayanan, et al., Gene Ther, 6:442-7, 1999), позволяющей конструирование векторов, содержащих большие районы гомологии относительно эукариотических эндогенных генов или хромосомных локусов. Однако, после их конструирования, эти векторы обычно не были применимы для модификации эндогенных генов или хромосомных локусов посредством гомологичной рекомбинации вследствие трудности детектирования редких правильных событий нацеливания, когда плечи гомологии имеют больший размер, чем 10-20 т.п.н. (Joyner, The Practical Approach Series, 293, 1999). Таким образом, векторы, генерируемые с использованием бактериальной гомологичной рекомбинации из геномных фрагментов ВАС, должны быть все еще приведены в порядок ("подрезаны") для применения в качестве нацеливающих векторов (Hill et al., Genomics, 64:111-3, 2000). Таким образом, все еще существует потребность в быстрой и удобной методологии, которая обеспечивает возможность применения нацеливающих векторов, содержащих большие районы гомологии, таким образом, чтобы модифицировать эндогенные гены или хромосомные локусы в эукариотических клетках.
В соответствии с данным изобретением, заявители обеспечивают новые способы, которые позволяют применять нацеливающие векторы, содержащие большие районы гомологии, таким образом, чтобы модифицировать эндогенные гены или хромосомные локусы в эукариотических клетках посредством гомологичной рекомбинации. Такие способы преодолевают вышеописанные ограничения существующих в настоящее время технологий. Кроме того, специалисту с квалификацией в данной области будет понятно, способы данного изобретения легко адаптируются для применения с любой геномной ДНК любого эукариотического организма, в том числе, но не только, животных, таких как мышь, крыса, другой грызун, или человека, а также растений, таких как соя, кукуруза и пшеница.
Сущность изобретения
Согласно данному изобретению, заявители разработали новый, быстрый, улучшенный и эффективный способ для создания и скрининга эукариотических клеток, которые содержат модифицированные эндогенные гены или хромосомные локусы. Эти новые способы впервые объединяют:
1. Бактериальную гомологичную рекомбинацию для точного конструирования желаемой генетической модификации в большом клонированном геномном фрагменте, с получением таким образом большого нацеливающего вектора для применения в эукариотических клетках (LTVEC).
2. Прямое введение этих LTVEC в эукариотические клетки для модификации представляющего интерес эндогенного хромосомного локуса в этих клетках.
3. Анализ для определения редких эукариотических клеток, в которых аллель-мишень был модифицирован желательным образом, предусматривающий анализ на модификацию аллеля (МОА) исходного аллеля, не требующий информации последовательности вне нацеливающей последовательности, такой как, например, количественная ПЦР.
Предпочтительным вариантом данного изобретения является способ генетической модификации эндогенного гена или хромосомного локуса в эукариотических клетках, предусматривающий: а) получение большого клонированного геномного фрагмента, содержащего представляющую интерес ДНК-последовательность; b) использование бактериальной гомологичной рекомбинации для генетической модификации этого большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в эукариотических клетках (LTVEC); с) введение LTVEC (b) в эукариотические клетки для модификации эндогенного гена или хромосомного локуса в этих клетках; и d) использование количественного анализа для детектирования модификации аллеля (МОА) в эукариотических клетках (с) для идентификации тех эукариотических клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован.
Другим вариантом данного изобретения является способ, в котором генетическая модификация в отношении эндогенного гена или хромосомного локуса включает в себя делецию кодирующей последовательности, генного сегмента или регуляторного элемента; изменение кодирующей последовательности, генного сегмента или регуляторного элемента; инсерцию новых кодирующей последовательности, генного сегмента или регуляторного элемента; создание условного аллеля; или замену кодирующей последовательности или генного сегмента из одного вида гомологичной или ортологичной кодирующей последовательностью из другого вида.
Альтернативным вариантом данного изобретения является способ, в котором изменение кодирующей последовательности, генного сегмента или регуляторного элемента предусматривает замену, добавление или слияние, где это слияние включает в себя эпитопную метку (тэг) или бифункциональный белок.
Еще одним вариантом данного изобретения является способ, в котором количественный анализ включает в себя количественную ПЦР, сравнительную геномную гибридизацию, изотермическую амплификацию ДНК, количественную гибридизацию с иммобилизованным зондом, Invader Probes®, или ММР-анализы®, или в котором количественная ПЦР включает в себя технологию с использованием зондов TaqMan®, Molecular Beacon или Eclipse™.
Другим предпочтительным вариантом данного изобретения является способ, в котором эукариотической клеткой является эмбриональная стволовая клетка млекопитающего и, в частности, в котором эта эмбриональная стволовая клетка является эмбриональной стволовой клеткой мыши, крысы или другого грызуна.
Другим предпочтительным вариантом данного изобретения является способ, в котором эндогенным геном или хромосомным локусом является ген или хромосомный локус млекопитающего, предпочтительно ген или хромосомный локус человека или ген или хромосомный локус мыши, крысы или другого грызуна.
Дополнительным предпочтительным вариантом является вариант, в котором LTVEC способен вмещать в себя большие ДНК-фрагменты величиной, большей, чем 20 т.п.н., и, в частности, большие ДНК-фрагменты величиной, большей, чем 100 т.п.н.
Другим предпочтительным вариантом является генетически модифицированный эндогенный ген или хромосомный локус, который получают по способу данного изобретения.
Еще одним предпочтительным вариантом является генетически модифицированная эукариотическая клетка, которую получают по способу данного изобретения.
Предпочтительным вариантом данного изобретения является организм (не человек), содержащий генетически модифицированный эндогенный ген или хромосомный локус, полученный по способу данного изобретения.
Предпочтительным также является организм (не человек), полученный из генетически модифицированных эукариотических клеток или эмбриональных стволовых клеток, полученных по способу данного изобретения.
Предпочтительным вариантом является организм (не человек), содержащий генетически модифицированный эндогенный ген или хромосомный локус, полученный по способу, предусматривающему стадии: а) получения большого клонированного геномного фрагмента, содержащего представляющую интерес ДНК-последовательность; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора (LTVEC) для применения в эмбриональных стволовых клетках; с) введения LTVEC (b) в эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в этих клетках; d) использования количественного анализа для детектирования модификации аллеля (МОА) в эмбриональных стволовых клетках (с) для идентификации тех эмбриональных стволовых клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован; е) введения эмбриональной стволовой клетки (d) в бластоцисту; и f) введения бластоцисты (е) в суррогатного родителя женского пола для вынашивания плода.
Дополнительным предпочтительным вариантом данного изобретения является организм (не человек), содержащий генетически модифицированный эндогенный ген или хромосомный локус, полученный по способу, предусматривающему стадии: а) получения большого клонированного геномного фрагмента, содержащего представляющую интерес ДНК-последовательность; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в эукариотических клетках (LTVEC); с) введения LTVEC (b) в эукариотические клетки для генетической модификации эндогенного гена или хромосомного локуса в этих клетках; и d) использования количественного анализа для детектирования модификации аллеля (МОА) в эукариотических клетках (с) для идентификации тех эукариотических клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован; (е) удаления ядра из эукариотической клетки (d); f) введения ядра (е) в ооцит; и g) введения ооцита (f) в суррогатного родителя женского пола для вынашивания плода.
Еще одним предпочтительным вариантом является организм (не человек), содержащий генетически модифицированный эндогенный ген или хромосомный локус, полученный по способу, предусматривающему стадии: а) получения большого клонированного геномного фрагмента, содержащего представляющую интерес ДНК-последовательность; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в эукариотических клетках (LTVEC); с) введения LTVEC (b) в эукариотические клетки для генетической модификации эндогенного гена или хромосомного локуса в этих клетках; d) использования количественного анализа для детектирования модификации аллеля (МОА) в эукариотических клетках (с) для идентификации тех эукариотических клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован; е) слияния эукариотической клетки (d) с другой эукариотической клеткой; f) введения слитой эукариотической клетки (е) в суррогатного родителя женского пола для вынашивания плода.
В предпочтительных вариантах организмом (не человеком) является мышь, крыса или другой грызун; бластоцистой является бластоциста мыши, крысы или другого грызуна; ооцитом является ооцит мыши, крысы или другого грызуна; и суррогатным родителем является мышь, крыса или другой грызун.
Другим предпочтительным вариантом является вариант, в котором эмбриональная стволовая клетка является эмбриональной стволовой клеткой млекопитающего, предпочтительно эмбриональной стволовой клеткой мыши, крысы или другого грызуна.
Дополнительным предпочтительным вариантом является применение генетически модифицированных эукариотических клеток данного изобретения для получения организма (не человека) и, в частности, применение генетически модифицированной эмбриональной стволовой клетки данного изобретения для получения организма (не человека).
Предпочтительным вариантом данного изобретения является способ генетической модификации представляющего интерес эндогенного гена или хромосомного локуса в мышиных эмбриональных стволовых клетках, предусматривающий стадии: а) получения большого клонированного геномного фрагмента, большего, чем 20 т.п.н., который содержит представляющую интерес ДНК-последовательность, где этот большой клонированный ДНК-фрагмент является гомологичным эндогенному гену или хромосомному локусу; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в мышиных эмбриональных стволовых клетках, где генетическая модификация является делецией кодирующей послеовательности, генного сегмента или регуляторного элемента; с) введения большого нацеливающего вектора (b) в мышиные эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в этих клетках; d) использования количественного анализа для детектирования модификации аллеля (МОА) в мышиных эмбриональных стволовых клетках (с) для идентификации тех эмбриональных стволовых клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован, где количественным анализом является количественная ПЦР. Предпочтительным вариантом является также генетически модифицированная мышиная эмбриональная стволовая клетка, полученная этим способом; мышь, содержащая генетически модифицированный эндогенный ген или хромосомный локус, полученная этим способом; и мышь, полученная из генетически модифицированной мышиной эмбриональной стволовой клетки.
Другим предпочтительным вариантом является мышь, содержащая генетически модифицированный представляющий интерес эндогенный ген или хромосомный локус, полученная по способу, предусматривающему стадии: а) получения большого клонированного геномного фрагмента, большего, чем 20 т.п.н., который содержит представляющую интерес ДНК-последовательность, где этот большой клонированный ДНК-фрагмент является гомологичным эндогенному гену или хромосомному локусу; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в мышиных эмбриональных стволовых клетках, где генетическая модификация является делецией кодирующей последовательности, генного сегмента или регуляторного элемента; с) введения большого нацеливающего вектора (b) в мышиные эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в этих клетках; d) использования количественного анализа для детектирования модификации аллеля (МОА) в мышиных эмбриональных стволовых клетках (с) для идентификации тех мышиных стволовых клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован, где количественным анализом является количественная ПЦР; е) введения мышиной эмбриональной стволовой клетки (d) в бластоцисту; и f) введения бластоцисты (е) в суррогатного роддителя женского пола для вынашивания плода.
Предпочтительным является также применение генетически модифицированной мышиной эмбриональной стволовой клетки, описанной выше, для получения мыши.
Предпочтительными являются также способы, в которых приблизительно 1-5 мкг большого нацеливающего ДНК-вектора вводят в приблизительно 1х107 эукариотических клеток.
Краткое описание чертежей
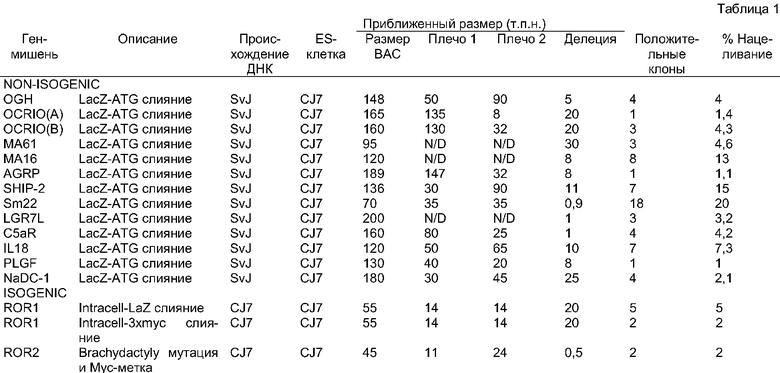
Фигура 1: Схематическая диаграмма генерирования типичного LTVEC с использованием бактериальной гомологичной рекомбинации.
(hb1 = блок гомологии 1; hb2 = блок гомологии 2; RE - сайт рестриктазы).
Фигура 2: Схематическая диаграмма донорного фрагмента и LTVEC для мыши OCR10.
(hb1 = блок гомологии 1; lacZ = ORF β-галактозидазы; SV40 polyA = ДНК-фрагмент, полученный из обезьяньего вируса 40, содержащий сайт и сигнал полиаденилирования; PGKp = промотор мышиной фосфоглицераткиназы (PGK); ЕМ7 = бактериальный промотор; neo = неомицинфосфотрансфераза; PGK polyA = 3'-нетранслируемый район, полученный из гена PGK и содержащий сайт и сигнал полиаденилирования; hb2 = блок гомологии 2).
Фигура 3А-3D: Последовательность кДНК OCR10 мыши, блок гомологии 1 (hb1), блок гомологии 2 (hb2) и зонды TaqMan® и праймеры, используемые в количественном ПЦР-анализе для детектирования модификации аллеля (МОА) в ES-клетках с использованием LTVEC mOCR10.
hb1: пары оснований 1-211
hb2: пары оснований 1586-1801
Зонд TaqMan® и соответствующий набор ПЦР-праймеров, полученных из экзона 3 mOCR10:
Зонд TaqMan®: нуклеотиды 413-439 - верхняя цепь
Праймер ех3-5': нуклеотиды 390-410 - верхняя цепь
Праймер ех3-3': нуклеотиды 445-461 - нижняя цепь
Зонд TaqMan® и соответствующий набор праймеров, полученных из экзона 4 mOCR10:
Зонд TaqMan®: нуклеотиды 608-639 - верхняя цепь
Праймер ех4-5': нуклеотиды 586-605 - верхняя цепь
Праймер ех4-3': нуклеотиды 642-662 - нижняя цепь
Определения
"Нацеливающий вектор" представляет собой ДНК-конструкцию, которая содержит последовательности, "гомологичные" эндогенным хромосомным последовательностям нуклеиновых кислот, фланкирующие желаемую генетическую модификацию (модификации). Фланкирующие последовательности гомологии, называемые "плечами гомологии", направляют нацеливающий вектор в специфическое хромосомное местоположение в геноме вследствие гомологии, которая существует между плечами гомологии и соответствующей эндогенной последовательностью, и вводят желаемую генетическую модификацию посредством процесса, называемого "гомологичной модификацией".
"Гомологичные" означает две или более последовательностей нуклеиновых кислот, которые являются либо идентичными, либо достаточно сходными, чтобы быть способными гибридизоваться друг с другом или подвергаться межмолекулярному обмену.
"Нацеливание на ген" является модификацией эндогенного хромосомного локуса инсерцией в него, делецией из него или заменой эндогенной последовательности посредством гомологичной рекомбинации с использованием нацеливающего вектора.
"Нокаут гена" является генетической модификацией, происходящей из разрушения генетической информации, кодируемой в хромосомном локусе.
"Присоединение ("вбивание гена") является генетической модификацией, происходящей из замены генетической информации в хромосомном локусе отличающейся ДНК-последовательностью.
"Организм с нокаутом" является организмом, в котором значительная доля клеток организма несет нокаут гена.
"Организм с присоединенным ("вбитым") геном" является организмом, в котором значительная доля клеток организма несет присоединенный ("вбитый") ген.
"Маркер" или "селектируемый маркер" является маркером отбора, который позволяет выделить редкие трансфицированные клетки, экспрессирующие этот маркер, из большинства обработанных клеток в популяции. Гены таких маркеров включают в себя, но не ограничиваются ими, гены неомицинфосфотрансферазы и гигромицин В-фосфотрансферазы или флуоресцирующих белков, таких как GFP.
"ES-клетка" является эмбриональной стволовой клеткой. Эту клетку обычно получают из внутренней клеточной массы эмбриона на стадии бластоцисты.
"Клон ES-клеток" является субпопуляцией клеток, полученных из единственной клетки популяции ES-клеток после введения ДНК и последующего отбора.
"Фланкирующая ДНК" является сегментом ДНК, который является колинеарным и смежным с конкретной точкой ссылочной последовательности.
"LTVEC" являются большими нацеливающими векторами для эукариотических клеток, которые получают из фрагментов клонированной геномной ДНК большего размера, чем фрагменты, обычно используемые другими подходами, предназначенными для выполнения гомологичного нацеливания в эукариотических клетках.
"Организм (не человек)" является организмом, который обычно не воспринимается публично как являющийся человеком.
"Модификация аллеля" (МОА) означает модификацию точной ДНК-последовательности одного аллеля гена (генов) или хромосомного локуса (локусов) в геноме. Эта модификация аллеля (МОА) включает в себя, но не ограничивается ими, делеции, замены или инсерции всего лишь одного нуклеотида или делеции многих т.п.н., включающих в себя представляющий интерес ген (гены) или хромосомный локус (локусы), а также любые и все возможные модификации между этими двумя крайностями.
"Ортологичная последовательность" обозначает последовательность из одного вида, которая является функционально эквивалентной этой последовательности в другом виде.
Описание и примеры, представленные infra, обеспечены для иллюстрации данного изобретения. Специалисту с квалификацией в данной области будет понятно, что эти примеры обеспечены только в качестве иллюстрации и не предназначены для ограничения данного изобретения.
Подробное описание изобретения
Заявители разработали новый, быстрый, улучшенный и эффективный способ для создания и скрининга эукариотических клеток, которые содержат модифицированные эндогенные гены или хромосомные локусы. В этих клетках модификацией могут быть нокауты гена (генов), присоединения (вбивания) генов, точковые мутации или большие геномные инсерции или делеции или другие модификации. В качестве неограничивающего примера, эти клетки могут быть эмбриональными стволовыми клетками, которые применимы в создании организмов с нокаутом или присоединением генов и, в частности, мышей с нокаутом или присоединением генов, для цели определения функции гена (генов), которые были изменены, делетированы и/или инсертированы.
Эти новые способы впервые объединяют:
1. Бактериальную гомологичную рекомбинацию для точного конструирования желаемой генетической модификации в большом клонированном геномном ДНК-фрагменте, с получением таким образом большого нацеливающего вектора для применения в эукариотических клетках (LTVEC);
2. Прямое введение этих LTVEC в эукариотические клетки для модификации представляющего интерес соответствующего эндогенного гена (генов) или хромосомного локуса (локусов) в эти клетки; и
3. Анализ для определения редких эукариотических клеток, в которых аллель-мишень был модифицирован желательным образом, включающий в себя количественный анализ на модификацию аллеля (МОА) исходного аллеля.
Следует подчеркнуть, что предыдущие способы для детектирования успешной гомологичной рекомбинации в эукариотических клетках не могут быть использованы вместе с LTVEC изобретения авторов, так как в этих LTVEC присутствуют длинные плечи гомологии. Использование LTVEC для преднамеренной модификации эндогенных генов или хромосомных локусов в эукариотических клетках посредством гомологичной рекомбинации становится возможным с использованием нового применения анализа для определения редких эукариотических клеток, в которых аллель-мишень был модифицирован желательным образом, причем такой способ предусматривает количественный анализ на модификацию аллеля (МОА) исходного аллеля, с применением, например, количественной ПЦР или других подходящих количественных анализов на МОА.
Возможность использования нацеливающих векторов с плечами гомологии, большими, чем плечи гомологии, используемые в существующих в настоящее время способах, является чрезвычайно ценной по следующим причинам:
1. Нацеливающие векторы являются более быстро и легко генерируемыми из доступных библиотек, содержащих большие геномные инсерты (например, библиотек ВАС или РАС), чем нацеливающие векторы, получаемые предыдущими технологиями, в которых геномные инсерты должны быть широко охарактеризованы и "приведены в порядок" (подрезаны) перед использованием (что объяснено более подробно ниже). Кроме того, должна быть известна лишь минимальная информация последовательности о представляющем интерес локусе, т.е. необходимо только знать приблизительно 80-100 нуклеотидов, которые требуются для генерирования блоков гомологии (описанных подробно ниже) и для генерирования зондов, которые могут быть использованы в количественных анализах на МОА (описанных подробно ниже).
2. Модификации большего размера, а также модификации, включающие в себя большие геномные районы, являются более легко и с меньшими стадиями генерируемыми, чем с использованием предыдущих технологий. Например, способ данного изобретения позволяет производить точную модификацию больших локусов, которые не могут быть вмещены традиционными нацеливающими векторами на основе плазмид вследствие ограничений их размеров. Он позволяет также модифицировать любой конкретный локус во множественных точках (например, введение специфических мутаций в различных экзонах мультиэкзонного гена) в одной стадии, уменьшая необходимость конструирования множественных нацеливающих векторов и выполнения множественных раундов нацеливания и скрининга на гомологичную рекомбинацию в ES-клетках.
3. Применение длинных районов гомологии (длинных плеч гомологии) увеличивает частоту нацеливания на "трудные для нацеливания" локусы в эукариотических клетках, что согласуется с прежними открытиями того, что нацеливание гомологичной рекомбинации в эукариотических клетках связано, по-видимому, с общей гомологией, содержащейся в нацеливающем векторе.
4. Увеличенная частота нацеливания, получаемая с использованием длинных плеч гомологии, по-видимому, уменьшает полезность, если она имеется, использования изогенной ДНК в этих нацеливающих способах.
5. Применение количественных анализов МОА для скрининга эукариотических клеток на гомологичную рекомбинацию не только дает возможность использования LTVEC в качестве нацеливающих векторов (преимущества, очерченные выше), но также уменьшает время, требующееся для идентификации точно модифицированных эукариотических клеток, с обычных нескольких дней до нескольких часов. Кроме того, применение количественных МОА не требует применения зондов, локализованных вне эндогенного гена (генов) или хромосомного локуса (локусов), которые модифицируются, устраняя таким образом необходимость знания последовательности, фланкирующей модифицированный ген (гены) или локус (локусы). Это представляет собой важное улучшение в способе, которым выполняли скрининг в прошлом, и делает его гораздо менее трудоемким и гораздо более экономически эффективным подходом к скринингу на события гомологичной рекомбинации в эукариотических клетках.
Способы
Многие из способов, используемых для конструирования ДНК-векторов, описанных здесь, являются стандартными способами молекулярной биологии, хорошо известными специалисту с квалификацией в данной области (см., например, Sambrook, J., E. F. Fritsch And T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989; Current Protocols in Molecular Biology, Eds. Ausubel et al., Greene Publ. Assoc., Wiley Interscience, NY). Все секвенирования ДНК выполняются стандартными способами с использованием ДНК-секвенатора ABI 373A и набора для секвенирования Taq Dideoxy Terminator Cycle Sequencing Kit (Applied Biosystems, Inc., Foster City, CA).
Стадия 1. Получение клона большой геномной ДНК, содержащий представляющий интерес ген (гены) или хромосомный локус (локусы).
Представляющие интерес ген (гены) или локус (локусы) могут быть выбраны на основании специфических критериев, таких как подробные структурные или функциональные данные, или он может быть выбран в отсутствие такой подробной информации, так как потенциальные гены или генные фрагменты становятся прогнозируемыми в результате усилий различных проектов секвенирования генома.
Важно отметить, что не является необходимым знание полной последовательности и структуры представляющих интерес гена (генов) для применения способа данного изобретения для получения LTVEC. Фактически, единственной информацией о последовательности, которая требуется, являются приблизительно 80-100 нуклеотидов, так чтобы получить представляющий интерес геномный клон, а также генерировать блоки гомологии, используемые в получении LTVEC (описанные подробно ниже), и изготовить зонды для применения в количественных анализах МОА.
После отбора представляющих интерес гена (генов) или локуса (локусов) получают большой геномный клон (клоны), содержащий этот ген (гены) или локус (локусы). Этот клон (клоны) может быть получен любым из нескольких путей, в том числе, но не только, скринингом подходящих библиотек ДНК (например, библиотек ВАС, РАС, YAC или космид) стандартными способами гибридизации или ПЦР или любыми другими способами, известными специалисту с квалификацией в данной области.
Стадия 2. Присоединение блоков гомологии 1 и 2 к модификационной кассете и генерирование LTVEC.
Блоки гомологии маркируют сайты бактериальной гомологичной рекомбинации, которые используют для генерирования LTVEC из больших клонированных геномных фрагментов (фигура 1). Блоки гомологии являются короткими сегментами ДНК, обычно двухцепочечными и имеющими длину по меньшей мере 40 нуклеотидов, которые являются гомологичными районам в большом клонированном геномном фрагменте, фланкируя "район, который подлежит модификации". Блоки гомологии присоединяют к модификационной кассете, так что после гомологичной рекомбинации в бактериях эта модификационная кассета заменяет район, подлежащий модификации (фигура 1). Способ создания нацеливающего вектора с использованием бактериальной гомологичной рекомбинации может выполняться в различных системах (Yang et al, Nat Biotechnol, 15:859-65, 1997; Muyrers et al, Nucleic Acids Res, 27:1555-7, 1999; Angrand et al., Nucleic Acids Res, 27:e16, 1999; Narayanan et al., Gene Ther, 6:442-7,1999; Yu, et al., Proc Natl Acad Sci USA, 97:5978-83, 2000). Одним из примеров предпочтительной используемой в настоящее время технологии является ЕТ-клонирование (Zhang et al., Nat Genet, 20:123-8, 1998; Narayanan et al., Gene Ther, 6:442-7, 1999) и вариации этой технологии (Yu, et al., Proc Natl Acad Sci USA, 97:5978-83, 2000). ЕТ обозначает белки recE (Hall and Kolodner, Proc Natl Acad Sci USA, 91:3205-9, 1994) и recT (Kusano et al., Gene,138:17-25,1994), которые осуществляют реакцию гомологичной рекомбинации. RecE является экзонуклеазой, которая разрезает одну цепь линейной двухцепочечной ДНК (по существу донорный ДНК-фрагмент, описанный infra) 5' → 3', оставляя позади себя линейный двухцепочечный фрагмент с 3'-одноцепочечным выступом. Этот одноцепочечный выступ покрывается белком recT, который имеет активность связывания одноцепочечной ДНК (ssDNA) (Kovall and Matthews, Science, 277:1824-7, 1997). ЕТ-клонирование выполняют с использованием E. coli, которая временно экспрессирует продукты гена recE и recT E. coli (Hall and Kolodner, Froc Natl Acad Sci USA, 91:3205-9, 1994; Clark et al., Cold Spring Harb Symp Quant Biol, 49:453-62, 1984; Noirot and Kolodner, J Biol Chem, 273:12274-80, 1998; Thresher et al., J Mol Biol, 254:364-71, 1995; Kolodner et al., Mol Microbiol, 11:23-30, 1994; Hall et al., J Bacteriol, 175:277-87, 1993), и белка λgam бактериофага лямбда (λ) (Murphy, J Bacteriol,173:5808-21, 1991; Poteete et al., J Bacteriol, 170:2012-21, 1988). Белок λgam необходим для защиты донорного ДНК-фрагмента от деградации системой экзонуклеазы recBC (Myers and Stahl, Annu Rev Genet, 28:49-70, 1994), и он необходим для эффективного ЕТ-клонирования в recBC+-хозяевах, таких как часто используемый штамм E. coli DH10b.
Район, подлежащий модификации и заменяемый с использованием бактериальной гомологичной рекомбинации, может находиться в пределах от нуля нуклеотидов длиной (создавая инсерцию в первоначальный локус) до многих десятков т.п.н. (создавая делецию и/или замену первоначального локуса). В зависимости от модификационной кассеты, эта модификация может приводить к следующему:
(а) делеции кодирующих последовательностей, генных сегментов или регуляторных элементов;
(b) изменению (изменениям) кодирующей последовательности, генных сегментов или регуляторных элементов, в том числе заменам, добавлениям и слияниям (например, эпитопных меток или созданию бифункциональных белков, таких как белки с CFP);
(с) инсерции новых кодирующих районов, генных сегментов или регуляторных элементов, таких как кодирующие районы, генные сегменты или регуляторные элементы для селектируемых маркерных генов или репортерных генов, или помещению новых генов под эндогенный транскрипционный контроль;
(d) созданию условных аллелей, например, введением сайтов loxP, фланкирующих район, подлежащий вырезанию Cre-рекомбиназой (Abremski and Hoess, J Biol Chem, 259:1509-14, 1984), или сайтов FRT, фланкирующих район, подлежащий вырезанию Flp-рекомбиназой (Andrews et al., Cell, 40:795-803, 1985; Meyer-Leon et al., Cold. Spring Harb Symp Quant Biol, 49:797-804, 1984; Cox, Proc Natl Acad Sci USA, 80:4223-7, 1983); (е) замене кодирующих последовательностей или генных сегментов из одного вида ортологичными кодирующими последовательностями из отличающегося вида, например, замены мышиного генетического локуса ортологичным генетическим локусом человека для конструирования мыши, в которой этот конкретный локус является "гуманизированным".
Любая из всех этих модификаций может быть включена в LTVEC. Конкретным, неограничивающим примером, в котором эндогенная кодирующая последовательность полностью делетирована и одновременно заменена как репортерным геном, так и селектируемым маркером, обеспечена ниже в примере 1, так же, как и преимущества способа данного изобретения по сравнению с предыдущими технологиями.
Стадия 3 (необязательная). Подтверждение того, что каждый LTVEC был сконструирован правильно.
Подтверждение того, что каждый LTVEC был сконструирован правильно, получают посредством:
а. Диагностической ПЦР для подтверждения новых мест соединений, созданных введением донорного фрагмента в представляющий интерес ген (гены) или хромосомный локус (локусы). Полученные таким образом ПЦР-фрагменты могут быть секвенированы для дополнительного подтверждения новых мест соединений, созданных введением донорного фрагмента в представляющий интерес ген (гены) или хромосомный локус (локусы).
b. Диагностического расщепления рестриктазами для получения уверенности в том, что только желаемые модификации были введены в LTVEC во время процесса бактериальной гомологичной рекомбинации.
с. Прямого секвенирования LTVEC, в частности, районов, включающих в себя сайт модификации, для подтверждения новых мест соединений, созданных введением донорного фрагмента в представляющий интерес ген (гены) или хромосомный локус (локусы).
Стадия 4. Очистка, получение и линеаризация ДНК LTVEC для введения в эукариотические клетки.
а. Получение ДНК LTVEC:
Получите минипрепарат ДНК (Sambrook, J., E. F. Fritsch And T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989; Tillett and Neilan, Biotechniques, 24:568-70, 572, 1998; http://www.qiagen.com/ literature/handbooks/plkmmi/plm_399.pdf) выбранного LTVEC и повторно трансформируйте минипрепарат ДНК LTVEC в E. coli при помощи электропорации (Sambrook, J., E. F. Fritsch and T. Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989). Эта стадия необходима для удаления плазмиды, кодирующей рекомбиногенные белки, которые используются для стадии бактериальной гомологичной рекомбинации (Zhang et al., Nat Genet, 20:123-8, 1998; Narayanan et al., Gene Ther, 6:442-7, 1999). От этой плазмиды полезно избавиться (а), так как она является высококопийной плазмидой и может снижать выходы, получаемые в крупномасштабных препаратах LTVEC; (b) для исключения возможности индукции экспрессии рекомбиногенных белков; и (с) так как она может затруднять физическое картирование LTVEC. Перед введением LTVEC в эукариотические клетки получают большие количества ДНК LTVEC стандартной методологией (http://www.qiagen.com/literature/handbooks/plk/ plklow.pdf; Sambrook, J., E. F. Fritsch And T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989; Tillett and Neilan, Biotechniques, 24:568-70, 572, 1998). Однако этой стадией можно пренебречь, если используют способ бактериальной гомологичной рекомбинации с применением рекомбиногенного профага, т.е. когда гены, кодирующие рекомбиногенные белки, интегрированы в бактериальную хромосому (Yu, et al., Proc Natl Acad Sci USA, 97:5978-83, 2000).
b. Линеаризация ДНК LTVEC:
Для получения LTVEC для введения в эукариотические клетки LTVEC предпочтительно линеаризуют таким способом, который оставляет ДНК модифицированного эндогенного гена (генов) или хромосомного локуса (локусов), фланкированную длинными плечами гомологии. Это может быть выполнено линеаризацией LTVEC, предпочтительно в векторном каркасе, любой из рестриктаз, которые расщепляют лишь редко. Примеры подходящих рестриктаз включают в себя NotI, PacI, SfiI, SrfI, SwaI, FseI и т.д. Выбор рестрикционного фермента может быть определен экспериментально (т.е. испытанием нескольких различных кандидатов в качестве редко расщепляющих рестриктаз) или, если последовательность данного LTVEC известна, анализом последовательности и выбором подходящего рестрикционного фермента на основании этого анализа. В ситуациях, где LTVEC имеет векторный каркас, содержащий сайты редкого расщепления, такие как сайты CosN, он может расщепляться ферментами, узнающими такие сайты, например, λ-терминазой (Shizuya et al., Proc Natl Acad Sci USA, 89:8794-7, 1992; Becker and Gold, Proc Natl Acad Sci USA, 75:4199-203, 1978; Rackwitz et al., Gene, 40:259-66, 1985).
Стадия 5. Введение LTVEC в эукариотические клетки и отбор клеток, в которых имело место успешное введение LTVEC.
ДНК LTVEC может быть введена в эукариотические клетки с использованием стандартной методологии, такой как трансфекция, опосредованная фосфатом кальция, липидами, или электропорация (Sambrook, J., E. F. Fritsch And T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1,2, and 3, 1989). Клетки, в которые LTVEC был введен успешно, могут отбираться подверганием действию агентов отбора, в зависимости от селектируемого маркерного гена, который был встроен в LTVEC. В качестве неограничивающего примера, если селектируемым маркером является ген неомицинфосфотрансферазы (neo) (Beck, et al., Gene, 19:327-36, 1982), то клетки, которые включили в себя LTVEC, могут быть отобраны на G418-содержащей среде, клетки, которые не включили в себя LTVEC, будут погибать, тогда как клетки, которые включили в себя LTVEC, будут выживать (Santerre, et al., Gene, 30:147-56, 1984). Другие подходящие селектируемые маркеры включают в себя любое лекарственное средство, которое имеет активность в эукариотических клетках (Joyner, The Practical Approach Series, 293, 1999), так же как гидромицин В (Santerre, et al., Gene, 30:147-56, 1984; Bernard, et al., Exp Cell Res, 158:237-43, 1985; Giordano and McAllister, Gene, 88:285-8, 1990), Бластицидин S (Izumi, et al., Exp Cell Res, 197:229-33, 1991) и другие, которые известны специалистам с квалификацией в данной области.
Стадия 6. Скрининг на события гомологичной рекомбинации в эукариотических клетках с использованием количественного анализа на модификацию аллеля (МОА).
Эукариотические клетки, которые были успешно модифицированы нацеливанием LTVEC в представляющий интерес локус, могут быть идентифицированы с использованием различных подходов, которые могут детектировать модификацию аллеля в представляющем интерес локусе и которые не зависят от анализов, охватывающих полное плечо гомологии или полные плечи гомологии. Такие подходы могут включать в себя, но не ограничиваются ими:
(а) количественную ПЦР с использованием TaqMan® (Lie and Petropoulos, Curr Opin Biotechnol, 9:43-8, 1998);
(b) количественный анализ МОА с использованием молекулярных маяков (Tan, et al, Chemistry, 6:1107-11, 2000);
(с) гибридизацию с флуоресценцией in situ FISH (Laan, et al, Hum Genet, 96:275-80, 1995) или сравнительную геномную гибридизацию (CGH) (Forozan, et al, Trends Genet, 13:405-9, 1997; Thompson and Gray, J Cell Biochem Suppl, 139-43, 1993; Houldsworth and Chaganti, Am J Pathol, 145:1253-60, 1994);
(d) изотермическую амплификацию ДНК (Lizardi, et al, Nat Genet, 19:225-32, 1998; Mitra and Church, Nucleic Acids Res, 27:e34, 1999);
(е) количественную гибридизацию с иммобилизованным зондом (зондами) (Southern, J. Mol. Biol. 98: 503, 1975; Kafatos FC; Jones CW; Efstratiadis A, Nucleic Acids Res 7(6):1541-52, 1979);
(f) Invader Probes® (зонды-захватчики) (Third Wave Technologies); (Технологии Третьей Волны);
(g) Eclipse™ и Молекулярные зонды-маяки (Synthetic Genetics); и
(h) ММР-анализы (High Throughput Genomics).
Авторы изобретения обеспечивают здесь пример, в котором количественную ПЦР с TaqMan® используют для скрининга на успешно нацеленные эукариотические клетки. В этом неограничивающем примере TaqMan® используют для идентификации эукариотических клеток, которые подверглись гомологичной рекомбинации, в результате которой часть одного их двух эндогенных аллелей в диплоидном геноме была заменена другой последовательностью. В противоположность традиционным способам, в которых различие в длине рестрикционных фрагментов, включающих в себя все плечо (или плечи) гомологии, указывает на модификацию одного из двух аллелей, количественный способ с использованием TaqMan® будет детектировать модификацию одного аллеля измерением уменьшения копийности (наполовину) немодифицированного аллеля. Конкретно, этот зонд детектирует немодифицированный аллель, а не модифицированный аллель. Таким образом, этот способ не зависит от точной природы модификации и не ограничивается заменой последовательности, описанной в этом примере. TaqMan® используют для количественного определения числа копий ДНК-матрицы в пробе геномной ДНК, в частности, сравнением со ссылочным геном (Lie and Petropoulos, Curr Opin Biotechnol, 9:43-8, 1998). Ссылочный ген количественно определяют в той же самой геномной ДНК, в которой определяют ген-мишень (гены) или локус-мишень (локусы). Таким образом, выполняют две TaqMan®-амплификации (каждая с ее соответствующим зондом). Один зонд TaqMan® определяет "Ct" (пороговый цикл) ссылочного гена, тогда как другой зонд определяет Ct района гена-мишени (генов) или локуса-мишени (локусов), который заменен успешным нацеливанием. Ct является количеством, которое отражает количество стартовой ДНК для каждого из зондов TaqMan®, т.е. менее представленная последовательность требует больше циклов ПЦР для достижения порогового цикла. Уменьшение наполовину числа копий матричной последовательности для реакции TaqMan® будет приводить к увеличению на приблизительно одну Ct-единицу. Реакции TaqMan® в клетках, в которых один аллель гена-мишени (генов) или локуса-мишени (локусов) был заменен с помощью гомологичной рекомбинации, будет приводить к увеличению на одну Ct-единицу для TaqMan®-реакции гена-мишени без увеличения Ct для ссылочного гена при сравнении с ДНК из клеток без успешного нацеливания. Это позволяет легко детектировать модификацию одного аллеля представляющего интерес гена (генов) в эукариотических клетках с использованием LTVEC.
Как отмечалось выше, скрининг модификации аллеля (МОА) является применением любого способа, который детектирует модификацию одного аллеля, для идентификации клеток, которые подверглись гомологичной рекомбинации. Он не требует, чтобы аллели-мишени были идентичными (гомологичными) друг другу, и, фактически, они могут содержать полиморфизмы, как это имеет место в потомстве, происходящем из скрещивания двух разных штаммов мышей. Кроме того, одной особенной ситуацией, которая также охватывается скринингом МОА, является нацеливание на гены, которые в норме присутствуют в виде единственной копии в клетках, такие как некоторые из локализованных на половых хромосомах генов, и, в частности, на Y-хромосоме. В этом случае способы, которые будут детектировать модификацию этого единственного аллеля-мишени, такие как количественная ПЦР, блоттинги по Саузерну и т.д., могут быть использованы для детектирования события нацеливания. Ясно, что способ данного изобретения может быть использован для генерирования модифицированных эукариотических клеток даже в том случае, когда аллели являются полиморфными или когда они присутствуют в виде единственной копии в клетках-мишенях.
Стадия 8. Применения генетически модифицированных эукариотических клеток.
(а) Генетически модифицированные эукариотические клетки, генерируемые способами, описанными в стадиях 1-7, могут быть использованы в любом анализе in vitro или in vivo, где желательной является изменение фенотипа такой клетки.
(b) Генетически модифицированные эукариотические клетки, генерируемые способами, описанными в стадиях 1-7, могут быть также использованы для генерирования организма, несущего эту генетическую модификацию. Генетически модифицированные организмы могут быть получены несколькими различными способами, включающими, но не ограничивающимися ими: 1. Модифицированные эмбриональные стволовые (ES) клетки, такие как часто применяемые ES-клетки крысы и мыши. ES-клетки могут быть использованы для создания генетически модифицированных крыс или мышей стандартной технологией с инъекцией бластоцисты или способом агрегации (Robertson, Practical Approach Series, 254, 1987; Wood, et al., Nature, 365:87-9, 1993; Joyner, The Practical Approach Series, 293, 1999), инъекцией тетраплоидной бластоцисты (Wang, et al, Mech Dev, 62:137-45,1997),или переносом ядер и клонированием (Wakayama, et al., Proc Natl Acad Sci USA, 96:14984-9, 1999). ES-клетки, полученные из других организмов, таких как кролики (Wang, et al., Mech Dev, 62:137-45, 1997; Schoonjans, et al., Mol Reprod Dev, 45:439-43, 1996) или куры (Pain, et al., Development, 122:2339-48, 1996) или другие виды, должны быть также пригодными для генетической модификации (модификаций) с использованием способов данного изобретения.
2. Модифицированные протопласты могут быть использованы для генерирования генетически модифицированных растений (например, см. патент США 5350689 "Zea mays plants and transgenic Zea mays plants regenerated from protoplasts or protoplast-derived cells", и патент США 5508189 "Regeneration of plants from cultured guard cell protoplasts" и ссылки в них).
3. Перенос ядер из модифицированных эукариотических клеток в ооциты для генерирования клонированных организмов с модифицированным аллелем (Wakayama, et al., Proc Natl Acad Sci USA, 96:14984-9, 1999; Baguisi, et al., Nat Biotechnol, 17:456-61, 1999; Wilmut, et al., Reprod Fertil Dev, 10:639-43, 1998; Wilmut, et al., Nature, 385:810-3, 1997; Wakayama, et al., Nat Genet, 24:108-9, 2000; Wakayama, et al., Nature, 394:369-74, 1998; Rideout, et al., Nat Genet, 24:109-10, 2000; Campbell, et al., Nature, 380:64-6, 1996).
4. Слияние клеток для переноса модифицированного аллеля в другую клетку, включающее в себя перенос сконструированной хромосомы (хромосом), и применения такой клетки (клеток) для генерирования организмов, несущих модифицированный аллель или сконструированную хромосому (хромосомы) (Kuroiwa, et al., Nat Biotechnol, 18:1086-1090, 2000).
5. Способ данного изобретения применим также для любых других подходов, которые были использованы или еще будут открыты.
Хотя многие из способов, используемых в применении на практике отдельных стадий способов данного изобретения, являются известными для специалиста с квалификацией в данной области, заявители утверждают, что новизна способа данного изобретения заключается в уникальном комбинировании этих стадий и способов, связанных с никогда ранее не описанным способом введения LTVEC непосредственно в эукариотические клетки для модификации хромосомного локуса, и использовании количественных МОА-анализов для идентификации эукариотических клеток, которые были подходящим образом модифицированы. Эта новая комбинация представляет важное усовершенствование по сравнению с прежними технологиями для создания организмов, обладающих модификациями эндогенных генов или хромосомных локусов.
Примеры
Пример 1: Конструирование мышиных ES-клеток, несущих делецию гена OCR10.
а. Отбор клона большой геномной ДНК, содержащей mOCR10.
Клон бактериальной искусственной хромосомы (ВАС), несущий большой фрагмент геномной ДНК, который содержал кодирующую последовательность мышиного гена OCR10 (mOCR10), был получен скринингом матричной библиотеки ВАС мышиных геномных ДНК (Incyte Genomics) при помощи ПЦР. Праймеры, используемые для скрининга этой библиотеки, были произведены из кДНК-последовательности гена mOCR10.
Использовали две пары праймеров:
(а) OCR10.RAA (5'-AGCTACCAGCTGCAGATGCGGGCAG-3') и
OCR10.PVIrc (5'-CTCCCCAGCCTGGGTCTGAAAGATGACG-3'), которая амплифицирует ДНК размером 102 п.н.; и
(b) OCR10.TDY (5'-GACCTCACTTGCTACACTGACTAC-3') и OCR10.QETrc (5'-ACTTGTGTAGGCTGCAGAAGGTCTCTTG-3', которая амплифицирует ДНК размером 1500 п.н.
Эта mOCR10 ВАС содержала приблизительно 180 т.п.н. геномной ДНК, в том числе полную кодирующую последовательность mOCR10. Этот ВАС-клон использовали для генерирования LTVEC, который затем использовали для делеции части кодирующего района mOCR10 при одновременном введении репортерного гена, инициирующий кодон которого точно заменял инициирующий кодон OCR10, а также инсертировании гена селектируемого маркера, применимого для отбора как в E. coli, так и в клетках млекопитающих, после репортерного гена (фигура 2). Этот репортерный ген (в данном неограничительном примере LacZ, последовательность которого легко доступна для специалиста в данной области) кодирует фермент β-галактозидазу E. coli. Вследствие положения инсерции LacZ (его инициирующий кодон находится в том же самом положении, что и инициирующий кодон mOCR10) экспрессия lacZ должна имитировать экспрессию mOCR10, как наблюдалось в других примерах, где осуществляли подобные замены с применением LacZ с использованием прежних технологий (см. "Gene trap strategies in ES cells", by W Wurst and A. Gossler, in Joyner, The Practical Approach Series, 293, 1999). Ген LacZ позволяет выполнять простой и стандартный ферментативный анализ, который может выявить картину его экспрессии in situ, обеспечивая таким образом суррогатный анализ, который отражает картину нормальной экспрессии замененного гена (генов) или хромосомного локуса (локусов).
b. Конструирование донорного фрагмента и генерирование LTVEC.
Модификационной кассетой, используемой в конструировании LTVEC mOCR10, является кассета lacZ-SV40 polyA-PGKp-EM7-neo-PGK polyA, где lacZ является маркерным геном, описанным выше, polyA SV40 является фрагментом, произведенным из обезьяньего вируса 40 (Subramanian, et al., Prog Nucleic Acid Res Mol Biol, 19:157-64, 1976; Thimmappaya, et al., J Biol Chem, 253:1613-8, 1978; Dhar, et al., Proc Natl Acad Sci USA, 71:371-5, 1974; Reddy, et al., Science, 200:494-502, 1978) и содержащим сайт и сигнал полиаденилирования (Subramanian, et al., Prog Nucleic Acid Res Mol Biol, 19:157-64, 1976; Thimmappaya, et al., J Biol Chem, 253:1613-8, 1978; Dhar, et al., Proc Natl Acad Sci USA, 71:371-5, 1974; Reddy, et al., Science, 200:494-502, 1978), PGKp является промотором мышиной фосфоглицераткиназы (PGK) (Adra, et al., Gene, 60:65-74, 1987) (который использовали широко для запуска экспрессии генов устойчивости к лекарственным средствам в клетках млекопитающих), EM7 является сильным бактериальным промотором, который имеет преимущество, заключающееся в том, что он позволяет производить положительный отбор в бактериях полной конструкции LTVEC посредством запуска экспрессии гена неомицинфосфотрансферазы (neo), neo является селектируемым маркером, который придает устойчивость к канамицину в прокариотических клетках и устойчивость к G418 в эукариотических клетках (Beck, et al., Gene, 19:327-36, 1982), и polyA PGK является 3'-нетранслируемым районом, произведенным из гена PGK и содержащим сайт и сигнал полиаденилирования (Boer, et al., Biochem Genet, 28:299-308, 1990).
Для конструирования LTVEC mOCR10 сначала генерировали донорный фрагмент, состоящий из блока гомологии 1 (hb1) mOCR10, присоединенного слева от гена LacA в модификационной кассете, и блока гомологии 2 (hb2) mOCR10, присоединенного справа от последовательности polyA neo-PGK в модификационной кассете (фигура 2), с использованием стандартной технологии рекомбинантной генетической инженерии. Блок гомологии 1 (hb1) состоит из 211 п.н. нетранслируемой последовательности непосредственно слева от инициирующего метионина открытой рамки считывания mOCR10 (mOCR10 ORF) (фигура 3А-3D). Блок гомологии 2 (hb2) состоит из последних 216 п.н. ORF mOCR10, заканчивающихся стоп-кодоном (фигура 3А-3D).
Затем, с использованием бактериальной гомологичной рекомбинации (Zhang, et al., Nat Genet, 20:123-8, 1998; Angrand, et al., Nucleic Acids Res, 27:e16, 1999; Muyrers, et al., Nucleic Acids Res, 27:1555-7, 1999; Narayanan, et al., Gene Ther, 6:442-7, 1999; Yu, et al., Proc Natl Acad Sci USA, 97:5978-83, 2000), этот донорный фрагмент использовали для точной замены кодирующего района mOCR10 (от инициирующего метионина до стоп-кодона) инсерционной кассетой, что приводило к конструированию LTVEC mOCR10 (фигура 2). Таким образом, в этом LTVEC mOCR10 кодирующая последовательность mOCR10 была заменена инсерционной кассетой с созданием делеции размером приблизительно 20 т.п.н. в локусе mOCR10 с оставлением в то же время приблизительно 130 т.п.н. гомологии слева (левое плечо гомологии) и 32 т.п.н. гомологии справа (правое плечо гомологии).
Важно отметить, что LTVEC могут быть более быстро и легко генерированы из доступных библиотек ВАС, чем нацеливающие векторы, получаемые с использованием прежних технологий, так как требуется только одна стадия бактериальной гомологичной рекомбинации и единственной требующейся информацией о последовательности является информация последовательности, необходимая для генерирования блоков гомологии. В противоположность этому, прежние подходы для генерирования нацеливающих векторов с использованием бактериальной гомологичной рекомбинации требуют, чтобы большие нацеливающие векторы были "подрезаны" перед их введением в ES-клетки (Hill et al., Genomics, 64:111-3, 2000). Это подрезание является необходимым вследствие необходимости генерирования плеч гомологии, достаточно коротких для адаптации к способам скрининга, используемым прежними подходами. Одним из главных недостатков способа Hill et al. является то, что требуются две дополнительные стадии гомологичной рекомбинации просто для подрезания (одна для подрезания района слева от модифицированного локуса и одна для подрезания района справа от модифицированного локуса). Чтобы выполнить это, требуется существенно больше информации о последовательности, в том числе информации о последовательности, включающей в себя сайты подрезания.
Кроме того, другим очевидным преимуществом, иллюстрируемым приведенным выше примером, является то, что очень большая делеция, включающая в себя ген mOCR10 (приблизительно 20 т.п.н.), может быть легко генерирована с помощью единственной стадии. В противоположность этому, прежние технологии могут требовать для выполнения той же самой задачи нескольких стадий и могут включать в себя маркирование районов слева и справа от кодирующих последовательностей сайтами loxP для применения Cre-рекомбиназы для удаления последовательности, фланкированной этими сайтами, после введения модифицированного локуса в эукариотические клетки. Это может быть невыполнимым в одной стадии, и, следовательно, может требовать конструирования двух нацеливающих векторов, использующих различные маркеры отбора, и двух последовательных событий нацеливания в ES-клетках, одного для введения сайта lozP в районе слева от кодирующей последовательности и другого для введения сайта loxP в районе справа от кодирующей последовательности. Далее следует отметить, что создание больших делеций часто происходит с низкой эффективностью при использовании прежних технологий нацеливания в эукариотических клетках, так как частота получения гомологичной рекомбинации может быть низкой при использовании нацеливающих векторов, содержащих большую делецию, фланкированную относительно короткими плечами гомологии. Высокая эффективность, получаемая с использованием способа данного изобретения (см. ниже), обусловлена очень длинными плечами гомологии, присутствующими в LTVEC, которые увеличивают скорость гомологичной рекомбинации в эукариотических клетках.
с. Подтверждение, получение и введение ДНК LTVEC mOCR10 в ES-клетки.
Последовательность, окружающую место соединения инсерционной кассеты, и последовательность гомологии подтверждали секвенированием ДНК. Размер LTVEC mOCR10 подтверждали рестрикционным анализом с последующим электрофорезом в пульсирующем (электрическом) поле (PFGE) (Cantor, et al., Annu Rev Biophys Biophys Chem, 17:287-304, 1988; Schwartz and Cantor, Cell, 37:67-75, 1984). Выполняли стандартное крупномасштабное получение плазмиды LTVEC mOCR10, плазмидную ДНК расщепляли рестриктазой NotI, которая производит разрез в каркасе вектора LTVEC mOCR10 с образованием линейной ДНК. Затем линеаризованную ДНК вводили в мышиные ES-клетки электропорацией (Robertson, Practical Approach Series, 254, 1987; Joyner, The Practical Approach Series, 293, 1999; Sambrook, et al., Sambrook, J., E. F. Fritsch and T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989). ES-клетки, успешно трансфицированные LTVEC mOCR10, отбирали в G418-содержащей среде с использованием стандартных способов отбора (Robertson, Practical Approach Series, 254, 1987; Joyner, The Practical Approach Series, 293, 1999).
d. Идентификация ES-клеток с успешным нацеливанием с использованием количественного анализа модификации аллеля (МОА).
Для идентификации ES-клеток, в которых один из двух эндогенных генов mOCR10 был заменен последовательностью модификационной кассеты, ДНК из отдельных клонов ES-клеток анализировали количественной ПЦР с использованием стандартной TaqMan®-методологии, как описано (Applied Biosystems, TaqMan® Universal PCR Master Mix, catalog number P/N 4304437; см. также http://www.pebiodocs.com/pebiodocs/04304449.pdf). Используемые праймеры и TaqMan®-зонды являются такими, как и описанные на фигуре 3А-3D. Были скринированы в целом 69 независимых клонов ES-клеток и 3 из них были идентифицированы как положительные, т.е. как клоны, в которых одна из эндогенных кодирующих mOCR10 последовательностей была заменена описанной выше модификационной кассетой.
Несколько преимуществ МОА-подхода являются очевидными:
(i) Он не требует применения зонда вне подлежащего модификации локуса, что устраняет необходимость знания последовательности, фланкирующей модифицированный локус.
(ii) Он требует небольшого времени для выполнения по сравнению с общепринятой методологией блоттинга по Саузерну, который был ранее предпочтительным способом (Robertson, Practical Approach Series, 254, 1987, Joyner, The Practical Approach Series, 293, 1999), уменьшая, следовательно, время для идентификации правильно модифицированных клеток с обычных нескольких дней до всего лишь нескольких часов.
Это является существенным улучшением пути скрининга, выполняемого в прошлом, и делает этот способ менее трудоемким и более экономически эффективным подходом к скринингу на события гомологичной рекомбинации в эукариотических клетках.
Другим преимуществом способа данного изобретения является то, что он превосходит также предыдущие технологии вследствие его способности производить нацеливание на трудные для нацеливания локусы. С использованием прежних технологий было показано, что для определенных локусов частота успешного нацеливания может быть такой низкой, как 1 на 2000 событий интеграции, возможно, даже более низкой. С использованием способа данного изобретения заявители продемонстрировали, что такие трудные локусы могут обнаруживать гораздо более эффективное нацеливание с использованием LTVEC, которые содержат длинные плечи гомологии (т.е. более длинные, чем плечи гомологии, возможные в случае прежних технологий). В качестве неограничивающего примера, вышеописанное демонстрирует, что заявители выполняли нацеливание на локус OCR10, локус, который, как было ранее показано, является не поддающимся для нацеливания с использованием общепринятой технологии. С использованием способа данного изобретения заявители показали, что они получили успешное нацеливание в 3 из 69 клонов ES-клеток, в которые был интегрирован LTVEC mOCR10 (содержащий более чем 160 т.п.н. плеч гомологии и вводящий делецию 20 т.п.н.), тогда как с применением прежней технологии для нацеливания на ES-клетки (Joyner, The Practical Approach Series, 293, 1999) с использованием вектора на основе плазмиды с плечами гомологии, более короткими, чем 10-20 т.п.н., делеция менее 15 т.п.н. хотя и вводилась, не были идентифицированы события нацеливания среди более чем 600 интегрантов этого вектора. Эти данные ясно демонстрируют превосходство способа данного изобретения над прежними технологиями.
Пример 2: Увеличенная частота нацеливания и отмена необходимости применения изогенной ДНК при использовании LTVEC в качестве нацеливающих векторов.
Как отмечалось выше, увеличенная частота нацеливания, получаемая с использованием длинных плеч гомологии, должна уменьшать выгоду, если она имеется, получаемую из применения геномной ДНК в конструировании LTVEC, которая является изогенной (т.е. идентичной по последовательности) с ДНК эукариотической клетки-мишени. Для испытания этой гипотезы заявители сконструировали несколько LTVEC с применением геномной ДНК, полученной из того же субштамма мыши, из которого получена эукариотическая клетка, подлежащая нацеливанию (предположительно изогенной), и большое число других LTVEC с применением геномной ДНК, полученной из мышиных субштаммов, отличающихся от субштамма эукариотической клетки, подлежащей нацеливанию (предположительно неизогенной). Неизогенные LTVEC проявляли среднюю частоту нацеливания 6% (в диапазоне 1-20%, таблица 1), тогда как изогенные LTVEC проявляли среднюю частоту нацеливания 3% (в диапазоне 2-5%), что свидетельствует о том, что частота успешного нацеливания с использованием LTVEC не зависит от изогенности.
Пример 3: Подробное описание анализа МОА на основе TaqMan® для идентификации ES-клонов с успешным нацеливанием.
Клоны ES-клеток, которые поглотили LTVEC и включили его в геном в локусе-мишени гомологичной рекомбинацией, идентифицируют анализом модификации аллеля (МОА), который использует количественную ПЦР реального времени для обнаружения различия между клонами ES-клеток с успешным нацеливанием, в которых один из двух аллелей-мишеней является модифицированным, и клонов ES-клеток без успешного нацеливания, в которых оба аллеля остаются немодифицированными. Анализ МОА состоит из первичного и вторичного скрининга. Первичный скрининг включает в себя следующие стадии: (1) выращивание LTVEC-трансфицированных клонов ES-клеток на покрытых желатином 96-луночных планшетах; (2) выделение геномной ДНК из каждого клона ES-клеток; (3) использование каждой пробы геномной ДНК в качестве матрицы в 8 отдельных количественных ПЦР на двух 384-луночных планшетах, в которых 2 из этих ПЦР используют набор специфических для локуса-мишени праймеров, которые гибридизуются с ДНК-последовательностями на одной стороне геномного фрагмента, нацеленного на делецию ("левая ПЦР"), 2 из этих ПЦР используют набор специфических для локуса-мишени праймеров, которые гибридизуются с ДНК-последовательностями на другой стороне геномного фрагмента, нацеленного на делецию ("правая ПЦР"), 4 из ПЦР используют набор праймеров, которые узнают четыре не имеющих нацеливания ссылочных локуса ("ссылочные ПЦР"), и каждая ПЦР включает в себя флуоресцентный зонд (например, TaqMan® [ABI], Eclipse™ или Молекулярный маяковый зонд [Synthetic Genetics]), который узнает амплифицированную последовательность и сигнал флуоресценции которого прямо пропорционален количеству ПЦР-продукта; (4) проведение этих ПЦР в устройстве, которое является комбинацией термоциклера и детектора флуоресценции (например, ABI 7900HT), которое определяет накопление продуктов амплификации во время ПЦР и определяет пороговый цикл (CТ), точку в ПЦР, в которой сигнал флуоресценции является детектируемым выше фонового шума; (5) для пробы ДНК каждого клона ES-клеток расчет различия в величинах CТ (ΔCТ) между "левыми" ПЦР и каждой из четырех ссылочных ПЦР и между "правыми" ПЦР и каждой из четырех ссылочных ПЦР для создания 8 таблиц из 96 величин ΔCТ; (6) нормализацию величин ΔCТ относительно положительных величин; (7) расчет медианы величины ΔCТ для каждой таблицы сравнения мишень-ссылочный локус; (8) определение доверительного уровня при помощи компьютерной программы, которая испытывает восемь таблиц ΔCТ и рассчитывает, в каком числе случаев конкретная проба ДНК клона ES-клеток дает более высокую величину ΔCТ в толерантных (допустимых) пределах 0,5-1,5, 0,25-1,5, 0,5-2,0, 0,25-2,0, 0,5-3,0 и 0,25-3,0 циклов, чем медиана ΔCТ (примеры языков компьютерного программирования, пригодных для создания или записи такой программы, включают в себя visual basics, Java или любой другой язык компьютерного программирования, известный специалисту с квалификацией в данной области); (9) построение этих величин и их медиан для каждой из восьми таблиц ΔCТ в виде гистограмм; и (10) идентификацию клонов-кандидатов ES-клеток с правильным нацеливанием из рассмотрения доверительных уровней и гистограмм ΔCТ. В предпочтительном примере величина ΔCТ для клонов-кандидатов с успешным нацеливанием находится в диапазоне на 0,5-1,5 циклов большем, чем медиана в 8 из 8 ссылочных сравнений.
Клоны-кандидаты, идентифицированные первичным скринингом анализа МОА, подтверждают или отвергают во вторичном скрининге, который включает в себя следующие стадии: (1) использование геномной ДНК из каждого из положительных клонов-кандидатов ES-клеток, из большего числа отрицательных клонов и из стандартов числа копий геномной ДНК из мышей, которые несут одну или две копии кассеты LacZ-Neo LTVEC на диплоидный геном, в качестве матриц в 8 отдельных количественных ПЦР на двух 384-луночных планшетах, в которых 1 реакция является "левой" ПЦР (как в первичном скрининге), одна реакция является "правой" ПЦР (как в первичном скрининге), 4 реакции являются ссылочными ПЦР с двумя ссылочными локусами, которые отличаются от ссылочных локусов, используемых в первичном скрининге, одна реакция является ПЦР с праймерами и зондом, которые являются специфическими для гена LacZ LTVEC, и одна реакция является ПЦР с праймерами и зондом, которые являются специфическими для гена Neo LTVEC; (2) проведение этих ПЦР в устройстве для количественной ПЦР, как в первичном скрининге; (3) расчет, как в первичном скрининге, величин (ΔCТ) между "левой" ПЦР и каждой из двух ссылочных ПЦР, между "правыми" ПЦР и каждой из двух ссылочных ПЦР, между ПЦР LacZ и каждой из ссылочных ПЦР и между ПЦР Neo и каждой из двух ссылочных ПЦР для создания восьми таблиц ΔCТ; (4) нормализацию величин ΔCТ относительно положительных величин; (5) расчет величины медианы для каждой таблицы ΔCТ; (6) расчет доверительных уровней, как в первичном скрининге; (7) построение этих величин и их медиан для каждой из восьми таблиц ΔCТ в виде гистограмм.
Из рассмотрения доверительных уровней и гистограмм ΔCТ как для первичного, так и для вторичного скринингов клоны-кандидаты ES-клеток с правильным нацеливанием либо подтверждаются, либо отвергаются. В предпочтительном примере величина ΔCТ для клонов-кандидатов с успешным нацеливанием находится в диапазоне на 0,5-1,5 циклов большем, чем медиана в 12 из 12 ссылочных сравнений из комбинированных первичного и вторичного скринингов.
Для оценки числа копий LTVEC на диплоидный геном в подтвержденных ES-клонах с правильным нацеливанием их величины ΔCТ из сравнений ПЦР LacZ и Neo с двумя ссылочными ПЦР сравнивают с величинами ΔCТ для стандартов числа копий LacZ-Neo. Каждый клон ES-клеток оценивают как имеющий 1, 2 или более 2 копий LTVEC. Для каждого модифицированного аллельного продукта клоны ES-клеток подвергают скринингу в группах из 96 (обычно меньше, чем 288 клонов в целом), пока не будут идентифицированы 3 клона, которые оцениваются как положительные в анализе МОА и имеют единственную копию кассеты LacZ-Neo.
Пример 4: Применение FISH (гибридизации с флуоресценцией in situ) для идентификации правильно нацеленных LTVEC в ES-клетках.
С использованием технологии LTVEC, описанной здесь, заявители разрушили ген SM22альфа в ES-клетках. SM22альфа является белком с Нг 22 кДа, ограниченным линией дифференцировки клеток гладких мышц (SMC), который физически связывает пучки филаментов актина цитоскелета в сократительных SMC. Затем ES-клетки с успешным нацеливанием подвергают стандартной гибридизации с флуоресценцией in situ (FISH) на метафазных хромосомных распределениях для подтверждения, что нацеливание на ген было правильным. Этот эксперимент выполняли с двумя зондами: 1) зондом гена SM22альфа, состоящим из немодифицированного клона ВАС SM22альфа, используемым для генерирования LTVEC, и 2) зондом ДНК LacZ и неомицина, который детектирует только модификацию гена, произведенную событием нацеливания (инсертирование кассет генов LacZ и Neo). Метафазные хромосомные распределения получали из клеток, и гибридизацию выполняли одновременно с обоими зондами, которые были помечены различными окрашенными флуорофорами для обеспечения возможности детектирования гибридизации каждого зонда в одном и том же хромосомном распределении. Линию ES-клеток без нацеливания анализировали параллельно в качестве контроля. Как и ожидалось, в контрольных хромосомных распределениях два аллеля SM22альфа детектировали на гомологичных хромосомных плечах, но не было гибридизации зонда LacZ-Neo. Как и в контролях, в распределениях ES-клеток с нацеливанием два аллеля детектировали только в одном и том же хромосомном положении и на гомологичных хромосомах, но двойное мечение зондом LacZ-Neo было заметным на одной из двух хромосом, что указывало на совместную локализацию ДНК-последовательностей SM22альфа и LacZ-Neo в этом аллеле SM22альфа. Важно, что последовательности ДНК гена SM22альфа или генов LacZ-Neo не детектировались в неправильных местоположениях в этих хромосомных распределениях. Отсутствие экстраинтеграции последовательностей гена SM22альфа и совместной локализации LacZ-Neo с SM22альфа в одной хромосоме гомологичной пары в значительной степени предполагает, что имело место правильное нацеливание LacZ-Neo на один из аллелей SM22альфа посредством гомологичной рекомбинации.
Пример 5: Снижение количества ДНК, используемой для электропорации ES-клеток, улучшает эффективность нацеливания.
Стандартные способы для нацеленной модификации генов в мышиных эмбриональных стволовых (ES) клетках обычно используют 20-40 мкг нацеливающего вектора в процедуре электропорации. Авторы изобретения обнаружили, что с использованием LTVEC электропорация с гораздо более низкими количествами ДНК - в диапазоне от приблизительно 1 до 5 мкг на 1х107 клеток - удваивает частоту правильно нацеленных событий гомологичной рекомбинации, значительно уменьшая число вторичных, негомологичных инсерционных событий. Это явное улучшение эффективности нацеливания является важным, так как оно значительно уменьшает число клонов ES-клеток, которые необходимо подвергнуть скринингу для нахождения нескольких положительных клонов с правильно нацеленной однокопийной модификацией. Связанными с этим преимуществами являются уменьшенная стоимость и увеличенная производительность способа.
Пример 6: Применение способа изобретения для создания мышей с нокаутом МА61 для исследования мышечной атрофии.
МА61, также называемая MAFbx, является недавно открытой убиквитинлигазой, которая отрицательно регулируется при различных состояниях мышечной атрофии (См. Предварительную заявку США №60/264926, поданную 30 января 2001 года, Предварительную заявку США №60/311697, поданную 10 августа 2001 года, и Предварительную заявку США (регистрационный номер еще не известен), поданную 22 октября 2001 года, все переуступленные Regeneron Pharmaceuticals, Inc., каждая из которых включена здесь в ее полном виде в качестве ссылки). Для дополнительного исследования биологического значения этого гена в мышечной атрофии создавали мышей с нокаутом гена с использованием способа данного изобретения следующим образом.
Сначала для получения большого клонированного геномного фрагмента, содержащего ген МА61, библиотеку бактериальных искусственных хромосом (ВАС) подвергали скринингу с праймерами, произведенными из кДНК-последовательности МА61. Полученный таким образом клон ВАС использовали затем для создания Большого Нацеливающего Вектора для Эукариотических клеток (LTVEC) следующим образом. Конструировали модификационную кассету, содержащую 5'-блок гомологии/ген lacZ/polyA/промотор PGK/neo/polyA/3'-блок гомологии. Блоки гомологии присоединяли для маркирования сайтов бактериальной гомологичной рекомбинации во время генерирования LTVEC. LacZ является репортерным геном, который помещали таким образом, что его инициирующий кодон был в том же самом положении, что и инициирующий кодон МА61. После гомологичной рекомбинации в бактериях эта модификационная кассета заменяла ген МА61. Таким образом, создавали LTVEC МА61, где кодирующие последовательности МА61 в клоне ВАС заменяли модификационной кассетой, сконструированной как описано выше. Затем получали ДНК LTVEC, очищали и линеаризировали для введения в эукариотические клетки, как описано infra.
Получали минипрепарат ДНК LTVEC МА61 (Sambrook, J., E. F. Fritsch And T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989; Tillett and Neilan, Biotechniques, 24:568-70, 572, 1998; http://www.qiagen.com/ literature/handbooks/plkmini/plm_399.pdf) и повторно трансформировали в E. coli при помощи электропорации (Sambrook, J., E. F. Fritsch and T. Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989) для удаления плазмиды, кодирующей рекомбиногенные белки, которые используются для стадии бактериальной гомологичной рекомбинации (Zhang et al., Nat Genet, 20:123-8, 1998; Narayanan et al., Gene Ther, 6:442-7, 1999). Перед введением LTVEC МА61 в эукариотические клетки большие количества LTVEC МА61 получали стандартной методологией (http:,,www.qiagen.com/literature/ handbooks/plk/plklow.pdf; Sambrook, J, E. F. Fritsch And T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2 and 3, 1989; Tillett and Neilan, Biotechniques, 24:568-70, 572, 1998).
Затем, для получения LTVEC МА61 для введения в эукариотические клетки LTVEC МА61 линеаризировали. Это выполняли расщеплением рестриктазой NotI, что приводит к получению ДНК модифицированного эндогенного гена (генов) или хромосомного локуса (локусов), фланкированной длинными плечами гомологии.
Затем LTVEC МА61 вводили в эукариотические клетки с использованием стандартной методологии электропорации (Sambrook, J, E. F. Fritsch And T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989). Клетки, в которых LTVEC МА61 вводился успешно, отбирали посредством подвергания действию селектирующего агента. Поскольку селектируемым маркером, используемым в модификационной кассете, был ген неомицинфосфотрансферазы (neo) (Beck, et al., Gene, 19:327-36, 1982), клетки, которые поглотили LTVEC МА61, отбирали в среде, содержащей G418; клетки, которые не имеют LTVEC МА61, погибали, тогда как клетки, которые поглощали LTVEC МА61, выживали (Santerre, et al., Gene, 30:147-56, 1984).
Эукариотические клетки, которые были успешно модифицированы нацеливанием LTVEC МА61 в локус МА61, идентифицировали с использованием способа количественной ПЦР с TaqMan® (Lie and Petropoulos, Curr Opin Biotechnol, 9:43-8, 1998).
Наконец, генетически модифицированные ES-клетки использовали для создания генетически модифицированных, в этом случае имеющих нокаут гена, мышей стандартной инъекцией бластоцисты. Таким образом были созданы мыши с нокаутом МА61, т.е. мыши, в которых был делетирован ген МА61.
Как мышей с нокаутом, так и мышей дикого типа (WT) подвергали действию индуцирующих мышечную атрофию условий, создаваемых денервацией этих мышей, и уровни атрофии сравнивали. Сначала выделяли седалищный нерв в области середины бедра правой задней конечности и перерезали в мышах. Перерезание седалищного нерва ведет к денервации и, на протяжении 14-дневного периода, к атрофии в мышцах задней конечности, в частности передней большеберцовой и икроножной мышцах, на протяжении 14-дневного периода. При 7 и 14 днях после денервации животных умерщвляли ингаляцией диоксида углерода. Затем переднюю большеберцовую мышцу (ТА) и икроножный комплекс (GA) мышц удаляли из правой (денервированной) и левой (интактной) нижних конечностей, взвешивали и замораживали на определенном отрезке в охлажденном жидким азотом изопентане. Степень атрофии оценивали сравнением веса мышц из денервированной конечности с весом мышц из неденервированной конечности.
Мышечную атрофию оценивали спустя 7 и 14 дней после перерезания правого седалищного нерва. Сырые веса правых денервированных мышц сравнивали с сырыми весами левых, неденервированных мышц. Сравнения правые:левые приведены в таблице 2.
В дни 7 и 14 мышцы из мышей с нокаутом обнаружили значимо (р<0,001) меньшую атрофию, чем мышцы из мышей дикого типа. Различие между мышами с нокаутом и дикого типа было большим при 14 днях, чем при 7 днях. Хотя мыши дикого типа обнаружили продолжающуюся атрофию между днями 7 и 14, мыши с нокаутом не обнаруживали дополнительной атрофии.
В целом, можно заключить, что подход создания LTVEC и прямого их использования в качестве нацеливающих векторов в комбинации со скринингом МОА на события гомологичной рекомбинации в ES-клетках создает новый способ для конструирования генетически модифицированных локусов, который является быстрым, недорогим и представляет собой существенное улучшение по сравнению с утомительными, трудоемкими способами, используемыми ранее. Таким образом, этот подход открывает возможность быстрого крупномасштабного функционального генетического анализа in vivo по существу любых и всех генов в геноме организма с использованием лишь части времени и затрат, необходимых для прежних методологий.
Хотя вышеизложенное изобретение было описано с некоторыми подробностями в качестве иллюстрации и примеров, специалистам с квалификацией в данной области будет понятно, что некоторые изменения и модификации могут быть произведены в отношении описанного изобретения без отклонения от сути или объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПОСРЕДОВАННОЕ НУКЛЕАЗОЙ НАЦЕЛИВАНИЕ С БОЛЬШИМИ НАЦЕЛИВАЮЩИМИ ВЕКТОРАМИ | 2013 |
|
RU2645475C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННОЙ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ С ИСПОЛЬЗОВАНИЕМ ПАРНЫХ ГИДОВЫХ РНК | 2015 |
|
RU2734770C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННЫХ ГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2711740C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННЫХ ГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2771532C2 |
| СПОСОБЫ ПРЕОДОЛЕНИЯ ИММУНОЛОГИЧЕСКОЙ ТОЛЕРАНТНОСТИ С ИСПОЛЬЗОВАНИЕМ МНОЖЕСТВА НАПРАВЛЯЮЩИХ РНК | 2017 |
|
RU2745563C2 |
| ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ХАРАКТЕРИЗУЮЩИЕСЯ ЭКСПАНСИЕЙ ГЕКСАНУКЛЕОТИДНЫХ ПОВТОРОВ В ЛОКУСЕ C9ORF72 | 2017 |
|
RU2760877C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДИФИКАЦИИ ЦЕЛЕВОГО ЛОКУСА | 2015 |
|
RU2704283C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННОЙ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ ПОСРЕДСТВОМ ОДНОЭТАПНОГО МНОЖЕСТВЕННОГО НАЦЕЛИВАНИЯ | 2015 |
|
RU2707137C2 |
| СПОСОБЫ ПРЕОДОЛЕНИЯ ИММУНОЛОГИЧЕСКОЙ ТОЛЕРАНТНОСТИ С ИСПОЛЬЗОВАНИЕМ МНОЖЕСТВА НАПРАВЛЯЮЩИХ РНК | 2017 |
|
RU2829155C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2685914C1 |
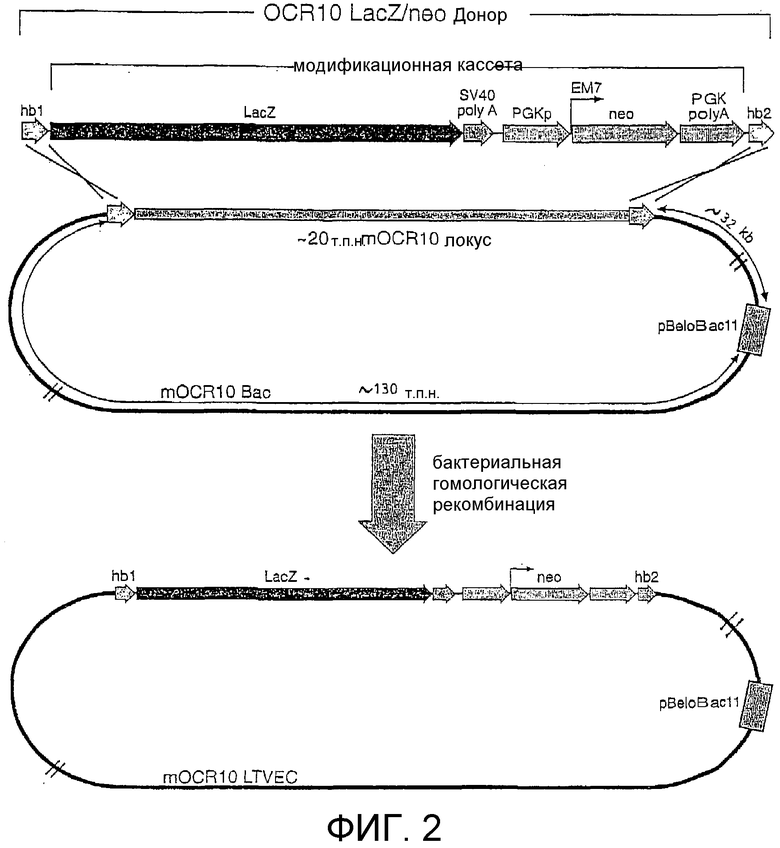




Изобретение относится к области генной инженерии. Предложен способ модификации интересующего эндогенного гена или хромосомного локуса в эукариотических клетках. Способ предусматривает получение большого клонированного геномного фрагмента, размером более 20 т.п.н., и создание на его основе с использованием бактериальной гомологичной рекомбинации большого нацеливающего вектора (LTVEC). Далее проводят введение LTVEC в эукариортические клетки для модификации эндогенного гена или хромосомного локуса. В заключение проводят количественный анализ для определения модификации аллеля (МОА) в этих клетках. Способ позволяет осуществлять модификацию большими последовательностями ДНК. Описано также применение этих клеток для генерирования организмов, несущих эту генетическую модификацию. 15 н. и 21 з.п. ф-лы, 6 ил., 2 табл.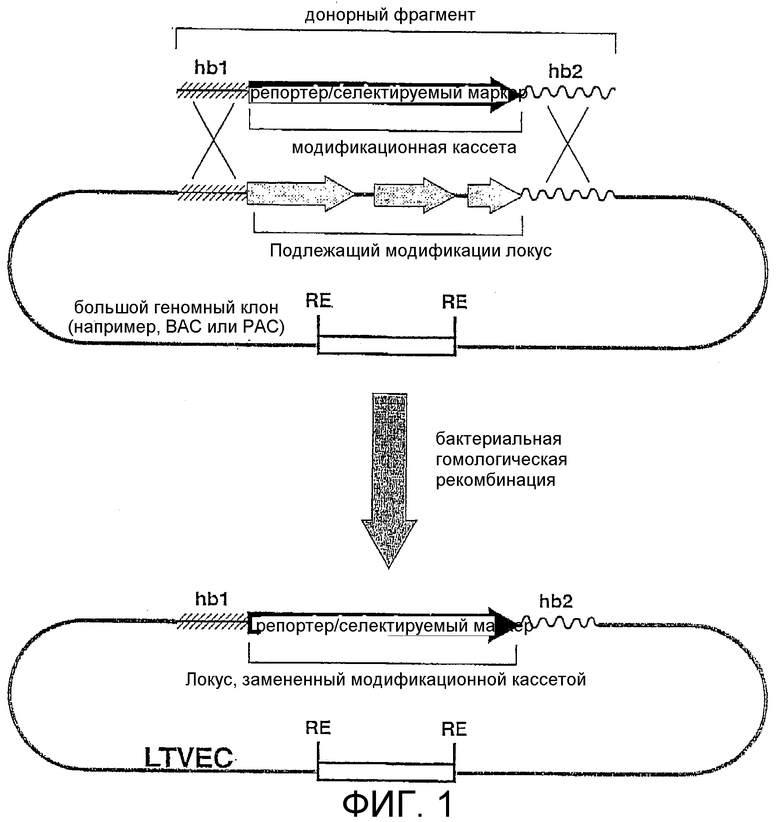
a) получение большого клонированного геномного фрагмента размером более 20 т.п.н., содержащего представляющую интерес последовательность ДНК;
b) использование бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора (LTVEC) для применения в эукариотических клетках; суммарный размер плечей гомологии LTVEC составляет более 20 т.п.н.
c) введение LTVEC (b) в эукариотические клетки для модификации эндогенного гена или хромосомного локуса в этих клетках путем гомологичной рекомбинации и
d) использование количественного анализа для определения модификации аллеля (МОА) в эукариотических клетках (с) для идентификации тех эукариотических клеток, в которых эндогенный ген или хромосомный локус был генетически модифицирован.
a) получение большого клонированного геномного фрагмента размером более 20 т.п.н., который содержит интересующую последовательность ДНК, где большой клонированный фрагмент ДНК гомологичен эндогенному гену или хромосомному локусу;
b) использование бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в мышиных эмбриональных стволовых клетках, суммарный размер плечей более 20 т.п.н., где генетическая модификация является делецией кодирующей последовательности, сегмента гена или регуляторного элемента;
c) введение большого нацеливающего вектора (b) в мышиные эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в этих клетках путем гомологичной рекомбинации и
d) использование количественного анализа для определения модификации аллеля (МОА) в мышиных эмбриональных стволовых клетках (с) для идентификации эмбриональных стволовых клеток мыши, в которых эндогенный ген или хромосомный локус был генетически модифицирован, где количественным анализом является количественная ПЦР.
a) получения большого клонированного геномного фрагмента размером более 20 т.п.н., содержащего интересующую последовательность ДНК;
b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора (LTVEC) с суммарным размером плечей гомологии, равным более 20 т.п.н., для применения в эмбриональных стволовых клетках;
c) введения LTVEC (b) в эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в клетках путем гомологичной рекомбинации;
d) использования количественного анализа для определения модификации аллеля (МОА) в эмбриональных стволовых клетках (с) для идентификации эмбриональных стволовых клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован;
e) введения эмбриональной стволовой клетки (d) в бластоцисту и
f) введения бластоцисты (е) в суррогатного родителя женского пола для вынашивания плода.
a) получения большого клонированного геномного фрагмента, большего 20 т.п.н., который содержит интересующую последовательность ДИК, где большой клонированный фрагмент ДИК гомологичен эндогенному гену или хромосомному локусу;
b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в мышиных эмбриональных стволовых клетках, суммарный размер плечей гомологии большого нацеливающего вектора составляет более 20 т.п.н., где эта генетическая модификация является делецией кодирующей последовательности, сегмента гена или регуляторного элемента;
c) введения большого нацеливающего вектора (b) в мышиные эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в этих клетках путем гомологичной рекомбинации и
d) использования количественного анализа для определения модификации аллеля (МОА) в мышиных эмбриональных стволовых клетках (с) для идентификации мышиных эмбриональных стволовых клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован, где количественный анализ является количественной ПЦР;
e) введения мышиной эмбриональной стволовой клетки (d) в бластоцисту и
f) введения бластоцисты (е) в суррогатного родителя женского пола для вынашивания плода.
a) получения большого клонированного геномного фрагмента размером более 20 т.п.н., содержащего представляющую интерес ДНК-последовательность;
b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в эукариотических клетках (LTVEC); суммарный размер плечей гомологии большого нацеливающего вектора составляет более 20 т.п.н.;
c) введения LTVEC (b) в эукариотические клетки для генетической модификации эндогенного гена или хромосомного локуса в этих клетках путем гомологичной рекомбинации;
d) использования количественного анализа для определения модификации аллеля (МОА) в эукариотических клетках (с) для идентификации эукариотических клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован;
(е) удаления ядра из эукариотической клетки (d);
f) введения ядра (е) в ооцит и
g) введения ооцита (f) в суррогатного родителя женского пола для вынашивания плода.
a) получения большого клонированного геномного фрагмента размером более 20 т.п.н., содержащего интересующую последовательность ДНК;
b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в эукариотических клетках (LTVEC); суммарный размер плечей гомологии большого нацеливающего вектора составляет более 20 т.п.н.;
c) введения LTVEC (b) в эукариотические клетки для генетической модификации эндогенного гена или хромосомного локуса в этих клетках путем гомологичной рекомбинации;
d) использования количественного анализа для определения модификации аллеля (МОА) в эукариотических клетках (с) для идентификации эукариотических клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован;
e) слияния эукариотической клетки (d) с другой эукариотической клеткой и
f) введения слитой эукариотической клетки (е) в суррогатного родителя женского пола для вынашивания плода.
| YANG X.W | |||
| et al., "Homologous recombination based modification in Escherichia coli and germline transmission in transgenic mice of a bacterial artificial chromosome", Nat Biotechnol | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
Авторы
Даты
2006-12-27—Публикация
2001-10-31—Подача