Изобретение относится к области получения и транспортировки чистого водорода, который может быть использован как энергоноситель для добавки к топливу и как источник поступления чистого водорода к потребителю.
Известны способы получения водорода [Тезисы доклада IV Международной конференции "Устойчивое развитие горных территорий: проблемы регионального сотрудничества и региональной политики горных районов". Том 1, Владикавказ, 2001, с.186-188] путем парового реформинга углеводородных соединений, термохимическим разложением воды с последующей транспортировкой водорода по трубопроводам или в стальных баллонах.
Недостатком способов является использование дорогостоящего оборудования и материалов.
Наиболее близким техническим решением является способ получения водорода, включающий электролиз воды или водного раствора [US 4146446, С 25 В 1/04, 27.03.29], в котором в качестве катода используют материалы, поглощающие водород, а в качестве анода используются материалы, окисляющиеся в электрохимическом процессе выделения кислорода. При этом связанный водород вновь выделяется при термообработке катода и накапливается в приемнике водорода. Аналогично, связанный кислород выделяется из соответствующих оксидов при термообработке и накапливается в приемнике кислорода.
Недостатком способа является то, что в процессе электролиза периодически необходима термообработка материала катода и анода после их насыщения продуктами электролиза с последующим использованием выделившихся водорода и кислорода по назначению.
Задачей изобретения является создание эффективного способа непрерывного получения, транспортировки и использования водорода.
Технический результат, который может быть достигнут при осуществлении изобретения, заключается в более эффективном использовании водорода: сокращаются его потери при транспортировке, так как отсутствуют промежуточные емкости сбора водорода, повышается чистота водорода, сокращается число операций от источника получения до места потребления водорода.
Этот технический результат достигается тем, что способ получения и транспортировки водорода включает электролиз водного раствора с использованием катода, один конец которого находится в водном растворе, а другой - у потребителя, давление на конце катода, находящемся у потребителя, ниже, а температура выше, чем на другом конце катода, находящемся в водном растворе, причем катод выполняют из таких материалов как Та, Pd, Pt, Ni, Mg, Ti, V, Nb, U, Mg2Ni, TiFe, LaNi5, сплавы V-Nb, Ni-Ta и другие материалы, которые внедряют водород в решетку.
Сущность способа заключается в том, что транспорт водорода осуществлялся непосредственно к потребителю, где происходит выделение водорода, полученного на катоде при электролизе, путем диффузии водорода по материалу катода за счет, например, перепада температур (более высокой температуры у потребителя водорода по сравнению с температурой в электролизере) или за счет перепада давления (более низкого давления у потребителя водорода по сравнению с давлением в электролизере), а также путем диффузии в материал с более высокими способностями поглощать водород. Аналогично, выделяющийся на инертном аноде кислород можно доставлять к потребителю кислорода.
Например, весь процесс при использовании зависимости растворимости водорода в материале катода от температуры можно разбить на следующие стадии:
I. В электрохимической системе
1. Электролитическая диссоциация:
Катодная реакция
2Н2O+2хМе+2е→2OН-+2МехН
Анодная реакция
2OH-→H2O+l/2O2+2e
Суммарная реакция
Н2О+2хМе→2МехН+1/2О2
II. У потребителя:
Термическая диссоциация:
2МехН→2хМе+Н2.
Чтобы увеличить проводимость воды, в нее могут быть добавлены электролиты: щелочи, кислоты, соли и т.п.Тогда суммарная реакция при электролизе может быть выражена, например, уравнениями
2HCl→H2+Cl2
2Н2О+2NaCl→Н2+2NaOH+Cl2.
Такие реакции могут служить не только для получения водорода, но также для получения хлора.
В качестве материала катода можно использовать Та, Pd, Pt, Ni, Mg, Ti, V, Nb, U, Mg2Ni, TiFe, LaNi5 сплавы V-Nb, Ni-Ta и др., т.е. такие материалы, которые внедряют водород в решетку и выделяют его при термообработке.
В качестве анодного материала можно использовать серебро, нержавеющую сталь, ртуть, оксид марганца Mn2О3 и др. В процессе электролиза могут образовываться оксиды, хлориды и др., которые при последующей термообработке также способны выделять кислород, галогены и т.п.
Таким образом, в процессе термообработки катод и анод регенерируются и вновь используются в электрохимическом процессе.
Для максимального поглощения водорода, кислорода или галогена лучше применять материалы с хорошо развитой поверхностью.
При использовании в качестве катода, например, палладия известно [Свойства элементов.- справочник, под ред. М.Е.Дрица - т.2. - М.: Металлургия, ГУП «Журнал Цветные металлы», - 1997. - С.225-226], что он интенсивно поглощает водород (при 20°С до 800 объемов), с чем связана его высокая каталитическая активность. С повышением температуры растворимость водорода в палладии быстро снижается, а скорость его диффузии возрастает. Параметры диффузии водорода в палладии при температурах 196-998 К:
частотный множитель D=2,9·10-7,
энергия активации Е=22,2 кДж/моль,
начальная теплота адсорбции водорода на палладии Q0=124 кДж/моль.
Принято считать, что палладий образует с водородом две нестехиометрические фазы: 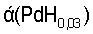 и β(PdH0,59).
и β(PdH0,59).
Нормальный электродный потенциал реакции Pd-2е→Pd2+ равен ϕ0=0,987 В, его окислительно-восстановительный потенциал в кислотных средах равен 0,64-0,83 В, электрохимический эквивалент палладия Pd2+ составляет 0,553 мг/Кл.
Согласно данным авторов [Р.Рипан, И.Читяну. Неорганическая химия. - ч.2.- М.: Мир, 1972. - с.653], наибольшей абсорбционной способностью по отношению к водороду обладает коллоидный палладий, затем порошкообразный и, наконей, губчатый палладий. При комнатной температуре один объем металлического палладия поглощает 2800 объемов водорода и поглощающая способность возрастает при добавлении к металлическому палладию серебра, золота или бора. Палладий может отдавать водород в вакууме при нагревании до 300°. Абсорбция водорода палладием сопровождается образованием твердого раствора или образованием гидридов включения Pd2H, PdH0,6.
По данным авторов [Курдюмов А.В. и др. Производство отливок из сплавов цветных металлов. М.: Металлургия. - 1986. - c.332-333] равновесная растворимость водорода в палладии описывается уравнением
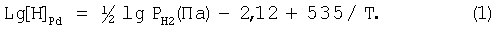
При температуре плавления палладий растворяет до 60 см3 водорода в 100 г палладия, при комнатной температуре - 850 объемов водорода.
Таким образом, при получении водорода электрохимическим способом из воды или водного раствора, когда катодом является палладий, выделяющийся в результате электрохимического процесса на катоде, водород будет поглощаться палладием, затем палладий будет транспортировать водород к месту его использования, для чего другой конец палладия может быть выполнен в виде губки с хорошо развитой поверхностью.
Для передачи водорода от катода к потребителю можно использовать зависимость растворимости и диффузии водорода в палладии от температуры и давления:
- конец катода, обращенный к потребителю имеет более высокую температуру, чем другой конец катода, находящийся в источнике водорода;
- у конца катода, обращенного к потребителю давление ниже, чем у другого конца катода, находящегося в источнике водорода.
Для передачи водорода можно использовать биметаллическую пластинку из материалов с различной растворимостью водорода, причем материал пластинки с меньшей растворимостью находится в электролизере, а с большей растворимостью - у потребителя, передача водорода осуществляется путем диффузии в местах контакта материалов биметаллической пластинки с различной растворимостью водорода.
Известно, что водород в металле находится в атомарном состоянии, что создает дополнительные предпосылки для использования атомарного водорода в качестве активных центров различных цепных процессов. Если в качестве анода использовать титан, сталь и другие инертные материалы, то выделяющийся на аноде кислород может быть практически использован, а в случае выхода в атмосферу улучшает экологию окружающей среды.
Пример практического применения.
На чертеже показана установка (электрохимический генератор (ЭХГ) получения и транспортировки водорода), работающая по принципу непрерывного процесса: 1 - корпус, 2 - катод, 3 - анод, 4 - водный раствор электролита.
Применительно к работе двигателя внутреннего сгорания (ДВС) источником питания в начальный момент является аккумуляторная батарея (АБ).
АБ на автомобиле служит также для питания электрическим током стартера при пуске двигателя и резервной системы питания двигателя бензином для кратковременной работы двигателя с целью подогрева конца катода и подачи выделяющегося из катода при подогреве водорода в смеситель ДВС.
В случае, если мощность, потребляемая включенными потребителями, превышает мощность, развиваемую генератором, АБ, разряжаясь, обеспечивает питание потребителей одновременно с работающим генератором.
Ток в ванне регулируется и управляется из кабины грузового или кузова легкового автомобиля. С увеличением оборотов двигателя автомобиля генератор вырабатывает больше электроэнергии (повышается напряжение и электрический ток в ванне), что соответственно интенсифицирует выделение водорода на катоде, ускоряет и увеличивает количество поглощаемого катодом водорода.
Пуск и подогрев двигателя, а следовательно, и катода, осуществляется на бензине с последующим переходом на водород. Остановку двигателя производят выключением зажигания, при этом электролиз в ванне прекращается.
Водород также можно подавать к углеводородному топливу в ДВС для увеличения его реакционной способности, мощности и экономии топлива, а также для уменьшения токсичности отработанных газов.
Для повышения мощности установки ЭХГ можно выполнить в виде многокамерного электролизера, можно поставить также необходимое количество генераторов и АБ.
Электрохимический генератор работает следующим образом. Водный раствор заливают в ЭХГ, подключают АБ к полюсам (минус - к катоду 2, плюс - к аноду 3 в соответствии с чертежом). В ЭХГ создают повышенное давление и охлаждение, после чего проводят процесс электролиза. У потребителя при атмосферном давлении и подогреве выделяют водород в соответствии с уравнением (1). Выделяющийся у потребителя водород зафиксирован с помощью обычных аналитических средств, что подтверждает возможность транспортировки водорода. Более высокие результаты получены при откачке водорода у потребителя.
Способ получения и транспортировки водорода может быть использован:
- для доставки водорода в качестве топлива в смеситель ДВС,
- для добавки водорода к топливу в ДВС,
- в реакциях с участием водорода, особенно, если катод используется в качестве катализатора,
- для доставки сверхчистого водорода при наполнении емкостей.
По сравнению с прототипом предлагаемый способ получения и транспортировки водорода интенсифицирует процессы, в которых используется водород, сокращает потери водорода при транспортировке, сохраняет высокую чистоту водорода, сокращает число операций от источника получения до потребителя водорода, при этом отпадает необходимость использования промежуточных сборников водорода.
Изобретение относится к области получения и транспортировки чистого водорода, который может быть использован как энергоноситель для добавки к топливу и как источник поступления чистого водорода к потребителю. Осуществляется электролиз водного раствора с использованием катода, один конец которого находится в водном растворе, а другой - у потребителя. Давление на конце катода, находящемся у потребителя, ниже, а температура выше, чем на другом конце катода, находящемся в водном растворе. Катод выполняют из таких материалов, как Та, Pd, Pt, Ni, Mg, Ti, V, Nb, U, Mg2Ni, TiFe, LaNi5, сплавы V-Nb, Ni-Ta, которые внедряют водород в решетку. Изобретение позволяет сократить потери водорода при транспортировке, повысить его чистоту и сократить число операций от источника получения до места потребления водорода. 1 ил.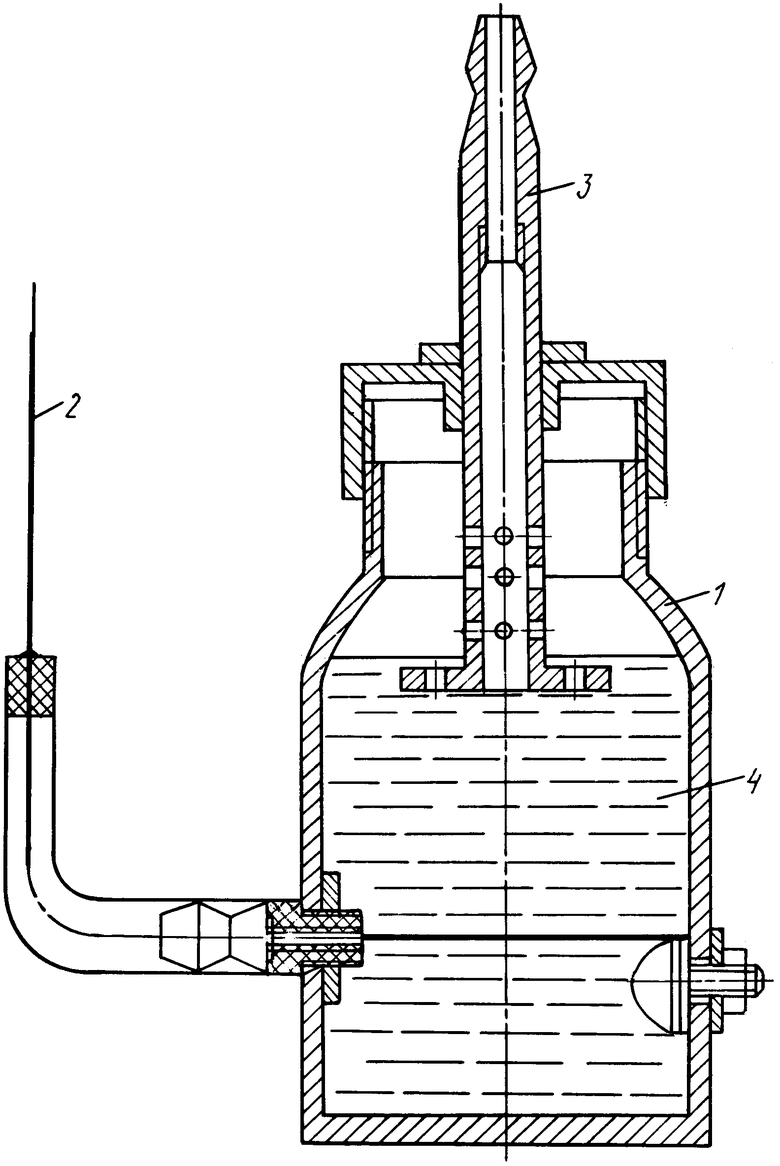
Способ получения и транспортировки водорода, включающий электролиз водного раствора с использованием катода, один конец которого находится в водном растворе, а другой - у потребителя, при этом давление на конце катода, находящемся у потребителя, ниже, а температура выше чем на другом конце катода, находящемся в водном растворе, причем катод выполняют из таких материалов, как Та, Pd, Pt, Ni, Mg, Ti, V, Nb, U, Mg2Ni, TiFe, LaNi5, сплавы V-Nb, Ni-Ta и другие материалы, которые внедряют водород в решетку.
| US 4146446 А, 27.03.1979 | |||
| Способ поглощения водорода | 1960 |
|
SU140046A1 |
| УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА | 1965 |
|
SU433921A1 |
| US 4265720 A, 05.05.1981. | |||
Авторы
Даты
2007-01-27—Публикация
2004-09-13—Подача