ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому применению экстракта обработанного женьшеня и выделенных из него сапониновых соединений для профилактики и лечения инсульта мозга и заболеваний мозга у человека или млекопитающих. Более конкретно, настоящее изобретение относится к новому применению продукта из обработанного женьшеня с усиленными фармакологическими эффектами, обусловленными последовательной обработкой, например - обработкой кислотой и последующей биоконвертирующей обработкой, такой как процессы молочнокислого ферментирования и ферментирования кишечными бактериями.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Инсульт мозга бывает двух типов, а именно - ишемический инсульт, возникающий из-за ишемического состояния ткани мозга, вызванного нарушением или снижением кровоснабжения мозга, и геморрагический инсульт, возникающий из-за кровотечения из кровеносных сосудов мозга, причем первый тип составляет примерно 80% от общего числа больных с инсультом мозга.
Сообщалось, что причиной повреждения нейрональных клеток мозга являются выделение избыточного количества медиатора, возбуждающего нейроны, продукция свободных радикалов, ингибирование синтеза белка, аномальная экспрессия генов, активация иммунного ответа и т.д., однако, еще не разработано терапевтически эффективное средство для профилактики повреждения нейрональных клеток мозга.
Ингибирование циклооксигеназы-2 (СОХ-2) поддерживает активность нейронов мозга посредством ингибирования выделения глутамата, вызванного ингибированием репродукции ПГЕ2. Поэтому, поскольку многие больные, страдающие ревматизмом и болями, уже принимали ингибитор СОХ-2, большое внимание было уделено результатам клинического исследования, посвященного корреляции между частотой возникновения инсульта мозга и популяцией пациентов, принимавших лекарственный препарат, который может быть новым объектом исследования при поиске эффективных средств для профилактики и лечения инсульта мозга (ladecola С. et al., PNAS, 30, pp.1294-1299, 2001).
Известно, что существует много видов растений рода Panax, относящегося к семейству Araliaceae, например - Panax ginseng, распространенный или культивируемый в дальневосточном регионе Азии, Panax quinquefolia - в Америке и Канаде, Panax notoginseng - в Китае, Panax trifolia - в восточном регионе Северной Америки, Panax japonica - в Японии, Китае и Непале, Panax pseudoginseng - в Непале, Panax vietnamensis - во Вьетнаме, Panax elegatior, Panax wangianus и Panax bipinratifidus и т.д.
До сих пор женьшень был широко известен как типичное пищевое тонизирующее средство. Недавно были опубликованы различные научные исследования химического состава и фармакологических эффектов женьшеня, так что его таинственные фармакологические эффекты изучались с использованием современных научных подходов. К настоящему времени установлено, что женьшень оказывает различные фармакологические эффекты, такие как эффект предупреждения старения, противоатеросклеротический эффект, лечение гиперлипидемии, лечение печеночной недостаточности, улучшение функции печени, защита от радиационного поражения, усиление иммунитета, улучшение функции мозга, антитромботический, антистрессорный, антидиабетический, антигипертензивный, противоопухолевый эффекты и т.п.
Было установлено, что основным компонентом растений рода Panax является сапонин с основой даммаранового типа. Основными сапонинами Panax ginseng являются гинсенозиды Rb1, Rb2, Rc, Rd, Rg1 и Re. Все они имеют различную биологическую активность, в зависимости от химической структуры.
Было предпринято много попыток модифицировать структуру сапонинов посредством обработки с целью повышения их фармакологической активности.
В корейской Патентной публикации №10-1997-000239, выпущенной 21 января 1997 г., описан процесс получения обработанного женьшеня, который получают посредством высокотемпературной обработки и который содержит высокие концентрации гинсенозида Rg3 и Rg5, так что полученный обработанный женьшень обладает повышенной активностью, отличающейся от активности исходной формы женьшеня.
В корейской Патентной публикации №10-1997-061909, выпущенной 12 сентября 1997 г., описан процесс получения метаболитов сапонинов, например - соединения К, из сапонинов женьшеня с использованием кишечных бактерий.
Тем не менее, не было открытий или предложений, касающихся процесса получения обработанного растения рода Panax посредством последовательной обработки, включающей обработку кислотой и последующую обработку посредством ферментации с использованием молочнокислых бактерий или кишечных бактерий.
Авторы настоящего изобретения интенсивно проводили научные исследования химического состава и фармакологических эффектов женьшеня, в частности - способов обработки женьшеня и физиологической активности обработанного женьшеня. В результате исследований авторы обнаружили, что в результате последовательной обработки, включающей обработку кислотой и последующую обработку экстракта женьшеня посредством ферментации с использованием молочнокислых бактерий или кишечных бактерий, экстракт из экстракта обработанного женьшеня проявляет значительно усиленные фармакологические эффекты, в частности - повышенную активность в отношении профилактики или лечения инсульта мозга, и, в конечном итоге, они совершили настоящее изобретение.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, задачей настоящего изобретения является обеспечение применения обработанного экстракта женьшеня, полученного посредством осуществления стадий, включающих обработку экстракта женьшеня кислотой и последующую ферментационную обработку с использованием молочнокислых бактерий или кишечных бактерий, и выделенных из него сапонинов для производства медикамента для профилактики или лечения болезни инсульта мозга.
Другая задача настоящего изобретения состоит в обеспечении способа лечения или профилактики болезни инсульта мозга у млекопитающих, включающего введение указанному млекопитающему эффективного количества указанного экстракта и сапониновых соединений, выделенных из него, совместно с фармацевтически приемлемым носителем.
Настоящее изобретение предусматривает фармацевтическую композицию, содержащую обработанный экстракт женьшеня, полученный посредством осуществления стадий, по существу включающих обработку экстракта женьшеня кислотой и последующую ферментационную обработку с использованием молочнокислых бактерий или кишечных бактерий, в качестве активного ингредиента в количестве, эффективном для лечения или профилактики у человека или млекопитающих, страдающих инсультом мозга или другими заболеваниями мозга, совместно с фармацевтически приемлемым носителем.
Настоящее изобретение также предусматривает применение экстракта женьшеня, полученного посредством осуществления стадий, включающих обработку экстракта женьшеня кислотой и последующую ферментационную обработку с использованием молочнокислых бактерий или кишечных бактерий, для приготовления медикамента для профилактики или лечения инсульта мозга и заболеваний мозга.
Кроме того, настоящее изобретение также предусматривает способ лечения или профилактики болезни инсульта мозга у млекопитающего, включающий введение указанному млекопитающему эффективного количества указанного экстракта совместно с фармацевтически приемлемым носителем.
Описанный экстракт может быть получен посредством проведения следующих стадий:
1-я стадия:
Первая стадия является стадией обработки растительного материала кислотой, состоящей в следующем:
(1) Стадия обработки кислотой
Более конкретно, на 1-й стадии высушенный растительный материал рода Panax (например - корни Panax ginseng) подвергают следующей обработке кислотой: например, к растительному материалу примерно 1-50 раз, предпочтительно - 5-20 раз, добавляют 0,1-10% кислотного компонента, предпочтительно - уксусную кислоту, лимонную кислоту, молочную кислоту или содержащий кислоту пищевой продукт, например - плоды Schizandra chinensis, a затем подвергают его инкубации при температуре, варьирующей от 20 до 80°С, предпочтительно - в диапазоне от 40 до 70°С, в течение периода, варьирующего от 1 до 48 часов, предпочтительно - от 3 до 12 часов. К материалу добавляют органический растворитель, например - метанол, этанол, пропанол, бутанол, диэтиловый эфир или этилацетат, а затем производят экстракцию с получением экстракта, растворимого в органическом растворителе; в завершение экстракт нейтрализуют основанием с получением экстракта из химически обработанного экстракта женьшеня.
Обработанный таким образом женьшень можно высушить при температуре, более низкой, чем температура нагрева при процедуре обработки, то есть при нормальной температуре, равной 80°С, известными способами с получением сухого обработанного женьшеня, или, если это необходимо, его можно обрабатывать дальше с получением порошкообразного женьшеня.
Альтернативно, можно производить экстракцию из обработанного женьшеня известными способами с получением экстракта обработанного женьшеня. Более конкретно, производят экстракцию из обработанного женьшеня с использованием растворителя, а затем растворитель удаляют in vacuo или посредством сублимационной сушки с получением экстракта обработанного женьшеня в виде сухого порошка.
Растворители, которые могут быть использованы, включают воду, низшие спирты, такие как метанол, этанол и т.п., низшие кетоны, такие как ацетон, метилэтилкетон и т.п., суперкритическую жидкость или смесь указанных растворителей.
Растительный материал, который может быть использован, включает, но не ограничивается им, растение рода Panax, например - свежий женьшень, белый женьшень и красный женьшень, мелкие корни женьшеня или листья женьшеня, или экстракты из них, которые могут быть использованы как есть, в измельченном или порошкообразном виде, в виде обработанных продуктов из них и в виде побочного продукта, который содержит сапонин даммаранового типа, предпочтительно - корень, стебель, лепестки, листья и плоды Panax ginseng, Panax quinquefolia, Panax notoginseng, Panax trifolia, Panax japonica, Panax pseudoginseng, Panax vietnamensis, Panax elegatior, Panax wangianus, Panax bipinratifidus и Panax angustifolium и культуры их тканей, и экстракты из них.
Указанный процесс (1) может быть проведен над растительным материалом перед описанной ниже 2-й стадией.
2-я стадия: стадия ферментации
Экстракт, полученный на 1-й стадии, далее подвергают процессу биопревращения (биоконверсии), например - ферментации с использованием молочнокислых или кишечных бактерий, следующим образом:
Например, молочнокислые бактерии или кишечные бактерии добавляют к экстракту, полученному на 1-й стадии, и инкубируют при температуре, варьирующей от 20 до 50°С, предпочтительно - от 25 до 40°С, в течение периода от 8 часов до 8 дней, предпочтительно - от 24 часов до 3 дней, с получением экстракта, ферментированного бактериями.
Время инкубации варьирует в зависимости от рода использованных бактерий.
Молочнокислые бактерии, которые могут быть использованы, включают любые бактерии, способные метаболизировать гинсенозид Rh3 до гинсенозида Rh2, предпочтительно - молочнокислые бактерии, относящиеся к роду Bifidobacterium, более предпочтительно - по меньшей мере, один вид бактерий или смесь бактерий, выбранных из группы, состоящей из Bifidobacterium infants, Bifidobacterium bifidum, Lactobadllus tactis, Clostridium butyricum, Bifidobacterium K-103, Bifidobacterium K-506, Bifidobacterium K-513, Bifidobacterium K-525, Bifidobacterium KK-1 и Bifidobacterium KK-2 (описаны в Arch. Pharm. Res., 21, p.54-61, 1988).
Кишечные бактерии, которые могут быть использованы, включают любые бактерии, способные метаболизировать гинсенозид Rh3 до гинсенозида Rh2, предпочтительно - кишечные бактерии, относящиеся к родам Bacteriodes, Fusobacterium и Eubacterium, более предпочтительно - по меньшей мере, один вид бактерий или смесь бактерий, выбранных из группы, состоящей из Bacteriodes JY-6 (описана в Biol. Pharm. Bull., 23, pp.1481-1485, 2000), Bacteriodes stercoris, Fusobacterium K-60 (описана в Biol. Pharm. Bull., см. выше) и Eubacterium L-8 (описана в Biol. Pharm. Bull., см. выше).
После описанных стадий для выделения фракций сапонинов или сапониновых соединений из экстракта, полученного на описанной 2-й стадии, можно осуществить следующий процесс.
3-я стадия: процесс выделения.
Для выделения фармакологически активных фракций или сапониновых соединений из экстракта, полученного на 2-й стадии, воду, низшие спирты, такие как метанол, этанол, пропанол, бутанол, этилацетат, дихлорметан, хлороформ, гексан, диэтиловый эфир или смесь этих растворителей можно использовать в качестве подходящего растворителя для экстрагирования или выделения фракций или соединений из экстракта, полученного на 2-й стадии.
Кроме того, активный ингредиент можно экстрагировать или выделить с использованием специального способа экстракции, например - путем экстракции суперкритической жидкостью ("supercritical fluid extraction" - SFE) с получением частично очищенных фракций сапонинов, а затем - с использованием способа хроматографии на колонке с силикагелем для выделения из них отдельных сапонинов.
После описанной стадии, если это необходимо, в дополнение к описанным стадиям можно провести дальнейшие процессы, такие как процесс лиофилизационной сушки, перемешивание или процесс разведения.
Из приведенных ниже процессов можно выбрать один или оба, в зависимости от форм конечного продукта согласно настоящему изобретению.
4-я стадия: процесс сушки.
(1) Описанный выше экстракт, полученный на стадиях 2 или 3, концентрируют in vacuo, а затем высушивают посредством лиофилизации или распылительной сушки.
(2) Описанный выше экстракт, полученный на стадиях 2 или 3, центрифугируют для удаления и осаждения загрязнений, и супернатант концентрируют in vacuo, а затем высушивают посредством лиофилизации или распылительной сушки.
Через описанные выше процессы 1-й и 2-й стадий сапонины, такие как гинсенозиды Rb1, Rb2, Rc и т.д., содержащиеся в растительном материале, преобразуются в химически модифицированные гинсенозиды, такие как гинсенозид Rg3, посредством обработки кислотой или тепловой обработки на стадии 1, а затем сахарная часть в положении 3 в модифицированных сапонинах далее деградирует с образованием дополнительно модифицированных сапонинов, содержащих деградированный сапонин - гинсенозид Rh2.
Настоящее изобретение также предусматривает фармацевтическую композицию, содержащую сапониновые соединения, выбранные из группы, состоящей из гинсенозида Rb1, Rb2, Rc, Rd, Re, Rf, Rg1, 20-гинсенозид Rg3 и их смеси, предпочтительно - 20-гинсенозид Rg3, в качестве активного ингредиента в количестве, эффективном для лечения или профилактики у людей или млекопитающих, страдающих от заболеваний мозга, совместно с фармацевтически приемлемым носителем.
Настоящее изобретение также предусматривает применение сапониновых соединений, выбранных из группы, состоящей из гинсенозида Rb1, Rb2, Rc, Rd, Re, Rf, Rg1, 20-гинсенозид Rg3, их смеси, предпочтительно - 20-гинсенозида Rg3, для приготовления медикамента для профилактики и лечения инсульта мозга и заболеваний мозга.
Кроме того, настоящее изобретение также предусматривает способ лечения или профилактики инсульта мозга и заболеваний мозга у млекопитающих, включающий введение указанному млекопитающему эффективного количества сапониновых соединений, выбранных из группы, состоящей из гинсенозида Rb1, Rb2, Rc, Rd, Re, Rf, Rg1, 20-гинсенозид Rg3 и их смеси, предпочтительно - 20-гинсенозида Rg3, совместно с фармацевтически приемлемым носителем.
Композиция согласно настоящему изобретению может дополнительно включать стандартные носители, адъюванты или разбавители, в зависимости от использованного способа. Предпочтительно, чтобы указанный носитель был использован в качестве подходящего вещества в зависимости от применения и способа введения, но это не ограничивает его выбор. Подходящие разбавители перечислены в печатном издании Remington's Pharmaceutical Science (Mack Publishing Co., Easton PA).
Приведенные далее в этой работе способы составления рецептуры и наполнители являются исключительно примерами и никоим образом не ограничивают изобретение.
Композиция согласно настоящему изобретению может быть выполнена как фармацевтическая композиция, содержащая фармацевтически приемлемые носители, адъюванты или разбавители, например - лактозу, декстрозу, сахарозу, сорбит, манит, ксилит, эритрит, мальтит, крахмалы, акациевую смолу, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло. Рецептуры могут, кроме того, включать наполнители, антиагглютинирующие агенты, смазывающие агенты, смачивающие агенты, вкусовые агенты, эмульгаторы, консерванты и тому подобное. Композиции согласно настоящему изобретению могут быть составлены так, чтобы они обеспечивали быстрое, длительное или отсроченное выделение активного ингредиента после их введения пациенту посредством выполнения любых процедур, хорошо известных в данной области техники.
Например, композиции согласно настоящему изобретению могут быть растворены в маслах, пропиленгликоле или других растворителях, которые обычно используют для выполнения инъекций.
Подходящие примеры носителей включают физиологический раствор, полиэтиленгликоль, этанол, растительные масла, изопропилмиристат и т.п., но не ограничиваются ими. Для местного применения соединения согласно настоящему изобретению могут быть включены в рецептуры, имеющие форму мазей и кремов.
Фармацевтические рецептуры, содержащие композицию согласно настоящему изобретению, могут быть приготовлены в любой форме, например - в форме для перорального приема (порошок, таблетка, капсула, мягкая капсула, водный лекарственный препарат, сироп, пилюля с эликсиром, саше с порошком, гранулы), для местного нанесения (крем, мазь, лосьон, гель, бальзам, пластырь, паста, раствор для распыления, аэрозоль и т.п.) или в форме препарата для инъекций (раствор, суспензия, эмульсия).
Композиция согласно настоящему изобретению в фармацевтических дозировочных формах может быть использована в форме ее фармацевтически приемлемых солей, а также может быть использована отдельно или в подходящем сочетании, а также в комбинации с другими фармацевтически активными соединениями.
Желательная доза экстракта, являющегося предметом изобретения, или соединений согласно настоящему изобретению варьирует в зависимости от состояния и массы субъекта, тяжести заболевания, формы препарата, пути и длительности введения и может быть выбрана специалистом в данной области техники. Однако, для получения желаемого эффекта, в целом, рекомендуется вводить количество экстракта, являющегося предметом изобретения, или соединений согласно настоящему изобретению, варьирующее от 0,01-10 г/кг, предпочтительно - от 1 до 5 г/кг массы в день. Доза может быть введена в виде одной дозы или разделена на несколько приемов в день. Что касается состава, то комплексная растительная композиция должна присутствовать в количестве 0,01-80 мас.%, предпочтительно - в количестве 0,5-50 мас.% от общей массы композиции.
Фармацевтическую композицию согласно настоящему изобретению можно вводить целевому животному, например - млекопитающему (крыса, мышь, домашние животные или человек), через различные пути. Пригодны любые способы введения, например, введение может быть произведено перорально, ректально или посредством внутривенных, внутримышечных, подкожных, внутрикожных, интратекальных, эпидуральных или интрацеребровентрикулярных инъекций.
Авторы настоящего изобретения продемонстрировали, что композиция согласно настоящему изобретению, содержащая описанный экстракт женьшеня или соединения согласно настоящему изобретению, обладает профилактической или лечебной активностью в отношении инсульта мозга, при проведении эксперимента in vivo, хорошо известного в данной области техники, например - испытания с моделью окклюзии средней мозговой артерии, которое состоит из следующих стадий: нейлоновый филамент вводят во внутреннюю сонную артерию с целью закупорки средней мозговой артерии, а через 120 минут филамент удаляют для обеспечения реперфузии артерии.
Соответственно, еще одна задача настоящего изобретения состоит в том, чтобы обеспечить продукты лечебного (оздоровительного) питания, содержащие описанный экстракт или соединения согласно настоящему изобретению, полученные посредством описанных процессов, и приемлемые с ситологической точки зрения добавки для профилактики инсульта мозга и заболеваний мозга.
При этом описанную композицию можно добавить к пищевому продукту, пищевой добавке или к напитку для профилактики заболевания инсультом мозга. С целью профилактики заболевания инсультом мозга количество описанного экстракта или соединения согласно настоящему изобретению в пищевом продукте или напитке может, в целом, варьировать в диапазоне от 0,1 до 15 мас.%, предпочтительно - от 1 до 10 мас.%, от общей массы композиции оздоровительного пищевого продукта и в диапазоне от 1 до 30 г, предпочтительно - от 3 до 10 г, на 100 мл композиции оздоровительного напитка.
Если композиция оздоровительного напитка согласно настоящему изобретению содержит описанный экстракт или соединения согласно настоящему изобретению в качестве активного компонента в указанном количестве, нет определенного ограничения по другому компоненту жидкости, причем другой компонент жидкости может быть различным подсластителем или природным углеводом и т.п., как в обычном напитке. Примерами упомянутых природных углеводов являются моносахариды, такие как глюкоза, фруктоза и т.п.; дисахариды, такие как мальтоза, сахароза и т.п.; обычные сахара, такие как декстрин, циклодекстрин; и сладкие спирты, такие как ксилит и эритрит и т.п. В качестве других подсластителей, кроме упомянутых выше, можно с успехом использовать природные подсластители, например - тауматин, экстракт стевии, например - леводиозид А, глицирризин и др.; и синтетические подсластители, например - сахарин, аспартам и др. Количество описанного природного углевода обычно варьирует от примерно 1 до 20 г, предпочтительно - от 5 до 12 г, на 100 мл существующей композиции напитка.
Другими компонентами, кроме указанной композиции, являются различные питательные вещества, витамины, минеральные вещества или электролиты, синтетические вкусовые добавки, красители и добавки, улучшающие качество, например - в случае шоколадной пасты и т.п., пектиновая кислота и ее соли, альгиновая кислота и ее соли, органические кислоты, защитные коллоидные связующие вещества, рН-регулирующие агенты, стабилизаторы, консерванты, глицерин, спирт, газирующий агент, используемый в газированных напитках, и т.п. Дополнительными компонентами, кроме перечисленных выше, могут быть фруктовый сок для приготовления натурального фруктового сока, напитков на основе фруктового сока и овощных напитков, причем этот компонент может быть использован отдельно или в комбинации. Доля этих компонентов не очень важна, но обычно варьирует примерно от 0 до 20 мас.% на 100 мас.% существующей композиции.
Примерами пищевых продуктов, содержащих указанный экстракт или соединения согласно настоящему изобретению, являются различные пищевые продукты, напитки, жевательные резинки, витаминные комплексы, оздоровительные (диетические) пищевые продукты и тому подобное.
Специалисту в данной области техники будет очевидно, что в композициях, применениях и препаратах согласно настоящему изобретению могут быть произведены различные модификации и вариации без отклонения от сущности и объема изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Указанные и иные цели, признаки и другие преимущества настоящего изобретения будут более понятны из приведенного ниже подробного описания, рассматриваемого совместно с прилагаемым чертежом, который демонстрирует эффект обработанного экстракта женьшеня и выделенных из него сапониновых соединений.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение более конкретно разъясняется приведенными ниже примерами. Тем не менее, следует понимать, что настоящее изобретение никоим образом не ограничивается этими примерами.
Пример 1. Получение обработанного экстракта женьшеня (1)
500 г корня шестилетнего растения Panax ginseng с рынка Kyung Dong разрезали на куски, пять раз экстрагировали 5 л метанола и концентрировали с получением 25 г необработанного экстракта женьшеня. Экстракт растворяли в 30 мл дистиллированной воды, четыре раза экстрагировали 1500 мл бутанола и концентрировали с получением 10 г бутанольной фракции. К ней добавляли 10 г Bifidobacterium КК-1 (инвентарный номер депозитария: КССМ 10364) и 10 г Bifidobacterium KK-2 (инвентарный номер депозитария: КССМ 10365) и инкубировали при 37°С в течение 72 часов. Инкубаты экстрагировали бутанолом, концентрировали и высушивали с получением 4 г обработанного экстракта женьшеня, далее в этой работе обозначаемого как GBM.
Пример 2. Получение обработанного экстракта женьшеня (2)
1 кг корня шестилетнего растения Panax ginseng разрезали на куски, пять раз экстрагировали 10 л метанола и концентрировали с получением 50 г экстракта женьшеня. Экстракт растворяли в 50 мл дистиллированной воды, четыре раза экстрагировали 3000 мл бутанола и концентрировали с получением 20 г бутанольной фракции, далее в этой работе обозначаемой как GB.
Пример 3. Получение обработанного экстракта женьшеня (3)
10 г корня шестилетнего растения Panax ginseng разрезали на куски. К нему добавляли 1 л дистиллированной воды, содержащей 0,1% молочной кислоты, и инкубировали при 60°С в течение 5 часов. рН культивата доводили до 6,8-7,0 и три раза экстрагировали 3 л бутанола с получением 6,5 г обработанного экстракта женьшеня, далее в этой работе обозначаемого как GA.
Пример 4. Получение обработанного экстракта женьшеня (4)
10 г корня шестилетнего растения Panax ginseng разрезали на куски. К нему добавляли 1 л дистиллированной воды, содержащей 0,1% молочной кислоты, и инкубировали при 60°С в течение 5 часов. рН культивата доводили до 6,8-7,0 и три раза экстрагировали 3 л бутанола с получением 6,5 г обработанного экстракта женьшеня. К нему добавляли по 5 г Bifidobacterium KK-1 (инвентарный номер депозитария: КССМ 10364) и Bifidobacterium KK-2 (инвентарный номер депозитария: КССМ 10365) и затем инкубировали при 37°С в течение 72 часов с получением инкубатов. Инкубаты экстрагировали бутанолом, концентрировали и высушивали с получением 3,5 г обработанного экстракта женьшеня, далее в этой работе обозначаемого как GAM.
Пример 5. Получение обработанного экстракта женьшеня (5)
1 кг разрезанного на куски Panax ginseng пять раз экстрагировали 10 л метанола и концентрировали in vacuo с получением 50 г экстракта. Экстракт растворяли в 50 мл дистиллированной воды, четыре раза экстрагировали 3000 мл бутанола и концентрировали с получением 20 г бутанольной фракции. Фракцию далее хроматографировали на колонке с силикагелем (размер колонки: 3,5×60 см, система проявляющих растворителей: хлороформ:МеОН=10:1) с выделением 2 г сапониновой фракции, содержащей большое количество гинсенозидов Re, Rf и Rg1, далее в этой работе обозначаемой как GPT.
Пример 6. Получение обработанного экстракта женьшеня (6)
1 кг разрезанного на куски Panax ginseng пять раз экстрагировали 10 л метанола и концентрировали in vacuo с получением 50 г экстракта. Экстракт растворяли в 50 мл дистиллированной воды, четыре раза экстрагировали 3000 мл бутанола и концентрировали с получением 20 г бутанольной фракции. Фракцию далее хроматографировали на колонке с силикагелем (размер колонки: 3,5×60 см, система проявляющих растворителей: хлороформ:МеОН=10:1) с выделением 2 г сапониновой фракции, содержащей большое количество гинсенозидов Re, Rf и Rg. К ней добавляли по 3 г (влажной массы) Bifidobacterium KK-1 (инвентарный номер депозитария: КССМ 10364) и Bifidobacterium KK-2 (инвентарный номер депозитария: КССМ 10365) и затем инкубировали при 37°С в течение 72 часов с получением инкубатов. Инкубаты экстрагировали бутанолом, концентрировали и высушивали с получением 1,2 г обработанного экстракта женьшеня, далее в этой работе обозначаемого как GTMP.
Пример 7. Получение обработанного экстракта женьшеня (7)
1 кг разрезанного на куски шестилетнего Panax ginseng пять раз экстрагировали 10 л метанола и концентрировали in vacuo с получением 50 г экстракта. Экстракт растворяли в 50 мл дистиллированной воды, четыре раза экстрагировали 3000 мл бутанола и концентрировали с получением 20 г бутанольной фракции. Фракцию далее хроматографировали на колонке с силикагелем (размер колонки: 3,5×60 см, система проявляющих растворителей: хлороформ:МеОН=10:1) с выделением 2,5 г сапониновой фракции, содержащей большое количество гинсенозидов Rb1, Rb2, Rc и Rd, далее в этой работе обозначаемой как GPD.
Пример 8. Получение обработанного экстракта женьшеня (8)
1 кг разрезанного на куски шестилетнего Panax ginseng пять раз экстрагировали 10 л метанола и концентрировали in vacuo с получением 50 г экстракта. Экстракт растворяли в 50 мл дистиллированной воды, четыре раза экстрагировали 3000 мл бутанола и концентрировали с получением 20 г бутанольной фракции. Фракцию далее хроматографировали на колонке с силикагелем (размер колонки: 3,5×60 см, система проявляющих растворителей: хлороформ:МеОН=10:1) с выделением 2 г сапониновой фракции, содержащей большое количество гинсенозидов Rb1, Rb2, Rc и Rd. К ней добавляли по 3 г (влажной массы) Bifidobacterium KK-1 (инвентарный номер депозитария: КССМ 10364) и Bifidobacterium KK-2 (инвентарный номер депозитария: КССМ 10365) и затем инкубировали при 37°С в течение 72 часов с получением инкубатов. Инкубаты экстрагировали бутанолом, концентрировали и высушивали с получением 2 г обработанного экстракта женьшеня, далее в этой работе обозначаемого как GPDM.
Сравнительный пример 1. Получение необработанного экстракта женьшеня.
20 г разрезанного на куски пятилетнего Panax ginseng пять раз экстрагировали дистиллированной водой при 60°С в течение 5 часов, концентрировали in vacuo в испарителе (Eyella, модель KN-IN, Япония) и высушивали посредством лиофилизации (Samwon Nangyul Co. Модель SFDSM24L, Корея) с получением 1 г порошкообразного необработанного экстракта женьшеня.
Сравнительный пример 2. Получение экстракта женьшеня, обработанного кислотой.
20 г корня пятилетнего растения Panax ginseng разрезали на куски. Добавляли 2000 мл дистиллированной воды, содержащей 0,1% молочной кислоты, и инкубировали при 60°С в течение 5 часов. К инкубату добавляли 5000 мл бутанола, экстрагировали, концентрировали in vacuo в испарителе (Eyella, модель KN-IN, Япония) и высушивали посредством лиофилизации (Samwon Nangyul Co. Модель SFDSM24L, Корея) с получением 1,5 г экстракта женьшеня, обработанного кислотой.
Экспериментальный пример 1:
Эксперимент по анализу содержания
По 2 г экстрактов, полученных в приведенных выше Сравнительных примерах 1 и 2 и Примерах 1 и 5, три раза экстрагировали 100 мл метанола. Фазу, растворимую в метаноле, концентрировали in vacuo и суспендировали в 100 мл дистиллированной воды. Суспензию три раза экстрагировали 100 мл эфирного растворителя и концентрировали in vacuo. Далее концентраты три раза экстрагировали 100 мл бутанола и концентрировали in vacuo с получением концентратов. Концентраты растворяли в 100 мл МеОн с получением 100 мг сапониновой фракции. Анализ содержания был выполнен посредством ТСХ (система растворителей: хлороформ:метанол:вода=65:35:10, распыляемый реагент: 5% раствор серной кислоты в метаноле) с использованием ТСХ-сканера (Shimadzu, CS-9301PC) в качестве детектора. Полученные результаты приведены в Таблице 1.
В результате, хотя содержание гинсенозида F2 и соединения К достоверно увеличивалось в Примере 1, где обработка производилась молочнокислыми бактериями, содержание гинсенозида Rg3, Rh2 и протопанаксадиола достоверно увеличивалось в Примере 4, где обработка производилась кислотой, а затем - молочнокислыми бактериями.
Экспериментальный пример 2:
Активность в отношении профилактики или лечения инсульта мозга
Чтобы подтвердить профилактическую или лечебную активность обработанного экстракта женьшеня и выделенных из него сапонинов в отношении инсульта мозга и сравнить активность экстракта согласно настоящему изобретению с активностью необработанного экстракта женьшеня из Сравнительного примера 1 и обработанного кислотой экстракта женьшеня из Сравнительного примера 2, был выполнен эксперимент с использованием следующей процедуры.
Способ
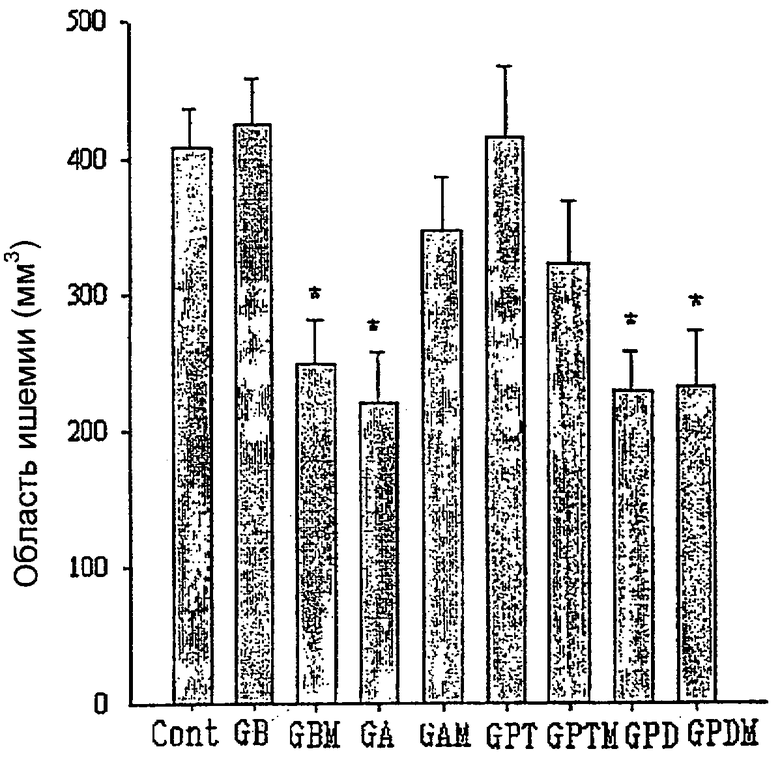
Примерно за пять минут до реперфузии животному с моделью инсульта мозга вводили различные концентрации испытываемых образцов. Затем начинали реперфузию. Через 24 часа после 1-й операции животное умерщвляли и выделяли у него мозг, который затем разрезали на срезы мозга толщиной 2 мм и окрашивали по способу окраски 2,3,5-трифенилтетразолия хлоридом (ТТС). Область инфаркта мозга анализировали с помощью системы анализа изображений.
Результат
Как показано на чертеже, обработанный экстракт женьшеня из Примера 1 (GBM), сапониновая фракция из Примера 3 (GA), сапониновые соединения из Примера 7 (GPD) и Примера 8 (GPDM) демонстрировали достоверную активность в отношении защиты нейрональных клеток мозга, и было подтверждено, что их активность выше активности Ebselin® (компания Sigma) и байкалеина, использованных в качестве положительного контроля. Контрольная группа, которой вводили только носитель, обозначена как Cont, Пример 1 - как GBM, Пример 2 - как GB, Пример 3 - как GA, Пример 4 - как САМ, Пример 5 - как GPT, Пример 6 - как GPTM, Пример 7 - как GPD, Пример 8 - как GPDM. "*" обозначает, что значение достоверно с 95%-ным уровнем достоверности, по сравнению с контрольной группой.
Как описано выше, подтверждено, что обработанный экстракт женьшеня, полученный согласно настоящему изобретению, обнаруживает терапевтический и защитный эффект на инсульт мозга, и поэтому его можно применять в качестве лекарства против инсульта мозга или в качестве оздоровительной пищи.
Экспериментальный пример 3. Испытание на токсичность.
Способы (1)
Испытания на острую токсичность на ICR-мышах (средняя масса тела 25±5 г) и крысах линии Sprague-Dawley (235±10 г, Hyochang Science) были выполнены с использованием экстракта из Примера 1. Четыре группы, состоявшие из 10 мышей или крыс, получали перорально по 500 мг/кг, 725 мг/кг, 1000 мг/кг и 5000 мг/кг испытываемого образца или растворителей (0,2 мл внутрибрюшинно), соответственно, и за ними наблюдали в течение 2 недель.
Способы (2)
Испытания на острую токсичность на ICR-мышах (средняя масса тела 25±5 г) и крысах линии Sprague-Dawley (235±10 г, Hyochang Science) были выполнены с использованием экстракта из Примера 1. Четыре группы, состоявшие из 10 мышей или крыс, получали внутрибрюшинно по 25 мг/кг, 250 мг/кг, 500 мг/кг и 725 мг/кг испытываемого образца или растворителей (0,2 мл внутрибрюшинно), соответственно, и за ними наблюдали в течение 24 часов.
Результаты
Не было обнаружено связанных с воздействием эффектов на смертность, клинические симптомы, изменения массы тела и макроскопические анатомические признаки ни в одной группе и ни у одного рода животных. Эти результаты подтверждают, что экстракт, приготовленный согласно настоящему изобретению, является эффективным и безопасным.
Далее будут описаны способы составления рецептур и виды наполнителей, но они не ограничивают настоящее изобретение. Репрезентативные примеры препаратов описаны следующим образом.
Приготовление порошка
Порошкообразный препарат был получен посредством смешивания указанных компонентов и заполнения герметично закрытой упаковки.
Приготовление таблеток
Препарат в виде таблеток был получен посредством смешивания указанных компонентов и таблетирования.
Приготовление капсул
Препарат в виде капсул был получен посредством смешивания указанных компонентов и заполнения желатиновой капсулы, изготовленной традиционным способом.
Приготовление препарата для инъекций
Препарат для инъекций был получен посредством растворения активного компонента, доведения рН до примерно 7,5 и последующей заливки всех компонентов в ампулу объемом 2 мл и стерилизации посредством стандартного способа приготовления препаратов для инъекций.
Приготовление жидкого препарата
Жидкий препарат был получен посредством растворения активного компонента, разливки всех компонентов и стерилизации посредством стандартного способа приготовления жидких препаратов.
Приготовление оздоровительной пищи
Указанную смесь витаминов и минералов можно варьировать разнообразными способами. Такие вариации не следует считать отклонением от сущности и объема настоящего изобретения.
Приготовление оздоровительного напитка
Препарат оздоровительного напитка приготавливали посредством растворения активного компонента, смешивания, перемешивания при 85°С в течение 1 часа, фильтрования и последующего розлива всех компонентов в ампулу и стерилизации с использованием стандартного для приготовления оздоровительных напитков способа.
Из приведенного описания изобретения очевидно, что его можно варьировать различными способами. Такие вариации не следует считать отклонением от сущности и объема изобретения, и специалисту в данной области техники должно быть очевидно, что все модификации такого рода должны быть включены в объем приведенной ниже формулы изобретения.
Промышленная применимость
Композиция, содержащая обработанный экстракт женьшеня, обработанный кислотой и последующей ферментацией посредством биологической обработки культурами молочнокислых или кишечных бактерий согласно настоящему изобретению, обнаруживает профилактический или лечебный эффект на инсульт мозга. Поэтому ее можно использовать для профилактики или лечения инсульта мозга у человека или млекопитающего.
Изобретение относится к медицине, а именно к созданию лечебно-профилактического средства. Предложенное средство содержит экстракт обработанного женьшеня, обладающего активностью в отношении профилактики и лечения инсульта мозга и обладает усиленным фармакологическим эффектом, обусловленным последующей обработкой, например - обработкой женьшеня кислотой и биоконвертирующей обработкой, такой как процесс ферментации молочнокислыми бактериями. Изобретение обеспечивает повышенную эффективность в отношении профилактики или лечения инсульта мозга и заболеваний мозга человека и млекопитающих. 4 н. и 6 з.п.ф-лы, 1 табл., 1 ил.
| Способ изготовления огнеупорного раствора | 1961 |
|
SU149704A1 |
| Система автоматического регулирования уровня воды в барабане парового котла | 1984 |
|
SU1209996A1 |
| US 6083932, 04.07.2000 | |||
| СПОСОБ ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ ЧЕЛОВЕКА И УСТРОЙСТВО ДЛЯ ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ ЧЕЛОВЕКА | 2001 |
|
RU2179042C1 |
| Осевой подшипник | 1936 |
|
SU53204A1 |
| 1999 |
|
RU2174822C2 | |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ ПИЩЕВОЙ ДОБАВКИ | 1993 |
|
RU2057462C1 |
| RU 2064268 C1, 27.07.1996. | |||
Авторы
Даты
2007-02-27—Публикация
2003-04-08—Подача