Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения по-новому обработанного женьшеня для достижения повышенного количества гинзенозида Rg5. Более конкретно настоящее изобретение относится к способу получения обработанного продукта женьшеня и его экстракта, который содержит повышенное количество гинзенозида Rg5, путем обработки женьшеня в специфическом интервале давления и температуры.
Уровень техники
Обнаружено, что женьшень усиливает неспецифическую устойчивость к физиологическому стрессу и оказывает поддерживающее действие на гомеостаз человека наряду с другими сильнодействующими фармакологическими активностями, т.е. облегчает симптомы гипертензии, усиливает активность инсулина, снижает активность глюкозы в крови, оказывает стимулирующее действие на синтез РНК печени, метаболизм белка, глюкозы и липида или обладает противораковой активностью.
Имеется много растений рода Panax genus, принадлежащих к Araliaceae, например Panax ginseng, распространенный или выращиваемый в дальневосточном регионе Азии, Panax quinquefolia в Америке и Канаде, Panax notoginseng в Китае, Panax trifolia в восточном регионе Северной Америки, Panax japonica в Японии, Китае и Непале, Panax pseudoginseng в Непале, Panax vietnamensis во Вьетнаме, Panax elegatior, Panax wangianus и Panax bipinratifidus и т.д.
Три типа продукта женьшеня являются коммерчески пригодными, т.е. женьшень четырехлетнего, пятилетнего и шестилетнего возраста, и описано, что наиболее сильнодействующим среди них является продукт женьшеня шестилетнего возраста, выращенного до осени. Кожица лишенного кожицы женьшеня содержит особенно большое количество сапонина, который проявляет высокую активность.
Гинзенозидные сапонины, выделенные из женьшеня, имеющие скелет даммаровой смолы, связанный с несколькими сахаридами, отличаются от сапонинов, выделенных из других растений. Конкретно описано, что женьшень содержит приблизительно 30 видов сапониновых ингредиентов, в особенности гинзенозид Rb1, Rb2, Rc, Rd, Rg, Re и т.д. в качестве главных компонентов. Такие сапониновые соединения проявляют различные фармакологические активности и эффективности согласно их химической структуре и среди них гинзенозид Rg5 широко описан в последнее время как лекарственное средство благодаря его сильной иммуностимулирующей активности, а также сосудорасширяющей активности, противораковой активности, активности защиты нейрональных клеток и т.д.
В настоящее время обычный женьшень пытаются обрабатывать так, чтобы получать более высокую эффективность или пригодность посредством изменения структуры сапонинов женьшеня при обработке.
В корейском патенте №10-0192678 описан способ получения обработанного женьшеня, полученного путем высокотемпературной обработки, с высоким содержанием гинзенозида Rg5, при котором полученный обработанный женьшень имеет повышенную эффективность, отличающуюся от исходной формы женьшеня. Однако способ обработки не может предоставить информацию относительно корреляции между изменением содержания Rg5 и изменением температуры и внутреннего давления, и в способе требуется токсичный органический растворитель, такой как бутанол.
Авторы настоящего изобретения провели интенсивное научное исследование, касающееся нового способа обработки для получения безопасного и однородного продукта женьшеня. В результате исследования авторы нашли новый способ обработки с получением фармакологически сильнодействующего продукта женьшеня, который имеет более высокое содержание гинзенозида Rg5, подтвержденное сравнением с обычным женьшенем и обработанным продуктом женьшеня, описанным в предшествующем уровне техники, и в результате авторы получили настоящее изобретение.
Раскрытие изобретения
Технические проблемы
Соответственно задачей настоящего изобретения является обеспечения способа обработки с получением фармакологически сильнодействующих продуктов женьшеня, которые имеют повышенное содержание гинзенозида Rg5.
Техническое решение
Согласно настоящему изобретению предлагается способ обработки с получением фармакологически сильнодействующего продукта женьшеня и экстракта из него, в котором достигается максимальное содержание гинзенозида Rg5, отличающийся обработкой женьшеня в выбранных интервалах давления и температуры.
Конкретно настоящее изобретение предлагает способ обработки с получением фармакологически сильнодействующего продукта женьшеня, включающий стадии: добавление приблизительно 1-3-кратной массы воды, основанной на массе женьшеня, к материалу женьшеня пяти-семилетнего возраста, предпочтительно материалу женьшеня шестилетнего возраста; и обработку под внутренним давлением в интервале от 1,10 до 4,00 кг силы/см2, предпочтительно, 1,20-1,50 кг силы/см2 в случае очищенного от кожицы женьшеня или 2,30-3,00 кг силы/см2 в случае женьшеня с кожицей, в интервале температур приблизительно от 70 до 150°С, предпочтительно при 110-130°С в течение периода времени, в интервале от 1 до 5 час, предпочтительно, приблизительно 2 час с получением целевого обработанного женьшеня, имеющего большое количество гинзенозида Rg5.
Полученный с помощью вышеописанного способа обработки в случае женьшеня, лишенного кожицы, конечный продукт женьшеня настоящего изобретения содержит значительно большее количество гинзенозида Rg5, приблизительно в два-пять раз, конкретно приблизительно в 4,4 раза больше, чем обработанный женьшень, полученный способом, описанным в корейском патенте №10-0192678.
Полученный с помощью вышеописанного способа обработки в случае женьшеня с кожицей конечный продукт женьшеня настоящего изобретения содержит значительно большее количество гинзенозида Rg5, приблизительно в два-пять раз, конкретно приблизительно в 3,3 раза больше, чем обработанный женьшень, полученный способом, описанным в корейском патенте №10-0192678.
В настоящем изобретении также предложен способ экстрагирования обработанного экстракцией женьшеня, состоящий из стадий, включающих в себя экстрагирование обработанного материала женьшеня, полученного на вышеописанной стадии, смесью органических растворителей, предпочтительно смесью метанола и метиленхлорида, более предпочтительно смесью метанола и метиленхлорида, смешанных в интервале соотношений от 0,60:1,40 до 1,20:0,80, более предпочтительно смесью метанола и метиленхлорида приблизительно 1:1 (об/об), посредством способа экстракции при кипячении с обратным холодильником в течение периода времени в интервале от 1 час до двух дней, предпочтительно более 1 час; фильтрование с получением фильтрата, концентрирование фильтрата для удаления оставшегося растворителя и сушку с получением сильнодействующего женьшеневого экстракта, имеющего большое количество гинзенозида Rg5.
В настоящем изобретении предпочтительно применяют описанный выше «материал женьшеня» шестилетнего возраста, поскольку женьшень шестилетнего возраста содержит более высокое количество гинзенозида Rg5, чем женьшень четырехлетнего возраста, что подтвердили нижеуказанные эксперименты, проведенные авторами настоящего изобретения.
Описанный здесь «материал женьшеня» включает в себя его листья, которые как описано, являются неиспользованными, а также корневую часть женьшеня, поскольку настоящее изобретение утверждает, что обработанные листья женьшеня настоящего изобретения содержат количество гинзенозида Rg5, эквивалентное количеству в корневой части женьшеня, что подтверждают нижеуказанные эксперименты, проведенные авторами настоящего изобретения.
Обработанный таким образом женьшень или его экстракт можно сушить известным способом с получением высушенного обработанного женьшеня, например высушенного при более низкой температуре, т.е. ниже 70°С, в течение периода времени в интервале приблизительно от 48 до 60 час или способом высушивания вымораживанием, и можно дополнительно обработать путем измельчения или превращения в порошок с меньшим размером частиц, предпочтительно с размером в интервале приблизительно от 50 до 200 микрометров, способом, хорошо известным в данной области, если требуется, для получения коммерчески пригодного конечного продукта, такого как капсула, таблетка и т.д., с применением фармацевтически приемлемого носителя или адьюванта.
Предложенный обработанный женьшень нестоящего изобретения содержит повышенное количество гинзенозида Rg5, обладающего сильной фармакологической активностью, такой как сосудорасширяющая активность, иммуностимулирующая активность, противораковая активность, активность нейрональной клеточной защиты и т.д., в особенности противораковая активность.
Кроме того, настоящее изобретение также предлагает фармацевтическую композицию, включающую в себя экстракт женьшеня, полученный вышеописанным способом обработки, и фармацевтически приемлемый носитель или адьюванты, для лечения или предотвращения ракового заболевания, и способ настоящего изобретения может обеспечить максимальное содержание гинзенозида Rg5 посредством выбранных интервалов давления и температуры.
Указанный здесь термин «рак» включает в себя различные формы рака, такие как рак желудка, рак печени, рак легкого, цервикальный рак, рак кожи или рак молочной железы, в особенности рак кожи.
Экстракт женьшеня настоящего изобретения обладает высокой противораковой активностью и, следовательно, фармацевтическую композицию настоящего изобретения можно применять для лечения или предотвращения различных раковых заболеваний.
Настоящее изобретение также предлагает применение женьшеневого экстракта, полученного вышеописанным способом обработки, для изготовления лекарственного средства, применяемого при лечении или предотвращении различных форм рака, таких как рак желудка, рак печени, рак легкого у мужчины, и цервикального рака, рака кожи, рака молочной железы.
Согласно другому аспекту настоящего изобретения предложен также способ лечения или предотвращения различных форм рака, таких как рак желудка, рак печени, рак легкого у мужчин, и цервикального рака, рака молочной железы, где способ включает в себя введение терапевтически эффективного количества экстракта женьшеня, полученного вышеописанным способом обработки.
Композиция изобретения может дополнительно включать в себя обычный носитель, адьюванты или разбавители согласно применяемому способу. Предпочтительно названный носитель применяют как соответствующее вещество согласно способу применения и нанесения, но не ограничиваются этим. Соответствующие разбавители перечислены в публикации Remington's Pharmaceutical Science (Mack Publishing со, Easton PA).
Следующие ниже по тексту способы приготовления лекарственного средства и эксципиенты являются только иллюстративными и никоим образом не ограничивают изобретение.
Композицию согласно настоящему изобретению можно приготовить как фармацевтическую композицию, содержащую фармацевтически приемлемые носители, адьюванты или разбавители, например лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмалы, смолу акации, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло. Препараты могут дополнительно включать в себя наполнители, антиагглютинирующие агенты, смазывающие агенты, увлажняющие агенты, корригенты, эмульгаторы, консерванты и тому подобное. Композиции изобретения можно изготавливать так, чтобы обеспечить быстрое, длительное или замедленное высвобождение активного ингредиента после их введения в организм пациента путем применения любой из методик, хорошо известных в данной области.
Например, композиции настоящего изобретения могут быть растворимы в маслах, пропиленгликоле или других растворителях, которые обычно применяют для получения инъекции. Подходящие примеры носителей включают в себя физиологический солевой раствор, пропиленгликоль, этанол, растительные масла, изопропилмиристат и т.д., но не ограничиваются этим. Для местного применения соединения настоящего изобретения можно изготавливать в форме мазей или кремов.
Фармацевтические препараты, содержащие указанную композицию, можно изготавливать в любой форме, такой как пероральная форма дозы (порошок, latinor-pulves, гранула, таблетка, капсула, мягкая капсула, лекарственное средство в воде, сироп, эликсиры, пилюля, раствор, порошок, саше, гранула), или препарат для местного нанесения (крем, мазь, лосьон, гель, бальзам, пластырь, паста, раствор спрея, аэрозоль и тому подобное), или инъецируемый препарат (раствор, суспензия, эмульсия, инъекция).
Композицию настоящего изобретения в фармацевтических лекарственных формах можно применять в форме их фармацевтически приемлемых солей и также можно применять только одну или в соответствующей ассоциации, а также в комбинации с другими фармацевтически активными соединениями.
Требуемая доза предложенного экстракта или композиции изменяется в зависимости от состояния и массы субъекта, тяжести состояния, лекарственной формы, пути и периода применения и может быть выбрана специалистом в данной области. Однако для того, чтобы получить требуемые воздействия, обычно рекомендуют для применения количество экстракта изобретения или соединений данного изобретения в интервале 0,2-200 мг/кг, предпочтительно 2-100 мг/кг согласно показателю масса/день. Дозу можно вводить однократно или разделить на несколько приемов в день. Исходя из композиции комплексная травяная композиция будет присутствовать в интервале от 0,01 до 80% масс, предпочтительно 0,5-50% масс, считая на суммарную массу композиции.
Фармацевтическую композицию настоящего изобретения можно вводить субъекту животному, такому как млекопитающие (крыса, мышь, домашние животные или человек) различными путями. Предусматриваются все способы введения, например можно вводить перорально, ректально или внутривенной, внутримышечной, подкожной, внутрикожной, интраректальной, эпидуральной или интрацеребровентрикулярной инъекцией.
Кроме того, другой задачей настоящего изобретения является получение полезного для здоровья пищевого продукта, содержащего вышеуказанный экстракт, полученный указанным выше способом обработки, и диетически приемлемой добавки для предупреждения различных заболеваний.
Вышеописанную композицию можно применять для предотвращения или облегчения симптомов различных раковых заболеваний. Для цели предотвращения или облегчения симптомов различных раковых заболеваний количество вышеописанного экстракта обычно может быть в интервале приблизительно от 0,1 до 15 масс/масс %, предпочтительно 1-10 масс/масс % суммарной массы пищевого продукта для композиции полезного для здоровья пищевого продукта и 1-30 г, предпочтительно 3-10 г по отношению к 100 мл композиции полезного для здоровья напитка. Композицию настоящего изобретения можно вводить субъектам животным, таким как млекопитающие (крыса, мышь, домашние животные или человек) различными путями. Предусматриваются все способы введения, например можно вводить перорально, ректально или внутривенной, внутримышечной, подкожной, внутрикожной, интраректальной, эпидуральной или интрацеребровентрикулярной инъекцией, в любой форме, такой как пероральная лекарственная форма (порошок, latinor-pulves, гранула, таблетка, капсула, мягкая капсула, сироп, эликсиры, пилюля, раствор, порошок, саше или гранула).
Для обеспечения изобретения композиция полезного для здоровья напитка настоящего изобретения содержит вышеописанный экстракт в качестве важного компонента в указанном отношении, не имеется конкретного ограничения на другой жидкий компонент, где другим компонентом может быть различный дезодорант или природный углевод и т.д., такой как в общепринятом напитке. Примеры вышеупомянутого природного углевода представляют собой моносахарид, такой как глюкоза, фруктоза и т.д.; дисахарид, такой как мальтоза, сахароза и т.д.; общепринятый сахар, такой, как декстрин, циклодекстрин, и сахар в форме спирта, такой, как ксилит и эритрит и т.д. В качестве другого дезодоранта, чем вышеназванные компоненты, можно с пользой применять природный дезодорант такой как тауматин, экстракт стевии, такой как леваудиозид А, глицирризин и т.д., и синтетический дезодорант, такой как сахарин, аспартам и т.д. Количество вышеописанного природного углевода обычно находится в интервале приблизительно от 1 до 20 г, предпочтительно 5-12 г по отношению к 100 мл настоящей композиции напитка.
Иные компоненты, чем вышеназванная композиция, представляют собой различные питательные вещества, витамин, минерал или электролит, синтетический корригентный агент, окрашивающий агент и улучшающий агент в случае сыра, шоколада и т.д., пектиновую кислоту и ее соль, альгиновую кислоту и ее соль, органическую кислоту, защитное коллоидное связующее вещество, агент, регулирующий рН, стабилизатор, консервант, глицерин, спирт, карбонизирующий агент, применяемый в насыщенном углекислым газом напитке, и т.д. Другим компонентом, чем вышеназванные компоненты, может быть фруктовый сок для получения природного фруктового сока, напиток с фруктовым соком и овощной напиток, в котором компонент можно применять независимо или в сочетании. Отношение компонентов не является таким важным, но обычно оно находится в интервале приблизительно от 0 до 20 масс/масс % на 100 масс/масс % настоящей композиции.
Примеры пригодного для добавки продукта, включающего в себя вышеуказанный экстракт, представляют собой различный пищевой продукт, напиток, жвачку, витаминный комплекс, полезный для здоровья пищевой продукт и тому подобное.
Для специалиста в данной области будет очевидно, что различные модификации и варианты могут быть сделаны в композициях, применении и препаратах настоящего изобретения без отступления от сущности или объема изобретения.
Полезные эффекты
Способ получения обработанного женьшеня согласно настоящему изобретению может обеспечивать повышенное количество гинзенозида Rg5, проявляющего различные фармакологические действия, путем применения в способе выбранного специфического давления и температуры, а композиция, включающая в себя обработанный женьшень и его экстракт, может быть применена как лекарственный препарат или полезный для здоровья пищевой продукт для предотвращения или лечения различных заболеваний, в особенности рака.
Краткое описание чертежей
Вышеуказанные и другие задачи, отличительные признаки и другие преимущества настоящего изобретения будут несомненно более понятны из следующего подробного описания, включенного в сочетании с сопроводительными чертежами, на которых:
на фиг.1 показан результат ЖХ и масс-спектр экстракта женьшеня (G1-1);
на фиг.2 показан результат ЖХ и масс-спектр экстракта женьшеня (G1-2);
на фиг.3 показан результат ЖХ и масс-спектр экстракта женьшеня (G1-3);
на фиг.4 показан результат ЖХ и масс-спектр экстракта женьшеня (G1-4);
на фиг.5 показан результат ЖХ и масс-спектр экстракта женьшеня (G1-5);
на фиг.6 показан результат ЖХ и масс-спектр экстракта женьшеня (G1-6);
на фиг.7 показан результат ЖХ и масс-спектр экстракта женьшеня (G1-7);
на фиг.8 показан результат ЖХ и масс-спектр экстракта женьшеня (G2-1);
на фиг.9 показан результат ЖХ и масс-спектр экстракта женьшеня (G2-2);
на фиг.10 показан результат ЖХ и масс-спектр экстракта женьшеня (G2-3);
на фиг.11 показан результат ЖХ и масс-спектр экстракта женьшеня (G3);
на фиг.12 показан результат ЖХ и масс-спектр экстракта женьшеня (G4);
на фиг.13 показан результат ЖХ и масс-спектр экстракта женьшеня (STD);
на фиг.14 показана противораковая активность экстракта женьшеня.
Описание предпочтительного варианта осуществления изобретения
Настоящее изобретение более конкретно объясняется посредством следующих примеров. Однако должно быть понятно, что настоящее изобретение никоим образом не ограничивается этими примерами.
Вариант осуществления изобретения
Сравнительный пример 1. Получение обработанного женьшеня согласно способу, описанному в патенте KR №10-0192678
Невысушенный и нарезанный на части 1 кг корней Panax ginseng поместили в устройство для экстракции неочищенного лекарственного средства (20L/Kukje-kigong, Корея) и затем нагревали паром при 130°С в течение 2 часов. Обработанный паром женьшень сушили при 50-60°С и распыляли в мелкий порошок с размером частиц порошка в интервале 50-200 микрометров с получением 195 г порошка женьшеня, применяемого в качестве сравнительного образца (обозначенного ниже по тексту как «STD»).
Пример 1. Получение предложенного в изобретении экстракта женьшеня без кожицы
1-1. Получение экстракта женьшеня (G1-1)
Высушенные на воздухе и нарезанные на части 300 г корней Panax ginseng шестилетнего возраста, без кожицы, погруженные в 600 мл дистиллированной воды, поместили в устройство для экстракции неочищенного лекарственного средства (20L/Kukje-kigong, Корея) и затем нагревали, поддерживая внутреннюю температуру в интервале от 126°С до 130°С и внутреннее давление в интервале от 1,4 до 1,5 кг силы/см2 в течение 2 часов. Обработанный женьшень извлекали из воды и сушили при 60-70°С и измельчали в мелкий порошок с размером частиц порошка в интервале 50-200 микрометров с получением 255 г женьшеневого порошка (выход: 85,0%), применяемого в качестве образца (обозначенного ниже по тексту как «G1-1»).
1-2. Получение экстракта женьшеня (G1-2)
Вся методика, за исключением изменения внутренней температуры в интервале от 103°С до 107°С и внутреннего давления в интервале от 1,40 до 1,50 кг силы/см2 была аналогична методике, описанной в примере 1-1, с получением 280 г женьшеневого порошка (выход 93,3%), применяемого в качестве образца (обозначенного ниже по тексту как «G1-2»).
1-3. Получение экстракта женьшеня (G1-3)
Вся методика, за исключением изменения внутренней температуры в интервале от 110°С до 114°С и внутреннего давления в интервале от 1,40 до 1,50 кг силы/см2 была аналогична методике, описанной в примере 1-1, с получением 260 г женьшеневого порошка (выход: 86,7%), применяемого в качестве образца (обозначенного ниже по тексту как «G1-3»).
1-4. Получение экстракта женьшеня (G1-4)
Вся методика, за исключением изменения внутренней температуры в интервале от 126°С до 130°С и внутреннего давления в интервале от 1,85 до 2,00 кг силы/см2 была аналогична методике, описанной в примере 1-1, с получением 245 г женьшеневого порошка (выход: 81,7%), применяемого в качестве образца (обозначенного ниже по тексту как «G1-4»).
1-5. Получение экстракта женьшеня (G1-5)
Вся методика, за исключением изменения внутренней температуры в интервале от 126°С до 130°С и внутреннего давления в интервале от 2,30 до 2,50 кг силы/см2 была аналогична методике, описанной в примере 1-1, с получением 240 г женьшеневого порошка (выход: 80%), применяемого в качестве образца (обозначенного ниже по тексту как «G1-5»).
1-6. Получение экстракта женьшеня (G1-6)
Вся методика, за исключением изменения внутренней температуры в интервале от 126°С до 130°С и внутреннего давления в интервале от 2,80 до 3,00 кг силы/см2, была аналогична методике, описанной в примере 1-1, с получением 235 г женьшеневого порошка (выход: 78,3%), применяемого в качестве образца (обозначенного ниже по тексту как «G1-6»).
1-7. Получение экстракта женьшеня (G1-7)
Вся методика, за исключением изменения внутренней температуры в интервале от 133°С до 137°С и внутреннего давления в интервале от 3,30 до 3,50 кг силы/см2, была аналогична методике, описанной в примере 1-1, с получением 162 г женьшеневого порошка (выход: 54,0%), применяемого в качестве образца (обозначенного ниже по тексту как «G1-7»).
Пример 2. Получение предложенного в изобретении экстрагированного женьшеня с кожицей
2-1. Получение экстракта женьшеня (G2-1)
Высушенные на воздухе и нарезанные на части 300 г корней Panax ginseng с кожицей, шестилетнего возраста, погруженные в 600 мл дистиллированной воды, поместили в устройство для экстракции необработанного лекарственного средства (20L/Kukje-kigong, Корея) и затем нагревали, поддерживая внутреннюю температуру в интервале от 126°С до 130°С и внутреннее давление в интервале от 2,80 до 3,00 кг силы/см2 в течение 2 часов. Обработанный женьшень извлекали из воды и сушили при 60-70°С и измельчали в мелкий порошок с размером частиц порошка в интервале 50-200 микрометров, с получением 249 г женьшеневого порошка (выход: 83,0%), применяемого в качестве образца (обозначенного ниже по тексту как «G2-1»).
2-2. Получение экстракта женьшеня (G2-2)
Вся методика, за исключением изменения внутренней температуры в интервале от 126°С до 130°С и внутреннего давления в интервале от 1,40 до 1,50 кг силы/см2, была аналогична методике, описанной в примере 2-1, с получением 260 г женьшеневого порошка (выход: 86,7%), применяемого в качестве образца (обозначенного ниже по тексту как «G2-2»).
2-3. Получение экстракта женьшеня (G2-3)
Вся методика, за исключением изменения внутренней температуры в интервале от 133°С до 137°С и внутреннего давления в интервале от 3,30 до 3,50 кг силы/см2, была аналогична методике, описанной в примере 2-1, с получением 220 г женьшеневого порошка (выход: 73,3%), применяемого в качестве образца (обозначенного ниже по тексту как «G2-3»).
Пример 3. Получение предложенного в изобретении женьшеня (G3)
Вся методика, за исключением того, что применяли 300 г круглого Panax ginseng без кожицы, четырехлетнего возраста и условия экстракции при внутренней температуре и внутреннем давлении, установленных в интервале от 126°С до 130°С и от 1,40 до 1,50 кг силы/см2, была аналогична методике, описанной в примере 1, с получением 236 г женьшеневого порошка (выход: 78,7%), применяемого в качестве образца (обозначенного ниже по тексту как «G3»).
Пример 6. Получение предложенного в изобретении женьшеня (G4)
Вся методика, за исключением того, что применяли 300 г женьшеня второго сорта шестилетнего возраста без кожицы и условия экстракции при внутренней температуре и внутреннем давлении, установленных в интервале от 126°С до 130°С и от 1,40 до 1,50 кг силы/см2, была аналогична методике, описанной в примере 1, с получением 250 г женьшеневого порошка (выход: 83,3%), применяемого в качестве образца (обозначенного ниже по тексту как «G4»).
Экспериментальный пример 1. Анализ компонента и его содержание
Приготовление образца
20 мл метанола и 20 мл метиленхлорида добавляли к 2 г каждого из образцов, полученных по сравнительному примеру и примерам, и подвергали экстракции при кипячении с обратным холодильником в течение 60 мин. Раствор охлаждали, фильтровали для удаления нерастворимого вещества и супернатанат концентрировали с получением его остатка. Масса каждого конечного образца экстракта была следующей: 0,183 г (G1-1), 0,110 (G1-2), 0,160 (G1-3), 0,154 г (G1-4), 0,131 г (G1-5), 0,192 г (G1-6), 0,079 г (G1-7), 0,148 г (G2-1), 0,070 (G2-2), 0,061 г (G2-3), 0,079 г (G3), 0,083 (G4) и 0,124 г (STD) соответственно.
Анализ методом хроматомасс-спектрометрии
Смесь растворителей метанола и метиленхлорида (1:1) добавляли к тест-образцам, полученным на стадии 1-1, в количестве 18,3 мл (G1-1), 11,0 мл (G1-2), 16,0 мл (G1-3), 15,4 мл (G1-4), 13,1 мл (G1-5), 19,2 мл (G1-6), 7,9 мл (G1-7), 14,8 мл (G2-1), 7,0 мл (G2-2), 6,1 мл (G2-3), 7,9 мл (G3), 8,3 мл (G4) и 12,4 мл (STD) соответственно, в таком количестве, чтобы установленная конечная концентрация каждого из образцов была идентичной друг с другом. 3 мл каждого образца подвергали микроцентрифугированию со скоростью 1300 об/мин в течение 15 мин. 5 микролитров каждого супернатаната вводили в устройство для хроматомасс-спектрометрии в условиях, указанных в таблице 1, и результаты представлены на фиг.1-13.
Результаты сравнения для каждого образца показаны в таблице 2.
Как можно видеть в таблице 1, подтверждено, что количество гинзенозида Rg5, полученного в примерах, приблизительно в 4,4 и 3,3 раза выше, чем его количество в сравнительном примере.
Кроме того, подтверждено, что способ получения настоящего изобретения превосходит способ, известный ранее в данной области.
Кроме того, авторы настоящего изобретения провели исследование для выяснения оптимального условия экстракции, в особенности соотношения в смеси системы экстракционных растворителей путем изменения отношения объемов в смеси метанола и метиленхлорида в интервале от 0,60:1,40 до 1,20:0,80 и в результате обнаружили, что наиболее эффективным условием экстракции из этого является смесь растворителей метанола и метиленхлорида (1:1), константа электрической проводимости которой составляет 20,75.
В соответствии с этим авторы утверждают, что наиболее эффективная система экстракционного растворителя для получения повышенного количества гинзенозида Rg5 представляет собой смесь растворителей метанола и метиленхлорида (1:1) с получением повышенного количества гинзенозида Rg5.
Экспериментальный пример 2: Определение противораковой активности
Противораковую активность женьшеневого экстракта, содержащего повышенное количество гинзенозида Rg5, полученного в экспериментальном примере 1, определяли следующими экспериментами.
Приготовление образца
Женьшеневый экстракт изобретения, экстрагированный смесью растворителей метанола и метиленхлорида (1:1), полученный способом, соответствующим методике, описанной в примере 2-1, применяли в качестве тест-образца (обозначенного ниже по тексту как «GMM») при растворении в дистиллированной воде (5 мг/мл).
Тест-животные
Мышей C57BL/6 четырехнедельного возраста массой 10-15 г, разведенных в идентичных условиях, классифицировали на две группы, т.е. 80 мышей в качестве тест-группы и 20 мышей в качестве контрольной группы. Тест-группы обрабатывали клеточной линией меланомы В16, чтобы вызвать рак, а контрольные группы не обрабатывали. Тест-группы дополнительно классифицировали на две группы, т.е. тест-группу (1), обработанную только дистиллированной водой, и тест-группу (2), обработанную количеством экстракта GMM изобретения на 5 неделе, и контрольные группы также классифицировали на две группы, т.е. контрольную группу (1), обработанную только дистиллированной водой, и контрольную группу (2), обработанную эквивалентным количеством экстракта изобретения на 5 неделе.
Тест-методика
Мышам C57BL/6 четырехнедельного возраста, массой 10-15 г, разведенным в идентичных условиях, был предоставлен свободный доступ для питья раствора, содержащего экстракт изобретения, полученный вышеописанной стадией в контрольной группе (2) и тест-группе (2) после делактации мышей (четырех недель после рождения). Клетки меланомы В16 инъецировали в брюшной отдел мышей подкожно в группах наблюдения рака.
Клетки меланомы В16 субкультивировали в инкубаторе с СО2 в течение 1 недели и плавающие клетки, разбавленные средой RMPI 1640, содержащей 10% плодной сыворотки теленка, с установленной концентрацией 1×106 клеток/мл, инъецировали по 0,1 мл.
Скорость роста рака и период выживания определяли по размеру рака каждые пять дней после инъекции и периоду выживания каждой группы. Скорость роста рака сравнивали с массой рака и результат вычисляли, следуя математическому расчету по формуле 1.
Формула 1 для математического расчета:
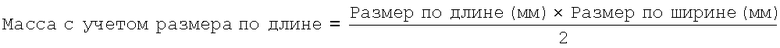
Тест-результат
Как можно видеть на фиг.14, на 1 неделе у 55% мышей наблюдали рак в тест-группе (1), в то же время в тест-группе (2) - у 25% мышей. На 12 день и на 17 день у 80% и 95% мышей наблюдали рак в тест-группе (1) соответственно, в то же время - у 35% и 42,5% в тест-группе (2) соответственно. На 24 день у 100% мышей наблюдали рак в тест-группе (1), в то же время - у 52,5% в тест-группе (2).
Как можно видеть в таблице 3, не проявилось значительного различия между средней массой рака на 1 неделе после инъекции раковой клеточной линии (средняя масса рака 0,1 г,), однако, различие между средними массами рака между тест-группами постепенно увеличилось, т.е. средняя масса рака в тест-группе (1) и (2) была 0,4 г и 0,3 г на 12 день, 1,8±0,3 г и 1,5±0,2 г на 17 день, 5,1±0,2 г и 3,3±1,0 г на 22 день и 22,4±5,3 г и 9,8±2,1 г на 57 день соответственно.
Кроме того, не обнаружена смерть мышей в тест-группе (1) и (2) на 12 день, в то же время одна мышь погибла в тест-группе (1) на 17 день. 85% мышей в тест-группе (2) выживали в течение более чем 42 дней после инъекции раковых клеток и приблизительно 50% мышей выживали в тест-группе (1). На 60 день все мыши в тест-группе (1) погибли, в то же время 60% мышей в тест-группе (2) выжили.
Соответственно подтверждено, что женьшеневый экстракт, полученный способом настоящего изобретения, показал сильнодействующую противоракую активность, так как способ настоящего изобретения может обеспечивать повышенное количество гинзенозида Rg5, проявляющего сильнодействующую противораковую активность.
Экспериментальный пример 3: Испытание токсичности
Методы
Испытания острой токсичности на мышах SD (со средней массой тела 25±5 г) и крысах Sprague-Dawley (235±10 г) производили с использованием экстракта изобретения. Каждой группе, состоящей из 3 мышей или крыс, вводили перорально 1 г/кг тест-образца или раствора (0,2 мл, внутрибрюшинно) соответственно и наблюдали в течение 24 час.
Результаты
Не обнаружили связанных с обработкой влияний на смертность, клинические признаки, изменения массы тела и суммарные данные в любой группе или любого пола и подтвердили, что LD50 при пероральном введении экстракта изобретения было не более чем 1 g/кг. Эти результаты свидетельствуют о том, что экстракт изобретения, полученный в настоящем изобретении, был сильнодействующим и безопасным.
В дальнейшем будут описаны способы приготовления лекарственного средства и виды эксципиентов, но настоящее изобретение не ограничивается их перечислением.
Репрезентативные примеры препаратов описаны ниже по тексту.
Препарат в форме порошка
Высушенный порошок (G1-1) по примеру 1, 20 мг
Лактоза, 100 мг
Тальк, 10 мг
Препарат в виде порошка получали смешиванием вышеназванных компонентов и наполнением герметичной упаковки.
Препарат в форме таблетки
Высушенный порошок (G1-1) по примеру 1, 10 мг
Кукурузный крахмал, 100 мг
Лактоза, 100 мг
Стеарат магния, 2 мг
Препарат в форме таблетки получали смешиванием вышеназванных компонентов и формованием таблетки.
Препарат в форме капсулы
Высушенный порошок (G1-1) по примеру 1, 10 мг
Кристаллическая целлюлоза, 100 мг
Лактоза, 100 мг
Стеарат магния, 2 мг
Препарат в форме таблетки получали смешиванием вышеназванных компонентов и наполнением желатиновой капсулы способом, общепринятым для желатинового препарата.
Препарат в форме инъекции
Экстракт (G2-1) по примеру 2, 10 мг
Дистиллированная вода для инъекции, оптимальное количество
Агент для регулирования рН, оптимальное количество
Препарат в форме инъекции получали растворением активного компонента, установлением рН приблизительно 7,5 и затем наполнением всех компонентов в 2 мл ампулу и стерилизацией способом, общепринятым для препаратов в форме инъекции.
Жидкий препарат
Экстракт (G2-1) по примеру 2, 0,1~80 г
Сахар, 5~10 г
Лимонная кислота, 0,05~0,3%
Карамель, 0,005~0,02%
Витамин С, 0,1~1%
Дистиллированная вода, 79~94%
СО2, газ, 0,5~0,82%
Жидкий препарат получали растворением активного компонента, наполнением всех компонентов и стерилизацией способом, общепринятым для жидкого препарата.
Препарат в виде полезного для здоровья пищевого продукта
Экстракт (G2-1) по примеру 1, 1000 мг
Витаминная смесь, оптимальное количество
Витамин А, ацетат, 70 мг
Витамин Е, 1,0 мг
Витамин B1, 0,13 мг
Витамин В2, 0,15 мг
Витамин В6, 0,5 мг
Витамин В12, 0,2 мг,
Витамин С, 10 мг
Биотин, 10 мг
Амид никотиновой кислоты, 1,7 мг
Фолиевая кислота, 50 мг
Кальциевая соль пантотеновой кислоты, 0,5 мг
Смесь минералов, оптимальное количество
Сульфат железа, 1,75 мг
Оксид цинка 0,82 мг
Карбонат магния 25,3 мг
Монокалийфосфат, 15 мг
Дикальцийфосфат, 55 мг
Цитрат калия, 90 мг
Карбонат кальция, 100 мг
Хлорид магния, 24,8 мг
Вышеназванную витаминную и минеральную смесь можно изменять несколькими путями. Такие варианты не рассматриваются как отступление от сущности и объема настоящего изобретения.
Препарат в виде полезного для здоровья напитка
Экстракт (G2-1) по примеру 2, 1000 мг
Лимонная кислота, 1000 мг
Олигосахарид, 100 г
Абрикосовый концентрат, 2 г
Таурин, 1 г
Дистиллированная вода, 900 мл
Препарат в виде полезного для здоровья напитка получали растворением активного компонента, смешиванием, перемешиванием при 85°С в течение 1 часа, фильтрованием и затем наполнением всех компонентов в 1000 мл ампул и стерилизацией способом, общепринятым для препарата в виде полезного для здоровья напитка.
Из описанного таким образом изобретения будет очевидно, что представленное в изобретении можно изменять несколькими путями. Такие варианты не рассматриваются как отступление от сущности и объема настоящего изобретения и все такие модификации, как будет очевидно для специалиста в данной области, предназначены для включения в объем следующей далее формулы изобретения.
Промышленная применимость
Способ получения обработанного женьшеня согласно настоящему изобретению может обеспечивать повышенное количество гинзенозида Rg5, обладающего различными фармакологическими активностями при применении в способе выбранного специфического давления и температуры, а композицию, включающую в себя обработанный женьшень и его экстракт, можно применять как лекарственное средство или полезный для здоровья пищевой продукт для предотвращения или лечения различных заболеваний, в особенности рака.
Изобретение относится к фармакологии. Проводят добавление 1-3-кратного количества воды к массе женьшеня пяти-семилетнего возраста и обработку при давлении от 1,20 до 1,50 кг/см2 в случае женьшеня без кожицы или от 2,30 до 3,00 кг/см2 в случае женьшеня с кожицей при 110-130°С, в течение от 1 до 5 час с получением обработанного женьшеня, экстракцию обработанного женьшеня смесью метанола и метиленхлорида при соотношении от 0,6:1,40 до 1,2:0,8 методом экстракции при кипячении с обратным холодильником в течение от 1 часа до двух дней, фильтрование, концентрирование фильтрата и сушку. Фармацевтическая композиция для лечения или предотвращения рака желудка, печени, легкого, кожи или молочной железы содержит женьшеневый экстракт. Пищевой продукт содержит женьшеневый экстракт. Изобретение позволяет получить продукт с высоким содержанием гинезенозида Rg5. 3 н. и 3 з.п. ф-лы, 3 табл., 14 ил.
1. Способ получения обработанного женьшеневого экстракта, предусматривающий стадии: добавление 1-3 кратной массы воды к материалу женьшеня пяти-семилетнего возраста, обработку при внутреннем давлении в интервале от 1,20 до 1,50 кг силы/см2 в случае женьшеня без кожицы или от 2,30 до 3,00 кг силы/см2 в случае женьшеня с кожицей в температурном интервале от 110 до 130°С, в течение от 1 до 5 ч с получением обработанного женьшеня, экстракцию обработанного женьшеня смесью метанола и метиленхлорида, имеющей их соотношение от 0,60:1,40 до 1,20:0,80, методом экстракции при кипячении с обратным холодильником в течение от 1 ч до двух дней, фильтрование с получением фильтрата, концентрирование фильтрата для удаления оставшегося растворителя и сушку с получением указанного женьшеневого экстракта.
2. Способ по п.1, где указанный материал женьшеня представляет собой женьшень шестилетнего возраста без кожицы или женьшень с кожицей.
3. Фармацевтическая композиция, содержащая женьшеневый экстракт, полученный способом по п.1 и фармацевтически приемлемый носитель или адъювант, для лечения или предотвращения ракового заболевания, такого как рак желудка, рак печени, рак легкого, рак кожи или рак молочной железы.
4. Фармацевтическая композиция по п.3, где указанную композицию изготавливают в виде порошка, гранулы, таблетки, капсулы, мягкой капсулы, водного раствора лекарственного средства, сиропа, эликсира, пилюль, раствора, порошка, саше, гранулы, крема, мази, лосьона, геля, бальзама, пластыря, пасты, распыляемого раствора, аэрозоля или инъекции.
5. Полезный для здоровья пищевой продукт, содержащий экстракт, полученный способом по п.1, обладающий сильнодействующей противораковой активностью, и диетически приемлемую пищевую добавку.
6. Полезный для здоровья пищевой продукт по п.5, где указанный полезный для здоровья пищевой продукт изготавливают в виде таблетки, капсулы, порошка или гранулы.
Приоритет по пунктам:
12.04.2005 - пп.1, 2;
11.04.2006 - пп.3-6.
| KR 100192678 В, 15.06.1999 | |||
| KR 20040020693 A, 09.03.2004 | |||
| KR 20020052639 A, 04.07.2002 | |||
| KR 20030089649 A, 22.11.2003 | |||
| АДАПТОГЕННЫЙ, ТОНИЗИРУЮЩИЙ, ИММУНОМОДУЛИРУЮЩИЙ, ГИПОГЛИКЕМИЧЕСКИЙ, АНТИГИПОКСИЧЕСКИЙ, ПРОТИВОВОСПАЛИТЕЛЬНЫЙ, НООТРОПНЫЙ, РАДИОПРОТЕКТОРНЫЙ, ФЕРВОПРОТЕКТОРНЫЙ, АКТОПРОТЕКТОРНЫЙ ПРЕПАРАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2195950C1 |
Авторы
Даты
2009-06-20—Публикация
2006-04-11—Подача