Настоящее изобретение относится к способу получения (2R)-2-пропилоктановой кислоты. Более конкретно, настоящее изобретение относится к способу получения (2R)-2-пропилоктановой кислоты, заключающегося в том, что (2S)-2-(2-пропинил)октановую кислоту или (2S)-2-(2-пропенил)октановую кислоту восстанавливают, используя в качестве катализатора платину на угле.
Оптически активная (2R)-2-пропилоктановая кислота (далее здесь называемая рассматриваемым соединением), полученная настоящим способом, полезна в качестве фармацевтического средства.
Для фармации важна оптическая чистота целевого соединения. В отношении активности оптических изомеров существует несколько сообщений в области фармации о том, что один из изомеров превосходит остальные в главном, а именно один из них не токсичен, тогда как другие обладают сильной токсичностью. Незначительное количество оптических примесей вызывает опасное непредвиденное побочное действие.
Следовательно, для создания безопасных фармацевтических препаратов необходимо использовать вместо рацемата оптически активное соединение, и требуется, чтобы оптическая чистота составляла почти 100%.
Рассматриваемое соединение по настоящему изобретению полезно в качестве фармацевтического средства. Например, рацемат (2R)-2-пропилоктановой кислоты описывается в примере 7 (33) патента JP-A-7-316092 (ЕР 632008) как средство для лечения или профилактики нейродегенеративных заболеваний, вызванных функциональной аномальностью астроцитов.
В ходе дополнительных исследований было найдено, что оптически активное соединение R-конфигурации обладает высокой активностью и низкой токсичностью. Поэтому были проведены разнообразные исследования для обнаружения эффективного способа получения оптически активного соединения R-конфигурации.
Способ получения (2R)-2-пропилоктановой кислоты описан, например, в JP-A-8-291106, где оптически активную соль получают оптическим разделением рацемической 2-(2-пропинил)октановой кислоты с помощью оптически активного амина и образующуюся соль обрабатывают кислотой, что дает оптически активную (2S)-2-(2-пропинил)октановую кислоту, которую затем восстанавливают. Кроме того, в WO 99/58513, (2R)-2-пропилоктановую кислоту получают, восстанавливая 2S-(2-пропенил)октановую кислоту или 2S-(2-пропинил)октановую кислоту.
В указанных выше патентах описано, что предпочтительно восстановление осуществляют каталитическим способом, в частности, оно может быть проведено в органическом растворителе с использованием катализатора (например, палладия на угле, палладия, платины, оксида платины, никеля) в атмосфере водорода при 0-60°С. Например, использование палладия на угле указано в описаниях обоих патентов.
Однако установлено, что несколько процентов соединения S-конфигурации неизбежно образуется в качестве побочного продукта за счет изомеризации при восстановлении в указанных условиях.
Проведены интенсивные исследования с целью решения проблемы образования соединения S-конфигурации в качестве побочного продукта. Таким образом, заявителями найдено, что при использовании платины на угле вместо палладия на угле по существу не происходит изомеризации и можно получать рассматриваемое соединение с высокой оптической чистотой, что позволило завершить настоящее изобретение. То есть способ согласно настоящему изобретению позволяет избежать изомеризации продукта и получить безопасные лекарственные препараты с высокой чистотой.
Тот факт, что при использовании платины на угле оказывается, по существу, не происходит изомеризация и рассматриваемое соединение может быть получено с высокой оптической чистотой, до сих пор был не известен, и впервые установлен настоящим исследованием.
(2S)-2-(2-Пропинил)октановая кислота и (2S)-2-(2-пропенил)октановая кислота, используемые в качестве исходного материала, являются известными соединениями, например, описаны в WO 99/58513.
По настоящему изобретению гидрирование исходного вещества может быть осуществлено в органическом растворителе (например, таком, как этилацетат, тетрагидрофуран, диоксан, диметоксиэтан, диэтиловый эфир, дифениловый эфир, метиловый спирт, этиловый спирт, изопропиловый спирт, бензол, толуол, ксилол, НМРА - ГМФА, диметилформамид, диметилимидазолидин, их смесь) с использованием платины на угле в атмосфере водорода при 0-60°С.
Платина на угле, используемая по настоящему изобретению, выпускается в промышленном масштабе.
Предпочтительное для использования количество составляет 0,1-20 мас.%, более предпочтительно, 0,1-10 мас.% в отношении вещества.
Согласно способу по настоящему изобретению изомеризации не происходит, и может быть получена (2R)-2-пропилоктановая кислота с высокой оптической чистотой по сравнению с общепринятым способом (где в качестве катализатора используют палладий на угле).
То есть при обычном способе возможна частичная изомеризация, и оптическая чистота может быть снижена, а при проведении способа по настоящему изобретению изомеризация по существу не происходит, и может быть получено рассматриваемое соединение с высокой оптической чистотой.
В следующей таблице приведена оптическая чистота рассматриваемого соединения, полученного по способу настоящего изобретения и общепринятому способу (примеры сравнения 1 и 2, описанные ниже).
Приведенная выше таблица показывает, что оптическая чистота рассматриваемого соединения, полученного способом по настоящему изобретению, соответствует высокой оптической чистоте, а оптическая чистота соединения, полученного по способу примера сравнения, значительно снижена.
В частности, оптическая чистота рассматриваемого соединения, полученного по способу примеров сравнения, ниже на 3,8% и 2,8% по сравнению с исходным веществом, а оптическая чистота рассматриваемого соединения (полученного способом по настоящему изобретению) снижена только на 0,4% и 0,6% и оптическая чистота для рассматриваемого соединения остается высокой.
Как упомянуто выше, для фармации очень важно обеспечить возможно более низкое содержание побочного продукта. С этой точки зрения важным достижением является тот факт, что количество побочного продукта снижено и оптическая чистота рассматриваемого соединения остается высокой. Никак нельзя было предположить, что такие результаты можно будет получить способом по настоящему изобретению.
Следовательно, по способу настоящего изобретения рассматриваемое соединение может быть получено без изомеризации и рассматриваемое соединение имеет высокую оптическую чистоту, поэтому считается, что данный способ является исключительным.
Наилучший способ воплощения изобретения
Далее настоящее изобретение описывается детально с помощью примеров и примеров сравнения, но указанные примеры являются исключительно иллюстративными и не могут истолковываться как ограничивающие.
Стандартный пример 1
(2S)-2-(2-Пропенил)октановая кислота циклогексиламин
К раствору N-(2S-(2-пропенил)октаноил)-(1S)-(-)-2,10-камфорсультама (описан в WO 99/58513) (300 г) в диметоксиэтане (DME - ДМЭ) (3 л) добавляют при -5--10°С 2-метил-2-бутен (165 г) и водный раствор перекиси водорода (30%, 177 г). К указанному раствору добавляют по каплям, в течение 30 минут при -10-0°С, раствор тетра-н-бутил-аммонийгидрохлорид (40%; 1015 г) в ДМЭ (749 мл). Полученный раствор нагревают до 0°С и перемешивают в течение 3 часов. К реакционной смеси добавляют по каплям, за 10 минут, водный раствор сульфита натрия (198,5 г/1050 мл) и смесь нагревают до комнатной температуры и перемешивают в течение 30 минут. К смеси добавляют водный раствор соляной кислоты (1,5 л/вода З л) и продукт экстрагируют трет-бутилметиловым эфиром (3 л). Органический слой промывают водным раствором щавелевой кислоты (151 г/вода 1,5 л), водой (1,5 л ×3 раза) и насыщенным водным раствором хлорида натрия (2 л) и концентрируют. К концентрированному раствору добавляют гептан (300 мл) и концентрируют снова. К остатку добавляют гептан (600 мл) и нерастворимое вещество удаляют фильтрованием. Фильтрат концентрируют и остаток растворяют в этилацетате (1 л) и циклогексиламине (70,2 г) при нагревании и оставляют стоять при температуре окружающей среды в течение ночи. Раствор охлаждают на водяной бане в течение 1 часа и выпавшие кристаллы собирают и сушат, получая указанное в заглавии соединение (145 г; выход 65%).
Стандартный пример 2
(2S)-2-(2-Пропенил)октановая кислота
Н-Гексан/этилацетат (4/1; 2790 мл) и 2 н соляную кислоту (270 мл) добавляют к соединению, полученному по стандартному примеру 1 (140 г), и смесь перемешивают 30 минут. Водный слой удаляют из реакционного раствора и органический слой промывают водой (690 мл ×3 раза) и продукт экстрагируют 2,6 н гидроксидом натрия (750 мл). Водный слой промывают смесью н-гексан/этилацетат (4/1; 2790 мл ×2 раза). К водному слою добавляют 2 н соляную кислоту (990 мл) и продукт экстрагируют смесью н-гексан/этилацетат (4/1; 2790 мл). Органический слой промывают водой (690 мл к 3 раза) и насыщенным водным раствором хлорида натрия и концентрируют, получая указанное в заглавии соединение (89 г; выход 98%). Оптическая чистота (измеренная газовой хроматографией): 99,8 ээ.
Пример 1
Получение (2R)-2-пропилоктановой кислоты с использованием платины на угле
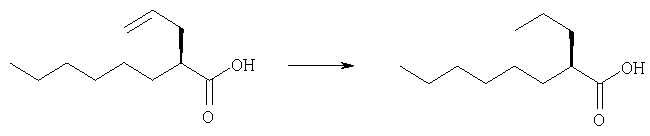
Раствор соединения, полученного по стандартному примеру 2 (87 г), в 2-пропиловом спирте (2,17 л) добавляют к 5% платине на угле (44 мас.%) (9,91 г) и смесь гидрируют под давлением водорода (5 кг/см2) при 30°С в течение 4 часов. Реакционную смесь фильтруют и фильтрат концентрируют. К остатку добавляют смесь н-гексан/этил-ацетат (5/1; 1,7 л) и продукт экстрагируют 2 н гидроксидом натрия (511 мл). Добавляют к водному слою концентрированную соляную кислоту (86 мл) и продукт экстрагируют смесью н-гексан/этилацетат (5/1; 1,7 л). Органический слой промывают очищенной водой (430 мл ×3 раза), насыщенным водным раствором хлорида натрия, сушат и концентрируют. Остаток перегоняют, получая указанное в заглавии соединение (75,0 г; выход: 85%), имеющее следующую физическую характеристику.
Оптическая чистота (измеренная ВЭЖХ): 99,4% ээ.
Пример 2
Получение (2R)-2-пропилоктановой кислоты с использованием платины на угле
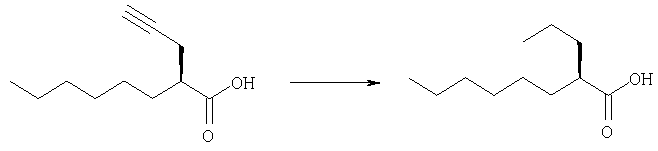
5% Платину на угле (270 г) добавляют к раствору (23)-2-(2-пропинил)октановой кислоты (описанной в JP-A-8-291106) (43,0 кг; 99,90% ээ) в изопропиловом спирте (344 л) и смесь гидрируют под давлением водорода (3,9˜15,0 кг/см2) при 20˜30°С в течение 8 часов. Аналогично 5% платину на угле (149 г) добавляют к раствору (23)-2-(2-пропинил)-октановой кислоты (23,7 кг; 99,90% ээ) в 2-пропиловом спирте (190 л) и смесь гидрируют под давлением водорода (2,6-15,0 кг/см2) при 16˜30°С в течение 5 часов. Катализатор удаляют из двух вышеуказанных растворов. Полученные фильтраты концентрируют. Остаток перегоняют, получая указанное в заглавии соединение (54,48 кг; выход: 82,8%), имеющее следующую физическую характеристику.
Оптическая чистота (измеренная ВЭЖХ): 99,34% ээ.
Пример сравнения 1
Получение (2R)-2-пропилоктановой кислоты с использованием палладия на угле
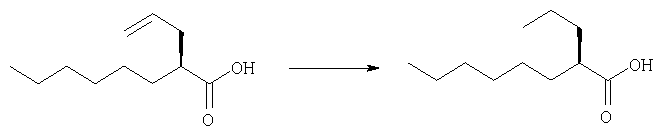
10% Палладий на угле (17 мг) добавляют к раствору (2S)-2-(2-пропинил)октановой кислоты (168 мг; 99,0% ээ (измерена газовой хроматографией)) в смешанном растворителе из метанола (1,2 мл) и этилацетата (1,2 мл). Смесь перемешивают в течение 1 часа при комнатной температуре в атмосфере газообразного водорода. Остаток фильтруют через целит и фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=9:1→4:1), получая указанное в заглавии соединение (109 мг; выход: 65%), имеющее следующую физическую характеристику.
Оптическая чистота (измеренная ВЭЖХ): 95,2% ээ.
Пример сравнения 2
Получение (2R)-2-пропилоктановой кислоты с использованием палладия на угле

5% Палладий на угле (2,60 кг) и ДМЭ (250 кг) добавляют к раствору (23)-2-(2-пропинил)октановой кислоты (13,0 кг; 99,88% ээ) в ДМЭ (23,0 кг). Смесь гидрируют под давлением водорода (5,1 м3) при 20˜30°С в течение 19 часов. Реакционную смесь фильтруют и промывают ДМЭ (40 л). Фильтрат и промывной раствор объединяют и концентрируют. Остаток растворяют в смеси н-гексан/этилацетат (215 л/43 л) и продукт экстрагируют 2 н гидроксидом натрия (72 л). К экстрагированному водному слою добавляют смесь н-гексан/этилацетат (215 л/43 л) и смесь перемешивают. К смеси добавляют концентрированную соляную кислоту (13 л). Органический слой промывают водой (3 раза), насыщенным водным раствором хлорида натрия (1 раз), сушат над безводным сульфатом магния и концентрируют, получая сырое указанное в заглавии соединение (12,25 кг). Сырой продукт перегоняют, получая указанное в заглавии соединение (8399,7 г; выход: 63,2%), имеющее следующую физическую характеристику.
Оптическая чистота (измеренная ВЭЖХ): 97,14% ээ.
Промышленная применимость
Способом по настоящему изобретению может быть получена (2R)-2-пропилоктановая кислота с высокой оптической чистотой, используемая для фармацевтических препаратов, и это дает возможность получения безопасных лекарственных средств, не содержащих побочного продукта, оказывающего побочные действия.
Настоящее изобретение относится к способу получения 2(R)-2-пропилоктановой кислоты с высокой оптической чистотой, используемой для фармацевтических препаратов. Способ заключается в том, что (2S)-2-(2-пропинил)октановую кислоту или (2S)-2-(2-пропенил)октановую кислоту восстанавливают в органическом растворителе в атмосфере водорода при температуре в интервале 0-60°С, используя платину на угле. Изобретение также относится к продукту, включающему от 97,14 до 99,4% ээ 2(R)-2-пропилоктановой кислоты и 2(S)-2-пропилоктановую кислоту - остальное, а также к продукту, включающему 2(R)-2-пропилоктановую кислоту, имеющую оптическую чистоту, по крайней мере, 97,14% ээ и 2(S)-2-пропилоктановую кислоту - остальное. 3 н. и 3 з.п. ф-лы, 1 табл.
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Коллектор свч-прибора с системой охладжения | 1976 |
|
SU632008A1 |
| СПОСОБ ПОЛУЧЕНИЯ α АРИЛПРОПИОНОВЫХ КИСЛОТ | 1990 |
|
RU2086532C1 |
| RU 93044488 A, 20.06.1996 | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
Авторы
Даты
2007-04-20—Публикация
2000-02-17—Подача