Предшествующий уровень техники
Настоящее изобретение относится к замещенным остатком сахара 2-азетидинонам, пригодным для использования в качестве гипохолестеринемических препаратов для лечения и предупреждения атеросклероза, и к комбинации замещенного остатком сахара 2-азетидинона, соответствующего настоящему изобретению, с ингибитором биосинтеза холестерина, предназначенной для лечения и предупреждения атеросклероза.
Атеросклеротическая ишемическая болезнь сердца является главной причиной смерти и смертности от сердечно-сосудистых заболеваний в западном мире. К факторам риска при атеросклеротической ишемической болезни сердца относятся гипертензия, сахарный диабет, семейный анамнез, мужской пол, курение и концентрация холестерина в сыворотке. Уровень общего холестерина, превышающий 225-250 мг/дл, связывается со значительным увеличением риска.
Сложные эфиры холестерина являются основным компонентом атеросклеротических поражений и основной формой хранения холестерина в клетках стенок артерий. Образование сложных эфиров холестерина также является ключевой стадией всасывания пищевого холестерина в кишечнике. В дополнение к регуляции пищевого холестерина регуляция гомеостаза холестерина во всем организме человека и животного включает модуляцию биосинтеза холестерина, биосинтеза желчных кислот и катаболизма содержащих холестерин липопротеинов плазмы. Печень является основным органом, обеспечивающим биосинтез и катаболизм холестерина, и по этой причине она в основном определяет уровень холестерина в плазме. Печень является местом синтеза и секреции липопротеинов очень низкой плотности (ЛОНП), которые затем в кровотоке подвергаются метаболизму в липопротеины низкой плотности (ЛНП). ЛНП являются основными содержащими холестерин липопротеинами плазмы и увеличение их концентрации коррелирует с усилением атеросклероза.
Если независимо от того с помощью каких средств всасывание холестерина в кишечнике снижается, в печень поступает меньше холестерина. Следствием этого является уменьшение продуцирования в печени липопротеина (ЛОНП) и увеличение печеночного клиренса холестерина плазмы, в основном в виде ЛНП. Таким образом, суммарным эффектом ингибирования всасывания холестерина в кишечнике является снижение уровня холестерина в плазме.
Сообщают, что некоторые производные 2-азетидинона полезны для снижения холестерина и/или ингибирования образования содержащих холестерин образований в стенках артерий млекопитающих: в WO 93/02048 описаны производные 2-азетидинона, в которых заместителями в положении 3 являются арилалкилен, арилалкенилен или арилалкинилен, где алкиленовый, алкениленовый или алкиниленовый фрагмент прерывается гетероатомом, фениленом или циклоалкиленом; в WO 94/17038 описаны производные 2-азетидинона, в которых заместителем в положении 3 является арилалкилспироциклическая группа; в WO 95/08532 описаны производные 2-азетидинона, в которых заместителем в положении 3 является арилалкиленовая группа, в алкиленовом фрагменте которой в качестве заместителя содержится гидроксигруппа; в PCT/US95/03196 описаны соединения, в которых заместителем в положении 3 является арил-(оксо или тио)-алкиленовая группа, в алкиленовом фрагменте которой в качестве заместителя содержится гидроксигруппа; и в заявке на патент США US порядковый №08/463619, поданной 5 июня 1995 г., описано получение соединений, в которых заместителем в положении 3 является арилалкиленовая группа, в алкиленовом фрагменте которой в качестве заместителя содержится гидрокси-группа, и в которых алкиленовая группа присоединена к азетидиноновому кольцу через группу -S(O)0-2.
Кроме того, в Европейском патенте 199630В1 и Европейской заявке на патент 337549 А1 раскрыты ингибирующие эластазу замещенные азетидиноны, пригодные для использования при лечении воспалительных состояний, приводящих к разрушению тканей, которые сопутствуют различным заболеваниями, например атеросклерозу.
К другим известным гипохолестеринемическим средствам относятся экстракты растений, такие как сапогенины, в частности тигогенин и диосгенин. Гликозидные производные тигогенина и диосгенина раскрыты в WO 94/00480 и WO 95/18143.
Показано, что ингибирование биосинтеза холестерина с помощью ингибиторов 3-гидрокси-3-метилглутарил-кофермента А-редуктазы (HMG СоА редуктазы) (ЕС1.1.1.34) является эффективным способом снижения холестерина в плазме (Witzum, Circulation, 80, 5 (1989), p.1101-1114) и ослабления атеросклероза. Показано, что комбинированная терапия с использованием ингибитора HMG СоА редуктазы и препарата, увеличивающего экскрецию желчных кислот, при лечении людей, страдающих гиперлипидемией, является более эффективной, чем монотерапия (lllingworth, Drugs, 36 (Suppl. 3) (1988), p.63-71).
Краткое описание изобретения
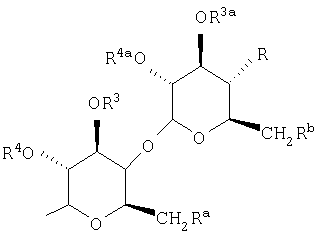
Настоящее изобретение относится к замещенным остатком сахара 2-азетидинонам, в частности, к содержащим фрагмент глюкозы конъюгатам 2-азетидинонов, снижающих концентрацию холестерина, которые содержат арильную или замещенную арильную группу в качестве заместителя в положении 1 и содержат замещенную, главным образом, гидроксизамещенную фенильную группу, в частности, 4-гидроксифенильную группу, в положении 4. Примеры сахаров, пригодных для использования в качестве заместителей в настоящем изобретении, включают (без наложения ограничений) гексозу и рибозу.
Соединения, соответствующие настоящему изобретению, описываются формулой I:
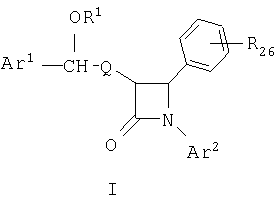
или являются ее приемлемой с фармацевтической точки зрения солью, где
R26 выбран из группы, включающей:
a) ОН;
b) ОСН3;
c) фтор и
d) хлор,
R1 выбран из группы, включающей:
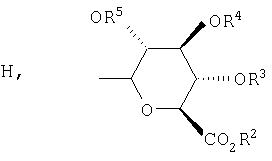 ,
, 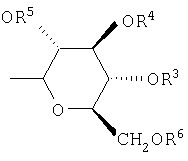 ,
, 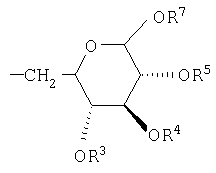 ,
,
 ,
,
-SO3H; природные и не являющиеся природными аминокислоты.
R, Ra и Rb независимо выбраны из группы, включающей Н, -ОН, галоген, -NH2, азидогруппу, (С1-С6)-алкокси-(С1-С6)-алкоксил и -W-R30;
W независимо выбран из группы, включающей -NH-С(О)-, -О-С(О)-, -О-С(О)-N(R31)-, -NH-C(O)-N(R31)- и -O-C(S)-N(R31)-;
R2 и R6 независимо выбраны из группы, включающей Н, (С1-С6)-алкил, арил и арил-(С1-С6)-алкил;
R3, R4, R5, R7, R3а и R4a независимо выбраны из группы, включающей Н, (С1-С6)-алкил, арил-(С1-С6)-алкил, -С(O)(С1-С6)-алкил и -С(O)-арил;
R30 независимо выбран из группы, включающей R32-замещенный Т, R32-замещенный-Т-(С1-С6)-алкил, R32-замещенный-(C2-C4)-алкенил, R32-замещенный-(С1-С6)-алкил, R32-замещенный-(С3-С7)-циклоалкил и R32-замещенный-(С3-С7)-циклоалкил-(С1-С6)-алкил;
R31 независимо выбран из группы, включающей Н и (С1-С4)-алкил;
Т независимо выбран из группы, включающей фенил, фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, бензотиазолил, тиадиазолил, пиразолил, имидазолил и пиридил;
R32 независимо выбран из группы, включающей 1-3 заместителя, независимо выбранные из группы, включающей Н, галоген, (С1-С4)-алкил, -ОН, феноксил, -CF3, -NO2, (С1-С4)-алкоксил, метилендиокси, оксо, (C1-C4)-алкилсульфанил, (С1-С4)-алкилсульфинил, (С1-С4)-алкилсульфонил, -N(CH3)2, -С(O)-NH(С1-С4)-алкил, -С(O)-N((С1-С4)-алкил)2, -С(O)-(С1-С4)-алкил, -С(O)-(С1-С4)-алкоксил и пирролидинилкарбонил; или R32 означает ковалентную связь и R31, атом азота, к которому он присоединен, и R32 образуют пирролидинильную, пиперидинильную, N-метилпиперазинильную, индолильную или морфолинильную группу или (С1-С4)-алкоксикарбонилзамещенную пирролидинильную, пиперидинильную, N-метилпиперазинильную, индолильную или морфолинильную группу;
Ar1 означает арил или R10-замещенный арил;
Ar2 означает арил или R11-замещенный арил;
Q означает -(CH2)q-, где q равно 2-6, или, совместно с циклическим атомом углерода, находящимся в положении 3 азетидинона, образует спирановую группу 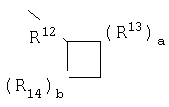 ;
;
R12 означает
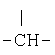 ,
, 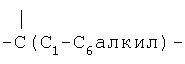 ,
, 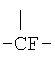 ,
, 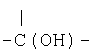 ,
, 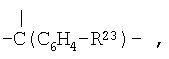
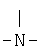 , или
, или 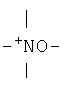 ;
;
R13 и R14 независимо выбраны из группы, включающей -СН2-, -СН(С1-С6-алкил)-, -С(ди-(С1-С6)-алкил), -СН=СН- и -С((С1-С6)-алкил)=СН-; или R12 совместно с соседним R13, или R12 совместно с соседним R14 образуют -СН=СН- или -СН=С((С1-С6)-алкильную группу;
а и b независимо равны 0, 1, 2 или 3 при условии, что оба они не равны нулю; при условии, что, если R13 означает -СН=СН- или -С((С1-С6)-алкил)=СН-, то а равно 1; при условии, что, если R14 означает -СН=СН- или -С((С1-С6)-алкил)=СН-, то b равно 1; при условии, что, если а равно 2 или 3, то R13 могут быть одинаковыми или разными; и при условии, что, если b равно 2 или 3, то R14 могут быть одинаковыми или разными;
R10 и R11 независимо выбраны из группы, включающей 1-3 заместителя, независимо выбранные из группы, включающей (С1-С6)-алкил, -OR19, -O(CO)R19, -O(CO)OR21, -O(CH2)1-5OR19, -O(CO)NR19R20, -NR19R20, -NR19(CO)R20, -NR19(CO)OR21, -NR19(CO)NR20R25, -NR19SO2R21, -COOR19, -CONR19R20, -COR19, -SO2NR19R20, S(O)0-2R21, -O(CH2)1-10-COOR19, -O(CH2)1-10CONR19R20, -((С1-С6)-алкилен)-COOR19, -CH=CH-COOR19, -CF3, -CN, -NO2 и галоген;
Ar1 также может означать пиридил, изоксазолил, фуранил, пирролил, тиенил, имидазолил, пиразолил, тиазолил, пиразинил, пиримидинил или пиридазинил;
R19 и R20 независимо выбраны из группы, включающей Н, (С1-С6)-алкил, арил и арилзамещенный (С1-С6)-алкил;
R21 означает (С1-С6)-алкил, арил или R24-замещенный арил;
R22 означает Н, (С1-С6)-алкил, арил-(С1-С6)-алкил, -C(O)R19 или -COOR19;
R23 и R24 независимо выбраны из группы, включающей 1-3 заместителя, независимо выбранные из группы, включающей Н, (С1-С6)-алкил, (C1-С6)-алкоксил, -СООН, NO2, -NR19R20, -ОН и галоген; и
R25 означает Н, -ОН или (С1-С6)-алкоксил.
Ar2 предпочтительно означает фенил или R11-фенил, в особенности (4-R11)-замещенный фенил. Предпочтительными значениями R11 являются низший алкоксил, в особенности метоксил, и галоген, в особенности фтор.
Ar1 предпочтительно означает фенил или R10-замещенный фенил, в особенности (4-R10)-замещенный фенил. Предпочтительным значением R10 является галоген, в особенности фтор.
Предпочтительно, чтобы Q означал низший алкил или спирановую группу, как это определено выше, причем предпочтительно, чтобы оба R13 и R14 означали этилен и R12 означал
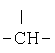 или
или 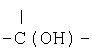
Поэтому предпочтительным соединением формулы I является соединение, в котором R1 является таким, как определено выше, и в котором остальные переменные определены следующим образом:
Ar1 означает фенил или R10-замещенный фенил, где R10 означает галоген;
Ar2 означает фенил или R11-фенил, где R11 означает от 1 до 3 заместителей, независимо выбранных из группы, включающей (С1-С6)-алкоксил и галоген;
Q означает низший алкил (т.е. от С-1 до С-2), причем предпочтительным является Q=С-2, или Q, совместно с циклическим атомом углерода, находящимся в положении 3 азетидинона, образует группу
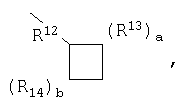
где предпочтительно, чтобы оба R13 и R14 означали этилен и оба а и b равнялись 1, и где R12 означает
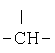 или
или 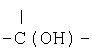
Предпочтительными значениями групп R1 формулы
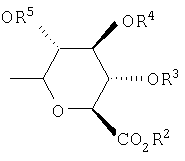 ,
,  и
и 
являются следующие:
R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей Н, (C1-С6)-алкил, бензил и ацетил.
Предпочтительными значениями группы R1 формулы

являются следующие:
R3, R3a, R4 и R4a выбраны из группы, включающей Н, (С1-С6)-алкил, бензил и ацетил;
R, Ra и Rb независимо выбраны из группы, включающей Н, -ОН, галоген, -NH2, азидогруппу, (С1-С6)-алкокси-(С1-С6)-алкоксил и -W-R30, где W означает -О-С(О)- или -O-C(O)-NR31-, R31 означает Н и R30 означает (C1-С6)-алкил, -С(O)-(С1-С4)-алкоксил-(С1-С6)-алкил, Т, Т-(С1-С6)-алкил, или Т или Т-(С1-С6)- алкил, где Т замещен одной или двумя галогенидными или (C1-С6)-алкильными группами.
Предпочтительными заместителями R30 являются 2-фторфенил, 2,4-дифторфенил, 2,6-дихлорфенил, 2-метилфенил, 2-тиенилметил, 2-метоксикарбонилэтил, тиазол-2-илметил, 2-фурил, 2-метоксикарбонилбутил и фенил. Предпочтительными комбинациями R, Ra и Rb являются следующие: 1) R, Ra и Rb независимо означают -ОН или -O-C(O)-NH-R30, в особенности если Ra означает -ОН и R и Rb означают -O-C(O)-NH-R30 и R30 выбран из группы указанных выше предпочтительных заместителей, или если R и Ra означают -ОН и Rb означает -O-C(O)-NH-R30, где R30 означает 2-фторфенил, 2,4-дифторфенил, 2,6-дихлорфенил; 2) Ra означает -ОН, галоген, азидогруппу или (С1-С6) -алкокси-(С1-С6)-алкоксил, Rb означает Н, галоген, азидогруппу или (С1-С6)-алкокси-(С1-С6)-алкоксил и R означает -O-C(O)-NH-R30, в особенности соединения, в которых Ra означает -ОН, Rb означает Н и R30 означает 2-фторфенил; 3) R, Ra и Rb независимо означают -ОН или -O-C(O)-R30 и R30 означает (С1-С6)-алкил, Т, или Т, в качестве заместителей содержащий одну или две галогенидные или (С1-С6)-алкильные группы, в особенности соединения, в которых R означает -ОН и Ra и Rb означают -O-С(O)-R30, где R30 означает 2-фурил; и 4) R, Ra и Rb независимо означают -ОН или галоген. Тремя дополнительными классами предпочтительных соединений являются соединения, в которых окси-группа аномерного атома С1' находится в бета-конфигурации, в которых окси-группа аномерного атома С2' находится в бета-конфигурации, и в которых группа R находится в альфа-конфигурации.
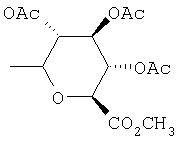
Предпочтительно, чтобы R1 был выбран из группы, включающей:
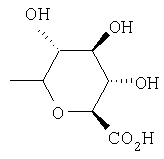 ,
, 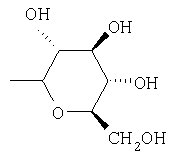 ,
, 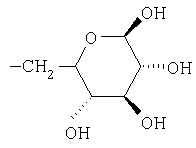 ,
, 
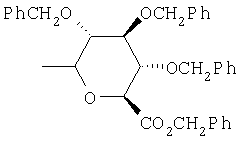 ,
, 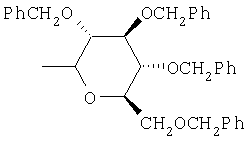 ,
, 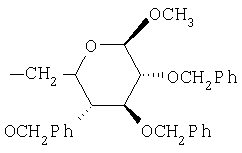 ,
,
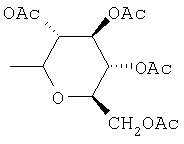 ,
, 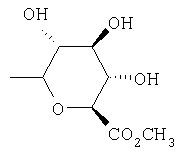 ,
, 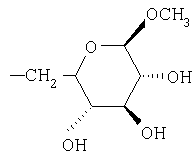 ,
,
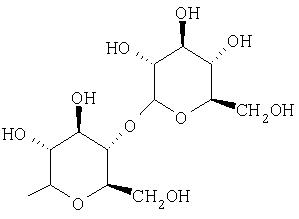 ,
, 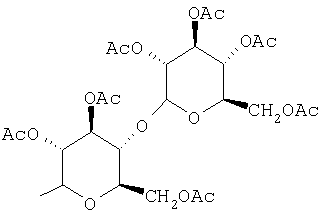 , и
, и 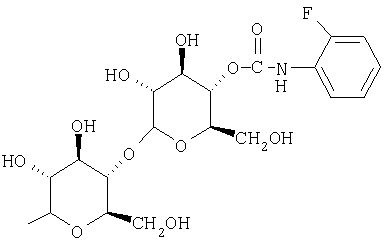
где Ас означает ацетил и Ph означает фенил.
Таким образом, предпочтительным соединением, соответствующим настоящему изобретению, является соединение, представленное формулой II:
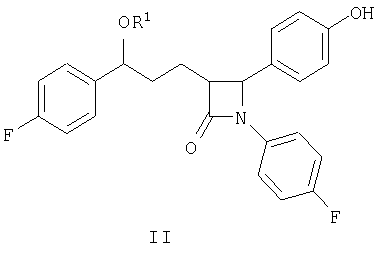
где R1 является таким, как определено выше.
Более предпочтительным соединением является соединение, представленное формулой III:
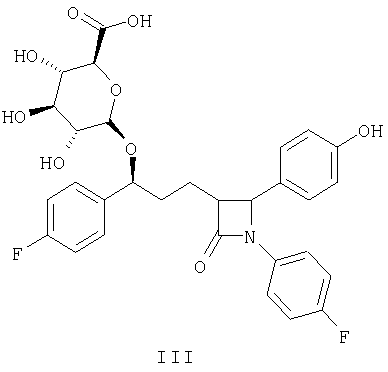
Настоящее изобретение также относится к способу применения замещенного остатком сахара 2-азетидинона, в особенности обладающего формулой I, для лечения и предупреждения атеросклероза или уменьшения уровня холестерина в плазме, включающему введение млекопитающему, нуждающемуся в таком лечении и предупреждении или уменьшении, эффективного количества соединения формулы I.
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая замещенный остатком сахара 2-азетидинон, главным образом формулы I, и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к способу снижения уровня холестерина в печени, способу снижения уровня холестерина в плазме и к способу лечения и предупреждения атеросклероза, включающему введение млекопитающему, нуждающемуся в таком лечении, эффективного количества комбинации замещенного остатком сахара 2-азетидинона, соответствующего настоящему изобретению, в особенности имеющего формулу I, с ингибитором биосинтеза холестерина. Это означает, что настоящее изобретение относится к использованию замещенного остатком сахара 2-азетидинона в комбинации с ингибитором биосинтеза холестерина (и, аналогичным образом, использования ингибитора биосинтеза холестерина в комбинации с замещенным остатком сахара 2-азетидиноном) для лечения и предупреждения атеросклероза или для снижения уровня холестерина в плазме.
Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая эффективное количество комбинации замещенного остатком сахара 2-азетидинона с ингибитором биосинтеза холестерина и фармацевтически приемлемым носителем. В последнем варианте осуществления настоящее изобретение относится к комплекту, содержащему в одном контейнере эффективное количество замещенного остатком сахара 2-азетидинона в фармацевтически приемлемом носителе и в отдельном контейнере эффективное количество ингибитора биосинтеза холестерина в фармацевтически приемлемом носителе.
Подробное описание изобретения
При использовании в настоящем изобретении термин "алкил" или "низший алкил" означает линейные или разветвленные алкильные цепи, содержащие от 1 до 6 атомов углерода, а "алкоксил" аналогичным образом означает алкоксильные группы, содержащие от 1 до 6 атомов углерода.
"Алкенил" означает линейные или разветвленные углеродные цепи, содержащие в цепи одну или большее количество двойных связей, сопряженных или несопряженных. Аналогичным образом "алкинил" означает линейные или разветвленные углеродные цепи, содержащие в цепи одну или большее количество тройных связей. Если алкильная, алкенильная или алкинильная цепь соединяет две других группы и по этой причине является двухвалентной, то используются термины "алкилен", "алкенилен" или "алкинилен".
"Циклоалкил" означает насыщенное углеродное кольцо, содержащее от 3 до 6 атомов углерода, а "циклоалкилен" означает соответствующее двухвалентное кольцо, в котором места присоединения к другим группам включают все изомеры положения.
"Галоген" означает радикалы фтора, хлора, брома или йода.
"Арил" означает фенил, нафтил, инденил, тетрогидронафтил или инданил. "Фенилен" означает двухвалентную фенильную группу, включая орто-, мета- паразамещенную.
"Аминокислота" означает природные и не являющиеся природными аминокислоты и включает (без наложения ограничений) аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глицин, лейцин, серин и валин.
R24-Бензил и R24-бензилоксил означают бензильные и бензилоксильные радикалы, которые замещены по фенильному циклу.
Приведенные выше формулировки, в которых, например, указано, что R19, R20 и R25 независимо выбраны из группы заместителей, означают, что R19, R20 и R25 выбраны независимо, а также и то, что, когда группа R19, R20 или R25 содержится в молекуле более одного раза, эти группы выбираются независимо (например, если R10 означает -OR19, где R19 означает водород, то R11 может означать -OR19, где R19 означает низший алкил). Специалистам в данной области техники должно быть понятно, что размер и природа заместителя (заместителей) будут влиять на количество заместителей, которые могут содержаться.
Соединения, соответствующие настоящему изобретению, содержат хотя бы один асимметрический атом углерода и поэтому все изомеры, включая диастереоизомеры и поворотные изомеры, считаются частью настоящего изобретения. Настоящее изобретение включает α- и β-стереоизомеры в оптически чистом виде и в смеси, включая рацемические смеси. Изомеры можно получить с помощью обычных методик или по реакции оптически чистых или обогащенных определенными оптическими изомерами исходных веществ, или путем разделения изомеров формулы I.
Соединения, соответствующие настоящему изобретению, которые содержат аминогруппы, могут образовывать фармацевтически приемлемые соли с органическими и неорганическими кислотами. Примерами органических и неорганических кислот, подходящих для образования таких солей, являются хлористоводородная, серная, фосфорная, уксусная, лимонная, щавелевая, малоновая, салициловая, яблочная, фумаровая, янтарная, аскорбиновая, малеиновая, метансульфоновая и другие органические и неорганические карбоновые кислоты, хорошо известные специалистам в данной области техники. Соль получают путем взаимодействия свободного основания с достаточным количеством необходимой кислоты с образованием соли. Свободное основание можно выделить путем обработки соли подходящим разбавленным водным раствором основания, таким как разбавленный водный раствор бикарбоната натрия. Свободное основание отличается от соответствующей соли по некоторым физическим характеристикам, таким как растворимость в полярных растворителях, однако для задач настоящего изобретения по остальным характеристикам соль эквивалентна соответствующему свободному основанию.
Некоторые соединения, соответствующие настоящему изобретению, являются кислотными (например, соединения, которые содержат карбоксильную группу). Эти соединения образуют фармацевтически приемлемые соли с органическими и неорганическими основаниями. Примерами таких солей являются соли натрия, калия, кальция, алюминия, золота и серебра. Также включаются соли, образующиеся с фармацевтически приемлемыми аминами, такими как аммиак, алкиламины, гидроксиалкиламины, N-метилглюкамин и т.п.
Ингибиторы биосинтеза холестерина, предназначенные для использования совместно с соединениями, соответствующими настоящему изобретению, включают ингибиторы HMG СоА редуктазы, такие как ловастатин, правастатин, флувастатин, симвастатин, аторвастатин, NK-104 (итавастатин) и ZD4522; ингибиторы HMG СоА синтетазы, например, L-659, 699 ((E,E-11-[3'R-(гидроксиметил)-4'-оксо-2'R-оксетанил]-3,5,7R-триметил-2,4-ундекадиеновая кислота); ингибиторы синтеза сквалена, например, сквалестатин 1; и ингибиторы скваленэпоксидазы, например, NB-598 ((Е)-N-этил-N-(6,6-диметил-2-гептен-4-инил)-3-[(3,3'-битиофен-5-ил)-метокси]-бензолметанамингидрохлорид). Предпочтительными ингибиторами HMG СоА редуктазы являются ловастатин, правастатин, флувастатин, аторвастатин и симвастатин. Наиболее предпочтительным является ингибитор HMG СоА редуктазы, симвастатин.
Снижающие концентрацию холестерина 2-азетидиноновые фрагменты соединений формулы 1 можно получить с помощью известных методик.
Сахара и их производные, определенные с помощью заместителей R1, указанных выше, известны в данной области техники или их легко получить по известным методикам.
Предпочтительно, чтобы описанные выше реакции включали производное сахара, в котором не вводимые в реакцию гидроксильные группы защищены с помощью подходящих защитных групп, таких как определенные выше для R2, R3, R3a, R4, R4а, R5 и R7 и не означающих водород, предпочтительно означающих низший алкил, ацетил или бензил, и эти группы после проведения реакции можно удалить и получить конъюгат сахара. Если боковые цепи 2-азетидинона, находящиеся в положениях 1 и 4, содержат замещающие группы, которые при использованных условиях могут вступать в реакцию, указанные реакционноспособные группы защищают с помощью подходящих защитных групп до проведения реакции с сахаром или его производным, а затем защитные группы удаляют. В зависимости от природы защитных групп защитные группы, находящиеся в сахарном фрагменте и в боковых цепях 2-азетидинона в положениях 1 и 4, можно удалять последовательно или одновременно.
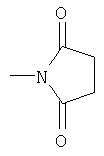
Реакционноспособные группы, не участвующие в указанных выше реакциях, можно для проведения реакции защитить с помощью обычных защитных групп, которые после завершения реакции можно удалить по стандартным методикам. Типичные защитные группы приведены в таблице 1:
 ,
, 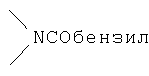 ,
, 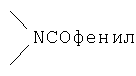 ,
,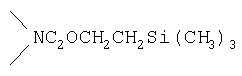 ,
, 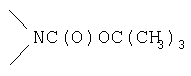 ,
,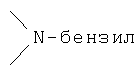 ,
, 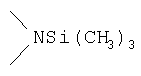 ,
, 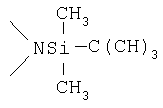
По сравнению со снижающими концентрацию холестерина производными 2-азетидинона, которые не замещены остатком сахара, соединения, соответствующие настоящему изобретению, обладают некоторыми фармакологическими и физическими преимуществами. Эти соединения всасываются с меньшей скоростью, что приводит к меньшим концентрациям в плазме и более высоким концентрациям в кишечнике. Проведенные ранее исследования показали, что кишечник, вероятно, является областью, в которой проявляют реакционную способность производные 2-азетидинона, которые не замещены остатком сахара. См. van Heek, M. et al., "In vivo mechanism-based discovery of a potent cholesterol absorption inhibitor (SCH 58235) through the identification of the active metabolites of SCH 48461," J. Pharmacol Exp. Ther., 283 (1997), pp.157-163, и van Heek M. et al, "Comparison of the activity and deposition of the novel cholesterol absorption inhibitor, SCH 58235, and its glucuronide," Br. J. Pharmacol., 129, (2001), pp.1748-1754. Заявленные в настоящем изобретении соединения, которые поступают в желчь, обеспечивают эффективное направление этого соединения в нужный участок организма при сведении к минимуму системного воздействия, что ослабляет возможные токсические проявления.
Наряду с тем, что настоящее изобретение относится к соединениям, оно также относится к способу снижения уровня холестерина в плазме, и этот способ включает введение млекопитающему, нуждающемуся в таком лечении, эффективного с точки зрения гипохолестеринемического воздействия количества соединения формулы I, соответствующего настоящему изобретению. Предпочтительно вводить это соединение в фармацевтически приемлемом носителе, пригодном для перорального введения.
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение формулы I, соответствующее настоящему изобретению, и фармацевтически приемлемый носитель. Соединения формулы I можно вводить в любой обычной пероральной дозировочной форме, такой как капсулы, таблетки, порошки, капсулы, суспензии или растворы. Рецептуры и фармацевтические композиции можно приготовить с использованием обычных, фармацевтически приемлемых инертных наполнителей и добавок и обычных методик. К таким фармацевтически приемлемым инертным наполнителям и добавкам относятся нетоксичные совместимые наполнители, связующие, вещества, обеспечивающие распадаемость, буферные вещества, консерванты, антиоксиданты, смазывающие вещества, вкусовые добавки, загустители, окрашивающие вещества, эмульгаторы и т.п.
Эффективное количество соединения формулы I находится в диапазоне от около 0,001 до около 30 мг/кг массы тела в сутки, предпочтительно - от около 0,001 до около 1 мг/кг в виде одной дозы или разделенных доз. Таким образом, для средней массы тела, равной 70 кг, эффективное количество составляет от примерно 0,1 до примерно 100 мг лекарственного препарата в сутки, назначаемое в виде одной дозы или 2-4 разделенных доз. Однако точная доза определяется лечащим врачом и зависит от активности вводимого соединения, возраста, массы, состояния и реакции пациента.
Для комбинаций, соответствующих настоящему изобретению, когда замещенный азетидинон вводится в комбинации с ингибитором биосинтеза холестерина, типичная суточная доза ингибитора биосинтеза холестерина составляет от 0,1 до 80 мг/кг тела млекопитающего в сутки, назначаемая в виде одной дозы или разделенных доз, обычно один или два раза в сутки: например, в случае ингибитора HMG СоА редуктазы доза, равная от примерно 10 до примерно 40 мг, назначается от 1 до 2 раз в сутки, что приводит к полной суточной дозе, равной от примерно 10 до примерно 80 мг в сутки, а в случае других ингибиторов биосинтеза холестерина доза, равная от примерно 1 до примерно 1000 мг, назначается от 1 до 2 раз в сутки, что приводит к полной суточной дозе, равной от примерно 1 мг до примерно 2 г в сутки. Точная доза любого компонента вводимой комбинации определяется лечащим врачом и зависит от активности назначаемого соединения, возраста, массы, состояния и реакции пациента.
Если компоненты комбинации назначаются по отдельности, то количества доз каждого компонента, назначаемых в сутки, не обязательно являются одинаковыми, например, в случае, когда один компонент может обладать большей длительностью действия и поэтому будет назначаться реже.
Поскольку настоящее изобретение относится к снижению уровня холестерина в плазме посредством лечения с помощью комбинации активных компонентов, при котором указанные активные компоненты могут назначаться по отдельности, настоящее изобретение также относится к комбинированным фармацевтическим композициям в виде комплекта. Это означает, что рассматривается комплект, в который включены два препарата: фармацевтическая композиция с ингибитором биосинтеза холестерина и фармацевтическая композиция с ингибитором всасывания - замещенным остатком сахара 2-азетидиноном. Предпочтительно, чтобы в комплект входила инструкция по введению отдельных компонентов. Форма комплекта является особенно подходящей, когда два компонента необходимо назначать в виде разных дозировочных форм (например, пероральной и парентеральной) или вводить дозы с разными интервалами.
Мы обнаружили, что соединения, соответствующие настоящему изобретению, снижают концентрации липидов в плазме и концентрации холестерина в печени. При испытаниях на животных обнаружено, что соединения, соответствующие настоящему изобретению, ингибируют всасывание холестерина в кишечнике и значительно уменьшают образование сложных эфиров холестерина в печени. Таким образом, соединения, соответствующие настоящему изобретению, являются гипохолестеринемическими препаратами вследствие их способности ингибировать этерификацию и/или всасывание холестерина в кишечнике; поэтому они пригодны для использования при лечении и предупреждении атеросклероза у млекопитающих, в частности, у человека.
Приведенные ниже соединение 6А и соединение "Пример 1", раскрытые в патентах США № US 5767115 и 5756470 соответственно, обнаруживают фармакологическую активность, как гипохолестеринемические препараты.
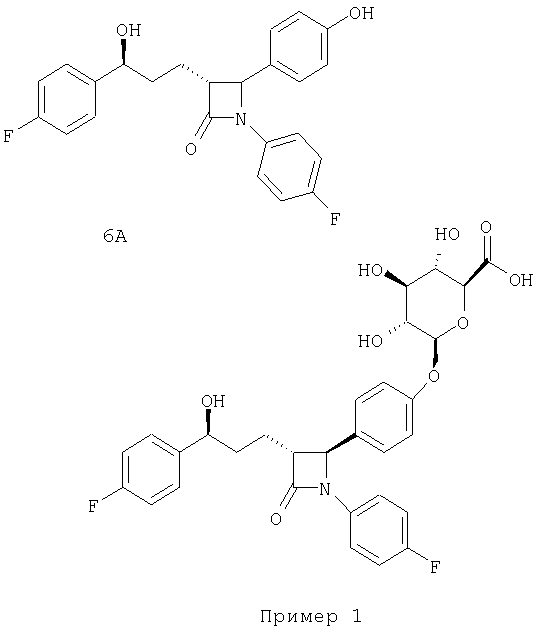
Активность in vivo (см. таблицу 1) приведенных выше соединений 6А и Примера 1 можно определить с помощью следующей процедуры.
Анализ гиполипидемического препарата in vivo с использованием хомяков, страдающих гиперлипидемией
Хомяков разделяют на группы по шесть животных и им в течение семи дней дают кормовой рацион с регулируемым содержанием холестерина (Purina Chow #5001, содержащий 0,5% холестерина). Для определения поступления холестерина с кормом в присутствии исследуемых соединений регистрируют потребление кормового рациона. Животным вводят исследуемое соединение один раз в сутки с момента начала использования кормового рациона. Пероральным путем через зонд вводят 0,2 мл чистого кукурузного масла (контрольная группа) или раствор (или суспензию) исследуемого соединения в кукурузном масле. Всех умирающих или находящихся в плохом физическом состоянии животных умерщвляют. Через семь дней животных анестезируют с помощью внутримышечной инъекции кетамина и умерщвляют путем обезглавливания. Для проведения анализов по определению общего холестерина и триглицеридов в плазме кровь собирают в пробирки Vacutainer™, содержащие ЭДТК (этилендиаминтетрауксусная кислота), а печень вырезают для проведения анализов по определению концентрации свободного и этерифицированного холестерина и триглицеридов в ткани. Данные приводят в виде выраженного в процентах снижения концентраций холестерина в плазме и сложных эфиров холестерина в печени по сравнению с контролем.
Данные приводят в виде процентного изменения (то есть, в виде выраженного в процентах снижения холестерина в плазме и сложных эфиров холестерина в печени) по сравнению с контролем; поэтому отрицательные значения указывают на способность снижать концентрацию холестерина. Результаты анализов приведены в таблице 2.
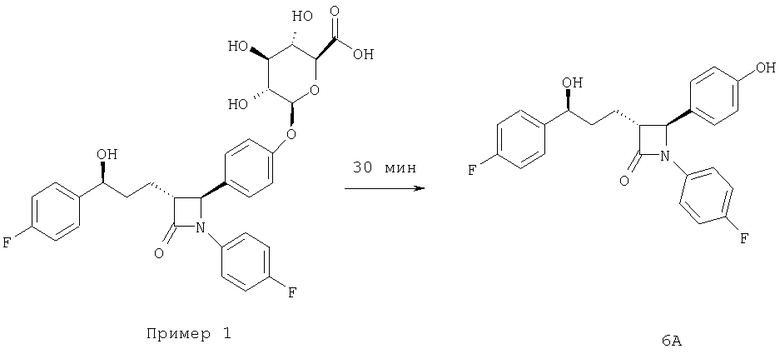
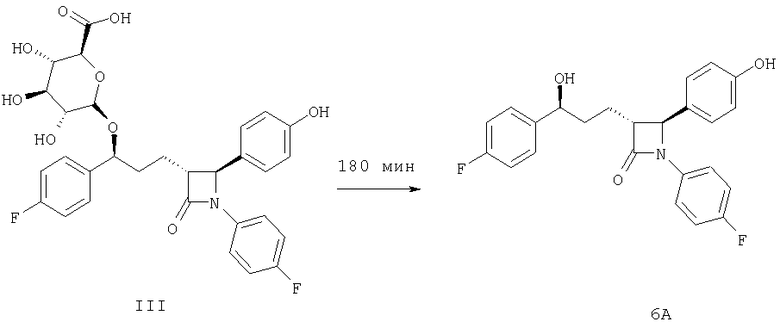
В описанном ниже эксперименте 3 показано, что оба соединения, формулы III и Примера 1 после гидролиза с помощью β-глюкуронидазы дают соединение 6А (все они приведены выше в настоящем изобретении). Эксперименты №1 и 2 подтверждают, что соединение 6А приводит к образованию и соединения Примера 1, и соединения формулы III после инкубации соединения 6А с микросомами желудочно-кишечного тракта или UGT2B7. Поскольку показано, что и соединение 6А, и соединение Примера 1 обладают фармакологической активностью (таблица 2), предполагается, что соединения формул I, II и III, соответствующие настоящему изобретению, будут проявлять сходную фармакологическую активность.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Инкубирование соединения 6А с пулом микросом печени человека (n=10), к которым прибавлена уридин-5'-дифосфатглюкуроновая кислота (UDPGA), дает один глюкуронид соединения 6А (время удерживания ˜7 мин), согласующийся с соединением Примера 1 (фенольный глюкуронид). Однако инкубирование соединения 6А с пулом (n=4) и микросомами тощей кишки двух людей, к которым прибавлена UDPGA, дает два разных глюкуронида соединения 6А (времена удерживания ˜7 и ˜9 мин), согласующиеся с глюкуронидами соединения Примера 1 (фенольный) и соединения III (бензильный) соответственно. Анализ с помощью ЖХ/МС (жидкостная хроматография/масс-спектрометрия) показывает, что оба пика характеризуются значениями m/z=584.
2. Соединение 6А инкубируют с коммерчески доступными экспрессированными 9-рекомбинантной кДНК UDP-глюкуронозилтрансферазами человека (UDP - уридиндифосфат) (суперсомы UGT) в присутствии UDPGA (таблица 3). Суперсомы UGT1A1 и UGT1A3 дают только соединение Примера 1. Инкубирование с суперсомами UGT2B7 в основном дает соединение III с небольшим количеством соединения Примера 1.
3. Проведенный с помощью β-глюкуронидазы гидролиз смеси соединения Примера 1 и соединения III (бензильные глюкурониды соединения 6А), полученного из микросом тощей кишки (5, 10, 20, 30 и 180 мин, таблица 4), показывает, что соединение Примера 1 гидролизуется с большей скоростью, чем соединение III. После гидролиза в течение 18 ч оба пика сливаются, образуя один пик соединения 6А.
Получение в увеличенном объеме и идентификация структуры соединения III
Получение в увеличенном объеме и экстракция соединения III
Получение в увеличенном объеме соединения III проводят с использованием 1,23 мг (0,05 мМ) 14C-SCH 58235 и 60 мг белка экспрессированных кДНК рекомбинантных суперсом UGT2B7 человека с прибавлением UDPGA (2 мМ) в 60 мл буферного раствора Tris (трис(гидроксиметиламино)метан), рН 7,4. Инкубирование проводят в течение 2 ч при 37°С и смесь подвергают твердофазной экстракции (ТФЭ). Полученный при ТФЭ метанольный экстракт сушат и соединение III дополнительно очищают так, как это описано ниже.
Выделение соединения III для проведения анализа с помощью ЖХ/ЯМР
Соединение III выделяют с помощью препаративной ВЭЖХ (высокоэффективная жидкостная хроматография) с отбором фракций. Высушенный остаток полученного при ТФЭ метанольного экстракта размешивают примерно в 3 мл СН3ОН и центрифугируют (16000 g) для удаления твердого осадка. Метанол выпаривают и остаток повторно растворяют примерно в 2 мл смеси СН3ОН: ДМСО (диметилсульфоксид) (20:80, об.: об.). При использовании колонки для препаративной ВЭЖХ (Inertsil C8, 250×20 мм) времена удерживания найдены равными примерно 15,0 и 20,6 мин для соединения Примера 1 и соединения III соответственно. Соединение III выделяют путем инжектирования порций по 200 мкл (всего 10) в препаративную колонку с отбором фракций через 0,5 мин. При каждом инжектировании соединение III элюируется во фракциях от №37 (18,5 мин) до №44 (22,0 мин). Эти фракции, выходящие при времени элюирования, наблюдающемся для соединения III, анализируют с помощью ЖХ-МС/МС. Эти фракции (18,5-22 мин) объединяют и сушат.
Определение структуры соединения III с помощью ЖХ/ЯМР
ЖХ/ЯМР проводят с использованием подвижной фазы, состоящей из 20 мМ ацетата аммония-d3 (рН 7,0) и ацетонитрила. ВЭЖХ проводят в градиентном режиме с использованием 30% ацетонитрила в течение 10 мин, а затем при повышении концентрации до 40% в течение 20 мин. Метаболит элюируется примерно за 10 мин. ЖХ/ЯМР проводят в режиме остановленной струи в максимуме пика метаболита. Одномерные и двумерные протон-протонные корреляционные спектры снимают на спектрометре ЯМР Varian при 600 МГц и 20°С. Соответствующие данные ЯМР получают для синтетических стандартов соединения 6А и соединения Примера 1 (фенольный глюкуронид соединения 6А). На основании данных ЯМР для образца и сопоставления с данными для стандартов проводят отнесение пиков протонов для этого метаболита (MW 585). Показано, что структура этого метаболита соответствует структуре бензильного глюкуронида соединения 6А (соединение III).
Изобретение относится к новому замещенному остатком сахара соединению 2-азетидинона формулы III:
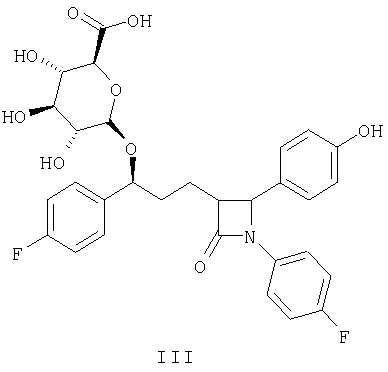
а также к способу снижения уровня холестерина путем введения указанного соединения к фармацевтической композиции, обладающей гипохолестеринемическим воздействием на основе этого соединения формулы III, содержащей комбинацию соединения формулы III и дополнительно ингибитора биосинтеза холестерина. Изобретение также относится к способу лечения и предупреждения атеросклероза или снижения уровня холестерина. Технический результат - получение новых соединений, обладающих гипохолестеринемической активностью. 5 н. и 5 з.п. ф-лы, 4 табл.
| WO 9716455 A, 09.05.1997 | |||
| WO 9616037 А, 30.05.1996 | |||
| US 5756470 A, 26.05.1998 | |||
| Способ получения -замещенных произ-ВОдНыХ блЕОМициНА | 1972 |
|
SU797584A3 |
Авторы
Даты
2007-04-20—Публикация
2001-12-17—Подача