Настоящее изобретение относится к новым производным имидазолидина формулы I,
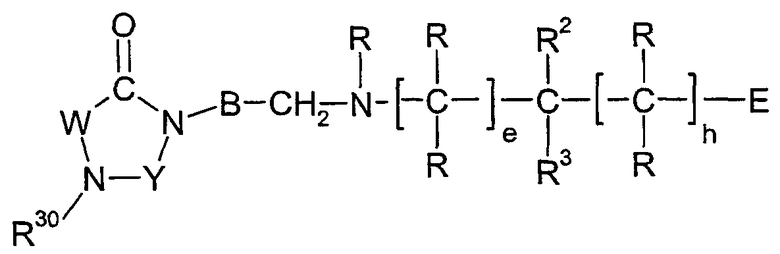 I
I
в которой B, E, W, Y, R, R2, R3, R30, e и h имеют значения, указанные ниже. Соединения формулы I представляют собой ценные фармацевтически активные соединения, которые пригодны, например, для лечения воспалительных заболеваний, например ревматоидного артрита, или аллергических заболеваний. Соединения формулы I представляют собой ингибиторы адгезии и миграции лейкоцитов и/или антагонисты рецептора адгезии VLA-4, относящегося к группе интегринов. Они в целом подходят для лечения заболеваний, которые вызваны или связаны с нежелательной степенью адгезии лейкоцитов и/или миграции лейкоцитов, или в которых играют роль взаимодействия между клетками или между клетками и матриксом, основанные на взаимодействиях рецепторов VLA-4 с их лигандами. Изобретение, кроме того, относится к способам получения соединений формулы I, к применению соединений и к фармацевтическим композициям, которые содержат соединения формулы I.
Интегрины представляют собой группу рецепторов адгезии, которые играют существенную роль в процессах межклеточного связывания и связывания между клетками и внеклеточным матриксом. Они обладают αβ-гетеродимерной структурой, имеют широкое клеточное распределение и проявляют высокую степень эволюционного консерватизма. Интегрины включают, например, рецептор фибриногена на тромбоцитах крови, причем данный рецептор взаимодействует, в частности, с последовательностью RGD фибриногена, и рецептор витронектина на остеокластах, причем данный рецептор взаимодействует, в частности, с последовательностью RGD витронектина или остеопонтином. Интегрины делятся на три основные группы, т.е. подсемейство β2, содержащее представители LFA-1, Mac-1 и p150/95, которые являются ответственными, в частности, за межклеточные взаимодействия в иммунной системе, и подсемейства β1 и β3, представители которых в принципе модулируют адгезию клеток к компонентам внеклеточного матрикса (Ruoslahti, Annu. Rev. Biochem. 1988, 57, 375). Интегрины, относящиеся к подсемейству β1, которые также называют белками VLA (антигена очень поздней (активации)), включают, по меньшей мере, 6 рецепторов, которые специфически взаимодействуют с фибронектином, коллагеном и/или ламинином в качестве лигандов. Внутри семейства VLA интегрин VLA-4 (α4β1) является пока атипичным, поскольку он, главным образом, ограничен лимфоидными и миелоидными клетками, и в данных клетках является ответственным за межклеточные взаимодействия с большим количеством других клеток. Например, VLA-4 опосредует взаимодействие Т-лимфоцитов и В-лимфоцитов со связывающим гепарин II фрагментом фибронектина (FN) плазмы человека. Связывание VLA-4 со связывающим гепарин II фрагментом фибронектина плазмы основано, в частности, на взаимодействии с последовательностью LDVP. В отличие от рецептора фибриногена или рецептора витронектина VLA-4 не является типичным интегрином, связывающим RGD (Kilger and Holzmann, J. Mol. Meth. 1995, 73, 347).
Обычно лейкоциты, которые циркулируют в крови, проявляют лишь низкую степень аффинности с сосудистыми эндотелиальными клетками, которые выстилают кровеносные сосуды. Цитокины, которые высвобождаются из воспаленной ткани, активируют эндотелиальные клетки и, таким образом, экспрессию большого числа антигенов клеточной поверхности. Данные антигены включают, например, молекулы адгезии ELAM-1 (молекула 1 адгезии эндотелиальных клеток, также именуемая Е селектином), которые связывают нейтрофилы, наряду с другими, ICAM-1 (молекула 1 межклеточной адгезии), которая взаимодействует с LFA-1 (антиген 1, связанный с функцией лейкоцитов) на лейкоцитах, и VCAM-1 (молекула 1 адгезии сосудистых клеток), которая связывает различные лейкоциты, наряду с другими, лимфоциты (Osborn et al., Cell 1989, 59, 1203). Как и ICAM-1, VCAM-1 является членом суперсемейства гена иммуноглобулина. VCAM-1 (сначала известная как INCAM-110) была идентифицирована как молекула адгезии, которая индуцирована на эндотелиальных клетках воспалительными цитокинами, такими как TNF и IL-1 и липополисахариды (LPS). Elices et al. (Cell 1990, 60, 577) продемонстрировали, что VLA-4 и VCAM-1 образуют пару рецептор-лиганд, которая опосредует адгезию лимфоцитов с активированным эндотелием. Связывание VCAM-1 с VLA-4 не происходит здесь посредством взаимодействия VLA-4 с последовательностью RGD, поскольку VCAM-1 не содержит такой последовательности (Bergelson et al., Current Biology 1995, 5, 615). Однако VLA-4 также появляется на других лейкоцитах, и прилипание лейкоцитов, отличных от лимфоцитов, также опосредуется через механизм адгезии VCAM-1/VLA-4. Таким образом, VLA-4 представляет единичный пример рецептора интегрина β1, который посредством лигандов VCAM-1 и фибронектина играет существенную роль и в межклеточных взаимодействиях, и во взаимодействиях между клетками и внеклеточным матриксом.
Молекулы адгезии, вызванной цитокином, играют важную роль в мобилизации лейкоцитов во внесосудистые области ткани. Лейкоциты мобилизуются в области воспалительной ткани молекулами клеточной адгезии, которые экспрессированы на поверхности эндотелиальных клеток и служат в качестве лигандов для белков или белковых комплексов (рецепторов) клеточной поверхности лейкоцитов (термины «лиганд» и «рецептор» можно также использовать взаимозаменяемо). Лейкоциты из крови должны, прежде всего, прилипнуть к эндотелиальным клеткам перед тем, как они будут способны мигрировать в синовиальную оболочку. Поскольку VCAM-1 связывается с клетками, которые несут интегрин VLA-4 (α4β1), такими как эозинофилы, Т-лимфоциты, В-лимфоциты, моноциты и нейтрофилы, она и механизм VCAM-1/VLA-4 ответственны за функцию мобилизации таких клеток из потока крови в инфицированные области и очаги воспаления (Elices et al., Cell 1990, 60, 577; Osborn, Cell 1990, 62, 3; Issekutz et al., J. Exp. Med. 1996, 183, 2175). Механизм адгезии VCAM-1/VLA-4 был связан с рядом физиологических и патологических процессов. В дополнение к индуцированному цитокином эндотелию VCAM-1 также экспрессируется, наряду с другими, следующими клетками: миобластами, лимфоидными дендритными клетками и тканевыми макрофагами, ревматоидной синовиальной оболочкой, нервными клетками, стимулированными цитокином, париетальными эпителиальными клетками капсулы Боумена, почечным канальцевым эпителием, воспаленной тканью в связи с отторжением трансплантата сердца и почек и интерстициальной тканью в связи с реакцией трансплантат против хозяина. Обнаружено также, что VCAM-1 экспрессирована в тех областях артериальной эндотелиальной ткани, которые соответствуют ранним атеросклеротическим бляшкам на модели у кроликов. Кроме того, VCAM-1 экспрессирована на фолликулярных дендритных клетках в лимфоузлах человека и присутствует на стромальных клетках костного мозга, например в ротовой полости. Последние из указанных обнаруженных данных свидетельствуют о том, что VCAM-1 несет функцию в развитии В клеток. Кроме присутствия на клетках гематопоэтического происхождения, VLA-4 также обнаруживают, например, на линиях клеток меланомы, и механизм адгезии VCAM-1/VLA-4 был связан с метастазами таких опухолей (Rice et al., Science 1989, 246, 1303).
Основная форма, в которой VCAM-1 встречается in vivo на эндотелиальных клетках и которая представляет собой доминантную форму in vivo, обозначена как VCAM-7D и несет 7 доменов иммуноглобулина. Аминокислотные последовательности доменов 4, 5 и 6 напоминают таковые доменов 1, 2 и 3. Четвертый домен удален альтернативным сплайсингом в другой форме, которая составлена из шести доменов и которая обозначена здесь как VCAM-6D. VCAM-6D способна также связывать клетки, экспрессирующие VLA-4.
Дополнительную информацию в отношении VLA-4, VCAM-1, интегринов и белков адгезии можно найти, например, в статьях Kilger and Holzmann, J. Mol. Meth. 1995, 73, 347; Elices, Cell Adhesion in Human Disease, Wiley, Chichester 1995, p. 79 и Kuijpers, Springer Semin. Immunopathol. 1995, 16, 379.
По причине роли механизма VCAM-1/VLA-4 в процессах клеточной адгезии, которые важны, например, при инфекциях, воспалениях и атеросклерозе, предпринимали попытки борьбы с указанными заболеваниями, в частности, например, воспалениями (Osborn et al., Cell 1989, 59, 1203), вмешательством в указанные адгезионные процессы. Одним из способов осуществления этого является применение моноклональных антител, которые направлены против VLA-4. Моноклональные антитела (Mabs) данного типа, которые, как антагонисты VLA-4, блокируют взаимодействие между VCAM-1 и VLA-4, известны. Так, антитела против VLA-4 HP2/1 и HP1/3, например, ингибируют адгезию клеток Ramos (клеток, подобных В клеткам), экспрессирующих VLA-4, к эндотелиальным клеткам пупочного канатика человека и к клеткам COS, трансфицированным VCAM-1. Таким же образом, антитело против VCAN-1 4В9 ингибирует адгезию клеток Ramos, клеток Jurkat (клеток, подобных Т-клеткам) и клеток HL60 (клеток, подобных гранулоцитам) к клеткам COS, которые были трансфицированы продуктами генной инженерии, которые вызывают экспрессию VCAM-6D и VCAM-7D. Данные in vitro, полученные с использованием антител, которые направлены против субъединицы α4 VLA-4, показывают, что адгезия лимфоцитов к синовиальным эндотелиальным клеткам, которая играет роль при ревматоидном артрите, блокируется (van Dinther-Janssen et al., J. Immunol. 1991, 147, 4207).
Эксперименты in vivo показали, что моноклональное антитело Mab против α4 может ингибировать экспериментальный аутоиммунный энцефаломиелит. Моноклональное антитело, направленное против цепи α4 VLA-4, аналогичным образом блокирует миграцию лейкоцитов в очаг воспаления. Способность антител оказывать эффект на механизм зависимой от VLA-4 адгезии также исследовали на модели астмы для изучения роли VLA-4 в мобилизации лейкоцитов в воспаленную легочную ткань (WO-A-93/13798). Введение антител против VLA-4 ингибировало реакцию поздней фазы и повышенную реакцию дыхательных путей у овец с аллергией. Значение VLA-4 в качестве мишени для лечения астмы подробно обсуждается в публикации Metzger, Springer Semin. Immunopathol. 1995, 16, 467.
Механизм зависимой от VLA-4 клеточной адгезии также исследовали на модели воспалительного заболевания кишечника (ВЗК) у приматов. На данной модели, которая соответствует язвенному колиту у людей, введение антитела против α4 привело к значительному уменьшению острого воспаления.
В дополнение к этому, было продемонстрировано, что зависимая от VLA-4 клеточная адгезия играет роль при следующих клинических состояниях, включая следующие хронические воспалительные процессы: ревматоидный артрит (Cronstein and Weismann, Arthritis Rheum. 1993, 36, 147; Elices et al., J. Clin. Invest. 1994, 93, 405), сахарный диабет (Yang et al., Proc. Natl. Acad. Sci. USA 1993, 90, 10494), системная красная волчанка (Takeuchi et al., J. Clin. Invest. 1993, 92, 3008), аллергии отсроченного типа (аллергия IV типа) (Elices et al., Clin. Exp. Rheumatol. 1993, 11, S77), рассеянный склероз (Yednock et al., Nature 1992, 356, 63), малярия (Oskenhouse et al., J. Exp. Med. 1992, 176, 1183), атеросклероз (O'Brien et al., J. Clin. Invest. 1993, 92, 945; Shih et al., Circ. Res. 1999, 84, 345), трансплантация (Isobe et al., Transplantation Proceedings 1994, 26, 867), различные злокачественные заболевания, например меланома (Renkonen et al., Am. J. Pathol. 1992, 140, 763), лимфома (Freedman et al., Blood 1992, 79, 206) и другие (Albelda et al., J. Cell Biol. 1991, 114, 1059).
Взаимодействие VLA-4 с VCAM-1 и фибронектином было связано с некоторыми патофизиологическими процессами при сердечно-сосудистых заболеваниях. В клеточной системе in vitro иммигрировавшие нейтрофилы ингибируют укорочение (отрицательную инотропию) кардиомиоцитов на 35%. Можно было ингибировать данный отрицательный инотропный эффект нейтрофилов антителом против α4, но не антителом против CD18 (Poon et al., Circ. Res. 1999, 84, 1245). Значение VLA-4 в патогенезе атеросклероза было продемонстрировано на мышиной модели атеросклероза. Так, пептид CS-1, который направлен против участка связывания VLA-4 на фибронектине, ингибирует мобилизацию лейкоцитов и накопление жира в аорте и, следовательно, образование атеросклеротических бляшек у мышей, получавших атерогенный рацион, с исключением рецепторов липопротеида низкой плотности (ЛНП) (Shih et al., Circ. Res. 1999, 84, 345). С использованием того же пептида CS-1 было, кроме того, возможно показать на модели гетеротопической трансплантации сердца у кроликов, что формирование васкулопатии трансплантата можно значительно уменьшить блокадой взаимодействия VLA-4 и фибронектина (Molossi et al., J. Clin. Invest. 1995, 95, 2601). В публикации WO-A-00/02903 описаны CS-1 пептидомиметики, которые содержат в молекуле единицу аспарагиновой кислоты или ее производное и которые ингибируют связывание VLA-4 с последовательностью CS-1 фибронектина белка матрикса.
Соответственно, блокада VLA-4 подходящими антагонистами предоставляет возможности достижения эффективного лечения, в частности, например, лечения различных воспалительных состояний, включая астму и ВЗК. Особая уместность антагонистов VLA-4 для лечения ревматоидного артрита следует, как уже было указано, из того обстоятельства, что лейкоциты из крови должны, прежде всего, прилипнуть к эндотелиальным клеткам перед тем, как они будут способны мигрировать в синовиальную оболочку, и из того обстоятельства, что рецептор VLA-4 играет роль при данной адгезии. Выше уже было упомянуто, что воспалительные агенты индуцируют VCAM-1 на эндотелиальных клетках (Osborn, Cell 1990, 62, 3; Stoolman, Cell 1989, 56, 907) и что различные лейкоциты мобилизуются в области инфекции и очаги воспаления. В связи с этим Т-клетки прилипают к активированному эндотелию главным образом посредством механизмов адгезии LFA-1/ICAM-1 и VLA-4/VCAM-1 (Springer, Cell 1994, 76, 301). При ревматоидном артрите способность VLA-4 связываться с VCAM-1 возрастает на большинстве синовиальных Т-клетках (Postigo et al., J. Clin. Invest. 1992, 89, 1445). Кроме того, наблюдалась возросшая адгезия синовиальных Т-клеток к фибронектину (Laffon et al., J. Clin. Invest. 1991, 88, 546; Morales-Ducret et al., J. Immunol. 1992, 149, 1424). Таким образом, происходит стимулирующая регуляция VLA-4 и в отношении его экспрессии, и в отношении его функции на Т-лимфоцитах ревматоидной синовиальной оболочки. Блокированием связывания VLA-4 с его физиологическими лигандами, VCAM-1 и фибронектином можно эффективно предотвратить или облегчить суставные воспалительные процессы. Это также подтверждается экспериментами с использованием антитела HP2/1, которые были проведены на крысах Lewis, страдающих адъювантным артритом и у которых наблюдали эффективное предотвращение заболевания (Barbadillo et al., Springer Semin. Immunopathol. 1995, 16, 427). Таким образом, VLA-4 представляет собой важную терапевтическую молекулу-мишень.
Упомянутые выше антитела против VLA-4 и применение антител в качестве антагонистов VLA-4 описаны в патентных заявках WO-A-93/13798, WO-A-93/15764, WO-A-94/16094, WO-A-94/17828 и WO-A-95/19790. В патентных заявках WO-A-94/15958, WO-A-95/15973, WO-A-96/00581, WO-A-96/06108 и WO-A-96/20216 описаны пептидные соединения, которые представляют собой антагонисты VLA-4. Однако применение антител и пептидных соединений в качестве фармацевтических препаратов имеет недостатки, например отсутствие доступности при пероральном применении, способность быстро распадаться или иммуногенное действие при длительном введении, и поэтому существует необходимость в антагонистах VLA-4, обладающих благоприятным профилем свойств для применения при лечении и профилактике различных болезненных состояний.
В публикациях WO-A-95/14008, WO-A-93/18057, US-A-5658935, US-A-5686421, US-A-5389614, US-A-5397796, US-A-5424293 и US-A-5554594 описаны замещенные 5-членные гетероциклы, которые обладают амино, амидино или гуанидино функцией на N-конце молекулы и которые проявляют эффекты, ингибирующие агрегацию тромбоцитов. В публикации ЕР-А-796855 описаны другие гетероциклы, которые представляют собой ингибиторы резорбции кости. В публикациях ЕР-А-842943, ЕР-А-842945 и ЕР-А-842944 описано, что соединения данного ряда и другие соединения, к удивлению, также ингибируют адгезию лейкоцитов и являются антагонистами VLA-4.
В публикациях ЕР-А-903353, ЕР-А-905139, ЕР-А-918059, WO-99/23063, WO-A-99/24398, WO-A-99/54321, WO-A-99/60015 и WO-A-00/69831 описаны другие соединения, которые ингибируют адгезию лейкоцитов и являются антагонистами VLA-4. Дальнейшие исследования показали, что соединения настоящего изобретения, к удивлению, также являются сильными ингибиторами адгезии лейкоцитов и антагонистами VLA-4.
Настоящее изобретение относится к соединениям формулы I,
 I
I
в которой W представляет двухвалентный остаток из ряда R1-A-C(R13), R1-A-C(R13)=C,

в которых кольцевые системы
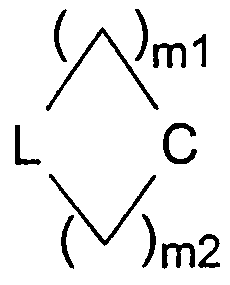
могут содержать один или два одинаковых или различных кольцевых гетероатома из ряда азота, кислорода и серы, могут быть насыщенными или мононенасыщенными или полиненасыщенными и могут быть замещены 1, 2 или 3 одинаковыми или различными заместителями R13 и/или одним или двумя оксозаместителями и/или тиоксозаместителями, и в которых L представляет C(R13) или N, и в которых m1 и m2 равны, независимо друг от друга, одному из чисел 0, 1, 2, 3, 4, 5 и 6, но сумма m1 + m2 равна одному из чисел 1, 2, 3, 4, 5 или 6;
Y представляет карбонильную группу, тиокарбонильную группу или метиленовую группу;
А представляет прямую связь, один из двухвалентных остатков (C1-C6)-алкилена, (C3-C7)-циклоалкилена, фенилена, фенилен-(C1-C6)-алкила и фенилен-(C2-C6)-алкенила, или представляет двухвалентный остаток 5-членного или 6-членного, насыщенного или ненасыщенного гетероцикла, который может содержать один или два кольцевых атома азота и может быть монозамещен или дизамещен одинаковыми или различными заместителями из ряда (C1-C6)-алкила, оксо и тиоксо, где в остатках фениленалкила и фениленалкенила остаток R1 связан с фениленовой группой;
В представляет двухвалентный остаток из ряда (C1-C6)-алкилена, (C2-C6)-алкенилена, фенилена, фенилен-(C1-C3)-алкила, (C1-C3)-алкиленфенила и (C1-C3)-алкиленфенил-(C1-C3)-алкила, где (C1-C6)-алкиленовый остаток и (C2-C6)-алкениленовый остаток являются незамещенными или замещены одним или более одинаковыми или различными остатками из ряда (C1-C8)-алкила, (C2-C8)-алкенила, (C2-C8)-алкинила, (C3-C10)-циклоалкила, (C3-C10)-циклоалкил-(C1-C6)-алкила, необязательно замещенного (C6-C14)-арила, (C6-C14)-арил-(C1-C6)-алкила, который необязательно замещен в арильном остатке, необязательно замещенного гетероарила и гетероарил-(C1-C6)-алкила, который необязательно замещен в гетероарильном остатке;
Е представляет тетразолил, (R8O)2P(O), R10OS(O)2, R9NHS(O)2, R6CO, R7CO, R10CO, HCO, R8O-CH2, R8CO-O-CH2, R8aO-CO-O-CH2 или (R8O)2P(O)-O-CH2;
R представляет водород, (C1-C8)-алкил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил или гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке, где все остатки R независимы друг от друга и остатки R могут быть одинаковыми или различными;
R1 представляет водород, (C1-C10)-алкил, который может быть необязательно монозамещен или полизамещен фтором, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, R21-((C6-C14)-арил), который необязательно замещен в арильном остатке, (R21-((C6-C14)-арил))-(C1-C8)-алкил, который необязательно замещен в арильном остатке, остаток Het или остаток Het-(C1-C8)-алкила, или представляет один из остатков X-NH-C(=NH)-R20-, X1-NH-R20-, R21O-R20-, R21N(R21)-R20-, R21C(O)-, R21O-C(O)-, R22N(R21)-C(O)-, R22C(O)-N(R21)-, R21O-N=, оксо и тиоксо;
Х представляет водород, (C1-C6)-алкил, (C1-C6)-алкилкарбонил, (C1-C6)-алкоксикарбонил, (C1-C10)-алкилкарбонилокси-(C1-C6)-алкоксикарбонил, необязательно замещенный (C6-C14)-арилкарбонил, необязательно замещенный (C6-C14)-арилоксикарбонил, (C6-C14)-арил-(C1-C6)-алкоксикарбонил, который может быть также замещен в арильном остатке, циано, гидроксил, (C1-C6)-алкокси, (C6-C14)-арил-(C1-C6)-алкокси, необязательно замещенный в арильном остатке, или амино;
Х1 имеет одно из значений Х или представляет R'-NH-C(=N-R"), в котором R' и R", независимо друг от друга, имеют одно из значений Х;
R2 представляет водород, (C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, или (C3-C8)-циклоалкил;
R3 представляет водород, (C1-C10)-алкил, который может быть необязательно монозамещен или полизамещен фтором, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке, (C3-C8)-циклоалкил, (C3-C8)-циклоалкил-(C1-C8)-алкил, (C6-C12)-бициклоалкил, (C6-C12)-бициклоалкил-(C1-C8)-алкил, (C6-C12)-трициклоалкил, (C6-C12)-трициклоалкил-(C1-C8)-алкил, (C2-C8)-алкенил, (C2-C8)-алкинил, R11NH, CON(CH3)R4, CONHR4, COOR21, COOR15, CON(CH3)R15 или CONHR15;
R4 представляет водород или (C1-C10)-алкил, который является незамещенным или монозамещен или полизамещен одинаковыми или различными остатками из ряда гидроксила, (C1-C8)-алкокси, R5, необязательно замещенного (C3-C8)-циклоалкила, гидроксикарбонила, аминокарбонила, моно- или ди-((C1-C10)-алкил)аминокарбонила, (C6-C14)-арил-(C1-C8)-алкоксикарбонила, необязательно замещенного в арильном остатке, (C1-C8)-алкоксикарбонила, R6-CO, R7-CO, тетразолила и трифторметила;
R5 представляет необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, или остаток необязательно замещенного моноциклического или бициклического, 5-членного-12-членного гетероциклического кольца, которое может быть ароматическим, частично насыщенным или полностью насыщенным и которое может содержать 1, 2 или 3 одинаковых или различных кольцевых гетероатомов из ряда азота, кислорода и серы;
R6 представляет остаток природной или неприродной аминокислоты, остаток иминокислоты, остаток необязательно N-(C1-C8)-алкилированной или N-((C6-C14)-арил-(C1-C8)-алкилированной) азааминокислоты, где арильный остаток может быть необязательно замещен, или представляет остаток дипептида, трипептида или тетрапептида, или их сложный эфир или амид, где функциональные группы могут быть защищены защитными группами и где атомы азота в амидных группах группы R6-CO могут нести остаток R в качестве заместителя;
R7 представляет остаток 5-членного-10-членного, насыщенного моноциклического или полициклического гетероцикла, который связан через кольцевой атом азота, который может содержать один, два, три или четыре одинаковых или различных дополнительных кольцевых гетероатомов из ряда кислорода, азота и серы и который может быть необязательно замещен у атомов углерода и у дополнительных кольцевых атомов азота, где дополнительные кольцевые атомы азота могут нести, в качестве заместителей, одинаковые или различные остатки из ряда водорода, Rh, HCO, RhCO, RhO-CO, HO-CO-(C1-C4)-алкила и RhO-CO-(C1-C4)-алкила, и Rh представляет (C1-C8)-алкил, (C3-C8)-циклоалкил, (C3-C8)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил или (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке;
R8 представляет водород, (C1-C10)-алкил, необязательно замещенный (C6-C14)-арил или (C6-C14)-арил-(C1-C8)-алкил, необязательно замещенный в арильном остатке, где остатки R8 независимы друг от друга и могут быть одинаковыми или различными;
R8a имеет, независимо от R8, одно из значений R8, за исключением водорода;
R9 представляет водород, аминокарбонил, (C1-C10)-алкиламинокарбонил, (C3-C8)-циклоалкиламинокарбонил, необязательно замещенный (C6-C14)-ариламинокарбонил, (C1-C10)-алкил, необязательно замещенный (C6-C14)-арил или (C3-C8)-циклоалкил;
R10 представляет гидроксил, (C1-C10)-алкокси, (C6-C14)-арил-(C1-C8)-алкокси, необязательно замещенный в арильном остатке, необязательно замещенный (C6-C14)-арилокси, (C1-C8)-алкилкарбонилокси-(C1-C6)-алкокси, (C6-C14)-арилкарбонилокси-(C1-C6)-алкокси, который необязательно замещен в арильном остатке, (C6-C14)-арил-(C1-C6)-алкилкарбонилокси-(C1-C6)-алкокси, который необязательно замещен в арильном остатке, (C1-C8)-алкоксикарбонилокси-(C1-C6)-алкокси, (C6-C14)-арилоксикарбонилокси-(C1-C6)-алкокси, который необязательно замещен в арильном остатке, (C6-C14)-арил-(C1-C6)-алкоксикарбонилокси-(C1-C6)-алкокси, который необязательно замещен в арильном остатке, амино, моно- или ди-((C1-C10)-алкил)амино или R8R8N-CO-(C1-C6)-алкокси, в котором остатки R8 независимы друг от друга и могут быть одинаковыми или различными;
R11 представляет водород, R12a, R12a-CO, H-CO, R12a-O-CO, R12b-CO, R12b-CS, R12a-S(O)2 или R12b-S(O)2;
R12а представляет (C1-C10)-алкил, (C2-C8)-алкенил, (C2-C8)-алкинил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке, или остаток R15;
R12b представляет амино, ди-((C1-C10)-алкил)амино или R12а-NH;
R13 представляет водород, (C1-C6)-алкил, который может быть необязательно монозамещен или полизамещен фтором, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C6)-алкил, который необязательно замещен в арильном остатке, (C3-C8)-циклоалкил или (C3-C8)-циклоалкил-(C1-C6)-алкил;
R15 представляет R16-(C1-C6)-алкил или представляет R16;
R16 представляет 6-членный-24-членный бициклический или трициклический остаток, который является насыщенным или частично ненасыщенным и который может также содержать один, два, три или четыре одинаковых или различных кольцевых гетероатомов из ряда азота, кислорода и серы и который может также быть замещен одним или более одинаковыми или различными заместителями из ряда (C1-C4)-алкила и оксо;
R20 представляет прямую связь или двухвалентный остаток (C1-C6)-алкилена;
R21 представляет водород, (C1-C8)-алкил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, остаток Het или остаток Het-(C1-C8)-алкила, в котором алкильные остатки могут быть монозамещены или полизамещены фтором, и, когда остатки R21 встречаются более одного раза, они независимы друг от друга и могут быть одинаковыми или различными;
R22 представляет R21-, R21-O-, R21-N(R21)-, R21C(O)-, R21O-C(O)-, R21N(R21)-C(O)-, R21N(R21)-C(=N(R21))- или R21C(O)-N(R21)-;
R30 представляет один из остатков R32(R)N-CO-N(R)-R31, R32(R)N-CS-N(R)-R31, R32(R)N-S(O)n-N(R)-R31, R32-CO-N(R)-R31, R32-CS-N(R)-R31, R32-S(O)n-N(R)-R31, R32(R)N-CO-R31, R32(R)N-CS-R31, R32(R)N-S(O)n-R31, R32-CO-R31, R32-CS-R31, R32-S(O)n-R31 или R12а-O-CO-N(R)-R31;
R31 представляет двухвалентный остаток -R33-R34-R35-R36-, где R36 связан с атомом азота в кольце имидазолидина в формуле I;
R32 представляет водород, (C1-C8)-алкил, который может быть необязательно замещен 1-8 атомами фтора, (C2-C8)-алкенил, (C2-C8)-алкинил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, (C6-C12)-бициклоалкил, (C6-C12)-бициклоалкил-(C1-C8)-алкил, (C6-C12)-трициклоалкил, (C6-C12)-трициклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил или гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке;
R33 представляет прямую связь или двухвалентный остаток (C1-C6)-алкилена;
R34 представляет двухвалентный остаток из ряда (C1-C8)-алкилена, (C3-C12)-циклоалкилена, (C6-C12)-бициклоалкилена, (C6-C12)-трициклоалкилена, необязательно замещенного (C6-C14)-арилена и необязательно замещенного гетероарилена;
R35 представляет прямую связь или двухвалентный остаток (C1-C8)-алкилена;
R36 представляет прямую связь, группу -СО- или группу -S(O)n-;
Het представляет остаток моноциклического или полициклического, 4-членного-14-членного, ароматического или неароматического кольца, которое содержит 1, 2, 3 или 4 одинаковых или различных кольцевых гетероатомов из ряда азота, кислорода и серы и может быть необязательно замещено одним или более одинаковыми или различными заместителями;
e и h, независимо друг от друга, равны 0 или 1;
n равно 1 или 2, где, когда они встречаются более одного раза, числа n независимы друг от друга и могут быть одинаковыми или различными;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимые соли.
Когда остатки или заместители могут встречаться более чем один раз в соединениях формулы I, они все могут, обычным образом, независимо друг от друга иметь данные значения и быть одинаковыми или различными. Если остатки составлены из двух или более компонентов, таких как, например, арилалкил, свободная связь, посредством которой остаток связан, расположена на компоненте, который определен в правом конце названия, то есть в случае арилалкильного остатка, свободная связь находится на алкильной группе, к которой арильная группа затем присоединяется в качестве заместителя.
Алкильные остатки могут быть с прямой цепью или разветвленными. Это также относится к случаям, когда они несут заместители или встречаются в виде заместителей других остатков, например, в алкоксиостатках, алкоксикарбонильных остатках или арилалкильных остатках. Примерами подходящих алкильных остатков являются метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, н-ундецил, н-тридецил, н-тетрадецил, н-пентадецил, н-гексадецил, н-гептадецил, н-октадецил, изопропил, изобутил, изопентил, изогексил, 3-метилпентил, неопентил, неогексил, 2,3,5-триметилгексил, втор-бутил, трет-бутил и трет-пентил. Предпочтительными алкильными остатками являются метил, этил, н-пропил, изопропил (=1-метилэтил), н-бутил, изобутил (=2-метилпропил), втор-бутил, трет-бутил (=1,1-диметилэтил), н-пентил, изопентил, н-гексил и изогексил. Если алкильные остатки замещены атомами фтора, то они при отсутствии других указаний могут содержать, например, 1, 2, 3, 4, 5, 6 или 7 атомов фтора. Например, метильная группа в замещенном фтором алкильном остатке может присутствовать в виде трифторметильной группы. Примерами замещенных фтором алкильных остатков являются трифторметил, 2-фторфенил, 2,2,2-трифторэтил и гептафторизопропил.
Алкиленовые производные (=алкандиильные производные), которые представляют собой двухвалентные остатки, полученные из алкана, могут аналогичным образом быть с прямой цепью или разветвленными. Они могут быть связаны через любое требуемое положение. Примерами алкиленовых производных являются двухвалентные остатки, которые соответствуют указанным выше одновалентным остаткам, например метилен, этилен (=1,2-этилен или 1,1-этилен), триметилен (=1,3-пропилен), тетраметилен (=1,4-бутилен), пентаметилен, гексаметилен или метилен или этилен, который замещен алкильными остатками. Примерами замещенного метилена являются метиленовые группы, которые несут метильную группу, этильную группу, группу н-пропила, изопропила, н-бутила, изобутила, трет-бутила, н-пентила, изопентила, н-гексила или две метильные группы в качестве заместителей. Замещенный этилен может быть замещен на одном или другом атоме углерода или на обоих атомах углерода.
Алкенильные остатки и алкениленовые остатки (=алкендиильные остатки) и алкинильные остатки могут также быть с прямой цепью или разветвленными. Примерами алкенильных остатков являются винил, 1-пропенил, аллил, бутенил, 2-метил-1-пропенил, 2-метил-2-пропенил и 3-метил-2-бутенил. Примерами алкениленовых остатков являются винилен, пропенилен и бутенилен. Примерами алкинильных остатков являются этинил, 1-пропинил и пропаргил.
Примерами циклоалкильных остатков являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил, которые могут также быть замещены, например, одним или более, например одним, двумя, тремя или четырьмя, одинаковыми или различными (C1-C4)-алкильными остатками. Примерами замещенных циклоалкильных остатков являются 4-метилциклогексил и 2,3-диметилциклопентил. Данные объяснения в отношении одновалентных циклоалкильных остатков относятся, соответствующим образом, к циклоалкиленовым остаткам (=циклоалкандиильным остаткам), то есть двухвалентным остаткам, которые получают из циклоалканов. Циклоалкиленовые остатки могут быть связаны через любые требуемые положения.
Бициклоалкильные остатки и трициклоалкильные остатки и 6-членные-24-членные бициклические и трициклические остатки, которые представляют R16, формально получают удалением атома водорода из бициклов и трициклов, соответственно. Лежащие в основе бициклы и трициклы могут содержать только атомы углерода в качестве членов кольца, то есть они могут представлять бициклоалканы или трициклоалканы, или они могут, в случае остатков, которые представляют R16, также содержать от одного до четырех одинаковых или различных кольцевых гетероатомов из ряда азота, кислорода и серы, то есть они могут представлять аза-, окса- и тиабициклоалканы и -трициклоалканы. Когда кольцевые гетероатомы присутствуют, предпочтительно присутствует один или два кольцевых гетероатома, в частности атома азота или атома кислорода. Кольцевые гетероатомы могут занимать любые желательные положения в бициклической или трициклической системе; они могут присутствовать в мостиках остатка или, в случае атомов азота, также в головных частях мостиков. И бициклоалканы, и трициклоалканы, а также их гетероаналоги могут быть полностью насыщенными или содержать одну или более двойных связей. Предпочтительно, они являются полностью насыщенными или содержат одну или две двойные связи; особенно предпочтительно, они являются полностью насыщенными. И бициклоалканы, и трициклоалканы, а также гетероаналоги, и насыщенные, и ненасыщенные представители могут быть незамещенными, или они могут быть замещены в любом желательном и подходящем положениях одной или более оксогруппами и/или одной или более, например одной, двумя, тремя или четырьмя, одинаковыми или различными (C1-C4)-алкильными группами, например метильными группами и/или изопропильными группами, предпочтительно метильными группами. Свободная связь бициклического или трициклического остатка может быть расположена в любом произвольном положении в молекуле; остаток может, следовательно, быть связан через атом головной части мостика или атом в мостике остатка. Свободная связь может быть расположена в любом стереохимическом положении, например в экзоположении или эндоположении.Примерами родительских бициклических кольцевых систем, из которых может быть получен бициклический остаток, являются норборнан (=бицикло[2.2.1]гептан), бицикло[2.2.2]октан и бицикло[3.2.1]октан; примерами ненасыщенных систем, или замещенных систем, или систем, которые содержат гетероатомы, являются 7-азабицикло[2.2.1]гептан, бицикло[2.2.2]окт-5-ен и камфора (=1,7,7-триметил-2-оксобицикло[2.2.1]гептан).
Примерами трициклических кольцевых систем, из которых может быть получен трициклический остаток, являются
твистан (=трицикло[4.4.0.03,8]декан),
адамантан (=трицикло[3.3.1.13,7]декан),
норадамантан (=трицикло[3.3.1.03,7]нонан),
трицикло[2.2.1.02,6]гептан, трицикло[5.3.2.04,9]додекан,
трицикло[5.4.0.02,9]ундекан и трицикло[5.5.1.03,11]тридекан.
Бициклические или трициклические остатки, предпочтительно, получают, соответственно, из мостиковых бициклов и трициклов, то есть из систем, в которых кольца обладают двумя или более чем двумя общими атомами. При отсутствии других указаний предпочтение, кроме того, отдают бициклическим или трициклическим остаткам, имеющим от 6 до 18 членов кольца, причем особое предпочтение отдают остаткам, имеющим от 6 до 14 членов кольца, а очень предпочтительными являются остатки, имеющие от 7 до 12 членов кольца. Особенно предпочтительными бициклическими или трициклическими остатками, которые могут, например, представлять бициклоалкильную группу или трициклоалкильную группу, являются 2-норборнильный остаток, как остаток, имеющий свободную связь в экзоположении, и остаток, имеющий свободную связь в эндоположении, остаток 2-бицикло[3.2.1]октила, остаток адамантила, остаток как 1-адамантила, так и 2-адамантила, гомоадамантила и норадамантила, например 3-норадамантила. Кроме того, предпочтительными являются остатки 1-адамантила и 2-адамантила.
Приведенные выше разъяснения в отношении одновалентных бициклоалкильных остатков и трициклоалкильных остатков относятся, соответствующим образом, к бициклоалкиленовым остаткам и трициклоалкиленовым остаткам (=бициклоалкандиильным остаткам и трициклоалкандиильным остаткам).
Примерами (C6-C14)-арильных групп являются фенил, нафтил, включая 1-нафтил и 2-нафтил, бифенилил, включая 2-бифенилил, 3-бифенилил и 4-бифенилил, антрил и флуоренил; примерами (C6-C10)-арильных групп являются 1-нафтил, 2-нафтил и фенил. Остатки бифенилила, нафтила и, в частности, фенильные остатки являются предпочтительными арильными остатками. Арильные остатки, в частности фенильные остатки, могут быть незамещенными или замещены один или более раз, например один, два, три или четыре раза, одинаковыми или различными остатками. Замещенные арильные остатки, в частности фенильные остатки, предпочтительно замещены заместителями из ряда (C1-C8)-алкила, в частности (C1-C4)-алкила, такого как метил; (C1-C8)-алкокси, в частности (C1-C4)-алкокси, такого как метокси; (C1-C8)-алкокси, в частности (C1-C4)-алкокси, который замещен одним или более атомами фтора, например 1, 2, 3, 4 или 5 атомами фтора, таким как трифторметокси; галогена; нитро; амино; трифторметила; гидроксила; гидрокси-(C1-C4)-алкила, такого как гидроксиметил или 1-гидроксиэтил или 2-гидроксиэтил; метилендиокси; диметилметилендиокси; этилендиокси; формила; ацетила; циано; гидроксикарбонила; аминокарбонила; (C1-C4)-алкоксикарбонила; фенила; фенокси; бензила; бензилокси и тетразолила.
В монозамещенных фенильных остатках заместитель может быть расположен в положении 2, положении 3 или положении 4. Фенил, который замещен дважды, может содержать заместители в положении 2,3, положении 2,4, положении 2,5, положении 2,6, положении 3,4 или положении 3,5. В фенильных остатках, которые замещены три раза, заместители могут быть расположены в положении 2,3,4, положении 2,3,5, положении 2,4,5, положении 2,4,6, положении 2,3,6 или положении 3,4,5.
Примерами замещенных фенильных остатков являются 2-метилфенил. 3-метилфенил, 4-метилфенил, 2,3-диметилфенил, 2,4-диметилфенил, 2,5-диметилфенил, 2,6-диметилфенил, 3,4-диметилфенил, 3,5-диметилфенил, 2,4,5-триметилфенил, 2,4,6-триметилфенил, 3,4,5-триметилфенил, 2-(н-бутил)фенил, 3-(н-бутил)фенил, 4-(н-бутил)фенил, 2-изобутилфенил, 3-изобутилфенил, 4-изобутилфенил, 3-трет-бутилфенил, 4-трет-бутилфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2,3-диметоксифенил, 2,4-диметоксифенил, 2,5-диметоксифенил, 2,6-диметоксифенил, 3,4-диметоксифенил, 3,5-диметоксифенил, 2,4,5-триметоксифенил, 2,4,6-триметоксифенил, 3,4,5-триметоксифенил, 2-(н-бутокси)фенил, 3-(н-бутокси)фенил, 4-(н-бутокси)фенил, 2-изобутоксифенил, 3-изобутоксифенил, 4-изобутоксифенил, 2-трет-бутоксифенил, 3-трет-бутоксифенил, 4-трет-бутоксифенил, 2,3-метилендиоксифенил, 3,4-метилендиоксифенил, 2,3-этилендиоксифенил, 3,4-этилендиоксифенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 2,3-дифторфенил, 2,4-дифторфенил, 2,5-дифторфенил, 2,6-дифторфенил, 3,4-дифторфенил, 3,5-дифторфенил, 2,4,5-трифторфенил, 2,4,6-трифторфенил, 3,4,5-трифторфенил, 2,3,5,6-тетрафторфенил, 2,3,4,5,6-пентафторфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2,3-дихлорфенил, 2,4-дихлорфенил, 2,5-дихлорфенил, 2,6-дихлорфенил, 3,4-дихлорфенил, 3,5-дихлорфенил, 2-бромфенил, 3-бромфенил, 4-бромфенил, 3-йодфенил, 4-йодфенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 3,4-бис(трифторметил)фенил, 3,5-бис(трифторметил)фенил, 2-трифторметоксифенил, 3-трифторметоксифенил, 4-трифторметоксифенил и т.д. Однако в замещенных фенильных остатках именно столь различные заместители в любой желательной и подходящей комбинации могут присутствовать так, как, например, в остатках 3-метокси-4-метилфенил, 4-фтор-3-метоксифенил, 3-фтор-4-метоксифенил, 3,5-дифтор-4-метоксифенил, 3-фтор-4,5-метилендиоксифенил, 3-фтор-4,5-этилендиоксифенил, 2-хлор-3-метилфенил, 3-хлор-4-метилфенил, 3-хлор-4-фторфенил и т.д.
Приведенные выше объяснения относятся соответствующим образом к замещенным арильным остаткам в группах, таких как, например, арилалкил, арилкарбонил и т.д. Примерами арилалкильных остатков являются 1- и 2-нафтилметил, 2-, 3- и 4-бифенилметил и 9-флуоренилметил и, в частности, бензил, все из которых могут также быть замещенными. Примерами замещенных арилалкильных остатков являются бензильные остатки и нафтилметильные остатки, которые замещены в арильной части одним или более (C1-C8)-алкильными остатками, в частности (C1-C4)-алкильными остатками, например 2-, 3- и 4-метилбензил, 4-изобутилбензил, 4-трет-бутилбензил, 4-октилбензил, 3,5-диметилбензил, пентаметилбензил, 2-, 3-, 4-, 5-, 6-, 7- и 8-метилнафт-1-илметил, 1-, 3-, 4-, 5-, 6-, 7- и 8-метилнафт-2-илметил; бензильные остатки и нафтилметильные остатки, которые замещены в арильной части одним или более (C1-C8)-алкоксиостатками, в частности (C1-C4)-алкоксиостатками, например 4-метоксибензил, 4-неопентилоксибензил, 3,5-диметоксибензил, 2,3,4-триметоксибензил; 3,4-метилендиоксибензил; трифторметоксибензильные остатки; нитробензильные остатки, например 2-, 3- и 4-нитробензил; галогенбензильные остатки, например 2-, 3- и 4-хлор- и 2-, 3- и 4-фторбензил, 3,4-дихлорбензил и пентафторбензил; трифторметилбензильные остатки, например 3- и 4-трифторметилбензил и 3,5-бистрифторметилбензил. Однако замещенные арилакильные остатки могут также содержать заместители, которые отличны друг от друга. В целом, предпочтение отдают соединениям формулы I, которые не содержат более чем две нитрогруппы в молекуле.
Приведенные выше объяснения в отношении одновалентных арильных остатков относятся, соответствующим образом, к двухвалентным ариленовым остаткам, то есть двухвалентным остаткам, которые получены из ароматических соединений. Ариленовые остатки могут быть связаны через любые желательные положения. Примерами ариленовых остатков являются фениленовые остатки, которые включают 1,4-фенилен, 1,3-фенилен и 1,2-фенилен.
Фениленалкил представляет собой, например, фениленметил (-С6Н4-СН2-) или фениленэтил (например, -С6Н4-СН2-СН2-). Алкиленфенил представляет собой, например, метиленфенил (-СН2-С6Н4-). Фениленалкенил представляет собой, например, фениленэтенил или фениленпропенил.
Гетероарил представляет собой остаток моноциклической или полициклической ароматической системы, которая имеет от 5 до 14 членов кольца и которая содержит 1, 2, 3, 4 или 5 гетероатомов в качестве членов кольца. Примерами кольцевых гетероатомов являются азот, кислород и сера. Когда присутствуют несколько гетероатомов, они могут быть одинаковыми или различными. Гетероарильые остатки могут быть незамещенными или монозамещены или полизамещены, например замещены один, два или три раза одинаковыми или различными заместителями из ряда (C1-C8)-алкила, в частности (C1-C4)-алкила; (C1-C8)-алкокси, в частности (C1-C4)-алкокси; (C1-C8)-алкокси, в частности (C1-C4)-алкокси, который замещен одним или более, например 1, 2, 3, 4 или 5, атомами фтора; галогена; нитро; амино; трифторметила; гидроксила; гидрокси-(C1-C4)-алкила, такого как гидроксиметил или 1-гидроксиэтил или 2-гидроксиэтил; метилендиокси; диметилметилендиокси; этилендиокси; формила; ацетила; циано; гидроксикарбонила; аминокарбонила; (C1-C4)-алкоксикарбонила; фенила; фенокси; бензила; бензилокси и тетразолила. Гетероарил предпочтительно представляет моноциклический или бициклический ароматический остаток, который содержит 1, 2, 3 или 4, в частности 1, 2 или 3, одинаковых или различных кольцевых гетероатомов из ряда азота, кислорода и серы и который может быть замещен 1, 2, 3 или 4, в частности 1, 2 или 3, одинаковыми или различными заместителями из ряда (C1-C6)-алкила, (C1-C6)-алкокси, фтора, хлора, нитро, амино, трифторметила, гидроксила, гидрокси-(C1-C4)-алкила, (C1-C4)-алкоксикарбонила, фенила, фенокси, бензилокси и бензила. Особенно предпочтительно гетероарил представляет собой моноциклический или бициклический ароматический остаток, имеющий от 5 до 10 членов кольца, и, в частности, представляет 5-членный-6-членный моноциклический ароматический остаток, который содержит 1, 2 или 3, в частности 1 или 2, одинаковых или различных кольцевых гетероатомов из ряда азота, кислорода и серы и который может быть замещен 1 или 2 одинаковыми или различными заместителями из ряда (C1-C4)-алкила, (C1-C4)-алкокси, фенила, фенокси, бензилокси и бензила.
Гетероциклы, которые представляют моноциклические или бициклические 5-членные-12-членные гетероциклические кольца, могут быть ароматическими или частично насыщенными или полностью насыщенными. Они могут быть незамещенными или замещены у одного или более атомов углерода или у одного или более атомов азота, одинаковыми или различными заместителями, как определено для остатка гетероарила. В частности, гетероциклическое кольцо может быть монозамещено или полизамещено, например, замещено один, два, три или четыре раза у атомов углерода одинаковыми или различными остатками из ряда (C1-C8)-алкила, например (C1-C4)-алкила, (C1-C8)-алкокси, например (C1-C4)-алкокси, такого как метокси, фенил-(C1-C4)-алкокси, например бензилокси, гидроксила, оксо, галогена, нитро, амино и трифторметила, и/или кольцевые атомы азота в гетероциклических кольцах, а также в гетероарильных остатках могут быть замещены (C1-C8)-алкилом, например (C1-C4)-алкилом, таким как метил или этил, или необязательно замещены фенилом или фенил-(C1-C4)-алкилом, таким как, например, бензил.
С одной стороны, группа Het охватывает ароматические гетероциклы и, следовательно, также группы, представляющие собой гетероарил, до тех пор, пока указанные группы входят в определение Het в отношении числа членов кольца и гетероатомов. С другой стороны, Het дополнительно также охватывает неароматические гетероциклы, которые являются полностью насыщенными или которые содержат одну или более двойных связей в кольцевой системе. Het может быть замещен у атомов азота и/или атомов углерода одним или более, например 1, 2, 3 или 4, одинаковыми или различными заместителями, например (C1-C8)-алкилом, в частности (C1-C4)-алкилом, (C3-C12)-циклоалкилом, (C3-C12)-циклоалкил-(C1-C8)-алкилом, необязательно замещенным (C6-C14)-арилом, (C6-C14)-арил-(C1-C8)-алкилом, который необязательно замещен в арильном остатке, гетероарилом, гетероарил-(C1-C8)-алкилом, (C1-C8)-алкокси, в частности (C1-C4)-алкокси, необязательно замещенным фенокси, бензилокси, галогеном, нитро, амино, (C1-C8)-алкиламино, ди-((C1-C8)-алкил)амино, трифторметилом, гидроксилом, метилендиокси, диметилметилендиокси, этилендиокси, циано, гидроксикарбонилом, аминокарбонилом, (C1-C4)-алкоксикарбонилом и сложноэфирными группами в основном, ацильными группами, оксо (=атом кислорода с двойной связью) и тиоксо (=атом серы с двойной связью), где алкильные остатки могут быть монозамещены или полизамещены фтором.
Примерами родительских соединений гетероциклов, из которых можно получить гетероарильный остаток, остаток Het, остаток моноциклического или бициклического 5-12-членного гетероциклического кольца, двухвалентный остаток 5-членного или 6-членного гетероцикла, гетероциклический остаток, представляющий R7, или гетероциклический остаток, представляющий R16, являются, до тех пор, пока они входят в соответствующее определение, в конкретном случае, пиррол, фуран, тиофен, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, тетразол, пиридин, пиразин, пиримидин, пиридазин, индол, изоиндол, индазол, фталазин, хинолин, изохинолин, хиноксалин, хиназолин, циннолин и β-карболин и бензоконденсированные, циклопента-, циклогекса- или циклогептаконденсированные производные указанных гетероциклов. Обычно азотсодержащие гетероциклы могут также присутствовать в виде N-оксидов или в виде четвертичных солей.
Примерами гетероциклических остатков, которые могут, например, представлять собой гетероарил или остаток моноциклического или бициклического 5-12-членного гетероциклического кольца до тех пор, пока они входят в соответствующее определение в конкретном случае, являются 2- или 3-пирролил, фенилпирролил, например 4- или 5-фенил-2-пирролил, 2- или 3-фурил, 2- или 3-тиенил, 4-имидазолил, метилимидазолил, например 1-метил-2-, -4- или -5-имидазолил, 1,3-тиазол-2-ил, пиридил, 2-пиридил, 3-пиридил, 4-пиридил, 2-, 3- или 4-пиридил-N-оксид, 2-пиразинил, 2-, 4- или 5-пиримидинид, индолил, 2-, 3- или 5-индолил, замещенный 2-индолил, например 1-метил-, 5-метил-, 5-метокси-, 5-бензиолкси-, 5-хлор- или 4,5-диметил-2-индолил, 1-бензил-2- или -3-индолил, 4,5,6,7-тетрагидро-2-индолил, циклопента[b](5-пирролил), 2-, 3- или 4-хинолил, 1-, 3- или 4-изохинолил, 1-оксо-1,2-дигидроизохинол-3-ил, 2-хиноксалинил, 2-бензофуранил, 2-бензотиенил, 2-бензоксазолил и 2-бензотиазолил. Примерами остатков частично насыщенных или полностью насыщенных гетероциклических колец являются дигидропиридинил, пирролидинил, например 2- или 3-(N-метилпирролидинил), пиперазинил, морфолинил, тиоморфолинил, тетрагидротиенил и бензодиоксоланил.
Объяснения в отношении одновалентных гетероциклических остатков, включая гетероарильные остатки, относятся соответствующим образом к двухвалентным гетероциклическим остаткам, например гетероариленовым остаткам (=двухвалентные остатки, полученные из гетероароматических соединений).
Гетероциклические остатки, которые представляют остаток R7, могут быть незамещенными или монозамещены или полизамещены, например замещены один, два, три, четыре или пять раз, у атомов углерода и/или у дополнительных кольцевых атомов азота одинаковыми или различными заместителями. Атомы углерода могут быть замещены, например, (C1-C8)-алкилом, в частности (C1-C4)-алкилом, (C1-C8)-алкокси, в частности (C1-C4)-алкокси, галогеном, нитро, амино, трифторметилом, гидроксилом, оксо, циано, гидроксикарбонилом, аминокарбонилом, (C1-C4)-алкоксикарбонилом, фенилом, фенокси, бензилом, бензилокси или тетразолилом, в частности (C1-C4)-алкилом, например метилом, этилом или трет-бутилом, (C1-C4)-алкокси, например метокси, гидроксилом, оксо, фенилом, фенокси, бензилом или бензилокси. Атомы серы могут быть окислены до сульфоксида или до сульфона. Примерами таких остатков R7, которые связаны через кольцевой атом азота, являются 1-пирролидинил, 1-пиперидинил, 1-пиперазинил, 4-замещенный 1-пиперазинил, 4-морфолинил, 4-тиоморфолинил, 1-оксо-4-тиоморфолинил, 1,1-диоксо-4-тиоморфолинил, пергидроазепин-1-ил, 2,6-диметил-1-пиперидинил, 3,3-диметил-4-морфолинил, 4-изопропил-2,2,6,6-тетраметил-1-пиперазинил, 4-ацетил-1-пиперазинил и 4-этоксикарбонил-1-пиперазинил.
Галоген представляет собой фтор, хлор, бром или йод, в частности фтор или хлор.
В одном варианте реализации изобретения заместитель на замещенном алкиленовом остатке или алкениленовом остатке, представляющем В, содержит циклическую часть, как в случае, когда заместитель выбран из ряда (C3-C10)-циклоалкила, (C3-C10)-циклоалкил-(C1-C6)-алкила, необязательно замещенного (C6-C14)-арила, (C6-C14)-арил-(C1-C6)-алкила, который необязательно замещен в арильном остатке, необязательно замещенного гетероарила и гетероарил-(C1-C6)алкила, который необязательно замещен в гетероарильном остатке. В другом варианте реализации изобретения заместитель на замещенном алкиленовом остатке или алкениленовом остатке, представляющем В, является ациклическим, как в случае, когда заместитель выбран из ряда (C1-C8)-алкила, (C2-C8)-алкенила и (C2-C8)-алкинила. Ациклические заместители могут содержать 2, 3, 4, 5, 6, 7 или 8 атомов углерода, а в случае насыщенного алкильного заместителя также 1 атом углерода. В случае алкенильных заместителей и алкинильных заместителей двойная связь или тройная связь может быть расположена в любом желательном положении, а в случае двойной связи иметь цис-конфигурацию или транс-конфигурацию. Как объяснено выше, указанные алкильные остатки, алкенильные остатки и алкинильные остатки могут быть с прямой цепью или разветвленными.
Примерами заместителей, которые может нести (C1-C6)-алкиленовый остаток или (C2-C6)-алкениленовый остаток, представляющий В, являются, в частности, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил, н-октил, изопропил, изобутил, изопентил, изогексил, втор-бутил, трет-бутил, трет-пентил, неопентил, неогексил, 3-метилфенил, 2-этилбутил, винил, аллил, 1-пропенил, 2-бутенил, 3-бутенил, 3-метил-2-бутенил, этинил, 1-пропинил, 2-пропинил, 6-гексинил, фенил, бензил, 1-фенилэтил, 2-фенилэтил, 3-фенилпропил, 4-бифенилилметил, циклопропил, циклопропилметил, циклобутил, циклобутилметил, циклопентил, циклопентилметил, циклогексил, циклогексилметил, 2-циклогексилэтил, 3-циклооктилпропил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, 2-(4-пиридил)этил, 2-фурилметил, 3-фурилметил, 2-тиенилметил, 3-тиенилметил и 2-(3-индолил)этил.
Остаток аминокислоты, иминокислоты, азааминокислоты, дипептида, трипептида или тетрапептида, представляющий R6, получают обычными способами химии пептидов из соответствующей аминокислоты, иминокислоты, азааминокислоты, дипептида, трипептида или тетрапептида формально удалением атома водорода из аминогруппы, например N-концевой аминогруппы, или из иминогруппы. Затем данная группа связывается через полученную в результате свободную связь на аминогруппе или иминогруппе посредством амидной связи, по типу пептидной, с группой СО в группе R6-CO.
Природные и неприродные аминокислоты могут присутствовать во всех стереохимических формах, например в D-форме или L-форме, или в форме смеси стереоизомеров, например в форме рацемата. Предпочтительными аминокислотами являются α-аминокислоты и β-аминокислоты, причем α-аминокислоты являются особенно предпочтительными. Подходящими аминокислотами, которые можно привести в качестве примера, являются (см. Houben-Weyl, Methoden der organischen Chemie [Методы органической химии], Volumes 15/1 и 15/2, Georg Thieme Verlag, Stuttgart, 1974):
Aad, Abu, γAbu, ABz, 2ABz, εAca, Ach, Acp, Adpd, Ahb, Aib, βAib, Ala, βAla, ΔAla, Alg, All, Ama, Amt, Ape, Apm, Apr, Arg, Asn, Asp, Asu, Aze, Azi, Bai, Bph, Can, Cit, Cys, (Cys)2, Cyta, Daad, Dab, Dadd, Dap, Dapm, Dasu, Djen, Dpa, Dtc, Fel, Gln, Glu, Gly, Guv, hAla, hArg, hCys, hGln, hGlu, His, hlle, hLeu, hLys, hMet, hPhe, hPro, hSer, hThr, hTrp, hTyr, Hyl, Hyp, 3Hyp, Ile, Ise, Iva, Kyn, Lant, Lcn, Leu, Lsg, Lys, βLys, ΔLys, Met, Mim, Min, nArg, Nle, Nva, Oly, Orn, Pan, Pec, Pen, Phe, Phg, Pic, Pro, ΔPro, Pse, Pya, Pyr, Pza, Qin, Ros, Sar, Sec, Sem, Ser, Thi, βThi, Thr, Thy, Thx, Tia, Tle, Tly, Trp, Trta, Tyr, Val, трет-бутилглицин (Tbg), неопентилглицин (Npg), циклогексилглицин (Chg), циклогексилаланин (Cha), 2-тиенилаланин (Thia), 2,2-дифениламиноуксусная кислота, 2-(п-толил)-2-фениламиноуксусная кислота и 2-(п-хлорфенил)аминоуксусная кислота.
Когда R6 представляет остаток природной и неприродной α-аминокислоты, то данный остаток может, например, соответствовать формуле -N(R)-CH(SC)-CO-AG, в которой CO-AG представляет кислотную группу аминокислоты или ее производного, например группу сложного эфира, амидную группу или группу, содержащую пептидный остаток, а SC представляет боковую цепь α-аминокислоты, то есть, например, представляет заместитель, который присутствует в α-положении в одной из перечисленных выше α-аминокислот. Примерами боковых цепей являются алкильные остатки, например метильная группа в аланине или изопропильная группа в валине, бензильный остаток в фенилаланине, фенильный остаток в фенилглицине, 4-аминобутильный остаток в лизине или гидроксикарбонилметильная группа в аспарагиновой кислоте. Так же как на основании структурных признаков, боковые цепи, а следовательно, лежащие в основе аминокислоты можно группировать также на основании, например, их физико-химических свойств. Например, липофильные боковые цепи можно отличить от гидрофильных боковых цепей, причем последние содержат полярные группы, и боковые цепи и аминокислоты можно группировать соответствующим образом. Примерами липофильных боковых цепей, которые могут присутствовать в аминокислотах, представляющих R6, являются алкильные остатки, арилалкильные остатки и арильные остатки. То же относится соответствующим образом к аминокислотам, которые являются частью дипептидного, трипептидного или тетрапептидного остатка, представляющего R6.
Азааминокислоты представляют собой природные или неприродные аминокислоты, в которых элемент СН заменен атомом азота так, как, например, замена в α-аминокислотах центрального структурного блока

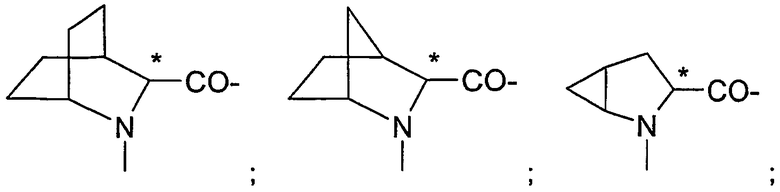
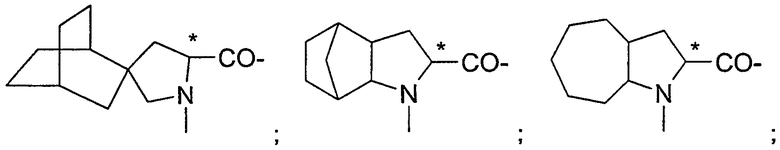
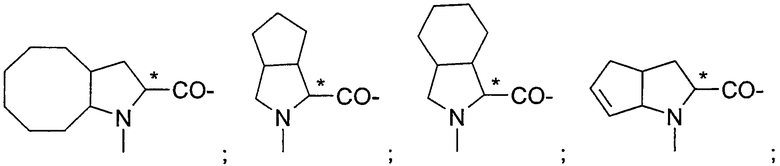
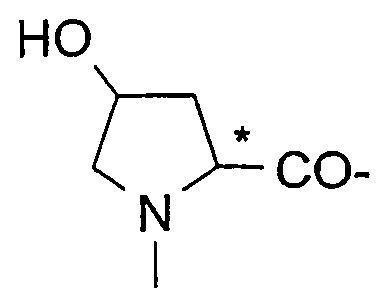
Подходящие остатки аминокислот включают остатки следующих гетероциклических соединений, получение которых описано в литературе: пирролидин-2-карбоновой кислоты;
пиперидин-2-карбоновой кислоты;
1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты;
декагидроизохинолин-3-карбоновой кислоты;
октагидроиндол-2-карбоновой кислоты;
декагидрохинолин-2-карбоновой кислоты;
октагидроциклопента[b]пиррол-2-карбоновой кислоты;
2-азабицикло[2.2.2]октан-3-карбоновой кислоты;
2-азабицикло[2.2.1]гептан-3-карбоновой кислоты;
2-азабицикло[3.1.0]гексан-3-карбоновой кислоты;
2-азаспиро[4.4]нонан-3-карбоновой кислоты;
2-азаспиро[4.5]декан-3-карбоновой кислоты;
спиро(бицикло[2.2.1]гептан)-2,3-пирролидин-5-карбоновой кислоты;
спиро(бицикло[2.2.2]октан)-2,3-пирролидин-5-карбоновой кислоты;
2-азатрицикло[4.3.0.16,9]декан-3-карбоновой кислоты;
декагидроциклогепта[b]пиррол-2-карбоновой кислоты;
декагидроциклоокта[с]пиррол-2-карбоновой кислоты;октагидроциклопента[с]пиррол-2-карбоновой кислоты;
октагидроизоиндол-1-карбоновой кислоты;
2,3,3а,4,6а-гексагидроциклогепта[b]пиррол-2-карбоновой кислоты;
2,3,3а,4,5,7а-гексагидроиндол-2-карбоновой кислоты;
тетрагидротиазол-4-карбоновой кислоты;
изоксазолидин-3-карбоновой кислоты;
пиразолидин-3-карбоновой кислоты и
гидроксипирролидин-2-карбоновой кислоты, все из которых могут быть необязательно замещенными, в частности остатки, которые изображены в следующих формулах:
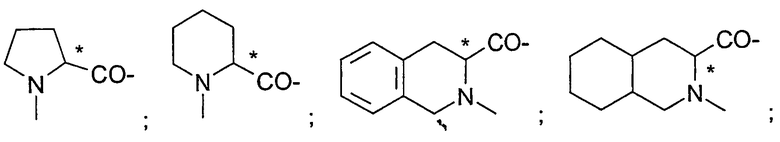
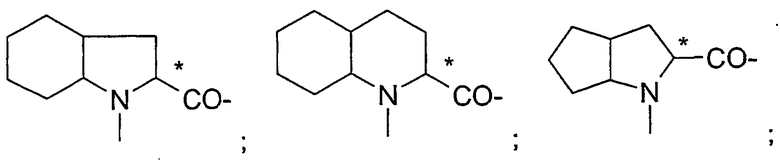

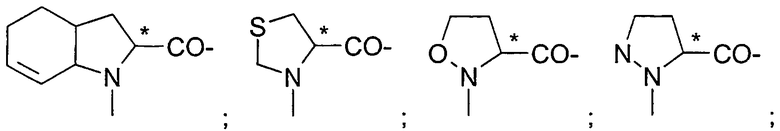
 .
.
Дипептиды, трипептиды и тетрапептиды могут содержать природные или неприродные аминокислоты или азааминокислоты в качестве структурных блоков. Природные или неприродные аминокислоты, иминокислоты, азааминокислоты, дипептиды, трипептиды и тетрапептиды могут, обычным образом, также присутствовать в форме производных группы карбоновых кислот, например в виде сложного эфира или амида, например в виде сложного (C1-C4)-алкилового эфира, такого как сложный метиловый эфир, сложный этиловый эфир, сложный н-пропиловый эфир, сложный изопропиловый эфир, сложный изобутиловый эфир или сложный трет-бутиловый эфир, сложный бензиловый эфир, незамещенный амид, N-(C1-C4)-алкиламид, такой как метиламид или этиламид, семикарбазид или ω-амино-(C2-C8)-алкиламид.
Функциональные группы в остатках аминокислот, иминокислот, азааминокислот, дипептидах, трипептидах и тетрапептидах, а также в других частях соединений формулы I могут присутствовать в защищенной форме. Подходящие защитные группы, такие как уретановые защитные группы, карбоксильные защитные группы и группы, защищающие боковые цепи, описаны в руководствах Hubbuch, Kontakte (Merck) 1979, No. 3, pages 14 to 23, и в Bullesbach, Kontakte (Merck) 1980, No. 1, pages 23 to 35. В частности, можно привести следующие: Aloc, Pyoc, Fmoc, Tcboc, Z, Boc, Ddz, Bpoc, Adoc, Msc, Moc, Z(NO2), Z(Haln), Bobz, Iboc, Adpoc, Mboc, Acm, трет-бутил, OBzl, ONbzl, OMbzl, Bzl, Mob, Pic, Trt.
Физиологически переносимыми солями соединений формулы I являются, в частности, фармацевтически утилизируемые соли или нетоксичные соли. Соединения формулы I, которые содержат кислотные группы, такие как группы карбоновых кислот, могут, например, присутствовать в виде солей щелочных металлов или солей щелочно-земельных металлов, таких как соли натрия, соли калия, соли магния и соли кальция, или в виде солей аммония, таких как соли с физиологически переносимыми ионами четвертичного аммония и кислотно-аддитивные соли с аммиаком и физиологически переносимыми органическими аминами, такими как метиламин, этиламин, триэтиламин, 2-гидроксиэтиламин, трис(2-гидроксиэтил)амин, α,α,α-трис(гидроксиметил)метиламин (трометамин) или аминокислоты, в частности основные аминокислоты. Соли, составленные из кислотного соединения формулы I и органического амина, могут содержать указанные два компонента в соотношении 1:1 или приблизительно 1:1 или даже в другом соотношении, например в соотношении от приблизительно 1:0,5 до приблизительно 1:4 (1 молекула соединения формулы I на 0,5-4 молекулы амина), в частности в соотношении от приблизительно 1:0,5 до приблизительно 1:2 (1 молекула соединения формулы I на 0,5-2 молекулы амина).
Соединения формулы I, которые содержат основные группы, например аминогруппу, амидиногруппу, гуанидиногруппу или пиридильную группу, могут, например, присутствовать в виде солей с неорганическими кислотами, такими как хлористо-водородная кислота, серная кислота или фосфорная кислота, или с органическими карбоновыми кислотами или сульфоновыми кислотами, такими как уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, метансульфоновая кислота или п-толуолсульфоновая кислота. Соединения, которые содержат и кислотные группы, и основные группы, могут также присутствовать в виде внутримолекулярных солей, цвиттерионов или бетаинов, которые аналогичным образом охватываются настоящим изобретением.
Соли можно получить из соединений формулы I с использованием обычных способов, которые известны специалистам в данной области, например, взаимодействием соединения формулы I с органической или неорганической кислотой или щелочью в растворителе или разбавителе, или, именно таким же образом из других солей посредством обмена анионов или обмена катионов. Настоящее изобретение также охватывает соли соединений формулы I, которые непосредственно не подходят для использования в качестве фармацевтических средств ввиду более низкой физиологической переносимости, но которые можно использовать, например, в качестве промежуточных соединений для химических реакций или для получения физиологически переносимых солей.
Соединения формулы I могут присутствовать в стереоизомерных формах. Когда соединения формулы I содержат один или более центров асимметрии, может присутствовать S-конфигурация или R-конфигурация или смесь RS, независимо друг от друга, у каждого из асимметричных центров. Изобретение включает все возможные стереоизомеры соединений формулы I, например энантиомеры и диастереомеры, и смеси двух или более стереоизомерных форм, например смеси энантиомеров и/или диастереомеров во всех соотношениях. Таким образом, изобретение относится к энантиомерам в энантиомерно чистой форме или по существу в энантиомерно чистой форме, левовращающему антиподу, а также к правовращающему антиподу и к энантиомерам в форме рацематов и в форме смесей двух энантиомеров в любом соотношении. Изобретение аналогичным образом относится к диастереомерам в диастереомерно чистой форме или по существу диастереомерно чистой форме и в форме смесей в любом соотношении. Когда присутствует цис/транс изомерия, изобретение относится как к цис-форме, так и к транс-форме и к смесям данных форм во всех соотношениях. При желании, отдельные стереоизомеры можно получить, используя стереохимически однородные исходные вещества при синтезе, посредством стереоселективного синтеза, или разделением смеси с использованием обычных способов, например посредством хроматографии или кристаллизации, включая хроматографию с хиральными фазами в случае разделения энантиомеров. Когда это целесообразно, перед разделением стереоизомеров может иметь место получение функциональных производных. Стереоизомерные смеси можно разделить на уровне соединений формулы I или на уровне исходного вещества или промежуточного соединения в ходе синтеза.
Соединения формулы I в соответствии с изобретением могут содержать подвижные атомы водорода, то есть присутствовать в различных таутомерных формах. Настоящее изобретение относится ко всем таутомерам соединений формулы I. Настоящее изобретение, кроме того, охватывает производные соединений формулы I, например, сольваты, такие как гидраты и аддукты со спиртами, сложными эфирами, пролекарства и другие физиологически переносимые производные соединений формулы I, а также активные метаболиты соединений формулы I. Изобретение относится, в частности, к пролекарствам соединений формулы I, которые не являются обязательно фармакологически активными in vitro, но которые превращаются in vivo в физиологических условиях в активные соединения формулы I. Специалист в данной области знаком с подходящими пролекарствами для соединений формулы I, которые представляют собой химически модифицированные производные соединений формулы I, обладающие свойствами, которые были улучшены желательным образом. Дополнительные детали в отношении пролекарств можно найти, например, в публикациях Fleisher et al., Advanced Drug Delivery Reviews 19 (1996) 115-130; Design of Prodrugs, H. Bundgaard, Ed., Elsevier, 1985; или H. Bundgaard, Drugs of the Future 16 (1991) 443. Пролекарства, которые особенно подходят для соединений формулы I, представляют собой сложноэфирные пролекарства групп карбоновых кислот, амидные пролекарства групп карбоновых кислот и спиртовые пролекарства групп карбоновых кислот, а также ацильные пролекарства и карбаматные пролекарства способных к образованию ацилатов азотсодержащих групп, таких как аминогруппы, амидиногруппы и гуанидиногруппы. В ацильных пролекарствах или карбаматных пролекарствах атом водорода, который расположен на атоме азота, заменен ацильной группой или карбаматной группой. Подходящими ацильными группами и карбаматными группами для ацильных пролекарств и карбаматных пролекарств являются, например, группы Rp-CO и RpaO-CO, в которых Rp представляет водород, (С1-С18)-алкил, (С3-С12)-циклоалкил, (С3-С12)-циклоалкил-(С1-С8)-алкил, (С6-С14)-арил, (С6-С14)-арил-(С1-С8)-алкил, гетероарил или гетероарил-(С1-С8)-алкил, а Rpa имеет значения, приведенные для Rp, за исключением водорода. Так, например, соединения формулы I, в которых группа Е представляет гидроксиметил, алкоксиметил или формил и которые проявляют антагонизм в отношении VLA-4 in vivo, являются пролекарствами соединений формулы I, в которых группа Е представляет гидроксикарбонил. Примерами сложноэфирных пролекарств и амидных пролекарств, которые можно привести, являются сложные (С1-С4)-алкиловые эфиры, такие как сложные метиловые эфиры, сложные этиловые эфиры, сложные н-пропиловые эфиры, сложные изопропиловые эфиры, сложные н-бутиловые эфиры и сложные изобутиловые эфиры, замещенные сложные алкиловые эфиры, такие как сложные гидроксиалкиловые эфиры, сложные ацилоксиалкиловые эфиры, сложные аминоалкиловые эфиры, сложные ациламиноалкиловые эфиры и сложные диалкиламиноалкиловые эфиры, незамещенные амиды и N-(С1-С4)-алкиламиды, такие как метиламиды или этиламиды.
Отдельные структурные элементы в соединениях формулы I в соответствии с изобретением предпочтительно имеют следующие значения, которые все они могут иметь независимо друг от друга. Остатки, которые встречаются более одного раза, могут иметь значения независимо друг от друга и могут быть одинаковыми или различными.
W представляет предпочтительно двухвалентный остаток из ряда R1-A-C(R13) и
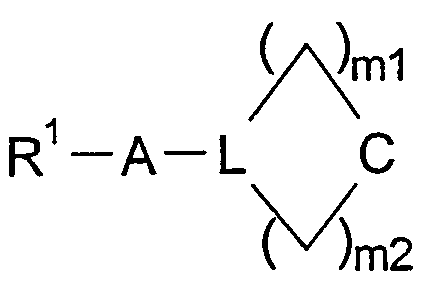
в которой кольцевые системы

могут содержать один или два одинаковых или различных кольцевых гетероатомов из ряда азота и кислорода, могут быть насыщенными или мононенасыщенными и могут быть замещены 1 или 2 одинаковыми или различными заместителями R13 и/или могут содержать один или два оксозаместителя и в которых L представляет С(R13) или N, в котором m1 и m2, независимо друг от друга, равны одному из чисел 0, 1, 2, 3 и 4, а сумма m1 + m2 равна одному из чисел 1, 2, 3 и 4, в частности одному из чисел 1, 3 и 4. Особенно предпочтительно W представляет двухвалентный остаток R1-A-C(R13), в котором R13 имеет указанные выше значения. Еще более особенно предпочтительно W представляет двухвалентный остаток R1-A-C(R13), в котором R13 имеет указанные выше значения, но отличается от водорода. Примерами конкретных групп W данного типа являются двухвалентные остатки ди-((С1-С4)-алкил)метилена (то есть ((С1-С4)-алкил)2C<), такие как диметилметилен или бис(трифторметил)метилен (то есть (СН3)2С< или (CF3)2С<), или (метил)(фенил)метилен (то есть (СН3)(С6Н5)С<).
Подгруппа соединений, в которых W представляет остаток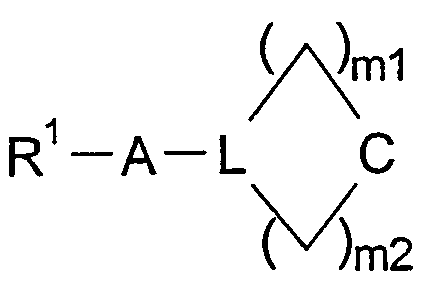
образованный соединениями, в которых W представляет карбоциклические группы формулы (СН2)m3С<, которые необязательно замещены, как определено, и в которых число m3, которое обозначает число метиленовых групп в полиметиленовой цепи, которая связана со спироатомом углерода C< посредством концевых групп, равно 2, 3, 4, 5 или 6. Примерами конкретных групп W данного типа являются двухвалентные остатки 1,1-циклопропилиден (=диметиленметилен), 1,1-циклопентилиден (=тетраметиленметилен) и 1,1-циклогексилиден (=пентаметиленметилен), то есть остатки
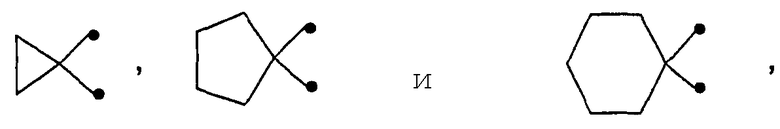
в которых свободные связи обозначены линиями, имеющими точку на конце, причем остатки, которые получены из 5-членного кольца и из 6-членного кольца, способны нести в качестве заместителя атом кислорода с двойной связью. В целом, соединения формулы I, в которых W имеет значение, отличное от СН2, образуют группу предпочтительных соединений.
Y представляет предпочтительно карбонильную группу или тиокарбонильную группу, особенно предпочтительно карбонильную группу.
А представляет предпочтительно прямую связь, один из двухвалентных остатков (С1-С6)-алкилена, в частности (С1-С4)-алкилена, (С5-С6)-циклоалкилена, фенилена, фенилен-(С1-С4)-алкила, в частности фенилен-(С1-С2)-алкила, или представляет двухвалентный остаток 5-членного или 6-членного насыщенного или ненасыщенного гетероцикла, который может содержать один или два атома азота и который может быть замещен один раз или дважды (С1-С6)-алкилом и/или оксо, и/или тиоксо. Особенно предпочтительно А представляет прямую связь или один из двухвалентных остатков (С1-С4)-алкилена, фенилена и фенилен-(С1-С2)-алкила. Когда W представляет остаток R1-A-C(R13), то ряд предпочтительных остатков R1-A- образуется из остатков (С1-С4)-алкила, необязательно замещенного фенила и фенил-(С1-С2)-алкила, который необязательно замещен в фенильном остатке, в частности из остатков (С1-С4)-алкила и необязательно замещенного фенила, причем возможно, чтобы остаток (С1-С4)-алкила был замещен одним или более атомами фтора, и, например, представлял собой метильный остаток или трифторметильный остаток.
В представляет предпочтительно двухвалентный метиленовый остаток (СН2) или 1,2-этиленовый остаток (CH2-CH2), где метиленовый остаток и этиленовый остаток являются незамещенными или замещены одним или более одинаковыми или различными остатками из ряда (С1-С6)-алкила, (С2-С8)-алкенила, (С2-С8)-алкинила, (С3-С10)-циклоалкила, в частности (С3-С6)-циклоалкила, (С3-С10)-циклоалкил-(С1-С6)-алкила, в частности (С3-С6)-циклоалкил-(С1-С6)-алкила, необязательно замещенного (С6-С14)-арила, в частности необязательно замещенного (С6-С10)-арила, (С6-С14)-арил-(С1-С6)-алкила, который необязательно замещен в арильном остатке, в частности (С6-С10)-арил-(С1-С6)-алкила, который необязательно замещен в арильном остатке, необязательно замещенного гетероарила и гетероарил-(С1-С6)-алкила, который необязательно замещен в гетероарильном остатке. В представляет особенно предпочтительно метиленовый остаток или этиленовый остаток, который замещен, как описано выше, в частности метиленовый остаток, который замещен, как описано выше. Если алкиленовый остаток или алкениленовый остаток, представляющий В, монозамещен или полизамещен, он предпочтительно замещен один, два или три раза, в частности предпочтительно один раз или дважды, в частности предпочтительнее один раз. Если метиленовый остаток или этиленовый остаток, представляющий В, замещен, он предпочтительно замещен одним или двумя одинаковыми или различными заместителями, в частности одним заместителем, из ряда (С1-С8)-алкила, который является алкилом с прямой цепью или разветвленным алкилом, имеющим 1, 2, 3, 4, 5, 6, 7 или 8 атомов углерода, в частности (С1-С6)-алкилом, и (С3-С6)-циклоалкил-(С1-С4)-алкила, в частности (С3-С6)-циклоалкил-(С1-С2)-алкила.
Е представляет предпочтительно тетразолил, R6CO, R7CO, R10CO, HCO, R8O-CH2, R8CO-O-CH2 или (R8O)2P(O)-O-CH2, особенно предпочтительно тетразолил, R10CO, R8O-CH2, R8CO-O-CH2 или (R8O)2P(O)-O-CH2, особенно еще предпочтительнее R10CO, R8O-CH2 или R8CO-O-CH2. Остаток R8O-CH2, представляющий группу Е, представляет предпочтительно гидроксиметильный остаток НО-СН2. Особенно предпочтительно Е представляет R10CO, НО-СН2 или R8CO-O-CH2, в частности R10CO.
Остатки R представляют предпочтительно, независимо друг от друга, водород или (С1-С8)-алкил, в частности водород, метил или этил.
R2 представляет предпочтительно водород или (С1-С8)-алкил, в частности водород или (С1-С6)-алкил, в частности водород, метил или этил.
R3 представляет предпочтительно водород, (С1-С8)-алкил, который может быть необязательно замещен 1-8 атомами фтора, необязательно замещенный (С6-С12)-арил, (С6-С12)-арил-(С1-С6)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(С1-С6)-алкил, который необязательно замещен в гетероарильном остатке, (С3-С8)-циклоалкил, (С3-С8)-циклоалкил-(С1-С6)-алкил, (С6-С12)-бициклоалкил, (С6-С12)-бициклоалкил-(С1-С6)-алкил, (С6-С12)-трициклоалкил, (С6-С12)-трициклоалкил-(С1-С6)-алкил, (С2-С8)-алкенил, (С2-С8)-алкинил или R11NH. Особенно предпочтительно R3 представляет водород, (С1-С8)-алкил, который может быть необязательно замещен 1-8 атомами фтора, необязательно замещенный (С6-С12)-арил, (С6-С12)-арил-(С1-С6)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(С1-С6)-алкил, который необязательно замещен в гетероарильном остатке, (С3-С8)-циклоалкил, (С3-С8)-циклоалкил-(С1-С6)-алкил, (С6-С12)-бициклоалкил, (С6-С12)-бициклоалкил-(С1-С6)-алкил, (С2-С8)-алкенил, (С2-С8)-алкинил или R11NH. Особенно предпочтительнее R3 представляет водород, (С1-С8)-алкил, который может быть необязательно замещен 1-6 атомами фтора, необязательно замещенный (С6-С10)-арил, (С6-С10)-арил-(С1-С4)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(С1-С4)-алкил, который необязательно замещен в гетероарильном остатке, (С3-С8)-циклоалкил, (С3-С8)-циклоалкил-(С1-С4)-алкил, (С6-С12)-бициклоалкил, (С6-С12)-бициклоалкил-(С1-С4)-алкил или R11NH. Особенно предпочтительно R3 представляет водород, (С1-С8)-алкил, который может быть необязательно замещен 1-6 атомами фтора, необязательно замещенный (С6-С10)-арил, (С6-С10)-арил-(С1-С4)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(С1-С4)-алкил, который необязательно замещен в гетероарильном остатке, (С3-С8)-циклоалкил или (С3-С8)-циклоалкил-(С1-С4)-алкил. Еще особенно предпочтительнее R3 представляет, например, (С1-С8)-алкил, в частности (С1-С4)-алкил, например метил, который может быть необязательно замещен 1-6 атомами фтора, или (С6-С10)-арил, в частности фенил, который может быть незамещенным или замещен.
R4 представляет предпочтительно (С1-С8)-алкил, который является незамещенным или замещен, как определено в указанном выше определении R4. Особенно предпочтительно R4 представляет (С1-С8)-алкил, в частности (С1-С6)-алкил, который является незамещенным или замещен одним или двумя одинаковыми или различными заместителями из ряда гидроксила, (С1-С8)-алкокси, R5, необязательно замещенного (С3-С8)-циклоалкила, гидроксикарбонила, аминокарбонила, (С6-С10)-арил-(С1-С4)-алкоксикарбонила, необязательно замещенного в арильном остатке, (С1-С6)-алкоксикарбонила, R6-CO, R7-CO, тетразолила и трифторметила. В частности, очень предпочтительно, когда один из заместителей в алкильной группе, представляющей R4, связан в положении 1 алкильной группы, то есть с тем атомом углерода алкильной группы, с которым связан атом азота в группе CONHR4 или в группе CON(CH3)R4, и когда указанный заместитель в положении 1 представляет собой один из остатков гидроксикарбонила, аминокарбонила, (С6-С10)-арил-(С1-С4)-алкоксикарбонила, необязательно замещенного в арильном остатке, R6-CO, R7-CO, (С1-С6)-алкоксикарбонила или тетразолила. В данном особенно предпочтительном случае остаток -NHR4 или остаток -N(CH3)R4 тогда представляет собой остаток, соответственно, α-аминокислоты или N-метил-α-аминокислоты, или ее производного, причем остаток аминокислоты формально получен удалением атома водорода из аминогруппы аминокислоты (если заместитель в положении 1 представляет собой группу R6-CO, остаток -NHR4 или остаток -N(CH3)R4 тогда, соответственно, представляет собой остаток дипептида, трипептида, тетрапептида или пентапептида). Особенно предпочтительно, когда такие α-аминокислоты являются α-аминокислотами, имеющими липофильную боковую цепь, например фенилглицин, фенилаланин, валин, лейцин, изолейцин и их гомологи, включая производные указанных аминокислот, такие как сложные эфиры, амиды или производные, в которых группа карбоновой кислоты превращена в остаток R6-CO или R7-CO.
R5 представляет предпочтительно (С6-С12)-арил, в частности необязательно замещенный (С6-С10)-арил, особенно, необязательно замещенный фенил.
R8 представляет предпочтительно водород, (С1-С8)-алкил, необязательно замещенный (С6-С12)-арил или (С6-С12)-арил-(С1-С8)-алкил, необязательно замещенный в арильном остатке, особенно предпочтительно водород, (С1-С6)-алкил, необязательно замещенный (С6-С10)-арил или (С6-С10)-арил-(С1-С6)-алкил, необязательно замещенный в арильном остатке, особенно очень предпочтительно водород, (С1-С6)-алкил или фенил-(С1-С4)-алкил, который необязательно замещен в фенильном остатке. R8а предпочтительно имеет одно из предпочтительных значений R8, за исключением водорода.
R10 представляет предпочтительно гидроксил, (С1-С8)-алкокси, (С6-С12)-арил-(С1-С8)-алкокси, необязательно замещенный в арильном остатке, необязательно замещенный (С6-С12)-арилокси, (С1-С8)-алкилкарбонилокси-(С1-С6)-алкокси, (С6-С12)-арил-(С1-С6)-алкилкарбонилокси-(С1-С6)-алкокси, который необязательно замещен в арильном остатке, (С1-С8)-алкоксикарбонилокси-(С1-С6)-алкокси, (С6-С12)-арил-(С1-С6)-алкоксикарбонилокси-(С1-С6)-алкокси, который необязательно замещен в арильном остатке, амино, моно- или ди-((С1-С8)-алкил)амино, аминокарбонил-(С1-С6)-алкокси, (моно- или ди-((С1-С8)-алкил)амино)карбонил-(С1-С6)-алкокси, (моно- или ди-((С6-С12)-арил-(С1-С6)-алкил))амино)карбонил-(С1-С6)-алкокси или (N-((С1-С8)-алкил)-N-((С6-С12)-арил-(С1-С6)-алкил)амино)карбонил-(С1-С6)-алкокси, оба из которых необязательно замещены в арильном остатке. Особенно предпочтительно R10 представляет гидроксил, (С1-С8)-алкокси, (С6-С10)-арил-(С1-С6)-алкокси, необязательно замещенный в арильном остатке, необязательно замещенный (С6-С10)-арилокси, (С1-С6)-алкилкарбонилокси-(С1-С6)-алкокси, (С1-С6)-алкоксикарбонилокси-(С1-С6)-алкокси, амино, моно- или ди-((С1-С6)-алкил)амино, аминокарбонил-(С1-С6)-алкокси или (моно- или ди-((С1-С6)-алкил)амино)карбонил-(С1-С6)-алкокси. Особенно предпочтительно R10 представляет гидроксил, (С1-С8)-алкокси, (С6-С10)-арил-(С1-С6)-алкокси, необязательно замещенный в арильном остатке, необязательно замещенный (С6-С10)-арилокси, (С1-С6)-алкилкарбонилокси-(С1-С6)-алкокси или (С1-С6)-алкоксикарбонилокси-(С1-С6)-алкокси. Особенно предпочтительно R10 представляет гидроксил или (С1-С8)-алкокси, например гидроксил или (С1-С6)-алкокси.
R11 представляет предпочтительно водород, R12a, R12a-CO, R12a-O-CO, R12b-CO, R12b-CS или R12a-S(O)2, в частности предпочтительно водород, R12a, R12a-CO, R12a-O-CO, R12b-CO или R12a-S(O)2, в частности еще предпочтительнее R12a, R12a-CO, R12a-O-CO или R12a-S(O)2.
R12а представляет предпочтительно (C1-C10)-алкил, (C2-C8)-алкенил, (C2-C8)-алкинил, (C5-C10)-циклоалкил, (C5-C10)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C12)-арил, (C6-C12)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке, или остаток R15, особенно предпочтительно (C1-C10)-алкил, (C2-C8)-алкенил, (C2-C8)-алкинил, (C5-C10)-циклоалкил, (C5-C10)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C12)-арил, (C6-C12)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил или гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке.
R13 представляет предпочтительно водород или (C1-C6)-алкил, который может быть необязательно замещен одним или более атомами фтора, где предпочтительными алкильными остатками, представляющими R13, являются метильный остаток и трифторметильный остаток. В частности, предпочтительно R13 представляет (C1-C6)-алкил, в частности очень предпочтительно (C1-C4)-алкил, оба из которых могут быть необязательно замещены одним или более атомами фтора, например метил или трифторметил.
R15 представляет предпочтительно R16-(C1-C3)-алкил или R16,в частности R16-C1-алкил или R16.
R20 представляет предпочтительно прямую связь или двухвалентный остаток (C1-C4)-алкилена, в частности предпочтительно прямую связь или двухвалентный остаток (C1-C2)-алкилена, в частности прямую связь или метиленовый остаток или 1,2-этиленовый остаток, в частности очень предпочтительно прямую связь или метиленовый остаток.
R21 представляет предпочтительно водород, (C1-C8)-алкил, (C3-C10)-циклоалкил, (C3-C10)-циклоалкил-(C1-C6)-алкил, необязательно замещенный (C6-C10)-арил, (C6-C10)-арил-(C1-C6)-алкил, который необязательно замещен в арильном остатке, остаток Het или остаток Het-(C1-C6)-алкил, где алкильные остатки могут быть монозамещены или полизамещены фтором и, когда остатки R21 встречаются более одного раза, они независимы друг от друга и могут быть одинаковыми или различными. R21 представляет особенно предпочтительно водород, (C1-C6)-алкил, (C3-C6)-циклоалкил, (C3-C6)-циклоалкил-(C1-C4)-алкил, необязательно замещенный (C6-C10)-арил, (C6-C10)-арил-(C1-C4)-алкил, который необязательно замещен в арильном остатке, где алкильные остатки могут быть монозамещены или полизамещены фтором. R21 представляет особенно очень предпочтительно водород, (C1-C6)-алкил, (C3-C6)-циклоалкил, (C3-C6)-циклоалкил-(C1-C2)-алкил, необязательно замещенный (C6-C10)-арил или (C6-C10)-арил-(C1-C2)-алкил, необязательно замещенный в арильном остатке, где алкильные остатки могут быть монозамещены или полизамещены фтором и, когда остатки R21 встречаются более одного раза, они независимы друг от друга и могут быть одинаковыми или различными.
R30 представляет предпочтительно один из остатков R32(R)N-CO-N(R)-R31, R32(R)N-CS-N(R)-R31, R32(R)N-S(O)n-N(R)-R31, R32-CO-N(R)-R31, R32-CS-N(R)-R31, R32-S(O)n-N(R)-R31, R32(R)N-CO-R31, R32(R)N-CS-R31, R32(R)N-S(O)n-R31, R32-CO-R31, R32-S(O)n-R31 и R12a-O-CO-N(R)-R31, в которых n равно 1 или 2. Особенно предпочтительно R30 представляет один из остатков R32(R)N-CO-N(R)-R31, R32(R)N-CS-N(R)-R31, R32-CO-N(R)-R31, R32-CS-N(R)-R31, R32(R)N-CO-R31 и R32(R)N-CS-R31. Особенно очень предпочтительно R30 представляет один из остатков R32(R)N-CO-N(R)-R31, R32(R)N-CS-N(R)-R31, R32-CO-N(R)-R31 и R32(R)N-CO-R31. Особенно предпочтительно R30 представляет R32(R)N-CO-N(R)-R31 или R32(R)N-CS-N(R)-R31, особенно очень предпочтительно R32(R)N-CO-N(R)-R31, в частности R32NH-CO-NH-R31.
R32 представляет предпочтительно водород, (C1-C8)-алкил, который может быть необязательно замещен 1-8 атомами фтора, (C2-C8)-алкенил, (C2-C8)-алкинил, (C3-C10)-циклоалкил, (C3-C10)-циклоалкил-(C1-C8)-алкил, (C6-C12)-бициклоалкил, (C6-C12)-бициклоалкил-(C1-C8)-алкил, (C6-C12)-трициклоалкил, (C6-C12)-трициклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C12)-арил, (C6-C12)-арил-(C1-C8)-алкил, необязательно замещенный в арильном остатке, необязательно замещенный гетероарил или гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке. Особенно предпочтительно R32 представляет водород, (C1-C6)-алкил, который может быть необязательно замещен 1-6 атомами фтора, (C2-C6)-алкенил, (C2-C6)-алкинил, (C5-C6)-циклоалкил, (C5-C6)-циклоалкил-(C1-C6)-алкил, необязательно замещенный (C6-C10)-арил, (C6-C10)-арил-(C1-C6)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил или гетероарил-(C1-C6)-алкил, который необязательно замещен в гетероарильном остатке. Особенно очень предпочтительно R32 представляет водород, (C1-C6)-алкил, который может быть необязательно замещен 1-6 атомами фтора, (C2-C6)-алкенил, (C2-C6)-алкинил, (C5-C6)-циклоалкил, (C5-C6)-циклоалкил-(C1-C4)-алкил, необязательно замещенный (C6-C10)-арил, (C6-C10)-арил-(C1-C4)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил или гетероарил-(C1-C4)-алкил, который необязательно замещен в гетероарильном остатке. Особенно предпочтительным остатком, представляющим R32, является необязательно замещенный (C6-C10)-арил, в частности незамещенный фенил или фенил, который замещен одним или более, например одним, двумя или тремя одинаковыми или различными заместителями, выбранными из указанных выше заместителей, которые могут присутствовать на арильной группе, например алкильными заместителями, такими как метил. Если остаток R32 связан с атомом серы, то он предпочтительно имеет значение, отличное от водорода.
R33 представляет предпочтительно прямую связь или двухвалентный остаток (C1-C4)-алкилена, особенно предпочтительно прямую связь или двухвалентный остаток (C1-C2)-алкилена, особенно очень предпочтительно прямую связь.
R34 представляет предпочтительно двухвалентный остаток из ряда (C1-C8)-алкилена, (C5-C10)-циклоалкилена, (C6-C12)-бициклоалкилена, необязательно замещенного (C6-C14)-арилена и необязательно замещенного гетероарилена, особенно предпочтительно двухвалентный остаток из ряда (C1-C6)-алкилена, (C5-C6)-циклоалкилена, необязательно замещенного (C6-C10)-арилена и необязательно замещенного гетероарилена. Особенно очень предпочтительно R34 представляет двухвалентный остаток из ряда (C1-C6)-алкилена, необязательно замещенного (C6-C10)-арилена и необязательно замещенного гетероарилена. Особенно предпочтительно R34 представляет двухвалентный остаток из ряда (C1-C4)-алкилена и необязательно замещенного (C6-C10)-арилена, в частности необязательно замещенного (C6-C10)-арилена, например незамещенного фенилена или фенилена, который замещен одним или более, например одним, двумя или тремя одинаковыми или различными заместителями, выбранными из указанных выше заместителей, которые могут присутствовать на арильной группе, например алкоксизаместителями, такими как метокси или трифторметокси. Предпочтительно в фениленовом остатке, представляющем R34, остатки R33 и R35 находятся в положении 1,3 или положении 1,4 в отношении друг к другу, в частности в положении 1,4.
R35 представляет предпочтительно прямую связь или двухвалентный остаток (C1-C4)-алкилена, особенно предпочтительно прямую связь или двухвалентный остаток (C1-C2)-алкилена, особенно очень предпочтительно (C1-C2)-алкилен, в частности метилен или 1,2-этилен.
R36 представляет предпочтительно прямую связь.
R31 представляет предпочтительно двухвалентный остаток -R33-R34-R35-R36-, в котором один или более из остатков R33, R34, R35 и R36 имеют предпочтительные значения. Особенно предпочтительно R31 представляет двухвалентный остаток из ряда (C1-C8)-алкилена, (C5-C6)-циклоалкилена, (C5-C6)-циклоалкилен-(C1-C6)-алкила, необязательно замещенного (C6-C10)-арилена, (C6-C10)-арилен-(C1-C6)-алкила, который необязательно замещен в ариленовом остатке, необязательно замещенного гетероарилена, гетероарилен-(C1-C6)-алкила, который необязательно замещен в гетероариленовом остатке, (C1-C8)-алкилен-СО, необязательно замещенного (C6-C10)-арилен-СО, (C6-C10)-арилен-(C1-C6)-алкил-СО, который необязательно замещен в ариленовом остатке, необязательно замещенного гетероарилен-CO, гетероарилен-(C1-C6)-алкил-CO, который необязательно замещен в гетероариленовом остатке, необязательно замещенного (C6-C10)-арилен-S(O)n, (C6-C10)-арилен-(C1-C6)-алкил-S(O)n, который необязательно замещен в ариленовом остатке, необязательно замещенного гетероарилен-S(O)n и гетероарилен-(C1-C6)-алкил-S(O)n, который необязательно замещен в гетероариленовом остатке, в котором n равно 1 или 2, и в котором группа СО и группа S(O)n связаны с атомом азота в имидазолидиновом кольце в формуле I, и, в случае остатков циклоалкиленалкила, ариленалкила и гетероариленалкила, алкильная группа связана с атомом азота в имидазолидиновом кольце в формуле I. Особенно очень предпочтительно R31 представляет двухвалентный остаток из ряда (C1-C6)-алкилена, необязательно замещенного (C6-C10)-арилена и (C6-C10)-арилен-(C1-C4)-алкила, который необязательно замещен в арильном остатке, в котором в случае ариленалкильного остатка алкильная группа связана с атомом азота в имидазолидиновом кольце в формуле I. Особенно предпочтительно R31 представляет двухвалентный остаток из ряда (C1-C6)-алкилена и (C6-C10)-арилен-(C1-C4)-алкила, который необязательно замещен в арильном остатке, в частности, (C6-C10)-арилен-(C1-C2)-алкила, который необязательно замещен в арильном остатке, в котором в случае ариленалкильного остатка алкильная группа связана с атомом азота в имидазолидиновом кольце в формуле I. Особенно очень предпочтительно R31 представляет двухвалентный остаток фениленметила (-С6Н4-СН2-), в частности остаток -(1,4-фенилен)-метила-, в котором метильная группа связана с атомом азота в имидазолидиновом кольце в формуле I и в котором фениленовый остаток является незамещенным или монозамещен или полизамещен, как описано выше, например, алкоксигруппой, такой как метокси или трифторметокси.
Если R3 представляет водород или один из остатков (C1-C10)-алкила, который может быть необязательно замещен фтором, необязательно замещенного (C6-C14)-арила, (C6-C14)-арил-(C1-C8)-алкила, который необязательно замещен в арильном остатке, необязательно замещенного гетероарила, гетероарил-(C1-C8)-алкила, который необязательно замещен в гетероарильном остатке, (C3-C8)-циклоалкила, (C3-C8)-циклоалкил-(C1-C8)-алкила, (C6-C12)-бициклоалкила, (C6-C12)-бициклоалкил-(C1-C8)-алкила, (C6-C12)-трициклоалкила, (C6-C12)-трициклоалкил-(C1-C8)-алкила, (C2-C8)-алкенила, (C2-C8)-алкинила, COOR21, CON(CH3)R4, CONHR4, COOR15, CON(CH3)R15 или CONHR15, предпочтение отдают е, равному 0, и h, равному 1.
Если R3 представляет R11NH, предпочтение отдают е, равному 1, и h, равному 0. В одном варианте реализации изобретения е равно 0, а h равно 1. В данном варианте реализации группа -NR-[C(R)(R)]e-C(R2)(R3)-[C(R)(R)]h-E в формуле I представляет предпочтительно группу -NH-CH(R3)-CH2-E.
Предпочтительными соединениями формулы I являются те соединения, в которых один или более из остатков имеют предпочтительные значения или имеют одно или более конкретных значений из их определений, причем все комбинации предпочтительных значений и/или конкретных значений являются предметом изобретения.
Особое предпочтение отдают соединениям формулы I, в которых W представляет двухвалентный остаток из ряда R1-A-C(R13) и
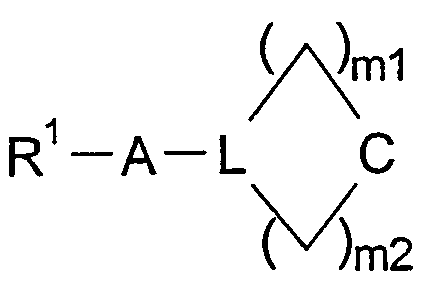
где кольцевые системы

могут содержать один или два одинаковых или различных кольцевых гетероатомов из ряда азота, кислорода и серы, могут быть насыщенными или мононенасыщенными или полиненасыщенными и могут быть замещены 1, 2 или 3 одинаковыми или различными заместителями R13 и/или одним или двумя оксозаместителями и/или тиоксозаместителями, и в которых L представляет C(R13) или N, и в которых m1 и m2, независимо друг от друга, равны одному из чисел 0, 1, 2, 3, 4, 5 и 6, а сумма m1 + m2 равна одному из чисел 1, 2, 3, 4, 5 или 6;
Y представляет карбонильную группу или тиокарбонильную группу;
А представляет прямую связь или один из двухвалентных остатков (C1-C6)-алкилена, (C3-C7)-циклоалкилена, фенилена, фенилен-(C1-C6)-алкила и фенилен-(C2-C6)-алкенила, где в остатках фениленалкила и фениленалкенила остаток R1 связан с фениленовой группой;
В представляет остаток из ряда (C1-C6)-алкилена, (C2-C6)-алкенилена, фенилена, фенилен-(C1-C3)-алкила, (C1-C3)-алкиленфенила и (C1-C3)-алкиленфенил-(C1-C3)-алкила, где (C1-C6)-алкиленовый остаток и (C2-C6)-алкениленовый остаток являются незамещенными или замещены одним или более одинаковыми или различными остатками из ряда (C1-C8)-алкила, (C2-C8)-алкенила, (C2-C8)-алкинила, (C3-C10)-циклоалкила, (C3-C10)-циклоалкил-(C1-C6)-алкила, необязательно замещенного (C6-C14)-арила, (C6-C14)-арил-(C1-C6)-алкила, который необязательно замещен в арильном остатке, необязательно замещенного гетероарила и гетероарил-(C1-C6)-алкила, который необязательно замещен в гетероарильном остатке;
Е представляет R8OCH2, R8CO-OCH2 или R10CO;
R представляет водород, (C1-C8)-алкил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил или (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, где все остатки R являются независимыми друг от друга и остатки R могут быть одинаковыми или различными;
R1 представляет водород, (C1-C10)-алкил, который может быть необязательно монозамещен или полизамещен фтором, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, R21-((C6-C14)-арил), который необязательно замещен в арильном остатке, (R21-((C6-C14)-арил))-(C1-C8)-алкил, который необязательно замещен в арильном остатке, оксо или тиоксо;
R2 представляет водород, (C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, или (C3-C8)-циклоалкил;
R3 представляет водород, (C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке, (C3-C8)-циклоалкил, (C3-C8)-циклоалкил-(C1-C8)-алкил, (C6-C12)-бициклоалкил, (C6-C12)-бициклоалкил-(C1-C8)-алкил, (C6-C12)-трициклоалкил, (C6-C12)-трициклоалкил-(C1-C8)-алкил, (C2-C8)-алкенил, (C2-C8)-алкинил или R11NH;
R8 представляет водород, (C1-C10)-алкил, необязательно замещенный (C6-C14)-арил или (C6-C14)-арил-(C1-C8)-алкил, необязательно замещенный в арильном остатке, где остатки R8 независимы друг от друга;
R10 представляет гидроксил, (C1-C8)-алкокси, (C6-C12)-арил-(C1-C8)-алкокси, необязательно замещенный в арильном остатке, необязательно замещенный (C6-C12)-арилокси, (C1-C8)-алкилкарбонилокси-(C1-C6)-алкокси, (C6-C12)-арил-(C1-C6)-алкилкарбонилокси-(C1-C6)-алкокси, который необязательно замещен в арильном остатке, (C1-C8)-алкоксикарбонилокси-(C1-C6)-алкокси, (C6-C12)-арил-(C1-C6)-алкоксикарбонилокси-(C1-C6)-алкокси, который необязательно замещен в арильном остатке, амино, моно- или ди-((C1-C10)-алкил)амино, или R8R8N-CO-(C1-C6)-алкокси, в котором остатки R8 независимы друг от друга и могут быть одинаковыми или различными;
R11 представляет водород, R12a, R12a-CO, H-CO, R12a-O-CO, R12b-CO, R12b-CS, R12a-S(O)2 или R12b-S(O)2;
R12а представляет (C1-C10)-алкил, (C2-C8)-алкенил, (C2-C8)-алкинил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил или гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке;
R12b представляет амино, ди-((C1-C10)-алкил)амино или R12а-NH;
R13 представляет водород, (C1-C6)-алкил, который может быть необязательно монозамещен или полизамещен фтором, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C6)-алкил, который необязательно замещен в арильном остатке, (C3-C8)-циклоалкил или (C3-C8)-циклоалкил-(C1-C6)-алкил;
R21 представляет водород, (C1-C8)-алкил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил или (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, где алкильные остатки могут быть монозамещены или полизамещены фтором;
R30 представляет один из остатков R32(R)N-CO-N(R)-R31, R32(R)N-CS-N(R)-R31, R32-CO-N(R)-R31, R32-CS-N(R)-R31, R32(R)N-CO-R31 и R32(R)N-CS-R31;
R31 представляет двухвалентный остаток -R33-R34-R35-R36-, где R36 связан с атомом азота в кольце имидазолидина в формуле I;
R32 представляет водород, (C1-C8)-алкил, который может быть необязательно замещен 1-8 атомами фтора, (C2-C8)-алкенил, (C2-C8)-алкинил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, (C6-C12)-бициклоалкил, (C6-C12)-бициклоалкил-(C1-C8)-алкил, (C6-C12)-трициклоалкил, (C6-C12)-трициклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил, (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил или гетероарил-(C1-C8)-алкил, который необязательно замещен в гетероарильном остатке;
R33 представляет прямую связь или двухвалентный остаток (C1-C6)-алкилена;
R34 представляет двухвалентный остаток из ряда (C1-C8)-алкилена, (C3-C12)-циклоалкилена, (C6-C12)-бициклоалкилена, (C6-C12)-трициклоалкилена, необязательно замещенного (C6-C14)-арилена и необязательно замещенного гетероарилена;
R35 представляет прямую связь или двухвалентный остаток (C1-C8)-алкилена;
R36 представляет прямую связь;
е и h равны, независимо друг от друга, 0 или 1;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимые соли.
Особое предпочтение отдают соединениям формулы I, в которых
W представляет двухвалентный остаток R1-A-C(R13);
Y представляет карбонильную группу;
А представляет прямую связь или один из двухвалентных остатков (C1-C6)-алкилена, (C3-C7)-циклоалкилена, фенилена, фенилен-(C1-C6)-алкила и фенилен-(C2-C6)-алкенила, где в остатках фениленалкила и фениленалкенила остаток R1 связан с фениленовой группой;
В представляет двухвалентный метиленовый остаток, где метиленовый остаток является незамещенным или замещен одним или двумя одинаковыми или различными остатками из ряда (C1-C8)-алкила, (C2-C8)-алкенила, (C2-C8)-алкинила, (C3-C10)-циклоалкила, (C3-C10)-циклоалкил-(C1-C6)-алкила, необязательно замещенного (C6-C14)-арила, (C6-C14)-арил-(C1-C6)-алкила, который необязательно замещен в арильном остатке;
Е представляет R10CO, R8O-CH2 или R8CO-O-CH2;
R представляет водород или (C1-C8)-алкил, где все остатки R независимы друг от друга, и остатки R могут быть одинаковыми или различными;
R1 представляет водород или (C1-C10)-алкил, который может быть необязательно монозамещен или полизамещен фтором;
R2 представляет водород или (C1-C8)-алкил;
R3 представляет водород или (C1-C8)-алкил, который может быть необязательно замещен 1-8 атомами фтора, необязательно замещенный (С6-С14)-арил, (С6-С14)-арил-(С1-С8)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(С1-С8)-алкил, который необязательно замещен в гетероарильном остатке, (С3-С8)-циклоалкил, (С3-С8)-циклоалкил-(С1-С8)-алкил, (С6-С12)-бициклоалкил, (С6-С12)-бициклоалкил-(С1-С8)-алкил, (С2-С8)-алкенил, (С2-С8)-алкинил или R11NH;
R8 представляет водород, (C1-C6)-алкил, необязательно замещенный (C6-C10)-арил или (C6-C10)-арил-(C1-C6)-алкил, необязательно замещенный в арильном остатке;
R10 представляет гидроксил, (C1-C8)-алкокси, (C6-C12)-арил-(C1-C8)-алкокси, необязательно замещенный в арильном остатке, необязательно замещенный (C6-C12)-арилокси, (C1-C8)-алкилкарбонилокси-(C1-C6)-алкокси, (C6-C12)-арил-(C1-C6)-алкилкарбонилокси-(C1-C6)-алкокси, который необязательно замещен в арильном остатке, (C1-C8)-алкоксикарбонилокси-(C1-C6)-алкокси, (C6-C12)-арил-(C1-C6)-алкоксикарбонилокси-(C1-C6)-алкокси, который необязательно замещен в арильном остатке, амино, моно- или ди-((C1-C8)-алкил)амино, аминокарбонил-(C1-C6)-алкокси, (моно- или ди-((C1-C8)-алкил)амино)карбонил-(C1-C6)-алкокси или (моно- или ди-((C6-C12)-арил-(C1-C6)-алкил))амино)-карбонил-(C1-C6)-алкокси или (N-((C1-C8)-алкил)-N-((C6-C12)-арил)-(C1-C6)-алкил)амино)-карбонил-(C1-C6)-алкокси, оба из которых являются необязательно замещены в арильном остатке;
R11 представляет водород, R12a, R12a-CO, R12a-O-CO, R12b-CO, R12b-CS или R12b-S(O)2;
R12а представляет (C1-C10)-алкил, (C2-C8)-алкенил, (C2-C8)-алкинил, (C5-C10)-циклоалкил, (C5-C10)-циклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил или (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке;
R12b представляет амино, ди-(((C1-C10)-алкил)амино или R12а-NH;
R13 представляет водород или (C1-C6)-алкил, который может быть необязательно монозамещен или полизамещен фтором;
R30 представляет один из остатков R32(R)N-CO-N(R)-R31 и R32(R)N-CS-N(R)-R31;
R31 представляет двухвалентный остаток -R33-R34-R35-R36-, где R36 связан с атомом азота в кольце имидазолидина в формуле I;
R32 представляет водород, (C1-C8)-алкил, который может быть необязательно замещен 1-8 атомами фтора, (C2-C8)-алкенил, (C2-C8)-алкинил, (C3-C12)-циклоалкил, (C3-C12)-циклоалкил-(C1-C8)-алкил, (C6-C12)-бициклоалкил, (C6-C12)-бициклоалкил-(C1-C8)-алкил, (C6-C12)-трициклоалкил, (C6-C12)-трициклоалкил-(C1-C8)-алкил, необязательно замещенный (C6-C14)-арил или (C6-C14)-арил-(C1-C8)-алкил, который необязательно замещен в арильном остатке;
R33 представляет прямую связь или двухвалентный остаток (C1-C6)-алкилена;
R34 представляет двухвалентный остаток из ряда (C1-C8)-алкилена, (C5-C10)-циклоалкилена, (C6-C12)-бициклоалкилена и необязательно замещенного (C6-C14)-арилена;
R35 представляет прямую связь или двухвалентный остаток (C1-C8)-алкилена;
R36 представляет прямую связь;
е и h равны, независимо друг от друга, 0 или 1;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимым солям.
Особое предпочтение отдают соединениям формулы I, в которых
W представляет двухвалентный остаток R1-A-C(R13);
Y представляет карбонильную группу;
А представляет прямую связь или двухвалентный остаток (C1-C6)-алкилена;
В представляет двухвалентный метиленовый остаток, где метиленовый остаток является незамещенным или замещен одним или двумя одинаковыми или различными остатками из ряда (C1-C8)-алкила, (C3-C6)-циклоалкил-(C1-C6)-алкила и (C6-C10)-арил-(C1-C6)-алкила, который необязательно замещен в арильном остатке;
Е представляет R10CO, HO-CH2 или R8CO-O-CH2;
R представляет водород или (C1-C8)-алкил, где все остатки R независимы друг от друга и остатки R могут быть одинаковыми или различными;
R1 представляет водород или (C1-C10)-алкил, который может быть необязательно монозамещен или полизамещен фтором;
R2 представляет водород;
R3 представляет водород, (C1-C8)-алкил, который может быть необязательно замещен 1-6 атомами фтора, необязательно замещенный (С6-С10)-арил, (С6-С10)-арил-(С1-С6)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(С1-С6)-алкил, который необязательно замещен в гетероарильном остатке, (С3-С8)-циклоалкил или (С3-С8)-циклоалкил-(С1-С6)-алкил;
R8 представляет водород, (C1-C6)-алкил или фенил-(C1-C4)-алкил, который необязательно замещен в фенильном остатке;
R10 представляет гидроксил, (C1-C8)-алкокси, (C6-C10)-арил-(C1-C6)-алкокси, необязательно замещенный в арильном остатке, необязательно замещенный (C6-C10)-арилокси, (C1-C6)-алкилкарбонилокси-(C1-C6)-алкокси или (C1-C6)-алкоксикарбонилокси-(C1-C6)-алкокси;R13 представляет водород или (C1-C6)-алкил, который может быть необязательно монозамещен или полизамещен фтором;
R30 представляет один из остатков R32(R)N-CO-N(R)-R31 и R32(R)N-CS-N(R)-R31;
R31 представляет двухвалентный остаток -R33-R34-R35-R36-, где R36 связан с атомом азота в кольце имидазолидина в формуле I;
R32 представляет водород, (C1-C6)-алкил, который может быть необязательно замещен 1-6 атомами фтора, необязательно замещенный (C6-C10)-арил или (C6-C10)-арил-(C1-C6)-алкил, который необязательно замещен в арильном остатке;
R33 представляет прямую связь или двухвалентный остаток (C1-C4)-алкилена;
R34 представляет двухвалентный остаток из ряда (C1-C6)-алкилена, (C5-C6)-циклоалкилена и необязательно замещенного (C6-C10)-арилена;
R35 представляет прямую связь или двухвалентный остаток (C1-C4)-алкилена;
R36 представляет прямую связь;
е и h равны, независимо друг от друга, 0 или 1;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимым солям.
Очень особое предпочтение отдают соединениям формулы I, в которых
W представляет двухвалентный остаток R1-A-C(R13);
Y представляет карбонильную группу;
А представляет прямую связь;
В представляет двухвалентный метиленовый остаток, который замещен изобутилом или циклопропилметилом;
Е представляет R10CO или HO-CH2;
R представляет водород;
R1 представляет метил или трифторметил;
R2 представляет водород;
R3 представляет водород, (C1-C8)-алкил, который может быть необязательно замещен 1-6 атомами фтора, необязательно замещенный (С6-С10)-арил, (С6-С10)-арил-(С1-С4)-алкил, который необязательно замещен в арильном остатке, необязательно замещенный гетероарил, гетероарил-(С1-С4)-алкил, который необязательно замещен в гетероарильном остатке, (С3-С8)-циклоалкил или (С3-С8)-циклоалкил-(С1-С4)-алкил;
R10 представляет гидроксил, (C1-C8)-алкокси, (C6-C10)-арил-(C1-C6)-алкокси, необязательно замещенный в арильном остатке, необязательно замещенный (C6-C10)-арилокси, (C1-C6)-алкилкарбонилокси-(C1-C6)-алкокси или (C1-C6)-алкоксикарбонилокси-(C1-C6)-алкокси;
R13 представляет метил или трифторметил;
R30 представляет один из остатков R32(R)N-CO-N(R)-R31 и R32(R)N-CS-N(R)-R31;
R31 представляет двухвалентный остаток фениленметила, который необязательно замещен в фенильном остатке, где метильная группа фениленметильного остатка связана с атомом азота в имидазолидиновом кольце в формуле I;
е равно 0 и h равно 1;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимым солям.
В целом, предпочтение отдают соединениям формулы I, которые присутствуют в одинаковой конфигурации или в по существу одинаковой конфигурации, в одном или более хиральных центрах, например у атома углерода, несущего остатки R2 и R3 и/или в центре W в имидазолидиновом кольце в формуле I, при условии, что они соответствующим образом замещены для того, чтобы быть хиральными. То есть предпочтение отдают соединениям, которые присутствуют однородно или по существу однородно в конфигурации R или конфигурации S в одном или более хиральных центрах, но не присутствуют в виде смеси RS. Однако отдельные хиральные центры в указанных соединениях формулы I могут проявлять конфигурацию R или конфигурацию S независимо друг от друга и могут иметь одинаковые или различные конфигурации.
Соединения формулы I можно получить восстановительным аминированием соединения формулы II
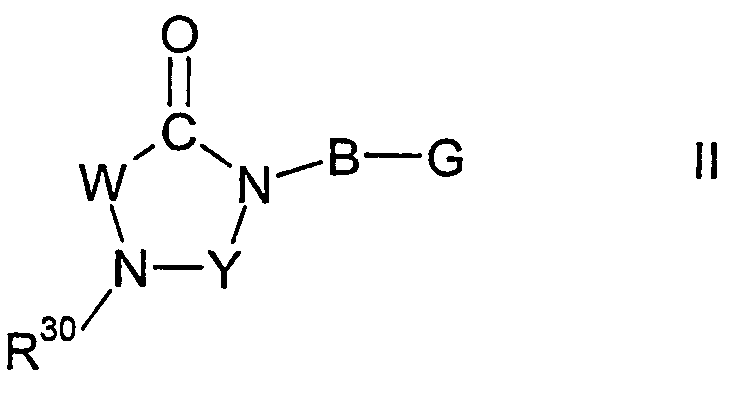
с соединением формулы III,
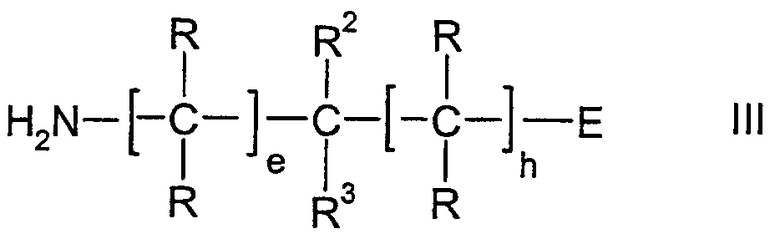
где в формулах II и III группы B, E, W, Y, R, R2, R3 и R30 и е и h определены, как указано выше, или, кроме того, функциональные группы могут присутствовать в данных группах в защищенной форме или в форме предшественников, и где G представляет альдегидную группу СНО. Когда нужно получить соединения формулы I, в которых группа, например группа R3, представляет группу, полученную из карбоновой кислоты, или содержит такую группу, соответствующую группе, например, R3, в соединениях формулы III может исходно присутствовать гидроксикарбонильная группа, которая присутствует в защищенной форме, или содержаться такая группа, причем желательную конечную группу R3 синтезируют лишь в последующем в одну или более дополнительных стадий. Предшественники функциональных групп представляют собой группы, которые могут быть превращены в желательную функциональную группу с использованием обычных способов синтеза, которые известны специалисту в данной области. Например, нитрогруппу можно превратить в аминогруппу восстановлением, например, каталитическим гидрированием, и она может рассматриваться как предшественник аминогруппы или группы, которую можно получить из аминогруппы посредством дальнейших реакций. Цианогруппу, которую можно превратить восстановлением в аминометильную группу или гидролизом в карбоксамидную группу или группу карбоновой кислоты, можно рассматривать как предшественник указанных групп. Спиртовую группу, которую можно окислить с получением альдегидной группы или кетонной группы, можно рассматривать как предшественник указанных групп. Однако предшественник группы может также представлять собой группу, из которой относительно бульшую часть молекулы-мишени можно синтезировать в несколько стадий, которые проводят последовательно. Примеры защитных групп, которые присоединены к молекуле перед проведением взаимодействия или последовательности взаимодействий и которые в последующем отщепляются снова, указаны выше.
Аминосоединения формулы III коммерчески доступны или их можно синтезировать хорошо известными стандартными способами, или по аналогии с такими способами из исходных соединений, которые коммерчески доступны или которые можно получить, как описано в литературе, или по аналогии с методиками, описанными в литературе. Например, оптически активные 3-замещенные 3-аминопропионовые кислоты формулы III или их сложные эфиры, в частности сложные 3-арил-3-аминопропионовые эфиры, можно получить из соответствующих 3-замещенных акриловых кислот, которые можно получить из соответствующих альдегидов. 3-Замещенные акриловые кислоты могут быть, например, превращены в хлорангидриды оксалилхлоридом, а указанные хлорангидриды могут быть превращены спиртами в сложные эфиры, например в сложные трет-бутиловые эфиры с использованием трет-бутанола. Для введения аминогруппы затем можно подвергнуть взаимодействию с литиевой солью оптически активного амина, например с литиевой солью (R)-(+)-N-бензил-N-(1-фенилэтил)амина, а в последующем бензильную группу и фенилэтильную группу в полученном в результате 3-замещенном трет-бутил-3-(N-бензил-N-(1-фенилэтил)амино)пропионате можно отщепить посредством каталитического гидрирования (см. публикации S.G.Davies et al., Tetrahedron: Asymmetry 2, 183 (1991) и J. Chem. Soc. Perkin Trans 1, 1129, (1994)). Для получения соединений формулы III, в которых Е представляет гидроксиметильную группу СН2ОН или этерифицированную гидроксиметильную группу, можно использовать в реакции конденсации 3-замещенные 3-аминопропанолы или их простые эфиры, которые можно получить из 3-замещенных 3-аминопропионовых кислот или их сложных эфиров восстановлением кислотной группы или группы сложного эфира, например из сложного этилового эфира или сложного трет-бутилового эфира с использованием литийалюминийгидрида или литийалюминийгидрида/алюминийтрихлорида.
Восстановительное аминирование соединений формулы II с соединениями формулы III можно проводить в стандартных условиях, которые хорошо известны специалисту в данной области (см., например, публикации J. Matrinez et al., J. Med. Chem. 1985, 28, 1874; L. Kosynkina et al., Tetrahedron Lett. 1994, 35, 5173; T. Kolter et al., Liebigs Ann. 1995, 625). Кроме использования сложных гидридов, такого как использование цианоборгидрида натрия, восстановление иминового промежуточного соединения, которое первоначально образуется при реакции восстановительного аминирования из альдегида и амина, можно также осуществить, например, с использованием водорода в присутствии металлического катализатора, такого как палладий/активированный уголь. Как уже указывалось в общем плане, при проведении реакции восстановительного аминирования может быть предпочтительно или необходимо, чтобы функциональные группы были защищены защитными группами, которые затем удаляют подходящим образом после реакции.
Соединения формулы II, в которых G представляет альдегидную группу СНО, можно получить из соответствующих карбоновых кислот или из производных соответствующих карбоновых кислот, то есть из соответствующих соединений формулы IV,
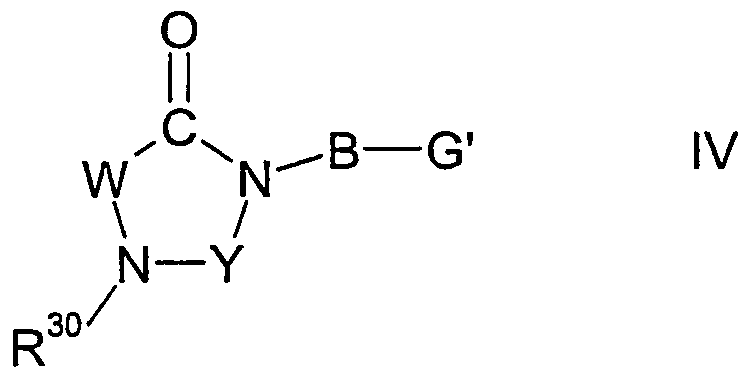
в которой G' представляет группу карбоновой кислоты СООН или производное группы карбоновой кислоты, например группу сложного эфира, такого как группа сложного (C1-C6)-алкилового эфира, или подходящую амидную группу, а другие группы имеют значения, приведенные выше для формулы II. Карбоновую кислоту формулы IV или ее сложный эфир можно сначала восстановить в спирт, то есть в соединение формулы IV, которое содержит гидроксиметильную группу СН2ОН, вместо группы G', например, с использованием литийалюминийгидрида, а полученный в результате спирт можно в последующем окислить до альдегида, например, с использованием метода Сверна в присутствии диметилсульфоксида. По другой методике получения альдегидов соединения формулы IV, в которых G' представляет гидроксикарбонил, например, подвергают взаимодействию с N-метокси-N-метиламином с применением стандартных способов получения амидов с получением соответствующих N-метокси-N-метиламидов (амидов Weinreb), которые в последующем восстанавливают в альдегиды, например, с использованием литийалюминийгидрида (см., например, публикацию J.-A. Fehrentz, B. Castro, Synthesis 1983, 676). Как уже указывалось в общем плане, в данных реакциях также может быть предпочтительнее или необходимо, чтобы функциональные группы были защищены защитными группами, которые затем удаляют подходящим образом после реакции, или чтобы функциональные группы присутствовали в форме предшественников.
Соединения формулы IV, в которых W представляет R1-A-C(R13), а Y представляет карбонильную группу, можно получить, например, сначала взаимодействием соединений формулы V
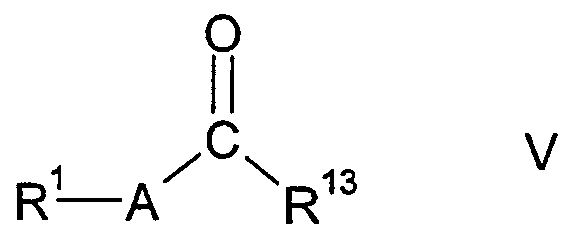
по реакции Бухерера, например, с использованием карбоната аммония и цианида калия, с получением соединений формулы VI

где в формулах V и VI группы R1, R13 и А определены, как указано выше.
Соединения формулы VII,
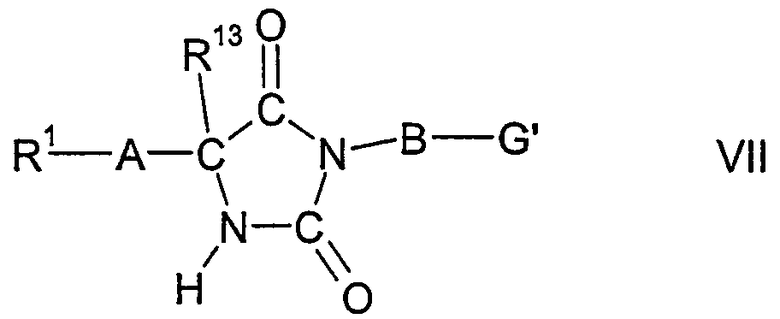
в которой R1, R13, А и В определены, как указано выше, а G' представляет (C1-C6)-алкоксикарбонил или гидроксикарбонил, можно затем получить, например, сначала взаимодействием соединений формулы VI с алкилирующим реагентом, который вводит в молекулу остаток -B-G'. Последующее взаимодействие соединений формулы VII с реагентом формулы R30-LG, в которой R30 имеет указанные выше значения, а LG представляет способную к нуклеофильному замещению удаляемую группу, например галоген, такой как хлор или бром, сульфонилоксигруппу, такую как тозилокси, метилсульфонилокси или трифторметилсульфонилокси, (C1-C4)-алкокси, необязательно замещенную фенокси или гетероциклическую удаляемую группу, такую как имидазолил, затем приводит к получению соответствующих соединений формулы IV, в которых G' представляет (C1-C6)-алкоксикарбонил или гидроксикарбонил, а W представляет R1-A-C(R13).
В целом, может также быть предпочтительнее, в зависимости от значений остатка R30 и других остатков не использовать реагент R30-LG для введения конечного остатка R30 непосредственно в молекулу, но, вместо этого, синтезировать остаток R30 на имидазолидиновом кольце после присоединения предшественника группы R30 к имидазолидиновому кольцу. Это может быть осуществлено, например, на стадии синтеза соединения формулы VII или на стадии синтеза другого промежуточного соединения. В качестве примера данный подход описан ниже с использованием соединений, в которых R30 представляет группу мочевины R32(R)N-CO-N(R)-R31. Соединения формулы IV, в которых R30 представляет R32(R)N-CO-N(R)-R31, можно получить в соответствии с данным подходом, например, сначала взаимодействием соединения формулы VII с реагентом формулы PG-N(R)-R31-LG, в которой LG представляет способную к нуклеофильному замещению удаляемую группу, как объяснено выше, с получением соединения формулы VIII
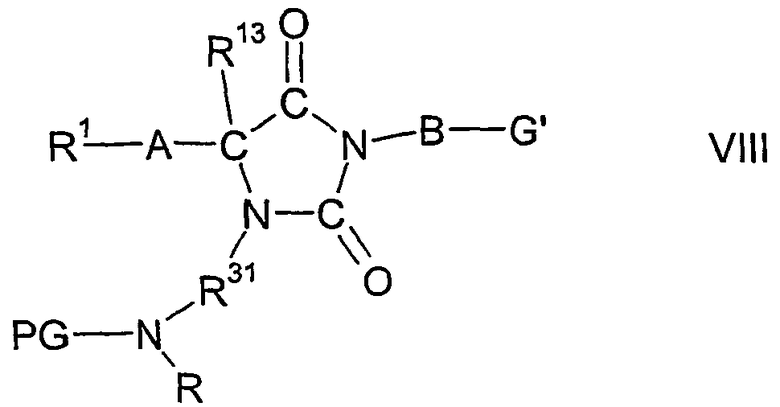
в которой PG представляет аминозащитную группу, например трет-бутоксикарбонил или бензилоксикарбонил, и в которой другие радикалы имеют значения, приведенные выше для соединений формулы VII и I. После удаления защитной группы PG соединения формулы IV, в которой R30 представляет R32NH-CO-N(R)-R31, затем получают взаимодействием образовавшейся аминогруппы -NHR с изоцианатом формулы R32-N=C=O. Соединения формулы IV, в которой R30 представляет R32(R)N-CO-N(R)-R31, получают использованием в реакции, например, карбамоилхлорида формулы R32(R)N-CO-Cl. Соответствующим образом аналогичные производные тиомочевины можно получить с использованием изотиоцианатов и тиокарбамолихлоридов. (Тио)ациламины, сульфониламины, сульфиниламины и сульфамиды можно получить взаимодействием аминогруппы с реакционноспособными производными карбоновой кислоты, производными тиокарбоновой кислоты, производными сульфоновой кислоты, производными сульфиновой кислоты и сульфамоилхлоридами. Точно как соединения формулы VIII, можно также получить и использовать на последующих стадиях реакции соединения, в которых в формуле VIII группа PG-N(R)- была заменена группой, которая представляет собой предшественник аминогруппы и которая затем превращается в аминогруппу на последующей стадии реакции. Например, сначала можно осуществить взаимодействие соединения формулы VII с нитросоединением формулы O2N-R31-LG или цианосоединением формулы NC-R31-LG с получением соединения, соответствующего соединению формулы VIII, в котором нитрогруппа или цианогруппа может быть превращена, например, каталитическим гидрированием в аминогруппу, причем данную аминогруппу можно затем превратить в желательную группу-мишень, например, с использованием изоцианата формулы R32-N=C=O с получением производного мочевины, в котором R30 представляет R32NH-CO-NH-R31, или также с использованием других соединений. Данный подход можно использовать для синтеза большого числа других соединений формулы I, причем реакции, которые предстоит выполнить, представляют собой стандартные способы, которые знакомы специалисту в данной области.
В целом, отдельные стадии, выполняемые при получении соединений формулы I, можно проводить с использованием способов, которые известны как таковые и знакомы специалисту в данной области, или по аналогии с такими способами. Как уже объяснялось, в зависимости от конкретного случая может быть целесообразно на всех стадиях, включенных в синтез соединений формулы I, временно блокировать функциональные группы, которые могут быть способны привести к побочным реакциям или нежелательным реакциям, с использованием стратегии защитной группы, которая приспособлена к пути синтеза, как известно специалисту в данной области. Объясненный выше подход без введения функциональных групп непосредственно в молекулу в их конечной форме, а, вместо этого, первоначальное введение предшественников в молекулу, а затем синтез конечной функциональной группы на стадии промежуточного соединения может, как уже было указано, также применяться соответственно для других частей молекулы формулы I, например для группы R1 или для группы R3.
Соединения формулы IV, в которых W представляет
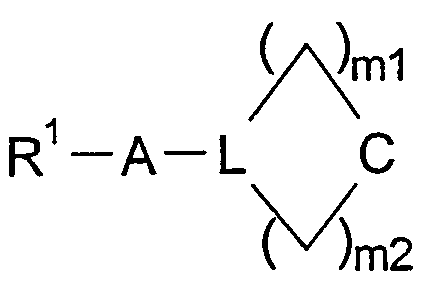
а Y представляет карбонильную группу, можно получить, например, взаимодействием соединений формулы IX,
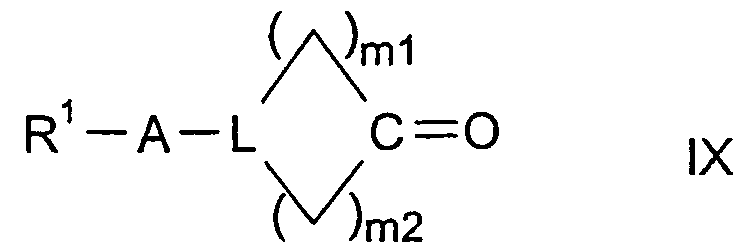
в которой R1, A, L, m1 и m2 являются такими, как определено выше, по реакции Бухерера, как описано выше для получения соединений формулы VI, с получением соединений формулы Х
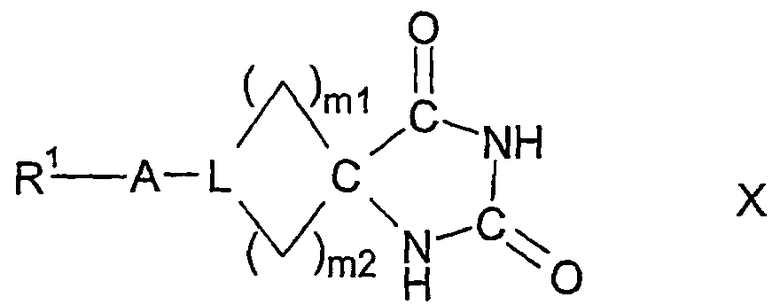
и превращением указанных соединений с использованием реагента, который вводит в молекулу остаток -B-G', как описано выше для получения соединений формулы VII, в соединения формулы XI
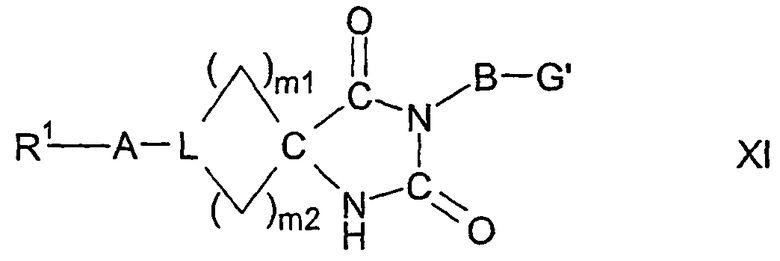
где в соединениях формул X и XI группы R1, A, B и L и m1 и m2 имеют указанные выше значения, а G' определена, как в формуле IV. Затем соединения формулы XI могут быть подвергнуты взаимодействию, в соответствии с описанными выше реакциями соединений формулы VII, например, с реагентом формулы R30-LG или реагентом формулы PG-N(R)-R31-LG.
Если W представляет остаток R1-A-C(R13)=C или остаток
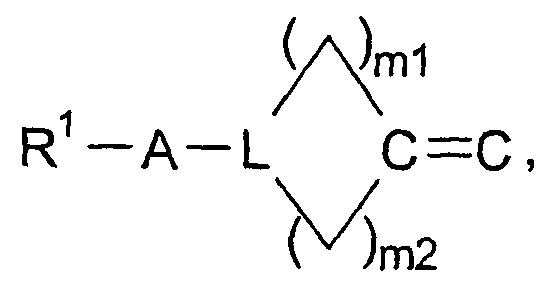
данный структурный элемент можно, например, ввести конденсацией соответствующего альдегида или соответствующего кетона, по аналогии с известными способами, с диоксо- или тиоксооксоимидазолидином, который содержит незамещенную метиленовую группу в положении, которое соответствует группе W в формуле I или группе R1-A-C(R13) в формуле VI.
Соединения формулы I, в которой W представляет R1-A-C(R13), можно также получить взаимодействием соединения формулы XII,
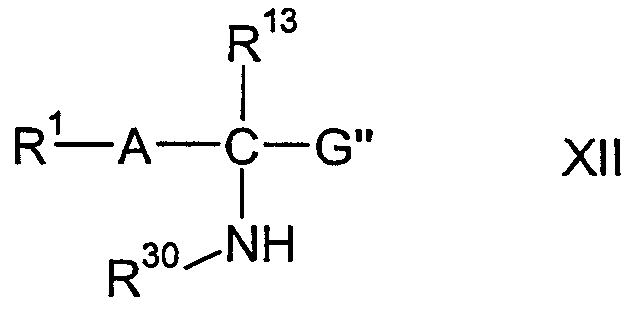
в которой А, R1, R13 и R30 определены, как указано выше, а G" представляет, например, группу сложного эфира, такую как (C1-C6)-алкоксикарбонил, с изоцианатом или изотиоцианатом формулы XIII
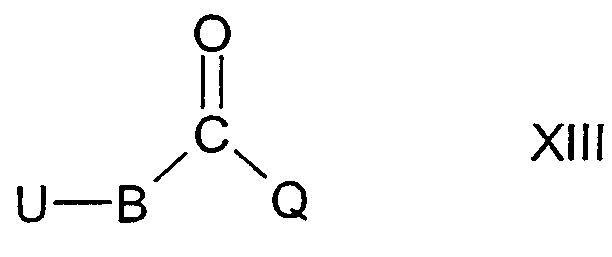
в которой В определено, как указано выше для формулы I, и U представляет изоцианато или изотиоцианато, а Q представляет алкоксигруппу, например (C1-C4)-алкоксигруппу, такую как метокси, этокси или трет-бутокси, (C6-C14)-арилоксигруппу, такую как фенокси, или (C6-C14)-арил-(C1-C4)-алкоксигруппу, такую как бензилокси. Данная реакция приводит к получению соединения формулы XIV
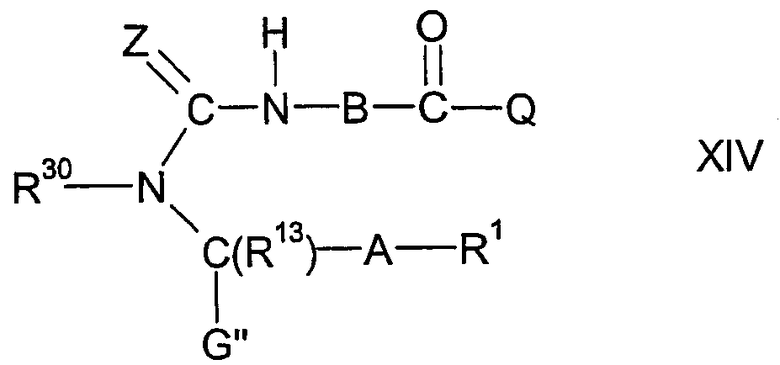
в которой Z представляет кислород или серу, а A, B, G", Q, R1, R13 и R30 определены, как указано для формул XII и XIII, причем соединение затем подвергают циклизации под влиянием кислоты или основания с получением соединения формулы XV,
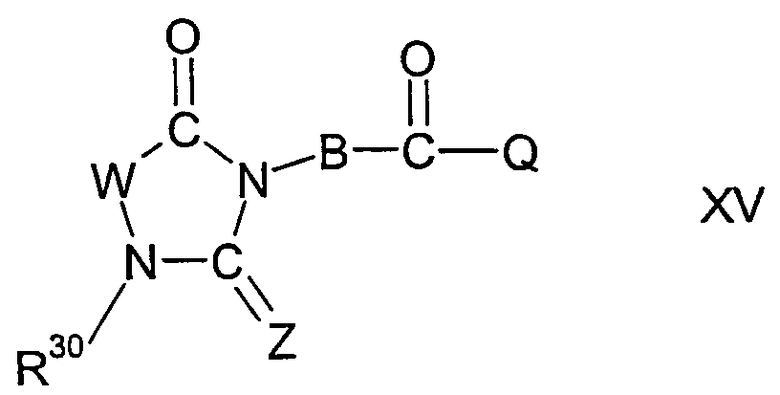
W представляет R1-A-C(R13), а Z, B, Q и R30 определены, как указано выше. Циклизация может быть достигнута катализом с помощью основания, например обработкой гидридом натрия в инертном апротонном растворителе, таком как диметилформамид. Соединение формулы I, в котором W представляет R1-A-C(R13), можно затем получить из соединения формулы XV, например, гидролизом группы CO-Q с получением карбоновой кислоты СООН, превращением ее в амид Weinreb, восстановлением амида Weinreb в соответствующий альдегид и впоследствии выполнением восстановительного аминирования с использованием соединения формулы III, как описано выше для восстановительного аминирования соединений формулы II. В данном способе синтеза также может быть целесообразно, чтобы функциональные группы присутствовали в защищенной форме или в форме предшественников.
Соединения формулы I, в которых Y представляет карбонильную группу, можно также получить сначала сочетанием соединения формулы XVI,
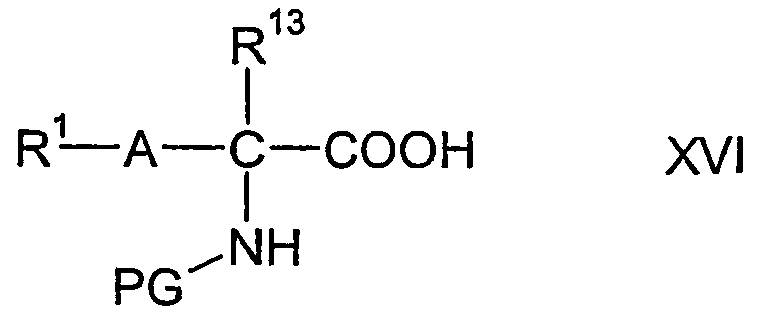
в которой A, R1 и R13 имеют указанные выше значения, а PG представляет аминозащитную группу, такую как бензилоксикарбонильная группа, с использованием стандартного способа образования амидной связи, с соединением формулы XVII,
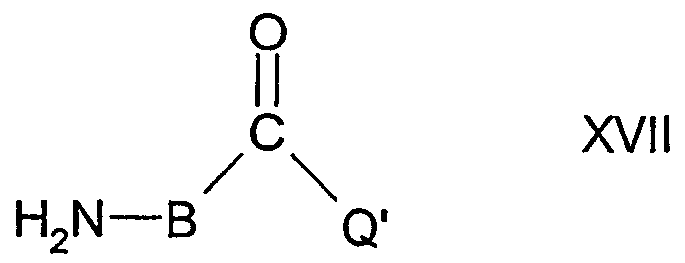
в которой В имеет указанные выше значения, а COQ' представляет защищенную группу карбоновой кислоты, например алкоксикарбонильную группу, такую как трет-бутоксикарбонил, с получением соединения формулы XVIII

в которой R1, R13, A, B, PG и COQ' имеют указанные выше значения. Защитную группу PG в соединении формулы XVIII можно затем селективно удалить из аминогруппы, например, посредством гидрирования в случае бензилоксикарбонильной группы, и можно выполнить закрытие кольца введением карбонильной группы с получением соединения формулы XIX,
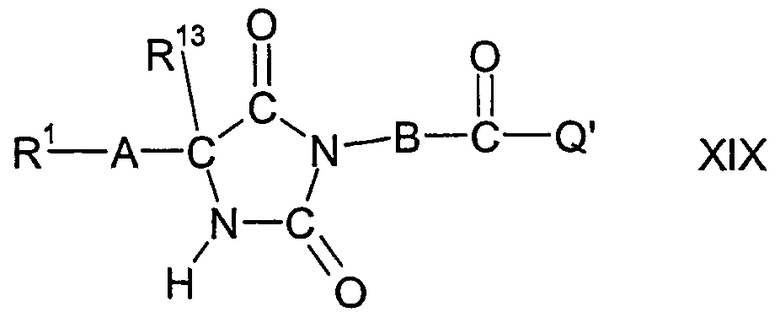
в которой R1, R13, A, B и COQ' имеют указанные выше значения. Фосген или эквивалент фосгена, такой как дифосген или трифосген, можно использовать, например, для введения карбонильной группы. В качестве промежуточной стадии при превращении соединения формулы XVIII в соединение формулы XIX, например изоцианат может появиться или может быть получен специально. Превращение соединения формулы XVIII в соединение формулы XIX может проходить в одну или более стадий. Например, циклизация, которую осуществляют после того, как карбонильная группа была введена, можно провести подобно описанным выше циклизациям, отдельно в присутствии основания, такого как гидрид натрия. Соединения формулы XVIII, в которых PG представляет алкоксикарбонильную группу, арилалкоксикарбонильную группу или арилоксикарбонильную группу, можно также превратить непосредственно в соединения формулы XIX без синтетического образующего блока, такого как фосген, используемого для введения карбонильной группы. Если, например, соединения формулы XVIII, в которых PG представляет бензилоксикарбонил, обрабатывают основанием, таким как гидрид натрия или карбонат натрия, то можно получить соединения формулы VII непосредственно.
Соединения формулы IV, в которых G' представляет гидроксикарбонильную группу СООН, можно преимущественно получить из соединений формулы ХХ,
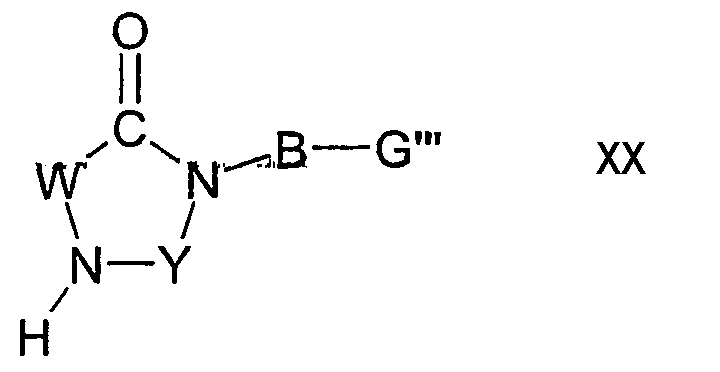
в которой G"' представляет гидроксикарбонильную группу, а W и Y являются такими, как определено выше, взаимодействием соединений формулы ХХ в присутствии избыточного основания, например в присутствии избытка н-бутиллития, с алкилирующим реагентом, например с алкилирующим агентом формулы R30-LG, в которой R30 и LG определены выше, и последующего подкисления. При проведении указанной реакции алкилирования также может быть целесообразно для функциональных групп присутствовать в защищенной форме или в форме предшественника. В зависимости от значения остатка R30 и других остатков может также быть предпочтительным в случае указанной реакции синтезировать остаток R30 на имидазолидиновом кольце, как объяснено выше.
Соединения формулы I можно, кроме того, получить восстановлением амидной группы C(=O)-NR в соединениях формулы XXI,
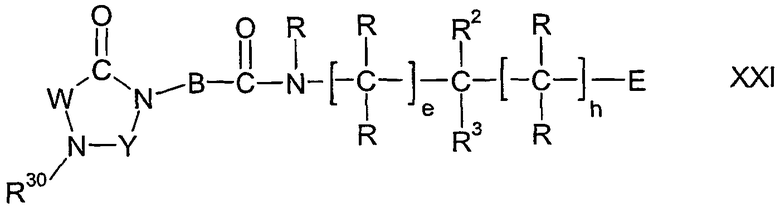
в которой B, E, W, Y, R, R2, R3, R30, e и h имеют значения, приведенные для соединений формул II и III, в аминогруппу CH2-NR в условиях, известных специалисту в данной области, например, с использованием боран-диметилсульфидного комплекса. Соединения формулы XXI можно получить, используя стандартные способы образования амидных связей, из соединений формулы III или аналогичных соединений, которые содержат группу RNH вместо концевой группы H2N в формуле III, и соединений формулы IV.
Следующие реагенты, например, можно использовать для получения гуанидиногруппы, содержащейся в остатке R1, из аминогруппы, причем аминогруппу, в свою очередь, можно получить, например, из нитрогруппы или цианогруппы восстановлением:
a) О-метилизомочевины (S. Weiss and H. Krommer, Chemiker-Zeitung 98 (1974), 617-618),
b) S-метилизотиомочевины (R.F. Borne, M.L. Forrester and I.W. Waters, J. Med. Chem. 20(1977), 771-776),
c) нитро-S-метилизотиомочевины (L.S. Hafner and R.E. Evans, J. Org. Chem. 24(1959) 57),
d) формамидиносульфоновой кислоты (K. Kim, Y.-T. Lin and H.S. Mosher, Tetrah. Lett. 29 (1988), 3183-3186),
e) нитрата 3,5-диметил-1-пиразолилформамидиния (F.L. Scott, D.G. O'Donovan and J. Reilly, J. Amer. Chem. Soc. 75 (1953), 4053-4054),
f) N,N'-ди-трет-бутилоксикарбонил-S-метилизотиомочевины (R.J. Bergeron and J.S. McManis, J. Org. Chem. 52 (1987), 1700-1703),
g) N-алкоксикарбонил-, N,N'-диалкоксикарбонил-, N-алкилкарбонил- и N,N'-диалкилкарбонил-S-метилизотиомочевины (H. Wollweber, H. Kölling, E. Niemers, A. Widdig, P. Andrews, H.-P- Schulz and H. Thomas, Arzneim. Forsch./Drug Res. 34 (1984), 531-542).
Амидины можно получить из соответствующих цианосоединений добавлением спиртов, например метанола или этанола, в кислой безводной среде, например диоксане, метаноле или этаноле, и последующим аминолизом, например обработкой аммиаком в спиртах, таких как изопропанол, метанол или этанол (G. Wagner, P. Richter and Ch. Garbe, Pharmazie 29 (1974), 12-55). Другим способом получения амидинов является добавление сероводорода к цианогруппе с последующим метилированием полученного тиоамида и последующее взаимодействие с аммиаком (Патент ГДР № 235866). Кроме того, гидроксиламин можно добавить к цианогруппе с получением N-гидроксиамидинов, которые, при желании, можно аналогичным образом превратить в амидины, например, путем гидрирования.
Соединения формулы I, в которых W представляет (CF3)2C, можно получить, например, превращением соединения формулы VII, в которой R1 представляет трифторметил, А представляет прямую связь, а R13 представляет трифторметил, как объяснено выше для соединений формулы VII, в соединение формулы IV, в которой G' представляет (C1-C6)-алкоксикарбонил или гидроксикарбонил, из которого можно получить соответствующее соединение формулы II, в которой G представляет СНО, как описано выше. Соединения формулы VII, в которой остатки R1-A- и R13 представляют трифторметил, а G' представляет группу сложного эфира, такую как (C1-C6)-алкоксикарбонил, то есть имеет значение G", можно преимущественно получить взаимодействием изонитрила формулы XXII с 2-трет-бутокси-4,4-бис(трифторметил)-1,3-оксазабута-1,3-диеном формулы XXIII с получением соединения формулы XXIV:
где В и G" имеют указанные выше значения, то есть группа G" представляет (C1-C6)-алкоксикарбонил, например (C1-C4)-алкоксикарбонил, такой как метокси, этокси или трет-бутокси. Взаимодействие соединений формул XXII и XXIII с получением соединений формулы XXIV преимущественно проводят при нагревании в углеводороде или простом эфире в качестве растворителя, например в бензоле или толуоле. Изоцианиды (изонитрилы) формулы XXII можно получить, используя стандартные способы, известные специалисту в данной области, из соответствующих сложных эфиров аминокислоты формулы H2N-B-G", в которой B и G" имеют указанные выше значения. Преимущественно сложный эфир аминокислоты формулы H2N-B-G" сначала превращают взаимодействием с реакционноспособным сложным эфиром муравьиной кислоты, например цианометилформиатом, в сложный эфир N-формиламинокислоты формулы HC(=O)-NH-B-G", который затем превращают, например, взаимодействием с фосгеном или эквивалентом фосгена, таким как дифосген или трифосген, в присутствии третичного амина, такого как триэтиламин, в изоцианид формулы XXII. 2-трет-Бутокси-4,4-бис(трифторметил)-1,3-оксазабута-1,3-диен формулы XXIII можно получить, используя способ, описанный Steglich et al., Chemische Berichte 107 (1974), 1488, из трет-бутилкарбамата (трет-бутоксикарбониламида) и безводного гексафторацетона и с последующей обработкой 2-трет-бутоксикарбониламино-2-гидрокси-1,1,1,3,3,3-гексафтопропана, который первоначально получают с трифторуксусным ангидридом в присутствии основания, такого как хинолин.
Стандартные способы можно использовать для превращения соединений формулы I, в которых Е представляет, например, гидроксикарбонил или гидроксиметил, в соединения формулы I, в которых Е имеет другие значения, или в другие пролекарства, или производные соединений формулы I. Так, для получения сложных эфиров, например, соединения формулы I, в которых Е представляет гидроксикарбонил, можно этерифицировать спиртами, например, в присутствии конденсирующего реагента, такого как карбонилдиимидазол или карбодиимид, такой как DCC (дициклогексилкарбодиимид), или соединения формулы I, в которых Е представляет гидроксикарбонил, можно алкилировать алкилгалогенидами, такими как алкилхлориды или алкилбромиды, например, используя амиды хлоралкановой кислоты, с получением соединений формулы I, в которой Е представляет R8R8N-CO-алкокси-СО-, или используя ацилоксиалкилгалогениды, с получением соединений формулы I, в которых Е представляет ацилоксиалкокси-СО-. Соединения формулы I, в которых Е представляет гидроксикарбонил, можно превратить в амиды, используя аммиак или органические амины, в присутствии конденсирующего реагента. Соединения формулы I, в которых Е представляет CO-NH2, можно преимущественно также получить в твердой фазе сочетанием соединения, в котором Е представляет СООН, в присутствии конденсирующего агента, такого как TOTU (тетрафторборат О-((циано(этоксикарбонил)метилен)амино)-N,N,N',N'-тетраметилурония), с амидной смолой Rink, а затем его отщепления от смолы с использованием трифторуксусной кислоты. Соединения формулы I, в которых Е представляет гидроксиметильную группу СН2ОН, можно превратить в простой или сложный эфир у гидроксиметильной группы, используя стандартные способы. Стандартные способы для селективного окисления спиртов в альдегиды, например, с использованием гипохлорита натрия в присутствии 4-ацетамидо-2,2,6,6-тетраметил-1-пиперидинилокси (4-ацетамидо-ТЕМРО) можно использовать для превращения соединений формулы I, в которых Е представляет СН2ОН, в соединения формулы I, в которых Е представляет альдегидную группу -СНО.
Кроме того, в отношении получения соединений формулы I, содержание WO-A-95/14008, EP-A-796855 и заявок, соответствующих ему, ЕР-А-918059 и заявок, соответствующих ему, и WO-A-96/33976 включены в данное описание посредством ссылки во всей их полноте. В частности, делается ссылка на описание в заявке WO-A-96/33976, касающееся получения соединений формул VI и VII, которое представляет неотъемлемую часть настоящего описания.
Соединения формулы I представляют собой ценные фармацевтически активные соединения, которые подходят, например, для лечения воспалительных заболеваний, аллергических заболеваний или астмы. В соответствии с изобретением соединения формулы I и их физиологически переносимые соли и производные можно вводить в виде фармацевтических средств животным, предпочтительно млекопитающим, и, в частности, людям для лечения болезненных состояний. Лечение понимают как означающее в общем плане и лечение, включающее облегчение, и излечение симптомов заболеваний, и профилактику или предотвращение симптомов заболеваний, такое как, например, предотвращение появления симптомов аллергических или астматических заболеваний или предотвращение инфаркта миокарда или повторного инфаркта миокарда у соответствующих пациентов. Симптомы заболеваний могут быть острыми или хроническими. Соединения формулы I и их соли и производные можно вводить сами по себе, в смесях друг с другом или в виде фармацевтических композиций, которые обеспечивают возможность энтерального или парентерального применения и которые содержат в качестве активного ингредиента эффективную дозу, по меньшей мере, одного соединения формулы I и/или его физиологически переносимых солей и/или производных и фармацевтически приемлемый носитель.
Поэтому настоящее изобретение также относится к соединениям формулы I и/или физиологически переносимым солям и производным для применения в качестве фармацевтических средств, к применению соединений формулы I и/или физиологически переносимых солей и производных для изготовления фармацевтических средств для лечения указанных выше и ниже заболеваний, например для лечения воспалительных заболеваний, а также к применению соединений формулы I и/или физиологически переносимых солей и производных при лечении указанных заболеваний. Настоящее изобретение, кроме того, относится к фармацевтическим средствам (или фармацевтическим композициям), которые содержат эффективную дозу, по меньшей мере, одного соединения формулы I и/или его физиологически переносимых солей и/или производных и фармацевтически приемлемый носитель, то есть один или более фармацевтически приемлемых носителей и/или добавок или вспомогательных средств.
Фармацевтические средства можно вводить системно или местно. Их можно вводить орально, например, в виде пилюль, таблеток, таблеток, покрытых пленкой, таблеток, покрытых сахаром, гранул, твердых и мягких желатиновых капсул, порошков, растворов, сиропов, эмульсий или суспензий, или в других галеновых формах. Однако введение можно также осуществлять вагинально или ректально, например, в виде суппозиториев, или парентерально, или посредством имплантата, например, в форме растворов для инъекций или растворов для вливаний, микрокапсул или стержней, или местно или чрескожно, например, в виде кремов, мазей, порошков, растворов, эмульсий или настоек, или другим путем, например, в форме спреев для носа или аэрозольных смесей. Парентеральное введение растворов может осуществляться, например, внутривенно, внутримышечно, подкожно, внутрисуставно или внутрисиновиально, или других образом.
Фармацевтические композиции в соответствии с изобретением изготавливают известным образом, причем соединение или соединения формулы I и/или их физиологически переносимые соли и/или производные смешивают с фармацевтически инертными неорганическими и/или органическими носителями и/или добавками и доводят до подходящей дозированной формы и формы введения. Например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли, полиэтиленгликоли и т.д. можно использовать для изготовления пилюль, таблеток, таблеток, покрытых сахаром, и твердых желатиновых капсул, в то время как жиры, воски, полутвердые и жидкие полиолы, полиэтиленгликоли, природные или загущенные масла и т.д. можно, например, использовать для изготовления мягких желатиновых капсул и суппозиториев. Примерами подходящих носителей для изготовления растворов, например растворов для инъекций, или эмульсий, или сиропов, являются вода, спирты, глицерин, диолы, полиолы, сахароза, инвертированный сахар, глюкоза, растительные масла и т.д. Примерами подходящих веществ-носителей для микрокапсул, имплантатов или стержней являются сополимеры гликолевой кислоты и молочной кислоты. Фармацевтические композиции обычно содержат от около 0,5 до около 90% масс. соединений формулы I и/или их физиологически переносимых солей и производных. Количество активного соединения формулы I и/или его физиологически переносимых солей и производных в фармацевтических композициях составляет обычно от около 0,2 до около 1000 мг, предпочтительно от около 1 до около 500 мг. Однако в зависимости от природы фармацевтической композиции количество активного соединения может также быть больше.
Кроме активных соединений и носителей, фармацевтические композиции могут также содержать вспомогательные вещества или добавки, например наполнители, дезинтеграторы, связывающие агенты, глиданты, смачивающие агенты, стабилизаторы, эмульгирующие агенты, консерванты, подслащивающие вещества, красители, отдушки, ароматизирующие агенты, загустители, разбавители, вещества, буферные вещества, растворители, солюбилизирующие агенты, агенты для достижения эффекта депо, соли для изменения осмотического давления, покрывающие агенты или антиоксиданты. Они могут также включать два или более соединений формулы I и/или их физиологически переносимые соли и/или производные. Кроме того, помимо, по меньшей мере, одного соединения формулы I и/или его физиологически переносимых солей и/или производных, фармацевтические композиции могут также включать одно или более дополнительных фармацевтически активных соединений, например соединений, которые обладают противовоспалительным воздействием.
Когда соединения формулы I или фармацевтические композиции, включающие их, вводят в виде аэрозолей, например в виде аэрозолей для носовой полости, или ингаляцией, это можно проводить, например, с использованием спрея, распылителя, насосного распылителя, ингаляционного приспособления, дозированного ингалятора или ингалятора сухого порошка. Фармацевтические формы для введения соединений формулы I в виде аэрозолей можно изготовить с использованием способов, которые хорошо известны специалисту в данной области. Для их изготовления можно, например, использовать растворы или дисперсии соединений формулы I в воде, водно-спиртовых смесях или подходящие растворы хлорида натрия с использованием обычных добавок, например, бензилового спирта или других подходящих консервантов, средств, улучшающих всасывание для увеличения биодоступности, солюбилизирующих агентов, диспергирующих агентов и других средств, и, в случаях целесообразности, обычных газов-вытеснителей, например фторхлоруглеводородов и/или фторуглеводородов.
Другие фармацевтически активные соединения, которые могут присутствовать вместе с соединениями формулы I в фармацевтических композициях в соответствии с изобретением, но с которыми соединения формулы I можно также комбинировать другими путями в пределах контекста комбинированного лечения, представляют собой, в частности, те активные соединения, которые подходят для лечения, то есть для терапии или профилактики указанных выше или ниже заболеваний, и для лечения которых подходят соединения формулы I. Примерами классов активных соединений данного типа, которые можно привести, являются стероиды, нестероидные противовоспалительные вещества, нестероидные противовоспалительные производные уксусной кислоты, нестероидные противовоспалительные производные пропионовой кислоты, нестероидные средства против астмы, производные салициловой кислоты, пиразолоны, оксикамы, антагонисты лейкотриена, ингибиторы биосинтеза лейкотриена, ингибиторы циклооксигеназы, ингибиторы циклооксигеназы-2 (ингибиторы СОХ-2), антигистаминные препараты, антагонисты Н1-гистамина, антигистаминные средства, не оказывающие седативный эффект, соединения золота, β2-агонисты, антихолинергические средства, мускариновые антагонисты, средства, снижающие уровень липидов, средства, снижающие уровень холестерина, ингибиторы HMG-CoA редуктазы, статины, производные никотиновой кислоты, иммуносуппрессоры, циклоспорины, β-интерфероны, средства для лечения опухолей, цитостатические средства, ингибиторы метастазирования, антиметаболиты, производные 5-аминосалициловой кислоты, антидиабетические средства, инсулины, сульфонилмочевины, бигуаниды, глитазоны, ингибиторы α-глюкозидазы и другие. Примерами подходящих активных соединений, которые можно привести, являются ацетилсалициловая кислота, бенорилат, сульфасалазин, фенилбутазон, оксифенбутазон, метамизол, мофебутазон, фепразон, целекоксиб, рофекоксиб, диклофенак, фентиазак, сулиндак, зомепирак, толметин, индометацин, ацеметацин, ибупрофен, напроксен, карпрофен, фенбуфен, индопрофен, кетопрофен, пирпрофен, тиапрофеновая кислота, дифлюнизал, флюфенамовая кислота, меклофенамовая кислота, мефенамовая кислота, нифлюмовая кислота, толфенамовая кислота, пироксикам, изоксикам, теноксикам, никотиновая кислота, преднизон, дексаметазон, гидрокортизон, метилпреднизолон, бетаметазон, беклометазон, будезонид, монтелукаст, пранлукаст, зафирлукаст, зилейтон, циклоспорин, циклоспорин А, рапамицин, такролимус, метотрексат, 6-меркаптопурин, азатиоприн, интерферон-бета 1а, интерферон-бета 1b, 5-аминосалициловая кислота, лефлюномид, D-пеницилламин, хлорохин, глибенкламид, глимепирид, троглитазон, метформин, акарбоз, аторвастатин, флювастатин, ловастатин, симвастатин, правастатин, колестипол, колестирамин, пробукол, клофибрат, фенофибрат, безафибрат, гемфиброзил, ипатропий бромид, кленбутерол, фенотерол, метапротеренол, пирбутерол, тулобутерол, салбутамол, салметерол, тербуталин, изоэтарин, кетотифен, эфедрин, окситропий бромид, атропин, кромоглицевая кислота, теофиллин, фексофенадин, терфенадин, цетризин, диметинден, дифенгидрамин, дифенилпиралин, фенирамин, бромфенирамин, хлорфенирамин, дексхлорфенирамин, алимемезаин, антазолин, астемизол, азатадин, клемастин, ципрогептадин, гидроксизин, лоратидин, мепирамин, прометазин, трипеленнамин, трипролидин и другие.
Когда соединения формулы I и/или их физиологически переносимые соли и/или производные предстоит применять вместе с одним или более другими активными соединениями при комбинированном лечении, его можно проводить, как упоминалось, введением всех активных соединений вместе в одной фармацевтической композиции, например таблетке или капсуле. Настоящее изобретение аналогичным образом относится именно к таким фармацевтическим композициям, к которым соответственно относятся все приведенные выше объяснения. В целом, количество активных соединений в указанных фармацевтических композициях выбирают так, чтобы присутствовало эффективное количество каждого из активных соединений. Однако комбинированное лечение можно также проводить активными соединениями, содержащимися в двух или более отдельных фармацевтических композициях, которые могут присутствовать в одной упаковке, или в двух или более отдельных упаковках. Соединения формулы I и/или их физиологически переносимые соли или производные и другие активные соединения можно вводить или совместно, или отдельно и вводить одновременно или последовательно. Введение можно также производить различными путями, например одно активное соединение можно вводить орально, а другое вводить инъекцией, ингаляцией или местным нанесением.
Соединения формулы I способны, например, ингибировать процессы межклеточного взаимодействия и процессы взаимодействия между клетками и матриксом, причем указанные взаимодействия играют роль при взаимодействиях между VLA-4 и его лигандами. Активность соединений формулы I можно продемонстрировать, например, в анализе, который определяет связывание клеток, которые обладают рецептором VLA-4, например, лейкоцитов с лигандами данного рецептора, например, с VCAM-1, который можно преимущественно получить рекомбинантно для данной цели. Детали такого анализа описаны ниже. В частности, соединения формулы I способны ингибировать адгезию и миграцию лейкоцитов, например адгезию лейкоцитов к эндотелиальным клеткам, причем указанная адгезия, как объяснялось выше, регулируется посредством механизма адгезии VCAM-1/VLA-4. Кроме их применения в качестве противовоспалительных средств, соединения формулы I и их физиологически переносимые соли и производные поэтому подходят в целом для лечения, то есть терапии и профилактики, заболеваний, которые основаны на взаимодействии между рецептором VLA-4 и его лигандами или на которые может влиять ингибирование данного взаимодействия, и, в частности, подходят для лечения заболеваний, которые, по меньшей мере, частично, вызваны или связаны с нежелательной степенью адгезии лейкоцитов и/или миграции лейкоцитов, и для предотвращения, облегчения или излечения которых необходимо уменьшить адгезию и/или миграцию лейкоцитов.
Поэтому настоящее изобретение также относится к соединениям формулы I и к их физиологически переносимым солям и производным для ингибирования адгезии и/или миграции лейкоцитов или для ингибирования рецептора VLA-4, и к применению соединений формулы I и/или их физиологически переносимых солей и производных для изготовления фармацевтических препаратов для данной цели, то есть фармацевтических препаратов для лечения заболеваний, при которых степень адгезии лейкоцитов и/или миграции лейкоцитов является нежелательной, или для лечения заболеваний, при которых играют роль процессы адгезии, зависимые от VLA-4, и к применению соединений формулы I и/или их физиологически переносимых солей и производных при лечении таких заболеваний.
Соединения формулы I можно применять в качестве противовоспалительных средств в случае воспалительных симптомов, возникающих от очень широкого разнообразия причин, для предотвращения, уменьшения или подавления нежелательных или повреждающих последствий воспаления. Соединения формулы I применяют, например, для лечения, то есть терапии, или профилактики артрита, ревматоидного артрита, полиартрита, воспалительных заболеваний кишечника (язвенного колита, болезни Крона), системной красной волчанки, воспалительных заболеваний центральной нервной системы, таких как рассеянный склероз, или астмы или аллергий, таких как аллергии отсроченного типа (аллергия IV типа). Указанные соединения, кроме того, подходят для кардиозащиты, для защиты от удара и для вторичной профилактики удара и для лечения, то есть терапии и профилактики сердечно-сосудистых заболеваний, атеросклероза, инфаркта миокарда, повторного инфаркта миокарда, острого коронарного синдрома, удара, рестеноза, сепсиса, септического шока, сахарного диабета, поражения трансплантатов органов, иммунных заболеваний, аутоиммунных заболеваний, роста опухолей или метастазов опухолей в случаях различных злокачественных заболеваний, малярии и других заболеваний, при которых блокирование интегрина VLA-4 и/или влияние на активность лейкоцитов представляется целесообразным для достижения предотвращения, облегчения или излечения. Предпочтение отдают применению для предотвращения инфаркта миокарда или повторного инфаркта миокарда или для лечения, то есть терапии и предотвращения атеросклероза, астмы или рассеянного склероза.
Доза при применении соединений формулы I может варьироваться в широких пределах и в каждом отдельном случае должна подбираться в соответствии с определенными обстоятельствами, что обычно и известно врачу. Доза зависит, например, от природы и тяжести заболевания, подлежащего лечению, от состояния пациента и от используемого соединения, от того, осуществляется ли лечение или профилактика острого или хронического болезненного состояния, или от того, вводятся ли другие активные соединения в дополнение к соединениям формулы I. В целом, при оральном введении дозы суточная доза от около 0,01 до около 100 мг/кг, предпочтительно от около 0,1 до около 10 мг/кг (в каждом случае мг на 1 кг массы тела) является целесообразной для достижения эффективных результатов, когда дозу вводят взрослому массой приблизительно 75 кг. При внутривенном введении суточная доза в целом составляет приблизительно от 0,01 до 50 мг/кг, предпочтительно от 0,01 до 10 мг/кг массы тела. Особенно когда вводят относительно большие количества, суточную дозу можно разделить на несколько, например 2, 3 или 4, частичных введения. При целесообразности, в зависимости от индивидуальной реакции, может быть необходимо отклониться в пределах выше или ниже определенной суточной дозы.
Кроме применения в качестве фармацевтически активных соединений в медицине человека и ветеринарной медицине, соединения формулы I и их соли и производные, которые пригодны для желательного применения, можно использовать для диагностических целей, например диагностики in vitro клеточных образцов или образцов ткани, и в качестве вспомогательных средств или научных инструментов в биохимических исследованиях, при которых желательно блокирование VLA-4 или влияние на межклеточные взаимодействия или взаимодействия между клетками и матриксом. Соединения формулы I и их соли можно также применять в качестве промежуточных соединений для получения других соединений, в частности других фармацевтически активных соединений, которые можно получить из соединений формулы I, например, модифицированием или введением остатков или функциональных групп, например этерификацией, восстановлением, окислением или другими превращениями функциональных групп.
ПРИМЕРЫ
Пример 1
Гидрохлорид (R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)масляной кислоты

1а) 4-(3-(2-Метилфенил)уреидо)-3-метоксибензиловый спирт
15 г (81,8 ммоль) 3-метокси-4-нитробензилового спирта гидрируют в 500 мл метилтрет-бутилового эфира над 1,3 г палладия на активированном угле (10%; 50% воды) при охлаждении льдом. После того как поглощение водорода прекратится, катализатор отфильтровывают и к фильтрату в течение 30 мин при перемешивании добавляют 10,14 мл (81,8 ммоль) 2-метилфенилизоцианата. Реакционную смесь оставляют стоять в течение ночи и осажденное твердое вещество отфильтровывают отсасыванием и промывают метилтрет-бутиловым эфиром. Выход: 20,5 г (88%).
1b) 4-(3-(2-Метилфенил)уреидо)-3-метоксибензилхлорид
7,65 мл (104,8 ммоль) тионилхлорида добавляют по каплям, при охлаждении льдом, к суспензии 15 г (52,4 ммоль) соединения примера 1а) в 300 мл дихлорметана. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, оставляют стоять в течение ночи, а затем выливают в 1000 мл гептана. Гептан декантируют из масла, которое отделилось; затем осадок снова однократно суспендируют гептаном, и гептан декантируют. Указанную процедуру повторяют еще два раза. Затем осадок растворяют в дихлорметане, и данный раствор выливают в 800 мл охлажденного льдом диизопропилового эфира. Смесь перемешивают в течение 2 ч при охлаждении льдом, продукт отфильтровывают отсасыванием и промывают диизопропиловым эфиром. Получают 12 г (75%) указанного в заголовке соединения после сушки над пентоксидом фосфора.
1с) Бензил-(S)-2-амино-3-циклопропилпропионат
1 н. раствор гидроксида натрия добавляют при 0°С к суспензии 10 г (77,5 ммоль) (S)-2-амино-3-циклопропилпропионовой кислоты в 160 мл диоксана до тех пор, пока не будет достигнуто значение рН 8-9. Затем добавляют 16,9 г (77,5 ммоль) ди-трет-бутилдикарбоната, ледяную баню удаляют, и рН поддерживают на уровне 8-9 дальнейшим добавлением 1 н. раствора гидроксида натрия. После того как смесь оставили стоять в течение ночи, диоксан удаляют в вакууме, добавляют этилацетат к водной фазе, и фазы разделяют. Доводят pH водной фазы до 4,5 с помощью 1 н. хлористо-водородной кислоты и экстрагируют этилацетатом. Полученную этилацетатную фазу сушат над сульфатом натрия, осушающий агент отфильтровывают, и фильтрат концентрируют в вакууме. Остаток растворяют в 1000 мл дихлорметана и добавляют 53,4 мл бензилового спирта, 8,37 г 4-диметиламинопиридина и 18,8 г DCC. После перемешивания смеси в течение 6 ч и стояния в течение ночи ее фильтруют, и фильтрат концентрируют, а к остатку добавляют 300 мл 90% трифторуксусной кислоты. После перемешивания полученной смеси при комнатной температуре в течение 10 мин трифторуксусную кислоту удаляют в вакууме, и остаток дважды хроматографируют на силикагеле с использованием смеси дихлорметан/метанол (95/5). Выход: 11,48 г (68%).
1d) (S)-2-(4,4-Диметил-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропионовая кислота
321 мг НОВТ (N-гидроксибензотриазол) и 4,75 г (23,7 ммоль) DCC добавляют к раствору 3,82 г (23,7 ммоль) 2-метоксикарбониламино-2-метилпропионовой кислоты (полученной из 2-амино-2-метилпропионовой кислоты и метилхлорформиата) и 5,2 г (23,7 ммоль) соединения примера 1с) в 100 мл ТГФ (тетрагидрофуран), и смесь перемешивают при комнатной температуре в течение 4 ч. После того как смесь оставили стоять в течение ночи, ее фильтруют, ТГФ удаляют в вакууме, остаток забирают в метилтрет-бутиловый эфир, и раствор дважды промывают, каждый раз насыщенным раствором NaHCO3 и водным раствором KHSO4/K2SO4. Органическую фазу сушат над сульфатом натрия, и после фильтрования растворитель удаляют в вакууме. Остаток растворяют в этилацетате и гидрируют в присутствии палладия на активированном угле (10%; 50% воды). Катализатор отфильтровывают и к органической фазе добавляют 500 мл воды и 10,1 г карбоната натрия. После экстракции и разделения фаз водную фазу перемешивают при 100°С в течение 24 ч, а затем оставляют стоять в течение ночи. Добавляют 500 мл 6 н. хлористо-водородной кислоты, и водную фазу экстрагируют три раза метилтрет-бутиловым эфиром. Объединенные органические фазы сушат над сульфатом натрия и после фильтрования концентрируют в вакууме. Остаток кристаллизуют с использованием диизопропилового эфира, и продукт отфильтровывают. Выход: 2,88 г (51%).
1е) (S)-2-(4,4-Диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропионовая кислота
9,44 мл Раствора н-бутиллития (2,5 М раствор в гексане) добавляют в атмосфере аргона и при -40°С к раствору 2,85 г (11,8 ммоль) соединения примера 1d) в 60 мл абсолютного ТГФ. После перемешивания реакционной смеси при -40°С в течение 30 мин ей дают возможность нагреться до 0°С и добавляют раствор 3,6 г (11,8 ммоль) соединения примера 1b) в 20 мл N-метил-2-пирролидона. Реакционной смеси дают возможность нагреться до 0°С и оставляют перемешиваться при 0°С в течение 2 ч. Добавляют 15 мл 1 н. хлористо-водородной кислоты и ТГФ удаляют в вакууме. Остаток выливают в 300 мл метилтрет-бутилового эфира. Фазы разделяют, и органическую фазу промывают водой. Объединенные органические фазы сушат над сульфатом натрия и после фильтрования концентрируют в вакууме. Остаток очищают препаративной ВЭЖХ. После концентрирования фракций продукта и последующей лиофилизации получают 1,33 г (22%) указанного в заголовке соединения.
1f) (S)-2-(4,4-Диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропил-N-метокси-N-метилпропионамид
При охлаждении льдом 1,29 г (3,93 ммоль) TOTU и 1,26 мл (7,74 мл) диизопропилэтиламина добавляют к раствору 2 г (3,93 ммоль) соединения примера 1е) и 384 мг (3,93 ммоль) гидрохлорида N,O-диметилгидроксиламина в 30 мл абсолютного DMF (диметилформамида), и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворитель удаляют в вакууме, остаток забирают в этилацетат, и раствор дважды промывают насыщенным раствором гидрокарбоната натрия. Фазы разделяют, и органическую фазу сушат над сульфатом магния. После фильтрования и удаления растворителя в вакууме остаток хроматографируют на силикагеле с использованием смеси этилацтетат/гептан (7/3). Концентрирование фракций продукта дает 1,84 г (85%) указанного в заголовке соединения.
1g) (S)-2-(4,4-Диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропаналь
160 мг (3,77 ммоль) литийалюминийгидрида добавляют при -72°С к раствору 1,8 г (3,26 ммоль) соединения примера 1f) в 90 мл абсолютного ТГФ, и реакционную смесь перемешивают при 0°С в течение 30 мин. Затем устанавливают рН=4 добавлением 0,5 М раствора KHSO4, добавляют дихлорметан, и фазы разделяют. Водную фазу экстрагируют дихлорметаном. Объединенные органические фазы промывают дважды 5% раствором лимонной кислоты и сушат над сульфатом магния. После фильтрования и удаления растворителя в вакууме полученное неочищенное указанное в заголовке соединение используют непосредственно в последующей реакции.
1h) трет-Бутил-(R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)бутират 222 мг (3,54 ммоль) цианоборгидрида натрия добавляют к раствору 586 мг (1,18 ммоль) соединения примера 1g) и 378 мг (2,37 ммоль) трет-бутил-(R)-3-аминобутирата в 20 мл смеси ТГФ/метанол (9/1) и 0,2 мл уксусной кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем выливают в раствор хлорида аммония; затем смесь экстрагируют дважды дихлорметаном. Объединенные органические фазы промывают насыщенным раствором гидрокарбоната натрия и сушат над сульфатом магния. После фильтрования и удаления растворителя в вакууме остаток хроматографируют на силикагеле с использованием смеси этилацетат/гептан (2/1). Концентрирование фракций продукта дает 263 мг (35%) указанного в заголовке соединения.
1i) Гидрохлорид (R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)масляной кислоты
259 мг (0,408 ммоль) соединения примера 1h) растворяют в 20 мл трифторуксусной кислоты и раствор оставляют стоять при комнатной температуре в течение 3 ч. После того как реакционную смесь концентрировали в вакууме, остаток дважды обрабатывают дихлорметаном и в каждом случае концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием смеси дихлорметан/метанол/уксусная кислота/вода (95/5/0,5/0,5). Фракции продукта объединяют, растворитель удаляют в вакууме, остаток лиофилизируют, обрабатывают 1,5 эквивалентами 1 М хлористо-водородной кислоты и еще раз лиофилизируют. Получают 200 мг (85%) указанного в заголовке соединения.
ES(+)-MS: 580,6 (3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)масляная кислота + Н)+.
Пример 2
Гидрохлорид этил-(R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)бутирата
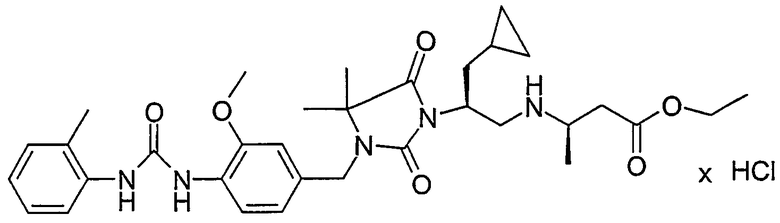
Указанное в заголовке соединение получают по аналогии с примером 1h) из 520 мг (1,06 ммоль) соединения примера 1g) и 340 мг (2,32 ммоль) этил-(R)-3-аминобутирата. Выход после превращения в гидрохлорид: 164 мг (25%).
ES(+)-MS: 608,6 (этил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-метилпропионат + Н)+.
Пример 3
Гидрохлорид изопропил-(R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)бутирата
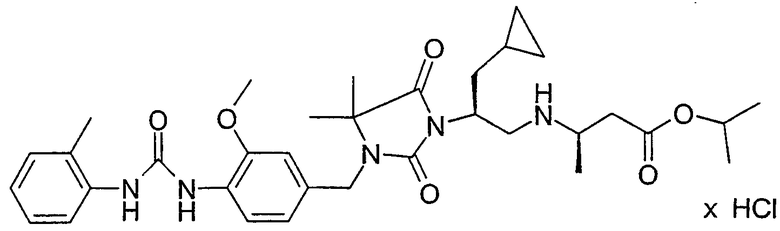
Указанное в заголовке соединение получают по аналогии с примером 1h) из 2,62 г соединения примера 1g) и 1,44 г (9,91 ммоль) изопропил-(R)-3-аминобутирата. После хроматографии неочищенного продукта с использованием смеси этилацетат/гептан (2/1), хроматографической очистки посредством препаративной ВЭЖХ и превращения в гидрохлорид получают 855 мг (26%) указанного в заголовке соединения.
ES(+)-MS: 622,7 (изопропил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)бутират + Н)+.
Пример 4
Гидрохлорид изопропил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропионата
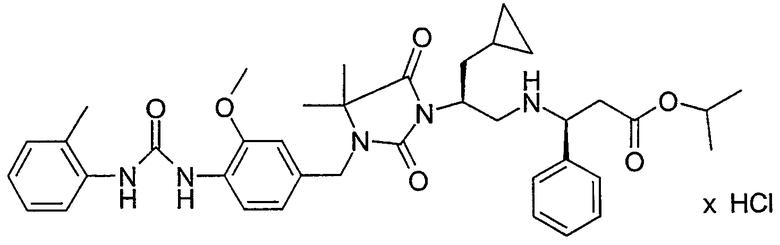
Раствор 780 мг (3,77 ммоль) изопропил-(S)-3-амино-3-фенилпропионата и 226 мг уксусной кислоты в 20 мл смеси метанол/уксусная кислота (99/1) добавляют к раствору 1,86 г (3,77 ммоль) соединения примера 1g) в 50 мл смеси метанол/уксусная кислота (99/1). Добавляют 710 мг (11,31 ммоль) цианоборгидрида натрия. После перемешивания смеси при комнатной температуре в течение 1 ч добавляют еще 237 мг (3,77 ммоль) цианоборгидрида натрия и еще через 1 ч добавляют 390 мг (1,885 ммоль) изопропил-(S)-3-амино-3-фенилпропионата, 113 мг уксусной кислоты и 237 мг (3,77 ммоль) цианоборгидрида натрия. После перемешивания смеси при комнатной температуре в течение 1 ч добавляют еще 237 мг (3,77 ммоль) цианоборгидрида натрия и реакционную смесь перемешивают при комнатной температуре в течение еще 1 ч. Доводят рН реакционной смеси до 4 с помощью 1 н. хлористо-водородной кислоты, метанол удаляют в вакууме, и остаток экстрагируют дважды дихлорметаном. Объединенные органические фазы сушат над сульфатом магния. После фильтрования, концентрирования, хроматографической очистки остатка на силикагеле с использованием смеси этилацетат/гептан (1/1), последующей очистки посредством препаративной ВЭЖХ и превращения в гидрохлорид получают 980 мг (36%) указанного в заголовке соединения.
ES(+)-MS: 684,4 (изопропил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропионат + Н)+.
Пример 5
Гидрохлорид этил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропионата
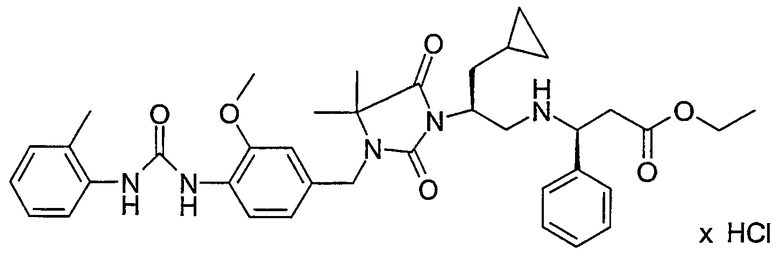
5а) (S)-2-(4,4-Диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропил-N-метокси-N-метилпропионамид
Растворяют 250 мг (0,49 ммоль) соединения примера 1d) вместе со 167 мкл (1,08 ммоль) диизопропилкарбодиимида и 146 мг (1,08 ммоль) НОВТ в 4 мл дихлорметана и 2 мл ацетонитрила. После охлаждения раствора до 0°С добавляют раствор 120 мг (1,23 ммоль) гидрохлорида N,O-диметилгидроксиламина в 1 мл ацетонитрила и 710 мкл (1,23 ммоль) диизопропилэтиламина. Через 12 ч реакционную смесь обрабатывают водным раствором хлорида аммония и экстрагируют дихлорметаном. Органическую фазу промывают водным раствором гидрокарбоната натрия, сушат над сульфатом магния, фильтруют и концентрируют в вакууме. После хроматографического разделения на силикагеле с использованием смеси этилацетат/гептан (1/1) получают 250 мг (92%) указанного в заголовке соединения.
5b) Гидрохлорид этил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропионата
335 мг (0,6 ммоль) соединения примера 5а) в 2 мл абсолютного ТГФ по каплям добавляют при -78°С к суспензии 23 мг (0,6 ммоль) литийалюминийгидрида в 2 мл абсолютного ТГФ. Через 1 ч при 0°С реакционную смесь обрабатывают водным раствором KHSO4 и экстрагируют этилацетатом. Органическую фазу промывают водным раствором хлористо-водородной кислоты и раствором NaHCO3, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток и 234 мг (1,22 ммоль) этил-(S)-3-амино-3-фенилпропионата встряхивают в течение 8 ч в атмосфере водорода в 20 мл этанола в присутствии 20 мг палладия на активированном угле (10%). Реакционную смесь фильтруют и концентрируют в вакууме. После хроматографической очистки посредством препаративной ВЭЖХ, взаимодействия с водной хлористо-водородной кислотой и лиофилизации получают 50 мг (12%) указанного в заголовке соединения.
ES(+)-MS: 670,4 (Этил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропионат + Н)+.
Пример 6
Гидрохлорид (S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропионовой кислоты

360 мкл (0,36 ммоль) 1 М водного раствора гидроксида лития добавляют к 60 мг (0,09 ммоль) соединения примера 5 в 3 мл метанола. Через 12 ч реакционный раствор нейтрализуют водной хлористо-водородной кислотой и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. После хроматографической очистки посредством препаративной ВЭЖХ и последующего взаимодействия с водной хлористо-водородной кислотой и лиофилизации получают 21 мг (34%) указанного в заголовке соединения.
ES(+)-MS: 642,2 (3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропионовая кислота + Н)+.
Пример 7
Гидрохлорид (R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)бутанола
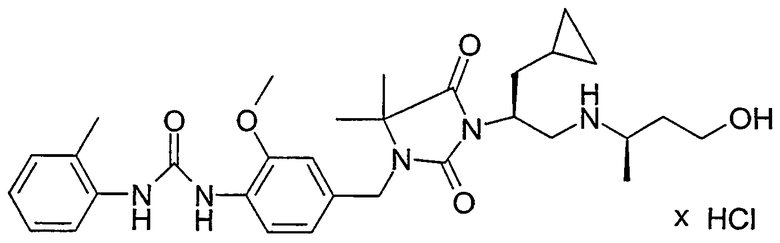
7а) трет-Бутил-(R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)бутират
626 мг (1,91 ммоль) TOTU и 308 мкл (1,81 ммоль) диизопропилэтиламина последовательно добавляют при охлаждении льдом к раствору 974 мг (1,91 ммоль) соединения примера 1е) и 305 мг (1,91 ммоль) трет-бутил-(R)-3-аминобутирата в 10 мл абсолютного DMF. После перемешивания смеси при комнатной температуре в течение 2 ч растворитель удаляют в вакууме, остаток растворяют в этилацетате и этилацетатный раствор промывают последовательно, каждым дважды, водным раствором KHSO4/K2SO4, насыщенным раствором NaHCO3 и водой. После сушки органической фазы над сульфатом натрия и фильтрования растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с использованием смеси этилацетат/гептан (1/1). Выход: 880 мг (71%).
7b) Гидрохлорид (R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)бутанола
48 мкл (0,38 ммоль) эфирата трифторида бора добавляют к 250 мг (0,38 ммоль) соединения примера 7а) в 4 мл абсолютного ТГФ. Реакционный раствор нагревают до 80°С и добавляют 760 мкл (0,76 ммоль) 1 М раствора боран-диметилсульфида в дихлорметане. Через 4 ч реакционную смесь обрабатывают водой и экстрагируют дихлорметаном. Объединенные органические фазы сушат над сульфатом натрия. После фильтрования, удаления растворителя в вакууме, хроматографической очистки посредством препаративной ВЭЖХ, последующего взаимодействия с водной хлористо-водородной кислотой и лиофилизации получают 120 мг (56%) указанного в заголовке соединения.
ES(+)-MS: 566,3 (3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)бутанол + Н)+.
Пример 8
Гидрохлорид (S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропанола
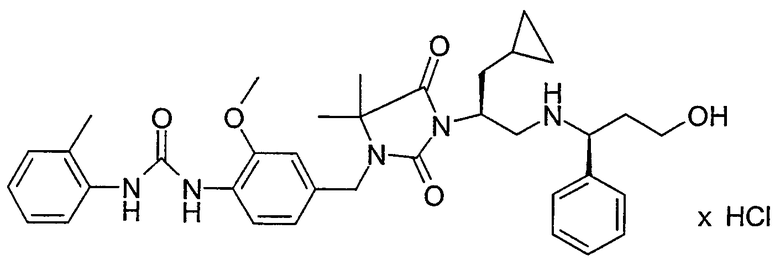
Соединение получают по аналогии с примером 7. Получают 35 мг (40%) указанного в заголовке соединения в 2 мл абсолютного ТГФ из 100 мг (0,14 ммоль) первоначально полученного трет-бутил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиониламино)-3-фенилпропионата, 18 мкл (0,14 ммоль) эфирата трифторида бора и 280 мкл (0,28 ммоль) 1 М раствора боран-диметилсульфида в дихлорметане.
ES(+)-MS: 628,3 (3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-фенилпропанол + Н)+.
Пример 9
Гидрохлорид этил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)-3-фенилпропионата

9а) (S)-2-(4,4-Диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентановая кислота
16,5 мл раствора н-бутиллития (2,5 М в гексане) добавляют в атмосфере аргона и при -40°С к раствору 5 г (20,66 ммоль) (S)-2-(4,4-диметил-2,5-диоксоимидазолидин-1-ил)-4-метилпентановой кислоты (полученной по аналогии с примерами 1с) и 1d) с использованием L-лейцина вместо (S)-2-амино-3-циклопропилпропионовой кислоты) в 125 мл абсолютного ТГФ. Реакционной смеси дают нагреться до 0°С, и добавляют раствор 6,28 г (20,66 ммоль) соединения примера 1b) в 40 мл N-метил-2-пирролидона и 20 мл 1,3-диметил-2-имидазолидона. Реакционную смесь перемешивают при 0°С в течение 1 ч, затем добавляют 30 мл 1 н. хлористо-водородной кислоты и ТГФ удаляют в вакууме. Остаток выливают в 300 мл воды. Осадок отфильтровывают отсасыванием, промывают водой и растворяют в дихлорметане. Затем раствор по каплям добавляют к 600 мл метилтрет-бутилового эфира. Осадок отфильтровывают, и органическую фазу сушат над сульфатом магния. Осушитель отфильтровывают, и растворитель удаляют в вакууме. Остаток очищают посредством препаративной ВЭЖХ. Получают 2,84 г (27%) указанного в заголовке соединения после концентрирования фракций продукта и последующей лиофилизации.
9b) (S)-2-(4,4-Диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4,N-диметил-N-метоксипентанамид
1,89 мл (12,25 ммоль) диизопропилкарбодиимида и 1,65 г (12,25 ммоль) НОВТ добавляют к раствору 2,84 г (5,56 ммоль) соединения примера 9а) в 32 мл абсолютного дихлорметана и 12 мл ацетонитрила. Раствор 1,35 г (13,9 ммоль) гидрохлорида N,O-диметилгидроксиламина и 2,36 мл (13,9 ммоль) диизопропилэтиламина затем добавляют по каплям при 0°С и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. После того как ее оставили стоять в течение ночи, смесь выливают в 300 мл насыщенного раствора хлорида аммония. Фазы разделяют, и водную фазу экстрагируют дважды дихлорметаном. Объединенные органические фазы промывают дважды насыщенным раствором гидрокарбоната натрия и сушат над сульфатом магния. После фильтрования растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с использованием смеси этилацетат/гептан (7/3). Получают 2,62 г (88%) указанного в заголовке соединения после концентрирования фракций продукта в вакууме.
9с) (S)-2-(4,4-Диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентаналь
Получение проводят, как описано в примере 5b). Неочищенное указанное в заголовке соединение используют непосредственно в последующей реакции.
9d) Гидрохлорид этил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)-3-фенилпропионата
Смесь 2,48 г (5,01 ммоль) соединения примера 9с) и 1,93 г (10,03 ммоль) этил-(S)-3-амино-3-фенилпропионата гидрируют над 200 мг палладия на активированном угле (10%) в абсолютном этаноле. После завершения реакции катализатор отфильтровывают, растворитель удаляют и остаток хроматографируют на силикагеле с использованием смеси гептан/этилацетат (1/2). Фракции продукта объединяют, лиофилизируют и очищают посредством препаративной ВЭЖХ. Фракции продукта объединяют, лиофилизируют и растворяют в дихлорметане. Дихлорметановый раствор промывают насыщенным раствором гидрокарбоната натрия и сушат над сульфатом магния. После фильтрования и удаления растворителя в вакууме остаток растворяют в смеси ацетонитрил/вода; добавляют 2 эквивалента 1 н. хлористо-водородной кислоты и смесь лиофилизируют. Выход: 850 мг (25%).
ES(+)-MS: 672,5 (Этил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)-3-фенилпропионат + Н)+.
Пример 10
Гидрохлорид (S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)-3-фенилпропионовой кислоты
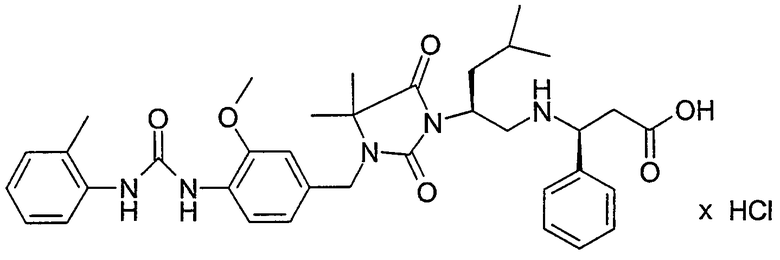
Раствор 100 мг (0,149 ммоль) соединения примера 9 в 6 н. хлористо-водородной кислоте, и ТГФ нагревают при 60°С в течение 4 ч. ТГФ удаляют в вакууме, и остаток лиофилизируют. После очистки посредством препаративной ВЭЖХ, хроматографии на силикагеле с использованием смеси дихлорметан/метанол/уксусная кислота/вода (9,5/0,5/0,05/0,05), концентрирования фракций продукта и лиофилизации в присутствии 2 н. хлористо-водородной кислоты получают 20 мг (21%) указанного в заголовке соединения.
ES(+)-MS: 644,5 (3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)-3-фенилпропионовая кислота + Н)+.
Пример 11
Гидрохлорид этил-(R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)бутирата
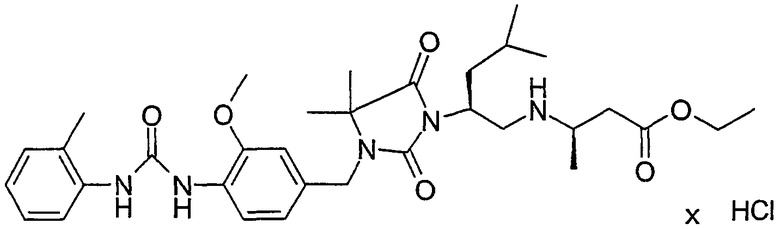
Соединение получают по аналогии с примером 9. Из 2,2 г (4,44 ммоль) соединения примера 9с) и 1,16 г (8,89 ммоль) этил-(R)-3-аминобутирата получают 140 мг (5%) указанного в заголовке соединения после очистки неочищенного продукта хроматографией на силикагеле с использованием смеси этилацетат/гептан (2/1), концентрирования фракций продукта, лиофилизации, превращения в гидрохлорид и очистки еще раз хроматографией на силикагеле.
ES(+)-MS: 610,4 (Этил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)бутират + Н)+.
Пример 12
Гидрохлорид (R)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)масляной кислоты
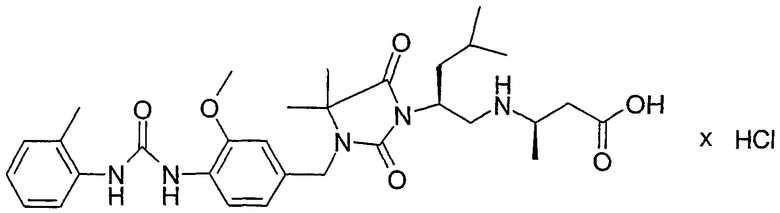
Соединение получают по аналогии с примером 10. Получают 17,5 мг (18%) указанного в заголовке соединения из 100 мг (0,164 ммоль) соединения примера 11.
ES(+)-MS: 582,5 (3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-4-метилпентиламино)масляная кислота + Н)+.
Пример 13
трет-Бутил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-диметоксифенил)пропионат
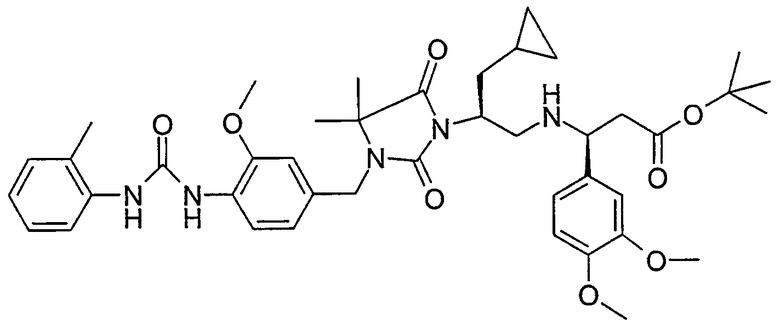
Раствор 285 мг (1,013 ммоль) трет-бутил-(S)-3-амино-3-(3,4-диметоксифенил)пропионата (полученного по аналогии со способом, описанным S.G. Davies et al., в Tetrahedron: Asymmetry 2, 183 (1991) и J. Chem. Soc. Perkin Trans 1, 1129 (1994)) и 61 мг уксусной кислоты в 5 мл смеси метанол/уксусная кислота (99/1) добавляют к раствору 499 мг (1,013 ммоль) соединения примера 1g) в 20 мл смеси метанол/уксусная кислота (99/1). Затем добавляют 191 мг (3,039 ммоль) цианоборгидрида натрия и смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют еще 64 мг (1,013 ммоль) цианоборгидрида натрия и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Затем добавляют 142 мг (0,507 ммоль) трет-бутил-(S)-3-амино-3-(3,4-диметоксифенил)пропионата, 30 мг (0,507 ммоль) уксусной кислоты и 64 мг (1,013 ммоль) цианоборгидрида натрия, и смесь перемешивают при комнатной температуре в течение 1 ч. После добавления еще 64 мг (1,013 ммоль) цианоборгидрида натрия реакционную смесь перемешивают при комнатной температуре в течение еще 1 ч, после чего доводят рН до 4 добавлением 1 н. хлористо-водородной кислоты. Метанол удаляют в вакууме и остаток экстрагируют дважды дихлорметаном. Объединенные органические фазы концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием смеси этилацетат/гептан, а затем очищают посредством препаративной ВЭЖХ. Получают 214 мг (28%) указанного в заголовке соединения после концентрирования фракций продукта и лиофилизации.
TOF ES(+)-MS: 758,44 (M + H)+.
Пример 14
Гидрохлорид (S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-диметоксифенил)пропионовой кислоты
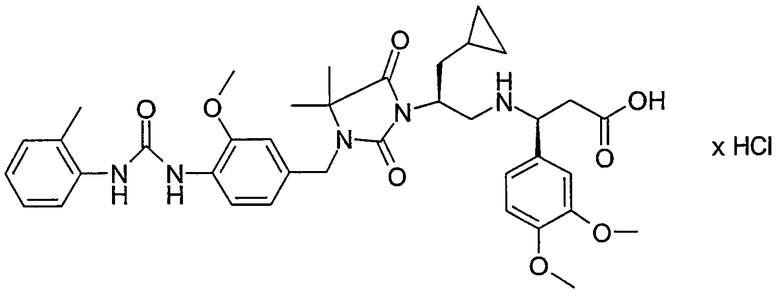
Раствор 214 мг (0,282 ммоль) соединения примера 13 в 10 мл 90% трифторуксусной кислоты перемешивают при комнатной температуре в течение 1,5 ч. Трифторуксусную кислоту удаляют в вакууме и остаток растворяют в смеси вода/ацетонитрил и лиофилизируют. Получают 210 мг (99%) указанного в заголовке соединения после превращения в гидрохлорид.
TOF ES(+)-MS: 702,41 (3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-диметоксифенил)пропионовая кислота + Н)+.
Пример 15
Гидрохлорид изопропил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-диметоксифенил)пропионата
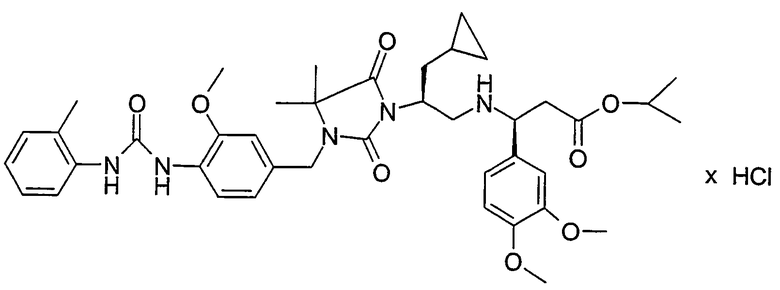
Соединение получают по аналогии с примером 13. Из 499 мг (1,013 ммоль) соединения примера 1g) и 270 мг (1,013 ммоль) изопропил-(S)-3-амино-3-(3,4-диметоксифенил)пропионата (полученного из (S)-3-амино-3-(3,4-диметоксифенил)пропионовой кислоты, которую получают расщеплением соответствующего сложного трет-бутилового эфира), получают 227 мг (29%) указанного в заголовке соединения после очистки неочищенного продукта хроматографией с использованием смеси этилацетат/гептан (2/1), очистки посредством препаративной ВЭЖХ и превращения в гидрохлорид.
TOF ES(+)-MS: 744,48 (изопропил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-диметоксифенил)пропионат + Н)+.
Пример 16
трет-Бутил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-метилендиоксифенил)пропионат
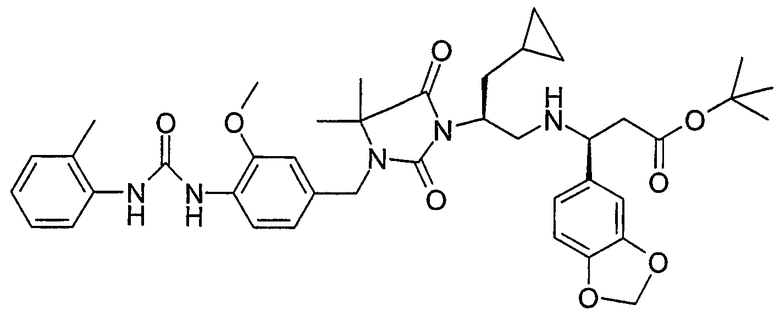
Соединение получают по аналогии с примером 13. Из 499 мг соединения примера 1g) и 269 мг (1,013 ммоль) трет-бутил-(S)-3-амино-3-(3,4-метилендиоксифенил)пропионата (полученного по аналогии со способом, описанным S.G. Davies et al., в Tetrahedron: Asymmetry 2, 183 (1991) и J. Chem. Soc. Perkin Trans 1, 1129 (1994)) получают 233 мг (31%) указанного в заголовке соединения после хроматографической очистки на силикагеле с использованием смеси этилацетат/гептан (1/1), очистки посредством препаративной ВЭЖХ, концентрирования фракций продукта и лиофилизации.
TOF ES(+)-MS: 742,59 (M + H)+.
Пример 17
Гидрохлорид (S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-метилендиоксифенил)пропионовой кислоты
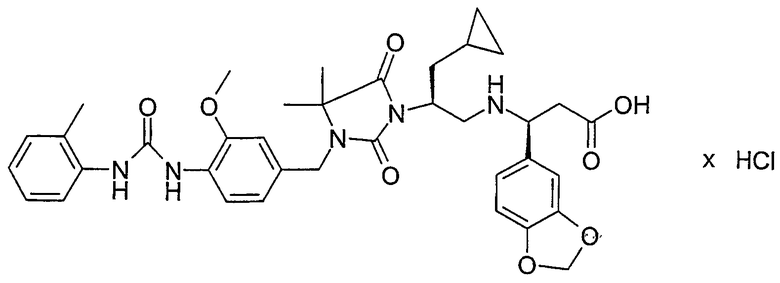
Раствор 229 мг (0,309 ммоль) соединения примера 16 в 10 мл 90% трифторуксусной кислоты оставляют стоять при комнатной температуре в течение 3 ч. Трифторуксусную кислоту удаляют в вакууме и остаток растворяют в смеси вода/ацетонитрил и лиофилизируют. Получают 181 мг (81%) указанного в заголовке соединения после превращения в гидрохлорид.
TOF ES(+)-MS: 686,51 (3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-метилендиоксифенил)пропионовая кислота + Н)+.
Пример 18
Гидрохлорид изопропил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-метилендиоксифенил)пропионата
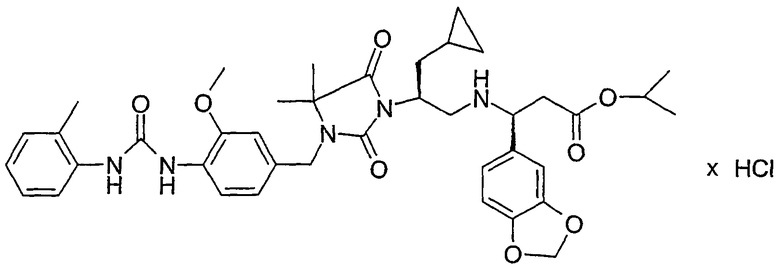
Соединение получают по аналогии с примером 13. Из 499 мг соединения примера 1g) и 257 мг (1,013 ммоль) изопропил-(S)-3-амино-3-(3,4-метилендиоксифенил)пропионата (полученного из (S)-3-амино-3-(3,4-метилендиоксифенил)пропионовой кислоты, которую получают расщеплением соответствующего сложного трет-бутилового эфира) получают 185 мг (24%) указанного в заголовке соединения после очистки неочищенного продукта хроматографией с использованием смеси этилацетат/гептан (1/1), последующей очистки посредством препаративной ВЭЖХ и затем превращения в гидрохлорид.
TOF ES(+)-MS: 728,58 (изопропил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-метилендиоксифенил)пропионат + Н)+.
Пример 19
Гидрохлорид этил-(S)-3-((S)-2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-диметоксифенил)пропионата
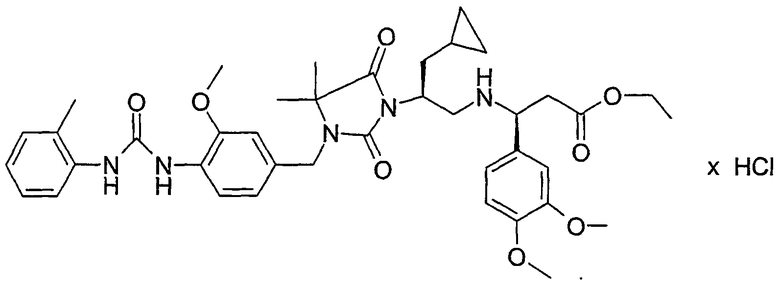
Раствор 500 мг (0,64 ммоль) соединения примера 15 в 40 мл этанола и 0,5 мл концентрированной хлористоводородной кислоты нагревают при кипячении с обратным холодильником в течение 50 ч. Реакционную смесь концентрируют в вакууме, остаток растворяют в дихлорметане и раствор промывают насыщенным раствором гидрокарбоната натрия, сушат над сульфатом натрия, фильтруют и концентрируют. Получают 200 мг (41%) указанного в заголовке соединения после очистки неочищенного продукта хроматографией на силикагеле с использованием смеси этилацетат/гептан (1/1), очистки дважды посредством препаративной ВЭЖХ и превращения в гидрохлорид.
TOF ES(+)-MS: 730,58 (Этил-3-(2-(4,4-диметил-3-(4-(3-(2-метилфенил)уреидо)-3-метоксибензил)-2,5-диоксоимидазолидин-1-ил)-3-циклопропилпропиламино)-3-(3,4-диметоксифенил)пропионат + Н)+.
Исследование биологической активности
А) Тест адгезии клеток U937 к VCAM-1
Описанный ниже анализ, который специфичен для взаимодействия между VCAM-1 и VLA-4, используют в качестве способа тестирования активности соединений формулы I по данному взаимодействию. Партнеры клеточного связывания, то есть интегрины VLA-4, поставляются в их природной форме в качестве поверхностных молекул на клетках U937 человека (ATCC CRL 1593), которые относятся к лейкоцитарной группе. Используемые партнеры специфического связывания представляют собой рекомбинантно полученные растворимые слитые белки, которые состоят из экстрацитоплазматического домена VCAM-1 человека и константной области иммуноглобулина человека подкласса IgG1.
Анализ для измерения адгезии клеток U937 (ATCC CRL 1593) к hVCAM-1(1-3)-IgG
1. Получение VCAM-1(1-3)-IgG человека и CD4-IgG человека
Использовали генную конструкцию для экспрессии внеклеточного домена VCAM-1 человека, связанного с генной последовательностью для тяжелой цепи человеческого иммуноглобулина IgG1 (шарнир, области СН2 и СН3) (от д-ра Brian Seed, Massachusetts General Hospital, Boston, USA; cf. Damle and Aruffo, Proc. Natl. Acad. Sci. USA 1991, 88, 6403). Растворимый слитый белок hVCAM-1(1-3)-IgG, содержащий три аминоконцевых домена, подобных внеклеточному иммуноглобулину человека VCAM-1 (Damle and Aruffo, Proc. Natl. Acad. Sci. USA 1991, 88, 6403). CD4-IgG (Zettlmeissl et al., DNA and Cell Biology 1990, 9, 347) использовали в качестве слитого белка для отрицательных контролей. Рекомбинантные белки экспрессировали в качестве растворимых белков после опосредованной DEAE/декстраном трансфекции ДНК в клетки COS (ATCC CRL 1651) с использованием стандартных методик (Ausubel et al., Current protocols in molecular biology, John Wiley & Sons, Inc., 1994).
2. Анализ для измерения адгезии клеток U937 к hVCAM-1(1-3)-IgG
2.1. 96-Луночные титрационные тестирующие микропланшеты (Nunc Maxisorb), содержащие 100 мкл/лунка раствора козьего антитела против IgG человека (10 мкг/мл в 50 мМ Tris, рН 9,5), инкубировали при комнатной температуре в течение 1 ч. После удаления раствора антитела планшеты промывали один раз забуференным фосфатом физиологическим раствором (PBS).
2.2. 150 мкл/лунка блокирующего буфера (1% альбумина бычьей сыворотки, BSA, в PBS) инкубировали в планшетах при комнатной температуре в течение 0,5 ч. После удаления блокирующего буфера планшеты однократно промывали PBS.
2.3. 100 мкл/лунка надосадочной жидкости клеточной культуры от трансфицированных клеток COS инкубировали в планшетах при комнатной температуре в течение 1,5 ч. Клетки COS трансфицировали плазмидой, которая кодирует три N-концевых подобных иммуноглобулину доменов VCAM-1, соединенных с фрагментом Fc IgG1 человека (hVCAM-1(1-3)-IgG). Содержание hVCAM-1(1-3)-IgG составило приблизительно 0,5-1 мкг/мл. После удаления надосадочной жидкости культуры планшеты однократно промывали PBS.
2.4. Планшеты инкубировали со 100 мкл/лунка буфера, блокирующего рецептор Fc (1 мг/мл γ-глобулина, 100 мМ NaCl, 100 мкМ MgCl2, 100 мкМ MnCl2, 100 мкМ CaCl2, 1 мг/мл BSA в 50 мМ HEPES, рН 7,5) при комнатной температуре в течение 20 мин. После удаления буфера, блокирующего рецептор Fc, планшеты однократно промывали PBS.
2.5. Вводили 20 мкл связывающего буфера (100 мМ NaCl, 100 мкМ MgCl2, 100 мкМ MnCl2, 100 мкМ CaCl2, 1 мг/мл BSA в 50 мМ HEPES, рН 7,5), вещества, подлежащие тестированию, добавляли к 10 мкл связывающего буфера и планшеты инкубировали в течение 20 мин. Антитела, направленные против VCAM-1 (BBT, № ВВА6) и против VLA-4 (Immunotech, № 0764), использовали в качестве контролей.
2.6. Клетки U937 инкубировали в буфере, блокирующем рецептор Fc, в течение 20 мин, а затем переносили пипетками при концентрации 1 х 106/мл и в количестве 100 мкл на лунку (конечный объем: 125 мкл/лунка).
2.7. Планшеты медленно погружали под углом 45° в останавливающий буфер (100 мМ NaCl, 100 мкМ MgCl2, 100 мкМ MnCl2, 100 мкМ CaCl2 в 25 мМ Tris, рН 7,5) и избыток жидкости затем удаляли ее отбором. Процедуру повторяли.
2.8. 50 мкл/лунка раствора красителя (16,7 мкг/мл красителя 33258 Hoechst, 4% формальдегида, 0,5% Triton-X-100 в PBS)/лунка затем инкубировали в планшетах в течение 15 мин.
2.9. Избыток жидкости удаляли из планшетов ее отбором и планшеты затем медленно погружали под углом 45° в останавливающий буфер (100 мМ NaCl, 100 мкМ MgCl2, 100 мкМ MnCl2, 100 мкМ CaCl2 в 25 мМ Tris, рН 7,5). Процедуру повторяли. Затем планшеты измеряли с присутствующей жидкостью (останавливающий буфер) в цитофлюориметре (Millipore) (чувствительность: 5, фильтр: длина волны возбуждения: 360 нм, длина волны эмиссии: 460 нм).
Интенсивность света, испускаемого окрашенными клетками U937, представляет собой меру количества клеток U937, которые прилипли к hVCAM-1(1-3)-IgG, и, таким образом, оставались на планшете, и, следовательно, являются мерой способности добавленного тестируемого вещества ингибировать указанную адгезию. Концентрацию IC50, которая приводит к ингибированию адгезии на 50%, рассчитывали по ингибированию адгезии, наблюдаемому при различных концентрациях тестируемого вещества.
3. Результаты
Следующие результаты были получены в тесте адгезии клеток U937 к VCAM-1 (величины IC50 в нМ (нмоль/л)).
Фармакологические свойства соединений формулы I можно также исследовать на следующих моделях.
В) Адгезия лейкоцитов у крыс
На модели адгезии лейкоцитов у крыс исследовали способность соединений формулы I влиять на адгезию лейкоцитов в венулах крыс. Адгезию лейкоцитов к эндотелию посткапиллярных венул рассматривают как важный этап при реакциях воспаления (J.M. Harlan, Blood 1985, 65, 513). Хорошо координированная динамическая последовательность событий, в которых хемотаксические цитокины и молекулы клеточной адгезии играют активную роль, происходит, когда лейкоциты мобилизуются из крови в воспаленные области. Было обнаружено, что взаимодействия между VCAM-1 и VLA-4 играют ключевую роль в адгезии и эмиграции лейкоцитов и в возросшей проницаемости кровеносных сосудов для макромолекул, которые индуцируются различными веществами-медиаторами и цитокинами (D. Seiffge, Int. J. Microcirc. 1995, 15, 301). В настоящей модели местные или системные инъекции эндотоксинов, например зимосана, бактериальных токсинов, таких как липополисахариды (LPS), или адъюванта Фрейнда используют для того, чтобы вызвать генерализованное воспаление или ревматоидный артрит, который приводит к прилипанию и эмиграции лейкоцитов в пораженные области органов. Определяют возросшую адгезию лейкоцитов к эндотелию венул, которая вызвана эндотоксином.
Для определения адгезии лейкоцитов использовали микроскоп с инвертированной камерой (от компании Zeiss), который снабжен видеосистемой. Зимосан или бактериальный эндотоксин инъецировали самцам крыс Sprague-Dawley (масса тела: приблизительно 250 г), которым давали легкую галотановую премедикацию. Контрольным животным вводили такой же объем 0,9% раствора хлорида натрия. Затем животным вводили тестируемое вещество подкожно или орально в виде однократной дозы или в виде множественных доз. Для проведения измерения крыс анестезировали внутримышечной инъекцией 1,25 г уретана/кг. Им давали возможность дышать спонтанно через трахеальную трубку. Регулируемое нагревающее одеяло использовали для поддержания температуры тела на уровне 37°С. Брыжейку осторожно выделяли через разрез в брюшной полости, помещали на термостатируемое (37°С) окно на столик микроскопа и покрывали жидким парафином при 37°С. Илеоцекальную область брыжейки удерживали в положении с помощью трех тупых иголок и пластицина. После 30-минутного периода уравновешивания, в течение которого ткани давали возможность стабилизироваться, определяли адгезию лейкоцитов в посткапиллярных венулах диаметром 20-30 мкм и длиной приблизительно 100 мкм подсчетом в 2-3 сегментах венул с интервалами 10 мин в течение периода 1 ч. Считают, что лейкоцит прилипает к эндотелию, когда он находится в неподвижном состоянии в течение более чем 30 с. После эксперимента определяли лейкоцитарную формулу в системной крови и содержание фибриногена в крови. Ингибрование адгезии лейкоцитов, вызванное тестируемым веществом, выражается уменьшением (в %) количества прилипших лейкоцитов у обработанных животных, по сравнению с количеством у контрольных животных.
С) Гиперчувствительность отсроченного типа у мышей
Модель гиперчувствительности отсроченного типа (DTH) использовали для исследования антиаллергического или противовоспалительного эффекта соединений формулы I. DTH представляет собой воспалительную реакцию кожи, которая вызвана сенсибилизацией антигенными веществами. Для определения in vivo соответствующей воспалительной реакции и вовлечения лейкоцитов в воспаленные области, вещества тестируют на следующей модели DTH у мышей (см. также T.B. Issekutz, J. Immunol. 1991, 147, 4178).
Группы самок мышей BALB/c (масса тела: приблизительно 20 г) сенсибилизируют накожно, на выбритую часть кожи, 150 мкл 3% раствора оксазолона, который вызывает сильную воспалительную реакцию DTH. Через 6 дней реакцию провоцируют введением 20 мкл 1% раствора оксазолона в правые уши животных. Тестируемые вещества в каждом случае вводят подкожно или орально за 44 ч до провокации реакции, за 20 ч до провокации реакции и через 4 ч после провокации реакции. Непосредственно перед провокацией реакции и через 24 ч после провокации используют микрометр Mituyoto Engineering для измерения изменения толщины правого уха вследствие воспалительного отека уха. Разность между указанными двумя измерениями определяют для каждого животного в группе. Средние величины различий у группы животных, получавших тестируемое вещество, с одной стороны, и у не получавшей лечение контрольной группы, с другой стороны, сравнивают. Процентную долю ингибирования отека ушей принимают в качестве меры эффекта вещества.
D) Антиастматический эффект у морских свинок
Способность соединений формулы I влиять на легочную функцию и их антиастматический эффект можно определить на модели морских свинок, которая основана на способе, описанном G. Moacevic, Arch. Toxicol. 1975, 34, 1. Технические приготовления к данному исследованию проводят в соответствии с деталями, описанными Moacevic. Используют самцов белых морских свинок, имеющих массу тела 300-500 г. Животных помещают в плетизмограф (от FMI) и регистрируют три исходные величины параметров частоты дыхания и амплитуды дыхания. На данной модели астматическая реакция характеризуется уменьшением амплитуды дыхания (=уменьшению дыхательного объема вследствие сужения бронхов) и увеличением частоты дыхания (=рефлекторной реакции). У пациентов с астмой данное состояние известно как диспноэ.
За 22 дня до начала исследования белых морских свинок сенсибилизируют 0,1% раствором яичного альбумина, 1 мл которого вводят каждому животному в два последовательных дня. Приступ экспериментальной астмы вызывают ингаляцией 0,3% раствора яичного альбумина в течение 1 мин. После фазы восстановления длительностью 40-60 мин животные вдыхают тестируемое вещество в виде водного раствора. Непосредственно после этого в течение 1 мин подают 0,3% раствор яичного альбумина. В течение следующей фазы восстановления длительностью 30 мин животные дышат обычным воздухом. Данную процедуру повторяют дважды. Если приступы астмы становятся угрожающими для жизни, животным дают кислород.
Антиастматический эффект у овец можно определить как описано, например, Abraham et al., J. Clin. Invest. 1994, 93, 776.
Е) Антиатеросклеротический эффект можно исследовать на следующих животных моделях
Е1) Манжетная модель формирования неоинтимы
Мышей дикого типа линии C57BL/6J поставляет компания-питомник Charles River Wiga GmbH (Sulzfeld), в то время как гомозиготных мышей КО линии C57BL/6J-ApoE tm1Unc (ApoE KO) поставляет The Jackson Laboratory (Maine, USA). В начале эксперимента возраст всех мышей составляет от 10 до 12 недель, и их содержат в помещениях с полностью кондиционируемым воздухом при температуре 22°С. Фазы день/ночь программы регулируемого освещения устанавливают на периоды 12 ч в каждом случае. Сначала мышей анестезируют 60 мг пентобарбитала натрия/кг массы тела, который вводят внутрибрюшинно. Затем каждому животному дополнительно вводят внутримышечно 0,01 мг ксилазина/10 г массы тела.
Мышей фиксируют в положении лежа на спине, внутренние поверхности каждой из двух задних лап бреют и дезинфицируют. Кожу на внутренней стороне левого бедра вскрывают посредством продольного разреза длиной около 1 см и бедренную артерию выделяют от окружающей ткани и от бедренной вены и седалищного нерва. Кусочек полиэтиленовой трубки длиной приблизительно 2 мм (внутренний диаметр 0,58 мм, наружный диаметр 0,965 мм, Becton Dickinson, Sparks, MD, USA) затем вскрывают разрезом вдоль его длины и укладывают вокруг бедренной артерии и фиксируют с использованием проленовых нитей (7/0, 0,5 м от компании Ethicon, Norderstedt). Затем кожу снова зашивают с использованием непрерывного шва. Правую заднюю лапу оперируют аналогичным образом, но без помещения манжеты вокруг бедренной артерии. Затем животное возвращают в его клетку. С момента операции и в последующем животное обрабатывают ежедневно тестируемым веществом.
В конце эксперимента мышей снова анестезируют 60 мг пентобарбитала натрия/кг массы тела, вводимого внутрибрюшинно, и 0,01 мг ксилазина/10 г массы тела, вводимого внутримышечно. Для фиксации сосудов in situ каждой мыши затем производят инъекцию 4% раствора формалина в брюшную аорту. Затем правую и левую бедренные артерии удаляют. Отрезок артерии, который охватывает область около 1 мм, ближайшую к манжете, отрезок, заключенный в саму манжету, и область сосуда, на 1 мм отдаленную от манжеты, удаляют с левой стороны. С правой стороны такой отрезок соответствует области, которая только выделена, но не охвачена манжетой во время операции.
Отрезки левой и правой бедренной артерии, которые были фиксированы в 4% растворе формалина, теперь заливают в парафин. Несколько срезов, которые в последующем окрашивают гематоксилином и эозином для проводимого с помощью программного обеспечения (LeicaQWin от Leica Imaging Systems, Cambridge, GB) морфометрического анализа, готовят из области левой артерии, окруженной манжетой, и из соответствующей области правой, контрольной артерии.
Оценивают три среза ткани из области левой бедренной артерии, окруженной манжетой, и три среза из соответствующей области правой, контрольной артерии на мышь. После маркировки наружной эластической пластины, внутренней эластической пластины и границы между просветом и эндотелием аналитическая программа рассчитывает следующие площади: просвета, неоинтимы и среднего слоя. Размеры указанных площадей даны в единицах мкм2. Эффект соединения указан уменьшением соотношения неоинтима/средний слой, по сравнению с контрольной группой.
Е2) Трансплантация сердца
На модели аллогенной трансплантации сердца трансплантации проводят между двумя генетически несовместимыми линиями крыс. Для этого крыс Wistar-Furth используют в качестве животных-доноров, а крыс Lewis используют в качестве животных-реципиентов. Животных получают от компании-питомника Charles River Wiga GmbH (Sulzfeld, Germany). Самцов крыс Lewis массой 270-330 г и в возрасте от 2,5 до 3 месяцев и самцов крыс Wistar-Furth массой 200-250 г и в возрасте от 1,5 до 2 месяцев содержат в постоянных, регулируемых условиях (температура 19-22°С; относительная влажность атмосферы 50-55%; фазы день/ночь программы регулируемого освещения устанавливают на периоды 12 ч каждый).
Для операции крысам вводят комбинацию 3,3 мг ксилазина/кг массы тела и 115 мг кетамина/кг массы тела. После того как анестетик окажет эффект, брюшную полость реципиента вскрывают срединным разрезом. Брюшную аорту и нижнюю полую вену отделяют друг от друга между почечной артерией и веной и подвздошно-поясничными сосудами. Аорту затем пережимают краниально с использованием сосудистого зажима. На каудальном конце шелковую нить накладывают вокруг двух сосудов и плотно затягивают. Вторую шелковую нить накладывают в незатянутом состоянии вокруг краниального конца нижней полой вены. Животное-донор забивают после вскрытия брюшной полости пересечением крупных брюшных кровеносных сосудов. Данная точка времени служит сигналом начала периода, в течение которого донорский орган подвергается ишемии. Затем вскрывают диафрагму и обнажают сердце. Верхнюю и нижнюю полую вену перевязывают и пересекают со стороны, отдаленной от сердца. Шелковую нить затем используют для выполнения перевязки единой массой легочных вен. Затем легочную аорту и артерию приподнимают пинцетом и перерезают. Теперь трансплантат освобождают от остатков крови в сосудистой системе. Затем сердце поднимают, отделяют вместе с массовой лигатурой от легких и хранят от одной до двух минут в холодном физиологическом растворе NaCl. Затем накладывают анастомоз конец-в-бок аорты и легочной артерии донорского органа соответственно с брюшной артерией и нижней полой веной животного-реципиента. После завершения сосудистых анастомозов последовательно открывают венозное кровообращение, а затем артериальное кровообращение. Наконец, брюшную полость снова зашивают с использованием брюшинного/мышечного шва и кожного шва. После возобновления кровообращения и короткой фазы восстановления трансплантированное сердце сокращается с частотой синусового ритма приблизительно от 100 до 120 сокращений/мин. Для подавления иммунитета циклоспорин А (CSA) вводят или подкожно (п/к), или орально с питьевой водой. После преодоления периода острого отторжения дозу 25 мг/кг массы тела можно снизить с 15-го дня после операции и далее до 5 мг/кг массы тела. Инъекции выполняют 1 раз/день утром в область задней части шеи животных.
Переход от подкожного введения CSA к оральному введению CSA происходит на 22-й день после операции для того, чтобы была уверенность в преодолении периода острого отторжения. Подлежащее исследованию вещество вводят в течение периода 100 дней со времени операции и далее. После окончания периода наблюдения (100 дней) животных анестезируют и вскрывают брюшную полость. Затем сердце отдаляют от брюшных сосудов, в то же самое время сохраняя культи сосудов, затем разрезают на срезы и хранят в 4% растворе формалина. После фиксации срезов сердца их заливают в парафин и окрашивают на эластический слой с использованием стандартизированной гистологической методики van Gieson. Пролиферацию неоинтимы и сужение просвета сосудов, связанное с ней, классифицируют в соответствии со способом Adams et al. (Transplantation 1993, 56, 794). Классифицируют увеличенные тканевые образования между внутренним эластическим слоем и эндотелием. Специальная краска van Gieson, которая избирательно окрашивает эластические волокна, облегчает оценку. На эффект соединения указывает уменьшение пролиферации неоинтимы и, таким образом, атеросклероза трансплантата по сравнению с контрольной группой.
Е3) Модель атеросклероза у мышей, «оглушенных» АроЕ (КО)
Гомозиготных мышей КО линии C57BL/6J-ApoE tm1Unc (ApoE KO) поставляет The Jackson Laboratory (Maine, USA). В начале эксперимента возраст всех мышей составляет от 10 до 12 недель, и их содержат на стандартном корме для лабораторных животных (Altromin, Lage) в помещениях с полностью кондиционируемым воздухом при температуре 22°С. Фазы день/ночь программы регулируемого освещения устанавливают на периоды 12 ч каждый. Животных обрабатывают тестируемым веществом в течение 4 месяцев.
В конце эксперимента мышей анестезируют 60 мг пентобарбитала натрия/1 кг массы тела, вводимого внутрибрюшинно, и 0,01 мг ксилазина/10 г массы тела, вводимого внутримышечно. Затем удаляют сердце и дугу аорты, а также нисходящую грудную аорту и фиксируют в 4% растворе формалина. Нисходящую аорту обрабатывают красителем Масляный красный О для окрашивания жировых поражений. Морфометрический анализ жировых поражений выполняют с использованием микроскопа (типа Leitz DM RBE, от Leica, Bensheim), камеры, которая соединена с ним и которая имеет блок регулировки (типа CF 15 MCC, Kappa Messtechnik, Gleichen), и компьютера (Leica, Bensheim). Измерения выполняют с использованием компьютерной программы для анализа изображений (LeicaQWin от Leica Imaging Systems, Cambridge, GB). Сердце и дугу аорты разрезают в продольном направлении и окрашивают гематоксилином и эозином для морфометрического анализа. В каждом случае оценивают 15-20 срезов. Дополнительные срезы исследуют иммуногистохимически для выявления макрофагов и Т-лимфоцитов. На эффект соединения указывает уменьшение образования бляшек в аорте по сравнению с контрольной группой.
F) Эффект кардиозащиты можно исследовать на следующей животной модели
Размер инфаркта сердца у крыс
Самцов крыс Wistar в возрасте от 2,5 до 3 месяцев и имеющих массу тела 270-330 г получают от компании-питомника Charles River Wiga GmbH (Sulzfeld, Germany). Животных содержат в постоянных, регулируемых условиях (температура 19-22°С; относительная атмосферная влажность 50-55%; фазы день/ночь программы регулируемого освещения устанавливают на периоды 12 ч каждый). Для операции крысам вводят комбинацию 3,3 мг ксилазина/кг массы тела и 115 мг кетамина/кг массы тела. Затем животных интубируют и проводят искусственную вентиляцию легких с использованием 30% кислорода. Грудную область бреют, дезинфицируют и вскрывают посредством левой латеральной торакотомии. Левую коронарную артерию или перевязывают постоянно в течение 48 ч, или в течение 4 недель, на 2-3 мм ниже ушка левого предсердия, или еще ее перевязывают на 30 мин и реперфузируют в течение 47,5 ч или в течение 4 недель.
После операции грудную полость вновь зашивают и животных экстубируют, как только начинается спонтанное дыхание. Тестируемое вещество вводят через 30 мин после перевязки или непосредственно перед реперфузией. Затем животных обрабатывают ежедневно тестируемым веществом. В конце эксперимента животных еще раз анестезируют комбинацией 3,3 мг ксилазина/кг массы тела и 115 мг кетамина/кг массы тела. Для анализа движения стенки животных, сердца которых реперфузировали, исследуют ядерно-магнитно-резонансной томографией. В случае животных, чьи сердца не реперфузировали, через сонную артерию в левый желудочек вводят катетер с наконечником для измерения давления в левом желудочке и его сократимости. После этого сердца всех животных удаляют и перфузируют в аппарате Langendorff ретроградным образом через аорту 1% раствором красителя Эванса синего при 37°С для определения анатомической зоны с риском и неишемической зоны. Затем сердца разрезают на 5-6 тонких срезов и инкубируют в течение 15 мин в растворе 2,3,5-трифенилтетразолийхлорида с целью определения жизнеспособной сердечной ткани и мертвой сердечной ткани. Планиметрический анализ зоны с риском и области инфаркта выполняют с использованием камеры (Leica, Bensheim) и прикрепленного компьютерного блока с аналитическим программным обеспечением (Leitz, Bensheim). Зону с риском выражают в процентах на основании левого желудочка плюс перегородки, а область инфаркта выражают в процентах на основании зоны с риском. На эффект соединения указывает уменьшение области инфаркта на основании зоны с риском по сравнению с контрольной группой.
Изобретение относится к новым производным имидазолидина формулы (I):
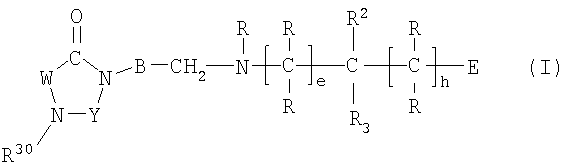
в которой В, Е, W, Y, R, R2, R3, R30, е и h имеют значения, приведенные в п.1 формулы изобретения. Соединения формулы (I) представляют собой фармацевтически активные соединения. Соединения формулы (I) представляют собой ингибиторы адгезии и миграции лейкоцитов и/или антагонисты рецептора адгезии VLA-4, который относится к группе интегринов. Они пригодны для лечения заболеваний, которые вызваны или связаны с нежелательной степенью адгезии лейкоцитов и/или миграции лейкоцитов или в которых играют роль взаимодействия между клетками или между клетками и матриксом, которые основаны на взаимодействиях рецепторов VLA-4 с их лигандами. Изобретение, кроме того, относится к способам получения соединений формулы (I) и к фармацевтическим композициям, которые содержат соединения формулы (I). 3 н. и 9 з.п. ф-лы.
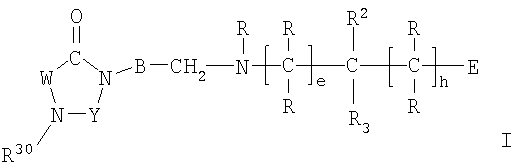
в которой W представляет двухвалентный остаток R1-A-C(R13);
Y представляет карбонильную группу;
А представляет прямую связь;
В представляет двухвалентный остаток из ряда (C1-C6)-алкилена, где этот остаток незамещен или замещен одним или более остатками, выбранными из ряда (C1-C8) -алкила, (C3-C10)-циклоалкила и (C3-C10)-циклоалкил-(C1-C6)-алкила;
Е представляет R10CO, R8-O-CH2;
R представляет водород или (C1-C8)-алкил, где все остатки R независимы друг от друга и могут быть одинаковыми или различными;
R1 представляет водород или (C1-С10)-алкил, который может быть необязательно монозамещен или полизамещен фтором;
R2 представляет водород или (C1-C8)-алкил;
R3 представляет водород, (C1-C10)-алкил, фенил, необязательно замещенный одной или несколькими одинаковыми или различными (C1-C8)-алкоксигруппами, метилендиоксигруппой, диметилметилендиоксигруппой или этилендиоксигруппой;
R8 представляет водород;
R10 представляет гидроксил или (C1-C10)-алкокси;
R13 представляет водород или (C1-C6)-алкил, который может быть необязательно монозамещен или полизамещен фтором;
R30 представляет собой R32(R)N-CO-N(R)-R31;
R31 представляет двухвалентный остаток -R33-R34-R35-R36-, где R36 связан с атомом азота в кольце имидазолидина в формуле I;
R32 представляет фенил, необязательно замещенный (C1-C8)-алкилом;
R33 представляет прямую связь;
R34 представляет двухвалентный остаток фенилена, необязательно замещенный (C1-C8)-алкоксигруппой;
R35 представляет двухвалентный остаток (C1-C8)-алкилена;
R36 представляет прямую связь;
е и h, независимо друг от друга, равны 0 или 1;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимые соли.
W представляет двухвалентный остаток R1-A-C(R13),
В представляет двухвалентный остаток из ряда (C1-C6)-алкилена, где этот остаток замещен одним или более остатками, выбранными из ряда (C1-C8)-алкила, (C3-C10)-циклоалкил-(C1-C6)-алкила;
Е представляет R8OCH2 или R10CO;
R представляет водород или (C1-C8)-алкил, где все остатки R являются независимыми друг от друга и могут быть одинаковыми или различными;
R1 представляет собой (C1-С10)-алкил;
R2 представляет водород или (C1-C8)-алкил;
R3 представляет водород, (C1-C8)-алкил, фенил, необязательно замещенный (C1-C8)-алкокси группой, метилендиоксигруппой, диметилметилендиоксигруппой или этилендиоксигруппой;
R8 представляет водород;
R10 представляет гидроксил или (C1-C8)-алкокси;
R13 представляет (C1-C8)-алкил;
R30 представляет собой R32 (R)N-CO-N(R)-R31;
R31 представляет двухвалентный остаток -R33-R34-R35-R36-, где R36 связан с атомом азота в кольце имидазолидина в формуле I;
R32 представляет фенил, замещенный (C1-C8)-алкилом;
R33 представляет прямую связь;
R34 представляет двухвалентный остаток фенилена, замещенный (C1-C8)-алкоксигруппой;
R35 представляет двухвалентный остаток (C1-C8)-алкилена;
R36 представляет прямую связь;
е и h равны, независимо друг от друга, 0 или 1;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимые соли.
W представляет двухвалентный остаток R1-A-C(R13);
В представляет двухвалентный метиленовый остаток, где метиленовый остаток является незамещенным или замещен одним или двумя остатками из ряда (C1-C8)-алкила, (C3-C6)-циклоалкил-(C1-C6)-алкила;
Е представляет R10CO или НО-СН2;
R представляет водород или (C1-C8)-алкил, где все остатки R независимы друг от друга и могут быть одинаковыми или различными;
R1 представляет (C1-C10)-алкил, который может быть необязательно монозамещен или полизамещен фтором;
R2 представляет водород;
R3 представляет водород, (C1-C8)-алкил, фенил, необязательно замещенный одной или несколькими одинаковыми или различными (C1-C8)-алкоксигруппами, метилендиоксигруппой, диметилметилендиоксигруппой или этилендиоксигруппой;
R10 представляет гидроксил или (C1-C8)-алкокси;
R13 представляет (C1-C6)-алкил, который может быть необязательно монозамещен или полизамещен фтором;
R30 представляет R32(R)N-CO-N(R)-R31;
R31 представляет двухвалентный остаток -R33-R34-R35-R36-, где R36 связан с атомом азота в кольце имидазолидина в формуле I;
R32 представляет фенил, замещенный (C1-C8)-алкилом;
R33 представляет прямую связь;
R34 представляет двухвалентный остаток фенилена, замещенный (C1-C8)-алкоксигруппой;
R35 представляет двухвалентный остаток (C1-C4)-алкилена;
R36 представляет прямую связь;
е и h равны, независимо друг от друга, 0 или 1;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимые соли.
W представляет двухвалентный остаток R1-A-C(R13);
В представляет двухвалентный метиленовый остаток, который замещен изобутилом или циклопропилметилом;
Е представляет R10CO или НО-СН2;
R представляет водород;
R1 представляет метил или трифторметил;
R2 представляет водород;
R3 представляет водород, (C1-C8)-алкил, фенил, необязательно замещенный одной или несколькими одинаковыми или различными (C1-C8)-алкоксигруппами, метилендиоксигруппой, диметилметилендиоксигруппой или этилендиоксигруппой;
R10 представляет гидроксил или (C1-C8)-алкокси;
R13 представляет метил или трифторметил;
R30 представляет R32(R)N-CO-N(R)-R31;
R31 представляет двухвалентный остаток фениленметила, который необязательно замещен в фенильном остатке (C1-C8)-алкоксигруппой, где метильная группа фениленметильного остатка связана с атомом азота в имидазолидиновом кольце в формуле I;
е равно 0 и h равно 1;
во всех их стереоизомерных формах и их смесях во всех соотношениях, и их физиологически переносимые соли.
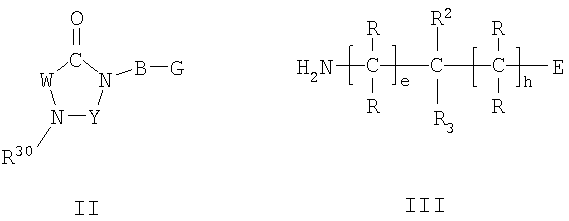
при восстановительном аминировании, где в формулах II и III группы В, Е, W, Y, R, R2, R3 и R30 и е и h определены, как указано в пп.1-4, или, кроме того, функциональные группы могут присутствовать в данных группах в защищенной форме, и группа G представляет альдегидную группу СНО.
| Устройство для доводки конического отверстия | 1979 |
|
SU918059A1 |
| Способ и устройство для рассортировки идущих по разным горизонтам рыб при их ловле | 1946 |
|
SU69831A1 |
| Способ изготовления сердечниковблОКА МАгНиТНыХ гОлОВОК | 1979 |
|
SU842945A1 |
| Способ изготовления сердечниковМАгНиТНыХ гОлОВОК | 1979 |
|
SU842944A1 |
| Устройство для определения среднейМОщНОСТи и диСпЕРСии СлучАйНОгОпРОцЕССА | 1979 |
|
SU796855A1 |
| RU 98117230 А, 27.06.2000. | |||
Авторы
Даты
2008-03-10—Публикация
2002-07-20—Подача