Настоящее изобретение относится к новым производным дигидроимидазо[5,1-a]-β-карболина общей формулы (I)
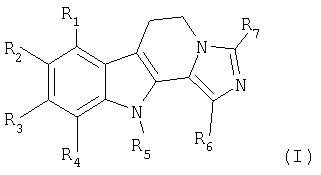
в которой:
R1, R2, R3 и R4, одинаковые или разные, независимо друг от друга, означают атом водорода, атом галогена, линейный или разветвленный (С1-С6)-алкил, гидроксил, линейный или разветвленный (С1-С6)-алкоксил, линейный или разветвленный (С1-С6)-тригалогеналкил, линейный или разветвленный (С1-С6)-тригалогеналкоксил, нитрогруппу, цианогруппу, аминогруппу, линейную или разветвленную (С1-С6)-алкиламиногруппу, линейную или разветвленную ди-[(С1-С6)-алкил]аминогруппу, арил, линейный или разветвленный арил-(С1-С6)-алкил, карбоксил, линейную или разветвленную (С1-С6)-алкилкарбонилоксигруппу, линейный или разветвленный (С1-С6)-ацил, арилоксигруппу или линейный или разветвленный арил-(С1-С6)-алкоксил;
R5 означает атом водорода, линейный или разветвленный (С1-С6)-алкил или линейный или разветвленный арил-(С1-С6)-алкил;
R6 и R7, одинаковые или разные, независимо друг от друга, означают атом водорода, атом галогена, линейный или разветвленный (С1-С6)-алкил, гидроксил, линейный или разветвленный (С1-С6)-алкоксил, линейный или разветвленный (С1-С6)-тригалогеналкил, линейный или разветвленный (С1-С6)-тригалогеналкоксил, цианогруппу, аминогруппу, линейную или разветвленную (С1-С6)-алкиламиногруппу, линейную или разветвленную ди-[(С1-С6)-алкил]аминогруппу, арил, линейный или разветвленный арил-(С1-С6)-алкил, карбоксил, линейную или разветвленную (С1-С6)-алкилкарбонилоксигруппу, линейный или разветвленный (С1-С6)-ацил, арилоксигруппу или линейный или разветвленный арил-(С1-С6)-алкоксил;
их изомерам, а также их аддитивным солям с фармацевтически приемлемой кислотой.
Согласно настоящему описанию под арилом понимают фенильную, нафтильную, тетрагидронафтильную, дигидронафтильную, инденильную или инданильную группу, причем каждая из этих групп может быть замещена, одинаковым или различным образом, одним или несколькими атомами галогена, гидроксилом, цианогруппой, нитрогруппой, линейным или разветвленным (С1-С6)-алкилом, линейным или разветвленным (С1-С6)-алкоксилом, аминогруппой, линейной или разветвленной (С1-С6)-алкиламиногруппой, линейной или разветвленной ди[(C1-C6)-алкил]аминогруппой, арилоксигруппой, линейным или разветвленным арил-(С1-С6)-алкоксилом, линейным или разветвленным (С1-С6)-тригалогеналкилом, линейным или разветвленным (С1-С6)-ацилом, линейным или разветвленным (С1-С6)-алкоксикарбонилом, линейным или разветвленным (С1-С6)-алкиламинокарбонилом или оксогруппой.
Согласно предпочтительному варианту предлагаемыми в изобретении предпочтительными соединениями являются такие, в которых:
R1, R3 и R4 означают атом водорода;
R6 и R7, независимо друг от друга, означают атом водорода, линейный или разветвленный (С1-С6)-алкил, арил; и
R5 означает атом водорода, линейный или разветвленный (С1-С6)-алкил.
Предпочтительными заместителями R2 согласно изобретению являются атом водорода, атом галогена (атом фтора, хлора или брома), линейный или разветвленный (С1-С6)-алкил, гидроксил, линейный или разветвленный (С1-С6)-алкоксил.
Предпочтительными соединениями согласно изобретению являются следующие:
3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-метокси-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-метокси-5,6-дигидроимидазо[5,1-a]-β-карболин;
8-метокси-3-метил-1-фенил-5,6-дигидроимидазо[5,1-a]-β-карболин;
1-этил-8-метокси-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболин;
8-метокси-3-изопропил-5,6-дигидроимидазо[5,1-a]-β-карболин;
8-метокси-3-пропил-5,6-дигидроимидазо[5,1-a]-β-карболин;
8-метокси-11-метил-3-пропил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-метокси-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-гидрокси-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-гидрокси-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-хлор-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-метокси-3-фенил-5,6-дигидроимидазо[5,1-a]-β-карболин;
11-этил-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-хлор-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-хлор-3-метил-11-этил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
3,8-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
3,8,11-триметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
11-этил-3,8-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-фтор-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-бром-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-фтор-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-фтор-11-этил-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-бром-11-этил-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат.
Изобретение относится также к способу получения соединений формулы (I), отличающемуся тем, что в качестве исходного соединения используют соединение формулы (II)

в котором R1, R2, R3, R4 и R5 имеют такое же значение, как в формуле (I), которое вводят во взаимодействие согласно условиям синтеза типа пептидного связывания, с соединением формулы (III)

в которой R6 и R7 являются такими, как указанные в формуле (I), получая соединение формулы (IV)
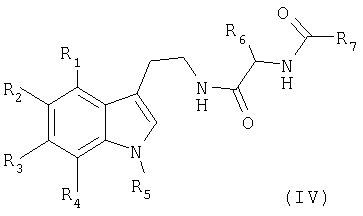
в котором R1, R2, R3, R4, R5, R6 и R7 имеют вышеуказанные значения, которое обрабатывают в присутствии оксихлорида фосфора в растворителе, таком, как толуол, с получением соединения формулы (I)

в котором R1, R2, R3, R4, R5, R6 и R7 имеют вышеуказанные значения, полученные соединения формулы (I) согласно изобретению, при желании, превращают в их аддитивные соли с фармацевтически приемлемой кислотой.
Соединения формул (II) и (III) либо имеются в продаже, либо их получают способами, известными в органическом синтезе.
Объектом настоящего изобретения также являются фармацевтические композиции, включающие в качестве действующего начала по меньшей мере одно соединение формулы (I), или его аддитивные соли с фармацевтически приемлемой кислотой, индивидуально или в сочетании с одним или несколькими эксципиентами или инертными, нетоксическими, фармацевтически приемлемыми наполнителями.
Из фармацевтических композиций согласно изобретению в особенности следует назвать такие, которые пригодны для перорального, парентерального (внутривенного, внутримышечного или подкожного), чрескожного, назального, ректального, подъязычного, глазного или респираторного введения, и, в частности, в виде простых или дражированных таблеток, подъязычных таблеток, пакетиков, желатиновых капсул, лепешек, свечей, кремов, мазей, гелей для лечения кожи, препаратов для инъекций или пригодных для питья препаратов, аэрозолей, глазных капель или капель в нос.
Следующие примеры поясняют изобретение, но никоим образом не ограничивают его объема охраны.
Производные дигидроимидазо[5,1-a]-β-карболина описаны в уровне техники в качестве промежуточных соединений синтеза:
соединения, в которых R1=R2=R3=R4=R5=R6=H и R7=CH3, описаны Y.Kanaoke, E.Sato, O.Yonemitsu, Tetrahedron, 24, 2591-2594 (1968);
соединения, в которых R1=R2=R3=R4=R5=R6=H и R7=C6H5, описаны Elliott, J. Chem., 3302-3305 (1962).
Однако эти производные описаны только как промежуточные продукты и их терапевтическая активность неизвестна. Они составляют часть настоящего изобретения только в качестве лекарственного средства, в частности как снотворное.
Исходные продукты и/или используемые реагенты представляют собой известные или получаемые по известным методикам продукты.
Структуры соединений, описанных в примерах и на стадиях синтеза, определены обычными спектрофотометрическими методами (инфракрасная спектроскопия, ядерный магнитный резонанс, масс-спектрометрия).
Для иллюстрации объекта настоящего изобретения ниже приводится несколько примеров производных общей формулы (I), в которых R1=R3=R4=H:
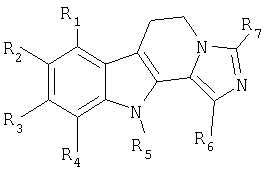
ПРИМЕР 1
3,11-Диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Стадия А
2-Ацетиламино-N-[2-(1H-индол-3-ил)этил]ацетамид
К охлажденной до температуры 0°С смеси 4,32 г (27 ммоль) триптамина и 3,3 г (28 ммоль) N-ацетилглицина в 100 мл диметилформамида последовательно добавляют 5,8 мл (27,5 ммоль) дифенилфосфорилазида и 3,85 мл (27,5 ммоль) триэтиламина. Смесь перемешивают в атмосфере азота при комнатной температуре в течение 12 часов, растворитель удаляют при пониженном давлении. Полученный остаток подвергают флэш-хроматографии на силикагеле, получая 5,5 г (21 ммоль) целевого продукта, или выход составляет 78%.
Стадия В
2-Ацетиламино-N-[2-(1-метил-1H-индол-3-ил)этил]ацетамид
К 2 г (8,23 ммоль) полученного согласно методике А амида в 20 мл диметилформамида добавляют 0,35 г (8,75 ммоль) NaH (60%, в масле) и алкилгалогенид (CH3I - 0,55 мл, 8,83 ммоль). Перемешивают в течение 12 часов при комнатной температуре, после чего удаляют растворитель при пониженном давлении. Тогда после флэш-хроматографии на силикагеле получают 1,02 г (3,96 ммоль) целевого продукта, или выход составляет 48%.
Стадия С
3,11-Диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
1,02 г (3,96 ммоль) полученного согласно методике В амида в 50 мл толуола доводят до температуры кипения с обратным холодильником, в течение 30 минут добавляют 10 мл POCl3 в 15 мл толуола. Реакционную смесь концентрируют при пониженном давлении и остаток обрабатывают с помощью 5 мл этанола, затем добавляют 50 мл 20%-ного раствора NaOH. Выдерживают при перемешивании в течение 30 минут, образовавшееся твердое вещество рекуперируют путем отфильтровывания. Продукт очищают путем флэш-хроматографии на силикагеле; получают 280 мг (1,26 ммоль) целевого продукта (выход=32%).
3,11-Диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат растворяют в этаноле, добавляют 1 эквивалент метансульфокислоты, путем осаждения получают соответствующий мезилат.
1Н-ЯМР (300 МГц, CDCl3), δ (м.д.):
2,72 (с, 3H); 2,78 (с, 3H); 3,23 (т, J=6,9 Гц, 2H), 3,71 (с, 3H); 4,22 (т, J=6,9 Гц, 2H); 7,11 (м; 2Н); 7,24 (с, 2H), 7,48 (м, 2H)
Масс-спектрометрия (m/z): 237 (100); 221; 195; 181.
ПРИМЕР 2
8-Метокси-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и N-ацетилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3), δ (м.д.):
2,40 (с, 3H); 2,80 (с, 3H); 3,00 (т, J=6,6 Гц, 2H); 3,80 (с, 3H); 3,96 (т, J=6,6 Гц, 2H); 6,78 (м, 2H); 7,20 (д, J=8,8 Гц, 1H); 7,50 (с, 1H)
Пример 3
8-Метокси-5,6-дигидроимидазо[5,1-a]-β-карболин
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и N-формилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3: CD3OD/90:10), δ (м.д.):
3,09 (т, J=6,9 Гц, 2H); 3,82 25 (с, 3H); 4,2 (т, J=6,9 Гц, 2H); 6,79 (дд, J=2,4 и 8,8 Гц, 1H); 6,91 (д, J=2,4 Гц, 1H); 7,10 (с, 1H); 7,23 (д, J=8,8 Гц, 1H); 7,50 (с, 1Н)
Масс-спектрометрия (m/z): 239 (100); 196; 168; 140.
Пример 4
8-Метокси-3-метил-1-фенил-5,6-дигидроимидазо[5,1-a]-β-карболин
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и N-ацетил-2-фенилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3), δ (м.д.):
2,5 (с, 3H); 3,15 (т, J=6,9 Гц, 2H); 3,85 (с, 3H), 4,08 (т, J=6,9 Гц, 2H); 6,8 (дд, J=2,4 и 8,8 Гц, 1H); 6,94 (д, J=2,4 Гц, 1H); 7,15 (д, J=8,8 Гц, 1H); 7,36 (м, 1H); 7,46 (м, 2H); 7,74 (м, 2H); 8,30 (с, 1H).
Масс-спектрометрия (m/z): 329 (100); 286; 165; 143.
Пример 5
1-Этил-8-метокси-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболин
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и N-ацетил-2-этилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3), δ (м.д.):
1,30 (т, 7 Гц, 3H); 2,43 (с, 3H); 2,80 (кв, 7 Гц, 2H); 3,11 (т, J=7 Гц, 2H); 3,88 (с, 3H), 4,06 (т, J=7 Гц, 2H); 6,83 (дд, J=2,4 И 8,7 Гц, 1H); 6,97 (д, J=2,4 Гц, 1H); 7,27 (д, J=8,7 Гц, 1H); 8,71 (уш. с, 1H).
Масс-спектрометрия (m/z): 281 (100); 266; 250; 233.
Пример 6
8-Метокси-3-изопропил-5,6-дигидроимидазо[5,1-a]-β-карболин
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и N-изобутирилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
1,33 (д, J=6,8 Гц, 6H); 3,04 (м, 4H); 3,86 (с, 3H); 4,04 (т, J=6,8 Гц, 2H); 6,79 (д, J=8,76 Гц, 1H); 6,95 (с, 1H); 6,98 (с, 1H); 7,22 (д, J=8,76 Гц, 1H); 10,30 (с, 1H)
Масс-спектрометрия (m/z): 281 (100); 266; 196; 133.
Пример 7
8-Метокси-3-пропил-5,6-дигидроимидазо[5,1-a]-β-карболин
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и N-бутирилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3), δ (м.д.):
1,00 (т, 7,5 Гц, 3H); 1,76 (м, 2H); 2,70 (т, 7,5 Гц, 2H); 3,08 (т, J=7,5 Гц, 2H); 3,87 (с, 3H), 3,97 (т, J=7,5 Гц, 2H); 6,81 (дд, J=2,7 и 8,7 Гц, 1H); 6,88 (д, J=2,7 Гц, 1H); 7,08 (с, 1H); 7,28 (д, J=8,7 Гц, 1H), 10,38 (уш. с, 1H).
Масс-спектрометрия (m/z): 281 М+; 269; 252 (100); 209.
Пример 8
8-Метокси-11-метил-3-пропил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и N-бутирилглицин.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
1,06 (т, 7,5 Гц, 3H); 1,83 (м, 2H); 2,75 (т, 7,5 Гц, 2H); 3,08 (т, J=6,8 Гц, 2H); 3,8 (с, 3H), 3,88 (с, 3H), 4,06 (т, J=6,8 Гц, 2H); 6,86 (дд, J=2,4 и 8,7 Гц, 1H); 6,96 (д, J=2,4 Гц, 1H); 7,15 (с, 1H); 7,18 (д, J=8,7 Гц, 1H).
Масс-спектрометрия (m/z): 295 (100); 266; 223; 133.
Пример 9
8-Метокси-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и N-ацетилглицин.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,44 (с, 3H); 3,05 (т, J=6,9 Гц, 2H); 3,77 (с, 3H), 3,85 (с, 3H), 3,99 (т, J=6,9 Гц, 2H); 6,86 (дд, J=2,4 и 8,7 Гц, 1H); 6,93 (д, J=2,4 Гц, 1H); 7,15 (д, J=8,7 Гц, 1H).
Масс-спектрометрия (m/z): 267 (100); 251; 235; 224.
Пример 10
8-Гидрокси-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
300 мг (1 ммоль) 8-Метокси-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболина, полученного согласно примеру 9, растворяют в безводном дихлорметане при температуре -78°С. Затем добавляют 8 мл BBr3 и выдерживают в течение 12 часов при перемешивании и в атмосфере азота при повышении температуры до комнатной. Добавляют 15 мл 2М раствора NaHCO3, после декантации продукт осаждают в дихлорметане; рекуперируют 150 мг (0,6 ммоль) целевого продукта (выход=50%).
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,45 (с, 3H); 3,05 (т, J=6,7 Гц, 2H), 3,84 (с, 3H), 4,06 (т, J=6,7 Гц, 2H); 6,80 (д, J=8,7 Гц, 1H); 6,91 (с, 1H)); 7,15 (д, J=8,7 Гц, 1H).
Масс-спектрометрия (m/z): 253 (100); 224; 211; 126.
Пример 11
8-Гидрокси-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
350 мг (1,4 ммоль) 8-Метокси-3-метил-5,6-дигидроимидазо-[5,1-a]-β-карболина, полученного согласно примеру 2, растворяют в безводном дихлорметане при температуре -78°С. Затем добавляют 8 мл BBr3 и выдерживают в течение 12 часов при перемешивании и в атмосфере азота при повышении температуры до комнатной. Добавляют 15 мл 2М раствора NaHCO3, после декантации продукт осаждают в дихлорметане, рекуперируют 200 мг (0,83 ммоль) целевого продукта (выход=59%).
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,67 (с, 3H); 3,19 (т, J=7,2 Гц, 2H); 4,21 (т, J=7,2 Гц, 2H); 6,78 (дд, J=2,4 и 8,7 Гц, 1H); 6,88 (д, J=2,4 Гц, 1H); 7,23 (д, J=8,7 Гц, 1H).
Пример 12
3-Метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А триптамин и N-ацетилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3), δ (м.д.):
2,53 (с, 3H); 3,08 (т, J=6,8 Гц, 2H), 3,99 (т, J=6,8 Гц, 2H); 7,04 (м, 2H), 7,16 (м, 2H); 7,36 (с, 1H); 7,44 (д, 1H)
Масс-спектрометрия (m/z): 223 (100); 208; 181; 154.
Пример 13
8-Хлор-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-хлортриптамин и N-ацетилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,72 (с, 3H); 2,81 (с, 3H); 3,16 (т, J=6,9 Гц, 2H); 4,13 (т, J=6,9 Гц, 2H); 7,12 (дд, J=2 и 8,7 Гц, 1H); 7,31 (д, J=8,7 Гц, 1H); 7,44 (д, J=2 Гц, 1H); 7,52 (с, 1H)
Масс-спектрометрия (m/z): 257 (100); 242; 221; 215.
Пример 14
8-Метокси-3-фенил-5,6-дигидроимидазо[5,1-a]-β-карболин
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метокситриптамин и гиппуровую кислоту, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CD3COCD3), δ (м.д.):
2,87 (с, 3H); 3,16 (т, J=6,8 Гц, 2H); 3,82 (с, 3H), 4,45 (т, J=6,8 Гц, 2H); 6,77 (дд, J=2,4 и 9,6 Гц, 1H); 7,05 (д, J=2,4 Гц, 1H); 7,30 (с, 1H); 7,31 (д, J=9,6 Гц, 1H); 7,52 (м, 3H); 7,75 (м, 2H); 8,02 (с, 1H)
Масс-спектрометрия (m/z): 315 (100); 272; 211; 168.
Пример 15
11-Этил-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А триптамин и N-ацетилглицин, а также используя этилбромид в качестве алкилирующего агента на стадии В.
1Н-ЯМР (300 МГц, CD3OD), δ (м.д.):
1,33 (т, 7,1 Гц, 3H); 2,76 (с, 3H); 2,78 (с, 3H); 3,25 (т, J=6,9 Гц, 2H), 4,24 (м, 4H); 7,12 (т, 1H); 7,3 (м, 2H); 7,49 (д+1с, 2Н).
Пример 16
8-Хлор-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-хлортриптамин и N-ацетилглицин.
1Н-ЯМР (300 МГц, CDCl3), δ (м.д.):
2,60 (с, 3H); 2,70 (с, 3H); 3,16 (т, J=6,8 Гц, 2H); 4,20 (т, 6,8 Гц, 2H); 7,12 (д, J=8,8 Гц, 1H); 7,25 (д, J=8,8 Гц, 1H); 7,50 (с, 1H); 7,6 (с, 1H).
Масс-спектрометрия (m/z): 271 (100); 235; 193; 167.
Пример 17
8-Хлор-3-метил-11-этил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-хлортриптамин и N-ацетилглицин, а также используя этилбромид в качестве алкилирующего агента на стадии В.
1Н-ЯМР (300 МГц, CDCl3), δ (м.д.):
1,39 (т, J=4,8 Гц, 3H); 2,70 (с, 3H); 2,85 (с, 3H); 3,2 (т, J=7 Гц, 2H); 4,3 (м, 4H); 7,2 (дд, J=2,4 и 8,8 Гц, 1H); 7,35 (д, J=8,8 Гц, 1H); 7,53 (д, J=2,4 Гц, 1H); 7,6 (с, 1H).
Масс-спектрометрия (m/z): 285 (100); 270; 249; 180.
Пример 18
3,8-Диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метилтриптамин и N-ацетилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,43 (с, 3H); 2,61 (с, 3H); 2,85 (с, 3H); 3,14 (т, J=7 Гц, 2H); 4,08 (т, J=7 Гц, 2H); 7,05 (д, 8,6 Гц, 1H); 7,28 (с, 1H), 7,32 (д, J=8,6 Гц, 1H); 7,51 (с, 1H).
Масс-спектрометрия (m/z): 237 (50); 129; 73; 55 (100).
ПРИМЕР 19
3,8,11-Триметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метилтриптамин и N-ацетилглицин.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,40 (с, 3H); 2,70 (с, 3H); 2,75 (с, 3H); 3,2 (т, J=6,9 Гц, 2H); 3,75 (с, 3H); 4,18 (т, J=6,9 Гц, 2H); 7,07 (д, J=8,5 Гц, 1H), 7,21 (д, J=8,5 Гц, 1H); 7,27 (с, 1H); 7,50 (с, 1H)
Масс-спектрометрия (m/z): 251 (100); 235; 203.
Пример 20
11-Этил-3,8-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-метилтриптамин и N-ацетилглицин, а также используя этилбромид в качестве алкилирующего агента на стадии В.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
1,32 (т, J=7,2 Гц, 3H); 2,40 (с, 3H); 2,72 (с, 3H); 2,78 (с, 3H); 3,21 (т, J=6,9 Гц, 2H); 4,19 (м, 4H); 7,08 (д, J=8,4 Гц, 1H); 7,20 (д, J=8,4 Гц, 1H); 7,29 (с, 1H); 7,45 (с, 1H)
Масс-спектрометрия (m/z): 265 (100); 250; 236; 223.
Пример 21
8-Фтор-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-фтортриптамин и N-ацетилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,60 (с, 3H); 2,75 (с, 3H); 3,09 (т, J=7 Гц, 2H); 4,10 (т, J=7 Гц, 2H); 6,87 (дт, J=2,4 и 9 Гц, 1H), 7,02 (дд, J=2,4 и 9 Гц, 1H); 7,26 (дд, J=3 и 9 Гц, 1H); 7,50 (с, 1H).
Масс-спектрометрия (m/z): 241 (100); 226; 199; 172.
ПРИМЕР 22
8-Бром-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-бромтриптамин и N-ацетилглицин, полученный амид прямо вводят в реакцию циклизации на стадии С.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,68 (с, 3H); 2,86 (с, 3H); 3,19 (т, J=7,2 Гц, 2H); 4,20 (т, J=7,2 Гц, 2H); 7,28 (м, 2H); 7,34 (с, 1H); 7,58 (с, 1H), 7,61 (с, 1Н)
Масс-спектрометрия (m/z): 301/302 (100); 286; 259; 234.
Пример 23
8-Фтор-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-фтортриптамин и N-ацетилглицин.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
2,78 (с, 3H); 2,83 (с, 3H); 3,25 (т, J=6,9 Гц, 2H); 4,31 (т, J=6,9 Гц, 2H); 7,07 (д, J=2,4 и 9 Гц, 1H), 7,22 (дд, J=2,4 и 9 Гц, 1H); 7,32 (дд, J=3 и 9 Гц, 1H), 7,66 (с, 1H).
Масс-спектрометрия (m/z): 255 (100); 213; 185; 128.
Пример 24
8-Фтор-11-этил-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-фтортриптамин и N-ацетилглицин, а также используя этилбромид в качестве алкилирующего агента на стадии В.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
1,32 (т, J=7,2 Гц, 3H); 2,70 (с, 3H); 2,80 (с, 3H); 3,16 (т, J=6,9 Гц, 2H); 4,2 (м, 4H); 6,97 (дт, J=2,4 и 9 Гц, 1H), 7,13 (дд, J=2,4 и 9 Гц, 1H); 7,23 (дд, J=4 и 9 Гц, 1H); 7,65 (с, 1H).
Масс-спектрометрия (m/z): 269 (100); 254; 227; 199.
Пример 25
8-Бром-11-этил-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат
Следуют методике примера 1, используя в качестве субстрата на стадии А 5-бромтриптамин и N-ацетилглицин, а также используя этилбромид в качестве алкилирующего агента на стадии В.
1Н-ЯМР (300 МГц, CDCl3:CD3OD/90:10), δ (м.д.):
1,32 (т, J=7 Гц, 3H); 2,70 (с, 3H); 2,75 (с, 3H); 3,18 (т, J=7 Гц, 2H); 3,59 (с, 3H); 4,20 (м, 4H); 7,19 (д, J=8,7 Гц, 1H), 7,30 (дд, J=1,8 и 8,7 Гц, 1H); 7,53 (с, 1H); 7,63 (д, J=1,8 Гц, 1H).
Масс-спектрометрия (m/z): 329/330 (100); 316; 300; 273.
Производные дигидроимидазо[5,1-a]-β-карболина согласно изобретению, особенно в форме (растворимой) метилсульфонатов, были подвергнуты тестированию на цыпленке и некоторые, активные в случае цыпленка соединения вводили в разовых дозах 6 собакам породы коротконогих гончих обоих полов для полисомнографического исследования по меньшей мере в течение 4 часов.
Экспериментальный протокол тестирования на цыпленке
Цыплят вида JA 657, происходящих из Couvoir Gauguet, 44 Le Pin, содержали по меньшей мере в течение 6 дней по программе чередующегося освещения: 12 часов в дневное время и 12 часов в ночное время, при температуре, регулируемой при 25°С±2°С. Их кормили по желанию и подвергали испытанию в виварии группами по 3 индивидуума со средней массой 100±10 г в день опыта. В этом возрасте у этого вида не существует эффективного менингеального (гемато-мозгового) барьера. Тестируемые продукты вводили путем инъекции в трех дозах (1, 3 и 10 мг/кг) внутримышечно в виде водного раствора или в виде водной суспензии (1 капля твина 80 на мл) каждой из двух групп по 3 цыпленка, за которыми наблюдали в течение 90 минут. Для каждой серии теста (18 вивариумов) существует по меньшей мере одна группа контрольных "отрицательных" цыплят, получающая такой же объем (0,2 мл внутримышечно) воды для инъецируемых препаратов.
В течение периода наблюдения, составляющего 90 минут, всех цыплят интенсивно стимулировали каждые 15 минут путем предоставления полной кормушки и в каждый период, составляющий 5 минут, присваивали оценку, соответствующую состоянию бодрствования на рассматриваемый период, выбранному из следующих 5 состояний: мобильное; лежачее во время бодрствования; состояние дремоты; сонливое; сон стоя (подобное сну состояние). Исследуемыми параметрами являются срок наступления дремотного состояния (ТА), протекающий между инъекцией и первым этапом сна, продолжительность первого сна (TS) и общее время успокоенного состояния за период наблюдения (Tsed), выраженное в минутах и в % от периода наблюдения (Sed).
Для сравнения результатов опытов, реализованных в различные даты, определяли удлинение продолжительности первого сна (TS) по сравнению с контрольными подопытными группами.
Результаты
У цыплят этого возраста вне опыта продолжительность цикла бодрствование-сон составляет 20-30 минут в течение дня. Следовательно, начиная с дозы 1 мг, оказалось, что по меньшей мере 11 соединений (из 20) вызывают очень сильное уменьшение двигательной активности, судя по продолжительности первого сна (TS), когда эта продолжительность превышает 20 минут.
При более высоких дозах: 3 мг/кг и 10 мг/кг число тестируемых продуктов с таким же эффектом составляет 18 из 20 и 20 из 20.
Существует четкая положительная зависимость доза-эффект для большинства тестированных соединений, заключающаяся в уменьшении срока наступления дремотного состояния, если доза повышается.
За 90 минут наблюдения отклонение между временем в успокоенном состоянии и тем же временем, наблюдаемым при введении плацебо, превышает 52 минуты для двух соединений, начиная с дозы 1 мг/кг, для 4 соединений при дозе 3 мг/кг и для 12 соединений при дозе 10 мг/кг.
Экспериментальный протокол тестирования на собаке
Полисомнографические опыты осуществляли с каждым из 3 продуктов группы на 6 собаках обоих полов, взрослых, происходящих из питомника "HARLAN à 03 Gannat", при использовании электродов из нержавеющей стали, хирургически имплантированных на время опыта и контактирующих с лобными костями через синус, напротив моторных участков головного мозга. Использовали метод Nishino и др., адаптированный Tafani, Valin и др. Он включает регистрацию 2 путей для глазных движений, мышечного пути (концентрический электрод в мышцах затылка) и 2 электроэнцефалографических (EEG) путей. Регистрацию EEG, преобразованную в цифровую форму, осуществляли на полиграфе Nicollet Schwarzer или подобном аппарате (DELTAMED Cohérence 2 et 3, MEI Galileo NT) в течение 4 часов после введения желатиновой капсулы 00, содержащей 0, 16 или 48 мг тестируемого продукта (или в среднем 0,1 и 3 мг/кг живой массы).
Каждую собаку регистрировали 4 часа 2 раза в течение 2 последовательных дней либо утром, либо во второй половине дня, после недельного пребывания в клетке для регистрации, имеющей площадь 1 м2, высоту 80 см, выполненной из нержавеющей стали, типа SHOR-LINE. Для каждой собаки регистрация всегда начиналась в один и тот же час. Пищу давали за 30 минут до начала регистрации.
Полисомнографические кривые позволяют различить по меньшей мере 4 стадии для каждого периода, составляющего 30 последовательных секунд: бодрствование, дремота, ортодоксальный сон и парадоксальный сон. Для каждой собаки определяли латентный период появления каждого из первых эпизодов в отсутствие бодрствующего состоянии и продолжительность каждой стадии в двухчасовой период. Сравнение средних значений позволяет изучить воздействие тестируемых продуктов на микроструктуру сна.
РЕЗУЛЬТАТЫ
Латентности представлены в таблицах V-VII:
сон, минуты
сон, минуты
При использовании трех тестируемых продуктов наблюдается четкое уменьшение латентного периода появления первой дремоты, более четкое при дозе 3 мг/кг для продукта примера 1. Латентность первого эпизода ортодоксального сна (характеризующегося "пучками" на кривых EEG) уменьшена вдвое при использовании тестируемых продуктов.
Три соединения вызывают положительный снотворный эффект.
В нижеприводимых таблицах VIII-X представлено время каждой стадии бодрствования.
В течение 4 часов регистрации наблюдают тенденцию к уменьшению времени бодрствования, в особенности при дозе 3 мг/кг для трех соединений. Это уменьшение времени бодрствования происходит главным образом за счет увеличения этапов ортодоксального сна и парадоксального сна.
Наблюдаемые эффекты проявляются более отчетливо в течение первых двух часов, особенно при дозе 1 мг/кг, что может соответствовать кинетике удаления соединений.
Три соединения обладают снотворными свойствами.
В отличие от известных соединений нет изменений во временном отношении ни в состояния дремоты, ни парадоксального сна в период отсутствия бодрствования.
Все имидазопиридоиндольные производные согласно изобретению обладают фармакологической активностью в отношении центральной нервной системы по меньшей мере в отношении двух видов животных. Они уменьшают бодрствование, ускоряют наступление сна (положительный снотворный эффект). У цыпленка и у собаки происходит уменьшение активности во время бодрствования. В этом последнем случае не происходит изменения ультраструктуры сна. Следовательно, соединения согласно изобретению пригодны в качестве лекарственных средств, в особенности как снотворные.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРАНА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В ПАРФЮМЕРИИ | 2009 |
|
RU2577250C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ДИОКСАНЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2010 |
|
RU2562973C2 |
| НОВЫЕ ПИРРОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2607788C2 |
| СПОСОБ ПОЛУЧЕНИЯ АМИНОФЕНОЛЬНЫХ СОЕДИНЕНИЙ | 2005 |
|
RU2376280C2 |
| КОНДЕНСИРОВАННОЕ ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2833338C1 |
| ПИРИДИЛОКСИ ПРОИЗВОДНЫЕ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АКТИВАТОРА/МОДУЛЯТОРА ГАММА-РЕЦЕПТОРА, АКТИВИРУЕМОГО ПРОЛИФЕРАТОРОМ ПЕРОКСИСОМ (PPAR) ГАММА | 2010 |
|
RU2480463C1 |
| КОНДЕНСИРОВАННОЕ 4-ОКСОПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ | 2005 |
|
RU2358969C2 |
| НОВЫЕ ФОСФАТНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2617682C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2005 |
|
RU2409582C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВОЗНИКАЮЩИХ ВСЛЕДСТВИЕ ДИСФУНКЦИИ НИКОТИНОВЫХ РЕЦЕПТОРОВ АЛЬФА7 | 2004 |
|
RU2376290C2 |
Описываются новые производные дигидроимидазо[5,1-a]-β-карболина общей формулы (I)
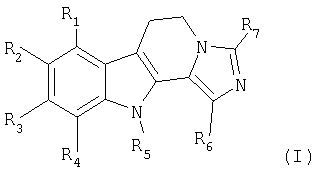
где R1=R3=R4=H;
R2 - водород, галоген, (C1-C6)-алкил, гидроксил, (C1-C6)-алкоксил;
R5 - водород или (C1-C6)-алкил;
R6 и R7 независимо обозначают водород или (C1-C6)-алкил или фенил;
за исключением соединений общей формулы (I), в которой R1-R6 обозначают водород и R7 обозначает группу CH3 или фенил;
их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой, способ их получения и фармацевтическая композиция.
Новые соединения обладают снотворным действием и могут быть использованы при производстве лекарственного средства. 3 н. и 2 з.п. ф-лы, 10 табл.

в которой R1=R3=R4 - H;
R2 обозначает атом водорода, атом галогена, линейный или разветвленный (C1-C6)-алкил, гидроксил, линейный или разветвленный (C1-C6)-алкоксил;
R5 обозначает атом водорода, линейный или разветвленный (C1-C6)-алкил;
R6 и R7, одинаковые или разные, независимо друг от друга обозначают атом водорода или линейный или разветвленный (C1-C6)-алкил или фенил,
за исключением соединений общей формулы (I), в которой R1-R6 обозначают атом водорода и R7 обозначает группу CH3 или фенил,
их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой.
3,11-диметил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-метокси-3-метил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-метокси-5,6-дигидроимидазо[5,1-а]-β-карболин;
8-метокси-3-метил-1-фенил-5,6-дигидроимидазо[5,1-а]-β-карболин;
1-этил-8-метокси-3-метил-5,6-дигидроимидазо[5,1-а]-β-карболин;
8-метокси-3-изопропил-5,6-дигидроимидазо[5,1-а]-β-карболин;
8-метокси-3-пропил-5,6-дигидроимидазо[5,1-a]-β-карболин;
8-метокси-11-метил-3-пропил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-метокси-3,11-диметил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-гидрокси-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-гидрокси-3-метил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-хлор-3-метил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-метокси-3-фенил-5,6-дигидроимидазо[5,1-a]-β-карболин;
11-этил-3-метил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-хлор-3,11-диметил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-хлор-3-метил-11-этил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
3,8-диметил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
3,8,11-триметил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
11-этил-3,8-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-фтор-3-метил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-бром-3-метил-5,6-дигидроимидазо[5,1-а]-β-карболинметансульфонат;
8-фтор-3,11-диметил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-фтор-11-этил-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат;
8-бром-11-этил-3-метил-5,6-дигидроимидазо[5,1-a]-β-карболинметансульфонат.
введения во взаимодействие, в условиях синтеза типа пептидного сочетания, соединения формулы (II)

в которой R1, R2, R3, R4 и R5 имеют такое же значение, как в формуле (I),
с соединением формулы (III)

в которой R6 и R7 являются такими, как указанные в формуле (I),
с получением соединения формулы (IV)

в котором R1, R2, R3, R4, R5, R6 и R7 имеют вышеуказанные значения,
циклизации полученного соединения формулы (IV) в растворителе, таком, как толуол, при температуре кипения в присутствии оксихлорида фосфора с получением соединения формулы (I)

в которой R1, R2, R3, R4, R5, R6 и R7 имеют вышеуказанные значения,
превращения, в случае необходимости, соединения общей формулы (I) в его аддитивную соль с фармацевтически приемлемой кислотой.
| KANAOKA, YUICHI et al., Tetrahedron, 24(6) p.2591-2594, 1968 | |||
| WO 9947521 A, 23.09.1999 | |||
| WO 9608490 A, 21.03.1996 | |||
| WO 9524191 A, 14.09.1995 | |||
| 1995 |
|
RU2142463C1 | |
| ПРОИЗВОДНЫЕ β-КАРБОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1999 |
|
RU2210571C2 |
Авторы
Даты
2007-04-27—Публикация
2002-05-16—Подача