Настоящая заявка претендует на приоритет на основе заявки на патент Китая за № 0210090.7, поданной 7 февраля 2002 г., которая упоминается здесь в качестве ссылки в своей полноте и для всех целей.
Область техники, к которой относится изобретение
Настоящее изобретение относится к твердому каталитическому компоненту для полимеризации олефинов, в частности, к твердому каталитическому компоненту, содержащему, по меньшей мере, одно соединение сложного эфира полиола специального типа, к катализатору, содержащему твердый каталитический компонент, и к его использованию в полимеризации CH2=CHR, где R представляет водород или С1-С6-алкильную или арильную группу. В частности, в полимеризации пропилена может быть получен полимер высокой степени изотактичности с высоким выходом.
Предпосылки создания изобретения
Хорошо известно, что твердый титановый каталитический компонент с магнием, титаном, галогеном и донором электронов в качестве основных компонентов может быть использован в полимеризации олефина CH2=CHR, в частности, в полимеризации альфа-олефинов, имеющих 3 или более углеродных атомов, при этом может быть получен полимер более высокой степени изотактичности с более высоким выходом. Электронодонорное соединение является одним из обязательных составляющих каталитического компонента, и за счет образования внутреннего донорного соединения полиолефиновый катализатор непрерывно обновляется. В настоящее время разработано большое количество различных электронодонорных соединений, например, поликарбоновые кислоты, сложные эфиры монокарбоновых кислот или сложные эфиры поликарбоновых кислот, ангидриды, кетоны, простые моноэфиры или простые полиэфиры, спирты, амины и их производные, среди которых является общеизвестным сложный эфир ароматической дикарбоновой кислоты, такой как ди-н-бутилфталат или диизобутилфталат (смотри US 4784983).
В последние годы делались попытки использовать другие соединения в качестве электронодонорных соединений катализатора полимеризации олефинов, например, US 4971937 и ЕР 0728769 раскрывают каталитический компонент полимеризации олефинов, в котором в качестве донора электронов используются специальные соединения простых 1,3-диэфиров, содержащие две простые эфирные группы, такие как 2-изоамил-2-изопропил-1,3-диметоксипропан, 2,2-диизобутил-1,3-диметоксипропан и 9,9-бис(метоксиметил)флуорен и т.п.
Позже был описан специальный тип соединений сложных эфиров алифатических дикарбоновых кислот, таких как сукцинат, малонат, глутарат и т.п.(смотри WO 98/56830, WO 98/56834, WO 01/57099, WO 01/63231 и WO 00/55215), и использование указанного электронодонорного соединения не только улучшает активность катализатора, но также значительно расширяет распределение молекулярной массы полученного полимера пропилена.
Однако вышеуказанные катализаторы полимеризации олефинов, полученные с использованием соединения сложного эфира ароматической дикарбоновой кислоты, соединения простого 1,3-диэфира, содержащего две простые эфирные группы, и соединения сложного эфира алифатической дикарбоновой кислоты имеют некоторые недостатки при реальном использовании. Например, каталитическая активность катализатора с соединением сложного эфира ароматической дикарбоновой кислоты является низкой, и распределение молекулярной массы полученного полимера является узким; хотя катализатор с соединением простого 1,3-диэфира имеет высокую каталитическую активность и хорошую водородную чувствительность, распределение молекулярной массы полученного полимера является узким, и это является неблагоприятным при разработке различных сортов полимеров; и каталитическая активность катализатора с соединением сложного эфира алифатической дикарбоновой кислоты, разработанного недавно, все же является довольно низкой, и, когда не используется внешнее донорное соединение, стереорегулярность полученного полимера является более низкой.
Авторами изобретения было неожиданно установлено, что катализатор полимеризации олефинов с превосходными общими свойствами может быть получен при использовании в качестве донора электронов соединения сложного эфира полиола со специальной структурой. При использовании катализатора в полимеризации пропилена может быть получен удовлетворительный выход полимеризации, и стереорегулярность полимера является очень высокой. Даже если внешний донор не используется, все же может быть получен относительно высокоизотактический полимер. Между тем, водородная чувствительность катализатора является превосходной, а распределение молекулярной массы полученного полимера является относительно широким, и указанные свойства являются желательными в разработке различных сортов полимеров. Кроме того, при использовании катализатора в сополимеризации олефинов, особенно в сополимеризации этилена и пропилена, может быть достигнуто меньшее содержание геля, поэтому улучшается качество сополимеризации.
Краткое описание изобретения
Одной из целей настоящего изобретения является создание твердого каталитического компонента для полимеризации олефина CH2=CHR, где R представляет С1-С6-алкильную или арильную группу, содержащего магний, титан, галоген и электронодонорное соединение, где указанное электронодонорное соединение содержит, по меньшей мере, одно соединение сложного эфира полиола формулы (I):
R1CO-O-CR3R4-A-CR5R6-O-CO-R2 (I),
в которой группы R1 и R2, которые могут быть одинаковыми или различными, могут быть замещенным или незамещенным гидрокарбилом, имеющим 1-20 углеродных атомов, группы R3-R6, которые могут быть одинаковыми или различными, могут быть выбраны из группы, состоящей из водорода, галогена и замещенного или незамещенного гидрокарбила, содержащего 1-20 углеродных атомов, причем группы R1-R6 необязательно содержат один или несколько гетероатомов, замещающих атом углерода, атом водорода или оба атома, причем указанный гетероатом выбран из группы, состоящей из атома азота, кислорода, серы, кремния, фосфора и галогена, причем две или более групп R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического или полициклического кольца;
А представляет собой простую связь или двухвалентную соединительную группу с длиной цепи 1-10 атомов между двумя свободными радикалами, где указанная соединительная группа выбрана из группы, состоящей из алифатических, алициклических и ароматических двухвалентных радикалов, и может нести С1-С20 линейные или разветвленные заместители; один или несколько углеродных атомов и/или водородных атомов на вышеуказанной двухвалентной соединительной группе и заместителях могут быть заменены на гетероатом, выбранный из группы, состоящей из атома азота, кислорода, серы, кремния, фосфора и галогена, и два или более указанных заместителей на соединительной группе, а также вышеуказанные группы R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического или полициклического кольца.
Другой целью настоящего изобретения является создание твердого каталитического компонента для полимеризации указанного выше олефина CH2=CHR, содержащего магний, титан, галоген и электронодонорное соединение, где указанное электронодонорное соединение содержит комбинацию, по меньшей мере, одного соединения - сложного эфира полиола формулы (I) и других известных внутренних электронодонорных соединений.
Еще одной целью настоящего изобретения является создание твердого каталитического компонента для полимеризации вышеуказанного олефина, содержащего продукт взаимодействия титанового соединения, магниевого соединения и соединения сложного эфира полиола изобретения.
Еще одной целью настоящего изобретения является создание катализатора для полимеризации олефина CH2=CHR, где R представляет собой водород или С1-С6-алкильную или арильную группу, причем катализатор содержит продукт взаимодействия следующих компонентов:
(а) твердого каталитического компонента согласно настоящему изобретению, содержащего Mg, Ti, галоген и соединение сложного эфира полиола формулы (I) по изобретению;
(b) по меньшей мере, одного алюмоорганического соединения формулы AlRnX3-n, в которой R представляет собой водород или гидрокарбил, содержащий 1-20 углеродных атомов, Х представляет собой галоген, n имеет значение, удовлетворяющее условию 1<n≤3; и
(с) необязательно, одного или нескольких внешних электронодонорных соединений.
Еще одной целью настоящего изобретения является создание форполимеризованного катализатора для полимеризации олефина CH2=CHR, где R представляет собой водород или С1-С6-алкильную или арильную группу, содержащего форполимер, полученный форполимеризацией олефина в присутствии твердого каталитического компонента по любому из пп.1-20 формулы изобретения в такой степени, что получается 0,1-1000 г полимера олефина на 1 г твердого каталитического компонента.
Еще одной целью настоящего изобретения является создание способа полимеризации олефина CH2=CHR, где R представляет собой водород или С1-С6-алкильную или арильную группу, содержащего стадию контактирования олефина (олефинов) с катализатором по изобретению в условиях полимеризации олефина.
Подробное описание изобретения
Настоящее изобретение предлагает твердый каталитический компонент для полимеризации олефина CH2=CHR, где R представляет собой водород или С1-С6-алкил или арил, содержащий магний, титан, галоген и донор электронов, где указанный донор электронов содержит, по меньшей мере, одно соединение сложного эфира полиола формулы (I):
R1CO-O-CR3R4-A-CR5R6-O-CO-R2 (I),
в которой группы R1 и R2, которые могут быть одинаковыми или различными, могут быть замещенным или незамещенным гидрокарбилом, содержащим 1-20 углеродных атомов, группы R3-R6, которые могут быть одинаковыми или различными, могут быть выбраны из группы, состоящей из водорода, галогена и замещенного или незамещенного гидрокарбила, содержащего 1-20 углеродных атомов,причем группы R1-R6 необязательно содержат один или несколько гетероатомов, замещающих (заменяющих) атом углерода, атом водорода или оба этих атома, причем указанный гетероатом выбран из группы, состоящей из атома азота, кислорода, серы, кремния, фосфора и галогена, и две или более групп R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического или полициклического кольца;
А представляет собой простую связь или двухвалентную соединительную группу с длиной цепи 1-10 атомов между двумя свободными радикалами, где указанная соединительная группа выбрана из группы, состоящей из алифатических, алициклических и ароматических двухвалентных радикалов, и может нести С1-С20 линейные или разветвленные заместители; один или несколько атомов углерода и/или атомов водорода на вышеуказанной двухвалентной соединительной группе и заместителях могут быть заменены на гетероатом, выбранный из группы, состоящей из атома азота, кислорода, серы, кремния, фосфора и галогена, и два или более указанных заместителей на соединительной группе, а также вышеуказанные группы R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического или полициклического кольца.
Как он используется здесь, термин "гидрокарбил" включает в себя линейный или разветвленный алифатический радикал, такой как алкил, алкенил и алкинил; алициклический радикал, такой как циклоалкил, циклоалкенил; ароматический радикал, такой как моноциклический или полициклический ароматический радикал, а также их комбинации, такие как алкарил и аралкил.
В предпочтительном варианте изобретения указанным соединением сложного эфира полиола формулы (I) являются соединения формулы (II):
R1CO-O-CR3R4-B-CR5R6-O-CO-R2 (II),
в которой R1-R6 имеют значения, определенные для формулы (I),
В представляет собой простую связь или двухвалентную соединительную группу с длиной цепи 1-10 атомов между двумя свободными радикалами, где указанная соединительная группа выбрана из группы, состоящей из алифатических, алициклических и ароматических двухвалентных радикалов, и может нести С1-С20 линейные или разветвленные заместители; один или несколько углеродных атомов и/или водородных атомов на заместителях могут быть заменены на гетероатом, выбранный из группы, состоящей из атома азота, кислорода, серы, кремния, фосфора и галогена, и два или более указанных заместителей, а также вышеуказанные группы R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического или полициклического кольца.
В более предпочтительном варианте изобретения указанные R3, R4, R5 и R6 в формуле (II) не представляют собой водород все одновременно. В другом более предпочтительном варианте изобретения, по меньшей мере, одна группа из R3, R4, R5 и R6 в формуле (II) выбрана из группы, состоящей из галогена, линейной или разветвленной С1-С10-алкильной, С3-С10-циклоалкильной, С6-С10-арильной и С7-С10-алкарильной или аралкильной группы. В другом более предпочтительном варианте изобретения, по меньшей мере, одна группа из R3, R4, R5 и R6 в формуле (II) выбрана из группы, состоящей из метильной, этильной, пропильной, изопропильной, бутильной, трет-бутильной, фенильной и галогенфенильной группы. В другом более предпочтительном варианте изобретения, по меньшей мере, одна группа среди R3 и R4 и, по меньшей мере, одна группа среди R5 и R6 в формуле (II) независимо выбраны из группы, состоящей из метильной, этильной, пропильной, изопропильной, бутильной, трет-бутильной, фенильной и галогенфенильной группы.
В соединениях сложного эфира полиола формулы (I) и формулы (II) R1 и R2, предпочтительно, выбраны из группы, состоящей из группы, содержащей бензольное кольцо, такой как фенил, фенил, замещенный алкилом, алкокси или галогеном, причем, необязательно, углеродный атом (атомы) на бензольном кольце заменен на гетероатом из атома кислорода и/или атома азота; алкенил или фенил, замещенный алкенилом, такие как винил, пропенил, стирил; алкил, такой как метил, этил, пропил и т.д. Более предпочтительно, по меньшей мере, один из R1 и R2 представляет собой группу, содержащую бензольное кольцо, еще более предпочтительно, оба R1 и R2 представляют собой группу, содержащую бензольное кольцо, и, наиболее предпочтительно, R1 и R2 независимо выбраны из группы, состоящей из фенила, галогенфенила, алкилфенила и галогеналкилфенила.
В одном из вариантов изобретения В в формуле (II) представляет собой простую связь, и указанным соединением - сложным эфиром полиола является сложный эфир 1,2-диола следующей формулы:
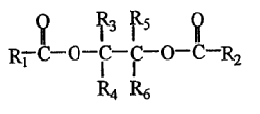
в которой R3, R4, R5 и R6 имеют значения, как определено для формулы (II). В соединении сложного эфира 1,2-диола вышеуказанной формулы, предпочтительно, один из R3 и R4, R5 и R6, соответственно, представляет собой водород, а другой представляет собой метил, этил, пропил, изопропил, бутил, трет-бутил, фенил или галогенфенил.
В одном из вариантов изобретения В в формуле (II) представляет собой замещенный или незамещенный метилен, и указанным соединением - сложным эфирам полиола является сложный эфир 1,3-диола следующей формулы:
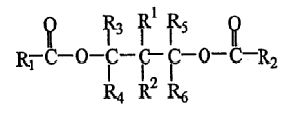
в которой R3, R4, R5 и R6 имеют значения, как определено для формулы (II), R1 и R2, которые являются одинаковыми или различными, представляют собой водород или метильную, этильную, пропильную, изопропильную, бутильную, трет-бутильную, аллильную, фенильную или галогенфенильную группу. В соединении сложного эфира 1,3-диола вышеуказанной формулы, предпочтительно, все R1, R2, R3, R4, R5, R6 не представляют собой водород все одновременно, более предпочтительно, по меньшей мере, одна группа из R3, R4, R5 и R6 выбрана из группы, состоящей из метила, этила, пропила, изопропила, бутила, трет-бутила, фенила или галогенфенила. Еще более предпочтительно, один из R3 и R4, R5 и R6, соответственно, представляет собой водород, а другой представляет собой метил, этил, пропил, изопропил, бутил, трет-бутил, фенил или галогенфенил.
В одном из вариантов изобретения В в формуле (II) представляет собой замещенный или незамещенный этилен, и указанным соединением - сложным эфиром полиола является сложный эфир 1,4-диола следующей формулы:
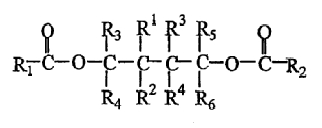
в которой R3, R4, R5 и R6 имеют значения, как определено для формулы (II), R1-R4, которые являются одинаковыми или различными, представляют собой водород или метильную, этильную, пропильную, изопропильную, бутильную, трет-бутильную, аллильную, фенильную или галогенфенильную группу. В соединении сложного эфира 1,4-диола вышеуказанной формулы, предпочтительно, по меньшей мере, одна группа из R3, R4, R5 и R6 выбрана из группы, состоящей из метила, этила, пропила, изопропила, бутила, трет-бутила, фенила или галогенфенила. Более предпочтительно, один из R3 и R4, R5 и R6, соответственно, представляет собой водород, а другой представляет собой метил, этил, пропил, изопропил, бутил, трет-бутил, фенил или галогенфенил.
В одном из вариантов изобретения В в формуле (II) представляет собой замещенный или незамещенный триметилен, и указанным соединением - сложным эфиром полиола является сложный эфир 1,5-диола следующей формулы:
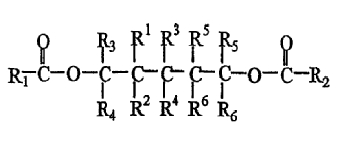
в которой R3, R4, R5 и R6 имеют значения, как определено для формулы (II), R1-R6, которые являются одинаковыми или различными, представляют собой водород или метильную, этильную, пропильную, изопропильную, бутильную, трет-бутильную, аллильную, фенильную или галогенфенильную группу. В соединении сложного эфира 1,5-диола вышеуказанной формулы, предпочтительно, R1-R6 и R3-R6 не представляют собой водород все одновременно.
В одном из вариантов изобретения В в формуле (II) представляет собой замещенный или незамещенный тетраметилен, и указанным соединением - сложным эфиром полиола является сложный эфир 1,6-диола следующей формулы:
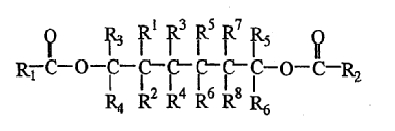
в которой R3-R6 имеют значения, как определено для формулы (II), R1-R6, которые являются одинаковыми или различными, представляют собой водород или метильную, этильную, пропильную, изопропильную, бутильную, трет-бутильную, аллильную, фенильную или галогенфенильную группу. В соединении сложного эфира 1,6-диола вышеуказанной формулы, предпочтительно, R1-R8 и R3-R6 не представляют собой водород все одновременно.
Примеры подходящих соединений - сложных эфиров полиолов формулы (I) и формулы (II) включают (не ограничиваясь этим):
1,2-пропиленгликольдибензоат,
1,2-пропиленгликольди(пара-хлорбензоат),
1,2-пропиленгликольди(мета-хлорбензоат),
1,2-пропиленгликольди(пара-бромбензоат),
1,2-пропиленгликольди(орто-бромбензоат),
1,2-пропиленгликольди(пара-метилбензоат),
1,2-пропиленгликольди(пара-трет-бутилбензоат),
1,2-пропиленгликольди(пара-бутилбензоат),
1,2-пропиленгликольмонобензоатмоноциннамат,
1,2-пропиленгликольдициннамат,
2-метил-1,2-пропиленгликольдибензоат,
2-метил-1,2-пропиленгликольди(пара-хлорбензоат),
2-метил-1,2-пропиленгликольди(мета-хлорбензоат),
2-метил-1,2-пропиленгликольди(пара-бромбензоат),
2-метил-1,2-пропиленгликольди(орто-бромбензоат),
2-метил-1,2-пропиленгликольди(пара-метилбензоат),
2-метил-1,2-пропиленгликольди(пара-трет-бутилбензоат),
2-метил-1,2-пропиленгликольди(пара-бутилбензоат),
2-метил-1,2-пропиленгликольмонобензоатмоноциннамат,
2-метил-1,2-пропиленгликольдициннамат,
1,3-пропиленгликольдибензоат,
2-метил-1,3-пропиленгликольдибензоат,
2-этил-1,3-пропиленгликольдибензоат,
2-пропил-1,3-пропиленгликольдибензоат,
2-бутил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-пропиленгликольдибензоат,
(R)-1-фенил-1,3-пропиленгликольдибензоат,
(S)-1-фенил-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдибензоат,
2-метил-1,3-дифенил-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдипропионат,
2-метил-1,3-дифенил-1,3-пропиленгликольдипропионат,
2-метил-1,3-дифенил-1,3-пропиленгликольдиацетат,
2,2-диметил-1,3-дифенил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-дифенил-1,3-пропиленгликольдипропионат,
2-этил-1,3-ди(трет-бутил)-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдиацетат,
2-бутил-2-этил-1,3-пропиленгликольдибензоат,
2,2-диэтил-1,3-пропиленгликольдибензоат,
2-диметоксиметил-1,3-пропиленгликольдибензоат,
2-метил-2-пропил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-хлорбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(мета-хлорбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-метоксибензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-метилбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольмонобензоатмонопропионат,
2-изоамил-2-изопропил-1,3-пропиленгликольдипропионат,
2-изоамил-2-изопропил-1,3-пропиленгликольдиакрилат,
2-изоамил-2-изопропил-1,3-пропиленгликольдициннамат,
2,2-диизобутил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликоль-2,2'-бифенилдиформиат,
2-изоамил-2-изопропил-1,3-пропиленгликольфталат,
1,3-диизопропил-1,3-пропиленгликольди(4-бутилбензоат),
2-этил-2-метил-1,3-пропиленгликольдибензоат,
2-амино-1-фенил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-пропиленгликольдибензоат,
1,2-бутиленгликольдибензоат,
2-метил-1,2-бутиленгликольдибензоат,
2,3-диметил-1,2-бутиленгликольдибензоат,
2,3-диметил-1,2-бутиленгликольди(пара-хлорбензоат),
2,3,3-триметил-1,2-бутиленгликольдибензоат,
2,3,3-триметил-1,2-бутиленгликольди(пара-хлорбензоат),
1,2-бутиленгликольди(пара-хлорбензоат),
2,3-бутиленгликольдибензоат,
2,3-бутиленгликольди(орто-бромбензоат),
2,3-бутиленгликольди(метилбензоат),
2,3-бутиленгликольди(мета-хлорбензоат),
2-метил-2,3-бутиленгликольдибензоат,
2-метил-2,3-бутиленгликольди(орто-бромбензоат),
2-метил-2,3-бутиленгликольди(метилбензоат),
2-метил-2,3-бутиленгликольди(мета-хлорбензоат),
2,3-диметил-2,3-бутиленгликольдибензоат,
2,3-диметил-2,3-бутиленгликольди(орто-бромбензоат),
2,3-диметил-2,3-бутиленгликольди(метилбензоат),
2,3-диметил-2,3-бутиленгликольди(мета-хлорбензоат),
2-метил-1-фенил-1,3-бутиленгликольдибензоат,
2-метил-1-фенил-1,3-бутиленгликольдипивалат,
2-метил-2-(2-фурил)-1,3-бутиленгликольдибензоат,
1,4-бутиленгликольдибензоат,
2,3-диизопропил-1,4-бутиленгликольдибензоат,
2,3-диметил-1,4-бутиленгликольдибензоат,
2,3-диэтил-1,4-бутиленгликольдибензоат,
2,3-дибутил-1,4-бутиленгликольдибензоат,
2,3-диизопропил-1,4-бутиленгликольдибутират,
4,4,4-трифтор-1-(2-нафтил)-1,3-бутиленгликольдибензоат,
2,3-пентандиолдибензоат,
2-метил-2,3-пентандиолдибензоат,
3-метил-2,3-пентандиолдибензоат,
4-метил-2,3-пентандиолдибензоат,
2,3-диметил-2,3-пентандиолдибензоат,
2,4-диметил-2,3-пентандиолдибензоат,
3,4-диметил-2,3-пентандиолдибензоат,
4,4-диметил-2,3-пентандиолдибензоат,
2,3,4-триметил-2,3-пентандиолдибензоат,
2,4,4-триметил-2,3-пентандиолдибензоат,
3,4,4-триметил-2,3-пентандиолдибензоат,
2,3,4,4-тетраметил-2,3-пентандиолдибензоат,
3-этил-2,3-пентандиолдибензоат,
3-этил-2-метил-2,3-пентандиолдибензоат,
3-этил-2,4-диметил-2,3-пентандиолдибензоат,
3-этил-2,4,4-триметил-2,3-пентандиолдибензоат,
2,4-пентандиолдибензоат,
3-метил-2,4-пентандиолдибензоат,
3-этил-2,4-пентандиолдибензоат,
3-пропил-2,4-пентандиолдибензоат,
3-бутил-2,4-пентандиолдибензоат,
3,3-диметил-2,4-пентандиолдибензоат,
(2S,4S)-(+)-2,4-пентандиолдибензоат,
(2R,4R)-(+)-2,4-пентандиолдибензоат,
2,4-пентандиолди(пара-хлорбензоат),
2,4-пентандиолди(мета-хлорбензоат),
2,4-пентандиолди(пара-бромбензоат),
2,4-пентандиолди(орто-бромбензоат),
2,4-пентандиолди(пара-метилбензоат),
2,4-пентандиолди(пара-трет-бутилбензоат),
2,4-пентандиолди(пара-бутилбензоат),
2,4-пентандиолмонобензоатмоноциннамат,
2,4-пентандиолдициннамат,
1,3-пентандиолдипропионат,
2-метил-1,3-пентандиолдибензоат,
2-метил-1,3-пентандиолди(пара-хлорбензоат),
2-метил-1,3-пентандиолди(пара-метилбензоат),
2-бутил-1,3-пентандиолди(пара-метилбензоат),
2-метил-1,3-пентандиолди(пара-трет-бутилбензоат),
2-метил-1,3-пентандиолдипивалат,
2-метил-1,3-пентандиолмонобензоатмоноциннамат,
2,2-диметил-1,3-пентандиолдибензоат,
2,2-диметил-1,3-пентандиолмонобензоатмоноциннамат,
2-этил-1,3-пентандиолдибензоат,
2-бутил-1,3-пентандиолдибензоат,
2-аллил-1,3-пентандиолдибензоат,
2-метил-1,3-пентандиолмонобензоатмоноциннамат,
2-метил-1,3-пентандиолдибензоат,
2-этил-1,3-пентандиолдибензоат,
2-пропил-1,3-пентандиолдибензоат,
2-бутил-1,3-пентандиолдибензоат,
1,3-пентандиолди(пара-хлорбензоат),
1,3-пентандиолди(мета-хлорбензоат),
1,3-пентандиолди(пара-бромбензоат),
1,3-пентандиолди(орто-бромбензоат),
1,3-пентандиолди(пара-метилбензоат),
1,3-пентандиолди(пара-трет-бутилбензоат),
1,3-пентандиолди(пара-бутилбензоат),
1,3-пентандиолмонобензоатмоноциннамат,
1,3-пентандиолдициннамат,
2,2,4-триметил-1,3-пентандиолдибензоат,
2,2,4-триметил-1,3-пентандиолди(изопропилформиат),
3-метил-1-трифторметил-2,4-пентандиолдибензоат,
2,4-пентандиолди(пара-фторметилбензоат),
2,4-пентандиолди(2-фуранкарбоксилат),
3-бутил-3-метил-2,4-пентандиолдибензоат,
2,2-диметил-1,5-пентандиолдибензоат,
1,5-дифенил-1,5-пентандиолдибензоат,
1,5-дифенил-1,5-пентандиолдипропионат,
2,3-гександиолдибензоат,
2-метил-2,3-гександиолдибензоат,
3-метил-2,3-гександиолдибензоат,
4-метил-2,3-гександиолдибензоат,
5-метил-2,3-гександиолдибензоат,
2,3-диметил-2,3-гександиолдибензоат,
2,4-диметил-2,3-гександиолдибензоат,
2,5-диметил-2,3-гександиолдибензоат,
3,4-диметил-2,3-гександиолдибензоат,
3,5-диметил-2,3-гександиолдибензоат,
4,4-диметил-2,3-гександиолдибензоат,
4,5-диметил-2,3-гександиолдибензоат,
5,5-диметил-2,3-гександиолдибензоат,
2,3,4-триметил-2,3-гександиолдибензоат,
2,3,5-триметил-2,3-гександиолдибензоат,
2,4,4-триметил-2,3-гександиолдибензоат,
2,4,5-триметил-2,3-гександиолдибензоат,
2,5,5-триметил-2,3-гександиолдибензоат,
3,4,4-триметил-2,3-гександиолдибензоат,
3,4,5-триметил-2,3-гександиолдибензоат,
3,5,5-триметил-2,3-гександиолдибензоат,
2,3,4,4-тетраметил-2,3-гександиолдибензоат,
2,3,4,5-тетраметил-2,3-гександиолдибензоат,
2,3,5,5-тетраметил-2,3-гександиолдибензоат,
3-этил-2,3-гександиолдибензоат,
3-пропил-2,3-гександиолдибензоат,
3-изопропил-2,3-гександиолдибензоат,
4-этил-2,3-гександиолдибензоат,
3-этил-2-метил-2,3-гександиолдибензоат,
4-этил-2-метил-2,3-гександиолдибензоат,
2-метил-3-пропил-2,3-гександиолдибензоат,
4-этил-3-метил-2,3-гександиолдибензоат,
3,4-диэтил-2,3-гександиолдибензоат,
4-этил-3-пропил-2,3-гександиолдибензоат,
3-этил-2,4-диметил-2,3-гександиолдибензоат,
3-этил-2,5-диметил-2,3-гександиолдибензоат,
3-этил-2,4,4-триметил-2,3-гександиолдибензоат,
3-этил-2,4,5-триметил-2,3-гександиолдибензоат,
2,5-диметил-3-пропил-2,3-гександиолдибензоат,
2,4,4-триметил-3-пропил-2,3-гександиолдибензоат,
2,5,5-триметил-3-пропил-2,3-гександиолдибензоат,
2,4,5-триметил-3-пропил-2,3-гександиолдибензоат,
3,4-диэтил-2-метил-2,3-гександиолдибензоат,
2-этил-1,3-гександиолдибензоат,
2-пропил-1,3-гександиолдибензоат,
2-бутил-1,3-гександиолдибензоат,
4-этил-1,3-гександиолдибензоат,
4-метил-1,3-гександиолдибензоат,
3-метил-1,3-гександиолдибензоат,
3-этил-1,3-гександиолдибензоат,
2,2,4,6,6-пентаметил-3,5-гександиолдибензоат,
2,5-гександиолдибензоат,
2,5-диметил-2,5-гександиолдибензоат,
2,5-диметил-2,5-гександиолдипропионат,
2,5-диметилгекса-3-ин-2,5-диолдибензоат,
гекса-3-ин-2,5-диолдибензоат(Т),
гекса-3-ин-2,5-диолдибензоат(S),
гекса-3-ин-2,5-диолди(2-фуранкарбоксилат),
3,4-дибутил-1,6-гександиолдибензоат,
1,6-гександиолдибензоат,
гепта-6-ен-2,4-диолдибензоат,
2-метилгепта-6-ен-2,4-диолдибензоат,
3-метилгепта-6-ен-2,4-диолдибензоат,
4-метилгепта-6-ен-2,4-диолдибензоат,
5-метилгепта-6-ен-2,4-диолдибензоат,
6-метилгепта-6-ен-2,4-диолдибензоат,
3-этилгепта-6-ен-2,4-диолдибензоат,
4-этилгепта-6-ен-2,4-диолдибензоат,
5-этилгепта-6-ен-2,4-диолдибензоат,
6-этилгепта-6-ен-2,4-диолдибензоат,
3-пропилгепта-6-ен-2,4-диолдибензоат,
4-пропилгепта-6-ен-2,4-диолдибензоат,
5-пропилгепта-6-ен-2,4-диолдибензоат,
6-пропилгепта-6-ен-2,4-диолдибензоат,
3-бутилгепта-6-ен-2,4-диолдибензоат,
4-бутилгепта-6-ен-2,4-диолдибензоат,
5-бутилгепта-6-ен-2,4-диолдибензоат,
6-бутилгепта-6-ен-2,4-диолдибензоат,
3,5-диметилгепта-6-ен-2,4-диолдибензоат,
3,5-диэтилгепта-6-ен-2,4-диолдибензоат,
3,5-дипропилгепта-6-ен-2,4-диолдибензоат,
3,5-дибутилгепта-6-ен-2,4-диолдибензоат,
3,3-диметилгепта-6-ен-2,4-диолдибензоат,
3,3-диэтилгепта-6-ен-2,4-диолдибензоат,
3,3-дипропилгепта-6-ен-2,4-диолдибензоат,
3,3-дибутилгепта-6-ен-2,4-диолдибензоат,
3,5-гептандиолдибензоат,
2-метил-3,5-гептандиолдибензоат,
3-метил-3,5-гептандиолдибензоат,
4-метил-3,5-гептандиолдибензоат,
5-метил-3,5-гептандиолдибензоат,
6-метил-3,5-гептандиолдибензоат,
3-этил-3,5-гептандиолдибензоат,
4-этил-3,5-гептандиолдибензоат,
5-этил-3,5-гептандиолдибензоат,
3-пропил-3,5-гептандиолдибензоат,
4-пропил-3,5-гептандиолдибензоат,
3-бутил-3,5-гептандиолдибензоат,
2,3-диметил-3,5-гептандиолдибензоат,
2,4-диметил-3,5-гептандиолдибензоат,
2,5-диметил-3,5-гептандиолдибензоат,
2,6-диметил-3,5-гептандиолдибензоат,
3,3-диметил-3,5-гептандиолдибензоат,
4,4-диметил-3,5-гептандиолдибензоат,
6,6-диметил-3,5-гептандиолдибензоат,
3,4-диметил-3,5-гептандиолдибензоат,
3,5-диметил-3,5-гептандиолдибензоат,
3,6-диметил-3,5-гептандиолдибензоат,
4,5-диметил-3,5-гептандиолдибензоат,
4,6-диметил-3,5-гептандиолдибензоат,
4,4-диметил-3,5-гептандиолдибензоат,
6,6-диметил-3,5-гептандиолдибензоат,
3-этил-2-метил-3,5-гептандиолдибензоат,
4-этил-2-метил-3,5-гептандиолдибензоат,
5-этил-2-метил-3,5-гептандиолдибензоат,
3-этил-3-метил-3,5-гептандиолдибензоат,
4-этил-3-метил-3,5-гептандиолдибензоат,
5-этил-3-метил-3,5-гептандиолдибензоат,
3-этил-4-метил-3,5-гептандиолдибензоат,
4-этил-4-метил-3,5-гептандиолдибензоат,
5-этил-4-метил-3,5-гептандиолдибензоат,
2-метил-3-пропил-3,5-гептандиолдибензоат,
2-метил-4-пропил-3,5-гептандиолдибензоат,
2-метил-5-пропил-3,5-гептандиолдибензоат,
3-метил-3-пропил-3,5-гептандиолдибензоат,
3-метил-4-пропил-3,5-гептандиолдибензоат,
3-метил-5-пропил-3,5-гептандиолдибензоат,
4-метил-3-пропил-3,5-гептандиолдибензоат,
4-метил-4-пропил-3,5-гептандиолдибензоат,
4-метил-5-пропил-3,5-гептандиолдибензоат,
6-метил-2,4-гептандиолди(пара-хлорбензоат),
6-метил-2,4-гептандиолди(пара-метилбензоат),
6-метил-2,4-гептандиолди(мета-метилбензоат),
6-метил-2,4-гептандиолдипивалат,
гепта-6-ен-2,4-диолдипивалат,
3,6-диметил-2,4-гептандиолдибензоат,
2,2,6,6-тетраметил-3,5-гептандиолдибензоат,
2,6-диметил-2,6-гептандиолдибензоат,
4-метил-3,5-октандиолдибензоат,
4-этил-3,5-октандиолдибензоат,
4-пропил-3,5-октандиолдибензоат,
5-пропил-3,5-октандиолдибензоат,
4-бутил-3,5-октандиолдибензоат,
4,4-диметил-3,5-октандиолдибензоат,
4,4-диэтил-3,5-октандиолдибензоат,
4,4-дипропил-3,5-октандиолдибензоат,
4-этил-4-метил-3,5-октандиолдибензоат,
3-фенил-3,5-октандиолдибензоат,
3-этил-2-метил-3,5-октандиолдибензоат,
4-этил-2-метил-3,5-октандиолдибензоат,
5-этил-2-метил-3,5-октандиолдибензоат,
6-этил-2-метил-3,5-октандиолдибензоат,
5-метил-4,6-нонандиолдибензоат,
5-этил-4,6-нонандиолдибензоат,
5-пропил-4,6-нонандиолдибензоат,
5-бутил-4,6-нонандиолдибензоат,
5,5-диметил-4,6-нонандиолдибензоат,
5,5-диэтил-4,6-нонандиолдибензоат,
5,5-дипропил-4,6-нонандиолдибензоат,
5,5-дибутил-4,6-нонандиолдибензоат,
4-этил-5-метил-4,6-нонандиолдибензоат,
5-фенил-4,6-нонандиолдибензоат,
4,6-нонандиолдибензоат,
1,1-циклогександиметанолдибензоат,
1,2-циклогександиолдибензоат,
1,3-циклогександиолдибензоат,
1,4-циклогександиолдибензоат,
1,1-бис(бензоилоксиэтил)циклогексан,
1,4-бис(бензоилоксиметил)циклогексан,
1,1-бис(бензоилоксиметил)-3-циклогексен,
1,1-бис(пропионилоксиметил)-3-циклогексен,
9,9-бис(бензоилоксиметил)флуорен,
9,9-бис((мета-метоксибензоилокси)метил)флуорен,
9,9-бис((мета-хлорбензоилокси)метил)флуорен,
9,9-бис((пара-хлорбензоилокси)метил)флуорен,
9,9-бис(циннамоилоксиметил)флуорен,
9-(бензоилоксиметил)-9-(пропионилоксиметил)флуорен,
9,9-бис(пропионилоксиметил)флуорен,
9,9-бис(акрилоилоксиметил)флуорен,
9,9-бис(пивалоилоксиметил)флуорен,
9,9-флуорендиметанолдибензоат,
1,2-фенилендибензоат,
1,3-фенилендибензоат,
1,4-фенилендибензоат,
2,2'-бифенилендибензоат,
бис(2-бензоилоксинафтил)метан,
1,2-ксилендиолдибензоат,
1,3-ксилендиолдибензоат,
1,4-ксилендиолдибензоат,
2,2'-бифенилдиметанолдипивалат,
2,2'-бифенилдиметанолдибензоат,
2,2'-бифенилдиметанолдипропионат,
2,2'-бинафтилдиметанолдибензоат,
пентаэритриттетрабензоат,
1,2,3-пропантриолтрибензоат.
Соединение сложного эфира полиола формулы (II) может быть выбрано из группы, состоящей из соединений формулы (III):
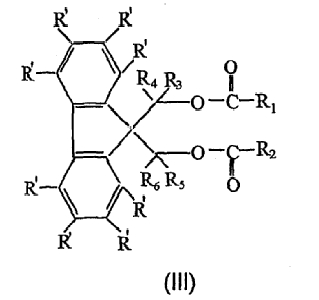
в которой R1-R6 определены, как указано для формулы (I), R' могут быть одинаковыми или различными и представляют собой водород, атом галогена, линейную или разветвленную С1-С20-алкильную, С3-С20-циклоалкильную, С6-С20-арильную, С7-С20-алкарильную или С7-С20-аралкильную группу.
В соединениях формулы (III), предпочтительно, R3, R4, R5 и R6 не представляют собой водород все одновременно. Более предпочтительно, по меньшей мере, один из R3 и R4, R5 и R6, соответственно, выбран из группы, состоящей из галогензамещенной или незамещенной линейной или разветвленной С1-С10-алкильной, С3-С10-циклоалкильной, С6-С10-арильной, С7-С10-алкарильной или С7-С10-аралкильной группы. Наиболее предпочтительно, по меньшей мере, один из R3 и R4, R5 и R6, соответственно, выбран из группы, состоящей из метила, этила, пропила, изопропила, бутила, трет-бутила, фенила или галогенфенила.
В соединениях формулы (III) R1 и R2, предпочтительно, выбраны из группы, состоящей из группы, содержащей бензольное кольцо, такой как фенил, фенил, замещенный алкилом, алкокси или галогеном, причем, необязательно, углеродный атом (атомы) в бензольном кольце заменены на гетероатом из атома кислорода и/или атома азота; алкенил или фенил, замещенный алкенилом, такие как винил, пропенил, стирил; алкил, такой как метил, этил, пропил и т.д. Более предпочтительно, по меньшей мере, один из R1 и R2 представляет собой группу, содержащую бензольное кольцо, еще более предпочтительно, оба R1 и R2 представляют собой группу, содержащую бензольное кольцо, и, наиболее предпочтительно, R1 и R2 независимо выбраны из группы, состоящей из фенила, галогенфенила, алкилфенила и галогеналкилфенила.
Примеры соединений формулы (III) включают (не ограничиваясь этим):
9,9-бис(бензоилоксиметил)флуорен,
9,9-бис((мета-метоксибензоилокси)метил)флуорен,
9,9-бис((мета-хлорбензоилокси)метил)флуорен,
9,9-бис((пара-хлорбензоилокси)метил)флуорен,
9,9-бис(циннамоилоксиметил)флуорен,
9-(бензоилоксиметил)-9-(пропионилоксиметил)флуорен,
9,9-бис(пропионилоксиметил)флуорен,
9,9-бис(акрилоилоксиметил)флуорен,
9,9-бис(пивалилоксиметил)флуорен,
9,9-флуорендиметанолдибензоат и т.п.
Вышеописанные соединения сложного эфира полиола могут быть синтезированы известными сами по себе способами, например, этерификация полиола формулы (IV) кислотой, галогенангидридом или ангидридом кислоты может дать соответствующий сложный эфир полиола
HO-CR3R4-A-CR5R6-OH (IV)
где А, R3-R6 являются такими, как определено в формуле (I).
Полиол формулы (IV) может быть синтезирован известными в технике способами, например, может быть сделана ссылка на Acta Chemica Scandinavica 21, 1967, pp. 718-720 в отношении синтеза 9,9-бис(гидроксиметил)флуорена и на CN 1141285А в отношении способа получения двухатомного спирта.
Твердый каталитический компонент для полимеризации олефинов согласно настоящему изобретению, предпочтительно, содержит продукт взаимодействия титанового соединения, магниевого соединения и соединения сложного эфира полиола, выбранного из группы, состоящей из соединений формул (I)-(III).
Указанное магниевое соединение выбрано из группы, состоящей из дигалогенида магния, гидрата или аддукта спирта дигалогенида магния, производного, образованного замещением одного атома галогена дигалогенида магния алкокси-группой или галогеналкокси-группой, или их смеси. Указанным дигалогенидом магния является, предпочтительно, MgCl2 в активном состоянии, который хорошо известен в качестве одного из компонентов катализаторов Циглера-Натта из многих патентных документов.
Указанное титановое соединение имеет общую формулу TiXn(OR)4-n, в которой R представляет собой углеводородный радикал, имеющий 1-20 углеродных атомов, Х представляет собой галоген, и n равно от 1 до 4. Титановым соединением является, предпочтительно, TiCl4 или TiCl3.
Твердый каталитический компонент согласно настоящему изобретению может быть получен различными способами.
Согласно одному из способов безводный дихлорид магния и соединение (соединения) сложного эфира полиола, выбранное(-ые) из группы, состоящей из соединений формул (I)-(III), измельчают вместе в условиях активирования дихлорида магния, и полученный таким образом продукт может быть обработан избытком вышеуказанного титанового соединения при 80-135°C один или несколько раз, затем промыт углеводородным растворителем до тех пор, пока промываемый раствор не становится по существу свободным от иона хлорида. Согласно другому способу безводный дихлорид магния, титановое соединение и соединение (соединения) сложного эфира полиола, выбранное из группы, состоящей из соединений формул (I)-(III), измельчают вместе и полученный таким образом продукт обрабатывают галогенуглеводородом, таким как 1,2-дихлорэтан, хлорбензол, дихлорметан, при температуре от 40°C до точки кипения указанного углеводорода в течение периода времени от 1 до 4 ч, затем обычно промывают инертным углеводородным растворителем, таким как гексан, с получением твердого каталитического компонента.
Согласно другому способу дихлорид магния предварительно активируют способом, хорошо известным в технике, затем обрабатывают избытком вышеуказанного титанового соединения при 80-135°C, где реакционная смесь содержит соединение (соединения) сложного эфира полиола формул (I)-(III). Обработка с использованием титанового соединения может быть выполнена несколько раз. Полученный твердый продукт промывают гексаном для удаления свободного титанового соединения.
Согласно другому способу алкоголяты или хлоралкоголяты магния, особенно, хлоралкоголяты магния, полученные согласно US 4220554, взаимодействуют с избытком титанового соединения, содержащего соединение (соединения) сложного эфира полиола формул (I)-(III), в растворе при температуре от примерно 80°C до 135°C. Согласно предпочтительному способу титановое соединение формулы TiXn(OR)4-n, в которой R представляет собой независимо друг от друга углеводородный радикал, имеющий 1-20 углеродных атомов, Х представляет собой галоген, n имеет значение от 1 до 4, предпочтительно TiCl4, взаимодействует с аддуктом формулы MgCl2·pROH, в которой р составляет от 0,1 до 6, предпочтительно, от 2 до 3,5, R представляет собой углеводородный радикал, имеющий 1-18 углеродных атомов, с получением твердого каталитического компонента. Аддукт может быть с удобством получен в виде сфер согласно следующему способу: спирт смешивают с дихлоридом магния в присутствии инертного углеводорода, который является несмешивающимся с аддуктом, и эмульсию быстро охлаждают с затвердеванием аддукта в форме сферических частиц. Примеры сферического аддукта MgCl2·pROH, полученного согласно способу, описаны в патентах US 4399054 и US 4469648. Полученный таким образом аддукт может непосредственно взаимодействовать с титановым соединением, или прежде, чем взаимодействовать с титановым соединением, он может быть подвергнут терморегулируемой деалкоголизации при температуре от 80 до 130°C с получением аддукта, в котором мольное число спирта обычно составляет ниже 3, предпочтительно, от 0,1 до 2,5. Аддукт (деалкоголизованный или как таковой) может быть суспендирован в холодном TiCl4 (обычно 0°C) и взаимодействовать с титановым соединением при программируемом нагревании при температуре от 80 до 130°C и выдержке при указанной температуре в течение 0,5-2 ч. Обработка с помощью TiCl4 может проводиться один или несколько раз. В процессе обработки с помощью TiCl4 может добавляться соединение (соединения) сложного эфира полиола формул (I)-(III), и указанная обработка может также повторяться один или несколько раз.
Другой способ получения твердого каталитического компонента изобретения содержит стадию галогенирования соединений дигидрокарбилоксимагния, таких как диалкоголят магния или диарилоксид магния, раствором вышеуказанного титанового соединения в ароматическом углеводородном растворителе (таком как толуол, ксилол) при температуре от 80 до 130°C. Обработка раствором титанового соединения в ароматическом углеводородном растворителе может быть повторена один или несколько раз, и в процессе одной или нескольких таких обработок в раствор может вводиться соединение (соединения) сложного эфира полиола формул (I)-(III).
Твердый каталитический компонент изобретения может быть также получен согласно способу получения твердого титансодержащего каталитического компонента, рассмотренному в US4784983, следующим образом:
Сначала магниевое соединение растворяют в системе растворителей, состоящей из органического эпоксидного соединения, фосфорорганического соединения и инертного разбавителя, с образованием однородного раствора, затем раствор смешивают с титановым соединением и твердое вещество осаждают в присутствии осаждающей добавки. Полученное твердое вещество обрабатывают указанным соединением (соединениями) сложного эфира полиола с осаждением его на твердом веществе, и, при необходимости, твердое вещество может быть снова обработано титановым соединением и инертным разбавителем с получением твердого титансодержащего каталитического компонента. Указанной осаждающей добавкой является вещество из ангидридов органических кислот, органических кислот, простых эфиров и кетонов. Отдельные исходные материалы могут быть использованы в количестве от 0,2 до 10 моль для органического эпоксидного соединения, от 0,1 до 3 моль для фосфорорганического соединения, от 0,03 до 1,0 моль для осаждающей добавки и от 0,5 до 150 моль для галогенидов титана и их производных на 1 моль галогенида магния.
Другой способ получения твердого каталитического компонента изобретения включает: растворение магниевого соединения в донорном соединении, таком как спирты, простые эфиры и т.п., с образованием однородного раствора, смешение раствора с титановым соединением и обеспечение их взаимодействия с переосаждением. Указанный способ рассмотрен в ЕР 0452156. Кроме того, может быть сделана ссылка на US 4866022 и US 4829037 в отношении способа получения твердого каталитического компонента изобретения. В указанных способах соединение (соединения) сложного эфира полиола формул (I)-(III) изобретения может вводиться до, в процессе или после контактирования магниевого соединения и титанового соединения.
В любом способе получения соединение (соединения) сложного эфира полиола формул (I)-(III) может вводиться как таковое или, необязательно, может быть получено, например, in situ при использовании подходящего предшественника, который может быть превращен в указанное соединение сложного эфира полиола посредством известной химической реакции, такой как этерификация или переэтерификация, в ходе получения твердого каталитического компонента. Обычно указанное соединение сложного эфира полиола используют в таком количестве, что мольное отношение соединения сложного эфира полиола к Mg-соединению находится в интервале от 0,01 до 5, предпочтительно, от 0,05 до 1,0.
Обычно твердый каталитический компонент изобретения содержит от 0,5 до 10 мас.% титана, от 1 до 30 мас.% магния, от 2 до 65 мас.% галогена и от 2 до 40 мас.% соединения сложного эфира полиола по отношению к общей массе твердого каталитического компонента.
Кроме того, установлено, и это также составляет еще один предмет изобретения, что, когда другие известные соединения - внутренние доноры электронов и соединения сложного эфира полиола по изобретению используются вместе, могут быть получены очень интересные результаты, например, могут быть получены полимеры, имеющие более широкое молекулярно-массовое распределение. Указанные другие электронодонорные соединения могут быть выбраны из группы, состоящей из простых эфиров, сложных моно- и полиэфиров органических карбоновых кислот, иных, чем соединения сложного эфира полиола формул (I)-(III), и аминов. Количество указанного другого электронодонорного соединения может находиться в интервале от 5 до 95 мол.% от общего количества электронодонорных соединений.
Предпочтительно, указанные другие соединения - внутренние доноры электронов, которые могут комбинироваться с соединением (соединениями) сложного эфира полиола изобретения, выбирают из группы, состоящей из:
простого диэфира 1,3-пропандиола формулы (V):
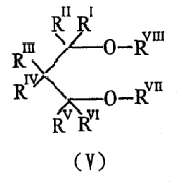
в которой RI, RII, RIII, RIV, RV и RVI, которые могут быть одинаковыми или различными, представляют собой водород или углеводородный радикал, содержащий 1-18 углеродных атомов, RVII и RVIII, которые могут быть одинаковыми или различными, представляют собой углеводородный радикал, содержащий 1-18 углеродных атомов, и два или более из RI-RVIII могут быть связаны с образованием насыщенного или ненасыщенного моноциклического или полициклического кольца; и
органических сложных моно- или полиэфиров карбоновых кислот, иных, чем соединения - сложные эфиры полиолов формул (I)-(III), особенно фталатов.
Предпочтительно, в вышеуказанной формуле (V) RVII и RVIII независимо представляют собой С1-С4-алкил, RIII и RIV образуют ненасыщенное конденсированное кольцо, и RI, RII, RV и RVI представляют собой водород.
Соединением формулы (V) могут быть, например, соединения - простые 1,3-диэфиры, рассмотренные в ЕР 0395083, включая: 2-изопропил-1,3-диметоксипропан, 2-бутил-1,3-диметоксипропан, 2-втор-бутил-1,3-диметоксипропан, 2-циклогексил-1,3-диметоксипропан, 2-фенил-1,3-диметоксипропан, 2-(2-фенилэтил)-1,3-диметоксипропан, 2-(2-циклогексилэтил)-1,3-диметоксипропан, 2-(пара-хлорфенил)-1,3-диметоксипропан, 2-дифенилметил-1,3-диметоксипропан, 2-(1-нафтил)-1,3-диметоксипропан, 2-(1-декагидронафтил)-1,3-диметоксипропан, 2-(пара-трет-бутилфенил)-1,3-диметоксипропан, 2,2-дициклогексил-1,3-диметоксипропан, 2,2-дициклопентил-1,3-диметоксипропан, 2,2-диэтил-1,3-диметоксипропан, 2,2-дипропил-1,3-диметоксипропан, 2,2-диизопропил-1,3-диметоксипропан, 2,2-дибутил-1,3-диметоксипропан, 2-метил-2-пропил-1,3-диметоксипропан, 2-метил-2-бензил-1,3-диметоксипропан, 2-метил-2-фенил-1,3-диметоксипропан, 2-метил-2-циклогексил-1,3-диметоксипропан, 2,2-бис(пара-хлорфенил)-1,3-диметоксипропан, 2,2-бис(2-циклогексилэтил)-1,3-диметоксипропан, 2-(2-этилгексил)-2-метил-1,3-диметоксипропан, 2,2-диизобутил-1,3-диметоксипропан, 2,2-дифенил-1,3-диметоксипропан, 2,2-дибензил-1,3-диметоксипропан, 2,2-бис(циклогексилметил)-1,3-диметоксипропан, 2-изобутил-2-изопропил-1,3-диметоксипропан, 2-изопропил-2-(1-метилбутил)-1,3-диметоксипропан, 2-(1-метилбутил)-2-втор-бутил-1,3-диметоксипропан, 2,2-ди-втор-бутил-1,3-диметоксипропан, 2,2-ди-трет-бутил-1,3-диметоксипропан, 2-изоамил-2-изопропил-1,3-диметоксипропан, 2-изопропил-2-фенил-1,3-диметоксипропан, 2-втор-бутил-2-фенил-1,3-диметоксипропан, 2-бензил-2-изопропил-1,3-диметоксипропан, 2-бензил-2-втор-бутил-1,3-диметоксипропан, 2-бензил-2-фенил-1,3-диметоксипропан, 2-циклопентил-2-изопропил-1,3-диметоксипропан, 2-втор-бутил-2-циклопентил-1,3-диметоксипропан, 2-циклогексил-2-изопропил-1,3-диметоксипропан, 2-втор-бутил-2-циклогексил-1,3-диметоксипропан, 2-втор-бутил-2-изопропил-1,3-диметоксипропан, 2-циклогексил-2-циклогексилметил-1,3-диметоксипропан, 1,1-бис-(метоксиметил)циклопентадиен, 1,1-бис(метоксиметил)-2,3,4,5-тетраметилциклопентадиен, 1,1-бис(метоксиметил)-2,3,4,5-тетрафенилциклопентадиен, 1,1-бис(метоксиметил)-2,3,4,5-тетрафторциклопентадиен, 1,1-бис(метоксиметил)-3,4-дициклопентилциклопентадиен, 1,1-бис(метоксиметил)инден, 1,1-бис(метоксиметил)-4,7-диметилинден, 1,1-бис(метоксиметил)-4-фенилинден, 1,1-бис-(метоксиметил)-2-метил-4-фенилинден, 1,1-бис(метоксиметил)-4,7-диметил-4,5,6,7-тетрагидроинден, 1,1-бис(метоксиметил)-7-метилинден, 9,9-бис(метоксиметил)флуорен, 9,9-бис(метоксиметил)-2,3,6,7-тетраметилфлуорен, 9,9-бис(метоксиметил)-2,3,4, 5,6,7-гексафторфлуорен, 9,9-бис(метоксиметил)бензо[2,3]инден, 9,9-бис(метоксиметил)дибензо[2,3,6,7]инден, 9,9-бис(метоксиметил)-2,7-дициклопентилфлуорен, 9,9-бис(метоксиметил)-1,2,3,4-тетрагидрофлуорен, 9,9-бис(метоксиметил)-4-трет-бутилфлуорен, 1,1-бис(1'-изопропокси-н-пропил)циклопентадиен, 1-метоксиметил-1-(1'-метоксиэтил)-2,3,4,5-тетраметилциклопентадиен, 1,1-бис(альфа-метоксибензил)инден, 9,9-бис(альфа-метоксифенил)флуорен, 9,9-бис(1'-изопропокси-н-бутил)-4,5-дифенилфлуорен, 9,9-бис(1'-метоксиэтил)флуорен, 9-(метоксиметил)-9-(1'-метоксиэтил)-2,3,6,7-тетрафторфлуорен, 1,1-бис(метоксиметил)-2,5-циклогексадиен, 1,1-бис(метоксиметил)бензонафталин, 7,7-бис(метоксиметил)-2,5-норборнадиен, 9,9-бис(метоксиметил)-1,4-метилдигидронафталин, 9,9-бис(метоксиметил)-9,10-дигидроантрацен, 4,4-бис(метоксиметил)-1-фенил-1,4-дигидронафталин, 4,4-бис(метоксиметил)-1-фенил-3,4-дигидронафталин, 5,5-бис-(метоксиметил)-1,3,6-циклогептатриен.
Указанными сложными эфирами органических карбоновых кислот могут быть соединения - сложные полиэфиры карбоновых кислот, рассмотренные в US 4784983, особенно, фталаты, включая: диэтилфталат, дипропилфталат, диизопропилфталат, ди-н-бутилфталат, диизобутилфталат, диамилфталат, дигексилфталат, диоктилфталат, динонилфталат, дидецилфталат, дигептилфталат и т.п., а также галогенированные производные вышеуказанных сложных полиэфиров карбоновых кислот.
Твердые каталитические компоненты изобретения превращают в катализаторы для полимеризации олефинов при взаимодействии с алюмоорганическим соединением в соответствии с известными сами по себе способами.
В частности, одной из целей настоящего изобретения является создание катализатора для полимеризации олефина CH2=CHR, где R представляет собой водород или С1-С6-алкил или арил, причем катализатор содержит продукт взаимодействия следующих компонентов:
(а) твердого каталитического компонента согласно настоящему изобретению, содержащего Mg, Ti, галоген и соединение сложного эфира полиола формул (I)-(III) по изобретению;
(b) по меньшей мере, одного алюмоорганического соединения формулы AlRnX3-n, в которой R представляет собой водород или гидрокарбил, содержащий 1-20 углеродных атомов, Х представляет собой галоген, n имеет значение, удовлетворяющее выражению 1<n≤3; и
(с) необязательно, одного или нескольких соединений - внешних доноров электронов.
Отношение твердого каталитического компонента (а) к алюмоорганическому соединению (b) и к соединению - внешнему донору электронов (с) может находиться в интервале 1:5-1000:0-500, предпочтительно, 1:25-100:25-100, рассчитанном на мольное отношение титан:алюминий:соединение - внешний донор электронов.
Предпочтительно, алюмоорганическим соединением (b) являются соединения триалкилалюминия, такие как триэтилалюминий, триизобутилалюминий, три-н-бутилалюминий, три-н-гексилалюминий, три-н-октилалюминий. Можно использовать смесь триалкилалюминия и гидридов алюминия или галогенидов алюминия, такую как AlEt2Cl и Al2Et3Cl3. Можно также использовать алкилалюмоксан.
Одним аспектом изобретения, который является особенно важным, является то, что даже если полимеризация осуществляется при отсутствии внешних донорных соединений (с), при использовании вышеуказанных катализаторов могут быть получены полимеры, имеющие высокий показатель стереорегулярности, например, полимеры пропилена, имеющие стереорегулярность более 95%. С учетом того, что при использовании соединений - сложных эфиров дикарбоновых кислот, известных в технике, в качестве внутренних доноров электронов, когда полимеризация осуществляется при отсутствии соединений - внешних доноров электронов, полученные полимеры имеют плохой показатель стереорегулярности, указанная специальная характеристика является абсолютно неожиданной.
Так как для практического применения требуется очень высокий показатель стереорегулярности, использование внешнего электронодонорного соединения является обычно целесообразным. Внешние электронодонорные соединения (с) могут быть выбраны из группы, состоящей из соединений кремния, простых эфиров, сложных эфиров, аминов, гетероциклических соединений и кетонов и т.д.
Например, внешние донорные соединения (с) могут быть также выбраны из группы, состоящей из соединений сложного эфира полиола формул (I)-(III), которые могут быть одинаковыми или различными с внутренними электронодонорными соединениями, используемыми в твердых каталитических компонентах, предпочтительно, выбранными из группы, включающей в себя:
2-метил-1,3-пропиленгликольдибензоат,
2-этил-1,3-пропиленгликольдибензоат,
2-пропил-1,3-пропиленгликольдибензоат,
2-бутил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-пропиленгликольдибензоат,
(R)-1-фенил-1,3-пропиленгликольдибензоат,
(S)-1-фенил-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдибензоат,
2-метил-1,3-дифенил-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдипропионат,
2-метил-1,3-дифенил-1,3-пропиленгликольдипропионат,
2-метил-1,3-дифенил-1,3-пропиленгликольдиацетат,
2,2-диметил-1,3-дифенил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-дифенил-1,3-пропиленгликольдипропионат,
1,3-ди(трет-бутил)-2-этил-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдиацетат,
2-бутил-2-этил-1,3-пропиленгликольдибензоат,
2,2-диэтил-1,3-пропиленгликольдибензоат,
2,2-диметоксиметил-1,3-пропиленгликольдибензоат,
2-метил-2-пропил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-хлорбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(мета-хлорбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-метоксибензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-метилбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольмонобензоатмонопропионат,
2-изоамил-2-изопропил-1,3-пропиленгликольдипропионат,
2-изоамил-2-изопропил-1,3-пропиленгликольдиакрилат,
2-изоамил-2-изопропил-1,3-пропиленгликольдициннамат,
2,2-диизобутил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликоль-2,2'-бифенилдиформиат,
2-изоамил-2-изопропил-1,3-пропиленгликольфталат,
1,3-диизопропил-1,3-пропиленгликольди(4-бутилбензоат),
2-этил-2-метил-1,3-пропиленгликольдибензоат,
2-амино-1-фенил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-пропиленгликольдибензоат,
2-метил-1-фенил-1,3-бутиленгликольдибензоат,
2-метил-5-фенил-1,3-бутиленгликольдипивалат,
2-метил-6-(1-фурил)-1,3-бутиленгликольдибензоат,
2,4-пентандиолдибензоат,
3-метил-2,4-пентандиолдибензоат,
3-этил-2,4-пентандиолдибензоат,
3-пропил-2,4-пентандиолдибензоат,
3-бутил-2,4-пентандиолдибензоат,
3,3-диметил-2,4-пентандиолдибензоат,
(2S,4S)-(+)-2,4-пентандиолдибензоат,
(2R,4R)-(+)-2,4-пентандиолдибензоат,
2,4-пентандиолди(пара-хлорбензоат),
2,4-пентандиолди(мета-хлорбензоат),
2,4-пентандиолди(пара-бромбензоат),
2,4-пентандиолди(орто-бромбензоат),
2,4-пентандиолди(пара-метилбензоат),
2,4-пентандиолди(пара-трет-бутилбензоат),
2,4-пентандиолди(пара-бутилбензоат),
2,4-пентандиолмонобензоатмоноциннамат,
2,4-пентандиолдицинннамат,
1,3-пентандиолдипропионат,
2-метил-1,3-пентандиолдибензоат,
2-метил-1,3-пентандиолди(пара-хлорбензоат),
2-метил-1,3-пентандиолди(пара-метилбензоат),
2-бутил-1,3-пентандиолди(пара-метилбензоат),
2-метил-1,3-пентандиолди(пара-трет-бутилбензоат),
2-метил-1,3-пентандиолдипивалат,
2-метил-1,3-пентандиолмонобензоатмоноциннамат,
2,2-диметил-1,3-пентандиолдибензоат,
2,2-диметил-1,3-пентандиолмонобензоатмоноциннамат,
2-этил-1,3-пентандиолдибензоат,
2-бутил-1,3-пентандиолдибензоат,
2-аллил-1,3-пентандиолдибензоат,
2-метил-1,3-пентандиолмонобензоатмоноциннамат,
2-метил-1,3-пентандиолдибензоат,
2-этил-1,3-пентандиолдибензоат,
2-пропил-1,3-пентандиолдибензоат,
2-бутил-1,3-пентандиолдибензоат,
2,2-диметил-1,3-пентандиолдибензоат,
1,3-пентандиолди(пара-хлорбензоат),
1,3-пентандиолди(мета-хлорбензоат),
1,3-пентандиолди(пара-бромбензоат),
1,3-пентандиолди(орто-бромбензоат),
1,3-пентандиолди(пара-метилбензоат),
1,3-пентандиолди(пара-трет-бутилбензоат),
1,3-пентандиолди(пара-бутилбензоат),
1,3-пентандиолмонобензоатмоноциннамат,
1,3-пентандиолдициннамат,
2,2,4-триметил-1,3-пентандиолдибензоат,
2,2,4-триметил-1,3-пентандиолдиизопропилформиат,
3-метил-1-трифторметил-2,4-пентандиолдибензоат,
2,4-пентандиолди(пара-фторметилбензоат),
2,4-пентандиолди(2-фуранкарбоксилат),
3-бутил-3-метил-2,4-пентандиолдибензоат,
2-этил-1,3-гександиолдибензоат,
2-пропил-1,3-гександиолдибензоат,
2-бутил-1,3-гександиолдибензоат,
4-этил-1,3-гександиолдибензоат,
4-метил-1,3-гександиолдибензоат,
3-метил-1,3-гександиолдибензоат,
3-этил-1,3-гександиолдибензоат,
2,2,4,6,6-пентаметил-3,5-гександиолдибензоат,
2,5-гександиолдибензоат,
гепта-6-ен-2,4-диолдибензоат,
2-метил-гепта-6-ен-2,4-диолдибензоат,
3-метил-гепта-6-ен-2,4-диолдибензоат,
4-метил-гепта-6-ен-2,4-диолдибензоат,
5-метил-гепта-6-ен-2,4-диолдибензоат,
6-метил-гепта-6-ен-2,4-диолдибензоат,
3-этил-гепта-6-ен-2,4-диолдибензоат,
4-этил-гепта-6-ен-2,4-диолдибензоат,
5-этил-гепта-6-ен-2,4-диолдибензоат,
6-этил-гепта-6-ен-2,4-диолдибензоат,
3-пропил-гепта-6-ен-2,4-диолдибензоат,
4-пропил-гепта-6-ен-2,4-диолдибензоат,
5-пропил-гепта-6-ен-2,4-диолдибензоат,
6-пропил-гепта-6-ен-2,4-диолдибензоат,
3-бутил-гепта-6-ен-2,4-диолдибензоат,
4-бутил-гепта-6-ен-2,4-диолдибензоат,
5-бутил-гепта-6-ен-2,4-диолдибензоат,
6-бутил-гепта-6-ен-2,4-диолдибензоат,
3,5-диметил-гепта-6-ен-2,4-диолдибензоат,
3,5-диэтил-гепта-6-ен-2,4-диолдибензоат,
3,5-дипропил-гепта-6-ен-2,4-диолдибензоат,
3,5-дибутил-гепта-6-ен-2,4-диолдибензоат,
3,3-диметил-гепта-6-ен-2,4-диолдибензоат,
3,3-диэтил-гепта-6-ен-2,4-диолдибензоат,
3,3-дипропил-гепта-6-ен-2,4-диолдибензоат,
3,3-дибутил-гепта-6-ен-2,4-диолдибензоат,
3,5-гептандиолдибензоат,
2-метил-3,5-гептандиолдибензоат,
3-метил-3,5-гептандиолдибензоат,
4-метил-3,5-гептандиолдибензоат,
5-метил-3,5-гептандиолдибензоат,
6-метил-3,5-гептандиолдибензоат,
3-этил-3,5-гептандиолдибензоат,
4-этил-3,5-гептандиолдибензоат,
5-этил-3,5-гептандиолдибензоат,
3-пропил-3,5-гептандиолдибензоат,
4-пропил-3,5-гептандиолдибензоат,
3-бутил-3,5-гептандиолдибензоат,
2,3-диметил-3,5-гептандиолдибензоат,
2,4-диметил-3,5-гептандиолдибензоат,
2,5-диметил-3,5-гептандиолдибензоат,
2,6-диметил-3,5-гептандиолдибензоат,
3,3-диметил-3,5-гептандиолдибензоат,
4,4-диметил-3,5-гептандиолдибензоат,
6,6-диметил-3,5-гептандиолдибензоат,
2,6-диметил-3,5-гептандиолдибензоат,
3,4-диметил-3,5-гептандиолдибензоат,
3,5-диметил-3,5-гептандиолдибензоат,
3,6-диметил-3,5-гептандиолдибензоат,
4,5-диметил-3,5-гептандиолдибензоат,
4,6-диметил-3,5-гептандиолдибензоат,
4,4-диметил-3,5-гептандиолдибензоат,
3-этил-2-метил-3,5-гептандиолдибензоат,
4-этил-2-метил-3,5-гептандиолдибензоат,
5-этил-2-метил-3,5-гептандиолдибензоат,
3-этил-3-метил-3,5-гептандиолдибензоат,
4-этил-3-метил-3,5-гептандиолдибензоат,
5-этил-3-метил-3,5-гептандиолдибензоат,
3-этил-4-метил-3,5-гептандиолдибензоат,
4-этил-4-метил-3,5-гептандиолдибензоат,
5-этил-4-метил-3,5-гептандиолдибензоат,
2-метил-3-пропил-3,5-гептандиолдибензоат,
2-метил-4-пропил-3,5-гептандиолдибензоат,
2-метил-5-пропил-3,5-гептандиолдибензоат,
3-метил-3-пропил-3,5-гептандиолдибензоат,
3-метил-4-пропил-3,5-гептандиолдибензоат,
3-метил-5-пропил-3,5-гептандиолдибензоат,
4-метил-3-пропил-3,5-гептандиолдибензоат,
4-метил-4-пропил-3,5-гептандиолдибензоат,
4-метил-5-пропил-3,5-гептандиолдибензоат,
6-метил-2,4-гептандиолди(пара-хлорбензоат),
6-метил-2,4-гептандиолди(пара-метилбензоат),
6-метил-2,4-гептандиолди(мета-метилбензоат),
6-метил-2,4-гептандиолдипивалат,
гепта-6-ен-2,4-диолдипивалат,
3,6-диметил-2,4-гептандиолдибензоат,
2,2,6,6-тетраметил-3,5-гептандиолдибензоат,
4-метил-3,5-октандиолдибензоат,
4-этил-3,5-октандиолдибензоат,
4-пропил-3,5-октандиолдибензоат,
5-пропил-3,5-октандиолдибензоат,
4-бутил-3,5-октандиолдибензоат,
4,4-диметил-3,5-октандиолдибензоат,
4,4-диэтил-3,5-октандиолдибензоат,
4,4-дипропил-3,5-октандиолдибензоат,
4-метил-4-этил-3,5-октандиолдибензоат,
3-фенил-3,5-октандиолдибензоат,
3-этил-2-метил-3,5-октандиолдибензоат,
4-этил-2-метил-3,5-октандиолдибензоат,
5-этил-2-метил-3,5-октандиолдибензоат,
6-этил-2-метил-3,5-октандиолдибензоат,
5-метил-4,6-нонандиолдибензоат,
5-этил-4,6-нонандиолдибензоат,
5-пропил-4,6-нонандиолдибензоат,
5-бутил-4,6-нонандиолдибензоат,
5,5-диметил-4,6-нонандиолдибензоат,
5,5-диэтил-4,6-нонандиолдибензоат,
5,5-дипропил-4,6-нонандиолдибензоат,
5,5-дибутил-4,6-нонандиолдибензоат,
5-метил-4-этил-4,6-нонандиолдибензоат,
5-фенил-4,6-нонандиолдибензоат,
4,6-нонандиолдибензоат,
9,9-бис(бензоилоксиметил)флуорен,
9,9-бис((мета-метоксибензоилокси)метил)флуорен,
9,9-бис((мета-хлорбензоилокси)метил)флуорен,
9,9-бис((пара-хлорбензоилокси)метил)флуорен,
9,9-бис(циннамоилоксиметил)флуорен,
9-(бензоилоксиметил)-9-(пропионилоксиметил)флуорен,
9,9-бис(пропионилоксиметил)флуорен,
9,9-бис(акрилоилоксиметил)флуорен,
9,9-бис(пивалилоксиметил)флуорен,
9,9-флуорендиметанолдибензоат.
Внешними донорными соединениями (с) также могут быть соединения простого диэфира 1,3-пропандиола формулы (V), указанной выше, где особенно предпочтительными являются 2-изоамил-2-изопропил-1,3-диметоксипропан и 9,9-бис(метоксиметил)флуорен.
Другим типом предпочтительных внешних донорных соединений (с) являются соединения кремния формулы R10 aR11 bSi(OR9)c, в которой a и b независимо друг от друга представляют собой целое число от 0 до 2, с представляет собой целое число от 1 до 3, и сумма a+b+c равна 4; R10, R11 и R9 независимо друг от друга представляют собой каждый С1-С18-гидрокарбил, необязательно, содержащий гетероатом (гетероатомы). Указанным соединением кремния, особенно предпочтительно, является соединение кремния вышеуказанной формулы, в которой a=1, b=1 и с=2, по меньшей мере, один из R10 и R11 выбран из группы, состоящей из разветвленной алкильной, алкенильной, алкиленовой, циклоалкильной или арильной группы, имеющей 3-10 углеродных атомов, необязательно содержащей гетероатомы, и R9 представляет собой С1-С10-алкильную группу, особенно метил.
Примеры подходящих соединений кремния включают (не ограничиваясь этим) циклогексилметилдиметоксисилан, диизопропилдиметоксисилан, ди-н-бутилдиметоксисилан, диизобутилдиметоксисилан, дифенилдиметоксисилан, метил-трет-бутилдиметоксисилан, дициклопентилдиметоксисилан, (2-этилпиперидил)(2-трет-бутил)диметоксисилан, (1,1,1-трифторпропан-2-ил)(2-этилпиперидил)диметоксисилан и (1,1,1-трифторпропан-2-ил)метилдиметоксисилан.
Кроме того, предпочтительными соединениями кремния могут быть соединения кремния вышеуказанной формулы, в которой a=0, b=1, c=3, R11 представляет собой разветвленную алкильную или циклоалкильную группу, необязательно содержащую гетероатомы, и R9 представляет собой метильную группу. Примеры таких соединений кремния включают циклогексилтриметоксисилан, трет-бутилтриметоксисилан и трет-гексилтриметоксисилан.
Другим типом предпочтительных соединений - внешних доноров электронов (с) являются бензоаты. Необходимо особенно отметить, что это является одной из характеристик катализаторов согласно настоящему изобретению. Вообще, при использовании комбинации катализатора, известного в технике, с бензоатным соединением в качестве внешнего донора электронов в полимеризации пропилена полученные полимеры имеют низкую стереорегулярность, и активность полимеризации катализатора является также низкой. Однако при использовании комбинации твердых каталитических компонентов по изобретению с бензоатным соединением в качестве внешнего донора электронов в полимеризации пропилена может быть достигнута очень высокая активность полимеризации, и полученные полимеры могут иметь относительно высокую стереорегулярность.
В случае использования соединения - внешние доноры электронов (с) могут использоваться в таком количестве, что мольное отношение алюмоорганических соединений (b) к соединениям - внешним донорам электронов (с) находится в интервале от примерно 0,1 до примерно 500, предпочтительно, от примерно 1 до примерно 300, более предпочтительно, от примерно 3 до примерно 100, и мольное отношение титана, содержащегося в твердых каталитических компонентах (а), к соединениям - внешним донорам электронов (с) находится в интервале 1:0-500, предпочтительно, 1: 25-100. Как рассмотрено выше, при использовании в полимеризации олефинов, особенно пропилена, катализаторы по изобретению могут давать полимеры, имеющие очень высокий показатель стереорегулярности, с высоким выходом, имеющие хороший баланс характеристик.
Термин "полимеризация", как он использован здесь, предназначен охватывать гомополимеризацию и сополимеризацию. Термин "полимер", как он использован здесь, предназначен охватывать гомополимер, сополимер и тройной сополимер.
Катализаторы изобретения могут использоваться в полимеризации вышеуказанного олефина CH2=CHR, причем примеры указанного олефина включают этилен, пропилен, 1-бутен, 4-метил-1-пентен, 1-гексен и 1-октен. В частности, указанные катализаторы могут быть использованы для получения, например, следующих продуктов: полиэтилена высокой плотности (HDPE (ПЭВП), имеющего плотность выше 0,940 г/см3), который включает гомополимер этилена и сополимер этилена и α-олефинов, имеющих 3-12 углеродных атомов; линейного полиэтилена низкой плотности (LLDPE (ЛПЭНП), имеющего плотность ниже 0,940 г/см3); и полиэтилена очень низкой плотности и ультранизкой плотности (VLDPE (ПЭОНП) и ULDPE (ПЭУНП), имеющего плотность ниже 0,920 г/см3 и вплоть до 0,880 г/см3), состоящего из сополимера этилена и одного или нескольких α-олефинов, имеющих 3-12 углеродных атомов, в котором мольное содержание звена, производного от этилена, составляет выше 80%; эластомерного сополимера этилена и пропилена и эластомерных тройных сополимеров этилена и пропилена, а также диолефинов при небольшом соотношении, в котором массовое содержание звена, производного от этилена, составляет от 30% до 70%; изотактического полипропилена и кристаллического сополимера пропилена и этилена и/или других α-олефинов, в котором содержание звена, производного от пропилена, составляет выше 85 мас.% (статистический сополимер); ударопрочного полимера пропилена, который получают последовательной полимеризацией пропилена и смеси пропилена и этилена, с содержанием этилена до 40 мас.%; сополимера пропилена и 1-бутена, содержащего большое количество, такое как от 10 до 40 мас.% звена, производного от 1-бутена. Особенно важно, что полимеры пропилена, полученные при использовании катализаторов по изобретению, имеют очень широкое молекулярно-массовое распределение ((MWD)(ММР) и очень высокий показатель стереорегулярности.
Катализаторы по изобретению могут использоваться в различных известных способах полимеризации олефинов, включая непрерывную полимеризацию и полимеризацию в реакторе периодического действия. Например, полимеризация может проводиться в суспензии с инертными углеводородными растворителями в качестве разбавителя или в массе с жидкими мономерами, такими как пропилен, в качестве реакционной среды. Альтернативно, полимеризация может быть выполнена в газообразной фазе в одном или нескольких реакторах с псевдоожиженным слоем или с механически перемешиваемым слоем.
Реакцию полимеризации обычно проводят при температуре от 20 до 120°C, предпочтительно, от 40 до 80°C. Когда полимеризацию проводят в газообразной фазе, рабочее давление находится обычно в интервале от 0,5 до 10 МПа (абсолютное давление, также и в дальнейшем), предпочтительно, от 1 до 5 МПа. Рабочее давление при полимеризации в массе находится обычно в интервале от 1 до 6 МПа, предпочтительно, от 1,5 до 4 МПа. Водород или другие соединения, которые действуют как регулятор степени полимеризации, могут быть использованы для регулирования молекулярной массы полимеров.
Катализаторы изобретения могут непосредственно вводиться в реакторы для полимеризации. Альтернативно, катализаторы могут быть форполимеризованы перед введением в первый полимеризационный реактор. Термин "форполимеризованный катализатор", как он использован здесь, предназначен для обозначения катализатора, который был подвергнут полимеризации с низкой степенью превращения. Согласно настоящему изобретению указанные форполимеризованные катализаторы содержат форполимеры, полученные форполимеризацией олефина с использованием твердых каталитических компонентов по изобретению со степенью превращения форполимеризации в интервале от примерно 0,1 до 1000 г полимера олефина на 1 г указанного твердого каталитического компонента.
Можно использовать в форполимеризации, по меньшей мере, один из α-олефинов, которые являются идентичными с вышеуказанными олефинами, причем этилен или пропилен являются предпочтительными. В частности, особенно предпочтительно использовать в реакции форполимеризации этилен или смесь этилена с одним или несколькими α-олефинами в количестве до 20 мол.% Предпочтительно, степень превращения форполимеризованных твердых каталитических компонентов находится в интервале от примерно 0,2 до примерно 500 г полимера на 1 г твердого каталитического компонента.
Способ форполимеризации может осуществляться при температуре от -20 до 80°C, предпочтительно, от 0 до 50°C, в жидкой фазе или газообразной фазе. Давление способа форполимеризации может обычно находиться в интервале от 0,01 до 10 МПа, а время форполимеризации зависит от используемых температуры и давления форполимеризации и требуемой степени превращения. Стадия форполимеризации может быть осуществлена последовательно как часть непрерывного способа полимеризации или осуществлена отдельно при периодическом режиме работы.
Когда катализатор по изобретению используют для полимеризации CH2=CHR, может быть получен удовлетворительный выход полимеризации, и полученные полимеры имеют высокую стереорегулярность, например, полученные гомополимеры пропилена имеют показатель стереорегулярности более 95%, даже если катализатор не комбинируют с внешним донором, и молекулярно-массовое распределение полимеров является относительно широким. Кроме того, когда катализатор используют в сополимеризации этилена и пропилена, могут быть получены сополимеры с относительно небольшим содержанием геля. Это значит, что, когда катализатор используют для получения статистического полипропилена, могут быть получены полимеры, имеющие лучшую прозрачность; когда катализатор используют для получения многофазного сополимера пропилена, могут быть получены сополимеры с лучшей характеристикой ударной прочности; когда катализатор используют для получения сополимера этилена, могут быть получены сополимеры, имеющие более однородное распределение чередования сомономера; и когда катализатор используют для получения этиленпропиленового эластомера, могут быть получены полимеры, имеющие лучшую эластичность.
Варианты изобретения
Следующие примеры дополнительно описывают изобретение, но не ограничивают изобретение никаким образом.
Методы испытаний
1. Температура плавления: микроскопический прибор измерения температуры плавления ХТ4А (тип с регулируемой температурой).
2. Измерение ядерно-магнитного резонанса: использование ядерно-магнитнорезонансного спектрометра Брука dmx300 для 1Н-ЯМР (300 МГц, если не указано иное, растворитель - CDCl3, ТМС используется в качестве внутреннего эталона, и температура измерения составляет 300 К).
3. Молекулярная масса и молекулярно-массовое распределение (ММР)(ММР=Mw/Mn) полимера: определяются гельпроникающей хроматографией с использованием ТС-ГПХ 220 с трихлорбензолом в качестве растворителя при 150°С (эталонный образец: полистирол, скорость потока: 1,0 мл/мин, колонки: 3хPI гель 10 мкм М1хED-B 300х7,5 нм).
4. Стереорегулярность полимера: определяют методом экстракции гептаном (экстракция кипящим гептаном в течение 6 ч) следующим образом: 2 г образца высушенного полимера экстрагируют кипящим гептаном в экстракторе в течение 6 ч, затем оставшееся вещество сушат до постоянной массы, и отношение массы оставшегося полимера (г) к 2 рассматривается как стереорегулярность.
5. Индекс расплава: определяется согласно ASTM D1238-99.
Примеры синтеза 1-90
Пример синтеза 1
Синтез 1,2,3-пропантриолтрибензоата
К 3,7 г 1,2,3-пропантриола добавляют 50 мл тетрагидрофурана, затем добавляют 14,5 мл пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 17,4 мл (0,15 моль) бензоилхлорида и смесь перемешивают в течение 1 ч при комнатной температуре, затем нагревают с обратным холодильником в течение 6 ч. После завершения реакции добавляют 40 мл воды для растворения полученной соли. Смесь экстрагируют толуолом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза, сушат над безводным сульфатом натрия и фильтруют. Растворитель удаляют с получением белого твердого вещества. Перекристаллизация из этилацетата дает 1,2,3-пропантриолтрибензоат в виде белых кристаллов, выход составляет 89% и температура плавления составляет 67-69°C.
1Н ЯМР δ (м.д.): 4,73 (д, 4Н, СН2), 5,83 (м, 1Н, СН), 7,41-8,07 (м, 15Н, ароматическое кольцо Н).
Пример синтеза 2
Синтез 1,2-бутиленгликольдибензоата
В реактор вводят 1,2-бутиленгликоль (2,5 г), бензоилхлорид (7,8 г), пиридин (8,8 г) и тетрагидрофуран (70 мл). Реагенты смешивают и нагревают с обратным холодильником в течение 4 ч, затем охлаждают до комнатной температуры. В реакционную систему добавляют воду до тех пор, пока неорганическая фаза не станет прозрачной. Органическую фазу отделяют. Неорганическую фазу экстрагируют этиловым эфиром. Объединенную органическую фазу промывают водой, сушат над безводным сульфатом натрия. После концентрирования отделяют 3,95 г продукта.
1Н ЯМР δ (м.д.): 1,0-1,1 (3Н), 1,7-1,9 (2Н), 4,4-4,6 (2Н), 5,4-5,5 (1Н) и 7,4-8,2 (10Н).
Пример синтеза 3
Синтез 2,3-бутиленгликольдибензоата
Методика синтеза подобна методике синтеза, описанной в примере синтеза 2, и 4,4 г продукта получают из 2,3-бутиленгликоля.
1Н ЯМР δ (м.д.): 1,4-1,6 (6Н), 5,3-5,5 (2Н), 7,4-8,2 (10Н).
Пример синтеза 4
Синтез 1,2-фенилендибензоата
К 5,5 г пирокатехина добавляют 50 мл тетрагидрофурана и 12,1 мл пиридина при перемешивании. Затем к полученной гомогенной смеси медленно добавляют 14,5 мл бензоилхлорида и реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем нагревают с обратным холодильником в течение 4 ч. Затем добавляют 70 мл воды для растворения полученной соли. Реакционную смесь экстрагируют толуолом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза, сушат над безводным сульфатом натрия. Удаление растворителя дает твердое белое вещество. После перекристаллизации из этилацетата получают 1,2-фенилендибензоат в виде белых кристаллов, выход составляет 94% и температура плавления составляет 75-77°C.
1Н ЯМР δ (м.д.): 7,35-7,54 (м, 10Н, ароматическое кольцо Н), 8,05-8,12 (м, 4Н, ароматическое кольцо Н).
Пример синтеза 5
Синтез 2,4-пентандиолдибензоата
(1) Синтез 2,4-пентандиола
К смеси 2,5 г боргидрида натрия, 0,1 г гидроксида натрия и 25 мл воды добавляют по каплям раствор 10 г 2,4-пентандиона в 30 мл метанола при 0-10°C. После завершения реакции растворитель удаляют перегонкой при пониженном давлении и остаток непрерывно экстрагируют с использованием 40 мл этилацетата в течение 15 ч. Растворитель удаляют и отделение хроматографией на колонках дает 9,4 г 2,4-пентандиола в виде бесцветной жидкости с выходом 90%. ИК-спектр имеет пик сильного поглощения при 3400 см-1, но не имеет пика поглощения при примерно 1700 см-1. Это показывает, что реакция восстановления прошла полностью.
(2) Синтез 2,4-пентандиолдибензоата
К 3,1 г (0,03 моль) 2,4-пентандиола добавляют 30 мл тетрагидрофурана и 7,1 г (0,09 моль) пиридина, затем добавляют 10,5 г (0,075 моль) бензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Реакционную смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия и фильтруют. После удаления растворителя неочищенный продукт очищают хроматографией на колонках с получением 8,9 г 2,4-пентандиолдибензоата в виде бесцветной жидкости, выход составляет 95%.
1Н ЯМР δ (м.д.): 1,3-1,4 (8Н, м, СН3), 2,0-2,1 (2Н, м, СН2), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 6
Синтез (2S,4S)-(+)-2,4-пентандиолдибензоата
Методика синтеза идентична методике синтеза, описанной в примере синтеза 5, стадия (2), и получают 8,9 г требуемого продукта в виде бесцветной жидкости из 3,1 г (2S,4S)-(+)-2,4-пентандиола, выход составляет 95%.
1Н ЯМР δ (м.д.): 1,2-1,4 (8Н, м, СН3), 2,0-2,1 (2Н, м, СН2), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 7
Синтез (2R,4R)-(+)-2,4-пентандиолдибензоата
Методика синтеза идентична методике синтеза, описанной в примере синтеза 6, за исключением замены (2S,4S)-(+)-пентандиола (2R,4R)-(+)-пентандиолом.
1Н ЯМР δ (м.д.): 1,3-1,4 (8Н, м, СН3), 2,0-2,1 (2Н, м, СН2), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 8
Синтез пентаэритриттетрабензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 1, и требуемый продукт в виде белого твердого вещества получают из 4,1 г пентаэритрита, выход составляет 89%, и температура плавления составляет 95-97°C.
1Н ЯМР δ (м.д.): 4,77 (с, 8Н, СН2), 7,38-8,02 (м, 2Н, ароматическое кольцо Н).
Пример синтеза 9
Синтез 2,4-пентандиолди(мета-хлорбензоата)
К 0,03 моль 2,4-пентандиола добавляют 30 мл тетрагидрофурана и 0,09 моль пиридина, затем добавляют 0,075 моль мета-хлорбензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Реакционную смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия и фильтруют. После удаления растворителя неочищенный продукт очищают хроматографией на колонках с получением 2,4-пентандиолди(мета-хлорбензоата) в виде бесцветной вязкой жидкости, выход составляет 95%.
1Н ЯМР δ (м.д.): 1,3-1,4 (6Н, д, СН3), 1,9-2,3 (2Н, м, СН2), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,1 (8Н, м, ArH).
Пример синтеза 10
Синтез 2,4-пентандиолди(пара-бромбензоата)
Методика синтеза является идентичной методике синтеза, описанной в примере синтеза 9, за исключением того, что мета-хлорбензоилхлорид заменяют пара-бромбензоилхлоридом. Получают 2,4-пентандиолди(пара-бромбензоат) в виде бесцветной жидкости, выход составляет 90%.
1Н ЯМР δ (м.д.): 1,3-1,4 (6Н, д, СН3), 1,8-2,2 (2Н, м, СН2), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,4-7,9 (8Н, м, ArH).
Пример синтеза 11
Синтез 2,4-пентандиолди(орто-бромбензоата)
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 9, за исключением того, что мета-хлорбензоилхлорид заменяют орто-бромбензоилхлоридом. Получают 2,4-пентандиолди(орто-бромбензоат) в виде бесцветной жидкости, выход составляет 90%.
1Н ЯМР δ (м.д.): 1,3-1,4 (6Н, м, СН3), 2,06-2,09 (2Н, д, СН2), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-7,9 (8Н, м, ArH).
Пример синтеза 12
Синтез 2,4-пентандиолди(пара-н-бутилбензоата)
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 9, за исключением того, что метахлорбензоилхлорид заменяют пара-н-бутилбензоилхлоридом. Получают 2,4-пентандиолди(пара-н-бутилбензоат) в виде бесцветной жидкости, выход составляет 90%.
1Н ЯМР δ (м.д.): 0,910,98 (6Н, м, СН3 из бутила), 1,3-1,4 (8Н, м, СН2 из бутила), 1,5-1,6 (6Н, м, СН3), 2,0-2,1 (2Н, т, СН2), 2,6-2,7 (4Н, т, СН2 из бутила), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,1-8,0 (8Н, м, ArH).
Пример синтеза 13
Синтез 2,4-пентандиолмонобензоатмоноциннамата
К 0,03 моль 2,4-пентандиола добавляют 30 мл тетрагидрофурана и 0,04 моль пиридина, затем добавляют 0,03 моль бензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч и охлаждают. Затем к реакционной смеси добавляют 20 мл тетрагидрофурана и 0,05 моль пиридина с последующим добавлением 0,04 моль циннамилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Реакционную смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия и фильтруют. После удаления растворителя неочищенный продукт очищают хроматографией на колонках с получением 2,4-пентандиолмонобензоатмоноциннамата в виде бесцветной вязкой жидкости. Выход составляет 89%.
1Н ЯМР δ (м.д.): 0,8-1,4 (8Н, м, СН3), 1,9-2,1 (1Н, м, СН), 5,1-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 6,2-8,0 (12Н, м, ArH и =СН-).
Пример синтеза 14
Синтез 2,4-пентандиолдициннамата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 9, за исключением того, что мета-хлорбензоилхлорид заменяют циннамилхлоридом. Получают 2,4-пентандиолдициннамат в виде бесцветной жидкости и выход составляет 88%.
1Н ЯМР δ (м.д.): 1,2-1,3 (6Н, м, СН3), 2,0-2,1 (2Н, д, СН2), 5,1-5,2 (2Н, м, СН связанный с радикалом сложного эфира), 6,3-7,6 (14Н, м, ArH и =СН-).
Пример синтеза 15
Синтез 2,4-пентандиолдипропионата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 9, за исключением того, что мета-хлорбензоилхлорид заменяют пропионилхлоридом. Получают 2,4-пентандиолдипропионат в виде бесцветной жидкости и выход составляет 95%.
1Н ЯМР δ (м.д.): 1,0-1,1 (6Н, д, СН3), 1,21-1,24 (6Н, т, СН3), 1,74-1,77 (2Н, м, СН2), 2,2-2,3 (4Н, м, СН2 из пропионилокси), 4,9-5,0 (2Н, м, СН связанный с радикалом сложного эфира).
Пример синтеза 16
Синтез 2-метил-2,4-пентандиолдибензоата
К 0,03 моль 2-метил-2,4-пентандиола добавляют 30 мл тетрагидрофурана и 0,09 моль пиридина, затем добавляют 0,075 моль бензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Реакционную смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия и фильтруют. После удаления растворителя неочищенный продукт очищают хроматографией на колонках с получением 2-метил-2,4-пентандиолдибензоата в виде бесцветной жидкости и выход составляет 88%.
1Н ЯМР δ (м.д.): 1,42-1,43 (3Н, д, СН3), 1,68 (6Н, с, СН3), 2,2-2,7 (2Н, д, СН2), 5,53-5,58 (1Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 17
Синтез 1,4-ксилендиолдибензоата
К 0,03 моль 1,4-ксилендиола добавляют 30 мл тетрагидрофурана и 0,09 моль пиридина, затем добавляют 0,075 моль бензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Реакционную смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия и фильтруют. После удаления растворителя неочищенный продукт очищают перекристаллизацией из этилацетата и петролейного эфира (1:1, об./об.) с получением 1,4-ксилендиолдибензота в виде белого твердого вещества, и выход составляет 95%, температура плавления составляет 84-85°C.
1Н ЯМР δ (м.д.): 5,3 (4Н, с, СН2 связанный с радикалом сложного эфира), 7,4-8,1 (10Н, м, ArH).
Пример синтеза 18
Синтез гепта-6-ен-2,4-диолдибензоата
В азотной атмосфере, свободной от воды и кислорода, в реактор вводят последовательно 0,02 моль 2,4-дигидрокси-6-гептена, 20 мл тетрагидрофурана и 0,06 моль пиридина. Затем к реакционной смеси медленно по каплям добавляют 0,05 моль бензоилхлорида. После окончания добавления реакционную смесь нагревают с обратным холодильником в течение 8 ч и обеспечивают взаимодействие при комнатной температуре в течение еще 12 ч. Затем реакционную смесь фильтруют и осадок на фильтре промывают безводным этиловым эфиром в течение трех раз. Фильтрат промывают насыщенным солевым раствором полностью и сушат над безводным сульфатом натрия. Удаление растворителя дает 5,1 г продукта.
1Н ЯМР δ (м.д.): 1,2 (3Н, СН3), 1,7 (2Н, СН2), 2,2 (2Н, СН2), 4,8 (2Н, СН2), 5,1 (2Н, СН), 5,6 (1Н, =СН-), 7,8 (10Н, ArH).
Пример синтеза 19
Синтез 3,5-гептандиолдибензоата
(1) Синтез 3,5-гептандиола
К смеси 2,5 г борогидрида натрия, 0,05 г гидроксида натрия и 25 мл воды добавляют по каплям раствор 14,2 г 3,5-гептандиона в 30 мл метанола при 0-10°C. После завершения реакции растворитель удаляют перегонкой при пониженном давлении и остаток непрерывно экстрагируют с использованием 40 мл этилацетата в течение 15 ч. Растворитель удаляют с получением 3,5-гептандиола в виде белого твердого вещества с выходом 90%. ИК-спектр имеет пик сильного поглощения при 3400 см-1, но не имеет пика поглощения при примерно 1700 см-1. Это показывает, что реакция восстановления прошла полностью.
(2) Синтез 3,5-гептандиолдибензоата
К 0,03 моль 3,5-гептандиола добавляют 30 мл тетрагидрофурана и 0,09 моль пиридина, затем добавляют 0,075 моль бензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Реакционную смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия и фильтруют. После удаления растворителя неочищенный продукт очищают хроматографией на колонках с получением 3,5-гептандиолдибензоата в виде бесцветной вязкой жидкости и выход составляет 92%.
1Н ЯМР δ (м.д.): 0,9-1,0 (6Н, м, СН3), 1,7-1,8 (4Н, м, СН2 из этила), 2,0-2,1 (2Н, м, СН2), 5,21-5,37 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,1 (10Н, м, ArH).
Пример синтеза 20
Синтез 2,6-диметил-3,5-гептандиолдибензоата
(1) Синтез 2,6-диметил-3,5-гептандиола
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 19 (1), за исключением того, что 3,5-гептандион заменяют 2,6-диметил-3,5-гептандионом, и, наконец, продукт очищают перегонкой при пониженном давлении. 2,6-диметил-3,5-гептандиол получают в виде бесцветной жидкости с выходом 90%.
(2) Синтез 2,6-диметил-3,5-гептандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 19 (2), и 2,6-диметил-3,5-гептандиолдибензоат получают в виде бесцветной жидкости из 2,6-диметил-3,5-гептандиола с выходом 88%.
1Н ЯМР δ (м.д.): 0,95-0,99 (12Н, м, СН3), 1,9-2,0 (4Н, м, СН2и СН), 5,10-5,17 (2Н, м, СН связанный с радикалом сложного эфира), 7,2-8,0 (10Н, м, ArH).
Пример синтеза 21
Синтез 6-метил-2,4-гептандиолдибензоата
(1) Синтез 6-метил-2,4-гептандиола
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 19 (1), за исключением того, что 3,5-гептандион заменяют 6-метил-2,4-гептандионом, и, наконец, продукт очищают перегонкой при пониженном давлении. 6-диметил-2,4-гептандиол получают в виде бесцветной жидкости с выходом 90%.
(2) Синтез 6-метил-2,4-гептандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 19 (2), за исключением того, что 3,5-гептандиол заменяют 6-метил-2,4-гептандиолом. Наконец, 6-метил-2,4-гептандиолдибензоат получают в виде бесцветной жидкости и выход составляет 95%.
1Н ЯМР δ (м.д.): 1,42-1,43 (3Н, д, СН3), 1,68 (6Н, с, СН3), 2,2-2,7 (2Н, м, СН2), 5,53-5,58 (1Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 22
Синтез 6-метил-2,4-гептандиолди(пара-метилбензоата)
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 21, за исключением того, что бензоилхлорид заменяют пара-метилбензоилхлоридом. Наконец, 6-метил-2,4-гептандиолди(пара-метилбензоат) получают в виде бесцветной жидкости и выход составляет 95%.
1Н ЯМР δ (м.д.): 1,42-1,43 (3Н, д, СН3), 1,68 (6Н, с, СН3), 2,2-2,7 (2Н, д, СН2), 5,53-5,58 (1Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 23
Синтез 1,4-ди(бензоилоксиметил)циклогексана
К 0,03 моль 1,4-дигидроксиметилциклогексана добавляют 30 мл тетрагидрофурана и 0,09 моль пиридина, затем добавляют 0,075 моль бензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Реакционную смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия и фильтруют. После удаления растворителя неочищенный продукт очищают перекристаллизацией из этилацетата и петролейного эфира (2:1, об./об.) с получением 1,4-ди(бензоилоксиметил)циклогексана в виде белого твердого вещества. Выход составляет 95%, и температура плавления составляет 111-113°C.
1Н ЯМР δ (м.д.): 1,1-1,2 (8Н, м, циклогексан Н), 1,8-1,9 (2Н, м, циклогексан Н), 4,2-4,3 (4Н, д, СН2), 7,4-8,1 (10Н, м, ArH).
Пример синтеза 24
Синтез 3-метил-2,4-пентандиолдибензоата
(1) Синтез 3-метил-2,4-пентандиона
К 0,1 моль гидрида натрия добавляют 100 мл безводного тетрагидрофурана, медленно по каплям добавляют 0,1 моль 2,4-пентандиона при комнатной температуре. При завершении добавления смесь перемешивают в течение 0,5 ч, затем медленно по каплям добавляют 0,12 моль иодометана. После перемешивания при комнатной температуре в течение 10 ч добавляют 20 мл воды для растворения твердого вещества. Смесь экстрагируют этилацетатом. Растворитель удаляют. Дистилляцию проводят при пониженном давлении и собирают отобранную фракцию 84-86°C/4 кПа (165-166°C при атмосферном давлении). Выход составляет 94%.
(2) Синтез 3-метил-2,4-гептандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 19, и требуемый продукт получают в виде бесцветной жидкости из 3-метил-2,4-пентандиона с общим выходом 86%.
1Н ЯМР δ (м.д.): 1,1-1,2 (3Н, м, СН3), 1,3-1,4 (6Н, м, СН3), 2,0-2,1 (1Н, м, СН), 5,1-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 25
Синтез 3-метил-2,4-пентандиолди(пара-хлорбензоата)
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 24, за исключением того, что бензоилхлорид заменяют пара-хлорбензоилхлоридом. Наконец, 3-метил-2,4-пентандиолди(пара-хлорбензоат) получают в виде бесцветной жидкости из 3-метил-2,4-пентандиона, и общий выход составляет 83%.
1Н ЯМР δ (м.д.): 1,0-1,1 (3Н, м, СН3), 1,3-1,4 (6Н, м, СН3), 1,9-2,1 (1Н, м, СН), 5,1-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-7,9 (8Н, м, ArH).
Пример синтеза 26
Синтез 3-метил-2,4-пентандиолди(пара-метилбензоата)
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 24, за исключением того, что бензоилхлорид заменяют пара-метилбензоилхлоридом. Окончательно требуемый продукт получают в виде белого твердого вещества из 3-метил-2,4-пентандиона, и общий выход составляет 83%, температура плавления составляет 91-92°C.
1Н ЯМР δ (м.д.): 1,1-1,2 (3Н, м, СН3), 1,3-1,4 (6Н, м, СН3), 2,1-2,2 (1Н, м, СН), 2,3-2,4 (6Н, м, ArCH3), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,1-8,0 (8Н, м, ArH).
Пример синтеза 27
Синтез 3-бутил-2,4-пентандиолди(пара-метилбензоата)
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 26, за исключением того, что 3-метил-2,4-пентандиол заменяют 3-бутил-2,4-пентандиолом. Окончательно требуемый продукт получают в виде бесцветной жидкости, и выход составляет 95%.
1Н ЯМР δ (м.д.): 0,8-0,9 (3Н, м, СН3), 1,3-1,4 (6Н, м, СН3), 1,5-1,7 (6Н, м, СН2), 1,9-2,0 (1Н, м, СН), 2,3-2,4 (6Н, м, ArCH3), 5,3-5,4 (2Н, м, СН связанный с радикалом сложного эфира), 7,0-8,0 (8Н, м, ArH).
Пример синтеза 28
Синтез 3-метил-2,4-пентандиолди(пара-трет-бутилбензоата)
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 24, за исключением того, что бензоилхлорид заменяют пара-трет-бутилбензоилхлоридом. Окончательно 3-метил-2,4-пентандиолди(пара-трет-бутилбензоат) получают в виде бесцветной жидкости из 3-метил-2,4-пентандиона, и общий выход составляет 81%.
1Н ЯМР δ (м.д.): 1,1-1,4 (27Н, м, СН3), 2,0-2,1 (1Н, м, СН), 5,2-5,4 (2Н, м, СН связанный с радикалом сложного эфира), 7,4-8,1 (8Н, м, ArH).
Пример синтеза 29
Синтез 3-метил-2,4-пентандиолмонобензоатмоноциннамата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 13, и требуемый продукт получают в виде бесцветной жидкости из 3-метил-2,4-пентандиола с общим выходом 86%.
1Н ЯМР δ (м.д.): 0,8-1,4 (9Н, м, СН3), 1,9-2,1 (1Н, м, СН), 5,1-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 6,2-8,0 (12Н, м, ArH и =СН-).
Пример синтеза 30
Синтез 3,3-диметил-2,4-пентандиолдибензоата
(1) Синтез 3,3-диметил-2,4-пентандиона
К 0,1 моль гидрида натрия добавляют 100 мл безводного тетрагидрофурана и медленно по каплям добавляют 0,12 моль 3-метил-2,4-пентандиона при комнатной температуре. По завершении добавления смесь перемешивают в течение 0,5 ч, затем медленно по каплям добавляют 0,12 моль иодметана. После перемешивания при комнатной температуре в течение 10 ч добавляют 20 мл воды для растворения твердого вещества. Смесь экстрагируют этилацетатом. Растворитель удаляют. Проводят перегонку при пониженном давлении и собирают отобранную фракцию 82-84°C/1 кПа. Выход составляет 98%.
(2) Синтез 3,3-метил-2,4-пентандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 19, и требуемый продукт получают в виде бесцветной жидкости из 3,3-диметил-2,4-пентандиона с общим выходом 86%.
1Н ЯМР δ (м.д.): 1,1-1,2 (6Н, м, СН3), 1,3-1,4 (6Н, м, СН3), 5,2-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,4-8,1 (10Н, м, ArH).
Пример синтеза 31
Синтез 3,3-диметил-2,4-пентандиолмонобензоатмоноциннамата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 13, и требуемый продукт получают в виде бесцветной жидкости из 3,3-диметил-2,4-пентандиола с выходом 88%.
1Н ЯМР δ (м.д.): 1,0-1,1 (6Н, м, СН3), 1,2-1,3 (6Н, м, СН3), 5,0-5,2 (2Н, м, СН связанный с радикалом сложного эфира), 6,3-8,0 (12Н, м, ArH и =СН-).
Пример синтеза 32
Синтез 3-этил-2,4-пентандиолдибензоата
(1) Синтез 3-этил-2,4-пентандиона
В трехгорлую колбу в атмосфере азота, не содержащего воды и кислорода, последовательно вводят 0,066 моль трет-бутилата калия и 150 мл тетрагидрофурана. Затем к полученной смеси медленно по каплям добавляют 0,06 моль ацетилацетона при перемешивании при охлаждении смеси на бане со льдом. Обеспечивают прохождение реакции при комнатной температуре в течение 1 ч, затем добавляют по каплям 0,07 моль иодэтана при комнатной температуре. Затем дают реакции протекать при комнатной температуре в течение еще 48 ч. После завершения реакции растворитель удаляют дистилляцией. К твердой смеси добавляют насыщенный солевой раствор до полного растворения твердой смеси. Раствор экстрагируют подходящим количеством безводного этилового эфира в течение трех раз. Органическую фазу объединяют и сушат над безводным сульфатом натрия. Растворитель удаляют с получением 6,5 г продукта.
(2) Синтез 3-этил-2,4-пентандиола
В атмосфере азота, не содержащего воды и кислорода, в реактор последовательно вводят 0,024 моль LiAlH4 и 100 мл тетрагидрофурана с последующим добавлением по каплям 0,04 моль 3-этил-2,4-пентандиона при охлаждении смеси на бане со льдом. Обеспечивают прохождение реакции при комнатной температуре в течение еще 48 ч. Осторожно добавляют водный раствор гидроксида натрия для прекращения реакции. Реакционную смесь фильтруют и осадок на фильтре промывают безводным этиловым эфиром в течение трех раз. Органическую фазу объединяют и сушат над безводным сульфатом натрия. Растворитель удаляют с получением 3,4 г продукта.
(3) Синтез 3-этил-2,4-пентандиолдибензоата
В атмосфере азота, не содержащего воды и кислорода, в реактор последовательно вводят 0,02 моль 3-этил-2,4-пентандиола, 20 мл тетрагидрофурана и 0,06 моль пиридина, затем медленно по каплям добавляют 0,05 моль бензоилхлорида. Реакционную смесь нагревают с обратным холодильником в течение 8 ч и дают реакции протекать при комнатной температуре в течение еще 12 ч. После завершения реакции реакционную смесь фильтруют и осадок на фильтре промывают безводным этиловым эфиром в течение трех раз. Органическую фазу полностью промывают насыщенным солевым раствором и сушат над безводным сульфатом натрия. Удаляют растворитель с получением 5,1 г продукта.
1Н ЯМР δ (м.д.): 7,25-8,17 (10Н, ArH), 5,39-5,47 (2Н, СН), 1,80 (1Н, СН), 1,66 (2Н, СН2), 1,1-1,42 (9Н, CH3).
Пример синтеза 33
Синтез 3-бутил-2,4-пентандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 19, и требуемый продукт получают в виде бесцветной жидкости из 3-бутил-2,4-пентандиона с общим выходом 86%.
1Н ЯМР δ (м.д.): 1,1-1,2 (3Н, м, СН3), 1,3-1,4 (6Н, м, СН3), 2,0-2,1 (1Н, м, СН), 5,1-5,3 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 34
Синтез 3-аллил-2,4-пентандиолдибензоата
Повторяют методику, описанную в примере синтеза 32, за исключением того, что заменяют иодэтан бромпропиленом и получают 5,3 г требуемого продукта.
1Н ЯМР δ (м.д.): 7,37-8,13 (10Н, ArH), 6,0 (2Н, =СН2), 5,38 (1Н, СН), 5,12 (2Н, СН), 2,49 (2Н, СН2), 2,27 (Н, СН), 1,38-1,52 (6Н, СН3).
Пример синтеза 35
Синтез 4-метил-3,5-гептандиолдибензоата
(1) Синтез 4-метил-3,5-гептандиона
К 0,02 моль гидрида натрия добавляют 100 мл безводного тетрагидрофурана и медленно по каплям добавляют 0,02 моль 3,5-гептандиона при комнатной температуре. По завершении добавления смесь перемешивают в течение 0,5 ч, затем медленно по каплям добавляют 0,04 моль иодметана. После перемешивания при комнатной температуре в течение 10 ч добавляют 20 мл воды. Осаждается белое твердое вещество. Твердое вещество отфильтровывают, промывают водой и сушат с получением 4-метил-3,5-гептандиона в виде белого твердого вещества, и выход составляет 94%, температура плавления составляет 91-92°C.
(2) Синтез 4-метил-3,5-гептандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 19, и требуемый продукт получают в виде бесцветной жидкости из 4-метил-3,5-гептандиона с общим выходом 79%.
1Н ЯМР δ (м.д.): 0,9-1,0 (6Н, м, СН3), 1,1-1,2 (3Н, м, СН3), 1,7-1,8 (4Н, м, СН2 из этила), 2,1-2,2 (1Н, м, СН2), 5,21-5,27 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,1 (10Н, м, ArH).
Пример синтеза 36
Синтез 2-этил-1,3-гександиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной жидкости из 2-этил-1,3-гександиола с выходом 91%.
1Н ЯМР δ (м.д.): 0,9-1,1 (6Н, м, СН3), 1,4-1,6 (6Н, м, СН2), 2,2-2,3 (1Н, м, СН), 4,3-4,5 (2Н, м, СН2 связанный с радикалом сложного эфира), 5,42-5,44 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 37
Синтез 2,2,4-триметил-1,3-пентандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной вязкой жидкости из 2,2,4-триметил-1,3-пентандиола с выходом 85%.
1Н ЯМР δ (м.д.): 1,01-1,07 (6Н, м, СН3), 1,1 (6Н, д, СН3), 4,1-4,2 (2Н, м, СН2 связанный с радикалом сложного эфира), 5,17-5,18 (1Н, д, СН связанный с радикалом сложного эфира), 7,4-8,0 (10Н, м, ArH).
Пример синтеза 38
Синтез 1,3-циклогександиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной жидкости из 1,3-циклогександиола с выходом 95%.
1Н ЯМР δ (м.д.): 1,2-2,1 (8Н, м, СН2 из циклогексана), 5,1-5,4 (2Н, м, СН связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 39
Синтез 4-метил-3,5-октандиолдибензоата
(1) Синтез 3,5-октандиона
В трехгорлую колбу, помещенную на баню со льдом и оборудованную дополнительной воронкой и обратным холодильником, в атмосфере азота, не содержащего воды и кислорода, последовательно вводят 0,07 моль гидрида натрия и 100 мл тетрагидрофурана. К смеси по каплям добавляют раствор 0,06 моль этилбутирата и 0,03 моль бутанона при перемешивании. По завершении добавления смесь нагревают с обратным холодильником в течение 4 ч. Растворитель и соединение с точкой кипения ниже 110°C удаляют дистилляцией. К остатку добавляют подходящее количество насыщенного солевого раствора до растворения твердой композиции. Смесь экстрагируют этиловым эфиром в течение трех раз. Органическую фазу объединяют и сушат над безводным сульфатом натрия. Растворитель удаляют дистилляцией с получением 2,4 г продукта.
(2) Синтез 4-метил-3,5-октандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 32, и требуемый продукт получают из 3,5-октандиона.
Пример синтеза 40
Синтез 5-метил-4,6-нонандиолдибензоата
Требуемый продукт получают в соответствии с методикой синтеза, описанной в примере синтеза 39, за исключением того, что заменяют бутанон 2-пентаноном.
Пример синтеза 41
Синтез 1,3-дифенил-1,3-пропандиолдибензоата
Требуемый продукт получают в соответствии с методикой, описанной в примере синтеза 32.
1Н ЯМР δ (м.д.): 7,13-7,35 (10Н, ArH), 5,7 (2Н, СН), 2,6 (2Н, СН2), 2,0 (6Н, СН3).
Пример синтеза 42
Синтез 1,3-дифенил-2-метил-1,3-пропандиолдибензоата
(1) Синтез 1,3-дифенил-2-метил-1,3-пропандиона
В трехгорлую колбу в атмосфере азота, не содержащего воды и кислорода, последовательно вводят 0,066 моль трет-бутилата калия и 150 мл тетрагидрофурана. Затем к полученной смеси медленно по каплям добавляют 0,06 моль дибензоилметана при перемешивании, при охлаждении смеси на бане со льдом. Реакции дают протекать при комнатной температуре в течение 1 ч, затем добавляют по каплям 0,07 моль иодметана при комнатной температуре. Затем реакции дают протекать при комнатной температуре в течение еще 48 ч. После завершения реакции растворитель удаляют дистилляцией. К твердой смеси добавляют насыщенный солевой раствор до полного растворения твердой смеси. Раствор экстрагируют подходящим количеством безводного этилового эфира в течение трех раз. Органическую фазу объединяют и сушат над безводным сульфатом натрия. Растворитель удаляют с получением 12 г продукта.
(2) Синтез 1,3-дифенил-2-метил-1,3-пропандиола
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 32 (2), и получают 5,9 г требуемого продукта из 1,3-дифенил-2-метил-1,3-пропандиона.
(3) Синтез 1,3-дифенил-2-метил-1,3-пропандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 32 (3), и получают 7,3 г требуемого продукта из 1,3-дифенил-2-метил-1,3-пропандиола.
1Н ЯМР δ (м.д.): 7,5 (20Н, ArH), 5,93 (2Н, СН), 1,24 (1Н, СН), 0,95 (3Н, СН3).
Пример синтеза 43
Синтез 1,3-дифенил-1,3-пропандиолдипропионата
(1) Синтез 1,3-дифенил-1,3-пропандиола
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 42 (2), за исключением того, что заменяют 1,3-дифенил-2-метил-пропандион дибензоилметаном.
(2) Синтез 1,3-дифенил-1,3-пропандиолдипропионата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 42 (3), за исключением того, что бензоилхлорид заменяют пропионилхлоридом, и 1,3-дифенил-2-метил-1,3-пропандиол заменяют 1,3-дифенил-1,3-пропандиолом.
1Н ЯМР δ (м.д.): 7,13-7,36 (10Н, ArH), 5,76 (2Н, СН), 2,5 (4Н, СН2), 2,11 (2Н, СН2) 1,1 (6Н, CH3).
Пример синтеза 44
Синтез 1,3-дифенил-2-метил-1,3-пропандиолдипропионата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 42, за исключением того, что бензоилхлорид заменяют пропионилхлоридом.
1Н ЯМР δ (м.д.): 7,25 (10Н, ArH), 5,76 (2Н, СН), 2,5 (4Н, СН2), 2,11 (2Н, СН2) 1,1 (6Н, CH3).
Пример синтеза 45
Синтез 1,3-дифенил-2-метил-1,3-пропандиолдиацетата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 42, за исключением того, что бензоилхлорид заменяют ацетилхлоридом.
1Н ЯМР δ (м.д.): 7,3 (10Н, ArH), 5,6 (2Н, СН), 2,4 (1Н, СН), 1,0 (9Н, СН3).
Пример синтеза 46
Синтез 1-фенил-2-метил-1,3-бутандиолдибензоата
(1) Синтез 1-фенил-2-метил-1,3-бутандиона
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 42 (1), за исключением того, что исходный материал дибензоилметан заменяют 1-фенил-1,3-бутандионом.
(2) Синтез 1-фенил-2-метил-1,3-бутандиола
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 42 (2), за исключением того, что восстановитель LiAlH4 заменяют боргидридом натрия.
(3) Синтез 1-фенил-2-метил-1,3-бутандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 42 (3).
Пример синтеза 47
Синтез гепта-6-ен-2,4-диолдипивалата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 42 (3), за исключением того, что исходным материалом является гепта-6-ен-2,4-диол, и бензоилхлорид заменяют трет-бутилформилхлоридом.
1Н ЯМР δ (м.д.): 5,6 (1Н, =СН-), 5,1 (2Н, СН), 4,8 (2Н, =СН2), 2,2 (2Н, СН2) 1,7 (2Н, CH2), 1,2 (24Н, СН3).
Пример синтеза 48
Синтез 2,2,4,6,6-пентаметил-3,5-гептандиолдибензоата
Требуемый продукт синтезируют с дипивалилметаном в качестве исходного материала в соответствии со способом, описанным в примере синтеза 42.
1Н ЯМР δ (м.д.): 8,0 (10Н, ArH), 5,3 (2Н, СН), 2,1 (1Н, СН), 1,3 (21Н, СН3).
Пример синтеза 49
Синтез 2,2,6,6-тетраметил-4-этил-3,5-гептандиолдибензоата
Повторяют способ синтеза, описанный в примере синтеза 48, за исключением того, что заменяют иодметан иодэтаном.
Пример синтеза 50
Синтез 2-метил-2-(2-фурил)-1,3-бутандиолдибензоата
Требуемый продукт синтезируют с 2-(2-фурил)-1,3-бутан-дионом в качестве исходного материала в соответствии со способом, описанным в примере синтеза 42.
Пример синтеза 51
Синтез 1,1-ди(бензоилоксиметил)_-3-циклогексена
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной вязкой жидкости из 1,1-ди(гидроксиметил)-3-циклогексена с выходом 97%.
1Н ЯМР δ (м.д.): 1,2-1,3 (2Н, т, СН2 из циклогексена), 2,1-2,2 (4Н, м, СН2 из циклогексена), 4,3-4,4 (4Н, с, СН2), 5,6-5,7 (2Н, м, двойная связь Н) 7,4-8,2 (10Н, м, ArH).
Пример синтеза 52
Синтез 1,1-ди(пропионилоксиметил)-3-циклогексена
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной жидкости из 1,1-ди(гидроксиметил)-3-циклогексена и пропионилхлорида с выходом 92%.
1Н ЯМР δ (м.д.): 1,07-1,11 (6Н, т, СН3 из пропионата), 1,2-1,3 (2Н, т, СН2 из циклогексена), 2,1-2,2 (4Н, м, СН2 из циклогексена), 2,23-2,25 (4Н, м, СН2 из пропионата) 4,3-4,4 (4Н, м, CH2).
Пример синтеза 53
Синтез 2-бутил-2-этил-1,3-пропандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной жидкости из 2-бутил-2-этил-1,3-пропандиола с выходом 93%.
1Н ЯМР δ (м.д.): 0,89-0,97 (6Н, м, СН3), 1,1-1,6 (8Н, м, СН2), 4,3 (4Н, с, СН2 связанный с радикалом сложного эфира), 7,4-8,2 (10Н, м, ArH).
Пример синтеза 54
Синтез 2,2'-бифенилдиметанолдипропионата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 52, и требуемый продукт получают в виде бесцветной вязкой жидкости из 2,2'-бифенилдиметанола с выходом 93%.
1Н ЯМР δ (м.д.): 1,0-1,1 (6Н, т, СН3), 2,2-2,3 (4Н, м, СН2), 4,8-4,9 (4Н, т, СН2 связанный с радикалом сложного эфира), 7,2-7,5 (8Н, м, ArH).
Пример синтеза 55
Синтез 2,2-диметоксиметил-1,3-пропандиолдибензоата
(1) Синтез 2,2-дигидроксиметил-1,3-пропандиолдибензоата
К 0,05 моль пентаэритрита добавляют 50 мл тетрагидрофурана и 0,15 моль пиридина, затем добавляют 0,12 моль бензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Реакционную смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия. После удаления растворителя неочищенный продукт очищают хроматографией на колонках с получением 2,2-дигидроксиметил-1,3-пропандиолдибензоата в виде бесцветной вязкой жидкости и выход составляет 95%.
(2) Синтез 2,2-диметоксиметил-1,3-пропандиолдибензоата
К 0,03 моль 2,2-дигидроксиметил-1,3-пропандиолдибензоата добавляют 30 мл тетрагидрофурана и 0,15 моль иодметана, затем добавляют 0,08 моль гидрида натрия при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 10 ч. Избыток иодметана удаляют. К смеси добавляют 10 мл насыщенного солевого раствора и смесь экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом натрия. После удаления растворителя неочищенный продукт очищают хроматографией на колонках с получением 8,9 г 2,2-диметоксиметил-1,3-пропандиолдибензоата в виде желтой вязкой жидкости и выход составляет 85%.
1Н ЯМР δ (м.д.): 3,3 (6Н, с, СН3 из радикала простого эфира), 3,6 (4Н, с, СН2 из радикала простого эфира), 4,5 (4Н, с, СН2 связанный с радикалом сложного эфира), 7,4-8,0 (10Н, м, ArH).
Пример синтеза 56
Синтез 2-метил-2-пропил-1,3-пропандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной жидкости из 2-метил-2-пропил-1,3-пропандиола с выходом 92%.
1Н ЯМР δ (м.д.): 0,93-0,97 (3Н, т, СН3 из пропила), 1,1 (4Н, с, СН3), 1,1-1,5 (4Н, м, СН2), 4,3 (4Н, с, СН2 связанный с радикалом сложного эфира), 7,4-8,2 (10Н, м, ArH).
Пример синтеза 57
Синтез 9,9-бис(бензоилоксиметил)флуорена
К 11,3 г (0,05 моль) 9,9-дигидроксиметилфлуорена добавляют 50 мл тетрагидрофурана, затем добавляют 12,1 мл (0,15 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 14,5 мл (0,125 моль) бензоилхлорида. Смесь перемешивают в течение 1 ч при комнатной температуре и затем нагревают с обратным холодильником в течение 4 ч. После завершения реакции добавляют 70 мл воды для растворения полученной соли. Смесь экстрагируют толуолом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза, сушат над безводным сульфатом натрия. Растворитель удаляют с получением белого твердого вещества. Перекристаллизация из этилацетата дает 9,9-бис(бензоилоксиметил)флуорен в виде белых кристаллов, выход составляет 89%, и температура плавления составляет 144-146°C.
1Н ЯМР δ (м.д.): 4,74 (с, 4Н, СН2), 7,25-7,75 (м, 18Н, ArH).
Пример синтеза 58
Синтез 9,9-бис((мета-метоксибензоилокси)метил)флуорена
К 4,5 г (0,02 моль) 9,9-дигидроксиметилфлуорена добавляют 30 мл тетрагидрофурана, затем добавляют 4,8 мл (0,06 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 6,8 мл (0,04 моль) мета-метоксибензоилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем нагревают с обратным холодильником в течение 5 ч. По завершении реакции добавляют 40 мл воды для растворения полученной соли. Реакционную смесь экстрагируют толуолом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза и сушат над безводным сульфатом натрия. Растворитель удаляют. Перекристаллизация из этилацетата дает 9,9-бис((мета-метоксибензоилокси)метил)флуорен в виде белых кристаллов, выход составляет 78%, и температура плавления составляет 129-130°C.
1Н ЯМР δ (м.д.): 3,82 (с, 6Н, СН3О), 4,74 (м, 4Н, СН2), 6,91 (м, 4Н, ArH), 7,12-7,81 (м, 16Н, ArH).
Пример синтеза 59
Синтез 9,9-бис((мета-хлорбензоилокси)метил)флуорена
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 17, и требуемый продукт получают в виде белого твердого вещества из 9,9-дигидроксиметилфлуорена и мета-хлорбензоилхлорида с выходом 93%.
1Н ЯМР δ (м.д.): 4,73 (4Н, с, СН2 связанный с радикалом сложного эфира), 7,3-8,0 (8Н, м, ArH).
Пример синтеза 60
Синтез 9-(бензоилоксиметил)-9-(пропионилоксиметил)-флуорена
К 4,5 г (0,02 моль) 9,9-ди(гидроксиметил)флуорена добавляют 30 мл тетрагидрофурана и добавляют 3,3 мл (0,03 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 2,3 мл (0,02 моль) бензоилхлорида и реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем нагревают с обратным холодильником в течение 5 ч. Затем смесь охлаждают до комнатной температуры и добавляют 20 мл тетрагидрофурана и 3,3 мл (0,03 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 1,8 мл (0,02 моль) пропионилхлорида и реакционную смесь перемешивают при комнатной температуре в течение 1 ч и нагревают с обратным холодильником в течение 5 ч. Затем добавляют 30 мл воды для растворения полученной соли. Реакционную смесь экстрагируют толуолом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза и сушат над безводным сульфатом натрия. Растворитель удаляют. Перекристаллизация из этилацетата дает 9-(бензоилоксиметил)-9-(пропионилоксиметил)флуорен в виде белых кристаллов, и выход составляет 79%.
1Н ЯМР δ (м.д.): 1,23 (т, 3Н, СН3), 2,39 (м, 2Н, СН2), 4,48 (с, 2Н, СООСН2), 4,62 (с, 2Н, ОСН2 связывающий с бензоилом), 7,33-8,03 (м, 13Н, ArH).
Пример синтеза 61
Синтез 9,9-бис(акрилоилоксиметил)флуорена
К 6,8 г (0,03 моль) 9,9-ди(гидроксиметил)флуорена добавляют 4,3 мл (0,06 моль) акриловой кислоты и 30 мл толуола. К полученной гомогенной смеси добавляют 0,2 мл концентрированной серной кислоты. Затем реакционную смесь нагревают с обратным холодильником в течение 7 ч, и воду, образовавшуюся в процессе реакции, отделяют сепаратором воды. Смесь охлаждают до 70°C, нейтрализуют до щелочности насыщенным раствором карбоната натрия и экстрагируют толуолом. Органическую фазу промывают насыщенным солевым раствором до нейтральности и сушат над безводным сульфатом натрия. Растворитель удаляют. Очистка хроматографией на колонках дает 9,9-бис(акрилоилоксиметил)флуорен в виде белых кристаллов, и выход составляет 35%, температура плавления составляет 73-75°C.
1Н ЯМР δ (м.д.): 4,48 (с, 4Н, ОСН3), 5,85-6,43 (м, 6Н, Н на акриле), 7,32-7,78 (м, 8Н, ArH).
Пример синтеза 62
Синтез 2,2'-бифенилдиметанолдибензоата
(1) Синтез диэтил-2,2'-бифенилдикарбоксилата
К 0,1 моль ангидрида 2,2'-бифенилдикарбоновой кислоты добавляют 0,3 моль этанола, 40 мл толуола и 0,4 мл концентрированной серной кислоты при перемешивании. Затем реакционную смесь нагревают с обратным холодильником и получаемую воду удаляют с использованием сепаратора воды до тех пор, пока количество выделившейся воды не достигнет теоретического значения. По завершении реакции смесь нейтрализуют насыщенным раствором карбоната натрия и экстрагируют этилацетатом. Верхний слой отделяют, промывают насыщенным солевым раствором до нейтральности и сушат над безводным сульфатом натрия. Растворитель удаляют. Дистилляция при пониженном давлении дает диэтил-2,2'-бифенилдикарбоксилат в виде бесцветной жидкости, и выход составляет 90%.
(2) Синтез 2,2'-бифенилдиметанола
К 3 г LiAlH4 добавляют 100 мл безводного этилового эфира. При охлаждении на бане со льдом и интенсивном перемешивании медленно по каплям добавляют 0,05 мл 2,2'-бифенилдикарбоксилата. Реакционную смесь нагревают с обратным холодильником в течение 5 ч, затем охлаждают. Избыток LiAlH4 разлагают водой. Смесь фильтруют и фильтрат экстрагируют этиловым эфиром. Экстракт сушат над безводным сульфатом натрия. Растворитель удаляют. Хроматография на колонках дает 2,2'-бифенилдиметанол в виде белого твердого вещества, выход составляет 75%, температура плавления составляет 98-103°C. ИК-спектр имеет пик сильного поглощения при 3400 см-1 и не имеет пика поглощения при примерно 1700 см-1. Это показывает, что реакция восстановления прошла полностью.
(3) Синтез 2,2'-бифенилдиметанолдибензоата
К 0,03 моль 2,2'-бифенилдиметанола добавляют 30 мл тетрагидрофурана и 0,09 моль пиридина, затем добавляют 0,075 моль бензоилхлорида при перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и добавляют 20 мл насыщенного солевого раствора. Смесь экстрагируют этилацетатом и экстракт сушат над безводным сульфатом натрия. Растворитель удаляют. Хроматография на колонках дает 2,2'-бифенилдиметанолдибензоат в виде бесцветной вязкой жидкости, и выход составляет 93%.
1Н ЯМР δ (м.д.): 5,16 (4Н, с, СН2 связанный с радикалом сложного эфира), 7,2-8,2 (18Н, м, ArH).
Пример синтеза 63
Синтез 2-изоамил-2-изопропил-1,3-пропандиолдибензоата
(1) Синтез 2-изопропил-5-метил-2-гексенала (со ссылкой на CN1036846С)
207 г изовалерианового альдегида и 26 мл смолы Amberlite ORA910 ОН--типа (выпускаемой фирмой Rohm & Haas) нагревают с обратным холодильником. Получаемую воду удаляют с использованием сепаратора воды и реакция прекращают, когда собирается примерно 26 мл воды. Смолу фильтруют. Перегонка при пониженном давлении дает отобранную фракцию 85-90°C/20 мм рт.ст.
(2) Синтез 2-изопропил-5-метилгексанала
К 10 г 2-изопропил-5-метил-2-гексенала, синтезированного, как указано выше, добавляют 70 мл этанола, 1 мл насыщенного раствора NaHCO3 и 0,25 г 10% Pd на углероде. Вводят N2, затем Н2 и аппарат соединяют с градуированной трубкой титрования, заполненной Н2. Реакции дают протекать при перемешивании при комнатной температуре и атмосферном давлении до тех пор, пока абсорбция Н2 не достигнет расчетного значения. Реакционную смесь фильтруют и фильтрат используют на следующей стадии.
(3) Синтез 2-изоамил-2-изопропил-1,3-пропандиола
К вышеуказанному фильтрату добавляют раствор 5,3 г К2СО3 в 13,1 мл воды и 16,9 мл 60% СН2О. Смесь нагревают с обратным холодильником в течение 7 ч. По завершении реакции этанол удаляют. Органическую фазу отделяют и промывают горячей водой до нейтральности. Дистилляция при пониженном давлении дает 2-изоамил-2-изопропил-1,3-пропандиол, и температура кипения составляет 165°C/20 мм рт.ст.
(4) Синтез 2-изоами-2-изопропил-1,3-пропандиолдибензоата
К 9,4 г (0,05 моль) 2-изоамил-2-изопропил-1,3-пропандиола добавляют 50 мл тетрагидрофурана, затем добавляют 12,1 мл (0,15 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 14,5 мл (0,125 моль) бензоилхлорида. Затем реакционную смесь перемешивают при комнатной температуре в течение 1 ч и нагревают с обратным холодильником в течение 4 ч. По завершении реакции добавляют 70 мл воды для растворения полученной соли. Реакционную смесь экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза и сушат над безводным сульфатом натрия. Растворитель удаляют. Перегонка при пониженном давлении дает 2-изоамил-2-изопропил-1,3-пропандиолдибензоат в виде светло-желтой жидкости, и выход составляет 91%.
1Н ЯМР δ (м.д.): 0,88 (д, 6Н, СН3 из изоамила), 1,05 (д, 6Н, СН3 из изопропила), 1,24 (м, 2Н, СН2 из изоамила), 1,27 (м, 2Н, СН2 из изоамила), 1,58 (м, 1Н, СН из изоамила), 2,04 (1Н, м, СН из изопропила), 4,42 (м, 4Н, СН2О из 1,3-пропандиола), 7,38-8,02 (м, 10Н, ArH).
Пример синтеза 64
Синтез 2-изоамил-2-изопропил-1,3-пропандиолди(пара-хлорбензоата)
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной жидкости из 2-изоамил-2-изопропил-1,3-пропандиола и пара-хлорбензоилхлорида с выходом 92%.
1Н ЯМР δ (м.д.): 0,86-0,88 (6Н, д, СН3), 1,01-1,04 (6Н, д, СН3), 1,2-1,3 (4Н, м, СН2), 1,54-1,57 (1Н, м, СН), 2,01-2,04 (1Н, м, СН), 4,3-4,4 (4Н, м, СН2 связанный с радикалом сложного эфира), 7,2-7,9 (8Н, м, ArH).
Пример синтеза 65
Синтез 2-изоамил-2-изопропил-1,3-пропандиолди(пара-метоксибензоата)
К 3,8 г (0,02 моль) 2-изоамил-2-изопропил-1,3-пропандиола, который был получен в соответствии со способом, описанным в примере синтеза 63, добавляют 30 мл тетрагидрофурана, затем добавляют 4,8 мл (0,06 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 6,8 мл (0,04 моль) пара-метоксибензоилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем нагревают с обратным холодильником в течение 5 ч. По завершении реакции добавляют 40 мл воды для растворения полученной соли. Реакционную смесь экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза и сушат над безводным сульфатом натрия. Растворитель удаляют. Перегонка при пониженном давлении дает 2-изоамил-2-изопропил-1,3-пропандиолди(пара-метоксибензоат) в виде бесцветной жидкости, и выход составляет 79%.
1Н ЯМР δ (м.д.): 0,89 (д, 6Н, СН3 из изоамила), 0,98 (д, 6Н, СН3 из изопропила), 1,19 (м, 2Н, СН2 из изоамила), 1,38 (м, 2Н, СН2 из изоамила), 1,49 (м, 1Н, СН из изоамила), 1,89 (м, 1Н, СН из изопропила), 3,84 (с, 6Н, СН3О из бензольного кольца), 4,34 (м, 4Н, СН2О из 1,3-пропандиола), 6,91 (м, 4Н, ArH), 7,96 (м, 4Н, ArH).
Пример синтеза 66
Синтез 2-изоамил-2-изопропил-1,3-пропандиолди(пара-метилбензоата)
Требуемый продукт получают в соответствии с методикой, описанной в примере синтеза 65, за исключением того, что заменяют пара-метилоксибензоилхлорид пара-метилбензоилхлоридом. Выход составляет 88%.
1Н ЯМР δ (м.д.): 0,88 (д, 6Н, СН3 из изоамила), 0,97 (д, 6Н, СН3 из изопропила), 1,21 (м, 2Н, СН2 из изоамила), 1,37 (м, 2Н, СН2 из изоамила), 1,47 (м, 1Н, СН из изоамила), 1,89 (м, 1Н, СН из изопропила), 2,38 (с, 6Н, СН3 из ароматического кольца), 4,36 (м, 4Н, СН2О из 1,3-пропандиола), 7,21 (м, 4Н, ArH), 7,90 (м, 4Н, ArH).
Пример синтеза 67
Синтез 2-изоамил-2-изопропил-1,3-пропандиолмонобензоатмонопропионата
К 7,5 г (0,05 моль) 2-изоамил-2-изопропил-1,3-пропандиола, который был получен в соответствии со способом, описанным в примере синтеза 63, добавляют 50 мл тетрагидрофурана, затем добавляют 4,8 мл (0,06 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 4,6 мл (0,04 моль) бензоилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и нагревают с обратным холодильником в течение 5 ч. По завершении реакции реакционную смесь охлаждают до комнатной температуры. К смеси добавляют 30 мл тетрагидрофурана, затем добавляют 4,8 мл (0,06 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 3,5 мл (0,04 моль) пропионилхлорида. Смесь перемешивают при комнатной температуре в течение 1 ч и нагревают с обратным холодильником в течение 5 ч. По завершении реакции добавляют 40 мл воды для растворения полученной соли. Реакционную смесь экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза и сушат над безводным сульфатом натрия. Растворитель удаляют. Дистилляция при пониженном давлении дает бесцветную жидкость 2-изоамил-2-изопропил-1,3-пропандиолмонобензоатмонопропионата, и выход составляет 91%.
1Н ЯМР δ (м.д.): 0,87 (д, 6Н, СН3 из изоамила), 0,93 (д, 6Н, СН3 из изопропила), 0,99 (т, 2Н, СН2 из пропионила), 1,06 (м, 4Н, СН2 из изоамила), 1,11 (м, 1Н, СН из изоамила), 1,14 (м, 1Н, СН из изопропила), 2,29 (м, 2Н, СН2О из 1,3-пропандиола), 4,28 (м, 2Н, СН2О из 1,3-пропандиола), 4,38 (м, 2Н, СН2 из пропионила), 7,41-8,03 (м, 5Н, ArH).
Пример синтеза 68
Синтез 2-изоамил-2-изопропил-1,3-пропандиолдипропионата
Требуемый продукт получают в соответствии с методикой, описанной в примере синтеза 65, за исключением того, что заменяют пара-метилоксибензоилхлорид пропионилхлоридом. Выход составляет 91%.
1Н ЯМР δ (м.д.): 0,88 (д, 6Н, СН3 из изоамила), 0,93 (д, 6Н, СН3 из изопропила), 1,14 (м, 6Н, СН3 из пропионила), 1,34-1,39 (м, 4Н, СН2 из изоамила), 1,44 (м, 1Н, СН из изоамила), 1,85 (м, 1Н, СН из изопропила), 2,32 (м, 4Н, СН2О из 1,3-пропандиола), 4,07 (м, 4Н, СН2О из пропионила).
Пример синтеза 69
Синтез 2-изоамил-2-изопропил-1,3-пропандициннамата
К 7,5 г (0,04 моль) 2-изоамил-2-изопропил-1,3-пропандиола, который был получен в соответствии со способом, описанным в примере синтеза 63, добавляют 50 мл тетрагидрофурана, затем добавляют 9,7 мл (0,12 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 16,7 г (0,1 моль) циннамоилхлорида. Смесь перемешивают при комнатной температуре в течение 1 ч и нагревают с обратным холодильником в течение 4 ч. По завершении реакции добавляют 50 мл воды для растворения полученной соли. Реакционную смесь экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза и сушат над безводным сульфатом натрия. Растворитель удаляют. Хроматография на колонках дает 2-изоамил-2-изопропил-1,3-пропандиолдициннамат в виде желтой вязкой жидкости, и выход составляет 51%.
1Н ЯМР δ (м.д.): 0,88 (д, 6Н, СН3 из изоамила), 0,99 (д, 6Н, СН3 из изопропила), 1,21 (м, 2Н, СН2 из изоамила), 1,47 (м, 2Н, СН2 из изоамила), 1,51 (м, 1Н, СН из изоамила), 1,96 (м, 1Н, СН из изопропила), 4,26 (м, 4Н, СН2О из 1,3-пропандиола), 6,45 (д, 2Н, СН связанный с карбонилом), 7,26-7,70 (м, 12Н, ArH и =СН-).
Пример синтеза 70
Синтез 2,2-диизобутил-1,3-пропандиолдибензоата
Синтез диэтил-2,2-диизобутилмалоната
В атмосфере азота в реактор вводят 100 мл этанола и 5 г Na. После завершения реакции в реактор добавляют 16 г (0,1 моль) диэтилмалоната и смесь перемешивают при комнатной температуре несколько минут. Затем добавляют 28 г (0,21 моль) изобутилбромида и смесь нагревают с обратным холодильником в течение 6 ч. К реакционной смеси добавляют 7,5 г (0,12 моль) этилата натрия, с последующим добавлением 14 г (0,1 моль) изобутилбромида и реакционную смесь нагревают с обратным холодильником в течение 8 ч. По завершении реакции большую часть растворителя удаляют перегонкой при пониженном давлении. Остаток экстрагируют гексаном. После удаления гексана перегонка при пониженном давлении дает диэтил-2,2-диизобутилмалонат, точка кипения составляет 145-146°C/20 мм рт.ст.
(2) Синтез 2,2-диизобутил-1,3-пропандиола
К 3 г (0,079 моль) LiAlH4 добавляют 100 мл этилового эфира, затем добавляют 15,5 г (0,057 моль) диэтил-2,2-диизобутилмалоната по каплям при интенсивном перемешивании. Реакционную смесь нагревают с обратным холодильником в течение 5 ч, затем выливают на 100 г льда, который был подкислен разбавленной хлористоводородной кислотой. Смесь экстрагируют этиловым эфиром. После удаления этилового эфира из экстракта, 2,2-диизобутил-1,3-пропандиол перекристаллизовывают в виде белого твердого вещества из гексана, и выход составляет 78%, температура плавления составляет 75-77°C.
(3) Синтез 2,2-диизобутил-1,3-пропандиолдибензоата
К 7,5 г (0,04 моль)2,2-диизобутил-1,3-пропандиола добавляют 50 мл тетрагидрофурана, затем добавляют 9,7 мл (0,12 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 11,6 мл (0,1 моль) бензоилхлорида. Смесь перемешивают при комнатной температуре в течение 1 ч и нагревают с обратным холодильником в течение 5 ч. По завершении реакции добавляют 40 мл воды для растворения твердого вещества. Смесь экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза и сушат над безводным сульфатом натрия. Растворитель удаляют. Дистилляция при пониженном давлении дает 2,2-диизобутил-1,3-пропандиолдибензоат в виде светло-желтой жидкости, выход составляет 93%.
1Н ЯМР δ (м.д.): 0,91 (д, 12Н, СН3), 1,21 (д, 4Н, СН2 из изобутила), 2,05 (т, 2Н, СНиз изобутила), 4,43 (м, 4Н, СН2О из 1,3-пропандиола), 7,40-8,05 (м, 10Н, ArH).
Пример синтеза 71
Синтез 3-метил-1-трифторметил-2,4-пентандиолдибензоата
Способ синтеза идентичен способу в примере синтеза 2, и 4,3 г требуемого продукта получают из 3-метил-1-трифторметил-2,4-пентандиола (3,4 г), бензоилхлорида (4 г), пиридина (4,5 г) и тетрагидрофурана (70 мл).
1Н ЯМР δ (м.д.): 1,4 (6Н), 2,2-2,4 (2Н), 5,1-2,6 (1Н), 5,8 (1Н), 7,3-7,9 (10Н).
Пример синтеза 72
Синтез 1,1,1-трифтор-3-метил-2,4-пентандиолдибензоата
Способ синтеза идентичен способу в примере синтеза 2, и 5,2 г требуемого продукта получают из 1,1,1-трифтор-3-метил-2,4-пентандиола (3,8 г), бензоилхлорида (4,5 г), пиридина (4,5 г) и тетрагидрофурана (70 мл).
1Н ЯМР δ (м.д.): 1,4 (3Н), 2,2-2,4 (2Н), 5,3-5,7 (2Н), 5,8 (1Н), 7,3-7,9 (10Н).
Пример синтеза 73
Синтез 2,4-пентандиолди(пара-фторметилбензоата)
Способ синтеза идентичен способу в примере синтеза 2, и 3,5 г требуемого продукта получают из 2,4-пентандиола (2,1 г), пара-фторметилбензоилхлорида (9,2 г), пиридина (6 г) и тетрагидрофурана (70 мл).
1Н ЯМР δ (м.д.): 1,4 (6Н), 1,9-2,2 (2Н), 5,3-5,4 (2Н), 7,4-8,2 (8Н).
Пример синтеза 74
Синтез 2,2'-бифенилдиметанолдипивалата
В соответствии с методикой, описанной в примере синтеза 16, требуемый продукт в виде бесцветной вязкой жидкости получают из 2,2'-бифенилдиметанола и пивалоилхлорида с выходом 93%.
1Н ЯМР δ (м.д.): 1,1-1,2 (18Н, с, СН3), 4,84-4,86 (4Н, д, СН2 связанный с радикалом сложного эфира), 7,3-7,4 (8Н, м, ArH).
Пример синтеза 75
Синтез 3,6-диметил-2,4-гептандиолдибензоата
(1) Синтез 3,6-диметил-2,4-гептандиона
К 0,1 моль гидрида натрия добавляют 100 мл безводного тетрагидрофурана, затем медленно по каплям добавляют 0,1 моль 6-метил-2,4-гептандиона при комнатной температуре. Реакционную смесь перемешивают в течение 0,5 ч, затем по каплям добавляют 0,12 моль иодметана и реакционную смесь перемешивают при комнатной температуре еще 10 ч. По завершении реакции добавляют 20 мл воды. Смесь экстрагируют этилацетатом. После удаления растворителя перегонка при пониженном давлении дает отобранную фракцию 88-90°C/1 кПа (165-166°C при атмосферном давлении), и выход составляет 94%.
(2) Синтез 3,6-диметил-2,4-гептандиола
К смеси 2,5 г боргидрида натрия, 0,05 г гидроксида натрия и 25 мл воды добавляют по каплям смесь 14,2 г 3,6-диметил-2,4-гептандиона и 30 мл метанола при 0-10°C. При завершении добавления растворитель удаляют перегонкой при пониженном давлении. Реакционную смесь непрерывно экстрагируют с использованием 40 мл этилацетата в течение 15 ч. Растворитель удаляют. Перегонка при пониженном давлении дает бесцветную жидкость 3,6-диметил-2,4-гептандиола, и выход составляет 90%. ИК-спектр имеет пик сильного поглощения при 3400 см-1 и не имеет пика поглощения при примерно 1700 см-1. Это показывает, что реакция восстановления прошла полностью.
(3) Синтез 3,6-диметил-2,4-гептандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной жидкости из 3,6-диметил-2,4-гептандиола с выходом 88%.
Пример синтеза 76
Синтез 2,2,6,6-тетраметил-3,5-гептандиолдибензоата
Требуемый продукт получают в соответствии со способом синтеза, аналогичным способу, описанному в примере синтеза 48.
1Н ЯМР δ (м.д.): 8,0 (10Н, ArH), 5,3 (2Н, СН), 2,0 (2Н, СН2), 1,3 (1Н, СН3).
Пример синтеза 77
Синтез 2,3-диизопропил-1,4-бутандиолдибензоата
(1) Синтез 2,3-диизопропил-1,4-бутандиола
Смесь 5,1 г LiAlH4 и 120 мл этилового эфира охлаждают до 0°C, затем при данной температуре по каплям добавляют раствор 11 г диэтил-2,3-диизопропил-1,4-сукцината и 60 мл этилового эфира. По завершении добавления смесь нагревают с обратным холодильником в течение 1 ч. Затем реакционную смесь снова охлаждают до 0°C и по каплям добавляют 5 мл 15% раствора гидроксида натрия и 20 мл воды. Смесь нагревают до комнатной температуры и дают протекать реакции в течение 0,5 ч. Реакционную смесь фильтруют и фильтрат промывают, сушат, концентрируют и подвергают дистилляции при пониженном давлении с получением 8,4 г продукта с выходом 76%. Точка кипения составляет 118°C/0,1 мм рт.ст.
1Н ЯМР δ (м.д.): 0,9 (14Н), 1,4 (2Н), 1,9 (4Н), 3,7 (2Н).
(2) Синтез 2,3-диизопропил-1,4-бутандиолдибензоата
Смешивают 7,7 г 2,3-диизопропил-1,4-бутандиола и 100 мл тетрагидрофурана и к смеси добавляют 12,5 г бензоилхлорида и 14 г пиридина. Смесь нагревают с обратным холодильником в течение 4 ч. По завершении реакции добавляют воду для растворения твердого вещества. Органическую фазу отделяют, промывают, сушат и концентрируют с получением 13,9 г продукта, и выход составляет 87%.
1Н ЯМР δ (м.д.): 1,2-1,4 (14Н), 2,0-2,2 (2Н), 4,4-4,6 (4Н), 7,3-8,2 (10Н).
Пример синтеза 78
Синтез 2,3-диметил-1,4-бутандиолдибензоата
В соответствии со способами синтеза, описанными в примере синтеза 77, синтезируют следующие вещества:
(1) 2,3-диметил-1,4-бутандиол
Точка кипения составляет 95°C/0,1 мм рт.ст.
1Н ЯМР δ (м.д.): 0,7-1,8 (8Н), 3,2-3,8 (4Н), 4,8 (2Н).
(2) 2,3-диметил-1,4-бутандиолдибензоат
1Н ЯМР δ (м.д.): 1,1-1,6 (8Н), 5,0-5,5 (4Н), 7,3-8,2 (10Н).
Пример синтеза 79
Синтез 2,2'-дифенолдибензоата
Требуемый продукт синтезируют в соответствии со способом, описанным в примере синтеза 77.
1Н ЯМР δ (м.д.): 7,2-8,0 (18Н).
Пример синтеза 80
Синтез дибензоата фталилового спирта
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 17, и требуемый продукт получают в виде белых твердых хлопьев из 1,2-ксилендиола с выходом 95%. Температура плавления составляет 65-66°C.
1Н ЯМР δ (м.д.): 5,5 (4Н, с, СН2 связанный с радикалом сложного эфира), 7,3-8,0 (10Н, м, ArH).
Пример синтеза 81
Синтез 2,5-гександиолдибензоата
К 2,4 г (0,02 моль) 2,5-гександиола добавляют 30 мл тетрагидрофурана, затем добавляют 4,8 мл (0,06 моль) пиридина при перемешивании. К полученной гомогенной смеси медленно добавляют 5,8 мл (0,05 моль) бензоилхлорида и смесь перемешивают в течение 1 ч при комнатной температуре, затем нагревают с обратным холодильником в течение 5 ч. После завершения реакции добавляют 20 мл воды для растворения полученной соли. Смесь экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным солевым раствором два раза и сушат над безводным сульфатом натрия. Растворитель удаляют. Перегонка при пониженном давлении дает бесцветную жидкость 2,5-гександиолдибензоат, и выход составляет 94%.
1Н ЯМР δ (м.д.): 1,36 (д, 6Н, СН3), 1,86 (м, 4Н, СН2), 5,21 (м, 2Н, СН), 7,40-8,16 (м, 10Н, ArH).
Пример синтеза 82
Синтез 2,5-диметил-2,5-гександиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной вязкой жидкости из 2,5-диметил-2,5-гександиола с выходом 93%.
1Н ЯМР δ (м.д.): 1,6 (12Н, с, СН3), 2,0 (4Н, с, СН2), 7,4-8,0 (10Н, м, ArH).
Пример синтеза 83
Синтез 2,5-диметил-2,5-гександиолдипропионата
Повторяют методику примера синтеза 82, за исключением того, что заменяют бензоилхлорид пропионилхлоридом. Требуемый продукт получают в виде бесцветной вязкой жидкости с выходом 94%.
1Н ЯМР δ (м.д.): 1,07-1,11 (6Н, т, СН3 из пропионилокси), 1,4 (12Н, с, СН3), 1,8 (4Н, с, СН2), 2,23-2,25 (4Н, м, СН2 из пропионилокси).
Пример синтеза 84
Синтез 2,5-диметил-гекса-3-ин-2,5-диолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной вязкой жидкости из 2,5-диметил-гекса-3-ин-2,5-диола с выходом 93%.
1Н ЯМР δ (м.д.): 1,7 (12Н, с, СН3), 7,4-8,0 (10Н, м, ArH).
Пример синтеза 85
Синтез 2,2-диметил-1,5-пентандиолдибензоата
(1) Синтез диэтил-2,2-диметилглутарата
К 0,1 моль 2,2-диметилглутаровой кислоты добавляют 0,3 моль этанола, 40 мл толуола и 0,4 мл концентрированной серной кислоты при перемешивании. Смесь нагревают с обратным холодильником и получаемую воду удаляют с использованием сепаратора воды до тех пор, пока количество отделенной воды не достигнет теоретического значения. Смесь нейтрализуют насыщенным раствором карбоната натрия и экстрагируют этилацетатом. Раствор верхнего слоя отделяют, промывают насыщенным солевым раствором до нейтральности и сушат над безводным сульфатом натрия. После удаления растворителя перегонка при пониженном давлении дает диэтил-2,2-диметилглутарат в виде бесцветной жидкости, и выход составляет 90%.
1Н ЯМР δ (м.д.): 1,18 (6Н, с, СН3), 1,23-1,27 (6Н, т, СН3 из этила), 1,7-1,8 (2Н, т, СН2), 2,25-2,29 (2Н, т, СН2), 4,0-4,1 (4Н, м, СН2 из этила).
(2) Синтез 2,2-диметилпентандиола
0,05 г охлажденного на бане со льдом диэтил-2,2-диметилглутарата при интенсивном перемешивании добавляют медленно по каплям к смеси 3 г LiAlH4 и 100 мл безводного этилового эфира. Смесь нагревают с обратным холодильником в течение 5 ч, затем охлаждают. Избыток LiAlH4 разлагают водой. После фильтрования фильтрат экстрагируют этиловым эфиром, а экстракт сушат над безводным сульфатом натрия. Растворитель удаляют. Хроматография на колонках дает 2,2-диметилпентандиол в виде бесцветной жидкости, и выход составляет 75%. ИК-спектр имеет пик сильного поглощения при 3400 см-1 и не имеет пика поглощения при примерно 1700 см-1. Это показывает, что реакция восстановления прошла полностью.
(3) Синтез 2,2-диметил-1,5-пентандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной вязкой жидкости из 2,5-диметилпентиандиола с выходом 93%.
1Н ЯМР δ (м.д.): 1,0 (6Н, с, СН3), 1,3-1,4 (2Н, т, СН2), 1,6-1,7 (2Н, м, СН2), 4,0-4,3 (4Н, м, СН2 связанный с радикалом сложного эфира), 7,4-8,1 (10Н, м, ArH).
Пример синтеза 86
Синтез 1,1-бис(бензоилоксиэтил)циклогексана
(1) Синтез 1,1-бис((этилоксикарбонил)метил)циклогексана
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 85 (1), и 1,1-бис((этилоксикарбонил)метил)циклогексан получают в виде бесцветной жидкости из циклогексан-1,1-диуксусной кислоты с выходом 90%.
1Н ЯМР δ (м.д.): 1,12-1,13 (6Н, т, СН3), 1,3-1,4 (10Н, м, СН2 из циклогексана), 2,48 (4Н, с, СН2), 4,0-4,1 (4Н, м, СН2 из этила).
(2) Синтез циклогексан-1,1-диэтанола
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 85 (2), и циклогексан-1,1-диэтанол получают в виде бесцветной вязкой жидкости из 1,1-бис((этилоксикарбонил)метил)циклогексана с выходом 75%. ИК-спектр имеет пик сильного поглощения -ОН при 3400 см-1 и не имеет пика поглощения -СО- при примерно 1700 см-1. Это показывает, что реакция восстановления прошла полностью.
(3) Синтез 1,1-бис(бензоилоксиэтил)циклогексана
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 85 (3), и требуемый продукт получают в виде бесцветной вязкой жидкости из циклогексан-1,1-диэтанола с выходом 93%.
1Н ЯМР δ (м.д.): 1,2-1,4 (6Н, м, СН2 из циклогексана), 1,4-1,5 (4Н, т, СН2 из циклогексана), 2,0-2,1 (4Н, т, СН2), 4,1-4,4 (4Н, м, СН2 связанный с радикалом сложного эфира), 7,4-8,1 (10Н, м, ArH).
Пример синтеза 87
Синтез 1,5-дифенил-1,5-пентандиолдибензоата
(1) Синтез 1,5-дифенил-1,5-пентандиола
0,05 г 1,5-дифенил-1,5-пентандиона при охлаждении на бане со льдом и интенсивном перемешивании добавляют медленно по каплям к смеси 3 г LiAlH4 и 100 мл безводного тетрагидрофурана. Смесь нагревают с обратным холодильником в течение 5 ч, затем охлаждают. Избыток LiAlH4 разлагают водой. После полного смешения реакционной смеси с этилацетатом смесь фильтруют и фильтрат сушат над безводным сульфатом натрия. Растворитель удаляют. Хроматография на колонках дает 1,5-дифенил-1,5-пентандиол в виде белого твердого вещества, и выход составляет 85%. Температура плавления составляет 64-67°C. ИК-спектр имеет пик сильного поглощения -ОН при 3400 см-1 и не имеет пика поглощения -СО- при примерно 1700 см-1. Это показывает, что реакция восстановления прошла полностью.
(2) Синтез 1,5-дифенил-1,5-пентандиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной вязкой жидкости из 1,5-дифенил-1,5-пентандиола с выходом 93%.
1Н ЯМР δ (м.д.): 1,3-1,5 (2Н, с, СН2), 1,9-2,1 (4Н, м, СН2), 5,94-5,97 (2Н, т, СН2 связанный с радикалом сложного эфира), 7,2-8,0 (20Н, м, ArH).
Пример синтеза 88
Синтез 1,5-дифенил-1,5-пентандиолдипропионата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 16, и требуемый продукт получают в виде бесцветной вязкой жидкости из 1,5-дифенил-1,5-пентандиола и пропионилхлорида с выходом 94%.
1Н ЯМР δ (м.д.): 1,0-1,1 (6Н, м, СН3), 1,2-1,3 (2Н, м, СН2), 1,7-1,9 (4Н, м, СН2), 2,2-2,3 (4Н, м, СН2 из пропила), 5,6-5,7 (2Н, т, СН2 связанный с радикалом сложного эфира), 7,2-7,8 (10Н, м, ArH).
Пример синтеза 89
Синтез бис(2-бензоилоксинафтил)метана
Требуемый продукт получают способом синтеза, аналогичным способу синтеза, описанному в примере синтеза 77.
1Н ЯМР δ (м.д.): 3,7-3,9 (2Н), 6,8-8,1 (22Н).
Пример синтеза 90
Синтез 3,4-дибутил-1,6-гександиолдибензоата
Методика синтеза аналогична методике синтеза, описанной в примере синтеза 2, и 4,3 г продукта получают из 3,4-дибутил-1,6-гександиола (4,4 г), бензоилхлорида (3,8 г), пиридина (4,0 г) и тетрагидрофурана (70 мл).
1Н ЯМР δ (м.д.): 0,8-1,6 (18Н), 2,1-2,3 (6Н), 4,3-4,5 (4Н), 7,4-8,1 (10Н).
Примеры катализаторов 1-90
Получение твердых каталитических компонентов
В реактор, полностью заполненный высокочистым N2, вводят последовательно 4,8 г хлорида магния, 95 мл толуола, 4 мл эпоксихлорпропана и 12,5 мл трибутилфосфата. Смесь нагревают до 50°C при перемешивании и выдерживают при данной температуре в течение 2,5 ч для полного растворения твердого вещества, затем добавляют 1,4 г фталевого ангидрида и выдерживают при указанной температуре в течение еще одного часа. Раствор охлаждают до температуры ниже -25°C и добавляют по каплям 56 мл TiCl4 в течение 1 ч, затем медленно нагревают до 80°C. В процессе нагревания твердое вещество постепенно осаждается. В систему вводят 6 ммоль соединений - сложных эфиров, синтезированных в примерах синтеза 1-90, соответственно, и реакционную смесь выдерживают при указанной температуре при перемешивании в течение еще одного часа. После удаления надосадочного слоя к остатку добавляют 70 мл толуола и надосадочный слой снова удаляют после полного смешения. Операцию промывки повторяют дважды. Полученный твердый осадок обрабатывают с использованием 60 мл толуола и 40 мл TiCl4 при 100°C в течение 2 ч, и после удаления надосадочного слоя остаток снова обрабатывают с использованием 60 мл толуола и 40 мл TiCl4 при 100°C в течение 2 ч. После удаления надосадочного слоя остаток промывают три раза 60 мл толуола в состоянии кипения, два раза 60 мл гексана в состоянии кипения, два раза 60 мл гексана при нормальной температуре с получением твердого каталитического компонента примеров катализаторов 1-90, соответственно.
Сравнительные примеры 1-3
Повторяют методику получения твердого каталитического компонента, описанную в примерах катализаторов 1-90, за исключением того, что соединение - внутренний донор электронов замяют ди-н-бутилфталатом, 9,9-ди(метоксиметил)флуореном и диэтил-2,3-диизопропилсукцинатом, соответственно.
Пример катализатора 91
100 мл TiCl4 вводят в реактор, полностью заполненный высокочистым N2, и охлаждают до -20°C, затем вводят 7,0 г сферического носителя MgCl2·2,6 CH3CH2OH (способ получения аналогичен способу получения, рассмотренному в примере 2 USP 4399054, за исключением того, что операцию осуществляют при 2800 об/мин, а не при 10000 об/мин). Реакционную смесь нагревают до 0°C в течение 1 ч, непрерывно нагревают до 20°C в течение 2 ч и непрерывно нагревают до 40°C в течение 1 ч. Затем добавляют 1,6 г 9,9-бис(бензоилоксиметил)флуорена, который был синтезирован в примере синтеза 57, и реакционную смесь нагревают до 100°C в течение 1 ч и выдерживают при данной температуре в течение 2 ч. После удаления надосадочного слоя вводят 100 мл TiCl4 и смесь нагревают до 120°C в течение 1 ч и выдерживают при данной температуре в течение 2 ч. После удаления надосадочного слоя остаток промывают 60 мл гексана в состоянии кипения 5 раз и 60 мл гексана при нормальной температуре 3 раза с получением 4,9 г сферического каталитического компонента.
Пример катализатора 92
Методика получения сферического каталитического компонента является идентичной методике, описанной в примере катализатора 91, за исключением того, что введенное соединение сложного эфира полиола заменяют на 1,7 г 2-изоамил-2-изопропил-1,3-пропиленгликольдибензоата, полученного в примере синтеза 63. Получают 5,1 г сферического каталитического компонента.
Эксперименты по проведению полимеризации пропилена
Каталитические компоненты, полученные в примерах катализаторов 1-92, соответственно, используют для полимеризации пропилена. Методика полимеризации является следующей: в 5 л автоклав из нержавеющей стали, заполненный полностью газообразным пропиленом, вводят 2,5 ммоль AlEt3, 0,1 ммоль циклогексилметилдиметоксисилана (CHMMS), около 10 мг твердого каталитического компонента, полученного в примерах катализаторов 1-92, и 1,2 л водорода с последующим введением 2,3 л жидкого пропилена. Реактор нагревают до 70°C и полимеризацию проводят при данной температуре и аутогенном давлении в течение одного часа. После снижения температуры и сброса давления удаляют порошок полипропилена. Результаты полимеризации обобщены в таблице 1.
Твердые каталитические компоненты сравнительных примеров 1, 2 и 3, соответственно, используют для полимеризации пропилена в соответствии с вышеуказанной методикой полимеризации. Результаты полимеризации обобщены в таблице 2.
Результаты полимеризации пропилена с твердыми каталитическими компонентами настоящего изобретения
(мас.%)
Результаты полимеризации пропилена с твердыми каталитическими компонентами сравнительных примеров
Полимеризация пропилена в отсутствии внешнего донора электронов
В соответствии с вышеуказанной методикой полимеризации, но в отсутствие внешнего донора электронов твердые каталитические компоненты, полученные в примерах катализаторов 5, 24, 57, 63 и в сравнительном примере 3, используют, соответственно, для полимеризации пропилена. Результаты полимеризации и результаты полимеризации, полученные в присутствии внешнего донора электронов, сравниваются в таблице 3.
Сравнение результатов полимеризации в присутствии и в отсутствии внешнего донора электронов
Из приведенных в таблице 3 результатов можно видеть, что в отсутствие внешнего донора электронов полимеры, полученные при использовании твердых каталитических компонентов изобретения, все еще имеют высокую стереорегулярность, и активность полимеризации выше, чем активность полимеризации, полученная в присутствии внешнего донора электронов. Однако полимеры, полученные при использовании катализатора, известного в технике (сравнительный пример 3), в отсутствие внешнего доноров электронов имеют низкую стереорегулярность.
Пример катализатора 93
Твердый каталитический компонент получают в соответствии с методикой, описанной в примерах катализаторов 1-90, за исключением того, что внешний донор электронов заменяют комбинацией 3 ммоль ди-н-бутилфталата и 3 ммоль 2-изоамил-2-изо-пропил-1,3-пропиленгликольдибензоата.
Каталитический компонент используют в полимеризации пропилена в таких же условиях, как в примерах 1-90, за исключением того, что количество водорода изменяют на 2,0 л. Активность полимеризации составляет 34,1 кг ПП /г кат., и молекулярно-массовое распределение (ММР) полимеров составляет 8,6.
Пример катализатора 94
Твердый каталитический компонент получают в соответствии с методикой, описанной в примерах катализаторов 1-90, за исключением того, что внешний донор электронов заменяют комбинацией 3 ммоль 2-изоамил-2-изопропил-1,3-пропиленгликольдибензоата и 3 ммоль 9,9-ди(метилметокси)флуорена.
Каталитический компонент используют в полимеризации пропилена в таких же условиях, как в примерах 1-90, за исключением того, что количество водорода изменяют на 2,0 л. Активность полимеризации составляет 58,7 кг ПП/г кат., и молекулярно-массовое распределение (ММР) полимеров составляет 7,1.
Пример катализатора 95
В реактор, полностью заполненный высокочистым N2, вводят последовательно 4,8 г хлорида магния, 95 мл толуола, 4 мл эпоксихлорпропана и 12,5 мл трибутилфосфата. Смесь нагревают до 50°C при перемешивании и выдерживают при данной температуре в течение 2,5 ч для полного растворения твердого вещества, затем добавляют 1,4 г фталевого ангидрида и выдерживают при указанной температуре в течение еще одного часа. Раствор охлаждают до температуры ниже -25°C и добавляют по каплям 56 мл TiCl4 в течение 1 ч, затем медленно нагревают до 80°C. В процессе нагревания постепенно осаждается твердое вещество. В систему вводят 4 ммоль 9,9-бис(бензоилоксиметил)флуорена и реакционную смесь выдерживают при указанной температуре при перемешивании в течение еще одного часа. После удаления надосадочного слоя к остатку добавляют 70 мл толуола и надосадочный слой снова удаляют после полного смешения. Операцию промывки повторяют дважды. Полученный твердый осадок обрабатывают с использованием 60 мл толуола и 40 мл TiCl4 при 110°C в течение 0,5 ч. Операцию обработки TiCl4 повторяют три раза. После удаления надосадочного слоя остаток промывают три раза 60 мл толуола в состоянии кипения, два раза 60 мл гексана в состоянии кипения, два раза 60 мл гексана при нормальной температуре с получением 6,0 г твердого каталитического компонента.
Твердый каталитический компонент используют для полимеризации пропилена в таких же условиях, как в примерах катализаторов 1-90. Активность полимеризации составляет 52,7 кгПП/г катализатора, и стереорегулярность полимера составляет 98,5%.
Пример катализатора 96
Методики получения твердого каталитического компонента и полимеризации пропилена идентичны методике, описанной в примере катализатора 95, за исключением того, что 9,9-бис(бензоилоксиметил)флуорен заменяют 2-изоамил-2-изопропил-1,3-пропиленгликольдибензоатом. Активность полимеризации составляет 47,5 кгПП/г катализатора, и стереорегулярность полимера составляет 98,1%.
Примеры катализаторов 97-104
Твердый каталитический компонент, полученный в примере 96, используют для полимеризации пропилена в условиях примеров катализаторов 1-90, за исключением того, что CHMMS заменяют различными внешними донорами электронов. Результаты представлены в таблице 4.
Результаты полимеризации пропилена с использованием различных внешних доноров электронов
В таблице:
CHMMS - циклогексилметилдиметоксисилан.
МРТ - метил-пара-метилбензоат.
DIBS - диизобутилдиметоксисилан.
DIPS - диизопропилдиметоксисилан.
PPDE - 2-изоамил-2-изопропил-1,3-диметоксипропан.
DCPMS - дициклопентилдиметоксисилан.
PPDB - 2-изоамил-2-изопропил-1,3-дибензоилоксипропан.
Примеры катализаторов 105 и 106 и сравнительные примеры 4 и 5
В примерах катализаторов 105 и 106 и в сравнительных примерах 4 и 5 твердые каталитические компоненты, полученные в примерах катализаторов 95 и 96 и в сравнительных примерах 1 и 2, используют для полимеризации этилена, соответственно.
Методика полимеризации этилена является следующей: в 2 л автоклав из нержавеющей стали, который несколько раз был эвакуирован и заполнен высокочистым водородом, вводят 1 л гексана, подходящее количество твердого каталитического компонента и 2,5 ммоль сокатализатора AlEt3 в азотной атмосфере при перемешивании. Реактор нагревают до 75°C, вводят подходящее количество высокочистого водорода, так чтобы фракционное давление водорода в автоклаве составило 0,28 МПа, затем вводят газообразный этилен, так чтобы его фракционное давление составило 0,75 МПа. Реакцию полимеризации проводят в течение 2 ч при постоянной температуре 85°C и вводят этилен в процессе полимеризации для поддержания фракционного давления этилена неизменным. Затем температуру автоклава снижают, давление сбрасывают и продукт выгружают. После удаления растворителя полимер сушат полностью и взвешивают и определяют характеристики. Результаты полимеризации этилена приведены в таблице 5.
Результаты полимеризации этилена
Из приведенных в таблице 5 результатов можно видеть, что удовлетворительная активность полимеризации может быть достигнута при использовании твердых каталитических компонентов настоящего изобретения в комбинации с алкилалюминием, морфология частиц полимеров является хорошей и водородная чувствительность катализатора также является хорошей.
Примеры катализаторов 107-110 и сравнительные примеры 6-9
В примерах катализаторов 107-110 и в сравнительных примерах 6-9 для сополимеризации этилена и пропилена используют твердые каталитические компоненты, полученные в примерах катализаторов 95 и 96 и в сравнительном примере 1.
Методика сополимеризации:
В 2 л автоклав из нержавеющей стали, который был несколько раз эвакуирован и заполнен пропорциональной газообразной смесью этилена и пропилена (объемное соотношение этилена и пропилена 1:3), вводят 1 л гексана, подходящее количество твердого каталитического компонента и 2,5 ммоль сокатализатора AlEt3 в азотной атмосфере при перемешивании. Внешний донор электронов CHMMS вводят или не вводят в автоклав. В автоклав вводят подходящее количество высокочистого водорода, так чтобы фракционное давление водорода в автоклаве составило 0,035 МПа, нагревают и непрерывно подают газообразную смесь так, что, когда температура в системе достигает заданной температуры 60°C, давление в системе составляет 0,30 МПа. Давление и температура в системе поддерживаются постоянными, и полимеризация продолжается в течение 0,5 ч. Затем температуру автоклава снижают и продукт выгружают. Нерастворимое вещество отделяют от твердого вещества и полимер полностью высушивают и взвешивают. Результаты приведены в таблице 6.
Результаты сополимеризации этилена и пропилена
Из приведенных в таблице 6 результатов можно видеть, что при использовании твердых каталитических компонентов изобретения в сополимеризации этилена и пропилена может быть достигнуто меньшее содержание геля. Это показывает, что твердые каталитические компоненты изобретения имеют лучшие свойства в отношении сополимеризации.
Хотя настоящее изобретение описано в связи с определенными вариантами и примерами, для специалистов в данной области техники из данного описания будут очевидны другие модификации и альтернативные варианты различных аспектов изобретения. Соответственно, данное описание построено только иллюстративно и в целях указания общего пути осуществления изобретения. Кроме того, все приведенные документы полностью введены в данное описание посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОНЕНТ КАТАЛИЗАТОРА РЕАКЦИИ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ И КАТАЛИЗАТОР, ВКЛЮЧАЮЩИЙ УКАЗАННЫЙ КОМПОНЕНТ | 2011 |
|
RU2586114C2 |
| СФЕРИЧЕСКИЕ НОСИТЕЛИ ДЛЯ КАТАЛИЗАТОРА ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ, КОМПОНЕНТЫ КАТАЛИЗАТОРА, КАТАЛИЗАТОР И МЕТОДЫ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2668082C2 |
| КОМПОНЕНТ КАТАЛИЗАТОРА, ПРИМЕНЯЕМЫЙ ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И КАТАЛИЗАТОР, СОДЕРЖАЩИЙ ТАКОЙ КОМПОНЕНТ | 2010 |
|
RU2532543C2 |
| КОМПОНЕНТ КАТАЛИЗАТОРА ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНА, КАТАЛИЗАТОР И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2757372C2 |
| КАТАЛИТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНА, И ЕЕ ПРИМЕНЕНИЕ | 2014 |
|
RU2715995C2 |
| КОМПОНЕНТ КАТАЛИЗАТОРА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ПОЛИМЕРИЗАЦИИ ПРОПЕНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩИЙ ЕГО КАТАЛИЗАТОР | 2015 |
|
RU2690192C2 |
| НОСИТЕЛЬ КАТАЛИЗАТОРА ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ, ТВЕРДЫЙ КОМПОНЕНТ КАТАЛИЗАТОРА И КАТАЛИЗАТОР | 2011 |
|
RU2586684C2 |
| КОМПОНЕНТ КАТАЛИЗАТОРА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНА, И СОДЕРЖАЩИЙ ЕГО КАТАЛИЗАТОР | 2015 |
|
RU2688689C2 |
| ЭФИРЫ КРЕМНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2375370C2 |
| КОМПОНЕНТ КАТАЛИЗАТОРА ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И КАТАЛИЗАТОР, СОДЕРЖАЩИЙ ТАКОВОЙ | 2014 |
|
RU2674026C2 |
Настоящее изобретение предлагает твердый каталитический компонент для полимеризации олефинов, содержащий магний, титан, галоген и донор электронов, где указанный донор электронов содержит, по меньшей мере, одно соединение - сложный эфир полиола формулы (I):
R1CO-O-CR3R4-A-CR5R6-O-CO-R2 (I), в которой группы R1 и R2, которые могут быть одинаковыми или различными, могут быть замещенным или незамещенным углеводородом, содержащим 1-20 углеродных атомов, группы R3-R6, которые могут быть одинаковыми или различными, могут быть выбраны из группы, состоящей из водорода, галогена и замещенного или незамещенного углеводорода, содержащего 1-20 углеродных атомов, причем группы R1-R6 необязательно содержат один или несколько гетероатомов, заменяющих атом углерода, атом водорода или оба этих атома, причем указанный гетероатом выбран из группы, состоящей из атома кислорода и атома галогена, две или более групп R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического кольца; А представляет собой двухвалентную соединительную группу с длиной цепи между двумя свободными радикалами в 1-10 атомов, где указанная соединительная группа выбрана из группы, состоящей из алифатических, алициклических и ароматических двухвалентных радикалов, и может нести C1-С20 линейные или разветвленные заместители; один или несколько углеродных атомов и/или водородных атомов на вышеуказанной двухвалентной соединительной группе и заместителях могут быть заменены на гетероатом, выбранный из группы, состоящей из атома азота, атома кислорода и атома галогена, и два или более указанных заместителей на соединительной группе, а также вышеуказанные группы R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического кольца; катализатор, содержащий твердый каталитический компонент и к его использованию в полимеризации СН2=CHR, где R представляет водород или C1-С6-алкильную группу. Технический результат - полимеры имеют высокую стереорегулярность и высокий выход полимеризации. 4 н. и 30 з.п. ф-лы, 6 табл.
R1CO-O-CR3R4-A-CR5R6-O-CO-R2,(I)
где группы R1 и R2, которые могут быть одинаковыми или различными, могут быть замещенным или незамещенным гидрокарбилом, содержащим 1-20 углеродных атомов; группы R3-R6, которые могут быть одинаковыми или различными, могут быть выбраны из группы, состоящей из водорода, галогена и замещенного или незамещенного гидрокарбила, содержащего 1-20 углеродных атомов,
причем группы R1-R6 необязательно содержат один или несколько гетероатомов, заменяющих атом углерода, атом водорода или оба этих атома, причем указанный гетероатом выбран из группы, состоящей из атома кислорода и атома галогена,
две или более групп R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического кольца;
А представляет собой двухвалентную соединительную группу с длиной цепи между двумя свободными радикалами в 1-10 атомов, где указанная соединительная группа выбрана из группы, состоящей из алифатических, алициклических и ароматических двухвалентных радикалов, и может нести C1-C10 линейные или разветвленные заместители; один или несколько углеродных атомов и/или водородных атомов на вышеуказанной двухвалентной соединительной группе и заместителях могут быть заменены на гетероатом, выбранный из группы, состоящей из атома азота, атома кислорода и атома галогена, и два или более указанных заместителей на соединительной группе, а также вышеуказанные группы R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического кольца.
R1CO-O-CR3R4-B-CR5R6-O-CO-R2, (II)
где R1-R6 имеют значения, определенные для формулы (I),
В представляет собой двухвалентную соединительную группу с длиной цепи между двумя свободными радикалами в 1-10 атомов, где указанная соединительная группа выбрана из группы, состоящей из алифатических, алициклических и ароматических двухвалентных радикалов, и может нести C1-C20 линейные или разветвленные заместители; один или несколько углеродных атомов и/или водородных атомов на заместителях могут быть заменены на гетероатом, выбранный из группы, состоящей из атома азота, атома кислорода и атома галогена, и два или более указанных заместителей на соединительной группе, а также вышеуказанные группы R3-R6 могут быть соединены с образованием насыщенного или ненасыщенного моноциклического кольца.
1,3-пропиленгликольдибензоат,
2-метил-1,3-пропиленгликольдибензоат,
2-этил-1,3-пропиленгликольдибензоат,
2-пропил-1,3-пропиленгликольдибензоат,
2-бутил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-пропиленгликольдибензоат,
(R)-1-фенил-1,3-пропиленгликольдибензоат,
(S)-1-фенил-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдибензоат,
2-метил-1,3-дифенил-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдипропионат,
2-метил-1,3-дифенил-1,3-пропиленгликольдипропионат,
2-метил-1,3-дифенил-1,3-пропиленгликольдиацетат,
2,2-диметил-1,3-дифенил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-дифенил-1,3-пропиленгликольдипропионат,
2-этил-1,3-ди(трет-бутил)-1,3-пропиленгликольдибензоат,
1,3-дифенил-1,3-пропиленгликольдиацетат,
2-бутил-2-этил-1,3-пропиленгликольдибензоат,
2,2-диэтил-1,3-пропиленгликольдибензоат,
2-диметоксиметил-1,3-пропиленгликольдибензоат,
2-метил-2-пропил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-хлорбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(мета-хлорбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-метоксибензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольди(пара-метилбензоат),
2-изоамил-2-изопропил-1,3-пропиленгликольмонобензоатмонопропионат,
2-изоамил-2-изопропил-1,3-пропиленгликольдипропионат,
2-изоамил-2-изопропил-1,3-пропиленгликольдиакрилат,
2-изоамил-2-изопропил-1,3-пропиленгликольдициннамат,
2,2-диизобутил-1,3-пропиленгликольдибензоат,
2-изоамил-2-изопропил-1,3-пропиленгликоль-2,2'-бифенилдиформиат,
2-изоамил-2-изопропил-1,3-пропиленгликольфталат,
1,3-диизопропил-1,3-пропиленгликольди(4-бутилбензоат),
2-этил-2-метил-1,3-пропиленгликольдибензоат,
2,2-диметил-1,3-пропиленгликольдибензоат,
2-метил-1-фенил-1,3-бутиленгликольдибензоат,
2-метил-1-фенил-1,3-бутиленгликольдипивалат,
2-метил-2-(2-фурил)-1,3-бутиленгликольдибензоат,
1,4-бутиленгликольдибензоат,
2,3-диизопропил-1,4-бутиленгликольдибензоат,
2,3-диметил-1,4-бутиленгликольдибензоат,
2,3-диэтил-1,4-бутиленгликольдибензоат,
2,3-дибутил-1,4-бутиленгликольдибензоат,
2,3-диизопропил-1,4-бутиленгликольдибутират,
2,4-пентандиолдибензоат,
3-метил-2,4-пентандиолдибензоат,
3-этил-2,4-пентандиолдибензоат,
3-пропил-2,4-пентандиолдибензоат,
3-бутил-2,4-пентандиолдибензоат,
3,3-диметил-2,4-пентандиолдибензоат,
(2S,4S)-(+)-2,4-пентандиолдибензоат,
(2R,4R)-(+)-2,4-пентандиолдибензоат,
2,4-пентандиолди(пара-хлорбензоат),
2,4-пентандиолди(мета-хлорбензоат),
2,4-пентандиолди(пара-бромбензоат),
2,4-пентандиолди(орто-бромбензоат),
2,4-пентандиолди(пара-метилбензоат),
2,4-пентандиолди(пара-трет-бутилбензоат),
2,4-пентандиолди(пара-бутилбензоат),
2,4-пентандиолмонобензоатмоноциннамат,
2,4-пентандиолдициннамат,
1,3-пентандиолдипропионат,
2-метил-1,3-пентандиолдибензоат,
2-метил-1,3-пентандиолди(пара-хлорбензоат),
2-метил-1,3-пентандиолди(пара-метилбензоат),
2-бутил-1,3-пентандиолди(пара-метилбензоат),
2-метил-1,3-пентандиолди(пара-трет-бутилбензоат),
2-метил-1,3-пентандиолдипивалат,
2-метил-1,3-пентандиолмонобензоатмоноциннамат,
2,2-диметил-1,3-пентандиолдибензоат,
2,2-диметил-1,3-пентандиолмонобензоатмоноциннамат,
2-этил-1,3-пентандиолдибензоат,
2-бутил-1,3-пентандиолдибензоат,
2-аллил-1,3-пентандиолдибензоат,
2-метил-1,3-пентандиолмонобензоатмоноциннамат,
2-метил-1,3-пентандиолдибензоат,
2-этил-1,3-пентандиолдибензоат,
2-пропил-1,3-пентандиолдибензоат,
2-бутил-1,3-пентандиолдибензоат,
1,3-пентандиолди(пара-хлорбензоат),
1,3-пентандиолди(мета-хлорбензоат),
1,3-пентандиолди(пара-бромбензоат),
1,3-пентандиолди(орто-бромбензоат),
1,3-пентандиолди(пара-метилбензоат),
1,3-пентандиолди(пара-трет-бутилбензоат),
1,3-пентандиолди(пара-бутилбензоат),
1,3-пентандиолмонобензоатмоноциннамат,
1,3-пентандиолдициннамат,
2,2,4-триметил-1,3-пентандиолдибензоат,
2,2,4-триметил-1,3-пентандиолди(изопропилформиат),
3-метил-1-трифторметил-2,4-пентандиолдибензоат,
2,4-пентандиолди(пара-фторметилбензоат),
2,4-пентандиолди(2-фуранкарбоксилат),
3-бутил-3-метил-2,4-пентандиолдибензоат,
2,2-диметил-1,5-пентандиолдибензоат,
1,5-дифенил-1,5-пентандиолдибензоат,
1,5-дифенил-1,5-пентандиолдипропионат,
2-этил-1,3-гександиолдибензоат,
2-пропил-1,3-гександиолдибензоат,
2-бутил-1,3-гександиолдибензоат,
4-этил-1,3-гександиолдибензоат,
4-метил-1,3-гександиолдибензоат,
3-метил-1,3-гександиолдибензоат,
3-этил-1,3-гександиолдибензоат,
2,2,4,6,6-пентаметил-3,5-гександиолдибензоат,
2,5-гександиолдибензоат,
2,5-диметил-2,5-гександиолдибензоат,
2,5-диметил-2,5-гександиолдипропионат,
2,5-диметил-гекса-3-ин-2,5-диолдибензоат,
гекса-3-ин-2,5-диолдибензоат(Т),
гекса-3-ин-2,5-диолдибензоат(S),
гекса-3-ин-2,5-диолди(2-фуранкарбоксилат),
3,4-дибутил-1,6-гександиолдибензоат,
1,6-гександиолдибензоат,
гепта-6-ен-2,4-диолдибензоат,
2-метил-гепта-6-ен-2,4-диолдибензоат,
3-метил-гепта-6-ен-2,4-диолдибензоат,
4-метил-гепта-6-ен-2,4-диолдибензоат,
5-метил-гепта-6-ен-2,4-диолдибензоат,
6-метил-гепта-6-ен-2,4-диолдибензоат,
3-этил-гепта-6-ен-2,4-диолдибензоат,
4-этил-гепта-6-ен-2,4-диолдибензоат,
5-этил-гепта-6-ен-2,4-диолдибензоат,
6-этил-гепта-6-ен-2,4-диолдибензоат,
3-пропил-гепта-6-ен-2,4-диолдибензоат,
4-пропил-гепта-6-ен-2,4-диолдибензоат,
5-пропил-гепта-6-ен-2,4-диолдибензоат,
6-пропил-гепта-6-ен-2,4-диолдибензоат,
3-бутил-гепта-6-ен-2,4-диолдибензоат,
4-бутил-гепта-6-ен-2,4-диолдибензоат,
5-бутил-гепта-6-ен-2,4-диолдибензоат,
6-бутил-гепта-6-ен-2,4-диолдибензоат,
3,5-диметил-гепта-6-ен-2,4-диолдибензоат,
3,5-диэтил-гепта-6-ен-2,4-диолдибензоат,
3,5-дипропил-гепта-6-ен-2,4-диолдибензоат,
3,5-дибутил-гепта-6-ен-2,4-диолдибензоат,
3,3-диметил-гепта-6-ен-2,4-диолдибензоат,
3,3-диэтил-гепта-6-ен-2,4-диолдибензоат,
3,3-дипропил-гепта-6-ен-2,4-диолдибензоат,
3,3-дибутил-гепта-6-ен-2,4-диолдибензоат,
3,5-гептандиолдибензоат,
2-метил-3,5-гептандиолдибензоат,
3-метил-3,5-гептандиолдибензоат,
4-метил-3,5-гептандиолдибензоат,
5-метил-3,5-гептандиолдибензоат,
6-метил-3,5-гептандиолдибензоат,
3-этил-3,5-гептандиолдибензоат,
4-этил-3,5-гептандиолдибензоат,
5-этил-3,5-гептандиолдибензоат,
3-пропил-3,5-гептандиолдибензоат,
4-пропил-3,5-гептандиолдибензоат,
3-бутил-3,5-гептандиолдибензоат,
2,3-диметил-3,5-гептандиолдибензоат,
2,4-диметил-3,5-гептандиолдибензоат,
2,5-диметил-3,5-гептандиолдибензоат,
2,6-диметил-3,5-гептандиолдибензоат,
3,3-диметил-3,5-гептандиолдибензоат,
4,4-диметил-3,5-гептандиолдибензоат,
6,6-диметил-3,5-гептандиолдибензоат,
3,4-диметил-3,5-гептандиолдибензоат,
3,5-диметил-3,5-гептандиолдибензоат,
3,6-диметил-3,5-гептандиолдибензоат,
4,5-диметил-3,5-гептандиолдибензоат,
4,6-диметил-3,5-гептандиолдибензоат,
4,4-диметил-3,5-гептандиолдибензоат,
6,6-диметил-3,5-гептандиолдибензоат,
3-этил-2-метил-3,5-гептандиолдибензоат,
4-этил-2-метил-3,5-гептандиолдибензоат,
5-этил-2-метил-3,5-гептандиолдибензоат,
3-этил-3-метил-3,5-гептандиолдибензоат,
4-этил-3-метил-3,5-гептандиолдибензоат,
5-этил-3-метил-3,5-гептандиолдибензоат,
3-этил-4-метил-3,5-гептандиолдибензоат,
4-этил-4-метил-3,5-гептандиолдибензоат,
5-этил-4-метил-3,5-гептандиолдибензоат,
2-метил-3-пропил-3,5-гептандиолдибензоат,
2-метил-4-пропил-3,5-гептандиолдибензоат,
2-метил-5-пропил-3,5-гептандиолдибензоат,
3-метил-3-пропил-3,5-гептандиолдибензоат,
3-метил-4-пропил-3,5-гептандиолдибензоат,
3-метил-5-пропил-3,5-гептандиолдибензоат,
4-метил-3-пропил-3,5-гептандиолдибензоат,
4-метил-4-пропил-3,5-гептандиолдибензоат,
4-метил-5-пропил-3,5-гептандиолдибензоат,
6-метил-2,4-гептандиолди(пара-хлорбензоат),
6-метил-2,4-гептандиолди(пара-метилбензоат),
6-метил-2,4-гептандиолди(мета-метилбензоат),
6-метил-2,4-гептандиолдипивалат,
гепта-6-ен-2,4-диолдипивалат,
3,6-диметил-2,4-гептандиолдибензоат,
2,2,6,6-тетраметил-3,5-гептандиолдибензоат,
2,6-диметил-2,6-гептандиолдибензоат,
4-метил-3,5-октандиолдибензоат,
4-этил-3,5-октандиолдибензоат,
4-пропил-3,5-октандиолдибензоат,
5-пропил-3,5-октандиолдибензоат,
4-бутил-3,5-октандиолдибензоат,
4,4-диметил-3,5-октандиолдибензоат,
4,4-диэтил-3,5-октандиолдибензоат,
4,4-дипропил-3,5-октандиолдибензоат,
4-этил-4-метил-3,5-октандиолдибензоат,
3-фенил-3,5-октандиолдибензоат,
3-этил-2-метил-3,5-октандиолдибензоат,
4-этил-2-метил-3,5-октандиолдибензоат,
5-этил-2-метил-3,5-октандиолдибензоат,
6-этил-2-метил-3,5-октандиолдибензоат,
5-метил-4,6-нонандиолдибензоат,
5-этил-4,6-нонандиолдибензоат,
5-пропил-4,6-нонандиолдибензоат,
5-бутил-4,6-нонандиолдибензоат,
5,5-диметил-4,6-нонандиолдибензоат,
5,5-диэтил-4,6-нонандиолдибензоат,
5,5-дипропил-4,6-нонандиолдибензоат,
5,5-дибутил-4,6-нонандиолдибензоат,
4-этил-5-метил-4,6-нонандиолдибензоат,
5-фенил-4,6-нонандиолдибензоат,
4,6-нонандиолдибензоат,
1,1-циклогександиметанолдибензоат,
1,3-циклогександиолдибензоат,
1,4-циклогександиолдибензоат,
1,1-бис(бензоилоксиэтил)циклогексан,
1,4-бис(бензоилоксиметил)циклогексан,
1,1-бис(бензоилоксиметил)-3-циклогексен,
1,1-бис(пропионилоксиметил)-3-циклогексен,
9,9-бис(бензоилоксиметил)флуорен,
9,9-бис((мета-метоксибензоилокси)метил)флуорен,
9,9-бис((мета-хлорбензоилокси)метил)флуорен,
9,9-бис((пара-хлорбензоилокси)метил)флуорен,
9,9-бис(циннамоилоксиметил)флуорен,
9-(бензоилоксиметил)-9-(пропионилоксиметил)флуорен,
9,9-бис(пропионилоксиметил)флуорен,
9,9-бис(акрилоилоксиметил)флуорен,
9,9-бис(пивалилоксиметил)флуорен,
9,9-флуорендиметанолдибензоат,
1,3-фенилендибензоат,
1,4-фенилендибензоат,
2,2'-бифенилендибензоат,
бис(2-бензоилоксинафтил)метан,
1,2-ксилендиолдибензоат,
1,3-ксилендиолдибензоат,
1,4-ксилендиолдибензоат,
2,2'-бифенилдиметанолдипивалат,
2,2'-бифенилдиметанолдибензоат,
2,2'-бифенилдиметанолдипропионат,
2,2'-бинафтилдиметанолдибензоат,
пентаэритриттетрабензоат,
1,2,3-пропантриолтрибензоат.
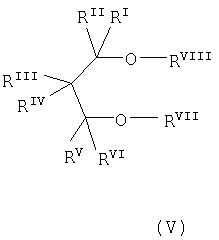
в которой RI, RII, RIII, RIV, RV и RVI, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород или углеводородный радикал, содержащий 1-18 углеродных атомов, RVII и RVIII, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой углеводородный радикал, содержащий 1-18 углеродных атомов, и два или более из RI-RVIII могут быть связаны с образованием насыщенного моноциклического кольца или насыщенного или ненасыщенного полициклического кольца.
указанное титановое соединение имеет общую формулу TiXn(OR)4-n, в которой R представляет собой углеводородный радикал, содержащий 1-20 углеродных атомов, Х представляет собой галоген и n имеет значение от 1 до 4.
(a) твердого каталитического компонента по любому из пп.1-19;
(b) по меньшей мере, одного алюмоорганического соединения формулы AlRnХ3-n, в которой R представляет собой водород или гидрокарбил, содержащий 1-20 углеродных атомов, Х представляет собой галоген, п имеет значение, удовлетворяющее выражению 1<n≤3; и
(c) необязательно, по меньшей мере, одного соединения - внешнего донора электронов.
| WO 00/55215, 21.09.2000 | |||
| ТВЕРДЫЙ КОМПОНЕНТ КАТАЛИЗАТОРА ПОЛИМЕРИЗАЦИИ АЛЬФА-ОЛЕФИНОВ, КАТАЛИЗАТОР ПОЛИМЕРИЗАЦИИ АЛЬФА-ОЛЕФИНОВ И СПОСОБ ПОЛУЧЕНИЯ ПОЛИОЛЕФИНОВ | 1990 |
|
RU2092495C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОГО ТИТАНОВОГО КАТАЛИТИЧЕСКОГО КОМПОНЕНТА, КАТАЛИЗАТОР ПОЛИМЕРИЗАЦИИ ОЛЕФИНА, СОДЕРЖАЩИЙ ЕГО, И СПОСОБ ПОЛИМЕРИЗАЦИИ ОЛЕФИНА | 1996 |
|
RU2153932C2 |
| Устройство для сортировки и учета штучных изделий по габаритам | 1973 |
|
SU489536A1 |
| Способ холодильной обработки мясных продуктов и устройство для холодильной обработки мясных продуктов | 1983 |
|
SU1259528A1 |
| Устройство для хранения и подачи буровых штанг | 1983 |
|
SU1099041A1 |
Авторы
Даты
2007-04-27—Публикация
2003-01-30—Подача