Изобретение относится к органической химии, конкретно к способу получения новых химических соединений пиридинового ряда общей формулы:
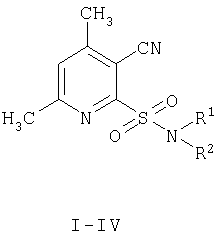
I R1=аллил, R2=аллил; II R1=H, R2=циклогексил;
III R1=H, R2=2-этилфенил; IV R1=H, R2=изопропил;
которые могут найти применение и сельском хозяйстве в качестве биологически активных веществ.
Известен способ получения ароматических и гетероциклических N-замещенных сульфониламидов путем взаимодействия соответствующих сульфонилхлоридов с первичными и вторичными аминами [1. Вейганд-Хильгетаг. Методы эксперимента в органической химии. - М.: Химия. 1969. С.621-622].
В свою очередь, ароматические и гетероциклические сульфонилхлориды удобно получать окислительным хлорированием соответствующих меркаптопроизводных [там же, с.613].
Для синтеза сульфониламидов в реакцию с аминами вводится высушенный и очищенный сульфонилхлорид, реакция проводится в среде безводного растворителя, так как сульфонилхлориды являются легкогидролизуемыми веществами. Однако этот метод не позволяет получить N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды.
Наиболее близким к предлагаемому способу по технической сущности является способ получения N-замещенных 1,2,4-триазолил-3-сульфониламидов, который выбран в качестве прототипа, заключающийся в том, что полученный окислительным хлорированием и высушенный 1,2,4-триазолил-3-сульфонилхлорид прибавляют к водному раствору аминов при 20°С и после перемешивания при этой же температуре выделяют целевые продукты [2. Патент ЧССР №177897 от 15.03.79 «Гербицид - средство и способ получения основного компонента»]. Недостатком этого способа является то, что он тоже не позволяет получить N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды.
Задачей настоящего изобретения является разработка удобного и надежного способа получения N-замещенных 4,6-диметил-3-цианопиридил-2-сульфониламидов I-IV, которые могут найти применение в сельском хозяйстве в качестве биологически активных веществ.
Поставленная задача достигается проведением двухстадийного синтеза: стадия первая - синтез 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V, стадия вторая - взаимодействие последнего с аминами по схеме:
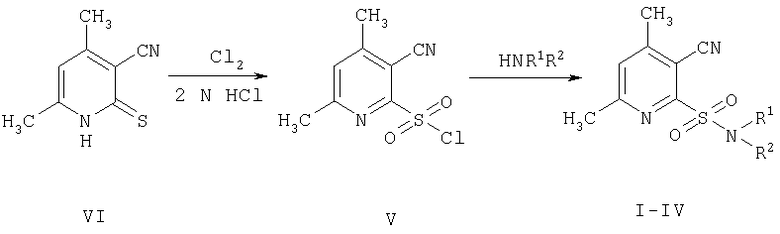
Синтез 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V осуществляли окислительным хлорированием 4,6-диметил-3-циано(1Н)пиридил-2-тиона VI в среде 2N HCl при температуре -2-0°С, аналогично описанному в аналогах [1, 2].
Особенностью полученного сульфонилхлорида V является то, что при его сушке в разных условиях (температура комнатная, давление атмосферное или 5-10 мм рт.ст., либо осушивание вытяжки с последующей отгонкой растворителя) во всех случаях происходит элиминирование группы SO2 из молекулы последнего, и вместо целевого 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V выделяется нежелательный 4,6-диметил-2-хлорникотинонитрил. Чтобы избежать разложение 4,6-диметил-3-цианопиридил-2-сульфонилхлорида, сырой продукт V, минуя стадию сушки, немедленно использовали в реакциях с аминами. Для этого к водной суспензии V при температуре 8-10°С прибавляли по каплям раствор соответствующего амина в ацетоне и после 3-4 ч перемешивания выделяли сульфониламиды I-IV с достаточно высокими выходами - 69-74%.
В том случае, когда к раствору аминов в воде прибавляли сульфохлорид V при 20°С, как описано в [2], реакционная масса разогревалась до 35-40°С и выход сульфониламидов I-IV резко снижался до 42-46%, вероятно в результате разложения сульфонилхлорида V.
Таким образом, предлагаемый способ позволяет с высокими выходами получать целевые N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды I-IV.
Этот результат достигается тем, что 4,6-диметил-3-цианопиридил-2-сульфонилхлорид V, исключая стадию сушки, вводят в реакцию с аминами, причем к водной суспензии сульфонилхлорида V прибавляют раствор амина (а не наоборот) при температуре 8-10°С.
Исходный 4,6-диметил-3-циано-(1Н)пиридин-2-тион получен известным способом [3. Е.А.Кайгородова, Л.Д.Конюшкин и др. // Изв. Академии наук. Сер. химич. - 1994. - №12. - С.2215-2219.].
Синтезированные N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды I-IV испытывали на антидотную активность на проростках подсолнечника по отношению к гербициду 2,4-дихлорфеноксиуксусной кислоте в условиях лабораторного опыта. Соединения I-IV снижали отрицательное действие 2,4-Д на гипокотиле проростков подсолнечника на 20-31%, на корнях на 25-33%.
Очевидно, что ряд N-замещенных 4,6-диметил-3-цианопиридил-2-сульфониламидов I-IV является перспективным в плане поиска новых средств защиты растений от нежелательного действия гербицидов и, в случае расширения этого ряда соединений, могут быть найдены более эффективные антидоты. Изобретение иллюстрируется следующими примерами:
Пример 1. N,N-диаллил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение I).
Стадия 1. В суспензию 2,0 г (10 ммоль) 4,6-диметил-3-циано(1Н)пиридил-2-тиона в 20 мл 2 N HCl при перемешивании в течение 1 ч барботируют Cl2, поддерживая температуру реакционной смеси в интервале 0...-2°С. После отключения тока хлора перемешивание продолжают при этой же температуре еще 20 мин. Осадок образовавшегося 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V отфильтровывают, промывают на фильтре ледяной водой и немедленно используют в стадии 2.
Стадия 2. Навеску 1,5 г (6,5 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 6 мл воды, имеющей температуру 8-10°С, и при перемешивании прикапывают раствор 1,26 г (13 ммоль) диаллиламина в 2 мл ацетона, поддерживая температуру реакционной смеси постоянной. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 1,5-2 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из гексана получают 1,33 г (70%) целевого продукта I с т.пл.=52-53°С.
Найдено, %: С=57,58; Н=5,69; N=14,57; S=11,11; C14H17N3O2S;
Вычислено, %: С=57,71; Н=5,88; N=14,42, S=11,00.
Спектр ЯМР 1Н(ДМСО-D6):7,69 (1Н, с, Н-5), 5,77 (2Н, м, СН2СН=СН2), 5,20 (4Н, м, СН2СН=СН2), 3,93 (4Н, д, CH2CH=СН2), 2,62 (3Н, с, 6-СН3 Ру), 2,57 (3Н, с, 4-СН3 Ру).
Масс-спектр (m/z, относительная интенсивность, %): 186 [М-SO2, - CH2CH=CH2]+ (8), 171 [186-СН3]+ (5), 131 [М-SO2N(CH2CH=CH2)2]+ (23), 96 [N(CH2CH=CH2)2]+ (100).
Пример 2. N-циклогексил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение II).
Стадия 1. Так же, как в примере 1.
Стадия 2. 1,5 г (6,5 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 6 мл воды, имеющей температуру 8-10°С, и при перемешивании прикапывают раствор 1,29 г (13 ммоль) циклогексиламина в 2 мл ацетона. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 1,5-2 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из смеси гексан: этилацетат =1:3 получают 1,41 г (74%) целевого продукта II с т.пл.=151-152°С.
Найдено, %: С=57,12; Н=6,41; N=14,17; S=11,08; C14H19N3O2S;
Вычислено, %: С=57,31; Н=6,53; N=14,32, S=10,93.
Спектр ЯМР 1H(ДМСО-D6): 8,30 (1Н, уш. с, NH), 7,65 (1Н, с, Н-5), кольцо циклогексана: 3,18 (м), 1,81 (м), 1,75 (м), 1,48 (м), 1,21 (м), 1,10 (м), 2,62 (3Н, с, 6-СН3 Ру), 2,55 (3Н, с, 4-СН3 Ру).
Масс-спектр (m/z, относительная интенсивность, %): 293 [M]+ (2), 250 [М-C3H7]+ (57), 186 [250-SO2]+ (28), 159 [186-HCN]+ (38), 131 [М-SO2NHC6H11]+ (49), 98 [NH C6H11]+ (100).
Пример 3. N-этилфенил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение III).
Стадия 1. Так же, как в примере 1.
Стадия 2. 1,1 г (4,8 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 5 мл воды, имеющей температуру 8-10°С, и при перемешивании прикапывают раствор 0,58 г (4,8 ммоль) 2-этиланилина и 1,48 г триэтиламина (4,8 ммоль) в 2 мл ацетона. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 3,5-4 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из смеси гексан:этилацетат=1:1 получают 1,04 г (69%) целевого продукта III ст.пл.=147-148°С.
Найдено, %: С=61,17; Н=5,62; N=13,18; S=10,34; С16Н17N3O2S;
Вычислено, %: С=60,93; Н=5,43; N=13,32, S=10,17.
Спектр ЯМР 1Н (ДМСО-D6): 10,24 (1Н, уш. с, NH), 7,70 (1Н, с, Н-5), 7,24...7,05 (4Н, м, Ar), 2,66 (2Н, к, J=5, СН2СН3), 2,60 (3Н, с, 6-СН3 Ру), 2,55 (3Н, с, 4-СН3 Ру), 1,08 (3Н, т, J=5, СН2СН3).
Масс-спектр (m/z, относительная интенсивность, %): 314 [M]+ (23), 251 [М-SO2]+ (16), 236 [251-СН3]+ (23), 222 [251-С2Н5]+ (27), 131 [М-SO2NH С6Н4 С2Н5-2]+ (11), 120 [NH С6Н4 С2Н5-2]+ (100).
Пример 4. N-изопропил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение IV).
Стадия 1. Так же, как в примере 1.
Стадия 2. 1,1 г (4,8 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 5 мл воды, имеющей температуру 8-10°С, и при перемешивании прикапывают раствор 0,57 г (9,6 ммоль) изопропиламина в 2 мл ацетона. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 1,5-2 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из гексана получают 0,87 г (72%) целевого продукта IV с т.пл.=98-99°С.
Найдено, %: С=51,17; Н=5,64; N=16,72; S=12,43; C11H15N3O2S;
Вычислено, %: С=52,16; Н=5,97; N=16,59, S=12,66.
Спектр ЯМР 1H(ДМСО-D6): 8,18 (1Н, д, J=, NH), 7,66 (1Н, с, Н-5), 3,52 [1Н, м, J=, СН(СН3)2], 2,60 (3Н, с, 6-СН3 Ру), 2,55 (3Н, с, 4-СН3 Ру), 1,12 [6Н, д, J=, CH(CH3)2].
Масс-спектр (m/z, относительная интенсивность, %): 238 [М-СН3]+ (61), 174 [238-SO2]+ (42), 131 [М-SO2NHC3H7-i]+ (84), 104 [131-HCN]+ (37), 58 [NHC3H7-i]+ (100).
Пример 5. N-циклогексил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение II).
Стадия 1. Так же, как в примере 1.
Стадия 2. К раствору 1,29 г (13 ммоль) циклогексиламина в 5 мл воды при температуре 8-10°С прибавляют 1,5 г (6,6 ммоль)) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида (температура реакционной массы при этом поднимается до 38°С), перемешивают 30-40 мин, подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, сушат. После переосаждения из 5% раствора КОН получают 0,79 г (42%) целевого продукта II с т.пл.=151-152°С.
Элементный анализ и спектральные характеристики идентичны приведенным в примере 2.
Пример 6. N-циклогексил-4,6-диметил-3-цианопиридил-2-сульфониламид (соединение II).
Стадия 1. Так же, как в примере 1.
Стадия 2. 1,5 г (6,5 ммоль) влажного 4,6-диметил-3-цианопиридил-2-сульфонилхлорида V суспендируют в 6 мл воды, имеющей комнатную температуру, и при перемешивании прикапывают раствор 1,29 г (13 ммоль) циклогексиламина в 2 мл ацетона. После окончания прибавления перемешивание продолжают при той же температуре 1,5-2 ч, затем температуру постепенно поднимают до комнатной и перемешивают еще 1,5-2 ч. Реакционную массу подкисляют конц. HCl до рН=3-4, осадок отфильтровывают, промывают водой, сушат. После перекристаллизации из смеси гексан: этилацетат =1:3 получают 0,9 г (47%) целевого продукта II с т.пл.=151-152°С.
Элементный анализ и спектральные характеристики идентичны приведенным в примере 2.
Пример 7. 4,6-диметил-3-цианопиридил-2-сульфонилхлорид (соединение V).
В суспензию 2,0 г (10 ммоль) 4,6-диметил-3-циано(Н)пиридил-2-тиона в 20 мл 2N HCl при перемешивании в течение 1 ч барботируют Cl2, поддерживая температуру реакционной смеси в интервале 0...-2°С. После отключения тока хлора перемешивание продолжают при этой же температуре еще 20 мин. Осадок отфильтровывают, промывают на фильтре ледяной водой и немедленно подвергают взаимодействию с амином.
Структура продукта V подтверждена косвенно, соединениями I-IV, синтезированными на его основе.
Пример 6. 4,6-диметил-2-хлорникотинонитрил
Способ А. Продукт V (пример 5) после промывания ледяной водой сушат в вакуумном эксикаторе при 5-10 мм рт.ст., получают побочный 2-хлорникотинонитрил с выходом 81%.
Способ Б. Продукт V (пример 5) после промывания ледяной водой экстрагируют бензолом, вытяжку сушат безводным Na2SO4, растворитель отгоняют с помощью ротационного испарителя, получают побочный 2-хлорникотинонитрил с выходом 73%.
Найдено, %: C=57,82; Н=4,38; N=17,02; C8H7ClN2;
Вычислено, %: С=57,67; Н=4,23; N=16,81.
Спектр ЯМР 1H(ДМСО-D6): 7,45 (1Н, с, 5Н), 2,62 (3Н, с, СН3-6), 2,55 (3Н, с, СН3-4).
Масс-спектр (m/z, относительная интенсивность, %): 166 [М]+ (100), 130 [М-CN]+ (30), 104 [130-CN]+ (24), 103 [130-HCN]+ (26).
| название | год | авторы | номер документа |
|---|---|---|---|
| N-ЗАМЕЩЕННЫЕ ПИРАЗОЛО[3,4-b]ПИРИДИЛ-3-СУЛЬФОНИЛАМИДЫ, ПРОЯВЛЯЮЩИЕ РОСТРЕГУЛИРУЮЩУЮ АКТИВНОСТЬ | 2008 |
|
RU2357966C1 |
| Способ повышения урожайности подсолнечника | 2020 |
|
RU2741872C1 |
| ПРИМЕНЕНИЕ N-ЗАМЕЩЕННЫХ 3-ЦИАНО-4,6-ДИМЕТИЛ-5-ХЛОРПИРИДИЛ-2-СУЛЬФОНИЛАМИДОВ В КАЧЕСТВЕ АНТИДОТОВ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ НА ПОДСОЛНЕЧНИКЕ | 2005 |
|
RU2287273C1 |
| 3-АМИНО-4,5,6-ТРИМЕТИЛ-2-(БЕНЗИМИДАЗОЛИЛ-2)ТИЕНО[2,3-b]ПИРИДИН В КАЧЕСТВЕ РЕГУЛЯТОРА РОСТА САХАРНОЙ СВЕКЛЫ | 2007 |
|
RU2338748C1 |
| 7',9'-ДИМЕТИЛ-3'-АРИЛ-1'-СПИРО[ИНДЕН-2,2'-ПИРИДО[3',2':4,5]ТИЕНО]3,2-D]ПИРИМИДИН]-1,3,4'(3'H)ТРИОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИДОТОВ 2,4-Д НА ПОДСОЛНЕЧНИКЕ | 2020 |
|
RU2754220C1 |
| СОЕДИНЕНИЯ 4-ОКСО-3,4-ДИГИДРОХИНАЗОЛИНОНА ДЛЯ ЛЕЧЕНИЯ BRAF-АССОЦИИРОВАННЫХ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ | 2021 |
|
RU2814662C1 |
| АНТИДОТ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ НА ПОДСОЛНЕЧНИКЕ | 2014 |
|
RU2557550C1 |
| N-АЦИЛИРОВАННЫЕ 3-АМИНО-4,6-ДИМЕТИЛТИЕНО[2,3-b]ПИРИДИН-2-КАРБОКСАМИДЫ В КАЧЕСТВЕ АНТИДОТОВ 2,4-Д НА ПОДСОЛНЕЧНИКЕ | 2011 |
|
RU2475490C1 |
| Способ повышения урожайности сои | 2020 |
|
RU2742741C1 |
| ПРИМЕНЕНИЕ ХИРАЛЬНЫХ АРИЛКЕТОНОВ В ЛЕЧЕНИИ НЕЙТРОФИЛ-ЗАВИСИМЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2345759C2 |
Описывается способ получения N-замещенных 4,6-диметил-3-цианопиридил-2-сульфониламидов, которые могут найти применение в качестве биологически активных веществ. Способ заключается в том, что 4,6-диметил-3-цианопиридил-2-сульфонилхлорид, образующийся путем окислительного хлорирования 4,6-диметил-3-циано(1Н)пиридил-2-тиона, минуя стадию сушки, подвергают взаимодействию с амином. При этом взаимодействие с аминами осуществляют, прибавляя к водной суспензии 4,6-диметил-3-цианопиридил-2-сульфонилхлорида раствор амина в ацетоне при температуре 8-10°С. Технический результат: получение целевых продуктов с высокими выходами - 69-74%. N-замещенные 4,6-диметил-3-цианопиридил-2-сульфониламиды проявляют антидотную активность по отношению к гербициду 2,4-Д на проростках подсолнечника. 2 з.п. ф-лы.
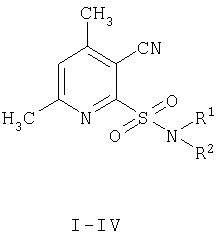
I R1=аллил, R2=аллил; II R1=H, R2=циклогексил; III R1=H, R2=2-этилфенил; IV R1=H, R2=изопропил, отличающийся тем, что 4,6-диметил-3-цианопиридил-2-сульфонилхлорид, образующийся путем окислительного хлорирования 4,6-диметил-3-циано(1Н)пиридил-2-тиона, минуя стадию сушки, подвергают взаимодействию с амином.
| 0 |
|
SU177897A1 | |
| Способ получения производных 2-пиридин-тиола или их кислотно-аддитивных солей (его варианты) | 1985 |
|
SU1346042A3 |
| 2-ТИОАЛКИЛПИРИДИНЫ И ТИЕНО[2,3-B]ПИРИДИНЫ-АНТИДОТЫ ГЕРБИЦИДА ГОРМОНАЛЬНОГО ДЕЙСТВИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2003 |
|
RU2232762C1 |
| Способ получения газогипса | 1956 |
|
SU109751A1 |
| DE 19548781 A1, 03.07.1997. | |||
Авторы
Даты
2007-06-10—Публикация
2006-01-19—Подача