Изобретения относится к получению синтетических, биологически активных веществ из ряда гетероциклических соединений, и их использованию в сельском хозяйстве для защиты растений подсолнечника от фитотоксического действия гербицида - 2,4-дихлорорфеноксиуксусной кислоты.
Как известно, подсолнечник является чрезвычайно чувствительной культурой к гормональным гербицидам группы 2,4-Д и, в случаях непреднамеренного попадания гербицида на его посевы, потери могут составлять, в зависимости от дозы, до 100% [Чкаников, Д.И., Соколов, М.С. Гербицидное действие 2,4-Д и других галоидфеноксикислот. М.: Наука, 1973].
Несмотря на интенсивные исследования по изысканию новых антидотов для защита вегетирующих растений подсолнечника от повреждающего действия, 2,4-Д остается актуальной и нерешенной [Стрелков В.Д., Дядюченко Л.В., Дмитриев И.Г. Синтез новых гербицидных антидотов для подсолнечника. Краснодар: Просвещение - Юг, 2014, с. 79].
Известны 2-R-3-амино-4,6-диметил-5-Х-тиено[2,3-b]пиридины строения:

которые применяют в качестве эффективного антидота гербицидов гормонально типа действия [патент РФ №2232762, МПК C07D 495/02 (2000.01), C07D 213/82 (2000.01), A01N 43/90 (2000.01), A01N 43/40 (2000.01), A01N 25/32 (2000.01) / Е.А. Кайгородова, В.К. Василии, В.А. Тыморин, Н.И. Ненько, Г.Д. Крапивин, Л.В. Дядюченко, Л.И. Исакова, В.Д. Стрелков. Тиоалкилпиридины и тиено[2,3-b]пиридины - антидоты гербицидов гормонального действия 2,4-дихлорфеноксиуксусной кислоты, БИ №20, 2004]. Это соединение испытано только в лабораторных условиях на проростках подсолнечника, при этом совершенно не очевидно, что высокая биологическая активность сохранится при испытании его в полевых условиях. Очень часто соединения сложной химической структуры не выдерживают действия солнечного УФ-облучения и теряют активность.
Наиболее близким аналогом по структуре и свойствам к заявляемым соединениям является 3-амино-N-(2'-йодфенил)карбоксамидо]-4,6-диметилтиено[2,3-b]пиридин формулы

[патент РФ №2276845, МПК A01N 43/90 (2006.01), C07D 495/04 (2006.01), А01Р 21/00 (2006.01). Применение 3-амино-N-(2'-йодфенил)карбоксамидо]-4,6-диметилтиено[2,3-b]пиридина в качестве стимулятора прорастания семян. - №2005104358; заявл. 17.02.2005; опубл. 27.05.2006]. Однако это соединение обладает невысокой антидотной активностью.
3-амино-N-(2'-йодфенил)карбоксамидо]-4,6-диметилтиено[2,3-b]пиридин и аналогичные соединения получают известным двустадийным методом -взаимодействием соответствующих 3 -циано-4,6-диметилпиридин-2(1Н)-тионов с эквимольным количеством KОН и 2-иодфениламида хлоруксусной кислоты при температуре 20-25°С с последующей циклизацией [Синтез замещенных 2-алкил(арил)тио-3-цианопиридинов и 3-аминотиено-[2,3-b]пиридинов / Е.А. Кайгородова, Л.Д. Конюшкин, С.Н. Михайличенко. В.К. Василии, В.Г. Кульневич // ХГС, 1996, №10, с. 1432-1437].
Применение соединения 3-амино-N-(2'-йодфенил)карбоксамидо]-4,6-диметилтиено[2,3-b]пиридина в качестве ростстимулятора в условиях полевого опыта в дозе 200 г/га увеличивает урожай семян подсолнечника на 2,4 ц/га или на 16%.
Следует отметить основной недостаток использования этих соединений - большая дозировка его применения, а именно доза 200 г/га. Это очень высокая доза для стимулятора роста, которая непременно вызовет соответствующие экологические проблемы, а следовательно, является препятствием для внедрения данного препарата в систему растениеводства.
Техническим результатом предлагаемого изобретения является расширение арсенала биологически активных веществ, применяемые в сельском хозяйстве в качестве антидотов.
Технический результат достигается синтезом соединений 7', 9'-диметил-3'-арил-1'-спиро[инден-2,2'-пиридо[3',2':4,5]тиено[3,2-d]пиримидин]-1,3,4'(3'Н)-трионов формулы 1;2

где 1 Ar=2-метилфенил;
2 Ar=2-метил-5-хлорфенил;
и применением их на поврежденных гербицидом вегетирующих растениях подсолнечника с целью снижения негативного действия 2,4-Д в качестве антидота через 3 суток после обработки гербицидом в виде водного раствора в дозе 30 г/га с нормой расхода рабочей жидкости 300 л/га.
Нами установлено, что тиенопиридины не вступают в реакцию с нингидрином в кипящей АсОН или в присутствии HCl в кипящем диоксане. Однако найдено, что реакция легко протекает при непродолжительном нагревании в ледяной АсОН в присутствии каталитических количеств концентрированной H2SO4:

В свою очередь, 3-амино-4,6-диметилтиено[2,3-b]пиридин-2-карбоксамиды 3;4 получают известным двустадийным методом - взаимодействием 4,6-диметил-3-цианопиридин-2(1Н)-тиона с эквимольным количеством КОН и соответствующего амида хлоруксусной кислоты при температуре 20-25°С с последующей циклизацией [Кайгородова, Е.А. и др. Синтез замещенных 2-алкил(арил)тио-3-цианопиридинов и 3-аминотиено[2,3-b]пиридинов / Е.А. Кайгородова, Л.Д. Конюшкин, С.Н. Михайличенко. В.К. Василии, В.Г. Кульневич / ХГС, 1996, №10, с. 1432-1437]:

Исходный 4,6-диметил-3-цианопиридин-2(1Н)-тион получен взаимодействием 4,6-диметил-2-хлорникотинонитрила с тиомочевиной [Synthesis, reactions and biological activity of 2-substituted 3-cyano-4,6-dimethylpyridine derivatives/ F. A. Yassin // ХГС, 2009, №1, c. 43-51].
Способ получения соединений формулы 1;2 включает взаимодействие 3-амино-4,6-диметил-N-(2-метил-5-хлорфенил)тиено[2,3-b]пиридин-2-карбоксамида или 3-амино-4,6-диметил-N-(2-метилфенил)тиено[2,3-b]пиридин-2-карбоксамида, растворенных в уксусной кислоте при нагревании, с нингидрином, взятых в соотношении 1:1 в присутствии концентрированной серной кислоты и кипячении в течение 5 мин с обратным холодильником, с последующим охлаждением и разбавлением холодной водой, а затем фильтрацией.
Изобретение иллюстрируется следующими примерами.
Пример 1. 7',9'-Диметил-3'-(2-метилфенил)-1'-спиро[инден-2,2'-пиридо[3',2':4,5]тиено[3,2-d]пиримидин]-1,3,4'(3'Н)-трион (соединение 1).
1,00 г (3,2 ммоль) 3-амино-4,6-диметил-N-(2-метилфенил)тиено[2,3-b]пиридин-2-карбоксамида помещают в кругл о донную колбу объемом 25 мл и растворяют в 10 мл уксусной кислоты при нагревании до 45-50 градусов до полного растворения исходного вещества. В горячий раствор помещают 0,57 г (3,2 ммоль) нингидрина, что соответствует мольному соотношению 1:1, прибавляют 4 капли концентрированной серной кислоты и кипятят в течение 5 мин с обратным холодильником до завершения реакции, ход которой контролируют с помощью тонкослойной хроматографии. Смесь охлаждают до комнатной температуры и тонкой струей выливают в 30 мл дистиллированной воды, разбавляя реакционную массу до концентрации уксусной кислоты 25%, в результате чего выпадают кристаллы желтого цвета. Продукт отфильтровывают, промывают 10 мл 5%-ного раствора едкого натра. Проверку чистоты продукта осуществляют методом тонкослойной хроматографии, в качестве элюента используется смесь ацетон: петролейный эфир - 1:1. После перекристаллизации из ацетона получают 1,25 г (86%) целевого продукта 1 в виде кристаллов с т.пл. 163°С.
Найдено, %: С 68,82; Н 4,21; N 9,26. C26H19N3C3S;
Вычислено, %: С 68,80; Н 4,18; N 9,26.
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 2,28 [3Н, с., СН3(Ar)]; 2,51 [3Н, с., СН3(Ру)]; 2,55 [3Н, с., СН3(Ру)]; 6,56 [1H, д., J=7,8, 3-HAr]; 6,85 [1H, м, 4-HAr]; 7,11 [1Н, с, НРу]; 7,13 [1Н, м, 4-HAr,]; 7,25 [1H, д., J=7,8, 6-HAr]; 7,41 [1H, с, NH]; 7,88 [1Н, д., J=7,8, 3'-HAr]; 8,00 [1Н, д., J=6,9, 4'-HAr]; 8,06-8,13 [2Н, м., 5',6'-HAr].
Пример 2. 7', 9'-Диметил-3'-(2-метил-5-хлорфенил)-1'-спиро[инден-2,2'-пиридо[3',2':4,5]тиено[3,2-d]пиримидин]-1,3,4'(3'Н)-трион (соединение 2).
1,00 г (2,9 ммоль) 3-амино-4,6-диметил-N-(2-метил-5-хлорфенил)тиено[2,3-b]пиридин-2-карбоксамида помещают в круглодонную колбу объемом 25 мл и растворяют в 10 мл уксусной кислоты при нагревании до 45-50 градусов до полного растворения исходного вещества. В горячий раствор помещают 0,52 г (2,9 ммоль) нингидрина, что соответствует соотношению 1:1, прибавляют 4 капли концентрированной серной кислоты и кипятят в течение 5 мин с обратным холодильником до завершения реакции, ход которой контролируют с помощью тонкослойной хроматографии. Смесь охлаждают до комнатной температуры и тонкой струей выливают в 30 мл дистиллированной воды, разбавляя реакционную массу до концентрации уксусной кислоты 25%, в результате чего выпадают кристаллы желтого цвета. Продукт отфильтровывают, промывают 10 мл 5%-ного раствора едкого натра. Проверку чистоты продукта осуществляют методом тонкослойной хроматографии, в качестве элюента используется смесь ацетон : петролейный эфир - 1:1. После перекристаллизации из ацетона получают 1,29 г (85%) целевого продукта 2 в виде кристаллов с т.пл. 165°С.
Найдено, %: С 63,93; Н 3,67; N 8,63. C26H18ClN3O3S;
Вычислено, %: С 63,94; Н 3,69; N 8,61.
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 2,24 [3Н, c., СН3(Ar)]; 2,55 [6Н, с., 2 СН3(Ру)]; 6,55 [1Н, д., J=1,9, 6-HAr]; 7,12 [1Н, с., НРу]; 7,24 [1Н, м., 4-HAr]; 7,30 [1Н, д., J=7,2, 3-HAr]; 7,57 [1Н, с., NH]; 7,91 [1H, д., J=7,8, 3'-HAr]; 8,04 [1Н, д., J=7,8, 6'-HAr]; 8,11 [2Н, м., 6',5'-HAr].
Пример 3. Оценка соединений 1, 2 и 3 на антидотную активность на растениях подсолнечника в условиях полевого опыта.
Оценку антидотной активности заявляемых соединений формулы 1;2 соединения формулы

взятого за прототип, и сульфалена, взятого за эталон, осуществляли на экспериментальном поле ВНИИБЗР. Сульфален - фармацевтический антибактериальный препарат, проявляющий антидотные (по отношению к 2,4-Д) свойства [патент РФ №2043021, МПК A01N 43/90 (2006.01), C07D 495/04 (2006.01), А01Р 21/00 (2006.01). Антидот гербицидов гормонального действия 2,4-дихлорфеноксиуксусной и 4-амино-3,5,6-трихлорпиколиновой кислот. - №2043021; заявл. 14.05.1992; опубл. 10.09.1995]. Испытания проводили по следующей методике.
В полевых условиях растения подсолнечника сорта Флагман в фазу 10-16 листьев обрабатывали водным раствором бутилового эфира 2,4-дихлорфеноксиуксусной кислоты в дозе 18 г/га, а через 3 суток каждую из делянок отрабатывали растворами соединений формулы 1;2, соединения формулы 5 и эталона в воде в качестве антидотов, в дозе 30 г/га с нормой расхода рабочей жидкости 300 л/га с помощью ранцевого опрыскивателя. Расход рабочей жидкости 300 л/га обусловлен паспортными данными серийной опрыскивающей аппаратуры, которая в настоящее время используется в системе защиты растений.
В опыте предусмотрены следующие варианты:
- контроль - необработанные растения;
- «гербицид» - растения, обработанные гербицидом бутиловым эфиром 2,4-дихлорфеноксиуксусной кислоты;
- «гербицид + антидот» - растения, обработанные гербицидом, а затем и антидотом, в качестве которого использовали заявляемые соединения общей формулы 1;2;
- эталон - растения, обработанные сульфаленом.
Опыты проводили на делянках площадью 2,8 м2, повторность пятикратная. Уборку урожая подсолнечника проводили в момент полного созревания семян.
Антидотный эффект определяли по абсолютной величине прибавки урожая к гербицидному варианту и в процентах по формуле
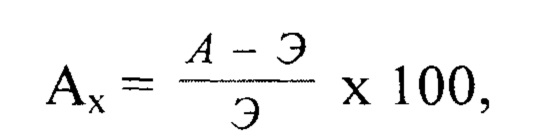
Ах - антидотный эффект, %;
А - урожай в варианте антидот + гербицид;
Э - урожай в варианте гербицид. Полученные данные статистически обработаны с использованием t-критерия Стьюдента.
Результаты испытаний представлены в таблице.
Таблица. Антидотная активность 7',9'-диметил-3'-арил-1'-спиро[инден-2,2'-пиридо[3',2':4,5]тиено[3,2-d]пиримидин]-1,3,4'(3'Н)-трионов (соединения 1;2), прототипа (соединение 5) и эталона (сульфален) в отношении 2,4-Д на подсолнечнике


Различия между вариантами достоверны при Р=0,90.
Как видно из таблицы, использование заявляемых 7', 9'-диметил-3'-арил-1'-спиро[инден-2,2'-пиридо[3',2':4,5]тиено[3,2-d]пиримидин]-1,3,4'(3'Н)-трионов формулы 1;2 в качестве антидотов позволяет обеспечить антидотный эффект на уровне 45-50% против 16% у прототипа и 12,6% у эталона, что позволяет сделать вывод об их применении в качестве антидотов.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-АЦИЛИРОВАННЫЕ 3-АМИНО-4,6-ДИМЕТИЛТИЕНО[2,3-b]ПИРИДИН-2-КАРБОКСАМИДЫ В КАЧЕСТВЕ АНТИДОТОВ 2,4-Д НА ПОДСОЛНЕЧНИКЕ | 2011 |
|
RU2475490C1 |
| АНТИДОТ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ НА ПОДСОЛНЕЧНИКЕ | 2014 |
|
RU2557550C1 |
| 3-амино-4-арил-N-[(2Z)-3-арил-4-фенил-1,3-тиазол-2(3Н)-илиден]-5,6,7,8-тетрагидротиено[2,3-b]хинолин-2-карбоксамиды, способ их получения и применение в качестве антидотов 2,4-Д на подсолнечнике | 2022 |
|
RU2786236C1 |
| 2-{ [3-циано-4-R-5,6,7,8-тетрагидрохинолин-2-ил]тио} -N[(2Z)-3-Ar-4-фенил-1,3-тиазол-2(3Н)-илиден]ацетамиды, способ их получения и применение в качестве антидотов 2,4-Д на подсолнечнике | 2022 |
|
RU2786234C1 |
| 3-Амино-4,6-диметил-N-(4-циано-3-(цианометил)-1H-пиразол-5-ил)тиено[2,3-b]пиридин-2-карбоксамиды в качестве антидотов 2,4-Д на подсолнечнике | 2024 |
|
RU2831200C1 |
| N-арил-3[(цианоацетил)амино]-4,6-диметилтиено[2,3-b]-пиридил-2-карбоксамиды в качестве антидотов 2,4-Д на подсолнечнике | 2021 |
|
RU2776586C1 |
| Замещенные 3-(3-амино-4,6-диметилтиено[2,3-b]пиридин-2-ил)-3-оксо-N-фенилпропанамиды в качестве антидотов 2,4-Д на подсолнечнике | 2022 |
|
RU2798590C1 |
| N-Арил-3-(1,3-диоксоизоиндолин-2-ил)тиено[2,3-b]пиридин-2-карбоксамиды в качестве антидотов 2,4-Д на подсолнечнике | 2023 |
|
RU2811272C1 |
| АНТИДОТЫ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2009 |
|
RU2421992C1 |
| 3-Имино-N-арил-2-хлорофуро[2,3-b]пиридин-2-карбоксамиды в качестве антидотов 2,4-Д на подсолнечнике и способ их получения | 2024 |
|
RU2829740C1 |
Настоящее изобретение относится к соединениям 7',9'-диметил-3'-арил-1'-спиро[инден-2,2'пиридо[3',2':4,5]тиено[3,2-d]пиримидин]-1,3,4'(3'Н)трионов формулы:
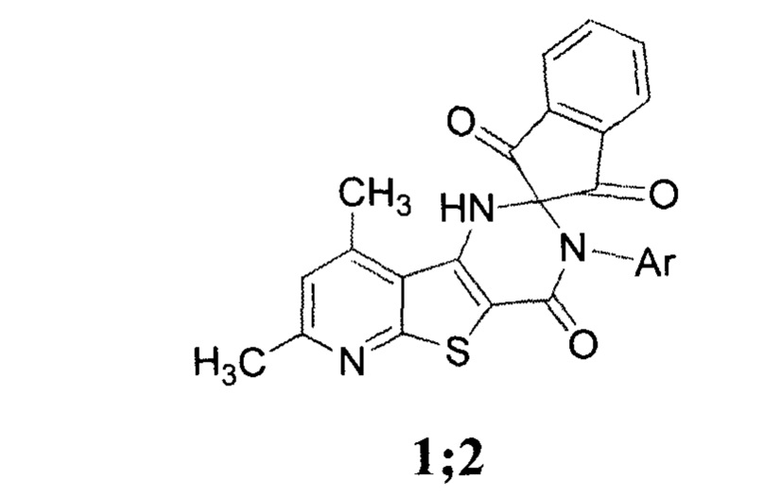
где 1 Ar=2-метилфенил; 2 Ar=2-метил-5-хлорфенил, обладающим антидотной активностью в отношении бутилового эфира 2,4-дихлорфеноксиуксусной кислоты. Также предложены способ получения и применение вышеуказанных соединений. Техническим результатом предлагаемого изобретения является расширение арсенала биологически активных веществ, применяемых в сельском хозяйстве в качестве антидотов. 3 н.п. ф-лы, 1 табл., 3 пр.
1. Соединения 7',9'-диметил-3'-арил-1'-спиро[инден-2,2'пиридо[3',2':4,5]тиено[3,2-d]пиримидин]-1,3,4'(3'Н)трионов формулы:

где 1 Ar=2-метилфенил;
2 Ar=2-метил-5-хлорфенил,
обладающие антидотной активностью в отношении бутилового эфира 2,4-дихлорфеноксиуксусной кислоты.
2. Способ получения соединений по п. 1, включающий взаимодействие 3-амино-4,6-диметил-N-(2-метил-5-хлорфенил)тиено[2,3-b]пиридин-2-карбоксамида или 3-амино-4,6-диметил-N-(2-метилфенил)тиено[2,3-b]пиридин-2-карбоксамида, растворенного в уксусной кислоте при нагревании, с нингидрином, взятых в мольном соотношении 1:1, в присутствии концентрированной серной кислоты и кипячении, в течение 5 мин с обратным холодильником, с последующим охлаждением и разбавлением холодной водой до концентрации уксусной кислоты 25%, а затем фильтрацией.
3. Применение соединений по п. 1 в качестве антидотов бутилового эфира 2,4-дихлорфеноксиуксусной кислоты на растениях подсолнечника через 3 суток, после их обработки гербицидом, в виде водного раствора в дозе 30 г/га с нормой расхода рабочей жидкости 300 л/га.
| ПРИМЕНЕНИЕ 2-[N-(2`-ИОДФЕНИЛ) КАРБОКСОАМИДО]-3-АМИНО-4,6-ДИМЕТИЛТИЕНО[2,3-b]ПИРИДИНА В КАЧЕСТВЕ СТИМУЛЯТОРА ПРОРАСТАНИЯ СЕМЯН ПОДСОЛНЕЧНИКА | 2005 |
|
RU2276845C1 |
| 6-МЕТИЛ-8-МЕТОКСИМЕТИЛ-3-ФЕНИЛИЗОКСАЗОЛО[3',4':4,5]ТИЕНО-[2,3-b]ПИРИДИН, ПРОЯВЛЯЮЩИЙ РОСТОРЕГУЛИРУЮЩУЮ И АНТИСТРЕССОВУЮ АКТИВНОСТЬ | 2001 |
|
RU2196772C1 |
| 2-ТИОАЛКИЛПИРИДИНЫ И ТИЕНО[2,3-B]ПИРИДИНЫ-АНТИДОТЫ ГЕРБИЦИДА ГОРМОНАЛЬНОГО ДЕЙСТВИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2003 |
|
RU2232762C1 |
| WO 2014073627 А1, 15.05.2014 | |||
| Дмитриева И.Г | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2021-08-30—Публикация
2020-07-30—Подача