Настоящее изобретение относится к способу экстрагирования, очистки и ферментативной модификации α'-субъединицы β-конглицинина.
В соответствии с данным изобретением β-конглицинин извлекают методом селективного экстрагирования из молотой обезжиренной сои с последующим осаждением путем обработки экстракта водным раствором этанола; обогащенную фракцию затем подвергают аффинной хроматографии с использованием металлов (MAC) в денатурирующих условиях с получением α'-субъединицы. Последнюю обрабатывают химотрипсином, после чего подвергают дополнительной стадии аффинной хроматографии с выделением аминоконцевой области указанного полипептида (с молекулярной массой 28000 Да).
Предшествующий уровень техники
Известная холестерин-понижающая способность сои и ее производных обусловлена содержанием в ней изофлавонов (Kirk и др., 1998) и протеинов (Anderson et. al, 1995).
Соевые белки состоят, главным образом, из глицининов (11S фракция) и конглицининов (7S фракция), причем последняя состоит из 3 субъединиц, называемых α', α и β-субъединицами (Thanh and Shibasaki, 1976). В ходе исследований, проведенных по изучению белкового состава сои, было установлено, что фракция 7S (Lovati et. al, 1992, 1996), в частности α'-субъединица (Manzoni et. al, 1998) способна активировать рецептор липопротеина низкой плотности (ЛНП), и таким образом, она ответственна, главным образом, за снижение холестерина в плазме крови. Фактически, при обработке линии клеток печени 7S-глобулином происходит индукция экстенсивной деградации α' и α-субъединиц и стимулирование активности ЛНП-рецептора, в то время как β-субъединицы не деградируют, и стимуляции указанного рецептора не происходит. Более того, соевые мутанты, у которых отсутствует α-субъединица во фракции 7S, не способны модифицировать активность ЛПН-рецептора даже при высоких концентрациях.
В итоге этих экспериментальных наблюдений стало необходимым получение β-конглицинина в чистом виде, а также извлечение и очистка α'-субъединицы, из которой затем можно получить специфические аминокислотные последовательности посредством ферментативной обработки без использования пептидного синтеза.
Способ, предложенный Than и др., (1975 и 1976), который был модифицирован в дальнейшем O'Keefe и др., (1991) позволяет разделять глицинины и β-конглицинины на основании их различных показателей растворимости при различных pH; однако его недостаток заключается в том, что наличие примесей в образцах все еще высоко, и необходимо для их очистки проводить гель-фильтрацию и аффинную хроматографию, которые дорогостоящи и представляют трудности для их осуществления в промышленном масштабе. Также модификация, предложенная Nagano и др., (1992), хотя и позволяет увеличить чистоту фракций, он остается дорогостоящим способом, который может быть использован только в лабораторной практике.
В последних публикациях Wu и др., (1999) сообщали об осуществлении способа разделения глицининов и конглицининов в масштабе исследований на пилотной установке. В соответствии с этим методом глицинины осаждают путем проведения двух последовательных водных экстракций при pH 8,5 с последующей обработкой супернатанта с помощью бисульфитного раствора при концентрации 0,98 г/л, в то время как конглицинины осаждают путем прибавления 0,25 M NaCl к маточным жидкостям, полученным при осаждении глицининов, с последующим доведением pH до 4,8. Указанный способ позволяет обрабатывать большие количества исходного материала, а также обеспечивает высокие выходы продукции по белку, однако чистота полученных фракций все еще недостаточна; β-конглицинин, в частности претерпевает деградацию, по-видимому, во время диафильтрации водой, но эта обработка необходима для снижения избыточного количества бисульфитных ионов и удаления солей.
Вышеуказанные способы не только не обеспечивают выход чистых β-конглицининов, но прежде всего не обеспечивают разделение и очистку α'-субъединицы.
Согласно настоящему изобретению обогащенную β-конглицинином твердую фракцию получают путем экстрагирования обезжиренной молотой сои в водной среде в соответствии со стандартными методами с последующим осаждением супернатанта при использовании водного раствора этанола; полученную фракцию затем очищают методом аффинной хроматографии с использованием металлов (MAC) в денатурирующих условиях, что дает чистую α'-субъединицу, которую подвергают ферментативной обработке химотрипсином с получением аминоконцевой области, которая, как оказывается, обладает высокой активностью по активации ЛНП-рецептора.
Подробное описание изобретения
Настоящее изобретение относится к способу селективного экстрагирования, очистки и ферментативной модификации α'-субъединицы соевого β-конглицинина, характеризующегося тем, что указанный способ включает следующие стадии:
а) экстрагирования обезжиренной молотой сои водным раствором бисульфита натрия при слабокислом pH c получением растворимой белковой фракции, обогащенной β-конглицинином;
b) осаждения указанной β-конглицининовой фракции из стадии a) путем обработки этанолом;
c) очистки осажденной фракции из стадии b) методом аффинной хроматографии с использованием металлов (MAC) в денатурирующих условиях с выделением α'-субъединицы;
d) ферментативной обработки полученной из стадии c) α'-субъединицы протеолитическим ферментом и последующей очистке с помощью МАС хроматографии;
e) осаждения полученной α'-субъединицы органическими растворителями.
β-конглицинин обогащают по методике, проиллюстрированной на фиг.1. В качестве исходного материала используют соевую муку, обезжиренную путем удаления липидной фракции с помощью растворителей. Этот материал экстрагируют водным раствором бисульфита натрия при слабокислом pH. Используют раствор, который по объему в 14-16 раз больше массы исходного материала, предпочтительно от 14,5 до 15,5 раз. Концентрация бисульфита варьирует в интервале от 0,80 до 1,20 г/л, предпочтительно от 0,90 до 1,10 г/л и более предпочтительно от 0,95 до 1,05 г/л. Экстрагирование осуществляют в течение промежутка времени от 14 до 18 часов при температуре в интервале от -2 до 8°С. В соответствии с предпочтительным вариантом осуществления изобретения экстрагирование осуществляют в течение 16 часов с использованием 15 объемов бисульфитного раствора при концентрации бисульфита 0,98 г/л, при pH 6,4 и при температуре в интервале от 0 до 4°С.
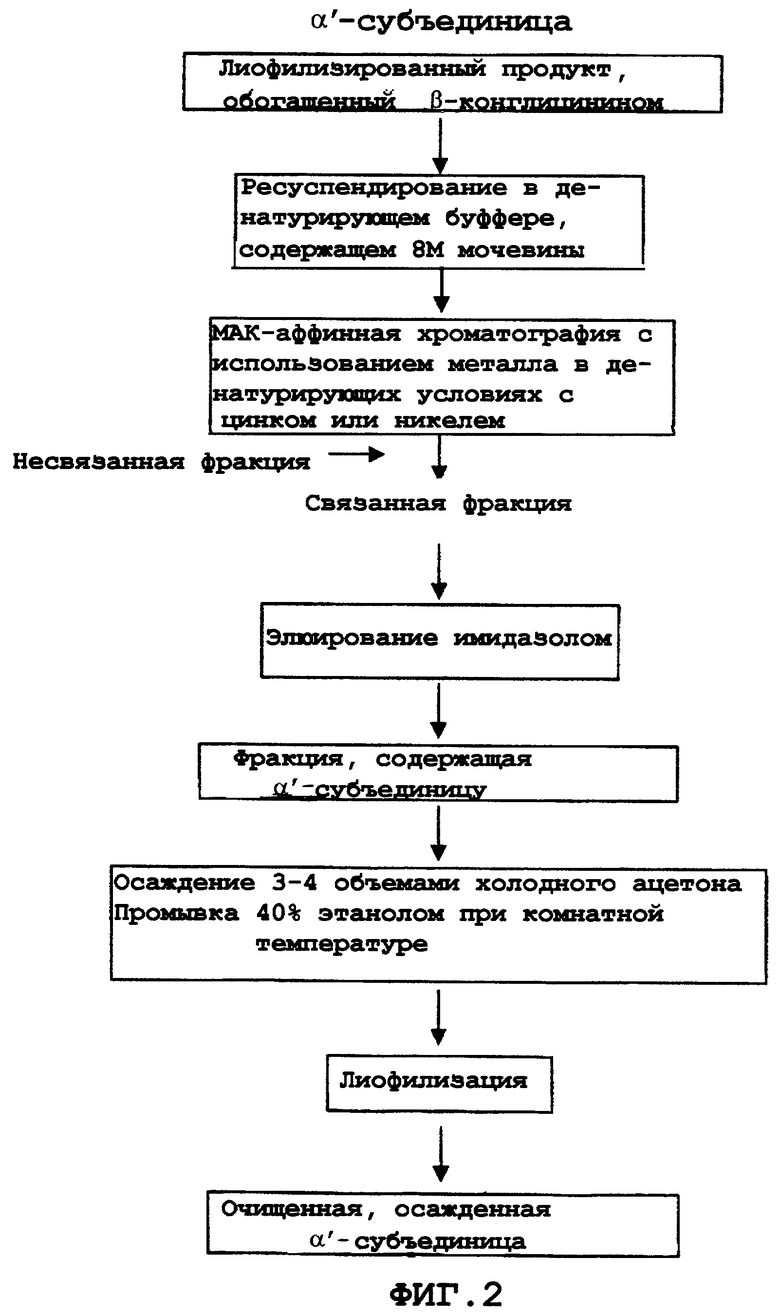
При таких значениях pH и температуры растворимость глицининов очень низка, и поэтому они осаждаются вместе с другим нерастворимым материалом. Преципитат затем отделяют центрифугированием и растворимую фракцию обрабатывают 35-60% (об./об.) водным этанолом, предпочтительно 40% водным этанолом при температуре в интервале от 20 до 30°С, предпочтительно при комнатной температуре, равной 25°С. Супернатант центрифугируют и отделяют, и затем образовавшийся преципитат, главным образом, состоящий из β-конглицинина, лиофилизируют. Полученный порошок подвергают следующей стадии обработки, показанной на фиг.2.
Выбор для разделения и очистки α'-субъединицы с помощью MAC (Ostrove и Weiss, 1990) зависит от ее способности образовывать координационную связь с ионами металлов, таких как Zn2+ и Ni2+, вследствие того, что эта субъединица имеет более высокое содержание гистидина, чем α- и β-субъединицы (Thanh и Shibasaki, 1978).
Используют матрицу, конъюгированную с цинком или никелем, предпочтительно с цинком. В соответствии с предпочтительным вариантом осуществления изобретения матрица состоит из агарозы, модифицированной иминодиуксусной кислотой. Лиофилизированный белковый материал суспендируют в денатурирующем буфере, состоящем из 50 мМ Трис, 0,5 M NaCl, pH 7,2 и содержащего от 5 до 8 M мочевины, предпочтительно 5 M мочевины. В этих условиях α'-субъединица избирательно связывается с указанной матрицей, а α- и β-субъединицы могут быть отделены путем элюирования с использованием вышеуказанного буферного раствора; α'-субъединицу затем элюируют с помощью 0,1 M имидазола в том же самом буфере или в дистиллированной воде.
Белковую фракцию, обогащенную по α'-субъединице, собирают и обрабатывают органическими растворителями, используемыми для осаждения белков, предпочтительно холодным ацетоном. Ацетон используют в объеме, варьирующем от 2 до 5 раз, большем чем объем белковой фракции, предпочтительно от 3 до 4 объемов, при температуре в интервале от -10 до -30°С, предпочтительно в интервале от -15 до -25°С. В соответствии с предпочтительным вариантом осуществления изобретения используют 3 объема ацетона при температуре -20°С. Полученный преципитат отделяют методом центрифугирования, затем ресуспендируют в этаноле, предпочтительно в 95% этаноле, затем опять центрифугируют и сушат методом лиофилизации. Полученный лиофилизат содержит 94% белкового материала, который в 10 раз более обогащен по сравнению с исходным материалом по содержанию α'-субъединицы.
В таблице 1 приведены выходы по β-конглицинину и α'-субъединице в результате экстракции из соевой муки.
Пептидные фрагменты α'-субъединицы получают из лиофилизата, полученного на предыдущей стадии, который подвергают ферментативному превращению с использованием протеолитического фермента. В соответствии с предпочтительным вариантом осуществления изобретения в качестве протеолитического фермента используют химотрипсин, и полученный фрагмент состоит, главным образом, из аминоконцевого участка, который имеет молекулярную массу 28000 Да.
Методика заключается в следующем: лиофилизат, полученный на предыдущей стадии, растворяют при концентрации 5 мг/мл в 0,2 М растворе NH4HCO3, содержащем 1,6 M мочевины при pH в интервале от 7,5 до 8,5. К субстрату прибавляют химотрипсин из расчета от 1:10 до 1: 50, предпочтительно 1:25 мас./мас., и инкубируют при температуре 37°С при перемешивании в течение 24 часов. После этого осуществляют стадию МАС по методике, описанной выше.
Полученный продукт после элюирования имидазолом содержит три полипептидных фрагмента, причем основной фрагмент имеет молекулярную массу 28000 Да, и составляет N-концевую область α'-субъединицы.
При введении α'-субъединицы и химотрипсинового фрагмента крысам (Таблица 2) оказалось, что оба способны заметно снижать уровни холестерина и суммарных триглицеридов в плазме крови. В частности, химотрипсиновый фрагмент, как оказалось, не только более эффективен в снижении уровней холестерина в плазме крови, чем другие компоненты сои, но также по сравнению с клофибратом, причем он позволяет получить сопоставимые результаты по триглицеридам.
На основе результатов биологических экспериментов можно сделать предположение о том, что продукты, получаемые в соответствии со способом настоящего изобретения, в частности α'-субъединица и ее фрагменты, могут быть использованы в качестве лекарственных средств, в особенности для лечения патологий, которые требуют снижения уровней холестерина и/или триглицеридов в плазме крови. Указанные соединения можно использовать в чистом виде, или в комбинации с другими активными средствами и в смеси с подходящими носителями, которые используют для получения фармацевтических композиций, в частности для лечения гиперлипидемий. Более того, их можно использовать для получения добавок или пищевых продуктов в схемах диетического питания, назначаемых при вышеуказанных состояниях.
Примеры
Первая стадия. Очистка 7S-глобулина из сои
В качестве исходного материала использовали размолотую сою, обезжиренную в соответствии с методом Soxhlet, используя пентан в качестве растворителя.
Белки экстрагировали с использованием раствора NaHSO3 при концентрации 0,98 г/л в количествах, в 15 раз превышающих объем обезжиренной размолотой сои, в течение 16 часов при температуре в интервале от 0 до 4°С, поддерживая pH при 6,4. После центрифугирования супернатант обрабатывают 40% этанолом (об./об.) при комнатной температуре. Полученный преципитат, обогащенный по β-конглицинину и содержащий α'-субъединицу при концентрации, которая в два раза выше, чем у исходного материала, лиофилизируют.
Вторая стадия. Очистка α'-субъединицы
Обогащенную β-конглицинином фракцию ресуспендируют в денатурирующем буфере (50 мМ Трис, 0,5M NaCl, pH 7,2), содержащем 5 M мочевины и очищают при помощи MAC на матрице из агарозы, модифицированной иминодиуксусной кислотой (фирмы Sigma), конъюгированной с ионами цинка. Несвязанный белковый материал элюируют с помощью того же самого буфера, приведенного выше, в то время как связанный белковый материал, состоящий главным образом из α'-субъединицы, элюируют с помощью 0,1 M имидазола в том же самом буфере или в дистиллированной воде.
Обогащенные α'-субъединицей фракции обрабатывают 3-4 объемами ацетона при температуре -20°С. Полученный преципитат суспендируют в 40% этаноле при комнатной температуре, затем центрифугируют и сушат методом лиофилизации. Полученный порошок содержит 94% белков и представляет собой в 10 раз более обогащенный продукт по сравнению с исходным материалом по содержанию α'-субъединицы.
Третья стадия. Ферментативная обработка α'-субъединицы
Лиофилизат, полученный на предыдущей стадии, растворяют при концентрации 5 мг/мл в 0,2 М растворе NH4HCO3, содержащем 1,6 M мочевины при pH в интервале от 7,5 до 8,5. Полученный раствор затем обрабатывают химотрипсином в соотношении 1:25 мас./мас. к белковому субстрату и инкубируют при перемешивании при температуре 37°С в течение 24 часов, после этого осуществляют очистку с использованием МАС по методике, описанной выше. Продукт, оставшийся на смоле и элюированный 0,1М имидазолом, содержит три полипептидных фрагмента, причем основной фрагмент из них имеет молекулярную массу 28000 Да и составляет N-концевую область α'-субъединицы.
Биологические эксперименты
Животные
В экспериментах использовали самцов крыс CD SPF/VAF весом 75-100 г. Животных содержали в макролоновых клетках (по 4-5 животных на клетку) в условиях с автоматическим регулированием света (циклы по 12 часов света и 12 часов темноты) при температуре (21±1°С) и относительной влажности (60±5%).
Протокол экспериментов
Через 7 дней содержания животных разделяли рандомизированным методом на семь групп по 20 крыс в каждой группе (Таблица 2). В течение 28 дней одна группа получала обычный пищевой рацион (код 014RF25C; от Mucedola S.r.l., Settimo Milanese, MI, Италия), в то время как другие получали рацион с гипохолестеринемическим действием, содержащим 1% холестерина, 0,5% холевой кислоты и 25% гидрогенизированного кокосового масла (партия 332000, изготовленная 01.09. 2000 в Laboratorio Dottori Piccioni, Gessate, MI, Италия), при этом животные имели доступ к воде без ограничения. Этот рацион крысы получали ежедневно (по 40 г в 09.00 утра), при этом непотребленный остаток пищи взвешивали. Лечение осуществляли по следующей методике.
Группа 1 (контрольная): животные получали обычный пищевой рацион и им перорально вводили в течение 28 дней 0,5% раствор карбоксиметилцеллюлозы.
Группа 2: животные получали гиперхолестеринемический пищевой рацион и им перорально вводили в течение 28 дней 0,5% раствор карбоксиметилцеллюлозы.
Группа 3: животные получали гиперхолестеринемический пищевой рацион и им перорально вводили в течение 28 дней клофибрат в дозе 200 мг/кг.
Группа 4: животные получали гиперхолестеринемический пищевой рацион и им перорально вводили в течение 28 дней экстракт общего белка сои (TPE) в дозе 200 мг/кг.
Группа 5: животные получали гиперхолестеринемический пищевой рацион и им перорально вводили в течение 28 дней β-конглицинин в дозе 50 мг/кг.
Группа 6: животные получали гиперхолестеринемический пищевой рацион и им перорально вводили в течение 28 дней α'-субъединицу в дозе 10 мг/кг.
Группа 7: животные получали гиперхолестеринемический пищевой рацион и им перорально вводили в течение 28 дней фрагмент α'-субъединицы, полученный обработкой химотрипсином, в дозе 1 мг/кг.
Суммарное содержание холестерина и триглицеридов в плазме измеряли в конце 28-дневного периода лечения и через 16 часов голодной выдержки. Испытуемых животных усыпляли этиловым эфиром и делали забор крови из нижней полой вены в пробирки с EDTA(1мг/мл). После центрифугирования в течение 15 минут при 4°С при скорости центрифуги 3000 об/мин плазму извлекали, замораживали и хранили при -20°С до определения показателей.
Суммарные концентрации холестерина и триглицеридов в плазме (результаты приведены в Таблице 2) определяли стандарными методами иммуноферментного анализа.
Источники информации
Anderson J.W., Bryan M.J., Cook-Newall M-E., 1995, N. Engl. J. Med. 333, 276-282.
Kirk E.A., Sutherland P., Wang S.A., Chait A., LeBoeuf R.C., 1998 Journal of Nutrition. 128, 954-959.
Lovati M.R., Manzoni C., Corsini A., Granata A., Frattini R., Fumagalli R., Sirtori C., 1992, J. Nutr. 122, 1971-1978.
Lovati M.R., Manzoni C., Corsini A., Granata A., Fumagalli R., Sirtori C., 1996 J. Nutr. 126, 2831-2842.
Manzoni C., Lovati M.R., Gianazza E., Morita Y., Sirtori C., 1998 J. Agric.Food. Chem. 46,2481-2484.
Nagano T., Hirotsuka M., Mori H., Kohyama K., Nishinari K., 1992 J. Agric. Food Chem. 40,941-944.
O'Keefe S.F., Wilson L.A., Resurreccion A. P., Murphy P.A., 1991 J. Agric. Food. Chem. 39,1022-1027.
Ostrove S., Weiss S., 1990, Methods in Enzimology 182, 371-379.
Thanh V.H., Okubo K., Shibasaki K., 1975 Plant Physiol. 56: 19-22.
Thanh V.H., Shibasaki K., 1976 J. Agric. Food. Chem. 24, 1117-1121.
Thanh V.H., Shibasaki K., 1978 J. Agric. Food Chem. 26, 695-698.
Wu S., Murphy P.A., Johnson L.A., Fratzke A.R., Reuber M.A. 1999 JAOCS 76, 285-293.
Изобретение относится к способу экстрагирования, очистки и ферментативной модификации α' - субъединицы β-конглицина. Способ экстрагирования, очистки и ферментативной модификации α' - субъединицы β-конглицинина характеризуется тем, что β-конглицинин извлекают методом селективного экстрагирования из молотой обезжиренной сои с последующим осаждением путем обработки экстракта водным раствором этанола. Обогащенную фракцию затем подвергают аффинной хроматографии с использованием металла (MAC) в денатурирующих условиях с получением α'-субъединицы, которую затем обрабатывают химотрипсином, после чего подвергают дополнительной обработке с использованием MAC с выделением аминоконцевой области указанного полипептида (с молекулярной массой 28000 Да). Предлагаемый способ позволяет повысить чистоту выделяемой фракции. 7 н. и 3 з.п. ф-лы, 2 ил., 2 табл.
a) экстрагирования обезжиренной молотой сои водным раствором бисульфита натрия по объему, в 14-16 раз превышающему массу исходного материала, содержащего 0,98 г/л бисульфита натрия при рН, равном 6,4, с получением обогащенной β-конглицинином растворимой белковой фракции;
b) осаждения указанной β-конглицининовой фракции из стадии а) путем обработки 40% этанолом;
c) очистки осажденной фракции из стадии b) методом аффинной хроматографии с использованием металлов (MAC) на матрице из агарозы, модифицированной иминодиуксусной кислотой, конъюгированной с цинком или никелем в денатурирующих условиях с выделением α' - субъединицы, при этом денатурирующим агентом является мочевина;
d) осаждения α' - субъединицы органическими растворителями, которыми является ацетон;
е) ферментативной обработки α' - субъединицы со стадии с) протеолитическим ферментом химотрипсином с последующей очисткой ее с использованием (MAC);
обогащенную β-конглицинином фракцию и α' - субъединицу стабилизируют лиофильной сушкой.
| WUS et al "Pilot-Plant Fractionation of Soybaen Glicinin and β-Conglicinin" JOURNAL OF THE AMERICAN OIL CHEMISTS SOCIETY, vol.76, no.3, 1999,p.285-293 | |||
| ДЖУИЧ И | |||
| и др | |||
| ПРОБЛЕМНАЯ СТАТЬЯ | |||
| Предотвращение (профилактика) дефицита селена у человека с помощью селенированной сои | |||
| Микроэлементы в медицине, 2001, т.2, ч.4, с.5 | |||
| ШЕРБАКОВ В.Г., ИВАНИЦКИЙ |
Авторы
Даты
2007-06-20—Публикация
2003-01-27—Подача