Изобретение относится к способу для поледовательноспецифического расщепления полученных биотехнологией протеинов с применением IgA-протеаз (называемых также и газами) и особенно к способу для получения рекомбинантных протеинов или пептидов в прокариотах и к последующему удалению N-концевой последовательности.
Получение протеинов методом биотехнологии осуществляют с применением микроорганизмов, которые легко культивируются и позволяют простым путем получать протеин. Подходящими микроорганизмами являются для этого, например, грамотрицательная бактерия Escherichia coli, грамположительная бактерия Streptococcus carnosus и хлебопекарные дрожжи Saccharomyces cerevisiae. Однако экспрессия аутентичных чужеродных генов в таких микроорганизмах часто имеет недостатки. Например в E. coli обусловленный трансляцией аминоконцевой остаток метионина природных протеинов протеза в большинстве случаев эффективно отщепляется. Однако при чужеродных белках это отщепление первого остатка метионина происходит в большинстве случаев параллельно. Поэтому подходящим методом является получение таких протеинов с определенным аминоконцом, их образование сначала в форме слившихся протеинов и затем их отщепление посредством определенной последовательноспецифической протеазы.
Кроме того, в противоположность аутентичным протеинам такие слившиеся протеины имеют то преимущество, что они укрупняются в клетке микроорганизма и образуют плотные осажденные тела ("Inclusion Bodies"), которые с небольшим усилием можно отделять от других частей клетки и тем самым облегчать выделение и очистку желаемого протеина. С другой стороны, протеины-носители, которые при помощи способов генной инженерии прежде всего сливаются с собственно желательным протеином, придают слившемуся партнеру особую устойчивость против неспецифического протеолитического расщепления; проблема расщепления полипептидов, которые считаются чужеродными, относится особенно к биотехнологическому получению меньших пептидов. Другие протеины-носители снова позволяют распределять желательные протеины в определенных отделениях клеток, из которых их можно особенно легко очищать, где они особенно стабильны и/или где они доступны для испытательных целей. Наконец, протеины-носители могут иметь также специальные свойства, которые позволяют проводить эффективную очистку, например хроматографией сродства. Для многих целей применения предпочитают слившиеся протеины, которые несут протеин-носитель на аминоконце и желательный протеин на карбоксильном конце. Но в определенных случаях может быть также желательным обратный вариант или связывание желательного протеина с двумя партнерами слияния. Далее, может быть выгодным обратное повторение желательного протеина в пределах слияния.
Для получения желательного протеина в свободной форме из подобного слияния необходимо отщепление ковалентно связанных партнеров слияния друг от друга. В принципе, этого можно достигнуть при помощи химических или биохимических (ферментативных) способов. Однако при этом в большинстве случаев имеет место ограниченная специфичность имеющихся до сих пор способов; так как для получения желательного протеина важно, чтобы подобное расщепление происходило в последовательности между партнерами слияния, т.е. в переходной области, но ни в коем случае дополнительно внутри самого желательного протеина. Поэтому расщепление партнеров слияния должно быть высокоспецифичным.
Применяемыми до сих пор химическими способами для последовательноспецифического разделения слившихся протеинов являются, например, расщепление бромцианом на аминокислоте метионина внутри протеина и расщепление между аминокислотами Asp.'Pro в кислой среде с применением муравьиной кислоты. Но эти способы пригодны только в том случае, если специфическое место расщепления в желательном протеине, независимо от переходной области к партнеру слияния, не повторяется второй раз. Однако, в общем, биохимические способы расщепления следует предпочитать химическим способам, так как первые в большинстве случаев можно осуществлять при физиологических или по крайней мере при химически мягких условиях реакции, которые не причиняют ущерба желательному протеину.
Биохимические способы для расщепления слившихся протеинов основываются на применении по возможности специфических протеаз. Например, трипсин расщепляют следующие за аминокислотами аргинин или лизин пептидные связи внутри протеинов. Повышение специфичности может быть достигнуто предшествующей химической модификацией аминокислоты LYS, в результате чего специфическое распознавание можно ограничить аминокислотой аргинин. Другой примененной в биотехнологии протеазой является Клострипаин; этот фермент расщепляет пептидные связи между аминокислотой аргинин и любой следующей за ним аминокислотой. Обзор о применяемых до сих пор ферментативных способах для расщепления слившихся протеинов был составлен F.A. О Marston (B [D.M. Clover, E.] : DNA cloning III, JRL PRESS Оксфорд и Вашингтон DC, 1987). Ферментативные способы расщепления ограничивают также в результате того, что специфическая для точки расщепления аминокислота (аминокислоты) может встречаться одновременно также в самом желательном протеине. Поэтому для биохимического расщепления слияний протеинов пригодны особенно ферменты, которые для расщепления распознают не только аминокислоту, но и последовательность аминокислот; так как вероятность того, что определенная последовательность аминокислот кроме в точке расщепления между партнерами слияния встречается еще раз в самом желательном протеине, тем незначительнее, чем больше число аминокислот, необходимых для распознавания и расщепления последовательности расщепления.
Протеазы, которые очень специфически перерезают определенный протеин, известны. Хотя большинство таких селективных протеаз (которые встречаются, например, в комплементарной системе и в системе свертывания крови человека) расщепляет в определенной точке субстрата; однако при переносе соответствующей области расщепления в другой протеин (например, слившийся протеин) подобные протеазы, как правило, больше не способны расщеплять. Причины для этого разнообразные и заключаются, например, в распознавании определенной вторичной или третичной структуры в субстрате протеазой или в недоступности точки расщепления в слившихся протеинах.
Список последовательноспецифических протеаз, которые применяются до сих пор для расщепления слившихся протеинов, содержит в настоящее время фактор Xa. Эта протеаза перерезает специфически последовательность расщепления Ile-Glu-Gly-Arg X, причем . . показывает точку расщепления и X показывает любую аминокислоту. Однако оказывается, что и эту протеазу нельзя применять универсально для расщепления слившихся протеинов, которые несут соответствующую последовательность расщепления в своей переходной области; часто такие субстраты (т.е. слившиеся протеины, которые содержат желательный протеин, ковалентно связанный с протеином-носителем) вообще не расщепляют, расщепляют в очень небольшой степени или только в растворимой форме.
Особенно значительным является эффективное расщепление слившихся протеинов при получении рекомбинантных протеинов в прокарионтных организмах. А именно, там требуется клонирование ДНК-последовательности, которая содержит AUG в качестве начального кодона перед началом собственной ДНК-последовательности. Как результат этого в прокарионтах, как, например, E. coli, экспримируют рекомбинантный протеин, который содержит остаток метионина в положении-1 аминокислоты.
Однако во многих случаях требуется получение не содержащих метионина в положении-1 рекомбинантных протеинов. Получение таких протеинов из прокарионтов можно осуществлять, например, через метионин-специфическую пептидазу, которая отщепляет N-концевой метионин. Однако этот способ связан с очень большими затратами, так как отщепление можно проверить только через последовательность протеинов. Кроме того, разделение содержащего метионин в положении-1 и не содержащего метионин протеина по причине почти идентичного молекулярного веса является очень трудным и тем самым может быть достигнуто только неполностью.
PCT-заявка W084/02351 раскрывает отщепление N-концевых аминокислот от слившегося протеина. При этом многие аминокислоты протеина от N-конца благодаря постепенному отщеплению экзопептидазой, предпочтительно лейцинпептидазой, могут быть удалены до последовательности X - Pro. Последовательность X - Pro отщепляют из этого продукта или в две стадии, или в 1 стадию реакции с применением постпролин-дипептидил-аминопептидазы (EC 3.4.14). Однако этот способ имеет тот недостаток, что обусловленный постепенным отщеплением аминокислот N-конца протеина должен образовываться не единый продукт, в всегда смесь продуктов, которая наряду с желательным продуктом содержит как неполностью, так и в значительном количестве отщепленные протеины.
Другой способ для ферментативного расщепления слившегося протеина известен из европейского патента N 0020290. При этом способе фермент Коллагеназы применяют для отщепления слившейся части протеина с определенной последовательностью распознавания. После этого можно удалять затем другие аминокислоты слившейся части в результате дальнейшей ферментативной обработки. Однако было установлено, что Коллагеназа и также другие эндопептидазы имеют лишь небольшую специфичность (см. Biochim Biophys Acta 271 (1972), 133-144). Кроме того, Коллагеназы активны только при протеинах, которые имеют специфическую пространственную структуру.
Применение уже упомянутого фактора Xa для отщепления N-концевой части слияния протеинов известно. Однако и это способ наряду с уже упомянутыми проблемами эффективности расщепления имеет другие недостатки, а именно такого типа, что, по всей возможности, распознаются и расщепляются также внутренние последовательности протеина. Кроме того, следует выделять фактор Xa из сыворотки крови крупного рогатого скота, вследствие чего при отщеплении применяемых в терапии протеинов требуется связанная с затратами очистка и аналитика, чтобы обнаруживать возможные имеющиеся факторы патогенности или вирусы.
Различные виды патогенных бактерий (например, рода Neissria, как Neisseria gonorrhoea и Neissria meningititis или рода Haemophilus, как Haemophilus influenrae и Haemophilus aegypticus, которые развиваются на слизистой оболочке человека, выделяются между собой своей последовательностью, близкой к родственным протеазам, которые специфичны для IgAl человека и поэтому, резюмируя, обозначаются как IgA - протеазы или игазы. Иммуноглобулин IgAl является важной компонентой секретного иммунного ответа, который должен защищать против инфекций таких патогенных организмов (Обзор: Jornfeld и Plaut, Rev, Jnfect. Dis 3 (1981), 521-534). Наряду с этим IgA - протеаза расщепляет также свой собственный протеин-предшественник в результате аутопротеолиза. Образование и действие IgA-протеазы из Neisseria gonorrhoeal MSll в аутентичном штамме бактерий и в грамотрицательных клетках хозяина уже было подробно описано (патент ФРГ N 3622221.6, EP N 0254090).
IgA-протеаза расщепляет следующие последовательности распознавания, как, например, описано у Pohlner (Nature 325) (1987), 458-462):
1. Pro - Ala - Pro' Ser - Pro
2. Pro - Pro .'. Se - Pro
3. Pro - Pro .'. Ala - Pro
4. Pro - Pro .'. Thr - Pro
При этом символ .'. обозначает соответственно точку разреза IgA-протеазой. Клонирование IgA-протеазы описано выше, например, у Pohlner и др., 1987.
Поэтому задачей настоящего изобретения была разработка усовершенствованного способа для биохимического (ферментативного) расщепления слившихся протеинов, чтобы полученные методом генной технологии слившиеся протеины, состоящие из любых партнеров слияния и специфической последовательности расщепления в переходной области, можно было применять как субстрат для получения желательных протеинов по возможности с высоким выходом и со способностью к воспроизведению.
Эту задачу решали методом генной технологии путем введения точки распознавания или последовательности расщепления Pro'X - Pro в переходную область слившихся протеинов и путем специфического расщепления этой последовательности расщепления IgA-протеазой на обозначенной символом .'. точке расщепления, причем X обозначает преимущественно аминокислоты Ser, Thr Ala и особенно предпочтительно Ser или Thr, но может обозначать также другие аминокислоты.
Поэтому предметом настоящего изобретения является способ для ферментативного расщепления слившихся протеинов и для получения желательных частей этих слившихся протеинов, который отличается тем, что
(1) переходную область, в которой связаны друг с другом две части слившегося протеина, модифицируют при помощи геннотехнических средств таким образом, что в этой переходной области образуется по меньшей мере одна точка распознавания IgA-протеазы с последовательностью аминокислот Y - Pro .'. X - Pro, причем X может быть любой аминокислотой и Y - одной или несколькими любыми аминокислотами,
(2) получающийся из стадии (1) слившийся протеин расщепляют IgA-протеазой на обозначенном символом . ' . положении точки распознавания и
(3) после расщепления получают одну часть или несколько желательных частей слившегося протеина.
Под понятие "IgA - протеазы" по настоящему изобретению попадают протеазы, которые специфически расщепляют IgA, которые описаны, например, в Rev. Infekt. Dis. 3(1981 521-534). Но пригодны также и рекомбинантные IgA - протеазы, которые описаны, например, в заявке на патент ФРГ N 3622221, Proc. Natl. Acad Sci США 79 (1982) 7881 - 7885, Proc. Natl. Acad Sci США 80 (1983) 2681 - 2685, Nature 325 (1987) 458 - 462 и ЕМВО Jour 3 (1984) 1595 - 1601.
При способе по изобретению происходит модификация переходной области слившихся протеинов преимущественно таким образом, что в переходную область слившегося протеина встраивают последовательности нуклеотидов, которые кодируют точку распознавания IgA-протеазы или часть ее, причем эти последовательности нуклеотидов встраивают впереди или/и позади одного или нескольких кодирующих желательные части слияния протеинов ДНК - отрезков. Для этой цели применяют преимущественно последовательности нуклеотидов, которые были синтезированы химическим путем.
Неожиданно было установлено, что способ по изобретению особенно пригоден также для расщепления слившихся протеинов, которые первоначально (т.е. перед модификацией переходной области) не имеют никакой природной точки распознавания Iga-протеазы.
Точка распознавания IgA-протеазы для способа изобретения имеет согласованную последовательность аминокислоты Y - Pro .'. X - Pro. При этом X может обозначать любую аминокислоту и Y может обозначать одну или несколько любых аминокислот. Преимущественно X обозначает серин, треонин или аланин, особенно преимущественно серин или треонин. Y обозначает преимущественно многие аминокислоты, которые оканчиваются последовательностью Pro, Pro - Ala, Arg - Pro, Pro - Arg - Pro, Ala - Pro - Arg - Pro или Pro - Ala - Pro - Arg - Pro.
Поэтому способ по изобретению раскрывает, что точку распознавания IgA - протеазы по меньшей мере с согласованной последовательностью расщепления Pro . '. X - Pro можно вводить в переходную область любого слившегося протеина, например, между протеином-носителем и желательным протеином, и использовать для отщепления и получения желательного протеина благодаря IgA-протеазе. При этом в последовательности расщепления Pro .'. X - Pro применяют преимущественно аминокислоты Ser, Ala или Thr в положении X. Для дальнейшей оптимизации расщепления в указанной точке можно предвключать к последовательности расщепления другие специальные аминокислоты, особенно аминокислоту Pro.
Особенно предпочитают последовательность аминокислот
a) Pro - Ala - Pro .'. Ses - Pro
b) Pro - Pro .'. Ser - Pro,
c) Pro - Arg - Pro - Pro .'. Ala - Pro,
d) Pro - Pro .'. Thr - Pro,
e) AlA - Pro - Arg - Pro - Pro .'. Thr - Pro или
f) Pro - AlA - Pro - Arg - Pro - Pro .'. Thr - Pro.
При применении способа по изобретению к расщеплению слившихся протеинов, в которых желательный протеин включен после протеина-носителя, образуется после расщепления IgA-протеазой протеин, аминоконец которого охарактеризован последовательностью X - Pro. Эта последовательность как часть желательного протеина может быть выгодной, невыгодной или же незначительной. Выгодна эта последовательность, в общем, тогда, когда полученный методом генной технологии желательный протеин и в своей природной форме содержит на своем аминоконце обе соответствующие аминокислоты X - Pro. Охарактеризованные аминоконцевым X - Pro протеины, которые имеют важное значение в биотехнологии, встречаются в природе.
Способ по изобретению, в противоположность всем другим известным способам для расщепления слияний протеинов, имеет те преимущества, что его неожиданно можно применять универсально к слившимся протеинам, которые в своей переходной области несут указанную последовательность расщепления и что его можно применять также к нерастворимым, растворимым, соединенным мембранной и связанным клеткой слияниям протеинов. Кроме того, в качестве особого преимущества способ дает возможность расщеплять слившиеся протеины или слияния протеинов в форме осажденных тел такого рода, как они получаются в микроорганизмах и где их как таковые легко обогащать. Другое преимущество способа состоит в том, что примененный расщепляющий фермент, игазу, можно получать с небольшими затратами из питательных сред непатогенных бактерий.
Встраивание последовательности расщепления для Jgas в переходную область слияния протеинов осуществляют средствами генной технологии. Так, например, последовательность нуклеотидов или нуклеотидную последовательность, которая кодирует последовательность расщепления или часть его, можно синтезировать химическим путем и встраивать при помощи известных средств генной технологии между ДНК - отрезками для протеина - носителя и желательного протеина. Соответственно можно встраивать также природную последовательность нуклеотидов, которая кодирует подходящую последовательность расщепления или часть ее. Кодирующий слияние протеинов ген ставится преимущественно под контроль надлежащих (преимущественно индуцируемых) сигналов экспрессии, так что становится возможным соответствующее требованиям производство слившихся протеинов. В качестве клеток-хозяев для производства слияний протеинов можно применять прокарионтные или эукарионтные (как растительные, так и животные) клетки; но возможны также не содержащие клеток системы. Примененные при этом протеины-носители могут иметь любые функции, в зависимости от того, какие свойства они должны придавать слиянию протеинов, как определенные функции переноса, функции, которые улучшают очистку слияния протеинов или их устойчивость и многое другое. Предпочтительные протеины-носители объяснены ниже.
Соответствующее способу по изобретению расщепление слияний протеинов происходит преимущественно при помощи Jgas, которую образуют из сверхпродуцирующего непатогенного штамма бактерий и получают очисткой из надосадочных жидкостей культуры (см., например, патент ФРГ N 3622221).
Способ по изобретению можно использовать как для получения, так и для аналитических целей. Способ служит для получения методом биотехнологии важных протеинов, которые могут находить применение, например, в медицине, при научном исследовании, при защите окружающей среды или при промышленных процессах или продуктах. При аналитическом применении способ в сочетании с подходящими системами экспрессии может служить, например, для стандартного исследования слияний генов.
Предпочтительный вариант осуществления способа по изобретению для ферментативного расщепления слившихся протеинов и для получения желательных частей этих слившихся протеинов отличается тем, что
(1) трансформируют клетку с рекомбинантной ДНК или с рекомбинантным носителем, причем ДНК или носитель содержит по меньшей мере копию гена, кодирующего слившийся протеин, которые содержит по меньшей мере точку распознавания IgA-протеазы в переходной области,
(2) культивируют трансформированную клетку в подходящей среде,
(3) доводят до экспрессии кодирующий слившийся протеин ген в трансформированной клетке,
(4) расщепляют слившийся протеин при помощи IgA-протеазы
(5) выделяют одну или несколько желательных частей слившегося протеина.
При этом обработку слившегося протеина IgA-протеазой в среде (питательном бульоне) можно проводить после растворения клеток и/или после частичного или полного отделения клеточных протеинов.
Далее, предпочтительно для обработки слившегося протеина, преимущественно прокарионтного продукта экспрессии, иммобилизировать IgA-протеазу известным специалисту методом, например, как описано в европейском патенте B 0141223 или в европейском патенте B 0141224.
Особенно предпочтительным применением способа по изобретению является получение рекомбинантных протеинов или пептидов без N-концевого остатка метионина из слившихся протеинов или пептидов с последовательностью аминокислот Met - Y - Pro .'. X - Pro - A, где X обозначает любую аминокислоту, преимущественно Thr, Ala или Ser, Y обозначает одну или несколько любых аминокислот, которая преимущественно, если X обозначает Thr или Ala, оканчивается Pro, или если X обозначает Ser, оканчивается последовательностью Pro - Ala или Pro - Pro, и A обозначает любую последовательность аминокислот. При этом расщепляют слившийся протеин или пептид при помощи Iga-протеазы и получают продукт расщепления с последовательностью аминокислот X - Pro - A. Например, этот способ для получения рекомбинантных протеинов из прокарионтных клеток без N-концевого остатка метионина включает следующие стадии:
(1) трансформация прокарионтной клетки с геном, который кодирует протеин или пептид с последовательностью аминокислот Met - Y - Pro. ' . X - Pro - A, где X, Y и A имеют вышеназванные значения.
(2) культивирование трансформированной клетки в подходящей среде и экспимирование трансформированного гена,
(3) расщепление продукта экспрессии из трансформированной клетки с последовательностью аминокислот Met - Y - Pro.' . X - Pro - A IgA-протеазой и
(4) выделение получающегося продукта расщепления с последовательностью аминокислот X - Pro - A без N-концевого остатка метионина.
Благодаря способу по изобретению неожиданно можно получать с высоким выходом и хорошей специфичностью в одной стадии протеины без N-концевого остатка метионина, которые имеют N-концевую последовательность X - Pro, причем X обозначает преимущественно Thr, Ala или Ser.
Часть носителя Y слившегося протеина обозначает последовательность аминокислот по меньшей мере 1, преимущественно до 100, особенно преимущественно от 1 до 50 аминокислот, которая оканчивается распознанной IgA-протеазой последовательностью расщепления. Если X обозначает аминокислоту серин, то Y оканчивается преимущественно последовательностью Pro - AlA или Pro. Если X обозначает Thr или Ala, то Y оканчивается преимущественно Pro, особенно преимущественно Arg - Aro, Pro - Arg - Pro или Ala - Pro - Arg - Pro.
В особенности предпочтительном варианте осуществления Y обозначает по меньшей мере 5 аминокислот, которые оканчиваются последовательностью Pro - Ala - Pro - Arg - Pro. Однако для способа по изобретению применяются все распознанные IgA - протеазой точки расщепления.
Часть носителя Y может содержать еще другие любые аминокислоты, преимущественно до 100, особенно преимущественно до 50 аминокислот. Однако для этого применяют преимущественно такие последовательности аминокислот, которые на уровне ДНК улучшают экспрессию протеина Met - Y - Pro .'. X - Pro - A или /и на уровне аминокислоты облегчают ее очистку из клетки.
Экспрессию протеина Met - Y- Pro .'. X - Pro- A на уровне ДНК можно улучшать, например, слиянием с фрагментами гена β-галактозидазы, т.е. часть носителя Y включает часть β-галактозидазы-протеина. Известны специалисту и другие возможности, чтобы повышать экспрессию протеина Met - Y - Pro .'. X - Pro - A. Слиянием с другими полипептидами, особенно с высокозаряженными (например, поли (Lys, Arg)) или со связывающими определенные вещества с высоким сродством (например, стрептавидин) полипептидами или протеинами можно облегчать очистку и отделение продукта экспрессии (см. например европейский патент A 0089626, европейский патент A 0306610).
Далее, предметом настоящего изобретения является слившийся протеин, который содержит много частей полипептида и который, встроенный по меньшей мере в переходной области между различными частями полипептида, имеет одну или несколько точек распознавания IgA- протеазы с последовательностью аминокислот Pro . '. X - Pro, причем X обозначает любую аминокислоту, однако преимущественно Ser, Thr или Ala. Особенно предпочтительно точка распознавания имеет последовательность аминокислот
(а) Pro - Ala - Pro .'. Ser - Pro,
(b) Pro - Pro .'. Ser - Pro,
(c) Pro - Arg - Pro - Pro .'. Ala - Pro,
(d) Pro - Pro .'. The - Pro,
(e) Ala - Pro - Arg -Pro -Pro .'. Thr - Pro или
(f) Pro - Ala - Pro - Arg -Pro - Pro .'. The - Pro,
причем .'. показывает точку расщепления.
Настоящее изобретение включает также, в частности, протеин или пептид с последовательностью аминокислот Met - Y -Pro . '. X - Pro - A, где X - обозначает преимущественно Thr, Ala или Ser, Y обозначает одну или несколько любых аминокислот и преимущественно, если X обозначает The или Ala, оканчивается Pro, или, если X обозначает Ser, оканчивается последовательностью Pro - Ala или Pro и А обозначает любую последовательность аминокислот. Подобный протеин или пептид экспримируют по способу изобретения трансформацией прокарионтной клетки с рекомбинантным носителем, который содержит по меньшей мере копию гена, который кодирует подобный протеин или пептид.
Последовательность А может обозначать любую последовательность аминокислот. Однако целесообразно, чтобы внутри этой последовательности аминокислот не было другой точки расщепления для IgA -протеазы.
Далее, предметом настоящего изобретения является рекомбинантная ДНК, которая колирует протеин или пептид по изобретению и где по меньшей мере в переходной области слившегося протеина встроены одна или несколько точек распознавания Iga-протеазы или последовательностей расщепления.
Рекомбинантную ДНК по изобретению можно получать известным специалисту в области молекулярной биологии способом. Обычно для этого носитель, который содержит кодирующую последовательность аминокислот А ДНК-последовательность, расщепляют ограничительным эндонуклеазами в области 5' - конца этого гена и повторно перевязывают олигонуклеотидами, которые содержит желательную последовательность. При этом олигонуклеотид должен содержать последовательность, которая кодирует точку расщепления IgA-протеазы или часть ее.
Далее, предметом изобретения является также рекомбинантный носитель, который содержит по меньшей мере копию рекомбинантной ДНК по изобретению. Подходящие для экспрессии протеина в прокарионтных организмах основные носители известны специалисту. Целесообразным носителем является такой носитель, который обеспечивает высокую экспрессию ренкомбинантной ДНК по изобретению. Рекомбинантная ДНК находится преимущественно под контролем индуцируемого сигнала экспрессии (например, λ, , tac, Iac или trp промотор).
Носитель по изобретению может быть как внехромосомным (например, плазмид), так и интегрированным (например, бактериофак ламбда) в геноме организма-хозяина.
Преимущественно носитель по изобретению представляет плазмид. Носители, которые пригодны, соответственно, для экспрессии гена в определенном организме-хозяине, известны специалисту в области молекулярной биологии. Речь может идти об эукарионтном, но преимущественно о прокарионтном носителе. Примерами носителей, пригодных для экспрессии ДНК по изобретению в прокарионтах, являются имеющиеся в продаже pUC- и puR - носители.
Другим предметом изобретения является клетка, преимущественно прокарионтная клетка, особенно преимущественно E.coli- клетка, которая трансформирована с рекомбинантной ДНК по изобретению или/и с рекомбинантным носителем по изобретению.
Примерами для протеинов, которые имеют N - концевую последовательность X - Pro, причем X обозначает Thr, Ala или Ser, и которые можно получать по способу изобретения в одной стадии, являются эритропоэтин человека, β - цепь Т-клеточного рецептора человека и особенно стимулирующий гранулоциты фактор человека ( G - CSF).
G - CSF синтезируют как лимфокин активированных моноцитов, макрофагов, а также ряда других клеточных линий. Лимфокины участвуют в созревании клеток иммунной системы или системы клеток крови.
Они стимулируют созревание основных клеток костного мозга до раздифференцированных клеток. Так, например, G - CSF индуцирует образование нейтрофилена и гранулоцитов.
Так как G - CSF может значительно повышать популяцию нейтрофильных клеток в течение короткого срока, для G - CSF получаются широкие возможности применения в области терапии. Так, G - CSF можно было бы применять, например, после химиотерапии при раке, при которой разрушаются клетки иммунной системы. Далее, G - CSF можно было бы применять при пересадках костного мозга, при тяжелых ожоговых ранах, при обусловленных слабым иммунитетом враждебных инфекциях и при лейкемии.
G - CSF представляет секторную молекулу протеина. Поэтому первичный продукт трансплантации содержит N-концевую последовательность сигналов, которая при секреции отщепляется, так что последовательность зрелого G-CSF начинается с аминокислот Thr (+1) - Pro (+2) (положения аминокислот +1 и +2). Про продуцировании G - CSF в прокарионтах этот сигнальный пептид расщепляется только плохо или совсем не расщепляется, так что для получения G - CSF без сигнальной последовательности из прокарионтов необходимо клонировать AUC (Met) в качестве инициирующего кодона перед началом кодирующей зрелой G - CSF последовательности ДНК, которая начинается на уровне протеина с Thr (+1) - Pro (+2). В результате этого в прокарионтах, как E. coli, экспримируют G - CSF, который содержит метионин в 1-положении аминокислоты.
По способу изобретения можно простым путем получать не содержащий метионина в 1-положении аминокислоты G - CSF из прокарионтов, который начинается с аминокислот Thr (+1) - Pro (+2).
Это происходит в результате того, что получают производное G - CSF не прокарионтов, которое в положении +1 и +2 последовательности аминокислот содержит аминокислоты Thr (+1) - Pro (+2) и перед этим, начиная с положения - 1 последовательности аминокислот, содержит такую последовательность аминокислот, которая распознается IgA-протеазой и может отщепляться от последовательности аминокислот G - CSF, которая начинается с Thr (+1) - Pro (+2).
В предпочтительном варианте осуществления производное содержит в положении -1 и -2 по Pro, в положении -3 до положения -I последовательность аминокислот Arg-Pro-Pro, в положении 4- до -1 последовательность аминокислот Pro - Arg - Pro - Pro или в положении -5 до положения -1 последовательность аминокислот Ala - Pro - Arg - Pro - Pro.
В особенно предпочтительном варианте осуществления производное содержит в положении -6 до положения -1 последовательность аминокислот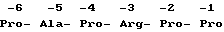
Под G - CSF в смысле изобретения понимают, конечно, существующий G - CSF, последовательность которого раскрыта, например, в Science 232 (1986) 61, а также образованные от него производные со стимулирующей гранулоциты активностью, у которых последовательности аминокислот начинаются с X (+1) - Pro (+2). X обозначает Thr, Ser или Ala, особенно предпочтительно Thr.
G - CSF производное по изобретению после экспрессии в прокарионтах можно расщеплять обработкой IgA-протеазой между положением +1 и -1 (между Thr (+1) и Pro (-1). Тем самым в результате единственной стадии гидролиза получают не содержащий метионина в положении -1 G - CSF, последовательность аминокислот которого на N-конце начинается с аминокислот Thr (+1) - Pro (+2) встречающегося в природе G - CSF.
При экспрессии G - CSF в прокарионтах образуют труднорастворимые агрегаты (refractie bodies), которые неактивны. Прежде чем применять протеин, например, для терапевтических целей, его следует перевести в его активную форму. При известных специалисту способах (ср. например европейский патент A 0219874, европейский патент A 0114506, WO 84/03711) сначала осуществляют растворение добавкой денатурирующих средств, к которому присоединяются ренатурирование и в случае необходимости дальнейшие стадии очистки. Обработку протеина по изобретению IgA-протеазой можно проводить перед растворением, после растворения или лишь после ренатурирования. В случае, если обработка IgA-протеазой должна проводиться непосредственно после растворения, следует перед добавкой IgA-протеазы отделять растворитель (например гидрохлорид гуанидина или мочевину) диализом. Однако обработку IgA-протеазой проводят преимущественно после ренатурирования, так как в этом случае выходы G - CSF особенно высокие.
Условия для обработки G - CSF или другого отщепляемого протеина IgA-протеазой сами по себе не являются критическими. Однако предпочтительно применять при этом G - CSF (или другой протеин) относительно IgA-протеазы в весовом отношении 1 : 1 до 100 : 1. Превращение происходит предпочтительно в буферном водном растворе с pH от 6,5 до 8,5. Концентрация буферного раствора лежит преимущественно в области между 50 и 300 ммоль/л, в случае необходимости при добавке 20 - 100 ммоль/л хлористого натрия. Преимущественно расщепление происходит при комнатной температуре свыше 20 - 60 мин.
После растворения, ренатурирования и расщепления IgА-протеазой полученный таким путем продукт расщепления очищают преимущественно через ионообменник и крупное фракционирование. Загрязнение полученного таким путем и не содержащего метионина в положении -1 G - CSF другими протеинами составляет ниже 0,1%, преимущественно ниже 10-3%.
Следовательно, не содержащий метионина в положении -1 G - CSF расщеплением IgA-протеазой можно отделять или очищать практически количественно от содержащего метионин слитого протеина.
По способу изобретения можно получать рекомбинантный G - CSF из прокарионтов, который менее чем на 0,1%, преимущественно менее чем на 10-3% загрязнен другими протеинами и количественно не содержит G - CSF из прокарионтов, который в положении -1 содержит метионин.
Предметом изобретения является также лекарственное средство на основе полученного по способу изобретения G - CSF из прокарионтов в качестве активного вещества, в случае необходимости вместе с обычными фармацевтическими веществами-носителями, наполнителями и вспомогательными веществами. Такое лекарственное средство особенно пригодно для лечений, при которых следует стимулировать образование гранулоцитов, особенно нейтрофилов.
Фармацевтические препараты по изобретению применяются преимущественно как растворы для инъекций и вливаний. Это можно осуществлять в результате того, что имеется в распоряжении уже готовый для впрыскивания раствор, который содержит состав по изобретению. Однако возможно также использование фармацевтических препаратов в форме лиофилизатов. Последние образуются при помощи известных, подходящих для целей инъекции средств или растворов. В качестве среды для инъекции применяют преимущественно воду, которая содержит обычные в растворах для инъекций добавки, как стабилизаторы, агенты растворения, буферные растворы и изотонические добавки, например физиологический раствор хлористого натрия. Подобными добавками являются, например, маннит, буферный раствор тартрата или цитрата, этанол, комплексообразователь, как, например, этилендиаминтетрауксусная кислота и ее нетоксичные соли, а также высокомолекулярные полимеры, как жидкая окись полиэтилена для регулирования вязкости. Жидкие вещества-носители для инъекционных растворов должны быть стерильными и разливаются преимущественно в ампулы.
Наконец, настоящее изобретение включает также применение не содержащего метионина в положении -1, G - CSF из прокарионтов для получения фармацевтических препаратов по изобретению.
Для того случая, когда при расщеплении любого слитого протеина способом по изобретению качестве образующегося продукта получают протеин X - Pro - A (причем X обозначает любую аминокислоту и A обозначает любую последовательность аминокислот), который однако на своем аминоконце несет нежелательный дипептид X - Pro, тогда можно отделять этот нежелательный дипептид как часть способа по изобретению дальнейшей обработкой дипептидиламинопептидазами (ДРАР). Дипептидиламинопептидазы находили до сих пор у ряда микроорганизмов, насекомых, амфибий и в различных тканях человека. Они служат, например, для постепенной химизированной переработки протеинов-предвестников и имеют частично ярковыраженную специфичность для аминоконцевого расщепления дипептида X - Pro (X Pro - ДРАРазы; G. Kreil, Trendsin Biochemical Scienсes 15, 23 - 26, 1990. Поэтому комбинацией способа по изобретению игазы и X - Pro - ДРАР можно получать желательные протеины с любыми аминоконцевыми кислотами.
Теперь при помощи вышеописанной комбинации игазы и X - Pro - ДРАР удается получать также протеины с другой N-концевой последовательностью аминокислот из прокарионтов в положении - 1 без метионина. Для этого сначала получают слитый протеин, который имеет последовательность аминокислот Met - Y - Pro .'. X - Pro - A, причем теперь в этом случае последовательность аминокислот A без обоих N-концевых аминокислот X - Pro представляет желательную часть экспримируемого протеина.
Продукт экспрессии прокарионтной клетки с аминопоследовательностью Met - Y - Pro.'. X - Pro - A сначала расщепляют IgA-протеазой, так что образуется первый продукт расщепления с аминопоследовательностью X - Pro - A.
Теперь этот протеин, как описано выше, можно обрабатывать дипептидиламино-пептидазой, которая специфически распознает последовательность X - Pro и расщепляет после Pro. Таким образом, образуется второй продукт расщепления с любой последовательностью аминокислоты A. Способ по изобретению оказывается, следовательно, исключительно полезным для получения самых различных протеинов без N-концевого остатка метионина и не ограничивается только получением протеинов с N-концевой последовательностью X - Pro, причем X обозначает преимущественно Ser, Thr или Ala.
Наконец, изобретение включает также рекомбинантную ДНК, которая содержит кодированную для (определенной выше) точки распознавания IgA-протеазы область и пригодна для встраивания в переходную точку слившихся протеинов. При этом речь идет преимущественно о химически синтезированном ДНК - фрагменте, на концах которого находятся обычно одна или несколько подходящих ограничительных точек пересечения.
Определения понятия
Способ по изобретению включает биотехнологическое получение желательных протеинов. Под биотехнологией подразумевают в этой связи, что желательный протеин или его промежуточный продукт получают с применением геннотехнологических средств и других биотехнологических способов (например, ферментация микроорганизмов).
Желательный протеин представляет промежуточный продукт или конечный продукт, который может найти применение, например, в области медицины, исследования, в защите окружающей среды или в промышленных процессах или продуктах.
Способ по изобретению включает, что желательный протеин образуется из слитого протеина (обозначаемого также как слияние протеинов), причем слитый протеин или слияние протеинов составляется из нескольких ковалентно связанных друг с другом партнеров слияния. При этом по меньшей мере один из партнеров слияния представляет желательный протеин. Последовательность партнеров слияния и степень их повторения в слитом протеине любая; однако преимущественно она состоит из аминоконцевого протеина-носителя и карбоксиконцевого желательного протеина.
Протеин-носитель или часть носителя служит для того, чтобы придавать желательному протеину в форме слитого протеина особенные свойства. Подобные свойства могут выражаться, например, в повышенной устойчивости слитых протеинов, которая основывается на структурных особенностях и тем самым в значительной степени на более высокой резистентности в противоположность клеточным протеазам или же на переносе слитых протеинов в окружающую среду с небольшой протеолитической активностью. Кроме того, в протеине-носителе могут содержаться свойства, которые обеспечивают эффективную очистку слитых протеинов. Сюда относятся, например, связывание определенных лиганд в связи с методом хроматографии сродства, отложение слитых протеинов в отделяемых с небольшими затратами осажденных телах и перенос протеинов на легко доступные места.
Области внутри слитого протеина, в которых компоненты (протеины-носители и желательные протеины) слитого протеина соединяются друг с другом, называют переходными областями.
Каждая переходная область может быть определена одной или несколькими последовательностями аминокислот. Последовательности аминокислот (как и все прочие последовательности аминокислот и протеинов) подразумевают и изображают от аминоконцевой (слева) в направлении к карбоксиконцевой (справа).
В пределах способа изобретения все те последовательности аминокислот в переходных областях, которые должны быть расщеплены IgA-протеазами, содержат последовательность расщепления или последовательность распознавания по способу изобретения.
То место между двумя аминокислотами последовательности аминокислот, в котором происходит расщепление слитых протеинов или слияний протеинов, называют точкой расщепления.
Способ по изобретению включает ферментативное расщепление слитых протеинов в переходных областях IgA-протеазой. Под IgA-протеазой или игазой в пределах способа изобретения понимают IgА-протеазу штамма Neisseria gonorrhocae MSII и все другие ферменты, родственные с этой протеазой на уровне нуклеотида и по процессу ее образования. Сюда причисляют также особенно IgA-протеазы рода Neisseria и Hacmophilus.
Микроорганизм E. coli ED 8654 был депонирован под номером DSM 2102 в Немецком Центре микроорганизмов. Гризебахштрассе 8, 3400 Геттинген.
Изобретение поясняется следующими примерами в сочетании с чертежами.
Фиг. 1 показывает схематически слияние протеинов между протеином-носителем MS2-полимеразой (99 аминокислот) и β- областью (положение аминокислот 1195 - 1505) предвестника IgA-протеазы из N.gonorrhoеae MSll. Переходная область между этими двумя частями состоит из 12 аминокислот и содержит последовательность расщепления - Pro - Pro .'. Thr - Pro - для игазы. Для конструирования места расщепления встраивали четыре олигонуклеотида от (1) до (4) между ограничительными точками пересечения Eco RI и Hind III. Получение полипептида и расщепление с очищенной игазой пояснены подробно в примере 5.
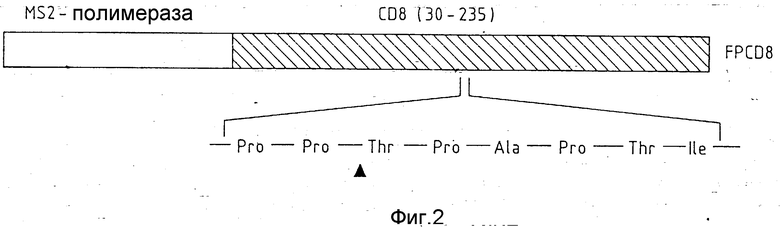
Фиг. 2 показывает слияние протеинов, состоящее из протеиноносителя 99 аминокислот MS2-полимеразы и 6 кодированных плазмидом аминокислот, и 206 аминокислот от CD8-протеина T-лимфоцитов человека. В последовательности аминокислот CD8-протеина находится природная последовательность расщепления, которая расщепляется игазой (см. пример 6).
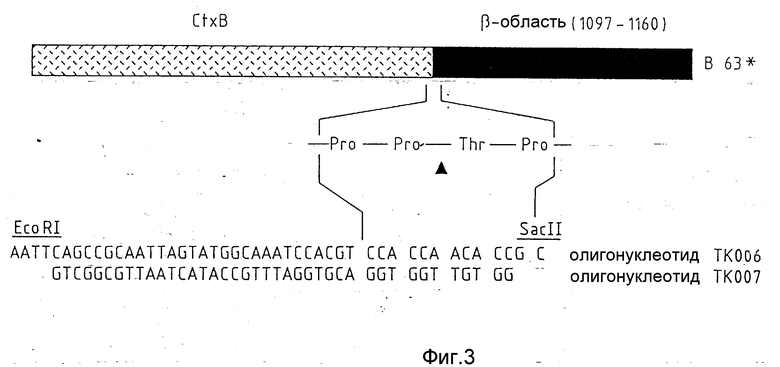
Фиг. 3 показывает слияние протеинов B63, которое было продуцировано при помощи секреторной системы экспрессии от E. coli-клеток. Оно состоит на аминоконце из холерного токсина B нижняя часть (103 аминокислоты), сопровождаемая соединительной областью (11 аминокислот) с точкой расщепления игазы, и на карбоксилконце из части (положение аминокислоты 1097 - 1160) B-области предвестника IgA-протеазы. Точку пересечения игазы встраивали при помощи обоих олигонуклеотидов Тк 006 и Тк 007 между обоими областями протеинов.
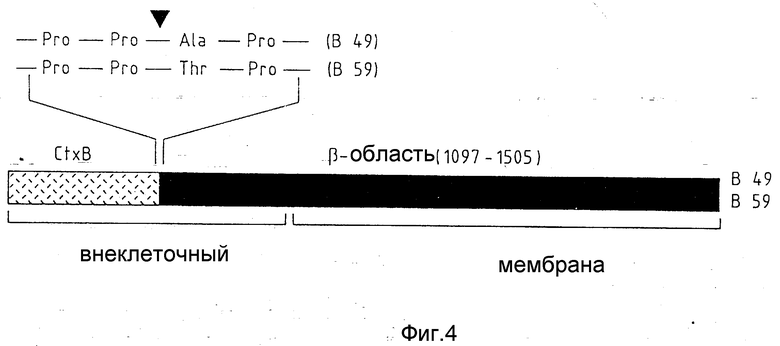
Фиг. 4 схематически показывает слияния протеинов B49 и B59. Они состоят из холерного токсина B нижней части и B - области предвестника IgA - протеазы. Между этими частями они содержат две различные переходные области с двумя различными последовательностями расщепления игазы (-Pro - Pro - Ala - Pro и Pro - Pro - Thr - Pro -). Последовательность расщепления конструирования с синтетическими олигонуклеотидами (см. фиг. 3).
Пример 1. Конструирование плазмиды для экспрессии не содержащего метионина G - CSF
Конструирование производят при применении носителя экспрессии pPZ07 - mg 11 аc (WO. 86/09373). Для этого носитель экспрессии pPZ07 - mg 11 ac расщепляют с Nco I и удаляют выступающие концы с Mung bean - нуклеазой. Затем расщепляют носитель с Bam HI. Последовательность распознавания IgA на уровне ДНК получают через следующие олигонуклеотиды.
Олигонуклеотид A:
Олигонуклеотид B:
Обе олигонуклеотиды добавляют в эквимолярных количествах и вводят приблизительно в 100-кратном избытке в расщепленный, как описано выше, носитель pPZ07 - mg11 ac. После повторного перевязывания трансформируют обычным образом сделанные прочными клетки E. coli K12. Известными методами выделяют ДНК из клеток и расщепляют с Apal и Bam H1. Фрагмент G - CSF длиной приблизительно 520 бп выделяют при применении ограничительных эндонуклеаз Apal и Bam H1 из G - CSF - последовательности (Science 232 (1986), 61 - 65). Этот фрагмент вводят в расщепленный также с Apal и Bam H1 носитель.
Пример 2. Дополнительно к последовательности распознавания IgAl слившийся протеин может содержать еще также пептиды в качестве помощи для очистки. Последние могут состоять из ДНК, которая кодирует стрептавидин. Для этого стрептавидин - ген (WO 89/03422) клонируют в правильную трансляционную решетку перед последовательностью распознавания IgA-протеазы.
Пример 3. При помощи описанной в примере 1 плазмиды трансформируют E - coli K12 - клетки (ED 8654, DSM 2102), селекционируют на маркер - антибиотик (ампициллин) и характеризуют плазмид ограничительным анализом. Такой клон применяют для культивирования и экспрессии G - CSF. Клетки культивируются полной средой. Эта среда содержит на 1 л 16 г бактотриптона (Дифко), 10 г дрожжевого экстракта (Дифко) и 5 г хлористого натрия. Клетки оставляют для роста до ОД (поверхностной дозы) 546 2,0 и затем индуцируют с 1--3 моль/л IPTG. Еще через 4 ч клетки собирают центрифугированием, растворяют при помощи лизозима /EDTA (этилендиаминтетрауксусной кислоты) и выделяют G - CSF как включенные тела (IB's, ср. европейский патент A 0219874).
Денатурирование или ренатурирование выделенных нерастворимых частиц слияния G - CSF осуществляют, как описано в европейском патенте A 0219874. Денатурирование производят диализом относительно 6 моль/л гуанидингидрохлорида. Здесь можно отбирать уже делящуюся без остатка часть и после диализа относительно 5 ммоль/л буферного раствора фосфата калия с pH 7 применять для расщепления с IgA-протеазой (пример 4).
В качестве альтернативы осуществляют после денатурирования в гуанидингидрохлориде диализ относительно 5 ммол/л буферного раствора фосфата калия с pH 7, который содержит 1 ммоль/л GSH и 3 ммоль/л G SSG. После ренатурирования здесь также происходит диализ относительно 5 ммол/л буферного раствора фосфата калия с pH 7.
Пример 4. Расщепление слитого протеина IgAl - протеазой для получения нативного G - CSF без метионина в положении -1
IgAl-протеазу выделяют, как описано в EMBO Jour 3. (1984), 1595 - 1601. К 10 μ г ренатурированного или денатурированного по примеру 3 G - CSF добавляют 2 - 5 μ г IgA - протеазы и инкубируют 30 мин при комнатной температуре. Часть различные ионообменные колонки, как Моно-Q или Моно-S, можно выделять не содержащий метионина G - CSF. Последовательность протеинов аминоконца показывает, что очищенный G - CSF начинается с правильной последовательности аминокислот Thr (+1) - Pro (+2).
Пример 5. Получение слияния протеинов и расщепление нерастворимых протеиновых агрегатов из "включенных тел" на специфической точке пересечения игазы
Прокариотный носитель экспрессии pEX31C (k. Strebel, Journal of Virology 57, 983 - 991, 1986) был модифицирован таким образом, что сверхпродуцированное с этой системой в E. coli - клетках слияние протеинов можно было расщеплять игазой на протеин-носитель и желательный протеин. Для этого был составлен из полученных синтетическим путем олигонуклеотидов двунитевой ДНК - фрагмент, который кодирует последовательность аминокислот Thr - Pro - Ala - Pro - Arg - Pro - Pro . ' . Thr - Pro. Этот ДНК - фрагмент при помощи методов генной технологии вводили в точку пересечения EcoR1 носителя экспрессии pEX31C. Кроме того, непосредственно на границе в точке пересечения Hind III вставляли два других синтетических ДНК-фрагмента, которые содержали ряд подходящих точек пересечения для органических эндонуклеаз и концевых сигналов для участвующих в экспрессии гена ферментов бактерий. В полученный таким путем плазмид экспрессии pEV37, используя точки пересечения для SmaI и Hind III, вводили ДНК - фрагмент, который кодирует β- область IgA - протеазы-протеина-предвестника из Neisseria gonorrhoeae MSII. В результате этого получался гибридный ген, при выражении которого в E. coli образовывался слитый протеин. Последний содержал на аминоконце в качестве протеина-носителя 99 аминокислот MS2-полимеразы, сопровождаемые центральной переходной областью 12 аминокислот с последовательностью расщепления игазы и с желательной β- областью на карбоксильном конце (см. фиг. 1). При помощи очищенной игазы можно было отщеплять β- область от карбоксильного конца слияния протеинов в точке пересечения Pro . ' . Thr внутри переходной области.
Поазмидус гибридным геном вводили трансформацией в E.coli-клетки, которые для регулируемого перепроизводства слияния протеинов содержали фактор регуляции Cl857 из бактериофага лямбда (E. Remaut, Gene 22, 103 - 113, 1983). Повышением температуры с 28oC до 42oC инактивировали Cl857 - репрессор и вследствие этого активировали производство протеина в рекомбинантных E. coli-клетках. Для этого 50 мл выросшей в течение 12 ч при 28oC E.coli-культуры переводили в 200 мл предварительно подогретой до 45oC среды и культивировали дальше 2 ч при 42oC. В этой стадии накапливали слияние протеинов в цитоплазме бактерий в больших количествах в форме "включенных тел". Затем собирали бактерии центрифугированием, суспендировали в 20 мл буферного раствора лизиса (10% сахарозы, 50 ммоль трис/ HCl pH 8,0, 1 ммоль EDTA) и после добавки 400 μл раствора лизозима (5 мг/мл) инкубировали в течение 30 мин при 22oC. Добавляли детергент тритон-X-100 до конечной концентрации 0,1% и инкубировали раствор снова в течение 30 мин. Высвобожденную при лизисе клеток ДНК измельчали обработкой ультразвуком, нерастворимые составные части, в том числе находящееся в осаждаемых телах слияние протеинов, центрифугировали и затем промывали в 5 мл HINTE - буферного раствора (1 моль мочевины, 50 ммоль NaCl, 50 ммоль трис/HCl pH 8, 0, 1 ммоль EDTA). После повторного центрифугирования осадок суспендировали облучением ультразвуком в 5 мл PBS - буферного раствора (20 ммоль фосфата калия, H 7, 5, 140 ммоль NaCl) и промывали. Этот процесс повторяли несколько раз, чтобы удалять полностью остатки мочевины. Наконец, нерастворимую фракцию, которая содержала слитый протеин, суспендировали облучением ультразвуком в 5 мл PBS-буферного раствора.
Количество и количество суспендированного слияния протеинов определяли при помощи электрофореза на SDS - полиакриламид - геле (12,5%) и последующего окрашивания при помощи Coomassie - голубого. Для расщепления инкубировали суспензию протеинов в отношении фермент/субстрат 1/100 (вес/вес) в течение 3 ч при 37oC. Последующее расщепление неочищенного и нерастворимого слияния протеинов исследовали аналитически при помощи электрофореза на SDS-полиакриламид-геле, причем оказалось, что образовался полипептид ожидаемого для β- протеина размера. Этот протеин был перенесен на мембрану из нитроцеллюлозы и подвергнут автоматизированному анализу последовательностей. Последовательность концевых аминокислот подтвердила его образование из слияния протеинов точным расщеплением на имеющейся точке расщепления игазы.
Однако при расщеплении превращали только приблизительно до 50% всего количества введенного субстрата. Добавкой больших количеств игазы и более продолжительными временами реакции не могли достичь никакого повышения. Это указывает на то, что в непересеченной части слитого протеина точка пересечения для игазы недоступна. Гибридный протеин и продукты расщепления и после инкубирования игазой находятся в форме нерастворимых агрегатов и поэтому не могут быть седиментированы из суспензии центрифугированием.
Выходы расщепления до 90% достигали в том случае, когда вместо загрязненной фракции "включенных тел" применяли слияние протеинов, которое предварительно было подвергнуто дополнительной стадии очистки. Для этого нерастворимый осадок после промывки в H1NTE - буферном растворе (см. выше) поглощали в 5 мл H7NTE - буферного раствора (7 моль мочевины, 50 ммоль NaCl, 50 ммоль трис/HCl pH, 8, 1, 1 ммоль EDTA). Нерастворимые части отделяли центрифугированием, в растворимую фракцию подвергали диализу относительно 5 л PBS-буферного раствора при 4oC. При удалении мочевины диализом слитый протеин осаждался из раствора в форме нерастворимых агрегатов. Осажденные агрегаты в результате обработки облучением ультразвуком переводили в тонкую суспензию и, как описано выше, расщепляли игазой и анализировали.
Пример 6. Специфическое расщепление ренатурированного, растворимого слияния протеинов игазой
При применении pEX-системы экспрессии получали гибридный протеин (см. пример), который состоит из MS2-полимеразы и части CD8 - протеина цитотоксических Т-лимфоцитов человека (см. фиг. 2). После предварительной очистки и растворения протеина из "включенных тел" в H7NTE - буферном растворе в качестве следующей стадии очистки применяли приготовленный 12,5%-ный SDS - полиакриламидный гель. Слияние протеинов как отдельную полосу после окрашивания Coomassie - голубым вырезали из геля и затем по методу Hunkapiller (Methodsin Enzymology 91, 227 - 235, 1983) отделяли от материала геля. При этом электроэлюцию производили в TAE - буферном растворе (40 ммоль трис/ацетат, pH 7,9), к которому был добавлен 0,1%-ный SDS (лаурилсульфат натрия). SDS позднее удаляли диализом относительно 5 л TAE - буферного раствора при 22oC. При дальнейшем диализе протеин переводили в буферный раствор для хранения (20 ммоль фосфата калия, pH 7, 5, 140 ммоль NaCl, 50% глицерина). Полученный таким путем растворимый слитый протеин инкубировали очищенной игазой (см. пример 5) и при этом полностью расщепляли на содержащейся в CD8-молекуле точке расщепления (-Pro - Pro. ' . Thr - Pro - Ala -, см. фиг. 2) на два полипептидных фрагмента. Специфичность расщепления проверяли анализом последовательности аминокислот на аминоконце меньшего продукта расщепления. При этом получалась, как ожидали, последовательность Thr - Pro - Ala -Pro - Thr - Ile.
Пример 7. Специфическое расщепление растворимого, полученного из надосадочных жидкостей культуры слияния протеинов при помощи игазы.
Слияние протеинов, состоящее из холератоксина B нижняя часть и части β- области (позиции 1097 - 1160; J Pohlmer, Nature 325, 458- 462, 1987) предвестника IgA-протеазы из N. gonorrhoeae VSII получали в растворимой форме из надосадочных жидкостей культуры рекомбинантных E. coli-клеток. Чтобы можно было отделять друг от друга обе части протеинов, в переходную область между холератоксином B - нижней частью и β-областью при помощи методов генной технологии была введена искусственная последовательность расщепления для игазы (Pro - Pro. ' . Thr - Pro-). Для этого олигонуклеотиды Tк006 и Tк007 были введены между ограничительными точками пересечения EcoRI и SacII в переходной области (см. фиг. 3). Протеин слияния собрали из 2 л надосадочной жидкости, выращенной в течение 12 ч при 37oC бактериальной культуры осаждением при помощи сульфата аммония и затем диализом относительно 5 л PBS - буферного раствора. Для расщепления его при концентрации 50 μ г/мл в PBS - буферном растворе при отношении фермент/субстрат 1/50 вес/вес) инкубировали с очищенной игазой в течение 2 ч при 37oC. Иммунный анализ показал, что появляющийся при полном расщеплении более крупный фрагмент расщепления по своему молекулярному весу и по своей реакции с антисывороткой соответствовал природному холератоксину B - нижней части.
Пример 8. Специфическое расщепление слияний протеинов на поверхности грамотрицательных бактерий при помощи игазы
Секреторную систему экспрессии использовали для того, чтобы слияния протеинов ТКВ 49 и ТКВ 59, состоящие из холератоксина в нижней части и IgA-протеазы β- области на поверхности рекомбинантных салмонелл, экспонировать наружу. Кодирующий ТКВ 49 гибридный ген содержал в переходной области между областью токсина и β- областью оригинальную последовательность расщепления (c) (-Pro - Pro. ' . Ala - Pro -) для игазы. Напротив, в ген для ТкВ 59 вводили искусственный ДНК - фрагмент, состоящий из олигонуклеотидов Тк 006 и Тк 007 между ограничительными точками пересечения EcoRI и SacII, который кодировал последовательность расщепления (-Pro - Pro. ' . Thr - Pro -) (см. фиг. 3). Если неповрежденные бактерии, которые несли такие сцепленные с их поверхностью слияния протеинов, инкубировали с очищенной игазой, то можно было наблюдать специфическое расщепление на точках пересечения игазы. В иммунных анализах было показано, что появляющиеся при расщеплении небольшие фрагменты расщепления по своему размеру и по реакции с антисывороткой соответствовали природному холератоксину B нижней части.
Пример 9.
Очищение активной игазы из надосадочных жидкостей культуры рекомбинантных E. coli-клеток.
Рекомбинантные E. coli C600 - клетки, которые содержат плазмиду pEX1070 (патент ФРГ 3622221.6) с модифицированным геном IgА-протеазы, выделяют активную игазу в надосадочную жидкость культуры. Фильтрованием через мембрану можно было накапливать фермент в надосадочной жидкости культуры и затем осаждать из раствора сульфатом аммония (0,42 г/мл). После центрифугирования осадок растворяли в Биорекс-буферном растворе (50 ммоль фосфата калия, pH 7, 0, 8,6% глицерина) (1 мл буферного раствора на 1 л надосадочной жидкости культуры), уравновешивали диализом относительно 2 л буферного раствора и затем подвергали катионообменной хроматографии (Биорекс 70). Связанную IgA-протеазу в одной стадии элюировали отмывающим буферным раствором (500 ммоль фосфата калия, pH 7,0, 8,6% глицерина) с колонки и фракционировали. Затем содержащие IgA-протеазу фракции анализировали электрофорезом на SDS-полиакриламидгеле (12,5%). В этой точке очистки получали среднюю степень чистоты > 90%. Для получения игазы в чистой форме осуществляли гельфильтрацию с Сефакрилом HR300 в Биорекс-буферном растворе, сопровождаемую последующей катионообменной хроматографией (см. выше). Активность игазы проверяли инкубированием с IgA-антителами и разделением образующихся продуктов расщепления в SDS - полиакриламидгеле.
Пример 10. Конструирование плазмиды для экспрессии не содержащего метионина интерлейкина 3
Конструирование осуществляют с применением носителя экспрессии pPZO7-mgLac (WO 88/09373). Для этого носитель экспрессии pPZO7-mgILac расщепляют при помощи NCOl и выступающие концы удаляют с Mung bean - нуклеазой. Затем дополнительно расщепляют носитель с BamHI. Оптимизированную аминоконцевую область слитого протеина получают на уровне ДНК через следующие олигонуклеотиды:
Первичный 1A :
Первичный 1B :
Оба олигонуклеотида добавляют вместе в эквимолярных количествах и вводят приблизительно в 100-кратном избытке в расщепленный, как описано выше, носитель pPZO7-mgILac. После перевязывания сделанные обычным путем компетентными клетки E. coli K12 трансформируют. Известными методами выделяют из клеток ДНК, расщепляют при помощи SalL/BamH1 и перевязывают с ДНК - фрагментом, который содержит кодирующую область интерлейкина 3 без сигнальной последовательности (описано ниже).
Получение кодирующей области интерлейкина 3 с областью распознавания для IgA-протеазы на уровне ДНК осуществляют через известную технику PCR, причем проводят PCR-реакцию с с-ДНК интерлейкина 3 в качестве шаблона и с нижеописанными первичными:
Первичный 2A: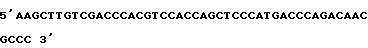
Первичный 2B
5,TTCGTTGGATCCCTAAAAGATCGCGAGGCTCAAAGT 3,
Получающийся PCR-фрагмент дополнительно перерезают ферментами Sall и BamH1 и его можно вставлять непосредственно в вышеописанный носитель ДНК и связывать ковалентно при помощи лигазы.
После трансформации ДНК в соответствующего хозяина, например E. coli K12 C600, можно синтезировать IL 3 в E. coli в форме Rb'S и затем выделять. Как описано для G - CSF, осуществляют денатурирование и ренатурирование протеина и расщепляют ренатурированный протеин при помощи IgA-протеазы. Полученный таким путем не содержащий метионина IL 3 после дальнейших стадий очистки можно применять для терапии.
Пример 11 Конструирование плазмида для экспрессии не содержащего метионина интерлейкина 2
Конструирование можно осуществлять с применением носителя экспрессии pPZO7 - mgllac (WO 88/09373), который после включения первичных 1A и 1B, как описано в примере 10, расщепляли с Sall/BamH1. Получение кодирующей области интерлейкина 2 с областью распознавания IgA-протеазы на уровне ДНК осуществляют методом PCR, причем проводят PCR - реакцию с с-ДНК интерлейкина 2 в качестве шаблона и первичными 3A и 3B, которые также кодируют область распознавания для IgA-протеазы.
Первичный 3A :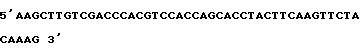
Первичный 3B :
5,TTCGTTGGATCCTCAAGTTAGTGTTGAGATGATGCTTT 3,
Полученный таким путем PCR - фрагмент дополнительно перерезают ферментами Sall и BamH1 и его можно непосредственно вставлять в вышеописанный носитель ДНК. Дальнейшее происходит, как описано при IL 3. В предыдущем примере было описано, как соответствующим применением точки распознавания IgA-протеазы и последующим способом можно получать не содержащие метионина терапевтические протеины, которые начинаются с последовательности кислот Ala - Pro. Другие протеины, которые аналогично вышеописанным примерам можно получать без метионина, а именно при применении олигонуклеотидов, которые содержат область распознавания для IgA-протеазы и область, которая по аналогии соответствует 5' или 3' концу опубликованной последовательности и может быть получена через PCR-увеличение. Ниже приведены другие соответствующие терапевтические протеины, которые в зрелой встречающейся в природе форме начинаются с Ala - Pro и поэтому могут быть получены аналогичным образом по способу изобретения.
Cathepsin L (EC 3.4.22.15), Mason, R. W. et al, Biochem. J. 240, 373 - 377, 1986.
Эритропоэтин, Lai, P.H. et al. J. Biol. Chem. 261, 3116 - 3121, 1986.
Интерлейкин - 1 бета, Zsebo, K.M. et al. BLood 71, 962 - 968, 1988.
Остеонектин, Fisher, L.N. et al. J. Biol. Chem 262, 9702 - 9708, 1987.
Тип IV коллагеназы, Collier I.E. et al. J. Biol, Chem 263, 6579 - 6587, 1988.
Далее, таким путем можно получать протеины, которые в зрелой форме начинаются последовательностью аминокислот Ser, Pro. В качестве примера здесь следует назвать
Альфа-1 антитрипсин, Hill, R.E. et аl., Nature 311, 175 - 177, 1984.
Atrial natriuretic factor, Kambayashi, J. et al., FEBS Lett. 259, 341 - 345, 1990.
Другими примерами для протеинов, которые в своей зрелой форме начинаются с Thr - Pro и могут быть соответственно терапевтическими, являются, например, Complement factor B, Campell R.D. et al., Proc. Nat. Acad. Sci 80, 4464 - 4468, 1983.
Аполипопротеин A, Eaton, D. L. et al. Proc. Nat. Acad Sci. 84, 3224 - 3228, 1987.
Ниже приведены данные о депонировании для упомянутого микроорганизма.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТ-КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР (G - CSF) БЕЗ ДОПОЛНИТЕЛЬНОГО ОСТАТКА МЕТИОНИНА НА N-КОНЦЕ | 1991 |
|
RU2108386C1 |
| ВЫДЕЛЕННЫЙ ФРАГМЕНТ ДНК, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА С НЕЙРОТРОПНОЙ АКТИВНОСТЬЮ, БЕЛОК NT-3 И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1990 |
|
RU2128226C1 |
| ДНК-ФРАГМЕНТ, КОДИРУЮЩИЙ НЕЙРОТРОПНЫЙ ФАКТОР МОЗГА (BDNF), БЕЛОК BDNF И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1990 |
|
RU2131926C1 |
| МУТАНТНЫЙ КАНАЛЬНЫЙ РОДОПСИН-2 | 2011 |
|
RU2595384C2 |
| МАЛЫЕ МОЛЕКУЛЫ РНК, ОПОСРЕДУЮЩИЕ ИНТЕРФЕРЕНЦИЮ РНК | 2007 |
|
RU2470073C2 |
| МАЛЫЕ МОЛЕКУЛЫ РНК, ОПОСРЕДУЮЩИЕ ИНТЕРФЕРЕНЦИЮ РНК | 2001 |
|
RU2322500C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИНА С УЛУЧШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2004 |
|
RU2342400C2 |
| Способ получени -лейцин-13-мотилина | 1976 |
|
SU593659A3 |
| АДАПТИРОВАННАЯ РЕКОМБИНАЗА ДЛЯ РЕКОМБИНАЦИИ АСИММЕТРИЧНЫХ УЧАСТКОВ-МИШЕНЕЙ ВО МНОЖЕСТВЕ ШТАММОВ РЕТРОВИРУСОВ | 2011 |
|
RU2617968C2 |
| ПРОМОТОР ДЛЯ СПЕЦИФИЧЕСКОЙ ЭКСПРЕССИИ ТРАНСГЕНОВ В ЭПИДЕРМИСЕ РАСТЕНИЙ | 2004 |
|
RU2382079C2 |
Изобретение относится к биотехнологии и, в частности, к способам получения рекомбинантных полипептидов через промежуточную форму слитого белка. Предлагаемый способ предусматривает создание гибридной ДНК-конструкции, кодирующей белок, в котором две полипептидные последовательности связаны переходной областью, содержащей сайт распознавания Ig A-протеазой, трансформацию хозяйских клеток рекомбинантным вектором экспрессии, содержащим названную конструкцию, выделение полученного слитого белка, обработку его Ig A-протеазой при весовом соотношении фермента и субстрата от 1:1 до 100:1 и pH 6,5 - 8,5 и изолирование представляющего интерес полипептида. Получены, охарактеризованы и испытаны конкретные формы гибридных ДНК и слитых белков. Изобретение обеспечивает возможность получения представляющих интерес полипептидов в безметиониновой форме, а также позволяет повысить уровень их экспрессии и степень очистки. 11 с. и 8 з.п. ф-лы, 4 ил.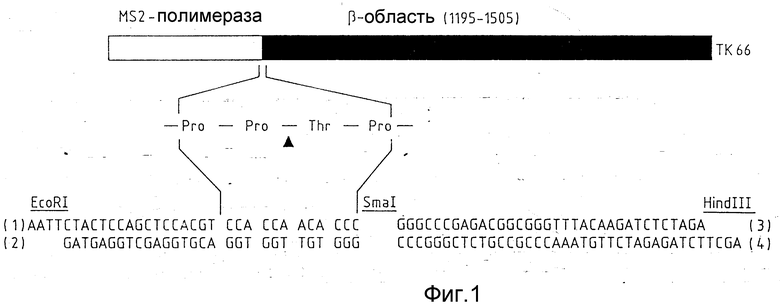

а для обработки экспрессированного слитого белка используют JgA-протеазу при весовом соотношении фермента к субстрату от 1:1 до 100:1 и pH от 6,5 до 8,5.
A' - P' - B'
где A' соответствует кодону метионина;
B' соответствует нуклеотидной последовательности, кодирующей G-CSG, имеющий N-концевую последовательность Thr - Pro;
P' соответствует нуклеотидной последовательности, кодирующей переходную область с C-концевой последовательностью Pro-Pro.
A' - P' - B',
где A' соответствует нуклеотидной последовательности, кодирующей MS2-полимеразу;
B' соответствует нуклеотидной последовательности, кодирующей фрагмент (1195-1505) β-области предшественника JgA-протеазы N gonorrhoeae MSII, имеющий N-концевую последовательность Thr-Pro;
P' соответствует нуклеотидной последовательности, кодирующей переходную область из 12 аминокислот с C-концевой последовательностью Pro-Pro.
A' - P' - B',
где A' соответствует нуклеотидной последовательности, кодирующей B-субъединицу холерного токсина;
B' соответствует нуклеотидной последовательности, кодирующей фрагмент (1097-1160) β-области предшественника JgA-протеазы N.gonorrhoeae MSII, имеющий N-концевую последовательность Thr-Pro;
P' соответствует нуклеотидной последовательности, кодирующей переходную область из 11 аминокислот с C-концевой последовательностью Pro-Pro.
A' - P' - B',
где A' соответствует нуклеотидной последовательности, кодирующей B-субъединицу холерного токсина;
B' соответствует нуклеотидной последовательности, кодирующей фрагмент (1097-1505) β-области предшественника JgA-протеазы N.gonorrhoeae MSII, имеющий N-концевую последовательность Thr-Pro;
P' соответствует нуклеотидной последовательности, кодирующей переходную область с C-концевой последовательностью Pro-Pro.
A' - P' - B',
где A' соответствует нуклеотидной последовательности, кодирующей B-субъединицу холерного токсина;
B' соответствует нуклеотидной последовательности, кодирующей фрагмент (1097-1505) β-области предшественника JgA-протеазы N.gonorrhoeae MSII, имеющий N-концевую последовательность Ala-Pro;
P' соответствует нуклеотидной последовательности, кодирующей переходную область с C-концевой последовательностью Pro-Pro.
Приоритет по пунктам:
17.05.90 по пп.1-9, 12-19;
10.12.90 по пп. 10 и 11.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИПИЕВО-ЦИРКОНИЕВЫХЛИГАТУР | 0 |
|
SU254090A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J | |||
| Bricker et al., Proc.Nat | |||
| Acad | |||
| Sci, USA, 80, 2681-2685, 1983 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| J.Pohlner et al., Nature 325, 458/462, 1987. | |||
Авторы
Даты
1998-10-20—Публикация
1991-02-01—Подача