Данное изобретение относится к способу получения катализатора гидроцианирования, который представляет собой комплекс никеля с бидентатным фосфорсодержащим соединением.
Из уровня техники хорошо известно, что комплексы никеля с фосфорсодержащими лигандами являются полезными в качестве катализаторов в реакциях гидроцианирования. Известно, что такие комплексы никеля, использующие монодентатные фосфиты, катализируют гидроцианирование бутадиена с получением смеси пентеннитрилов. Данные катализаторы также полезны при последующем гидроцианировании пентеннитрилов для получения адипонитрила, важного промежуточного соединения при производстве найлона. Кроме того, известно, что для получения катализаторов на основе никеля для осуществления таких реакций гидроцианирования можно использовать бидентатные фосфитовые и фосфинитовые лиганды.
Патент США 3903120 описывает способ получения комплексов никеля нулевой валентности осуществлением реакции элементарного никеля с монодентатным фосфорсодержащим лигандом формулы PZ3, где Z представляет собой алкильную или алкоксильную группу, предпочтительно арилоксильную группу. В способе используют мелкодисперсный элементарный никель, и его предпочтительно проводят в присутствии нитрильного растворителя. Описывается, что реакцию проводят в присутствии избытка лиганда.
Патент США 3846461 описывает способ получения комплексов никеля нулевой валентности с трехзамещенными органическими фосфитами осуществлением реакции соединений трехзамещенных органических фосфитов с хлоридом никеля в присутствии мелкодисперсного восстанавливающего металла, который является более электроположительным чем никель, и в присутствии активатора, выбранного из группы, состоящей из NH3, NH4X, Zn(NH3)2X2 и смесей NH4X и ZnX2, где X представляет собой галоген. Восстанавливающие металлы включают Na, Li, Mg, Ca, Ba, Sr, Ti, V, Fe, Co, Cu, Zn, Cd, Al, Ga, In, Sn, Pb и Th, причем Zn является предпочтительным.
Патент США 5523453 описывает способ получения никелевых катализаторов гидроцианирования, содержащих бидентатные фосфорсодержащие лиганды. Соединения никеля нулевой валентности, содержащие лиганды, которые могут замещаться бидентатными фосфорсодержащими лигандами, являются предпочтительным источником никеля. Два таких соединения представляют собой Ni(COD)2, где COD представляет собой 1,5-циклооктадиен, и (oTTP)2Ni(C2H4), где oTTP представляет собой P(O-орто-C6H4CH3)3. Альтернативно, чтобы получить подходящий источник никеля, можно смешивать соединения двухвалентного никеля с восстановителями. В последнем способе получения катализатора с повышением температуры приготовления катализатора увеличивается скорость образования катализатора, но также увеличивается количество продуктов разложения. Соответственно, существует необходимость в способе, который дает высокие скорости реакции и незначительное разложение.
Настоящее изобретение относится к способу получения катализатора гидроцианирования путем взаимодействия бидентатного фосфорсодержащего лиганда с хлоридом никеля в присутствии нитрильного растворителя и восстанавливающего металла, который является более электроположительным чем никель, причем хлорид никеля присутствует в молярном избытке относительно восстанавливающего металла.
Катализаторы по настоящему изобретению можно приготовить путем взаимодействия хлорида никеля с бидентатным фосфорсодержащим лигандом в присутствии восстанавливающего металла, причем хлорид никеля присутствует в молярном избытке относительно восстанавливающего металла. Восстанавливающий металл может представлять собой любой металл, который является более электроположительным чем никель. Такие металлы включают Na, Li, K, Mg, Ca, Ba, Sr, Ti, V, Fe, Co, Cu, Zn, Cd, Al, Ga, In, Sn, Pb и Th. Наиболее предпочтительными являются Fe и Zn. Восстанавливающий металл (в дальнейшем ″МЕТ″), предпочтительно, является мелкодисперсным. Выражение ″мелкодисперсный″ означает, что металл находится в виде частиц с размером менее 20 меш.
Неожиданно было обнаружено, что скорость реакции по существу не зависит от концентрации фосфорсодержащего лиганда или количества восстанавливающего металла, а скорее зависит от количества присутствующего NiCl2 и температуры реакции. Соответственно, увеличение количества NiCl2 увеличивает скорость реакции. Поскольку нежелательные побочные реакции, особенно разложение, увеличиваются с температурой, использование избытка хлорида никеля для увеличения скорости образования катализатора может позволить снизить температуру реакции, что будет уменьшать нежелательные побочные реакции. Реакцию обычно проводят таким образом, что восстанавливающий металл является лимитирующим реагентом. Другими словами, количество NiCl2, конвертируемое в катализатор, контролируют количеством добавленного восстанавливающего металла.
Источником никеля для данного изобретения, предпочтительно, является хлорид никеля (II), NiCl2. Можно использовать гидратированные либо безводные формы NiCl2. Безводный NiCl2 является предпочтительным для сведения к минимуму гидролитического разложения лиганда. Выражение ″безводный″ означает, что хлорид никеля содержит менее 2% мас. воды. Предпочтительным является хлорид никеля, содержащий 1% воды или менее. Безводный хлорид никеля можно получить, нагревая гидратированные формы NiCl2 до температуры примерно от 200°С до 240°С. Нагревание NiCl2 выше примерно 240°С дает NiCl2, который менее реакционноспособный при приготовлении катализатора и не является предпочтительным. Кроме того, нагревание NiCl2 в течение продолжительного периода времени также будет приводить к получению продукта с более низкой реакционной способностью. Соответственно, NiCl2 не следует нагревать выше примерно 200°С в течение более 12 часов.
Выражение ″гидратированный NiCl2″ обозначает NiCl2, содержащий 2% мас. воды или более. Примеры гидратированного NiCl2 включают дигидрат, гексагидрат и водные растворы NiCl2. Предпочтительными источниками получения безводного NiCl2 являются гексагидратный продукт и водный раствор. NiCl2 в виде водного раствора является особенно предпочтительным. Водный раствор имеется в продаже в виде водного раствора NiCl2 с концентрацией примерно 29% мас. Однако считается, что изобретение не ограничивается данными массовыми процентами и будут включаться водные растворы с другими массовыми процентами NiCl2. На практике предпочтительный водный раствор содержит от 20 до 31% мас. NiCl2. Нижний предел обусловлен стоимостной эффективностью дегидратирования разбавленного раствора. Верхний предел обусловлен растворимостью NiCl2 при комнатной температуре, в частности, осаждением NiCl2(H2O)6.
Предпочтительный метод сушки гидратированного NiCl2 заключается в сушке NiCl2 сначала распылительной сушкой, или флэш-сушкой, и затем в дополнительной сушке полученного в результате продукта термической сушкой. Специалисту в данной области известен ряд типов распылительных или термических сушилок. Известно, что пневматические ленточные сушилки и флэш-сушилки являются взаимозаменяемой терминологией в области сушки. Выбор того, какой тип использовать, не является критическим. Примерами распылительных сушилок являются сушилки с прямоточным потоком, противоточным потоком и смешанным потоком. В данном предпочтительном способе распылительная сушка должна иметь температуру на выходе от 120 до 150°С, предпочтительно от 130 до 135°С. Среднее время воздействия тепла в распылительной сушилке должно составлять от 1 до 75 секунд, предпочтительно от 1 до 45 секунд. Полученный в результате продукт типично представляет собой дигидратный продукт, который содержит примерно 22% мас. воды.
После распылительной сушки или флэш-сушки продукт, предпочтительно, дополнительно сушат термической сушкой. Выбор типа сушилки не является критическим. Термическая сушка может представлять собой сушку с прямым или косвенным нагревом, где тепло, главным образом, подводят за счет теплопроводности или конвекции. Термическую сушку можно осуществлять при пониженном давлении или потоком сухого инертного газа. По экономическим причинам сухой инертный газ, предпочтительно, представляет собой азот. Термическую сушку следует проводить при температуре примерно от 200 до 240°С. Время сушки не должно превышать примерно 12 часов.
Получение катализатора осуществляют в присутствии нитрильного растворителя, предпочтительно 3-пентеннитрила или 2-метил-бутеннитрила. Концентрация лиганда может находиться в диапазоне примерно от 1% до 90% мас. Исходя из практики предпочтительный диапазон концентрации лиганда составляет от 5% до 50%. Количество восстанавливающего металла (МЕТ) определяется желаемой концентрацией никелевого каталитического продукта. Предпочтительное количество восстанавливающего металла (МЕТ) обычно будет находиться в диапазоне от 0,1% до 5% от реакционной массы. Количество NiCl2 будет в молярном избытке по отношению к восстанавливающему металлу. Молярное отношение NiCl2 к МЕТ находится в диапазоне от 1,1:1 до 100:1. Предпочтительное отношение NiCl2 к МЕТ находится в диапазоне от 2:1 до 50:1. Температура реакции может находиться в диапазоне от 0°С до 120°С. Предпочтительный температурный диапазон зависит от формы NiCl2. Гидратированные формы NiCl2 быстро реагируют при более низких температурах по сравнению с безводным NiCl2. Для NiCl2·2H2O предпочтительный температурный диапазон составляет от 0°С до 60°С, и наиболее предпочтительный диапазон составляет от 25°С до 50°С. Для безводного NiCl2 предпочтительный температурный диапазон составляет от 30°С до 100°С, и наиболее предпочтительный диапазон составляет от 50°С до 90°С. Реакция может протекать внутри широкого диапазона давлений. Исходя из практики предпочтительное давление находится в диапазоне примерно от 5 фунт./кв. дюйм абс. до 50 фунт./кв. дюйм абс. (от 34 до 340 кПа). Реакция может протекать в периодическом или непрерывном режиме.
Подходящими лигандами по настоящему изобретению являются бидентатные фосфорсодержащие лиганды, выбранные из группы, состоящей из бидентатных фосфитов, бидентатных фосфинитов и бидентатных фосфинов. Наиболее предпочтительными лигандами являются бидентатные фосфитные лиганды.
Наиболее предпочтительные бидентатные фосфитные лиганды имеют следующие структурные формулы:
(R1O)2P(OZO)P(OR1)2,
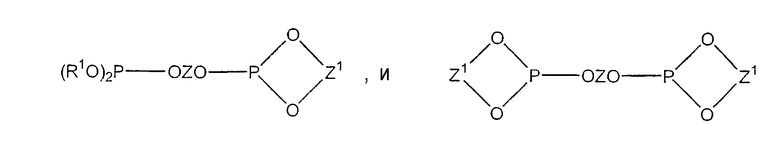
В данных формулах R1 представляет собой фенил, незамещенный или замещенный одной или несколькими С1-С12 алкильными или С1-С12 алкоксильными группами; или нафтил, незамещенный или замещенный одной или несколькими С1-С12 алкильными или С1-С12 алкоксильными группами; и Z и Z1 независимо выбраны из группы, состоящей из соединений со структурными формулами I, II, III и IV:
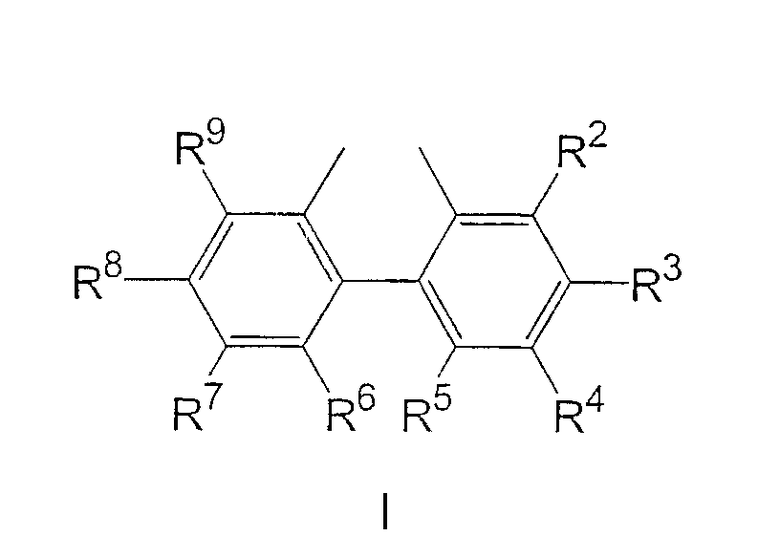
где:
R2 и R9 являются одинаковыми и выбраны из H, С1-С12 алкила и С1-С12 алкокси;
R3 и R8 являются одинаковыми и выбраны из H, С1-С12 алкила и С1-С12 алкокси;
R4 и R7 являются одинаковыми и выбраны из H, С1-С12 алкила и С1-С12 алкокси;
R5 и R6 являются одинаковыми и выбраны из H, С1-С12 алкила и С1-С12 алкокси;
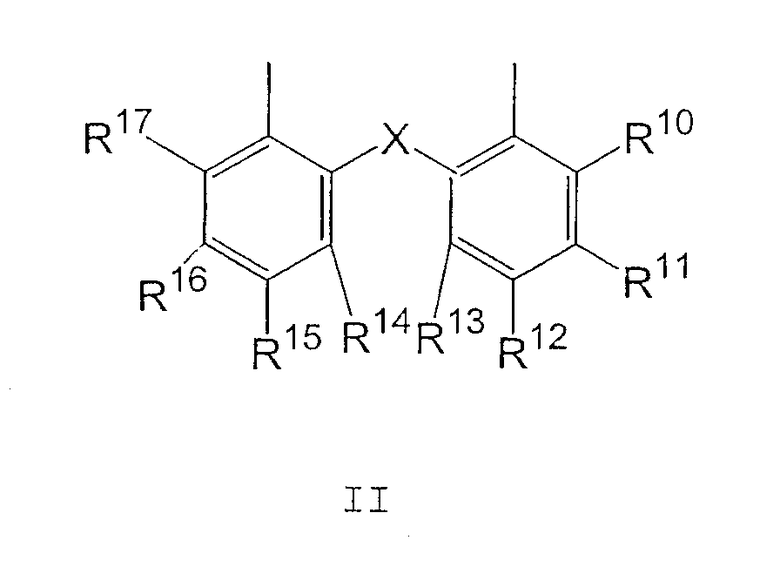
где:
X представляет собой O, S или CH(R18);
R10 и R17 являются одинаковыми и выбраны из H, С1-С12 алкила и С1-С12 алкокси;
R11 и R16 являются одинаковыми и выбраны из H, С1-С12 алкила и С1-С12 алкокси;
R12 и R15 являются одинаковыми и выбраны из H, С1-С12 алкила и С1-С12 алкокси;
R13 и R14 являются одинаковыми и выбраны из H, С1-С12 алкила и С1-С12 алкокси и
R18 представляет собой H или С1-С12 алкил;
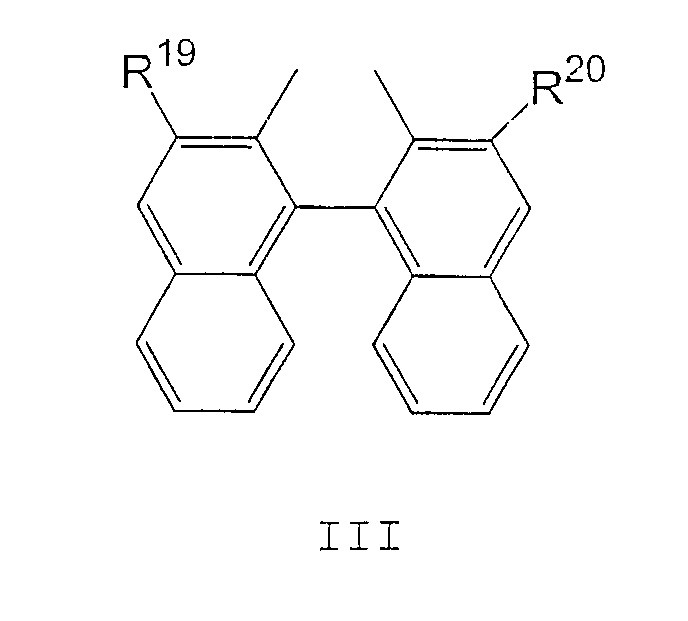
где:
R19 и R20 являются одинаковыми и выбраны из H, С1-С12 алкила, С1-С12 алкокси и CO2R21;
R21 представляет собой С1-С12 алкил или С6-С10 арил, незамещенный или замещенный С1-С4 алкильными группами. Арильные группы, предпочтительно, представляют собой фенил или нафтил.
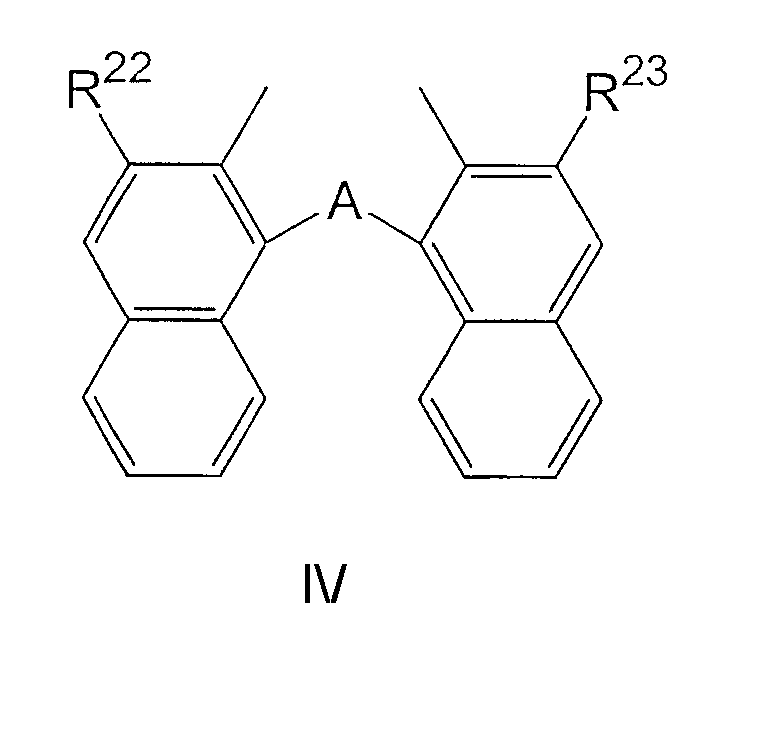
где:
A представляет собой O, S, CH(R24);
R22 и R23 являются одинаковыми и выбраны из H и CO2R25;
R24 представляет собой H или С1-С12 алкил;
R25 представляет собой С1-С12 алкил.
В вышеуказанных структурных формулах С1-С12 алкильные и С1-С12 алкоксильные группы могут быть линейными или разветвленными.
Примеры соединений двухзамещенных органических фосфитов, которые можно получить настоящим способом, включают соединения формул V-XXVI, которые показаны ниже.
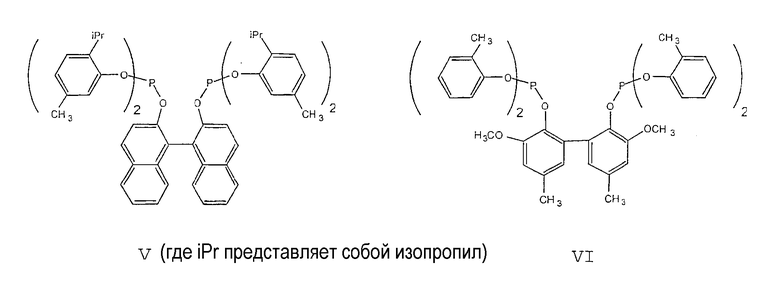
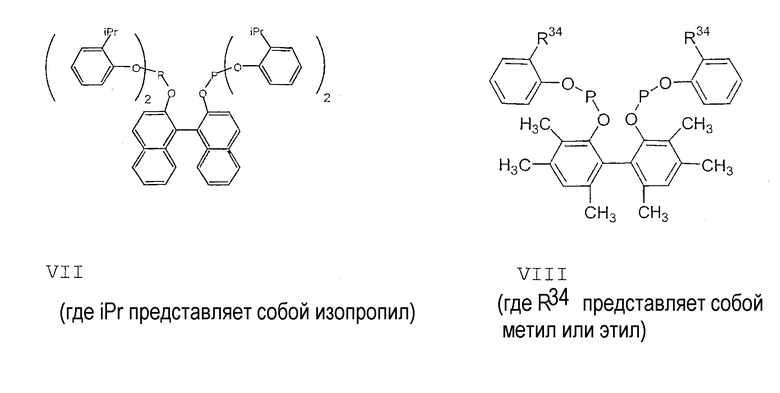
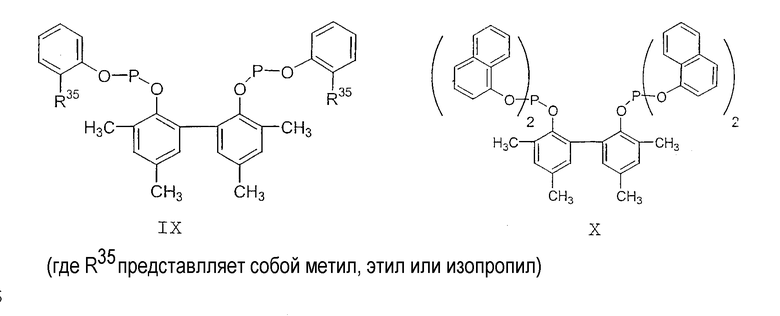
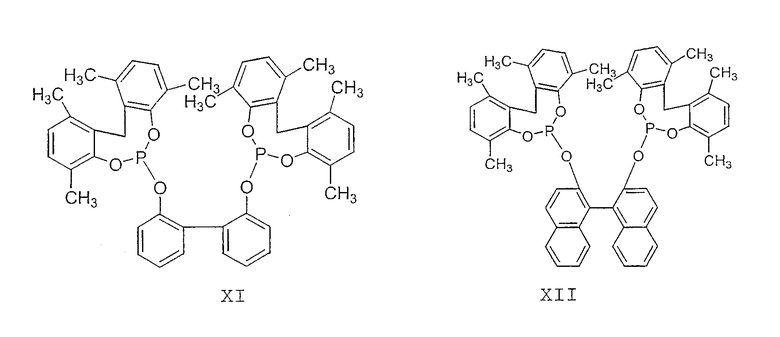
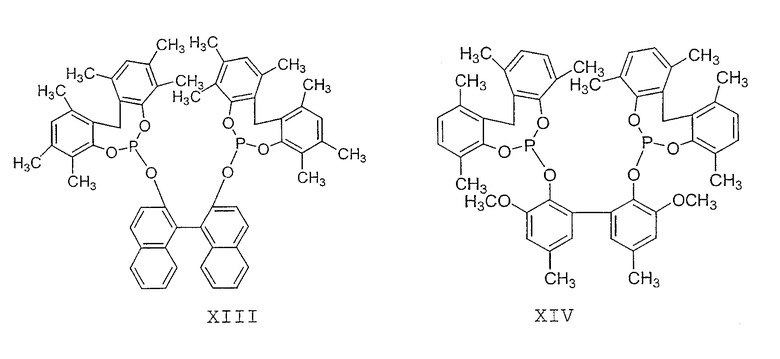
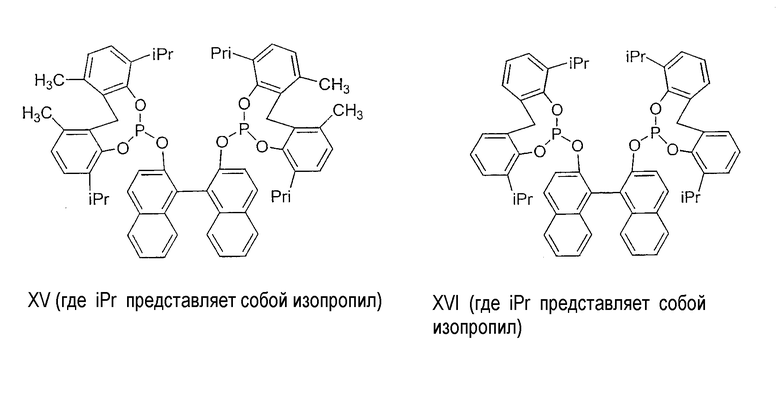
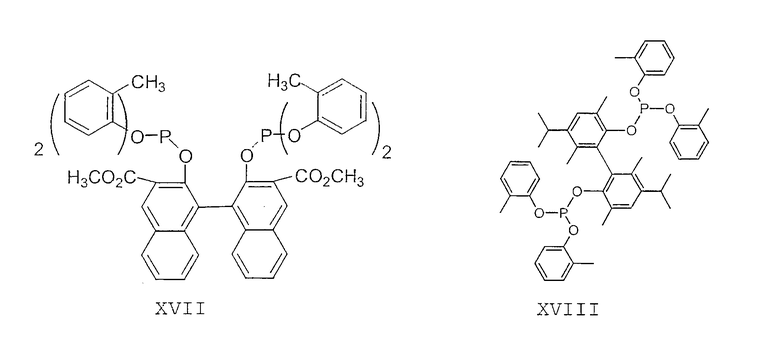
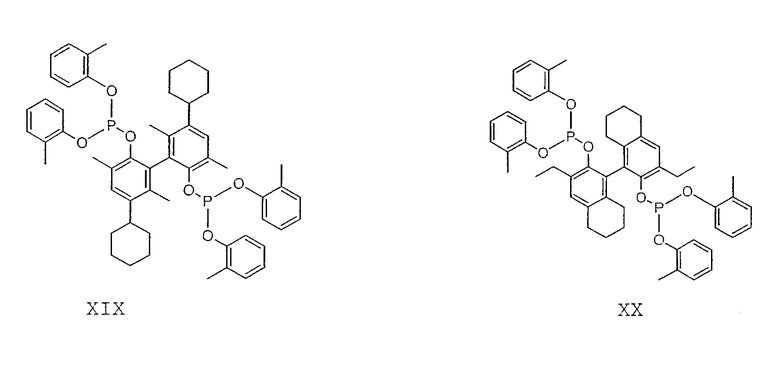
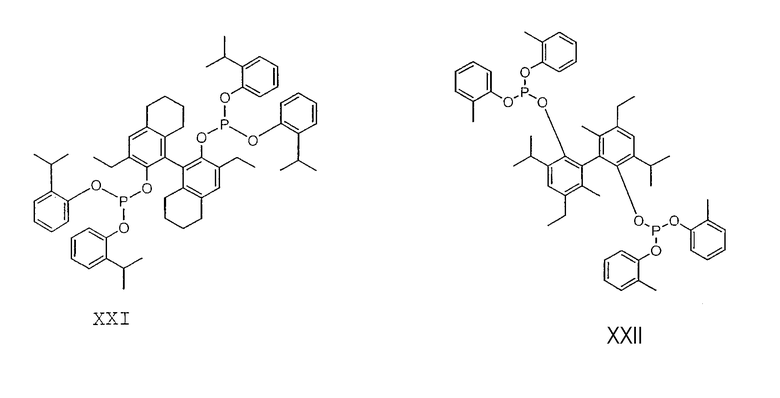
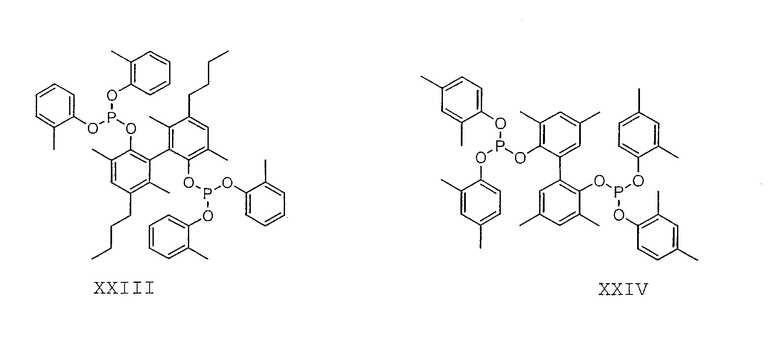
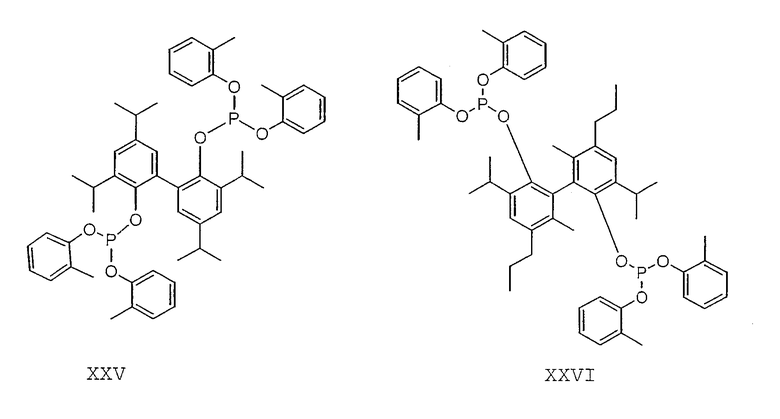
Подходящие бидентатные фосфиты описаны в патентах США 5512695, 5512696, 5663369 и 5723641, описание которых включается здесь в качестве ссылки. Подходящие бидентатные фосфиниты описаны в патентах США 5523453 и 5693843, описание которых включается здесь в качестве ссылки.
Реакцию можно осуществлять таким образом, что непрореагировавший избыток NiCl2 можно отделить от реакционного продукта фильтрованием или центрифугированием. Собранный избыток хлорида никеля затем можно повторно использовать в реакторе для получения катализатора.
ПРИМЕРЫ
Изобретение иллюстрируется следующими ниже неограничивающими примерами. В следующих ниже примерах восстанавливающий металл является лимитирующим реагентом в каждой реакции, и поэтому степень протекания реакции (конверсию) выражают в виде процента прореагировавшего восстанавливающего металла. Если это не отмечено иным образом, степень протекания реакции (конверсии) определяют, анализируя количество активного никеля, полученного реакцией синтеза катализатора. Анализ проводят, обрабатывая не содержащую твердые вещества аликвоту реакционного раствора диметилацетилендикарбоксилатом (ДМАД), который образует стабильный комплекс с никелем, (лиганд)Ni(ДМАД), и количественно анализируя содержание данного комплекса жидкостной хроматографией высокого давления (ВЭЖХ).
Примеры 1-6 и 11-18 используют безводный NiCl2, полученный в примере 20. Используемый в примерах 7-10 NiCl2·2H2O получают нагреванием гексагидрата хлорида никеля примерно до 130°С при пониженном давлении.
Примеры 1-6 иллюстрируют, что скорость реакции синтеза катализатора зависит от количества безводного NiCl2, загруженного в реакционный сосуд.
Пример 1
В 100 мл реакционный сосуд, оборудованный механической мешалкой, под атмосферой азота загружают 3-пентеннитрил (80 мл, 830 ммоль), лиганд V (18 г, 19 ммоль), NiCl2 (3,22 г, 24,8 ммоль) и порошок цинка (0,61 г, 9,3 ммоль). Реакционную смесь перемешивают при 100°С в течение 3 часов, и образцы отбирают каждые 30 минут для анализа. По прошествию 2 часов происходит 70% превращение (конверсия) NiCl2 в катализатор, а после 3 часов происходит более чем 95% конверсия NiCl2 в катализатор.
Пример 2
Реакцию осуществляют так же, как в примере 1, за исключением того, что количество загруженного NiCl2 (1,61 г, 12,4 ммоль) вдвое меньше. После 2 часов происходит почти 37% конверсия NiCl2 в катализатор, а после 3 часов происходит примерно 60% конверсия NiCl2 в катализатор.
В следующих ниже примерах 3-10 повторно загружают источник катализатора, который истощен по активному никелю, называемый ″рецикловый катализатор″. В данных случаях ″рецикловый катализатор″ содержит 11% мас. лиганда V в 3-пентеннитриле.
Пример 3
В 100 мл реакционный сосуд, оборудованный механической мешалкой, под атмосферой азота загружают рецикловый катализатор (100 г, содержащий 11% мас. лиганда V), NiCl2 (1,21 г, 9,3 ммоль) и порошок цинка (0,61 г, 9,3 ммоль). Реакционную смесь перемешивают при 80°С в течение 4 часов, и каждые 30 минут отбирают образцы на анализ. После 4 часов происходит конверсия NiCl2 в катализатор примерно менее 2%.
Пример 4
Реакцию проводят таким же образом, как в примере 3, за исключением того, что количество загруженного NiCl2 (2,42 г, 18,6 ммоль) в два раза превышает количество, используемое в примере 3. После 4 часов происходит 35% конверсия NiCl2 в катализатор.
Пример 5
Реакцию проводят таким же образом, как в примере 3, за исключением того, что количество загруженного NiCl2 (4,84 г, 37,2 ммоль) в четыре раза превышает количество, используемое в примере 3. После 4 часов происходит 75% конверсия NiCl2 в катализатор.
Пример 6
Реакцию проводят таким же образом, как в примере 3, за исключением того, что количество загруженного NiCl2 (7,26 г; 56,0 ммоль) в шесть раз превышает количество, используемое в примере 3. После 2 часов происходит 77% конверсия NiCl2 в катализатор, а после 4 часов происходит 83% конверсия NiCl2 в катализатор.
Следующие ниже примеры 7-10 показывают, что использование гидратированного NiCl2 (NiCl2·2H2O) дает такую же зависимость скорости от концентрации хлорида никеля, как в случае безводного NiCl2, но при более низкой температуре.
Пример 7
В 100 мл реакционный сосуд, оборудованный механической мешалкой, под атмосферой азота загружают рецикловый катализатор (100 г, содержащий 11% масс. лиганда V), NiCl2·2H2O (1,21 г, 7,3 ммоль) и порошок цинка (0,61 г, 9,3 ммоль). Реакционную смесь перемешивают при 25°С в течение 4 часов, и образцы отбирают на анализ каждые 30 минут. После 4 часов происходит примерно 13% конверсия NiCl2 в катализатор.
Пример 8
Реакцию проводят таким же образом, как в примере 7, за исключением того, что количество загруженного NiCl2·2H2O (2,42 г, 14,6 ммоль) в два раза превышает количество, используемое в примере 7. После 4 часов происходит 27% конверсия NiCl2 в катализатор.
Пример 9
Реакцию проводят таким же образом, как в примере 7, за исключением того, что количество загруженного NiCl2·2H2O (4,84 г, 29,2 ммоль) в четыре раза превышает количество, используемое в примере 7. После 4 часов происходит 93% конверсия NiCl2 в катализатор.
Пример 10
Реакцию проводят таким же образом, как в примере 7, за исключением того, что количество загруженного NiCl2·2H2O (7,26 г, 43,8 ммоль) в шесть раз превышает количество, используемое в примере 7. После 30 минут конверсия NiCl2 в катализатор превышает 95%.
Пример сравнения 1 иллюстрирует, что увеличение молярного отношения восстанавливающего металла к NiCl2 не увеличивает скорость реакции. В данном примере NiCl2 является лимитирующим реагентом, и степень протекания реакции сообщается в виде конверсии NiCl2. NiCl2 является таким, как полученный в примере 20.
Пример сравнения 1
Раствор ″рециклового катализатора″ (9 г 30% масс. лиганда V) обрабатывают NiCl2 (0,11 г) и цинком (0,10 г). Смесь интенсивно перемешивают и нагревают при температуре примерно 100°С. Анализ прозрачного жидкого образца после 2 часов показывает 54% конверсию NiCl2. Реакцию проводят таким же образом за исключением того, что загруженное количество цинка составляет 0,20 г и 0,40 г, приводя к конверсиям 54% и 50% соответственно.
Следующие ниже примеры 11-17 показывают, что способ по настоящему изобретению применим для дополнительных фосфорсодержащих лигандов и что аналогичные эффекты наблюдаются, когда в качестве восстановителя используют железо. В данных примерах степень протекания реакции определяют, измеряя содержание никеля в растворе спектрометрией с индуктивно связанной плазмой (ИСП).
Пример 11
Готовят раствор лиганда XXIV, растворяя 2,497 г лиганда XXIV в 24,008 г сухого 3-пентеннитрила. Аликвоту данного раствора (13,0 г) смешивают с безводным NiCl2 (1,22 г) и цинком (0,102 г). Смесь интенсивно перемешивают и нагревают при температуре примерно 80°С. Анализ прозрачного жидкого образца, отобранного после 2 часов, показывает 56% конверсию. В аналогичной реакции, за исключением того, что в смесь загружают только 0,20 г NiCl2, после 2 часов обнаруживают конверсию, составляющую только 10%.
Пример 12
Готовят раствор лиганда XXI, растворяя 3,03 г лиганда XXI в 24,16 г сухого 3-пентеннитрила. Аликвоту данного раствора (13,38 г) смешивают с 1,20 г безводного NiCl2 и 0,10 г цинка. Смесь интенсивно перемешивают и нагревают при температуре примерно 81°С. Анализ прозрачного жидкого образца, отобранного после 2 часов, показывает 41% конверсию. В аналогичной реакции, за исключением того, что в смесь загружают только 0,20 г NiCl2, после 2 часов обнаруживают конверсию, составляющую только 10%.
Пример 13
Готовят раствор лиганда XVIII, растворяя 2,59 г лиганда XVIII в 24,0 г сухого 3-пентеннитрила. Аликвоту данного раствора (13,38 г) смешивают с 1,20 г безводного NiCl2 и 0,10 г цинка. Смесь интенсивно перемешивают и нагревают при температуре примерно 80°С. Анализ прозрачного жидкого образца, отобранного после 2 часов, показывает 73% конверсию. В аналогичной реакции, за исключением того, что в смесь загружают только 0,20 г NiCl2, после 2 часов обнаруживают конверсию, составляющую только 14%.
Пример 14
Готовят раствор лиганда XIX, растворяя 2,85 г лиганда XIX в 24,0 г сухого 3-пентеннитрила. Аликвоту данного раствора (13,4 г) смешивают с 1,20 г безводного NiCl2 и 0,10 г цинка. Смесь интенсивно перемешивают и нагревают при температуре примерно 78°С. Анализ прозрачного жидкого образца, отобранного после 2 часов, показывает 38% конверсию. В аналогичной реакции, за исключением того, что в смесь загружают только 0,20 г NiCl2, после 2 часов обнаруживают конверсию, составляющую только 10%.
Пример 15
Готовят раствор лиганда XX, растворяя 2,67 г лиганда XX в 24,0 г сухого 3-пентеннитрила. Аликвоту данного раствора (13,0 г) смешивают с 1,23 г безводного NiCl2 и 0,10 г цинка. Смесь интенсивно перемешивают и нагревают при температуре примерно 81°С. Анализ прозрачного жидкого образца, отобранного после 2 часов, показывает 59% конверсию. В аналогичной реакции, за исключением того, что в смесь загружают только 0,20 г NiCl2, после 2 часов обнаруживают конверсию, составляющую только 10%.
Пример 16
Готовят раствор лиганда XXV, растворяя 2,68 г лиганда XXV в 24,0 г сухого 3-пентеннитрила. Аликвоту данного раствора (13,1 г) смешивают с 1,20 г безводного NiCl2 и 0,10 г цинка. Смесь интенсивно перемешивают и нагревают при температуре примерно 81°С. Анализ прозрачного жидкого образца, отобранного после 2 часов, показывает 45% конверсию. В аналогичной реакции, за исключением того, что в смесь вместо цинка загружают порошок железа (0,43 г), после 2 часов обнаруживают конверсию, составляющую 34%.
Пример 17
Готовят раствор лиганда XXVI, растворяя 2,77 г лиганда XXVI в 24,0 г сухого 3-пентеннитрила. Аликвоту данного раствора (12,6 г) смешивают с 1,20 г безводного NiCl2 и 0,10 г цинка. Смесь интенсивно перемешивают и нагревают при температуре примерно 80°С. Анализ прозрачного жидкого образца, отобранного после 2 часов, показывает 37% конверсию. В аналогичной реакции, за исключением того, что в смесь вместо цинка загружают порошок железа (0,42 г), после 2 часов обнаруживают конверсию, составляющую 38%.
Пример 18
Готовят раствор лиганда V, растворяя 3,03 г лиганда V в 24,0 г сухого 3-пентеннитрила. Аликвоту данного раствора (13,3 г) смешивают с 1,20 г безводного NiCl2 и 0,44 г железа. Смесь интенсивно перемешивают и нагревают при температуре примерно 81°С. Анализ прозрачного жидкого образца, отобранного после 2 часов, показывает 16% конверсию. В аналогичной реакции, за исключением того, что в смесь загружают только 0,2 г NiCl2, после 2 часов обнаруживают конверсию, составляющую только 7%.
Примеры 19-24 демонстрируют предпочтительные способы сушки NiCl2. Примеры сравнения 2-3 представлены для сравнения с настоящим изобретением и показывают, что перегрев при сушке будет приводить к менее реакционно-способному материалу. Анализ ″площади поверхности по БЭТ″ относится к аналитическому методу измерения площади поверхности твердого вещества, хорошо известному специалисту в данной области. Буквы ″БЭТ″ относятся к Браунауэру, Эммету, Теллеру, которые разработали теорию многослойной адсорбции/абсорбции газа на твердых поверхностях. Например, используя газообразный азот при 77 К, можно оценить площадь поверхности твердого вещества, измеряя количество молей адсорбированного азота в виде функции парциального давления газа для данной навески твердого вещества. Используя теорию сорбции БЭТ для полученной в результате кривой изотермы абсорбции, легко определить эффективную площадь поверхности твердого вещества.
Пример 19
10 г гексагидрата хлорида никеля тонко распределяют в чистой кварцевой лодочке в облицованной кварцем трубчатой печи, оборудованной устройством подачи потока сухого азота со скоростью 100 мл/мин. Выходящий поток азота пропускают через барботер с минеральным маслом и выпускают в вытяжной шкаф. Затем образец нагревают до 240°С в течение 15 минут и выдерживают в течение полных 60 минут. Затем образец охлаждают, запаивают и помещают в продуваемую азотом защитную камеру с перчатками для сбора и хранения перед экспериментами по приготовлению катализатора. Небольшую часть вещества анализируют на содержание воды термогравиметрическим анализом (ТГА), нагревая до 400°С со скоростью 10°С/мин. Потеря массы примерно при 200°С дает меру воды в образце.
Данный образец содержит 0,3% мас. воды, имеет площадь поверхности по БЭТ 35 м2/г и оцененный размер кристаллитов 9 нм. При использовании для приготовления катализатора аналогично процедуре примера 1, данный материал дает 76% конверсию.
Пример сравнения 2
Повторяют процедуру примера 19 за исключением того, что хлорид никеля дополнительно нагревают до 350°С в течение 30 минут в атмосфере азота. Полученный образец имеет менее 0,05% мас. воды, площадь поверхности по БЭТ 13 м2/г и оцененный размер кристаллитов 22 нм. При использовании для приготовления катализатора аналогично процедуре примера 1, данный материал дает конверсию 36%.
Пример сравнения 3
Повторяют процедуру примера 19 за исключением того, что хлорид никеля дополнительно нагревают до 500°С в течение 30 минут в атмосфере азота. Полученный образец имеет менее 0,05% мас. воды, площадь поверхности по БЭТ 2 м2/г и оцененный размер кристаллитов 44 нм. При использовании для приготовления катализатора аналогично процедуре примера 1, данный материал дает конверсию 1%.
Пример 20
9,1 кг гидрата NiCl2, содержащего 10,9% мас. H2O, загружают в вакуумную барабанную сушилку. В сушилку добавляют 20 кг гексагидрата NiCl2, приводя к эквивалентной загрузке NiCl2, содержащей 34,7% мас. H2O. Давление в сушилке снижают до 100 торр (690 кПа), а температуру в сушилке постепенно увеличивают до 100°С в течение 5-часового периода. Выражение ″температура в сушилке″ относится к температуре содержания объема. Вакуумную сушилку косвенно нагревают подводом горячего масла с температурой, превышающей измеренную температуру объема не более чем на 20°С. Тесты ТГА подтверждают, что содержимое сушилки дегидратируют до остаточной влажности 21,5% мас. H2O, эквивалентной дигидратному состоянию. Затем температуру в сушилке повышают до 200°С в течение 4-часового периода и затем повышают до 240°С в течение 2-часового периода. Тесты ТГА показывают, что остаточная влажность понижается до менее 0,1% мас. H2O. Площадь поверхности по БЭТ составляет 24 м2/г, и оцененный размер кристаллитов равен 17 нм. Получают примерно 17 кг безводного NiCl2 продукта. При использовании для приготовления катализатора аналогично процедуре примера 1, данный материал дает конверсию 79%.
Пример 21
Водный раствор, содержащий примерно 29% мас. NiCl2, нагнетают в распылительную сушилку со средней скоростью 33,5 кг/час. Пропущенный через фильтр атмосферный воздух косвенно нагревают до 400°С и инжектируют прямотоком со средней скоростью 327 кг/час. При данных условиях средняя температура воздуха на выходе из распылительной сушилки составляет 135°С. В течение 4-часовых тестов получают 50 кг дигидрата NiCl2, содержащего примерно 22% мас. H2O.
Примерно 30 кг высушенного распылительной сушкой продукта загружают в такую же вакуумную барабанную сушилку, как в примере 20. Давление в барабанной сушилке снижают до 50 торр (345 кПа), а температуру в сушилке увеличивают до 220°С в течение 2-часового периода и поддерживают в течение дополнительных 3 часов. Тесты ТГА показывают, что остаточная влажность понижается до менее 0,1% мас. H2O, и оцененный размер кристаллитов равен 18 нм. При использовании для приготовления катализатора аналогично процедуре примера 1, данный материал дает конверсию 82%. При использовании в аналогичной процедуре приготовления катализатора, за исключением того, что температура реакции составляет примерно 80°С, конверсия составляет 64% после 2 часов.
Пример 22
Данный пример 22 показывает, что продукт распылительной сушки можно непрерывно подавать в установку для термообработки, и что для получения удовлетворительных результатов низкое давление в установке для термообработки не требуется.
Повторяют процедуру примера 21 за исключением того, что дигидрат NiCl2 из распылительной сушилки затем непрерывно подают в установку для термообработки, которую косвенно нагревают подачей горячего масла с температурой 244°С, приводя к тому, что температура объема примерно на 10°С ниже. Давление в установке для термообработки поддерживают слегка ниже атмосферного. Выгружаемый из установки для термообработки безводный продукт содержит остаточную влажность менее 1% мас. H2O. При использовании для приготовления катализатора аналогично процедуре примера 1, за исключением того, что температура реакции составляет примерно 80°С, данный материал дает конверсию 62%.
Данное изобретение относится к способу получения катализатора гидроцианирования, который представляет собой комплекс никеля с бидентатным фосфорсодержащим соединением. Способ получения включает взаимодействие, по меньшей мере, одного бидентатного фосфорсодержащего лиганда, выбранного из группы, состоящей из бидентатных фосфитов, бидентатных фосфинитов и бидентатных фосфинов, с хлоридом никеля в присутствии нитрильного растворителя и восстанавливающего металла. Восстанавливающий металл является более электроположительным чем никель и может быть выбран из группы, состоящей из Na, Li, К, Mg, Са, Ва, Sr, Ti, V, Fe, Со, Cu, Zn, Cd, Al, Ga, In и Sn. Хлорид никеля присутствует в молярном избытке относительно восстанавливающего металла. Катализатор получают предпочтительно при температуре от 30 до 100°С и давлении от 34 до 340 кПа. Технический результат - снижение температуры реакции и уменьшение образования побочных продуктов. 15 з.п. ф-лы.
(R1O)2P(OZO)P(OR1)2,
и
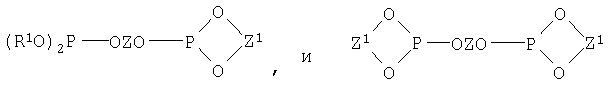
где R1 представляет собой фенил, незамещенный или замещенный одной или несколькими C1-C12 алкильными или C1-C12 алкоксильными группами; нафтил, незамещенный или замещенный одной или несколькими C1-C12 алкильными или C1-C12 алкоксильными группами;
Z и Z1 независимо выбраны из группы, состоящей из радикалов, имеющих формулы I, II, III и IV
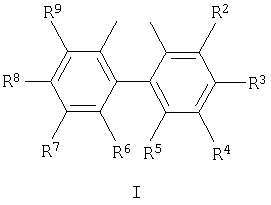
где R2 и R9 являются одинаковыми и выбраны из Н, С1-С12 алкила и C1-С12 алкокси;
R3 и R8 являются одинаковыми и выбраны из Н, С1-С12 алкила и С1-С12 алкокси;
R4 и R7 являются одинаковыми и выбраны из Н, С1-С12 алкила и С1-С12 алкокси;
R5 и R6 являются одинаковыми и выбраны из Н, С1-С12 алкила и С1-С12 алкокси;
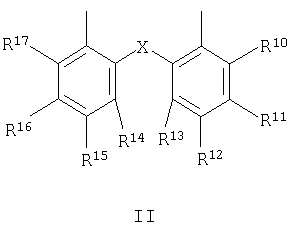
где X представляет собой О, S или CH(R18);
R10 и R17 являются одинаковыми и выбраны из Н, C1-C12 алкила и C1-C12 алкокси;
R11 и R16 являются одинаковыми и выбраны из Н, C1-C12 алкила и C1-C12 алкокси;
R12 и R15 являются одинаковыми и выбраны из Н, C1-C12 алкила и C1-C12 алкокси;
R13 и R14 являются одинаковыми и выбраны из Н, C1-C12 алкила и C1-C12 алкокси и
R18 представляет собой Н или C1-C12 алкил;
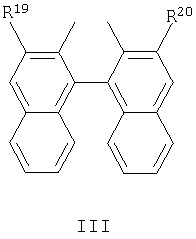
где R19 и R20 являются одинаковыми и выбраны из Н и CO2R21;
R21 представляет собой C1-C12 алкил или С6-С10 арил, незамещенный или замещенный С1-С4 алкильными группами;
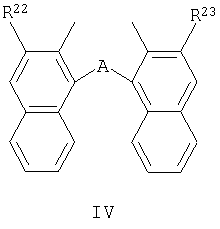
где А представляет собой О, S, CH(R24);
R22 и R23 являются одинаковыми и выбраны из Н и CO2R25;
R24 представляет собой Н или C1-C12 алкил;
R25 представляет собой C1-C12 алкил.
(a) распылительную сушку водного раствора хлорида никеля при температуре на выходе примерно от 120 до 150°С и
(b) термическую сушку продукта из стадии (а) при температуре примерно от 200 до 240°С в течение периода времени менее 12 ч.
| US 5512695 А, 30.04.1996 | |||
| RU 98107641 A, 10.02.2000 | |||
| US 5523453 A, 04.06.1996 | |||
| US 5510470 A, 23.04.1996 | |||
| US 3631191 A, 28.12.1971 | |||
| US 3846461 A, 05.11.1974 | |||
| US 3847959 А, 12.11.1974 | |||
| US 5061669 А, 29.10.1991 | |||
| JP 11263625 А, 28.09.1999 | |||
| СПОСОБ ТЕРМИЧЕСКОЙ ОБРАБОТКИ ВЛАЖНЫХ ГИДРАТОВ | 1992 |
|
RU2096365C1 |
| Способ получения безводного хлорида никеля | 1981 |
|
SU1096223A1 |
Авторы
Даты
2007-06-27—Публикация
2002-11-14—Подача