Данное изобретение касается применения класса производных дикетопиперазина в качестве эффективных и селективных антагонистов окситоцина, новых соединений этого класса и способов их получения.
Патент США 5817751 раскрывает комбинаторные и твердофазные способы синтеза разнообразных производных дикетопиперазина и применения данных способов для создания библиотек разнообразных производных дикетопиперазина.
WO 99/47549 описывает производные дикетопиперазина, включая производные 3-бензил-2,5-дикетопиперазина, в качестве ингибиторов фруктозы 1,6-бисфосфата (FBP-аза).
WO 99/38844 описывает способ получения N-[(алифатический или ароматический)карбонил]-2-аминоацетамидных соединений и их циклизации с получением среди прочего производных дикетопиперазина.
WO 99/37304 описывает оксагетероциклильные соединения, включая оксапиперазинильные соединения, которые ингибируют фактор Ха.
Гормон окситоцин является эффективным агентом сокращения матки и используется для вызова или усиления родовой деятельности. Также плотность окситоциновых рецепторов матки существенно увеличивается, >100-кратно, во время беременности и пиков родов (преждевременных или своевременных). Преждевременное рождение/роды (от 24 до 37 недель) дают примерно 60% смертность/болезненность детей, и, таким образом, соединение, которое ингибирует активность окситоцина матки, например, антагонист окситоцина, должно быть полезно для профилактики или контроля преждевременных родов.
Авторы обнаружили класс производных дикетопиперазина, которые демонстрируют особо полезный уровень активности как селективные антагонисты окситоциновых рецепторов.
Таким образом, настоящее изобретение касается способа лечения или профилактики заболеваний или состояний, опосредованных действием окситоцина, который включает введение нуждающемуся в таком лечении млекопитающему эффективного количества соединения формулы (I)
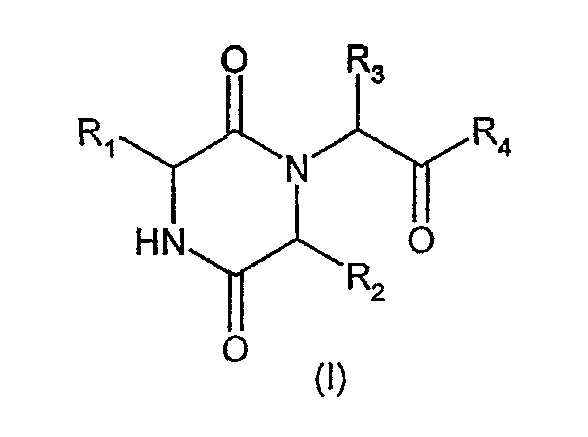
и/или его физиологически приемлемого производного, где
R1 обозначает арил(С1-4)алкил или 5-7-членную циклоалкильную группу, необязательно замещенную одной или несколькими гидроксильными группами, которая сконденсирована с необязательно замещенным бензольным кольцом;
R2 обозначает С1-6алкил (необязательно замещенный С1-2алкокси, С1-2алкилтио, ди(С1-2алкил)амино или С3-6циклоалкильной группой), или С3-6циклоалкил, или 5-6-членную гетероциклическую группу, содержащую один гетероатом, выбранный из O, S или N, причем атом азота несет атом водорода или метильную или этильную группу;
R3 обозначает необязательно замещенный фенил, 5- или 6-членную гетероарильную группу или конденсированную бициклическую кольцевую систему, содержащую 9-10 кольцевых членов, которая может представлять собой карбоциклическую группу или может содержать до 3 гетероатомов, выбранных из O, S или N, и одно из конденсированных колец является бензолом;
R4 обозначает ОН или ОС1-4алкил (необязательно замещенный С1-4алкилкарбонилокси) или NR5R6;
R5 обозначает водород, С1-6алкил (необязательно замещенный С1-4алкокси) или С3-7циклоалкил;
R6 обозначает водород, метил, С1-4алкокси, С3-7циклоалкил, C1-4алкил [необязательно замещенный одной или несколькими группами, выбранными из карбоксила, C1-4 алкилсульфонила или C1-4алкоксикарбонила], C2-4 алкил [необязательно замещенный одной или несколькими группами, выбранными из галогена, гидрокси, C1-4алкокси или NR7R8, где R7 и R8 независимо представляют водород или C1-4 алкил, или вместе с атомом азота, к которому они присоединены, образуют 3-7-членное насыщенное гетероциклическое кольцо, которое может содержать дополнительный гетероатом, выбранный из О, S или N (и указанная гетероциклическая группа может быть замещена 1-3 группами, выбранными из C1-3алкила, гидрокси, C1-3алкокси (необязательно замещенного C3-6циклоалкилом или необязательно замещенного фенилом), C3-6циклоалкила или NRcRd, где Rc и Rd каждый независимо представляет группу, выбранную из С1-3алкила (необязательно замещенного С3-6циклоалкилом или необязательно замещенного фенилом) или С3-6циклоалкила)] или R6 обозначает фенильную или бензильную группу (необязательно замещенную одной или несколькими метокси- или бензилоксигруппами), или необязательно замещенную гетероарилметильную группу или гетероарильную группу, или С3-7циклоалкил, или группу CH2CONR9R10, где R9 обозначает водород или C1-4 алкил, R10 обозначает водород, С1-4алкил, необязательно замещенный 5- или 6-членной гетероарильной группой, или R9, R10 и атом азота, к которому они присоединены, вместе образуют 5- или 6-членное насыщенное гетероциклическое кольцо, и где 6-членная гетероциклическая группа может содержать дополнительный гетероатом, выбранный из кислорода, серы или азота, и дополнительный атом азота либо несет атом водорода, либо C1-4 алкильную или C1-4алканоильную группу; или R5 И R6 вместе с атомом азота, к которому они присоединены, образуют 3-7-членное насыщенное гетероциклическое кольцо, гетероцикл которого может содержать дополнительный гетероатом, выбранный из кислорода, серы и азота, и где атом серы может быть в окисленном виде, например, SO2 и дополнительный атом азота либо несет атом водорода, или C1-4алкильную или C1-4алканоильную группу, или C1-4алкилсульфонильную группу, или C1-3алкоксиC2-4алкил [указанные гетероциклические группы могут быть замещены одним или несколькими атомами галогена или группой, выбранной из C1-3алкила, гидрокси, оксо, С3-6циклоалкила или NReRf, где Rе и Rf каждый независимо представляет группу, выбранную из С1-3алкила (необязательно замещенного С3-6циклоалкилом или необязательно замещенного фенилом) или С3-6циклоалкила].
Данное изобретение касается также новых соединений формулы (I). Особо полезный класс соединений формулы (I) представляют соединения, в которых R1 обозначает 2-инданил, необязательно замещенный гидроксилом, и особенно 2-инданильную группу, и R2, R3 и R4 имеют значения, определенные выше, и/или их физиологически приемлемые производные. Еще один полезный класс соединений формулы (I) представляют соединения, в которых R1 обозначает 2-енетил, и R2, R3 и R4 имеют значения, определенные выше, и/или их физиологически приемлемые производные.
Соединения формулы (I) содержат, по меньшей мере, три центра асимметрии, а именно, атомы углерода, несущие заместители R1, R2 и R3, соответственно, и следует понимать, что формула (I) включает все возможные стереоизомеры и их смеси. Заместитель R3 может существовать более чем в одной таутомерной форме, и следует понимать, что формула (I) включает все возможные таутомерные формы и их смеси.
Соединения формулы (I), в которых, по меньшей мере, одна из групп R1, R2, R3 или R4 содержит основную или кислотную группировку, могут образовывать соли с физиологически приемлемыми кислотами или основаниями, и ссылка здесь на соединения формулы (I) включает такие соли.
Используемые здесь термины "физиологически приемлемое производное" или "фармацевтически приемлемое производное", обозначают любую фармацевтически приемлемую соль, сольват или пролекарство, например, сложный эфир или карбамат, или соль или сольват такого пролекарства соединения формулы (I), который после введения реципиенту способен обеспечить (прямо или косвенно) соединение формулы (I), или его активный метаболит или остаток. Предпочтительными фармацевтически приемлемыми производными являются соли и сольваты.
Используемый здесь термин "пролекарство" обозначает соединение, которое превращается в организме, например, путем гидролиза в крови, в свою активную форму, которая обладает лекарственными эффектами. Фармацевтически приемлемые пролекарства описаны в работах T. Higuchi и V. Stella, Prodrugs as Novel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series, и Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association и Pergamon Press, 1987, которые обе включены здесь в виде ссылок. Сложные эфиры могут быть сами активны и/или гидролизоваться в in vivo условиях в организме человека. Подходящие фармацевтически приемлемые in vivo гидролизуемые сложноэфирные группы включают группы, которые легко разрушаются в организме человека, образуя исходную кислоту или ее соль. Примеры таких сложных эфиров включают алкиловые и 1-(ацетилокси)этиловые эфиры.
Термин "алкил" как группа или часть группы обозначает линейную или разветвленную алкильную группу, например, метил, этил, пропил, изопропил, н-бутил, 1-метилпропил, 2-метилпропил, трет-бутил, пентил или гексил.
Термин "С3-6циклоалкил" как группа или часть группы включает циклопропильную, циклобутильную, циклопентильную и циклогексильную группы. Термин "С3-7циклоалкил" включает также циклогептил.
Термин "галоген" обозначает фтор, хлор, бром или йод.
Если не указано иначе, термин "необязательно замещенный фенил" обозначает фенильную группу, которая может быть замещена 1-3 заместителями, которые могут быть одинаковыми или разными и выбраны из галогена, гидрокси, С1-4алкила (необязательно замещенного 1-3 атомами галогена, или NRgRh [где Rg обозначает водород или С1-4алкил, Rh обозначает водород, С1-4алкил, или Rg иRh вместе с атомом азота, к которому они присоединены, образуют 5-7-членное кольцо, которое является насыщенным и может содержать дополнительный гетероатом, выбранный из азота, кислорода или серы]), С1-4алкилсульфонила, карбоксила, С1-4алкоксикарбонила, ди(С1-4алкил)аминокарбонилокси, С1-4алкокси (необязательно замещенного 1-3 атомами галогена, амино, С1-4алкиламино или ди(С1-4алкил)амино), фенила (необязательно замещенного галогеном или алкиламиносульфонилом), С1-4алкокси, или NRaRb [где Ra обозначает водород или С1-4алкил, Rb обозначает водород, С1-4алкил, С1-4алканоил или С1-4алкилсульфонил, или Ra иRb вместе с атомом азота, к которому они присоединены, образуют 5-7-членное кольцо, которое является насыщенным и может быть замещено гидроксилом или 1 или 2 С1-4алкильными группами, или может быть спироконденсировано с диоксалановым кольцом, или может содержать дополнительный гетероатом, выбранный из азота, кислорода или серы, и может быть замещено 1 или 2 С1-4алкильными группами, или данное кольцо является ненасыщенным и содержит 1-3 дополнительных атома азота], 5- или 6-членной гетероарильной группы, необязательно N-замещенной аминокарбонильной группы или аминосульфонильной группы (в которой заместителями могут быть 1 или 2 С1-4алкильные группы) или дигидроксиборильной группы).
Выражение "5-членный гетероарил" обозначает 5-членное кольцо, которое содержит гетероатом, выбранный из кислорода, серы или азота и которое может также содержать от 1 до 3 дополнительных атомов азота, и группы которого могут быть замещены 1 или несколькими группами, выбранными из галогена, трифторметильной, С1-4алкильной, циклоалкильной, гетероарильной, насыщенной гетероциклической или фенильной группы. Примеры таких 5-членных гетероарильных групп включают фуранил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил или тетразолил, и данные гетероциклы могут быть замещены, как описано выше.
Выражение "6-членная гетероарильная группа" обозначает 6-членное ненасыщенное кольцо, которое содержит от 1 до 3 атомов азота и которое может быть замещено 1-3 С1-4алкильными группами, или трифторметильными, или алкоксигруппами. Примеры таких групп включают пиридил, метилпиридил, трифторметилпиридил, пиримидинил и тиазинил.
Если R3 обозначает 5- или 6-членную гетероарильную группу, то она связана с остатком молекулы через атом углерода в кольце.
Если R3 обозначает конденсированную бициклическую карбоциклическую систему, то она может представлять, например, нафтильную, тетрагидронафтильную, инданильную или инденильную группу.
Если R3 обозначает конденсированную бициклическую систему, содержащую до 3 гетероатомов, которые могут быть одинаковыми или разными, то обычно она представляет 6,5- или 6,6-кольцевую систему, в которой гетероцикл может быть частично насыщенным, или вместе с бензольным кольцом, с которым она конденсирована, образуют гетероарильную группу, и гетероцикл может быть замещен 1 или 2 группами, выбранными из С1-4алкила, или галогена, или галогеналкила, и может содержать карбонильную группу. Указанная группа R3 может быть связана с остатком молекулы через атом углерода в бензольном кольце или атом углерода в гетероциклической группе.
Если R3 обозначает конденсированную 6,6-гетероарильную группу, то гетерокольцо содержит 1-3 атома азота и примеры таких гетероарильных групп включают хинолинил, изохинолинил, фталазинил, циннолинил, хиназолинил, хиноксалинил, 1,2,3-ензотриазинил или 1,2,4-бензотриазинил.
Если R3 обозначает 6,5-бициклическую гетероарильную группу, то 5-членный гетероцикл содержит гетероатом, выбранный из O, S или N, и, кроме того, может содержать еще 1 или 2 атома азота, и гетероциклическое кольцо также может быть замещено 1 или 2 С1-4алкилами, или галогенами, или галогеналкилами, или может содержать карбонильную группу. Примеры таких 6,5-бициклических гетероарильных групп включают бензофуранил, бензотиенил, индолил, бензооксадиазолил, бензотиадиазолил, бензооксазолил, бензотиазолил, бензоизотиазолил, бензоизоксазолил, бензимидазолил, индазолил или бензотриазолил, и данные группы могут быть замещены, как описано выше.
Если R3 обозначает 6,6- или 6,5-бициклическую гетероциклическую группу, и гетероцикл является частично насыщенным, он может содержать 1 или 2 гетероатома, выбранные из O, S или N. Примеры таких групп включают индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, 1,3-ензодиоксолил, бензопирролил, 1,3-бензодитиолил, 1,4-ензодиоксанил, фталил, тиофталил, хроманил или хроменил, и группы могут быть замещены одним или несколькими галогенами или С1-4алкильными группами, галогеналкилами, или могут содержать карбонильную группу.
Если R3 обозначает конденсированный бициклический гетероарил, связанный через бензольное кольцо, то подходящие примеры таких групп включают 6-хинолинил, 4-изоиндолинил, 4-(N-етилизоиндолинил, бензимидазолил, бензотиазолил, бензофуранил, бензотиенил, бензимидазолил, бензоксазолил, 2-метилбензооксазолил, бензотиадиазолил, бензотриазолил и 1-етилбензотриазолил.
Если R3 обозначает конденсированную бициклическую гетероарильную группу, связанную через гетероарильное кольцо, то она может представлять, например, 2-бензофуранил, 2-бензотиенил или 2-N-метилиндолильную группу.
Если R3 обозначает 6,6- или 6,5-гетероциклическую группу, в которой гетероцикл является частично насыщенным, то он обычно связан через бензольное кольцо, и подходящие примеры включают дигидробензофуран, дигидробензопиррол, 1,3-бензодиоксолил, 2,2-ифторо-1,3-бензодиоксолил и 1,4-бензодиоксанил.
Если R3 обозначает замещенную фенильную группу, то указанная группа обычно несет от 1 до 3 заместителей, которые могут быть одинаковыми или разными, выбранными из фтора, хлора, брома, С1-3алкила (метил), С1-3галогеналкила (трифторметил), С1-3алкокси (метокси, этокси), галогеналкокси (трифторметокси), аминоэтокси, например, диметиламиноэтокси, С1-3алкоксикарбонила, карбокси, гидрокси, фенила или фенила, замещенного галогеном или алкиламиносульфонилом, NRaRb [где Ra обозначает водород или С1-2алкил, и Rb обозначает С1-2алкил, С1-4алканоил, С1-4алкилсульфонил, С1-3алкиламинокарбонил] или NRaRb обозначает пирролидиновое или пиперидиновое кольцо, которое может быть замещено С1-2алкилом, гидроксилом или 2,2-1,3-диоксолановой группой, или NRaRb обозначает морфолино- или пиперазиногруппу, которая может быть замещена 1 или 2 С1-2алкильными группами, или NRaRb обозначает 5- или 6-членную гетероарильную группу, содержащую от 1 до 4 атомов азота (такую как 1-имидазолильный, 1,2-пиразолильный, 1,2,3-триазолильный или 1,2,4-триазолильный заместитель), С1-3алкилсульфонил, С1-3алкиламинокарбонил, С1-3алкиламиносульфонил, дигидроксиборил или 5- или 6-членную гетероарильную группу, содержащую от 1 до 4 атомов азота и которая связана с фенильной группой через атом углерода в гетероарильной группе (например, пиридиле, пиразолиле, имидазолиле или тетразол-5-иле), указанные гетероарильные группы могут быть замещены 1 или несколькими С1-4алкильными группами.
Примеры подходящих групп R3, где R3 обозначает необязательно замещенный фенил, включают фенил, галогенфенил, такой как 2-торфенил, 3-фторфенил, 4-фторфенил, 4-хлорфенил, 3-хлорфенил, 2-хлорфенил, 4-бромфенил, 2,3-дифторфенил, 3,4-дифторфенил, 2,4-дифторфенил, 3,5-дифторфенил, 2,5-дифторфенил, 2-хлор-4-фторфенил, 2,4-дихлорфенил, 3,4-дихлорфенил, 2-фтор-4-бромфенил, 4-хлор-3-фторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил или 2,4,6-трифторфенил, 2-фтор-4,5-диметоксифенил, 3-фтор-4-метоксифенил, 4-фтор-3-метоксифенил, 2-фтор-4-метоксифенил, 2-фтор-4-гидроксифенил, 2-фтор-4-диметиламинометилфенил, 2-фтор-4-гидроксиметилфенил, 3-фтор-4-(4-морфолино)фенил,
3-фтор-4-карбоксиметилоксифенил,
3-фтор-4-трет-бутилоксикарбонилметилоксифенил, 3-фтор-4-диметиламинокарбонилоксифенил, 3-хлор-4-трифторметоксифенил, 2,3-дифторо-4-метилфенил, 4-трифторметоксифенил,
4-трифторметилфенил, 4-гидроксифенил, 4-метоксифенил,
4-метоксикарбонилфенил, 3-метоксикарбонилфенил,
4-метилсульфонилфенил, 4-метиламинокарбонилфенил,
4-аминокарбонилфенил, 4-метиламиносульфонилфенил,
3-(3-пиразолил)фенил, 4-(3-пиразолил)фенил,
4-(4-пиразолил)фенил, 4-(3-пиридил)фенил, 4-(2-пиридилфенил),
4-(2-имидазолил)фенил, 3-(2-имидазолил)фенил, 4-(1-трет-бутилтетразол-5-ил)фенил, 4-метиламинофенил, 4-диметиламинофенил,
4-диэтиламинофенил, 4-ацетиламинофенил, 3-ацетиламинофенил,
4-гидрокси-3-ацетиламинофенил, 4-метилсульфониламинофенил,
4-N-метилпиперазинофенил, 4-N-пирролидинофенил,
2-фтор-4-(4-морфолино)фенил, 4-(4-морфолино)фенил,
4-(4-гидроксипиперидино)фенил,
2-фтор-4-(4-гидроксипиперидино)фенил, 3-(1-пиразолил)фенил,
4-(1-пиразолил)фенил, 4-(1-3,5-ди-трет-бутилпиразолил)фенил,
3-(1-имидазолил)фенил, 4-(1-имидазолил)фенил, 4-(1-1,2,4-триазолил)фенил, 4-(1-1,2,3-триазолил)фенил, 4-(2-4-трет-бутилтиазолил)фенил, 4-(5-2-трет-бутилтетразолил)фенил,
4-(4-спиро-1,3-диоксоланил)пиперидинофенил,
4-(4-фторфенил)фенил, 4-(4-этиламиносульфонилфенил)фенил,
4-диметиламиноэтоксифенил или 3-(дигидроксиборил)фенил.
Если R3 обозначает 5- или 6-членную гетероарильную группу, то подходящие примеры таких групп включают 2-фуранил, 3-тиенил, 3-фуранил, 2-тиенил, 4-бром-2-тиенил, 5-бром-2-тиенил, 5-хлор-2-тиенил, 3-фтор-5-метил-2-тиенил, 5-фтор-2-тиенил, 5-метил-2-тиенил, 5-метил-2-фуранил, 5-бром-2-фуранил, 4,5-диметил-2-фуранил, 2,3-диметил-5-тиенил, 5-трифторметил-2-фуранил, метиламид 2-фуранил-4-карбоновой кислоты, метиламид 2-фуранил-5-карбоновой кислоты, 2-пиридил, 6-метил-2-пиридил, 6-метил-3-пиридил, 6-гидрокси-3-пиридил, 6-метокси-3-пиридил, 6-трифторметил-3-пиридил, 3-пиридил, 4-пиридил, 3,5-пиримидинил, 2-тиазолил, 4-оксазолил, 4-тиазолил, 2-метил-4-оксазолил, 2-тил-4-оксазолил, 2-циклопропил-4-оксазолил, 2-трифторметил-4-оксазолил, 2,5-диметил-4-оксазолил, 4-тиазолил, 2-метил-4-тиазолил, 2-трифторметил-4-тиазолил, 2-трифторметил-5-тиазолил, 4-изоксазолил, 1-метил-4-пиразолил, 1,3-диметил-5-пиразолил, 5-(2-пиридил)-2-тиенил, 2-(4-морфолино)-5-тиазолил или 2-(4-метил-1-пиперазино)-5-тиазолил.
Если R3 обозначает необязательно замещенную конденсированную бициклическую кольцевую систему, то примеры подходящих групп включают 2,3-дигидро-1-бензофуран-5-ил, 1,3-бензодиоксол-5-ил, 1H-1,2,3-бензотриазол-5-ил, 2,3-дигидро-1,4-бензодиоксин-6-ил, 2,2-дифтор-1,3-бензодиоксол-5-ил, 1,3-бензотиазол-6-ил, 1-метил-1H-1,2,3-бензотриазол-5-ил, 1-метил-1H-1,2,3-бензотриазол-6-ил, 1,2,3-бензотиадиазол-6-ил, 2-метил-1,3-бензоксазол-5-ил, 2-етил-1,3-бензоксазол-6-ил, 1-бензофуран-5-ил, 1-метил-1H-индол-5-ил, 1-бензотиен-5-ил, 1-бензофуран-6-ил, 1H-индол-6-ил, 1-метил-1H-бензимидазол-6-ил, 1-метил-1H-бензимидазол-5-ил, 3-етил-1,2-бензоизоксазол-5-ил, 2-фтор-1-бензофуран-5-ил, 1H-ндол-5-ил, 2-метил-1H-бензофуран-5-ил, 1H-индазол-5-ил, 1H-ндазол-6-ил, 1-бензофуран-2-ил или 1-метил-1H-бензимидазол-2-ил.
Если R1 обозначает 5-7-членную циклоалкильную группу, которая конденсирована с необязательно замещенным бензольным кольцом, необязательные заместители могут составлять от 1 до 3 групп, которые могут быть одинаковыми или разными и выбраны из галогена, алкила, алкокси, гидрокси, трифторметила, нитро, карбоксила, алкоксикарбонила или карбоксамидо.
Если R1 обозначает аралкил, арильная часть обозначает фенил, необязательно замещенный 1-3 группами, которые могут быть одинаковыми или разными и выбраны из галогена, алкила, алкокси, гидрокси, трифторметила, нитро, карбоксила, алкоксикарбонила или карбоксамидо.
Примеры подходящих групп R1 включают фенетил или инданил, необязательно замещенный гидроксилом, например, 2-инданил, 1-идрокси-2-инданил, 5-гидрокси-2-инданил. Примеры подходящих групп R2 включают C3-4алкил, например, изопропил, 1-метилпропил или 2-метилпропил, C3-6циклоалкил, например, циклопентил.
Обычно R4 обозначает гидрокси, C1-4алкокси, например, метокси, пропокси, трет-бутокси, 1-ацетилоксиэтокси или NR5R6.
Предпочтительный класс соединений формулы (I) представляют соединения, где R4 обозначает гидрокси или группу NR5R6 или более предпочтительно NR5R6.
Еще один предпочтительный класс соединений представлен формулой (1a)
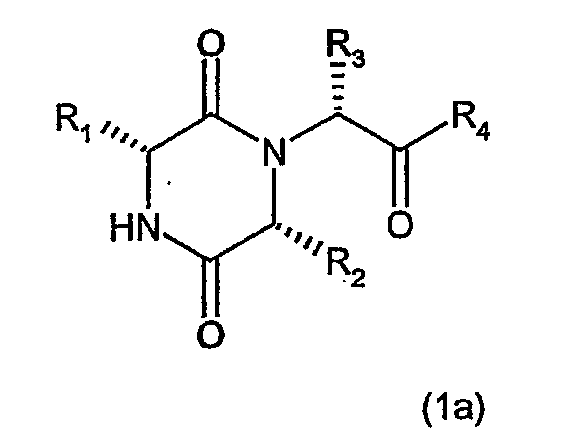
где группы R1, R2, R3 и R4 имеют значения, определенные формулой (I). Обычно R1 обозначает группу, выбранную из 2-енетила или 2-инданила, необязательно замещенного гидроксилом, и более конкретно 2-инданила. Обычно R2 обозначает группу, выбранную из изопропила, 1-метилпропила, 2-метилпропила или циклопентила, и более предпочтительно R2 обозначает группу, выбранную из 1-метилпропила или 2-метилпропила.
Обычно R3 обозначает группу, выбранную из следующих: фенил, галогенфенил, такой как 2-фторфенил, 3-фторфенил, 4-фторфенил, 4-хлорфенил, 3-хлорфенил, 2-хлорфенил, 4-бромфенил,
2,3-дифторфенил, 3,4-дифторфенил, 2,4-дифторфенил,
3,5-дифторфенил, 2,5-дифторфенил, 2-хлор-4-фторфенил,
2,4-дихлорфенил, 3,4-дихлорфенил, 2-фтор-4-бромфенил,
4-хлор-3-фторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил или 2,4,6-трифторфенил, 2-фтор-4,5-диметоксифенил,
3-фтор-4-метоксифенил, 4-фтор-3-метоксифенил,
2-фтор-4 метоксифенил, 2-фтор-4-гидроксифенил,
2-фтор-4-диметиламинометилфенил, 2-фтор-4-гидроксиметилфенил,
3-фтор-4-(4-морфолино)фенил, 3-фтор-4-карбоксиметилоксифенил,
3-фтор-4-трет-бутилоксикарбонилметилоксифенил,
3-фтор-4-диметиламинокарбонилоксифенил,
3-хлор-4-трифторметоксифенил, 2,3-дифторо-4-метилфенил,
4-трифторметоксифенил, 4-трифторметилфенил, 4-гидроксифенил,
4-метоксифенил, 4-метоксикарбонилфенил, 3-метоксикарбонилфенил, 4-метилсульфонилфенил, 4-метиламинокарбонилфенил,
4-аминокарбонилфенил, 4-метиламиносульфонилфенил,
3-(3-пиразолил)фенил, 4-(3-пиразолил)фенил,
4-(4-пиразолил)фенил, 4-(3-пиридил)фенил, 4-(2-пиридилфенил),
4-(2-имидазолил)фенил, 3-(2-имидазолил)фенил, 4-(1-трет- бутилтетразол-5-ил)фенил, 4-метиламинофенил, 4-диметиламинофенил,
4-диэтиламинофенил, 4-ацетиламинофенил, 3-ацетиламинофенил,
4-гидрокси-3-ацетиламинофенил, 4-метилсульфониламинофенил,
4-N-метилпиперазинофенил, 4-N-пирролидинофенил,
2-фтор-4-(4-морфолино)фенил, 4-(4-морфолино)фенил,
4-(4-гидроксипиперидино)фенил,
2-фтор-4-(4-гидроксипиперидино)фенил, 3-(1-пиразолил)фенил,
4-(1-пиразолил)фенил, 4-(1-3,5-ди-трет-бутилпиразолил)фенил,
3-(1-имидазолил)фенил, 4-(1-имидазолил)фенил,
4-(1-1,2,4-триазолил)фенил, 4-(1-1,2,3-триазолил)фенил,
4-(2-4-трет-бутилтиазолил)фенил,
4-(5-2-трет-бутилтетразолил)фенил,
4-(4-спиро-1,3-диоксоланил)пиперидинофенил,
4-(4-фторфенил)фенил, 4-(4-этиламиносульфонилфенил)фенил,
4-диметиламиноэтоксифенил,3-(дигидроксиборил)фенил, 2-фуранил, 3-тиенил, 3-фуранил, 2-тиенил, 4-бром-2-тиенил, 5-бром-2-тиенил, 5-хлор-2-тиенил, 3-фтор-5-метил-2-тиенил, 5-метил-2-тиенил,
5-метил-2-фуранил, 5-бром-2-фуранил, 4,5-диметил-2-фуранил,
5-трифторметил-2-фуранил, метиламид 2-фуранил-4-карбоновой кислоты, метиламид 2-фуранил-5-карбоновой кислоты, 2-пиридил,
6-метил-2-пиридил, 6-метил-3-пиридил, 6-метокси-3-пиридил,
6-гидрокси-3-пиридил, 6-трифторметил-3-пиридил, 3-пиридил,
4-пиридил, 3,5-пиримидинил, 2-тиазолил, 2-метил-4-оксазолил,
2-этил-4-оксазолил, 2-циклопропил-4-оксазолил, 2-трифторметил-4-оксазолил, 2,5-диметил-4-оксазолил, 4-тиазолил, 2-метил-4-тиазолил, 2-трифторметил-4-тиазолил, 2-трифторметил-5-тиазолил, 1-метил-4-пиразолил, 1,3-диметил-5-пиразолил, 5-(2-пиридил)-2-тиенил, 2,3-дигидро-1-бензофуран-5-ил, 1,3-бензодиоксол-5-ил, 1H-1,2,3-бензотриазол-5-ил, 2,3-дигидро-1,4-бензодиоксин-6-ил, 2,2-дифторо-1,3-бензодиоксол-5-ил, 1,3-бензотиазол-6-ил,
1-метил-1H-1,2,3-бензотриазол-5-ил,
1-метил-1H-1,2,3-бензотриазол-6-ил, 1,2,3-бензотиадиазол-6-ил, 2-метил-1,3-бензоксазол-5-ил, 2-метил-1,3-бензоксазол-6-ил,
1-бензофуран-5-ил, 1-метил-1H-индол-5-ил, 1-бензотиен-5-ил,
1-бензофуран-6-ил, 1H-индол-6-ил, 1-метил-1H-бензимидазол-6-ил, 1-метил-1H-бензимидазол-5-ил, 3-метил-1,2-бензоизоксазол-5-ил, 2-фтор-1-бензофуран-5-ил, 1H-индол-5-ил, 2-метил-1H-бензофуран-5-ил, 1H-индазол-5-ил, 1H-индазол-6-ил, 1-бензофуран-2-ил или
1-метил-1H-бензимидазол-2-ил.
Обычно группа R5 обозначает водород, С1-4алкил, например, метил, или С1-4алкоксиС2-4алкил, например, 2-метоксиэтил, и R6 обозначает группу, выбранную из следующих: водород, С1-4алкокси, например, метокси, С1-4алкил, например, метил, н-пропил, изопропил или трет-бутил, С1-4алкил, замещенный 1-3 атомами галогена, например, 2,2,2-трифторэтил или 2-фторэтил, С1-4алкил, замещенный алкоксикарбонилом или карбоксилом, например, метоксикарбонилметил или карбоксиметил, алкил, замещенный алкокси, например, метоксиэтил, 2,2-диметоксиэтил, алкил, замещенный гидрокси, например, гидроксиэтил, или алкил, замещенный диалкиламино, например, диметиламиноэтил, 2-бензилоксифенил, диметоксибензил, необязательно замещенный гетероарилметил, например, 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, 3-метилимидазолилметил, гетероарил, такой как тиазолил, например, 2-1,3-тиазолил, алкил, замещенный NR7R8 [где NR7R8 образует 6-членное гетероциклическое кольцо (например, пиперидиноэтил или морфолиноэтил)], циклоалкил, например, циклопропил или циклогексил, или NR5R6 обозначает азетидино, 3-гидроксиазетидино, 3-метоксиазетидино, пирролидино, пиперидино, 4-диметиламинопиперидино, 4-метил 1,4-диазепан-1-ил, морфолино, необязательно замещенное пиперазиновое кольцо, например, N-метилпиперазино, N-метансульфонилпиперазино, N-2-метоксиэтилпиперазино, тиоморфолино, или его сульфоксид или сульфон.
Предпочтительным классом соединений данного изобретения являются соединения формулы (la), где R1 обозначает 2-инданил, R2 обозначает группу, выбранную из 1-метилпропила или 2-метилпропила, и R4 обозначает гидрокси и/или особенно группу NR5R6.
Еще одним предпочтительным классом соединений данного изобретения являются соединения формулы (1a), где R5 обозначает группу, выбранную из водорода, C1-4алкила, например, метила или C1-4алкоксиC2-4алкила, например, 2-метоксиэтила, и R6 обозначает группу, выбранную из следующих: водород, C1-4алкокси, например, метокси, C1-4алкил, например, метил, н-пропил, изопропил или трет-бутил, C1-4алкил, замещенный 1-3 атомами галогена, например, 2,2,2-трифторэтил или 2-фторэтил, C1-4алкил, замещенный алкоксикарбонилом или карбоксилом, например, метоксикарбонилметил или карбоксиметил, алкил, замещенный алкокси, например, метоксиэтил, 2,2-диметоксиэтил, алкил, замещенный гидрокси, например, гидроксиэтил, или алкил, замещенный диалкиламино, например, диметиламиноэтил, 2-бензилоксифенил, диметоксибензил, необязательно замещенный гетероарилметил, например, 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, 3-метилимидазолилметил, гетероарил, такой как тиазолил, например, 2-1,3-тиазолил, алкил, замещенный NR7R8 [где NR7R8 образует 6-членное гетероциклическое кольцо (например, пиперидиноэтил или морфолиноэтил)], циклоалкил, например, циклопропил или циклогексил, или NR5R6 обозначает азетидино, 3-гидроксиазетидино, 3-метоксиазетидино, пирролидино, пиперидино, 4-диметиламинопиперидино, 4-метил-1,4-диазепан-1-ил, морфолино, необязательно замещенное пиперазиновое кольцо, например, N-метилпиперазино, N-метансульфонилпиперазино, N-2-метоксиэтилпиперазино, тиоморфолино, или его сульфоксид или сульфон.
Еще одним предпочтительным классом соединений данного изобретения являются соединения формулы (1a), где R3 обозначает группу, выбранную из следующих: фенил, галогенфенил, такой как 2-фторфенил, 3-фторфенил, 4-фторфенил, 4-хлорфенил, 3-хлорфенил, 2-хлорфенил, 4-бромфенил, 2,3-дифторфенил, 3,4-дифторфенил,
2,4-дифторфенил, 3,5-дифторфенил, 2,5-дифторфенил,
2-хлор-4-фторфенил, 2,4-дихлорфенил, 3,4-дихлорфенил,
2-фтор-4-бромфенил, 4-хлор-3-фторфенил 2,3,4-трифторфенил, 2,4,5-трифторфенил или 2,4,6-трифторфенил, 2-фтор-4,5-диметоксифенил, 3-фтор-4-метоксифенил, 4-фтор-3-метоксифенил,
2-фтор-4-метоксифенил, 2-фтор-4-гидроксифенил,
2-фтор-4-диметиламинометилфенил, 2-фтор-4-гидроксиметилфенил,
3-фтор-4-(4-морфолино)фенил, 3-фтор-4-карбоксиметилоксифенил,
3-фтор-4-трет-бутилоксикарбонилметилоксифенил,
3-фтор-4-диметиламинокарбонилоксифенил,
3-хлор-4-трифторметоксифенил, 2,3-дифторо-4-метилфенил,
4-трифторметоксифенил, 4-трифторметилфенил, 4-гидроксифенил,
4-метоксифенил, 4-метоксикарбонилфенил, 3-метоксикарбонилфенил, 4-метилсульфонилфенил, 4-метиламинокарбонилфенил,
4-аминокарбонилфенил, 4-метиламиносульфонилфенил,
3-(3-пиразолил)фенил, 4-(3-пиразолил)фенил,
4-(4-пиразолил)фенил, 4-(3-пиридил)фенил, 4-(2-пиридилфенил),
4-(2-имидазолил)фенил, 3-(2-имидазолил)фенил, 4-(1-трет- бутилтетразол-5-ил)фенил, 4-метиламинофенил, 4-диметиламинофенил,
4-диэтиламинофенил, 4-ацетиламинофенил, 3-ацетиламинофенил,
4-гидрокси-3-ацетиламинофенил, 4-метилсульфониламинофенил,
4-N-метилпиперазинофенил, 4-N-пирролидинофенил,
2-фтор-4-(4-морфолино)фенил, 4-(4-морфолино)фенил,
4-(4-гидроксипиперидино)фенил,
2-фтор-4-(4-гидроксипиперидино)фенил, 3-(1-пиразолил)фенил,
4-(1-пиразолил)фенил, 4-(1-3,5-ди-трет-бутилпиразолил)фенил,
3-(1-имидазолил)фенил, 4-(1-имидазолил)фенил,
4-(1-1,2,4-триазолил)фенил, 4-(1-1,2,3-триазолил)фенил,
4-(2-4-трет-бутилтиазолил)фенил,
4-(5-2-трет-бутилтетразолил)фенил,
4-(4-спиро-1,3-диоксоланил)пиперидинофенил, 4-(4-фторфенил)фенил, 4-(4-этиламиносульфонилфенил)фенил, 4-диметиламиноэтоксифенил, 3-(дигидроксиборил)фенил, 2-фуранил, 3-тиенил, 3-фуранил,
2-тиенил, 4-бром-2-тиенил, 5-бром-2-тиенил, 5-хлор-2-тиенил,
3-фтор-5-метил-2-тиенил, 5-метил-2-тиенил, 5-метил-2-фуранил,
5-бром-2-фуранил, 4,5-диметил-2-фуранил, 5-трифторметил-2-фуранил, метиламид 2-фуранил-4-карбоновой кислоты,
метиламид 2-фуранил-5-карбоновой кислоты, 2-пиридил,
6-метил-2-пиридил, 6-метил-3-пиридил, 6-метокси-3-пиридил,
6-гидрокси-3-пиридил, 6-трифторметил-3-пиридил, 3-пиридил,
4-пиридил, 3,5-пиримидинил, 2-тиазолил, 2-метил-4-оксазолил,
2-этил-4-оксазолил, 2-циклопропил-4-оксазолил, 2-трифторметил-4-оксазолил, 2,5-диметил-4-оксазолил, 4-тиазолил, 2-метил-4-тиазолил, 2-трифторметил-4-тиазолил, 2-трифторметил-5-тиазолил, 1-метил-4-пиразолил, 1,3-диметил-5-пиразолил, 5-(2-пиридил)-2-тиенил, 2,3-дигидро-1-бензофуран-5-ил, 1,3-бензодиоксол-5-ил, 1H-1,2,3-бензотриазол-5-ил, 2,3-дигидро-1,4-бензодиоксин-6-ил, 2,2-дифторо-1,3-бензодиоксол-5-ил, 1,3-бензотиазол-6-ил,
1-метил-1H-1,2,3-бензотриазол-5-ил,
1-метил-1H-1,2,3-бензотриазол-6-ил, 1,2,3-бензотиадиазол-6-ил, 2-метил-1,3-бензоксазол-5-ил, 2-метил-1,3-бензоксазол-6-ил,
1-бензофуран-5-ил, 1-метил-1H-индол-5-ил, 1-бензотиен-5-ил,
1-бензофуран-6-ил, 1H-индол-6-ил, 1-метил-1H-бензимидазол-6-ил, 1-метил-1H-бензимидазол-5-ил, 3-метил-1,2-бензоизоксазол-5-ил, 2-фтор-1-бензофуран-5-ил, 1H-индол-5-ил, 2-метил-1H-бензофуран-5-ил, 1H-индазол-5-ил, 1H-индазол-6-ил, 1-бензофуран-2-ил или
1-метил-1H-бензимидазол-2-ил.
Особо предпочтительные соединения данного изобретения включают:
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид;
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид;
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]морфолинамид;
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид;
(2R)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-[4-(4-гидроксипиперидин-1-ил)фенил]этанамид;
(2R)-2-{(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-[(1R)-1-метилпропил]-2,5-диоксопиперазин-1-ил}-2-(2-фтор-4-морфолин-4-илфенил)-N-изопропилэтанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(4-фторфенил)-N-(2,2,2-трифторэтил)этанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид;
(2R)-N-циклопропил-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метилэтанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-морфолин-4-ил-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-(3-гидроксиазетидин-1-ил)-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(3R,6R)-1-[(1R)-2-азетидин-1-ил-1-(2,4-дифторфенил)-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксиэтил)-N-метилэтанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-[2-(метилсульфонил)этил]этанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-(2,2,2-трифторэтил)этанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-(пиридин-2-илметил)этанамид;
(3R,6R)-1-{(1R)-1-(2,4-дифторфенил)-2-[4-(метилсульфонил)пиперазин-1-ил]-2-оксоэтил}-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метокси-N-метилэтанамид;
(2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этановая кислота;
метил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат;
пропил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат;
1-(ацетилокси)этил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат;
(2R)-N-(трет-бутил)-2-(2,4-дифторфенил)-2-{(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-[(1R)-1-метилпропил]-2,5-диоксопиперазин-1-ил}этанамид;
(2R)-N-(трет-бутил)-2-(2,4-дифторфенил)-2-{(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-[(1S)-1-метилпропил]-2,5-диоксопиперазин-1-ил}этанамид;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-морфолин-4-ил-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-[(1S)-1-метилпропил]пиперазин-2,5-дион;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-морфолин-4-ил-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-[(1R)-1-метилпропил]пиперазин-2,5-дион;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-(3-фторазетидин-1-ил)-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-[5-(трифторметил)-2-фурил]этанамид;
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-(5-метилтиен-2-ил)этанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-[5-(трифторметил)-2-фурил]этанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(2-метил-1,3-оксазол-4-ил)этанамид;
(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-1-[(1R)-1-(2-метил-1,3-оксазол-4-ил)-2-морфолин-4-ил-2-оксоэтил]пиперазин-2,5-дион;
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(5-метилтиен-2-ил)этанамид;
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(3-фтор-5-метилтиен-2-ил)-N,N-диметилэтанамид;
(2R)-2-(1-бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид;
(2R)-2-(1,2,3-бензотиадиазол-6-ил)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид;
(2R)-2-(2,3-дигидро-1-бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид;
(2R)-2-(1,3-бензодиоксол-5-ил)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид;
(2R)-2-(бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(2-метил-1-бензофуран-5-ил)этанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-(2-метил-1-бензофуран-5-ил)этанамид;
(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-1-[(1R)-1-(2-метил-1-бензофуран-5-ил)-2-морфолин-4-ил-2-оксоэтил]пиперазин-2,5-дион;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(2-фтор-1-бензофуран-5-ил)-N,N-диметилэтанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(2-фтор-1-бензофуран-5-ил)-N-изопропилэтанамид;
(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-1-[(1R)-1-(2-фтор-1-бензофуран-5-ил)-2-морфолин-4-ил-2-оксоэтил]-6-изобутилпиперазин-2,5-дион;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(1H-индол-6-ил)-N,N-диметилэтанамид;
(2R)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид.
Способность соединений формулы (I) ингибировать действие окситоцина можно определить, используя ряд общеизвестных методик.
Таким образом, соединения формулы (I) имеют высокое сродство к окситоциновым рецепторам на матке крысы и человека, и это можно определить, применяя общеизвестные методики. Например, сродство к окситоциновым рецепторам на матке крыс можно определить по методике Pettibone и др., Drug Development Research 30.129-142 (1993). Соединения данного изобретения также демонстрируют высокое сродство на рекомбинантном окситоциновом рецепторе человека в CHO-клетках, и это удобно продемонстрировать, применяя методику, описанную Wyatt и др. Bioorganic & Medicinal Chemistry Letters, 2001 (11), стр. 1301-1305.
Следовательно, соединения данного изобретения полезны при лечении или профилактике заболеваний и/или состояний, опосредованных действием окситоцина. Примеры таких заболеваний и/или состояний включают преждевременные роды, дисменорею и эндометриоз.
Данные соединения также могут быть полезны для задержки родов до рекомендуемого кесарева сечения или перевозки пациента в центр специализированной медицинской помощи. Соединения данного изобретения также могут быть полезны для улучшения степени фертильности у животных, например, сельскохозяйственных животных.
Таким образом, данное изобретение касается применения соединения формулы (I) и/или его физиологически приемлемых солей в терапии и, в частности, применения в качестве лекарственного средства, обладающего антагонистическим действием в отношении окситоцина на окситоциновых рецепторах.
Данное изобретение касается также применения соединения формулы (I) и/или его физиологически приемлемой соли в производстве лекарственного средства, обладающего антагонистическим действием в отношении окситоцина на окситоциновых рецепторах.
Согласно еще одному аспекту данное изобретение касается способа антагонизации действия окситоцина на окситоциновых рецепторах, включающего введение нуждающемуся пациенту антагонистического количества соединения формулы (I) и/или его физиологически приемлемой соли.
Специалисты в данной области понимают, что указанное здесь лечение распространяется на профилактику, а также лечение укоренившихся заболеваний и симптомов.
Понятно также, что количество соединения данного изобретения, необходимое для применения при лечении, меняется в зависимости от природы подлежащего лечению состояния, способа введения и возраста и состояния пациента и, в конечном счете, зависит от решения лечащего врача. Однако, как правило, дозы, применяемые для лечения взрослых людей, обычно составляют от 2 до 800 мг в день, в зависимости от способа введения.
Таким образом, дневная доза для парентерального введения обычно составляет от 2 до 50 мг, предпочтительно от 5 до 25 мг в день. Ежедневная доза для орального приема обычно составляет от 10 до 800 мг, например, от 20 до 150 мг в день.
Необходимую дозу удобно представить в виде единой дозы или поделенной на дозы, принимаемые с подходящими интервалами, например, в виде двух, трех, четырех и более поделенных доз.
При том, что для применения при терапии можно вводить соединение данного изобретения в виде сырого химического вещества, предпочтительно представлять активный ингредиент в виде фармацевтического препарата.
Таким образом, данное изобретение касается также фармацевтического препарата, содержащего соединение формулы (I) или его фармацевтически приемлемой соли или нетоксических метаболически лабильных сложных эфиров вместе с одним или несколькими фармацевтически приемлемыми носителями и необязательно другими терапевтическими и/или профилактическими ингредиентами. Носитель (носители) должен быть "приемлемым" в смысле совместимости с другими ингредиентами данного препарата и не вредным для реципиента.
Композиции данного изобретения включают композиции в специально приготовленном виде для перорального, буккального, парентерального введения, ингаляции или инсуффляции, имплантации или ректального введения.
Таблетки и капсулы для перорального приема могут содержать обычные наполнители, такие как связующие агенты, например, сироп, аравийскую камедь, желатин, сорбит, трагакант, клейстер из крахмала или поливинилпирролидон; наполнители, например, лактозу, сахар, микрокристаллическую целлюлозу, кукурузный крахмал, фосфат кальция или сорбит; лубриканты, например, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например, картофельный крахмал или натрийкрахмал гликолат, или смачивающие агенты, такие как лаурилсульфат натрия. На таблетки можно нанести покрытие согласно способам, хорошо известным в данной области. Жидкие препараты для перорального приема могут быть, например, в виде водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для восстановления в воде или другом подходящем носителе перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например, сироп сорбита, метилцеллюлозу, сироп глюкоза/сахар, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрированные пищевые жиры; эмульгирующие агенты, например, лецитин, моноолеат сорбитана или аравийскую камедь; неводные носители (которые могут включать пищевые масла), например, миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры, пропиленгликоль или этиловый спирт; агенты, способствующие растворению, такие как поверхностно-активные вещества, например полисорбаты или другие агенты, такие как циклодекстрины; и консерванты, например, метил- или пропил пара-гидроксибензоаты или аскорбиновую кислоту. Композиции можно также приготовить в виде суппозиториев, например, содержащих обычные основы для суппозиториев, такие как масло какао или другие глицериды.
Композиции для буккального приема могут иметь вид таблеток или лепешек, приготовленных обычным способом.
Композиции данного изобретения можно приготовить для парентерального введения путем инъекции или продолжительного вливания. Препараты для инъекций могут представлять стандартную дозированную форму в виде ампул, или мультидозовых контейнеров с добавленными консервантами. Данные композиции могут иметь такие формы как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. По-другому, активный ингредиент может быть в виде порошка для восстановления перед применением при помощи подходящего носителя, например, стерильной воды, не содержащей пирогенов.
Композиции данного изобретения могут содержать 0,1-99% активного ингредиента, обычно 30-95% для таблетки и капсулы и 3-50% для жидких препаратов.
Соединения формулы (I), где R4 обозначает группу NR5R6 можно получить циклизацией соединения формулы (II)
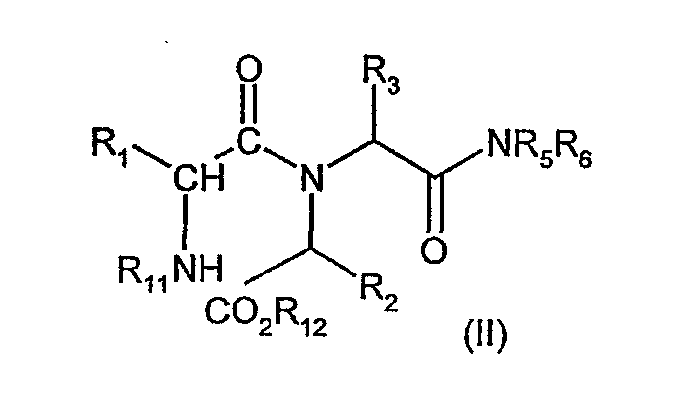
где R1, R2 и R3 имеют значения, определенные в формуле (I), R11 обозначает водород и R12 обозначает C1-3алкильную группу (например, метил), в подходящем растворителе, таком как алканол, например, метанол и/или 2,2,2-трифторэтанол, диоксан или их смесь, или галогенуглеводород, например, дихлорметан.
Соединения формулы (II), где R11 обозначает водород, обычно получают на месте путем обработки соединения формулы (II), где R11 обозначает защитную группу для лабильного к действию кислоты азота, и R12 обозначает водород или C1-3алкил, кислотой в подходящем растворителе с последующей обработкой галогенуглеводородной кислотой и метанолом, если R12 в исходном веществе обозначает водород, и последующим добавлением подходящего основания, например, триэтиламина или путем обработки соединения формулы (II), где R11 обозначает подверженную гидрогенолизу защитную группу азота, и R12 обозначает C1-3алкил, в подходящем растворителе, таком как метанол или 2,2,2-трифторэтанол, водородом в присутствии подходящего катализатора, например, палладия на угле.
Примеры подходящих защитных групп азота R11 включают алкоксикарбонил, например, трет-бутилоксикарбонильную или необязательно замещенную бензилоксикарбонильную группу.
Если R12 обозначает C1-3алкил, то обычно он представляет собой этил или особенно метил.
Примеры подходящих кислот включают минеральные кислоты, такие как галогенводородные кислоты, например, хлористоводородная кислота, или органические кислоты, такие как трифторуксусная кислота. Взаимодействие удобно проводить в растворителе, таком как 1,4-диоксан или алканол, например, метанол, или их смесь, или галогенуглеводород, например, дихлорметан.
Соединения формулы (II) можно получить путем взаимодействия смешанного ангидрида (III)
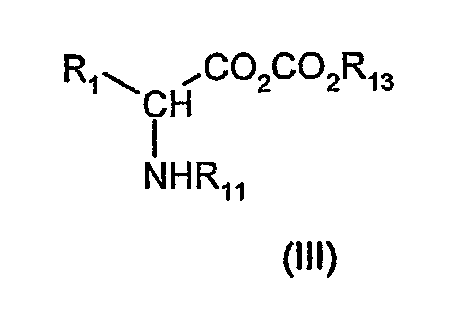
где R1 И R11 имеют значения, определенные выше, и где R13 обозначает C1-6алкил с линейной или разветвленной цепью, необязательно замещенную фенильную или бензильную группу, с амином (IV)
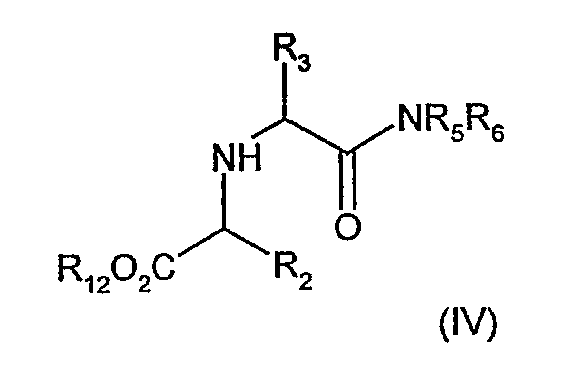
где R2, R3, R5 И R6 имеют значения, определенные выше, и R12 обозначает водород.
Взаимодействие предпочтительно проводят в апротонном растворителе, таком как простой эфир, например, тетрагидрофуран или третичный амид, такой как N,N-диметилформамид, или их смесь. Соединения формулы (III) можно получить путем обработки N-ащищенной аминокислоты (V)
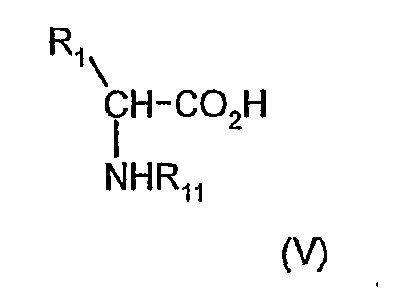
где R1 И R11 имеют значения, определенные выше, соответствующим галогенформиатом (VI; R13CO2X, где R13 имеет значение, определенное в формуле (III), и X обозначает галоген, например, хлор или бром), в присутствии подходящего третичного органического амина, например, N-метилморфолина и в апротонном растворителе, например, простом эфире, таком как тетрагидрофуран или углеводород, например, толуол.
Амин (IV), где R5 обозначает водород, можно получить, обрабатывая аминокислоту (VII)
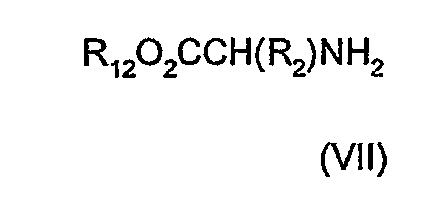
где R2 имеет значения, определенные выше, и R12 обозначает водород, альдегидом (VIII; R3CHO, где R3 имеет значение, определенное в формуле (I)) в подходящем растворителе, таком как алканол, например, метанол, с последующим взаимодействием с изонитрилом (IX; R6N=C, где R6 имеет значения, определенные в формуле I, отличные от водорода). В альтернативном случае, соединения формулы (II), где R1, R2 и R3 имеют значения, данные в формуле (I), и R11 обозначает защитную группу азота, и R13 обозначает защитную группу карбоксила, можно получить путем взаимодействия производного аминокислоты (VII), где R2 имеет значение, данное в формуле (I), и R12 обозначает защитную группу карбоксила, с альдегидом (VIII), где R3 имеет значение, данное в формуле (I), в растворителе, таком как алканол, например, метанол или 2,2,2-трифторэтанол, с дальнейшим последовательным добавлением аминокислоты (V), где R1 имеет значения, данные в формуле (I), и R11 обозначает защитную группу карбоксила, и изонитрила (IX), где R6 имеет значения, данные в формуле (I).
Соединения формулы (II), где R12 обозначает C1-3алкильную группу, можно также получить путем взаимодействия карбоновой кислоты (X) или ее активированного производного
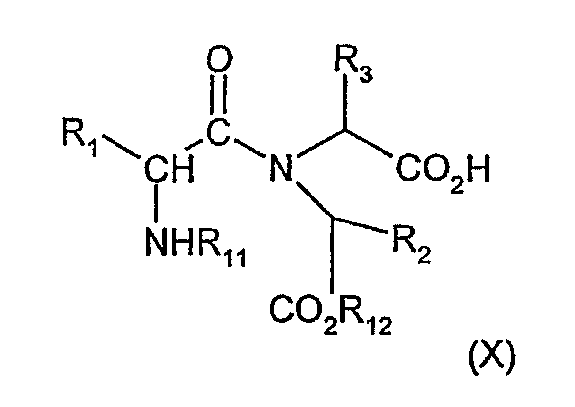
где R1, R2, R3 и R11 имеют значения, определенные выше, и R12 обозначает C1-3алкильную группу, с амином NHR5R6, где R5 и R6 имеют значения, определенные в формуле (I). Примеры подходящего активированного производного карбоновой кислоты (X) включают соединения, обычно используемые в синтезе пептидов, например, полученные по реакции бензотриазол-1-илокситрипирролидинофосфоний гексафторфосфата в присутствии подходящего амина, такого как диизопропилэтиламин.
Карбоновую кислоту (X) можно получить из соответствующего соединения формулы (II), где R5 обозначает водород, и R6 обозначает 2-гидроксифенил путем взаимодействия с карбонилдиимидазолом или тиокарбонилдиимидазолом в подходящем растворителе, таком как дихлорметан, и последующего взаимодействия полученного таким образом продукта с водным ацетоном.
Соединения формулы (II), где R6 обозначает 2-гидроксифенил, удобно получать каталитическим гидрированием (например, Pd/H2) соответствующего соединения, где R6 обозначает 2-бензилоксифенильную группу.
Еще в одном аспекте данного изобретения соединения формулы (I), которые определены выше, можно превратить в другие соединения формулы (I). Таким образом, соединения формулы (I), где R4 обозначает гидроксил, можно получить из соединения формулы (I), где R4 обозначает группу NR5R6, и R5 обозначает водород, R6 обозначает 2-гидроксифенил, путем взаимодействия с карбонилдиимидазолом или тиокарбонилдиимидазолом в подходящем растворителе, таком как дихлорметан, и последующего взаимодействия полученного таким образом продукта с водным ацетоном.
Соединения формулы (I), где R5 обозначает водород и R6 обозначает 2-гидроксифенил, можно получить из соответствующего соединения формулы (I), где R6 обозначает 2-бензилоксифенильную группу, гидрированием с применением водорода и палладиевого катализатора.
Соединения формулы (I), где R4 обозначает группу NR5R6, можно получить путем взаимодействия соединения формулы (I), где R4 обозначает гидроксил, или его активированного производного с амином NHR5R6, где R5 и R6 имеют значения, определенные в формуле (I), при стандартных условиях для получения амидов из карбоновой кислоты и амина, такого как NHR5R6.
Таким образом, амиды можно получить путем обработки соединения формулы (I), где R4 обозначает гидроксил, с активирующим агентом, таким как BOP (бензотриазол-1-илокси-трис(диметиламино)фосфоний гексафторфосфат), TBTU(2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний тетрафторборат), BOP-Cl (хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты) или оксалилхлорид, в апротонном растворителе, таком как дихлорметан, необязательно в присутствии третичного амина, такого как триэтиламин, и последующего взаимодействия полученного таким образом продукта с амином NHR5R6.
Альтернативно, соединения формулы (I), где R4 обозначает группу NR5R6, можно получить путем взаимодействия соединения формулы (I), где R5 обозначает водород и R6 обозначает 2-гидроксифенил, с карбонилдиимидазолом или тиокарбонилдиимидазолом в подходящем растворителе, таком как дихлорметан, и последующего взаимодействия полученного таким образом продукта с амином NHR5R6.
Соединения формулы (I), где R4 обозначает OC1-4алкил (необязательно замещенный C1-4алкилкарбонилокси), можно получить путем взаимодействия соответствующей карбоновой кислоты (R4 обозначает OH) или ее активированного производного с подходящим спиртом (R4OH) или алкилгалогенидом (R4галогенид) в стандартных условиях получения таких сложных эфиров. Подходящие активированные производные включают галогенангидриды кислот, смешанные ангидриды, полученные при взаимодействии реагентов, обычно используемых в синтезе пептидов, например, карбонилдиимидазола и основных солей кислот, например, солей щелочных металлов.
Соединения формулы (IV) можно превратить в другие соединения формулы (IV), применяя стандартные методики. Таким образом, соединения формулы (IV), где R5 обозначает водород и R6 обозначает 2-бензилоксифенил, можно превратить в другие соединения формулы (IV), где R5 и R6 имеют значения, отличные от определенных в формуле (I), применяя те же методики, которые описаны выше для проведения аналогичных реакций на соединениях формулы (I).
Соединения формулы (I), где стереохимия любого из заместителей R1, R2 и R3 такова, как показана в формуле (1a), можно получить, исходя из соответствующих отдельных изомеров промежуточных продуктов (III), (IV) и (VII), и/или различные изомерные смеси можно разделить по общеизвестным методикам.
Промежуточные продукты (V), (VI), (VII), (VIII) и (IX) либо являются известными соединениями, либо их можно получить способами, аналогичными известным способам получения структурно родственных соединений.
Соединения формулы группы (I), где R4 обозначает OH, можно получить циклизацией соответствующего соединения формулы (II) в условиях, описанных выше для получения соединения формулы (I).
Физиологически приемлемые соли соединения формулы (I), где R4 обозначает OH, или одна из групп R1, R2, R3 или NR4R5 имеет основный или кислотный центр, можно получить путем обработки указанного основания или кислоты необходимой физиологически приемлемой кислотой или основанием, и данное взаимодействие удобно проводить в растворителе для указанного соединения формулы (I). Физиологически приемлемые производные соединения формулы (I) можно получить из подходящего промежуточного продукта, соответствующего формуле (II), используя способ, описанный выше для получения соединения формулы (I), или непосредственно из соединения формулы (I) по общеизвестным методикам для получения таких производных. Таким образом, метаболически лабильные сложные эфиры можно получить этерификацией свободной карбоксильной или гидроксильной группы, используя стандартные методики этерификации.
Следующие примеры являются иллюстративными, а не ограничительными вариантами настоящего изобретения.
Основные способы очистки и аналитического исследования
Аналитическую ВЭЖХ проводят на колонке Supelcosil LCABZ+PLUS (3,3 см Ч 4,6 мм внутренний диаметр), элюируя 0,1% HCO2H и 0,01 M ацетатом аммония в воде (растворитель A) и 0,05% HCO2H 5% вода в ацетонитриле (растворитель B), применяя следующий градиент элюирования 0-0,7 мин 0%B, 0,7-4,2 мин 0%-100%B, 4,2-5,3 мин 100%B, 5,3-5,5 мин 0%B при скорости потока 3 мл/мин. Масс-спектры (MS) регистрируют на спектрометре Fisons VG Platform, применяя варианты с положительным электрораспылением [(ES+ve, получая молекулярные ионы MH+ и M(NH4)+] или отрицательным электрораспылением [(ES-ve, получая молекулярный ион (M-H)-] на масс-спектрометре Micromass серии 2 или Waters ZQ. Спектры 1Н ЯМР регистрируют на спектрометре Bruker DPX, 400 МГц, используя тетраметилсилан в качестве внешнего стандарта.
Biotage™ хроматография относится к очистке, проводимой с использованием оборудования, продаваемого Dyax Corporation (либо Flash 40i, либо 150i), и картриджей с предварительно упакованным KPSil. Масс-нацеленная автоматическая система относится к способам, где вещества очищают методом высокоэффективной жидкостной хроматографии на колонке HPLCABZ+ 5 мкм (5 см × 10 мм внутренний диаметр) с 0,1% HCO2H в воде и 95% MeCN, 5% воды (0,5% HCO2H), используя градиентное элюирование при скорости потока 8 мл·мин-1. Фракционный коллектор Gilson 202 настраивается масс-спектрометром VG Platform на детектирование интересующей массы.
Гидрофобные фритты относятся к фильтровальным пробиркам, продаваемым Whatman. SPE (твердофазная экстракция) относится к применению картриджей, продаваемых International Sorbent Technology Ltd. ТСХ (тонкослойная хроматография) относится к применению ТСХ-пластин, продаваемых Merck, покрытых силикагелем 60 F254. Oasis™ относится к Waters® Oasis™ HLB экстракционным картриджам, продаваемым Waters Corporation®.
Способ 1
Пример 1
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид
К раствору гидрохлорида метилового эфира (D)-лейцина (300 мг) в метаноле (4 мл) добавляют триэтиламин (230 мкл) и 4-фторбензальдегид (177 мкл). Смесь перемешивают в течение 2,5 час, а затем последовательно добавляют (2R)-[(трет-бутоксикарбонил)амино](2,3-дигидро-1H-инден-2-ил)этановую кислоту (481 мг) и изопропилизоцианид (225 мкл). После перемешивания в течение 16 час растворитель удаляют в вакуумеиостаток растворяют в хлороформе. Данный раствор промывают насыщенным водным раствором карбоната натрия (×2), водной лимонной кислотой (0,5M, ×2) и насыщенным раствором соли (×1), сушат над сульфатом магния и выпаривают в вакууме. Остаток растворяют в дихлорметане (2 мл) и трифторуксусной кислоте (5 мл) и перемешивают в течение 3 час при температуре окружающей среды. После этого растворитель удаляют в вакууме и остаток выпаривают совместно с толуолом (×3) и смесью циклогексан/эфир (1:1, ×2). Остаток обрабатывают раствором триэтиламина в диоксане (2% раствор, 10 мл) и оставляют перемешиваться в течение ночи. После этого диоксан удаляют в вакууме и остаток растворяют в этилацетате. Раствор промывают раствором лимонной кислоты (0,5M, ×2), насыщенным водным раствором бикарбоната натрия (×1) и насыщенным раствором соли (×1). Далее жидкости сушат над сульфатом магния и в вакууме и затем выпаривают совместно со смесью циклогексан:простой эфир (1:1, ×2). Данное сырое вещество очищают на Biotage™ (90 г диоксида кремния), элюируя смесью толуол:этилацетат:циклогексан (5:3:2) с 5% триэтиламином, получая (2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид (149 мг)
ВЭЖХ Время удерж. (Rt) = 3,42 мин; m/z [M+H]+ = 480.
1H ЯМР (CDCl3) δ: 7,44 (м, 2H), 7,22 (м, 2H), 7,16 (м, 2H), 7,11 (т, 2H), 6,50 (д, 1H), 5,60 (д, 1H), 5,11 (с, 1H), 4,10 (м, 1H), 3,96 (м, 2H), 3,16 (дд, 1H), 3,07 (д, 1H), 2,91 (м, 1H), 2,77 (м, 1H), 1,84 (м, 1H), 1,73 (м, 1H), 1,42 (м, 1H), 1,13 (д, 3H), 1,12 (д, 3H), 0,84 (д, 3H), 0,79 (д, 3H)
Аналогично получают:
Пример 2
(2R)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-[4-(4-гидроксипиперидин-1-ил)фенил]этанамид
ВЭЖХ Время удерж. (Rt) = 3,27 мин; m/z [M+H]+ = 575
(CDCl3) δ: 7,3 (д, 2H), 7,2 (м, 2H), 7,15 (м, 2H), 6,9 (д, 2H), 6,1 (д, 1H), 5,5 (с, 1H), 5,15 (с, 1H), 3,95 (м, 2H), 3,9 (м, 1H), 3,6 (м, 2H), 3,15 (м, 1H), 3,1 (м, 2H), 3,0 (м, 2H), 2,9 (м, 1H), 2,75 (м, 1H), 2,0 (м, 2H), 1,75 (м, 1H), 1,65 (м, 3H), 1,45 (м, 1H), 1,3 (с, 9H), 0,8 (д, 3H), 0,7 (д, 3H)
Пример 3
(2R)-2-{(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-[(1R)-1-метилпропил)-2,5-диоксопиперазин-1-ил}-2-(2-фтор-4-морфолин-4-илфенил)-N-изопропилэтанамид
ВЭЖХ Время удерж. (Rt) = 3,34 мин; m/z [M+H]+ = 565
1H ЯМР (CDCl3) δ: 7,52 (т, 1H), 7,22-7,11 (м, 4H), 7,04 (ушир. с, 1H), 6,66 (дд, 1H), 6,56 (дд, 1H), 5,07 (с, 1H), 4,19-4,08 (м, 2H), 3,98 (дд, 1H), 3,86-3,81 (4H, м), 3,21-2,91 (м, 8H), 2,80-2,73 (м, 1H), 1,96-1,86 (м, 1H), 1,72-1,61 (м, 1H), 1,51-1,40 (м, 1H), 1,19 (д, 3H), 1,16 (д, 3H), 1,06 (д, 3H), 0,92 (т, 3H)
Способ 2
Пример 4
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(4-фторфенил)-N-(2,2,2-трифторэтил)этанамид
Метил (2R)-2-{[(1R,S)-2-{[2-(бензилокси)фенил]амино}-1-(4-фторфенил)-2-оксоэтил][(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил]амино}-4-метилпентаноат
Смесь 4-фторбензальдегида (1,2 г), гидрохлорида метилового эфира (D)-лейцина (1,7 г), триэтиламина и метанола (56 мл) перемешивают при комнатной температуре в течение 3 час. Затем добавляют последовательно 2-бензилоксифенилизоцианид (2,0 г) и N-трет-бутоксикарбонил-(D)-инданилглицин (2,77 г). Через 40 час реакционную смесь распределяют между 2M соляной кислотой и этилацетатом. Отделенный органический слой промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над сульфатом магния и выпаривают в вакууме. Полученное сырое вещество очищают методом колоночной хроматографии (элюируя 0,5% и 0,2% метанол/дихлорметан), получая метил (2R)-2-{[(1R,S)-2-{[2-(бензилокси)фенил]амино}-1-(4-фторфенил)-2-оксоэтил][(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил]амино}-4-метилпентаноат (4,3 г).
ВЭЖХ Время удерж. (Rt) = 4,34 мин, m/z [M+H]+ = 752
Метил N-[(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил]-N-{(1R,S)-1-(4-фторфенил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-D-лейцинат
Смесь метил (2R)-2-{[(1R,S)-2-{[2-(бензилокси)фенил]амино}-1-(4-фторфенил)-2-оксоэтил][(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил]амино}-4-метилпентаноата (560 мг), палладия на угле (70 мг) и этанола (15 мл) перемешивают в атмосфере водорода в течение 5 час. Данную смесь фильтруют через целит и фильтрат выпаривают в вакууме. Сырой продукт очищают методом колоночной хроматографии (диоксид кремния), элюируя смесью этилацетат:циклогексан (от 10% до 15%) и получая метил N-[(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил]-N-{(1R,S)-1-(4-фторфенил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-D-лейцинат.
ВЭЖХ Время удерж. (Rt) = 4,06 мин, m/z [M+H]+ = 662
(2R)-{[(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил][(1R)-1-(метоксикарбонил)-3-метилбутил]амино}(4-фторфенил)этановая кислота
Карбонилдиимидазол (558 мг) добавляют к раствору метил N-[(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил]-N-{(lR,S)-1-(4-фторфенил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-D-лейцината (2,0 г) в дихлорметане (20 мл) и полученную смесь перемешивают при комнатной температуре в течение 24 час. Затем реакционную смесь концентрируют досуха, растворяют в смеси ацетон:вода (60 мл:40 мл) и перемешивают в течение 17 час при комнатной температуре. Затем раствор распределяют между 2M водной соляной кислотой и этилацетатом. Отделенный органический слой промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли перед сушкой над сульфатом магния и выпариванием в вакууме. Половину вещества берут сырым для использования в дальнейших экспериментах. Вторую половину очищают на Biotage™ (90 г диоксида кремния), элюируя смесью метанол:дихлорметан:аммиак (от 1:98,5:0,5 до 2,5:86,5:1). Выпаривание подходящих фракций дает (2R)-{[(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил][(1R)-1-(метоксикарбонил)-3-метилбутил]амино}(4-фторфенил)этановую кислоту (173 мг).
ВЭЖХ Время удерж. (Rt) = 3,91 мин, m/z [M+H]+ = 571
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(4-фторфенил)-N-(2,2,2-трифторэтил)этанамид
Раствор (2R)-{[(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил][(1R)-1-(метоксикарбонил)-3-метилбутил]амино}(4-фторфенил)этановой кислоты (73 мг) в N,N-диметилформамиде (2 мл) последовательно обрабатывают диизопропилэтиламином (51 мкл), фосфор(1-гидрокси-1H-бензотриазолато-O)три-1-пирролидинил-(T-4)-гексафторфосфатом
(80 мг) и затем через 2 мин 2,2,2-трифторэтиламином (25 мкл). Данную реакционную смесь перемешивают в течение 2 час перед распределением между 2M водной соляной кислотой и этилацетатом. Органический слой промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли перед сушкой над сульфатом магния и выпариванием в вакууме. Остаток растворяют в 4M растворе хлористого водорода в диоксане и перемешивают в течение 7 час при комнатной температуре. Реагент удаляют в вакууме и остаток распределяют между этилацетатом и насыщенным водным раствором бикарбоната натрия. Отделенную органическую фракцию промывают насыщенным раствором соли перед сушкой над сульфатом магния и выпариванием в вакууме. Сырое вещество очищают методом колоночной хроматографии (диоксид кремния), элюируя смесью метанол:дихлорметан (от 1% до 3%), получая (2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(4-фторфенил)-N-(2,2,2-трифторэтил)этанамид (10 мг)
ВЭЖХ Время удерж. (Rt) = 3,4 мин, m/z [M+H]+ = 520
1Н ЯМР (CDC13) δ: 7,42 (м, 2H), 7,34 (д, 1H), 7,20-7,10 (м, 6H), 6,61 (т, 1H), 5,28 (с, 1H), 4,08-3,96 (м, 3H), 3,88 (м, 1H), 3,14 (дд, 1H), 3,02 (м, 2H), 2,95-2,77 (м, 2H), 1,88-1,70 (м, 2H), 1,40 (ддд, 1H), 0,85 (д, 3H), 0,79 (д, 3H),
Следующие соединения получают аналогичным образом
Пример 5
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
ВЭЖХ Время удерж. (Rt) = 3,37 мин, m/z [M+H]+ = 466
1H ЯМР (CDCl3) δ: 7,47-7,40 (м, 2H), 7,25-7,12 (м, 6H), 6,50 (д, 1H), 6,47 (с, 1H), 4,15 (дд, 1H), 3,98 (дд, 1H), 3,21-3,01 (м, 3H), 2,99 (с, 3H), 2,92-2,73 (м, 2H), 2,83 (м, 3H), 1,59-1,49 (м, 1H), 1,42 (дт, 1H), 0,66-0,57 (м, 1H), 0,62 (д, 3H), 0,40 (д, 3H).
Пример 6
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]морфолинамид
ВЭЖХ Время удерж. (Rt) = 3,32 мин, m/z [M+H]+ = 508
1H ЯМР (CDCl3) δ: 7,44-7,39 (м, 2H), 7,26-7,12 (м, 6H), 6,87 (д, 1H), 6,51 (с, 1H), 4,12 (дд, 1H), 4,00 (дд, 1H), 3,73-3,62 (м, 3H), 3,60-3,54 (м, 2H), 3,37 (м, 1H), 3,23 (м, 1H), 3,20-3,02 (м, 4H), 2,91-2,75 (м, 2H), 1,60-1,50 (м, 1H), 1,45 (дт, 1H), 0,63 (д, 3H), 0,62-0,55 (м, 1H), 0,42 (д, 3H).
Используемый в данном синтезе 2-фтор-4-(морфолино)бензальдегид получают по следующей методике.
2-фтор-4-(морфолино)бензонитрил
Раствор 2,4-дифторобензонитрила (6,03 г, 43,35 ммоль) и морфолина (8,3 мл, 95,17 ммоль) в тетрагидрофуране (27 мл) перемешивают при комнатной температуре в течение 24 час. Смесь выпаривают и белое твердое вещество очищают на колонке Biotage™ (90 г диоксида кремния), элюируя смесью циклогексан:этилацетат (4:1), получая 2-фтор-4-(морфолино)бензонитрил в виде белого твердого вещества (5,81 г, 65%).
ВЭЖХ Время удерж. (Rt) = 2,83 мин; m/z [M+H]+ = 207.
2-фтор-4-(морфолино)бензальдегид
К раствору 2-фтор-4-(морфолино)бензонитрила (2,82 г, 13,7 ммоль) в тетрагидрофуране (27 мл) в атмосфере азота добавляют по капле 1,5M раствор DIBAL-H в толуоле (18,3 мл, 27,3 ммоль) в течение 13 мин и полученную смесь перемешивают в течение 23,5 час при комнатной температуре. Смесь охлаждают до -50°C и разлагают избыток DIBAL-H, осторожно добавляя метанол (27 мл). Затем смесь перемешивают при комнатной температуре в течение 10 мин, добавляют насыщенный хлорид аммония (27 мл) и полученную смесь перемешивают при комнатной температуре в течение 40 мин и затем выпаривают при пониженном давлении до желтого твердого вещества. Данное твердое вещество распределяют между дихлорэтаном (120 мл) и водой (120 мл) и добавляют твердый карбонат калия до рН водной фазы 10. Фазы разделяют при помощи гидрофобной фритты, органическую фазу выпаривают и остаток очищают на колонке Biotage™ (40 г диоксида кремния), элюируя смесью циклогексан:этилацетат (7:3) и получая 2-фтор-4-(морфолино)бензальдегид (1,96 г, 68%) в виде белого твердого вещества.
ВЭЖХ Время удерж. (Rt) = 2,63 мин; m/z [M+H]+ = 210.
Способ 3
Пример 7
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид
Метил N-[(1R)-1-(2,4-дифторфенил)-2-(изопропиламино)-2-оксоэтил)-L-лейцинат
К перемешиваемой суспензии (L)-лейцина (1,3 г) в метаноле (100 мл) в атмосфере азота добавляют 2,4-дифторбензальдегид (1,42 г). После перемешивания при температуре окружающей среды в течение 3 дней суспензию охлаждают до -30°C и добавляют раствор изопропилизоцианида (0,691 г) в метаноле (5 мл). Через 3 час при -30°C реакционной смеси дают нагреться до комнатной температуры и перемешивают еще в течение 20 час. Растворитель удаляют в вакууме, остаток очищают, используя колонку Biotage™ (40 г, диоксид кремния), элюируя смесью циклогексан:этилацетат (градиент от 8:1 до 1:1). Нужные фракции объединяют и концентрируют в вакууме, получая метил N-[(1R)-1-(2,4-дифторфенил)-2-(изопропиламино)-2-оксоэтил]-L-лейцинат (1,326 г).
1H ЯМР (CDCl3) δ: 7,32 (м, 1H), 6,88 (м, 1H), 6,82 (м, 1H), 6,78 (м, 1H), 4,42 (с, 1H), 4,07 (м, 1H), 3,69 (с, 3H), 3,18 (т, 1H), 1,66 (м, 1H), 1,49 (т, 2H), 1,18 (д, 3H), 1,15 (д, 3H), 0,88 (д, 3H), 0,77 (д, 3H)
N-[(1R)-1-(2,4-дифторфенил)-2-(изопропиламино)-2-оксоэтил]-L-лейцин
К раствору метил N-[(lR)-1-(2,4-дифторфенил)-2-(изопропиламино)-2-оксоэтил]-L-лейцината (1,32 г) в метаноле (15 мл) добавляют раствор гидроксида лития (294 мг) в воде (15 мл). Реакционную смесь быстро перемешивают в течение 1,5 час и затем выпаривают в вакууме. Остаток растворяют в воде и нейтрализуют 2N соляной кислотой. Полученное твердое вещество собирают фильтрованием и сушат в вакууме. Фильтрат помещают в 4 картриджа Oasis (6 г), которые элюируют водой (×2) и метанолом (×2). Необходимые фракции объединяют и концентрируют в вакууме,получая N-[(lR)-1-(2,4-дифторфенил)-2-(изопропиламино)-2-оксоэтил]-L-лейцин (1,01 г).
ВЭЖХ Время удерж. (Rt) = 2,51 мин; m/z [M+H]+ = 343.
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид
К раствору (2R)-[(трет-бутоксикарбонил)амино](2,3-дигидро-1H-инден-2-ил)этановой кислоты (291 мг) в сухом тетрагидрофуране (5 мл) в атмосфере азота при -20°C добавляют N-метилморфолин (l0l мг) и раствор изопропилхлорформиата в толуоле (1,0M, 1 мл). Через 10 мин добавляют раствор N-[(1R)-1-(2,4-дифторфенил)-2-изопропиламино)-2-оксоэтил]-L-лейцина (342 мг) в смеси N,N-иметилформамид/тетрагидрофуран (5 мл/10 мл) и полученную смесь перемешивают при комнатной температуре в течение 4 час. Затем удаляют растворитель в вакууме и остаток обрабатывают 4N соляной кислотой в диоксане (2 мл). Через 4 час добавляют к реакционной смеси метанол (5 мл) и оставляют стоять на 18 час. Затем удаляют растворитель в вакууме и остаток очищают на картридже SPE (50 г, диоксид кремния), элюируя смесью циклогексан/этилацетат (градиент от 4:1 до чистого этилацетата), что дает два диастереомера (2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамида в виде белых твердых веществ (0,137 г).
ВЭЖХ Время удерж. (Rt) = 3,47 мин, m/z [M+H]+ = 498.
1H ЯМР (CDCl3) δ: 7,68 (м, 1H), 7,21 (м, 2H), 7,17 (м, 2H), 6,95 (м, 1H), 6,89 (м, 1H), 6,79 (д, 1H), 5,91 (д, 1H), 5,33 (с, 1H), 4,12 (м, 1H), 4,02 (м, 1H), 3,92 (дд, 1H), 3,16 (м, 1H), 3,05 (м, 2H), 2,90 (м, 1H), 2,78 (м, 1H), 1,85 (м, 1H), 1,79 (м, 1H), 1,49 (м, 1H), 1,17 (м, 6H), 0,88 (д, 3H), 0,82 (д, 3H)
Способ 4
Пример 8
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
Метил N-[(1R)-2-{[2-(бензилокси)фенил]амино}-1-(2,4-дифторфенил)-2-оксоэтил]-L-лейцинат
К суспензии L-лейцина (2,33 г) в метаноле (200 мл) при -30°C в атмосфере азота добавляют раствор 2,4-дифторбензальдегида (2,52 г) в метаноле (10 мл) и суспензию 2-бензилоксифенилизонитрила (3,7 г) в метаноле (40 мл). Реакционную смесь перемешивают при -30°C в течение 2,5 час и затем дают нагреться до комнатной температуры и перемешивают еще в течение 6 дней. Растворитель удаляют в вакуумеиостаток пропускают через колонку Biotage™ (90 г), элюируя смесью циклогексан:этилацетат (8:1 и 7:1), получая после выпаривания нужных фракций метил N-[(1R)-2-{[2-(бензилокси)фенил]амино}-1-(2,4-дифторфенил)-2-оксоэтил]-L-лейцинат (5,06 г).
ВЭЖХ Время удерж. (Rt) = 4,0 мин, m/z [M-H]- = 495
Метил N-{(1R)-1-(2,4-дифторфенил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-L-лейцинат
Смесь палладия на угле (10%, 300 мг), метил N-[(1R)-2-{[2-(бензилокси)фенил]амино}-1-(2,4-дифторфенил)-2-оксоэтил]-L-лейцината (2,88 г) и этилацетата (30 мл) перемешивают в атмосфере водорода в течение 3 час. Затем реакционную смесь фильтруют через целит и промывают набивку фильтра дополнительной порцией этилацетата. Объединенные органические фракции выпаривают, получая метил N-{(1R)-1-(2,4-дифторфенил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-L-лейцинат (2,179 г).
ВЭЖХ Время удерж. (Rt) = 3,52 мин, m/z [M-H]- = 405
Метил N-[1-(2,4-дифторфенил)-2-(диметиламино)-2-оксоэтил]-L-лейцинат
Раствор метил N-{(1R)-1-(2,4-дифторфенил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-L-лейцината (203 мг) и 1,1'-тиокарбонилдиимидазола (100 мг) в дихлорметане (5 мл) оставляют стоять на 18 час. К реакционной смеси добавляют воду (10 мл) и быстро перемешивают в течение 30 мин. После этого добавляют 1H-бензотриазолий, 1-[бис(диметиламино)метилен]-, тетрафторборат(1-), 3-оксид (TBTU, 321 мг) и раствор диметиламина в тетрагидрофуране (0,5 мл 2M раствора). Реакционную смесь перемешивают еще в течение 18 час и затем пропускают вниз по SPE (5 г диоксида кремния), элюируя с градиентом (смесь циклогексан:этилацетат, от 8:1 до 1:2). Нужные фракции объединяют и выпаривают, получая метил N-[1-(2,4-дифторфенил)-2-(диметиламино)-2-оксоэтил]-L-лейцинат (100 мг).
ВЭЖХ Время удерж. (Rt) = 3,16 мин m/z [M+H]+ = 343.
N-[1-(2,4-дифторфенил)-2-(диметиламино)-2-оксоэтил]-L-лейцин
К раствору метил N-[1-(2,4-дифторфенил)-2-(диметиламино)-2-оксоэтил]-L-лейцината (100 мг) в метаноле (3 мл) добавляют раствор гидроксида лития (15,4 мг) в воде (1 мл). После интенсивного перемешивания в течение 4 час растворитель удаляют в вакууме.Остаток разбавляют водой (10 мл), затем нейтрализуют 2N соляной кислотой. Данный раствор помещают в картридж Oasis™ (6 г) и элюируют водой (×2) и метанолом (×2). Необходимые фракции объединяют и выпаривают, получая N-[1-(2,4-дифторфенил)-2-(диметиламино)-2-оксоэтил]-L-лейцин (95 мг).
ВЭЖХ Время удерж. (Rt) = 2,23 мин m/z [M+H]+ = 329
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
К раствору (2R)-[(трет-бутоксикарбонил)амино](2,3-дигидро-1H-инден-2-ил)этановой кислоты (84 мг) в сухом тетрагидрофуране (6 мл) при -20°C в атмосфере азота добавляют N-метилморфолин (32 мл) и раствор изопропилхлорформиата в толуоле (1,0M, 290 мл). Через 10 мин добавляют раствор N-[1-(2,4-дифторфенил)-2-(диметиламино)-2-оксоэтил]-L-лейцина (95 мг) в тетрагидрофуране (10 мл) и дают реакционной смеси нагреться до комнатной температуры. Через 20 час растворитель удаляют в вакууме иостаток растворяют в 4N соляной кислоте в диоксане (4 мл). Через 4 час добавляют метанол (5 мл) и реакционную смесь оставляют стоять еще в течение 18 час. Затем растворитель удаляют в вакууме, остаток растворяют в диоксане (5 мл) и добавляют триэтиламин (0,5 мл). Через 1 час растворитель удаляют и остаток помещают в SPE (10 г, диоксид кремния). Продукт элюируют, используя метанол. Второй картридж SPE используют для дополнительной очистки вещества (2 г диоксида кремния), применяя градиент смеси этилацетат:метанол (от 20:1 до 1:1) и получая (2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид (38 мг)
ВЭЖХ Время удерж. (Rt) = 3,5 мин, m/z [M+H]+ = 484
1H ЯМР (CDCl3) δ: 7,42 (м, 1H), 7,22 (м, 2H), 7,17 (м, 2H), 7,02-6,90 (м, 2H), 6,62 (с, 1H), 6,37 (м, 1H), 4,09 (м, 1H), 3,98 (дд, 1H), 3,20-3,02 (м, 3H), 2,99 (с, 3H), 2,87 (м, 1H), 2,85 (с, 3H), 2,74 (м, 1H), 1,55 (м, 2H), 0,70 (м, 1H), 0,67 (д, 3H), 0,41 (д, 3H)
Аналогично получают:
Пример 9
(2R)-N-циклопропил-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид
ВЭЖХ Время удерж. (Rt) = 3,41 мин, m/z [M+H]+ = 496.
1H ЯМР (CDCl3) δ: 7,67 (дт, 1H), 7,59 (1H, д), 7,21-7,11 (м, 4H), 6,99-6,92 (м, 1H), 6,92-6,84 (м, 1H), 6,35 (д, 1H), 5,43 (с, 1H), 3,99 (дд, 1H), 3,93 (дд, 1H), 3,17-2,71 (м, 6H), 1,88-1,70 (м, 2H), 1,48-1,38 (м, 1H), 0,86 (с, 3H), 0,81-0,74 (м, 5H), 0,51-0,45 (м, 2H).
Пример 10
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид:
(2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-бензилоксифенил)этанамид
Смесь 2,4-дифторбензальдегида (1,421 г), гидрохлорида метилового эфира (D)-лейцина (1,817 г), триэтиламина (1,391 мл) и метанола (20 мл) перемешивают при комнатной температуре в течение 16 час, затем добавляют последовательно N-трет-бутоксикарбонил-(D)-инданилглицин (2,914 г) и 2-бензилоксифенилизоцианид (2,090 г). Через 24 час растворитель удаляют при пониженном давлении и реакционную смесь переносят в дихлорметан (около 20 мл) и очищают методом колоночной флэш-хроматографии на Biotage™ (картриджи с диоксидом кремния 2Ч90 г в системе Biotage Quad 3 элюируют смесью этилацетат/циклогексан, 1:9), получая метил (2R)-2-{[(1R,S)-2-{[2-(бензилокси)фенил]амино}-1-(2,4-дифторфенил)-2-оксоэтил][(2R)-2-[(трет-бутоксикарбонил)амино]-2-(2,3-дигидро-1H-инден-2-ил)этаноил]амино}-4-метилпентаноат (5,100 г) (ВЭЖХ Время удерж. (Rt) = 4,40 мин m/z [M+H]+ = 770). Данную смесь переносят в 4M хлористый водород в 1,4-диоксане (20 мл) и оставляют при комнатной температуре на 3 час. Растворитель и хлористый водород выдувают, применяя поток азота в течение ночи. Сырое вещество переносят в метанол (90 мл), содержащий триэтиламин (10 мл). Через 30 мин метанол и избыток триэтиламина удаляют при пониженном давлении. Сырой продукт очищают методом колоночной флэш-хроматографии на Biotage™ (картриджи с диоксидом кремния 2Ч90 г в системе Biotage Quad 3 элюируют смесью этилацетат/циклогексан, 1:2), получая (2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-бензилоксифенил)этанамид (3,381 г). ВЭЖХ Время удерж. (Rt) = 3,99 мин, m/z [M+H]+ = 638
(2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид
(2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-бензилоксифенил)этанамид (3,381 г) растворяют в этилацетате (200 мл) и гидрируют при атмосферном давлении на катализаторе (10% палладий на угле) (0,980 г 10% Pd/C:вода 1:1 масс./масс.) при комнатной температуре в течение 5 час. Реакционную смесь фильтруют через целит и растворитель удаляют при пониженном давлении, получая (2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид в виде пены кремового цвета (2,650 г).
ВЭЖХ Время удерж. (Rt) = 3,61 мин, m/z [M-H+]- = 546 (не видно [M+H]+)
(2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этановая кислота
(2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (2,650 г) перемешивают в дихлорметане (20 мл) и добавляют карбонилдиимидазол (1,178 г). Смесь оставляют при комнатной температуре на 16 час, затем удаляют растворитель при пониженном давлении. Остаток переносят в смесь 1:1 ацетон/вода (об./об.) (80 мл) и оставляют при комнатной температуре на 30 мин. Далее удаляют ацетон при пониженном давлении и остаток распределяют между дихлорметаном и 0,5M соляной кислотой. Органическую фазу отделяют (гидрофобная фритта) и выпаривают при пониженном давлении. Сырой продукт очищают (колоночная флэш-хроматография на Biotage™, картридж с 90 г диоксида кремния элюируют (i) смесью 1:1 этилацетат:циклогексан, (ii) этилацетатом, (iii) смесью 9:1 этилацетат:метанол), получая (2RS)-2-(2,4-дифторфенил) 2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этановую кислоту в виде бесцветного твердого вещества (1,524 г) как смесь эпимеров.
ВЭЖХ Время удерж. (Rt) = 3,44 и 3,58 мин, оба m/z [M+Н+] = 457
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
(2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этановую кислоту (0,747 г), полученную, как описано выше, сушат над P4О10 в вакууме в течение 5 час, получая 0,724 г более сухого вещества; его растворяют в безводной смеси дихлорметан:ацетонитрил (1:1 об./об., 6 мл), обрабатывают триэтиламином (0,223 мл) и BOP-Cl (хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты, 0,450 г) и воздействуют на смесь ультразвуком в течение примерно 1 мин, получая гелеобразную массу. Через 10 мин при комнатной температуре добавляют раствор диметиламина в тетрагидрофуране (10 мл 2M раствора), получая прозрачный раствор; его оставляют на 16 час при комнатной температуре. Растворители удаляют при пониженном давлении и смесь распределяют между дихлорметаном и 0,1M соляной кислотой. Органическую фазу отделяют (гидрофобная фритта) и выпаривают при пониженном давлении. Сырой продукт очищают методом колоночной флэш-хроматографии (Biotage™ картридж, 12 г диоксида кремния, элюируют (i) смесью 1:1 этилацетат/циклогексан, (ii) этилацетатом, (iii) смесью 9:1 этилацетат:метанол), получая (2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид в виде бесцветного твердого вещества (0,285 г).
ВЭЖХ Время удерж. (Rt) = 3,43 мин, m/z [M+H]+ = 484
1H ЯМР (CDCl3) δ: 7,47-7,40 (м, 1H), 7,24-7,11 (м, 4H), 7,01-6,91 (м, 3H), 6,62 (с, 1H), 4,09 (дд, 1H), 3,98 (дд, 1H), 3,19-3,01 (м, 3H), 2,99 (3,3H), 2,92-2,75 (м, 5H), 1,64-1,51 (м, 2H), 0,76-0,66 (м, 4H), 0,43 (д, 3H).
Способ 5
Пример 11
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
(2R)-[(бензилоксикарбонил)амино](2,3-дигидро-1H-инден-2-ил)этановая кислота
R-Инданилглицин (1,91 г) суспендируют в диоксане (10 мл) и воде (10 мл). Добавляют триэтиламин (1,7 мл) и N-(бензилоксикарбонилокси)сукцинимид (2,54 г) и реакционную смесь быстро перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь выливают в воду (50 мл) и экстрагируют хлороформом (100 мл). Органическую фазу промывают 1N соляной кислотой (50 мл) и водой (50 мл). Смесь сушат над сульфатом магния и удаляют растворитель в вакууме,получая (2R)-[(бензилоксикарбонил)амино](2,3-дигидро-1H-инден-2-ил)этановую кислоту (3,06 г).
ВЭЖХ Время удерж. (Rt) = 3,35 мин; m/z [M+H]+ = 326.
1Н ЯМР (CDCl3) δ: 7,40-7,29 (м, 5H), 7,21-7,11 (м, 4H), 5,28 (д, 1H), 5,11 (с, 2H), 4,57 (м, 1H), 3,14-2,79 (м, 5H).
(2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид
К раствору гидрохлорида метилового эфира (D)-лейцина (1,45 г) в метаноле (10 мл) добавляют триэтиламин (1,12 мл) и 2,4-ифторбензальдегид (0,875 мл). Смесь перемешивают в течение 3 дней перед последовательным добавлением
(2R)-[(бензилоксикарбонил)амино](2,3-дигидро-1H-инден-2-ил)этановой кислоты (2,6 г) и 2-бензилоксифенилизоцианида (1,76 г). Реакционную смесь оставляют стоять на 24 час. Растворитель удаляют в вакууме иостаток делят между этилацетатом (200 мл) и водой (200 мл). Органическую фазу промывают насыщенным раствором соли. К данному раствору добавляют палладий на угле (2,0 г) и уксусную кислоту (10 мл) и реакционную смесь перемешивают в атмосфере водорода в течение 2 час. Данную смесь фильтруют через целит и промывают водой (3×100 мл), насыщенным раствором бикарбоната натрия, насыщенным раствором соли и сушат над сульфатом магния. Растворитель выпаривают в вакууме. Сырой продукт очищают методом колоночной хроматографии (диоксид кремния), элюируя смесью этилацетат:циклогексан (от 50% до 66%) и получая (2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (2,0 г).
ВЭЖХ Время удерж. (Rt) = 3,59 мин; m/z [M+H]+ = 548.
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
Карбонилдиимидазол (4,80g, 1,54 экв.) суспендируют в безводном дихлорметане (40 мл) и суспензию оставляют при комнатной температуре на 15 мин. Затем добавляют (2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (10,50 г, предварительно высушенный в вакууме над Р4О10 в течение 24 час) при перемешивании и полученный раствор перемешивают при комнатной температуре в течение 6 час. Затем полученный желтый раствор обрабатывают 2,0M раствором диметиламина в тетрагидрофуране (54 мл, 5,6 экв.) и полученную смесь перемешивают при комнатной температуре в течение 16 час. Растворители плюс остаточный диметиламин удаляют при пониженном давлении и реакционную смесь переносят в дихлорметан (200 мл) и промывают 1M соляной кислотой (200 мл). Органическую фазу отделяют, используя гидрофобную фритту, и выпаривают при пониженном давлении примерно до 50 мл. Сырой продукт вносят в колонки Biotage™, 4×90 г диоксида кремния, системы Quad 3; каждую колонку элюируют (i) смесью 2:1 об./об. этилацетат/циклогексан (12 × 50 мл фракции), (ii) этилацетатом (12 × 50 мл фракции), (iii) смесью 9:1 об./об. этилацетат:метанол, получая (2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид (5,753 г, 62%) в виде бесцветного твердого вещества.
ВЭЖХ Время удерж. (Rt) = 3,41 мин, m/z [M+H]+ = 484
1H ЯМР (CDCl3) δ: 7,48-7,38 (м, 2H), 7,24-7,11 (м, 4H), 7,01-6,90 (м, 2H), 6,62 (с, 1H), 4,09 (дд, 1H), 3,98 (дд, 1H), 3,19-3,01(м, 3H), 2,99 (3,3H), 2,92-2,75 (м, 5H), 1,64-1,51 (м, 2H), 0,76-0,66 (м, 4H), 0,43 (д, 3H).
Аналогично получают:
Пример 12
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метилэтанамид, бесцветное твердое вещество, 41%
ВЭЖХ Время удерж. (Rt) = 3,4 мин, m/z [M+H]+ = 470
Пример 13
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид, бесцветное твердое вещество, 36%
ВЭЖХ Время удерж. (Rt) = 3,3 мин, m/z [M+H]+ = 456
Пример 14
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-морфолин-4-ил-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион, бесцветное твердое вещество, 61%.
ВЭЖХ Время удерж. (Rt) = 3,4 мин, m/z [M+H]+ = 526
Пример 15
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-(3-гидроксиазетидин-1-ил)-2-оксоэтил)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион, бесцветное твердое вещество, 45%
ВЭЖХ Время удерж. (Rt) = 3,2 мин, m/z [M+H]+ = 512
(Азетидин-3-ол получают способом S.S.Chatterjee и D.J Triggle; J. Chem. Soc. Chem. Comm. (2) 93 (1968)).
Пример 16
(3R,6R)-1-[(1R)-2-азетидин-1-ил-1-(2,4-дифторфенил)-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион, бесцветное твердое вещество, 46%.
ВЭЖХ Время удерж. (Rt) = 3,4 мин, m/z [M+H]+ = 496
Пример 17
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксиэтил)-N-метилэтанамид, бесцветное твердое вещество, 59%.
ВЭЖХ Время удерж. (Rt) = 3,3 мин, m/z [M+H]+ =514
Пример 18
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-[2-(метилсульфонил)этил]этанамид, бесцветное твердое вещество, 22%.
ВЭЖХ Время удерж. (Rt) = 3,2 мин, m/z [M+H]+ = 576.
Пример 19
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-(2,2,2-трифторэтил)этанамид, бесцветное твердое вещество, 11%.
ВЭЖХ Время удерж. (Rt) = 3,5 мин, m/z [M+H]+ = 552
(2,2,2-трифторэтилметиламин гидрохлорид получают способом E.R.Bissell и M.Finger; J. Org. Chem., 24, 1256-1259 (1959))
Пример 20
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-(пиридин-2-илметил)этанамид, рыжевато-коричневая пена, 19%.
ВЭЖХ Время удерж. (Rt) = 3,5 мин, m/z [M+H]+ = 561
Пример 21
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метокси-N-метилэтанамид
ВЭЖХ Время удерж. (Rt) = 3,4 мин, m/z [M+H]+ = 500
Пример 22
(2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этановая кислота
Карбонилдиимидазол (1,42 г, 1,6 экв.) суспендируют в безводном дихлорметане (10 мл) и суспензию оставляют при комнатной температуре на 15 мин. Затем добавляют (2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (3,00 г) и полученный раствор перемешивают при комнатной температуре в течение 16 час. Полученный желтый раствор далее выпаривают при пониженном давлении и остаток обрабатывают смесью 1:l (об./об.) вода/ацетон (10 мл). Данную смесь перемешивают в течение 2 час, затем ацетон удаляют при пониженном давлении и остаток распределяют между дихлорметаном и 0,1M водной HCl. Органическую фазу отделяют, применяя гидрофобную фритту, затем выпаривают до меньшего объема и очищают хроматографически на системе Biotage Quad 3 (колонка с 90 г диоксида кремния), элюируют смесью 1:l (об./об.) этилацетат:циклогексан, затем этилацетатом, затем смесью 1:1 (об./об.) этилацетат/метанол, получая смесь диастереомеров (2,61 г). Их разделяют на хиральной колонке с обращенной фазой (Chiralcel OD, элюируют смесью 15% пропан-2-ол/гептан, содержащей 0,1% ТФУ), получая: (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этановую кислоту (1,60 г)
ВЭЖХ Время удерж. (Rt) = 3,4 мин, m/z [M+H]+ = 457
Пример 23
Метил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат
Карбонилдиимидазол (0,324 г, 1,6 экв.) суспендируют в безводном дихлорметане (4 мл) и суспензию оставляют при комнатной температуре на 15 мин. Затем добавляют (2RS)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (0,800 г) при перемешивании и полученный раствор оставляют при комнатной температуре на 16 час. Затем смесь обрабатывают метанолом (10 мл) и оставляют при комнатной температуре на ночь. Растворители удаляют при пониженном давлении и остаток очищают методом препаративной хроматографии на пластинах с диоксидом кремния (пластины 20×20 см × 4 элюируют смесью 1:3 этилацетат:циклогексан × 5), получая метил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат (0,453 г, 66%).
ВЭЖХ Время удерж. (Rt) = 3,42 мин, m/z [M+H]+ = 471.
Аналогично получают:
Пример 24
Пропил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат
ВЭЖХ Время удерж. (Rt) = 3,71 мин, m/z [M+H]+ = 499
Пример 25
1-(ацетилокси)этил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат
(2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этановую кислоту (пример 22) (0,130 г) перемешивают в безводном ДМФА (1 мл) и добавляют безводный карбонат калия (0,020 г, 0,5 экв.). Смесь перемешивают при комнатной температуре в течение 1 час, затем охлаждают до -10°C (баня лед-соль). Гетерогенную смесь обрабатывают 1-бромэтилацетатом (0,120 мл, избыток) и перемешивают в течение 3,5 час, поддерживая температуру бани между -10 и -5°C. Затем реакционную смесь распределяют между ДХМ и 1M водной HCl (20 мл каждого). Органическую фазу отделяют (гидрофобная фритта) и выпаривают при пониженном давлении, получая пурпурную смолу; ее очищают на картридже SPE (5 г диоксида кремния, элюируют (i) циклогексаном ×2, (ii) ДХМ ×2, (iii) диэтиловым эфиром ×2, (iv) этилацетатом ×2, (v) метанолом ×2, получая 1-(ацетилокси)этил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат (0,081 г) в виде желтой пены.
ВЭЖХ Время удерж. (Rt) = 3,5 мин, m/z [M+H]+ = 543.
Аналогично получают
Приведенные в таблице 1 примеры 26, 54-55, 66-104, 107-117, 124-131 получают способом 1. Трет-бутиловый эфир примера 39 получают путем трансэтерификации, катализируемой перхлорной кислотой, соответствующей кислоты (пример 22) трет-бутилацетатом по методике T. Kolasa и M. J. Miller, Journal of Organic Chemistry (1990), 55(6), 1711-21. Другие примеры, приведенные в таблице 1, получают способом 5.
Таблица 1
№
/мин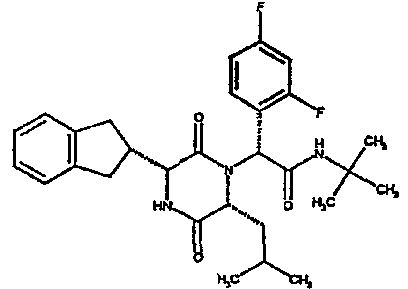
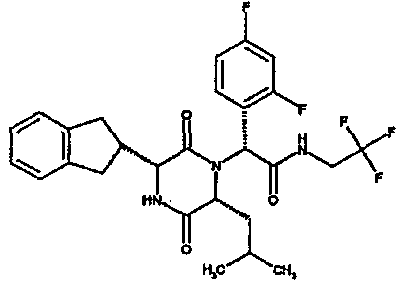
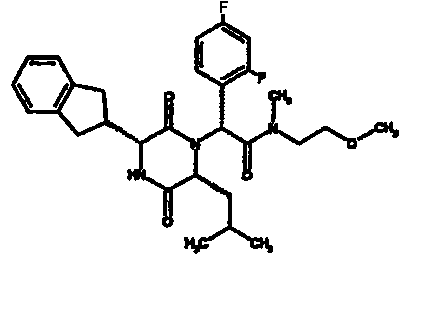
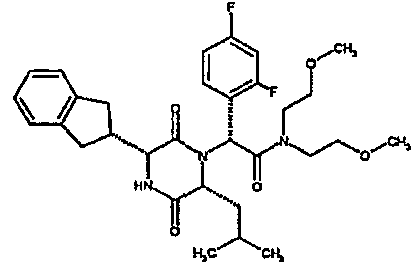
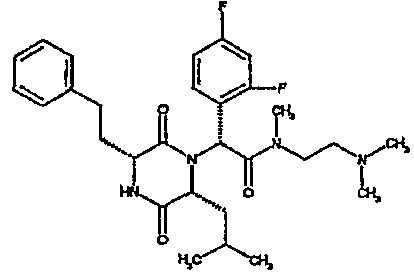
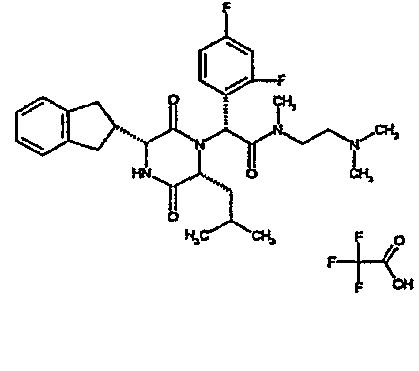
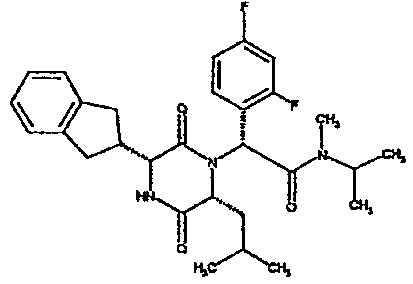
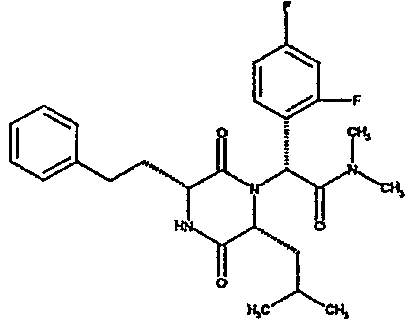
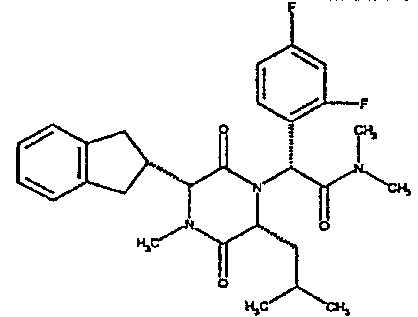
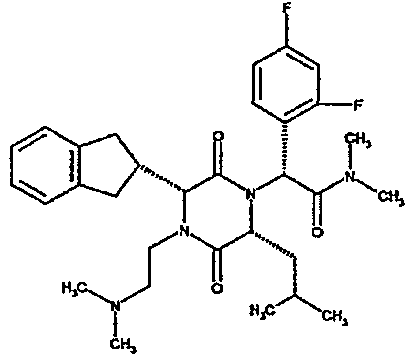
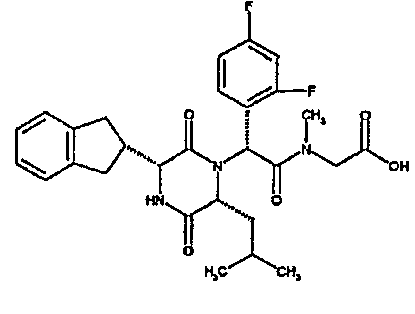
уксусная кислота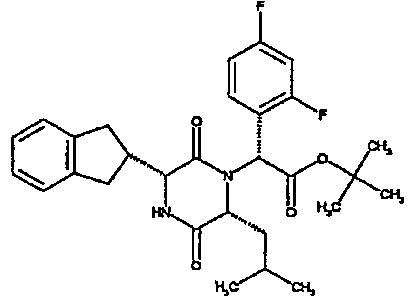
диоксопиперазин-1-ил]этаноат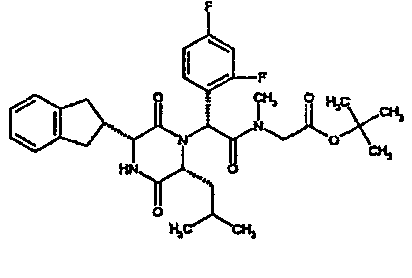
диоксопиперазин-l-ил]этаноил}(метил)амино]
ацетат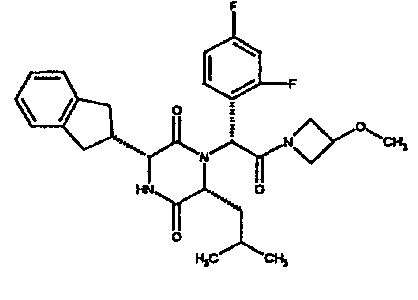
изобутилпиперазин-2,5-дион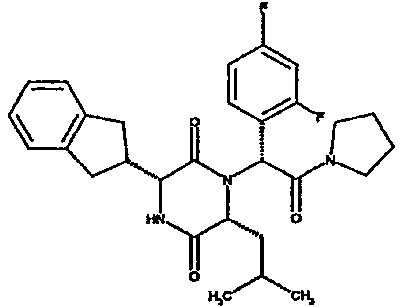
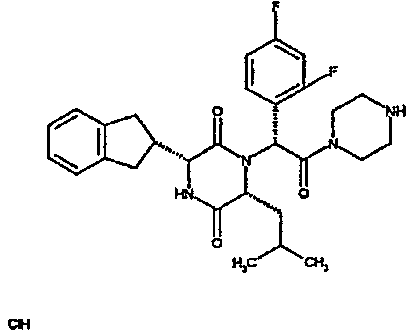
пиперазин-1-илэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-диона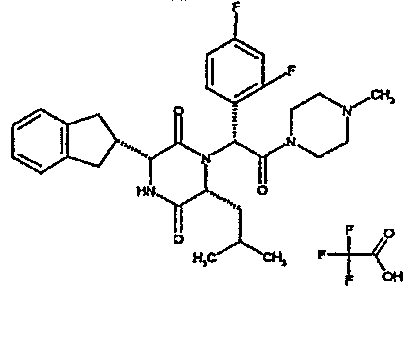
изобутилпиперазин-2,5-дион трифторацетат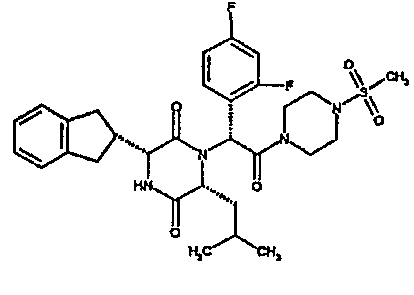
изобутилпиперазин-2,5-дион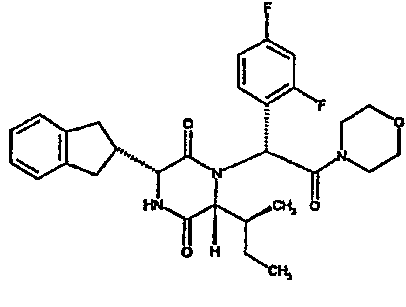
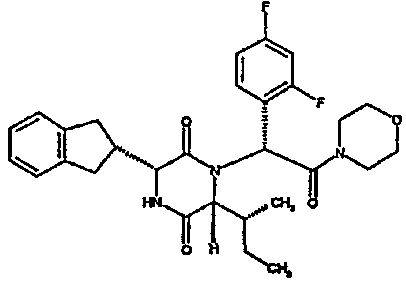
изобутилпиперазин-2,5-дион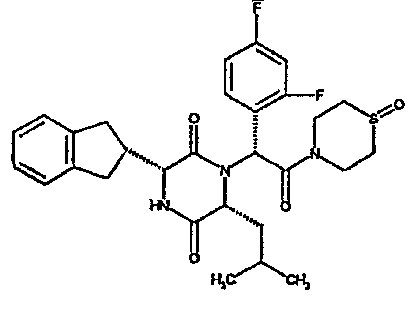
изобутилпиперазин-2,5-дион
этанамид
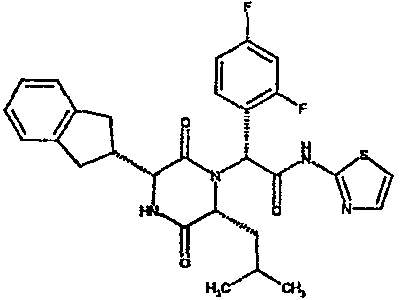
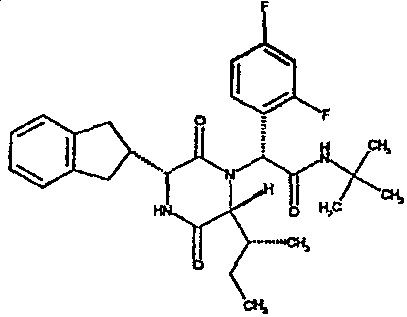
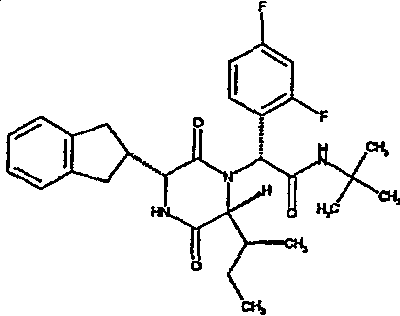
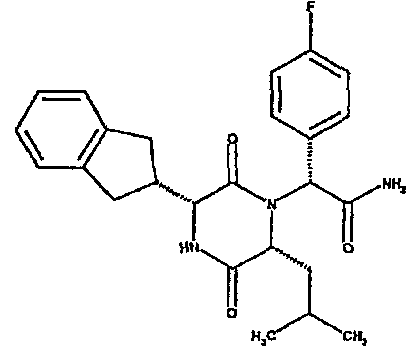
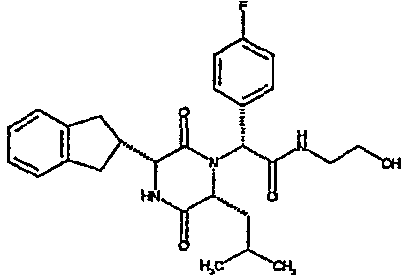
амино]уксусная кислота
диоксопиперазин-1-ил]-2-(4-фторфенил)этаноил]амино}
ацетат
дион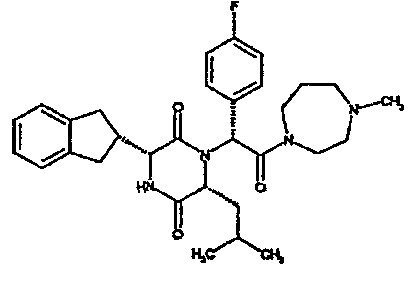
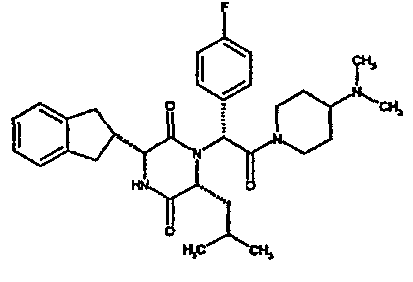
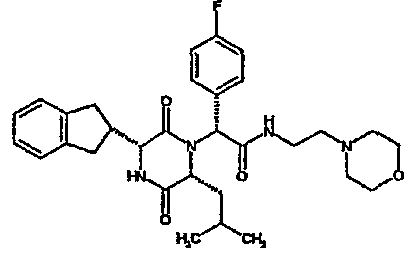
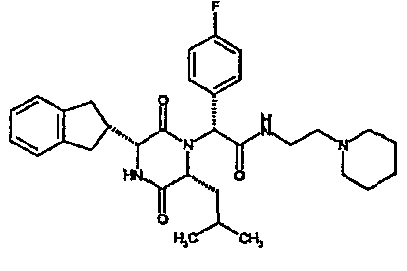
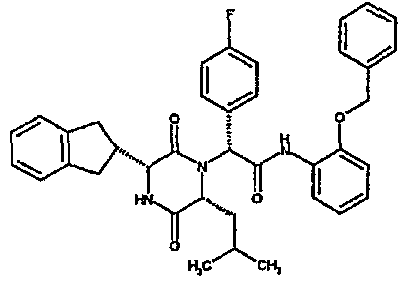
Аналогично получают:
№
/мин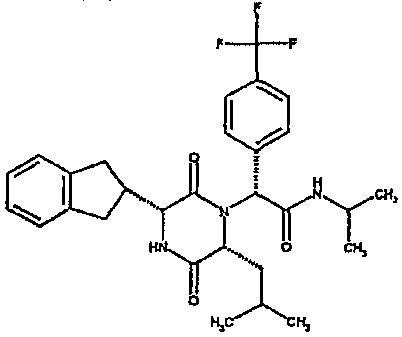
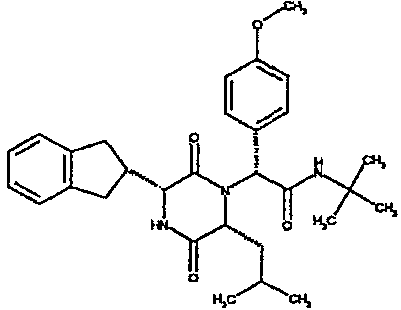
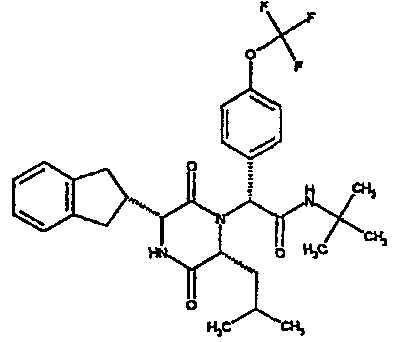
этанамид
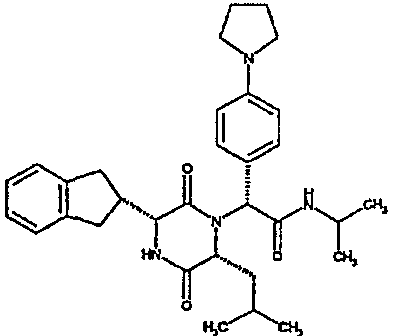
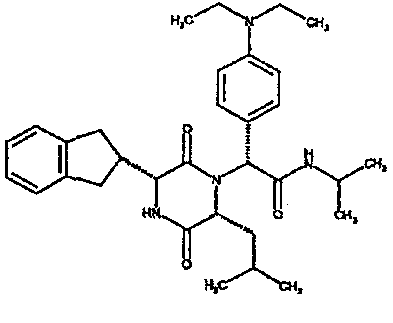
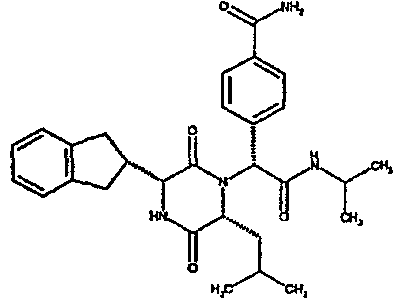
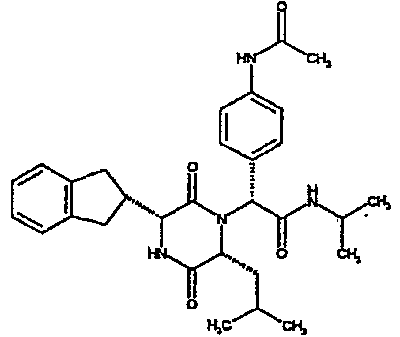
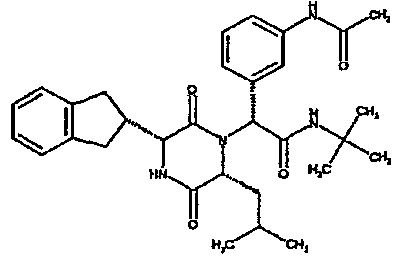
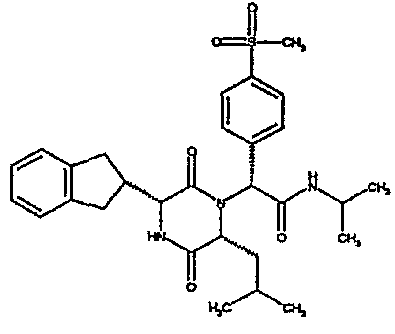
этанамид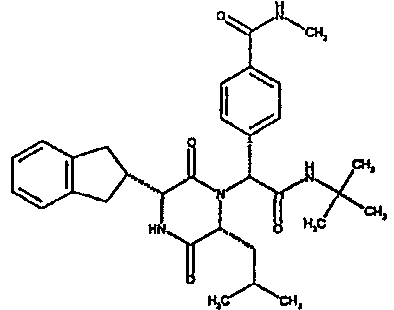

фенил}этанамид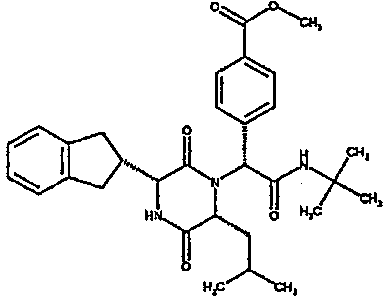
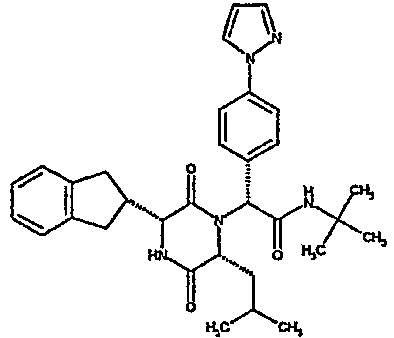
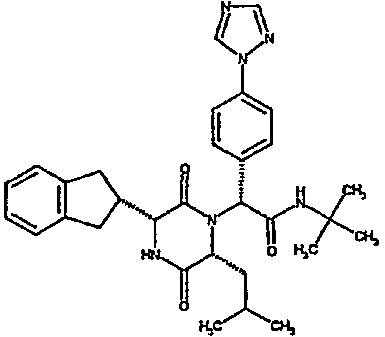
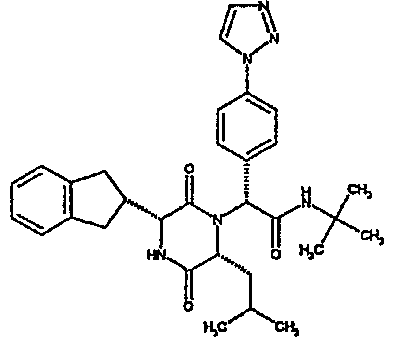
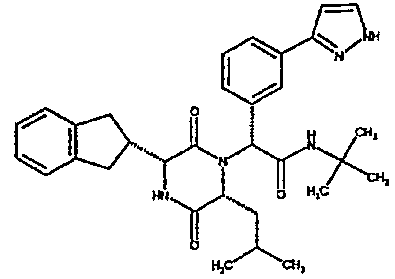
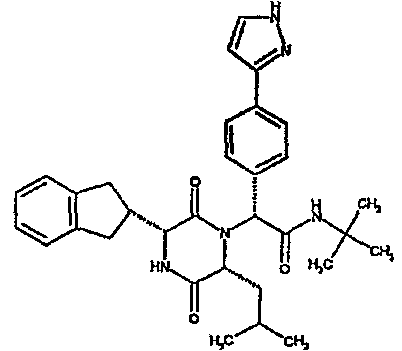
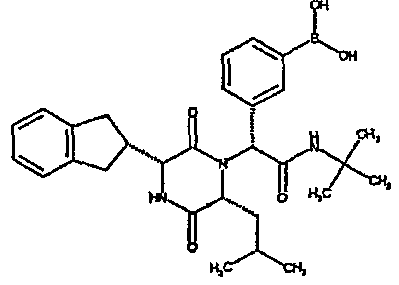
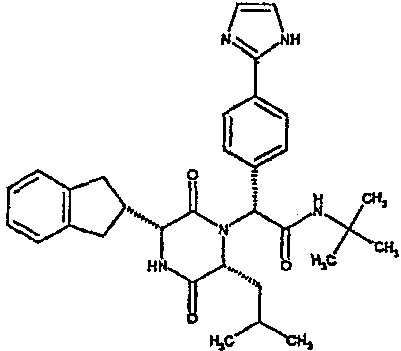
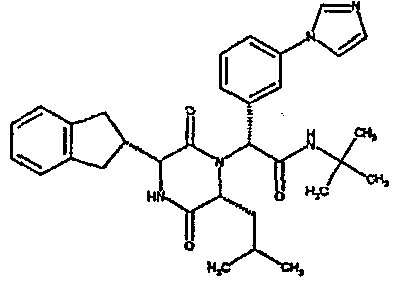
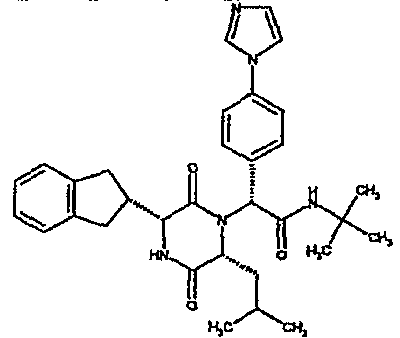
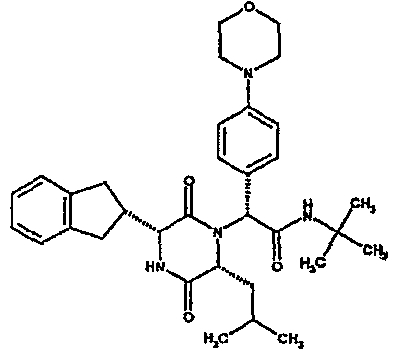
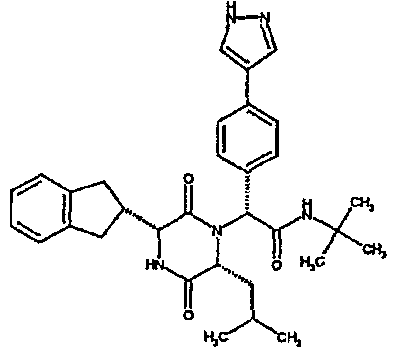
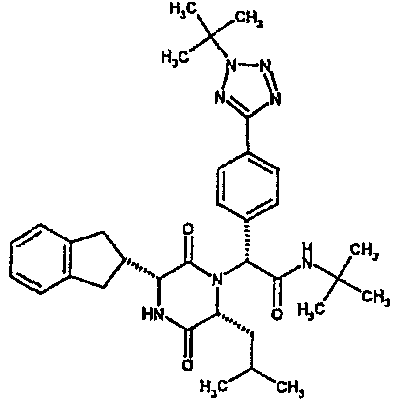
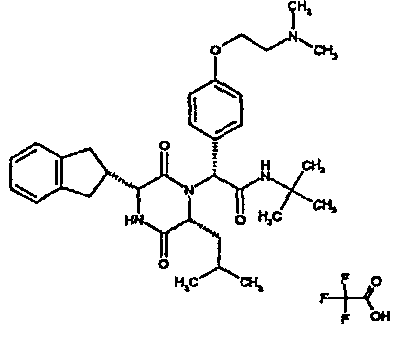
фенил}этанамид трифторацетат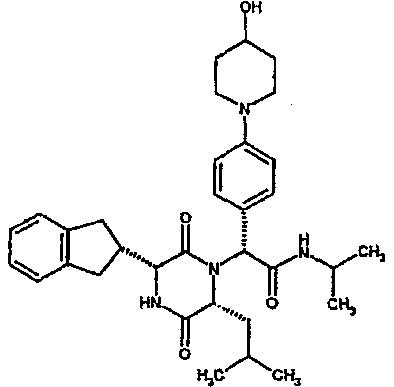
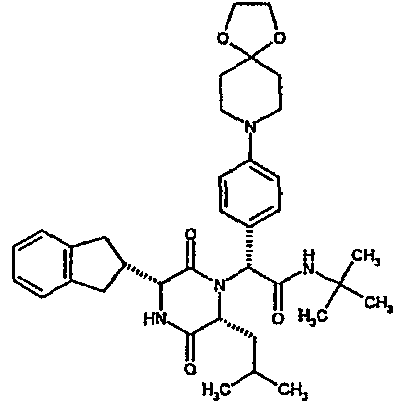
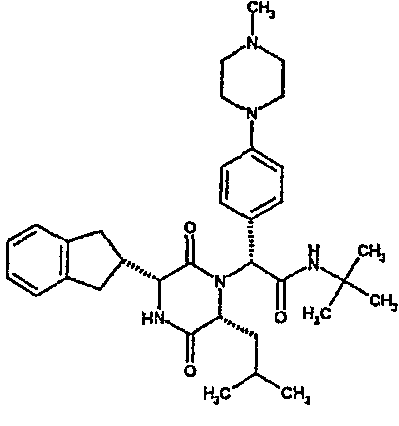
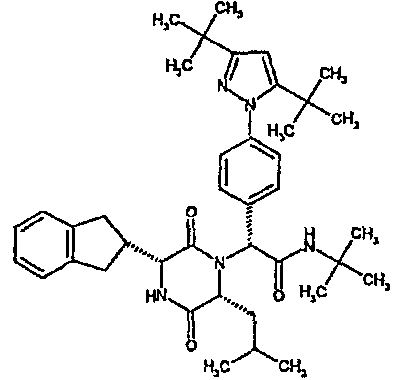
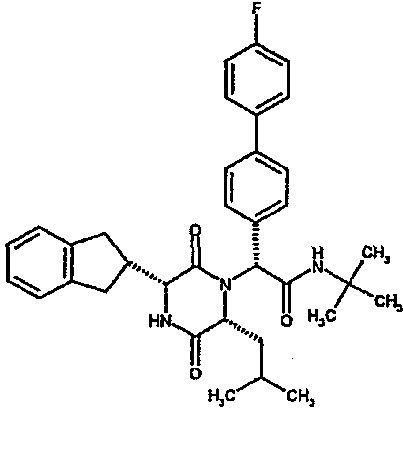
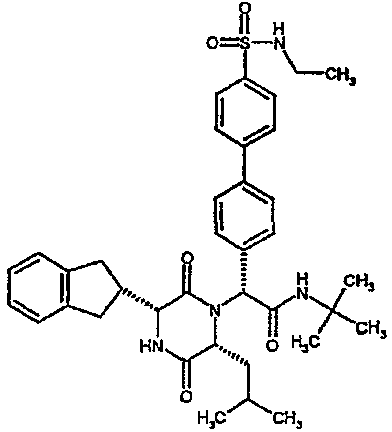
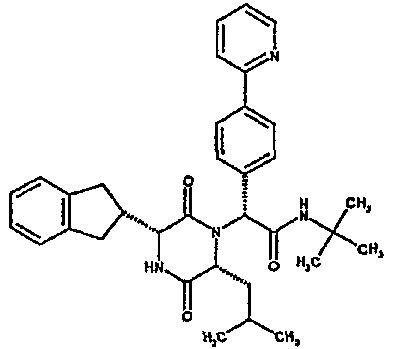
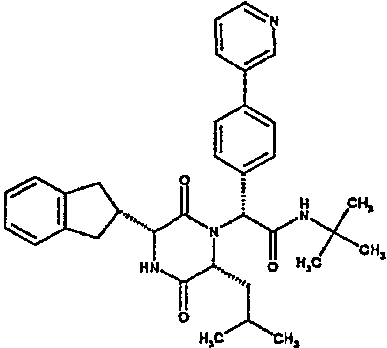
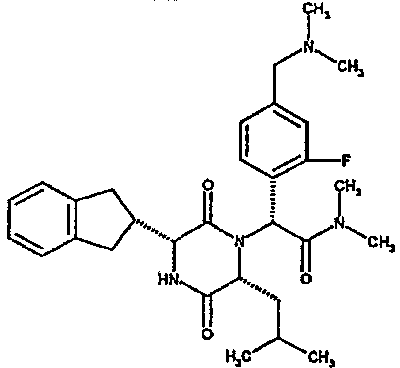
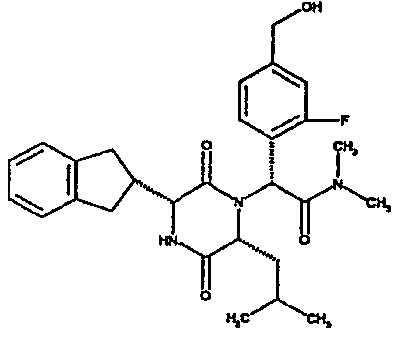
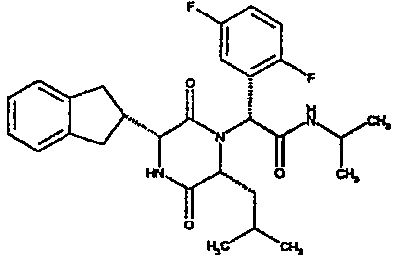
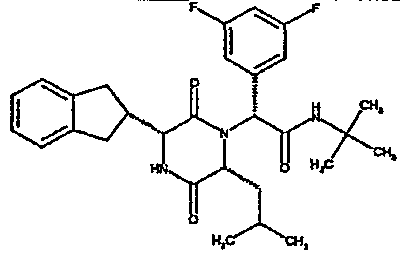
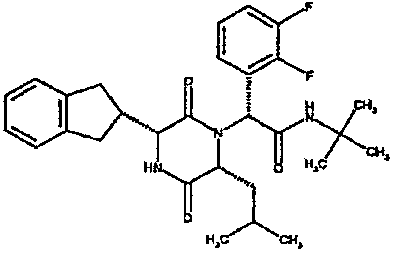
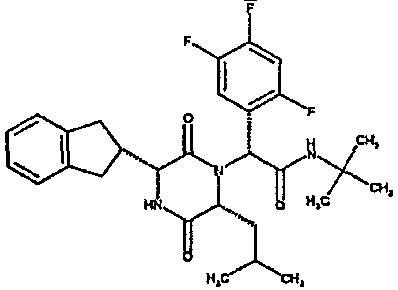
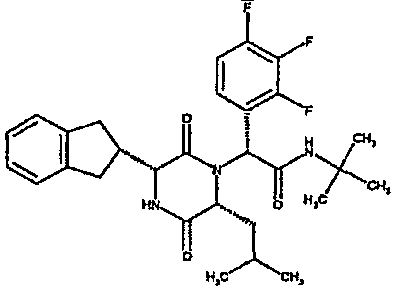
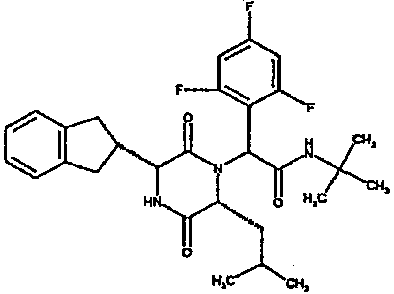
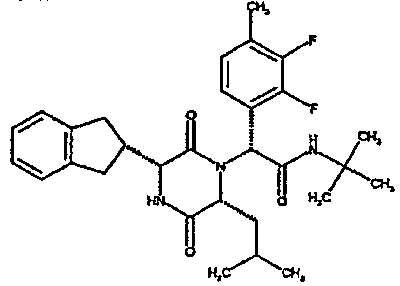
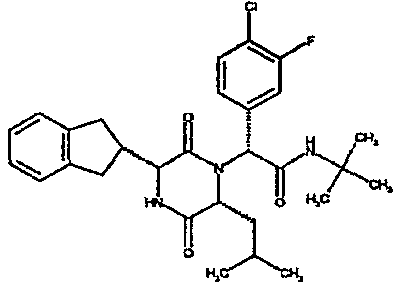
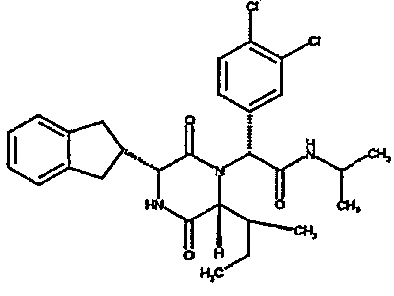
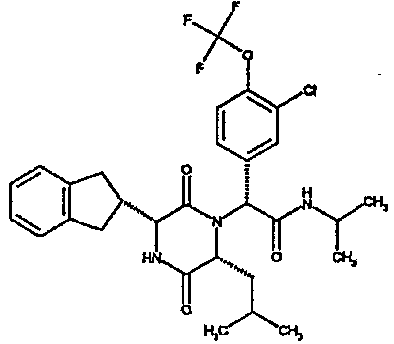
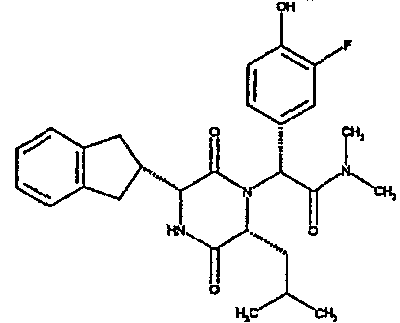
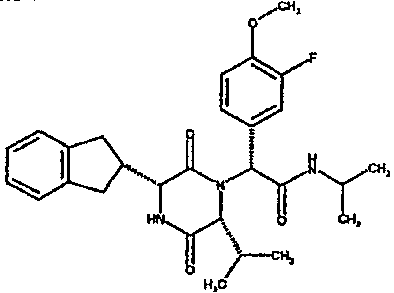
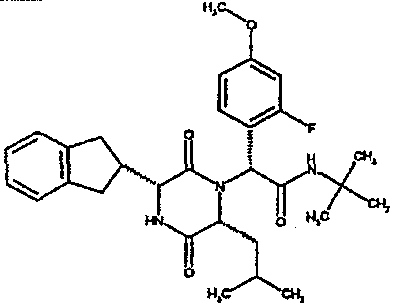
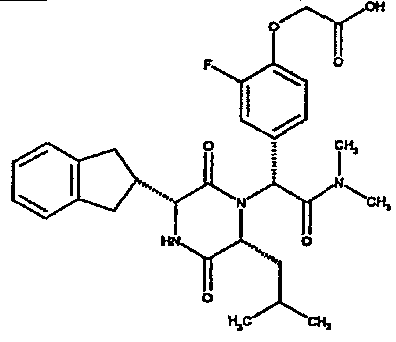
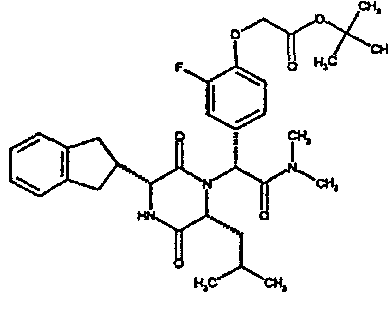
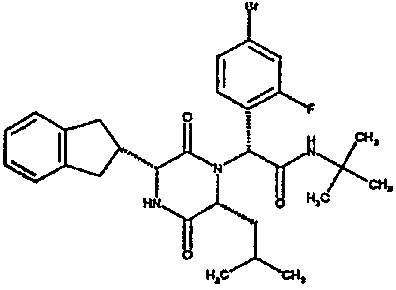
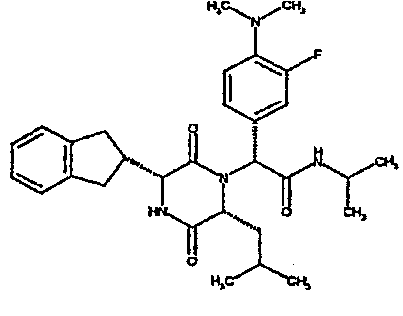
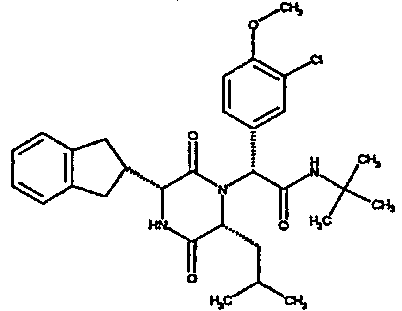
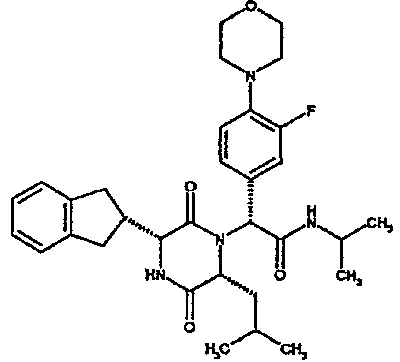
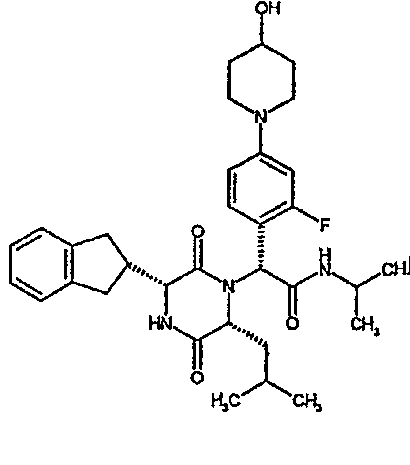
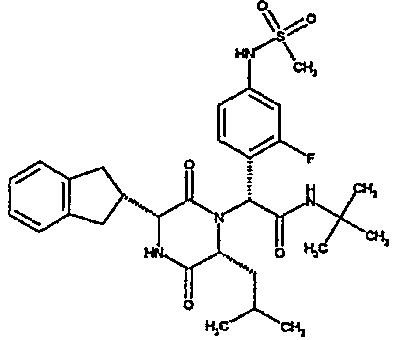
амино]фенил}этанамид
Гидроксилированные метаболиты (2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамида получают следующим образом:
Используют 2 л развивающихся клеточных культур Streptomyces rimosus BS33 для биотрансформации GW796679Х. Через 3 дня культивирования добавляют 500 мг GW796679X и через 5 дней инкубации собирают урожай клеток в питательном бульоне. В собранные клетки добавляют 2 л метанола, затем удаляют клетки центрифугированием. Удаляют метанол из супернатанта выпариванием. Затем экстрагируют соединения этилацетатом, выпаривают досуха и очищают методом препаративной ВЭЖХ, получая примеры 132, 133, 134 и 135 (см. табл.2).
Таблица 2
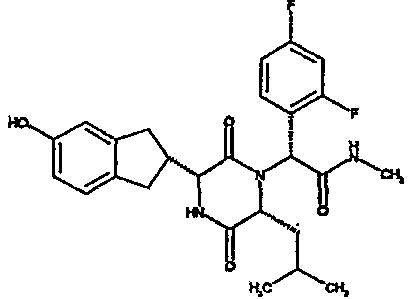
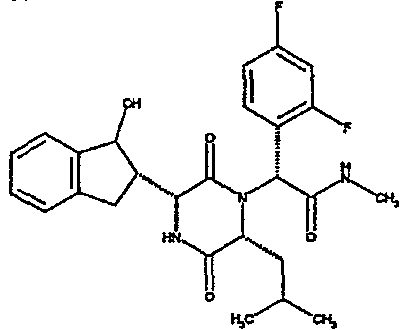
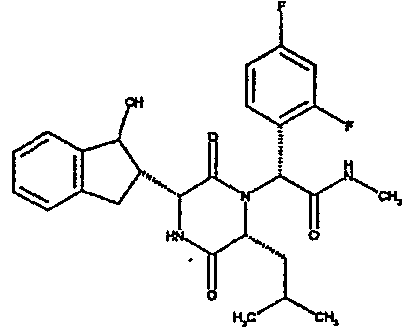
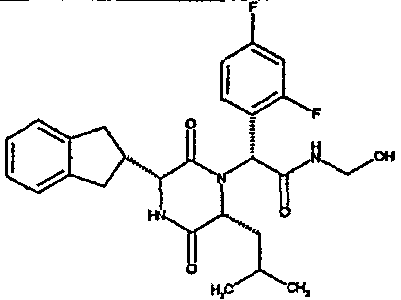
Пример 136
(2R)-2-(1-бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид
Бензофуран-5-карбоксальдегид (215 мг, 1,47 ммоль) и гидрохлорид трет-бутилового эфира D-лейцина (329 мг, 1,47 ммоль) растворяют в метаноле (1,5 мл) и добавляют триэтиламин (0,205 мл, 1,47 ммоль). Смесь (светло-желтый раствор) оставляют стоять при комнатной температуре в течение ночи (23,5 час). Затем добавляют Boc-D-инданилглицин (429 мг, 1,47 ммоль), а затем изопропилизонитрил (0,138 мл, 1,51 ммоль). Смесь (желтый раствор) оставляют стоять при комнатной температуре в течение ночи (23,5 час) перед выпариванием растворителя при пониженном давлении с получением желтой смолы. Данную смолу растворяют в 4M хлористом водороде в диоксане (3 мл, 12 ммоль) и оставляют стоять при комнатной температуре в течение 7,5 час перед выпариванием при пониженном давлении с получением оранжево-коричневой смолы. Смолу растворяют в метаноле (2 мл) и добавляют 4M хлористый водород в диоксане (1 мл, 4 ммоль). Данную смесь оставляют стоять при комнатной температуре на 5,5 час перед удалением растворителя выпариванием при пониженном давлении. Остаток растворяют в дихлорметане (4 мл) и добавляют триэтиламин (0,5 мл, избыток). Смесь перемешивают при комнатной температуре в течение ночи (18,3 час) перед удалением растворителя выпариванием при пониженном давлении. Остаток в дихлорметане загружают на колонку SPE (10 г диоксида кремния, картридж Mega Bond Elut, предварительно элюированный циклогексаном). Колонку элюируют постадийно (каждая стадия 40-45 мл) 100% хлороформом, смесью 3:1 циклогексан:диэтиловый эфир, смесью 1:1 циклогексан:диэтиловый эфир, смесью 1:3 циклогексан:диэтиловый эфир, 100% диэтиловый эфир, смесью 1:1 циклогексан:этилацетат, смесью 1:2 циклогексан:этилацетат и 100% этилацетатом. Фракции от "1:3 циклогексан:диэтиловый эфир" до "1:2 циклогексан:этилацетат" включительно объединяют, получая светло-желтое твердое вещество (336 мг). Данное твердое вещество в дихлорметане загружают на 6 пластин для препаративной хроматографии (пластины с силикагелем 60, 20×20 см). Пластины элюируют четыре раза смесью 30:1 дихлорметан:изопропанол. Необходимые полосы экстрагируют смесью 9:1 этилацетат:метанол, получая (2R)-2-(1-бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид в виде белого твердого вещества (141 мг, 0,28 ммоль).
ВЭЖХ Время удерж. (Rt) = 3,46 мин; m/z [M+H]+ = 502.
1H ЯМР δ: 7,95 (д, 1H), 7,73 (д, 1H), 7,68 (д, 1H), 7,53 (д, 1H), 7,37 (дд, 1H), 7,16 (м, 4H), 6,79 (д, 1H), 5,79 (д, 1H), 5,37 (с, 1H), 4,11 (м, 1H), 4,03 (ушир. дд, 1H), 3,99 (дд, 1H), 3,16-2,97 (м, 3H), 2,95-2,78,(м, 2H), 1,79(м, 1H), 1,69 (м, 1H), 1,33 (м, 1H), 1,09 (т, 6H), 0,78 (д, 3H), 0,67 (д, 3H),
Аналогично получают:
Пример 137
(2R)-2-(1,2,3-бензотиадиазол-6-ил)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид
ВЭЖХ Время удерж. (Rt) = 3,50 мин; m/z [M+H]+ = 534.
1H ЯМР δ: 8,66 (д, 1H), 7,82 (д, 1H), 7,67 (дд, 1H), 7,20 (м, 4H), 6,72 (ушир. д, 1H), 6,13 (с, 1H), 5,19 (с, 1H), 4,06 (ушир. дд, 1H), 4,00 (дд, 1H), 3,18 (м, 1H), 3,07 (м, 2H), 2,92 (м, 1H), 2,81 (м, 1H), 1,86 (м, 1H), 1,80 (м, 1H), 1,54 (м, 1H), 1,36 (с, 9H), 0,85 (д, 3H), 0,78 (д, 3H),
Пример 138
(2R)-2-(2,3-дигидро-1-бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,S-диоксопиперазин-1-ил]-N-изопропилэтанамид
ВЭЖХ Время удерж. (Rt) = 3,34 мин; m/z [M+H]+ = 504.
1H ЯМР δ: 7,81 (ушир. с, 1H), 7,18 (м, 5H), 6,79 (д, 1H), 6,44 (ушир. д, 1H), 5,50 (д, 1H), 5,06 (с, 1H), 4,61 (т, 2H), 4,08 (м, 1H), 3,96 (м, 2H), 3,22 (т, 2H), 3,15 (м, 1H), 3,07 (д, 2H), 2,90 (м, 1H), 2,79 (дд, 1H), 1,82 (м, 1H), 1,71 (м, 1H), 1,42 (м, 1H), 1,12 (дд, 6H), 0,83 (д, 3H), 0,77 (д, 3H).
Пример 139
(2R)-2-(1,3-бензодиоксол-5-ил)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид
ВЭЖХ Время удерж. (Rt) = 3,48 мин; m/z [M+H]+ = 520.
1H ЯМР (CDCl3): δ 7,21 (м, 2H), 7,16 (м, 2H), 6,97 (д, 1H), 6,88 (дд, 1H), 6,82 (д, 1H), 6,58 (м, 1H), 6,06 (м, 2H), 5,64 (с, 1H), 5,02 (м, 1H), 3,95 (м, 2H), 3,16 (м, 1H), 3,07 (м, 2H), 2,89 (м, 1H), 2,77 (м, 1H), 1,82 (м, 1H), 1,71 (м, 1H), 1,41 (м, 1H), 1,32 (с, 9H), 0,83 (д, 3H), 0,79 (д, 3H)
Пример 140
(2R)-2-(бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
Метил N-[(1R)-2-{[2-(бензилокси)фенил]амино}-1-(бензофуран-5-ил)-2-оксоэтил]-L-лейцинат
К суспензии L-лейцина (2,62 г) в метаноле (250 мл) при -30°C под азотом добавляют раствор бензофуран-5-карбальдегида (2,92 г) в метаноле (15 мл) и суспензию 2-бензилоксифенилизонитрила (4,19 г) в метаноле (15 мл). Реакционную смесь перемешивают при -30°C в течение 2 час, дают нагреться до комнатной температуры и перемешивают еще в течение 3 дней. Растворитель удаляют в вакуумеиостаток пропускают через колонку Biotage™ (3 Ч 90 г), элюируя смесью циклогексан:этилацетат (5:1) и получая после выпаривания подходящих фракций метил N-[(1R)-2-{[2(бензилокси)фенил]амино}-1-(бензофуран-5-ил)-2-оксоэтил]-L-лейцинат (5,11 г).
ВЭЖХ Время удерж. (Rt) = 3,97 мин, m/z [M+H]+ = 499.
Метил N-{(1R)-1-(бензофуран-5-ил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-L-лейцинат
Смесь палладия на угле (10%, 500 мг), метил N-[(1R)-2-{[2-(бензилокси)фенил]амино}-1-(бензофуран-5-ил)-2-оксоэтил]-L-лейцината (5,1 г) и этилацетата (60 мл) перемешивают в атмосфере водорода в течение 5 час. Далее реакционную смесь фильтруют через целит и промывают набивку фильтра дополнительными порциями этилацетата. Объединенные органические фракции выпаривают, получая метил N-{(1R)-1-(бензофуран-5-ил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-L-лейцинат (3,429 г).
ВЭЖХ Время удерж. (Rt) = 3,49 мин, m/z [M+H]+ = 411
Метил N-[1-(бензофуран-5-ил)-2-(диметиламино)-2-оксоэтил]-L-лейцинат
Раствор метил N-{(1R)-1-(бензофуран-5-ил)-2-[(2-гидроксифенил)амино]-2-оксоэтил}-L-лейцината (410 мг) и 1,1'-тиокарбонилдиимидазола (196 мг) в дихлорметане (5 мл) оставляют стоять на 18 час. Добавляют к реакционной смеси воду (20 мл) и быстро перемешивают в течение 30 мин. После этого добавляют 1H-бензотриазолий, 1-[бис(диметиламино)метилен]-, тетрафторборат(1-), 3-оксид (TBTU, 710 мг) и раствор диметиламина в тетрагидрофуране (3 мл 2M раствора). Реакционную смесь перемешивают еще в течение 18 час и затем пропускают вниз по SPE (5 г диоксида кремния), элюируя с градиентом (смесью циклогексан:этилацетат от 3:1 до 1:2). Необходимые фракции объединяют и выпаривают, получая метил N-[1-(бензофуран-5-ил)-2-(диметиламино)-2-оксоэтил]-L-лейцинат (140 мг).
ВЭЖХ Время удерж. (Rt) = 2,70 мин m/z [M+H]+ = 347
N-[1-(бензофуран-5-ил)-2-(диметиламино)-2-оксоэтил]-L-лейцин
К раствору метил N-[1-(бензофуран-5-ил)-2-(диметиламино)-2-оксоэтил]-L-лейцината (520 мг) в метаноле (5 мл) добавляют раствор гидроксида лития (91 мг) в воде (3 мл). После интенсивного перемешивания в течение 24 час растворитель удаляют в вакууме. Остаток разбавляют водой (10 мл) и затем нейтрализуют 2N соляной кислотой. Данный раствор вносят в картриджи Oasis™ (2Ч6 г) и элюируют водой (×2) и метанолом (×2). Необходимые фракции объединяют и выпаривают, получая N-[1-(бензофуран-5-ил)-2-(диметиламино)-2-оксоэтил]-L-лейцин (478 мг).
ВЭЖХ Время удерж. (Rt) = 2,27 мин m/z [M+H]+ = 333.
(2R)-2-(бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
К раствору (2R)-[(трет-бутоксикарбонил)амино](2,3-дигидро-1H-инден-2-ил)этановой кислоты (419 мг) в сухом тетрагидрофуране (5 мл) при -20°C в атмосфере азота добавляют N-метилморфолин (158 мкл) и раствор изопропилхлорформиата в толуоле (1,0M, 1,44 мл). Через 10 мин добавляют раствор N-[1-(бензофуран-5-ил)-2-(диметиламино)-2-оксоэтил]-L-лейцина (478 мг) в диметилформамиде (5 мл) и дают реакционной смеси нагреться до комнатной температуры. Через 20 час растворитель удаляют в вакуумеиостаток растворяют в 4N соляной кислоте в диоксане (4 мл). Через 4 час добавляют метанол (13 мл) и реакционную смесь оставляют стоять еще на 18 час. Затем удаляют растворитель в вакуумеиостаток делят между дихлорметаном и насыщенным раствором бикарбоната натрия. Органические фазы выпаривают в вакуумеиостаток вносят в SPE (10 г диоксида кремния). Продукт элюируют, применяя градиент смеси этилацетат:метанол (от 3:1 до 1:3) и получая (2R)-2-(бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид (51 мг).
ВЭЖХ Время удерж. (Rt) = 3,36 мин, m/z [M+H]+ = 488
1H ЯМР (D6-ДМСО) δ: 8,47 (д, 1H), 8,07 (д, 1H), 7,71 (м, 1H), 7,69 (д, 1H), 7,38 (дд, 1H), 7,21 (м, 2H), 7,12 (м, 2H), 7,03 (м, 1H), 6,47 (с, 1H), 3,88 (м, 1H), 3,69 (дд, 1H), 3,07-2,67 (м, 5H), 2,87 (с, 3H), 2,77 (с, 3H), 1,40-1,70 (м, 2H), 0,46 (м, 1H), 0,42 (д, 3H), 0,02 (д, 3H)
Пример 141
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(2-метил-1-бензофуран-5-ил)этанамид
(2RS)-2-(2-метил-1-бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид
Смесь 2-метил-5-формилбензофурана (1,26 г), гидрохлорида метилового эфира (D)-лейцина (1,57 г), триэтиламина (1,2 мл) и метанола (20 мл) перемешивают при комнатной температуре в течение 6 час и оставляют стоять на 19 час. Затем последовательно добавляют N-бензилкарбонил-(D)-инданилглицин (2,80 г) и 2-бензилоксифенилизоцианид (1,89 г) и смесь перемешивают в течение 2 дней. Реакционную смесь концентрируют при пониженном давлении и разбавляют этилацетатом. Данную смесь промывают 1N соляной кислотой, насыщенным раствором бикарбоната натрия и насыщенным раствором соли. Органические фазы сушат над MgSO4 и концентрируют в вакууме. Остаток разбавляют этилацетатом (100 мл) и уксусной кислотой (10 мл) и гидрируют при атмосферном давлении на 10% палладии на активированном угле (1,5 г). Через 4 час катализатор удаляют фильтрованием через слой целита и промывают смесью дихлорметан/метанол (500 мл смеси 1:1 об./об.). Фильтрат и смывы объединяют, выпаривают при пониженном давлении. Остаток делят между этилацетатом и водой. Органические фазы промывают водой, насыщенным раствором бикарбоната натрия и насыщенным раствором соли. Органические фазы сушат над MgSO4 и выпаривают при пониженном давлении. Остаток вносят в картридж с диоксидом кремния (100 г) и элюируют смесью циклогексан/этилацетат (500 мл 3:1, 2:1, 1:1 об./об.) и этилацетатом (500 мл). Необходимые фракции объединяют и выпаривают в вакууме, получая (2RS)-2-(2-метилбензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (1,58 г).
ВЭЖХ Время удерж. (Rt) = 3,60 мин; m/z [M+H]+ = 566.
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(2-метил-1-бензофуран-5-ил)этанамид
Карбонилдиимидазол (92 мг, 1,6 экв.) суспендируют в безводном дихлорметане (5 мл) и суспензию оставляют при комнатной температуре на 15 мин. Затем добавляют (2RS)-2-(2-метилбензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (200 мг) и смесь перемешивают при комнатной температуре в течение 5 час. Полученный коричневый раствор обрабатывают 2,0M раствором диметиламина в тетрагидрофуране (1,06 мл, 6 экв.), полученную смесь перемешивают 30 мин и затем оставляют стоять при комнатной температуре на 18 час. Реакционную смесь разбавляют дихлорметаном (2 мл) и промывают 1M соляной кислотой (2 мл). Органические фазы отделяют, используя гидрофобную фритту, и выпаривают при пониженном давлении, получая коричневую смолу. Сырой продукт вносят в картридж с диоксидом кремния (10 г). Реакционную смесь элюируют циклогексаном (100 мл), смесью циклогексан/этилацетат (100 мл 2:1, 3:2, 1:1, 2:3 и 1:2 об./об.), этилацетатом (200 мл) и смесью этилацетат/метанол (100 мл 19:1 об./об.). Необходимые фракции объединяют и выпаривают в вакууме, получая (2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(2-метил-1-бензофуран-5-ил)этанамид в виде не совсем белого твердого вещества (88 мг).
ВЭЖХ Время удерж. (Rt) = 3,40 мин; m/z [M+H]+ = 502.
1H ЯМР (CDCl3) δ: 7,52 (д, 1H), 7,43 (д, 1H), 7,27-7,13 (м, 5H), 6,54 (с, 1H), 6,38 (м, 1H), 6,31 (д, 1H), 4,24 (м, 1H), 3,99 (дд, 1H), 3,22-3,05 (м, 3H), 2,99 (с, 3H), 2,86 (м, 1H), 2,82 (с, 3H), 2,75 (м, 1H), 2,48 (м, 3H), 1,45 (м, 1H), 1,36 (м, 1H), 0,57 (м, 1H), 0,51 (д, 3H), 0,19 (д, 3H).
Аналогично получают:
Пример 142
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-(2-метил-1-бензофуран-5-ил)этанамид
ВЭЖХ Время удерж. (Rt) = 3,40 мин; m/z [M+H]+ = 516.
1H ЯМР (CDCl3) δ: 7,57 (м, 1H), 7,41 (д, 1H), 7,28-7,11 (м, 5H), 6,61 (м, 1H), 6,37 (м, 1H), 5,49 (д, 1H), 5,23 (с, 1H), 4,11 (м, 1H), 4,02-3,93 (м, 2H), 3,19-3,05 (м, 3H), 2,92 (м, 1H), 2,77 (м, 1H), 2,48 (м, 3H), 1,79 (м, 1H), 1,70 (м, 1H), 1,38 (м, 1H), 1,10 (м, 6H), 0,78 (д, 3H), 0,69 (д, 3H).
Пример 143
(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-1-[(1R)-1-(2-метил-1-бензофуран-5-ил)-2-морфолин-4-ил-2-оксоэтил]пиперазин-2,5-дион
ВЭЖХ Время удерж. (Rt) = 3,38 мин; m/z [M+H]+ = 544.
1H ЯМР (CDCl3) δ: 7,51 (д, 1H), 7,45 (д, 1H), 7,26-7,14 (м, 5H), 6,57 (с, 1H), 6,39 (м, 1H), 6,34 (м, 1H), 4,20 (м, 1H), 3,99 (м, 1H), 3,73-3,33 (6H), 3,22-3,03 (м, 5H), 2,88 (м, 1H), 2,75 (м, 1H), 2,49 (м, 3H), 1,45 (м, 1H), 1,37 (м, 1H), 0,54 (м, 1H), 0,51 (д, 3H), 0,20 (д, 3H).
Пример 144
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(2-фтор-1-бензофуран-5-ил)-N,N-диметилэтанамид
ВЭЖХ Время удерж. (Rt) = 3,39 мин; m/z [M+H]+ = 505.
1H ЯМР (CDCl3) δ: 7,56 (д, 1H), 7,45 (д, 1H), 7,32 (дд, 1H), 7,23 (м, 2H), 7,16 (м, 2H), 6,55 (с, 1H), 6,23 (д, 1H), 5,89 (д, 1H), 4,22 (м, 1H), 3,99 (дд, 1H), 3,21-3,04 (м, 3H), 3,00 (с, 3H), 2,87 (м, 1H), 2,84 (с, 3H), 2,75 (м, 1H), 1,47 (м, 1H), 1,38 (м, 1H), 0,58-0,49 (м, 4H), 0,22 (д, 3H).
5-Бром-2-фтор-1-бензофуран
5-Бромбензофуран-2-карбоновую кислоту (4,68 г) суспендируют в четыреххлористом водороде (150 мл) и воде (50 мл). К данной смеси добавляют бикарбонат натрия (3,36 г), а затем Selectflor (7,1 г) и реакционную смесь быстро перемешивают в течение 20 час. Реакционную смесь разбавляют дихлорметаном и 2N раствором гидроксида натрия. Органические фазы отделяют, промывают насыщенным раствором соли и сушат над безводным MgSO4. Растворитель выпаривают при пониженном давлении и комнатной температуре. Остаток вносят в картридж с диоксидом кремния (20 г) и элюируют диэтиловым эфиром. Это дает 5-бром-2-фтор-1-бензофуран (1,4 г).
1H ЯМР (CDCl3) δ: 7,61 (д, 1H), 7,36 (дд, 1H), 7,26 (д, 1H), 5,84 (дд, 1H).
2-фтор-5-формил-1-бензофуран
Суспензию порошка магния (219 мг) и йода (катализатор) в сухом тетрагидрофуране (3 мл) нагревают при 50°C под азотом в течение 20 мин. 5-Бром-2-фтор-1-бензофуран (1,4 г) растворяют в сухом тетрагидрофуране (6 мл). Порцию данного раствора (1 мл) добавляют к суспензии при 50°C без перемешивания. Через 30 мин медленно добавляют оставшийся раствор и реакционную смесь нагревают при кипении с обратным холодильником в течение 3 час. Реакционную смесь охлаждают на бане лед/вода и добавляют по капле диметилформамид (1 мл), поддерживая температуру ниже 10°C. Через 1 час добавляют смесь 2N соляной кислоты (12,5 мл) и насыщенного раствора соли (12,5 мл). Реакционную смесь экстрагируют, используя этилацетат (3×25 мл). Объединенные органические фазы промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель удаляют в вакууме и остаток вносят в картридж с диоксидом кремния (50 г). Проводят элюирование циклогексаном, смесью циклогексан/этилацетат (6:1, 5:1 об./об.). Это дает 2-фтор-5-формил-1-бензофуран (376 мг).
1H ЯМР (CDCl3) δ: 10,05 (с, 1H), 8,04 (м, 1H), 7,83 (дд, 1H), 7,54 (д, 1H), 6,01 (дд, 1H).
Пример 145
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(2-фтор-1-бензофуран-5-ил)-N-изопропилэтанамид
ВЭЖХ Время удерж. (Rt) = 3,42 мин; m/z [M+H]+ = 520.
1H ЯМР (CDCl3) δ: 7,61 (д, 1H), 7,42 (д, 1H), 7,31 (дд, 1H), 7,21 (м, 2H), 7,16 (м, 2H), 6,70 (д, 1H), 5,89 (д, 1H), 5,57 (д, 1H), 5,18 (с, 1H), 4,11 (м, 1H), 3,98 (м, 2H), 3,16 (м, 1H), 3,08 (м, 2H), 2,91 (м, 1H), 2,78 (м, 1H), 1,82 (м, 1H), 1,73 (м, 1H), 1,41 (м, 1H), 1,12 (д, 3H), 1,10 (д, 3H), 0,81 (д, 3H), 0,72 (д, 3H).
Пример 146
(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-1-[(1R)-1-(2-фтор-1-бензофуран-5-ил)-2-морфолин-4-ил-2-оксоэтил]-6-изобутилпиперазин-2,5-дион
ВЭЖХ Время удерж. (Rt) = 3,35 мин; m/z [M+H]+ = 548.
1H ЯМР (CDCl3) δ: 7,55 (д, 1H), 7,47 (д, 1H), 7,31 (дд, 1H), 7,27-7,14 (м, 4H), 6,58 (с, 1H), 6,38 (д, 1H), 5,91 (д, 1H), 4,19 (м, 1H), 4,00 (дд, 1H), 3,73-3,50 (м, 5H), 3,39 (м, 1H), 3,23-3,04 (м, 5H), 2,87 (м, 1H), 2,76 (м, 1H), 1,47 (м, 1H), 1,40 (м, 1H), 0,53 (д, 3H), 0,51 (м, 1H), 0,24 (д, 3H).
Пример 147
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(1H-индол-6-ил)-N,N-диметилэтанамид
ВЭЖХ Время удерж. (Rt) = 3,38 мин; m/z [M+H]+ = 487.
1H ЯМР (CDCl3) δ: 9,03 (с, 1H), 7,66 (д, 1H), 7,49 (д, 1H), 7,30 (м, 1H), 7,21 (м, 1H), 7,18-7,10 (м, 4H), 7,02 (м, 1H), 6,57 (с, 1H), 6,55 (м, 1H), 4,29 (м, 1H), 4,00 (дд, 1H), 3,22-3,03 (м, 3H), 3,00 (с, 3H), 2,92-2,73 (м, 5H), 1,40 (м, 1H), 1,33 (м, 1H), 0,57 (м, 1H), 0,45 (д, 3H), 0,06 (д, 3H).
Пример 148
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(1H-индол-6-ил)-N-метил-N-[2-(метилсульфонил)этил]этанамид
ВЭЖХ Время удерж. (Rt) = 3,20 мин; m/z [M+H]+ = 579.
1H ЯМР (CDCl3) δ: 9,62 (с, 1H), 7,64 (д, 1H), 7,41 (д, 1H), 7,30 (м, 1H), 7,26-7,10 (м, 6H), 6,51 (м, 1H), 6,48 (с, 1H), 4,18 (м, 1H), 4,05-3,90 (м, 2H), 3,68-3,50 (м, 2H), 3,28-3,01 (м, 4H), 2,96-2,69 (м, 8H), 1,41 (м, 2H), 0,65 (м, 1H), 0,47 (д, 3H), -0,10 (д, 3H).
Пример 149
(2R)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид
(2RS)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-бензилоксифенил)этанамид
Смесь 5-формилбензотиофена (2,0 г), гидрохлорида метилового эфира (D)-лейцина (2,24 г), триэтиламина (1,72 мл) и метанола (20 мл) перемешивают при комнатной температуре в течение 24 час. Затем последовательно добавляют N-трет-бутоксикарбонил-(D)-инданилглицин (3,59 г) и 2-бензилоксифенилизоцианид (2,58 г) и смесь перемешивают в течение 4 дней. Затем растворитель удаляют при пониженном давлении. Остаток переносят в дихлорметан (20 мл) и 4M хлористый водород в 1,4-диоксане (20 мл) и смесь перемешивают при комнатной температуре в течение 2 час. Растворитель и хлористый водород выпаривают при пониженном давлении. Сырое вещество растворяют в дихлорметане (30 мл) и добавляют триэтиламин (10 мл). Смесь перемешивают в течение 18 час перед удалением дихлорметана и избытка триэтиламина при пониженном давлении. Сырой продукт растворяют в дихлорметане (100 мл) и промывают 1N соляной кислотой (2×100 мл) и насыщенным раствором соли. Органические фазы сушат над MgSO4 и выпаривают в вакууме, получая (2RS)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-бензилоксифенил)этанамид в виде коричневой пены (7,5 г).
ВЭЖХ Время удерж. (Rt) = 3,88 мин, m/z[M+H]+ = 658.
(2RS)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид
(2RS)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-бензилоксифенил)этанамид (1,0 г) растворяют в дихлорметане (5 мл) и туда добавляют по капле 1,0M раствор BBr3 в дихлорметане (2,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 час. К реакционной смеси добавляют 1N соляную кислоту (30 мл) и дихлорметан (20 мл). Фазы разделяют и органические фазы промывают 1N соляной кислотой (30 мл) и насыщенным раствором соли (30 мл). Органические фазы сушат над MgSO4 и выпаривают в вакууме.Остаток очищают методом колоночной флэш-хроматографии на Biotage™, элюируя смесью 3:2 этилацетат:циклогексан. Необходимые фракции объединяют и выпаривают в вакууме, получая (2RS)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (210 мг).
ВЭЖХ Время удерж. (Rt) = 3,55 мин, m/z [M+H]+ = 568.
(2R)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил)-N,N-диметилэтанамид
Карбонилдиимидазол (100 мг) суспендируют в безводном дихлорметане (1 мл) и суспензию оставляют при комнатной температуре на 15 мин. Добавляют (2RS)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)этанамид (200 мг) и смесь перемешивают при комнатной температуре в течение 5 час 20 мин. Полученный коричневый раствор обрабатывают далее 2,0M раствором диметиламина в тетрагидрофуране (1,0 мл, 6 экв.), полученную смесь перемешивают 30 мин и затем оставляют стоять при комнатной температуре на 18 час 15 мин. Реакционную смесь выпаривают при пониженном давлении. Сырой продукт очищают методом колоночной хроматографии на диоксиде кремния, элюируя смесью 1:1 об./об. этилацетат:циклогексан. Необходимые фракции объединяют и выпаривают в вакууме,получая (2R)-2-(бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид в виде белого твердого вещества (90 мг).
ВЭЖХ Время удерж. (Rt) = 3,35 мин, m/z [M+H]+ = 504.
1Н ЯМР (CDCl3) δ:7,94 (д, 1H), 7,89 (м, 1H), 7,70 (д, 1H), 7,54 (д, 1H), 7,41 (м, 1H), 7,35 (д, 1H), 7,23 (м, 1H), 7,13 (м, 3H), 6,63 (с, 1H), 4,25 (м, 1H), 4,02 (дд, 1H), 3,23-3,04 (м, 3H), 3,01 (с, 3H), 2,93-2,77 (м, 5H), 1,50-1,32 (м, 2H), 0,52 (м, 1H), 0,49 (д, 3H), 0,12 (д, 3H).
Соединения 150-169 и 174-175 получают способом 1. Соединение 170 получают способом 2. Соединения 171, 172 и 173 получают способом 5 (см. табл.3).
Таблица 3
№
/мин
+
-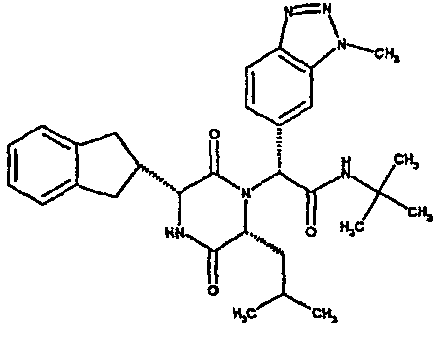
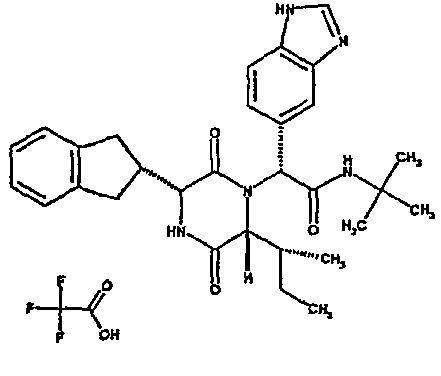
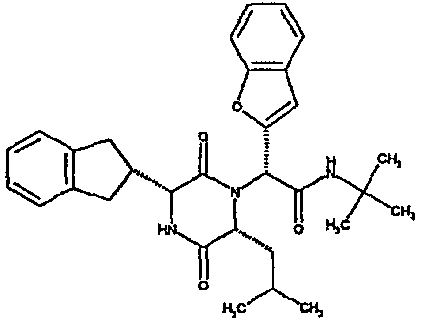
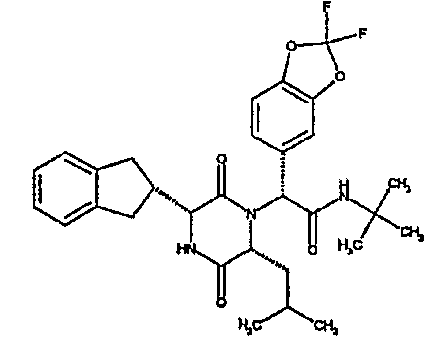
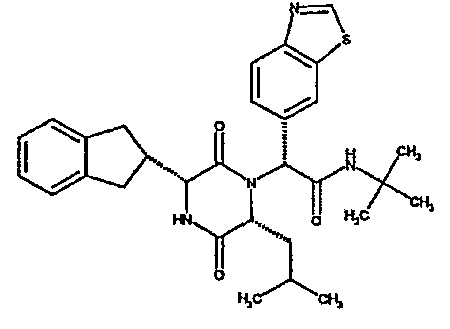
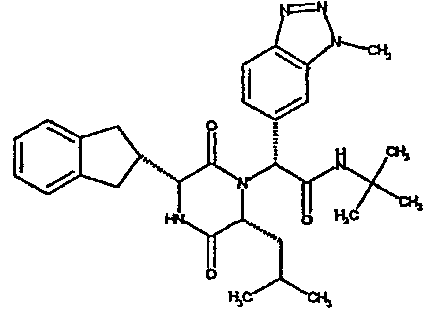
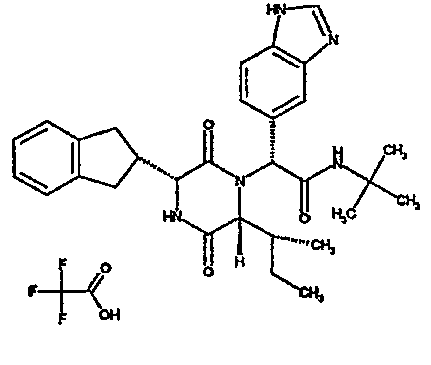
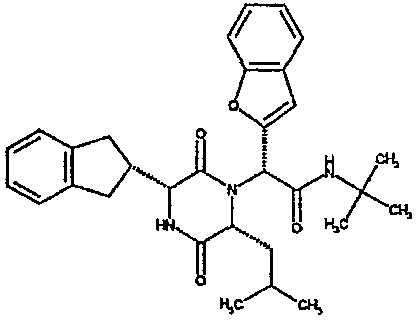
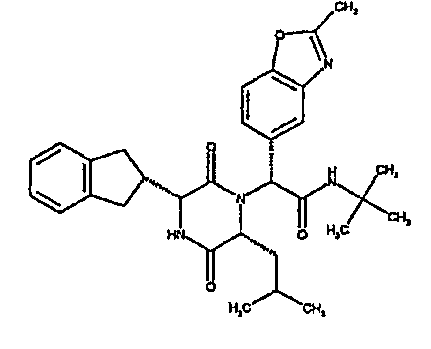
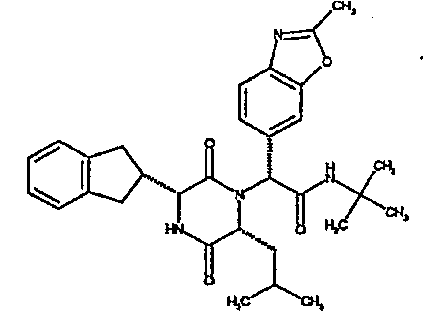
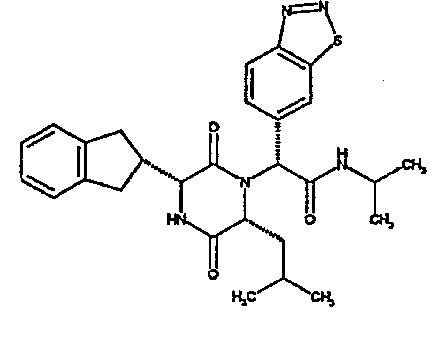
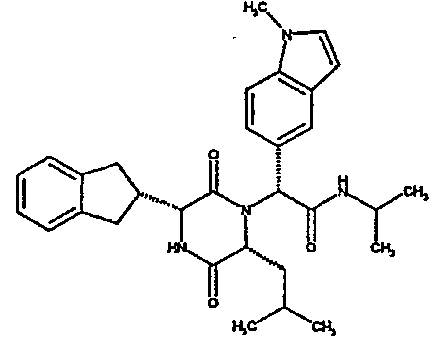
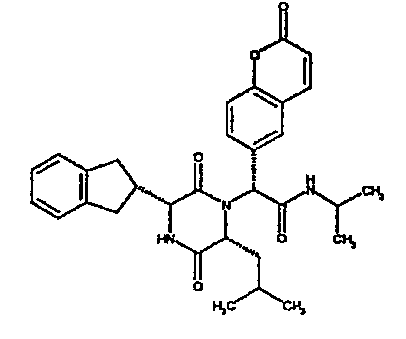
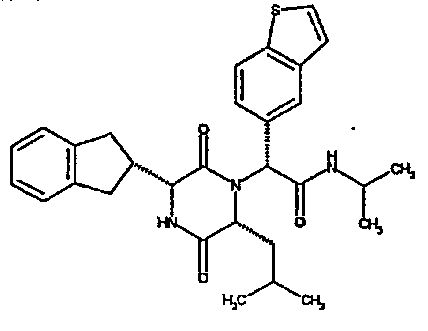
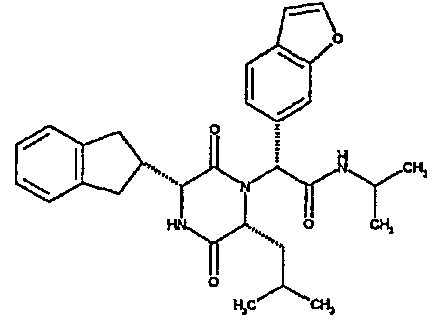
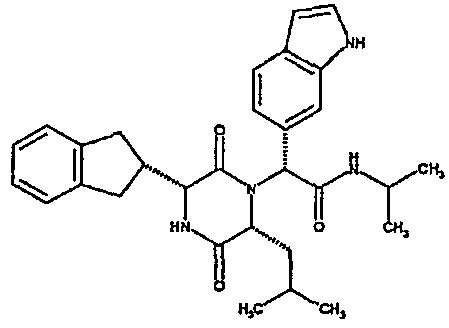
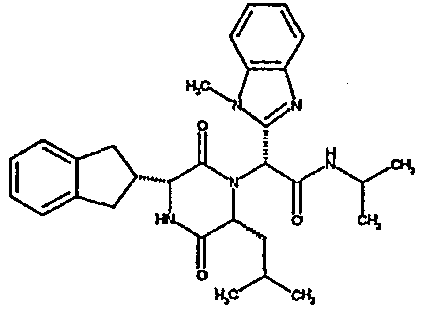
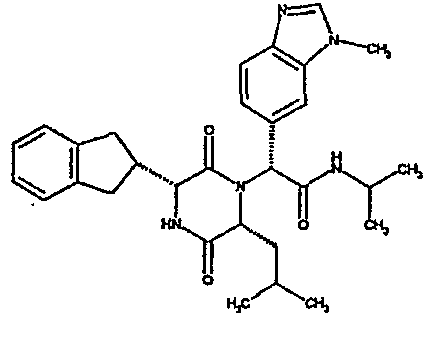
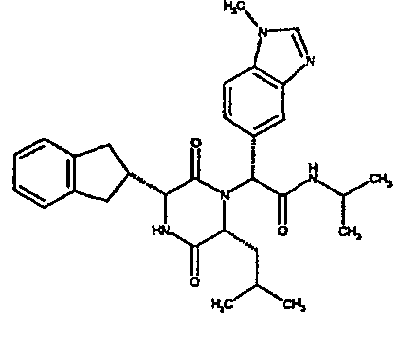
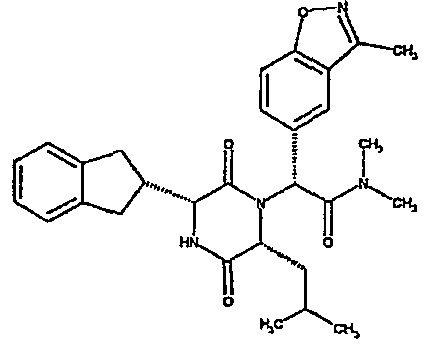
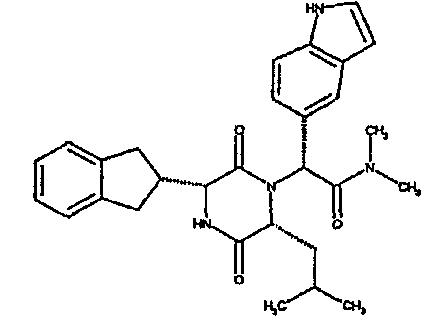
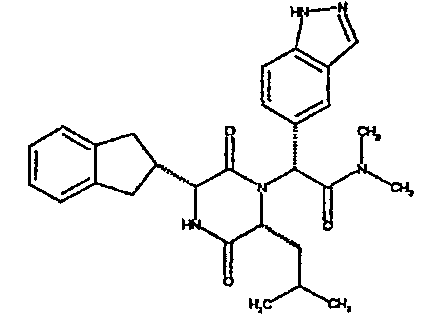
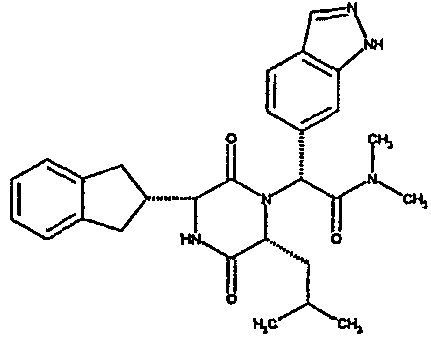
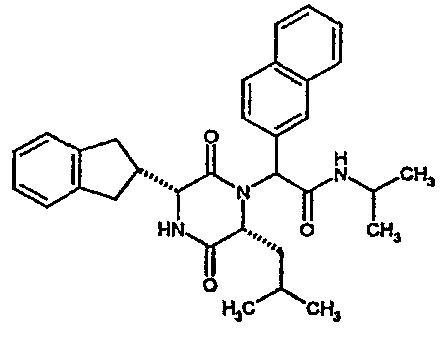
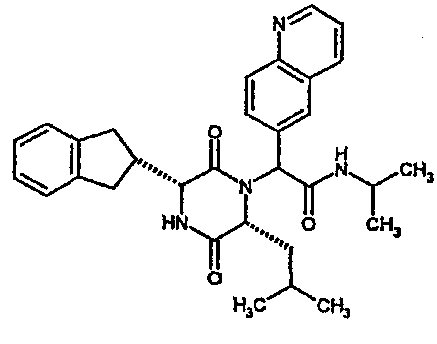
Пример 176
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил)-N-изопропил-2-[5-(трифторметил)-2-фурил]этанамид
К раствору 5-трифторметилфуран-2-карбальдегида (140 мг) [получен как в работе Chem. Heterocycl. Compd. 13, 1977, 1280-1282, R.V. Grigorash, V.V. Lyalin, L.A. Alekseeva и L.M. Yagupol'skii: 5-Trifluoromethylfuran Derivatives] в метаноле (1,1 мл) добавляют триэтиламин (118 мкл) и гидрохлорид трет-бутилового эфира (D)-лейцина (190 мг). Смесь оставляют стоять на 16,33 час перед последовательным добавлением (2R)-[(трет-бутоксикарбонил)амино](2,3-дигидро-1H-инден-2-ил)этановой кислоты (246 мг) и изопропилизоцианида (77,4 мкл). Смесь, желтый раствор, оставляют стоять на 24 час перед удалением растворителя в вакууме. Остаток растворяют в 4M хлористом водороде в диоксане (3 мл) и оставляют стоять на 6,75 час при температуре окружающей среды. После этого растворитель удаляют в вакууме. Остаток растворяют в метаноле (4 мл) и обрабатывают раствором 4M хлористого водорода в диоксане (0,2 мл) и оставляют стоять в течение ночи. Затем растворитель удаляют в вакууме.Остаток перемешивают в диоксане (9,5 мл), содержащем триэтиламин (0,5 мл) и дихлорметан (5 мл), в течение 4,75 час. Затем смесь выпаривают в вакууме, получая светло-коричневое твердое вещество. Данное сырое вещество очищают на колонке SPE (10 г диоксида кремния Mega Bond Elut™), элюируя по очереди 100% хлороформом, смесью 4:1 циклогексан:диэтиловый эфир, смесью 3:1 циклогексан:диэтиловый эфир, смесью 2:1 циклогексан:диэтиловый эфир, смесью 1:1 циклогексан:диэтиловый эфир, смесью 1:2 циклогексан:диэтиловый эфир, смесью 1:3 циклогексан:диэтиловый эфир, 100% диэтиловым эфиром, смесью 1:1 этилацетат:циклогексан, смесью 2:1 этилацетат:циклогексан, смесью 3:1 этилацетат:циклогексан, 100% этилацетатом. Объединяют фракции от 1:2 циклогексан:диэтиловый эфир до 2:1 этилацетат:циклогексан включительно, получая оранжевую смолу (215 мг). Данную смолу дополнительно очищают для разделения изомеров методом препаративной хроматографии. Пластины с силикагелем 60 Whatman PK6F, 20 × 20 см, элюируют шесть раз в смеси 1:1 этилацетат:циклогексан и экстрагируют смесью 9:1 этилацетат:метанол, получая (2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-[5-(трифторметил)-2-фурил]этанамид (64 мг).
ВЭЖХ Время удерж. (Rt) = 3,59 мин; m/z [M+H]+ = 520.
1Н ЯМР (CDCl3) δ: 7,88 (д, 1H), 7,16 (м, 4H), 6,85 (д, 1H), 6,74 (д, 1H), 6,30 (д, 1H), 5,73 (с, H), 4,19 (дд, 1H), 4,08 (м, 1H), 3,97 (дд, 1H), 3,14 (м, 2H), 3,01 (м, 1H), 2,84 (м, 2H), 1,81 (м, 1H), 1,68 (м, 1H), 1,15 (д, 6H), 1,11 (м, 1H), 0,82 (дд, 6H).
Аналогично получают:
Пример 177
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-(5-метилтиен-2-ил)этанамид
По методике примера 176, но используя 5-метилтиофен-2-карбальдегид.
ВЭЖХ Время удерж. (Rt) = 3,46 мин; m/z [M+H]+ = 482.
1H ЯМР (CDCl3) δ: 7,21 (м, 2H), 7,16 (м, 2H), 6,94 (д, 1H), 6,67 (д, 1H), 6,63 (д, 1H), 5,73 (д, 1H), 4,94 (с, 1H), 4,07 (м, 1H), 3,93 (м, 2H), 3,16 (дд, 1H), 3,05 (м, 2H), 2,93 (м, 1H), 2,77 (м, 1H), 2,47 (с, 3H), 1,96 (м, 1H), 1,86 (м, 1H), 1,72 (м, 1H), 1,17 (д, 3H), 1,12 (д, 3H), 0,94 (д, 3H), 0,92 (д, 3H)
Пример 178
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-[5-(трифторметил)-2-фурил]этанамид
N-[2-(бензилокси)фенил]-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-[5-(трифторметил)-2-фурил]ацетамид
Смесь 5-трифторметилфуран-2-карбальдегида (351 мг), гидрохлорида метилового эфира (D)-лейцина (389 мг), триэтиламина (0,298 мл) и метанола (2,2 мл) перемешивают при комнатной температуре в течение 4 час и затем оставляют стоять на 19 час. Затем последовательно добавляют N-трет-бутоксикарбонил-(D)-инданилглицин (623 мг) и 2-бензилоксифенилизоцианид (448 мг) и смесь перемешивают в течение 7 час до того, как оставляют стоять при комнатной температуре на 41 час. Затем удаляют растворитель при пониженном давлении, получая оранжево-коричневый сироп. Его переносят в 4M хлористый водород в 1,4-диоксане (2,8 мл) и смесь перемешивают при комнатной температуре в течение 2 час. Растворитель и хлористый водород выпаривают при пониженном давлении. Сырое вещество растворяют в метаноле (5 мл) и добавляют триэтиламин (0,54 мл). Смесь перемешивают в течение 18 час перед удалением метанола и избытка триэтиламина при пониженном давлении. Сырой продукт очищают методом колоночной флэш-хроматографии Biotage™ (картридж с 40 г диоксида кремния элюируют смесью 1:5 этилацетат:циклогексан (600 мл), смесью 1:3 этилацетат:циклогексан (400 мл) и смесью 1:2 этилацетат:циклогексан (450 мл)), получая N-[2-(бензилокси)фенил]-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-[5-(трифторметил)-2-фурил]ацетамид в виде оранжевого твердого вещества (472 мг).
ВЭЖХ Время удерж. (Rt) = 4,04 мин, m/z[M+H]+ = 660.
2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)-2-[5-(трифторметил)-2-фурил]ацетамид
N-[2-(бензилокси)фенил]-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-[5-(трифторметил)-2-фурил]ацетамид (469 мг) растворяют в этилацетате (10 мл) и гидрируют при атмосферном давлении на 10% палладии на активированном угле (100 мг). Через 4 час катализатор удаляют фильтрованием через фильтры из стекловолокна и промывают этилацетатом. Фильтрат и смывы объединяют, выпаривают при пониженном давлении и сушат в вакуумепри комнатной температуре, получая желто-коричневое твердое вещество (400 мг). Данное твердое вещество сушат над P2О5 в течение ночи, получая 2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)-2-[5-(трифторметил)-2-фурил]ацетамид (365 мг).
ВЭЖХ Время удерж. (Rt) = 3,64 мин, m/z [M+H]+ = 570.
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-[5-(трифторметил)-2-фурил]этанамид
Карбонилдиимидазол (78 мг, 1,6 экв.) суспендируют в безводном дихлорметане (1 мл) и суспензию оставляют при комнатной температуре на 15 мин. Затем добавляют (R)-N-(2-гидроксифенил)-2-((3R,6R)-3-индан-2-ил-6-изобутил-2,5-диоксопиперазин-1-ил)-2-(5-трифторметилфуран-2-ил)ацетамид (172 мг) и смесь перемешивают при комнатной температуре в течение 5 час 20 мин. Полученный коричневый раствор обрабатывают 2,0M раствором диметиламина в тетрагидрофуране (0,9 мл, 6 экв.) и полученную смесь перемешивают в течение 30 мин, а затем оставляют стоять при комнатной температуре на 18 час 15 мин. Реакционную смесь разбавляют дихлорметаном (2 мл) и промывают 1M соляной кислотой (2 мл). Органические фазы отделяют, используя гидрофобную фритту, и выпаривают при пониженном давлении, получая коричневую смолу. Сырой продукт наносят на 3 пластины для препаративной хроматографии, которые элюируют смесью 1:1 об./об. этилацетат:циклогексан. Необходимые полосы экстрагируют этилацетатом, получая (2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-[5-(трифторметил)-2-фурил]этанамид в виде светло-желтого твердого вещества (87 мг).
ВЭЖХ Время удерж. (Rt) = 3,51 мин, m/z [M+H]+ = 506.
1H ЯМР (CDCl3) δ: 7,19 (м, 5H), 6,86 (дд, 1H), 6,64 (д, 1H), 6,61 (с, 1H), 4,25 (м, 1H), 3,97 (дд, 1H), 3,20-3,02 (м, 3H), 3,01 (с, 3H), 2,96 (с, 3H), 2,88 (м, 1H), 2,80 (м, 1H), 1,70 (м, 1H), 1,67 (м, 1H), 0,74 (д, 3H), 0,70 (м, 1H), 0,63 (д, 3H).
Пример 179
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(2-метил-1,3-оксазол-4-ил)этанамид
По методике примера 178, используя (2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)-2-(2-метил-1,3-оксазол-4-ил)этанамид
ВЭЖХ: Время удерж. (Rt) = 2,88 мин; m/z (M+H)+= 453.
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)-2-(2-метил-1,3-оксазол-4-ил)этанамид
Смесь 2-метилоксазол-4-карбальдегида(1) (340 мг), гидрохлорида метилового эфира (D)-лейцина (568 мг), триэтиламина (0,435 мл) и безводного метанола (20 мл) перемешивают при комнатной температуре в течение 18 час. Далее добавляют последовательно N-бензилоксикарбонил-(D)-инданилглицин (1,015 г) и 2-бензилоксифенилизоцианид (648 мг) и смесь перемешивают в течение 12 дней до того, как оставляют стоять при комнатной температуре на 10 дней. Растворитель удаляют при пониженном давлении, получая темно-оранжевую смолу, которую растворяют в этилацетате (150 мл) и промывают 2M соляной кислотой (100 мл), насыщенным раствором бикарбоната натрия (100 мл) и насыщенным раствором хлорида натрия (50 мл), затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении до объема 5 мл. Данный сырой раствор разбавляют этанолом (80 мл), содержащим уксусную кислоту (1,6 мл), и добавляют в вакууме к 10% палладию на угле (50% воды, 425 мг). Полученную суспензию перемешивают в атмосфере водорода в течение 20 час, фильтруют (целит), промывают этанолом (50 мл) и фильтрат добавляют в вакууме ко второй порции 10% палладия на угле (50% воды, 670 мг). Данную суспензию перемешивают в атмосфере водорода в течение 2 час, затем аппарат для гидрирования освобождают и вторично заполняют водородом и суспензию перемешивают еще в течение 20 час. Данную суспензию фильтруют (целит), промывают этанолом (200 мл) и объединенные фильтраты концентрируют при пониженном давлении. Остаток распределяют между насыщенным раствором бикарбоната натрия (100 мл) и дихлорметаном (60 мл), органический слой сушат (гидрофобная фритта) и удаляют растворитель при пониженном давлении. Очистка методом флэш-хроматографии Biotage (40 г диоксида кремния) при элюировании смесью этилацетат:циклогексан (3:1, 300 мл), этилацетатом (300 мл), затем смесью этилацетат:метанол (20:1, 600 мл), дает (2R)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксифенил)-2-(2-метил-1,3-оксазол-4-ил)этанамид в виде коричневой пены (197 мг).
ВЭЖХ: Время удерж. (Rt) = 3,28 мин; m/z (M+H)+ = 517
Ссылка (1) CAS 113732-84-6
Пример 180
(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-1-[(1R)-1-(2-метил-1,3-оксазол-4-ил)-2-морфолин-4-ил-2-оксоэтил]пиперазин-2,5-дион
По методике примера 179, используя морфолин.
ВЭЖХ: Время удерж. (Rt) = 2,89 мин; m/z(M+H)+ = 495
Пример 181
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил)-N,N-диметил-2-(5-метилтиен-2-ил)этанамид
По методике примера 180, используя 5-метилтиофен-2-карбальдегид.
ВЭЖХ Время удерж. (Rt) = 3,25 мин; m/z M+ = 468.
Пример 182
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(3-фтор-5-метилтиен-2-ил)-N,N-диметилэтанамид
По методике примера 178, используя 3-фтор-5-метилтиофен-2-карбальдегид
ВЭЖХ: Время удерж. (Rt) = 3,20 мин; m/z M+ = 486.
2-(3-Бром-5-метилтиофен-2-ил)-[1,3]диоксан
3-Бром-5-метил-2-тиофенкарбальдегид (1,00 г) растворяют в сухом 1,4-диоксане (8 мл). Добавляют молекулярные сита (4 Ангстрема, 2 г), 1,3-пропандиол (9 мл), пара-толуолсульфоновую кислоту (362 мг) и перемешивают смесь в атмосфере азота при комнатной температуре в течение ночи. Молекулярные сита удаляют фильтрованием и фильтрат выпаривают. Остаток переносят в этилацетат и промывают насыщенным раствором карбоната натрия. Водную фазу экстрагируют еще раз этилацетатом и объединенные слои промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют до желтого масла (1 г).
Очистку осуществляют фильтрованием на картридже SPE (10 г диоксида кремния), используя дихлорметан в качестве элюента. Данный раствор, в конечном счете, концентрируют, получая 2-(3-бром-5-метилтиофен-2-ил)-[1,3]диоксан в виде желтого твердого вещества (1,18 г).
1H ЯМР (CDCl3, 400 МГц) δ: 6,60 м.д. (с, 1H); 5,72 м.д. (с, 1H); 4,23 м.д. (м, 2H); 3,98 м.д. (м, 2H); 2,44 м.д. (д, 3H); 2,22 м.д. (м, 1H); 1,42 м.д. (м, 1H).
3-Фтор-5-метилтиофен-2-карбальдегид
К раствору 2-(3-бром-5-метилтиофен-2-ил)-[1,3]диоксана (1,16 г) в сухом тетрагидрофуране (10 мл) в атмосфере азота при -78°C добавляют по капле 1,6M н-бутиллитий в гексане (3,30 мл). Через 15 мин перемешивания добавляют порциями N-фторбензолсульфонилимид (1,66 г). Раствор перемешивают при -78°C еще в течение 10 мин, дают нагреться до комнатной температуры и затем перемешивают еще в течение 60 мин. Реакционную смесь гасят водой (5 мл), разбавляют диэтиловым эфиром (20 мл) и промывают 1N гидроксидом натрия (30 мл). Водную фазу снова экстрагируют диэтиловым эфиром (2×10 мл), объединенные органические слои сушат над сульфатом магния, фильтруют и выпаривают. Остаток повторно растворяют в 1,4-диоксане (15 мл) и воде (10 мл), добавляют пара-толуолсульфоновую кислоту (837 мг) и раствор перемешивают при комнатной температуре в течение ночи, нейтрализуют насыщенным раствором бикарбоната натрия (10 мл), экстрагируют дважды эфиром. Органические фазы сушат над сульфатом магния и выпаривают при пониженном давлении (200 мбар). Остаточный диоксан удаляют перегонкой при пониженном давлении, остаток дополнительно очищают методом флэш-хроматографии (петролейный эфир/дихлорметан 55/45), получая 3-фтор-5-метилтиофен-2-карбальдегид в виде бесцветного масла (366 мг) примерно 70% чистоты.
1H ЯМР (CDCl3, 400 МГц) δ: 9,93 м.д. (с, 1H); 6,62 м.д. (с, 1H); 2,52 м.д. (м, 3H).
Аналогично получают:
Соединения 183-206, 213, 215, 218, 222-225 получают способом 1. Соединения 207, 208, 216 получают способом 2. Соединения 209-212, 214, 217, 219-221 и 226 получают способом 5 (см. табл.4).
Таблица 4
№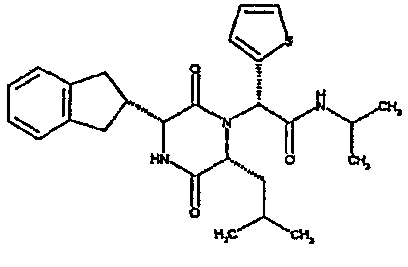
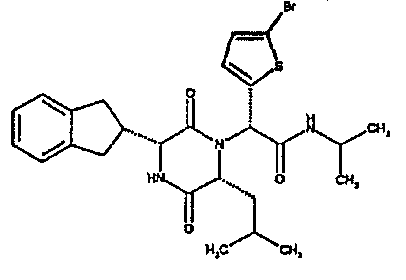
548
544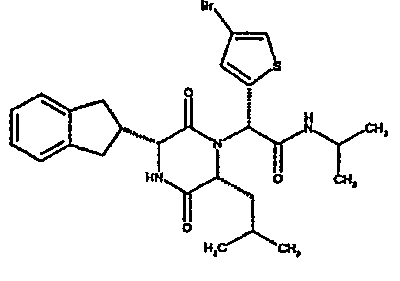
548
546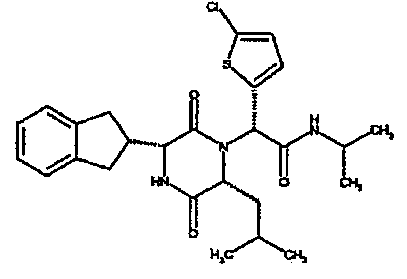
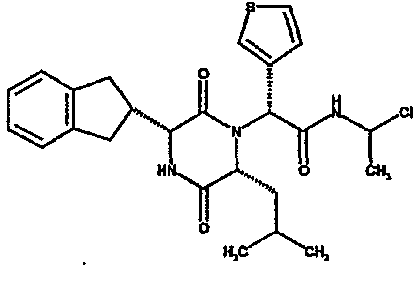
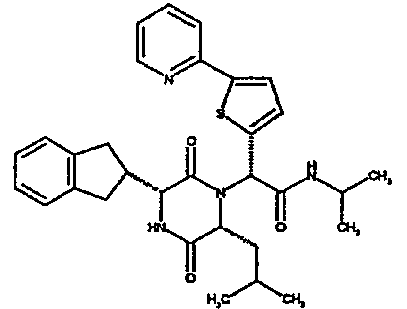
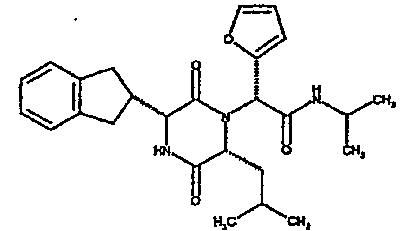
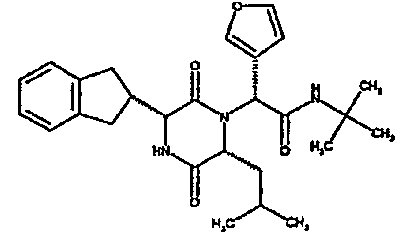
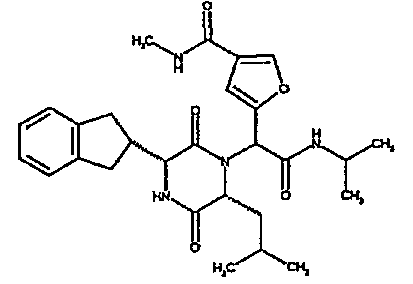
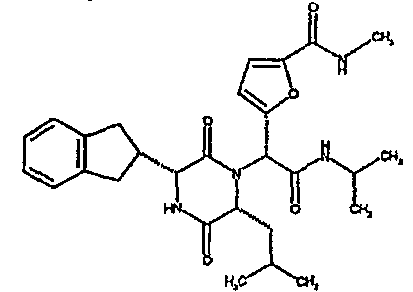
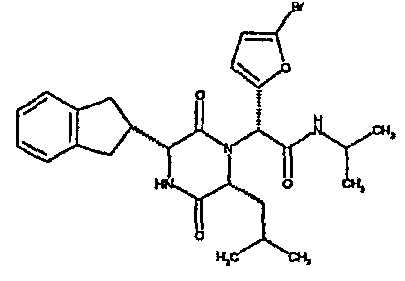
531
529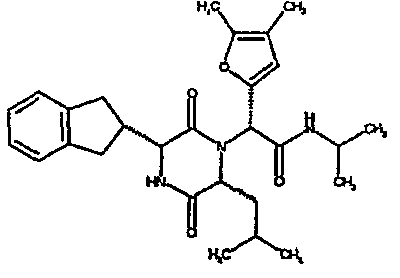
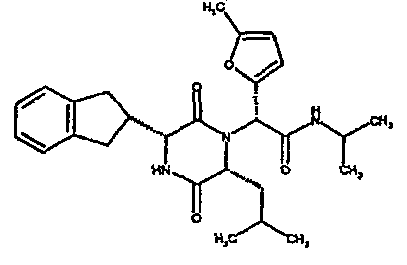
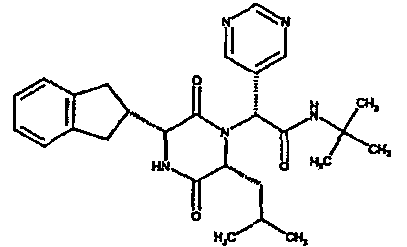
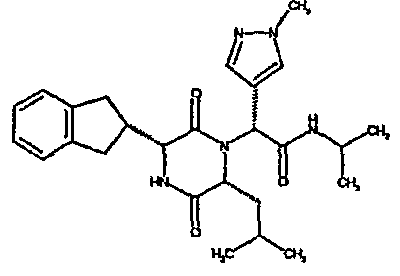
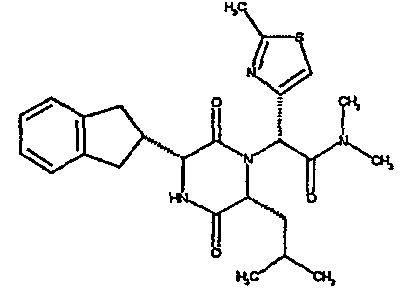
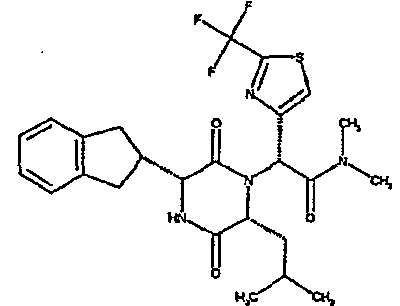
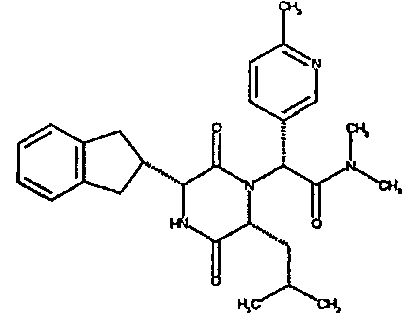
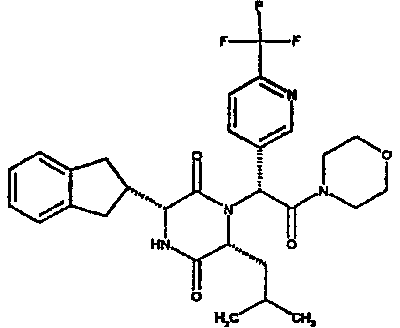
пиридин-3-ил]этил}
пиперазин-2,5-дион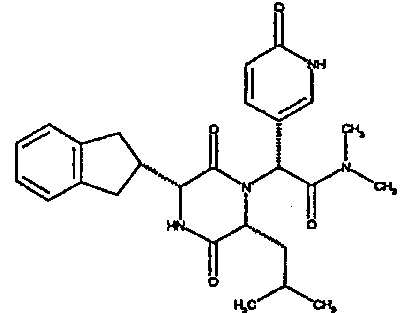
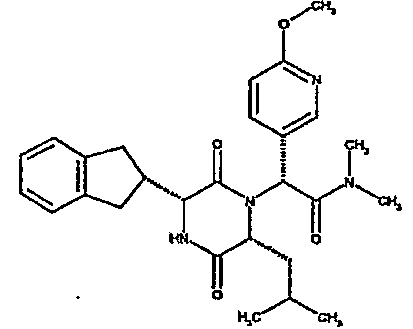
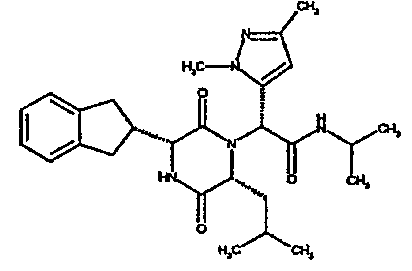
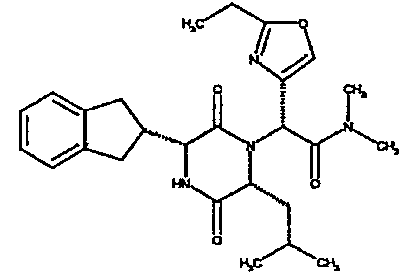
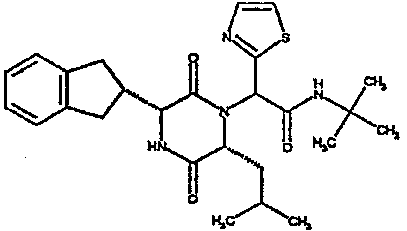
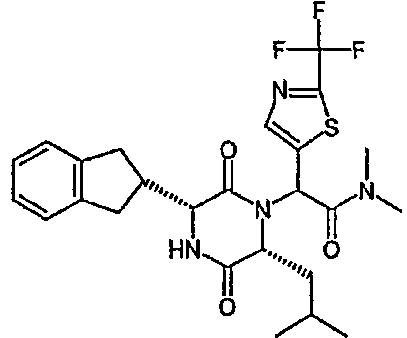
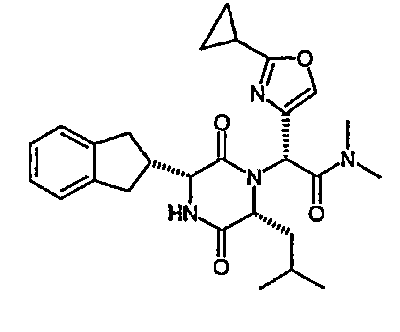
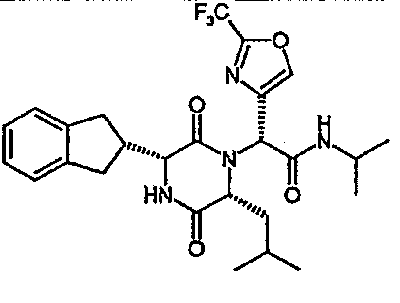
диоксопиперазин-1-ил]-N-изопропил-2-[2-(трифторметил)-1,3-оксазол-4-ил]этанамид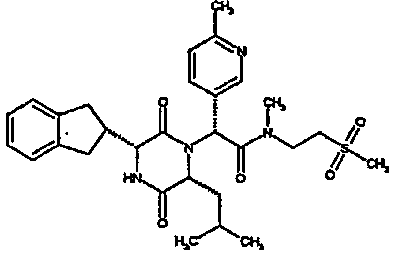
диоксопиперазин-1-ил]-N-метил-2-(6-метилпиридин-3-ил)-N-[2-(метилсульфонил)
этил]этанамид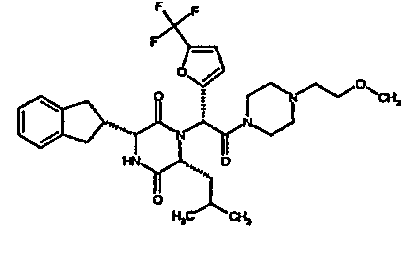
пиперазин-1-ил]-2-оксо-1-[5-(трифторметил)-2-фурил]этил}пиперазин-2,5-дион
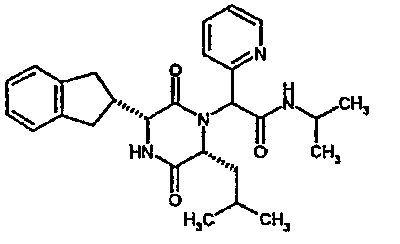
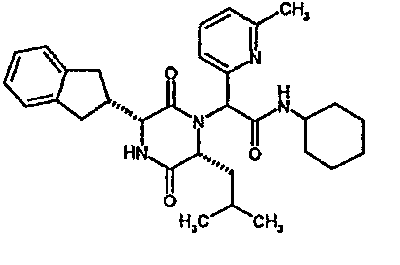
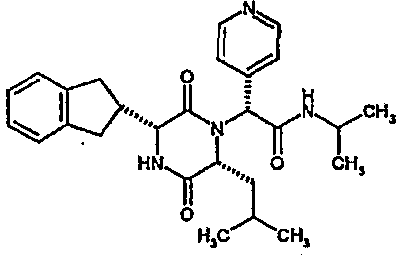
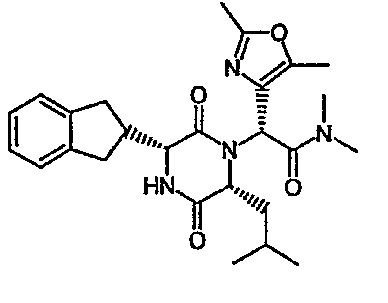
Пример 227
(3R,6R)-1-[(1R)-1-(2,4-Дифторфенил)-2-(3-фторазетидин-1-ил)-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион
Перемешивают азетидинол (пример 15) (57 мг) в безводном дихлорметане (2 мл) при -5°C и добавляют одной порцией трифторид диэтиламинсеры (50 мкл, избыток). Смесь оставляют при комнатной температуре на ночь и добавляют насыщенный водный гидрокарбонат натрия (3 мл). Смесь разбавляют дихлорметаном (10 мл) и органическую фазу отделяют, используя гидрофобную фритту, и продувают азотом. Сырую реакционную смесь очищают, применяя масс-нацеленную автоматическую систему и получая (3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-(3-фторазетидин-1-ил)-2-оксоэтил]-3-(2,3-дигидро-1H-инден-2-ил)-6-изобутилпиперазин-2,5-дион (26 мг) в виде белого твердого вещества.
ВЭЖХ Время удерж. (Rt) = 3,34 мин, m/z [M+H]+ = 514
Примеры фармацевтических препаратов
Таблетки
Соединение данного изобретения, микрокристаллическую целлюлозу, лактозу и сшитый поливинилпирролидон просеивают через сито 500 мкм и смешивают в подходящем миксере. Стеарат магния просеивают через сито 250 мкм и смешивают с активной смесью. Данную смесь прессуют в виде таблеток, используя подходящие штампы.
Соединение данного изобретения, лактозу и предварительно желированный крахмал смешивают вместе и гранулируют с водой. Влажную массу сушат и перемалывают. Стеарат магния и сшитый поливинилпирролидон просеивают через сито 250 мкм и смешивают с гранулами. Полученную смесь прессуют, используя подходящие штампы для таблеток.
Капсулы
Соединение данного изобретения и предварительно желированный крахмал пропускают через сито 500 мкм, смешивают вместе и добавляют стеарат магния (просеянный через сито 250 мкм). Данной смесью заполняют твердые желатиновые капсулы подходящего размера.
Соединение данного изобретения и лактозу смешивают вместе и гранулируют с раствором поливинилпирролидона. Влажную массу сушат и перемалывают. Стеарат магния и сшитый поливинилпирролидон просеивают через сито 250 мкм и смешивают с гранулами. Полученной смесью заполняют твердые желатиновые капсулы подходящего размера.
Препарат для инъекций
Для регулировки тоничности раствора можно добавлять хлорид натрия и рН можно доводить до значения, при котором наблюдается максимальная стабильность, и/или с целью облегчения образования раствора соединения данного изобретения, используя разбавленную кислоту или щелочь или добавляя подходящие буферные соли.
Для облегчения образования раствора соединения данного изобретения можно также добавлять агенты, способствующие растворению, такие как сорастворители. Можно также включать антиоксиданты и металлхелатирующие соли. Раствор осветляют, доводят водой до конечного объема и повторно измеряют и, если необходимо, регулируют рН, получая 1 мг/мл соединения формулы (I).
Раствор можно упаковать в контейнеры для инъекций, например, заполняя и запечатывая ампулы, пробирки или шприцы. Ампулы, пробирки или шприцы можно заполнять асептически (например, можно стерилизовать раствор путем фильтрования и заливать в стерильные ампулы в асептических условиях) и/или в заключение стерилизовать (например, нагреванием в автоклаве, используя один из приемлемых циклов). Раствор можно упаковывать в инертной атмосфере азота.
Предпочтительно заполнять раствором ампулы, запаивать стекло и в заключение стерилизовать.
Кроме того, аналогичным образом получают стерильные препараты, содержащие 0,05, 0,20 и 0,5% мас./об. соединения данного изобретения, обеспечивая, таким образом, соответственно, 0,5, 2 и 5 мг/мл соединения данного изобретения.
Измерение активности антагонистов окситоцина
В данном исследовании применяют следующий буфер: 50 мМ HEPES, 10 мМ MgCl2, 0,125 мг/мл BSA, pH доводят до 7,4 при помощи KOH.
Мембраны hOT-CHO получают при концентрации 0,3 мг белка/мл в буфере для исследования. Исследуемые соединения сначала растворяют в ДМСО (до 10 мМ) и разбавляют в ДМСО (Beckman Biomek FX). 1 мкл соединения переносят на черные исследовательские планшеты 384 (NUNC), используя Biomek FX. Добавляют во все ячейки (Labsystems Multidrop) по 20 мкл 1 нМ окситоцина Bodipy TMR (Perkin Elmer) в буфере для исследования, затем во все ячейки (Multidrop) добавляют 20 мкл мембран. Планшеты инкубируют при комнатной температуре в течение 60 мин.
Поляризацию определяют на приборе LJL Analyst (=535 нм, =580 нм, дихроизм=555 нм). Данные вставляют в 4-параметровое логистическое уравнение. Определенное значение Ki рассчитывают как IC50/5.
В приведенном выше исследовании соединения данного изобретения, как правило, имеют значение pKi в диапазоне от 7 до 11. Таким образом, соединения примеров 1-227 имеют значения pKi в диапазоне от 8,5 до 10,8.
Соединения данного изобретения по существу не являются токсическими при терапевтически активных дозах. По крайней мере, соединение примера 10 вводили крысам при дозах до 300 мг/кг перорально в течение 4 дней и не наблюдали вредных токсикологических эффектов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИПЕРАЗИНДИОНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ОКСИТОЦИНА | 2005 |
|
RU2382038C2 |
| Бициклические гетероциклические соединения и их применения в терапии | 2012 |
|
RU2662827C2 |
| С-ГЛИКОЗИДНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ КОНДЕНСИРОВАННОЕ ФЕНИЛЬНОЕ КОЛЬЦО, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ ТАКОВЫХ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТАКОВЫЕ | 2017 |
|
RU2739024C2 |
| ПРОИЗВОДНЫЕ ДИАЗЕПИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АРИТМИИ | 1994 |
|
RU2155587C2 |
| НОВОЕ ПИРРОЛОПИРИМИДИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕЕ, В ЧАСТНОСТИ, АГЕНТ ДЛЯ ПРЕДОТВРАЩЕНИЯ И/ИЛИ ЛЕЧЕНИЯ ОПУХОЛЕЙ, И ТОМУ ПОДОБНОЕ, НА ОСНОВЕ ИНГИБИТОРНОГО ВОЗДЕЙСТВИЯ НА NAE | 2015 |
|
RU2658008C2 |
| УСИЛИТЕЛЬ ПРОТИВООПУХОЛЕВОГО ВОЗДЕЙСТВИЯ, СОДЕРЖАЩИЙ СОЕДИНЕНИЕ ПИРРОЛОПИРИМИДИНА | 2016 |
|
RU2710380C1 |
| Аналоги сплицеостатина | 2013 |
|
RU2618523C2 |
| АЗОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОТИВОГРИБКОВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 1998 |
|
RU2189982C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2014 |
|
RU2696310C1 |
| ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА ИЛИ ТЕТРАГИДРОПИРАНА, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ИЛИ ГИДРАТЫ, ИЛИ СОЛЬВАТЫ ЭТИХ СОЕДИНЕНИЙ, ИЛИ ИХ СОЛЕЙ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНОЕ СРЕДСТВО | 1992 |
|
RU2084439C1 |
Настоящее изобретение относится к замещенным дикетопиперазинам общей формулы I или их физиологически приемлемым солям,
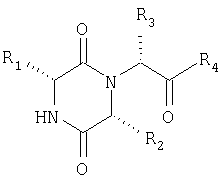
в которой
R1 обозначает 5-членную циклоалкильную группу, необязательно замещенную одной или несколькими гидроксильными группами, которая сконденсирована с необязательно замещенным бензольным кольцом; R2 обозначает С1-6алкил; R3 обозначает необязательно замещенный фенил, 5- или 6-членную гетероарильную группу, или конденсированную бициклическую кольцевую систему, содержащую 9-10 кольцевых членов; R4 обозначает ОН, ОС1-4алкил или NR5R6. Соединения обладают антагонистическим действием в отношении окситоцина на окситоциновом рецепторе. Описаны также фармацевтическая композиция на основе соединения I, применение соединений I для получения лекарственного средства, способы получения соединений I. 7 н. и 9 з.п. ф-лы, 4 табл.
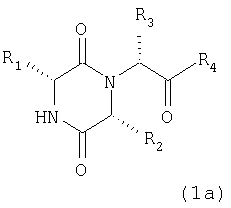
и/или его физиологически приемлемая соль,
где R1 обозначает 5-членную циклоалкильную группу, необязательно замещенную одной или несколькими гидроксильными группами, которая сконденсирована с необязательно замещенным бензольным кольцом;
R2 обозначает C1-6алкил;
R3 обозначает необязательно замещенный фенил, 5- или 6-членную гетероарильную группу, или конденсированную бициклическую кольцевую систему, содержащую 9-10 кольцевых членов, которая может представлять собой карбоциклическую группу или может содержать до 3 гетероатомов, выбранных из N, и одно из конденсированных колец является бензолом;
R4 обозначает ОН или ОС1-4алкил (необязательно замещенный С1-4алкилкарбонилокси) или NR5R6;
R5 обозначает водород, C1-6алкил (необязательно замещенный С1-4алкокси) или С3-7циклоалкил;
R6 обозначает водород, метил, С1-4алкокси, С3-7циклоалкил, С2-4алкил [необязательно замещенный одной или несколькими группами, выбранными из карбоксила, С1-4алкилсульфонила или С1-4алкоксикарбонила], С2-4алкил [необязательно замещенный одной или несколькими группами, выбранными из галогена, гидрокси, С1-4алкокси или NR7R8, где R7 и R8 независимо представляют водород или С1-4алкил, или вместе с атомом азота, к которому они присоединены, образуют 3-7-членное насыщенное гетероциклическое кольцо, которое может содержать дополнительный гетероатом, выбранный из О, S или N (и указанная гетероциклическая группа может быть замещена 1-3 группами, выбранными из C1-3алкила, гидрокси, С1-3алкокси (необязательно замещенного С3-6циклоалкилом или необязательно замещенного фенилом), С3-6циклоалкила или NRcRd, где Rc и Rd каждый независимо представляет группу, выбранную из С1-3алкила (необязательно замещенного С3-6циклоалкилом или необязательно замещенного фенилом) или С3-6циклоалкила)] или R6 обозначает фенильную или бензильную группу (необязательно замещенную одной или несколькими метокси- или бензилоксигруппами), или необязательно замещенную гетероарилметильную группу или гетероарильную группу, или С3-7циклоалкил, или группу CH2CONR9R10, где R9 обозначает водород или С1-4алкил, R10 обозначает водород, С1-4алкил, необязательно замещенный 5- или 6-членной гетероарильной группой, или R9, R10 и атом азота, к которому они присоединены, вместе образуют 5- или 6-членное насыщенное гетероциклическое кольцо, и где 6-членная гетероциклическая группа может содержать дополнительный гетероатом, выбранный из кислорода, серы или азота, и дополнительный атом азота либо несет атом водорода, либо С1-4алкильную или С1-4алканоильную группу; или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют 3-7-членное насыщенное гетероциклическое кольцо, гетероцикл которого может содержать дополнительный гетероатом, выбранный из кислорода, серы и азота, и где атом серы может быть в окисленном виде, например, SO2, и дополнительный атом азота либо несет атом водорода, либо С1-4алкильную или С1-4алканоильную группу, или С1-4алкилсульфонильную группу, или C1-3алкоксиС2-4алкил [указанные гетероциклические группы могут быть замещены одним или несколькими атомами галогена или группой, выбранной из C1-3алкила, гидрокси, оксо, С3-6циклоалкила или NReRf, где Re и Rf каждый независимо представляет группу, выбранную из C1-3 алкила (необязательно замещенного С3-6циклоалкилом или необязательно замещенного фенилом) или С3-6циклоалкила].
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид;
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид;
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-морфолинамид;
(2R)-2-(4-фторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид;
(2R)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-[4-(4-гидроксипиперидин-1-ил)фенил]этанамид;
(2R)-2-{(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-[(1R)-1-метилпропил]-2,5-диоксопиперазин-1-ил}-2-(2-фтор-4-морфолин-4-илфенил)-N-изопропилэтанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(4-фторфенил)-N-(2,2,2-трифторэтил)этанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид;
(2R)-N-циклопропил-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метилэтанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-морфолин-4-ил-2-оксоэтил]-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-(3-гидроксиазетидин-1-ил)-2-оксоэтил]-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(3R,6R)-1-[(1R)-2-азетидин-1-ил-1-(2,4-дифторфенил)-2-оксоэтил]-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-(2-гидроксиэтил)-N-метилэтанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-[2-(метилсульфонил)этил]этанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-(2,2,2-трифторэтил) этанамид;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метил-N-(пиридин-2-илметил)этанамид;
(3R,6R)-1-{(1R)-1-(2,4-дифторфенил)-2-[4-(метилсульфонил)пиперазин-1-ил]-2-оксоэтил}-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(2R)-2-(2,4-дифторфенил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-метокси-N-метилэтанамид;
(2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этановая кислота;
метил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат;
пропил (2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат;
1-(ацетилокси)этил(2R)-(2,4-дифторфенил)[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этаноат;
(2R)-N-(трет-бутил)-2-(2,4-дифторфенил)-2-{(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-[(1R)-1-метилпропил]-2,5-диоксопиперазин-1 -ил}этанамид;
(2R)-N-(трет-бутил)-2-(2,4-дифторфенил)-2-{(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-[(1S)-1-метилпропил]-2,5-диоксопиперазин-1-ил}этанамид;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-морфолин-4-ил-2-оксоэтил-3-(2,3-дигидро-1Н-инден-2-ил)-6-[(1S)-1-метилпропил]пиперазин-2,5-дион;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-морфолин-4-ил-2-оксоэтил]-3-(2,3-дигидро-1Н-инден-2-ил)-6-[(1R)-1-метилпропил]пиперазин-2,5-дион;
(3R,6R)-1-[(1R)-1-(2,4-дифторфенил)-2-(3-фторазетидин-1-ил)-2-оксоэтил]-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутилпиперазин-2,5-дион;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-[5-(трифторметил)-2-фурил] этанамид;
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-(5-метилтиен-2-ил)этанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-[5-(трифторметил)-2-фурил]этанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(2-метил-1,3-оксазол-4-ил)этанамид;
[3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-1-[(1R)-1-(2-метил-1,3-оксазол-4-ил)-2-морфолин-4-ил-2-оксоэтил]пиперазин-2,5-дион;
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(5-метилтиен-2-ил)этанамид;
(2S)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(3-фтор-5-метилтиен-2-ил)-N,N-диметилэтанамид;
(2R)-2-(1-бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид;
(2R)-2-(1,2,3-бензотиадиазол-6-ил)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид;
(2R)-2-(2,3-дигидро-1-бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропилэтанамид;
(2R)-2-(1,3-бензодиоксол-5-ил)-N-(трет-бутил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]этанамид;
(2R)-2-(бензофуран-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметил-2-(2-метил-1-бензофуран-5-ил)этанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N-изопропил-2-(2-метил-1-бензофуран-5-ил)этанамид;
(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-1-[(1R)-1-(2-метил-1-бензофуран-5-ил)-2-морфолин-4-ил-2-оксоэтил]пиперазин-2,5-дион;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(2-фтор-1-бензофуран-5-ил)-N,N-диметилэтанамид;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(2-фтор-1-бензофуран-5-ил)-N-изопропилэтанамид;
(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-1-[(1R)-1-(2-фтор-1-бензофуран-5-ил)-2-морфолин-4-ил-2-оксоэтил]-6-изобутилпиперазин-2,5-дион;
(2R)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-2-(1Н-индол-6-ил)-N,N-диметилэтанамид;
(2R)-2-(1-бензотиен-5-ил)-2-[(3R,6R)-3-(2,3-дигидро-1Н-инден-2-ил)-6-изобутил-2,5-диоксопиперазин-1-ил]-N,N-диметилэтанамид.
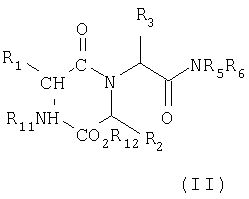
где R1, R2 и R3 имеют значения, определенные в формуле (Ia), R11 обозначает водород и R12 обозначает C1-3алкильную группу, в подходящем растворителе.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| ВПИТЫВАЮЩЕЕ ИЗДЕЛИЕ С ЭЛАСТОМЕРНЫМ МАТЕРИАЛОМ | 2003 |
|
RU2326639C2 |
Авторы
Даты
2007-07-20—Публикация
2002-12-20—Подача