Область изобретения
Настоящее изобретение относится к новым бициклическим гетероциклическим соединениям, к фармацевтическим композициям, включающим указанные соединения, и к применению указанных соединений для лечения заболеваний, например, рака.
Родственные заявки
Настоящая заявка является родственной: временной патентной заявке США № 61/477726, поданной 21 апреля 2011 года, и патентной заявке Великобритании № 1106817.8, поданной 21 апреля 2011 года, содержание которых включено в настоящую заявку посредством ссылки во всей их полноте.
Предпосылки изобретения
IAP семейство
Семейство белков-ингибиторов апоптоза (IAP) включает 8 членов, XIAP, cIAP1, cIAP2, NAIP, ILP2, ML-IAP, сурвирин и BRUCE (также известный как аполлон). Было показано, что члены IAP семейства ингибируют запрограммированную клеточную гибель через их способность к ингибированию непосредственно членов каспазного семейства апоптических ферментов, хотя точная роль всех 8 членов еще не полностью определена. Общей структурной особенностью всех членов IAP семейства является цинк-связывающая складка в молекуле ~70 аминокислот, называемая доменом бакуловирусного IAP повтора (BIR), который присутствует в одной из трех копий.
Многие взаимодействия между IAP и другими белками опосредованы через поверхностную бороздку в BIR домене. BIR домены могут быть классифицированы в соответствии с их пептид-связывающей специфичностью. Существуют три типа BIR доменов; домены III типа (способны к связыванию каспазных (и каспаза-подобных) пептидов со специфичностью в отношении пролина в третьем (P3) положении (например, XIAP BIR3), домены II типа (подобные доменам III типа, но без специфичности в отношении пролина, например, XIAP BIR2) и домены I типа (которые не связывают каспазы или подобные пептиды, например, XIAP BIR1) (Eckelman et al. Cell Death and Differentiation 2008; 15: 920-928). BIR представляют собой небольшие (~70 аминокислот) Zn-координированные домены, и различные белки используют их N-конец для взаимодействия с бороздками BIR доменов. Антагонисты BIR препятствуют связыванию каспаз с BIR и, таким образом, приводят к повышенной каспазной активности, индуцируя аутоубихитинирование и протеасомное расщепление IAP.
IAP чрезмерно экспрессируются во многих типах рака, включая ренальный рак, меланому, рак толстой кишки, рак легкого, рак молочной железы, рак яичника и рак предстательной железы (Tamm et al., Clin. Cancer Research 2000; 6(5): 1796-803), и вовлечены в опухолевый рост, патогенез и резистентность к химио- и лучевой терапии (Tamm 2000).
XIAP
XIAP представляет собой 57 кДа белок с тремя BIR доменами, второй и третий из которых связывают каспазы и цинковый палец RING-типа (E3 лигаза). XIAP связывает некоторые белки помимо каспаз, включая субстраты для лигирования, такие как TAK1 и кофактор TAB1, MURR1, вовлеченный в гомеостаз меди (Burstein et al., EMBO 2004; 23: 244-254), эндогенные ингибиторы, такие как второй активатор каспаз митохондриального происхождения (SMAC), и те, функция которых является менее ясной, такие как MAGE-D1, NRAGE (Jordan et al., J. Biol. Chem. 2001; 276: 39985-39989).
BIR3 домен связывает и ингибирует каспазу-9, апикальную каспазу в митохондриальном пути активации каспазы. Бороздка на поверхности BIR3 домена взаимодействует с N-концом малой субъединицы каспазы-9, фиксируя каспазу-9 в ее неактивной мономерной форме с недостаточным каталитическим сайтом (Shiozaki et al., Mol. Cell 2003; 11: 519-527).
Помимо связывания каспазы, XIAP также ингибирует апоптоз через другие механизмы. XIAP образует комплекс с TAK1 киназой и ее кофактором TAB1, что приводит к активации путей сигнальной трансдукции JNK и MAPK, приводя, в свою очередь, к активации NFκB (Sanna et al., Mol Cell Biol 2002; 22: 1754-1766). XIAP также активирует NFκB путем промотирования NFκB транслокации к ядру и расщепления IκB (Hofer-Warbinek et al., J. Biol. Chem. 2000; 275: 22064-22068, Levkau et al., Circ. Res. 2001; 88: 282-290).
Клетки, трансфицированные XIAP, способны блокировать запрограммированную клеточную гибель в ответ на различные апоптические стимулы (Duckett et al., EMBO 1996; 15: 2685-2694, Duckett et al., MCB 1998; 18: 608-615, Bratton, Lewis, Butterworth, Duckett and Cohen, Cell Death and Differentiation 2002; 9: 881-892).
XIAP повсеместно экспрессируется во всех нормальных тканях, но его уровень патологически повышается во многих типах острого и хронического лейкоза, раке предстательной железы, раке легкого, ренальном раке и других типах опухолей (Byrd et al., 2002; Ferreira et al., 2001; Hofmann et al., 2002; Krajewska et al., 2003; Schimmer et al., 2003; Tamm et al., 2000). В de novo остром миелогенном лейкозе (AML) экспрессия XIAP соотносится с миеломоноцитарными Французский-Американский-Британский (FAB) подтипами M4/M5 (P<0,05) и экспрессией моноцитных маркеров в AML бластах. Кроме того, было обнаружено, что XIAP чрезмерно экспрессируется в нормальных моноцитах, но не поддается обнаружению в гранулоцитах. В AML экспрессия XIAP была значительно ниже у пациентов с благоприятной, но не со средней или плохой цитогенетикой (n=74; P<0,05) (Tamm et al., Hematol. J. 2004; 5(6): 489-95).
Чрезмерная экспрессия делает клетки резистентными к нескольким терапевтическим средствам и ассоциируется с плохим клиническим результатом при заболевании, включая AML, ренальный рак, меланому (Tamm et al., Clin. Cancer Research 2000; 6: 1796-1803) и рак легкого (Hofmann et al., J. Cancer Res. Clin. Oncology 2002; 128(10): 554-60).
XIAP транслируется кэп-независимым механизмом инициации трансляции, который опосредован уникальным элементом последовательности внутреннего сайта входа в рибосому (IRES), расположенным в его 5' нетранслируемой области. Это делает возможной активную трансляцию мРНК XIAP в условиях клеточного стресса, когда большая часть синтеза клеточных белков ингибируется. Трансляционная активация XIAP в ответ на стресс повышает резистентность к индуцированному облучением некрозу клеток (Holcik et al., Oncogene 2000; 19: 4174-4177).
Ингибирование XIAP было исследовано in vitro несколькими методами, включая РНК сайленсинг, генный нокаут, миметики пептидных лигандов и малые молекулы-антагонисты, и, как было показано, промотирует апоптоз в качестве монотерапии и сенсибилизирует многие типы опухолей к химиотерапии, в том числе опухоли мочевого пузыря (Kunze et al., 2008; 28(4B): 2259-63). Мыши с XIAP-нокаутом рождаются с ожидаемой по Менделю частотой, без каких-либо очевидных физических или гистологических дефектов, и имеют нормальную продолжительность жизни (Harlin et al., Mol. Cell Biol. 2001; 21(10): 3604-3608). Это говорит о том, что отсутствие XIAP активности не является токсичным в нормальных тканях и предполагает терапевтическое окно для опухолевых клеток. Было замечено, что регуляция уровней cIAP1 и cIAP2 повышается у мышей с XIAP-нокаутом и может защитить от патологии через компенсаторный механизм, и это дает основание предположить, что pan-ингибирование может быть необходимым для функционального нокаута. Подобным образом, мыши с cIAP1 и cIAP2 нокаутом также являются асимптоматическими (Conze et al., Mol. Biol. Cell 2005; 25(8): 3348-56). В то время как отсутствие любого одного из IAP не продуцировало никакого явного фенотипа у мышей, делеция cIAP1 с cIAP2 или XIAP приводила к средней эмбрионной летальности (Moulin, EMBO J., 2012).
Эндогенные антагонисты IAP, такие как SMAC, применяются для подтверждения членов этого семейства в качестве мишеней для терапевтических средств. SMAC пептиды хемосенсибилизируют опухолевые клетки, и в комбинации с препаратами платины и лигандом, индуцирующим связанный с фактором α некроза опухоли апоптоз (TRAIL) в ксенотрансплантатах, приводят к замедлению роста опухоли (Fulda et al., Nat. Med. 2002; 808-815; Yang et al., Cancer Res. 2003; 63: 831-837).
Природный продукт, эмбеллин, был идентифицирован как связывающийся на поверхностной бороздке BIR3 домена XIAP с подобным сродством, как природный SMAC пептид. Эмбеллин индуцирует апоптоз в клеточных линиях in vitro и приводит к замедлению роста опухоли в ксенотрансплантатах (Nikolovska-Coleska et al., J. Med. Chem. 2004; 47(10): 2430-2440; Chitra et al., Chemotherapy 1994; 40: 109-113).
XIAP антисмысловые олигонуклеотиды были разработаны как терапевтические средства для солидных опухолей и гематологических злокачественных заболеваний. Как было показано in vitro, эти антисмысловые олигонуклеотиды снижают уровни экспрессии белка на ~70%, индуцируют апоптоз и сенсибилизируют клетки к химиотерапии и замедляют рост опухоли in vivo. Одно из этих средств, AEG351156, было исследовано в клинических испытаниях (Hu et al., Clin. Cancer Res. 2003; 9: 2826-2836; Cummings et al., Br. J. Рак 2005; 92: 532-538).
Малые молекулы-антагонисты XIAP, которые были разработаны, включают пептидомиметики, а также синтетические средства. Пептидомиметики направленно действуют на BIR3 домен, имитируя разрушение посредством SMAC связывания каспаза-9 с XIAP, и показали индукцию апоптоза в различных опухолевых клеточных линиях при применении в качестве отдельного средства, а также являются хемосенсибилизаторами, и в настоящее время проходят дополнительные клинические исследования (Oost et al., J. Med. Chem. 2004; 47: 4417-4426; Sun et al., Bioorg. Med. Chem. Lett. 2005; 15: 793-797).
Синтетические малые молекулы-антагонисты BIR3 и BIR2 доменов также демонстрируют противоопухолевую активность в некоторых различных моделях, включая индукцию апоптоза с аннексин-V окрашиванием и значения ИК50<10 мкМ против более чем одной трети панели NCI60 клеточных линий. XIAP антагонисты также индуцировали дозо-зависимую клеточную гибель первично-культивированных лейкозных клеток в 5 из 5 клеточных линий хронического лимфоцитарного лейкоза и в 4 из 5 клеточных линий острого миелогенного лейкоза (Schimmer et al., Рак Cell 2004; 5: 25-35; Berezovskaya et al., Cancer Res. 2005; 65(6): 2378-86).
Высокие уровни XIAP белка в опухолевых клеточных линиях обратно соотносится с чувствительностью к некоторым противораковым лекарственным средствам, в частности, цитарабину и другим нуклеозидам (Tamm et al., Clin. Cancer Research 2000; 6: 1796-1803). XIAP ингибирование усиливает TRAIL-индуцированную противоопухолевую активность в двух предклинических моделях панкреатического рака in vivo (Vogler 2008). Исследования генной экспрессии и трансфекции говорят о том, что повышенная экспрессия супрессора апоптоза XIAP играет важную роль в резистентности к аноикису и в выживании циркулирующих клеток карциномы предстательной железы человека, промотируя, таким образом, метастазы. Было обнаружено, что малые молекулы-антагонисты являются анти-метастатическими в этих моделях (Berezovskaya et al., Cancer Res. 2005; 65(6): 2378-86).
Также было обнаружено, что XIAP вовлечен в другие пути, ассоциированные с раком и другими заболеваниями, и для этого также могут быть полезны XIAP-таргетирующие средства. Активность E3 лигазы RING пальцевого домена XIAP может обеспечить связывание как с TAB1, так и находящимся на этом пути выше BMP рецептором (тип 1), и это говорит о том, что XIAP может передавать сигнал в TGF-β-опосредованном пути (Yamaguchi et al., EMBO 1999; 179-187). Было показано, что чрезмерная экспрессия киназы фокальной адгезии (FAK) приводят к повышенной регуляции экспрессии XIAP (Sonoda et al., J. Biol. Chem. 2000; 275: 16309-16315). E3 лигазы являются привлекательными терапевтическими мишенями, и в настоящее время разрабатываются молекулы, которые направленно действуют на эту активность в других белках, таких как MDM2 (Vassilev et al., Science 2004; 303: 844-848). Непосредственное или опосредованное ингибирование активности XIAP лигазы также может быть полезным для лечения рака и других заболеваний. Нарушенная регуляция передачи сигналов апоптоза, которая может быть результатом ингибирования функции IAP, заключающейся в контроле запрограммированной клеточной гибели, также вовлечена во многие заболевания, включая расстройства, ассоциированные с клеточной аккумуляцией (например, рак, аутоиммунное заболевание, воспаление и рестеноз), или расстройства, где чрезмерный апоптоз приводит к потере клеток (например, удар, сердечная недостаточность, нейродегенерация, такая как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, амиотрофический боковой склероз, СПИД, ишемия (удар, инфаркт миокарда) и остеопороз).
XIAP является важным апоптическим регулятором в экспериментальном аутоиммунном энцефаломиелите и потенциальной фармакологической мишенью для лечения аутоиммунных заболеваний, таких как рассеянный склероз (MS) (Moore et al., 2004; 203(1): 79-93). Опосредованный антисмысловыми нуклеотидами нокдаун XIAP приводит к регрессии паралича в животной модели MS, и это говорит о том, что лечения, мишенью которых является XIAP, и возможно другие IAP, могут быть полезными для лечения MS (Hebb et al., Curr. Drug Disc. Tech. 2008; 5(1): 75-7).
cIAP1, cIAP-2, XIAP и сурвирин чрезмерно экспрессируются в злокачественной плевральной мезотелиоме и являются ответственными за высокую степень резистентности культивированных клеток мезотелиомы к цисплатину. Уровни циркулирующего TNF-α значительно выше у пациентов с мезотелиомой до хирургического уменьшения массы опухоли по сравнению с уровнями после хирургической операции. TNF-α повышает уровни мРНК и белка IAP-1, IAP-2 и XIAP (Gordon et al., 2007). Повышающая регуляция NF-κb играет важную для выживания роль в мезотелиомах в ответ на воспалительные эффекты воздействия асбестовых волокон (Sartore-Bianchi et al., 2007). IAP антагонисты обладают потенциалом, задающим обратное развитие про-выживающего эффекта TNF-α.
Способность клеточных линий повышать экспрессию TNF-альфа достаточно, чтобы действовать аутокринным образом и убивать клетки, как только cIAP1 & 2 истощаются, считается важной для IAP активности (Nature Reviews Cancer (2010), 10(8), 561-74, Gryd-Hansen, M). In vivo, однако, некоторые типы опухолей окружены сетью про-воспалительных цитокинов, и, следовательно, опухолевые клетки, которые при истощении cIAP1/2 переключаются на клеточную гибель посредством апоптоза, могут приводиться в действие, направленное на апоптоз, посредством TNF-альфа (или другими цитокиновыми агонистами рецептора апоптоза), который уже продуцируется окружающими клетками в микроокружении опухоли, такими как опухоль-ассоциированные макрофаги, или самими опухолевыми клетками. Некоторые типы опухолей, такие как рак молочной железы, рак яичника и меланома, демонстрируют этот «воспалительный фенотип», потенциальное прицельное действие на который могут оказывать IAP антагонисты.
cIAP1 и cIAP2
Клеточные IAP (cIAP) 1 и 2 являются близкородственными членами IAP семейства с тремя BIR доменами, RING доменом и каспаза-рекрутинговым (CARD) доменом. Функциональный ядерный экспортный сигнал существует в CARD домене cIAP1, который, как оказалось, является важным для клеточной дифференциации (Plenchette et al., Blood 2004; 104: 2035-2043). Присутствие этого CARD домена является уникальным для cIAP1 и cIAP2, входящих в IAP семейство белков. Эти два гена находятся в тандеме на хромосоме 11q22, и, учитывая высокую степень их сходства, считают, что их происхождение имело место в результате генной дупликации.
cIAP1, такой как XIAP и сурвирин, широко экспрессируется в опухолевых клеточных линиях, и высокие уровни его экспрессии были обнаружены, в частности, в колоректальных раках, а также раке легкого, раке яичника, ренальном раке, раке ЦНС и молочной железы (Tamm et al., Clin. Cancer Res. 2000; 6: 1796-1803). Экспрессия cIAP2, как правило, более ограничена, и считают, что она регулируется через конститутивное убихитинирование и расщепление посредством cIAP1 (Conze et al., Mol. Biol. Cell 2005; 25(8): 3348-56; Mahoney et al., PNAS 2008; 105: 11778-11783). Иммуногистохимический и вестерн-блот анализ определили cIAP1 и cIAP2 как потенциальные онкогены, поскольку они оба чрезмерно экспрессируются в различных типах рака легкого с или без большого числа копий (Dia et al., Human Mol. Genetics 2003; 12(7): 791-801). По-видимому, уровень экспрессии cIAP1 преимущественно играет важную роль в низкой стадии аденокарциномы (Hofmann et al., J. Cancer Res. Clin. Oncology 2002; 128(10): 554-60).
Повышенные уровни cIAP1 и cIAP2 и пониженные уровни эндогенных ингибиторов ассоциируются с хеморезистентностью, как это наблюдали для XIAP. Было обнаружено, что чрезмерная экспрессия cIAP соотносится с in vitro резистентностью к ДНК алкилирующим средствам, таким как карбоплатин, цисплатин и ингибитор топоизомеразы VP-16 (Tamm et al., Clin. Cancer Res. 2000; 6: 1796-1803). Было обнаружено, что уровни cIAP1 и сурвирина являются высокими в клетках рака щитовидной железы после лечения цисплатином и доксорубицином. Клетки, резистентные к химиотерапии, такой как таксол, демонстрировали пониженную экспрессию SMAC и высвобождали минимальные количества этого белка из митохондрий. Было обнаружено, что даун-регуляция cIAP1 и сурвирина повышает цитотоксичность цисплатина и доксорубицина, тогда как чрезмерная экспрессия SMAC повышает эффективность таксола. Однако сайленсинг cIAP1 и сурвирина посредством РНК интерференции восстанавливал чувствительность к доксорубицину и цисплатину (Tirrò et al.; Cancer Res. 2006; 66(8): 4263-72).
Изначально считалось, что SMAC миметики, такие как LBW242, преимущественно нацелены на XIAP. Однако исследования показали, что cIAP1 является мишенью для расщепления путем аутоубихитинирования в клетках (Yang et al., J. Biol. Chem. 2004; 279(17): 16963-16970) и мог способствовать апоптическим эффектам, которые имели место. Было обнаружено, что siРНК cIAP1 и индукция (или стимуляция) Фактора Некроза Опухоли (TNF)-альфа объединяются синергетически и делают клеточные линии более чувствительными (Gaither et al. Cancer Res. 2007; 67 (24): 11493-11498).
cIAP1 и cIAP2, как было продемонстрировано, являются критическими регуляторами сигнального пути NFκB, который вовлечен в различные биологические процессы, в частности, во врожденный и приобретенный иммунитет, а также в пролиферацию и выживание. Нарушение регуляции NFκB пути ассоциируется с воспалением и раковыми заболеваниями, включая гепатит и язвенный колит, гастрит, гепатоклеточную карциному колоректальный рак и различные типы гастрального рака, а также ангиогенез и метастазы (Shen et al., Апоптоз 2009; 14: 348-363).
При связывании с лигандом, TNF Рецептор (TNFR) осуществляет рекрутинг TNFR-ассоциированного Домена Апоптоза (TRADD) и взаимодействующего с рецептором белка (RIP) 1. Затем следует рекрутмент TRAF2 и cIAP1/cIAP2 с образованием большого мембранного комплекса. RIP1 убихитинируется, и эти полиубихитиновые цепи служат в качестве стыковочного сайта для действующих по ходу транскрипции киназ, приводя к эффектам пути передачи сигнала NFκB (Ea et al., Mol. Cell 2006; 22: 245-257; Wu et al., Nat. Cell Biol. 2006; 8: 398-406). Более широкие роли являются сложными и еще полностью не определены, но cIAP1 и cIAP2 определены в качестве ключевых компонентов TNF-альфа-опосредованной регуляции сигнального пути NFκB, а также конститутивного (лиганд-независимого/классического) сигнального пути NFκB (Varfolomeev et al., Cell 2007; 131(4): 669-81). Было показано, что cIAP1 и cIAP2 связываются с TRAF2, адаптерным белком, который функционирует как в классическом, так и в альтернативном NFκB путях, а также в MAPK сигнальном пути (Rothe et al., Cell 2005; 83: 1243-1252). cIAP1 и cIAP2 непосредственно нацелены на RIP1 для убихитинирования in vitro (Betrand et al., Mol. Cell 2008; 30: 689-700).
TNF-альфа регулирует многие клеточные функции, включая апоптоз, воспаление, иммунный ответ и клеточный рост и дифференциацию (Trace et al., Annu. Rev. Med. 1994; 45: 491-503), и терапевтические IAP антагонисты могут быть полезны при состояниях, где эти функции поражаются.
Продукцию TNF-альфа наблюдают во многих злокачественных опухолях, и он является одним из ключевых драйверов связанного с раком воспаления, который направляет развитие и/или прогрессирование опухоли. cIAP защищают раковые клетки от летальных эффектов TNF-альфа.
NAIP
NAIP был первым IAP, который был обнаружен (Roy et al., Cell 1995; 80: 167-178). NAIP является уникальным среди IAP, поскольку он обладает нуклеотид-связывающим и олигомеризационным доменом, а также лейцин-обогащенными повторами, аналогичными тем, которые содержатся в белках, обычно вовлеченных в врожденный иммунитет. Существуют показания, что NAIP также может чрезмерно экспрессироваться в некоторых типах рака, включая рак молочной железы и эзофагеальный рак (Nemoto et al., Exp. Mol. Pathol. 2004; 76(3): 253-9), а также MS (Choi et al., J. Korean Med. 2007; 22 Suppl: S17-23; Hebb et al., Mult. Sclerosis 2008; 14(5): 577-94).
ML-IAP
Ингибитор белка апоптоза меланомы (ML-IAP) содержит один BIR и RING пальцевый мотив. ML-IAP представляет собой сильный ингибитор апоптоза, индуцируемый рецепторами апоптоза и химиотерапевтическими средствами, возможно функционирующий как непосредственный ингибитор действующих по ходу транскрипции эффекторных каспаз (Vucic et al., Curr. Biol. 2000; 10(21): 1359-66). ML-IAP также известен как Бакуловирусный IAP повтор-содержащий белок 7 (BIRC7), ингибитор белка апоптоза почек (KIAP), белок Ring пальца 50 (RNF50) и Ливин. BIR домен ML-IAP содержит эволюционно сохранившуюся складку в молекуле, которая необходима для анти-апоптической активности. Было обнаружено, что большинство меланомных клеточных линий экспрессируют высокие уровни ML-IAP в отличие от первичных меланоцитов, которые экспрессировали неопределяемые уровни. Эти меланомные клетки были значительно более резистентными к лекарственно-индуцируемому апоптозу. Повышенная экспрессия ML-IAP делает меланомные клетки резистентными к апоптическим стимулам и, таким образом, потенциально способствует патогенезу этого злокачественного развития.
ILP-2
ILP-2, также известный как BIRC8, содержит один BIR домен и RING домен. ILP-2 экспрессируется только в мужских половых железах в нормальных клетках и связывается с каспазой 9 (Richter et al, Mol. Cell. Biol. 2001; 21: 4292-301).
Сурвирин
Сурвирин, также известный как BIRC5, ингибирует как каспазу 3, так и каспазу 7, но его основной функцией является регуляция митотической прогрессии, а не регуляция апоптоза. Сурвирин промотирует образование микротрубочек в митотическом веретене, противодействуя апоптозу на протяжении клеточного цикла. Ингибирование апоптоза сурвирином является плохим прогнозом при колоректальном раке (Kawasaki et al., Cancer Res. 1998; 58(22): 5071-5074) и стадии III рака желудка (Song et al., Japanese J. Clin. Oncol. 2009; 39(5): 290-296).
BRUCE
BRUCE (BIR повтор-содержащий убихитин-конъюгирующий фермент) представляет собой периферический мембранный белок в транс-Гольджи сети с одним BIR доменом, наиболее схожим с присутствующим в сурвирине. BRUCE ингибируется через три механизма: (i) SMAC связывание, (ii) HtrA2 протеаза и (iii) каспаза-опосредованное расщепление. Кроме того, BRUCE действует как E2/E3 убихитинлигаза через убихитин-конъюгирующий (UBC) домен.
Краткое описание изобретения
Настоящее изобретение обеспечивает соединения формулы (I). Настоящее изобретение обеспечивает соединения, которые являются полезными в терапии, в частности, для лечения рака. Соединения формулы (I) могут быть антагонистами IAP семейства белков (IAP), и особенно XIAP, и/или cIAP (таких как cIAP1 и/или cIAP2) и могут быть полезными для лечения IAP-опосредованных состояний.
В соответствии с первым аспектом настоящего изобретения, обеспечивается соединение формулы (I):
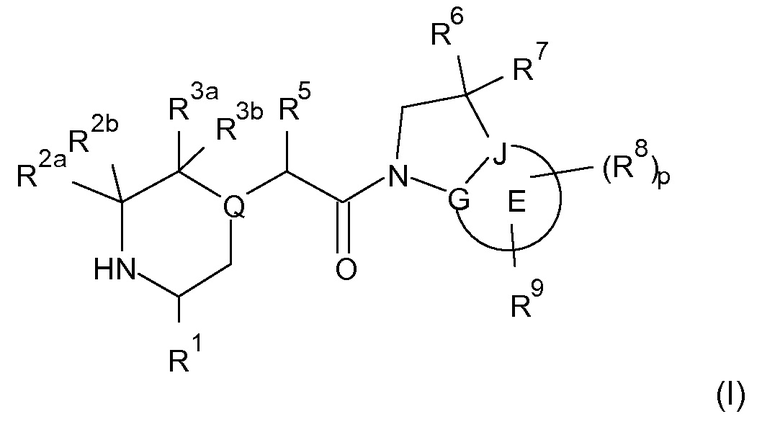
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где
Кольцо E представляет собой 6-членную ароматическую карбоциклическую или гетероциклическую группу;
G и J независимо выбраны из C или N;
Q представляет собой CR4 или N;
R1 выбран из C1-4 алкила, C2-4 алкенила и -(CH2)s-C3-8 циклоалкила, где указанный C1-4 алкил, C2-4 алкенил и C3-8 циклоалкил, необязательно, может быть замещен одной или несколькими группами Ra;
Ra выбран из галогена, -OH и -O-C1-6алкила;
R2a и R2b независимо выбраны из водорода, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил) и -(CH2)s-C3-12 карбоциклила,
или R2a и R2b группы, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-10-членной насыщенной карбоциклической или гетероциклической группы, где указанные C1-6 алкильные, C2-6 алкенильные, C2-6 алкинильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb;
R3a и R3b независимо выбраны из водорода, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил), -(CH2)s-C3-12 карбоциклила, -C(=O)-(3-12-членный гетероциклил) и -C(=O)-C3-12 карбоциклила,
или R3a и R3b группы, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-10-членной насыщенной карбоциклической или гетероциклической группы, где указанные C1-6 алкильные, C2-6 алкенильные, C2-6 алкинильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb;
R4 выбран из водорода, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил), -(CH2)s-C3-12 карбоциклила, -C(=O)-(3-12-членный гетероциклил) и -C(=O)-C3-12 карбоциклила, где указанные C1-6 алкильные, C2-6 алкенильные, C2-6 алкинильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb;
R5 выбран из водорода, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -(CH2)s-C3-8 циклоалкила и -(CH2)s-C3-8 циклоалкенила, где указанный C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил и C3-8 циклоалкенил, необязательно, может быть замещен одной или несколькими группами Ra;
R6 и R7 независимо выбраны из водорода, C1-8 алкила, C2-8 алкенила, C2-8 алкинила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz, -(CH2)s-CN, -S(O)q-Rx, -C(=O)Rx, -C(=S)Rx, -C(=N)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy, -(CH2)s-NRxRy, -NRx-(CH2)s-Rz, -(CRxRy)s-C(=S)NRz, -(CRxRy)s-C(=N)NRz, -(CH2)s-O-C(=O)-C1-4алкил-NRxRy, -(CH2)s-NRx-(CH2)n-O-C(=O)-Rz, -(CH2)s-NRx-(CH2)s-SO2-Ry, -(CH2)s-NH-SO2-NRxRy и -(CH2)s-SO2NRxRy групп,
или R6 и R7 группы, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-10-членной частично или полностью насыщенной карбоциклической или гетероциклической группы, и которая, необязательно, может быть конденсирована с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом,
где указанные C1-8 алкильные, C2-8 алкенильные и C2-8 алкинильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb;
R8 и R9 независимо выбраны из водорода, галогена, C1-8 алкила, C2-8 алкенила, C2-8 алкинила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz, =O, =S, нитро, Si(Rx)4, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -C(=O)Rx, -C(=S)Rx, -C(=N)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy, -(CH2)s-NRxRy, -NRx-(CH2)s-Rz, -(CRxRy)s-C(=S)NRz, -(CRxRy)s-C(=N)NRx, -S(O)(=NRx)Ry, -(CH2)s-O-C(=O)-C1-4алкил-NRxRy, -(CH2)s-NRx-(CH2)n-O-C(=O)-Rz, -(CH2)s-NRx-(CH2)s-SO2-Ry, -(CH2)s-NH-SO2-NRxRy, -(CH2)s-SO2NRxRy групп и -P(=O)(Rx)2, где указанные C1-8 алкильные, C2-8 алкенильные и C2-8 алкинильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb;
Rb независимо выбран из галогена, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, -(CH2)s-C3-8 циклоалкила, -(CH2)s-C3-8 циклоалкенила, -(CH2)s-фенила, -(CH2)s-(4-7-членный насыщенный гетероциклил), -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz, галогенC1-6 алкила, галогенC1-6 алкокси, C1-6 алканола, =O, =S, нитро, Si(Rx)4, -(CH2)s-CN, -S(O)q-Rx, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy -(CH2)s-NRxRy, -NRx-(CH2)s-Rz, -(CH2)s-O-C(=O)-C1-4алкил-NRxRy, -(CH2)s-NRx-(CH2)n-O-C(=O)-Rz, -(CH2)s-NRx-(CH2)s-SO2-Ry, -(CH2)s-NH-SO2-NRxRy, -(CH2)s-SO2NRxRy групп и -P(=O)(Rx)2, где указанные C1-6 алкильные, C2-6 алкенильные, C2-6 алкинильные, C3-8 циклоалкильные, C3-8 циклоалкенильные и гетероциклические группы, необязательно, могут быть замещены одной или несколькими группами Rx;
Rx, Ry и Rz независимо представляют собой галоген, водород, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-C3-8 циклоалкенил, -(CH2)s-фенил, -(CH2)s-(4-7-членный насыщенный гетероциклил), C1-6 алканол, необязательно замещенный одним или несколькими галогенами, -C(=O)OC1-6 алкил, гидрокси, C1-6 алкокси, галогенC1-6 алкил, -(CH2)n-O-C1-6алкил, -C(=O)-(CH2)n-C1-6алкокси, -C(=O)-C1-6алкил, -(CH2)s-CN, C1-6 алкил-N(H)2-q(C1-6алкил)q, -N(H)2-q(C1-6алкил)q, -C(=O)-N(H)2-q(C1-6алкил)q, -(CH2)s-NH-SO2-N(H)2-q (C1-6алкил)q, -(CH2)s-N(C1-4алкил)-SO2-N(H)2-q(C1-6алкил)q и -(CH2)s-O-C(=O)-C1-4алкил-N(H)2-q(C1-6алкил)q, и, когда они связаны с атомом азота, углерода, кремния или фосфора, Rx и Ry могут объединяться с образованием 3-7-членного кольца, необязательно содержащего один или два дополнительных гетероатома, выбранных из O, N, S и окисленных форм N или S;
Y и Z независимо выбраны из связи, -(CRxRy)m-, -C(=CRx)-, -C(=O)-, -NRx, -C(=O)NRx-, -NRxC(=O)-, -(CRxRy)q-O-, -O-(CRxRy)q-, -S(O)2-NH, NH-S(O)2- и -S(O)q-;
s независимо представляет собой целое число, имеющее значение 0-4;
n независимо представляет собой целое число, имеющее значение 1-4;
p независимо представляет собой целое число, имеющее значение 0-4;
q представляет собой целое число, имеющее значение 0-2; и
m представляет собой целое число, имеющее значение 1-2.
В следующем аспекте настоящего изобретения обеспечиваются соединение формулы (I) для применения в профилактике или лечении заболевания или состояния, описанного в настоящей заявке, фармацевтические композиции, включающие соединение формулы (I), и способы синтеза соединения формулы (I).
Определения
Если в контексте не указано иное, ссылки на формулу (I) во всех разделах настоящего документа (включая применения, способы и другие аспекты настоящего изобретения) включают ссылки на все другие подформулы, подгруппы, предпочтения, варианты воплощения и примеры, определенные в настоящей заявке.
Под “IAP” подразумевается любой из членов IAP семейства XIAP, cIAP (cIAP1 и/или cIAP2), NAIP, ILP2, ML-IAP, сурвирин и/или BRUCE, в частности, XIAP, cIAP1, cIAP2, ML-IAP, более конкретно, XIAP, cIAP1 и/или cIAP2, особенно XIAP и/или cIAP1. В частности, подразумеваются BIR домены IAP, в особенности, BIR домены XIAP, cIAP1 или cIAP2.
Под выражением “один или несколько членов IAP семейства” подразумеваются любые из членов IAP семейства, в частности, XIAP, cIAP1 и/или cIAP2, более конкретно, XIAP и/или cIAP1.
“Действенность” представляет собой показатель активности лекарственного средства, выражаемый как количество, необходимое для обеспечения эффекта определенной силы. Высокодейственное лекарственное средство вызывает более сильный ответ при низких концентрациях. Действенность пропорциональна сродству и эффективности. Сродство означает способность лекарственного средства к связыванию с рецептором. Эффективность означает взаимосвязь между занятостью рецептора и способностью инициировать ответ на молекулярном, клеточном, тканевом или системном уровне.
Термин “антагонист” относится к типу лиганда рецептора или лекарственного средства, который блокирует или подавляет агонист-опосредованные биологические ответы. Антагонисты обладают сродством, но не агонистической эффективностью в отношении их родственных рецепторов, и связывание будет разрушать взаимодействие и ингибировать функцию любого лиганда (например, эндогенных лигандов или субстратов, агониста или обратного агониста) на рецепторах. Антагонизм может возникать непосредственно или опосредованно и может быть опосредован любым механизмом и на любом физиологическом уровне. Примером опосредованного антагонизма может быть опосредованный антагонизм cIAP как результат убихинирования cIAP, в результате чего происходит его расщепление. Как результат, антагонизм лигандов может в разных обстоятельствах проявляться функционально различными путями. Антагонисты опосредуют их эффекты путем связывания с активным сайтом или с аллостерическими сайтами на рецепторах, или они могут взаимодействовать на уникальных сайтах связывания, которые в нормальных условиях не вовлечены в биологическую регуляцию активности рецептора. Антагонистическая активность может быть обратимой или необратимой, в зависимости от долговечности комплекса антагонист-рецептор, которая, в свою очередь, зависит от природы связывания антагониста с рецептором.
Термин «лечение», как он используется в настоящей заявке в контексте лечения состояния, т.е. состояния, расстройства или заболевания, как правило, относится к лечению и терапии, либо в применении к человеку, либо животному (например, для применения в ветеринарии), при котором достигается некоторый желаемый терапевтический эффект, например, ингибирование прогрессирования состояния, и включает уменьшение скорости прогрессирования, задержку скорости прогрессирования, улучшение состояния, ослабление или облегчение по меньшей мере одного симптома, связанного с, или вызванного, состоянием, подлежащего лечению, и излечение такого состояния. Например, лечение может означать ослабление одного или нескольких симптомов расстройства или полную ликвидацию расстройства.
Термин “профилактика” (т.е. применение соединения для профилактических целей), как он используется в настоящей заявке в контексте лечения состояния, т.е. состояния, расстройства или заболевания, как правило, относится к профилактике или предотвращению, либо в применении к человеку, либо животному (например, для применения в ветеринарии), при котором достигается некоторый желаемый превентивный эффект, например, предотвращение возникновения заболевания или защита от заболевания. Профилактика включает полное и общее блокирование всех симптомов расстройства на неопределенный период времени, просто замедление возникновения одного или нескольких симптомов заболевания или обеспечение меньшей вероятности возникновения заболевания.
Ссылки на профилактику или лечение заболевания или состояния, такого как рак, включают в своем объеме облегчение симптомов или уменьшение вероятности возникновения рака.
Как он используется в настоящей заявке, термин “опосредованный”, используемый, например, в связи с IAP, как описано в настоящей заявке (и в применении, например, к различным физиологическим процессам, заболеваниям, состояниям, терапиям, лечениям или вмешательствам) следует рассматривать как ограничительный, т.е. различные процессы, заболевания, состояния, лечения и вмешательства, к которым применим этот термин, представляют собой такие, в которых этот белок играет биологическую роль. В случаях, когда термин применяют к заболеванию или состоянию, биологическая роль, которую выполняет белок, может быть непосредственной или опосредованной и может быть необходимой и/или достаточной для проявления симптомов заболевания или состояния (или его этиологии или прогрессирования). Таким образом, функция белка (и, в частности, аберрантные уровни функции, например, чрезмерная или недостаточная экспрессия) необязательно должна быть проксимальной причиной заболевания или состояния: скорее считается, что опосредованные заболевания или состояния включают такие, которые имеют полифакториальные этиологии и комплексные прогрессирования, в которых определенный рассматриваемый белок только частично вовлечен. В случаях, когда термин применяют к лечению, профилактике или вмешательству, роль, которую играет белок, может быть непосредственной или опосредованной и может быть необходимой и/или достаточной для действия лечения, профилактики или результата вмешательства. Таким образом, заболевание или состояние, опосредованное белком, включает развитие резистентности к любому конкретному противораковому лекарственному средству или лечению.
Термин 'необязательно замещенный', используемый в настоящей заявке, относится к группе, которая может быть замещенной или незамещенной заместителем, определенным в настоящей заявке.
Префикс “Cx-y” (где x и y представляют собой целые числа), используемый в настоящей заявке, относится к количеству атомов углерода в указанной группе. Таким образом, C1-6 алкильная группа содержит от 1 до 6 атомов углерода, C3-6 циклоалкильная группа содержит от 3 до 6 атомов углерода, C1-4 алкокси группа содержит от 1 до 4 атомов углерода и т.д.
Термин 'гало' или 'галоген', используемый в настоящей заявке, относится к фтору, хлору, брому или иоду.
Термин 'нитро', используемый в настоящей заявке, относится к NO2 группе.
Термин 'C1-4алкил', 'C1-6алкил' или 'C1-8алкил', используемый в настоящей заявке, как группа или часть группы, относится к линейной или разветвленной насыщенной углеводородной группе, содержащей от 1 до 4, от 1 до 6 или от 1 до 8 атомов углерода, соответственно. Примеры таких групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил или гексил и т.п.
Термин 'C2-4алкенил', 'C2-6алкенил' или 'C2-8алкенил', используемый в настоящей заявке, как группа или часть группы, относится к линейной или разветвленной углеводородной группе, содержащей от 2 до 4, от 2 до 6 или от 2 до 8 атомов углерода, соответственно, и содержащей углерод-углеродную двойную связь. Примеры таких групп включают C3-4алкенильные или C3-6алкенильные группы, такие как этенил (винил), 1-пропенил, 2-пропенил (аллил), изопропенил, бутенил, бута-1,4-диенил, пентенил и гексенил.
Термин 'C2-6алкинил' или 'C2-8алкинил', используем в настоящей заявке, как группа или часть группы, относится к линейной или разветвленной углеводородной группе, содержащей от 2 до 6 или от 2 до 8 атомов углерода, соответственно, и содержащей углерод-углеродную тройную связь. Примеры таких групп включают C3-4алкинил или C3-6алкинильные группы, такие как этинильные и 2 пропинильные (пропаргил) группы.
Термин 'C1-4алкокси' или 'C1-6алкокси', используемый в настоящей заявке, как группа или часть группы, относится к -O-C1-4алкильной или -O-C1-6алкильной группе, где C1-4алкил и C1-6алкил имеют значение, определенное в настоящей заявке. Примеры таких групп включают метокси, этокси, пропокси, бутокси и т.п.
Термин 'C1-6алканол', используемый в настоящей заявке, как группа или часть группы, относится к C1-6 алкильной группе, определенной в настоящей заявке, где один или более чем один атом водорода замещен гидроксильной группой.
Термин 'C3-8циклоалкил', используемый в настоящей заявке, относится к насыщенному моноциклическому углеводородному кольцу, включающему от 3 до 8 атомов углерода. Примеры таких групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил и т.п.
Термин 'C3-8циклоалкенил', используемый в настоящей заявке, относится к моноциклическому углеводородному кольцу, включающему от 3 до 8 атомов углерода, содержащему углерод-углеродную двойную связь.
Термин 'галогенC1-4алкил' или 'галогенC1-6алкил', используемый в настоящей заявке, как группа или часть группы, относится к C1-4алкильной или C1-6алкильной группе, определенной в настоящей заявке, где один или более чем один атом водорода замещен галогеном. Термины 'галогенC1-4алкил' или 'галогенC1-6алкил' поэтому включают моногалогенC1-6алкил, а также полигалогенC1-6алкил. Один, два, три или более атомов водорода могут быть замещены галогеном, таким образом, галогенC1-4алкил или галогенC1-6алкил могут содержать один, два, три или более атомов галогена. Примеры таких групп включают фторэтил, фторметил, трифторметил или трифторэтил и т.п.
Термин 'галогенC1-6алкокси', используемый в настоящей заявке, как группа или часть группы, относится к -O-C1-6 алкильной группе, определенной в настоящей заявке, где один или более чем один атом водорода замещен галогеном. Термин 'галогенC1-6алкокси' поэтому включает моногалогенC1-6алкокси, а также полигалогенC1-6алкокси. Один, два, три или более атомов водорода могут быть замещены галогеном, таким образом, галогенC1-6алкокси может содержать один, два, три или более атомов галогена. Примеры таких групп включают фторэтилокси, дифторметокси или трифторметокси и т.п.
Термин “гетероциклил” и “карбоциклил”, используемый в настоящей заявке, если в контексте не указано иное, включает как ароматические, так и не-ароматические кольцевые системы. Таким образом, например, термины “гетероциклическая группа” и “карбоциклическая группа” охватывают своим объемом ароматические, неароматические, ненасыщенные, частично насыщенные и полностью насыщенные карбоциклические или гетероциклические кольцевые системы. Как правило, если в контексте не указано иное, такие группы могут быть моноциклическими или бициклическими (включая конденсированные и связанные мостиковой связью бициклические группы) и могут содержать, например, от 3 до 12 кольцевых членов, более типично от 5 до 10 кольцевых членов. Ссылки на от 4 до 7 кольцевых членов включают 4, 5, 6 или 7 атомов в кольце, и ссылки на от 4 до 6 кольцевых членов включают 4, 5 или 6 атомов в кольце. Примеры моноциклических групп включают группы, содержащие 3, 4, 5, 6, 7 и 8 кольцевых членов, более типично от 3 до 7 или от 4 до 7, и предпочтительно 5, 6 или 7 кольцевых членов, более предпочтительно 5 или 6 кольцевых членов. Примеры бициклических групп включают группы, содержащие 8, 9, 10, 11 и 12 кольцевых членов, и более типично 9 или 10 кольцевых членов. Гетероциклические группы могут представлять собой гетероарильные группы, содержащие от 5 до 12 кольцевых членов, более типично от 5 до 10 кольцевых членов. Когда в настоящем описании делается ссылка на гетероциклические или карбоциклические группы, гетероциклическое или карбоциклическое кольцо может быть, если в контексте не указано иное, необязательно замещенным, т.е. незамещенным или замещенным одним или несколькими (например, 1, 2, 3 или 4, в частности, одним или двумя) заместителями, определенными в настоящей заявке.
Гетероциклическая группа может представлять собой, например, пятичленное или шестичленное моноциклическое кольцо или бициклическую структуру, образованную из конденсированных пяти- и шестичленного колец или двух конденсированных шестичленных колец или двух конденсированных пятичленных колец. Каждое кольцо может содержать до пяти гетероатомов, типично выбранных из азота, серы и кислорода. Типично, гетероциклическое кольцо содержит до 4 гетероатомов, более типично до 3 гетероатомов, более типично до 2, например, только один гетероатом. В одном варианте воплощения, гетероциклическое кольцо содержит один или два гетероатома выбраных из N, O, S и окисленных форм N или S. В одном варианте воплощения, гетероциклическое кольцо содержит по меньшей мере один кольцевой атом азота. Атомы азота в гетероциклических кольцах могут быть основными, как в случае имидазола или пиридина, или по существу не-основными, как в случае азота индола или пиррола. Как правило, количество основных атомов азота, присутствующих в гетероциклической группе, включая любые амино заместители в кольце, должно быть меньше пяти.
Гетероциклические группы могут быть присоединены через атом углерода или гетероатом (например, азот). Также, гетероциклические группы могут быть замещены по атому углерода или по гетероатому (например, азоту).
Термин “гетероарил” используется в настоящей заявке для обозначения гетероциклической группы, имеющей ароматический характер. Термин “гетероарил” охватывает полициклические (например, бициклические) кольцевые системы, где одно или несколько колец являются неароматическими, при условии, что по меньшей мере одно кольцо является ароматическим. В таких полициклических системах группа может быть присоединена при помощи ароматического кольца или при помощи неароматического кольца.
Примеры гетероарильных групп включают моноциклические и бициклические группы, содержащие от пяти до двенадцати кольцевых членов, и более типично от пяти до десяти кольцевых членов.
Примеры пятичленных гетероарильных групп включают, но не ограничиваются этим, пиррольные, фурановые, тиофеновые, имидазольные, фуразановые, оксазольные, оксадиазольные, оксатриазольные, изоксазольные, тиазольные, тиадиазольные, изотиазольные, пиразольные, триазольные и тетразольные группы.
Примеры шестичленных гетероарильных групп включают, но не ограничиваются этим, пиридин, пиразин, пиридазин, пиримидин и триазин.
Бициклическая гетероарильная группа может представлять собой, например, группу, выбранную из следующих:
a) бензольное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 1, 2 или 3 кольцевых гетероатома;
b) пиридиновое кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1, 2 или 3 кольцевых гетероатома;
c) пиримидиновое кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1 или 2 кольцевых гетероатома;
d) пиррольное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1, 2 или 3 кольцевых гетероатома;
e) пиразольное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1 или 2 кольцевых гетероатома;
f) имидазольное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1 или 2 кольцевых гетероатома;
g) оксазольное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1 или 2 кольцевых гетероатома;
h) изоксазольное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1 или 2 кольцевых гетероатома;
i) тиазольное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1 или 2 кольцевых гетероатома;
j) изотиазольное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1 или 2 кольцевых гетероатома;
k) тиофеновое кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1, 2 или 3 кольцевых гетероатома;
l) фурановое кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 0, 1, 2 или 3 кольцевых гетероатома;
m) циклогексильное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 1, 2 или 3 кольцевых гетероатома; и
n) циклопентильное кольцо, конденсированное с 5- или 6-членным кольцом, содержащим 1, 2 или 3 кольцевых гетероатома.
Конкретные примеры бициклических гетероарильных групп, содержащих пятичленное кольцо, конденсированное с другим пятичленным кольцом, включают, но не ограничиваются этим, имидазотиазол (например, имидазо[2,1-b]тиазол) и имидазоимидазол (например, имидазо[1,2-a]имидазол).
Конкретные примеры бициклических гетероарильных групп, содержащих шестичленное кольцо, конденсированное с пятичленным кольцом, включают, но не ограничиваются этим, бензофурановые, бензотиофеновые, бензимидазольные, бензоксазольные, изобензоксазольные, бензизоксазольные, бензотиазольные, бензизотиазольные, изобензофурановые, индольные, изоиндольные, индолизиновые, индолиновые, изоиндолиновые, пуриновые (например, адениновые, гуаниновые), индазольные, пиразолопиримидиновые (например, пиразоло[1,5-a]пиримидиновые), триазолопиримидиновые (например, [1,2,4]триазоло[1,5-a]пиримидиновые), бензодиоксольные, имидазопиридиновые и пиразолопиридиновые (например, пиразоло[1,5-a]пиридиновые) группы.
Конкретные примеры бициклических гетероарильных групп, содержащих два конденсированных шестичленных кольца, включают, но не ограничиваются этим, хинолиновые, изохинолиновые, хромановые, тиохромановые, изохромановые, хроменовые, изохроменовые, бензодиоксановые, хинолизиновые, бензоксазиновые, пиридопиридиновые, хиноксалиновые, хиназолиновые, циннолиновые, фталазиновые, нафтиридиновые и птеридиновые группы.
Примеры полициклических гетероарильных групп, содержащих ароматическое кольцо и неароматическое кольцо, включают тетрагидроизохинолиновые, тетрагидрохинолиновые, дигидробензтиофеновые, дигидробензофурановые, 2,3-дигидробензо[1,4]диоксиновые, бензо[1,3]диоксоловые, 4,5,6,7-тетрагидробензофурановые, тетрагидротриазолопиразиновые (например, 5,6,7,8-тетрагидро-[1,2,4]триазоло[4,3-a]пиразин), хромановые, тиохромановые, изохромановые, хроменовые, изохроменовые, бензодиоксановые, бензоксазиновые, бензодиазепиновые и индолиновые группы.
Азотсодержащее гетероарильное кольцо может содержать по меньшей мере один кольцевой атом азота. Азотсодержащее гетероарильное кольцо может быть N-связанным или C-связанным. Это кольцо может, кроме того, содержать приблизительно до четырех других гетероатомов типично выбранных из азота, серы и кислорода. Типично гетероарильное кольцо содержит до 3 гетероатомов, например, 1, 2 или 3, более типично до 2 атомов азота, например, один атом азота. Атомы азота в гетероарильных кольцах могут быть основными, как в случае имидазола или пиридина, или по существу не-основными, как в случае азота индола или пиррола. Как правило, количество основных атомов азота, присутствующих в гетероарильной группе, включая любые амино-заместители кольца, должно быть меньше пяти.
Примеры азотсодержащих гетероарильных групп включают, но не ограничиваются этим, пиридил, пирролил, имидазолил, оксазолил, оксадиазолил, тиадиазолил, оксатриазолил, изоксазолил, тиазолил, изотиазолил, фуразанил, пиразолил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил (например, 1,2,3-триазолил, 1,2,4-триазолил), тетразолил, хинолинил, изохинолинил, бензимидазолил, бензоксазолил, бензизоксазол, бензотиазолил и бензизотиазол, индолил, 3H-индолил, изоиндолил, индолизинил, изоиндолинил, пуринил (например, аденин [6-аминопурин], гуанин [2-амино-6-гидроксипурин]), индазолил, хинолизинил, бензоксазинил, бензодиазепинил, пиридопиридинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил и птеридинил.
Примеры азотсодержащих полициклических гетероарильных групп, содержащих ароматическое кольцо и неароматическое кольцо, включают тетрагидроизохинолинил, тетрагидрохинолинил и индолинил.
Термин “неароматическая группа” охватывает, если в контексте не указано иное, ненасыщенные кольцевые системы без ароматического характера, частично насыщенные и полностью насыщенные гетероциклические кольцевые системы. Термины “ненасыщенный” и “частично насыщенный” относятся к кольцам, где кольцевая структура (структуры) содержит атомы, имеющие общую для них более чем одну валентную связь, т.е. кольцо содержит по меньшей мере одну многократную связь, например, C=C, C≡C или N=C связь. Термин “полностью насыщенный” относится к кольцам, где существуют многократные связи между кольцевыми атомами. Насыщенные гетероциклические группы включают пиперидин, морфолин, тиоморфолин. Частично насыщенные гетероциклические группы включают пиразолины, например, пиразолин-2-ил и пиразолин-3-ил.
Примеры неароматических гетероциклических групп включают группы, содержащие от 3 до 12 кольцевых членов, более типично от 5 до 10 кольцевых членов. Такие группы могут быть моноциклическими или бициклическими, например, они типично содержат от 1 до 5 гетероатомов в качестве кольцевых членов (более типично 1, 2, 3 или 4 гетероатомов в качестве кольцевых членов), обычно выбранных из азота, кислорода и серы. Гетероциклические группы могут содержать, например, циклические эфирные группы (например, как в тетрагидрофуране и диоксане), циклические тиоэфирные группы (например, как в тетрагидротиофене и дитиане), циклические аминовые группы (например, как в пирролидине), циклические амидные группы (например, как в пирролидоне), циклические тиоамиды, циклические тиоэфиры, циклические мочевины (например, как в имидазолидин-2-оне), циклические сложноэфирные группы (например, как в бутиролактоне), циклические сульфоны (например, как в сульфолане и сульфолене), циклические сульфоксиды, циклические сульфонамиды и их сочетания (например, тиоморфолин).
Конкретные примеры включают морфолин, пиперидин (например, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил и пиперидин-4-ил), пиперидинон, пирролидин (например, пирролидин-1-ил, пирролидин-2-ил и пирролидин-3-ил), пирролидон, азетидин, пиран (2H-пиран или 4H-пиран), дигидротиофен, дигидропиран, дигидрофуран, дигидротиазол, тетрагидрофуран, тетрагидротиофен, диоксан, тетрагидропиран (например, тетрагидропиран-4-ил), имидазолин, имидазолидинон, оксазолин, тиазолин, пиразолин-2-ил, пиразолидин, пиперазинон, пиперазин и N-алкилпиперазины, такие как N-метилпиперазин. Как правило, предпочтительные неароматические гетероциклические группы включают насыщенные группы, такие как пиперидин, пирролидин, азетидин, морфолин, пиперазин и N-алкилпиперазины.
В азотсодержащем неароматическом гетероциклическом кольце это кольцо должно содержать по меньшей мере один кольцевой атом азота. Азотсодержащее гетероциклическое кольцо может быть N-связанным или C-связанным. Гетероциклические группы могут содержать, например, циклические аминовые группы (например, как в пирролидине), циклические амиды (такие как пирролидинон, пиперидинон или капролактам), циклические сульфонамиды (такие как изотиазолидин 1,1-диоксид, [1,2]тиазинан 1,1-диоксид или [1,2]тиазепан 1,1-диоксид) и их сочетания.
Конкретные примеры азотсодержащих неароматических гетероциклических групп включают азиридин, морфолин, тиоморфолин, пиперидин (например, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил и пиперидин-4-ил), пирролидин (например, пирролидин-1-ил, пирролидин-2-ил и пирролидин-3-ил), пирролидон, дигидротиазол, имидазолин, имидазолидинон, оксазолин, тиазолин, 6H-1,2,5-тиадиазин, пиразолин-2-ил, пиразолин-3-ил, пиразолидин, пиперазин и N-алкил пиперазины, такие как N-метил пиперазин.
Гетероциклические группы могут представлять собой полициклические конденсированные кольцевые системы или связанные мостиковой связью кольцевые системы, такие как окса- и аза- аналоги бициклоалканов, трициклоалканов (например, адамантан и окса-адамантан). Объяснение разницы между конденсированными и связанными мостиковой связью кольцевыми системами см. в Advanced Organic Chemistry, by Jerry March, 4th Edition, Wiley Interscience, pages 131-133, 1992.
Карбоциклические группы могут представлять собой арильные группы, содержащие от 5 до 12 кольцевых членов, более типично от 5 до 10 кольцевых членов. Термин 'арил', используемый в настоящей заявке, относится к карбоциклическим ароматическим группам, включающим фенильные, нафтильные, инданильные, инденильные и тетрагидронафтильные группы. Термин “арил” охватывает полициклические (например, бициклические) кольцевые системы, где один или несколько колец являются неароматическими, при условии, что по меньшей мере одно кольцо является ароматическим. Примеры полициклических (например, бициклических) арильных групп, содержащих ароматическое кольцо и неароматическое кольцо, включают инданильные группы. В таких полициклических системах, группа может быть присоединена при помощи ароматического кольца или при помощи неароматического кольца. Неароматические карбоциклические группы включают циклоалкильные и циклоалкенильные группы, определенные в настоящей заявке.
Гетероциклические или карбоциклические группы могут быть, каждая, незамещенными или замещены одной или несколькими группами заместителей. Например, гетероциклические или карбоциклические группы могут быть незамещенными или замещены 1, 2, 3 или 4 заместителями. Когда гетероциклическая или карбоциклическая группа является моноциклической или бициклической, она типично является незамещенной или содержит 1, 2 или 3 заместителей, определенных в настоящей заявке.
Комбинация заместителей возможно только, если такая комбинация приводит к стабильному или химически достижимому соединению (т.е. такому, которое по существу не изменяется, когда его выдерживают при температуре 40°C или ниже в течение по меньшей мере недели).
Различные функциональные группы и заместители, входящие в состав соединений по настоящему изобретению, типично выбирают таким образом, чтобы молекулярная масса соединения по настоящему изобретению не превышала 1000. Более типично, молекулярная масса соединения должна быть меньше 750, например, меньше чем 700, или меньше чем 650, или меньше чем 600, или меньше чем 550. Более предпочтительно, молекулярная масса составляет меньше чем 525, и, например, составляет 510, 500 или меньше.
Подробное описание изобретения
В одном варианте воплощения, G и J оба представляют собой углерод, или один представляет собой углерод, а другой представляет собой азот. В следующем варианте воплощения, G и J оба представляют собой углерод. В одном варианте воплощения, G…-J представляет собой C…C, C…N или N…C. В следующем варианте воплощения, G…J представляет собой C…C, где … указывает ароматическую или простую связь как того требует формула I.
В одном варианте воплощения, кольцо E представляет собой 6-членную ароматическую гетероциклическую кольцевую систему. В одном варианте воплощения, кольцо E представляет собой 6-членную ароматическую карбоциклическую кольцевую систему. В одном варианте воплощения, кольцо E представляет собой пиримидинильное, пиридазинильное, фенильное или пиридильное кольцо. В следующем варианте воплощения, кольцо E представляет собой фенильное, пиридильное или пиридазинильное кольцо. В следующем варианте воплощения, кольцо E представляет собой фенильное или пиридильное кольцо. Еще в одном варианте воплощения, кольцо E представляет собой пиридильное кольцо. Еще в одном варианте воплощения, кольцо E представляет собой фенильное кольцо.
В одном варианте воплощения, кольцо E представляет собой одно из следующих колец E1-E6:
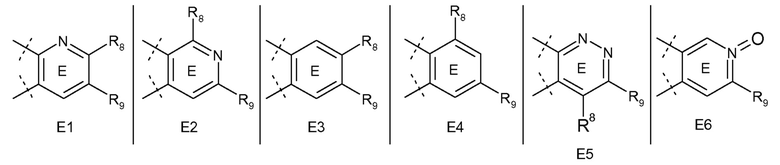 .
.
В следующем варианте воплощения, кольцо E представляет собой одно из следующих колец E1-E4.
Еще в одном варианте воплощения, кольцо E представляет собой кольца E1 или E1A.
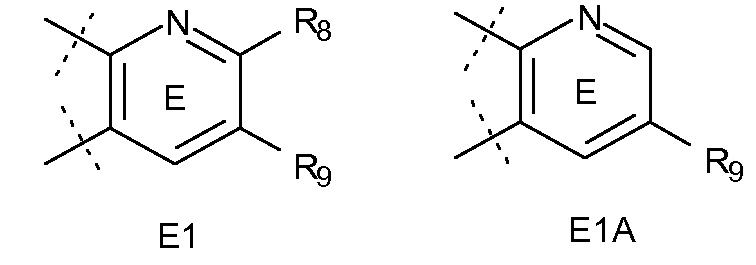 .
.
Еще в одном варианте воплощения, кольцо E представляет собой кольцо E1A.
В одном варианте воплощения, R1 необязательно замещен одной или двумя группами Ra. В одном варианте воплощения, R1 представляет собой C1-4 алкил, необязательно замещенный одной или несколькими группами Ra. В следующем варианте воплощения, R1 представляет собой метил, необязательно замещенный одной или несколькими группами Ra. В одном варианте воплощения, Ra представляет собой галоген. В другом варианте воплощения, Ra представляет собой фтор, например, R1 представляет собой -CF3 или -CH2F.
В одном варианте воплощения, R1 представляет собой C1-4 алкил (например, метил), необязательно замещенный одной, двумя или тремя группами галогена. В одном варианте воплощения, R1 представляет собой -CH3, -CF3 или -CH2F. Еще в одном варианте воплощения, R1 представляет собой незамещенный C1-4 алкил (например, метил). В одном варианте воплощения, R1 выбран из незамещенного метила (например, -CH3 или -CD3), моногалогенметила или тригалогенметила. В одном варианте воплощения, R1 представляет собой незамещенный метил (например, -CH3 или -CD3). В следующем варианте воплощения, R1 представляет собой -CH3.
В одном варианте воплощения, R1 присоединен к пиперазиновому кольцу, имеющему (2R) стереохимию.
В одном варианте воплощения, группы R2a и R2b, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-10-членной насыщенной карбоциклической группы или гетероциклической группы, содержащей один или два гетероатома, выбранных из N, O, S и окисленных форм N или S, где указанные гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В одном варианте воплощения, R2a и R2b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил) и -(CH2)s-C3-12 карбоциклила, где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В одном варианте воплощения, R2a и R2b независимо выбраны из водорода и C1-4 алкила. В следующем варианте воплощения, R2a и R2b оба представляют собой водород.
В одном варианте воплощения, группы R3a и R3b вместе с атомом углерода, с которым они связаны, объединены с образованием 3-10-членной насыщенной карбоциклической группы или гетероциклической группы, содержащей один или два гетероатома, выбранных из N, O, S и окисленных форм N или S, где указанные гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В одном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил), -(CH2)s-C3-12 карбоциклила, -C(=O)-(3-12-членный гетероциклил) и -C(=O)-C3-12 карбоциклила, где указанный C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В альтернативном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил), -(CH2)s-C3-12 карбоциклила, -C(=O)-(3-12-членный гетероциклил) и -C(=O)-C3-12 карбоциклила, где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В одном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(3-12-членный гетероциклил), -CH2-(3-12-членный гетероциклил) и -C(=O)-(3-12-членный гетероциклил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В альтернативном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(3-12-членный гетероциклил), -CH2-(3-12-членный гетероциклил) и -C(=O)-(3-12-членный гетероциклил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В альтернативном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(4-7-членный гетероциклил), -CH2-(4-7-членный гетероциклил) и -C(=O)-(4-7-членный гетероциклил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В одном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(4-6-членный гетероциклил), -CH2-(4-6-членный гетероциклил) и -C(=O)-(4-6-членный гетероциклил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В альтернативном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(4-6-членный гетероциклил), -CH2-(4-6-членный гетероциклил) и -C(=O)-(4-6-членный гетероциклил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В одном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(4-6-членный ароматический гетероциклил), -CH2-(4-6-членный ароматический гетероциклил), -CH2-(4-6-членный насыщенный гетероциклил), -CH2-(9-10-членный бициклический гетероциклил) и -C(=O)-(4-6-членный насыщенный гетероциклил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В альтернативном варианте воплощения, R3a и R3b независимо выбраны из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -(4-6-членный ароматический гетероциклил), -CH2-(4-6-членный ароматический гетероциклил) и -C(=O)-(4-6-членный насыщенный гетероциклил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В одном варианте воплощения, один из R3a и R3b представляет собой водород, а другой представляет собой: C1-6 алкил, необязательно замещенный группой -(CRxRy)s-O-Rz или одним или несколькими атомами галогена; -(CH2)s-NRxC(=O)Ry); -C(=O)NH(2-q)(C1-6 алкил)q; -(CH2)s-(3-6-членный гетероциклил); -CH2-(9-10-членный бициклический гетероциклил); или -C(=O)-(3-6-членный гетероциклил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В альтернативном варианте воплощения, один из R3a и R3b представляет собой водород, а другой представляет собой: C1-6 алкил, необязательно замещенный группой -(CRxRy)s-O-Rz; -(CH2)s-NRxC(=O)Ry); -C(=O)NH(2-q)(C1-6 алкил)q; -(CH2)s-(3-6-членный гетероциклил); или -C(=O)-(3-6-членный гетероциклил).
В одном варианте воплощения, один из R3a и R3b представляет собой водород, а другой представляет собой: C1-6 алкил (например, метил, этил или CH(CH3)2), необязательно замещенный группой -(CRxRy)s-O-Rz (например, -OCH3 или -OH), -(CH2)s-NRxC(=O)Ry) (например, -CH2-NHC(=O)CH3) или одним или несколькими атомами галогена (например, -CH2F или -CHF2), -C(=O)NH(2-q) C1-6 алкил)q (например, -C(=O)NHCH3 или -C(=O)N(CH3)2), -(CH2)s-(3-12-членный гетероциклил) (например, -CH2-пиразолил, -CH2-тиазолил, -CH2-триазолил, -CH2-пиразинил, -CH2-пиридазинил, -CH2-оксазолидинил, -CH2-имидазолидинил, -CH2-пиримидинил, -CH2-пиридинил, -CH2-пирролидинил, -CH2-пиперидинил, -CH2-пиперазинил, -CH2-морфолинил или -CH2-пирролопиридинил) или -C(=O)-(3-12-членный гетероциклил) (например, -C(=O)-азетидинил, -C(=O)-пирролидинил, -C(=O)-пиперидинил или -C(=O)-морфолинил), где указанные C1-6 алкильные, гетероциклические и карбоциклические группы, необязательно, могут быть замещены одной или несколькими группами Rb.
В альтернативном варианте воплощения, один из R3a и R3b представляет собой водород, а другой представляет собой: C1-6 алкил (например, метил, этил или CH(CH3)2), необязательно замещенный группой -(CRxRy)s-O-Rz (например, -OCH3 или -OH), -(CH2)s-NRxC(=O)Ry) (например, -CH2-NHC(=O)CH3), -C(=O)NH(2-q)(C1-6 алкил)q (например, -C(=O)NHCH3 или -C(=O)N(CH3)2), -(CH2)s-(3-12-членный гетероциклил) (например, -CH2-пиразолил) или -C(=O)-(3-12-членный гетероциклил) (например, -C(=O)-азетидинил или -C(=O)-морфолинил).
В одном варианте воплощения, R3b представляет собой водород.
В одном варианте воплощения, R3a представляет собой водород, C1-6 алкил (например, метил, этил или CH(CH3)2), необязательно замещенный группой -(CRxRy)s-O-Rz (например, -OCH3 или -OH), -(CH2)s-NRxC(=O)Ry) (например, -CH2-NHC(=O)CH3) или одним или несколькими атомами галогена (например, -CH2F или -CHF2), -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил) (например, -(CH2)s-5-6-членный гетероарил, -(CH2)s-5-6-членный насыщенный гетероциклил или -(CH2)s-9-10-членный бициклический гетероциклил) или -C(=O)-(4-6-членный насыщенный гетероциклил).
В альтернативном варианте воплощения, R3a представляет собой водород, C1-6 алкил (например, метил, этил или CH(CH3)2), необязательно замещенный группой -(CRxRy)s-O-Rz (например, -OCH3 или -OH), -(CH2)s-NRxC(=O)Ry) (например, -CH2-NHC(=O)CH3), -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил) (например, -(CH2)s-5-6-членный гетероарил) или -C(=O)-(4-6-членный насыщенный гетероциклил).
В другом варианте воплощения, R3a представляет собой водород, метил, этил, CH(CH3)2, -CH2OCH3, -CH2OH, -CH2-NHC(=O)CH3, -CH2F, CHF2, -C(=O)NHCH3, -C(=O)N(CH3)2, -CH2-(пиразолил), -CH2-тиазолил, -CH2-триазолил, -CH2-пиразинил, -CH2-пиридазинил, -CH2-оксазолидинил, -CH2-имидазолидинил, -CH2-пиримидинил, -CH2-пиридинил, -CH2-пирролидинил, -CH2-пиперидинил, -CH2-пиперазинил, -CH2-морфолинил, -CH2-пирролопиридинил, -C(=O)-азетидинил, -C(=O)-пирролидинил, -C(=O)-пиперидинил или -C(=O)-морфолинил.
В альтернативном варианте воплощения, R3a представляет собой водород, метил, этил, CH(CH3)2, -CH2OCH3, -CH2OH, -CH2-NHC(=O)CH3, -C(=O)NHCH3, -C(=O)N(CH3)2, -CH2-(пиразолил), -C(=O)-азетидинил или -C(=O)-морфолинил.
В другом варианте воплощения, R3a представляет собой водород, метил, этил, CH(CH3)2, -CH2OCH3, -CH2OH, -CH2-NHC(=O)CH3, -CH2F, CHF2, -C(=O)NHCH3, -C(=O)N(CH3)2, -CH2-(пиразол-1-ил), -CH2-(тиазол-2-ил), -CH2-(1,2,4-триазол-1-ил), -CH2-(пиразин-1-ил), -CH2-(пиридазин-2-ил), -CH2-(оксазолидин-3-ил), -CH2-(имидазолидин-1-ил), -CH2-(пиримидин-1-ил), -CH2-(пиридин-1-ил), -CH2-(пирролидин-1-ил), -CH2-(пиперидин-1-ил), -CH2-(пиперазин-4-ил), -CH2-(морфолин-4-ил), -CH2-(пирролопиридин-1-ил), -C(=O)-(азетидин-1-ил) или -C(=O)-(морфолин-4-ил).
В альтернативном варианте воплощения, R3a представляет собой водород, метил, этил, CH(CH3)2, -CH2OCH3, -CH2OH, -CH2-NHC(=O)CH3, -C(=O)NHCH3, -C(=O)N(CH3)2, -CH2-(пиразол-1-ил), -C(=O)-(азетидин-1-ил) или -C(=O)-(морфолин-4-ил).
В одном варианте воплощения, R3b представляет собой водород, и R3a выбран из групп -(5-6-членный гетероарил), -CH2-(5-6-членный гетероарил), -CH2-(4-6-членный насыщенный гетероциклил) и -C(=O)-(4-6-членный насыщенный гетероциклил).
В альтернативном варианте воплощения, R3b представляет собой водород, и R3a выбран из групп -(5-6-членный гетероарил), -CH2-(5-6-членный гетероарил), -CH2-(3-12-членный гетероциклил) и -C(=O)-(4-6-членный насыщенный гетероциклил).
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -C(=O)-(4-6-членный насыщенный гетероциклил), например, -C(=O)-морфолинил, -C(=O)-пирролидинил, -C(=O)-пиперидинил или -C(=O)-азетидинил, где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb. В альтернативном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -C(=O)-(4-6-членный насыщенный гетероциклил), например, -C(=O)-морфолинил или -C(=O)-азетидинил, где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb. В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -C(=O)-(незамещенный 4-6-членный насыщенный гетероциклил), например, -C(=O)-морфолинил, -C(=O)-пирролидинил, -C(=O)-пиперидинил или -C(=O)-азетидинил. В альтернативном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -C(=O)-(незамещенный 4-6-членный насыщенный гетероциклил), например, -C(=O)-морфолинил или -C(=O)-азетидинил. В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -C(=O)-(морфолин-4-ил), C(=O)-(пирролидин-1-ил), -C(=O)-(пиперидин-1-ил) или -C(=O)-(азетидин-1-ил). В альтернативном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -C(=O)-(морфолин-4-ил) или -C(=O)-(азетидин-1-ил). В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -C(=O)-морфолинил, например, -C(=O)-(морфолин-4-ил).
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(4-6-членный ароматический гетероциклил), например, CH2-пиразолил, -CH2-тиазолил, -CH2-триазолил, -CH2-пиразинил, -CH2-пиридазинил, -CH2-пиримидинил или -CH2-пиридинил, где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb (например, =O или C1-6 алкил, такой как метил).
В альтернативном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(4-6-членный ароматический гетероциклил), например, CH2-пиразолил, где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb.
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(незамещенный 4-6-членный ароматический гетероциклил), например, CH2-пиразолил или -CH2-тиазолил. В альтернативном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(незамещенный 4-6-членный ароматический гетероциклил), например, CH2-пиразолил. В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой CH2-(пиразол-1-ил).
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(3-12-членный гетероциклил), например, пирролопиридинил, где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb. В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(незамещенный 3-12-членный гетероциклил), например, пирролопиридинил (такой как пирролопиридин-1-ил).
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(4-6-членный насыщенный гетероциклил), например, -CH2-оксазолидинил, -CH2-имидазолидинил, -CH2-пирролидинил, -CH2-пиперидинил, -CH2-пиперазинил или -CH2-морфолинил, где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb (например, =O, галоген (такой как фтор), C1-6 алкил (такой как метил или этил) или -(CRxRy)s-O-Rz (например, -CH2OCH3). В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(4-6-членный насыщенный гетероциклил), например, -CH2-(оксазолидин-3-ил), -CH2-(имидазолидин-1-ил), -CH2-(пирролидин-1-ил), -CH2-(пиперидин-1-ил), -CH2-(пиперазин-4-ил) или -CH2-(морфолин-4-ил), где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb (например, =O, галоген (такой как фтор), C1-6 алкил (такой как метил или этил) или -(CRxRy)s-O-Rz (например, -CH2OCH3).
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -(CH2)s-(3-12-членный гетероциклил), такой как -CH2-(3-12-членный гетероциклил). В следующем варианте воплощения, R3a представляет собой -(CH2)s-(3-7-членный гетероциклил), такой как -CH2-(3-7-членный неароматический гетероциклил).
В одном дополнительном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(3-7-членный насыщенный гетероциклил), например, -CH2-пирролидинил, -CH2-пиперидинил, -CH2-пиперазинил или -CH2-морфолинил, где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb (например, =O, галоген (такой как фтор), C1-6 алкил (такой как метил или этил) или -(CRxRy)s-O-Rz (например, -CH2OCH3).
Еще в одном дополнительном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(6-членный насыщенный гетероциклил), например, -CH2-пиперидинил, -CH2-пиперазинил или -CH2-морфолинил, где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb (например, =O, C1-6 алкил (такой как метил или этил) или -(CRxRy)s-O-Rz (например, -CH2OCH3).
В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), необязательно замещенный одной или несколькими группами Rb, определенными в настоящей заявке.
В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), необязательно замещенный одной или несколькими группами Rb, такими как галоген, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-C3-8 циклоалкенил, -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz или галогенC1-6 алкил.
В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), необязательно замещенный 0-2 группами Rb, такими как галоген, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-C3-8 циклоалкенил, -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz или галогенC1-6 алкил.
В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), необязательно замещенный 1 или 0 группами Rb, такими как галоген, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-C3-8 циклоалкенил, -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz или галогенC1-6 алкил.
В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), необязательно замещенный одной группой Rb, такой как галоген, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-C3-8 циклоалкенил, -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz или галогенC1-6 алкил.
В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), необязательно замещенный 0, 1 или 2 группами Rb (например, =O, C1-6 алкил (такой как метил или этил) или -(CRxRy)s-O-Rz (например, -CH2OCH3).
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), замещенный одной или несколькими группами Rb (например, C1-6 алкил (такой как метил).
В другом варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), замещенный одной или несколькими группами Rb, такими как метил.
В другом варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), замещенный одной или двумя группами Rb, такими как метил.
В другом варианте воплощения, R3b представляет собой водород, и R3a представляет собой -CH2-(морфолин-4-ил), замещенный одной группой Rb, такой как метил (например, 3-метил).
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой морфолинометил (например, 3-метил-морфолин-4-ил, такой как (R)-3-метил-морфолин-4-ил).
В одном варианте воплощения, R3a и R3b независимо выбраны из водорода и C1-6 алкила, где указанный C1-6 алкил, необязательно, может быть замещен одной или несколькими группами галогена.
В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой C1-6 алкил, необязательно замещенный одной или несколькими группами галогена. В одном варианте воплощения, R3b представляет собой водород, и R3a представляет собой C1-6 алкил (например, метил), необязательно замещенный одной или двумя группами галогена (например, фтора). В следующем варианте воплощения, R3b представляет собой водород, и R3a представляет собой C1-6 алкил (например, метил), замещенный одной или двумя группами галогена (например, фтора) (например, -CH2F или CHF2).
В одном варианте воплощения, R3a и R3b оба представляют собой водород.
В альтернативном варианте воплощения, один из R3a и R3b представляет собой водород, а другой представляет собой C1-6 алкил (например, метил, этил или CH(CH3)2), необязательно замещенный одной или несколькими группами Rb.
В следующем варианте воплощения, один из R3a и R3b представляет собой водород, а другой представляет собой этил, CH(CH3)2, -CH2OH, CH2OCH3, -CH2NHC(=O)CH3, -C(=O)NHCH3 или -C(=O)N(CH3)2. Еще в одном варианте воплощения, один из R3a и R3b представляет собой водород, а другой представляет собой CH2OCH3.
В одном варианте воплощения, R3a присоединен к пиперазиновому кольцу, имеющему (5R) стереохимию.
В одном варианте воплощения, Q представляет собой N.
Когда Q представляет собой CR4, в одном варианте воплощения R4 выбран из водорода и C1-4 алкила.
В одном варианте воплощения, R5 представляет собой водород или C1-6 алкил. В следующем варианте воплощения, R5 представляет собой водород, метил или этил. Еще в одном варианте воплощения, R5 представляет собой водород или метил. Еще в одном варианте воплощения, R5 представляет собой водород.
В одном варианте воплощения, R6 и R7 независимо выбраны из водорода и C1-8 алкила. В следующем варианте воплощения, R6 и R7 независимо выбраны из водорода и C1-4 алкила. Еще в одном варианте воплощения, R6 и R7 независимо выбраны из водорода и незамещенного метила (например, -CH3 или -CD3).
В одном варианте воплощения, R6 и R7 оба представляют собой водород. В следующем варианте воплощения, R6 и R7 оба представляют собой C1-6 алкил (например, метил или этил). В альтернативном варианте воплощения, R6 и R7 оба представляют собой C1-6 алкил (например, метил). В одном варианте воплощения, один из R6 и R7 представляет собой метил, а другой представляет собой этил. В одном варианте воплощения, R6 и R7 оба представляют собой этил. В одном варианте воплощения, R6 и R7 оба представляют собой метил.
В одном варианте воплощения, один из R6 и R7 представляет собой C1-6 алкил (например, метил), а другой представляет собой -Y-C3-12 карбоциклил (например, -фенил или -CH2-фенил), -Z-(3-12-членный гетероциклил) (например, -пиридил или -оксазолил), -(CRxRy)s-C(=O)ORz (например, -COOCH3) или -(CRxRy)s-O-Rz (например, -CH2-O-CH2-фенил или -CH2OCH3), где указанная гетероциклическая группа, необязательно, может быть замещена одной или несколькими группами Rb (например, C1-6 алкил, такой как метил). В альтернативном варианте воплощения, один из R6 и R7 представляет собой C1-6 алкил (например, метил), а другой представляет собой -Y-C3-12 карбоциклил (например, -CH2-фенил) или -(CRxRy)s-O-Rz (например, -CH2-O-CH2-фенил). В следующем варианте воплощения, один из R6 и R7 представляет собой C1-6 алкил (например, метил), а другой представляет собой -(CRxRy)s-O-Rz (например, -CH2-O-CH2-фенил).
В одном варианте воплощения, R6 и R7 независимо выбраны из водорода, C1-6 алкила (например, незамещенный метил или этил), -Y-C3-12 карбоциклила (например, -Y-фенил), -Z-(3-12-членный гетероциклил) (например, -Z-пиридил или -Z-оксазолил), -(CRxRy)s-C(=O)ORz (например, -COOCH3) или -(CRxRy)s-O-Rz группы, такой как -CH2OCH3 или -CH2-O-CH2-фенил. В альтернативном варианте воплощения, R6 и R7 независимо выбраны из водорода, C1-6 алкила, (например, незамещенный метил), -Y-C3-12 карбоциклила (например, -Y-фенил); или -(CRxRy)s-O-Rz группы, такой как -CH2-O-CH2-фенил. В другом варианте воплощения, R6 и R7 независимо выбраны из водорода, C1-6 алкила, -Y-C3-6 карбоциклила; или -(CRxRy)s-O-Rz.
В альтернативном варианте воплощения, R6 и R7 независимо выбраны из водорода, C1-6 алкила, такого как незамещенный метил или этил, -Y-C3-12 карбоциклила, такого как -фенил или -CH2-фенил; -Z-(3-12-членный гетероциклил), такого как -пиридил или -оксазолил; -(CRxRy)s-C(=O)ORz группы, такой как -COOCH3, или -(CRxRy)s-O-Rz группы, такой как -CH2OCH3 или -CH2-O-CH2-фенил. В альтернативном варианте воплощения, R6 и R7 независимо выбраны из водорода, C1-6 алкила, такого как незамещенный метил, -Y-C3-12 карбоциклила, такого как -CH2-фенил; или -(CRxRy)s-O-Rz группы, такой как -CH2-O-CH2-фенил. В альтернативном варианте воплощения, R6 и R7 независимо выбраны из водорода, C1-6 алкила, такой как незамещенный метил, -Y-C3-12 карбоциклила, такого как фенил, -CH2-фенил; или -(CRxRy)s-O-Rz группы, такой как -CH2-O-CH2-фенил. В альтернативном варианте воплощения, R6 и R7 независимо выбраны из незамещенного метила и -Y-C3-12 карбоциклила, такого как фенил или -CH2-фенил. В альтернативном варианте воплощения, R6 и R7 независимо выбраны из незамещенного метила и фенила, в частности, один из R6 или R7 представляет собой незамещенный метил, а другой представляет собой фенил или -CH2-фенил, например, фенил.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-10-членной частично или полностью (например, полностью) насыщенной карбоциклической группы или гетероциклической группы, содержащей один или два гетероатома, выбранных из N, O, S и окисленных форм N или S, и которая, необязательно, может быть конденсирована с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-10-членной частично или полностью (например, полностью) насыщенной карбоциклической группы, которая, необязательно, может быть конденсирована с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом, необязательно замещенным одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-10-членной частично или полностью (например, полностью) насыщенной карбоциклической группы, выбранной из циклопропила, циклобутила и циклопентила, которая, необязательно, может быть конденсирована с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом, необязательно замещенным одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-10-членной частично или полностью (например, полностью) насыщенной карбоциклической группы, выбранной из циклопропила, циклобутила и циклопентила, которая, необязательно, может быть конденсирована с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной частично или полностью (например, полностью) насыщенной карбоциклической группы или гетероциклической группы, содержащей один или два гетероатома, выбранных из N, O, S и окисленных форм N или S, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной полностью насыщенной карбоциклической или гетероциклической группы, содержащей один или два гетероатома, выбранных из N, O, S и окисленных форм N или S, и которая, необязательно, может быть конденсирована с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены 1, 2 или 3 группами Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной частично или полностью (например, полностью) насыщенной карбоциклической или гетероциклической группы, содержащей один или два гетероатомов азота, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-10-членной полностью насыщенной карбоциклической группы или гетероциклической группы, содержащей один или два гетероатома, выбранных из N, O, S и окисленных форм N или S, и которая, необязательно, может быть конденсирована с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной полностью насыщенной карбоциклической или гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, где указанные гетероциклические группы, необязательно, могут быть замещены одной группой Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной полностью насыщенной карбоциклической или гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, где указанные гетероциклические группы, необязательно, могут быть замещены одной группой C(=O)Rx. В следующем варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием азетидиновой группы, необязательно замещенной одной группой C(=O)Rx (например, -C(=O)CH3).
В следующем варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием азетидинильной или пиперидинильной группы, замещенной группой -C(=O)CH3, или указанная пиперидинильная группа представляет собой замещенный -C(=O)O-CH2-фенил.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-10-членной частично или полностью (например, полностью) насыщенной карбоциклической группы или гетероциклической группы, содержащей один или два гетероатома, выбранных из N, O, S и окисленных форм N или S, которая является конденсированной с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6 (например, 4-5)-членной частично или полностью (например, полностью) насыщенной карбоциклической группы или гетероциклической группы, содержащей один или два гетероатома, выбранных из N, O, S и окисленных форм N или S, которая является конденсированной с 5-6-членным ароматическим карбоциклическим или гетероциклическим кольцом, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 5-членной частично или полностью (например, полностью) насыщенной карбоциклической группы, которая является конденсированной с 6-членным ароматическим карбоциклическим или гетероциклическим кольцом, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb. В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием циклопентила, который является конденсированным с фенильным, пиразинильным или пиридазинильным кольцом, где указанные карбоциклические или гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb. В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием циклопентила, который является конденсированным с фенильным кольцом, где указанные карбоциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb. В одном варианте воплощения, R6 и R7 группы, вместе с атомом углерода, к которому они присоединены, соединены с необязательно замещенным (например, незамещенным) инданилом.
В одном варианте воплощения, R6 и R7 независимо представляют собой водород, C1-6 алкил (например, метил), -Y-C3-12 карбоциклил (например, -CH2-фенил), -(CRxRy)s-O-Rx (например, -CH2-O-CH2-фенил), или R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной полностью насыщенной карбоциклической и гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, которая необязательно является конденсированной с фенильным кольцом, где указанные гетероциклические группы, необязательно, могут быть замещены одной -C(=O)Rx группой (например, -C(=O)CH3) или -C(=O)ORz (-C(=O)O-CH2-фенил). В одном варианте воплощения, R6 и R7 независимо представляют собой водород, метил, CH2-фенил, -CH2-O-CH2-фенил, или R6 и R7 группы, вместе с атомом углерода, с которым они связаны, объединены с образованием циклопропила, циклобутила, циклопентила, азетидина, пиперидина или инданила, где указанные азетидинильные и пиперидинильные группы замещены группой -C(=O)CH3, или указанная пиперидинильная группа представляет собой замещенный -C(=O)O-CH2-фенил.
В одном варианте воплощения, p имеет значение 0. В одном варианте воплощения, p имеет значение 1. В одном варианте воплощения, p имеет значение 2. В одном варианте воплощения, p имеет значение 0.
В одном варианте воплощения, R8 независимо выбран из водорода, C1-6 алкила, галогена, =O и -(CRxRy)s-O-Rz. В альтернативном варианте воплощения, R8 независимо выбран из водорода, галогена, =O и -(CRxRy)s-O-Rz.
В одном варианте воплощения, R8 независимо выбран из водорода, C1-6 алкила, галогена и -(CRxRy)s-O-Rz. В альтернативном варианте воплощения, R8 независимо выбран из водорода, галогена и -(CRxRy)s-O-Rz.
В одном варианте воплощения, R8 независимо выбран из водорода, C1-6 алкила, галогена и -O-Rx. В альтернативном варианте воплощения, R8 независимо выбран из водорода, галогена и -O-Rx.
В одном варианте воплощения, R8 независимо выбран из водорода, галогена (например, хлор, фтор или бром), C1-6 алкила (например, метил) и -O-C1-6алкила (например, -O-CH3). В альтернативном варианте воплощения, R8 независимо выбран из водорода, галогена (например, хлор, фтор или бром) и -O-C1-6алкила (например, -O-CH3). В одном варианте воплощения, R8 независимо выбран из водорода, галогена (например, фтор или бром) и -O-C1-6алкила (например, -O-CH3).
В одном варианте воплощения, p имеет значение 1, и R8 выбран из галогена, =O и -(CRxRy)s-O-Rz.
В одном варианте воплощения, p имеет значение 1, и R8 представляет собой =O.
В одном варианте воплощения, p имеет значение 1, и R8 представляет собой C1-6 алкил (например, метил).
В одном варианте воплощения, p имеет значение 1, и R8 представляет собой галоген (например, хлор, фтор или бром).
В одном варианте воплощения, p имеет значение 2, и R8 независимо выбран из галогена, =O и -(CRxRy)s-O-Rz. В одном варианте воплощения, p имеет значение 2, и один R8 представляет собой =O.
В одном варианте воплощения, p имеет значение 2, и R8 независимо выбран из галогена (например, хлор), =O и -(CRxRy)s-O-Rz.
В одном варианте воплощения, R9 выбран из водорода, галогена, C1-8 алкила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy, -(CH2)s-NRx-(CH2)s-SO2-Ry - и -(CH2)s-SO2NRxRy групп, где указанные C1-8 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R9 выбран из галогена, C1-8 алкила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy, -NRx-(CH2)s-Rz и -(CH2)s-SO2NRxRy групп, где указанные C1-8 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R9 выбран из водорода, галогена, C1-8 алкила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy и -(CH2)s-SO2NRxRy групп, где указанные C1-8 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-8 алкила (например, метил, этил, пропил, бутил или пентил), -Y-C3-12 карбоциклила (например, -Y-циклопропил, -Y-фенил, -Y-циклобутил, -Y-циклопентил, -Y-циклопентенил, -Y-циклогексил, -Y-циклогексенил), группы -Z-(3-12-членный гетероциклил) (например, -Z-фуранил, -Z-пиразолил, -Z-пирролидинил, -Z-тиенил, -Z-оксадиазолил, -Z-тетразолил или -Z-бензофуранил), -O-Rx, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy и -(CH2)s-SO2NRxRy групп, где указанные C1-8 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Ra, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb, и где Rx, Ry и Rz независимо представляют собой водород, C1-6 алкил (например, метил, этил, пропил, бутил), -(CH2)s-C3-8 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил).
В альтернативном варианте воплощения, R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-8 алкила (например, метил, пропил бутил или пентил), -Y-C3-12 карбоциклила (например, -Y-циклопропил, -Y-фенил, -Y-циклопентил, -Y-циклопентенил, -Y-циклогексил, -Y-циклогексенил), -Z-(3-12-членный гетероциклил), -O-Rx, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy и -(CH2)s-SO2NRxRy групп, где указанные C1-8 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Ra, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb, и где Rx, Ry, и Rz независимо представляют собой водород, C1-6 алкил (например, метил, этил, пропил, бутил), -(CH2)s-C3-8 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил).
В одном варианте воплощения, R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-6 алкила (например, метил, этил, пропил, изопропил, изобутил, бутил или изопентил), -Y-C3-6 карбоциклила (например, -Y-циклопропил, -Y-фенил, -Y-циклобутил, -Y-циклопентил, -Y-циклопентенил, -Y-циклогексил, -Y-циклогексенил), группы -Z-(4-6-членный гетероциклил) (например, -Z-фуранил, -Z-пиразолил, -Z-пирролидинил, -Z-тиенил, -Z-оксадиазолил, -Z-тетразолил или -Z-бензофуранил), -O-Rx, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy и -(CH2)s-SO2NRxRy групп, где указанные C1-6 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Ra, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb, и где Rx, Ry, и Rz независимо представляют собой водород, C1-6 алкил (например, метил, этил, пропил, бутил), -(CH2)s-C3-6 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил, например, пирролидинил).
В альтернативном варианте воплощения, R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-6 алкила (например, метил, изопропил, изобутил или изопентил), -Y-C3-6 карбоциклила (например, -Y-циклопропил, -Y-фенил, -Y-циклопентил, -Y-циклопентенил, -Y-циклогексил, -Y-циклогексенил), -Z-(4-6-членный гетероциклил), -O-Rx, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy и -(CH2)s-SO2NRxRy групп, где указанные C1-6 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Ra, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb, и где Rx, Ry, и Rz независимо представляют собой водород, C1-6 алкил (например, метил, этил, пропил, бутил), -(CH2)s-C3-6 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил, например, пирролидинил).
В одном варианте воплощения, R9 выбран из водорода, галогена, C1-6 алкила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy и -(CH2)s-SO2NRxRy групп, где указанные C1-6 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R9 выбран из галогена, C1-6 алкила, -Y-C3-12 карбоциклила, -Z-(3-12-членный гетероциклил), -(CRxRy)s-O-Rz, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy и -(CH2)s-SO2NRxRy групп, где указанные C1-6 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb.
В одном варианте воплощения, R9 выбран из галогена; C1-6 алкила; -Y-циклопропила; -Y-фенила; -Y-циклобутила; -Y-циклопентила; -Y-циклопентенила; -Y-циклогексила; -Y-циклогексенила; -Z-пирролидинила; -Z-пиразолила; -Z-фуранила; -Z-тиенила; -Z-оксадиазолила; -Z-тетразолила; -Z-бензофуранила; -O-Rx; -(CH2)s-CN; -S(O)q-(CRxRy)s-Rz; -(CRxRy)s-C(=O)ORz; -(CRxRy)s-C(=O)NRxRy; -(CH2)s-NRxRy; и -(CH2)s-SO2NRxRy групп, где указанные C1-6 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Ra, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены 1, 2 или 3 группами Rb, и где Rx, Ry, и Rz независимо представляют собой водород, C1-6 алкил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил).
В альтернативном варианте воплощения, R9 выбран из галогена; C1-6 алкила; -Y-циклопропила; -Y-фенила; -Y-циклопентила; -Y-циклопентенила; -Y-циклогексила; -Y-циклогексенила; -Z-пирролидинила; -Z-пиразолила; -O-Rx; -(CH2)s-CN; -S(O)q-(CRxRy)s-Rz; -(CRxRy)s-C(=O)ORz; -(CRxRy)s-C(=O)NRxRy; -(CH2)s-NRxRy; и -(CH2)s-SO2NRxRy групп, где указанные C1-6 алкильные группы, необязательно, могут быть замещены одной или несколькими группами Ra, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены 1, 2 или 3 группами Rb, и где Rx, Ry, и Rz независимо представляют собой водород, C1-6 алкил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил).
В одном варианте воплощения, R9 выбран из -S(O)q-(CRxRy)s-Rz и -Y-C3-12 карбоциклила, необязательно замещенного одной или несколькими (например, 1, 2 или 3) группами Rb, где Y выбран из связи, -(CRxRy)m-, -C(=O)-, -NRx, -O- и -S(O)q-. В одном варианте воплощения, R9 выбран из -S(O)2-CH2-фенила и -Y-фенила, где указанная фенильная группа необязательно замещена одной или несколькими (например, 1, 2 или 3) группами Rb, и где Y выбран из связи, -CH2-, -CH(CH3)-, -C(=O)-, -NH, -NCH3-, -O- и -S(O)2-.
В одном варианте воплощения, R9 представляет собой -Y-C3-12 карбоциклил, необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, и Y выбран из связи, -(CRxRy)m-, -C(=O)-, -NRx, -O- и -S(O)q-. В одном варианте воплощения, R9 представляет собой -Y-C3-12 карбоциклил, необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, и Y выбран из связи, -CRxRy-, -(CRxRy)-(CRxRy)-, -C(=O)-, -NRx, -O- и -S(O)2-. В альтернативном варианте воплощения, R9 представляет собой -Y-C3-12 карбоциклил, необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, и Y выбран из связи, -CRxRy-, -C(=O)-, -NRx, -O- и -S(O)2-. В одном варианте воплощения, R9 представляет собой -Y-C3-6 карбоциклил, необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, и Y выбран из связи, -CRxRy-, -(CRxRy)-(CRxRy)-, -C(=O)-, -NRx, -O- и -S(O)2-. В альтернативном варианте воплощения, R9 представляет собой -Y-C3-6 карбоциклил, необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, и Y выбран из связи, -CRxRy-, -C(=O)-, -NRx, -O- и -S(O)2-. В одном варианте воплощения, C3-6 карбоциклическая группа выбрана из -Y-циклопропила, -Y-фенила, -Y-циклобутила, -Y-циклопентила, -Y-циклопентенила, -Y-циклогексила и -Y-циклогексенила. В альтернативном варианте воплощения, C3-6 карбоциклическая группа выбрана из -Y-циклопропила, -Y-фенила, -Y-циклопентила, -Y-циклопентенила, -Y-циклогексила и -Y-циклогексенила. В одном варианте воплощения, R9 представляет собой -Y-фенил, где указанная фенильная группа необязательно замещена одной или несколькими (например, 1, 2 или 3) группами Rb, и где Y выбран из связи, -CH2-, -CF2-, -CF2-CH2-, -CH(CH3)-, -CH(OCH3)-, -C(=O)-, -NH, -NCH3-, -O- и -S(O)2-. В альтернативном варианте воплощения, R9 представляет собой -Y-фенил, где указанная фенильная группа необязательно замещена одной или несколькими (например, 1, 2 или 3) группами Rb, и где Y выбран из связи, -CH2-, -CH(CH3)-, -C(=O)-, -NH, -NCH3-, -O- и -S(O)2-. В одном варианте воплощения, R9 представляет собой -Y-фенил, необязательно замещенной одним или несколькими (например, 1, 2 или 3) группами, выбранными из галогена (например, хлор или фтор), C1-4 алкила (например, метил), C1-4 алкоксила (например, OCH3) и -CN, и Y выбран из связи, -CRxRy-, -C(=O)-, -NRx, -O- и -S(O)2-.
В одном варианте воплощения, R9 представляет собой -Y-C3-12 карбоциклил (например, -Y-фенил или Y-циклопропил), необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, выбранными из галогена (например, хлор или фтор), C1-4 алкила (например, метил), C1-4 алкоксила (например, OCH3) и -CN, Y выбран из -CRxRy-, и Rx и Ry независимо выбраны из водорода, галогена (например, фтор), C1-4алкоксила (например, метокси). В альтернативном варианте воплощения, R9 представляет собой -Y-C3-12 карбоциклил (например, -Y-фенил), необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, выбранными из галогена (например, хлор или фтор), C1-4 алкила (например, метил), C1-4 алкоксила (например, OCH3) и -CN, Y выбран из -CRxRy-, -C(=O)- или -O-, и Rx и Ry независимо выбраны из водорода, галогена (например, фтор), C1-4алкоксила (например, метокси). В одном варианте воплощения, Y представляет собой -CRxRy-, который независимо выбран из -CH(OCH3)-, -CH(CH3)-, -CH2CH2-, -CF2- и -CH2-. В альтернативном варианте воплощения, Y представляет собой -CRxRy-, который независимо выбран из -CH(OCH3)-, -CH(CH3)-, -CH2CH2-, -CF2CH2-, -CF2- и -CH2-.
В одном варианте воплощения, R9 представляет собой -Z-(3-12-членный гетероциклил), например, -Z-пиразолил, -Z-фуранил, -Z-тиенил, -Z-оксадиазолил, -Z-тетразолил, -Z-бензофуранил или -Z-пирролидинил, где указанная гетероциклическая группа необязательно замещена одной или несколькими (например, 1, 2 или 3) группами Rb. В альтернативном варианте воплощения, R9 представляет собой -Z-(3-12-членный гетероциклил), где указанная гетероциклическая группа необязательно замещена одной или несколькими (например, 1, 2 или 3) группами Rb. В одном варианте воплощения, R9 представляет собой -Z-(3-6-членный гетероциклил), например, -Z-пиразолил, -Z-фуранил, -Z-тиенил, -Z-оксадиазолил, -Z-тетразолил или -Z-пирролидинил, который необязательно замещен одной или несколькими (например, 1, 2 или 3) группами Rb. В альтернативном варианте воплощения, R9 представляет собой -Z-(3-6-членный гетероциклил), например, -Z-пиразолил или -Z-пирролидинил, необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb. В одном варианте воплощения, R9 представляет собой -Z-(4-6-членный насыщенный гетероциклил), например, -Z-пирролидинил, необязательно замещенный группой =O. В альтернативном варианте воплощения, R9 представляет собой -Z-(4-6-членный насыщенный гетероциклил), например, -CH2-пирролидинил, необязательно замещенный группой =O. В одном варианте воплощения, R9 представляет собой -Z-(5-членный гетероарил), например, -Z-пиразолил, -Z-фуранил, -Z-тиенил, -Z-оксадиазолил или -Z-тетразолил. В следующем варианте воплощения, R9 представляет собой -Z-(5-членный гетероарил), например, -пиразолил, -фуранил, -тиенил, -оксадиазолил или -тетразолил. В альтернативном варианте воплощения, R9 представляет собой -Z-(5-членный гетероарил), например, -Z-пиразолил. В одном варианте воплощения, R9 представляет собой 5-членный гетероарил. В одном варианте воплощения, R9 представляет собой -CH2-пиразолил.
В одном варианте воплощения, R9 независимо выбран из галогена (например, хлор), C1-8 алкила (например, метил), галогенC1-8алкила (например, CF3) и -(CH2)s-CN (например, -CN).
В одном варианте воплощения, R9 независимо выбран из хлора и -CN.
В одном варианте воплощения, R9 представляет собой -CN.
В одном варианте воплощения, R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-6 алкила (например, метил, этил, пропил, бутил или пентил), C1-6 алкила, замещенного галогеном (например, -CF3, -CF2-CH3, -CF2-CH2-CH3, -CF2-CH(CH3)2, -CF2-CH2-CH2-CH3, -CF2-CH2-CH(CH3)2), -Y-карбоциклила (например, -фенил, -CH2-фенил, -CF2-фенил, -CH(CH3)-фенил, -CH(OCH3)-фенил, -C(=CH2)-фенил, -NH-фенил, -N(CH3)-фенил, -O-фенил, -SO2-фенил, -C(=O)-фенил, -CH2-циклогексил, -CF2-циклопропил, -CF2-CH2-циклопропил, -CF2-циклобутил, циклопентенил, циклопентил, циклогексил, циклогексенил, -SO2-циклопропил), групп -Z-(4-6-членный гетероциклил) (например, -SO2-пирролидинил, -C(=O)- пирролидининил, пирролидинил, -CH2-пиразолил, -пиразолил, -фуранил, -тиенил, -оксадиазолил, -пирролидинил или -тетразолил), -O-Rx (например, -OCH3 или -OCF3), -(CH2)s-CN (например, -CN), -S(O)q-(CRxRy)s-Rz (например, -SO2CH3, -SO2CH2CH3, -SO2-CH2CH(CH3)2), -(CRxRy)s-C(=O)ORz (например, -C(=O)OCH3), -(CRxRy)s-C(=O)NRxRy (например, -C(=O)NHCH3, -C(=O)N(CH3)2) -(CH2)s-NRxRy (например, -NH2) и -(CH2)s-SO2NRxRy (например, -SO2-CH2-фенил, -SO2NHCH3, -SO2N(CH3)2, -SO2NHCH(CH3)2), где указанные карбоциклические или гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами, выбранными из галогена (например, хлор или фтор), =O, C1-4 алкила, (например, метил), C1-4 алкоксила (например, -OCH3) и -CN; где Y и Z независимо выбраны из связи, -CRxRy-, -C(=O)-, -NRx, -O- и -S(O)2- (например, связь, -CH2-, -CH(CH3)-, -C(=O)-, -NH, -NCH3-, -O- и -S(O)2-); и где Rx, Ry и Rz независимо представляют собой водород, C1-4 алкил (например, метил, этил, изопропил), галогенC1-4 алкил (например, трифторметил) и -(CH2)s-фенил (например, -CH2-фенил).
В альтернативном варианте воплощения, R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-6 алкила (например, метил, пропил, бутил или пентил), C1-4 алкила, замещенного галогеном (например, -CF3), -Y-карбоциклила (например, -фенил, -CH2-фенил, -CH(CH3)-фенил, -C(=CH2)-фенил, -NH-фенил, -N(CH3)-фенил, O-фенил, -SO2-фенил, -C(=O)-фенил, -CH2-циклогексил, циклопентенил, циклопентил, циклогексенил, -SO2-циклопропил), -Z-(4-6-членный гетероциклил) (например, -SO2-пирролидинил, -C(=O)-пирролидининил, пирролидинил, -CH2-пиразолил), -O-Rx (например, -OCH3 или -OCF3), -(CH2)s-CN (например, -CN), -S(O)q-(CRxRy)s-Rz (например, -SO2CH3, -SO2CH2CH3, -SO2-CH2CH(CH3)2), -(CRxRy)s-C(=O)ORz (например, -C(=O)OCH3), -(CRxRy)s-C(=O)NRxRy (например, -C(=O)NHCH3, -C(=O)N(CH3)2) -(CH2)s-NRxRy (например, -NH2) и -(CH2)s-SO2NRxRy (например, -SO2-CH2-фенил, -SO2NHCH3, -SO2N(CH3)2, -SO2NHCH(CH3)2), где указанные карбоциклические или гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами, выбранными из галогена (например, хлор или фтор), =O, C1-4 алкила, (например, метил), C1-4 алкоксила (например, -OCH3) и -CN; где Y и Z независимо выбраны из связи, -CRxRy-, -C(=O)-, -NRx, -O- и -S(O)2- (например, связь, -CH2-, -CH(CH3)-, -C(=O)-, -NH, -NCH3-, -O- и -S(O)2-); и где Rx, Ry и Rz независимо представляют собой водород, C1-4 алкил (например, метил, этил, изопропил), галогенC1-4 алкил (например, трифторметил) и -(CH2)s-фенил (например, -CH2-фенил).
В одном варианте воплощения, R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-6 алкила (например, метил, этил, пропил, изопропил, изобутил, бутил или изопентил), -Y-циклопропила, -Y-фенила, -Y-циклобутила, -Y-циклопентила, -Y-циклопентенила, -Y-циклогексила, -Y-циклогексенила, групп -Z-(4-6-членный гетероциклил) (например, -Z-пиразолил, -Z-фуранил, -Z-тиенил, -Z-оксадиазолил, -Z-тетразолил или -Z-пирролидинил), -O-Rx, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy, -(CH2)s-NRx-SO2-Ry - и -(CH2)s-SO2NRxRy, где Y и Z независимо выбраны из связи, -CRxRy-, -(CRxRy)-(CRxRy)-, -C(=O)-, -NRx, -O- и -S(O)2-, и где Rx, Ry и Rz независимо представляют собой водород, C1-6 алкил (например, метил, этил, пропил, бутил), -(CH2)s-C3-6 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил, например, пирролидинил).
В альтернативном варианте воплощения, R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-6 алкила (например, метил, изопропил, изобутил или изопентил), -Y-циклопропила, -Y-фенила, -Y-циклопентила, -Y-циклопентенила, -Y-циклогексила, -Y-циклогексенила, групп -Z-(4-6-членный гетероциклил), -O-Rx, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy, -(CH2)s-NRx-SO2-Ry - и -(CH2)s-SO2NRxRy, где Y и Z независимо выбраны из связи, -CRxRy-, -C(=O)-, -NRx, -O- и -S(O)2-, и где Rx, Ry и Rz независимо представляют собой водород, C1-6 алкил (например, метил, этил, пропил, бутил), -(CH2)s-C3-6 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил, например, пирролидинил).
В одном варианте воплощения, R9 независимо выбран из галогена (например, хлор, фтор или бром), -(CH2)s-CN (например, -CN), C1-8 алкила (например, этил, пропил, изобутил, бутил или -(CH2)2-CH(CH3)2), -Y-C3-12 карбоциклила (например, -CH2-фенил, -CF2-фенил, -CH(CH3)-фенил, -CH(OCH3)-фенил, -C(=CH2)-фенил, -O-фенил, -SO2-фенил, -C(=O)-фенил, -CF2-циклопропил, -CF2-циклобутил, -CF2-CH2-циклобутил, -циклопентил, -циклопентенил, -CH2-циклогексил, циклогексил или циклогексенил), групп -Z-(3-12-членный гетероциклил) (например, -пиразолил, -фуранил, -тиенил, -оксадиазолил, -тетразолил, -бензофуранил или -CH2-пирролидинил), -S(O)q-(CRxRy)s-Rz (например, -SO2CH3, -SO2-CH2CH(CH3)2 или -SO2-CH2-фенил) или -(CH2)s-SO2NRxRy (например, -SO2N(CH3)2), где указанные карбоциклические группы (например, фенил) или гетероциклические группы (например, пиразолил, фуранил, тиенил, оксадиазолил, тетразолил, бензофуранил или пирролидинил), необязательно, могут быть замещены одной или несколькими группами Rb, такими как =O, галоген (например, фтор или хлор), C1-6 алкил (например, метил), -(CH2)s-CN (например, -CN), -(CRxRy)s-O-Rz (например, метокси).
В альтернативном варианте воплощения, R9 независимо выбран из галогена (например, хлор), -(CH2)s-CN (например, -CN), C1-8 алкила (например, -(CH2)2-CH(CH3)2), -Y-C3-12 карбоциклила (например, -CH2-фенил, -CH(CH3)-фенил, -C(=CH2)-фенил, -O-фенил, -SO2-фенил, -C(=O)-фенил, -циклопентил, -циклопентенил, -CH2-циклогексил или циклогексенил), -S(O)q-(CRxRy)s-Rz (например,-SO2CH3, -SO2-CH2CH(CH3)2 или -SO2-CH2-фенил) или -(CH2)s-SO2NRxRy (например, -SO2N(CH3)2), где указанные карбоциклические группы (например, фенил), необязательно, могут быть замещены одной или несколькими группами Rb, такими как галоген (например, фтор или хлор), C1-6 алкил (например, метил), -(CH2)s-CN (например, -CN), -(CRxRy)s-O-Rz (например, метокси).
В одном варианте воплощения, R9 независимо выбран из -Y-C3-12 карбоциклила (например, -CH2-фенил) и C1-8 алкила (например, этил, пропил или бутил), где указанная алкильная группа необязательно замещена одним или несколькими атомами галогена (например, фтор), и указанная карбоциклическая группа необязательно замещена одним или несколькими атомами галогена (например, фтор).
В следующем варианте воплощения, R9 независимо выбран из -(CRxRy)1-2-циклопропила, -(CRxRy)-циклобутила, -(CRxRy)-фенила, этила, пропила или бутила, каждый из которых, необязательно, может быть замещен одним или несколькими атомами галогена (например, фтор), и где Rx и Ry независимо выбраны из водорода и фтора.
В следующем варианте воплощения, R9 независимо выбран из -(CRxRy)-фенила, этила, пропила или бутила, каждый из которых, необязательно, может быть замещен одним или несколькими атомами галогена (например, фтор), и где Rx и Ry независимо выбраны из водорода и фтора.
В следующем варианте воплощения, R9 независимо выбран из групп -CF2-(фенил), -CH2-(фенил), -CH2-(2-фторфенил), -CH2-(4-фторфенил), -CH2-(2,4-дифторфенил), -CF2-циклопропил, -CF2-циклобутил, -CF2-CH2-циклобутил, -CF2-CH3, -CF2-CH2-CH3, -CF2-CH(CH3)2, -CF2-CH2-CH(CH3)2 или -CF2-CH2-CH2-CH3.
В следующем варианте воплощения, R9 независимо выбран из -CH2-фенила, этила, пропила или бутила, каждый из которых, необязательно, может быть замещен одним или несколькими атомами галогена (например, фтор).
В следующем варианте воплощения, R9 независимо выбран из групп -CH2-(фенил), -CH2-(2-фторфенил), -CH2-(4-фторфенил), -CH2-(2,4-дифторфенил), -CF2-CH3, -CF2-CH2-CH3, -CF2-CH(CH3)2, -CF2-CH2-CH(CH3)2 или -CF2-CH2-CH2-CH3. В следующем варианте воплощения, R9 независимо выбран из групп -CH2-(2-фторфенил), -CH2-(4-фторфенил), -CH2-(2,4-дифторфенил), -CF2-CH3, -CF2-CH2-CH3, -CF2-CH(CH3)2, -CF2-CH2-CH(CH3)2 или -CF2-CH2-CH2-CH3.
В одном варианте воплощения, R9 представляет собой -Y-фенил, необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, выбранными из галогена (например, хлор или фтор), C1-4 алкила (например, метил), C1-4 алкоксила (например, OCH3) и -CN, Y выбран из -CRxRy-, и Rx и Ry независимо выбраны из водорода, галогена (например, фтор), C1-4алкоксила (например, метокси).
В следующем варианте воплощения, R9 представляет собой -CH2-фенил, необязательно замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, выбранными из галогена (например, хлор или фтор), C1-4 алкила (например, метил), C1-4 алкоксила (например, OCH3) и -CN.
В одном варианте воплощения, R9 представляет собой -CH2-фенил, замещенный одной или несколькими (например, 1, 2 или 3) группами Rb, выбранными из галогена (например, хлор или фтор).
В одном варианте воплощения, R9 представляет собой -CH2-фенил, необязательно замещенный (в частности, замещенный) одной группой Rb, такой как галоген (например, хлор или фтор).
В одном варианте воплощения, R9 представляет собой -CH2-фенил, необязательно замещенный (в частности, замещенный) одним атомом фтора.
В одном варианте воплощения, R9 представляет собой -CH2-(4-фторфенил).
В одном варианте воплощения, один из R8 и R9 должен быть отличным от водорода. В одном варианте воплощения, R8 является отличным от водорода. В одном варианте воплощения, R9 является отличным от водорода.
В одном варианте воплощения, Y и Z независимо выбраны из связи, -(CRxRy)m-, -C(=Rx)-, -C(=O)-, -NRx, -O- и -S(O)q-.
В одном варианте воплощения, Y и Z независимо выбраны из связи, -(CRxRy)m-, -C(=Rx)-, -NRx, -O- и -S(O)q-.
В одном варианте воплощения, Y и Z независимо выбраны из связи, -C(=CRx)- (например, -C(=CH2)-) и -(CRxRy)m-. В одном варианте воплощения, Y или Z представляет собой группу -CRxRy-, которая независимо выбрана из -CH(OCH3)-, -CH(CH3)-, -CH2CH2-, -CF2CH2-, -CF2- и -CH2-. В альтернативном варианте воплощения, Y или Z представляет собой группу -CRxRy-, которая независимо выбрана из -CH(OCH3)-, -CH(CH3)-, -CH2CH2-, -CF2- и -CH2-.
В одном варианте воплощения, m имеет значение 1. В другом варианте воплощения, Y и Z независимо выбраны из связи, -CH(CH3)-, -CH2CH2-, -CF2- и -CH2-.
В другом варианте воплощения, Y и Z независимо выбраны из связи, -CH(CH3), -CH2CH2 и -CH2-. В другом варианте воплощения, Y и Z независимо выбраны из связи и -CH2-. В следующем варианте воплощения, Y представляет собой -CH2-.
В одном варианте воплощения, когда кольцо E представляет собой фенильное кольцо, и R9 представляет собой -SO2-гетероциклическое кольцо, указанное гетероциклическое кольцо замещено группой Rb, отличной от -C3-8 циклоалкила, фенила или 4-7-членного насыщенного гетероциклила.
В одном варианте воплощения, R6 и R7 представляют собой группу, отличную от -Y-C3-12 карбоциклила или от -Z-(3-12-членный гетероциклил).
В одном варианте воплощения, R2a, R2b, R3a и R3b, каждый, представляют собой группу, отличную от -(CH2)s-(3-12-членный гетероциклил) или -(CH2)s-C3-12 карбоциклила.
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из галогена, C1-6 алкила, -(CH2)s-C3-8 циклоалкила, -(CH2)s-C3-8 циклоалкенила, -(CH2)s-фенила, групп -(CH2)s-(4-7-членный насыщенный гетероциклил), -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz, галогенC1-6 алкил, галогенC1-6 алкокси, C1-6 алканол, -(CH2)s-CN, -S(O)q-Rx, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy, -(CH2)s-NRxRy, -(CH2)s-NH-SO2-NRxRy, -(CH2)s-SO2NRxRy, где указанные C1-6 алкильные, C3-8 циклоалкильные, C3-8 циклоалкенильные и гетероциклические группы, необязательно, могут быть замещены одной или несколькими группами Rx.
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из галогена, C1-6 алкила, -(CRxRy)s-O-Rz, -(CH2)s-CN, C1-6 алкил-N(H)2-q(C1-6алкил)q, -N(H)2-q(C1-6алкил)q, -(CH2)s-C3-8 циклоалкила, -(CH2)s-C3-8 циклоалкенила, -(CH2)s-фенила, -(CH2)s-(4-7-членный насыщенный гетероциклил), -S(O)q-Rx, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy, -(CH2)s-NRxRy; где указанные C1-6 алкильные, C3-8 циклоалкильные, C3-8 циклоалкенильные, фенильные и гетероциклические группы, необязательно, могут быть замещены одной или несколькими группами Rx;
Rx, Ry, и Rz независимо представляют собой водород, C1-6 алкил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-C3-8 циклоалкенил, -(CH2)s-(4-7-членный насыщенный гетероциклил), C1-6 алканол, -C(=O)OC1-6 алкил, гидрокси, C1-6 алкокси, галогенC1-6 алкил, -(CH2)n-O-C1-6алкил, -C(=O)-C1-6алкил, -(CH2)s-CN, C1-6 алкил-N(H)2-q(C1-6алкил)q, -N(H)2-q(C1-6алкил)q, -C(=O)-N(H)2-q(C1-6алкил)q, и, когда они присоединены к атому азота или углерода, Rx, и Ry могут объединяться с образованием 3-7-членного кольца, необязательно содержащего один или два дополнительных гетероатома, выбранных из O, N, S и окисленных форм N или S.
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из галогена, C1-6 алкила, -(CRxRy)s-O-Rz, -(CH2)s-CN, C1-6 алкил-N(H)2-q(C1-6алкил)q, -N(H)2-q(C1-6алкил)q, -(CH2)s-C3-8 циклоалкила, -(CH2)s-C3-8 циклоалкенила, -(CH2)s-фенила, -(CH2)s-(4-7-членный насыщенный гетероциклил), -S(O)q-Rx, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-O-C(=O)-Rz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxC(=O)Ry, -(CH2)s-OC(=O)NRxRy, -(CH2)s-NRxC(=O)ORy, -(CH2)s-NRxRy; где указанные C1-6 алкильные, C3-8 циклоалкильные, C3-8 циклоалкенильные, фенильные и гетероциклические группы, необязательно, могут быть замещены одной или несколькими группами Rx;
Rx, Ry и Rz независимо представляют собой водород, C1-6 алкил, C1-6 алканол, -C(=O)OC1-6 алкил, гидрокси, C1-6 алкокси, галогенC1-6 алкил, -(CH2)n-O-C1-6алкил, -C(=O)-C1-6алкил, -(CH2)s-CN, C1-6 алкил-N(H)2-q(C1-6алкил)q, -N(H)2-q(C1-6алкил)q, -C(=O)-N(H)2-q(C1-6алкил)q, и, когда они присоединены к атому азота или углерода, Rx, и Ry могут объединяться с образованием 3-7-членного кольца, необязательно содержащего один или два дополнительных гетероатома, выбранных из O, N, S и окисленных форм N или S.
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из галогена, C1-6 алкила, -(CH2)s-C3-8 циклоалкила, -(CH2)s-C3-8 циклоалкенила, -(CH2)s-фенила, -(CH2)s-(4-7-членный насыщенный гетероциклил), -(CRxRy)s-O-Rz, -O-(CRxRy)n-ORz, -(CH2)s-CN, C1-6 алкил-N(H)2-q(Rx)q, -N(H)2-q(Rx)q, -S(O)q-Rx, -C(=O)Rx и -(CH2)s- N(H)2-q(Rx)q, где указанные C1-6 алкильные, C3-8 циклоалкильные, C3-8 циклоалкенильные, фенильные и гетероциклические группы, необязательно, могут быть замещены одной или несколькими группами Rx, и где Rx независимо выбран из водорода, галогена, C1-6 алкила, C1-6 алканола, гидрокси, C1-6 алкокси и галогенC1-6 алкила.
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из галогена, C1-6 алкила, -(CH2)s-O-Rx, -(CH2)s-CN, C1-6 алкил-N(H)2-q(Rx)q, -N(H)2-q(Rx)q, -S(O)q-Rx, -C(=O)Rx, -(CH2)s- N(H)2-q(Rx)q, где Rx независимо выбран из водорода, C1-6 алкила, C1-6 алканола, гидрокси, C1-6 алкокси и галогенC1-6 алкила.
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из галогена, C1-6 алкила, C1-6алкокси, -(CH2)s-CN, C1-6 алкил-N(H)2-q(C1-6алкил)q, -N(H)2-q(C1-6алкил)q, -S(O)q-C1-6алкил, -C(=O)C1-6алкил, -(CH2)s- N(H)2-q(C1-6алкил)q.
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из галогена, C1-6 алкила, галогенC1-6 алкила, галогенC1-6 алкокси, C1-6 алканола, -(CH2)s-O-C1-6 алкила, -C(=O)C1-6алкила, -(CH2)s-C3-8 циклоалкила, -(CH2)s-C3-8 циклоалкенила и -(CH2)s-(4-7-членный насыщенный гетероциклил).
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из фтора, хлора, метокси, этокси, дифторметокси, метила, этила, изопропила, трет-бутила, трифторметила, -C(=O)метила, -N(H)2-q(C1-6алкил)q, морфолино, трифторметила, N-метилпиперазинила, пиперазинила, пиперидинила, пирролидинила, пирролидинилметила и морфолинометила.
В одном варианте воплощения, R6, R7, R8 и R9 необязательно замещены Rb или Rc, которые независимо выбраны из фтора, хлора, метила, метокси и -CN.
Группы R6, R7, R8, и R9 могут быть замещены более чем одним заместителем. Таким образом, например, может быть 1 или 2 или 3 или 4 заместителя, более типично 1, 2 или 3 заместителя. В одном варианте воплощения, где R6, R7, R8 или R9 содержит шестичленное кольцо (такое как фенильное кольцо), может быть один заместитель, который может присутствовать в любом из 2-, 3- и 4-положений в кольце. В другом варианте воплощения, могут быть два или три заместителя, и они могут присутствовать в 2-, 3-, 4- или 6-положениях в кольце. В качестве примера, R6, R7, R8 или R9 фенильное кольцо может быть 2,6-дизамещенным, 2,3-дизамещенным, 2,4-дизамещенным 2,5-дизамещенным, 2,3,6-тризамещенным или 2,4,6-тризамещенным.
В одном варианте воплощения, когда R8 и R9 представляют собой фенильное или бензильное кольцо, оно может быть монозамещенным в 2-, 3- или 4-положении или дизамещенным в положениях 2- и 6- заместителями, независимо выбранными из фтора и хлора.
В одном варианте воплощения, Rx, Ry и Rz независимо представляют собой водород, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-C3-8 циклоалкенил, -(CH2)s-фенил, -(CH2)s-(4-7-членный насыщенный гетероциклил), C1-6 алканол, необязательно замещенный одним или несколькими галогенами, -C(=O)OC1-6 алкил, гидрокси, C1-6 алкокси, галогенC1-6 алкил, -(CH2)n-O-C1-6алкил, -C(=O)-(CH2)n-C1-6 алкокси, -C(=O)-C1-6алкил, -(CH2)s-CN, C1-6 алкил-N(H)2-q(C1-6алкил)q, -N(H)2-q(C1-6алкил)q, -C(=O)-N(H)2-q(C1-6алкил)q, -(CH2)s-NH-SO2-N(H)2-q (C1-6алкил)q, -(CH2)s-N(C1-4алкил)-SO2-N(H)2-q(C1-6алкил)q и -(CH2)s-O-C(=O)-C1-4алкил-N(H)2-q(C1-6алкил)q, и, когда они связаны с атомом азота, углерода, кремния или фосфора, Rx и Ry могут объединяться с образованием 3-7-членного кольца, необязательно содержащего один или два гетероатома, выбранных из O, N, S и окисленных форм N или S.
В одном варианте воплощения, Rx, Ry и Rz независимо представляют собой водород, C1-6 алкил (например, метил, этил, пропил, бутил), -(CH2)s-C3-8 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил) [например, пирролидинил].
В одном варианте воплощения, Rx, Ry и Rz независимо представляют собой водород или C1-6 алкил. В одном варианте воплощения, Rx, Ry и Rz независимо представляют собой водород или метил. В одном варианте воплощения, Rx и Ry представляют собой водород.
Подформулы
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ia):
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты;
где  представляет собой простую или двойную связь,
представляет собой простую или двойную связь,
и, когда  представляет собой двойную связь, тогда
представляет собой двойную связь, тогда
A выбран из CR8 и N,
W выбран из CH и N,
U выбран из CR8 и N, и
V выбран из CR9 и N,
или, когда представляет собой простую связь, тогда
представляет собой простую связь, тогда
A выбран из CR8 и N,
W выбран из CH и N, и
U представляет собой C(=O), и V представляет собой NR9, или V представляет собой C(=O), и U представляет собой NR9,
при условии, что не более чем два из A, U, V и W представляют собой азот;
где R1, R2a, R3a, R3b, R6, R7, R8, и R9 имеют значения, определенные в настоящем изобретении или в любом из его вариантов воплощения.
В одном варианте воплощения,  представляет собой двойную связь, А представляет собой CR8 (например, CH), W представляет собой CH, U представляет собой CR8, и V представляет собой N.
представляет собой двойную связь, А представляет собой CR8 (например, CH), W представляет собой CH, U представляет собой CR8, и V представляет собой N.
В одном варианте воплощения,  представляет собой двойную связь, А представляет собой CR8 (например, CH), W представляет собой CH, U представляет собой N, и V представляет собой CR9.
представляет собой двойную связь, А представляет собой CR8 (например, CH), W представляет собой CH, U представляет собой N, и V представляет собой CR9.
В одном варианте воплощения,  представляет собой двойную связь, А представляет собой CR8 (например, CH), W представляет собой N, U представляет собой CR8 (например, CH), и V представляет собой CR9.
представляет собой двойную связь, А представляет собой CR8 (например, CH), W представляет собой N, U представляет собой CR8 (например, CH), и V представляет собой CR9.
В одном варианте воплощения,  представляет собой двойную связь, А представляет собой CR8 (например, CH), W представляет собой CH, U представляет собой CR8 (например, CH), и V представляет собой CR9.
представляет собой двойную связь, А представляет собой CR8 (например, CH), W представляет собой CH, U представляет собой CR8 (например, CH), и V представляет собой CR9.
В одном варианте воплощения,  представляет собой простую связь, А выбран из CR8 (например, CH) и N (например, А представляет собой CH), W выбран из CH и N (например, CH), и U представляет собой C(=O), и V представляет собой NR9.
представляет собой простую связь, А выбран из CR8 (например, CH) и N (например, А представляет собой CH), W выбран из CH и N (например, CH), и U представляет собой C(=O), и V представляет собой NR9.
В одном варианте воплощения, R9 независимо выбран из водорода, галогена, C1-8 алкила, C2-8 алкенила, C2-8 алкинила, -Y-C3-12 карбоциклила, групп -Z-(3-12-членный гетероциклил), -(CH2)s-CN, -(CRxRy)s-O-Rz, -S(O)q-Rx, -C(=O)Rx, -C(=S)Rx, -C(=N)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy, -(CRxRy)s-C(=S)NRz, -(CRxRy)s-C(=N)NRz, -(CH2)s-NRx-(CH2)s-SO2-Ry и -(CH2)s-SO2NRxRy, где указанные C1-8 алкильные, C2-8 алкенильные и C2-8 алкинильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rc. В альтернативном варианте воплощения, R9 независимо выбран из водорода, C1-8 алкила, C2-8 алкенила, C2-8 алкинила, -Y-C3-12 карбоциклила, групп -Z-(3-12-членный гетероциклил), -(CH2)s-CN, -S(O)q-Rx, -C(=O)Rx, -C(=S)Rx, -C(=N)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CRxRy)s-C(=S)NRz, -(CRxRy)s-C(=N)NRz и -(CH2)s-SO2NRxRy, где указанные C1-8 алкильные, C2-8 алкенильные и C2-8 алкинильные группы, необязательно, могут быть замещены одной или несколькими группами Rb, и где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rc.
Когда  представляет собой простую связь, в одном варианте воплощения А выбран из CR8, такого как CH.
представляет собой простую связь, в одном варианте воплощения А выбран из CR8, такого как CH.
Когда  представляет собой простую связь, в одном варианте воплощения W представляет собой CH.
представляет собой простую связь, в одном варианте воплощения W представляет собой CH.
Когда  представляет собой простую связь, в одном варианте воплощения U представляет собой C(=O), и V представляет собой NR9. Когда V представляет собой NR9, в одном варианте воплощения R9 представляет собой C1-8 алкил (например, метил или -CH2-CH(CH3)2) или -Y-C3-12 карбоциклил (например, -CH2-фенил). Когда V представляет собой NR9, в одном варианте воплощения R9 представляет собой метил.
представляет собой простую связь, в одном варианте воплощения U представляет собой C(=O), и V представляет собой NR9. Когда V представляет собой NR9, в одном варианте воплощения R9 представляет собой C1-8 алкил (например, метил или -CH2-CH(CH3)2) или -Y-C3-12 карбоциклил (например, -CH2-фенил). Когда V представляет собой NR9, в одном варианте воплощения R9 представляет собой метил.
В одном варианте воплощения, по меньшей мере один из A, U, V, W представляет собой N, и один R8 представляет собой =O. В одном варианте воплощения, один из A, U, V, W представляет собой N, и один R8 представляет собой =O.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ib):
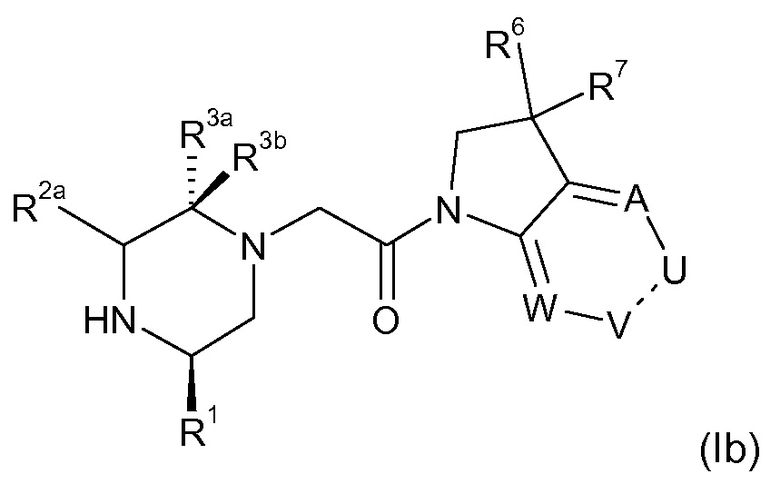
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где R1, R2a, R3a, R3b, R6, R7, A, U, V и W имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения.
В одном варианте воплощения, W представляет собой CH, U представляет собой CR8, и V представляет собой N.
В одном варианте воплощения, W представляет собой CH, U представляет собой N, и V представляет собой CR9.
В одном варианте воплощения, W представляет собой N, U представляет собой CR8 (например, CH), и V представляет собой CR9.
В одном варианте воплощения, W представляет собой CH, U представляет собой CR8 (например, CH), и V представляет собой CR9.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ic):
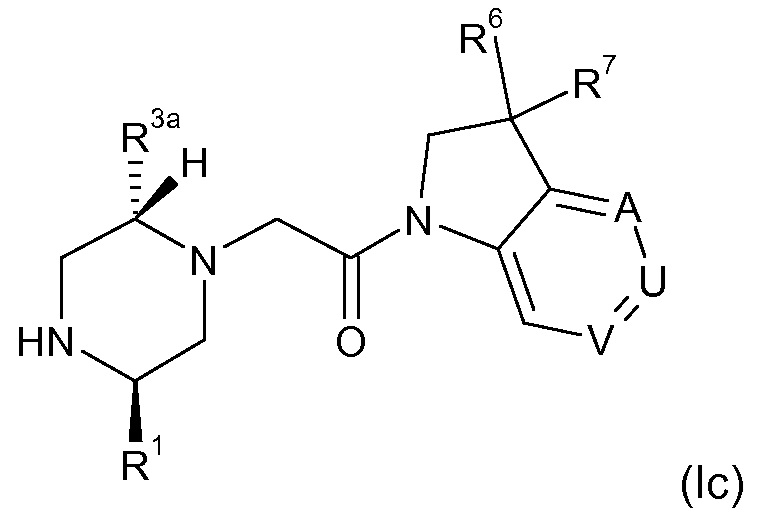
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где R1, R3a, R6, R7, A, U и V имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения.
В одном варианте воплощения, A представляет собой CH, U представляет собой CR8, и V представляет собой N.
В одном варианте воплощения, A представляет собой CH, U представляет собой N, и V представляет собой CR9.
В одном варианте воплощения, A представляет собой N, U представляет собой CR8 (например, CH), и V представляет собой CR9.
В одном варианте воплощения, A представляет собой CH, U представляет собой CR8 (например, CH), и V представляет собой CR9.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Id)a или (Id)b:
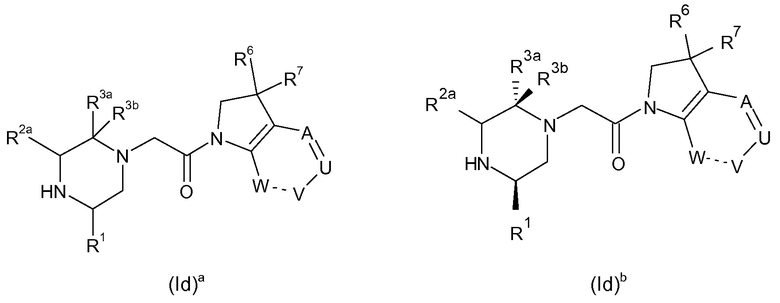
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где  представляет собой простую или двойную связь,
представляет собой простую или двойную связь,
и, когда  представляет собой двойную связь, тогда
представляет собой двойную связь, тогда
A выбран из CR8 и N,
W выбран из CH и N,
U выбран из CR8 и N, и
V выбран из CR9 и N,
или, когда  представляет собой простую связь, тогда
представляет собой простую связь, тогда
A выбран из CR8 и N,
U выбран из CH и N, и
W представляет собой C(=O) и V представляет собой NR9, или V представляет собой C(=O), и W представляет собой NR9,
при условии, что не более чем два из A, W, U и W представляют собой азот;
где R1, R2a, R3a, R3b, R6, R7, R8, и R9 имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ie)a или (Ie)b:
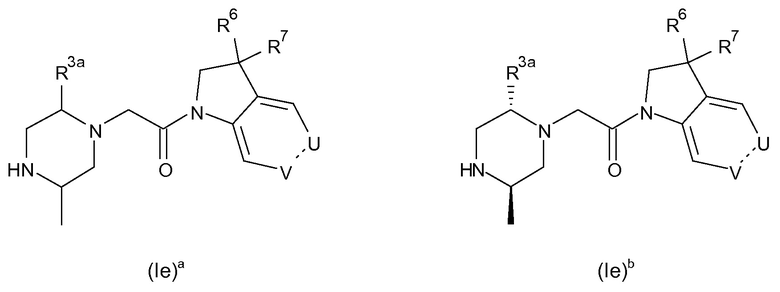
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где  представляет собой простую или двойную связь,
представляет собой простую или двойную связь,
и, когда  представляет собой двойную связь, тогда
представляет собой двойную связь, тогда
U выбран из CR8 и N, и
V представляет собой CR9;
или, когда  представляет собой простую связь, тогда
представляет собой простую связь, тогда
U представляет собой C(=O), и V представляет собой NR9;
где R3a, R6, R7, R8, и R9 имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения.
В следующем варианте воплощения, соединения формулы (Ie)a или (Ie)b, R3a представляет собой водород, C1-6 алкил (например, метил, этил или CH(CH3)2), необязательно замещенный одной или несколькими группами Rb, где группы Rb выбраны из галогена (например, фтор), -(CRxRy)s-O-Rz (например, -CH2O-CH3), -(CH2)s-NRxC(=O)Ry) (например, -CH2NHC(=O)CH3), -C(=O)NH(2-q)(C1-6 алкил)q (например, -C(=O)NH CH3 или -C(=O)N(CH3)2), -(CH2)s-(3-12-членный гетероциклил) (например, -CH2-пиразолил, -CH2-тиазолил, -CH2-пиперазинил, -CH2-пирролопиридинил, -CH2-триазолил, -CH2-имидазолидинил, -CH2-пиразинил, -CH2-пиридазинил, -CH2-пиперидинил, -CH2-морфолинил, -CH2-оксазолидинил, -CH2-пиримидинил, -CH2-пирролидинил или -CH2-пиридинил) или -C(=O)-(3-12-членный гетероциклил) (например, -C(=O)-азетидинил, -C(=O)-пирролидинил, -C(=O)-пиперидинил или -C(=O)-морфолинил).
В следующем альтернативном варианте воплощения соединения формулы (Ie)a или (Ie)b, R3a представляет собой водород, C1-6 алкил (например, метил, этил или CH(CH3)2), необязательно замещенный одной или несколькими группами Rb, где группы Rb выбраны из -(CRxRy)s-O-Rz (например, -CH2O-CH3), -(CH2)s-NRxC(=O)Ry) (например, -CH2NHC(=O)CH3), -C(=O)NH(2-q)(C1-6 алкил)q (например, -C(=O)NH CH3 или -C(=O)N(CH3)2), -(CH2)s-(3-12-членный гетероциклил) (например, -CH2-пиразолил) или -C(=O)-(3-12-членный гетероциклил) (например, -C(=O)-азетидинил или -C(=O)-морфолинил).
В следующем варианте воплощения соединения формулы (Ie)a или (Ie)b:
R6 и R7 оба представляют собой водород; или
R6 и R7 оба представляют собой C1-6 алкил (например, метил); или
R6 и R7 оба представляют собой C1-6 алкил (например, этил); или
один из R6 и R7 представляет собой C1-6 алкил (например, метил), а другой представляет собой C1-6 алкил (например, этил), -(CRxRy)s-O-Rz (например, -CH2-O-CH3 или -CH2-O-CH2-фенил), -(CRxRy)s-C(=O)ORz (например, -COOCH3), -Z-(3-12-членный гетероциклил) (например, -пиридил или -оксазолил), где указанный гетероциклил, необязательно, может быть замещен одним или несколькими C1-6 алкильными группами (например, метил) или -Y-C3-12 карбоциклил, (например, -фенил или -CH2-фенил); или
R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной насыщенной карбоциклической (например, циклопропил, циклобутил или циклопентил) или гетероциклической группы (например, азетидин или пиперидин), необязательно замещенный одной C(=O)Rx группой (например, -C(=O)CH3) или одной -(CRxRy)s-C(=O)ORz группой (например, -COO-CH2-фенил); или
R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием 5-членной насыщенной карбоциклической группы, которая является конденсированной с 6-членным ароматическим карбоциклическим или гетероциклическим кольцом, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb, такими как необязательно замещенный (например, незамещенный) инданил.
В следующем альтернативном варианте воплощения соединения формулы (Ie)a или (Ie)b:
R6 и R7 оба представляют собой водород; или
R6 и R7 оба представляют собой C1-6 алкил (например, метил); или
один из R6 и R7 представляет собой C1-6 алкил (например, метил), а другой представляет собой -(CRxRy)s-O-Rz (например, -CH2-O-CH2-фенил) или -Y-C3-12 карбоциклил, (например, -фенил); или
R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной насыщенной карбоциклической и гетероциклической группы (например, азетидин), необязательно замещенной одной C(=O)Rx группой (например, -C(=O)CH3); или
R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием 5-членной насыщенной карбоциклической группы, которая является конденсированной с 6-членным ароматическим карбоциклическим или гетероциклическим кольцом, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb, такими как необязательно замещенный (например, незамещенный) инданил.
В следующем варианте воплощения соединения формулы (Ie)a или (Ie)b:
R6 и R7 оба представляют собой водород; или
R6 и R7 оба представляют собой C1-6 алкил (например, метил); или
один из R6 и R7 представляет собой C1-6 алкил (например, метил), а другой представляет собой -(CRxRy)s-O-Rz (например, -CH2-O-CH2-фенил); или
R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной насыщенной карбоциклической и гетероциклической группы (например, азетидин), необязательно замещенной одной C(=O)Rx группой (например, -C(=O)CH3); или
R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием 5-членной насыщенной карбоциклической группы, которая является конденсированной с 6-членным ароматическим карбоциклическим или гетероциклическим кольцом, где указанные карбоциклические и гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами Rb, такими как необязательно замещенный (например, незамещенный) инданил.
В следующем варианте воплощения соединения формулы (Ie)a или (Ie)b, R8 представляет собой галоген (например, фтор, хлор или бром), =O или C1-6 алкил (например, метил). Еще в одном варианте воплощения соединения формулы (Ie), R8 представляет собой галоген (например, фтор).
В следующем варианте воплощения соединения формулы (Ie)a или (Ie)b, R9 выбран из галогена (например, хлор, фтор или бром), -(CH2)s-CN (например, -CN), C1-8 алкила (например, метил, этил, пропил, изопропил, изобутил, бутил или -(CH2)2-CH(CH3)2), -Y-C3-12 карбоциклила (например, -фенил, -CH2-фенил, -CF2-фенил, -CH(CH3)-фенил, -CH(OCH3)-фенил, -C(=CH2)-фенил, -N(H)-фенил, -N(CH3)-фенил, -O-фенил, -SO2-фенил, -C(=O)-фенил, -CH2-циклогексил, -CF2-циклопропил, -CF2-CH2-циклопропил, -SO2-циклопропил, -CF2-циклобутил, циклопентенил, циклопентил, циклогексил или циклогексенил), групп -Z-(3-12-членный гетероциклил) (например, -фуранил, -пиразолил, -CH2-пирролидинил, --тиенил, -оксадиазолил, -бензофуранил, -тетразолил, -CO-пирролидинил, -SO2-пирролидинил, -CH2-пиразолил, пирролидинил), -S(O)q-(CRxRy)s-Rz (например, -SO2 CH3, -SO2-CH2CH(CH3)2 или -SO2-CH2-фенил) или -(CH2)s-SO2NRxRy (например, -SO2N(CH3)2), где указанные карбоциклические группы (например, фенил) или гетероциклические группы (например, фуранил, пиразолил, пирролидинил, тиенил, оксадиазолил, бензофуранил или тетразолил), необязательно, могут быть замещены одной или несколькими группами Rb, такими как =O, галоген (например, фтор или хлор), C1-6 алкил (например, метил), -(CH2)s-CN (например, -CN) или -(CRxRy)s-O-Rz (например, метокси).
В следующем альтернативном варианте воплощения соединения формулы (Ie)a или (Ie)b, R9 выбран из галогена (например, хлор), -(CH2)s-CN (например, -CN), C1-8 алкила (например, -(CH2)2-CH(CH3)2), -Y-C3-12 карбоциклила (например, -CH2-фенил, -CH(CH3)-фенил, -C(=CH2)-фенил, -O-фенил, -SO2-фенил, -C(=O)-фенил, -CH2-циклогексил, циклопентенил, циклопентил или циклогексенил), -S(O)q-(CRxRy)s-Rz (например, -SO2 CH3, -SO2-CH2CH(CH3)2 или -SO2-CH2-фенил) или -(CH2)s-SO2NRxRy (например, -SO2N(CH3)2), где указанные карбоциклические группы (например, фенил), необязательно, могут быть замещены одной или несколькими группами Rb, такими как галоген (например, фтор или хлор), C1-6 алкил (например, метил), -(CH2)s-CN (например, -CN) или -(CRxRy)s-O-Rz (например, метокси).
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (If)a или (If)b:
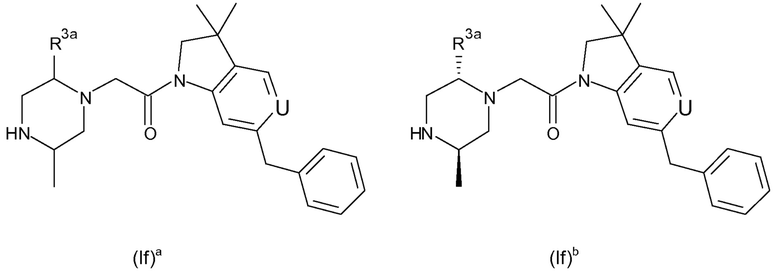
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где
U выбран из CH и N;
и R3a имеет значение, определенное в настоящем изобретении или в любом из вариантов воплощения.
В следующем варианте воплощения, соединения формулы (If)a или (If)b, R3a представляет собой -(CRxRy)s-O-Rz (например, -CH2OCH3), -(CH2)s-(3-12-членный гетероциклил) (например, -CH2-пиразолил, -CH2-тиазолил, -CH2-пиперазинил, -CH2-пирролопиридинил, -CH2-триазолил, -CH2-имидазолидинил, -CH2-пиразинил, -CH2-пиридазинил, -CH2-пиперидинил, -CH2-морфолинил, -CH2-оксазолидинил, -CH2-пиримидинил, -CH2-пирролидинил или -CH2-пиридинил) или -C(=O)-(3-12-членный гетероциклил) (например, -C(=O)-морфолинил). В следующем альтернативном варианте воплощения соединения формулы (If), R3a представляет собой -(CRxRy)s-O-Rz (например, -CH2OCH3), -(CH2)s-(3-12-членный гетероциклил) (например, -CH2-пиразолил) или -C(=O)-(3-12-членный гетероциклил) (например, -C(=O)-морфолинил). В следующем варианте воплощения соединения формулы (If), R3a представляет собой -CH2OCH3, -CH2-пиразолил (например, -CH2-(пиразол-1-ил) или -C(=O)-морфолинил (-C(=O)-(морфолин-4-ил)).
В одном варианте воплощения соединения формулы (If)a или (If)b, R3a представляет собой -(CH2)s-(3-12-членный гетероциклил) (например, -CH2-морфолинил), необязательно замещенный одной или несколькими C1-6 алкильными группами (например, метил).
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ig)a или (Ig)b:
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где R1, R3a, R6, R7, A, U, V и W имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ig)a или (Ig)b:
где
A выбран из CH и C-Cl;
W выбран из CH и N;
U выбран из CR8 и N;
V выбран из CR9 и N;
R1 представляет собой C1-4 алкил (например, метил), необязательно замещенный одним, двумя или тремя галогенами;
R3a выбран из водорода, C1-6 алкила (например, метил, этил или CH(CH3)2), необязательно замещенного группой -(CRxRy)s-O-Rz (например, -OCH3 или -OH) или группой -(CH2)s-NRxC(=O)Ry) (например, -NHC(=O)CH3), -C(=O)NH(2-q)(C1-6 алкил)q (например, -CONHCH3 или CON(CH3)2), -(CH2)s-(3-12-членный гетероциклил) (например, -(CH2)s-5-6-членный гетероарил) или -C(=O)-(4-6-членный насыщенный гетероциклил);
R6 и R7 независимо выбраны из водорода, C1-6 алкила (например, метил или этил), -Y-C3-12 карбоциклила (например, -фенил или -CH2-фенил), -(CRxRy)s-C(=O)ORz (например, -COOCH3), -(CRxRy)s-O-Rx (например, -CH2-O-CH3 или -CH2-O-CH2-фенил), -Z-(3-12-членный гетероциклил) (например, -пиридил или -оксазолил), где указанный гетероциклил, необязательно, может быть замещен одним или несколькими C1-6 алкильными группами (например, метил), или группы R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной полностью насыщенной карбоциклической и гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, которая необязательно является конденсированной с фенильным кольцом, где указанные гетероциклические группы, необязательно, могут быть замещены одной -C(=O)Rx группой (например, -C(=O)CH3) или -C(=O)ORz (-C(=O)O-CH2-фенил);
R8 выбран из водорода, галогена (например, хлор, бром или фтор), =O, C1-6 алкила (например, метил) и -O-C1-6алкила (например, -O-CH3);
R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-6 алкила (например, метил, этил, пропил, изопропил, бутил, изобутил или пентил), C1-4 алкила, замещенного галогеном (например, -CF3, -CF2-CH3, -CF2-CH2-CH3, -CF2-CH(CH3)2, -CF2-CH2-CH(CH3)2 или -CF2-CH2-CH2-CH3), --Y-фенила, -Y-циклопентила, -Y-циклопентенила, -Y-циклогексила, -Y-циклогексенила, -Y-циклопропила, Y-циклобутила (например, -фенил, -CH2-фенил, -CF2-фенил, -CH(CH3)-фенил, -CH(OCH3)-фенил, -C(=CH2)-фенил, -NH-фенил, -N(CH3)-фенил, -O-фенил, -SO2-фенил, -C(=O)-фенил, -CH2-циклогексил, циклопентенил, циклопентил, циклогексил, циклогексенил, -CF2-циклопропил, -CF2-CH2-циклопропил, -CF2-циклобутил, -SO2-циклопропил), -Z-пиразолила, -Z-фуранила, -Z-тиенила, -Z-оксадиазолила, -Z-бензофуранила, -Z-тетразолила или -Z-пирролидинила (например, -SO2-пирролидинил, -C(=O)-пирролидинил, пирролидинил, -CH2-пирролидинил, -CH2-пиразолил, -фуранил, -пиразолил, -тиенил, -оксадиазолил, -бензофуранил или -тетразолил), групп -O-Rx (например, -OCH3 или -OCF3), -(CH2)s-CN (например, -CN), -S(O)q-(CRxRy)s-Rz (например, -SO2CH3, -SO2CH2CH3, -SO2-CH2CH(CH3)2), -(CRxRy)s-C(=O)ORz (например, -C(=O)OCH3), -(CRxRy)s-C(=O)NRxRy (например, -C(=O)NHCH3, -C(=O)N(CH3)2) -(CH2)s-NRxRy (например, -NH2), -(CH2)s-NRx-(CH2)s-SO2-Ry (например, -NHSO2CH3) и -(CH2)s-SO2NRxRy (например, -SO2-CH2-фенил, -SO2NHCH3, -SO2N(CH3)2, -SO2NHCH(CH3)2), где указанные карбоциклические или гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами, выбранными из галогена (например, хлор или фтор), =O, C1-4 алкила, (например, метил), C1-4 алкоксила (например, -OCH3) и -CN; где Y и Z независимо выбраны из связи, -CRxRy-, -C(=O)-, -NRx, -O- и -S(O)2- (например, связь, -CH2-, -CH(CH3)-, -C(=O)-, -NH, -NCH3-, -O- и -S(O)2-); и где Rx, Ry и Rz независимо представляют собой водород, C1-4 алкил (например, метил, этил, изопропил), галогенC1-4 алкил (например, трифторметил) и -(CH2)s-фенил (например, -CH2-фенил).
В альтернативном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ig)a или (Ig)b:
где
A выбран из CH и C-Cl;
W выбран из CH и N;
U выбран из CR8 и N;
V выбран из CR9 и N;
R1 представляет собой C1-4 алкил (например, метил), необязательно замещенный одним, двумя или тремя атомами галогена;
R3a выбран из водорода, C1-6 алкила (например, метил, этил или CH(CH3)2), необязательно замещенного группой -(CRxRy)s-O-Rz (например, -OCH3 или -OH) или группой -(CH2)s-NRxC(=O)Ry) (например, -NHC(=O)CH3), -C(=O)NH(2-q)(C1-6 алкил)q, -(CH2)s-(3-12-членный гетероциклил) (например, -(CH2)s-5-6-членный гетероарил) или -C(=O)-(4-6-членный насыщенный гетероциклил);
R6 и R7 независимо выбраны из водорода, C1-6 алкила (например, метил), -Y-C3-12 карбоциклила (например, -CH2-фенил), -(CRxRy)s-O-Rx (например, -CH2-O-CH2-фенил), или группы R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной полностью насыщенной карбоциклической и гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, которая необязательно является конденсированной с фенильным кольцом, где указанные гетероциклические группы, необязательно, могут быть замещены одной -C(=O)Rx группой (например, -C(=O)CH3) или -C(=O)ORz (-C(=O)O-CH2-фенил);
R8 выбран из водорода, галогена (например, бром, фтор), =O и -O-C1-6алкил (например, -O-CH3);
R9 выбран из водорода, галогена (например, бром, хлор или фтор), C1-6 алкила (например, метил, пропил, бутил или пентил), C1-4 алкила, замещенного галогеном (например, -CF3), --Y-фенила, -Y-циклопентила, -Y-циклопентенила, -Y-циклогексила, -Y-циклогексенила, -Y-циклопропила (например, -фенил, -CH2-фенил, -CH(CH3)-фенил, -C(=CH2)-фенил, -NH-фенил, -N(CH3)-фенил, O-фенил, -SO2-фенил, -C(=O)-фенил, -CH2-циклогексил, циклопентенил, циклопентил, циклогексенил, -SO2-циклопропил), -Z-пиразолила или -Z-пирролидинила (например, -SO2-пирролидинил, -C(=O)-пирролидининил, пирролидинил, -CH2-пиразолил), групп -O-Rx (например, -OCH3 или -OCF3), -(CH2)s-CN (например, -CN), -S(O)q-(CRxRy)s-Rz (например, -SO2CH3, -SO2CH2CH3, -SO2-CH2CH(CH3)2), -(CRxRy)s-C(=O)ORz (например, -C(=O)OCH3), -(CRxRy)s-C(=O)NRxRy (например, -C(=O)NHCH3, -C(=O)N(CH3)2) -(CH2)s-NRxRy (например, -NH2) и -(CH2)s-SO2NRxRy (например, -SO2-CH2-фенил, -SO2NHCH3, -SO2N(CH3)2, -SO2NHCH(CH3)2), где указанные карбоциклические или гетероциклические группы, необязательно, могут быть замещены одной или несколькими (например, 1, 2 или 3) группами, выбранными из галогена (например, хлор или фтор), =O, C1-4 алкила, (например, метил), C1-4 алкоксила (например, -OCH3) и -CN; где Y и Z независимо выбраны из связи, -CRxRy-, -C(=O)-, -NRx, -O- и -S(O)2- (например, связь, -CH2-, -CH(CH3)-, -C(=O)-, -NH, -NCH3-, -O- и -S(O)2-); и где Rx, Ry и Rz независимо представляют собой водород, C1-4 алкил (например, метил, этил, изопропил), галогенC1-4 алкил (например, трифторметил) и -(CH2)s-фенил (например, -CH2-фенил).
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ig)a или (Ig)b:
где;
A выбран из CH и C-Cl;
W выбран из CH и N;
U выбран из CR8 и N;
V выбран из CR9 и N;
R1 представляет собой -CH3, -CF3 или -CH2F.
R3a представляет собой водород, метил, этил, CH(CH3)2, -CH2O-CH3, -CH2OH, -CH2-NHC(=O)CH3, -C(=O)NHCH3, -C(=O)N(CH3)2, -CH2-(пиразол-1-ил), -CH2-(тиазол-2-ил), -CH2-(пиперазин-4-ил), -CH2-(пирролопиридин-1-ил), -CH2-(триазол-1-ил), -CH2-(имидазолидин-1-ил), -CH2-(пиразин-1-ил), -CH2-(пиридазин-2-ил), -CH2-(пиперидин-1-ил), -CH2-(морфолин-4-ил), -CH2-(оксазолидин-3-ил), -CH2-(пиримидин-1-ил), -CH2-(пирролидин-1-ил) или -CH2-(пиридин-1-ил), -C(=O)-азетидинил, -C(=O)-пирролидинил, -C(=O)-пиперидинил или -C(=O)-морфолинил;
R6 и R7 независимо представляют собой водород, метил, этил, -фенил, CH2-фенил, -CH2-O-CH3, -COOCH3, -CH2-O-CH2-фенил, пиридинил, оксазолил, или группы R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием циклопропила, циклобутила, циклопентила, азетидина, пиперидина или инданила, где указанные азетидинильные и пиперидинильные группы замещены группой -C(=O)CH3, или указанная пиперидинильная группа представляет собой замещенный -C(=O)O-CH2-фенил;
R8 выбран из водорода, брома, фтора, хлора, =O, метила и -O-CH3;
R9 независимо выбран из водорода, брома, хлора, фтора, метила, этила, пропила, изопропила, бутила, изобутила, изопентила, -CF3, -CF2-CH3, -CF2-CH2-CH3, -CF2-CH(CH3)2, -CF2-CH2-CH(CH3)2, -CF2-CH2-CH2-CH3, -фенила, -CF2-фенила, фторхлорфенила (например, 2-фтор-5-хлорфенил), -CH2-фенила, -CH(OCH3)-фенила, -CH2-нитрофенила (-CH2-3-нитрофенил), -CH2-фторфенила (например, -CH2-2-фторфенил, -CH2-3-фторфенил, -CH2-4-фторфенил или -CH2-2,4-дифторфенил), -CH2-дифторфенила (-CH2-2,4-дифторфенил), -CH2-хлорфенила (например, -CH2-2-хлорфенил, -CH2-3-хлорфенил, -CH2-4-хлорфенил), -CH2-метоксифенила (например,-CH2-3-метоксифенил, -CH2-4-метоксифенил), -CH(CH3)-фенила, -C(=CH2)-фенила, -NH-фенила, -N(CH3)-фенила, -O-фенила, -O-хлорфенила (например, O-(2-хлорфенил)), -O-фторфенила (например, -O-(2,6-дифторфенил)), -O-хлорметилфенила (например, -O-(2-хлор-6-метилфенил)), -O-метилфенила (например, O-(2-метилфенил) или -O-(2,6-диметилфенил)), -SO2-фенила, -SO2-метоксифенила (например, -SO2-(p-метоксифенил), -C(=O)-фенила, -C(=O)-пирролидининила, -CH2-циклогексила, циклогексила, циклопентенила, циклопентила, циклогексенила, -SO2-циклопропила, -CF2-циклопропила, -CF2-CH2-циклопропила, -CF2-циклобутила, -SO2-пирролидинила, -CO-пирролидинила, пирролидинила, необязательно замещенного группой =O, -CH2-пирролидинила, необязательно замещенного группой =O, -CH2-пиразолила, -фуранила, -пиразолила, замещенного метилом, -тиенила, необязательно замещенного метилом, -оксадиазолила, необязательно замещенного метилом, -бензофуранила, -тетразолила, -OCH3, -OCF3, -CN, -SO2CH3, -SO2CH2CH3, -SO2-CH2CH(CH3)2, -SO2-CH2-фенила, -SO2NHCH3, -SO2N(CH3)2, -SO2NHCH(CH3)2), -C(=O)OCH3, -C(=O)NHCH3, -C(=O)N(CH3)2, -NHS(O)2CH3, -NH2.
В одном альтернативном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ig)a или (Ig)b:
где;
A выбран из CH и C-Cl;
W выбран из CH и N;
U выбран из CR8 и N;
V выбран из CR9 и N;
R1 представляет собой -CH3, -CF3 или -CH2F.
R3a представляет собой водород, метил, этил, CH(CH3)2, -CH2O-CH3, -CH2OH, -CH2-NHC(=O)CH3, -C(=O)NHCH3, -C(=O)N(CH3)2, -CH2-(пиразол-1-ил), -C(=O)-азетидинил или -C(=O)-морфолинил;
R6 и R7 независимо представляют собой водород, метил, CH2-фенил, -CH2-O-CH2-фенил, или группы R6 и R7, вместе с атомом углерода, с которым они связаны, объединены с образованием циклопропила, циклобутила, циклопентила, азетидина, пиперидина или инданила, где указанные азетидинильные и пиперидинильные группы замещены группой -C(=O)CH3, или указанная пиперидинильная группа представляет собой замещенный -C(=O)O-CH2-фенил;
R8 выбран из водорода, брома, фтора, =O и -O-CH3;
R9 независимо выбран из водорода, брома, хлора, фтора, метила, изопропила, изобутила, изопентила, -CF3, -фенила, фторхлорфенила (например, 2-фтор-5-хлорфенил), -CH2-фенила, -CH2-нитрофенила (-CH2-3-нитрофенил), -CH2-фторфенила (например, -CH2-2-фторфенил, -CH2-3-фторфенил, -CH2-4-фторфенил), -CH2-дифторфенила (-CH2-2,4-дифторфенил), -CH2-хлорфенила (например, -CH2-2-хлорфенил, -CH2-3-хлорфенил, -CH2-4-хлорфенил), -CH2-метоксифенила (например, -CH2-3-метоксифенил, -CH2-4-метоксифенил), -CH(CH3)-фенила, -C(=CH2)-фенила, -NH-фенила, -N(CH3)-фенила, O-фенила, O-хлорфенила (например, O-(2-хлорфенил)), O-метилфенила (например, O-(2-метилфенил)), -SO2-фенила, -SO2-метоксифенила (например, -SO2-(p-метоксифенил), -C(=O)-фенила, -C(=O)-пирролидининила, -CH2-циклогексила, циклопентенила, циклопентила, циклогексенила, -SO2-циклопропила, -SO2-пирролидинила, пирролидинила, необязательно замещенного группой =O, -CH2-пиразолила, -OCH3, -OCF3, -CN, -SO2CH3, -SO2CH2CH3, -SO2-CH2CH(CH3)2, -SO2-CH2-фенила, -SO2NHCH3, -SO2N(CH3)2, -SO2NHCH(CH3)2), -C(=O)OCH3, -C(=O)NHCH3, -C(=O)N(CH3)2, -NHS(O)2CH3, -NH2.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ih)a или (Ih)b:
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где R1, R2a, R3a, R3b, R6, R7 и R9 имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ii)a или (Ii)b:
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где R3a, R6, R7 и R9 имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения. В одном варианте воплощения, R6 и R7 оба представляют собой метил.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ij)a или (Ij)b:
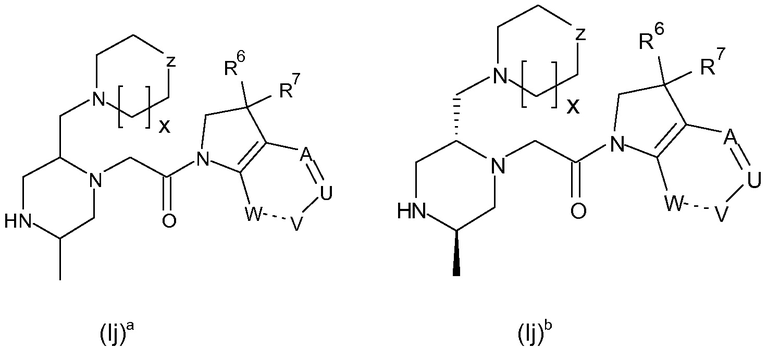
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где  представляет собой простую или двойную связь,
представляет собой простую или двойную связь,
и, когда  представляет собой двойную связь, тогда
представляет собой двойную связь, тогда
A выбран из CR8 и N,
W выбран из CH и N,
U выбран из CR8 и N, и
V выбран из CR9 и N,
где R1, R2a, R3a, R3b, R6, R7, R8 и R9 имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения, и где z представляет собой C, N или O, и x имеет значение 0, 1 или 2. В одном варианте воплощения, формулы (Ih) z имеет значение 0 и 1.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Ik)a или (Ik)b:
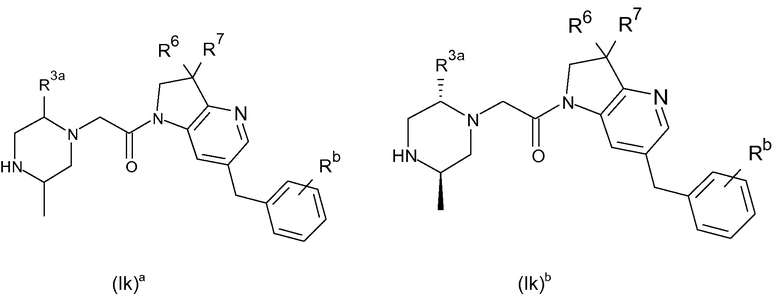
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где R3a, R6, R7, и Rb имеют значения, определенные в настоящем изобретении или в любом из вариантов воплощения.
В одном варианте воплощения, соединение формулы (I) представляет собой соединение формулы (Im) или (In):
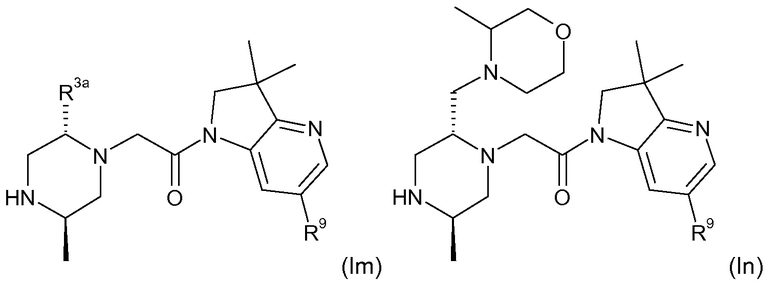
или его таутомерные или стереохимически изомерные формы, N-оксиды, фармацевтически приемлемые соли или сольваты; где R9 имеет значение, определенное в настоящем изобретении или в любом из вариантов воплощения.
В одном варианте воплощения, настоящее изобретение обеспечивает соединение формулы (I), которое представляет собой форму свободного основания соединения E1-E266 или его таутомерную или стереохимически изомерную форму, N-оксид, фармацевтически приемлемую соль или сольват.
В одном конкретном варианте воплощения, который можно указать, настоящее изобретение обеспечивает соединение формулы (I), которое представляет собой форму свободного основания соединения E1-E116 или его таутомерную или стереохимически изомерную форму, N-оксид, фармацевтически приемлемую соль или сольват.
В соответствии с одним аспектом настоящего изобретения, обеспечивается соединение формулы (I), определенное выше в настоящей заявке, при условии, что соединение является отличным от 1-{6-бензил-3,3-диметил-1H,2H,3H-пирроло[3,2-c]пиридин-1-ил}-2-[3-(трифторметил)пиперазин-1-ил]этан-1-она (E113).
В соответствии с одним аспектом настоящего изобретения, обеспечивается соединение формулы (I), определенное выше в настоящей заявке, при условии, что соединение является отличным от 3,3-диметил-1-[(2S)-2-[(3R)-3-метилпиперазин-1-ил]бутаноил]-2,3-дигидро-1H-индол-6-карбонитрила (E266).
В следующем варианте воплощения, соединение формулы (I) представляет собой следующее соединение:
1-(6-Бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-((2R,5R)-2-метоксиметил-5-метилпиперазин-1-ил)этанон;
1-{6-Бензил-3,3-диметил-1H,2H,3H-пирроло[3,2-c]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-[(морфолин-4-ил)карбонил]пиперазин-1-ил]этан-1-он;
1-(6-Бензил-3,3-диметил-2,3-дигидроиндол-1-ил)-2-[(2R,5R)-5-метил-2-(морфолин-4-карбонил)пиперазин-1-ил]этанон;
1-(6-Бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-((2R,5R)-5-метил-2-пиразол-1-илметилпиперазин-1-ил)этанон (E112);
или его таутомерную или стереохимически изомерную форму, N-оксид, фармацевтически приемлемую соль или сольват, такую как:
1-(6-Бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-((2R,5R)-2-метоксиметил-5-метилпиперазин-1-ил)этанон, гидрохлоридная соль (E63);
1-{6-Бензил-3,3-диметил-1H,2H,3H-пирроло[3,2-c]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-[(морфолин-4-ил)карбонил]пиперазин-1-ил]этан-1-он, гидрохлоридная соль (E101); или
1-(6-Бензил-3,3-диметил-2,3-дигидроиндол-1-ил)-2-[(2R,5R)-5-метил-2-(морфолин-4-карбонил)пиперазин-1-ил]этанон, гидрохлоридная соль (E111).
В одном варианте воплощения, соединение формулы (I) представляет собой следующее соединение: 1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метил-морфолин-4-илметил)пиперазин-1-ил]-этанон (E259), 1-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон (E260), 1-[6-(2-фтор-бензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон (E261), 1-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон (E264), или его таутомерную или стереохимически изомерную форму, N-оксид, фармацевтически приемлемую соль или сольват, такую как 1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]-этанон дигидрохлорид (E259), 1-[6-(1,1-Дифтор-бутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон дигидрохлорид (E260), 1-[6-(2-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метил-морфолин-4-илметил)-пиперазин-1-ил]-этанон дигидрохлорид (E261) или 1-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон дигидрохлорид (E264).
В одном варианте воплощения, соединение формулы (I) представляет собой 1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон (E259) или его таутомерную или стереохимически изомерную форму, N-оксид, фармацевтически приемлемую соль или сольват, такую как гидрохлоридная соль 1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]-этанона, т.е. 1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон дигидрохлорид.
Во избежание каких-либо сомнений, должно быть понятно, что каждое общее и конкретное предпочтение, вариант воплощения и пример для одного заместителя можно комбинировать с каждым общим и конкретным предпочтением, вариантом воплощения и примером для одного или нескольких, предпочтительно всех других заместителей, определенных в настоящей заявке, и что все такие варианты воплощения охватываются настоящей заявкой.
Соли, сольваты, таутомеры, изомеры, N-оксиды, сложные эфиры, пролекарства и изотопы
Ссылка на соединение формулы (I) и подгруппы такого соединения также включает его ионные формы, соли, сольваты, изомеры (включая геометрические и стереохимические изомеры), таутомеры, N-оксиды, сложные эфиры, пролекарства, изотопы и их защищенные формы, например, обсуждаемые ниже; предпочтительно, их соли или таутомеры, или изомеры, или N-оксиды, или сольваты; и более предпочтительно, их соли или таутомеры, или N-оксиды, или сольваты, еще более предпочтительно, их соли или таутомеры, или сольваты.
Соли
Многие соединения формулы (I) могут существовать в форме солей, например, кислотно-аддитивных солей или, в некоторых случаях, солей органических и неорганических оснований, таких как карбоксилатные, сульфонатные и фосфатные соли. Все такие соли охватываются объемом настоящего изобретения, и ссылки на соединения формулы (I) включают солевые формы соединений.
Соли по настоящему изобретению можно синтезировать из исходного соединения, которое содержит щелочную или кислотную группу, традиционными химическими способами, такими как способы, описанные в Pharmaceutical Salts: Properties, Selection and Use, P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, Hardcover, 388 pages, August 2002. Как правило, такие соли можно получить путем взаимодействия формы свободной кислоты или основания этих соединений с подходящим основанием или кислотой в воде или в органическом растворителе или в смеси таких двух типов растворителей; как правило, используют неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил.
Кислотно-аддитивные соли (моно- или ди-соли) могут быть образованы с множеством различных кислот, как неорганических, так и органических. Примеры кислотно-аддитивных солей включают моно- или ди-соли, образованные с кислотой, выбранной из группы, состоящей из уксусной, 2,2-дихлоруксусной, адипиновой, альгиновой, аскорбиновой (например, L-аскорбиновой), L-аспарагиновой, бензолсульфоновой, бензойной, 4-ацетамидобензойной, бутановой, (+) камфорной, камфор-сульфоновой, (+)-(1S)-камфор-10-сульфоновой, каприновой, капроновой, каприловой, коричной, лимонной, цикламиновой, додецилсерной, этан-1,2-дисульфоновой, этансульфоновой, 2-гидроксиэтансульфоновой, муравьиной, фумаровой, галактуроновой, гентизиновой, глюкогептоновой, D-глюконовой, глюкуроновой (например, D-глюкуроновой), глутаминовой (например, L-глутаминовой), α-оксоглутаровой, гликолевой, гиппуровой, галогенводородных кислот (например, бромистоводородной, хлористоводородной, иодистоводородной), изетионовой, молочной (например, (+)-L-молочной, (±)-DL-молочной), лактобионовой, малеиновой, яблочной, (-)-L-яблочной, малоновой, (±)-DL-миндальной, метансульфоновой, нафталин-2-сульфоновой, нафталин-1,5-дисульфоновой, 1-гидрокси-2-нафтойной, никотиновой, азотной, олеиновой, оротовой, щавелевой, пальмитиновой, памовой, фосфорной, пропионовой, пирувиновой, L-пироглутаминовой, салициловой, 4-амино-салициловой, себациновой, стеариновой, янтарной, серной, дубильной, (+)-L-винной, тиоциановой, п-толуолсульфоновой, ундециленовой и валериановой кислот, а также ацилированных аминокислот и катионообменных смол.
Одна конкретная группа солей состоит из солей, образованных из уксусной, хлористоводородной, иодистоводородной, фосфорной, азотной, серной, лимонной, молочной, янтарной, малеиновой, яблочной, изетионовой, фумаровой, бензолсульфоновой, толуолсульфоновой, метансульфоновой (мезилат), этансульфоновой, нафталинсульфоновой, валериановой, уксусной, пропановой, бутановой, малоновой, глюкуроновой и лактобионовой кислотой. Одна конкретная соль представляет собой гидрохлоридную соль.
Если соединение является анионным или содержит функциональную группу, которая может быть анионной (например, -COOH может быть -COO-), тогда соль может быть образована с органическим или неорганическим основанием, генерирующим подходящий катион. Примеры подходящих неорганических катионов включают, но не ограничиваются этим, ионы щелочных металлов, такие как Li+, Na+ и K+, катионы щелочноземельных металлов, такие как Ca2+ и Mg2+, и другие катионы, такие как Al3+ или Zn+. Примеры подходящих органических катионов включают, но не ограничиваются этим, аммониевый ион (т.е. NH4+) и замещенные аммониевые ионы (например, NH3R+, NH2R2+, NHR3+, NR4+). Примеры некоторых подходящих замещенных аммониевых ионов включают ионы, происходящие из: метиламина, этиламина, диэтиламина, пропиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, таких как лизин и аргинин. Примером обычного четвертичного аммониевого иона является N(CH3)4+.
Где соединения формулы (I) содержат функциональную группу амина, они могут образовывать четвертичные аммониевые соли, например, путем взаимодействия с алкилирующим агентом в соответствии со способами, хорошо известными специалистам в данной области. Такие четвертичные аммониевые соединения охватываются объемом формулы (I).
Соединения по настоящему изобретению могут существовать в виде моно- или ди-солей в зависимости от pKa кислоты, из которой образована соль.
Солевые формы соединений по настоящему изобретению типично представляют собой фармацевтически приемлемые соли, и примеры фармацевтически приемлемых солей обсуждаются в Berge et al., 1977, «Pharmaceutically Acceptable Salts,» J. Pharm. Sci., Vol. 66, pp. 1-19. Однако соли, которые не являются фармацевтически приемлемыми, также можно получить в виде промежуточных форм, которые затем можно преобразовать в фармацевтически приемлемые соли. Такие не являющиеся фармацевтически приемлемыми солевые формы, которые могут быть полезными, например, для очистки или разделения соединений по настоящему изобретению, также составляют часть настоящего изобретения.
В одном варианте воплощения настоящего изобретения, обеспечивается фармацевтическая композиция, включающая раствор (например, водный раствор), содержащий соединение формулы (I) и его подгруппы и примеры, описанные в настоящей заявке, в форме соли в концентрации больше чем 10 мг/мл, типично больше чем 15 мг/мл, и предпочтительно больше чем 20 мг/мл.
N-Оксиды
Соединения формулы (I), содержащие функциональную группу амина, также могут образовывать N-оксиды. В настоящей заявке ссылка на соединение формулы (I), которое содержит функциональную группу амина, также включает N-оксид.
Когда соединение содержит несколько функциональных групп амина, один или более чем один атом азота может быть окислен с образованием N-оксида. Конкретные примеры N-оксидов включают N-оксиды третичного амина или атома азота азотсодержащего гетероцикла.
N-Оксиды могут быть образованы путем обработки соответствующего амина окислителем, таким как пероксид водорода или перкислота (например, пероксикарбоновая кислота), см., например, Advanced Organic Chemistry, by Jerry March, 4th Edition, Wiley Interscience, pages. Более конкретно, N-оксиды можно получить с использованием процедуры, описанной L. W. Deady (Syn. Comm. 1977, 7, 509-514), в которой аминовое соединение подвергают взаимодействию с м-хлорпероксибензойной кислотой (MCPBA), например, в инертном растворителе, таком как дихлорметан.
Геометрические изомеры и таутомеры
Соединения формулы (I) могут существовать в различных геометрических изомерных и таутомерных формах, и ссылки на соединения формулы (I) включают все такие формы. Во избежание каких-либо сомнений, когда соединение может существовать в одной из нескольких геометрических изомерных или таутомерных форм, и только одна из них конкретно описана или показана, все другие, тем не менее, охватываются формулой (I).
Например, в соединениях формулы (I), кольцо E может существовать в двух таутомерных формах, как проиллюстрировано ниже. Для простоты, общая формула (I) иллюстрирует одну форму A, но формулу следует рассматривать как охватывающую обе таутомерные формы.
Другие примеры таутомерных форм включают, например, кето-, енол- и енолят- формы, как, например, в следующих таутомерных парах: кето/енол (проиллюстрированы ниже), имин/енамин, амид/иминоспирт, амидин/ендиамины, нитрозо/оксим, тиокетон/ентиол и нитро/аци-нитро.
Стереоизомеры
Если не оговорено или не указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм.
Стереоцентры проиллюстрированы обычным образом с использованием 'прерывистых' или 'клиновидных' линий, например,
Когда соединение описано как смесь двух диастереоизомеров/эпимеров, конфигурация стереоцентра не указана и представлена прямыми линиями.
Когда соединения формулы (I) содержат один или несколько хиральных центров и могут существовать в форме двух или более оптических изомеров, ссылки на соединения формулы (I) включают все их оптические изомерные формы (например, энантиомеры, эпимеры и диастереоизомеры), либо в виде индивидуальных оптических изомеров, либо смесей (например, рацемических смесей) или двух или более оптических изомеров, если из контекста не следует иное.
Оптические изомеры могут быть охарактеризованы и идентифицированы по их оптической активности (т.е. как + и - изомеры или d и l изомеры), или они могут быть охарактеризованы на основании их абсолютной стереохимии с использованием “R и S” номенклатуры, разработанной Cahn, Ingold и Prelog, см. Advanced Organic Chemistry by Jerry March, 4th Edition, John Wiley & Sons, New York, 1992, pages 109-114, также см. Cahn, Ingold & Prelog, Angew. Chem. Int. Ed. Engl., 1966, 5, 385-415.
Оптические изомеры можно разделить различными способами, включая хиральную хроматографию (хроматографию на хиральном носителе), и такие способы хорошо известны специалистам в данной области.
В качестве альтернативы хиральной хроматографии, оптические изомеры можно разделить путем образования диастереоизомерных солей с хиральными кислотами, такими как (+)-винная кислота, (-)-пироглутаминовая кислота, (-)-ди-толуоил-L-винная кислота, (+)-миндальная кислота, (-)-яблочная кислота и (-)-камфорсульфоновая кислота, разделения диастереоизомеров путем селективной кристаллизации с последующей диссоциацией солей с получением индивидуального энантиомера свободного основания.
Кроме того, энантиомерное разделение можно осуществить путем ковалентного связывания энантиомерно обогащенного хирального вспомогательного агента на соединении и с последующим осуществлением разделения диастереоизомеров с использованием традиционных способов, таких как хроматография. Затем осуществляют расщепление указанной выше ковалентной связи с образованием подходящего энантиомерно чистого продукта.
Когда соединения формулы (I) существуют в виде двух или более оптических изомерных форм, один энантиомер в паре энантиомеров может демонстрировать преимущества по сравнению с другим энантиомером, например, связанное с биологической активностью. Таким образом, в некоторых обстоятельствах, может быть желательным использование в качестве терапевтического средства только одного из пары энантиомеров или только одного из множества диастереоизомеров. Соответственно, настоящее изобретение обеспечивает композиции, содержащие соединение формулы (I), содержащее один или несколько хиральных центров, где по меньшей мере 55% (например, по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95%) соединения формулы (I) присутствует в виде одного оптического изомера (например, энантиомера или диастереоизомера). В одном общем варианте воплощения, 99% или более (например, по существу все) из общего количества соединения формулы (I) может присутствовать в виде одного оптического изомера (например, энантиомера или диастереоизомера).
Соединения, включающие двойные связи, могут иметь E (entgegen) или Z (zusammen) стереохимию по указанной двойной связи. Заместители на бивалентных циклических или (частично) насыщенных радикалах могут иметь либо цис-, либо транс-конфигурацию. Термины цис и транс, когда они встречаются в настоящей заявке, используются в соответствии с номенклатурой Chemical Abstracts (J. Org. Chem. 1970, 35 (9), 2849-2867), и относятся к положению заместителей в кольцевой группе.
Особый интерес представляют такие соединения формулы (I), которые являются стереохимически чистыми. Когда соединение формулы (I), например, указано как R, это значит, что соединение по существу не содержит S изомера. Когда соединение формулы (I), например, указано как E, это значит, что соединение по существу не содержит Z изомера. Термины цис, транс, R, S, E и Z хорошо известны специалистам в данной области.
Изотопные варианты
Настоящее изобретение включает все фармацевтически приемлемые изотопно-меченные соединения по настоящему изобретению, т.е. соединения формулы (I), где один или несколько атомов замещены атомами, имеющими такое же атомное число, но имеющими атомную массу или массовое число, отличные от атомной массы или массового числа, обычно присутствующих в природе.
Примеры изотопов, подходящих для включения в соединения по настоящему изобретению, включают изотопы водорода, такие как 2H (D) и 3H (T), углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, иода, такие как 123I, 125I и 131I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32P, и серы, такие как 35S.
Некоторые изотопно-меченные соединения формулы (I), например, соединения, включающие радиоактивный изотоп, являются полезными в исследованиях распределения лекарственного средства и/или тканей субстрата. Соединения формулы (I) также могут обладать ценными диагностическими свойствами, так как их можно использовать для детекции или идентификации образования комплекса между меченым соединением и другими молекулами, пептидами, белками, ферментами или рецепторами. В способах детекции или идентификации можно использовать соединения, которые являются меченными агентами мечения, такими как радиоизотопы, ферменты, флуоресцентные вещества, люминесцентные вещества (например, люминол, производные люминола, люциферин, экворин и люцифераза) и т.п. Радиоактивные изотопы трития, т.е. 3H (T) и углерода-14, т.е. 14C, являются особенно полезными для этих целей в свете простоты их включения и простых средств детекции.
Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H (D), может дать некоторые терапевтические преимущества, являющиеся результатом их лучшей метаболической стабильности, например, более длительный период полужизни in vivo или более низкие необходимые дозы, и, следовательно, они могут быть предпочтительными в некоторых обстоятельствах.
Замещение позитрон-испускающими изотопами, такие как 11C, 18F, 15O и 13N, может быть полезным в исследованиях методом Позитрон-Эмиссионной Томографии (PET) для исследования заполнения мишени.
Изотопно-меченные соединения формулы (I), как правило, можно получить традиционными способами, известными специалистам в данной области, или способами, аналогичными тем, которые описаны в сопроводительных Примерах и Получениях, с использованием подходящих изотопно-меченых реагентов вместо немеченого реагента, используемого ранее.
Сложные эфиры
Сложные эфиры, такие как эфиры карбоновых кислот, ацилокси эфиры и фосфатные эфиры соединений формулы (I), содержащих карбоновокислотную группу или гидроксильную группу, также охватываются Формулой (I). Примерами сложных эфиров являются соединения, содержащие группу -C(=O)OR, где R представляет собой сложноэфирный заместитель, например, C1-7 алкильную группу, C3-12 гетероциклическую группу или C5-12 арильную группу, предпочтительно C1-6 алкильную группу. Конкретные примеры сложноэфирных групп включают, но не ограничиваются этим, -C(=O)OCH3, -C(=O)OCH2CH3, -C(=O)OC(CH3)3 и -C(=O)OPh. Примеры ацилокси (обратимых сложноэфирных) групп включают -OC(=O)R, где R представляет собой ацилокси заместитель, например, C1-6 алкильную группу, C3-12 гетероциклическую группу или C5-12 арильную группу, предпочтительно C1-6 алкильную группу. Конкретные примеры ацилокси групп включают, но не ограничиваются этим, -OC(=O)CH3 (ацетокси), -OC(=O)CH2CH3, -OC(=O)C(CH3)3, -OC(=O)Ph и -OC(=O)CH2Ph. Примеры фосфатных сложных эфиров включают соединения, образованные из фосфорной кислоты.
В одном варианте воплощения настоящего изобретения, формула (I) включает в своем объеме сложные эфиры соединений формулы (I), содержащих карбоновокислотную группу или гидроксильную группу. В другом варианте воплощения настоящего изобретения, формула (I) не включает в своем объеме сложные эфиры соединений формулы (I), содержащих карбоновокислотную группу или гидроксильную группу.
Сольваты и кристаллические формы
Также охватываются формулой (I) любые полиморфные формы соединений и сольваты, такие как гидраты, алкоголяты и т.п.
Соединения по настоящему изобретению могут образовывать сольваты, например, с водой (т.е. гидраты) или обычными органическими растворителями. Как он используется в настоящей заявке, термин “сольват” означает физическую ассоциацию соединений по настоящему изобретению с одной или несколькими молекулами растворителя. Эта физическая ассоциация включает различные степени ионного и ковалентного связывания, включая водородное связывание. В некоторых случаях сольват может быть выделен, например, когда одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. Термин “сольват” охватывает как находящиеся в фазе раствора, так и выделяемые сольваты. Неограничивающие примеры подходящих сольватов включают соединения по настоящему изобретению в комбинации с водой, изопропанолом, этанолом, метанолом, ДМСО, этилацетатом, уксусной кислотой или этаноламином и т.п. Соединения по настоящему изобретению могут проявлять их биологические эффекты, находясь при этом в растворе.
Сольваты хорошо известны в области фармацевтической химии. Они могут иметь важное значение в способах для получения вещества (например, в связи с очисткой, хранением вещества (например, его стабильность) и для простоты обращения с веществом, и их часто получают как часть стадий выделения или очистки в химическом синтезе. Специалист в данной области может определить с использованием стандартных и давно используемых способов, был ли образован гидрат или другой сольват в условиях выделения или в условиях очистки, используемых для получения данного соединения. Примеры таких способов включают термогравиметрический анализ (TGA), дифференциальную сканирующую калориметрию (DSC), рентгеновскую кристаллографию (например, рентгеновскую кристаллографию на монокристалле или рентгеновскую порошковую дифракцию) и ЯМР твердого образца (SS-ЯМР, также известный как ЯМР с магическим углом вращения или MAS-ЯМР). Такие способы составляют часть стандартного аналитического набора инструментов квалифицированного химика, например, ЯМР, ИК, ВЭЖХ и MS.
Альтернативно, специалист в данной области может преднамеренно получить сольват с использованием условий кристаллизации, которые включают определенное количество растворителя, необходимое для конкретного сольвата. Затем можно использовать стандартные способы, описанные выше, для определения были или нет образованы сольваты.
Кроме того, соединения по настоящему изобретению могут иметь один или несколько полиморфов или аморфных кристаллических форм, и как таковые включены в объем настоящего изобретения.
Комплексы
Формула (I) также охватывает своим объемом комплексы (например, комплексы включения или клатраты с соединениями, такими как циклодекстрины, или комплексы с металлами) соединений. Комплексы включения, клатраты и комплексы с металлами могут быть образованы способами, хорошо известными специалистам в данной области.
Пролекарства
Также охватываются формулой (I) любые пролекарства соединений формулы (I). Под “пролекарствами” подразумевают, например, любое соединение, которое преобразуется in vivo в биологически активное соединение формулы (I).
Например, некоторые пролекарства представляют собой сложные эфиры активного соединения (например, физиологически приемлемый метаболически лабильный сложный эфир). В процессе метаболизма сложноэфирная группа (-C(=O)OR) отщепляется с образованием активного лекарственного средства. Такие сложные эфиры могут быть образованы путем этерификации, например, любой из карбоновокислотных групп (-C(=O)OH) в исходном соединении, где это является подходящим, с предварительной защитой любых других реакционноспособных групп, присутствующих в исходном соединении, с последующим удалением защиты, если это необходимо.
Примеры таких метаболически лабильных сложных эфиров включают соединения формулы -C(=O)OR, где R представляет собой:
C1-7алкил (например, -Me, -Et, -nPr, -iPr, -nBu, -sBu, -iBu, -tBu);
C1-7аминоалкил (например, аминоэтил; 2-(N,N-диэтиламино)этил; 2-(4-морфолино)этил); и ацилокси-C1-7алкил (например, ацилоксиметил; ацилоксиэтил; пивалоилоксиметил; ацетоксиметил; 1-ацетоксиэтил; 1-(1-метокси-1-метил)этил-карбонилоксиэтил; 1-(бензоилокси)этил; изопропокси-карбонилоксиметил; 1-изопропокси-карбонилоксиэтил; циклогексил-карбонилоксиметил; 1-циклогексил-карбонилоксиэтил; циклогексилокси-карбонилоксиметил; 1-циклогексилокси-карбонилоксиэтил; (4-тетрагидропиранилокси) карбонилоксиметил; 1-(4-тетрагидропиранилокси)карбонилоксиэтил; (4-тетрагидропиранил)карбонилоксиметил; и 1-(4-тетрагидропиранил)карбонилоксиэтил).
Также, некоторые пролекарства активируются ферментативно с образованием активного соединения или соединения, которое в результате последующей химической реакции дает активное соединение (например, как в антиген-направленной ферментной пролекарственной терапии (ADEPT), ген-направленной ферментной пролекарственной терапии (GDEPT) и лиганд-направленной ферментной пролекарственной терапии (LIDEPT) и т.п.). Например, пролекарство может представлять собой производное сахара или другой гликозидный конъюгат, или может представлять собой сложноэфирное производное аминокислоты. В одном варианте воплощения, формула (I) не включает пролекарства соединений формулы (I) в своем объеме.
Способы получения соединений формулы (I)
В данном разделе, как во всех других разделах настоящей заявки, если в контексте не указано иное, ссылки на формулу (I) также включают все другие подгруппы и примеры этой формулы, определенные в настоящей заявке.
Соединения формулы (I) можно получить в соответствии со способами синтетеза, хорошо известными специалистам в данной области.
В соответствии со следующим аспектом настоящего изобретения, обеспечивается способ получения соединения формулы (I), определенного выше в настоящей заявке, который включает:
(a) (i) взаимодействие соединения формулы (II):
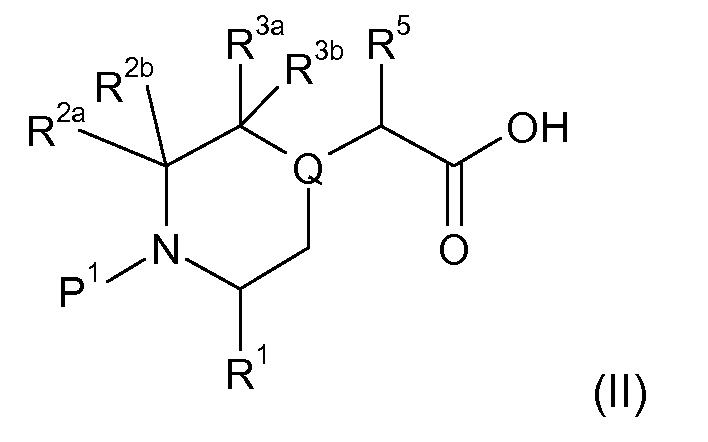 ,
,
где R1, R2a, R2b, R3a, R3b, R5 и Q имеют значение, определенное в настоящей заявке выше для соединений формулы (I), и P1 представляет собой подходящую защитную группу, такую как трет-бутилоксикарбонильная (tBoc) группа, с соединением формулы (III):
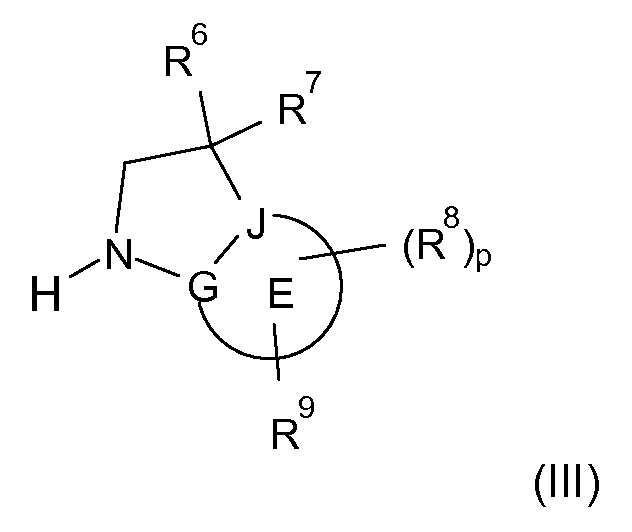 ,
,
где R6, R7, R8, R9, p, G, J и E имеют значение, определенное в настоящей заявке выше для соединений формулы (I), с последующей реакцией удаления защиты, подходящей для удаления P1 защитной группы; или
(ii) для соединений формулы (I), где Q представляет собой NH, взаимодействие соединения формулы (III), определенного выше, с соединением формулы (IV):
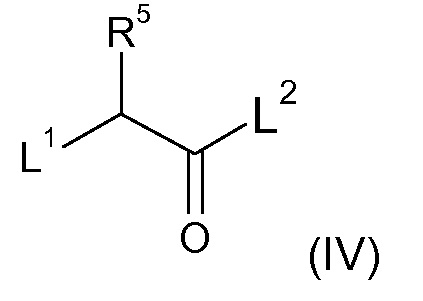 ,
,
где R5 имеет значение, определенное в настоящей заявке выше для соединений формулы (I), и L1 и L2 независимо представляют собой подходящие удаляемые группы, такие как галоген, с последующим взаимодействием с соединением формулы (V):
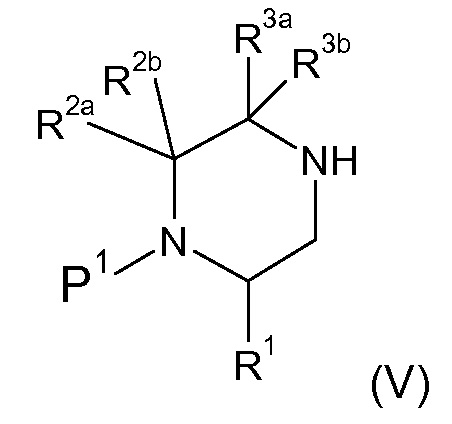 ,
,
где R1, R2a, R2b, R3a, и R3b имеют значение, определенное в настоящей заявке выше для соединений формулы (I), и P1 представляет собой водород или подходящую защитную группу, такую как трет-бутилоксикарбонильная (tBoc) группа, с последующей реакцией удаления защиты, подходящей для удаления P1 защитной группы; и/или
(b) удаление защиты у защищенного производного соединения формулы (I); и/или
(c) взаимопреобразование соединения формулы (I) или его защищенного производного в другое соединение формулы (I) или его защищенное производное; и
(d) необязательное образование фармацевтически приемлемой соли соединения формулы (I).
Способ (a) (i) типично включает взаимодействие соединения формулы (II) с соединением формулы (III) в подходящем растворителе и при подходящей температуре, например, при температуре окружающей среды, в присутствии подходящего основания и реагента, способного к активации карбоновокислотной группы, присутствующей в соединении формулы (II). Подходящий растворитель должен быть инертным по отношению к используемым реагентам, например, дихлорметан. Примерами подходящих оснований являются триэтиламин и N,N-диизопропилэтиламин (DIPEA). Примеры подходящих активирующих реагентов включают гексафторфосфат бром-трис-пирролидино-фосфония (PyBrop), гексафторфосфат O-бензотриазол-N,N,N',N'-тетраметилурония (HBTU), 1,1'-карбонилдиимидазол, гидрохлорид 1-этил-3-(3'-диметиламинопропил)-карбодиимида (EDC) и гексафторфосфат 2-(7-аза-1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония) (HATU). Этот способ, необязательно, можно осуществлять в присутствии каталитического или стехиометрического количества подходящего ко-активирующего реагента, такого как 1-гидроксибензотриазол (HOBt) или 1-гидроксиазабензотриазол (HOAt).
Способ (a) можно осуществить в соответствии с процедурой, описанной в настоящей заявке как Общая Процедура 1 (PyBrop Связывание) или Общая Процедура 2 (HBTU связывание), или в соответствии с процедурой, описанной в настоящей заявке как Общая Процедура 4 (HATU связывание).
Способ (a) (ii) типично включает растворение соединения формулы (III) в подходящем растворителе, таком как дихлорметан, затем обработку подходящим основанием, таким как триэтиламин, затем соединением формулы (IV). Реакционноспособное промежуточное соединение, образованное в результате взаимодействия соединений формул (III) и (IV), затем обрабатывают соединением формулы (V) в подходящем растворителе, таком как тетрагидрофуран, в присутствии подходящего основания, такого как триэтиламин или N,N-диизопропилэтиламин. Примеры подходящих удаляемых групп L1 и L2 в соединении формулы (IV) включают хлор и бром.
Способ (a) (ii) можно осуществить с выделением первоначально образованного реакционноспособного промежуточного соединения, в соответствии с процедурами, описанными в настоящей заявке как Получение 1 и Получение 6 или Получение 442 и Получение 443. В такой двухстадийной процедуре, первую стадию можно осуществить в присутствии основания, такого как пиридин, триэтиламин или N,N-диизопропилэтиламин, в подходящем растворителе, таком как диэтиловый эфир или дихлорметан. Предпочтительно, первую стадию можно осуществить без добавления основания, в растворителе, выбранном таким образом, чтобы полученное на первой стадии промежуточное соединение осаждалось из реакционной смеси в виде кислотно-аддитивной соли, например, толуоле или ацетонитриле. Вторую стадию затем можно осуществить в подходяще инертном растворителе, таком как тетрагидрофуран, дихлорметан или ацетонитрил, в присутствии основания, такого как триэтиламин или безводный карбонат калия. Когда L1 представляет собой хлор в соединении формулы (IV), реакцию, необязательно, можно ускорить путем добавления иодидной соли, такой как иодид калия.
Этот способ также можно осуществить без выделения реакционноспособного промежуточного соединения, образованного в результате взаимодействия соединения формулы (III) с соединением формулы (IV). Таким образом, смесь соединения формулы (III) и подходящего основания в избыточном количестве, такого как триэтиламин или N,N-диизопропилэтиламин, растворенную в подходящем инертном растворителе, таком как дихлорметан, обрабатывают соединением формулы (IV), затем, через подходящий промежуток времени, например, 1 или 2 часа, соединением формулы (V).
Способ (a) (ii) можно осуществить в соответствии с процедурами, описанными в настоящей заявке как Получения 203, 204, 205 и Общая Процедура 5.
В альтернативном способе, способ (a) (ii) можно осуществить в две стадии, как описано в Получениях 442 и 443.
Способ (b) типично включает любую подходящую реакцию удаления защиты, условия которой будут зависеть от природы защитной группы. Когда защитная группа представляет собой tBoc, такая реакция удаления защиты типично включает использование подходящей кислоты в подходящем растворителе. Например, кислота подходящим образом может включать трифторуксусную кислоту или хлористый водород, и растворитель подходящим образом может включать дихлорметан, этилацетат, 1,4-диоксан, метанол или воду. Можно, но необязательно, использовать смесь растворителей, например, водный раствор метанола или этилацетат/1,4-диоксан.
Способ (b) можно осуществить в соответствии с процедурами, описанными в настоящей заявке как Общие Процедуры для получения соединений формулы (I), Способы 1-4.
Должно быть понятно, что, когда защитная группа представляет собой tBoc, удаление защиты с использованием подходящей кислоты, как описано выше, может привести к образованию соединения формулы (I) в виде фармацевтически приемлемой соли, которая может быть выделена непосредственно. Альтернативно, соединение формулы (I) может быть выделено в форме свободного основания с использованием способов, хорошо известных из уровня техники, и затем необязательно преобразовано в фармацевтически приемлемую соль, в соответствии со способом (d).
Способ (c) типично включает процедуры взаимопреобразования, известные специалистам в данной области. Например, соединения формулы (I), в которых R8 или R9 представляет собой первый заместитель, можно преобразовать способами, известными специалистам в данной области, в соединения формулы (I), в которых R8 или R9 представляет собой второй, альтернативный заместитель. Подходящие экспериментальные примеры для такой реакции взаимопреобразования описаны в настоящей заявке в Получениях 134-152. В частности, соединения формулы (I), где R8 или R9 представляет собой атом галогена, такого как хлор или бром, можно преобразовать в соединения формулы (I), где R8 или R9 представляет собой -Y-C3-12 карбоциклическую группу, такую как-CH2-фенильная группа. Подходящий экспериментальный пример для такой реакции взаимопреобразования описан в настоящей заявке как Общая Процедура 3 (присоединение органоцинкгалогенида).
Другой конкретный случай способа (c) включает взаимодействие защищенного производного соединения формулы (I), где R3a или R3b представляют собой C1-6алкил, замещенный одной группой Rb, где Rb представляет собой хлор, бром или иод, с подходящим нуклеофилом для введения необязательно замещенной 3-12-членной гетероциклической группы, определенной выше. Такой способ можно осуществить в инертном растворителе, таком как ацетонитрил, в присутствии подходящего основания, такого как карбонат калия, необязательно в присутствии иодидной соли, такой как иодид калия. Такой способ можно осуществить в соответствии с процедурой, описанной в настоящей заявке как Получение 436, 438, 440 или Общая Процедура 6.
В одном варианте воплощения, процедура взаимопреобразования способа (c) включает следующую реакцию:
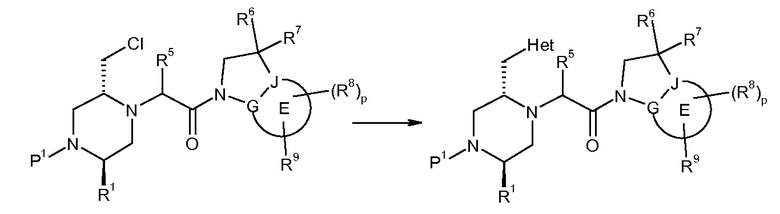 ,
,
где P1 представляет собой подходящую защитную группу, такую как трет-бутилоксикарбонильная (tBoc) группа, и Het представляет собой 3-12-членную гетероциклическую группу, которая, необязательно, может быть замещена одной или несколькими группами Rb, и где Rb, R1, R5, R6, R7, R8, R9, G, J, E и p имеют значение, определенное в настоящей заявке выше, с последующей реакцией удаления защиты, подходящей для удаления P1 защитной группы.
Способ (d) можно осуществить путем обработки соединения формулы (I) в форме свободного основания, растворенного в подходящем растворителе, с использованием стехиометрического количества или избыточного количества фармацевтически приемлемой органической или неорганической кислоты, затем выделения полученной соли способами, хорошо известными из уровня техники, например, выпаривание растворителя или кристаллизация.
Когда это является подходящим, до или после реакций, описанных выше в способах (a), (b) и (c), можно осуществить одну или несколько реакций, известных специалистам в данной области, и реакции осуществляют в подходящей последовательности для осуществления необходимых замещений на R1, R2a, R2b, R3a, R3b, R5, R6, R7, R8 и R9, которые определены выше, для получения других соединений формулы (I). Неограничивающие примеры таких реакций, условия которых можно найти в литературе, включают следующие:
защита реакционноспособных функциональных групп,
удаление защиты у реакционноспособных функциональных групп,
галогенирование,
дегалогенирование,
деалкилирование,
алкилирование и арилирование амина, анилина, спирта и фенола,
реакция Мицунобу по гидроксильным группам,
реакции циклоприсоединения по подходящим группам,
восстановление нитро, сложных эфиров, циано, альдегидов,
катализируемые переходными металлами реакции связывания,
ацилирование,
сульфонилирование/введение сульфонильных групп,
омыление/гидролиз сложноэфирных групп,
амидирование или переэтерификация сложноэфирных групп,
этерификация или амидирование карбоксильных групп,
галогеновый обмен,
нуклеофильное замещение амином, тиолом или спиртом,
восстановительное аминирование,
образование оксима по карбонильным и гидроксиламино группам,
S-окисление,
N-окисление,
образование соли.
Соединения формулы (II), где Q представляет собой NH, и где R1, R2a, R2b, R3a, R3b, и R5 имеют значение, определенное в настоящей заявке выше, можно получить путем взаимодействия соединения формулы (V), определенного в настоящей заявке выше, с соединением формулы (VI)
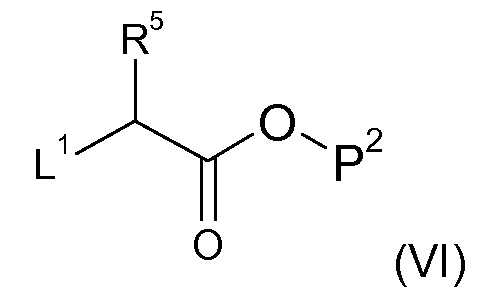 ,
,
где R5 и L1 имеют значение, определенное в настоящей заявке выше, и P2 представляет собой подходящую защитную группу, с последующим удалением защитной группы P2. Такое взаимодействие можно осуществить в подходящем инертном растворителе, таком как ацетонитрил, в присутствии подходящего основания, такого как карбонат натрия или карбонат калия, при подходящей температуре, такой как температура окружающей среды или повышенная температура, например, при температуре кипения с обратным холодильником. Предпочтительно, группа P2 должна удаляться таким образом, чтобы защитная группа P1 оставалась интактной, следовательно, подходящие примеры для P2 включают необязательно замещенный бензил и аллил, где удаление можно осуществить путем каталитического гидрогенолиза или катализируемого палладием де-аллилирования, соответственно. Альтернативно, когда группа P2 представляет собой низший алкил, удаление можно осуществить путем омыления, например, гидролиза с использованием водно-щелочного раствора.
Соединения формулы (III), где J представляет собой C, можно получить из соединения формулы (VII)
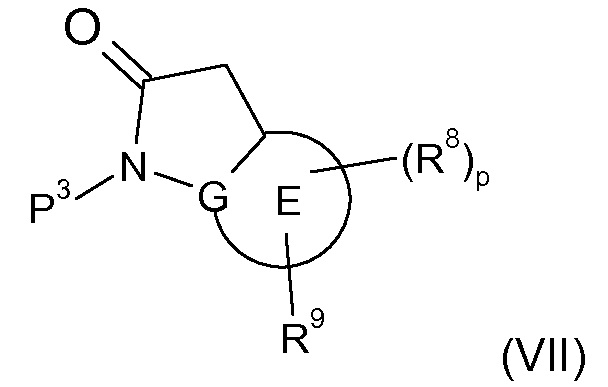 ,
,
где R8, R9, p, G и E имеют значение, определенное в настоящей заявке выше для соединений формулы (I), и P3 представляет собой либо водород, либо подходящую защитную группу, такую как tBoc или триметилсилилэтоксиметил, путем обработки подходящим основанием и последовательного взаимодействия с подходящими электрофильными реагентами для введения групп R6 и R7, например, с соединениями формулы R6-L3, и R7-L3, где R6 и R7 имеют значение, определенное в настоящей заявке выше, и L3 представляет собой подходящую удаляемую группу, такую как галоген, метилсульфонилокси или трифторметилсульфонилокси; с последующим восстановлением циклической амидной группы способами, хорошо известен из уровня техники. Необязательно, функциональные группы, присутствующие в R6 и R7, могут быть взаимопреобразованы с использованием способов, хорошо известных из уровня техники; такие взаимопреобразования можно осуществить до или после стадии восстановления амида. Примеры подходящих оснований для опосредованного основанием введения групп R6 и R7 включают соли щелочных металлов, такие как карбонат натрия или карбонат калия, и алкилметаллические реагенты, такие как бутиллитий. Реакции, указанные выше, с использованием солей щелочных металлов можно осуществить в совместимом растворителе, таком как N,N-диметилформамид или ацетонитрил. Реакции, указанные выше, с использованием алкилметаллического реагента в качестве основания можно осуществить в подходящем инертном растворителе, таком как тетрагидрофуран, необязательно вместе с подходящей добавкой, такой как N,N,N',N'-тетраметилэтилендиамин (TMEDA) или галогенид лития. Должно быть понятно, что соединения, в которых R6 и R7 объединены с образованием карбоцикла или гетероцикла, определенного в настоящей заявке выше, можно получить аналогичным способом с использованием подходящего бидентатного электрофила, например, 1,2-дибромэтана, 1,3-дииодпропана или 1,4-дииодбутана. Другим примером подходящего электрофила для использования в указанном выше преобразовании является низкомолекулярный альдегид, например, формальдегид или соединение формулы C1-6алкил-CHO. Например, использование избыточного количества формальдегида в присутствии соли щелочного металла, такой как карбонат калия, обеспечивает необязательно N-защищенные соединения формулы (III), в которых оба R6 и R7 представляют собой CH2OH; можно осуществить последующее взаимопреобразование функциональных групп, например, преобразование гидроксильных групп в подходящую удаляемую группу, и взаимодействие с подходящим нуклеофилом или нуклеофилами, с получением необязательно защищенных соединений формулы (III), где R6 и R7 могут быть, или не могут быть, объединены с образованием карбоцикла или гетероцикла, определенного в настоящей заявке выше. Конкретный случай этой типичной последовательности описан в настоящей заявке для образования спиро-азетидиновых систем с использованием процедур, описанных для Получений 91-98 включительно. Подходящие реагенты для восстановления циклической амидной группы включают комплекс боран - диметилсульфид или Red-Al®, и такие реакции можно осуществить в подходящем инертном растворителе, таком как тетрагидрофуран или толуол.
Соединения формулы (VII) являются коммерчески доступными, известными из литературы, или их можно получить из соединения формулы (VIII)
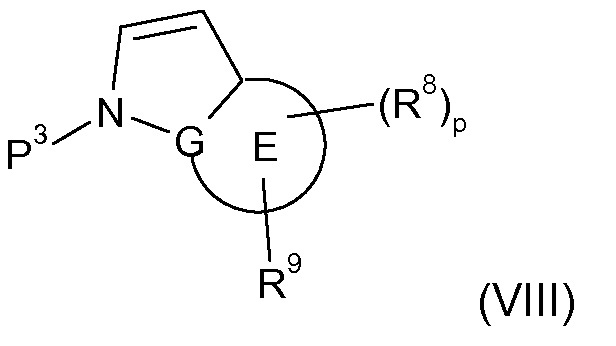 ,
,
где R8, R9, p, G и E имеют значение, определенное в настоящей заявке выше для соединений формулы (I), и P3 представляет собой либо водород, либо подходящую защитную группу, такую как tBoc или триметилсилилэтоксиметил, с использованием окислительно-восстановительных процедур. Например, соединение формулы (VII) можно обработать агентом бромирования, таким как бром или трибромид пиридиния, в подходящем растворителе, таком как 1,4-диоксан, с последующей гидролитической обработкой; продукт, необязательно растворенный в подходящем со-растворителе, таком как тетрагидрофуран, затем можно обработать подходящим восстановителем, таким как тонкоизмельченный металл в присутствии кислоты, например, цинковый порошок в уксусной кислоте или водном растворе хлорида аммония. Такой способ можно осуществить с использованием процедур, аналогичных описанным в настоящей заявке как Получения 102 и 103.
Соединения формулы (III), определенные в настоящей заявке выше, где R6 и R7 представляют собой водород, можно получить путем непосредственного восстановления соединения формулы (VIII), определенного в настоящей заявке выше, с использованием подходящего восстановителя, например, борана в тетрагидрофуране или цианоборогидрида натрия, в присутствии кислоты, такой как уксусная кислота.
Соединения формулы (VIII) являются коммерчески доступными, известными из литературы, их получают способами, аналогичными тем, которые описаны в литературе, или получают способами, аналогичными тем, которые описаны в экспериментальных процедурах в примерах ниже. Например, обзор способов, известных из уровня техники для синтеза индолов см. в J. Chem. Soc. Perkin Trans. 1, 2000, 1045.
Альтернативно, соединения формулы (III), где J представляет собой C, и R7 представляет собой группу CHR7aR7b (где R7a и R7b независимо представляют собой C1-7алкил, C1-4алкокси-C1-4алкил, карбоциклил-C1-4алкокси-C1-4алкил, гетероциклил-C1-4алкокси-C1-4алкил карбоциклил, гетероциклил, карбоциклил-C1-4алкил, гетероциклил-C1-4алкил, карбоциклил-окси или гетероциклил-окси; или могут быть объединены вместе с образованием карбоциклической или гетероциклической группы) можно получить из соединения формулы (IX)
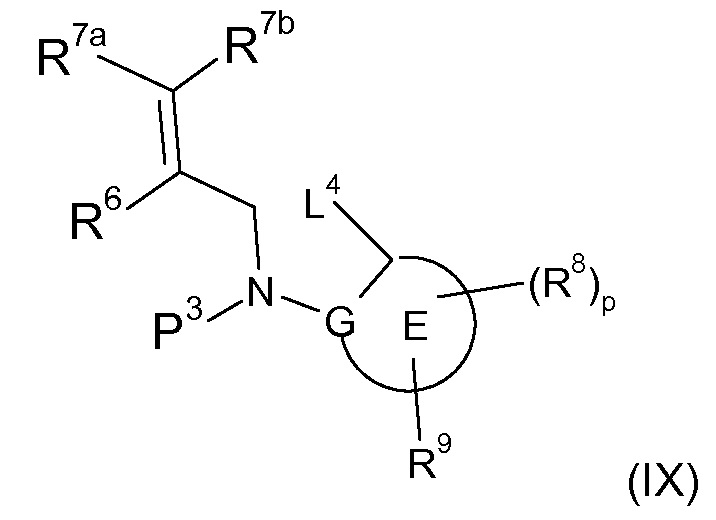 ,
,
где R6, R7a, R7b R8, R9, p, G, E и P3 имеют значение, определенное в настоящей заявке выше, и L4 представляет собой подходяще реакционноспособную группу, например, удаляемую группу, такую как галоген или трифторметилсульфонилокси, путем циклизации с использованием подходящего катализируемого переходным металлом или радикал-опосредованного способа. Например, в этом способе можно использовать катализатор, такой как кобальт, никель или палладий, и его можно осуществить аналогично тому, как описано в Tetrahedron Letters 1987, 28, 5291-5294, в этом случае необходим подходящий источник переходного металла, такой как ацетат палладия, и L4 предпочтительно представляет собой иод. Этот способ требует присутствия основания, такого как соль щелочного металла, такая как карбонат натрия или ацетат натрия, или органическое основание, такое как триэтиламин, и его можно осуществить в присутствии триалкиламмониевой соли, такой как тетрабутиламмонийхлорид. Реакцию можно осуществить в восстановительных условиях, например, в присутствии соли муравьиной кислоты, такой как формиат натрия, и необязательно в присутствии подходящего лиганда, такого как трифенилфосфин. Подходящие растворители для этой циклизации включают N,N-диметилформамид и смешанные системы растворителей, такие как толуол - вода или диметилсульфоксид - вода. Конкретный случай этого способа циклизации описан в Получениях 107-109 и в Получении 236. Для радикальной циклизации, необходим подходящий реагент для образования радикала, такой как оловоорганический реагент, например, трибутилстаннан. Пример радикал-опосредованной циклизации в соответствии с этим способом описан в J. Amer. Chem. Soc. 1992, 114, 9318-9327.
Соединения формулы (IX) можно получить путем взаимодействия соединения формулы (X)
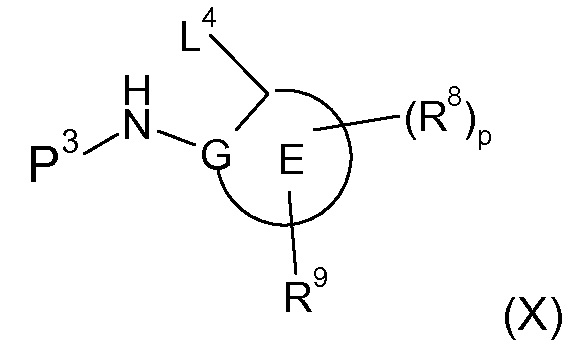 ,
,
где R8, R9, p, G, E, L4 и P3 имеют значение, определенное в настоящей заявке выше, с соединением формулы (XI)
 ,
,
где R6, R7a, R7b и L1 имеют значение, определенное в настоящей заявке выше. Этот способ осуществляют в присутствии основания, такого как трет-бутоксид калия, в подходящем растворителе, таком как тетрагидрофуран.
Альтернативно, соединения формулы (III), где G и J оба представляют собой C, и кольцо E представляет собой фенилен, можно получить путем взаимодействия соединения формулы (XII)
 ,
,
где R8, R9 и p имеют значение, определенное в настоящей заявке выше, с соединением формулы R6R7CHCHO, где R6 и R7 имеют значение, определенное в настоящей заявке выше, с образованием гидразона, с последующей циклизацией с образованием желаемого замещенного индолина. Такой способ типично осуществляют с использованием кислотных условий, например, с использованием уксусной кислоты в качестве растворителя или с использованием подходящей кислоты в инертном растворителе, таком как толуол. Должно быть понятно, что для некоторых комбинаций R8 и R9 эта последовательность будет приводить к получению смеси региоизомеров, и что их разделение можно осуществить стандартными способами, известными специалистам в данной области, например, с использованием колоночной хроматографии. Такому разделению может способствовать N-ацилирование продукта этого способа, например, с использованием хлорацетилхлорида, или N-защита с использованием, например, tBoc защитной группы, после чего соединение формулы (III), необязательно, может быть восстановлено путем удаления защиты с использованием стандартных условий, например, для tBoc защищенного соединения, осуществление обработки подходящей кислотой, такой как HCl.
Соединения формулы (III), где J представляет собой N, можно получить из соединения формулы (XIII)
 ,
,
R8, R9, p, G, E и P3 имеют значение, определенное в настоящей заявке выше и соединение формулы (XIV)
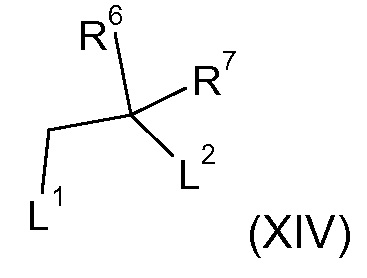 ,
,
где R6, R7, L1 и L2 имеют значение, определенное в настоящей заявке выше. Такой способ можно осуществить в присутствии подходящего основания, такого как соль щелочного металла, такая как карбонат калия, в подходящем растворителе, таком как N,N-диметилформамид или ацетонитрил.
Некоторые соединения формул (III), (VII) и (VIII) можно получить путем взаимопреобразований функциональных групп в других соединениях формул (III), (VII) и (VIII) или их подходяще защищенных производных и, необязательно, с последующим удалением защиты, если это является подходящим. Примеры взаимопреобразований функциональных групп включают C-арилирование, C-алкилирование или C-аминирование с использованием опосредованных переходными металлами способов, хлорсульфонилирование и последующее преобразование в сульфоны и сульфонамиды, де-галогенирование с использованием восстановительных способов, таких как каталитическое гидрирование, преобразование арилгалогенида в арилкетон (например, путем обмена металл-галоген и гашения подходящим ацилирующим агентом), преобразование группы кетона в дифторметиленовую группу с использованием подходящего агента фторирования и преобразование карбоновокислотного производного в амид. Некоторые иллюстративные способы представлены в настоящей заявке (см. экспериментальные процедуры, описанные в примерах ниже).
Альтернативно, соединения формулы (III), где G и J оба представляют собой C, и кольцо E представляет собой фенилен, можно получить в соответствии со следующей схемой:
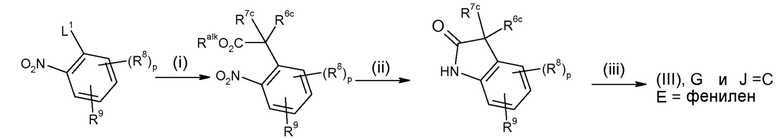 ,
,
где R8, R9, p и L1 имеют значение, определенное выше, Ralk представляет собой C1-4 алкильную группу или необязательно замещенный бензил, R6c имеет значение, определенное для R6, или может быть преобразован в R6 путем взаимопреобразований функциональных групп, таких как определенные выше, и R7c имеет значение, определенное для R7, или представляет собой атом водорода. Стадия (i) включает взаимодействие с соединением RalkO2CCH(R6cR7c) в присутствии основания, такого как гидрид натрия, в подходящем растворителе, таком как N,N-диметилформамид. В этом способе, L1 предпочтительно представляет собой низший галоген, такой как фтор. Преобразование R7c=H в R7c=R7, необязательно, можно осуществить на этой стадии путем взаимодействия с соединением R7L3 (где L3 имеет значение, определенное выше) с использованием подходящего основания, такого как гидрид натрия, в подходящем растворителе, таком как N,N-диметилформамид. Стадию (ii) можно осуществить с использованием подходящих восстановительных условий, например, гидрирования или подходящего металла, такого как железо, в присутствии кислоты, такой как уксусная кислота. Стадию (iii) можно осуществить с использованием подходящего восстановителя, например, комплекса боран-метилсульфид, в подходящем растворителе, таком как тетрагидрофуран. Необязательно, взаимопреобразования функциональных групп можно осуществить по группам R6c, R7c, R8, и R9 в промежуточных соединениях, полученных на стадиях (i) и (ii), с использованием способов, хорошо известных из уровня техники.
Соединения формулы (III), где G и J оба представляют собой C, и кольцо E представляет собой пиридиновое кольцо, можно получить из подходяще замещенного галоген-нитропиридина аналогично тому, как показано на схеме выше.
Некоторые соединения формулы (V) являются коммерчески доступными или известными из литературы. Другие соединения формулы (V), где R2a и R2b представляют собой водород, можно получить путем восстановления соединения формулы (XV)
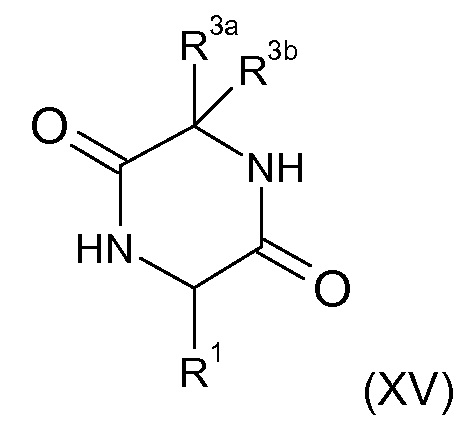 ,
,
где R1, R3a и R3b имеют значение, определенное в настоящей заявке выше. Подходящие реагенты для восстановления соединений формулы (XV) включают гидриды металлов, такие как литийалюминийгидрид или боргидридные соединения, такие как боран, и такие реакции типично осуществляют в подходящем инертном растворителе, таком как тетрагидрофуран или диэтиловый эфир.
Соединения формулы (XV) можно получить путем циклизации соединения формулы (XVI)
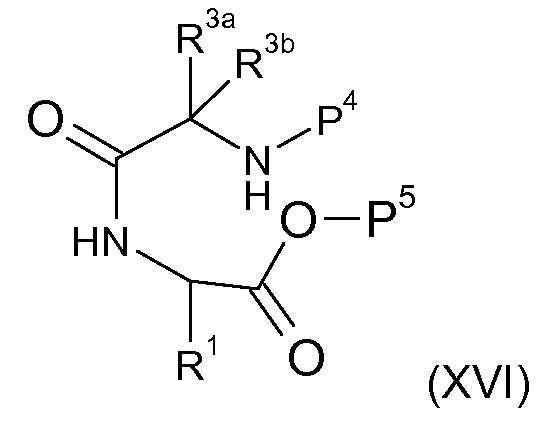 ,
,
где R1, R3a и R3b имеют значение, определенное в настоящей заявке выше, и P4 и P5 независимо представляют собой водород или подходящую защитную группу, например, P4 может представлять собой tBoc или Cbz, и P5 может представлять собой C1-4 алкильную группу. Такой способ можно осуществить с использованием процедур, хорошо известных из уровня техники для образования амидной связи, например, с использованием процедур, подобных тем, которые описаны для способа (a) выше. В некоторых обстоятельствах, циклизация может происходить одновременно с удалением защитных групп P4 или P5, например, как описано ниже в Получении 3 (см. описанные в примере экспериментальные процедуры).
Некоторые соединения формулы (XVI) известны из литературы и/или могут быть получены путем связывания двух подходяще защищенных аминокислотных производных с использованием способов, хорошо известных из уровня техники для образования амидных связей, например, с использованием процедуры, аналогичной той, которая описана ниже в Получении 2 (см. описанные в примере экспериментальные процедуры).
Другие соединения формулы (V) можно получить путем взаимопреобразования функциональных R1, R2a, R2b, R3a и R3b групп с использованием способов, хорошо известных из уровня техники. Такие взаимопреобразования можно осуществить в соединениях формул (V) или (XV), которые могут быть подходящим образом защищенными, например, при помощи tBoc и/или бензилоксикарбонильной (Cbz) группы. Например, соединение формулы (V), где R3a или R3b представляют собой C1-6алкил, замещенный одной группой Rb, где Rb представляет собой хлор, бром или иод, можно обработать подходящим нуклеофилом для введения необязательно замещенной 3-12-членной гетероциклической группы, определенной выше. Такой способ можно осуществить в инертном растворителе, таком как ацетонитрил или N,N-диметилформамид, в присутствии подходящего основания, такого как карбонат калия или гидрид натрия, необязательно в присутствии иодидной соли, такой как иодид калия.
Должно быть понятно, что соединения формул (V), (XV) и (XVI) могут существовать в различных диастереомерных и/или энантиомерных формах, и что в способах их получения можно использовать энантиомерно чистые синтетические предшественники.
Альтернативно, можно использовать рацемические предшественники, и смеси диастереоизомеров, образованные в этих способах, можно разделить способами, хорошо известными специалистам в данной области, например, с использованием не-хиральной или хиральной препаративной хроматографии или разделения с использованием диастереомерных производных: например, кристаллизация соли, образованной с энантиомерно чистой кислотой, такой как L-винная кислота; или энантиомерное разделение диастереомерного производного, образованного путем ковалентного связывания энантиомерно чистого хирального вспомогательного вещества на соединении, с последующим разделением с использованием традиционных способов, таких как хиральная хроматография. Указанную выше ковалентную связь затем расщепляют с образованием подходящего энантиомерно чистого продукта.
Соединения формулы (II), где Q представляет собой CH, можно получить путем взаимодействия соединения формулы (XVII)
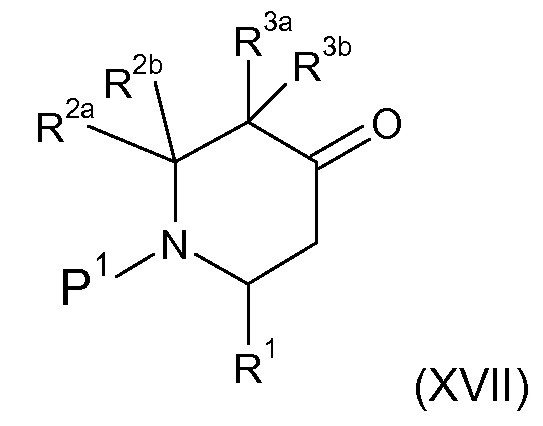 ,
,
где R1, R2a, R2b, R3a, R3b и P1 имеют значение, определенное в настоящей заявке выше; с соединением формулы (XVIII)
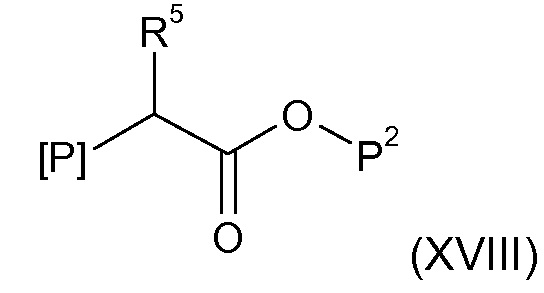 ,
,
где R5 и P2 имеют значение, определенное в настоящей заявке выше, и [P] представляет собой фосфорсодержащий остаток, такой как трифенилфосфоний [Ph3P+] или диалкилфосфонат [(alkO)2P(=O), где, например, alk представляет собой C1-4 алкил], с последующим восстановлением полученной алкеновой двойной связи. Взаимодействие между соединениями формул (XVII) и (XVIII), определенных в настоящей заявке выше, можно осуществить в присутствии подходящего основания, такого как трет-бутоксид калия, в подходящем инертном растворителе, таком как тетрагидрофуран. Последующую стадию можно осуществить с использованием способов, хорошо известных из уровня техники для восстановления алкенов, например, с использованием каталитического гидрирования.
Множество способов взаимопреобразований функциональных групп хорошо известны специалистам в данной области для преобразования соединения-предшественника в соединение формулы I, и такие способы описаны в Advanced Organic Chemistry by Jerry March, 4th Edition, John Wiley & Sons, 1992. Например, возможные металл-катализируемые функционализации, например, с использованием оловоорганических реагентов (реакция Стилле), реагентов Гриньяра и реакции с азотными нуклеофилами, описаны в 'Palladium Reagents and Catalysts' [Jiro Tsuji, Wiley, ISBN 0-470-85032-9] и в Handbook of OrganoPalladium Chemistry for Organic Synthesis [Volume 1, Edited by Ei-ichi Negishi, Wiley, ISBN 0-471-31506-0].
Соединения (IV), (VI), (X), (XI), (XII), (XIII), (XIV), (XVII) и (XVIII) являются коммерчески доступными, известными из литературы, или их можно получить способами, аналогичными тем, которые описаны в литературе, или способами, аналогичными тем, которые описаны в иллюстративных экспериментальных процедурах ниже.
В следующем варианте воплощения, настоящее изобретение обеспечивает новое промежуточное соединение. В одном варианте воплощения, настоящее изобретение обеспечивает новое промежуточное соединение формулы (II) или (III) или (V).
Защитные группы
Во многих реакциях, описанных выше, может потребоваться защита одной или нескольких групп для предотвращения взаимодействий на нежелательных участках молекулы. Примеры защитных групп и способы введения и удаления защиты функциональных групп можно найти в Protective Groups in Organic Synthesis (T. Green and P. Wuts; 3rd Edition; John Wiley and Sons, 1999).
Гидроксигруппу можно защитить, например, в виде простого эфира (-OR) или сложного эфира (-OC(=O)R), например, как: трет-бутиловый эфир; тетрагидропираниловый (THP) эфир; бензиловый, бензгидриловый (дифенилметиловый) или тритиловый (трифенилметиловый) эфир; триметилсилиловый или трет-бутилдиметилсилиловый эфир; или ацетиловый сложный эфир (-OC(=O)CH3).
Группу альдегида или кетона можно защитить, например, в виде ацеталя (R-CH(OR)2) или кеталя (R2C(OR)2), соответственно, где карбонильную группу (>C=O) обрабатывают, например, первичным спиртом. Группу альдегида или кетона легко восстанавливают путем гидролиза с использованием большого избыточного количества воды в присутствии кислоты.
Группу амина можно защитить, например, в виде амида (-NRCO-R) или карбамата (-NRCO-OR), например, как: метиламид (-NHCO-CH3); бензилкарбамат (-NHCO-OCH2C6H5, -NH-Cbz или NH-Z); как трет-бутилкарбамат (-NHCO-OC(CH3)3, -NH-Boc); 2-бифенил-2-пропилкарбамат (-NHCO-OC(CH3)2C6H4C6H5, -NH-Bpoc), как 9-флуоренилметилкарбамат (-NH-Fmoc), как 6-нитровератрилкарбамат (-NH-Nvoc), как 2-триметилсилилэтилкарбамат (-NH-Teoc), как 2,2,2-трихлорэтилкарбамат (-NH-Troc), как аллилкарбамат (-NH-Alloc) или как 2(-фенилсульфонил)этилкарбамат (-NH-Psec).
Например, в соединениях формулы II, содержащих аминогруппу, аминогруппа может быть защищена при помощи защитной группы, определенной выше в настоящей заявке, где одна предпочтительная группа представляет собой трет-бутилоксикарбонильную (Boc) группу, при этом вводится дополнительная функционализация. Когда не требуется никакой последующей модификации аминогруппы, защитную группу можно подвергнуть последовательным реакциям с получением N-защищенной формы соединения формулы (I), которую затем можно подвергнуть процедуре удаления защиты стандартными способами (например, обработка кислотой в случае Boc группы), с получением соединения формулы (I).
Другие защитные группы для аминов, таких как циклические амины и гетероциклические N-H группы, включают толуолсульфонильную (тозил) и метансульфонильную (мезил) группы, бензильную, такую как пара-метоксибензильную (PMB) группу и тетрагидропиранильные (THP) группы.
Карбоновокислотную группу можно защитить в виде сложного эфира, например, как: C1-7 алкиловый эфир (например, метиловый эфир; трет-бутиловый эфир); C1-7 галогеналкиловый эфир (например, C1-7 тригалогеналкиловый эфир); триC1-7 алкилсилил-C1-7алкиловый эфир; или C5-20 арил-C1-7 алкиловый эфир (например, бензиловый эфир; нитробензиловый эфир; пара-метоксибензиловый эфир. Тиольную группу можно защитить, например, в виде тиоэфира (-SR), например, как: бензилтиоэфир; ацетамидометиловый эфир (-S-CH2NHC(=O)CH3).
Выделение и очистка соединений по настоящему изобретению
Соединения по настоящему изобретению могут быть выделены и очищены в соответствии со стандартными методами, хорошо известными специалистам в данной области, и примеры таких методов включают хроматографические методы, такие как колоночная хроматография (например, флэш-хроматография) и ВЭЖХ. Один особенно полезный метод очистки соединений представляет собой препаративную жидкостную хроматографию с использованием масс-спектрометрии как средства детекции очищенных соединений, выходящих из хроматографической колонки.
Препаративная LC-MS представляет собой стандартный и эффективный способ, используемый для очистки малых органических молекул, таких как соединения, описанные в настоящей заявке. Способы, используемые для жидкостной хроматографии (LC) и масс-спектрометрии (MS), могут варьироваться для обеспечения лучшего разделения неочищенных веществ и лучшей детекции образцов при помощи MS. Оптимизация препаративного градиентного LC метода включает варьирования используемых колонок, летучих элюентов и модификаторов и градиентов. Такие способы хорошо известны из уровня техники для оптимизации методов препаративной LC-MS и затем использования их для очистки соединений. Такие способы описаны в Rosentreter U, Huber U.; Optimal fraction collecting in preparative LC/MS; J Comb Chem.; 2004; 6(2), 159-64, и в Leister W, Strauss K, Wisnoski д, Zhao Z, Lindsley C., Development of a custom high-throughput preparative liquid chromatography/mass spectrometer platform for the preparative purification and analytical analysis of compound libraries; J Comb Chem.; 2003; 5(3); 322-9. Пример такой системы для очистки соединений при помощи препаративной LC-MS описан ниже в разделе Примеры настоящей заявки (под заголовком “Система масс-направленной очистки LC-MS”).
Способы перекристаллизации соединений формулы (I) и их солей можно осуществить способами, хорошо известными специалистам в данной области - см., например, (P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, Handbook of Pharmaceutical Salts: Properties, Selection and Use, Chapter 8, Publisher Wiley-VCH). Продукты, полученные в результате органических реакций, редко являются чистыми, когда их выделяют непосредственно из реакционной смеси. Если соединение (или его соль) представляет собой твердое вещество, его можно очистить и/или кристаллизовать путем перекристаллизации из подходящего растворителя. Хороший растворитель перекристаллизации должен растворять умеренное количество вещества, которое подлежит очистке, при повышенных температурах, но только небольшое количество вещества при низкой температуре. Он должен легко растворять примеси при низких температурах, или не растворять вообще. Наконец, растворитель должен легко удаляться из очищенного продукта. Это обычно означает, что он имеет относительно низкую температуру кипения, и специалисты в данной области смогут определить растворители перекристаллизации для конкретного вещества, или если такая информация отсутствует, испытать некоторые растворители. Для получения хорошего выхода очищенного вещества используют минимальное количество горячего растворителя для растворения всех неочищенных веществ. На практике используют на 3-5% больше растворителя, чем это необходимо, чтобы раствор не был насыщенным. Если неочищенное соединение содержит примесь, которая является нерастворимой в растворителе, ее затем можно удалить путем фильтрования и затем оставить раствор кристаллизоваться. Кроме того, если неочищенное соединение содержит следовые количества окрашенного вещества, которое не является присущим данному соединению, его можно удалить путем добавления небольшого количества обесцвечивающего вещества, например, активированного угля, к горячему раствору, фильтрования раствора с последующей его кристаллизацией. Обычно кристаллизация происходит самопроизвольно при охлаждении раствора. Если этого не происходит, кристаллизацию можно индуцировать путем охлаждения раствора ниже комнатной температуры или путем добавления монокристалла чистого вещества (затравочный кристалл). Также можно осуществить перекристаллизацию и/или оптимизировать выход путем использования анти-растворителя или со-растворителя. В этом случае, соединение растворяют в подходящем растворителе при повышенной температуре, фильтруют и затем добавляют дополнительный растворитель, в котором требуемое соединение имеет низкую растворимость, для облегчения кристаллизации. Затем кристаллы типично выделяют с использованием вакуум-фильтрации, промывают и затем сушат, например, в печи или путем обезвоживания.
Другие примеры способов очистки включают сублимацию, которая включает стадию нагрева в условиях вакуума, например, с использованием охлаждающего пальца, и кристаллизацию из расплава (Crystallization Technology Handbook 2nd Edition, edited by A. Mersmann, 2001).
Биологические эффекты
Соединения по настоящему изобретению, подгруппы и примеры таких соединений являются антагонистами белков-ингибиторов апоптоза (IAP) и могут быть полезными для профилактики лечения заболеваний или состояний, описанных в настоящей заявке. Кроме того, соединения по настоящему изобретению и их подгруппы будут полезными для профилактики или лечения заболевания или состояния, опосредованного IAP. Ссылки на предотвращение или профилактику или лечение заболевания или состояния, такого как рак, охватывают своим объемом облегчение симптомов или уменьшение случаев развития рака.
Таким образом, например, предусматривается, что соединения по настоящему изобретению будут полезными для облегчения симптомов или уменьшения случаев развития рака.
Соединения по настоящему изобретению могут быть полезными для лечения взрослого населения. Соединения по настоящему изобретению могут быть полезными для лечения педиатрических пациентов.
Более конкретно, соединения формулы (I) и подгруппы таких соединений являются антагонистами IAP. Например, соединения по настоящему изобретению обладают сродством к XIAP, cIAP1 и/или cIAP2 и, в частности, IAP, выбранного из XIAP и cIAP1.
Предпочтительные соединения представляют собой соединения, которые обладают сродством в отношении одного или нескольких IAP, выбранных из XIAP, cIAP1 и cIAP2. Предпочтительные соединения по настоящему изобретению представляют собой такие, которые имеют значения ИК50 меньше чем 0,1 мкМ.
Являющиеся антагонистами соединения формулы (I) способны к связыванию с IAP и демонстрируют эффективность в отношении IAP. В одном варианте воплощения, антагонистические соединения формулы (I) демонстрируют селективность в отношении одного или нескольких IAP по сравнению с другими членами IAP семейства и могут быть способными к связыванию и/или проявлению сродства предпочтительным образом с XIAP и/или cIAP по сравнению со связыванием и/или проявлением сродства с другими членами IAP семейства.
Кроме того, многие соединения по настоящему изобретению демонстрируют селективность в отношении XIAP по сравнению с cIAP, или наоборот, селективность в отношении cIAP по сравнению с XIAP (в частности, cIAP1), и такие соединения представляют собой один вариант воплощения настоящего изобретения. В частности, соединения по настоящему изобретению могут обладать по меньшей мере в 10 раз большим сродством в отношении одного или нескольких членов семейства IAP, в частности, XIAP, cIAP1 и/или cIAP2, по сравнению с другими членами семейства IAP. Это можно определить с использованием способов, описанных в настоящей заявке. В следующем варианте воплощения, соединения по настоящему изобретению могут обладать эквивалентным сродством в отношении XIAP, cIAP1 и/или cIAP2, в частности, эквивалентным сродством (т.е. разница в сродстве меньше чем в 10 раз) в отношении XIAP и cIAP1.
Активность против XIAP и cIAP может быть особенно предпочтительной. Антагонистическое действие в отношении XIAP и cIAP1/2 с равной эффективностью должно способствовать запуску апоптоза через активацию каспазы-8 и переключению от сигнала про-выживания NF-каппаB на апоптоз; и сильный антагонизм XIAP будет обеспечивать достижение апоптоза до активации какого-либо механизма внутренней устойчивости для блокирования процесса. При истощении cIAP1/2 через аутоубихитинирование и протеасомное расщепление, имеет место временная активация NF-каппаB сигнала, который является ответственным за экспрессию TNF-альфа в чувствительных клеточных линиях - он также является ответственным за активацию анти-апоптических факторов, таких как cIAP2 и c-FLIP. Следовательно, необходим сильный антагонизм XIAP для усиления активации эффекторной каспазы и клеточной гибели, но не накопления cIAP1/2 антагонизм-опосредованной резистентности. Как правило, считают, что токсичность, которая возникает при введении этих соединений in vivo, возникает в результате временной индукции NFкаппаB сигнала и являющейся результатом этого активации про-воспалительных цитокинов, которая опосредована исключительно cIAP1/2 антагонизмом. Поэтому двойная эффективность должна обеспечить возможность получения терапевтического окна до достижения доза-ограничивающих токсичностей.
IAP функция, заключающаяся в контроле запрограммированной клеточной гибели, также вовлечена во многие заболевания, включая расстройства, ассоциированные с клеточной аккумуляцией (например, рак, аутоиммунное заболевание, воспаление и рестеноз), расстройства, где чрезмерный апоптоз приводит к потере клеток (например, удар, сердечная недостаточность, нейродегенерация, такая как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, амиотрофический боковой склероз, СПИД, ишемия (удар, инфаркт миокарда) и остеопороз, или лечение аутоиммунных заболеваний, таких как рассеянный склероз (MS).
Поэтому также предусматривается, что соединения по настоящему изобретению могут быть полезными в лечении других состояний, таких как воспаление, гепатит, язвенный колит, гастрит, аутоиммунное заболевание, воспаление, рестеноз, удар, сердечная недостаточность, нейродегенеративные состояния, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, миотоническая дистрофия и амиотрофический боковой склероз, СПИД, ишемия, такая как травматическое поражение головного мозга, поражение спинного мозга, церебральная ишемия, церебральная ишемия/реперфузионное (I/R) поражение, острое и хроническое поражение ЦНС, ишемия, удар или инфаркт миокарда, дегенеративные заболевания костно-мышечной системы, такие как остеопороз, аутоиммунное заболевания, такие как рассеянный склероз (MS) и диабет I типа, и глазные заболевания, такие как дегенерация сетчатки, которые являются результатом потери контроля запрограммированной клеточной гибели.
Как следствие их сродства в отношении IAP, соединения будут полезными для обеспечения средств контроля запрограммированной клеточной гибели. Поэтому предполагают, что соединения могут оказаться полезными для лечения или профилактики пролиферативных расстройств, таких как рак. Кроме того, соединения по настоящему изобретению могут быть полезными для лечения заболеваний, где имеет место расстройство, ассоциированное с клеточной аккумуляцией, или где чрезмерный апоптоз приводит к потере клеток.
Примеры раковых заболеваний (и их доброкачественных аналогов), которые можно лечить (или ингибировать), включают, но не ограничиваются этим, опухоли эпителиального происхождения (аденомы и карциномы различных типов, включая аденокарциномы, сквамозные карциномы, переходно-клеточные карциномы и другие карциномы), такие как карциномы мочевого пузыря и мочевых путей, молочной железы, желудочно-кишечного тракта (включая пищевод, желудок (гастральный), тонкого кишечника, толстой кишки, прямой кишки и анального отверстия), печени (гепатоклеточная карцинома), желчного пузыря и желчных протоков, экзокринной поджелудочной железы, почки, легкого (например, аденокарциномы, мелкоклеточные карциномы легких, не-мелкоклеточные карциномы легких, бронхоальвеолярные карциномы и мезотелиомы), головы и шеи (например, рак языка, буккальной полости, глотки, гортани, носоглотки, миндалин, слюнных желез, носовой полости и околоносовых пазух), яичника, фаллопиевых труб, брюшной полости, влагалища, вульвы, мужского полового члена, шейки матки, миометрия, эндометрия, щитовидной железы (например, фолликулярная карцинома щитовидной железы), надпочечников, предстательной железы, кожи и придатков (например, меланома, базально-клеточная карцинома, сквамозно-клеточная карцинома, кератоакантома, диспластический невус); гематологические злокачественные заболевания (т.е. лейкозы, лимфомы) и пред-злокачественные гематологические расстройства и расстройства, граничащие со злокачественностью, включая гематологические злокачественные заболевания и родственные состояния лимфоидного происхождения (например, острый лимфоцитарный лейкоз [ALL], хронический лимфоцитарный лейкоз [CLL], B-клеточные лимфомы, такие как диффузная крупно-B-клеточная лимфома [DLBCL], фолликулярная лимфома, лимфома Беркетта, лимфома клеток ткани, одевающей спорангий, Т-клеточные лимфомы и лейкозы, натурально-киллерноклеточные [NK] лимфомы, лимфомы Ходжкина, волосистоклеточный лейкоз, моноклональная гаммопатия неопределенного значения, плазмацитома, множественная миелома и лимфопролиферативные расстройства после трансплантации) и гематологические злокачественные заболевания и родственные состояния миелогенного происхождения (например, остр миелогенный лейкоз [AML], хронический миелогенный лейкоз [CML], хронический миеломоноцитарный лейкоз [CMML], гиперэозинофильный синдром, миелопролиферативные расстройства, такие как истинная полицитемия, эссенциальная тромбоцитемия и первичный миелофиброз, миелопролиферативный синдром, миелодиспластический синдром и промиелоцитарный лейкоз); опухоли мезенхимального происхождения, например, саркомы мягкой ткани, кости или хряща, такие как остеосаркомы, фибросаркомы, хондросаркомы, рабдомиосаркомы, лейомиосаркомы, липосаркомы, ангиосаркомы, саркома Капоши, саркома Эвинга, синовиальные саркомы, эпителоидные саркомы, желудочно-кишечные стромальные опухоли, доброкачественные и злокачественные гистиоцитомы и выбухающая дерматофибросаркома; опухоли центральной или периферической нервной системы (например, астроцитомы, глиомы и глиобластомы, менингиомы, эпендиомы, пинеальные опухоли и шванномы); эндокринные опухоли (например, гипофизарные опухоли, адренальные опухоли, островковоклеточные опухоли, опухоли паращитовидной железы, карциноидные опухоли и медуллярная карцинома щитовидной железы); глазные и придаточные опухоли (например, ретинобластома); зародышевоклеточные и трофобластные опухоли (например, тератомы, семиномы, дисгерминомы, хороионаденомы и хориокарциномы); и педиатрические и эмбриональные опухоли (например, медуллобластома, нейробластома, опухоль Вильмса и примитивные нейроэктодермальные опухоли); или синдромы, врожденные или другие, которые делают пациента, чувствительным к злокачественности (например, пигментозная ксеродерма).
Рост клеток представляет собой тщательно контролируемую функцию. Рак, состояние аномального клеточного роста, возникает, когда клетки воспроизводятся неконтролируемым образом (увеличение количества), неконтролируемо растут (становятся больше), и/или происходит меньшая клеточная гибель в результате апоптоза (запрограммированная клеточная гибель), некроз или annoikis. В одном варианте воплощения, аномальный клеточный рост выбран из неконтролируемой клеточной пролиферации, чрезмерного клеточного роста или уменьшенной запрограммированной клеточной гибели. В частности, состояние или заболевание аномального клеточного роста представляет собой рак. Таким образом, в фармацевтических композициях, применениях или способах по настоящему изобретению для лечения заболевания или состояния, включающего аномальный клеточный рост (т.е. неконтролируемый и/или быстрый клеточный рост), заболевание или состояние, включающее аномальный клеточный рост, в одном варианте воплощения, представляет собой рак.
В одном варианте воплощения, гематологическое злокачественное заболевание представляет собой лейкоз. В другом варианте воплощения, гематологическое злокачественное заболевание представляет собой лимфому.
Многие заболевания характеризуются персистентным и нерегулируемым ангиогенезом. Хронические пролиферативные заболевания часто сопровождаются сильным ангиогенезом, который может способствовать или поддерживать воспалительное и/или пролиферативное состояние, или который приводит к деструкции ткани через инвазивную пролиферацию кровеносных сосудов. Было обнаружено, что рост опухоли и метастазы являются ангиогенез-зависимыми. Соединения по настоящему изобретению поэтому могут быть полезными для предотвращения и разрушения опухолевого ангиогенеза. В частности, соединения по настоящему изобретению могут быть полезными для лечения метастаз и метастатических раков.
Метастазы или метастатическое заболевание представляют собой распространение заболевания от органа или участка на другой несмежный орган или участок. Раковые заболевания, которые можно лечить соединениями по настоящему изобретению, включают первичные опухоли (т.е. раковые клетки на исходном участке), локальную инвазию (раковые клетки, которые проникают и просачиваются в окружающие нормальные ткани на ограниченном участке) и метастатические (или вторичные) опухоли, т.е. опухоли, которые образовались из злокачественных клеток, которые циркулировали через кровоток (гематогенное распространение) или через лимфатические сосуды или через полости тела (транс-целомические) к другим участкам и тканям в организме.
Конкретные раковые заболевания включают гепатоклеточную карциному, меланому, эзофагеальный, ренальный рак, рак толстой кишки, колоректальный рак, рак легкого, например, мезотелиому или аденокарциному легкого, рак молочной железы, мочевого пузыря, желудочно-кишечного тракта, яичника и предстательной железы.
Конкретные раковые заболевания включают ренальный рак, меланому, рак толстой кишки, рак легкого, рак молочной железы, рак яичника и рак предстательной железы. В одном варианте воплощения, рак выбран из меланомы, рака толстой кишки, молочной железы и яичника. В одном варианте воплощения, рак представляет собой меланому. В одном варианте воплощения, рак представляет собой воспалительный рак молочной железы.
Следующий аспект настоящего изобретения включает соединение по настоящему изобретению для применения в профилактике или лечении рака у пациента, выбранного из субпопуляции, имеющей раковые заболевания с высоким воспалительным компонентом. Такие раковые заболевания также известны как «воспалительный фенотип» и включают опухоли с повышенной сигнальной активностью цитокинов (например, TNF). В одном варианте воплощения, рак представляет собой воспалительную опухоль, например, меланому, рак толстой кишки, молочной железы и яичника, в частности, меланому.
В одном варианте воплощения, заболевание, подлежащее лечению, представляет собой лейкоз, такой как острые и хронические лейкозы, острый миелогенный лейкоз (AML) и хронический лимфоцитарный лейкоз (CLL). В одном варианте воплощения, лейкоз представляет собой рефрактерный DLBCL.
В одном варианте воплощения, рак представляет собой мезотелиому, включая злокачественную перитонеальную мезотелиому или злокачественную плевральную мезотелиому.
Некоторые раковые заболевания являются резистентными к лечению определенными лекарственными средствами. Это может быть из-за типа опухоли (чаще всего эпителиальные злокачественные заболевания являются по существу хеморезистентными), или резистентность может возникать спонтанно по мере прогрессирования заболевания или как результат лечения. В этой связи, ссылки на мезотелиому включают мезотелиому с резистентностью к топоизомеразным ядам, алкилирующим средствам, антитубулинам, антифолатам, платиновым соединениям и лучевой терапии, в частности, цисплатин-резистентную мезотелиому. Подобным образом, ссылки на множественную миелому включают бортезомиб-чувствительную множественную миелому или рефрактерную множественную миелому, и ссылки на хронический миелогенный лейкоз включают иматиниб-чувствительный хронический миелогенный лейкоз и рефрактерный хронический миелогенный лейкоз.
Раковые заболевания могут представлять собой раковые заболевания, которые являются чувствительными к антагонизму любого одного или нескольких IAP, выбранных из XIAP, cIAP1, cIAP2, NAIP, ILP2, ML-IAP, сурвирина и BRUCE, более предпочтительно XIAP, cIAP1, cIAP2, ML-IAP, наиболее предпочтительно XIAP.
Кроме того, предусматривается, что соединения по настоящему изобретению и, в частности, те соединения, которые обладают сродством к IAP, будут особенно полезными для лечения или профилактики типов рака, ассоциированных с, или характеризующихся, присутствием повышенных уровней IAP или амплификацией 11q22, например, типов рака, указанных в этом контексте в вводной части настоящей заявки.
Повышенные уровни IAP из-за чрезмерной экспрессии IAP обнаружены во многих типах рака, и они ассоциируются с плохим прогнозом. Кроме того, раковые заболевания с 11q22 амплификацией также могут быть чувствительными к антагонисту IAP. Повышенные уровни IAP и амплификацию 11q22 можно определить методами описанными в настоящей заявке. Является ли конкретный рак таким, который является чувствительным к функции IAP, можно определить способом, описанным в разделе, озаглавленном “Способы диагностики”.
Следующий аспект обеспечивает применение соединения для получения лекарственного средства для лечения заболевания или состояния, описанного в настоящей заявке, в частности, рака.
Соединения также могут быть полезными для лечения опухолевого роста, патогенеза, резистентности к химио- и лучевой терапии путем сенсибилизации клеток к химиотерапи и в качестве анти-метастатического средства.
Терапевтические противораковые вмешательства всех типов обязательно усиливают стрессы, оказываемые на мишеневые опухолевые клетки. В процессе ослабления губительных эффектов таких стрессов IAP непосредственно вовлечены в сопротивление эффектам противораковых лекарственных средств и режимам лечения. Таким образом, антагонисты IAP представляют собой класс химиотерапевтических средств с потенциалом для: (i) сенсибилизации злокачественных клеток к противораковым лекарственным средствам и/или лечениям; (ii) облегчения симптомов или снижения уровня резистентности к противораковым и лекарственным средствам и/или лечениям; (iii) реверсирования резистентности к противораковым лекарственным средствам и/или лечениям; (iv) усиления активности противораковых лекарственных средств и/или лечений; (v) замедление или предотвращение развития резистентности к противораковым и лекарственным средствам и/или лечениям.
Как следствие их сродства в отношении IAP, соединения будут полезными для обеспечения средств контроля запрограммированной клеточной гибели. Поэтому, также предусматривается, что соединения по настоящему изобретению могут быть полезными для лечения других состояний, таких как воспалительные расстройства, такие как гепатит, язвенный колит и гастрит; нейродегенеративные состояния, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, миотоническая дистрофия и амиотрофический боковой склероз; СПИД, ишемия, например, рестеноз, травматическое поражение головного мозга, поражение спинного мозга, церебральная ишемия, церебральная ишемия/реперфузионное (I/R) поражение, острое и хроническое поражение ЦНС, ишемия, удар или инфаркт миокарда; дегенеративные заболевания костно-мышечной системы, такие как остеопороз; аутоиммунные заболевания, такие как рассеянный склероз (MS) и диабет I типа, и глазные заболевания, такие как дегенерация сетчатки.
Сродство соединений по настоящему изобретению как антагонистов IAP можно измерить с использованием биологических и биофизических анализов, описанных в примерах в настоящей заявке, и уровни сродства, демонстрируемые данным соединением, можно определить как значение ИК50. Предпочтительными соединениями по настоящему изобретению являются соединения, имеющие значение ИК50 меньше чем 1 мкМ, более предпочтительно меньше чем 0,1 мкМ.
В одном варианте воплощения, настоящее изобретение обеспечивает соединение для применения в лечении заболевания или состояния, которое опосредовано IAP (например, XIAP и/или cIAP, например, cIAP1). В следующем варианте воплощения, настоящее изобретение обеспечивает соединение для применения в лечении заболевания или состояния, в котором имеет место чрезмерная экспрессия IAP (например, XIAP и/или cIAP, например, cIAP1).
В одном варианте воплощения, настоящее изобретение обеспечивает соединение для применения в лечении заболевания или состояния, которое опосредовано IAP, где соединение представляет собой антагонист IAP, имеющий значение ИК50 меньше чем 50 мкМ, по меньшей мере, в одном анализе (например, вытеснительное связывание), против IAP. В частности, IAP представляет собой XIAP, cIAP1 и/или cIAP2. В следующем варианте воплощения, заболевание или состояние, которое опосредовано IAP, представляет собой рак, который характеризуется чрезмерной экспрессией по меньшей мере одного IAP и/или амплификацией 11q22.
В одном варианте воплощения, настоящее изобретение обеспечивает соединение для применения в лечении заболевания или состояния, которое опосредовано IAP, где соединение имеет значение ИК50 меньше чем 10 мкМ против, по меньшей мере, одного IAP в анализе (например, вытеснительное связывание) против IAP.
Следующий аспект обеспечивает применение соединения для получения лекарственного средства для лечения заболевания или состояния, которое опосредовано IAP, где соединение представляет собой антагонист IAP, имеющий значение ИК50 меньше чем 50 мкМ против, по меньшей мере, одного IAP в анализе (например, вытеснительное связывание).
Способы диагностики
Перед введением соединения формулы (I) пациента можно обследовать методом скрининга для определения, является ли заболевание или состояние, от которого страдает или может страдать пациент, таким, которое будет чувствительным к лечению соединением, обладающим сродством в отношении IAP. Термин 'пациент' включает человека и ветеринарных субъектов.
Например, можно осуществить анализ биологического образца, взятого у пациента, для определения является ли состояние или заболевание, такое как рак, от которого страдает или может страдать пациент, таким, которое характеризуется генетическим отклонением или аномальной экспрессией белка, которая приводит к повышению уровней IAP или к сенсибилизации пути к нормальной функции IAP или к активации биохимического пути ниже от IAP активации.
Примеры таких отклонений, которые приводят к активации или сенсибилизации IAP, включают потерю или ингибирование апоптических путей, активацию рецепторов или лигандов, цитогенетические аберрации или присутствие мутантных вариантов рецепторов или лигандов. Опухоли с активацией IAP, в частности, чрезмерной экспрессией IAP, могут быть особенно чувствительными к антагонистам IAP. Например, чрезмерная экспрессия XIAP и cIAP была определена в ряде типов рака, обсуждаемых в разделе Предпосылки изобретения.
Амплификация хромосомы 11q22 была обнаружена в клеточных линиях и первичных опухолях из сквамозно-клеточных карцином пищевода (Imoto et al., 2001) и шеи (Imoto et al., 2002), а также в первичных раках легкого/клеточных линиях (Dai et al., 2003). Иммуногистохимический и вестерн-блот анализ идентифицировали cIAP1 и cIAP2 в качестве потенциальных онкогенов в этой области, поскольку оба чрезмерно экспрессируются в типах рака, в которых возникает эта редкая амплификация.
Термин активация включает повышенную экспрессию или чрезмерную экспрессию, включая генную амплификацию (т.е. множество генных копий), цитогенетическую аберрацию и повышенную экспрессию посредством транскрипционного эффекта. Таким образом, можно провести диагностическое обследование пациента для определения маркера, характерного для активации IAP. Термин диагноз включает скрининг. Маркер включает генетические маркеры, включая, например, определение композиции ДНК для выявления присутствия мутаций IAP или амплификации 11q22. Термин маркер также включает маркеры, которые, являются характерными для активации IAP, включая уровни белка, состояние белка и уровни мРНК указанных выше белков.
Диагностические исследования и скрининги типично осуществляют на биологическом образце (т.е. ткань или жидкости организма), выбранном из образцов биопсии опухоли, образцов крови (выделение и обогащение отделившихся опухолевых клеток), цереброспинальной жидкости, плазмы, сыворотки, слюны, биопсий стула, мокроты, хромосомного анализа, плевральной жидкости, перитонеальной жидкости, мазков соскоба щеки, биопсии кожи или мочи.
Способы идентификации и анализа цитогенетической аберрации, генетической амплификации мутаций и активации белков известен специалистам в данной области. Методы скрининга могут включать, но не ограничиваются этим, стандартные методы, такие как обратная транскриптаза-полимеразная цепная реакция (RT-PCR) или in-situ гибридизация, такая как флуоресцентная in situ гибридизация (FISH).
В скрининговом анализе методом RT-PCR, уровни мРНК в опухоли оценивают путем создания кДНК копии мРНК с последующей амплификацией кДНК при помощи PCR. Методы PCR амплификации, выбор праймеров и условий для амплификации известны специалистам в данной области. Манипуляции с нуклеиновыми кислотами и PCR осуществляют стандартными способами, как описано, например, в Ausubel, F.M. et al., eds. (2004) Current Protocols in Molecular Biology, John Wiley & Sons Inc. или в Innis, M.A. et al., eds. (1990) PCR Protocols: a guide to methods and applications, Academic Press, San Diego. Реакции и манипуляции с вовлечением нуклеиновых кислот также описаны в Sambrook et al., (2001), 3rd Ed, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press. Альтернативно, можно использовать коммерчески доступный набор для RT-PCR (например, Roche Molecular Biochemicals) или процедуры, описанные в патентах США №№ 4666828; 4683202; 4801531; 5192659, 5272057, 5882864 и 6218529, которые включены в настоящую заявку посредством ссылки.
Примером процедуры in situ гибридизации для оценки мРНК экспрессии может быть флуоресцентная in-situ гибридизация (FISH) (см. Angerer (1987) Meth. Enzymol., 152: 649).
Как правило, in situ гибридизация включает следующие основные стадии: (1) фиксация ткани, подлежащей анализу; (2) пред-гибридизационная обработка образца для повышения доступности целевых нуклеиновых кислот и для уменьшения неспецифического связывания; (3) гибридизация смеси нуклеиновых кислот с нуклеиновой кислотой в биологической структуре или ткани; (4) пост-гибридизационные промывки для удаления нуклеиновокислотных фрагментов, оставшихся несвязанными при гибридизации, и (5) детекция гибридизованных нуклеиновокислотных фрагментов. Зонды, используемые для таких целей, типично являются меченными, например, радиоизотопами или флуоресцентными репортерами. Предпочтительные зонды являются достаточно длинными, например, от около 50, 100 или 200 нуклеотидов до около 1000 или более нуклеотидов, чтобы обеспечить специфическую гибридизацию с целевой нуклеиновой кислотой (кислотами) в жестких условиях. Стандартные способы для осуществления FISH описаны Ausubel, F.M. et al., eds. (2004) Current Protocols in Molecular Biology, John Wiley & Sons Inc. и в Fluorescence In Situ Hynridization: Technical Overview by John M. S. Bartlett in Molecular Diagnosis of Cancer, Methods and Protocols, 2nd ed.; ISBN: 1-59259-760-2; March 2004, pps. 077-088; Series: Methods in Molecular Medicine.
Методы профилирования генной экспрессии описаны в (DePrimo et al. (2003), BMC Рак, 3:3). Вкратце, использовали следующий протокол: двухцепочечную кДНК синтезируют из полной РНК с использованием (dT)24 олигомера для прайминга синтеза первой цепи кДНК, с последующим синтезом второй цепи кДНК с произвольными гексамерными праймерами. Двухцепочечную кДНК используют в качестве матрицы для in vitro транскрипции кРНК с использованием биотинилированных рибонуклеотидов. кРНК химически фрагментируют в соответствии с протоколами, описанными Affymetrix (Santa Clara, CA, USA), и затем гибридизуют в течение ночи на Human Genome Arrays.
Альтернативно, белковые продукты, экспрессированные из мРНК, можно анализировать при помощи иммуногистохимического анализа образцов опухоли, твердофазного иммуноанализа с использованием микротитровальных планшетов, методом Вестерн-блоттинга, электрофореза на 2-мерном SDS-полиакриламидном геле, ELISA, проточной цитометрии и другими методами, известными из уровня техники для детекции специфических белков. Способы детекции включают использование сайт-специфических антител. Специалистам в данной области должно быть понятно, что все такие хорошо известные методы для детекции активирующей регуляции IAP, детекции IAP вариантов или мутантов или детекции 11q22 амплификации могут быть применимы в данном случае.
Аномальные уровни белков, таких как IAP, можно измерить с использованием стандартных анализов белка, например, анализов, которые описаны в настоящей заявке. Повышенные уровни или чрезмерную экспрессию также можно определить в образце ткани, например, опухолевой ткани, путем измерения уровней белка при помощи анализа, такого как анализ из Chemicon International. Осуществляют иммунопреципитацию белка, представляющего интерес, из лизата образца и измеряют его уровни.
Альтернативные способы для определения чрезмерной экспрессии или повышения уровней IAP, включая все его изоформы, включают определение плотности микрососудов. Это, например, можно измерить с использованием способов, описанных Orre and Rogers (Int J Cancer (1999), 84(2), 101-8). Методы анализа также включают использование маркеров.
Поэтому все эти методы также можно использовать для определения опухолей, особенно подходящих для лечения соединениями по настоящему изобретению.
Поэтому в следующем аспекте настоящее изобретение включает применение соединения в соответствии с настоящим изобретением для получения лекарственного средства для лечения или профилактики заболевания или состояния у пациента, который прошел скрининг, и было определено, что он страдает от, или подвержен такому риску, заболевания или состояния, которое будет чувствительным к лечению соединением, обладающим сродством в отношении IAP (т.е. антагонист IAP).
Другой аспект настоящего изобретения включает соединение по настоящему изобретению для применения в профилактике или лечении рака у пациента, выбранного из субпопуляции, имеющей чрезмерную экспрессию одного или нескольких членов семейства IAP (например, cIAP и/или XIAP).
Другой аспект настоящего изобретения включает соединение по настоящему изобретению для применения в профилактике или лечении рака у пациента, выбранного как имеющего цитогенетическую аберрацию, которая приводит к чрезмерной экспрессии IAP, например, пациента, выбранного как имеющего 11q22 амплификацию.
MRI определение сосудистой нормализации (например, методы, использующие MRI градиентное эхо, спиновое эхо и контрастное усиление для измерения объема крови, относительного размера сосуда и сосудистой проницаемости) в сочетании с циркулирующими биомаркерами также можно использовать для идентификации пациента для лечения соединением по настоящему изобретению.
Таким образом, следующий аспект настоящего изобретения представляет собой способ для диагностики и лечения заболевания или состояния, опосредованного IAP, который включает (i) скрининговое обследование пациента для определения, является ли заболевание или состояние, от которого страдает или может страдать пациент, таким, которое будет чувствительным к лечению соединением, обладающим сродством в отношении IAP; и (ii) если показано, что заболевание или состояние, от которого страдает пациент, является соответственно чувствительным, затем введение пациенту соединения формулы (I) и подгрупп или примеров такого соединения, определенных в настоящей заявке.
Фармацевтические композиции
Хотя возможно введение активного соединения отдельно, предпочтительно, когда оно представлено в виде фармацевтической композиции (например, композиции).
Таким образом, настоящее изобретение также обеспечивает фармацевтические композиции, определенные выше, и способы получения фармацевтической композиции, включающей (например, в смеси) по меньшей мере одно соединение формулы (I) (и подгруппы такого соединения, определенные в настоящей заявке), вместе с одним или несколькими фармацевтически приемлемыми эксципиентами и, необязательно, другими терапевтическими или профилактическими средствами, описанными в настоящей заявке.
Фармацевтически приемлемый эксципиент (эксципиенты) может быть выбран, например, из носителей (например, твердый, жидкий или полутвердый носитель), адъювантов, разбавителей, наполнителей или агентов, создающих объем, агентов гранулирования, агентов покрытия, агентов, контролирующих высвобождение, связующих, разрыхлителей, смазывающих веществ, консервантов, антиоксидантов, буферных веществ, суспендирующих веществ, загустителей, отдушек, подсластителей, вкусовых добавок, стабилизаторов или любых других эксципиентов, традиционно используемых в фармацевтических композициях. Примеры эксципиентов для различных типов фармацевтических композиций описаны более подробно ниже.
Термин “фармацевтически приемлемый”, используемый в настоящей заявке, относится к соединениям, веществам, композициям и/или лекарственным формам, которые, согласно взвешенной медицинской оценке, являются подходящими для использования в контакте с тканями субъекта (например, человека) без чрезмерный токсичности, раздражения, аллергических реакций или других проблем или осложнений, и соответствуют разумному соотношению польза/риск. Каждый носитель, эксципиент и т.п. должен быть также “приемлемым”, в том смысле, что он должен быть совместимым с другими ингредиентами композиции.
Фармацевтические композиции, содержащие соединения формулы (I), могут быть сформулированы в соответствии с известными способами, см., например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA, USA.
Фармацевтические композиции могут быть в любой форме, подходящей для перорального, парентерального, местного, интраназального, интрабронхиального, сублингвального, внутриглазного, внутриушного, ректального, интравагиального или чрескожного введения. Когда композиции предназначены для парентерального введения, они могут быть сформулированы для внутривенного, внутримышечного, интраперитонеального, подкожного введения или для непосредственной доставки в являющийся мишенью орган или ткань путем инъекции, инфузии или другим путем доставки. Доставку можно осуществить путем болюсной инъекции, кратковременной инфузии или более длительной инфузии, и это можно осуществить путем пассивной доставки или путем использования подходящего инфузионного насоса или доставки через шприц.
Фармацевтические композиции, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические вещества, со-растворители, поверхностно-активные вещества, смеси органических растворителей, циклодекстрин-комплексобразующие вещества, эмульгаторы (для образования и стабилизации композиций в виде эмульсии), липосомные компоненты для образования липосом, гель-образующие полимеры для образования полимерных гелей, агенты защиты для лиофилизации и комбинации веществ для, среди прочего, стабилизации активного ингредиента в растворимой форме, и чтобы сделать композицию изотонической с кровью предполагаемого реципиента. Фармацевтические композиции для парентерального введения также могут быть в форме водных и неводных стерильных суспензий, которые могут включать суспендирующие вещества и загустители (R. G. Strickly, Solubilizing Excipients in oral and injectable formulations, Pharmaceutical Research, Vol 21(2) 2004, p. 201-230).
Композиции могут быть представлены в однодозовых или многодозовых контейнерах, например, герметично закрытых ампулах, флаконах и предварительно заполненных шприцах, и их можно хранить в высушенном замораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед использованием.
Фармацевтическую композицию можно получить путем лиофилизации соединения формулы (I) или подгруппы такого соединения. Лиофилизация относится к процедуре сушки замораживанием композиции. Сушка замораживанием и лиофилизация поэтому используются в настоящей заявке как синонимы.
Импровизированные растворы и суспензии для инъекций можно получить из стерильных порошков, гранул и таблеток.
Фармацевтические композиции по настоящему изобретению для парентеральной инъекции также включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для реструктурирования в стерильные растворы или дисперсии для инъекций непосредственно перед использованием.
Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и подобные), карбоксиметилцеллюлозу и подходящие смеси таких веществ, растительные масла (такие как подсолнечное масло, сафлоровое масло, кукурузное масло или оливковое масло) и органические сложные эфиры для инъекций, такие как этилолеат. Подходящую текучесть можно поддерживать, например, при помощи загустителей или агентов покрытия, таких как лецитин, путем поддержания необходимого размера частиц в случае дисперсий, и при помощи поверхностно-активных веществ.
Композиции по настоящему изобретению также могут содержать адъюванты, такие как консерванты, смачивающие вещества, эмульгаторы и диспергирующие вещества. Предотвращение действия микроорганизмов можно обеспечить путем включения различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Также может быть желательным включение веществ для регулирования тоничности, таких как сахара, хлорид натрия и т.п. Пролонгированную абсорбцию фармацевтической формы для инъекций можно получить путем включения веществ, которые замедляют абсорбцию, таких как алюминиймоностеарат и желатин.
В одном предпочтительном варианте воплощения настоящего изобретения, фармацевтическая композиция представлена в форме, подходящей для в/в (внутривенного) введения, например, путем инъекции или инфузии. Для внутривенного введения раствор можно вводить как таковой, или его можно инжектировать в баллон для инфузии (содержащий фармацевтически приемлемый эксципиент, такой как 0,9% физиологический раствор или 5% раствор декстрозы) перед введением.
В другом предпочтительном варианте воплощения, фармацевтическая композиция представлена в форме, подходящей для подкожного (п/к) введения.
Фармацевтические лекарственные формы, подходящие для перорального введения, включают таблетки (с покрытием или без покрытия), капсулы (твердые или мягкие оболочки), таблетки в форме капсул, пилюли, лепешки, сиропы, растворы, порошки, гранулы, эликсиры и суспензии, сублингвальные таблетки, облатки или накладки, такие как защечные накладки.
Таким образом, композиции таблеток могут содержать стандартную дозу активного соединения вместе с инертным разбавителем или носителем, таким как a сахар или сахарный спирт, например, лактоза, сахароза, сорбит или маннит; и/или не-сахарный разбавитель, такой как карбонат натрия, фосфат кальция, карбонат кальция или целлюлоза или ее производное, такое как микрокристаллическая целлюлоза (MCC), метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза, и крахмалы, такие как кукурузный крахмал. Таблетки также могут содержать такие стандартные ингредиенты, как связующие и гранулирующие вещества, такие как поливинилпирролидон, разрыхлители (например, набухаемые сшитые полимеры, такие как сшитая карбоксиметилцеллюлоза), смазывающие вещества (например, стеараты), консерванты (например, парабены), антиоксиданты (например, BHT), буферные вещества (например, фосфатные или цитратные буферы) и шипучие вещества, такие как цитратные/бикарбонатные смеси. Такие эксципиенты хорошо известны, и их подробное обсуждение в настоящем описании не является необходимым.
Таблетки могут быть предназначены для высвобождения лекарственного средства либо при контакте с жидкостями желудка (таблетки немедленного высвобождения) или для высвобождения контролируемым образом (таблетки контролируемого высвобождения) в течение продолжительного периода времени или на определенном участке желудочно-кишечного тракта.
Композиции в форме капсул могут быть из твердого желатина или мягкого желатина и могут содержать активный компонент в твердой, полутвердой или жидкой форме. Желатиновые капсулы могут быть из животного желатина или его синтетических или растительных эквивалентов.
Твердые лекарственные формы (например, таблетки, капсулы и т.п.) могут быть с покрытием или без покрытия. Покрытия могут действовать либо как защитная пленка (например, полимер, воск или лак), либо как механизм для контроля высвобождения лекарственного средства, либо для эстетических или идентификационных целей. Покрытие (например, полимер типа Eudragit™) может быть предназначено для высвобождения активного компонента в желаемом месте желудочно-кишечного тракта. Таким образом, покрытие может быть выбрано таким образом, чтобы оно разлагалось в определенных условиях pH в желудочно-кишечном тракте, таким образом, селективно высвобождая соединение в желудке или в подвздошной кишке, двенадцатиперстной кишке, тощей кишке или толстой кишке.
Вместо или помимо покрытия, лекарственное средство может быть представлено в твердой матрице, включающей вещество, контролирующее высвобождение, например, замедляющее высвобождение вещество, которое может быть подходящим для высвобождения соединения контролируемым образом в желудочно-кишечном тракте. Альтернативно, лекарственное средство может быть представлено в полимерном покрытии, например, полиметакрилатном полимерном покрытии, которое может быть подходящим для селективного высвобождения соединения в условиях меняющейся кислотности или щелочности в желудочно-кишечном тракте. Альтернативно, материал матрицы или замедляющее высвобождение покрытие могут представлять собой эродируемый полимер (например, малеиновый ангидрид), который по существу непрерывно эродирует по мере прохождения лекарственной формы через желудочно-кишечный тракт. В другом альтернативном варианте, покрытие может быть предназначено для разложения под действием микронной среды в кишечнике. В качестве следующей альтернативы, активное соединение может быть включено в систему доставки, которая обеспечивает осмотический контроль высвобождения соединения. Композиции для осмотического высвобождения и другого замедленного высвобождения или отсроченного высвобождения (например, композиции на основе ионообменных смол) можно получить в соответствии со способами, хорошо известными специалистам в данной области.
Соединение формулы (I) можно сформулировать с носителем и вводить в форме наночастиц, при этом увеличенная площадь поверхности наночастиц способствует их абсорбции. Кроме того, наночастицы дают возможность непосредственной пенетрации в клетку. Системы доставки лекарственных средств в форме наночастиц описаны в “Nanoparticle Technology for Drug Delivery”, edited by Ram B Gupta and Uday B. Kompella, Informa Healthcare, ISBN 9781574448573, published 13th March 2006. Наночастицы для доставки лекарственных средств также описаны в J. Control. Release, 2003, 91 (1-2), 167-172, и в Sinha et al., Mol. Cancer Ther. August 1, (2006) 5, 1909.
Фармацевтические композиции типично включают от приблизительно 1% (масс/масс) до приблизительно 95% (масс/масс) активного ингредиента и от 99% (масс/масс) до 5% (масс/масс) фармацевтически приемлемого эксципиента или комбинации эксципиентов. Предпочтительно, композиции включают от приблизительно 20% (масс/масс) до приблизительно 90%,% (масс/масс) активного ингредиента и от 80% (масс/масс) до 10% фармацевтически приемлемого эксципиента или комбинации эксципиентов. Фармацевтические композиции включают от приблизительно 1% до приблизительно 95%, предпочтительно от приблизительно 20% до приблизительно 90%, активного ингредиента. Фармацевтические композиции в соответствии с настоящим изобретением может быть, например, в стандартной лекарственной форме, такой как ампулы, флаконы, суппозитории, предварительно заполненные шприцы, драже, таблетки или капсулы.
Фармацевтически приемлемый эксципиент (эксципиенты) можно выбрать в соответствии с желаемой физической формой композиции, и его, например, можно выбрать из разбавителей (например, твердых разбавителей, таких как наполнители или агенты, создающие объем; и жидких разбавителей, таких как растворители и со-растворители), разрыхлителей, буферных веществ, смазывающих веществ, добавок, улучшающих текучесть, контролирующих высвобождение (например, задерживающие или замедляющие высвобождение полимеры или воски) веществ, связующих, агентов гранулирования, пигментов, пластификаторов, антиоксидантов, консервантов, отдушек, вкусовых добавок, регулирующих тоничность веществ и агентов покрытия.
Специалист в данной области должен знать, как выбрать подходящие количества ингредиентов для использования в композиции. Например, таблетки и капсулы типично содержат 0-20% разрыхлителей, 0-5% смазывающих веществ, 0-5% добавок, улучшающих текучесть, и/или 0-99% (масс/масс) наполнителей/или агентов, создающих объем (в зависимости от дозы лекарственного средства). Они могут также содержать 0-10% (масс/масс) полимерных связующих, 0-5% (масс/масс) антиоксидантов, 0-5% (масс/масс) пигментов. Таблетки медленного высвобождения, кроме того, могут содержать 0-99% (масс/масс) контролирующих (например, замедляющих) высвобождение полимеров (в зависимости от дозы). Пленочные покрытия таблеток или капсул типично содержат 0-10% (масс/масс) полимеров, 0-3% (масс/масс) пигментов и/или 0-2% (масс/масс) пластификаторов.
Парентеральные композиции типично содержат 0-20% (масс/масс) буферов, 0-50% (масс/масс) со-растворителей и/или 0-99% (масс/масс) воды для инъекций (WFI) (в зависимости от дозы и в случае лиофилизированной композиции). Композиции для внутримышечных депо-препаратов также могут содержать 0-99% (масс/масс) масел.
Фармацевтические композиции для перорального введения можно получить путем объединения активного ингредиента с твердыми носителями, если желательно, гранулирования полученной смеси и переработки смеси, если это желательно или необходимо, после добавления подходящих эксципиентов, в таблетки, ядра для драже или капсулы. Также возможно их включение в полимерную или восковую матрицу, которая обеспечивает возможность диффузии или высвобождения активных ингредиентов в отмеренных количествах.
Соединения по настоящему изобретению также могут быть сформулированы в виде твердых дисперсий. Твердые дисперсии представляют собой гомогенные чрезвычайно тонкодисперсные фазы двух или более твердых веществ. Твердые растворы (молекулярно дисперсные системы), один тип твердой дисперсии, хорошо известны для использования в фармацевтической технологии (см. (Chiou and Riegelman, J. Pharm. Sci., 60, 1281-1300 (1971)) и являются полезными для повышения скорости растворения и повышения биодоступности плохо растворимых в воде лекарственных средств.
Настоящее изобретение также обеспечивает твердые лекарственные формы, включающие твердый раствор, описанный выше. Твердые лекарственные формы включают таблетки, капсулы, жевательные таблетки и диспергируемые или шипучие таблетки. Известные эксципиенты можно смешать с твердым раствором с получением желаемой лекарственной формы. Например, капсула может содержать твердый раствор, смешанный с (a) разрыхлителем и смазывающим веществом, или (b) разрыхлителем, смазывающим веществом и поверхностно-активным веществом. Кроме того, капсула может содержать агент, создающий объем, такой как лактоза или микрокристаллическая целлюлоза. Таблетка может содержать твердый раствор, смешанный по меньшей мере с одним разрыхлителем, смазывающим веществом, поверхностно-активным веществом, агентом, создающим объем, и агентом скольжения. Жевательная таблетка может содержать твердый раствор, смешанный с агентом, создающим объем, смазывающим веществом и, если желательно, дополнительным подсластителем (таким как искусственный подсластитель) и подходящими отдушками. Твердые растворы также можно получить путем разбрызгивания растворов лекарственного средства и подходящего полимера на поверхность инертных носителей, таких как сахарные шарики ('non-pareils'). Эти шарики затем заключают в капсулы или прессуют в таблетки.
Фармацевтические композиции можно предоставлять пациенту в “упаковках для пациента”, содержащих полный курс лечения в одной упаковке, обычно в блистерной упаковке. Упаковка для пациента имеет преимущество по сравнению с традиционными рецептами, где фармацевт выделяет необходимое для пациента количество фармацевтического препарата из большого количества этого препарата, заключающееся в том, что пациент всегда имеет доступ к вкладышу, содержащемуся в упаковке для пациента, который обычно отсутствует в рецептах, выписываемых пациенту. Было показано, что включение в упаковку вкладыша улучшает соблюдение пациентом предписаний лечащего врача.
Композиции для местного применения и назальной доставки включают мази, кремы, спреи, накладки, гели, жидкие капли и вставки (например, внутриглазные вставки). Такие композиции могут быть сформулированы в соответствии с известными способами.
Примеры композиций для ректального или интравагиального введения включают пессарии и суппозитории, который могут быть получены, например, из формуемого или воскообразного вещества, содержащего активное соединение. Растворы активного соединения также можно использовать для ректального введения.
Композиции для введения путем ингаляции могут быть в форме порошка для ингаляции или жидких или порошкообразных спреев, и их можно вводить в стандартной форме с использованием устройств для ингаляции порошка или устройств для доставки в виде аэрозоля. Такие устройства хорошо известны. Для введения путем ингаляции, порошкообразные композиции типично включают активное соединение вместе с инертным твердым порошкообразным разбавителем, таким как лактоза.
Соединения формулы (I), как правило, могут быть представлены в стандартной лекарственной форме, и, таким образом, они типично будут содержать достаточное количество соединения для обеспечения желаемого уровня биологической активности. Например, композиция может содержать от 1 нанограмма до 2 грамм активного ингредиента, например, от 1 нанограмма до 2 миллиграмм активного ингредиента. В этих пределах, конкретные суб-диапазоны соединения составляют от 0,1 миллиграмм до 2 грамм активного ингредиента (более типично от 10 миллиграмм до 1 грамма, например, от 50 миллиграмм до 500 миллиграмм) или от 1 микрограмма до 20 миллиграмм (например, от 1 микрограмма до 10 миллиграмм, например, от 0,1 миллиграмм до 2 миллиграмм активного ингредиента).
Для пероральных композиций, стандартная единица лекарственной формы может содержать от 1 миллиграмма до 2 грамм, более типично от 10 миллиграмм до 1 грамма, например, от 50 миллиграмм до 1 грамма, например, от 100 миллиграмм до 1 грамма активного соединения.
Активное соединение следует вводить пациенту, нуждающемуся в этом (например, пациенту, которым является человек или животное), в количестве, достаточном для достижения желаемого терапевтического эффекта.
Способы лечения
Соединения формулы (I) и подгруппы, определенные в настоящей заявке, могут быть полезными в профилактике или лечении ряда заболеваний или состояний, опосредованных IAP. Примеры таких заболеваний и состояний описаны выше.
Соединения, как правило, вводят субъекту, нуждающемуся в таком введении, например, пациенту, которым является человек или животное, предпочтительно человеку.
Соединения типично вводят в количествах, которые являются терапевтически или профилактически полезными, и которые, как правило, не являются токсичными. Однако в некоторых ситуациях (например, в случае угрожающего жизни заболевания), преимущества введения соединения формулы (I) могут перевешивать недостатки, связанные с какими-либо токсическими эффектами или побочными эффектами, в этом случае возможно будет желательным введение соединений в количествах, которые ассоциируются с определенной степенью токсичности.
Соединения можно вводить в течение продолжительного периода для поддержания благоприятных терапевтических эффектов, или их можно вводить только в течение короткого периода. Альтернативно, их можно вводить в непрерывном режиме или в режиме, который обеспечивает прерывистое введение (например, пульсирующим образом).
Типичная суточная доза соединения формулы (I) может находиться в пределах от 100 пикограмм до 100 миллиграмм на килограмм массы тела, более типично от 5 нанограмм до 25 миллиграмм на килограмм массы тела, и более типично от 10 нанограмм до 15 миллиграмм на килограмм (например, от 10 нанограмм до 10 миллиграмм, и более типично от 1 микрограмма на килограмм до 20 миллиграмм на килограмм, например, от 1 микрограмма до 10 миллиграмм на килограмм) на килограмм массы тела, хотя можно вводить более высокие или более низкие дозы, когда это необходимо. Соединение формулы (I) можно вводить в ежедневном режиме или в повторяющемся режиме, например, через каждые 2 или 3 или 4 или 5 или 6 или 7 или 10 или 14 или 21 или 28 дней.
Соединения по настоящему изобретению можно вводить перорального при дозах, находящихся в диапазоне, например, от 1 до 1500 мг, от 2 до 800 мг или от 5 до 500 мг, например, от 2 до 200 мг или от 10 до 1000 мг, при этом конкретные примеры доз включают 10, 20, 50 и 80 мг. Соединение можно вводить один раз или более одного раза каждый день. Соединение можно вводить непрерывно (т.е. принимать каждый день, без перерыва, на протяжении всего курса лечения). Альтернативно, соединение можно вводить прерывистым образом (т.е. принимать непрерывно в течение определенного периода, такого как неделя, затем перерыв в течение определенного периода, такого как неделя, и затем принимать непрерывно в течение еще одного периода, такого как неделя, и т.д. на протяжении всего курса лечения). Примеры схем лечения, включающих прерывистое введение, включают схемы, где введение осуществляют циклами, такими как одна неделя введения, одна неделя перерыва; или две недели введения, одна неделя перерыва; или три недели введения, одна неделя перерыва; или две недели введения, две недели перерыва; или четыре недели введения и две недели перерыва; или одна неделя введения и три недели перерыва - для одного или нескольких циклов, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более циклов.
В одной конкретной схеме введения, пациенту вводят инфузию соединения формулы (I) в течение периодов времени один час ежедневно в течение до десяти дней, в частности, до пяти дней в течение одной недели, и лечение повторяют с желаемым интервалом, таким как от двух до четырех недель, в частности, через каждые три недели.
Более конкретно, пациенту можно вводить инфузию соединения формулы (I) в течение одного часа ежедневно в течение 5 дней, и лечение повторяют через каждые три недели.
В другой конкретной схеме введения, пациенту вводят инфузию в течение времени от 30 минут до 1 часа, с последующим поддержанием инфузий различной протяженности, например, от 1 до 5 часов, например, 3 часа.
В следующей конкретной схеме введения, пациенту вводят непрерывную инфузию в течение периода от 12 часов до 5 дней, в частности, непрерывную инфузию от 24 часов до 72 часов.
Однако, в конечном счете, вводимое количество соединения и тип используемой композиции должны быть сопоставимы с природой заболевания или физиологического состояния, подлежащего лечению, и это должен определять лечащий врач.
Было обнаружено, что антагонисты IAP можно использовать как отдельное средство или в комбинации с другими противораковыми средствами. Например, может быть предпочтительным использование антагониста, который индуцирует апоптоз, в комбинации с другим средством, которое действует через другой механизм для регуляции клеточного роста, таким образом, лечить два характерных признака развития рака. Эксперименты с комбинированием можно осуществить, например, как описано в Chou TC, Talalay P. Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors. Adv Enzyme Regulat 1984;22: 27-55.
Соединения, определенные в настоящей заявке, можно вводить как единственное терапевтическое средство, или их можно вводить в виде комбинированной терапии с одним или несколькими другими соединениями (или терапиями) для лечения конкретного болезненного состояния, например, неопластического заболевания, такого как рак, определенного выше в настоящей заявке. Для лечения указанных выше состояний соединения по настоящему изобретению предпочтительно можно использовать в комбинации с одним или несколькими другими лекарственными средствами, более конкретно, с другими противораковыми средствами или адъювантами (поддерживающие средства в терапии) в терапии рака. Примеры других терапевтических средств или лечений, которые можно вводить вместе (либо одновременно, либо с разными интервалами времени) с соединениями формулы (I), включают, но не ограничиваются этим:
• Ингибиторы топоизомеразы I
• Антиметаболиты
• Тубулин-таргетирующие средства
• Ингибиторы ДНК-связующего и топоизомеразы II
• Алкилирующие средства
• Моноклональные Антитела.
• Анти-Гормоны
• Ингибиторы сигнальной трансдукции
• Ингибиторы протеасомы
• ДНК метилтрансферазы
• Цитокины и ретиноиды
• Хроматин-таргетирующие терапии
• Лучевая терапия и
• Другие терапевтические или профилактические средства.
Конкретные примеры противораковых средств или адъювантов (или их солей), включают, но не ограничиваются этим, любое из средств, выбранных из групп (i)-(xlvi) и, необязательно, группы (xlvii), представленных ниже:
(i) Платиновые соединения, например, цисплатин (необязательно в комбинации с амифостином), карбоплатин или оксалиплатин;
(ii) Таксановые соединения, например, паклитаксел, связанные с белком паклитаксела частицы (AbraxaneTM), доцетаксел, кабазитаксел или ларотаксел;
(iii) Ингибиторы топоизомеразы I, например, камптотециновые соединения, например, камптотецин, иринотекан(CPT11), SN-38 или топотекан;
(iv) Ингибиторы топоизомеразы II, например, противоопухолевые эпиподофиллотоксины или производные подофиллотоксинов, например, этопозид или тенипозид;
(v) Алкалоиды барвинка, например, винбластин, винкристин, липосомный винкристин (Onco-TCS), винорелбин, виндезин, винфлунин или винвесир;
(vi) Нуклеозидные производные, например, 5-фторурацил (5-FU, необязательно в комбинации с лейковорином), гемцитабин, капецитабин, тегафур, UFT, S1, кладрибин, цитарабин (Ara-C, цитозин арабинозид), флударабин, клофарабин или неларабин;
(vii) Антиметаболиты, например, клофарабин, аминоптерин или метотрексат, азацитидин, цитарабин, флоксуридин, пентостатин, тиогуанин, тиопурин, 6-меркаптопурин или гидроксимочевина (гидроксикарбамид);
(viii) Алкилирующие средства, такие как азотные иприты или нитрозомочевина, например, циклофосфамид, хлорамбуцил, кармустин (BCNU), бендамустин, тиотепа, мелфалан, треосульфан, ломустин (CCNU), алтретамин, бусульфан, дакарбазин, эстрамустин, фотемустин, ифосфамид (необязательно в комбинаци с месна), пипоброман, прокарбазин, стрептозоцин, темозоломид, урацил, мехлоретамин, метилциклогексилхлорэтилнитрозомочевина или нимустин (ACNU);
(ix) Антрациклины, антрацендионы и родственные лекарственные средства, например, даунорубицин, доксорубицин (необязательно в комбинаци с декстразоксаном), липосомные композиции доксорубицина (например, Caelyx™, Myocet™, Doxil™), идарубицин, митоксантрон, эпирубицин, амсакрин или валрубицин;
(x) Эпотилоны, например, иксабепилон, патупилон, BMS-310705, KOS-862 и ZK-EPO, эпотилон A, эпотилон B, дезоксиэпотилон B (также известный как эпотилон D или KOS-862), аза-эпотилон B (также известный как BMS-247550), аулималид, изолаулималид или луетеробин;
(xi) Ингибиторы ДНК метилтрансферазы, например, темозоломид, азацитидин или децитабин;
(xii) Антифолаты, например, метотрексат, преметрексед динатрий или ралитрексед;
(xiii) Цитотоксичные антибиотики, например, антиномицин D, блеомицин, митомицин C, дактиномицин, карминомицин, дауномицин, левамизол, пликамицин или митрамицин;
(xiv) Тубулин-связывающие средства, например, комбрестатин, колхицины или нокодазол;
(xv) Ингибиторы сигнальной трансдукции, такие как ингибиторы киназы (например, ингибиторы EGFR (рецептор эпителиального ростового фактора), ингибиторы VEGFR (рецептор сосудистого эндотелиального ростового фактора), ингибиторы PDGFR (рецептор тромбоцитарного ростового фактора), ингибиторы MTKI (ингибиторы многоцелевых киназ), ингибиторы Raf, ингибиторы mTOR, например, иматиниб мезилат, эрлотиниб, гефитиниб, дазатиниб, лапатиниб, довотиниб, акситиниб, нилотиниб, вандетаниб, ваталиниб, пазопаниб, сорафениб, сунитиниб, темсиролимус, эверолимус (RAD 001) или вемурафениб (PLX4032/RG7204);
(xvi) Ингибиторы киназы Aurora, например, AT9283, барасертиб (AZD1152), TAK-901, MK0457 (VX680), ценисертиб (R-763), данусертиб (PHA-739358), алисертиб (MLN-8237) или MP-470;
(xvii) Ингибиторы CDK, например, AT7519, росковитин, селициклиб, алвоцидиб (флавопиридол), динациклиб (SCH-727965), 7-гидрокси-стауроспорин (UCN-01), JNJ-7706621, BMS-387032 (также известный под названием SNS-032), PHA533533, PD332991, ZK-304709 или AZD-5438;
(xviii) Ингибиторы PKA/B и ингибиторы PKB (akt) пути, например, AT13148, AZ-5363, Семафор, ингибиторы SF1126 и MTOR, такие как рапамициновые аналоги, AP23841 и AP23573, ингибиторы калмодулина (ингибиторы транслокации вильчатой головки), API-2/TCN (трицирибин), RX-0201, энзастаурин HCl (LY317615), NL-71-101, SR-13668, PX-316 или KRX-0401 (перифосин/NSC 639966);
(xix) Ингибиторы Hsp90, например, AT13387, гербимицин, гелданамицин (GA), 17-аллиламино-17-дезметоксигелданамицин (17-AAG), например, NSC-330507, Kos-953 и CNF-1010, 17-диметиламиноэтиламино-17-деметоксигелданамицин гидрохлорид (17-DMAG), например, NSC-707545 и Kos-1022, NVP-AUY922 (VER-52296), NVP-BEP800, CNF-2024 (BIIB-021 пероральный пурин), ганетеспиб (STA-9090), SNX-5422 (SC-102112) или IPI-504;
(xx) Моноклональные антитела (неконъюгированные или конъюгированные с радиоизотопами, токсинами или другими веществами), производные антител и родственные средства, такие как анти-CD, анти-VEGFR, анти-HER2 или анти-EGFR антитела, например, ритуксимаб (CD20), офатумумаб (CD20), ибритумомаб тиуксетан (CD20), GA101 (CD20), тозитумомаб (CD20), эпратузумаб (CD22), линтузумаб (CD33), гемтузумаб озогамицин (CD33), алемтузумаб (CD52), галиксимаб (CD80), трастузумаб (HER2 антитело), пертузумаб (HER2), трастузумаб-DM1 (HER2), эртумаксомаб (HER2 и CD3), цетуксимаб (EGFR), панитумумаб (EGFR), нецитумумаб (EGFR), нимотузумаб (EGFR), бевацизумаб (VEGF), ипилимумаб (CTLA4), катумаксумаб (EpCAM и CD3), абаговомаб (CA125), фарлетузумаб (рецептор фолата), элотузумаб (CS1), деносумаб (лиганд RANK), фигитумумаб (IGF1R), CP751,871 (IGF1R), мапатумумаб (рецептор TRAIL), metMAB (met), митумомаб (GD3 ганглиозид), наптумомаб эстафенатокс (5T4) или силтуксимаб (IL6);
(xxi) Антагонисты рецептора эстрогена или селективные модуляторы рецептора эстрогена (SERM) или ингибиторы синтеза эстрогена, например, тамоксифен, фулвестрант, торемифен, дролоксифен, фаслодекс или ралоксифен;
(xxii) Ингибиторы ароматазы и родственные лекарственные средства, такие как эксеместан, анастрозол, летразол, тестолактон аминоглутетимид, митотан или ворозол;
(xxiii) Антиандрогены (т.е. антагонисты андрогенового рецептора) и родственные средства, например, бикалутамид, нилутамид, флутамид, ципротерон или кетоконазол;
(xxiv) Гормоны и их аналоги, такие как медроксипрогестерон, диэтилстилбестрол (также известный под названием диэтилстилбестрол) или октреотид;
(xxv) Стероиды, например, дромостанолон пропионат, мегестрол ацетат, нандролон (деканоат, фенпропионат), флуоксиместрон или госсипол,
(xxvi) Стероидный ингибитор цитохром P450 17альфа-гидроксилаза-17,20-лиазы (CYP17), например, абиратерон;
(xxvii) Агонисты или антагонисты гонадотропин-высвобождающего гормона (GnRA), например, абареликс, госерелин ацетат, гистрелин ацетат, леупролид ацетат, трипторелин, бусерелин или деслорелин;
(xxviii) Глюкокортикоиды, например, преднизон, преднизолон, дексаметазон;
(xxix) Дифференцирующие средства, такие как ретиноиды, рексиноиды, витамин D или ретиноевая кислота и средства, блокирующие метаболизм ретиноевой кислоты (RAMBA), например, аккутан, алитретиноин, бексаротен или третиноин;
(xxx) Ингибиторы фарнезилтрансферазы, например, типифарниб;
(xxxi) Хроматин-таргетирующие терапевтические средства, такие как ингибиторы гистондеацетилазы (HDAC), например, бутират натрия, субероиланилид гидроксамид кислота (SAHA), депсипептид (FR 901228), дациностат (NVP-LAQ824), R306465/JNJ-16241199, JNJ-26481585, трихостатин A, вориностат, кламидоцин, A-173, JNJ-MGCD-0103, PXD-101 или апицидин;
(xxxii) Ингибиторы протеасомы, например, бортезомиб, карфилзомиб, CEP-18770, MLN-9708 или ONX-0912;
(xxxiii) Фотодинамические лекарственные средства, например, порфимер натрий или темопорфин;
(xxxiv) Выделенные из морских организмов противораковые средства, такие как трабектидин;
(xxxv) Радиоактивно-меченные лекарственные средства для лучевой иммунотерапии, например, испускающим бета-частицы изотопом (например, Иод-131, Иттрий-90) или испускающим альфа-частицы изотопом (например, Висмут-213 или Актиний-225), например, ибритумомаб или Иод тозитумомаб;
(xxxvi) Ингибиторы теломеразы, например, теломестатин;
(xxxvii) Ингибиторы металлопротеиназы матрикса, например, батимастат, маримастат, приностат или метастат;
(xxxviii) Рекомбинантные интерфероны (такие как интерферон-γ и интерферон-α) и интерлейкины (например, интерлейкин 2), например, альдеслейкин, денилейкин дифтитокс, интерферон альфа 2a, интерферон альфа 2b или пэгинтерферон альфа 2b;
(xxxix) Селективные модуляторы иммунного ответа, например, талидомид или леналидомид;
(xl) Терапевтические вакцины, такие как сипулейсел-T (Provenge) или OncoVex;
(xli) Цитокин-активирующие средства, включающие Пицибанил, Ромуртид, Сизофиран, Вирулизин или Тимозин;
(xlii) Триоксид мышьяка;
(xliii) Ингибиторы связанных с G-белком рецепторов (GPCR), например, антрасентан;
(xliv) Ферменты, такие как L-аспарагиназа, пегаспаргаза, расбуриказа или пегамедаза;
(xlv) Ингибиторы репарации ДНК, такие как ингибиторы PARP, например, олапариб, велапариб, инипариб, INO-1001, AG-014699 или ONO-2231;
(xlvi) Агонисты рецептора апоптоза (например, рецептора TNF-связанного апоптоз-индуцирующего лиганда (TRAIL)), такие как мапатумумаб (прежнее название HGS-ETR1), конатумумаб (прежнее название AMG 655), PRO95780, лексатумумаб, дуланермин, CS-1008, апомаб или рекомбинантные TRAIL лиганды, такие как рекомбинантные человеческий TRAIL/Apo2 лиганд;
(xlvii) Профилактические средства (вспомогательные средства); т.е. средства, которые снижают или облегчают некоторые из побочных эффектов, ассоциированных с химиотерапевтическими средствами, например,
- противорвотные средства,
- средства, которые предотвращают или уменьшают длительность химиотерапия-ассоциированной нейтропении и предотвращают осложнения, которые возникают в результате пониженных уровней тромбоцитов, эритроцитов или лейкоцитов, например, интерлейкин-11 (например, опрелвекин), эритропоэтин (EPO) и их аналоги (например, дарбепоэтин альфа), аналоги колониестимулирующего фактора, такие как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (например, саргамостим) и гранулоцитарный колониестимулирующий фактор (G-CSF) и их аналоги (например, филграстим, пэгфилграстим),
- средства, которые ингибируют резорбцию кости, такие как денозумаб или бисфосфонаты, например, золедронат, золедроновая кислота, памидронат и ибандронат,
- средства, которые подавляют воспалительные ответы, такие как дексаметазон, преднизон и преднизолон,
- средства, используемые для снижения уровней гормона роста и IGF-I (и других гормонов) в крови пациентов с акромегалией или другими редкими гормон-продуцирующими опухолями, такие как синтетические формы гормона соматостатина, например, октреотид ацетат,
- антидоты к лекарственным средствам, которые снижают уровни фолиевой кислоты, такие как лейковорин или фолиновая кислота,
- средства от боли, например, опиаты, такие как морфин, диаморфин и фентанил,
- не-стероидные противовоспалительные лекарственные средства (НСПВЛС), такие как ингибиторы COX-2, например, целекоксиб, эторикоксиб и лумиракоксиб,
- средства от воспаления слизистой оболочки, например, палифермин,
- средства для лечения побочных эффектов, включая анорексию, кахексию, отек или тромбоэмболические случаи, такие как мегестрол ацетат.
Каждое из соединений, присутствующих в комбинациях по настоящему изобретению, можно вводить по индивидуально изменяемым схемам введения и различными путями. Таким образом, введение доз каждого из двух или более средств может отличаться: каждое средство можно вводить в одно и то же или в разное время. Специалист в данной области сможет определить, на основании его или ее общих знаний, схемы введения и комбинированные терапии для применения. Например, соединение по настоящему изобретению можно использовать в комбинации с одним или несколькими другими средствами, которые вводят в соответствии с их существующей схемой комбинирования. Примеры стандартных схем комбинирования представлены ниже.
Таксановое соединение предпочтительно вводят при дозе 50-400 мг на квадратный метр (мг/м2) площади поверхности тела, например, 75-250 мг/м2, в частности, для паклитаксела - при дозе около 175-250 мг/м2, и для доцетаксела - около 75-150 мг/м2 на курс лечения.
Камптотециновое соединение предпочтительно вводят при дозе 0,1-400 мг на квадратный метр (мг/м2) площади поверхности тела, например, от 1 до 300 мг/м2, в частности, для иринотекана - при дозе около 100-350 мг/м2 и для топотекана - около 1-2 мг/м2 на курс лечения.
Противоопухолевое подофиллотоксиновое производное предпочтительно вводят при дозе 30-300 мг на квадратный метр (мг/м2) площади поверхности тела, например, 50-250 мг/м2, в частности, для этопозида - при дозе около 35-100 мг/м2 и для тенипозида - около 50-250 мг/м2 на курс лечения.
Противоопухолевый алкалоид барвинка предпочтительно вводят при дозе от 2 до 30 мг на квадратный метр (мг/м2) площади поверхности тела, в частности, для винбластина - при дозе около от 3 до 12 мг/м2, для винкристина - при дозе около от 1 до 2 мг/м2 и для винорелбина - при дозе около 10-30 мг/м2 на курс лечения.
Противоопухолевое нуклеозидное производное предпочтительно вводят при дозе 200-2500 мг на квадратный метр (мг/м2) площади поверхности тела, например, 700-1500 мг/м2, в частности, для 5-FU - при дозе 200-500 мг/м2, для гемцитабина - при дозе около 800-1200 мг/м2 и для капецитабина - около 1000-2500 мг/м2 на курс лечения.
Алкилирующирующие средства, такие как азотный иприт или нитрозомочевина, предпочтительно вводят при дозе 100-500 мг на квадратный метр (мг/м2) площади поверхности тела, например, 120-200 мг/м2, в частности, для циклофосфамида - при дозе около 100-500 мг/м2, для хлорамбуцила - при дозе около 0,1-0,2 мг/кг, для кармустина - при дозе около 150-200 мг/м2 и для ломустина - при дозе около 100-150 мг/м2 на курс лечения.
Противоопухолевое антрациклиновое производное предпочтительно вводят при дозе 10-75 мг на квадратный метр (мг/м2) площади поверхности тела, например, 15-60 мг/м2, в частности, для доксорубицина - при дозе около 40-75 мг/м2, для даунорубицина - при дозе около 25-45мг/м2 и для идарубицина - при дозе около 10-15 мг/м2 на курс лечения.
Антиэстрогеновое средство предпочтительно вводят при дозе около 1-100 мг ежедневно, в зависимости от конкретного средства и состояния, подлежащего лечению. Тамоксифен предпочтительно вводят перорального при дозе от 5 до 50 мг, предпочтительно от 10 до 20 мг два раза в день, продолжая лечения в течение времени, достаточного для достижения и поддержания терапевтического эффекта. Торемифен предпочтительно вводят перорально при дозе около 60 мг один раз в день, продолжая лечение в течение времени, достаточного для достижения и поддержания терапевтического эффекта. Анастрозол предпочтительно вводят перорально при дозе около 1 мг один раз в день. Дролоксифен предпочтительно вводят перорально при дозе около 20-100 мг один раз в день. Ралоксифен предпочтительно вводят перорально при дозе около 60 мг один раз в день. Эксеместан предпочтительно вводят перорально при дозе около 25 мг один раз в день.
Антитела предпочтительно вводят при дозе около 1-5 мг на квадратный метр (мг/м2) площади поверхности тела, или как это известно из уровня техники в случае, если используют другие дозы. Трастузумаб предпочтительно вводят при дозе от 1 до 5 мг на квадратный метр (мг/м2) площади поверхности тела, в частности, от 2 до 4 мг/м2 на курс лечения.
Когда соединение формулы (I) вводят в виде комбинированной терапии с одним, двумя, тремя, четырьмя или более другими терапевтическими средствами (предпочтительно одним или двумя, более предпочтительно одним), соединения можно вводить одновременно или последовательно. В последнем случае, два или более соединений можно вводить в течение периода и в количестве и способом, которые являются достаточными для обеспечения достижения предпочтительного или синергического эффекта. Когда средства вводят последовательно, их можно вводить через очень небольшие промежутки времени (например, через 5-10 минут) или через более длительные промежутки времени (например, с промежутком 1, 2, 3, 4 или более часов, или даже с еще большими промежутками, когда это необходимо), при этом точный режим дозирования должен соотноситься со свойствами терапевтического средства (средств). Эти дозы можно вводить например, один раз, два раза или более на курс лечения, который можно повторять, например, через каждые 7, 14, 21 или 28 дней.
Должно быть понятно, что предпочтительный способ и порядок введения и соответствующие вводимые количества и схемы введения для каждого компонента комбинации зависят от конкретного другого лекарственного средства и соединения по настоящему изобретению, которые вводят, пути их введения, конкретной опухоли, подлежащей лечению, и конкретного хозяина, подлежащего лечению. Оптимальный способ и порядок введения, и соответствующие вводимые количества и схему введения легко сможет определить специалист в данной области с использованием традиционных способов и в свете информации, представленной в настоящей заявке.
Массовое отношение соединения в соответствии с настоящим изобретением и одного или нескольких других противораковых средств, когда их используют в комбинации, может определить специалист в данной области. Указанное отношение и точная доза и частота введения зависят от конкретного соединения в соответствии с настоящим изобретением и другого используемого противоракового средства (средств), конкретного состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста, массы тела, полу, режима питания, времени введения и общего физического состояния конкретного пациента, пути введения, а также другого лечения, которое может принимать субъект, как это хорошо известно специалистам в данной области. Кроме того, очевидно, что эффективное ежедневное количество можно уменьшить или увеличить в зависимости от ответа принимающего лечение субъекта и/или в зависимости от оценки лечащего врача, предписывающего соединения по настоящему изобретению. Конкретное массовое отношение для соединения формулы (I) по настоящему изобретению и другого противоракового средства может составлять от 1/10 до 10/1, более конкретно от 1/5 до 5/1, еще более конкретно от 1/3 до 3/1.
Соединения по настоящему изобретению также можно вводить в вместе с не-химиотерапевтическими лечениями, такими как лучевая терапия, фотодинамическая терапия, генная терапия; хирургическая операция и контролируемые диеты.
Соединения по настоящему изобретению также имеют терапевтические применения для сенсибилизации опухолевых клеток для лучевой терапии и химиотерапии. Следовательно, соединения по настоящему изобретению можно использовать в качестве «радиосенсибилизатора» и/или “хемосенсибилизатора”, или их можно вводить в комбинации с другим «радиосенсибилизатором» и/или “хемосенсибилизатором”. В одном варианте воплощения, соединение по настоящему изобретению предназначено для использования в качестве хемосенсибилизатора.
Термин «радиосенсибилизатор» определяется как молекула, которую вводят пациентам в терапевтически эффективных количествах для усиления чувствительности клеток к ионизирующему облучению и/или для промотирования лечения заболеваний, которые можно лечить при помощи ионизирующего облучения.
Термин “хемосенсибилизатор” определяется как молекула, которую вводят пациентам в терапевтически эффективных количествах для усиления чувствительности клеток к химиотерапии и/или для промотирования лечения заболеваний, которые можно лечить при помощи химиотерапевтических средств.
Многие протоколы лечения рака в настоящее время используют радиосенсибилизаторы вместе с рентгеновским облучением. Примеры активируемых рентгеновскими лучами радиосенсибилизаторов включают, но не ограничиваются этим, следующие: метронидазол, мизонидазол, десметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин C, RSU 1069, SR 4233, EO9, RB 6145, никотинамид, 5-бромдезоксиуридин (BUdR), 5-иоддезоксиуридин (IUdR), бромдезоксицитидин, фтордезоксиуридин (FudR), гидроксимочевина, цисплатин и их терапевтически эффективные аналоги и производные.
Фотодинамическая терапия (PDT) раковых заболеваний использует видимый свет в качестве радиационного активатора сенсибилизирующего средства. Примеры фотодинамических радиосенсибилизаторов включают, но не ограничиваются этим, следующие: гематопорфириновые производные, Фотофрин, бензопорфириновые производные, олово этиопорфирин, феоборбид-a, бактериохлорофилл-a, нафталоцианины, фталоцианины, цинк фталонцианин и их терапевтически эффективные аналоги и производные.
Радиосенсибилизаторы можно вводить вместе с терапевтически эффективным количеством одного или нескольких других соединений, включая, но не ограничиваясь этим: соединения, которые промотируют включения радиосенсибилизаторов в клетки-мишени; соединения, которые контролируют приток терапевтических средств, питательных веществ и/или кислорода в клетки-мишени; химиотерапевтические средства, которые действуют на опухоль с или без дополнительного облучения; или другие терапевтически эффективные соединения для лечения рака или других заболеваний.
Хемосенсибилизаторы можно вводить вместе с терапевтически эффективным количеством одного или нескольких других соединений, включая, но не ограничиваясь этим: соединения, которые промотируют включения хемосенсибилизаторов в клетки-мишени; соединения, которые контролируют приток терапевтических средств, питательных веществ и/или кислорода в клетки-мишени; химиотерапевтические средства, которые действуют на опухоль, или другие терапевтически эффективные соединения для лечения рака или других заболеваний. Было обнаружено, что антагонисты кальция, например, верапамил, являются полезными в комбинации с противоопухолевыми средствами до установления хемочувствительности в опухолевых клетках, резистентных к общепринятым химиотерапевтическим средствам, и для повышения эффективности таких соединений в чувствительных к лекарственному средству злокачественных опухолях.
Для использования в комбинированной терапии с другим химиотерапевтическим средством, соединение формулы (I) и одно, два, три, четыре или более других терапевтических средств можно, например, сформулировать вместе в лекарственную форму, содержащую два, три, четыре или более терапевтических средств, т.е. в единую фармацевтическую композицию, содержащую все компоненты. В альтернативном варианте воплощения, индивидуальные терапевтические средства могут быть сформулированы отдельно и представлены вместе в виде набора, необязательно с инструкциями для их применения.
В одном варианте воплощения, обеспечивается комбинация соединения формулы (I) с одним или несколькими (например, 1 или 2) другими терапевтическими средствами (например, противораковыми средствами, описанными выше).
В другом варианте воплощения, обеспечивается соединение формулы (I) в комбинации с одним или несколькими (например, 1 или 2) другими терапевтическими средствами (например, противораковыми средствами) для применения в терапии, например, для профилактики или лечения рака.
В одном варианте воплощения, фармацевтическая композиция включает соединение формулы (I) вместе с фармацевтически приемлемым носителем и, необязательно, одно или несколько терапевтических средств.
В другом варианте воплощения, настоящее изобретение относится к применению комбинации в соответствии с настоящим изобретением для получения фармацевтической композиции для ингибирования роста опухолевых клеток.
В следующем варианте воплощения, настоящее изобретение относится к продукту, содержащему соединение формулы (I) и одно или несколько противораковых средств, в виде комбинированного препарата для одновременного, раздельного или последовательного применения для лечения пациентов, страдающих от рака.
ПРИМЕРЫ
Настоящее изобретение далее будет проиллюстрировано, но не ограничено, посредством ссылки на конкретные варианты воплощения, описанные в следующих примерах. Соединения названы с использованием пакета программ автоматического наименования, такого как AutoNom (MDL), или названы как у поставщика химических соединений.
Следующих процедуры синтеза представлены для иллюстрации используемых способов; для конкретного получения или стадии используемый предшественник необязательно может происходить из единственной партии, синтезированной в соответствии со стадией, представленной в описании. В примерах используют следующие аббревиатуры.
SiO2
диоксид кремния
ЯМР данные: Если не указано, 1H-ЯМР спектры записывали при 25°C на спектрометре Bruker Avance I, работающем при 400 МГц. Данные обрабатывали и анализировали с использованием программы Topspin 2.1. Для ЯМР данных, где количество приписанных протонов меньше чем теоретическое количество протонов в молекуле, предполагается, что очевидно отсутствующий сигнал (сигналы) скрыты пиками растворителя и/или воды. Кроме того, в случае спектров, полученных в протонных ЯМР растворителях, происходит обмен NH и/или OH протонов с растворителем, и, следовательно, такие сигналы обычно не наблюдаются.
ИК данные: ИК спектры регистрировали с использованием ИК спектрометра Bruker Альфа P.
Системы аналитической и препаративной LC-MS
Описание системы и способа аналитической LC-MS
В следующих примерах соединения охарактеризованы методом масс-спектроскопии с использованием систем и рабочих условий, описанных ниже. Когда присутствуют атомы с различными изотопами и указана только одна масса, масса, указанная для соединения, представляет собой моноизотопную массу (т.е. 35Cl; 79Br и т.п.).
Waters Platform LC-MS система:
• Platform MS условия:
Электроспрей Отрицательный или
Электроспрей Положительный & Отрицательный
Waters FractiOnlynx LC-MS система:
• FractiOnlynx MS условия:
Agilent 1200SL-6140 LC-MS система - RAPID:
• Agilent MS условия:
Описание системы и способа препаративной LC-MS
Препаративная LC-MS представляет собой стандартный и эффективный способ, используемый для очистки малых органических молекул, таких как соединения, описанные в настоящей заявке. Способы жидкостной хроматографии (LC) и масс-спектрометрии (MS) могут варьироваться для получения лучшего разделения неочищенных веществ и улучшения детекции образцов при помощи MS. Оптимизация препаративного градиентного способа LC включает использование различных колонок, летучих элюентов и модификаторов, и градиентов. Способы оптимизации методов препаративной LC-MS хорошо известны из уровня техники, и их можно использовать для очистки соединений. Такие способы описаны в Rosentreter U, Huber U.; Optimal fraction collecting in preparative LC/MS; J Comb Chem.; 2004; 6(2), 159-64, и в Leister W, Strauss K, Wisnoski д, Zhao Z, Lindsley C., Development of a custom high-throughput preparative liquid chromatography/mass spectometer platform for the preparative purification and analytical analysis of compound libraries; J Comb Chem.; 2003; 5(3); 322-9.
Некоторые системы для очистки соединений при помощи препаративной LC-MS описаны ниже, хотя специалистам в данной области должно быть понятно, что можно использовать системы и способы альтернативные тем, которые описаны. На основании информации, представленной в настоящей заявке, или используя альтернативные хроматографические системы, специалист в данной области сможет осуществить очистку соединений, описанных в настоящей заявке, с использованием препаративной LC-MS.
Waters FractiOnlynx система:
•Оборудование:
2767 Автоматический пробоотборник с двойной петлей/Коллектор фракций
2525 препаративный насос
CFO (устройство, контролирующее поток жидкости в колонке) для выбора колонки
RMA (управляющее устройство Waters для подачи реагентов) в виде встроенного в систему насоса
Waters ZQ Масс-спектрометр
Waters 2996 фотодиодный матричный детектор
Waters ZQ Масс-спектрометр
• Условия работы Waters MS:
Препаративная система Agilent 1100 LC-MS:
• Оборудование:
Автоматический пробоотборник: 1100 серии “prepALS”
Насос: 1100 серии “PrepPump” для препаративного градиента потока, и 1100 серии “QuatPump” для подачи модификатора в препаративном потоке
УФ детектор: 1100 серии “MWD” мульти-длинноволновой детектор
MS детектор: 1100 серии “LC-MSD VL”
Коллектор фракций: 2דPrep-FC”
Встроенный в систему насос: “Waters RMA”
Активный расщепитель Agilent
• Условия работы Agilent MS:
• Колонки:
Ряд коммерчески доступных колонок - как ахиральных, так и хиральных - можно использовать таким образом, чтобы они, вместе с изменениями подвижной фвазы, органического модификатора и pH, могли обеспечить наибольший охват с точки зрения широкого диапазона селективности. Все колонки использовали в соответствии с рекомендованными изготовителем рабочими условиями. Типично, использовали колонки с размером частиц 5 микрон, если это было возможно. Например, колонки от компании Waters (включая, но не ограничиваясь этим, XBridge™ Prep OBD™ C18 и Phenyl, Atlantis® Prep T3 OBD™ и Sunfire™ Prep OBD C18 5 мкм 19×100 мм), Phenomenex (включая, но не ограничиваясь этим, Synergy MAX-RP и LUX™ Cellulose-2), Astec (Chirobiotic™ колонки, включая, но не ограничиваясь этим, V, V2 и T2) и Diacel® (включая, но не ограничиваясь этим, Chiralpak® AD-H) были доступны для скрининга.
• Элюенты:
Элюент для подвижной фазы выбирали в связи с рекомендованными изготовителем колонки ограничениями стационарной фазы в целях оптимизации работы разделительных колонок.
• Методы:
Ахиральная препаративная хроматография
Соединения, описанные в качестве примеров, подвергали ВЭЖХ очистке, где это указано, с использованием способов, которые были разработаны в соответствии с рекомендациями, как описано в Snyder L. R., Dolan J. W., High-Performance Gradient Elution The Practical Application of the Linear-Solvent-Strength Model, Wiley, Hoboken, 2007.
Хиральная препаративная хроматография
Препаративные разделения с использованием хиральных стационарных фаз (CSP) представляют собой естественный способ, предназначенный для разделения энантиомерных смесей. Аналогичным образом, его можно использовать для разделения диастереомеров и ахиральных молекул. Из уровня техники хорошо известны способы для оптимизации препаративных хиральных разделений на CSP, и их можно использовать для очистки соединений. Такие способы описаны в Beesley T. E., Scott R.P.W.; Chiral Chromatography; Wiley, Chichester, 1998.
Получение 1: 2-Хлор-1-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)этанон
Гидразингидрохлорид (5,0 г, 28 ммоль) и изобутиральдегид (2,56 мл, 28 ммоль) в ледяной уксусной кислоте (93 мл) нагревали до 60°C в течение 3 часов. Реакционную смесь охлаждали на бане с ледяной водой и разбавляли 1,2-дихлорэтаном (93 мл). Добавляли по порциям NaBH(OAc)3 (3,96 г, 18,7 ммоль) в течение 15 минут и реакционную смесь оставляли для перемешивания в течение 30 минут. Растворитель удаляли в вакууме и остаток разбавляли при помощи EtOAc (200 мл) и насыщенного раствора карбоната натрия (200 мл). Смесь экстрагировали при помощи EtOAc (200 мл) и объединенные органические слои промывали насыщенным солевым раствором (400 мл), сушили над сульфатом натрия, фильтровали и растворитель выпаривали в вакууме. Хроматография на силикагеле (градиентное элюирование, 0-0% 0-50%, EtOAc/петролейный эфир) давала (2,65 г) в виде желтого масла (смесь 4 и 6-хлор изомеров). Смесь (2,65 г, 14,6 ммоль) растворяли в Et2O (73 мл) охлаждали до -20°C (ацетон/сухой лед). Добавляли пиридин (1,18 мл, 14,6 ммоль) и бромацетилхлорид (1,46 мл, 17,5 ммоль). Реакционной смеси давали осторожно нагреться до температуры окружающей среды в течение 18 часов. Добавляли воду (50 мл) и органический слой отделяли и оставшуюся водную фазу экстрагировали при помощи Et2O (2×60 мл). Объединенные органические экстракты сушили над сульфатом натрия и фильтровали. Неочищенное масло очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-30% EtOAc/петролейный эфир), с получением указанного в заголовке соединения (353 мг, 26%) в виде красного/ярко-розового твердого вещества. 1H-ЯМР (Me-d3-OD): 8,11 (1H, дд), 7,22 (1H, д), 7,16-7,06 (1H, м), 4,39 (1H, с), 4,13 (1H, с), 4,00 (2H, д), 1,38 (6H, д).
Получение 2: Метиловый эфир (R)-2-((S)-2-бензилоксикарбониламино-3-гидроксипропиониламино)пропионовой кислоты
Диизопропилэтиламин (375 мл) добавляли по каплям к охлажденной смеси метилового эфира (R)-2-аминопропионовой кислоты гидрохлорида (100 г, 0,716 моль), EDC (165 г, 0,86 моль), карбобензилокси-L-серина (171,4 г, 0,716 моль) и DCM (3,6 л). Полученную смесь перемешивали в атмосфере азота при температуре окружающей среды в течение 16 часов. После удаления растворителя в вакууме при 40°C, остаток разбавляли насыщенным раствором карбоната натрия (1 л), водой (1 л) и экстрагировали при помощи EtOAc (2 л, 2×1 л). Объединенные органические фазы промывали раствором 2 M хлористоводородной кислоты (1 л), насыщенным солевым раствором (1 л), сушили над сульфатом магния и концентрировали в вакууме при 40°C, с получением указанного в заголовке соединения (172 г) в виде бесцветного твердого вещества. 1H-ЯМР (Me-d3-OD): 7,44-7,28 (6H, м), 5,13 (2H, с), 4,46 (1H, д), 4,43 (1H, д), 4,25 (1H, т), 3,82-3,68 (5H, м), 1,39 (3H, д).
Получение 3: (3S,6R)-3-Гидроксиметил-6-метилпиперазин-2,5-дион
К метиловому эфиру (R)-2-((S)-2-бензилоксикарбониламино-3-гидроксипропиониламино)пропионовой кислоты (172 г, 0,53 моль) добавляли 10% Pd/C (8,6 г), MeOH (530 мл) и циклогексен (344 мл) в атмосфере азота. Смесь нагревали до температуры кипения с обратным холодильником в течение 17 часов. Добавляли MeOH (500 мл) и кипячение с обратным холодильником продолжали в течение 1 часа. Горячую реакционную смесь фильтровали через слой целита, промывая лепешку горячим MeOH (2×500 мл). Объединенные фильтраты концентрировали. Полученное твердое вещество суспендировали в 2-бутаноне (400 мл) и добавляли петролейный эфир (400 мл) постепенно в течение 10 минут. После перемешивания в течение 30 минут, твердые вещества фильтровали, лепешку промывали смесью 2:1 петролейный эфир/2-бутанон (300 мл). Фильтровальную лепешку сушили в вакууме при 40°C, с получением указанного в заголовке соединения (68,3 г) в виде не совсем белого твердого вещества. 1H-ЯМР (ДМСО-d6): 8,08 (1H, с), 7,90 (1H, с), 5,11 (1H, т), 3,92 (1H, кв.), 3,80-3,71 (1H, м), 3,71-3,60 (1H, м), 3,58-3,47 (1H, м), 1,24 (3H, д).
Получение 4: ((2R,5R)-5-Метилпиперазин-2-ил)-метанол гидрохлорид
К (3S,6R)-3-гидроксиметил-6-метилпиперазин-2,5-диону (34 г, 0,215 моль) добавляли раствор борана в ТГФ (1 M, 1,6 л, 1,6 моль) и смесь нагревали до 70°C в течение 18 часов. Раствор охлаждали на льду, затем постепенно добавляли MeOH (425 мл), с последующим добавлением 5 M хлористоводородной кислоты (113 мл). Смесь нагревали до 70°C в течение 2 часов и затем охлаждали до температуры окружающей среды. Полученное твердое вещество фильтровали, лепешку промывали при помощи ТГФ (200 мл) и сушили в вакууме при 40°C, с получением указанного в заголовке соединения (39,3 г) в виде бесцветного твердого вещества. 1H-ЯМР (ДМСО-d6): 9,79 (3H, с), 5,59 (1H, с), 3,76-3,40 (5H, м), 3,19-2,94 (2H, м), 1,28 (3H, д).
Получение 5: трет-Бутиловый эфир (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
К пиперазин дигидрохлориду (20 г, 119 ммоль) в MeOH (96 мл) при 0°C (ледяная баня) добавляли триэтиламин (48,7 мл, 357 ммоль). Добавляли трет-бутилдикарбонат (61 г, 280 ммоль) в MeOH (145 мл) в течение 30 минут. Температуру реакции поддерживали при <10°C в течение 1 часа, нагревали до температуры окружающей среды в течение 1 часа и затем нагревали до 50°C в течение 18 часов. Реакционную смесь концентрировали и остаток растворяли в этаноле (397 мл). Добавляли раствор NaOH (23,8 г, 595 ммоль) в воде (397 мл) и реакционную смесь нагревали до 100°C в течение 18 часов, затем охлаждали до температуры окружающей среды. Смесь нейтрализовали при помощи 1M HCl (~300 мл) до pH 9 (с использованием измерителя кислотности), затем экстрагировали хлороформом (3×700 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растворяли в MeOH и концентрировали, затем сушили в вакууме при 40°C, с получением указанного в заголовке соединения (21 г, 75%) в виде бесцветного твердого вещества. 1H-ЯМР (Me-d3-OD): 4,20-4,07 (1H, м), 3,79 (1H, дд), 3,71-3,58 (2H, м), 3,54 (1H, дд), 3,24 (1H, дд), 3,18-3,01 (1H, м), 3,01-2,89 (1H, м), 2,55 (1H, дд), 1,48 (9H, с), 1,25 (3H, с).
Получение 6: трет-Бутиловый эфир (2R,5R)-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
К 2-хлор-1-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-этанону (397 мг, 1,31 ммоль) в безводном ТГФ (1,23 мл) добавляли триэтиламин (366 мкл, 2,60 ммоль) и раствор трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (380 мг, 1,6 ммоль) в безводном ТГФ (730 мкл). Реакционную смесь нагревали до 65°C в течение 3 часов, охлаждали до температуры окружающей среды и растворитель удаляли в вакууме. Остаток очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-80%, EtOAc/петролейный эфир), с получением указанного в заголовке соединения (447 мг, 75%) в виде бесцветного твердого вещества. 1H-ЯМР (Me-d3-OD): 8,15 (1H, д), 7,20 (1H, д), 7,09 (1H, дд), 5,51 (2H, с), 4,23-4,13 (1H, м), 4,09-3,96 (3H, м), 3,81-3,65 (2H, м), 3,64-3,47 (2H, м), 2,97-2,82 (2H, м), 2,67 (1H, дд), 1,48 (9H, с), 1,37 (6H, с), 1,26-1,22 (3H, м).
Получение 7: трет-Бутиловый эфир (2R,5R)-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
К охлажденному раствору трет-бутилового эфира (2R,5R)-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (100 мг, 0,22 ммоль) в DMF (1,1 мл) при 0°C (ледяная баня) добавляли гидрид натрия (60%, 10 мг, 0,24 ммоль). После перемешивания в течение 1 часа, добавляли метилиодид (15 мкл, 0,24 ммоль) и реакционную смесь перемешивали в течение 30 минут. Реакционной смеси давали осторожно нагреться до температуры окружающей среды в течение 18 часов. Растворитель удаляли в вакууме и остаток очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир), с получением указанного в заголовке соединения (20 мг, 19%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 8,14 (1H, с), 7,27-7,13 (1H, м), 7,09 (1H, дд), 4,19 (1H, дд), 4,13-3,84 (3H, м), 3,78-3,44 (3H, м), 3,44-3,38 (1H, м), 3,36 (3H, с), 3,29 (1H, д), 3,07-2,94 (1H, м), 2,94-2,81 (1H, м), 2,66 (1H, дд), 1,48 (9H, с), 1,37 (6H, с), 1,34-1,20 (3H, м).
Получение 8: трет-Бутиловый эфир (2R,5R)-5-азидометил-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5R)-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (175 мг, 0,39 ммоль) растворяли в безводном DCM (3,87 мл) и охлаждали на ледяной бане. Добавляли триэтиламин (0,27 мл, 1,94 ммоль) с последующим добавлением толуол-4-сульфонилхлорида (148 мг, 0,77 ммоль). Реакционную смесь перемешивали в течение 1 часа при 0°C (ледяная баня) и осторожно нагревали до температуры окружающей среды в течение 18 часов. Растворитель удаляли в вакууме и остаток очищали колоночной хроматографией на силикагеле (0-50%, EtOAc/петролейный эфир). Продукт (117 мг, 0,25 ммоль) растворяли в DMF (2,5 мл) и добавляли азид натрия (24 мг, 0,37 ммоль). Реакционную смесь нагревали до 65°C в течение 18 часов, затем охлаждали до температуры окружающей среды и растворитель удаляли в вакууме. Остаток суспендировали в Et2O, фильтровали и фильтрат упаривали в вакууме. Полученное масло очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-75%, EtOAc/петролейный эфир), с получением указанного в заголовке соединения (81 мг, 44%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 8,14 (1H, д), 7,21 (1H, д), 7,09 (1H, дд), 4,26-4,15 (1H, м), 4,10-3,97 (3H, м), 3,76-3,46 (3H, м), 3,46-3,36 (1H, м), 3,05-2,91 (1H, м), 2,85 (1H, дд), 2,70 (1H, дд), 1,50 (9H, с), 1,38 (6H, с), 1,24 (3H, д).
Получение 9: трет-Бутиловый эфир (2R,5S)-5-(ацетиламинометил)-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5R)-5-азидометил-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (81 мг, 0,17 ммоль) растворяли в тиоуксусной кислоте (459 мкл) и оставляли для перемешивания в течение 18,5 часов, затем концентрировали. Неочищенное масло очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100%, EtOAc/петролейный эфир) с получением указанного в заголовке соединения (47 мг, 56%) в виде бесцветного твердого вещества. 1H-ЯМР (Me-d3-OD): 8,15 (1H, д), 7,21 (1H, д), 7,09 (1H, дд), 4,24-4,14 (1H, м), 4,06-3,96 (2H, м), 3,84 (1H, д), 3,71 (1H, д), 3,56 (1H, д), 3,48-3,40 (1H, м), 3,25-3,13 (1H, м), 3,04-2,96 (1H, м), 2,92 (1H, дд), 2,65 (1H, дд), 1,97 (3H, с), 1,49 (9H, с), 1,38 (6H, с), 1,32-1,19 (3H, м).
Получение 10: (2R,5R)-2-Гидроксиметил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир
К трет-бутиловому эфиру (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (21 г, 90 ммоль) в ТГФ (210 мл) при 3-4°C (ледяная баня) добавляли 1 M водный раствор NaOH (99,5 мл) и бензилхлорформиат (12,9 мл, 90,43 ммоль). После перемешивания в течение 1 часа при указанной температуре, смесь оставляли для перемешивания еще в течение 1 часа и затем нагревали до комнатной температуры. Органический слой отделяли и водную фазу экстрагировали при помощи EtOAc (2×50 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (150 мл), затем сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенное масло очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100%, EtOAc/петролейный эфир), с получением указанного в заголовке соединения (26 г) в виде бледно-желтого масла, которое использовали непосредственно в Получении 11. 1H-ЯМР (Me-d3-OD): 7,47-7,15 (5H, м), 5,26-5,07 (2H, м), 4,25 (2H, с), 4,04-3,88 (1H, м), 3,83 (1H, д), 3,61 (2H, шир. с), 3,31-3,09 (2H, м), 1,48 (9H, с), 1,14 (3H, т).
Получение 11: (2R,5R)-2-Метоксиметил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир
(2R,5R)-2-Гидроксиметил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир (25 г, 68 ммоль) в DCM (823 мл) охлаждали до 4°C (ледяная баня). Добавляли 1,8-бис(диметиламино)нафталин (72 г, 337 ммоль) одной порцией, с последующим добавлением триметилтетрафторбората оксония (50 г, 337 ммоль) по порциям в течение 5 минут. Смесь перемешивали в течение 35 минут при 5°C, ледяную баню удаляли, затем нагревали от 5 до 17°C в течение 1 часа. После перемешивания еще в течение 20 минут медленно добавляли насыщенный водный раствор хлорида аммония (300 мл), и реакционную смесь перемешивали в течение 10 минут. Органический слой отделяли и водную фазу экстрагировали при помощи DCM (2×300 мл). Объединенные органические экстракты промывали 1,0 M раствором HCl (3×1,5 л), насыщенным раствором бикарбоната натрия (3×1,5 л), сушили над сульфатом натрия, фильтровали и концентрировали. Масло растворяли в DCM и добавляли петролейный эфир до тех пор, пока не происходило осаждение 1,8-бис(диметиламино)нафталина. Очистка колоночной хроматографией (силикагель, 0-0%, 0-100%, EtOAc/петролейный эфир) давала масло, которое содержало 1,8-бис(диметиламино)нафталин в виде примеси. Оставшийся 1,8-бис(диметиламино)нафталин получали в процессе фильтрования через a SCX-2 колонку с использованием для элюирования MeOH, с получением указанного в заголовке соединения (18 г, 52% от двух стадий) в виде бледно-желтого масла. 1H-ЯМР (Me-d3-OD): 7,46-7,26 (5H, м), 5,26-5,07 (2H, м), 4,31 (2H, д), 4,04-3,85 (1H, м), 3,79 (1H, д), 3,46 (2H, с), 3,28-3,09 (2H, м), 1,48 (9H, с), 1,15 (3H, дд).
Получение 12: трет-Бутиловый эфир (2R,5R)-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
10% Pd/C (5,05 г, 4,76 ммоль) и (2R,5R)-2-метоксиметил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир (18 г, 48 ммоль) смешивали с MeOH (190 мл) при температуре окружающей среды и смесь гидрировали при температуре окружающей среды и ~1 бар в течение 3 часов. Смесь фильтровали через целит и фильтрат концентрировали, с получением указанного в заголовке соединения (11 г, 99%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 4,16 (1H, дд), 3,80 (1H, д), 3,71-3,47 (1H, м), 3,47-3,40 (1H, м), 3,39 (3H, с), 3,30-3,17 (2H, м), 3,17-3,00 (2H, м), 2,60 (1H, дд), 1,48 (9H, с), 1,25 (3H, д).
Получение 13: трет-Бутиловый эфир (2R,5R)-4-бензилоксикарбонилметил-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
К перемешиваемой суспензии трет-бутилового эфира (2R,5R)-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты (11 г, 45 ммоль), карбоната калия (6,79 г, 49,14 ммоль) и ацетонитрила (48 мл) добавляли бензилбромацетат (7,08 мл, 44,67 ммоль) по каплям при температуре окружающей среды. Реакционную смесь перемешивали в течение 18 часов при температуре окружающей среды, затем разбавляли хлороформом (150 мл), фильтровали и фильтрат концентрировали. Неочищенное масло очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-70%, EtOAc/петролейный эфир), с получением указанного в заголовке соединения (16 г, 92%) в виде бледно-желтого масла. 1H-ЯМР (Me-d3-OD): 7,45-7,22 (5H, м), 5,21-5,12 (2H, м), 4,84 (2H, с), 4,16-4,03 (1H, м), 3,91 (1H, д), 3,62 (1H, д), 3,56-3,40 (2H, м), 3,31-3,19 (3H, м), 3,04-2,92 (1H, м), 2,80 (1H, дд), 2,68 (1H, дд), 1,48 (9H, с), 1,19 (3H, д).
Получение 14: трет-Бутиловый эфир (2R,5R)-4-карбоксиметил-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
Получали с использованием способа гидрогенолиза аналогично тому, как описано в Получении 12; с перемешиванием в течение 2 часов. 1H-ЯМР (Me-d3-OD): 4,35-4,17 (1H, м), 4,01 (1H, д), 3,85-3,55 (3H, м), 3,55-3,34 (6H, м), 3,21-2,94 (2H, м), 1,50 (9H, с), 1,28 (3H, д).
Получение 15: трет-Бутиловый эфир (R)-4-карбоксиметил-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (R)-2-метилпиперазин-1-карбоновой кислоты аналогично тому, как описано для трет-бутилового эфира (2R,5R)-4-карбоксиметил-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты в Получениях 13 и 14. 1H-ЯМР (Me-d3-OD): 4,51-4,42 (1H, м), 4,10-3,99 (1H, м), 3,58 (1H, д), 3,53-3,39 (2H, м), 3,28 (1H, с), 2,99-2,82 (2H, м), 1,49 (9H, с), 1,36 (3H, д).
Получение 16: (2R,5R)-5-Метилпиперазин-1,2,4-трикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир
К периодату натрия (1,76 г, 8,24 моль), растворенному в воде (10,3 мл) и диметилкарбонате/ацетонитриле (1:1, 5,5 мл), добавляли RuCl3 (7 мг, 0,05 моль) и (2R,5R)-2-гидроксиметил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир (1,5 г, 4,12 ммоль) в 1:1 смеси DMC/MeCN (15 мл). Реакционную смесь перемешивали в течение 1,5 часов при температуре окружающей среды. Добавляли воду (20 мл) и реакционную смесь экстрагировали при помощи EtOAc (3×30 мл); объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над сульфатом натрия и фильтровали через пробку из целита с использованием для элюирования EtOAc. Растворитель удаляли в вакууме и остаток растворяли в Et2O, упаривали и полученное твердое вещество растирали в порошок с петролейным эфиром, с получением указанного в заголовке соединения (1,21 г, 78%) в виде бежевого твердого вещества. 1H-ЯМР (Me-d3-OD): 7,45-7,27 (5H, м), 5,26-5,10 (2H, м), 4,70 (1H, с), 4,55-4,18 (2H, м), 3,83-3,66 (1H, м), 3,52-3,36 (2H, м), 1,46 (9H, с), 1,18 (3H, т).
Получение 17: (2R,5R)-2-Метил-5-метилкарбамоилпиперазин-1,4-дикарбоновой кислоты 4-бензиловый эфир 1-трет-бутиловый эфир
(2R,5R)-5-Метилпиперазин-1,2,4-трикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир (200 мг, 0,53 ммоль) растворяли в безводном DMF (2,65 мл). Добавляли HATU (221 мг, 0,58 моль) и реакционную смесь перемешивали в течение 20 минут. Добавляли DIPEA (184 мкл, 1,06 ммоль) и метиламин в ТГФ (2,0M, 0,53 мл, 1,06 ммоль) и реакционную смесь перемешивали в течение 2 часов. Добавляли воду (10 мл) и водную фазу экстрагировали при помощи EtOAc (3×5,0 мл). Объединенные органические экстракты промывали насыщенным водным раствором бикарбоната натрия (3×15 мл), насыщенным солевым раствором (3×15 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Колоночная хроматография на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир) давала указанное в заголовке соединение (0,12 г, 58%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 7,48-7,26 (5H, м), 5,30-5,04 (2H, м), 4,44 (1H, д), 4,21 (2H, с), 3,64 (2H, д), 3,44 (1H, д), 2,72 (3H, д), 1,46 (9H, с), 1,16 (3H, дд).
Получение 18: трет-Бутиловый эфир (2R,5R)-2-метил-5-метилкарбамоилпиперазин-1-карбоновой кислоты
Получали способом аналогичным способу, описанному в Получении 12, исходя из (2R,5R)-2-метил-5-метилкарбамоилпиперазин-1,4-дикарбоновой кислоты 4-бензилового эфира 1-трет-бутилового эфира. 1H-ЯМР (Me-d3-OD): 4,23 (1H, дд), 4,09-3,94 (1H, м), 3,46 (1H, д), 3,28 (1H, дд), 2,98 (1H, дд), 2,78 (3H, с), 2,66 (1H, дд), 1,46 (9H, с), 1,18 (3H, д).
Получение 19: трет-Бутиловый эфир (2R,5R)-4-бензилоксикарбонилметил-2-метил-5-метилкарбамоилпиперазин-1-карбоновой кислоты
Получали способом аналогичным способу, описанному в Получении 13, исходя из трет-бутилового эфира (2R,5R)-4-бензилоксикарбонилметил-2-метил-5-метилкарбамоилпиперазин-1-карбоновой кислоты. 1H-ЯМР (Me-d3-OD): 7,45-7,29 (5H, м), 5,19 (2H, с), 4,19-4,03 (2H, м), 3,58-3,35 (4H, м), 3,01-2,89 (1H, м), 2,89-2,67 (4H, м), 1,43 (9H, с), 1,10 (3H, д).
Получение 20: трет-Бутиловый эфир (2R,5R)-4-карбоксиметил-2-метил-5-метилкарбамоилпиперазин-1-карбоновой кислоты
Использовали способ аналогичный тому, как описано в Получении 14, исходя из трет-бутилового эфира (2R,5R)-4-бензилоксикарбонилметил-2-метил-5-метилкарбамоилпиперазин-1-карбоновой кислоты. 1H-ЯМР (Me-d3-OD): 4,30-4,05 (2H, м), 3,62-3,38 (4H, м), 3,05-2,82 (2H, м), 2,82-2,68 (3H, м), 1,45 (9H, с), 1,14 (3H, д).
Получение 21: Метиловый эфир (R)-2-бензиламино-пропионовой кислоты
Суспензию метилового эфира D-аланина гидрохлорида (5,0 г, 36 ммоль) и бензилальдегида (3,8 г, 36 ммоль) в безводном DCM (60 мл) перемешивали в течение 18 часов при температуре окружающей среды. Добавляли триацетоксиборогидрид натрия по порциям в течение 0,5 часа и реакционную смесь перемешивали в течение 18 часов при температуре окружающей среды. Растворитель удаляли в вакууме и остаток распределяли между EtOAc (20 мл) и 1 M раствором хлористоводородной кислоты (80 мл). Водную фазу отделяли и промывали при помощи EtOAc (2×30 мл), затем подщелачивали до pH 10 при помощи 1 M водного раствора NaOH и экстрагировали при помощи EtOAc (3×50 мл) и промывали насыщенным солевым раствором (50 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме, с получением указанного в заголовке соединения (5,3 г, 77%) в виде бледно-желтого масла. 1H-ЯМР (Me-d3-OD): 7,43-7,19 (4H, м), 3,85-3,44 (5H, м), 3,39 (1H, кв.), 3,33 (1H, с), 1,32 (3H, д).
Получение 22: (3S,6R)-1-Бензил-3-этил-6-метилпиперазин-2,5-дион
К раствору метилового эфира (R)-2-бензиламинопропионовой кислоты (3,5 г, 18,1 ммоль) и EDC (3,65 г, 19,0 ммоль) в безводном DCM (30 мл) добавляли Boc-Abu-OH (3,68 г, 18,1 ммоль). Реакционную смесь перемешивали в течение 18 часов, затем к реакционной смеси добавляли дополнительное количество Boc-Abu-OH (0,74 ммоль, 3,62 ммоль), EDC (1,35 г, 7,1 ммоль) и DMF (2,4 мл), с последующим перемешиванием в течение 18 часов. Растворитель удаляли в вакууме и полученное масло растворяли в EtOAc (50 мл) и промывали раствором 1 M хлористоводородной кислоты (50 мл ×3), 1 M водным раствором NaOH (50 мл ×3), насыщенным солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали и концентрировали, с получением метилового эфира (R)-2-[бензил-((S)-2-трет-бутоксикарбониламинобутирил)- амино]пропионовой кислоты (6,0 г, 87%) в виде бледно-бесцветного масла. Аликвоту (3,9 г, 10,3 ммоль) растворяли в DCM (52 мл) и газообразный HCl барботировали через реакционную смесь в течение 30 минут при температуре окружающей среды. Реакционную смесь перемешивали еще в течение одного часа и затем растворитель удаляли в вакууме. Полученное твердое вещество растирали в порошок с Et2O, с получением метилового эфира (R)-2-[((S)-2-аминобутирил)бензиламино]пропионовой кислоты гидрохлорида (3,0 г, 93%) в виде бесцветного твердого вещества. Это вещество суспендировали в EtOAc (47 мл) при температуре окружающей среды и добавляли насыщенный водный раствор бикарбоната натрия (14 мл). После перемешивания в течение 18 часов органический слой отделяли и промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали, с получением указанного в заголовке соединения (1,68 г, 72%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 7,44-7,23 (5H, м), 5,19 (1H, д), 4,28-4,08 (2H, м), 3,86 (1H, кв.), 2,18-1,99 (1H, м), 1,96-1,79 (1H, м), 1,46 (3H, д), 0,95 (3H, т).
Получение 23: трет-Бутиловый эфир (2R,5S)-4-карбоксиметил-5-этил-2-метилпиперазин-1-карбоновой кислоты
Стадия 1: Раствор борана в ТГФ (1 M, 197 мл) медленно добавляли к (3S,6R)-1-бензил-3-этил-6-метилпиперазин-2,5-диону (4,9 г, 19,7 ммоль) в течение 15 минут в атмосфере азота. Реакционную смесь затем перемешивали при 70°C в течение 72 часов. Полученный раствор охлаждали до 0°C и медленно добавляли MeOH (60 мл) и 5 M раствор хлористоводородной кислоты (16 мл), затем раствор нагревали при 70°C при перемешивании в течение 2 часов. Растворитель удаляли в вакууме и остаток распределяли между водой и Et2O. Добавляли 1 M водный раствор NaOH с получением pH 12 и продукт экстрагировали при помощи EtOAc (3×). Органическую фазу сушили (MgSO4), фильтровали и концентрировали с получением (2R,5S)-1-бензил-5-этил-2-метилпиперазина (3,5 г) в виде желтой жидкости. MC: [M+H]+=219.
Стадия 2: Бензилбромацетат (2,6 мл, 16 ммоль) добавляли к раствору (2R,5S)-1-бензил-5-этил-2-метилпиперазина (3,5 г, 16 ммоль) в ацетонитриле (20 мл), который содержал K2CO3 (2,4 г, 17,6 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Суспензию разбавляли при помощи CHCl3 и твердое вещество отфильтровывали. Фильтрат упаривали в вакууме и остаток очищали при помощи SiO2 хроматографии (EtOAc:петролейный эфир 4:6), с получением бензилового эфира ((2S,5R)-4-бензил-2-этил-5-метилпиперазин-1-ил)-уксусной кислоты (3,4 г) в виде бледно-желтого масла. 1H-ЯМР (CDCl3): 7,46-7,14 (10H, м), 5,18 (2H, д), 4,10 (1H, д), 3,49 (1H, д), 3,32 (1H, д), 3,17 (1H, д), 2,91-2,79 (1H, м), 2,73 (1H, дд), 2,60-2,42 (3H, м), 2,01-1,79 (1H, м), 1,60-1,44 (1H, м), 1,41-1,23 (1H, м), 1,14 (3H, д), 0,77 (3H, т).
Стадия 3: Раствор бензилового эфира ((2S,5R)-4-бензил-2-этил-5-метилпиперазин-1-ил)уксусной кислоты (3,4 г, 9,3 ммоль) в MeOH (93 мл), содержащем Pd/C (10%, 985 мг) и уксусную кислоту (1,57 мл), перемешивали в течение ночи в атмосфере H2 (3,5 бар). Смесь фильтровали через Целит и растворитель удаляли в вакууме с получением ((2S,5R)-2-этил-5-метилпиперазин-1-ил)уксусной кислоты (1,87 г) в виде белого твердого вещества. Это соединение непосредственно использовали на следующей стадии без дополнительной очистки.
Стадия 4: трет-Бутилдикарбонат (2,1 г, 9,6 ммоль) и триэтиламин (6,7 мл, 48,4 ммоль) добавляли к суспензии ((2S,5R)-2-этил-5-метилпиперазин-1-ил)уксусной кислоты (1,8 г, 9,6 ммоль) в DCM. Полученный раствор перемешивали при комнатной температуре в течение 24 часов. Растворитель удаляли в вакууме с получением трет-бутилового эфира (2R,5S)-4-карбоксиметил-5-этил-2-метилпиперазин-1-карбоновой кислоты в форме соли с триэтиламином (3,8 г) в виде желтого смолистого вещества. 1H-ЯМР (CDCl3): 11,73-9,75 (1H, м), 4,20 (1H, с), 3,86 (1H, д), 3,34-3,07 (3H, м), 2,97 (6H, кв., триэтиламин), 2,77-2,65 (2H, м), 2,60 (1H, дд), 1,47-1,36 (11H, м), 1,26 (3H, д), 1,24-1,14 (9H, м, триэтиламин), 0,87 (3H, т).
Стадия 5: Cs2CO3 (3,4 г, 10,5 ммоль) добавляли к раствору соли с триэтиламином трет-бутилового эфира (2R,5S)-4-карбоксиметил-5-этил-2-метилпиперазин-1-карбоновой кислоты (3,9 г, 9,6 ммоль) в DMF (20 мл). После перемешивания в течение 2 часов при комнатной температуре добавляли раствор бензилбромида (1,25 мл, 10,5 ммоль) в DMF (10 мл) в течение 30 минут. Реакционную смесь перемешивали в течение ночи при комнатной температуре и полученное твердое вещество отфильтровывали и фильтрат упаривали в вакууме. Остаток растворяли в EtOAc и промывали водой. Органическую фазу сушили (MgSO4), фильтровали и концентрировали и остаток очищали при помощи SiO2 хроматографии (EtOAc:Петролейный эфир 1:1) с получением трет-бутилового эфира (2R,5S)-4-бензилоксикарбонилметил-5-этил-2-метилпиперазин-1-карбоновой кислоты (2,8 г) в виде бледно-желтого масла. 1H-ЯМР (CDCl3): 7,45-7,29 (5H, м), 5,26-5,08 (2H, м), 4,27-4,08 (1H, м), 3,89 (1H, д), 3,52-3,22 (3H, м), 2,75 (1H, дд), 2,68-2,40 (2H, м), 1,47 (11H, д), 1,26 (3H, д), 0,90 (3H, т).
Стадия 6: Pd/C (10%, 810 мг) добавляли к раствору трет-бутилового эфира (2R,5S)-4-бензилоксикарбонилметил-5-этил-2-метилпиперазин-1-карбоновой кислоты (2,8 г, 7,6 ммоль) в MeOH (50 мл). Суспензию перемешивали в течение ночи в атмосфере H2 и катализатор удаляли фильтрованием через Целит и фильтрат упаривали в вакууме, с получением указанного в заголовке соединения (1,7 г) в виде бледно-желтого твердого вещества. 1H-ЯМР (ДМСО-d6): 4,41-3,89 (1H, м), 3,89-3,64 (1H, м), 3,37-3,21 (1H, м), 3,21-3,05 (2H, м), 2,71-2,55 (2H, м), 2,54-2,42 (3H, м), 1,45-1,36 (9H, м), 1,16 (3H, д), 0,83 (3H, т). МС: [M+H]+=287.
Получение 24: трет-Бутиловый эфир (2R,5S)-4-карбоксиметил-5-изопропил-2-метилпиперазин-1-карбоновой кислоты, соль с триэтиламином
Получали с использованием процедуры, аналогичной той, которая описана в Получениях 22 и 23, исходя из Boc-валина вместо Boc-Abu-OH и исключая стадии 5 и 6 из Получения 23. 1H-ЯМР (Me-d3-OD): 4,11 (1H, дд), 3,96 (1H, д), 3,56-3,35 (3H, м), 3,19 (9H, кв., триэтиламин), 3,16-3,04 (1H, м), 3,04-2,82 (1H, м), 2,82-2,60 (1H, м), 1,48 (9H, с) 1,32 (14H, т, триэтиламин), 1,22 (3H, д), 1,02 (6H, дд).
Получение 25: 6-Хлор-3,3-диметил-2,3-дигидро-1H-индол и 4-хлор-3,3-диметил-2,3-дигидро-1H-индол
Стадию 1 синтеза 2-хлор-1-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-этанона (Получение 1) повторяли с использованием 3-хлорфенилгидразина (1,0 г, 5,6 ммоль) и два изомера разделяли хроматографией на силикагеле (градиентное элюирование, 0-60% EtOAc/петролейный эфир, затем 0-100% Et2O/петролейный эфир), с получением 6-хлор-3,3-диметил-2,3-дигидро-1H-индола (38 мг, 4%) в виде желтого масла, 1H-ЯМР (CDCl3): 6,93 (1H, д), 6,71 (1H, дд), 6,61 (1H, д), 3,34 (2H, с), 1,31 (6H, с) и 4-хлор-3,3-диметил-2,3-дигидро-1H-индола (146 мг, 14%), в виде желтого масла. 1H-ЯМР (Me-d3-OD): 6,93 (1H, т), 6,58 (1H, д), 6,53 (1H, д), 3,27 (2H, с), 1,43 (6H, с).
Получение 26: 6-Бензил-2,3-дигидро-1H-индол
Pd(PPh3)4 (108 мг, 0,1 ммоль), индол-6-бороновую кислоту (300 мг, 1,9 ммоль), бензилбромид (333 мкл, 2,8 ммоль), ТГФ (3,73 мл) и 2,0 M водный раствор K2CO3 (2,80 мл, 5,6 ммоль) добавляли в микроволновую пробирку. Реакционную смесь дегазировали при помощи азота и нагревали до 80°C в течение 4 часов в условиях микроволнового облучения. Органический слой отделяли и концентрировали. Очистка колоночной хроматографией на силикагеле (градиентное элюирование, 0-20% EtOAc/петролейный эфир) давала желтое масло (0,27 г). Неочищенное масло (242 мг) растворяли в 1,0 M BH3 в ТГФ (1,75 мл) при 0°C и перемешивали в течение 30 минут. Добавляли по каплям TFA (1,75 мл) и раствор перемешивали при 0°C в течение 30 минут. Добавляли 6 M водный раствор NaOH до тех пор, пока раствор не становился щелочным (pH 11). Водный раствор экстрагировали при помощи DCM (3×25 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Хроматография на силикагеле (градиентное элюирование, 0-100%, EtOAc/петролейный эфир) давала указанное в заголовке соединение (139 мг), MC: [M+H]+ 210.
Получение 27: Метиламид 5-бром-2,3-дигидро-1H-индол-6-сульфоновой кислоты
К суспензии 1-ацетил-5-бром-2,3-дигидро-1H-индол-6-сульфонилхлорида (см. Получение 43) (0,40 г, 1,2 ммоль) в ТГФ (3,38 мл) добавляли триэтиламин (0,660 мл, 4,73 ммоль) и 40% раствор метиламина в воде (0,18 мл, 2,4 ммоль). Реакционную смесь нагревали до температуры кипения с обратным холодильником и перемешивали в течение 1,5 часов, затем охлаждали и концентрировали. Остаток суспендировали в горячем MeOH и фильтровали в условиях вакуума, промывая при помощи MeOH. Твердое вещество сушили в вакууме при 40°C с получением метиламида 1-ацетил-5-бром-2,3-дигидро-1H-индол-6-сульфоновой кислоты (0,33 г, 85%) в виде бесцветного твердого вещества. Этот продукт (320 мг, 1,0 ммоль) суспендировали в 1,4-диоксане (0,98 мл) и концентрированной хлористоводородной кислоте (0,72 мл), нагревали до 100°C в течение 1,5 часов, затем охлаждали до температуры окружающей среды и растворитель удаляли в вакууме. pH доводили до ~7 при помощи 1 M водного раствора NaOH и образовавшийся осадок собирали путем фильтрования под вакуумом, промывали водой, и сушили в вакууме при 40°C, с получением указанного в заголовке соединения (0,176 г, 62%) в виде бежевого твердого вещества; MC: [M+H]+ 291
Получение 28: Диметиламид 5-бром-2,3-дигидро-1H-индол-6-сульфоновой кислоты
Исходя из диметиламина и 1-ацетил-5-бром-2,3-дигидро-1H-индол-6-сульфонилхлорида, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны для Получения 27. 1H-ЯМР (ДМСО-d6): 7,40 (1H, с), 7,01 (1H, с), 3,51 (2H, т), 3,01 (2H, т), 2,77 (6H, с).
Получение 29: Бензиловый эфир 6-хлор-1,2-дигидроспиро[индол-3,4'-пиперидин]-1'-карбоновой кислоты
Исходя из 3-хлор-гидразингидрохлорида и бензилового эфира 4-формил-пиперидин-1-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны для Получения 25. 1H-ЯМР (CDCl3): 7,46-7,31 (5H, м), 6,92 (1H, д), 6,71 (1H, дд), 6,62 (1H, д), 5,25-5,11 (2H, м), 4,16 (2H, д), 3,94-3,70 (1H, м), 3,00 (2H, с), 1,70 (6H, д).
Получение 30: 6-Хлор-2,3-дигидро-1H-индол
6-Хлориндол (1,0 г, 6,6 ммоль) растворяли в растворе борана в ТГФ (1 M, 9,83 ммоль) при 0°C и перемешивали в течение 30 минут. Добавляли по каплям TFA (9,83 мл) и раствор перемешивали при 0°C в течение 30 минут. Добавляли 6 M водный раствор NaOH до тех пор, пока раствор не становился щелочным (pH 11). Водный раствор экстрагировали при помощи DCM (3×25 мл), сушили над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения (864 мг, 86%) в виде желтого масла. 1H-ЯМР (Me-d3-OD): 6,99 (1H, д), 6,64-6,55 (2H, м), 3,50 (2H, т), 2,95 (2H, т).
Получение 31: 6-Метил-2,3-дигидро-1H-индол
6-Метилиндол (0,50 г, 3,8 ммоль) растворяли в ледяной уксусной кислоте (19,1 мл) и охлаждали до 0°C. Добавляли цианоборогидрид натрия (0,48 г, 7,6 ммоль) по порциям и смесь нагревали до температуры окружающей среды и перемешивали в течение 2 часов. Реакционную смесь разбавляли водой (8,0 мл), подщелачивали при помощи 40% водного раствора NaOH и экстрагировали при помощи EtOAc (3×10 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (3×30 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Очистка колоночной хроматографией на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир) давала указанное в заголовке соединение (0,256 г, 51%) в виде масла пурпурного цвета. 1H-ЯМР (Me-d3-OD): 6,96 (1H, д), 6,53 (2H, д), 3,44 (2H, т), 2,94 (2H, т), 2,23 (3H, с).
Получение 32: 6-Метокси-2,3-дигидро-1H-индол
Исходя из 6-метоксииндола, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны для Получения 31. 1H-ЯМР (Me-d3-OD): 6,96 (1H, д), 6,37-6,18 (2H, м), 3,72 (3H, с), 3,47 (2H, т), 2,91 (2H, т).
Получение 33: 6-Трифторметил-2,3-дигидро-1H-индол
Исходя из 6-трифторметилиндола, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны для Получения 31. 1H-ЯМР (Me-d3-OD): 7,19 (1H, д), 6,89 (1H, д), 6,81 (1H, с), 3,55 (2H, т), 3,05 (2H, т).
Получение 34: Метиловый эфир 2,3-дигидро-1H-индол-6-карбоновой кислоты
Исходя из метил 6-индолкарбоксилата, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны для Получения 31. 1H-ЯМР (Me-d3-OD): 7,37 (1H, дд), 7,24 (1H, д), 7,16 (1H, д), 3,86 (3H, с), 3,53 (2H, т), 3,04 (2H, т).
Получение 35: 6-Хлор-2,3-дигидро-1H-пирроло[3,2-c]пиридин
В атмосфере азота, 6-хлор-5-азаиндол (500 мг, 3,29 ммоль) растворяли в 2,0 M BH3.SMe2 в ТГФ (6,6 мл, 13,16 ммоль) и осторожно нагревали до 68°C в течение 2 часов. После охлаждения до температуры окружающей среды медленно добавляли MeOH (6,0 мл) в течение 20 минут. После того как выделение пузырьков прекращалось, реакционную смесь нагревали до 68°C в течение 30 минут, затем охлаждали до температуры окружающей среды и концентрировали в вакууме. Хроматография на силикагеле (градиентное элюирование, 0-60% EtOAc/петролейный эфир) давала указанное в заголовке соединение (209 мг, 41%) в виде бесцветного масла. 1H-ЯМР (CDCl3): 7,86 (1H, с), 6,43 (1H, с), 4,33 (1H, с), 3,80-3,65 (2H, м), 3,05 (2H, т).
Получение 36: 5-Фтор-6-фенил-2,3-дигидро-1H-индол
Смесь 6-бром-5-фтор-1H-индола (0,214 г, 1 ммоль), фенилбороновой кислоты (0,171 г, 1,4 ммоль), карбоната натрия (1,06 г, 10 ммоль), Pd(PPh3)4 (0,116 г, 0,1 ммоль), 1,2-диметоксиэтана (5 мл) и воды (5 мл) перемешивали в атмосфере азота при 85°C в течение 18 часов. Смесь распределяли между водой (20 мл) и DCM (2×30 мл) и объединенные экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-50% Et2O в петролейном эфире) давала 5-фтор-6-фенил-1H-индол (0,202 г, 95%) в виде бледно-зеленого твердого вещества. MC: [M+H]+=212. Раствор борана в ТГФ (1 M, 1,42 мл) добавляли к 5-фтор-6-фенил-1H-индолу (0,20 г, 0,95 ммоль) в атмосфере азота при внешнем охлаждении с использованием бани лед-MeOH. Полученную смесь перемешивали при 0°C в течение 0,5 часов, затем добавляли по каплям TFA в течение 0,1 часов. Смесь перемешивали при 0°C в течение 1 часа, затем добавляли по каплям раствор гидроксида натрия (0,8 г, 20 ммоль) и воды (5 мл) в течение 0,1 часа. Полученную смесь распределяли между водой (20 мл) и DCM (2×30 мл) и объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-100% Et2O в петролейном эфире) давала указанное в заголовке соединение (0,17 г, 85%) в виде масла. MC: [M+H]+=214.
Получение 37: 6-Трифторметокси-2,3-дигидро-1H-индол
Получали из 6-трифторметокси-1H-индола способом аналогичным тому, который использовали в Получении 30. MC: [M+H]+=204.
Получение 38: 6-Метилсульфонил-2,3-дигидро-1H-индол
Получали из 6-метилсульфонил-1H-индола способом аналогичным тому, который использовали в Получении 30. MC: [M+H]+=198.
Получение 39: 6-Бром-1-триизопропилсиланил-1H-индол
К перемешиваемому раствору 6-бром-1H-индола (2,04 г, 1,04 ммоль) в ТГФ в атмосфере азота при 0°C добавляли гидрид натрия (60%, 1,25 г, 31,2 ммоль) по порциям в течение 0,2 часа. Смесь перемешивали при 0-20°C в течение 1 часа, затем охлаждали на бане лед-MeOH, после этого добавляли по каплям триизопропилсилилтрифторметилсульфонат (3,83 г, 12,5 ммоль) в течение 3 часов. Полученную смесь перемешивали при ~0°C в течение 1 часа, затем при 20°C в течение 72 часов. Смесь гасили (осторожно!) смесью ТГФ (30 мл) и воды (1 мл) при внешнем охлаждении льдом и полученный прозрачный раствор распределяли между водой (100 мл) и DCM (3×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-40% Et2O в петролейном эфире) давала указанное в заголовке соединение (3,48 г) в виде бесцветного масла. 1H-ЯМР (CDCl3): 7,66-7,64 (1H, м), 7,50 (1H, д), 7,25-7,21 (2H, м), 6,61 (1H, д), 1,76-1,64 (3H, м), 1,17 (18H, д).
Получение 40: 6-Фенилсульфонил-1-триизопропилсиланил-1H-индол
К перемешиваемому раствору 6-бром-1-триизопропилсиланил-1H-индола (0,687 г, 1,95 ммоль) в ТГФ (12 мл) при -78°C в атмосфере азота добавляли по каплям в течение 0,3 часа раствор трет-бутиллития в пентане (1,7 M, 2,52 мл, 4,29 ммоль) (внутреннюю температуру поддерживали ниже -70°C). Смесь перемешивали при -78°C в течение 0,1 часа, затем добавляли по каплям фенилсульфонилфторид (0,26 мл, 0,343 г, 2,15 ммоль). Смесь перемешивали при -78°C, затем нагревали до 20°C и перемешивали таким образом в течение 1 часа. Избыток трет-бутиллития гасили путем добавления льда и полученную смесь распределяли между водой (100 мл) и EtOAc (3×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением полутвердого вещества. Хроматография (SiO2; градиентное элюирование с использованием 0-40% Et2O в петролейном эфире) давала указанное в заголовке соединение (0,365 г, 45%). 1H-ЯМР (CDCl3): 8,21 (1H, с), 8,00-7,89 (2H, м), 7,70 (1H, д), 7,63 (1H, дд), 7,57-7,41 (4H, м), 6,69 (1H, д), 1,82-1,65 (3H, м), 1,16 (18H, д).
Получение 41: 6-Фенилсульфонил-1H-индол
К раствору 6-фенилсульфонил-1-триизопропилсиланил-1H-индола 0,365 г, 0,88 ммоль) в ТГФ (10 мл) добавляли раствор TBAF в ТГФ (1 M, 1 мл) с последующим добавлением раствора борной кислоты (0,062 г, 1 ммоль) в воде (1 мл) и перемешивание осуществляли в течение 2 часов. Смесь распределяли между водой (50 мл) и DCM (3×30 мл) и объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-40% EtOAc в петролейном эфире) давала указанное в заголовке соединение (0,21 г) в виде бесцветного твердого вещества. MC: [M+H]+=258.
Получение 42: 6-Фенилсульфонил-2,3-дигидро-1H-индол
Получали из 6-фенилсульфонил-1H-индола способом аналогичным тому, который использовали в Получении 30. MC: [M+H]+=260.
Получение 43: 1-Ацетил-5-бром-2,3-дигидро-1H-индол-6-сульфонилхлорид
1-(5-Бром-2,3-дигидроиндол-1-ил)этанон (0,249 г, 1,04 ммоль) добавляли порциями к хлорсульфоновой кислоте (1 мл) при 20°C при перемешивании и смесь перемешивали в течение 26 часов, затем выливали на измельченный лед. Полученное твердое вещество собирали путем фильтрования и сушили в вакууме. Фильтрат экстрагировали при помощи EtOAc и органическую фазу сушили (Na2SO4) и упаривали в вакууме с получением дополнительного количества твердого вещества. Две партии твердого вещества объединяли с получением указанного в заголовке соединения (0,25 г), которое использовали на следующей стадии без дополнительной очистки. MC: [M-H]-=336.
Получение 44: 1-[5-Бром-6-(пирролидин-1-сульфонил)-2,3-дигидроиндол-1-ил]этанон
Смесь 1-ацетил-5-бром-2,3-дигидро-1H-индол-6-сульфонилхлорида (0,25 г, 0,74 ммоль), пирролидина (0,156 г, 2,2 ммоль) и ТГФ (10 мл) перемешивали при 20°C в течение 18 часов, затем распределяли между водой (50 мл) и EtOAc (2×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением твердого вещества. Хроматография (SiO2; градиентное элюирование с использованием 50-100% EtOAc в петролейном эфире) давала указанное в заголовке соединение (0,206 г) в виде бесцветного твердого вещества. MC: [M+H]+=373.
Получение 45: 5-Бром-6-(пирролидин-1-сульфонил)-2,3-дигидро-1H-индол
Смесь 1-[5-бром-6-(пирролидин-1-сульфонил)-2,3-дигидроиндол-1-ил]этанона (0,203 г, 0,54 ммоль), концентрированной хлористоводородной кислоты (2 мл) и 1,4-диоксана (5 мл) нагревали при 100°C в герметично закрытом сосуде в течение 2 часов. Смесь охлаждали, затем нейтрализовали насыщенным водным раствором гидрокарбоната натрия и полученное твердое вещество собирали путем фильтрования, с получением указанного в заголовке соединения (0,13 г, 72%). MC: [M+H]+=331.
Получение 46: трет-Бутиловый эфир 5-метокси-2,3-дигидропирроло[2,3-c]пиридин-1-карбоновой кислоты
Смесь 5-метокси-1H-пирроло[2,3-c]пиридина (0,536 г, 3,6 ммоль) и раствора комплекса боран•диметилсульфид в ТГФ (2 M, 18 мл) нагревали при температуре кипения с обратным холодильником в атмосфере азота в течение 6 часов, затем охлаждали до 20°C и оставляли таким образом в течение 16 часов. Добавляли по каплям MeOH (4 мл) при внешнем охлаждении на ледяной бане (осторожно!) в течение 0,3 часа и полученный прозрачный раствор нагревали при температуре кипения с обратным холодильником в течение 1 часа. Избыток растворителя затем упаривали в вакууме. Смесь полученного остатка с ди-трет-бутилдикарбонатом (0,865 г, 4 ммоль) и DCM (20 мл) перемешивали при 20°C в течение 2 часов, затем упаривали в вакууме с получением полутвердого вещества. Хроматография (SiO2; градиентное элюирование с использованием 0-50% EtOAc в петролейном эфире) давала указанное в заголовке соединение (0,429 г, ~47%). MC: [M+H]+=251.
Получение 47: трет-Бутиловый эфир 6-бензил-5-оксо-2,3,5,6-тетрагидропирроло[2,3-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 5-метокси-2,3-дигидропирроло[2,3-c]пиридин-1-карбоновой кислоты (0,065 г, 0,26 ммоль), бензилбромида (0,053 г, 0,31 ммоль), иодида натрия (0,077 г, 0,52 ммоль) и ацетонитрила (2 мл) перемешивали при 60°C в течение 40 часов. Смесь выливали в смесь воды (10 мл) и насыщенного водного раствора тиосульфата натрия (10 мл) и экстрагировали при помощи DCM (3×20 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением коричневого масла. Хроматография (SiO2; градиентное элюирование с использованием 0-100% EtOAc в петролейном эфире) давала указанное в заголовке соединение (0,054 г, ~64%) в виде бесцветного масла. MC: [M+H]+=327.
Получение 48: 6-Бензил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-она, гидрохлорида
Смесь трет-бутилового эфира 6-бензил-5-оксо-2,3,5,6-тетрагидропирроло[2,3-c]пиридин-1-карбоновой кислоты (0,050 г, 0,15 ммоль), 1,4-диоксана (1 мл) и раствора хлористого водорода в 1,4-диоксане (4 M, 0,5 мл) перемешивали при 20°C в течение 18 часов, затем упаривали в вакууме. Остаток растворяли в MeOH, затем снова упаривали и азеотропный процесс повторяли с получением указанного в заголовке соединения в виде бледно-зеленого стекловидного вещества, которое использовали без дополнительной очистки. MC: [M+H]+=227.
Получение 49: 1-Бензолсульфонил-3-фтор-бензол
Смесь 1-фтор-3-иодбензола (2,22 г, 10 ммоль), фенилсульфината натрия (2,16 г, 13 ммоль), меди (1) комплекса трифторметилсульфонат - бензол (0,15 г, 0,3 ммоль), N,N'-диметилэтилендиамина (0,95 г, 1,09 ммоль) и диметилсульфоксида (20 мл) нагревали при 90°C в атмосфере азота при перемешивании в течение 2 часов, затем при 115°C в течение 18 часов. Смесь охлаждали, затем распределяли между водой (150 мл) и 1:1 Et2O-EtOAc (100 мл) и органическую фазу промывали водой (3×100 мл), сушили (Na2SO4) и упаривали в вакууме с получением бежевого твердого вещества. Хроматография (SiO2; градиентное элюирование с использованием 0-40% Et2O в петролейном эфире) давала указанное в заголовке соединение (1,725 г, 73%) в виде бесцветного твердого вещества. 1H-ЯМР (CDCl3): 8,02-7,93 (2H, м), 7,81-7,71 (1H, м), 7,71-7,46 (5H, м), 7,28 (1H, м).
Получение 50: (3-Бензолсульфонилфенил)гидразин
Смесь 1-бензолсульфонил-3-фторбензола (1,34 г, 5,7 ммоль), гидразингидрата (1,4 мл) и диметилсульфоксида (2 мл) перемешивали при 118°C в течение 18 часов, затем охлаждали и выливали в воду (100 мл). Полученные бесцветные кристаллы собирали путем фильтрования с получением указанного в заголовке соединения (1,34 г, 95%). 1H-ЯМР (ДМСО-d6): 7,95-7,84 (2H, м), 7,73-7,56 (3H, м), 7,37-7,21 (3H, м), 7,06 (1H, д), 6,96 (1H, дд), 4,14 (2H, шир. м).
Получение 51: 6-Бензолсульфонил-3,3-диметил-2,3-дигидро-1H-индол
Смесь (3-бензолсульфонилфенил)гидразина (0,824 г, 3,3 ммоль), изобутиральдегида (0,245 г, 3,4 ммоль) и толуола (12 мл) перемешивали при 20°C в течение 2 часов. Добавляли уксусную кислоту (12 мл), с последующим добавлением раствора HCl в 1,4-диоксане (4 M, 0,83 мл, 3,3 ммоль), и перемешивание продолжали в течение 2 часов. Добавляли 1,2-дихлорэтан (12 мл), с последующим добавлением триацетоксиборогидрида натрия (1,05 г, 5 ммоль), и перемешивание продолжали в течение 1 часа. Смесь концентрировали до ~5 мл в вакууме и остаток распределяли между насыщенным водным раствором гидрокарбоната натрия (200 мл) и DCM (3×60 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением оранжевого масла. Хроматография (SiO2; градиентное элюирование с использованием 0-30% Et2O в петролейном эфире) давала указанное в заголовке соединение (0,044 г). MC: [M+H]+=288.
Получение 52: 4,6-Дихлор-3,3-диметил-2,3-дигидро-1H-индол
Получали из 3,5-дихлорфенилгидразингидрохлорида аналогично тому, как описано для 6-хлор-3,3-диметил-2,3-дигидро-1H-индола (Получение 25). MC: [M+H]+=216.
Получение 53: 6' Хлорспиро[циклопентан-1,3'-[3H]индол]-2'(1'H)-он
К перемешиваемому раствору 6-хлор-1,3-дигидроиндол-2-она (1,0 г, 6 ммоль) в ТГФ (20 мл) при -25°C в атмосфере азота добавляли по каплям в течение 0,15 часа раствор бутиллития в гексане (1,6 M, 7,5 мл, 12 ммоль). Добавляли тетраметилэтилендиамин (1,39 г, 12 ммоль) по каплям в течение 0,02 часа и полученную коричневую суспензию перемешивали в течение 0,5 часа при -25°C. Затем добавляли 1,4-дииодбутан в течение 0,02 часа и полученную смесь медленно нагревали до 20°C и перемешивали таким образом в течение 18 часов. Смесь затем гасили насыщенным водным раствором хлорида аммония затем распределяли между водой (100 мл) и EtOAc (100 мл). Органическую фазу промывали водным раствором HCl (2 M, 100 мл), водой (100 мл) затем сушили (Na2SO4) и упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 0-40% EtOAc в петролейном эфире) давала указанное в заголовке соединение (0,509 г). MC: [M+H]+=222.
Получение 54: 6'-Хлор-1',2'-дигидроспиро[циклопентан-1,3'-[3H]индол]
Раствор комплекса боран - диметилсульфид в ТГФ (2 M, 3,75 мл) добавляли к 6' хлорспиро[циклопентан-1,3'-[3H]индол]-2'(1'H)-ону в атмосфере азота и полученный раствор перемешивали при 20°C в течение 0,2 часа, затем при температуре кипения с обратным холодильником в течение 1 часа. Смесь охлаждали, затем медленно добавляли MeOH (3 мл) (осторожно!), и снова нагревали до температуры кипения с обратным холодильником в течение 1 часа. Избыток растворителя выпаривали в вакууме и хроматография остатка (SiO2; градиентное элюирование с использованием 0-40% Et2O в петролейном эфире) давала указанное в заголовке соединение (0,335 г, 88%). MC: [M+H]+=208.
Получение 55: трет-Бутиловый эфир 6-хлор-2-оксо-2,3-дигидроиндол-1-карбоновой кислоты
Смесь 6-хлор-1,3-дигидроиндол-2-она (11,35 г, 67,7 ммоль), карбоната натрия (35,9 г, 338,5 ммоль), трет-бутилдикарбоната (36,7 г, 168,2 ммоль) и ТГФ (300 мл) перемешивали при 20°C в течение 88 часов, затем твердые вещества удаляли путем фильтрования и фильтрат упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 5-25% EtOAc в петролейном эфире) давала указанное в заголовке соединение (8,746 г) в виде масла. MC: [M-H]-=266.
Получение 56: трет-Бутилового эфира 6' Хлорспиро[циклопропан-1,3'-[3H]индол]-2'(1'H)-он-1-карбоновой кислоты
Смесь трет-бутилового эфира 6-хлор-2-оксо-2,3-дигидроиндол-1-карбоновой кислоты (2,00 г, 7,5 ммоль), карбоната калия (2,18 г, 15,8 ммоль), 1,2-дибромэтана (1,56 г, 8,3 ммоль) и DMF (20 мл) перемешивали при 20°C в течение 18 часов, затем распределяли между водой (100 мл) и EtOAc (100 мл). Органическую фазу промывали водой (100 мл) и насыщенным солевым раствором (50 мл), затем сушили (Na2SO4) и упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 0-100% EtOAc в петролейном эфире) давала указанное в заголовке соединение (0,594 г). 1H-ЯМР (CDCl3): 8,00 (1H, д), 7,13 (1H, дд), 6,74 (1H, д), 1,90-1,80 (2H, м), 1,67 (9H, с), 1,58-1,55 (2H, м).
Получение 57: 6' Хлор-спиро[циклопропан-1,3'-[3H]индол]-2'(1'H)-он
Смесь трет-бутилового эфира 6' хлор-спиро[циклопропан-1,3'-[3H]индол]-2'(1'H)-он-1-карбоновой кислоты (0,70 г, 2,4 ммоль), DCM (5 мл) и TFA (2,5 мл) перемешивали при 0°C в течение 1 часа, затем упаривали в вакууме с получением твердого вещества. Хроматография (SiO2; градиентное элюирование с использованием 10-30% EtOAc в петролейном эфире) давала указанное в заголовке соединение (0,359 г) в виде бежевого твердого вещества. MC: [M+H]+=194.
Получение 58: 6'-Хлор-1',2'-дигидроспиро[циклопропан-1,3'-[3H]индол]
Смесь 6' хлорспиро[циклопропан-1,3'-[3H]индол]-2'(1'H)-она (0,291 г, 1,5 ммоль) и комплекса боран - диметилсульфид в ТГФ (2 M, 3,0 мл) нагревали при температуре кипения с обратным холодильником в атмосфере азота в течение 2 часов. Смесь охлаждали и добавляли по каплям (осторожно!) MeOH (3 мл). Полученную смесь нагревали при температуре кипения с обратным холодильником в течение 2 часов, затем охлаждали и растворитель выпаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 0-100% Et2O в петролейном эфире) давала указанное в заголовке соединение (0,142 г). MC: [M+H]+=180.
Получение 59: 6' Хлорспиро[циклобутан-1,3'-[3H]индол]-2'(1'H)-он
Получали аналогично тому, как описано в Получении 53, с использованием 1,3-дииодпропана вместо 1,4-дииодбутана. MC: [M+H]+=208.
Получение 60: 6'-Хлор-1',2'-дигидроспиро[циклобутан-1,3'-[3H]индол]
Получали аналогично тому, как описано для в Получении 54, с использованием 6' хлор-спиро[циклобутан-1,3'-[3H]индол]-2'(1'H)-она в качестве исходного вещества. MC: [M+H]+=194.
Получение 61: 1-(5-Бром-3,3-диметил-2,3-дигидроиндол-1-ил)-этанон и 5-бром-3,3-диметил-2,3-дигидро-1H-индол
Указанные в заголовке соединения получали, исходя из 4-бромфенилгидразингидрохлорида (4г, 17,9 ммоль) и изобутиральдегида (1,6 мл, 17,9 ммоль), следуя способам, аналогичным тем, которые описаны в Получении 25, с получением 1-(5-бром-3,3-диметил-2,3-дигидроиндол-1-ил)этанона (2,0 г) в виде темно-оранжевого масла [1H-ЯМР (CDCl3): 8,09 (1H, д), 7,32 (1H, дд), 7,23 (1H, д), 3,80 (2H, с), 2,23 (3H, с), 1,37 (6H, с). МС: [M+H]+ 268] и 5-бром-3,3-диметил-2,3-дигидро-1H-индола (1,3 г) в виде оранжевой жидкости. [MC: [M+H]+ 226].
Получение 62: 1-(5-Бром-3,3-диметил-2,3-дигидроиндол-1-ил)-этанон
К раствору 5-бром-3,3-диметил-2,3-дигидро-1H-индола (1,6 г, 7,1 ммоль) в DCM (40 мл) и пиридине (1,1 мл, 14,2 ммоль) добавляли уксусный ангидрид (1 мл, 11 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем растворитель удаляли в вакууме и остаток распределяли между водой и насыщенным водным раствором NH4Cl. Органическую фазу отделяли, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (1,8 г), которое использовали без дополнительной очистки. Аналитические данные согласовывались с данными, представленными в Получении 61.
Получение 63: 1-Ацетил-5-бром-3,3-диметил-2,3-дигидро-1H-индол-6-сульфонилхлорид
1-(5-Бром-3,3-диметил-2,3-дигидроиндол-1-ил)этанон (2,0 г, 7,5 ммоль) медленно добавляли к хлорсульфоновой кислоте (20 мл) и полученный раствор перемешивали при комнатной температуре в течение 3 дней. Смесь затем осторожно выливали на лед и полученное твердое вещество фильтровали, промывали водой и сушили в вакууме с получением указанного в заголовке соединения (2,7 г) в виде бледно-коричневого твердого вещества. 1H-ЯМР (Ацетон-d6): 9,02 (1H, с), 7,89 (1H, с), 4,11 (2H, с), 2,26 (3H, с), 1,49 (6H, с).
Получение 64: 1-(5-Бром-6-этансульфонил-3,3-диметил-2,3-дигидроиндол-1-ил)этанон
Суспензию 1-ацетил-5-бром-3,3-диметил-2,3-дигидро-1H-индол-6-сульфонилхлорида (300 мг, 0,81 ммоль), Na2SO3 (206 мг, 1,6 ммоль) и NaHCO3 (134 мг, 1,6 ммоль) в воде (5 мл) перемешивали при 105°C в течение 1,5 часа. Полученный раствор охлаждали до 70°C, затем добавляли TBABr (1,5 мг, 0,005 ммоль) и иодэтан (323 мкл, 4 ммоль) и перемешивание поддерживали при указанной температуре в течение 4 часов. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли водой (15 мл) и экстрагировали при помощи DCM (3×). Органическую фазу сушили (MgSO4), фильтровали и концентрировали и неочищенное вещество очищали с использованием SiO2 хроматографи (50% EtOAc/Петролейный эфир) с получением указанного в заголовке соединения (0,21 г) в виде бледно-желтого масла. 1H-ЯМР (CDCl3): 8,92 (1H, с), 7,45 (1H, с), 3,87 (2H, с), 3,43 (2H, кв.), 2,23 (3H, с), 1,39 (6H, с), 1,33-1,26 (3H, м).
Получение 65: 1-(6-Этансульфонил-3,3-диметил-2,3-дигидроиндол-1-ил)этанон
К раствору 1-(5-бром-6-этансульфонил-3,3-диметил-2,3-дигидроиндол-1-ил)этанона (180 мг, 0,5 ммоль) в ТГФ (5 мл), содержащем насыщенный водный раствор NH4Cl (1 мл), добавляли цинковую пыль (325 мг, 5 ммоль). Суспензию перемешивали при комнатной температуре в течение 3 дней и затем распределяли между водой и EtOAc. Водную фазу экстрагировали два раза при помощи EtOAc. Органические экстракты фильтровали через пробку из целита и фильтрат упаривали в вакууме с получением указанного в заголовке соединения (130 мг) в виде бесцветного смолистого вещества, которое использовали на следующей стадии без дополнительной очистки. MC: [M+H]+=282.
Получение 66: 6-Этансульфонил-3,3-диметил-2,3-дигидро-1H-индол
1-(6-Этансульфонил-3,3-диметил-2,3-дигидроиндол-1-ил)-этанон (130 мг, 0,46 ммоль) растворяли в MeOH (7 мл) и добавляли 5 M раствор хлористоводородной кислоты (920 мкл, 4,6 ммоль). Раствор перемешивали при 90°C в течение 1,5 часа, затем растворитель удаляли в вакууме. Остаток гасили насыщенным водным раствором NaHCO3 и продукт экстрагировали при помощи EtOAc. Органическую фазу сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (60 мг), которое использовали без дополнительной очистки. MC: [M+H]+=240.
Получение 67: 3,3-Диметил-6-(2-метилпропан-1-сульфонил)-2,3-дигидро-1H-индол
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получениях 64-66, с использованием 1-бром-2-метилпропана вместо иодэтана. MC: [M+H]+=268.
Получение 68: 3,3-Диметил-6-фенилметансульфонил-2,3-дигидро-1H-индол
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получениях 64-66, с использованием бензилбромида вместо иодэтана. MC: [M+H]+=302.
Получение 69: Метиламид 1-ацетил-5-бром-3,3-диметил-2,3-дигидро-1H-индол-6-сульфоновой кислоты
Метиламин (2 M раствор в ТГФ, 2,4 мл, 4,9 ммоль) добавляли к раствору 1-ацетил-5-бром-3,3-диметил-2,3-дигидро-1H-индол-6-сульфонилхлорида (300 мг, 0,82 ммоль) в ТГФ (10 мл). Раствор перемешивали при комнатной температуре в течение 30 минут, затем растворитель удаляли в вакууме и остаток распределяли между водой и EtOAc. Органическую фазу сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (271 мг) в виде желтого твердого вещества. 1H-ЯМР (CDCl3): 8,93 (1H, с), 7,44 (1H, с), 5,07 (1H, с), 3,88 (2H, с), 2,68 (3H, д), 2,25 (3H, с), 1,48-1,22 (6H, с).
Получение 70: Метиламид 1-ацетил-3,3-диметил-2,3-дигидро-1H-индол-6-сульфоновой кислот
Метиламид 1-ацетил-5-бром-3,3-диметил-2,3-дигидро-1H-индол-6-сульфоновой кислоты (270 мг, 0,75 ммоль), Pd/C (10%, 79 мг) и триэтиламин (209 мкл, 1,5 ммоль) суспендировали в MeOH (10 мл). Реакционную смесь перемешивали в атмосфере водорода в течение 1 часа, затем смесь фильтровали через Целит и фильтрат упаривали в вакууме с получением указанного в заголовке соединения (160 мг) в виде белого твердого вещества. 1H-ЯМР (CDCl3): 8,65 (1H, с), 7,62 (1H, д), 7,26 (1H, д), 4,52 (1H, с), 3,88 (2H, с), 2,70 (3H, д), 2,26 (3H, с), 1,40 (6H, с). МС: [M+H]+=283.
Получение 71: Метиламид 3,3-диметил-2,3-дигидро-1H-индол-6-сульфоновой кислоты
Метиламид 1-ацетил-3,3-диметил-2,3-дигидро-1H-индол-6-сульфоновой кислоты (160 мг, 0,56 ммоль) обрабатывали способом аналогичным тому, как описано для Получения 66. Указанное в заголовке соединение (91 мг) получали в виде бесцветного смолистого вещества. MC: [M+H]+=241.
Получение 72: Диметиламид 3,3-диметил-2,3-дигидро-1H-индол-6-сульфоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получениях 69-71, с использованием диметиламина вместо метиламина. 1H-ЯМР (CDCl3): 7,14 (2H, с), 6,97 (1H, с), 3,41 (2H, с), 2,74 (6H, с), 1,35 (6H, с).
Получение 73: Изопропиламид 3,3-диметил-2,3-дигидро-1H-индол-6-сульфоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получениях 69-71, с использованием изопропиламина вместо метиламина. 1H-ЯМР (CDCl3): 7,23 (1H, дд), 7,15-7,00 (2H, м), 4,60 (1H, д), 3,54-3,40 (1H, м), 3,37 (2H, с), 1,32 (6H, с), 1,09 (6H, д).
Получение 74: 5-Фтор-3,3-диметил-2,3-дигидро-1H-индол
Указанное в заголовке соединение (1,6 г) получали следуя процедуре аналогичной той, которая описана в Получении 25, с использованием 4-фторфенилгидразингидрохлорида (8,0 г) вместо 3-хлорфенилгидразингидрохлорида. 1H-ЯМР (ДМСО-d6): 6,85 (1H, дд), 6,77-6,62 (1H, м), 6,44 (1H, дд), 5,32 (1H, с), 3,18 (2H, с), 1,21 (6H, с). Также выделяли 1-(5-Фтор-3,3-диметил-2,3-дигидроиндол-1-ил)-этанон (3,1 г). 1H-ЯМР (ДМСО-d6): 8,01 (1H, дд), 7,25-7,10 (1H, м), 7,05-6,90 (1H, м), 3,87 (2H, с), 2,15 (3H, с), 1,30 (6H, с).
Получение 75: Бром-5-фтор-3,3-диметил-2,3-дигидро-1H-индол
К раствору 5-фтор-3,3-диметил-2,3-дигидро-1H-индола (1,6 г, 9,6 ммоль) в 98% H2SO4 (20 мл) добавляли Ag2SO4 (1,6 г, 5,1 ммоль) и суспензию перемешивали в атмосфере азота в течение 30 минут. Смесь затем охлаждали до -5°C, медленно добавляли Br2 (508 мкл, 9,9 ммоль) в течение 15 минут и перемешивание поддерживали при указанной температуре в течение 1 часа. Реакционную смесь медленно выливали в 200 мл смеси вода/лед и затем фильтровали через Целит. К полученному раствору добавляли 50% водный раствор NaOH (до pH=9-10) и продукт экстрагировали при помощи EtOAc (3×). Органическую фазу сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (1,58 г) в виде темного масла. 1H-ЯМР (ДМСО-d6): 7,03 (1H, д), 6,64 (1H, д), 5,59 (1H, с), 3,20 (2H, с), 1,25-1,15 (6H, м). МС: [M+H]+=244.
Получение 76: 6-Бром-5-фтор-3,3-диметил-1-триизопропилсиланил-2,3-дигидро-1H-индол
Триизопропилсилилтрифторметансульфонат (3,5 мл, 13,0 ммоль) и DIPEA (3,2 мл, 19,5 ммоль) добавляли к раствору 6-бром-5-фтор-3,3-диметил-2,3-дигидро-1H-индола (1,5 г, 6,5 ммоль) в DCM (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем гасили насыщенным водным раствором NaHCO3 и экстрагировали при помощи DCM (×3). Органическую фазу сушили (MgSO4), фильтровали и концентрировали. Неочищенное вещество очищали при помощи SiO2 хроматографии (10% EtOAc в петролейном эфире) с получением указанного в заголовке соединения (1,8 г) в виде белого твердого вещества. 1H-ЯМР (ДМСО-d6): 7,07 (1H, д), 6,65 (1H, д), 3,44 (2H, с), 1,64-1,33 (3H, м), 1,33-1,17 (6H, м), 1,10 (18H, д).
Получение 77: 6-Бензолсульфонил-5-фтор-3,3-диметил-1-триизопропилсиланил-2,3-дигидро-1H-индол
BuLi (2,2 M раствор в Et2O. 2,4 мл, 5,4 ммоль) медленно добавляли к раствору 6-бром-5-фтор-3,3-диметил-1-триизопропилсиланил-2,3-дигидро-1H-индола (1,8 г, 4,5 ммоль) в ТГФ (20 мл) при -78°C в атмосфере азота. Раствор перемешивали в течение 15 минут при -78°C и затем медленно добавляли фенилсульфонилфторид (541 мкл, 4,5 ммоль). Перемешивание поддерживали в течение 1 часа при указанной температуре. Реакционную смесь гасили путем добавления насыщенного водного раствора NH4Cl и продукт экстрагировали при помощи EtOAc. Органическую фазу сушили (MgSO4), фильтровали и концентрировали. Неочищенное вещество очищали при помощи SiO2 хроматографии (10% EtOAc в петролейном эфире) с получением указанного в заголовке соединения (1,4 г) в виде желтого твердого вещества. 1H-ЯМР (CDCl3): 7,98 (2H, д), 7,64-7,56 (1H, м), 7,56-7,48 (2H, м), 7,23 (1H, д), 6,68 (1H, д), 3,50 (2H, с), 1,55-1,45 (3H, м), 1,24 (6H, с), 1,21-1,11 (18H, м).
Получение 78: 6-Бензолсульфонил-5-фтор-3,3-диметил-2,3-дигидро-1H-индол
6-Бензолсульфонил-5-фтор-3,3-диметил-1-триизопропилсиланил-2,3-дигидро-1H-индол (1,43 мг, 3,1 ммоль) обрабатывали при помощи TBAF (1M раствор в ТГФ, 4,0 мл) в безводном ТГФ (20 мл) и полученный раствор перемешивали при комнатной температур в течение 1,5 часа. Реакционную смесь гасили насыщенным водным раствором NH4Cl и экстрагировали при помощи EtOAc. Неочищенное вещество очищали хроматографией (петролейный эфир: EtOAc 1:1) с получением указанного в заголовке соединения (810 мг) в виде бесцветного масла. MC: [M+H]+=306.
Получение 79: 4-Метокси-бензолсульфонилфторид
К раствору 4-метокси-бензолсульфонилхлорида (1,0 г, 4,8 ммоль) в ацетонитриле (20 мл) добавляли KF (563 мг, 9,7 ммоль) и полученную смесь перемешивали в течение 16 часов при комнатной температуре. Твердое вещество отфильтровывали и фильтрат концентрировали в вакууме. Остаток растворяли в EtOAc и промывали водой. Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения (780 мг) в виде бесцветного масла. 1H-ЯМР (CDCl3): 7,97 (2H, д), 7,09 (2H, д), 3,94 (3H, с).
Получение 80: 5-Фтор-6-(4-метоксибензолсульфонил)-3,3-диметил-1-триизопропилсиланил-2,3-дигидро-1H-индол
Указанное в заголовке соединение получали, исходя из 6-бром-5-фтор-3,3-диметил-1-триизопропилсиланил-2,3-дигидро-1H-индола (400 мг, 1,0 ммоль) и 4-метоксибензолсульфонилфторида (190 мг, 1,0 ммоль), следуя способам аналогичным тем, которые описаны для Получения 77, с получением указанного в заголовке соединения (270 мг) в виде желтого масла. 1H-ЯМР (CDCl3): 7,92 (2H, дд), 7,20 (1H, д), 7,01-6,94 (2H, м), 6,67 (1H, д), 3,87 (3H, с), 3,49 (2H, с), 1,56-1,43 (3H, м), 1,25-1,21 (6H, м), 1,17 (18H, д).
Получение 81: 5-Фтор-6-(4-метоксибензолсульфонил)-3,3-диметил-2,3-дигидро-1H-индол
5-Фтор-6-(4-метоксибензолсульфонил)-3,3-диметил-1-триизопропилсиланил-2,3-дигидро-1H-индол (250 мг, 0,51 ммоль) обрабатывали при помощи TBAF, следуя способам аналогичным тем, которые описаны в Получении 78, с получением указанного в заголовке соединения (110 мг) в виде бледно-желтого масла. 1H-ЯМР (CDCl3): 7,99-7,81 (2H, м), 7,21 (1H, д), 7,04-6,92 (2H, м), 6,73 (1H, д), 3,87 (3H, с), 3,35 (2H, с), 1,27 (6H, с).
Получение 82: 1-Ацетил-5-фтор-3,3-диметил-2,3-дигидро-1H-индол-6-сульфонилхлорид
1-(5-Фтор-3,3-диметил-2,3-дигидроиндол-1-ил)этанон (1,1 г, 6,0 ммоль) обрабатывали хлорсульфоновой кислотой (10 мл), следуя способам аналогичным тем, которые описаны в Получении 63, с получением желаемого соединения (900 мг) в виде серого твердого вещества. 1H-ЯМР (Ацетон-d6): 8,76 (1H, д), 7,54 (1H, д), 4,10 (2H, с), 2,32-2,23 (3H, м), 1,48 (6H, с).
Получение 83: 1-[5-Фтор-3,3-диметил-6-(пирролидин-1-сульфонил)-2,3-дигидроиндол-1-ил]этанон
Указанное в заголовке соединение получали, исходя из 1-ацетил-5-фтор-3,3-диметил-2,3-дигидро-1H-индол-6-сульфонилхлорида (400 мг, 1,3 ммоль) и пирролидина (650 мкл, 7,87 ммоль), следуя способам, аналогичным тем, которые описаны в Получении 69, с получением указанного в заголовке соединения (287 мг) в виде темно-оранжевого твердого вещества. MC: [M+H]+=341.
Получение 84: 5-Фтор-3,3-диметил-6-(пирролидин-1-сульфонил)-2,3-дигидро-1H-индол
Указанное в заголовке соединение получали путем обработки 1-[5-фтор-3,3-диметил-6-(пирролидин-1-сульфонил)-2,3-дигидроиндол-1-ил]-этанона (287 мг, 0,84 ммоль) хлористоводородной кислотой (5 M, 1,7 мл), следуя способам, аналогичным тем, которые описаны в Получении 66, с получением указанного в заголовке соединения (145 мг) в виде светло-коричневого масла. 1H-ЯМР (ДМСО-d6): 7,13 (1H, д), 6,79 (1H, д), 5,79 (1H, д), 3,25 (2H, с), 3,23-3,11 (4H, м), 1,83-1,68 (4H, м), 1,25 (6H, с).
Получение 85: 1-(6-Этансульфонил-5-фтор-3,3-диметил-2,3-дигидроиндол-1-ил)-этанон
Указанное в заголовке соединение получали из 1-ацетил-5-фтор-3,3-диметил-2,3-дигидро-1H-индол-6-сульфонилхлорида (300 мг, 0,98 ммоль), иодэтана (396 мкл, 4,9 ммоль), Na2SO3 (236 мг, 1,87 ммоль), NaHCO3 (165 мг, 1,96 ммоль) и TBABr (2 мг, 0,006 ммоль), следуя способам, аналогичным тем, которые описаны в Получении 64, с получением указанного в заголовке соединения (160 мг). 1H-ЯМР (CDCl3): 8,67 (1H, д), 6,98 (1H, д), 3,86 (2H, с), 3,38-3,19 (2H, м), 2,22 (3H, с), 1,38 (6H, с), 1,34-1,27 (3H, м).
Получение 86: 6-Этансульфонил-5-фтор-3,3-диметил-2,3-дигидро-1H-индол
1-(6-Этансульфонил-5-фтор-3,3-диметил-2,3-дигидроиндол-1-ил)этанон (160 мг, 0,53 ммоль) обрабатывали хлористоводородной кислотой (5 M, 1,1 мл), следуя способам, аналогичным тем, которые описаны в Получении 66, с получением указанного в заголовке соединения (80 мг). MC: [M+H]+ 258.
Получение 87: 5-Фтор-3,3-диметил-6-(пропан-2-сульфонил)-2,3-дигидро-1H-индол
Получали, следуя способам аналогичным тем, которые описаны в Получениях 85 и 86, с использованием 2-иодпропана вместо иодэтана. MC: [M+H]+=272.
Получение 88: 1-[6-(3-Хлорпропан-1-сульфонил)-5-фтор-3,3-диметил-2,3-дигидроиндол-1-ил]этанон
Получали из 1-ацетил-5-фтор-3,3-диметил-2,3-дигидро-1H-индол-6-сульфонилхлорида (500 мг, 1,64 ммоль) и 1-хлор-3-иодпропана (863 мкл, 8,2 ммоль), следуя способам, аналогичным тем, которые описаны в Получении 64. Указанное в заголовке соединение (502 мг) получали в виде бледно-желтого масла. 1H-ЯМР (CDCl3): 8,72 (1H, д), 7,01 (1H, д), 3,88 (2H, с), 3,75-3,57 (2H, м), 3,57-3,35 (2H, м), 2,37-2,18 (5H, м), 1,41 (6H, с).
Получение 89: 1-(6-Циклопропансульфонил-5-фтор-3,3-диметил-2,3-дигидроиндол-1-ил)-этанон
К раствору 1-[6-(3-хлорпропан-1-сульфонил)-5-фтор-3,3-диметил-2,3-дигидроиндол-1-ил]этанона (502 мг, 1,44 ммоль) при -78°C в ТГФ (30 мл) в атмосфере N2 медленно добавляли KHMDS (0,5 M в толуоле, 3 мл). Раствор перемешивали в течение 10 минут при указанной температуре и затем в течение 30 минут при температуре окружающей среды, затем гасили 1 M раствором хлористоводородной кислоты и экстрагировали при помощи EtOAc. Органическую фазу сушили (MgSO4), фильтровали и концентрировали. Неочищенное вещество очищали при помощи SiO2 хроматографии (EtOAc:Петролейный эфир 1:1), с получением указанного в заголовке соединения (310 мг). MC: [M+H]+=312.
Получение 90: 6-Циклопропансульфонил-5-фтор-3,3-диметил-2,3-дигидро-1H-индол
1-(6-Циклопропансульфонил-5-фтор-3,3-диметил-2,3-дигидроиндол-1-ил)-этанон (310 мг, 0,99 ммоль) обрабатывали способом, аналогичным тому, который описан в Получении 66, с получением указанного в заголовке соединения (106 мг), которое использовали без дополнительной очистки. MC: [M+H]+=270.
Получение 91: трет-Бутиловый эфир 6-хлор-3,3-бис-гидроксиметил-2-оксо-2,3-дигидроиндол-1-карбоновой кислоты
Смесь трет-бутилового эфира 6-хлор-2-оксо-2,3-дигидроиндол-1-карбоновой кислоты (2,7 г, 10,1 ммоль), карбоната калия (4,2 г, 30,3 ммоль), ТГФ (150 мл) и параформальдегида (7,2 г, 0,24 моль) перемешивали при 20°C в течение 2 часов, затем выливали на лед (100 г) и насыщенный водный раствор NaHCO3 (100 мл) и экстрагировали при помощи EtOAc (4×100 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 30-100% EtOAc в петролейном эфире) давала оранжевое твердое вещество (3,7 г). Кристаллизация из EtOAc и петролейного эфира давала указанное в заголовке соединение (1,23 г). Хроматография маточного раствора давала дополнительное количество продукта (0,978 г). MC: [M-t-Bu]+=272 (фрагментный ион).
Получение 92: 6-Хлор-3,3-бис-гидроксиметил-1,3-дигидроиндол-2-он
Смесь трет-бутилового эфира 6-хлор-3,3-бис-гидроксиметил-2-оксо-2,3-дигидроиндол-1-карбоновой кислоты (1,9 г, 5,8 ммоль), DCM (50 мл) и TFA (10 мл) перемешивали при 20°C в течение 5 часов, затем упаривали в вакууме с получением полутвердого вещества. Осуществляли азеотропную перегонку с ТГФ, с получением указанного в заголовке соединения (2,5 г). MC: [M+H]+=228.
Получение 93: (6-Хлор-3-гидроксиметил-2,3-дигидро-1H-индол-3-ил)-метанол
Смесь 6-хлор-3,3-бис-гидроксиметил-1,3-дигидроиндол-2-она (5,8 ммоль), ТГФ (10 мл) и раствора комплекса боран-диметилсульфид в ТГФ (2 M, 30 мл) нагревали при 70°C в течение 3 часов, затем охлаждали до 20°C. MeOH (30 мл) добавляли по каплям (осторожно!) в течение 0,2 часа, затем смесь нагревали при температуре кипения с обратным холодильником в течение 2 часов. Полученную смесь охлаждали, затем упаривали в вакууме с получением маслянистого остатка. Хроматография (SiO2; градиентное элюирование с использованием 20-100% EtOAc в петролейном эфире) давала указанное в заголовке соединение (1,15 г) в виде масла, которое кристаллизовалось. MC: [M+H]+=214.
Получение 94: трет-Бутиловый эфир 6-хлор-3,3-бис-гидроксиметил-2,3-дигидроиндол-1-карбоновой кислоты
Смесь (6-хлор-3-гидроксиметил-2,3-дигидро-1H-индол-3-ил)метанола (1,1 г, 5,15 ммоль), ди-трет-бутилдикарбоната (1,24 г, 5,67 ммоль) и ТГФ (20 мл) перемешивали при 20°C в течение 24 часов, затем при ~40°C в течение 1 часа, затем упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-100% EtOAc в петролейном эфире) давала указанное в заголовке соединение (1,15 г) в виде масла, которое затем отверждалось. MC: [M-H]-=312.
Получение 95: трет-Бутиловый эфир 1-дифенилметил-6'-хлор-1',2'-дигидроспиро[азетидин-3,3'-индол]-1'-ил-карбоновой кислоты
К перемешиваемой смеси трет-бутилового эфира 6-хлор-3,3-бис-гидроксиметил-2,3-дигидроиндол-1-карбоновой кислоты (0,31 г, 1 ммоль), DIPEA (0,645 г, 5 ммоль) и ацетонитрила (5 мл) при -25°C в атмосфере азота добавляли раствор трифторметилсульфонового ангидрида в DCM (1 M, 2,1 мл) по каплям в течение 0,3 часов (T<-20°C), и полученную смесь перемешивали при -20°C в течение 1 часа), затем добавляли раствор C,C-дифенилметиламина (0,179 г, 0,98 ммоль) в ацетонитриле (2 мл) (T<-20°C) и перемешивание продолжали в течение 0,5 часа. Смесь медленно нагревали до 20°C и оставляли таким образом в течение 16 часов, нагревали при 75°C в течение 8 часов и затем упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 0-40% Et2O в петролейном эфире) давала указанное в заголовке соединение (0,273 г). 1H-ЯМР (CDCl3): 7,47 (4H, д), 7,35-7,27 (6H, м), 7,22 (2H, т), 7,05 (1H, дд), 4,41 (1H, с), 4,15-4,10 (2H, м), 3,37 (2H, д), 3,30 (2H, д), 1,64-1,55 (9H, м).
Получение 96: трет-Бутиловый эфир 6'-хлор-1',2'-дигидроспиро[азетидин-3,3'-индол]-1'-ил-карбоновой кислоты
трет-Бутиловый эфир 1-дифенилметил-6'-хлор-1',2'-дигидроспиро[азетидин-3,3'-индол]-1'-ил-карбоновой кислоты (0,10 г, 0,22 ммоль) растворяли в DCM (2 мл) и затем охлаждали на бане лед-вода в атмосфере N2. Добавляли по каплям предварительно смешанные 1-хлорэтилхлорформиат (26 мкл, 0,24 ммоль) и DIPEA (76 мкл, 0,43 ммоль) в DCM (1 мл). Реакционную смесь перемешивали в течение 15 минут и затем перемешивали при комнатной температуре в течение 2 часов. Добавляли MeOH (10 мл) и смесь нагревали до температуры кипения с обратным холодильником в течение 30 минут. Смесь концентрировали в вакууме и использовали без дополнительной очистки. MC: [M+H]+=295.
Получение 97: трет-Бутиловый эфир 1-ацетил-6'-хлор-1',2'-дигидроспиро[азетидин-3,3'-индол]-1'-ил-карбоновой кислоты
К перемешиваемому раствору AcOH (19 мкл, 0,33 ммоль) в DCM (2,2 мл) в атмосфере N2 последовательно добавляли EDC (63 мг, 0,33 ммоль), HOAt (46 мг, 0,33 ммоль) и DIPEA (173 мкл, 0,99 ммоль). Через 10 минут добавляли амин и реакционную смесь перемешивали в течение 16 часов, затем гасили путем добавления насыщенного водного раствора NaHCO3 с последующим экстрагированием при помощи DCM (×3). Объединенные органические слои промывали водой, насыщенным солевым раствором и сушили над MgSO4, затем концентрировали в вакууме с получением указанного в заголовке соединения. MC: [M+H]+=337.
Получение 98: 1-Ацетил-6'-хлор-1',2'-дигидроспиро[азетидин-3,3'-индол] гидрохлорид
Осуществляли поглощение трет-бутилового эфира 1-ацетил-6'-хлор-1',2'-дигидроспиро[азетидин-3,3'-индол]-1'-ил-карбоновой кислоты (56 мг) в насыщенный раствор HCl в EtOAc (5 мл). Реакционную смесь перемешивали в течение 1 часа при температуре окружающей среды и затем концентрировали в вакууме. Осуществляли поглощение остатка в MeOH и снова концентрировали в вакууме, с получением указанного в заголовке соединения. MC: [M+H]+=237.
Получение 99: трет-Бутиловый эфир 1-ацетил-6'-бензил-1',2'-дигидроспиро[азетидин-3,3'-индол]-1'-ил-карбоновой кислоты
(1,3-Диизопропилимидазол-2-илиден)(3-хлорпиридил)палладий (II) дихлорид (2 мг, 10 моль%) и LiBr (41 мг, 0,47 ммоль) растворяли в безводном NMP и раствор дегазировали при помощи N2 в течение 5 минут. Затем добавляли трет-бутиловый эфир 1-ацетил-6'-хлор-1',2'-дигидроспиро[азетидин-3,3'-индол]-1'-ил-карбоновой кислоты (100 мг, 0,29 ммоль) и бензилцинкбромид (0,5M раствор в толуоле, 950 мкл, 0,475 ммоль). Реакционную смесь перемешивали в атмосфере N2 в течение 4 часов. Добавляли вторую аликвоту катализатора (2 мг) и бензилцинкбромида (950 мкл) и перемешивание поддерживали в течение 4 часов. Реакцию гасили водой и экстрагировали при помощи EtOAc. Органическую фазу сушили (MgSO4), фильтровали и концентрировали. Неочищенное вещество очищали колоночной хроматографией (EtOAc:петролейный эфир 1:1 до EtOAc 100%), с получением указанного в заголовке соединения (200 мг) в виде бледно-желтого масла (чистота ~50% по данным ЯМР, с примесями NMP), которое использовали без дополнительной очистки. MC: [M+H]+=393.
Получение 100: 1-Ацетил-6'-бензил-1',2'-дигидроспиро[азетидин-3,3'-индол] гидрохлорид
Осуществляли поглощение трет-бутилового эфира 1-ацетил-6'-бензил-1',2'-дигидроспиро[азетидин-3,3'-индол]-1'-ил-карбоновой кислоты в насыщенный раствор HCl в EtOAc (5 мл). Реакционную смесь перемешивали в течение 1 часа при температуре окружающей среды и затем концентрировали в вакууме. Осуществляли поглощение остатка в MeOH и снова концентрировали в вакууме, с получением указанного в заголовке соединения. MC: [M+H]+=293.
Получение 101: 6-Хлор-1-(2-триметилсиланилэтоксиметил)-1H-пирроло[3,2-c]пиридин
Гидрид натрия (60%, 1,40 г, 35,0 ммоль) добавляли по порциям в течение 20 минут к раствору 6-хлор-5-аза-индола (4,45 г, 29,1 ммоль) в DMF (17,2 мл) при 0°C (ледяная баня). Смесь перемешивали в течение 1 часа. Затем добавляли (2-хлорметоксиэтил)-триметилсилан (5,83 г, 35,0 ммоль) в течение 15 минут. После перемешивания в течение 1 часа реакцию гасили водой (100 мл) и смесь экстрагировали при помощи DCM (3×100 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (3×300 мл), сушили над Na2SO4, фильтровали и концентрировали. Хроматография на силикагеле (градиентное элюирование, 0-100%, EtOAc/петролейный эфир 40-60°C) давала указанное в заголовке соединение (6,7 г, 82%) в виде желтого масла. 1H-ЯМР (Me-d3-OD): 8,61 (1H, с), 7,63 (1H, с), 7,50 (1H, д), 6,71 (1H, д), 5,57 (2H, с), 3,53 (2H, т), 0,88 (2H, т), -0,04-0,16 (9H, м).
Получение 102: 3,3-Дибром-6-хлор-1-(2-триметилсиланилэтоксиметил)-1,3-дигидропирроло[3,2-c]пиридин-2-он
Раствор 6-хлор-1-(2-триметилсиланилэтоксиметил)-1H-пирроло[3,2-c]пиридина (6,70 г, 23,8 ммоль) в безводном 1,4-диоксане (41 мл) добавляли к раствору пиридинийгидробромида пербромида (38,0 г, 119 ммоль) в безводном 1,4-диоксане (41 мл) в течение 30 минут. После перемешивания в течение 1 часа добавляли воду (100 мл) и реакционную смесь перемешивали в течение 10 минут, экстрагировали при помощи EtOAc (100 мл ×3), промывали водой (3×100 мл) и насыщенным солевым раствором (3×100 мл), затем сушили над Na2SO4, фильтровали и концентрировали, с получением указанного в заголовке соединения (10,3 г) в виде красного масла. 1H-ЯМР (CDCl3): 8,56 (1H, с), 7,07 (1H, с), 5,21 (2H, с), 3,62 (2H, т), 0,99-0,92 (2H, м), 0,02-0,01 (9H, м). МС: [M+H]+=456.
Получение 103: 6-Хлор-1-(2-триметилсиланилэтоксиметил)-1,3-дигидропирроло[3,2-c]пиридин-2-он
Цинковый порошк (14,8 г, 226 ммоль) добавляли к бифазной смеси 3,3-дибром-6-хлор-1-(2-триметилсиланилэтоксиметил)-1,3-дигидропирроло[3,2-c]пиридин-2-она (10,3 г, 22,6 ммоль) в ТГФ (129 мл) и насыщенного раствора хлорида аммония (33 мл). Из-за замедленной экзотермы реакционную смесь охлаждали на льду. Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды, фильтровали и фильтрат концентрировали. Остаток растворяли в EtOAc (20 мл) и воде (20 мл) и пропускали через короткую пробку из целита, промывая при помощи EtOAc. Органический слой отделяли и водную фазу экстрагировали при помощи EtOAc (2×20 мл). Объединенные органические растворы промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали. Хроматография на силикагеле (градиентное элюирование, 0-100%, EtOAc/петролейный эфир) давала указанное в заголовке соединение (5,08 г, 75%) в виде бледно-желтого масла. 1H-ЯМР (Me-d3-OD): 8,14 (1H, с), 7,18 (1H, с), 5,17 (2H, с), 3,63 (2H, т), 0,94 (2H, т), 0,18-0,18 (9H, м).
Получение 104: 6-Хлор-3,3-диметил-1-(2-триметилсиланилэтоксиметил)-1,3-дигидропирроло[3,2-c]пиридин-2-он
6-Хлор-1-(2-триметилсиланилэтоксиметил)-1,3-дигидропирроло[3,2-c]пиридин-2-он (5,08 г, 17,05 ммоль) в безводном ТГФ (85 мл) охлаждали до -78°C. Добавляли1 M LiHMDS в ТГФ (37,5 мл) по каплям в течение 10 минут и реакционную смесь перемешивали в течение 30 минут. Добавляли метилиодид (3,18 мл, 51,1 моль) и реакционную смесь перемешивали в течение 30 минут, затем нагревали до температуры окружающей среды в течение 1,5 часа и гасили насыщенным водным раствором хлорида аммония (50 мл), затем экстрагировали при помощи EtOAc (3×50 мл). Объединенные органические экстракты промывали водой (3×150 мл), насыщенным солевым раствором (3×150 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Хроматография на силикагеле (градиентное элюирование 0-70%, EtOAc/петролейный эфир) давала указанное в заголовке соединение (2,83 г, 51%) в виде бледно-желтого масла; 1H-ЯМР (Me-d3-OD): 8,22 (1H, с), 7,22 (1H, с), 5,19 (2H, с), 3,60 (2H, т), 1,44 (6H, с), 0,93 (2H, т), 0,16-0,20 (9H, м).
Получение 105: 6-Хлор-3,3-диметил-1,3-дигидропирроло[3,2-c]пиридин-2-он
К раствору 6-хлор-3,3-диметил-1-(2-триметилсиланилэтоксиметил)-1,3-дигидропирроло[3,2-c]пиридин-2-она (7,25 г, 22,2 ммоль) в DCM (50 мл) добавляли TFA (50 мл) и полученную смесь перемешивали при 20°C в течение 1 часа. Раствор упаривали в вакууме и остаток растворяли в MeOH и растворитель снова выпаривали с получением твердого вещества. К аликвоте этого вещества (2,40 г) в ТГФ (53 мл) добавляли пиперазин (4,56 г, 52,9 ммоль). После перемешивания в течение 1 часа добавляли воду (30 мл) и EtOAc (30 мл) и органический слой отделяли. Органический слой промывали водой (30 мл ×2) и насыщенным солевым раствором (30 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Хроматография на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир) давала указанное в заголовке соединение (1,4 г, 67%) в виде бесцветного твердого вещества. 1H-ЯМР (Me-d3-OD): 8,12 (1H, с), 6,99 (1H, с), 1,41 (6H, с).
Получение 106: 6-Хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
6-Хлор-3,3-диметил-1,3-дигидропирроло[3,2-c]пиридин-2-он (1,4 г, 7,14 ммоль) растворяли в растворе комплекса боран - диметилсульфид в ТГФ (2 M, 36 мл, 71,4 ммоль) и нагревали до 65°C в течение 3 часов, затем охлаждали до температуры окружающей среды. Добавляли MeOH и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 1,5 часа. После перемешивания в течение ночи растворитель удаляли в вакууме. Колоночная хроматография на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир) давала указанное в заголовке соединение (1,23 г, 95%) в виде бесцветного твердого вещества. 1H-ЯМР (Me-d3-OD): 7,65 (1H, с), 6,42 (1H, с), 3,43 (2H, с), 1,34 (6H, с).
6-Хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин (альтернативный синтез)
Получение 107: 2-Хлор-5-иодпиридин-4-иламин
N-Иодсукцинимид (24,75 г, 110,0 ммоль) добавляли к раствору 2-хлорпиридин-4-иламина (12,85 г, 100,0 ммоль) в ацетонитриле (400 мл) и смесь перемешивали и поддерживали при температуре кипения с обратным холодильником в течение ночи. При охлаждении до комнатной температуры растворитель удаляли в вакууме и остаток распределяли между EtOAc (250 мл), насыщенным раствором тиосульфата натрия (100 мл) и водой (250 мл). Органический слой отделяли, промывали водой (2×250 мл), отделяли и растворитель удаляли в вакууме с получением оранжевого масла, которое подвергали колоночной хроматографии на диоксиде кремния. Градиентное элюирование с использованием 30-50% EtOAc в петролейном эфире давало бледно-оранжевое твердое вещество, которое промывали при помощи 25% EtOAc в петролейном эфире (80 мл). Твердые вещества собирали путем фильтрования и сушили досуха в вакууме с получением указанного в заголовке соединения (7,32 г) в виде не совсем белого твердого вещества. Маточные растворы концентрировали досуха в вакууме и остатки подвергали колоночной хроматографии на диоксиде кремния. Элюирование с использованием 30-50% EtOAc в петролейном эфире давал дополнительное количество чистого вещества (1,90 г). Объединенный выход: (9,22 г, 36%). 1H-ЯМР (ДМСО-d6) 8,20 (1H, с), 6,64 (1H, с), 6,50 (2H, шир. с). МС: [M+H]+ 255.
Получение 108: (2-Хлор-5-иодпиридин-4-ил)-(2-метилаллил)амин
Трет-бутоксид калия (4,56 г, 40,73 ммоль) добавляли к перемешиваемому раствору 2-хлор-5-иодпиридин-4-иламина (8,62 г, 33,94 ммоль) в безводном ТГФ (140 мл) и смесь перемешивали при комнатной температуре в течение 0,25 часов. Добавляли 3-бром-2-метилпропен (5,51 г, 40,73 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме и остатки распределяли между DCM (100 мл) и водой (100 мл). Органический слой отделяли, растворитель удаляли в вакууме и остатки подвергали колоночной хроматографии на диоксиде кремния. Градиентное элюирование с использованием 5-20% EtOAc в петролейном эфире давало указанное в заголовке соединение (7,93 г, 76%) в виде бледно-желтого масла. 1H-ЯМР (ДМСО-d6) 8,24 (1H, с), 6,50 (1H, шир. т), 6,39 (1H, с), 4,84 (1H, д), 4,73 (1H, д), 3,83 (2H, д), 1,70 (3H, с). МС: [M+H]+ 309.
Получение 109: 6-Хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Ацетат палладия (II) (300 мг, 1,34 ммоль), формиат натрия (2,40 г, 30,53 ммоль), тетра-н-бутил-аммонийхлорид (8,48 г, 30,53 ммоль) и триэтиламин (10,6 мл, 76,32 ммоль) добавляли к раствору (2-хлор-5-иодпиридин-4-ил)-(2-метилаллил)амина (7,85 г, 25,44 ммоль) в толуоле (200 мл) и воде (10 мл) и смесь перемешивали и поддерживали при 100°C в атмосфере азота в течение ночи. Смесь фильтровали в горячем состоянии и твердые вещества промывали толуолом (50 мл), водой (50 мл) и EtOAc (50 мл). Органический растворитель удаляли в вакууме, водные остатки разбавляли водой (100 мл) и экстрагировали при помощи EtOAc (2×200 мл). Органический слой отделяли, растворитель удаляли в вакууме и остатки подвергали колоночной хроматографии на диоксиде кремния. Элюирование с использованием 30-100% EtOAc в петролейном эфире давало указанное в заголовке соединение (4,12 г, 89%) в виде бесцветного твердого вещества. 1H-ЯМР (ДМСО-d6) 7,72 (1H, с), 6,75 (1H, шир. с), 6,33 (1H, с), 3,32 (2H, д), 1,25 (6H, с). МС: [M+H]+ 183.
Получение 110: трет-Бутиловый эфир 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
К раствору 6-хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридина (1,3 г, 7,4 ммоль) в ТГФ (20 мл) добавляли трет-бутилдикарбонат (4,1 г, 18,6 ммоль) и диметилпиридин-4-ил-амин (2,22 г, 18,6 ммоль) и раствор перемешивали в течение 2 часов. Добавляли воду (60 мл) и продукт экстрагировали при помощи EtOAc. Органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и упаривали. Хроматография (SiO2, с использованием для элюирования смеси петролейный эфир - EtOAc 0-40%) давала указанное в заголовке соединение (1,04 г). 1H-ЯМР (Me-d3-OD): 8,04 (1H, с), 7,60 (1H, с), 3,81 (2H, с), 1,59 (9H, с), 1,40 (6H, с). МС: [M+H]+=283.
Альтернативная процедура: трет-Бутоксид калия (600 мг, 5,36 ммоль) добавляли к перемешиваемому раствору 6-хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридина (800 мг, 4,38 ммоль) в безводном ТГФ (15 мл) и смесь перемешивали при комнатной температуре в течение 10 минут. Добавляли раствор ди-трет-бутилдикарбонат (1,07 г, 4,89 ммоль) в безводном ТГФ (15 мл) и смесь перемешивали при комнатной температуре в течение ночи. Органический растворитель удаляли в вакууме, водные остатки разбавляли водой (100 мл) и экстрагировали при помощи EtOAc (2×200 мл). Органические слои объединяли и растворитель удаляли в вакууме, с получением указанного в заголовке соединения (1,19 г, 96%), ЯМР данные соответствовали данным, полученным ранее.
Получение 111: трет-Бутиловый эфир 3,3-диметил-6-фениламино-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Сосуд, содержащий трет-бутиловый эфир 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (100 мг, 0,35 ммоль), анилин (64 мкл, 0,71 ммоль), 2-(дициклогексилфосфино)-3,6-диметокси-2'-4'-6'-три-изопропил-1,1'-бифенил (19 мг, 0,035 ммоль), Pd2(dba)3 (16 мг, 0,018 ммоль) и NaOtBu (51 мг, 0,53 ммоль) в толуоле (2 мл), дегазировали и продували азотом. Смесь перемешивали при 110°C в течение ночи, затем давали охладиться и затем распределяли между EtOAc и водой. Органический экстракт промывали насыщенным солевым раствором, сушили (Na2SO4) и упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 50-100% EtOAc в петролейном эфире) давала указанное в заголовке соединение (60 мг, 50%) в виде бесцветного твердого вещества. MC: [M+H]+=340.
Получение 112: (3,3-Диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин-6-ил)фениламин гидрохлорид
трет-Бутиловый эфир 3,3-диметил-6-фениламино-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (60 мг, 0,18 ммоль) обрабатывали при помощи HCl (насыщенный раствор в EtOAc) и перемешивали в течение 4 часов. Смесь затем упаривали досуха в вакууме с получением бесцветного смолистого вещества, которое использовали без дополнительной очистки. MC: [M+H]+=240.
Получение 113: трет-Бутиловый эфир 3,3-Диметил-6-o-толилокси-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Сосуд, содержащий трет-бутиловый эфир 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (100 мг, 0,35 ммоль), 2-метилфенол (38 мг, 0,42 ммоль), 2-ди-третбутилфосфино-2',4',6'-триизопропилбифенил (tBuXPhos) (5 мг, 0,01 ммоль), Pd(OAc)2 (1,6 мг, 0,007 ммоль) и фосфат калия (150 мг, 0,70 ммоль) в толуоле (2 мл), дегазировали и продували азотом. Смесь перемешивали при 110°C в течение ночи, затем давали охладиться и затем распределяли между EtOAc и водой. Органический экстракт промывали насыщенным солевым раствором, сушили (Na2SO4) и упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 0-10% EtOAc в петролейном эфире) давала указанное в заголовке соединение (89 мг) {MC: [M+H]+=355} в виде неразделимой смеси с исходным веществом.
Получение 114: 3,3-Диметил-6-o-толилокси-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Продукт из Получения 113 (89 мг) обрабатывали при помощи HCl (насыщенный раствор в EtOAc) и перемешивали в течение 5 часов. Смесь затем упаривали досуха в вакууме с получением бесцветного смолистого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
Получение 115: трет-Бутиловый эфир 3,3-диметил-6-(метилфениламино)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Раствор трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (116 мг, 0,41 ммоль), N-метиланилина (89 мкл, 0,82 ммоль), RuPhos (20 мг, 0,041 ммоль), хлор(2-дициклогексилфосфино-2',6'-ди-изопропокси-1,-1'-бифенил)[2-(2-аминоэтилфенил)палладия(II), продукта присоединения метил-трет-бутилового эфира (33 мг, 0,041 ммоль) и NaOtBu (99 мг, 1,8 ммоль) в толуоле (2 мл) дегазировали и продували азотом. Смесь перемешивали при 110°C в течение 5 часов. Смеси давали охладиться и затем распределяли между EtOAc и водой. Органический экстракт промывали насыщенным солевым раствором, сушили (Na2SO4) и упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 5-20% EtOAc в петролейном эфире) давала указанное в заголовке соединение (112 мг, 56%) в виде бесцветного твердого вещества. MC: [M+H]+=354.
Получение 116: (3,3-Диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин-6-ил)метилфениламин
трет-Бутиловый эфир 3,3-диметил-6-(метилфениламино)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (112 мг, 0,32 ммоль) обрабатывали при помощи HCl (насыщенный раствор в EtOAc) и перемешивали в течение 4 часов. Смесь затем упаривали досуха в вакууме с получением бесцветного смолистого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки.
Получение 117: трет-Бутиловый эфир 6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
К азот-дегазированной смеси трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (1,12 г, 4 ммоль), бромида лития (1,39 г, 16 ммоль), (1,3-диизопропилимидазол-2-илиден)(3-хлорпиридил)палладий (II) дихлорида (0,056 г, 0,08 ммоль), 1-метил-2-пирролидинона (10 мл) и ТГФ (10 мл) добавляли раствор бензилцинкбромида в ТГФ (0,5 M, 32 мл) и полученную смесь перемешивали при 20°C в течение 24 часов. Смесь выливали в воду (100 мл) и 5% водный раствор лимонной кислоты (30 мл) и полученную смесь экстрагировали при помощи 1:1 EtOAc - петролейный эфир. Органическую фазу промывали водой (3×50 мл), сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2, с использованием для элюирования смеси петролейный эфир - Et2O 0-80%) давала указанное в заголовке соединение (1,1 г) в виде масла. 1H-ЯМР (CDCl3): 8,20 (1H, с), 7,32 (4H, д), 7,27-7,03 (2H, м), 4,13 (2H, с), 3,71 (2H, с), 1,51 (9H, с), 1,37 (6H, с).
Получение 118: трет-Бутиловый эфир 6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Исходя из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Получении 117, с использованием 2-фторбензилцинкхлорида вместо бензилцинкхлорида. 1H-ЯМР (Me-d3-OD): 8,15 (1H, с), 7,64-7,20 (3H, м), 7,20-7,03 (2H, м), 4,12 (2H, с), 3,74 (2H, с), 1,50 (9H, с), 1,37 (6H, с). МС: [M+H]+=357.
Получение 119: 6-(2-Фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали из трет-бутилового эфира 6-(2-фторбензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способов подобных тем, которые описаны в Получении 116. MC: [M+H]+=257.
Получение 120: 6-(2-Хлорбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали способом, аналогичным способу получения 6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорида (Получение 119), с использованием 2-хлорбензилцинкхлорида вместо 2-фторбензилцинкхлорида. MC: [M+H]+=273.
Получение 121: 6-Циклогексилметил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали способом, аналогичным способу получения 6-(2-фтор-бензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорида (Получение 119), с использованием циклогексилметилцинкбромида вместо 2-фторбензилцинкхлорида. MC: [M+H]+=245.
Получение 122: 6-(3-Цианобензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали способом, аналогичным способу получения 6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорида (Получение 119), с использованием 3-цианобензилцинкбромида вместо 2-фторбензилцинкхлорида. MC: [M+H]+=264.
Получение 123: 6-(4-Хлорбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали способом, аналогичным способу получения 6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорида (Получение 119), с использованием 4-хлорбензилцинкхлорида вместо 2-фторбензилцинкхлорида. MC: [M+H]+=273.
Получение 124: трет-Бутиловый эфир (6-Метокси-4-метилпиридин-3-ил)-карбаминовой кислоты
К 5-амино-2-метокси-4-пиколину (5,0 г, 36,2 ммоль) и ди-трет-бутилдикарбонату (7,9 г, 36,2 моль) в ТГФ (80 мл) добавляли насыщенный водный раствор Na2CO3 (21 мл). Реакционную смесь перемешивали в течение ночи при температуре окружающей среды, затем концентрировали в вакууме и остаток распределяли между DCM и водой. Продукт экстрагировали при помощи DCM (×3). Объединенные органические слои промывали насыщенным солевым раствором и сушили над MgSO4. Продукт фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (8,6 г, чистота >90%) в виде красного твердого вещества. 1H-ЯМР (Me-d3-OD): 7,97 (1H, с), 6,69 (1H, с), 3,88 (3H, с), 2,25 (3H, с), 1,51 (9H, с). МС: [M+H]+=239.
Получение 125: (5-трет-Бутоксикарбониламино-2-метоксипиридин-4-ил)уксусная кислота
s-BuLi (2,2 экв., 1,4 M в циклогексане (59 мл)) медленно добавляли к интенсивно перемешиваемому раствору трет-бутилового эфира (6-метокси-4-метилпиридин-3-ил)карбаминовой кислоты (10,0 г, 37,8 ммоль) в ТГФ (315 мл) при -78°C в атмосфере N2. Через 10 минут осуществляли барботирование CO2 из твердого источника через канюлю в течение 1 часа, при этом давая смеси медленно нагреться до комнатной температуры. Реакционную смесь осторожно гасили при помощи 2 M раствора хлористоводородной кислоты до тех пор, пока pH2 не доводили до pH 4 при помощи водного раствора NaOH (1 M), и экстрагировали при помощи EtOAc (×3). Объединенные органические слои промывали водой, насыщенным солевым раствором и сушили над MgSO4. Продукт фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (10,8 г, чистота >85%) в виде красного масла, которое использовали без дополнительной очистки. Образец очищали препаративной ВЭЖХ. 1H-ЯМР (Me-d3-OD): 8,26 (1H, шир. с), 6,74 (1H, с), 3,88 (3H, с), 3,48 (2H, с), 1,52 (9H, с). МС: [M+H]+=283.
Получение 126: трет-Бутиловый эфир 5-метокси-2-оксо-2,3-дигидропирроло[2,3-c]пиридин-1-карбоновой кислоты
(5-трет-Бутоксикарбониламино-2-метоксипиридин-4-ил)-уксусную кислоту (10 г, 35,4 ммоль) растворяли в DCM (142 мл) и последовательно добавляли EDC (7,5 г, 39 ммоль), HOAt (5,4 г, 39 ммоль) и DIPEA (15 мл, 85,7 ммоль) в атмосфере N2. Реакционную смесь перемешивали в течение 2 часов при температуре окружающей среды, затем гасили путем добавления насыщенного водного раствора NaHCO3 и экстрагировали при помощи DCM (×3). Объединенные органические экстракты промывали водой и насыщенным солевым раствором, затем сушили над MgSO4 и концентрировали в вакууме. Продукт очищали колоночной хроматографией, с получением указанного в заголовке соединения (9,5 г) в виде бледно-коричневого твердого вещества. 1H-ЯМР (ДМСО-d6): 8,38 (1H, с), 6,83 (1H, с), 3,84 (3H, с), 3,77 (2H, с), 1,57 (9H, с). МС: [M+H]+=265.
Получение 127: трет-Бутиловый эфир 5-метокси-3,3-диметил-2-оксо-2,3-дигидропирроло[2,3-c]пиридин-1-карбоновой кислоты
трет-Бутиловый эфир 5-метокси-2-оксо-2,3-дигидропирроло[2,3-c]пиридин-1-карбоновой кислоты (5,8 г, 22,0 ммоль) растворяли в ацетоне (73 мл) и добавляли K2CO3 (10,6 г, 46,1 ммоль) и затем MeI (7,8 г, 55,9 ммоль) в атмосфере N2. Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение ночи, давали охладиться и затем фильтровали. Фильтрат концентрировали в вакууме и продукт очищали колоночной хроматографией (100% DCM, Rf 0,21), с получением указанного в заголовке соединения. 1H-ЯМР (Me-d3-OD): 8,53 (1H, с), 6,86 (1H, с), 3,92 (3H, с), 1,66 (9H, с), 1,44 (6H, с). МС: [M+H]+=293.
Получение 128: трет-Бутиловый эфир 3,3-диметил-6-(2-метилаллил)-2,5-диоксо-2,3,5,6-тетрагидропирроло[2,3-c]пиридин-1-карбоновой кислоты
трет-Бутиловый эфир 5-метокси-3,3-диметил-2-оксо-2,3-дигидропирроло[2,3-c]пиридин-1-карбоновой кислоты нагревали с 3-бром-2-метилпропеном (4 экв.) при 100°C в течение 4 часов в реакционном сосуде и затем давали охладиться. Добавляли насыщенный раствор HCl в EtOAc ~10 об.) и реакционную смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь затем концентрировали в вакууме с получением указанного в заголовке соединения, которое использовали без дополнительной очистки. MC: [M+H]+=333.
Получение 129: трет-Бутиловый эфир 6-изобутил-3,3-диметил-2,5-диоксо-2,3,5,6-тетрагидропирроло[2,3-c]пиридин-1-карбоновой кислоты
Осуществляли поглощение 3,3-диметил-6-(2-метилаллил)-1,6-дигидро-3H-пирроло[2,3-c]пиридин-2,5-диона в MeOH (0,10 M) и добавляли 10% Pd/C (0,15 экв.). Реакционную смесь встряхивали в атмосфере H2 в течение 16 часов, затем фильтровали и концентрировали в вакууме. Продукт очищали колоночной хроматографией, с получением указанного в заголовке соединения. MC: [M+H]+=335.
Получение 130: 6-Изобутил-3,3-диметил-1,2,3,6-тетрагидропирроло[2,3-c]пиридин-5-он
трет-Бутиловый эфир 6-изобутил-3,3-диметил-2,5-диоксо-2,3,5,6-тетрагидропирроло[2,3-c]пиридин-1-карбоновой кислоты обрабатывали насыщенным раствором HCl в EtOAc в течение 1 часа, затем реакционную смесь упаривали в вакууме. Остаток растворяли в MeOH и растворитель снова выпаривали, с получением 6-изобутил-3,3-диметил-1,6-дигидро-3H-пирроло[2,3-c]пиридин-2,5-диона. Red-Al (1,5 экв., 67% в толуоле) добавляли к этому веществу в толуоле (0,20 M) при 80°C в атмосфере N2. Реакционную смесь поддерживали при 80°C в течение 1,5 часа. Добавляли дополнительное количество Red-Al, необходимое для доведения реакции до завершения. Реакционной смеси затем давали охладиться и осторожно гасили при помощи NaOH (1 M, водн.) на ледяной бане. Смесь затем разбавляли водой и продукт экстрагировали при помощи CHCl3:IPA (3:1, ×3). Объединенные органические слои промывали водой, насыщенным солевым раствором и сушили над MgSO4, затем концентрировали в вакууме, с получением указанного в заголовке соединения, которое использовали без дополнительной очистки. MC: [M+H]+=221.
Получение 131: 5-Метокси-3,3-диметил-2,3-дигидро-1H-пирроло[2,3-c]пиридин
Получали из трет-бутилового эфира 5-метокси-3,3-диметил-2-оксо-2,3-дигидропирроло[2,3-c]пиридин-1-карбоновой кислоты (Получение 126) путем удаления защиты и восстановления с использованием способов, аналогичных тем которые описаны в Получениях 116 и 130. MC: [M+H]+=179.
Получение 132: 3,3,6-Триметил-1,2,3,6-тетрагидропирроло[2,3-c]пиридин-5-он
Получали аналогично способу получения 6-изобутил-3,3-диметил-1,2,3,6-тетрагидропирроло[2,3-c]пиридин-5-она, с использованием иодметана вместо 3-бром-2-метилпропена и с исключением стадии гидрирования (см. Получения 128 и 130).
Получение 133: 6-Бензил-3,3-диметил-1,2,3,6-тетрагидропирроло[2,3-c]пиридин-5-он
Получали аналогично способу получения 6-изобутил-3,3-диметил-1,2,3,6-тетрагидропирроло[2,3-c]пиридин-5-она, с использованием бензилбромида вместо 3-бром-2-метилпропена и с исключением стадии гидрирования (см. Получения 128 и 130).
Общая Процедура 1 (PyBrop Связывание): трет-Бутиловый эфир (R)-4-[2-(6-бром-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (R)-4-карбоксиметил-2-метилпиперазин-1-карбоновой кислоты (100 мг, 0,39 ммоль), 6-броминдолин (100 мг, 0,43 ммоль) и триэтиламин (0,148 мл, 1,06 ммоль) растворяли в DCM (1,94 мл) при температуре окружающей среды. Добавляли PyBrop (199 мг, 0,43 ммоль) и реакционную смесь перемешивали в течение 18 часов. Растворитель удаляли в вакууме и остаток очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир), с получением указанного в заголовке соединения (97 мг, 52%) в виде бледно-желтого масла. 1H-ЯМР (Me-d3-OD): 8,32 (1H, с), 7,24-7,10 (2H, м), 5,50 (1H, с), 4,38-4,17 (3H, м), 3,83 (1H, д), 3,31 (1H, с), 3,17 (2H, т), 2,91 (1H, д), 2,81 (1H, д), 2,33 (1H, дд), 2,20-2,09 (1H, м), 1,48 (9H, с), 1,30 (3H, д).
Соединения, представленные в Таблице 1 ниже, были получены с использованием процедур, аналогичных тем, которые описаны выше, исходя из подходящего замещенного 2,3-дигидроиндола или дигидропирролопиридина и замещенного карбоксиметилпиперазина (синтезированных, как описано выше, номера Получений указаны, где это необходимо).
(1H-ЯМР Me-d3-OD, если не указано иное)
Общая Процедура 2 (HBTU связывание)
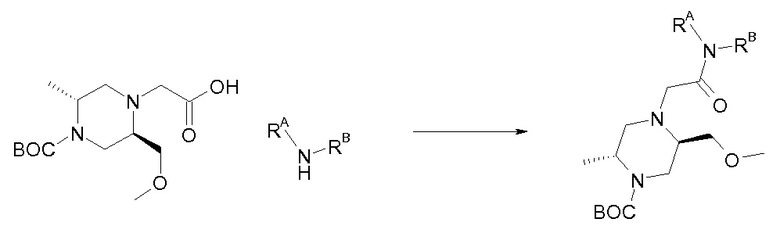
Исходный амин растворяли в DCM (0,1 M) и обрабатывали последовательно HBTU (1,5 экв.), трет-бутиловым эфиром (2R,5R)-4-карбоксиметил-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты (1,3 экв.) и затем DIPEA (3,0 экв.) в атмосфере N2. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакцию гасили путем добавления насыщенного водного раствора NaHCO3. Продукт экстрагировали при помощи DCM (×2). Объединенные органические слои промывали водой, насыщенным солевым раствором и сушили над MgSO4, затем концентрировали в вакууме. Продукт очищали при помощи ВЭЖХ или колоночной хроматографии.
Соединения, представленные в Таблице 2 ниже, были получены с использованием процедур, аналогичных тем, которые описаны выше, исходя из подходящего замещенного дигидропирролопиридина или терагидропирролопиридинона или дигидроспиро[азетидин-3,3'-индол] и замещенного карбоксиметилпиперазина (синтезированных, как описано выше, номера Получений указаны, где это необходимо).
Получение 134: 2-((R)-3-Метилпиперазин-1-ил)-1-(6-фениламино-2,3-дигидроиндол-1-ил)этанон
К Pd2(dba)3 (4 мг, 0,005 ммоль), (2-бифенил)P(t-Bu)2 (1 мг, 0,005 ммоль) и NaOtBu (31 мг, 0,32 ммоль) добавляли раствор анилина (26 мг, 0,27 ммоль) в толуоле (0,57 мл), с последующим добавлением трет-бутилового эфира (R)-4-[2-(6-бром-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (50 мг, 0,11 ммоль). Смесь нагревали до 100°C в течение 18 часов, затем фильтровали и концентрировали и остаток очищали препаративной ВЭЖХ (TFA способ), с получением указанного в заголовке соединения (12 мг, 24%) в виде оранжевого/коричневого твердого вещества. 1H-ЯМР (Me-d3-OD): 8,05 (1H, дд), 7,30-7,17 (2H, м), 7,13 (1H, д), 7,10-7,02 (2H, м), 6,91-6,81 (2H, м), 4,58 (1H, с), 4,43-4,26 (2H, м), 4,26-4,16 (1H, м), 4,16-4,04 (2H, м), 3,71 (1H, д), 3,58-3,38 (2H, м), 3,29-3,18 (4H, м), 1,51 (9H, с), 1,43 (3H, д).
Получение 135: 1-[6-(Метилфениламино)-2,3-дигидроиндол-1-ил]-2-((R)-3-метилпиперазин-1-ил)этанон
Исходя из N-метиланилина, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Получении 134 MC: [M+H]+=465.
Получение 136: трет-Бутиловый эфир (R)-4-[2-(6-изопропил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
Pd(PPh3)4 (32 мг, 0,03 ммоль), трет-бутиловый эфир (R)-4-[2-(6-бром-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (246 мг, 0,56 ммоль) и 2-изопропенил-4,4,5,5-тетраметил-1,3,2-диоксаборолан (113 мг, 0,67 ммоль) растворяли в DMF (1,87 мл). К DMF раствору добавляли Cs2CO3 (549 мг, 1,7 ммоль), растворенный в воде (0,37 мл). Реакционную смесь дегазировали и нагревали до 85°C в течение 18 часов, затем фильтровали и концентрировали. Колоночная хроматография на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир) давала трет-бутиловый эфир (R)-4-[2-(6-изопропенил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (0,18 г) в виде желтого масла. 10% Pd/C (48 мг, 0,05 ммоль) и трет-бутиловый эфир (R)-4-[2-(6-изопропенил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (0,18 г) смешивали с MeOH (4,5 мл). Реакционную смесь гидрировали при ~1 бар в течение 30 минут при температуре окружающей среды, затем фильтровали в условиях вакуума и концентрировали, с получением указанного в заголовке соединения (157 мг, 86%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 8,08 (1H, с), 7,15 (1H, д), 6,95 (1H, д), 4,35-4,18 (3H, м), 3,83 (1H, д), 3,30 (2H, с), 3,25-3,12 (3H, м), 2,97-2,76 (3H, м), 2,33 (1H, дд), 2,20-2,08 (1H, м), 1,48 (9H, с), 1,31 (3H, д), 1,25 (6H, д).
Получение 137: трет-Бутиловый эфир (R)-4-[2-(6-амино-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (R)-2-метил-4-[2-(6-нитро-2,3-дигидроиндол-1-ил)-2-оксоэтил]пиперазин-1-карбоновой кислоты (390 мг, 0,96 ммоль) и 10% Pd/C (0,102 мг, 0,10 ммоль) смешивали с MeOH (9,6 мл). Реакционную смесь гидрировали при ~1 бар в течение 30 минут при температуре окружающей среды, затем фильтровали в условиях вакуума и концентрировали, с получением указанного в заголовке соединения (360 мг, 100%) в виде не совсем белого стекловидного вещества. 1H-ЯМР (Me-d3-OD): 7,64 (1H, д), 6,97 (1H, д), 6,47 (1H, дд), 4,32-4,17 (3H, м), 3,82 (1H, д), 3,28 (2H, с), 3,24-3,14 (1H, м), 3,07 (2H, т), 2,92 (1H, д), 2,81 (1H, д), 2,32 (1H, дд), 2,24-2,07 (1H, м), 1,48 (9H, с), 1,30 (3H, д).
Получение 138: трет-Бутиловый эфир (R)-4-[2-(6-метансульфониламино-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (R)-4-[2-(6-амино-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (75 мг, 0,20 ммоль) растворяли в безводном DCM (1,0 мл) и добавляли триэтиламин (43 мкл, 0,24 ммоль) и метансульфонилхлорид (17 мкл, 0,22 ммоль). После перемешивания в течение 18 часов добавляли дополнительное количество триэтиламина (43 мкл) и метансульфонилхлорида (17 мкл). После перемешивания в течение 1 часа растворитель удаляли в вакууме и смесь растворяли в ТГФ (1,0 мл) и H2O (0,6 мл). Добавляли гидроксид натрия (24 мг, 0,6 ммоль) и реакционную смесь перемешивали в течение 18 часов. Очистка колоночной хроматографией на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир) давала указанное в заголовке соединение (65 мг, 72%) в виде не совсем белого стекловидного вещества. 1H-ЯМР (CDCl3): 8,17 (1H, с), 7,68 (1H, с), 7,19 (2H, с), 4,37-4,19 (3H, м), 3,85 (1H, д), 3,32 (2H, с), 3,29-3,10 (3H, м), 2,94 (3H, с), 2,88 (1H, д), 2,74 (1H, д), 2,41 (1H, д), 2,23 (1H, т), 1,47 (9H, с), 1,28-1,25 (3H, м).
Получение 139: трет-Бутиловый эфир (R)-4-[2-(2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
10% Pd/C (62 мг, 0,06 ммоль) и трет-бутиловый эфир (R)-4-[2-(4-хлор-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (232 мг, 0,6 ммоль) смешивали с ТГФ (5,82 мл) и добавляли триэтиламин (1,22 мл, 0,87 ммоль). Реакционную смесь гидрировали при ~1 бар в течение 5 часов при температуре окружающей среды, затем фильтровали в условиях вакуума и растворитель выпаривали в вакууме. Остаток растворяли в MeOH и загружали на SCX колонку с использованием для элюирования MeOH, затем 2 M раствора аммиака в MeOH для выделения амина, и концентрировали с получением указанного в заголовке соединения (111 мг, 53%) в виде желтого масла, 1H-ЯМР (Me-d3-OD): 8,35 (1H, с), 8,31 (1H, д), 8,05 (1H, с), 4,33 (2H, т), 4,28-4,17 (1H, м), 3,83 (1H, д), 3,28 (2H, д), 3,24-3,08 (1H, м), 3,00-2,79 (3H, м), 2,36 (1H, дд), 2,26-2,12 (1H, м), 1,48 (9H, с), 1,31 (3H, д).
Получение 140: трет-Бутиловый эфир (R)-2-метил-4-[2-(6-метилкарбамоил-2,3-дигидроиндол-1-ил)-2-оксоэтил]пиперазин-1-карбоновой кислоты
Метиловый эфир 1-[2-((R)-4-трет-бутоксикарбонил-3-метилпиперазин-1-ил)ацетил]-2,3-дигидро-1H-индол-6-карбоновой кислоты (200 мг, 0,48 ммоль) растворяли в растворе 2,0 M метиламина в MeOH (2,4 мл) и нагревали в условиях микроволнового облучения при 120°C в течение 4 часов. Растворитель удаляли в вакууме и полученное масло очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир), с получением указанного в заголовке соединения (39 мг, 20%) в виде бесцветного твердого вещества, 1H-ЯМР (Me-d3-OD): 8,58 (1H, с), 7,51 (1H, д), 7,33 (1H, д), 4,39-4,28 (2H, м), 4,23 (1H, д), 3,88-3,77 (1H, м), 3,31-3,14 (3H, м), 2,92 (3H, с), 2,84 (1H, д), 2,39-2,30 (1H, м), 2,24-2,12 (1H, м), 1,48 (9H, с), 1,30 (3H, д).
Получение 141: 1-[2-((R)-4-трет-Бутоксикарбонил-3-метилпиперазин-1-ил)ацетил]-2,3-дигидро-1H-индол-6-карбоновая кислота
Метиловый эфир 1-[2-((R)-4-трет-бутоксикарбонил-3-метилпиперазин-1-ил)ацетил]-2,3-дигидро-1H-индол-6-карбоновой кислоты (690 мг, 1,65 ммоль) растворяли в ТГФ/MeOH/H2O (3,3/3,3/1,7 мл) и добавляли гидроксид натрия (331 мг, 8,27 ммоль). Реакционную смесь перемешивали в течение 18 часов и нейтрализовали при помощи 2 M раствора хлористоводородной кислоты (4,1 мл). Растворитель удаляли в вакууме и остаток подвергали азеотропной перегонке с MeOH досуха, с получением указанного в заголовке соединения (630 мг, 95%) в виде красного/ярко-розового твердого вещества. 1H-ЯМР (Me-d3-OD): 8,76 (1H, с), 7,71 (1H, дд), 7,27 (1H, д), 4,39-4,28 (2H, м), 4,27-4,10 (1H, м), 3,83 (1H, д), 3,28-3,07 (3H, м), 2,93 (1H, д), 2,84 (1H, д), 2,33 (1H, дд), 2,26-2,08 (1H, м), 1,47 (9H, с), 1,34-1,27 (3H, м).
Получение 142: трет-Бутиловый эфир (R)-4-[2-(6-диметилкарбамоил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
Исходя из диметиламина и 1-[2-((R)-4-трет-бутоксикарбонил-3-метилпиперазин-1-ил)ацетил]-2,3-дигидро-1H-индол-6-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Общей Процедуре 1. MC: [M+H]+=431.
Получение 143: трет-Бутиловый эфир (R)-2-метил-4-{2-оксо-2-[6-(пирролидин-1-карбонил)-2,3-дигидроиндол-1-ил]этил}-пиперазин-1-карбоновой кислоты
Исходя из пирролидина и 1-[2-((R)-4-трет-бутоксикарбонил-3-метилпиперазин-1-ил)ацетил]-2,3-дигидро-1H-индол-6-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Общей Процедуре 1. 1H-ЯМР (Me-d3-OD): 8,31 (1H, с), 7,34 (1H, д), 7,22 (1H, дд), 4,32 (2H, т), 4,24 (1H, с), 3,83 (1H, д), 3,67-3,54 (2H, м), 3,54-3,41 (2H, м), 3,31-3,09 (5H, м), 2,93 (1H, д), 2,83 (1H, д), 2,41-2,23 (1H, м), 2,23-2,09 (1H, м), 2,02-1,98 (2H, м), 1,96-1,84 (2H, м), 1,48 (9H, с), 1,30 (3H, д).
Получение 144: 1-{1'-Ацетил-6-хлор-1,2-дигидроспиро[индол-3,4'-пиперидин]-1-ил}-2-[(3R)-4-трет-бутоксикарбонил-3-метилпиперазин-1-ил]этан-1-он
10% Pd/C (9 мг, 0,01 ммоль) и бензиловый эфир 6-хлор-1-{2-[(3R)-4-трет-бутоксикарбонил-3-метилпиперазин-1-ил]ацетил}-1,2-дигидроспиро[индол-3,4'-пиперидин]-1'-карбоновой кислоты (51 мг, 0,09 ммоль) смешивали с EtOAc (0,34 мл) при температуре окружающей среды и добавляли ледяную уксусную кислоту (0,02 мл). Реакционную смесь гидрировали при ~1 бар в течение 1 часа при температуре окружающей среды, затем фильтровали и концентрировали в вакууме. Неочищенное коричневого масло очищали препаративной ВЭЖХ, с получением продукта (21 мг). К раствору этого вещества в безводном DCM (0,18 мл) добавляли триэтиламин (13 мкл, 0,09 ммоль) и уксусный ангидрид (6 мкл, 0,06 ммоль). После перемешивания в течение 2 часов при температуре окружающей среды растворитель удаляли в вакууме и остаток растворяли в MeOH и загружали на SCX колонку с использованием для элюирования MeOH и затем 2,0 M раствора аммиака в MeOH для выделения амина. Растворитель удаляли в вакууме с получением указанного в заголовке соединения (21 мг, 92%) в виде бесцветного масла. MC: [M+H]+ 505.
Получение 145: трет-Бутиловый эфир (R)-2-метил-4-[2-(6-метилсульфамоил-2,3-дигидроиндол-1-ил)-2-оксоэтил]пиперазин-1-карбоновой кислоты
Исходя из трет-бутилового эфира (R)-4-[2-(5-бром-6-метилсульфамоил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Получении 139. 1H-ЯМР (Me-d3-OD): 8,63 (1H, с), 7,55 (1H, дд), 7,44 (1H, д), 4,35 (2H, т), 4,24 (1H, д), 3,83 (1H, д), 3,26-3,12 (1H, м), 2,93 (1H, д), 2,83 (1H, д), 2,55 (3H, с), 2,35 (1H, дд), 2,24-2,12 (1H, м), 1,48 (9H, с), 1,31 (3H, д).
Получение 146: трет-Бутиловый эфир (R)-4-[2-(6-диметилсульфамоил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
Исходя из трет-бутилового эфира (R)-4-[2-(5-Бром-6-диметилсульфамоил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Получении 139. 1H-ЯМР (Me-d3-OD): 8,56 (1H, с), 7,54-7,42 (2H, м), 4,43-4,18 (3H, м), 3,83 (1H, д), 3,26-3,10 (1H, м), 3,01-2,78 (2H, м), 2,70 (6H, с), 2,35 (1H, дд), 2,24-2,10 (1H, м), 1,48 (9H, с), 1,31 (3H, д).
Получение 147: трет-Бутиловый эфир (R)-2-метил-4-{2-оксо-2-[6-(пирролидин-1-сульфонил)-2,3-дигидроиндол-1-ил]этил}-пиперазин-1-карбоновой кислоты
Исходя из трет-бутилового эфира (R)-4-{2-[5-бром-6-(пирролидин-1-сульфонил)-2,3-дигидроиндол-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Получении 139). MC: [M+H]+=493
Получение 148: трет-Бутиловый эфир (R)-4-[2-(3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
Исходя из трет-бутилового эфира (R)-4-[2-(4-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Получении 139. 1H-ЯМР (Me-d3-OD): 8,10 (1H, д), 7,36-7,15 (2H, м), 7,15-7,04 (1H, м), 4,24 (1H, с), 4,13-4,01 (2H, м), 3,83 (1H, д), 3,29 (2H, с), 3,23-3,06 (1H, м), 2,96-2,86 (1H, м), 2,82 (1H, д), 2,38-2,23 (1H, м), 2,22-2,08 (1H, м), 1,48 (9H, с), 1,37 (6H, с), 1,30 (3H, д).
Получение 149: трет-Бутиловый эфир (R)-4-[2-(5-бром-6-диметилсульфамоил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
Исходя из трет-бутилового эфира (R)-4-[2-(5-бром-6-диметилсульфамоил-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты, указанное в заголовке соединение получали с использованием способов, подобных тем, которые описаны в Получении 139. 1H-ЯМР (Me-d3-OD): 8,56 (1H, с), 7,54-7,42 (2H, м), 4,43-4,18 (3H, м), 3,83 (1H, д), 3,26-3,10 (1H, м), 3,01-2,78 (2H, м), 2,70 (6H, с), 2,35 (1H, дд), 2,24-2,10 (1H, м), 1,48 (9H, с), 1,31 (3H, д).
Получение 150: трет-Бутиловый эфир (2R,5R)-4-[2-(3,3-диметил-6-фенокси-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5R)-4-[2-(6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты (100 мг, 0,21 моль), фенол (24 мг, 0,206 моль), K3PO4 (96 мг, 0,43 ммоль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (3 мг, 0,01 ммоль), Pd(OAc)2 объединяли и суспендировали в толуоле (0,714 мл). Реакционную смесь дегазировали при помощи азота и нагревали до 100°C. Через 18 часов реакционную смесь охлаждали до комнатной температуры. Добавляли MeOH и раствор пропускали через колонку Phenomenex NH2, с использованием для элюирования MeOH и затем 2,0 M раствора аммиака в MeOH для выделения амина. Остаток очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир), с получением (75 мг). Дополнительная очистка при помощи препаративной ВЭЖХ (щелочной способ) давала указанное в заголовке соединение (19 мг, 17%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 7,91 (1H, с), 7,51 (1H, с), 7,42 (2H, т), 7,22 (1H, т), 7,10 (2H, д), 4,22-4,12 (1H, м), 4,05 (2H, кв.), 3,95 (1H, д), 3,70 (1H, д), 3,60 (1H, дд), 3,52 (1H, д), 3,00 (1H, с), 2,85 (1H, дд), 2,64 (1H, дд), 1,48 (9H, с), 1,43 (6H, с), 1,22 (3H, д).
Получение 151: трет-Бутиловый эфир (R)-4-[2-(6-бензолсульфонил-5-фтор-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
Смесь трет-бутилового эфира (R)-4-[2-(6-бром-5-фтор-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (0,137 г, 0,30 ммоль), фенилсульфината натрия (0,064 г, 0,39 ммоль), комплекса трифторметилсульфонат меди (1)-бензол (0,0045 г, 0,009 ммоль), N,N'-диметилэтилендиамина (0,29 г, 0,33 ммоль) и диметилсульфоксида (1,5 мл) перемешивали при 150°C в атмосфере азота в течение 18 часов в герметично закрытом сосуде. Полученную смесь распределяли между водой (50 мл) и 1:1 Et2O-EtOAc (30 мл) и органическую фазу промывали водой (2×20 мл), сушили (Na2SO4) и упаривали в вакууме, с получением коричневого масла. Хроматография (SiO2; градиентное элюирование с использованием 0-100% EtOAc в петролейном эфире) давала указанное в заголовке соединение (0,031 г, ~25%). MC: [M+H]+=518.
Получение 152: трет-Бутиловый эфир (R)-4-{2-[6-(4-хлор-2-фторфенил)-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты трет-Бутиловый эфир (R)-4-[2-(6-хлор-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты, 2-фтор-5-хлорфенилбороновую кислоту, 2,0 M водный раствор K2CO3 и 1,4-диоксан дегазировали в атмосфере азота в течение 5 минут. Добавляли Pd(PPh3)4 и реакционную смесь нагревали до 110°C в течение 18 часов. После охлаждения до температуры окружающей среды реакционную смесь растворяли в MeOH, фильтровали и загружали на SCX колонку. Осуществляли элюирование с использованием MeOH и затем 2,0 M раствора аммиака в MeOH и щелочной элюат концентрировали в вакууме. Полученное коричневого масло очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100% EtOAc/петролейный эфир). Твердое вещество дополнительно очищали препаративной ВЭЖХ (щелочной способ), с получением указанного в заголовке соединения (17 мг, 14%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 8,46 (2H, с), 7,80 (1H, дд), 7,52-7,41 (1H, м), 7,27 (1H, т), 4,38 (2H, т), 4,24 (1H, с), 3,83 (1H, д), 3,27-3,06 (1H, м), 3,06-2,76 (3H, м), 2,36 (1H, дд), 2,25-2,11 (1H, м), 1,95-1,76 (1H, м), 1,48 (9H, с), 1,30 (3H, д).
Общая Процедура 3 (Добавление органоцинкгалогенида)
трет-Бутиловый эфир (2R,5R)-4-[2-(6-бензил-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
К дегазированному (N2) раствору LiBr (20 мг, 0,2 ммоль) и (1,3-диизопропилимидазол-2-илиден)(3-хлорпиридил)палладий (II) дихлорида (1,0 мг, 0,14 ммоль) в безводном ТГФ/NMP (1:1, 0,48 мл) добавляли раствор трет-бутилового эфира (2R,5R)-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (65 мг, 0,14 ммоль), ТГФ (0,1 мл) и бензилцинкбромида (575 мкл, 0,30 ммоль). Реакционную смесь перемешивали в течение 18 часов и разбавляли при помощи MeOH, затем загружали на SCX колонку с использованием для элюирования MeOH и затем 2,0 M раствора аммиака в MeOH для выделения амина. Растворитель удаляли в вакууме, с получением указанного в заголовке соединения (9,0 мг, 12%) в виде бесцветного масла. 1H-ЯМР (Me-d3-OD): 8,03 (1H, с), 7,33-7,03 (6H, м), 6,96 (1H, д), 4,15 (1H, д), 4,10-3,93 (5H, м), 3,76 (1H, дд), 3,67 (1H, д), 3,59-3,49 (2H, м), 2,93-2,83 (2H, м), 2,65 (1H, дд), 1,48 (9H, с), 1,35 (6H, с), 1,23 (3H, д).
Соединения, представленные в Таблице 3 ниже, были получены с использованием процедур, аналогичных тем, которые описаны выше, исходя из подходящего галоген-замещенного дигидроиндола или дигидропирролопиридина (синтез описан выше).
Получение 153: 6-Бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин, гидрохлоридная соль
Получали из трет-бутилового эфира 6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 116. MC: [M+H]+=239.
Соединения Получений 154-160 ниже были получены в две стадии, исходя из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты, путем (i) взаимодействия с подходящим арилалкилцинкгалогенидом, следуя процедуре, аналогичной той, которая описана для Получения 117, и (ii) удаления защиты, следуя процедуре, аналогичной той, которая описана для Получения 116.
Получение 154: 6-(3-Хлорбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль. MC: [M+H]+=273.
Получение 155: 3,3-Диметил-6-(1-фенилэтил)-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль. MC: [M+H]+=253.
Получение 156: 6-(4-Фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль. MC: [M+H]+=257.
Получение 157: 6-(3-Метоксибензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль. MC: [M+H]+=269.
Получение 158: 6-(3-Фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль. MC: [M+H]+=257.
Получение 159: 6-(4-Метоксибензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль. MC: [M+H]+=269.
Получение 160: 6-(2,4-Дифторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль. MC: [M+H]+=275.
Получение 161: трет-Бутиловый эфир 6-циклопент-1-енил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
Смесь трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (340 мг, 1,2 ммоль), циклопентен-1-илбороновой кислоты (270 мг, 2,4 ммоль), карбоната калия (414 мг, 3,0 ммоль) и дихлорбис(три-o-толилфосфин)палладия(II) (38 мг, 0,04 ммоль) в 1,4-диоксане (6 мл) и воде (1,5 мл) дегазировали и нагревали в реакционном сосуде при 90°C в течение 2 часов. Реакционную смесь охлаждали, добавляли воду (20 мл) и продукт экстрагировали при помощи EtOAc (2×20 мл). Объединенные органические слои сушили, фильтровали и растворитель выпаривали. Неочищенное вещество очищали колоночной хроматографией (SiO2, петролейный эфир-EtOAc 0-60%), с получением указанного в заголовке соединения (213 мг, 57%). MC: [M+H]+=315.
Получение 162: 6-Циклопент-1-енил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль.
Получали из трет-бутилового эфира 6-циклопент-1-енил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=215.
Получение 163: трет-Бутиловый эфир (2R,5R)-4-[2-(6-циклопентил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты.
К раствору трет-бутилового эфира (2R,5R)-4-[2-(6-циклопент-1-енил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты (см. Таблица 1) (60 мг, 0,12 ммоль) в ТГФ (5 мл) и MeOH (5 мл) добавляли палладий на углероде (10%, 10 мг) и смесь гидрировали в течение 2 часов. Катализатор фильтровали и фильтрат упаривали с получением указанного в заголовке соединения (52 мг, 87%) в виде белого твердого вещества. MC: [M+H]+=501.
Получение 164: трет-Бутиловый эфир 3,3-диметил-6-(1-фенилвинил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
Указанное в заголовке соединение получали с использованием процедуры, аналогичной той, которая описана для Получения 161, с использованием 1-фенилвинил-бороновой кислоты вместо циклопентен-1-илбороновой кислоты; реакционную смесь нагревали при 90°C в течение ночи. MC: [M+H]+=351.
Получение 165: 3,3-Диметил-6-(1-фенилвинил)-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль.
Получали из трет-бутилового эфира 3,3-диметил-6-(1-фенилвинил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=251.
Получение 166: трет-Бутиловый эфир 6-бензоил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
К раствору трет-бутилового эфира 3,3-диметил-6-(1-фенилвинил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (914 мг, 2,6 ммоль) в ТГФ (10 мл), ацетона (5 мл) и воды (5 мл) добавляли NaIO4 (2,8 г, 13,05 ммоль), затем OsO4 (2 мл 4% раствора в воде, 0,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали в вакууме, добавляли воду (20 мл) и продукт экстрагировали при помощи EtOAc (2×20 мл). Органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и растворитель выпаривали. Неочищенный продукт очищали колоночной хроматографией на диоксиде кремния с использованием для элюирования смеси петролейный эфир - EtOAc 0-40%, с получением указанного в заголовке соединения (654 мг, 65%). MC: [M+H]+=353.
Получение 167: 6-Бензоил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль.
Получали из трет-бутилового эфира 6-бензоил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=253.
Получение 168: трет-Бутиловый эфир 6-циклогекс-1-енил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
Указанное в заголовке соединение получали с использованием способа аналогичного тому, который описан для Получения 161, с использованием циклогексен-1-илбороновой кислоты вместо циклопентен-1-илбороновой кислоты; реакционную смесь нагревали при 90°C в течение ночи. MC: [M+H]+=329.
Получение 169: 6-Циклогекс-1-енил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль.
Получали из трет-бутилового эфира 6-циклогекс-1-енил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=229.
Получение 170: трет-Бутиловый эфир 3,3,6-триметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
Получали из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты способом аналогичным тому, который описан для Получения 117, с использованием метилцинкхлорида (2,0 M в ТГФ, 9,75 ммоль), с получением указанного в заголовке соединения (510 мг, 55%) в виде бесцветного масла. MC: [M+H]+=263.
Получение 171: трет-Бутиловый эфир 3,3,6-триметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты, 5-оксид.
К трет-бутиловому эфиру 3,3,6-триметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,4 г, 1,53 ммоль) в DCM (3,2 мл) добавляли 3-хлорпербензойную кислоту (0,29 г, 1,7 ммоль) при температуре окружающей среды. Реакционную смесь перемешивали в течение 18 часов при температуре окружающей среды. Добавляли дополнительное количество 3-хлорпербензойной кислоты (750 мг) и реакционную смесь перемешивали в течение 6 часов. Добавляли DCM (5,0 мл) и органический раствор промывали насыщенным водным раствором бикарбоната натрия (3×5,0 мл), сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Хроматография (SiO2, градиентное элюирование, 0-100%, EtOAc/петролейный эфир, затем SiO2, градиентное элюирование, 0-10%, MeOH/DCM) давала указанное в заголовке соединение (0,38 г, 90%) в виде бледно-желтого пенистого вещества. MC: [M+H]+=279.
Получение 172: трет-Бутиловый эфир 6-ацетоксиметил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
трет-Бутиловый эфир 3,3,6-триметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты, 5-оксид (0,375 г, 1,34 ммоль) растворяли в уксусном ангидриде (1,68 мл) и нагревали до 125°C в течение 1 часа. Реакционную смесь охлаждали до температуры окружающей среды и концентрировали в вакууме. Хроматография (SiO2, градиентное элюирование, 0-100%, EtOAc/петролейный эфир) давала указанное в заголовке соединение (0,280 мг, 65%) в виде желтого масла. MC: [M+H]+=321.
Получение 173: трет-Бутиловый эфир 6-гидроксиметил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
К трет-бутиловому эфиру 6-ацетоксиметил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,261 г, 0,82 ммоль) в MeOH (8,2 мл) добавляли карбонат калия (0,45 г, 3,3 ммоль) при температуре окружающей среды. Реакционную смесь перемешивали в течение 2 часов при температуре окружающей среды. Добавляли воду (10 мл) и реакционную смесь экстрагировали при помощи EtOAc (3×10 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (30 мл), сушили над сульфатом натрия, фильтровали и концентрировали, с получением указанного в заголовке соединения (0,268 г) в виде бледно-желтого масла, которое использовали без дополнительной очистки. MC: [M+H]+=279.
Получение 174: трет-Бутиловый эфир 6-метансульфонилоксиметил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
К трет-бутиловому эфиру 6-гидроксиметил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,268 г, 0,96 ммоль) и триэтиламину (0,417 мл, 3 ммоль) в EtOAc (4,8 мл) добавляли метансульфонилхлорид (0,224 мл, 2,9 ммоль) при 0°C. Реакционную смесь перемешивали при указанной температуре в течение 1 часа. Добавляли воду (5 мл) и водную смесь экстрагировали при помощи EtOAc (3×5,0 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (20 мл), сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме, с получением указанного в заголовке соединения (0,279 г) в виде бледно-желтого масла. MC: [M+H] +=357.
Получение 175: трет-Бутиловый эфир 3,3-диметил-6-пиразол-1-илметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты.
К раствору трет-бутоксида калия (0,090 г, 0,80 ммоль) в безводном ТГФ (4,0 мл) добавляли пиразол (0,104 г, 1,52 ммоль). Реакционную смесь перемешивали в течение 30 минут. Добавляли трет-бутиловый эфир 6-метансульфонилоксиметил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,271 г, 0,76 ммоль) при температуре окружающей среды и реакционную смесь перемешивали в течение 1 часа. Добавляли второй эквивалент пиразола (104 мг), с последующим добавлением трет-бутоксида калия (90 мг), и реакционную смесь перемешивали в течение 1 часа. Добавляли воду (4,0 мл) и реакционную смесь экстрагировали при помощи EtOAc (3×5,0 мл), промывали насыщенным солевым раствором (15 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Хроматография (SiO2, градиентное элюирование, 0-100%, EtOAc/петролейный эфир затем SiO2, градиентное элюирование, 0-5%, MeOH/DCM) давала указанное в заголовке соединение (0,13 г, 52%) в виде бледно-желтого масла MC: [M+H]+=329.
Получение 176: 3,3-Диметил-6-пиразол-1-илметил-2,3-дигидропирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 3,3-диметил-6-пиразол-1-илметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=229.
Получение 177: 3,3-Диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин-6-карбонитрил
Смесь трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,405 г, 1,43 ммоль), K4[Fe(CN)6] (1,21 г, 2,86 ммоль), Pd(OAc)2 (16 мг, 0,07 ммоль), бутил ди-1-адамантилфосфина (77 мг, 0,21 ммоль) и карбоната натрия (0,304 г, 2,86 ммоль) суспендировали в NMP (14,3 мл) при температуре окружающей среды. Реакционную смесь нагревали в условиях микроволнового облучения при 185°C в течение 2 часов. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали. Фильтрат растворяли в воде и экстрагировали смесью диэтиловый эфир/петролейный эфир (1:1, 3×). Объединенные органические экстракты промывали насыщенным солевым раствором (3×), сушили над сульфатом натрия и растворитель удаляли в вакууме. Хроматография (SiO2, градиентное элюирование, 0-100%, EtOAc/петролейный эфир) давала указанное в заголовке соединение (36 мг, 15%) в виде бесцветного твердого вещества. MC: [M+H]+=174.
Получение 178: (2-Хлорметилаллилоксиметил)бензол
Бензиловый спирт (3,5 мл, 33,6 ммоль) и DMF (8 мл) добавляли к суспензии NaH (60% суспензия в минеральном масле, 1,8 г, 43,7 ммоль, промывали гексаном перед использованием) в ТГФ (35 мл). Полученную смесь перемешивали в течение 30 минут при комнатной температуре и затем в течение 1 часа при температуре кипения с обратным холодильником. Смесь охлаждали до комнатной температуры и медленно добавляли в течение 1 часа к раствору 3-хлор-2-хлорметилпропена (4,2 г, 33,6 ммоль) в ТГФ (40 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, гасили насыщенным солевым раствором/водой (1:1) и экстрагировали при помощи Et2O. Органическую фазу сушили (MgSO4), фильтровали и концентрировали. Хроматография (SiO2, EtOAc:Петролейный эфир 1:9) давала указанное в заголовке соединение (3,1 г) в виде бесцветного масла. 1H-ЯМР (CDCl3): 7,46-7,29 (5H, м), 5,35 (1H, с), 5,30 (1H, д), 4,56 (2H, с), 4,24-4,06 (4H, м).
Получение 179: (2-Бромметилаллилоксиметил)бензол
LiBr (2,7 г, 31,6 ммоль) высушивали пламенем в условиях вакуума и затем охлаждали до комнатной температуры. Затем добавляли TBABr (255 мг, 0,79 ммоль), (2-хлорметилаллилоксиметил)бензол (3,1 г, 15,8 ммоль) и ТГФ (5 мл), и суспензию перемешивали при 60°C в течение 2 часов. Смесь фильтровали через Целит и растворитель удаляли в вакууме, с получением указанного в заголовке соединения (3,4 г) в виде бесцветного масла, которое использовали на следующей стадии без дополнительной очистки. 1H-ЯМР (CDCl3): 7,47-7,30 (5H, м), 5,47-5,33 (1H, м), 5,30 (1H, кв.), 4,56 (2H, с), 4,19 (2H, с), 4,08 (2H, с).
Получение 180: (2-Бензилоксиметилаллил)-(2-хлор-5-иодпиридин-4-ил)амин
Указанное в заголовке соединение получали из 2-хлор-5-иодпиридин-4-ил-амина и (2-бромметилаллилоксиметил)бензола, следуя способу, аналогичному описанному в Получении 108. Реакционную смесь перемешивали при 55°C в течение 3 часов. MC: [M+H]+=415.
Получение 181: 3-Бензилоксиметил-6-хлор-3-метил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Указанное в заголовке соединение получали из (2-бензилоксиметилаллил)-(2-хлор-5-иодпиридин-4-ил)амина путем катализируемой палладием циклизации, следуя способу, аналогичному описанному в Получении 109, с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. MC: [M+H]+=289.
Получение 182: трет-Бутиловый эфир 3-бензилоксиметил-6-хлор-3-метил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Указанное в заголовке соединение получали из 3-бензилоксиметил-6-хлор-3-метил-2,3-дигидро-1H-пирроло[3,2-c]пиридина (500 мг, 1,74 ммоль), следуя способу, аналогичному описанному в Получении 110. MC: [M+H]+=389.
Получение 183: трет-Бутиловый эфир 6-бензил-3-бензилоксиметил-3-метил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Указанное в заголовке соединение получали из трет-бутилового эфира 3-бензилоксиметил-6-хлор-3-метил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (520 мг), следуя способу, аналогичному описанному для Получения 117. [M+H]+=445.
Получение 184: 6-Бензил-3-бензилоксиметил-3-метил-2,3-дигидро-1H-пирроло[3,2-c]пиридин, гидрохлоридная соль
Указанное в заголовке соединение получали из трет-бутилового эфира 6-бензил-3-бензилоксиметил-3-метил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (82 мг), следуя способу, аналогичному описанному в Получении 116. MC: [M+H]+=345.
Получение 185: 6-Хлор-3-метил-1,3-дигидроиндол-2-он
К охлажденному (-78°C) раствору 6-хлор-1,3-дигидроиндол-2-она (4,0 г, 24 ммоль) и TMEDA (11,2 мл, 79 ммоль) в ТГФ (100 мл) медленно добавляли BuLi (2,2 M раствор в циклогексане, 22 мл, 48 ммоль). Раствор перемешивали в течение 30 минут при указанной температуре и затем медленно добавляли иодметан (2,2 мл, 36 ммоль). Реакционную смесь перемешивали при -20°C в течение 1,5 часа. Реакцию гасили насыщенным водным раствором NH4Cl и экстрагировали при помощи EtOAc. Органическую фазу сушили (MgSO4), фильтровали и концентрировали в вакууме. Хроматография (SiO2, EtOAc/Петролейный эфир 2:8) давала указанное в заголовке соединение (2,7 г) в виде бледно-ярко-розового твердого вещества. MC: [M+H]+=182.
Получение 186: 3-Бензил-6-хлор-3-метил-1,3-дигидроиндол-2-он
Указанное в заголовке соединение получали из 6-хлор-3-метил-1,3-дигидроиндол-2-она (700 мг), следуя способам, аналогичным тем, которые описаны в Получении 185, с использованием бензилбромида вместо иодметана, с получением указанного в заголовке соединения (641 мг) в виде белого твердого вещества. MC: [M+H]+=272.
Получение 187: 3-Бензил-6-хлор-3-метил-2,3-дигидро-1H-индол
3-Бензил-6-хлор-3-метил-1,3-дигидроиндол-2-он (641 мг) восстанавливали при помощи BH3.Me2S, следуя способу, аналогичному описанному в Получении 54, с получением указанного в заголовке соединения (410 мг) в виде бесцветного смолистого вещества. MC: [M+H]+=258.
Получение 188: трет-Бутиловый эфир 3,3-диметил-6-(2-оксопирролидин-1-ил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Сосуд, содержащий раствор трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (150 мг, 0,53 ммоль), 2-пирролидинона (68 мг, 0,80 ммоль), 9,9-диметил-4,5-бис(дифенилфосфино)ксантена (Xantphos) (46 мг, 0,079 ммоль), Pd2(dba)3 (50 мг, 0,052 ммоль) и карбоната цезия (260 мг, 0,79 ммоль) в 1,4-диоксане (3 мл), дегазировали и продували азотом. Смесь перемешивали при 110°C в течение ночи. Смеси давали охладиться и затем распределяли между EtOAc и водой. Органический экстракт промывали насыщенным солевым раствором, сушили (MgSO4) и упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 50-100% EtOAc в петролейном эфире) давала указанное в заголовке соединение (102 мг). MC: [M+H]+=332.
Получение 189: 1-(3,3-Диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин-6-ил)пирролидин-2-он, гидрохлоридная соль
трет-Бутиловый эфир 3,3-диметил-6-(2-оксопирролидин-1-ил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (100 мг) обрабатывали при помощи HCl (насыщенный раствор в EtOAc) и перемешивали в течение 4 часов. Смесь затем упаривали досуха в вакууме, с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. MC: [M+H]+=232.
Получение 190: трет-Бутиловый эфир 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Указанное в заголовке соединение получали из 2-бром-пиридин-4-иламина с использованием способов, аналогичных тем, которые описаны выше для трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (Получения 107-110). Бесцветное твердое вещество. 1H-ЯМР (CDCl3) 8,00 (1H, с), 7,87 (1H, шир. с), 3,75 (2H, с), 1,59 (9H, шир. с), 1,39 (6H, с). МС: [M+H-tBu]+ 271, 273. Синтетические промежуточные соединения, выделенные в этом способе, представляли собой следующие: 2-Бром-5-иодпиридин-4-иламин (бледно-оранжевое твердое вещество, 1H-ЯМР (ДМСО-d6) 8,18 (1H, с), 6,78 (1H, с), 6,48 (2H, шир. с); MC: [M+H]+ 299, 301); (2-Бром-5-иодпиридин-4-ил)-(2-метилаллил)амин (бледно-оранжевое масло, 1H-ЯМР (ДМСО-d6) 8,20 (1H, с), 6,52 (1H, с), 6,47 (1H, шир. т), 4,85 (1H, д), 4,74 (1H, д), 3,82 (2H, д), 1,68 (3H, с); MC: [M+H]+ 353, 355); 6-Бром-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин (бесцветное твердое вещество, 1H-ЯМР (ДМСО-d6) 7,70 (1H, с), 6,73 (1H, шир. с), 6,47 (1H, с), 3,30 (2H, д), 1,26 (6H, с); MC: [M+H]+ 227, 229).
Общий способ для синтеза защищенных амидо-замещенных пиперазинов:
Стадия 1: 1,1'-Карбонилдиимидазол (490 мг, 3,0 ммоль) добавляли к перемешиваемому раствору (2R,5R)-5-метилпиперазин-1,2,4-трикарбоновой кислоты 1-бензилового эфира 4-трет-бутилового эфира (950 мг, 2,5 ммоль) в дихлорметане (20 мл) и смесь перемешивали при комнатной температуре в течение 3 часов, после этого добавляли вторичный амин (3,75 ммоль) и смесь перемешивали при комнатной температуре в течение 16-48 часов. Добавляли хлористоводородную кислоту (2 M, 20 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Органический слой отделяли и упаривали досуха в вакууме с получением неочищенного продукта, который использовали без дополнительной очистки. Соединения Получений 191-196 были получены таким же путем с использованием в качестве реагента подходящего указанного вторичного амина:
Получение 191: (2R,5R)-2-Диметилкарбамоил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир- С использованием диметиламина (40% масс. в воде; 2 мл). MC: [M+H-tBu]+ 350.
Получение 192: (2R,5R)-2-(Азетидин-1-карбонил)-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир- С использованием азетидина. MC: [M+H-tBu]+ 362.
Получение 193: (2R,5R)-2-Метил-5-(морфолин-4-карбонил)пиперазин-1,4-дикарбоновой кислоты 4-бензиловый эфир 1-трет-бутиловый эфир- С использованием морфолина. MC: [M+H-tBu]+ 392.
Получение 194: (2R,5R)-2-Диэтилкарбамоил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензиловый эфир 4-трет-бутиловый эфир- С использованием диэтиламина. MC: [M+H]+ 434.
Получение 195: (2R,5R)-2-Метил-5-(пирролидин-1-карбонил)-пиперазин-1,4-дикарбоновой кислоты 4-бензиловый эфир 1-трет-бутиловый эфир- С использованием пирролидина. MC: [M+H]+ 432.
Получение 196: (2R,5R)-2-Метил-5-(пиперидин-1-карбонил)-пиперазин-1,4-дикарбоновой кислоты 4-бензиловый эфир 1-трет-бутиловый эфир- С использованием пиперидина. MC: [M+H]+ 446.
Стадия 2: 10% Палладий на углероде (200 мг) добавляли к раствору бензилоксикарбонил-защищенного пиперазинового производного (2,5 ммоль) в метаноле (40 мл) и смесь перемешивали при температуре окружающей среды в атмосфере водорода в течение 16-48 часов. Твердые вещества удаляли путем гравитационного фильтрования и промывали метанолом (10 мл). Объединенные фильтраты упаривали досуха в вакууме с получением неочищенного продукта, который использовали без дополнительной очистки. Соединения Получений 197-202 были получены таким же путем с использованием указанного подходящего предшественника:
Получение 197: трет-Бутиловый эфир (2R,5R)-5-диметилкарбамоил-2-метилпиперазин-1-карбоновой кислоты - Из (2R,5R)-2-диметилкарбамоил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензилового эфира 4-трет-бутилового эфира. MC: [M+H]+ 272.
Получение 198: трет-Бутиловый эфир (2R,5R)-5-(азетидин-1-карбонил)-2-метилпиперазин-1-карбоновой кислоты - Из (2R,5R)-2-(азетидин-1-карбонил)-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензилового эфира 4-трет-бутилового эфира. MC: [M+H]+ 284.
Получение 199: трет-Бутиловый эфир (2R,5R)-2-метил-5-(морфолин-4-карбонил)пиперазин-1-карбоновой кислоты - Из (2R,5R)-2-метил-5-(морфолин-4-карбонил)пиперазин-1,4-дикарбоновой кислоты 4-бензилового эфира 1-трет-бутилового эфира. MC: [M+H]+ 314.
Получение 200: трет-Бутиловый эфир (2R,5R)-5-диэтилкарбамоил-2-метилпиперазин-1-карбоновой кислоты - Из (2R,5R)-2-диэтилкарбамоил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензилового эфира 4-трет-бутилового эфира. MC: [M+H]+ 300.
Получение 201: трет-Бутиловый эфир (2R,5R)-2-метил-5-(пирролидин-1-карбонил)пиперазин-1-карбоновой кислоты - Из (2R,5R)-2-метил-5-(пирролидин-1-карбонил)пиперазин-1,4-дикарбоновой кислоты 4-бензилового эфира 1-трет-бутилового эфира. MC: [M+H]+ 298.
Получение 202: трет-Бутиловый эфир (2R,5R)-2-метил-5-(пиперидин-1-карбонил)пиперазин-1-карбоновой кислоты: Из (2R,5R)-2-метил-5-(пиперидин-1-карбонил)пиперазин-1,4-дикарбоновой кислоты 4-бензилового эфира 1-трет-бутилового эфира. MC: [M+H]+ 312.
Общий способ для синтеза защищенных связанных продуктов:
Триэтиламин (0,230 мл, 1,65 ммоль) добавляли к перемешиваемому раствору 6-бензил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридингидрохлорида (137 мг, 0,5 ммоль) в безводном DCM (2,5 мл) и смесь перемешивали при комнатной температуре в течение 10 минут. Добавляли хлорацетилхлорид (0,044 мл, 0,55 ммоль) и смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли замещенное пиперазиновое производное (0,6 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь распределяли между DCM (20 мл) и водой (20 мл), органический слой отделяли и растворитель удаляли в вакууме. Хроматография (SiO2, 20-100% EtOAc в петролейном эфире) давала продукт в виде бесцветного твердого вещества. Соединения Получений 203-205 были получены таким же путем с использованием указанного подходящего замещенного пиперазина:
Получение 203: трет-Бутиловый эфир (2R,5R)-4-[2-(6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-диметилкарбамоил-2-метилпиперазин-1-карбоновой кислоты. Из трет-бутилового эфира (2R,5R)-5-диметилкарбамоил-2-метилпиперазин-1-карбоновой кислоты. MC: [M+H]+ 550.
Получение 204: трет-Бутиловый эфир (2R,5R)-5-(азетидин-1-карбонил)-4-[2-(6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты. Из трет-бутилового эфира (2R,5R)-5-(азетидин-1-карбонил)-2-метилпиперазин-1-карбоновой кислоты. MC: [M+H]+ 562.
Получение 205: трет-Бутиловый эфир (2R,5R)-4-[2-(6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-2-метил-5-(морфолин-4-карбонил)пиперазин-1-карбоновой кислоты. Из трет-бутилового эфира (2R,5R)-2-метил-5-(морфолин-4-карбонил)пиперазин-1-карбоновой кислоты. MC: [M+H]+ 592.
Получение 206: трет-Бутиловый эфир (2R,5R)-4-[2-(6-бензил-3-бензилоксиметил-3-метил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-диметилкарбамоил-2-метилпиперазин-1-карбоновой кислоты.
Указанное в заголовке соединение (40 мг) получали из гидрохлоридной соли 6-бензил-3-бензилоксиметил-3-метил-2,3-дигидро-1H-пирроло[3,2-c]пиридина (60 мг, 0,15 ммоль), хлорацетилхлорида (18 мкл, 0,22 ммоль), TEA (75 мкл, 0,54 ммоль) и трет-бутилового эфира (2R,5R)-5-диметилкарбамоил-2-метил-l-пиперазин-1-карбоновой кислоты (59 мг, 0,22 ммоль), следуя способу, аналогичному описанному в Получении 203. MC: [M+H]+=656.
Получение 207: (1,4-Дибензилпиперазин-2-ил)метанол.
К перемешиваемому раствору литийалюминийгидрида в ТГФ (1 M, 49,6 мл, 49,6 ммоль) при -5°C в атмосфере азота добавляли по каплям в течение 0,5 часа раствор этилового эфира (1,4-дибензил-пиперазин-2-ил)-карбоновой кислоты (8,4 г, 24,8 ммоль) в ТГФ (30 мл), внутреннюю температуру поддерживали <5°C. Полученную смесь перемешивали при 0°C в течение 1 часа, затем при 20°C в течение 18 часов, затем гасили путем добавления смеси воды (4 мл) и ТГФ (100 мл) при внешнем охлаждени на бане лед-метанол. Полученную суспензию обрабатывали насыщенным водным раствором калий-натрий тартрата (~50 мл) и смесь оставляли для перемешивания при 0°C в течение 1 часа. Надосадочную жидкость сливали и упаривали в вакууме. Полученное масло растворяли в дихлорметане и раствор сушили (Na2SO4) и упаривали в вакууме, с получением указанного в заголовке соединения (8,04 г) в виде масла. MC: [M+H]+=297.
Получение 208: 1,4-Дибензил-2-фторметилпиперазин.
К перемешиваемому раствору трифторида диэтиламиносеры (0,89 г, 5,53 ммоль) в DCM (4 мл) при -78°C в атмосфере азота добавляли раствор (1,4-дибензилпиперазин-2-ил)метанола (1,364 г, 4,61 ммоль) в DCM (6 мл) по каплям в течение 0,2 часа (внутренняя температура <-65°C). Полученный раствор перемешивали при -78°C в течение 1 часа, затем медленно нагревали до 20°C и перемешивали таким образом в течение 16 часов. Смесь охлаждали на бане лед-метанол, затем добавляли лед при перемешивании. Смесь выливали в насыщенный водный раствор NaHCO3 (100 мл) и экстрагировали при помощи DCM (3×30 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-25% диэтилового эфира в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,471 г) в виде масла. 1H-ЯМР (CDCl3): 7,38-7,23 (10H, м), 4,93-4,64 (1H, м), 4,55 (1H, ддд), 4,03 (1H, д), 3,52 (3H, д), 2,91 (1H, д), 2,84-2,64 (2H, м), 2,56 (1H, с), 2,48-2,21 (3H, м).
Получение 209: 2-Фторметилпиперазин, диацетатная соль
Смесь 1,4-дибензил-2-фторметилпиперазина (0,47 г, 1,6 ммоль), этанола (20 мл), уксусной кислоты (0,4 мл) и 10% палладия на углероде (0,2 г) гидрировали при 20°C и 4 бар в течение 72 часов. Твердые вещества удаляли путем фильтрования и фильтрат упаривали в вакууме с получением бесцветного твердого вещества. Растирание в порошок (два раза) с простым эфиром давало указанное в заголовке соединение (0,332 г) в виде бесцветного твердого вещества. 1H-ЯМР (ДМСО-d6): 7,38-5,74 (4H, м), 4,40-4,27 (1H, м), 4,27-4,14 (1H, м), 2,94-2,69 (4H, м), 2,69-2,58 (1H, м), 2,58-2,52 (1H, м), 2,32 (1H, дд), 1,87 (6H, с).
Получение 210: трет-Бутиловый эфир (2R,5R)-4-[2-(6-хлор-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метил-5-(морфолин-4-карбонил)пиперазин-1-карбоновой кислоты
Получали из 6-хлор-3,3-диметил-2,3-дигидро-1H-индола и трет-бутилового эфира (2R,5R)-2-метил-5-(морфолин-4-карбонил)пиперазин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 203. MC: [M+H]+ =535.
Получение 211: (1'-трет-Бутилоксикарбонил-6'-хлор)-1,1',2',3-тетрагидроспиро[инден-2,3'-индол]
К трет-бутиловому эфиру 6-хлор-2-оксо-2,3-дигидроиндол-1-карбоновой кислоты (2,5 г, 9,36 ммоль) и K2CO3 (2,85 г, 20,6 ммоль) в DMF (25 мл) добавляли o-ксилилендибромид (5,98 г, 22,7 ммоль) при температуре окружающей среды. Реакционную смесь перемешивали при температуре окружающей среды в течение 18 часов. Добавляли воду (150 мл) и реакционную смесь экстрагировали при помощи DCM (3×). Органические слои объединяли и промывали насыщенным солевым раствором, сушили при помощи сульфата натрия и растворитель удаляли в вакууме. Неочищенный продукт очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100%, EtOAc/петролейный эфир), вторая колонка (градиентное элюирование, 0-100%, DCM/петролейный эфир), с получением указанного в заголовке соединения (541 мг, 30%) в виде бесцветного твердого вещества. MC: [M+H]=314 (M-tBu).
Получение 212: (6'-Хлор)-1,1',2',3-тетрагидроспиро[инден-2,3'-индол]
(1'-трет-Бутилоксикарбонил-6'-хлор)-1,1',2',3-тетрагидроспиро[инден-2,3'-индол] (0,541 г, 1,5 ммоль) растворяли в 50% TFA в DCM (7,3 мл) при температуре окружающей среды и реакционную смесь перемешивали в течение 1 часа при температуре окружающей среды. Растворитель удаляли в вакууме, и остаток растворяли в толуоле и упаривали. Хроматография на силикагеле (градиентное элюирование, 0-50%, EtOAc/петролейный эфир) давала бесцветное твердое вещество. MC: [M+H]=270. Раствор этого вещества (0,226 г, 0,84 ммоль) в 2,0M BH3.SMe2 в ТГФ (4,2 мл) нагревали до 75°C в течение 3 часов, затем охлаждали до температуры окружающей среды. Добавляли MeOH (4 мл) и реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 1 часа, затем концентрировали в вакууме. Хроматография на силикагеле (градиентное элюирование, 0-50%, EtOAc/петролейный эфир) давала указанное в заголовке соединение (0,17 г, 80%) в виде бесцветного твердого вещества. MC: [M+H]=256.
Получение 213: 1,1',2',3-Тетрагидроспиро[инден-2,3'-индол]-6'-карбонитрил
(6'-Хлор)-1,1',2',3-тетрагидроспиро[инден-2,3'-индол (348 мг, 1,92 ммоль), Zn(CN)2 (0,257 мг, 2,19 ммоль), Pd2(dba)3 (35 мг, 0,15 ммоль), Sphos (0126 мг, 0,31 ммоль) объединяли и растворяли в NMP (9,6 мл). Суспензию дегазировали (N2) в течение 5 минут. Реакционную смесь нагревали в условиях микроволнового облучения в течение 2 часов при 180°C, затем охлаждали до температуры окружающей среды. Добавляли дополнительные количества реагентов: Zn(CN)2 (0,257 мг, 2,19 ммоль), Pd2(dba)3 (35 мг, 0,15 ммоль), Sphos (126 мг, 0,31 ммоль) и реакционную смесь нагревали до 185°C в течение 1 часа. Реакционную смесь разбавляли водой и экстрагировали смесью диэтиловый эфир/петролейный эфир (1:1) (3×). Объединенные органические экстракты промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Хроматография на силикагеле (градиентное элюирование, 0-100%, EtOAc/петролейный эфир) давала указанное в заголовке соединение (0,06 г, 18%) в виде бледно-желтого твердого вещества. MC: [M+H] =247.
Получение 214: 1'-{2-[(2R,5R)-4-(трет-Бутилоксикарбонил)-5-метил-2-[(морфолин-4-ил)карбонил]пиперазин-1-ил]ацетил}-1,1',2',3-тетрагидроспиро[инден-2,3'-индол]-6'-карбонитрил
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 203: реакционную смесь нагревали до 50°C в течение 2 часов. MC: [M+H]=600.
Получение 215: трет-Бутиловый эфир 6-(2-хлорфенокси)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Раствор трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (150 мг, 0,46 ммоль), 2-хлорфенола (0,071 мл, 0,69 ммоль), CuI (17 мг, 0,046 ммоль), пиколиновой кислоты (23 мг, 0,092 ммоль) и фосфата калия (195 мг, 0,92 ммоль) в ДМСО (1 мл) перемешивали при 85°C в течение ночи. Смеси давали охладиться и затем распределяли между EtOAc и водой. Органический экстракт промывали насыщенным солевым раствором, сушили (MgSO4) и упаривали в вакууме. Хроматография (SiO2; градиентное элюирование с использованием 2-10% этилацетата в петролейном эфире) давала указанное в заголовке соединение (143 мг). MC: [M+H]+=375.
Получение 216: 6-(2-Хлорфенокси)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
трет-Бутиловый эфир 6-(2-хлорфенокси)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (143 мг) обрабатывали при помощи HCl (насыщенный раствор в этилацетате) и перемешивали в течение 4 часов. Смесь затем упаривали досуха в вакууме с получением бесцветного твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки. MC: [M+H]+=275.
Получение 217: трет-Бутиловый эфир (2R,5R)-4-бензил-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
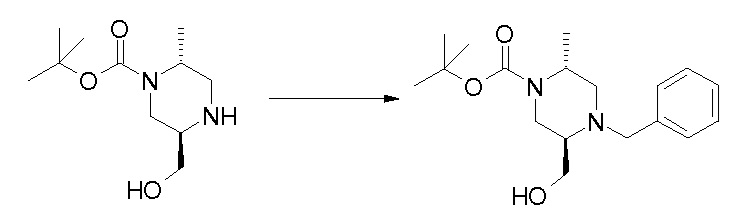
Смесь (2R,5R)-2-гидроксиметил-5-метилпиперазин-1,4-дикарбоновой кислоты 1-бензилового эфира 4-трет-бутилового эфира (3,48 г, 15,1 ммоль), бензальдегида (1,76 г, 16,6 ммоль), триацетоксиборгидрида натрия (3,84 г, 18,1 ммоль) и 1,2-дихлорэтана (30 мл) перемешивали при 20°C в течение 18 часов, затем распределяли между насыщенным водным раствором NaHCO3 (150 мл) и DCM (3×50 мл). Объединенные органические экстракты сушили (Na2SO4), затем упаривали в вакууме с получением масла. Хроматография (SiO2, 0-30% EtOAc в петролейном эфире) давала указанное в заголовке соединение (4,588 г, 74%) в виде бесцветного твердого вещества. MC: [M+H]+=321.
Получение 218: трет-Бутиловый эфир (2R,5R)-4-бензил-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира (2R,5R)-4-бензил-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,96 г, 3 ммоль) в DCM (10 мл), с внешним охлаждением на бане лед-метанол, добавляли триэтиламин (0,91 г, 1,25 мл, 9 ммоль), с последующим добавлением по каплям в течение 0,05 часов метилсульфонилхлорида (0,38 г, 0,26 мл, 3,3 ммоль). Смесь перемешивали при 0-20°C в течение 2 часов, затем добавляли одной порцией пиразол (0,27 г, 4 ммоль) и перемешивание продолжали при 20°C в течение 7 дней. Смесь выливали в насыщенный водный раствор NaHCO3 и экстрагировали при помощи DCM (3×20 мл). Объединенные органические экстракты сушили (Na2SO4), затем упаривали в вакууме с получением масла. Хроматография (SiO2, 0-100% Et2O в петролейном эфире) давала указанное в заголовке соединение (0,24 г). MC: [M+H]+=371.
Получение 219: трет-Бутиловый эфир (2R,5R)-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5R)-4-бензил-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты (0,24 г, 0,65 ммоль) гидрировали над 10% палладием на углероде при 4 бар с использованием процедуры, подобной той, которая описана в Получении 209. Неочищенный продукт растворяли в метаноле и растворитель снова выпаривали и остаток сушили в вакууме при 40°C в течение 6 часов, с получением указанного в заголовке соединения (0,21 г). MC: [M+H]+=281.
Получение 220: трет-бутиловый эфир (2R,5R)-4-[2-(6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты (0,103 г, 0,37 ммоль) и гидрохлоридной соли 6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридина (0,101 г, 0,37 ммоль) с использованием процедуры, аналогичной той, которая описана для Получения 203, за исключением того, что хлороформ (10 мл) добавляли к реакционной смеси после добавления реагентов, и смесь нагревали при температуре кипения с обратным холодильником в течение 7 дней. Указанное в заголовке соединение (0,019 г) получали в виде масла. MC: [M+H]+=559.
Получение 221: 3,3-Диметил-2,3-дигидро-1H-индол-6-карбонитрил
6-Хлор-3,3-диметил-2,3-дигидро-1H-индол (1 г, 5,5 ммоль), цианид цинка (0,74 г, 6,3 ммоль), трис(дибензилиденацетон)дипалладий (0) (0,2 г, 0,9 ммоль) и 2-дициклогексилфосфино-2′,6′-диметоксибифенил (0,4 г, 1,1 ммоль) объединяли и растворяли в N-метилпирролидиноне (27,6 мл). Суспензию дегазировали азотом в течение 5 минут. Реакционную смесь нагревали в условиях микроволнового облучения в течение 2 часов при 185°C, затем охлаждали до комнатной температуры и реакционную смесь разбавляли водой и экстрагировали смесью диэтиловый эфир/петролейный эфир (1:1) (3×). Объединенные органические экстракты промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (0,14 г, 15%) в виде бледно-желтого твердого вещества. MC: [M+H]+=173.
Получение 222: 1-(2-Хлорацетил)-3,3-диметил-2,3-дигидро-1H-индол-6-карбонитрил
К раствору 3,3-диметилиндолин-6-карбонитрила (0,35 г, 2,0 ммоль) и триэтиламина (0,56 мл, 4,0 ммоль) в DCM (10 мл) при 0°C добавляли хлорацетилхлорид (0,16 мл, 2,0 ммоль) по каплям. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь затем разбавляли водой. Органическую фазу затем отделяли, сушили над сульфатом магния и концентрировали, с получением указанного в заголовке соединения (0,39 г). 1H-ЯМР (CDCl3): 8,47 (с, 1H), 7,40 (д, 1H), 7,24 (д, 1H), 4,14 (с, 2H), 3,94 (с, 2H), 1,42 (с, 6H).
Получение 223: трет-Бутиловый эфир (R)-4-[2-(6-циано-3,3-диметил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
К раствору 1-(2-хлорацетил)-3,3-диметилиндолин-6-карбонитрила (0,10 г, 0,40 ммоль) и (R)-трет-бутил 2-метилпиперазин-1-карбоксилата (0,088 г, 0,41 ммоль) в ацетонитриле (1,5 мл) добавляли триэтиламин (0,083 мл, 0,6 ммоль). Реакционную смесь нагревали при 50°C в течение 3 часов. Реакционную смесь затем охлаждали и концентрировали. Реакцию повторяли в масштабе 0,6 ммоль и объединенное неочищенное вещество очищали колоночной флэш-хроматографией, с использованием для элюирования 20% EtOAc в гептане, с получением указанного в заголовке соединения (0,29 г) [M+H]+=413.
Получение 224: трет-Бутиловый эфир (R)-4-[(S)-2-(6-циано-3,3-диметил-2,3-дигидроиндол-1-ил)-1-метил-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты
К перемешиваемому раствору 2-хлор-1-пропионовой кислоты (0,11 мл, 1,16 ммоль) в DCM (20 мл) добавляли O-бензотриазол-N,N,N',N'-тетраметилуронийгексафторфосфат (0,55 г, 1,45 ммоль). Смесь перемешивали в течение 30 минут, затем добавляли триэтиламин (0,48 мл, 3,44 ммоль), 3,3-диметил-2,3-дигидро-1H-индол-6-карбонитрил (0,2 г, 1,16 ммоль) и каплю DMF, и полученную смесь перемешивали в течение ночи. Реакционную смесь затем разбавляли при помощи DCM и промывали водой. Органические фазы отделяли, сушили при помощи Na2SO4 и концентрировали. Неочищенный продукт промывали диэтиловым эфиром и фильтрат концентрировали и очищали колоночной флэш-хроматографией с использованием для элюирования 10% EtOAc в гептане, с получением (R)-1-(2-хлорпропаноил)-3,3-диметилиндолин-6-карбонитрила (0,133 г) [M+H]+=263. Раствор этого вещества, трет-бутилового эфира (R)-2-метилпиперазин-1-карбоновой кислоты (0,13 г, 0,51 ммоль) и карбоната калия (0,10 г, 0,51 ммоль) в ацетонитриле (2,5 мл) нагревали при 60°C в течение 48 часов. Реакционную смесь затем разбавляли при помощи EtOAc и промывали водой. Органическую фазу отделяли, сушили при помощи Na2SO4 и концентрировали. Остаток очищали колоночной флэш-хроматографией с использованием для элюирования 15% EtOAc в гептане, с получением указанного в заголовке соединения (33,5 мг), [M+H]+=427.
Получение 225: трет-Бутиловый эфир 3,3,6-триметил-2,3-дигидроиндол-1-карбоновой кислоты
Указанное в заголовке соединение получали из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидроиндол-1-карбоновой кислоты и метилцинкхлорида, следуя способам аналогичным тем, которые описаны в Получении 117, MC: [M+H]+=206 (-tBu).
Получение 226: трет-Бутиловый эфир 5-бром-6-бромметил-3,3-диметил-2,3-дигидроиндол-1-карбоновой кислоты
К трет-бутиловому эфиру 3,3,6-триметил-2,3-дигидроиндол-1-карбоновой кислоты (1,25 г, 1 ммоль) в тетрахлориде углерода (58,2 мл) добавляли дибензоилпероксид (0,02 г, 0,1 ммоль), 2,2′-азобис(2-метилпропионитрил) (17 мг, 0,10 ммоль) и N-бромсукцинимид (0,93 г, 5,2 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 1 часа при температуре кипения с обратным холодильником. Реакционную смесь охлаждали до комнатной температуры, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-20%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение, 1H-ЯМР (CDCl3): 7,83 (1H, с), 7,22 (1H, с), 3,71 (2H, с), 2,38 (2H, с), 1,58 (9H, с), 1,38-1,28 (6H, м).
Получение 227: трет-Бутиловый эфир 5-бром-3,3-диметил-6-(2-оксопирролидин-1-илметил)-2,3-дигидроиндол-1-карбоновой кислоты
К 2-пирролидинону (0,8 г, 9,4 ммоль) в ТГФ (15,6 мл) добавляли трет-бутоксид калия (1,05 г, 9,4 ммоль) и смесь перемешивали в течение 30 минут при комнатной температуре. Добавляли трет-бутиловый эфир 5-бром-6-бромметил-3,3-диметил-2,3-дигидроиндол-1-карбоновой кислоты одной порцией и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Добавляли насыщенный водный раствор хлорида аммония (15 мл) и смесь экстрагировали при помощи EtOAc. Органический слой промывали насыщенным солевым раствором, сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (0,17 г) MC: [M+H]+=424.
Получение 228: 1-(5-Бром-3,3-диметил-2,3-дигидро-1H-индол-6-илметил)пирролидин-2-он
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 116. Неочищенный продукт наносили на SCX колонку, амин высвобождали с использованием 2M раствор аммиака в метаноле, MC: [M+H]+=324.
Получение 229: 3,3,5-Триметил-2,3-дигидро-1H-индол- Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 25, MC: [M+H]+=162
Получение 230: 6-Бром-3,3,5-триметил-2,3-дигидро-1H-индол
3,3,5-Триметил-2,3-дигидро-1H-индол (1,84 г, 11,43 ммоль) растворяли в концентрированной серной кислоте (25 мл) и добавляли сульфат серебра (1,90 г, 6,06 ммоль). Реакционную смесь перемешивали в течение 1 часа и добавляли бром (0,6 мл, 11,77 ммоль) в течение 5 минут. Реакционную смесь перемешивали при этой температуре в течение 1 часа и очень медленно гасили путем медленного добавления к 50% водному раствору гидроксида натрия (100 мл) при охлаждении льдом (ОСТОРОЖНО!). Добавляли дополнительное количество водного раствора гидроксида натрия для доведения pH до щелочного. Полученную смесь экстрагировали диэтиловым эфиром (3×) и органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-50%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (1,30 г), MC: [M+H]+=241.
Получение 231: 3,3,5-Триметил-2,3-дигидро-1H-индол-6-карбонитрил
6-Бром-3,3,5-триметил-2,3-дигидро-1H-индол (1,0 г, 4,17 ммоль), цианид цинка (0,563 г, 4,79 ммоль), трис(дибензилиденацетон)дипалладий (0,094 г, 0,42 ммоль), 1,1'-бисдифенилфосфино)ферроцен (0,462 г, 0,83 ммоль) и порошок цинка (0,054 г, 0,83 ммоль) объединяли и растворяли в диметилацетамиде (20,8 мл). Реакционную смесь дегазировали в атмосфере азота в течение 5 минут, затем нагревали в условиях микроволнового облучения в течение 30 минут при 150°C. Реакционную смесь охлаждали до комнатной температуры и добавляли воду. Смесь экстрагировали диэтиловым эфиром (3×). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-20%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (110 мг) MC: [M+H]+=185.
Получение 232: (6-Хлор-3-иод-пиридин-2-ил)-(2-метилаллил)амин
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 108, 1H-ЯМР (270 МГц, CDCl3): 7,72-7,68 (1H, д), 6,36-6,33 (1H, д), 5,10 (1H, шир.с), 4,89-4,86 (2H, м), 4,02-4,00 (2H, м), 1,79 (3H, с).
Получение 233: 6-Хлор-3,3-диметил-2,3-дигидро-1H-пирроло[2,3-b]пиридин
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 109, MC: [M+H]+=183.
Получение 234: 5-Бром-2-иодпиридин-3-иламин
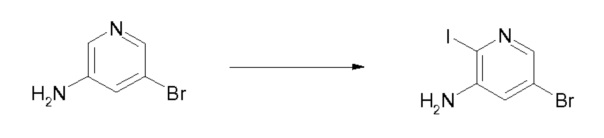
3-Амино-5-бромпиридин (13,8 г, 79,8 ммоль) растворяли в уксусной кислоте (440 мл) и помещали в атмосферу азота. N-иодсукцинимид (16,15 г, 71,8 ммоль) добавляли к реакционной смеси, которую перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и остаток распределяли между EtOAc (200 мл) и насыщенным водным раствором гидрокарбоната натрия (200 мл). Слои разделяли и органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия (200 мл). Водную фазу экстрагировали при помощи EtOAc (3×200 мл). Органические экстракты сушили над сульфатом магния, фильтровали и концентрировали. Хроматография (диоксид кремния; 1,4 кг насадочного материала в 70% DCM:30% гептана, с использованием для элюирования 70-100% DCM в гептане) давала указанное в заголовке соединение (11,5 г). 1H-ЯМР (270 МГц, CDCl3): 7,83 (1H, м), 7,04 (1H, м), 4,33 (2H, шир. с).
Получение 235: (5-Бром-2-иодпиридин-3-ил)-(2-метилаллил)амин
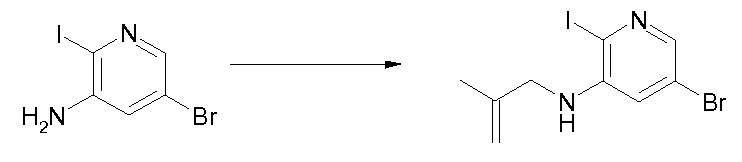
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 108, за исключением того, что использовали 5-бром-2-иодпиридинил-3-амин, трет-бутоксид калия (1,1 экв.) и 3-бром-2-метилпропан (1,1 экв.), 1H-ЯМР (270 МГц, CDCl3): 7,76 (1H, д), 6,72 (1H, д), 4,92 (2H, м), 4,61 (1H, с), 3,70 (2H, д), 1,69 (3H, с).
Получение 236: 6-Бром-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
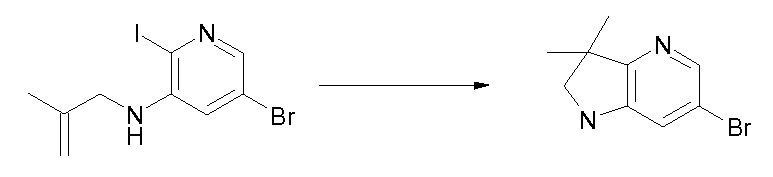
Смесь (5-бром-2-иодпиридин-3-ил)-(2-метилаллил)амина (10,2 г, 28,9 ммоль), тетрабутиламмонийхлорида (9,64 г, 34,7 ммоль), формиата натрия (2,36 г, 34,7 ммоль), ацетата палладия (0,97 г, 4,3 ммоль), триэтиламина (8,76 г, 86,7 ммоль), воды (12,1 мл) и диметилсульфоксида (255 мл) перемешивали при 100°C в атмосфере азота в течение 1 часа. Смесь охлаждали путем добавления льда (100 г), затем разбавляли водой (200 мл) при перемешивании. Смесь распределяли между водой (1 л) и смесью толуола (600 мл) и EtOAc (50 мл). Органическую фазу промывали водой (4×250 мл), сушили (Na2SO4) и упаривали в вакууме с получением коричневого масла. Хроматография (SiO2, градиентное элюирование с использованием 0-100% диэтилового эфира в 40-60 петролейном эфире) давала указанное в заголовке соединение (2,84 г) в виде желтого твердого вещества. MC: [M+H]+=227, 229.
Получение 237: трет-Бутиловый эфир 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
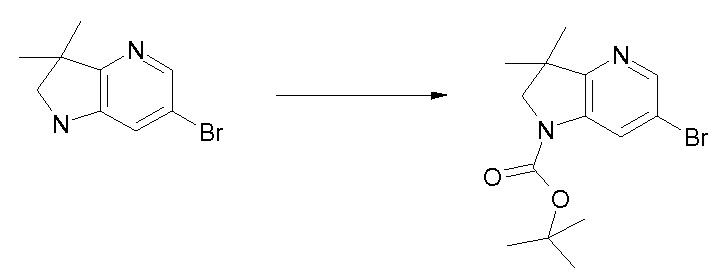
6-Бром-2,3-дигидро-3,3-диметил-1H-пирроло[2,3-b]пиридин (2,45 г, 10,8 ммоль) растворяли в ТГФ (44 мл) и помещали в атмосферу азота. К реакционной смеси добавляли трет-бутоксид калия (1,2 г, 10,8 ммоль), смесь перемешивали при комнатной температуре в течение 10 минут. К реакционной смеси добавляли ди-трет-бутилдикарбонат (2,73 мл, 11,9 ммоль) и перемешивали в течение 1 часа. К реакционной смеси добавляли дополнительное количество ди-трет-бутилдикарбоната (0,25 мл, 1,0 ммоль). Еще через 45 минут реакционную смесь концентрировали. Остаток распределяли между водой (50 мл) и DCM (50 мл). Слои разделяли и водный слой экстрагировали при помощи DCM (2×50 мл). Органические экстракты сушили над сульфатом магния, фильтровали и концентрировали. Хроматография (диоксид кремния; 250 г насадочного материала в гептане, с использованием для элюирования 5% EtOAc:гептан) давала указанное в заголовке соединение (2,3 г), MC: [M+H]+=327.
Получение 238: трет-Бутиловый эфир 6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты. Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 117, 1H-ЯМР (270 МГц, CDCl3): 8,00 (1H, с), 7,39-7,18 (6H, м), 3,91 (2H, с), 3,70 (2H, с), 1,50 (9H, с) и 1,34 (6H, с).
Получение 239: 6-Бензил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
трет-Бутиловый эфир 6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (1,66 г, 4,9 ммоль) растворяли в метаноле (16 мл) и помещали в атмосферу азота. Добавляли 4M HCl в 1,4-диоксане (18,5 мл, 74 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме с получением липкого смолистого вещества. Остаток осаждали из диэтилового эфира (2×30 мл) с получением липкого твердого вещества. Это твердое вещество растворяли в DCM (25 мл) и концентрировали, с получением указанного в заголовке соединения (1,2 г), MC: [M+H]+=239.
Получение 240: (3,6-Дихлорпиридазин-4-ил)-(2-метилаллил)амин
Трет-бутоксид калия (157,5 г) добавляли по порциям к перемешиваемому раствору 3,6-дихлорпиридазин-4-иламина (210 г) в ТГФ (3,36 л). Через 15 минут добавляли по каплям 3-бром-2-метилпропен (141,8 мл) в течение 30 минут, поддерживая температуру <25°C. Раствор оставляли для перемешивания при комнатной температуре в течение 16 часов, после этого реакционную смесь концентрировали и остаток распределяли между DCM (6 л) и водой (6 л). Водную фазу экстрагировали при помощи DCM (2×5 л). Объединенные органические фазы промывали (насыщенным солевым раствором, 5 л), сушили при помощи сульфата магния, фильтровали и концентрировали. Хроматография (силикагель, с использованием для элюирования 70:30 Гептан:- EtOAc) давала указанное в заголовке соединение (211,7 г). 1H-ЯМР (270 МГц, CDCl3): 6,49 (1H, с), 5,48 (1H, шир. с), 5,00 (1H, с), 4,91 (1H, с), 3,81 (2 H, д, J=6 ГЦ), 1,80 (3H, с).
Получение 241: трет-Бутиловый эфир (3,6-дихлорпиридазин-4-ил)-(2-метилаллил)карбаминовой кислоты
Ди-трет-бутилдикарбонат (267,5 мл) добавляли к перемешиваемому раствору (3,6-дихлорпиридазин-4-ил)-(2-метилаллил)амина (211,7 г) и 4-(диметиламино)пиридина (23,65 г) в ТГФ (4,54 л). После завершения добавления раствор нагревали до 60°C и оставляли для перемешивания в течение 2 часов. После этого растворитель удаляли в вакууме и остаток очищали колоночной хроматографией с использованием для элюирования 75:25 Гептан:EtOAc, с получением указанного в заголовке соединения (296,9 г). MC: [M+H]+=318.
Получение 242: трет-Бутиловый эфир 3-хлор-7,7-диметил-6,7-дигидропирроло[3,2-c]пиридазин-5-карбоновой кислоты
трет-Бутиловый эфир (3,6-дихлорпиридазин-4-ил)-(2-метилаллил)карбаминовой кислоты (239 г), Bu4NCl (251,8 г), формиат натрия (64,2 г), Et3N (354 мл) и Pd(OAc)2 (13 г) растворяли в ДМСО (6 л) и воде (354 мл). Реакционную смесь нагревали до 100°C и поддерживали при этой температуре в течение 10 минут, по прошествии этого времени реакция завершалась, и смеси давали охладиться до комнатной температуры. Смесь разбавляли водой (9 л) и экстрагировали при помощи EtOAc (4×3 л). Объединенные органические экстракты промывали насыщенным солевым раствором (3 л). Эмульсию оставляли для разделения в течение ночи и границу раздела обратно экстрагировали при помощи EtOAc (3 л). Объединенные органические экстракты сушили при помощи сульфата магния, фильтровали и концентрировали. Хроматография на диоксиде кремния, с использованием для элюирования градиента растворителя 10% EtOAc в гептане до 20% EtOAc в гептане, давала указанное в заголовке соединение (118 г) [M+H]+=284.
Получение 243: 3-Хлор-7,7-диметил-6,7-дигидро-5H-пирроло[3,2-c]пиридазин
трет-Бутиловый эфир 3-хлор-7,7-диметил-6,7-дигидропирроло[3,2-c]пиридазин-5-карбоновой кислоты (75 мг), суспендированный в EtOAc (0,5 мл), перемешивали в атмосфере N2. Медленно добавляли 4M HCl/EtOAc (5 мл) и после завершения добавления смесь перемешивали в течение 8 часов. LC анализ показал 10% оставшегося исходного вещества. Реакционную смесь концентрировали в вакууме и на следующее утро осуществляли поглощение в 4M HCl/EtOAc (5 мл). Раствор перемешивали в течение 1 часа, после этого LC анализ показал полное поглощение исходного вещества. Реакционную смесь концентрировали в вакууме и подвергали азеотропной перегонке с MeOH (2×5 мл), с получением указанного в заголовке соединения (61 мг) в виде белого твердого вещества. 1H-ЯМР (270 МГц, D4-MeOH): 6,92 (1H, с), 3,79 (2H, с) и 1,44 (6H, с). МС: [M+H]+=184.
Получение 244: трет-Бутиловый эфир 5-бром-6-хлор-3,3-диметил-2,3-дигидроиндол-1-карбоновой кислоты
К трет-бутиловому эфиру 6-хлор-3,3-диметил-2,3-дигидроиндол-1-карбоновой кислоты (0,500 г, 2,75 ммоль) в MeCN (3,78 мл) добавляли N-бромсукцинимид (0,492 г, 2,76 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 1 часа при комнатной температуре и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-40%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (356 мг), 1H-ЯМР (Me-d3-OD): 7,80 (1H, с), 7,43 (1H, с), 3,73 (2H, с), 1,66-1,51 (9H, м), 1,32 (6H, с).
Получение 245: 1-трет-Бутиловый эфир 6-хлор-3,3-диметил-2,3-дигидроиндол-1,5-дикарбоновой кислоты
трет-Бутиловый эфир 5-бром-6-хлор-3,3-диметил-2,3-дигидроиндол-1-карбоновой кислоты (0,336 г, 0,93 ммоль) растворяли в ТГФ (3,73 мл) и охлаждали до -78°C в атмосфере азота. Добавляли бутиллитий (2,5 M в гексане, 0,411 мл, 1,03 ммоль) по каплям. Реакционную смесь перемешивали в течение 20 минут и газообразный диоксид углерода барботировали через реакционную смесь и осторожно давали температуре повыситься до комнатной температуры. Добавляли воду и органический слой отделяли и экстрагировали при помощи 2 M водного раствора NaOH (3×). Объединенные водные слои промывали при помощи EtOAc (3×), подкисляли до pH 4 при помощи 2M HCl. Экстрагировали при помощи EtOAc (3×) и объединенные органические экстракты промывали насыщенным солевым раствором, сушили при помощи сульфата натрия и концентрировали, с получением указанного в заголовке соединения (67 мг), MC: [M+H]+=326.
Получение 246: трет-Бутиловый эфир 6-хлор-3,3-диметил-5-(3-метил-[1,2,4]оксадиазол-5-ил)-2,3-дигидроиндол-1-карбоновой кислоты
К 1-трет-бутиловому эфиру 6-хлор-3,3-диметил-2,3-дигидроиндол-1,5-дикарбоновой кислоты (0,067 г, 0,21 ммоль) в DMF (1,03 мл) добавляли N,N-диизопропилэтиламин (0,126 мкл, 0,72 ммоль) и гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (0,08 г, 0,21 ммоль) при комнатной температуре. После перемешивания в течение 10 минут добавляли N-гидроксиацетамидин (0,015 г, 0,41 ммоль) и реакционную смесь перемешивали в течение 18 часов. Добавляли DMF (3,44 мл) и реакционную смесь нагревали до 120°C в течение 3 часов. Добавляли воду и смесь экстрагировали диэтиловым эфиром (3×). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-60%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (36 мг). MC: [M+H]+=364.
Получение 247: 6-Хлор-3,3-диметил-5-(3-метил-[1,2,4]оксадиазол-5-ил)-2,3-дигидро-1H-индол
трет-Бутиловый эфир 6-хлор-3,3-диметил-5-(3-метил-[1,2,4]оксадиазол-5-ил)-2,3-дигидроиндол-1-карбоновой кислоты (36 мг, 0,11 ммоль) растворяли в 50% TFA в DCM (0,534 мл) и смесь перемешивали в течение 30 минут и концентрировали. Остаток растворяли в метаноле, загружали на SCX колонку и элюировали при помощи метанола, затем 2,0M раствора аммиака в метаноле для выделения амина, и фракции концентрировали, с получением указанного в заголовке соединения (26 мг), MC: [M+H]+=264.
Получение 248: трет-Бутиловый эфир 3,3-диметил-6-пропионил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
трет-Бутиловый эфир 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (1,33 г, 4,07 ммоль) в ТГФ (20,3 мл) охлаждали до -78°C в атмосфере азота и добавляли бутиллитий (2,5 M в гексане, 3,75 мл, 9,4 ммоль). Реакционную смесь перемешивали при этой температуре в течение 30 минут. К смеси добавляли N-метокси-N-метилпропионамид (0,71 г, 6,1 ммоль) и реакционную смесь перемешивали в течение 1 часа. Добавляли воду и EtOAc и органический слой отделяли, промывали насыщенным солевым раствором (3×) и сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-60%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (0,823 г), MC: [M+H]+=305, в виде 2:1 смеси с трет-бутиловым эфиром 3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты.
Получение 249: трет-Бутиловый эфир 6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Смесь продукта из Получения 248 (0,50 г) растворяли в ТГФ растворе Деоксофтора (50%, 1,64 г, 7,4 ммоль) и нагревали при 90°C в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и выливали в насыщенный водный раствор карбоната натрия. Смесь экстрагировали при помощи DCM (3×), сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-25%, EtOAc/петролейный эфир 40-60) давала указанное в заголовке соединение (0,25 г). MC: [M+H]+=327.
Получение 250: 6-(1,1-Дифторпропил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
трет-Бутиловый эфир 6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (0,245 г, 0,75 ммоль) растворяли в 5M водном растворе HCl и MeOH (1:1, 10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Растворитель удаляли в вакууме, с получением указанного в заголовке соединения (0,178 г) MC: [M+H]+=227.
Получение 251: трет-Бутиловый эфир 3-(2,4-дифторбензил)-7,7-диметил-6,7-дигидропирроло[3,2-c]пиридазин-5-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 117, MC: [M+H]+=376.
Получение 252: 3-(2,4-Дифтор-бензил)-7,7-диметил-6,7-дигидро-5H-пирроло[3,2-c]пиридазин
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны Получение 116. Неочищенный продукт загружали на SCX колонку с использованием для элюирования метанола, затем 2,0 M раствора аммиака в метаноле для выделения амина. Нужные фракции концентрировали, MC: [M+H]+=276.
Получение 253: ди-трет-Бутиловый эфир (2R,5R)-2-формил-5-метилпиперазин-1,4-дикарбоновой кислоты
К ди-трет-бутиловому эфиру (2R,5R)-2-гидроксиметил-5-метилпиперазин-1,4-дикарбоновой кислоты (1,42 г, 4,3 ммоль) в DCM (18,7 мл) добавляли периодинан Dess-Martin (1,83 г, 4,3 ммоль) при комнатной температуре. Реакционную смесь перемешивали при этой температуре в течение 1 часа. Добавляли насыщенный водный раствор гидрокарбоната натрия и тиосульфат натрия (1:1) и раствор экстрагировали этилацетатом (3×). Объединенные органические экстракты промывали насыщенным водным раствором гидрокарбоната и тиосульфатом натрия (1:1) (3×), сушили над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения (1,71 г, 96%) в виде бледно-желтого твердого вещества, которое использовали без дополнительной очистки. 1H-ЯМР (CDCl3): 9,58 (1H, с), 4,78-4,08 (3H, м), 3,73 (1H, м), 3,39-3,06 (2H, м), 1,53-1,41 (18H, м), 1,18 (3H, т).
Получение 254: ди-трет-Бутиловый эфир (2R,5R)-2-(гидрокситиазол-2-ил-метил)-5-метилпиперазин-1,4-дикарбоновой кислоты
2-Бромтиазол (0,500 г, 3,05 ммоль) растворяли в безводном ТГФ (7,62 мл) и охлаждали до 4°C (ледяная баня) в атмосфере азота. Добавляли i-PrMgCl.LiCl в ТГФ (2,0 M, 1,52 мл, 3,05 ммоль) и реакционную смесь перемешивали при этой температуре в течение 30 минут. Ледяную баню удаляли и реакционную смесь перемешивали в течение 30 минут при комнатной температуре. Добавляли ди-трет-бутиловый эфир (2R,5R)-2-формил-5-метилпиперазин-1,4-дикарбоновой кислоты (0,500 г, 1,52 ммоль) и реакционную смесь перемешивали в течение 2 часов. Реакцию гасили водой и экстрагировали при помощи DCM (3×). Объединенные органические экстракты сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (473 мг). MC: [M+H]+=414.
Получение 255: трет-Бутиловый эфир (2R,5R)-5-(гидрокситиазол-2-ил-метил)-2-метилпиперазин-1-карбоновой кислоты
Гидрид натрия (60% в минеральном масле, 0,08 г, 1,9 ммоль) добавляли к ди-трет-бутиловому эфиру (2R,5R)-2-(гидрокситиазол-2-ил-метил)-5-метилпиперазин-1,4-дикарбоновой кислоты (0,393 г, 0,95 ммоль) в ТГФ (4,8 мл) при 0°C (ледяная баня) в атмосфере азота. Реакционную смесь нагревали до 70°C в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали при помощи EtOAc (3×). Объединенные органические экстракты сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (0,111 г) MC: [M+H]+=314.
Получение 256: трет-Бутиловый эфир (2R,5R)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксэтил}-5-(гидрокситиазол-2-ил-метил)-2-метилпиперазин-1-карбоновой кислоты
К раствору 6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридина (0,252 г, 1,05 ммоль) и N,N-диизопропилэтиламина (0,28 г, 2,2 ммоль) в DCM (4,2 мл), охлажденному на ледяной бане, в атмосфере азота добавляли по каплям хлорацетилхлорид (0,09 г, 0,8 ммоль). После перемешивания при этой температуре в течение 1,5 часа добавляли трет-бутиловый эфир (2R,5R)-5-(гидрокситиазол-2-ил-метил)-2-метилпиперазин-1-карбоновой кислоты (0,18 г, 0,6 ммоль) в DCM (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, затем добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали при помощи DCM (3×). Объединенные органические экстракты фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (0,076 г). MC: [M+H]+=594.
Получение 257: трет-Бутиловый эфир (2R,5R)-5-(хлортиазол-2-ил-метил)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
К раствору трет-бутилового эфира (2R,5R)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-5-(гидрокситиазол-2-ил-метил)-2-метилпиперазин-1-карбоновой кислоты (0,076 г, 0,13 ммоль) и триэтиламина (36 мкл, 0,3 ммоль) в DCM (0,6 мл), охлажденному на ледяной бане, в атмосфере азота добавляли метансульфонилхлорид (12 мкл, 0,2 ммоль). Реакционную смесь перемешивали при этой температуре в течение 1 часа и затем нагревали при комнатной температуре в течение 18 часов. Добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали при помощи EtOAc. Объединенные органические слои промывали насыщенным солевым раствором, сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (0,03 г). MC: [M+H]+=612.
Получение 258: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метил-5-тиазол-2-илметилпиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5R)-5-(хлортиазол-2-ил-метил)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты (0,03 г, 0,05 ммоль), Pd/C (0,01 г, 0 ммоль), триэтиламин (0,01 г, 0,1 ммоль) растворяли в EtOAc (0,2 мл) и гидрировали при комнатной температуре и 1 бар в течение 30 минут, с последующим гидрированием при 40 ф/дюйм2 (2,812 кг/см2) в гидрогенизаторе Парра в течение 1 часа. Реакционную смесь фильтровали и твердые вещества промывали при помощи EtOAc. Фильтрат концентрировали и неочищенный продукт очищали колоночной хроматографией (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60), с получением указанного в заголовке соединения (0,011 г). MC: [M+H]+=578.
Получение 259: трет-Бутиловый эфир (2R,5S)-4-бензил-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты
Использовали три отдельных реакционных колбы, и в каждую загружали гидрид натрия (60% в минеральном масле, 0,486 г, 12,16 ммоль) и безводный DMF (40,5 мл). В колбы добавляли по каплям пирролидинон (0,924 мл, 12,16 ммоль). После перемешивания при этой температуре в течение 30 минут в каждую колбу добавляли трет-бутиловый эфир (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты (2,74 г, 8,11 ммоль) при комнатной температуре. Реакционные смеси перемешивали при 80°C в течение 4 часов. Реакционные смеси объединяли и добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали диэтиловым эфиром (3×). Объединенные органические слои промывали насыщенным солевым раствором, сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (5,9 г), MC: [M+H]+=388.
Получение 260: трет-Бутиловый эфир (2R,5S)-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5S)-4-бензил-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты (5,9 г, 15,25 ммоль) и 10% Pd/C (2,13 г, 1,5 ммоль) растворяли в ледяной уксусной кислоте/этаноле (27,2 мл/72,6 мл) и перемешивали в атмосфере водорода при 1 бар в течение 1 часа. Смесь фильтровали и фильтрат концентрировали. Добавляли насыщенный водный раствор гидрокарбоната натрия и EtOAc. EtOAc слой отделяли и водную фазу экстрагировали при помощи DCM (3×). Объединенные DCM слои сушили при помощи сульфата натрия, фильтровали и концентрировали. Остаток подвергали азеотропной перегонке с толуолом, с получением указанного в заголовке соединения (3,9 г), 1H-ЯМР (CDCl3): 4,23-4,08 (1H, м), 3,95-3,77 (1H, м), 3,69 (1H, д), 3,59-3,46 (1H, м), 3,46-3,34 (1H, м), 3,34-3,07 (3H, м), 3,07-2,89 (1H, м), 2,55-2,39 (3H, м), 2,15-1,92 (2H, м), 1,48 (9H, с), 1,23 (3H, д).
Получение 261: трет-Бутиловый эфир (2R,5S)-4-бензилоксикарбонилметил-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты
К трет-бутиловому эфиру (2R,5S)-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты (2,73 г, 9,19 ммоль) и карбонату калия (1,4 г, 10,1 ммоль) в MeCN (9,8 мл) добавляли бензилбромацетат (2,11 г, 9,2 ммоль) при комнатной температуре. Реакционную смесь перемешивали при этой температуре в течение 18 часов, затем разбавляли хлороформом, фильтровали и фильтрат концентрировали. Хроматография (силикагель, градиентное элюирование, 0-60%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (4 г). MC: [M+H]+=446.
Получение 262: трет-Бутиловый эфир (2R,5S)-4-карбоксиметил-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5S)-4-бензилоксикарбонилметил-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты (4,29 г, 9,64 ммоль) и 10% Pd/C (1,35 г, 1 ммоль) в EtOAc (45,9 мл) гидрировали при комнатной температуре и 1 бар. После перемешивания в течение 30 минут реакционную смесь фильтровали и твердые вещества промывали при помощи EtOAc. Фильтрат упаривали в вакууме и остаток подвергали азеотропной перегонке с толуолом, с получением указанного в заголовке соединения (2,9 г,). MC: [M+H]+=356.
Получение 263: трет-Бутиловый эфир 6-бутирил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Бутиллитий (12,0 мл, 2,5 M раствор в гексане, 30 ммоль) добавляли по каплям к раствору трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (8,0 г, 24,5 ммоль) в диэтиловом эфире (80 мл) при -78°C. Полученную оранжевую суспензию перемешивали в течение 30 минут при этой температуре, затем добавляли по каплям раствор N-метокси-N-метилбутирамида (получен способом, аналогичным тому, который описан в US2010/060696) (5,3 г, 36,6 ммоль) в диэтиловом эфире (40 мл) в течение 1 часа. Реакционной смеси давали нагреться до комнатной температуры и перемешивали еще в течение 1 часа, затем гасили насыщенным водным раствором хлорида аммония и два слоя разделяли. Водную фракцию дополнительно экстрагировали при помощи EtOAc (2×50 мл). Объединенные органические фракции сушили над MgSO4, фильтровали и концентрировали. Хроматография (0-30% EtOAc/петролейный эфир) давала указанное в заголовке соединение (5,6 г, 72%) в виде желтого твердого вещества. MC: [M+H]+=319.
Получение 264: трет-Бутиловый эфир 6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 6-бутирил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (1,43 г, 4,49 ммоль) и деоксофтора (9,9 мл, 50% раствор в ТГФ, 22,5 ммоль) нагревали при 70°C в течение 18 часов. Реакционную смесь охлаждали на льду и обрабатывали осторожно насыщенным водным раствором карбоната натрия до достижения pH 10. Добавляли EtOAc (20 мл) и слои разделяли. Водную фракцию дополнительно экстрагировали при помощи EtOAc (50 мл). Объединенные органические фракции сушили над MgSO4, фильтровали и концентрировали. Хроматография (0-25% EtOAc/петролейный эфир) давала указанное в заголовке соединение (0,47 г, 31%) в виде желтого твердого вещества. MC: [M+H]+=341. Добавляли дополнительное количество элюирование давало исходный кетон (0,30 г).
Получение 265: 6-(1,1-Дифторбутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали из трет-бутилового эфира 6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной процедуре Получения 116. MC: [M+H]+=241.
Получение 266: N-Метокси-3-N-диметилбутирамид
Раствор этилизовалерата (3,01 мл, 20 ммоль) и гидрохлорида N,O-диметилгидроксиламина (2,93 г, 30 ммоль) в ТГФ (40 мл) охлаждали до -20°C в атмосфере азота. Добавляли по каплям изопропилмагнийхлорид (30 мл 2M раствора в ТГФ, 60 ммоль) и реакционную смесь перемешивали при этой температуре в течение 40 минут, затем гасили насыщенным водным раствором хлорида аммония и давали нагреться до комнатной температуры. Слои разделяли и водную фракцию затем экстрагировали при помощи EtOAc (3×20 мл) и объединенные органические фракции промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали с получением указанного в заголовке соединения (2,84 г, 98%), которое использовали без дополнительной очистки. 1H-ЯМР (CDCl3): 3,69 (3H, с), 3,19 (3H, с), 2,32 (2H, д), 2,27-2,11 (1H, м), 0,98 (6H, д).
Получение 267: 6-(1,1-Дифтор-3-метилбутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали, исходя из N-Метокси-3,N-диметилбутирамида аналогично способу получения 6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (см. Получения 264 и 116. MC: [M+H]+=255.
Получение 268: трет-Бутиловый эфир (2R,5R)-4-бензил-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
Смесь трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (14,58 г, 63 ммоль), бензальдегида (7,39 г, 70 ммоль), триацетоксиборогидрида натрия (16,0 г, 76 ммоль) и 1,2-дихлорэтана (100 мл) перемешивали при 20°C, затем гасили насыщенным водным раствором гидрокарбоната натрия (500 мл). Смесь экстрагировали при помощи DCM (3×100 мл) и объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-25% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (15,4 г, 76%) в виде масла. MC: [M+H]+=321. 1H-ЯМР (CDCl3): 7,42-7,12 (5H, м), 4,12-3,88 (2H, м), 3,85-3,55 (4H, м), 3,27 (1H, дд), 2,91-2,79 (1H, м), 2,73 (1H, дд), 2,63 (1H, с), 2,33 (1H, дд), 1,49 (9H, с), 1,21 (3H, д).
Получение 269: трет-Бутиловый эфир (2R,5R)-4-бензил-5-фторметил-2-метилпиперазин-1-карбоновой кислоты
К перемешиваемому раствору трифторида диэтиламиносеры (0,32 мл, 0,393 г, 2,44 ммоль) в DCM (2 мл) при -78°C в атмосфере азота добавляли раствор трет-бутилового эфира (2R,5R)-4-бензил-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,651 г, 2,03 ммоль) в DCM (6 мл). Смесь перемешивали при -78°C в течение 0,5 часа, затем при 20°C в течение 3 часов. Смесь выливали в насыщенный водный раствор гидрокарбоната натрия (100 мл) и лед (20 г), затем экстрагировали при помощи DCM (3×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-40% Et2O в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,393 г) в виде масла. MC: [M+H]+=323.
Получение 270: трет-Бутиловый эфир (2R,5R)-5-фторметил-2-метилпиперазин-1-карбоновой кислоты, ацетат
Смесь трет-бутилового эфира (2R,5R)-4-бензил-5-фторметил-2-метилпиперазин-1-карбоновой кислоты (0,627 г, 1,95 ммоль), этанол (20 мл), уксусной кислоты (0,5 мл) и 10% палладия на углероде (0,30 г) гидрировали при 20°C и 3 бар в течение 4 часов. Катализатор удаляли путем фильтрования и фильтрат упаривали в вакууме с осуществлением азеотропной перегонки с толуолом (×2). Остаток сушили в вакууме при 40°C, с получением указанного в заголовке соединения (0,52 г). MC: [M+H]+=233.
Получение 271: трет-Ббутиловый эфир (2R,5R)-4-бензилоксикарбонилметил-5-фторметил-2-метилпиперазин-1-карбоновой кислоты
Смесь трет-бутилового эфира (2R,5R)-5-фторметил-2-метилпиперазин-1-карбоновой кислоты (0,371 г, 1,27 ммоль), карбоната калия (0,70 г, 5,1 ммоль), бензилбромацетата (0,38 г, 1,65 ммоль) и ацетонитрила (10 мл) перемешивали при 20°C в течение 18 часов. Смесь выливали в воду (50 мл) и экстрагировали при помощи DCM (3×30 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-100% Et2O в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,424 г, 87%) в виде масла. MC: [M+H]+=381.
Получение 272: трет-Бутиловый эфир (2R,5R)-4-карбоксиметил-5-фторметил-2-метилпиперазин-1-карбоновой кислоты
Смесь трет-бутилового эфира (2R,5R)-4-бензилоксикарбонилметил-5-фторметил-2-метилпиперазин-1-карбоновой кислоты (0,42 г, 1,1 ммоль), метанола (20 мл) и 10% палладия на углероде (0,14 г) гидрировали при 20°C и 1 бар в течение 18 часов. Катализатор удаляли путем фильтрования и фильтрат упаривали в вакууме, с получением указанного в заголовке соединения (0,289 г) в виде масла. MC: [M+H]+=291.
Получение 273: трет-Бутиловый эфир (2R,5R)-4-бензил-5-формил-2-метилпиперазин-1-карбоновой кислоты
К раствору оксалилхлорида в DCM (2 M, 3 мл, 6 ммоль) и DCM (5 мл) при -78°C в атмосфере азота добавляли, по каплям при перемешивании, раствор ДМСО (1,0 мл, 1,09 г, 14 ммоль) в DCM (5 мл) и смесь перемешивали при -78°C в течение 0,4 часа. Добавляли по каплям раствор трет-бутилового эфира (2R,5R)-4-бензил-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (1,12 г, 3,5 ммоль) в DCM (5 мл) в течение 0,2 часа и смесь перемешивали при -78°C в течение 0,6 часов. Добавляли триэтиламин (3,9 мл, 2,83 г, 28 ммоль) по каплям в течение 0,2 часа и перемешивание продолжали еще в течение 0,3 часа. Добавляли воду (10 мл) и смесь медленно нагревали до 20°C в течение 16 часов. Органическую фазу отделяли и водную фазу экстрагировали при помощи DCM (2×10 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением пастообразного вещества. Это вещество распределяли между 1:1 Et2O+40-60 петролейный эфир (50 мл) и водой (3×50 мл) и органическую фазу сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-20% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,275 г) в виде масла. MC: [M+H]+=319.
Получение 274: трет-Бутиловый эфир (2R,5R)-4-бензил-5-дифторметил-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-4-бензил-5-формил-2-метилпиперазин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 269. MC: [M+H]+=341.
Получение 275: трет-Бутиловый эфир (2R,5R)-5-дифторметил-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-4-бензил-5-дифторметил-2-метилпиперазин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 270. 1H-ЯМР (Me-d3-OD): 5,91 (1H, дт), 4,26-4,08 (1H, м), 4,04-3,88 (1H, м), 3,31-3,17 (1H, м), 3,15-2,94 (2H, м), 2,61 (1H, дд), 1,48 (9H, д), 1,24 (3H, д).
Получение 276: трет-Бутиловый эфир (2R,5R)-4-бензилоксикарбонилметил-5-дифторметил-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-5-дифторметил-2-метилпиперазин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 271. MC: [M+H]+=399.
Получение 277: трет-Бутиловый эфир (2R,5R)-4-карбоксиметил-5-дифторметил-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-4-бензилоксикарбонилметил-5-дифторметил-2-метилпиперазин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 272. MC: [M-H]-=307.
Получение 278: трет-Бутиловый эфир (2R,5R)-4-бензил-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты (альтернативная процедура)
Раствор метансульфонового ангидрида (0,65 г, 3,72 ммоль) в DCM (5 мл) медленно добавляли к раствору трет-бутилового эфира (2R,5R)-4-бензил-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (1,08 г, 3,38 ммоль) и триэтиламина (1,42 мл, 1,02 г, 10,1 ммоль) в DCM (10 мл) при перемешивании в атмосфере азота и внешнем охлаждении на ледяной бане. Перемешивание продолжали при 0°C в течение 2 часов, затем добавляли одной порцией пиразол (0,3 г, 4,4 ммоль). Перемешивание при 20°C продолжали в течение 18 часов, затем смесь распределяли между насыщенным водным раствором NaHCO3 (40 мл) и DCM (3×20 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-40% Et2O в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,811 г) в виде масла. MC: [M+H]+=371.
Получение 279: трет-Бутиловый эфир (2R,5R)-4-бензилоксикарбонилметил-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты (см. Получение 219) с использованием процедуры, аналогичной той, которая описана для Получения 271. MC: [M+H]+=429.
Получение 280: трет-Бутиловый эфир (2R,5R)-4-карбоксиметил-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-4-бензилоксикарбонилметил-2-метил-5-пиразол-1-илметилпиперазин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 272. MC: [M+H]+=339.
Получение 281: трет-Бутиловый эфир (2R,5R)-4-бензил-2-метил-5-(4-метилпиразол-1-илметил)пиперазин-1-карбоновой кислоты
Получали из 4-метилпиразола с использованием способа, аналогичного описанному для Получения 278. MC: [M+H]+=385.
Получение 282: трет-Бутиловый эфир (2R,5R)-2-метил-5-(4-метилпиразол-1-илметил)пиперазин-1-карбоновой кислоты, ацетат
Получали из трет-бутилового эфира (2R,5R)-4-бензил-2-метил-5-(4-метилпиразол-1-илметил)пиперазин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 270. MC: [M+H]+=295.
Получение 283: трет-Бутиловый эфир (2R,5R)-4-бензилоксикарбонилметил-2-метил-5-(4-метилпиразол-1-илметил)пиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-2-метил-5-(4-метилпиразол-1-илметил)пиперазин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 271. MC: [M+H]+=443.
Получение 284: трет-Бутиловый эфир (2R,5R)-4-карбоксиметил-2-метил-5-(4-метилпиразол-1-илметил)пиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-4-бензилоксикарбонилметил-2-метил-5-(4-метилпиразол-1-илметил)пиперазин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 272. MC: [M+H]+=353.
Получение 285: трет-Бутиловый эфир (2R,5R)-4-бензил-5-(4-фторпиразол-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Получали из 4-фторпиразола (см. England et al., Tetrahedron Letters 2010 51 2849-2851) с использованием способа, аналогичного описанному для Получения 278. 1H-ЯМР (Me-d3-OD): 7,63 (1H, д), 7,45-7,20 (6H, м), 4,31 (1H, дд), 4,27-4,08 (2H, м), 3,81 (1H, д), 3,65 (2H, д), 3,31-3,20 (2H, м), 2,84 (1H, дд), 2,38 (1H, дд), 1,57-1,45 (9H, м), 1,19 (3H, д).
Получение 286: трет-Бутиловый эфир (2R,5R)-5-(4-фторпиразол-1-илметил)-2-метилпиперазин-1-карбоновой кислоты, ацетат
Получали из трет-бутилового эфира (2R,5R)-4-бензил-5-(4-фторпиразол-1-илметил)-2-метилпиперазин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 270. MC: [M+H]+=299.
Получение 287: трет-Бутиловый эфир (2R,5R)-4-бензилоксикарбонилметил-5-(4-фторпиразол-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-5-(4-фторпиразол-1-илметил)-2-метилпиперазин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 271. MC: [M+H]+=447.
Получение 288: трет-Бутиловый эфир (2R,5R)-4-карбоксиметил-5-(4-фторпиразол-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-4-бензилоксикарбонилметил-5-(4-фторпиразол-1-илметил)-2-метилпиперазин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 272. MC: [M+H]+=357.
Получение 289: трет-Бутиловый эфир 6-(дифторфенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
К перемешиваемому раствору трифторида диэтиламиносеры (14,8 мл, 18 г, 112,5 ммоль) в DCM (20 мл) при -78°C в атмосфере азота добавляли раствор трет-бутилового эфира 6-бензоил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (9,9 г, 28,1 ммоль) в DCM (30 мл) и полученный раствор перемешивали при -78°C в течение 1 часа, затем при 20°C в течение 6 дней. Смесь охлаждали до -78°C и добавляли раствор этанола в DCM (2 мл) и полученный раствор перемешивали при 20°C в течение 11 дней. Реакционную смесь медленно добавляли к смеси льда (200 г) и насыщенного водного раствора NaHCO3 (300 мл) и полученную смесь экстрагировали при помощи DCM (5×100 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 10-40% Et2O в 40-60 петролейном эфире) давала желтое твердое вещество. Кристаллизация из EtOAc и 40-60 петролейного эфира давала указанное в заголовке соединение (6,22 г) в виде бесцветного твердого вещества. MC: [M+H]+=375.
Получение 290: 6-(Дифторфенилметил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Смесь трет-бутилового эфира 6-(дифторфенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (6,22 г, 16,6 ммоль), метанола (30 мл) и хлористоводородной кислоты (5 M, 30 мл) перемешивали при 20°C в течение 3 часов, при 35°C в течение 4 часов, затем оставляли при 20°C в течение 14 часов. Смесь упаривали в вакууме и остаток подвергали азеотропной перегонке с толуолом (×3), изопропанолом и метанолом (×3). Остаток сушили в вакууме при 50°C в течение 4 часов, с получением указанного в заголовке соединения. MC: [M+H]+=275.
Получение 291: трет-Бутиловый эфир 3,3-диметил-6-(1-метиленпропил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Смесь 4,4,5,5-тетраметил-2-(1-метиленпропил)-[1,3,2]диоксаборолана (0,793 г, 4,36 ммоль), трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин-1-карбоновой кислоты (0,821 г, 2,9 ммоль), карбоната калия (1,20 г, 8,7 ммоль), трис(дибензилиденацетон)дипалладия (0) (0,133 г, 0,145 ммоль), 2-дициклогексилфосфино-2',6'-диметоксибифенила (SPhos, 0,060 г, 0,145 ммоль), 1,4-диоксана (18 мл) и воды (45 мл) нагревали при 94°C в течение 18 часов, затем выливали в насыщенный водный раствор NaHCO3 (100 мл) и экстрагировали при помощи DCM (3×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-25% Et2O в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,487 г) в виде масла. MC: [M+H]+=303. Дополнительная хроматография смешанных фракций давала дополнительное количество указанного в заголовке соединения (0,20 г).
Получение 292: трет-Бутиловый эфир 3,3-диметил-6-пропионил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 3,3-диметил-6-(1-метиленпропил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,65 г, 2,15 ммоль), периодата натрия (1,89 г, 8,61 ммоль), 4% водного раствора тетроксида осмия (1,65 мл, 0,26 ммоль), ТГФ (16 мл), ацетона (8 мл) и воды (16 мл) перемешивали при 20°C в течение 4 часов, затем распределяли между водой (50 мл) и DCM (3×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-30% Et2O в 40-60 петролейном эфире) давала твердое вещество, которое растирали в порошок с 40-60 петролейным эфиром, с получением твердого вещества (0,25 г). Маточные растворы концентрировали и очищали хроматографией, как указано выше, с получением дополнительного количества твердого вещества (0,27 г). Две партии твердого вещества объединяли с получением указанного в заголовке соединения (0,52 г). MC: [M+H]+=305.
Получение 293: трет-Бутиловый эфир 6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
К перемешиваемому раствору трифторида диэтиламиносеры (0,53 мл, 0,64 г, 4 ммоль) в DCM (3 мл) при -78°C в атмосфере азота добавляли, по каплям в течение 0,2 часа, раствор трет-бутилового эфира 3,3-диметил-6-пропионил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,52 г, 1,7 ммоль) в DCM (7 мл). Смесь перемешивали при -78°C в течение 1 часа, затем при 20°C в течение 16 часов. Смесь выливали в лед (30 г) и насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали при помощи DCM (3×20 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-30% Et2O в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,398 г) в виде твердого вещества. 1H-ЯМР (Me-d3-OD): 8,30 (1H, с), 7,91 (1H, с), 3,87-3,76 (2H, м), 2,37-2,18 (2H, м), 1,60 (9H, с), 1,43 (6H, с), 0,98 (3H, т).
Получение 294: 6-(1,1-Дифторпропил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Смесь трет-бутилового эфира 6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,398 г, 1,2 ммоль), хлористоводородной кислоты (5 M, 12 мл) и метанола (12 мл) перемешивали при 20°C в течение 16 часов, затем упаривали в вакууме. Остаток подвергали азеотропной перегонке с метанолом (×3) и толуолом (×2), с получением указанного в заголовке соединения (0,3 г) в виде твердого вещества. MC: [M+H]+=227.
Получение 295: трет-бутиловый эфир 6-(1-гидрокси-2-метилпропил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 6-формил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,65 г, 2,36 ммоль) в ТГФ (20 мл) при -78°C в атмосфере азота добавляли, по каплям в течение 0,1 часа, раствор комплекса изопропилмагнийхлорид - литийхлорид в ТГФ (1,3 M, 2,7 мл, 3,53 ммоль). Полученный раствор перемешивали при -78°C, затем гасили водным раствором лимонной кислоты (5%, 30 мл) и экстрагировали при помощи DCM (4×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением пенистого вещества. Хроматография (SiO2; градиентное элюирование с использованием 0-100% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,398 г). 1H-ЯМР (Me-d3-OD): 8,15 (1H, с), 8,08-7,45 (1H, м), 4,41 (1H, д), 3,78 (2H, с), 2,10-1,97 (1H, м), 1,60 (9H, с), 1,40 (6H, д), 0,92 (6H, т).
Получение 296: трет-Бутиловый эфир 6-изобутирил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 6-(1-гидрокси-2-метилпропил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,366 г, 1,14 ммоль), DCM (50 мл) и оксида марганца (IV) (9,6 г, 110 ммоль) перемешивали при 20°C в течение 18 часов, затем твердые вещества удаляли путем фильтрования и фильтрат упаривали в вакууме, с получением твердого вещества. Хроматография (SiO2; градиентное элюирование с использованием 0-40% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,299 г) в виде бесцветного твердого вещества. МС: [M+H]+=319.
Получение 297: трет-Бутиловый эфир 6-(1,1-дифтор-2-метилпропил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-изобутирил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, подобной той, которая описана для Получения 293. MC: [M+H]+=341.
Получение 298: 6-(1,1-Дифтор-2-метилпропил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали из трет-бутилового эфира 6-(1,1-дифтор-2-метилпропил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 294. MC: [M+H]+=241.
Получение 299: трет-бутиловый эфир 6-(циклопропилгидроксиметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали, следуя способу, подобному тому, который описан для Получения 295, с использованием циклопропилмагнийхлорида. MC: [M+H]+=319.
Получение 300: трет-Бутиловый эфир 6-циклопропанкарбонил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-(циклопропилгидроксиметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 296. MC: [M+H]+=317.
Получение 301: трет-Бутиловый эфир 6-(циклопропилдифторметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 6-циклопропанкарбонил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,21 г, 0,66 ммоль), ТГФ (2 мл) и деоксофтора (50% в ТГФ, 1,4 мл, 1,5 г, 3,3 ммоль) нагревали при 80°C в течение 18 часов, затем охлаждали и распределяли между льдом (20 г), насыщенным водным раствором NaHCO3 (30 мл) и DCM (3×30 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-25% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,189 г) в виде масла, которое отверждалось. MC: [M+H]+=339.
Получение 302: 6-(Циклопропилдифторметил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 6-(циклопропилдифторметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 294. Остаток после упаривания преобразовывали в форму свободного основания путем распределения между DCM и водным раствором гидрокарбоната натрия, затем очищали хроматографией на диоксиде кремния, с получением указанного в заголовке соединения (0,085 г). MC: [M+H]+=239.
Получение 303: трет-Бутиловый эфир 3,3-диметил-6-(3-метилбутил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали, следуя способу, аналогичному тому, который описан для Получения 117, с использованием 3-метилбутилцинкбромида. MC: [M+H]+=319.
Получение 304: трет-Бутиловый эфир 3,3-диметил-6-(3-метилбутил)-5-окси-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 3,3-диметил-6-(3-метилбутил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (1,77 г, 5,57 ммоль), DCM (20 мл) и 3-хлорпербензойной кислоты (1,37 г, 6,12 ммоль) перемешивали при 20°C в течение 3 часов. Смесь наносили непосредственно на картридж с диоксидом кремния и элюирование осуществляли с использованием 20-100% EtOAc в 40-60 петролейном эфире, затем 0-20% MeOH в EtOAc, с получением указанного в заголовке соединения (1,596 г) в виде твердого вещества. MC: [M+H]+=335.
Получение 305: трет-Бутиловый эфир 6-(1-гидрокси-3-метилбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 3,3-диметил-6-(3-метилбутил)-5-окси-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (1,6 г, 4,8 ммоль) и уксусного ангидрида (10 мл) нагревали при 100°C в течение 2 часов, затем выливали в лед-воду (50 г) и перемешивали в течение 1 часа. Смесь нейтрализовали при помощи NaHCO3 затем экстрагировали при помощи DCM (3×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме с получением масла (2,096 г). Это вещество смешивали с метанолом (20 мл), гидроксидом натрия (0,25 г, 6,13 ммоль) и водой (1 мл) и перемешивали при 100°C в течение 1 часа. Смесь выливали в насыщенный солевой раствор и экстрагировали при помощи DCM (3×50 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме. Хроматография остатка (SiO2; градиентное элюирование с использованием 0-100% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (1,757 г) в виде бесцветного пенистого вещества. MC: [M+H]+=335.
Получение 306: трет-Бутиловый эфир 3,3-диметил-6-(3-метилбутирил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-(1-гидрокси-3-метилбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного тому, который описан для Получения 296. [M+H]+=333.
Получение 307: трет-Бутиловый эфир 6-(1,1-дифтор-3-метилбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 3,3-диметил-6-(3-метилбутирил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного тому, который описан для Получения 293. MC: [M+H]+=355.
Получение 308: 6-(1,1-Дифтор-3-метил-бутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 6-(1,1-дифтор-3-метилбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного тому, который описан для Получения 294. Остаток после упаривания преобразовывали в форму свободного основания путем распределения между DCM и водным раствором гидрокарбоната натрия, с получением указанного в заголовке соединения (0,795 г) в виде не совсем белого твердого вещества. MC: [M+H]+=255.
Получение 309: трет-Бутиловый эфир 6-бутил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали, следуя способу, аналогичному тому, который описан для Получения 117, с использованием бутилцинкбромида. MC: [M+H]+ 305.
Получение 310: трет-Бутиловый эфир 6-бутил-3,3-диметил-5-окси-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
К охлажденному раствору (ледяная баня 3-4°C) трет-бутилового эфира 6-бутил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (13,4 г, 44,08 ммоль) в DCM (490 мл) добавляли 3-хлорпербензойную кислоту (10,37 г, 46,28 ммоль) по порциям в течение 0,25 часа. Температуру поддерживали ниже 5°C в процессе добавления, затем смесь осторожно нагревали в течение ночи до 20°C. Органический слой промывали насыщенным водным раствором бикарбоната натрия (3×500 мл), сушили (Na2SO4) и упаривали в вакууме. Хроматография (SiO2 градиентное элюирование, 0-20%, MeOH в EtOAc) давала указанное в заголовке соединение (12 г, 85%) в виде бледно-желтого твердого вещества. MC: [M+H]+=321.
Получение 311: трет-Бутиловый эфир 6-(1-гидроксибутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-бутил-3,3-диметил-5-окси-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 305. MC: [M+H]+=321.
Получение 312: трет-Бутиловый эфир 6-бутирил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-(1-гидроксибутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 296. MC: [M+H]+=319.
Получение 313: трет-Бутиловый эфир 6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-бутирил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 293. MC: [M+H]+=341.
Получение 314: 6-(1,1-Дифтор-бутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 6-(1,1-дифтор-бутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием способа, аналогичного описанному для Получения 294. Остаток после упаривания преобразовывали в форму свободного основания путем распределения между DCM и водным раствором гидрокарбоната натрия, с получением указанного в заголовке соединения (0,799 г) в виде масла. MC: [M+H]+=241.
Получение 315: трет-Бутиловый эфир (2R,5R)-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты, хлорацетилхлорида и 6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридина с использованием способа, аналогичного описанному для Получения 203, но с использованием DIPEA в качестве основания вместо триэтиламина, и нагревание осуществляли при 40°C (см. также Общую Процедуру 5, ниже). MC: [M+H]+=527.
Получение 316: трет-Бутиловый эфир (2R,5R)-5-хлорметил-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира (2R,5R)-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,572 г, 0,97 ммоль) и триэтиламина (0,22 мл, 0,157 г, 1,55 ммоль) в DCM (10 мл) при -10°C в атмосфере азота добавляли раствор метансульфонилхлорида (0,09 мл, 0,133 г, 1,2 ммоль) в DCM (5 мл). Смесь перемешивали при 20°C в течение 18 часов, затем распределяли между насыщенным водным раствором NaHCO3 (50 мл) и DCM (3×30 мл) и объединенные органические экстракты сушили (Na2SO4) и упаривали в вакууме, с получением указанного в заголовке соединения (0,576 г) в виде масла, которое использовали без дополнительной очистки. MC: [M+H]+=545.
Получение 317: 6-(2,6-Диметилфенокси)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали из 2,6-диметилфенола с использованием способов, аналогичных тем, которые описаны для Получений 215 и 216. MC: [M+H]+=269.
Получение 318: 6-(2,6-Дифторфенокси)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали из 2,6-дифторфенола с использованием способов, аналогичных тем, которые описаны для Получений 215 и 216. MC: [M+H]+=277.
Получение 319: 6-(2-Хлор-6-метилфенокси)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорид
Получали из 2-хлор-6-метилфенола с использованием способов, аналогичных тем, которые описаны для Получений 215 и 216. MC: [M+H]+=289.
Получение 320: трет-Бутиловый эфир 6-формил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
трет-Бутиловый эфир 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (1 г, 3,5 ммоль), винилтрифторборат калия (950 мг, 7 ммоль), триэтиламин (986 мкл, 7 ммоль) и PdCl2 (dppf)2.DCM растворяли в EtOH и нагревали при 100°C в течение 11 часов. Смеси давали охладиться и затем концентрировали в вакууме. Остаток распределяли между DCM и водой. DCM слой промывали насыщенным солевым раствором и сушили (MgSO4). Очистка хроматографией на оксиде алюминия (с использованием для элюирования DCM) давала продукт в виде желтого масла (842 мг, 87%). MC: m/z=275 [M+H]+. Это вещество (842 мг, 3,07 ммоль) растворяли в смеси ТГФ/ацетон/вода (2:2:1; 25 мл) и затем обрабатывали при помощи NaIO4 (3,27 г, 15,3 ммоль) и OsO4 (2 мл, 4% в H2O; ~0,01 моль экв.). Смесь перемешивали в течение ночи и затем распределяли между EtOAc и водой. Водный слой экстрагировали два раза при помощи EtOAc. Объединенную органическую фракцию промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали в вакууме. Очистка при помощи SiO2 хроматографии (с использованием для элюирования 20-40% EtOAc-гексан) давала указанное в заголовке соединение (500 мг, 59%). MC: [M+H]+=277.
Получение 321: 6-Хлор-3-метил-1,3-дигидроиндол-2-он
BuLi (2,2 M в циклогексане, 22 мл, 48 ммоль) добавляли по каплям при -78°C к раствору 6-хлор-1,3-дигидроиндол-2-она (4 г, 24 ммоль) и TMEDA (11,2 мл, 79 ммоль) в ТГФ (100 мл) в атмосфере N2. Раствор перемешивали в течение 30 минут при указанной температуре и затем добавляли MeI (2,2 мл, 36 ммоль). Реакционную смесь нагревали до -20°C и перемешивали при этой температуре в течение 1,5 часа. Реакцию гасили насыщенным водным раствором NH4Cl и экстрагировали при помощи EtOAc. Органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме. Хроматография давала указанное в заголовке соединение (2,7 г) в виде бледно-ярко-розового твердого вещества. MC: [M+H]+=182.
Получение 322: 6-Хлор-3-этил-3-метил-1,3-дигидроиндол-2-он
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 321, с использованием 6-хлор-3-метил-1,3-дигидроиндол-2-она (500 мг, 2,76 ммоль) и EtI (242 мкл, 3 ммоль), с получением указанного в заголовке соединения (250 мг) в виде белого твердого вещества. MC: [M+H]+=210.
Получение 323: 6-Хлор-3-этил-3-метил-2,3-дигидро-1H-индол
BH3-Me2S (2 M в ТГФ, 5,7 мл, 11,5 ммоль) добавляли к раствору 6-хлор-3-этил-3-метил-1,3-дигидроиндол-2-она (240 мг, 1,1 ммоль) в ТГФ (10 мл). Реакционную смесь перемешивали при 70°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и осторожно добавляли MeOH (чистота ~20 мл). Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 2 часов. Растворители затем удаляли в вакууме и остаток очищали флэш-хроматографией, с получением указанного в заголовке соединения (147 мг) в виде бесцветного масла. MC: [M+H]+=196.
Получение 324: Диметиловый эфир 2-(4-бром-2-нитрофенил)-малоновой кислоты
К охлажденному (0°C) раствору диметилмалоната (16,7 мл, 146 ммоль) в DMF (100 мл) добавляли 4-бром-1-фтор-2-нитробензол (21,4 г, 97,3 ммоль) и K2CO3 (40 г, 291 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем выливали в смесь 2 M водный раствор HCl/лед. Добавляли дополнительное количество 2 M водного раствора HCl до тех пор, пока не завершалось осаждение продукта. Образовавшееся твердое вещество фильтровали, промывали водой и сушили в вакууме, с получением указанного в заголовке соединения (24 г) в виде не совсем белого твердого вещества. MC: [M+H]+=332.
Получение 325: Диметиловый эфир 2-(4-бром-2-нитрофенил)-2-метилмалоновой кислот
Следуя способам аналогичным тем, которые описаны в Получении 324, с использованием диметилового эфира 2-(4-бром-2-нитрофенил)малоновой кислоты (10 г, 30 ммоль), MeI (2 мл, 33 ммоль) и K2CO3 (4,6 г, 33 ммоль), получали указанное в заголовке соединение (9,4 г) в виде желтого твердого вещества. MC: [M+H]+=346.
Получение 326: Метиловый эфир 6-бром-3-метил-2-оксо-2,3-дигидро-1H-индол-3-карбоновой кислоты
Смесь диметилового эфира 2-(4-бром-2-нитрофенил)-2-метилмалоновой кислоты (5 г, 14,4 ммоль) в AcOH (30 мл), содержащем порошок железа (2,4 г, 43,3 ммоль) перемешивали при 95°C в течение 1 часа. После этого добавляли вторую аликвоту порошка железа (803 мг, 14,4 ммоль) и перемешивание поддерживали еще в течение одного часа. Растворитель затем удаляли в вакууме и остаток растворяли в EtOAc. Твердое вещество собирали путем фильтрования и растворяли в 2 M водном растворе HCl (20 мл). Смесь перемешивали в течение 1 часа при комнатной температуре и продукт затем экстрагировали при помощи DCM (3×). Органическую фазу сушили над MgSO4 и концентрировали в вакууме, с получением указанного в заголовке соединения (2,7 г) в виде белого твердого вещества. MC: [M+H]+=284.
Получение 327: (6-Бром-3-метил-2,3-дигидро-1H-индол-3-ил)-метанол
Следуя способам аналогичным тем, которые описаны в Получении 323, с использованием метилового эфира 6-бром-3-метил-2-оксо-2,3-дигидро-1H-индол-3-карбоновой кислоты (500 мг, 1,76 ммоль) и BH3-Me2S (2M в ТГФ, 8,8 мл, 17,6 ммоль) получали указанное в заголовке соединение (279 мг) в виде белого полутвердого вещества. MC: [M+H]+=242.
Получение 328: трет-бутиловый эфир 6-бром-3-гидроксиметил-3-метил-2,3-дигидроиндол-1-карбоновой кислоты
Ди-трет-бутилдикарбонат (271 мг, 1,24 ммоль) и DIPEA (226 мкл, 1,3 ммоль) добавляли к раствору (6-бром-3-метил-2,3-дигидро-1H-индол-3-ил)метанола (279 мг, 1,15 ммоль) в DCM (5 мл) и смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь распределяли между насыщенным водным раствором NaHCO3 и DCM, органическую фазу сушили над MgSO4 и концентрировали в вакууме, с получением указанного в заголовке соединения (360 мг) в виде белого полутвердого вещества, MC: [M-tBu]+=286.
Получение 329: трет-бутиловый эфир 6-Бром-3-метоксиметил-3-метил-2,3-дигидроиндол-1-карбоновой кислоты
NaH (60% дисперсия в минеральном масле, 60 мг, 1,5 ммоль) добавляли к раствору трет-бутилового эфира 6-бром-3-гидроксиметил-3-метил-2,3-дигидроиндол-1-карбоновой кислоты (360 мг, 1,05 ммоль) в безводном DMF (5 мл). Через 10 минут добавляли MeI (66 мкл, 1,1 ммоль) и перемешивание поддерживали в течение 2 часов. Реакцию гасили водой и экстрагировали при помощи EtOAc. Органическую фазу сушили над MgSO4 и концентрировали в вакууме. Хроматография (20% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (300 мг) в виде бесцветной жидкости. MC: [M-tBu]+=300.
Получение 330: 6-Бром-3-метоксиметил-3-метил-2,3-дигидро-1H-индол, гидрохлоридная соль
Насыщенный раствор HCl в EtOAc (10 мл) добавляли к трет-бутиловому эфиру 6-бром-3-метоксиметил-3-метил-2,3-дигидроиндол-1-карбоновой кислоты (300 мг, 0,84 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли в вакууме, твердое вещество промывали при помощи Et2O и сушили в вакууме, с получением указанного в заголовке соединения (220 мг) в виде желтого полутвердого вещества. MC: [M+H]+=256.
Получение 331: Метиловый эфир 6-бром-3-метил-2,3-дигидро-1H-индол-3-карбоновой кислоты
К раствору метилового эфира 6-бром-3-метил-2-оксо-2,3-дигидро-1H-индол-3-карбоновой кислоты (200 мг, 0,7 ммоль) в толуоле в атмосфере N2 добавляли Fe3(CO12) (14 мг, 0,028 ммоль) и PhSiH3 (33 мкл) и смесь перемешивали при 100°C в течение 16 часов. Полученную смесь фильтровали через целит (промывали при помощи EtOAc). Растворитель удаляли в вакууме, с получением указанного в заголовке соединения (70 мг) в виде бесцветного смолистого вещества. MC: [M+H]+=270.
Получение 332: Метиловый эфир 2-(4-бром-2-нитрофенил)-2-фенилпропионовой кислоты
Раствор метилового эфира фенилуксусной кислоты (4 г, 27,3 ммоль) и 4-бром-1-фтор-2-нитробензола (5 г, 22,7 ммоль) в DMF (30 мл) медленно добавляли к суспензии NaH (60% в минеральном масле, 3 г, 77,1 ммоль) в DMF (80 мл) при 0°C в атмосфере N2. Реакционную смесь затем перемешивали в течение 3 часов при комнатной температуре. Затем добавляли MeI (5,6 мл, 91 ммоль), и реакционную смесь перемешивали в течение ночи при указанной температуре. Реакцию гасили насыщенным водным раствором NaHCO3 и экстрагировали при помощи EtOAc. Органическую фазу сушили над MgSO4 и концентрировали в вакууме. Хроматография (10% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (2,6 г) в виде оранжевого полутвердого вещества. 1H-ЯМР (ДМСО-d6): 8,21-8,14 (1H, м), 7,86-7,77 (1H, м), 7,44-7,36 (5H, м), 6,84 (1H, д), 3,53 (3H, с), 2,06 (3H, с).
Получение 333: 6-Бром-3-метил-3-фенил-1,3-дигидроиндол-2-он
Следуя способам аналогичным тем, которые описаны в Получении 326, исходя из метилового эфира 2-(4-бром-2-нитрофенил)-2-фенилпропионовой кислоты (1,3 г, 4,9 ммоль) и порошка железа (890 мг, 15 ммоль), получали указанное в заголовке соединение (875 мг) в виде желтого твердого вещества. MC: [M+H]+=302.
Получение 334: 6-Бром-3-метил-3-фенил-2,3-дигидро-1H-индол
Следуя способам аналогичным тем, которые описаны в Получении 323, с использованием 6-бром-3-метил-3-фенил-1,3-дигидроиндол-2-она (875 мг, 2,89 ммоль) и BH3-Me2S (2M в ТГФ, 14,58 мл, 28,9 ммоль) получали указанное в заголовке соединение (600 мг) в виде бесцветного масла. MC: [M+H]+=288.
Получение 335: 1-(6-Бром-3-метил-3-фенил-2,3-дигидроиндол-1-ил)этанон
Ацетилхлорид (163 мкл, 2,29 ммоль) и TEA (313 мкл, 2,29 ммоль) добавляли к раствору 6-бром-3-метил-3-фенил-2,3-дигидро-1H-индола (600 мг, 2,1 ммоль) в DCM (20 мл) при 0°C. Реакционную смесь перемешивали в течение 45 минут при комнатной температуре и затем гасили при помощи 1 M водного раствора HCl и экстрагировали при помощи EtOAc. Органическую фазу сушили над MgSO4 и концентрировали в вакууме, с получением указанного в заголовке соединения (660 мг) в виде желтого твердого вещества. MC: [M+H]+=330.
Получение 336: 1-Ацетил-3-метил-3-фенил-2,3-дигидро-1H-индол-6-карбонитрил
CuCN (179 мг, 2 ммоль) добавляли к раствору 1-(6-бром-3-метил-3-фенил-2,3-дигидроиндол-1-ил)этанона (330 мг, 1 ммоль) в NMP (5 мл). Реакционную смесь перемешивали при 175°C в течение 16 часов. К смеси добавляли Et2O и твердое вещество отфильтровывали. Фильтрат промывали 2 M водным раствором HCl и насыщенным водным раствором NaHCO3. Растворитель удаляли в вакууме, с получением указанного в заголовке соединения (250 мг) в виде коричневого твердого вещества. MC: [M+H]+=277.
Получение 337: 3-Метил-3-фенил-2,3-дигидро-1H-индол-6-карбонитрил
5 M водный раствор HCl (3 мл) добавляли к раствору 1-ацетил-3-метил-3-фенил-2,3-дигидро-1H-индол-6-карбонитрила (250 мг, 0,9 ммоль) в ацетонитриле (10 мл). Раствор перемешивали при температуре кипения с обратным холодильником в течение 1 часа и затем охлаждали до комнатной температуры. Затем к реакционной смеси добавляли насыщенный водный раствор NaHCO3 до тех пор, пока pH раствора не достигал уровня 8, и продукт затем экстрагировали при помощи EtOAc. Органическую фазу сушили над MgSO4 и концентрировали в вакууме, с получением указанного в заголовке соединения (200 мг) в виде светло-коричневого смолистого вещества. MC: [M+H]+=235.
Получение 338: Этиловый эфир 2-(4-бром-2-нитрофенил)-2-пиридин-2-ил-пропионовой кислоты
Следуя способам, аналогичным тем, которые описаны в Получении 332, исходя из 4-бром-1-фтор-2-нитробензола (5 г, 22,7 ммоль), этилового эфира пиридин-2-ил-уксусной кислоты (4,5 г, 27,3 ммоль), MeI (5,6 мл, 91 ммоль) и NaH (60% в минеральном масле, 3 г, 77,1 ммоль), получали указанное в заголовке соединение (7,2 г) в виде желтого твердого вещества. MC: [M+H]+=379.
Получение 339: 6-Бром-3-метил-3-пиридин-2-ил-1,3-дигидроиндол-2-он
Следуя способам аналогичным тем, которые описаны в Получении 326, с использованием этилового эфира 2-(4-бром-2-нитрофенил)-2-пиридин-2-ил-пропионовой кислоты (4 г, 10,5 ммоль) и порошка Fe(0) (1,76 г, 31,6 ммоль) получали указанное в заголовке соединение (2,8 г) в виде бледно-коричневого полутвердого вещества. MC: [M-H]-=302.
Получение 340: 6-Бром-3-метил-3-пиридин-2-ил-2,3-дигидро-1H-индол
Следуя способам аналогичным тем, которые описаны в Получении 323, с использованием 6-бром-3-метил-3-пиридин-2-ил-1,3-дигидроиндол-2-она (1,4 г, 4,6 ммоль) и BH3-Me2S (2M в ТГФ, 23 мл, 46 ммоль) получали указанное в заголовке соединение (1,2 г) в виде желтого смолистого вещества. MC: [M+H]+=289.
Получение 341: 1-(6-Бром-3-метил-3-пиридин-2-ил-2,3-дигидроиндол-1-ил)этанон
Следуя способам аналогичным тем, которые описаны в Получении 335, с использованием 6-бром-3-метил-3-пиридин-2-ил-2,3-дигидро-1H-индола (1,2 г, 4,1 ммоль), ацетилхлорида (360 мкл, 5 ммоль) и TEA (721 мкл, 5 ммоль) получали указанное в заголовке соединение в виде бледно-желтого масла. MC: [M+H]+=331.
Получение 342: 1-(6-Бензил-3-метил-3-пиридин-2-ил-2,3-дигидроиндол-1-ил)этанон
К дегазированному раствору LiBr (165 мг, 1,9 ммоль) и (1,3-диизопропилимидазол-2-илиден)(3-хлорпиридил)палладий (II) дихлорида (8 мг, 0,012 ммоль) в NMP (3 мл) в атмосфере N2 добавляли раствор 1-(6-бром-3-метил-3-пиридин-2-ил-2,3-дигидроиндол-1-ил)этанона (400 мг, 1,2 ммоль) в ТГФ (3 мл) и бензилцинкбромид (0,5 M в ТГФ, 3,8 мл, 1,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов и затем распределяли между насыщенным солевым раствором и EtOAc. Органическую фазу отделяли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Хроматография (50% EtOAc в петролейном эфире) давала указанное в заголовке соединение (350 мг) в виде бесцветного смолистого вещества. MC: [M+H]+=343.
Получение 343: 6-Бензил-3-метил-3-пиридин-2-ил-2,3-дигидро-1H-индол
Получали, следуя способам аналогичным тем, которые описаны в Получении 337. MC: [M+H]+=301.
Получение 344: 1-Ацетил-3-метил-3-пиридин-2-ил-2,3-дигидро-1H-индол-6-карбонитрил
Получали, следуя способам аналогичным тем, которые описаны в Получении 336, исходя из 1-(6-бром-3-метил-3-пиридин-2-ил-2,3-дигидроиндол-1-ил)-этанона. MC: [M+H]+=278.
Получение 345: 3-Метил-3-пиридин-2-ил-2,3-дигидро-1H-индол-6-карбонитрил
Получали, следуя способам аналогичным тем, которые описаны в Получении 337, исходя из 1-ацетил-3-метил-3-пиридин-2-ил-2,3-дигидро-1H-индол-6-карбонитрила. MC: [M+H]+=236.
Получение 346: Метиловый эфир пиридин-3-ил-уксусной кислоты
Раствор гидрохлорида пиридин-3-ил-уксусной кислоты (10 г, 57,6 ммоль) в MeOH (30 мл) обрабатывали тионилхлоридом (4,2 мл, 57,6 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли в вакууме и остаток распределяли между насыщенным водным раствором NaHCO3 и EtOAc. Органическую фазу собирали, сушили над MgSO4 и упаривали, с получением указанного в заголовке соединения (7,9 г) в виде бесцветного масла. 1H-ЯМР (CDCl3): 8,53 (2H, м), 7,64 (1H, д), 7,33-7,20 (1H, м), 3,72 (3H, с), 3,64 (2H, с).
Получение 347: 6-Бензил-3-метил-3-пиридин-3-ил-2,3-дигидро-1H-индол
Следуя способам аналогичным тем, которые описаны в Получениях 338-343, исходя из 4-бром-1-фтор-2-нитробензола и метилового эфира пиридин-3-ил-уксусной кислоты, получали указанное в заголовке соединение (117 мг) в виде бледно-желтого смолистого вещества. MC: [M+H]+=301.
Получение 348: 6-Бензил-3-метил-3-(3-метилизоксазол-5-ил)-2,3-дигидро-1H-индол
Следуя способам аналогичным тем, которые описаны в Получениях 338-343, исходя из 4-бром-1-фтор-2-нитробензола и метилового эфира (3-метилизоксазол-5-ил)-уксусной кислоты (получен из соответствующей кислоты с использованием способа, аналогичного описанному для Получения 346), получали указанное в заголовке соединение (370 мг) в виде бледно-желтого смолистого вещества. MC: [M+H]+=305.
Получение 349: 6-Хлор-3,3-диэтил-1,3-дигидроиндол-2-он
Следуя способам аналогичным тем, которые описаны в Получении 321, исходя из 6-хлор-1,3-дигидроиндол-2-она (4 г, 25 ммоль), TMEDA (11,2 мл, 79 ммоль), BuLi (1,6M в гексане, 30 мл, 48 ммоль) и EtI (2,9 мл, 36 ммоль), получали указанное в заголовке соединение (1,3 г). MC: [M+H]+=224.
Получение 350: 6-Хлор-3,3-диэтил-2,3-дигидро-1H-индол
Следуя способам аналогичным тем, которые описаны в Получении 323, исходя из 6-хлор-3,3-диэтил-1,3-дигидроиндол-2-она (1,3 г, 5,8 ммоль) и BH3-Me2S (2M в ТГФ, 29 мл, 58 ммоль), получали указанное в заголовке соединение. MC: [M+H]+=210.
Получение 351: трет-бутиловый эфир (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты
Метансульфонилхлорид (570 мкл, 7,35 ммоль) добавляли к раствору трет-бутилового эфира (2R,5R)-4-бензил-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (1,9 г, 6,12 ммоль), содержащего TEA (2,6 мл, 18,4 ммоль), в DCM (30 мл) при 0°C. Раствор перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь распределяли между водным раствором NH4Cl и DCM. Органическую фазу собирали, сушили над MgSO4, фильтровали и концентрировали в вакууме. Хроматография (30% EtOAc в петролейном эфире) давала указанное в заголовке соединение (1,6 г) в виде белого твердого вещества. MC: [M+H]+=339.
Получение 352: трет-Бутиловый эфир (2R,5S)-4-бензил-2-метил-5-(2-оксооксазолидин-3-илметил)пиперазин-1-карбоновой кислоты
K2CO3 (610 мг, 4,4 ммоль), KI (730 мг, 4,4 ммоль) и оксазолидинон (170 мг, 2,2 ммоль) добавляли к раствору трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты (500 мг, 1,47 ммоль) в ацетонитриле (10 мл). Реакционную смесь перемешивали при 60°C в течение 3 дней. Твердые вещества отфильтровывали и растворитель удаляли в вакууме. Хроматография (40% EtOAc в петролейном эфире) давала указанное в заголовке соединение (450 мг) в виде белого твердого вещества, MC: [M+H]+=390.
Получение 353: трет-Бутиловый эфир (2R,5S)-2-метил-5-(2-оксо-оксазолидин-3-илметил)пиперазин-1-карбоновой кислоты, ацетатная соль
Уксусную кислоту (1,5 мл) и Pd/C (400 мг) добавляли к раствору трет-бутилового эфира (2R,5S)-4-бензил-2-метил-5-(2-оксо-оксазолидин-3-илметил)пиперазин-1-карбоновой кислоты (450 мг, 1,15 ммоль) в EtOH (20 мл) и осуществляли взаимодействие полученной смеси в атмосфере H2 (1 бар) в течение 3 часов. Катализатор удаляли путем фильтрования через пробку из целита и растворитель удаляли в вакууме, с получением указанного в заголовке соединения (530 мг) в виде бесцветного смолистого вещества. MC: [M+H]+=300.
Получение 354: трет-Бутиловый эфир (2R,5S)-4-бензилоксикарбонилметил-2-метил-5-(2-оксо-оксазолидин-3-илметил)пиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 13, с использованием трет-бутилового эфира (2R,5S)-2-метил-5-(2-оксо-оксазолидин-3-илметил)пиперазин-1-карбоновой кислоты (530 мг), бензилбромацетата (183 мкл) и K2CO3 (467 мг), с получением указанного в заголовке соединения (265 мг). MC: [M+H]+=448.
Получение 355: трет-Бутиловый эфир (2R,5S)-4-карбоксиметил-2-метил-5-(2-оксо-оксазолидин-3-илметил)пиперазин-1-карбоновой кислоты
Следуя способам аналогичным тем, которые описаны в Получении 12, исходя из трет-бутилового эфира (2R,5S)-4-бензилоксикарбонилметил-2-метил-5-(2-оксо-оксазолидин-3-илметил)пиперазин-1-карбоновой кислоты (265 мг) и Pd/C (65 мг), получали указанное в заголовке соединение (189 мг) в виде белого твердого вещества. MC: [M+H]+=358.
Получение 356: трет-Бутиловый эфир (2R,5S)-4-бензил-2-метил-5-(3-оксоморфолин-4-илметил)пиперазин-1-карбоновой кислоты
Морфолин-3-он (896 мг, 8,87 ммоль) добавляли к суспензии NaH (60% в минеральном масле, 355 мг, 8,87 ммоль) в DMF (10 мл) в атмосфере N2. Суспензию перемешивали в течение 30 минут при комнатной температуре и затем медленно добавляли раствор трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты (2,0 г, 5,9 ммоль) в DMF (10 мл). Полученную смесь перемешивали при 65°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и распределяли между EtOAc и насыщенным водным раствором NaHCO3. Органическую фазу сушили над MgSO4 и концентрировали в вакууме. Хроматография (50% EtOAc в петролейном эфире) давала указанное в заголовке соединение (1,76 г) в виде бледно-желтого смолистого вещества. MC: [M+H]+=404.
Получение 357: трет-Бутиловый эфир (2R,5S)-2-метил-5-(3-оксоморфолин-4-илметил)пиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5S)-4-бензил-2-метил-5-(3-оксоморфолин-4-илметил)пиперазин-1-карбоновой кислоты (1,75 г), уксусной кислоты (8 мл) и Pd/C (1,3 г) с использованием способа аналогичного тому, который описан для Получения 353. Катализатор удаляли путем фильтрования и растворитель удаляли в вакууме. Неочищенное вещество распределяли между DCM и насыщенным водным раствором NaHCO3. Органическую фазу сушили над MgSO4 и концентрировали в вакууме, с получением указанного в заголовке соединения (870 мг) в виде бесцветного смолистого вещества. 1H-ЯМР (CDCl3): 4,18 (3H, д), 4,00 (1H, дд), 3,90 (2H, т), 3,70 (1H, д), 3,55-3,37 (2H, м), 3,37-3,16 (3H, м), 3,08 (1H, дд), 2,51 (1H, дд), 2,38-1,78 (1H, м), 1,47 (9H, с), 1,22 (3H, д).
Получение 358: трет-Бутиловый эфир (2R,5S)-4-бензил-2-метил-5-(2-оксопиперидин-1-илметил)пиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 356, исходя из пиперидин-2-она. MC: [M+H]+=402.
Получение 359: трет-Бутиловый эфир (2R,5S)-2-метил-5-(2-оксопиперидин-1-илметил)пиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 357, исходя из трет-бутилового эфира (2R,5S)-4-бензил-2-метил-5-(2-оксопиперидин-1-илметил)пиперазин-1-карбоновой кислоты. 1H-ЯМР (CDCl3): 4,24-4,05 (1H, м), 4,05-3,78 (1H, м), 3,66 (1H, д), 3,46-3,34 (1H, м), 3,34-3,15 (4H, м), 3,03-2,92 (1H, м), 2,48 (1H, дд), 2,44-2,32 (2H, м), 2,07 (2H, с), 1,97-1,72 (3H, м), 1,45 (9H, с), 1,21 (3H, д).
Получение 360: трет-Бутиловый эфир (2R,5S)-4-бензил-2-метил-5-(3-метил-2-оксоимидазолидин-1-илметил)пиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 356, исходя из 1-метилимидазолидин-2-она. MC: [M+H]+=403.
Получение 361: трет-Бутиловый эфир (2R,5S)-2-метил-5-(3-метил-2-оксоимидазолидин-1-илметил)пиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 357, исходя из трет-бутилового эфира (2R,5S)-4-бензил-2-метил-5-(3-метил-2-оксоимидазолидин-1-илметил)пиперазин-1-карбоновой. 1H-ЯМР (CDCl3): 4,17 (1H, т), 3,82 (1H, дд), 3,71 (1H, д), 3,57-3,41 (1H, м), 3,41-3,19 (5H, м), 3,19-3,08 (1H, м), 2,87-2,76 (4H, м), 2,48 (1H, дд), 1,92 (1H, с), 1,47 (9H, с), 1,24 (3H, д).
Получение 362: трет-Бутиловый эфир (2R,5S)-4-бензил-5-((S)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 352, исходя из трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты (300 мг, 0,88 ммоль) и (S)-3-фторпирролидина (165 мг, 1,32 ммоль). MC: [M+H]+=392.
Получение 363: трет-Бутиловый эфир (2R,5S)-5-((S)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 357, исходя из трет-бутилового эфира (2R,5S)-4-бензил-5-((S)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты. 1H-ЯМР (CDCl3): 5,30-5,01 (1H, м), 4,28-3,98 (1H, м), 3,69 (1H, д), 3,42-3,25 (1H, м), 3,11 (1H, дд), 3,05-2,63 (5H, м), 2,63-2,32 (2H, м), 2,32-1,83 (4H, м), 1,47 (9H, с), 1,27 (3H, д).
Получение 364: трет-Бутиловый эфир (2R,5S)-4-бензил-5-((R)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 352, исходя из трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты и (R)-3-фторпирролидина. MC: [M+H]+=392.
Получение 365: трет-Бутиловый эфир (2R,5S)-5-((R)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 357. 1H-ЯМР (CDCl3): 5,28-5,01 (1H, м), 4,25-3,95 (1H, м), 3,70 (1H, д), 3,31 (1H, дд), 3,11 (1H, дд), 3,06-2,68 (5H, м), 2,68-2,35 (2H, м), 2,35-1,82 (4H, м), 1,48 (9H, с), 1,28 (3H, д).
Получение 366: трет-Бутиловый эфир (2R,5S)-4-бензил-5-(2,5-диоксопирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 356, исходя из трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты и пирролидин-2,5-диона. 1H-ЯМР (CDCl3): 7,37-7,01 (5H, м), 4,24-4,06 (1H, м), 3,89 (1H, д), 3,80-3,47 (4H, м), 3,22 (2H, д), 3,09-2,78 (1H, м), 2,70-2,55 (4H, м), 2,33 (1H, дд), 1,48 (9H, с), 1,19 (3H, д).
Получение 367: трет-Бутиловый эфир (2R,5S)-5-(2,5-диоксопирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 357. 1H-ЯМР (CDCl3): 4,21-4,06 (1H, м), 3,96 (1H, дд), 3,68 (1H, д), 3,39 (1H, дд), 3,29 (2H, дд), 3,15 (1H, дд), 2,72 (4H, с), 2,38 (1H, дд), 1,81 (1H, с), 1,46 (9H, с), 1,17 (3H, д).
Получение 368: трет-Бутиловый эфир (2R,5R)-4-{2-[6-(1,1-дифторэтил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 203, исходя из трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (1,74 г, 7,5 ммоль), 6-(1,1-дифторэтил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (1,1 г, 5,0 ммоль), хлорацетилхлорида (490 мкл, 6,1 ммоль) и DIPEA (3 мл, 16,6 ммоль), с получением указанного в заголовке соединения (1,47 г) в виде оранжевого полутвердого вещества. MC: [M+H]+=483.
Получение 369: трет-Бутиловый эфир (2R,5R)-5-хлорметил-4-{2-[6-(1,1-дифторэтил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 351, исходя из трет-бутилового эфира (2R,5R)-4-{2-[6-(1,1-дифторэтил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты. MC: [M+H]+=501.
Получение 370: трет-Бутиловый эфир (2R,5R)-4-{2-[6-(дифторфенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 203, исходя из трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (1,1 г, 3,2 ммоль), 6-(дифторфенилметил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорида (1,0 г, 3,55 ммоль), хлорацетилхлорида (282 мкл, 3,55 ммоль) и DIPEA (2 мл, 11,3 ммоль), с получением указанного в заголовке соединения (1,37 г) в виде оранжевого смолистого вещества. MC: [M+H]+=545.
Получение 371: трет-Бутиловый эфир (2R,5R)-5-хлорметил-4-{2-[6-(дифторфенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Получении 351, исходя из трет-бутилового эфира (2R,5R)-4-{2-[6-(дифторфенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (1,37 г, 2,5 ммоль), метансульфонилхлорида (234 мкл, 3,0 ммоль) и TEA (582 мкл, 4,0 ммоль), с получением указанного в заголовке соединения (1,0 г) в виде бледно-желтого смолистого вещества. MC: [M+H]+=563.
Получение 372: трет-Бутиловый эфир (2R,5S)-4-бензил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
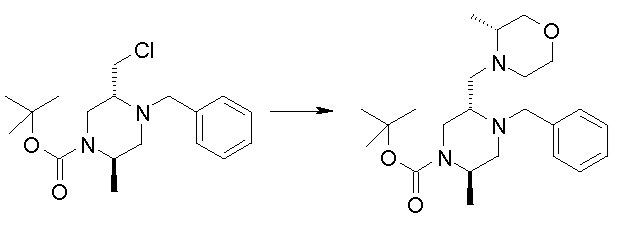
K2CO3 (81,6 г, 591 ммоль) и KI (73,6 г, 443 ммоль) добавляли к раствору трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты (50 г, 147,9 ммоль) в ацетонитриле (400 мл) с последующим добавлением (R)-3-метилморфолингидрохлорида (26,4 г, 192 ммоль). Реакционную смесь перемешивали при 70°C в течение 18 часов. Твердое вещество затем удаляли путем фильтрования и растворитель удаляли в вакууме. Неочищенное вещество очищали хроматографией с использованием слоя диоксида кремния (20% EtOAc в петролейном эфире), с получением указанного в заголовке соединения (41,3 г) в виде белого твердого вещества. MC: [M+H]+=404.
Получение 373: трет-Бутиловый эфир (2R,5S)-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
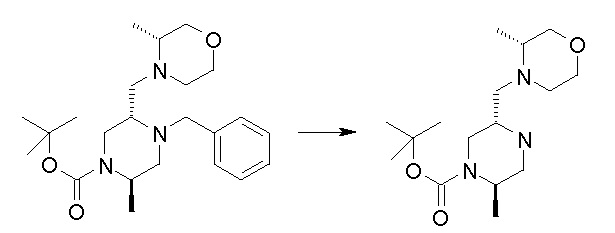
Pd/C (33 г) и уксусную кислоту (220 мл) добавляли к раствору трет-бутилового эфира (2R,5S)-4-бензил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (41,3 г, 102 ммоль) в EtOH (300 мл). Смесь перемешивали в атмосфере H2 (1 атмосфера) при комнатной температуре в течение 18 часов. Реакционную смесь затем фильтровали через слой Целита для удаления катализатора и растворитель удаляли в вакууме. Неочищенное вещество распределяли между насыщенным водным раствором NaHCO3 и DCM и продукт экстрагировали при помощи DCM (3×). Органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме, с получением указанного в заголовке соединения (30,5 г) в виде бледно-желтого масла. 1H-ЯМР (CDCl3): 4,43-3,87 (1H, м), 3,78 (1H, д), 3,73-3,55 (3H, м), 3,32 (1H, дд), 3,22 (1H, дд), 3,16-2,93 (3H, м), 2,93-2,72 (1H, м), 2,55-2,35 (2H, м), 2,35-2,15 (2H, м), 1,89 (1H, дд), 1,45 (9H, с), 1,26 (3H, д), 0,96 (3H, д).
Получение 374: трет-Бутиловый эфир (2R,5S)-4-бензилоксикарбонилметил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
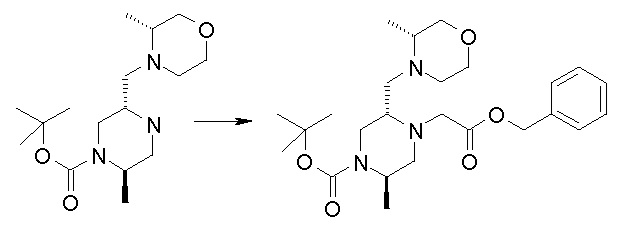
Бензилбромацетат (25,2 мл, 126 ммоль) и K2CO3 (50 г, 389 ммоль) добавляли к раствору трет-бутилового эфира (2R,5S)-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (30,5 г, 97,4 ммоль) в ацетонитриле (300 мл) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Твердое вещество удаляли путем фильтрования и растворитель удаляли в вакууме. Неочищенное вещество очищали хроматографией с использованием слоя диоксида кремния и с использованием для элюирования смеси EtOAc/Петролейный эфир (1/9 до 4/6), с получением указанного в заголовке соединения (39 г). MC: [M+H]+=462.
Получение 375: трет-Бутиловый эфир (2R,5S)-4-карбоксиметил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
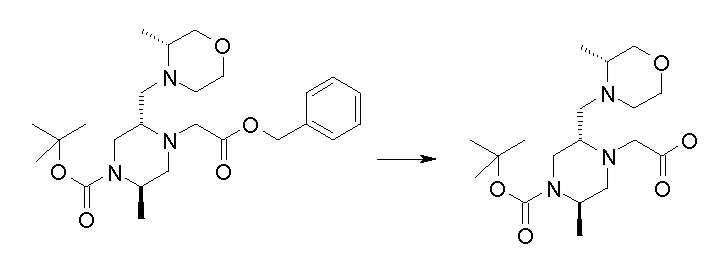
трет-Бутиловый эфир (2R,5S)-4-бензилоксикарбонилметил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (39 г, 84,6 ммоль) в EtOH (200 мл) гидрировали (1 атмосфера H2) в присутствии Pd/C (8,9 г) при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через Целит и растворитель удаляли в вакууме, с получением указанного в заголовке соединения (28 г) в виде бледно-желтого твердого вещества. 1H-ЯМР (CDCl3): 4,21-4,05 (1H, м), 4,05-3,83 (3H, м), 3,83-3,55 (4H, м), 3,55-3,27 (4H, м), 3,27-3,13 (1H, м), 3,05 (1H, с), 2,87 (1H, с), 2,64 (1H, дд), 2,50 (1H, д), 1,48 (9H, с), 1,37-1,06 (6H, м). МС: [M+H]+=372.
Получение 376: 6-(2,4-Дифторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин 5-оксид
3-Хлорпербензойную кислоту (895 мг, 3,58 ммоль) добавляли к раствору трет-бутилового эфира 6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (895 мг, 2,39 ммоль) в DCM (45 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Смесь промывали два раза насыщенным водным раствором гидрокарбоната натрия, органический слой отделяли и растворитель удаляли в вакууме, с получением трет-бутилового эфира 6-(2,4-дифторбензил)-3,3-диметил-5-окси-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты в виде бледно-желтого масла, которое использовали немедленного без дополнительной очистки. MC: [M+H]+ 391. Перемешиваемый раствор этого вещества в этилацетате (10 мл) обрабатывали 4 M раствором хлористого водорода в 1,4-диоксане (5 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь упаривали досуха в вакууме и распределяли между этилацетатом и 2 M раствором гидроксида натрия. Органический слой отделяли и растворитель удаляли в вакууме, с получением бледно-желтого твердого вещества, которое промывали петролейным эфиром, фильтровали и сушили досуха в вакууме при пониженном давлении, с получением указанного в заголовке соединения (570 мг, 82%) в виде бледно-желтого твердого вещества. 1H-ЯМР (ДМСО-d6) 7,90 (1H, с), 7,40 (1H, м), 7,23 (1H, тд), 7,06 (1H, тд), 6,38 (1H, шир. с), 6,08 (1H, с), 3,98 (2H, с), 3,27 (2H, с), 1,26 (6H, с). МС: [M+H]+=291.
Получение 377: трет-Бутиловый эфир (2R,5R)-5-хлорметил-4-{2-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
Хлорацетилхлорид (0,995 мл, 12,0 ммоль) добавляли по каплям к перемешиваемому раствору 6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин гидрохлорида (3,10 г, 10,0 ммоль) и триэтиламина (4,6 мл, 33,0 ммоль) в безводном DCM (50 мл) и смесь перемешивали при комнатной температуре в течение 16 часов. Добавляли трет-бутиловый эфир (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (2,76 г, 12,0 ммоль) и смесь перемешивали при комнатной температуре еще в течение 16 часов. Добавляли дополнительное количество триэтиламина (1 мл) и трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (700 мг) и смесь перемешивали еще в течение 16 часов. Смесь разбавляли при помощи DCM, промывали водой, органический слой отделяли и растворитель удаляли в вакууме. Хроматография (диоксид кремния, элюирование с использованием 30-100% этилацетата в петролейном эфире) давала трет-бутиловый эфир (2R,5R)-4-{2-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (4,36 г, 80%) в виде пенистого вещества бледного желтовато-коричневого цвета. MC: [M+H]+ 545. Метансульфонилхлорид (0,78 мл, 10,0 ммоль) добавляли по каплям к перемешиваемому раствору трет-бутилового эфира (2R,5R)-4-{2-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (4,36 г, 8,0 ммоль) и триэтиламина (1,67 мл, 12,0 ммоль) в безводном DCM (40 мл) и смесь перемешивали при комнатной температуре в течение 16 часов. Смесь разбавляли при помощи DCM, промывали последовательно насыщенным водным раствором гидрокарбоната натрия и затем водой. Органический слой отделяли и растворитель удаляли в вакууме, с получением указанного в заголовке соединения (4,0 г, 71%) в виде бледно-желтого пенистого вещества. MC: [M+H]+=563, 565.
Получение 378: трет-Бутиловый эфир (2R,5R)-4-[2-(6-циклогексил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
К раствору трет-бутилового эфира (2R,5R)-4-[2-(6-циклогекс-1-енил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты (см. Таблицу 1) (65 мг, 0,13 ммоль) в EtOH (5 мл) добавляли палладий на углероде (10%, 20 мг) и смесь гидрировали в течение 2 часов. Катализатор фильтровали и фильтрат упаривали, с получением указанного в заголовке соединения (60 мг, 92%) в виде белого твердого вещества. MC: [M+H]+=515.
Получение 379: трет-Бутиловый эфир 3,3-диметил-6-(1-метил-1H-пиразол-4-ил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Смесь 1-метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1H-пиразола (0,609 г, 3,0 ммоль), трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,282 г, 1,0 ммоль), карбоната калия (0,414 г, 3,0 ммоль), трис(дибензилиденацетон)дипалладия (0) (0,091 г, 0,1 ммоль) и 2-дициклогексилфосфино-2',6'-диметоксибифенила (SPhos, 0,041 г, 0,1 ммоль), 1,4-диоксана (6 мл) и воды (1,5 мл) нагревали при 90°C в течение 18 часов. Растворитель упаривали, добавляли воду (30 мл) и продукт экстрагировали при помощи EtOAc (3×20 мл). Объединенные органические экстракты сушили (MgSO4) и упаривали в вакууме, с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-100% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,267 г) в виде масла. MC: [M+H]+=329.
Получение 380: 3,3-Диметил-6-(1-метил-1H-пиразол-4-ил)-2,3-дигидропирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 3,3-диметил-6-(1-метил-1H-пиразол-4-ил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной процедуре Получения 116. MC: [M+H]+ 229.
Получение 381: трет-Бутиловый эфир 3,3-диметил-6-тиофен-3-ил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты и тиофен-3-бороновой кислоты с использованием процедуры, аналогичной процедуре Получения 379. MC: [M+H]+ 331.
Получение 382: 3,3-Диметил-6-тиофен-3-ил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 3,3-диметил-6-тиофен-3-ил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=231.
Получение 383: трет-Бутиловый эфир 6-(гидроксифенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
К раствору трет-бутилового эфира 6-бензоил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,35 г, 1,0 ммоль) в метаноле (10 мл) добавляли борогидрид натрия (0,114 г, 3,0 ммоль) и реакционную смесь перемешивали в течение 1 часа. Добавляли воду (5 мл) и реакционную смесь концентрировали. Добавляли воду и продукт экстрагировали при помощи EtOAc. Объединенную органическую фазу сушили (MgSO4) и упаривали в вакууме, с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-60% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,26 г, 73%) в виде масла. MC: [M+H]+=355.
Получение 384: трет-Бутиловый эфир 6-(метоксифенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
К раствору трет-бутилового эфира 6-(гидроксифенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты (0,15 г, 0,42 ммоль) в ТГФ (5 мл) добавляли гидрид натрия (60%, 0,02 г, 0,50 ммоль) и смесь перемешивали в течение 1 часа. Добавляли метилиодид (52 мкл, 0,84 ммоль) и реакционную смесь перемешивали в течение 18 часов при температуре окружающей среды. Добавляли воду (10 мл) и продукт экстрагировали при помощи EtOAc (2×10 мл). Объединенную органическую фазу сушили (MgSO4) и упаривали в вакууме, с получением масла. Хроматография (SiO2; градиентное элюирование с использованием 0-70% EtOAc в 40-60 петролейном эфире) давала указанное в заголовке соединение (0,11 г, 70%) в виде масла. MC: [M+H]+=369.
Получение 385: 6-(Метоксифенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 6-(метоксифенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной процедуре Получения 116. MC: [M+H]+ 269.
Получение 386: трет-Бутиловый эфир 6-фуран-3-ил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты и фуран-3-бороновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 161. MC: [M+H]+=315.
Получение 387: 6-Фуран-3-ил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 6-фуран-3-ил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=215.
Получение 388: трет-Бутиловый эфир 3,3-диметил-6-(5-метилтиофен-2-ил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты и 4,4,5,5-тетраметил-2-(5-метилтиофен-2-ил)-[1,3,2]диоксаборолана с использованием процедуры, подобной той, которая описана для Получения 379. MC: [M+H]+=345.
Получение 389: 3,3-Диметил-6-(5-метилтиофен-2-ил)-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 3,3-диметил-6-(5-метилтиофен-2-ил)-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=245.
Получение 390: трет-Бутиловый эфир 6-бензофуран-2-ил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты и бензофуран-2-бороновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 161. MC: [M+H]+=365.
Получение 391: 6-Бензофуран-2-ил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 6-бензофуран-2-ил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=265.
Получение 392: трет-Бутиловый эфир 6-изопропенил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин-1-карбоновой кислоты и 2-изопропенил-4,4,5,5-тетраметил-[1,3,2]диоксаборолана с использованием процедуры, аналогичной той, которая описана для Получения 379. MC: [M+H]+=289.
Получение 393: трет-Бутиловый эфир 6-ацетил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-изопропенил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 166. MC: [M+H]+=291.
Получение 394: трет-Бутиловый эфир 6-(1,1-дифторэтил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-ацетил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 293. MC: [M+H]+=313.
Получение 395: 6-(1,1-Дифторэтил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридин
Получали из трет-бутилового эфира 6-(1,1-дифторэтил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=213.
Получение 396: трет-Бутиловый эфир 6-бензоил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
н-Бутиллитий (5,0 мл 2,5 M раствора в гексане, 12 ммоль) добавляли по каплям к раствору трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (3,27 г, 10,0 ммоль) в диэтиловом эфире (20 мл) при -78°C. Полученную оранжевую суспензию перемешивали в течение 30 минут при этой температуре, затем добавляли по каплям раствор N-метокси-N-метилбензамида (2,3 мл, 15,0 ммоль) в диэтиловом эфире (10 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали еще в течение 1 часа, затем гасили насыщенным водным раствором хлорида аммония и два слоя разделяли. Водную фракцию дополнительно экстрагировали при помощи EtOAc (2×20 мл). Объединенные органические фракции сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией (0-30% EtOAc/петролейный эфир), с получением указанного в заголовке соединения (2,4 г, 67%) в виде желтого твердого вещества. MC: [M+H]+=353.
Получение 397: 6-Бензоил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали из трет-бутилового эфира 6-бензоил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=253.
Получение 398: трет-Бутиловый эфир 6-ацетил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты и N-метокси-N-метилацетамида с использованием процедуры, аналогичной той, которая описана для Получения 263. MC: [M+H]+=291.
Получение 399: трет-Бутиловый эфир 6-(1,1-дифтор-этил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-ацетил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 264. MC: [M+H]+=313.
Получение 400: 6-(1,1-Дифторэтил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали из трет-бутилового эфира 6-(1,1-дифторэтил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=213.
Получение 401: трет-Бутиловый эфир 6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
К дегазированной при помощи азота смеси трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (4,90 г, 15,0 ммоль), бромида лития (3,87 г, 45,0 ммоль), (1,3-диизопропилимидазол-2-илиден)(3-хлорпиридил)палладий(II) дихлорида (0,2 г, 0,3 ммоль), 1-метил-2-пирролидинона (40 мл) и ТГФ (40 мл) добавляли раствор 2,4-дифторбензилцинкбромида в ТГФ (0,5 M, 60 мл, 30 ммоль) и полученную смесь перемешивали при 20°C в течение 1 часа. Смесь выливали в воду (200 мл) и 5% водный раствор лимонной кислоты (50 мл) и полученную смесь экстрагировали при помощи Et2O (3×100 мл). Органическую фазу промывали водой (100 мл), насыщенным солевым раствором (3×100 мл), сушили (MgSO4) и упаривали в вакууме, с получением масла. Хроматография (SiO2, с использованием для элюирования смеси петролейный эфир - EtOAc 0-30%) давала указанное в заголовке соединение (5,7 г, 100%) в виде масла. MC: [M+H]+=375.
Получение 402: 6-(2,4-Дифтор-бензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали из трет-бутилового эфира 6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=275.
Получение 403: трет-Бутиловый эфир 6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
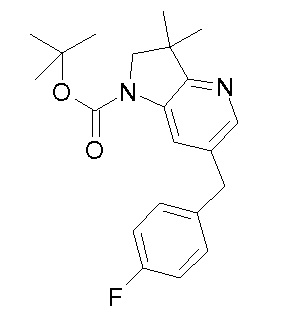
К дегазированной при помощи азота смеси трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (3,27 г, 10,0 ммоль), бромида лития (2,58 г, 30,0 ммоль), (1,3-диизопропилимидазол-2-илиден)(3-хлорпиридил)палладий(II) дихлорида (0,136 г, 0,2 ммоль), 1-метил-2-пирролидинона (30 мл) и ТГФ (30 мл) добавляли раствор 4-фторбензилцинкхлорида в ТГФ (0,5 M, 40 мл, 20 ммоль) и полученную смесь перемешивали при 20°C в течение 3 часов. Смесь выливали в воду (150 мл) и 5% водный раствор лимонной кислоты (30 мл) и полученную смесь экстрагировали при помощи Et2O (3×70 мл). Органическую фазу промывали водой (100 мл), насыщенным солевым раствором (3×100 мл), сушили (MgSO4) и упаривали в вакууме, с получением масла. Хроматография (SiO2, с использованием для элюирования смеси петролейный эфир - EtOAc 0-30%) давала указанное в заголовке соединение (3,5 г, 99%) в виде масла. MC: [M+H]+=357.
Получение 404: 6-(4-Фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Раствор трет-бутилового эфира 6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (9,0 г, 25 ммоль) в метаноле (62,5 мл) обрабатывали 5 M раствором хлористоводородной кислоты (62,5 мл) и смесь перемешивали при 20°C в течение 18 часов, затем нагревали при 50°C в течение 2 часов. Растворитель упаривали и остаток распределяли между водой (200 мл) и EtOAc (3×). Водную фазу медленно выливали в насыщенный водный раствор NaHCO3 и полученное твердое вещество собирали путем фильтрования, с получением указанного в заголовке соединения (3,45 г). 1H-ЯМР (CDCl3): 7,81 (1H, с), 7,16 (2H, дд), 6,99 (2H, т), 6,58 (1H, д), 3,84 (2H, с), 3,38 (2H, с), 1,36 (6H, с). МС: [M+H]+=257. Дополнительное количество указанного в заголовке соединения (1,5 г) получали путем экстрагирования объединенных органических экстрактов при помощи водного раствора кислоты и последующего подщелачивания объединенных водных экстрактов.
Получение 405: трет-Бутиловый эфир 6-(дифторфенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-бензоил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 264. MC: [M+H]+=375.
Получение 406: 6-(Дифторфенилметил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали из трет-бутилового эфира 6-(дифторфенилметил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. MC: [M+H]+=275.
Получение 407: Метоксиметиламид циклобутанкарбоновой кислоты
К охлажденной на ледяной бане суспензии N,O-диметоксигидроксиламин гидрохлорида (1,95 г, 20 ммоль) в DCM (50 мл) добавляли DIPEA (7,0 мл, 40,0 ммоль) и циклобутанкарбоновую кислоту (1,9 мл, 20 ммоль). После перемешивания в течение 5 минут добавляли EDC (4,2 г, 22,0 ммоль) и реакционную смесь перемешивали в течение ночи, давая при этом нагреться до комнатной температуры. Смесь разбавляли при помощи DCM (50 мл) и переносили в делительную воронку. Органический слой промывали насыщенным водным раствором NaHCO3 (2×50 мл), водой (1×50 мл), насыщенным солевым раствором (50 мл), сушили (MgSO4) и концентрировали. Хроматография (SiO2, с использованием для элюирования смеси петролейный эфир - EtOAc 0-40%) давала указанное в заголовке соединение (1,9 г, 67%) в виде масла. MC: [M+H]+=144.
Получение 408: трет-Бутиловый эфир 6-циклобутанкарбонил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты и метоксиметиламида циклобутанкарбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 263. MC: [M+H]+=331.
Получение 409: трет-Бутиловый эфир 6-(циклобутилдифторметил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-циклобутанкарбонил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 264. MC: [M+H]+=353.
Получение 410: 6-(Циклобутил-дифтор-метил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали из трет-бутилового эфира 6-(циклобутилдифторметил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. Изначально полученную гидрохлоридную соль распределяли между насыщенным водным раствором NaHCO3 и EtOAc, с получением указанного в заголовке соединения. MC: [M+H]+=253.
Получение 411: 2-Циклопропил-N-метокси-N-метилацетамид
Получали из циклопропилуксусной кислоты аналогично способу Получения 407 MC: [M+H]+=144.
Получение 412: трет-Бутиловый эфир 6-(2-циклопропилацетил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты и 2-циклопропил-N-метокси-N-метилацетамида с использованием процедуры, аналогичной той, которая описана для Получения 263. MC: [M+H]+=331.
Получение 413: трет-Бутиловый эфир 6-(2-циклопропил-1,1-дифторэтил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Получали из трет-бутилового эфира 6-(2-циклопропилацетил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 264. MC: [M+H]+=353.
Получение 414: 6-(2-Циклопропил-1,1-дифторэтил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали из трет-бутилового эфира 6-(2-циклопропил-1,1-дифторэтил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты с использованием процедуры, аналогичной той, которая описана для Получения 116. Изначально полученную гидрохлоридную соль распределяли между насыщенным водным раствором NaHCO3 и EtOAc, с получением указанного в заголовке соединения. MC: [M+H]+=253.
Получение 415: трет-Бутиловый эфир (2R,5S)-4-бензил-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты
K2CO3 (12,4 г, 90,0 ммоль), KI (8,29 г, 51,0 ммоль) и морфолин (3,9 мл, 45,0 ммоль) добавляли к раствору трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метилпиперазин-1-карбоновой кислоты (10,0 г, 30,0 ммоль) в ацетонитриле (150 мл). Реакционную смесь перемешивали при 70°C в течение 18 часов. Твердые вещества отфильтровывали и растворитель удаляли в вакууме. Остаток распределяли между DCM (150 мл) и водой (150 мл). Органическую фазу сушили (MgSO4) и упаривали. Хроматография (SiO2, с использованием для элюирования смеси петролейный эфир - EtOAc 0-50%) давала указанное в заголовке соединение (9,0 г, 77%) в виде белого твердого вещества. MC: [M+H]+=390.
Получение 416: трет-Бутиловый эфир (2R,5S)-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты
Уксусную кислоту (30,0 мл) и Pd/C (10%, 6,0 г) добавляли к раствору трет-бутилового эфира (2R,5S)-4-бензил-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты (9,0 г, 23,1 ммоль) в EtOH (240 мл) и полученную смесь гидрировали при 1 бар в течение 3 часов. Катализатор удаляли путем фильтрования и растворитель удаляли в вакууме. Остаток растворяли в DCM (150 мл), органический раствор промывали насыщенным водным раствором NaHCO3 (150 мл), водой (150 мл), сушили (MgSO4) и упаривали, с получением указанного в заголовке соединения в виде бесцветного смолистого вещества (6,57 г, 95%). 1H-ЯМР (CDCl3): 4,32-3,90 (1H, м), 3,77-3,64 (5H, м), 3,30 (1H, дд), 3,16-2,82 (2H, м), 2,67 (1H, дд), 2,59-2,49 (2H, м), 2,47-2,30 (2H, м), 2,21 (1H, дд), 2,17-2,07 (2H, м), 1,47 (9H, с), 1,27 (3H, д).
Получение 417: трет-Бутиловый эфир (2R,5S)-4-бензилоксикарбонилметил-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты
Следуя способам аналогичным тем, которые описаны в Получении 13, с использованием трет-бутилового эфира (2R,5S)-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты (3,13, 10,5 ммоль), бензилбромацетата (2,16 м, 13,69 ммоль) и K2CO3 (4,33 г, 31,5 ммоль) получали указанное в заголовке соединение (4,28 г, 91%). MC: [M+H]+=448.
Получение 418: трет-Бутиловый эфир (2R,5S)-4-карбоксиметил-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты
Следуя способам аналогичным тем, которые описаны в Получении 14, исходя из трет-бутилового эфира (2R,5S)-4-бензилоксикарбонилметил-2-метил-5-морфолин-4-илметил)-пиперазин-1-карбоновой кислоты (4,28 г, 9,57 ммоль) и Pd/C (0,5 г), получали указанное в заголовке соединение (3,2 г, 94%) в виде белого твердого вещества. 1H-ЯМР (CDCl3): 4,13 (2H, с), 3,96-3,78 (4H, м), 3,73 (1H, д), 3,59 (2H, д), 3,34 (1H, дд), 3,20 (1H, дд), 2,99 (1H, д), 2,84-2,74 (2H, м), 2,74-2,63 (2H, м), 2,55 (1H, дд), 2,38 (1H, дд), 1,56-1,37 (9H, м), 1,25 (3H, д).
Получение 419: трет-Бутиловый эфир (2R,5R)-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
Следуя способам, подобным тем, которые описаны в Получении 203 или Общей Процедуре 5, исходя из трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (1,38 г, 6,0 ммоль), 6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин гидрохлорида (1,17 г, 4,0 ммоль), с использованием DIPEA в качестве основания, получали указанное в заголовке соединение (1,34 г, 64%) в виде оранжевого полутвердого вещества. MC: [M+H]+=527.
Получение 420: трет-Бутиловый эфир (2R,5R)-5-хлорметил-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
Следуя способам аналогичным тем, которые описаны в Получении 316, исходя из трет-бутилового эфира (2R,5R)-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (1,38 г, 2,6 ммоль), получали указанное в заголовке соединение (1,11 г, 78%) в виде оранжевого полутвердого вещества. MC: [M+H]+=545.
Получение 421: трет-Бутиловый эфир (2R,5R)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
Следуя способам аналогичным тем, которые описаны в Получении 203 или Общей Процедуре 5, исходя из трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,69 г, 3,0 ммоль), 6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин хлорацетилхлорида (185 мкл, 2,3 ммоль) и DIPEA (1,42 мл, 8,4 ммоль), получали указанное в заголовке соединение (0,61 г, 60%). MC: [M+H]+=511.
Получение 422: трет-Бутиловый эфир (2R,5R)-5-хлорметил-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
Следуя способам, подобным тем, которые описаны в Получении 316, исходя из трет-бутилового эфира (2R,5R)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,61 г, 1,2 ммоль), получали указанное в заголовке соединение (0,7 г, 100%) в виде коричневого полутвердого вещества. MC: [M+H]+=529.
Получение 423: трет-Бутиловый эфир 6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
К дегазированной при помощи азота смеси трет-бутилового эфира 6-бром-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (4,09 г, 12,5 ммоль), бромида лития (3,22 г, 37,5 ммоль), (1,3-диизопропилимидазол-2-илиден)(3-хлорпиридил)палладий(II) дихлорида (0,17 г, 0,25 ммоль), 1-метил-2-пирролидинона (30 мл) и ТГФ (30 мл) добавляли раствор 2-фторбензилцинкхлорида в ТГФ (0,5 M, 40 мл, 20 ммоль) и полученную смесь перемешивали при 20°C в течение 3 часов. Смесь выливали в воду (150 мл) и 5% водный раствор лимонной кислоты (30 мл) и полученную смесь экстрагировали при помощи Et2O (3×70 мл). Органическую фазу промывали водой (100 мл), насыщенным солевым раствором (3×100 мл), сушили (MgSO4) и упаривали в вакууме, с получением масла. Хроматография (SiO2, с использованием для элюирования смеси петролейный эфир - EtOAc 0-30%) давала указанное в заголовке соединение (4,29 г 96%) в виде масла. MC: [M+H]+=357.
Получение 424: 6-(4-Фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Получали из трет-бутилового эфира 6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты (3,69 г, 10,3 ммоль) с использованием процедуры, аналогичной той, которая описана для Получения 404, с получением указанного в заголовке соединения (2,33 г, 88%) в виде не совсем белого твердого вещества. [M+H]+=257.
Получение 425: трет-Бутиловый эфир (2R,5R)-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
Следуя способам, подобным тем, которые описаны в Получении 203 или Общей Процедуре 5, исходя из трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,69 г, 3,0 ммоль) и 6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (0,55 г, 2,0 ммоль), с использованием DIPEA в качестве основания, получали указанное в заголовке соединение (0,92 г, 87%) в виде оранжевого полутвердого вещества. MC: [M+H]+=527.
Получение 426: трет-Бутиловый эфир (2R,5R)-5-хлорметил-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
Следуя способам, подобным тем, которые описаны в Получении 316, исходя из трет-бутилового эфира (2R,5R)-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]- 2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,92 г, 1,74 ммоль), получали указанное в заголовке соединение (0,8 г, 84%) в виде оранжевого полутвердого вещества. MC: [M+H]+=545.
Получение 427: трет-Бутиловый эфир (2R,5R)-4-{2-[6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты
Следуя способам, подобным тем, которые описаны в Получении 203 или Общей Процедуре 5, исходя из трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,35 г, 3,0 ммоль) и 6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (0,23 г, 1,0 ммоль), с использованием DIPEA в качестве основания, получали указанное в заголовке соединение (0,33 г, 66%). MC: [M+H]+=497.
Получение 428: трет-Бутиловый эфир (2R,5R)-5-хлорметил-4-{2-[6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты
Следуя способам, подобным тем, которые описаны в Получении 316, исходя из трет-бутилового эфира (2R,5R)-4-{2-[6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-гидроксиметил-2-метилпиперазин-1-карбоновой кислоты (0,32 г, 0,65 ммоль), получали указанное в заголовке соединение (0,33 г, 100%) в виде желто-коричневого твердого вещества. MC: [M+H]+=515.
Получение 429: трет-Бутиловый эфир (2R,5S)-4-бензилоксикарбонилметил-5-((R)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5S)-5-((R)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты аналогично тому, как описано в Получении 13. MC: [M+H]+=450.
Получение 430: трет-Бутиловый эфир (2R,5S)-4-карбоксиметил-5-((R)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты
Получали из трет-бутилового эфира (2R,5S)-4-бензилоксикарбонилметил-5-((R)-3-фторпирролидин-1-илметил)-2-метилпиперазин-1-карбоновой кислоты с использованием подобного способа, который описан в Получении 272 (EtOH использовали в качестве растворителя). 1H-ЯМР (CDCl3): 10,12-9,12 (1H, шир. с), 5,27 (1H, д), 4,17-3,89 (1H, м), 3,81-3,45 (3H, м), 3,45-2,78 (8H, м), 2,78-2,43 (2H, м), 2,42-1,99 (2H, м), 1,47 (9H, с), 1,23 (3H, д).
Соединения, представленные в Таблице 4 ниже, были получены с использованием процедур, аналогичных тем, которые описаны в Общей Процедуре 1 (см. выше), исходя из подходящего замещенного 2,3-дигидроиндола или дигидропирролопиридина и замещенного карбоксиметилпиперазина (синтезированных, как описано выше, указаны номера Получений и существенные отличия от общей процедуры, где это необходимо).
(MS или ЯМР)
[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты
Общая Процедура 4 (Амидное связывание с использованием HATU)
трет-Бутиловый эфир (2R,5S)-4-{2-[6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты
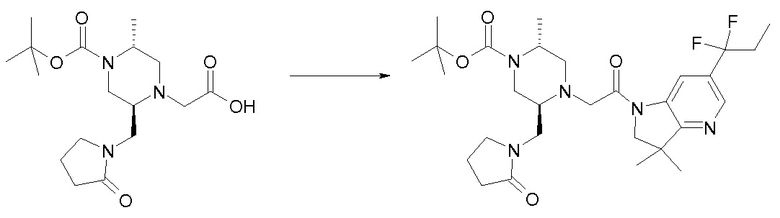
трет-Бутиловый эфир (2R,5S)-4-карбоксиметил-2-метил-5-(2-оксопирролидин-1-илметил)пиперазин-1-карбоновой кислоты (0,20 г, 0,56 ммоль) и 6-(1,1-дифторпропил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин (0,15 г, 0,6 ммоль) растворяли в DMF (2,8 мл). Добавляли N,N-диизопропилэтиламин (0,36 г, 2,8 ммоль) и гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (0,43 г, 1,1 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Добавляли насыщенный водный раствор бикарбоната натрия (10 мл) и водную фазу экстрагировали при помощи EtOAc (3×10 мл). Объединенные органические экстракты разбавляли уайт-спиритом (20 мл), промывали водой (3×), сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-5%, метанола в EtOAc) давала указанное в заголовке соединение (0,178 г), MC: [M+H]+=564.
Соединения, представленные в Таблице 5 ниже, были получены с использованием процедур, аналогичных тем, которые описаны в Общей Процедуре 4 выше, исходя из подходящего замещенного 2,3-дигидроиндола или дигидропирролопиридина и замещенного карбоксиметилпиперазина (синтезированных, как описано выше, указаны номера Получений и существенные отличия от общей процедуры, где это необходимо).
Общая Процедура 5 (3-компонентное связывание)
трет-Бутиловый эфир (2R,5S)-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты
К перемешиваемому раствору 6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридина (0,11 г, 0,43 ммоль) и диизопропилэтиламина (0,082 мл, 0,061 г, 0,47 ммоль) в DCM (3 мл) при 0°C в атмосфере азота добавляли хлорацетилхлорид (0,036 мл, 0,051 г, 0,45 ммоль) и смесь перемешивали при 20°C в течение 1 часа. Добавляли дополнительное количество диизопропилэтиламина (0,22 мл, 0,166 г, 1,29 ммоль), с последующим добавлением раствора трет-бутилового эфира (2R,5S)-4-карбоксиметил-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты (0,141 г, 0,47 ммоль) в DCM (2 мл). Смесь перемешивали при 35°C в течение 64 часов, затем смесь распределяли между насыщенным водным раствором NaHCO3 и DCM (×3) и объединенные органические экстракты сушили и упаривали. Хроматография (SiO2, градиентное элюирование с использованием 0-100% EtOAc в 40-60 PE) давала указанное в заголовке соединение (0,184 г) в виде масла. MC: [M+H]+=596.
Соединения, представленные в Таблице 6 ниже, были получены с использованием процедур, аналогичных тем, которые описаны в Общей Процедуре 5 выше, исходя из подходящего замещенного 2,3-дигидроиндола или дигидропирролопиридина и замещенного пиперазина (синтезированных, как описано выше). В случаях, когда стадия алкилирования протекала медленно, осуществляли легкое нагревание реакционной смеси (как иллюстрировано выше), либо реакции осуществляли при комнатной температуре. Указаны номера Получений и существенные отличия от общей процедуры, где это необходимо.
Общая Процедура 6 (Алкилирование с использованием связанных хлорметилпиперазинов)
трет-Бутиловый эфир (2R,5S)-4-{2-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метил-5-(2-оксо-2H-пиримидин-1-илметил)пиперазин-1-карбоновой кислоты
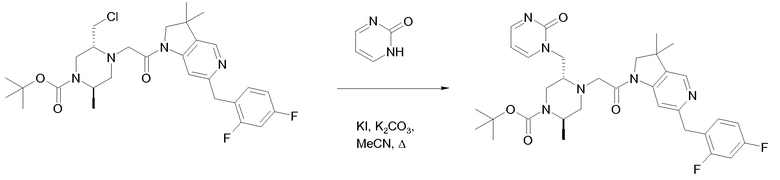
Смесь трет-бутилового эфира (2R,5R)-5-хлорметил-4-{2-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты (124 мг, 0,23 ммоль), иодида калия (83 мг, 0,5 ммоль), безводного карбоната калия (276 мг, 2,0 ммоль) и 1H-пиримидин-2-она (48 мг, 0,5 ммоль) в ацетонитриле (5 мл) перемешивали и поддерживали при температуре кипения с обратным холодильником в герметично закрытой пробирке в течение 16 часов. После охлаждения до комнатной температуры растворитель удаляли в вакууме и остатки распределяли между DCM и водой. Органический слой отделяли, растворитель удаляли в вакууме и остатки очищали колоночной хроматографией (диоксид кремния, элюирование с использованием 30-100% этилацетата в петролейном эфире, затем 0-50% метанола в этилацетате), с получением трет-бутилового эфира (2R,5S)-4-{2-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метил-5-(2-оксо-2H-пиримидин-1-илметил)пиперазин-1-карбоновой кислоты (70 мг, 49%) в виде бесцветного твердого вещества. MC: [M+H]+=623.
Соединения, представленные в Таблице 7 ниже, были получены с использованием процедур, аналогичных тем, которые описаны в Общей Процедуре 6 выше, путем взаимодействия подходящего нуклеофила с подходящим замещенным галогенпиперазинамидом (синтезирован, как описано выше, указан номер Получения).
Получение 431: трет-Бутиловый эфир (2R,5R)-4-{2-[3,3-диметил-6-(2-оксопирролидин-1-илметил)-2,3-дигидроиндол-1-ил]-2-оксоэтил}-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
10% Pd/C (12 мг, 0,1 ммоль) и трет-бутиловый эфир (2R,5R)-4-{2-[5-бром-3,3-диметил-6-(2-оксопирролидин-1-илметил)-2,3-дигидроиндол-1-ил]-2-оксоэтил}-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты (66 мг, 0,1 ммоль) растворяли в метаноле (0,44 мл) и добавляли триэтиламин (23 мкл, 0,16 ммоль). Реакционную смесь гидрировали при 1 бар в течение 1 часа при температуре окружающей среды, затем фильтровали в условиях вакуума и концентрировали. Остаток растворяли в метаноле, загружали на SCX колонку с использованием для элюирования метанола, затем 2,0 M раствора аммиака в метаноле для выделения амина, и нужные фракции концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (60 мг), MC: [M+H]+=529.
Получение 432: трет-Бутиловый эфир (2R,5R)-4-[2-(6-бензил-3,3-диметил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Общей Процедуре 3, MC: [M+H]+=523.
Получение 433: трет-Бутиловый эфир (2R,5R)-4-[2-(6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали, следуя способам аналогичным тем, которые описаны в Общей Процедуре 3, MC: [M+H]+=523
Получение 434: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил]-2-оксоэтил}-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты
Перемешиваемый раствор 6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-c]пиридина (100 мг, 0,42 ммоль) в DCM (5 мл) и пиридине (0,5 мл) при 0°C обрабатывали хлорацетилхлоридом (0,036 мл, 0,46 ммоль). Через 2 часа раствор обрабатывали трет-бутиловым эфиром (2R,5S)-2-метил-5-морфолин-4-илметилпиперазин-1-карбоновой кислоты (124 мг, 0,42 ммоль) и снова пиридином (0,5 мл). После перемешивания в течение ночи при комнатной температуре никакого связывания не происходило: смесь концентрировали в вакууме, разбавляли при помощи DMF (3 мл), обрабатывали при помощи DMAP (1 мг) и нагревали до 75°C. Через 6 часов LC/MS анализ показал ~80% завершение реакции. Смесь охлаждали и распределяли между DCM и водой. Водную фазу экстрагировали при помощи DCM. Объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали досуха. Очистка препаративной ВЭЖХ давала бледно-коричневое стекловидное вещество (30 мг, 12%). MC: [M+H]+=580
Получение 435: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
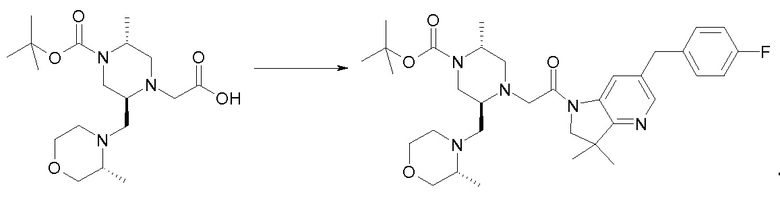
К трет-бутиловому эфиру (2R,5S)-4-карбоксиметил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (1,5 г, 4,04 ммоль) и 6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридину (1,14 г, 4,4 ммоль) в DMF (20,2 мл) добавляли гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (2,31 г, 6,1 ммоль) и N,N-диизопропилэтиламин (1,41 мл, 8,1 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, затем добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали диэтиловым эфиром (3×). Объединенные органические экстракты промывали водой (3×) и насыщенным солевым раствором (3×), затем сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (1,9 г, 77%), MC: [M+H]+=610.
Получение 436: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты, Альтернативная Процедура
Получали из трет-бутилового эфира (2R,5R)-5-хлорметил-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты (см. Получение 420) и (R)-3-метил-морфолина способом, подобным Общей Процедуре 6. MC: [M+H]+=610.
Получение 437: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
HATU (3,8 г, 9,9 ммоль) и DIPEA (2,4 мл, 13,3 ммоль) добавляли к раствору трет-бутилового эфира (2R,5S)-4-карбоксиметил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (1,7 г, 6,7 ммоль) и 6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (1,6 г, 6,7 ммоль) в DMF (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов и затем распределяли между насыщенным водным раствором NaHCO3 и EtOAc. Органическую фазу отделяли, промывали насыщенным солевым раствором (3×), сушили над MgSO4 и концентрировали в вакууме. Хроматография (70% EtOAc в петролейном эфире) давала указанное в заголовке соединение (2,1 г) в виде желтого твердого вещества. MC: [M+H]+=594.
Получение 438: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты, Альтернативная Процедура
Получали из трет-бутилового эфира (2R,5R)-5-хлорметил-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты и (R)-3-метилморфолина способом, подобным Общей Процедуре 6. MC: [M+H]+=594.
Получение 439: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
К трет-бутиловому эфиру (2R,5S)-4-карбоксиметил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (1,5 г, 4,04 ммоль) и 6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридину (1,14 г, 4,45 ммоль) в DMF (20,2 мл) добавляли гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (2,31 г, 6,1 ммоль) и N,N-диизопропилэтиламин (1,41 мл, 8,1 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали диэтиловым эфиром (3×). Объединенные органические экстракты промывали водой (3×) и насыщенным солевым раствором (3×), затем сушили при помощи сульфата натрия, фильтровали и концентрировали. Хроматография (силикагель, градиентное элюирование, 0-100%, EtOAc в петролейном эфире 40-60) давала указанное в заголовке соединение (1,43 г), MC: [M+H]+=610.
Получение 440: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты, Альтернативная Процедура
Получали из трет-бутилового эфира (2R,5R)-5-хлорметил-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты и (R)-3-метилморфолина способом, подобным Общей Процедуре 6. MC: [M+H]+=610.
Получение 441: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
Смесь трет-бутилового эфира (2R,5S)-4-карбоксиметил-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (0,12 г, 0,32 ммоль), 1,1'-карбонилдиимидазола (0,057 г, 0,35 ммоль) и DCM (5 мл) перемешивали при 20°C в течение 24 часов. Добавляли 6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин (0,088 г, 0,32 ммоль) и смесь нагревали при 35°C в течение 24 часов. Растворитель выпаривали и остаток растворяли в 1,2-дихлорэтане и смесь нагревали до 60°C в течение 24 часов. Смесь распределяли между насыщенным водным раствором NaHCO3 (30 мл) и DCM (3×20 мл) и объединенные органические экстракты сушили и упаривали с получением масла. Хроматография (SiO2, градиентное элюирование, 0-100% EtoAc в петролейном эфире 40-60) давала указанное в заголовке соединение (0,103 г) в виде масла. MC: [M+H]+=628.
Получение 442: 2-Хлор-1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]этанон гидрохлорид
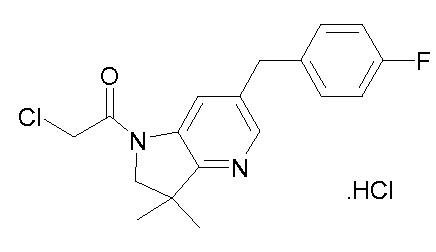
К перемешиваемой суспензии 6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (6,68 г, 26 моль) в ацетонитриле (20 мл) при 20°C добавляли, непрерывно в течение 0,2 часа, раствор хлорацетилхлорида (3,83 г, 2,7 мл, 33,9 ммоль) в ацетонитриле (10 мл), поддерживая реакционную смесь при температуре 20°C или ниже с использованием внешнего охлаждения на бане лед-метанол. Получали прозрачный раствор, затем, когда внутренняя температура достигала 0°C, начиналась кристаллизация твердого вещества из реакционной смеси. Перемешивание при 20°C продолжали в течение 1 часа, затем медленно добавляли толуол (20 мл) и 40-60 петролейный эфир (20 мл) и перемешивание продолжали в течение 0,2 часа. Полученное бесцветное твердое вещество собирали путем фильтрования, с получением указанного в заголовке соединения (8,0 г, 83%). 1H-ЯМР (Me-d3-OD): 8,81 (1H, с), 8,31 (1H, с), 7,39-7,29 (2H, м), 7,16-7,04 (2H, м), 4,45 (2H, с), 4,19 (4H, с), 1,58 (6H, с). МС: [M+H]+=333.
Получение 443: трет-Бутиловый эфир (2R,5S)-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты
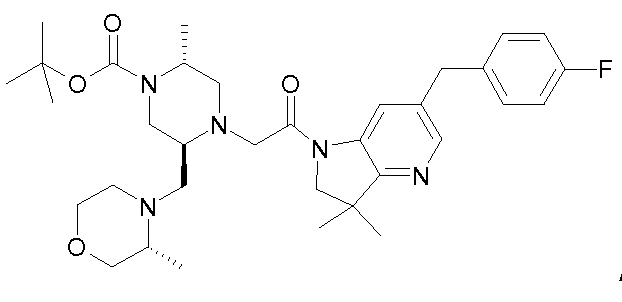
Смесь 2-хлор-1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]этанон гидрохлорида (6,63 г, 17,96 ммоль), трет-бутилового эфира (2R,5S)-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (5,62 г, 17,96 ммоль), карбоната калия (9,95 г, 72 ммоль) и тонкоизмельченного иодида калия (5,98 г, 36 ммоль) в ацетонитриле (40 мл) перемешивали при 20°C в течение 1 часа. Добавляли воду (200 мл) и смесь перемешивали в течение 0,2 часа, затем смесь экстрагировали при помощи EtOAc (200 мл). Органическую фазу сушили (Na2SO4) и упаривали в вакууме, с получением указанного в заголовке соединения (11,3 г) в виде масла, которое использовали без дополнительной очистки. 1H-ЯМР (Me-d3-OD): 8,28-8,19 (1H, м), 8,13-8,04 (1H, м), 7,25 (2H, дд), 7,04 (2H, т), 4,23-4,13 (1H, м), 4,13-4,04 (2H, м), 4,04-3,95 (3H, м), 3,81-3,58 (4H, м), 3,54 (1H, д), 3,25 (2H, дд), 3,01-2,66 (4H, м), 2,62-2,42 (2H, м), 2,42-2,17 (2H, м), 1,47 (9H, с), 1,43-1,37 (6H, м), 1,29-1,21 (3H, м), 1,01 (3H, д). МС: [M+H]+=610. IR: vC=O 1685, 1653 см-1.
Общие процедуры получения соединений формулы (I)
Как должно быть понятно специалистам в данной области, соединения, синтезированные с использованием указанных протоколов, могут существовать в виде сольвата, например, гидрата, и/или могут содержать остаточный растворитель или минорные примеси. Соединения, выделенные в форме соли, могут иметь целочисленную стехиометрию, т.е. моно- или ди-соли, или промежуточную стехиометрию.
Следующие процедуры являются иллюстративными для общих способов, используемых для получения Примеров 1-112, перечисленных в таблице 8 ниже.
Способ 1
Метиламид 1-[2-((R)-3-метилпиперазин-1-ил)ацетил]-2,3-дигидро-1H-индол-6-сульфоновой кислоты (Пример 27)
трет-Бутиловый эфир (R)-2-метил-4-[2-(6-метилсульфамоил-2,3-дигидроиндол-1-ил)-2-оксоэтил]пиперазин-1-карбоновой кислоты (65 мг, 0,14 ммоль) растворяли в TFA (0,72 мл) и перемешивали при температуре окружающей среды в течение 30 минут. Растворитель удаляли в вакууме. Остаток растворяли в MeOH и загружали на SCX колонку с использованием для элюирования MeOH, а затем 2,0 M NH3 MeOH для выделения амина. Растворитель удаляли в вакууме, с получением указанного в заголовке соединения (47 мг, 93%) в виде бесцветного твердого вещества.
Способ 2
1-(2,3-Дигидропирроло[2,3-b]пиридин-1-ил)-2-((R)-3-метилпиперазин-1-ил)этанон, гидрохлоридная соль (Пример 36)
трет-Бутиловый эфир (R)-4-[2-(2,3-дигидропирроло[2,3-b]пиридин-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (300 мг, 0,83 ммоль) растворяли в насыщенном растворе HCl в EtOAc (20,8 мл) и перемешивали при температуре окружающей среды в течение 1 часа. Растворитель удаляли в вакууме. Остаток растворяли в MeOH и концентрировали и остаток сушили при 40°C в вакууме, с получением указанного в заголовке соединения (241 мг) в виде бежевого твердого вещества.
Способ 3
1-(5-Фтор-6-фенил-2,3-дигидроиндол-1-ил)-2-((R)-3-метилпиперазин-1-ил)этанон, гидрохлоридная соль (Пример 24)
Смесь трет-бутилового эфира (R)-4-[2-(5-фтор-6-фенил-2,3-дигидроиндол-1-ил)-2-оксоэтил]-2-метилпиперазин-1-карбоновой кислоты (0,138 г), HCl в 1,4-диоксане (4 M, 2 мл) и MeOH (2 мл) перемешивали при 20°C в течение 3 часов и полученное твердое вещество собирали путем фильтрования, с получением указанного в заголовке соединения (0,076 г).
Способ 4
1-(6-Бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-((2R,5R)-2-метоксиметил-5-метилпиперазин-1-ил)этанон, гидрохлоридная соль (Пример 63)
Смесь трет-бутилового эфира (2R,5R)-4-[2-(6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты (0,17 г, 0,33 ммоль), MeOH (5 мл) и хлористоводородной кислоты (5 M, 5 мл) перемешивали при 20°C в течение 4 часов, затем при 40°C в течение 0,5 часа и смесь упаривали в вакууме. Остаток снова растворяли в MeOH, и снова упаривали в вакууме. Эту процедуру азеотропной перегонки с MeOH повторяли 4 раза, с получением указанного в заголовке соединения (0,145 г) в виде бесцветного твердого вещества.
ПРИМЕРЫ 1-112
Следуя способам, подобным и/или аналогичным тем, которые описаны выше, соединения, описанные в таблице 8, были получены из соответствующих N-Boc-защищенных производных, при этом любые существенные изменения указаны ниже, кроме тех случаев, когда указано иное. Указанные в заголовке соединения либо выделяли непосредственно в форме свободного основания или подходящей соли без дополнительной очистки, либо очищали например, с использованием масс-направленной препаративной ВЭЖХ, кристаллизации или растирания в порошок.
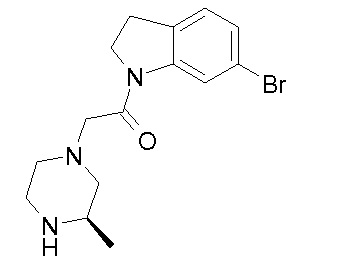
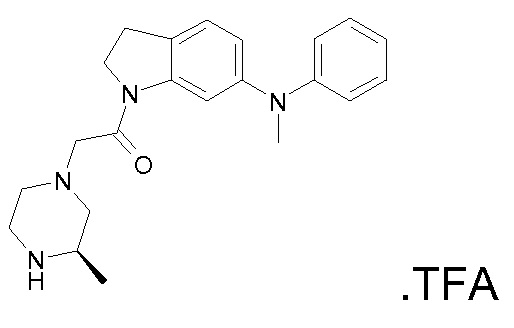
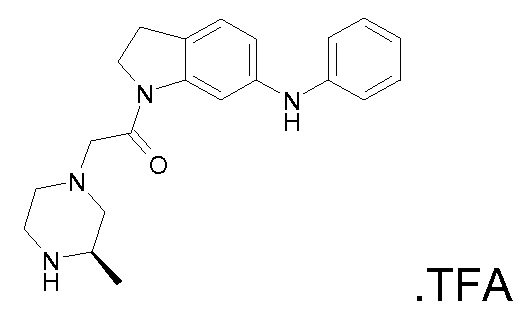
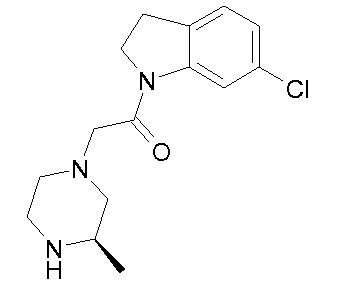
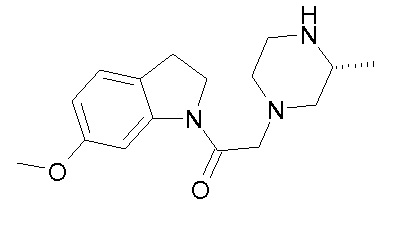
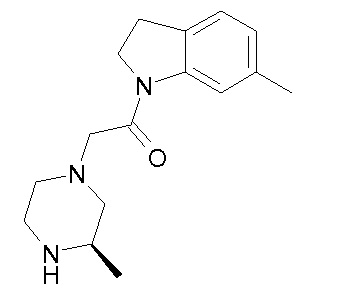
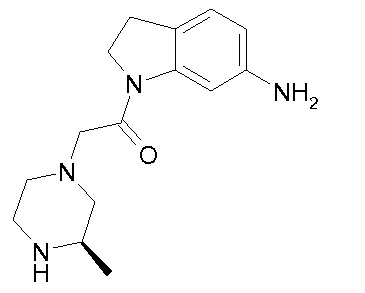
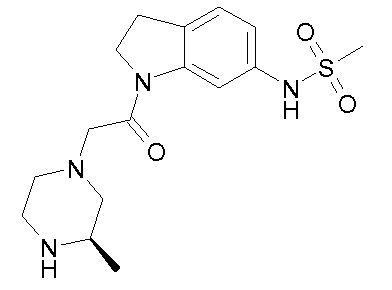
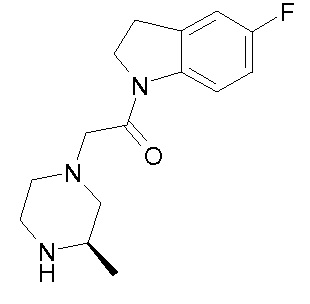
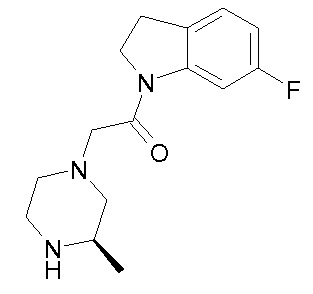
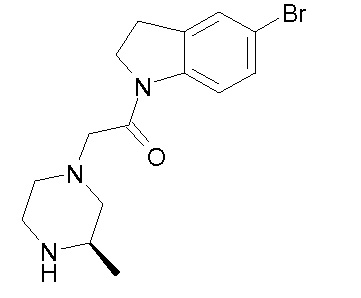
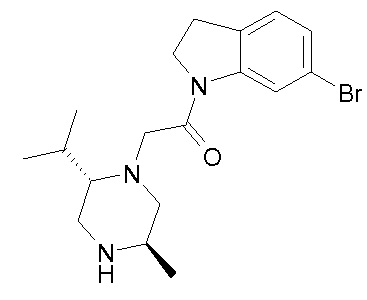
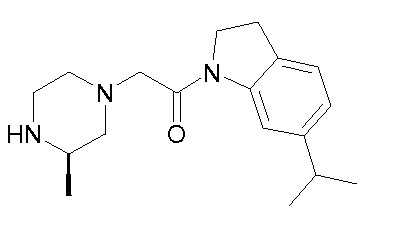
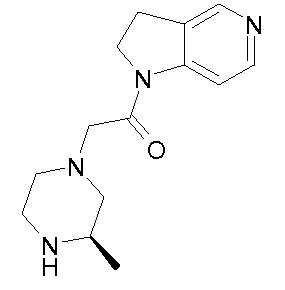
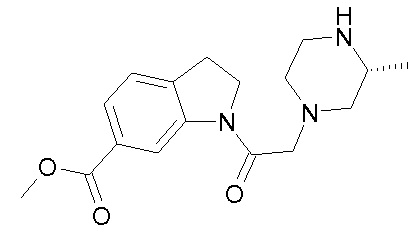
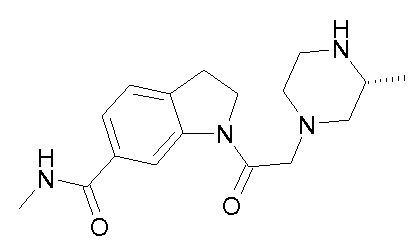
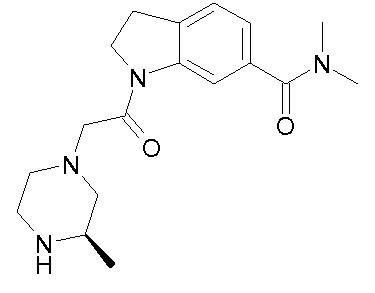
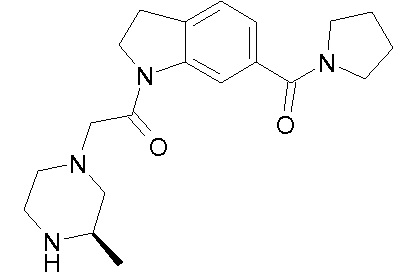
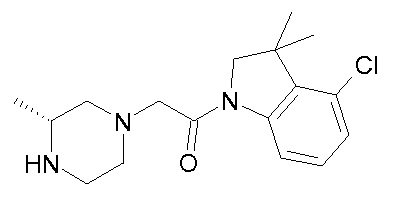
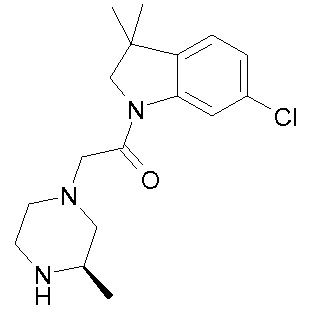
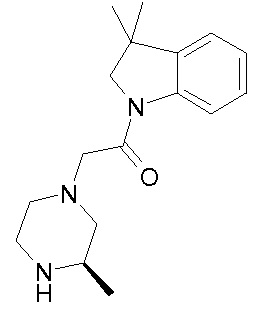
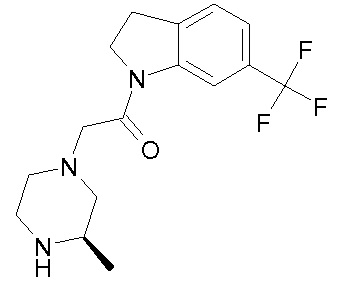
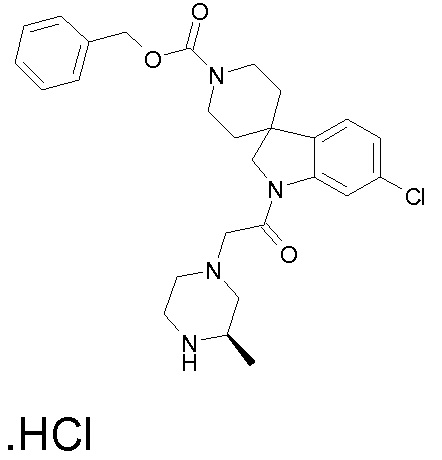
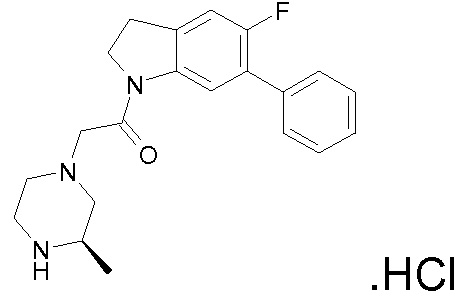
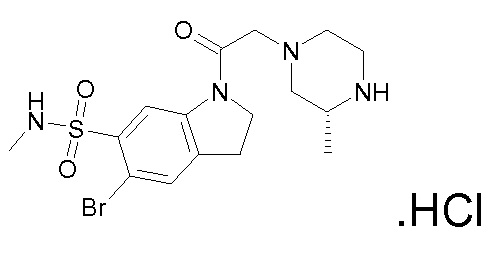
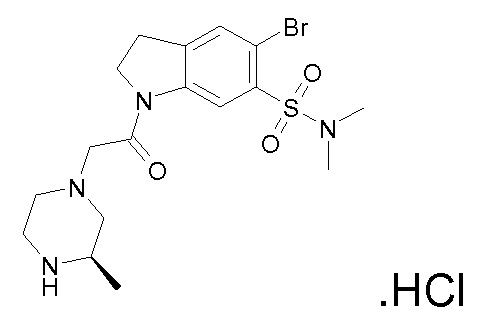
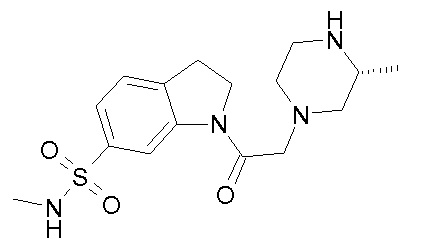
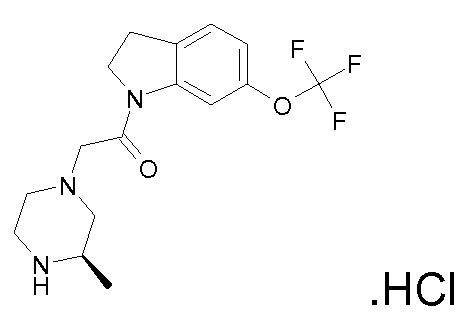
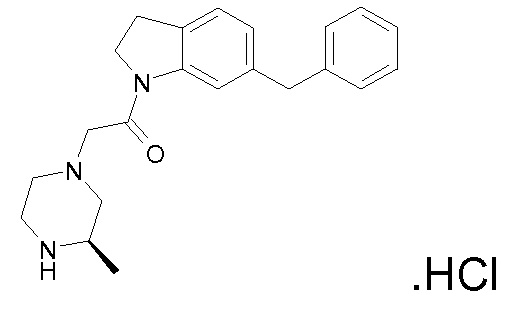
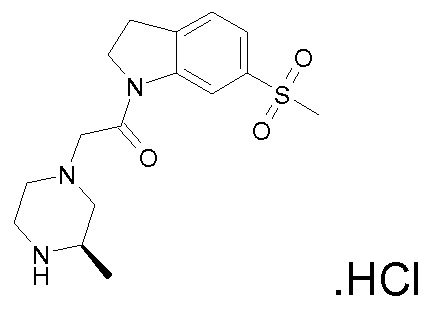
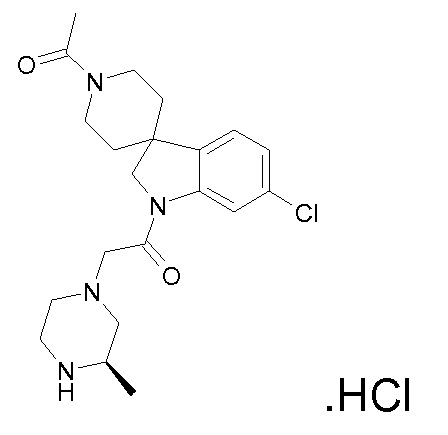
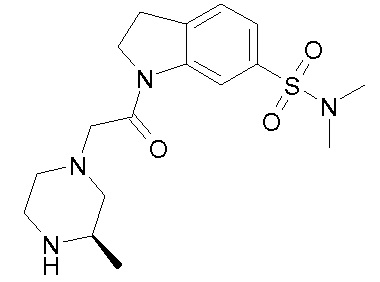
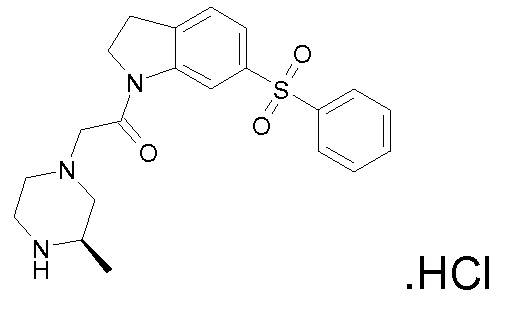
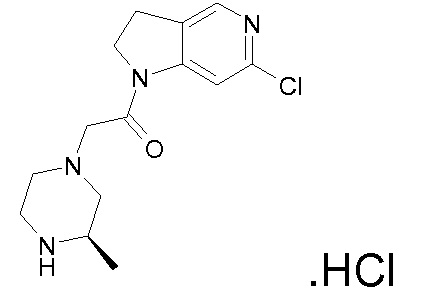
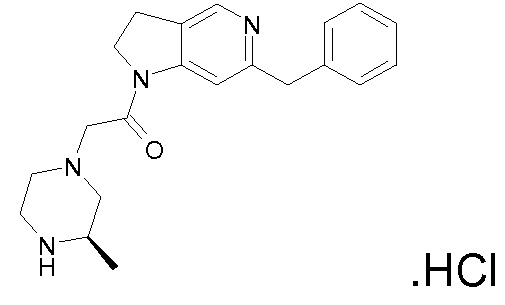
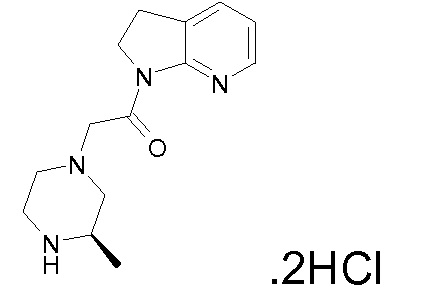
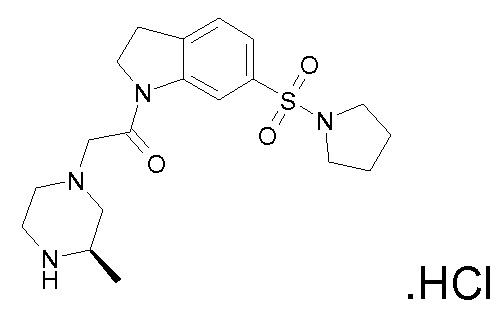
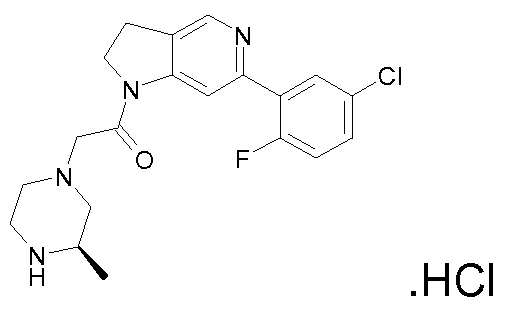
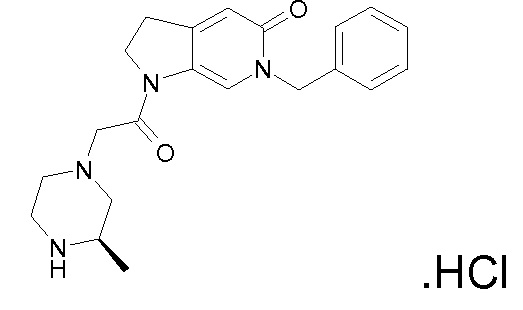
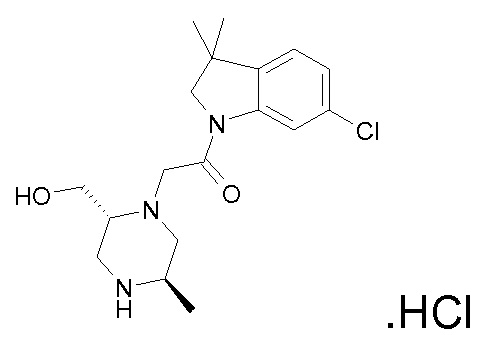
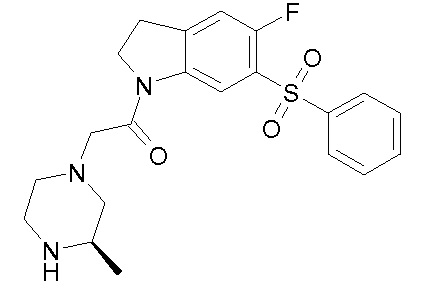
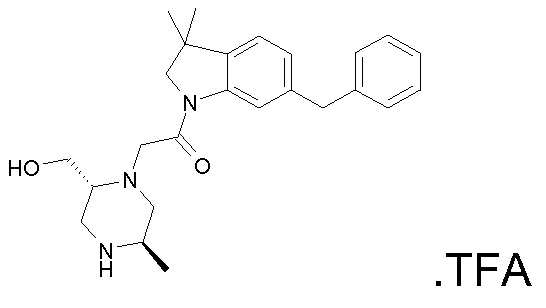
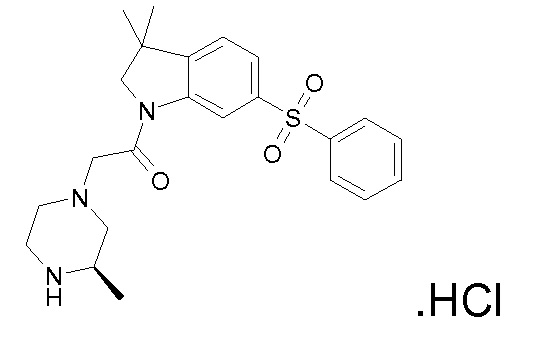
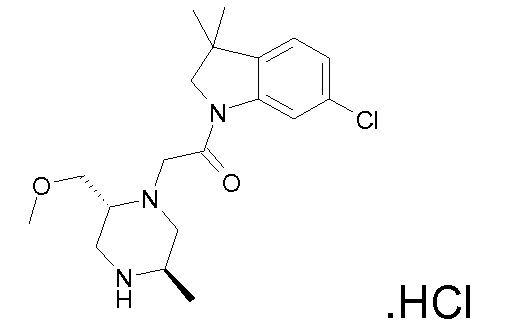
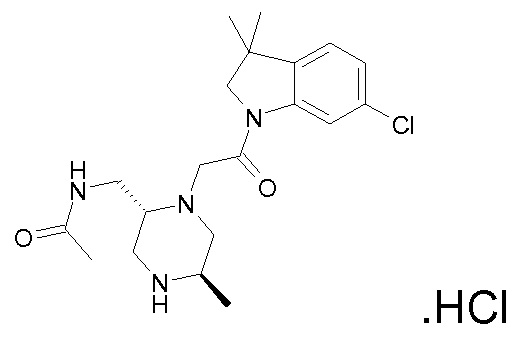
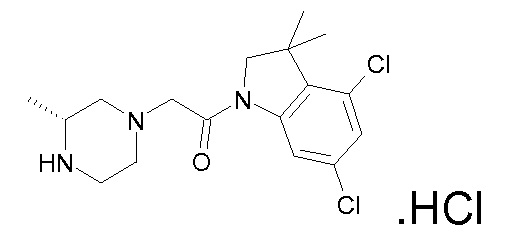
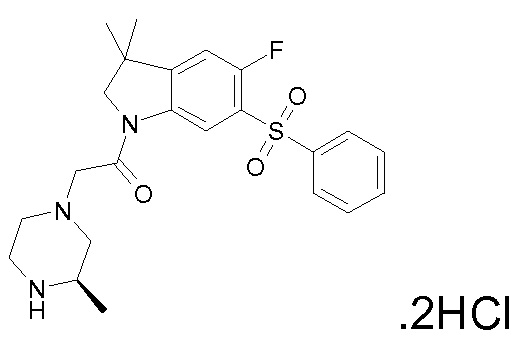
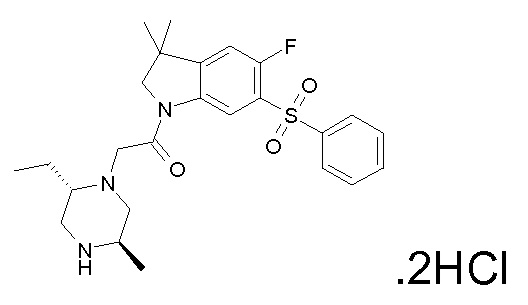
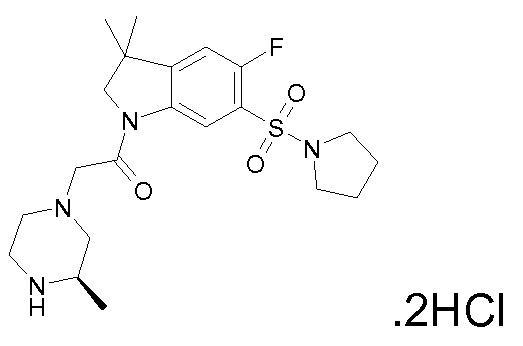
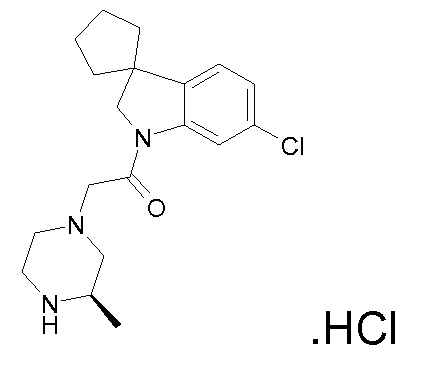
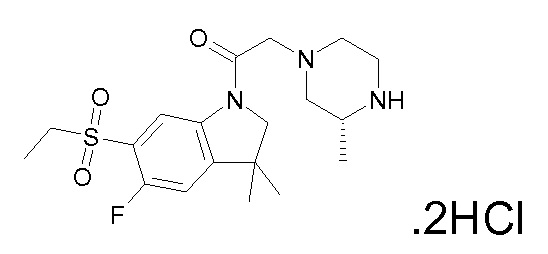
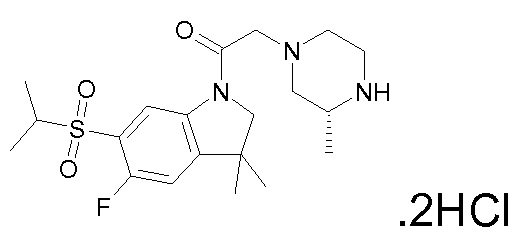
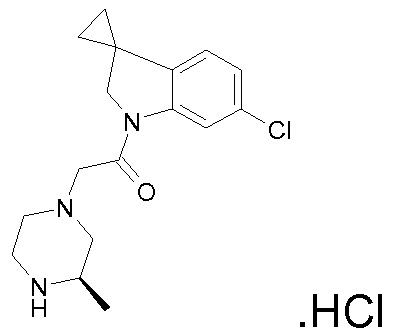
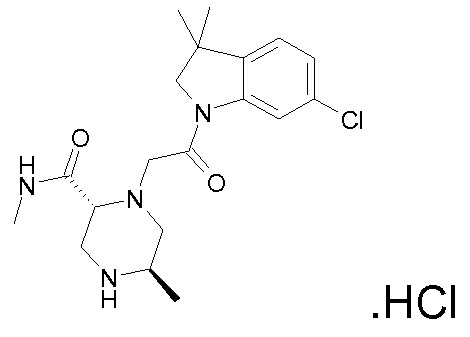
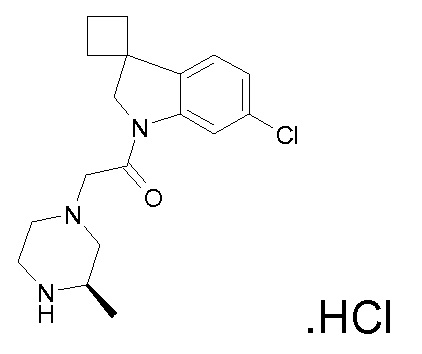
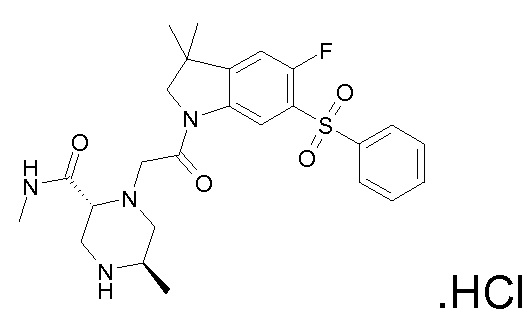
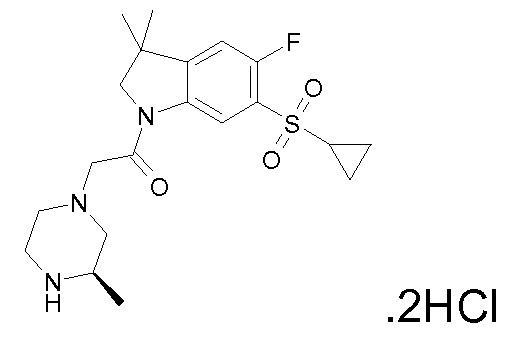
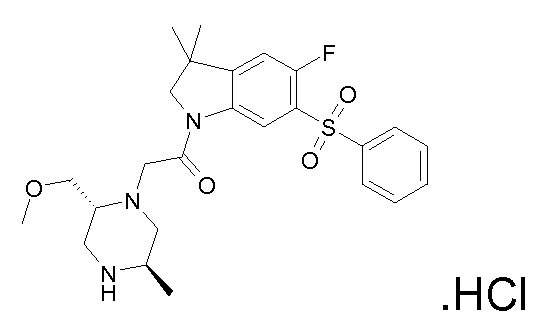
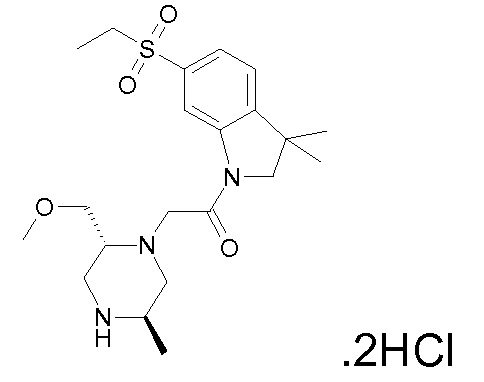
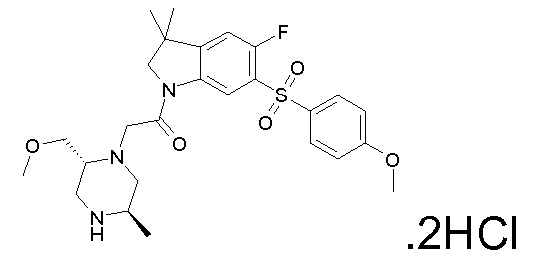
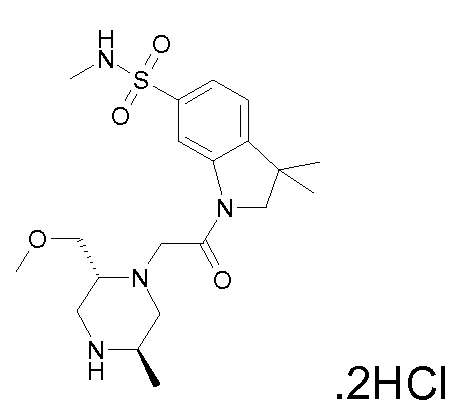
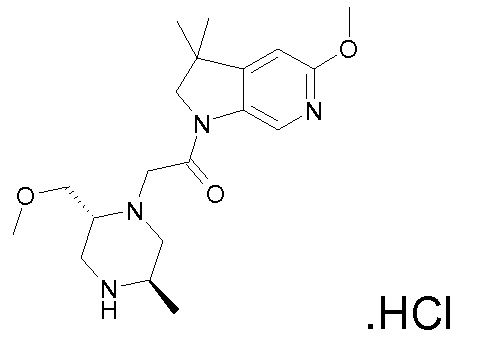
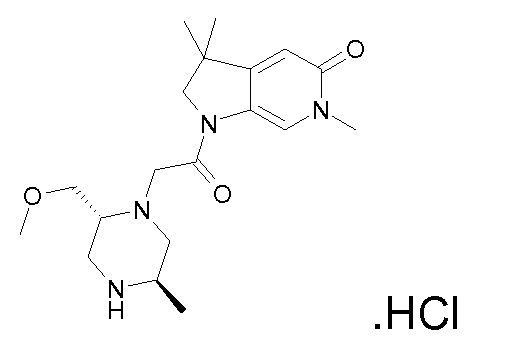
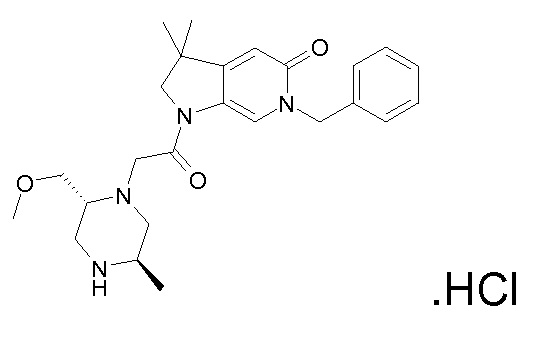
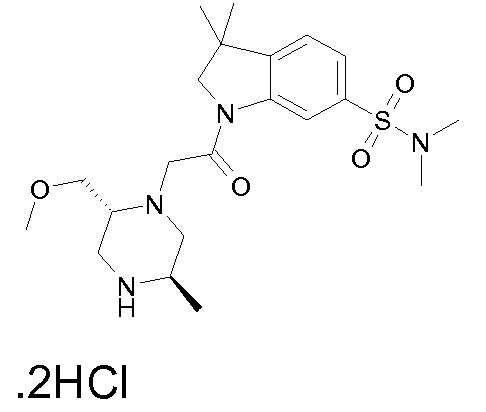
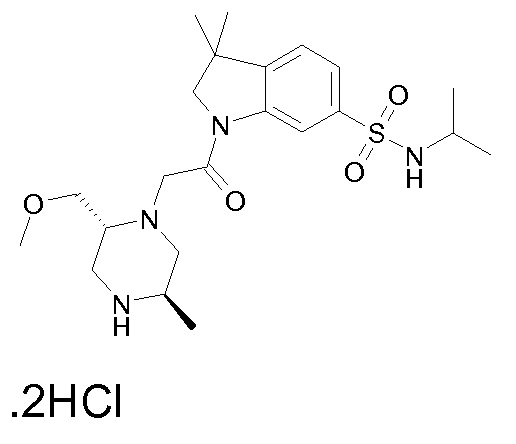
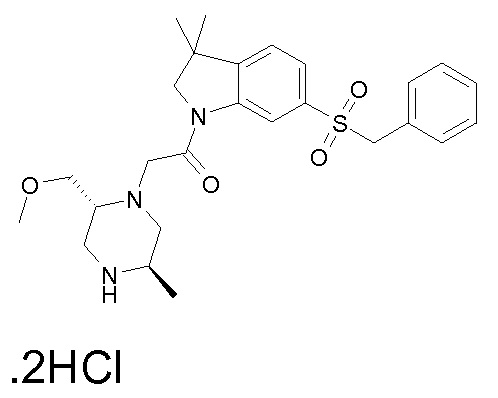
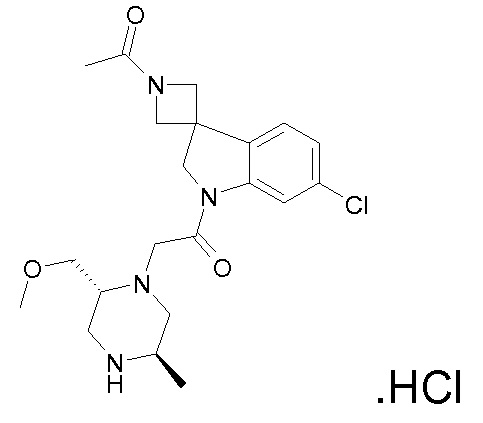
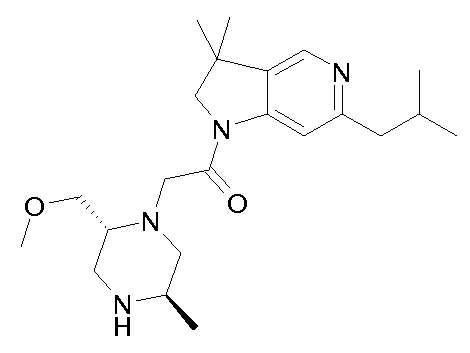

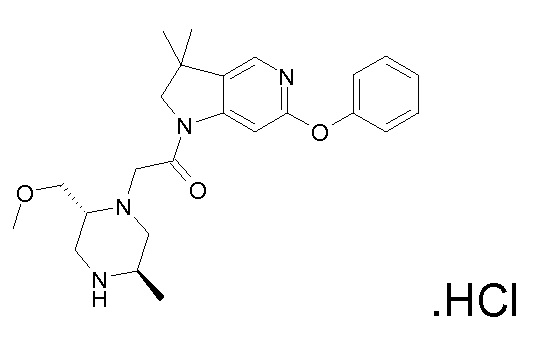
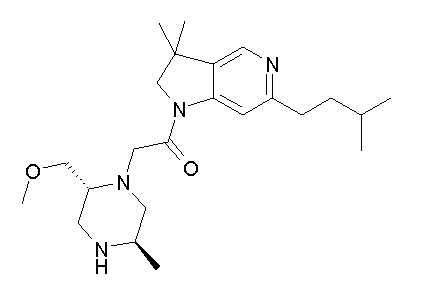
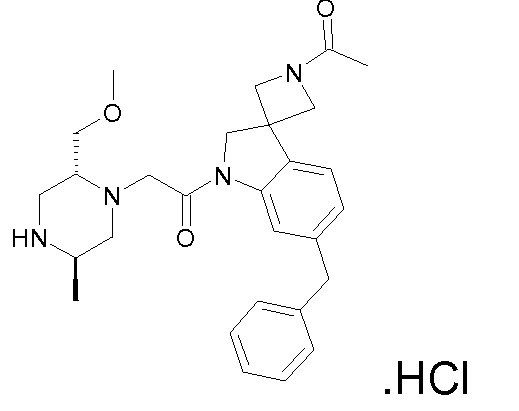
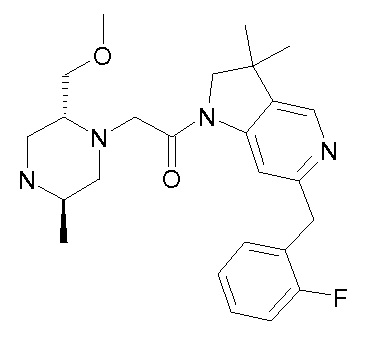
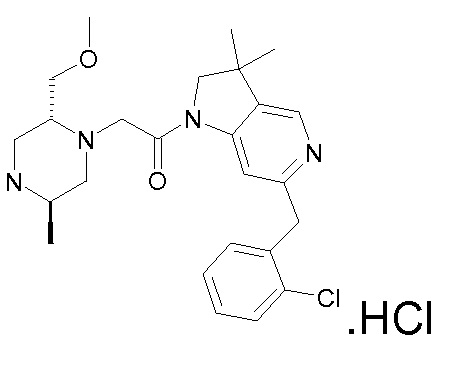
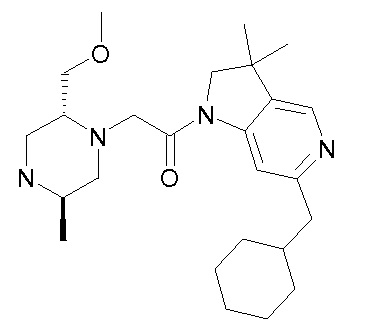
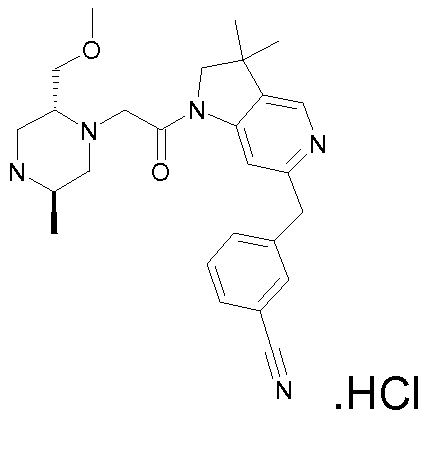
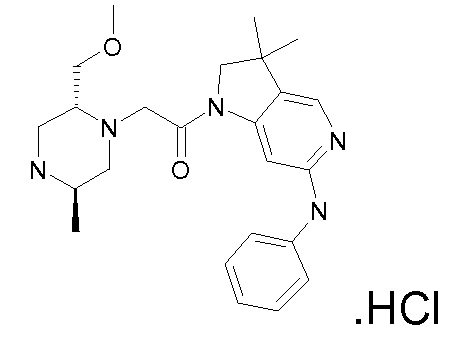
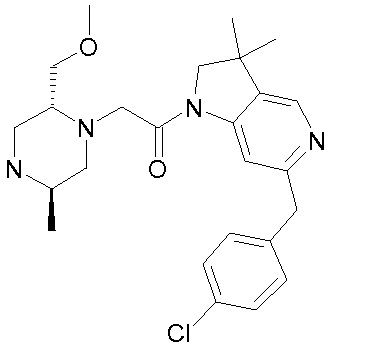
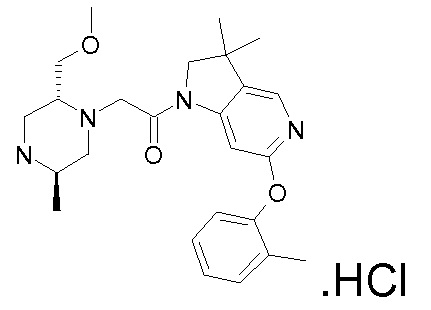
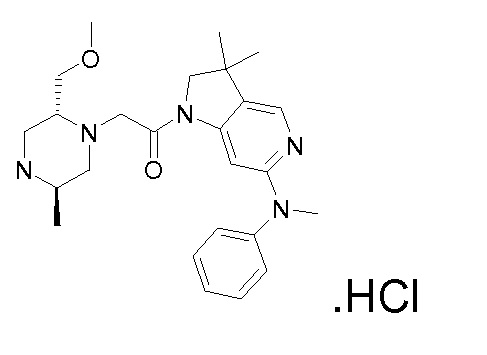
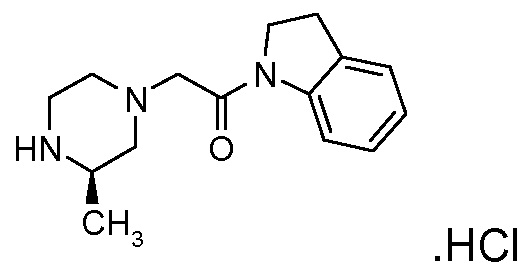
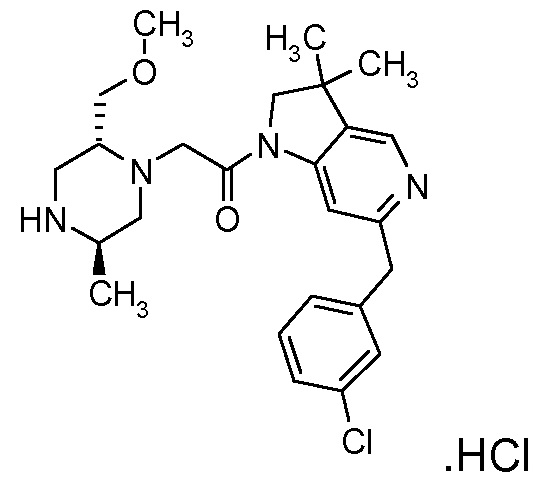
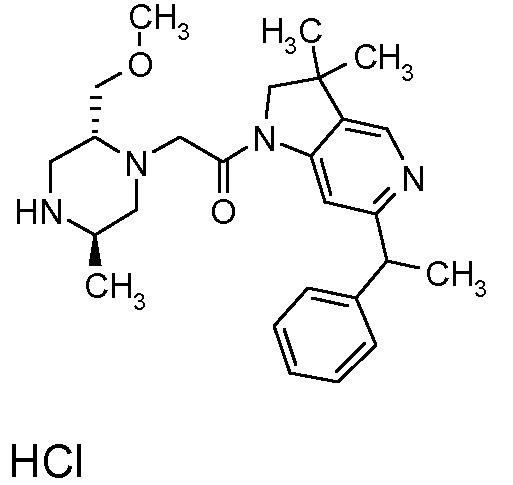
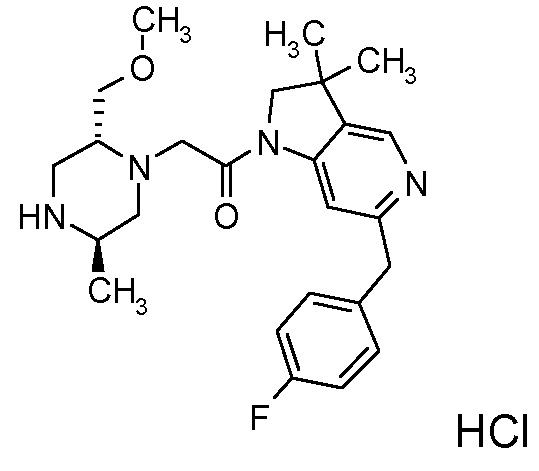
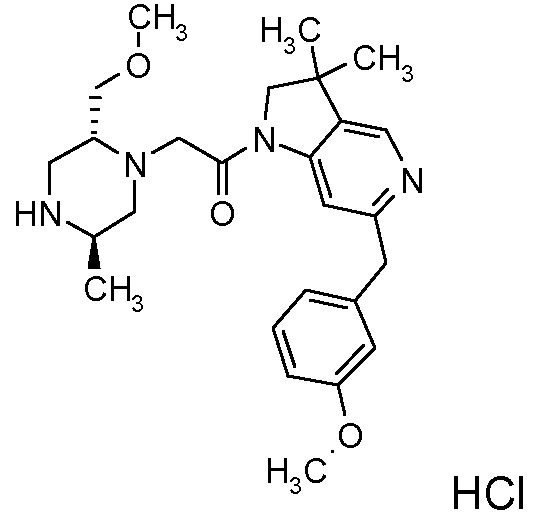
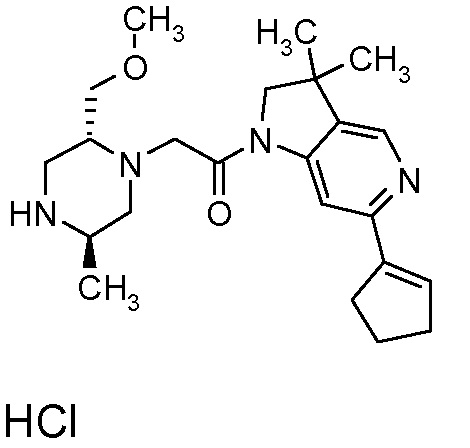
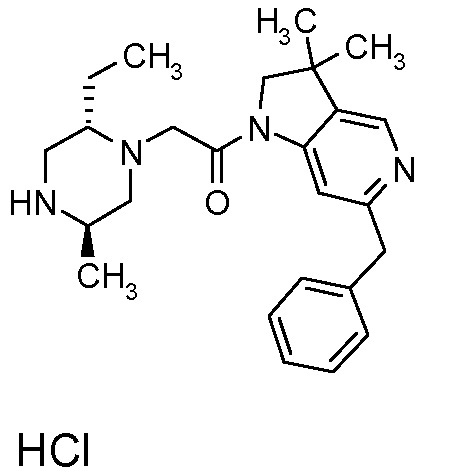
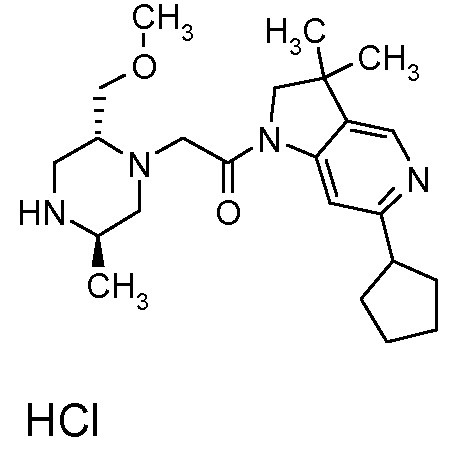
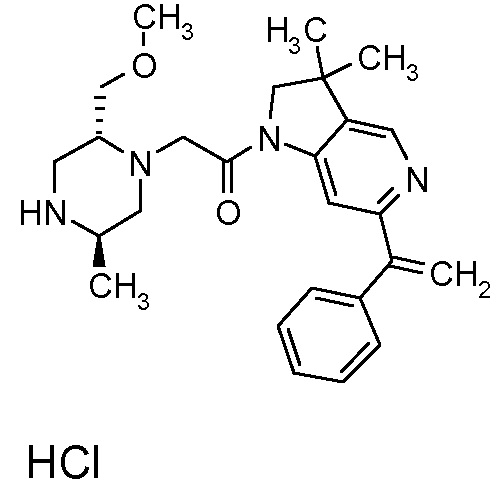
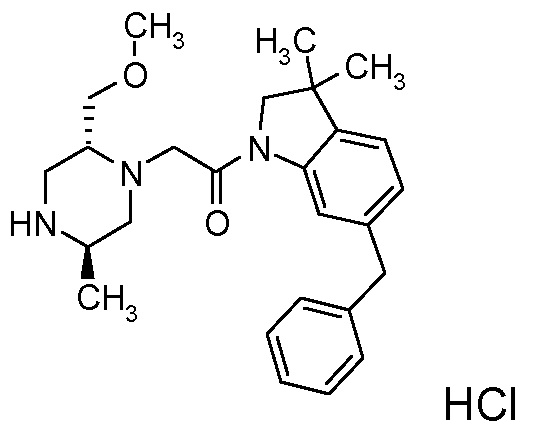
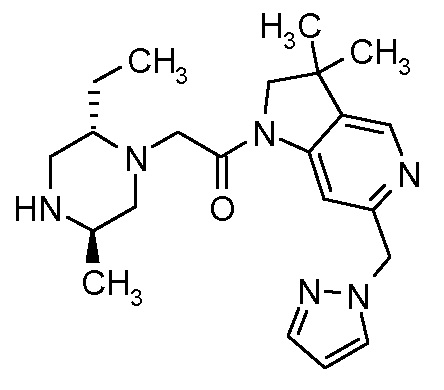
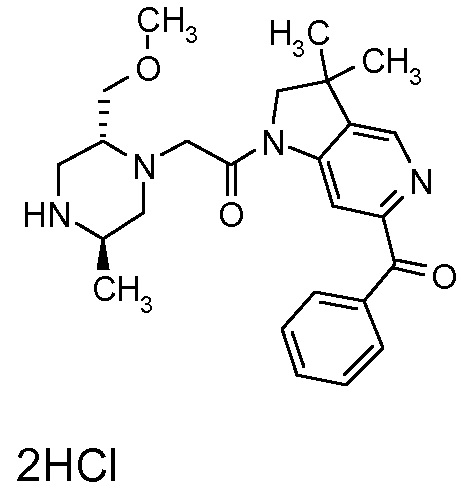
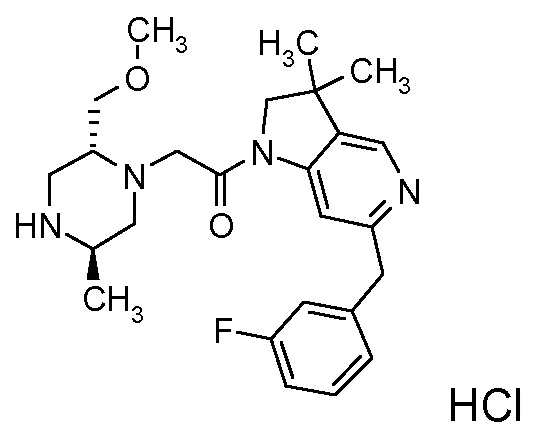
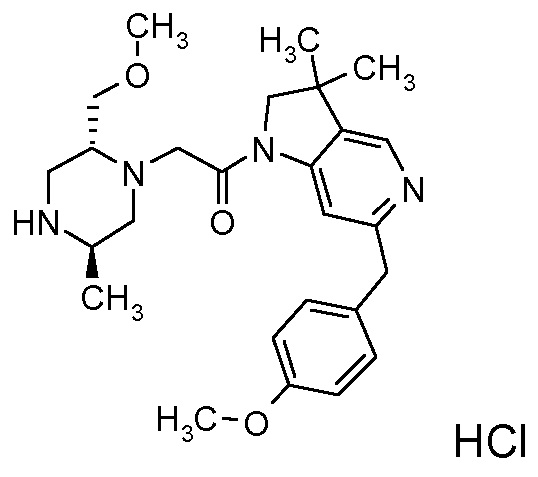
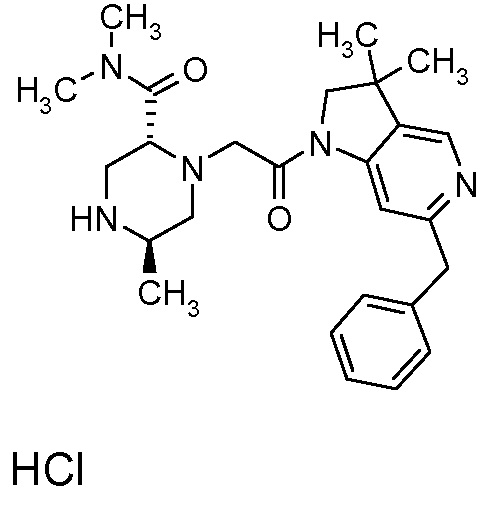
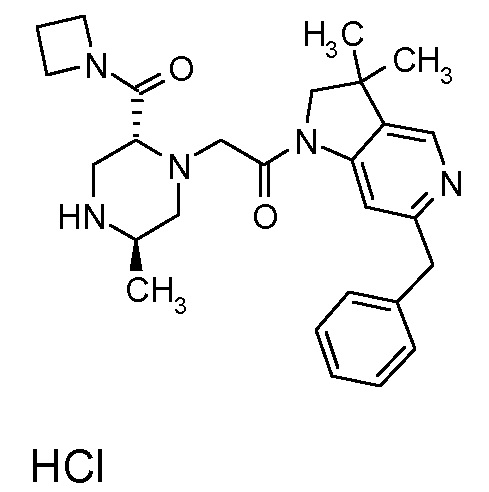
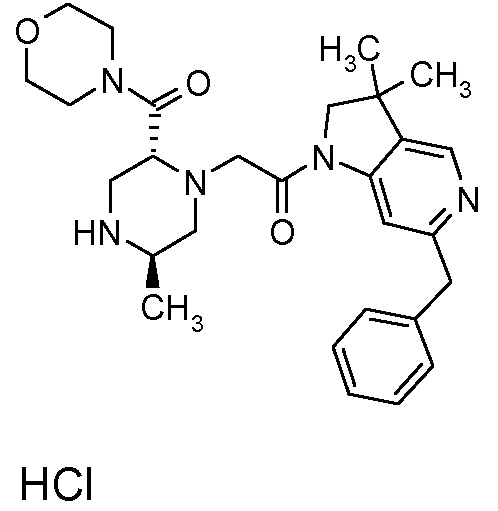
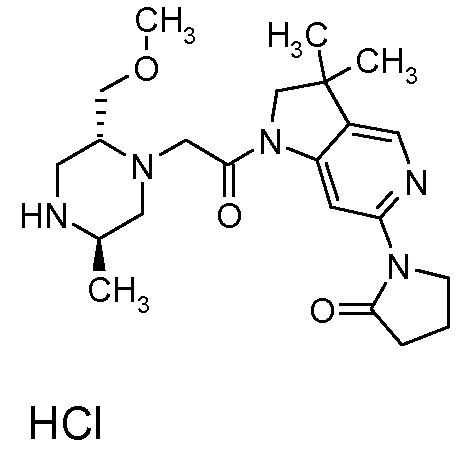
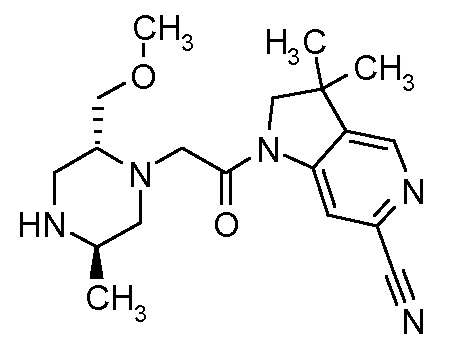
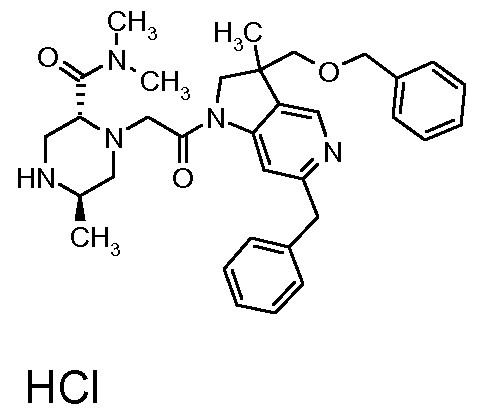
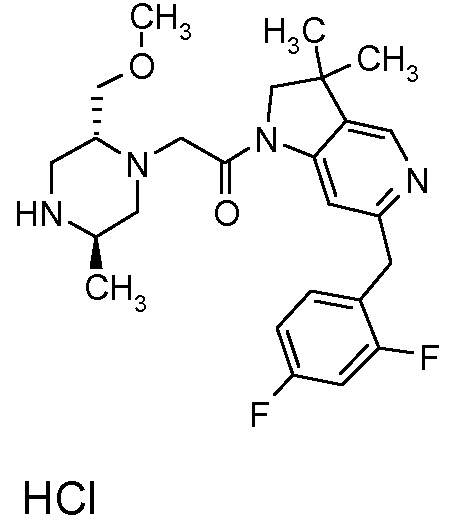
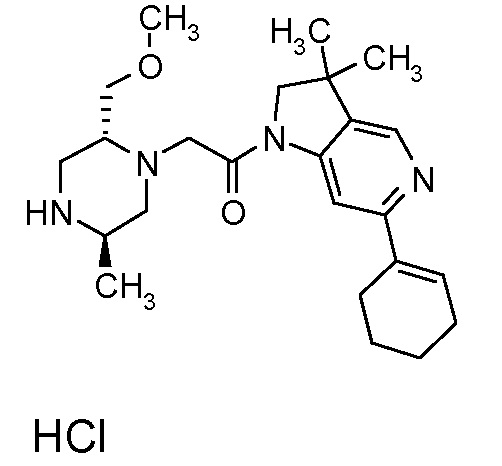
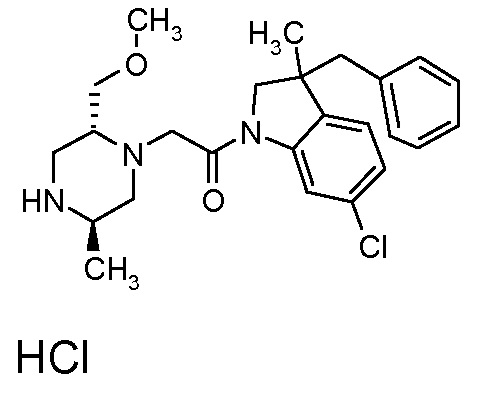
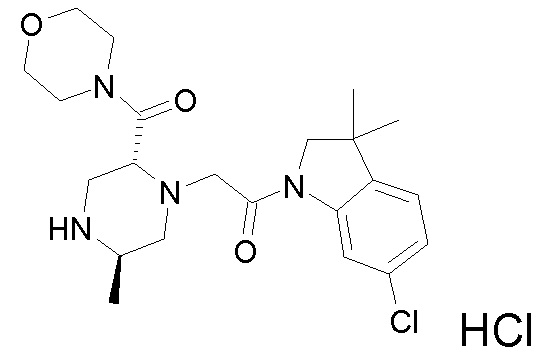
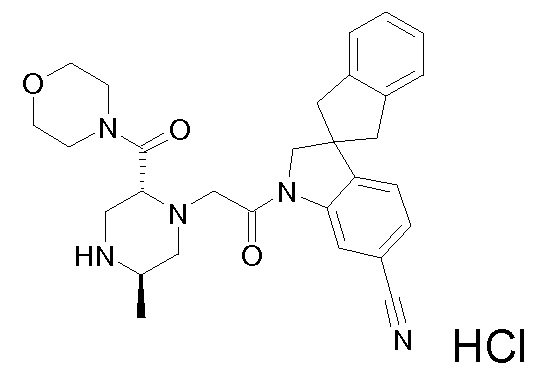
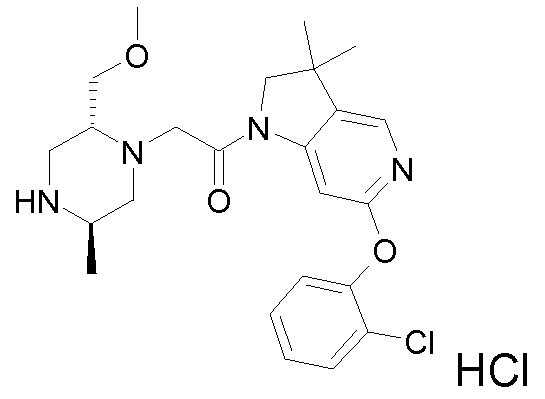
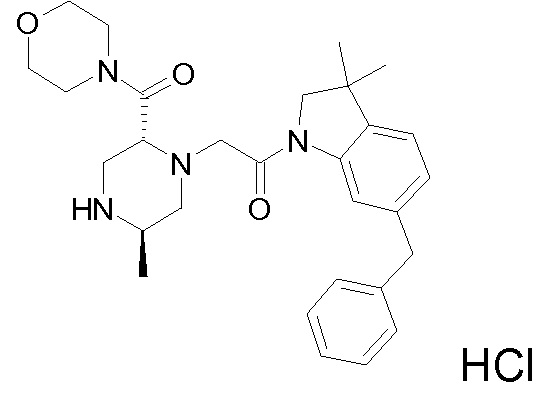
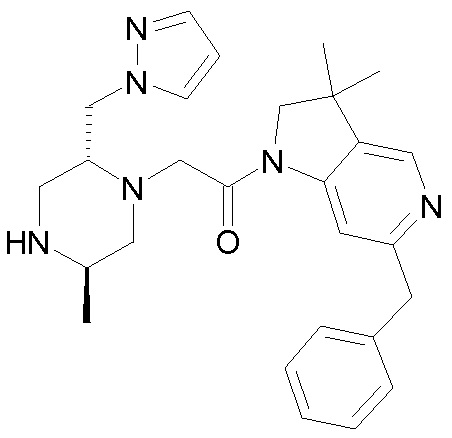
Пример 113: 1-{6-Бензил-3,3-диметил-1H,2H,3H-пирроло[3,2-c]пиридин-1-ил}-2-[3-(трифторметил)пиперазин-1-ил]этан-1-он
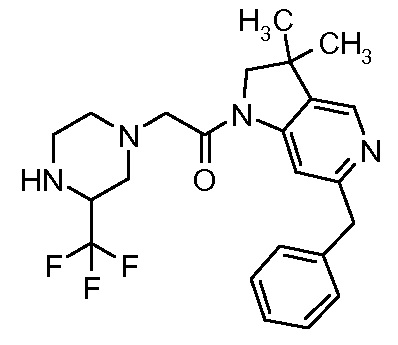
Раствор бромацетилхлорида (0,535 г, 3,4 ммоль) в DCM (5 мл) добавляли к двухфазной смеси 6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридина (0,467 г, 1,7 ммоль) гидрокарбоната натрия (1,43 г, 17 ммоль), DCM (20 мл) и воды (25 мл) при охлаждении льдом в течение 0,1 часа. Смесь перемешивали при ~0°C в течение 2 часов, затем органическую фазу отделяли и водную фазу экстрагировали при помощи DCM (25 мл). Объединенные органические фазы сушили (Na2SO4) и упаривали в вакууме, с получением масла, которое очищали хроматографией (SiO2, 20-50% EtOAc в петролейном эфире), с получением масла, которое отверждалось. Смесь этого вещества (0,081 г, 0,23 ммоль), 2-трифторметилпиперазина (0,039 г, 0,25 ммоль), карбоната калия (0,064 г, 0,46 ммоль) и ацетонитрила (2 мл) перемешивали при 20°C в течение 4 часов. Смесь распределяли между водой (30 мл) и DCM (3×20 мл) и объединенные экстракты сушили (Na2SO4) и упаривали в вакууме, с получением масла. Хроматография (SiO2, 0-20% MeOH в EtOAc), давала неочищенный продукт, и его подвергали дополнительной очистке при помощи хроматографии (SiO2, 0-5% MeOH в EtOAc), затем препаративной ВЭЖХ (щелочной способ), с получением указанного в заголовке соединения (0,005 г). 1H-ЯМР (Me-d3-OD): 8,24 (1H, с), 7,94 (1H, с), 7,34-7,23 (4H, м), 7,23-7,16 (1H, м), 4,11 (2H, с), 4,03-3,92 (2H, м), 3,45 (3H, с), 3,08 (1H, д), 3,04-2,81 (3H, м), 2,32 (2H, кв.), 1,42 (6H, с). МС: [M+H]+=433.
Пример 114: 1-{6-Бензил-3,3-диметил-1H,2H,3H-пирроло[3,2-c]пиридин-1-ил}-2-[3-(фторметил)пиперазин-1-ил]этан-1-он
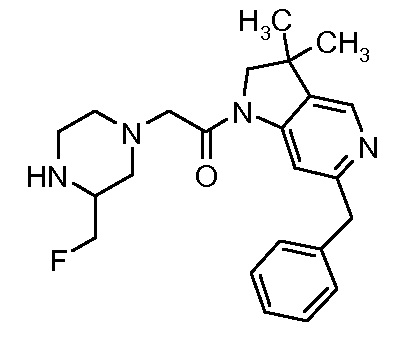
Получали способом, аналогичным описанному в Получении 203, с использованием 6-бензил-3,3-диметил-2,3-дигидропирроло[3,2-c]пиридина, хлорацетилхлорида и 2-фторметилпиперазина в форме диацетатной соли. Продукт очищали препаративной ВЭЖХ (щелочной способ), с получением указанного в заголовке соединения (0,05 г). 1H-ЯМР (Me-d3-OD): 8,24 (1H, с), 7,93 (1H, с), 7,36-7,14 (5H, м), 4,53-4,39 (1H, м), 4,39-4,26 (1H, м), 4,10 (2H, с), 4,05-3,66 (3H, м), 3,52-3,37 (2H, м), 3,25-2,76 (5H, м), 2,31 (1H, д), 2,25-2,08 (1H, м), 1,42 (6H, с). МС: [M+H]+=397.
Пример 115: 1-{6-Бензил-3,3-диметил-1H,2H,3H-пирроло[3,2-c]пиридин-1-ил}-2-[(3S)-3-(фторметил)пиперазин-1-ил]этан-1-он
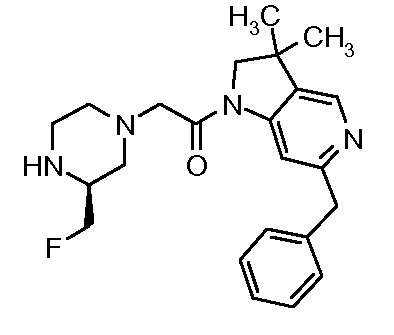
Получали путем хирального препаративного ВЭЖХ разделения Примера 114: LUX целлюлоза 2 (Phenomenex), 5 u, 250×21,2 мм, с использованием для элюирования смеси гептан - этанол 80:20, более быстро элюирующий изомер. 1H-ЯМР (Me-d3-OD): 8,24 (1H, с), 7,93 (1H, с), 7,34-7,15 (5H, м), 4,50-4,38 (1H, м), 4,38-4,25 (1H, м), 4,10 (2H, с), 3,99 (2H, с), 3,40-3,35 (2H, м), 3,11 (1H, д), 3,03-2,77 (4H, м), 2,28 (1H, т), 2,17-2,04 (1H, м), 1,42 (6H, с). МС: [M+H]+=397.
Пример 116: 1-{6-Бензил-3,3-диметил-1H,2H,3H-пирроло[3,2-c]пиридин-1-ил}-2-[(3R)-3-(фторметил)пиперазин-1-ил]этан-1-он
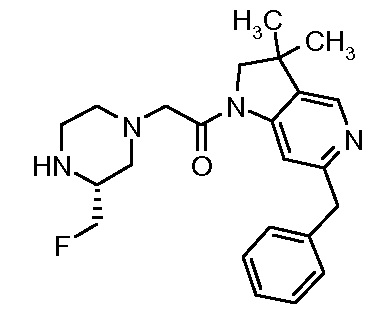
Получали путем хирального препаративного ВЭЖХ разделения Примера 113: LUX целлюлоза 2 (Phenomenex), 5 u, 250×21,2 мм, с использованием для элюирования смеси гептан - этанол 80:20, более медленно элюирующий изомер. 1H-ЯМР (Me-d3-OD): 8,24 (1H, с), 7,94 (1H, с), 7,39-7,15 (5H, м), 4,50-4,37 (1H, м), 4,37-4,24 (1H, м), 4,10 (2H, с), 3,99 (2H, с), 3,37 (2H, с), 3,12 (1H, с), 3,05-2,73 (4H, м), 2,35-2,21 (1H, м), 2,10 (1H, т), 1,42 (6H, с). МС: [M+H]+=397.
ПРИМЕРЫ 117-256
Следуя способам, подобным и/или аналогичным тем, которые описаны выше, соединения, описанные в Таблице 9, были получены из соответствующих N-Boc-защищенных производных, при этом любые существенные изменения указаны ниже, кроме тех случаев, когда указано иное. Указанные в заголовке соединения либо выделяли непосредственно в форме свободного основания или подходящей соли без дополнительной очистки, либо очищали например, с использованием масс-направленной препаративной ВЭЖХ, кристаллизации или растирания в порошок.
Примечания: a см. Общие Процедуры получения соединений формулы (I), Способы 1-4 выше. b Условия хирального хроматографического разделения: Phenomenex LUX-Целлюлоза 2, 5 мкМ, 250×21,2 мм с использованием для элюирования смеси 70/30 гептан - EtOH. c Условия хирального хроматографического разделения: Phenomenex LUX- Целлюлоза 2, 5 мкМ, 250×21,2 мм с использованием для элюирования смеси 50/50 гептан - EtOH.
(Me-d3-OD)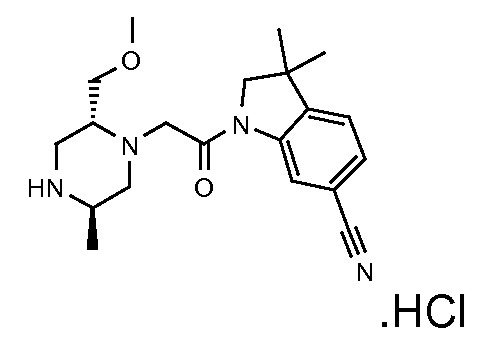
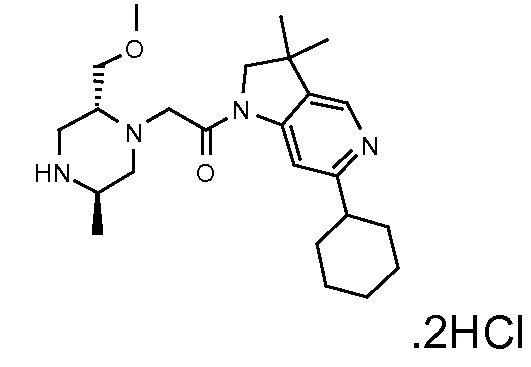
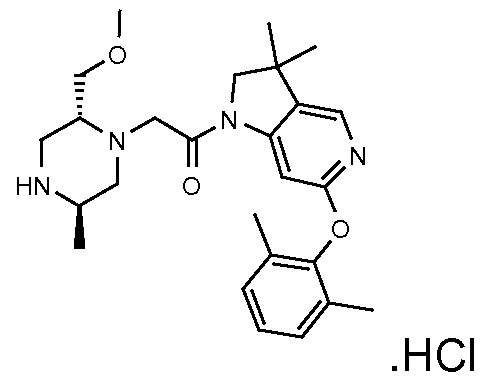
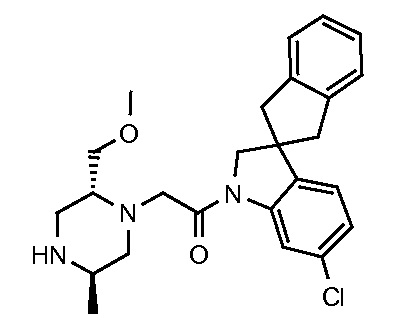
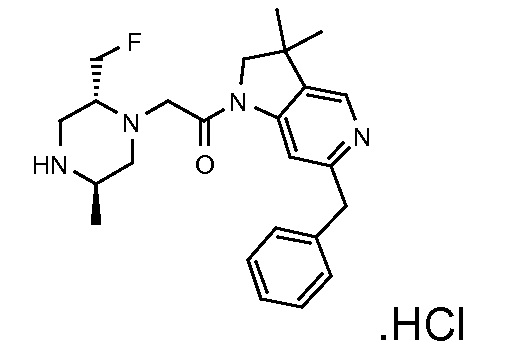
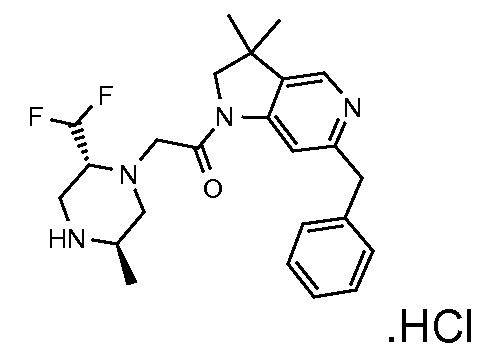
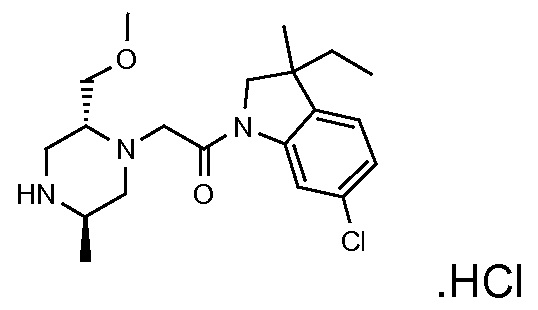
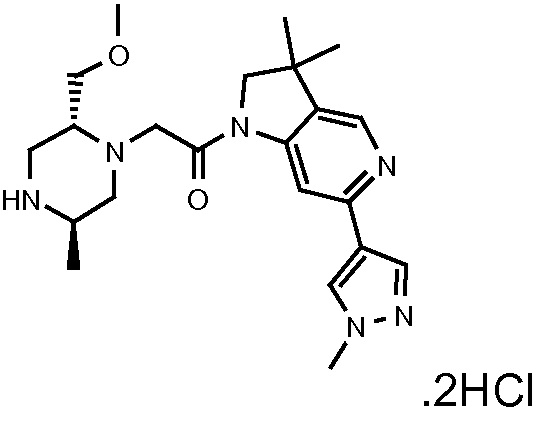
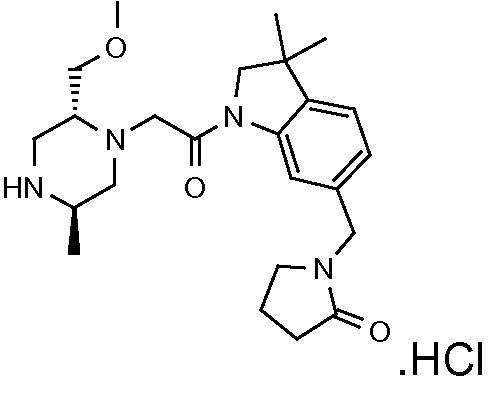
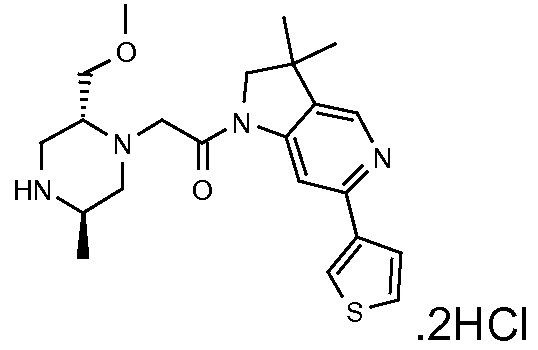
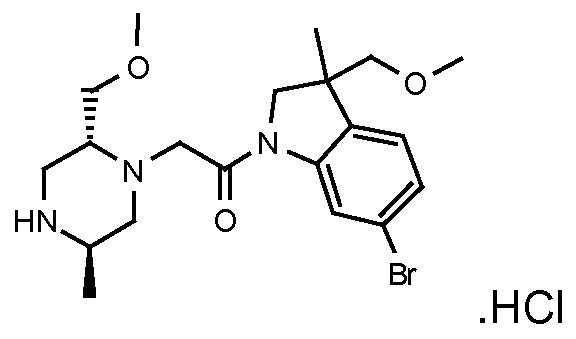
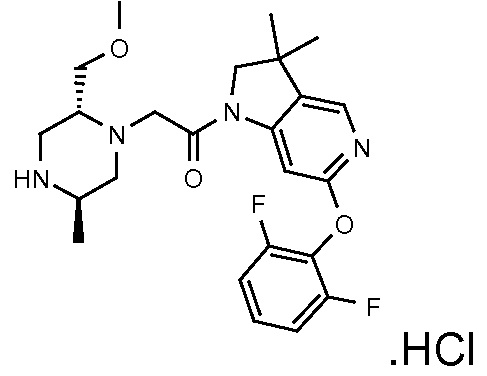
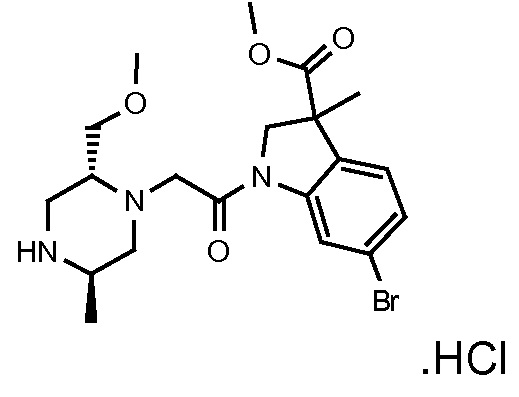
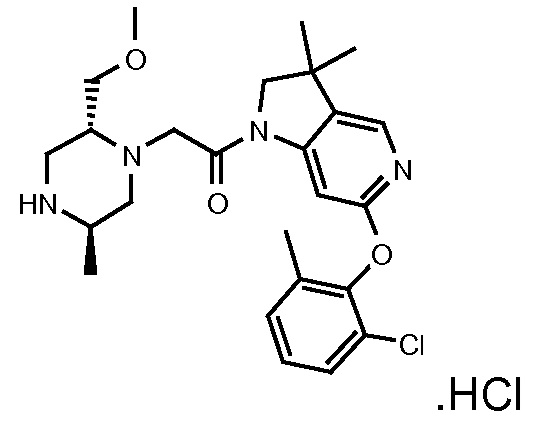
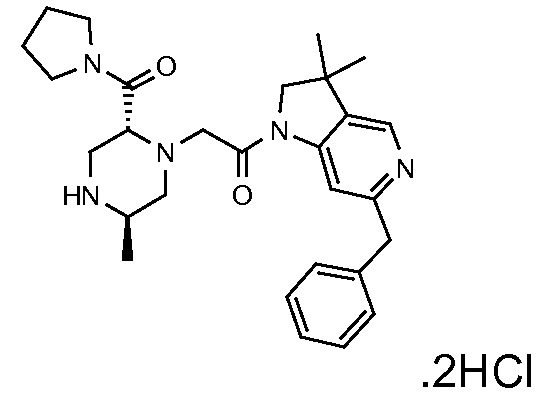
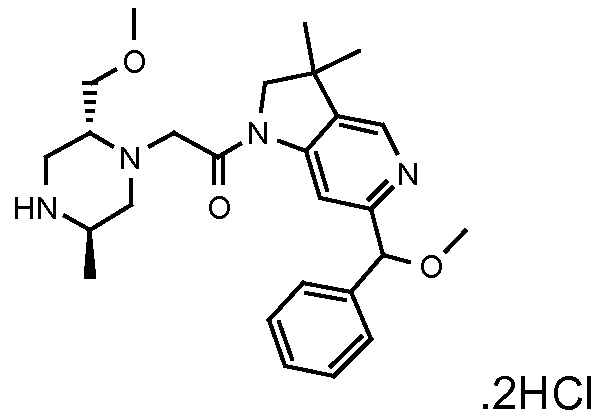
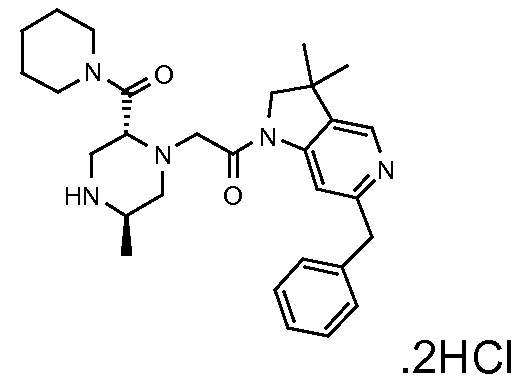
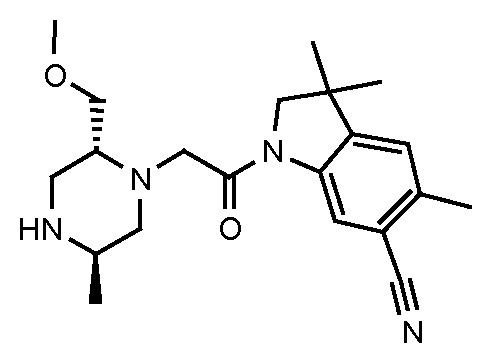
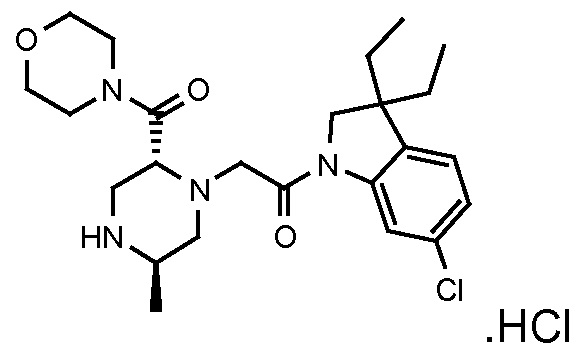
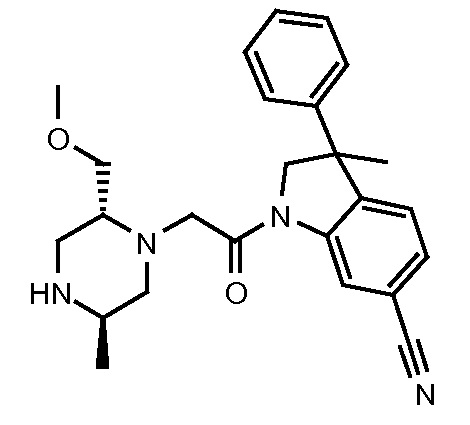
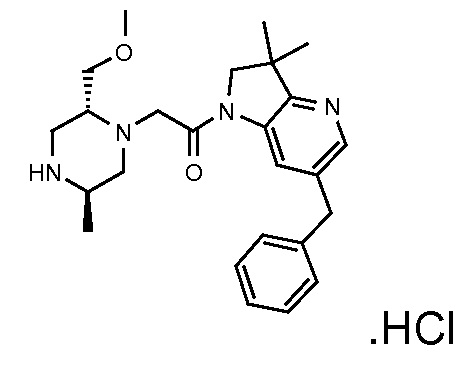
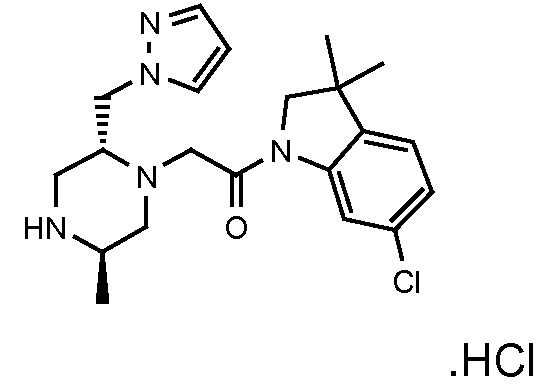
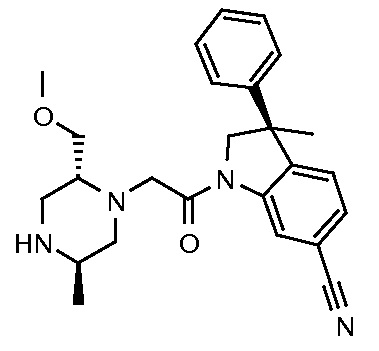
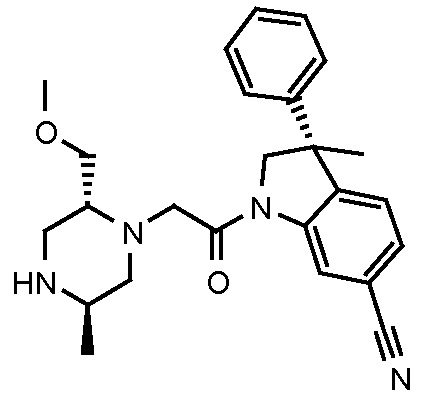
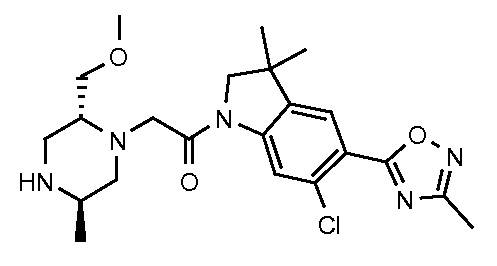
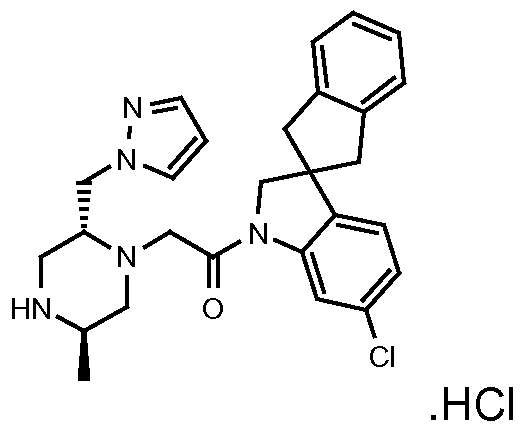
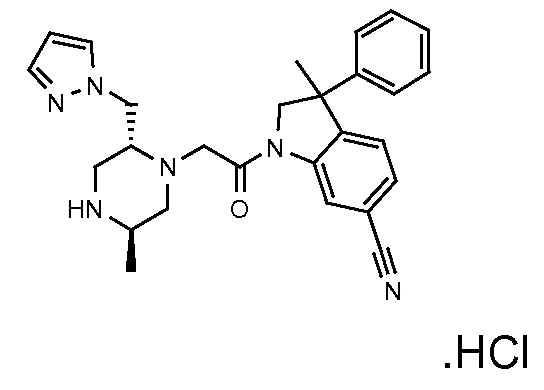
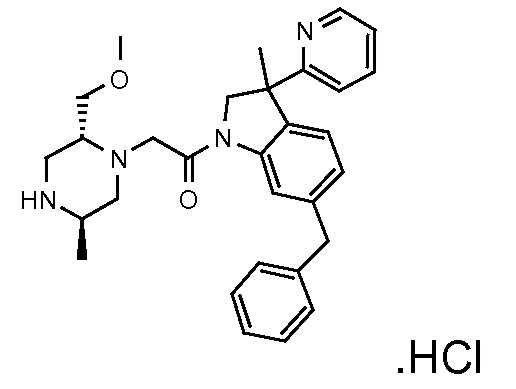
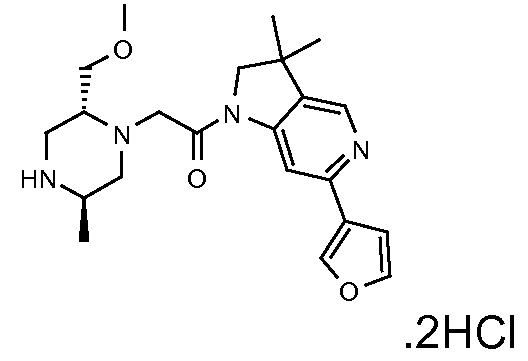
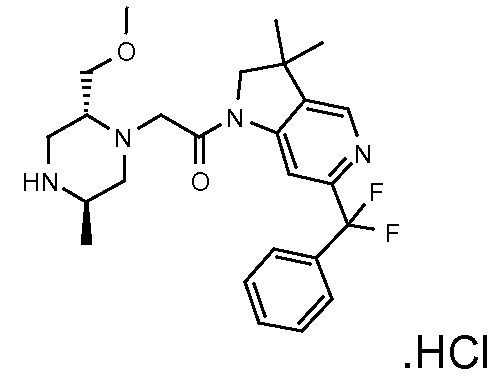
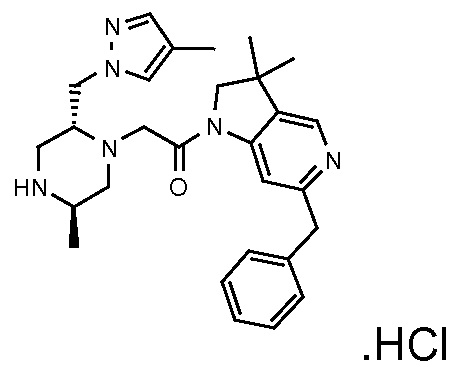
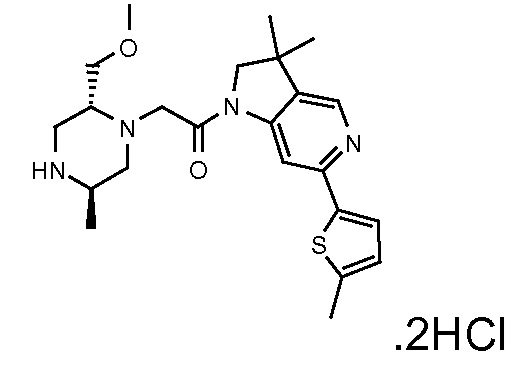
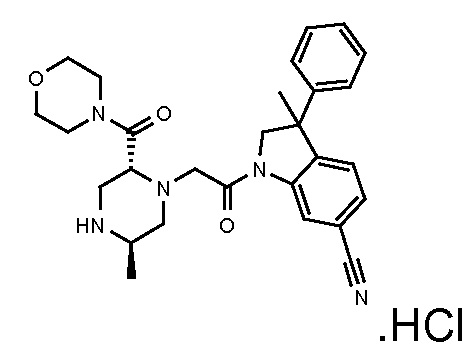
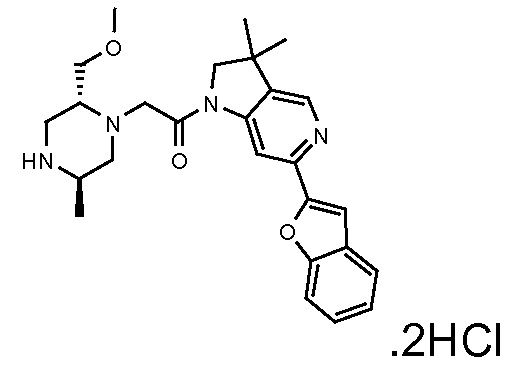
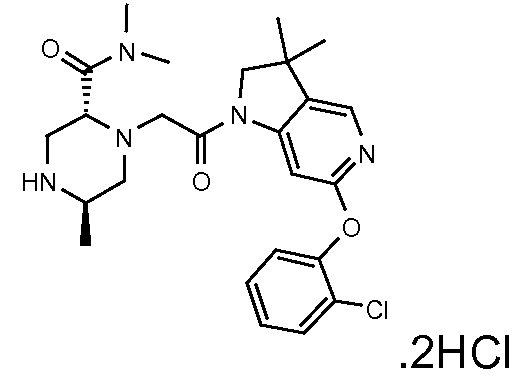
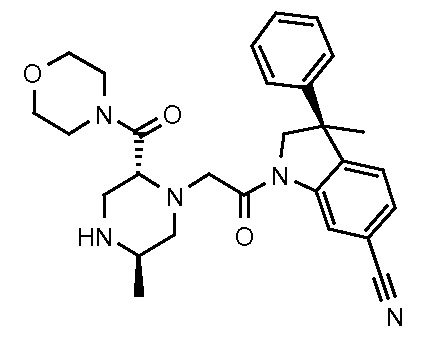
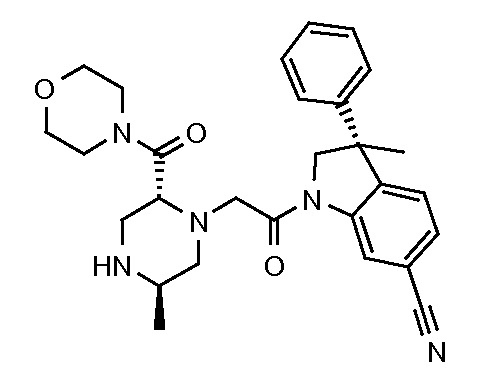
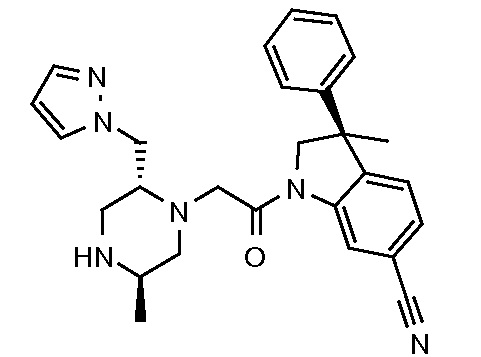
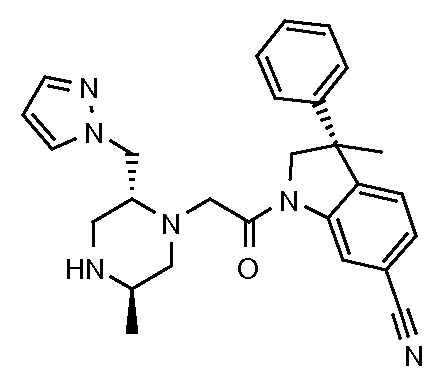
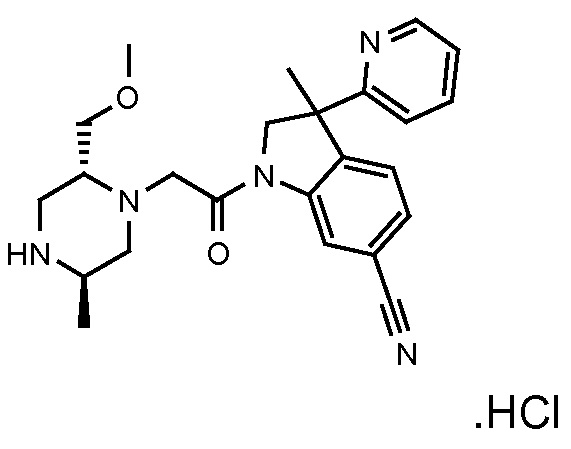
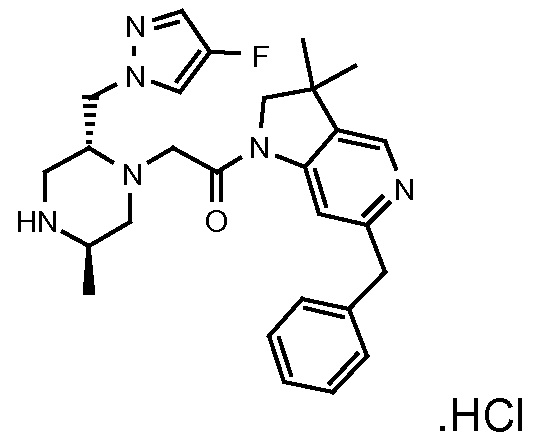
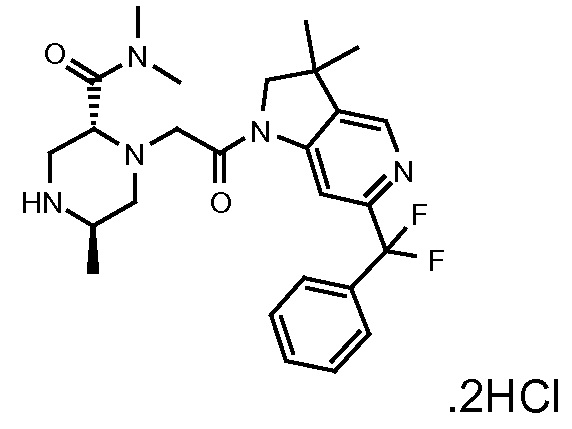
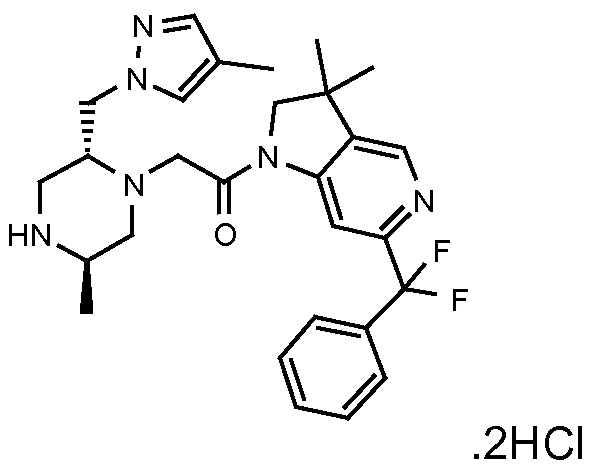
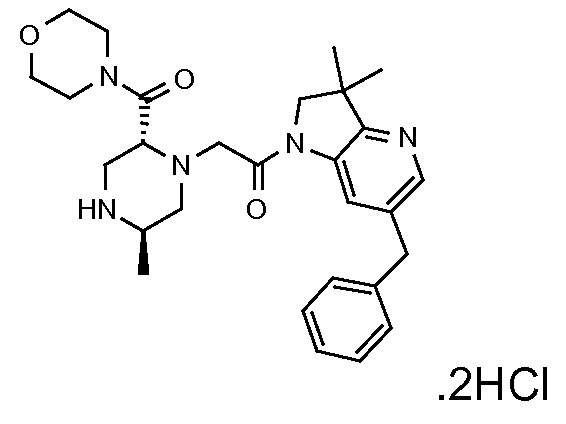
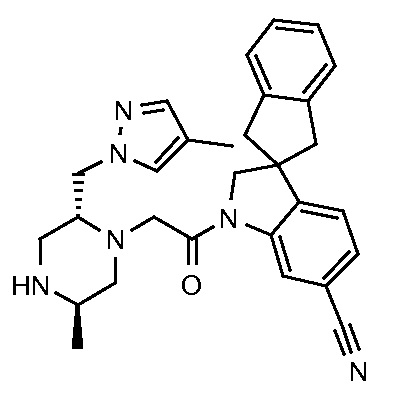
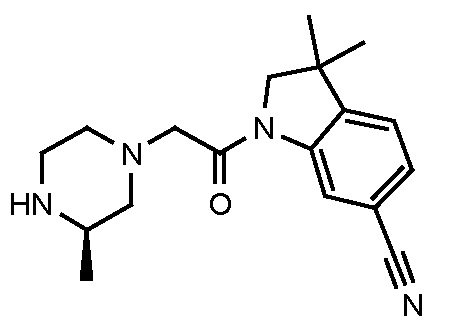
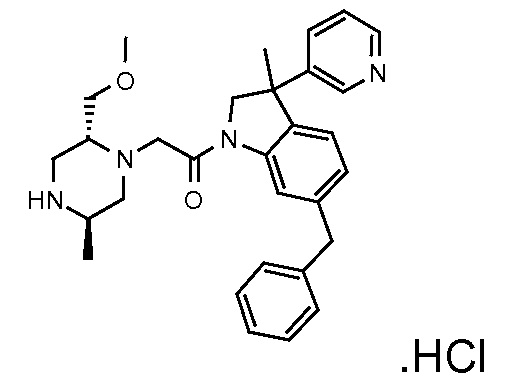
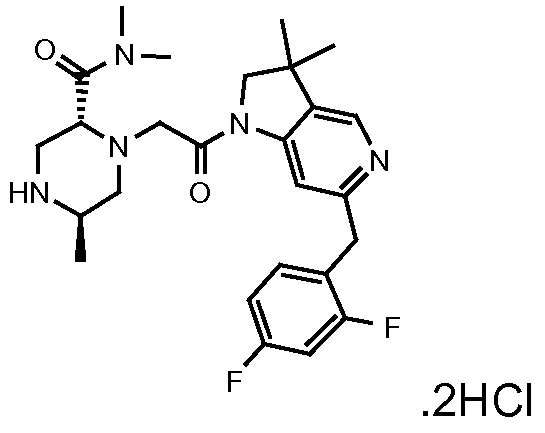
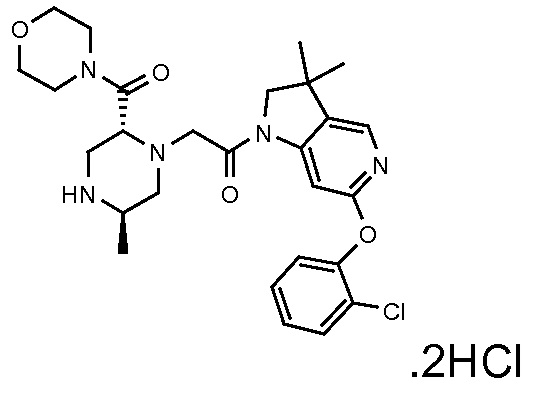
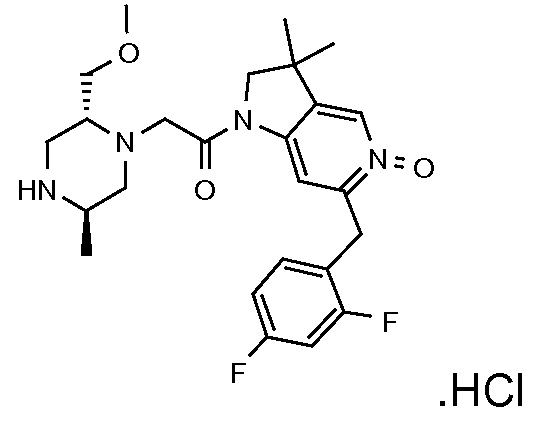
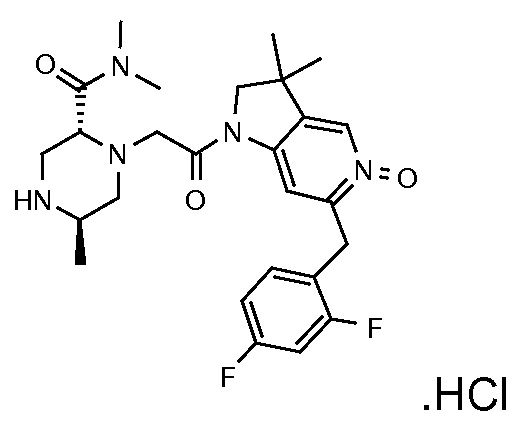
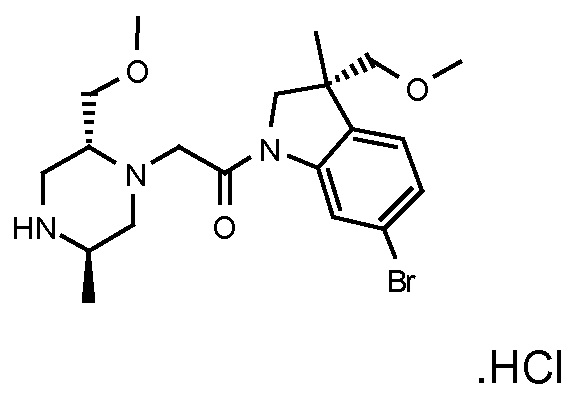
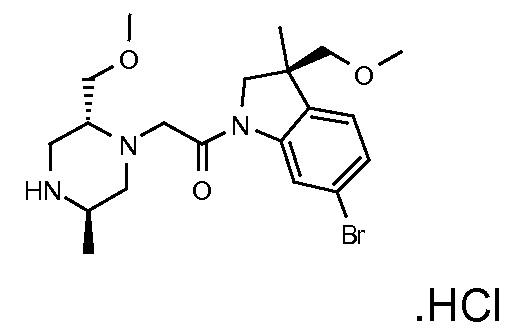
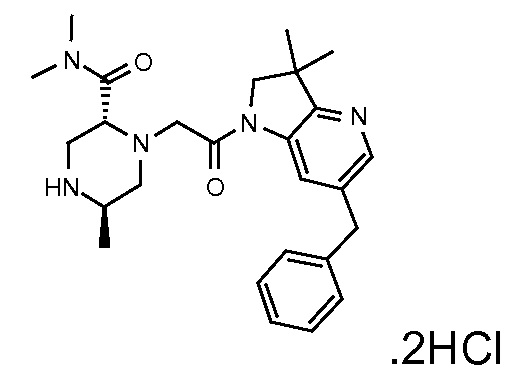
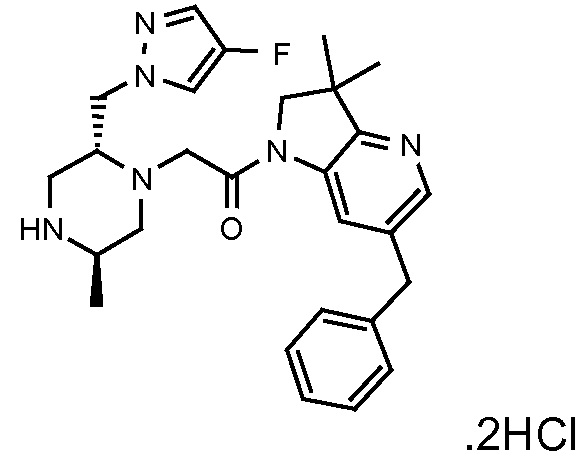
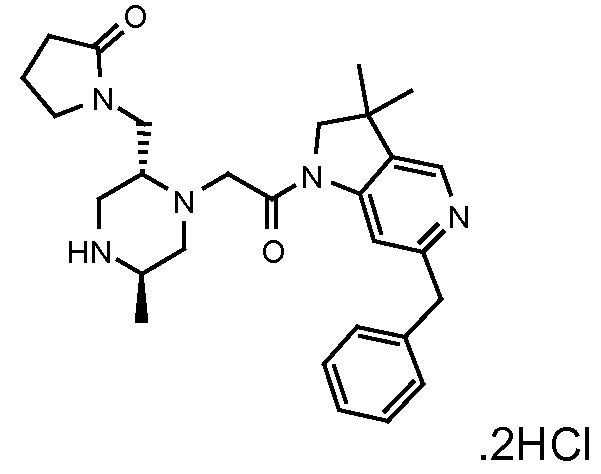
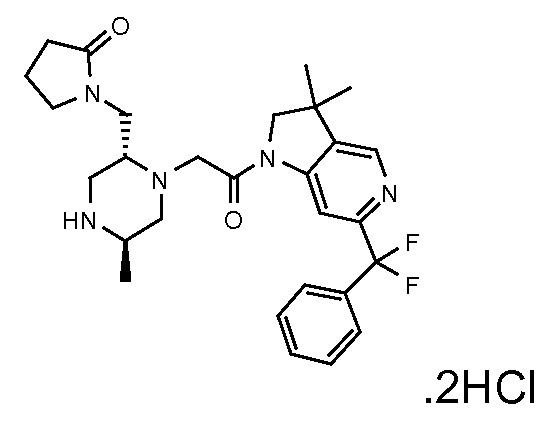
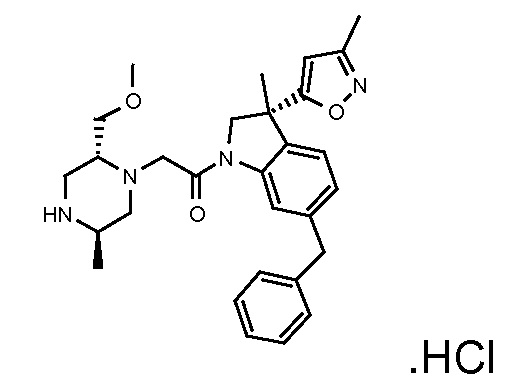
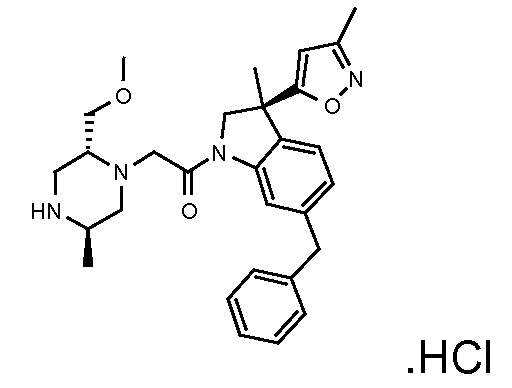
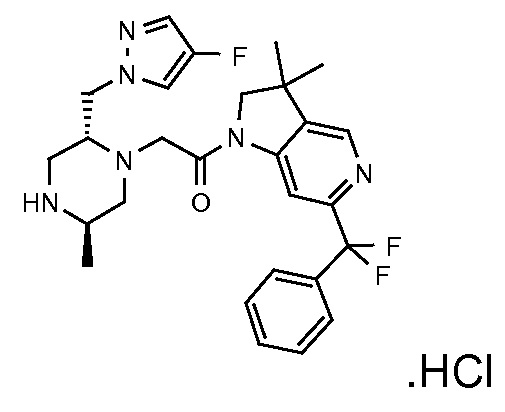
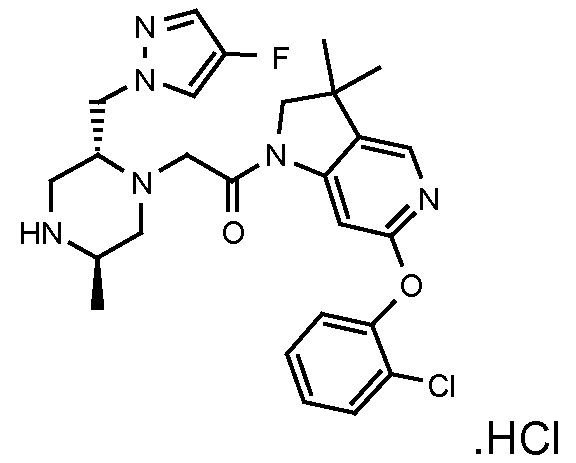
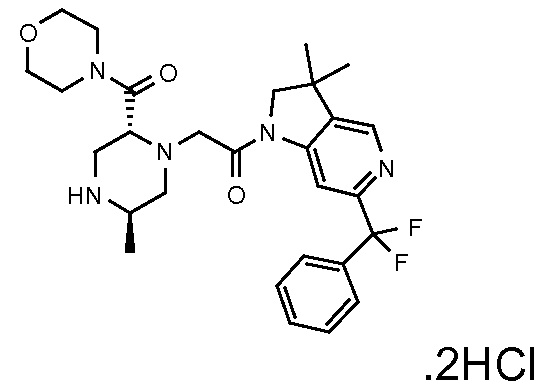
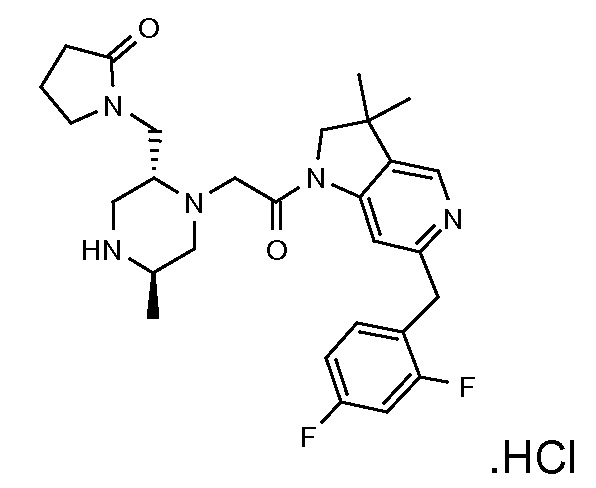
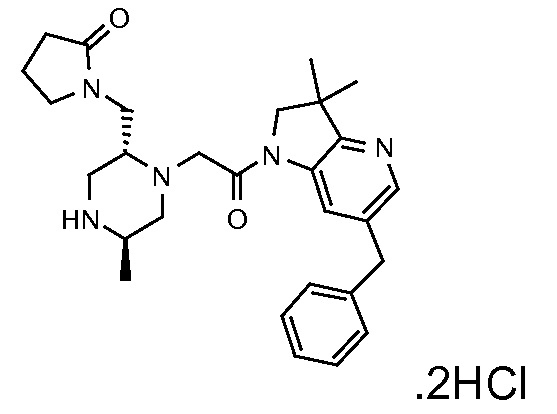
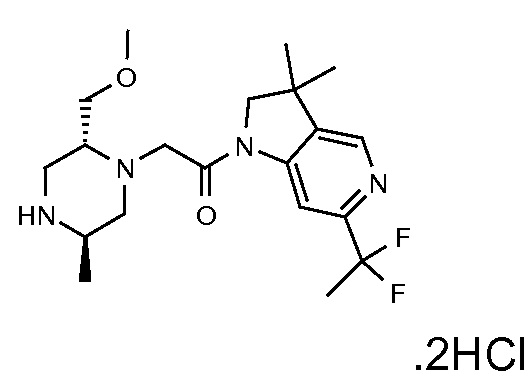
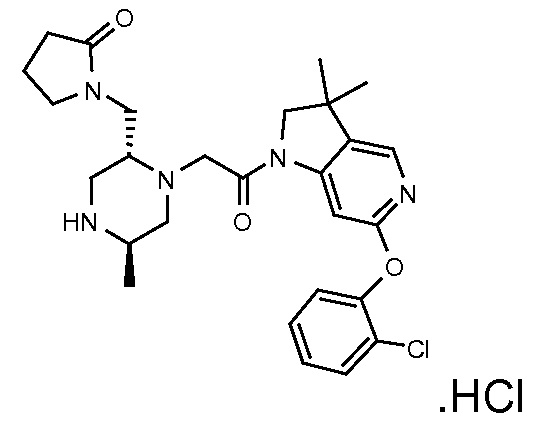
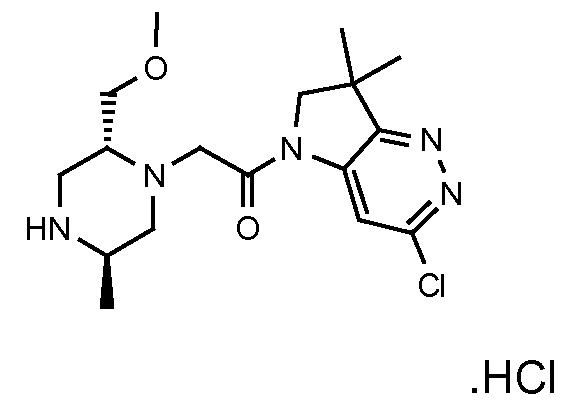
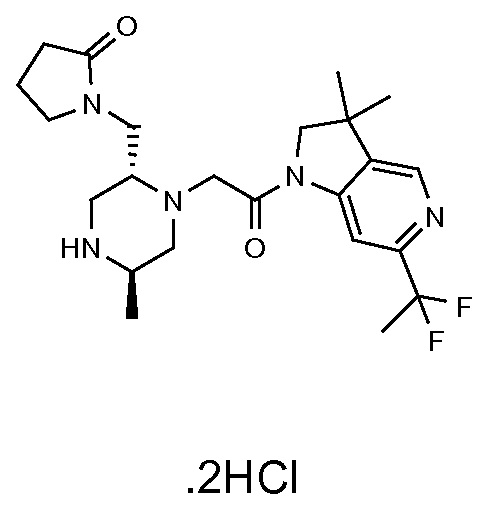
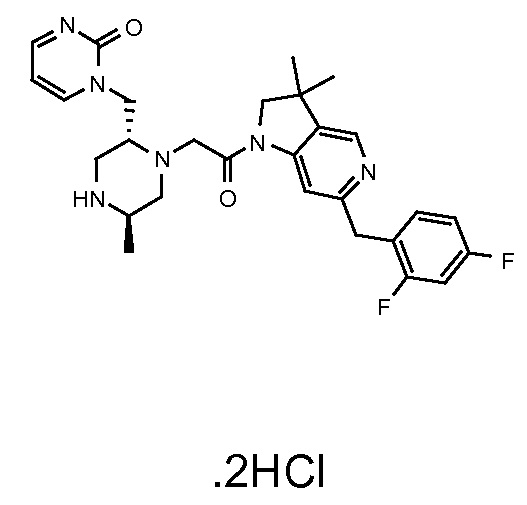
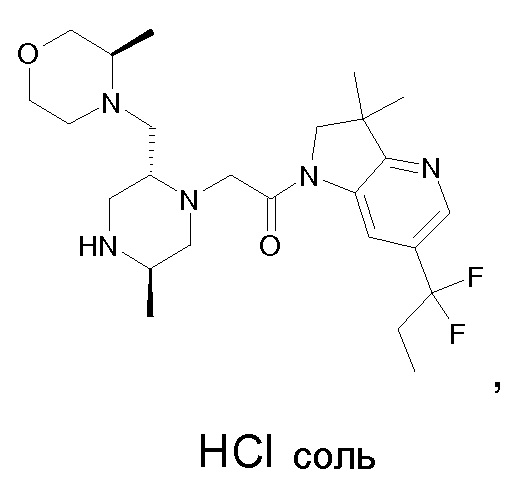
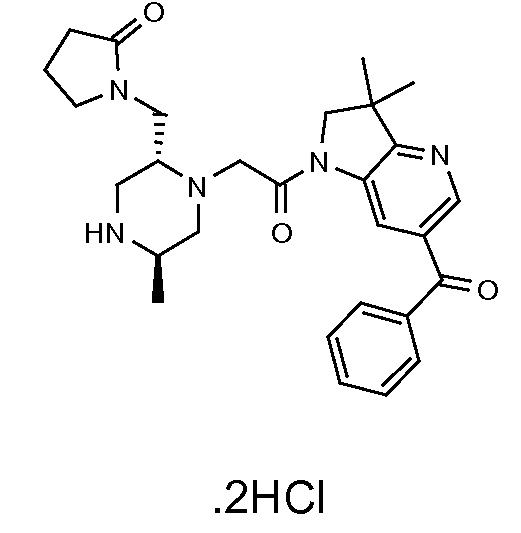
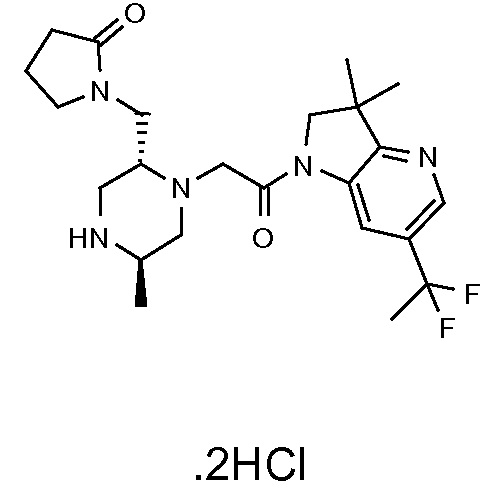
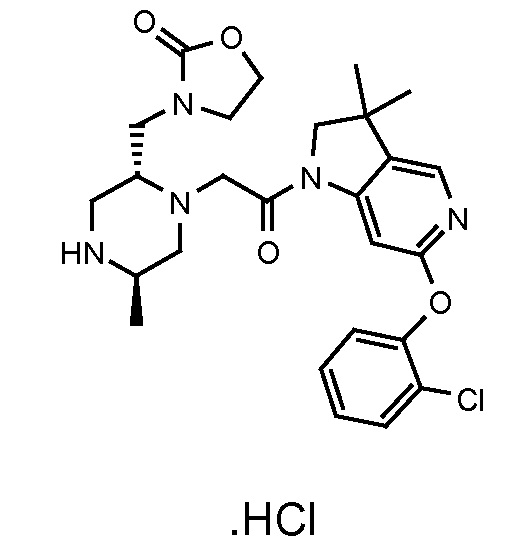
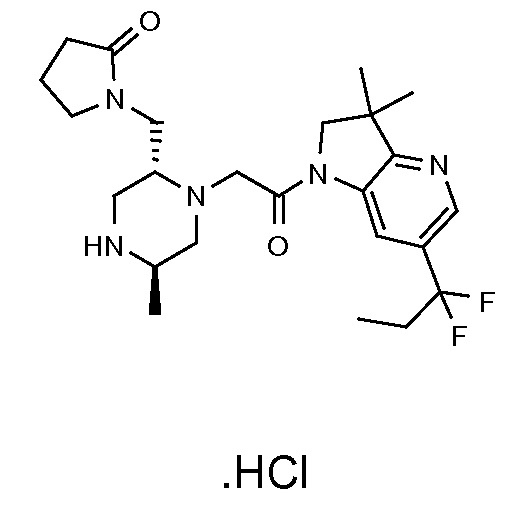
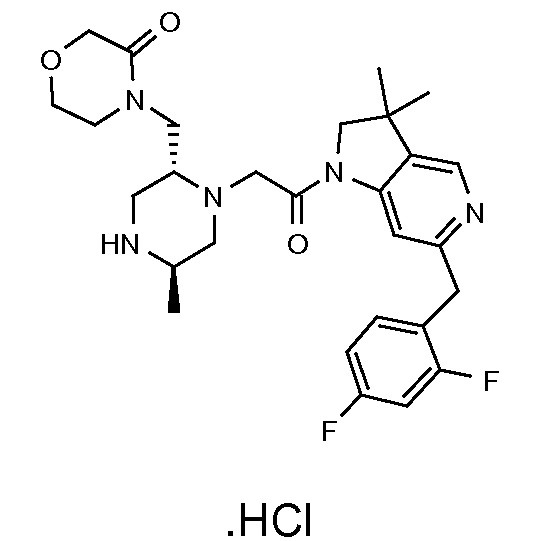
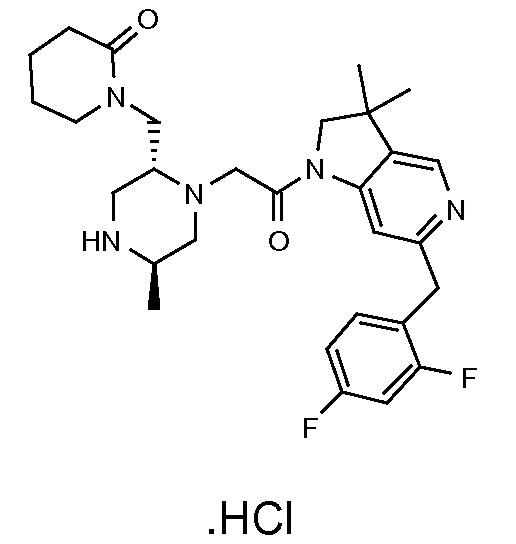
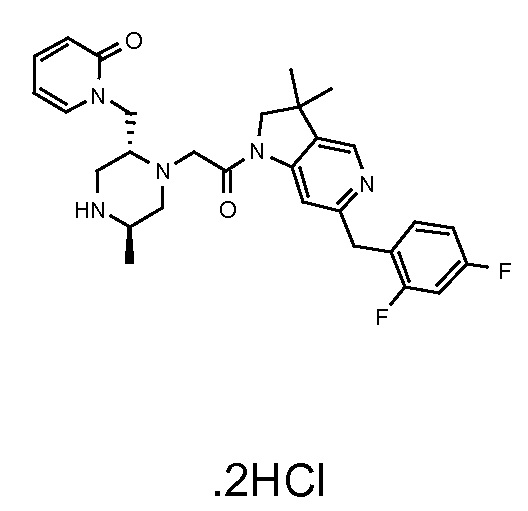
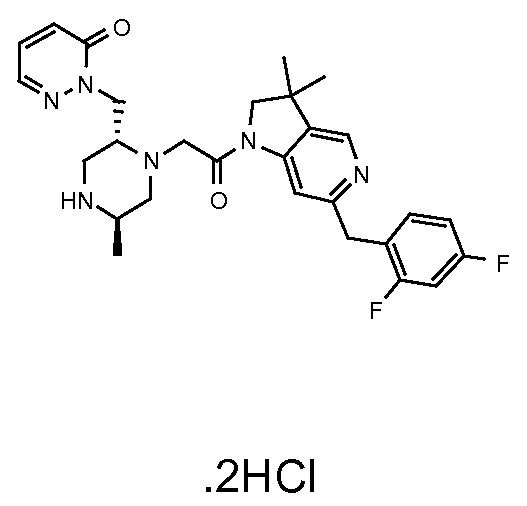
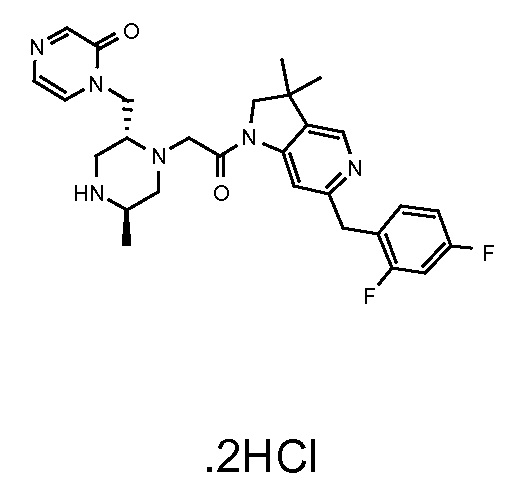
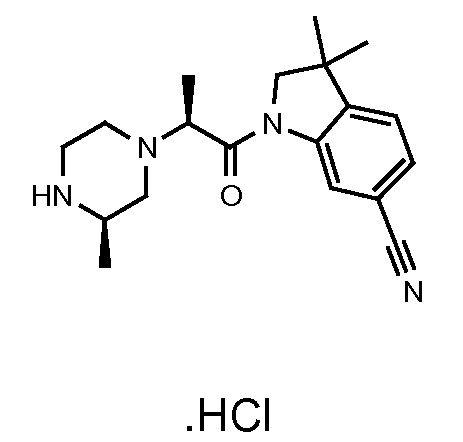
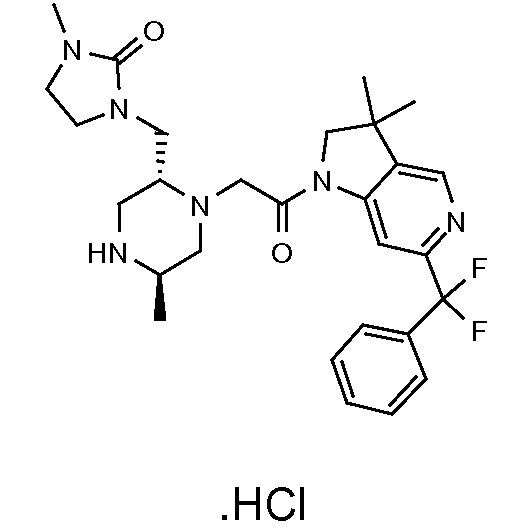
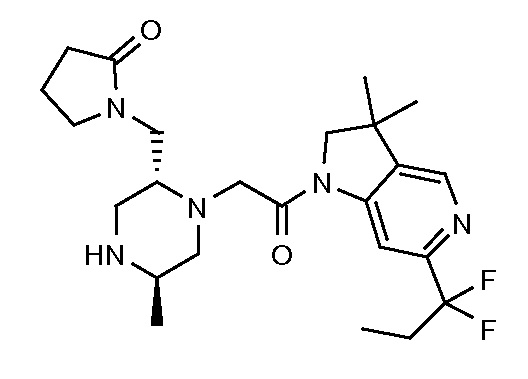
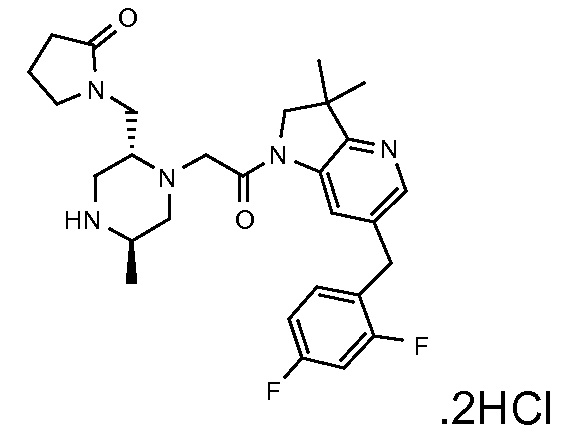
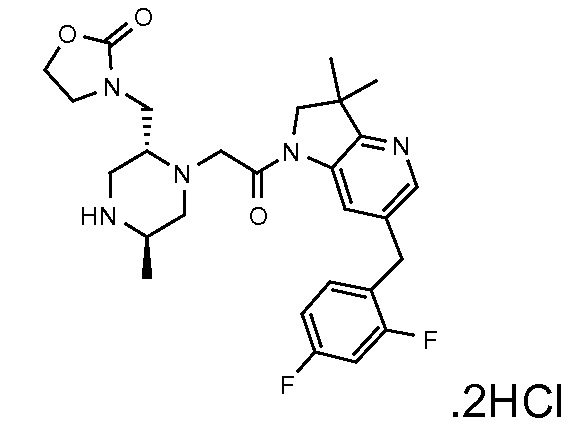
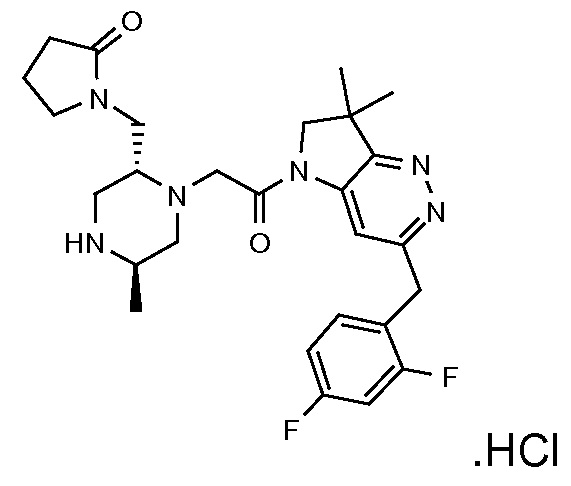
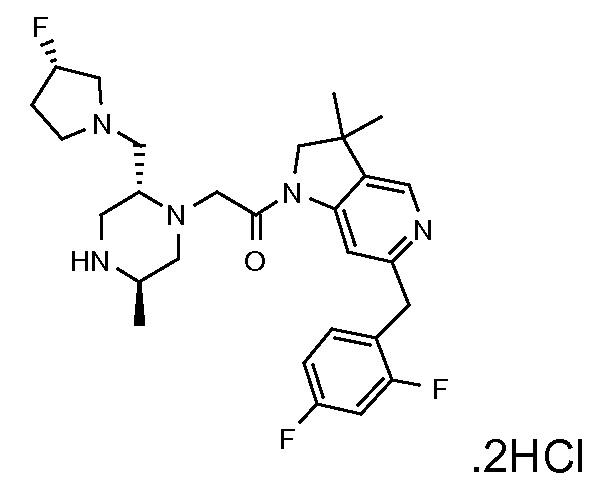
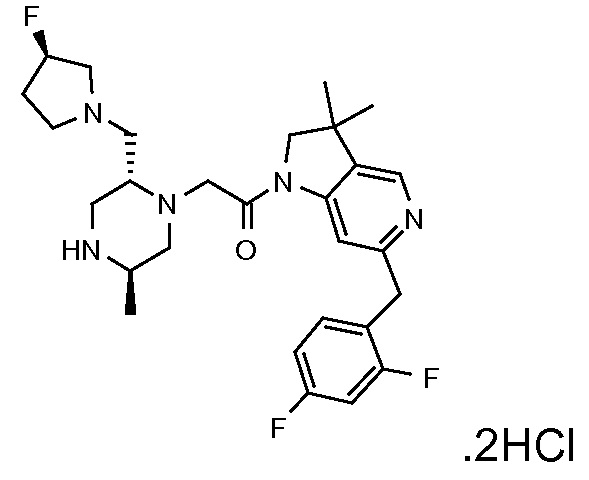
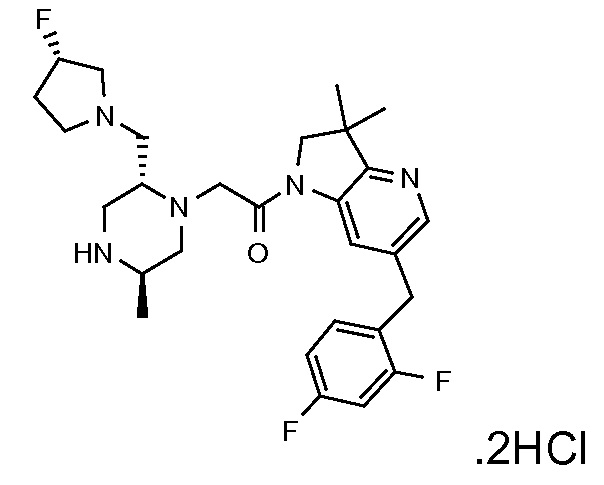
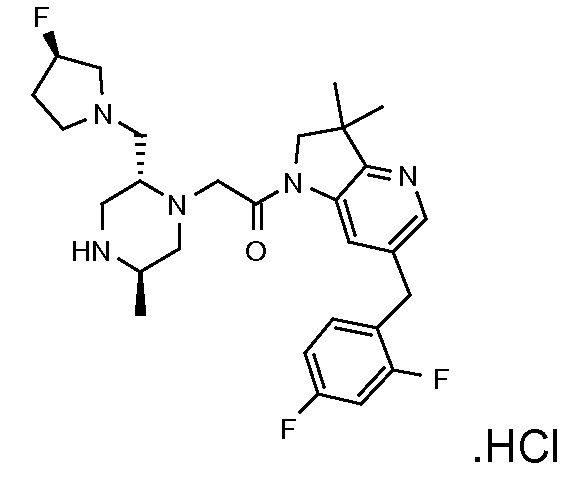
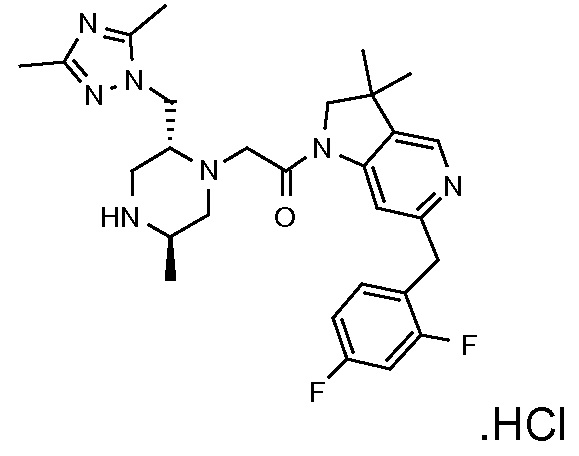
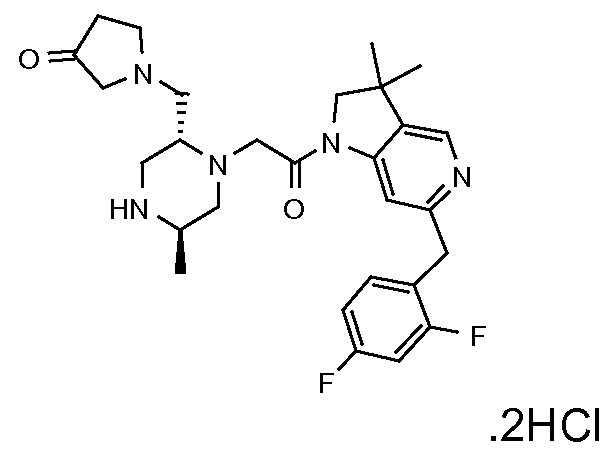
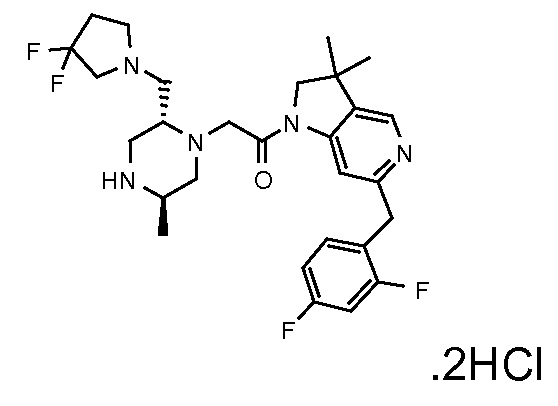
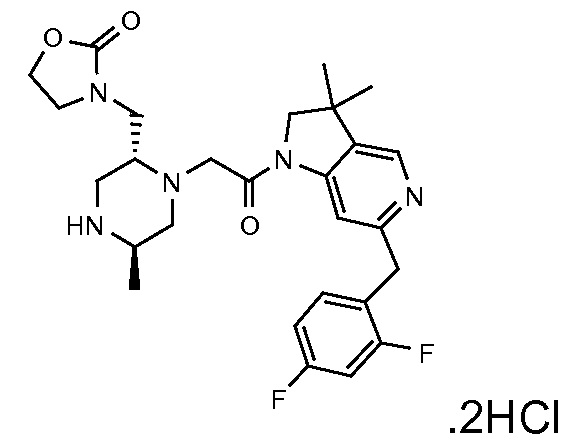
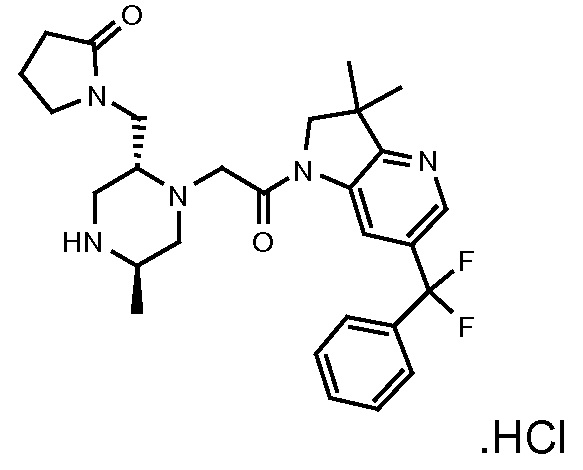
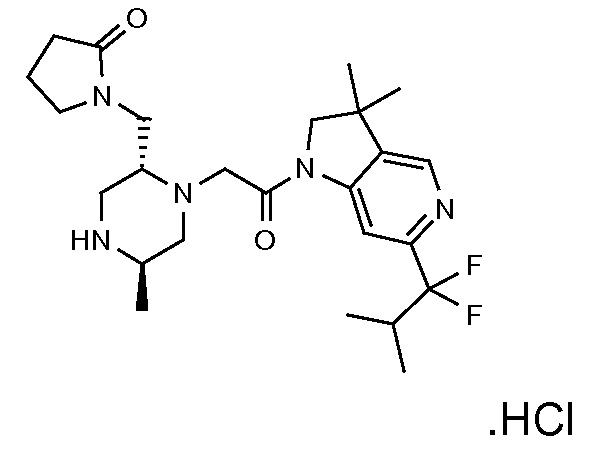
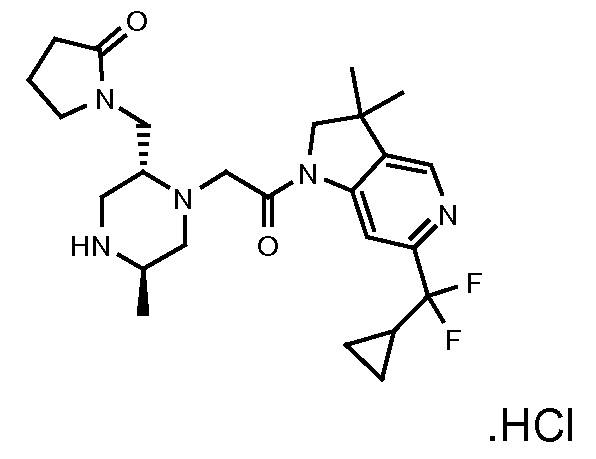
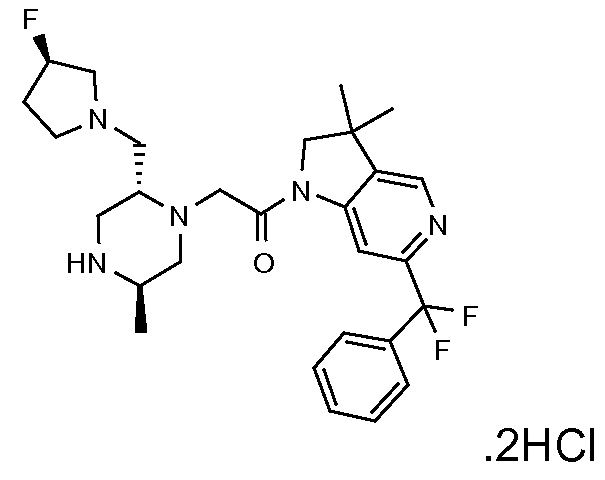
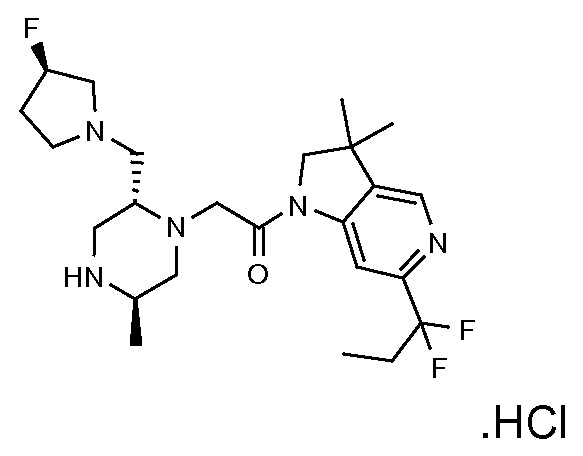
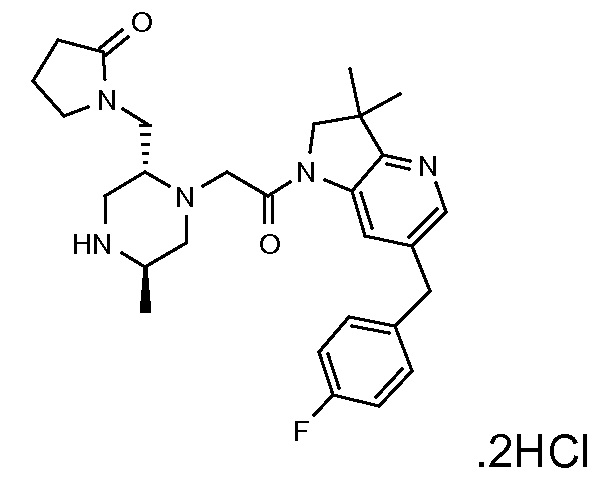
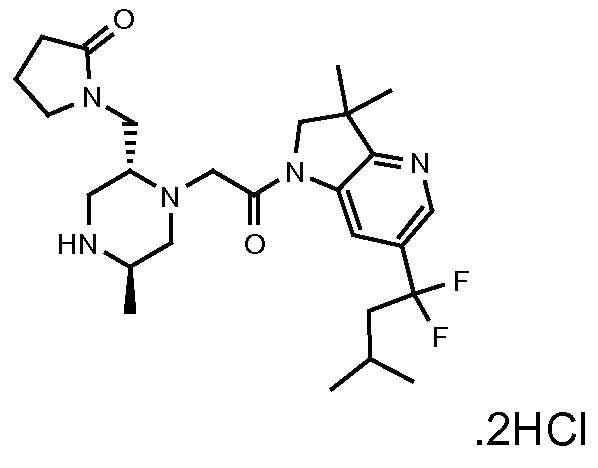
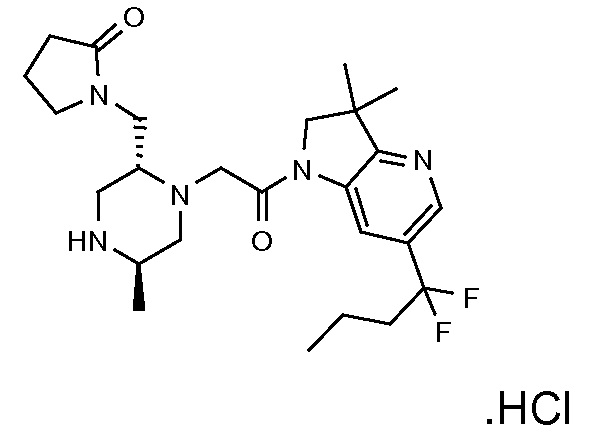
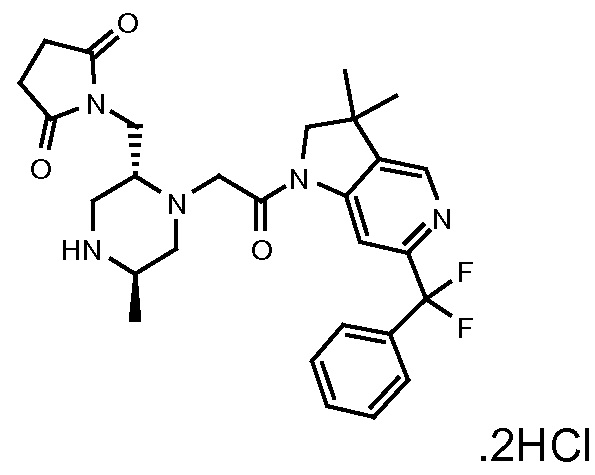
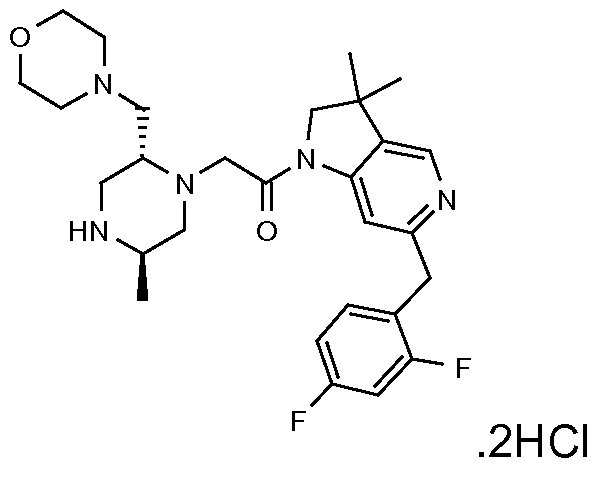
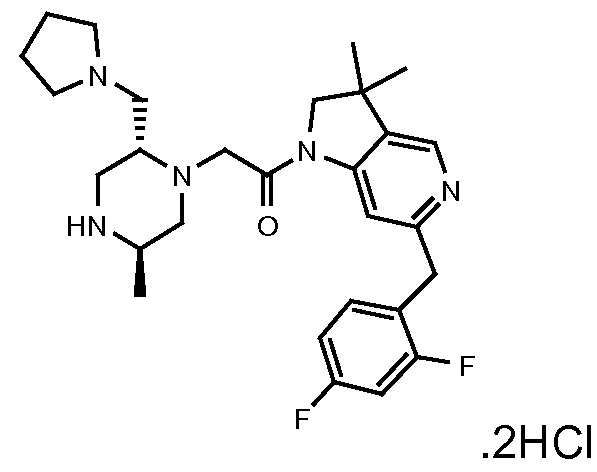
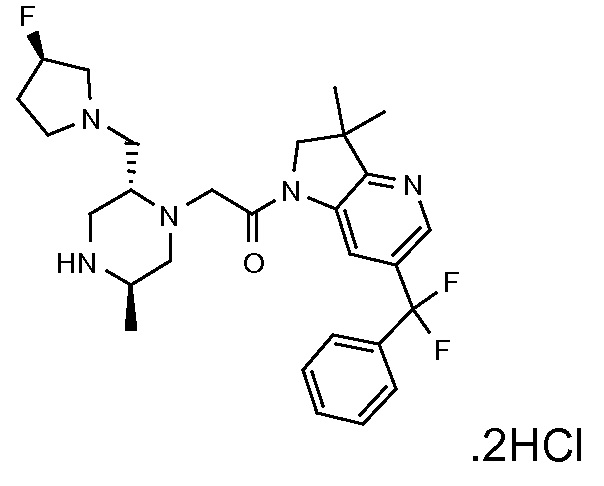
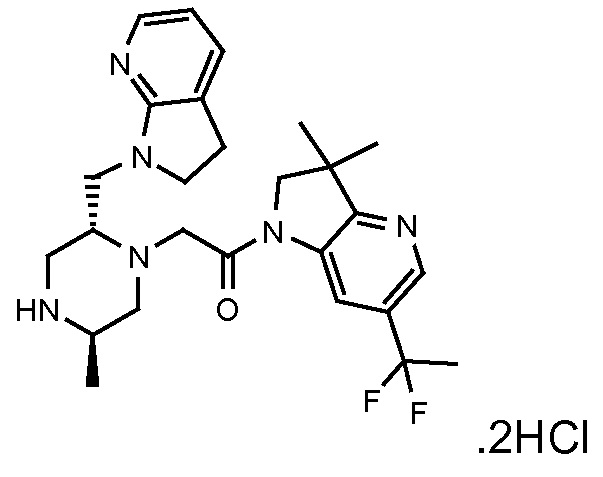
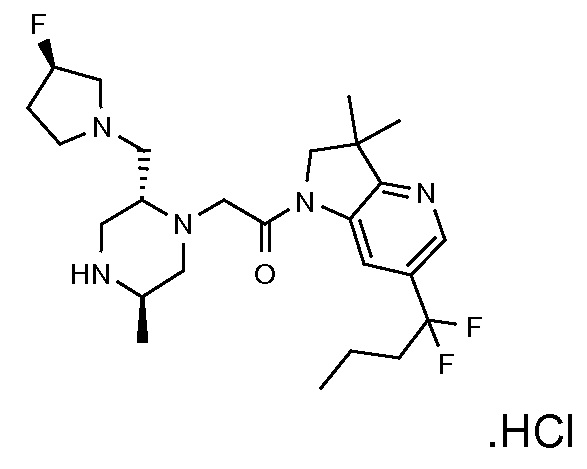
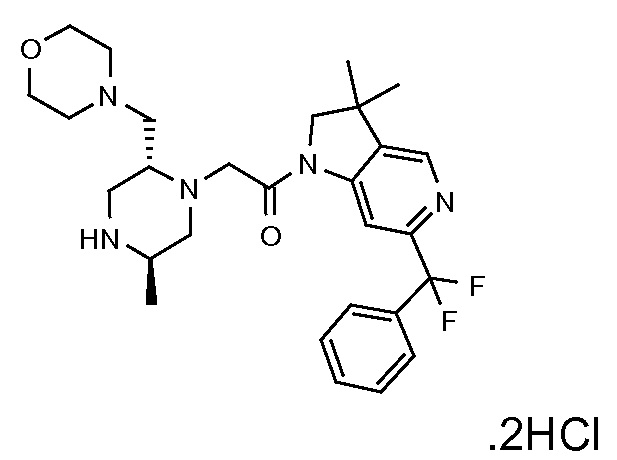
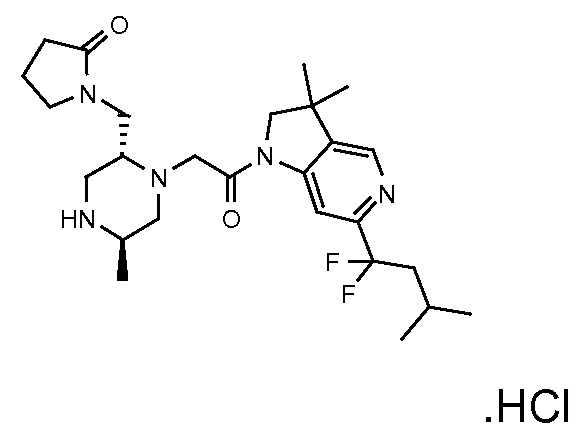
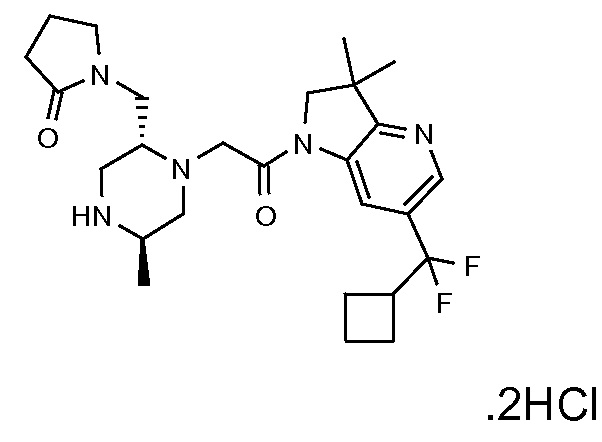
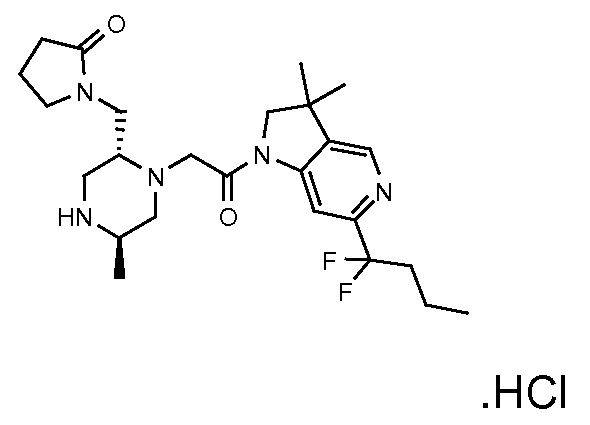
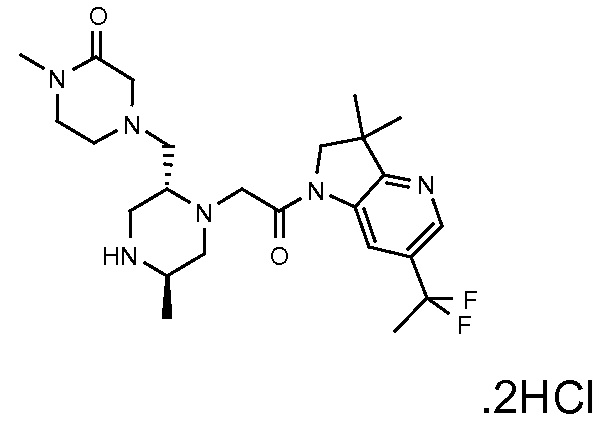
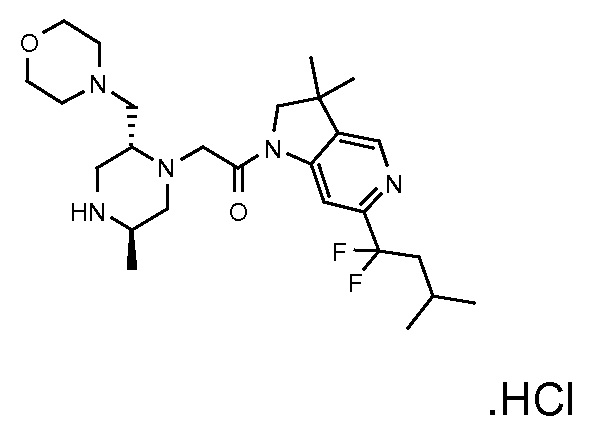
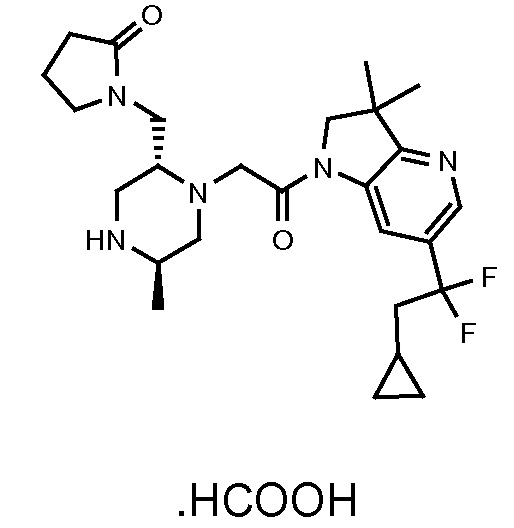
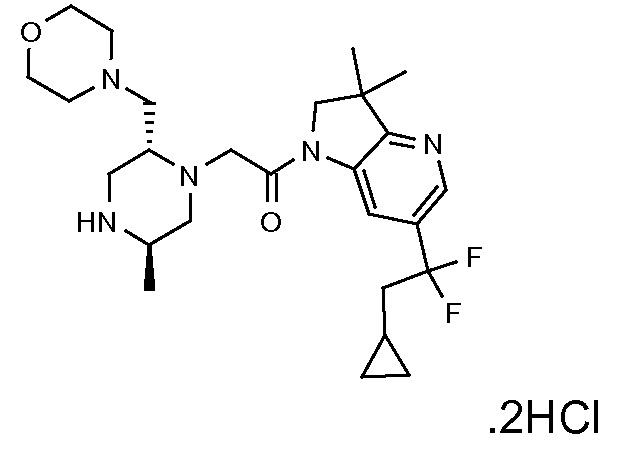
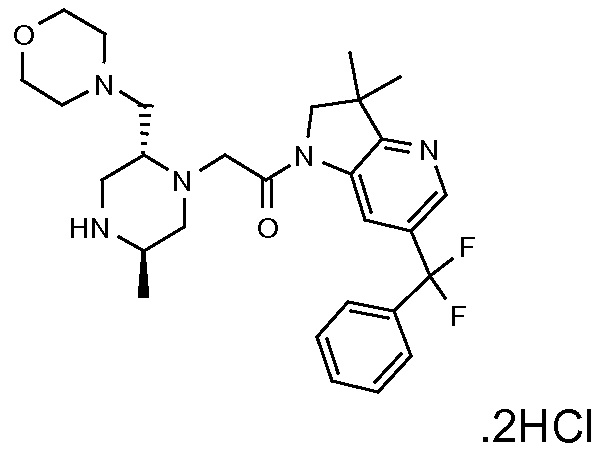
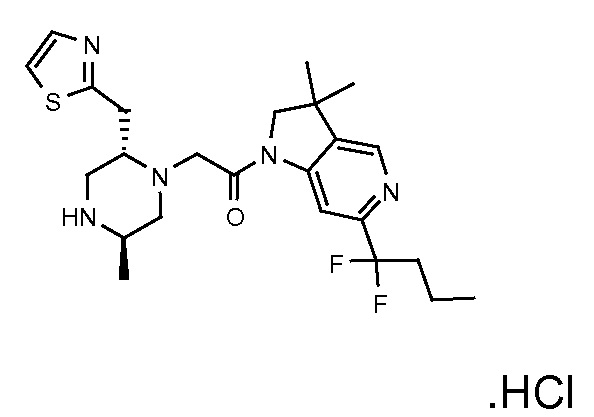
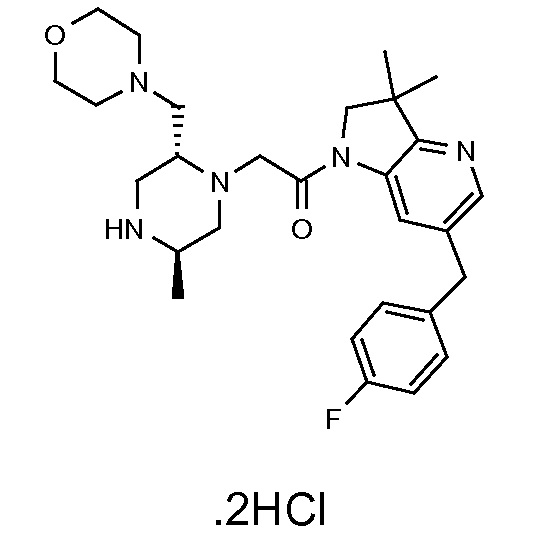
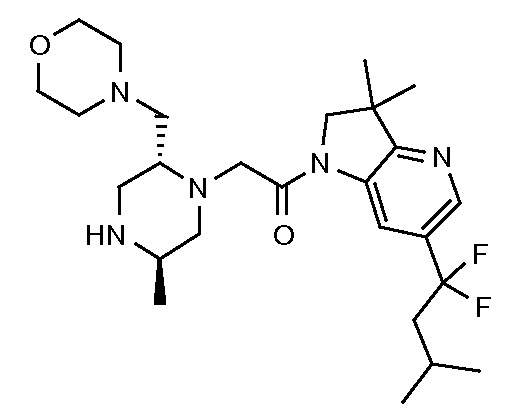
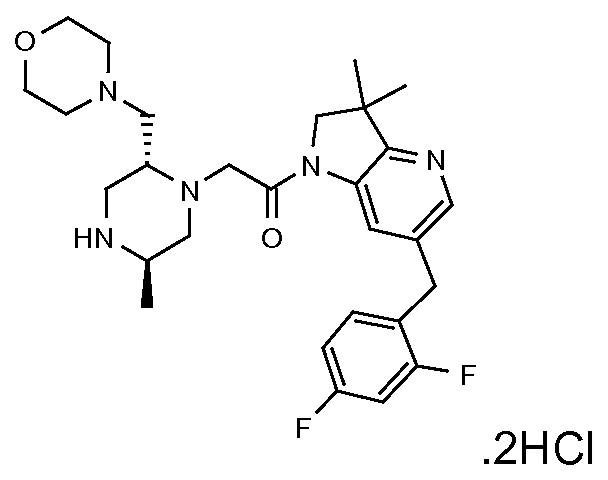
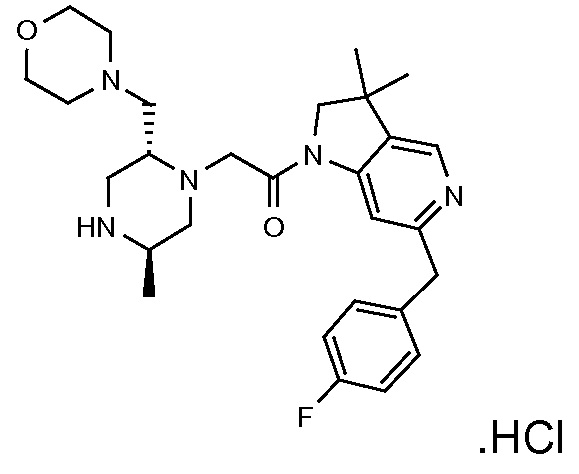
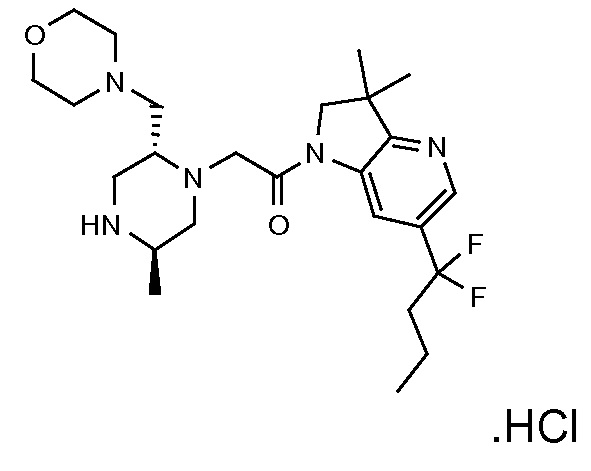
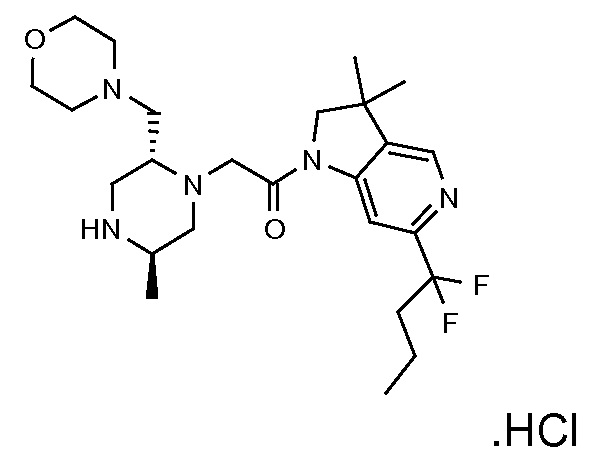
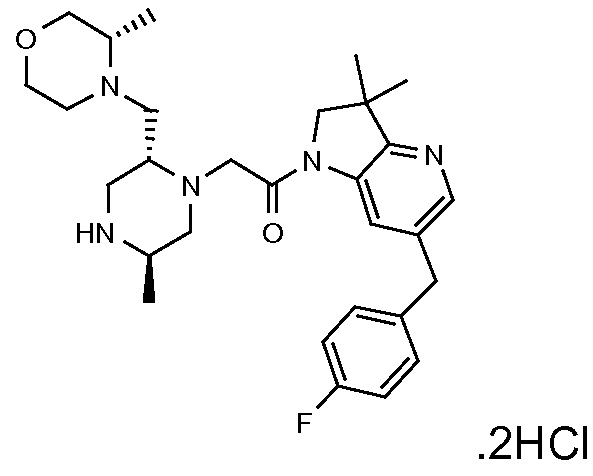
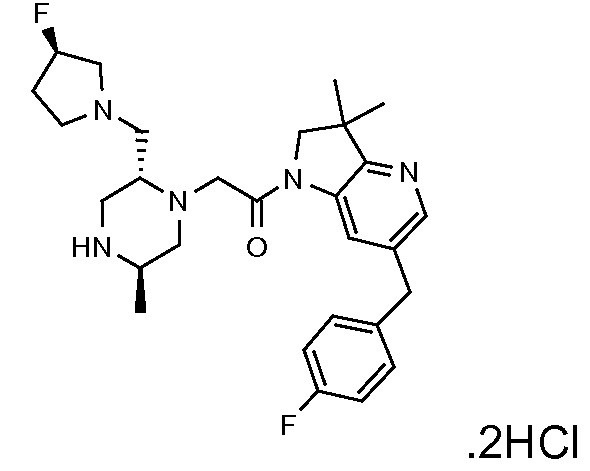
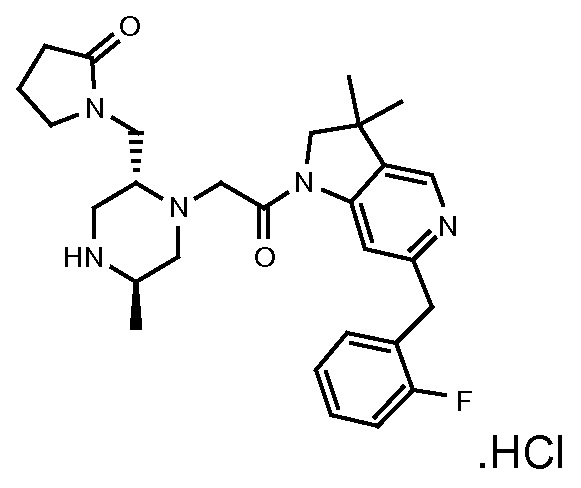
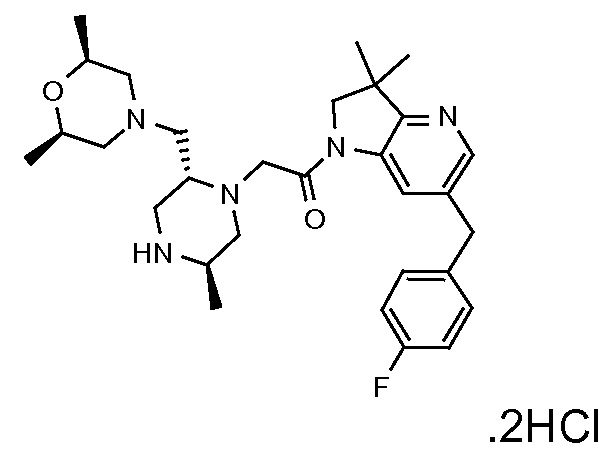
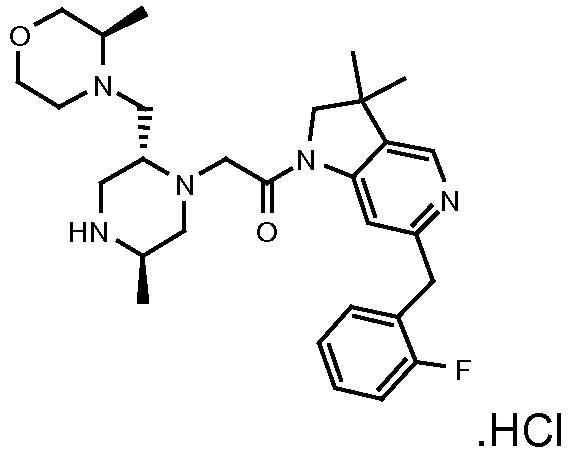
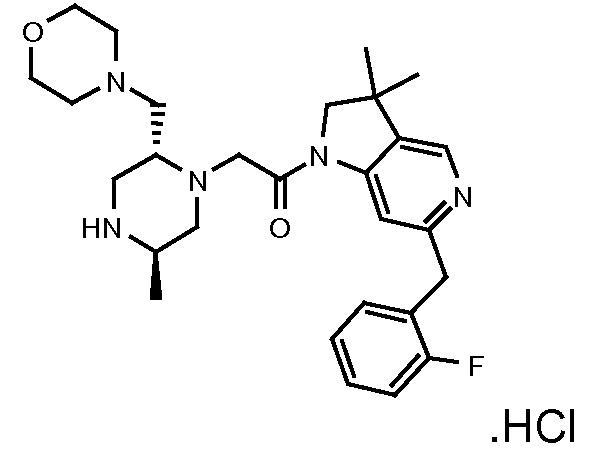
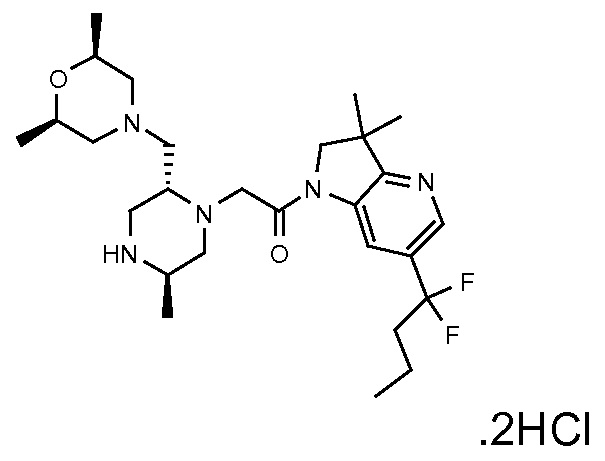
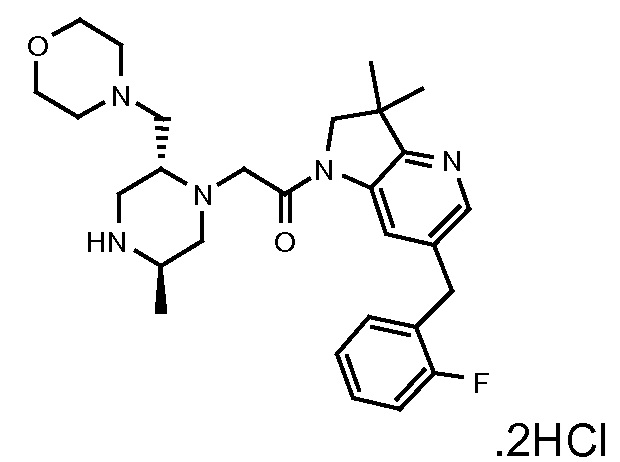
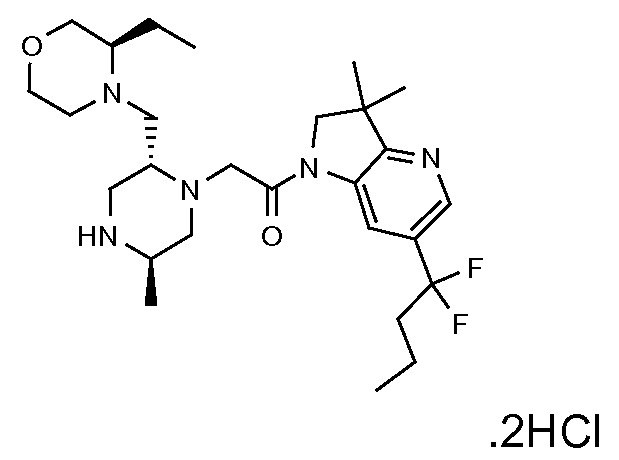
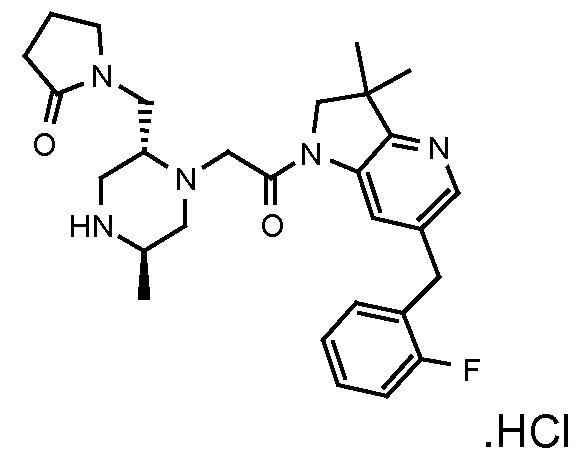
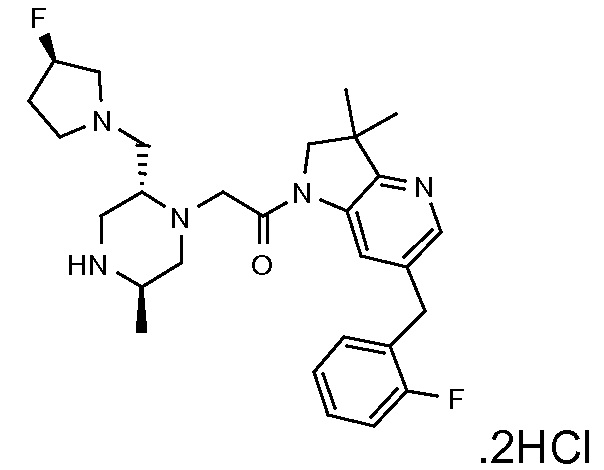
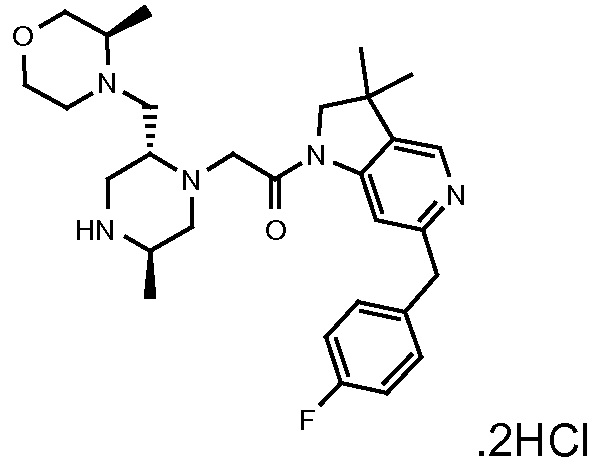
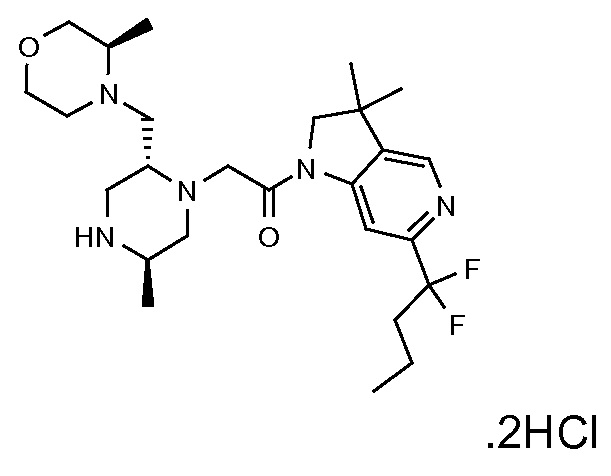
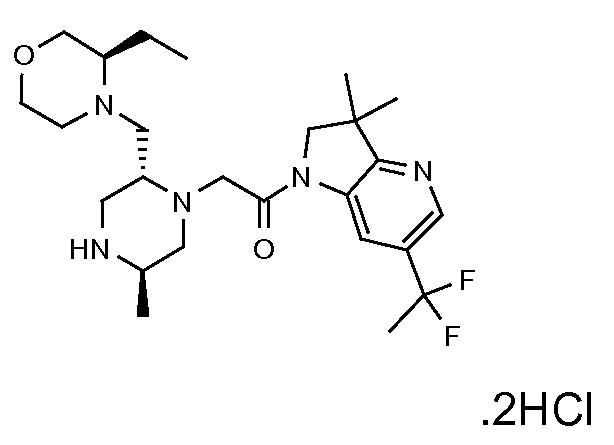
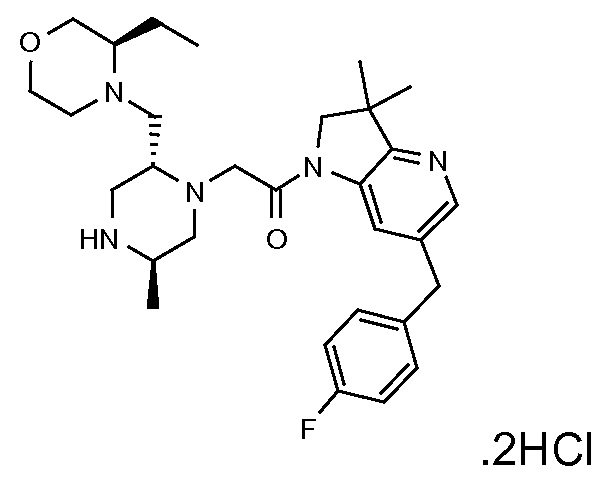
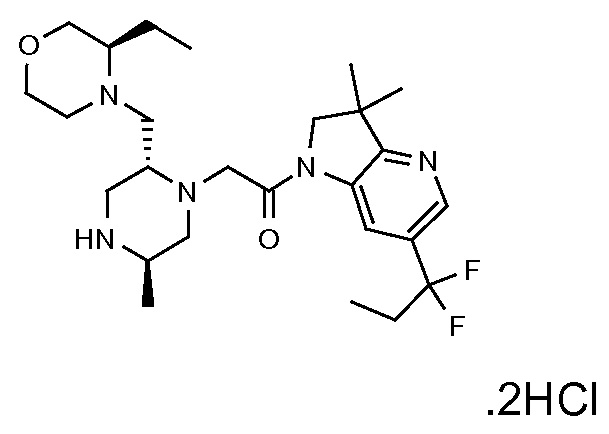
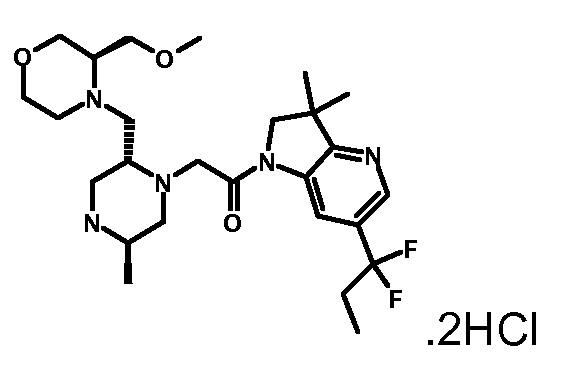
Пример 257: 1-(6-Бензил-3,3-диметил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)-2-((2R,5R)-2-метоксиметил-5-метилпиперазин-1-ил)этанон гидрохлорид
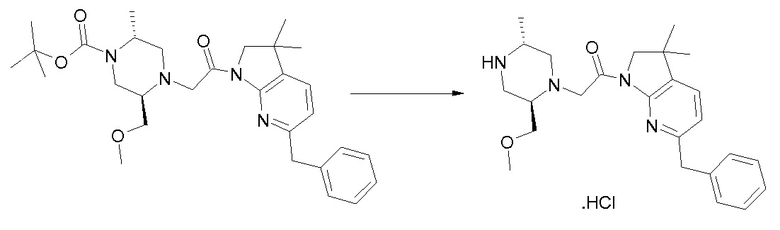
трет-Бутиловый эфир (2R,5R)-4-[2-(6-бензил-3,3-диметил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)-2-оксоэтил]-5-метоксиметил-2-метилпиперазин-1-карбоновой кислоты (200 мг, 0,38 ммоль) растворяли в DCM (10 мл) и помещали в атмосферу азота. TFA (2 мл) добавляли к реакционной смеси, которую перемешивали при комнатной температуре в течение 40 минут. Реакционную смесь концентрировали в вакууме. Остаток распределяли между DCM (100 мл) и водным раствором гидрокарбоната натрия (100 мл). Слои разделяли и водный слой экстрагировали при помощи DCM (2×100 мл). Органические экстракты сушили над сульфатом магния, фильтровали и концентрировали. Хроматография: (диоксид кремния; 30 г насадочного материала в DCM, с использованием для элюирования 5% MeOH в DCM-5-10% MeOH:DCM:0,5% NH4OH) давала продукт. Это вещество растворяли в EtOAc и раствор обрабатывали 2M раствором HCl в Et2O и концентрировали в вакууме, с получением белого твердого вещества, которое сушили в печи при 40°C в течение ночи, с получением указанного в заголовке соединения (132 мг). 1H-ЯМР (Me-d3-OD): 7,60 (1H, с), 7,33 (4H, с), 7,24 (1H, с), 7,03 (1H, с), 4,76 (1H, д), 4,67-4,54 (1H, м), 4,10 (2H, д), 3,84 (3H, с), 3,53 (6H, с), 3,26 (1H, д), 3,20 (3H, с), 1,38 (9H, с). МС: [M+H]+=423.
Пример 258: 1-[3,3-Диметил-6-(1H-тетразол-5-ил)-2,3-дигидроиндол-1-ил]-2-((2R,5R)-2-метоксиметил-5-метилпиперазин-1-ил)этанон гидрохлорид
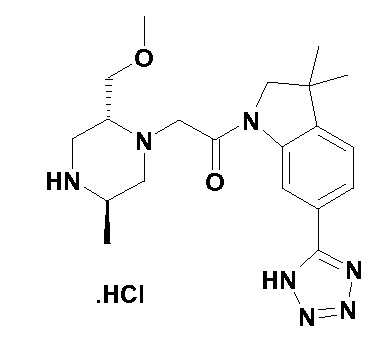
Перемешиваемый раствор 1-{2-[(2R,5R)-2-(метоксиметил)-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-2,3-дигидро-1H-индол-6-карбонитрил гидрохлорида (25 мг, 0,06 ммоль) в DMF (1 мл) обрабатывали азидом натрия (9,0 мг, 0,13 ммоль) и хлоридом аммония (4,0 мг, 0,06 ммоль) и нагревали при температуре кипения с обратным холодильником в атмосфере азота. Через 16 часов смесь фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ, щелочной способ, затем обрабатывали насыщенным раствором HCl в EtOAc, с последующим концентрированием досуха в вакууме, с получением указанного в заголовке соединения (1,2 мг, 4%). 1H-ЯМР (Me-d3-OD): 8,86-8,78 (1H, м), 7,77 (1H, д), 7,33 (1H, д), 3,95 (1H, д), 3,88 (1H, д), 3,78 (1H, д), 3,68 (1H, д), 3,62-3,46 (2H, м), 3,39-3,33 (3H, м), 3,33 (3H, с), 3,13 (1H, д), 3,07-2,91 (2H, м), 1,49-1,35 (6H, с), 1,29 (3H, д). МС: [M+H]+=400.
Пример 259: 1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон дигидрохлорид
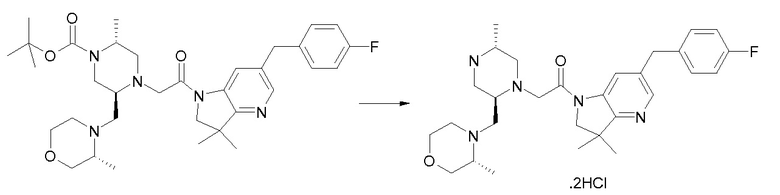
трет-Бутиловый эфир (2R,5S)-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)-пиперазин-1-карбоновой кислоты (1,9 г, 3,29 ммоль) растворяли в EtOAc (48 мл) и 4 M HCl в диоксане (82 мл) и перемешивали при комнатной температуре в течение 18 часов. Растворитель удаляли в вакууме и полученное твердое вещество растирали в порошок с диэтиловым эфиром и сушили в вакуум печи при 40°C, с получением указанного в заголовке соединения (1,36 г). 1H-ЯМР (ДМСО-d6): 11,71-10,46 (1H, м), 10,14 (1H, с), 9,52 (1H, с), 8,31 (1H, с), 8,25 (1H, с), 7,32 (2H, дд), 7,15 (2H, т), 4,12-4,01 (4H, м), 4,01-3,56 (7H, м), 3,45 (4H, с), 3,22 (2H, д), 3,17 (2H, с), 3,09 (1H, д), 2,89 (1H, д), 1,41 (6H, с), 1,24 (6H, м). МС: [M+H]+=510.
Пример 260: 1-[6-(1,1-Дифтор-бутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон дигидрохлорид
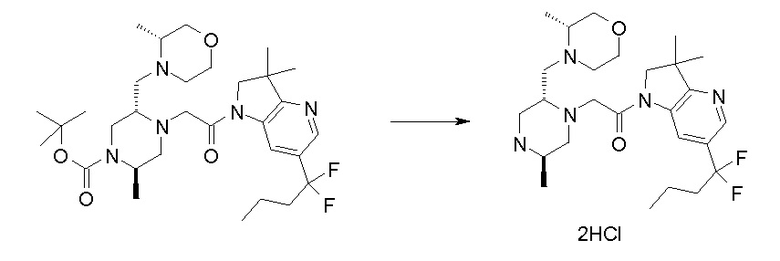
4н HCl в диоксане (35 мл) добавляли к раствору трет-бутилового эфира (2R,5S)-4-{2-[6-(1,1-дифторбутил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (2,1 г) в EtOAc (10 мл). Полученную суспензию перемешивали в течение 1 часа при комнатной температуре. Растворитель затем удаляли в вакууме. Твердое вещество растирали в порошок в Et2O, собирали путем фильтрования, промывали при помощи Et2O и сушили в вакууме, с получением указанного в заголовке соединения (1,7 г) в виде желтого твердого вещества. 1H-ЯМР (Me-d3-OD): 8,77 (1H, с), 8,52 (1H, с), 4,36-3,91 (9H, м), 3,91-3,41 (8H, м), 3,18-2,99 (1H, м), 2,34-2,15 (2H, м), 1,67-1,36 (15H, м), 1,00 (3H, т). МС: [M+H]+=494.
Пример 261: 1-[6-(2-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон дигидрохлорид
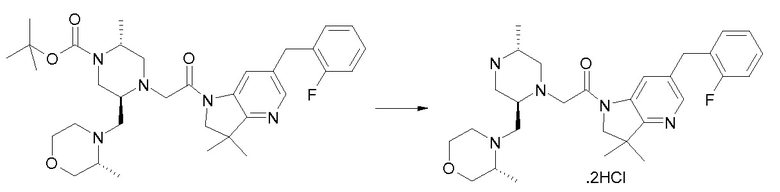
трет-Бутиловый эфир (2R,5S)-4-{2-[6-(2-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (1,43 г, 2,35 ммоль) растворяли в EtOAc (34 мл) и 4 M HCl в диоксане (59 мл) и перемешивали при комнатной температуре в течение 18 часов. Растворитель удаляли в вакууме, затем остаток снова растворяли в метаноле и концентрировали. Неочищенный продукт очищали путем перекристаллизации (изопропанол/диэтиловый эфир), с получением указанного в заголовке соединения (0,90 г). 1H-ЯМР (ДМСО-d6): 10,64-10,27 (1H, м), 9,97-9,64 (1H, м), 9,43-9,02 (1H, м), 8,23 (1H, с), 8,08 (1H, с), 7,43-7,35 (1H, м), 7,35-7,26 (1H, м), 7,22-7,13 (2H, м), 4,07-3,84 (8H, м), 3,69-3,30 (6H, м), 3,26-2,95 (4H, м), 2,91-2,82 (1H, м), 1,32 (6H, д), 1,28-1,13 (6H, м). МС: [M+H]+=510.
Пример 262: 1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон
1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон дигидрохлорид (1,8 г) растворяли в воде (50 мл) и полученный раствор экстрагировали этилацетатом (50 мл). Водную фазу подщелачивали (pH 8) насыщенным водным раствором NaHCO3, затем экстрагировали при помощи DCM (5×50 мл). Объединенные DCM экстракты сушили (Na2SO4) и упаривали в вакууме, с получением указанного в заголовке соединения (1,72 г) в виде пенистого вещества. 1H-ЯМР (Me-d3-OD): 8,24 (1H, с), 8,07 (1H, д), 7,24 (2H, дд), 7,03 (2H, т), 4,19-4,06 (1H, м), 3,99 (3H, д), 3,90 (1H, д), 3,71 (1H, д), 3,65-3,48 (2H, м), 3,19-2,70 (8H, м), 2,60-2,40 (2H, м), 2,26 (1H, с), 2,09-1,93 (1H, м), 1,87 (1H, д), 1,41 (6H, д), 1,04 (3H, д), 0,97 (3H, д).
Пример 262a: 1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон
К интенсивно перемешиваемому раствору трет-бутилового эфира (2R,5S)-4-{2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (11,3 г, 18,5 ммоль) в этилацетате (100 мл) при 20°C добавляли раствор HCl в диоксане (100 мл) и перемешивание продолжали в течение 18 часов. Полученный мелкозернистый желтый осадок собирали путем фильтрования и сушили в вакууме. Это вещество суспендировали в воде (200 мл) и экстрагировали при помощи EtOAc (200 мл). Органическую фазу промывали 0,1 M водным раствором HCl (50 мл) и объединенные водные экстракты охлаждали на ледяной бане и подщелачивали путем добавления по каплям 5 M водного раствора NaOH. Полученную смесь экстрагировали при помощи DCM (4×60 мл) и объединенные экстракты сушили (Na2SO4) и упаривали в вакууме, с получением указанного в заголовке соединения (8,29 г) в виде бесцветного пенистого вещества. 1H-ЯМР и MS данные соответствовали указанным выше данным, полученным для Примера 262. ИК vC=O 1685 см-1.
Пример 263: 1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон гидрохлорид
1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон (1,72 г) растворяли в EtOAc (40 мл), затем обрабатывали по каплям смесью 4 M HCl в диоксане и EtOAc (40 мл) при перемешивании при температуре окружающей среды. Полученному прозрачному раствору давали выстояться в течение 64 часов, затем упаривали в вакууме, с получением пенистого вещества, которое растворяли в изопропаноле, затем снова упаривали. Полученный остаток растирали в порошок с простым эфиром, с получением указанного в заголовке соединения (1,43 г) в виде белого порошка. 1H-ЯМР (Me-d3-OD): 8,19 (1H, с), 8,13 (1H, с), 7,31-7,19 (2H, м), 7,04 (2H, т), 4,16-3,79 (7H, м), 3,79-3,42 (4H, м), 3,02 (5H, м), 2,61-1,92 (2H, м), 1,42 (6H, д), 1,32 (3H, с), 1,17 (3H, д), 1,16-0,77 (3H, м).
Пример 264: 1-[6-(2,4-Дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-5-метил-2-((R)-3-метилморфолин-4-илметил)пиперазин-1-ил]этанон, дигидрохлорид
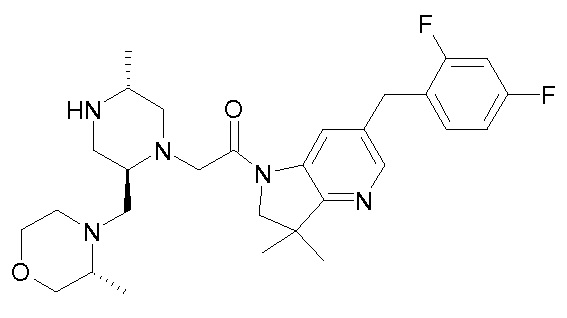
Смесь трет-бутилового эфира (2R,5S)-4-{2-[6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-((R)-3-метилморфолин-4-илметил)пиперазин-1-карбоновой кислоты (0,103 г), этилацетата (10 мл) и 4 M HCl в диоксане (10 мл) перемешивали при 20°C в течение 18 часов и полученное твердое вещество собирали путем фильтрования, с получением указанного в заголовке соединения (0,075 г). 1H-ЯМР (Me-d3-OD): 8,76 (1H, с), 8,48 (1H, с), 7,56-7,44 (1H, м), 7,11-6,98 (2H, м), 4,27 (5H, д), 4,16-3,96 (5H, м), 3,82 (3H, с), 3,66-3,41 (5H, м), 3,18 (4H, д), 1,62 (6H, с), 1,41 (6H, шир. м). МС: [M+H]+=528.
Пример 265: 1-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-((R)-3-метилпиперазин-1-ил)этанон
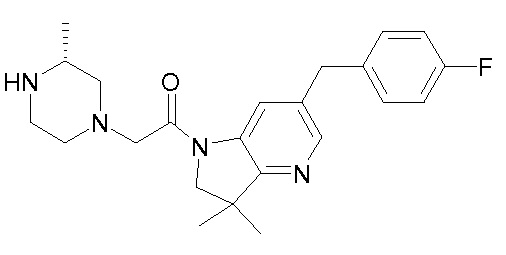
Получали из трет-бутилового эфира (R)-4-{2-[6-(4-Фторбензил)-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метилпиперазин-1-карбоновой кислоты способом, аналогичным способу получения Примера 264. 1H-ЯМР (Me-d3-OD): 8,75 (1H, с), 8,37 (1H, с), 7,33 (2H, дд), 7,09 (2H, т), 4,41 (2H, с), 4,19 (2H, с), 4,16 (2H, с), 3,87-3,68 (4H, м), 3,61-3,41 (2H, м), 3,27 (1H, т), 1,59 (6H, с), 1,44 (3H, д). МС: [M+H]+=397.
Пример 266: 3,3-Диметил-1-[(2S)-2-[(3R)-3-метилпиперазин-1-ил]бутаноил]-2,3-дигидро-1H-индол-6-карбонитрил, гидрохлоридная соль
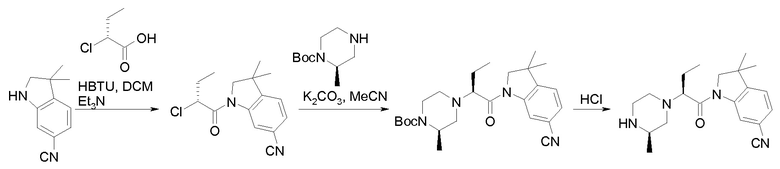
К перемешиваемому раствору (R)-2-хлор-1-масляной кислоты (0,47 мл, 4,60 ммоль) в DCM добавляли HBTU (2,18 г, 5,75 ммоль). После перемешивания в течение 30 минут добавляли триэтиламин (0,96 мл, 6,9 ммоль) и 3,3-диметил-2,3-дигидро-1H-индол-6-карбонитрил (0,80 г, 4,6 ммоль), полученную смесь перемешивали в течение ночи. Добавляли каплю DMF и реакционную смесь перемешивали в течение ночи. Реакционную смесь затем разбавляли этилацетатом и промывали водой. Органические слои отделяли, сушили при помощи сульфата натрия и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием для элюирования 20% этилацетата в гептане, с получением (R)-1-(2-хлорбутаноил)-3,3-диметилиндолин-6-карбонитрила, содержащего непрореагировавший 3,3-диметил-2,3-дигидро-1H-индол-6-карбонитрил. Осуществляли поглощение смеси в DCM и промывали 2M раствором HCl. Органические слои сушили при помощи сульфата натрия и концентрировали, с получением (R)-1-(2-хлорбутаноил)-3,3-диметилиндолин-6-карбонитрила (0,38 г). 1H-ЯМР (400 МГц, CDCl3) 8,53 (с, 1H), 7,38 (д, 1H), 7,25 (д, 1H), 4,22-4,29 (м, 1H), 4,15 (д, 1H), 3,87 (д, 1H), 2,19-2,04 (м, 2H), 1,39 (с, 6H), 1,09 (т, 3H).
К суспензии (R)-1-(2-хлорбутаноил)-3,3-диметилиндолин-6-карбонитрила (0,1 г, 0,36 ммоль), трет-бутилового эфира (R)-2-метилпиперазин-1-карбоновой кислоты (0,072 г, 0,36 ммоль) в ацетонитриле (2,5 мл) добавляли карбонат калия (0,049 г, 0,36 ммоль) и реакционную смесь нагревали до 50°C в течение 48 часов, затем при 80°C в течение 24 часов и при 60°C в течение 36 часов. Реакционную смесь затем разбавляли этилацетатом и промывали водой. Органические слои отделяли, сушили при помощи сульфата натрия и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле; с использованием для элюирования 20-30% этилацетата в гептане, с получением трет-бутилового эфира (R)-4-[(S)-1-(6-циано-3,3-диметил-2,3-дигидроиндол-1-карбонил)пропил]-2-метилпиперазин-1-карбоновой кислоты (0,023 г). MC: [M+H]+=441.
4M HCl в диоксане (1 мл) добавляли к (R)-1-(2-хлорбутаноил)-3,3-диметилиндолин-6-карбонитрилу (22 мг, 0,049 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали и полученные твердые вещества растирали в порошок с диэтиловым эфиром, с получением 3,3-диметил-1-((S)-2-((R)-3-метилпиперазин-1-ил)бутаноил)индолин-6-карбонитрил гидрохлорида (3,9 мг). MC: [M+H]+=341. Надосадочную жидкость также концентрировали с получением второй партии 3,3-диметил-1-((S)-2-((R)-3-метилпиперазин-1-ил)бутаноил)индолин-6-карбонитрил гидрохлорида (11,3 мг, общая чистота ~70%). MC: [M+H]+=341.
Биологические анализы
Экспрессия и очистка XIAP, cIAP-1 и cIAP-2 BIR3 доменов
Рекомбинантный BIR3 домен человеческого XIAP (остатки 252-350), гибридизованный с His-tag, человеческий cIAP-1 (остатки 267-363), гибридизованный с GST-tag, и человеческий cIAP-2 (остатки 244-337), гибридизованный с His-tag, были экспрессированы на чрезмерно высоком уровне из клеток Escherichia coli, выращенных в TB среде. Белок выделяли из лизатов с использованием Ni-NTA аффинной хроматографии (XIAP/cIAP-2) или глутатион сефараза 4B аффинной хроматографии (cIAP-1). Аффинные метки для XIAP и cIAP-1 отщепляли с использованием тромбина в 25 мМ HEPES pH 7,5, 100 мМ NaCl, 50 мкМ Zn(OAc)2 и 1 мМ Ca(OAc)2, с последующей очисткой BIR3 доменов методом хроматографии с исключением по размеру. His-tag оставался неотщепленным для cIAP-2, и белок не концентрировали выше 3 мг/мл из-за индуцированных агрегацией ковалентных самоолигомеризующихся продуктов. Очищенный белок хранили в 25 мМ Трис pH 7,5, 100 мМ NaCl при -80°C.
XIAP, cIAP-1 и cIAP-2 in vitro анализы конкурентного вытеснительного связывания
Модифицированные SMAC пептиды и соединения испытывали на их способность вытеснения флуоресцентной метки из XIAP, cIAP-1 или cIAP-2. BIR3 домены cIAP-1, cIAP-2 и XIAP инкубировали с испытываемыми соединениями или SMAC пептидами и их соответствующими пептидными зондами (Peptide Protein Research) в буфере для анализа (50 мМ Hepes pH 7,5, 0,025% Tween-20, 0,01% BSA и 1 мМ DTT). Положительные контроли состояли из BIR3 белков и метки (отсутствие ингибирования), и отрицательные контроли содержали только метку (100% ингибирование). Образцы инкубировали при комнатной температуре в течение 1 часа (XIAP и cIAP-2) или 3 часов (cIAP-1) перед их считыванием в BMG Pherastar в режиме поляризации флуоресценции (FP 485 нм, 520 нм, 520 нм). Значения ИК50 определяли из графиков доза-ответ с использованием нелинейного метода наименьших квадратов.
Соединения Примеров 1-24, 26-43 и 85 были испытаны в cIAP1 анализе с использованием Пептидного Зонда AVPIK(5&6FAM)-амид (Зонд A). Остальные соединения были испытаны в cIAP1 анализе с использованием Пептидного Зонда AbuRPFK(5&6FAM)-амидный зонд (Зонд B). Соединение Примера 25 было испытано в cIAP1 анализе с использованием Пептидного Зонда AVPIK(5&6FAM)-амид (Зонд A) и Пептидного Зонда AbuRPFK(5&6FAM)-амидный зонд (Зонд B). Соединения Примеров 12, 15, 20, 24, 29, 33, 35, 38, 40-49, 51-65, 67-72, 74-80, 83-84, 86-87, 89-100, 102-103, 106-110 и 114-130, 132, 134-146, 148-156, 161-163, 165, 168-170, 174-175, 177,181, 183-184, 186-190, 198, 211-212, 214, 220, 222, 226, 228, 231, 235, 253, 255-257 и 265 имеют значения ИК50 меньше чем 10 мкМ или обеспечивают по меньшей мере 50% ингибирование активности при концентрации 10 мкМ в анализе, тогда как соединения Примеров 35, 40, 42-45, 47-48, 56, 58-60, 62-64, 67, 70-72, 74-80, 83, 86-87, 89-100, 102-103, 106-110 и 114-130, 132, 134-146, 148-155, 161, 163, 165, 168-170, 174-175, 177,181, 183-184, 186-190, 198, 211-212, 214, 220, 222, 226, 228, 231, 235, 253 и 255-256 имеют значения ИК50 меньше чем 1 мкМ или обеспечивают по меньшей мере 50% ингибирование активности при концентрации 1 мкМ. Предпочтительные соединения по настоящему изобретению имеют значения ИК50 меньше чем 0,1 мкМ против XIAP и/или cIAP1 и или cIAP2. Данные для соединений по настоящему изобретению в описанных выше анализах представлены в Таблице 10.
Анти-пролиферативная активность
Ингибирование клеточного роста измеряли с использованием Alamar Blue анализа (Nociari, M. M, Shalev, A., Benias, P., Russo, C. Journal of Immunological Methods 1998, 213, 157-167). Способ основан на способности жизнеспособных клеток восстанавливать ресазурин до его флуоресцентного продукта резофурина. Для каждого анализа пролиферации клетки высевали на 96-луночные планшеты и давали восстановиться течение в течение 16 часов перед добавлением ингибиторных соединений (в 0,1% ДМСО об/об) еще в течение 72 часов. После завершения периода инкубации добавляли 10% (об/об) Alamar Blue и инкубировали еще в течение 6 часов перед определением флуоресцентного продукта при длине волны возбуждения 535 нм и длине волны эмиссии 590 нм.
Анти-пролиферативные активности соединений по настоящему изобретению можно определить путем измерения способности соединений ингибировать рост в 3 раковых клеточных линиях:
• EVSA-T (карцинома молочной железы человека) DSMZ cat. no. ACC 433
• MDA-MB-231 (карцинома молочной железы человека) ECACC cat. no. 92020424
• HCT116 (карцинома толстой кишки человека) ECACC cat. no. 91091005 (нечувствительная клеточная линия, используемая в качестве контроля для неспецифической цитоксичности)
Было обнаружено, что многие соединения по настоящему изобретению имеют значения EC50 меньше чем 1 мкМ в анализах EVSA-T клеточной линии (и меньше чем 10 мкМ против MDA-MB-231 клеточной линии), и предпочтительные соединения имеют значения EC50 меньше чем 0,1 мкМ в анализах EVSA-T клеточной линии (и меньше чем 1 мкМ против MDA-MB-231 клеточной линии) и EC50>10 мкМ против HCT116 клеток.
В анализе с использованием клеточной линии EVSA-T Примеры 29, 41-45, 47-48, 56, 58-60, 62-64, 67-68, 70-71, 74-80, 82-83, 86-94, 96-97, 99-101, 104-106, 108-112, 118-122, 126, 128, 130, 131-133, 135-137, 140-141, 143-153, 157-161, 163-167, 170-180, 182, 184-186, 188-195, 197-256 и 259-264 имеют значения EC50 меньше чем 10 мкМ. В анализе с использованием клеточной линии MDA-MB-231 Примеры 47-48, 58, 60, 63-64, 67, 75-80, 82-83, 86-91, 93-94, 96-97, 99-101, 104-106, 110-112, 119, 121-122, 128, 130, 131-133, 137, 144, 146-148, 150-151, 157-160, 163-167, 170-180, 182, 184-186, 188-195, 197-221, 223-256 и 259-264 имеют значения EC50 меньше чем 10 мкМ. Данные для соединений по настоящему изобретению в описанных выше анализах представлены в Таблице 10.
Если получали больше чем одну точку данных, в таблице выше представлены средние значения (например, среднее геометрическое) этих точек данных (до 2 значащих цифр).
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2014 |
|
RU2696310C1 |
| ЦИКЛИЧЕСКИЕ АЗАИНДОЛ-3-КАРБОКСАМИДЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2009 |
|
RU2487874C2 |
| ИНГИБИТОРЫ ФОСФОИНОЗИТИД-3-КИНАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2468027C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2005 |
|
RU2422449C2 |
| ТЕТРАГИДРОФУРО(3,2-b)ПИРРОЛ-3-ОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КАТЕПСИНА К | 2007 |
|
RU2456290C2 |
| БЕНЗОТРИАЗЕПИНЫ В КАЧЕСТВЕ ЛИГАНДОВ РЕЦЕПТОРОВ ГАСТРИНА И ХОЛЕЦИСТОКИНИНА | 2002 |
|
RU2304438C2 |
| РЕАКЦИИ МАКРОЦИКЛИЗАЦИИ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И ДРУГИЕ ФРАГМЕНТЫ, ПРИГОДНЫЕ В ПОЛУЧЕНИИ АНАЛОГОВ ХАЛИХОНДРИНА B | 2014 |
|
RU2710545C2 |
| ИНГИБИТОРЫ УРИДИН-5-ДИФОСФАТ (UDP) ГЛИКОЗИЛТРАНСФЕРАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2810928C2 |
| ПОЛИЦИКЛИЧЕСКИЕ АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ИММУННЫХ РАССТРОЙСТВ | 2016 |
|
RU2783748C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2020 |
|
RU2835082C2 |
Изобретение относится к соединению формулы (Ic) или его таутомерным или стереохимически изомерным формам, N-оксидам или фармацевтически приемлемым солям. В формуле (Ic) A представляет собой СН, U представляет собой CR8 и V представляет собой N, или A представляет собой СН, U представляет собой N и V представляет собой CR9, или A представляет собой N, U представляет собой CR8 и V представляет собой CR9, или A представляет собой СН, U представляет собой CR8 и V представляет собой CR9; R1 выбран из C1-4 алкила, необязательно замещенного 1, 2 или 3 атомами галогена; R3a выбран из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -CH2-(5-6-членный ароматический или неароматический гетероциклил), -CH2-(9-10-членный бициклический ароматический или неароматический гетероциклил), и -C(=O)-(4-6-членный ароматический или неароматический гетероциклил); R6 и R7 независимо выбраны из водорода, C1-6 алкила, -CH2-фенила, -СН2-О-СН2-фенила, или группы R6 и R7, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-6-членной насыщенной карбоциклической или гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, которая, необязательно, может быть конденсирована с фенильным кольцом. Значения остальных радикалов представлены в формуле изобретения. Изобретение также относится к индивидуальным соединениям, фармацевтической композиции, к применениям соединения и к способам его получения. Технический результат: получены новые соединения формулы (Ic), которые могут быть полезны для профилактики или лечения заболевания или состояния, опосредованного одним или более белков семейства IAP. 14 н. и 41 з.п. ф-лы, 10 табл., 266 пр.
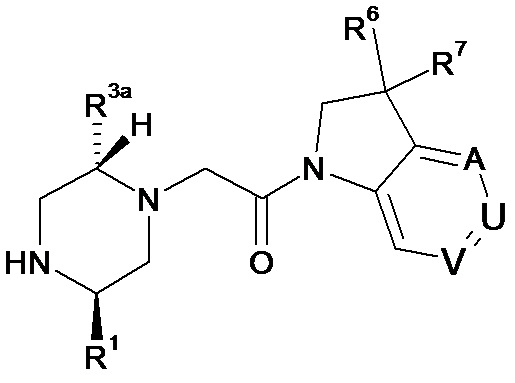 (Ic)
(Ic)
1. Соединение формулы (Ic)
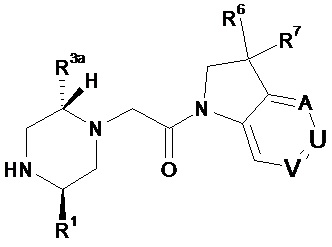
(Ic)
или его таутомерные или стереохимически изомерные формы, N-оксиды или фармацевтически приемлемые соли,
где A представляет собой СН, U представляет собой CR8 и V представляет собой N, или
A представляет собой СН, U представляет собой N и V представляет собой CR9, или
A представляет собой N, U представляет собой CR8 и V представляет собой CR9, или
A представляет собой СН, U представляет собой CR8 и V представляет собой CR9;
R1 выбран из C1-4 алкила, необязательно замещенного 1, 2 или 3 атомами галогена;
R3a выбран из водорода, C1-6 алкила, -C(=O)NH(2-q)(C1-6 алкил)q, -CH2-(5-6-членный ароматический или неароматический гетероциклил), -CH2-(9-10-членный бициклический ароматический или неароматический гетероциклил) и -C(=O)-(4-6-членный ароматический или неароматический гетероциклил),
где указанная C1-6 алкильная группа необязательно замещена -(CRxRy)s-O-Rz, -(CH2)s-NRxC(=O)Ry) или одним или более атомами галогена и указанная гетероциклическая группа необязательно может быть замещена 1 или 2 группами Rb, выбранными из =О, галогена, С1-6 алкила и -(CRxRy)s-O-Rz;
R6 и R7 независимо выбраны из водорода, C1-6 алкила, -CH2-фенила, -СН2-О-СН2-фенила,
или группы R6 и R7, вместе с атомом углерода, с которым они связаны, могут объединяться с образованием 3-6-членной насыщенной карбоциклической или гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, которая, необязательно, может быть конденсирована с фенильным кольцом,
где указанные гетероциклические группы, необязательно, могут быть замещены одной группой -C(=O)CH3 или -C(=O)O-CH2-фенил;
R8 выбран из водорода, C1-6алкила, галогена, =О и -(CRxRy)s-ORz;
R9 выбран из водорода, галогена, C1-8 алкила, -Y-C3-8 циклоалкила, -Y-C3-8циклоалкенила, -Y-фенила, -Z-(5-10-членный ароматический или неароматический гетероциклил), -(CRxRy)s-O-Rz, -(CH2)s-CN, -S(O)q-(CRxRy)s-Rz, -C(=O)Rx, -(CRxRy)s-C(=O)ORz, -(CRxRy)s-C(=O)NRxRy, -(CH2)s-NRxRy, -(CH2)s-NRx-(CH2)s-SO2-Ry и -(CH2)s-SO2NRxRy, где указанные C1-8 алкильные группы необязательно могут быть замещены 1, 2 или 3 группами, выбранными из галогена, C1-6 алкила, -(CH2)s-O-Rx, -(CH2)s-CN, C1-6алкил-N(H)2-q(Rx)q, -N(H)2-q(Rx)q, -S(O)q-Rx, -C(=O)Rx, -(CH2)s-N(H)2-q(Rx)q, где Rx независимо выбирают из водорода, C1-6 алкила, C1-6 алканола, гидрокси, C1-6 алкокси и галогенC1-6алкила, карбоциклические группы или гетероциклические группы необязательно могут быть замещены 1 или 2 группами Rb, выбранными из галогена, C1-6 алкила, -(CH2)s-O-Rx, -(CH2)s-CN, C1-6алкил-N(H)2-q(Rx)q, -N(H)2-q(Rx)q, -S(O)q-Rx, -C(=O)Rx, -(CH2)s-N(H)2-q(Rx)q, где Rx независимо выбирают из водорода, C1-6 алкила, C1-6 алканола, гидрокси, C1-6 алкокси и галогенC1-6алкила;
Rx, Ry и Rz независимо представляют собой галоген, C1-6 алкил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-фенил и -(CH2)s-(4-7-членный насыщенный гетероциклил), C1-6 алкокси, галогенC1-6 алкил, и, когда они связаны с атомом азота, Rx и Ry могут объединяться с образованием 3-7-членного кольца;
Y и Z независимо выбраны из связи, -(CRxRy)m-, -C(=CRx)-, -C(=O)-, -NRx, -O- и -S(O)q-;
s независимо представляет собой целое число, имеющее значение 0-4;
n представляет собой 1;
q представляет собой целое число, имеющее значение 0-2;
m представляет собой 1; и
где гетероциклические группы содержат до 4 гетероатомов, выбранных из N, O и S и окисленных форм N.
2. Соединение по п. 1, где A представляет собой CH, U представляет собой CR8 и V представляет собой CR9.
3. Соединение по п. 1, где
(i) A представляет собой CH, U представляет собой CR8 и V представляет собой N; или
(ii) A представляет собой CH, U представляет собой N и V представляет собой CR9; или
(iii) A представляет собой N, U представляет собой CR8 и V представляет собой CR9.
4. Соединение по п. 1, где R1 представляет собой метил.
5. Соединение по п. 1, где R3a представляет собой -CH2-(6-членный насыщенный гетероциклил), где указанная гетероциклическая группа, необязательно, может быть замещена 1 или 2 группами Rb, выбранными из =О, галогена, С1-6алкила и -(CRxRy)s-O-Rz.
6. Соединение по п. 5, где -CH2-(6-членный насыщенный гетероциклил) представляет собой -CH2-пиперидинил, -CH2-пиперазинил или -CH2-морфолинил.
7. Соединение по п. 5, где группа Rb представляет собой =O, C1-6 алкил или -(CRxRy)s-O-Rz.
8. Соединение по п. 5, где группа Rb представляет собой метил, этил или -CH2OCH3.
9. Соединение по п. 1, где R3a представляет собой -CH2-(4-морфолинил), необязательно замещенный 1 или 2 группами Rb, выбранными из =O, галогена, C1-6 алкила и -(CRxRy)s-O-Rz.
10. Соединение по п. 9, где Rb представляет собой C1-6 алкил.
11. Соединение по п. 9, где Rb представляет собой метил.
12. Соединение по п. 1, где R6 и R7 оба представляют собой метил.
13. Соединение по п. 1, где группы R6 и R7 вместе с атомом углерода, с которым они связаны, объединены с образованием 3-6-членной полностью насыщенной карбоциклической или гетероциклической группы, выбранной из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, которые необязательно могут быть конденсированы с фенильным кольцом, где указанные гетероциклические группы, необязательно, могут быть замещены одной группой -C(=O)CH3 или -C(=O)O-CH2-фенил.
14. Соединение по п. 1, где R9 выбран из галогена, -(CH2)s-CN, C1-8 алкила, -Y-C3-8циклоалкила, -Y-C3-8циклоалкенила, -Y-фенила, -Z-(5-10-членный ароматический или неароматический гетероциклил), -S(O)q-(CRxRy)s-Rz или -(CH2)s-SO2NRxRy, где указанные карбоциклические группы или гетероциклические группы, необязательно, могут быть замещены 1 или 2 группами Rb, выбранными из галогена, C1-6алкила, -(CH2)s-O-Rx, -(CH2)s-CN, C1-6 алкил-N(H)2-q(Rx)q, -N(H)2-q(Rx)q, -S(O)q-Rx, -C(=O)Rx, -(CH2)s- N(H)2-q(Rx)q, где Rx независимо выбирают из водорода, C1-6 алкила, C1-6 алканола, гидрокси, C1-6 алкокси и галогенC1-6алкила.
15. Соединение по п. 14, где R9 выбран из хлора, фтора, брома, -CN, метила, этила, пропила, изобутила, бутила, -(CH2)2-CH(CH3)2, -CH2-фенила, -CF2-фенила, -CH(CH3)-фенила, -CH(OCH3)-фенила, -C(=CH2)-фенила, -O-фенила, -SO2-фенила, -C(=O)-фенила, -CF2-циклопропила, -CF2-циклобутила, -CF2-CH2-циклобутила, -циклопентила, -циклопентенила, -CH2-циклогексила, циклогексила, циклогексенила, -пиразолила, -фуранила, -тиенила, -оксадиазолила, -тетразолила, -бензофуранила, -CH2-пирролидинил),-SO2CH3, -SO2-CH2CH(CH3)2, -SO2-CH2-фенила, -SO2N(CH3)2, где указанные фенильные, пиразолильные, фуранильные, тиенильные, оксадиазолильные, тетразолильные, бензофуранильные или пирролидинильные группы, необязательно, могут быть замещены 1 или 2 группами Rb, выбранными из галогена, C1-6 алкила, -(CH2)s-O- Rx, -(CH2)s-CN, C1-6алкил-N(H)2-q(Rx)q, -N(H)2-q(Rx)q, -S(O)q-Rx, -C(=O)Rx, -(CH2)s- N(H)2-q(Rx)q, где Rx независимо выбирают из водорода, C1-6 алкила, C1-6 алканола, гидрокси, C1-6 алкокси и галогенC1-6алкила.
16. Соединение по п. 14, где R9 выбран из -(CRxRy)1-2-циклопропила, -(CRxRy)-циклобутила, -(CRxRy)-фенила, этила, пропила или бутила, каждый из которых, необязательно, может быть замещен 1 или 2 атомами галогена, и где Rx и Ry независимо выбраны из водорода и фтора.
17. Соединение по п. 16, где замещающие атомы галогена представляют собой фтор.
18. Соединение по п. 16, где R9 представляет собой -CH2-(4-фторфенил).
19. Соединение по п. 1, которое представляет собой соединение формулы (Ii)a или (Ii)b:
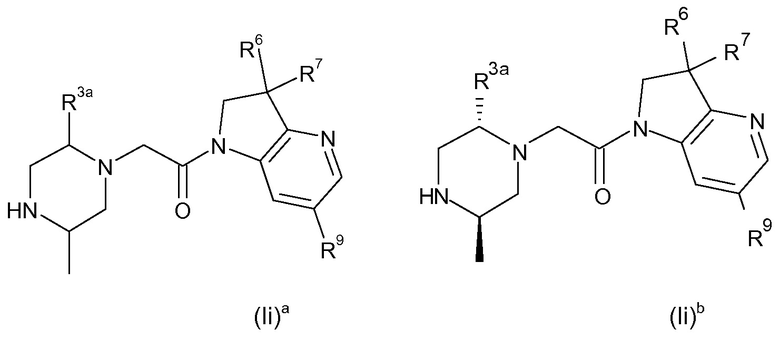
или его таутомерные или стереохимически изомерные формы, N-оксиды или фармацевтически приемлемые соли, где R3a, R6, R7 и R9 имеют значение, определенное в п. 1.
20. Соединение по п. 1, которое представляет собой соединение формулы (Ik)a или (Ik)b:
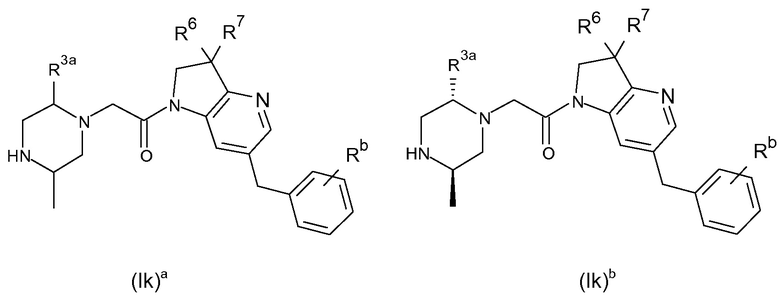
или его таутомерные или стереохимически изомерные формы, N-оксиды или фармацевтически приемлемые соли, где R3a, R6, R7 и Rb имеют значение, определенное в п. 1.
21. Соединение по п. 1, которое представляет собой соединение формулы (Im) или (In):
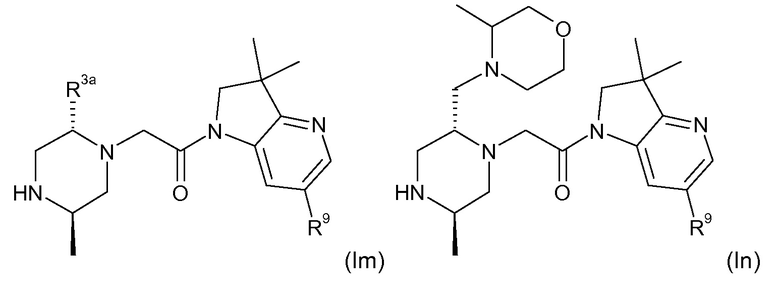
или его таутомерные или стереохимически изомерные формы, N-оксиды или фармацевтически приемлемые соли, где R3а и R9 имеют значения, определенные в п. 1.
22. Соединение формулы (Ic)

(Ic)
или его таутомерные или стереохимически изомерные формы, N-оксиды или фармацевтически приемлемые соли,
где A представляет собой N, U представляет собой CR8 и V представляет собой CR9;
R1 представляет собой метил;
R3a представляет собой -CH2-пиперидинил, -CH2-пиперазинил или -CH2-морфолинил, необязательно замещенный 1, 2 или 3 группами Rb, выбранными из =O, метила, этила и -CH2-O-CH3;
каждый из R6 и R7 представляет собой метил, или группы R6 и R7, вместе с атомом углерода, к которому они присоединены, образуют 3-6-членный полностью насыщенный карбоциклил или гетероциклил, выбранный из циклопропила, циклобутила, циклопентила, азетидина, пиперидина, который может быть необязательно конденсирован с фенильным кольцом, где указанные гетероциклильные группы могут быть необязательно замещены одной группой -C(=O)CH3 или -C(=O)O-CH2-фенила;
R8 выбирают из водорода, C1-6 алкила, галогена, =O и -(CRxRy)s-ORz;
R9 выбирают из галогена, -(CH2)s-CN, C1-8 алкила, -Y-C3-12 карбоциклила, -Z-(3-12-членный ароматический или неароматический гетероциклил), -S(O)q-(CRxRy)s-Rz и -(CH2)s-SO2NRxRy, где указанный карбоциклил или гетероциклил может быть необязательно замещен 1, 2 или 3 группами Rb, выбранными из =O, галогена, C1-6 алкила, -(CH2)s-CN и -(CRxRy)s-O-Rz;
Rx, Ry и Rz независимо представляют собой водород, метил, этил, пропил, бутил, -(CH2)s-C3-8 циклоалкил, -(CH2)s-фенил и -(CH2)s-пирролидинил;
Y и Z независимо выбирают из связи, -(CRxRy)m-, -C(=CRx)-, -C(=O)-, -NRx, -O- и -S(O)q-;
s независимо представляет собой целое число от 0 до 4;
n равен 1;
q представляет собой целое число от 0 до 2;
m равен 1; и
где гетероциклил содержит до 4 гетероатомов, выбранных из N, O, S и окисленных форм N.
23. Соединение, представляющее собой форму свободного основания соединения, выбранного из следующих:
или его таутомерную или стереохимически изомерную форму, N-оксид или фармацевтически приемлемую соль.
24. Фармацевтическая композиция для профилактики или лечения заболевания или состояния, опосредованного одним или более белков семейства IAP, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп. 1-23 вместе с одним или несколькими фармацевтически приемлемыми эксципиентами.
25. Применение соединения по любому из пп. 1-23 для получения лекарственного средства для профилактики или лечения заболевания или состояния, опосредованного одним или более белков семейства IAP.
26. Применение соединения по любому из пп. 1-23 для получения лекарственного средства для профилактики или лечения заболевания или состояния, опосредованного XIAP и/или cIAP.
27. Применение соединения по любому из пп.1-23 для получения лекарственного средства для профилактики или лечения заболевания или состояния, где имеет место чрезмерная экспрессия IAP.
28. Применение соединения по любому из пп. 1-23 для получения лекарственного средства для профилактики или лечения заболевания или состояния, где имеет место чрезмерная экспрессия XIAP и/или cIAP.
29. Применение соединения по любому из пп. 1-23 для получения лекарственного средства для профилактики или лечения рака, опосредованного одним или более белком семейства IAP.
30. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из опухолей эпителиального происхождения, гематологических злокачественных заболеваний, пред-злокачественных гематологических расстройств и расстройств, граничащих со злокачественностью, опухолей мезенхимального происхождения, опухолей центральной или периферической нервной системы, эндокринных опухолей, глазных и придаточных опухолей, зародышевоклеточных и трофобластных опухолей, педиатрических и эмбриональных опухолей или синдромов, врожденных или других, которые делают пациента чувствительным к злокачественности.
31. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из карциномы мочевого пузыря и мочевых путей, молочной железы, желудочно-кишечного тракта, печени, экзокринной поджелудочной железы, желчного пузыря и желчных протоков, почки, легкого, головы и шеи, яичника, фаллопиевых труб, брюшной полости, влагалища, вульвы, мужского полового члена, шейки матки, миометрия, эндометрия, щитовидной железы, надпочечников, предстательной железы, кожи и придатков.
32. Применение по п. 31, где карциному легкого выбирают из аденокарциномы, мелкоклеточной карциномы легких, не-мелкоклеточной карциномы легких, бронхоальвеолярной карциномы и мезотелиомы.
33. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, представляет собой мезотелиому.
34. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из гепатоклеточной карциномы, меланомы, эзофагеального рака, ренального рака, рака толстой кишки, колоректального рака, рака легкого, рака молочной железы, рака мочевого пузыря, рака желудочно-кишечного тракта, рака яичника и рака предстательной железы.
35. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из ренального рака, меланомы, рака толстой кишки, рака легкого, рака молочной железы, рака яичника и рака предстательной железы.
36. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из меланомы, рака толстой кишки, рака молочной железы и рака яичника.
37. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, представляет собой меланому.
38. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, представляет собой рак молочной железы.
39. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, представляет собой воспалительный рак молочной железы.
40. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, представляет собой воспалительную опухоль.
41. Применение по п. 40, где воспалительная опухоль представляет собой меланому, рак толстой кишки, молочной железы и яичника, в частности меланому.
42. Применение по п. 40, где воспалительная опухоль представляет собой меланому.
43. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из гематологических злокачественных заболеваний и родственных состояний лимфоидного происхождения и гематологических злокачественных заболеваний и родственных состояний миелогенного происхождения.
44. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из лейкоза и лимфомы.
45. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из острого лимфоцитарного лейкоза [ALL], хронического лимфоцитарного лейкоза [CLL], B-клеточных лимфом, таких как диффузная крупно-B-клеточная лимфома [DLBCL], фолликулярная лимфома, лимфома Беркетта, лимфома клеток ткани, одевающей спорангии, Т-клеточных лимфом и лейкозов, натурально-киллерноклеточных [NK] лимфом, лимфомы Ходжкина, волосистоклеточного лейкоза, моноклональной гаммопатии неопределенного значения, плазмацитомы, множественной миеломы и лимфопролиферативных расстройств после трансплантации.
46. Применение по п. 45, где B-клеточная лимфома представляет собой рефрактерную диффузную крупно-B-клеточную лимфому [DLBCL].
47. Применение по п. 29, где рак, опосредованный одним или более белком семейства IAP, выбирают из острого лимфоцитарного лейкоза [ALL], хронического лимфоцитарного лейкоза [CLL], хронического миеломоноцитарного лейкоза [CMML], гиперэозинофильного синдрома, миелопролиферативных расстройств, миелодиспластического синдрома и промиелоцитарного лейкоза.
48. Способ получения соединения формулы (Iс) по любому из пп. 1-23, включающий
взаимодействие соединения формулы (II)
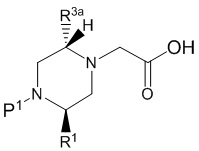
(II),
где R1 и R3a имеют значения, определенные в п. 1, и P1 представляет собой подходящую защитную группу, с соединением формулы (III)
(III),
где R6, R7, U, V и А имеют значения, определенные в п. 1, с последующей реакцией удаления защиты, подходящей для удаления P1 защитной группы.
49. Способ получения соединения формулы (Ic) по любому из пп. 1-23, включающий взаимодействие соединения формулы (III), определенного в п. 48, с соединением формулы (IV)
(IV),
где L1 и L2 независимо представляют собой подходящие удаляемые группы, с последующим взаимодействием с соединением формулы (V)
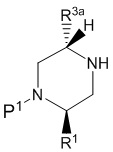
(V),
где R1 и R3a имеют значения, определенные в п. 1, и P1 представляет собой водород или подходящую защитную группу, с последующей реакцией удаления защиты, подходящей для удаления P1 защитной группы.
50. Способ получения соединения формулы (Ic) по любому из пп. 1-23, включающий удаление защиты у защищенного производного соединения формулы (Iс).
51. Способ получения соединения формулы (Ic) по любому из пп. 1-23, включающий взаимопреобразование соединения формулы (Iс) или его защищенного производного в другое соединение формулы (Iс) или его защищенное производное.
52. Способ получения соединения формулы (Ic) по любому из пп. 1-23, включающий образование фармацевтически приемлемой соли соединения формулы (Iс).
53. Способ по п. 49, где L1 и L2 независимо представляют собой галоген.
54. Способ получения соединения формулы (Iс) по п. 51, где взаимопреобразование соединения формулы (Iс) или его защищенного производного в другое соединение формулы (Iс) или его защищенное производное включает следующую реакцию:
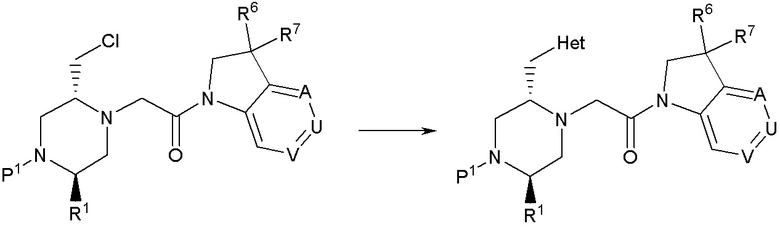 ,
,
где P1 представляет собой подходящую защитную группу и Het представляет собой 5-6-членную ароматическую или неароматическую гетероциклическую группу, содержащую до 4 гетероатомов, выбранных из N, O, S и окисленных форм N, где Het необязательно может быть замещена 1 или 2 группами Rb, и где Rb, R1, R6, R7, A, U и V имеют значения, определенные в п. 1, с последующей реакцией удаления защиты, подходящей для удаления P1 защитной группы.
55. Способ по любому из пп. 48, 49 и 54, где P1 представляет собой трет-бутилоксикарбонильную (tBoc) группу.
| WO 2004087714 A1, 14.10.2004 | |||
| ПРОИЗВОДНОЕ 1-[(ИНДОЛ-3-ИЛ) КАРБОНИЛ] ПИПЕРАЗИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И ЕГО ПРИМЕНЕНИЕ | 2003 |
|
RU2318821C2 |
| J | |||
| A | |||
| Flygare et al | |||
| "Small-molecule pan-IAP antagonists: a patent review" Expert Opinion, Vol | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| BP Eckelman et al | |||
| "The mechanism of peptide-binding specificity of IAP BIR domains" Cell Death and Differentiation, vol.20, 2008, 920-928. | |||
Авторы
Даты
2018-07-31—Публикация
2012-04-20—Подача