Настоящее изобретение относится к применению у млекопитающих аннелированных соединений пиррола и, в частности, ML3000, их солей или производных, при лечении и профилактике повреждения хрящевой и/или субхондральной кости и разрушения воспаленных суставов у таких млекопитающих. Такое повреждение хрящевой и/или субхондральной кости является естественным следствием процесса остеопороза и его последствий, когда он происходит у млекопитающего. Возможность достижения такого неожиданного эффекта названа «хондрозащитой».
Предпосылки изобретения
Нестероидные противовосполительные средства (NSAID), такие как ацетилсалициловая кислота (ASA), диклофенак, индометацин, ибупрофен и напроксен, широко используются в клинической медицине. С фармакологической точки зрения, они действуют как ингибиторы циклооксигеназы (COX).
Пирролизины, которые обладают сходным фармакологическим действием, известны из многих публикаций. Например, противовоспалительные активные пирролизины описаны в Arch. Pharm. 319, 65-69 (1986); 319, 231-234 (1986); 318, 661-663 (1985); 318, 663-664 (1985); 319, 500-505 (1986); 319, 749-755 (1986); 327, 509-514 (1994); 330, 307-312 (1997), а также в J. Med. Chem. 1987, 30, 820-823 и 1994, 37, 1894-1897.
Также можно указать пирролизины, описанные в US 5260451 (соответствует EP 0397175), а также в WO 95/32970; WO 95/32971; и WO 95/32972. Эти соединения представлены структурной формулой
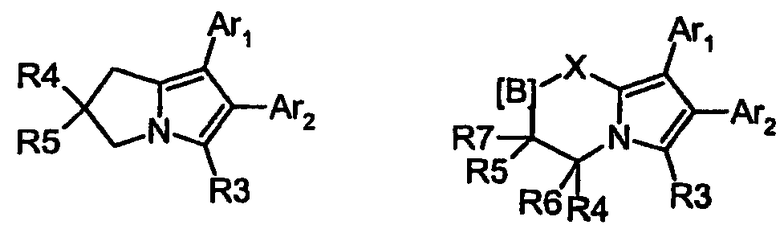
и содержат аннелированную диарилпиррольную группу, а также кислотный остаток R3 в качестве третьего заместителя. Эти соединения характеризуются высокой липофильностью, хорошей биодоступностью и средним уровнем продолжительности периода полувыведения, см. Drugs of the Future, 1995, 20 (10):1007-1009.
Кроме того, пирролизины подобного строения описаны в DE 19845446.6 и WO 01/05792. Более того, утверждается, что пирролизины, замещенные алкилсульфинилбензоилом и алкилсульфонилбензоилом, в соответствии с US 4232038, обладают противовоспалительными, аналгетическими и жаропонижающими свойствами. В соответствии с DE 19624290.8 и DE 19624289.4, некоторые соединения этого типа понижают уровень липидов.
ML3000 ([2,2-диметил-6-(4-хлорфенил)-7-фенил-2,3-дигидро-1H-пирролизин-5-ил]уксусная кислота) формулы (Ia)
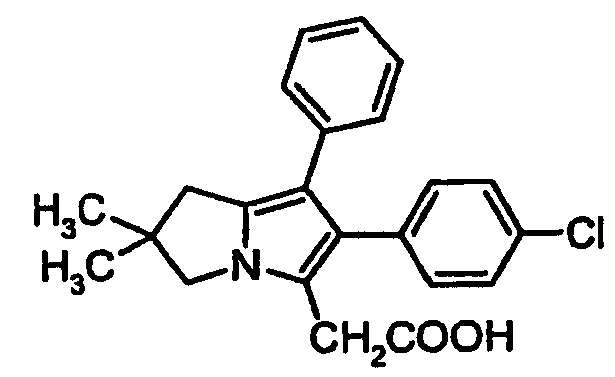
не обладая антиоксидантной активностью, является двойным сбалансированным ингибитором COX и 5-липоксигеназ (5-LO) (3). Препарат является неселективным ингибитором COX, ингибируя как COX-1, так и COX-2. Он обладает аналгетической, жаропонижающей и противовоспалительной активностью и, как было показано, оказывает сильный противовоспалительный эффект в большом количестве моделей на животных, включая отек конечности, вызванный каррагенаном, у крыс и адъювантный артрит крыс (4).
Остеоартрит (OA) является самым распространенным заболеванием среди болезней опорно-двигательного аппарата. В основном это заболевание поражает истинные суставы (диартрозы) несущих нагрузку конечностей, такие как тазобедренные и коленные суставы, а также поражает другие суставы, такие как межфаланговые суставы и суставы позвоночника. Структурные изменения при данном заболевании включают в себя прогрессирующее разрушение суставного хряща, образование остеофитов и, на клинической стадии заболевания, различную степень синовиального воспаления. С этими изменениями также связана значительная перестройка субхондральной кости, которая, по некоторым данным, вероятно, связана с чрезмерной резорбцией кости на ранних стадиях заболевания, с последующим чрезмерным костеобразованием, приводящим к склерозу кости и утолщению субхондральной кости.
Эти механизмы, приводящие к развитию и прогрессированию структурных изменений, наблюдаемых при остеоартрите (OA), включают в себя много факторов и являются многообразными и в большенстве своем остаются непонятными. Они вовлекают не только хрящ, в котором наблюдается большое число морфологических изменений, но также и синовиальную мембрану, которая является участком воспалительной реакции различной степени и тяжести (1). Вероятно, существует множество путей, ответственных за катаболизм матрикса хряща, включая повышение регуляции растворимых факторов, таких как интерлейкин-1 (IL-1), фактор некроза опухолей-α (TNF-α) и простагландины, которые могут индуцировать разрушение суставного хряща. Непосредственное повреждение хрондроцитов также стимулирует активность металлопротеазы матрикса (MMP), например, коллагеназ, стромелизинов и желатиназ, и продукцию различных медиаторов воспаления (2).
Предполагают, что метаболические процессы, постоянно протекающие в любом указанном выше суставе и необходимые для его восстановления и последующего нормального состояния, подвергают повреждению, такому как травматическое повреждение.
Следовательно, для того, чтобы соединение было приемлемым хондрозащитным агентом, оно, прежде всего, должно поддерживать такую метаболическую активность хондроцитов, то есть не ингибировать или не влиять на клеточное деление и биосинтез компонентов матрикса, которые является частью восстановительного процесса. В этом отношении, специалисту в данной области будет понятно, что большое количество NSAID обладают выраженной ингибиторной активностью в отношении биосинтеза главных компонентов внеклеточного матрикса.
В то же время, приемлемый хондрозащитный агент должен препятствовать деградирующей активности медиаторов, таких как различные цитокины, простагландины и протеиназы, в отношении хряща. Поэтому, что понятно специалисту в данной области, возможные хондрозащитные препараты следует оценивать как с точки зрения положительных эффектов в отношении анаболических путей, так и по их способности ингибировать катаболические процессы. Катаболические события, которые обычно рассматриваются, среди прочего, включают в себя высвобождение и ингибирование ферментов, деградирующих матрикс, действие на биосинтез простагландинов и лейкотриенов и способность препарата ингибировать IL-1, вызывающий деградацию суставного хряща.
Многие годы использовали ряд препаратов, таких как NSAID, активность которых была непосредственно связана с ингибированием ферментов COX. Хотя они способны эффективно снижать симптомы остеоартрита, такие как боль, они имеют ограниченную способность к снижению прогрессирования OA в экспериментах in vivo (8,9). При лечении тенидапом и царпрофеном - оба препарата являются NSAID с ингибиторной активностью в отношении как циклооксигеназы-1 (COX-1), так и COX-2, - эти препараты показали анти-OA действие (8,9), тогда как другие NSAID, такие как диклофенак или ASA, были неэффективны (10) или даже усиливали повреждение хряща в экспериментах на модели OA у собак (11). Аналогично, на людях последние исследования на основании критериев рентгенологического анализа пациентов, страдающих OA коленного сустава, показали, что, при лечении тиапрофеновой кислотой, другим представителем NSAID, в течение периода свыше 5 лет прогрессия повреждения хряща может не уменьшаться, а при лечении индометацином эта прогрессия может даже усиливаться (15).
Неожиданно были обнаружено, что некоторые аннелированные производные пиррола, такие как ML3000, значительно снижают развитие поражений экспериментального OA у собак. Защитный эффект этих соединений, в частности, был особенно очевиден в снижении развития поражений хряща. Этот феномен связывали не только со значительным ингибированием продукции как PGE2, так и LTB4, но также и со снижением in situ двух главных катаболических факторов, вовлеченных в деградацию хряща, а именно IL-1 и коллагеназы-1.
Краткое описание изобретения
Таким образом, настоящее изобретение относится к применению аннелированных производных пиррола, представленных общей формулой (I):
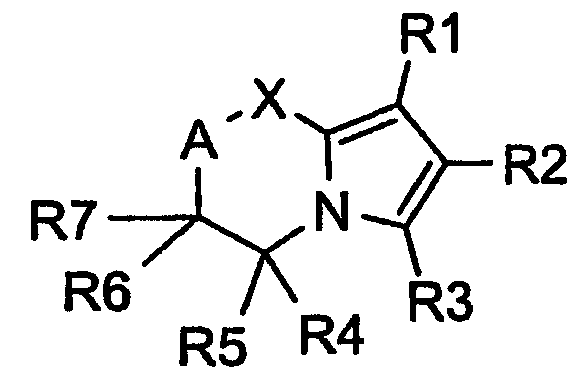
где X представляет собой CR8R9, S, O, NR12 или C(O);
A представляет собой CR10R11 или связь между X и атомом, несущим радикалы R6 и R7;
первый из радикалов R1, R2, R3 представляет собой арил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, включающей в себя галоген, алкил, галогеналкил, алкокси, арилокси, галогеналкокси, алкилтио, гидрокси, нитро, алкилсульфинил, алкилсульфонил, сульфамоил, N-алкилсульфамоил, N, N-ди-алкилсульфамоил, алкилсульфонамидо и алкилсульфон-N-алкиламидо; или ароматическую или неароматическую, моно- или бициклическую, необязательно бензоаннелированную, гетероциклическую группу с 1, 2 или 3 гетероатомами, независимо выбранными из N, O и S и, необязательно, замещенную одним или более одного заместителями, независимо выбранными из группы, включающей в себя галоген, алкил, галогеналкил, алкокси, арилокси, галогеналкокси, алкилтио, гидрокси, нитро, алкилсульфинил, алкилсульфонил, сульфамоил, N-алкилсульфамоил, N,N-ди-алкилсульфамоил, алкилсульфонамидо и алкилсульфон-N-алкиламидо;
второй из радикалов R1, R2, R3 представляет собой алкил, необязательно замещенный одним или более заместителями из группы, включающей в себя галоген, циклоалкил, алкокси, трифторметокси, гидрокси и трифторметил; циклоалкил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, включающей в себя галоген, алкил, галогеналкил, циклоалкил, алкокси, галогеналкокси и гидрокси; арил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, включающей в себя галоген, алкил, галогеналкил, алкокси, арилокси, галогеналкокси, алкилтио, гидрокси, нитро, алкилсульфинил, алкилсульфонил, сульфамоил, N-алкилсульфамоил, N,N-ди-алкилсульфамоил, алкилсульфонамидо и алкилсульфон-N-алкиламидо; или ароматическую или неароматическую, моно- или бициклическую, необязательно бензоаннелированную, гетероциклическую группу с 1, 2 или 3 гетероатомами, независимо выбранными из N, O и S, и необязательно замещенную одним или более заместителями, независимо выбранными из группы, включающей в себя галоген, алкил, галогеналкил, алкокси, арилокси, галогеналкокси, алкилтио, гидрокси, нитро, алкилсульфинил, алкилсульфонил, сульфамоил, N-алкилсульфамоил, N,N-ди-алкилсульфамоил, алкилсульфонамидо и алкилсульфон-N-алкиламидо;
третий из радикалов R1, R2, R3 представляеют собой H, алкил, галогеналкил, гидроксиалкил, -CHO, -COOH, галоген, циано, алкилсульфонил, сульфамоил или B-Y,
где
B представляет собой алкилен или алкенилен, необязательно замещенный гидрокси или алкокси;
Y представляет собой -COOH, SO3H, OPO(OH)2, OP(OH)2, -CHO или тетразолил; или
второй и третий радикалы из радикалов R1, R2, R3 представляют собой, вместе с атомом, к которому они присоединены, насыщенный или ненасыщенный циклоалкил;
R4-R11, которые могут быть одинаковыми или различными, представляют собой водород, алкил, гидроксиалкил, алкоксиалкил, гидрокси, COOH или ацилокси, где соседние радикалы могут также представлять связи или геминальные радикалы, вместе с атомом С, к которому они присоединены, могут также представлять собой карбонил или циклоалкил;
R12 представляет собой водород, алкил или фенил,
и к оптическим изомерам, физиологически приемлемым солям и производными, для лечения или профилактики дегенерации или деструкции суставного хряща и/или субхондральной кости.
Термин «алкил, алкокси и тому подобное» включает в себя линейные или разветвленные алкильные группу, такие как CH3, C2H5, н-пропил, CH(CH3)2, н-бутил, CH(CH3)-C2H5, изобутил, C(CH3)3, н-пентил или н-гексил, в частности, CH3, C2H5 или CH(CH3)2, предпочтительно содержащие, если не указано иного, от 1 до 8, в частности, от 1 до 6 и, более предпочтительно, от 1 до 4 атомов углерода; в качестве заместителей радикала R1-R12 «алкил, алкокси и тому подобное» предпочтительно содержат от 1 до 4 атомов углерода.
Замещенные «алкил, алкокси и тому подобное» включают в себя, в частности,
галогеналкил, то есть, алкил, который частично или полностью замещен фтором, хлором, бромом и/или йодом, например, CH2F, CHF2, CF3, CH2Cl, 2-фторэтил, 2-хлорэтил или 2,2,2-трифторэтил; в качестве заместителя радикала R1-R12 галогеналкил предпочтительно обозначает CHF2 и особенно CF3;
галогеналкокси, то есть алкокси, который частично или полностью замещен фтором, хлором, бромом и/или йодом, например, группы галогеналкокси соответствуют вышеуказанным группам галогеналкила; как заместитель радикала R1-R12 галогеналкокси предпочтительно обозначает OCHF2 и особенно OCF3;
алкоксиалкил, то есть, алкил, замещенный алкокси, например, -CH2-OCH3 или 2-метоксиэтил;
гидроксиалкил, то есть алкил, который предпочтительно монозамещен гидрокси, например, гидроксиметил или 2-гидроксиэтил;
трифторметилалкил, то есть алкил, который предпочтительно монозамещен трифторметилом, например, группы, описанные в отношении гидроксиалкила, которые замещены трифторметилом вместо гидрокси;
трифторметоксиалкил, то есть алкил, который предпочтительно монозамещен трифторметокси, например, группы, описанные в отношении гидроксиалкила, которые замещены трифторметокси вместо гидрокси;
циклоалкилалкил, то есть, алкил, который предпочтительно монозамещен циклоалкилом, например, группы, описанные в отношении гидроксиалкила, который замещен циклопропилом, циклобутилом, циклопентилом или циклогексилом вместо гидрокси.
Термин «циклоалкил» включает в себя моно- или бициклические алкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил и тому подобное, предпочтительно содержащие, если не указано иного, от 3 до 9, в частности, от 3 до 7 и, более предпочтительно, от 5 до 6 атомов углерода.
Термин «алкилен» включает в себя линейные или разветвленные алкиленовые группы, такие как метилен и этилен, предпочтительно содержащие, если не указано иного, от 1 до 8, в частности, от 1 до 6 и, более предпочтительно, от 1 до 4 атомов углерода. Если алкилен замещен гидроксилом или алкокси, то предпочтительно, если он является монозамещенным.
Термин «алкенилен» включает в себя линейные или разветвленные, моно- или полиненасыщенные алкиленовые группы, такие как этенилен, предпочтительно содержащие, если не указано иного, от 2 до 8, в частности, от 2 до 6 и, более предпочтительно, от 2 до 4 атомов углерода. Если алкенилен замещен гидроксилом или алкокси, то предпочтительно, если он является монозамещенным.
Ацилокси означает -OCOR, где R представляет собой алкил или арил. Предпочтительными примерами являются ацетилокси и бензоилокси.
-СООАлкил означает алкоксикарбонил, такой как CO-OCH3, CO-OC2H5, CO-OCH2-C2H5, CO-OCH(CH3)2, н-бутоксикарбонил, CO-OCH(CH3)-C2H5, CO-OCH2-CH(CH3)2, CO-OC(CH3)3, в частности, CO-OCH3, CO-OC2H5, CO-OCH(CH3)2 или CO-OCH2-CH(CH3)2.
-СООАлкФенил означает алкоксикарбонильную группу, которая замещена на алкильной группе фенилом, такую как бензилоксикарбонил.
Алкилтио означает -S-Алкил и также относится к алкилсульфанилу или алкилмеркапто, такому как SCH3, SC2H5, SCH2-C2H5, SCH(CH3)2, н-бутилтио, 1-метилпропилтио, 2-метилпропилтио, SC(CH3)3. Метилтио является предпочтительным.
Алкилсульфинил означает -S(O)-Алкил и также относится к алкилсульфоксо, такому как SO-CH3, SO-C2H5, н-пропилсульфинил, 1-метилэтилсульфинил, н-бутилсульфинил, 1-метилпропилсульфинил, 2-метилпропилсульфинил, 1,1-диметилэтилсульфинил. Метилсульфинил является предпочтительным.
Алкилсульфонил означает -S(O)2-алкил и также относится к алкилсульфону, такому как SO2-CH3, SO2-C2H5, н-пропилсульфонил, SO2-CH(CH3)2, н-бутилсульфонил, 1-метилпропилсульфонил, 2-метилпропилсульфонил, SO2-C(CH3)3. Метилсульфонил является предпочтительным.
Сульфамоил означает -S(O)2NH2 и также относится к амидосульфонилу или амиду сульфоновой кислоты.
N-Алкилсульфамоил означает монозамещенный сульфамоил-S(O)2NH-алкил, например, -S(О)2NH-CH3.
N,N-Диалкилсульфамоил означает ди-замещенный сульфамоил-S(O)2N-(алкил)2, где N-присоединенные алкильные группы могут быть одинаковыми или различными, например, -S(O)2N(CH3)2.
Алкилсульфонамидо означает -NHS(O)2-алкил, такой как NHSO2-CH3, NHSO2-C2H5, н-пропилсульфонамидо, NHSO2-CH(CH3)2, н-бутилсульфонамидо, 1-метилпропилсульфонамидо, 2-метилпропилсульфонамидо, NHSO2-C(CH3)3. Метилсульфонамидо является предпочтительным.
Алкилсульфон-N-алкиламидо означает -N(алкил)S(O)2-алкил, где N- и S-присоединенные алкильные группы могут быть одинаковыми или различными, например, N(CH3)SO2-CH3.
Карбонил, CHO, -COOH, -SO3H обозначает >C=O, формил, карбокси, карбоксикарбонил и сульфо- соответственно.
«Арил» предпочтительно означает нафтил и, в частности, фенил.
Термин «галоген» включает в себя атом фтора, хлора, брома или йода. Обычно предпочтительными являются фтор и хлор, и в некоторых случаях также бром.
«Гетероциклические остатки» включают в себя, в частности, 5- или 6-членные гетероциклические остатки, которые могут быть ароматическими или неароматическими, моно- или бициклическими и/или бензоаннелированными. Примерами являются азотсодержащие гетероциклические остатки, такие как пирролил, имидазолил, пиразолил, пиридазинил, пиразинил, индолил, хинолинил, особенно пиридил, пиримидил и изохинолинил. Ароматические остатки также включают в себя гетероциклические остатки, которые содержат атом кислорода или серы, такие как тиенил, бензотиенил, фуранил и особенно бензофуранил. Они также включают в себя гетероциклические остатки, содержащие 2 или более чем 2 различных гетероатомов, такие как тиазолил, изотиазолил, тиадиазолил, изоксазолил и оксазолил. Тиенил, пиридил и тиазолил являются предпочтительными ароматическими гетероциклическими остатками. Неароматические остатки включают в себя азотсодержащие гетероциклические остатки, такие как пирролидинил, пиперидинил и пиперазинил. Они также включают в себя гетероциклические остатки, которые содержат 2 или более 2 различных гетероатомов, такие как морфолинил.
Замещенные остатки, в частности, алкил, циклоалкил, арил и гетероарил являются предпочтительно моно-, ди- или тризамещенными.
[α]-Аннелированные соединения могут быть 6- или, особенно, 5-членными, гетероциклическими или - в особенности - алициклическими соединениями, если алициклическими, то ненасыщенными или, особенно, насыщенными, и/или замещенными или незамещенными.
[α]-Аннелированные производные пиррола формулы (I) включают в себя, в частности, производные, где Х представляет собой CR8R9, и A представляет собой связь между X и атомом, несущим радикалы R6 и R7 (пирролизины); X представляет собой CR8R9, и A представляет собой CR10R11 (индолизины); X представляет собой NR12, и A представляет собой связь между X и атомом, несущим радикалы R6 и R7 (пирроло[1,2-a]имидазолы); X представляет собой S, и A представляет собой связь между X и атомом, несущим радикалы R6 и R7 (пирроло[2,1-b]тиазолы); X представляет собой S, и A представляет собой CR10R11 (пирроло[2,1-b]1,3-тиазины); X представляет собой O, и A представляет собой CR10R11 (пирроло[2,1-b]1,3-оксазины); X представляет собой O, и A представляет собой связь между X и атомом, несущим радикалы R6 и R7 (пирроло[2,1-b]оксазолы), не указанные остатки имеют значения, определяемые выше.
Если [α]-аннелированное производное является 5-членным ненасыщенным остатком, то главным образом R4 и R6 представляют собой связь, так, например, как в пирролизине, пирроло[2,1-b]имидазоле и пирроло[2,1-b]тиазоле. Если [α]-аннелированное соединение является 6-членным ненасыщенным остатком, то главным образом R4 и R6, так, например, как в пирроло[2,1-b]1,3-тиазине, пирроло[2,1-b]-1,3-оксазине или 5,6-дигидроиндолизине, и, необязательно, также R8 и R10, так, например, как в индолизине, представляют собой связь.
Не ограничиваясь конкретным [α]-аннелированным производным по конкретному воплощению данного изобретения, R4-R7, которые могут быть одинаковыми или различными, представляют собой водород или алкил. В соответствии еще с одним из конкретных воплощений данного изобретения, по крайней мере одни из радикалов R4, R5, R6 и R7 представляет собой гидроксиалкил, в частности, гидроксиметил и оставшиеся радикалы из числа R4, R5, R6 и R7 независимо представляют собой H или алкил. В соответствии с этим воплощением, предпочтительно, чтобы R4 представлял собой гидроксиалкил, в частности, гидроксиметил, и R5 представлял бы собой H или алкил, а R6, R7 независимо представляли бы собой H или алкил. В соответствии еще с одним конкретным воплощением данного изобретения, один из радикалов R8 и R9 представляет собой H, алкил, гидроксиалкил или алкоксиалкил, а другой представляет собой гидроксил, алкокси, карбоксил или ацилокси, или R8 и R9, вместе с атомом C, к которому они присоединены, представляют собой карбонильную группу.
Особенно полезными являются 6,7-дигидро-5H-пирролизины, то есть соединения формулы (I), где X представляет собой CR8R9, A представляет собой связь между X и атомом, несущим радикалы R6 и R7, и R4, R5, R6, R7, R8, R9, которые могут быть одинаковыми или различными, имеют значения, приведенные выше, и предпочтительно представляют собой водород или алкил. Особенно предпочтительными являются 6,7-дигидро-5H-пирролизины, где R4-R9 представляют собой водород или по крайней мере один или два радикала R4-R9, например, R6 и/или R7 представляют собой алкил, в частности, метил.
В соответствии с важным аспектом настоящего изобретения, наиболее эффективными являются соединения формулы (I), где первый и второй радикал из радикалов R1, R2, R3, предпочтительно R1 и R2, независимо представляют собой систему, богатую π-электронами, выбранную из арильных и ароматических гетероциклических остатков, в частности, фенила, необязательно замещенных одним или более чем одним заместителем, которые, в частности, независимо выбраны из группы, включающей в себя галоген, алкил и галогеналкил, в частности, CF3, R1 предпочтительно представляет собой незамещенный фенил, и R2 предпочтительно представляет собой 4-замещенный фенил.
В соответствии еще с одним важным аспектом данного изобретения, особенно эффективными являются соединения формулы (I), где третий радикал из радикалов R1, R2, R3, предпочтительно R3, представляет собой кислотный остаток, такой как COOH, или B-Y, где Y представляет собой COOH, и B предпочтительно представляет собой алкилен, или представляет собой предшественник кислотной группы, такой как B-Y, где Y представляет собой тетразолил.
Особенно предпочтительным является применение соединения [6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1H-пирролизин-5-ил]уксусной кислоты (ML3000), представленной формулой (Ia):
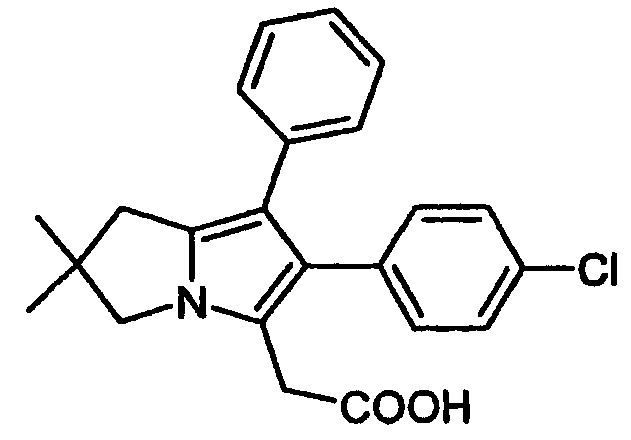
его физиологически приемлемых солей и производных, например физиологически гидролизируемых сложных эфиров.
Физиологически приемлемые соли включают в себя соли добавления кислот или оснований.
Солям добавления кислот являются, например, соли соединений формулы (I) с неорганическими кислотами, такими как хлористо-водородная кислота, серная кислота, азотная кислота или фосфорная кислота, или с органическими кислотами, в частности, карбоновыми кислотами, например, уксусной кислотой, винной кислотой, молочной кислотой, лимонной кислотой, яблочной кислотой, миндалевой кислотой, аскорбиновой кислотой, малеиновой кислотой, фумаровой кислотой, глюконовой кислотой или сульфоновой кислотой, например метансульфоновой кислотой, фенилсульфоновой кислотой и толуолсульфоновой кислотой и т.п.
Солями добавления основания являются, например, соли соединений формулы (I) с неорганическими основаниями, такими как гидроксид натрия или калия, или с органическими основаниями, такими как моно-, ди- или триэтаноламином и т.п.
Физиологически приемлемые производные включают в себя, в частности, пролекарства соединений формулы (I), которые преобразуются in vivo в соединения формулы (I) или их активные формы (метаболиты). Примерами являются гидролизируемые сложные эфиры соединений формулы (I), где третий радикал из радикалов R1, R2, R3 представляет собой кислотный остаток, например, его алкильный (третий радикал из радикалов R1, R2, R3, включающий в себя функциональную группу СООалкил), аралкильный (третий радикал из радикалов R1, R2, R3, включающий в себя функциональную группу СООалкарил, например, СООалкфенил), пивалоилоксиметильный, ацетоксиметильный, фталидильный, инданильный и метоксиметиловый сложный эфир.
В соответствии с особым аспектом, настоящее изобретение относится к применению хондрозащитных агентов, которые выбраны из числа соединений формулы (I).
Понятно, что используемый здесь термин «хондрозащитный агент» относится к тем соединениям, чье основное действие направлено на хрящ. Также нужно принять во внимание, что такие хондрозащитные агенты могут также обладать противовоспалительным действием в отношении синовиальной оболочки, могут положительно влиять на биосинетез клеток в субхондральной кости и в других соединительных тканях, таких как синовиальные фибробласты, и могут опосредовать миграцию клеток воспаления, с тем, чтобы препятствовать воспалительному процессу.
Настоящее изобретение относится к способу лечения и к эффективным в этом отношении фармацевтическим композициям, также вследствие этого подходящим образом упакованным, которые применимы для млекопитающих, имеющих или тех, которые могут иметь в будущем, повреждение или поражение суставного хряща и/или субхондральной кости в одном или нескольких суставах этого млекопитающего.
Использование соединений формулы (I) имеет определенные преимущество по сравнению с NSAID, особенно по сравнению с широко известными для применения, которые могут в действительности обострять прогресс остеоартрита, особенно тогда, когда показано длительное применение. Удивительно, что соединения формулы (I) эффективны при лечении или профилактике таких повреждений суставного хряща, при этом не оказывая побочного действия на процесс воспаления в таком суставе млекопитающего.
Способность соединений формулы (I) инвертировать процесс заболевания, которое в конце концов приводит к деструкции и поражению суставного хряща и/или субхондральной кости, имеет важное значение с точки зрения безопасности и эффективности лечения млекопитающих, особенно тех, у которых процесс дегенерации или деструкции суставного хряща и/или субхондральной кости находится на ранних стадиях.
Здесь под термином «млекопитающее(ие)» понимают любое млекопитающее, предпочтительно человека, кошку, собаку или лошадь и большое разнообразие их различных пород.
В соответствии с настоящим изобретением, лечение или профилактика дегенерации или деструкции суставного хряща и/или субхондральной кости в одном или нескольких суставах млекопитающих, при неоходимости такого лечения, заключается во введении указанному млекопитающему терапевтически эффективного количества для лечения или профилактики указанной дегенерации или деструкции суставного хряща и/или субхондральной кости одного или более одного соединения формулы (I).
Указанное лечение или профилактика главным образом включает в себя улучшение, уменьшение, усиление эффекта лечения, реверсию или профилактику любой дегенерации или деструкции, например, травмы, повреждения или поражения суставного хряща и/или субхондральной кости, особенно на указанных ранних стадиях указанной дегенерации или деструкции. Используемое здесь выражение «лечение или профилактика», относящееся к введению хондрозащитных соединений согласно настоящему изобретению относится как к терапевтической цели указанного введения, так и к терапевтическим результатам, по существу достигаемым указанным введением. Как рассматривается выше, объем терапии, осуществляемый введением указанного соединения, может находиться в области от улучшения состояния до значительного улучшения течения заболевания, и затем до активного лечения заболевания, включая реверсию патологического процесса. Наивысшую степень терапевтической эффективности дает профилактика любого повреждения или поражения суставного хряща и/или субхондральной кости на ранних стадиях дегенерации указанного суставного хряща и/или субхондральной кости.
Под выражением «ранние стадии дегенерации в суставном хряще и/или субхондральной кости» понимают самое начало определяемых патологических изменений в суставном хряще и/или субхондральной кости, которые являются результатом патологического процесса.
Хрящ представляет собой волокнистую соединительную ткань, существующую в нескольких формах, например, гиалиновый хрящ, эластический хрящ и волокнистый хрящ. Эта соединительная ткань состоит из воды, коллагена и протеогликанов, которые совместно образуют уникальный гидратированный гель, укрепленный волокнами, который является неэластичным, но упругим, и который обладает важной амортизационной способностью. Суставной хрящ представляет собой хрящ, находящийся в суставах млекопитающих. Он состоит из живых клеток (хондроцитов), которые синтезируют (и окружены им) интерстициальное вещество, обычно называемое внеклеточным матриксом. Хондроциты, продуцирующие внеклеточный матрикс в хряще, являются высокоактивными, и целостность такого матрикса поддерживается равновесием между действием катаболических цитокинов IL-1α, β и TNFα и анаболических цитокинов IGF и TGFβ. IL-1α, β и TNFα индуцируют продукцию специфических металлопротеаз, деградирующих матрикс, тогда как IGF и TGFβ действуют как факторы роста, индуцируют продукцию макромолекулярных строительных блоков хряща, коллагена и протеогликанов. Другие цитокины и их ингибиторы, а также тканевые ингибиторы металлопротеазы (TIMP) также влияют на это равновесие, называемое гомеостазом матрикса.
Использующийся здесь термин «металлопротеаза» относится к металлопротеазам матрикса (MMP), особенно включая те металлопротеазы этого ферментативного семейства, концентрация которых обычно увеличивается в процессе дегенерации суставного хряща, то есть, стромелизины, коллагеназы и желатиназы. Коллагеназа обычно отвечает за деградацию природного коллагена; стромелизин обычно отвечает за дегенерацию протеогликанов; и желатиназа обычно отвечает за деградацию денатурированного коллагена. Фермент аггреканаза со свойствами MMP также относится к этому классу, так как она отвечает за протеолиз агрегатов протеогликанов хряща, которые присутствуют на ранних стадиях дегенерации хряща. Тремя коллагеназами, присутствующими в суставном хряще на ранних стадиях дегенерации, являются коллагеназа-1 (MMP-1), коллагеназа-2 (MMP-8) и коллагеназа-3 (MMP-13). Из трех стромелизины, стромелизина-1 (MMP-3), стромелизина-2 (MMP-10) и стромелизина-3 (MMP-11), в суставном хряще на ранних стадиях его дегенерации присутствует только стромелизин-1.
Так как остеоартрит определен здесь как повреждение истинных суставов (подвижное, синовиальное сочленение), следовательно, в таких суставах всегда находится по крайней мере две поверхности кости, которые могут соприкасаться, но которые фактически окружены синовиальной мембраной, которая секретирует синовиальную жидкость, прозрачную щелочную вязкую жидкость, наполняющую суставную полость, и суставной хрящ, который вставлен между поверхностями сочлененных костей, обычно вместо синовиальной мембраны на этом месте.
Самые ранние макроскопические данные о патологии связаны с размягчением суставного хряща в обычно перегружаемых областях суставной поверхности, которые, в случае коленного сустава млекопитающего, особенно на моделях остеоартрита, включающих рассечение крестообразной связки в коленном суставе, состоят из бедренных мыщелков и большеберцового плато. С развитием остеоартрита целостность хрящевой поверхности повреждается, и суставной хрящ истончается с появлением вертикальных расщеплений, распространяющихся на всю толщину хряща, в процессе, называемом фибрилляцией. Движение сустава может вызвать фибрилляцию хряща до отщепления сегментов, оставляя без защиты нижнюю части кости (субхондральной), которая затем склерозируется. Также развиваются субхондральные кисты, которые могут быть наполнены синовиальной жидкостью. На границах сустава образуются остеофиты (костные шпоры).
Также в патологии дегенерации и деструкции хряща играют роль изменения в субхондральной кости. Изучение суставов млекопитающих, главным образом собак, которых подвергали фронтальному рассечению крестообразной связки, показали наличие субхондрального склероза и остеопении, то есть поражение кости в трубекуле субхондральной кости. Следствием этих изменений является утолщение субхондральной пластинки. Поражение субхондральной кости увеличивает механическое напряжение на расположенный выше суставной хрящ, что приводит к его дегенерации. Последующее утолщение субхондральной пластинки отрицательно влияет на основные механизмы восстановления и, таким образом, способствует прогрессии разрушения хряща.
Разрушение экстрацеллюлярного матрикса хряща сопровождается митотическим деление хондроцитов, которые затем образуют кластеры. Также происходит сокращение гликозаминогликановых компонентов хряща и неоднородное уменьшение протеогликанов. Во многих областях волокнистый хрящ, характеризующийся экстрацеллюлярным матриксом из толстых, компактных параллельных коллагеновых пучков, заменяется на гиалиновый хрящ. Однако необходимо отметить, что эти и вышеописанные патологические изменения в суставном хряще характерны для более поздних стадий остеоартрита, и что сначала возникает гипертрофия, то есть утолщение суставного хряща, как показано на модели с рассечением крестообразной связки млекопитающего, главным образом, на модели коленного сустава собак. Утолщение хряща происходит вследствие увеличения водного компонента, усиления синтеза протеогликанов и увеличения как содержания, так и концентрации протеогликанов в суставном хряще. Эта стадия гипертрофического восстановления суставного хряща может длиться некоторое время, но восстановленная хрящевая ткань лишена упругости и устойчивости к механическому стрессу, имеющихся в нормальном гиалиновом хряще. В конце концов, продукция протеогликанов ослабевает, и хондроциты не могут больше поддерживать свой внеклеточный матрикс. Эта заключительная стадия приводит к глубокому поражению суставного хряща.
Ранние стадии патологических изменений, приводящие к повреждению и поражению хряща, включают в себя попытку восстановления посредством увеличения синтеза макромолекул матрикса. Однако состав восстановленного хряща имеет дефекты в результате изменения композиции и распределения гликозаминогликанового компонента и изменения его способности к агрегации с гиалуроновой кислотой. Частицы, высвобождаемые в процессе патологических изменений, также могут вызывать воспалительные изменения синовиальной мембраны. Однако, несмотря на существующую патологию, начальные стадии повреждения и поражение хряща могут протекать без симптомов, с относительно слабой болью. Следовательно, существующей целью является идентификация тех компонентов внеклеточного матрикса и цитокинов, измеряемые изменения которых могут быть идентифицированы, профиль которых у млекопитающего на ранних стадиях повреждения и утраты хряща до возникновения фокального поражения хряща может быть идентифицирован радиографически. Достижение этой цели дает возможность диагностической классификации млекопитающих, являющихся кандидатами на раннее фармакологическое вмешательство еще до возникновения значительной дегенерации хряща.
Указанные патологические изменения в суставном хряще подразумевают изменения в составе, форме и плотности суставного хряща по сравнению с теми, которые были до начала указанного патологического процесса, приводящие к деградации полезных свойств указанного суставного хряща, включая силу, упругость, эластичность, конформационная целостность и стабильность, жизнеспособность и способность успешно противостоять различным типам механического стресса, особенно способность амортизировать механические удары. Эти патологические изменения в композиции главным образом включают в себя изменения в типе и количестве гликозаминогликанов и коллагеновых волокон в суставном хряще.
Патологические изменения в субхондральной кости включают в себя склероз, увеличение плотности наряду со снижением упругости и эластичности, и уменьшение способности к успешному сопротивлению механическому стрессу различных типов, особенно способности амортизировать механические удары. Эти патологические изменения главным образом включают в себя некорректное восстановление микротрещин трабекул с утолщением трабекул и патогенные изменения в продукции метаболитов остеобластов и дифференцированного фенотипа.
Синовит, то есть воспаление синовиальной оболочки, синовиальной мембраны может вносить вклад в патологическое повреждение и поражение хряща. Синовиальное воспаление характеризуется обширной инфильтрацией синовиальной жидкости мононуклеарными клетками, гиперплазией клеток синовиальной мембраны и появлением лимфоидных аггрегатов. Синовит вносит значительный вклад в повреждение хряща при ревматоидном артрите и других воспалительных артопатиях. Роль синовиального воспаления на ранних стадиях OA недостаточно понятна, однако синовит присутствует на клинической стадии OA.
В соответствии с первым аспектом настоящего изобретения, применение соединений формулы (I) направлено на лечение или профилактику дегенерации или деструкции суставного хряща и/или субхондральной кости, где указанная дегенерация или деструкция связана с остеоартритом. В частности, указанное использование непосредственно направлено на лечение или профилактику связанных с ним патологических изменений. Таким образом, настоящее изобретение также относится к лечению остеоартрита, где указанное лечение сопровождается терапевтически эффективным действием на суставной хрящ и/или субхондральную кость.
Лечение или профилактика дегенерации или деструкции суставного хряща и/или субхондральной кости может также включать в себя введение еще одного или более чем одного соединения формулы (I), одного или нескольких представителей группы, состоящей по существу из полисульфатированных гликозаминогликанов (PSGAG), глюкозамина, хондроитинсульфата (CS), гиалуроновой кислоты (HA), пентозанполисульфата (PPS), доксициклина и миноциклина.
Кроме того, соединения формулы (I) согласно изобретению также могут быть комбинированы с другими терапевтически активными ингредиентами, которые хорошо известны специалисту в данной области и выбор которых, как правило, определяется условиями, при которых вводится терапевтический агент согласно изобретению. Например, в том случае, когда сустав параллельно тяжело инфицирован микроорганизмами, например, бактериями, грибами, простейшими, вирусами и тому подобным, активный ингредиент согласно изобретению предпочтительно вводится в сочетании с одним или несколькими антибиотическими, противогрибковыми, противопротозойными, противовирусными или аналогичными терапевтическим агентами. Также активный ингредиент согласно изобретению может вводиться в сочетании с NSAIDs, а также с ингибиторами других медиаторов воспаления. Дополнительные классы таких ингибиторов и их примеры включают в себя, например, антагонисты H1-рецептора; антагонисты рецептора кинин-B1 и B2; ингибиторы простагландинов, такие как антагонисты рецепторов PGD, PGF PGI2 и PGE; ингибиторы тромбоксана A2 (TXA2); антагонисты рецептора PAF; золота в виде аурумтиогруппы вместе с различными гидрофильными группами; иммуносупрессивные агенты, например, циклоспорин, азатиоприн и метриксат; противовоспалительные глюкокортикоиды, например, дексаметазон; противопаразитные препараты с широким спектром действия, например, авермектины и милбемицины; пеницилламин; гидроксихлорохин; средства против подагры, например, колхицин, ингибиторы ксантиноксидазы, например, аллопуринол и урикозурические агенты, например, пробенецид, сульфинпиразон и бензбромарон.
Так как ранние стадии дегенерации суставного хряща преобладают среди гериатрических млекопитающих, специалисту в данной области будет понятно, что соединения формулы (I) могут также вводиться в сочетании с терапевтическими агентами, предназначенными для лечения множества заболеваний, синдромов и симптомов, которыми страдают млекопитающие в старости. Такие терапевтические агенты и состояния, при которых они могут использоваться, включают в себя, например, терапевтические агенты для улучшения когнитивных функций для улучшения памяти; и антидискинетические агенты/агенты для лечения паркинсонизма, например, селегелин. Другой большой класс таких терапевтических агентов включает в себя агенты против гипертензий и другие сердечно-сосудистые препараты, предназначенные для лечения гипертензии, ишемии миокарда, включая стенокардию, сердечную недостаточность с застойными явлениями и инфаркт миокарда, например, диуретики, вазодилятаторы, такие как гидралазин, антагонисты β-адренергических рецепторов, такие как пропранолол, ингибиторы ангиотензин-II-превращающего фермента (АСЕ-ингибиторы), такие как эналаприл, используемый для лечения гериатрических млекопитающих с митральной недостаточностью, и эналаприл вместе с ингибиторами нейтральной пептидазы, антагонисты рецептора ангиотензина II, такие как лозартан, ингибиторы ренина, блокаторы кальциевых каналов, такие как нифедипин, симпатолитические агенты, такие как метилдопа, α2-адренергический агонист, такой как клонидин, антагонисты α-адренергического рецептора, такие как празозин, и ингибиторы HMG-CoA-редуктазы (антигиперхолестеринемические агенты), такие как ловастатин или аторвастатин. Еще один класс таких терапевтических агентов включает в себя противоопухолевые агенты, особенно антимитотические препараты, включая алкалоиды барвинка, такие как винбластин и винкристин, для лечения различных форм рака; терапевтические агенты для лечения почечной недостаточности; препараты против ожирения для лечения проблем избыточного веса у млекопитающих; противопаразитарные препараты для лечения как эндо-, так и эктопаразитов, которыми обычно страдают млекопитающие; и противозудные средства для лечения различных типов зуда у млекопитающих.
Другие типы препаратов, которые могут использоваться в сочетании с противовоспалительными агентами согласно изобретению включают в себя средство, усиливающее синтез гормона роста; сильные анальгетики; местные и общие анестетики; и антагонисты Н2-рецептора и другие гастропротективные препараты. Специалисту в данной области понятно, что некоторые из представленных выше сочетаний терапевтических агентов могут зачастую использоваться для лечения различных острых состояний у млекопитающих, например, бактериальных инфекций одновременно присутствующих при дегенеративном заболевании сустава. Однако для специалиста в данной области так же, если не в большей степени, представляет интерес лечение хронических состояний млекопитающих.
В соответствии с режимом, который может использоваться для этой цели, предполагается, что соединения формулы (I) могут вводиться в сочетании с другими лекарственными препаратами, эффективными при постоянном лечении хронических состояний, таких как гиперлипидемия. Также полагают, что введение сочетаний может допускать большое число различных форм, оставаясь в рамках настоящего изобретения. Например, соединения формулы (I) можно легко комбинировать с одним или несколькими другими терапевтическими агентами, которые могут сочетаться необходимым образом, в удобной лекарственной форме, такой как пероральная таблетка, содержащая все препараты, образующие сочетание. При формировании композиции изменяющееся время полувыведения различных препаратов может быть согласовано специалистом в данной области путем создания форм с контролируемым высвобождением указанных препаратов с различным временем высвобождения таким образом, чтобы достигалось относительно одинаковое дозирование. Корм, насыщенный лекарством, использующийся здесь как лекарственная форма, также может быть получен в соответствии с хорошо известными правилами в области получения композиции, где используемые в сочетании лекарственные препараты просто находятся в смеси в составе корма. В настоящем изобретении также рассматривается одновременное введение, при котором сочетание препаратов достигается одновременным введением препаратов, которые должны вводиться в сочетании. Такое одновременное введение может достигаться даже посредством введения различных лекарственных форм и различными путями введения. В настоящем изобретении, кроме того, рассматривается применение таких сочетаний согласно различным, но постоянными и продолжительными графиками приема препарата, в силу чего у млекопитающих, получающих препарат, поддерживаются желаемые уровни вводимого препарата в плазме, даже если препараты, образующие сочетание, не вводятся указанному млекопитающему одновременно. Все такие сочетания могут быть приемлемы в данной области для разработки и введения.
Когда соединения формулы (I) используются в качестве активных ингредиентов в способах и композициях согласно изобретению, они могут вводиться в стандартных фармацевтических формах. Таким образом, настоящее изобретение также относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и количество соединения формулы (I), указанного выше, терапевтически эффективное для лечения или профилактики указанной дегенерации или деструкции суставного хряща и/или субхондральной кости. Например, они эффективны при системном или местном, пероральном или парентеральном применениях, и для этой цели они объединены с эффективными фармацевтическими эксципиентами, разбавителями и адъювантами, например органическими и неорганическими инертными носителями, такими как вода, желатин, лактоза, крахмал, стеарат магния, тальк, растительное масло, камедь, полиалкиленгликоли и тому подобное. Эти фармацевтические препараты могут использоваться в твердой форме, например, в виде таблеток, капсул и особенно в сочетании или в смеси с кормом, приятным на вкус и подходящим для млекопитающих; или же они могут вводиться в жидкой форме, например в виде растворов и эликсиров. Фармацевтические эксципиенты и адъюванты, которые могут быть добавлены, включают в себя консерваты, антиоксиданты, противомикробные агенты и другие стабилизаторы; смачивающие, эмульгирующие и суспендирующие агенты и противослеживающие соединения; ароматические и окрашивающие добавки; композиции для улучшения сжимаемости или создания замедленного, постоянного или контролируемого высвобождения активного ингредиента; и различные соли для изменения осмотического давления фармацевтического препарата или для действия в качестве буфера. Конкретные лекарственные формы, которые были успешно использованы, включают в себя 5% смешано-мицеллярный раствор ML3000 для внутривенного введения, 3% пасту, приятную на вкус, и пероральные таблетки.
Терапевтически эффективное количество соединения формулы (I), как указано, может системно вводиться указанному млекопитающему, где указанное системное введение включает в себя (1) инъекцию или инфузию в подходящую ткань или полость организма фармацевтической композиции, содержащей указанное соединение в подходящей жидкой форме, такой как водные растворы, эмульсии или суспензии для его внутриартериальной, интрадермальной или чрескожной (включая подкожную), или интраспинальной, особенно интратекальной, и, наиболее часто, внутримышечной или внутривенной доставки; или для использования в качестве депо для его доставки; (2) введение в подходящую ткань или полость организма фармацевтической композиции, содержащей указанное соединение в подходящей твердой форме, например, содержащей связующее вещество биосовместимых и биоразлагаемых веществ, в котором диспергированы частицы твердого хондрозащитного соединения формулы (I) или в которые, возможно, включены глобулы или отдельные клетки жидкого хондрозащитного соединения формулы (I), для использования его в качестве твердого имплантанта для замедленного, постоянного и/или контролируемого высвобождения; или (3) введение или поступление с пищей фармацевтической композиции, содержащей указанное соединение в подходящей твердой или жидкой форме, для чрескожной доставки, например, чрескожный пластырь или субэпидермальный (субкутикулярный) имплантант, для пероральной доставки.
Значительное количество описанных здесь лекарственных форм может быть получено таким образом, чтобы обеспечить замедленное, постоянное и/или контролируемое высвобождение активного ингредиента из указанной лекарственной формы.
Эффективной лекарственной формой ML3000 для контролируемого высвобождения согласно изобретению является форма, при которой уровень ML3000 в плазме поддерживается выше 100 нг/мл почти в течение суток после единичного приема дозы 5 мг/кг. Предпочтительными пероральными лекарственными формами ML3000 для контролируемого высвобождения согласно изобретению являются формы, при которых концентрация ML3000 в плазме поддерживается выше 100 нг/мл в период, больший, чем период, при котором поддерживается сопоставимый уровень ML3000 в плазме после приема лекарственной формы с немедленным высвобождением, когда указанная лекарственная форма с немедленным высвобождением вводится в той же дозе.
Лекарственная форма с немедленным высвобождением ML3000, содержащая дозы 2,5 и 5 мг/кг, поддерживает концентрацию ML3000 в плазме выше 100 и 200 нг/мл в течение 8 часов, соответственно.
Предпочтительными пероральными лекарственными формами для системного введения являются твердые формы, например пероральные композиции с приятным вкусом, такие как быстро растворяющиеся галеты, таблетки, капсулы, таблетки в форме капсулы и тому подобное с приятным вкусом, и жидкости, например растворы, суспензии, эмульсии и тому подобное. Могут использоваться специальные типы фармацевтических композиций, подходящие для перорального введения млекопитающим, и они включат в себя, но ими не ограничиваются, такие типы как пероральная паста, которую наносят на заднюю часть языка млекопитающему, подвергаемому лечению, гранулярная форма, которая доставляется путем включения в пищу млекопитающего, и жевательная форма, в которой активный ингредиент поглощается вместе с вкусной жвачкой, либо жевательная форма, которая может доставлять активный ингредиент путем поглощения несъедаемой жвачки в процессе жевания млекопитающим, подвергаемым лечению.
Указанное терапевтически эффективное количество соединения формулы (I), как указано, может также вводиться указанному млекопитающему местно, где указанное местное введение включает в себя (1) инъекцию или инфузию в локальный участок дегенерации или деструкции суставного хряща и/или субхондральной кости фармацевтической композиции, содержащей указанное соединение формулы (I) в подходящей жидкой форме для ее доставки, включая компоненты, которые обеспечивают замедленное, контролируемое и/или постоянное высвобождение указанного соединения на указанном локальном участке; или для применения в качестве депо для его доставки, где указанная композиция обеспечивает хранение указанного соединения и впоследствии его замедленное, постоянное и/или контролируемое высвобождение; или (2) введение фармацевтической композиции, содержащей указанное соединения в подходящей твердой форме, для использования в качестве твердого имплантанта для его доставки, указанная композиция необязательно обеспечивает замедленное, постоянное и/или контролируемое высвобождение указанного соединения на указанном локальном участке.
Местное введение сосредоточено на соответствующих тканях сустава, в которые может вводиться путем инъекции, инфузии, имплантироваться, депонироваться, вставляться или вводиться капельным путем соединение формулы (I). Такое введение может включать в себя, но ими не ограничиваться, внутрисуставное, интрахондральное, внутриреберное, внутрисвязочное, интрамедуллярное, внутримышечное, внутрикостное, внутритазовое, интраспинальное, интрастернальное, интрасиновиальное, внутрипредплюсное, интратекальное или внутривенное введение.
Фармацевтические композиции в жидкой форме, содержащие хондрозащитное соединение формулы (I), имеют преимущества инъекционного введения жидкости в участок сустава или в участок, находящийся рядом. При введении соединения формулы (I) непосредственно в сустав можно достичь высокой концентрации указанного соединения за короткий период времени, таким образом не только улучшая доступ указанного соединения к тканям сустава и, следовательно, улучшая терапевтическую активность соединения формулы (I), но в то же время сводя к минимуму неблагоприятные побочные реакции, которые в противном случае могут возникнуть. Результатом является высокая местная концентрация соединения формулы (I) и соответственно низкая системная концентрация.
Материал для инъекций также может быть получен из фармацевтических композиций, содержащих хондрозащитное соединение формулы (I), где фармацевтическая композиция составлена в виде композиции для замедленного, контролируемого или постоянного высвобождения. Эти смеси указанной композиции могут быть твердыми, полутвердыми, гелями или иными твердо/жидкими сочетаниями, в которых для продолжительного высвобождения соединения формулы (I) с предопределенной скоростью или изменяющимися скоростями, если желательно, используется разрушающийся матрикс или серия покрытий. Для описания этих смесей используются термины «длительное высвобождение» и «действие в течение длительного времени». Все эти различные сочетания биоразлагаемых полимеров, например, различных целлюлозных полимеров и природных материалов, например, кукурузный крахмал и стеарат магния, используются для получения медленного и/или равномерного распределения соединения формулы (I), содержащегося в матриксе. Эти фармацевтические композиции могут вводиться путем инъекции в соответствующий участок сустава, являясь, соответственно, жидкими или суспендированными, или могут быть доставлены другим способом, если по своей природе являются более твердыми.
Терапевтически эффективным количеством соединения формулы (I) для лечения или профилактики дегенерации или деструкции суставного хряща и/или субхондральной кости является количество, вводимое млекопитающему, при необходимости такого лечения, в количестве, выраженное в миллиграммах на килограмм массы тела указанного млекопитающего в день: «мг/кг/день». Используемое выражение «в день» не должно быть интерпретировано как обязательное требование ежедневного введения млекопитающему, при необходимости такого введения, любой конкретной лекарственной формы. Выражение «в день» является лишь обозначением наименьшего подходящего, но произвольного участка времени, который используется как часть суммарного отрезка для измерения дозы вводимого хондрозащитного соединения. Доза, то есть терапевтически эффективное количество соединения формулы (I) для лечения или профилактики дегенерации или деструкции суставного хряща и/или субхондральной кости обычно заключена в пределах примерно от 0,1 мг/кг/день до 20,0 мг/кг/день, предпочтительно, примерно от 0,1 мг/кг/день до 12,0 мг/кг/день, более предпочтительно, примерно от 0,5 мг/кг/день до 10,0 мг/кг/день, и, наиболее предпочтительно, примерно от 0,5 мг/кг/день до 8,0 мг/кг/день. Обычные лекарственные формы и количества в случае ML3000 включают в себя пероральное введение ML3000 с дозой в пределах от 2,5-5,0 мг/кг/день массы тела.
Специалисту в данной области необходимо не только определить предпочтительный путь введения и подходящую лекарственную форму и количество, но указанный специалист также должен определить режим введения дозы, то есть частоту ее введения. В общих условиях, наиболее подходящим является выбор между введением дозы один раз в сутки (s.i.d.) и введением дозы два раза в сутки (b.i.d.), и между тем, что первый вариант обеспечивает быстрый и сильный эффект лечения, тогда как последний вариант не обеспечивает сильного эффекта, но обеспечивает продолжительное лечение. Однако в этом общем правиле не принимаются во внимание такие важные переменные как конкретный тип претерпевающего дегенерацию или деструкцию суставного хряща или субхондральной кости, использующийся конкретный терапевтический агент и его фармакокинетические свойства и конкретный пациент (млекопитающее), которому назначают лечение. Для одобренного рыночного продукта большая часть этой информации уже имеется в результате клинических исследований, проводимых для получения такого одобрения. В других случаях эта информация может быть легко получена в соответствии со способами и принципами согласно настоящему подробному описанию в свете знаний в данной области. Полученные результаты также могут быть скоррелированы с данными, полученными из соответствующих оценок разрешенного продукта на основании тех же способов анализа.
Также настоящее изобретение относится к упаковке, подходящей для коммерческого использования для лечения или профилактики дегенерации или деструкции суставного хряща и/или субхондральной кости одного или нескольких суставов у млекопитающего, при необходимости такого лечения, состоящая из подходящего упаковочного картона и находящегося в нем внутреннего сменного контейнера; заключенной в указанный контейнер подходящей лекарственной формы соединения формулы (I), описанного выше; и сопровождающей указанный упаковочный картон или контейнер распечатанной инструкции и справочного материала, который может быть закреплен на указанном упаковочном картоне или на указанном контейнере, вложен в указанный упаковочный картон или изображен на неотъемлемой части указанного упаковочного картона или контейнера, указанная инструкция или справочный материал начинается со слов, которые сообщают читателю, что указанный активный ингредиент при введении млекопитающему с дегенерацией или деструкцией суставного хряща и/или субхондральной кости в одном или нескольких суставах улучшит, уменьшит, окажет эффективное влияние, будет способствовать реверсии или предотвращению любого повреждения или поражения суставного хряща или субхондральной кости. В предпочтительном воплощении указанная упаковка, состоящая из упаковочного картона и контейнера, как описано выше, соответствует всем нормативным требованиям, связанным с продажей и использованием препаратов для лечения животных, включая, в частности, указанную инструкцию и справочный материал.
Дополнительным объектом настоящего изобретения является упаковка, описанная непосредственно выше, состоящая из подходящего описанного контейнера; заключенной в указанный контейнер пероральной лекарственной формы соединения формулы (1); и сопровождающей указанный контейнер распечатанной инструкции и справочного материала, описанного выше.
Также в настоящем изобретении описывается способ, включающий в себя две основные стадии: (I) определение состояния млекопитающего, являющегося кандидатом для лечения, у которого уже имеется или наступит в дальнейшем состояние дегенерации или деструкции суставного хряща и/или субхондральной кости одного или нескольких суставов этого млекопитающего, таким образом подтверждая, что указанное млекопитающее нуждается в таком лечении; и затем (II) лечение или профилактика указанного состояния путем введения указанному млекопитающему терапевтически эффективного количества для лечения или профилактики указанной дегенерации или деструкции суставного хряща и/или субхондральной кости хондрозащитного соединения формулы(I). Различные аспекты стадии (II) уже были подробно описаны выше. Поэтому сейчас более подробно будут рассмотрены аспекты стадии (I).
Поскольку речь идет о диагностике, целесообразно установить состояние млекопитающего, которое является возможным объектом для лечения в соответствии с настоящим изобретением, в том отношении, имеется ли у млекопитающего в настоящий момент или будет ли иметься в будущем состояние дегенерации или деструкции суставного хряща и/или субхондральной кости в одном или нескольких суставах указанного млекопитающего. Используемое здесь выражение «в настоящий момент или в будущем» подразумевает, что, в соответствии с описываемыми ниже способами вынесения этого решения, можно определить, нуждается ли млекопитающее, являющееся кандидатом, в лечении в настоящий момент или, весьма вероятно, будет нуждаться в таком лечении в ближайшем будущем. Необходимость лечения в будущем может быть установлена на основании определения известных факторов, которые из практики специалиста в данной области непосредственно приводят к состоянию дегенерации или деструкции суставного хряща и/или субхондральной кости. Например, специалист в данной области может определить по данным клинического исследования млекопитающего, что у него начинается дисплазия бедра, и может подкрепить эти выводы радиографическим доказательством, из которого может быть определено, в соответствии с общепринятыми способами измерения, что у млекопитающего в скором будущем начнется дисплазия бедра.
Статус указанного млекопитающего как уже имеющего или у которого еще наступит состояние дегенерации или деструкции, и особенно на указанных ранних стадиях, а следовательно, нуждающегося в таком лечении, в частности, определяют
(A) по положительным результатам клинического артроскопического обследования и оценки суставов млекопитающего, возможно, нуждающегося в лечении. Диагностика начинающейся или существующей дисплазии бедра уже обсуждалась. Другие клинические симптомы и признаки могут включать в себя симптомы и признаки, полученные при непосредственном обследовании суставов млекопитающего, возможно, нуждающегося в лечении;
(B) по проведению любых инвазивных хирургических процедур на одном или нескольких суставах млекопитающего, что в большинстве случаев могло бы быть достаточной причиной для решения о необходимости такого лечения. Это следует из того факта, что инвазивная хирургия сустава млекопитающего неизбежно приводит к ухудшению способности этого сустава справляться со своей привычной нагрузкой так же эффективно, как это было до операции. Повышенная механическая нагрузка на сустав может, из практики специалиста в данной области, непосредственно приводить к ранним стадиям дегенерации суставного хряща и/или субхондральной кости. Такое хирургическое вмешательство в области сустава также может вызывать приток крови и других жидкостей, содержащих цитокины и другие факторы, которыя являются причинными факторами воспаления, и, таким образом, может дать возможность их миграции и абсорбции на твердых тканях сустава, включая хрящ и/или субхондральную кость. Специалисту в данной области следует принять во внимание, что это также может непосредственно привести к ранним стадиям дегенерации суставного хряща и/или субхондральной кости;
(C) по положительным результатам осмотра одного или нескольких суставов указанного млекопитающего, с использованием неинвазивных процедур, в том числе радиографической и магнитно-резонансной томографии (MRI). Последним методом, по сравнению с первым, можно лучше оценить состояние мягких тканей. MRI является методом полипозиционной сцинтиграфии организма с высоким контрастными разрешением мягких тканей. Так как с помощью MRI можно вируализировать изменения в мягких тканях, он подходит для визуализации изображения при патологии на ранних стадиях дегенерации суставного хряща и субхондральной кости;
(D) по положительным результатам биохимического анализа, проводимого на жидкостях организма или суставной ткани млекопитающего, являющегося кандидатом для лечения, в отношении одного или нескольких из следующих веществ: увеличение интерлейкина-1 бета (IL-1β); увеличение фактора некроза опухоли альфа (TNFα); увеличение отношения IL-1 β и белкового антагониста рецептора IL-1 (IL-1Ra); увеличение экспрессии рецепторов p55 TNF (p55 TNF-R); увеличение интерлейкина-6 (IL-6); увеличение фактора ингибирования лейкемии (LIF); норма или снижение инсулиноподобного фактора роста 1 (IGF-1); снижение трансформирующего фактора роста бета (TGF); норма или снижение тромбоцитарного фактора роста (PDGF); норма или снижение основного фактора роста фибробластов (b-FGF); увеличение кератинсульфата; увеличение стромелизина; увеличение отношения стромелизина к тканевым ингибиторам металлопротеаз (TIMP); увеличение остеокалцина; увеличение щелочных фосфатаз; увеличение ответа цАМФ на гормональный сигнал; увеличение ингибитора плазминогена урокиназного типа (uPA); увеличение олигомерного белка хрящевого матрикса и увеличение коллагеназы.
IL-1, который встречается в виде IL-1α и IL-1β, представляет собой катаболический цитокин, который опосредует повреждение и поражение суставного хряща в суставах млекопитающих. Он вызывает супрессию синтеза коллагена типа II, находящегося в суставном хряще, при этом увеличивая синтез коллагена типа I, характерного для фибробластов; индуцирует продукцию ферментов, вовлеченных в деградацию матрикса; и супрессирует способность хондроцитов синтезировать новые протеогликаны. Число рецепторов IL-1 на поверхности хондроцитов суставного хряща на ранних стадиях дегенерации, которые должны быть заняты, чтобы вызывать продукцию ферментов катаболизма, составляет лишь одну четвертую от числа, необходимого в норме (1% против 4%). IL-1 и его модулятор IL-1Ra продуцируются аутокринным и паракринным способом одними и теми же синовиальными макрофагами, и в присутствии гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) продукция IL-1Ra может увеличиваться. Однако между активностью IL-1 и IL-1Ra существует значительная диспропорция, для прекращения эффектов Il-1 требуется приблизительно в 130 раз больше IL-1Ra, что было измерено на хондроцитах и на эксплантатах хряща. Любое нарушение баланса между IL-1 и IL-1Ra будет дополнительно усиливать дегенерацию суставного хряща.
Следовательно, соответствующим объектом является измерение уровней IL-1 и IL-1Ra и их соотношения у млекопитающих с дегенерацией суставного хряща на ранней стадии, и измерение тех же показателей у непораженных млекопитающих, с тем, чтобы измеримые изменения можно было идентифицировать как профиль млекопитающих на ранних стадиях повреждения и утраты хряща перед идентификацией очаговое поражение хряща радиографически. Эти результаты дают диагностическую классификацию млекопитающих, которые являются кандидатами для раннего фармакологического вмешательства перед началом значительной дегенерации хряща. Более того, можно определить количественное соотношение макрофагов, секретирующих IL-1α и IL-1β, присутствующих в синовиальной жидкости и синовиальной ткани сустава на ранних стадиях дегенерации суставного хряща, и оно значительно выше количественного соотношения тех же клеток, выделенных из синовиальной жидкости и синовиальной ткани нормальных суставов, то есть суставов, в которых не протекают ранние стадии дегенерации суставного хряща. И опять, эти результаты представляют диагностическую классификацию млекопитающих, которые являются кандидатами для раннего фармакологического вмешательства до начала значительной дегенерации хряща.
Более того, изменения в субхондральной кости, протекающие до макроскопических изменений в суставном хряще, появляются в результате доступа цитокинов, ответственных за инициацию и поддержание воспалительного процесса, к нижним слоям хряща через микротрещины поперек кальцифицированной зоны. Метаболизм вовлеченных хондроцитов подвергается неблагоприятным воздействиям, и, кроме того, хондроциты в срединной зоне суставного хряща продуцируют большое количество цитокинов, включая цитокины, ответственные за инициацию и поддержание воспалительного процесса. Эти хондроциты, действующие аутокринным путем, таким образом способствуют разрушению собственного внеклеточного матрикса. Увеличение содержания воды в суставном хряще также содействует этому процесс путем увеличения диффузии цитокинов воспаления по всему матриксу. Следовательно, соответствующим объектом является измерение уровней различных воспалительных цитокинов, продуцируемых хондроцитами, синовиальными клетками и/или субхондральными остеоцитами у млекопитающих, особенно собак, в процессе дегенерации суставного хряща, и измерение тех же показателей у не пораженных млекопитающих, с тем, чтобы измеримые изменения можно было идентифицировать как профиль у млекопитающих на ранних стадиях повреждения и утраты хряща перед идентификацией очаговой утраты хряща радиографически.
Фактор некроза опухоли альфа (TNFα) обладает одной десятой активности IL-1 в отношении дегенерации суставного хряща, но его концентрация в синовиальной жидкости значительно увеличивается в коленных суставах млекопитающих, особенно при рассечении крестообразных связок, по сравнению с противоположным неоперированным коленом. Также увеличивается экспрессия рецепторов p55 TNF (TNF-R) на хондроцитах, выделенных из суставного хряща, присутствующих в таких коленных суставов. Следовательно, так как TNFα играет роль в патологических изменения, которые происходят на ранних стадиях повреждения и поражения хряща, следовательно, он является подходящим объектом для измерения уровней TNFα и TNF-R в суставах млекопитающих на ранних стадиях дегенерации суставного хряща и идентичных значений у здоровых млекопитающих, с тем, чтобы измеримые изменения можно было идентифицировать как профиль у млекопитающих на ранних стадиях повреждение и утраты хряща перед идентификацией очаговой утраты хряща радиографически. Эти результаты дают диагностическую классификацию млекопитающих, которые являются кандидатами для раннего фармакологического вмешательства до начала значительной дегенерации хряща.
Интерлейкин-6 (ИЛ-6) является многофунциональным цитокином, но играет роль в воспалении, и его повышенные уровни, по сравнению с контрольными, определяют в суставах и синовиальной жидкости при повреждении. IL-6 также отвечает за повышение экспрессии TNF-R на хондроцитах и увеличение продукции протеогликанов хондроцитами, а также индукции высвобождения гликозаминогликанов. Измерение уровней IL-6 в суставах, синовиальной жидкости и хондроцитах суставов млекопитающих на ранних стадиях повреждения и утраты суставного хряща по сравнению с контролем может использоваться как диагностический набор для идентификации млекопитающих, которые являются соответствующими кандидатами для фармакологического лечения, перед тем как любая очаговая утрата хряща становится заметной при радиографическом анализе.
Фактор ингибирования лейкемии (LIF) продуцируется моноцитами, гранулоцитами, T-клетками, фибробластами и другими клетками, связанными с состоянием воспаления. Синовиоциты и хондроциты синтезируют и секретируют LIF в присутствии IL-1β и TNFα. Таким образом, измерение относительного увеличения уровней LIF может использоваться диагностически для выбора млекопитающих, которые являются кандидатами для фармакологического лечения на ранних стадиях повреждения и утраты суставного хряща.
Дегенерация, повреждение и утрата суставного хряща у млекопитающих вызвана дисбалансом между цитокинами, которые запускают вышеописанные катаболические процессы, и теми цитокинами, которые отвечают за поддержание синтетических и пролиферативных ответов хондроцитов в хряще. Инсулиноподобный фактор роста (IGF-1), трансформирующий фактор роста бета (TGF), полученный из тромбоцитов фактор роста (PDGF) и фактор роста фибробластов, например, основной фактор роста фибробластов (b-FGF) являются митогенными факторами в отношении хондроцитов и стимулируют синтез матрикса в суставном хряще.
Инсулиноподобный фактор роста (IGF) существует в виде типа I и типа II, и IGF-1 является эффективным медиатором синтеза хряща. Более того, он снижает деградацию и стимулирует синтез протеогликанов даже в присутствии IL-1β и TNFα. Сывороточные уровни IGF-1 поддерживаются высокоаффинными связывающими белками (IGF-BP), и IGF-1 является важнейшим фактором как в круговороте веществ в кости, так и в хряще. Уровни IGF-1 по сравнению с контролем позволяют дать диагностическую оценку млекопитающему, которое является кандидатом для раннего фармакологического лечения дегенерации суставного хряща.
Трансформирующий фактор роста (TGF) продуцируется хондроцитами и является мощнейшим митогеном в круговороте веществ как хряща, так и кости. Более того, он стимулирует синтез матрикса и обладает противовоспалительной активностью. Он также ингибирует деградацию матрикса, стимулируя продукцию ингибиторов протеаз и блокируя высвобождение коллагеназы и металлопротеазы. Также он стимулирует восстановление хряща, стимулируя продукцию коллагена, фибронектина, ингибиторов активаторов плазминогена и тканевых ингибиторов металлопротеаз (TIMP) различными клетками сустава млекопитающих. На ранних стадиях повреждения и утраты суставного хряща у млекопитающих уровни TGFβ в синовиальной жидкости являются низкими. Следовательно, уровни TGFβ по сравнению с контролем позволяют дать диагностическую оценку млекопитающему, которое является кандидатом для раннего фармакологического лечения дегенерации суставного хряща.
С прогрессированием дегенерации, то есть катаболизма суставного хряща в суставах млекопитающих, увеличивается число метаболитов, которые могут использоваться в качестве маркеров дегенерации хряща, как на его наличие, так и на его прогрессирование. Например, при дегенерации хряща с участием IL-1α и IL-1β или TNFα высвобождаются гликозаминогликаны (GAGS), которые могут быть измерены в синовиальной жидкости исследуемого млекопитающего. Более того, уровни GAG изменяются после лечения, так что можно контролировать ход фармакологического вмешательства, используя в качестве маркеров круговорота веществ в суставном хряще уровни GAG синовиальной жидкости.
Так как в процесс деградации суставного хряща вовлечен коллаген, а также другие компоненты хряща, некоторые продукты коллагена служат в качестве маркеров деградации хряща у млекопитающих, особенно при повреждении и утрате суставного хряща у собак. В жидкостях организма, таких как синовиальная жидкость, плазма или моча, могут быть идентифицированы специфические продукты распада коллагена типа II, например, неоэпитопы из 20-30 аминокислот. Присутствие неоэпитопов в этих жидкостях организма могут использоваться в качестве индикаторов атаки и прогресса OA.
Кератинсульфат является представителем GAG, имеющим эпитоп, 5D4, уровень которого в синовиальной жидкости может использоваться в качестве маркера ранних стадий повреждения и утраты суставного хряща. Наоборот, уровни хондроитинсульфата, другого представителя GAG, экспрессируемые как большое количество эпитопов, связаны с анаболическими процессами в суставном хряще млекопитающего на ранних стадиях повреждения и утраты хряща. Уровни этих эпитопов в синовиальной жидкости, особенно 3B3, 7D4 и 846, могут быть определены с помощью их узнающих специфических моноклональных антител. Эпитоп 3B3 экспрессируется на хондроитинсульфатных цепях хряща в процессе восстановления и перестройки внеклеточного матрикса, и поэтому его уровни в синовиальной жидкости обратно коррелируют с уровнями вышеуказанного 5D4. Экспрессия 3B3 в новосинтезированных PG в поверхностном и более глубоком срединном слое суставного хряща означает, что 3B3 связан с ранними изменениями в суставном хряще млекопитающих на ранних стадиях дегенерации хряща. Следовательно, определение уровней 3B3 в синовиальной жидкости исследуемых млекопитающих и сравнение этих уровней с контрольными значениями дает возможность создать диагностический профиль млекопитающего, которое является кандидатом для раннего фармакологического лечения.
Дополнительными маркерами анаболической активности хряща являются пропептиды проколлагена типа II (PIIP). Тип II является основным коллагеном суставного хряща и он продуцируется хондроцитами как проколлаген. В процессе образования коллагеновых фибрилл неколлагеновые аминопропептиды отщепляются и высвобождаются в жидкости организма, в которых они могут быть измерены как отражение анаболической активности в суставном хряще. Уровни карбокси-PIIP будут увеличиваться, и его уровни в синовиальной жидкости коррелируют с радиографическим подтверждением изменений в хряще. Следовательно, измерение уровней карбокси-PIIP в синовиальной жидкости и сравнение с контрольными значениями дают возможность идентифицировать млекопитающее, которое является кандидатом для раннего фармакологического лечения.
Дисбаланс отношения стромелизин/TIMP в суставном хряще и жидкостях сустава млекопитающих на ранних стадиях дегенерации суставного хряща также может использоваться для идентификации таких млекопитающих. Измененный сустав loading following повреждение вызывает избыточную продукцию стромелизина, фермента, продуцируемого хондроцитами и синовиоцитами под действием IL-1. Концентрации стромелизина также выше в фибриллированном хряще по сравнению с хрящом, находящимся вдали от центра данного повреждения. Повышенные уровни стромелизина могут иметь место только в довольно короткий промежуток времени, но в том случае, когда повреждение сустава выходит за рамки двигательной зоны суставного хряща и достигает субхондральной кости, велика вероятность дальнейшей дегенерации суставного хряща, обычно предшествующей отвердению субхондральной кости.
Более того, на модели с рассечением крестообразных связок млекопитающих, используемой для определения ранних стадий дегенерации суставного хряща, наблюдается увеличение числа клеток, вовлеченных в синтез стромелизина, IL-1α, IL-1β и трех онкогенных белков, c-MYC, c-FOS и c-JUN. В синовиальной оболочке они находятся главным образом на поверхности синовиальных живых клеток, тогда как в хряще эти клетки представляют собой хондроциты на поверхностных и средних слоях, и клетки в фибриллированных областях верхней суставной поверхности большой берцовой кости. Кроме того, стромелизин и IL-1 диффундируют в матрикс хряща верхней суставной поверхности большой берцовой кости. Стромелизин, который вызывает деградацию компонентов соединительной ткани, включая протеогликаны и коллаген типа IX, активно синтезируется в синовиальной оболочке млекопитающих на ранних стадиях дегенерации суставного хряща и является основным протеолитических ферментом, вовлеченным в деструкцию хряща. В синовиальной жидкости таких млекопитающих можно обнаружить увеличение уровней мРНК стромелизина, а также увеличение уровней мРНК коллагеназы. Увеличение уровней обеих изоформ IL-1, но главным образом IL-1β, стимулирует увеличение синтеза стромелизина путем усиления индукции синовиальными фибробластами генной экспрессии стромелизина и коллагеназы. В то же время IL-1 не индуцирует мРНК тканевых ингибиторов металлопротеазы (TIMP), и уровни этих ингибиторов остаются неизмененными, тогда как определяемые уровни металлопротеазы в синовиальной оболочке значительно увеличиваются.
Металлопротеазы секретируются хондроцитами в виде проферментов, которые должны активироваться перед началом деградации макромолекул внеклеточного матрикса. Активация включает в себя ферментативный каскад, в котором ключевую роль играют сериновые протеазы, включая систему активатор плазминогена/плазмин.
Целостность суставного хряща в суставах млекопитающих зависит от адекватной поддержки, получаемой от костного ложа, которое он покрывает, то есть от структурных свойств подлежащей субхондральной кости. Изменение этого костного ложа предшествует деградационным изменениям в суставном хряще. Эти изменения включают в себя увеличение жесткости субхондральной кости, сопровождающее потерю амортизирующей способности. Эти изменения субхондральной кости вызваны неправильным восстановлением трабекулярных микротрещин, появляющихся, в свою очередь, в результате чрезмерной нагрузки сустава. Трабекулярное утолщение субхондральной кости является частью изменений кости, приводящих к увеличению минеральной плотности и/или объема кости в поврежденных суставах, что, в свою очередь, вызвано дефектом клеток кости в остеобластах, приводящим к изменению фенотипических свойств этих остеобластоподобных клеток субхондральной кости.
Эти изменения в плотности субхондральной кости не только являются подтверждением дисбаланса в процессах перестройки кости, но и ключевым звеном в конечном очаговом поражении хряща. Склероз кости также происходит вследствие нарушенной регуляции этого процесса перестройки кости. Более того, возникают сайт-связанные различия в метаболизме остеобластов, что приводит к продукции различных молекул, деградирующих хрящ. Эти изменения в метаболизме остеобластов, в свою очередь, приводят к соответствующим изменениям метаболизма хондроцитов, делая их более чувствительными к активности, индуцируемой цитокинами вышеописанных типов. Эти аномалии остеобластов и отличающийся фенотип характеризуются отличающимися уровнями продукции остеокальцина, щелочной фостфатазы, ответа цАМФ на гормональный сигнал, активатора плазминогена урокиназного типа (uPA) и инсулиноподобного фактора роста 1 (IGF-1).
Другим доказательством участия активности субхондральной кости в возможной дегенерации суставного хряща является сужение суставной щели, что может быть измерено сцинтиографией костей. Эти изменения в активности субхондральной кости сопровождаются соответствующими изменениями специфических метаболитов костных клеток, например, остеокальцина. Остеокальцин является витамин К-зависимым белком, связывающим кальций, который является наиболее широко представленным неколлагеновым белком в кости. Повышенные уровни остеокальцина являются маркером круговорота веществ кости при различных заболеваниях, включая, в частности, ранние стадии дегенерации суставного хряща. Уровни остеокальцина в жидкости тела, главным образом в синовиальной жидкости, непосредственно связаны с изменениями в субхондральной кости, как было измерено сцинтиографией.
В дополнение к указанным маркерам активности субхондральной кости на ранних стадиях дегенерации суставного хряща у млекопитающих, в качестве маркеров ранних стадий такой дегенерации хряща также могут быть использованы метаболиты активности хряща и синовиальной оболочки. Например, обнаружение в сыворотке повышенных уровней хрящевого олигомерного белка матрикса служит маркером круговорота веществ в хряще. Аналогично, обнаружение высоких уровеней гиалуроната в жидкостях организма, главным образом в сыворотке, служит маркером синовиального воспаления. В обоих случаях повышенные уровни этих маркерных метаболитов в жидкости организма, главным образом, в сыворотке, указывают на ранние стадии дегенерации суставного хряща.
Используемое здесь выражение «жидкость организма» относится ко всем доступным жидкостям тела, которые могут использоваться в качестве клинического образца, который может содержать исследуемое соединение в достаточной концентрации в указанной жидкости, чтобы быть в пределах обнаружения используемым прибором или анализом. Жидкости тела могут включать в себя цельную кровь, сыворотку, плазму, мочу, церебральную жидкость, синовиальную жидкость и интерстициальную и другие внеклеточные жидкости. Следовательно, вышеописанные измерения обычно проводят in vitro в образце, полученном от млекопитающего, которое является кандидатом на лечение.
Краткое описание рисунков
Фиг.1 - таблица, в которой перечислены макроскопические оценки изменений хряща мыщелков бедренной кости и верхних суставных поверхностей большеберцовой кости;
Фиг.2 - таблица, в которой перечислены гистологические оценки синовиальной мембраны;
Фиг.3 - таблица, в которой перечислен объем хрящевых клеток для коллагеназы-1 (MMP-1) и объемы клеток синовиальной мембраны для IL-1 R у собак с остеоартритом;
Фиг.4 - гистологическое отнесение хряща, взятого из бедренной мыщелки и большеберцовых плато у собак с остеоартритом;
Фиг.5 - уровни PGE2 в синовиальных жидкостях и LTB4 в культивированных синовиальных эксплантатах у собак с остеоартритом.
Фиг.6 - высвобождение остеокальцина первичными остеобластами собак;
Фиг.7 - активность щелочной фосфотазы в первичных остеобластах собак;
Фиг.8 - продуцирование IGF-1 первичными остеобластами собак;
Фиг.9 - активность первичных остеобластов собак;
Фиг.10 - продуцирование PGE2 первичными остеобластами собак.
Описание предпочтительных вариантов осуществления изобретения
С целью дальнейшей демонстрации способов и композиций согласно изобретению в последующих абзацах представлены конкретные примеры описания типичных процедур, которые могут быть использованы при проведении указанных способов. Однако эти примеры даны только с целью иллюстрации и не должны рассматриваться как ограничивающие каким-либо образом настоящее изобретение, для этой цели здесь прилагается формула изобретения.
Пример 1
Исследование терапевтической эффективности ML3000 при развитии повреждений в экспериментальной модели остеоартрита (OA) у собак. В частности, определяли действие ML3000 на синтез коллагеназы-1 (MMP-1) в хряще и интерлейкина-1β (IL-1 β) в синовиальной мембране, а также на активность щелочной фосфатазы, продукцию IGF-1, высвобождение остеокальцина, активность PEG2 и uPA в первичных остеобластах или первичными остеобластами.
Экспериментальные группы
В данном исследовании использовали двадцать одну взрослую гибридную собаку (возраст 2-3 года) весом 20-25 кг. Хирургическое рассечение фронтальной крестообразной связки (ACL) правого колена проводили посредством нанесения всем собакам колотой раны, как описано ранее (5,6). До хирургического вмешательства животных анастезировали внутривенным введением петорбарбитала натрия (25 мг/кг) и интубировали. После операции собак держали на ферме беспривязного содержания, где они свободно тренировались в большой отгороженной площадке.
Собак наугад разделяли на 3 обрабатываемые группы. Группа 1 (n=7 собак) состояла из собак, получающих плацебо (инкапсулированная метилцеллюлоза) (OA собаки); группа 2 и 3 (n=7 собак в группе) получали инкапсулированный ML3000 дважды в день в течение 8 недель с общей дозой 2,5 и 5 мг/кг, соответственно, начиная со дня операции. Лекарственный препарат вводили 7 дней/недель на протяжении исследования. Всех собак умерщвляли через 8 недель после операции.
Все собаки в каждой экспериментальной группе проходили полное исследование. В группе собак, получавших ML3000, не отмечалось никаких клинических признаков лекарственного токсичности, включая токсикоз, связанный с желудочно-кишечным трактом. Уровень дневной активности был одинаковым у всех собак в 3 экспериментальных группах, и в период исследования не было отмечено изменений массы тела собак.
Статистический анализ
Значения выражали как среднее SEM. Статистический анализ проводили, используя U-тест Mann-Whitney. Значения P менее 0,05 рассматривались как значимые.
Макроскопическая оценка
Сразу после умерщвления правое колено каждой собаки рассекали, помещали на лед, и синовиальную жидкость отсасывали. Каждое колено исследовали слепым методом 2 независимых наблюдателя (DVJ, JCF) на наличие макроскопических морфологических изменений, включая присутствие остеофитных образований и повреждений хряща, как было описано ранее (5,6). Степень остеофитных образований оценивали, измеряя максимальную ширину (мм) шпоры каждого бедренного мыщелка. Изменения хряща на медиальных и латеральных бедренных мыщелках и большеберцовых плато оценивали отдельно друг от друга под анатомическим микроскопом (Stereozoom; Bausch & Lomb, Rochester, NY).
Площадь поверхностных изменений хряща измеряли и выражали в мм2. Глубину повреждения оценивали по шкале 0-4 следующим образом: 0 = поверхность кажется нормальной, 1 = минимальная фибрилляция или слабое пожелтение на поверхности, 2 = повреждение распространяется в поверхностные или средние слои, 3 = повреждение распространяется в глубокие слои и 4 = повреждение распространяется до субхондральной кости.
Остеофиты. У собак OA, принимавших плацебо, количество остеофитов в мыщелках составляло 93%, и их ширина составляла 4,50±0,66 мм. У собак, принимавших 2,5 мг/кг/день и 5 мг/кг/день ML3000, количество остеофитов составляло 93% и 86% соответственно. Измеренная ширина остеофитов в двух группах приема была незначительно меньше по сравнению с группой ОА, принимавшей плацебо (3,57±0,56 и 3,86±0,66 соответственно), и эти различия не имели статистической значимости.
Хрящ. У собак ОА, принимавших плацебо, на обоих мыщелках и плато присутствовали повреждения средней степени и размера, однако на плато повреждения были более серьезными (фиг.1). В обеих группах, принимавших ML3000, на мыщелках и плато было значительное снижение размера повреждений. В группе, которая получала 2,5 мг/кг/день, размер повреждений на бедренных мыщелках был менее 39% (P<0,05), а на большеберцовых плато составлял 45% (P<0,01). В группе, получавшей 5 мг/кг/день, размер повреждений на бедренных мыщелках также был снижен (61%, P<0,04), хотя эффект на большеберцовых плато был приблизительно такой же, как в группе, получавшей 2,5 мг/кг/день (54%, P<0,01). В обоих случаях применения ML3000 наблюдалось значительное снижение размера повреждений на большеберцовых плато приблизительно до одинаковых величин. Хотя было показано, что повреждения бедренных мыщелков у обрабатываемых собак имели тенденцию к снижению своего размера, они не были статистически значимыми.
Синовиальная мембрана. Синовиальная мембрана у собак OA, получавших плацебо, была гипертрофированной, покрасневшей и пожелтевшей и содержала большое количество кровеносных сосудов. У собак, получавших ML3000, синовиальная мембрана была тоньше, содержала меньше кровеносных сосудов и изменяла цвет менее интенсивно по сравнению с собаками ОА, получавшими плацебо.
Гистологическая оценка
Гистологическую оценку проводили на сагиттальных срезах хряща поврежденных областей каждого бедренного мыщелка и большеберцового плато, как описано (7,8). Образцы препарировали, фиксировали в TissuFix #2 (Laboratoires Gilles Chaput, Montreal, Quebec, Canada) и помещали в парафин для гистологической оценки. Серийные срезы (5 мкм) окрашивали сафранином О. Серьезность OA повреждений оценивали по шкале 0-14, 2-мя независимыми исследователями (DJ, JF), с использованием гистологической/гистохимической шкалы Mankin et al (12). По этой шкале оценивали степень OA повреждений, основываясь на отсутствии окраски сафранином О (шкала 0-4), клеточных изменениях (шкала 0-3), инвазии кровеносными сосудами двигательной зоны сустава (шкала 0-1) и структурных изменениях (шкала 0-6, где 0 = нормальная структура хряща и 6 = поражение хряща до субхондральной кости). В этой оценочной системе исходили из наиболее серьезных гистологических изменений в пределах каждого среза хряща.
Характерные образцы синовиальной мембраны из углублений медиальных и латеральных отделов колена также отделяли от подлежащих тканей. Образцы фиксировали в TissuFix#2, помещали в парафин, препарировали (5 мкм) и окрашивали гематоксилином и эозином. Два образца синовиальной мембраны каждого отдела исследовали, делали несколько выборок по всему образцу и отдельно друг от друга оценивали. Наиболее высокие значения каждого образца записывали. Подсчитывали среднее и принимали его за единицу для всего колена. Степень тяжести синовита оценивали по шкале 0-10 (13) 2 независимых наблюдателя (DVJ, JCF), суммируя значения 3 гистологических критериев: гиперплазии клеток, выстилающих синовиальную мембрану, (шкала 0-2), гиперплазии ворсинок (шкала 0-3) и степени клеточной инфильтрации мононкулеарными и полиморфонуклеарными клетками (scale 0-5).
Хрящ. В хряще собак, принимавших OA, были отмечены морфологические изменения, включая фибрилляцию и трещины, повышенное количество клеток и клонов, и потеря окраски сафранином O. Гистологические оценки повреждений на плато были немного хуже, чем повреждений на мыщелках (фиг.4). У собак, принимавших ML3000, повреждения на мыщелках были менее серьезными по сравнению с собаками, принимавшими плацебо, и статистически значимые результаты были получены в группе, принимавшей наиболее высокую дозу препарата (5 мг/кг/день). Это снижение гистологической оценки было в значительной степени обусловлено снижением степени тяжести изменений и потерей окрашивания сафранином O. На большеберцовых плато статистически значимое уменьшение степени тяжести повреждений (P<0,002 и P<0,02, соответственно) было в случае обеих доз ML3000 (2,5 и 5 мг/кг/день). Эти результаты получены на основании снижения потери окрашивания сафранином O и степени тяжести структурных изменений, в дополнение к снижению клеточного деления.
Синовиальная мембрана. Синовиальная мембрана у собак OA, принимавших плацебо, была утолщена, имела многочисленные ворсинки и гиперплазию клеток, выстилающих синовиальную мембрану. У собак, принимавших ML3000, было значительное уменьшение ворсинчатой гиперплазии в группе, принимавшей 5 мг/кг/день.
Измерение PGE2 в синовиальной жидкости
Синовиальную жидкость, взятую в момент умерщвления, центрифугировали (14000 г, 15 минут, 4°C), и супернатанты использовали для определения PGE2. Уровни PGE2 определяли, используя специфический ферментный анализ (EIA) (Cayman Chemical, Ann Arbor, MI).
Синовиальные жидкости у собак ОА, принимавших плацебо, имели высокий уровень PGE2 (652,8±149,9 пг/мл). Прием ML3000 в дозе 2,5 и 5 мг/кг/день значительно снижал этот уровень (фиг.5).
Продукция LTB4 при культивировании синовиальной ткани в искусственной среде
Представительные образцы синовиальной мембраны у всех собак асептически отделяли от подлежащей ткани. Образцы несколько раз промывали модифицированной по способу Дульбекко средой Игла (DMEM; Gibco-BRL Life Technologies, Burlington, Ontario, Canada), и 150 мг ткани инкубировали (дублируя) в течение 48 часов при 37°C во влажной атмосфере 5% CO2/95% воздуха в среде DMEM в присутствии 1 мкг/мл липополисахарида (LPS; Sigma-Aldrich Canada, Oakville, Ontario, Canada). LTB4 экстрагировали из культурированной в искусственной среде синовиальной ткани следующим образом: мембраны гомогенизировали в буфере EIA (1 M фосфата, pH 7,4, содержащего 1% BSA, 4 M NaCl, 10 mM EDTA и 0,1% азида натрия) и центрифугировали (30000 г, 20 минут, 4°C). Супернатанты собирали, и определяли уровни LTB4, используя EIA (Cayman Chemical).
Культивированная синовиальная мембрана собак ОА, обработанная 1 мкг/мл LPS, содержала значительное количество LTB4 (2,48±0,69 пг/мг ткани). В обеих группах, принимавших ML3000, были значительно снижены уровни LTB4 (фиг.5).
Иммуноцитохимия
Образцы хряща и синовиальной мембраны подвергали описанному ранее иммуногистохимическому анализу (7,14). Кратко, образцы фиксировали в 4% нейтральном забуференном формалине в течение 24 часов, затем помещали в парафин. Срезы (5 мкм) запарафиненных образцов помещали на предметное стекло Superfrost Plus (Fisher Scientific, Nepean, Ontario, Canada), депарафинизировали в толуоле, дегидратировали в ступенчатых фракциях этанола, и преинкубировали в хондроитиназе ABC (0,25 единиц/мл) в забуференном фосфатом физиологическом растворе (PBS; Sigma-Aldrich Canada) в течение 60 минут при 37°C. После чего образцы промывали в PBS, затем опять в 0,3% перекиси водорода/PBS в течение 30 минут. Покровные стекла затем инкубировали в блокирующем растворе (Dako Diagnostics, Mississauga, Ontario, Canada) и 5% снятом молоке в течение 60 минут, проводили блоттинг и затем покрывали первичными моноклональными антителами против коллагеназы-1 (100 мкг/мл, разведение 1:500, Oncogene Research Products, Cambridge, MA) (хрящ) или первичными антителами против человеческого IL-1 (1 мкг/мл, разведение 1:50; Biosource International, Camarillo, CA) (синовиальная мембрана) в течение 18 часов при комнатной температуре во влажной камере.
Каждое покровное стекло промывали 3 раза PBS (pH 7,4) и окрашивали, используя метод с авидин-биотиновым комплексом (набор Vectastain ABC; DAKO Diagnostics Canada). После проведения этого метода следовала инкубация в присутствии биотин-связанных вторичных анитетел в течение 30 минут при комнатной температуре, затем добавляли авидин-биотин-пероксидазный комплекс в течение 30 минут. Инкубацию каждый раз проводили во влажной камере, и цвет проявляли 3,3'-даминобензидином (DAKO Diagnostics Canada), содержащим пероксид. Покровные стекла окрашивали контрастным красителем нейтральным красным (хрящ) или гематоксилин/эозином (синовиальная мембрана).
Для определения специфичности окрашивания использовали 3 контрольные процедуры в соответствии с тем же экспериментальным протоколом: 1) использование абсорбирующей иммунной сыворотки (1 час, 37°C) с 20-кратным молярным избытком рекомбинантной коллагеназы-1 или IL-1β; 2) пропуск первичного антитела; и 3) замена первичного антитела на аналогичную преиммунную сыворотку. Очищенными антигенами, использовавшимися в этом исследовании, были антигены человеческой рекомбинантной коллагеназы-1 (Oncogene Research Products) или человеческого рекомбинантного IL-1β (Genzyme, Cambridge, MA, USA).
Из каждого участка хряща готовили несколько образцов и для иммуногистохимического анализа обрабатывали несколько покровных стекол. Каждый участок исследовали под световым микроскопом (Leitz Orthoplan; Wild Leitz, St. Laurent, Quebec, Canada) и фотографировали на пленке Kodak Ektachrome 64 ASA (Kodak, Rochester, NY).
Хрящ (фиг.3). У собак, принимавших плацебо, большое количество хондроцитов в поверхностных слоях хрящевых образцов окрашивались положительно в отношении коллагеназы-1, как в случае образцов из мыщелков, так и из плато. У собак, принимавших ML3000, как в мыщелках, так и в плато наблюдалось значительное снижение хондроцитов, подсчитанных в отношении коллагеназы-1, этот эффект был менее выражен в группе, обрабатываемой большой дозой препарата.
Синовиальная мембрана (фиг.3). Исследование образцов синовиальной мембраны у собак ОА, принимавших плацебо, показало присутствие большого количества выстилающих клеток, интенсивно окрашенных положительно в отношении IL-1β. У собак, принимавших ML3000, наблюдалась зависимость от дозы и значительное снижение числа клеток, положительных в отношении IL-1β.
Морфометрический анализ
Хрящ. Определение количества различных антигенов в хряще проводили, используя опубликованные методы (7,14). Присутствие антигена оценивали путем определения числа хондроцитов, окрашенных положительно в верхней (поверхностные и прилежащие к ним средние слои) зоне хряща. В этой зоне хрящ делили на 3 микроскопических области (X 40; Leitz Diaplan) и усредняли. В случае каждого суставного образца, это было сделано для того, чтобы обеспечить оценку неповрежденной поверхности, которая может быть обнаружена и использована как маркер для проверки правильности морфометрического анализа. Определяли общее количество хондроцитов и количество хондроцитов, окрашенных положительно в отношении специфического антигена. Окончательные результаты выражали как процент хондроцитов, окрашенных положительно в отношении антигена (клеточная оценка) с максимальной оценкой 100%. Каждое покровное стекло дважды оценивали слепым методом, в результате чего разница составляла <5%. Полученные данные медиального и латерального мыщелков и большеберцовых плат рассматривали как независимые для целей статистического анализа.
Синовивальная мембрана. Для анализа синовиальной мембраны оценивали клетки различных образцов для каждого разреза, используя опубликованный способ (8). Каждый образец делили на 5 микроскопических областей (X 40) на уровне клеток, выстилающих синовиальную мембрану. В каждой области оценивали процент клеток, окрашенных положительно для каждого антигена, как описано выше для хряща. Оценки подсчитанных клеток проводили отдельно для клеток, выстилающих синовиальную мембрану, и инфильтрирующих мононуклеарных клеток с максимумом для каждой области, равным 100%.
Анализ остеобластов
Проксимальный конец большеберцовой кости отделяли, как описано выше, промывали в холодном физиологическом растворе и помещали на лед до и в процессе препарирования. Отделяли медиальные большеберцовые плато для получения эксплантатов и культуры первичных костных клеток; пограничную кортикальную костную ткань не захватывали. Подлежащий хрящ сначала удаляли из большеберцовых плато, и комплекс эксплантатов иссекали только из средней части медиального плато. Затем отсекали трабекулярную костную ткань из плато субхондральной кости. Все манипуляции проводили под увеличительным микроскопом для обеспечения полного удаления хряща и трабекулярной кости.
Для получения культуры первичных клеток использовались образцы, как описано в (16), с небольшими модификациями. Образцы кости разрезали на маленькие кусочки (2 мм2) перед последующим расщеплением в присутствии 1 мг/мл коллагеназы типа I (Sigma) в среде Ham F-12/Игла, модифицированной по способу Дульбекко (DMEM; Sigma) без сыворотки при 37°C в течение 20, 20 и 240 минут. При этой обработке из кусочков кортикального слоя кости удалялись как прилипшие, так и оставшиеся клетки костного мозга.
После промывки той же средой ферментированные кусочки кости культурировали в среде BGJ, содержащей 20% эмбриональной сыворотки теленка (FBS; Wisent, St. Bruno, Quebec, Canada). Эту среду заменяли каждые 2 дня до тех пор, пока клетки в чашке Петри не становились различимы, после чего культуру заменяли на свежую среду, содержащую 10% FBS. При накоплении, клетки пассировали один раз в пропорции 25000 клеток/см2 и растили в 24-луночных плашках (Falcon, Lincoln Park, NJ) в течение 5 дней до анализа. Полученные в этих культуральных условиях клетки имели остеобластноподобный клеточный фенотип, как указано в (16). Создание определенных условий в культуре проводили в течение 2 последних дней в присутствии или отсутствие 50 нМ 1,25 (OH)2D3 (1,25-дигидроксивитамин D) для максимальной стимуляции в среде Ham F-12/DMEM, содержащей 2% очищенный на угле FBS, которая давала максимальную стимуляцию активности щелочной фосфатазы и секреции остеобластов, как отмечено в (16). Среду собирали в конце периода инкубации и замораживали при -80°C до проведения анализа. Затем клетки промывали два раза забуференным фосфатом физиологическим раствором (PBS), pH 7,4 и солюбилизировали в буфере с щелочной фосфатазой (100 мМ глицин, 1 мМ MgCl2, 1 мМ ZnCl2, 1% Triton X-100; pH 10,5) в течение 60 минут при перемешивании при 4°C.
Высвобождение остеокальцина
Высвобождение остеокальцина измеряли в культуре остеобластоподобных клеток в условиях среды Ham F-12/DMEM (1:1), полученной в течение последних 2 дней, как описано в (16), содержащей 2% очищенных на угле FBS, и в присутствии 50 нМ 1,25 (OH)2D3 или носителя (0,1% этанол). Образующийся остеокальцин определяли с помощью специфического иммуноферментного анализа (Biomedical Technologies, Stoughton, MA). Предел чувствительности в этом анализе составляет 0,5 нг/мл, и 2% очищенный на угле FBS содержал <0,1 нг/мл остеокальцина. Результаты представлены на фиг.6.
Активность щелочной фосфатазы
Активность клеточной щелочной фосфатазы определяли в клетках, используемых для оценки высвобождения остеокальцина, как высвобождение паранитрофенола, гидролизированного из паранитрофенилфосфата (окончательная концентрация 12,5 мМ) при 37°C в течение 30 минут после солюбилизации клеток в буфере с щелочной фосфатазой, как описано выше. Щелочную фосфатазу определяли сразу в аликвотах. Определение белка проводили с помощью метода с бицинхониновой кислотой, как описано Smith, P. K.; Krohn, R. I.; Hermanson, G. T.; Mallia, A. K.; Gartner, F. H.; Provenzano, M. D.; et al.; «Measurement of Protein Using Bicinchoninic Acid», Anal Biochem, 150, 1985, 76-85. Результаты показаны на фиг.7.
Оценка uPA и IGF-1 в первичных остеобластах
Для оценки uPA и IGF-1 среду для культивирования конфлуэнтных остеобластоподобных клеток заменяли средой Ham F-12/DMEM, без PBS, но содержащей 1% смесь инсулин-трансферрин-селена (ITS, Sigma) в течение последних 2 дней культивирования. Сначала определяли уровни uPA с помощью специфических ферментно-связанного иммуннособрентного анализа (ELISA; American Diagnostica, Greenwich, CT). Затем использовалась процедура, описанная Leprince, P.; Rogister, B.; Moonen, G. A.; «Colorimetric Assay for the Simultaneous Measurement of Plasminogen Activators and Plasminogen Activator Inhibitors in Serum-Free Conditioned Media from Cultured Cells», Anal Biochem, 177, 1989, 341-346, для определения активности uPA посредством гидролиза специфического субстрата DL-Val-Leu-Arg-пара-нитроанилида (Sigma), который высвобождает паранитроанилин, который может быть определен при 405 нм. Уровни PAI-1 определяли с помощью ELISA, используя вещества, доступные от American Diagnostica (Greewich, CT). IGF-1 определяли, используя высокочувствительную ELISA (Diagnostic Systems Laboratories, Webster, TX), которая не имела перекрестных реакций с инсулином. Внутренним контролем исследования служила только среда, содержащая 1% ITS, и любые значения были ниже предела чувствительности. Для адаптации среды образцы культуры клеток, 3 или 4 супернатанта объединяли, лиофилизировали и затем восстанавливали в буфере PBS, pH 7.4. Образцы затем обрабатывали в соответствии со способом, описанным в Mohan, S.; Bautista, C. M.; Herring, S. J.; Linkhart, T. A.;Baylink, D. J.; «Development of Valid Methods to Measure Insulin-Like Factors-I and -II in Bone Cell-Conditioned Medium, Endocrinology, 126,1990, 2534-42. Результаты показаны на фиг.8 и 9.
Оценка PGE2 в первичных остеобластах
PGE2 в первичных остеобластах определяли по существу тем же способом, который был описан для синовиальной жидкости. Результаты показаны на фиг.10.
Из результатов, представленных выше, можно сделать вывод, что ML3000, сбалансированный двойной ингибитор COX/5-LO, может значительно снизить развитие ранних стадий экспериментального OA, а также ингибировать in vivo продукцию PGE2 и LTB4. Защитный эффект препарата скорее всего связан с явным ингибированием главных патологических путей OA, а именно чрезмерного синтеза IL-1β и коллагеназы-1. Некоторые из этих эффектов, по-видимому, связаны с ингибированием чрезмерной продукции LTB4.
Источники информации
1.Pelletier JP, Martel-Pelletier J, Howell DS. Etiopathogenesis of osteoarthritis. In: Koopman WJ, editor. Arthritis & Allied Conditions. A Textbook of Rheumatology. 14th ed. Baltimore: Lippincott Williams & Wilkins; 2000. p. 2195-245.
2. Martel-Pelletier J, Di Battista JA, Lajeunesse D. Biochemical factors in joint articular tissue degradation in osteoarthritis. In: Reginster JY, Pelletier JP, Martel-Pelletier J, Henrotin Y, editors. Osteoarthritis: Clinical и experimental aspects. Berlin: Springer-Verlag; 1999. p. 156-87.
3. Laufer S, Tries S, Augustin J,. Dannhardt G. Pharmacological profile of a new pyrrolizine derivative inhibiting the enzymes cyclo-oxygenase and 5-lipoxygenase. Arzneimittelforschung 1994; 44: 629-36.
4. Laufer S, Tries S, Augustin J, Elsasser R, Albrecht W, Guserle R, etal. Acute и chronic anti-inflammatory properties of [2,2-dimethyl-6-(4-chlorophenyl)-7-phenyl-2,3-dihydro-1H-pyrrolizine-5-yl]-acetic acid. Arzneimittelforschung 1995; 45: 27-32.
5. Fernandes JC, Martel-Pelletier J, Otterness IG, Lopez-Anaya A, Mineau F, Tardif G, et al. Effects of tenidap on canine experimental osteoarthritis: I. Morphologic и metalloprotease analysis. Arthritis Rheum 1995; 38: 1290-303.
6. Pelletier JP, Mineau F,Raynauld JP, Woessner JF Jr, Gunja-Smith Z, Martel-Pelletier J.Intraarticular injections with methylprednisolone acetate reduce osteoarthritic lesions in parallel with chondrocytestromelysin synthesis in experimental osteoarthritis. Arthritis Rheum 1994; 37: 414-23.
7. Pelletier JP, Lascau-Coman V, Jovanovic D, Fernandes JC, Manning P, Currie MG, et al. Selective inhibition of inducible nitric oxide synthase in experimental osteoarthritis is associated with reduction in tissue levels of catabolic factors. JRheumatol 1999; 26: 2002-14.
8. Fernandes JC, Martel-Pelletier J, Jovanovic D, Tardif G, DiBattista JA, Lascau-Coman V, et al. The effects of tenidap on canine experimental osteoarthritis. If: Study of the expression of collagenase-1 andinterleukin-1beta by in situ hybridization. JRheumatol 1998; 25: 951-8.
9. Pelletier JP, Lajeunesse D, Jovanovic DV, Lascau-Coman V, Jolicoeur FC, Hilal G, et al. Carprofen simultaneously reduces progression of morphological changes in cartilage и subchondral bone in experimental dog osteoarthritis. J Rheumatol 2000; 27: 2893-902.
10. Pelletier JP, Martel-Pelletier J. In vivo protective effects of prophylactic treatment with tiaprofenic acid or intraarticular corticosteroids on osteoarthritic lesions in the experimental dog model. JRheumatol Suppl 1991; 27: 127-30.
11.Palmoski MJ; Brandt KD. In vivo effect of aspirin on canine osteoarthritic cartilage. Arthritis Rheum 1983; 26: 994-1001.
12. Mankin HJ, Dorfman H,Lippiello L, Zarins A. Biochemical и metabolic abnormalities in articular cartilage from osteoarthritic human hips. II.
Correlation of morphology with biochemical и metabolic data. J Bone Joint Surg Am 1971; 53: 523-37.
13. Pelletier JP, Martel-Pelletier J,Ghandur-Mnaymneh L,Howell DS, Woessner JF Jr. Role of synovial membrane inflammation in cartilage matrix breakdown in the Pond-Nuki dog model of osteoarthritis. Arthritis Rheum 1985; 28: 554-61.
14. Moldovan F, Pelletier JP, Hambor J, Cloutier JM, Martel-Pelletier J. Collagenase-3 (matrix metalloprotease 13) is preferentially localized in the deep layer of human arthriticcartilage in situ: In vitro mimicking effect by transforming growth factor beta. Arthritis Rheum 1997; 40: 1653-61.
15. Huskisson EC, Berry H, Gishen P, Jubb RW, Whitehead J. Effects ofantiinflammatory drugs on the progression of osteoarthritis of the knee. LINK Study Group. Longitudinal Investigation of Nonsteroidal Antiinflammatory Drugs in Knee Osteoarthritis. JRheumatol 1995; 22: 1941-6.
16. Lajeunesse, D.; Busque, L.; Ménard, P.; Brunette, M. G.; Bonny, Y.; «Demonstration of an Osteoblast Defect in Two Cases of Human Malignant Osteoporosis: Correction of the Phenotype after Bone Marrow Transplant"; J. Clin Invest, 98,1996, 1835-1842.
| название | год | авторы | номер документа |
|---|---|---|---|
| СХЕМА ПРИМЕНЕНИЯ СОЕДИНЕНИЯ FGF-18 | 2015 |
|
RU2700582C2 |
| СХЕМА ПРИМЕНЕНИЯ СОЕДИНЕНИЯ FGF-18 | 2015 |
|
RU2691946C2 |
| РАСТВОРЫ И СПОСОБЫ ИНГИБИРОВАНИЯ БОЛИ, ВОСПАЛЕНИЯ И РАЗРУШЕНИЯ ХРЯЩА | 2000 |
|
RU2271825C2 |
| СПОСОБ ОЦЕНКИ ИНТЕНСИВНОСТИ ДЕСТРУКТИВНЫХ ПРОЦЕССОВ ПРИ ТРАВМАТИЧЕСКОМ ПОВРЕЖДЕНИИ КОЛЕННОГО СУСТАВА И ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ПОСТТРАВМАТИЧЕСКОГО АРТРОЗА | 2011 |
|
RU2463000C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТЕОАРТРОЗА КОЛЕННОГО СУСТАВА | 2011 |
|
RU2452999C1 |
| КОМПОЗИЦИЯ ДИЕТЫ ПРИ ОСТЕОАРТРИТЕ СОБАК | 2005 |
|
RU2351153C2 |
| СИСТЕМА IN-SITU ДЛЯ ВНУТРИАРТИКУЛЯРНОЙ РЕГЕНЕРАЦИИ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНЕЙ | 2007 |
|
RU2451527C2 |
| СПОСОБ ЛЕЧЕНИЯ ПОЛНОСЛОЙНЫХ ДЕФЕКТОВ ХРЯЩА КОЛЕННОГО СУСТАВА С ИСПОЛЬЗОВАНИЕМ КУЛЬТУРЫ АУТОЛОГИЧНЫХ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2007 |
|
RU2351020C1 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ОСТЕОАРТРИТА И ОСТЕОАРТРОЗА СУСТАВОВ | 2011 |
|
RU2509569C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ОСТЕОАРТРИТА, ОСТЕОПОРОЗА И&NBSP;ОСТЕОАРТРОЗА СУСТАВОВ | 2013 |
|
RU2521227C1 |



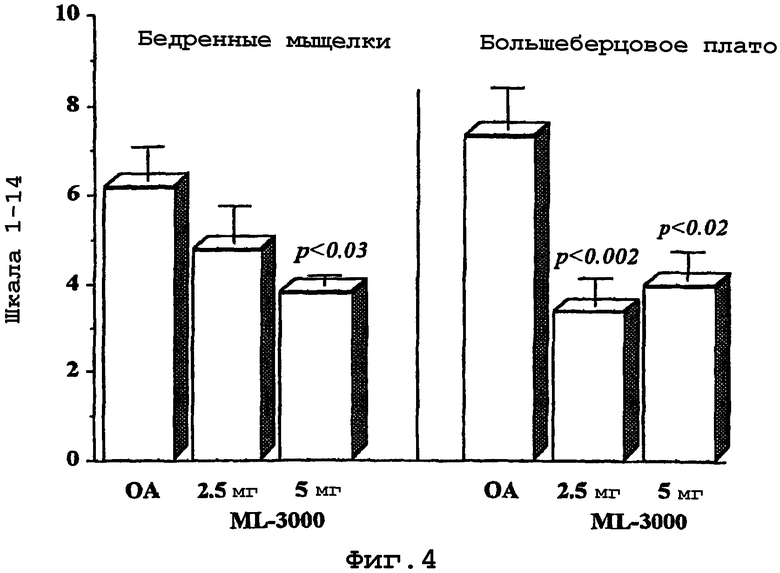
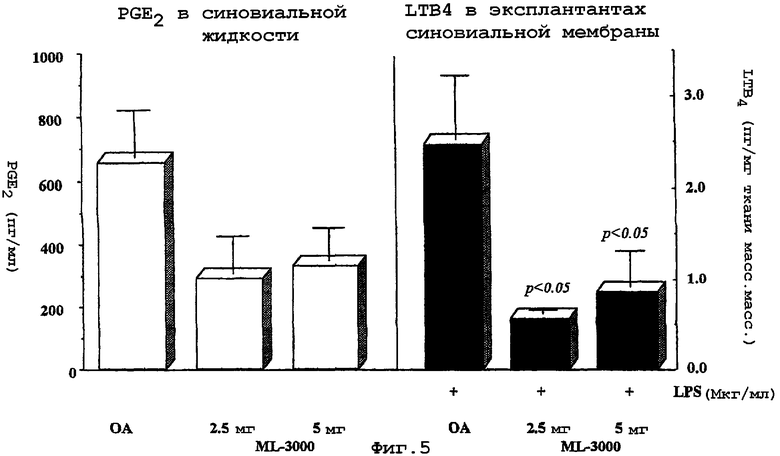
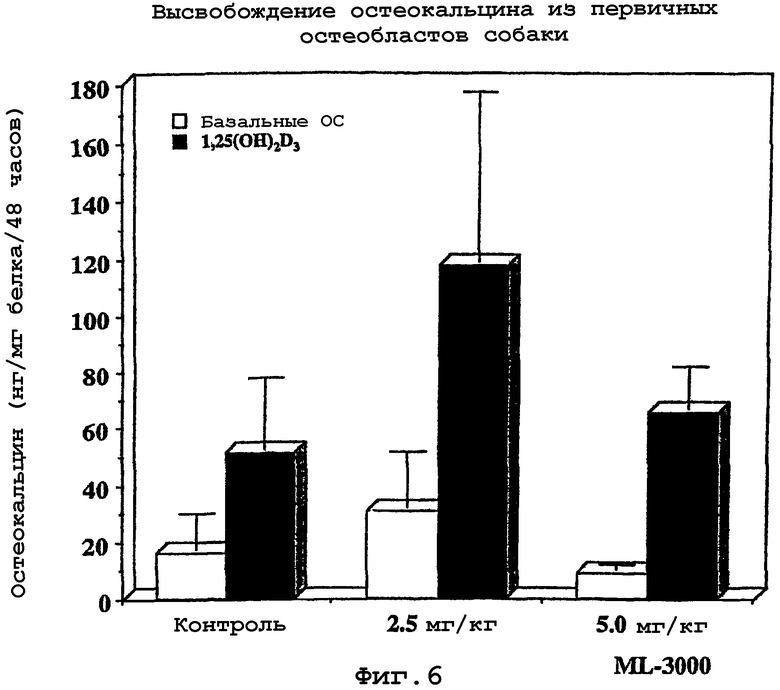
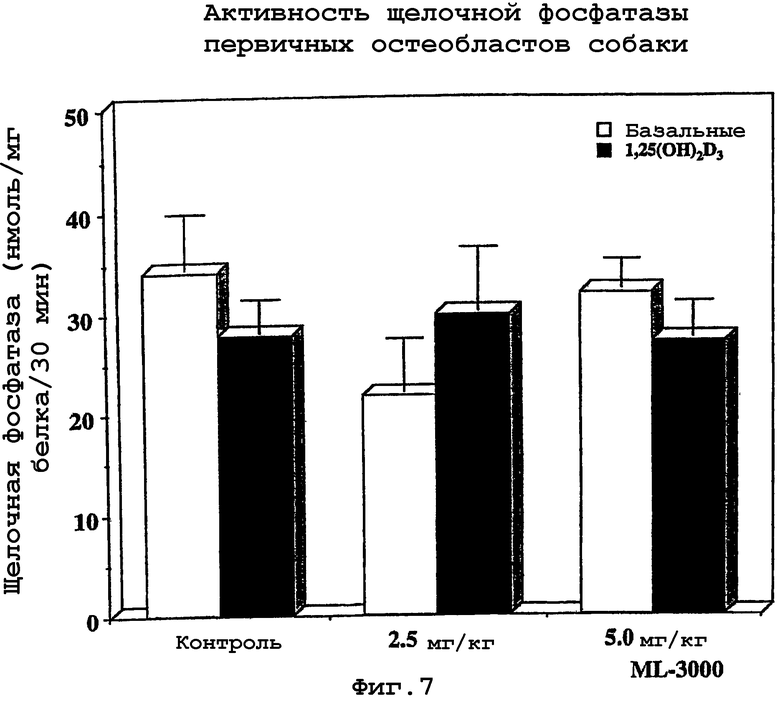
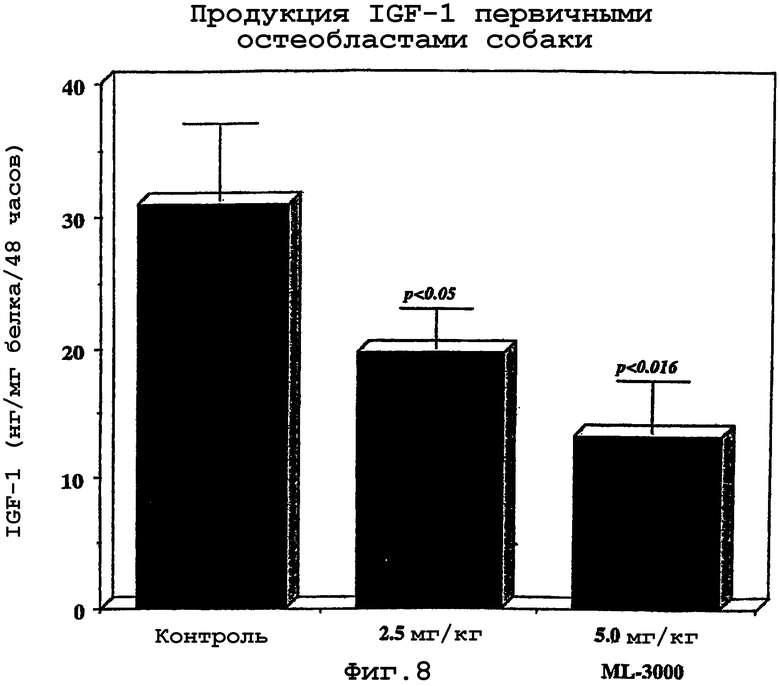
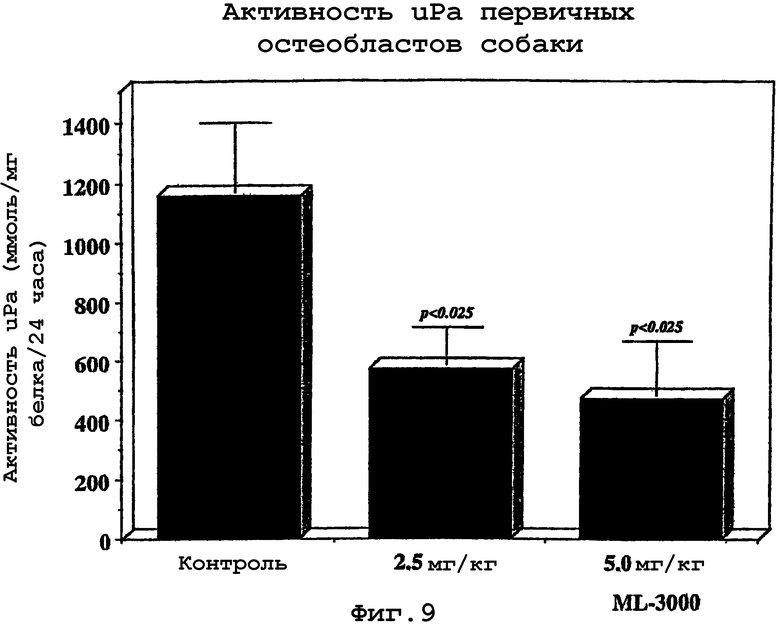
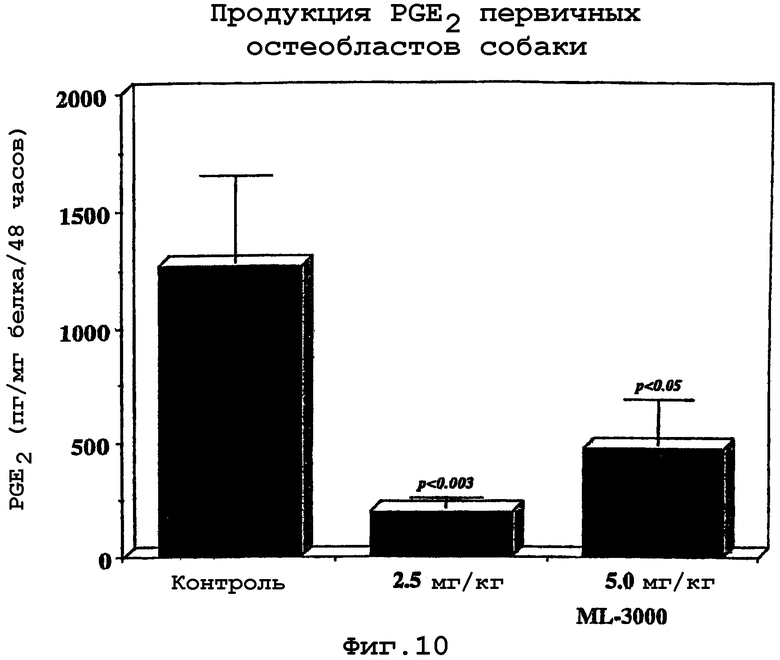
Изобретение относится к медицине. Описано лечение или профилактика дегенерации или деструкции суставного хряща и/или субхондральной кости в поврежденном суставе млекопитающего, заключающееся во введении соединения формулы (I), где переменные имеют значения, данные в настоящем описании. Это лечение улучшает, усиливает эффект лечения, реверсирует или предотвращает любую дегенерацию или деструкции суставного хряща и/или субхондральной кости, являющуюся результатом ранней стадии указанной дегенерации. 4 н. и 6 з.п. ф-лы, 10 ил.
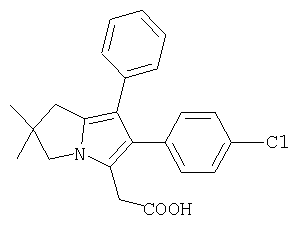
ее физиологически приемлемой соли или физиологически гидролизуемого эфира для получения фармацевтической композиции для лечения или профилактики дегенерации или деструкции суставного хряща и/или субхондральной кости.

ее физиологически приемлемой соли или физиологически гидролизуемого эфира для получения фармацевтической композиции для профилактики прогрессирования дегенерации или деструкции суставного хряща и/или субхондральной кости.
(1) повышенного уровня интерлейкина-1 бета (IL-1β);
(2) повышенного уровня фактора некроза опухоли альфа (TNFα);
(3) повышенного отношения IL-1β к белковому антагонисту рецептора IL-1 (IL-1Ra);
(4) повышенной экспрессии рецепторов р55 TNF (p55 TNF-R);
(5) повышенного уровня интерлейкина-6 (IL-6); увеличения фактора ингибирования лейкемии (LIF);
(6) неизмененного или сниженного уровня инсулиноподобного фактора роста 1 (IGF-1);
(7) снижения трансформирующего фактора роста бета (TGFβ); неизмененного или сниженного уровня тромбоцитарного фактора роста (PDGF);
(8) неизмененного или сниженного уровня основного фактора роста фибробластов (b-FGF);
(9) повышенного уровня кератинсульфата;
(10) повышенного уровня матриксных металлопротеаз (ММР), включая стромелизин;
(11) повышенного отношения матриксных металлопротеаз (ММР), включая стромелизин, к тканевому ингибитору металлопротеаз (TIMP);
(12) повышенного уровня остеокалцина;
(13) повышенного уровня щелочной фосфатазы;
(14) повышенного ответа цАМФ на гормональный сигнал;
(15) повышенного уровня ингибитора плазминогена урокиназного типа (uPA);
(16) повышенного уровня олигомерного белка хрящевого матрикса;
(17) присутствия специфических неоэпитопов коллагена типа II и
(18) повышенного уровня коллагеназы.

ее фармацевтически приемлемую соль или физиологически гидролизуемый эфир,
и одного или нескольких членов, выбранных из группы, состоящей, по существу, из полисульфатированного гликозаминогликана (PSGAG), глюкозамина, хондроитинсульфата (CS), гиалуроновой кислоты (НА), пентозанполисульфата (PPS), доксициклина и миноциклина.
(А) [6-(4-хлорфенил)-2,2-диметил-7-фенил-2,3-дигидро-1Н-пирролизин-5-ил]уксусную кислоту формулы (Ia)

ее фармацевтически приемлемую соль или физиологически гидролизуемый эфир и
(В) один или несколько членов, выбранных из группы, состоящей, по существу, из полисульфатированного гликозаминогликана (PSGAG), глюкозамина, хондроитинсульфата (CS), гиалуроновой кислоты (НА), пентозанполисульфата (PPS), доксициклина и миноциклина.
| US 5464609 А, 07.11.1995 | |||
| ЧЕТВЕРТИЧНЫЕ АМИДЫ ОСНОВНОГО ХАРАКТЕРА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2120436C1 |
| Fernandes JC et al, The effects of tenidap on canine experimental osteoarthritis: II | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| Fernandes JC et al, The effects of tenidap on canine experimental | |||
Авторы
Даты
2007-07-27—Публикация
2002-08-29—Подача