I. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лечебным растворам и к способам лечения и, в частности, растворам против воспаления, против боли и против разрушения хряща и к способам их лечения.
II. ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Артроскопия представляет хирургическую процедуру, при которой камера, соединенная с отдаленным источником света и видеомонитором, вводится в анатомический сустав (например, колено, плечо и т.п.) через небольшой портальный разрез в коже и суставной капсуле. Через подобные портальные разрезы в сустав можно ввести хирургические инструменты, их применение регулируется артроскопической визуализацией. По мере совершенствования техники артроскопии возрастающее число оперативных процедур, ранее осуществлявшихся "открытым" хирургическим способом, в настоящее время можно проводить артроскопически. Подобные процедуры включают, например, частичную менискоэктомию и восстановление связок в колене, акромиопластику плеча и санации манжета поворота плеча и синовэктомию локтя. В результате расширения хирургических показаний и разработки артроскопов с небольшим диаметром также стала обычной артроскопия запястья и голеностопного сустава.
При каждой артроскопии физиологическая орошающая жидкость (т.е. обычный физиологический раствор или лактированный раствор Рингера) постоянно пропускается через сустав, расширяя суставную капсулу и удаляя хирургические остатки, обеспечивая тем самым более четкую визуализацию внутри сустава. В патенте США 4504493 Маршалла раскрывается изомолярный раствор глицерина в воде в качестве непроводящего и оптически чистого орошающего раствора для артроскопии. Обычные физиологические орошающие жидкости не обеспечивают обезболивающего, противовоспалительного эффектов и эффекта против разрушения хряща.
Облегчение боли и страданий у пациентов в послеоперационном периоде представляет область особого внимания в клинической медицине, особенно с возрастающим числом амбулаторных хирургических вмешательств, проводимых ежегодно. Наиболее широко применяемые системные средства, ингибиторы циклооксигеназы (например, ибупрофен) и опиоиды (например, морфин, фентанил) обладают существенными побочными эффектами, включая раздражение желудка и кишечника/кровотечение и угнетение дыхания. Высокая частота проявления тошноты и рвоты, связанная с опиоидами, является особенной проблемой в послеоперационном периоде. Терапевтические средства, направленные на облегчение боли в послеоперационном периоде, с одновременным отсутствием у них вредных побочных эффектов, трудно разработать в силу того, что молекулярные мишени для данных агентов широко распространены в организме и опосредуют различные физиологические функции. Несмотря на значительную клиническую потребность в подавлении боли и воспаления, а также разрушения хряща, не разработаны способы доставки ингибиторов боли, воспаления и разрушения хряща в эффективных дозировках, при сведении до минимума при этом побочных системных эффектов. В качестве примера, обычные (т.е. внутривенный, пероральный, подкожный или внутримышечный) способы введения опиатов в терапевтических дозах часто связаны со значительными побочными эффектами, включая сильное угнетение дыхания, изменения в настроении, помутнение сознания, тяжелую тошноту и рвоту.
В предыдущих исследованиях была показана способность эндогенных агентов, таких как серотонин (5-гидрокситриптамин, иногда называемый в описании как "5-НТ"), брадикинин и гистамин, вызывать боль и воспаление. Sicuteri F. et al., Serotonin-Bradykinin Potentiation in the Pain Receptors in Man, Life Sci. 4, pp.309-316 (1965); Rosenthal S.R., Histamine as the Chemical Mediator for Cutaneous Pain, J. Invest. Dermat. 69, pp.98-105 (1977); Richardson В.P. et. al., Identification of Serotonin M-Receptor Subtypes and their Specific Blockade by a New Class of Drugs, Nature 316, pp.126-131 (1985); Whalley E.T. et. al., The Effect of Kinin Agonists and Antagonists, Naunyn-Schmiedeb Arch. Pharmacol. 36, pp.652-57 (1987); Lang E. et. al., Chemo-Sensitivity of Fine Afferents from Rat Skin In Vitro, J. Neurophysiol. 63, pp.887-901 (1990).
Например, было показано, что 5-НТ, нанесенный человеку на кожу, покрытую волдырями (оголенную кожу), вызывает боль, которую можно подавлять антагонистами 5-НТ3-рецепторов: Richardson et. al., (1985). Аналогичным образом примененный в периферических тканях брадикинин вызывает боль, которую можно блокировать антагонистами брадикининовых рецепторов: Sicuteri et. al., 1965; Whalley et. al., 1987; Dray A. et. al., Bradykinin and Inflammatory Pain, Trends Neurosci. 16, pp.99-104 (1993). Примененный в периферических тканях гистамин вызывает расширение сосудов, зуд и боль, которые можно подавлять антагонистами гистаминовых рецепторов: Rosenthal, 1977; Douglas W.W., "Histamine and 5-Hydroxytryptamine (Serotonin) and their Antagonists", in Goodman L.S. et. al., ed. The Pharmacological Basis of Therapeutics, MacMillan Publishing Company, New York, pp.605-638 (1985); Rumore M.M. et. al., Analgesic Effects of Antihistaminics, Life Sci 36, pp.403-416 (1985). Было показано, что комбинации данных трех агонистов (5-НТ, брадикинина и гистамина), использованных вместе, проявляют синергетический вызывающий боль эффект, вызывая длительный и интенсивный болевой сигнал. Sicuteri et. al., 1965; Richardson et. al., 1985; Kessler W. et. al., "Excitation of Cutaneous Afferent Nerve Endings In Vitro by a Combination of Inflammatory Mediators and Conditioning Effect of Substance P", Exp. Brain Res. 91: 467-476 (1992).
В организме 5-НТ находится в тромбоцитах и центральных нейронах, гистамин обнаружен в тучных клетках, и брадикинин образуется из более крупных молекул-предшественников во время травмирования тканей, изменений рН и изменений температуры. Поскольку 5-НТ может высвобождаться в больших количествах из тромбоцитов в местах травмирования тканей, приводя к концентрациям в плазме, превышающим в 20 раз таковые в состоянии покоя (Ashton J.H. et. al., "Serotonin as a Mediator of Cyclic Flow Variations in Stenosed Canine Coronary Arteries", Circulation 73: 572-578 (1986), возможно, что эндогенный 5-НТ играет роль в возникновении в послеоперационном периоде боли, гипералгезии и воспаления. Фактически было показано, что активация тромбоцитов приводит к возбуждению периферических ноцирецепторов в условиях in vitro. Ringkamp M. et. al., 'Activated Human Platelets in Plasma Excite Nociceptors in Rat Skin, In Vitro", Neurosci. Lett. 170: 103-106 (1994). Аналогичным образом гистамин и брадикинин также высвобождаются в ткани во время травмы. Kimura E. et. al., "Changes in Bradykinin Level in Coronary Sinus Blood After the Experimental Occlusion of a Coronary Artery", Am. Heart J. 85: 635-647 (1973); Douglas, 1985; Dray et. al. (1993).
Кроме того, известно, что простагландины также вызывают боль и воспаление. Обычно ингибиторы циклооксигеназы, например, ибупрофен, применяются при нехирургических и послеоперационных вмешательствах в целях блокирования продукции простагландинов, тем самым уменьшая опосредуемые простагландинами боль и воспаление: Flower R.J. et, al., Analgesic-Antipyretics and Anti-Inflammatory Agents; Drugs Employed in the Treatment of Gout, in Goodman L.S. et. al., The Pharmacological Basis of Therapeutics, MacMillan Publishing Company, New York, pp. 674-715 (1985). Ингибиторы циклооксигеназы связаны с некоторыми побочными системными эффектами, когда применяются обычными способами. Например, индометацин или кеторолак обладает общепризнанными побочными эффектами со стороны желудочно-кишечного тракта и почек.
Как обсуждалось, 5-НТ, гистамин, брадикинин и простагландины вызывают боль и воспаление. Известны и/или обсуждаются в течение двух последних десятилетий различные рецепторы, через которые данные агенты опосредуют свое действие в периферических тканях. Большая часть исследований была проведена на крысах или на других моделях животных. Однако имеются различия в фармакологии и последовательностях рецепторов у человека и животных.
Кроме того, антагонисты данных медиаторов в настоящее время не применяются для купирования боли в послеоперационном периоде. Группу препаратов, называемых антагонистами поглощения 5-НТ и норепинефрина, которая включает амитриптилин, использовали перорально со средним успехом при состояниях хронической боли. Однако полагают, что механизмы состояний хронической и острой боли значительно различаются. Фактически в двух исследованиях при подавлении острой боли с периоперативным использованием амитриптилина было показано отсутствие ослабляющего боль действия у амитриптилина: Levine J.D. et. al., "Desipramine Enhances Opiate Postoperative Analgesia", Pain 27: 45-49 (1986); Kerrick J.M. et. al., "Low-Dose Amitriptyline as an Adjunct to Opioids for Postoperative Orthopedic Pain: a Placebo-Controlled Trial Period", Pain 52: 325-30 (1993). В обоих исследованиях препарат вводили перорально. Во втором исследовании отмечалось, что перорально введенный амитриптилин действительно вызывает пониженную общую чувствительность у пациентов в послеоперационном периоде, что может быть за счет аффинности препарата для многих аминных рецепторов в мозге.
Амитриптилин помимо блокирования поглощения 5-НТ и норепинефрина, является сильным антагонистом 5-НТ-рецепторов. Следовательно, отсутствие эффективности в ослаблении боли в послеоперационном периоде в двух ранее указанных исследованиях противоречит предположению о роли эндогенного 5-НТ в развитии острой боли. Имеется ряд причин в отношении отсутствия ослабления острой боли под действием амитриптилина в данных двух исследованиях. (1) В первом исследовании (Levine et. al., 1986) амитриптилин использовался перед операцией в течение одной недели до ночи непосредственно перед операцией в то время, как во втором исследовании (Kerrick et. al., 1993) амитриптилин использовался только в послеоперационном периоде. Следовательно, не известны уровень амитриптилина, имеющийся в тканях в месте операции во время стадии фактического травмирования тканей, и время, когда 5-НТ начинает высвобождаться. (2) Известно, что амитриптилин интенсивно метаболизируется в печени. При пероральном введении во втором исследовании концентрация амитриптилина в тканях в месте операции может быть не достаточно высокой в течение достаточно длительного периода времени для ингибирования активности высвобожденного 5-НТ в послеоперационном периоде. (3) Поскольку существуют многочисленные медиаторы воспаления, и в исследованиях было показан синергизм медиаторов воспаления, то блокирование только одного вещества (5-НТ) может ингибировать воспалительный ответ на травмирование тканей не в достаточной степени.
Имеется несколько исследований, в которых была показана способность антагонистов гистаминовых рецепторов в очень высоких концентрациях (1%-3% растворы, т.е. 10-30 мг на миллилитр) действовать в качестве местных анестетиков при хирургических процедурах. Полагают, что данное анестезирующее действие опосредуется не через Hi-рецепторы, а в большей степени за счет неспецифического взаимодействия с натриевыми каналами мембран нейронов (аналогично действию лидокаина). Оказывая побочные эффекты (например, седативный эффект), связанные с данными высокими "анестезирующими" концентрациями антагонистов гистаминовых рецепторов, местное применение антагонистов гистаминовых рецепторов в настоящее время не практикуется в периоперативном периоде.
III. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает раствор, включающий смесь многих агентов в низких концентрациях, предназначенный для местного ингибирования медиаторов боли, воспаления и разрушения хряща в физиологической, содержащей электролиты жидкости-носителе. Изобретение также обеспечивает способ периоперативной доставки орошающего раствора, содержащего данные агенты, непосредственно в место операции, где он действует местно на уровне рецепторов и ферментов для упреждающего подавления боли, воспаления и разрушения хряща в месте операции. За счет способа местной периоперативной доставки согласно настоящему изобретению, желаемый терапевтический эффект может быть достигнут при более низких дозах агентов, чем необходимые при применении других способов доставки (т.е. внутривенного, внутримышечного, подкожного и перорального). Агенты против боли, и/или против воспаления, и/или против разрушения хряща в растворе включают агенты, выбранные из следующих групп антагонистов и агонистов рецепторов и активаторов и ингибиторов ферментов, где каждая группа действует через различный молекулярный механизм подавления боли, и/или воспаления, и/или разрушения хряща. Типичные агенты для подавления боли и/или воспаления включают, например: (1) антагонисты серотониновых рецепторов; (2) агонисты серотониновых рецепторов; (3) антагонисты гистаминовых рецепторов; (4) антагонисты брадикининовых рецепторов; (5) ингибиторы калликреина; (6) антагонисты тахикининовых рецепторов, включая антагонисты подтипов рецепторов нейрокинина1 и нейрокинина2; (7) антагонисты рецепторов пептида, связанного с геном кальцитонина (CGRP); (8) антагонисты интерлейкиновых рецепторов; (9) ингибиторы ферментов, активных в синтезе метаболитов арахидоновой кислоты, включая (а) ингибиторы фосфолипаз, в том числе ингибиторы изоформы PLA2 и ингибиторы изоформы PLC; (b) ингибиторы циклооксигеназы и (с) ингибиторы липооксигеназы; (10) антагонисты простаноидных рецепторов, включая антагонисты подтипа рецепторов эйкозаноида ЕР-1 и ЕР-4 и антагонисты подтипа рецепторов тромбоксана; (11) антагонисты лейкотриеновых рецепторов, включая антагонисты подтипа рецепторов лейкотриена D4 и антагонисты подтипа рецепторов лейкотриена D4; (12) агонисты опиоидных рецепторов, включая агонисты подтипов рецепторов μ-опиоида, δ-опиоида и κ-опиоида; (13) антагонисты пуриноцепторов, включая антагонисты рецепторов Р2X и антагонисты рецепторов Р2Y; (14) антагонисты кальциевых каналов. Каждый из вышеуказанных агентов функционирует в качестве либо агента против воспаления, либо против чувствительности, т.е. против боли, или анальгезирующего агента. Выбор агентов из данных групп соединений обусловлен конкретным применением. Типичные агенты для подавления разрушения хряща включают, например: (1) антагонисты рецепторов семейства белков интерлейкина-1, включая, например, IL-1β, IL-17 и IL-18; (2) антагонисты семейства рецепторов факторов некроза опухолей (TNF), например TNF-R1; (3) агонисты рецепторов интерлейкина 4, 10 и 13; (4) агонисты надсемейства рецепторов TGF-β, включая, например, BMP-2, BMP-4 и ВМР-7; (5) ингибиторы СОХ-2; (6) ингибиторы семейства МАР-киназ, включая, например, р38 МАРкиназу; (7) ингибиторы семейства белков матричных металлопротеиназ (ММР), включая, например, ММР-3 и ММР-9; (8) ингибиторы семейства белков NF-κВ, включая, например, димерный комплекс р50/р65 с IκВ; (9) ингибиторы семейства синтазы окиси азота (NOS), включая, например, iNOS; (10) агонисты и антагонисты интегриновых рецепторов, включая, например, агонисты αVβ3-интегрина; (11) ингибиторы семейства протеинкиназы С (РКС); (12) ингибиторы семейства тирозиновых протеинкиназ, включая, например, подсемейство src; (13) модуляторы (белок-тирозин)-фосфатаз; и (14) ингибиторы доменов гомологии 2 белков scr (SH2).
В других аспектах изобретения обеспечиваются способы и растворы для подавления или предупреждения разрушения суставного хряща введением непосредственно в сустав пациента композиции, которая включает один или более метаболически активных защитных для хряща агентов вместе с одним или более агентами для подавления боли, воспаления или тому подобное, как описано ранее, или альтернативно комбинации двух или более метаболически активных защитных для хряща агентов в фармацевтически эффективном носителе для внутрисуставной доставки. Метаболически активные агенты включают, но не ограничиваются соединениями, которые действуют непосредственно или опосредованно для модуляции или изменения биологического, биохимического или биофизического состояния клетки, включая агенты, которые изменяют электрический потенциал плазменной мембраны, активность связывания лиганда или ферментативную активность клеточных рецепторов, внутриклеточных или внеклеточных ферментов, взаимодействия белок-белок, взаимодействия РНК-белок или взаимодействия ДНК-белок. В одном аспекте настоящего изобретения обеспечиваются фармацевтические композиции метаболически активных защитных для хряща агентов, которые основаны на комбинации по меньшей мере двух агентов, которые действуют одновременно на различные молекулярные мишени. В типичном воплощении по меньшей мере один агент является агонистом рецепторов цитокинов или факторов роста, которые непосредственно обеспечивают противовоспалительную активность и/или способствуют анаболическим процессам в хряще, и по меньшей мере второй агент представляет антагонист рецепторов или ингибитор ферментов, который действует для подавления воспалительных и/или катаболических процессов в хряще. Противовоспалительные/анаболические цитокины, которые действуют функционально для подавления роли провоспалительных цитокинов в суставе, способствуют синтезу хрящевого матрикса и подавляют разрешение матрикса. Данные агонисты рецепторов включают, например, специфические противовоспалительные и анаболические цитокины, такие как агонисты интерлейкинов (IL) (например, IL-4, IL-10 и IL-13), и специфические члены подсемейства трансформирующего фактор роста-β (например, TGFβ и ВМР-7), инсулиноподобные факторы роста (например, IGF-1) и факторы роста фибробластов (например, bFGF). По меньшей мере второй агент выбран из группы антагонистов рецепторов или ингибиторов ферментов, который действует для подавления или снижения активности, или экспрессии провоспалительной молекулярной мишени (например, антагонисты IL-1-рецепторов, антагонисты TNF-α-рецепторов, ингибиторы циклооксигеназы-2, ингибиторы МАРкиназы, ингибиторы синтазы окиси азота (NOS) и ингибиторы ядерного фактора kappaB (NF-κВ). Множественная комбинация агентов из анаболических агентов и ингибиторов катаболизма может добавляться местно путем внутрисуставной инъекции или инфузии, включая периоперативное назначение (т.е. перед операцией и/или во время операции и/или после операции) во время хирургических артроскопических процедур.
Суставной хрящ представляет специализированный внеклеточный матрикс, который продуцируется и сохраняется метаболически активными суставными хондроцитами. Сохранение нормального, здорового внеклеточного матрикса отражает динамический баланс между скоростью биосинтеза и включением матричных компонентов и скоростью их разрушения и последующей потери из хряща в синовиальную жидкость. Несмотря на то, что регуляторные механизмы, которые лежат в основе гомеостаза в матриксе, не совсем еще хорошо понятны, они четко изменяются при воспалительных заболеваниях суставов и в ответ на травму суставов так, что скорость распада матрикса превышает скорость нового синтеза матричных компонентов. Гомеостаз в матриксе обычно рассматривается, как динамический баланс между катаболическими цитокинами и анаболическими цитокинами (включая факторы роста). Оптимальная комбинация терапевтических агентов, подходящих для защиты хряща, сдвигает динамическое равновесие в матриксе, ускоряя скорость синтеза и одновременно ингибируя скорость распада, таким образом делая максимальными анаболические процессы и способствуя восстановлению хряща.
Катаболические цитокины, такие как IL-1β и TNF-α, действуют на специфические рецепторы хондроцитов, индуцируя продукцию MMPs, которые индуцируют распад матрикса, в то время как разрушение ингибируется анаболическими цитокинами, такими как TGF-β, ВМР-2 и IGF-1. Следовательно, терапевтический подход, базирующийся только на ингибировании катаболических процессов (такой, как композиция ингибитора ММР и антагониста IL-1), не является оптимальным для восстановления хряща, поскольку необходимы анаболические агенты для индукции или ускорения биосинтеза и сборки компонентов для продукции матрикса. Второе, множество катаболических цитокинов (IL-1, TNF, IL-17, IL-18, LIF), которые участвуют в деструкции хрящевого матрикса, указывает, что будет непрактичным полностью блокировать катаболическую активность цитокинов. И наоборот, подход, который основывается только на использовании анаболических агентов таких, как IGF-1, BMP-2 или BMP-7, не является оптимальным, поскольку он не направлен на противорегуляторную роль катаболических цитокинов. TGF-β, ВМР-2 и IGF-1 также действуют на специфические рецепторы с индукцией хондроцитов продуцировать компоненты матрикса, которая тормозится под действием IL-1β, TNF-α, IL-17 и LIF. Следовательно, оптимальная терапевтическая комбинация для защиты хряща состоит из по меньшей мере одного анаболического агента и одного ингибитора катаболизма хряща.
Настоящее изобретение также обеспечивает способ получения лекарственного препарата, составленного в виде разбавленного орошающего раствора для использования при постоянном орошении места операции, обычно в месте сустава у пациента во время артроскопической хирургической процедуры. Способ включает растворение в физиологической, содержащей электролиты жидкости-носителе по меньшей мере одного агента против разрушения хряща и предпочтительно одного или более агентов ингибирующих боль/воспаления и для некоторых применений агентов против разрушения хряща, где каждый агент включен в концентрации предпочтительно не более чем 100000 нмоль, более предпочтительно не более чем примерно 25000 нмоль, и наиболее предпочтительно не более чем примерно 10000 нмоль.
Способ по настоящему изобретению обеспечивает доставку разбавленной комбинации многочисленных антагонистов и агонистов рецепторов и ингибиторов и активаторов ферментов непосредственно на рану или место операции во время терапевтических или диагностических процедур для подавления боли, воспаления и разрушения хряща. Поскольку активные ингредиенты в растворе применяются местно непосредственно на ткани в месте операции в течение постоянного периода времени, препараты можно эффективно использовать в очень низких дозах по сравнению с дозами, необходимыми для проявления терапевтического эффекта, когда те же препараты доставляются перорально, внутримышечно, подкожно или внутривенно. В том смысле, как он используется, термин "местный" включает применение препарата в или вокруг раны или другого места операции, и исключает пероральное, подкожное, внутривенное и внутримышечное введение. Термин "постоянный", в том смысле, как он используется, включает непрерывное применение, неоднократное применение с частыми интервалами, и применения, которые являются непрерывными за исключением коротких остановок, позволяющих ввести другие препараты, или агенты, или оборудование для процедуры, таким образом, что в основном постоянная, заранее определенная концентрация сохраняется местно в ране или месте операции.
Преимущества применения агентов в низких дозах являются троекратными. Наиболее важным является отсутствие системных побочных эффектов, которые часто ограничивают полезность данных агентов. Кроме того, агенты, выбранные для особых применений в растворах по настоящему изобретению, являются высоко специфичными в отношении медиаторов и опосредующих мишеней, на которые они действуют. Данная специфичность поддерживается используемыми низкими дозами. Наконец, стоимость данных активных агентов для хирургической процедуры является низкой.
Преимущества местного применения агентов путем орошения или другого применения жидкости являются следующими: (1) местное применение гарантирует наличие известной концентрации в целевом месте, независимо от вариабельности между пациентами в метаболизме, кровяном потоке и т.п.; (2) в результате прямого способа доставки терапевтическую концентрацию получают незамедлительно и, таким образом, обеспечивается усовершенствованный контроль дозирования; и (3) также местное применение активных агентов непосредственно на рану или место операции существенно снижает деградацию агентов в системных процессах, например, в результате первичного и вторичного метаболизма, что в противном случае будет иметь место, когда агенты вводят перорально, внутривенно, подкожно или внутримышечно. Это особенно касается тех активных агентов, которые по своей природе являются пептидами, которые быстро метаболизируются. Таким образом, местное применение позволяет использовать соединения или агенты, которые в противном случае нельзя использовать в терапевтических целях. Например, некоторые агенты в следующих группах являются пептидами; антагонисты брадикининовых рецепторов; антагонисты тахикининовых рецепторов; агонисты опиоидных рецепторов; антагонисты CGRP-рецепторов; и антагонисты интерлейкиновых рецепторов; антагонисты TNF-рецепторов; агонисты TGF-β-рецепторов; агонисты ВМР-2- и ВМР-7-рецепторов; агонисты рецепторов IL-4, IL-10 и IL-13; агонисты и антагонисты интегриновых рецепторов. Местная, постоянная доставка на рану или место операции сводит до минимума деградацию или метаболиз препаратов, в то же время обеспечивая постоянную замену той порции агента, которая может деградировать, для гарантии того, что местная, терапевтическая концентрация, достаточная для поддержания занятости рецептора или насыщения фермента, поддерживается во время всего периода хирургической процедуры.
Местное периоперативное применение раствора во время хирургической процедуры по настоящему изобретению дает упреждающий обезболивающий, противовоспалительный и защитный в отношении хряща эффект. В том смысле, как он используется, термин "периоперативный" включает применение во время процедуры, перед и во время процедуры, во время и после процедуры, и перед, во время и после процедуры. Для максимального проявления упреждающего противовоспалительного, обезболивающего (для некоторых применений) и защитного для хряща (для некоторых применений) действия растворы по настоящему изобретению наиболее предпочтительно применяют перед, во время и после операции. Занимая целевые рецепторы или инактивируя или активируя целевые ферменты до начала значительного местного травмирования во время операции агенты настоящего раствора модулируют специфические пути для упреждающего подавления целевого патологического процесса. Если медиаторы или процессы воспаления упреждающе подавляются по настоящему изобретению до того, как они могут вызвать повреждение ткани, польза является более существенной, чем, если она предоставляется после того, как повреждение уже началось.
Было показано, что ингибируя более чем один медиатор боли, воспаления или разрушения хряща, применением раствора из многих агентов по настоящему изобретению, наглядно снижается степень воспаления и боли, и теоретически будет обеспечиваться защитное действие в отношении хряща. Орошающие растворы по настоящему изобретению включают комбинации препаратов, где каждый раствор действует на многочисленные рецепторы или ферменты. Таким образом, лекарственные агенты являются одновременно эффективными против целой комбинации патологических процессов, включая боль и воспаление и потерю гомеостаза в хряще. Полагается, что действие данных агентов является синергетическим, а именно многие антагонисты рецепторов и ингибирующие агонисты по настоящему изобретению обеспечивают в комбинации диспропорционально повышенную эффективность по сравнению с эффективностью отдельных агентов. Синергетическое действие нескольких агентов по настоящему изобретению обсуждается с помощью примера ниже при подробном описании данных агентов.
Используемый периоперативно, раствор приводит к клинически заметному подавлению боли и воспаления в месте операции и разрушения хряща по сравнению с используемыми в настоящее время орошающими жидкостями, тем самым снижая потребность пациентов в анестетиках в послеоперационном периоде (т.е. опиате), и соответственно, позволяя проводить более раннюю мобилизацию места операции у пациента. Со стороны хирурга и персонала операционной не требуется дополнительных усилий для применения настоящего раствора по сравнению с обычными орошающими жидкостями. Для оптимальной защиты хряща растворы по изобретению применяются непосредственно на сустав перед, во время и/или после хирургической процедуры.
IV. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Настоящее изобретение будет подробнее описано с помощью примеров со ссылкой на сопровождающие чертежи, где:
Фигура 1 представляет схематичный вид хондроцита, показывающий молекулярные мишени и поток сигнальной информации, приводящей к продукции медиаторов воспаления и сдвигам в метаболизме хряща. Показано, что интеграция внешних сигналов посредством нескольких семейств клеточных поверхностных рецепторов, включая цитокиновые рецепторы, такие как семейство рецепторов интерлейкина-1 (IL-1) и семейство рецепторов фактора некроза опухолей (TNF), надсемейство TGF-β-рецепторов и интегрины, сходятся на общих внутриклеточных путях передачи сигналов, которые включают большие группы белковых молекул, являющихся терапевтическими мишенями для препаратов, включенных в растворы по настоящему изобретению (МАРкиназы, РКС, тирозинкиназы, SH2-белки, СОХ, PLA2 и NF-6B). Активация данных путей передачи сигналов регулирует экспрессию в хондроцитах ряда индуцируемых генных продуктов, включая IL-1, TNF-α, IL-6, IL-8 и стромелизин (ММР-3) и другие медиаторы (окись азота (NO) и PGE2), которые могут привести к воспалению и/или разрушению хряща, или синтезу матричных молекул и пролиферации хондроцитов.
Фигура 2 представляет схематичный вид синовиоцита, показывающий молекулярные мишени и поток сигнальной информации, приводящей к продукции медиаторов воспаления и сдвигам в метаболизме хряща. Показано, что интеграция внешних сигналов посредством нескольких семейств клеточных поверхностных рецепторов, включая цитокиновые рецепторы, которые включают семейство рецепторов интерлейкина-1 (IL-1) и семейство рецепторов фактора некроза опухолей (TNF), сопряженные с G-белком рецепторы, которые включают брадикининовые, гистаминовые и серотониновые подтипы, и интегрины, сходятся на общих внутриклеточных путях передачи сигналов, которые включают большие группы белковых молекул, являющихся терапевтическими мишенями для препаратов, включенных в растворы по настоящему изобретению (МАР-киназы, РКС, тирозинкиназы, SH2-белки, СОХ, PLA2 и NF-6B). Активация данных путей передачи сигналов регулирует экспрессию в синовиоцитах ряда индуцируемых генных продуктов, включая IL-1, TNF-α, IL-6, IL-8 и стромелизин (ММР-3), которые могут привести к воспалению и/или разрушению хряща.
Фигура 3 представляет диаграмму общих путей передачи сигналов в хондроцитах и синовиоцитах, включая ключевые сигнальные белки, ответственные за "перекрестное влияние" между активированными GPCR-рецепторными путями и провоспалительными цитокиновыми путями, которые приводят к воспалению и разрушению хряща.
Фигура 4 представляет диаграмму общих путей передачи сигналов в хондроцитах и синовиоцитах, включая ключевые сигнальные белки, ответственные за "перекрестное влияние" между активированными GPCR-рецепторными путями и провоспалительными цитокиновыми путями. Указаны специфические молекулярные сайты действия некоторых лекарственных препаратов в предпочтительном защитном для хряща растворе по настоящему изобретению.
Фигура 5 представляет диаграмму молекулярных мишеней, находящихся либо на хондроцитах, либо на синовиоцитах, которые способствуют анаболическому ответу в хряще. Указаны специфические сайты действия некоторых лекарственных препаратов в предпочтительном защитном для хряща растворе по настоящему изобретению.
Фигура 6 представляет диаграмму молекулярных мишеней, находящихся либо на хондроцитах, либо на синовиоцитах, которые способствуют катаболическому ответу в хряще. Указаны специфические сайты действия некоторых лекарственных препаратов в предпочтительном растворе для защиты хряща по настоящему изобретению.
Фигура 7 представляет графическое изображение продукции простагландина Е2 в культурах синовиоцитов регуляторными агонистами G-белка с последующим премированием в течение ночи интерлейкином-1 (IL-1, 10 Е/мл). Культуры стимулировали в течение указанных периодов времени гистамином (100 мкМ, незакрашенные столбцы) или брадикинином (1 мкМ, закрашенные столбцы) и определяли высвобождаемый в культуральный супернатант простагландин Е2, как описано в примере 6. Представленные значения представляют среднее значение±стандартное отклонение в типичном опыте и с поправкой на фоновую продукцию простагландина Е2 в не стимулированных культурах.
Фигура 8 представляет графическое изображение ингибирования продукции простагландина Е2 в синовиальных культурах под действием кетопрофена. Культуры примировали в течение ночи IL-1 (10 Е/мл) в присутствии (показано, как  ) или отсутствии (показано, как "Δ" или "▿") кетопрофена в указанных концентрациях. Через один день определяли простагландин Е2 в супернатантах культур, обработанных в течение ночи кетопрофеном, и оставшиеся культуры промывали, инкубировали в течение 10 мин с кетопрофеном в указанных концентрациях, и затем определяли продукцию простагландина Е2 в ответ на последующую стимуляцию гистамином в течение 3 мин (100 мкМ, ▿) или брадикинином (1 мкМ, Δ) в продолжающемся присутствии кетопрофена в указанных количествах. Представленные данные нормализованы по отношению к максимальному ответу, полученному для каждого агониста соответственно, и представляют среднее значение ± стандартное отклонение, полученное в трех опытах, проведенных на различных клеточных линиях.
) или отсутствии (показано, как "Δ" или "▿") кетопрофена в указанных концентрациях. Через один день определяли простагландин Е2 в супернатантах культур, обработанных в течение ночи кетопрофеном, и оставшиеся культуры промывали, инкубировали в течение 10 мин с кетопрофеном в указанных концентрациях, и затем определяли продукцию простагландина Е2 в ответ на последующую стимуляцию гистамином в течение 3 мин (100 мкМ, ▿) или брадикинином (1 мкМ, Δ) в продолжающемся присутствии кетопрофена в указанных количествах. Представленные данные нормализованы по отношению к максимальному ответу, полученному для каждого агониста соответственно, и представляют среднее значение ± стандартное отклонение, полученное в трех опытах, проведенных на различных клеточных линиях.
Фигура 9 представляет графическое изображение действия кетопрофена на продукцию IL-6 в синовиальных культурах на 16 ч в присутствии IL-1 в указанных концентрациях плюс добавленные лиганды рецепторов, сопряженные с G-белком. Культуры инкубировали в течение 16 ч с IL-1 в указанных концентрациях (0,3, 1,0 и 3,0 пг/мл) в отсутствии и присутствии 0/75 мкМ кетопрофена в экспериментальной культуральной среде с одним из следующих дополнительных рецепторных лигандов: 1) изопротеренолом (ISO) в концентрации 1,0 мкМ для активации общего пути или 2) гистамином (HIS) в концентрации 100 мкМ для активации IР3/кальциевого пути. Собирали культуральные супернатанты и замещали аликвотами свежей среды, содержащей добавки тех же агонистов с 8-часовыми интервалами. После обработки собирали супернатанты среды, соответствующие интервалам обработки от 8 до 16 ч, и анализировали на содержание IL-6.
V. ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА
ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Орошающие и инъекционные растворы по настоящему изобретению представляют растворы одного или более агентов для защиты хряща агентов и необязательно одного или более обезболивающих и/или противовоспалительных агентов в физиологическом носителе. Носитель является жидким раствором, который предназначен для включения биосовместимых растворителей, суспензий, полимеризующихся и неполимеризующихся гелей, паст и мазей, а также компонентов систем доставки с постоянным высвобождением, таких как микрочастицы, микросферы или наночастицы, состоящие из белков, липосом, углеводородов, синтетических органических соединений или неорганических соединений. Предпочтительно носитель представляет водный раствор, который может включать физиологические электролиты, такой как обычный физиологический раствор или лактированный раствор Рингера.
Агенты против воспаления и/или боли выбраны из группы, состоящей из (1) антагонистов, серотониновых рецепторов; (2) агонистов серотониновых рецепторов; (3) антагонистов гистаминовых рецепторов; (4) антагонистов брадикининовых рецепторов; (5) ингибиторов калликреина; (6) антагонистов тахикининовых рецепторов, включая антагонисты подтипов рецепторов нейрокинина1 и нейрокинина2; (7) антагонистов рецепторов пептида, связанного с геном кальцитонина (CGRP); (8) антагонистов интерлейкиновых рецепторов; (9) ингибиторов ферментов, активных в синтезе метаболитов арахидоновой кислоты, в том числе (а) ингибиторы фосфолипазы, включая ингибиторы изоформы PLA2 и ингибиторы изоформы PLC; (b) ингибиторы циклооксигеназы и (с) ингибиторы липооксигеназы; (10) антагонистов простаноидных рецепторов, включая антагонисты подтипа рецепторов эйкозаноида ЕР-1 и ЕР-4 и антагонисты подтипа рецепторов тромбоксана; (11) антагонистов лейкотриеновых рецепторов, включая антагонисты подтипа рецепторов лейкотриена В4 и подтипа рецепторов лейкотриена D4; (12) агонистов опиоидных рецепторов, включая агонисты рецепторов подтипа μ-опиоида, δ-опиоида и κ-опиоида; (13) агонистов и антагонистов пуриноцепторов, включая антагонисты рецепторов Р2X и антагонисты рецепторов P2Y; (14) антагонистов кальциевых каналов.
Подходящие защитные для хряща агенты включают, например, (1) антагонисты рецепторов семейства белков интерлейкинов-1, включая, например, IL-1β, IL-17 и IL-18; (2) антагонисты семейства рецепторов факторов некроза опухолей (TNF), включая, например, TNF-R1; (3) агонисты рецепторов интерлейкина 4, 10 и 13; (4) агонисты надсемейства рецепторов TGF-P, включая, например, BMP-2, BMP-4 и BMP-7; (5) ингибиторы COX-2; (6) ингибиторы семейства МАР-киназы, включая, например, р38 МАРкиназу; (7) ингибиторы семейства белков матричных металлопротеиназ (ММР), включая, например, ММР-3 и ММР-9; (8) ингибиторы семейства белков NF-кВ, включая, например, димерный комплекс р50/р65 с 1кВ; (9) ингибиторы семейства синтазы окиси азота (NOS), включая, например, iNOS; (10) агонисты и антагонисты интегриновых рецепторов, включая, например, агонисты αVβ3-интегрина; (11) ингибиторы семейства протеинкиназы С (РКС); (12) ингибиторы семейства тирозиновых протеинкиназ, включая, например, подсемейство src; (13) модуляторы протеин-тирозинфосфатаз; и (14) ингибиторы доменов гомологии-2 белков scr (SH2).
Специфические предпочтительные воплощения раствора по настоящему изобретению для использования для защиты хряща при артроскопических процедурах предпочтительно включают комбинацию агентов, которые действуют одновременно на различные молекулярные мишени для способствования анаболизму хряща и ингибирования нерегулируемых или избыточных катаболических процессов в хряще для достижения максимального ингибирования воспалительных процессов и сохранения гомеостаза в хряще, тем самым достигая защитное для хряща действие в суставе.
В каждом из хирургических растворов по настоящему изобретению агенты включены в низких концентрациях в жидком растворе или жидкой среде, и доставляются местно в низких дозах по сравнению с концентрациями и дозами, необходимыми при обычных способах введения лекарственных препаратов для достижения желаемого терапевтического эффекта. В том смысле, как он здесь используется, термин "жидкость" или "жидкая среда" предназначен для включения фармацевтически приемлемых, био совместимых растворителей, суспензий, полимеризуемых и неполимеризуемых гелей, паст и мазей. Предпочтительно носитель представляет водный раствор, который может включать физиологические электролиты такие, как обычный физиологический раствор или лактированный раствор Рингера. Представляется не возможным или непрактичным получить такой же терапевтический эффект при доставке агентов в таких же дозах другими (т.е. внутривенным, подкожным, внутримышечным или пероральным) путями введения лекарственных препаратов, поскольку лекарственные препараты, введенные системно подвергаются первичному и вторичному метаболизму. Концентрацию каждого агента отчасти определяют, ориентируясь на его константу диссоциации с рецептором, Kd, или константу ингибирования фермента, Ki. В том смысле, как он здесь используется, термин константа диссоциации предназначен включать константу равновесия диссоциации в отношении его типичного взаимодействия агонист-рецептор или антагонист-рецептор и константу равновесия ингибирования в отношении его типичного взаимодействия активатор-фермент или ингибитор-фермент. Каждый агент предпочтительно включен в низкой концентрации от 0,1 до 10000 раз от Kd или Ki, за исключением ингибиторов циклооксигеназы, для которой, возможно, требуются большие концентрации в зависимости от конкретного выбранного ингибитора. Предпочтительно каждый агент включен в концентрации от 1,0 до 1000 раз от Kd или Ki и наиболее предпочтительно 100 раз от Kd или Ki. Данные концентрации доводят при необходимости с учетом разбавления в отсутствии метаболической трансформации в месте локальной доставки. Конкретные агенты, выбранные для использования в растворе, и концентрации агентов варьируют в зависимости от конкретного применения, как описано ниже.
Раствор по настоящему изобретению может включать один или много агентов для подавления боли и/или воспаления, множественный защитный для хряща агент(ов), по меньшей мере один из которых является анаболическим защитным для хряща агентом, и по меньшей мере один из которых является ингибитором катаболизма хряща, или комбинацию защитного для хряща агента (ов) и агентов для подавления боли и/или воспаления в низкой концентрации. Однако за счет вышеуказанного синергетического действия многих агентов и желания полностью блокировать боль, воспаление и разрешение хряща, предпочтительно, чтобы использовались многие агенты.
Хирургические растворы представляют новый терапевтический подход при объединении многих фармакологических агентов, действующих на различные рецепторные и/или ферментные молекулярные мишени. К настоящему времени фармакологические стратегии сосредоточены на разработке высокоспецифичных лекарственных препаратов, которые являются селективными в отношении отдельных подтипов рецепторов и изоформ ферментов, которые опосредуют ответы на отдельные сигнальные нейромедиаторы и гормоны. Кроме того, несмотря на инактивирование одного подтипа рецептора или фермента, активация других подтипов рецептора или фермента и полученная сигнальная трансдукция часто может "запускать" каскадный эффект. Это объясняет значительную трудность при использовании одного лекарственного препарата, специфичного к одному рецептору для блокирования патофизиологического процесса, в котором играют роль многие сигнальные медиаторы (например, цитокины, факторы роста или эйкозаноиды). Следовательно, целенаправленное воздействие только на специфический отдельный подтип рецептора или изотип, вероятно, является неэффективным.
В противоположность обычному подходу к фармакологической терапии терапевтический подход с настоящими хирургическими растворами основан на рациональной основе, что комбинация лекарственных препаратов, действующих одновременно на различные молекулярные мишени, является высокоэффективным в отношении ингибирования полного спектра событий, которые лежат в основе развития патофизиологического состояния. Кроме того, вместо целенаправленного воздействия только на один специфический подтип рецепторов, хирургические растворы состоят из лекарственных препаратов, которые направлены на общие молекулярные механизмы, действующие в различных клеточных физиологических процессах, участвующих в развитии боли, воспаления или разрушения хряща (см. фигуру 1). Таким же образом каскад дополнительных рецепторов и ферментов в ноцицепторных, воспалительных и путях разрушения хряща сводится до минимума хирургическими растворами. В данных патофизиологических путях хирургические растворы ингибируют каскадный эффект "положительной регуляции" и "отрицательной регуляции".
Примером ингибирования по типу "положительной регуляции" являются антагонисты циклооксигеназы в подавлении боли и воспаления. Циклооксигеназы (COX2 и СОХ2) катализируют превращение арахидоновой кислоты в простагландин Н, который представляет промежуточный продукт в биосинтезе воспалительных и ноцицептивных медиаторов, включая простагландины, лейкотриены и тромбоксаны. Ингибиторы циклооксигеназы блокируют "положительную регуляцию" образования данных медиаторов воспаления и ноцицепторов. Данная стратегия предусматривает необходимость блокирования взаимодействий семи описанных подтипов простаноидных рецепторов с простаноидными продуктами на биохимическом пути с участием СОХ. Подобный ингибитор "положительной регуляции", включенный в хирургические растворы, представляет апротинин, ингибитор калликреина. Фермент калликреин, серинпротеаза, расщепляет высокомолекулярные кининогены в плазме с образованием брадикининов, важных медиаторов боли и воспаления. Ингибируя калликреин, апротинин эффективно ингибирует синтез брадикининов, тем самым обеспечивая эффективное ингибирование "положительной регуляции" данных медиаторов воспаления.
В хирургических растворах также используются ингибиторы "отрицательной регуляции" для регуляции патофизиологических путей. В препаратах синовиоцитов и хондроцитов, которые были обработаны различными цитокинами воспаления (например, IL-1β и TNF-α), участвующими в прогрессирующем разрушении суставного хряща, ингибиторы МАРкиназы представляют защитный эффект для хряща. р38 МАРкиназа представляет точку передачи в путях передачи сигналов для многих катаболических цитокинов, и ее ингибирование предупреждает "положительную регуляцию" многих клеточных продуктов, опосредующих разрушение хряща. Ингибиторы МАРкиназы, следовательно, обеспечивают значительное преимущество для хирургических растворов в подавлении воспаления суставов обеспечением "отрицательной регуляции" защитных эффектов для хряща, которые являются независимыми от физиологической комбинации агонистов цитокиновых рецепторов, индуцируя сдвиг гомеостаза в хряще.
Последующее представляет описание подходящих препаратов, попадающих в вышеуказанные группы агентов против воспаления/против боли и для защиты хряща, а также подходящие концентрации для применения в растворах по настоящему изобретению. Не желая ограничивать себя теорией, также приводится обоснование выбора различных групп агентов, которое, как полагается, делает агенты действующими.
I. ОБЕЗБОЛИВАЮЩИЕ И/ИЛИ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ АГЕНТЫ
1. АНТАГОНИСТЫ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ
Полагают, что серотонин (5-НТ) приводит к боли, стимулируя рецепторы серотонина2 (5-НТ2) и/или серотонина3 (5-НТ3) на чувствительных периферических нейронах. Большинство исследователей едины во мнении, что 5-НТ3-рецепторы на периферических ноцицепторах опосредуют мгновенное болевое ощущение, продуцированное 5-НТ (Richardson et al., 1985). Кроме того, ингибируя индуцированную 5-НТ боль антагонисты 5-НТ3-рецепторов, ингибируя активацию ноцицепторов, также могут ингибировать нейрогенное воспаление. Barnes P.J. et al., Modulation of Neurogenic Inflammation: Novel Approaches to Inflammatory Disease, Trends in Pharmacological Sciences 11, pp. 185-189 (1990). Исследование на локтевых суставах крыс, однако, свидетельствует о том, что 5-НТ2-рецептор ответственен за активацию ноцицепторов под действием 5-НТ. Grubb B.D. et al., A Study of 5-HT-Receptors Associated with Afferent Nerves Located in Normal and Inflamed Rat Ankle Joints, Agents Actions 25, pp.216-18 (1988). Следовательно, активация 5-НТ2-рецепторов также может играть роль в возникновении периферической боли и нейрогенного воспаления.
Назначением раствора по настоящему изобретению является блокирование боли и объема воспалительных процессов. Таким образом, антагонисты 5-НТ2-и 5-НТ3-рецепторов оба подходят для использования либо по отдельности, либо вместе в растворе по настоящему изобретению. Амитриптилин (Elavil™) подходит в качестве антагониста 5-НТ2-рецепторов для применения по настоящему изобретению. Амитриптилин использовался в клинике в течение многих лет в качестве антидепрессанта, и было установлено, что он оказывает полезное действие у некоторых пациентов с хронической болью. Метохлорпрамид (Reglan™) применялся в клинике в качестве препарата против рвоты, но он проявляет умеренную аффинность к 5-НТ3-рецептору и может ингибировать действие 5-НТ на данном рецепторе, возможно, ингибируя боль за счет высвобождения 5-НТ из тромбоцитов. Таким образом, он также пригоден для применения по настоящему изобретению.
Другие подходящие антагонисты 5-НТ2-рецепторов включают имипрамин, тразодон, дезипрамин и кетансерин. Кетансерин использовался в клинике за счет его антигипертензивного действия. Hedner Т. et al., Effects of a New Serotonin Antagonist, Ketanserin, in Experimental and Clinical Hypertension, Am J of Hypertension, pp.317s-23s (Jul. 1988). Другие пригодные антагонисты 5-НТ3-рецепторов включают цизаприд и ондасетрон. Подходящие антагонисты рецепторов серотонина1В включают иохимбин, N-[метокси-3-(4-метил-1-пиперазинил)фенил]-2'-метил-4'-(5-метил-1,2,4-оксадиазол-3-ил) [1, 1-бифенил]-4-карбоксамид («GR127935») и метиотепин. Терапевтические и предпочтительные концентрации для применения этих лекарственных препаратов в растворе по настоящему изобретению приведены в таблице 1.
Терапевтические и предпочтительные концентрации ингибирующих боль и/или противовоспалительных агентов
2. АГОНИСТЫ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ
Известно, что 5-HT1A-, 5-HT1B- и 5-НТ1D-рецепторы ингибируют активность аденилатциклазы. Таким образом, низкая доза агонистов данных рецепторов серотонина1A, серотонина1B и серотонина1D в растворе будет ингибировать нейроны, опосредующие боль и воспаление. Такое же действие ожидается от агонистов рецепторов серотонина1E и серотонина1F, поскольку данные рецепторы также ингибируют аденилатциклазу.
Буспирон является подходящим агонистом 1A-рецептора для применения по настоящему изобретению. Суматриптан является подходящим агонистом 1А-, 1В-, 1D- и 1F-рецепторов. Подходящим агонистом 1В- и 1D-рецепторов является дигидроэрготамин. Подходящим агонистом 1Е рецепторов является эргоновин. Терапевтические и предпочтительные концентрации данных агонистов рецепторов представлены в таблице 2.
Терапевтические и предпочтительные концентрации ингибирующих боль и/или противовоспалительных агентов
3. АНТАГОНИСТЫ ГИСТАМИНОВЫХ РЕЦЕПТОРОВ
Гистаминовые рецепторы обычно подразделяются на подтипы гистамина1 (H1) и гистамина2 (Н2). Классическая воспалительная ответная реакция на периферическое введение гистамина опосредуется через H1-рецептор: Douglas, 1985. Следовательно, раствор по настоящему изобретению предпочтительно включает антагонист рецептора гистамина H1. Прометазин (Phenergan™) представляет обычно применяемый против рвоты препарат, который в значительной степени блокирует H1-рецепторы и подходит для применения по настоящему изобретению. Интересно, что было показано, что данный препарат обладает местным анестезирующим действием, но концентрации, необходимые для проявления данного эффекта на несколько порядков выше, чем те, которые необходимы для блокирования H1-рецепторов, таким образом, полагают, что данные эффекты осуществляются по различным механизмам. Концентрация антагонистов гистаминовых рецепторов в растворе достаточна для ингибирования H1-рецепторов, участвующих в активации ноцицепторов, но не для достижения "местного анестезирующего" действия, тем самым устраняется значение системных побочных эффектов.
Другие подходящие антагонисты H1-рецепторов включают терфенадин, дифенгидрамин, амитриптилин, мепирамин и триполидин. Поскольку амитриптилин также эффективен в качестве антагониста рецептора серотонина2, он обладает двойной функцией при использовании по настоящему изобретению. Подходящие терапевтические и предпочтительные концентрации для каждого из данных агонистов H1-рецепторов приведены в таблице 3.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
4. АНТАГОНИСТЫ БРАДИКИНИНОВЫХ РЕЦЕПТОРОВ
Брадикининовые рецепторы обычно подразделяются на подтипы брадикинина1 (B1) и брадикинина2 (В2). В исследованиях было показано, что острая периферическая боль и воспаление, продуцируемые брадикинином, опосредуются подтипом B2 в то время, как индуцируемая брадикинином боль при хроническом воспалении опосредуется через подтип B1: Perkins M.N. et al., Antinociceptive Activity of the Bradykinin B1 and B2 Receptor Antagonists, des-Arg9, [Leu8]-BK and HOE 140, in Two Models of Persistent Hyperalgesia in the Rat, Pain 53, pp.191-197 (1993); Dray A. et al., Bradykinin and Inflammatory Pain, Trends Neurosci 16, pp.99-104 (1993), каждый из этих источников включен здесь для сведения.
В настоящее время антагонисты брадикининовых рецепторов не используются в клинике. Некоторые из этих препаратов являются пептидами, и их нельзя принимать перорально, поскольку они подвергнутся перевариванию. Антагонисты В2-рецепторов блокируют индуцируемую брадикинином острую боль и воспаление: Dray et al., 1993. Антагонисты B1-рецепторов ингибируют боль при хронических воспалительных состояниях. Perkins et al., 1993; Dray et al., 1993. Следовательно, в зависимости от применения раствор по настоящему изобретению предпочтительно включает один или оба антагониста брадикинина B1 и В2. Например, артроскопию проводят при острых и хронических состояниях, и, таким образом, орошающий раствор для артроскопии может включать антагонисты как B1-рецепторов, так и В2-рецепторов.
Подходящие антагонисты брадикининовых рецепторов для применения по настоящему изобретению включают следующие антагонисты брадикининовых1 рецепторов: [дез-Arg10] производное D-Arg-(Hyp3Thi5D-Tic7Oic8)-BK ("[дез-Arg10] производное НОЕ 140", от Hoechst Pharmaceuticals); и [Leu8] дез-Arg9ВК. Подходящие антагонисты брадикининовых2 рецепторов включают: [D-Phe7-BK; D-Arg-(Hyp3Thi5,8-Phe7)-BK ("NPC 349"); D-Arg-(Hyp3D-Phe7)-BK ("NPC 567"); и D-Arg-(Нур3Thi5 D-Tic7-Oic8)-ВК ("НОЕ 140"). Подходящие терапевтические и предпочтительные концентрации приведены в таблице 4.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
5. ИНГИБИТОРЫ КАЛЛИКРЕИНА
Пептид брадикинин представляет важный медиатор боли и воспаления, как уже отмечалось ранее. Брадикинин продуцируется в качестве продукта расщепления под действием калликреина на высокомолекулярных кининогенах в плазме. Следовательно, полагается, что ингибиторы калликреина будут оказывать лечебное действие при ингибировании продукции брадикинина и возникающих в результате болей и воспаления. Подходящим ингибитором калликреина для применения по настоящему изобретению является апротинин. Подходящие концентрации для применения в растворах по настоящему изобретению представлены ниже в таблице 5.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
6. АНТАГОНИСТЫ ТАХИКИНИНОВЫХ РЕЦЕПТОРОВ
Тахикинины (TKs) представляют семейство структурно близких пептидов, которые включают вещество Р, нейрокинин А (NKA) и нейрокинин В (NKB). Нейроны являются основным источником TKs в периферических тканях. Важным общим действием TKs является стимуляция нейронов, но другие эффекты включают зависимое от эндотелия расширение сосудов, экстравазацию белков плазмы, восстановление и дегрануляцию тучных клеток и стимуляцию клеток воспаления: Maggi С.A., Gen. Pharmacol., Vol.22, pp.1-24 (1991). За счет вышеуказанной комбинации физиологических эффектов, опосредуемых активацией рецепторов ТК, целенаправленное воздействие на ТК-рецепторы является разумным подходом к способствованию анальгезии и лечению нейрогенного воспаления.
6а. АНТАГОНИСТЫ ПОДТИПА НЕЙРОКИНИНОВЫХ1 РЕЦЕПТОРОВ
Вещество Р активирует подтип нейрокининовых рецепторов, относящихся к NK1. Вещество Р представляет ундекапептид, который находится в сенсорных нервных окончаниях. Известно, что вещество Р обладает многими эффектами, которые приводят к воспалению и боли в периферических тканях после активации С-волокон, включая расширение сосудов, экстравазацию плазмы и дегрануляцию тучных клеток. Levine J.D. et al., Peptides and the Primary Afferent Nociceptor, J. Neurosci. 13, p.2273 (1993). Подходящим антагонистом вещества Р является (CD-Pro9 [спиро-гамма-лактам] Leu10, Trp11] физалаемин-(1-11)) ("GR 82334"). Другими подходящими антагонистами для применения по настоящему изобретению, которые воздействуют на NK1-рецепторы, являются: 1-имино-2-(2-метоксифенил)этил)-7,7-дифенил-4-пер-гидроизоиндолон(3аR,7аR) ("RP 67580"); и 2S,3S-цис-3-(2-метоксибензиламино)-2-бензгидрилхинуклидан ("СР 96345"'). Подходящие концентрации данных агентов представлены в таблице 6.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
6b. АНТАГОНИСТЫ ПОДТИПА НЕЙРОКИНИНОВЫХ2 РЕЦЕПТОРОВ
Нейрокинин А представляет пептид, который находится в сенсорных нейронах с веществом Р и который также способствует возникновению воспаления и боли. Нейрокинин А активирует специфические нейрокининовые рецепторы, относящиеся к NKa. Edmonds-Alt S. et al., A Potent and Selective Non-Peptide Antagonist of the Neurokinin A (NK:2) Receptor, Life Sci. 50:PL101 (1992). Примеры подходящих антагонистов NK2 включают: ((S)-N-метил-N-[4-(4-ацетиламино-4-фенилпиперидино)-2-(3,4-дихлорфенил) бутил]-бензамид ("(±)-SR 48968"); Met-Asp-Trp-Phe-Dap-Leu ("MEN 10627"); и цик(GIn-Trp-Phe-Gly-Leu-Met) ("L 659877"). Подходящие концентрации данных агентов приведены в таблице 7.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
7. Антагонисты CGRP-рецепторов
Пептид, связанный с геном кальцитонина (CGRP), является пептидом, который также находится в сенсорных нейронах с веществом Р и который действует в качестве вазодилататора и усиливает действие вещества: Р. Brain S.D. et al., Inflammatory Oedema Induced by Synergism Between Calcitonin Gene-Related Peptide (CGRP) and Mediators of Increased Vascular Permeability, Br. J. Pharmacol. 99, p.202 (1985). Примером подходящего антагониста CGRP-рецепторов является I-CGRP-(8-37), усеченный вариант CGRP. Данный полипептид ингибирует активацию CGRP-рецепторов. Подходящие концентрации данного агента приведены в таблице 8.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
8. АНТАГОНИСТ ИНТЕРЛЕЙКИНОВЫХ РЕЦЕПТОРОВ
Интерлейкины представляют семейство пептидов, называемых цитокинами, продуцируемые лейкоцитами и другими клетками в ответ на медиаторы воспаления. Интерлейкины могут быть сильными гипералгическими агентами в периферических тканях. Ferriera S.H. et al., Interleukin-1β as a Potent Hyperalgesic Agent Antagonized by a Tripeptide Analogue, Nature 334, p.698 (1988). Примером подходящего антагониста IL-1β-рецептора является Lys-D-Pro-Thr, который представляет усеченный вариант IL-1β. Данный трипептид ингибирует активацию IL-1β-рецепторов. Подходящие концентрации данного агента приведены в таблице 9.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
9. ИНГИБИТОРЫ ФЕРМЕНТОВ, ВОВЛЕЧЕННЫХ В СИНТЕТИЧЕСКИЙ ПУТЬ МЕТАБОЛИЗМА АРАХИДОНОВОЙ КИСЛОТЫ
9а. Ингибиторы фосфолипазы
Продукция арахидоновой кислоты с участием фосфолипаз А2 (PLA2) (cPLA2, iPLA2, sPLA2) и фосфолипазы С (PLC) приводит к каскаду реакций, в которых образуются многочисленные медиаторы воспаления, известные как эйкозаноиды. Имеется ряд стадий на данном пути, которые можно ингибировать, тем самым снижая продукцию данных медиаторов воспаления. Примеры ингибирования на данных различных стадиях приведены ниже.
Ингибирование изоформы фермента PLA2 подавляет высвобождение арахидоновой кислоты из клеточных мембран и, следовательно, ингибирует продукцию простагландинов и лейкотриенов, приводя к подавлению воспаления и боли: Glaser К.В., Regulation of Phospholipase A2 Enzymes: Selective Inhibitors and Their Pharmacological Potential, Adv. Pharmacol. 32, p.31 (1995). Примером подходящего ингибитора изоформы PLA2 является маноалид. Подходящие концентрации данного агента включены в таблицу 10. Ингибирование изоформы фосфолипазы Сγ(PLCγ) также приведет к пониженной продукции простаноидов и лейкотриенов и, следовательно, будет приводить к пониженной боли и воспалению. Примером ингибитора изоформы PLCγ является 1-[6-((17β-3-метоксиэстра-1,3,5(10)-триен-17-ил)амино)гексил]-1Н-пиррол-2,5-дион.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
9b. Ингибиторы циклооксигеназы
Нестероидные противовоспалительные препараты (NSAIDs) широко используются в качестве противовоспалительных, антипиретических, антитромбических и аналгезирующих агентов. Lewis R.A., Prostaglandins and Leukotrienes, In: Texbook of Rheumatology, 3d ed. (Kelley W.N. et al., eds.), p.258 (1989). Молекулярными мишенями для данных лекарственных препаратов являются циклооксигеназы типа I и типа II (СОХ-1 и СОХ-2). Данные ферменты известны так же, как простагландин Н-синтаза (PGHS)-l (конститутивная) и -2 (индуцируемая), и они катализируют превращение арахидоновой кислоты в простагландин Н, который является промежуточным продуктом в биосинтезе простагландинов и тромбоксанов. Фермент СОХ-2 обнаружен в эндотелиальных клетках, макрофагах и фибробластах. Данный фермент индуцируется под действием IL-1 и TNF-α, и его экспрессия повышается в местах воспаления. Активность конститутивной СОХ-1 и активность индуцированной СОХ-2 приводят к синтезу простагландинов, которые участвуют в развитие боли и воспаления.
Многие коммерческие NSAIDs (диклофенак, напроксен, индометацин, ибупрофен и т.п.) в основном являются неселективными ингибиторами обеих изоформ СОХ, но могут проявлять более высокую селективность в отношении СОХ-1 по сравнению с СОХ-2, хотя данное соотношение варьирует для различных соединений. Применение ингибиторов СОХ-1 и 2 для блокирования образования простагландинов представляет лучшую терапевтическую стратегию, чем попытка блокировать взаимодействия естественных лигандов с семью описанными подтипами простаноидных рецепторов. Антагонисты эйкозаноидных рецепторов (ЕР-1, ЕР-2, ЕР-3), о которых сообщалось, являются довольно редкими и только специфическими, сообщалось об антагонистах с высокой аффинностью рецептора тромбоксана А2: Wallace J. and Cirino G. Trends in Pharm. Sci., Vol. 15, pp. 405-406 (1994).
Типичные терапевтические и предпочтительные концентрации ингибиторов циклооксигеназы для применения в растворе приводятся в таблице 11.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
9с.Ингибиторы липооксигеназы
Ингибирование фермента липооксигеназы подавляет продукцию лейкотриенов, таких как лейкотриен В4, который, как известно, является важным медиатором воспаления и боли. Lewis R.A., Prostaglandins and Leukotrienes, In: Texbook of Rheumatology, 3d ed. (Kelley W.N. et al., eds.), pp.258 (1989). Примером антагониста 5-липооксигеназы является 2,3,5-триметил-6-(12-гидрокси-5,10-додекадиинил)-1,4-бензохинон ("АА 861"), подходящие концентрации которого приведены в таблице 12.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
10. АНТАГОНИСТЫ ПРОСТАНОИДНЫХ РЕЦЕПТОРОВ
Специфические простаноиды, продуцируемые в качестве метаболитов арахидоновой кислоты, опосредуют их воспалительные эффекты через активацию простаноидных рецепторов. Примерами групп специфических простаноидных антагонистов являются антагонисты подтипов рецепторов эйкозаноида ЕР-1 и ЕР-4 и антагонисты подтипа рецепторов тромбоксана. Подходящим антагонистом рецептора простагландина Е2 является 8-хлорди-бенз[b,f][1,4]оксазепин-10(11Н)-карбоновая кислота, 2-ацетилгидразид ("SC 19220"). Подходящим антагонистом подтипа рецепторов тромбоксана является [15-[1α,2β(5Z),3β,4α]-7-[3-[2-(фениламино)-карбонил]гидразино]метил]-7-оксобицикло-[2,2,1]-гепт-2-ил]-5-гептановая кислота ("SO 29548"). Подходящие концентрации данных агентов приведены в таблице 13.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
11. АНТАГОНИСТЫ ЛЕЙКОТРИЕНОВЫХ РЕЦЕПТОРОВ
Лейкотриены (LTB4, LTC4 и LTD4) представляют продукты метаболизма арахидоновой кислоты при участии 5-липооксигеназы, которые продуцируются ферментативно и обладают важными биологическими свойствами. Лейкотриены участвуют в развитии ряда патологических состояний, включая воспаление. Многие фармацевтические компании в настоящее время ведут поиск специфических антагонистов в целях потенциального терапевтического вмешательства в данные патологии. Halushka P.V. et al., Annu. Rev. Pharmacol. Toxicol. 29: 213-239 (1989); Ford-Hutchinson A., Crit. Rev. Immunol. 10: 1-12 (1990). LTB4-рецептор обнаружен в некоторых клетках иммунной системы, включая эозинофилы и нейтрофилы. Связывание LTB4 с данными рецепторами приводит к хемотаксису и высвобождению лизосомальных ферментов, тем самым способствуя развитию процесса воспаления. Передача сигналов, связанная с активацией LTB4-рецептора, включает опосредуемую G-белком стимуляцию метаболизма фосфотидилинозита (PI) и увеличение внутриклеточного кальция (см. фигуру 2).
Примером подходящего антагониста рецептора лейкотриена В4 является SC(+)-(S)-7-(3-(2-циклопропилметил)-3-метокси-4-[(метиламино)-карбонил]фенокси(пропокси)-3,4-дигидро-8-пропил-2Н-1-бензопиран-2-пропановая кислота ("SC 53228"). Концентрации данного агента, которые подходят для практики настоящего изобретения, приведены в таблице 14. Другие подходящие антагонисты рецепторов лейкотриена 84 включают [3-[-2(7-[хлор-2-хинолил)этенил]фенил][[3-(диметиламино-3-оксопропил)тио]метил]тиопропановую кислоту ("МК 0571") и препараты LY 66071 и ICI 203219. МК 0571 также действует в качестве антагониста подтипа рецепторов LTD4.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
В4:
12. АГОНИСТЫ ОПИОИДНЫХ РЕЦЕПТОРОВ
Активация опиоидных рецепторов приводит к антиноцицептивным эффектам, и, следовательно, агонисты для данных рецепторов является желаемыми. Опиоидные рецепторы включают подтипы μ-, δ- и κ-опиоидных рецепторов, μ-рецепторы располагаются в окончаниях периферических сенсорных нейронов и активация данных рецепторов подавляет активность сенсорных нейронов: Basbaum A.I. et al., Opiate analgesia: How Central is a Peripheral Target?, N. Engi. J. Med., 325:1168 (1991). δ- и κ-рецепторы находятся в симпатических эфферентных окончаниях и ингибируют высвобождение простагландинов, тем самым подавляя боль и воспаление. Taiwo Y.O. et al., Kappa- and Delta-Opioids Block Sympathetically Dependent Hyperalgesia, J. Neurosci., Vol.11, page 928 (1991). Подтипы опиоидных рецепторов являются членами надсемейства сопряженных с G-белком рецепторов. Следовательно, все агонисты опиоидных рецепторов взаимодействуют и инициируют передачу сигнала через их родственный сопряженный с G-белком рецептор. Примерами подходящих агонистов α-опиоидных рецепторов являются фентанил и Try-D-Ala-Gly-[N-MePhe]-NH(CH2)-ОН ("DAMGO"). Примером подходящего агониста κ-опиоидных рецепторов является [D-Pen2,D-Pen5]энкефалин ("DPDPE"). Примером подходящего агониста к-опиоидных рецепторов является (транс)-3,4-дихлор-N-метил-N-[2-(1-пирролидинил)циклогексил]-бензолацетамид ("U 50488"). Подходящие концентрации каждого из данных агентов приведены в таблице 15.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
13. АНТАГОНИСТЫ ПУРИНОЦЕПТОРОВ
Внеклеточная АТФ действует в качестве сигнальной молекулы через взаимодействия с Р2-пуриноцепторами. Одной большой группой пуриноцепторов являются Р2X-пуриноцепторы, которые являются воротными лигандами ионных каналов, обладающими внутренними ионными каналами, проницаемыми для Na+, К+ и Са2+. Р2X-рецепторы, описанные в сенсорных нейронах, являются важными для первичной афферентной передачи нервного импульса и восприятия боли. Известно, что АТФ деполяризует сенсорные нейроны и играет роль в активации ноцицепторов, поскольку АТФ, высвобождаемая из поврежденных клеток, стимулирует Р2X-рецепторы, приводя к деполяризации ноцицептивных окончаний нервных волокон. Р2Х3-рецепторы имеют очень ограниченное распространение (Chen С.С. et al., Nature, Vol.377, pp.428-431 (1995)), поскольку они селективно экспрессируются в сенсорных нервных С-волокнах, которые проходят в спинной мозг, и известно, что многие данные С-волокна несут рецепторы для болевых стимулов. Таким образом, высоко ограниченная локализация экспрессии субъединиц Р2Х3-рецепторов делает эти подтипы превосходными мишенями для аналгезирующего действия (см. фигуры 3 и 7).
Кальций-мобилизующие пуриновые рецепторы, которые относятся к надсемейству рецепторов G-белка, описаны на поверхности суставных хондроцитов у млекопитающих. Было установлено, что АТФ стимулирует зависимое от дозы, временное повышение концентрации ионов кальция в дифференцированных первичных хондроцитах. В опытах с гетерологичной десенсибилизацией было показано, что хондроциты не проявляют последующий ответ на УТФ после начала стимуляции под действием АТФ. Эти результаты согласуются с наличием Р2Y-рецепторов на клеточной поверхности хондроцитов. Индуцированная пурином мобилизация кальция в пассажированных хондроцитах показывает аналогичный фармакологический профиль в отношении чувствительности к агонисту. АТФ и УТФ не изменяют синтез матрикса хряща, что было определено по скорости включения [35S]сульфата в гликозаминогликан в хрящевых эксплантатах или первичных хондроцитах. Разрушение матрикса, определенное по высвобождению гликозаминогликана из хрящевых эксплантатов, также не изменялось под действием любого агониста. Присутствие функциональных пуриновых Р2Y-рецепторов на поверхности первичных суставных хондроцитов способствует концентрациям внеклеточных пуринов, таких как АТФ, активировать метаболизм хондроцитов.
В других исследованиях была установлена экспрессия генами Р1- и Р2-пуриновых рецепторов в человеческих суставных хондроцитах и профильное опосредуемое лигандами высвобождение простагландина Е2. Агонисты Р2Y2-рецепторов АТФ и УТФ стимулировали незначительное высвобождение PGE2, которое синергетически усиливалось после предварительной обработки человеческим IL-1α. Высвобождение PGE2 в ответ на совместное добавление АТФ и УТФ после предварительной обработки IL-1 мимикрировалось форболмиристатом ацетатом. Функцией P2Y2-рецептора является усиление опосредуемого IL-1 высвобождения PGE2, что тем самым способствует возникновению боли и воспаления в суставе. Таким образом, применение антагонистов P2Y в настоящем изобретении будет предупреждать активацию продукции медиаторов воспаления, как синовиоцитами, так и хондроцитами.
Подходящие антагонисты Р2X/АТФ-пуриноцепторов для применения по настоящему изобретению включают, в виде примера, сурамин и пиридоксифосфат-6-азофенил-2,4-дисульфоновую кислоту ("PPADS"). Подходящие концентрации данных агентов приведены в таблице 16.
Терапевтические и предпочтительные концентрации агентов, ингибирующих боль и/или воспаление
14. АНТАГОНИСТЫ Са2+-каналов
Антагонисты кальциевых каналов представляют отдельную группу лекарственных препаратов, которые препятствуют трансмембранному потоку ионов кальция для активации клеточных ответов, опосредующих нейровоспаление. Вхождение ионов кальция в синовиоциты и хондроциты является ключевым событием, опосредующим активацию ответов в данных клетках. Кроме того, роль брадикининовых, гистаминовых, серотониновых (SHT2) и нейрокининовых рецепторов (NK1 и NK2) в опосредовании пути передачи сигнала при нейровоспалении, включает повышение внутриклеточного кальция, приводя таким образом к активации кальциевых каналов на плазменной мембране. Во многих тканях антагонисты кальциевых каналов, такие как нифедипин, могут снижать высвобождение арахидоновой кислоты, простагландинов и лейкотриенов, которые возникают под действием различных стимулов: Moncada S., Flower R. and Vane J. in Goodman's and Oilman's Phannacological Basis of Therapeutics, (7th ed.), MacMillan Publ. Inc., pp.660-5 (1995).
Наконец, антагонисты кальциевых каналов и каждый из антагонистов тахикинина, гистамина или брадикинина проявляют синергетическое действие в подавлении нейровоспаления. Установлена роль нейрокининовых рецепторов в опосредовании нейровоспаления. Путь передачи сигнала с участием рецепторов нейрокинина1 (NK1) и нейрокинина2 (NK2) (члены сопряженного с G-белком надсемейства) включает повышение внутриклеточного кальция, приводя таким образом к активации кальциевых каналов на плазменной мембране. Аналогичным образом, активация рецепторов брадикинина2 (ВК2) сопряжена с повышением внутриклеточного кальция в синовиоцитах и хондроцитах. Таким образом, антагонисты кальциевых каналов взаимодействуют с общим механизмом, вызывающим повышение внутриклеточного кальция, часть которого проходит через каналы L-типа. Это является основой для синергетического взаимодействия между антагонистами кальциевых каналов и антагонистами рецепторов нейрокинина, гистамина, P2Y и брадикинина2.
Подходящие антагонисты кальциевых каналов для практики настоящего изобретения включают нисолдипин, нифедипин, нимодипин, лацидипин, израдипин и амлодипин. Подходящие концентрации данных агентов приведены в таблице 17.
Терапевтические и предпочтительные концентрации агентов, подавляющих спазмы
II. АГЕНТЫ ДЛЯ ИНГИБИРОВАНИЯ РАЗРУШЕНИЯ ХРЯЩА
Недавние достижения в понимании биохимии и молекулярной биологии воспаления и деструкции хряща прояснили роль многочисленных эндогенных цитокинов. Многочисленными провоспалительными медиаторами, которые участвуют в распаде хряща в воспаленном суставе, являются цитокины, TNF-α, IL-1, IL-6 и IL-8. Повышенные уровни ряда данных провоспалительных цитокинов быстро появляются в синовиальной жидкости коленных суставов при остром повреждении и остаются повышенными у пациентов по меньшей мере в течение 4 недель (Cameron, ML et al., "Synovial fluid cytokine concentrations as possible prognostic indicators in the ACL-deficient knee". Knee Sung. Sports Traumatol. Arthroscopy 2:38-44 (1994)). Данные цитокины продуцируются местно в суставе несколькими активированными типами клеток, включая синовиальные фибробласты, синовиальные макрофаги и хондроциты. Образованные местно цитокины опосредуют патофизиологические события при острых и хронических воспалительных состояниях и являются важными аутокринными и паракринными медиаторами в катаболизме хряща. Действие данных цитокинов характеризуется их способностью вызывать многочисленные эффекты на различных клеточных мишенях и их способностью взаимодействовать позитивным или отрицательным синергетическим образом с другими цитокинами. Особенно важными являются IL-1 и TNF-α, поскольку они также инициируют разрушающие хрящ эффекты нарушением баланса между нормальным обменом и деструкцией компонентов хрящевого матрикса путем модуляции активности эндогенных белков, например матричных металлопротеиназ (MMPs), и тканевым ингибитором металлопротеиназы (TIMP). Регуляция под действием цитокинов гомеостаза в хряще представляет высоко регулируемый баланс между активными медиаторами, действующими в хондроцитах, который определяет, будет иметь место разрушение матрикса или его восстановление.
Повреждение сустава часто приводит к воспалительной ответной реакции внутри суставного пространства, которая вовлекает синовиальную ткань и может привести к разрушению суставного хряща. Описаны наглядные сдвиги метаболизма в синовиальной жидкости и хряще в колене у человека после повреждения сустава и атроскопической операции (Cameron M.L. et al. (1994), выше; Cameron M.L. et al. "The natural history of the anterior cruciate ligament-deficient knee: Changes in synovial fluid cytokine and keratan sulfate concentrations", Am. J. Sports Med. 25:751-754 (1997)). Уровни специфических провоспалительных цитокинов наглядно возрастают (на 2-4 порядка по сравнению с обычным значением) в синовиальной жидкости коленного сустава во время фазы острого воспаления после разрыва передней крестообразной связки колена (ACL). Значительные изменения также происходят в концентрациях молекул хрящевого матрикса за счет повышенной продукции матричных металлопротеиназ (MMPs), таких как коллагеназа и стромелизин-1, которые повышены в синовиальной жидкости пациентов после острой травмы (Lohmander L.S. et al. "Temporal patterns of stromelysin-1 tissue inhibitor, and proteoglycan fragments in human knee joint fluid after injury to the cruciate ligament or meniscus", J. Orthopaedic Res. 12:21-28 (1994)). Временные изменения цитокинов и маркеров хрящевого матрикса (например, протеогликанов) в синовиальной жидкости, которые коррелируют с разрушением хряща, являются максимальными в период острого повреждения, но остаются повышенными в течение продолжительного периода времени (от 3 месяцев до одного года), медленно снижаясь и оставаясь выше по сравнению с фоновыми уровнями до повреждения.
Сама по себе травма в результате артроскопической операции вызывает сильное послеоперационное воспаление, которое отражает дополнительную воспалительную активацию клеток в суставе, включая положительную регуляцию циклооксигеназы-2 и других провоспалительных цитокинов. У значительной части пациентов (60-90%) с разрывом ACL выявлены изменения колена на рентгеновских снимках, указывающие на остеоартрит (ОА) через 10-15 лет после повреждения (Cameron M.L. et al. (1994), выше). Таким образом, объединенные эффекты первоначального повреждения сустава и хирургической травмы могут индуцировать непрерывное воспалительное состояние и связанные изменения в метаболизме хрящевого матрикса, которые являются причинными факторами, приводящими к последующему развитию дегенеративных изменений в суставном хряще и вскоре развитию остеоартрита. Значение данной проблемы здравоохранения является существенным, поскольку общее установленное количество артроскопических вмешательств, проводимых только в США, составляло в 1996 году 1,8 млн с установленной скоростью роста примерно 10% в год. Таким образом, желательно обеспечить фармацевтический способ для предупреждения разрушения суставного хряща внутри сустава.
Несмотря на то, что боль и воспаление в послеоперационном периоде признаются, как значительные клинические проблемы, схемы фармакологического лечения в настоящее время направлены только на острую анальгезию в послеоперационном периоде. Существующие правила хирургического лечения не направлены на хроническое воспалительное состояние, которое возникает после операции, и необходимость подавлять деструкцию хряща в суставе после операции. Следовательно, имеется четкая необходимость в разработке эффективной интегрированной лекарственной терапии, которая будет направлена как на острые, так и на хронические аспекты боли и воспаления, а также патологические изменения в метаболизме хряща в поврежденном или оперированном суставе.
По данному аспекту изобретения обеспечивается способ подавления или профилактики деструкции суставного хряща в суставе введением непосредственно в сустав пациента композиции, которая включает один или более метаболически активных защитных для хряща агентов вместе с одним или более обезболивающими и противовоспалительными агентами, как описано ранее, или альтернативно комбинацию двух или более метаболически активных защитных для хряща агентов, по меньшей мере один из которых способствует протеканию анаболических процессов в хряще и по меньшей мере один из которых является ингибитором катаболических процессов в хряще, в фармацевтически эффективном носителе для внутрисуставной доставки. Метаболически активные агенты включают, но не ограничиваются, всеми соединениями, которые действуют прямо или опосредованно с модуляцией или изменением биологического, биохимического или биофизического состояния клетки, включая агенты, которые изменяют электрический потенциал плазменной мембраны, связывание лигандов или ферментативную активность клеточных рецепторов, внутриклеточных и внеклеточных ферментов, взаимодействия белок-белок, взаимодействия РНК-белок или взаимодействия ДНК-белок. Например, такие агенты могут включать агонисты рецепторов, которые начинают каскады передачи сигналов, антагонисты рецепторов, которые ингибируют пути передачи сигналов, активаторы и ингибиторы внутриклеточных и внеклеточных ферментов и агенты, которые модулируют связывание факторов транскрипции с ДНК.
В частности, один аспект настоящего изобретения обеспечивает фармакологический способ лечения поврежденного или оперированного сустава с использованием комбинации защитных для хряща агентов, доставленных местно для достижения максимального терапевтического эффекта. Применение комбинации защитных для хряща агентов преодолевает ограничения существующих терапевтических подходов, которые основаны на использовании одного агента для блокирования многофакторного процесса деструкции хряща, в котором происходит сдвиг между синтезом и деградацией в пользу катаболических процессов. Данный аспект изобретения исключительно использует подход объединения агентов, которые действуют одновременно на различные молекулярные мишени для способствования анаболизму хряща и ингибированию нерегулируемых или избыточных катаболических процессов в хряще с достижением максимального подавления воспалительных процессов и сохранением гомеостаза в хряще, тем самым достигая защитного для хряща эффекта внутри сустава. Ингибирование одной молекулярной мишени или биохимического механизма, известных как индуцирующие деструкцию (катаболизм) хряща, такое как ингибирование связывания интерлейкина-1 (IL-1) с рецептором IL-1, вероятно, не будет оптимальным, поскольку, например, действие TNF-α, опосредуемое через его уникальный рецептор, разделяет многие перекрывающиеся провоспалительные и катаболические функции в хряще с IL-1, и он также признан как один из важных медиаторов деструкции хряща в суставе. Аналогичным образом, использование фармацевтических агентов, которые только усиливают анаболические процессы в хряще в отсутствии подавления катаболических процессов, не будет оптимально противодействовать катаболическим факторам, присутствующим в поврежденном суставе.
В частности, один аспект настоящего изобретения обеспечивает фармацевтические композиции метаболически активных защитных для хряща агентов, которые базируются на комбинации по меньшей мере двух агентов, которые действуют одновременно на различные молекулярные мишени. В типичном воплощении по меньшей мере один агент является агонистом рецепторов цитокинов и факторов роста, который непосредственно обеспечивает противовоспалительную активность и/или способствует анаболическим процессам в хряще, и по меньшей мере второй агент является антагонистом рецепторов или ингибитором ферментов, который действует для подавления провоспалительных и/или катаболических процессов в хряще. Типичная комбинация лекарственных препаратов включает по меньшей мере один агент, выбранный из группы противовоспалительных/анаболических цитокинов, который действует функционально для подавления роли провоспалительных цитокинов в суставе, способствует синтезу хрящевого матрикса и ингибирует разрушение матрикса. Данные агонисты рецепторов включают, но не ограничиваются, специфическими противовоспалительными и анаболическими цитокинами, такими как агонисты интерлейкинов (IL) (например, IL-4, IL-10 и IL-13) и специфическими членами надсемейства трансформирующего фактора роста-β (например, TGFB-β и ВМР-7), инсулиноподобными факторами роста (например, IGF-1) и факторами роста фибробластов (например, bFGF). По меньшей мере второй агент выбран из группы антагонистов рецепторов и ингибиторов ферментов, который ингибирует и снижает активность или экспрессию провоспалительной молекулярной мишени (например, антагонисты IL-1-рецепторов, антагонисты TNF-α-рецепторов, ингибиторы циклооксигеназы-2, ингибиторы МАРкиназы, ингибиторы синтазы окиси азота (NOS) и ингибиторы ядерного фактора kappaB (NFκB). Метаболически активные агенты включают функциональные агонисты и антагонисты рецепторов, расположенных на поверхностях клеток, а также ингибиторы связывания с мембранами или внеклеточно секретируемых ферментов (например, стромелизина и коллагеназы). Кроме того, многие агенты направлены на новые мишени, которые являются внутриклеточными ферментами и факторами транскрипции, которые передают и интегрируют сигналы поверхностных рецепторов, включая ингибиторы ферментов NOS, COX-2 и митоген-активированных протеинкиназ (МАРК) и ингибиторы взаимодействий белок-ДНК, такие как фактор транскрипции NFκB. Данный способ позволяет сохранять целостность хряща, одновременно способствуя протеканию опосредуемых цитокинами анаболических процессов и ингибируя катаболические процессы.
Комбинацию из многих препаратов можно доставлять местно внутрисуставной инъекцией или инфузией, включая периоперативное введение (т.е. перед операцией и/или во время операции и/или после операции) во время хирургических артроскопических процедур, одно или в сочетании с постоперационной постоянной доставкой, такой как регулируемая система доставки с помощью насоса или другая система доставки с постоянным высвобождением. Системы доставки с постоянным высвобождением могут включать, но не ограничиваются, микрочастицами, микросферами или наночастицами, состоящими из белков, липосом, углеводородов, синтетических органических соединений или неорганических соединений. Таким образом, в некоторых воплощениях изобретение обеспечивает комбинацию агентов для доставки инъекцией или инфузией, одни или вместе с обезболивающими или противовоспалительными агентами. Быстрое начало действия, достигаемое прямой, местной доставкой защитных для хряща агентов во время или близко ко времени повреждения (например, периоперативно) имеет потенциал ингибировать начальные процессы перед тем, как они "запускают" последующие ответные реакции, и тем самым ограничивает местное повреждение тканей и последующее разрушение хряща.
Преимущества данного аспекта настоящего изобретения включают: 1) терапию комбинацией препаратов, направленную на многофакторные причины деструкции хряща во время острых и хронических состояний; 2) комбинацию защитных для хряща агентов можно сочетать с противовоспалительными и обезболивающими агентами; 3) местная доставка комбинации препаратов достигается мгновенным созданием терапевтической концентрации защитных для хряща агентов внутри сустава; 4) использование орошающего раствора периоперативно обеспечивает постоянное сохранение уровней лекарственных препаратов внутри сустава в терапевтически желаемом пределе во время артроскопической хирургической процедуры; 5) местная доставка позволяет снизить общую дозу лекарственного препарата и частоту дозирования по сравнению с системной доставкой; 6) местная, направленная на место операции доставка в сустав позволяет избежать системной токсичности и уменьшить побочные эффекты; и 7) прямая местная доставка в сустав позволяет применять новые фармацевтически активные пептиды и белки, включая цитокины и факторы роста, которые могут не быть терапевтически полезными, если ограничены системными путями введения.
1. АНТАГОНИСТЫ РЕЦЕПТОРОВ ИНТЕРЛЕЙКИНА-1 (IL-1)
Интерлейкин IL-1 находится в двух формах, IL-1α и IL-1β, которые представляют полипептиды, производные отдельных генных продуктов, которые разделяют одинаковый спектр иммунорегуляторных и провоспалительных функций. IL-1 является полипептидом массой 17 kD, который воздействует на и может продуцироваться рядом клеточных типов в суставе, включая синовиальные фибробласты и макрофаги, хондроциты, эндотелиальные клетки и моноциты, и макрофаги. Имеется существенное доказательство того, что IL-1 играет центральную роль в воспалении сустава и патофизиологической потере суставного хряща, которые имеют место в поврежденном суставе.
Действие обеих форм данного разрушающего хрящ цитокина опосредуется двумя IL-1-рецепторами (IL-1R), рецепторами типа I IL-1 или типа II IL-1. IL-1-рецепторы структурно различаются и относятся к отдельным надсемействам, характеризующимся наличием доменов связывания иммуноглобулинов. Данные рецепторы имеют тесную аминокислотную гомологию с другими рецепторами, включающими иммуноглобулиновые домены. Экспрессия IL-1-рецептора более крупного типа I имеется в Т-клетках и фибробластах, в то время как IL-1-рецептор меньшего типа II имеется в В-клетках, моноцитах, нейтрофилах и клетках костного мозга.
IL-1-рецепторы типа II связывают IL-1β с высокой аффинностью, но связывание IL-1β не инициирует внутриклеточную передачу сигнала, как это происходит при связывании с IL-1-рецепторами типа I. В противоположность рецептор типа II служит в качестве предшественника растворимого фактора связывания IL-1, который, как было показано, распространяется из клеток, и данный растворимый рецептор служит в качестве физиологического антагониста IL-1β. Описан естественный белок связывания IL-1, который соответствует растворимой внешней части рецептора типа II.
Естественный секретируемый растворимый лиганд, который связывается с IL-1-рецепторами, альтернативно относящийся к антагонисту IL-1-рецепторов (sIL-1RA, IL-1Ra, IL-1ra), был клонирован, секвенирован, и было установлено, что он кодирует белок массой 22 kD. IL-1Ra конкурентно ингибирует связывание IL-1α и IL-1β с IL-1-рецепторами обоих типов I и II. IL-1Ra представляет чистый антагонист рецепторов, поскольку его связывание с рецептором не активирует механизм клеточной передачи сигнала, связанных с мембраной IL-1-рецепторов. Несмотря на высокую аффинность связывания этого белка с IL-1Rs, необходим 10-100-кратный молярный избыток для ингибирования биологических ответов клеток на IL-1, которые экспрессируют тип I IL-1R. Известные клетки, которые продуцируют IL-1Ra, включают моноциты, нейтрофилы, макрофаги, синовиоциты и хондроциты. Было показано, что IL-1Ra ингибирует синтез PGE2, индукцию провоспалительных цитокинов и MMPs и продукцию окиси азота. Секретированный IL-1Ra высвобождается in vivo во время экспериментально индуцированного воспаления. Важно, что IL-1Ra экспрессируется в синовиальной ткани и находится в обычной синовиальной жидкости человека. У пациентов с повреждениями колена уровни IL-1Ra в синовиальной жидкости наглядно возрастают в острой фазе после повреждения и затем снижаются до нормальных уровней в подострой и хронической фазах. Таким образом, было показано, что IL-1Ra играет физиологическую роль в ответных реакциях сустава на травму.
IL-1 считается основным разрушающим хрящ цитокином, который играет центральную роль в деструкции сустава за счет его способности стимулировать продукцию ферментов деградации и провоспалительных цитокинов как хондроцитами, так и синовиоцитами. Кроме того, IL-1β является сильным ингибитором синтеза протеогликана и коллагена в хондроцитах. На клеточном уровне, индуцируемые IL-1β ответные реакции синовиальных фибробластов включают повышенную продукцию PGE2, коллагеназы и других нейтральных протеаз и положительную регуляцию уровня провоспалительных цитокинов, IL-6 и IL-8.
IL-1, который находится в суставной жидкости пациентов с артритными заболеваниями, стимулирует хондроциты к: 1) синтезу повышенных количеств ферментов, таких как стромелизин, коллагеназа фибробластов и нейтрофилов и активатор плазминогена и 2) ингибированию синтеза ингибитора-1 активатора плазминогена и ТМР. Кроме того, IL-1β представляет сильный ингибитор синтеза матричных компонентов, таких как коллаген типа II, преобладающая форма коллагена в суставном хряще и протеогликанов. Нарушение баланса между уровнями ингибиторов и протеаз приводит к увеличению количества активных протеаз. Данное повышение в сочетании с подавлением биосинтеза матрикса приводит к разрушению хряща. В опытах на животных инъекция IL-1 в коленные суставы кроликов вызывает истощение протеогликана из суставного хряща.
Поскольку IL-1 является одним из ключевых цитокинов, участвующих в патогенезе хронического синовита и разрушения хряща, снижение его продукции или блокирование его действия представляет соответствующую стратегию для новых видов лечения в целях подавления синовиального воспаления и обеспечения защитного для хряща эффекта. Можно использовать различные терапевтические подходы для препятствования взаимодействию агониста, IL-1, с его естественным связанным с мембраной рецептором, которые включают: 1) естественные специфические ингибиторы активности IL-1, которые были охарактеризованы к настоящему времени, включая IL-1Ra и растворимые IL-1-рецепторы; 2) анти-ILAbs и 3) небольшие молекулы-антагонисты, которые могут быть пептидами или непептидами.
Способность блокировать действие данного ключевого цитокина будет оказывать влияние на многие клеточные типы в суставе (например, синовиальные фибробласты и хондроциты), ингибируя таким образом патологические эффекты, такие как инфильтрация воспалительных клеток в сустав, синовиальная гиперплазия, активация синовиальных клеток, а также распад хряща и подавление синтеза хрящевого матрикса. Антагонист IL-1-рецепторов будет блокировать распространение воспалительного ответа на IL-1 и таким образом прерывать болезненный процесс. Установлен на моделях воспаления и артрита (RA и ОА) у животных терапевтический потенциал ряда антагонистов IL-1-рецепторов. Состояние пациентов, страдающих RA, улучшалось клинически после подкожной инъекции IL-1Ra или внутрисуставного введения растворимого IL-1R типа I.
Эффекты IL-1β и IL-1Ra зависят от их соответствующих местных концентраций. В супернатантах кусочков синовиума уровни IL-1β были в три раза выше, чем таковые для IL-1Ra. Таким образом, спонтанная местная продукция IL-1Ra не является достаточной для ингибирования эффектов IL-1β, поскольку необходим больший (10-100-кратный) молярный избыток IL-1Ra для ингибирования IL-1-индуцируемых биологических ответных реакций в клетках, которые экспрессируют IL-1R типа I. Таким образом, высокие дозы IL-1Ra использовались in vivo для блокирования IL-1 у добровольцев-пациентов с RA. IL-1Ra, находящийся местно в синовиуме, обеспечивает отрицательный сигнал, подавляющий по меньшей мере часть опосредуемых IL-1 процессов при синовите, таких как скопление лейкоцитов в воспаленной ткани, продукция PGE2 и продукция коллагеназы синовиальными клетками. Был показан защитный для хряща эффект IL-1Ra с использованием прямой инъекции IL-1Ra в сустав на модели ACL у собаки и с использованием подхода генной терапии, основанной на трансфекции гена IL-1Ra в человеческие синовиальные фибробласты.
Настоящее изобретение раскрывает местную доставку растворимого рецепторного белка IL-1, который состоит из внеклеточного домена IL-1 и который способен связываться с молекулой цитокина IL-1 в растворе. В частности, и в виде примера, здесь раскрывается растворимый человеческий IL-1-рецепторный полипептид (shuIL-1R), включающий в основном аминокислотную последовательность 1-312, как раскрывается в патенте США №5319071 и патенте США №5726148, для применения в комбинации с одним или более лекарственными препаратами, выбранными из противовоспалительной группы, обезболивающей группы или защитной для хряща группы. Альтернативно предлагается местная доставка слитого белка, состоящего из полипептида, включающего домен связывания sIL-1R, для применения в целях защиты хряща, как раскрыто в патенте США №5319071. Кроме того, местная доставка антагониста IL-1-рецептора, раскрытого в патенте США №5817306, раскрывается для применения по настоящему изобретению. Было показано, что растворимый рецептор shuIL-1R связывается с IL-1 с наномолярной аффинностью. Местная доставка терапевтически эффективной концентрации растворимого IL-1R-рецептора, такого как shuIL-1R, может происходить прямой инъекцией в сустав или в орошающем растворе (например, во время артроскопической хирургической процедуры) в комбинации с одним или более защитным для хряща лекарственным препаратом, противовоспалительными препаратами или обезболивающими препаратами, и раскрывается здесь в качестве защитного для хряща агента, при местном применении на ткани сустава при различных воспалительных или патофизиологических состояниях. Подобная обработка будет упреждающе ингибировать стимуляцию под действием IL-1 продукции коллагеназы-1 и стромелизина-1. Используя полностью иной способ, основанный на генной доставке в целях местной продукции растворимых рецепторов типа I для IL-1 и/или TNF-α, было установлено, что присутствие растворимых рецепторов для данных цитокинов способно предоставлять защиту коленного сустава у кроликов во время острой фазы воспаления индуцированного антигеном артрита.
Антагонисты-пептиды IL-1-рецепторов (11-15 аминокислот), которые специфически связываются с высокой аффинностью с человеческим IL-1-рецептором типа I подходят для применения по настоящему изобретению в качестве защитных для хряща агентов. Данные небольшие пептиды обеспечивают ряд преимуществ по сравнению с более крупными рекомбинантными растворимыми IL-1-рецепторами или рекомбинантными IL-1ra, которые включают простоту и стоимость синтеза и способность проникать через биологические барьеры. Двумя наиболее сильными пептидами, основываясь на данных по эффективности in vitro, являются: Ас-FEWTPGWYQJYALPL-NH2 (AF12198, IC50=0,5-2 нМ) и Ac-FEWTPGWYQJY-NH2 (AF11567). AF11567 представляет усеченный вариант AF12198 с потерей 4 С-концевых остатков и проявляющий несколько более низкую аффинность в отношении IL-1-рецепторов типа I, но обладающий сходным периодом полувыведения из плазмы крови 2,3-2,6 ч. Оказалось, что слабая растворимость и быстрый метаболизм ограничивают эффективность AF12198 в условиях in vivo при системном введении путем внутривенной инфузии. Данные ограничения частично преодолеваются с помощью способов прямой местной доставки, такой как инъекция во внутрисуставное пространство или включения в хирургическую орошающую жидкость или другой инфузией, как описано в данном изобретении. Примеры антагонистов-агентов IL-1-рецепторов, подходящих для настоящего изобретения, приведены ниже. Для всех способов местной доставки (т.е. инъекции, инфузии или орошения) оптимальной дозой и/или концентрацией каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий в перечень агент, предполагается, что данные концентрации являются терапевтически эффективными.
Терапевтические и предпочтительные концентрации антагонистов рецепторов интерлейкина-1
2. АНТАГОНИСТЫ РЕЦЕПТОРОВ ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ (TNF)
TNF-α, цитокин в основном продуцируемый активированными макрофагами, обладает многими биологическими эффектами, включая регуляцию транскрипции нескольких генов, которые опосредуются специфическими TNF-рецепторами, а также иммунорегуляторной активностью. Первоначально были клонированы и охарактеризованы два различных рецептора, обозначенные TNF-R1 и TNF-R2, и также было установлено, что они продуцируются в качестве растворимых рецепторов.
Рецепторы в данном семействе являются единственными трансмембранными белками со значительной гомологией в их внеклеточных доменах в то время, как их относительно короткие внутриклеточные домены имеют очень незначительную гомологию последовательностей. Действие TNF является результатом связывания фактора с рецепторами клеточной поверхности, которые находятся практически на всех типах клеток, которые были изучены. Были идентифицированы и клонированы два рецептора. Один тип рецептора, обозначенный как TNFR-II (или тип А, или 75 kDa), кодирует трансмембранный белок из 439 аминокислот и имеет кажущуюся молекулярную массу 75 kDa. Второй тип рецепторов, обозначенный TNFR-I (или тип В, или 55 kDa), имеет кажущуюся молекулярную массу 55 kDa и кодирует трансмембранный белок из 426 аминокислот. TNFR1 включает внутриклеточный домен, который может инициировать передачу сигнала по пути с участием NF-kB.
Оба TNF-рецептора показывают высокую аффинность для связывания TNF-α. Были выделены растворимые TNF-рецепторы (sTNFR), и было доказано, что они образуются в результате выделения внеклеточных доменов, связанных с мембраной рецепторов. Было идентифицировано два типа sTNFR и они были обозначены, как sTNFRl (TNF BRI) и sTNFRII (TNF BPII). Было показано, что обе эти формы растворимых рецепторов представляют усеченные формы двух типов TNFR, описанных выше.
TNF-α играет центральную роль в последовательности клеточных и молекулярных событий, лежащих в основе воспалительной ответной реакции и деструкции хряща. Многие эффекты TNF-α перекрываются с провоспалительными эффектами IL-1. Среди провоспалительных эффектов TNF-α находится его стимуляция высвобождения других провоспалительных цитокинов, включая IL-1, IL-6 и IL-8. TNF-α также индуцирует высвобождение матричных металлопротеиназ из нейтрофилов, фибробластов и хондроцитов, которые приводят к разрушению хряща, отчасти в результате стимуляции коллагеназы. Кроме того, TNF-α повышает активность СОХ-2 в обычных человеческих суставных хондроцитах и синовиальных фибробластах, приводя к повышенной продукции PGE2.
Считается, что данный цитокин, наряду с IL-1, инициирует и продуцирует патологические воздействия на хрящ в суставе, включая инфильтрацию лейкоцитами, синовиальную гиперплазию, активацию синовиальных клеток, распад хряща и ингибирование синтеза хрящевого матрикса. В частности, во время синовиального воспаления установлены повышенные уровни TNF-α в синовиальной жидкости суставов, и имеет место повышенная продукция TNF-α синовиальными клетками. Таким образом, местная доставка растворимого TNF-α-рецептора в орошающей жидкости, инфузии или инъекции будет приводить к связыванию свободного TNF-α и функционировать в качестве антагониста TNF-рецепторов в окружающей ткани, обеспечивая таким образом защитное действие в отношении хряща.
Настоящее изобретение описывает применение функциональных антагонистов TNF-α, которые действуют внеклеточно для блокирования взаимодействия лиганда с их родственными мембранными рецепторами либо утилизацией доступного свободного лиганда, либо прямым конкурентным взаимодействием с самим рецептором, одного или в комбинации с другими агентами с обеспечением защитного для хряща эффекта. Можно использовать различные терапевтические подходы, которые противодействуют взаимодействию агониста, TNF-α, с его естественным связанным с мембраной рецептором, которые включают: 1) применение естественных специфических ингибиторов активности TNF-α, которые охарактеризованы к настоящему времени, включая растворимые TNF-α-рецепторы; 2) применение анти-TNF-α антител и 3) применение небольших молекул-антагонистов, которые могут быть пептидами или непептидами.
Настоящее изобретение раскрывает применение химерного растворимого рецепторного (CSR) белка, в котором внеклеточный домен TNF-рецептора, который обладает активностью связывать молекулу TNF, ковалентно связан с доменом молекулы IgG. В частности, и в виде первого примера, можно использовать химерный полипептид (рекомбинантная химера), включающий внеклеточный домен TNF-рецепторного внеклеточного пептида, сопряженного с СН2- и СН3-областями тяжелой цепи мышиного IgGI, как раскрыто в патенте США №5447851. Было показано, что химерный растворимый TNF-рецептор (также обозначенный "химерным ингибитором TNF" в патенте США №5447851) связывается с TNF-α с высокой аффинностью, и было показано, что он высоко активен в качестве ингибитора биологической активности TNF-α. Кроме того, вторым примером является химерная слитая конструкция, включающая связывающий лиганд домен TNF-рецептора с участками Fc-антител (обозначенных слитыми растворимыми Fc-рецепторами), которые были получены для TNF-α-рецепторов. Настоящее изобретение также раскрывает применение растворимого TNF-рецептора: слитого Fc-белка или любых модифицированных форм, как раскрыто в патенте США №5605690. Молекулярная форма активного растворимого рецепторного слитого белка может быть либо мономерной, либо димерной. Имеются исследования, в которых было установлено, что такой растворимый TNF-рецептор: слитый Fc-белок сохраняет высокую связывающую активность для TNF-α.
В контексте определения растворимых рецепторов в качестве фармакологических антагонистов термин растворимые рецепторы включает, но не ограничивается: 1) растворимыми рецепторами, которые соответствуют естественно (эндогенным) образованным аминокислотным последовательностям или их растворимым фрагментам, состоящим из внеклеточного домена полной длины мембранного рецептора; 2) рекомбинантными растворимыми рецепторами, которые являются усеченными, или неполными последовательностями от полной длины естественных аминокислотных последовательностей рецепторов, которые сохраняют способность связываться с родственным лигандом и сохраняют биологическую активность и их аналоги; и 3) химерными растворимыми рецепторами, которые являются рекомбинантными растворимыми рецепторами, включающими усеченные или неполные последовательности, соответствующие участку внеклеточного связывающего домена, от полной длины аминокислотных последовательностей рецепторов, связанные через олигомеры (например, аминокислоты), с последовательностью, соответствующей участку IgG-полипептида (например, петля IgG и Fc-домен), которые сохраняют биологическую активность и способность связываться с родственным лигандом.
Растворимые внеклеточные связывающие лиганд домены цитокиновые рецепторов имеются в жидкостях организма, и полагают, что они участвуют в регуляции биологической активности цитокинов. Сообщалось о наличии естественных растворимых усеченных форм ряда гематопоэтических цитокиновых рецепторов (IL-1R, IL-4R, IL-6R, TNFR). Например, растворимый TNFR обнаружен в концентрациях примерно 1-2 нг/мл в сыворотке и моче здоровых субъектов. Теряя функции передачи сигнала, данные цитокиновые связывающие белки возникают в результате альтернативного сплайсинга мРНК для полной рецепторной последовательности (связанная с мембраной форма) или в результате протеолитического расщепления и высвобождения связанной с мембраной формы рецептора. Несмотря на то, что функции данных растворимых усеченных рецепторов in vivo полностью еще не установлены, оказалось, что они действуют в качестве физиологических антагонистов их комплементарных эндогенных цитокинов. Данный антагонизм имеет место в результате того, что 1) утилизация свободного лиганда посредством связывания с его родственным растворимым рецептором уменьшает эффективную свободную концентрацию, доступную для связанных с мембраной рецепторов и 2) действие цитокинов происходит только после последующего связывания с рецепторами клеточной поверхности.
Растворимый TNF-α-рецептор будет функционировать в качестве естественного антагониста TNF-R1 и TNF-R2, конкурируя с данными рецепторами клеточной поверхности за общий пул свободных лигандов. Фармакологически растворимый TNF-рецептор будет функционировать в качестве антагониста в большей степени за счет его способности уменьшать биодоступность свободных лигандов, чем механизма конкурентного ингибирования (т.е. конкурируя с эндогенными лигандами за общее место связывания на мембранном рецепторе). Введение терапевтически эффективного количества растворимого TNF-рецептора в сустав будет эффективно нейтрализовать биологическую активность лиганда. Опыты, в которых рекомбинантные растворимые рецепторы вводили in vivo, показали их способность ингибировать воспалительные ответные реакции и действовать в качестве антагонистов.
В данном изобретении агенты, подходящие в качестве защитных для хряща агентов для применения в комбинации с другими защитными для хряща, обезболивающими и/или противовоспалительными агентами для подавления разрушения хряща, включают растворимый TNFR, человеческий химерный полипептид (рекомбинантная химера), включающий внеклеточный домен TNF-α-рецептора (р80), связанный с Fc-участком человеческого IgGI, и анти-TNF-α антитела. Для всех способов местной доставки (т.е. инъекции, инфузии и орошения) оптимальной дозой и/или концентрацией каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий в перечень агент, предполагается, что данные концентрации являются терапевтически эффективными.
Терапевтические и предпочтительные концентрации антагонистов TNF-рецепторов
3. АГОНИСТЫ ИНТЕРЛЕЙКИНОВЫХ РЕЦЕПТОРОВ
Некоторые цитокины являются сигнальными гликопротеидами, которые представляют важные медиаторы синовиального воспаления и деструкции хряща. На основании недавно проведенного анализа механизма деструкции хряща можно предположить, что в определении деструкции хряща важен не только абсолютный уровень провоспалительного основного цитокина, IL-1, но и то, что регуляция цитокином гомеостаза в хряще определяется балансом катаболических и анаболических регуляторных цитокинов и факторов анаболического роста. Если баланс между продукцией IL-1β и IL-1Rα изменяется при воспалении в пользу IL-1β, тогда он способствует патогенезу хронических воспалительных состояний и деструкции хряща, что, как известно, происходит после хирургической операции на коленном суставе. Потенциальные терапевтические агенты, которые будут ингибировать продукцию провоспалительных цитокинов в местах воспаления внутри сустава, включают противовоспалительные цитокины, IL-4, IL-10 и IL-13. Наблюдали, что данные цитокины значительно снижают деструкцию суставного хряща in vitro и in vivo посредством их действия на ряд путей, которые снижают уровень дающего толчок IL-1. Таким образом, противовоспалительные цитокины, такие как IL-4, IL-10 и IL-13, могут быть подходящими для подавления воспаления посредством: 1) уменьшения продукции провоспалительных цитокинов и 2) индукции продукции естественных противовоспалительных цитокинов, таких как IL-IRa, как было недавно показано in vivo для IL-4.
Оказалось, что IL-4 ослабляет воспалительный процесс в синовиуме у пациентов с ревматоидным артритом (RA). Было показано, что IL-4 в синовиуме при ревматоидном артрите ингибирует продукцию провоспалительных цитокинов кусочками синовиума, с ингибированием пролиферации синовиоцитов и снижением резорбции кости. IL-4 может оказывать прямой защитный для хряща эффект через подавление синтеза матричной металлопротеиназы-3 (ММР-3) в человеческих суставных хондроцитах. Была использована клеточная культура человеческих суставных хондроцитов для оценки действия IL-4 на индуцированную IL-1 продукцию ММР-3 и тканевого ингибитора металлопротеиназы-1 (TIMP-1). Было установлено, что IL-4 подавляет IL-1-стимулированный ММР-3 белок и его ферментативную активность. Кроме того, IL-4 подавляет индуцированную IL-1 мРНК ММР-3. Индукция iNOS может ингибироваться IL-4, IL-10 и IL-13. Таким образом, IL-4 может быть охарактеризован как защитный медиатор в процессе деструкции сустава, обнаруживаемой при воспалительных заболеваниях суставов.
Кроме того, установлено, что эффекты IL-4 на баланс уровней регуляторных IL-1-цитокинов способствуют его защитной роли в отношениях хряща. Установлено, что IL-4 и IL-10 подавляли продукцию воспалительных цитокинов свежеприготовленными ревматоидными синовиальными клетками. Несмотря на то, что каждый интерлейкин эффективен по отдельности, комбинация IL-4 и IL-10 синергетически ингибировала стимулированную IL-1 и TNF-α, продукцию IL-6 и IL-8, не оказывая при этом действия на жизнеспособность клеток. Добавление IL-4 к культурам синовиума при RA повышает продукцию IL-1Ra и снижает таковую для IL-1β. Недавно появилось сообщение о том, что обработка IL-4 in vivo способствует подавлению экспериментального артрита у крыс, дифференцированно действуя на баланс IL-1β/IL-1Ra. IL-13, другой цитокин, который разделяет многие свойства IL-4, также индуцирует IL-1Ra в синовиуме при RA. Следовательно, местная доставка комбинации IL-4 и IL-13 может обеспечивать синергетический терапевтический эффект.
IL-10 обладает рядом свойств, которые указывают на то, что он является хорошим потенциальным кандидатом для подавления деструкции хряща. Он ингибирует высвобождение как IL-1, так и TNF-α, и стимулирует продукцию TIMP-1, в то же время ингибируя ММР-2. Недавно было сообщено о продукции IL-10 внутри синовиума при RA, и были оценены противовоспалительные эффекты IL-10. IL-10 подавляет продукцию IL-1β на модели RA ex vivo с использованием кусочков синовиума, но в меньшей степени, чем IL-4.
Установлено защитное действие обработки IL-4 и IL-10 в отношении деструкции хряща на моделях артрита у животных с использованием неместных способов доставки цитокинов. На модели индуцированного коллагеном артрита у мышей обработка комбинацией IL-4 и IL-10 приводила к значительному улучшению. Помимо подавления макроскопических признаков воспаления, комбинированная обработка IL-4 и IL-10 также уменьшала клеточные инфильтраты в синовиальной ткани и вызывала выраженную защиту от деструкции хряща. Кроме того, уровни мРНК для TNF-α, и IL-1 были в значительной мере снижены как в синовиальной ткани, так и в суставном хряще. В противоположность уровни мРНК антагониста IL-1-рецепторов (IL-IRa) оставались повышенными, на основании чего предполагается, что механизм защиты может быть связан с ингибированной продукцией TNF-α и IL-1, наряду с сопутствующим повышением баланса IL-1Ra/IL-1. Данные результаты согласуются с доминирующей ролью IL-10 в эндогенном подавлении воспалительной ответной реакции и деструкции суставного хряща, и оказывается, что комбинированная обработка IL-4 и IL-10 имеет потенциальную терапевтическую ценность.
Также исследовалась роль эндогенных IL-4 и IL-10 и терапевтическое действие добавления данных цитокинов на воспаление сустава и деструкцию хряща на ранних стадиях модели макрофагального стрептококкового артрита у мышей. Было показано, что эндогенный IL-10 играет роль в регуляции артрита SCW. Добавление эндогенного IL-10 дополнительно усиливало супрессивное действие эндогенного IL-10. Даже более выраженный эффект обнаруживали с комбинацией IL-4 и IL-10. Комбинация приводила к уменьшенному отеку и усилению синтеза протеогликана в хондроцитах. Обработка комбинацией IL-4 и IL-10 заметно снижала уровни TNF-α, как это имеет место при обработке одним IL-10, но также приводила к заметно пониженным уровням IL-1β в синовиуме, что представляет дополнительный эффект потенциальной пользы для клиники. В целом, данные согласуются с ролью как IL-4, так и IL-10 в качестве защитных для хряща агентов, доставленных местно в суставы для предотвращения деструкции хряща, и указывает, что комбинация, содержащая IL-4 и IL-10, может обеспечить больший потенциальный терапевтический эффект, чем любой агент один.
Мышей с тяжелым сочетанным иммунодефицитом использовали в качестве модели для оценки эффекта инъекции IL-4 или IL-10 на деградацию хряща или восстановление мононуклеарных клеток в синовиуме человека при ревматоидном артрите in vivo. В человеческий ревматоидный синовиум и хрящ от пяти пациентов с ревматоидным артритом вводили рекомбинантный человеческий IL-4 (rhIL-4, 100 нг; rhIL-10, 100 нг), комбинацию IL-4 и IL-10 или TNF-альфа (1000 Е), или забуференный фосфатом физиологический раствор дважды в неделю в течение 4 недель. Было установлено, что комбинация человеческих IL-4 и IL-10 ингибировала разрешение хряща и инвазию человеческой синовиальной тканью, что свидетельствует о защитных для хряща свойствах данных агонистов интерлейкинов.
Человеческий IL-13 был клонирован и секвенирован, и было установлено, что он разделяет многие свойства IL-4. IL-13 примерно на 25% гомологичен IL-4. Подобно IL-4 IL-13 снижает продукцию провоспалительных цитокинов, включая IL-1 и TNF-α, мононуклеарными клетками синовиальной жидкости. IL-13 проявляет противовоспалительное действие in vivo и, таким образом, обладает терапевтическим потенциалом при лечении деструкции хряща в суставе.
Подходящие в качестве агонистов IL-4, IL-10 и IL-13 соединения включают естественные человеческие IL-4, IL-10 и IL-13, человеческие рекомбинантные IL-4 (rhIL-4), rhIL-10 и rhIL-13, а также их неполные последовательности или пептидные последовательности, которые были сконструированы с использованием методов рекомбинантной ДНК с "узнаванием" IL-4-, IL-10- и IL-13-рецепторов, и которые способны активировать данные рецепторы на клеточной поверхности. Они, в частности, включают мультиспецифические молекулы, содержащие анти-Fc-рецепторный участок и aHTH-IL-4, анти-IL-10 и aHTH-IL-13 рецепторный участок, где по меньшей мере один участок сконструирован с использованием методов рекомбинантной ДНК. В контексте определения агонистов интерлейкинов в качестве фармакологических агонистов термин агонист интерлейкинов включает, но не ограничивается: 1) пептидными последовательностями, которые соответствуют естественно (эндогенным) образованным аминокислотным последовательностям или их фрагментам; 2) рекомбинантными интерлейкинами, которые являются усеченными или неполными последовательностями от полной длины естественных аминокислотных последовательностей интерлейкинов, которые сохраняют способность связываться с родственным рецептором и сохраняют биологическую активность и их аналоги и 3) химерными интерлейкинами, которые являются рекомбинантными полипептидами, состоящими из усеченных или неполных последовательностей, соответствующих участку от полной длины аминокислотных последовательностей, связанных через олигомеры (например, аминокислоты), с последовательностью, соответствующей участку IgG-полипептида (например, петля IgG и Fc-домен), которые сохраняют способность связываться с родственным рецептором и сохраняют биологическую активность.
Примеры агонистов интерлейкинов, подходящих для настоящего изобретения, приведены ниже. Для всех способов местной доставки (т.е. инъекции, инфузии и орошения) оптимальной дозой и/или концентрацией каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий в перечень агент, предполагается, что данные концентрации являются терапевтически эффективными.
Терапевтические и предпочтительные концентрации агонистов интерлейкинов
4. АГОНИСТЫ ПОДСЕМЕЙСТВА ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА-β
Члены подсемейства трансформирующего фактора роста-β (TGF-β) представляют плейотропные многофункциональные белки, способные оказывать влияние на различные клеточные функции, и известно, что они участвуют в восстановлении и реконструкции тканей. Во многих случаях, они усиливают взаимодействие клеток с внеклеточным матриксом (ЕСМ) и повышают накопление ЕСМ стимуляцией продукции и секреции белков ЕСМ и ингибиторов протеаз. Также было показано, что TGF-β имеет синергетические взаимодействия с другими цитокинами, в основном проявляющими противовоспалительную активность. Было идентифицировано много изоформ TGF-β, которые разделяют близкие гомологии аминокислотных последовательностей. TGF-β1, TGF-β2 и TGF-β3 были обнаружены в человеческой ткани, и они являются активными в клетках млекопитающих, хотя, различаются по аффинности связывания.
Члены подсемейства TGF-β являются сильными модуляторами пролиферации, дифференциации хондроцитов и накопления внеклеточного матрикса. В органных культурах хряща TGF-β1 регулирует метаболизм протеогликанов и стимулирует синтез гликогена и гликозаминогликана кроличьими суставными хондроцитами. Кроме того, TGF-β1 повышают экспрессию TIMP в человеческих суставных хондроцитах и снижают экспрессию IL-1-рецепторов в суставном хряще.
Костные морфогенетические белки (BMPs) являются многофункциональными регуляторами роста, дифференциации и апоптоза клеток, которые относятся к надсемейству трансформирующего фактора роста-β (TGF-β). У млекопитающих было идентифицировано более чем дюжина членов семейства белков BMP, которые можно подразделить на несколько групп в зависимости от их структуры. ВМР-2 и ВМР-4 являются очень сходными друг с другом. BMP-5, BMP-6, остеогенный белок (ОР)-1 (также обозначенный ВМР-7) и ОР-2/ВМР-8 в структурном отношении близки друг к другу. Фактор роста-дифференциации (GDF)-5 (также обозначенный морфогенетическим белком-1, производным хряща), GDF-6 (также обозначенный морфогенетическим производным хряща белком-2) и GDF-7 образуют другую близкую группу. В противоположность BMP-2, BMP-4, BMP-6 и ОР-1/ВМР-7, которые индуцируют образование костей и хряща in vivo, GDF-5, GDF-6 и GDF-7 более эффективно индуцируют образование хряща и подобных сухожилиям структур in vivo (Wolfman et al., 1997).
Члены надсемейства TGF-β оказывают их эффекты через связывание с двумя типами рецепторов серин/треонинкиназ, оба которых являются важными в передаче сигнала (Massague, 1998). Рецепторы типа II являются конститутивно активными киназами, которые трансфорилируют рецепторы типа I при связывании лиганда. Рецепторы типа I активируют внутриклеточные субстраты такие, как белки Smad, и полагается, что через данный механизм проявляется специфичность внутриклеточной передачи сигнала. У млекопитающих было выделено семь различных рецепторов типа I, которые были первоначально названы активин-рецептороподобной киназой (ALK)-1-ALK-7. ВМР-рецептор типа IA (BMPR-IA или ALK-3) и BMP-рецептор типа IB (BMPR-IB или ALK-6) структурно близки друг к другу и специфически связывают BMPs наряду с рецепторами типа II. Было показано, что ALK-2 связывает активин, но недавно полученные данные показали, что это рецептор типа I для некоторых BMPs, например, ОР-1/ВМР-7 (Macias-Silva et al., 1998). ALK-1 структурно очень близок к ALK-2, но его физиологический лиганд еще неизвестен. ALK-5 и ALK-4 являются рецепторами типа I соответственно для TGF-β (TβR-1) и активина (ActR-IB). ALK-7 структурно близок к ALK-4 и ALK-5, но его лиганд еще не установлен.
Естественные агонисты TGF-β и BMP, а также синтетические или человеческие рекомбинантные (rh) агонисты, подходящие для применения в защитном для хряща растворе по настоящему изобретению, могут взаимодействовать с любым из ВМР-рецепторов, описанных выше. В том смысле, как он здесь используется, термин "агонисты TGF-β и BMP" включает фрагменты, делеции, вставки, замены аминокислот, мутации и их модификации, которые сохраняют биологические свойства естественных человеческих лигандов агонистов TGF-β и BMP. Агонисты TGF-β или BMP могут использоваться по отдельности или в синергетической комбинации с другими членами надсемейства TGF-β в качестве анаболических для хряща агентов (хондрогенных или способствующих восстановлению матрикса хряща) или в комбинации с ингибирующими агентами, которые блокируют катаболизм хряща.
Рецепторы типа I функционируют в качестве отрицательно регулирующих компонентов для рецепторов типа II. Специфичность внутриклеточных сигналов рецепторов типа I определяется специфическим участком в домене серин/треонинкиназы, называемом петля L45. Таким образом, структуры петлей L45 у BMPR-IA/ALK-3 и BMPR-IB/ALK-6 (BMPR-I-группа) идентичны друг другу, они могут передавать одинаковые сигналы в клетках. Подобным образом петли L45 у Tβ3R-I/ALK-5, ActR-IB/ALK-4 и ALK-7 (T(3R-1-группа) идентичны друг другу, и они активируют одинаковые субстраты (Chen et al., 1998). Петли L45 у ALK-1 и ALK-2 (ALK-1-группа) наиболее отличаются от других рецепторов типа I, но они активируют субстраты, аналогичные таковым для рецепторов типа I BMPR-I группы (Armes et al., 1999).
Различные белки могут передавать сигналы от TGF-β- и ВМР-рецепторов серии/треонинкиназ. Среди них наиболее изученными молекулами являются белки семейства Smad. У млекопитающих было идентифицировано восемь различных белков Smad, и данные белки подразделяются на три подгруппы, т.е. регулируемые рецептором Smads (R-Smads), обычные партнерские (Co-Smads) и ингибирующие Smads. R-Smads являются непосредственно активированными рецепторами типа I, в результате образования комплексов с Co-Smads, и перемещаются в ядро. Smad-гетеромеры связываются с ДНК прямо или опосредовано через другие ДНК-связывающие белки, и таким образом регулируют транскрипцию целевых генов. Smad1, Smad5 и Smad8 активируются BMPs, в то время, как Smad2 и Smad3 активируются TGF-β. Например, Smad2 в комбинации с Smad4, который функционирует в качестве Co-Smad, перемещается в ядро, где он активирует транскрипцию генов, которые опосредуют биологические эффекты TGF. Smad6 и Smad7 в структурном отношении отличаются от других Smads и действуют в качестве ингибирующих Smads. Было показано, что BMPs индуцируют новое образование хряща и костей in vitro и in vivo и регулируют рост и дифференциацию хондроцитов. Кроме того, данные белки также участвуют в процессе восстановления хряща. В различных исследованиях было показано, что BMPs также способствуют и сохраняют хондрогенный фенотип, что указывает на их способность стимулировать синтез протеогликана в культуре клеток птичьих зачатков конечностей и эмбриональных крысиных хондробластах, а также в кроличьих и бычьих суставных хондроцитах. Значение BMPs для образования хряща и костей было доказано трансгенным подходом, при котором изучали выбрасывание специфических генов BMP.
Оказалось, что один член семейства BMP, остеогенный белок (ОР-1 или ВМР-7) особенно важен для поддержания гомеостаза в хряще в нормальных и патологических условиях, а также во время восстановления хряща. Оказалось, что ОР-1 является единственным членом семейства BMP наряду с морфогенетическими белками, производными хряща, который экспрессируется зрелыми суставными хондроцитами (Chubinskaya S., J. Histochemistry and Cytochemistry 48:239-50 (2000)). ОР-1 первоначально был выделен из костного матрикса, и было показано, что он индуцирует образование хряща и костей. Ген человеческого ОР-1 был клонирован, и были получены биологически активные рекомбинантные гомодимеры ОР-1. Человеческий рекомбинантный ОР-1 может стимулировать синтез аггрекана и коллагена типа II в человеческих суставных хондроцитах in vitro. Также он может противодействовать отрицательным эффектам IL-1 на метаболизм данных хондроцитов и блокировать повреждение бычьего хряща, опосредуемого фрагментами фибронектина. Данный эффект был показан при изучении действия рекомбинантного человеческого ОР-1 на продукцию протеогликана, простагландина Е2 и антагониста IL-1-рецепторов человеческими суставными хондроцитами, культивированными в присутствии интерлейкина-1бета. Обработка человеческих суставных хондроцитов ОР-1 была эффективной в преодолении снижения синтеза протеогликана, индуцированного низкими дозами IL-1β. Кроме того, в исследовании было установлено, что ОР-1 стимулирует синтез гиалурона и CD44, других молекул, необходимых для сборки матрикса в человеческих хондроцитах. На основании данных исследований по экспрессии и регуляции ОР-1 в человеческом зрелом хряще можно выказать предположение о роли ОР-1 в защите и восстановлении хряща, и они указывают на то, что ОР-1 можно использовать в качестве терапевтического агента, который способствует анаболизму хряща и восстановлению человеческого суставного хряща.
ОР-1 (ВМР-7) индуцирует образование хряща и костей, когда имплантирован в местах внутри и вне скелета in vivo. Исследовали влияние ОР-1 на заживление дефектов суставного хряща по полной толщине путем просверливания двух смежных отверстий через суставной хрящ в коленном суставе кроликов. ОР-1 индуцировал заживление суставного хряща и регенерацию поверхности сустава, которая состояла из клеток, напоминающих зрелые суставные хондроциты.
На основании этих данных можно предположить, что одно предпочтительное воплощение раствора, подходящего для практики настоящего изобретения в целях профилактики разрушения хряща и поддержания биологического гомеостаза в суставном хряще у людей после хирургической травмы, может включать местное применение члена надсемейства TGF-β, предпочтительно TGFβ2, BMP-7 (ОР-1) или ВМР-2, или эквивалентного агониста, который действует через одинаковые рецепторы, используемыми данными лигандами. Местная доставка может иметь место в комбинации с другим лекарственным препаратом или препаратами, которые являются ингибиторами катаболических процессов в хряще (например, такими как ингибиторы МАРкиназы, ММР-ингибиторы или ингибиторы синтазы окиси азота), и/или другими обезболивающими или противовоспалительными агентами.
В контексте определения агонистов TGF-β и BMP в качестве фармакологических агентов, термин агонист TGF-β и BMP включает, но не ограничивается: (1) пептидными последовательностями, которые соответствуют естественно (эндогенным) образованным аминокислотным последовательностям или их фрагментам, (2) рекомбинантными TGF-βs и BMPs, которые являются усеченными или неполными последовательностями от полной длины естественных аминокислотных последовательностей TGF-β и BMP, которые сохраняют способность связываться с их родственным типичным рецептором и сохраняют биологическую активность и их аналоги, и (3) химерными TGF-βs и BMPs, которые являются рекомбинантными полипептидами, включающими усеченные или неполные последовательности, соответствующие участку полной длины аминокислотных последовательностей, соединенных через олигомеры (например, аминокислоты) с последовательностью, соответствующей участку IgG-полипептида (например, петля IgG и Fc-домен), которые сохраняют способность связывать с родственным рецептором и сохраняют биологическую активность.
Примеры агонистов TGF-β и BMP, подходящих для настоящего изобретения, перечислены ниже. Для всех способов местной доставки (т.е. инъекции, инфузии и орошения) оптимальной дозой и/или концентраций каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий в перечень агент, предполагается, что данные концентрации являются терапевтически эффективными.
Пределы терапевтических концентраций для доставки в хирургическом растворе в сустав можно установить по значениям констант диссоциации (Kd) каждого лиганда для их родственного рецептора. Несмотря на то, что данные значения будут варьировать для конкретных клеточных типов и тканей, приводится следующий пример для ВМР-4. В опытах по оценке связывания с 125I-ВМР-4 было установлено наличие специфических, с высокой аффинностью мест связывания с кажущейся константной диссоциации 110 пМ и примерно 6000 рецепторов на клетку. Следовательно, при 11 нМ ВМР-4 связывание лиганда будет максимальным, и доступные рецепторы будут полностью заняты (насыщены). Было показано присутствие функциональных рецепторов для ВМР-4 на первичных суставных хондроцитах.
Терапевтические и предпочтительные концентрации агонистов TGF-β и ВМР-рецепторов
5. ИНГИБИТОРЫ ЦИКЛООКСИГЕНАЗЫ-2 (СОХ-2)
Нестероидные противовоспалительные препараты (NSAIDs) широко применяются в качестве противовоспалительных средств, но они не были специально разработаны или терапевтически используются в качестве защитных для хряща агентов. Непосредственной молекулярной мишенью для NSAID является первый фермент в синтезе простагландинов, относящийся либо к эндопероксид-синтазе простагландинов, либо к циклооксигеназе жирных кислот. Охарактеризованы две близкие формы циклооксигеназы, называемые циклооксигеназой-1 или (СОХ-1) типа I и циклооксигеназой-2 (СОХ-2). Данные изозимы известны также как простагландин G/H синтаза (PGHS)-1 и PGHS-2. Оба фермента катализируют ограничивающую скорость стадию образования простаноидов, на которой происходит превращение арахидоновой кислоты в простагландин Н2. СОХ-1 находится в тромбоцитах и эндотелиальных клетках и проявляет конститутивную активность. В противоположность СОХ-2 была обнаружена в эндотелиальных клетках, макрофагах, фибробластах и других клетках в суставе, и ее экспрессия индуцируется провоспалительными цитокинами такими, как IL-1 и TNF-α.
В воспаленном суставе экспрессия СОХ-2 повышена, и было показано, что значительное увеличение активности СОХ-2 происходит одновременно с ее положительной регуляцией, приводя к повышенному синтезу простагландинов, которые находятся в синовиальной жидкости пациентов, страдающих воспалительными артропатиями. Клеточные источники простагландинов (PGs) в суставе включают активированные хондроциты, синовиоциты типа А и В и инфильтрационные макрофаги. Клеточные функции, имеющие значение для метаболизма хряща, модулирующиеся под воздействием PGs, включают экспрессию генов, синтез внеклеточного матрикса и пролиферацию. Поскольку СОХ-2 экспрессируется в ткани воспаленного сустава или после воздействия медиаторов воспаления (например, в результате повреждения или хирургической травмы), предполагается, что применение ингибитора СОХ-2 обеспечит как противовоспалительное, так и защитное для хряща действие.
Деструкция хряща при воспалительных артропатиях может "запускаться" как последствие повреждения сустава и в результате артроскопических хирургических процедур. Хондроциты являются единственным типом клеток в суставном хряще, и известно, что они участвуют в распаде их собственного матрикса посредством высвобождения эндогенных медиаторов воспаления, включая PGs. В исследованиях было показано, что экспрессия гена СОХ-2, синтез белка и высвобождение PG в обычных человеческих суставных хондроцитах быстро индуцируются под действием цитокинов, включая IL-1, TNF-α и IL-6. Уровни мРНК обнаруживаются уже через 2 ч после индукции цитокинами, достигая высоких уровней через 6 ч, и имеется значительно длительная продолжительность экспрессии по меньшей мере в течение 72 ч. Аналогичным образом в исследованиях с клеточными культурами по активации человеческих синовиоцитов под действием IL-1α и TNF-α было показано, что имеет место значительное увеличение экспрессии СОХ-2 и продукции простагландина Е2 (PGE2). Лечение различными NSAIDs, такими как кетопрофен, устраняет индуцированный РСЕ2-ответ. В клеточной культуре хондроцитов специфический ингибитор СОХ-2, соединение NS-398, предотвращало увеличение продукции PGE2, индуцированной цитокинами, в то время как уровни СОХ-1 оставались стабильными (Morisset S., 1998, J. Rheumatol. 25:1146-53). Таким образом, можно прийти к выводу, что блокирование продукции PG активированными хондроцитами, которое связано с экспрессией СОХ-2, может обеспечить защитный для хряща эффект.
Обычно NSAIDs применяются для лечения пациентов с остеоартритом или ревматоидным артритом, но их действие на метаболизм суставного хряща в контексте данных артритных заболеваний остается предметом для обсуждения. Например, лечение в клинике остеоартрита и ревматоидного артрита с помощью NSAIDs является успешным в подавлении воспаления. Однако полагается, что некоторые NSAIDs, которые не являются селективными для СОХ-2, в основном это салицилаты и индометацин, ускоряют деструкцию хряща при остеоартрите, нарушая синтез протеогликана в хондроцитах, в то время как полагается, что другие NSAIDs обладают некоторым защитным для хряща действием, стимулируя восстановление хряща. Во многих исследованиях было показано, что NSAIDs оказывают небольшой эффект или отсутствие эффекта на хрящ. В результате того, что данная группа лекарственных препаратов не применяется в настоящее время при лечении синовита и деструкции хряща после травматического повреждения сустава и хирургической травмы, необходимо установить уникальные свойства каждого NSAID по воздействию на патофизиологические механизмы, которые участвуют в деструкции хряща.
Поскольку два изозима СОХ являются фармакологически различными, были разработаны специфические в отношении изозимов (селективные) ингибиторы циклооксигеназы, которые являются подходящими для лечения воспаления, и некоторые из данных ингибиторов СОХ-2 были проверены на моделях воспаления суставов. Однако эффекты ингибиторов СОХ-2 in vitro на синтез и деградацию протеогликанов хряща, а также продукцию IL-1, IL-6 и IL-8 и простаноидов в синовиальной жидкости указывают на то, что некоторые NSAIDs могут в значительной мере различаться по их воздействию на хрящ in vivo и продукцию в синовиальной жидкости интерлейкинов и эйкозаноидов, таким образом, что интегрированные эффекты данных параметров могут оказывать влияние на выход ингибиторов СОХ-2 на целостность хряща. Например, некоторые NSAIDs могут ускорять повреждение суставов при остеоартрите усилением продукции провоспалительных цитокинов или ингибированием синтеза протеогликанов. Однако несмотря на возможные различия в клиническом эффекте среди специфических ингибиторов СОХ-2, обычно ингибирование СОХ-2 приводит к подавлению синовита и предполагаемому снижению риска повреждения хряща.
Были разработаны различные биохимические, клеточные тесты на животных для оценки относительной селективности ингибиторов изоформ СОХ-1 и СОХ-2. В основном критерием определения селективности является соотношение констант ингибирования СОХ-1/СОХ-2 (или СОХ-2/СОХ-1), полученное в данном биохимическом или клеточном тесте. Соотношение селективности рассчитывается для различных абсолютных значений IC50 в отношении ингибирования ферментативной активности, которые получены в микросомальных и клеточных тестах (например, клеточные линии тромбоцитов и макрофагов, стабильно экспрессирующие рекомбинантные человеческие изозимы СОХ). Кроме того, ингибирование СОХ-2 напоминает ингибирующие эффекты, "запущенные" защитными для хряща (ингибирующими) цитокинами, такими как IL-4, которые снижают внутриклеточный синтез СОХ-2. Сравнение селективности более чем 45 NSAIDs и селективных ингибиторов СОХ-2 (1997, Can. J. Physiol. Pharmacol. 75:1088-95) показало следующую последовательность расположения относительной селективности для СОХ-2 по сравнению с COX-1: Dup 697 > SC-58451 = целекоксиб > нимесулид = мелоксикам = пироксикам = NS-398 = RS 57067 > SC-57666 > SC-58125 > флозулид > этодолак > L-745337 > DFU-T-614 при значениях IC50 в пределах между 7 нМ и 17 мкМ.
На основании молекулярного и клеточного механизма действия, установленного для селективных ингибиторов СОХ-2, таких как целекоксиб и ротекоксиб, а также результатов опытов на животных, предполагается, что данные соединения проявляют защитное для хряща действие, когда применяют периоперативно в орошающем растворе и при инъекции непосредственно в сустав. В частности, предполагается, что ингибиторы СОХ-2 будут эффективными лекарственными препаратами при доставке в орошающем растворе во время артроскопической хирургической процедуры или при прямой инъекции в сустав перед, во время или после хирургической процедуры или другого повреждения сустава.
Примеры ингибиторов СОХ-2, подходящих для настоящего изобретения, перечислены ниже. Для всех способов местной доставки (т.е. инъекции, инфузии и орошение) оптимальной дозой и/или концентрацией каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий в перечень агент, предполагается, что данные концентрации являются терапевтически эффективными.
Терапевтические и предпочтительные концентрации ингибиторов циклооксигеназы-2
6. ИНГИБИТОРЫ МАРкиназы
Митоген-активируемые протеинкиназы (MAP) представляют группу сериновых/треониновых протеинкиназ, которые активируются в ответ на различные внеклеточные сигналы, и функционируют в передаче сигналов от клеточной поверхности в ядро. Каскад МАРкиназы является одним из основных внутриклеточных путей передачи сигналов, который передает сигналы от факторов роста, гормонов и воспалительных цитокинов промежуточным ранним генам. В сочетании с другими путями передачи сигналов данные активные митоген-активируемые протеинкиназы (MAPKs) дифференцированно изменяют состояние фосфорилирования и активность факторов транскрипции, и в конечном итоге регулируют клеточную пролиферацию, дифференциацию и клеточный ответ на стресс окружающей среды. Например, член семейства МАРК (р38) опосредует основные биохимические пути передачи сигнала от сильных противовоспалительных цитокинов, IL-1 и TNF-α, приводя к индукции циклооксигеназы-2 (СОХ-2) в стимулированных макрофагах посредством цис-действующих факторов, участвующих в регуляции транскрипции гена СОХ-2.
Члены группы агентов МАРкиназ включают по меньшей мере три семейства, которые, как известно, различаются в последовательности, размере активационной петли, активации внеклеточными сигналами и участии в различных путях передачи сигнала. Известные члены данного семейства МАРкиназ включают регулируемые внеклеточными сигналами киназы (ERKs), ERK1 и ERK2 (р44МАРК и р42МАРК, соответственно); семейство активируемых стрессом протеинкиназ (SAPK1), которые также относятся к семейству JNK или N-концевому семейству киназ; и семейство р38-МАРкиназ, которое также известно, как активируемая стрессом киназа 2/3 (SAPK-2/3). р38-киназы активируются под влиянием стрессов, в наибольшей степени провоспалительными цитокинами. Внутри семейства р38 имеется по меньшей мере четыре различных гомолога (изотипы или изоферменты), чья стандартная номенклатура относится соответственно к SАРК2а, SAPK2b, SAPK2d, SAPK3 или р38 α, β, δ (SAPK4) и γ. Ингибиторы МАРкиназ, подходящие для практики данного изобретения, могут взаимодействовать с любым одним или комбинацией вышеуказанных МАРкиназ. Для специфических ингибиторов МАРкиназ, константы ингибирования, определенные в тестах in vitro на очищенных ферментах и в клеточных тестах, могут варьировать в широких пределах концентраций и показывают применимость в данной заявке. Активация р38-МАРкиназы опосредуется двойным фосфорилированием остатков треонина и тирозина. Было показано, что обработка клеток обоими TNF-α и IL-1 быстро увеличивает (в течение 5 мин) фосфорилирование и активирует р38-МАРкиназу.
В предшествующей работе было показано, что небольшие молекулы-ингибиторы могут специфично ингибировать р38-МАРкиназу (Lee J. et al., Nature 372: 739-746 (1994)) и проявляют противовоспалительное действие на биохимическом уровне и на различных моделях на животных. Cuenda и соавторы (Cuenda A. et al., FEBS Lett. 364: 229 (1995)) показали, что соединение SB203580 [4-(4-фторфенил)-2-(4-метилсульфинилфенил)-5-(4-пиридил)имидазол] ингибировал р38 in vitro (IC50=0,6 мкМ), подавлял активацию МАРК активирующей протеинкиназы-2 и предотвращал фосфорилирование белка теплового шока в ответ на воздействие IL-1 и клеточные стрессы in vivo. Была показана селективность ингибирующего действия SB203580 в отношении киназ для р38 по его неспособности ингибировать или в лучшем случае слабо ингибировать по меньшей мере 15 протеинкиназ in vitro, включая члены семейств РКС, РКА, src и рецепторных тирозинкиназ (Lee, J. Pharmacol. Ther. 82: 389-397 (1999)). В исследованиях на клетках было показано, что прединкубация SB203580 блокирует индуцированное IL-1 и TNF-α фосфорилирование фермента и последующую продукцию IL-8. Это обосновывает упреждающее действие доставки ингибиторов во время хирургической процедуры.
Изучали роль митоген-активируемой протеинкиназы р38 (МАРК) в биохимических воспалительных ответных реакциях при деструкции хряща с использованием SB203580, который специфически ингибирует фермент. Действие IL-1, которое селективно регулируется р38 МАРК, заключается в регуляции простагландин Н синтазы-2 (СОХ-2), металлопротеиназ и IL-6 (Ridley A. et al., 1997, J. Immunol. 158: 3165-73). В человеческих фибробластах и сосудистых эндотелиальных клетках SB203580 ингибировал (IC50=0,5 мкМ) индуцируемое IL-1 фосфорилированием hsp 27 (индикатор активности р38 МАРК) в фибробластах, не оказывая влияния на другие известные пути с участием активируемых IL-1 протеинкиназ (р42/р44 МАРК, р54 MAPK/c-Jun N-концевая киназа). Кроме того, SB203580 значительно ингибировал IL-6, стимулированный IL-1 (на 30-50% при 1 мкМ), но не продукцию IL-8 в человеческих фибробластах и эндотелиальных клетках.
Важно, что SB203580 в значительной мере ингибировал продукцию простагландинов, стимулированную IL-1, в фибробластах и человеческих эндотелиальных клетках. Это связано с ингибированием индукции белка и мРНК СОХ-2. PGE2 участвует в повышенной экспрессии матричных металлопротеиназ, которые представляют важные медиаторы разрушения хряща. Синовиальные фибробласты и хондроциты экспрессируют ген СОХ-2 на высоких уровнях при активации цитокинами и внеклеточными сигналами. Ингибиторы МАРК обеспечивают защитную для хряща активность за счет ингибирующей активности на МАРкиназу, экспрессируемую в данных и других типах клеток.
Предполагается, что ингибиторы МАРК будут эффективными в качестве защитных агентов для хряща, когда применяются местно на ткани сустава при различных воспалительных и патофизиологических состояниях. SB203580 был изучен на нескольких фармакологических моделях in vivo, и было показано, что он обладает активностью при длительном пероральном введении. Было установлено, что SB 203580 ингибирует стимуляцию продукции коллагеназы-1 и стромелизина-1 под действием IL-1, не влияя на синтез TIMP-1. Кроме того, SB 203580 предупреждал повышение мРНК стимулированных IL-1 коллагеназы-1 и стромелизина-1. На модели разрушение хряща SB 203580 не оказывал влияния на стимулированные IL-1, кратковременную резорбцию протеогликана и ингибирование синтеза протеогликана, в то время как предупреждался длительный распад коллагена. Кроме того, было установлено, что SB 203580 является эффективным при ингибировании индуцированной IL-1 продукции окиси азота в бычьих эксплантатах суставного хряща и хондроцитах (Badger 1998). Данные наблюдения in vitro обеспечивают основу для защитной активности в отношении хряща ингибитора МАРкиназ, введенного непосредственно и местно в данные ткани сустава.
р38-МАРкиназа участвует в индуцированной TNF экспрессии цитокинов, и лекарственные препараты, которые функционируют в качестве ингибиторов активности р38-МАРкиназы блокируют продукцию провоспалительных цитокинов (Beyaert R. et al., EMBO J. 15: 1914-23 (1996)). Обработка клеток TNF-α активировала путь с участием р38-МАРК, что было показано повышенным фосфорилированием самой р38-МАРК и активацией ее белков-субстратов. Предварительная обработка клеток SB203580 полностью блокировала индуцированную TNF-α активацию МАРК активирующей протеинкиназы-2 и фосфорилирование hsp27. В тех же самых условиях SB203580 также полностью ингибировал индуцированный TNF-α синтез IL-6 и экспрессию репортерного гена, который управляется минимальным промотором, содержащем два элемента NF-6B. Таким образом, в данных исследования и относящихся исследованиях по другим ингибиторам р38 было показано, что действие ингибиторов таких, как SB 203580 и FR 133605 на р38-МАРК, селективно препятствует индуцированной TNF-α и IL-1 активации различных белков, связанных с разрушением хряща. Таким образом, селективное подавление путей передачи сигналов с участием МАРкиназы данных ключевых провоспалительных цитокинов путем ингибирования отрицательной регуляции рецептора указывает, что ингибиторы МАРкиназы могут обеспечить защитный для хряща эффект.
SB203580 был оценен на нескольких моделях на животных ингибирования цитокинов и воспалительного заболевания. Он проявил себя как сильный ингибитор продукции цитокинов воспаления in vivo, как на мышах, так и на крысах со значениями IC50, равными 15-25 мг/кг. SB 203580 обладал терапевтической активностью при индуцированном коллагеном артрите у мышей DBA/LACJ в дозе 50 мг/кг, приводя к значительному ингибированию воспаления лапы. Антиартрическую активность также наблюдали при индуцированном адъювантом артрите на крысах Левис при пероральном введении SB 203580 в дозе 30 и 60 мг/кг/день. Было получено дополнительное доказательство полезных эффектов в отношении резорбции костей при IC50=0,6 мкМ.
В результате в различных биохимических, клеточных и исследований на животных показано, что р38-МАРК играет важную роль в регуляции ответов на IL-1 и TNF-α, и что она участвует в регуляции уровней мРНК некоторых ответственных за воспаление генов, таких как СОХ-2. Ингибиторы р38 блокируют продукцию провоспалительных цитокинов и ингибируют продукцию MMPs, и было показано, что они ингибируют распад коллагена в хрящевых эксплантатах.
Применение ингибитора МАРК для блокирования действия ключевых провоспалительных цитокинов, таких как IL-1 и TNF-α, будет оказывать полезные эффекты на многие клеточные типы в суставе, включая синовиальные фибробласты, макрофаги и хондроциты, ингибируя таким образом последующие патологические эффекты, такие как инфильтрация воспалительных клеток в сустав, синовиальная гиперплазия, активация синовиальных клеток и разрушение хряща. Таким образом, ингибитор МАРК будет блокировать распространение воспалительной ответной реакции на вышеуказанные цитокины и тем самым прерывать болезненный процесс.
Примеры ингибиторов МАРК, подходящих для настоящего изобретения, перечислены ниже. Для всех способов доставки (т.е. инъекция, инфузия и орошение) оптимальной дозой и/или концентрацией каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий в перечень агент, предполагается, что данные концентрации являются терапевтически эффективными.
Терапевтические и предпочтительные концентрации ингибиторов МАРкиназ
7. ИНГИБИТОРЫ МАТРИЧНЫХ МЕТАЛЛОПРОТЕИНАЗ
Деструкция суставного хряща является общим признаком при заболеваниях суставов, таких как остеоартрит и ревматоидный артрит, но она также имеет место после повреждения сустава. В патофизиологическом отношении наблюдается структурный распад протеогликанов и коллагена, что нарушает биомеханические свойства хряща. Сохранение нормального здорового внеклеточного матрикса отражает баланс между скоростью биосинтеза и включения матричных компонентов и скоростью их разрушения и последующей потери из хряща в синовиальную жидкость. Различные протеазы обладают потенциалом расщеплять хрящ и участвуют в процессе разрушения, в наибольшей мере матричные металлопротеиназы.
Матричные металлопротеиназы (MMPs) или матриксины представляют семейство по меньшей мере 15 цинк-эндопептидаз, которые функционируют внеклеточно и играют ключевую роль в патологическом разрушении ткани. Действующая в настоящее время номенклатура и альтернативные названия членов ММР приведены в таблице 23. Большая часть MMPs в значительной степени регулируется и большая часть конститутивно не экспрессируется в обычных тканях. Однако провоспалительные цитокины, такие как IL-1 и TNF-α, инициируют транскрипцию и экспрессию. Нарушение баланса, возникающее при положительной регуляции и активации разрушающих ткани MMPs, представляет основной причинный фактор в процессе разрушения хряща во время хронических воспалительных заболеваний и постоянных синовиальных воспалительных ответных реакций после повреждения сустава. Изучен метаболизм хрящевого матрикса у пациентов с повреждением мениска или разрывом передней крестообразной связки колена. Было показано, что концентрация стромелизина-1 (ММР-3), коллагеназы, тканевого ингибитора металлопротеиназ (TIMP-1) и фрагментов протеогликана возрастали в синовиальной жидкости колена человека после травматического повреждения колена. Временно данные показатели увеличивались мгновенно по сравнению с обычными уровнями и оставались достоверно повышенными (10-кратное увеличение) в течение одного года. Данные изменения, вероятно, приводят к возрастанию концентрации фрагментов протеогликанов, которые обнаруживают в синовиальной жидкости после повреждения коленной связки.



Было показано, что семейство ферментов ММР секретируется из человеческих хондроцитов и клетками синовиума, такими как синовиальные фибробласты. Кроме того, с использованием гибридизации in situ было показано, что человеческий синовиум синтезирует стромелизин-1 и коллагеназу. Стромелизин-1 (ММР-3) способен разрушать все компоненты хрящевого матрикса. Имеется доказательство того, что хондроциты участвуют в разрушении хряща высвобождением разрушающего матрикс фермента, коллагеназы-3. При активации провоспалительных цитокинов MMPs секретируются из клеток в латентной форме, внеклеточно активируются и ингибируются тканевыми ингибиторами металлопротеиназ (TIMPs). Полагается, что баланс между активностями MMPs и TIMPs важен для сохранения интактного хрящевого матрикса. В нескольких исследованиях было показано, что в патологических условиях, таких как остеоартрит и ревматоидный артрит, повышенные уровни MMPs приводят к нарушению баланса между MMPs и TIMPs, что, как полагается, отвечает за наблюдаемую деструкцию хряща.
MMPs находятся под контролем цитокинов, таких как интерлейкин-1 (IL-1) и факторы роста, которые действуют на хондроциты и синовиоциты с усилением продукции их протеаз. Другие провоспалительные цитокины, такие как IL-6, IL-8 и TNF-α, также усиливают продукцию разрушающих матрикс ферментов. Это приводит к деструкции хряща, которая обычно оценивается, как потеря сульфатированных гликозаминогликанов (GAGs) и разложение коллагена. IL-1, который находится в суставной жидкости у пациентов с артритными заболеваниями, стимулирует хондроциты к синтезу повышенных количеств ферментов, таких как стромелизин, коллагеназа фибробластов и нейтрофилов и активатор плазминогена. Кроме того, IL-1 ингибирует синтез ингибитора-1 активатора плазменогена и TIMP, и также ингибирует синтез матричных компонентов, таких как коллаген. Нарушение баланса между уровнями ингибиторов и ферментов приводит к увеличению количества активных протеаз и в сочетании с подавлением биосинтеза матрикса приводит к разрушению хряща.
С использованием срезов хряща на модели in vitro было показано, что ингибиторы коллагеназы могут ингибировать стимулированную IL-1 или IL-8 инвазию суставного хряща ревматоидными синовиальными фибробластами (RSF). Ингибиторы коллагеназы, 1,10-о-фенантролин и фосфорамидон, значительно ингибировали зависимое от концентрации проникновение в хрящ клеток RSF, при концентрациях 10-150 мкМ. Селективное действие цитокинов на секрецию протеиназ показывает, что опосредуемое синовиальными фибробластоподобными клетками разрушение суставного хряща представляет собой высоко регулируемый процесс. Так, предполагается, что способность ингибировать активность протеаз и связанное с ней разрушение матрикса местно внутри сустава, будет ингибировать процесс деструкции. На основании действия ингибиторов в ограниченной системе in vitro можно предположить, что терапевтическое вмешательство с использованием местной доставки синтетических ингибиторов ММР с соответствующей фармакокинетикой будет эффективным в качестве защитных для хряща агентов.
Примеры ингибиторов ММР, подходящих для настоящего изобретения, включают U-24522 ((R,S)-N-[2-[2-(гидроксиамино)-2-оксоэтил]-4-метил-1-оксопентил]-L-лейцил-L-фенилаланиамид), пептиды, такие как ингибитор-1 ММР и ингибитор ММР-3 и более крупные белки, такие как TIMP-1 или их фрагменты, и они перечислены в таблице ниже. Для всех способов местной доставки (т.е. инъекции, инфузии и орошение) оптимальной дозой и/или концентрацией каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий перечень агент, предполагается, что такие концентрации терапевтически эффективными.
Терапевтические и предпочтительные концентрации ингибиторов матричных металлопротеиназ (MMPs)
8. Ингибиторы ядерного фактора карра В (NFκB)
Провоспалительные и разрушающие для хряща клеточные пути регулируются внеклеточными и внутриклеточными сигнальными механизмами, которые являются мишенями для новой терапевтической местной доставки лекарственных препаратов. Полные молекулярные механизмы передачи сигналов, используемые провоспалительным цитокином, интерлейкином-1 (IL-1), для активации фактора транскрипции, ядерного фактора карра В (NFκB), плохо установлены. Тем не менее, ключевой молекулой, которая участвует во внутриклеточной передаче сигнала на уровне транскрипции гена, является провоспалительный фактор транскрипции (NFkB). Активность NFkB опосредуется семейством субъединиц фактора транскрипции, которые связываются с ДНК либо в форме гомодимеров, либо гетеродимеров. Данные субъединицы обычно находятся внутри цитоплазмы клеток в неактивной форме за счет связывания с ингибирующей субъединицей, называемой IkB. Активация IL-1-рецепторов и других внеклеточных сигналов индуцирует деградацию IkB и сопутствующую диссоциацию NFkB и ингибиторов с последующей транслокацией в ядро. Было установлено, что NFkB участвует в индуцированной IL-1 экспрессии и способен усиливать экспрессию провоспалительного белка СОХ-2 в синовиальных фибробластах при RA.
Определение NFkB в качестве ключевой молекулярной мишени основано на его роли в качестве общего отрицательно регулирующего сигнального элемента, регулирующего экспрессию гена несколько критических медиаторов воспаления, связанных с воспалением суставов и разрушающими хрящ путями. Ответ многих генов (СОХ-2, коллагеназы, IL-6, IL-8) управляется промоторами, которые включают оба промоторных элемента NFkB. Активация NFkB опосредует индукцию многих белков, важных для воспалительного процесса, таких как цитокины, молекулы клеточной адгезии, металлопротеиназы и другие белки, которые участвуют в продукции простагландинов и лейкотриенов (СОХ-2) в синовиоцитах. Таким образом, данный фактор транскрипции представляет физиологически значимую мишень при лечении, направленном на ответные реакции человеческих синовиальных фибробластов, человеческих суставных хондроцитов, а также других клеток при травме в суставе.
В частности, было показано, что воздействие на человеческие ревматоидные синовиальные фибробласты (RSF) интерлейкина-1бета (IL-1бera) приводит к согласованной положительной регуляции фосфолипазы А2 (PLA2) массой 85 кД и индуцируемой цикло-оксигеназы (СОХ-2). Вместе два этих фермента способствуют последующему биосинтезу PGE2, основного медиатора в суставе. Олигонуклеотидные ловушки и антисмысловые последовательности использовали для демонстрации участия (NFkB) в регуляции мета-болизирующих простаноиды ферментов. Противодействие мРНК NFkB с использованием антисмыслового олигонуклеотида привело к пониженному связыванию промотора гена СОХ.
Недавно был охарактеризован гимениалдизин, мышиный естественный продукт, в качестве ингибитора активации NFkB и стимулированной IL-1 и ингибированной RSF продукции PRGE2 зависимым от концентрации образом (IC50=1 мкМ). Была показана специфичность молекулярной мишени при использовании аналога алдизина и ингибитора протеинкиназы С, RO 32-0432, который был неактивен. Показано прямое действие гимениалдизина на индуцированную IL-1 активацию NFkB по значительному снижению (примерно на 80%) связывания NFkB с классическим kB-мотивом и ингибированию стимулированной миграции р65 из цитозоля обработанных клеток. Как предполагалось, для ингибитора регуляции транскрипции NFkB, обработанные гимениалдизином RSF, не транскрибировали мРНК для СОХ-2 или PLA2 в ответ на IL-1. Следовательно, наблюдали пониженные белковые уровни данных ферментов и снижение способности продуцировать PGE2. Кроме того, стимулированная IL-1 продукция интерлейкина-8 (IL-8), которая, как известно, является регулируемым NFkB событием, также ингибировалась под действием гимениалдизина, в то время как индуцированная IL-1 продукция сосудистого эндотелиального фактора роста, нерегулируемый NFkB ген, не подвергалась воздействию гимениалдизина. Таким образом, гимениалдизин ингибирует стимулированное IL-1 образование PGE2 синовиальными фибробластами посредством ингибирующего действия на активацию NFkB. Это обеспечивает основу для его использования в качестве нового ингибитора для блокирования роли NFkB в воспалении сустава и разрушении хряща.
Примеры ингибиторов NFkB, подходящих для настоящего изобретения, перечислены ниже. Для всех способов местной доставки (т.е. инъекции, инфузии и орошения) оптимальной дозой и/или концентрацией каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий в перечень агент, предполагается, что данные концентрации являются терапевтически эффективными.
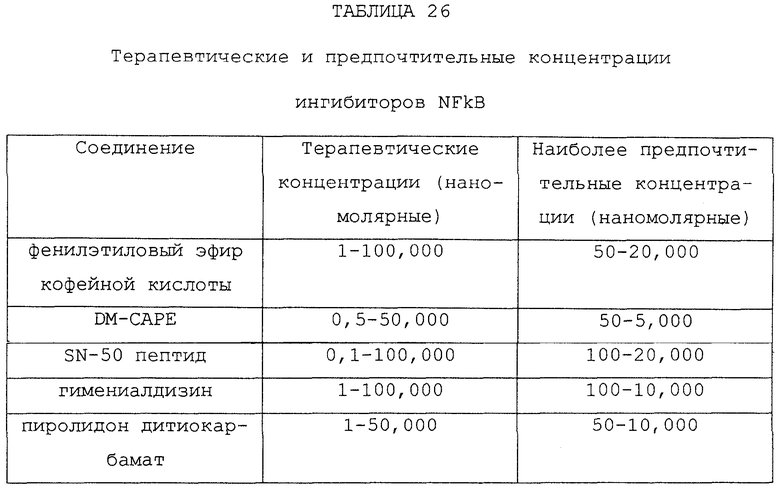
9. ИНГИБИТОРЫ СИНТАЗЫ ОКИСИ АЗОТА
Окись азота (NO) представляет широко распространенный внутриклеточный и межклеточный медиатор, участвующий в патофизиологических механизмах некоторых заболеваний соединительной ткани. NO образуется из L-аргинина при участии семейства ферментов, NO-синтаз, которые находятся внутри клеток. Были клонированы и секвенированы три изоформы NO-синтазы. Эндотелиальная клеточная NO-синтаза (ecNOS) и NO-синтаза мозга (bNOS) являются конститутивно активными. Другая изоформа NO-синтазы, индуцируемая NOS (iNOS), обнаружена во многих типах клеток, включая хондроциты. Она отсутствует в обычных условиях, но положительно регулируется в ответ на провоспалительные медиаторы, такие как IL-1β и TNF-α. В недавних открытиях было показано, что IL-1 является очень сильным стимулятором синтеза NO в хондроцитах, и что IL-1 действует посредством его способности повышать уровень iNOS. Внутри сустава хондроциты являются основным источником NO, и считается, что iNOS хондроцитов, индуцированная провоспалительными цитокинами, опосредует многие эффекты IL-1 при воспалительных артропатиях.
Лекарственные препараты, которые специфически ингибируют индуцируемую NO-синтазу (iNOS) хондроцитов, могут иметь терапевтическое значение в профилактике разрушения хряща, которое имеет место в результате повреждения сустава (например, хирургических вмешательств на суставе). Доказательство подобного полезного терапевтического действия базируется на достаточном числе исследований, в которых оценивались различные ингибиторы iNOS по их способности ингибировать активность индуцируемой NO-синтазы в культивируемых хондроцитах и эксплантатах хряща от пациентов с остеоартритом. Группа соединений, называемая S-замещенными изотиомочевинами, была охарактеризована в качестве сильных ингибиторов биосинтеза NO в хряще. 3-метилтиомочевина и S-(аминоэтил)изотиомочевина были в 2-4 раза активнее, чем NG-монометил-L-аргинин, в 5-10 раз активнее, чем аминогуанидин и в 300 раз активнее, чем Nω-нитро-L-аргинин и метиловый эфир Nω-нитро-L-аргинина. Данные производные изотиомочевины представляют группу сильных и относительно специфических ингибиторов iNOS в хряще и, таким образом, являются подходящими для местной доставки по настоящему изобретению (Jang D., 1996, Eur. J. Pharmacol. 312: 341-347).
Защитный для хряща терапевтический потенциал ингибиторов NO-синтазы был также оценен с использованием систем in vitro, таких как изолированные хондроциты, в целях определения действия на хрящевой матрикс. Ингибирование продукции эндогенной NO под действием Nω-нитро-L-аргинина (L-NMMA), признанного ингибитора NO-синтазы, приводит к подавлению продукции желатиназы, коллагеназы и стромелизина в стимулированных IL-1β хондроцитах. Ингибирование продукции NO также частично снижает увеличение продукции лактата, которое имеет место при воздействии на хондроциты IL-1β. Обработка хрящевых фрагментов L-NMMA частично подавляет ингибирующее действие IL-1β на синтез гликоза-миногликанов, ингибирует стимулированную IL-1β активность ММР и повышает продукцию антагониста IL-1-рецептора (IL-1ra). NO также может опосредовано модулировать синтез протеогликанов путем снижения продукции TGF-β1 хондроцитами после воздействия IL-1β. Она предупреждает аутокринное стимулированное повышение TGF-β1, снижая таким образом анаболические эффекты данного цитокина в хондроцитах.
В исследовании сравнивалась активность нового аминогуанидина, S-метилизотиомочевины (SMT), 3-аминоэтилизотиомочевины (AETU), L-NMMA и метилового эфира N-нитро-L-аргинина (L-NAME), в качестве ингибиторов NOS, на ингибирующее действие ответов рекомбинантного человеческого IL-1 на синтез протеогликанов и продукцию NO. В различных культуральных системах была показана ответная реакция в зависимости от концентрации на воздействие IL-1β, выражающаяся в значительном увеличении продукции NO и заметном подавлении синтеза протеогликанов. Вышеуказанные ингибиторы NOS (в концентрации 1-1000 мкМ) ингибировали продукцию NO клетками хряща, обработанными IL-1β, и оказывали заметное действие на восстановление синтеза протеогликанов в хондроцитах. Следовательно, если продукцию NO можно блокировать с использованием терапевтически эффективной концентрации и дозы, тогда ингибирование синтеза протеогликанов под действием IL-1β будет предупреждено.
NO-синтаза экспрессируется в хряще, полученном из сустава пациентов с артритом. У пациентов с ревматоидным артритом или остеоартритом наблюдали повышенные уровни нитрита в синовиальной жидкости, и было показано, что существенным источником продукции NO у этих пациентов является суставной хрящ. Кроме того, было установлено, что постоянная системная доставка L-NIL, сильного ингибитора iNOS, подавляет прогрессирование ОА у собак (индуцированное рассечением ACL) и вызывает значительное снижение продукции IL-1β, PGE2, NO и ММР. На основании данных открытий можно предположить, что NO является сильным регулятором эффектов IL-1β и вносит свой вклад в патофизиологию заболеваний суставов.
Таким образом, данные результаты in vitro и in vivo указывают на то, что ингибиторы NO-синтаз являются потенциальными новыми лекарственными препаратами для лечения в клинике синовиального воспаления и могут обеспечить защитные для хряща эффекты при местной доставке в комбинации с одним или более препаратов, выбранных из противовоспалительных, защищающих хрящ и обезболивающих групп для лечения хирургически обработанного сустава или другого поврежденного сустава.
Примеры ингибиторов NO-синтаз, подходящих для настоящего изобретения перечислены ниже. Для всех способов местной доставки (т.е. инъекции, инфузии и орошения) оптимальной дозой и/или концентрацией каждого подходящего агента является таковая, которая терапевтически эффективна. В качестве примера для каждого из перечисленных агентов приводятся предпочтительные и наиболее предпочтительные концентрации орошающего раствора, содержащего входящий в перечень агент, предполагается, что данные концентрации являются терапевтически эффективными. В одном воплощении предпочтительные ингибиторы NO-синтазы для включения в растворы по изобретению являются 1400 W (N-3-(аминометил)бензил)ацетамидин, селективный, медленный, тесно связывающийся ингибитор iNOS, дифениленйодиний и 1,3-PBIT.
Терапевтические и предпочтительные концентрации ингибиторов синтазы окиси азота
10. МОЛЕКУЛЫ КЛЕТОЧНОЙ АДИЗИИ
10а. АГОНИСТЫ И АНТАГОНИСТЫ ИНТЕГРИНОВ
Интегрины являются гетеродимерными рецепторами, расположенными на плазменной мембране, которые включают α-и β-субъединицы, которые связывают лиганды, которые представляют внеклеточные матричные (ЕСМ) компоненты, или могут быть другими крупными белками, такими как коллаген, ламинин, витронектин, остеопонтин (OPN) и фибронектин (FN). Разрушение хрящевого матрикса регулируется хондроцитами посредством механизмов, которые зависят от взаимодействия данных клеток с ЕСМ. Экспрессия генов в хондроцитах отчасти регулируется посредством клеточных контактов, в которых участвует взаимодействие интегринов с компонентами ЕСМ в среде, окружающей хондроцит. Следовательно, интегрины на хондроцитах участвуют в регуляции гомеостаза в хряще, и данное семейство рецепторов представляет группу терапевтических мишеней для профилактики разрушения хряща.
Человеческие хондроциты экспрессируют множество интегриновых рецепторов, состоящих из различных α- и β-субъединиц, включая α1β1, α5β1, αVβ1 и меньшие количества других. αVβ3-интегрин имеет особое значение, который, как известно, связывает OPN. αVβ3-комплексные специфические блокирующие моноклональные антитела действуют в качестве агониста таким же образом, как лиганд, OPN. Они снижают продукцию ряда провоспалительных и разрушающих хрящ медиаторов, таких как IL-1, NO и PGE2. Таким образом, полагается, что агонистические mAb LM609 подходят для применения по настоящему изобретению.
Кроме того, в фазе II клинических исследований изучали два пептидомиметика МК-383 (Merck) и RO 4483 (Hoffmann-LaRoche). Поскольку оба являются небольшими молекулами, они имеют короткий период полувыведения и высокую активность. Однако оказалось, что они также обладают меньшей специфичностью, взаимодействуя с другими очень близкими интегринами. Данные пептидомиметики также подходят для применения по настоящему изобретению.
Терапевтические и предпочтительные концентрации интегринов
11. АНТИХЕМОТАКСИЧЕСКИЕ АГЕНТЫ
Антихемотаксические агенты предотвращают хемотаксис воспалительных клеток. Типичные примеры антихемотаксических мишеней, на которых данные агенты будут действовать, включают, но не ограничиваются F-Met-Leu-Phe-рецепторами, IL-8-рецепторами, МСР-1-рецепторами и MIP-1-I/RANTES-рецепторами. Препараты данной группы агентов находятся на ранней стадии разработки, но теоретически они могут быть подходящими для применения по настоящему изобретению.
12. ИНГИБИТОРЫ ВНУТРИКЛЕТОЧНОЙ ПЕРЕДАЧИ СИГНАЛА
12А. ИНГИБИТОРЫ ПРОТЕИНКИНАЗ
i. Ингибиторы протеинкиназы С (РКС)
Протеинкиназа С (РКС) играет решающую роль в передаче сигнала с клеточной поверхности для ряда физиологических процессов. Изозимы РКС можно активировать в качестве ингибирующих мишеней в результате первоначальной активации сопряженных с G-белком рецепторов (например, серотонина, брадикинина и т.п.) или провоспалительных цитокиновых рецепторов. Обе этих группы рецепторов играют важную роль в опосредовании разрушения хряща.
При молекулярном клонировании было установлено, что РКС существует в виде большого семейства, включающего по меньшей мере 8 подвидов (изозимов). Данные изозимы существенно различаются по структуре и механизму активации связывающих рецепторов для изменений в пролиферативном ответе специфических клеток. Экспрессия специфических изозимов установлена в самых различных типах клеток, включая синовиоциты, хондроциты, нейтрофилы, миелоидные клетки и клетки гладкой мускулатуры. Следовательно, вероятно, ингибиторы РКС воздействуют на пути передачи сигнала в нескольких типах клеток, хотя ингибитор проявляет изозимную специфичность. Таким образом, можно предположить, что ингибиторы РКС будут эффективными в блокировании активации синовиоцитов и хондроцитов и могут также оказывать противовоспалительное действие при блокировании активации нейтрофилов и последующем прикреплении. Описано несколько ингибиторов, и в первоначальных работах была указана IC50, равная 50 мкМ, для ингибирующей активности калфостина С. G-6203 (также известен, как Go 6976) представляет новый, сильный ингибитор РКС с высокой селективностью для некоторых изотипов РКС со значениями IC50 в пределах 2-10 мкМ. Концентрации этих и другого препарата, GF 109203Х, также известного, как Go 6850 или бисиндоилмалеимид I (от Warner-Lambert), которые, как полагается, подходят для применения по настоящему изобретению, приведены ниже.
Терапевтические и предпочтительные концентрации агентов, подавляющих разрушение хряща
ii. Ингибиторы тирозиновых протеинкиназ
Несмотря на то, что среди многочисленных членов семейства рецепторных тирозинкиназ (RTK) имеется существенное различие, механизмы передачи сигнала, используемые данными рецепторами, имеют много общих свойств. В биохимических и молекулярно-генетических исследованиях было показано, что связывание лиганда с внеклеточным доменом RTK быстро активирует присущую тирозинкиназную каталитическую активность внеклеточного домена (см. фигуру 5). Повышенная активность приводит к специфическому фосфорилированию тирозина ряда внутриклеточных субстратов, которые содержат мотив общей последовательности. В результате это вызывает активацию многочисленных отрицательно регулирующих сигнальных молекул и каскад внутриклеточных путей, которые регулируют фосфолипидный обмен, обмен арахидоната, фосфорилирование белков (включая другие механизмы, чем с участием протеинкиназ), мобилизацию кальция и активацию транскрипции (см. фигуру 2). Зависимая от факторов роста активность тирозинкиназы цитоплазматического домена RTK является основным механизмом генерации внутриклеточных сигналов, который приводит к клеточной пролиферации. Таким образом, ингибиторы обладают потенциалом блокировать данную передачу сигнала и тем самым предотвращать активацию синовиоцитов и хондроцитов.
Любое из нескольких близких производных тирфостина имеет потенциал в качестве специфических ингибиторов активности тирозинкиназы (IC50 in vitro в пределах 0,5-1,0 мкМ), поскольку они оказывают незначительный эффект на другие протеинкиназы и другие системы передачи сигнала. К настоящему времени только немногие из большого числа производных тирфостина являются промышленно доступными и подходящие концентрации данных агентов для использования по настоящему изобретению приведены ниже. Кроме того, сообщалось, что стауроспорин показал сильное ингибирующее действие в отношении нескольких протеинтирозинкиназ подсемейства src и подходящие концентрации данного агента для применения по настоящему изобретению также приведены ниже
Терапевтические и предпочтительные концентрации ингибирующих агентов
12b. Модуляторы внутриклеточных (белок-тирозин)-фосфатаз
Нетрансмембранные (белок-тирозин)-фосфатазы (РТРазы), включающие SH2-домены src-гомологии2 известны и по номенклатуре они относятся к SH-PTP1 и SH-PTP2. Кроме того, SH-PTP1 известна также, как РТР1С, НСР или SHP. SH-PTP2 известна также, как PTP1D или РТР1С. Аналогичным образом SH-PTP1 экспрессируется в больших количествах в гематопоэтических клетках всех поколений и на всех стадиях дифференциации, и ген SH-PTP1 идентифицирован в качестве ответственного за материнский (me) мышиный фенотип, и это обеспечивает основу для предположения о том, что действие ингибиторов будет блокировать взаимодействие с ее клеточными субстратами. Известно, что стимуляция нейтрофилов хемотаксическими пептидами приводит к активации тирозинкиназ, которые опосредуют ответные реакции нейтрофилов (Cui et al., 1994 J. Immunol.), и РТР-азная активность модулирует индуцированную агонистом активность противоположным изменением эффектов тирозинкиназ, активированных на начальных фазах стимуляции клеток. Агенты, которые могут стимулировать активность РТР-аз могут иметь потенциал для терапевтических применений в качестве противовоспалительных медиаторов.
Было показано, что данные РТР-азы модулируют активность некоторых RTKs. Оказалось, что они противодействуют эффекту активированных рецепторных киназ и, таким образом, могут представлять важные мишени для лекарственных препаратов. В опытах in vitro показано, что инъекция РТР-азы блокирует стимулированное инсулином фосфорилирование тирозильных остатков на эндогенных белках. Таким образом, активаторы активности РТР-азы могут служить для противоположного изменения активации действия RTK-рецепторов при повторном станозе, и полагают, что они являются подходящими для растворов по настоящему изобретению. Кроме того, связанные с рецепторами РТР-азы также функционируют в качестве внеклеточных лигандов, близких к таковым для молекул клеточной адгезии. Функциональные последствия связывания лиганда с внеклеточным доменом еще пока не установлены, но является разумным предположить, что связывание будет служить для модуляции активности фосфатаз внутри клеток (Fashena and Zinn, 1995, Current Biology, 5, 1367-1369). Подобное действие может блокировать адгезию, опосредуемую другими молекулами клеточной поверхностной адгезии (NCAM), и обеспечивать противовоспалительное действие. Для данных применений лекарственные препараты еще не разработаны.
12с. ИНГИБИТОРЫ SH2-доменов (домены src гомологии2)
SH2-домены, первоначально установленные в подсемействе src тирозиновых протеинкиназ (PTKs), являются некаталитическими белковыми последовательностями и состоят примерно из 100 аминокислот, являющимися консервативными среди различных белков, участвующих в передаче сигнала (Cohen et al., 1995). SH2-домены функционируют в качестве фосфотирозин-связывающих модулей и тем самым опосредуют критические ассоциации белок-белок на путях передачи сигнала внутри клеток (Pawson, Nature, 573-580, 1995). В частности, была точно установлена роль SH2-доменов в качестве критических для рецепторных тирозинкиназ (RTK), опосредующих передачу сигнала, таких как в случае рецептора тромбоцитарного фактора роста (PDGF). Фосфотирозин-содержащие сайты на аутофосфорилированных RTKs служат в качестве сайтов связывания SН2-белков и тем самым опосредуют активацию биохимических путей передачи сигналов (см. фигуру 2) (Carpenter G., FASEB J. 6: 3283-3289, 1992; Sierke S. and Koland, J. Biochem. 32: 10102-10108, 1993). SH2-домены ответственны за связывание с активированными рецепторами факторов роста на клеточные ответы, которые включают изменения экспрессии генов и в конечном итоге клеточной пролиферации. Таким образом, ингибиторы, которые будут селективно блокировать эффекты активации специфических RTKs (исключая IGFR и FGFR), экспрессированные на поверхности синовиоцитов, будут эффективными в блокировании разрушения хряща после артроскопических вмешательств.
Идентифицировано по меньшей мере 20 цитозольных белков, которые включают SH2-домены и функционируют во внутриклеточной передаче сигнала. Распространение SH2-доменов не ограничивается конкретным семейством белков, и они обнаружены в нескольких группах белков, протеинкиназах, липидкиназах, протеинфосфатазах, фосфолипазах, Ras-регулирующих белках и некоторых факторах транскрипции. Многие SH2-содержащие белки имеют известные ферментативные активности, в то время как другие (Grb2 и Crk) функционируют в качестве "линкеров" и "адаптеров" между рецепторами клеточной поверхности и ингибирующими эффекторными молекулами (Marengere L. et al., Nature 369: 502-505, 1994). Примеры белков, включающих ЗН2-домены, с ферментативной активностью, которые активируются при передаче сигналов, включают, но не ограничиваются подсемейством scr тирозиновых протеинкиназ (scr (рр60c-src), abl, Ick, fyn, fgr и другие), фосфолипазойСγ (PLCγ), фосфатидилинозитинозит-3-киназой (PI-3-киназой), p21-ras активирующим GTP-азу белком (GAP) и SH2-содержащими протеин-тирозинфосфатазами (SH-РТРазами) (Songyang et al., Cell 72, 767-778, 1993). За счет центральной роли, которую играют данные различные SH2-белки в передаче сигнала от активированных рецепторов клеточной поверхности в каскад дополнительных молекулярных взаимодействий, которые в конечном итоге определяют клеточные ответные реакции, ингибиторы, которые блокируют специфическое связывание SH2-белка (например, c-src), являются желаемыми в качестве агентов потенциальными терапевтическими применениями для защиты хряща.
Кроме того, регуляция многих иммунных/воспалительных ответов опосредуется через рецепторы, которые передают сигналы через нерецепторные тирозинкиназы, включающие SH2-домены. Активация Т-клеток через антигенспецифические рецепторы Т-клеток (TCR) инициирует каскад передачи сигнала, приводящий к секреции лимфокинов и пролиферации Т-клеток. Одним из наиболее ранних биохимических ответов, последующих за активацией TCR, является повышение активности тирозинкиназ. В частности, активация нейтрофилов частично регулируется посредством ответных реакций рецепторов иммуноглобулина G на поверхности клеток. Активация данных рецепторов опосредует активацию неидентифицированных тирозинкиназ, которые, как известно, имеют SH2-домены. Дополнительное доказательство указывает на то, что несколько киназ (lck, bik, fyn), относящихся к семейству src, участвуют в путях передачи сигнала от цитокиновых и интегриновых рецепторов и, следовательно, могут служить для интеграции сигналов, полученных от нескольких независимых рецепторных структур. Таким образом, ингибиторы специфических SH2-доменов имеют потенциал блокировать многие функции нейтрофилов и служить в качестве противовоспалительных медиаторов.
В настоящее время предпринимались попытки разработать лекарственные препараты, целенаправлено воздействующие на SH2-домены на биохимическом in vitro и на клеточном уровне. Если такие попытки будут успешными, то теоретически можно предположить, что полученные в результате лекарственные препараты будут подходящими для практики настоящего изобретения.
III. СИНЕРГЕТИЧЕСКИЕ ВЗАИМОДЕЙСТВИЯ В РЕЗУЛЬТАТЕ ТЕРАПЕВТИЧЕСКИХ КОМБИНАЦИЙ АГЕНТОВ, ИНГИБИРУЮЩИХ БОЛЬ И/ИЛИ ВОСПАЛЕНИЕ, И ДРУГИХ АГЕНТОВ, ИСПОЛЬЗОВАННЫХ В РАСТВОРАХ ДЛЯ ЗАЩИТЫ ХРЯЩА
С учетом сложности болезненного процесса, связанного с воспалением и потерей гомеостаза в хряще после артроскопических терапевтических процедур и многочисленности участвующих молекулярных мишеней, блокада или ингибирование одной молекулярной мишени вряд ли обеспечит адекватную эффективность в профилактике разрушения хряща и развития остеоартрита. Действительно, в ряде исследований, проведенных на животных, было показано, что целенаправленное воздействие на различные отдельные молекулярные рецепторы или ферменты не является эффективным на моделях на животных, или оно не дало к настоящему времени эффективности в клинических испытаниях. Следовательно, желаемой является терапевтическая комбинация лекарственных препаратов, действующих на различные молекулярные мишени, и доставленная местно для проявления клинической эффективности при терапевтическом подходе к защите хряща. Как описано ниже, логическое обоснование для данной синергетической молекулярной целенаправленной терапии происходит из недавних достижений в понимании фундаментальных биохимических механизмов, с помощью которых синовиоциты и хондроциты в синовиуме и хряще передают и интегрируют сигналы, воздействию которых они подвергаются во время артроскопических процедур.
"ПЕРЕКРЕСТНОЕ ВЛИЯНИЕ" И КОНВЕРГЕНЦИЯ НАИБОЛЕЕ ВАЖНЫХ ПУТЕЙ ПЕРЕДАЧИ СИГНАЛОВ
Молекулярные "включатели", ответственные за передачу сигналов в клетке, традиционно разделяли на большие дискретные пути передачи сигналов, каждый из которых включает различный ряд белковых семейств, которые действуют в качестве трансдукторов для конкретного ряда внеклеточных сигналов и опосредуют различные клеточные ответы. На одном таком пути передаются сигналы от нейромедиаторов и гормонов через сопряженные с G-белком рецепторы (GPCRs) с образованием ответов, которые включают продукцию медиаторов воспаления, таких как PGE2. GPCRs соединяются с внутриклеточными мишенями через активацию тримерных G-белков (см. фигуру 2). Примерами сигнальных молекул, участвующих в активации синовиоцитов и хондроцитов через GPCR-путь, являются гистамин, брадикинин, серотонин и АТФ. Второй основной путь передает сигналы от провоспалительных цитокинов, таких как IL-1, через каскад киназ и NF-6В-белок, в регуляцию экспрессии генов и продукции катаболических цитокинов и других катаболических факторов, включая NO.
Сигналы, переданные от нейромедиаторов и гормонов, стимулируют одну из двух групп рецепторов: GPCRs, состоящих из семиспиральных трансмембранных участков, или ионных каналов с воротными лигандами. Торможение сигналов обоих видов рецепторов сходится на регуляции концентрации цитоплазматического Са2+ (см. фигуру 3). Каждый трансмембранный GPCR-рецептор активирует специфическую группу гримерных G-белков, включая Gq, Gi или многие другие. Gq-субъединицы активируют фосфолипазуСγ, приводя к активации протеинкиназы С (РКС) и повышению уровней цитоплазматического кальция (фигура 3). В свою очередь, повышенный внутриклеточный кальций приводит к активации сPLA2 и продукции арахидоновой кислоты (АА). АА служит в качестве субстрата для СОХ в синовиоцитах и хондроцитах, приводя к продукции PGE2. Активация РКС также приводит к активации МАРкиназы, приводя к активации NFB, и в клетках и тканях, которые были первоначально подвергнуты воздействию провоспалительных цитокинов, модулирует повышенную экспрессию генов белков, участвующих в катаболизме хряща.
Передача сигналов провоспалительными цитокинами, которая опосредуется IL-1 и TNF-α через их различные родственные рецепторы, также сходится на регуляции экспрессии генов в клетках. На путях передачи сигналов, использованных данными различными рецепторами, используются различные киназы, которые находятся проксимальнее рецепторов, но пути передачи сигналов в последующем сходятся на уровне МАРкиназ (фигура 3 и 4). Передача сигналов зависит от фосфорилирования остатков в каскаде киназ, включая ингибирующие ферменты, такие как р38-МАРкиназа. Активация IL-1-рецептора и TNF-α-рецептора также приводит к стимуляции МАРкиназы, общие стадии, разделяемые Gq-сопряженными GPCRs (см. фигуру 3). В настоящее время признается, что независимое от лиганда "перекрестное влияние" может трансактивировать пути с участием киназ в ответе на совместную стимуляцию специфических GPCRs и цитокинов, таких как IL-1, приводя к синергетическим клеточным ответам (см. фигуру 3). Таким образом, комбинация селективных ингибиторов, которые блокируют трансактивацию общего пути передачи сигналов (как показано на фигурах 1 и 2), приводя к повышенной экспрессии генов провоспалительных цитокинов, iNOS, COX-2 и MMPs, будет действовать синергетически для предотвращения воспаления и разрушения хряща после артроскопических хирургических процеДУР.
IV. ЗАКЛЮЧЕНИЕ
Исходя из молекулярных и клеточных механизмов действия, определенных для данных агентов для защиты хряща, предполагается, что данные соединения будут проявлять защитное для хряща действие, при применении периоперативно в орошающем растворе (в комбинации с другими описанными выше защитными для хряща агентами или в комбинации с другими обезболивающими и противовоспалительными агентами), или в противном случае введенные непосредственно в сустав с помощью инфузии или инъекции. В частности, предполагается, что данные агенты будут эффективными лекарственными препаратами, когда доставляются с орошающим раствором во время артроскопической хирургической операции. Каждый метаболически активный защитный для хряща агент может доставляться в комбинации с одним или более защитными для хряща агентами, включая небольшие молекулы-препараты, пептиды, белки, рекомбинантные химерные белки, антитела, олигонуклеотиды или векторы при генной терапии (вирусные и невирусные) в сустав. Например, лекарственный препарат, такой как ингибитор МАРК, проявляет свое действие на любых клетках, связанных с жидкими пространствами сустава и структурами, составляющими сустав, которые участвуют в нормальном функционировании сустава, или присутствуют в результате патологического состояния. Данные клетки и структуру включают, но не ограничиваются: синовиальными клетками, включая фибробласты типа А и макрофаги типа В; хрящевидные компоненты сустава, такие как хондробласты и хондроциты; клетки, связанные с костью, включая периостальные клетки, остеоциты, остеобласты, остеокласты; клетки воспаления, включая лимфоциты, макрофаги, тучные клетки, моноциты, эозинофилы; и другие клетки, включая эндотелиальные клетки, клетки гладкой мускулатуры, фибробласты и нервные клетки; и комбинации вышеуказанных.
Данный аспект настоящего изобретения также представляет композиции активного терапевтического агента(ов), который может доставляться композицией, подходящей для введения и назначения лекарственного препарата в сустав, что будет усиливать доставку, поглощение, стабильность или фармакокинетику защитного для хряща агента(ов). Такая композиция может включать, но не ограничиваться, микрочастицами, микросферами или наночастицами, состоящими из белков, липосом, углеводов, синтетических органических соединений или неорганических соединений. Настоящее изобретение обеспечивает доставку комбинации защитных для хряща агентов, или одного или более агентов для защиты хряща с одним или более агентами, ингибирующими боль и/или воспаление, присутствующих либо в виде многих фармацевтически активных соединений в гомогенном носителе (например, единичной инкапсулированной микросфере), или в виде дискретной смеси отдельных носителей для доставки (например, группе микросфер, включающих один или более агентов). Примеры молекул композиции включают, но не ограничиваются, гидрофильными полимерами, поликатионами (например, протамином, спермидином, полилизином), пептидом или синтетическими лигандами и антителами, способными целенаправленно воздействовать на конкретные типы клеток, гелями, матрицами для замедленного высвобождения, растворимыми и нерастворимыми частицами, а также элементами в композициях, которые не перечислены.
В одном аспекте настоящее изобретение обеспечивает местную доставку композиции двух или более агентов для защиты хряща, или одного или более агентов для защиты хряща в комбинации с одним или более агентами, ингибирующими боль и/или воспаление, одного или в комбинации с одним или более обезболивающим и/или противовоспалительным агентом, с помощью орошающего раствора, инфузии, содержащей лекарственные препараты, которые находятся в терапевтически эффективных низких концентрациях, и которые способствуют доставке лекарственных препаратов непосредственно в пораженную ткань или сустав. Инфузию или орошающий раствор, содержащие лекарственный препарат, можно использовать перед операцией, и/или во время операции, и/или после операции в связи с хирургической процедурой, или можно вводить в другие периоды времени, не связанные с хирургическими процедурами. Для других обычных способов, используемых для доставки лекарственных препаратов, необходимо системное (например, внутримышечное, внутривенное, подкожное) введение, для чего требуются более высокие концентрации лекарственных препаратов (и более высокая общая доза) для введения пациентам для того, чтобы достичь значительных терапевтических концентраций в целевом суставе. Системное введение также приводит к высоким концентрациям в тканях в большей степени, чем в целевом суставе, что является нежелательным и, в зависимости от дозы, может привести к проявлению побочных эффектов. При данных системных способах препарат подвергается вторичному метаболизму и быстрой деградации, тем самым ограничивая продолжительность сохранения эффективной терапевтической концентрации. Поскольку комбинацию агентов для защиты хряща (с или без одного или более обезболивающих и/или противовоспалительных агентов) вводят непосредственно в сустав инфузией или орошением, сосудистая перфузия не требуется для доставки лекарственного препарата в целевые ткани. Данное существенное преимущество позволяет применять для местной доставки более низкую терапевтически эффективную общую дозу различных защитных для хряща лекарственных препаратов.
V. СПОСОБ ПРИМЕНЕНИЯ
Растворы по настоящему изобретению применяются при различных хирургических/инвазивных процедурах, включая хирургические, диагностические и терапевтические методы. Комбинацию защитных для хряща агентов по изобретению можно вводить с помощью инъекции или орошения. В растворах для инъекции количество активного ингредиента, которое может быть соединено с носителями для получения разовой лекарственной формы, будет варьировать в зависимости от пациента, который подвергается лечению, природы активных агентов в растворе и конкретного способа введения. Однако, очевидно, понятно, что конкретная доза для любого конкретного пациента будет зависеть от разных факторов, включая активность конкретного используемого соединения, возраста, массы тела, общего состояния здоровья, пола и рациона пациента, времени введения, пути введения, скорости выделения комбинации лекарственных препаратов и тяжести конкретного заболевания, которое лечится.
Инъекционные препараты, например стерильные инъекционные водные или масляные суспензии, можно составлять способами, известными в данной области, с применением подходящих диспергирующих или смачивающих агентов или суспендирующих агентов. Стерильный инъекционный препарат может также быть стерильным инъекционным раствором или суспензией в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1/3-пропандиоле. Приемлемыми носителями или растворителями, которые могут использоваться, являются вода, раствор Рингера и изотонический раствор хлористого натрия. Кроме того, в качестве растворителя или суспендирующей среды могут использоваться стерильные, нелетучие масла. Для этой цели можно использовать любое нелетучее масло, включая моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение в инъекционных препаратах.
Растворы для инъекции по изобретению можно вводить в связи с артроскопической хирургической процедурой, или в любое время, определенное, как желаемое врачом, проводящим лечение пациента.
Орошающие растворы по изобретению можно применять периоперативно во время артроскопической операции на анатомических суставах. В том смысле, как он используется, термин "периоперативный" включает применение во время процедуры, перед и во время процедуры, во время и после процедуры, и перед, во время и после процедуры. Предпочтительно раствор применяют перед процедурой и/или после процедуры, а также во время процедуры. При таких процедурах обычно используются физиологические орошающие жидкости, такие как обычный физиологический раствор или лактированный раствор Рингера, примененные на место операции способами, хорошо известными специалистам в данной области. Способ по настоящему изобретению включает использование обезболивающих/противовоспалительных/защитных для хряща орошающих растворов по настоящему изобретению вместо обычно используемых орошающих жидкостей. Орошающий раствор наносится на рану или место операции до начала процедуры, предпочтительно перед травмой тканей и постоянно во время процедуры для упреждающего блокирования боли и воспаления и разрушения хряща. В том смысле, как он используется, термин "орошение" означает промывание под давлением раны или анатомической структуры струей жидкости. Термин "применение" включает орошение и другие способы местного введения раствора по настоящему изобретению, такие как введение поддающегося гелеобразованию раствора в место операции, с превратившимся в гель раствором, остающимся затем в месте в течение процедуры. В том смысле, как он используется, термин "постоянно" также включает ситуации, при которых имеет место многократное или частое орошение ран с частотой, достаточной для поддержания заранее определенной терапевтической местной концентрации применяемых агентов, и применяться при которых может прерывистая остановка потока орошающей жидкости, что требуется по методике операции.
Концентрации, перечисленные для каждого из агентов в растворах по настоящему изобретению, представляют концентрации агентов, доставленных местно, в присутствии метаболической трансформации, на место операции для того, чтобы достичь заранее определенного уровня действия в месте операции. Очевидно, понятно, что концентрации препаратов в данном растворе могут нуждаться в подведении с учетом местного разбавления во время доставки. Концентрации в растворах не подводятся с учетом метаболических превращений или разбавления за счет распределения во всем организме, поскольку данные обстоятельства исключаются при местной доставке, в противоположность пероральному, внутривенному, подкожному или внутримышечному применению.
Артроскопические методы, при которых можно применять настоящий раствор, включают в качестве неограничивающего примера, неполные менискоэктомии и восстановления связок в колене, акромиопластика плеча, санация манжета поворота плеча, синовэктомия локтевого сустава и артроскопия запястья и голеностопного сустава. Орошающий раствор продолжительно вводят интраоперативно в сустав со скоростью потока, достаточной для расширения суставной капсулы, для удаления хирургических остатков и для беспрепятственной внутрисуставной визуализации.
Подходящие артроскопические орошающие растворы для ингибирования разрушения хряща и борьбы с болью и воспалением во время артроскопических методик приведены в примерах 1-4 ниже.
В каждом из растворов по настоящему изобретению агенты включены в низких концентрациях и доставляются местно в низких дозах по сравнению с концентрациями и дозами, необходимыми для обычных способов введения препаратов, в целях достижения желаемого терапевтического эффекта. Невозможно получить эквивалентный терапевтический эффект при доставке агентов в аналогичных дозах другими (т.е. внутривенным, подкожным, внутримышечным и пероральным) путями введения препаратов, поскольку препараты, введенные системно, подвергаются первичному и вторичному метаболизму и часто быстро исчезают из системной циркуляции.
Практика настоящего изобретения должна отличаться от обычных внутрисуставных инъекций опиатов и/или местных анестетиков при проведении артроскопических или "открытых" на суставе (например, колене, плече и т.п.) процедур. Раствор по настоящему изобретению используется для продолжительной инфузии во время хирургической процедуры для обеспечения упреждающего подавления боли и воспаления. В противоположность высокие концентрации, необходимые для достижения терапевтической эффективности при постоянной инфузии используемых в настоящее время местных анестетиков могут привести к выраженной системной токсичности.
При проведении процедуры по настоящему изобретению может быть желательным вводить или применять иным образом более высокую концентрацию того же агента для защиты хряща (агентов) и/или обезболивающих, и/или противовоспалительных агентов, чем та, какая использована в орошающем растворе в месте операции, в качестве альтернативы или дополнения к опиатам. Кроме того, может быть желательным прямая инъекция комбинаций защитных для хряща агентов, как описано детально ниже. Подходящий защитный для хряща раствор для инъекций приведен в примере 5 ниже.
ПРИМЕРЫ
Представлено несколько композиций по настоящему изобретению, подходящих для некоторых хирургических процедур с последующим кратким описанием трех клинических исследований, в которых использовались агенты по настоящему изобретению.
ПРИМЕР 1
ОРОШАЮЩИЙ РАСТВОР ДЛЯ АРТРОСКОПИИ
Следующая композиция является подходящей для использования при орошении анатомического сустава во время артроскопических процедур. Каждый препарат солюбилизирован в жидкости-носителе, содержащем физиологические электролиты, такие как обычный физиологический раствор или лактированный раствор Рингера, как и другие растворы, описанные в последующих примерах.
ПРИМЕР 2
АЛЬТЕРНАТИВНЫЙ ОРОШАЮЩИЙ РАСТВОР ДЛЯ АРТРОСКОПИИ
Следующая композиция является альтернативной композицией, подходящей для применения при орошении анатомического сустава во время артроскопических процедур.
ПРИМЕР 3
АЛЬТЕРНАТИВНЫЙ РАСТВОР ДЛЯ ОРОШЕНИЯ
Последующие препараты и пределы концентраций в растворе в физиологическом жидкости-носителе подходят для использования по настоящему изобретению.
ПРИМЕР 4
АЛЬТЕРНАТИВНЫЙ РАСТВОР ДЛЯ ОРОШЕНИЯ
Следующая композиция также подходит для настоящего изобретения.
ПРИМЕР 5
РАСТВОР ДЛЯ ИНЪЕКЦИИ ДЛЯ ЗАЩИТЫ ХРЯЩА
Следующая композиция подходит для инъекции в анатомический сустав. Каждый препарат солюбилизирован в жидкости-носителе, содержащем физиологические электролиты, такие как обычный физиологический раствор или лактированный раствор Рингера. Доза в 20 мл раствора подходит для введения пациенту.
ПРИМЕР 6
СИНЕРГЕТИЧЕСКАЯ СТИМУЛЯЦИЯ БЫСТРОГО РЕЗКОГО ПОДЪЕМА PGE2 ПРИ ВОЗДЕЙСТВИИ АГОНИСТОВ IL-1 И GPCK
Фибробластоподобные синовиоциты проявляют свойства воспалительных клеток и, вероятно, являются решающими регуляторами воспаления суставов и разрушения хряща. Была использована модель культуры синовиоцитов для оценки синергетических взаимодействий между IL-1 и нецитокиновыми медиаторами воспаления, которые являются важными в модуляции деструкции суставной ткани, включая повреждение, которое имеет место, как последствие повреждения ткани во время артроскопической операции. Эксперименты проводили для изучения влияния агонистов сопряженных с G-белком рецепторов (GPCK) (гистамина, брадикинина и изопротеронола) на регуляцию продукции цитокинов и простаноидов в культивируемых человеческих синовиальных фибробластов и оценки активности кетопрофена в данной системе. Описана кинетика индукции простагландина Е2 (PGE2), интерлейкина-6 (IL-6) и интерлейкина-8 (IL-8) в ответ на стимуляцию интерлейкином-1. Изучалась способность GPCR-лигандов усиливать продукцию цитокинов после примирования IL-1.
В примерах 6-8 использовали следующие экспериментальные методы и материалы, если не указано иначе.
Культура клеток. Синовиальную ткань получали от пациентов с остеоартритом, подвергшихся операции по замещению сустава в клиническом исследовательском центре госпиталя MacNeal и транспортировали в лабораторию в модифицированной по способу Дульбекко среде Игла, содержащей пеницилин (100 единиц/мл), стрептомицин (100 мкг/мл) и фунгизон (0,25 мкг/мл). Синовиум иссекали и измельчали ножницами и помещали в виде эксплантатов в культуральную среду, состоящую из ДМЕМ, содержащую L-глутамин (2 мМ), инактивированную теплом фетальную бычью сыворотку (10% объем/объем) плюс антибиотики. Культуры содержали при 37°С во влажной атмосфере с 5% CO2. Слившиеся синовиальные клетки из эксплантатов росли в течение 2-3 недель и подвергались обработке трипсином. Посевные культуры подпитывали дважды в неделю и при слиянии пассажировали. Опыты проводили на клетках из пассажей 3-8. Экспериментальные культуры высевали на чашки диаметром 35 мм с плотностью 7,5×103 клеток/см2 в 2 мл культуральной среды. Культуры для опыта росли до тесного слияния и содержали 2,3±0,3×105 клеток (среднее значение ± стандартная средняя ошибка, n=3) и 104±13 мкг белка (n=10). Культуральную среду меняли дважды в неделю.
Экспериментальные обработки. За один день до начала экспериментальных обработок среду заменяли на экспериментальную культуральную среду, состоящую из ДМЕМ, включающую 2% инактивированной теплом фетальной бычьей сыворотки плюс L-глутамин и антибиотики, указанные выше, для получения клеток в состоянии покоя. На следующий день культуры примировали добавлением указанных концентраций IL-1 или дополнительных лигандов к кондиционированной культуральной среде на 12-24 ч, как указано. В некоторых опытах кондиционированную культуральную среду собирали для анализа после примирования IL-1. Острые экспериментальные примирования проводили после данного периода обработки следующим образом. Культуры удаляли из термостата, три раза промывали 2 мл порциями физиологического буфера Локке (состав LB в мМ: NaCl, 154; KCl, 2,6; КН2PO4, 2,25; К2HPO4, 0,85; MgCl2, 5; CaCl2, 2; D-глюкоза, 10; HEPES, 10; рН 7,4, BSA, 0,1% масса/объем) и затем уравновешивали дополнительным объемом LB, содержащим указанные лиганды, в течение 10 мин на бане при 37°С. Данный раствор удаляли аспирацией и заменяли порцией свежего буфера, содержащего указанные лиганды, в течение указанных периодов времени при 37°С. Фармакологические ингибиторы обычно добавляли в течение 10-минутного прединкубационного периода, и агонисты плюс указанные ингибиторы находились в течение 3-минутного периода стимуляции.
Определение простагландина Е2. После указанных обработок собирали аликвоты культурального супернатанта (1 мл) и быстро замораживали в жидком азоте. Пробы хранили при -80°С до обработки. Аликвоты культурального супернатанта анализировали радиоиммуноанализом с конкурентным связыванием, как указано изготовителем (Sigma Chemical Co.), с использованием антител с равной реакционной способностью по отношению к простагландинам Е2 и Е1. Для количественного анализа строили стандартную кривую для каждого теста с использованием постоянных концентраций [3H] простагландина Е2 и возрастающих концентраций аутентичного конкурирующего простагландина Е2.
Определение IL-6. Продукцию цитокина IL-6 также определяли в аликвотах супернатанта культуральной среды, который хранили замороженным при -80°С. IL-6 анализировали сэндвич-ELISA с детекцией по щелочной фосфатазе, как описано изготовителем (Pharmingen), и количественно определяли с использованием стандартных кривых, построенных с типичными чистыми рекомбинантными человеческими цитокинами. Экспериментальные определения проводили с двумя параллельными культурами.
Анализ включения [3H]тимидина и МТТ
Линии синовиоцитов обычно использовали для определения способности пролиферировать в ответ на IL-1, по включению [3H] тимидина (Kimball & Fisher, 1988). В данном препарате максимально эффективные концентрации IL-1 стимулировали включение [3H] тимидина в 10-20 раз сильнее по сравнению с культурами в состоянии покоя, поддерживаемыми в 2% сыворотке (данные не приводятся).
Анализ данных. Радиоиммуноанализ проводили с двумя параллельными аликвотами из каждой культуры. Экспериментальные определения ставили с двумя или тремя параллельными культурами. Каждый опыт повторяли по меньшей мере с двумя клеточными линиями. Построение нелинейной кривой регрессии и статический анализ проводили с использованием программы Graph-PAD Prism (San Diego, CA).
Материалы. Клеточная культура: культуральную среду для клеток получали от Sigma Gibco/BRL. Фетальную бычью сыворотку получали от Atlanta Biologicals Inc. (Norcross, GA). Препараты: рекомбинантный человеческий интерлейкин-1 получали от Genzyme (Cambrige, MA). Кетопрофен был получен от Omeros Medicak Systems, Inc. (Seattle, WA). Амитриптилин, форсколин, 5-гидрокситриптамин, изопротеренол, брадикинин, гистамин и простагландин Е2 были получены от Sigma. Меченые реактивы: [3H] простагландин Е2 получали от American Radiolabeled Chemicals, Inc. (St. Louis, МО). Все другие реагенты самой высокой степени чистоты получали от обычных коммерческих поставщиков.
Действие GPCK-агонистов, гистамина и брадикинина, на продукцию PGE2 в человеческих синовиоцитах определяли с и без предварительной стимуляции IL-1 для оценки функциональных взаимодействий между агонистами, опосредующими общее фармакологическое действие через их различные группы рецепторов. Воздействие IL-1 в течение ночи на культивируемые человеческие синовиальные фибробласты (10 Е/мл) приводило к замедленному (4 ч) и постоянному значительному увеличению продукции PGE2, которое можно определить радиоиммуноанализом в виде повышенного уровня PGE2 в культуральном супернатанте. Было показано, что прогрессивное увеличение продукции PGE2 во время длительной обработки IL-1 (16-24 ч) возникает в результате скооринированной повышенной экспрессии cPLA2 и COX-2 (Crofford, 1984, Hulkower et al., 1984). Культуры, которые были примированы IL-1 в течение ночи, давали реакцию на последующую стимуляцию максимально эффективными концентрациями гистамина (100 мкМ) или брадикинина (1 мкМ) дополнительной быстрой (в минутах) и сильной продукцией PGE2. Типичные данные по времени продукции PGE2 в ответ на стимуляцию гистамином или брадикинином представлены на фигуре 7. В данных условиях гистамин вызывал 5-10-кратное увеличение продукции PGE2 по сравнению с примированными IL-1 клетками без добавления агониста GPCR. Брадикинин показал 10-15-кратное увеличение. Абсолютное количество PGE2, продуцированное во время короткой 2-минутной стимуляции агонистом, приближается или превышает количества, которые кумулятивно продуцируются во время целого 18-часового периода примирования IL-1. Является удивительным, как показано на фигуре 7, что основной индуцируемый гистамином резкий подъем в продукции PGE2 происходит в первые 2 мин, поскольку в последующие 60 мин наблюдается минимальное дополнительное накопление. Стимулированный брадикинином ответ PGE2 продолжал увеличиваться (в 2 раза) в течение того же периода времени. При отсутствии примирования IL-1 не подвергнутые воздействию синовиоциты не показывали детектируемой продукции PGE2 в ответ на стимуляцию любым одним агонистом GPCR. В данных условиях примирования IL-1 оба, гистамин и брадикинин, синергетически усиливали высвобождение PGE2.
При использовании культивируемых синовиальных фибробластов от пациентов с остеоартритом заявители установили наличие зависимых от времени синергетических взаимодействий между провоспалительным цитокином, IL-1, и физиологически имеющими отношение сопряженными с G-белком рецепторами, в отношении продукции PGE2, и оценивали действие целевых терапевтических агентов. Агонисты GPCR, действующие через эндогенные рецепторы синовиоцитов, которые связаны с увеличением внутриклеточного кальция, инозитфосфатов и РКС путей передачи сигналов, быстро и наглядно повышают продукцию PGE2 в клетках, ранее примированных IL-1. Ингибиторы СОХ-2 эффективно ослабляли как индуцированный агонистом резкий подъем, так и длительное накопление PGE2. Таким образом, различные пути внутриклеточной передачи сигналов с участием GPCR и IL-1 синергетически взаимодействуют с получением или быстрой, или более медленной, длительной регуляции ответной реакции со стороны PGE2.
Синергизм между IL-1 и кальций-регуляторными GPCRs в синовиоцитах, который приводит к быстрому резкому подъему PGE2 отчасти можно объяснить быстрым усилением высвобождения арахидоновой кислоты, показателя активации cPLA2 во многих типах клеток. В дополнение к индуцированной экспрессии СОХ-2, IL-1 повышает экспрессию cPLA2 (Hulkower et al., 1994). Эти два белка действуют вместе с обеспечением свободного субстрата, арахидоновой кислоты, для СОХ-2. Следовательно, можно предположить, что положительная регуляция ключевых метаболизирующих эйкозаноиды ферментов, индуцируемая IL-1, в сочетании со способностью GPCR-лигандов активировать высвобождение арахидоната, будет увеличивать общий поток субстратов в синтезе простагландинов. cPLA2 является единственно известным PLA2, который проявляет функциональные свойства, указывающие на регуляцию рецепторов и, вероятно, он участвует в продукции эйкозаноидов и внутриклеточной передаче сигналов. Поскольку cPLA2 активируется для полной активности при увеличении концентраций кальция, и активация рецепторов брадикинина В2 и гистамина H1 сопряжена с мобилизацией внутриклеточного кальция, вероятно, это является основным фактором, регулирующим быстрый стимулированный агонистом резкий подъем продукции PGE2. Наконец, очень быстрое и кратковременное увеличение цитоплазматического кальция, "запущенное" активацией В2-или H1-рецепторов сходно с кинетикой, известной для активации cPLA2, высвобождения арахидоновой кислоты и наблюдаемого резкого подъема PGE2.
ПРИМЕР 7
ИНГИБИРОВАНИЕ РЕЗКОГО ПОДЪЕМА ОБРАЗОВАНИЯ PGE2 ПОД ДЕЙСТВИЕМ ИНГИБИТОРОВ ЦИКЛОКСИГЕНАЗЫ
Определяли действие кетопрофена, ингибитора циклооксигеназы, в отношении снижения образования PGE2 при совместной инкубации с IL-1 во время продолжительного воздействия (16 ч) и при короткой предварительной инкубации перед последующей стимуляцией агонистом GPCR, как показано на фигуре 8. Добавление указанных концентраций кетопрофена во время примирования IL-1 в течение ночи отменяло образование PGE2 со значением IC50=4,5±0,8 нМ, определенным нелинейным регрессионным анализом (среднее значение ± стандартная средняя ошибка, n=4 линии синовиоцитов). Подобные исследования (данные не представлены) были проведены с ингибиторами циклооксикиназы этодолаком (IC50=15, 2±4, 6 нМ, n=4), кеторолаком (2,2±0,4 нМ, n=4) и индометацином (3,2±1,5 нМ, n=2).
На фигуре 8 также показано зависимое от концентрации ингибирование индуцированного агонистом резкого подъема PGE2 в ответ на стимуляцию 100 мМ гистамина (IC50 3,4±0,2 нМ, n=3) или 1 мкМ брадикинина (IC50 9,5±2,0 нМ, n=3) в синовиоцитах, примированных в течение ночи IL-1 (10 Е/мл). Данные значения сравнимы с таковыми, установленными для ингибирования кетопрофеном IL-1-индукции в течение ночи PGE2. Данный результат показывает, что начало ингибирования под действием ингибитора СОХ происходит в течение 10 мин предварительной обработки перед добавлением агониста GPCR, что согласуется с прямым, обратимым ингибированием активности СОХ и не в результате механизма, связанного с изменениями в уровнях экспрессии регуляторных ферментов простаноидов. Данное мгновенное ингибирующее действие также обеспечивает основу для мгновенной эффективности данного препарата при местной доставке в сустав в орошающем растворе во время артроскопической операции.
ПРИМЕР 8
ИНДУКЦИЯ ПРОДУКЦИИ IL-6 ПОД ДЕЙСТВИЕМ АГОНИСТОВ IL-1 И GPCR
И ИНГИБИРОВАНИЕ КЕТОПРОФЕНОМ
Описана кинетика индукции интерлейкина-6 в ответ на стимуляцию IL-1. Культуры синовиоцитов подвергались указанным обработкам IL-1 плюс или гистамин для активации передачи сигналов через путь с участием инозиттрифосфата (InsP3)/протеинкиназы С, или изопротеренол для активации увеличения внутриклеточной сАМР. Продукцию PGE2, IL-6 и IL-8 определяли в культуральных супернатантах после 1-, 2-, 4-, 6-и 24-часовой обработки. В данном опыте каждую обработку проводили с отдельной культурой. При вышеуказанном режиме обработки продукция IL-6 резко увеличивалась под действием IL-1 после 24-часового воздействия, но IL-6 не обнаруживался в течение первых 6 ч. Продукция IL-6 в ответ на IL-1 не возрастала при последующем добавлении гистамина, и один гистамин не стимулировал продукцию IL-6. IL-1 также приводил к значительному возрастанию IL-8 (2000 пг/мл), который впервые обнаруживался через 6 ч обработки. Продукция IL-8 была постоянной и в значительной мере возрастала при 24-часовом воздействии IL-1.
Оценивали действие кетопрофена на индукцию продукции цитокинов под действием агонистов IL-1 и GPCR. Также определяли зависимое от концентрации действие IL-1 на индукцию IL-6 в состоянии покоя. Культуры синовиоцитов подвергались воздействию указанных концентраций агонистов IL-1 и GPCR. Собирали культуральные супернатанты и замещали порциями свежей среды, содержащей добавки тех же агонистов при 8-часовых периодах. Определяли PGE2, IL-6 и IL-8 в супернатантах, как описано.
Данные по продукции IL-6 представлены на фигуре 9, которая показывает продукцию IL-6 через 16 ч (соответствует периоду обработки от 8 до 16 ч) в присутствии указанных концентраций IL-1 плюс добавленный лиганд. Добавление гистамина или изопротеренола не увеличивает продукцию IL-6 по сравнению с одним IL-1. При концентрации IL-1 1,0 пг/мл кетопрофен вызывает частичное (≤50%) ингибирование индуцированной IL-1 продукции IL-6. Кроме того, кетопрофен ингибировал продукцию IL-6 в пробах совместно стимулированных гистамином или изопротеренолом/IL-l пробах.
Модель культуры синовиоцитов использовали для оценки синергетических взаимодействий между IL-1 и нецитокиновыми медиаторами воспаления, которые важны при модуляции деструкции суставной ткани, включая повреждение, которое имеет место, как последствие повреждения ткани во время артроскопической операции. Результаты можно суммировать следующим образом: (1) IL-1 индуцирует значительное возрастание PGE2, IL-6 и IL-8 в культивируемых синовиоцитах в то время, как культуры в состоянии покоя не продуцируют детектируемые количества данных медиаторов, (2) индукция PGE2 происходит наиболее быстро и приводит к высвобождению PGE2 в культуральный супернатант через 4 ч с последующим IL-8 через 6 ч и IL-6 через более длительные интервалы времени и (3) уровни всех трех медиаторов остаются повышенными в культуральных супернатантах после 24-часового воздействия IL-1.
В противоположность их действию на продукцию PGE2, агонисты GPCR не усиливали IL-1-индукцию IL-6 или IL-8 и также не увеличивали высвобождение IL-6 и IL-8 после примирование IL-1. Оказалось, что индукция IL-6 и IL-8 под действием IL-1 усиливается при сопутствующей индукции PGE2, поскольку кетопрофен снижает продукцию данных цитокинов в ответ на IL-1. Данный результат указывает, что кетопрофен может обеспечить терапевтический защитный для хряща эффект при доставке в сустав во время хирургических процедур.
Взятые вместе данные результаты показывают взаимодействие между специфическими путями передачи сигналов с участием G-сопряженных рецепторов и активацией синовиоцитов или провоспалительной стимуляции IL-1. Предполагается, что аналогичный механизм действует в хондроцитах. Данные взаимодействия обеспечивают способы интеграции и модуляции провоспалительных ответных реакций синовиоцитов и хондроцитов в зависимости от ввода других аутокоидных или рецепторных систем нейромедиаторов внутри сустава. Данные открытия подчеркивают рациональную основу и потенциальную клиническую пользу терапевтических вмешательств, которые направлены на ингибирование сопряженных с G-белком рецепторов, которые опосредуют передачу сигналов посредством мобилизации кальция, гидролиза фосфоинозитида и активации РКС, и они сопряжены с увеличением продукции PGE2 при артроскопической операции. Данные рецепторы на синовиоцитах и хондроцитах включают рецепторы гистамина H1, брадикинина, вещества Р, 5НТ2 и пуринергических Р2Y-рецепторов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ АННЕЛИРОВАННЫХ СОЕДИНЕНИЙ ПИРРОЛА ПРИ ЛЕЧЕНИИ ДЕГЕНЕРАЦИИ СУСТАВНОГО ХРЯЩА ИЛИ СТРУКТУРНЫХ ИЗМЕНЕНИЙ СУБХОНДРАЛЬНОЙ КОСТИ | 2002 |
|
RU2303447C2 |
| КОМПОЗИЦИЯ ДИЕТЫ ПРИ ОСТЕОАРТРИТЕ СОБАК | 2005 |
|
RU2351153C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ АРТРИТА | 2009 |
|
RU2563360C2 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ МЫШЬЯКА ДЛЯ ЛЕЧЕНИЯ ОТТОРЖЕНИЯ ТКАНИ ИЛИ ОРГАНА | 2013 |
|
RU2665362C2 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ МЫШЬЯКА ДЛЯ ЛЕЧЕНИЯ БОЛИ И ВОСПАЛЕНИЯ | 2008 |
|
RU2630574C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТАГОНИСТ P2X-РЕЦЕПТОРА И НЕСТЕРОИДНОЕ ПРОТИВОВОСПАЛИТЕЛЬНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2004 |
|
RU2338556C2 |
| ИНГИБИРУЮЩИЙ РАСТВОР И СПОСОБ ПОДАВЛЕНИЯ БОЛИ, ВОСПАЛЕНИЯ ИЛИ СПАЗМА | 1995 |
|
RU2180852C2 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА РАК ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ СУСТАВОВ | 2004 |
|
RU2360696C2 |
| МОДУЛЯЦИЯ ПУТЕЙ ОБМЕНА ПРОСТАГЛАНДИНА/ЦИКЛООКСИГЕНАЗЫ | 2007 |
|
RU2448712C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ПРОСТАГЛАНДИН Е2, И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2559525C2 |

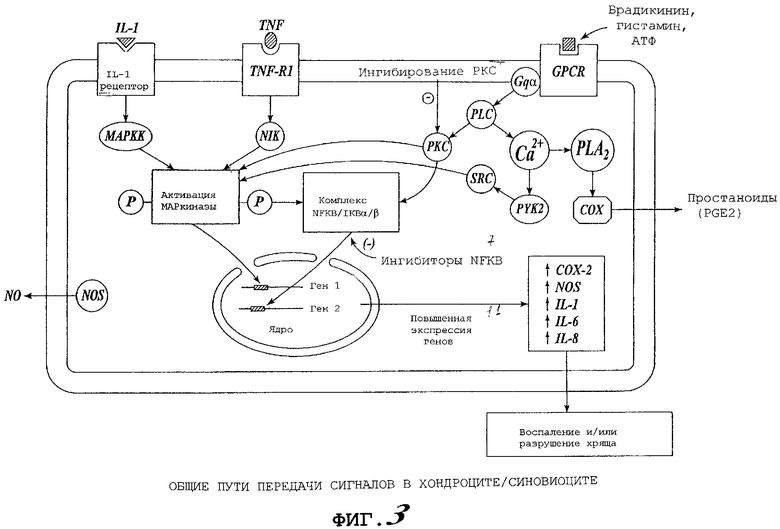

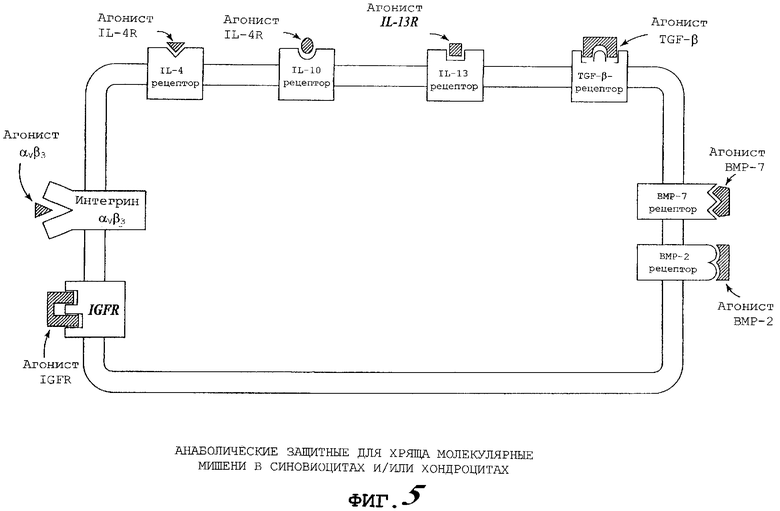




Изобретение относится к области медицины, в частности к лечебным растворам против воспаления, боли и разрушения хряща. Способы и растворы обеспечивает интеграцию и модуляцию противовоспалительных ответных реакций синовиоцитов и хондроцитов в зависимости от ввода аутокоидных или рецепторных систем нейромедиаторов внутри сустава. Для ингибирования разрушения хряща в сустав вводят растворы, включающие (а) терапевтически эффективное количество анаболического хондропротекторного агента, выбранного из группы, состоящей из агонистов интерлейкинов (IL), которые способствуют анаболическим процессам в хряще, членов надсемейства трансформирующего фактора роста-β, включая агонисты TGF-β и агонисты костных морфогенных белков, которые способствуют анаболическим процессам в хряще, инсулиноподобных факторов роста, которые способствуют анаболическим процессам в хряще, и факторов роста фибробластов, которые способствуют анаболическим процессам в хряще и (b) терапевтически эффективное количество ингибитора катаболизма хряща, выбранного из группы, состоящей из антагонистов IL-1-рецепторов, антагонистов TNF-α-рецепторов, специфических ингибиторов циклооксигеназы-2, ингибиторов синтазы окиси азота и ингибиторов ядерного фактора kB, ингибиторов матричных металлопротеиназ, молекул клеточной адгезии, включая агонисты интегринов и анатагонисты интегринов, антихемотаксических агентов, ингибиторов внутриклеточной передачи сигналов, включая ингибиторы протеинкиназы С и ингибиторы тирозиновых протеинкиназ, модуляторов внутриклеточных (белок-тиразин)-фосфатаз и ингибиторов SH2-доменов, которые ингибируют катаболизм хряща и раствор доставляют местно. 5 н. и 49 з.п. ф-лы, 30 табл., 9 ил.
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ КОЛЕННОГО СУСТАВА | 1997 |
|
RU2112495C1 |
| СПОСОБ АНАЛГЕЗИИ И СНЯТИЯ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ У ЧЕЛОВЕКА | 1994 |
|
RU2109293C1 |
| БОЛЕУТОЛЯЮЩАЯ КОМПОЗИЦИЯ И СПОСОБ ДОСТИЖЕНИЯ БОЛЕУТОЛЯЮЩЕГО ЭФФЕКТА У ЧЕЛОВЕКА | 1993 |
|
RU2125873C1 |
| WO 9926657 А, 03.06.1999 | |||
| БЕРТРАН Г | |||
| КАТЦУНГ Базисная и клиническая фармакология | |||
| Пер | |||
| с англ., М.-СПб Бином-Невский Диалект, 1998, т.1, с.22-25, 28-32, 43-45. | |||
Авторы
Даты
2006-03-20—Публикация
2000-07-21—Подача