Описание
Эта заявка заявляет на приоритет по отношению к предварительной заявке на патент США №60/107446, поданной 6 ноября 1998 г., которая в полном своем объеме включена здесь для сведения в виде библиографической ссылки.
1. Введение
Настоящее изобретение касается гена Nogo и, в частности, Nogo, т.е. кодируемых им продуктов, а также их производных и аналогов. Также представляется продуцирование белков Nogo, производных и антител. Далее настоящее изобретение касается терапевтических композиций и способов диагностики и терапии.
2. Предпосылки изобретения
В центральной нервной системе (ЦНС) высших позвоночных животных регенерация аксонов после повреждения практически отсутствует, а структурная пластичность ограничена. Важную роль предположительно играют ингибиторы роста, ассоциированные с миелином ЦНС. Это подтверждается моноклональным антителом (mAb) IN-1, которое нейтрализует миелиновый белок, обладающий мощной активностью по подавлению роста аксонов (нейритов), тем самым активируя регенерацию аксонов на значительном расстоянии и усиливая компенсаторную пластичность после повреждения спинного мозга или головного мозга у взрослых крыс.
Ряд наблюдений in vitro и in vivo открыл новый аспект регуляции роста нейритов, связанный с наличием отталкивающих и ингибиторных сигналов и факторов (Keynes & Cook, 1995, Curr. Opin. Neurosci., 5, 75-82). Большинство из этих сигналов, как представляется, являются белками или гликопротеинами. Первым прорывом к идентификации таких факторов была очистка и клонирование кДНК, производной от головного мозга домашней курицы молекулы, индуцирующей коллапс конуса нарастания, - коллапсина-1, в настоящее время называемого семафорином-3А.
Вторую группу недавно очищенных и клонированных стимуляторов отталкивания сейчас называют эфринами. Они являются лигандами семейства рецепторных тирозинкиназ Eph. Эфрин А5 и эфрин А2 экспрессируются как градиенты в оптической перемычке куриного эмбриона, а их эктопическая экспрессия или делеция обусловливает ошибки контроля во врастании аксонов сетчатки. Как и семафорины, семейство эфринов включает 15-20 членов, каждый из которых характеризуется комплексной динамической экспрессией в нервной системе и за ее пределами. Функции большинства из этих молекул еще предстоит исследовать.
Третья группа контрольных факторов, которые могут отталкивать растущие аксоны и экспрессированы в развивающейся нервной системе, представлена нетринами. Нетрин был очищен в виде производного от вентральной нервной пластинки хемоаттрактанта спаечных аксонов в зачаточном спинном мозге наподобие ортологичного белка unc-6 у C.elegans. Оказалось, что нетрин-1 обладает эффектом отталкивания в отношении некоторых типов нейронов, что зависит от типа рецептора, присутствующего в конусах нарастания нейронов-мишеней (Tessier-Lavigne et al., 1996, Science, 274, 1123-1133).
Ранее было сообщено (Canoni & Schwab, 1988, J. Cell Biol., 106, 1281-1288) о связи мощной активности по подавлению роста нейритов с олигодендроцитами и миелином взрослой ЦНС. Основным компонентом является высокомолекулярный мембранный белок (NI-250 с меньшим компонентом NI-35 у крысы), который недавно был очищен и который связан с объектом настоящего изобретения, а также связывается с нейтрализующим моноклональным антителом IN-1 (Canoni & Schwab, 1988, J. Cell Biol., 106, 1281-1288; патенты США №№5684133, 5250414, международная патентная заявка WO 93/00427).
Связанные с миелином ингибиторы роста нейритов играют ключевую роль в предотвращении регенерации поврежденных аксонов в ЦНС. Когда у курицы или крыс заблокированы развитие олигодендроцитов и образование миелина, пермиссивный регенерационный период после повреждений ЦНС удлиняется. Действительно, образование миелина совпадает во времени с окончанием периода развития, когда ЦНС проявляет высокую структурную пластичность и высокий потенциал по регенерации.
По-видимому, NI-250 и NI-35 являются основными компонентами связанного с миелином подавления роста, что подтверждается применением in vivo IN-1 к повреждениям спинного мозга у взрослых крыс, которое индуцирует регенерацию корково-спинно-мозговых аксонов на значительном расстоянии и обеспечивает двигательное и поведенческое функциональное восстановление, особенно по двигательной активности. Сходные эксперименты на зрительном нерве и холинэргическом септогиппокампальном пути также продемонстрировали преобладание in vivo антигена, распознаваемого антителом IN-1 - NI-35/250 (Schnell & Schwab, 1990, Nature, 343, 269-272; Bregman et al., 1995, Nature, 378, 498-501).
Неповрежденные волокнистые структуры также реагируют на нейтрализацию ингибиторов роста нейритов под действием IN-1. Недавно проведенные эксперименты окончательно показали, что после направленного повреждения корково-спинно-мозгового пучка (пирамидотомия) неповрежденные волокна в присутствие IN-1 разрастаются с ветвлениями вокруг оси спинного мозга и ствола головного мозга и воссоздают двусторонний параметр иннервации, что сопровождается практически полным восстановлением поведенческих реакций по точности движений (Z'Graggen et al., 1998, J. Neuroscience, 18 [12], 4744-4757).
Выделение гена, который кодирует белок-ингибитор роста нейритов, предоставляет множество возможностей для разработки продуктов, применимых для регенерации нейронов и в лечении различных нейрологических заболеваний, включая опухоли ЦНС.
Цитировавшиеся выше библиографические ссылки не призваны признать такие библиографические ссылки как являющиеся прототипом для настоящего изобретения.
3. Краткое содержание изобретения
Настоящее изобретение касается нуклеотидных последовательностей генов Nogo (Nogo человека, крысы и быка, а также гомологов Nogo других видов) и аминокислотных последовательностей кодируемых ими белков, а также их производных (например, фрагментов) и аналогов. Также предусматриваются нуклеиновые кислоты, гибридизующие с указанными выше нуклеотидными последовательностями или комплементарные им. В конкретном варианте белок Nogo является белком крысы, быка или человека.
Также настоящее изобретение касается способа идентификации генов, которые взаимодействуют с Nogo.
Nogo является представляемым настоящим изобретением геном, идентифицированным с помощью способа по настоящему изобретению, который и кодирует белки-регуляторы роста нейронов, и взаимодействует с ними.
Также изобретение касается производных и аналогов Nogo по настоящему изобретению, которые являются функционально активными, т.е. они способы проявлять одну или большее число известных функциональных активностей, ассоциированных с нативным белком Nogo. Например, был идентифицирован основной ингибиторный сегмент на участке аминокислот 542-722. Такие функциональные активности включают, тем самым не исчерпываясь, подавление роста нейритов у нервных клеток, распределения и миграции фибробластов или любых клеток, проявляющих новообразовательный рост, способность взаимодействовать или конкурировать за взаимодействие с регуляторными белками роста нейронов, антигенность, проявляющуюся как способность связываться (или конкурировать с Nogo за связывание) со специфичным для Nogo антителом, иммуногенность, проявляющуюся как способность образовывать антитела, которые связываются с Nogo. Эти антитела обладают потенциалом по индукции разрастания нейритов или предотвращению коллапса конуса нарастания заднекорешковых ганглиев за счет подавления функции Nogo, функциональных фрагментов или производных Nogo, способных подавлять разрастание нейритов.
Далее настоящее изобретение касается фрагментов (и их производных и аналогов) Nogo, которые включают один или несколько доменов белка Nogo, таких как кислый богатый пролином N-концевой сегмент (например, аминокислоты 31-58 из SEQ ID NO 2), высококонсервативный С-концевой сегмент и два гидрофобных мотива из 35 и 36 аминокислот в длину в составе Nogo крысы также в пределах С-концевого участка (например, аминокислоты 988-1023 и 1090-1125 из SEQ ID NO 2).
Дополнительно представляются антитела, специфичные по отношению к различным Nogo и производным и аналогам Nogo. В частности, как пример, были получены два антитела: первое антитело, обозначенное AS472, было получено при использовании в качестве иммуногена синтетического пептида, соответствующего аминокислотам 623-640 из SEQ ID NO 2, а второе антитело, обозначенное AS-Bruna, было получено в отношении С-концевого сегмента - аминокислоты 762-1163 из SEQ ID NO 2 - в составе Nogo.
Также представляются способы получения белков Nogo, их производных и аналогов, например, с помощью рекомбинантных технологий.
Настоящее изобретение также касается терапевтических и диагностических способов и композиций, основывающихся на белках и нуклеиновых кислотах Nogo. Терапевтические соединения по настоящему изобретению включают, тем самым не ограничиваясь, белки Nogo и их аналоги и производные (включая фрагменты); антитела к ним; нуклеиновые кислоты, кодирующие белки Nogo, их аналоги или производные; и рибозимы Nogo или антисмысловые нуклеиновые кислоты Nogo.
Также настоящее изобретение касается терапевтических и диагностических способов и композиций, основывающихся на белках и нуклеиновых кислотах Nogo и анти-Nogo антителах.
Настоящее изобретение представляет лечение ЦНС и опухолей нервной ткани путем введения соединений, которые запускают активность Nogo (например, белки Nogo и их функционально активные аналоги и производные, включая их фрагменты; нуклеиновые кислоты, кодирующие белки Nogo, аналоги или производные, агонисты Nogo).
Также настоящее изобретение представляет лечение заболеваний, расстройств и повреждений, которые в конечном счете проявляются в повреждении нервной системы; такими заболеваниями, расстройствами или повреждениями являются, тем самым не ограничиваясь, травма центральной нервной системы (ЦНС) (например, раны спинного мозга или головного мозга), инфаркт, инфекция, злокачественная опухоль, воздействие токсикантов, дефицит питания, паранеопластические синдромы и нейродегенеративные заболевания (включая, но тем самым не исчерпываясь, болезнь Альцгеймера, болезнь Паркинсона, хорею Гентингтона, рассеянный склероз, боковой амиотрофический склероз и прогрессирующий надъядерный паралич); путем введения соединений, которые блокируют активность Nogo (например, доминантно-негативного производного Nogo; антитела к Nogo; антисмысловых нуклеиновых кислот Nogo; рибозимов Nogo или химических групп, которые связываются в активном сайте Nogo).
Также настоящим изобретение представляются животные модели, диагностические способы и способы скрининга предрасположенности к заболеваниям, а также способы идентификации и оценки агонистов и антагонистов Nogo.
3.1. Определения
По использованию в данном тексте подчеркивание или набор курсивом названия гена должен указывать на ген в противоположность кодируемому им белковому продукту, который обозначается по имени гена в отсутствие подчеркивания или курсива. Например, «Nogo» должно обозначать ген Nogo в то время, как «Nogo» должно обозначать белковый продукт гена Nogo.
4. Описание фигур
Фигура 1a-1b. (а) Клоны кДНК Nogo: CWP1-3 является клоном кДНК быка, выделенным в ходе скрининга библиотеки кДНК белого вещества спинного мозга быка с использованием вырожденных олигонуклеотидов MSC5-8 (объединенные) и MSC9. Комплементарную РНК, производную от этого клона, использовали для последующего скрининга библиотеки кДНК крысы. Оli3 и Оli18 выделяют из праймированной олиго-дТ библиотеки олигодендроцитов крысы. R1-3U21, RO18U1 и RO18U37-3 выделяют из праймированной гексануклеотидами библиотеки спинного мозга/ствола головного мозга крысы (Stratagene). Положения шести аминокислотных последовательностей NI220 быка (bNI220) показаны на CWP1-3 и R13U21. Поверху каждого клона помечены последовательности сочленений различных экзонов. Пометки вопросительным знаком, указанные на RO18U1, идентифицируют последовательность в данном клоне, которая не соответствует последовательностям любых других клонов Nogo. RO18U37-3 был секвенирован только по его 5'-концу, и несеквенированный сегмент представлен точками. (b) Схематическое изображение гипотетического механизма образования трех транскриптов Nogo. Р1 и Р2 представляют предполагаемую локализацию альтернативных промоторов. Минимум три экзона необходимо для образования трех транскриптов, как это схематически показано, хотя каждый экзон потенциально может быть подразделен на несколько экзонов.
Фигура 2а-2b. (а) Нуклеотидная (SEQ ID NO 1) и аминокислотная (SEQ ID NO 2) последовательности транскрипта А Nogo (последовательность, сформированная путем сочетания последовательностей кДНК RO18U37-3, Оli18 и R1-3U21). Овал - предполагаемый старт-кодон; подчеркнуто точками - кислый мотив;  - потенциальные РКС-сайты; Δ - потенциальные сайты казеинкиназы-II; толстое подчеркивание - С-концевые гидрофобные сегменты и вероятные трансмембранные домены; тонкое подчеркивание - сайты потенциального N-гликозилирования. (b) Сравнение аминокислотных последовательностей между секвенированными очищенной NI220 быка (bNI220: SEQ ID NO 3-8) и соответствующими последовательностями быка (SEQ ID NO 9-14) и крысы (SEQ ID NO 15-20), транслированными с кДНК крысы и быка. Аминокислотные последовательности крысы и быка, которые не совпадают с аминокислотными последовательностями bNI200, показаны строчными символами.
- потенциальные РКС-сайты; Δ - потенциальные сайты казеинкиназы-II; толстое подчеркивание - С-концевые гидрофобные сегменты и вероятные трансмембранные домены; тонкое подчеркивание - сайты потенциального N-гликозилирования. (b) Сравнение аминокислотных последовательностей между секвенированными очищенной NI220 быка (bNI220: SEQ ID NO 3-8) и соответствующими последовательностями быка (SEQ ID NO 9-14) и крысы (SEQ ID NO 15-20), транслированными с кДНК крысы и быка. Аминокислотные последовательности крысы и быка, которые не совпадают с аминокислотными последовательностями bNI200, показаны строчными символами.
Фигура 3а-3b. (а) Сравнение аминокислотных последовательностей С-концевых 180 аминокислот в общих участках NSP (человек; SEQ ID NO 21), S-REX (крыса) (SEQ ID NO 22), CHS-REX (курица; SEQ ID NO 23), NOGOBOV (бык; SEQ ID NO 24), NOGORAT (крыса; SEQ ID NO 25), клон EST C.elegans (W06A7A; SEQ ID NO 26) и клон EST D.melanogaster (US51048; SEQ ID NO 27). (b) Эволюционный консерватизм двух гидрофобных сегментов. Показан процент сходства в пределах и между видами по общим гидрофобным сегментам. Затененные символы - консервативные аминокислоты.
Фигура 4а-4с. (а) Гибридизация по методу Нозерн-блоттинга различных тканей с общим Nogo-зондом. Общий зонд включает последовательность транскрипта А между нуклеотидами 2583-4678. ON - зрительный нерв; SC - спинной мозг; С - корковая область спинного мозга; DRG - заднекорешковые ганглии; SN - седалищный нерв; РС12 - клеточная линия РС12. (b) Гибридизация по методу Нозерн-блоттинга РНК спинного мозга и клеток РС12 с зондом, специфичным для 1-го экзона (левый рисунок), и РНК заднего мозга (НВ) и скелетных мышц (М) с зондом, специфичным для 2-го экзона (правый рисунок). (c) Гибридизация по методу Нозерн-блоттинга с общим Nogo-зондом. К - почки; В - хрящ (из грудины); Sk - кожа; М - скелетные мышцы; Lu - легкие; Li - печень; Sp - селезенка. Помечены три основных транскрипта (4,6 тысячи пар нуклеотидов (т.п.н.), 2,6 т.п.н. и 1,7 т.п.н.). Δ - диффузный, но отчетливый бэнд, примерно соответствующий размеру 1,3 т.п.н.
Фигура 5a-5f. Гибридизация in situ срезов спинного мозга и мозжечка взрослых крыс. (a, d) Ряды олигодендроцитов (OL) в белом веществе спинного мозга и мозжечка, соответственно, можно видеть благодаря мечению антисмысловым «общим» рибозондом Nogo. Это очень напоминает сигналы, выявленные в случае, когда последовательные срезы спинного мозга гибридизовали с антисмысловым «плоп-рибозондом» (b). (с) Нейроны серого вещества (GM) также помечают с помощью антисмыслового «общего» рибозонда Nogo. WM - белое вещество. Светлопольное и флуоресцентное изображение соответственно срезов мозжечка, дважды помеченных антисмысловым «общим» рибозондом Nogo (е) и анти-GFAP антителом (f). Клетки Пуркинье (двойные стрелки) интенсивно метятся Nogo-зондом, в то время как астроциты (короткие стрелки, черно-белые) негативны. Небольшое число клеток в гранулярном клеточном слое (Gr) также метятся Nogo-зондом; m - молекулярный слой. Масштабная линейка: а, b, d-f - 50 p.m; с - 280 p.m.
Фигура 6a-6i. Гибридизация in situ зрительных нервов в различные дни после рождения (а, f - Р0; b, g - Р3; с, h - Р7; d, е, i - Р22) с зондами Nogo либо plp (антисмысловыми или смысловыми). (a-d) антисмысловой Nogo-зонд; (е) смысловой Nogo-зонд; (g-i) антисмысловой зонд plp; (f) смысловой зонд plp. Экспрессия Nogo в предшественниках олигодендроцитов может быть выявлена уже в Р0, в то время как экспрессия plp становится выявляемой только в Р3 в зрительных нервах рядом с нервным перекрестом (g).
Фигура 7. Как AS-Bruna, так и AS472 распознают миелиновый белок с молекулярной массой примерно 200 кД. Экстракт миелина крысы и q-pool быка приготавливали в соответствии с Spillmann et al., 1998, J. Biol. Chem., 273 (30), 19283-19293. И AS-Bruna, и AS472 распознают бэнд 200-кД, равно как и меньшие бэнды в бычьем миелине, которые могут быть продуктами распада bNI200. AS-Bruna окрашивала бэнд 200-кД в крысином миелине. I - AS-Bruna; Р - AS-Bruna, преиммунная сыворотка; Е - аффинно очищенная AS472.
Фигура 8a-8i. Иммуногистохимия спинного мозга и мозжечка крысы с использованием IN-1 (а-е), AS-Bruna (d-f) и AS472 (g-i), что показано на левой части каждого рисунка. Интенсивное окрашивание миелина было отмечено в обеих тканях со всеми тремя антителами, если замороженные срезы фиксировали в этанолуксусной кислоте (a, b, d, e, g, h). Обработка срезов метанолом удаляла окрашивание миелина за исключением тел олигодендроцитов (стрелки: с, f, i). Короткие стрелки - клетки Пуркинье; WM - белое вещество; GM - серое вещество; DR - задний корешок спинного мозга; Gr - слой гранулярных клеток; m - молекулярный слой. Масштабная линейка: а, d, g - 415 мкм; b, с, e, f, h, i - 143 мкм.
Фигура 9a-9d. Нейтрализующая активность AS472 и AS-Bruna в различных биотестах. (а) Фибробласты NIH-3T3 высевали на чашки для культивирования клеток, покрытые q-pool и предварительно обработанные IN-1, AS-Bruna, AS472 или соответствующими преиммунными сыворотками. Обе поликлональные сыворотки показали даже немного лучшую нейтрализацию ингибиторного субстрата по сравнению с IN-1. Преиммунные сыворотки не проявляли существенного эффекта в отношении распределения клеток NIH-3T3. Добавление избытка пептида (Р472), который был использован для формирования AS472, конкурировало с нейтрализующей активностью, в то время как неспецифический пептид (Рх) влияния не оказывал. (b) Предобработка ингибиторного субстрата AS-Bruna или AS472 обусловливала разрастание нейритов в DRG по сравнению с тем, что можно наблюдать на субстрате ламинина. Примеры разрастания нейритов в DRG на q-pool с предобработкой ФСБ (с; оценка = 0) и предобработка AS-Bruna (d; оценка = 4).
Фигура 10а-10d. Инъекция эксплантатов зрительного нерва AS472 обусловливает врастание аксонов. (а) Пары зрительных нервов взрослых крыс вычленяли, инъецировали AS472 или преиммунной сывороткой и помещали в культуральные камеры так, чтобы один конец нерва находился в контакте с диссоциированными нейронами DRG крысы Р0. (b) Через две недели in vitro ЭМ-срезы нервов были взяты в 3,5 мм от участка разреза (стрелки в А) и подвергнуты общему скринингу на интактные аксоны (3 эксперимента). (с) Регенерированные аксонные пучки (стрелки) растут через дегенеративный зрительный нерв, инъецированный AS472. (d) Регенерирующие аксоны в контакте с миелином. Увеличение: с - 12000×; d - 35000×.
Фигура 11a-11c. Экспрессия рекомбинантного Nogo-A в трансфицированных клетках COS. (а) Вестерн-блот, показывающий иммунореактивность AS-Bruna в отношении рекомбинантного Nogo-А (дорожка 2) и эндогенного Nogo-A из первичной культуры крысиных олигодендроцитов (дорожка 3). Подвижности этих двух белков по существу идентичны на уровне примерно 200 кД в 5%-ном денатурирующем ДСН-геле. Образец, трансфицированный контрольной конструкцией с lacZ (дорожка 1), показал отсутствие иммунореактивности в отношении AS-Bruna. Тот же блот также был зондирован антителом 9Е10, специфичным в отношении myc, как это показано. Бэнд, реагировавший с AS-Bruna, также реагировал с анти-myc антителом-меткой 9Е10 (дорожка 5), в то время как эндогенный Nogo-A - нет (дорожка 6). Образец с контрольной трансфекцией lacZ показал ожидаемый бэнд на уровне примерно 118 кД (дорожка 4). Клетки COS, трансфицированные по непостоянному типу конструкцией Nogo-A, окрашивали дважды AS-Bruna (b) и IN-1 (с). Клетки, позитивные по окрашиванию AS-Bruna, были также позитивными по окрашиванию IN-1.
Фигура 12. Нуклеотидная последовательность (SEQ ID NO 28) кДНК Nogo быка.
Фигура 13. Аминокислотная последовательность Nogo-A крысы (SEQ ID NO 2), сопоставленная с теоретической аминокислотной последовательностью Nogo человека (SEQ ID NO 30). Аминокислотная последовательность Nogo человека является производной от сопоставления экспрессируемых маркерных последовательностей (EST-маркеров) с последовательностью Nogo крысы и от транслирования сопоставленных EST-маркеров человека с использованием Nogo крысы в качестве направляющей матрицы.
Фигура 14. Последовательность нуклеиновой кислоты Nogo-C крысы (SEQ ID NO 31) и соответствующая открытая рамка считывания.
Фигура 15а-15е. Nogo-A находится на плазматической мембране олигодендроцитов, на что указывают данные иммуноцитохимического анализа и биотинилирования клеточной поверхности олигодендроцитов, находящихся в культуре.
Иммуноцитохимический анализ (a-d). Олигодендроциты зрительного нерва крыс Р10 диссоциировали и культивировали в течение 2 дней. Прижизненное окрашивание клеток моно-клональным антителом IN-1 (а) или AS472 (с) показало иммунореактивность тел и отростков олигодендроцитов. В присутствие конкурентного пептида Р472 AS472 показало только фоновое мечение (во всех клеточных типах) (d). Сходное неспецифическое окрашивание было выявлено в случае, когда не были использованы первичные антитела (b). Оценка: пронумерованные шифром чашки перемешивали случайным образом и классифицировали с участием трех независимых наблюдателей. 8 из 10 чашек были верно определены как AS472-позитивные, позитивные по mAb IN-1 или контрольные, всеми тремя наблюдателями.
Биотинилирование (е). Культуры цельного головного мозга крыс Р4, обогащенные олигодендроцитами, биотинилировали по клеточной поверхности с помощью не проникающего через мембраны агента через 7 дней культивирования. После этого клеточные гомогенаты обрабатывали шариками Dynabead со стрептавидином. Преципитат (Ppt) и надосадочный слой (sup) проявляли с AS472: они продемонстрировали разные белковые параметры - обнаруженный в преципитате поверхностно-клеточный Nogo-A показал наивысшую выявленную молекулярную массу по сравнению со внутриклеточным Nogo-A. Этот сдвиг, по-видимому, обусловлен гликозилированием. Белок BiP просвета эндо-плазматического ретикулюма (ER) и подавляющее количество β-тубулина можно обнаружить только во внутриклеточной фракции.
Фигура 16a-16j. Функциональные тесты показывают присутствие Nogo-A на клеточной мембране олигодендроцитов. Преинкубация культур зрительного нерва с AS472 (а, b) позволила фибробластам NIH-3T3 распределяться по интенсивно ветвящимся олигодендроцитам, которые выделены с помощью иммунофлуоресцентного окрашивания на GalC (антитело 01) (а). Стрелки на соответствующем фазово-контрастном изображении (b) указывают на распределение фибробластов NIH-3T3 по поверхности олигодендроцитов. (с, d). Когда AS472 добавляли вместе с Р472, фибробласты NIH-3T3 четко избегали участков GalC-позитивных олигодендроцитов (короткие стрелки) (Caroni & Schwab, 1988, Neuron, 1, 85-96). (e, f). В присутствие AS472 диссоциированные нейроны DRG крыс Р0 были способны распространять свои нейриты через участок интенсивно ветвящихся олигодендроцитов (стрелки на f). (g, h). Пептид Р472 эффективно конкурировал с нейтрализующей активностью AS472: нейриты полностью уклонялись от олигодендроцитов. Использованная в этих экспериментах AS472 была получена к пептидной последовательности 472 крысы. (i, j). Количественный анализ этих результатов (что описано в разделе о методах) показал наличие мощной нейтрализующей активности AS472 в обоих тестах. Масштабная линейка - 40 мкм.
Фигура 17а-17е. Рекомбинантный Nogo-A является ингибиторным субстратом, и его ингибиторная активность нейтрализуется действием mAb IN-1. Обогащенные рекомбинантным Nogo-A экстракты стабильной клеточной линии CHO-Nogo-A или β-галактозидазу, выделенную из параллельной стабильной клеточной линии CHO-LacZ, использовали для покрытия в тестах на распределение фибробластов NIH-3T3 и разрастание нейритов DRG. (а) Окрашенный серебром гель с myc-his-химеризованными recLacZ (1-я дорожка) и recNogo-A (2-я дорожка) показывает наличие бэнда Nogo-A с молекулярной массой 180 кД. Идентичность бэнда Nogo-A была подтверждена с помощью Вестерн-блота, проинкубированного с AS-Bruna (3-я дорожка) и анти-myc антителом 9Е10 (4-я дорожка). (b) Чашки, покрытые RecNogo-A, обладали отчетливой ингибиторной активностью в отношении распределения клеток NIH-3T3. Преинкубация с mAb IN-1 или AS-Bruna обусловливала высокодостоверную (Р<0,01) нейтрализацию ингибиторной активности. Контрольные IgMmAb O1 и преиммунная сыворотка были неэффективными. Экстракт клеток CHO-LacZ обладал частичным ингибиторным эффектом в отношении клеток NIH-3T3, что, по-видимому, обусловливается эндогенными белками СНО. На эту ингибиторную активность не влияла преинкубация с антителами.
(с). В тестах на разрастание нейритов DRG те же белки, что и в (b), были смешаны с ламинином и использованы для покрытия. RecNogo-A обладал очень мощным ингибиторным действием на разрастание нейритов в диссоциированных DRG при зависимости от дозы. Эта активность нейтрализовывалась действием mAb IN-1 (P<0,001), но не контрольным mAb O1. Белковый материал, выделенный из клеток CHO-LacZ не был ингибиторным при любых использовавшихся концентрациях, равно как не было какого-либо влияния инкубации с антителами на разрастание нейритов. Примеры оценок показаны в (d): 1 мкг recNogo-A, оценка отсутствия или коротких нейритов (стрелки) - 2; и в (е): 1 мкг CHO-LaZ, оценка длинных разветвленных нейритов (короткие стрелки) - 5-6. Статистический анализ был проведен с помощью двустороннего критерия Стьюдента. Масштабная линейка - 280 мкм.
Фигура 18. Функциональный анализ делеционных мутантов Nogo. Следующие делеционные конструкции, кодирующие химерные белки, включающие фрагменты Nogo или укороченные участки Nogo (что перечислено далее), были сформированы в соответствии с описанным здесь далее в разделе 6.2.7.
Nogo-A: His-tag/T7-tag/вектор/Nogo-A, аминокислоты 1-1162
Nogo-B: His-tag/T7-tag/вектор/Nogo-A, аминокислоты 1-171+
975-1162
Nogo-C: His-tag/T7-tag/Nogo-C, N-конец (11 аминокислот) + Nogo-A, аминокислоты 975-1162
NiAext: His-tag/T7-tag/вектор/Nogo-A, аминокислоты 1-974/T7-tag
NiR: His-tag/T7-tag/вектор/Nogo-A, аминокислоты 1-171/вектор
NiG: His-tag/T7-tag/Nogo-A, аминокислоты 172-974/His-tag
EST: His-tag/T7-tag/Nogo-A, аминокислоты 760-1162
Nig-D1: His-tag/T7-tag/Nogo-A, аминокислоты 172-908/вектор
HiG-D2: His-tag/T7-tag/Nogo-A, аминокислоты 172-866/His-tag
NiG-D3: His-tag/T7-tag/Nogo-A, аминокислоты 172-723/His-tag
NiG-D4: His-tag/T7-tag/Nogo-A, аминокислоты 172-646/вектор
NiG-D5: His-tag/T7-tag/Nogo-A, аминокислоты 291-646/His-tag
NiG-D7: His-tag/T7-tag/Nogo-A, аминокислоты 172-234+292-974/His-tag
NiG-D8: His-tag/T7-tag/Nogo-A, аминокислоты 172-628
NiG-D9: His-tag/T7-tag/Nogo-A, аминокислоты 172-259+646-974/His-tag
NiG-D10: His-tag/T7-tag/Nogo-A, аминокислоты 291-974/His-tag
NiG-D14: His-tag/T7-tag/Nogo-A, аминокислоты 172-259
NiG-D15: His-tag/T7-tag/Nogo-A, аминокислоты 172-189+491-974/His-tag
NiG-D16: His-tag/T7-tag/Nogo-A, аминокислоты 172-189+619-974/His-tag
NiG-D17: His-tag/T7-tag/Nogo-A, аминокислоты 172-189+257-974/His-tag
NiG-D18: His-tag/T7-tag/Nogo-A, аминокислоты 172-189+261-974/His-tag
NiG-D20: His-tag/T7-tag/Nogo-A, аминокислоты 542-722/His-tag
Номера аминокислот основываются на нумерации аминокислотной последовательности Nogo-A крысы (SEQ ID NO 2), начиная от первого метионина. Метки His-tag и T7-tag состоят из 34 аминокислот. Последовательности N- и С-концевых векторов происходят от экспрессирующего вектора рЕТ28.
5. Подробное описание изобретения
Настоящее изобретение касается нуклеотидных последовательностей генов Nogo и аминокислотных последовательностей кодируемых ими белков. Далее настоящее изобретение касается фрагментов и других производных и аналогов белков Nogo. Нуклеиновые кислоты, кодирующие такие фрагменты или производные, также попадают в объем настоящего изобретения. Изобретение представляет гены Nogo и кодируемые ими белки от многих разных видов. Гены Nogo по настоящему изобретению включают гены Nogo человека, крысы и быка и родственные гены (гомологи) других видов. Субпоследовательности быка, описанные у Spillman et al., 1998, J. Biol. Chem., 273, 19283-19293, не заявляются как часть настоящего изобретения. В конкретных вариантах гены Nogo и белки происходят от позвоночных животных, а более конкретно - от млекопитающих. В предпочтительном варианте настоящего изобретения гены Nogo и белки происходят от человека. Представляется выработка названных выше белков и производных, например, с помощью рекомбинантных способов.
Представляемый настоящим изобретением ген Nogo охватывает молекулы нуклеиновых кислот, кодирующие три изоформы Nogo: а именно Nogo-A, Nogo-B и Nogo-C. Обозначение гена «Nogo» должно включить молекулы нуклеиновых кислот, кодирующие все три изоформы, если это специально не оговаривается. Подобным образом белок Nogo должен включать все три изоформы Nogo, если это специально не оговаривается. Белки Nogo по настоящему изобретению могут предотвращать регенерацию нейронов в спинном мозге или головном мозге (т.е. свойства непермиссивного субстрата), ингибировать разрастание аксонов в заднекорешковых ганглиях, индуцировать коллапс конуса нарастания заднекорешковых ганглиев, блокировать распределение клеток NIH-3T3, блокировать разрастание нейритов РС12 и т.п.
Белки Nogo, их фрагменты и производные свободны от всякого другого миелинового материала центральной нервной системы: в частности, они свободны от всякого другого миелинового материала в центральной нервной системе, с которым в нативных условиях белок Nogo ассоциирован. Такой материал может включать другие белки, липиды и углеводы миелина ЦНС. Белки Nogo, их фрагменты и производные по настоящему изобретению также предпочтительно свободны от реагентов, использованных для очистки из биологических образцов, таких как детергенты.
В конкретном варианте настоящее изобретение представляет рекомбинантные белки Nogo, их фрагменты и производные как полученные с помощью методов, известных в данной области техники, таких как экспрессия гена Nogo в генетически сконструированной клетке.
Также настоящее изобретение касается производных и аналогов Nogo по настоящему изобретению, которые функционально активны, т.е. они способны проявлять одну или большее число функциональных активностей, характерных для полноразмерного белка Nogo (дикого типа). Такие функциональные активности включают, тем самым не ограничиваясь, способность взаимодействовать (или конкурировать за связывание) с белками-регуляторами роста нервов, антигенность [способность связываться (или конкурировать с Nogo за связывание) с анти-Nogo антителом], иммуногенность (способность генерировать антитело, которое связывается с Nogo), предотвращение регенерации нейронов в спинном мозге или головном мозге, передачу субстрату свойства ограничения роста, распределения и миграции нервных клеток и клеток новообразований, подавление разрастания нейритов у заднекорешковых ганглиев, индукцию коллапса конуса нарастания в заднекорешковых ганглиях, блокировку распределения клеток NIH-3T3 in vitro, блокировку разрастания нейритов РС12, ограничение нейропластичности и т.п.
Далее настоящее изобретение касается фрагментов (и их производных и аналогов) Nogo, которые включают один или большее число доменов белка Nogo.
Кроме того, представляются антитела к Nogo, их производные и аналоги.
Также настоящее изобретение касается терапевтических и диагностических способов и композиций, базирующихся на белках и нуклеиновых кислотах Nogo и анти-Nogo антителах. Настоящее изобретение представляет лечение расстройств регуляции роста клеток или органов путем введения соединений, которые запускают активность Nogo (например, белки Nogo и их функционально активные аналоги и производные (включая фрагменты); нуклеиновые кислоты, кодирующие белки Nogo, аналоги или производные, агонисты Nogo).
Настоящее изобретение также представляет способы лечения повреждения или расстройства нервной системы путем введения соединений, которые являются антагонистами или подавляют функцию Nogo (например, антитела, антисмысловые нуклеиновые кислоты Nogo, производные антагонистов Nogo).
Также настоящим изобретением представляются животные модели, способы диагностики и способы скрининга на предрасположенность к заболеваниям.
Для ясности изложения, но не с целью какого-либо ограничения, подробное описание по настоящему изобретению подразделено на нижеследующие подразделы.
5.1. Выделение генов Nogo
Настоящее изобретение касается нуклеотидных последовательностей генов или нуклеиновых кислот Nogo. В одном варианте нуклеиновые кислоты Nogo включают последовательность кДНК крысы, показанной на фиг.2а (SEQ ID NO 1), идентифицированной в качестве Nogo-A, как это показано на фиг.1b, или ее кодирующих участков, или нуклеотидных последовательностей, кодирующих белок Nogo, состоящий из 1163 аминокислот, или любой функциональный фрагмент или его производное (например, белок, имеющий последовательность SEQ ID NO 2, как это показано на фиг.2а).
В другом варианте нуклеиновые кислоты Nogo включают нуклеотидную последовательность, кодирующую Nogo-B, в то время как белок Nogo-B эквивалентен N-концевым 172 аминокислотам, соединенным с С-концевыми 188 аминокислотами Nogo-A, в результате чего образуется укороченный белок из 360 аминокислот. Транскрипты Nogo-B возникают в результате альтернативного сплайсинга, который удаляет промежуточную кодирующую нуклеотидную последовательность.
Еще в одном варианте настоящего изобретения нуклеиновые кислоты Nogo включают нуклеотидные последовательности, кодирующие Nogo-C, причем белок Nogo-C включает 11 аминокислот по его N-концу, которые отсутствуют в составе Nogo-A, и С-концевые 188 аминокислот Nogo-A и -В. Белок Nogo-C состоит из 199 аминокислот. Транскрипт, кодирующий Nogo-C, является результатом транскрипции с альтернативного промотора гена Nogo.
Еще в следующем конкретном варианте настоящее изобретение представляет нуклеотидные последовательности Nogo быка (SEQ ID NO 28).
В другом конкретном варианте заявляемое изобретение представляет нуклеотидные последовательности, кодирующие Nogo человека, и фрагменты белков Nogo человека, включая человеческие эквиваленты Nogo-A, Nogo-B и Nogo-C крысы. Последовательность нуклеиновой кислоты Nogo человека установлена с использованием транскрипта Nogo-A крысы в качестве матрицы и с помощью сплайсинга экспрессированных маркерных последовательностей (EST-маркеров) человека с целью установления непрерывной нуклеотидной последовательности. Аминокислотные последовательности Nogo крысы и быка также предоставляют информацию о точной трансляционной кодирующей рамке так, чтобы аминокислотная последовательность Nogo человека была расшифрована. Настоящее изобретение также представляет аминокислотные последовательности фрагментов гена Nogo человека.
Изобретение также представляет очищенные нуклеиновые кислоты, включающие по крайней мере 8 нуклеотидов (т.е. гибридизуемый сегмент) последовательности Nogo; в других вариантах нуклеиновые кислоты включают, по крайней мере, 25 (расположенных подряд) нуклеотидов, 50 нуклеотидов, 100 нуклеотидов, 150 нуклеотидов, 200 нуклеотидов, 500 нуклеотидов, 700 нуклеотидов или 800 нуклеотидов последовательности Nogo или полноразмерную кодирующую последовательность Nogo. В другом варианте нуклеиновые кислоты имеют длину менее 35, 300 или 500 нуклеотидов. Нуклеиновые кислоты могут быть одно- или двухцепочечными. Также настоящее изобретение касается нуклеиновых кислот, гибридизуемых с указанными выше последовательностями или комплементарных им. В конкретных аспектах представляются нуклеиновые кислоты, которые включают последовательность, комплементарную, по крайней мере, 10, 25, 50, 100 или 200 нуклеотидам или полному кодирующему сегменту гена Nogo.
В конкретном варианте представляется нуклеиновая кислота, которая гибридизуется с нуклеиновой кислотой Nogo (например, имеющей последовательность SEQ ID NO 2, фиг.2а) или с нуклеиновой кислотой, кодирующей производное Nogo, в условиях низкой жесткости. В качестве примера, но не какого-либо ограничения, процедурами, использующими такие условия низкой жесткости, являются следующие (см. также Shilo & Weinberg, 1981, Proc. Natl. Acad. Sci. USA, 78, 6789-6792). Фильтры, содержащие ДНК, предварительно обрабатывают в течение 6 часов при 40°С в растворе, содержащем 35% формамида, 5×SSC, 50 мМ Трис-HCl (рН 7,5), 5 мМ ЭДТА, 0,1% PVP, 0,1% фиколла, 1% БСА и 500 мкг/мл денатурированной ДНК спермы лосося. Гибридизацию проводят в том же растворе со следующими модификациями: используют 0,02% PVP, 0,02% фиколла, 0,2% БСА, 100 мкг/мл ДНК спермы лосося, 10% (в./об.) декстрансульфата и 5-20×106 имп./мин 32Р-помеченного зонда. Фильтры инкубируют в гибридизационной смеси в течение 18-20 часов при 40°С и затем промывают в течение полутора часов при 55°С в растворе, содержащем 2×SSC, 25 мМ Трис-HCl (рН 7,4), 5 мМ ЭДТА и 0,1% ДСН. Промывочный раствор заменяют на свежий раствор и инкубируют в течение еще 1,5 часов при 60°С. Фильтры высушивают и анализируют авторадиографически. Если необходимо, фильтры промывают в третий раз при 65-68°С и вновь экспонируют на пленку. Другие условия низкой жесткости, которые можно использовать, хорошо известны в данной области техники (например, в соответствии с применяемым для межвидовой гибридизации, что продемонстрировано в примере раздела 6.1.1).
В другом конкретном варианте представляется нуклеиновая кислота, которая гибридизуется с нуклеиновой кислотой Nogo в условиях высокой жесткости. В качестве примера, но не какого-либо ограничения, процедуры использования таких условий высокой жесткости предусматриваются такими. Прегибридизацию фильтров, содержащих ДНК, проводят от 8 часов до ночи при 65°С в буфере, состоящем из 6×SSC, 50 мМ Трис-HCl (рН 7,5), 1 мМ ЭДТА, 0,02% PVP, 0,02% фиколла, 0,02% БСА и 500 мкг/мл денатурированной ДНК спермы лосося. Фильтры гибридизуют в течение 48 часов при 65°С в прегибридизационной смеси, содержащей 100 мкг/мл денатурированной ДНК спермы лосося и 5-20×106 имп./мин 32Р-помеченного зонда. Промывку фильтров проводят при 37°С в течение 1 часа в растворе, содержащем 2×SSC, 0,01% PVP, 0,01% фиколла и 0,01% БСА. После этого проводят промывку в 0,1×SSC при 50°С в течение 45 минут с последующей авторадиографией. Другие условия высокой жесткости, которые можно использовать, хорошо известны в данной области техники.
В другом конкретном варианте представляется нуклеиновая кислота, которая гибридизуется с нуклеиновой кислотой Nogo в условиях средней жесткости. Например, но тем самым не ограничиваясь, процедуры с использованием таких условий средней жесткости проводят следующим образом. Фильтры, содержащие ДНК, предобрабатывают в течение 6 часов при 55°С в растворе, содержащем 6×SSC, 5× раствора Денхардта, 0,5% ДСН и 100 мкг/мл денатурированной ДНК спермы лосося. Гибридизацию проводят в том же растворе, используя 5-20×106 имп./мин 32P-помеченного зонда. Фильтры инкубируют в гибридизационной смеси в течение 18-20 часов при 55°С, а затем промывают дважды в течение 30 минут при 60°С в растворе, содержащем 1×SSC и 0,1% ДСН. Фильтры высушивают и анализируют авторадиографически. Другие условия средней жесткости, которые можно использовать, хорошо известны в данной области техники. Промывку фильтров проводят при 37°С в течение 1 часа в растворе, содержащем 2×SSC, 0,1% ДСН. Такие условия жесткости пригодны для выделения молекул нуклеиновых кислот, включающих последовательности генов Nogo, у других видов, например, с использованием клонов кДНК Nogo крысы или быка в качестве зонда для выделения кДНК Nogo человека.
Ряд экспрессированных маркерных последовательностей (EST-маркеров) человека, опубликованных в базах данных по нуклеотидным последовательностям, проявляет высокий уровень идентичности последовательностей при сравнении с сегментами последовательностей генов Nogo по настоящему изобретению. Следующий предварительный список EST-маркеров человека был идентифицирован и приведен под их номерами в GenBank: АА158636 (SEQ ID NO 35), АА333267 (SEQ ID NO 36), AA081783 (SEQ ID NO 37), AA167765 (SEQ ID NO 38), AA322918 (SEQ ID NO 39), AA092565 (SEQ ID NO 40), AA081525 (SEQ ID NO 41) и AA081840 (SEQ ID NO 42), с использованием ENTREZ Nucleotide Query (ввод нуклеотидного запроса). До настоящего изобретения ни один из вышеперечисленных EST-маркеров не был охарактеризован в связи с аминокислотными последовательностями, которые бы эти EST-маркеры могли кодировать in vivo. Ничего не было известно о функциях белков, включающих предсказанные аминокислотные последовательности по EST-маркерам человека. Более того, EST-маркер, такой как АА158636, сопоставляемый с 5'-концом кДНК Nogo крысы, и другой EST-маркер, такой как AA081840, сопоставляемый с 3'-концом кДНК крысы, не перекрываются и поэтому не воспринимались как части одной и той же последовательности кДНК человека.
Основываясь на последовательностях гена Nogo по настоящему изобретению, считается, что эти EST-маркеры человека представляют собой части гена Nogo человека, который экспрессирован в ткани, из которой были выделены EST-маркеры. Следовательно, настоящее изобретение охватывает молекулы нуклеиновых кислот, включающие два или большее число из указанных выше EST-маркеров человека. EST-маркеры могут быть экспрессированы в той же ткани человека или в других тканях человека. Предпочтительно молекулы нуклеиновых кислот по настоящему изобретению включают нуклеотидные последовательности, по крайней мере, двух EST-маркеров человека, которые не перекрываются по отношению друг к другу или которые не перекрываются с третьим или большим числом EST-маркеров.
Поскольку указанные выше EST-маркеры человека теперь идентифицированы как фрагменты гена Nogo человека в результате клонирования нуклеиновых кислот Nogo быка и крысы, предусматривается, что EST-маркеры человека имеют сходные функции по сравнению с другими молекулами нуклеиновых кислот Nogo в различных способах по настоящему изобретению, например, таких как, тем самым не ограничиваясь, экспрессия полипептидов Nogo человека, гибридизационные тесты и подавление экспрессии Nogo в качестве антисмысловых молекул нуклеиновых кислот и т.п.
Более того, настоящее изобретение представляет и включает предсказанную аминокислотную последовательность белка Nogo человека и его фрагментов. Как показано на фиг.13, аминокислотная последовательность белка Nogo крысы (фиг.2а; SEQ ID NO 2) сопоставлена с предсказанной аминокислотной последовательностью белка Nogo человека (фиг.13; SEQ ID NO 30). Соответственно настоящее изобретение охватывает белки Nogo человека, включающие предсказанную аминокислотную последовательность Nogo человека, фиг.13 и SEQ ID NO 30, или субпоследовательность предсказанной аминокислотной последовательности Nogo человека, включающую, по крайней мере, 6 аминокислотных остатков, или одну или большее число из нижеследующих предсказанных аминокислотных последовательностей фрагментов Nogo человека: MEDLDQSPLVSSS (Nogo человека, соответствующий аминокислотам 1-13 из SEQ ID NO 43), KIMDLKEQPGNTISAG (Nogo человека, соответствующий аминокислотам 187-203 из SEQ ID NO 44), KEDEVVSSEKAKDSFNEKR (Nogo человека, соответствующий аминокислотам 340-358 из SEQ ID NO 45), QESLYPAAQLCPSFEESEATPSPVLPDIVMEAPLNSAVPSAGASVIQPSS (Nogo человека, соответствующий аминокислотам 570-619 из SEQ ID NO 46). Встречающийся в естественных условиях Nogo человека и рекомбинантный Nogo человека и их фрагменты, характеризующиеся аминокислотной последовательностью, по существу сходной с описанными выше аминокислотными последовательностями, и способные связываться с антителом, специфичным в отношении белка Nogo, попадают в объем настоящего изобретения.
Далее настоящее изобретение представляет молекулы нуклеиновых кислот, которые кодируют белок Nogo человека, характеризующийся аминокислотной последовательностью, по существу сходной с аминокислотной последовательностью, показанной на фиг.13 (фиг.13; SEQ ID NO 30). В конкретных вариантах молекулы нуклеиновых кислот, кодирующие фрагменты белка Nogo человека, характеризующиеся аминокислотной последовательностью, в существенной степени сходной с аминокислотной последовательностью, показанной на фиг.13 (SEQ ID NO 30), также представляются при условии, что такие молекулы нуклеиновых кислот не включают нуклеотидную последовательность указанных выше EST-маркеров человека.
Аминокислотная последовательность считается в существенной степени сходной с предсказанной аминокислотной последовательностью белка Nogo человека, когда более чем 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 97% аминокислотных остатков в двух молекулах идентичны в случае использования компьютерного алгоритма, в котором сопоставление осуществляется с помощью компьютерной программы анализа гомологии, известной в данной области техники, например, с использованием компьютерного поиска в программе BLAST (Altschul et al., 1994, Nature Genet., 6, 119-129).
В качестве примера и не для какого-либо ограничения применимыми компьютерными программами анализа гомологии являются следующие: Basic Local Alignment Search Tool (BLAST) (www.ncbi.nlm.nih.gov) (Altschul et al., 1990, J.Mol. Biol., 215, 403-410; "The BLAST Algorithm", Altschul et al., 1997, Nucl. Acids Res., 25, 3389-3402) - эвристический поисковый алгоритм, направленный на поиск сходства последовательностей, который характеризует значимость с помощью статистических методов Karlin & Altschul, 1990, Proc. Natl. Acad. Sci. USA, 87, 2264-2268; 1993, Proc. Natl. Acad. Sci. USA, 90, 5873-5877. Пять конкретных программ BLAST решают следующие задачи:
(1) Программа BLASTP сравнивает запрашиваемую аминокислотную последовательность с базой данных по последовательностям белков.
(2) Программа BLASTN сравнивает запрашиваемую нуклеотидную последовательность с базой данных по нуклеотидными последовательностями.
(3) Программа BLASTX сравнивает шестирамочные возможные трансляционные продукты запрашиваемой нуклеотидной последовательности (обе цепи) с базой данных по последовательностям белков.
(4) Программа TBLASTN сравнивает запрашиваемую последовательность белка с базой данной по нуклеотидным последовательностям, транслированным по всем 6 возможным рамкам считывания (по обеим цепям).
(5) Программы TBLASTX сравнивает 6-рамочные трансляционные продукты запрашиваемой нуклеотидной последовательности с 6-рамочными трансляционными продуктами базы данных по нуклеотидным последовательностям.
Как должно быть понятно специалисту в данной области техники, программа TBLASTN является конкретно применимой для идентификации нуклеиновых кислот с желательным процентом идентичности, а программа BLASTP конкретно применима для идентификации аминокислотных последовательностей с желательным процентом идентичности.
Алгоритм Смита-Уотермана (база данных: European Bioinformatics Institute - www.ebi.ac.uk/bic_sw/) (Smith-Waterman, 1981, J. Mol. Biol., 147, 195-197) является мощным математическим алгоритмом для сопоставления последовательностей.
FASTA (см. Pearson et al., 1988, Proc. Natl. Acad. Sci. USA, 85, 2444-2448) является эвристической аппроксимацией к алгоритму Смита-Уотермана. Для базового обсуждения процедуры и достоинств алгоритмов BLAST, Смита-Уотермана и FASTA см. Nicholas et al., 1998, "A Tutorial on Searching Sequence Databases and Sequence Scoring Methods" (www.psc.edu) и имеющиеся там библиографические ссылки.
Использование предсказанных аминокислотных последовательностей Nogo человека или нуклеотидных последовательностей EST-маркеров человека, включая вырожденные последовательности, кодирующие предсказанную аминокислотную последовательность Nogo человека, для выделения или идентификации гена Nogo человека, его фрагментов и встречающихся в естественных условиях мутантов и вариантов попадает в объем настоящего изобретения. Такое использование, которое должно быть известно специалисту в данной области техники, включает, тем самым не исчерпываясь, использование информации для приготовления нуклеотидных зондов для скрининга библиотек ДНК, амплификации ДНК, генетического скрининга популяций человека и для получения синтетических пептидов для генерирования антител. Подробное описание некоторых из этих путей использования представлено здесь в следующих разделах.
Дополнительно представляются нуклеиновые кислоты, кодирующие производные и аналоги белков Nogo, и антисмысловые нуклеиновые кислоты Nogo. Как легко понятно, по использованию в данном тексте «нуклеиновая кислота, кодирующая фрагмент или часть белка Nogo» призвана обозначить нуклеиновую кислоту, которая кодирует только указанный фрагмент или часть белка Nogo, но не другие соседние сегменты белка Nogo в виде непрерывной последовательности. В этом контексте «часть» обозначает одну или большее число аминокислот.
Также представляются фрагменты нуклеиновых кислот Nogo, включающие консервативные участки по сравнению с (с гомологией по отношению к) другими нуклеиновыми кислотами Nogo одного и того же или разных видов. Нуклеиновые кислоты, кодирующие один или большее число доменов Nogo, представлены на фиг.2а, например, консервативный С-концевой домен Nogo крысы, который состоит примерно из 180 аминокислот и который кодируется последними 540 нуклеотидами кодирующей последовательности перед стоп-кодоном. Также представляются нуклеотидные и аминокислотные последовательности двух гидрофобных доменов в пределах консервативного С-концевого домена, т.е. в пределах аминокислот 988-1023 и в пределах аминокислот 1090-1125 Nogo-A крысы. Также представляются нуклеотидная и аминокислотная последовательности N-концевого кислого домена Nogo-А крысы в пределах остатков 31-58.
Для проведения функционального анализа различных участков Nogo серия делеций гена Nogo была сформирована и клонирована в состав экспрессирующего вектора методами рекомбинантных ДНК с последующей экспрессией в виде химерного белка. Представляются нуклеиновые кислоты, которые кодируют фрагмент белка Nogo, например, нуклеиновые кислоты, которые кодируют аминокислотные остатки 1-171, 172-974, 259-542, 542-722, 172-259, 722-924 или 975-1162 из SEQ ID NO 2 или их сочетания; и нуклеиновые кислоты, которые кодируют аминокислотные остатки 1-131, 132-939, 206-501, 501-680, 132-206, 680-939 и 940-1127 из SEQ ID NO 29 или их сочетания. Некоторые из делеционных конструкций включают укороченные части Nogo и дополнительные нуклеотидные последовательности, кодирующие гексагистидиновую метку и/или Т7-метку. Представляются нуклеиновые кислоты, которые кодируют укороченные белки Nogo, которые утрачивают аминокислотные остатки 172-259, аминокислотные остатки 974-1162 или аминокислотные остатки 172-259 и 974-1162 из SEQ ID NO 2, но включают остальную часть SEQ ID NO 2; или аминокислотные остатки 132-206, аминокислотные остатки 939-1127 или аминокислотные остатки 132-206 и 939-1127 из SEQ ID NO 29, но включают остальную часть SEQ ID NO 29. Структура являющихся примерами делеционных конструкций показана на фиг.18. Делеционные конструкции образуют фрагменты или укороченную(ые) часть (части) Nogo после внесения их в клетку. Биологические активности этих мутантов были протестированы в различных функциональных тестах в соответствии с табл.2 в разделе 6.2.7.
Конкретные варианты клонирования гена Nogo, представленные в качестве конкретного примера, но не призванные быть ограничивающими, таковы.
Для экспрессионного клонирования (метод, хорошо известный в данной области техники) экспрессионная библиотека была сконструирована с помощью известных в данной области техники методов. Например, мРНК (например, человека) выделяют, получают кДНК и лигируют в состав такого экспрессирующего вектора (например, производного от бактериофага), который способен экспрессироваться клеткой-хозяином, в которую его вносят. Различные скрининг-тесты затем могут быть использованы для отбора экспрессированного продукта Nogo. В одном варианте антитела, специфичные в отношении Nogo, можно использовать для отбора.
В другом варианте полимеразную цепную реакцию (ПЦР) используют для амплификации перед отбором желательной последовательности из геномной или кДНК библиотеки. Олигонуклеотидные праймеры, представляющие известные последовательности Nogo, можно использовать в качестве праймеров для ПЦР. В предпочтительном аспекте олигонуклеотидные праймеры представляют, по крайней мере, часть консервативных сегментов Nogo, отражающих высокий уровень гомологии между Nogo разных видов. Синтетические олигонуклеотиды могут быть использованы в качестве праймеров для амплификации с помощью ПЦР последовательностей из источника (РНК или ДНК), предпочтительно библиотеки кДНК, представляющего конкретный интерес. ПЦР может быть проведена, например, путем использования амплификатора Perkin-Elmer Cetus и полимеразы Taq (GeneAmp™). Предназначенная для амплификации ДНК может включать мРНК, или кДНК, или геномную ДНК от любого вида эукариот. Можно предпочесть синтез нескольких разных вырожденных праймеров для использования их в реакциях ПЦР. Также возможным является варьирование уровнями жесткости условий гибридизации, применяемыми при праймировании реакций ПЦР, с целью обеспечения большей или меньшей степени сходства нуклеотидных последовательностей между известной нуклеотидной последовательностью Nogo и предназначенной для выделения гомологичной нуклеиновой кислоты. Для межвидовой гибридизации предпочтительны условия низкой жесткости. Для гибридизации в пределах одного вида предпочтительны условия средней жесткости.
После успешной амплификации сегмента гомолога Nogo этот сегмент может быть подвергнут молекулярному клонированию и секвенированию и использован в качестве зонда для выделения полного кДНК- или геномного клона. Это, в свою очередь, позволит определить полную нуклеотидную последовательность гена, проанализировать его экспрессию и выработать его белковый продукт для функционального анализа, что будет описано далее. В этом случае могут быть идентифицированы дополнительные гены, кодирующие белки Nogo и аналоги Nogo.
Описанные выше способы не призваны в чем-либо ограничить базовое описание способов, с помощью которых могут быть получены клоны Nogo.
Любая эукариотическая клетка потенциально может служить источником нуклеиновых кислот для молекулярного клонирования гена Nogo. Последовательности нуклеиновых кислот, кодирующие Nogo, могут быть выделены из позвоночного животного, млекопитающего, человека, свиньи, мыши, крупного рогатого скота (быка), кошки, птицы, лошади, собаки, равно как других приматов, насекомых и т.п. ДНК может быть выделена с помощью стандартных процедур, известных в данной области техники, из клонированной ДНК (например, «библиотеки» ДНК), с помощью химического синтеза, путем клонирования кДНК или путем клонирования геномной ДНК или ее фрагментов, очищенных из желательной клетки. (См., например, Sambrook et al., 1989, "Molecular Cloning: A Laboratory Manual", 2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; Glover D.M. (ed.), 1985, "DNA Cloning: A Practical Approach", MRL Press Ltd., Oxford, U.K., Vol.I, II). Клоны, производные от геномной ДНК, могут включать регуляторные и интронные ДНК-сегменты в дополнение к кодирующим сегментам; клоны, производные от кДНК, должны включать только экзонные последовательности. Независимо от источника ген должен быть подвергнут молекулярному клонированию в состав подходящего вектора для воспроизведения гена.
При молекулярном клонировании гена из геномной ДНК, формируют ДНК-фрагменты, некоторые из которых будут кодировать желательный ген. ДНК может быть расщеплена по специфическим сайтам с использованием различных рестриктаз. Как альтернатива, можно использовать ДНКазу в присутствие магния в отношении фрагментов ДНК, или ДНК может быть физически разрезана, например, с помощью ультразвука. Затем линейные фрагменты ДНК могут быть разделены в соответствии с их размерами с помощью стандартных методов, включая, но тем самым не ограничиваясь, электрофорез в агарозном и полиакриламидном геле и хроматографию на колонках.
После того как ДНК-фрагменты сформированы, идентификация конкретного ДНК-фрагмента, включающего желательный ген, может быть осуществлена различными путями. Например, если количество части гена Nogo (любого вида) или его конкретной РНК, или ее фрагмента (см. раздел 6.1.1) достаточно и может быть очищено и помечено, то сформированные ДНК-фрагменты могут быть подвергнуты скринингу с помощью гибридизации нуклеиновых кислот с помеченным зондом (W.Benton & R.Davis, 1977, Science, 196, 180; M.Grunstein & D.Hogness, 1975, Proc. Natl. Acad. Sci. USA, 72, 3961). Те ДНК-фрагменты, которые характеризуются существенной гомологией с зондом, будут гибридизоваться. Также возможной является идентификация подходящего фрагмента с помощью расщепления рестриктазой(ами) и сравнения размеров фрагментов с теми, которые ожидаются в соответствии с известной рестрикционной картой, если таковая доступна. Дальнейший отбор может быть проведен на основе свойств гена.
Как альтернатива присутствие гена может быть выявлено с помощью тестов, основывающихся на физических, химических или иммунологических свойствах экспрессируемого им продукта. Например, клоны кДНК или клоны ДНК, которые избирательно гибридизуют с точной мРНК, могут быть отобраны как дающие белок, который, например, характеризуется сходными или идентичными параметрами электрофоретической подвижности, поведением при электрофоретическом фокусировании, картами протеолитического расщепления, посттрансляционными модификациями, кислыми или основными свойствами или антигенными свойствами, которые известны у Nogo. Доступны антитела к Nogo, такие как IN-1 и IN-2 (патент США №5684133), AS-Bruna и AS472. Получение AS-Bruna и AS472 описано в разделе 6.1.7. Белок Nogo может быть идентифицирован по связыванию помеченного антитела с предполагаемыми синтезируемыми клонами Nogo в процедуре по типу ТИФА (твердофазный иммуноферментный анализ) или с помощью Вестерн-блоттинга очищенных или цельных клеточных экстрактов.
Ген Nogo также может быть идентифицирован с помощью отбора мРНК по гибридизации нуклеиновых кислот с последующей трансляцией in vitro. В этой процедуре фрагменты используют для выделения комплементарных мРНК с помощью гибридизации. Такие ДНК-фрагменты могут представлять доступные очищенные ДНК Nogo других видов (например, мыши, человека). В иммунопреципитационном анализе или функциональных тестах (например, на агрегационную способность in vitro; на связывание с рецептором: см. далее) трансляционных продуктов in vitro из выделенных продуктов выделенных мРНК идентифицируют мРНК и, следовательно, комплементарные ДНК-фрагменты, которые включают желательные последовательности. Кроме того, конкретные мРНК могут быть отобраны путем адсорбции полисом, выделенных из клеток, на иммобилизованные антитела, специфичные в отношении белка Nogo. Радиоактивно помеченная кДНК Nogo может быть синтезирована с использованием отобранной мРНК (из адсорбированных полисом) в качестве матрицы. Радиоактивно помеченные мРНК или кДНК могут быть затем использованы в качестве зонда для идентификации ДНК-фрагментов Nogo среди других геномных ДНК-фрагментов.
Альтернативами выделению геномной ДНК Nogo являются, тем самым не ограничиваясь, химический синтез самой генной последовательности по известной последовательности или получение кДНК на матрице мРНК, которая кодирует белок Nogo. Например, РНК для клонирования кДНК гена Nogo может быть выделена из клеток, которые экспрессируют Nogo. Возможны и другие способы в объеме настоящего изобретения.
Идентифицированный и выделенный ген может быть затем встроен в подходящий клонирующий вектор. Может быть использовано значительное число систем «вектор-хозяин», известных в данной области техники. Возможными векторами являются, тем самым не исчерпываясь, плазмиды или модифицированные вирусы, при этом векторная система должна быть совместимой с используемой клеткой-хозяином. Такими векторами являются, тем самым не ограничиваясь, бактериофаги, такие как производные λ-фага, или плазмиды, такие как pBR322 или производные плазмиды pUC, или вектор Bluescript (Stratagene). В конкретном варианте Nogo клонируют в состав pcDNA3 с эпитопами-метками для упрощения анализа экспрессии белков (раздел 6.1.10).
Вставка в клонирующий вектор может, например, быть осуществлена путем лигирования ДНК-фрагмента в клонирующий вектор, который имеет комплементарные «липкие концы». Однако, если комплементарные рестрикционные сайты, использованные для фрагментации ДНК, не присутствуют в клонирующем векторе, то концы молекул ДНК могут быть ферментативно модифицированы. Как альтернатива любой желательный сайт может быть получен путем лигирования нуклеотидных последовательностей (линкеров) на концы ДНК; эти лигированные линкеры могут включать конкретные химически синтезированные олигонуклеотиды, кодирующие последовательности распознавания рестрикционными эндонуклеазами. В альтернативном способе расщепленный вектор и ген Nogo могут быть модифицированы с помощью концевого присоединения гомополимера. Рекомбинантные молекулы могут быть внесены в клетки-хозяева с помощью трансформации, трансфекции, инфицирования, электропорации и т.п. так, чтобы были сформированы множественные копии генной последовательности.
В альтернативном способе желательный ген может быть идентифицирован и выделен после встраивания в подходящий клонирующий вектор с помощью метода «дробовика». Обогащение желательного гена, например, путем фракционирования по размеру, может быть осуществлено перед встраиванием в клонирующий вектор.
В конкретных вариантах трансформация клеток-хозяев молекулами рекомбинантной ДНК, которые включают выделенный ген Nogo, кДНК или синтезированную последовательность, позволяет формировать множественные копии этого гена. Таким образом, ген может быть выделен в больших количествах путем культивирования трансформантов, выделения молекул рекомбинантной ДНК из трансформантов и, если необходимо, вырезания встроенного гена из выделенной рекомбинантной ДНК.
Последовательности Nogo, представляемые заявляемым изобретением, включают те нуклеотидные последовательности, которые кодируют в существенной степени такие же аминокислотные последовательности, какие найдены в нативных белках Nogo, а также те, которые кодируют аминокислотные последовательности с функционально эквивалентными аминокислотами, равно как и те, которые кодируют другие производные или аналоги Nogo в соответствии с описанным в разделах 6.2.1 и 6.2.2 далее для производных и аналогов Nogo.
5.2. Экспрессия генов Nogo
Нуклеотидная последовательность, кодирующая белок Nogo или его функционально активный аналог, или фрагмент, или иное производное (см. фиг.1b и 2а; разделы 6.2.1 и 6.2.2), может быть встроена в подходящий экспрессирующий вектор, т.е. вектор, который включает элементы, необходимые для транскрипции и трансляции встроенной кодирующей белок последовательности. Необходимые для транскрипции и трансляции элементы также могут происходить от нативных гена Nogo и/или фланкирующих его участков. Кодирующая последовательность также может быть помечена последовательностью, которая кодирует хорошо известный антиген или биологическую молекулу, обладающую хорошо известными свойствами связывания с партнером по связыванию (например, эпитоп-метку онкогена myc, полигистидиновую метку, эпитоп-метку фага Т7 и т.п.: см. раздел 6.2.6 и фиг.11a-11c). Эта дополнительная последовательность затем может быть использована для очистки белка Nogo, белкового фрагмента или производного за счет взаимодействия группы связывания с соответствующим ей партнером, который присоединен к твердой подложке.
Различные системы «вектор-хозяин» могут быть использованы для экспрессии последовательности, кодирующей белок. Они включают, тем самым не ограничиваясь, системы клеток млекопитающих, инфицированных вирусом (например, вирусом коровьей оспы, аденовирусом и т.п.); системы клеток насекомых, инфицированных вирусом (например, бакуловирусом); микроорганизмы, такие как дрожжи, несущие дрожжевые векторы, или бактерии, трансформированные бактериофагом, ДНК, плазмидной ДНК или космидной ДНК. Регулирующие экспрессию элементы этих векторов варьируются по своей силе и специфичности. В зависимости от используемой системы «вектор-хозяин» можно использовать любой из ряда подходящих элементов-регуляторов транскрипции и трансляции. В конкретных вариантах экспрессируют ген Nogo человека или последовательность, кодирующую функционально активную часть Nogo человека: как конкретный пример, экспрессируют либо Nogo-A, либо Nogo-B, либо Nogo-C (фиг.1b). Еще в одном варианте экспрессируют фрагмент Nogo, включающий домен белка Nogo.
По использованию в данном тексте то, что клетка «трансформирована» нуклеиновой кислотой, обозначает наличие в такой клетке нуклеиновой кислоты, которая в нативных условиях отсутствует в этой клетке, в результате внесения нуклеиновой кислоты в клетку или ее предшественник, например, с помощью трансфекции, электропорации, трансдукции и т.п.
Также представляются нуклеотидные последовательности, кодирующие фрагменты Nogo-A человека, включающие аминокислотную последовательность, выбранную из группы, которая включает аминокислотные остатки 1-131, 132-939, 206-501, 501-680, 132-206, 680-939 и 940-1127 из SEQ ID NO 29. Также представляются нуклеотидные последовательности, которые кодируют укороченные сегменты Nogo-A человека: укороченные белки, лишенные аминокислотных остатков 132-206, аминокислотных остатков 939-1127 или аминокислотных остатков 132-206 и 939-1127 из SEQ ID NO 29, но при этом сохраняющие остальные части из SEQ ID NO 29.
Любой из ранее описанных способов встраивания фрагментов ДНК в вектор, может быть использован для конструирования экспрессирующих векторов, включающих химерный ген, имеющий подходящие элементы-регуляторы транскрипции/трансляции и последовательности, кодирующие белок. Эти способы могут включать способы рекомбинантных ДНК in vitro и синтеза, а также рекомбинации in vivo (генетической рекомбинации). Экспрессия последовательности нуклеиновой кислоты, кодирующей белок Nogo или пептидный фрагмент, может регулироваться последовательностью второй нуклеиновой кислоты таким образом, чтобы белок или пептид Nogo экспрессировался в хозяине, трансформированном рекомбинантной молекулой ДНК. Например, экспрессия белка Nogo может находиться под контролем любого промоторного/энхансерного элемента, известного в данной области техники. Являющийся примером вариант - это использование одного из нативных промоторов гена Nogo - либо Р1, либо Р2, что обсуждается в разделе 6.2.1. Также можно использовать ненативный промотор. Промоторами, которые можно использовать для регуляции экспрессии Nogo, являются, тем самым не ограничиваясь, сегмент ранних промоторов SV40 (Bernoist & Chambon, 1981, Nature, 290, 304-310), промотор, включающий длинные 3'-концевые повторы вируса саркомы Рауса (Yamamoto et al., 1980, Cell, 22, 787-797), промотор тимидинкиназы герпесвируса (Wagner et al., 1981, Proc. Natl. Acad. Sci. USA, 78, 1441-1445), регуляторные последовательности гена металлотионеина (Brinster et al., 1982, Nature, 296, 39-42); прокариотические экспрессирующие векторы, такие как промотор β-лактамазы (Villa-Kamaroff et al., 1978, Proc. Natl. Acad. Sci. USA, 3727-3731) или промотор tac (DeBoer et al., 1983, Proc. Natl. Acad. Sci. USA, 80, 21-25); см. также статью "Useful proteins from recombinant bacteria". Scientific American, 1980, 242, 74-94; экспрессирующие векторы для растений, включающие промоторный сегмент нопалинсинтазы (Herrera-Estrella et al., Nature, 303, 209-213) или промотор гена 35S-PHK вируса мозаики цветной капусты (Gardner et al., 1981, Nucl. Acids Res., 9, 2871) и промотор фотосинтетического фермента рибулозобифосфат-карбоксилазы (Herrera-Estrella et al., 1984, Nature, 310, 115-120); промоторные элементы дрожжей или других грибов, такие как промотор Gal4, промотор ADH (алкоголь-дегидрогеназа), промотор PGK (фосфоглицеролкиназа), промотор щелочной фосфатазы; и следующие элементы-регуляторы транскрипции у животных, которые характеризуются тканеспецифичностью и используются в трансгенных животных: контрольный сегмент гена эластазы-1, который активен в клетках концевого сегмента поджелудочной железы (Swift et al., 1984, Cell, 38, 639-646; Ornitz et al., 1986, Cold Spring Harbor Symp. Quant. Biol., 50, 399-409; MacDonald, 1987, Hepatology, 7, 425-515); контрольный сегмент гена инсулина, который активен в β-клетках поджелудочной железы (Hanahan, 1985, Nature, 315, 115-122), контрольный сегмент гена иммуноглобулина, который активен в лимфоидных клетках (Grosschedl et al., 1984, Cell, 38, 647-658; Adames et al., 1985, Nature, 318, 533-538; Alexander et al., 1987, Mol. Cell. Biol., 7, 1436-1444), контрольный сегмент вируса опухоли молочной железы мыши, который активен в клетках семенников, молочной железы, лимфоидных и тучных клетках (Leder et al., 1986, Cell, 45, 485-495), контрольный сегмент гена альбумина, который активен в печени (Pinkert et al., 1987, Genes and Develop., 1, 268-276), контрольный сегмент гена α-фетопротеина, который активен в печени (Krumlauf et al., 1985, Mol. Cell. Biol., 5, 1639-1648; Hammer et al., 1987, Science, 235, 53-58), контрольный сегмент гена α1-антитрипсина, который активен в печени (Kelsey et al., 1987, Genes and Develop., 1, 161-171), контрольный сегмент гена β-глобина, который активен в миелоидных клетках (Mogram et al., 1985, Nature, 315, 338-340; Kollias et al., 1986, Cell, 46, 89-94), контрольный сегмент гена основного миелинового белка, который активен в олигодендроцитах головного мозга (Readhead et al., 1987, Cell, 48, 703-712), контрольный сегмент гена легкой цепи-2 миозина, который активен в скелетной мускулатуре (Sani, 1985, Nature, 314, 283-286) и контрольный сегмент гена рилизинг-гормона гонадотропина, который активен в гипоталамусе (Mason et al., 1986, Science, 234, 1372-1378).
В конкретном варианте используют вектор, который включает промотор, функционально присоединенный к нуклеиновой кислоте, кодирующей Nogo, один или несколько сайтов начала репликации и, что необязательно, один или несколько селективных маркеров (например, гена резистентности к антибиотику).
В конкретном варианте экспрессионную конструкцию получают путем субклонирования кодирующей последовательности Nogo по рестрикционному EcoRI-сайту каждого из трех векторов pGEX (векторы, экспрессирующие глутатион-S-трансферазу: Smith & Johnson, 1988, Gene, 7, 31-40). Это позволяет экспрессировать белковый продукт Nogo из субклона в правильной рамке считывания.
Экспрессирующие векторы, включающие вставки гена Nogo, могут быть идентифицированы с помощью трех базовых подходов: (а) гибридизация нуклеиновых кислот, (b) присутствие или отсутствие функций «маркерного» гена и (с) экспрессия встроенных последовательностей. В первом подходе присутствие гена Nogo, встроенного в экспрессирующий вектор, можно выявить с помощью гибридизации нуклеиновых кислот с использованием зондов, включающих последовательности, которые гомологичны встроенному гену Nogo. Во втором подходе система из рекомбинантного вектора и хозяина может быть идентифицирована и отобрана на основании присутствия или отсутствия некоторых функций «маркерного» гена (например, тимидинкиназной активности, резистентности к антибиотикам, трансформированного фенотипа, образовании включенных телец бакуловирусов и т.п.), обусловливаемых встраиванием гена Nogo в вектор. Например, если ген Nogo встраивают в пределы последовательности маркерного гена в составе вектора, то рекомбинанты, несущие вставку Nogo, могут быть идентифицированы по отсутствию функции маркерного гена. В третьем подходе рекомбинантные экспрессирующие векторы могут быть идентифицированы путем анализа продукта Nogo, экспрессированного рекомбинантом. Такие тесты могут основываться, например, на физических или функциональных свойствах белка Nogo в тест-системах in vitro, например, на связывании с анти-Nogo антителом.
После того как конкретная рекомбинантная молекула ДНК была идентифицирована и выделена, для ее воспроизведения могут быть применены некоторые методы, известные в данной области техники. После того как были установлены подходящие хозяин и условия культивирования, рекомбинантные экспрессирующие векторы могут быть воспроизведены и получены в определенном количестве. Как объяснялось выше, экспрессирующие векторы, которые можно использовать, включают, тем самым не исчерпываясь, следующие векторы или их производные: вирусы человека или животных, такие как вирус коровьей оспы или аденовирус; вирусы насекомых, такие как бакуловирус; дрожжевые векторы; фаговые векторы (например, λ-фаговые), а также плазмидные и космидные векторы, и многое другое.
Кроме того, может быть выбран штамм клеток-хозяев, который модулирует экспрессию встроенных последовательностей или модифицирует и процессирует генный продукт в конкретном желательном направлении. Экспрессия с некоторых промоторов может быть усилена в присутствие некоторых индукторов: таким образом, может быть проконтролирована экспрессия генетически перестроенного белка Nogo. Более того, различные клетки-хозяева обладают характерными специфическими механизмами трансляционного и посттрансляционного процессинга и модифицирования (например, гликозилирования, фосфорилирования белков). Подходящие клеточные линии или хозяева могут быть выбраны с целью обеспечения желательной модификации и процессинга экспрессированного чужеродного белка. Например, экспрессия в бактериальной системе может быть использована для выработки негликозилированного базового белкового продукта. При экспрессии в дрожжах будет образовываться гликозилированный продукт. Экспрессия в клетках млекопитающих может быть использована для обеспечения «нативного» гликозилирования гетерологичного белка. Более того, различные экспрессионные системы «вектор/хозяин» могут влиять на реакции процессинга в различной степени.
В других конкретных вариантах белок Nogo, его фрагмент, аналог или производное могут быть экспрессированы в виде химерного или гибридного белкового продукта (включающего белок, фрагмент, аналог или производное, соединенные пептидной связью с последовательностью гетерологичного белка (другого белка)). Такой химерный продукт может быть получен путем лигирования последовательностей подходящих нуклеиновых кислот, кодирующих желательные аминокислотные последовательности, друг на друга с помощью методов, известных в данной области техники, в правильной кодирующей рамке, и экспрессии химерного продукта с помощью методов, обычных для данной области техники. Как альтернатива такой химерный продукт можно получить с помощью методов синтеза белков, например с применением пептидного синтезатора.
Клонированы и экспрессированы могут быть и последовательности кДНК, и геномные последовательности.
5.3. Идентификация и очистка продуктов генов Nogo
В конкретных аспектах настоящее изобретение представляет аминокислотные последовательности Nogo, предпочтительно Nogo человека и его фрагменты и производные, которые включают антигенную детерминанту (т.е. могут распознаваться антителом) или которые по-иному функционально активны, равно как и последовательности нуклеиновых кислот, кодирующие указанное выше. «Функционально активный» материал Nogo по использованию в данном тексте обозначает то, что этот материал проявляет одну или большее число известных функциональных активностей, характерных для полноразмерного белка Nogo-A (дикого типа), например, свойства непермиссивного субстрата, индуцирование коллапса конуса нарастания заднекорешковых ганглиев, подавление распределения клеток NIG-3T3, подавление разрастания нейритов, связывание с субстратом для Nogo или с партнером Nogo по связыванию, антигенность (связывание с анти-Nogo антителом), иммуногенность и т.п.
В конкретных вариантах настоящее изобретение представляет фрагменты белка Nogo, включающие, по крайней мере, 6 аминокислот, 10 аминокислот, 17 аминокислот, 50 аминокислот, 100 аминокислот или по крайней мере 220 аминокислот. В других вариантах белки включают или по существу состоят из высококонсервативного С-концевого домена Nogo (С-концевые 188 аминокислот Nogo-A). Также представляются фрагменты или белки, включающие фрагменты, утратившие из состава белка Nogo консервативный С-концевой домен или гидрофобные С-концевые мотивы, или N-концевой кислый домен, или N-концевой богатый пролином сегмент, или любое их сочетание. Представляются нуклеиновые кислоты, кодирующие указанное выше.
После идентификации рекомбинанта, который экспрессирует последовательность гена Nogo, можно проанализировать генный продукт. Для этого служат тесты, основывающиеся на физических или функциональных свойствах продукта, включая радиоактивное мечение продукта с последующим анализом с помощью электрофореза в геле, иммунологического теста и т.п.
После идентификации белка Nogo его можно выделить и очистить с помощью стандартных методов, включая хроматографию (например, ион-обменную, аффинную и гель-фильтрационную колоночную хроматографию), центрифугирование, дифференцированную растворимость, или с помощью любой другой стандартной технологии очистки белков. Функциональные свойства могут быть оценены с использованием любого подходящего теста, включая тест на коллапс конуса нарастания в заднекорешковых ганглиях, подавление распределения клеток NIH-3T3, подавление регенерации нейритов в зрительных нервах (см. разделы 6.2.4-6.2.5).
Как альтернатива после того как был идентифицирован белок Nogo, вырабатываемый рекомбинантом, аминокислотная последовательность белка может быть расшифрована на основе нуклеотидной последовательности химерного гена, имеющегося в рекомбинанте. В результате белок может быть синтезирован с помощью стандартных химических методов, известных в данной области техники (например, см. М.Hunkapiller et al., 1984, Nature, 310, 105-111).
В другом альтернативном варианте нативный Nogo-C может быть очищен из естественных источников с помощью стандартных методов, таких как методы, описанные выше (например, иммуноаффинная очистка).
В конкретном варианте настоящего изобретения такие белки Nogo, как выработанные с помощью методов рекомбинантной ДНК, с помощью методов химического синтеза, так и с помощью очистки нативных белков, включают, тем самым не ограничиваясь, те белки, которые в качестве первичной аминокислотной последовательности включают полностью или частично аминокислотную последовательность, по существу показанную на фиг.2а (SEQ ID NO 2), последовательность быка на фиг.12 (SEQ ID NO 28) или последовательность человека на фиг.13 (ESQ ID NO 29), а также их фрагменты и другие производные (такие как, тем самым не ограничиваясь, показанные на фиг.18) и аналоги, включая гомологичные им белки. Предпочтительно белки Nogo по настоящему изобретению свободны от всякого другого миелинового материала ЦНС, с которым они в норме связаны.
5.4. Структура гена и белка Nogo
Структура гена и белка Nogo может быть проанализирована с помощью различных методов, известных в данной области техники, и некоторые из этих методов описаны в нижеследующих подразделах.
5.4.1. Генетический анализ
Клонированная ДНК или кДНК, соответствующая гену Nogo, может быть проанализирована с помощью методов, включающих, тем самым не исчерпываясь, гибридизацию по Саузерну (Е.М.Southern, 1975, J. Mol. Biol., 98, 503-517), Нозерн-блот-гибридизацию (см., например. Freeman et al., 1983, Proc. Natl. Acad. Sci. USA, 80, 4094-4098), рестрикционное картирование (T.Maniatis, 1982, "Molecular Cloning: A Laboratory Manual", Cold Spring Harbor, New York) и анализ последовательности ДНК. Полимеразная цепная реакция (ПЦР) (патенты США №№4683202, 4683195 и 4889818; Gyllenstein et al., 1988, Proc. Natl. Acad. Sci. USA, 85, 7652-7656; Ochman et al., 1988, Genetics, 120, 621-623; Loh et al., 1989, Science, 243, 217-220) с последующей гибридизацией по Саузерну с Nogo-специфичным зондом может обеспечить выявление гена Nogo в ДНК клеток различного типа. Также известны и могут быть использованы другие помимо ПЦР методы амплификации. В одном варианте гибридизацию по Саузерну можно использовать для определения генетического сцепления Nogo. Анализ методом Нозерн-блот-гибридизации можно использовать для установления экспрессии гена Nogo. Клетки различного типа на различных этапах развития или активности можно протестировать на экспрессию Nogo. Жесткостью условий гибридизации и для Саузерн-, и для Нозерн-гибридизации можно манипулировать с целью обеспечения выявления нуклеиновых кислот, обладающих желательной степенью родства по отношению к конкретному используемому зонду Nogo. Можно использовать модификации этих методов и другие методы, хорошо известные в данной области техники.
Картирование с использованием рестрикционных эндонуклеаз можно использовать для приблизительного определения генетической структуры гена Nogo. Рестрикционные карты, полученные в результате расщепления рестриктазами, можно подтверждать с помощью анализа последовательности ДНК.
Анализ последовательности ДНК может быть осуществлен с помощью любого метода, известного в данной области техники, включая, но тем самым не ограничиваясь, метод Максама-Джилберта (Maxam & Gilbert, 1980, Meth. Enzymol., 65, 499-560), метод Сэйнджера (F.Sanger et al., 1977, Proc. Natl. Acad. Sci. USA, 74, 5463), использование ДНК-полимеразы фага Т7 (Tabor & Richardson, патент США №4795699) или использование автоматического ДНК-секвенатора (например, Applied Biosystems, Foster City, CA).
5.4.2. Анализ белка
Аминокислотная последовательность белка Nogo может быть получена с помощью расшифровки последовательности ДНК или, как альтернатива, путем прямого секвенирования белка, например, на автоматическом аминокислотном секвенаторе.
Последовательность белка Nogo может быть дополнительно охарактеризована в анализе на гидрофильность (Т.Норр & К.Woods, 1981, Proc. Natl. Acad. Sci. USA, 78, 3824). Профиль гидрофильности можно использовать для идентификации гидрофобных и гидрофильных участков в белке Nogo (см. раздел 8.5) и соответствующих участков в последовательности гена, который кодирует такие сегменты.
Во-вторых, можно провести структурный анализ (Р.Chou & G.Fasman, 1974, Biochemistry, 13, 222) с целью идентификации участков Nogo, которые образуют специфичные вторичные структуры.
Манипуляцию, трансляцию, предсказывание вторичной структуры, предсказывание открытой рамки считывания и графическое отображение, а также определение гомологии последовательностей также можно осуществить с помощью пакетов компьютерных программ, доступных в данной области техники.
Также могут быть использованы другие методы структурного анализа. Они включают, тем самым не ограничиваясь, рентгеновскую кристаллографию (A.Engstom, 1974, Biochem. Exp. Biol., 11, 7-13) и компьютерное моделирование (R.Fletterick & М.Zoller, eds., 1986, "Computer Graphics and Molecular Modeling", In "Current Communications in Molecular Biology", Cold Spring Harbor Laboratory, Cold Spring Harbor, New York).
5.5. Получение антител к белкам Nogo и их производным
В соответствии с настоящим изобретением белок Nogo, его фрагменты или другие производные или его аналоги могут быть использованы в качестве иммуногена для формирования антител, которые иммуноспецифическим образом связываются с таким иммуногеном. Такие антитела включают, тем самым не исчерпываясь, поликлональные, моноклональные, химерные, одноцепочечные антитела, фрагменты Fab и Fab-экспрессионную библиотеку. Вырабатываются антитела, специфичные в отношении рекомбинантного фрагмента Nogo крысы или быка (раздел 6.1.7), и эти антитела проявляют перекрестную реактивность в отношении эпитопов других видов. В другом варианте фрагменты белка Nogo, идентифицированные как гидрофильные, используют в качестве иммуногенов для получения антител.
Различные процедуры, известные в данной области техники, могут быть использованы для выработки поликлональных антител к белку Nogo или его производному или аналогу. В конкретном варианте могут быть получены кроличьи поликлональные антитела к эпитопу белка Nogo, кодируемого последовательностью SEQ ID NO 2 с фиг.2а, SEQ ID NO 28 с фиг.12, SEQ ID NO 32 с фиг.14 или SEQ ID NO 29 с фиг.13 (Nogo-A крысы, Nogo быка, Nogo-C крысы или Nogo человека соответственно) или их субпоследовательностью. Для получения антитела различные животные-реципиенты могут быть иммунизованы путем инъекции нативного белка Nogo или его синтетического варианта или его производного (например, фрагмента), включая, но тем самым не ограничиваясь, кроликов, мышей, крыс и т.п. Различные адъюванты могут быть использованы для усиления иммунного ответа, что зависит от вида реципиента, и включают, тем самым не ограничиваясь, адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроокись алюминия, поверхностно-активные вещества, такие как лизолецитин, плуроновые полиспирты, полианионы, пептиды, масляные эмульсии, гемоцианины слизней, динитрофенол и потенциально применимые человеческие адъюванты, такие как BCG (палочка Calmette-Guerin) и Corynebacterium parvum.
Для получения моноклональных антител, специфичных в отношении последовательности белка Nogo или его аналога, может быть использован любой метод, который обеспечивает выработку молекул антител в непрерывных культивируемых клеточных линиях. Например, гибридомный метод, исходно разработанный Келером-Мильштейном (Kohler & Milstein, 1875, Nature, 495-497), а также триомный метод, метод человеческих В-клеточных гибридом (Kozbor et al., 1983, Immunology Today, 4, 72) и ВЭБ-гибридомный метод используют для получения моноклональных антител человека (Cole et al., 1985, In "Monoclonal Antibodies and Cancer Therapy", Alan R. Liss Inc., pp.77-96). Моноклональные антитела могут быть получены в стерильных животных с использованием недавно разработанного способа (PCT/US90/02545). В соответствии с настоящим изобретением антитела человека могут быть использованы и могут быть получены с использованием человеческих гибридом (Cote et al., 1983, Proc. Natl. Acad. Sci. USA, 80, 2026-2030) или путем трансформации В-клеток человека вирусом Эпштейна-Барр in vitro (Cole et al., 1985, In "Monoclonal Antibodies and Cancer Therapy", Alan R. Liss Inc., pp.77-96). Действительно в соответствии с настоящим изобретением могут быть использованы методы, разработанные для выработки «химерных антител» (Morrison et al., 1984, Proc. Natl. Acad. Sci. USA, 81, 6851-6855; Neuberger et al., 1984, Nature, 312, 604-608; Takeda et al., 1985, Nature, 314, 452-454) путем сплайсинга генов, кодирующих молекулу антитела мыши, специфичную в отношении Nogo, с генами, кодирующими молекулу антитела человека с подходящей биологической активностью; такие антитела попадают в объем настоящего изобретения.
В соответствии с настоящим изобретением методы, описанные для получения одноцепочечных антител (патент США №4946778), могут быть адаптированы для получения Nogo-специфичных одноцепочечных антител. Методы, описанные в связи с конструированием Fab-экспрессионных библиотек, также можно использовать (Huse et al., 1989, Science, 246, 1275-1281) с целью обеспечения быстрой и простой идентификации моноклональных Fab-фрагментов с желательной специфичностью в отношении белков Nogo, его производных или аналогов.
Фрагменты антител, которые включают идиотип молекулы, могут быть получены с помощью известных методов. Например, такие фрагменты включают, тем самым не исчерпываясь: фрагмент F(ab')2» который можно получить обработкой молекулы антитела пепсином; фрагменты Fab', которые можно получить путем восстановления дисульфидных связей во фрагменте F(ab')2; фрагменты Fab, которые можно получить путем обработки молекулы антитела папаином и агентом-восстановителем; и фрагменты Fv.
При получении антител скрининг на желательное антитело может быть осуществлен с помощью методов, хорошо известных в данной области техники, например, ТИФА (твердофазный иммуноферментный анализ). Например, для отбора антител, которые распознают конкретный домен в белке Nogo, можно протестировать сформированные гибридомы на наличие продукта, который связывается с фрагментом Nogo, включающим такой домен. Для отбора антитела, которое специфически связывается в первым гомологом Nogo, но которое не связывается специфически с другим гомологом Nogo, можно проводить отбор на основе позитивного связывания с первым гомологом Nogo и отсутствия связывания со вторым гомологом Nogo.
Также предусматриваются антитела, специфичные в отношении домена белка Nogo.
Указанные выше антитела могут быть использованы в способах, известных в данной области техники, касающихся локализации и активности последовательностей белка Nogo по настоящему изобретения, например, для визуального представления этих белков, измерения его уровней в подходящих физиологических образцах, в способах диагностики и т.п.
Анти-Nogo антитела и их фрагменты, включающие домен связывания, являются терапевтическими средствами.
5.6. Белки Nogo, его производные и аналоги
Далее изобретение касается белков Nogo и производных (включая, но тем самым не ограничиваясь, фрагменты), и аналогов белков Nogo. Также представляются нуклеиновые кислоты, кодирующие производные белка Nogo и аналоги белка Nogo. В одном варианте белки Nogo кодируются нуклеиновыми кислотами Nogo, описанными выше в разделе 5.1. В конкретных аспектах белки Nogo-A, Nogo-B или Nogo-C, производные или аналоги, происходящие от животных, например, от мыши, крысы, свиньи, крупного рогатого скота, домашней собаки, обезьяны, человека, мухи или лягушки, также попадают в объем настоящего изобретения.
Получение и использование производных и аналогов, родственных Nogo, также попадают в объем по настоящему изобретению. В конкретном варианте производное или аналог являются функционально активными, т.е. способными проявлять одну или большее число функциональных активностей, характерных для полноразмерного белка Nogo дикого типа. Как один из примеров такие производные или аналоги, обладающие желательной иммуногенностью или антигенностью, могут быть использованы, например, в иммунологических тестах, для иммунизации, для подавления активности Nogo и т.п. Производные или аналоги, которые сохраняют или, как альтернатива, утрачивают или ингибируют желательное интересующее свойство Nogo (например, связывание со связывающим партнером Nogo), можно использовать в качестве индукторов или ингибиторов соответственно в отношении такого свойства и его физиологически связанных параметров. Конкретный вариант касается фрагмента Nogo, который может связываться с анти-Nogo антителом. Производные или аналоги Nogo могут быть протестированы на желательную активность в процедурах, известных в данной области техники, включая, но тем самым не ограничиваясь, тесты, описанные в разделах 6.1.10-6.1.12.
С целью картирования активного(ых) участка(ов) в составе Nogo серию делеционных мутантов Nogo сформировали с помощью методов рекомбинантной ДНК в соответствии с описанным в разделе 6.2.7. Участки Nogo, которые присутствуют в делеционных мутантах, показаны на фиг.18. В конкретном варианте настоящее изобретение представляет фрагменты Nogo, например, фрагменты, включающие (или, как альтернатива, состоящие из) аминокислоты положений 1-171, 172-974, 259-542, 542-722, 722-974, 172-259 или 975-1162 из состава Nogo-A (SEQ ID NO 2) или сочетания вышеуказанного. Также представляются укороченные мутанты Nogo, утратившие аминокислоты положений 172-259 и/или 975-1162 из SEQ ID NO 2, поскольку эти участки, как считается, не являются ключевыми и могут быть удалены из Nogo без нарушения биологической активности. Также представляются соответствующие фрагменты Nogo-A человека, включающие (или, как альтернатива, состоящие из) аминокислоты положений 1-131, 132-939, 206-501, 501-680, 132-206, 680-939 или 940-1127 из состава SEQ ID NO 29. Также представляются укороченные мутанты Nogo-A человека, которые утратили аминокислоты положений 132-206, аминокислотные остатки 939-1127 или аминокислотные остатки 132-206 и 939-1127 из состава SEQ ID NO 29.
В конкретном варианте фрагменты свободны от всякого другого миелинового материала ЦНС и/или проявляют ингибиторную активность Nogo. Также представляются химерные белки, включающие один или большее число указанных выше фрагментов, химеризованных на иную, чем Nogo, последовательность.
Производные гена Nogo могут быть получены путем изменения последовательностей Nogo с помощью замен, вставок или делений, в результате чего образуются функционально эквивалентные молекулы. Благодаря вырожденности кода нуклеотидных последовательностей, другие последовательности ДНК, которые кодируют по существу ту же аминокислотную последовательность, что и ген Nogo, могут быть использованы в практике настоящего изобретения. Они включают, тем самым не ограничиваясь, нуклеотидные последовательности, включающие полностью или частично гены Nogo, которые заменены путем замен в различных кодонах и кодируют функционально эквивалентный аминокислотный остаток в пределах последовательности, что выражается в несмысловой (молчащей) замене. Таким же образом производные Nogo по настоящему изобретению охватывают, тем самым не ограничиваясь, те производные, которые в качестве первичной аминокислотной последовательности включают полностью или частично аминокислотную последовательность белка Nogo, включая измененные последовательности, в составе которых функционально эквивалентные аминокислотные остатки заменены на остатки в пределах последовательности, обусловливающие молчащие замены. Например, один или большее число аминокислотных остатков в пределах последовательности могут быть по консервативному типу заменены на другую аминокислоту со сходной полярностью, которая является функционально эквивалентной, обусловливая молчащую замену. Замены аминокислоте в составе последовательности можно выбрать среди других членов того класса, к которому относится эта аминокислота. Например, неполярными (гидрофобными) аминокислотами являются аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Полярными нейтральными аминокислотами являются глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженными (основными) аминокислотами являются аргинин, лизин и гистидин. Отрицательно заряженными (кислыми) аминокислотами являются аспарагиновая кислота и глутаминовая кислота.
В конкретном варианте настоящего изобретения представляются белки, состоящие из или включающие фрагмент белка Nogo, состоящий по крайней мере из 10 (подряд расположенных) аминокислот белка Nogo. В других вариантах фрагменты состоят из по крайней мере 17-50 аминокислот белка Nogo. В конкретных вариантах такие фрагменты не превышают в длину 35, 100 или 200 аминокислот. Производные или аналоги Nogo включают, тем самым не ограничиваясь, те молекулы, которые включают участки, в существенной степени гомологичные Nogo или его фрагментам (например, в различных вариантах идентичные по крайней мере на 60% или 70%, или 80%, или 90%, или 95% по аминокислотной последовательности идентичного размера или при сравнении с сопоставляемой последовательностью, когда сопоставление выполняется с помощью компьютерной программы анализа гомологии, известной в данной области техники, например, с помощью поисковой программы BLAST (Altschul et al., 1994, Nature Genet., 6, 119-129)), или те молекулы, для которых кодирующие нуклеиновые кислоты способны гибридизоваться с кодирующей последовательностью Nogo в жестких, умеренно жестких или нежестких условиях.
Также представляются молекулы, включающие фрагменты Nogo, например, включающие углеводородные связки с другими составляющими, включая метки или биологически активные составляющие.
Производные и аналоги Nogo по настоящему изобретению могут быть получены с помощью различные методов, известных в данной области техники. Манипуляции, которые приводят к их получению, могут проводиться на уровне гена или белка. Например, клонированная последовательность Nogo может быть модифицирована с помощью многочисленных стратегий, известных в данной области техники (Т.Maniatis, 1990, "Molecular Cloning: A Practical Manual", 2d ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, New York). Последовательность может быть расщеплена по подходящим сайтам с помощью рестриктазы (рестриктаз) с последующими ферментной модификацией, если это желательно, выделением и лигированием in vitro. При получении гена, кодирующего производное или аналог Nogo, должна быть проявлена тщательность, чтобы обеспечить сохранение модифицированного гена в пределах той же самой трансляционной рамки считывания, что и Nogo, без прерывания ее стоп-кодонами в тех участках гена Nogo, которые кодируют желательную активность Nogo.
Кроме того, последовательность нуклеиновой кислоты, кодирующей Nogo, может быть мутирована in vitro или in vivo с целью создания и/или нарушения трансляции, инициации и/или терминации последовательностей или создания вариаций кодирующих участков и/или формирования новых рестрикционных сайтов или разрушения ранее существующих рестрикционных сайтов для облегчения дальнейшей модификации in vitro. Может быть использован любой метод мутагенеза, известный в данной области техники, включая, но тем самым не ограничиваясь, химический мутагенез, сайт-специфичный (направленный) мутагенез in vitro (С.Hurchinson et al., 1978, J. Biol. Chem., 253, 6551), использование линкеров TAB® (Pharmacia) и т.п.
Манипуляции с последовательностью Nogo также могут быть выполнены на уровне белка. В объем настоящего изобретения включаются фрагменты белка Nogo или другие его производные или аналоги, которые по-разному модифицированы в процессе трансляции или после нее, например, путем гликозилирования, ацетилирования, фосфорилирования, амидирования, дериватизации известными защитными/блокирующими группами, протеолитического расщепления, связывания с молекулой антитела или другим клеточным лигандом и т.п. Любые из многочисленных химических модификаций могут быть осуществлены с помощью известных методов, включая, но тем самым не ограничиваясь, специфическое химическое расщепление цианбромидом, трипсином, химотрипсином, папаином, протеазой V8, NaBH4; ацетилирование, формилирование, окисление, восстановление; метаболический синтез в присутствии туникамицина; и т.п.
Кроме того, аналоги и производные Nogo могут быть синтезированы химическим путем. Например, пептид, соответствующий части белка Nogo, которая включает желательный домен или которая опосредует желательную активность in vitro, может быть синтезирован с помощью пептидного синтезатора. Более того, если желательно, нетипичные аминокислоты или химические аналоги аминокислот могут быть внесены в последовательность Nogo путем замены или вставки. Нетипичными аминокислотами являются, тем самым не исчерпываясь, D-изомеры обычных аминокислот, α-аминоизомасляная кислота, 4-амино-масляная кислота, Abu, 2-аминомасляная кислота, γ-Abu, ε-Ahx, 6-аминогексаноевая кислота, Aib, 2-аминоизомасляная кислота, 3-аминопропионовая кислота, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, цистеиновая кислота, трет-бутилглицин, трет-бутилаланин, фенилглицин, циклогексилаланин, β-аланин, фтораминокислоты, сконструированные аминокислоты, такие как β-метиламинокислоты, Сα-метил-аминокислоты, Nα-матиламинокислоты и аминокислотные аналоги в целом. Более того, аминокислота может быть D (правовращающей) или L (левовращающей).
В конкретном варианте производное Nogo является химерным или гибридным белком, включающим белок Nogo или его фрагмент (предпочтительно включающий, по крайней мере, домен или мотив белка Nogo или, по крайней мере, 10 аминокислот из белка Nogo), соединенный пептидной связью по С- или N-концу с аминокислотной последовательностью другого белка. В одном варианте такой химерный белок получают в результате рекомбинантной экспрессии нуклеиновой кислоты, кодирующей белок (включающей последовательность, кодирующую Nogo, соединенную в общей рамке с кодирующей последовательностью другого белка). Такой химерный продукт может быть получен путем лигирования друг на друга последовательностей подходящих нуклеиновых кислот, кодирующих желательные аминокислотные последовательности, с помощью методов, известных в данной области техники, в точную кодирующую рамку с последующей экспрессией химерного продукта с помощью обычных методов, известных в данной области техники. Как альтернатива такой химерный продукт может быть получен с помощью методов белкового синтеза, например, с использованием пептидного синтезатора. Могут быть сконструированы химерные гены, включающие части Nogo, химеризованные на любые последовательности, кодирующие гетерологичные белки. Такие последовательности, кодирующие гетерологичные белки, включают, например, гексагистидиновую метку и Т7-метку. Конкретный вариант касается химерного белка, включающего фрагмент Nogo из по крайней мере шести аминокислот.
В другом конкретном варианте производное Nogo является молекулой, включающей участок гомологии с белком Nogo.
В предпочтительном варианте производные Nogo (например, фрагменты) являются белками, которые не встречаются в естественных условиях.
Другие конкретные варианты производных и аналогов описаны в подразделе ниже и далее в разделе примеров.
5.6.1. Производные Nogo, включающие один или несколько доменов этого белка
В конкретном варианте настоящее изобретение касается производных и аналогов Nogo, в частности, фрагментов и производных таких фрагментов, которые включают или, как альтернатива, состоят из одного или большего числа доменов белка Nogo, включая, но тем самым не ограничиваясь, консервативные С-концевые и гидрофобные домены или N-концевой кислый или богатый пролином домены, функциональные (например, по связыванию) фрагменты любого из вышеперечисленного или любые сочетания вышеперечисленного.
Конкретный вариант касается молекул, включающих конкретные фрагменты Nogo, которые являются теми фрагментами соответствующего белка Nogo, которые в наибольшей степени гомологичны конкретным фрагментам белка Nogo крысы или быка. Фрагмент, включающий домен гомолога Nogo, может быть идентифицирован путем анализа белка методами, описанными в разделах 6.1.2, 6.1.8, 6.1.9, 6.1.10, 6.1.11 или 6.1.12.
В другом конкретном варианте представляется молекула, которая включает один или большее число доменов (или их функциональных частей) белка Nogo, но которые также лишены одного или большего числа доменов (или их функциональных частей) белка Nogo. В другом варианте представляется молекула, которая включает один или большее число доменов (или их функциональных частей) белка Nogo и которая имеет один или большее число мутантных (например, вследствие делеции или точковой(ых) мутации(й)) доменов белка Nogo (например, таким образом, что мутантный домен характеризуется ослабленной функцией).
5.7. Тесты белков Nogo, их производных и аналогов
Функциональная активность белков Nogo, производных и аналогов может быть проанализирована с помощью различных способов. Описание функциональных тестов в нижеследующих разделах не призвано быть ограничивающим и может включать другие тесты, известные специалистам в данной области техники.
5.7.1. Тест Nogo на подавление роста нейритов in vitro
В конкретном варианте белки Nogo, его производные и аналоги могут быть протестированы по подавлению распределения клеток NIH-3T3 или подавлению разрастания нейритов РС12 с использованием тканевой культуры in vitro (раздел 6.1.10).
В альтернативном варианте белки Nogo, его производные и аналоги могут быть использованы в тесте на коллапс конуса нарастания у эксплантатов куриных заднекорешковых ганглиев, индуцированный присутствием Nogo. Сходным образом функция Nogo может быть протестирована по подавлению разрастания нейритов в эксплантате куриных заднекорешковых ганглиев (Spillman et al., 1998, J. Biol. Chem., 273, 19283-19293).
5.7.2. Тесты Nogo на функциональные свойства in vivo
В одном примере антагонисты белков Nogo, производных и аналогов могут быть использованы для функциональных тестов in vivo на животной модели регенерации корково-спинно-мозгового пути (КСП) на значительных расстояниях и восстановление поведенческих реакций.
В предпочтительном варианте корково-спинно-мозговой путь грызуна повреждают путем хирургической резекции и контузии спинного мозга, и этому животному вводят антагонисты Nogo. Нейропластичность, регенерацию и восстановление функций по сравнению с необработанными контрольными животными или животными, которым ввели контрольные антитела, контролируют по структурной пластичности или регенерации анатомическими методами, в основном путем мечения определенных нервных путей. Функциональное восстановление определяют по двигательной активности и по электрофизиологическим показателям этого грызуна (например, тест с липкой бумагой, задача нахождения пищи и т.п.) (Thallmair et al., 1998, Nat. Neuroscience, 1 [2], 124-131).
5.7.3. Подавление связывания лиганда Nogo и тестирование этого
В одном варианте, когда тестируется способность связывания или конкуренции с Nogo дикого типа за связывание с анти-Nogo антителом, могут быть использованы различные иммунологические тесты, известные в данной области техники, включая, но тем самым не ограничиваясь, конкурентные и неконкурентные тест-системы, основанные на таких методах, как радиоиммунологические тесты, ТИФА (твердофазный иммуноферментный анализ), иммунологические «сэндвич»-тесты, иммунорадиометрические тесты, гель-диффузные реакции с преципитином, иммунодиффузные тесты, иммунологические тесты in situ (с использованием коллоидного золота, фермента или радиоактивных изотопов-меток, например), Вестерн-блоттинг, реакции преципитации, тесты на агглютинацию (например, гельагглютинационные тесты, гемагглютинационные тесты), тесты на фиксацию комплемента, иммунофлуоресцентные тесты, тесты с белком-А и иммуноэлектрофоретические тесты и т.п. В одном варианте связывание антитела выявляют путем детекции метки в первичном антителе. В другом варианте первичное антитело выявляют путем детекции связывания вторичного антитела или реагента с первичным антителом. В следующем варианте помечают вторичное антитело. В данной области техники известно много способов детекции связывания в иммунологическом тесте, что попадает в объем настоящего изобретения.
В другом варианте, когда идентифицируют белок, связывающийся с Nogo, связывание может быть проанализировано, например, с помощью хорошо известных в данной области техники способов. В другом варианте можно протестировать свойства, физиологически ассоциированные со связыванием Nogo с его субстратами.
Другие способы известны специалистам в данной области техники и попадают в объем настоящего изобретения.
5.8. Терапевтические применения
Изобретение представляет лечение или профилактику различных заболеваний и расстройств путем введения терапевтического соединения (обозначаемого здесь как «терапевтическое средство»). Такими «терапевтическими средствами» являются, тем самым не ограничиваясь: белки Nogo, их аналоги и производные (включая фрагменты) (например в соответствии с описанным здесь выше); антитела к ним (в соответствии с описанным здесь выше); нуклеиновые кислоты, кодирующие белки Nogo, аналоги или производные (например в соответствии с описанным здесь выше); антисмысловые нуклеиновые кислоты Nogo, а также агонисты и антагонисты Nogo. Расстройства, связанные с разрегулированным клеточным ростом, например, опухоли ЦНС, подвергают лечению или профилактике путем введения терапевтического средства, которое активирует функцию Nogo. Лечение расстройств, при которых нарушены или являются желательными рост, регенерация или поддержание нейритов, осуществляют путем введения терапевтического средства, которое является антагонистом (ингибитором) функции Nogo. Указанное выше подробно описано в нижеследующих подразделах.
В целом предпочтительным является введение продуктов, происходящих от вида или реактивных по отношению к виду (в случае антител), который является тем же видом, к которому относится пациент. Таким образом, в предпочтительном варианте белок Nogo человека, производное или аналог, или нуклеиновая кислота, или антитело к белку Nogo человека вводят человеку-пациенту в лечебных или профилактических целях.
5.8.1. Лечение и профилактика заболевании, связанных с нарушенным клеточным ростом
Для лечения или профилактики заболеваний и расстройств, связанных с нарушением клеточного роста, используют введение терапевтического средства, которое активирует (т.е. усиливает или восполняет) функцию Nogo. Примерами такого терапевтического средства являются, тем самым не ограничиваясь, белки Nogo, производные или фрагменты, которые функционально активны, в частности, которые активны по подавлению разрастания нейритов или подавлению клеточного роста (например, как показано в тестах in vitro или в животных моделях), и нуклеиновые кислоты, кодирующие белок Nogo или функционально активные его производное или фрагмент (например, для использования в генотерапии). Предпочтительно белки Nogo, их производные или фрагменты свободны от всякого другого миелинового материала ЦНС, с которым они связаны в естественных условиях. Другие терапевтические средства, которые можно использовать, например, агонисты Nogo, могут быть идентифицированы с использованием тестов in vitro или животных моделей, примеры которых описаны далее.
В конкретных вариантах терапевтические средства, которые активируют функцию Nogo, вводят для лечения (включая профилактику): (1) заболеваний или расстройств, связанных с отсутствием или снижением (по отношению к норме или желаемому уровню) уровня или функции белка Nogo, например, у пациентов, у которых белок Nogo утрачен, генетически дефектен, биологически неактивен или снижен в активности, или экспрессирован в меньшей степени; или (2) заболеваний или расстройств, при которых тесты in vitro (или in vivo) (см. далее) указывают на применимость введения агонистов Nogo. Отсутствие или сниженные уровень или функции белка Nogo могут быть легко выявлены, например, путем взятия образца ткани пациента (например, с помощью тканевой биопсии) и тестирования его in vitro на уровни РНК или белка, структуру и/или активность экспрессированных РНК или белка Nogo. При этом могут быть использованы разнообразные методы, являющиеся стандартными для данной области техники, включая, но тем самым не исчерпываясь, киназные тесты, иммунологические тесты с целью выявления и/или визуализации белка Nogo (например, Вестерн-блоттинг, иммунопреципитация с последующим электрофорезом с додецилсульфатом натрия в полиакриламидном геле, иммуноцитохимический анализ и др.), и/или гибридизационные тесты с целью выявления экспрессии Nogo путем детекции и/или визуализации мРНК Nogo (например, тесты на основе Нозерн-блоттинга, дот-блот-гибридизация, гибридизация in situ и т.п.) и др.
Заболевания и расстройства, связанные с нарушением регуляции роста клеток, лечение и профилактика которых возможна, включают, тем самым не ограничиваясь, пролиферативные расстройства, злокачественные опухоли, опухоли нервной системы и др. Их примеры подробно описаны далее.
5.8.1.1. Новообразовательный рост
Новообразовательный (опухолевый) рост и связанные с ним заболевания, лечение или профилактика которых возможна путем введения терапевтического средства, которое активирует функцию Nogo, включают, тем самым не ограничиваясь, те заболевания, которые перечислены в табл.1 (как обзор таких заболеваний, см. Fishman et al., 1985, "Medicine", 2d ed., J.B.Lippincott Co., Philadelphia).
В конкретных вариантах проводится лечение или профилактика злокачественных или диспролиферативных изменений (таких как метаплазии и дисплазии) или гиперпролиферативных заболеваний в центральной нервной системе, спинном мозге или любой нервной ткани.
5.8.1.2. Предраковые состояния
Терапевтические средства по настоящему изобретению, которые запускают активность Nogo, также можно вводить с целью лечения предраковых состояний и профилактики развития в новообразовательного или злокачественного состояния, включая, но тем самым не ограничиваясь, те заболевания, которые перечислены в табл.1. Такое профилактическое или терапевтическое применение показано в условиях, известных или ожидаемых из предшествующей прогрессии в новообразование или рак, в частности, когда гиперплазия, метаплазия и особенно дисплазия захватывает рост неновообразовательных клеток (как обзор таких аномальных параметров роста см. Robbins & Angell, 1976, "Basic Pathology", 2d ed., W.B.Saunders Co., Philadelphia, pp.68-79). Гиперплазия является формой контролируемой клеточной пролиферации, проявляющейся в увеличении числа клеток в ткани или органе без существенного изменения их структуры или функции. Метаплазия является формой контролируемого роста клеток, при котором один тип зрелых или полностью дифференцировавшихся клеток заменяет другой тип зрелых клеток. Метаплазия может происходить в клетках эпителиальной или соединительной ткани. Атипичная метаплазия включает в некоторой степени нарушенный метапластический эпителий. Дисплазия часто бывает предшественником рака и обнаруживается в основном в эпителии: она является наиболее сильно нарушенной формой роста неопухолевых клеток, включая утрату однообразия отдельных клеток и структурной ориентации клеток. Диспластические клетки часто имеют аномально крупные, интенсивно прокрашиваемые ядра и характеризуются плеоморфизмом. Характерно наличие дисплазии при существовании хронического раздражения или воспаления.
В качестве альтернативы или в дополнение к присутствию аномального роста клеток, характеризуемого как гиперплазия, метаплазия или дисплазия, присутствие одного или большего числа симптомов трансформированного фенотипа или злокачественного фенотипа, проявляющихся in vivo или проявляющихся in vitro в образце клеток, взятом от больного, может указывать на желательность профилактического/лечебного введения терапевтического средства, которое активирует функцию Nogo. Как было указано выше, такими параметрами трансформированного фенотипа являются морфологические изменения, ослабление прикрепления к субстрату, утрата контактного торможения, утрата зависимости от якорной подложки, секреция протеазы, интенсификация углеводного транспорта, снижение потребности в сыворотке, экспрессия плодных антигенов, разрушение поверхностно-клеточного белка с молекулярной массой 250000 Д и т.п.(см. также цитированное выше, pp.84-90, где даны характеристики трансформированного или злокачественного фенотипа).
В других вариантах лечение больного, у которого выявляют один или большее число следующих факторов предрасположенности к злокачественным новообразованиям, проводят путем введения эффективного количества терапевтического средства: нейрофиброматоз фон-Реклингхаузена или ретинобластома: см. Robbins & Angell, 1976, "Basic Pathology", 2d ed., W.B.Saunders Co., Philadelphia, pp.112-113, и т.п.
В другом конкретном варианте терапевтическое средство по настоящему изобретению вводят пациенту-человеку с целью профилактики прогрессирования рака почек, хряща (грудины), кожи, скелетной мускулатуры, легких или селезенки, меланомы или саркомы.
5.8.1.3. Гиперпролиферативные и диспролиферативные заболевания
В другом варианте настоящего изобретения терапевтическое средство, которое запускает активность Nogo, используют для лечения или профилактики гиперпролиферативных или доброкачественных диспролиферативных заболеваний. Конкретные варианты направлены на лечение или профилактику цирроза печени (состояние, при котором рубцевание превосходит процессы нормальной регенерации печени), лечение образования келоидного рубца (гипертрофированный рубец) (поражение кожи, при котором процесс рубцевания превалирует над нормальным процессом обновления), псориаза (обычное состояние кожи, характеризующееся избыточной пролиферацией кожи и задержкой нормальной клеточной дифференцировки), доброкачественных опухолей, фиброзно-кистозных состояний и гипертрофии тканей (например, гиперплазия предстательной железы).
5.8.1.4. Генотерапия
В конкретном варианте нуклеиновые кислоты, включающие последовательность, кодирующую белок Nogo или его функциональное производное, вводят с целью активации функции Nogo, что является генотерапевтическим путем. Генотерапия обозначает терапию, осуществляемую путем введения субъекту нуклеиновой кислоты. В этом варианте настоящего изобретения нуклеиновая кислота вырабатывает кодируемый ею белок, который обеспечивает терапевтический эффект за счет активации функции Nogo.
Любой известный в данной области техники генотерапевтический способ можно использовать в соответствии с настоящим изобретением. Примеры таких способов описаны ниже.
Как базовые обзоры генотерапевтических способов, см. Goldspiel et al., 1993, Clinical Pharmacy, 12, 488-505; Wu & Wu, 1991, Biotherapy, 3, 87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol., 32, 573-596; Mulligan, 1993, Science, 260, 926-932; и Morgan & Anderson, 1993, Ann. Rev. Biochem., 62, 191-217; May, 1993, TIBTECH, 11 (5), 155-215. Известные в данной области техники способы, основанные на технологиях рекомбинантной ДНК, которые можно использовать, описаны у Ausubel et al., eds., 1993, "Current Protocols in Molecular Biology", John Wiley & Sons, NY; и Kriegler, 1990, "Gene Transfer and Expression: A Laboratory Manual", Stockton Press, NY.
В предпочтительном аспекте терапевтическое средство содержит нуклеиновую кислоту Nogo, являющуюся частью экспрессирующего вектора, который экспрессирует белок Nogo или его фрагмент, или химерный белок в подходящем хозяине. В частности, такая нуклеиновая кислота включает промотор, функционально присоединенный к кодирующему сегменту Nogo, причем упомянутый промотор является конститутивным или индуцибельным и необязательно тканеспецифичным. В другом конкретном варианте используют молекулу нуклеиновой кислоты, в которой кодирующие последовательности Nogo и любые другие желательные последовательности фланкированы участками, которые обеспечивают гомологичную рекомбинацию в желаемом сайте генома, что тем самым обусловливает внутрихромосомную экспрессию нуклеиновой кислоты Nogo (Koller & Smithies, 1989, Proc. Natl. Acad. Sci. USA, 86, 8932-8935; Zijlstra et al., 1989, Nature, 342, 435-438).
Доставка нуклеиновой кислоты пациенту может быть либо прямой (в этом случае пациент непосредственно подвергается воздействию нуклеиновой кислоты или вектора, несущего нуклеиновую кислоту) или непрямой, когда клетки сначала трансформируют нуклеиновой кислотой in vitro и затем трансплантируют пациенту. Эти два подхода известны соответственно как генотерапия in vivo или генотерапия ех vivo.
В конкретном варианте нуклеиновую кислоту напрямую вводят in vivo, где она экспрессируется с образованием кодируемого продукта. Этого можно достичь с помощью любого из многочисленных методов, известных в данной области техники, например путем конструирования ее в виде части подходящего экспрессирующего нуклеиновую кислоту вектора и введения его таким образом, чтобы он стал внутриклеточным, например путем инфицирования с использованием дефектного или ослабленного ретровирусного или иного вирусного вектора (см. патент США №4980286), или путем прямой инъекции «голой» ДНК, или путем использования бомбардировки микрочастицами (например, с помощью «генного ружья»: Biolistic, Dupont), или покрытия липидами или поверхностно-клеточными рецепторами или трансфицирующими агентами, инкапсуляции в липосомы, микрочастицы или микрокапсулы, или путем введения ее в связи с пептидом, для которого известно проникновение в ядро путем введения ее в связи с лигандом, обеспечивающим опосредованный рецептором эндоцитоз (см., например, Wu & Wu, 1987, J. Biol. Chem., 262, 4429-4432) (что может быть использовано для направления на те клеточные типы, которые специфически экспрессируют соответствующие рецепторы), и т.п. В другом варианте может быть образован комплекс нуклеиновой кислоты и лиганда, в котором лиганд включает вызывающий слияние вирусный пептид, призванный разрушать эндосомы, что позволяет нуклеиновой кислоте избегать лизосомного разрушения. Еще в одном варианте нуклеиновая кислота может быть in vivo нацелена на специфичное по типу клеток поглощение и экспрессию путем нацеливания на конкретный рецептор (см., например, международные патентные заявки WO 92/06180 от 16 апреля 1992 г.(Wu et al.,); WO 92/22635 от 23 декабря 1992 г.(Wilson et al.); WO 92/20316 от 26 ноября 1992 г. (Findeis et al.); WO 93/14188 от 22 июля 1993 г. (Clarke et al.); WO 93/20221 от 14 октября 1993 г. (Young)). Как альтернатива нуклеиновую кислоту можно внести внутрь клеток и встроить для экспрессии в ДНК клетки-хозяина с помощью гомологичной рекомбинации (Koller & Smithies, 1989, Proc. Natl. Acad. Sci. USA, 86, 8932-8935; Zijlstra et al., 1989, Nature, 342, 435-438).
В конкретном варианте используют вирусный вектор, который включает нуклеиновую кислоту Nogo. Например, можно использовать ретровирусный вектор (см. Miller et al., 1993, Meth. Enzymol., 217, 581-599). Эти ретровирусные векторы были модифицированы с целью удаления ретровирусных последовательностей, которые не являются необходимыми для упаковки вирусного генома и интеграции в ДНК клетки-хозяина. Предназначенную для генотерапевтического использования нуклеиновую кислоту Nogo клонируют в вектор, который обеспечивает доставку гена пациенту. Более подробное описание ретровирусных векторов можно найти у Boesen et al., 1994, Biotherapy, 6, 291-302, где описано использование ретровирусного вектора для доставки гена mdr1 в кроветворные стволовые клетки с целью повышения резистентности стволовых клеток к химиотерапии. Другие библиографические ссылки, иллюстрирующие применение ретровирусных векторов в генотерапии, таковы: Clowes et al., 1994, J. Clin. Invest., 93, 644-651; Kiem et al., 1994, Blood, 83, 1467-1473; Salmons & Gunzberg, 1993, Human Gene Therapy, 4, 129-141; и Grossman & Wilson, 1993, Curr. Opinion Genetics and Develop., 3, 110-114.
Аденовирусы являются другими вирусными векторами, которые можно использовать в генотерапии. Аденовирусы являются особенно привлекательными носителями в случае доставки генов в центральную нервную систему. В естественных условиях аденовирусы инфицируют дыхательный эпителий, где они вызывают заболевание слабой степени. Другими мишенями доставочных систем на основе аденовирусов являются печень, дыхательный эпителий, эндотелиальные клетки и мышцы. Преимущество аденовирусов состоит в том, что они способны инфицировать неделящиеся клетки. Обзор гемотерапии на основе аденовирусов представлен у Kozarsky & Wilson, 1993, Current Opinion in Genetics and Development, 3, 499-503. Было описано (Bout et al., 1994, Human Gene Therapy, 5, 3-10) использование аденовирусных векторов для переноса генов в дыхательный эпителий макаки-резус. Другие примеры использования аденовирусов в генотерапии можно найти у Rosenfeld et al., 1991, Science, 252, 431-434; Rosenfeld et al., 1992, Cell, 68, 1430155; и Mastrangeli et al., 1993, J. Clin. Invest., 91, 225-234.
В дополнение в аденовирусам также была подтверждена возможность использования адено-ассоциированного вируса (AAV) для генотерапии (Walsh et al., 1993, Proc. Soc. Exp. Biol. Med., 204, 289-300).
Другой генотерапевтический подход включает внесение гена в клетки тканевой культуры с помощью таких методов, как электропорация, липофекция, трансфекция с фосфатом кальция или вирусная инфекция. Обычно способ внесения включает внесение в клетки селективного маркера. Затем клетки помещают в селективные условия с целью выделения тех клеток, которые поглотили и проэкспрессировали вносимый ген. Эти клетки затем доставляют пациенту.
В этом варианте нуклеиновую кислоту вносят в клетку до введения in vivo полученной в результате рекомбинантной клетки. Такое внесение может быть осуществлено с помощью любого метода, известного в данной области техники, включая, но тем самым не ограничиваясь, трансфекцию, электропорацию, микроинъекцию, инфекцию вирусным или фаговым вектором, включающим последовательности нуклеиновой кислоты, слияние клеток, хромосомный перенос генов, перенос генов с помощью микроклеток, слияние сферопластов и т.п. Многочисленные методы известны в данной области техники в связи с внесением чужеродных генов в клетки (см., например, Loeffler & Behr, 1993, Meth. Enzymol., 217, 599-618; Cohen et al., 1993, Meth. Enzymol., 217, 618-644; Cline, 1985, Pharmac. Ther., 29, 69-92) и могут быть использованы в соответствии с настоящим изобретением, лишь бы необходимые онтогенетические и физиологические функции клеток-реципиентов не нарушались. Метод должен обеспечивать стабильный перенос нуклеиновой кислоты в клетку таким образом, чтобы нуклеиновая кислота экспрессировалась клеткой и предпочтительно наследовалась и экспрессировалась потомством этой клетки.
Полученные в результате рекомбинантные клетки могут быть доставлены пациенту с помощью различных методов, известных в данной области техники. В предпочтительном варианте эпителиальные клетки инъецируют, например, подкожно. В другом варианте рекомбинантные кожные клетки могут быть использованы в качестве кожного трансплантата для пересадки пациенту. Рекомбинантные клетки крови (например, кроветворные стволовые клетки или клетки-предшественники) предпочтительно вводят внутривенно. Количество клеток, предусмотренных для использования, зависит от желаемого эффекта, состояния пациента и т.п. и может быть определено специалистом в данной области техники.
Клетки, в которые нуклеиновая кислота может быть внесена для генотерапевтических целей, охватывают любой желательный доступный клеточный тип и включают, тем самым не ограничиваясь, эпителиальные клетки, эндотелиальные клетки, кератиноциты, фибробласты, мышечные клетки, гепатоциты, клетки крови, такие как Т-лимфоциты, В-лимфоциты, моноциты, макрофаги, нейтрофилы, эозинофилы, мегакариоциты, гранулоциты, различные стволовые клетки или клетки-предшественники, в частности кроветворные стволовые клетки или клетки-предшественники, например, выделенные из костного мозга, пуповины, периферической крови, печени плода и т.п.
В предпочтительном варианте используемые в генотерапии клетки аутологичны пациенту.
В варианте, в котором в генотерапии используют рекомбинантные клетки, нуклеиновую кислоту Nogo вносят в клетки таким образом, чтобы она экспрессировалась этими клетками или их потомством, а рекомбинантные клетки затем вводят in vivo для достижения терапевтического эффекта. В конкретном варианте используют стволовые клетки или клетки-предшественники. Любые стволовые клетки и/или клетки-предшественники, которые можно выделить и поддержать in vitro, могут быть потенциально использованы в соответствии с данным вариантом настоящего изобретения. Такими стволовыми клетками являются, тем самым не ограничиваясь, нервные стволовые клетки (Stemple & Anderson, 1992, Cell, 71, 973-985).
В конкретном варианте предназначенная для внесения в генотерапевтических целях нуклеиновая кислота включает индуцибельный промотор, функционально присоединенный к кодирующему сегменту таким образом, чтобы экспрессия нуклеиновой кислоты находилась под контролем присутствия или отсутствия подходящего индуктора транскрипции.
Дополнительные способы могут быть адаптированы для использования в доставке нуклеиновой кислоты, кодирующей белок Nogo или функциональное производное.
5.8.2. Лечение и профилактика заболевании, при которых Nogo блокирует регенерацию
Лечение заболеваний и расстройств, при которых желательными являются разрастание, рост или регенерация нейритов, проводят путем введения терапевтического средства, которое является антагонистом (ингибитором) функции Nogo. Заболевания, расстройства или повреждения, которые в конечном счете приводят к повреждениям нервной системы, включают, тем самым не исчерпываясь, травму центральной нервной системы (ЦНС) (например, раны спинного мозга или головного мозга), инфаркт, инфекцию, злокачественную опухоль, воздействие токсикантов, дефицит питания, паранеопластические синдромы и нейродегенеративные синдромы (включая, но тем самым не исчерпываясь, болезнь Альцгеймера, болезнь Паркинсона, хорею Гентингтона, рассеянный склероз, боковой амиотрофический склероз и прогрессирующий надъядерный паралич); путем введения соединений, которые блокируют активность Nogo (например, доминантно-негативное производное Nogo; антитела к Nogo; антисмысловые нуклеиновые кислоты Nogo; рибозимы Nogo или химические группы, которые связываются в активном сайте Nogo).
Терапевтические средства, которые можно использовать, включают, тем самым не ограничиваясь, антисмысловые нуклеиновые кислоты Nogo и нуклеиновые кислоты Nogo, которые являются дисфункциональными (например, вследствие гетерологичной (не относящейся к последовательности Nogo) вставки в кодирующую последовательность Nogo), которые используют для «выключения» эндогенной функции Nogo по механизму гомологичной рекомбинации (см., например, Capecchi, 1989, Science, 244, 1288-1292). Антитела, специфичные в отношении Nogo (и их фрагменты и производные, включающие их участок связывания), могут быть использованы в качестве антагонистов Nogo. В конкретном варианте настоящего изобретения в качестве антагониста Nogo используют нуклеиновую кислоту, включающую часть гена Nogo, в которой последовательности Nogo фланкируют (с обоих 5'- и 3'-концов) последовательность другого гена с целью индукции инактивации Nogo в результате гомологичной рекомбинации (см. также Koller & Smithies, 1989, Proc. Natl. Acad. Sci. USA, 86, 8932-8935; Zijistra et al., 1989, Nature, 342, 435-438). Другие терапевтические средства, которые подавляют функцию Nogo, можно идентифицировать путем использования известных стандартных тестов in vitro, например, на основе их способности подавлять связывание Nogo с другим белком или подавлять любую известную функцию Nogo, что предпочтительно тестируют in vitro или в клеточной культуре, хотя также можно использовать и генетические тесты. Предпочтительно подходящие тесты in vitro или in vivo используют для определения влияния конкретного терапевтического средства и установления того, показано ли его введение для лечения поврежденной ткани.
В конкретных вариантах терапевтические средства, которые подавляют функцию Nogo, вводят в лечебных целях (включая профилактические цели): (1) в случае заболеваний или расстройств, связанных с увеличенным (по отношению к нормальному или желательному) уровнем белка или функции Nogo, например, у пациентов, у которых белок Nogo сверхактивен или сверхэкспрессирован; или (2) в случае заболеваний или расстройств, при которых тесты in vitro (или in vivo) указывают на применимость введения антагониста Nogo. Увеличенные уровни белка или функции Nogo легко могут быть определены, например, с помощью количественного анализа белка и/или РНК путем взятия образца ткани пациента (например, тканевой биопсии) и тестирования его на уровни РНК или белка in vitro, структуры и/или активности экспрессированных РНК или белка Nogo. Так, многие стандартные для данной области техники методы могут быть использованы, включая, но тем самым не ограничиваясь, киназные тесты, иммунологические тесты с целью выявления и/или визуализации белка Nogo (например, Вестерн-блоттинг, иммунопреципитация с последующим электрофорезом с додецилсульфатом натрия в полиакриламидном геле, иммуноцитохимический анализ и др.) и/или гибридизационные тесты с целью выявления экспрессии Nogo путем детекции и/или визуализации мРНК Nogo (например, тесты на основе Нозерн-блоттинга, дот-блот-гибридизация, гибридизация in situ и т.п.) и др.
5.8.2.1. Антисмысловая регуляция экспрессии Nogo
В конкретном варианте функцию Nogo подавляют путем использования антисмысловых нуклеиновых кислот Nogo. Настоящее изобретение представляет терапевтическое или профилактическое применение нуклеиновых кислот из по крайней мере шести нуклеотидов, которые являются антисмысловыми по отношению к гену или кДНК, кодирующим Nogo или его часть. «Антисмысловая» нуклеиновая кислота Nogo по использованию в данном тексте обозначает нуклеиновую кислоту, способную гибридизовать с частью РНК Nogo (предпочтительно мРНК) за счет определенной комплементарности последовательностей. Антисмысловая нуклеиновая кислота может быть комплементарной кодирующему и/или некодирующему сегменту мРНК Nogo. Такие антисмысловые нуклеиновые кислоты применимы в качестве терапевтических средств, которые подавляют функцию Nogo и могут быть использованы для лечения или профилактики описанных выше заболеваний.
Антисмысловые нуклеиновые кислоты по настоящему изобретению могут быть олигонуклеотидами, которые являются двухцепочечными или одноцепочечными, РНК или ДНК, или их модификациями или производными, которые можно напрямую ввести в клетку или которые могут вырабатываться внутри клетки в результате транскрипции внесенных экзогенных последовательностей.
В конкретном варианте антисмысловые нуклеиновые кислоты Nogo, представляемые настоящим изобретением, могут быть использованы для индукции регенерации нейронов в центральной нервной системе, в частности, включая регенерацию корково-спинно-мозгового пути, восстановления пластичности, возобновление роста нейронов и заживление повреждений, связанных с травматическими повреждениями, инсультами и нейродегенеративными заболеваниями.
Далее настоящее изобретение представляет фармацевтические композиции, содержащие эффективное количество антисмысловых нуклеиновых кислот Nogo по настоящему изобретению в фармацевтически приемлемом носителе, что будет описано далее.
В другом варианте настоящее изобретение направлено на способы подавления экспрессии последовательности нуклеиновой кислоты Nogo в прокариотической или эукариотической клетке, включающие обработку клетки эффективным количеством композиции, содержащей антисмысловую нуклеиновую кислоту Nogo по настоящему изобретению.
Антисмысловые нуклеиновые кислоты Nogo и их использование подробно описаны ниже.
5.8.2.1.1. Антисмысловые нуклеиновые кислоты Nogo
Антисмысловые нуклеиновые кислоты Nogo состоят по крайней мере из шести нуклеотидов и предпочтительно являются олигонуклеотидами (в диапазоне от 6- до 50-мерных олигонуклеотидов). В конкретных аспектах олигонуклеотид состоит, по крайней мере, из 10 нуклеотидов, по крайней мере, из 15 нуклеотидов, по крайней мере, из 100 нуклеотидов или, по крайней мере, из 200 нуклеотидов. Олигонуклеотиды могут быть ДНК или РНК, или химерными смесями, или их производными или модифицированными версиями, одноцепочечными или двухцепочечными. Олигонуклеотид может быть модифицирован по основанию, по сахарной составляющей или по фосфатному скелету. Олигонуклеотид может включать другие дополнительные группы, такие как пептиды, или агенты, облегчающие транспорт через клеточную мембрану (см., например, Letsinger et al., 1989, Proc. Natl. Acad. Sci. USA, 86, 6553-6556; Lemaitre et al., 1987, Proc. Natl. Acad. Sci. USA, 84, 648-652; международная патентная заявка WO 88/09810, опубликованная 15 декабря 1988 г.) или через гематоэнцефалический барьер (см., например, международную патентную заявку WO 89/10134, опубликованную 25 апреля 1988 г.), связанные с гибридизацией расщепляющие агенты (см., например, Krol et al., 1988, BioTechniques, 6, 958-976) или интеркалирующие агенты (см., например, Zon, 1988, Pharm. Res., 5, 539-549).
В предпочтительном аспекте настоящего изобретения представляется антисмысловой олигонуклеотид Nogo, предпочтительно в виде одноцепочечной ДНК. В наиболее предпочтительном аспекте такой олигонуклеотид включает последовательность, являющуюся антисмысловой по отношению к последовательности, находящейся рядом с одной из двух промоторных последовательностей гена Nogo, или последовательности, кодирующей С-концевую часть гена Nogo. Желательным может быть избирательное подавление экспрессии одной из изоформ Nogo. Олигонуклеотид можно модифицировать по любому положению его структуры заместителями, в принципе известными в данной области техники.
Антисмысловой олигонуклеотид Nogo может включать по крайней мере одно модифицированное основание, которое выбирают из группы, которая включает, тем самым не исчерпываясь, 5-фторурацил, 5-бромурацил, 5-хлорурацил, 5-иодурацил, гипоксантин, ксантин, 4-ацетилцитозин, 5-(карбоксигидроксилметил)-урацил; 5-карбоксиметиламинометил-2-тиоуридин, 5-карбоксиметиламинометилурацил, дигидроурацил, β-D-галактозилквеозин, инозин, N6-изопентениладенин, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-аденин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, β-D-маннозилквеозин, 5'-метоксикарбоксиметилурацил, 5-метоксиурацил, 2-метилтио-N6-изопентениладенин, урацил-5-оксиуксусную кислоту (v), вибутоксозин, псевдоурацил, квеозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, сложный метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту (v), 5-метил-2-тиоурацил, 3-(3-амино-3-N-2-карбоксипропил)-урацил, (acp3)w и 2,6-диаминопурин.
В другом варианте олигонуклеотид включает, по крайней мере, одну модифицированную сахарную составляющую, выбираемую из группы, которая включает, но тем самым не ограничивается, арабинозу, 2-фторарабинозу, ксилулозу и гексозу.
Еще в одном варианте олигонуклеотид включает, по крайней мере, один модифицированный фосфатный скелет, выбираемый из группы, которая включает фосфотиоат, фосфодитиоат, фосфоамидотиоат, фосфоамидат, фосфодиамидат, метилфосфонат, триэфир алкилфосфата и формацеталь или его аналоги.
Еще в одном варианте олигонуклеотид является α-аномерным олигонуклеотидом. α-аномерный олигонуклеотид образует специфичные двухцепочечные дуплексы с комплементарной РНК, в которых в отличие от обычных β-единиц цепи параллельны друг другу (Gautier et al., 1987, Nucl. Acids Res., 15, 6625-6641).
Олигонуклеотид может быть соединен с другой молекулой, например с пептидом, опосредуемым гибридизацией перекрестно сшивающим агентом, агентом-переносчиком, опосредуемым гибридизацией расщепляющим агентом и т.п.
Олигонуклеотиды по настоящему изобретению могут быть синтезированы с помощью стандартных методов, известных в данной области техники, например с использованием автоматического ДНК-синтезатора (такого как имеющиеся в продаже синтезаторы от Biosearch, Applied Biosystems и др.). Как пример, фосфотиоатные олигонуклеотиды могут быть синтезированы с помощью метода Штейна с соавт. (Stein et al., 1988, Nucl. Acids Res., 16, 3209), метилфосфонатные олигонуклеотиды можно получить с использованием подложек из полимерного стекла с контролируемым размером пор (Sarin et al., 1988, Proc. Natl. Acad. Sci. USA, 85, 7448-7451) и т.п.
В конкретном варианте антисмысловой олигонуклеотид Nogo включает каталитическую РНК, или рибозим (см., например, международную патентную заявку WO 90/11364, опубликованную 4 октября 1990 г.; Sarver et al., 1990, Science, 247, 1222-1225). В другом варианте олигонуклеотид является 2'-0-метилрибонуклеотидом (Inoue et al., 1987, Nucl. Acids Res., 15, 6131-6148) или химерным аналогом РНК/ДНК (Inoue et al., 1987, FEBS Lett., 215, 327-330).
В альтернативном варианте антисмысловую нуклеиновую кислоту Nogo по настоящему изобретению получают внутри клеток с помощью транскрипции экзогенной последовательности. Например, вектор может быть внесен in vivo таким образом, чтобы он поглощался клеткой: внутри такой клетки вектор или его часть транскрибируется, вырабатывая антисмысловую нуклеиновую кислоту (РНК) по настоящему изобретению. Такой вектор должен включать последовательность, кодирующую антисмысловую нуклеиновую кислоту Nogo. Такой вектор может оставаться эписомой или интегрироваться в хромосому, лишь бы он транскрибировался с выработкой желательной антисмысловой РНК. Такие векторы могут быть сконструированы с помощью методов рекомбинантных ДНК, стандартных для данной области техники. Векторы могут быть плазмидными, вирусными или другими, известными в данной области техники, используемыми для репликации и экспрессии в клетках млекопитающих.
Экспрессия последовательности, кодирующей антисмысловую РНК Nogo, может осуществляться с любого промотора, известного в данной области техники, который активен в клетках млекопитающих, предпочтительно человека. Такие промоторы могут быть индуцибельными или конститутивными. Такими промоторами являются, тем самым не ограничиваясь: промотор раннего сегмента SV40 (Bernoist & Chambon, 1981, Nature, 290, 304-310), промотор, включающий длинные 3'-концевые повторы вируса саркомы Рауса (Yamamoto et al., 1980, Cell, 22, 787-797), промотор тимидинкиназы герпесвируса (Wagner et al., 1981, Proc. Natl. Acad. Sci. USA, 78, 1441-1445), регуляторные последовательности гена металлотионеина (Brinster et al., 1982, Nature, 296, 39-42) и т.п.
Антисмысловые нуклеиновые кислоты по настоящему изобретению включают последовательность, комплементарную по крайней мере части РНК-транскрипта гена Nogo, предпочтительно гена Nogo человека. Однако абсолютная комплементарность, хотя и является предпочтительной, необязательна. По использованию в данном тексте последовательность, «комплементарная, по крайней мере, части РНК», обозначает последовательность, характеризующуюся комплементарностью, достаточной для того, чтобы гибридизоваться с РНК, образуя стабильный дуплекс; в случае двухцепочечных антисмысловых нуклеиновых кислот Nogo можно таким путем протестировать одну цепь дуплексной ДНК или проанализировать образование триплекса. Способность к гибридизации будет зависеть и от степени комплементарности, и от длины антисмысловой нуклеиновой кислоты. В целом чем длиннее гибридизующая нуклеиновая кислота, тем больше нуклеотидных несовпадений с РНК Nogo она может включать, образуя стабильный дуплекс (или триплекс в соответствующем случае). Для специалиста в данной области техники будет ясна допустимая степень несовпадений, для чего используют стандартные процедуры определения точки плавления гибридного комплекса.
5.8.2.1.2. Терапевтическое применение антисмысловых нуклеиновых кислот Nogo
Антисмысловые нуклеиновые кислоты Nogo могут быть использованы для лечения (или профилактики) расстройств, связанных с типом клеток, которые экспрессируют или предпочтительно сверхэкспрессируют Nogo. В конкретном варианте таким расстройством является пролиферативное заболевание. В предпочтительном варианте используют одноцепочечный антисмысловой ДНК-олигонуклеотид Nogo.
Типы клеток, которые экспрессируют или сверхэкспрессируют РНК Nogo, можно идентифицировать с помощью различных методов, известных в данной области техники. Такими методами являются, тем самым не ограничиваясь, гибридизация со специфичными для Nogo нуклеиновыми кислотами (например, с помощью Нозерн-блоттинга, дот-блот-гибридизации, гибридизации in situ), анализ способности РНК из типа клеток транслироваться in vitro в Nogo, иммунологическое тестирование и др. В предпочтительном аспекте первичная ткань от пациента может быть протестирована на экспрессию Nogo до лечения, например, иммуноцитохимически или методом гибридизации in situ.
Фармацевтические композиции по настоящему изобретению, содержащие эффективное количество антисмысловой нуклеиновой кислоты Nogo в фармацевтически приемлемом носителе, могут быть введены пациенту, у которого диагностированы заболевание или расстройство, относящееся к типу, при котором экспрессируется или сверхэкпрессируется РНК Nogo или белок.
Количество антисмысловой нуклеиновой кислоты Nogo, которое будет эффективным в лечении конкретного заболевания или состояния, будет зависеть от природы заболевания или состояния и может быть определено с помощью стандартных клинических методов. Когда это возможно, желательным является определение антисмысловой цитотоксичности опухолевого типа, предназначенного для обработки in vitro, и затем - в применимых животных моделях перед анализом и применением для человека.
В конкретном варианте фармацевтические композиции, содержащие антисмысловые нуклеиновые кислоты Nogo, вводят с помощью липосом, микрочастиц или микрокапсул. В различных вариантах настоящего изобретения можно применить такие композиции с целью достижения постепенного выделения антисмысловых нуклеиновых кислот Nogo. В конкретном варианте желательным может быть использование липосом, которые с помощью антител направлены на конкретные идентифицируемые опухолевые антигены (Leonetti et al., 1990, Proc. Natl. Acad. Sci. USA, 87, 2448-2451; Renneisen et al., 1990, J. Biol. Chem., 265, 16337-16342).
5.9. Демонстрация терапевтического или профилактического применения
Терапевтические средства по настоящему изобретению предпочтительно тестируют in vitro и затем in vivo на желательную терапевтическую или профилактическую активность перед применением для человека. Например, тесты in vitro, которые можно использовать для определения того, будет ли показано введение конкретного терапевтического средства, включают тесты с клеточными культурами in vitro, в которых образец ткани пациента выращивают в культуре и подвергают воздействию или вводят как-либо по другому терапевтическое средство с последующим наблюдением за влиянием такого терапевтического средства на образец ткани. Например, терапевтическое средство, которое является ингибитором функции Nogo, может быть протестировано путем оценки возобновления роста нейритов или функционального восстановления двигательного контроля у пациента.
В различных конкретных вариантах тесты in vitro могут быть осуществлены с использованием репрезентативных клеток из клеточных типов, вовлеченных в заболевание у пациента, с целью определения того, обладает ли терапевтическое средство желательным эффектом в отношении этих типов клеток.
Соединения для терапевтического применения могут быть протестированы в подходящих животных модельных системах перед испытаниями на человеке, включая, но тем самым не исчерпываясь, крыс, мышей, кур, крупный рогатый скот, обезьян, кроликов и др. Для тестирования in vivo перед введением человеку можно использовать любую животную модельную систему, известную в данной области техники.
5.10. Терапевтическое/профилактическое введение и композиции
Изобретение представляет способы лечения (и профилактики) путем введения субъекту эффективного количества терапевтического средства по настоящему изобретению. В предпочтительном аспекте терапевтическое средство является в существенной степени очищенным. Предпочтительным субъектом является животное, включая, но тем самым не ограничиваясь, таких животных, как коровы, свиньи, лошади, куры, кошки, собаки и др., а предпочтительно - млекопитающие, и наиболее предпочтительно - человек. В конкретном варианте субъектом является не являющееся человеком млекопитающее.
Композиции и способы введения, которые можно использовать в случае вхождения в состав терапевтического средства нуклеиновой кислоты, были описаны выше; дополнительные подходящие композиции и пути введения могут быть выбраны из тех, которые описаны здесь далее.
Известны различные доставочные системы, которые могут быть использованы для введения терапевтического средства по настоящему изобретению, например, инкапсуляция в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать терапевтическое средство, опосредованный рецепторами эндоцитоз (см., например, Wu & Wu, 1987, J. Biol. Chem., 262, 4429-4432), конструирование терапевтической нуклеиновой кислоты в качестве составной части ретровирусного или иного вектора и т.п. Способы введения включают, тем самым не ограничиваясь, внутрикожные, внутримышечные, внутрибрюшинные, внутривенные, подкожные, интраназальные, эпидуральные и пероральные пути. Соединения могут быть введены с помощью любого стандартного пути, например путем инфузии или болюсной инъекции, за счет поглощения эпителиальными или кожно-слизистыми поверхностями (например, слизистой ротовой полости, слизистой прямого и тонкого кишечника и т.п.), и могут быть введены вместе с другими биологически активными агентами. Введение может быть системным или локальным. Кроме того, желательным может быть введение фармацевтических композиций по настоящему изобретению в центральную нервную систему с помощью любого подходящего пути, включая интравентрикулярные и интратекальные инъекции; интравентрикулярная инъекция может быть облегчена использованием интравентрикулярного катетера, например, соединенного с резервуаром, таким как резервуар Оммайи. Также может быть применено внутрилегочное введение, например, с помощью использования ингалятора или распылителя и препарата с образующим аэрозоль агентом.
В конкретном варианте желательным может быть введение фармацевтических композиций по настоящему изобретению локально в область, нуждающуюся в лечении: этого можно достичь, например, тем самым не ограничиваясь, местной инфузией в процессе хирургического вмешательства, топическим применением, например, в сочетании с зашиванием раны после операции, с помощью инъекции, с помощью катетера или с использованием имплантата, причем упомянутый имплантат изготовлен из пористого, непористого или желатиноподобного материала, включая мембраны, такие как сиаластические мембраны, или волокнистый материал. В одном варианте введением может быть прямая инъекция в район (или бывший район) злокачественной опухоли или раковой или предраковой ткани.
В другом варианте терапевтическое средство может быть доставлено в носителе, в частности, в липосоме (см. Langer, 1990, Science, 249, 1527-1533; Treat et al., 1989, In "Liposomes in the Therapy of Infectious Disease and Cancer", Lopez-Berestein & Filder (eds.), Liss, New York, pp.353-365; Lopez-Berestein, там же, pp.317-327; см. ту же ссылку в целом).
Еще в одном варианте терапевтическое средство может быть доставлено в системе с контролируемой секрецией. В одном варианте можно использовать насос (см. Langer, цит.выше; Sefton, 1987, CRC Crit. Ref. Biomed. Eng., 14, 201; Buchwald et al., 1980, Surgery, 88, 507; Saudek et al., 1989, N. England J. Med., 321, 574). В другом варианте можно использовать полимерные материалы (см. "Medical Applications of Controlled Release" Langer & Wise (eds.), CRC Pres., Boca Raton, Florida (1974); "Controlled Drug Bioavailability, Drug Product Design and Performance", Smolen & Ball (eds.), Wiley, New York (1984); Ranger & Peppas, 1983, J.Macromol. Sci. Rev. Macromol. Chem., 23, 61; см. также Levy et al., 1985, Science, 228, 190; During et al., 1989, Ann. Neurol., 25, 351; Howard et al., 1989, J.Neurosurg., 71, 105). Еще в одном варианте систему с контролируемой секрецией можно поместить рядом с терапевтической мишенью, т.е. в головном мозге, в результате чего потребуется только часть системной дозы (см., например, Goodson, 1984, In "Medical Applications of Controlled Release", цит.выше. Vol.2, pp.115-138).
Другие системы с контролируемой секрецией обсуждаются в обзоре Langer, 1990, Science, 249, 1527-1533.
В конкретном варианте, в котором терапевтическое средство является нуклеиновой кислотой, кодирующей белковое терапевтическое средство, нуклеиновая кислота может быть введена in vivo с целью активации экспрессии кодируемого ей белка путем встраивания ее как части подходящего вектора, экспрессирующего нуклеиновую кислоту, и введения его таким образом, чтобы он попадал внутрь клетки, например, с использованием ретровирусного вектора (см. патент США №4980286), или путем прямой инъекции, или путем использования бомбардировки микрочастицами (например, с помощью «генного ружья»; Biolistic, Dupont), или с помощью покрытия липидами или поверхностно-клеточными рецепторами, или трансфицирующими агентами, или путем введения его в сцеплении с гомеобоксоподобным белком, для которого известно проникновение в ядро (см., например, Joliot et al., 1991, Proc. Nati. Acad. Sci. USA, 88, 1864-1868), и т.п. Как альтернатива, терапевтическое средство в виде нуклеиновой кислоты может быть введено внутрь клеток и встроено в ДНК клетки-хозяина для экспрессии по механизму гомологичной рекомбинации.
Также настоящее изобретение представляет фармацевтические композиции. Такие композиции содержат терапевтически эффективное количество терапевтического средства и фармацевтически приемлемый носитель. В конкретном варианте термин «фармацевтически приемлемый» обозначает одобрение контрольным органом правительства штата или страны, или внесение в Фармакопею США, или другие в целом известные фармакопеи для использования в отношении животных и, в частности, человека. Термин «носитель» обозначает растворитель, адъювант, наполнитель или носитель, с которым вводят терапевтическое средство. Такими фармацевтическими носителями могут быть стерильные жидкости, такие как вода и масла, включая таковые нефтяного, животного, растительного или синтетического происхождения, такие как кокосовое масло, соевое масло, минеральное масло, кунжутное масло и подобное. Вода является предпочтительным носителем, когда фармацевтическую композицию вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина также можно использовать в качестве жидких носителей, в частности для растворов для инъекций. Подходящими фармацевтическими наполнителями являются крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат натрия, глицеринмоностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, вода, этанол и подобное. Композиция, если желательно, также может содержать малые количества смачивающих или эмульгирующих агентов или буферных агентов. Такие композиции могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, препаратов длительного высвобождения и подобного. Пероральные препараты могут включать стандартные носители, такие как фармацевтической чистоты маннитол, лактозу, крахмал, стеарат магния, сахарин натрия, целлюлозу, карбонат магния и т.п. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences", E.W.Martin. Такие композиции будут содержать терапевтически эффективное количество терапевтического средства, предпочтительно в очищенной форме, вместе с подходящим количеством носителя так, чтобы получить форму для точного введения пациенту. Препарат должен соответствовать пути введения.
В предпочтительном варианте композицию приготавливают в соответствии со стандартными процедурами в виде фармацевтической композиции, адаптированной для внутривенного введения человеку. Обычно композиции для внутривенного введения являются растворами в стерильном изотоническом водном буфере. При необходимости композиции также могут содержать солюбилизирующий агент и местный анестетик, такой как лигнокаин, для смягчения боли в месте инъекции. В целом компоненты вносят либо по отдельности, либо в смеси друг с другом с виде стандартной дозы, например, в виде сухого лиофилизованного порошка или обезвоженного концентрата в герметично закрытом контейнере, таком как ампула или упаковка с указанием количества активного компонента. Когда композиция предназначена для введения путем инфузии, она может быть диспергирована в инфузионном сосуде, содержащем стерильные воду или солевой раствор фармацевтической чистоты. Когда композицию вводят путем инъекции, ампула со стерильной водой для инъекций или солевым раствором может быть предусмотрена таким образом, чтобы компоненты можно было смешивать перед введением.
Терапевтические средства по настоящему изобретению могут быть включены в композицию в нейтральной форме или в виде соли. Фармацевтически приемлемыми солями является те соли, которые образуются со свободными аминогруппами, такие как те, которые образуются соляной, фосфорной, уксусной, щавелевой, винной кислотами и т.п., и те соли, которые образуются со свободными карбоксильными группами, такие как производные от гидроксидов натрия, калия, аммония, кальция, железа, от изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.п.
Количество терапевтического средства по настоящему изобретению, которое будет эффективно в лечении конкретного заболевания или состояния, будет зависеть от природы заболевания или состояния и может быть определено с помощью стандартных клинических методов. Кроме того, тесты in vitro необязательно могут быть применены как вспомогательные при определении оптимальных диапазонов доз. Точная доза, которая должна быть использована в композиции, также будет зависеть от пути введения и тяжести заболевания или расстройства и должна быть принята в соответствии с опытом практического врача и конкретными обстоятельствами для каждого пациента. Однако подходящие диапазоны доз для внутривенного введения обычно составляют примерно 20-500 микрограмм активного компонента на килограмм массы тела. Подходящие диапазоны доз для интраназального введения обычно составляют от 0,01 пкг/кг массы тела до 1 мг/кг массы тела. Эффективные дозы могут быть экстраполированы по калибровочным кривым, полученным на материале анализа in vitro или тестирования животных моделей.
Также настоящее изобретение представляет фармацевтическую упаковку или набор, включающие один или несколько контейнеров, наполненных одним или несколькими компонентами фармацевтических композиций по настоящему изобретению. Необязательно такой(ие) контейнер(ы) должен сопровождаться этикеткой в форме, предусматриваемой контролирующим органом, с указанием производителя, пользователя или продавца фармацевтических средств или биологических продуктов, так чтобы этикета отражала одобрение контрольным органом производства, применения или реализации для введения человеку.
5.11. Диагностика и скрининг
Белки Nogo, их аналоги, производные и субпоследовательности, нуклеиновые кислоты Nogo (и комплементарные им последовательности), анти-Nogo антитела применяются в диагностике. Такие молекулы могут быть использованы в тестах, таких как иммунологические тесты, для выявления, прогнозирования, диагностики или контроля за различными состояниями, заболеваниями и расстройствами, нарушающими экспрессию Nogo, или для контроля их лечения. В частности, такой иммунологический тест осуществляют с помощью способа, включающего контакт образца, происходящего от пациента, с анти-Nogo антителом в таких условиях, чтобы происходило иммуноспецифическое связывание, с последующим выявлением или измерением уровня любого иммуноспецифического связывания с участием антитела. В конкретном аспекте такое связывание антитела на тканевых срезах может быть использовано для выявления аномальной локализации Nogo или нарушенных (например, сниженных или отсутствующих) уровней Nogo. В конкретном варианте антитело, специфичное в отношении Nogo, может быть использовано для тестирования ткани пациента или образца сыворотки на присутствие Nogo, где аномальный уровень Nogo является индикатором болезненного состояния. Под «нарушенными уровнями» понимаются повышенные или сниженные уровни по отношению к имеющемуся или стандартному уровню, представляющему имеющееся в аналогичном образце той части тела или того субъекта, у которого нет заболевания.
Иммунологические тесты, которые можно использовать, включают, тем самым не ограничиваясь, конкурентные и неконкурентные тест-системы с использованием таких методов, как иммуноцитохимические, патологические, Вестерн-блоттинг, радиоиммуннологические тесты, ТИФА (твердофазный иммуноферментный анализ), иммунологические «сэндвич»-тесты, тесты с иммунопреципитацией, реакции с преципитином, гель-диффузные преципитиновые реакции, иммунодиффузные тесты, тесты на агглютинацию, тесты на фиксацию комплемента, иммунорадиометрические тесты, флуоресцентные иммунологические тесты, иммуногистохимические тесты, иммунологические тесты с белком А и многое другое.
Гены Nogo и родственные последовательности и субпоследовательности нуклеиновых кислот, включая комплементарные последовательности, также могут быть использованы в тестах на гибридизацию. Последовательности нуклеиновых кислот Nogo или их субпоследовательности, включающие примерно по крайней мере 8 нуклеотидов, могут быть использованы в качестве зондов для гибридизации. Тесты на гибридизацию могут быть использованы для выявления, прогнозирования, диагностики или контроля состояний, расстройств или заболеваний, связанных с аномальными изменениями экспрессии и/или активности Nogo в соответствии с описанным выше. В частности, такой тест на гибридизацию проводят с помощью метода, включающего контактирование образца, содержащего нуклеиновую кислоту, с нуклеотидным зондом, способным гибридизоваться с ДНК или РНК Nogo в таких условиях, чтобы происходила гибридизация, с последующим выявлением или измерением любой произошедшей гибридизации.
В конкретных вариантах могут быть диагностированы заболевания и расстройства, вовлекающие нарушения роста и дифференцировки клеток, или может быть проведен скрининг их ожидаемого присутствия, или может быть выявлена предрасположенность к развитию таких заболеваний с помощью выявления сниженных уровней белка Nogo, РНК Nogo или функциональной активности Nogo, что выявляется по подавлению роста, или с помощью выявления мутаций в РНК, ДНК или белке Nogo (например, транслокаций в нуклеиновых кислотах Nogo, укорочения в гене или белке Nogo, изменений в нуклеотидной или аминокислотной последовательности по сравнению с Nogo дикого типа), которые обусловливают снижение экспрессии или активности Nogo. Такие заболевания и расстройства включают, тем самым не ограничиваясь, те, которые были описаны в разделе 3 и разделе 5.8.1.1. Как пример, уровни белка Nogo могут быть выявлены с помощью иммунологического теста, уровни РНК Nogo могут быть выявлены с помощью тестов на гибридизацию (например, Нозерн-блоттинга, дот-блоттинга), связывание Nogo с клеточными рецепторами белков-ингибиторов роста может быть осуществлено в тестах на связывание, хорошо известных в данной области техники, транслокации и точковые мутации в нуклеиновых кислотах Nogo могут быть выявлены с помощью Саузерн-блоттинга, ПДРФ-анализа, ПЦР с использованием праймеров, которые предпочтительно генерируют фрагмент, охватывающий, по крайней мере, большую часть гена Nogo, секвенирования геномной ДНК или кДНК Nogo, полученной от пациента, и т.п.
Также представляются наборы для диагностического применения, которые включают в одном или большем числе контейнеров анти-Nogo антитело и необязательно помеченный партнер по связыванию с антителом. Как альтернатива анти-Nogo антитело может быть помечено (с помощью выявляемого маркера, например, хемолюминесцентной, ферментной, флуоресцентной или радиоактивной группой). Также представляется набор, который включает в одном или большем числе контейнеров нуклеотидный зонд, способный гибридизоваться с РНК Nogo. В конкретном варианте набор может включать в одном или большем числе контейнеров пару праймеров (например, каждый размером 6-30 нуклеотидов), которые способны затравлять амплификацию [например, в полимеразной цепной реакции (см., например, Innis et al., 1990, "PCR Protocols", Academic Press Inc., San Diego, CA), в лигазной цепной реакции (см. европейский патент 320308), использовании репликазы Qβ, реакции с циклическим зондом или других методах, известных в данной области техники] по крайней мере части нуклеиновой кислоты Nogo в подходящих условиях реакции. Необязательно набор может включать контейнер с заранее определенным количеством очищенного белка или нуклеиновой кислоты Nogo, например, для использования в качестве стандарта или контроля.
5.12. Скрининг дгонистов и антагонистов Nogo
Нуклеиновые кислоты, белки и производные Nogo также находят применение в скрининг-тестах с целью выявления молекул, которые специфически связываются с нуклеиновыми кислотами, белками или производными Nogo и тем самым могут потенциально служить агонистами или антагонистами Nogo, в частности, молекул, которые тем самым влияют на регуляцию клеточного роста. В предпочтительном варианте такие тесты осуществляют с целью скрининга молекул, потенциально применимых в качестве активаторов роста нервной ткани для разработки лекарственных средств. Таким образом, настоящее изобретение представляет тесты для выявления молекул, которые специфически связываются с нуклеиновыми кислотами, белками или производными Nogo. Например, рекомбинантные клетки, экспрессирующие нуклеиновые кислоты Nogo, могут быть использованы для рекомбинантной выработки белков Nogo в таких тестах с целью скрининга молекул, которые связываются с белком Nogo. Молекулы (например, предполагаемые партнеры по связыванию с Nogo) контактируют с белком Nogo (или его фрагментом) в условиях, обеспечивающих связывание, с последующей идентификацией молекул, которые специфически связываются с белком Nogo. Сходные способы могут быть использованы для скрининга молекул, которые связываются с производными или нуклеиновыми кислотами Nogo. Способы, которые можно использовать для осуществления вышеуказанного, хорошо известны в данной области техники.
Как пример, разнообразные библиотеки, такие как случайные или комбинаторные пептидные или непептидные библиотеки, могут быть подвергнуты скринингу на наличие молекул, которые специфически связываются с Nogo. В данной области техники известны многие библиотеки, которые могут быть использованы, например, химически синтезированные библиотеки, рекомбинантные библиотеки (например, библиотеки фаговых изображений) и библиотеки на базе трансляции in vitro.
Примеры химически синтезированных библиотек описаны у Fodor et al., 1991, Science, 251, 767-773; Houghten et al., 1991, Nature, 354, 84-86; Lam et al., 1991, Nature, 354, 82-84; Medynski, 1994, Bio/Technology, 12, 709-710; Gallop et al., 1994, J. Medical Chemistry, 37 (9), 1233-1251; Ohlmeyer et al., 1993, Proc. Natl. Acad. Sci. USA, 90, 10922-10926; Erb et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 11422-11426; Houghten et al., 1992, Biotechniques, 13, 412; Jayawickreme et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 1614-1618; Salmon et al., 1993, Proc. Natl. Acad. Sci. USA, 90, 11708-11712; в международной патентной заявке WO 93/20242; и Brenner & Lerner, 1992, Proc. Natl. Acad. Sci. USA, 89, 5381-5383.
Примеры библиотек фаговых изображений описаны у Scott & Smith, 1990, Science, 249, 386-390; Devlin et al., 1990, Science, 249, 404-406; R.B.Christian et al., 1992, J. Mol. Biol., 227, 711-718; Lenstra, 1992, J. Immunol. Meth., 152, 149-157; Kay et al., 1993, Gene, 128, 59-65; и в международной патентной заявке WO 94/18318, датированной 18 августом 1994 г.
Библиотеки, основанные на трансляции in vitro, включают, тем самым не ограничиваясь, библиотеки, описанные в международной патентной заявке WO 91/05058, датированной 18 апрелем 1991 г.; и Mattheakis et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 9022-9026.
В качестве примера непептидных библиотек для использования может быть адаптирована бенздиазепиновая библиотека (см., например, Bunin et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 4708-4712). Также могут быть использованы пептоидные библиотеки (Simon et al., 1992, Proc. Natl. Acad. Sci. USA, 89, 9367-9371). Другой пример библиотеки, которая может быть использована, в которой функциональные амидные группы пептидов перметилированы с целью образования химически трансформированной комбинаторной библиотеки, описан у Ostresh et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 11138-11142.
Скрининг библиотек может быть проведен с помощью любого из методов, известных в данной области техники - см., например, следующие ссылки, которые представляют скрининг пептидных библиотек: Parmley & Smith, 1989, Adv. Exp. Med. Biol., 251, 215-218; Scott & Smith, 1990, Science, 249, 386-390; Fowlkes et al., 1992, BioTechniques, 13, 422-427; Oldenburg et al., 1992, Proc. Natl. Acad. Sci. USA, 89, 5393-5397; Yu et al., 1994, Cell, 76, 933-945; Staudt et al., 1988, Science, 241, 577-580; Bock et al., 1992, Nature, 355, 564-566; Tuerk et al., 1992, Proc. Natl. Acad. Sci. USA, 89, 6988-6992; Ellington et al., 1992, Nature, 355, 850-852; патент США №5096815, патент США №5223409 и патент США №5198346 (все выданы Ladner et al.); Rebar & Pabo, 1993, Science, 263, 671-673; и международная патентная заявка WO 94/18318.
В конкретном варианте скрининг может быть осуществлен путем контактирования членов библиотеки с белком Nogo (или нуклеиновой кислотой, или производным), иммобилизованным на твердой подложке, со сбором тех членов библиотеки, которые связываются с этим белком (или с нуклеиновой кислотой, или с производным). Примеры таких способов скрининга, обозначаемых как «методы просеивания», описаны в качестве примера у Parmley & Smith, 1988, Gene, 73, 305-318; Fowlkes et al., 1992, BioTechniques, 13, 422-427; в международной патентной заявке WO 94/18318; и в материалах, цитированных в указанном выше.
В другом варианте дигибридная система для отбора взаимодействующих белков в дрожжах (Fields & Song, 1989, Nature, 340, 245-246; Chien et al., 1991, Proc. Natl. Acad. Sci. USA, 88, 9578-9582) может быть использована для идентификации молекул, которые специфически связываются с белком или производным Nogo.
5.13. Животные модели
Настоящее изобретение также представляет животные модели, включая, но тем самым не ограничиваясь, модели на мышах, хомячках, овцах, свиньях, крупном рогатом скоте и предпочтительно на млекопитающих, не являющихся человеком.
В одном варианте представляются животные модели заболеваний и расстройств, связанные с разрастанием, ростом и регенерацией нейритов. Такое животное исходно может быть получено путем проведения гомологичной рекомбинации между геном Nogo в месте его локализации на хромосоме и экзогенным геном Nogo, который был превращен в биологически неактивный (предпочтительно путем встраивания гетерологичной последовательности, например, гена резистентности к антибиотику). В предпочтительном аспекте эту гомологичную рекомбинацию проводят путем трансформирования эмбриональных стволовых клеток (ES) вектором, включающим инактивированный вставкой ген Nogo так, чтобы происходила гомологичная рекомбинация, с последующим инъецированием клеток ES в бластоцист и имплантированием этого бластоциста ложной матери, после чего произойдет рождение химерного животного («выключенного животного»), у которого ген Nogo инактивирован (см. Capecchi, 1989, Science, 244, 1288-1292). Химерное животное можно воспроизвести с целью получения дополнительных «выключенных» животных. Такими животными могут быть мыши, хомячки, овцы, свиньи, крупный рогатый скот и др., а предпочтительно - не являющиеся человеком млекопитающие. В конкретном варианте получают «выключенную» мышь.
Ожидается, что у таких «выключенных» животных разовьются заболевания или расстройства центральной нервной системы или будет иметь место предрасположенность к их развитию и, следовательно, их можно будет использовать в качестве животных моделей таких заболеваний и расстройств, например, для целей скрининга или тестирования молекул (например, потенциальных терапевтических средств для заболеваний нервной системы) на способность подавлять опухоли нервной ткани и, следовательно, вылечивать или предотвращать эти заболевания или расстройства.
Настоящее изобретение не ограничивается в своем масштабе депонированным микроорганизмом или описанными здесь конкретными вариантами. На самом деле различные модификации настоящего изобретения в дополнение к тем, которые описаны в данном тексте, будут ясны специалистам в данной области техники из предыдущего описания и сопровождающих фигур. Такие модификации призваны быть включенными в масштаб настоящего изобретения.
В данном тексте цитируются различные библиографические материалы, содержание которых в полном объеме включено здесь для сведения в виде библиографических ссылок.
6. Пример: характеристика нуклеотидного и белкового продукта гена Nogo
Примеры, описанные здесь, показывают, что клонированный ген Nogo кодирует белок, который является мощным ингибитором роста нервных клеток и также распознается моноклональными антителами, описанными у Schwab et al. в патенте США №5684133.
6.1. Материалы и методы
Нижеследующие разделы описывают материалы и методы, использованные в настоящем изобретении. Для специалиста в данной области техники будет понятно, что эти материалы и методы являются исключительно иллюстративными для заявляемого здесь изобретения, т.е. авторы настоящего изобретения предусматривают их модификации. Такие модификации призваны войти в объем прилагаемой формулы изобретения.
6.1.1. Очистка Nogo из миелина быка
Все стадии очистки осуществляли при 4°С, и ингибиторную субстратную активность полученных фракций стандартным образом определяли в тестах на распределение клеток NIH-3T3 и разрастание нейритов РС12 (раздел 6.1.10). Ткань спинного мозга быка тщательно очищали путем снятия мозговой оболочки и разрезали на небольшие кусочки. Затем экстрагировали миелин в экстракционном буфере (60 мМ CHAPS, 100 мМ Трис-Cl - рН 8,0; буфер 10 мМ ЭДТА - рН 8,0; 2,5 мМ иодацетамида, 1 мМ фенилметилсульфонилфторида, 0,1 мкг/мл апротинина, 1 мкг/мл лейпептина, 1 мкг/мл пепстатина-А).
Для получения экстракта спинного мозга ткань гомогенизировали непосредственно в экстракционном буфере CHAPS при соотношении 1:1 (в./об.). Гомогенат центрифугировали дважды при 100000 g (центрифуга Kontron, тип К50.13, фиксированный угол вращения) в течение 1 часа при 4°С. Прозрачный надосадочный слой (экстракт) немедленно загружали на колонку Q-сефарозы (2,6×11,5 см), уравновешенную буфером А (20 мМ Трис-Cl - рН 8,0; 0,5% CHAPS (в./об.)). Связанные белки элюировали пятью основными объемами при линейном градиенте 0-1 М NaCl в буфере А (100 мл градиента за 50 минут). Активные фракции, содержащие бычий NI220, элюировались около 0,4 М NaCl, и их объединяли (q-pool 1) для последующего внесения на колонку Супердекса-200 (2,6×60 см), уравновешенную буфером В (150 мМ NaCl, 20 мМ Трис-Cl рН 8,0; 0,5% CHAPS (в./об.)).
Активные фракции после гель-фильтрации (s-pool 1) разделяли электрофоретически в 6%-ном ПААГ с ДСН при восстанавливающих условиях и низкой постоянной мощности (2 Вт/гель) в течение всего 2500 вольт-часов. Бэнды и участки гелей идентифицировали после окрашивания кумасси голубым (0,1% R250, в./об., в 50% метаноле и 10% уксусной кислоте), вырезали и экстрагировали в 800 мкл гель-элюционного буфера (0,5% (в./об.) CHAPS, 20 мМ Трис-Cl - рН 8,0; 10 мМ ЭДТА - рН 8,0; 2,5 мМ иодацетамида, 1 мМ фенилметилсульфонилфторида, 0,1 мкг/мл апротинина, 1 мкг/мл лейпептина, 1 мкг/мл пепстатина-А) в течение, по крайней мере, 48 часов при 4°С.
6.1.2. Микросеквенирование очищенного Nogo
Нейтрализуемый антителом IN-1 активный гель-элюированный материал из нескольких гелей заново разгоняли методом электрофореза в 10%-ном ДСН-полиакриламидном геле при восстанавливающих условиях и окрашивали 0,1%-ным (в./об.) кумасси голубым R250 в 50% метанола и 10% уксусной кислоты. Бэнд 220-кД вырезали и непосредственно в геле проводили эндопротеиназное расщепление Lys-С (молярное отношение 1:50). Образец подкисляли и вносили в колонку для обращенно-фазовой высокоэффективной жидкостной хроматографии, пептиды разделяли с помощью линейного градиента (0-100%) 0,04%-ной трифторуксусной кислоты и 80% ацетонитрила, и фракции, содержащие единственные виды белков, подвергали автоматическому секвенированию по Эдману.
6.1.3. Электрофорез очищенного Nogo
Высокоразрешающий электрофорез в ДСН-ПААГ проводили с использованием 6%-ного (в./об.) ДСН-полиакриламидного геля (10×24×0,01 см) при восстанавливающих условиях (100 мМ дитиотреитола). Перенос на мембраны Immobilon-P (Millipore) осуществляли в 20 мМ основного Трис, 192 мМ глицина - рН 8,3; 0,037% (в./об.) ДСН, 20% метанола с помощью устройства для полусухого переноса (Bio-Rad, Trans Blot SD). Время переноса составило 2 часа при 0,8 мА/см2. Блокирующим агентом (1 час при комнатной температуре) был 3%-ный желатин в ФСБ (фосфатно-солевой буфер - рН 7,2: 8 г NaCl, 0,2 г КН2PO4, 2,8 г Na2HPO4·12Н2O и 0,2 г KCl, растворенные в 1 литре воды), а промывочный раствор содержал 20 мМ Трис-Cl - рН 7,5: 150 мМ NaCl и 0,4% Твин (3 раза по 10 минут при комнатной температуре). Инкубацию с первым антителом (для разбавления в 1%-ном желатине в ФСБ) обычно проводили в течение ночи при 4°С. Антимышиное вторичное IgG антитело, соединенное с пероксидазой хрена (1:2000), инкубировали в течение 1 часа при комнатной температуре. Для детекции применяли хемо-люминесцентную систему ECL (Amersham Pharmacia Biotech).
6.1.4. Зондирование библиотеки кДНК
Белое вещество выделяли из свежего спинного мозга быка и полиаденилированную РНК экстрагировали с использованием набора FastTrack kit (Invitrogen). Конструирование библиотек кДНК осуществляли с использованием набора Uni-ZAP kit (Stratagene) согласно инструкциям производителя. В целом сложность библиотек превышала 4 миллиона бляшко-образующих единиц, а средний размер вставки составлял приблизительно 1,8 тысяч пар нуклеотидов.
Вырожденные олигонуклеотиды MSC5-8 (MSC5 TCIGTIGGYAAIACIGCIGGYAARTC (SEQ ID NO 47); MSC6 TCIGTIGGIAGIACIGCIGGYAAYTC (SEQ ID NO 48); MSC7 TCIGTIGGYAAIACIGCIGGIAGRTC (SEQ ID NO 49); MSC8 TCIGTIGGIAGIACIGCIGGIAGRTC (SEQ ID NO 50)) были сконструированы по последовательности пептида-1 bNI220, a праймер MSC9 (GARATHGCIGAIATHCARGAYGGIGA (SEQ ID NO 51)) был сконструирован по последовательности пептида-2 bNI220. Олигонуклеотиды были синтезированы фирмой MWG Biotech (Munchenstein, Швейцария) и помечены с помощью набора для 3'-концевого мечения ДНК дигоксигенином. Рибозонды были синтезированы с использованием набора DIG RNA labeling kit (Boehringer Mannheim).
Условия гибридизации зондов и промывки соответствовали описанному у производителя (MSC5-8 и MSC9 использовали при температуре гибридизации и промывки 57°С). Выявление зондов проводили с использованием системы CDP-star (Boeringer Mannheim). Обработку и скрининг библиотеки кДНК проводили в соответствии с прописями для библиотек кДНК на векторах λZAP (Stratagene). Для снятия бляшек использовали нейлоновые мембраны Genescreen (DuPont).
6.1.5. Секвенирование ДНК
Обе цепи CWP1-3, Oli18, Oli3 и R1-3U21 секвенировали в системе секвенатора Perkin Elmer AB1377 по программе Microsynth (Balgach, Швейцария). Последовательности ДНК анализировали с помощью программы DNASIS (Hitachi). Поиск по базам данных проводили в программе BLAST (NCBI).
6.1.6. Анализ РНК
Тотальную РНК и поли(А)-РНК экстрагировали из тканей с использованием RNAgent (Promega) или FastTrack kit (Invitrogen) соответственно. РНК разделяли методом электрофореза в 1%-ном формальдегидном геле и переносили на мембраны Genescreen. Блоты гибридизовали с антисмысловыми рибозондами, которые были сформированы с помощью набора DIG RNA labeling kit (Boehringer Mannheim) на материале соответствующих плазмид. Условия проведения гибридизации блотов, промывки и детекции в системе CDP-star соответствовали описанному у производителя. «Общий» зонд EST111410 (TIGR, ATCC, Rockville, MD, США) включает нуклеотиды 2535-4678 последовательности транскрипта А, специфичный для 1-го экзона зонд включает нуклеотиды 65-769 последовательности транскрипта А, а специфичный для 2-го экзона зонд включает нуклеотиды 815-3183 последовательности транскрипта А.
6.1.7. Получение антисывороток
Антисыворотка 472 (AS472) была получена фирмой Research Genetics Inc. (Huntsville, AL, США) к синтетическому пептиду Р472-SYDSIKLEPENPPPYEEA (последовательность быка: SEQ ID NO 33), который соответствует аминокислотной последовательности Nogo крысы (SEQ ID NO 2) - аминокислоты 623-640 с тремя несовпадениями.
Антисыворотка Bruna (AS-Bruna) была получена к фрагменту рекомбинантного белка Nogo, экспрессированному в клетках E.coli в виде химерного белка. В частности, С-концевой участок нуклеотидной последовательностью Nogo-A крысы, кодирующий аминокислоты 762-1163 из состава SEQ ID NO 2 (экспрессирована в E.coli с использованием системы рЕТ от Novagen), использовали для формирования специфичной для Nogo антисыворотки AS-Bruna.
6.1.8. Электрофорез и вестерн-блоттинг
Электрофорез в ДСН-ПААГ и Вестерн-блоттинг проводили с помощью стандартных методов, хорошо известных в данной области техники. Антитела разводили следующим образом: AS-Bruna - 1:7500; AS472 - 1:2000; анти-myc (9Е10) - 1:5000 (Invitrogen); анти-BiP, 2 мкг/мл (Stressgen); гибридомный надосадочный слой mAb IN-1 использовали без разведения. Вторичные антитела таковы: антикроличье, соединенное с пероксидазой хрена (Pierce; 1:20000); антимышиное IgM (1:50000); и антимышиное, соединенное с щелочной фосфатазой (Milan Analytica AG, La Roche, Швейцария - 1:5000).
6.1.9. Иммуногистохимия
Спинной мозг или мозжечок быстро вырезали у взрослых крыс, погружали в соединение ОТС и замораживали при -40°С. Готовили двадцать гистологических срезов post mortem и фиксировали их в смеси этанола/уксусной кислоты при 40°С. Иммунное окрашивание проводили в соответствии с описанным у Rubin et al., 1994, J.Neurocytol., 23, 209-217, за исключением того, что этап охлаждения был исключен. Как альтернатива, тканевые срезы фиксировали метанолом (2 минуты при -20°С) и подвергали иммунному окрашиванию в соответствии с Rubin et al., цит. выше. Использованными первичными антителами были (антитело: (разведение)): гибридомная надосадочная фракция IN-1: (без разведения); AS-Bruna: (1:5000); или аффинно очищенная AS472: (1:50).
6.1.10. Тест на распределение фибробластов NIH-3T3
Фибробласты NIH-3T3 высевали на культуральные чашки, предварительно покрытые 5 мкг/лунка (=1 см2) q-pool. Фракция q-pool - объединенные активные фракции экстракта спинного мозга быка, разделенного на колонке Q-сефарозы. IN-1 использовали в качестве неразведенной надосадочной фракции (1-10 мкг/мл), AS-Bruna и преиммунную сыворотку разводили 1:1000 в ФСБ, a AS472 и преиммунную сыворотку разводили 1:500 в ФСБ. Для компенсации изменчивости активности в различных препаратах q-pool число ингибированных округлых клеток, высеянных на q-pool, нормировали к 100%, а высеянных на буферный контроль - к 0% (Spillman et al., 1998, J. Biol. Chem., 273, 19283-19293).
6.1.11. Тест на разрастание нейритов DRG
Заднекорешковые ганглии (DRG) вырезали у куриных эмбрионов на стадии Е16 в сбалансированный солевой раствор Хенкса (HBSS), разделяли на две части и помещали на чашки, предварительно покрытые q-pool в 100 мкл среды F12, дополненной 10% (ПТС) и 1% метоцеля. Разрастание нейритов от отдельных DRG оценивали через 24 часа инкубации при 37°С полуколичественным способом с использованием шкалы оценок от 0 (отсутствие разрастания) до 4 (максимальное разрастание).
6.1.12. Тест на совместное культивирование DRG и зрительного нерва
Зрительные нервы вырезали у взрослых крыс, облучали дозой 5500 Гр и инъецировали AS472 или соответствующей преиммунной сывороткой (разведение 1:10). Пары нервов культивировали в 3-камерных культурах таким образом, чтобы один конец каждого нерва проходил через тефлоновый барьер с силиконовой смазкой в среднюю камеру, в которую помещали диссоциированные прокультивированные первичные нейроны DRG от крыс Р0. Через 2 недели культивирования нервы фиксировали с помощью стандартных методов, известных в данной области техники, и делали заливку для электронной микроскопии (ЭМ), а ультратонкие срезы делали на расстоянии примерно 3,5 мм от основания обработанного DRG. Срезы анализировали систематически на присутствие заново отрастающих аксонов с использованием микроскопа Zeiss ЕМ 902.
6.1.13. Экспрессия Nogo в клетках COS
Открытая рамка считывания Nogo-A была субклонирована в вектор pcDNA3.1mychis (Invitrogen) с использованием стандартных методов клонирования, известных в данной области техники. Полученная в результате плазмида (Nogo-myc19) давала рекомбинантный белок, включающий последовательность Nogo-A, химеризованную на метку myc-his (21 аминокислота). Nogo-myc19 (2 мкг ДНК на 35-мм чашку) или контрольной плазмидой (pcDNAmychisLacZ) трансфицировали клетки COS с использованием Superfect (Qiagen) в соответствии с прописью производителя. Трансфицированные клетки собирали через 36-48 часов после трансфекции. Основываясь на иммунофлуоресцентном окрашивании с анти-myc антителом и каталитической цветной реакции с β-галактозидазой, средний уровень трансфекции был оценен на уровне около 20%. Трансфицированные клетки COS фиксировали 95%-ным этанолом с 5% уксусной кислоты (4°С, 25 минут), блокировали в ФСБ с 10% ПТС и инкубировали с AS-Bruna (1:200) или IN-1 (1:2) в течение 2 часов в ФСБ с 1% ПТС при комнатной температуре. Клетки промывали в ФСБ и проводили взаимодействие с флуоресцентными вторичными антителами (козье антикроличье-FITC для выявления AS-Bruna и козье антимышиное-TRITC для выявления IN-1: Jackson Immuno Research Lab. Inc., West Grove, PA).
6.1.14. Культуры олигодендроцитов
Олигодендроциты, выделенные из головного мозга новорожденных крысят, вносили в 75 см2 полилизиновые колбы (Sigma, St. Louis, МО) и культивировали в течение 10-12 дней в среде DMEM, дополненной 5% ПТС. Обогащенные смешанные популяции олигодендроцитов и их предковых клеток выделяли с монослоя астроцитов путем встряхивания в течение ночи при 210 об/мин в ротационном шейкере. Клетки высевали при плотности 1-2×106 клеток на покрытые полилизином чашки площадью 35 см2. Предковые клетки оставляли дифференцироваться в химически определенной среде (CDM) в течение 3-4 дней.
6.1.15. Биотинилирование клеточной поверхности
Культуры цельного головного мозга крыс Р4 приготавливали в соответствии с описанным у Van der Haar et al., 1998, J.Neurosci. Res., 51, 371-381. На 7-й день in vitro они были биотинилированы непроницаемым для клеток реагентом EZ-LINK-Sulfo-NHS-LC-Biotin (Pierce) в соответствии с описанным за исключением того, что все стадии проводили при 15°С и клетки лизировали в 1 мл литического буфера (0,05 М NaH2PO4 - рН 8,0; 0,15 М NaCl, 0,5% CHAPS (Sigma), 2,5 мМ иодацетамида, 1 мМ фенилметилсульфонилфторида, 0,1 мкг/мл апротинина, 1 мкг/мл лейпептина, 1 мкг/мл пепстатина-А). Биотинилированные белки подвергали иммунопреципитации с шариками Dynabeads M-280 со стрептавидином (Dynal), электрофорезу в ДСН-ПААГ и переносили на нитроцеллюлозные мембраны, которые зондировали с использованием AS472, α-BiP и α/β-тубулина. Мембраны разделяли с использованием набора Re-Blot Western Blot Recycling kit (Chemicon).
6.1.16. Иммуноцитохимия
Олигодендроциты зрительных нервов приготавливали в соответствии с описанным у Schwab & Caroni, 1988, J.Neurosci., 8, 2381-2393. Двухдневные культуры инкубировали с AS472 (1:200) или mAb IN-1 (1:3) в культуральной среде в течение 25 минут при комнатной температуре. Культуры промывали, фиксировали в 4% параформальдегиде + 5% сахарозе в ФСБ и блокировали в 0,1 М малеиновой кислоте + 2% блокирующего реагента (Boehringer Mannheim) в течение 1 часа. Вторичные антитела, соединенные с щелочной фосфатазой (Milan Analytica), использовали в разведении 1:7500 в 0,1 М малеиновой кислоте с 1% блокирующего реагента (1 час, комнатная температура). Трансфицированные клетки COS фиксировали в 95% этаноле с 5% уксусной кислоты (4°С, 25 минут), блокировали и инкубировали с AS-Bruna (1:200) или mAb IN-1 в течение 2 часов при комнатной температуре. Клетки взаимодействовали с козьим антикроличьим FITC-антителом и козьим антимышиным TRITC-антителом (Jackson Immuno Research Lab.).
6.1.17. Камера со зрительным нервом
Пары зрительных нервов культивировали в 3-камерной культуральной системе в соответствии с описанным у Schwab et al., 1988, J.Neurosci., 8, 2381-2393, инъецировали и подвергали обработке либо AS472, либо соответствующей преиммунной сывороткой (1:10). Зрительные нервы заливали для электронно-микроскопического анализа (ЭМ), и ультратонкие срезы делали на расстоянии примерно 3,5 мм от основания обработанного DRG. Срезы подвергали систематическому анализу на присутствие заново отрастающих аксонов с использованием микроскопа Zeiss ЕМ 902.
6.2. Экспериментальные результаты
Следующий раздел описывает экспериментальные результаты, полученные с помощью описанных выше в разделе 6.1 и подразделах методов.
6.2.1. Выделение кДНК Nogo
Очищали бычий гомолог NI-250 крысы - bNI220, и пептиды из очищенного белка получали с помощью протеазного расщепления. Множественные помеченные дигоксигенином вырожденные олигонуклеотиды конструировали в соответствии с шестью разными пептидными последовательностями bNI220. С использованием этих олигонуклеотидов в ходе скрининга библиотеки белого вещества быка было выделено несколько клонов кДНК. Вставку из самого длинного клона (CWP1-3, фиг.1а) использовали для синтеза зондов для последующего скрининга библиотек кДНК крысы. Отобранные в результате такого скрининга клоны показаны на фиг.1а. Анализ последовательностей ДНК этих клонов подтвердил, что с одного гена образуются три разных транскрипта, и этот ген был обозначен Nogo. Разные транскрипты, по-видимому, являются результатом и использования альтернативного промотора, и альтернативного сплайсинга (Nogo-A, Nogo-B и Nogo-C; фиг.1b). Последовательности ДНК были компилированы на материале клонов, показанных на фиг.1А, с целью получения транскрипта А, нуклеотидная последовательность которого показана на фиг.2а.
Стандартная трансляция трех транскриптов приводит к образованию белковых продуктов, обозначенных Nogo-A (1163 аминокислоты), Nogo-B (360 аминокислот) и Nogo-C (199 аминокислот). Поскольку Nogo-A включает все шесть пептидных последовательностей, полученных из очищенного bNI220 (фиг.2b), то, по-видимому, он эквивалентен очищенному белку - NI-250 крысы. Nogo А, В и С имеют общий С-концевой участок из 188 аминокислот (общие домен), а Nogo А и В имеют общий N-концевой участок из 172 аминокислот. Nogo-A длиннее, чем Nogo-B на 803 аминокислоты вследствие альтернативного сплайсинга.
Ни одна из изоформ Nogo не имеет гидрофобного мотива аминокислот в своем N-концевом участке, который мог бы выполнять роль стандартного сигнального сегмента. Однако были описаны белки, лишенные стандартного сигнального сегмента, но тем не менее переносимые через мембраны, например, фактор роста фибробластов (Florkiewicz et al., 1995, J.Cell. Physiology, 162, 388-399), реснитчатый нейротрофный фактор (Sendtner et al., 1994, J.Neurobiology, 25, 1436-1353) и интерлейкин-1 (Rubartelli et al., 1990, EMBO J., 9, 1503-1510). Мембранные белки, такие как белок снижения связывания (Tear et al., 1996, Neuron, 16, 501-514), также не имеют стандартного сигнального сегмента, хотя и проникают через мембрану.
Хотя в составе предполагаемого 5'-нетранслируемого участка нет внутрирамочного кодона, который бы мог однозначно определять старт-кодон, нижеследующее доказательство подтверждает, что метионин, показанный на фиг.2а, является старт-кодоном для Nogo-A и Nogo-B: (1) последовательность вокруг предполагаемого старт-кодона хорошо согласуется с последовательностью, консенсусной для старт-сайтов трансляции (GCCGCC A/G CCATGG; SEQ ID NO 39); (2) значительные усилия были приложены к поиску расположенных еще выше последовательностей и путем скрининга библиотек, и методом 5'-RACE. Ни один из этих поисков не привел к идентификации еще выше расположенных последовательностей; (3) эукариотический рекомбинантный Nogo-A, экспрессированный начиная с упоминавшегося выше метионина, имеет по оценке электрофореза в ДСН-ПААГ молекулярную массу примерно 200 кД, которая не отличается от эндогенного Nogo-A из олигодендроцитов крысы (фиг.11а).
6.2.2. Анализ последовательности Nogo
Nogo-A включает семь сайтов потенциального N-гликозилирования, однако биохимические данные указывают на отсутствие у Nogo-A существенного полисахаридного компонента. Также в составе Nogo-A имеется 19 сайтов распознавания для РКС и семь сайтов распознавания казеинкиназой-II (фиг.2а). Все три Nogo включают по два стандартных С-концевых гидрофобных домена из 35 и 36 аминокислот соответственно. Любой из них или они оба могут использоваться в качестве транс- или внутримембранных доменов, что согласуется с идентификацией bNI220 как интегрального мембранного белка. Nogo-A (равно как и Nogo В и С) не включает каких-либо мотивов, известных у молекул, обеспечивающих клеточную адгезию, белков внеклеточного матрикса или других молекул внеклеточных взаимодействий.
Последовательности Nogo были использованы для поиска в разных базах данных гомологичных генов: стандартный С-концевой домен трех продуктов Nogo сходен (62,5%) с идентифицированным геном человека nsp (c113 и s-rex у крысы и chs-rex у курицы) (фиг.3). По одному EST-маркеру у C.elegans и Drosophila melanogaster также имеют существенное сходство (16,6% и 13,6% соответственно) и с Nogo, и с nsp на том же участке. С-концевые 180-аминокислотные домены всех Nogo и Nsp высококонсервативны у видов млекопитающих (98,3% и 97,3% соответственно), что подтверждает возможное выполнение ими сходных ключевых функций. За пределами этого участка сходство этого белка у разных видов также значительно (73% при сравнении Nogo-A крысы и быка; 76,2% между NSP-A и S-rexb; 50% между Chs-rexb и NSP-A или S-rexb). Однако сходство между белками NSP и Nogo ограничено их С-концевым гидрофобным общим доменом (фиг.3а) и кислой природой белков за пределами этого консервативного домена. Ранее NSP (NSP-A, -В и -С) были описаны как специфические нейроэндокринные продукты с неизвестными функциями. Данные гибридизации in situ и иммуногистологического анализа показали локализацию NSP в нейронах нервной системы. Недавно был идентифицирован другой ген человека - nsp-подобный-1, который также имеет С-концевой гидрофобный участок, характеризующийся 50%-ным сходством и с Nsp, и Nogo.
6.2.3. Тканевая экспрессия Nogo
Параметры экспрессии Nogo анализировали методами Нозерн-блоттинга и гибридизации in situ. При использовании «общего» зонда (раздел 6.1.6) три основных транскрипта Nogo (обозначены: А - 4,6 т.п.н.; В - 2,6 т.п.н.; и С - 1,7 т.п.н.) выявлялись в зрительном нерве, спинном мозге и коре головного мозга (фиг.4а). В заднекорешковых ганглиях были выявлены только два наиболее крупных транскрипта. Транскрипт 2,6-т.п.н. был выявлен как основной в клетках РС12, в то время как бэнд 4,6-т.п.н. можно было обнаружить только после длительных экспозиций (фиг.4а). В седалищном нерве были выявлены более низкие уровни транскриптов, причем основным из них был транскрипт 2,6-т.п.н. При гибридизации поли-(А)-РНК из спинного мозга и клеток РС12 с зондом, специфичным для 1-го экзона, выявлялись только транскрипты 4,6-т.п.н. и 2,6-т.п.н.; при гибридизации поли-(А)-РНК из заднего мозга и скелетных мышц с зондом, специфичным для 2-го экзона, был выявлен только транскрипт 4,6-т.п.н. и только в заднем мозге (фиг.4b). Эти данные подтверждают транскрипционную карту, показанную на фиг.1В. Однако данные Нозерн-блоттинга также показывают, что экспрессия Nogo не ограничена нервной системой (фиг.4с): транскрипты Nogo также выявляются в скелетных мышцах (1,7 т.п.н.), почках (2,6 и 1,7 т.п.н.), хряще (из грудинной кости: 1,7 т.п.н.), коже (1,7 т.п.н.), легких (2,6 т.п.н.) и селезенке (2,6 т.п.н.). За исключением скелетных мышц, в которых транскрипты Nogo-C экспрессируются на высоком уровне, уровень транскриптов Nogo за пределами нервной системы ниже, чем в нервной системе. Следовательно, транскрипты Nogo-A 4,6-т.п.н. представляются как транскрибирующиеся исключительно в нервной системе.
Данные гибридизации in situ в отношении гистологических срезов ЦНС взрослых крыс с использованием общего зонда показали средний уровень мечения рядов клеточных тел в белом веществе в различных частях головного мозга и спинного мозга. Такое распределение типично для межпучковых олигодендроцитов (фиг.5а, d.). В дополнение к олигодендроцитам некоторые типы нейронов также экспрессируют транскрипты Nogo на высоких уровнях (фиг.5 с, е). В мозжечке двойное окрашивание срезов с использованием анти-GFAP антитела и гибридизация in situ четко показали интенсивное мечение клеток Пуркинье зондом Nogo, в то время как астроциты не метились (фиг.5е, f). В развивающихся зрительных нервах транскрипты Nogo были выявлены уже в день рождения (Р0), т.е. за несколько дней до того, как могут быть выявлены РНК основных миелиновых белков - протеолипидного белка (PLP) и основного миелинового белка (МВР) (фиг.6). Такая временная динамика согласуется с появлением вначале позитивных по галактоцереброзиду олигодендроцитов и экспрессией активности по подавлению роста нейритов, которая может быть нейтрализована антителом IN-1.
Были получены антисыворотки к синтетическому пептиду, основанному на конкретной последовательности Nogo-A быка (AS472), и к рекомбинантному белку 45-кД как части Nogo-A крысы (AS-Bruna) (раздел 6.1.7). И AS472, и AS-Bruna распознавали белок с молекулярной массой примерно 200 кД в миелине быка, а AS-Bruna, кроме того, распознавала крысиный миелиновый белок 200-кД на Вестерн-блотах (фиг.7). Срезы спинного мозга и мозжечка взрослых крыс окрашивали с помощью AS472, AS-Bruna и IN-1. В случае фиксации срезов смесью этанол/уксусная кислота (ранее было показано, что эта процедура необходима для консервации и доступности антигенов для IN-1) интенсивное окрашивание белого вещества/миелина отмечалось со всеми тремя антителами (фиг.8). В частности, отчетливым было окрашивание тел олигодендроцитов при использовании AS-Bruna. Обработка свежезамороженных срезов метанолом вместо этанола/уксусной кислоты уничтожало окрашивание миелина, но не тел олигодендроцитов.
Также AS472 и AS-Bruna окрашивали некоторые типы нейронов, включая двигательные нейроны в спинном мозге и гранулярные и молекулярные слои в мозжечке. Интенсивно сыворотки AS472 и AS-Bruna окрашивали клетки Пуркинье, однако при использовании IN-1 их окрашивание не выявлялось.
6.2.4. Антитела к Nogo подавляют индуцированное Nogo подавление роста in vitro
Частично очищенные препараты NI-220 спинного мозга быка (q-pool) способны предотвращать распределение фибробластов NIH-3T3 и разрастание нейритов. В присутствии антисывороток Nogo - AS-Bruna, AS472 или IN-1 - ингибиторная активность q-pool снижена, т.е. на чашках, покрытых q-pool, фибробласты NIH-3T3 характеризуются распределением и у заднекорешковых ганглиев (DRG) куриного эмбриона образуются отростки (нейриты) (фиг.9). Специфичность была подтверждена путем добавления пептида Р472, который является пептидом, использовавшимся для получения AS472 (раздел 6.1.7). Р472 эффективно блокировал ингибиторный эффект AS472, в то время как контрольный пептид не проявлял эффекта ингибирования.
Кроме того, присутствие Nogo-A на клеточной поверхности олигодендроцитов было продемонстрировано иммуноцитохимическими методами, функционально и биохимически использовавшими AS472. Будучи живыми, первичные культуры олигодендроцитов окрашивались либо mAb IN-1, либо AS472 относительно слабо (по сравнению с иммуноцитохимическим выявлением галактоцереброзида), однако отчетливое окрашивание поверхности было выявлено у дифференцировавшихся олигодендроцитов (фиг.15а, с). Добавление пептида-конкурента (Р472) для AS472 или удаление первичного антитела ликвидирует специфичное окрашивание (фиг.15b, d). Биотинилирование клеточной поверхности и последующая преципитация со стрептавидином дополнительно подтверждает присутствие Nogo-A на плазматической мембране олигодендроцитов. В преципитате AS472 маркирует бэнд, разгоняемый примерно на 40 кД выше внутриклеточного, по-видимому, непроцессированного и негликозилированного иммуно (А472)-позитивного бэнда. В биотинилированной фракции не удается выявить белок BiP эндоплазматического ретикулума (фиг.15е).
Также был проведен функциональный анализ Nogo-A как поверхностно-клеточной молекулы олигодендроцитов. Совместное культивирование олигодендроцитов и фибробластов NIH-3T3 или олигодендроцитов и нейронов DRG отчетливо показало ингибиторные свойства зрелых олигодендроцитов. Эти тесты показывают, что фибробласты NIH-3T3 и нейриты DRG жестко избегают территории, занятой олигодендроцитами, причем этот эффект нейтрализуется mAb IN-1. В присутствии AS472 такое подавление в равной степени снижается (фиг.16а, b и е, f), в то время как преинкубация AS472 с белком Р472 восстанавливает подавление, обусловливаемое олигодендроцитами (фиг.16с, d и g, h). Количественный анализ показал высокодостоверную нейтрализующую способность mAb In-1 и AS472 в обоих типах тестов (фиг.16i и j).
RecNogo-A (фиг.17а), полученный с помощью стабильно трансфицированной клеточной линии СНО, тестировали по его активности в отношении распределения фибробластов NIH-3T3 и разрастания нейритов DRG. Полученную рекомбинантным путем β-галактозидазу, выделенную из стабильной клеточной линии СНО (CHO-LacZ), обогащали параллельно варианту с recNogo-A и использовали в качестве контроля ингибиторной активности эндогенных белков СНО в обоих тестах. В тесте на распределение фибробластов NIH-3T3 экстракт СНО, содержащий recNogo-A (Nogo-A: примерно 1-5% от общего белка; фиг.9а), проявлял отчетливый ингибиторный эффект в отношении распределения клеток при 10 мкг/см2 (фиг.17b). Этот эффект был дозозависимым: при 20 мкг/см2 ингибиторная активность была выше, а при 5 мкг/см2 подавление отсутствовало (данные не показаны). Такая ингибиторная активность могла быть нейтрализована до фоновых уровней путем предварительной инкубации покрывающих белков с mAb IN-1 или AS-Bruna, в то время как контрольное антитело, специфичное в отношении галактоцереброзида (mAb О1), или преиммунная сыворотка AS-Bruna таким действием не обладали (фиг.17b).
В дополнение к сильному действию на распределение фибробластов NIH-3T3, экстракт СНО, содержащий recNogo-A, но не экстракт CHO-LacZ, обладал мощным ингибиторным действием на разрастание нейритов у нейронов в первичной культуре. Разделенные нейроны DRG подавлялись recNogo-A по дозозависимому типу (фиг.17с). Такая ингибиторная активность могла быть нейтрализована действием mAb IN-1, но не контрольного mAb O1 (фиг.17с-е). Рекомбинантный белок, выделенный из CHO-LacZ, не обладал ингибиторной активность при 1 и 5 мкг, а добавление mAb O1 или IN-1 не имело эффекта в отношении разрастания нейритов.
6.2.5. Возобновление роста нейритов in vitro
Исследовали способность нейритов в DGR новорожденных крысят регенерировать и расти через взрослую ткань ЦНС. Пары зрительных нервов вырезали у взрослых крыс и культивировали в специальной многокамерной системе таким образом, чтобы нейриты DRG имели отростки в один из концов каждого нерва (фиг.10а). В каждой культуре один из двух нервов инъецировали и подвергали воздействию преиммунной кроличьей сыворотки, а второй нерв инъецировали AS472, которая также присутствовала в боковой камере вокруг нерва. Через две недели in vitro в присутствие NGF культуры фиксировали, разбирали и заливали для электронно-микроскопического анализа (ЭМ). Срезы для ЭМ делали в 3,5 мм от конца нерва в контакте с нейронами DRG. Инъецированные преиммунной сывороткой нервы не имели вовсе или имели лишь несколько аксонов (фиг.10b). Последнее было обнаружено исключительно в связи с базальными мембранами и астроцитами на поверхности нервов. Напротив, большинство зрительных нервов, инъецированных AS472, имело значительное число аксонов, часто до нескольких сотен. Часто можно видеть контакт с миелином (фиг.10с, d.).
6.2.6. Распознавание рекомбинднтного Nogo-A антителом IN-1
При экспрессии Nogo-A в виде С-концевого рекомбинантного белка с присоединенной меткой myc-his в трансфицированных клетках COS по данным Вестерн-блоттинга с анти-myc-антителом и AS-Bruna видно, что рекомбинантный Nogo-A обладает молекулярной массой около 200 кД при оценке в ДСН-денатурирующих гелях (фиг.11а). На том же блоте бэнд со сходной подвижностью был выявлен с помощью AS-Bruna в первичной культуре олигодендроцитов крысы: это подтверждает, что рекомбинантный Nogo-A имеет почти идентичную молекулярную массу по сравнению с эндогенным Nogo-A из олигодендроцитов (фиг.1а). При иммунофлуоресцентном окрашивании трансфицированных клеток COS с использованием IN-1 и AS-Bruna те же трансфицированные клетки распознаются IN-1 и AS-Bruna (фиг.11b, с). Большинство иммунореактивных сигналов сосредоточено внутри клеток и доступно только после обеспечения проницаемости.
6.2.7. Картирование активного(ых) участка(ов) Nogo
Серия делеционных мутантов Nogo была сформирована с целью картирования ингибиторного(ых) домена(ов) или участка(ов) в составе Nogo. Делеционные конструкции гена Nogo были сформированы с использованием внутренних рестрикционных сайтов, расщепления экзонуклеазой-III фасоли-маш и полимеразных цепных реакций. Описание мутантов дано на фиг.18 в ее легенде в разделе «Краткое описание чертежей». Большинство конструкций включает N-концевую метку T7-tag для идентификации с помощью анти-Т7 моноклональных антител; и N-или С-концевую гексагистидиновую метку («His-tag») для очистки с использованием аффинной хроматографии с иммобилизованным Со (II). Все делеционные мутанты Nogo, обозначенные NiG-D1, NiG-D2 и далее до NiG-D20, были протестированы с использованием теста на распределение фибробластов NIH-3T3 с целью определения ингибиторной активности. Некоторые мутанты были проанализированы в тестах на разрастание нейритов РС12, разрастание нейритов в диссоциированных DRG крысы или рассечение ганглиев сетчатки. Полученные результаты показаны далее в табл.2.
Положительным в тесте с фибробластами NIH-3T3 (3Т3) или в тесте РС12 считается результат, когда фибробласты или клетки РС12 подавляются по их распределению по поверхности чашки, покрытой препаратом Nogo, полученным от делеционного мутанта. Положительный результат в тесте на разрастание нейритов в заднекорешковых ганглиях (DRG) куриного эмбриона или тесте на коллапс конуса нарастания ганглия (RGC) указывает на то, что разрастание нейритов подавляется, или на то, что обусловливается коллапс конуса нарастания в присутствие препарата Nogo, полученного от делеционного мутанта.
Полученные данные указывают на то, что основной ингибиторный домен был идентифицирован в конкретном участке Nogo-A аминокислот 172-974, в частности, аминокислот положений 542-722. Кроме того, N-концевая последовательность Nogo-A и Nogo-B (аминокислоты 1-171) также обладала ингибиторной активностью в отношении распределения 3Т3. Основываясь на этих результатах, участки Nogo аминокислот 172-259 и 975-1162, по-видимому, можно рассматривать как несущественные, которые можно удалять без утраты ингибиторной активности.
7. Пример: нуклеиновые кислоты и белки Nogo человека, производные и фрагменты
Настоящее изобретение представляет нуклеотидные последовательности, кодирующие белок Nogo человека, и фрагменты белков Nogo человека, включая человеческие эквиваленты Nogo-A, Nogo-B и части Nogo-C крысы. Аминокислотная последовательность Nogo человека показана на фиг.13 и обозначена как SEQ ID NO 29.
Также настоящее изобретение представляет нуклеотидные последовательности фрагментов гена Nogo человека. Нуклеотидная последовательность Nogo человека может быть определена с использованием транскрипта Nogo-A крысы для сопоставления и совместного сплайсинга с экспрессированными маркерными последовательностями человека (EST-маркерами), которые гомологичны последовательности кДНК крысы или быка.
Например, EST-маркеры АА081783 и АА333267 (раздел 5.1) перекрываются друг с другом и соответствуют положениям 765-1272 нуклеотидной последовательности Nogo-A крысы (фиг.2а: SEQ ID NO 1). EST-маркеры АА322592, АА092565 и АА081525 (раздел 5.1) также перекрываются друг с другом, и перекрывающиеся последовательности соответствуют нуклеотидам 1642-2131 нуклеиновой кислоты Nogo крысы. Эти две независимые группы перекрывающихся EST-маркеров невозможно сопоставить так, чтобы получить последовательность человека, без прямого компьютерного сравнения с нуклеотидной последовательностью Nogo крысы или быка по настоящему изобретению. Для исходного компьютерного сопоставления последовательностей предпочтительна программа ENTREZ Nucleotide QUERY. Другие компьютерные программы для сопоставления последовательностей перечислены в разделе 5.1 как альтернативные примеры, не призванные ограничить объем компьютерных программ, которые можно использовать.
8. Обсуждение
8.1. Клонирование ингибитора роста нейритов Nogo
Nogo-A обладает многими свойствами, которые подтверждают его тождество с ранее описанным белком NI-250 крысы основным белком-ингибитором роста нейритов в миелине ЦНС и антигеном для антитела IN-1. На молекулярном уровне Nogo-A включает все шесть пептидов, исходно полученных при секвенировании bNI-220 - наиболее мощного ингибиторного компонента миелина бычьего спинного мозга. На уровне экспрессии олигодендроциты являются основным типом клеток во взрослой ЦНС, экспрессирующих Nogo-A, а временная динамика экспрессии Nogo в зрительном нерве совпадает с описанной ранее нейтрализацией антителом IN-1 ингибиторной активности миелина в отношении роста нейритов. Более того, данные Вестерн-блоттинга указали на присутствие Nogo-A в активных фракциях q-pool, а белое вещество из различных участков ЦНС окрашивалось с AS-Bruna, а также с AS472 (специфичные для Nogo-A) с параметрами, идентичными таковым при использовании IN-1. Оба этих факта согласуются с такой интерпретацией, что Nogo-A тождествен NI-250.
Две антисыворотки, сформированные к последовательностям Nogo-A, - AS-Bruna и AS472 - в значительной степени снижают ингибиторную активность частично очищенного препарата спинного мозга быка (q-pool). AS472 также обеспечивает врастание большого числа аксонов заднекорешковых ганглиев на несколько миллиметров в эксплантаты зрительных нервов взрослых животных, что очень сходно с IN-1.
Хотя расчетная молекулярная масса Nogo-A составляет примерно 140 кД, имеет место выявленная молекулярная масса примерно 200 кД в ДСН-денатурирующих гелях, что попадает в диапазон сделанной ранее оценки в 250 кД. Аномальная подвижность Nogo-A в гелях с ДСН, по-видимому, вызвана его кислой природой, а не посттрансляционными модификациями. Аномальная подвижность белков при электрофорезе в ДСН-ПААГ была установлена для других высококислых белков, таких как ростовый белок GAP-43, а также NSP-A. Кроме того, экспрессированный в бактериях рекомбинантный Nogo-A имеет ту же выявляемую молекулярную массу, что и эндогенный Nogo-A, экспрессированный олигодендроцитами крысы. Это говорит против существенных модификаций Nogo-A по такому механизму, как гликозилирование.
8.2. Nogo предотвращает регенерацию и ограничивает пластичность взрослой ЦНС
Экспрессия Nogo в олигодендроцитах зрительных нервов крыс начиная с возраста Р0 хорошо согласуется с более ранними данными о нейтрализуемой антителом IN-1 активности по ингибированию роста нейритов. Интересно, что такая экспрессия на несколько дней предшествует основным миелиновым белкам и формированию компактного миелина. Появление Nogo, возможно, в ответ на аксонные сигналы, может предотвращать дальнейший рост аксонов в соответствующих пучках (число аксонов достигает пика в зрительных нервах крысы в день Е20). Nogo также способен подавлять образование боковых отростков, тем самым стабилизируя основную структуру сформировавшейся ЦНС. В сером веществе различных участков ЦНС содержание миелина и иммунореактивность с IN-1 находится в обратной корреляции с уровнем GAP-43 и пластическим потенциалом данных участков. Действительно, антитела IN-1 при действии на взрослую ЦНС приводят к ветвлениям и пластичности в стволовых отделах мозга и в спинном мозге в той степени, которая ранее была известна только для ЦНС новорожденных. Мощная восстановительная функция, параллельная такой пластичности, указывает на то, что разрастающиеся аксоны способны формировать функциональные нервные контакты.
Ранее было показано, что ответ нейронов на ингибиторные Nogo различается между нейронами разного возраста. Предположительно это объясняется разницей в экспрессии рецепторов, которые вскоре должны быть изучены и охарактеризованы. Как и в случаях с нетринами и многими факторами роста, сохраняется возможность существования различных рецепторов для Nogo, которые опосредуют разные физиологические ответы. Тот факт, что Nogo также экспрессирован в некоторых типах нейронов, указывает на возможность взаимодействий между теми же и/или разными изоформами Nogo.
8.3. Nogo относится к новому семейству молекул регуляции нейритов
Анализ последовательностей Nogo указывает на отсутствие известных мотивов поверхностно-клеточных или матричных белков, вовлеченных в контроль аксонов (притягивание или отталкивание): т.е. не удалось идентифицировать иммуноглобулино-подобные, фибронектиновые III-го типа или EGF-домены. Не было выявлено гомологии ни с одним из описанных ингибиторов роста нервной ткани - семафоринами, нетринами или эфринами.
Белки Nogo образуют новое семейство, включающее группу недавно описанных белков - белков NSP/s-rex и NSP-подобных-1, на что указывает сходство их С-концевых 180 аминокислот. Как и в случае с Nogo, использование и альтернативных промоторов (гены как Nsp, так и Nsp-like-1), и альтернативного сплайсинга (только Nsp) обусловливает выработку альтернативных белковых продуктов с общими С-концевыми участками, включающими два мотива гидрофобных аминокислот. Как ясно из обозначения, NSP (нейроэндокринно-специфичные белки) в основном экспрессированы в нейронах и некоторых типах клеток желез внутренней секреции. В основном они локализованы внутриклеточно и связаны с эндоплазматическим ретикулюмом. Ген NSP-like-1 в основном экспрессирован в головном мозге и мышцах. Ни функции NSP, ни функции Nsp-like-1 неизвестны. Тот факт, что вероятные ортологичные гены имеются и у C.elegans, и у Drosophila melanogaster, подтверждает, что Nogo при его активности по подавлению регенерации нервов и образования отростков может быть новым и ранее не описывавшимся членом семейства NSP.
8.4. Nogo в ненервных тканях
Транскрипт Nogo-C экспрессирован в скелетных мышцах на уровне, сравнимом с уровнем экспрессии в нервной системе. Одной из предполагаемых функций мышечного Nogo-C является отталкивание двигательных аксонов и ограничение их участком нервных окончаний двигательных нервов. Низкий уровень экспрессии Nogo также может быть выявлен в других ненервных тканях. Выявленное подавление распределения фибробластов и астроцитов экстрактом миелина и NI-250 указывает на существование в этих клетках рецепторов и механизмов ответов на белки Nogo. Это подтверждает возможную базовую функцию Nogo, заключающуюся в контактном ингибировании движения клеток.
8.5. Идентификация гидрофильных и гидрофобных участков белка Nogo и аминокислотных последовательностей по изобретению
Все заявленные соединения являются иммуногенными и, следовательно, могут быть использованы для получения антител. Профиль гидрофильности можно использовать для идентификации фрагментов в белке Nogo (см. раздел 5.4.2 описания), как указано в работе Норр & Wood. В этой работе подробно описывается методология и принцип оценки для установления иммуногености путем поиска антигенных детерминант на основе данных анализа по гидрофильности. В реферате этой работы указано, что "место самого высокого среднего числа гидрофильности неизменно расположено в антигенной детерминанте или непосредственно вблизи нее". Фрагменты белка Nogo, которые были идентифицированы как гидрофильные, используются как иммуногены для получения антител.
Соответственно анализ по гидрофильности может подтвердить и предсказать иммуногенные части заявленных белков и фрагментов.
Для аминокислотных последовательностей из 80 аминокислот или менее (по длине), были проанализированы приблизительно 200 аминокислотных фрагментов, которые включают более короткие фрагменты, как указано в обобщающей таблице 3. Анализ может быть выполнен в интерактивном режиме с использованием компьютерной системы, в частности, такой как Expert Protein Analysis System proteomics, доступной на сервере Швейцарского Института Биоинформатики (SIB), или аналогичной. Для интерактивного анализа, с использованием аминокислотной шкалы, предложенной в работе Норр & Wood, использовались окна из 7 аминокислот. Точки и зоны наибольшей локальной гидрофильности были выявлены для каждого исследуемого случая (т.е. для каждой из иследуемых последовательностей и приведены в последней колонке обобщающей таблицы), что указывает на наличие антигенной детерминанты (детерминант), которая предопределяет иммуногенную активность исследуемых последовательностей белков/фрагментов при сравнении их с белком NOGO.
Настоящее изобретение не должно ограничиваться в своем объеме описанными здесь конкретными примерами. Действительно, различные модификации настоящего изобретения в дополнение к тем, которые описаны здесь, будут понятны специалисту в данной области техники из предшествующего описания и сопровождающих фигур. Такие модификации должны попадать в объем прилагаемой формулы изобретения.
Различные публикации, цитировавшиеся в данном тексте, в полном своем объеме включены для сведения в виде библиографических ссылок.









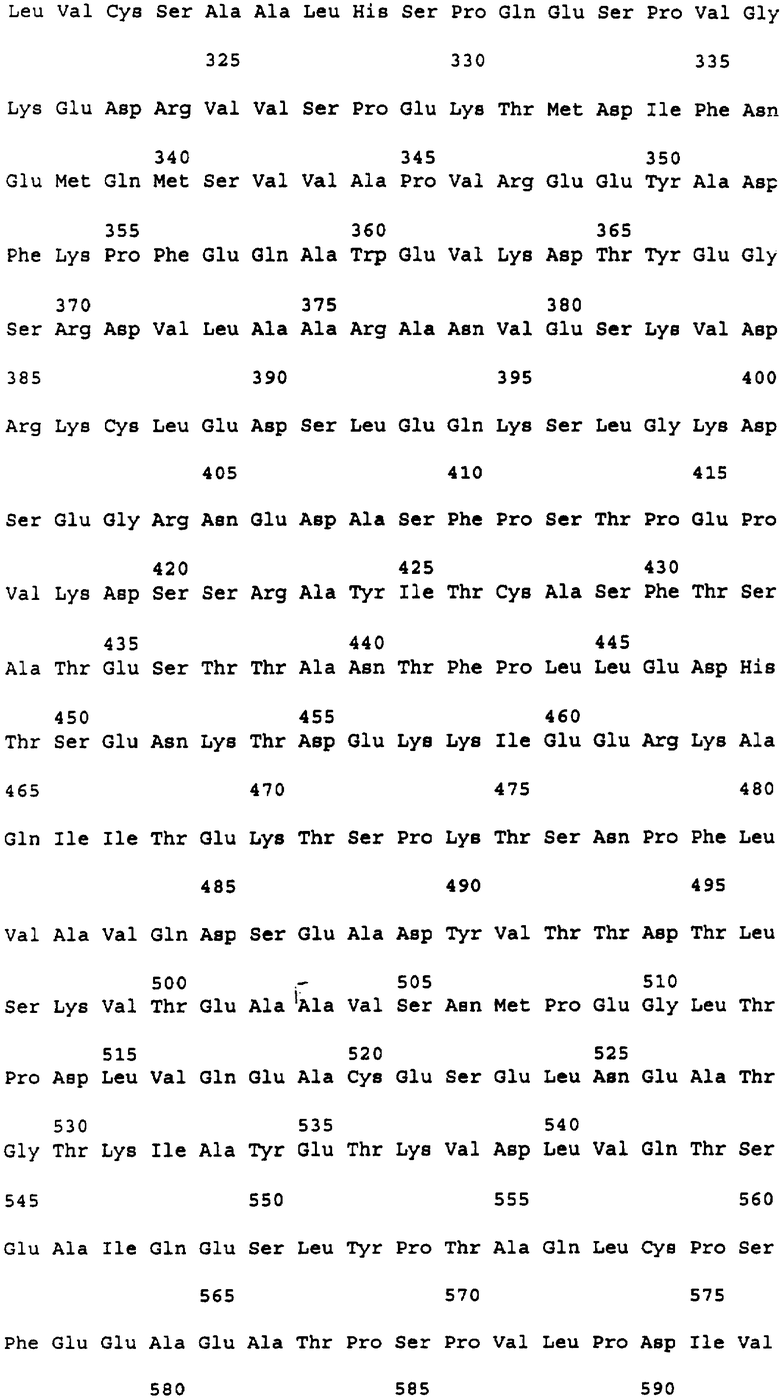


















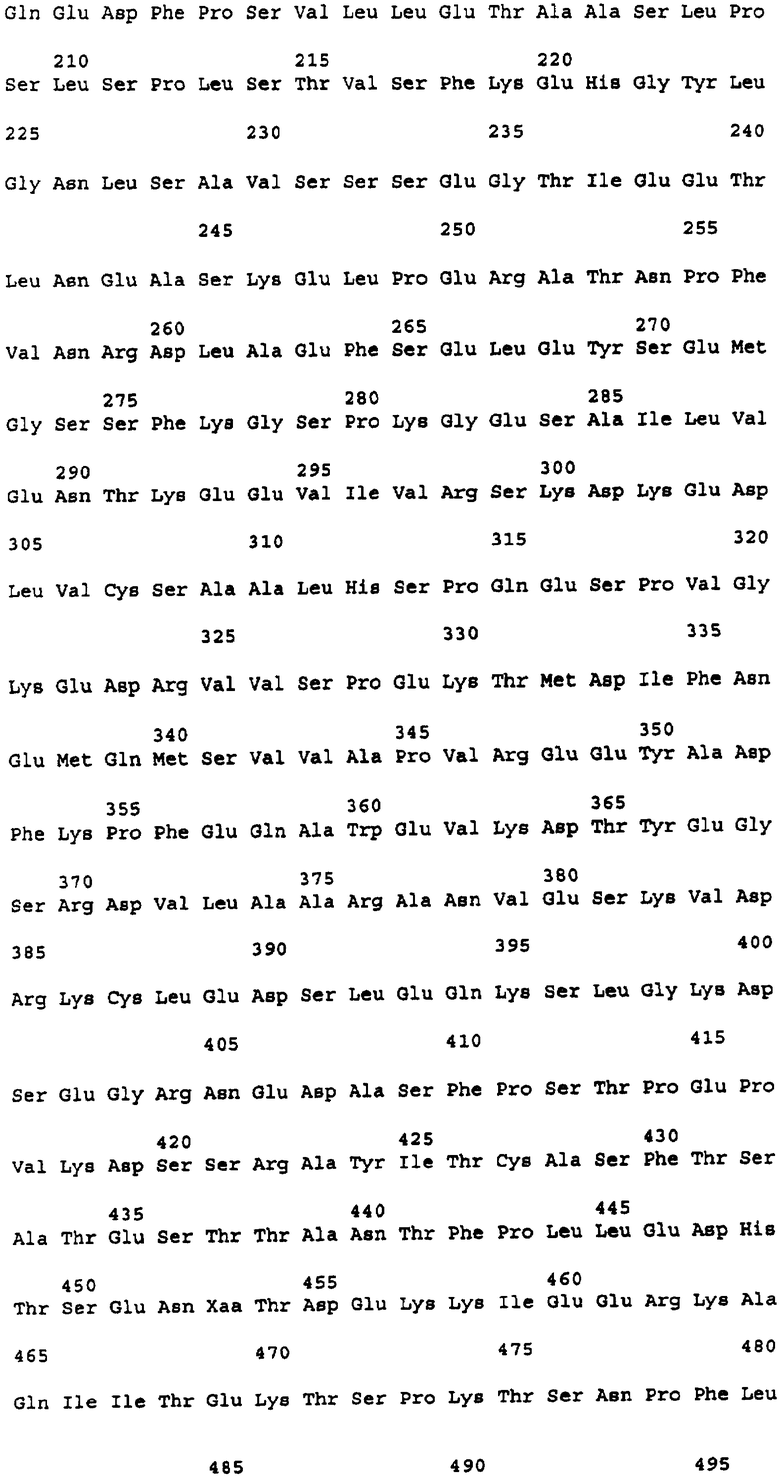










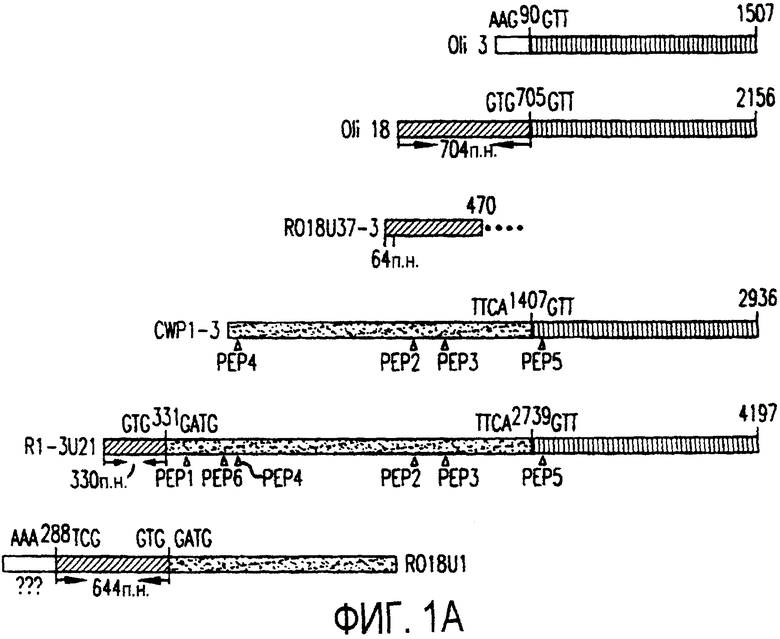
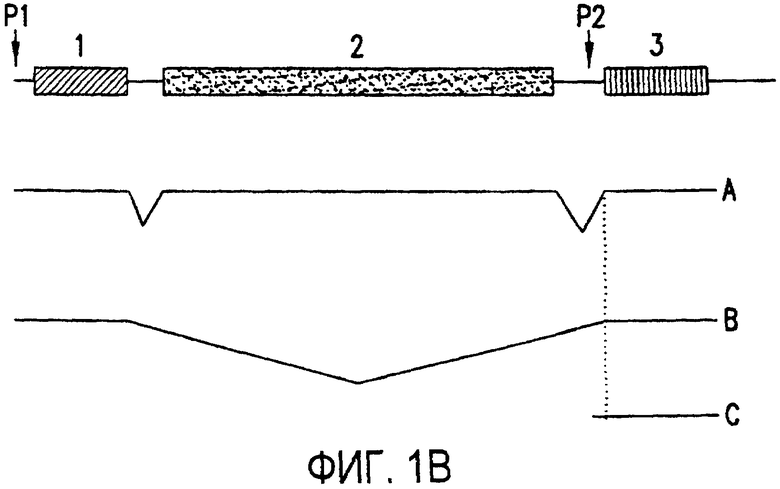







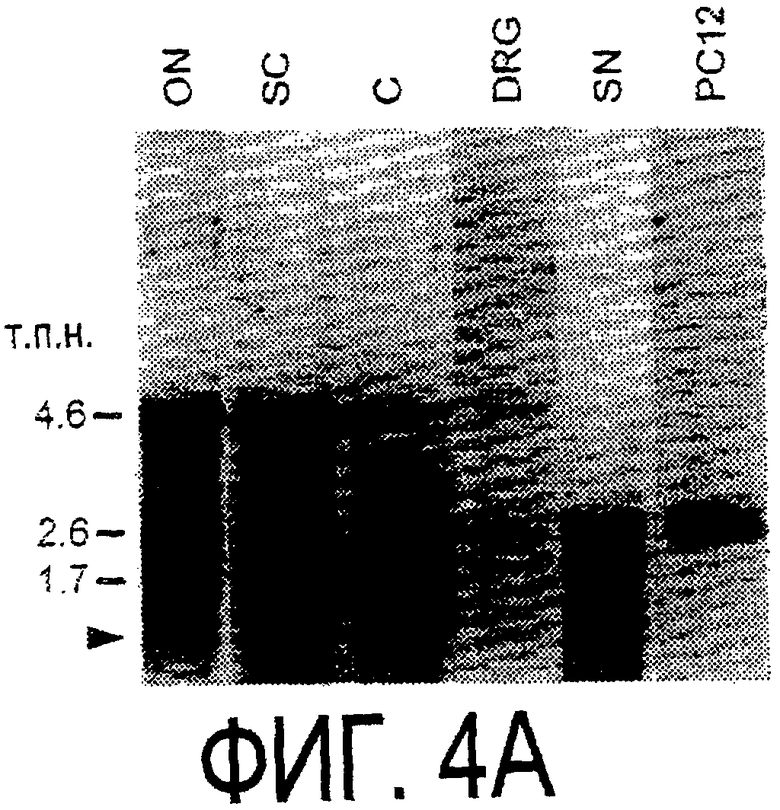

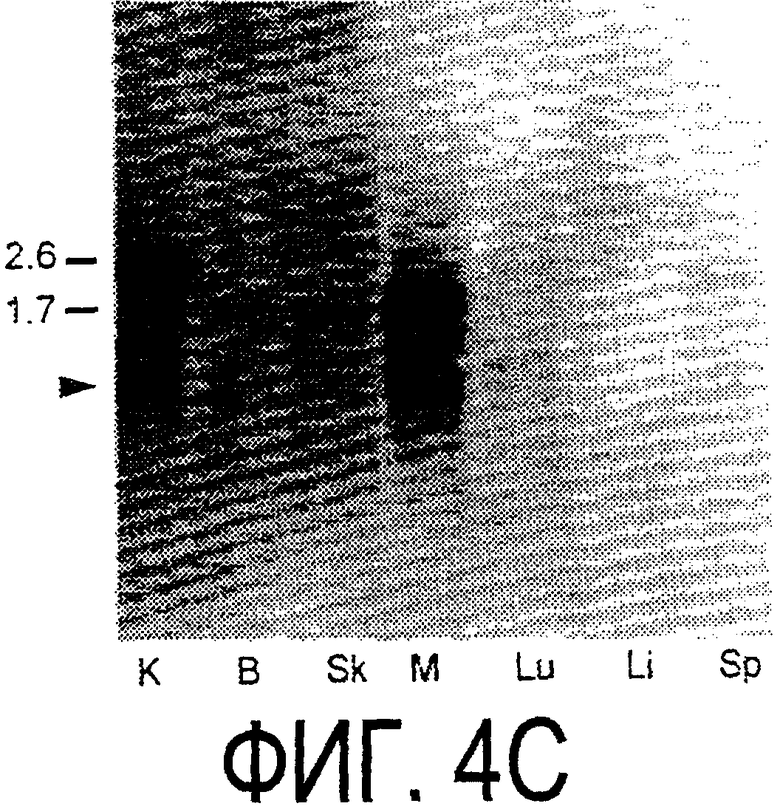

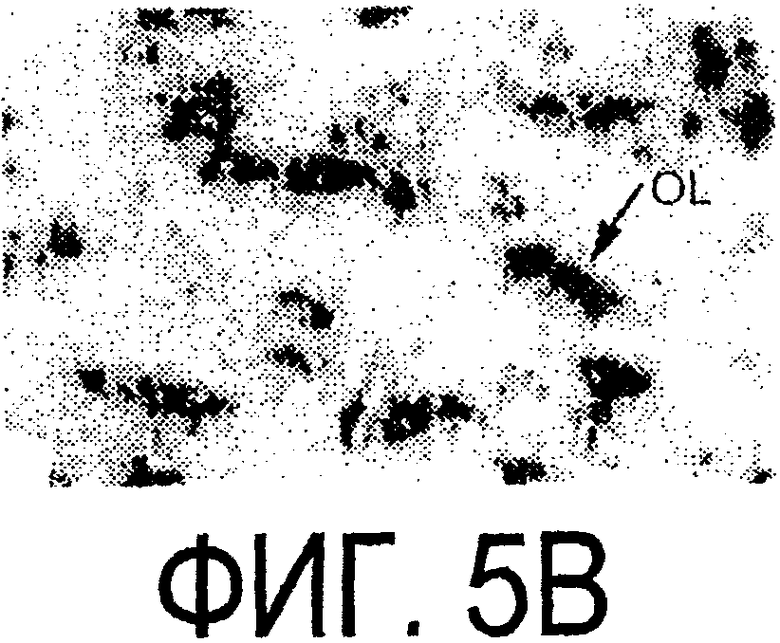


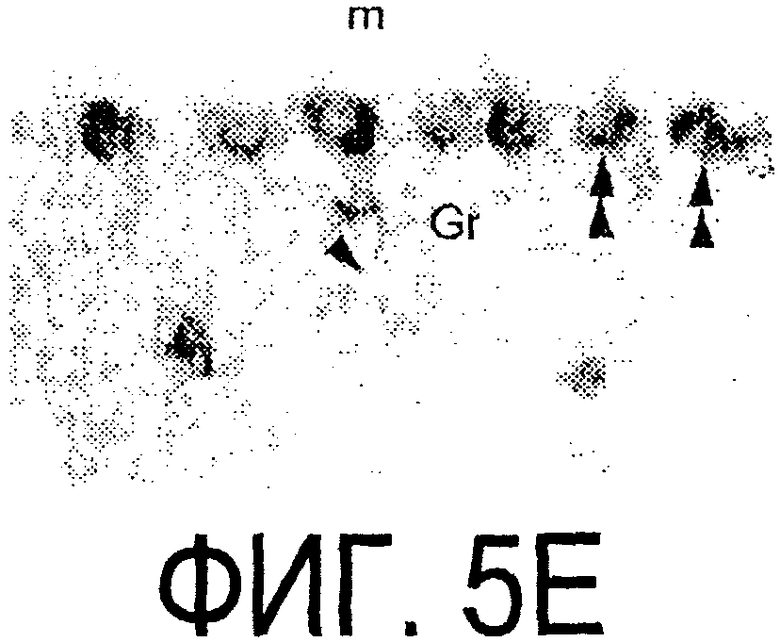











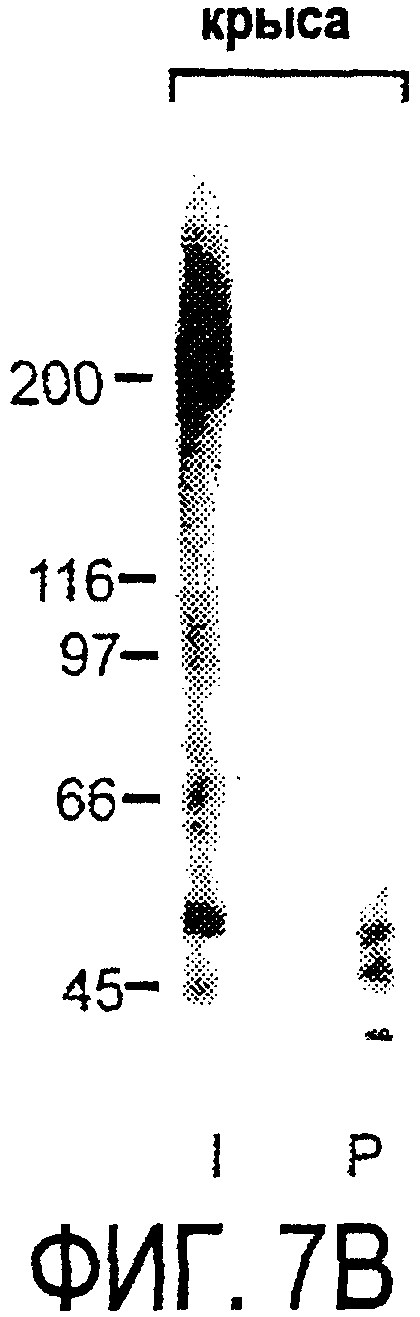
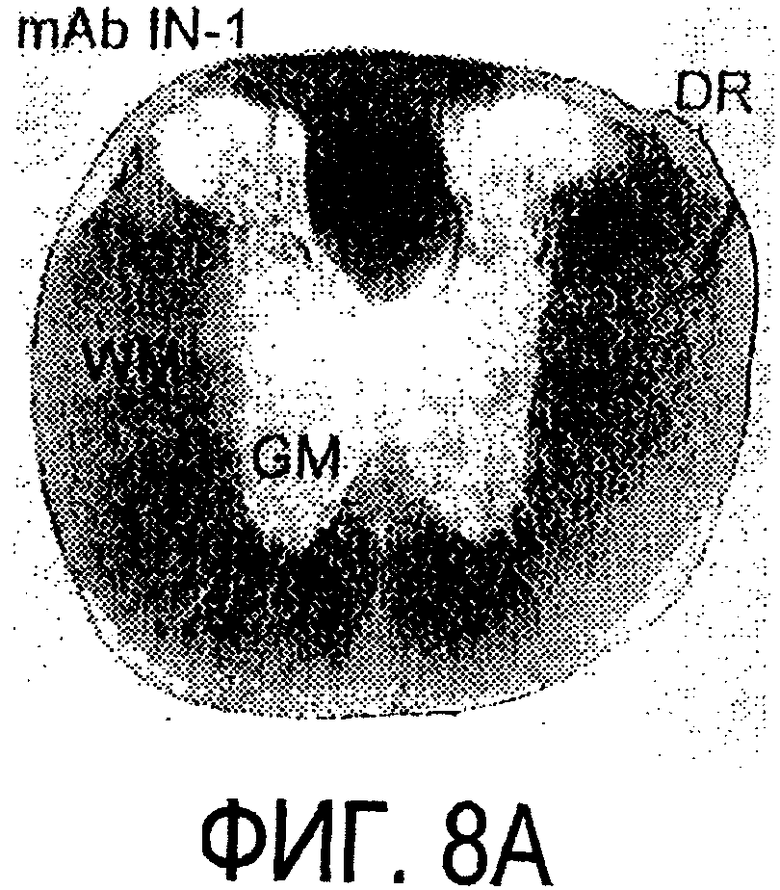


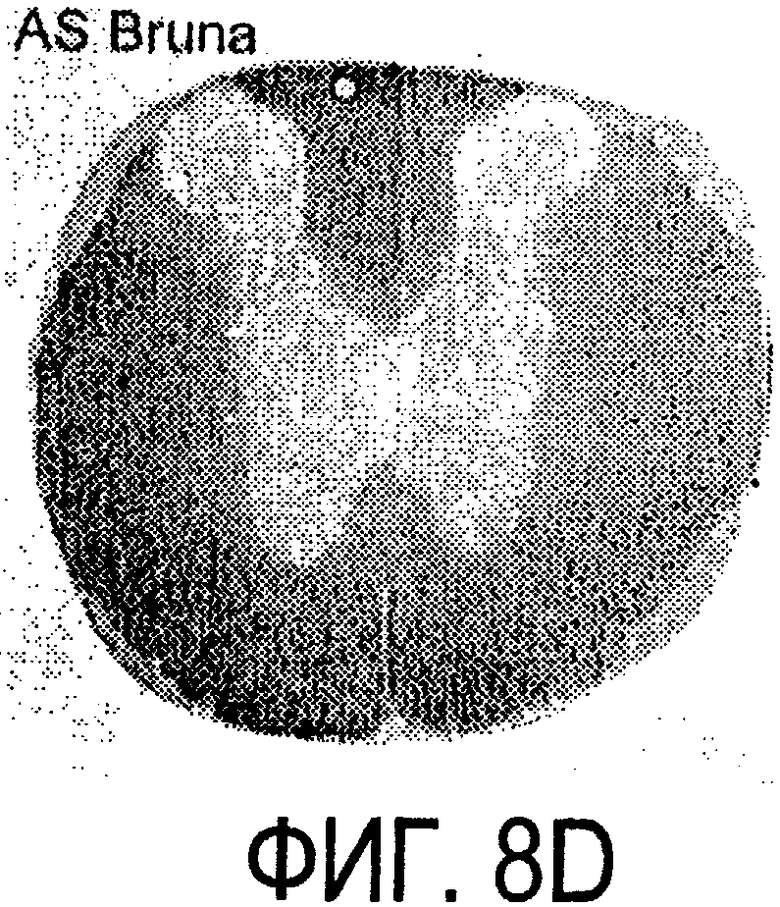






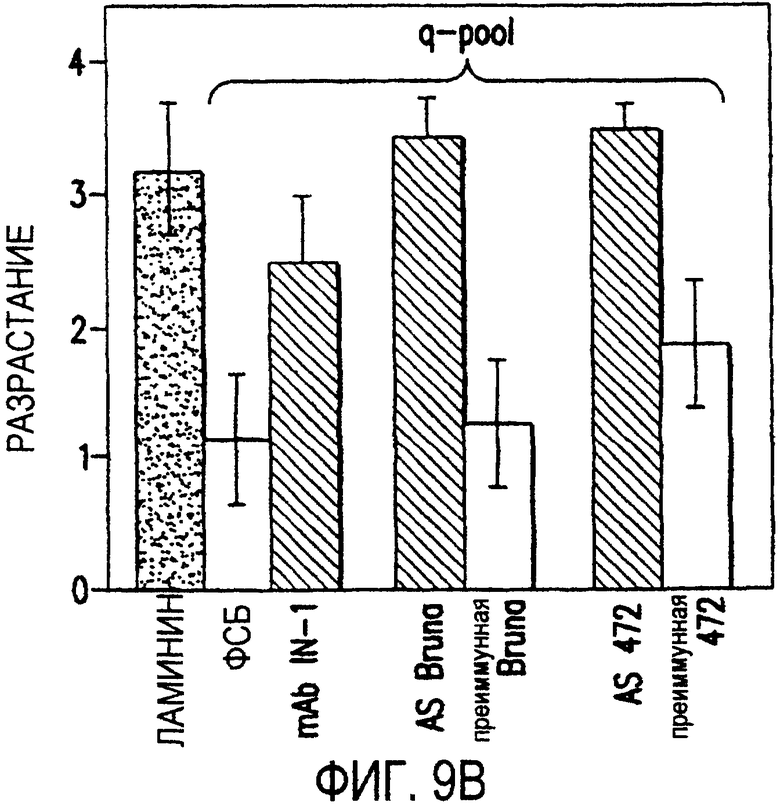

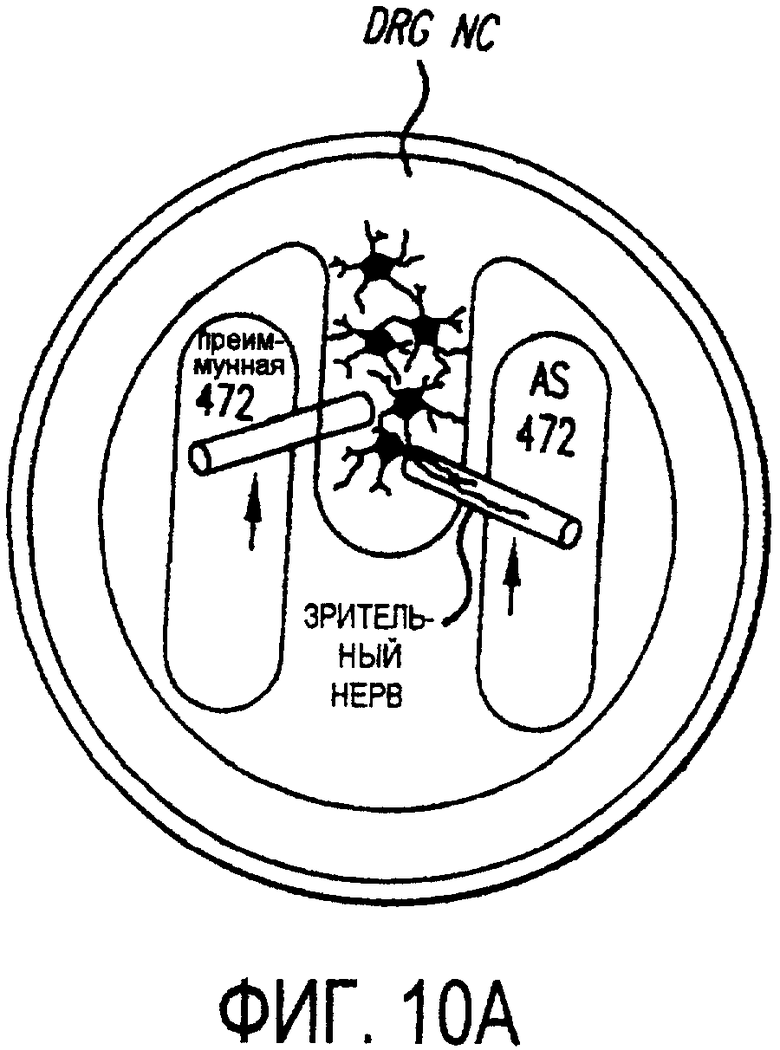
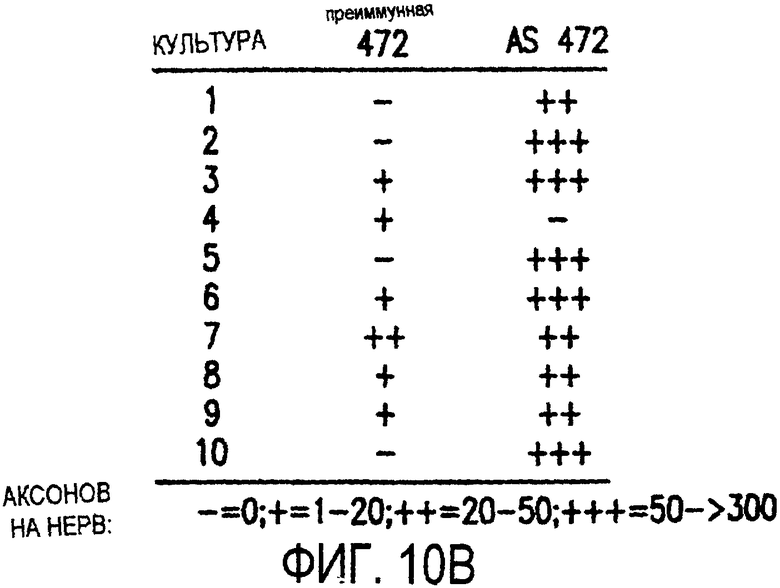
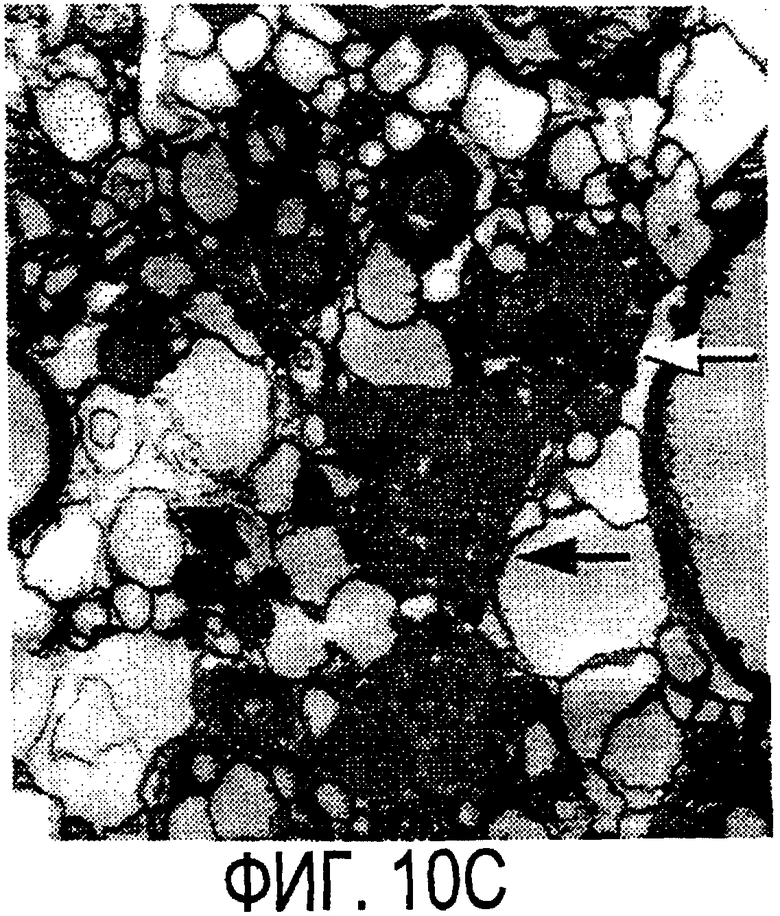
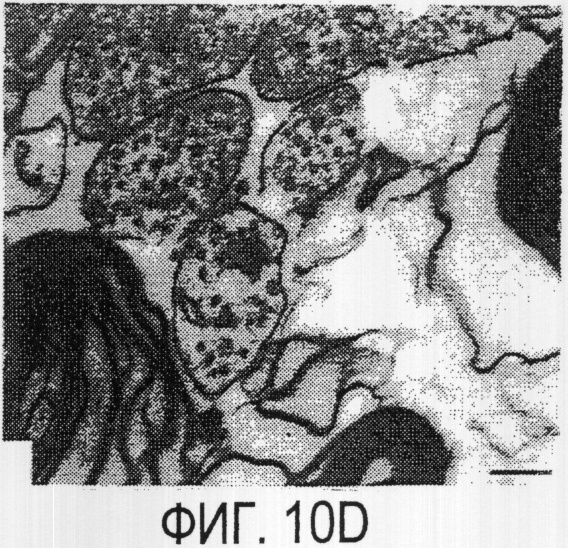
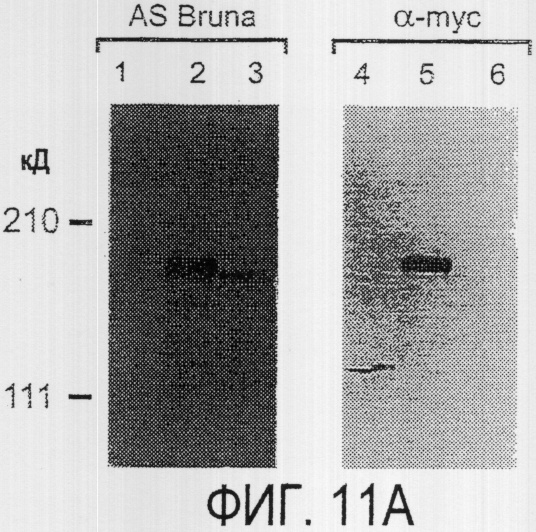
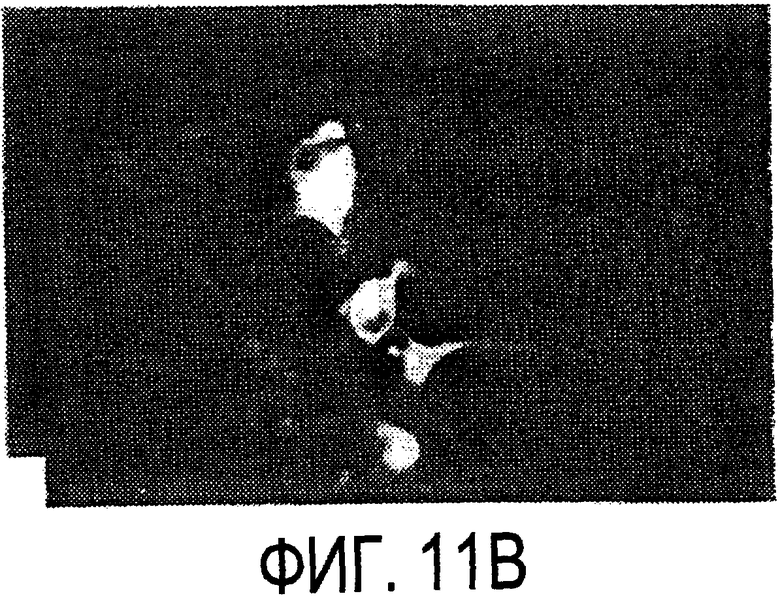














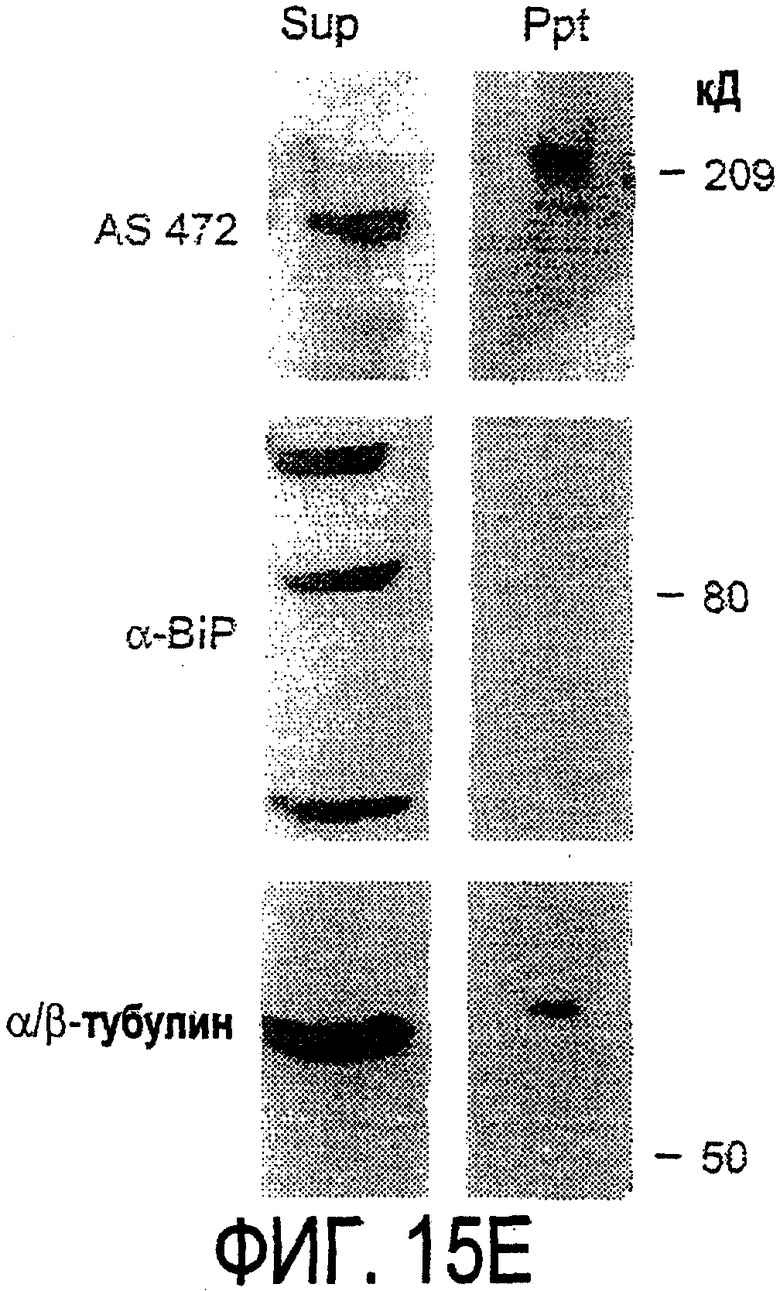

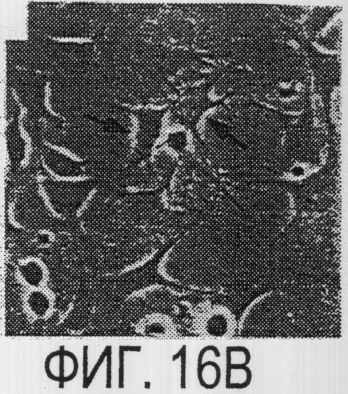

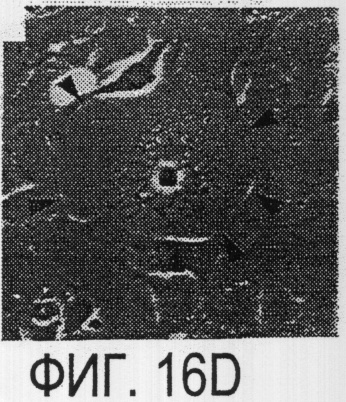



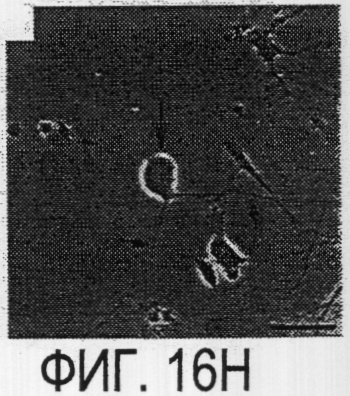
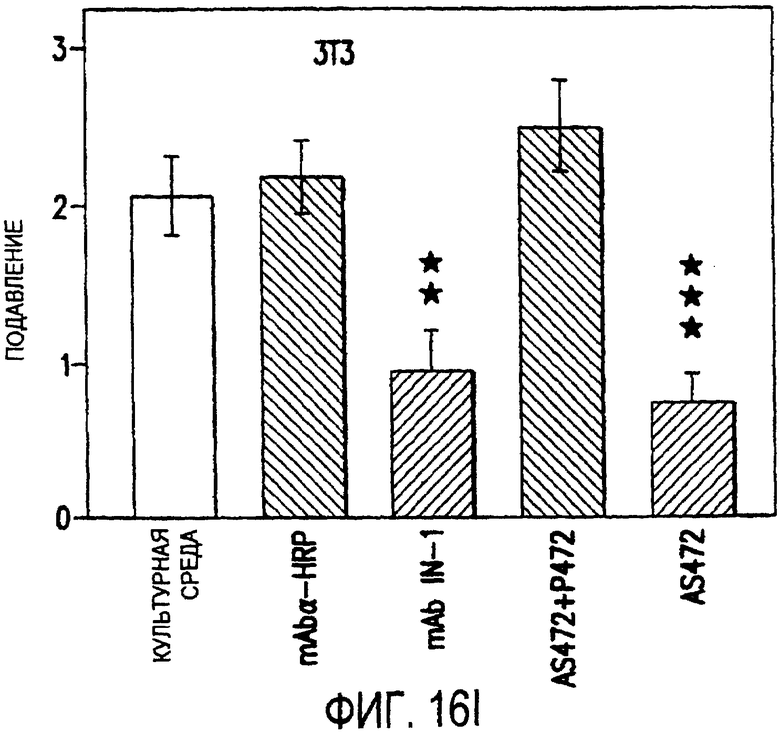
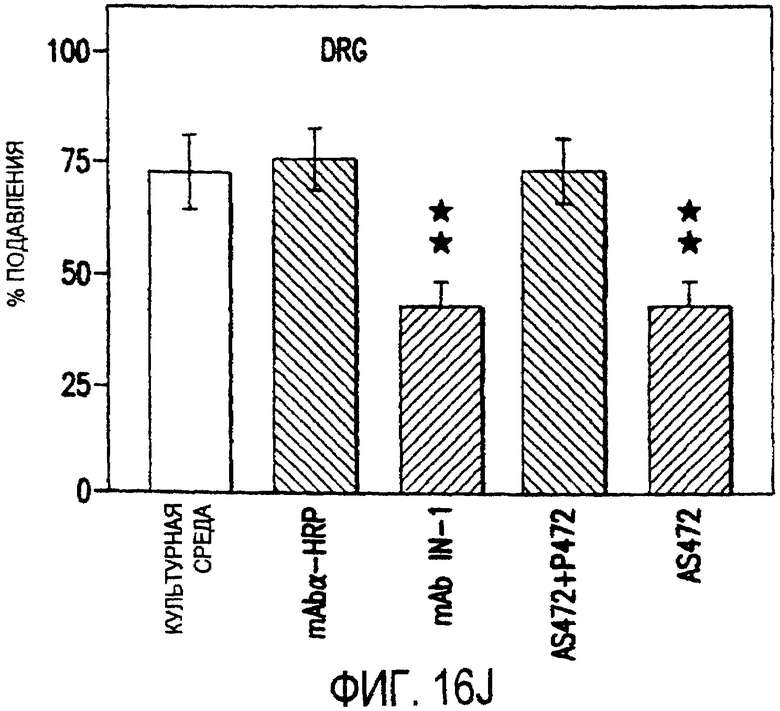
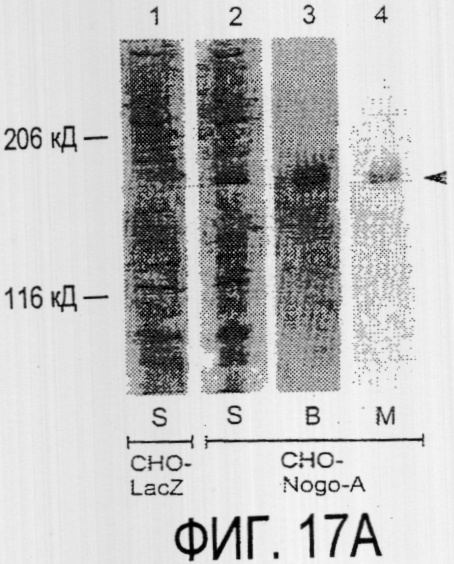
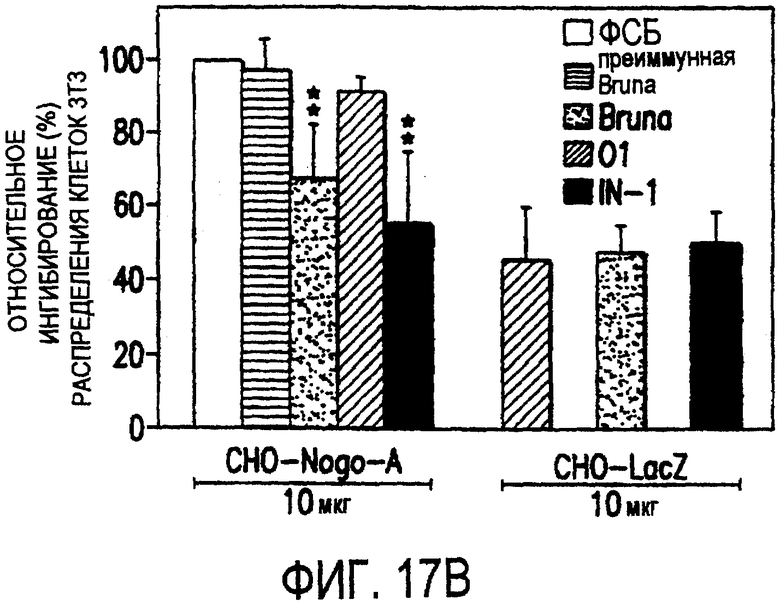
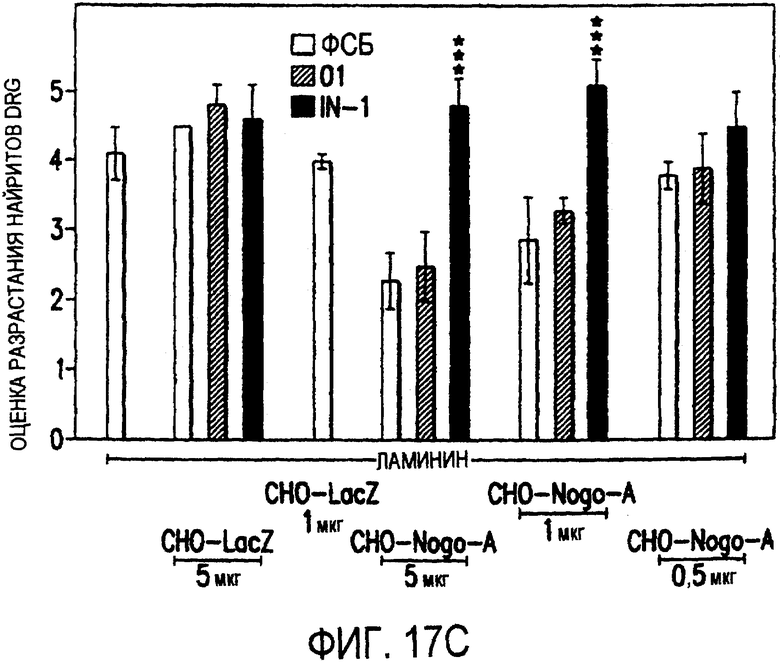

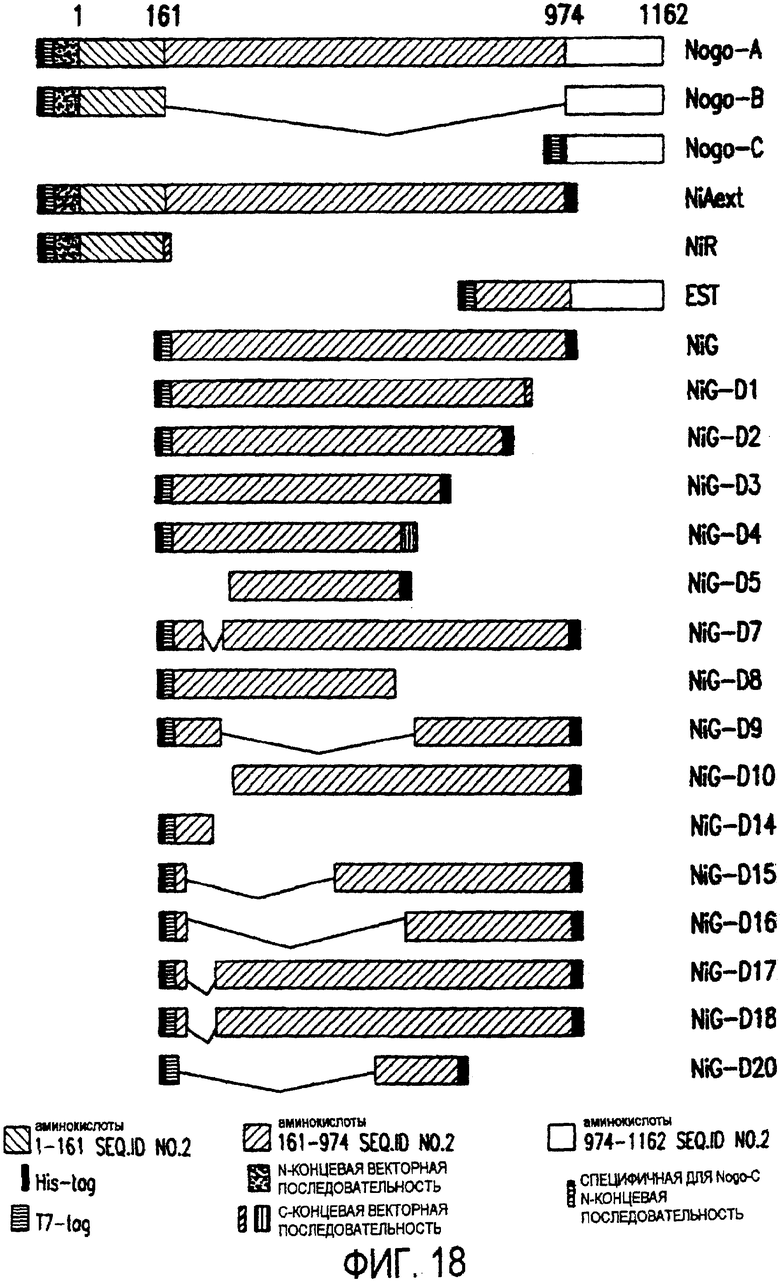
Изобретение относится к области биотехнологии и иммунологии и может быть использовано в медицине в диагностических и лечебных целях. Получены и охарактеризованы с точки зрения наличия у них иммуногенных свойств две формы связанного в природе с миелином белка Nogo, которые соответствуют природным продуктам альтернативного сплайсинга, их фрагменты и производные, в частности содержащие делеции аминокислотных остатков, а также химерные белки, включающие новые иммуногенные полипептиды и их фрагменты. 12 н. и 6 з.п. ф-лы, 79 ил., 3 табл.
(i) состоит из аминокислотной последовательности, в которой более чем 90% аминокислотных остатков при выравнивании с помощью компьютерной программы BLAST являются идентичными аминокислотным остаткам последовательности SEQ ID NO: 2, приведенной на фиг.2; или
(ii) состоит из аминокислотной последовательности, в которой более чем 90% аминокислотных остатков при выравнивании с помощью компьютерной программы BLAST являются идентичными аминокислотным остаткам второй аминокислотной последовательности, которая состоит из аминокислот 1-172, слитых с карбоксиконцевыми 188 аминокислотными остатками последовательности SEQ ID NO: 2.
(i) состоит из аминокислотной последовательности, в которой более чем 90% аминокислотных остатков при выравнивании с помощью компьютерной программы BLAST являются идентичными аминокислотным остаткам последовательности SEQ ID NO: 29, приведенной на фиг.13; или
(ii) состоит из аминокислот 1-172, слитых с карбоксиконцевыми 188 аминокислотными остатками последовательности SEQ ID NO: 29.
(i) остатков 988-1023 последовательности SEQ ID NO: 2;
(ii) остатков 994-1174 последовательности SEQ ID NO: 29, или
(iii) остатков 1079-1114 последовательности SEQ ID NO: 29.
| Кипятильник для воды | 1921 |
|
SU5A1 |
| CADELLI ET AL., Exper | |||
| Neurology, 115, 189-192, 1992 | |||
| CANONI, SCHWAB, J | |||
| Cell Biol., 106, 1281-1288, 1988. | |||
Авторы
Даты
2007-08-20—Публикация
1999-11-05—Подача