Настоящая заявка не является предварительной и заявляет приоритет согласно 35 U.S.С. §119(e) на основании предварительной заявки США 60/533719, поданной 31 декабря 2003 г., содержание которой включено в настоящую в своей полноте посредством ссылки.
Изобретение относится к области белкового фактора роста и дифференцировки 8 (далее обозначаемый GDF8), а именно к выделенному пептиду, обладающему связывающей анти-GDF8 антитело активностью, выделенной молекуле нуклеиновой кислоты, вектору экспрессии, клетке-хозяину, а также к способу получения пептида, вакцинной композиции и способу вызывания иммунного ответа анти-GDF8, способу скрининга для отбора анти-GDF-S антитела и способу понижающего регулирования активности анти-GDF-8 у животного. Таким образом, изобретение рассматривает методы лечения животных с целью модулирования активности фактора роста и дифференцировки 8.
Фактор роста и дифференцировки 8 представляет собой белок, относящийся к суперсемейству трансформирующих факторов роста β (TGF-β). В общем белки суперсемейства TGF-β сначала экспрессируются в виде предшественника (иначе назваемого прогормоном), который подвергается протеолитическому расщеплению по кластерам или основным остаткам приблизительно на расстоянии 110-140 аминокислот от С-конца предшественника. В каждом случае считается, что активные, или зрелые, факторы TGF-β представляют собой дисульфидно-связанный димер отщепленных от предшественника C-концевых областей.
Фактор роста и дифференцировки 8, далее обозначаемый GDF8, также известен в данной области как GDF-8 или миостатин. Гены, кодирующие предшественник GDF8 (далее обозначаемый «предшественник GDF8»), клонированы из широкого ряда организмов. К ним относятся предшественники GDF8 человека и крысы [Nestor et al., 1998, Proc. Natl. Acad. Sci. 95:14938-43; Патент США №5827733, содержания которых включены в своей полноте в настоящее описание посредством ссылки]. Также сообщалось, что иммунореактивность GDF8 определяется в скелетных мышцах человека в волокнах типа 1 и типа 2. Антитела и исследования для определения GDF8 описаны, например, в патенте США №6096506.
Также сообщалось, что GDF8 играет роль в понижающем регулировании или ингибировании роста и развития скелетной мышцы, что подтверждено на мышах, нокаутных по GDF8 (McPherron et al., 1997, Nature 387:83-90). По этой причине предпринимались попытки, особенно в области животноводства, различными способами модулировать активность GDF8 в животных с целью понижающего регулирования активности GDF8 для усиления роста и/или относительной мышечной массы различных сельскохозяйственных животных.
Например, в патенте США №6399312 описывается промотор гена предшественника GDF8 и исследование, которое предлагается использовать для идентификации теоретического ингибитора этого промотора. В патенте США №6656475 описан метод ингибирования эффекта GDF8 на клетку путем взаимодействия клетки с продоменом GDF8, который конкурирует за рецептор GDF8, в этой работе сообщается, что С-конец зрелого GDF8 может варьировать. В патенте США №6004937 описано применение фоллистатина как возможного антагониста GDF8. Ни один из этих методов не нашел практического применения в области животноводства или в клинической практике (человека или ветеринарной).
Также предпринимались попытки применения технологии антител и вакцин для понижающего регулирования функции GDF8. Например, в патенте США №6369201 (содержание которого включено в настоящее описание в своей полноте посредством ссылки) описаны пептиды, т.е. фрагменты белка GDF8, и вакцина, вызывающая образование антител анти-GDF8. Также в этом патенте сообщается о неуточненной степени прибавки в росте и весе по сравнению с контролем у грызунов, иммунизированных несколькими из описанных фрагментов пептида GDF8.
Также описаны другие физиологические функции GDF8. Например, в патенте США 6368597 (содержание которого включено в настоящее описание в своей полноте посредством ссылки) предполагается, что ингибирование функции GDF8 применимо в лечении диабета типа II, например, путем введения антител к GDF8 или вакцины против GDF8 пациенту, имеющему данное заболевание.
Задача данного изобретения заключается в предоставлении улучшенных антигенов и иммуногенов, вызывающих ответ анти-GDF-8, а также улучшенных антител к GDF-8, способных высокоспецифично связываться с GDF-8.
Цитирование любых ссылок не должно истолковываться как допущение, что такая ссылка доступна в качестве “Предшествующего уровня техники” для настоящей заявки.
Задача изобретения решается через выделенный пептид, обладающий специфической связывающей анти-GDF8 антитело активностью, состоящий из
(a) аминокислотных остатков с 327 по 346 последовательности SEQ ID NO:1, или
(b) аминокислотных остатков с 327 по 346 последовательности SEQ ID NO:1, содержащие консервативную аминокислотную замену, или
(c) аминокислотных остатков с 327 по 346 последовательности SEQ ID NO:1, содержащие аминокислотную замену в положении, выбираемом из группы, состоящей из остатков 328, 329, 331, 333 и 335, и их комбинаций, причем
(i) аминокислотный остаток 328 представляет собой His, Leu или Asn;
(ii) аминокислотный остаток 329 представляет собой Gln или Lys;
(iii) аминокислотный остаток 331 представляет собой Asn или Ser;
(iv) аминокислотный остаток 333 представляет собой Arg или Lys; и/или
(v) аминокислотный остаток 335 представляет собой Ser, Pro или Thr,
причем в случаях (b) и (c) между аминокислотными остатками с 327 по 346 имеется не более пяти аминокислотных замен, и пептид специфически связывается с моноклональным антителом крысы 788.
Настоящее изобретение восполняет эти и другие недостатки в области техники, обеспечивая пептиды GDF8 (т.е. пептидные фрагменты GDF8, включающие 50 остатков и менее), содержащие специфический нейтрализующий эпитоп для GDF8.
В одном из вариантов осуществления изобретения обеспечены пептиды GDF8, включающие, например, выделенный пептид, содержащий остатки приблизительно с 312 до 361 из природного предшественника GDF8 человека (SEQ ID NO:1). Предпочтительно пептид GDF8 по изобретению содержит остатки приблизительно с 320 по 350, более предпочтительно - остатки приблизительно с 321 по 346 и наиболее предпочтительно - приблизительно с 327 по 346 из природного предшественника GDF8 человека. Пример пептида GDF8, далее обозначаемый DJ5, приведен ниже как в однобуквенной, так и в трехбуквенной кодировке, для удобства нумерация остатков основана на нумерации предшественника GDF8 с последовательностью SEQ ID NO: 1.
В следующем варианте осуществления изобретения пептид GDF8 необязательно содержит консервативные единичные аминокислотные замены. В качестве примера, могут быть заменены от одной до, по меньшей мере, пяти аминокислот в пептиде. В конкретном варианте осуществления есть, по меньшей мере, одна консервативная аминокислотная замена, например, между остатками 327 и 346 последовательности GDF8. В другом варианте осуществления пептид GDF8 содержит консервативные аминокислотные замены не более чем в пяти положениях по длине пептида. В еще одном варианте осуществления между остатками 327 и 346 последовательности GDF8 находятся две консервативные аминокислотные замены. В еще одном варианте осуществления между остатками 327 и 346 последовательности GDF8 находятся три консервативные аминокислотные замены. В еще одном варианте осуществления между остатками 327 и 346 последовательности GDF8 находятся четыре консервативные аминокислотные замены.
Предпочтительно замены аминокислотных остатков осуществлены в одном или более положениях по отношению к последовательности природного предшественника GDF8 человека (SEQ ID NO:1), которые отмечены в выравнивании аминокислотных последовательностей разных видов на фиг.2. Это остатки 328, 329, 331, 333 и 335, и их комбинации, причем:
(a) аминокислотный остаток 328 представляет собой His, Leu или Asn;
(b) аминокислотный остаток 329 представляет собой Gln или Lys;
(c) аминокислотный остаток 331 представляет собой Asn или Ser;
(d) аминокислотный остаток 333 представляет собой Arg или Lys и/или
(e) аминокислотный остаток 335 представляет собой Ser, Pro или Thr.
Предпочтительно такие модифицированные пептиды GDF8 содержат специфический нейтрализующий эпитоп для анти-GDF8 антитела и, таким образом, сохраняют свойство специфически связываться с антителом анти-GDF8, причем антитело представляет собой моноклональное антитело mAb 788 и/или фракцию IgG поликлональной сыворотки козы анти-GDF8, как указано в примере ниже.
В еще одном варианте осуществления настоящего изобретения описаны молекулы нуклеиновой кислоты, т.е. полинуклеотиды, кодирующие указанные выше пептиды GDF8.
Предпочтительно молекулы нуклеиновой кислоты содержат часть встречающегося в природе гена предшественника GDF8 человека приблизительно от нуклеотида 112 до 1171 (номер в Генбанке Genebank accession NM_005259, ген GDF8 человека; SEQ ID NO:2). Эта часть кодирует пептид DJ5, описанный выше. Следует отметить, что последовательность NM_005259 включает большую последовательность, фланкирующую собственно кодирующую область. Специалисту в данной области техники будет понятно, что DJ5 соответствует нуклеотидам 979-1038 кодирующей области прогормона GDF8.
Также описаны векторы для клонирования и репликации и прокариотические и эукариотические клетки-хозяева, содержащие молекулы нуклеиновой кислоты, а также способы получения пептида GDF8, которые включают следующие этапы: культивирование клеток-хозяев, экспрессирование кодированного пептида и выделение пептида. Специалисту в данной области техники будет понятно, что пептид GDF8 по изобретению также можно получать любым стандартным, известным в данной области химическим методом синтеза.
В следующем варианте осуществления настоящего изобретения описана композиция вакцины, содержащая пептид GDF8 по изобретению (или его слитый белок), например, композиция, предпочтительно содержащая один или более адъювантов и других стандартных в данной области техники элементов вакцинной композиции, основанной на пептиде или белке. Также описаны методы вызывания иммунного ответа анти-GDF8 у животного, включающие введение животному эффективного количества вакцинной композиции.
В следующем варианте осуществления настоящего изобретения описан метод скрининга для селекции антитела анти-GDF8 или фрагмента антитела из множества антител и фрагментов, метод включает контакт пептида с одним или множеством антител или фрагментов антител и детекцию антитела или фрагмента антитела, селективно связывающегося с пептидом.
В еще одном аспекте настоящее изобретение описывает способ понижающей регуляции активности GDF8 у животных. В одном из таких вариантов осуществления способ включает введение животному антитела или фрагмента антитела, причем количество и продолжительность введения эффективны для понижающей регуляции активности GDF8 у животного, при этом антитело специфично связывается с пептидом, или метод включает иммунизацию животного описанной здесь вакцинной композицией. Животное предпочтительно представляет собой позвоночное, более предпочтительно - млекопитающее, птицу или рыбу. Предпочтительно млекопитающее представляет собой домашнее животное (например, используемое в животноводстве, или, как вариант, животное-спутник), но может представлять собой и человека, нуждающегося в таком понижающем регулировании GDF8.
Изобретение также охватывает слитые белки, содержащие пептиды GDF8 по изобретению. Слитые белки могут содержать домены, являющиеся сигнальными пептидами для усиления секреции или экспрессии на клеточной поверхности слитого белка GDF8 и/или для возможности выделения с селективной системой связывания. Также предполагается, что слитые белки связывают один или более пептидов GDF8 в одном белке-носителе для усиления иммуногенности пептидного домена GDF8. В конкретном варианте осуществления слитый белок по настоящему изобретению содержит пептид GDF8, состоящий из 50 или менее аминокислотных остатков, которые включают аминокислотные остатки с 327 по 346 из последовательности SEQ ID NO:1. В связанном варианте осуществления такого типа слитый белок содержит антигенный подфрагмент пептида GDF8, т.е. пептид GDF8, включающий около 10 последовательных аминокислотных остатков из последовательности DJ5 (SEQ ID NO:8).
Краткое описание чертежей
На фиг.1 приведены перекрывающиеся пептиды с DJ1 по DJ7 в активной области GDF8 (т.е. зрелого GDF8), в районе остатков 266-375 последовательности предшественника GDF8.
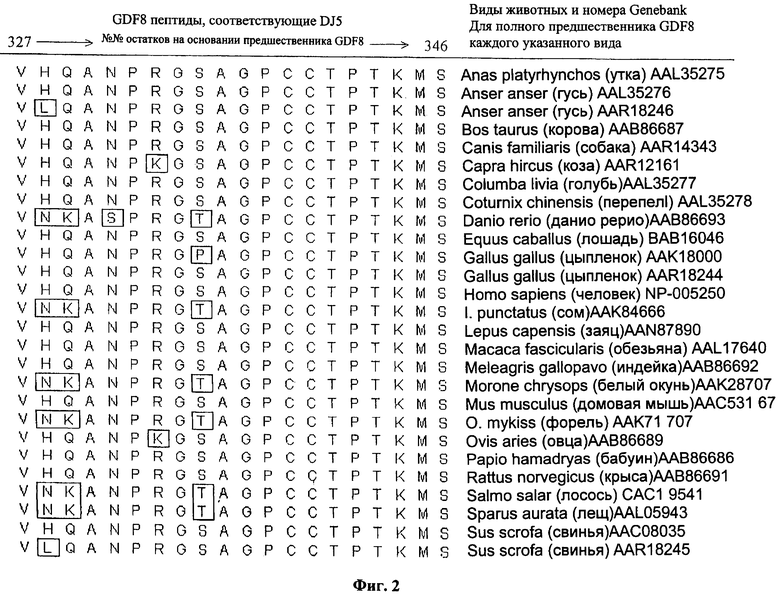
На фиг.2 приведено выравнивание последовательности пептида DJ5 человека (SEQ ID NO:8) по сравнению с аналогичными пептидами из 20 остатков, находящимися в белках предшественника GDF8 указанных дополнительных видов животных. Положения аминокислотных остатков с 321 по 347 основаны на последовательности предшественника GDF8 человека. Номера в Генбанке (Genebank accession numbers) (включенные в настоящее описание посредством ссылки) идентифицируют полные опубликованные последовательности белков для этих видов.
Пептиды, приведенные в выравнивании, имеют следующие номера последовательностей (SEQ ID NO).
Настоящее изобретение идентифицирует домены GDF8, служащие специфическим нейтрализующим эпитопом для поликлональной сыворотки козы анти-GDF8 и для других конкретных специфических антител анти-GDFS. Эти эпитопы также служат для получения фрагментов белка GDF8, применимых для вызывания активного и специфического иммунного ответа против белков GDF8, как in vitro, например, для детекции белка GDF8, так и in vivo, для понижающего регулирования активности GDF8. Эти фрагменты в общем обозначают как пептиды или пептидные фрагменты GDF8. Применение этих пептидов GDF8 включает использование их в качестве иммуногенов для вызывания анти-GDFS иммунного ответа у животных и использование в качестве высокоспецифичных мишеней, связывающихся с антителом, в исследованиях, включающих GDF8.
Специфически связывающиеся эпитопы GDF8 идентифицировали при взаимодействии антисыворотки к GDF8 с набором перекрывающихся пептидов GDF8 и определении степени связывания между пептидами и антителами IgG антисыворотки. Антисыворотку к GDF8 получали от козы, иммунизированной белком предшественника GDF8 со структурой, оптимизированной для экспрессии и антигенности.
Для более полного понимания настоящего изобретения приведены следующие определения. Единственное число при описании терминов используется для удобства и не должно рассматриваться как ограничение. Так, например, ссылка на композицию, содержащую «полипептид», означает ссылку на один или более таких полипептидов.
В настоящем описании термин «приблизительно» используется взаимозаменяемо с термином «около» и означает, что величина находится в 20%-ном интервале от указанной, т.е. пептид, содержащий «приблизительно» 50 аминокислотных остатков, может содержать от 40 до 60 остатков.
Также следует понимать, что настоящее изобретение не ограничивается конкретными конфигурациями, этапами процесса и материалами, описанными здесь, так как конфигурации, этапы процесса и материалы могут варьировать. Также следует понимать, что используемая терминология применяется только с целью описания конкретных вариантов осуществления и не должна рассматриваться как ограничивающая, так как объем настоящего изобретения ограничивается только прилагаемой формулой изобретения и ее эквивалентами.
В настоящем описании термин «полипептид» используется взаимозаменяемо с термином «белок» и означает полимер, содержащий две или более аминокислоты, связанные пептидными связями. В настоящем описании предпочтительно, если не указано иначе, термин «полипептид» отличается от термина «пептид» по размеру или длине цепи, причем термин «пептид» относится к цепи полимера из приблизительно 50 или менее аминокислот, а термин «полипептид» или «белок» относится к цепи полимера, содержащей приблизительно более 50 аминокислот. При необходимости, в пептиде или полипептиде могут отсутствовать определенные аминокислотные остатки, кодируемые геном или мРНК. Например, ген или молекула мРНК могут кодировать последовательность аминокислотных остатков на N-конце полипептида (т.е. сигнальную последовательность), которая отщепляется и, таким образом, не может быть частью конечного белка.
Согласно настоящему изобретению «пептид GDF8» является относительно коротким фрагментом, полученным из белка GDF8. Даже субфрагменты таких пептидов могут называться пептидами GDF8. Без ограничения максимального размера пептида GDF8 по изобретению предпочтительно, чтобы максимальный размер пептида составлял около 50 остатков, более предпочтительно - максимально около 40 остатков, еще более предпочтительно - максимально около 30 остатков и наиболее предпочтительный максимальный размер - около 25 остатков. В общем, предпочтительный размер пептида GDF8 составляет приблизительно от 10 до 50 аминокислотных остатков, более предпочтительно - приблизительно от 15 до 30 остатков и, в частности, около 20 аминокислотных остатков. Пептиды GDF8, являющиеся меньшими субфрагментами других пептидов GDF8 по настоящему изобретению, например, пептид GDF8, содержащий около 10 последовательных аминокислотных остатков из последовательности DJ5 (SEQ ID NO:8), предпочтительно содержат антигенную часть (например, эпитоп) большего пептида GDF8.
В конкретном варианте осуществления пептид GDF8 содержит пептидный домен, приблизительно на 50-100% гомологичный пептиду, определяемому остатками 327-346 (SEQ ID NO:8) из последовательности природного предшественника GDF8 человека (SEQ ID NO:1). Указанные вариации в гомологии предпочтительно представляют собой консервативные замены и/или вариации, сохраняющие антигенную структуру по изобретению, специфически распознаваемую определенными специфическими антителами к GDF8. Эти консервативные замены представляют собой замены, приведенные в сравнении межвидовой гомологии (например, на фиг.2), сохраняющие функцию GDF8 и/или представляют собой замены между аминокислотами аналогичной химической (например, физической) и электронной структуры, сохраняющие и/или оптимизирующие специфичность связывания пептидов GDF8 по изобретению с антителом. Примерами таких консервативных аминокислотных замен являются: замена одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой или замена одного полярного остатка эквивалентного заряда на другой, например замена аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин.
В частности, пептид GDF8 по изобретению также включает специфический нейтрализующий эпитоп для антитела к GDF8, т.е. эпитоп или антигенный домен, который специфически связывается с поликлональным антителом IgG анти-GDF8 сыворотки козы (PGA), описанном в примерах ниже, и/или специфически связывается с коммерчески доступным моноклональным крысиным антителом («mAb») Cat. No. MAB788 (R&D Systems Inc., Minneapolis, MN).
В настоящем описании термины "очищенный" или "выделенный" относятся к материалам, выделенным в условиях, которые снижают или исключают присутствие нежелательных материалов, т.е. примесей, включая природные материалы, из которых требуемый материал получают. Например, очищенный или выделенный белок предпочтительно свободен от других белков или нуклеиновых кислот, с которыми он находится в клетке. Очищенный материал может содержать менее около 50%, предпочтительно менее около 75% и наиболее предпочтительно менее около 90% клеточных компонентов, с которыми он исходно связан. Чистоту можно оценить методами хроматографии, гель-электрофореза, иммунологического анализа, структурного анализа, биологического анализа и другими методами, известными в данной области техники. С точки зрения функциональности выделенный пептид GDF8 по настоящему изобретению - это пептид, достаточно отделенный от других материалов, включая предшественник белка GDF8 и/или зрелый белок GDF8, так, что он способен вызывать иммунный ответ, специфичный для пептида GDF8.
Методы очистки хорошо известны в данной области техники. Например, нуклеиновые кислоты можно очищать преципитацией, хроматографией, ультрацентрифугированием и другими методами. Белки и полипептиды, а также пептиды, можно очищать различными методами, включая, без ограничения, препаративный диск-гель электрофорез, изоэлектрическое фокусирование, ВЭЖХ (высокоэффективную жидкостную хроматографию), обращено-фазовую ВЭЖХ, гель-фильтрацию, ионообменную и распределительную хроматографию, преципитационную и высаливающую хроматографию, экстракцию и противоточное распределение. Для некоторых целей предпочтительно получать полипептид в рекомбинантной системе, в которой белок содержит дополнительную последовательность tag, облегчающую выделение, такую как, без ограничения, последовательность полигистидина или последовательность, специфически связывающуюся с антителом, такую как FLAG® или GST (глутатион-S-трансфераза). Полипептид можно выделить из неочищенного лизата клетки-хозяина методом хроматографии или на соответствующей твердофазной матрице. Иначе, в качестве агентов для выделения можно использовать полученные к полипептиду антитела или их связывающиеся фрагменты.
Термин "по существу чистый" означает высшую степень чистоты, которая может быть достигнута при использовании традиционных методов очистки, известных в данной области техники, и означает нуклеиновую кислоту, полипептид, пептид или другой материал, свободный от других примесных белков, нуклеиновых кислот и других биологических материалов, полученных из организма-источника или системы экспрессии рекомбинантной ДНК. Практическую чистоту можно оценить стандартными методами, обычно эта величина превышает, по меньшей мере, 75%, предпочтительно превышает, по меньшей мере, 90%, еще более предпочтительно превышает, по меньшей мере, 95% и наиболее предпочтительно превышает, по меньшей мере, 99%. Оценку чистоты можно проводить на массовой или молярной основе.
Термин "полинуклеотид" или "молекула нуклеиновой кислоты" означает молекулу, содержащую нуклеотиды, включая, без ограничения, последовательности РНК, кДНК, геномной ДНК и даже синтетической ДНК. Термины также охватывают молекулы нуклеиновой кислоты, содержащие любые известные в данной области аналоги оснований ДНК и РНК.
Термин "вектор" или "вектор репликации" означает репликон, такой как плазмида, фаг или космида, к которому можно присоединить или встроить сегмент другой ДНК так, чтобы обеспечить репликацию присоединенного сегмента. Термин подразумевает также репликон, содержащий встроенный или присоединенный требуемый сегмент ДНК.
Векторы, которые можно использовать по настоящему изобретению, включают микробные плазмиды, вирусы, бактериофаги, интегрируемые фрагменты ДНК и другие носители, которые могут способствовать интеграции нуклеиновых кислот в геном хозяина. Наиболее широко применяемой формой вектора являются плазмиды, но подходят для использования также все другие формы векторов, имеющие эквивалентную функцию и известные в данной области техники. См., например, Pouwels et al., Cloning Vectors: A Laboratory Manual, 1985, и Supplements, Elsevier, N.Y., и Rodriguez et al. (eds.), Vectors: A Survey of Molecular Cloning Vectors and Their Uses, 1988, Buttersworth, Boston, MA.
Встройку ДНК, кодирующей пептид(ы) GDF8 по изобретению, в вектор легко осуществить, если концы ДНК и вектора содержат совместимые сайты рестриктаз. Если это невозможно осуществить, то может понадобиться модифицировать концы ДНК и/или вектора путем отщепления одноцепочечных концов ДНК, образованных эндонуклеазой рестрикции, для получения "тупых" концов; или того же результата можно достичь достраиванием одноцепочечных концов при помощи соответствующей ДНК-полимеразы. Иначе, требуемые сайты можно получить, например, лигированием нуклеотидных последовательностей (линкеров) с концами. Такие линкеры могут содержать специфические олигонуклеотидные последовательности, определяющие сайты требуемых рестриктаз. Сайты рестрикции можно также получить при использовании полимеразной цепной реакции (ПЦР), см., например, Saild et al., Science 239:487 (1988). Расщепленный вектор и фрагменты ДНК можно также модифицировать, при необходимости, методом гомополимерного наращивания.
Векторы для рекомбинантной экспрессии, используемые в настоящем изобретении, обычно являются самореплицирующимися конструкциями ДНК или РНК, содержащими нуклеиновые кислоты, кодирующие один из пептидов GDF8 по изобретению, обычно оперативно связанные с элементами для соответствующего генетического контроля, способными регулировать экспрессию нуклеиновых кислот в совместимых клетках-хозяевах. Элементы генетического контроля могут включать прокариотическую промоторную систему или эукариотическую промоторную систему контроля экспрессии и обычно содержат промотор транскрипции, необязательно - оператор для контроля начала транскрипции, энхансеры транскрипции для повышения уровня экспрессии мРНК, последовательность, кодирующую подходящий сайт связывания с рибосомой, и последовательности, терминирующие транскрипцию и трансляцию. Векторы экспрессии также могут содержать сайт начала репликации, позволяющий вектору реплицироваться независимо от клетки хозяина.
Экспрессию нуклеиновых кислот, кодирующих пептид(ы) GDF8 по изобретению, можно осуществлять традиционными методами либо в прокариотических, либо в эукариотических клетках.
Термин "кодирующая последовательность" ДНК или "последовательность ДНК, кодирующая" определенный белок или пептид, означает последовательность ДНК, которая транскрибируется и транслируется в полипептид in vitro или in vivo, будучи помещенной под контроль соответствующих регуляторных элементов. Границы кодирующей последовательности определяются старт-кодоном на 5'-конце и кодоном окончания трансляции на 3'-конце. Кодирующая последовательность может содержать, без ограничения, прокариотические последовательности, кДНК из эукариотических мРНК, геномные последовательности из ДНК эукариот (например, млекопитающих) и даже синтетические последовательности ДНК. Последовательность терминации транскрипции обычно расположены на 3'-конце кодирующей последовательности.
В настоящем описании термины "слитый белок" и "слитый пептид" используются взаимозаменяемо для обозначения "химерных белков и/или химерных пептидов" и слитых "интеиновых белков/пептидов". Слитый белок содержит, по меньшей мере, часть пептида GDF8 по настоящему изобретению, связанную пептидной связью с, по меньшей мере, частью другого белка. Например, слитые белки могут содержать маркерный белок или пептид, или белок или пептид, способствующий выделению и/или очистке и/или антигенности пептида GDF8 по настоящему изобретению. Слитый белок GDF8 может содержать, по меньшей мере, часть белка, не являющегося GDF8, соединенную пептидной связью с, по меньшей мере, частью полипептида GDF8. В предпочтительных вариантах осуществления настоящего изобретения часть GDF8 является функциональной, т.е. сохраняет антигенность. Последовательности, отличные от GDF8, могут находиться с амино- или карбоксиконца последовательностей GDF8.
Рекомбинантная молекула ДНК, кодирующая такой слитый белок, содержит последовательность, кодирующую, по меньшей мере, часть белка, не являющегося GDF8, соединенную в одной рамке считывания с последовательностью, кодирующей GDF8, такая молекула может кодировать сайт для расщепления определенной протеазой, например тромбин или Фактор Ха, предпочтительно непосредственно в сайге соединения последовательностей GDF8 и не-GDFS или около него. В определенном варианте осуществления настоящего изобретения слитый белок экспрессируется в клетках СНО. Такой слитый белок можно использовать для выделения пептидов GDF8 по настоящему изобретению путем использования аффинных колонок, специфических к белку и/или метке (tag), слитой с пептидом GDF8. Очищенный пептид GDF8 затем, например, можно выделить из слитого белка при использовании протеолитического фермента и сайта расщепления, таких как упомянуты выше.
В одном из вариантов осуществления настоящего изобретения можно получить химерный пептид GDF8, например белок, слитый с глутатион-S-трансферазой (GST), слитый с белком, связывающимся с мальтозой (МВР), или слитый с полигистидиновой меткой, для экспрессии в любой клетке или, как вариант, в бесклеточной системе. Например, GST связывается с глутатионом, связанным с матриксом твердой подложки, МВР связывается с мальтозным матриксом, а полигистидин хелатируется с матриксом N-хелатной подложки. Слитый белок можно элюировать со специфического матрикса при использовании соответствующих буферов или обработкой протеазой, специфической к сайту расщепления, обычно конструируемому между пептидом GDF8 и гибридным партнером (например, GST, МВР, FLAG®), как указано в примерах ниже, или поли-His, как описано выше.
Термин "гетерологичная нуклеотидная последовательность" в настоящем описании обозначает нуклеотидную последовательность, присоединяемую к нуклеотидной последовательности по настоящему изобретению методами рекомбинации для получения нуклеиновой кислоты, которая не образуется в природе. Такие нуклеиновые кислоты могут кодировать слитые (например, химерные) белки. Таким образом, гетерологичная нуклеотидная последовательность может кодировать пептиды и/или белки, имеющие регуляторные и/или структурные свойства. В другом варианте осуществления настоящего изобретения гетерологичная нуклеотидная последовательность может кодировать белок или пептид, служащий для детекции белка или пептида, кодируемого нуклеотидной последовательностью по настоящему изобретению после экспрессии нуклеиновой кислоты. В еще одном варианте осуществления настоящего изобретения гетерологичная нуклеотидная последовательность может функционировать как средство детекции нуклеотидной последовательности по настоящему изобретению. Гетерологичная нуклеотидная последовательность может содержать некодирующие последовательности, включая сайты рестрикции, регуляторные сайты, промоторы и подобные элементы.
"Клетка-хозяин" - это клетка, которая содержит или способна содержать и экспрессировать, временно или постоянно, молекулу экзогенной нуклеиновой кислоты. Клетка называется "трансформированной" экзогенной ДНК, если такая ДНК была введена внутрь клетки, ограниченной мембраной. Экзогенная ДНК может быть или не быть интегрирована (ковалентно связана) в хромосомную ДНК, составляющую геном клетки хозяина. Например, в прокариотах и дрожжах экзогенная ДНК может содержаться в виде эписомного элемента, такого как плазмида. По отношению к эукариотическим клеткам стабильно трансформированная клетка - это клетка, в которой экзогенная ДНК интегрирована в хромосому таким образом, что она наследуется дочерними клетками через репликацию хромосомы. Такая стабильность демонстрируется способностью эукариотической клетки установить клеточные линии или клоны, содержащие популяцию дочерних клеток, содержащих экзогенную ДНК.
К прокариотам относятся как грамположительные, так и грамотрицательные организмы, например Е.coli and В.subtilis. К высшим эукариотам относятся устойчивые культуры клеточных линий из клеток животных, как не млекопитающих, т.е. клетки насекомых и птиц, так и млекопитающих, т.е. человека, приматов и грызунов.
К системам "прокариотический хозяин - вектор" относится широкий спектр векторов для многих различных видов. В настоящем описании Е.coli и ее векторы используются для общего обозначения эквивалентных векторов, используемых в других прокариотах. Типичным вектором для амплификации ДНК является pBR322 или многие ее производные. К векторам, которые можно использовать для экспрессии GDF8 и/или пептидов GDF8, относятся, без ограничения, векторы, содержащие lac промотор (серия pUC); trp промотор (pBR-trp); Ipp промотор (серия pIN); lambda-pP или pR промоторы (pOTS); или гибридные промоторы, такие как ptac (pDR540). См. Brosius et al., "Expression Vectors Employing Lambda-, trp-, lac-, and Ipp-derived Promoters", in Rodriguez and Denhardt (eds.) Vectors: A Survey of Molecular Cloning Vectors and Their Uses, 1988, Buttersworth, Boston, pp.205-236.
Дрожжи, а также клеточные культуры клеток высших эукариот, являются предпочтительными хозяевами для рекомбинантного получения пептидов GDF8 по изобретению и/или антител к GDF8 и/или фрагментов этих антител. Хотя можно использовать любую линию культуры клеток высших эукариот, включая системы экспрессии бакуловируса насекомых, предпочтительными являются клетки млекопитающих. Трансформация или трансфекция и размножение таких клеток стали рутинной процедурой. Примерами применимых клеточных линий являются клетки HeLa, линии клеток яичника китайских хомячков (СНО), линии клеток почки молодых крыс (BRK), линии клеток насекомых, линии клеток птиц и линии клеток обезьян (COS).
Векторы для экспрессии в таких линиях обычно содержат, например, сайт начала репликации, промотор, сайт инициации трансляции, сайты сплайсинга РНК (если используется геномная ДНК), сайт полиаденилирования и сайт терминации транскрипции. Эти векторы также обычно содержат ген для селекции или ген для амплификации. Подходящими для экспрессии векторами могут быть плазмиды, вирусы или ретровирусы, несущие промоторы, происходящие, например, из таких источников, как аденовирусы, SV40, парвовирусы, вирус осповакцины или цитомегаловирус. Типичными примерами подходящих векторов для экспрессии являются pCR®3.1, pCDNA1, pCD [Okayama et al., Mol. Cell Biol. 5:1136 (1985)], pMC1neo Poly-A [Thomas et al., Cell 57:503 (1987)], pUC19, pREP8, pSVSPORT и их производные, и векторы на основе бакуловируса, такие как рАС 373 или рАС 610.
Обычно используемые прокариотические последовательности для контроля экспрессии включают промоторы, включая промоторы, полученные из промоторных систем β-лактамазы и лактозы [Chang et al., Nature, 795:1056 (1977)], триптофановой (trp) промоторной системы [Goeddel et al., Nucleic Acids Res. 5:4057 (1980)], промоторной системы lambda PL [Shimatake et al., Nature, 292:128 (1981)], и tac промотор [De Boer et al., Proc. Natl. Acad. Sci. USA 292:128 (1983)]. В данной области техники известно и коммерчески доступно множество таких векторов для экспрессии.
Термин "оперативно связанный" относится к организации элементов, при которой описываемые компоненты сконфигурированы таким образом, чтобы выполнять их обычные функции. Так, контролирующие элементы, оперативно связанные с кодирующей последовательностью, способны влиять на экспрессию кодирующей последовательности. Контролирующие элементы не должны быть обязательно непосредственно соединенными с кодирующей последовательностью, до тех пор, пока они функционируют для направления экспрессии. Так, например, между промотором и кодирующей последовательностью могут находиться нетранслируемые, но транскрибируемые последовательности, и промотор все равно считается "оперативно связанным" с кодирующей последовательностью.
Изобретение включает также поликлональные и моноклональные антитела (mAb), специфически связывающиеся с пептидами GDF8 по изобретению. В настоящем описании термин "антитело" относится к иммуноглобулину и/или его фрагментам. Природный иммуноглобулин состоит из одного или более полипептидов, в основном кодируемых генами иммуноглобулина. Известные гены иммуноглобулина включают каппа, лямбда, альфа, гамма, дельта, эпсилон и мю-гены константных областей, а также бесконечное количество вариабельных генов иммуноглобулина. Антитело или антитела по изобретению также охватывают фрагменты антител, т.е. антиген-связывающие фрагменты, например, Fv, Fab и F(ab')2, сконструированные белки, связывающиеся с одноцепочечными участками (например, Huston et al., Proc. Natl. Acad. Sci. U.S.A., 85, 5879-5883 (1988), и Bird et al., Science. 242, 423-426 (1988), включенные в настоящее описание в своей полноте посредством ссылки), а также бифункциональные гибридные антитела (например, Lan-zavecchia et al., Eur. J. Immunol. 17, 105 (1987)). [В общем, см. Hood et al., Immunology, Benjamin, N.Y., 2nd ed. (1984), Harlow and Lane, Antibodies. A Laboratory Manual. Cold Spring Harbor Laboratory (1988), и Hunkapiller and Hood, Nature, 323, 15-16 (1986), содержание которых включено в настоящее описание в своей полноте посредством ссылки.]
Например, сыворотку, полученную стандартными методами от животных, иммунизированных пептидами GDF8 по изобретению, можно использовать непосредственно или можно отделить фракцию IgG при использовании стандартных методов, таких как плазмафорез или адсорбционная хроматография с адсорбентами, специфичными к IgG, такими как иммобилизованный Белок А или Белок G. Иначе, можно получить моноклональные антитела и при необходимости фрагменты, связывающиеся с антигенами, или белки, связывающиеся с рекомбинантами, полученные из таких моноклональных антител. Такие моноклональные антитела (mAbs) или их фрагменты можно необязательно гуманизировать известными в данной области техники методами.
Гибридомы, продуцирующие моноклональные антитела, селективно связывающиеся с пептидами GDF8 по изобретению, получают хорошо известными методами. Обычно процесс включает слияние клеточной линии, несущей бессмертие, с В-лимфоцитом, продуцирующим требуемое антитело. Иначе, для получения бессмертных линий клеток, продуцирующих антитело, можно использовать методы, не задействующие слияние, например вирус-индуцированную трансформацию [Casali et al., Science 234:476 (1986)]. Клетки, несущие бессмертие, обычно представляют собой клетки млекопитающих, в частности миеломные клетки грызунов, быка и человека. Наиболее часто используют линии клеток миеломы мышей или крыс, ввиду удобства и доступности.
Хорошо известны методы получения лимфоцитов, продуцирующих антитело, от млекопитающих, которым сделали инъекцию антигена. В общем, если используют клетки млекопитающих, то используют лимфоциты периферической крови (PBL), или для клеток из источников, не являющихся млекопитающими, используют клетки селезенки или лимфатического узла. Животному-хозяину вводят повторяющиеся дозы очищенного антигена (клетки человека сенсибилизируют in vitro) и оставляют животное для выработки клеток, продуцирующих требуемое антитело, затем клетки собирают для слияния с бессмертной линией клеток. Методы слияния также хорошо известны в данной области техники и, в общем, включают смешивание клеток с агентом, способствующим слиянию, таким как полиэтиленгликоль.
Гибридомы отбирают стандартными методами, такими как HAT (гипоксантин-аминоптерин-тимидин) селекция. Гибридомы, секретирующие требуемое антитело, отбирают стандартными иммунологическими методами, такими как Вестерн-блоттинг, ELISA (твердофазный иммуноферментный анализ), RIA (РИА, радиоиммунный анализ) или подобными. Антитела выделяют из среды при использовании стандартных методов очистки белков [Tijssen, Practice and Theory of Enzyme Immunoassays (Elsevier, Amsterdam, 1985)].
Руководство по применению указанных методов можно найти во многих источниках [Kohler et al., Hybridoma Techniques (Cold Spring Harbor Laboratory, New York, 1980); Tijssen, Practice and Theory of Enzyme Immunoassays (Elsevier, Amsterdam, 1985); Campbell, Monoclonal Antibody Technology (Elsevier, Amsterdam, 1984); Hurreell, Monoclonal Hybridoma Antibodies: Techniques and Applications (CRC Press, Boca Raton, FL, 1982)]. Моноклональные антитела также можно получать при использовании хорошо известных систем фаговых библиотек. См., например, Huse et al., Science 246:1275 (1989); Ward et al., Nature, 341:544 (1989).
Полученные антитела, поликлональные или моноклональные, можно использовать, например, в иммобилизованном виде, связанными с твердой подложкой известными методами, для очистки пептидов GDF8 иммуноаффинной хроматографией.
Антитела к GDF8 также можно использовать, меченными или немеченными известными методами, в качестве основы для иммунологических анализов для детекции или количественного определения GDF8. Конкретная используемая метка зависит от типа иммунологического анализа. Примерами меток, которые можно использовать, являются, без ограничения, радиометки, такие как 32Р, 125I, 3H и 14С; флуоресцентные метки, такие как флуоресцеин и его производные, родамин и его производные, дансил и умбеллиферон; хемилюминесцентные метки, такие как люциферины и 2,3-дигидрофталазиндионы; ферменты, такие как пероксидаза хрена, щелочная фосфатаза, лизоцим и глюкоз-6-фосфатдегидрогеназа.
Такие метки можно присоединить к антителам известными методами. Например, для присоединения к антителам флуоресцентных, хемилюминесцентных или ферментных меток можно использовать агенты присоединения, такие как альдегиды, карбодиимиды, дималеимиды, имидаты, сукцинимиды, бисдиазобензаидин и подобные. Общие методы хорошо известны в данной области техники и описаны, например в Immunoassay: A Practical Guide, 1987, Chan (Ed.), Academic Press, Inc., Orlando, FL. Такие иммунологические исследования можно проводить, например, с фракциями, полученными при выделении рецепторов.
Антитела по настоящему изобретению также можно использовать для идентификации конкретных клонов кДНК, экспрессирующих связанные с gDF8 полипептиды, в системах клонирования и экспрессии. Нейтрализующие антитела, специфические к лиганд-связывающему сайту рецептора, можно также использовать в качестве антагонистов (ингибиторов) для блокировки или понижающего регулирования функции GDF8. Такие нейтрализующие антитела можно легко идентифицировать путем рутинного эксперимента, как описано в примерах ниже.
Функция антагониста активности GDF8 может обусловливаться использованием целых молекул антител или хорошо известных фрагментов, связывающихся с антигеном, таких как фрагменты Fab, Fc, F(ab)2 и Fv. Определения таких фрагментов можно найти в настоящем описании или, например, в Klein, Immunology (John Wiley, New York, 1982); Parham, Chapter 14, in Weir, ed. Immunochemistry, 4th Ed. (Blackwell Scientific Publishers, Oxford, 1986). Применение и получение фрагментов антител также описано, например, фрагментов Fab [Tijssen, Practice and Theory of Enzyme Immunoassays (Elsevier, Amsterdam, 1985)], фрагментов Fv [Hochman et al., Biochemistry 12:1130 (1973); Sharon et al., Biochemistry 75:1591 (1976); Ehrlich et al., U.S. Patent No. 4355023] и половин молекул антител (Auditore-Hargreaves, U.S. Patent No. 4470925). Методы получения рекомбинантных фрагментов Fv на основе известных последовательностей вариабельных областей тяжелой и легкой цепей антитела были описаны, например, Moore et al. (U.S. Patent No. 4642334) и Plückthun [Bio/Technology 9:545 (1991)]. Иначе, их можно химически синтезировать при использовании стандартных методов.
Настоящее изобретение охватывает также антиидиотипические антитела как поликлональные, так и моноклональные, получаемые при использовании вышеописанных антител в качестве антигенов. Такие антитела применимы благодаря тому, что они могут имитировать структуры лигандов.
Синтез пептидов
Поскольку пептиды GDF8 по изобретению, например указанный здесь пептид DJ5, являются относительно короткими (например, предпочтительно около 50 аминокислотных остатков и менее), их можно получать методами пептидного синтеза, известными в данной области техники. Синтетические пептиды или полипептиды, полученные известными методами в твердой фазе, жидкой фазе или методами пептидной конденсации или любой комбинацией этих методов, могут содержать природные и неприродные аминокислоты. Аминокислоты, используемые для пептидного синтеза, могут представлять собой стандартную смолу с Boc (Nальфа-аминозащищенный Nальфа-трет-бутоксикарбонил) аминокислотой со стандартными протоколами снятия защиты, нейтрализации, присоединения и промывки согласно оригинальной процедуре в твердой фазе, Merrifield [J. Am. Chem. Soc., 85: 2149-2154 (1963)], или лабильные в основной среде Nальфа-аминозащищенные 9-фторенилметоксикарбонил (Fmoc) аминокислоты, впервые описанные Carpino and Han [J. Org. Chem., 37:3403-3409 (1972)]. Как Fmoc-, так и Воc-Nальфа-защищенные аминокислоты можно приобрести в компаниях Fluka, Bachem, Advanced Chemtech, Sigma, Cambridge Research Biochemical, Bachem, или Peninsula Labs или других химических компаниях, известных специалистам в данной области техники. В дополнение, метод по изобретению можно использовать с другими Nальфа-защитными группами, известными специалистам в данной области техники. Твердофазный пептидный синтез можно проводить методами, известными в данной области техники, описанными, например, в Stewart and Young, SOLID PHASE SYNTHESIS, Second Edition, Pierce Chemical Co., Rockford, HI (1984); Fields and Noble, Int. J. Pept. Protein Res. 35:161-214 (1990), или при использовании автоматических синтезаторов, таких как синтезаторы, предлагаемые компанией ABS [Applied Biosystems, 850 Lincoln Centre Drive, Foster City, CA 94404 USA]. Так, пептиды GDF8 по изобретению могут содержать D-аминокислоты, комбинацию D- и L-аминокислот и различные "сконструированные" аминокислоты (например, бета-метиламинокислоты, Сальфа-метиламинокислоты и Naльфa-мeтиламинокислоты и т.д.) для придания специальных свойств. Синтетические аминокислоты включают орнитин вместо лизина, фторфенилаланин вместо фенилаланина и норлейцин вместо лейцина или изолейцина. Дополнительно путем введения определенных аминокислот на определенных этапах присоединения можно получать альфа-спирали, бета-повороты, бета-складки, гамма-повороты и циклические пептиды.
Антисыворотка к GDF8
Методы изобретения включают процесс скрининга пептидов GDF8 против поликлональной антисыворотки к GDF8. В результате этого процесса был идентифицирован эпитоп, с которым высокоспецифично связываются определенные антитела к GDF8. Антисыворотку к GDF8 получали иммунизацией животных предшественником GDF8. Ген предшественника GDF8 модифицировали так, чтобы обеспечить форму, оптимизированную для экспрессии и иммуногенности. Например, природную последовательность ДНК прогормона GDF8 (SEQ ID NO:2) оптимизировали для экспрессии в системах экспрессии млекопитающих и вирусов. Дополнительно были внесены изменения для исключения негативных эффектов вирусных механизмов выключения синтеза белков хозяина. Типичные вирусные механизмы выключения синтеза белков хозяина задействуют контроль транскрипции, стабильность РНК (сплайсинг) и подобные. Эти изменения сделали нуклеиновую кислоту менее похожей на нуклеиновую кислоту хозяина и более похожей на нуклеиновую кислоту вируса.
Далее, последовательность ДНК предпочтительно конструировали таким образом, чтобы она была настолько отличной от нуклеиновой кислоты млекопитающего, насколько возможно. Например, аминокислотную последовательность предшественника GDF8 обратно транслировали при использовании предпочтительных кодонов дрожжей. Полученную последовательность исследовали на наличие кодонов, которые сохраняли гомологию с последовательностью нуклеиновой кислоты GDF8 человека. Где возможно, эти кодоны заменяли на следующие по предпочтительности кодоны дрожжей, кодирующие те же аминокислоты.
Полученный оптимизированный ген (SEQ ID NO:3) можно экспрессировать в системе любого подходящего хозяина. Включая, например, известные в данной области техники системы экспрессии в насекомых, млекопитающих, бактериях, вирусах и дрожжах. Например, системы экспрессии в клетках насекомых, такие как бакуловирусные системы, хорошо известны в данной области техники и описаны, например, Summers and Smith, Texas Agricultural Experiment Station Bulletin No. 1555 (1987). Материалы и методы для систем экспрессии бакуловирус/клетка насекомого коммерчески доступны в виде наборов, например, среди прочих, у Iuvitrogen, San Diego Calif, (набор "МахВас"). Аналогично системы для экспрессии в клетках бактерий и млекопитающих хорошо известны в данной области техники и описаны, например, в Sambrook et al. (MOLECULAR CLONING: A laboratory manual; DNA Cloning, Vols. I and II; D.N.Glover ed.). Системы для экспрессии в дрожжах также известны в данной области техники и описаны, например, в YEAST GENETIC ENGINEERING (Barr et al., eds., 1989) Butterworths, London. Множество других подобных систем экспрессии известны в данной области техники и коммерчески доступны в виде наборов. Как указано здесь в примерах, модифицированный ген предшественника GDF8 (SEQ ID NO:3) экспрессировали в системе экспрессии Flp-In™ в клетках СНО (Invitrogen, Carlsbad, CA), что описано более подробно ниже, в примере 1.
Белок предшественника GDF8, так же как и пептиды зрелого белка GDF8, можно включать в любую вакцинную композицию, совместимую с белком или пептидом. Такие вакцинные композиции хорошо известны в данной области техники и включают, например, физиологически совместимые буферы и солевой раствор и подобные, а также адъюванты, как описано более подробно ниже. Вакцинную композицию, содержащую белок предшественника GDF8, используют для получения антисыворотки для скрининга и идентификации специфического эпитопа нейтрализации для антитела к GDF8.
Как описано ниже в примерах, очищенный белок предшественника GDF8, экспрессируемый вектором, содержащим последовательность SEQ ID NO:3, вводили козе в составе вакцинной композиции, содержавшей 1 г белка предшественника GDF8 в виде эмульсии с полным адъювантом Фрейнда (CFA). Вакцинную композицию предпочтительно вводили козе подкожно (SC). Предпочтительны последующие подстегивающие иммунизации. Их можно делать через подходящие дополнительные интервалы с той же или сниженной дозой белка, например через интервалы 2-5 недель после начальной инъекции.
Начиная с двух недель после первой инъекции, но предпочтительно через более долгий интервал времени, например от трех до пятнадцати недель или более, от иммунизированного животного по необходимости собирают сыворотку. Затем собранную сыворотку преимущественно очищают и/или фракционируют традиционными методами очистки иммуноглобулинов, такими как, например, белок А-сефарозная, белок G-агарозная, гидроксилапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография с подходящим лигандом. Как описано здесь в примерах, фракцию IgG сыворотки далее фракционировали на колонке с белком G-агарозой.
Затем IgG фракцию антисыворотки к GDF8 можно скринировать против набора пептидов зрелого GDF8, как описано более подробно ниже, в примере 3.
Связывающиеся эпитопы GDF8
Подходящие моноклональные или поликлональные антитела к GDF8 приводят во взаимодействие с белком GDF8 на период времени, достаточный для селективного связывания антител с белком. Затем биоисследованием подтверждают, что антитела практически нейтрализовали всю активность белка GDF8. Для этой цели можно применять любое биоисследование, хотя, как указано ниже, в примере 3, предпочтительным является исследование активации транскрипции in vitro согласно Thies et al., 2001 (Growth Factors 18, 251).
В общем, пептид GDF8, применимый в качестве антигена или связывающегося эпитопа по изобретению, содержит остатки приблизительно с 312 по 361 последовательности GDF8 (SEQ ID NO:1). В частности, пептид по изобретению содержит остатки приблизительно с 320 по 350 последовательности GDF8 (SEQ ID NO:1). Предпочтительно пептид содержит остатки приблизительно с 327 по 346 последовательности GDF8 (SEQ ID NO:1).
Специалисту в данной области техники будет понятно, что пептид GDF8 по изобретению можно модифицировать, введя, по меньшей мере, одну консервативную аминокислотную замену, в любом положении. Предпочтительно, чтобы этот пептид специфически связывался с крысиным моноклональным антителом 788, как описано в примерах ниже. Такие консервативные замены могут включать, например, вариации в положениях 328, 329 и 335 и их комбинации, причем аминокислотный остаток 328 представляет собой His, Leu, Asn или Val; аминокислотный остаток 329 представляет собой Lys или Leu; и аминокислотный остаток 335 представляет собой Ser или Pro или Thr. Остатки 328, 329 и 335 последовательности предшественника GDF8 варьируют в последовательностях белка GDF8 разных видов, как показано на фиг.2, но тем не менее зрелый GDF8 остается функциональным.
На фиг.1 приведена карта активной области GDF8 (образующей зрелый белок) в контексте его белка-предшественника. На карту активной области GDF8 наложены положения семи перекрывающихся пептидов. Эти перекрывающиеся пептиды были сконструированы для того, чтобы обеспечить мишени для идентификации эпитопа или эпитопов GDF8, связывающихся с антителом. Пептид, обозначенный DJ5, идентифицирован скринингом с фракцией IgG, описанной в примере антисыворотки козы к GDF8 как единственный значимо связывающийся эпитоп GDF8 для указанной в примере антисыворотки. Этот пептид имеет последовательность под номером SEQ ID NO:8, соответствующую остаткам с 327 по 346 предшественника GDF8 (SEQ ID NO:1).
Вакцинные композиции с пептидом GDF8
Пептиды GDF8, описанные выше, предпочтительно включают в состав вакцинных композиций. Эти вакцинные композиции можно использовать для иммунизации животного, чтобы вызвать высокоспецифичный иммунный ответ анти-GDF8. Результатом иммунизации будет понижающая регуляция функции GDF8 у иммунизированного животного. Такие вакцинные композиции хорошо известны в данной области техники и содержат, например, физиологически совместимые буферы, консерванты и солевой раствор и подобные компоненты, а также адъюванты.
"Адъюванты" - это агенты, которые неспецифически усиливают иммунный ответ на конкретный антиген, таким образом снижая количество антигена, необходимое в любой вакцине, и/или частоту инъекций, необходимых для получения адекватного иммунного ответа на интересующий антиген. Подходящими адъювантами для вакцинации животных являются, без ограничения, Адъювант 65 (содержащий арахисовое масло, маннид моноолеат и алюминия моностеарат); полный или неполный адъювант Фрейнда; минеральные гели, такие как гидроксид алюминия, фосфат алюминия и квасцы; поверхностно-активные вещества, такие как гексадециламин, октадециламин, лизолецитин, диметилдиоктадециламмония бромид, N,N-диоктадецил-N'-N'-бис(2-гидроксиметил)пропандиамин, метоксигексадецилглицерин и полиолы плуроники; полианионы, такие как пиран, декстрансульфат, полиинозиновая-полицитидиловая кислота (poly IC), полиакриловая кислота и карбопол; пептиды, такие как мурамил дипептид, диметилглицин и туфтсин, и масляные эмульсии. Белок или пептиды можно вводить также после включения их в липосомы или другие микроносители. Информацию касательно адъювантов и различных аспектов иммунологических исследований можно найти, например, в работе Р.Tijssen, Practice and Theory of Enzyme Immunoassays, 3rd Edition, 1987, Elsevier, New York, включенной в настоящее описание посредством ссылки.
Вакцинная композиция содержит требуемый иммуноген, такой как пептиды GDF8 по изобретению, в количестве, достаточном для вызывания иммунного ответа. Вводимое количество может находиться в пределах от около 0,0001 г/кг до около 1,0 г/кг, в зависимости от веса животного. Для получения поликлональной антисыворотки можно использовать любое подходящее позвоночное животное. Предпочтительно, чтобы животное было млекопитающим и представляло собой, без ограничения, грызунов, таких как мыши, крысы, кролики; лошадей; собачьих; кошачьих; крупный рогатый скот; овечьих, например коз и овец; приматов, например обезьян, высших приматов и человека и подобных.
Вакцинную композицию можно вводить любым стандартным способом, включая внутривенный, внутримышечный, подкожный, внутрибрюшинный, in оvо (внутрь яйца) (особенно для птиц) и/или пероральный. Для рыб методы введения вакцинной композиции или иммуногенной композиции включают вышеупомянутые, а также погружение рыбы в воду, содержащую антигенную концентрацию пептида, обрызгивание рыбы антигенной концентрацией пептида за короткий промежуток времени на воздухе, и т.д.
Специалисту в данной области техники будет понятно, что вакцинную композицию предпочтительно составляют согласно каждому типу животного и пути введения.
Подходящие животные включают диких животных, скот (например, выращиваемый для получения мяса, молока, масла, яиц, меха, кожи, перьев и/или шерсти), вьючных животных, животных для исследований, животных-спутников, а также животных, выращиваемых для/в зоопарках, животных в естественной среде или в цирках. В конкретном варианте осуществления настоящего изобретения животное представляет собой высшего примата, такого как горилла, или человека.
В одном из предпочтительных вариантов осуществления настоящего изобретения животное представляет собой животное, выращиваемое для получения продовольствия, и результатом иммунизации является прибавка в весе животного, особенно в мышечной массе, по сравнению с неиммунизированными животными. Для целей настоящего изобретения понятие "животное, выращиваемое для получения продовольствия" означает животное, которое предназначено для потребления человеком и/или другими животными или для получения продуктов питания, таких как яйца или молоко. Неограничивающий список таких животных включает птиц (например, цыплят, индеек, уток, гусей, страусов), семейство бычьих (например, быков/телят, дойных коров, быков-производителей, буйволов), свиней (свиней и поросят), овечьих (коз или овец), семейство лошадиных (например, лошадей), а также водных животных, включая моллюсков и рыб, таких как форель или лосось, и другие виды, выращиваемые для потребления человеком.
Для целей настоящего изобретения под термином "рыба" понимают, без ограничения, костистых рыб (Teleosti), т.е. телеостов. К ним относятся отряд лососеобразных (Sal-moniformes) (включающий семейство лососевых, Salmonidae) и отряд окунеобразных (Perciformes) (включающий семейство центрарховых, Centrarchidae).
Примерами потенциальных рыб реципиентов являются семейство лососевых, Salmonidae, семейство серрановых, Serranidae, семейство спаровых, Sparidae, семейство цихловых, Cichlidae, семейство центрарховых, Centrarchidae, трехполосый Грант, three-Line Grunt (Parapristipoma trilineatum) и голубоглазый плекостомус, Blue-Eyed Plecostomus (Plecostomus spp).
Семейство Salmonidae
Некоторые члены семейства Sparidae
Некоторые члены семейства Cichlidae
Некоторые члены семейства Centrarchidae
В следующем предпочтительном варианте осуществления настоящего изобретения животное представляет собой животное-спутника или человека, а вакцину вводят для долговременной понижающей регуляции GDF8 для любой ветеринарной или медицинской цели, отвечающей на такую понижающую регуляцию. Для целей настоящего изобретения под термином "животное-спутник" понимают всех животных: лошадей (семейство лошадиных), кошек (семейство кошачьих), собак (семейство псовых), грызунов (включая мышей, крыс, морских свинок), виды кроликов, и птиц, таких как голуби, попугаи и подобные.
Других птиц, получающих такую вакцинацию или антитела, можно отнести либо к коммерческому, либо к некоммерческому птицеводству. К ним относятся, например, птицы семейства утиных (Anatidae), такие как лебеди, птицы семейства голубиных, например различные голуби, такие как домашние голуби, семейство фазановых (Phasianidae), например граусы и куропатки, семейство Thesienidae, семейство Psittacines, например длиннохвостые попугаи, ара, и попугаи, например, выращиваемые для рынка домашних животных или коллекционирования, и члены семейства бескилевых.
В следующем предпочтительном варианте осуществления настоящего изобретения любое из указанных выше животных (предпочтительно - не человека) иммунизируют для получения антител к GDF8, которые специфически связываются с пептидами по изобретению, и полученные антитела собирают для использования в исследованиях, и/или ветеринарии или медицине человека, например, для понижающей регуляции GDF8 для любой ветеринарной или медицинской цели, отвечающей на такую понижающую регуляцию.
Настоящее изобретение пояснено ссылкой на следующие неограничивающие примеры, которые приведены в качестве характерных для настоящего изобретения. Следующие примеры приведены с целью более полной иллюстрации вариантов осуществления настоящего изобретения и не должны рассматриваться как ограничивающие объем изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Материалы и методы
А. Экспрессия и очистка предшественника GDF8 (прогормона GDF8)
Природную ДНК последовательность предшественника GDF8 или прогормона (SEQ ID NO:2) оптимизируют для экспрессии в системах экспрессии млекопитающих и вирусов. Для исключения негативных эффектов вирусных механизмов отключения синтеза белка хозяина последовательность ДНК конструируют таким образом, чтобы она была настолько отлична от нуклеиновой кислоты млекопитающего, насколько возможно. Для этого аминокислотную последовательность прогормона GDF8 обратно транслируют при использовании предпочтительных кодонов дрожжей. Полученную последовательность исследуют на наличие кодонов, сохраняющих гомологию с последовательностью нуклеиновой кислоты GDF8 человека. Где возможно, эти кодоны заменяют на следующие по предпочтительности кодоны дрожжей, кодирующие те же аминокислоты. Полученную молекулу нуклеиновой кислоты (SEQ ID NO:3) коммерчески синтезируют для включения в соответствующие векторы экспрессии.
Для экспрессии оптимизированного прогормона GDF8 используют систему экспрессии Flp-In™ CHO (hivitrogen, Carlsbad, CA). Вкратце, конструкцию прогормона GDF8, содержащую С-концевой слитый эпитоп FLAG® (Sigma-Aldrich Corp., St. Louis, МО), получают путем встраивания гена, кодирующего модифицированный прогормон GDF8, в плазмиду pCMVtag4B (Stratagene, San Diego, CA). Слитая метка FLAG® облегчает выделение белков, слитых с FLAG®, на гелевой колонке анти-FLAG®. ПЦР-фрагмент ДНК, содержащий модифицированный ген прогормона GDF8-FLAG®, затем клонируют в плазмидный вектор экспрессии pcDNA5/FRT (Invitrogen, Carlsbad, CA). Клеточную линию Flp-In™ CHO, экспрессирующую слитый белок "прогормон GDF8-FLAG®", получают котрансфекцией клеточной линии Flp-In™ CHO с вектором экспрессии Flp-In™, содержащим ген GDF8-FALG®, и плазмидой, экспрессирующей FLP рекомбиназу, POG44. Flp рекомбиназа опосредует встройку экспрессионной кассеты Flp-In в геном в интегрированный сайт FRT путем сайт-специфической ДНК-рекомбинации. При селекции гигромицином В получают стабильную линию клеток, экспрессирующую и секретирующую прогормон GDF8, содержащий эпитоп FLAG®.
Стабильную линию клеток СНО, экспрессирующую прогормон GDF8, содержащий метку FLAG®, адаптируют к суспензионной культуре в бессывороточной среде при использовании стандартных методов. Кондиционированную среду, содержащую секретированный прогормон GDF8, получают при использовании биореакторной системы WAVE (WAVE Biotech LLC, Bridgewater, NJ). Очистку прогормона GDF8, меченного FLAG®, осуществляют аффинной хроматографией при использовании аффинного геля анти-FLAG® М2 (Sigma-Aldrich Corp., St. Louis, МО).
В. Очистка антитела, специфического к DJ5
Фракции, специфические к DJ5 (SEQ ID NO:8, см. таблицу 2 ниже), очищают аффинной колоночной хроматографией. Аффинную колонку готовят соединением 10 мг синтетического пептида DJ5 с 0,8 г цианоген бромид - активированной Сефарозы 4 В (Sigma Genosys, Woodlands, TX). Колонку промывают и уравновешивают PBS (фосфатным солевым буфером). На аффинную колонку наносят приблизительно 11 мл фракции IgG сыворотки козы (10 мг/мл) и промывают 25 мл PBS. Собирают фракции объемом 1,0 мл и оценивают их поглощение при 280 нм. Связавшийся материал элюируют приблизительно 10 мл 0,2 М глицина (рН 1,85). Собирают фракции объемом 1,0 мл и нейтрализуют 0,25 мл раствора 0,5 М фосфата натрия, 0,75 М NaCl, рН 7,4. Аликвоты приблизительно по 25 мкл несвязавшихся фракций 1-10 и связавшихся фракций 25-35 проверяют в исследовании ELISA на реактивность по отношению к DJ5. Обнаружено, что несвязавшиеся фракции являются негативными в отношении DJ5 реактивности. Для связавшихся фракций продемонстрирован значительный пик реактивности по отношению к пептиду DJ5. Несвязавшиеся фракции 1-10 и связавшиеся фракции 26-34 объединяют. Объединенные образцы концентрируют, их буфер заменяют на PBS, как указано ниже. Концентрации образцов определяют по оптической плотности OD 280 (CURRENT PROTOCOLS IN IMMUNOLOGY. 2.7.3, John Wiley & Sons, Inc.). Для последующего использования концентрацию образца несвязавшейся фракции доводят до 10 мг/мл, а связавшейся - до 1 мг/мл.
ПРИМЕР 2
Поликлональная сыворотка козы IgG анти-GDF8
IgG козы к предшественнику GDF8 получают от иммунизированной козы следующими методами.
А. Иммунизация козы
Козу молочной породы Саанен (Saanen) (самца приблизительно 2 лет) иммунизируют рекомбинантным прогормоном GDF8 (полученным, как описано выше в примере 1) следующим способом. 0,5 мг белка эмульгируют в полном адъюванте Фрейнда (CFA) и вводят подкожно (SC) козе. Последующие подстегивающие иммунизации, вводимые подкожно на третьей, шестой и десятой неделях, содержат 0,3 мг белка, эмульгированного в неполном адъюванте Фрейнда (IFA). Кровь отбирают из яремной вены шприцом и иглой в вакуумированные бутылки и пробирки. Кровь собирают в бутылки с антикоагулянтом и центрифугируют при 2500 об/мин 20 минут для удаления эритроцитов. Плазму рекальцифицируют для получения сыворотки. Образец сыворотки, собранной через 15 недель после начальной иммунизации, используют для дальнейших исследований.
В. Сбор и очистка поликлональных IgG козы
Через 15 недель от козы собирают сыворотку и выделяют из нее фракцию IgG следующим методом. IgG фракцию сыворотки козы выделяют на колонке с белком G-агарозой согласно инструкции производителя (Kirkegaard and Perry Laboratories, Inc., Gaithersburg, MD). Элюированные фракции объединяют, концентрируют, буфер заменяют на фосфатный солевой буфер (PBS) при использовании фильтров для центрифуги Centriprep (Centriprep YM-10, Millipore Corporation, Billerica, MA). Концентрации образцов определяют методом измерения оптической плотности при 280 нм (CURRENT PROTOCOLS IN IMMUNOLOGY, Id.) и доводят до 10 мг/мл.
ПРИМЕР 3
Характеристика антисыворотки козы
Антисыворотку козы, описанную в примере 2, обозначают PGA. Предполагается, что фракция IgG PGA содержит антитела, направленные против различных эпитопов на молекуле прогормона GDF8. Антисыворотку PGA характеризуют методом исследования активации транскрипции in vitro, как описано ниже. Исследование активации транскрипции in vitro используют для количественной оценки бионейтрализации GDF8 и проводят согласно Thies et. al. (Growth Factors 18, 251 (2001)). 96-Луночные планшеты для люминометра ViewPlate™ (PerkinElmer Life and Analytical Sciences, Inc., Boston, MA) засевают клетками рабдомиосаркомы A204 (ATCC HTB-82) с плотностью 1.0×105 клеток/на лунку и инкубируют при 37°С, 5% СО2, во влажной среде. Полная среда A204 состоит из среды McCoy's 5A, 10% бычьей эмбриональной сыворотки, 2% L-глутамина и 1% пенициллина/стрептомицина. При достижении слияния около 80% клетки транзиторно трансфицируют смесью плазмид pDPC4-luciferase (с люциферазой) и HCMV IE-lacZ согласно протоколу, рекомендуемому производителем реагента для трансфекции FUGENE (Roche Diagnostics Corporation, Indianapolis, IN) и инкубируют 16 часов при 37°С, 5% CO2, во влажной среде. Плазмида pDPC4-luciferase содержит четыре копии участка CAGA, полученного из ингибитора активатора плазминогена человека (PAI-1), который придает GDF8 возможность отвечать на конструкцию с гетерологичным промотором и репортером.
Плазмида HCMV IE-lacZ содержит ген бета-галактозидазы под контролем конститутивного немедленно раннего промотора цитомегаловируса человека. Этот ген добавляют как контроль для оценки эффективности трансфекции. Затем к клеткам добавляют белок GDF8 (R&D Systems Inc., Minneapolis, MN) в количестве 100 нг/на лунку и инкубируют еще 16 часов при 37°С, 5% СО2, во влажной среде. Наличие люциферазы и бета-галактозидазы в обработанных клетках количественно оценивают в исследовании Dual-Light Luciferase (Tropix, Applied Biosystems, Foster City, CA).
Каждый образец исследуют в двух параллелях (2 лунки). Вычисляют сигнал каждой лунки как отношение сигнала люциферазы к сигналу бета-галактозидазы, умноженное на 100. Значение сигнала образца вычисляют как среднее из значений двух лунок.
Для исследования бионейтрализующей активности образца антитела различные концентрации очищенных фракций IgG инкубируют с белком GDF8 (приблизительно 16 часов при 4°С) перед обработкой клеток. Вычисляют процент ингибирования как 100 - (100 × сигнал образца) / (сигнал с одним GDF8 - сигнал без добавления GDF8). Результаты исследования активации транскрипции in vitro приведены в таблице 1.
Титры нейтрализации GDF8 для сыворотки козы PGA
Результаты исследования нейтрализации подтвердили, что фракция IgG полученной сыворотки козы содержит антитела, способные нейтрализовать, по меньшей мере, 95% GDF8, используемого в этом исследовании активности.
ПРИМЕР 4
Поликлональное антитело козы определяет специфический эпитоп нейтрализации белка GDF8
Для определения специфичности нейтрализующего иммунного ответа реактивность фракции IgG сыворотки PGA исследуют с набором семи перекрывающихся пептидов (DJ1-7, см. таблицу 2 и фиг.1), охватывающих всю кодирующую область активного белка GDF8. Реактивность IgG сыворотки козы PGA по отношению к каждому индивидуальному пептиду определяют в исследовании ELISA (твердофазный иммуноферментный анализ, Enzyme-Linked Immunosorbent Assay). Исследование ELISA с пептидом GDF8 проводят по существу согласно описанию набора Protein Detector™ ELISA Kit HRP, ABTS System (Kirkegaard and Perry Laboratories, Inc., Gaithersburg, MD). Применяют следующие модификации. Синтетические пептиды DJ1-7 (см. таблицу 2 ниже) были синтезированы на заказ в компании ProSci, Inc. (Poway, CA). Планшеты покрывают синтетическими пептидами в количестве 500 нг на лунку и очищенным прогормоном GDF8 - 250 нг на лунку. Первичными антителами являются фракции IgG из разных образцов. Вторичные тела используют в разведении 1:2000. Для образцов первичных антител козы вторичным антителом является меченное пероксидазой антитело кролика к IgG козы. Для образов первичных антител крысы вторичным антителом является меченное пероксидазой антитело козы к IgG крысы. Показатели оптической плотности OD 405 нм считывают 15 минут на считывателе для планшетов ELISA. Реактивность в исследовании ELISA вычисляют как значение OD 405 в минуту, умноженное на 1000.
Пептиды активной области GDF8
Результаты ELISA приведены в таблице 3.
Фракция IgG PGA специфически реагирует как с очищенным прогормоном GDF8, так и с пептидом DJ5. Из пептидов активной области GDF8 фракция IgG реагирует специфически и исключительно с пептидом DJ5. Это убедительно подтверждает то, что нейтрализующая способность этой сыворотки направлена против эпитопа, определяемого пептидом DJ5. Для подтверждения этой гипотезы выделяют DJ5-cпeцифичнyю фракцию сыворотки IgG PGA. Это выделение осуществляют методом аффинной хроматографии, как описано в Материалах и методах. Антитела PGA разделяют на фракции связавшихся и не связавшихся с пептидом DJ5. Обе фракции исследуют на нейтрализующую активность против белка GDF8.
Результаты в таблице 4 указывают на то, что большая часть способности к нейтрализации GDF8 приходится на антитела, специфически связывающиеся с пептидом DJ5. Это ясно указывает на то, что пептид DJ5 определяет нейтрализующий эпитоп белка GDF8.
Активность нейтрализации GDF8 антителами, специфичными к DJ5
Любопытно, что в предварительном эксперименте при введении двум кроликам человеческого антигена DJ5, конъюгированного с гемоцианином морского блюдечка (keyhole limpet), антитела, нейтрализующие GDF8, не были получены. Как можно видеть на фиг.2, последовательности, соответствующие DJ5 белков GDF8 кролика и человека, идентичны, в то время как аминокислотная последовательность DJ5 козы отличается.
Таким образом, ввиду данных, полученных на козе, предварительные данные, полученные на кролике, предполагают, что может быть предпочтительно использовать антиген DJ5, содержащий аминокислотную последовательность, отличающуюся от последовательности области/части GDF8 животного хозяина. Таким образом, в этом случае способность рекомбинантного прогормона GDF8 человека индуцировать бионейтрализующие антитела у козы может объясняться, по крайней мере, частично, тем фактом, что использованный антиген содержит аминокислотную последовательность, отличную от последовательности хозяина на одну аминокислотную замену в DJ5 области/части GDF8 [см. аминокислотный остаток 333 на фиг.2]. Более подробно, как указано на фиг.2, Arg333 в последовательности человека замещен Lys333 в последовательности козы. Эта единственная консервативная аминокислотная замена может обусловливать изменение, достаточно значительное для того, чтобы иммунологическая система козы распознавала белок как "чужой".
ПРИМЕР 5
Моноклональное антитело крысы mАВ788, нейтрализующее GDF8, определяет эпитоп специфической нейтрализации белка GDF8
Сообщалось, что моноклональное антитело крысы 788 нейтрализует биоактивность GDF8 (R&D Systems Inc., Cat. No. MAB788, Minneapolis, MN). Для подтверждения этого результата моноклональное антитело исследуют на нейтрализующую активность против белка GDF8. Антитело исследуют, как описано выше в примере 2. Результаты этого исследования приведены в таблице 5.
Титры нейтрализации GDF8 для моноклонального антитела 788
Данные таблицы 5 подтверждают, что это антитело способно нейтрализовать активность белка GDF8. Для определения специфичности такого нейтрализующего иммунного ответа моноклональное антитело крысы исследуют на реактивность с набором семи перекрывающихся пептидов (DJ1-7, см. таблицу 2 и фиг.1), охватывающих всю кодирующую область активного белка GDF8. Реактивность моноклонального антитела по отношению к каждому индивидуальному пептиду определяют в исследовании ELISA (см. Материалы и методы).
Реактивность моноклонального антитела крысы МАВ 788 (10 mg/ml) по отношению к пептидам активной области GDF8 в исследовании ELISA
Моноклональное антитело крысы специфично реагирует как с очищенным прогормоном GDP8, так и с пептидом DJ5. Обычно моноклональное антитело имеет моноспецифичность к единственному эпитопу. Среди пептидов активной области GDF8 антитело реагирует специфично и исключительно с пептидом DJ5. Этот результат дает еще одно независимое доказательство того, что пептид DJ5 определяет нейтрализующий эпитоп белка GDF8.
Специалисту в данной области техники будет понятно, что возможно множество модификаций и вариаций настоящего изобретения, не выходящих за рамки объема и сущности изобретения. Конкретные варианты осуществления настоящего изобретения, описанные здесь, приведены только в качестве примера, и изобретение ограничивается только приложенной формулой изобретения вместе с полным объемом эквивалентов, к которым применима формула изобретения. В описании процитированы многочисленные ссылки, включая номера в Генбанке (Genebank) опубликованных в печати и/или Интернете аминокислотных и полипептидных/белковых последовательностей, описания которых включены в настоящее в своей полноте посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА ПРОТИВ GDF-8 И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2360925C2 |
| УЛУЧШЕННЫЕ АНТИТЕЛА-АНТАГОНИСТЫ ПРОТИВ GDF-8 И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630634C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИ-CD38-АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2402568C2 |
| СПОСОБЫ РАЗРУШЕНИЯ КЛЕТОК С ИСПОЛЬЗОВАНИЕМ ЭФФЕКТОРНЫХ ФУНКЦИЙ АНТИ-EphA4 АНТИТЕЛ | 2007 |
|
RU2429246C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ ЛОВУШЕК GDF И АКТИВАТОРОВ РЕЦЕПТОРОВ ЭРИТРОПОЭТИНА ДЛЯ ПОВЫШЕНИЯ СОДЕРЖАНИЯ ЭРИТРОЦИТОВ | 2010 |
|
RU2592670C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ ЛОВУШЕК GDF И АКТИВАТОРОВ РЕЦЕПТОРОВ ЭРИТРОПОЭТИНА ДЛЯ ПОВЫШЕНИЯ СОДЕРЖАНИЯ ЭРИТРОЦИТОВ | 2017 |
|
RU2732229C2 |
| АНТИ-LAG-3 АНТИТЕЛА И ИХ КОМПОЗИЦИИ | 2017 |
|
RU2755503C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ ЛОВУШЕК GDF И АКТИВАТОРОВ РЕЦЕПТОРОВ ЭРИТРОПОЭТИНА ДЛЯ ПОВЫШЕНИЯ СОДЕРЖАНИЯ ЭРИТРОЦИТОВ | 2010 |
|
RU2642302C1 |
| НОВЫЕ АНТИ-IL 13 АНТИТЕЛА И ИХ ИСПОЛЬЗОВАНИЕ | 2004 |
|
RU2487887C2 |
| ГУМАНИЗИРОВАННОЕ АНТИ-ЭПИРЕГУЛИН-АНТИТЕЛО И ПРОТИВОРАКОВЫЙ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, СОДЕРЖАЩИЙ УКАЗАННОЕ АНТИТЕЛО, В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2012 |
|
RU2634383C2 |














Изобретение относится к области биотехнологии, конкретно к получению нейтрализующих эпитопов для антитела анти-GDF-8, и может быть использовано в медицине. Получают пептидные варианты из области с 327 по 346 аминокислоту последовательности SEQ ID NO:1, которые специфически связываются с моноклональным антителом крысы 788. Пептиды получают рекомбинантным путем с использованием клетки-хозяина, трансформированной вектором экспрессии с нуклеиновой кислотой, кодирующей указанный вариант пептида. На основе полученных пептидов готовят вакцинные композиции, которые используют для вызывания иммунного ответа aнти-GDF-8 и понижающего регулирования активности GDF-8 у животного. Также полученные пептиды можно использовать в способе скрининга для отбора анти-GDF-8 антител. Полученные пептиды обладают связывающей анти-GDF-8 антитело активностью, что позволяет использовать их для снижения активности фактора роста и дифференцировки 8. 9 н. и 8 з.п. ф-лы, 2 ил., 6 табл.
1. Выделенный пептид, обладающий специфической связывающей анти-GDF8 антитело активностью, состоящий из
(a) аминокислотных остатков с 327 по 346 последовательности SEQ ID NO:1, или
(b) аминокислотных остатков с 327 по 346 последовательности SEQ ID NO:1, содержащих консервативную аминокислотную замену; или
(c) аминокислотных остатков с 327 по 346 последовательности SEQ ID NO:1, содержащих аминокислотную замену в положении, выбираемом из группы, состоящей из остатков 328, 329, 331, 333 и 335, и их комбинаций, причем
(i) аминокислотный остаток 328 представляет собой His, Leu, или Asn;
(ii) аминокислотный остаток 329 представляет собой Gln или Lys;
(iii) аминокислотный остаток 331 представляет собой Asn или Ser;
(iv) аминокислотный остаток 333 представляет собой Arg или Lys; и/или
(v) аминокислотный остаток 335 представляет собой Ser, Pro или Thr,
причем в случаях (b) и (с) между аминокислотными остатками с 327 по 346 имеется не более пяти аминокислотных замен, и
пептид специфически связывается с моноклональным антителом крысы 788.
2. Выделенный пептид по п.1, в случае (а) содержащий эпитоп специфической нейтрализации для антитела анти-GDF-8.
3. Выделенный пептид по п.2, причем антитело выбирают из группы, включающей моноклональное антитело крысы анти-GDF-8 788 и фракцию IgG поликлональной антисыворотки козы aнти-GDF-8.
4. Выделенный пептид по п.1, содержащий не более одной аминокислотной замены между остатками с 327 по 346.
5. Выделенная молекула нуклеиновой кислоты, кодирующая пептид, обладающий специфической связывающей анти-GDF-8 антитело активностью, и
характеризующаяся нуклеотидной последовательностью, которая определяется аминокислотной последовательностью пептида по п.1.
6. Молекула нуклеиновой кислоты по п.5, содержащая последовательность нуклеиновой кислоты с нуклеотида 1112 по нуклеотид 1171 последовательности SEQ ID NO:2.
7. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующей пептид по п.1.
8. Клетка-хозяин для получения пептида по п.1, содержащая вектор экспрессии по п.7.
9. Клетка-хозяин по п.8, трансформированная вектором экспрессии по п.7.
10. Клетка-хозяин по п.8, представляющая собой эукариотическую клетку.
11. Способ получения пептида по п.1, включающий этапы культивирования клетки-хозяина по п.10 и экспрессии закодированного пептида.
12. Способ по п.11, дополнительно включает стадию выделения пептида.
13. Вакцинная композиция для вызывания иммунного ответа анти-GDF-8, содержащая активное вещество и фармацевтически приемлемые добавки, причем в качестве активного вещества содержит пептид по п.1, содержащий аминокислотные остатки с 327 по 346 последовательности SEQ ID NO:1, в эффективном количестве.
14. Вакцинная композиция по п.13, дополнительно содержащая адъювант.
15. Способ вызывания иммунного ответа анти-GDF-8 у животного, включающий введение животному эффективного количества вакцинной композиции по п.13, содержащей пептид по п.1.
16. Способ скрининга для отбора антитела анти-GDF-8 или фрагмента антитела из множества антител или фрагментов антител, имеющих отношение к антителу анти-GDF-8, включающий взаимодействие пептида по п.1 с образцом, содержащим одно или множество антител или фрагментов антител, и детекцию антитела или фрагмента антитела, селективно связывающегося с пептидом.
17. Способ понижающего регулирования активности GDF-8 у животного, включающий иммунизацию животного эффективным количеством вакцинной композиции по п.13.
| US 2003065137, 03.04.2003 | |||
| US 2002127234, 12.09.2002 | |||
| СПОСОБ КОНСЕРВИРОВАНИЯ ЯГОД | 2007 |
|
RU2333706C1 |
| АНТИИДИОТИПИЧЕСКИЕ АНТИТЕЛА, КОТОРЫЕ ИНДУЦИРУЮТ ИММУННЫЙ ОТВЕТ ПРОТИВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 1996 |
|
RU2172636C2 |
Авторы
Даты
2011-06-27—Публикация
2004-12-21—Подача