Область техники.
Настоящее изобретение относится к способу получения L-аминокислоты с помощью ферментации, более конкретно к генам, которые способствуют указанной ферментации. Эти гены положительно влияют на продукцию L-аминокислоты, например на продукцию L-треонина, L-лизина, L-гистидина, L-фенилаланина, L-аргинина и L-глутаминовой кислоты.
Предшествующий уровень техники.
Традиционно в промышленных масштабах L-аминокислоты получают с помощью ферментации штаммов микроорганизмов, полученных из природных источников, или мутантов этих микроорганизмов. Обычно эти микроорганизмы являются модифицированными таким образом, что выход L-аминокислот у этих штаммов повышается.
Описано множество способов повышения продукции L-аминокислот, включая трансформацию микроорганизмов рекомбинантной ДНК (смотри, например, патент США 4,278,765). Другие способы повышения продуктивности микроорганизмов включают в себя повышение активностей ферментов, участвующих в биосинтезе аминокислоты, и/или уменьшение чувствительности целевого фермента к обратному ингибированию накапливаемой L-аминокислотой по типу обратной связи (смотри, например, WO 95/16042 или патент США 4346170, 5661012 и 6040160).
Известны различные штаммы, использующиеся для производства L-треонина методом ферментации. Это штаммы с увеличенными активностями ферментов, вовлеченных в биосинтез L-треонина (патенты США 5175107; 5661012; 5705371 и 5939307; Европейский патент 219027), штаммы, устойчивые к некоторым химических реагентам, таким как L-треонин и его аналоги (заявка РСТ 01/14525 А1, Европейская заявка 301572А2, патент США 5,661,012), штаммы, в которых устранена чувствительность целевого фермента к ингибированию продуцируемой аминокислотой или ее побочными продуктами по типу обратной связи (патенты США 5175107 и 5661012), штаммы с инактивированными ферментами системы деградации треонина (патенты США 5939307 и 6297031).
Известный штамм-продуцент треонина ВКПМ В-3996 (патенты США 5175107 и 5705371) в настоящее время является одним из лучших продуцентов треонина. Для создания штамма ВКПМ В-3996 несколько мутаций и плазмида, описанная ниже, были введены в родительский штамм Е.coli К-12 (ВКПМ В-7). Мутантный ген thrA (мутация thrA442) кодирует белок аспартокиназагомосериндегидрогеназу I, который устойчив к ингибированию треонином по типу обратной связи. Мутантный ген ilvA (мутация ilvA442) кодирует белок треониндеаминазу, обладающую пониженной активностью, которая выражается в пониженном уровне биосинтеза изолейцина и в фенотипе с недостатком по изолейцину типа "leaky". В бактерии с мутацией ilvA442 транскрипция оперона thrABC не репрессируется изолейцином, что является очень эффективным при продукции треонина. Инактивация гена tdh, кодирующего треониндегидрогеназу, приводит к предотвращению деградации треонина. В указанный штамм была введена генетическая детерминанта ассимиляции сахарозы (гены scrKYABR). Для увеличения экспрессии генов, контролирующих биосинтез треонина, в промежуточный штамм TDH6 была введена плазмида pVIC40, содержащая мутантный треониновый оперон thrA442BC. Количество треонина, накопленного в ходе ферментации этого штамма, достигало 85 г/л.
Для оптимизации основных путей биосинтеза целевого соединения дальнейшее совершенствование штаммов-продуцентов L-аминокислот может быть произведено благодаря усилению снабжения бактерии возрастающими количествами сахаров, служащих источником углерода, например глюкозой. Несмотря на эффективный PTS транспорт глюкозы, доступность источников углерода для клеток высокопродуктивного штамма может оставаться недостаточной.
Известно, что активный транспорт сахаров и других метаболитов в бактериальную клетку осуществляется несколькими транспортными системами.
В том числе, белок XylE из Е.coli является пермеазой D-ксилозы, одной из двух систем в Е.coli, ответственных за поступление D-ксилозы в клетку; другая система - это АТФ-зависимый АВС транспортер XylFGH. Было показано, что клонированный ген xylE комплементирует мутацию xylE in vivo (Davis E.O. and Henderson P.J., J. Biol. Chem., 262(29); 13928-32 (1987)). Транспорт, осуществляемый посредством XylE в интактной клетке, ингибируется протонофорами и вызывает смещение рН в сторону защелачивания (Lam, V.M. et al., J. Bacteriol. 143(1); 396-402 (1980)). Эксперименты с мутантами xylE и xylF показали, что у белка XylE KM к D-ксилозе равна 63-169 мкМ (Sumiya. M. et al. Receptors Channels, 3(2); 117-28 (1995)). Белок XylE является членом суперсемейства транспортеров Major Facilitator Superfamily (MFS) (Griffith, J.K. et al., Curr. Opin. Cell Biol. 4(4); 684-95 (1992)) и функционирует как симпортер D-ксилозы/протона. Возможно, ген xylE является частью моноцистроного оперона, экспрессия которого индуцируется D-ксилозой. Импортированная в клетку ксилоза катаболизируется до ксилулозо-5-фосфата при участии ферментов XylA (ксилозоизомеразы) и XylB (ксилулокиназы). При определенных условиях, ксилозоизомераза, кодируемая геном xylA, также способна к эффективному катализу реакции превращения D-глюкозы в D-фруктозу (Wovcha, M.G. et al., Appl Environ Microbiol. 45(4): 1402-4 (1983)).
Однако к настоящему времени нет сообщений об использовании бактерии семейства Enterobacteriaceae, обладающей повышенной активностью пермеазы D-ксилозы для увеличения продукции L-аминокислот.
Краткое описание чертежей
На фиг.1 показана структура нуклеотидной последовательности перед геном xylE на хромосоме Е.coli и структура интегрированного фрагмента ДНК, содержащего ген cat и гибридный промотор PL-tac.
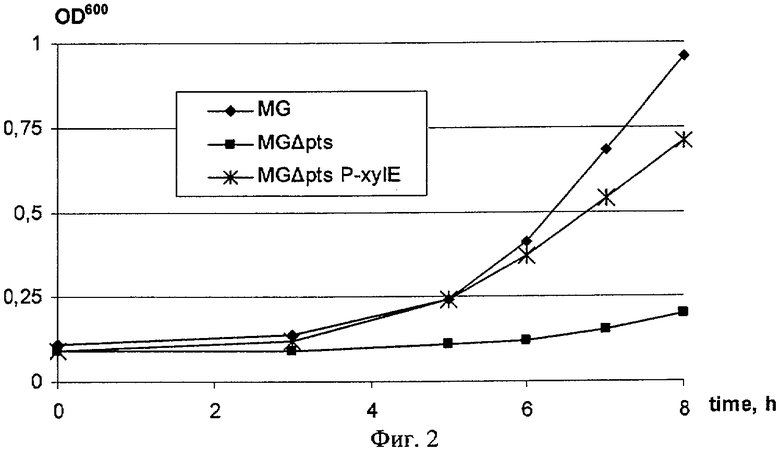
На фиг.2 показаны кривые роста штаммов Е.coli MG1655, MG1655 ΔptsHI-crr и MG1655PL-tacxylE, выращиваемых на среде с глюкозой. Условные обозначения: MG=Е.coli MG1655; MG Δpts=Е.coli MG1655 ΔptsHI-crr; MG Δpts P xylE=Е.coli MG1655 ΔptsHI-crr PL-tacxylE.
Описание изобретения
Целью настоящего изобретения является повышение продуктивности штаммов-продуцентов L-аминокислоты и предоставление способа получения неароматических или ароматических L-аминокислот с использованием указанных штаммов.
Данная цель была достигнута путем обнаружения того факта, что увеличение экспрессии гена xylE, кодирующего пермеазу D-ксилозы, повышает продукцию L-аминокислоты, например L-треонина, L-лизина, L-гистидина, L-фенилаланина, L-аргинина или L-глутаминовой кислоты. Таким образом, было совершено настоящее изобретение.
Целью настоящего изобретения является предоставление бактерии-продуцента L-аминокислоты семейства Enterobacteriaceae, где указанная бактерия модифицирована таким образом, что активность пермеазы D-ксилозы в клетках указанной бактерии повышена. Также целью настоящего изобретения является создание описанной выше бактерии, где активность указанной пермеазы D-ксилозы повышена за счет усиления экспрессии гена, кодирующего пермеазу D-ксилозы.
Также целью настоящего изобретения является создание описанной выше бактерии, где активность указанной пермеазы D-ксилозы повышена за счет модификации последовательности, контролирующей экспрессию гена, кодирующего пермеазу D-ксилозы таким образом, что экспрессия указанного гена усилена или увеличено количество копий гена, кодирующего пермеазу D-ксилозы.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия дополнительно модифицирована таким образом, что активность глюкокиназы в клетках этой бактерии повышена.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия дополнительно модифицирована таким образом, что активность изомеразы ксилозы в клетках этой бактерии повышена.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия модифицирована таким образом, что в клетках этой бактерии усилена экспрессия локуса xylABFGHR.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия выбрана из группы, состоящей из родов Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Providencia, Salmonella, Serratia, Shigella и Morganella.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанный ген кодирует пермеазу D-ксилозы, выбранную из группы, состоящей из:
(A) белка, включающего в себя аминокислотную последовательность, представленную в Списке последовательностей под номером 2 (SEQ ID NO:2);
(B) вариант белка с аминокислотной последовательностью, представленной в Списке последовательностей под номером 2 (SEQ ID NO:2), который обладает активностью пермеазы D-ксилозы.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанный ген, кодирующий пермеазу D-ксилозы включает в себя ДНК, выбранную из группы, состоящей из:
(a) ДНК, включающей в себя последовательность нуклеотидов с нуклеотидом 1 по нуклеотид 1476, представленную в Списке последовательностей под номером 1 (SEQ ID NO:1);
(b) ДНК, которая гибридизуется с последовательностью нуклеотидов с нуклеотидом 1 по нуклеотид 1476, представленной в Списке последовательностей под номером 1 (SEQ ID NO:1), или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности, в жестких условиях и кодирует белок, обладающий активностью пермеазы D-ксилозы.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанные жесткие условия включают в себя такие условия, при которых said отмывание производится при 60°С в течение 15 минут при концентрации солей 1×SSC и 0.1% SDS.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-треонина.
Также целью настоящего изобретения является создание описанной выше бактерии, где указанная бактерия дополнительно модифицирована таким образом, что повышена экспрессия гена, выбранного из группы, состоящей из:
- мутантного гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи;
- гена thrB, кодирующего гомосеринкиназу;
- гена thrC, кодирующего треонинсинтазу;
- гена rhtA, кодирующего предполагаемый трансмембранный белок;
- любой комбинации вышеуказанных генов.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия модифицирована таким образом, что экспрессия указанного мутантного гена thrA, указанного гена thrB, указанного гена thrC и указанного гена rhtA в этой бактерии повысилась.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-лизина.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-гистидина.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-фенилаланина.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-аргинина.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где указанная бактерия является бактерией-продуцентом L-глутаминовой кислоты.
Также целью настоящего изобретения является предоставление способа получения L-аминокислоты, который включает в себя выращивание описанной выше бактерии в ферментационной среде, что позволяет накапливать указанную L-аминокислоту в культуральной жидкости, а также выделение указанной L-аминокислоты из культуральной жидкости.
Также целью настоящего изобретения является предоставление описанного выше способа, где питательная среда содержит ксилозу.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-треонином.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-лизином.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-гистидином.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-фенилаланином.
Также целью настоящего изобретения является предоставление описанного выше метода, где L-аминокислота является L-аргинином.
Также целью настоящего изобретения является предоставление описанного выше способа, где L-аминокислота является L-глутаминовой кислотой.
Наилучший способ осуществления изобретения.
Согласно настоящему изобретению «бактерия - продуцент L-аминокислоты» означает бактерию, обладающую способностью к накоплению L-аминокислоты в питательной среде, в условиях, когда бактерия согласно настоящему изобретению выращивается в указанной питательной среде. Способность к продукции L-аминокислоты может быть придана или улучшена путем селекции. Используемый здесь термин «бактерия-продуцент L-аминокислоты» также означает бактерию, которая способна к продукции L-аминокислоты и вызывает накопление L-аминокислоты в ферментационной среде в больших количествах, по сравнению с природным или родительским штаммом Е.coli, таким как штамм Е.coli К-12 и предпочтительно обозначает микроорганизм, способный накапливать в среде целевую L-аминокислоту в количествах, не меньше, чем 0.5 г/л, более предпочтительно не менее чем 1.0 г/л целевой L-аминокислоты. "L-аминокислоты" включают в себя L-аланин, L-аргинин, L-аспарагин, L-аспартат, L-цистеин, L-глутаминовая кислота, L-глутамин, L-глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин. L-треонин, L-лизин, L-гистидин, L-фенилаланин, L-аргинин и L-глутаминовая кислота более предпочтительны.
Семейство Enterobacteriaceae включает в себя бактерии, принадлежащие к родам Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и т.д. В частности, могут быть использованы бакетрии, классифицированные как относящиеся к семейству Enterobacteriaceae в соответствии с таксономической классификацией, приведенной в базе данных NCBI (Национальный Центр Биотехнологической Информации) (http://www.ncbi.nlm.nih.gov/htbinpost/Taxonomy/wgetorg?mode=Tree&id=1236&lvl=3&keep=1&srchmode=1&unlock). Бактерия, принадлежащая к родам Escherichia или Pantoea, предпочтительна. Термин «бактерия, принадлежащая к роду Escherichia» означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (Е.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в их число согласно настоящему изобретению.
Термин "бактерия, принадлежащая к роду Pantoea" означает, что бактерия относится к роду Pantoea в соответствии с классификацией, известной специалисту в области микробиологии. На основе анализа нуклеотидной последовательности 16S рРНК и т.д. некоторые виды Enterobacter agglomerans недавно были классифицированы как Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или подобны им (Int. J. Syst. Bacteriol., 43, 162-173 (1993)).
Бактерия согласно настоящему изобретению включает в себя штамм семейства Enterobacteriaceae, обладающий способностью к продукции L-аминокислоты и который был модифицирован таким образом, что активность пермеазы D-ксилозы повышена. Кроме того, бактерия согласно настоящему изобретению включает в себя штамм бактерии семейства Enterobacteriaceae, который обладает способностью к продукции L-аминокислоты и не имеет природной активности пермеазы D-ксилозы и который трансформирован фрагментом ДНК, кодирующим пермеазу D-ксилозы.
Термин "активность пермеазы D-ксилозы" обозначает активность по транспорту сахаров, таких как ксилоза и глюкоза, в клетку. Активность пермеазы D-ксилозы может быть определена по комплементации задержки роста у бактерий с разрушенной PTS-системой транспорта сахаров (смотри, например, мутант ΔptsHI-crr, описанный в разделе Примеры) или по комплементации мутаций xylE in vivo (Davis, E.O. and Henderson, P.J., J. Biol. Chem., 262(29); 13928-32 (1987)).
Термин "бактерия модифицирована таким образом, что активность пермеазы D-ксилозы повышена" означает, что указанная удельная активность выше, чем эта же активность у немодифицированного, например у природного, штамма. Примеры такой модификации включают в себя увеличение количества молекул пермеазы D-ксилозы на клетку, повышение специфической активности в пересчете на молекулу пермеазы D-ксилозы, и так далее. Кроме того, примеры природного штамма, который можно использовать для сравнения, включают, например, штамм Escherichia coli К-12. В настоящем изобретении количество накопленной L-аминокислоты, например L-треонина или L-аргинина, может быть повышено в культуральной жидкости в результате повышения внутриклеточной активности пермеазы D-ксилозы.
Повышение активности пермеазы D-ксилозы в бактериальной клетке может быть достигнуто за счет усиления экспрессии гена xylE, кодирующего пермеазу D-ксилозы. Любой ген xylE, полученный из бактерий, принадлежащих к роду Escherichia, как и любой ген xylE, полученный из других бактерий, таких как коринеформные бактерии, может быть использован как ген пермеазы D-ксилозы согласно настоящему изобретению. Гены xylE, полученные из бактерий, принадлежащих к роду Escherichia, предпочтительны.
Термин "усиление экспрессии гена" обозначает, что экспрессируемое количество данного гена выше по сравнению с экспрессией данного гена в немодифицированном, например природном, штамме. Примеры такой модификации включают повышение количества копий экспрессируемого гена в пересчете на клетку, повышение уровня экспрессии этого гена и так далее. Количество копий экспрессируемого гена измеряется, например, разрезанием хромосомной ДНК с последующей гибридизацией по Саузерну с использованием зонда, полученного на основе нуклеотидной последовательности данного гена, флуоресцентной гибридизацией in situ (FISH) и подобными им. Уровень экспрессии гена может быть измерен с помощью различных способов, включая гибридизацию по Нозерну, количественный обратный ПЦР (RT-PCR) и подобные им. Кроме того, примеры природного штамма, который может использоваться в качестве контроля, включают, например, штамм Escherichia coli К-12 или Pantoea ananatis PERM ВР-6614 (патентная заявка США US 2004180404 A1). Штамм Pantoea ananatis FERM ВР-6614 был депонирован в Национальном институте бионауки и человеческих технологий (National Institute of Bioscience and Human-Technology) Агентства по промышленной науке и технологиям (Agency of Industrial Science and Technology) Министерства международной торговли и промышленности (Ministry of International Trade and Industry) (в настоящее время, Международный депозитарий патентных организмов Национального института прогрессивной промышленной науки и технологии - International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology) 19 февраля 1998 г. под инвентарным номером FERM P-16644. Затем штамм был переведен на международное депонирование в соответствии с Будапештским договором 11 января 1999 под инвентарным номером FERM ВР-6614. Хотя указанный штамм на момент его выделения описан как Enterobacter agglomerans, он был переклассифицирован в Pantoea ananatis на основании анализа нуклеотидной последовательности 16S rRNA, как описано выше.
В результате повышения внутриклеточной активности пермеазы D-ксилозы повышается накопление в среде L-аминокислоты, например L-треонина, L-лизина, L-гистидина, L-фенилаланина или L-глутаминовой кислоты.
Нуклеотидная последовательность гена xylE, кодирующего пермеазу D-ксилозы, а именно D-ксилоза/протон симпортер из Escherichia coli, приведена в базе данных GenBank в последовательности с инвентарным номером NC_000913.2, gi:49175990 (номера нуклеотидов с 4240277 по 4238802). Ген xylE расположен на хромосоме штамма Е.coli К-12 между открытой рамкой считывания yjbA ORF и геном malG. Нуклеотидные последовательности других генов xylE, кодирующих пермеазы D-ксилозы, также приведены в базе данных GenBank под номерами AAN45595. xylose-proton sym...[gi:24054686], ААМ41050. MFS transporter...[gi:21112853]: Xanthomonas campestris: XCC1759. В описании настоящего изобретения нуклеотидная последовательность гена xylE из Escherichia coli представлена в Списке последовательностей под номером 1 (SEQ ID NO.1).
При транспорте в клетку глюкоза фосфорилируется с помощью глюкокиназы, кодируемой геном glk. Следовательно, желательно модифицировать бактерию таким образом, чтобы активность глюкокиназы в клетках указанной бактерии была повышена. Нуклеотидная последовательность гена glk, который кодирует глюкокиназу из Escherichia coli, приведена в базе данных GenBank в последовательности с инвентарным номером NC_000913.1, gi:16127994 (номера нуклеотидов с 2506481 по 2507446). Ген glk расположен на хромосоме штамма Е.coli К-12 между открытыми рамками считывания b2387 и b2389 ORF.
В определенных условиях изомераза ксилозы, кодируемая геном xylA, также эффективно катализирует превращение D-глюкозы в D-фруктозу (Wovcha, M.G. et al., Appl Environ Microbiol. 45(4): 1402-4 (1983)). Следовательно, желательно модифицировать бактерию таким образом, чтобы активность изомеразы ксилозы в клетках указанной бактерии была повышена. Нуклеотидная последовательность гена xylA, который кодирует изомеразу ксилозы из Escherichia coli, приведена в базе данных GenBank в последовательности с инвентарным номером NC_000913.2, gi:49175990 (номера нуклеотидов с 3728788 по 3727466). Ген xylA расположен на хромосоме штамма Е.coli К-12 между генами xylB и xylF.
В случае, когда питательная среда в качестве дополнительного источника содержит ксилозу, необходимо увеличить активность ферментов утилизации ксилозы. Термин «ферменты утилизации ксилозы» включает белки транспорта ксилозы, ферменты изомеризации и фосфорилирования ксилозы, а также регуляторные белки. Такие ферменты включают изомеразу ксилозы, ксилулокиназу, транспортеры ксилозы и транскрипционные активаторы, реагирующие на присутствие ксилозы. Изомераза ксилозы катализирует реакцию изомеризации D-ксилозы в D-ксилулозу. Ксилулокиназа катализирует реакцию фосфорилирования D-ксилулозы с помощью АТФ с образованием D-ксилулозо-5-фосфата и АДФ. Присутствие активности ферментов утилизации ксилозы, таких как изомераза ксилозы и ксилулокиназа, определяется по комплементации соответствующих минус-мутаций в изомеразе ксилозы и ксилулокиназе в мутантных штаммах Е.coli, соответственно.
Гены, кодирующие вышеуказанные ферменты утилизации ксилозы расположены в локусе xylABFGHR в хромосоме Escherichia coli. Ген, кодирующий ксилулокиназу (ЕС numbers 2.7.1.17), известен и обозначен как xylB (номера нуклеотидов с 3725546 по 3727000 в последовательности с номером NC_000913.1, gi:16131435 в базе данных GenBank). Ген, кодирующий белок связывания ксилозы системы транспорта, известен и обозначен как xylF (номера нуклеотидов с 3728760 по 3729752 в последовательности с номером NC_000913.1, gi:16131437 в базе данных GenBank). Ген, кодирующий предположительно АТФ-связывающий белок системы транспорта ксилозы, известен и обозначен как xylG (номера нуклеотидов с 3729830 по 3731371 в последовательности с номером NC_000913.1, gi:16131438 в базе данных GenBank). Ген, кодирующий компонент пермеазы в системе транспорта ксилозы типа АВС, известен и обозначен как xylH (номера нуклеотидов с 3731349 по 3732530 в последовательности с номером NC_000913.1, gi:16131439 в базе данных GenBank). Ген, кодирующий транскрипционный регулятор оперона xyl, известен и обозначен как xylR (номера нуклеотидов с 3732608 по 3733786 в последовательности с номером NC_000913.1, gi:16131440 в базе данных GenBank).
Таким образом, гены xylE, glk и локуса xylABFGHR могут быть получены с помощью ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al., Trends Genet., 5, 185 (1989)), с использованием праймеров, синтезированных на основе известных нуклеотидных последовательностей генов. Гены, кодирующие пермеазу D-ксилозы из других микроорганизмов могут быть получены сходным образом.
Ген xylE, полученный из Escherichia coli, представлен ДНК, которая кодирует следующий белок (А) или (В):
(А) белок, включающий в себя аминокислотную последовательность, представленную в Списке последовательностей под номером 2 (SEQ ID NO:2);
(В) вариант белка с аминокислотной последовательностью, представленной в Списке последовательностей под номером 2 (SEQ ID NO:2), и который обладает активностью пермеазы D-ксилозы.
Используемый в настоящем изобретении термин "вариант белка" обозначает белок с изменениями в его последовательности, которые могут быть делециями, вставками, добавлениями нуклеотидов или заменами аминокислот, но при этом сохраняет желаемую активность на необходимом уровне, например необходимом для повышения продукции L-аминокислоты. Количество изменений в варианте белка зависит от вида аминокислотного остатка или от положения в трехмерной структуре данного белка. Это количество может составлять от 2 до 30, предпочтительно от 2 до 15, и еще более предпочтительно от 2 до 5 для белка (А). Эти замены в вариантах белка могут происходить в областях данного белка, не являющихся критичными для функционирования этого белка. Это связано с тем, что некоторые аминокислоты обладают высокой гомологией друг к другу, и трехмерная структура белка и его активность не изменяются в результате такой замены. Такие замены в варианте белка могут происходить в областях данного белка, не являющихся критичными для функционирования этого белка. Таким образом, вариантом белка (В) может являться белок, обладающий гомологией не менее 70%, предпочтительно 80%, более предпочтительно 90% и еще более предпочтительно 95% по отношению к полной аминокислотной последовательности пермеазы D-ксилозы, приведенной в Списке последовательностей под номером 2 (SEQ ID NO.2), до тех пор, пока измеряется активность пермеазы D-ксилозы. Степень гомологии между двумя аминокислотными последовательностями может быть определена с помощью известных методов, например с помощью компьютерной программы BLAST 2.0, которая просчитывает следующие три параметра: счет (score), идентичность (identity) и схожесть (similarity).
ДНК, которая кодирует практически такой же белок, как описанная выше пермеаза D-ксилозы, может быть получена, например, путем модификации нуклеотидной последовательности ДНК, кодирующей пермеазу D-ксилозы (SEQ ID NO:1), например, с использованием сайт-направленного мутагенеза, таким образом, что в специфическом сайте происходит замена, делеция, вставка или добавления одного или более аминокислотных остатков. ДНК, модифицированная описанным выше способом, может быть получена с помощью традиционных способов мутагенеза. Такие способы включают обработку ДНК, кодирующей белок, согласно настоящему изобретению, гидроксиламином или обработку бактерии, содержащей указанную ДНК, УФ излучением или реагентом, таким как N-метил-N'-нитро-N-нитрозогуанидиная или азотистая кислота.
Замены, делеции, вставки и добавления одного или нескольких аминокислотных остатков должны быть консервативными мутациями(мутацией), для того, чтобы сохранялась активность белка. Примером консервативной мутации является консервативная замена. Примеры консервативных замен включают замены Ser или Thr на Ala, замены Gln, His или Lys на Arg, замены Glu, Gln, Lys, His или Asp на Asn, замены Asn, Glu или Gln на Asp, замены Ser или Ala на Cys, замены Asn, Glu, Lys, His, Asp или Arg на Gln, замены Asn, Gln, Lys или Asp на Glu, замену Pro на Gly, замены Asn, Lys, Gln, Arg или Tyr на His, замены Leu, Met, Val или Phe на Ile, замены Ile, Met, Val или Phe на Leu, замены Asn, Glu, Gln, His или Arg на Lys, замены Ile, Leu, Val или Phe на Met, замены Trp, Tyr, Met, Ile или Leu на Phe, замены Thr или Ala на Ser, замены Ser или Ala на Thr, замены Phe или Tyr на Trp, замены His, Phe или Trp на Tyr и замены Met, Ile или Leu на Val.
ДНК, кодирующая практически такой же белок, как пермеаза D-ксилозы, может быть получена в результате экспрессии ДНК, содержащей указанную мутацию, в соответствующей клетке-хозяине, с последующим определением активности экспрессируемого продукта. ДНК, кодирующая практически такой же белок, как пермеаза D-ксилозы, также может быть получена путем выделения ДНК, которая гибридизуется с зондом, нуклеотидная последовательность которого содержит, например, нуклеотидную последовательность, приведенную в Списке последовательностей под номером 1 (SEQ ID NO:1), в жестких условиях, и которая кодирует белок, обладающий активностью пермеазы D-ксилозы. Термин «жесткие условия», упомянутый здесь, означает условия, при которых образуются так называемые специфические гибриды, а неспецифические - не образуются. Например, к жестким условиям относятся условия, при которых гибридизуются ДНК, обладающие высокой степенью гомологии, к примеру ДНК, предпочтительно обладающие гомологией не менее 50% друг относительно друга, предпочтительно 80%, более предпочтительно 90% и наиболее предпочтительно 95%, но ДНК, имеющие гомологию менее 50% друг относительно друга, не гибридизуются. С другой стороны, примером жестких условий являются условия, при которых ДНК гибридизуются друг с другом, при концентрации солей, соответствующей стандартным условиям отмывки при гибридизации по Саузерну, например 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS при 60°С. Продолжительность отмывки зависит от вида фильтра, используемого для блоттинга и, как правило, от рекомендаций изготовителя. Например, рекомендованная продолжительность отмывки нейлонового фильтра Hybond™ N+(Amersham) в жестких условиях составляет 15 минут. Предпочтительно, чтобы отмывку проводили 2-3 раза.
Также в качестве зонда может быть использована часть нуклеотидной последовательности, приведенной в списке последовательностей под номером 1 (SEQ ID NO:1). Зонды могут быть получены в результате ПЦР с использованием в качестве праймеров олигонуклеотидов, полученных на основе нуклеотидной последовательности под номером 1, и фрагмента ДНК, содержащего нуклеотидную последовательность под номером 1, в качестве матрицы. В случае, когда в качестве зонда используется фрагмент ДНК длиной около 300 пар оснований, условия отмывки при гибридизации соответствуют, например 50°С, 2×SSC и 0.1% SDS.
Описанные выше замены, делеции, вставки или добавления нуклеотидов также включают мутации, встречающиеся в природе (мутант или вариант), например, из-за природного разнообразия в пределах вида или рода бактерии, содержащей пермеазу D-ксилозы.
Термин «трансформация бактерии ДНК, кодирующей белок» означает введение указанной ДНК в бактерию, например, традиционными способами. Трансформация указанной ДНК приводит к повышению экспрессии гена, кодирующего белок и таким образом повышает активность указанного белка в бактериальной клетке. Методы трансформации включают в себя все описанные или известные к настоящему времени методы. Например, может быть использован метод обработки клеток-реципиентов с помощью хлорида кальция для увеличения проницаемости ДНК через клеточную мембрану, описанный для Escherichia coli K-12 (Mandel, M. and Higa, A., J. Mol. Biol., 53, 159 (1970)).
Способы усиления экспрессии гена включают увеличение количества копий гена. Введение гена в вектор, способный функционировать в бактерии семейства Enterobacteriaceae, повышает количество копий гена. Предпочтительно использование низкокопийных генов. Примеры низкокопийных векторов включают, но не ограничиваются векторами pSC 101, pMW 118, pMW 119 и подобными им. Термин "низкокопийный вектор" используется для векторов, количество копий которых в клетке не превышает 5.
Усиление экспрессии гена может также быть достигнуто за счет введения нескольких копий гена в бактериальную хромосому, например, с помощью методов гомологичной рекомбинации, Mu интеграции и подобных им. Например, один раунд Mu интеграции позволяет интегрировать до 3 копий целевого гена в бактериальную хромосому.
Увеличение количества копий гена пермеазы D-ксилозы может быть достигнуто путем интеграции нескольких копий гена пермеазы D-ксилозы в хромосомную ДНК бактерии. Для того чтобы интегрировать несколько копий этого гена в бактериальную хромосому, производится гомологичная рекомбинация с использованием последовательности, чьи многочисленные копии присутствуют в хромосомной ДНК и используются в качестве мишеней. Последовательности, присутствующие в виде нескольких копий в хромосомной ДНК включают, но не ограничиваются, повторами ДНК или инвертированными повторами, присутствующими на концах элементов транспозиции. Также, как описано в патенте США 5595889, возможно включение гена пермеазы D-ксилозы в состав транспозона, позволяющее интегрировать несколько копий этого гена в хромосомную ДНК.
Усиление экспрессии гена также достигается помещением ДНК согласно настоящему изобретению под контроль сильного промотора. Например, lac промотор, trp промотор, trc промотор, PR или PL промоторы фага лямбды известны как сильные промоторы. Усиление экспрессии гена также может быть достигнуто путем помещения сильного терминатора после ДНК согласно настоящему изобретению. Использование сильного промотора и/или терминатора может комбинироваться с увеличением количества копий гена.
С другой стороны, влияние промотора может быть усилено, например, введением мутации в промотор для повышения уровня транскрипции структурного гена (кодирующего участка гена), расположенного за промотором. Аналогично, эффект терминатора может быть усилен, например, путем введения мутации в терминатор для увеличения числа инициации транскрипции гена, расположенного перед терминатором.
Более того, известно, что замена нескольких нуклеотидов в промежутке между сайтом связывания рибосомы (RBS) и старт-кодоном, особенно последовательности, находящиеся непосредственно перед старт-кодоном, существенно влияют на транслируемость мРНК. Например, был обнаружен 20-кратный разброс уровней экспрессии, в зависимости от того, какие именно три нуклеотида предшествовали старт-кодону (Gold et al., Annu. Rev. Microbiol., 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984). Ранее было показано, что rhtA23 мутация является заменой А-на-G в положении -1 относительно старт-кодона ATG (ABSTRACTS of 17th International Congress of Biochemistry and Molecular Biology in conjugation with 1997 Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract №457). Таким образом, можно предположить, что мутация rhtA23 усиливает экспрессию гена rhtA и, следовательно, повышает устойчивость к треонину, гомосерину и другим веществам, выбрасываемым из клетки.
Более того, также вполне возможно ввести нуклеотидную замену в промоторную или терминаторную область гена пермеазы D-ксилозы в бактериальной хромосоме, что приведет к усилению промотора. Может быть произведено изменение последовательности, регулирующей экспрессию гена, например, таким же способом, как замена гена с использованием температур - чувствительной плазмиды, как описано в опубликованной заявке РСТ WO 00/18935 и выложенной патентной заявке Японии 1-215280.
Способы получения плазмидной ДНК включают, но не ограничиваются разрезанием и лигированием ДНК, трансформацией, подбором олигонуклеотидов в качестве праймеров и подобные им способы, или другие способы, хорошо известные специалисту в данной области. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F., and Maniatis, Т., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
Бактерия согласно настоящему изобретению может быть получена путем введения вышеупомянутых ДНК в бактерию, которая уже обладает наследственным признаком - способностью к продукции L-аминокислоты. С другой стороны, бактрия согласно настоящему изобретению может быть получена путем придания способности к продукции L-аминокислоты бактерии, которая уже содержит указанные ДНК.
Бактерии-продуценты L-треонина.
Примерами родительского штамма являются штаммы - продуценты треонина, принадлежащие к роду Escherichia, такие как штамм Е.coli TDH-6/pVIC40 (ВКПМ В-3996) (патенты США 5175107 и 5,705.371), штамм Е.coli NRRL-21593 (патент США 5939307), штамм Е.coli FERM BP-3756 (патент США 5474918), штаммы Е.coli FERM BP-3519 и FERM BP-3520 (патент США 5376538), штамм Е.coli MG442 (Гусятинер и др., Генетика, 14, 947-956 (1978)), штаммы Е.coli VL643 и VL2055 (Европейская патентная заявка ЕР 1149911 А) и подобные им, но не ограничиваются указанными штаммами.
Штамм TDH-6 является дефицитным по гену thrC, способен ассимилировать сахарозу и содержит ген ilvA с мутацией типа "leaky". Указанный штамм содержит мутацию в гене rhtA, которая обуславливает устойчивость к высоким концентрациям треонина и гомосерина. Штамм В-3996 содержит плазмиду pVIC40, которая была получена путем введения в вектор, производный от вектора RSF1010, оперона thrA*ВС, включающего мутантный ген thrA, кодирующий аспартокиназа-гомосериндегидрогеназу I, у которой существенно снижена чувствительность к ингибированию треонином по типу обратной связи. Штамм В-3996 был депонирован 19 ноября 1987 года во Всесоюзном научном центре антибиотиков (РФ, 113105 Москва, Нагатинская ул., 3-А) с инвентарным номером РИА 1867. Указанный штамм также был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 113545 Москва, 1-й Дорожный проезд, 1) с инвентарным номером В-3996.
Предпочтительно, чтобы бактерия согласно настоящему изобретению была далее модифицирована для того, чтобы иметь повышенную экспрессию одного или нескольких следующих генов:
- мутантного гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи;
- гена thrB, кодирующего гомосеринкиназу;
- гена thrC, кодирующего треонинсинтазу;
- гена rhtA, кодирующего предположительно трансмембранный белок;
- гена asd, кодирующего аспартат-β-полуальдегиддегидрогеназу;
- гена aspC, кодирующего аспартатаминотрансферазу (аспартаттрансаминазу).
Нуклеотидная последовательность гена thrA, кодирующего аспартокиназу гомосериндегидрогеназу I из Escherichia coli, представлена в базе данных GenBank в последовательности с инвентарным номером NC_000913.2, gi:49175990 (номера нуклеотидов с 337 по 2799). Ген thrA расположен на хромосоме Е.coli К-12 между генами thrL и thrB. Нуклеотидная последовательность гена thrB, кодирующего гомосеринкиназу из Escherichia coli представлена в базе данных GenBank в последовательности с инвентарным номером NC_000913.2, gi:49175990 (номера нуклеотидов с 2801 по 3733). Ген thrB расположен на хромосоме Е.coli К-12 между генами thrA и thrC. Нуклеотидная последовательность гена thrC, кодирующего треонинсинтазу из Escherichia coli представлена в базе данных GenBank в последовательности с инвентарным номером NC_000913.2, gi:49175990 (номера нклеотидов с 3734 по 5020). Ген thrC расположен на хромосоме Е.coli K-12 между геном thrB и открытой рамкой считывания уааХ. Все три указанных гена функционируют как один треониновый оперон.
Как мутантный ген thrA, кодирующий аспартокиназу гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи, так и гены thrB и thrC могут быть получены в составе оперона из известной плазмиды pVIC40, присутствующей в составе депонированного штамма-продуцента треонина Е.coli ВКПМ В-3996. Плазмида pVIC40 подробно описана в патенте США 5705371.
Ген rhtA расположен на 18 минуте хромосомы Е.coli поблизости от оперона gInHPQ, кодирующего компоненты системы транспорта глутамина. Ген rhtA идентичен ORF1 (ген ybiF, положения с 764 по 1651 в последовательности под номером ААА218541, gi:440181 в базе данных GenBank) и расположен между генами рехВ и ompX. Модуль, экспрессирующий белок, кодируемый ORF1, был обозначен как ген rhtA (rht: resistance to homoserine and threonine - устойчивость к гомосерину и треонину). Также было установлено, что мутация rhtA23 является заменой А на G в положении -1 по отношению к старт-кодону ATG (ABSTRACTS of the 17th International Congress of Biochemistry and Molecular Biology in conjugation with the Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California, August 24-29, 1997, abstract №457, EP 1013765 A).
Ген asd из Е.coli известен (номера нуклеотидов с 3572511 по 3571408 в последовательности с номером NC_000913.1, gi:16131307 в базе данных GenBank) и может быть получен с помощью ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al., Trends Genet., 1989, 5:185) с использованием праймеров, сконструированных на основе нуклеотидной последовательности гена. Ген asd из других микроорганизмов может быть получен подобным образом.
Ген aspC из Е.coli также известен (номера нуклеотидов с 983742 по 984932 в последовательности с номером NC_000913.1, gi:16128895 в базе данных GenBank)H может быть получен с помощью ПЦР. Ген aspC из других микроорганизмов может быть получен подобным образом.
Бактерии-продуценты L-лизина.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-лизина, принадлежащей к роду Escherichia, включают мутантные штаммы, обладающие устойчивостью к аналогам L-лизина. Аналоги L-лизина ингибируют рост бактерий, принадлежащих к роду Escherichia, но это ингибирование полностью или частично снимается, когда в среде присутствует L-лизин. Примеры аналогов L-лизина включают, но не ограничиваются, оксализином, гидроксаматом лизина, S-(2-аминоэтил)-L-цистеином (АЕС), γ-метиллизином, α-хлорокапролактамом и так далее. Мутанты, обладающие устойчивостью к этим аналогам лизина, могут быть получены путем обработки бактерий, принадлежащих к роду Escherichia, традиционными методами мутагенеза. Частные примеры бактериальных штаммов, используемых для получения L-лизина, включают штаммы Escherichia coli АJ11442 (FERM BP-1543, NRRL В-12185; смотри патент США 4346170) и Escherichia coli VL611. В указанных микроорганизмах снято ингибирование аспартокиназы L-лизином по типу обратной связи.
Штамм WC196 может быть использован как пример бактерии-продуцент L-лизина Escherichia coli. Этот бактериальный штамм был получен путем придания АЕС устойчивости штамму W3110, производному от штамма Escherichia coli К-12. Полученный штамм получил название Escherichia coli AJ13069 и был депонирован в Национальном Институте Биологических Наук и Человеческих Технологий, Агентство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry) (в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония - National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan) 6 декабря 1994 года и ему был присвоен инвентарный номер FERM P-14690. Затем, 29 сентября 1995 г. было произведено международное депонирование этого штамма согласно условиям Будапештского Договора, и штамм получил инвентарный номер FERM BP-5252 (смотри патент США 5827698).
Бактерии-продуценты L-гистидина.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-гистидина согласно настоящему изобретению, включают, но не ограничиваются, штаммами, принадлежащими к роду Escherichia, такими как штамм Е.coli 24 (ВКПМ В-5945, RU 2003677); штамм Е.coli 80 (ВКПМ В-7270, RU 2119536); штаммы Е.coli NRRL В-12116-В12121 (патент США 4,388,405); штаммы Е.coli H-9342 (FERM ВР-6675) и Н-9343 (FERM ВР-6676) (патент США 6,344,347); штамм Е.coli Н-9341 (FERM ВР-6674) (Европейский патент 1085087); штамм Е.coli AI80/pFM201 (патент США 6258554) и подобные им.
Бактерии-продуценты L-фенилаланина.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-фенилаланина согласно настоящему изобретению, включают, но не ограничиваются, штаммами, принадлежащими к роду Escherichia, такими как штамм AJ 12739 (tyrA::Tn10, tyrR) (ВКПМ В-8197); штамм HW1089 (АТСС инвентарный номер 55371), содержащий ген pheA34 (патент США 5,354,672); мутантный штамм MWEC101-b (патент Южной Кореи 8903681); штаммы NRRL B-12141, NRRL B-12145, NRRL В-12146 и NRRL В-12147 (патент США 4407952) и подобные им. Также в качестве родительского штамма для последующего повышения в нем активности белка согласно настоящему изобретению могут быть использованы бактерии-продуценты L-фенилаланина, принадлежащие к роду Escherichia, штаммы Е.coli К-12 [W3110 (tyrA)/pPHAB (FERM ВР-3566), Е.coli K-12 [W3110 (tyrA)/pPHAD] (FERM BP-12659), Е.coli K-12 [W3110 (tyrA)/pPHATerm] (FERM BP-12662) и Е.coli K-12 [W3110 (tyrA)/pBR-aroG4, pACMAB], называемый также AJ 12604 (FERM BP-3579) (Европейский патент 488424 B1). Кроме того, могут быть использованы бактерии-продуценты L-фенилаланина, принадлежащие к роду Escherichia с повышенной активностью белка, кодируемого геном yedA или геном yddG (патентные заявки США 2003/0148473 А1 и 2003/0157667 А1).
Бактерии-продуценты L-аргинина.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-аргинина согласно настоящему изобретению, включают, но не ограничиваются, штаммами, принадлежащими к роду Escherichia, такими как мутанты Е.coli, обладающие устойчивостью к α-метилметионину, р-флуорофенилаланину, D-аргинину, аргинингидроксамату, S-(2-аминоэтил)-цистеину, α-метилсерину, β-2-тиенилаланину или сульфагуанидину (выложенная патентная заявка Японии 56-106598); штамм-продуцент L-аргинина, в который введен ген argA, кодирующий N-ацетилглутаматсинтетазу (Европейский патент 1170361 А1); штаммы 237 (ВКПМ В-7925) и 382 (ВКПМ В-7926), описанные в Европейском патенте ЕР 1170358 А1 и подобные им.
Бактерии-продуценты L-глутаминовой кислоты.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-глутаминовой кислоты согласно настоящему изобретению, включают мутантные штаммы, лишенные активности α-кетоглутаратдегидрогеназы или обладающие сниженным уровнем активности α-кетоглутаратдегидрогеназы. Бактерии, принадлежащие к роду Escherichia, лишенные активности α-кетоглутаратдегидрогеназы или обладающие сниженным уровнем активности α-кетоглутаратдегидрогеназы, а также способы их получения описаны в патентах США 5378616 и 5573945. В частности, такие штаммы могут быть представлены следующими штаммами:
E.coli W3110sucA::Kmr
Е.coli AJ12624 (FERM ВР-3853)
Е.coli АJ12628 (FERM BP-3854)
Е.coli АJ12949 (FERM BP-4881)
Штамм Е.coli W3110sucA::Kmr - это штамм, полученный в результате разрушения гена, кодирующего α-кетоглутаратдегидрогеназу (далее называемый "ген sucA") в штамме Е.coli W3110. Активность α-кетоглутаратдегидрогеназы в полученном штамме полностью отсутствует.
Также примеры бактерии-продуцента L-глутаминовой кислоты включают в себя бактерии, принадлежащие к роду Escherichia и обладающие устойчивостью к антиметаболиту - аспарагиновой кислоте. Также такие штаммы могут не иметь активности дегидрогеназы альфа-кетоглутаровой кислоты и включать в себя, например, штамм AF13199 (FERM ВР-5807) (патент США 5.908,768) или штамм FFRM Р-12379, дополнительно обладающий сниженной способностью к деградации L-глутаминовой кислоты (патент США 5393671); штамм Е.coli AJ13138 (FERM BP-5565) (патент США 6110714) и подобные им.
Примеры бактерии-продуцента L-глутаминовой кислоты, принадлежащей к роду Pantoea, включают в себя мутантные штаммы, лишенные активности α-кетоглутаратдегидрогеназы или имеющие сниженную активность α-кетоглутаратдегидрогеназы, и могут быть получены описанным выше способом. Примерами таких штаммов являются штамм Pantoea ananatis АJ13356 (патент США 6331419), штамм Pantoea ananatis AJ13356, депонированный в Национальном Институте Биологических Наук и Человеческих Технологий, Агенство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry) (в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония - National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan) 19 февраля, 1998 и получивший инвентарный номер FERM P-16645. Затем было произведено международное депонирование этого штамма согласно условиям Будапештского Договора от 11 января 1999 г., и штамм получил инвентарный номер FERM BP-6615. Штамм Pantoea ananatis AJ13356 не имеет α-KGDH активности в результате разрушения гена αKGDH-E1 субъединицы (sucA). Вышеупомянутый штамм при выделении был идентифицирован как Enterobacter agglomerans и депонирован как штамм Enterobacter agglomerans AJ13355. Тем не менее, позднее он был классифицирован как Pantoea ananatis на основе нуклеотидной последовательности 16S рРНК и других доказательств (смотри раздел Примеры). Несмотря на то, что оба штамма - AJ13355 и полученный из него штамм AJ13356 были депонированы в указанный выше депозитарий как Enterobacter agglomerans, для целей данного описания они будут упоминаться как Pantoea ananatis.
Получение L-аминокислот.
Оксалоацетат (ОАА) служит субстратом для реакций, являющихся частью путей биосинтеза Thr и Lys. ОАА образуется из фосфоенолпирувата (PEP) с фосфоенолпируваткарбоксилазой (РЕРС) в качестве катализатора. Следовательно, повышение концентрации РЕРС в клетке может оказаться очень существенной для ферментативного получения этих аминокислот. В случае использования глюкозы в качестве источника углерода для ферментации, глюкоза поступает внутрь клетки благодаря глюкозо-фосфотрансферазной (Glc-PTS) системе. Эта система потребляет PEP, белки PTS системы кодируются генами ptsG и ptsHIcrr. В процессе усвоения глюкозы из одной молекулы глюкозы образуются одна молекула PEP и одна молекула пирувата (Pyr).
Штамм-продуцент L-треонина и штамм-продуцент L-лизина, которые были модифицированы таким образом, что стали способны утилизировать сахарозу (Scr-PTS), обладали повышенной продуктивностью указанных аминокислот, при культивировании на сахарозе, по сравнению с глюкозой (Европейский патент 1149911 А2). Считается, что с помощью Scr-PTS из одной молекулы сахарозы образуются три молекулы PEP и одна молекула Pyr, повышая тем самым соотношение РЕР/Pyr и облегчая таким образом синтез Thr и Lys из сахарозы. Кроме того, сообщалось, что экспрессия генов системы Glc-PTS подвержена регуляции (Postma P.W. et al., Microbiol Rev., 57(3), 543-94 (1993); Clark В. et al. J. Gen. Microbiol., 96(2), 191-201 (1976); Plumbridge J., Curr, Opin. Microbiol., 5(2), 187-93 (2002); Ryu S. et al., J. Biol. Chem., 270(6):2489-96 (1995)) и таким образом, возможно, что само по себе усвоение глюкозы может быть лимитирующим скорость фактором в ферментативном получении аминокислот.
Еще большее повышение соотношения РЕР/Pyr за счет усиления экспрессии гена xylE в штамме-продуценте треонина, в штамме-продуценте лизина, в штамме-продуценте гистидина, в штамме-продуценте фенилаланина и/или в штамме-продуценте глутаминовой кислоты должно повысить продукцию аминокислоты. Поскольку из двух молекул глюкозы образуется четыре молекулы PEP, ожидается, что соотношение РЕР/Pyr значительно повысится. Благодаря повышенной экспрессии гена xylE ожидается снятие экспрессионного контроля glc-PTS.
Способ получения L-аминокислоты согласно настоящему изобретению включает в себя этапы выращивания бактерии согласно настоящему изобретению в ферментационной среде, что позволяет L-аминокислоте накапливаться в культуральной жидкости, и выделения L-аминокислоты из культуральной жидкости. Далее, способ согласно настоящему изобретению включает способы получения L-треонина, L-лизина, L-гистидина, L-фенилаланина, L-аргинина или L-глутаминовой кислоты, включая этапы выращивания бактерии согласно настоящему изобретению в ферментационной среде, что позволяет L-треонину, L-лизину, L-гистидину, L-фенилаланину, L-аргинину или L-глутаминовой кислоте накапливаться в культуральной жидкости, и выделения L-треонина, L-лизина, L-гистидина, L-фенилаланина, L-аргинина или L-глутаминовой кислоты из культуральной жидкости.
Согласно настоящему изобретению выращивание, выделение и очистка L-аминокислот из культуральной жидкости могут быть осуществлены традиционными методами ферментации, в которых L-аминокислоту получают путем ферментации микроорганизма.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. К источникам углерода относятся различные углеводы, такие как глюкоза, сахароза и ксилоза, а также различные органические кислоты. В зависимости от характера ассимиляции используемого микроорганизма, могут использоваться спирты, такие как этанол и глицерин. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин и дрожжевой экстракт. Дополнительные питательные вещества могут быть при необходимости добавлены в среду. Например, если микроорганизму для роста требуется L-аминокислота (ауксотрофность по L-аминокислоте), необходимое количество указанной L-аминокислоты может быть добавлено в ферментационную среду.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-треонин может быть выделен и очищен методами ионообменной хроматографии, концентрирования и кристаллизации.
Примеры
Настоящее изобретение будет более детально описано ниже со ссылкой на следующие примеры, не ограничивающие область его применения.
Пример 1: Замена природной промоторной области гена xylE в Е.coli на гибридный промотор РL-tac.
Для замены природной промоторной области гена xylE в эту промоторную область хромосомы штамма Е.coli MG1655 (АТСС 700926) интегрировали фрагмент ДНК, содержащий гибридный промотор РL-tac и маркер устойчивости к хлорамфениколу (CmR), кодируемый геном cat, с помощью способа, описанного у Datsenko K.A. и Wanner B.L. (Proc. Natl. Acad. Sci. USA, 2000, 97, 6640-6645), также известного как "Red-зависимая интеграция" и/или "Red-направленная интеграция". Рекомбинантная плазмида pKD46 (Datsenko, K.A., Wanner, B.L., Proc. Natl. Acad. Sci. USA, 2000, 97, 6640-6645) с термочувствительным репликоном использовалась как донор генов, полученных из фага λ, ответственных за Red-зависимую систему рекомбинации. Штамм Escherichia coli BW25113, содержащий рекомбинантную плазмиду pKD46, может быть получен из Е.coli Genetic Stock Center, Yale University, New Haven, USA, инвентарный номер CGSC7630.
Гибридный промотор PL-tac был синтезирован химическим способом. Нуклеотидная последовательность заменяемого промотора представлена в Списке последовательностей под номером 3 (SEQ ID NO:3). Синтезированный фрагмент ДНК содержит гибридный промотор PL-tac, в свою очередь содержащий в 5'-конце сайт узнавания рестриктазы BglII, необходимый для дальнейшего присоединения гена cat и 36 нуклеотидов, гомологичных 5'-концу гена xylE, введенных для дальнейшей интеграции фрагмента в бактериальную хромосому.
Фрагмент ДНК, содержащий маркер CmR, кодируемый геном cat, был получен с помощью ПЦР, с использованием в качестве матрицы коммерчески доступной плазмиды pACYC184 (GenBank/EMBL инвентарный номер Х06403, "Fermentas", Литва), и праймеров PI (SEQ ID NO:4) и Р2 (SEQ ID NO:5). Праймер P1 содержит в 5'-конце сайт узнавания рестриктазы BglII, необходимый для дальнейшего присоединения гибридного промотора РL-tac, а праймер Р2 содержит в 5'-конце 36 нуклеотидов, гомологичных области хромосомы, расположенной за 217 п.о. до старт кодона гена xylE, введенных в праймер для дальнейшей интеграции полученного фрагмента в бактериальную хромосому.
ПЦР проводили с использованием амплификатора "TermoHybaid PCR Express". Реакционная смесь (общий объем - 50 мкл) состояла из 5 мкл 10×ПЦР-буфера с 15 мМ MgCl2 ("Fermentas", Литва), 200 мкМ каждой из dNTP, 25 пМ каждого из используемых праймеров и 1 ед. Taq-полимеразы ("Fermentas", Литва). Примерно 5 нг плазмидной ДНК добавляли в реакционную смесь в качестве матрицы для ПЦР. Использовали следующий температурный профиль: начальная денатурация ДНК при 95°С в течение 5 мин, затем 25 циклов денатурации при 95°С в течение 30 с, отжиг при 55°С в течение 30 с, наращивание цепи при 72°С в течение 30 с и финальная достройка цепи при +72°С в течение 7 мин. Далее, амплифицированный фрагмент ДНК концентрировали с помощью электрофореза в агарозном геле и очищали с использованием колонок "GenElute Spin Columns" ("Sigma", USA) и переосаживали этанолом.
Оба описанных выше фрагмента ДНК были обработаны BglII и лигированы. Продукт лигирования был амплифицирован с помощью ПЦР, для этого испльзовались праймеры Р2 (SEQ ID NO:5) и Р3 (SEQ ID NO:6). Праймер Р3 содержит содержит в 5'-конце 36 нуклеотидов, гомологичных 5'-концу гена xylE, введенных в праймер для дальнейшей интеграции полученного фрагмента в бактериальную хромосому.
Амплифицированный фрагмент ДНК концентрировали с помощью электрофореза в агарозном геле, очищали с использованием колонок "GenElute Spin Columns" ("Sigma", USA) и переосаживали этанолом. Полученный фрагмент ДНК использовали для электропорации и Red-зависимой интеграции в бактериальную хромосому штамма E.coli MG1655/pKD46.
Клетки штамма MG1655/pKD46 выращивали ночь при 30°С в жидкой среде LB с добавлением ампициллина (100 мкг/мл), затем разбавляли средой SOB в соотношении 1:100 (Дрожжевой экстракт, 5 г/л; NaCl, 0.5 г/л; триптон, 20 г/л; KCl, 2.5 мМ; MgCl2, 10 мМ) с добавлением ампициллина (100 мкг/мл) и L-арабинозы (10 мМ) (арабиноза используется для индукции плазмиды, содержащей гены Red-системы) и выращивались при 30°С до достижения оптической плотности бактериальной культуры OD600=0.4-0.7. Клетки из 10 мл подращенной бактериальной культуры отмывали 3 раза ледяной деионизированной водой, с последующим ресуспендированием клеток в 100 мкл воды. 10 мкл фрагмента ДНК (100 нг) растворили в деионизированной воде и добавили к суспензии клеток. Электропорация проводилась на электропораторе "Bio-Rad" (США) (№165-2098, версия 2-89) в соответствии с инструкциями производителя. Парированные клетки были помещены в 1-мл среды SOC (Sambrook et al., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)), инкубировались в течение 2 часов при 37°С и затем высевались на чашки с L-агаром, содержащие 25 мкг/мл хлорамфеникола. Колонии, выросшие за 24 часа, были проверены на наличие CmR маркера вместо природной промоторной области гена xylE с помощью ПНР с использованием праймеров Р4 (SEQ ID NO:7) и Р5 (SEQ ID NO:8). Для этой цели свежевыращенные колонии были ресуспендированы в 20 мкл воды, после чего 1 мкл полученной суспензии использовался для ПЦР. Использовали следующий температурный профиль: начальная денатурация ДНК при 95°С в течение 10 мин, затем 30 циклов денатурации при 95°С в течение 30 с, отжиг при 55°С в течение 30 с, наращивание цепи при 72°С в течение 1 мин и финальная достройка цепи при +72°С в течение 7 мин. Несколько протестированных CmR колоний, содержащих искомый фрагмент ДНК размером ˜2000 п.о., вместо природной промоторной области гена xylE размером 192 п.о. (смотри фиг.1). Один из полученных штаммов был излечен от температурочувствительной плазмиды pKD46 путем выращивания при 37°С, полученный штамм был назван Е.coli МG1655РL-tacxylE.
Пример 2. Влияние усиления экспрессии гена xylE на рост штамма Е.coli с нарушенной PTS системой транспорта.
Для того чтобы продемонстрировать эффект влияния усиления экспрессии гена xylE на рост штамма Е.coli, был сконструирован штамм Е.coli с нарушенной PTS системой транспорта.
Для этой цели фрагмент ДНК, содержащий маркер устойчивости к канамицину (KmR), был интегрирован в хромосому штамма Е.coli MG1655/pKD46 вместо оперона ptsHI-crr методом, описанным у Datsenko К.А. и Wanner B.L. (Proc. Natl. Acad. Sci. USA, 2000, 97, 6640-6645), также известного как "Red-зависимая интеграция" и/или "Red-направленная интеграция", также описанным в Примере 1.
Оперон ptsHI-crr является известным (номера нуклеотидов с 2531786 по 2532043, с 2532088 по 2533815 и с 2533856 по 2534365 для генов ptsH, ptsI и err соответственно, в базе данных GenBank, последовательность с инвентарным номером NC_000913.2, gi:49175990). Оперон ptsHI-crr расположен между генами cysK и pdxK в хромосоме штамма Е.coli K-12.
Фрагмент ДНК, содержащий ген KmR, был получен с помощью ПЦР с использованием в качестве матрицы коммерчески доступной плазмиды pUC4KAN (GenBank/EMBL инвентарный номер Х06404, "Fermentas", Литва) и праймеров Р6 (SEQ ID NO:9) и Р7 (SEQ ID NO:10). Праймер Р6 содержит 36 нуклеотидов, гомологичных 5'-концу гена ptsH, а праймер Р7 содержит 36 нуклеотидов, гомологичных 3'-концу гена err. Эти последовательности были введены в праймеры Р6 и Р7 для дальнейшей интеграции в бактериальную хромосому.
Методика проведения ПЦР описана в Примере 1.
Далее, амплифицированный фрагмент ДНК концентрировали с помощью электрофореза в агарозном геле, очищали с использованием колонок "GenElute Spin Columns" ("Sigma", USA) и переосаживали этанолом. Полученный фрагмент ДНК был использован для электропорации и Red-зависимой интеграции в бактериальную хромосому штамма Е.coli MG1655/pKD46, аналогично тому, как описано в Примере 1, за исключением того, что клетки после электропорации высевались на чашки с L-агаром, содержащим 50 мкг/мл канамицина.
Колонии, выращенные в течение 24 часов, были протестированы на предмет наличия маркера KmR вместо оперона ptsHI-crr, с помощью ПЦР с использованием праймеров Р8 (SEQ ID NO:11) и Р9 (SEQ ID NO:12). Для этой цели свежевыращенные колонии были ресуспендированы в 20 мкл воды, после чего 1 мкл полученной суспензии использовался для ПЦР. Условия ПЦР были аналогичны описанным в Примере 1. Несколько протестированных KmR колоний содержали искомый фрагмент ДНК размером ˜1300 п.о., что подтвердило замену оперона ptsHI-crr на ген KmR. Один из полученных штаммов был излечен от температурочувствительной плазмиды pKD46 путем выращивания при 37°С, полученный штамм был назван Е.coli MG1655 ΔptsHI-crr.
Далее, фрагмент ДНК из хромосомы вышеупомянутого штамма Е.coli MG1655PL-tacxylE был перенесен в штамм Е.coli MG1655 ΔptsHI-crr by P1 трансдукцией (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY), в результате чего был получен штамм MG1655 ΔptsHI-crr РL-tacxylE.
У четырех штаммов Е.coli MG1655, MG1655 ΔptsHI-crr и MG1655 ΔptsHI-crr PL-tacxylE проверили способность к росту на минимальной среде Adams с глюкозой (4%) в качестве источника углерода. Как видно из фиг.2, штамм Е.coli MG1655 ΔptsHI-crr плохо растет на минимальной среде Adams, содержащей глюкозу, (μ˜0.06). Усиление экспрессии гена xylE значительно улучшает ростовые характеристики штаммов-реципиентов на минимальной среде Adams с глюкозой.
Пример 3. Эффект влияния усиления экспрессии гена xylE на продукцию треонина.
Для выявления эффекта влияния усиления экспрессии гена xylE под контролем промотора РL-tac на продукцию треонина, фрагменты ДНК из хромосомы описанного выше штамма Е.coli МG1655РL-tacxylE были перенесены в штамм-продуцент треонина Е.coli ВКПМ В-3996 Р1 трансдукцией (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY)). Штамм ВКПМ В-3996 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 117545 Москва, 1-й Дорожный проезд, 1) 7 апреля 1987 г. под номером В-3996.
Оба штамма Е.coli В-3996 и В-3996 РL-tacxylE выращивались в течение 18-24 часов при 37°С на чашки с L-агаром. Для получения посевной культуры штамм выращивался в пробирках 20×200 мм, содержащих 2 мл L-бульона с 4% сахарозы на роторной качалке (250 об/мин) при 32°С в течение 18 часов. Далее, посевной материал 0.21 мл (10%) внесли в ферментационную среду. Ферментацию проводили в пробирках 20×200 мм с 2 мл минимальной ферментационной среды. Клетки выращивались в течение 48 часов при 32°С с использованием шейкера со скоростью вращения 250 об/мин.
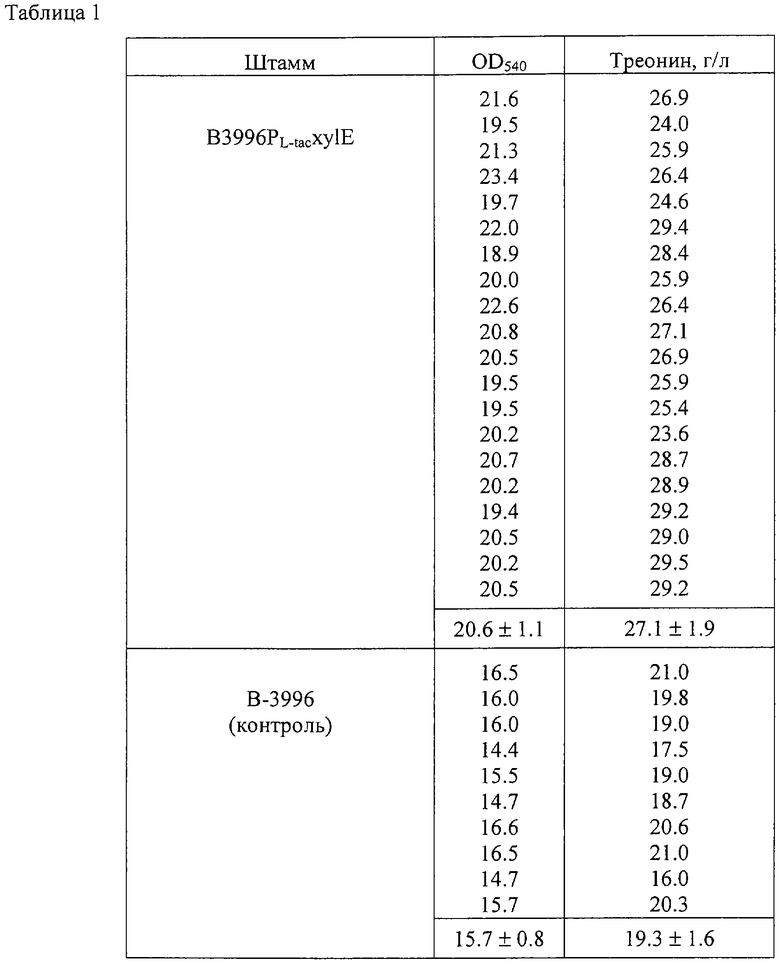
После культивирования накопленное в среде количество L-треонина определялось с помощью бумажной хроматографии. Использовался следующий состав жидкой фазы: бутанол : уксусная кислота : вода = 4:1:1 (v/v). Для визуализации использовали раствор нингидрина в ацетоне (2%). Пятна с L-треонином вырезали, L-треонин элюировали в 0.5% водном растворе CdCl2, и количество L-треонина измеряли с помощью спектрофотометра при 540 нм. Результаты представлены в Таблице 1. Продукция треонина увеличилась за счет введения промотора PL-tacxylE.
Использовали следующий состав ферментационной среды (г/л):
Сахарозу и сульфат магния стерилизовали отдельно. СаСО3 стерилизовали сухим жаром при 180°С в течение 2 ч, рН доводили до 7.0. Антибиотики добавляли в среду после стерилизации.
Пример 4. Эффект влияния усиления экспрессии гена xylE на продукцию L-лизина.
Полная нуклеотидная последовательность хромосомной ДНК штамма Е.coli W3110 известна (Science, 277, 1453-1474 (1997)). На основе опубликованной нуклеотидной последовательности были синтезированы праймеры и ген xylE был амплифицирован с помощью ПЦР, как описано ниже.
Хромосомная ДНК была получена традиционным способом (Sambrook, J., Fritsch E.F. and Maniatis Т. (1989): Molecular Cloning: A laboratory manual, 2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.). Праймер 10 (SEQ ID NO:13) был создан как последовательность нуклеотидов 7479-7508 в последовательности с инвентарным номером АЕ000476, в 5'-конец которой был введен сайт узнавания рестриктазы EcoRI, и праймер 11 (SEQ ID NO:14) был создан как последовательность, комплементарная последовательности нуклеотидов 8963-8992, в последовательности с инвентарным номером АЕ000476, в 5'-конец которой был введен сайт узнавания рестриктазы Sail. Эти праймеры были использованы для амплификации гена xylE в стандартных условиях, как описано в "PCR protocols. Current methods and applications" (White, B.A., ed., Humana Press, Totowa, New Jersey, 1993).
ПЦР продукт был очищен традиционным способом. Полученный фрагмент был обработан рестриктазами SalI и EcoRI, и с использованием набора для лигирования, клонирован в вектор pSTV29, предварительно обработанный теми же рестриктазами.
Компетентые клетки штамма Е.coli JM109 были трансформированы продуктом лигирования (Sambrook, J., Fritsch E.F. and Maniatis T. (1989) Molecular Cloning: A laboratory manual, 2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.), после чего клетки были высеяны на чашки с L-агаром (Bacto-триптон: 10 г/л, дрожжевой экстракт: 5 г/л, NaCl: 5 г/л, агар: 15 г/л, рН 7.0), содержащие 10 мкг/мл IPTG (изопропил-β-D-тиогалактопиранозид), 40 мкг/мл X-Gal (5-бромо-4-хлоро-3-индолил-β-D-галактозид) и 50 мкг/мл хлорамфеникола, и выращивались ночь. Возникшие белые колонии стерильно пересеяли, таким образом были получены трансформанты. Плазмиды из трансформантов выделяли с помощью щелочной экстракции, таким образом была получена плазмида pSTV29-xylE, в которой ген xylE помещен под lac промотор.
Штамм Е.coli WC196 использовали в качестве примера штамма-продуцента L-лизина, принадлежащего к роду Escherichia.
WC196 трансформировали либо плазмидой pSTV29-xylE или вектором pSTV29, в результате чего были получены штаммы WC196/pSTV29-xylE и WC196/pSTV29. Каждый из этих штаммов выращивался в L-среде, содержащей 50 мг/л хлорамфеникола, при 37°С до достижения значения оптической плотности OD около 0.6 при длине волны 600 нм. Затем равные объемы 40% раствора глицерола были добавлены к культуре клеток, после чего эту смесь помещали в определенный объем и хранили при -80°С. Эта смесь называлась "глицериновый музей".
Для оценки эффекта влияния повышения активности ксилозопермеазы на продукцию L-лизина штамм WC196 трансформировали плазмидами pSTV29-xylE и pCABD2 в соответствии с описанной выше методикой. pCABD2 - это плазмида, содержащая ген dapA, кодирующий мутантную дигидропиколинатсинтазу, не ингибирующуюся L-лизином по типу обратной связи, ген lysC, кодирующий мутантную аспартокиназу III, не ингибирующуюся L-лизином по типу обратной связи, ген dapB, кодирующий дигидропиколинатредуктазу, и ген ddh, кодирующий диаминопимелатдегидрогеназу (патент США 6040160). Для контроля штамм WC196 был трансформирован плазмидами pSTV29 и pCABD2. Каждый из полученных трансформантов культивировался в L-среде, содержащей 50 мг/л хлорамфеникола и 20 мг/л стрептомицина, при 37°С до достижения значения оптической плотности OD около 0.6 при длине волны 600 нм. Затем равные объемы 40% раствора глицерола были добавлены к культуре клеток, после чего эту смесь помещали в определенный объем и хранили при -80°C.
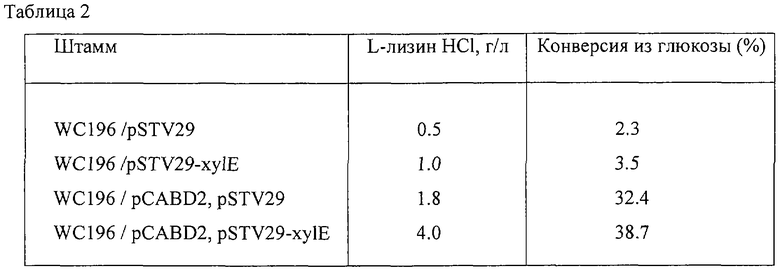
Глицериновый музей штаммов WC196/pSTV29-xylE и WC196/pSTV29 растопили и по 100 мкл из каждого образца равномерно рассеяли на чашках с L-агаром, содержащих 50 мг/л хлорамфеникола, и выращивали при 37°С в течение 24 часов. Кроме того, каждый из штаммов WC196/(pCABD2, pSTV29-xylE) и WC196/(pCABD2, pSTV29) равномерно посеяли на чашки с L-агаром, содержащие 50 мг/л хлорамфеникола и 20 мг/л стрептомицина, и выращивали при 37°С в течение 24 часов. Примерно 1/8 количества клеток на чашке внесли в 20 мл ферментационной среды, содержащей необходимые добавки, в колбе объемом 500 мл. Выращивание производилось при 37°С в течение 16 часов с использованием обратно-поступательного шейкера со скоростью вращения 115 об/мин. После выращивания количество накопленного в среде L-лизина и остаточной глюкозы измеряли известными методами (анализатор Biotech-analyzer AS210, производитель Sakura Seiki Co.). После этого рассчитывали выход L-лизина по отношению к использованной глюкозе для каждого из штаммов.
Использовали следующий состав ферментационной среды (г/л):
рН доводили до 7,0 с помощью КОН и среду автоклавировали при 115°С в течение 10 мин. Глюкозу и MgSO4×7H2O стерилизовали отдельно. Также добавляли 30 г/л СаСО3, который стерилизовали сухим жаром при 180°С в течение 2 часов.
Результаты приведены в Таблице 2. Штамм WC196/pSTV29-xylE накапливает большее количество L-лизина по сравнению со штаммом WC196/pSTV29, в котором экспрессионное количество гена ксилозопермеазы не увеличено. Кроме того, было отмечено, что повышение активности ксилозопермеазы положительно влияет на накопление и выход L-лизина и в штамме WC196/pCABD2, у которого выход L-лизина повысился.
Пример 5. Эффект влияния усиления экспрессии гена xylE на продукцию L-аргинина.
Для выявления эффекта влияния усиления экспрессии гена xylE под контролем промотора PL-tac на продукцию аргинина, фрагменты ДНК из хромосомы описанного выше штамма Е.coli MG1655PL-tacxylE были перенесены в штамм-продуцент аргинина Е.coli 382 P1 трансдукцией (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY). Штамм 382 был депонирован в Всероссийскую Национальную Коллекцию Промышленных Микроорганизмов (ВКПМ) (Россия, 117545 Москва, 1-й Дорожный проезд, 1) 10 апреля 2000 г. с инвентарным номером ВКПМ В-7926.
Полученный штамм 382 PL-tacxylE и родительский штамм 382 культивировали при 32°С в течение 18 часов в 2 мл питательного бульона LB и 0.3 мл полученной культуры вносили в пробирки 20×200 мм с 2 мл ферментационной среды и культивировали при 32°С в течение 48 часов на роторной качалке.
После культивирования накопленное в среде количество L-аргинина определялось с помощью бумажной хроматографии. Использовался следующий состав жидкой фазы: бутанол : уксусная кислота : вода = 4:1:1 (v/v). Для визуализации использовали раствор нингидрина в ацетоне (2%). Пятна с L-аргинином вырезали, L-аргинин элюировали в 0,5% водном растворе CdCl2 и количество L-аргинина измеряли с помощью спектрофотометра при длине волны в 540 нм.
Использовали следующий состав ферментационной среды (г/л):
Глюкозу и сульфат магния стерилизовали отдельно. СаСО3 стерилизовали сухим жаром при 180°С в течение 2 ч, рН доводили до 7.0.
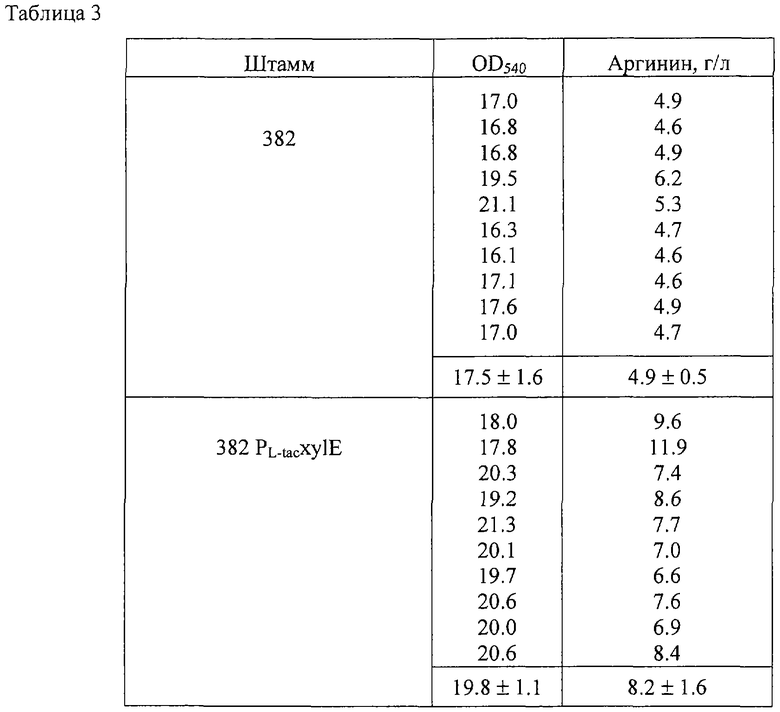
Результаты 10 независимых экспериментов представлены в Таблице 3.
Как видно из Таблицы 3, штамм 382 РL-tacxylE накапливает большее количество L-аргинина по сравнению со штаммом 382, в котором экспрессионное количество пермеазы D-ксилозы не увеличено.
Пример 6: Продукция L-гистидина с помощью бактерии - продуцента L-гистидина путем ферментации смеси глюкозы и ксилозы.
Штамм Е.coli 80 - продуцент L-гистидина использовали для продукции L-гистидина путем ферментации смеси глюкозы и ксилозы. Штамм Е.coli 80 (ВКПМ В-7270) детально описан в патенте РФ №2119536.
Для проверки эффекта усиления экспрессии гена xylE, находящегося под контролем промотора РL-tac, на продукцию гистидина, фрагмент ДНК их хромосомы вышеописанного штамма Е.coli МG1655РL-tacxylE переносили в штамм Е.coli 80 - продуцент гистидина методом Р1 трансдукции (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY). Трансформацию штамма 80 и полученного штамма 80 PL-tacxylE плазмидой pMW119mod-xylA-R проводили стандартным методом с получением штаммов 80/pMW119mod-xylA-R и 80 PL-tacxylE/pMW119mod-xylA-R. Клонирование локуса xylABFGHR из хромосомы штамма Е.coli MG1655 описано в Российской патентной заявке №2005106720.
Для получения посевной культуры оба штамма 80/pMW119mod-xylA-R и 80 PL-tacxylE/pMW119mod-xylA-R выращивали на роторной мешалке (250 об/мин) при 27°С в течение 6 часов в 40 мл пробирках (⊘ 18 мм), содержащих 2 мл L-бульона с 1 г/л стрептомицина и 100 мг/л ампициллина. Затем 2 мл (5%) посевного материала переносили в питательную среду для ферментации. Ферментацию проводили на роторной качалке (250 об/мин) при 27°С в течение 50 часов в 40 мл пробирках, содержащих 2 мл питательной среды для ферментации.
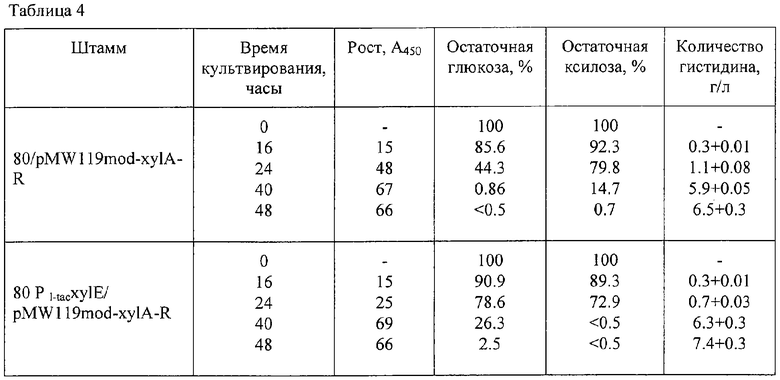
После выращивания количество накопленного в культуральной жидкости L-гистидина определяли с помощью бумажной хроматографии. Состав подвижной фазы был следующий: бутанол : ацетат : вода = 4:1:1 (v/v). Раствор нингидрина в ацетоне (0,5%) в качестве визуализирующего. Результаты представлены в Таблице 4.
Состав питательной среды для ферментации (г/л):
Углеводы (глюкоза, ксилоза), L-пролин, бетаин и сульфат магния стерилизовали отдельно. СаСО3 стерилизовали нагреванием до 110°С в течение 30 минут. рН среды поддерживали при 6,0 добавлением КОН после стерилизации.
Как видно из Таблицы 4, штамм 80 PL-tacxylE/pMW119mod-xylA-R накапливал большее количество L-гистидина в среде, содержащей смесь глюкозы и ксилозы, по сравнению со штаммом 80/pMW119mod-xylA-R, в котором экспрессия пермеазы D-ксилозы не была усилена.
Хотя указанное изобретение описано в деталях со ссылкой на конкретные Примеры, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Каждый из вышеупомянутых в описании документов является частью указанного описания во всей его полноте.










| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA | 2005 |
|
RU2311454C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-треонина С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2006 |
|
RU2351646C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ МЕТОДОМ ФЕРМЕНТАЦИИ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ОБЛАДАЮЩИХ ПОВЫШЕННОЙ ЭКСПРЕССИЕЙ ГЕНОВ УТИЛИЗАЦИИ КСИЛОЗЫ | 2005 |
|
RU2283346C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН lrhA | 2006 |
|
RU2337956C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН dicB | 2005 |
|
RU2315099C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН hipA | 2005 |
|
RU2320718C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН mazEF | 2005 |
|
RU2313573C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН dinJ-yafQ | 2005 |
|
RU2314343C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН relBE | 2005 |
|
RU2313574C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН ltaE | 2005 |
|
RU2304166C2 |
Изобретение относится к биотехнологии и представляет собой способ получения L-аминокислот, таких как L-треонин, L-лизин, L-гистидин, L-фенилаланин, L-аргинин или L-глутаминовая кислота, с использованием бактерии рода Escherichia, причем бактерия модифицирована таким образом, что активность пермеазы D-ксилозы в указанной бактерии повышена. Изобретение позволяет получать L-аминокислоты с высокой степенью эффективности. 2 н. и 23 з.п. ф-лы, 2 ил, 4 табл.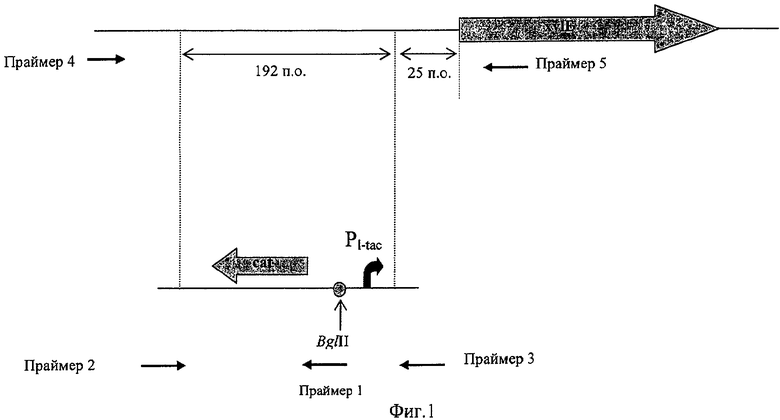
(A) белка, включающего аминокислотную последовательность под номером SEQ ID NO:2; и
(B) варианта белка с аминокислотной последовательностью под номером SEQ ID NO:2,
(a) ДНК, включающей нуклеотидную последовательность с нуклеотида 1 по нуклеотид 1476 в последовательности SEQ ID NO:1; и
(b) ДНК, которая гибридизуется с нуклеотидной последовательностью с нуклеотида 1 по нуклеотид 1476 в последовательности SEQ ID NO:1, или с зондом, который может быть приготовлен на основе указанной нуклеотидной последовательности в жестких условиях, и кодирует белок, обладающий активностью пермеазы D-ксилозы.
мутантного гена thrA, кодирующего аспартокиназу гомосериндегидрогеназу I и устойчивого к ингибированию треонином по принципу обратной связи;
гена thrB, кодирующего гомосеринкиназу;
гена thrC, кодирующего треонинсинтазу;
гена rhtA, кодирующего гипотетический трансмембранный белок; и
любой комбинации указанных генов.
| US 5661012, 26.08.1997 | |||
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ МЕТОДОМ ФЕРМЕНТАЦИИ, ШТАММ БАКТЕРИИ ESCHERICHIA COLI - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 1999 |
|
RU2207376C2 |
Авторы
Даты
2007-08-20—Публикация
2005-10-12—Подача