Изобретение относится к медицине, а именно к травматологии и ортопедии, и может быть использовано для лечения ложных суставов длинных трубчатых костей различных локализаций.
Принятое в анатомии деление костей на трубчатые, губчатые, плоские, воздухоносные и смешанные основано не только на их внешней форме, но и их внутренней структуре. Трубчатые кости обладают хорошо выраженным компактным веществом в их диафизах, окружающим костномозговое пространство, и губчатым веществом, окруженным более тонкой каемкой компактной же кости, а также имеют суставные поверхности для сочленения с соседними костями.
Костномозговая полость имеется в собственно диафизе, где она ограничена в одних случаях совершенно гладкой эндостальной поверхностью коркового слоя, в других - довольно неровной его поверхностью из-за наличия костных перекладин и гребешков, выступающих с этой поверхности в просвет костномозгового пространства. Трубчатые кости (большие кости): большеберцовая, бедренная, плечевая, лучевая, локтевая, сложны в лечении переломов. Отчасти это связано с анатомическими особенностями их кровоснабжения.
Сложный биологический процесс консолидации перелома протекает под влиянием многих факторов. Факторов местных: своевременность и качество репозиции, адекватная иммобилизация как при консервативном, так и при оперативном лечении, степень повреждения - объем разрушения костной ткани и внутрикостного кровотока, разрушение окружающих мягких тканей, и общих факторов: алиментарных, эндокринных, неврогенных и др. Образование костной мозоли связано с жизнедеятельностью кости как единого целого. Костная мозоль (регенеративное костное образование) формируется одновременно от камбиального глубокого слоя периоста, от сосудов и стромы костного мозга, от эндоста и гаверсовых каналов коркового вещества.
Иногда процесс регенерации протекает с нарушениями. Так переломы с замедленной консолидацией в дальнейшем переходят в ложный сустав (псевдоартроз), сопровождающийся стойкой патологической подвижностью и нарушением опороспособности конечности. Ложный сустав может образоваться после закрытой, открытой и огнестрельной травмы.
Задача лечения сводится к получению непрерывности кости, восстановлению ее как органа, прочная скелетная структура которой необходима для нормальной функции конечности. Наиболее важным моментом при этом является создание условий для регенеративной деятельности самой костной ткани за счет своих камбиальных элементов, а не простое механическое скрепление костных обломков. Внесенные дополнительно трансплантаты часто являются матрицей для костеобразования.
Способы лечения ложных суставов совершенствовались по следующим направлениям: свободная костная пластика, микрокомпрессия-микродистракция в аппаратах внешней фиксации, использование кровоснабжаемых трансплантатов (васкуляризованного или реваскуляризованного), использование клеточных технологий. При использовании аутотрансплантатов для свободной костной пластики нельзя избежать фазы частичной резорбции трансплантата перед тем, как в него начнет врастать новобразованная костная ткань. Определенным преимуществом обладают деминерализованные костные трансплантаты, при которых фаза резорбции сведена к минимуму за счет предварительной обработки и доказаны их остеоиндуктивные свойства.
1. Известен способ костной аллопластики ложных суставов с использованием цельного деминерализованного костного матрикса, заключающийся в экономной резекции патологического участка кости со вскрытием костномозгового канала, пластике цельным пластинчатым деминерализованным костным матриксом, помещенным в выполненный паз, стабилизацией в аппарате внешней фиксации (Болтрукевич С.И., Калугин А.В., Иванцов В.А. Аллопластика деминерализованным костным матриксом осложненных переломов костей конечностей. // Деминерализованные костные трансплантаты и их использование в восстановительной хирургии / Сборник научных работ. - СПб, 1996. - с.121-123). Недостатками способа является следующее: замещение деминерализованного матрикса новообразованной костью происходит за счет прорастания ее со стороны костных фрагментов; этот процесс в значительной мере зависит от выраженности процессов склероза в костной ткани и может протекать длительно.
2. Известен способ лечения ложных суставов путем инъекционного введения в область ложного сустава клеточного эмбрионального ксенотрансплантата с сохранением иммобилизации гипсовой повязкой, аппаратом внешней фиксации или интрамедуллярной фиксации (Белоусов В.Д., Чобану А.А., Чобану Ф.И. Консервативное лечение ложных суставов длинных трубчатых костей (клинические аспекты клеточной ксеноблефопластики). - Кишинев: «ШТИИНЦА», 1990. - 231 с.). Основными недостатками метода являются возможные аллергические реакции, отторжение ксеноматериала, опасность опухолевой трансформации.
3. Известен способ лечения ложных суставов с помощью костномиелоидного трансплантата, состоящего из деминерализованного матрикса и аллогенной кости, пропитанных культивированными в течение нескольких недель клетками аутологичного костного мозга. Способ предложен в 1986 году А.Я.Фридейнштейном (Сирый О.М. Аутотрансплантация костного мозга при повреждениях костной ткани: Автореф. дис. канд. мед. наук. - М., 1987. - С.3). В литературе нет четких данных о результатах клинического применения этого способа при лечении ложных суставов. Недостатком данного способа является следующее: культуры клеток костного мозга на этих сроках культивирования содержат относительно малое количество мезенхимальных стволовых клеток, обладающих остеогенным потенциалом.
4. В клинической практике известно использование введения в область ложного сустава аутологичных мезенхимных стволовых клеток (МСК), выделенных из костного мозга пациента. Клетки вводили инъекционно, сращение было достигнуто (Колосов Н.Г., Селедцов В.И., Гольник В.Н., Белогородцев С.Н., Величко А.Я., Шивцова О.А. Стволовые клетки в травматологии и хирургии // Современные методы лечения больных с травмами и их осложнениями / материалы всероссийской научно-практической конференции. - Курган, 2006 г., с.207-209). Недостатком метода является то, что мезенхимные стволовые клетки для дальнейшей дифференцировки в остеобласты нуждаются в наличии поверхности, обладающей высокоадгезивными свойствами, и в среде для осмотического питания. Среда отсутствует в рубцово-измененных тканях ложного сустава, и большая часть клеток будет погибать или мигрировать за пределы этой области.
Целесообразно совмещение клеточных технологий с методами свободной костной пластики, используя клеточный материал в зависимости от выбранных костных матриц.
Сроки сращения после костной пластики ложных суставов - при алло- и аутопластике - в 1,5-2,5 (по данным различных авторов) превышают средние сроки сращивания переломов соответствующей локализации. В частности, для большеберцовой кости 6-9 месяцев против 3-5 месяцев соответственно. Это связано с выраженными нарушениями трофики и микроциркуляции в зоне ложного сустава.
Целью предлагаемого изобретения является повышение эффективности костной пластики ложных суставов путем создания условий для организации на раннем этапе после операции дополнительных очагов костеобразования в трансплантате, обеспечивающих сокращение сроков консолидации и восстановление функции кости в оптимальные сроки, приближающиеся к срокам сращения переломов соответствующей локализации.
Задача решена с помощью внесения в операционную зону трансплантата, представляющего собой деминерализованный костный аллотрансплантат (ДКТ) из трубчатой кости, заселенный аутологичными однородными мезенхимальными стволовыми клетками, с плотностью МСК 7-10 млн/см3. Биотрансплантат при костной пластике помещают в паз кости после резекции ложного сустава или экономной обработки костных фрагментов до кровоточащей кости. Биотрансплантат фиксируют и стабилизируют на срок до образования прочной структуры кости.
Кроме того, дополнительно параоссально помещают цельный биотрансплантат размером, достаточным для покрытия выполненного костного паза, фиксируя его циркулярными швами.
Для подготовки биотрансплантата используется деминерализованный костный аллотрансплантат (ДКТ), изготовленный в лаборатории консервации тканей (фиг.1-2) ФГУ «РНИИТО им. Р.Р.Вредена Росздрава» (лицензия №99-01-001953 от 9.06.2005 г., приложение №1 от 09.06.2005 г., в т.ч. на забор и заготовку органов и тканей человека) по методическим рекомендациям МЗ РСФСР, утвержденным 26.03.1990 г.«Способы химической стерилизации деминерализованных костных трансплантатов».
Использование МСК на костном матриксе в лечении ложного сустава имеет много преимуществ. Главное - заселение деминерализованного костного матрикса однородными аутологичными МСК активирует ангиогенез и остеогенез в месте повреждения кости, в результате чего формируется кость, по строению аналогичная той, куда внесен биотрансплантат (в данном изобретении - трубчатая).
Мезенхимальные стволовые клетки - плюрипотентные клетки. Они способны к самоподдержанию и дифференцировке в нескольких направлениях, в том числе и костном.
При инъекционном введении МСК они вымываются из кости, окружающие ткани поглощают их, сокращая количество для регенерации кости, образования остеоцитов. Невозможно оценить качество ткани, на которую попадают МСК, рубцово-измененные ткани ложного сустава не обладают поверхностью для адгезии.
То, что у больного возник ложный сустав, показывает, что в организме имеются нарушения, мешающие (препятствующие) образованию костной мозоли в длинных трубчатых костях. Недостаточное кровоснабжение не способствует лечению повреждения. Трансплантат вносили так, чтобы он полностью заполнял выполненный паз, без образования дефекта, создавая дополнительные очаги остеогенеза и выполняя остеокондуктивную функцию. Трансплантат инициировал образование остеоцитов в объеме повреждения (остеоиндуктивная функция) и биоинтеграцию - врастание клеток новообразующейся кости в структуру матрикса. Биотрансплантат биосовместим, т.к. содержит аутологичные МСК.
Для подготовки биотрансплантата у пациента производят забор костного мозга путем пункции, чаще - из подвздошной кости. Гепаринизированный пунктат в среде Игла в модификации Дюльбекко (ДМЕМ) центрифугировали с фиколлом с выделением фракции однородных по фенотипу МСК, которые затем пассировали неоднократно в среде ДМЕМ с добавлением 15-22% FBS in vitro до накопления их массы. В качестве носителя используют деминерализованный костный аллотрансплантат из трубчатой кости, который ранее в сочетании с аутологичными МСК не применяли.
Известно, что в экспериментах на крысах на свежих повреждениях плоских костей (теменная кость) испытывали биотрансплантаты с недифференцированными МСК, в результате чего подобрали оптимальную для лечения плотность МСК на 1 см3 трансплантата (Кругляков П.В., Соколова И.Б. и др. Влияние сингенных МСК на восстановление костной ткани при имплантации деминерализованного костного матрикса // Цитология. - 2005, Т.47 (№6). - С.466-477).
В предлагаемом по изобретению трансплантате его пористая внутренняя поверхность (все структурные плоскости внутри костной ткани) заполнены прикрепившимися к ней МСК, обладающими остеогенным потенциалом, однородными по CD 34-; CD 45-; CD 44+; CD 90+; CD 105+; CD 106+. Плотность МСК 7-10 млн/см3. Объем заселенных деминерализованных костных аллотрансплантов из трубчатых костей от 15 до 40 см3.
Из костного мозга пациента выделяют аутологичные мезенхимные стволовые клетки фенотипа: CD 34-; CD 45-; CD 44+; CD 90+; CD 105+; CD 106+. Биотрансплантат из ДКТ и выделенных МСК готовят заранее. В лабораторных условиях ДКТ отмывают в растворе Хенкса в течение 24-48 часов, что обеспечивает РН среды для дальнейшей работы с жизнеспособным клеточным материалом, и помещают в среду с аутосывороткой. На трансплантат наносится суспензия подготовленных аутологичных мезенхимных стволовых клеток. Заселение трансплантата клетками проводят до достижения необходимой плотности клеток в 1 см3, т.е. оптимальной плотности заселения для получения очагов костеобразования. Заселение трансплантата производится в течение 24-72 часов (в зависимости от размеров трансплантатов от 15 до 40 см3) с плотностью 7-10 млн на 1 см3 трансплантата (фиг.3-4).
В полученной губчатой матрице поры позволяют клеткам мигрировать в толщу трансплантата и укрепляться на имеющихся поверхностях.
Подготовленные и заселенные аутологичными МСК биотрансплантаты доставляют из лаборатории в операционную в среде на аутосыворотке в стерильных контейнерах в день операции (фиг.5-6).
Биотрансплантат используют цельными фрагментами требуемого (рассчитанного) для лечения объема и площади. Объем трансплантатов определяется локализацией ложного сустава (сегмент) и планируемым оперативным вмешательством (резекция ложного сустава или экономная резекция рубцовой ткани и склерозированных участков костных фрагментов до кровоточащей кости), преимущественно использовались трансплантаты объемом 15-20 см3.
Лечение ложных суставов длинных трубчатых костей осуществляют с помощью остеосинтеза, т.е. оперативного соединения фрагментов кости и скрепления их в положении, обеспечивающем лучшие условия срастания с восстановлением нормальной формы кости и сохранение функции конечности. Оперативная техника остеосинтеза подчинена идее максимальной заботы о жизнеспособности тканей поврежденного сегмента, что выражается в рациональном доступе, сохраняющем в целости основные сосудистые и нервные стволы, в щадящем воздействии на надкостницу, костный мозг, мышцы и другие образования.
При костной пластике ложных суставов необходимо обеспечить стабильный остесинтез. Преимущественно используется метод внеочаговой фиксации, чтобы не наносить дополнительной механической травмы пораженному участку кости.
Методика оперативного лечения ложных суставов путем костной пластики по заявляемому способу заключается в следующем.
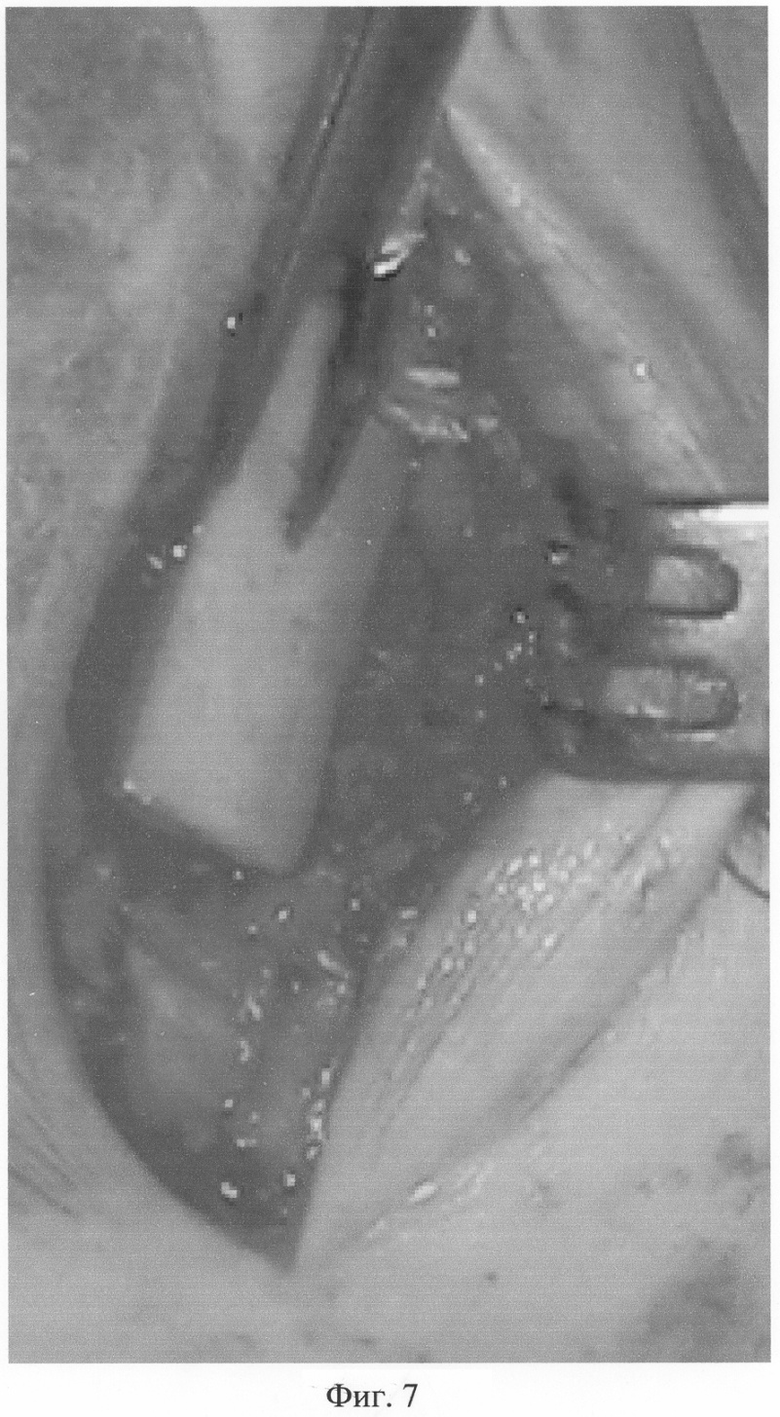
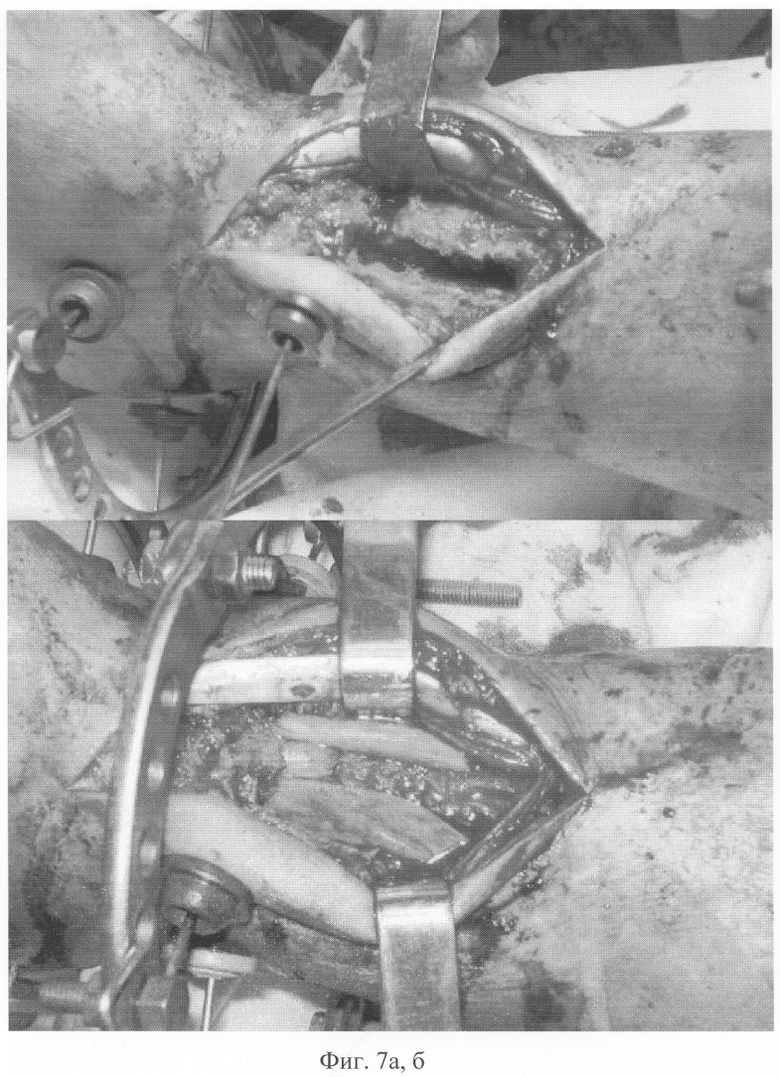
Операция выполняется под спинномозговой анестезией. После резекции ложного сустава или экономной резекции рубцовой ткани и склерозированных участков костных фрагментов до кровоточащей кости и открытой адаптации через проксимальный и дистальный отломок формируют паз размером до 5×1,5 см на всю толщину кортикального слоя, в который помещают подготовленные биотрансплантаты (при необходимости адаптации подготовленные трансплантаты рассекают на фрагменты), перекрывая зону ложного сустава (фиг.7, 7а, 7б), с заполнением костномозгового канала на этом уровне.
В процессе проведения операции было опробовано наложение дополнительного биотрансплантата параосально на надкостницу и фиксация его циркулярными швами поверх фрагментов кости с внесенным в сформированный паз биотрансплантатом. Этот дополнительный ДКТ с МСК покрывал или даже перекрывал зону операции. Результат от такого параоссально установленного дополнительного биотрансплантата оказался неожиданным. При дальнейшем наблюдении (по результатам компьютерной томографии) этот участок трансплантата частично перестраивался и включался в костную мозоль, давая дополнительную прочность. В то же время (по нашим клиническим наблюдениям) этот фрагмент биотрансплантата выполняет барьерную роль, защищая область костной пластики при возможных воспалительных осложнениях со стороны послеоперационной раны. Это иллюстрируется клиническим примером 2.
Предпочтительный способ фиксации - внеочаговый остеосинтез, как наносящий минимальную дополнительную (операционную) травму и позволяющий осуществлять как клинический контроль консолидации (клиническая проба в аппарате внешней фиксации), так и выполнять контроль посредством компьютерной томографии. Также может быть использован погружной остеосинтез (интрамедуллярный или накостный). Рана ушивается послойно с оставлением активного дренажа на 24-72 часа. Контроль состояния трансплантатов и регенерации осуществляли путем рентгенографии и компьютерной томографии.
Прошли лечение 5 пациентов, имеющих 6 ложных суставов (большеберцовой и бедренной костей).
Иллюстрируем сказанное клиническим наблюдением.
Пример 1.
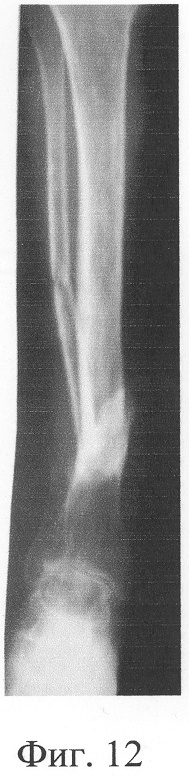
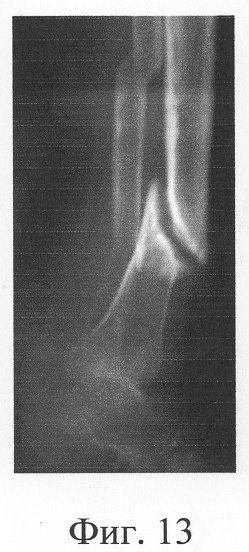
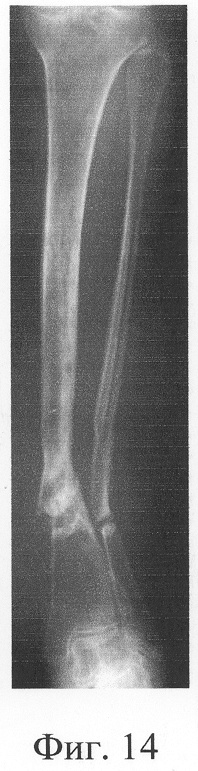
Больная П., 42 лет, поступила для оперативного лечения с диагнозом «атрофические ложные суставы обеих большеберцовых костей; сросшийся с укорочением 5 см перелом левой бедренной кости, хронический остеомиелит левой бедренной кости, фаза ремиссия; посттравматическая невропатия правого малоберцового нерва». В анамнезе - накостный, а затем дважды внеочаговый остеосинтез левой большеберцовой кости с исходом в ложный сустав; 4 операции внеочагового остеосинтеза правой большеберцовой кости, в том числе с костной пластикой; сроки фиксации в аппарате от 5 до 10 мес. Результат не достигнут: с обеих сторон сформировались ложные суставы (фиг.8-11 - клинические и фиг.12-15 - рентгенологические данные до лечения по предложенному методу).
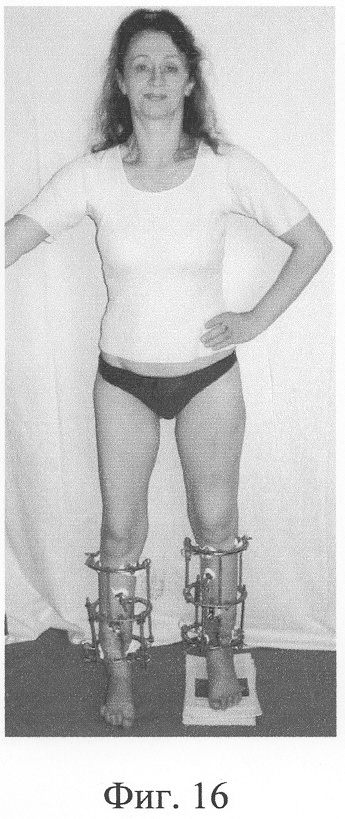
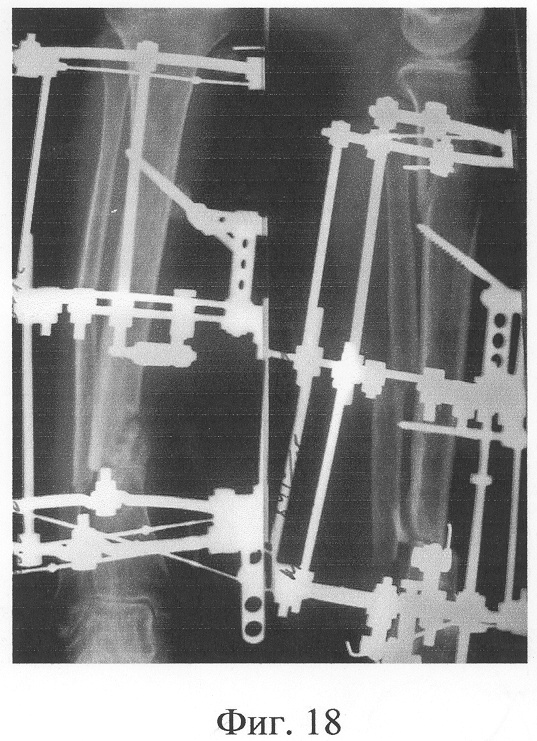
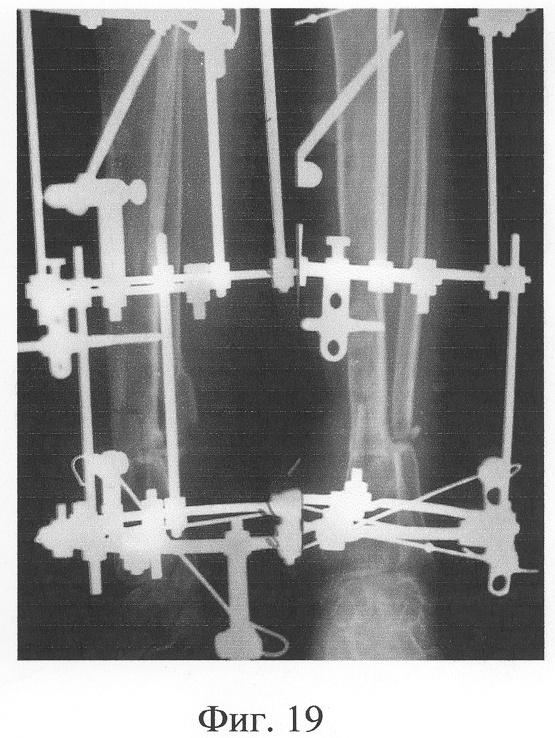
Одномоментно выполнены операции: резекция ложных суставов обеих большеберцовых костей, резекция левой малоберцовой кости, комбинированный чрескостный остеосинтез костей обеих голеней, костная пластика ложных суставов деминерализованным костным аллотрансплантатом из трубчатой кости, предварительно в лабораторных условиях заселенным аутологичными мезенхимными стволовыми клетками, выделенными из костного мозга пациентки, с плотностью заселения 7-10 млн на 1 см3 трансплантата. В послеоперационном периоде потребовалась дополнительная коррекция положения фрагментов на правой голени, что привело к смещению трансплантата из костного паза. Дренажи удалены на 3-е сутки, швы сняты на 15 сутки, антибактериальная терапия под контролем клинического фармаколога с учетом анамнеза. Ходьба с дополнительными средствами опоры с 7 суток послеоперационного периода. Компенсация укорочения бедра обувью (фиг.16-17 - клинические и фиг.18-19 - рентгенологические данные в процессе лечения, трансплантаты отчетливо видны на рентгенограммах, отмечается нарастание плотности костной ткани в области трансплантатов).
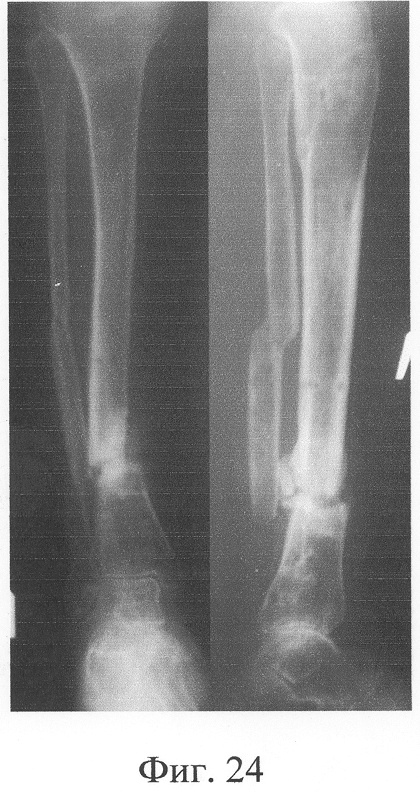
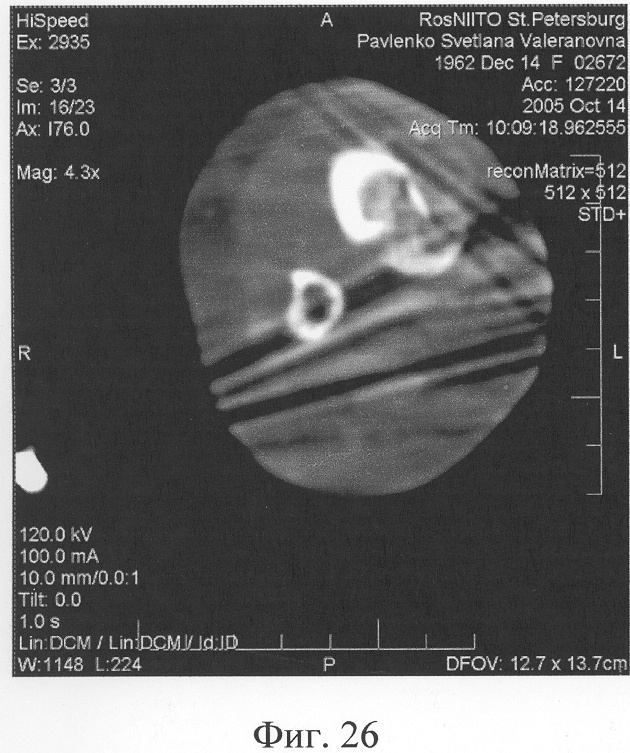
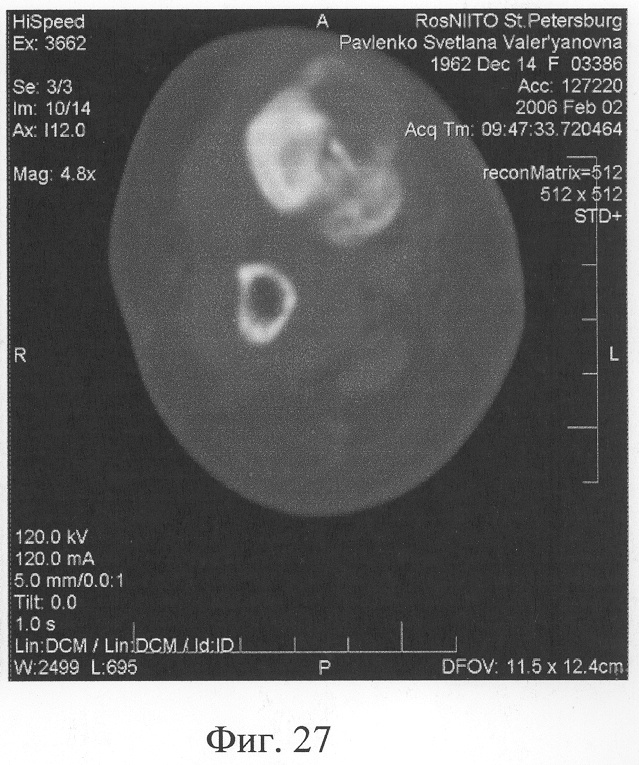
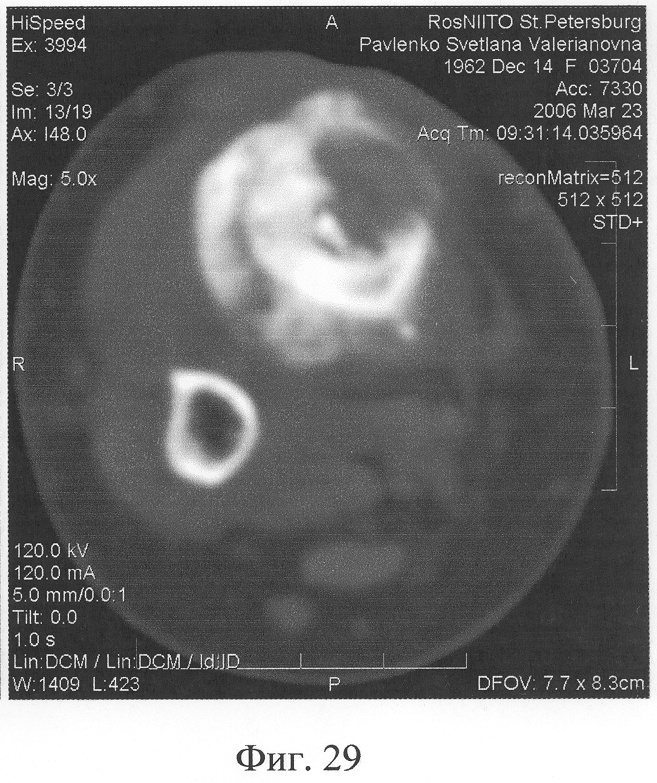
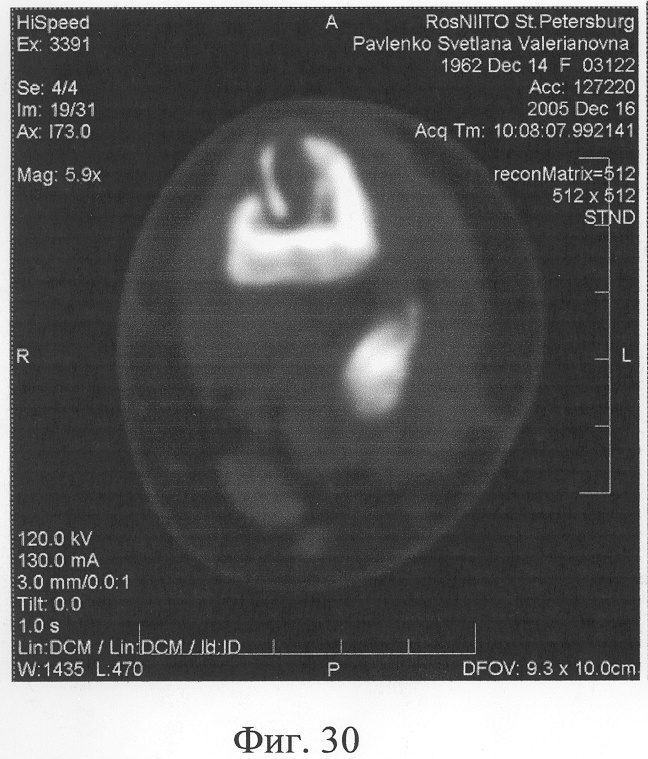
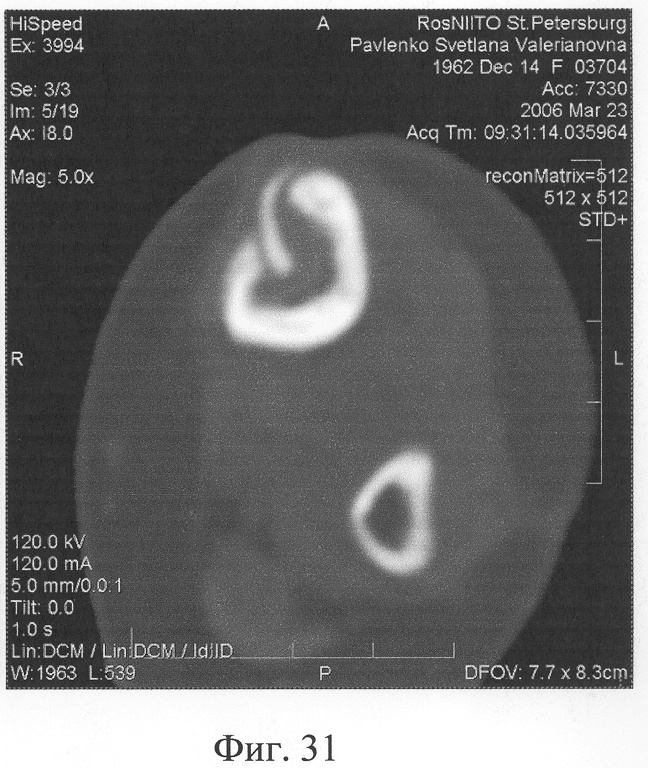
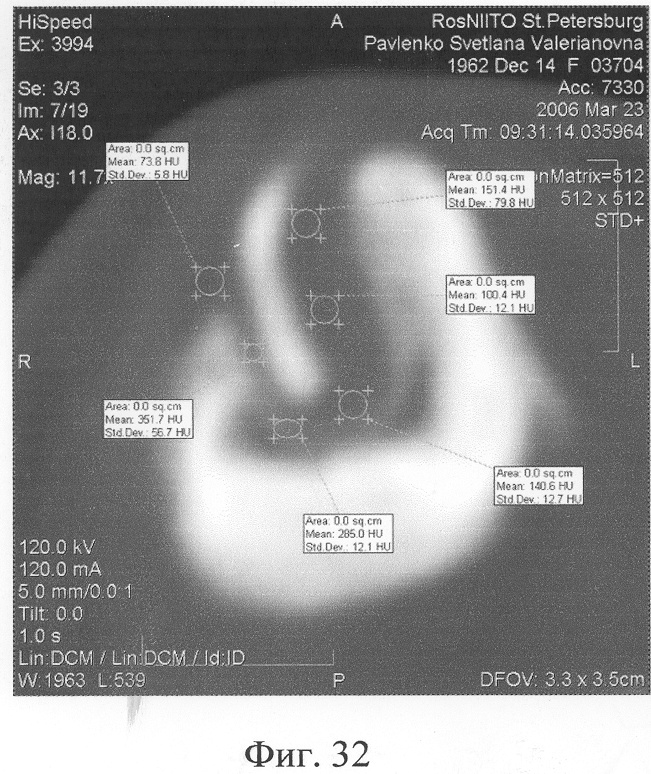
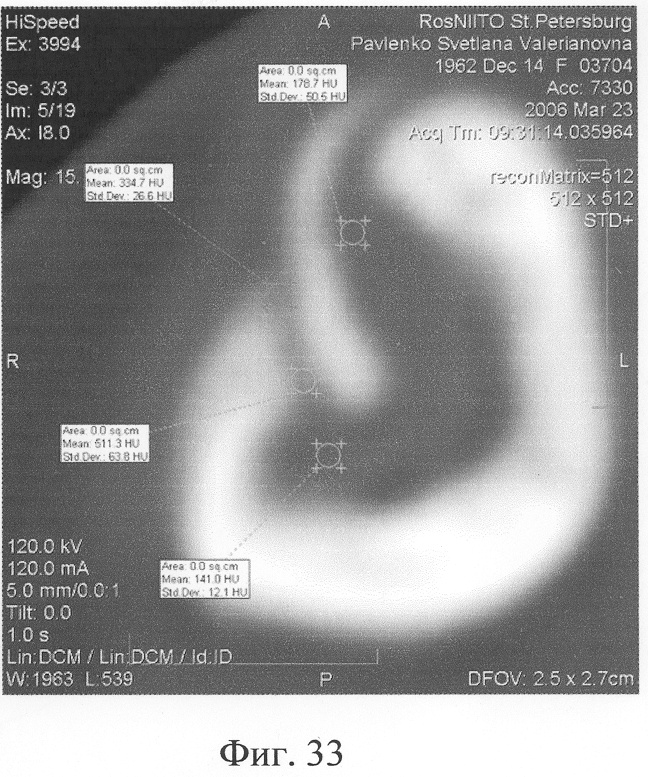
Аппарат внешней фиксации с левой голени демонтирован через 3 месяца после операции при клинико-рентгенологической картине сращения перелома. Аппарат внешней фиксации с правой голени демонтирован через 7 месяцев после операции при клинико-рентгенологической картине сращения перелома (фиг.20-25 - результат лечения). При рентгенологическом и томографическом контроле в трансплантатах отмечалось постепенное нарастание плотности костной ткани с формированием костной мозоли на всем протяжении между трансплантатом и костными фрагментами (фиг.26-29 - динамика данных компьютерной томографии правой голени: отмечается нарастание плотности костной ткани в области трансплантатов и формирование регенерата между смещенным трансплантатом и костными фрагментами; фиг.30-33 - динамика данных компьютерной томографии левой голени: отмечается нарастание плотности костной ткани в области трансплантатов и формирование регенерата между трансплантатом и костными фрагментами).
Пример 2.
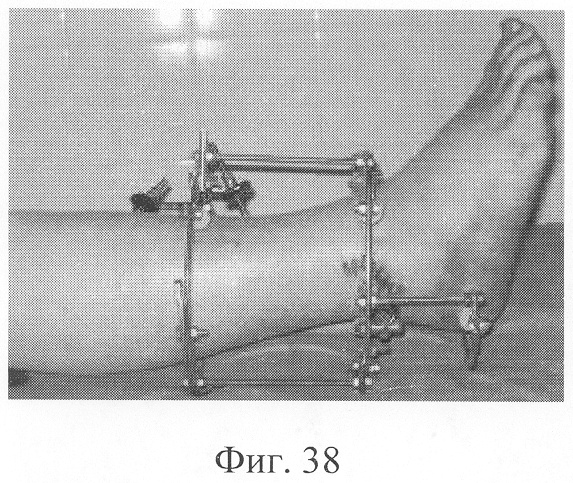
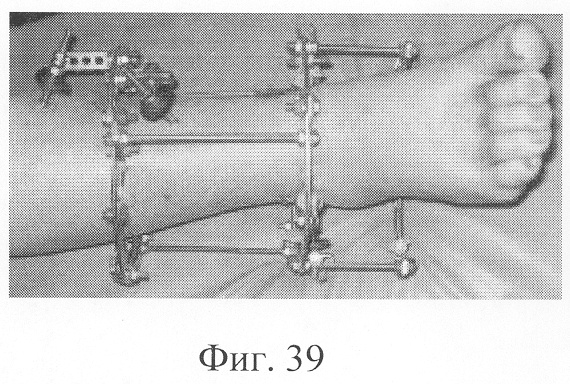
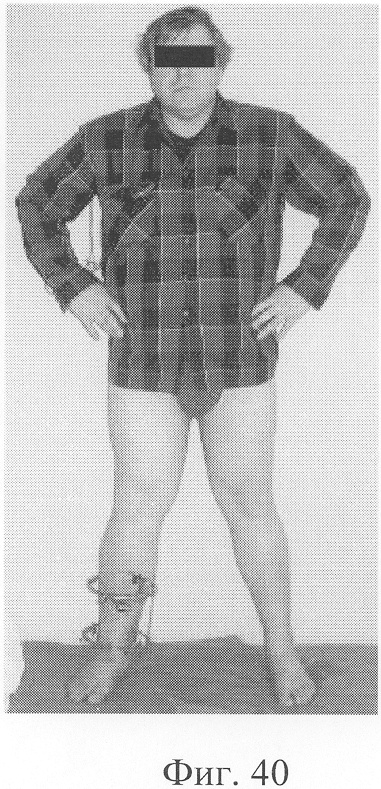
Больной Р., 46 лет, поступил для планового оперативного лечения с диагнозом «ложный сустав правой большеберцовой кости с варусно-антекурвационной деформацией» (фиг.34-37 клинико-рентгенологические данные до операции). Предшествующее лечение перелома проводилось консервативным способом, можно отметить несостоятельность и недостаточную продолжительность иммобилизации, что является у данного пациента основным фактором в формировании ложного сустава. Из сопутствующей патологии необходимо отметить гипертоническую болезнь II ст., ИБС, атеросклеротический кардиосклероз, НК II А ст. Во время операции произведена экономная резекция фрагментов, устранение деформации в аппарате внешней фиксации, костная пластика деминерализованным костным трансплантатом, заселенным аутологичными мезенхимальными стволовыми клетками, по предложенной методике (при этом костный паз был выполнен по внутренней поверхности в области диастаза между костными фрагментами). В послеоперационном периоде дренажи удалены на 2-е сутки, швы сняты на 21 сутки в связи с развитием краевого некроза в области послеоперационной раны. Ходьба при помощи костылей с 7-х суток послеоперационного периода, дозированная нагрузка на конечность с третьего месяца после операции с учетом локализации повреждения в дистальной части большеберцовой кости (фиг.38-42 - клинические и рентгенологические данные в процессе лечения). Из осложнений необходимо отметить воспаление в области чрескостных элементов в конце периода фиксации, что купировано после снятия аппарата. Демонтаж аппарата внешней фиксации через 5,5 месяцев при клинико-рентгенологической картине сращения.
В дальнейшем отмечен переход воспалительного процесса на послеоперационный рубец, потребовавший его иссечения и выполнения кожной пластики. При операции были удалены частично резорбировавшиеся в области воспаленной раны фрагменты трансплантата, уложенные параоссально. При этом основная область пластики, где уже сформировалась мощная костная мозоль, оказалась интактной от воспаления.
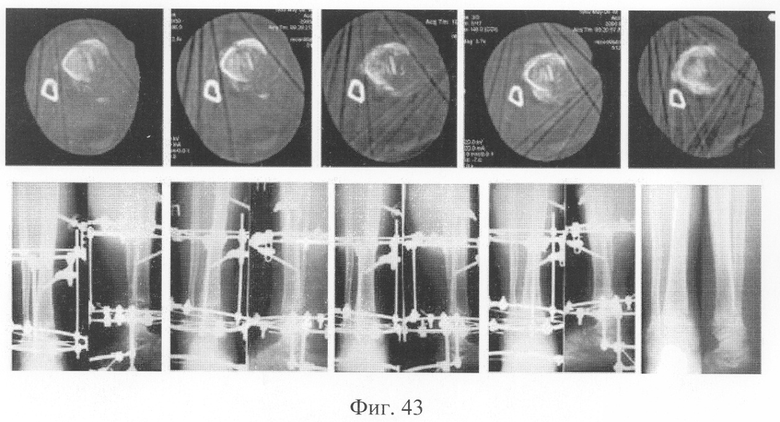
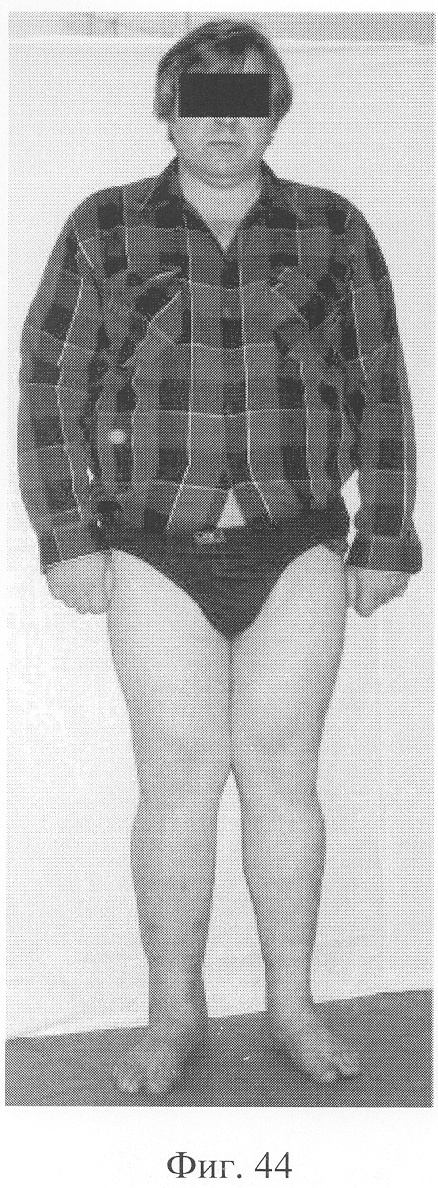
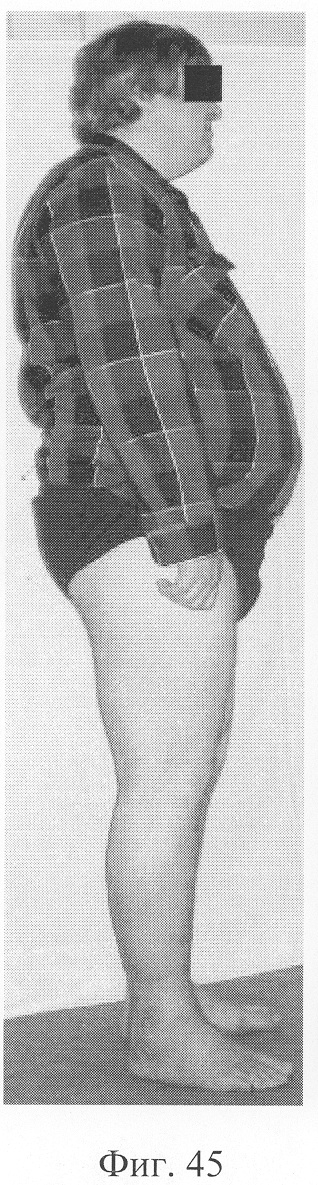
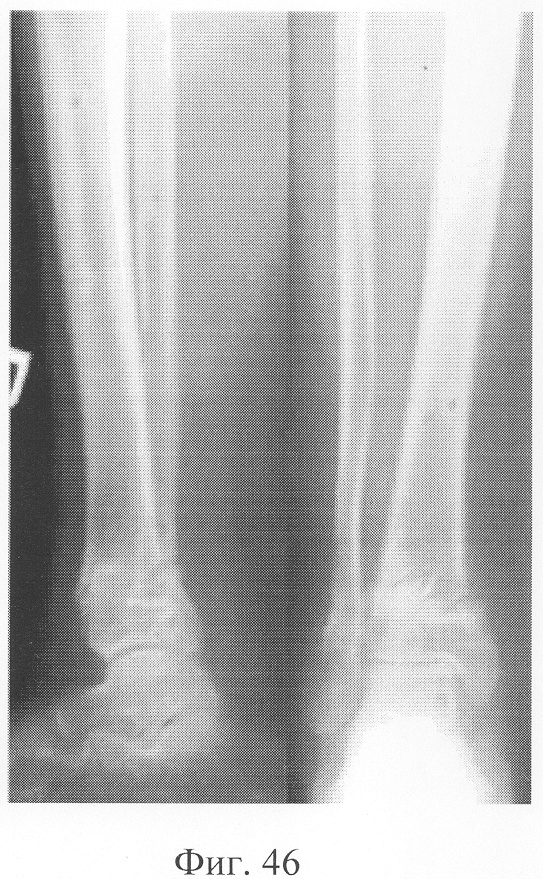
При рентгенологическом и томографическом контроле в динамике отмечалось отчетливое нарастание плотности костной ткани в трансплантатах без предварительной резорбции (фиг.43 - динамика рентгенологической и томографической картины). Таким образом, развившиеся воспалительные процессы были своевременно купированы и не сказались на результате лечения (фиг.44-46 - результат лечения).
Пример 3.
Больной П., 46 лет, поступил для планового оперативного лечения с диагнозом «ложный сустав левой большеберцовой кости» (фиг.47-49 - клинические и рентгенологические данные до операции). В анамнезе открытый перелом обеих костей голени, по поводу которого после проведения первичной хирургической обработки раны был наложен аппарат внешней фиксации с одномоментной репозицией. В связи с замедленной консолидацией проводилась микрокомпрессия и микродистракция, что не имело четкого положительного эффекта. Через 11 месяцев после травмы отмечалась выраженная патологическая подвижность при клинической пробе, рентгенологически отмечены признаки формирования ложного сустава. Аппарат внешней фиксации был демонтирован, и после заживления ран выполнена операция: экономная резекция костных фрагментов, фиксация в аппарате, костная пластика деминерализованным костным трансплантатом, заселенным аутологичными мезенхимальными стволовыми клетками по предложенной методике. В послеоперационном периоде дренажи удалены на 2-е сутки, швы сняты на 14 сутки, с 5-х суток разрешена ходьба при помощи костылей, с 7-х суток нагрузка на оперированную конечность (фиг.50-52 - клинические и рентгенологические данные в процессе лечения). Аппарат внешней фиксации демонтирован через 3 месяца при клинико-рентгенологической картине сращения (фиг.53-55 - результат лечения).
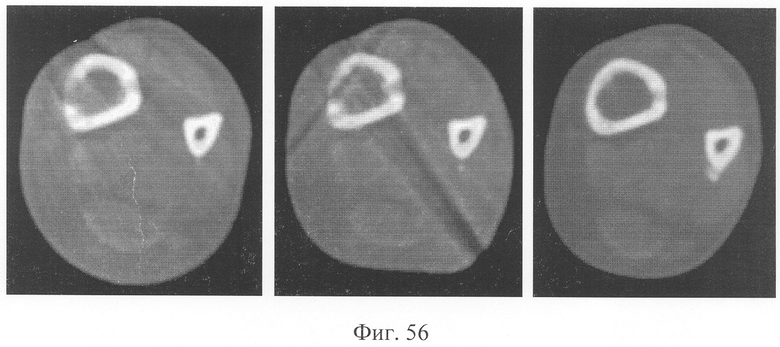
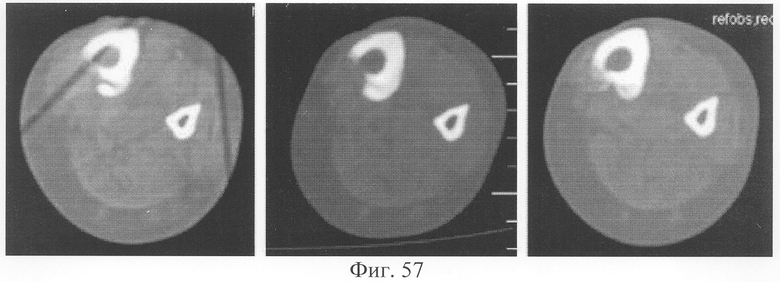
При оценке результатов томографического исследования в динамике отмечено быстрое нарастание плотности костной мозоли между дистальным и проксимальным фрагментами (фиг.56 - динамика томографической картины на уровне контакта костных фрагментов), что позволяет говорить об остеоиндуктивном воздействии предложенного биотрансплантата. В то же время в области трансплантата также отмечены очаги остеогенеза с нарастанием их плотности в динамике и включением в костную мозоль (фиг.57 - динамика томографической картины на уровне трансплантата).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ МНОГООСКОЛЬЧАТЫХ И МНОЖЕСТВЕННЫХ ПЕРЕЛОМОВ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ | 2008 |
|
RU2370227C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗАМЕДЛЕННО СРАСТАЮЩИХСЯ ПЕРЕЛОМОВ ПУТЕМ ТРАНСПЛАНТАЦИИ АУТОЛОГИЧНЫХ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2008 |
|
RU2375981C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ОСТЕОМИЕЛИТА С ДЕФЕКТОМ КОСТИ | 2008 |
|
RU2389442C1 |
| БИОТРАНСПЛАНТАТ НА ОСНОВЕ ПЕНОКЕРАМИЧЕСКИХ НОСИТЕЛЕЙ СИСТЕМЫ ОКСИД ЦИРКОНИЯ - ОКСИД АЛЮМИНИЯ И МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК КОСТНОГО МОЗГА ЧЕЛОВЕКА ДЛЯ ВОССТАНОВЛЕНИЯ ПРОТЯЖЕННЫХ ДЕФЕКТОВ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2386453C1 |
| Способ осуществления прицельного малоинвазивного доступа для клеточных трансплантаций в костный регенерат | 2020 |
|
RU2748544C1 |
| СПОСОБ УСКОРЕНИЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ ПРИ ПРОВЕДЕНИИ ОСТЕОСИНТЕЗА | 2009 |
|
RU2410050C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ТКАНЕЙ ПАРОДОНТА | 2008 |
|
RU2368338C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ ХРЯЩЕВОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2301677C1 |
| КУЛЬТУРА КЛЕТОК, СОДЕРЖАЩАЯ КЛЕТКИ-ПРЕДШЕСТВЕННИКИ ОСТЕОГЕНЕЗА, ИМПЛАНТАТ НА ЕЕ ОСНОВЕ И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ ВОССТАНОВЛЕНИЯ ЦЕЛОСТНОСТИ КОСТИ | 2003 |
|
RU2240135C1 |
| Трансплантат, способ аутотрансплантации костного мозга для стимуляции репаративной регенерации кости и устройство для осуществления трансплантации | 2021 |
|
RU2778615C1 |














Изобретение относится к травматологии и ортопедии и может быть применимо для лечения ложных суставов. Проводят резекцию ложного сустава. Формируют оперативным путем на всю толщину кортикального слоя паз через дистальный и проксимальный фрагменты. Заполняют сформированный паз биотрансплантатом, содержащим жизнеспособные аутологичные однородные по фенотипу CD 44+; CD 90+; CD 105+; CD 106+; CD 45-; CD 34- мезенхимальные стволовые клетки, выделенные из костного мозга, заселенные на матрицу, выполненную из деминерализованного костного аллотрансплантата. Производят фиксацию и стабилизацию костных фрагментов. Изобретение позволяет ускорить остеогенез и ангиогенез, восстановить структуру кости в месте поражения. 2 н. и 5 з.п.ф-лы, 57 ил.
| КУЛЬТУРА КЛЕТОК, СОДЕРЖАЩАЯ КЛЕТКИ-ПРЕДШЕСТВЕННИКИ ОСТЕОГЕНЕЗА, ИМПЛАНТАТ НА ЕЕ ОСНОВЕ И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ ВОССТАНОВЛЕНИЯ ЦЕЛОСТНОСТИ КОСТИ | 2003 |
|
RU2240135C1 |
| Способ лечения ложных суставов проксимального отдела бедра | 1991 |
|
SU1808316A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ IN VITRO ОСТЕОИНТЕГРАТИВНЫХ СВОЙСТВ ПЛАСТИЧЕСКИХ МАТЕРИАЛОВ ДЛЯ ИМПЛАНТАТОВ | 2004 |
|
RU2259851C1 |
| БЕЛОУСОВ А.Е | |||
| Пластическая, реконструктивная и эстетическая хирургия | |||
| - СПб.: Гиппократ, 1998, с.550-551 | |||
| МОВШОВИЧ И.А | |||
| Оперативная ортопедия | |||
| - М.: Медицина, 1994, с.33-41 | |||
| БИОТРАНСПЛАНТАТ И СПОСОБ ЛЕЧЕНИЯ ОСТЕОПОРОЗА | 2004 |
|
RU2265442C1 |
| CN 1563364, 12.01.2005 | |||
| WU J.I | |||
| Progress of study on placenta | |||
Авторы
Даты
2007-11-10—Публикация
2006-07-03—Подача