Настоящее изобретение относится к усовершенствованиям при выделении компонентов из цельной крови или телесной жидкости. Более конкретно настоящее изобретение относится к способу, где крови или телесной жидкости (или, иначе говоря, жидкости организма) дают возможность проходить через жесткую интегральную разделительную матрицу без вытеснения из нее.
Воспалительные процессы, такие как сепсис, являются основной причиной заболеваемости и смертности у людей. Согласно оценкам, только в США от 400000 до 500000 случаев сепсиса приводят к смерти 100000-175000 людей ежегодно. В Германии отмечены уровни сепсиса, достигающие 19%, у пациентов, госпитализированных в отделениях интенсивной терапии. Сепсис также становится ведущей причиной смерти в отделениях не являющихся отделениями интенсивной терапии, среди пациентов с нетравматическими заболеваниями. Несмотря на большие успехи, достигнутые в последнее десятилетие, при лечении серьезных инфекций несчастные случаи и смертность, связанные с сепсисом, продолжают расти.
Существует три главных типа сепсиса, характеризуемые типом инфицирующего организма. Грамотрицательный сепсис является наиболее распространенным. Большинство этих инфекций вызываются Escherichia coli, Klebsiella pneumoniae и Pseudomonas aeruginosa. Грамположительные патогены, такие как стафиллококки и стрептококки, являются второй главной причиной сепсиса. Третья главная группа включает в себя грибки. Грибковые инфекции составляют относительно малый процент случаев сепсиса, но они приводят к высокому уровню смертности.
Хорошо установленный механизм при сепсисе связан с токсичными компонентами грамотрицательных бактерий, то есть с липополисахаридной структурой клеточной стенки (LPS, эндотоксин), которая состоит из группы жирной кислоты, фосфатной группы и углеводной цепи.
Идентифицированы несколько откликов хозяев на эндотоксины, таких как высвобождение цитокинов, которые продуцируются локально. Однако в случае экстенсивной стимуляции имеет место выброс в периферийную кровь, и получают потенциально вредные эффекты, такие как индуцированная дисфункция органов.
Ключевыми медиаторами септического шока являются фактор некроза опухоли (TNF-α), Интерлейкин 1 (Il-1) и Интерлейкин 17 (Il-17), которые высвобождаются моноцитами и макрофагами. Они действуют синэргически, вызывая систему физиологических изменений, приводящих к коллапсу кровообращения и к множественному отказу органов. В самом деле, высокие концентрации TNF-α могут давать те же симптомы и результаты, что и сепсис.
Как правило, эндотоксины удерживаются в просвете кишечника. Например, во время кардиопульмонарного шунтирования наличие ишемии (недостатка кровоснабжения) или дизоксии (недостатка кислорода) внутренних органов вызывает разрушение слизистого барьера и транслокацию (то есть перенос эндотоксинов из кишечника в систему кровообращения) эндотоксинов из просвета кишечника в портальное кровообращение.
Антибиотики различных типов широко используются для предотвращения и лечения инфекций. Однако для множества повсеместно используемых антибиотиков среди различных типов бактерий развивается резистентность (устойчивость) к антибиотикам. Это особенно верно для микробной флоры, присутствующей в больницах, где организмы находятся под постоянным селективным давлением среды, развивающим у них резистентность. Кроме того, в больнице большая плотность потенциально инфицированных пациентов и широкие контакты персонала между собой и персонала с пациентами облегчают распространение организмов, устойчивых к антибиотикам. Используемые антибиотики являются наиболее экономичными, наиболее безопасными и наиболее простыми при введении и могут и не иметь спектра действия достаточно широкого для подавления определенных инфекций. Антибиотики могут быть токсичными до разных уровней, вызывая аллергию, взаимодействие с другими лекарственными средствами и вызывая непосредственное повреждение главных органов (например, печени, почек). Многие антибиотики также изменяют нормальную флору кишечника, что может вызвать диарею и недостаточное всасывание пищи.
Определенные антибиотики, как известно, нейтрализуют действия эндотоксинов, такие как полимиксин B. Этот антибиотик связывается с липидной частью A эндотоксина и нейтрализует ее активность. Полимиксин не используется широко из-за его токсичности. Его назначают пациентам только под постоянным наблюдением и при мониторинге функции почек.
Кроме того, для преодоления некоторых ограничений, присущих активной иммунизации против бактериальных компонентов, используются различные методики для продуцирования антител, связывающих эндотоксины. Большое количество антител получают путем иммунизации людей бактериями. Для разработки более совместимых препаратов терапевтических антител были разработаны многочисленные LPS-реактивные моноклональные антитела. К сожалению, клинические испытания не привели к каким-либо преимуществам. Однако необходимо заметить, что эти исследования осуществлялись на людях после наступления симптомов сепсиса. Широко распространено мнение, что лечение антителами против эндотоксинов, назначаемое после возникновения сепсиса, может дать только небольшое преимущество, поскольку эти антитела не могут обратить вспять действие воспалительной системы, инициируемое эндотоксином.
В патенте Японии JP 06022633 описывается адсорбент для антител против липидов, который содержит соединение с анионной функциональной группой, иммобилизованной на водонерастворимом пористом материале. Пористый материал может представлять собой агарозу, целлюлозу, декстран, полиакриламид, стекло, силикагель или твердый полимер, изготовленный из сополимера стирола-дивинилбензола, и пористый материал набивают в виде слоя из отдельных частиц в разделительное устройство.
В попытках удаления компонентов из крови были получены различные материалы адсорбентов. Адсорбент для удаления эндотоксина, содержащий лиганд, иммобилизованный на твердофазной среде подложки, описывается в заявке на Международный патент WO 01/23413. Предпочтительная среда подложки находится в форме шариков. Когда ее набивают в разделительное устройство, твердофазная среда подложки является достаточно пористой для того, чтобы сделать возможным прохождение клеток крови между шариками.
В заявке на Международный патент WO 00/62836, материал адсорбента имеет размер и структуру, адаптированную для удаления микроглобулина β-2 из крови. Материал адсорбента этого документа может представлять собой макропористый синтетический полимер с поверхностью шариков и с порами, модифицированный таким образом, чтобы предотвратить адсорбцию белков и тромбоцитов. Однако отдельные сферические шарики из полимера механически разрушаются при нагрузке примерно 500 г, которую они получают, например, в колонке, набитой шариками. Такая нагрузка приводит к значительному падению давления на колонке.
Для уменьшения падения давления в Европейском патенте EP 464872 получили адсорбент, который содержит пористые твердые частицы геля, нерастворимые в воде, имеющие предел исключения 106-109 Дальтон. Слой геля используют для селективного удаления липопротеинов из крови или плазмы при лечении с помощью экстракорпоральной циркуляции.
Подобным же образом в заявке на Международный патент WO 01/23413 пористый материал подложки для удаления эндотоксина представляет собой шарики, которыми можно наполнять контейнер, причем шарики имеют размер, достаточный для создания между шариками необходимого пространства, когда их набивают в колонку или они присутствуют в виде фильтрующего слоя. Пористый материал подложки может также представлять собой полые волокна для микрофильтрации или плоские листовые мембраны для сведения к минимуму перепадов давления.
В Европейском патенте EP 424698 описывается адсорбент для устранения биологических макромолекул, который состоит из носителя из пористых сферических частиц, имеющих размер частиц 50-150 микрон, и предел исключения, равный, по меньшей мере, 105 Дальтон. Полимиксин B связывается с частицами, которыми впоследствии заполняют картридж, который должен использоваться в системе для экстракорпорального удаления эндотоксина из цельной крови.
В этих традиционных системах для экстракорпорального удаления токсичных компонентов из крови контейнер или картридж сначала заполняют жидкостью, а после этого вводят адсорбирующие пористые шарики. В патенте США № 6408894 описывается способ, который обеспечивает более однородное распределение и более плотную набивку шариков. Способ включает в себя принудительное введение смеси жидкости и шариков в контейнер таким образом, чтобы жидкость выжималась из смеси и из контейнера.
Таким образом, устранение клеток крови облегчает удаление соединений, присутствующих в плазме, как описывается выше, например, в заявке на Международный патент WO 00/62836 или в заявке на Международный патент WO 01/23413. Однако такая методика включают в себя две стадии разделения, которые обе могут вносить вклад в увеличение риска неблагоприятного активирования клеток из-за биологической несовместимости.
Целью настоящего изобретения является создание нового способа для селективного связывания и выделения, по меньшей мере, одного компонента из цельной крови или телесных жидкостей, посредством чего устраняются указанные выше проблемы, связанные с воспалительными процессами.
Другой целью является создание такого способа, при котором селективное связывание и разделение может достигаться на цельной крови, без необходимости в разделении крови на плазму и клетки крови.
Еще одной целью настоящего изобретения является создание такого способа, в котором нет зависимости от размеров, то есть компоненты крови не разделяются посредством исключения (по размерам).
Еще одной целью настоящего изобретения является создание такого способа, при котором в разделительном устройстве могут быть получены высокие скорости потока без появления со временем значительного перепада давления.
Еще одной целью является создание такого способа, в котором кровь в разделительном устройстве не подвергается воздействию сил сдвига, даже при очень высоких скоростях потока, в то время как в линии поддерживается низкое давление для предотвращения повреждений кровеносных сосудов.
Эти цели достигаются с помощью настоящего изобретения, имеющего характерные признаки по п.1 формулы изобретения. Другие преимущества настоящего изобретения станут ясны из пункта 21 формулы изобретения и зависимых пунктов формулы изобретения.
В соответствии с настоящим изобретением предусматривается способ селективного связывания и выделения, по меньшей мере, одного компонента из цельной крови или телесной жидкости. Крови или телесной жидкости дают возможность для прохождения через жесткую интегральную разделительную матрицу без вытеснения из нее, причем матрица имеет пористую структуру с размерами пор, находящимися в пределах от 5 микрон до 500 микрон, и активную поверхность, находящуюся в пределах от 0,5 см2 до 10 м2, которая способна связывать один или несколько компонентов.
В предпочтительном воплощении настоящего изобретения матрица, кроме того, содержит, по меньшей мере, одну функциональную группу, которую вводят посредством нанесения покрытия на поверхность пористой структуры и/или ее модификации. Это приводит к тому, что полученная активная поверхность сама по себе или в сочетании с ее нефункционализованными участками способна к селективному связыванию, по меньшей мере, одного компонента цельной крови или телесной жидкости. Компоненты, которые должны удаляться, могут быть как природного, так и неприродного происхождения, то есть к этому компоненту может прикрепляться конкретный лиганд, такой как антитело.
Кроме того, функциональные группы, получаемые посредством непосредственного или опосредованного селективного преобразования поверхности пористой структуры, могут впоследствии использоваться для иммобилизации лигандов. Однако могут использоваться и функциональные группы пористой структуры, поскольку они находятся в рамках способа по настоящему изобретению.
Размер пор, а также поверхность скелетообразной пористой структуры адаптируют для использования в разделительной матрице способа по настоящему изобретению в связи с очисткой цельной крови. Однако способ в соответствии с настоящим изобретением может также использоваться для удаления компонентов из других телесных жидкостей, а также из водных растворов. Важным аспектом настоящего изобретения является то, что ни один из компонентов и ни один из растворителей не исключается (не вытесняется) из матрицы в ходе процедуры разделения.
В соответствии с настоящим изобретением, жесткая интегральная матрица должна иметь доступную поверхность от 0,5 см2 до 10 м2, и плотность структуры матрицы не является ограничивающей для осуществления способа по настоящему изобретению.
В этой связи термин "жесткий" означает, что матрица не является гибкой, не изгибается или не является мягкой, но способна противостоять давлению, равному, по меньшей мере, 0,5 бар. Термин "интегральная" обозначает, что матрица с высокой площадью поверхности представляет собой единое целое.
Пористая структура матрицы способа по настоящему изобретению изготавливается из металла, оксида неорганического соединения, углерода, стекла, керамики, синтетического полимера и/или природного полимера, или из их смесей. Пористые твердые металлические структуры с хорошо определенными размерами пор и высокими площадями поверхности могут производиться путем использования строго контролируемых способов спекания, которые дают поры, однородные по размерам.
Получены различные полимеры для матрицы в виде формованного или экструдированного пористого материала с пористой структурой, имеющей желаемый размер пор, а также высокую площадь поверхности. Они также производятся в виде пены. Например, полиуретаны, полученные из изоцианатов и различных других органических соединений, имеют активные атомы водорода, которые используются для получения продуктов полиприсоединения. Этот активный водород может приходить из бифункциональных или полифункциональных соединений, таких как полиспирты, полиамины. Реакции с водой приводят к получению первичных аминов, которые используются для ковалентной иммобилизации конкретных лигандов.
Могут использоваться разнообразные металлы и сплавы, такие как нержавеющая сталь, никель, титан, никелево-медный сплав (монель), инконель, хастеллой и другие специальные материалы на основе металла. Оксиды неорганических соединений с высокой площадью поверхности, в частности оксид алюминия и оксид циркония, также могут использоваться с помощью тех же методик для получения керамических материалов с заданными структурами пор. Подобным же образом такая керамика, а также спеченное стекло, которые имеют адекватные размеры пор, могут приобретаться в продаже.
Другие жесткие природные материалы, такие как аморфная окись кремния, например цеолиты и вулканическая порода, также могут использоваться.
Природные материалы и их гибриды, которые могут использоваться в качестве материала матрицы в способе по настоящему изобретению, представляют собой полисахариды, такие как целлюлоза, и другие полимерные углеводные материалы. Другие пригодные для использования природные полимерные материалы представляют собой полиаминокислоты, также кислоты, включающие в себя синтетические аминокислоты, полимолочную кислоту, полигликолевую кислоту и ее сополимеры с молочной кислотой.
В этой связи термин «гибрид» охватывает производные таких природных материалов, например диацетатцеллюлозу, которая представляет собой предпочтительное полисахаридное производное.
Пригодные синтетические полимеры для матрицы, которая должна использоваться в настоящем изобретении, представляют собой полиолефины, такие как полиэтилен, полипропилен, полибутилен, полиметилпентен и сополимеры этилена и винилацетата; виниловые полимеры, такие как поливиниловый спирт, поливинилацетали и поливинилпирролидон; фторсодержащие полимеры, такие как политетрафторэтилен, сополимер фторированного этилена-пропилена, полихлорфторэтилен, поливинилфторид и поливинилиденфторид; полиакрилаты, такие как полиметилметакрилат, цианоакрилат, полиакрилонитрил и полиметакрилаты; полиамиды, такие как полиакриламид; полиимиды, такие как полиэтиленимины; полистирол и его сополимеры, такие как полистирол и полимеры акрилонитрила-бутадиен-стирола; силиконовые каучуки; сложные/простые полиэфиры; поликарбонаты; полиуретаны; полисульфонаты; полигликоли; полиалкиленоксиды, такие как полиэтиленоксид, полипропиленоксид; и их сополимеры или гибриды.
В предпочтительном воплощении в пористую структуру жесткой интегральной разделительной матрицы вводят, по меньшей мере, одну функциональную группу. Функциональные группы могут быть различных видов, то есть анионного, катионного или неионного типа. Функциональные группы пористой структуры используются для ковалентного связывания веществ, подобных пептидам/белкам и желчным кислотам (например, дезоксихолевой кислоты), антител и их фрагментов, а также других биологических молекул и веществ, обладающих способностью к селективному связыванию эндотоксинов и/или провоспалительных медиаторов.
Модификация поверхности, то есть функционализация поверхности опосредованным способом осуществляется посредством электроосаждения, электроиспарения, плазмостимулированного химического осаждения, осаждения из потока ионов плазмы или химического осаждения из паровой фазы (то есть плазмостимулированной полимеризации, плазмохимического поверхностного осаждения полимера). Способы модификации поверхности сами по себе известны и находятся в "Plasma surface modification and plasma polymerization" N. Inagaki, 1996, Technomic Publishing, Lancaster, USA. Различные трехмерные матричные структуры обрабатывают посредством этих способов, причем получают очень гомогенную модификацию активной поверхности.
Полимеризацию бифункциональных мономеров акрильных или аллильных двойных связей полярными группами, такими как OH, NH2, CN и COOH, используют для получения плазменных полимеров с высокой плотностью функциональных групп. Например, поверхностную функционализацию неорганических и органических поверхностей осуществляют в плазменной среде аллильных соединений, таких как аллиламин.
Это также является возможным для органических полимерных поверхностей в плазменных средах NH3, O2 или CO2, в которых образуются либо функциональные группы =NH, -NH2, =CN, -OH либо одинарная связь -COOH. Другие примеры используемых газов хорошо известны в данной области.
Плазмохимическую обработку также объединяют с классическим химическим синтезом, при этом селективность модификации поверхности для полимеров значительно повышается. Один из подходов заключается в применении функционализации поверхности конкретным газом в состоянии плазмы, после чего непосредственно следует химическая унификация сосуществующих с плазмой функциональных групп.
Другой способ введения функциональных групп осуществляют путем непосредственной функционализации, то есть нанесения на поверхность покрытия из полимерного материала. В этой связи синтетический или природный полимер наносят на металл, оксид неорганического соединения, углерод, стекло, керамику с высокой площадью поверхности, а также на другой пригодный для использования синтетический полимер и/или природный полимер, или их смеси.
Многие из указанных выше полимеров, в частности полимеры без функциональных групп, такие как полиэтилен, полипропилен, политетрафторэтилен и тому подобное, требуют дополнительной обработки для изменения их поверхностных свойств. Таким образом, обработка в плазме или коронном разряде поверхности полимера, как указано выше, будет генерировать одни и те же функциональные группы, подобные гидроксильным, карбонильным, карбоксильным, амино- и имино-группам и тому подобное, которые ковалентно присоединены к поверхности.
Нанесение также осуществляется посредством адгезии или адсорбции полимерного вещества, имеющего функциональные группы. Примерами таких веществ являются полилизин, полиаргинин и полиэтиленимин.
Путем использования, например, плазменной технологии получают на пористой поверхности вещества подобные полиэтиленимину. Когда разделительную матрицу используют в способе в соответствии с настоящим изобретением для селективного связывания и выделения, по меньшей мере, одного компонента из цельной крови или телесной жидкости, гидрофильные, а также гидрофобные участки белковых компонентов крови могут взаимодействовать с обработанной поверхностью для удаления желаемых компонентов. После функционализации, когда поверхность матрицы для селективного связывания и разделения содержит полиолефин, например полиэтилен или полипропилен, положительные заряды аминогрупп подобным же образом используются для электростатических взаимодействий, а гидрофобные участки используются для гидрофобных взаимодействий. Этот подход используют в способе по настоящему изобретению для селективного связывания различных областей соединений, например липополисахаридов.
Полимеры и металлы, имеющие, например, реакционноспособные гидроксилы, могут также быть функционилизированы посредством силанизации.
В соответствии с этим, разнообразные функциональные группы различных видов ковалентно связаны со структурой пористой матрицы с высокой площадью поверхности. После непосредственной и/или опосредованной функционализации пористая структура может иметь как гидрофильные, так и гидрофобные участки, которые могут взаимодействовать с различными компонентами крови. Таким образом, характерные свойства вещества, представляющего интерес, используются при подготовке поверхности, которая должна использоваться в способе в соответствии с настоящим изобретением.
Предпочтительно функциональные группы активной поверхности представляют собой сульфгидрилы, карбоксилаты, амины, альдегиды, кетоны, гидроксилы, галогены, гидразиды и активный водород.
В другом предпочтительном воплощении лиганд связан, по меньшей мере, с одной функциональной группой пористой структуры с высокой площадью поверхности ковалентным образом. В связи с этим лиганд представляет собой вещество с высоким сродством к компоненту, который должен удаляться из цельной крови или телесной жидкости. Таким образом, лиганд используется для повышения свойств адсорбции и эффективности связывания.
Лиганд может представлять собой белок, предпочтительно рекомбинантный белок, пептид, антитело или его фрагмент, углевод, например полисахарид, гормон, антиоксидант, гликопротеин, липопротеин, липид, жирорастворимый витамин, например витамин E, желчную кислоту, реакционноспособный краситель, аллантоин, мочевую кислоту или полимиксин, или их сочетания.
Соответствующая желчная кислота представляет собой дезоксихолевую кислоту, которая является эндогенным гидрофобным веществом. Такая желчная кислота может присоединяться либо непосредственно к функциональным группам посредством спейсера либо присоединяться через большую молекулу, а затем она используется для удаления эндотоксинов из крови, телесных жидкостей и водных растворов, как в способе в соответствии с настоящим изобретением.
В этой связи спейсер представляет собой молекулу, большую или малую, которая соединяет лиганд с поверхностью пористой структуры.
Например, если в способе по настоящему изобретению пористая структура разделительной матрицы содержит полиолефин, имеющий присоединенную аминовую группу, эта группа может иметь альбумин, присоединенный к ней, и, в свою очередь, по меньшей мере, один остаток желчной кислоты, соединенный с этой большой молекулой.
Таким образом, настоящее изобретение также относится к новому использованию остатка желчной кислоты, иммобилизованного на подложке, для устранения компонента из содержащего его водного раствора. Предпочтительно остаток желчной кислоты представляет собой остаток дезоксихолевой кислоты.
Соответственно твердая подложка, пригодная для иммобилизации остатка желчной кислоты, представляет собой жесткую интегральную разделительную матрицу, имеющую пористую структуру с размером пор в пределах от 5 микрон до 500 микрон, предпочтительно от 70 микрон до 170 микрон, и активную поверхность в пределах от 0,5 см2 до 10 м2.
Является также предпочтительным, чтобы лиганд матрицы в способе по настоящему изобретению представлял собой альбумин или альбумин, полученный посредством рекомбинантной технологии, который может использоваться вместо сывороточного альбумина, полимиксин B (то есть заряженные группы на гидрофобной структуре) или дезоксихолевую кислоту.
Таким образом, в способе по настоящему изобретению лиганд также может действовать в качестве спейсера. Например, является также возможным сначала ковалентное присоединение рекомбинантного белка человека или другой большой молекулы (например, гиалуроновой кислоты) к пористой структуре, что дает возможность для последующего связывания лиганда, специфичного к тому компоненту, который должен быть удален.
Если это необходимо, между одной, по меньшей мере, функциональной группой и лигандом ковалентным образом присоединяют кросслинкер. В связи с этим, кросслинкер представляет собой элемент, который ковалентно связывает лиганд с пористой структурой подложки, причем этот элемент является спейсером при связывании лиганда на некотором расстоянии от самой пористой структуры. Такие молекулярные спейсеры известны в данной области. Они вводятся для повышения сродства к компоненту, который должен связываться и выделяться из цельной крови или телесных жидкостей путем обеспечения лучшей доступности для лигандов. Биологическая совместимость поверхности структуры пористой матрицы также повышается путем введения этих молекулярных спейсеров.
Кросслинкер/спейсер может содержать кросслинкер нулевой длины сам по себе или в сочетании с промежуточным кросслинкером, при этом конечный полученный комплекс связывается вместе посредством химических веществ, которые добавляют структуры к поперечносшитому веществу. Эти промежуточные кросслинкеры могут быть типа гомобифункционального (например, диальдегиды), гетеробифункционального (например, аминокислоты) или трифункционального типа поперечной сшивки.
Главной задачей спейсера является повышение биологической доступности конкретного используемого лиганда.
Спейсер может представлять собой, например, силан, диизоцианат, гликолят, полиэтиленгликоль, сукцинимидиловый реагент, дигидразин, адипиновую кислоту, диамин, аминокислоту, поли- или олигоаминокислоту, полиаминокислоту, пептид или белок. Предпочтительно белок представляет собой рекомбинантный белок человека.
Функциональные группы кросслинкера предназначены для взаимодействия с аминогруппами (Lys, Arg), с сульфгидрилами (Cys) или с карбоксилами (Asp, Glu) и так далее.
В связи с химией реакционноспособных групп можно упомянуть Bioconjugate Techniques, Greg T. Hermanson, Academic Press, USA 1996.
Таким образом, активная поверхность пористой матрицы в способе по настоящему изобретению является способной к удалению, например, эндотоксинов, сама по себе или в сочетании с нефункционилизованными участками доступной поверхности пористой структуры. Активная поверхность также может использоваться в качестве инструмента для ковалентной иммобилизации реагентов, таких как биологические молекулы, подобные аминокислотам, полипетиды и антитела, для селективного улучшения устранения таких конкретных компонентов.
Разделительная матрица, которая предназначается для селективного удаления, по меньшей мере, одного компонента из цельной крови или телесных жидкостей, может быть получена с помощью пористой структуры с определенным размером пор и/или с определенным диапазоном размеров пор в зависимости от предполагаемого применения. Предпочтительно пористая структура должна давать возможность для прохождения клеток крови. Соответственно определенные типы клеток крови также могут удаляться из цельной крови посредством способа по настоящему изобретению. Такие клетки представляют собой больные клетки или клетки со специфическими поверхностными рецепторами, например активированные фагоцитирующие клетки.
Металлическая структура может для особых применений быть магнитной. Магнитная матрица может, например, получаться путем нанесения на спеченный магнетит покрытия из полимера, например полиэтилена. Затем может осуществляться эффективное удаление клеток, давая возможность антителам, имеющим магнитную метку из железа в декстране, прикрепляться к конкретным клеткам в крови.
Размер пор должен находиться в пределах от 5 микрон до 500 микрон, предпочтительно от 70 микрон до 170 микрон, наиболее предпочтительно от 80 микрон до 100 микрон, так чтобы высокие скорости потока могли поддерживаться без повреждения клеток или вытеснения клеток. Таким образом, разделение, которое осуществляют с помощью способа в соответствии с настоящим изобретением, не основывается на каком-либо распределении компонентов по размерам. Практически все компоненты цельной крови или телесной жидкости могут быть устранены посредством способа по настоящему изобретению.
После удаления одного или нескольких первичных токсичных эффекторов, то есть эндотоксинов, могут быть удалены дополнительные вторичные токсичные эффекторы. Вторичные эффекторы могут представлять собой цитокины (например, TNF-α), интерлейкины (например, Il-l), реакционноспособные радикалы кислорода и азота и тому подобное.
Когда осуществляют способ в соответствии с настоящим изобретением, одну или несколько разделительных матриц заключают в корпус, который может иметь различные формы и изменяющиеся и/или различные входы и выходы в зависимости от применения. Затем такое устройство может использоваться для удаления эндотоксина и/или удаления цитокинов, и/или нейтрализации цитокинов. Это осуществляют путем прохождения крови или других телесных жидкостей через устройство, применяемое интра-, пара- или экстракорпорально, без вытеснения жидкости из находящейся в нем жесткой интегральной разделительной матрицы. Затем активная поверхность пористой структуры, функциональные группы и/или конкретные лиганды на ней селективно связывают и выделяют, по меньшей мере, один компонент из жидкости. Устройство также может преимущественно использоваться для удаления эндотоксинов из водных растворов.
Важной особенностью настоящего способа является то, что могут быть предусмотрены все аспекты септического шока, то есть первичные, а также вторичные токсичные эффекторы могут удаляться посредством способа по настоящему изобретению.
Обратимся к фиг.1 в связи с осуществлением способа в соответствии с настоящим изобретением. Устройство 1 содержит корпус 2, причем корпус (или картридж) устройства интегрирован в замкнутую систему циркуляции, в которой цельная кровь или телесные жидкости циркулируют посредством насоса. В корпусе 2 расположена, по меньшей мере, одна из разделительных матриц 5a, 5b,..., каждая из которых предназначена для селективного удаления одного из компонентов из цельной крови или телесных жидкостей. Корпус 2 снабжают входом 3 и выходом 4, положения которых не являются важными постольку, поскольку получается адекватный поток в разделительной матрице (матрицах) и корпусе. Предпочтительно насос располагается перед входом 3.
Таким образом, получают устройство, которое может поддерживать скорости потока от 5 мл/час до 6000 мл/мин без значительных перепадов давления. Когда его применяют экстракорпорально, получают давление в линии не больше чем 300 мм рт.ст. от насоса до канюли, даже при очень высоких скоростях потока.
Жесткая интегральная разделительная матрица для использования в способе по настоящему изобретению может быть произведена в различных формах. Например, она может быть сконструирована в виде диска, стержня, цилиндра, кольца, сферы, трубки, полой трубки, плоского листа или другой формованной формы.
Поскольку поток в каждой разделительной матрице зависит от ее пористости, время контакта компонентов в крови или телесной жидкости с активной поверхностью может контролироваться. Кроме того, желаемый градиент потока может создаваться в разделительном устройстве путем изменения пористости и конфигурации индивидуальных разделительных матриц в ней.
На фиг.2 и 3 изображены различные схематические воплощения устройств, которые могут быть использованы, когда осуществляется способ в соответствии с настоящим изобретением. Стрелки показывают поток крови или телесной жидкости в индивидуальных разделительных матрицах и их корпусах, стрелки большего размера указывают на более высокую скорость потока, чем малые стрелки. В этих примерах различных конфигураций разделительные матрицы могут иметь или одинаковую или различную пористость с одними и теми же или различными типами функциональных групп или лигандов для удаления одного или нескольких компонентов из крови или телесной жидкости, или без них.
Разделительные матрицы предпочтительно составляют единое целое с корпусами (каждый имеет вход 3 и выход 4) для предотвращения того, что какая-либо жидкость или компоненты в ней не могут поступать в матрицу или матрицы, то есть исключаются из нее. На фиг.2(a) и (b) приведены примеры разделительной матрицы 5 внутри корпуса 2, при этом матрица имеет различные конфигурации. Примеры двух разделительных матриц 5a, 5b внутри корпуса 2 изображены на фиг.2 (c) и (d). В устройстве на фиг.2(c) непроницаемое покрытие 6, такое как нанесенная пленка, на наружной периферии разделительной матрицы 5a обеспечивает то, что весь материал, поступивший в устройство, будет проходить через всю матрицу. В устройстве на фиг.2(d), с другой стороны, некоторая часть поступающего материала будет иметь более короткое время пребывания в разделительной матрице 5a, чем в разделительной матрице 5b, и наоборот.
На фиг.3 каждое устройство содержит несколько разделительных матриц 5a-5g. На фиг.3(a) разделительная стенка 7 обеспечивает поток через все матрицы. Разделительные матрицы могут располагаться продольным или поперечным образом по отношению к их продольным направлениям, как на фиг.3(b) и (c) соответственно. На фиг.3(d) устройство содержит разделительные матрицы различных размеров.
В итоге способ по настоящему изобретению может быть использован вместе с устройством, применяемым интра-, пара- или экстракорпорально, или вместе с отдельно расположенным устройством, которое при этом является способным к уменьшению количества циркулирующих эндотоксинов и потенциально вредных провоспалительных медиаторов, в частности TNF-α, IL-1 и IL-17, предпочтительно в крови. Является также возможным селективное удаление эндотоксинов из других водных растворов. Компоненты, как считают, связываются с активной поверхностью жесткой интегральной разделительной матрицы посредством адгезии.
ПРИМЕРЫ
Настоящее изобретение теперь будет дополнительно описываться и иллюстрироваться путем ссылок на следующие далее примеры, которые были тщательно отобраны для того, чтобы они охватывали настоящее изобретение. Соответственно они не должны рассматриваться как ограничивающие настоящее изобретение каким-либо образом.
Способы модификации поверхности
Пример 1
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 350 микрон и активную поверхность 10 см2, модифицируют посредством плазмостимулированного химического осаждения из паровой фазы с использованием O2 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Формирование гидроксильных групп на поверхности пористой структуры полученной матрицы анализируют с помощью исследования с использованием красителя, при этом ее гидрофильность подтверждается.
Пример 2
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 100 микрон и активную поверхность 20 см2, модифицируют посредством плазмостимулированного химического осаждения из паровой фазы с использованием CO2 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Формирование карбоксильных групп и их количество на поверхности пористой структуры полученной матрицы определяют путем преобразования в гидроксамовые кислоты. В этой связи все гидроксамовые кислоты дают красный или фиолетовый цвет с хлоридом железа (III) в кислотном растворе, как описывается в Feigel et al.; Microchemie 15:18, 1934.
Пример 3
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 170 микрон и активную поверхность 0,04 м2, модифицируют посредством плазмостимулированной полимеризации с использованием аллиламина (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Количество первичных аминов на поверхности пористой структуры полученной матрицы определяют посредством анализа с использованием тринитробензолсульфоновой кислоты (TNBS).
Пример 4
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 70 микрон и активную поверхность 0,26 м2, модифицируют посредством плазмостимулированной полимеризации с использованием акриловой кислоты (Plasma Science, USA, Type PS 0350 Plasma Science Treatment System).
Количество карбоксильных групп на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 2.
Пример 5
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 5 микрон и активную поверхность 0,9 м2, модифицируют посредством плазмостимулированной полимеризации с использованием NH3 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 6
Поверхность матрицы из пористого политетрафторэтилена, PTFE (W.L. Gore & Associates Inc., USA), имеющего пористость 10 микрон и активную поверхность 100 см2, модифицируют посредством плазмостимулированного химического осаждения из паровой фазы с использованием NH3 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 7
Поверхность матрицы из пористого полистирола (Dow Chemical, USA), имеющего пористость 10 микрон и активную поверхность 300 см2, модифицируют посредством плазмостимулированного химического осаждения из паровой фазы с использованием CO2 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Количество карбоксильных групп на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 2.
Пример 8
Поверхность матрицы из пористого полиуретана (Polymers Unlimited, Sweden), имеющего пористость 80 микрон и активную поверхность 100 см2, модифицируют посредством 2% раствора Aldehydic Alkoxy Silane, Art No. (PSX 1050, United Chemical Technologies Inc., USA) в 95% этаноле. pH раствора доводится до pH 5,5 с помощью уксусной кислоты и раствор заливают в матрицу, которую инкубируют в течение ночи при комнатной температуре, а затем промывают 0,9% физиологическим солевым раствором.
Функциональную группу альдегида полученной матрицы оценивают путем использования каталитического ускорения окисления п-фенилендиамина с помощью перекиси водорода, п-фенилендиамин окисляется под действием перекиси водорода в кислотном растворе, который известен как основание Бандровского.
Пример 9
Поверхность матрицы из пористого силикона (Nusil, France), имеющего пористость 200 микрон и активную поверхность 0,5 м2, модифицируют посредством 2% раствора Amine-Silane (Art No. 0750, United Chemical Technologies Inc., USA) в 95% этаноле. Раствор заливают в матрицу, которую инкубируют в течение ночи при комнатной температуре и, наконец, промывают 0,9% физиологическим солевым раствором.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Нанесение покрытия посредством ковалентного связывания
Пример 10
Poly-Lysine (полилизин) (200 мг) растворяют в 10 мл 50 мМ раствора карбоната натрия, а затем матрицу из пористого поликарбоната с пористостью 100 микрон (MicroPore Plastics, USA) погружают в раствор и поддерживают при 4°C в течение 24 часов для получения ковалентного связывания между полилизином и поликарбонатной матрицей. Наконец, пористую матрицу промывают избытком дистиллированной воды.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 11
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 4, заливают водным раствором 1-циклогексил-3-(2-морфолиноэтил)карбодиимид-мета-п-толуолсульфоната (WCCM) (Aldrich) при скорости потока 5 мл/мин в замкнутом контуре при комнатной температуре в течение 6 часов. Затем ее промывают водой и, наконец, добавляют раствор полиэтиленимина (Sigma) (10 мг/мл, pH 7,0) и матрицу инкубируют в течение ночи.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 12
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 3, конъюгируют с использованием 1,0% глутарового диальдегида в 0,2 M фосфатном буфере, pH 7,5, и заливают со скоростью потока 1 мл/мин в течение 6 часов при комнатной температуре. Затем матрицу промывают буфером перединкубированием с раствором гиалуроновой кислоты (2 мг/мл) в течение 16 часов при комнатной температуре. Наконец, избыток гиалуроновой кислоты отмывают.
Содержание гиалуроновой кислоты на поверхности пористой структуры полученной матрицы проверяют и определяют с помощью Alcian Blue (Sigma).
Нанесение покрытия посредством адгезии
Пример 13
Матрицу из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 70 микрон и активную поверхность 0,18 м2, заливают при скорости потока 1 мл/мин в замкнутом контуре в течение 16 часов при комнатной температуре 2 мг/мл раствором гиалуроновой кислоты (BioHyos, Sweden, 12-106 Да) при pH, равном 3,3, которую устанавливают с помощью 0,1 M HCl.
Содержание гиалуроновой кислоты на поверхности пористой структуры полученной матрицы проверяют как в примере 12.
Пример 14
Матрицу из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 70 микрон и активную поверхность 7,0 м2, помещают в стеклянную пробирку. Пробирку с пористой матрицей внутри заполняют раствором 0,13% полилизина Poly-lysine (Sigma) в 350 мл воды и pH доводят до pH 3,3 с помощью 0,1 M HCl. Затем раствор полилизина рециркулируют через пробирку с ее фильтрующей матрицей в течение 16 часов при комнатной температуре при скорости потока <5 мл/мин. Наконец пористую матрицу промывают водой, очищенной с помощью обратного осмоса.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 15
Матрицу из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 70 микрон и активную поверхность 3,4 м2, помещают в стеклянную пробирку. Пробирку с пористой матрицей внутри заполняют раствором 0,2% Recombumin™ (рекомбинантный сывороточный альбумин человека, Hoechst-Pharma, USA) в 350 мл воды, очищенной с помощью обратного осмоса, а затем доводят до pH 3,3 с помощью 0,1 M HC1.
Затем раствор Recombumin™ рециркулируют через пробирку с ее фильтрующей матрицей в течение 16 часов, при комнатной температуре с использованием насоса, при скорости потока <5 мл/мин. Наконец пористую матрицу промывают водой, очищенной с помощью обратного осмоса.
Содержание белка на поверхности пористой структуры полученной матрицы определяют с использованием Coomassie Brilliant Blue (BioRad, USA).
Пример 16
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 4, заливают раствором полиэтиленимина (Sigma), 10 мг/мл, в течение ночи, при скорости потока 5 мл/мин, в замкнутом контуре. Затем пористую матрицу промывают водой.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Непосредственное конъюгирование лигандов
Пример 17
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 5, конъюгируют дезоксихолатом (DOC) путем использования водного раствора WCCM. Раствор из 300 мл 40% диметилформамида (DMF) (Sigma) в воде, который содержит 1 ммоль дезоксихолата натрия, добавляют к пористому поликарбонату при перемешивании, при этом доводят pH с помощью 0,3 M HCl до pH 4,8. Затем раствор 6 мМ WCCM в DMF:воде (1:1,8) добавляют в течение 10 минут. Суспензию выдерживают при pH 4,8 в течение 3 часов путем добавления 0,3 M HCl.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют путем использования набора Bile Acid Kit (Sigma).
Пример 18
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 3, конъюгируют с использованием 12% глутарового диальдегида в 0,15 M фосфатном буфере, pH 7,0, в течение 24 часов, при комнатной температуре. Матрицу промывают 0,15 M фосфатным буфером, а затем добавляют антитела против CD14 (DAKO, Denmark) при концентрации 1 мг/мл и инкубируют при 8°C в течение 24 часов. Следующее далее восстановление цианоборгидридом натрия осуществляют для получения стабильных связей вторичных аминов.
Содержание антител на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора антител, до и после инкубирования с пористой матрицей.
Пример 19
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 8, промывают 0,15 M фосфатным буфером, а затем добавляютрекомбинантный рецептор IL-1 (Kineret, Amgen, USA) при концентрации 1 мг/мл и инкубируют при 8°C, в течение 24 часов. Следующее далее восстановление цианоборгидридом натрия осуществляют для получения стабильных связей вторичных аминов.
Содержание рецепторов IL-1 на поверхности пористой структуры полученной матрицы определяют опосредованно посредством УФ-спектроскопии буферного раствора рецепторов IL-1 до и после инкубирования вместе с пористой матрицей.
Пример 20
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 5, конъюгируют с использованием 1,0% глутарового диальдегида и 0,2 M фосфатного буфера, pH 7,5. Матрицу инкубируют с этим раствором в течение 3 часов. После промывки фосфатным буфером матрицу инкубируют в растворе сульфата Polymyxin B (Sigma), 1 мг/мл, в течение ночи, при рециркулировании. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Пример 21
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 2, конъюгируют рекомбинантным рецептором TNF-α (Enbrel, Wyeth, UK) при концентрации 5 мг/мл, в 0,1 M буфере с 2-(N-морфолино)этансульфоновой кислотой (MES) (Sigma), pH 4,8. Добавляют тридцать мг/мл водного раствора WCCM, и матрицу инкубируют в течение ночи, при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание рецептора TNF-α на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора рецептора TNF-α, до и после инкубирования с пористой матрицей.
Пример 22
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 3, конъюгируют с антителом против TNF-α человека (Sigma) с использованием 1,0% глутарового диальдегида в 0,2 M фосфатном буфере, pH 7,5. Матрицу инкубируют вместе с буферным раствором с антителом к TNF-α в течение 3 часов. После промывки пористой матрицы фосфатным буфером добавляют антитело против TNF-α человека (1 мг/мл) в фосфатном буфере и инкубируют при комнатной температуре в течение 6 часов, при рециркулировании, при скорости потока 1 мл/мин. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание антитела TNF-α на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора антитела TNF-α, до и после инкубирования с пористой матрицей.
Пример 23
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 5, конъюгируют с белком человека, усиливающим бактерицидную проницаемость (BPI) (Wieslab, Sweden), при концентрации 2 мг/мл, в 0,1 M буфере MES, pH 4,8. К этой матрице добавляют водный раствор WCCM при концентрации 15 мг/мл, и матрицу инкубируют в течение ночи при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание BPI на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора BPI, до и после инкубирования с пористой матрицей.
Пример 24
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 15, инкубируют в растворе DOC, в 0,1 M буфере MES, pH 4,8, при концентрации 1 мг/мл. Затем добавляют водный раствор WCCM, и матрицу инкубируют в течение ночи при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют, как в примере 17.
Конъюгирование лигандов со спейсером
Пример 25
Пористую полиэтиленовую матрицу получают в соответствии с примером 3 и активируют 1,2% глутаровым диальдегидом в 0,2 M фосфатном буфере, pH 7,0, в течение 24 часов при комнатной температуре. Матрицу промывают буфером, а затем инкубируют в течение 24 часов в 1,6-диаминогексане (DAH) (Sigma), 50 мг/мл, в 0,2 M фосфатном буфере, pH 7,0. После этого к раствору добавляют 10 мг/мл цианоборгидрида натрия (Sigma). Пористую матрицу промывают 0,1 M фосфатным буфером, а затем инкубируют в растворе DOC (1 мг/мл), в 0,1 M буфере MES, pH 4,8. Затем добавляют водный раствор WCCM и матрицу инкубируют в течение ночи при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют как в примере 17.
Пример 26
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 5, активируют в течение 24 часов, при комнатной температуре 1,2% глутаровым диальдегидом в 0,2 M фосфатном буфере, pH 7,0. Матрицу промывают буфером, а затем инкубируют в течение 24 часов с дигидразидом адипиновой кислоты (Aldrich) при концентрации 10 мг/мл, в 0,2 M фосфатном буфере, pH 7,4. Затем в раствор добавляют 10 мг/мл цианоборгидрида натрия (Sigma).
Пористую матрицу промывают 0,1 M фосфатным буфером, а затем инкубируют с раствором DOC, при концентрации 1 мг/мл, в 0,1 M буфере MES, pH 4,8. Затем добавляют водный раствор WCCM и матрицу инкубируют в течение ночи при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют как в примере 17.
Пример 27
Матрицу, полученную в соответствии с примером 10, конъюгируют с DOC путем использования водного раствора WCCM. Водный раствор 300 мл 40% DMF (Sigma), содержащий 1 ммоль дезоксихолата натрия, добавляют к пористой поликарбонатной матрице при перемешивании. pH суспензии доводят до 4,8 с помощью 0,3 M HCl. Добавляют 6 мМ раствор WCCM в DMF:воде (1:1,8), в течение 10 минут, и суспензию выдерживают при pH 4,8, в течение 3 часов путем периодического добавления 0,3 M HCl. Затем ее выдерживают при комнатной температуре в течение 24 часов.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют как в примере 17.
Пример 28
Матрицу, полученную в соответствии с примером 14, активируют в течение 10 часов при комнатной температуре 1,2% глутаровым диальдегидом в 0,2 M фосфатном буфере, pH 7,0, а затем промывают избыточными количествами буфера. Полиэтиленимин (Sigma) при концентрации 10 мг/мл в 0,1 M бикарбонатном буфере, pH 8,0, вводят в пористую матрицу, и матрицу инкубируют раствором в течение 16 часов.
Затем матрицу промывают буфером и конъюгируют с DOC с использованием водного раствора WCCM. Раствор 300 мл 40% DMF в воде, содержащий 1 ммоль дезоксихолата натрия, добавляют к пористой матрице при перемешивании. pH доводят до 4,8 с помощью 0,3 M HCl. Затем добавляют 6 мМ раствор WCCM в DMF:воде (1:1,8) в течение 10 минут. Суспензию выдерживают при pH 4,8 в течение 3 часов путем периодического добавления 0,3 M HCl. Затем ее выдерживают при комнатной температуре в течение 24 часов.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют как в примере 17.
Пример 29
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 3, активируют в течение 24 часов при комнатной температуре 1,2% глутаровым диальдегидом в 0,2 M фосфатном буфере, pH 7,0. Затем матрицу промывают буфером и инкубируют в течение 24 часов с 1,6-диаминогексаном (DAH) (Sigma) при концентрации 50 мг/мл в 0,2 M фосфатном буфере, pH 7,0. Затем пористую матрицу промывают 0,1 M фосфатным буфером и инкубируют в течение 12 часов при 8°C в видесуспензии в растворерецептора TNF-α (Enbrel, Wyeth, UK) с концентрацией 10 мг/мл, в 0,1 M фосфатном буфере, pH 7,4. Затем к суспензии добавляют раствор цианоборгидрида натрия (Sigma) при концентрации 10 мг/мл. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание рецептора TNF-α на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора рецептора TNF-α до и после инкубирования с пористой матрицей.
Селективное связывание и разделение компонентов крови
Разделение клеток осуществляют, давая возможность цельной крови проходить через фильтр из матрицы, имеющей форму диска и имеющей активную поверхность 0,02 м2.
Удаление эндотоксинов и цитокинов осуществляют с помощью исследовательской системы, изображенной на фиг.4. Контейнер 8, заполненный цельной кровью или плазмой в объеме вплоть до 2 л, соединяют с насосом 9, монитором давления 10 и фильтрующим устройством 1, содержащим до 40 пластинок матрицы, то есть обеспечивается активная поверхность до 7 м2, имеющая пористость, находящуюся в пределах между 70 и 130 микронами.
Разделение клеток
Пример 30
Пористую магнитную матрицу, содержащую смесь полиэтилена и магнитного феррита (80% FeO, 20% BaO2, Porex Technologies, Germany), которая имеет пористость 100 микрон, используют для выделения лейкоцитов из цельной крови путем использования специфично меченых антител против CD45+ (MACS Antibody Microbeads; Miltenyi Biotec, Germany). После магнитного мечения лейкоцитов такими антителами крови дают возможность для прохождения через пористую матрицу.
Счет клеток лейкоцитов осуществляют путем использования автоматического цитометра, который после проведения разделения показывает уменьшение содержания лейкоцитов в крови на 90%.
Пример 31
Поверхность матрицы из пористой диацетат целлюлозы (Tenite, Eastman Chemicals, USA), имеющей пористость 200 микрон и активную поверхность 0,2 м2, используют для выделения фагоцитирующих клеток крови человека в качестве нейтрофилов и моноцитов. Цельную кровь человека собирают в пробирках EDTA vacutainer (B&D, UK) и крови дают возможность для прохождения через пористую матрицу.
Уменьшение количество нейтрофилов и моноцитов в собранной крови составляет 50% и 35% соответственно, что определяется микроскопически путем дифференциального подсчета клеток в гемоцитометре Бюркнера, путем использования Turks Reagent.
Удаление цитокинов
Пример 32
Матрицу, полученную в соответствии с примером 22, которая имеет покрытие с группами для удаления эндотоксинов, используют в виде пористых дисков в исследовательской системе, изображенной на фиг.4.
Устранение TNF-α из цельной крови исследуют после иммобилизации поликлональных антител против TNF-α на аминогруппах на пористой полимерной структуре с помощью глутарового диальдегида. Выработку TNF-α индуцируют путем добавления в кровь LPS, и активированную цельную кровь заливают на иммобилизованный фильтр в устройстве.
Количества TNF-α в цельной крови (фиг.5) определяют до (◆) и после (▪) иммуноферментного анализа (Enzymimmuno-assay, Milenia Biotec GmbH, Germany) в устройстве для исследования поглощения TNF-α фильтрующими дисками. Как видно, может быть получено значительное понижение патологических концентраций TNF-α в цельной крови.
Удаление эндотоксинов
Пример 33
Матрица, полученная в соответствии с примером 25, то есть модифицированная с помощью плазмы полиэтиленовая матрица имеет на себе DOC, иммобилизованный на ней посредством спейсера из диаминогексана, который сначала связывают с матрицей посредством глутарового диальдегида, а затем с дезоксихолатом с использованием карбодиимида. Полученную матрицу используют в виде пористых дисков в фильтрующем устройстве системы, изображенной на фиг.4.
Устранение LPS из плазмы осуществляется способом, подобным примеру 32.
Количество LPS в плазме определяют посредством средств Limulus Amebocyte Lysate assay (Endochrome-K, Charles River Laboratories Inc. USA) в объеме через различные интервалы времени, во время рециркулирования через фильтрующее устройство.
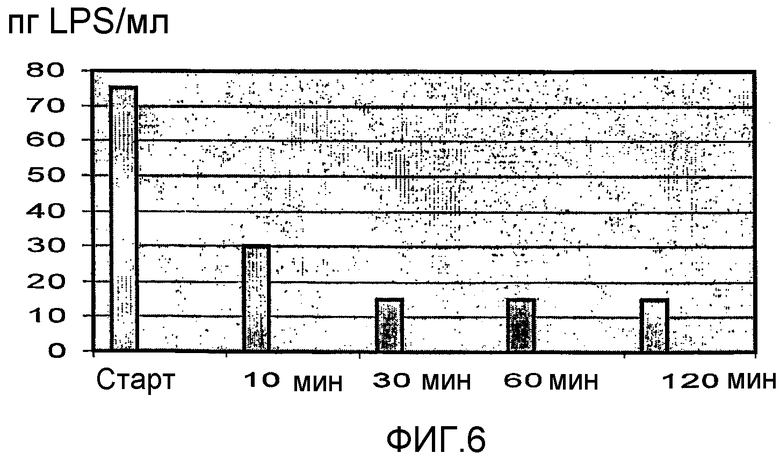
На фиг.6 изображено уменьшение количества эндотоксина (пг/мл) со временем. После рециркулирования в течение 2 часов нагрузка эндотоксина уменьшается от 75 пг/мл в начале до 15 пг/мл, что представляет собой предел детектирования.
Пример 34
Матрицы, полученные в соответствии с примером 3 (неиммобилизованные аминогруппы) и примером 17 (иммобилизованный DOC), соответственно используют в виде пористых дисков и сравнивают в отношении их способности к устранению LPS. Исследования с рециркулированием, подобные примеру 33, осуществляют с тем различием, что LPS растворяют в дистиллированной воде.
Устранение LPS из водного раствора определяют как показано на фиг.4, при рециркулировании со скоростью потока 0,22 мл/мин по 10 мл через каждый фильтр в устройстве.
В таблице 1 ниже значения для устранения LPS с помощью двух матриц из примера 3 и примера 17 соответственно приводят как процент от начальной концентрации LPS после рециркулирования в течение 120 мин.
Различия в степени устранения между плазмой (пример 34) и водой (пример 35) могут объясняться конкурентными взаимодействиями белков, LPS и лиганда.
Комбинированное удаление
Пример 35
Матрицы, полученные в соответствии с примером 19 и примером 29, используют для комбинированного удаления TNF-α и IL-1 соответственно.
Две матрицы с различной специфичностью объединяют последовательно в тестовую систему из двух фильтрующих устройств типа замкнутой петли, как показано на фиг.4. Цельную кровь в контейнере, выдерживаемом при 37°C, активируют путем добавления LPS и вводят в систему. Отбор образцов для анализа цитокинов осуществляют через различные интервалы времени одновременно из выходов контейнера и фильтра.
Результаты демонстрируют понижение концентраций цитокинов для обеих матриц на 70% и 55% для TNF-α и IL-β соответственно.
Таблица 2 ниже демонстрирует сводку многосторонней применимости и значительной эффективности способа по настоящему изобретению для селективного связывания и выделения различных компонентов из цельной крови или телесной жидкости. Для этой цели различные пористые матрицы используют в качестве подложек для присоединения лигандов либо со спейсером либо без него. Таким образом, способы иммобилизации осуществляют с глутаровым диальдегидом, используя две конечных группы -NH2, и с 1-этил-3-(3-диметиламинопропил)карбодиимидом, с одной конечной группой -NH2 и одной конечной группой -OH или -COOH соответственно. Также используется силанизация посредством связывающих реагентов на основе альдегида или аминофункциональных силанов для специфичного связывания аминогрупп, антител, ферментов, пептидов, белков, причем альдегидные группы спонтанно взаимодействуют с аминами, пептидами и белками.
Аббревиатуры: BPI = белок, повышающий бактерицидную проницаемость; DAH = 1,6-диамино-гексан; DOC = дезоксихолат; EDC = 1-этил-3(3-диметиламинопропил)карбодиимид; GDA = глутаровый диальдегид; HA = гиалуроновая кислота; IL-1 = Интерлейкин-1; PEI = полиэтиленимин; Recombumin = рекомбинантный альбумин человека; Sil.ald. = связывающий реагент с альдегид-функциональным силаном; Sil.-NH2 = связывающий реагент с аминофункциональным силаном; TNF-α = фактор некроза опухоли - α.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СЕЛЕКТИВНОГО УДАЛЕНИЯ КОМПОНЕНТА ИЗ ВОДНОЙ ЖИДКОСТИ | 2007 |
|
RU2429902C2 |
| СПОСОБ ОЧИСТКИ АНТИТЕЛ | 2005 |
|
RU2389552C2 |
| ХРОМАТОГРАФИЧЕСКИЙ ЛИГАНД | 2005 |
|
RU2396246C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ПРОДУКТОВ ПРОТЕОЛИЗА В ПЛАЗМЕ КРОВИ И ДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2015 |
|
RU2597782C1 |
| ХРОМАТОГРАФИЧЕСКИЙ ЛИГАНД | 2005 |
|
RU2541429C2 |
| Группа антигенов и тест-система для диагностики инфекции М.tuberculosis complex | 2022 |
|
RU2802789C1 |
| СПОСОБ СВЯЗЫВАНИЯ MYCOBACTERIA | 2011 |
|
RU2573921C2 |
| ФРАГМЕНТЫ АНТИТЕЛ В ТЕРАПИИ | 1994 |
|
RU2139092C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И АНАЛИЗА ЭКЗОСОМ | 2022 |
|
RU2788198C1 |
| СПОСОБ ВЫЯВЛЕНИЯ АНТИТЕЛ К ВИРУСУ АЛЕУТСКОЙ БОЛЕЗНИ НОРОК | 1992 |
|
RU2074393C1 |




Способ для селективного связывания и выделения, по меньшей мере, одного компонента из жидкости организма. Предложенный способ включает прохождение жидкости организма, такой как цельная кровь, через жесткую интегральную разделительную матрицу, без исключения компонентов по размерам из указанной матрицы, причем указанная матрица имеет пористую структуру с размером пор в пределах от 5 микрон до 500 микрон, а также активную поверхность в пределах от 0,5 см2 до 10 м2, связывание, по меньшей мере, одного компонента жидкости организма, по меньшей мере, с одной функциональной группой, расположенной в указанной матрице, при этом указанную матрицу получают с помощью способа, выбранного из группы, включающей в себя способы спекания, формования и вспенивания. Предложено применение остатка желчной кислоты, иммобилизованного на подложке, для устранения компонента из содержащего его водного раствора. Предложено устройство для селективного связывания и выделения, по меньшей мере, одного компонента из жидкости организма, содержащее корпус, вход, выход и, по меньшей мере, одну разделительную матрицу, причем указанная матрица является жесткой и интегральной при прохождении указанной крови или жидкости организма через нее, и указанная матрица имеет пористую структуру с размерами пор, находящимися в пределах от 5 микрон до 500 микрон, а также активную поверхность, находящуюся в пределах от 0,5 см2 до 10 м2, которая способна связывать указанный, по меньшей мере, один компонент, где указанная разделительная матрица имеет пористую структуру, полученную с помощью способа, выбранного из группы спекания, формования и вспенивания. Группа изобретений обеспечивает селективное связывание и выделение, по меньшей мере, одного компонента из жидкости организма, при этом жидкости дается возможность для прохождения через жесткую интегральную разделительную матрицу без вытеснения из нее. 3 н. и 29 з.п. ф-лы, 2 табл., 4 ил.
прохождение жидкости организма, такой как цельная кровь, через жесткую интегральную разделительную матрицу, без исключения компонентов по размерам указанной матрицей, причем указанная матрица имеет пористую структуру с размером пор в пределах от 5 до 500 мкм, а также активную поверхность в пределах от 0,5 см2 до 10 м2,
связывание, по меньшей мере, одного компонента жидкости организма, по меньшей мере, с одной функциональной группой, расположенной в указанной матрице, где указанная функциональная группа размещена на указанной матрице путем покрытия или поверхностной модификации указанной пористой структуры указанной матрицы, для размещения указанной, по меньшей мере, одной функциональной группы на указанной матрице,
при этом указанную матрицу получают с помощью способа, выбранного из группы, включающей в себя способы спекания, формования и вспенивания.
Авторы
Даты
2007-11-27—Публикация
2003-04-04—Подача